Дисплазия сосудов головного мозга у детей
Дисплазия головного мозга – это дефект внутриутробного развития, характеризующийся массовым или локальным нарушением формирования нервной ткани. Заболевание имеет множество вариантов развития, среди которых, например, фокальная корковая дисплазия, или образование полостей в отдельных участках мозга. Дисплазия сосудов головного мозга – один из вариантов, затрагивающий нарушение формирования артерий и вен.
Причины
Дисплазия обуславливается нарушением созревания головного мозга в период формирования центральной нервной системы во время развития плода. Из-за неправильного дозревания и миграции клеток, в участке головного мозга образуются дефекты.
Фокальная корковая дисплазия, например, формируется на 1-2 месяца до родов. Степень патологии определяется временем воздействия патологического фактора: в первый и второй триместр беременности плод наиболее уязвим. Поэтому воздействие даже незначительного фактора в первые 6 месяцев может привести к грубым дефектам мозга.
В дисплазии решающую роль играет повреждение генетической информации, из-за которой и происходит сбой дифференциации нервных клеток. Также имеют значения такие факторы:
- Окружающая среда: загрязнение, избыточная инсоляция, радиация.
- Питание и вредные привычки беременной.
- Перенесенные мамой заболевания, особенно инфекционной природы.
Классификация и симптомы
Дисплазия головного мозга имеет разновидности:
Фокальная корковая дисплазия
Это заболевание характеризуется нарушением строения коркового шара головного мозга. Чаще всего располагается в лобной и височной доле. Подразделяется на три типа:
- 1 тип – локальное ограниченное поражение мозга; характеризуется легким течением и редкостью эпилептических припадков; проявляется преимущественно задержкой развития;
- 2 тип – локальное поражение, углубляющееся во все шары коры мозга; проявляется локальными припадками и задержкой нервно-психического развития;
- 3 тип – полная дисплазия коры больших полушарий в результате нейроинфекции и мальформации сосудов; характеризуется тяжелым нарушением умственных способностей и генерализованнымы эпилептическими припадками.
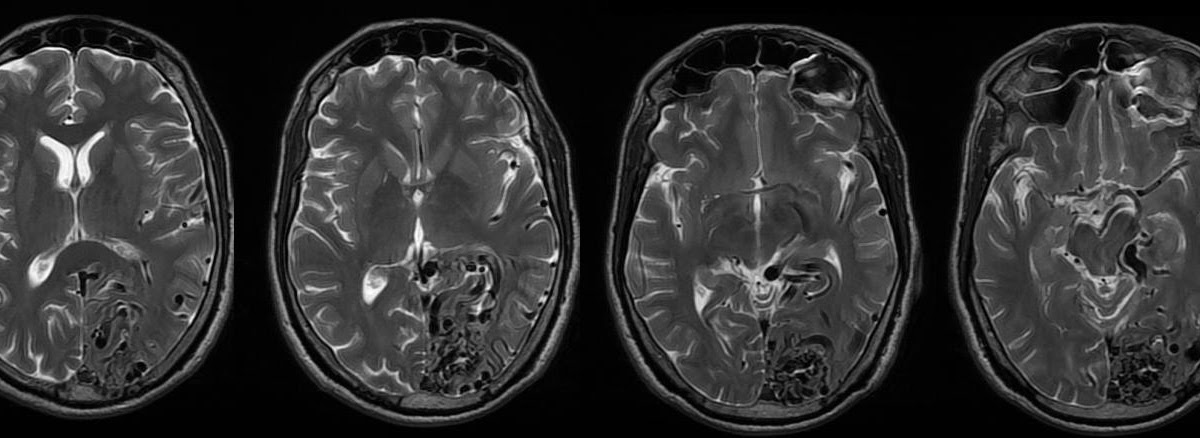
Корковая дисплазия проявляется фокальной эпилепсией, которая впервые проявляется в раннем возрасте. Дисплазия головного мозга у детей по фокальному типу проявляется кратковременной потерей сознания во время припадков. Также наблюдаются синдромы нарушения сознания, например, сумеречное помрачение.
Эпилепсия при фокальной дисплазии проявляется преимущественно двигательными расстройствами, при которых развивается спутанность сознания и дезориентация в пространстве. В таком случае больные внезапно падают. Характерна генерализация приступов, когда судороги возникают во всех скелетных мышцах.
Психическое и интеллектуальное развитие зависит от возраста, в котором дебютировала первая эпилепсия: чем раньше она началась, тем глубже будет задержка психики и когнитивных способностей.
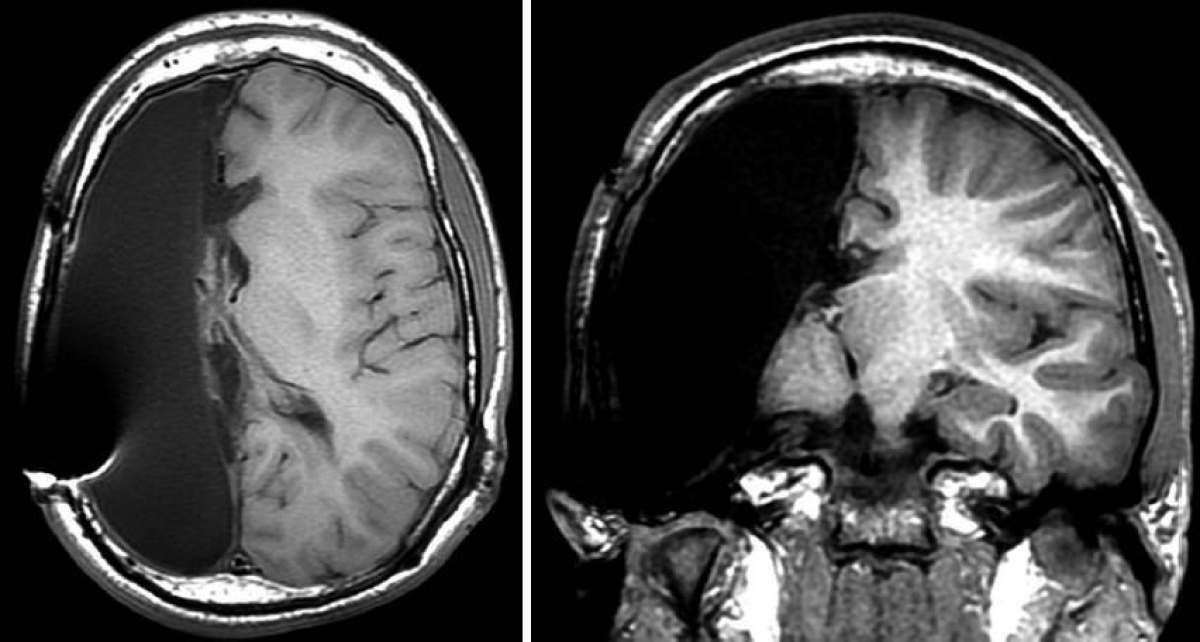
Поликистоз головного мозга
Клиническая картина характеризуется эпилептическими припадками, если область дисплазии находится в пределах больших полушарий. Также наблюдаются дефицитарные неврологические симптомы:
- гемипарез – частичное ослабление мышечной силы в половине тела;
- расстройство деятельности черепно-мозговых нервов;
- нарушение сознания: оглушенность, ступор;
- снижение точности зрения.
Симптомокомплекс поликистоза также включает общемозговые симптомы:
- головная боль, головокружение;
- тошнота;
- апатия, раздражительность, нарушение сна, эмоциональная лабильность;
- вегетативные нарушения в виде потливости, нарушения аппетита, расстройства стула и дрожания рук.
Третья разновидность – венозная дисплазия. Однако она часто имеет бессимптомное течение. Если симптомы и есть, они проявляются в виде дефицитарных неврологических признаков. Часто венозная дисплазия имитирует сосудистую мальформацию. Несмотря на скрытность течения, дисплазия (редко) грозит геморрагическим инсультом и тромбозом вен.
Диагностика и лечение
Фокальная корковая дисплазия диагностируется с помощью магнитно-резонансной томографии. На послойных изображениях наблюдается гипоплазия коры и отсутствие границы между белым и серым веществом головного мозга. Второй способ – электроэнцефалография. С ее помощью выявляются «зачатки» эпилепсии между приступами.
Фокальная корковая дисплазия лечится противосудорожными препаратами. Обычно назначают препараты вальпроевой кислоты, Сибазон, Диазепам или Карбамазепин. Часто эпилепсия при фокально дисплазии не поддается терапии. В таком случае показана операция.
Поликистоз можно диагностировать с помощью таких исследований:
Специфика диагностики заключается в том, что поликистоз диагностируется применением комбинации методов: нужно использовать сразу несколько способов исследования, так как ни один из них не дает точных сведений. Используя в комбинации ангиографию, часто одновременно выявляется венозная дисплазия головного мозга.
Больным с поликистозом показано хирургическое лечение. Обычно патология легко поддается оперативному вмешательству из-за того, что поликистоз имеет четкие и выраженные границы.
Если очаги поликистоза находятся в функционально значимых зонах головного мозга, применяют выжидательную тактику, а оперативное вмешательство оставляют на задний план.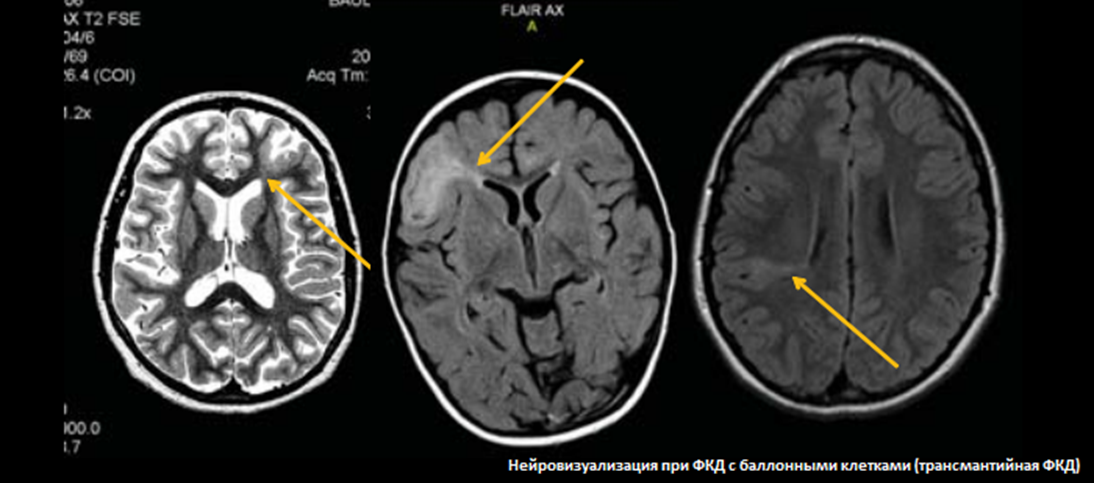
Венозная дисплазия диагностируется магнитно-резонансной томографией и ангиографией. Обыкновенно методы выявляют аномальное расширение вен мозга.
Дисплазия вен часто не нуждается в лечении, так как имеет бессимптомную клиническую картину и обнаруживается на исследовании головного мозга случайно. К лечению дисплазии приступают в том случае, когда она сочетается с другими сосудистыми патологиями мозга, например, с сосудистой мальформацией.
Не нашли подходящий ответ?
Найдите врача и задайте ему вопрос!
Смотрите также:
как выявить с помощью МРТ
Відповідно до Закону України «Про захист населення від інфекційних хвороб», приймаючи до уваги офіційні рекомендації ВООЗ та МОЗ, медичним центром «Юнімед» затверджено план протиепідемічної готовності та тимчасово (на час дії встановленого в Україні карантину) запроваджено особливі Правила внутрішнього розпорядку, які, серед іншого, передбачають наступні заходи та обмеження щодо надання медичних послуг: Перебувати на території медичного центру пацієнти/відвідувачі можуть виключно у захисних медичних масках та бахілах (МЦ «Юнімед» забезпечує зазначеними засобами захисту кожного пацієнта/відвідувача на безоплатній основі).
Перебувати на території медичного центру пацієнти/відвідувачі можуть виключно у захисних медичних масках та бахілах (МЦ «Юнімед» забезпечує зазначеними засобами захисту кожного пацієнта/відвідувача на безоплатній основі).
2. Перед входом до медичного центру пацієнти/відвідувачі зобов’язані здійснити дезінфікуючу обробку рук спиртовмісними дезінфікуючими засобами (засоби дезінфекції надаються пацієнтам/відвідувачам МЦ «Юнімед» на безоплатній основі).
3. При наявності ознак хвороби (нежить, кашель, чхання, сльозотеча тощо) у пацієнта/відвідувача, персонал медичного центру має право здійснити вимірювання температури тіла безконтактними інфрачервоними термометрами.
4. Супровід пацієнта безпосередньо до приміщень медичного центру здійснюється іншими особами лише у виключних випадках, коли пацієнт не може самостійно пересуватись та/або пройти діагностику (малолітні/неповнолітні особи, пацієнти у супроводі співробітників реанімації тощо).
5. Персонал медичного центру має право відмовити у доступі до приміщень центру та подальшому веденні пацієнта у випадках, коли на вимогу співробітника медичного центру пацієнт/відвідувач відмовляється дотримуватись заходів, передбачених Правилами внутрішнього розпорядку та/або у разі виявлення підвищеної температури тіла пацієнта/відвідувача більше 37 градусів.
6. Наполегливо рекомендуємо пацієнтам після проходження діагностичної процедури очікувати висновки за межами території медичного центру або використовувати для отримання результатів електронний сервіс «MedOffice» (medoffice.zp.ua).
Невиконання вказаних положень Правил загрожуватиме життю і здоров’ю населення, а отже буде причиною відмови від ведення пацієнта згідно ст. ст. 11, 29 ЗУ «Про захист населення від інфекційних хвороб» та ст. 34 Закону України «Основи законодавства України про охорону здоров’я».
Лечение
Помощь в лечение детей, страдающих тяжелыми заболеваниями, — главная задача Благотворительного фонда «Под флагом Добра».
Для более эффективной помощи тяжелобольным детям Фонд активно работает со многими медицинскими учреждениями и учреждениями, находящимися в ведении министерства социального развития:
20 федеральных специализированных научных центров,
22 научно-исследовательских института различного профиля
19 клинических больниц
20 областных, городских и районных больниц
4 реабилитационных центра
10 медицинских училищ
2 детских оздоровительных центра: ФДЦ «Смена» (Анапа) и ВДЦ «Орлёнок» (Туапсе).
Фонд оказывает помощь в лечении более 200 заболеваний и все они очень тяжелые: редкие наследственные заболевания, онкология, сердечно-сосудистые заболевания, гематологические и иммунологические проблемы, неврологические, психические и эндокринные заболевания, наследственные и врожденные отклонения, заболевания опорно-мышечного аппарата, последствия травм и аварий:
Анапластическая эпендиома
Ангиодисплазия верхней челюсти
Анемия Даймонда-Блекфана
Анемия Фанкони
Анкилоз
Анофальм
Аплазия левой кисти
Аплазия проксимального отдела правого бедра
Апластическая анемия
Атактический синдром
Атопический дерматит
Атрофия зрительного нерва
Аутоиммунный гепатит
Белково-калорийная недостаточность
Болезнь Шейрман-Мау
Болезнь Байлера
Болезнь Гиршпрунга
Болезнь Гоше
Болезнь Крона
Болезнь Легг-Кальве-Пертеса
Болезнь Наманна Пика
Бронхиальная астма
Бронхолегочная дисплазия
Булезный эпидермолиз
Вазоренальная гипертензия
Венозная дисплазия
Вирусный гепатит «С»
В-клеточная лимфома илеоцекального угла
ВПС. Тетрада Фалло
Тетрада Фалло
Врожденная анафтальмия
Врожденная аномалия левой голени и стопы
Врожденная аномалия мочевыводящей системы
Врожденная аномалия развития кищечника
Врожденная аномалия развития конечностей
Врожденная аномалия развития правой нижней конечности
Врожденная аномалия ЦНС
Врожденная воронкообразная деформация грудной клетки
Врожденная гиперплазия коры надпочечников
Врожденная двусторнняя косолапость
Врожденная катаракта обоих глаз
Врожденная мышечная дистрофия
Врожденная экстромелия
Врожденная ядерная катаракта обоих глаз
Врожденный агранулоцитоз
Врожденный артрогрипоз
Врожденный вывих правого бедра
Врожденный гидронефроз
Врожденный кифоскотоз
Врожденный порок развития (волчия пасть, заячья губа)
Врожденный порок развития вен
Врожденный порок развития желудочно-кишечного тракта
Рубец гортани
Рубцовая деформация пищевода
Сагиттальный синогстоз
Саркома мочевого пузыря
Саркома мягких тканей
Саркома Юинга
Сахарный диабет
Сенсоневральная тугоухость
Симптоматическая парциальная эпилепсия
Синдактилия
Синдром WPW
Синдром Аперта
Синдром Гольденхара
Синдром Дауна
Синдром жаберных дуг
Синдром Йохансона-Близзарда
Синдром Картагенера
Синдром Картагенера
Синдром короткой кишки
Синдром Мардена Уолкера
Синдром Марфана
Синдром Секкеля
Синдром Сетр-Котцена
Синдром слабости синусового узла
Синдром удлиненного интервала QT
Синдром врожденной центральной гиповентиляции
Синдром Юинга
Синкопальные состояния неясной этиологии
Системная склеродермия
Следствия перенесенной ЧМТ
Состояние после перенесенного термического ожога
Состояние после трансплантации донорской печени
Врожденный порок развития ЦНС
Врожденный порок сердца Галактоземия
Гемангиома
Гемолитико-уремический синдром
Гемофилия
Гидроцафалия
Гистеоцитоз
Глеобластома
Гликогенез
Гликогеновая болезнь
Глутаровая ациденемия
Глутаровая ацидурия
Гомоцистеинурия
Детский церебральный паралич
Деформация грудной клетки
Деформация шейно-грудного отдела
Дисплазия вен, пищевода и кардии
Дисплазия дисков зрительных нервов
Дисплазия позвоночника
Дисплазия почек
Дисплазия правого тазобедренного сустава
Дифференцированно-токсический зоб
Диффузная глиома ствола головного мозга
Долихосигма
ДЦП
Желудочковая тахикардия
Заболевания сердца
Злокачественная мезотелиома
Злокачественная опухоль головного мозга
Идиопатическая тромбоцитопеническая пурпура
Иммунная недостаточность
Иммунная тромбоцитопеническая пурпура
Интрадуллярная опухоль спинного мозга
Интрамедулярная опухоль
Ишемически гипоксическое поражение ЦНС
Кавернозная ангиома
Катехоламинергическая
Кистозное поражение правого легкого
Клоака, 2-х сторонний мегауретер
Колобома верхнего века
Контузия тяжелой степени
Краниосиностоз
Левосторонний хронический отит
Легечная гипертензия
Легочная гипертензия
Лейкодистрофия
Лейциноз
Лимфома Беркитта
Лимфоэпителиомная карцинома
Малые мозговые дисфункции
Мегаректум
Мезинхимальная тамартома
Мелилмалоновая ацидурия
Миелодисплазия поясничного отдела
Миопия
Сочетанный врожденный порок развития ЦНС
Спинальная амиотрофия Верднига-Гоффмана
Спино-мозговая грыжа
Стойкие резидуальные последствия тяжелой открытой черепно-мозговой травмы
Суколиоз
Тирозинемия
Тромбоцитопеническая пурпура
Туберкулезный спондилит
Туберозный склероз
Туболопатия
Утопление в пресной воде
Фенилкетонурия
Функциональная диспепсия
Хондросаркома
Хроническая болезнь почек
Хроническая иммунная тромбоцитопения
Хронический герпес
Хронический гломерулонефрит
Хронический мнелолейкоз
Хронический тубулоинтерсити-циальный нефрит
Хроническое трахеальное канюленосительство
Х-сцепленная адренолейко-дистрофия
Целиакия
Циклоспориновая нефропатия
Цирроз печени
Цистиноз.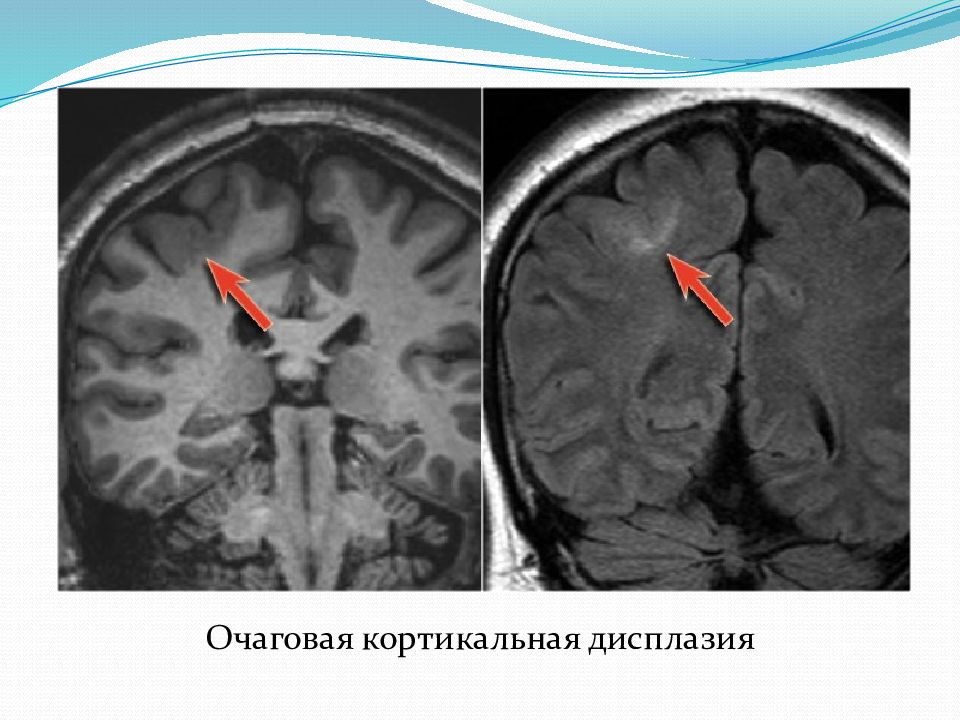 ХНП
ХНП
Цитомеголовирусная инфекция
Шунтозависимая гидроцефалия
Электротравма
Эмбриональная рабттомиосаркома
Множественная экзостозная хондролисплазия
Множественные пороки развития
Муковисцидоз
Мукополисахаридоз
Нарушение ритма сердца
Недостаточность Биотинидазы
Нейробластома
Нейросенсорная тугоухость
Нейрофиброматоз
Нейроэндокринная опухоль
Несовершенный остеогенез
Неспецифический язвенный колит
Ниманна Пика
Опухоль Вилмса
Опухоль головного мозга
Органическое поражение ЦНС
Остеобластокластомы
Остеогенная саркома
Остеоид-остеома
Остеосаркома
Остеохондроз
Острый лейкоз
Очаговая склеродермия
Папиллома хориодального сплетения
Папилломатоз
Пароксимальная тахикардия
Первичный иммунодефицит
Переходная липома конуса спинного мозга
Перинатальня патология головного мозга
Пигментный невус
Пинеоцитома головного мозга
Плевропульмональная бластома
Повреждение спинного мозга, диплегия
Полиоссальная форма дисплазии
Порок развития челюстно — лицевой области
Портальная гипертензия
Последствия клещевого инцефалита
Последствия краниофациальной травмыТравматический синовиит
Последствия перитониальной патологии ЦНС
Последствия спино-мозговой травмы
Послеожоговая деформация лица
Послеожоговые келоидные рубцы
Постгипоксическая энцефалопатия
Посттравматическая частичная ампутация стоп
Привычный вывих левого плеча
Посттравматический церебральный арахноидит
Преждевременное половое развитие
Пропионовая ацидемия
Рабдомиосаркома
Рассеянный склероз
Ретинопатия недоношенных
Ретинопатия недоношенных
Рецидивирующий вентрикулит
Рецидивирующий кератит смешанного генеза
Энцефалопатия неуточненная
Эпилепсия
Ювенильный ревматоидный артрит
Юношеский эпифизиолиз
Флеболог в Кудрово — Первая Невская клиника
Флеболог – это врач, который занимается диагностикой, лечением и профилактикой заболеваний вен и артерий. Флебология – сравнительно молодое направление в медицине, однако в последние годы количество людей с проблемами вен сильно выросло. Ниже приведены основные заболевания в данной сфере и методы их диагностики и лечения
Флебология – сравнительно молодое направление в медицине, однако в последние годы количество людей с проблемами вен сильно выросло. Ниже приведены основные заболевания в данной сфере и методы их диагностики и лечения
Самые распространённые поводы для обращения к врачу:
- Варикоз, варикозное расширение вен на ногах, на руках, вен пищевода, вен малого таза
- Воспаление венозных стенок (флебит)
- Тромбоз вен
- Тромбофлебит – воспаление в сочетании с образованием тромбов, как правило, является осложнением варикоза
- Трофические язвы на коже
- Венозная недостаточность, венозная дисплазия
Звоните нам прямо сейчас
+7 (812) 456-31-30
или оставьте заявку, мы вам перезвоним
Когда нужна консультация флеболога
В категорию риска по флебологии входят следующие группы людей
- Люди, большую часть рабочего дня проводящие на ногах – учителя, спортсмены, грузчики, танцоры и так далее)
- Женщины, которые постоянно ходят на высоких каблуках
- Люди, ведущие сидячий образ жизни – т.
 к. снижается кровообращение нижних конечностей
к. снижается кровообращение нижних конечностей - Женщины, которые родили одного и более детей
- Люди с избыточным весом
- Люди с наследственной предрасположенностью к заболеваниям вен
Основные симптомы для обращения
- Появились отёки в ногах
- Тяжелеют ноги
- Появились судороги в ногах
- Болят ноги, болят щиколотки и ступни ног
- Появилась венозная сеточка на ногах или сосудистые звёздочки
- Изменился цвет кожных покровов на ногах
- Сильно стали видны вены на ногах
Флеболог в Первой Невской клинике проводит диагностику, малоинвазивное оперативное и консервативное лечение вен и артерий. Сюда входят также лимфатические сосуды.
У нас можно сделать дуплексное сканирование вен и артерий нижних конечностей. УЗИ-диагностика проводится на современном аппарате с высокой точностью показаний.
В любом случае врач-флеболог нашей клиники будет стремиться к тому, чтобы провести лечение максимально без хирургического вмешательства.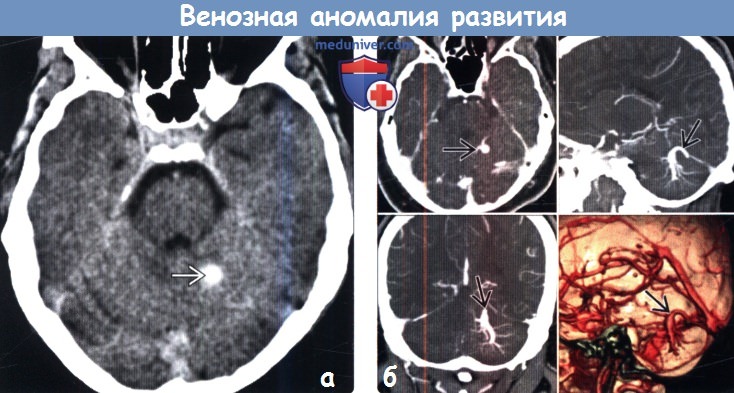 В ходе данного курса лечения может быть назначен компрессионный трикотаж, лекарственная терапия, постановка микрокапельниц. Первое, что необходимо сделать при симптомах заболеваний вен – это восстановить кровоснабжение, поэтому пациенту может быть назначена физиотерапия или лечебная физкультура.
В ходе данного курса лечения может быть назначен компрессионный трикотаж, лекарственная терапия, постановка микрокапельниц. Первое, что необходимо сделать при симптомах заболеваний вен – это восстановить кровоснабжение, поэтому пациенту может быть назначена физиотерапия или лечебная физкультура.
Дуплексное сканирование сосудов – это пожалуй самый эффективный метод диагностики флебологических заболеваний. Оно позволяет с высокой точностью определить стадию болезни и места, где находятся проблемные участки.
Для того, чтобы избежать риска развития заболеваний вен и артерий, советы достаточно типичны, однако от этого они не теряют своей силы и актуальности:
- Подвижный образ жизни! Особенно людям, которые большую часть дня вынуждены проводить сидя (водители, офисные работники)
- Избегайте чрезмерных нагрузок на ноги – особенно актуально профессиональным спортсменам, а также любителям — людям занимающимся в спортзалах.
- Ешьте больше овощей и пейте больше воды (до 2х литров ежедневно)
Если же вышеназванные проблемы с венами или артериями всё-таки возникли – не затягивайте с визитом к врачу и не занимайтесь самолечением, от этого заболевание может только усугубиться.
Записаться на приём к флебологу можно у наших администраторов.
Хроническая ишемия мозга (дисциркуляторная энцефалопатия): симптомы, диагностика, лечение хронической ишемии мозга (дисциркуляторная энцефалопатия)
Хроническая ишемия мозга (ХИМ)(дисциркуляторная энцефалопатия) – особая форма сосудистой патологии головного мозга, обусловленная медленно прогрессирующей недостаточностью кровоснабжения мозговой ткани, что сопровождается ухудшением ее функционирования.
Основными причинами, приводящими к развитию хронической ишемии головного мозга, являются артериальная гипертензия, атеросклеротическое поражение сосудов венозная недостаточность, диабетическая ангиопатия, васкулиты различной этиологии, заболевания крови. Однако, основным фактором риска ХИМ (ДЭ) и сосудистой деменции является артериальная гипертензия. Несмотря на то, что ХИМ (ДЭ) возникает при различных заболеваниях, в характере клинических проявлениях и в течение заболевания имеется много общего.
В зависимости от выраженности клинических нарушений выделяют 3 стадии заболевания. Каждая из стадий в свою очередь может быть компенсированной, субкомпенсированной и декомпенсированной. В I стадии – наблюдаются головные болей, ощущение тяжести в голове, головокружения, нарушения сна, снижением памяти и внимания, в неврологическом статусе выявляется рассеянная мелкоочаговая неврологическая симптоматика, недостаточная для диагностики очерченного неврологического синдрома. Во II стадии – наблюдаются аналогичные, но более интенсивные жалобы, прогрессивно ухудшается память, присоединяется шаткость при ходьбе, возникают затруднения в профессиональной деятельности; появляется отчетливая симптоматика органических, неврологических поражений головного мозга. III стадия характеризуется уменьшением количества предъявляемых жалоб, что связано с прогрессированием когнитивных нарушений (возможно развитие сосудистой деменции) и снижением критики к своему состоянию. В неврологическом статусе выявляются несколько неврологических синдромов, что свидетельствует о многоочаговом поражении головного мозга.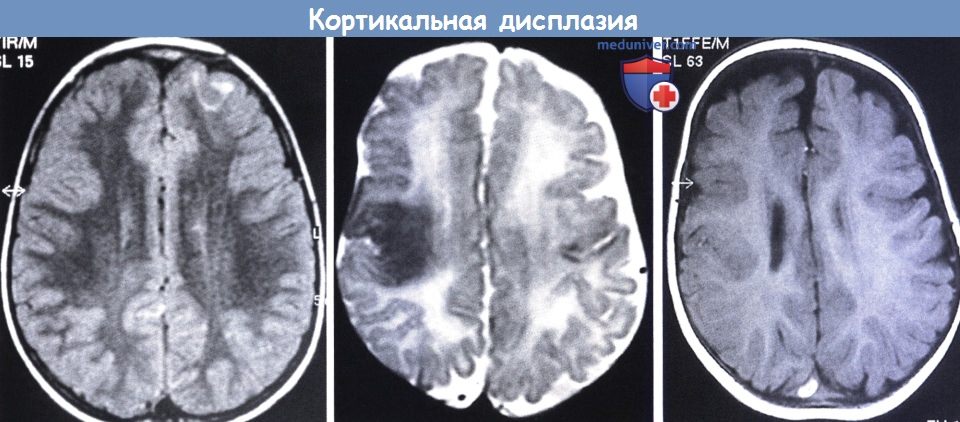
В неврологическом отделении ЦКБ РАН при диагностике ХИМ, особенно на ранних ее этапах, помимо стандартного неврологического и соматического обследования, большое внимание уделяется современным методам нейровизуализации и параклиническим исследованиям, которые позволяют подтвердить сосудистый характер заболевания и выявить связь имеющихся клинических нарушений с поражением сосудов. Среди инструментальных методов диагностики в используются: КТ или МРТ головного мозга, ультразвуковая допплерография экстра- и интракраниальных сосудов головы. Обязательным для таких пациентов является нейропсихологическое тестирование для определения степени выраженности когнитивных нарушений.
При лечении ХИМ в неврологическом отделении ЦКБ РАН большое внимание уделяется коррекции факторов риска (гипертонии, атеросклероза), своевременной и адекватной коррекции когнитивных нарушений, нейропсихологическому консультированию больных и их родственников.
Любые тревожные признаки являются поводом для записи на прием к неврологу – промедление в данном случае только приведет к усугублению ситуации. В Москве квалифицированную консультацию невролога можно получить в ЦКБ РАН. Записаться можно как в телефонном режиме, так и с помощью формы на сайте клинической больницы.
В Москве квалифицированную консультацию невролога можно получить в ЦКБ РАН. Записаться можно как в телефонном режиме, так и с помощью формы на сайте клинической больницы.
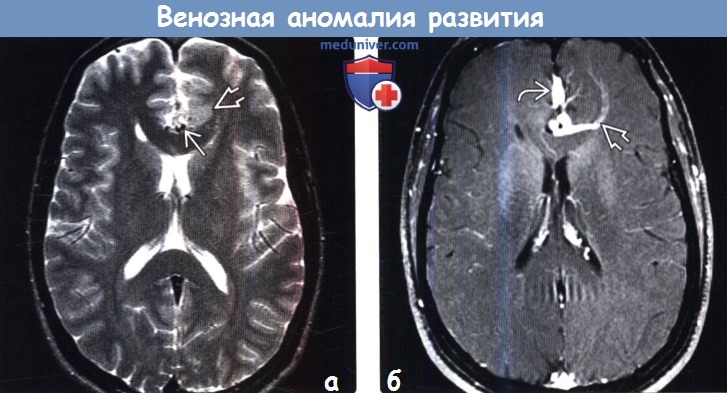
Венозная ангиома головного мозга — Неврология — LiveJournal
Венозные ангиомы (ВА) являются самыми частыми анатомическими (ВА составляют 60% всех церебро-васкулярных мальформаций, выявляемых при аутопсии) и наиболее редкими клиническими вариантами сосудистых мальформаций. Они возникают на поздних стадиях формирования сосудистой системы головного мозга — венозной (40 — 90-й день эмбриогенеза) и представляют собой скопление расширенных венозных сосудов, не имеющих питающих сосудов и капиллярной сети.Наиболее часто ВА локализуются в белом веществе больших полушарий и мозжечка, вблизи стенок желудочковой системы. В основном, они единичные, асимптоматические (в 50% случаев), и обнаруживаются случайно при КТ или МРТ. Множественные ВА встречаются в 2,5 — 9%. Формирующие ВА вены имеют вид лучей, отчего их сравнивают с головой медузы, зонтиком, колесом велосипеда. Микроскопически венозные ангиомы состоят из расширенных венозных каналов, стенки которых иногда утолщены и гиалинизированы. Описаны случаи смешанных сосудистых мальформаций, включающих, кроме ВА, кавернономы. Некоторые ВА не подходят под типичное описание. Часть из них, возможно, представляет артериовенозные мальформации (АВМ). Артериальный компонент присутствует у 5% атипичных форм в виде множественных мелких, слегка расширенных артерий, дренирующихся в медуллярные вены, где каждый сосуд работает как единичная миниатюрная артериовенозная фистула. В венозной фазе они образуют классическую голову медузы.
Микроскопически венозные ангиомы состоят из расширенных венозных каналов, стенки которых иногда утолщены и гиалинизированы. Описаны случаи смешанных сосудистых мальформаций, включающих, кроме ВА, кавернономы. Некоторые ВА не подходят под типичное описание. Часть из них, возможно, представляет артериовенозные мальформации (АВМ). Артериальный компонент присутствует у 5% атипичных форм в виде множественных мелких, слегка расширенных артерий, дренирующихся в медуллярные вены, где каждый сосуд работает как единичная миниатюрная артериовенозная фистула. В венозной фазе они образуют классическую голову медузы.
ВА очень редко проявляются клинически в виде головной боли, головокружения, эпиприпадков, нарушения речи, парезов и нарушения чувствительности. Также описаны случаи гемифациальных спазмов, компрессии водопровода мозга. Инсульт при ВА возможен, но происходит редко. Риск кровоизлияния при ВА очень низок: по данным McLaughlin et al. (1998), он составляет 0,34% случаев в год, по данным Garner et al.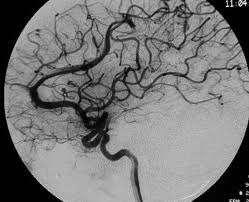 (1991) — 0,22%. В литературе описаны случаи спонтанного тромбоза ВА.
(1991) — 0,22%. В литературе описаны случаи спонтанного тромбоза ВА.
Методом выбора при диагностике ВА является ангиография. ВА контрастируются в конце капиллярной фазы, и контрастное вещество держится в них до поздней венозной фазы вследствие медленного кровотока. Ангиограмма, полученная в артериальную фазу, нормальная. Часто в месте вхождения в дуральный синус выявляется локальный стеноз. Дренирующая вена впадает в поверхностную вену, дуральный синус или субэпендимальную вену. На бесконтрастных КТ ВА обычно не выявляются (для уточнения характера изменений проведят КТ-ангиографию на мультиспиральном КТ). МРТ без контрастного усиления также не дает однозначно интерпретируемой картины. На таких изображениях ВА могут визуализироваться в виде линейных участков с низким МР-сигналом на Т1 взвешенных изображениях, низким или высоким МР сигналом на Т2 взвешенных изображениях. МРТ с контрастным усилением является более чувствительным методом в диагностике ВА. На постконтрастных МРТ четко выявляются мелкие вены, сходящиеся в радиальном направлении и образующие типичную «кисточку».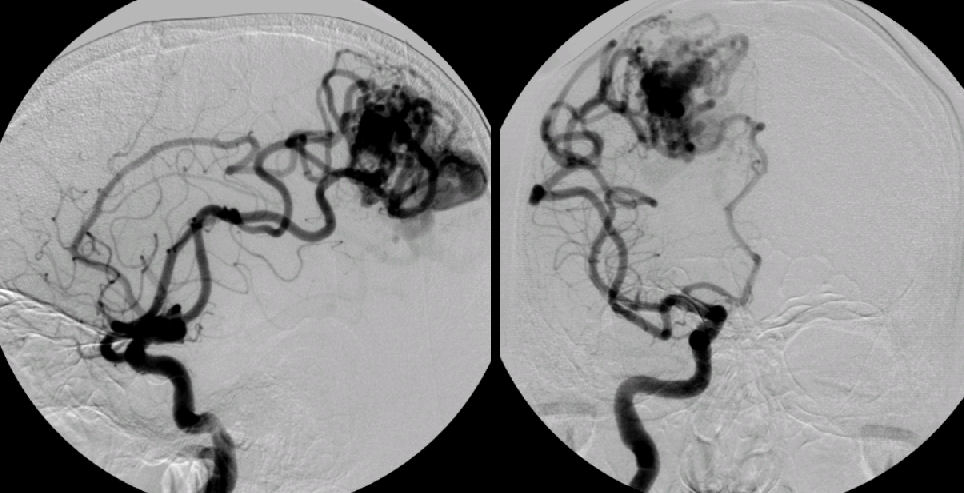
ВА осуществляют дренирование крови из окружающей ткани головного мозга, в связи с чем хирургическое лечение сопряжено с высоким риском развития венозного инфаркта, поэтому [хирургическое лечение] практически не производится.
использованы материалы статьи «Венозная ангиома моста (Случай из практики)» О.В. Божко, Ю.В. Буковская, А.А. Баев, В.Н. Халатов (Поликлиника ОАО «Газпром»), Н.М. Никифорук (ЦКБ гражданской авиации»; журнал «Радиология — практика» № 4, 2008
Венозных мальформаций — Диагностика и лечение | Гора Синай
Венозные мальформации (ВМ) — это тип сосудистой мальформации, которая возникает в результате аномального развития вен, которые со временем растягиваются или увеличиваются в размерах. ВМ могут быть чрезвычайно болезненными и чувствительными.
ВМ обычно выглядит как голубоватое пятно. Это может быть единичное поражение или одно из многих. Он может быть ограничен одной конкретной областью или распространен; и он может быть поверхностным или глубоким. Стенки вены с ВМ лишены гладкомышечных клеток нормальной вены.ВМ становятся больше, если вы плачете, толкаетесь или иным образом увеличиваете давление на венозную систему. Если ВМ является поверхностным, он станет синего цвета и может появиться в различных областях вашего тела (так называемых мультифокальных), особенно вокруг рта, губ, языка, щеки, стороны лица, кожи головы и шеи. Поверхностные виртуальные машины могут иметь размер от крошечных точек до больших искажений.
Стенки вены с ВМ лишены гладкомышечных клеток нормальной вены.ВМ становятся больше, если вы плачете, толкаетесь или иным образом увеличиваете давление на венозную систему. Если ВМ является поверхностным, он станет синего цвета и может появиться в различных областях вашего тела (так называемых мультифокальных), особенно вокруг рта, губ, языка, щеки, стороны лица, кожи головы и шеи. Поверхностные виртуальные машины могут иметь размер от крошечных точек до больших искажений.
ВМ мягкие. Обычно они вдавливаются, если вы нажимаете на них, и становятся меньше, когда вы поднимаете пораженный участок, например, поднимаете руку над головой.Кровь в ВМ циркулирует очень медленно, вызывая образование и кальцификацию тромбов, что приводит к образованию «флеболитов» или венозных камней. Когда виртуальные машины наполняются кровью, а кровь остается в аномальных венах, это вызывает отек. Отек усиливается, когда пораженный участок находится ниже, чем остальная часть тела (зависимость) или когда повышается давление в венах (например, когда вы задерживаете дыхание).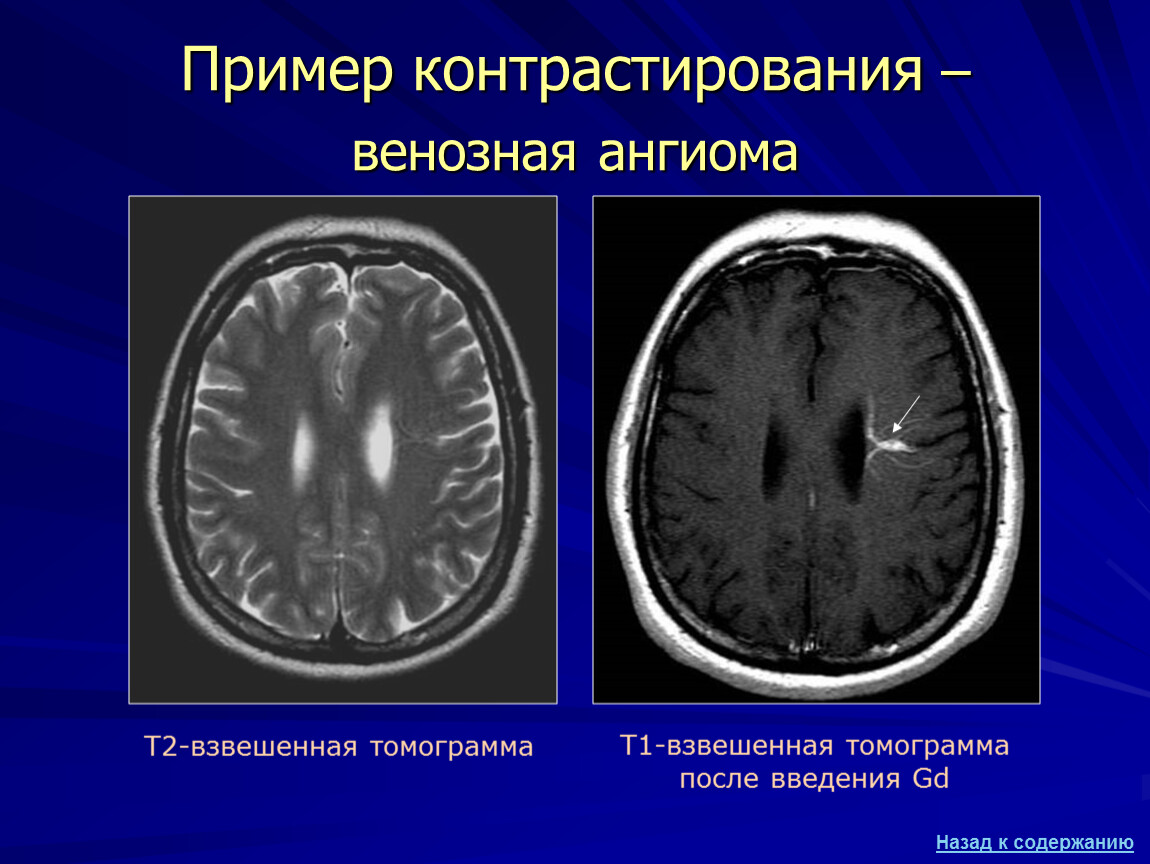 Они могут увеличиваться в размерах из-за возраста, травмы, полового созревания или беременности, а также могут образовывать тромбы, которые могут затруднить попадание крови в область вокруг ВМ.ВМ редко вызывают нагрузку на сердце.
Они могут увеличиваться в размерах из-за возраста, травмы, полового созревания или беременности, а также могут образовывать тромбы, которые могут затруднить попадание крови в область вокруг ВМ.ВМ редко вызывают нагрузку на сердце.
Симптомы различаются в зависимости от расположения виртуальной машины. Те, которые связаны с языком или другими структурами вокруг дыхательных путей, могут вызвать проблемы с дыханием или речью, а те, которые находятся в руках и ногах, обычно приводят к болезненному отеку. В редких случаях сгустки крови, образующиеся в ВМ, могут перемещаться в легкие, вызывая тромбоэмболию легочной артерии . Чрезвычайно большие ВМ могут потреблять белки свертывания крови, что делает организм неспособным образовывать сгустки крови (так называемая локализованная внутрисосудистая коагуляция).
Несколько заболеваний и состояний включают различные типы ВМ.
- Гломовенозные мальформации содержат нервные клетки и приводят к тому, что пороки становятся твердыми и напряженными.
 Эти типы пороков развития могут передаваться по наследству и часто возникают в нескольких местах.
Эти типы пороков развития могут передаваться по наследству и часто возникают в нескольких местах. - Синдром невуса с синими резиновыми пузырями включает многочисленные эластичные образования, которые могут появляться как снаружи, так и внутри.
- Поражения желудка или желудочно-кишечного тракта могут вызвать сильную боль в животе и кровотечение; мы удаляем их хирургическим путем.
- Синдром Маффуччи может приводить к ВМ и костным разрастаниям, называемым энхондромами. Это может привести к серьезным деформациям, которые с возрастом могут ухудшиться и стать злокачественными.
Диагностика
Мы можем диагностировать ВМ в коже и поверхностных тканях путем физического обследования. Магнитно-резонансная томография (МРТ) — лучший метод визуализации для диагностики ВМ и определения степени заболевания. Ультрасонография также полезна, когда ВМ находится близко к поверхности.
Несмотря на то, что мы не понимаем точную причину ВМ, тестирование предполагает наличие нескольких генетических мутаций.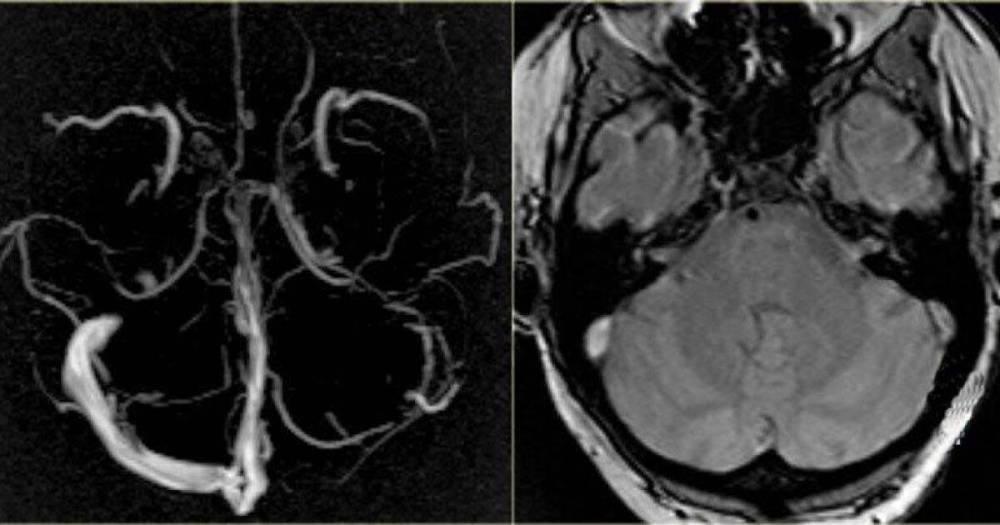
Варианты лечения
ВМ, не вызывающая симптомов, не требует лечения. Базовое лечение заключается в использовании эластичных компрессионных чулок или рукавов (для ВМ ноги или руки), чтобы предотвратить отек, и аспирина в низких дозах, чтобы свести к минимуму образование болезненных сгустков крови.
Если этих мер недостаточно, мы закрываем или удаляем увеличенные венозные пространства, используя один из нескольких методов:
- Склеротерапия проводится в ангиографическом кабинете (операционная со специализированным рентгеновским и ультразвуковым оборудованием), обычно под общим наркозом.Мы вводим иглу в ВМ, вводим контрастное вещество, чтобы очертить ВМ на рентгеновском снимке, а затем вводим склерозант в аномальные вены. Склерозант заставляет вены постепенно сокращаться; обычно нам необходимо выполнить эту процедуру несколько раз, чтобы добиться полной и постоянной усадки.
- Эндовенозная лазерная терапия похожа на склеротерапию, но включает введение световода диодного лазера через иглу или катетер.
 Это полезно для лечения крупных венозных каналов или пространств и часто сочетается со склеротерапией.Комбинация эндовенозной лазерной терапии и инъекции склерозанта, по-видимому, дает более быстрый ответ и более легкое выздоровление.
Это полезно для лечения крупных венозных каналов или пространств и часто сочетается со склеротерапией.Комбинация эндовенозной лазерной терапии и инъекции склерозанта, по-видимому, дает более быстрый ответ и более легкое выздоровление. - Венозная эмболизация включает размещение постоянных устройств, таких как спирали или клей для эмболизации, через катетер в ВМ, чтобы изолировать место, где ВМ соединяется с циркулирующими венами. Мы часто выполняем эту технику в сочетании со склеротерапией или хирургией.
- Хирургическое иссечение включает удаление аномальных вен и тканей вокруг них.Мы используем этот подход чаще всего с ВМ лица, чтобы восстановить более нормальный контур лица. Обычно мы проводим операцию после склеротерапии, которая помогает уменьшить кровотечение и облегчает удаление ВМ.
Мы полагаем, что причиной VMS является генетическая аномалия пораженной ткани. Следовательно, ВМ неизлечимы, за исключением небольших поражений; как бы мы ни относились к ним, они обычно повторяются.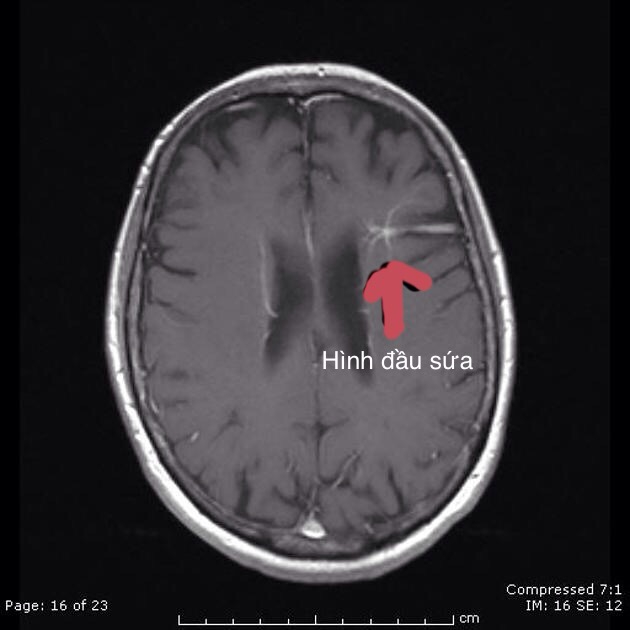 Обширные ВМ часто требуют серии процедур абляции, а через несколько лет — дополнительного лечения.Однако важно помнить, что лечение помогает контролировать рост и симптомы в долгосрочной перспективе.
Обширные ВМ часто требуют серии процедур абляции, а через несколько лет — дополнительного лечения.Однако важно помнить, что лечение помогает контролировать рост и симптомы в долгосрочной перспективе.
венозных аномалий развития | Johns Hopkins Medicine
Что такое аномалии развития вен?
Венозная аномалия развития (DVA) — это необычное или неправильное расположение мелких вен, которые могут выглядеть как спицы колеса. Вены впадают в более крупную центральную вену. DVA доброкачественные (не злокачественные).
DVA также можно назвать венозными ангиомами или доброкачественными вариациями венозного оттока.Некоторые врачи называют их caput medusae , латинский термин, обозначающий голову Медузы , потому что скопление вен напоминает змею на голове греческого мифологического персонажа по имени Медуза.
Эти необычные образования вен могут возникать в любом месте тела, но чаще всего встречаются в головном или спинном мозге. По некоторым оценкам, 1 из 50 человек имеет хотя бы одно DVA.
По некоторым оценкам, 1 из 50 человек имеет хотя бы одно DVA.
Что вызывает аномалии развития вен?
Венозные аномалии развития (DVA) — это врожденные пороки развития кровеносных сосудов — это означает, что человек рождается с ними.
Каковы симптомы венозных аномалий развития?
Венозные аномалии развития (DVA) обычно не вызывают симптомов. Многие люди не знают, что они у них есть.
Как диагностируются венозные аномалии развития?
Венозные аномалии развития (DVA) не имеют симптомов и могут быть обнаружены только при проведении визуализационных тестов для поиска причины других проблем со здоровьем. Визуализирующие тесты могут включать МРТ или МРА, обычную ангиограмму или определенные типы компьютерной томографии, которые показывают области кровотока.
Большинство людей могут никогда не узнать, что у них есть DVA, и его можно будет обнаружить только после их смерти, если будет проведено вскрытие.
Как лечат венозные аномалии развития?
Обычно венозные аномалии развития (DVA) не требуют лечения. Эти вены выполняют необходимую работу по попаданию крови в мозг и из него, поэтому их не нужно удалять или закрывать хирургическим путем. Поскольку они нормальны и не опасны, долгосрочная визуализация обычно не требуется.
Эти вены выполняют необходимую работу по попаданию крови в мозг и из него, поэтому их не нужно удалять или закрывать хирургическим путем. Поскольку они нормальны и не опасны, долгосрочная визуализация обычно не требуется.
Ключевые моменты о DVA
- Венозная аномалия развития (DVA) — это неправильное расположение мелких вен, которые могут выглядеть как спицы колеса, которые впадают в более крупную центральную вену.
- DVA врожденные — с ними рождается человек.
- DVA не опасны, и большинство людей не знают, есть ли они у них.
- DVA можно найти только при выполнении визуализационных тестов для поиска причины других проблем со здоровьем.
- DVA не требует лечения.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от визита к врачу:
- Знайте причину вашего визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Возьмите с собой кого-нибудь, кто поможет вам задать вопросы и запомнить, что вам говорит поставщик.
- Во время посещения запишите название нового диагноза и любые новые лекарства, методы лечения или тесты.Также запишите все новые инструкции, которые дает вам ваш провайдер.
- Узнайте, почему прописано новое лекарство или лечение и как они вам помогут. Также знайте, какие бывают побочные эффекты.
- Спросите, можно ли вылечить ваше состояние другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если вы не примете лекарство, не пройдете тест или процедуру.
- Если вам назначена повторная встреча, запишите дату, время и цель этого визита.
- Узнайте, как можно связаться с вашим поставщиком медицинских услуг, если у вас возникнут вопросы.
Артериовенозные мальформации
Что такое артериовенозная мальформация головного мозга (АВМ)?
Артериовенозная мальформация головного мозга (АВМ) — это аномалия кровеносных сосудов головного мозга, которая выглядит как клубок кровеносных сосудов. Обычно артерии (кровеносные сосуды, несущие кровь в мозг) выходят через вены после прохождения через более мелкие кровеносные сосуды, называемые капиллярами, а затем в вены.В АВМ этой нормальной связи нет, и обычно существует прямая связь между артериями и венами. Это означает, что высокое давление в артериях передается в вены, которые обычно не используются для этого более высокого давления
Обычно артерии (кровеносные сосуды, несущие кровь в мозг) выходят через вены после прохождения через более мелкие кровеносные сосуды, называемые капиллярами, а затем в вены.В АВМ этой нормальной связи нет, и обычно существует прямая связь между артериями и венами. Это означает, что высокое давление в артериях передается в вены, которые обычно не используются для этого более высокого давления
Насколько распространены АВМ мозга и почему они случаются?
В целом АВМ головного мозга встречаются редко, и только у 1 из 200 человек в общей популяции есть АВМ. Причина возникновения АВМ головного мозга неизвестна. Считается, что большинство АВМ головного мозга присутствует с рождения, хотя некоторые могут образоваться во взрослой жизни.
Как проявляются АВМ мозга?
Большинство АВМ не вызывают симптомов и выявляются при обычном сканировании, которое часто проводится по другим причинам.
При симптомах АВМ:
- Около половины пациентов имеют кровоизлияние в мозг
- Около четверти пациентов поступают с судорогами или эпилепсией
- Около 15% могут иметь проблемы со слабостью или нарушениями речи
Каков риск кровотечения из головного мозга АВМ
Риск кровотечения из АВМ зависит от того, было ли кровотечение из АВМ ранее или нет. В целом риск кровотечения из АВМ составляет около 1-2% в год. Если кровотечение уже было в прошлом, то риск повторного кровотечения выше (6-20%) в первые два года, но затем этот риск постепенно снижается до исходного уровня около 4% в год. Трудно предсказать, из каких ПТрП и когда произойдет кровотечение.
В целом риск кровотечения из АВМ составляет около 1-2% в год. Если кровотечение уже было в прошлом, то риск повторного кровотечения выше (6-20%) в первые два года, но затем этот риск постепенно снижается до исходного уровня около 4% в год. Трудно предсказать, из каких ПТрП и когда произойдет кровотечение.
Как диагностируются АВМ головного мозга?
Большинство АВМ головного мозга можно идентифицировать с помощью компьютерной томографии или магнитно-резонансной томографии. Для подтверждения диагноза АВМ почти всегда требуется КТ или МР-ангиограмма.Большинству пациентов также обычно делают церебральную ангиограмму, которая помогает лучше понять детали аномалии кровеносных сосудов. Это почти наверняка требуется, если есть планы лечения АВМ.
Как лечится АВМ?
В целом, АВМ может рассматриваться для лечения, если она кровоточила, если она находится в области мозга, которую легко лечить, и если она не слишком велика. Данные недавних клинических испытаний показывают, что лучше не лечить АВМ головного мозга, если они не разорваны, но эти решения принимаются индивидуально для каждого пациента.
Все клинические сценарии и визуализация обычно обсуждаются с группой врачей, которые имеют опыт лечения АВМ головного мозга (обсуждение в мультидисциплинарной группе (MDT)).
Ниже описаны различные методы лечения АВМ головного мозга.
- Консервативный менеджмент. Если АВМ была обнаружена случайно при сканировании головного мозга и не было никаких симптомов, связанных с ней, может быть рекомендовано консервативное лечение.
- Хирургия.Если АВМ кровоточила и / или находится в области, которую можно легко прооперировать, может быть рекомендовано хирургическое удаление. Пациента усыпляют под наркозом, удаляют часть черепа и хирургическим путем удаляют АВМ. Когда АВМ полностью удалена, возможность дальнейшего кровотечения должна быть исключена. ~
- Стереотаксическая радиохирургия. АВМ также можно лечить с помощью целенаправленной лучевой терапии. Часто это означает поездку в национальный центр радиохирургии в Шеффилде для встречи со специалистами, которые проводят это лечение.
 В этой процедуре делается церебральная ангиограмма для локализации АВМ. Затем сфокусированные источники высокой энергии концентрируются на АВМ головного мозга, чтобы вызвать прямое повреждение сосудов, которое вызовет рубцевание и позволит АВМ «свернуться». Эффект от этого лечения проявляется не сразу. Обычно на то, чтобы убедиться, что АВМ вылечили, требуется около 3 лет.
В этой процедуре делается церебральная ангиограмма для локализации АВМ. Затем сфокусированные источники высокой энергии концентрируются на АВМ головного мозга, чтобы вызвать прямое повреждение сосудов, которое вызовет рубцевание и позволит АВМ «свернуться». Эффект от этого лечения проявляется не сразу. Обычно на то, чтобы убедиться, что АВМ вылечили, требуется около 3 лет. - Интервенционная нейрорадиология / эндоваскулярная нейрохирургия. Иногда можно лечить часть или всю АВМ, помещая клей в АВМ с помощью катетеров, которые были введены в кровеносные сосуды, снабжающие АВМ.Этого подхода может быть достаточно для лечения АВМ самостоятельно, но иногда эта процедура используется, чтобы сделать операцию более безопасной.
Существуют ли разные типы АВМ головного мозга?
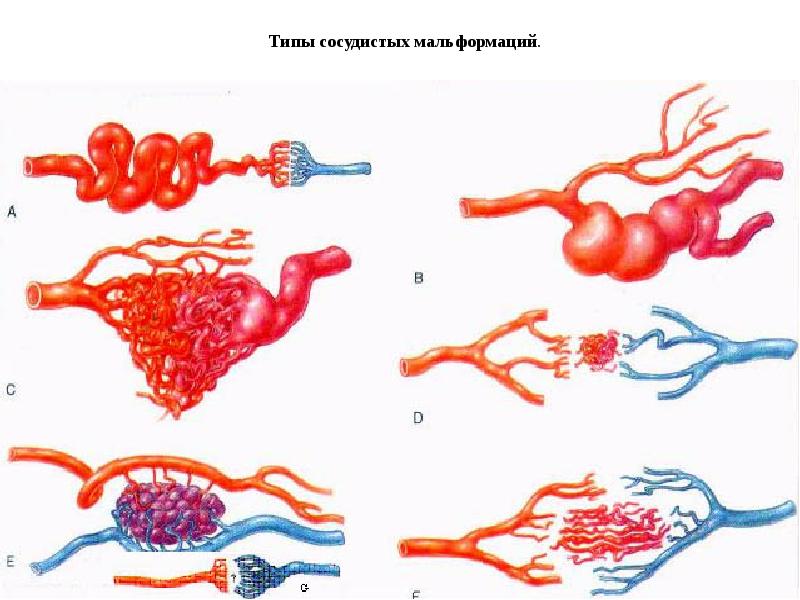
Все пороки развития кровеносных сосудов, затрагивающие головной мозг и окружающие его структуры, обычно называют АВМ. Однако мы различаем несколько типов:
- Истинная артериовенозная мальформация (АВМ).
 Это наиболее распространенная сосудистая мальформация головного мозга. Он состоит из путаницы аномальных сосудов, соединяющих артерии и вены, без нормальной ткани мозга.
Это наиболее распространенная сосудистая мальформация головного мозга. Он состоит из путаницы аномальных сосудов, соединяющих артерии и вены, без нормальной ткани мозга. - Скрытая или скрытая АВМ или кавернозные пороки развития. Это сосудистая аномалия головного мозга, которая не отводит большое количество крови. Он может кровоточить и часто вызывать судороги.
- Венозная мальформация. Это аномалия только вен. Вены либо увеличены, либо появляются в аномальных местах головного мозга.
- Гемангиома. Это аномальные структуры кровеносных сосудов, обычно обнаруживаемые на поверхности мозга, а также на коже или структурах лица.Они представляют собой большие и ненормальные карманы крови в пределах нормальных тканевых плоскостей тела.
- Дуральный свищ. Покрытие головного мозга называется твердой мозговой оболочкой. Аномальное соединение между кровеносными сосудами, которое затрагивает только это покрытие, называется дуральной фистулой.
 Дуральные свищи могут возникать в любой части головного мозга. Дуральные свищи:
Дуральные свищи могут возникать в любой части головного мозга. Дуральные свищи:
Свищ дуральной каротидной кавернозной пазухи. Они возникают за глазом и обычно вызывают симптомы, потому что отводят слишком много крови к глазу.У пациентов наблюдается отек глаз, снижение зрения, покраснение и заложенность глаз. Часто слышен свистящий шум.
Поперечный дуральный свищ / сигмовидный синус. Это происходит за ухом. Пациенты обычно жалуются на непрерывный шум (шум), возникающий при каждом ударе сердца, локальную боль за ухом, головные боли и боли в шее.
Сагиттальный синус и дуральная фистула волосистой части головы. Это происходит ближе к макушке головы. Пациенты жалуются на шум (шум), головные боли и боли в области макушки.У них могут быть выступающие кровеносные сосуды на коже черепа и над ухом.
Сосудистые мальформации головного и спинного мозга у детей — PM&R KnowledgeNow
Автор (ы): Кэтрин Шустер, MD, Майкл Штольц, BS, Дэвид Минс, BS, Рошель Т. Дай, MD
Дай, MD
Первоначально опубликовано: 14 сентября 2015 г. Последнее обновление: 8 октября 2019 г.
1.ЗАБОЛЕВАНИЕ / НАРУШЕНИЕ
Определение
Артерио-венозные мальформации (АВМ) — это врожденные сосудистые поражения, характеризующиеся аномальным соединением между артериями и венами, в которых отсутствует промежуточное капиллярное русло, что приводит к прямому артериовенозному шунтированию. Это наиболее распространенный из четырех типов сосудистых мальформаций центральной нервной системы, которые также включают венозные аномалии развития (DVA), кавернозные мальформации (CM) и капиллярные телеангиэктазии. 1,2,3
Этиология
В целом этиология АВМ сложна и недостаточно изучена. Первоначально считалось, что АВМ возникают из-за нарушения дифференцировки сосудистых каналов в зрелые артерии, капилляры и вены примерно на третьей неделе эмбриогенеза. Более новые исследования показали, что АВМ могут возникать послеродовой период. 4 Большинство теорий предполагают либо сохранение примитивного артериовенозного соединения, либо его развитие после первоначального закрытия примитивного соединения. 1,2 Считается, что он имеет многофакторные причины с факторами, включая генетические манипуляции и ангиогенную стимуляцию. 5
Первоначально считалось, что АВМ возникают из-за нарушения дифференцировки сосудистых каналов в зрелые артерии, капилляры и вены примерно на третьей неделе эмбриогенеза. Более новые исследования показали, что АВМ могут возникать послеродовой период. 4 Большинство теорий предполагают либо сохранение примитивного артериовенозного соединения, либо его развитие после первоначального закрытия примитивного соединения. 1,2 Считается, что он имеет многофакторные причины с факторами, включая генетические манипуляции и ангиогенную стимуляцию. 5
Эпидемиология
Общую частоту АВМ трудно оценить, поскольку они не часто обнаруживаются, если не возникают осложнения. Было заявлено, что в настоящее время заболеваемость составляет 1–1,5 на 100 000 человеко-лет. В настоящее время распространенность АВМ в общей популяции неизвестна. Предполагаемая распространенность может достигать 0,2%, но обнаруживается только 0,02% при подтвержденном диагнозе. 6 Несмотря на то, что общая распространенность невысока, АВМ головного мозга являются основной причиной внутричерепных кровоизлияний у детей (за исключением кровотечений у недоношенных и в раннем детстве), составляя около 30-50% детских геморрагических инсультов. 1,2,7 АВМ спинного мозга составляют от 20% до 30% всех сосудистых мальформаций спинного мозга и являются наиболее частой причиной нетравматического внутриспинального кровотечения или гематомиелии. 8
1,2,7 АВМ спинного мозга составляют от 20% до 30% всех сосудистых мальформаций спинного мозга и являются наиболее частой причиной нетравматического внутриспинального кровотечения или гематомиелии. 8
Как правило, они возникают спорадически с редкой семейной заболеваемостью и немногими сообщениями о ее связи с другими аномалиями, такими как болезнь Ослера-Вебера-Ренду и синдром Стерджа-Вебера. 2,3 Однако АВМ головного мозга могут быть обычным явлением у лиц с наследственной геморрагической телеангиэктазией.Это аутосомно-доминантное заболевание является наиболее частой генетической причиной АВМ головного мозга и несет 10-25% пожизненного риска развития АВМ головного мозга. 9
Патологоанатомия и физиология
Имеется структурный дефект в формировании артериолярной капиллярной сети, которая обычно присутствует между артериями и венами. Из-за отсутствия капиллярного сообщения шунтирование повышает внутрипросветное венозное давление и вызывает эктазию и мускуляризацию, которые образуют гибридные сосуды и сосудистую сеть, называемую очагом (очаговый тип) или, главным образом, прямым соединением между артерией и веной (свищевой тип) .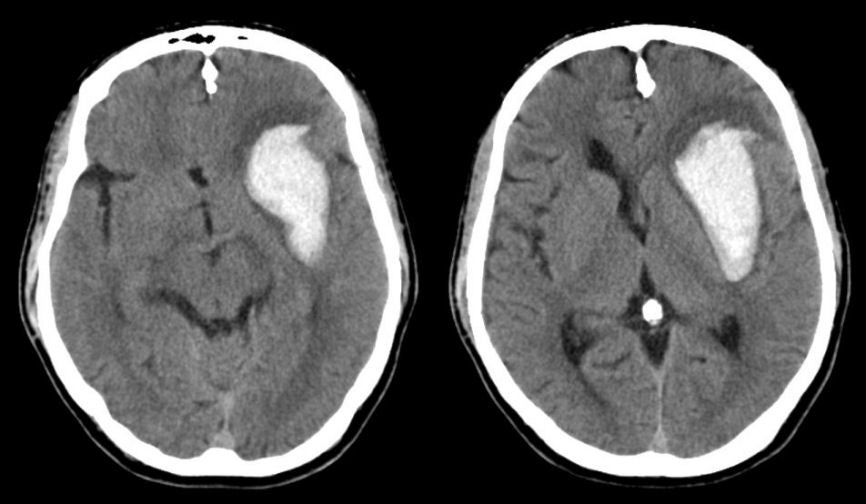 Со временем очаг поражения увеличивается из-за перепада давления. До сих пор неясно, почему АВМ становится геморрагической у детей. Предполагается, что эти поражения нестатичны по своей природе и во время роста может происходить быстрое расширение, возможно, связанное с ангиогенными / сосудистыми факторами роста. 2,7
Со временем очаг поражения увеличивается из-за перепада давления. До сих пор неясно, почему АВМ становится геморрагической у детей. Предполагается, что эти поражения нестатичны по своей природе и во время роста может происходить быстрое расширение, возможно, связанное с ангиогенными / сосудистыми факторами роста. 2,7
У детей чаще встречается АВМ в задней черепной ямке, базальных ганглиях и таламусе, которые более склонны к кровотечению и могут привести к катастрофическим последствиям. 2 В спинном мозге АВМ очагового типа ассоциируется с повышенным риском кровотечения, а свищевой тип обычно проявляется как прогрессирующая миелопатия из-за своего массового эффекта. 8
Развитие болезни
Естественная история АВМ в педиатрической популяции изучена недостаточно. Это наиболее частая причина спонтанного внутричерепного кровоизлияния у детей, причем 80-85% педиатрических пациентов страдают геморрагическим событием в качестве начального симптома. Общее проявление симптомов зависит от расположения и степени поражения головного или спинного мозга, вызванного кровотечением или ишемией в результате сдавления венозным застоем. Факторы риска кровотечения из АВМ включают: предшествующее кровотечение в анамнезе (в течение 5 лет), глубокое или инфратенториальное, наличие исключительно глубокого венозного дренажа, женский пол, очагового типа, с ассоциированной аневризмой и диффузной морфологией. 1,2,10
Общее проявление симптомов зависит от расположения и степени поражения головного или спинного мозга, вызванного кровотечением или ишемией в результате сдавления венозным застоем. Факторы риска кровотечения из АВМ включают: предшествующее кровотечение в анамнезе (в течение 5 лет), глубокое или инфратенториальное, наличие исключительно глубокого венозного дренажа, женский пол, очагового типа, с ассоциированной аневризмой и диффузной морфологией. 1,2,10
Вторичные состояния и осложнения
Церебральные АВМ могут проявляться внутричерепным кровоизлиянием, судорогами, головной болью и очаговыми неврологическими нарушениями, которые могут привести к длительной инвалидности.Неврологические симптомы зависят от локализации в головном или спинном мозге и проявляются как инсульт или прогрессирующая миелопатия. 2,11
Острые геморрагические события у детей связаны с уровнем морали до 25%. 2 Геморрагическое предлежание является важным независимым предиктором будущего кровотечения. Годовой риск повторного кровотечения у детей составляет 2–4%, но может достигать 65%, если прогнозируется на протяжении всей жизни ребенка. 2 В спинном мозге поражения со стойкими перимедуллярными венами, а также те, которые расположены на шейном и верхнем грудном уровнях, по-видимому, имеют более высокий риск повторного кровотечения. 12
Годовой риск повторного кровотечения у детей составляет 2–4%, но может достигать 65%, если прогнозируется на протяжении всей жизни ребенка. 2 В спинном мозге поражения со стойкими перимедуллярными венами, а также те, которые расположены на шейном и верхнем грудном уровнях, по-видимому, имеют более высокий риск повторного кровотечения. 12
2. ОСНОВНЫЕ ПРИНЦИПЫ ОЦЕНКИ
История
Важен подробный анамнез с компонентами, аналогичными другим приобретенным травмам головного или спинного мозга, включая время появления симптомов и начало головной боли, судорог, слабости, нарушений зрения или глотания, прогрессирующей слабости конечностей, а также симптомов со стороны мочевого пузыря и кишечника. Характеристики головной боли и боли в спине могут быть неспецифическими, хотя некоторые могут сообщать о постоянстве в определенной области.
Физическое
Требуется полное медицинское обследование с акцентом на неврологическое обследование, как при инсульте или миелопатии, с обращением внимания на асимметрию и признаки / симптомы внутричерепного давления или поражения спинного мозга.Неврологические данные могут включать слабость / паралич конечностей, атаксию, сенсорные, зрительные и черепно-мозговые аномалии, психический статус и когнитивные нарушения, а также дисфункцию мочевого пузыря и кишечника. Наличие сосудистых поражений кожи может быть связано с некоторыми наследственными / генетическими аномалиями, такими как болезнь Ослера-Вебера-Ренду и синдром Стерджа-Вебера, что может потребовать дальнейшего диагностического обследования и генетического тестирования. 3
Клиническая функциональная оценка
В зависимости от области поражения и проявления симптомов можно использовать инструменты клинической функциональной оценки, такие как шкала комы Глазго, шкала инсульта Peds NIHHS, шкала ASIA для повреждения спинного мозга и мера функциональной независимости для детей.Также может потребоваться когнитивная и нейропсихологическая оценка.
Лабораторные исследования
Специальных лабораторных исследований АВМ не проводилось; однако, основываясь на его представлении и вторичных медицинских осложнениях, можно контролировать клинический анализ крови, метаболическую панель, почечную панель и исследования коагуляции.
Изображения
Окончательный диагноз и характеристика АВМ выполняется с помощью цифровой субтракционной ангиографии (ДСА), хотя компьютерная томография (КТ) часто является первоначальной визуализацией, чтобы показать наличие кровоизлияния или любой кальцификации. 9 КТ-ангиография может дополнительно детализировать сосудистую природу кровоизлияния и предоставить оценку размера, местоположения и дренажа АВМ. Магнитно-резонансная томография (МРТ) с контрастом и без него, с магнитно-резонансной ангиографией (МРА) мозга и / или позвоночника помогает исключить другие геморрагические поражения, такие как опухоли и кавернозные мальформации, и может лучше очертить анатомию сосудов поражения. (Рисунок 1). Все эти визуализационные исследования могут использоваться в комбинации для составления более четкой картины АВМ.DSA остается золотым стандартом, поскольку обеспечивает максимальную чувствительность и детализацию среди всех типов изображений. 9
Инструменты дополнительной оценки
Визуализирующие исследования других областей тела, таких как легкие, печень, селезенка и желудочно-кишечный тракт, могут быть выполнены для исключения других возможных связанных состояний. Кардиологическое обследование может потребоваться в случаях подозрения на сердечно-сосудистую недостаточность из-за феномена шунтирования при определенных типах сосудистых мальформаций, которые чаще наблюдаются при аномалиях развития вен, но реже при АВМ. 3
Раннее предсказание исхода
АВМ часто диагностируются как случайная находка, а не как катастрофическое проявление из-за разрыва / кровотечения, что затрудняет прогнозирование результатов. При возникновении неврологического дефицита основное внимание уделяется предотвращению ухудшения симптомов с помощью вторичных мер. После разрыва или кровотечения повышается риск рецидива, особенно в первый год. АВМ спинного мозга узлового типа имели более низкую частоту полной облитерации, что могло вызвать отсроченное повторное кровотечение и клиническое прогрессирование от кровотечения до миелопатии и долгосрочное ухудшение состояния. 11 Необходимо тщательное наблюдение за этими поражениями. Случайно обнаруженные АВМ имеют несколько факторов, которые можно использовать для оценки риска геморрагического проявления. АВМ с ассоциированной аневризмой, одной дренирующей веной, одним питателем, глубоким венозным дренажом, инфратенториальным расположением, глубоким расположением и диффузной морфологией, а также высокой степенью Spetzler-Martin (SM) имеют более высокий риск кровотечения. 9,13
Окружающая среда
В зависимости от неврологических последствий и вызванной им инвалидности может потребоваться постоянная физическая, профессиональная и логопедическая терапия.Модификации дома и окружающей среды, а также адаптивное оборудование и средства передвижения / походки могут потребоваться, чтобы приспособиться к возникающим стойким функциональным нарушениям.
Социальные
Острое неврологическое осложнение с последующим функциональным нарушением в результате приобретенного повреждения головного или спинного мозга требует хорошей семьи и социальной поддержки. По мере того, как ребенок возвращается в дом, школу и сообщество, могут потребоваться надлежащие приспособления и помощь для мобильности и повседневной деятельности.
Профессиональный
Диагноз часто задерживается из-за низкой общей заболеваемости, поэтому для своевременного диагноза необходимо повышенное клиническое подозрение. На начальном этапе, когда контролируются и устраняются возникающие симптомы, может произойти задержка в окончательном лечении АВМ, что может стать стрессовым временем для пациента и его семьи, и многие хотели бы знать о риске рецидива возникающих симптомов. симптомы.
3. РЕАБИЛИТАЦИЯ И ЛЕЧЕНИЕ
Текущие рекомендации по лечению
Лечение зависит от характера и местоположения поражения, а также от результатов обследования, взвешивающих риски и преимущества каждого варианта терапии.Терапия может быть одно- или многомодальной с конечной целью ликвидации поражения. Варианты лечения включают эндоваскулярную эмболизацию посредством катетерной доставки жидких эмболий или спиралей, микрохирургическое иссечение и радиохирургию (например, гамма-нож). Сама по себе эмболизация редко представляет собой лечебное лечение. Однако уменьшение размера очага или потока АВМ может сделать возможным выполнение радиохирургии или облегчить хирургическое удаление. Шкала оценок Spetzler-Martin (SM) используется в качестве инструмента принятия решений для оценки риска хирургической резекции путем оценки размера АВМ, характера венозного оттока и красноречия расположения головного мозга, при этом более высокие баллы 4 и 5 связаны с большим хирургическим вмешательством. заболеваемость и смертность. 2,11
На разных стадиях болезни
Острый : наблюдение, лечение и экстренное хирургическое вмешательство могут потребоваться, особенно в случаях острого геморрагического проявления, в качестве меры спасения жизни и предотвращения дальнейшего неврологического нарушения. Окончательное лечение может быть отложено на более позднее время, чтобы позволить заживление, или может потребоваться поэтапное лечение из-за размера, местоположения и сложности поражения.
Подострый : в зависимости от локализации и типа сосудистой мальформации проводится последующий мониторинг поражения с выявлением симптомов и визуализационные исследования, которые помогут определить дальнейшую потребность в хирургическом вмешательстве с целью облитерации поражения и предотвращения повторного кровотечения и в дальнейшем. неврологические последствия.При случайном обнаружении некоторых бессимптомных АВМ может быть достаточно клинического наблюдения с мониторингом.
Хронический / стабильный : Долгосрочное наблюдение гарантировано с учетом риска повторного кровотечения. Не существует установленных правил относительно продолжительности мониторинга. Неврологический дефицит может сохраняться годами или бесконечно долго. Любые новые симптомы или изменение симптомов потребуют дополнительных визуализаций / обследований, чтобы гарантировать стабильность сосудистого поражения. Стратегии реабилитации применимы так же, как и в случае любой другой причины приобретенного повреждения головного или спинного мозга.(См. Раздел «Реабилитационная помощь при инсульте и травме спинного мозга у детей»).
Координация оказания помощи
В настоящее время не существует научно обоснованных рекомендаций по лечению нервно-сосудистых заболеваний у детей. Многопрофильная и междисциплинарная помощь жизненно важна, учитывая ее сложный характер и курс, а лечение подбирается индивидуально для каждого случая. 14 Это относится как к медикаментозному / хирургическому лечению сосудистых поражений, так и к реабилитационному лечению приобретенных травм головного и спинного мозга.
Обучение пациентов и их семей
Обучение пациентов и членов их семей относительно диагноза и возможных вариантов лечения с хорошим пониманием его риска и преимуществ, а также необходимость последующего наблюдения невозможно переоценить.
Оценка результатов лечения
Лечение должно предотвращать рецидивы, которые могут ухудшить клинический статус. Оценка результатов в основном основана на предотвращении повторного кровотечения и последующих последующих неврологических нарушений. Для определения результатов лечения проводятся серийные клинические осмотры и визуализирующие исследования.Функциональные показатели результатов, такие как WeeFIM (для детей), могут использоваться для тех, у кого развиваются стойкие неврологические расстройства с вытекающими из них функциональными нарушениями.
Практический перевод
Не применимо
4. ПРЕВОСХОДНЫЙ КРАЙ И НОВЫЕ КОНЦЕПЦИИ
Национальный институт неврологических расстройств и инсульта (подразделение NIH) проводит активные и продолжающиеся исследования в области АВМ и других сосудистых мальформаций. В настоящее время проводятся исследования, чтобы лучше предсказать естественное течение и последующий риск разрыва.Это включает использование бета-блокаторов для лечения АВМ, а также исследования конкретных биомаркеров, которые могут помочь в оценке риска и выборе лечения. В последнее десятилетие особое внимание уделялось мультимодальному планированию с использованием многопрофильного командного подхода, чтобы подобрать наилучший подход к лечению для каждого человека. Использование неинвазивной радиохирургии, по-видимому, превосходит микрохирургию и, как было показано, имеет приемлемую частоту облитерации. 11 Недавнее продольное исследование пациентов в течение пяти лет после стереотаксической радиохирургии показало частоту облитерации 60.6% и частота кровотечений 0%, что позволяет предположить, что это постепенно становится эффективным и безопасным. 15 Каждый случай следует лечить индивидуально, хотя радиохирургия показана при АВМ с более высоким риском кровотечения. 9 Кроме того, использование МРТ с маркировкой спиновых артерий демонстрирует некоторый потенциал в качестве неинвазивного диагностического и последующего исследования детских АВМ. 16
5. ПРОБЕЛЫ В ДОКАЗАТЕЛЬНЫХ ЗНАНИЯХ
Нервно-сосудистые поражения остаются значительной причиной заболеваемости и смертности.Несмотря на то, что неинвазивная визуализация мозга привела к увеличению выявления этих поражений, остаются значительные пробелы в управленческих решениях, учитывая плохо определенную естественную историю болезни и относительно низкую заболеваемость, что затрудняет проведение проспективных исследований для получения более точных данных. Исследования должны быть сосредоточены на измерении риска разрыва, повторного разрыва, лечения или медикаментозного лечения. 17
ССЫЛКИ
- Р. Новакович, М. Лаззаро, А. Кастонгуай и О Зайдат.Диагностика и лечение артериовенозных мальформаций головного мозга. Neurol Clin. 21 (2013) 749-63.
- Т. Ниази, П. Климо-младший, Р. Андерсон и С. Раффель. Диагностика и лечение артериовенозной мальформации у детей. Neurosurg Clin N Am. 21 (2010) 443-456.
- F Toulgoat и P Lasjaunias. Сосудистые мальформации головного мозга. Справочник по клинической неврологии. 112 (3). Эльзевир. (2013) 1043-1051.
- Чен, Ванцю, Ын-Юнг Чой, Кэмерон М. Макдугалл и Хуа Су.«Моделирование артериовенозной мальформации головного мозга, патогенез и новые терапевтические цели». Исследование трансляционного инсульта 3 (2014): 316-29.
- Лааксо, Аки. «Эпидемиология и естественная история АВМ». Артериовенозные мальформации головного мозга (2017): 37-49.
- Ким, Хелен, Хуа Су, Шантель Вайншеймер, Людмила Павликовска и Уильям Л. Янг. «Патогенез артериовенозной мальформации головного мозга: парадигма реакции на травму». Исследование внутримозговых кровоизлияний Acta Neurochirurgica Supplementum (2011): 83-92.
- TM OLynnger, WN Al-Holou, JJ Gemmete, AS Pandey, BG Thompson, HJ Garton, et al. Влияние возраста на артериовенозные мальформации у детей и молодых людей, которым проводится магнитно-резонансная томография. Детская нервная система . 27 (2011) 1273-79.
- Derdeyn, Colin P., et al. «Лечение артериовенозных мальформаций головного мозга: научное заявление для медицинских работников от Американской кардиологической ассоциации / Американской ассоциации инсульта». Ход , об. 48, вып.8, 22 июня 2017 г.
- YJ Lee, K Terbrugge, G Saliuo, T. Krings. Клинические особенности и исходы артериовенозных мальформаций спинного мозга. Ход . 45 (2014) 2606-12.
- С. Яманда, И Такаги, К. Нодзаки и др. Факторы риска последующего кровотечения у пациентов с атериовенозными мальформациями головного мозга. Журнал нейрохирургии 107 (2007) 965-972.
- Н. Аджибойе, Н. Чалухи, Р. Старке и Р. Белл. Церебральные артериовенозные мальформации: оценка и лечение. Научный мировой журнал. 14 (2014) 1-6.
- G Saliuo, A Tej, M Theaudin, M Tardieu, A Ozanne, M Sachet, D Ducreux и K Deiva. Факторы риска рецидива гематомиелии и клинические исходы у детей с интрадуральными артериовенозными мальформациями спинного мозга. Am J Neuroradiol. 35 (2014) 1440-46.
- Ai, Xiaolin, et al. «Факторы, связанные с геморрагическими проявлениями у детей с нелеченой артериовенозной мальформацией головного мозга: метаанализ. Журнал нейрохирургии: педиатрия , вып. 23, нет. 3. 2019. С. 343–354.
- Т. Ладнер, Дж. Махди, А Аттиа и др. Многопрофильная педиатрическая нейроваскулярная конференция: модель междисциплинарного лечения сложных заболеваний. Детская неврология 52 (2015) 165-173.
- Mohr, J.P., et al. «Медицинское лечение с интервенционной терапией неразорвавшихся артериовенозных мальформаций головного мозга (ARUBA) с интервенционной терапией или без нее: многоцентровое неслепое рандомизированное исследование». Ланцет , т.383, нет. 9917, 2014. С. 614–621.
- Т. Блаубломм, О Наггара, Ф. Брюнель, Д. Гревент и др. Магнитно-резонансная томография с маркировкой спина артерий: к неинвазивной диагностике и последующему наблюдению за артериовенозными мальформациями головного мозга у детей. J Нейрохирург-педиатр (2015) 1-8.
- Мелинг, Торстейн Р. «Лечить или не лечить АВМ мозга — это все еще вопрос». Acta Neurochirurgica 8 (2017): 1451-454.
Оригинальная версия темы
Рошель Т.Ди, доктор медицины, Кэтрин Шустер, доктор медицины. Сосудистые мальформации головного и спинного мозга у детей. 14.09.2015
Раскрытие автора
Кэтрин Шустер, MD
Ничего не раскрывать
Майкл Штольц, BS
Ничего не раскрывать
Дэвид Минс, BS
Ничего не раскрывать
Рошель Т. Дай, MD
Ничего не раскрывать
Эпилепсия и внутричерепные сосудистые мальформации, a Возможно недостающее звено!
Austin J Clin Neurol 2017; 4 (1): 1101.
* Автор, ответственный за переписку: Хосам Махер Аль-Джехани, Отделение нейрохирургии, интервенционной радиологии и нейрокритической помощи, Больница Короля Фахда Университет, Университет имама Абдулрахмана Альфейсал, Саудовская Аравия Arabia
Поступила: 22.01.2017; Принята к печати: 27 февраля 2017 г .; Опубликован: 2 марта 2017 г.
Абстрактные
Остается развитие артериовенозных мальформаций головного мозга (АВМ). загадочный.Их обычное представление с кровотечением могло быть разрушительным. мероприятие. Их второй способ представления; Захват представляет собой механистический, диагностическая и терапевтическая проблема. По большей части сосудистое развитие и нарушения кровотока участвуют в развитии судорог в контекст АВМ головного мозга. Предлагается гипотеза, согласно которой общие корковые и пути развития сосудов приводят к нарушению сосудистого фенотипа приводя к артериовенозному шунтированию, одновременно приводя к очаговой форме корковая дисплазия, способствующая захвату.
Ключевые слова: Внутричерепная сосудистая мальформация; Эпилепсия; Судорожные расстройства; Корковое развитие; Кортикальная дисплазия
,00Введение
Кавернозные мальформации головного мозга и артериовенозные пороки развития (АВМ) представляют большую часть спектра внутричерепных сосудистых мальформаций (ВВМ) [1]. Они представляют собой распространенный источник кровотечения у молодых людей, которые являются наиболее частая причина внутримозгового кровоизлияния (ВЧК) у молодых людей что часто предвещается эпилептическим припадком при обращении к врачу. внимание [2,3].ИВМ может вызвать внутримозговое кровоизлияние, представляющий второе разрушительное проявление IVMs, происходящих у 15% всех пациентов с АВМ [4]. Кроме того, многие из этих ПТрМ и CCM приводит к так называемой негеморрагической очаговой неврологической дефицит », для которого множество возможных патофизиологических механизмов были предложены, в том числе воспалительный процесс и церебральный нарушение ауторегуляции вокруг IVMs [5,6]. Это могло быть очень серьезно и такие разрушительные, как мигрень и парез Тодда, а иногда может быть неотличим от припадка [7].
Разработка IVM плохо изучена, и некоторые из них обнаружены в ходе обследования другого неврологического состояние или жалоба или, если система здравоохранения организована, скрининг семей известного пострадавшего пациента. Распространенность этих поражений сообщается около 1: 625 для CCM и 1: 2000 для AVM [8,9]. Этот представляет собой большой пул потенциальных пациентов с рефрактерными приступами в население. Но с другой стороны, из-за непонятного болезненный процесс и ограниченное количество по сравнению с другими заболеваниями условия, есть серьезные дебаты относительно триггера для лечения случайной АВМ без происшествий [10].У пациента с судороги на фоне АВМ, выявление геморрагического событие можно различить с помощью изображений, но споры все еще существуют, погода этого достаточно, чтобы изменить курс и изменить отношение к лечению. В дихотомия проявления приступов, если они клинически очевидны или субклинического характера выявляется только при электроэнцефалографии. Эти факторы усложнили бы определение того, какой захват, т. Е. клинический или электрографический, например; будет считаться спусковым крючком для лечения.
Специально для изъятий было предложено несколько механизмов в сочетании с IVM, включая потерю нейронов, глиальную пролиферацию, нарушение нейротрансмиттеров и образование свободных радикалов [11]. Именно по этой причине одно из взглядов на ИВМ при судорогах — хирургическая резекция для уменьшения судорожной тенденции через вторичный эпилептогенез [12], вызвав огромные дебаты с результат недавней работы, ставящей под сомнение положительную роль хирургии при возникновении или повторении приступа.Это в сочетании с разнообразие хирургических решений по борьбе с «эпилептогенными рубцами» которые на сегодняшний день никогда не были рандомизированы, чтобы позволить идентифицировать наиболее эффективный метод снижения риска возникновения судорог после резекции ВМС.
Но что, если мы смотрим не на ту цель?
Гипотезы и доказательства
Несколько исследований развития АВМ предполагают генетическое нарушения, как в факторах некроза опухоли, рост опухоли факторы, интерлейкины, рост эндотелия сосудов и многие другие другие в формировании, или, лучше сказать, порок развития АВМ разработка АВМ [13].Недавние данные указывают на то, что гены Сигнальный путь Notch в развитии АВМ [14]. Как эти гены могут быть вовлечены в некоторые аспекты нарушения артериальной дифференцировка и венозная регрессия, приводящая к образованию очаг с прямым артериовенозным шунтированием; их мутации хорошо известно, что нарушает корковое развитие.
В упрощенном виде классическое описание АВМ — это порок треугольной формы, ведущий к поверхность желудочка с дренирующей веной либо в сторону поверхностного или глубокий венозный отток.Это по большей части напоминает колонка теории коркового развития [15]. Последнее предполагает что каждый сегмент желудочковой зоны отвечает для заполнения столба коры нервными и глиальными элементами. Интуитивно можно предположить, что такое же формирование паттернов возможно в сосудистые элементы.
Значение и обсуждение
Поскольку процессы нервного и сосудистого развития частично руководствоваться; набором общих и общих генетических путей, это справедливо предположить, что нарушение одного генетического пути может привести к развитию АВМ и фокального коркового порок развития, связанный с этим, исключительно для этой конкретной «кортико-сосудистой» столбец.Таким образом, развитие приступа могло быть Клинико-патологически приписывается лежащей в основе корковой дисплазии или порок развития, а не сосудистое заболевание или кровь нарушение потока. Параллели этого многолинейного расстройства существуют в литература [16,17].
Эту гипотезу легко проверить, если проанализировать мозг ткань вокруг АВМ. К сожалению, операция IVM — одна из наиболее изощренная в микро-нейрохирургии, при которой мозг IVM уважают. Его нужно минимально манипулировать, оставляя лежащий в основе и окружающий мозг вне досягаемости наших научных расследование.Это было бы еще интереснее, если бы эта конкретная часть мозг «красноречив», с огромным потенциалом избавиться от свет на адаптивный механизм, который использует развивающийся мозг, пока столкнувшись с враждебным поражением, таким как АВМ. Может быть, при вскрытии мы найдем ответ. Ответ, который, вероятно, улучшил бы наше понимание корково-сосудистого генетического взаимодействия в связи с эпилептогенными АВМ. Изменение в нашем понимании этих механизмов могло бы позволяют врачам использовать альтернативные или даже новые планы лечения при эпилепсии при АВМ.Такая стратегия будет означать конкретный режим назначается каждому отдельному пациенту на основе генетического рецепта его или ее собственное изготовление. Такой индивидуальный подход к лечению может привести к лучшему контролю над приступами, не прибегая к спорным хирургическое иссечение АВМ для уменьшения судорожной тенденции и предотвращения вместе риск вторичного эпилептогенеза из-за стойких Наличие АВМ или хирургическое рубцевание.
Список литературы
- Brown RD, Flemming KD, Meyer FB, Cloft HJ, Pollock BE, Link ML.Естественный история, оценка и лечение внутричерепных сосудистых мальформаций. Mayo Clin Proc. 2005; 80: 269-281.
- Claassen J, Jetté N, Chum F, Green R, Schmidt M, Choi H, et al. Электрографический судороги и периодические выделения после внутримозгового кровоизлияния. Неврология. 2007; 69: 1356-1365.
- De Herdt V, Dumont F, Hénon H, Derambure P, Vonck K, Leys D, et al. Ранние приступы при внутримозговом кровоизлиянии: частота возникновения, сопутствующие факторы, и результат. Неврология. 2011; 77: 1794-1800.
- Josephson CB, Leach JP, Duncan R, Roberts RC, Counsell CE, Al-Shahi Салман Р. Шотландский аудит внутричерепных сосудистых мальформаций (SAIVM) руководящий комитет и сотрудники. Риск судорог от кавернозных или артериовенозные мальформации: проспективное популяционное исследование. Неврология. 2011; 76: 1548-1554.
- Аль-Шахи Салман Р. Перспективы взрослых с эпилептическими припадками при кавернозных или артериовенозных мальформациях головного мозга. Эпилепсия. 2012; 53: 34-42.
- Фиерстра Дж., Конклин Дж., Крингс Т., Слессарев М., Хан Дж. С., Фишер Дж. А. и др. Нарушение перинидального цереброваскулярного резерва у пациентов с эпилепсией головного мозга артериовенозные мальформации. Головной мозг. 2011; 134: 100-109.
- Choi JH, Mast H, Hartmann A, Marshall RS, Pile-Spellman J, Mohr JP и др. al. Клинико-морфологические детерминанты очагового неврологического дефицита у пациенты с неразорвавшейся артериовенозной мальформацией головного мозга. J Neurol Sci. 2009; 287: 126-130.
- Моррис З., Уайтли В. Н., Лонгстрет В. Т., Вебер Ф., Ли Ю. С., Цусима Ю. и др.Случайные результаты магнитно-резонансной томографии головного мозга: систематический обзор и метаанализ. BMJ. 2009; 339: b3016.
- Аль-Шахи Салман Р. Рулетка МРТ мозга. Pract Neurol. 2010; 10: 188-190.
- Stapf C. Обоснование «Рандомизированного исследования неразорвавшегося мозга». ПТрМ »(ARUBA). Acta Neurochir Suppl. 2010; 107: 83-85.
- Kraemer DL, Awad IA. Сосудистые мальформации и эпилепсия: клиника соображения и основные механизмы. Эпилепсия. 1994; 6: S30-S43.
- Yeh HS, Tew JM, Jr., Gartner M. Контроль над приступами после операции на головном мозге. артериовенозные мальформации. J Neurosurg. 1993; 78: 12-18.
- Ким Х., Марчук Д.А., Павликовская Л., Чен Й., Су Х., Ян Г. Ю. и др. Генетический соображения, относящиеся к внутричерепному кровоизлиянию и артериовенозному мозговому кровоизлиянию. пороки развития. Acta Neurochir Suppl. 2008; 105: 199-206.
- Krebs LT, Starling C, Червонский А.В., Гридли Т. Активация Notch2 у мышей вызывает артериовенозные мальформации, фенокопированные эфриномB2 и EphB4 мутанты. Бытие.2010; 48: 146-150.
- Хортон Дж. С., Адамс ДЛ. Кортикальный столбик: структура без функции. Philos Trans R Soc Lond B Biol Sci. 2005; 360: 837-862.
- Guzeloglu-Kayisli O, Amankulor NM, Voorhees J, Luleci G, Lifton RP, Gunel Белок M. KRIT1 / кавернозной мальформации головного мозга 1 локализуется в сосудистой оболочке. эндотелий, астроциты и пирамидные клетки головного мозга взрослого человека кора. Нейрохирургия. 2004; 54: 943-949.
- Tanriover G, Sozen B, Gunel M, Demir N. Экспрессия CCM2 во время пренатального периода развитие и неокортекс взрослого человека.Int J Dev Neurosci. 2011; 29: 509- 514.
Модели на животных при изучении артериовенозной мальформации головного мозга
Артериовенозная мальформация головного мозга (АВМ) является важной причиной геморрагического инсульта. Этиология в значительной степени неизвестна, а методы лечения спорны. Обзор моделей животных, связанных с АВМ, может быть полезным для понимания современных знаний и содействия дальнейшим исследованиям этого заболевания. Мы искали в PubMed до 31 декабря 2014 г., используя термин «артериовенозная мальформация», ограничивая результаты поиском животных и английского языка.Были рассмотрены публикации, в которых описывалось создание моделей АВМ на животных или исследовались связанные с АВМ механизмы и методы лечения с использованием этих моделей. Было выявлено более 100 статей, удовлетворяющих нашим критериям включения, и из них были обобщены восемь различных типов исходных моделей. Были продемонстрированы предпосылки и процедуры этих моделей, их применения и результаты исследований. Модели на животных полезны для изучения патогенеза образования, роста и разрыва АВМ, а также для разработки и тестирования новых методов лечения.Ожидается создание предпочтительных моделей.
1. Введение
Артериовенозные мальформации головного мозга (АВМ) — это сосудистые аномалии, при которых артерии и вены напрямую связаны сложной запутанной сетью аномальных сосудов вместо нормальной капиллярной сети. Обычно кровоток через питающие артерии, очаги и дренажные вены высок. АВМ представляют собой высокий риск геморрагического инсульта, ведущего к значительной неврологической заболеваемости и смертности у относительно молодых людей [1].Как патологические и гемодинамические особенности играют роль в разрыве АВМ, неизвестно.
В случае внезапного кровотечения лечение направлено на восстановление жизненно важной функции и предотвращение повторного кровотечения, обычно с помощью некоторой комбинации хирургической резекции, эмболизации и стереотаксической лучевой терапии. Но все эти методы лечения создают риск серьезных осложнений, и необходимо оценить оптимальное лечение [2]. Для неразорвавшихся АВМ неясно, является ли профилактическое лечение полезным, потому что невмешательство может привести к благоприятному долгосрочному результату [3].
Считается, что АВМ имеют эмбриональное происхождение и постнатальное развитие, они в большей степени динамичны, чем статичны [4, 5]. В очаге поражения АВМ происходит ангиогенез или пролиферация сосудов. Понимание точных молекулярных механизмов формирования и прогрессирования АВМ имеет решающее значение для разработки новых методов лечения, таких как таргетная терапия сосудов и генная терапия.
На модели животных дается гарантия на соответствие требованиям, указанным выше. К настоящему времени было разработано несколько экспериментальных моделей на животных для изучения гемодинамики, патогенеза и лечения АВМ.Таким образом, был сделан обзор предыстории, процедуры и применения этих моделей, а также кратко проанализированы их преимущества и недостатки.
Целью обзора было поощрение создания более выгодных моделей АВМ и содействие дальнейшим исследованиям этого расстройства.
2. Методы
Мы искали в PubMed до 31 декабря 2014 г., используя термин «артериовенозная мальформация», ограничивая результаты исследованиями животных и английского языка.
Два исследователя читают названия и отрывки из публикаций, чтобы выяснить, возможно, соответствующие публикации, в которых описывается создание моделей АВМ на животных или исследуются связанные с АВМ механизмы и методы лечения с использованием этих моделей.Были исключены статьи, описывающие создание моделей дуральной артериовенозной фистулы или поражения АВМ в других органах. Были получены полные тексты выбранных статей, а также те, которые соответствовали нашим критериям включения, были идентифицированы и, наконец, обобщены.
Основное внимание в обзоре уделялось предыстории, процедуре и применению каждой конкретной модели. Также кратко обсуждались выбранные животные, преимущества и недостатки каждой модели.
3. Результаты
Из общего числа 911 публикаций, найденных в соответствии с поисковым запросом, мы отобрали более 100 статей по критериям включения, описывающим создание оригинальных или модифицированных моделей животных или принятие этих моделей для создания экспериментальные исследования.
Животные модели при изучении АВМ были разнообразны в соответствии с целями исследования, от моделей, основанных на изменениях цереброваскулярного кровообращения, до моделей, основанных на методах генной манипуляции. Были обобщены восемь различных типов исходных моделей, и их основные характеристики были показаны в таблицах 1 и 2.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| АВМ: артериовенозная мальформация; СМА: средняя мозговая артерия; SSS: верхний сагиттальный синус; ОСА: общая сонная артерия; EJV: наружная яремная вена. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| АВМ: артериовенозная мальформация; VEGF: фактор роста эндотелия сосудов. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.1. Каротидно-яремная фистула
Чтобы объяснить феномен, согласно которому ткань головного мозга, окружающая поражение АВМ, подвержена набуханию и кровотечению сразу после хирургического иссечения поражения, Spetzler et al. во-первых, предположил, что хроническая ишемическая ткань мозга около АВМ с высоким потоком может испытывать потерю сосудистой ауторегуляторной способности, теория прорыва нормального перфузионного давления (NPPB) с использованием модели каротидно-яремной фистулы (CJF) у кошек [6]. Эта модель была создана посредством анастомоза между ростральным концом общей сонной артерии (ОСА) и каудальным концом наружной яремной вены (EJV) вместе с перевязкой оставшихся культи сосуда, так что была достигнута неинфарктная церебральная гипоперфузия. путем ретроградного слива крови из уиллисова круга через анастомоз (рис. 1 (а)).Спустя 6 недель только животные с выраженным расширением сосудов свищей демонстрировали снижение ауторегуляции цереброваскулярной системы как при открытых, так и при закрытых свищах, что указывает на пагубное влияние высокого потока через АВМ на окружающие ткани. Другие исследователи переоценили эту модель кошки, но обнаружили, что цереброваскулярные гемодинамические изменения были фактически минимальными и преходящими из-за образования CJF и систематического вмешательства артериального давления, а реактивность CO 2 в закрытой фистуле была сохранена.Вероятно, этой модели было недостаточно для выяснения механизмов явления NPPB [36–38].
Таким образом, Морган и его коллеги представили модифицированную модель CJF на крысах. Они наложили сквозной анастомоз обоих ростральных концов ОСА и EJV (внутренняя яремная вена у крыс гипопластична, а церебральная венозная кровь стекает в основном в EJV) с правой стороны и лигировали каудальные концы оба сосуда и ипсилатеральная наружная сонная артерия (НСА), создавая функциональную артериовенозную фистулу между Виллизиевым кругом и правым боковым синусом (рис. 1 (b)).По прошествии периода от 8 до 12 недель присутствие CJF значительно снизило церебральный кровоток (CBF) на стороне свища по сравнению с исходным уровнем. Закрытие свища значительно увеличивает CBF, вызывая разрушение гематоэнцефалического барьера (BBB) при индуцированной гипертензии, но не при нормальном давлении [7, 39, 40]. Дальнейшие исследования подтвердили, что гистопатологические изменения церебральных капилляров были структурной основой феномена NPPB [41]. Интересно, что реактивность сосудов головного мозга на CO 2 оставалась неизменной на протяжении всего эксперимента.Исследовательская группа рекомендовала избегать интраоперационной гипервентиляции и послеоперационной гипертензии для удаления поражений АВМ. Используя эту модель, группа исследователей проверила гипотезу о том, что внутримозговый, внеклеточный норэпинефрин может быть ключевым фактором, влияющим на уровни CBF [42], а другая группа оценила влияние ионизирующего излучения на паренхиму, украденную кровью, и пришла к выводу, что лучевая терапия связана с повреждение нормальных или гипоперфузированных тканей мозга было сходным [43].
Кроме того, предполагалось, что «окклюзионная гиперемия» связана с отеком мозга и кровоизлиянием после резекции большой АВМ. Высокий кровоток и массовый эффект поражений АВМ могут вызывать обструкцию венозного оттока и застой артериального притока в прилегающей к ним паренхиме с последующим ухудшением существующей гипоперфузии и ишемии в этих тканях. Bederson et al. оценили это предположение на модели CJF на крысах с помощью проксимального CCA к дистальному анастомозу EJV с контралатеральной окклюзией EJV [8].Свищ значительно увеличил торкулярное давление и снизил систематическое давление, а венозная окклюзия в течение одной недели вызвала венозный инфаркт, субарахноидальное кровоизлияние и тяжелый отек мозга. На основании этого Hai et al. разработали более умеренную модель хронической гипоперфузии головного мозга в сочетании с гипертензией дренирующих вен путем анастомоза конец в бок между EJV и CCA с правой стороны с перевязкой двусторонних ECA и левой вены, дренирующей поперечный синус (Рисунок 1 ( в)).Через 90 дней окклюзия CJF привела к феномену NPPB, который, как было дополнительно продемонстрировано, имеет общие патологические механизмы с острым ишемическим реперфузионным повреждением, таким как инфильтрация воспалительных клеток и активация свободных радикалов кислорода [9, 44]. Гемодилюция высокой концентрацией человеческого сывороточного альбумина оказывает определенное предварительное воздействие на это повреждение головного мозга [45]. Кодзима и др. создали очень похожие модели CJF на крысах не только с падением перфузионного давления, но и с нарушением дренирующего венозного оттока [46].
Крысы были выбраны в качестве модельных животных, вероятно, потому, что они экономичны и доступны, несмотря на их анатомические отличия от людей. Модели CJF были также испытаны на обезьянах; однако с ними было трудно обращаться, их было дорого создавать, а также возникали сложные этические проблемы [10].
3.2. Внутричерепной артериовенозный свищ
Каротидно-яремный свищ приводил к гемодинамическим изменениям всего мозга или преимущественно полушария со стороны свища, но не регионарной паренхимы.Модель собаки с местной церебральной гипоперфузией была опробована с использованием внутричерепной артериовенозной фистулы [11]. Собака была выбрана не только потому, что ее мозг был достаточно большим для работы, но и потому, что физиология и гемодинамическая ситуация были сопоставимы между мозгом собаки и человека. После трепанации черепа был создан свищ бедренным венозным трансплантатом с анастомозом конец в бок как с кортикальной ветвью средней мозговой артерии (MCA), так и с верхним сагиттальным синусом (SSS). Открытие шунта заметно уменьшило региональный CBF (rCBF) на территории СМА, но не в других областях.Повторная окклюзия шунта заставила rCBF отскочить и вернуться к значению до открытия в течение 15 минут. Региональный CO 2 реактивность значительно снизилась при открытии шунта. Региональные гемодинамические изменения в этой животной модели имитировали реальное состояние тканей мозга, окружающих АВМ человека. Однако это была острая модель, и процедура была немного сложной.
В моделях как экстракраниальной, так и внутричерепной артериовенозной фистулы не было реального очага АВМ, эти модели фокусировались на гемодинамических и патофизиологических изменениях прилегающей паренхимы АВМ, но не на самом поражении АВМ.
3.3. Rete Mirabile как AVM Nidus
Каротидный rete mirabile (RM) свиней представляет собой особую сосудистую структуру с клубком микрокартерий и артериол, расположенных на окончании каждой восходящей глоточной артерии (APA), пронизывающей основание черепа. Две стороны RM, которые связаны друг с другом по средней линии, также снабжаются другими небольшими коллатеральными артериями и изливаются, образуя внутренние сонные артерии ипсилатерально (Рисунок 2 (а)).В конце 1980-х годов несколько авторов начали сообщать, что СО свиней можно использовать в качестве очага АВМ для оценки различных материалов для эмболизации и воздействия однократной радиации из-за их морфологического сходства [47–50]. Окклюзионный эффект лечения можно было оценить с помощью суперселективной ангиографии и гистопатологического наблюдения. Важным отличием структуры RM от реального очага АВМ является гемодинамическое различие; первая — артериоартериальная система, вторая — артериовенозная система с более высоким градиентом давления между питающими и дренирующими сосудами.
Чтобы устранить этот недостаток, Chaloupka et al. произвел артериовенозный шунт с высоким потоком в RM свиньи путем введения иглы через орбиту для создания связи между сеткой и окружающей кавернозной пазухой [12]. Суперселективная ангиография в APA показала быстрое последовательное заполнение сетчатой оболочки, кавернозного синуса и базилярного синуса. Однако эта модель имела ограничения в виде очевидных глазных осложнений, спонтанной окклюзии артериовенозного шунта и использовалась только для краткосрочных исследований.
Massoud et al. разработали отличительную модель АВМ свиней с индуцированным высоким кровотоком через обе ретии путем хирургического формирования поперечной артериовенозной фистулы между ОСА и ВЭП с перевязкой ОСА проксимальнее свища с правой стороны [13]. . Ангиография показала четкую демонстрацию питающих артерий (в основном левой APA), очага (двусторонняя ретия) и дренирующей вены (правая APA до свища), что очень похоже на АВМ человека (Рисунок 2 (b)). .Среднее кровяное давление левой APA упало с 77 мм рт. Ст. До 67 мм рт. Ст. После формирования модели, а давление правой APA упало еще до 46 мм рт. Путем дополнительной окклюзии сетчатых ветвей с правой стороны исследовательская группа также успешно сохранила ту же модель для последующего исследования до 180 дней [51]. В хронической модели наблюдались поразительные трансмуральные изменения сосудов очага, представляющие реалистичные гистопатологические особенности АВМ человека. И острая, и хроническая модели получили широкое распространение при изучении АВМ [52–58], особенно в аспектах гемодинамических изменений, эмболизационной терапии и радиохирургии.
На основе модели Масуда были представлены модифицированные модели AVM для свиней. Они создавали более высокий градиент давления, близкий к значениям, обнаруженным в АВМ человека, тем самым снижая частоту спонтанного тромбоза в сетчатке [59, 60].
Кроме того, у свиньи естественная структура каротидного RM также наблюдается у других парнокопытных животных, таких как овца, коза, бык и кошка, но не у собаки, кролика и крысы. Можно ли продублировать модели RM свиней у других животных, было неизвестно, за исключением технико-экономического обоснования на овцах [14].Сосудистое строение и кровоснабжение РМ у овец (восходящая глоточная артерия атрофирована) незначительно отличаются от таковых у свиней. Модель АВМ овцы была успешно создана с помощью хирургического анастомоза из стороны в сторону между ОСА и EJV с перевязкой вены выше и артерии ниже анастомоза (рис. 3). Ангиографический вид был продемонстрирован для имитации АВМ человека на всех моделях животных. Создание модели овцы было довольно простым и рентабельным, но обычно не применялось в исследовании АВМ.
3.4. Экстракраниальное венозное сплетение как узел АВМ
В 2004 г. Yassari et al. описали модель крысы с фиктивным очагом АВМ, просто перевязав левую EJV в месте слияния подключичной вены и наложив анастомоз конец в бок между EJV и CCA [15]. За этими крысами наблюдали до 90 дней. Ангиографические и гемодинамические исследования показали, что высокий кровоток отводился через свищ в EJV (как питающую артерию) через сеть венозных ветвей (как очаг), затем повторно соединялся и дренировался в сигмовидный синус (как дренирующая вена). ), демонстрируя сходные черты с АВМ человека (рис. 4).Высокий кровоток возник сразу и оставался стабильным после образования свища, в то время как среднее давление в свище значительно упало на 7 день и имело тенденцию к стабилизации на 21 день.
Дальнейший анализ в этой модели показал, что сосуды очага претерпели морфологические изменения от нормальные вены подобны незрелым сосудам в АВМ человека, включая неоднородно утолщенные стенки, расщепление эластической пластинки и утолщенные эндотелиальные слои [61]. Другое исследование обнаружило, что произошли эндотелиальные молекулярные изменения в очаге, такие как повышенная экспрессия фактора роста эндотелия сосудов (VEGF), что также аналогично наблюдаемым в АВМ человека [62].Эти данные подтверждают теорию о том, что сосудистые изменения в АВМ являются вторичными по отношению к увеличению кровотока, а не первичным фенотипическим отклонением.
Активация сосудистых клеток в очаге сделала его уникальной моделью для изучения окклюзионного эффекта радиохирургии на сосуды АВМ, поскольку мало было известно о молекулярных механизмах радиационно-опосредованной облитерации сосудов. Одно исследование с использованием этой модели показало, что экспрессия молекул эндотелиальной адгезии в очаговых клетках изменилась после радиохирургии [63].В других исследованиях пытались найти стратегии для усиления облитерации АВМ и сообщалось об увеличении частоты облитерации за счет индуцированного тромбоза в очаге с радиохирургией и одновременным введением низких доз липополисахарида и растворимого тканевого фактора [64].
3.5. AVM-подобное поражение, полученное из имплантатов
Оба AVM-очага с моделированием очагов с использованием RM и венозного сплетения фактически не локализовались в паренхиме головного мозга. Pietilä et al. разработали новую модель индуцированного поражения АВМ в головном мозге собаки [16].Между MCA и SSS был создан сосудистый обходной анастомоз, вставив сегмент поверхностной височной артерии (STA). Мышечный трансплантат, снабжаемый ветвью вставленного сегмента сосуда, был имплантирован в область головного мозга с украденной кровью из-за артериовенозного шунта. Послеоперационная ангиография через 6 месяцев показала питающую артерию (сегмент STA рядом с СМА) и расширенную дренажную вену (сегмент STA рядом с SSS). Между ними, вокруг мышечного имплантата были замечены АВМ-подобные поражения с недавно развитыми сосудами.Гистопатологическое исследование через 8 месяцев показало выраженный глиоз и пролиферацию эндотелия / капилляров в этой области. Все пролиферирующие сосуды имели нежные стенки и небольшие просветы и не дифференцировались на артериальные и венозные сосуды. Они предполагают, что поражения АВМ в мозге взрослого человека могут развиваться с течением времени, в первую очередь в результате ангиогенеза, в условиях церебральной ишемии и / или венозной гипертензии. Идея использования трансплантата ножной мышцы в качестве стимула для индукции внутримозгового АВМ-подобного поражения была получена в результате наблюдательных и терапевтических исследований болезни Моямоя.
В этой модели были некоторые характерные особенности, напоминающие внешний вид АВМ у человека, включая утолщение и фиброз дренирующей венозной стенки, новообразование сосудов и пролиферацию сосудов, окружающие ткани мозга с признаками ишемии и кровоизлияния. Хотя для создания модели на животных требовалась изысканная хирургическая технология, она могла бы помочь обнаружить патологические механизмы, участвующие в развитии АВМ.
3.6. Ксенотрансплантат артериовенозной фистулы
В настоящее время радиохирургия является разновидностью менее инвазивного лечения АВМ.Он оказал терапевтический эффект за счет облитерации очага АВМ с низкой частотой облитерации и латентным периодом до 2 лет. Дальнейшее понимание механизма радиохирургии может быть полезным для разработки передовых фармакологических методов лечения для улучшения окклюзионных эффектов на основе традиционной радиохирургии.
Для этой цели была создана модель артериовенозной фистулы ксенотрансплантата, поскольку сегмент магистральных артерий трансгенных мышей помещался между каудальным концом ОСА и ростральным концом EJV у иммунодефицитных голых крыс [17].Имплантированный артериальный трансплантат не был настоящим очагом АВМ, но имел гемодинамические особенности АВМ с низким сопротивлением и высоким потоком. Мыши были выбраны в качестве источника донорских артерий, потому что были доступны различные трансгенные мыши. Небольшой размер мышей затруднял гомотрансплантацию, поэтому в качестве рецептора были выбраны крысы.
В этой модели артериовенозная фистула с предварительной лучевой обработкой воспроизводила отчетливую лучевую артериопатию, наблюдаемую в резецированных образцах АВМ человека, предварительно обработанных радиохирургией.Если предварительная лучевая обработка приведет к определенным молекулярным изменениям в трансплантате фистулы или если трансплантат фистулы от разных трансгенных мышей будет иметь различный ответ на облучение, эта модель, вероятно, дала ключ к разгадке таргетной терапии сосудов и генной терапии. В одном исследовании было обнаружено, что некоторые устойчивые, но модифицированные радиационные реакции наблюдались в трансгенных артериовенозных свищах, нокаутировавших эндоглин и eNOS [65].
Модель технически осуществима, и общая ангиографическая проходимость составляет около 50%.Тем не менее, было ограничение по времени в 4 месяца, чтобы позволить трансплантированным тканям сохранить свои фенотипы из-за реакции отторжения.
3.7. Роговица крысы с тканями АВМ человека
Хирургически удаленные очаги АВМ человека были ценными образцами для гистопатологического исследования. Когда образцы были трансплантированы в микрокарманы роговицы крыс, они продолжали жить и расти. Ангиогенную активность имплантированных тканей можно многократно измерять в соответствии со стандартом неоваскуляризации, оцениваемым по подсчету микрососудов и экспрессии VEGF [18].
На основании модели имплантированные ткани АВМ показали самый высокий ангиогенез по сравнению с другими цереброваскулярными нарушениями, кавернозной мальформацией и венозной ангиомой, что указывает на то, что очаги АВМ были более активными и прогрессирующими. Имплантированные ткани АВМ, предварительно обработанные эмболизацией, показали наивысшую ангиогенную активность, за которыми следовали необработанные ткани АВМ, обработанные гамма-ножом; это могло бы объяснить, почему рецидив АВМ после внутрисосудистой эмболизации был более частым.Более того, эта модель роговицы крысы, содержащая ткани АВМ человека, может быть использована для оценки молекулярных механизмов процесса неоваскуляризации с течением времени [66].
3.8. Поражения АВМ путем манипуляции с генами
Наследственная геморрагическая телеангиэктазия (НГТ) — аутосомно-доминантное сосудистое заболевание, характеризующееся повторяющимися носовыми кровотечениями, кожно-слизистыми телеангиэктазами и образованиями АВМ в головном мозге и других внутренних органах [67]. Гетерозиготные мутации в двух генах, эндоглине ( Eng ) и киназе, подобной рецептору активина 1 ( Alk1 ), соответственно, вызывают HHT типа 1 и типа 2.Логично, что модели на животных, содержащие спонтанные или индуцированные поражения АВМ, могут быть созданы путем регулирования генов.
Нокдаун Alk1 за счет его блокирования сайтов сплайсинга морфолино вызывал спектр морфологических и функциональных дефектов в виде повреждений АВМ у эмбрионов рыбок данио [68]. Трансгенные мыши, лишенные обоих аллелей генов Eng или Alk1 , погибли в эмбриональном периоде из-за дефектов развития сосудов и сердца [19, 21, 69]. Могли быть успешно получены мыши Eng +/- и Alk1 +/- гаплонедостаточных мышей.У этих мышей развиваются сосудистые поражения в различных органах, но спонтанные поражения в головном мозге были умеренными у мышей Eng +/- и минимальными у Alk1 +/- мышей [20, 22]. Исследовательская группа, возглавляемая Su et al. индуцировала церебральную микрососудистую дисплазию путем переноса опосредованного вирусом гена VEGF в мозг взрослых мышей Eng +/- или Alk1 +/- [23-25]. АВМ-подобная капиллярная дисплазия была более выражена у мышей Eng +/- , чем у мышей Alk1 +/- .Интересно, что усиление церебральной перфузии при внутрижелудочковой инфузии гидралазина или никардипина после доставки VEGF способствовало капиллярной дисплазии у мышей Alk1 +/- . Эти исследования продемонстрировали, что доставка VEGF в мозг мышей широкого типа приводила к увеличению количества микрососудов, но не к микрососудистой дисплазии, а инъекция физиологического раствора не вызывала значительных микрососудистых изменений даже у гаплонедостаточных мышей, подтверждая, что развитие и прогрессирование поражений АВМ во взрослом мозге были возможны, когда наследственная изменчивость сочеталась с доставкой эндогенного или экзогенного фактора роста.Несмотря на несколько схожий фенотип, индуцированных локальных микрососудистых дисплазий было недостаточно, чтобы служить прямыми моделями заболевания. Однако они могут быть полезны для выявления возможных факторов, которые сыграли роль в патогенезе АВМ.
Техника условного нокаута с системой рекомбинации Cre / LoxP позволила удалить гены-мишени в запланированное время или в ожидаемых клетках, поскольку экспрессию фермента Cre можно было точно контролировать. Условная делеция обоих аллелей Alk1 у взрослых мышей с помощью индуцируемого тамоксифеном Cre привела к формированию АВ свищей и спонтанному кровоизлиянию в основном в легкие, желудочно-кишечный тракт и матку, но не заметно в головном мозге, хотя de novo сосудистые мальформации развивались после индукция кожных ран у этих мышей [26].Подобный феномен можно было наблюдать у мышей с условной делецией Eng , у которых аномалии сосудов, имитирующие очаг АВМ человека, были индуцированы в головном мозге при наличии ангиогенной стимуляции, такой как механическое повреждение или доставка VEGF [27]. Тем временем исследовательская группа Су успешно произвела повреждения АВМ в мозге взрослых мышей, напоминающие болезнь человека, путем инъекции векторов, экспрессирующих Cre и VEGF, в базальные ганглии мышей и мышей [28, 29]. Результаты показали, что цереброваскулярные поражения у мышей были более серьезными из-за более эффективной делеции гена.Фактически, региональная делеция Eng вызывала более тяжелую цереброваскулярную мальформацию на копию, чем Alk1 при стимуляции VEGF. Эти модели были многообещающими для оценки патогенных механизмов АВМ и для открытия потенциальных медицинских методов лечения для замедления роста АВМ и стабилизации аномальной сосудистой сети, склонной к разрыву.
Антенатальная делеция обоих аллелей Alk1 в ограниченных эндотелиальных клетках (ЭК) вызвала тяжелые и фатальные висцеральные артериовенозные мальформации [70].Условная делеция Alk1 специфически в ЭК взрослых мышей приводила к образованию АВМ в кишечнике, легких и вокруг ран на ушной бирке, а также в области мозга, ранее инъецированной векторами, экспрессирующими EVGF [30]. Модельные мыши погибли через 6–13 дней из-за кровотечения и анемии. Этот фенотип был таким же, как у мышей с глобальной делецией Alk1 [26], что указывает на ключевую роль ECs в патогенезе AVMs. Напротив, делеции Alk1 в перицитах было недостаточно для инициации развития АВМ у взрослых мышей.Точно так же специфическая для эндотелия делеция Eng приводила к пролиферации эндотелия и формированию АВМ в сетчатке новорожденных и локальной веномегалии во взрослой коже, вызванной механической стимуляцией и стимуляцией VEGF [31]. Из-за отсутствия поражений головного мозга Milton et al. успешно создали мышиные модели со спонтанными АВМ в головном и / или спинном мозге путем делеции Alk1 в эмбрионе с помощью SM22-Cre, который экспрессировался в гладкомышечных клетках, ECs и некоторых других типах клеток в разных органах [32].Большинство мышей демонстрировали фенотип паралича или летальности из-за внутреннего кровотечения в течение первых 10-15 недель жизни. Однако у мышей, переживших этот период, уровень летальности снизился, даже если они несли несколько АВМ. Choi et al. создали аналогичную модель со спонтанным началом АВМ в; у мышей с экспрессией SM22-Cre, у которых АВМ были обнаружены в центральной нервной системе и кишечнике, более половины мышей умерли от внутреннего кровотечения в возрасте до 6 недель [27]. Эти отличительные модели, возможно, позволили нам изучить патофизиологию разрыва АВМ.
Другие гены, участвующие в ангиогенезе, также можно манипулировать для создания моделей АВМ. Принимая важные роли в развитии сосудов и их повторном формировании, сигнальный путь Notch активируется в AVMs человека и может быть важным молекулярным регулятором патогенеза AVM [71]. Мутации Notch, связанные с потерей функции и увеличением функции, нарушают развитие сосудов, приводя к артериовенозному шунтированию у эмбрионов рыбок данио и мышей, указывая тем самым, что правильные пространственные и временные паттерны активности Notch являются критическими для ангиогенеза [33, 72, 73].Постнатальная сверхэкспрессия конститутивно активного Notch5 в эндотелии за счет системы регуляции тетрациклина вызывает церебральное артериовенозное шунтирование у мышей, и репрессия гена обращает прогрессирование AVM [33]. Дальнейший анализ этой модели показал, что АВМ возникли в результате увеличения ранее существовавших микрососудов по размеру капилляров, без покрытия гладкомышечными клетками, но с высоким кровотоком, что подразумевает клеточные и гемодинамические механизмы, лежащие в основе патогенеза АВМ [74]. Сходным образом, эндотелиальная экспрессия конститутивно активного Notch2 приводит к образованию AVM в мозгу новорожденных мышей, а активация Notch2 у взрослых мышей вызывает образования AVM в др. Органах, но не в головном мозге [73, 74].
Отсутствие матричного белка Gla (Mgp) также вызывает появление АВМ у мышей. Увеличенные сосуды головного мозга и прямые связи между артериями и венами были обнаружены у мышей Mgp — / — , но не у мышей Mgp +/- в возрасте 4 недель. Mgp является ингибитором костного морфогенетического белка (BMP). Повышенная активность BMP из-за дефицита Mgp индуцированной экспрессии Alk1 и впоследствии усиленная экспрессия лигандов Notch Jagged 1 и Jagged 2, что ненормально увеличивало активность Notch.Как и ожидалось, снижение экспрессии Jagged у мышей Mgp — / — путем скрещивания их с мышами с дефицитом Jagged нормализовало эндотелиальную дифференцировку и предотвращало образование АВМ [34]. Более того, делеция эндотелиального Rbpj , медиатора передачи сигналов Notch, в первый постнатальный день привела к особенностям АВМ в головном мозге мышей, включая аномальное АВ шунтирование и извилистые сосуды. Делеция гена Rbpj у взрослых мышей не вызывала АВМ головного мозга [35].
Цереброваскулярные аномалии, образования АВМ и кровоизлияния возникали спонтанно в некоторых случаях, когда соответствующие гены были напрямую или условно удалены на антенатальной или постнатальной стадиях, хотя в большинстве случаев модельные мыши демонстрировали либо минимальные сосудистые поражения, либо очевидные сосудистые поражения вне тела. головной мозг.Спонтанные церебральные поражения АВМ частично имитировали естественное клиническое течение заболевания, но поражениям не хватало единообразия и воспроизводимости по размеру и локализации. Фокальная ангиогенная стимуляция, основанная на дефиците гена, помогла создать взрослые модели начала индуцированных поражений АВМ в головном мозге. Эти модели, содержащие сопоставимые поражения АВМ, могут быть более подходящими для изучения механизмов и терапевтических исследований. Несмотря на недостатки, такие как сложные процедуры, большое расширение и трудоемкость, модели с помощью генных манипуляций были уникальными для исследования патогенеза АВМ и тестирования новых методов лечения.
4. Обсуждение и выводы
Как показано в таблицах 1 и 2, животные модели при изучении АВМ были разнообразны. В раннем периоде исследователи производили гипоперфузию и / или венозную гипертензию во всем или региональном мозге с помощью экстра- или внутричерепных артериовенозных свищей, чтобы оценить гемодинамические и патофизиологические изменения паренхимы, прилегающей к АВМ, при наличии поражения АВМ или после ее резекции. чтобы объяснить симптомы и защитить себя от послеоперационных осложнений.Открытие особых сосудистых структур, таких как очаг АВМ у животных (СО у парнокопытных и венозное сплетение у крыс), позволило практиковать окклюзионные методы лечения (эндоваскулярную эмболизацию и лучевую терапию) и анализировать терапевтические эффекты. В последнее время манипуляции с генами, связанными с ангиогенезом, помогли создать мутантных мышей с настоящими повреждениями АВМ в головном мозге. С улучшением стабильности эта многообещающая модель оказалась полезной для изучения механизмов возникновения, развития и разрыва АВМ.Другие гениально разработанные модели, включая индуцированные АВМ-подобные поражения в мозгу собаки и имплантированную трансгенную артериовенозную фистулу от мышей к крысам, обладали собственными ценностями для исследования патогенеза и новых методов лечения. Модель роговицы крысы была предназначена для оценки ангиогенных механизмов, особенно образцов АВМ человека.
Идеальная модель АВМ, которая полностью разделяла бы те же анатомические, физиологические, биологические и клинические особенности, что и болезнь АВМ человека, отсутствовала. Даже модель трансгенных мышей, проведенная со спонтанными, но систематическими повреждениями сосудов, не могла полностью представить спорадические случаи, чаще всего наблюдаемые в клинике.Несмотря на ограничения, эти различные модели помогли ответить на конкретные вопросы при изучении АВМ.
Происхождение AVM до сих пор остается загадкой. Обычно считалось, что сосудистое заболевание возникает во время эмбрионального развития. Однако данные на животных моделях показали, что постнатальные образования АВМ были возможны из-за двух причинных факторов: ангиогенной стимуляции и дефицита гена. С помощью полногеномного исследования ассоциации исследователи попытались идентифицировать мутантные гены, связанные с восприимчивостью к АВМ у спорадических пациентов с АВМ.Возможные вовлеченные гены включали Alk1, Eng, интерлейкин-6 (IL-6) и интерлейкин-1 β (IL-1 β ) с однонуклеотидными полиморфизмами (SNP), но ограниченные результаты были противоречивыми [75, 76].
Механизмы, лежащие в основе роста и прогрессирования АВМ, остаются плохо изученными. Аномально высокий кровоток и сила сдвига в очаговых сосудах активировали молекулярные пути в гладкомышечных клетках и ЭК. Гипоперфузия и гипоксия очаговых и окружающих тканей стимулировали ангиогенез и воспалительные реакции.Оба они приводят к пролиферации и ремоделированию сосудов [77]. Эти гипотетические механизмы были продемонстрированы на животных моделях Яссари и Пиетила, а также были подтверждены анализом резецированных образцов АВМ человека, где были обнаружены связанные факторы, такие как трансформирующий фактор роста (TGF), VEGF, матриксная металлопротеиназа-9 (MMP-9), BMP, молекулы клеточной адгезии и т. д. были сверхэкспрессированы [78].
Внутричерепное кровоизлияние является наиболее тяжелым и наиболее частым клиническим проявлением пациентов с АВМ.Факторы риска, связанные с разрывом АВМ, включают определенные генетические мутации, интранадальные аневризмы, исключительный или ограниченный венозный дренаж, глубокое или инфратенториальное расположение, а также предшествующее кровотечение в анамнезе [79–81]. ОНП IL-6, фактор некроза опухоли- α (TNF- α ), MMP-9 и другие гены в образцах АВМ, по-видимому, влияют на клиническое течение разрыва АВМ [82]. Однако точные молекулярные механизмы разрыва АВМ необходимо тщательно изучить. Исследования поражений АВМ человека показали, что множественные механизмы, включая воспаление, ремоделирование внеклеточного матрикса, аномалии ЭК и незрелые очаговые сосуды, вероятно, способствовали тенденции к геморрагии [83].Ожидаются дальнейшие исследования с использованием животных моделей со спонтанными геморрагическими поражениями АВМ.
Среди традиционных методов лечения в настоящее время рекомендуется микрохирургическая резекция АВМ I и II степени по Спетцлер-Мартин. Для АВМ высокой степени злокачественности часто используются комбинированные методы лечения без стандартной процедуры. Учитывая, что большинство поражений высокой степени нельзя лечить без относительно высокой заболеваемости и смертности, разрабатываются новые биологические методы лечения и генные терапии, направленные на ремоделирование сосудов.Исследование показало, что лозартан, антагонист рецептора ангиотензина II, ослабляет аномальную морфологию кровеносных сосудов у рыбок данио, нокаутированных по Alk1 , посредством модуляции сигнального пути BMP [84]. В модели мышей с очаговыми АВМ, опосредованными вирусами Cre и VEGF, индуцированный ангиогенез и сосудистая дисплазия были ослаблены введением антагониста VEGF бевацизумаба [85], который позже успешно лечил пациентку с HHT [86]. Более того, с более глубоким пониманием терапевтических механизмов радиохирургии в моделях Яссари и Лоутона, таргетная терапия сосудов может улучшить частоту облитерации и уменьшить осложнения радиохирургии.
Мы надеемся, что этот обзор предоставит основные из имеющихся в настоящее время моделей AVM. Представленные здесь разнообразные методы и методы могут пролить свет на создание предпочтительных моделей АВМ в будущем, что в целом будет способствовать дальнейшим исследованиям этого заболевания.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарности
Работа поддержана грантами Китайского национального фонда естественных наук (No.81000489) и Фонд Шанхайской муниципальной комиссии по науке и технологиям (№ 131400).
Делеция интегрина β8 усиливает сосудистую дисплазию и кровоизлияние в мозг взрослых гетерозиготных мышей Alk1.
AbstractАртериовенозная мальформация головного мозга (артериовенозная мальформация головного мозга), характеризующаяся спутанными диспластическими сосудами, является важной причиной внутричерепного кровоизлияния у молодых людей, и ее патогенез и прогрессирование до конца не изучены. Пациенты с гаплонедостаточностью рецепторов трансформирующего фактора роста-β (TGF-β), активин-рецептор-подобной киназы 1 (ALK1) или эндоглина (ENG) имеют более высокую заболеваемость bAVM, чем население в целом.Однако bAVM не развивается эффективно у мышей с такой же гаплонедостаточностью. Экспрессия субъединицы интегрина β8 (ITGB8), другого члена суперсемейства TGF-β, снижена при спорадических человеческих bAVM. Ангиогенная стимуляция мозга возникает на капиллярном уровне сосудистой мальформации у взрослых мышей с гаплонедостаточностью Alk1 (Alk1 +/- ). Мы предположили, что делеция Itgb8 усиливает развитие bAVM у взрослых мышей Alk1 +/- . Аденовирусный вектор, экспрессирующий Cre-рекомбиназу (Ad-Cre), инъецировали совместно с аденоассоциированным вирусным вектором, экспрессирующим фактор роста эндотелия сосудов (AAV-VEGF), в мозг Alk1 +/- ; Itgb8-floxed мышей для индукции фокального Делеция гена Itgb8 и ангиогенез.Мы показали, что по сравнению с мышами Alk +/- (4,75 ± 1,38 / мм 2 ), мыши с дефицитом Alk1 +/- ; Itgb8 имели больше диспластических сосудов в ангиогенных очагах (7,14 ± 0,68 / мм ). 2 , P = 0,003). Более тяжелое кровоизлияние было связано с диспластическими сосудами в головном мозге Alk1 +/- с делецией Itgb8, о чем свидетельствуют более крупные положительные области берлинского голубого (1278 ± 373 пикселей / мм 2 по сравнению с Alk1 +/- : 320 ± 104 пикселей / мм 2 ; P = 0.028). Эти данные показывают, что как Itgb8, так и Alk1 важны для поддержания нормального церебрального ангиогенеза в ответ на VEGF. Дефицит Itgb8 усиливает образование диспластических сосудов и кровотечение у мышей Alk1 +/- .
Многие научные публикации, созданные UC, находятся в свободном доступе на этом сайте из-за политики открытого доступа UC. Сообщите нам, насколько этот доступ важен для вас.
Основное содержаниеЗагрузить PDF для просмотраПросмотреть больше
Больше информации Меньше информации
Закрывать
Введите пароль, чтобы открыть этот PDF-файл:
Отмена Ok
Подготовка документа к печати…
Отмена
.