CBMS
Лечение тремора рук при заболевании Паркинсоном
Болезнь Паркинсона (дрожательный паралич) – это хроническое прогрессирующее заболевание головного мозга, при котором человек страдает от непроизвольного дрожания рук, ног или головы, мышечного тонуса, нарушения координации, двигательных функций и речи.
Тремор – дрожание конечностей, является одним из первых и основных симптомов болезни Паркинсона. Это тяжелое заболевание считается неизлечимым и часто становится причиной инвалидности.
Болезнь Паркинсона с течением времени прогрессирует. При этом внутри мозга происходят необратимые изменения. Поэтому эффективность лечения напрямую зависит от стадии заболевания!
Современная медицина обладает достаточно широким спектром возможностей в плане замедления процесса развития симптоматики болезни Паркинсона.
СУТЬ МЕТОДИКИ
В отличие от хирургического вмешательства и радиохирургии, применяемых на сегодняшний день для лечения тремора, метод ExAblate Neuro абсолютно безопасный и безболезненный. Во время данной процедуры врач под контролем МРТ направляет точечно сфокусированные ультразвуковые волны индивидуально подобранной частоты и температуры, которые воздействуют на определенные участки головного мозга, не влияя при этом на окружающие ткани. Точечное прижигание соответствующих участков прекращает неисправную передачу импульсов и тремор прекращается.
Преимущества методики лечения фокусированным УЗИ
— безопасность и безболезненность
— высокоточное воздействие без повреждения окружающих тканей
— полный контроль во время процедуры
— моментальный эффект и продолжительное действие лечения
— нет необходимости находиться под постоянным наблюдением
— значительное улучшение качества жизни и уменьшение зависимости от медикаментов
— отсутствие побочных эффектов
Длительность процедуры — 4 часа.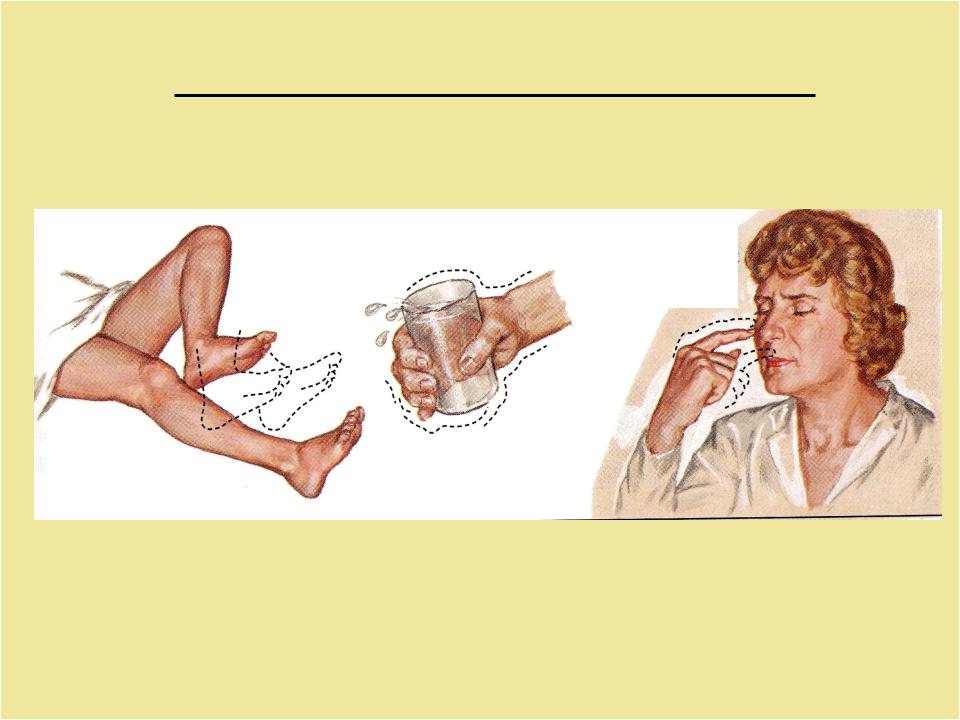
Что происходит после лечения?
Выраженный эффект наблюдается сразу же после проведения процедуры. У большинства пациентов наблюдается существенное уменьшение тремора : они могут самостоятельно выпить воду из чашки или написать текст. Эффект от лечения сохраняется длительное время, которое зависит от индивидуальных особенностей человека.
Посмотреть как проходит процедура можно здесь:
СПЕЦИАЛИСТЫ CBMS GROUP РЕКОМЕНДУЮТ ПРИ ПЕРВОМ ЖЕ ПРОЯВЛЕНИИ ТРЕМОРА, НЕ ОТКЛАДЫВАЯ ОБРАЩАТЬСЯ ЗА КВАЛИФИЦИРОВАННОЙ ВРАЧЕБНОЙ ПОМОЩЬЮ.
Если у Вас возникли вопросы, связанные с данной методикой и возможностью прохождения ее в Израиле, обращайтесь к нам и мы поможем Вам победить болезнь!
Israel, CBMS Group — Центральное Бюро Медицинских Услуг.
Дрожь в руках — чем может быть вызван этот симптом?
Дрожание конечностей – это симптом, хорошо знакомый буквально каждому.
Дрожание рук может быть симптомом множества заболеваний – поэтому определиться с диагнозом самостоятельно бывает очень сложно. При появлении первых неприятных симптомов – немотивированного, не проходящего длительное время тремора – необходимо обратиться к неврологу.
В ЦЭЛТ вы можете получить консультацию специалиста-невролога.
- Первичная консультация — 4 000
- Повторная консультация — 2 500
Тремором называют движения конечностей, туловища, которые происходят из-за мышечных сокращений и практически не контролируются сознательно. Дрожь бывает физиологического и патологического характера. Физиологический тремор – нормальный, он не требует лечения и не свидетельствует о развитии патологи. А вот при появлении признаков патологической дрожи, потребуется консультация специалиста и лечение.
Физиологический тремор
Физиологический – означает, нормальный, неопасный для организма. Он вызван естественными процессами в организме и встречается у здоровых людей. Основные признаки такого тремора: дрожь только в конечностях, подергивания проходят самостоятельно, не влияют на качество жизни и не мешают выполнению повседневных задач.
Самые распространенные причины для развития физиологического тремора:
- Переутомление. Усталость физического характера часто приводит к дрожанию рук – наверняка, многие замечали, что руки трясутся после тяжелой тренировки или длительного бега. В таком случае тремор наблюдается не только в руках – может затрагивать ноги, колени.
- Эмоциональная перегрузка – вторая по частоте причина. Чрезмерное волнение, затянувшееся депрессивное состояние, истерики, стрессовые ситуации – все это подстегивает возбудимость центральной нервной системы и приводит к появлению тремора.
- Юношеский тремор – это понятие, которое введено специально для описания еще одного физиологического феномена, связанного с тремором. Отличительная особенность – дрожь появляется внезапно, на фоне полного спокойствия, невозможно установить причину-провокатора. Очень часто тремор переходит с одной руки на другую, на ноги или даже на голову. Такой тремор не требует лечения, но для снятия неприятных симптомов могут быть назначены специальные препараты.
Специалисты сходятся во мнении, что определить точную причину можно достаточно быстро – но для некоторых заболеваний могут потребоваться специализированные тесты. В случае если дрожь носит физиологический характер, врач может определить отсутствие необходимости в лечении еще на первом приеме – но для этого ему потребуется точное описание симптомов и обстановки, в которой они возникают чаще всего.
Патологический тремор
Причины патологического тремора гораздо более разнообразны. Такая дрожь – симптом заболевания, она не пройдет до тех пор, пока не будет устранена первопричина. Патологический тремор обычно характеризуется большой силой проявления, он доставляет неудобства в бытовой жизни или сочетается с другими неприятными симптомами.
Такая дрожь – симптом заболевания, она не пройдет до тех пор, пока не будет устранена первопричина. Патологический тремор обычно характеризуется большой силой проявления, он доставляет неудобства в бытовой жизни или сочетается с другими неприятными симптомами.
Основные причины развития патологического тремора можно разделить на несколько условных групп:
- Связанные с алкоголизацией или приемом наркотических веществ и резким прекращением их приема.
- Связанные с длительным приемом некоторых групп лекарственных препаратов или их резкой отменой.
- Являющиеся важным симптомом основного заболевания – например, при болезни Паркинсона.
- Развивающиеся как вторичный симптом на фоне нехарактерного заболевания.
Рассмотрим более подробно наиболее частые причины для возникновения тремора рук.
Прием фармацевтических препаратов
Дрожь пальцев рук, мелкоразмашистая и неподдающаяся контролю может быть последствием приема некоторых лекарств, либо иных химических веществ (например, наркотических). В подавляющем большинстве случаев тремор исчезает спустя некоторое время после отмены провоцирующего препарата. Если этого не произошло – назначают симптоматическое лечение.
В подавляющем большинстве случаев тремор исчезает спустя некоторое время после отмены провоцирующего препарата. Если этого не произошло – назначают симптоматическое лечение.
Злоупотребление алкоголем
Развивается постепенно. Выраженный тремор – это симптом того, что алкогольная зависимость развилась до тяжелой формы. Отличительная черта алкогольного тремора – это отсутствие четкой локализации. У пациента могут подергиваться произвольные мышцы, дрожит голова или все тело. Симптоматика наиболее ярко выражена в утренние часы. Чтобы избавиться от дрожи пациенты часто принимают еще одну дозу алкоголя. Но в долгосрочной перспективе, такое лечение только усиливает дрожь. При обнаружении признаков алкогольного тремора у родственников – необходимо обратиться к наркологу как можно быстрее. Тремор – сигнал о том, что организм пациента сильно зависит от приема спиртосодержащих напитков.
Гормональные сбои
Гормональные нарушения тоже могут стать причиной дрожи в руках. Колебания уровня биологически активных веществ, вырабатываемых щитовидной железой приводят к целому ряду неприятных симптомов: дрожат руки, может появиться дрожание языка, наблюдаются проблемы с терморегуляцией, иногда возникают психологические проблемы. Наиболее характерные сопутствующие симптомы – это потеря или истончение волос, потливость, тревожность.
Колебания уровня биологически активных веществ, вырабатываемых щитовидной железой приводят к целому ряду неприятных симптомов: дрожат руки, может появиться дрожание языка, наблюдаются проблемы с терморегуляцией, иногда возникают психологические проблемы. Наиболее характерные сопутствующие симптомы – это потеря или истончение волос, потливость, тревожность.
Кроме заболеваний, связанных с нарушением выработки гормонов щитовидной железы, к тремору может привести снижение уровня сахара в крови, характерное для сахарного диабета. В таком случае к тремору прибавляют слабость, повышенная потливость. Неприятные симптомы проходят после дозы быстрых углеводов.
Болезнь Паркинсона
Это самая известная причина для тремора. Главная диагностическая отличительная особенность этой болезни – тремор возникает в состоянии покоя и проходит во время совершения какого-либо действия с мышечным напряжением. У подавляющего большинства заболеваний симптомы проявляются наоборот.
Болезнь Паркинсока как правило вызывает дрожь в правой руке или в левой – болезнь проявляется ассиметрично, с одной стороны тремор сильнее. Чтобы ослабить дрожь достаточно совершить какое-то целенаправленное действие. Но в покое подергивания возникают снова.
Чтобы ослабить дрожь достаточно совершить какое-то целенаправленное действие. Но в покое подергивания возникают снова.
Тремор действия
Другое название – эссенциальный интенционный тремор. Это классический вариант тремора, который возникает при напряжении – при совершении какого-либо физического действия. Появляется чаще в пожилом возрасте, хотя может быть диагностирован и у подростков, и у детей. Есть предположения о наследственной предрасположенности. Сама по себе дрожь не очень сильная, но при употреблении алкоголя усиливается и становится более заметной.
Мозжечковый тремор
Как понятно из названия, возникает на фоне патологий мозжечка. Характерные особенности: руки трясутся при попытке удержать их ровно в воздухе без опоры, либо при совершении движений, требующих особого напряжения. Дрожь усиливается при физической активности.
Для уменьшения тремора помогает последовательное расслабление мышц – от рук до всего тела. Такие симптомы, как при мозжечковом треморе, характерны для различных интоксикаций и других заболеваний, поэтому требуется дифференциальная диагностика. В первую очередь нужно исключить рассеянный склероз и травмы черепа.
В первую очередь нужно исключить рассеянный склероз и травмы черепа.
Астериксис
Тремор может быть разного характера, но всегда размашистый. Дрожь в левой руке чаще возникает у левшей, в правой – у правшей. Тремор затрагивает именно те мышцы, которые несут более серьезную нагрузку. Усиление симптоматики наблюдается при попытке согнуть пальцы или удержать руки вытянутыми перед собой.
Ритмичный миоклонус
Так называется болезнь, которая проявляется размашистым тремором, который можно остановить, добившись полного расслабления мышц. Усиление наблюдается при движении и физической активности. Это может быть как самостоятельная болезнь, так и симптом других заболеваний – поэтому при выявлении требуется дополнительная диагностика, чтобы исключить поражение сосудов, демиелинизирующие заболевания и более редкие патологии.
Диагностика
Начинается со стандартного сбора анамнеза и анализа жалоб пациента. На этом этапе врач должен выяснить:
- Как давно беспокоят симптомы.

- Где именно возникает тремор.
- Есть ли наследственная предрасположенность.
- Есть ли провоцирующие факторы.
Следующие этап – осмотр у невролога, где определяют такие показатели как особенности тремора, физическую картину, наличие видимых неврологических патологий (например, нистагм).
Очень часто используют инструментальные методы диагностики:
- Электромиография – применяется для оценки функционального состояния мышц.
- Электроэнцефалография – для оценки функциональных показателей головного мозга.
- КТ и МРТ – при подозрении на поражения головного мозга.
В зависимости от диагноза, может потребоваться консультация других узких специалистов.
Наши врачи
Врач-невропатолог, кандидат медицинских наук, врач высшей категории
Стаж 39 лет
Записаться на приемЛечение тремора
Лечение напрямую зависит от причины. Так, если тремор определен как физиологический, то специализированной терапии не требуется. Могут быть назначены легкие противосудорожные препараты в том случае, если симптомы мешают пациенту при выполнении рутинных действий.
Так, если тремор определен как физиологический, то специализированной терапии не требуется. Могут быть назначены легкие противосудорожные препараты в том случае, если симптомы мешают пациенту при выполнении рутинных действий.
Если диагностирована болезнь Паркинсона, то применяют ряд препаратов, разработанных специально для лечения паркинсонизма. Основная цель лечения – остановить прогрессию заболевания и повысить качество жизни пациента.
Если причиной послужили алкогольная интоксикация, злоупотребление лекарственными средствами или наркотическая зависимость, то требуется отмена провоцирующего препарата. В случае с алкоголизмом и наркоманией, назначают лечение в сопровождении врача-нарколога. Обычно специального лечения тремора не требуется. При алкогольном треморе назначают витамины группы В.
Если диагностированы причины гормонального характера – то требуется коррекция соответствующими гормональными препаратами.
При хроническом нарушении кровообращения головного мозга применяют препараты для улучшения кровоснабжения тканей.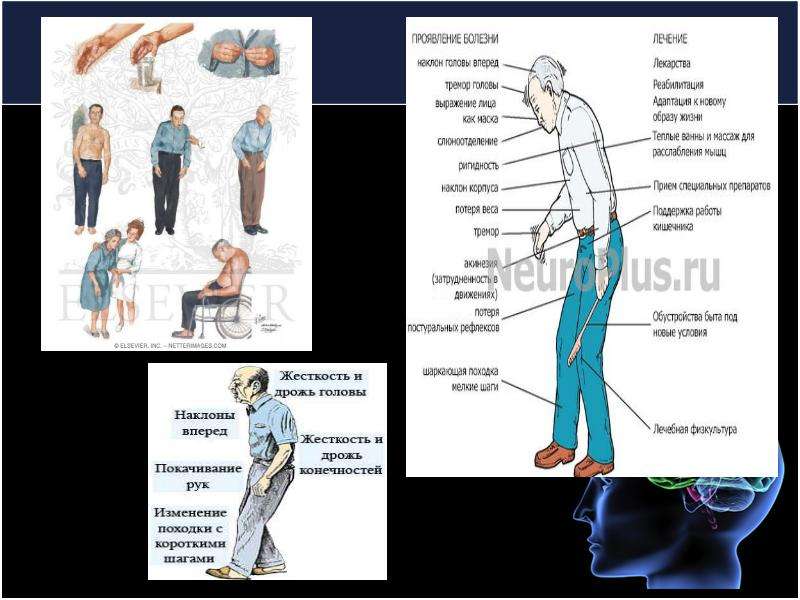
При несвоевременном оказании медицинской помощи (если затянуть обращение к врачу) тремор может привести к таким осложнениям как нарушение социальной адаптации, трудности на работе.
Профилактика заключается в отказе от курения и алкоголя, в профилактике сосудистых заболеваний. Но в большинстве случаев заболевания, связанные с тремором невозможно предотвратить – только вовремя начать лечение.
Это можно сделать с квалифицированными врачами многофункциональной клиники «ЦЭЛТ».
Тремор — это… Что такое Тремор?
Тре́мор (лат. tremor — дрожание) —
а) быстрые, ритмические, с частотой около 10 Гц., движения конечностей или туловища, вызванные мышечными сокращениями и связанные с временной задержкой корректирующей афферентной импульсации, в силу чего реализация движения и сохранение позы происходит за счет постоянной подстройки движений к какому-то среднему значению. При утомлении и сильных эмоциях, а также при патологии нервной системы тремор существенно усиливается. В частности, патологический тремор (тремор покоя) наблюдается при болезни Паркинсона.
При утомлении и сильных эмоциях, а также при патологии нервной системы тремор существенно усиливается. В частности, патологический тремор (тремор покоя) наблюдается при болезни Паркинсона.
б) фиксационные движения глаз, обладающие высокой частотой и малой амплитудой.
Феноменологическая классификация
- Тремор покоя — возникает в мышцах, находящихся в состоянии относительного покоя.
- Тремор действия (акционный тремор) — возникает при произвольном сокращении мышц.
- Постуральный (позный) тремор — возникает при удержании позы (например, тремор вытянутых рук).
- Кинетический тремор — возникает при движении.
- Интенционный тремор (от лат. intentio — намерение) — возникает при приближении к цели (например, попытке попасть пальцем в нос).
Этиопатогенетическая классификация
- Физиологический и усиленный (акцентуированный) физиологический тремор.
- Эссенциальный (семейный и спорадический).

- Паркинсонический тремор при болезни Паркинсона и синдрома паркинсонизма.
- Церебеллярный (мозжечковый).
- «Рубральный» (среднемозговой).
- Дистонический.
- Нейропатический.
- Психогенный.
- Ятрогенный (лекарственно индуцированный).
Этиология
Виды тремора
Физиологический тремор — это преимущественно постуральный тремор, появляющийся в руках или другой части тела (губы, шея и т.д.), обычно не ощущается человеком. Акцентуированный тремор может возникать на фоне тревоги, утомления, переохлаждения, алкогольной абстиненции, тиреотоксикозе, феохромоцитоме, гипогликемии, отравлении ртутью, свинцом, мышьяком, окисью углерода, а также под действием ряда лекарственных средств.
Лечение включает воздействие на основное заболевание, избегание провоцирующих факторов (таких, как кофе или чай).
Эссенциальный тремор — это постуральный и кинетический тремор, обычно наиболее выражен в руках, чаще двусторонний, хотя иногда бывает асимметричным, является наследственным. Вместе с руками нередко вовлекаются голова, голосовые связки.
Вместе с руками нередко вовлекаются голова, голосовые связки.
Паркинсонический тремор — это дрожание покоя, ослабевающее при движении, но усиливающееся в покое, при ходьбе и отвлечении внимания. Особенно характерен для болезни Паркинсона, но может проявляться и при других заболеваниях, проявляющихся синдромом паркинсонизма, например мультисистемной атрофии. Особенно часто наблюдается в руках, иногда вовлекаются ноги, подбородок, губы, но исключительно редко — голову. Часто бывает асимметричным и может довольно долго оставаться односторонним.
Мозжечковый тремор — это преимущественно интенционный тремор, но иногда, особенно при рассеянном склерозе, возникает и медленный постуральный тремор, вовлекающий туловище и проксимальные отделы конечностей, иногда голову.
Рубральный (мезенцефальный) тремор или тремор Холмса — это комбинация постурального и кинетического тремора с тремором покоя («тремор треморов»). Этот вид тремора чаще всего возникает при поражении среднего мозга, реже — таламуса.
Дистонический тремор — наблюдается у больных с генерализованной или фокальной дистонией и представляет собой фокальный, асимметричный тремор; часто он возникает на фоне дистонической позы и усиливается при попытке больного сопротивляться тоническому гиперкинезу, но уменьшается под действием корригирующих жестов.
Невропатический тремор — это постурально-кинетическое дрожание, нередко возникающее при полиневропатиях — наследственной моторно-сенсорной невропатии I типа (невральной амиотрофии Шарко-Мари-Тута), хронической воспалительной демиелинизирующей полирадикулоневропатии, диспротеинемической полиневропатии, реже при диабетической, уремической и порфирийной полиневропатиях.
См. также
Литература
- Д.Р. Штульман, О.С.Левин. Неврология. Справочник практического врача. // М. «Медпресс», 2008.
- Голубев В.Л., Вейн А.М. Неврологические синдромы // М. МЕДпресс-информ, 2007.
Ссылки
| Заболевания ЦНС | |
|---|---|
| Головной мозг Энцефалопатия |
|
| Головная боль | Мигрень • Кластерные головные боли • Сосудистая головная боль • Головная боль напряжения |
| Расстройства сна | Бессонница • Гиперсомния • Апноэ во сне • Нарколепсия • Катаплексия • Синдром Клейне — Левина • Нарушения цикличности сна и бодрствования |
| Двигательные и экстрапирамидные расстройства |
Дискинезия: Дистония • Хорея • Миоклония • Болезнь Унферрихта — Лундборга • Тремор (Эссенциальный тремор, Интенционный тремор) • Синдром беспокойных ног • Синдром мышечной скованности |
| Эпилептические припадки Эпилепсия |
Локализованная эпилепсия • Генерализованная эпилепсия • Эпилептический статус • Миоклоническая эпилепсия • Туберозный склероз |
| Деменция | Болезнь Альцгеймера • Лобно-височная деменция/Лобно-височная лобарная дегенерация • Мультиинфарктная деменция |
| Цереброваскулярные болезни | Преходящие нарушения мозгового кровообращения (Гипертензивный церебральный криз, Транзиторная ишемическая атака) • Дисциркуляторная энцефалопатия (Церебральный атеросклероз, Подкорковая атеросклеротическая энцефалопатия, Хроническая гипертоническая энцефалопатия) • Инсульт (Ишемический инсульт, Внутримозговое кровоизлияние, Субарахноидальное кровоизлияние) • Тромбоз синусов твёрдой мозговой оболочки (Тромбоз кавернозного синуса) |
| Воспалительные заболевания | Абсцесс головного мозга • Менингит • Арахноидит • Энцефалит • Менингоэнцефалит • Энцефалит Расмуссена • Клещевой энцефалит |
| Демиелинизирующие заболевания | Аутоиммунные заболевания (Рассеянный склероз, Оптикомиелит, Болезнь Шильдера) • Наследственные заболевания (Адренолейкодистрофия, Болезнь Краббе) • Центральный понтинный миелинолиз • Синдром Маркиафавы — Биньями • Синдром Альперса |
| Системная атрофия | Болезнь Пика • Болезнь Хантингтона • Спинномозговая атаксия Спинальная мышечная атрофия: Синдром Кеннеди • Спинальная мышечная атрофия у детей • Болезнь двигательного нейрона • Синдром Фацио-Лонде • Боковой амиотрофический склероз |
| Митохондриальные заболевания | Синдром Лея |
| Опухоли | Опухоль головного мозга • Туберозный склероз |
| Спинномозговая жидкость | Внутричерепная гипертензия • Отёк мозга • Внутричерепная гипотензия |
| Травмы | Черепно-мозговая травма (Сотрясение мозга, Ушиб головного мозга, Диффузное аксональное повреждение головного мозга) |
| Другие заболевания | Спинномозговая грыжа • Синдром Рея • Печёночная кома • Токсическая энцефалопатия • Гематомиелия |
| Спинной мозг Миелопатия |
|
| Воспалительные заболевания | Менингит • Арахноидит • Менингоэнцефалит • Миелит • Полиомиелит • Демиелинизирующие заболевания • Тропический спастический парапарез |
| Другие заболевания | Сирингомиелия • Сирингобульбия • Синдром Морвана • Сосудитая миелопатия • Спинальный инсульт • Сдавление спинного мозга • Энцефаломиелит |
Тремор рук — причины, диагностика и лечение
Причины тремора рук
Эссенциальный тремор
Частой причиной дрожания рук у взрослых является эссенциальный тремор. В его развитии предполагается роль гиперактивации нейронов мозжечка, базальных ядер, таламокортикальных связей. Заболевание обычно рассматривается как моносимптомное, его единственным проявлением становится тремор рук, возникающий при движении и поддержании позы (кинетико-постуральный). Это дрожание охватывает лучезапястные и пястно-фаланговые суставы, имеет частоту 8-10 Гц.
В его развитии предполагается роль гиперактивации нейронов мозжечка, базальных ядер, таламокортикальных связей. Заболевание обычно рассматривается как моносимптомное, его единственным проявлением становится тремор рук, возникающий при движении и поддержании позы (кинетико-постуральный). Это дрожание охватывает лучезапястные и пястно-фаланговые суставы, имеет частоту 8-10 Гц.
Наряду с тремором верхних конечностей у некоторых пациентов отмечается дрожание голоса, головы, реже – других участков тела. Проявления усиливаются при волнении, физическом и умственном напряжении, но уменьшаются после приема алкоголя. Со временем интенсивность дрожания может снижаться, а амплитуда увеличиваться. Иногда в клинической картине присутствуют мягкие неврологические симптомы: неустойчивость при ходьбе, феномен «зубчатого колеса», когнитивные расстройства.
Болезнь Паркинсона
Классический тремор при болезни Паркинсона возникает в покое, при полном расслаблении мышц, имеет частоту от 3 до 6 Гц. Чаще всего вовлекаются кисти, иногда – нижние конечности, подбородок, губы. Дрожание обусловлено дегенеративными изменениями в экстрапирамидной системе. Тремор рук асимметричный, по типу «счета монет» или «катания пилюль», исчезает с началом движения. За много лет до появления других симптомов может возникнуть постуральное дрожание.
Чаще всего вовлекаются кисти, иногда – нижние конечности, подбородок, губы. Дрожание обусловлено дегенеративными изменениями в экстрапирамидной системе. Тремор рук асимметричный, по типу «счета монет» или «катания пилюль», исчезает с началом движения. За много лет до появления других симптомов может возникнуть постуральное дрожание.
Кроме тремора рук типичными признаками болезни Паркинсона считаются замедленность движений (брадикинезия, гипомимия), мышечная ригидность. Характерна сгибательная поза больного, шаркающая походка и застывание при ходьбе. Немоторные симптомы представлены вегетативными, психическими, чувствительными и иными расстройствами. Пациенты страдают от когнитивных нарушений, депрессии, апатии. Среди частых проявлений присутствует нарушение глотания, приводящее к аспирации пищи.
Эндокринно-обменные расстройства
В генезе дрожательного гиперкинеза большое значение имеет гиперчувствительность центральных адренергических рецепторов, что влечет за собой нарушение контроля над периферическими механизмами регуляции мышечного напряжения. Усиление симпатической стимуляции с развитием тремора наблюдается на фоне тиреотоксикоза, гипогликемии. Такой же механизм включается при заболеваниях надпочечников – феохромоцитоме, болезни Аддисона.
Усиление симпатической стимуляции с развитием тремора наблюдается на фоне тиреотоксикоза, гипогликемии. Такой же механизм включается при заболеваниях надпочечников – феохромоцитоме, болезни Аддисона.
Причиной поражения нервной системы при гиперпаратиреозе становится отложение кальция в базальных ганглиях. Там же накапливается медь у детей с болезнью Галлервордена-Шпатца и Вильсона-Коновалова, что провоцирует нейродегенерацию. В этих случаях возникают различные виды тремора, включая «хлопающий» (астериксис), которые сочетаются с мышечной ригидностью, неустойчивостью при ходьбе, дизартрией. Прогрессируют психические нарушения, деменция. Для болезни Вильсона характерна печеночная недостаточность.
Очаговая патология ЦНС
Тремор рук наблюдается при очаговом поражении мозжечка или ствола мозга. Он представляет собой низкочастотное (3-5 Гц) крупноразмашистое дрожание проксимальных отделов конечностей, возникающее в начале движения и усиливающееся по мере приближения к цели. Интенционный терминальный тремор может дополняться различными видами постурального. Такие изменения провоцируются следующими патологиями ЦНС:
Тремор возникает сразу после ОНМК или спустя некоторое время (недели, месяцы). При поражении среднего мозга он сопровождается атаксией и другими гиперкинезами, при вовлечении пирамидного пути – гемипарезом. Очаг в лобной доле может привести к развитию изолированного писчего тремора с вращательными движениями кисти, а геморрагии или опухоли теменно-затылочной области – кинетического дрожания.
Наследственная патология
Тремором проявляются некоторые наследственные заболевания нервной системы. Двустороннее дрожание рук в покое характерно для синдрома сенситивной атаксии, невропатии, дизартрии и офтальмоплегии (SANDO). Симптоматика дополняется нестабильностью походки, глазодвигательными нарушениями, деменцией. У лиц, страдающих синдромом ломкой X-хромосомы (FXTAS), отмечается интенционный тремор рук, мозжечковая атаксия, полинейропатия.
Для амиотрофии Кеннеди, имеющей X-сцепленное рецессивное наследование, типичен тремор, судороги при физической нагрузке, мелкие фасцикуляции в проксимальных отделах конечностей. Постепенно снижается сила мышц, они уменьшаются в объеме. Среди неврологических симптомов присутствуют бульбарные нарушения (дизартрия, дисфагия), картина дополняется эндокринными расстройствами – гинекомастией, тестикулярной атрофией.
Полинейропатии
Периферический механизм формирования тремора задействуется при полинейропатиях. Задержка передачи чувствительных импульсов от проприорецепторов сначала приводит к избыточному сокращению мышц-антагонистов, а затем сопровождается осцилляторными колебаниями в обоих направлениях. Нейропатический тремор рук обычно является постурально-кинетическим и возникает при широком спектре патологических состояний:
Интоксикации
Токсические вещества способствуют активации не только периферических механизмов тремора – вредное воздействие реализуется через поражение нейрональных структур экстрапирамидной системы. В основе патологического процесса лежит нарушение генерации и проведения импульса, расстройство энергетического и пластического обмена. Нейротоксичностью обладают следующие соединения:
- Тяжелые металлы: ртуть, свинец, мышьяк.
- Газообразные вещества: угарный газ, сероуглерод.
- Растительные алкалоиды: гармин, эрготамин, кодеин.
Другой механизм развития тремора наблюдается при абстинентном синдроме, вызванном прекращением приема алкоголя, синдроме отмены других психоактивных веществ (опиоидов, транквилизаторов). Дрожание появляется из-за стимуляции симпатической нервной системы, сочетается с вегетативно-соматическими и психическими нарушениями. Многие из этих симптомов схожи с постинтоксикационным состоянием.
Побочные эффекты препаратов
Широко известен медикаментозный тремор рук, вызванный приемом лекарств. Некоторые препараты способны вызывать дозозависимое усиление физиологического дрожания, исчезающее после их отмены. Нейрохимические механизмы тремора связаны с воздействием на центральные холинергическую и моноаминергическую или периферическую адренергическую системы. Побочный эффект в виде дрожания имеют следующие медикаменты:
- Адрено- и симпатомиметики: эпинефрин, изопреналин, сальбутамол.
- Антиаритмические: мексилетин, амиодарон, новокаинамид.
- Антидепрессанты: трициклические (амитриптилин), ингибиторы МАО (моклобемид, селегилин).
- Метилксантины: кофеин, эуфиллин, теофиллин.
- Антигистаминные: дифенгидрамин, хлоропирамин, пиперазин.
- Противосудорожные: фенитоин, соли лития, вальпроаты.
- Антагонисты кальция: нифедипин, флунаризин, циннаризин.
Частой патологией является нейролептический паркинсонизм, возникающий при лечении антипсихотическими препаратами из-за блокады дофаминовых рецепторов в нигростриарных структурах. Схожим образом действуют метоклопрамид, центральные симпатолитики (резерпин), ингибиторы обратного захвата серотонина (флуоксетин). При лекарственном паркинсонизме отмечается постурально-кинетический тремор рук, который относительно быстро нарастает, купируется после отмены препаратов.
Диагностика
Выявить причину тремора рук удается по результатам комплексного обследования. На первичном этапе врач-невролог соотносит клиническую симптоматику с диагностическими критериями и выносит предварительное заключение, но в определении источника нарушений без дополнительных исследований обойтись практически невозможно. При дрожательном гиперкинезе рекомендуются следующие процедуры:
- Лабораторные тесты. Для исключения эндокринных заболеваний исследуют спектр гормонов (тиреоидных, кортикостероидов, инсулина). В биохимическом анализе крови оценивают почечные пробы (мочевину, креатинин), острофазовые показатели, концентрацию церулоплазмина. Токсикологическая экспертиза помогает выявить вредные вещества, при нейроинфекциях проводят серологическую диагностику, анализ ликвора.
- Томографию. Признаки очагового или диффузного поражения ЦНС являются показанием для выполнения КТ или МРТ мозга. Методами нейровизуализации диагностируют опухоли, гематомы, инсульты. При наследственных заболеваниях определяют атрофию мозжечка, демиелинизацию белого вещества. ПЭТ-КТ указывает на локализацию функциональных нарушений. Сосудистое поражение подтверждают МР-ангиографией.
- Треморографию. Для оценки активности мышц-антагонистов применяют треморографию с акселерометрическим или электромиографическим методами регистрации. По данным ЭМГ определяют частоту и паттерн сокращений, влияние когнитивной нагрузки, предполагают наличие центрального осциллятора. Блок нервно-мышечного проведения говорит о наличии нейропатии.
Некоторые авторы предлагают для диагностики ранних стадий болезни Паркинсона исследовать частотно-временные свойства сигналов ЭЭГ. При эндокринной патологии назначают УЗИ щитовидной железы и надпочечников, увидеть смещение срединных структур при объемных процессах можно с помощью эхоэнцефалографии. Врачу приходится дифференцировать между собой различные заболевания, сопровождающиеся тремором, и отличать его от других гиперкинезов.
Лечение
Консервативная терапия
Тактика лечения тремора рук определяется его причиной. Усиленное физиологическое дрожание купируется устранением провоцирующего фактора, но патологические варианты требуют активной терапии. Медикаментозная коррекция имеет преимущественно симптоматический или патогенетический характер. Чем лечить тремор рук в конкретном случае, определяет врач. Исходя из клинической ситуации, используют медикаменты нескольких групп:
- Бета-блокаторы. Препаратами первой линии для лечения эссенциального и других разновидностей тремора являются неселективные бета-блокаторы (пропранолол, соталол). Их применяют под контролем ЧСС с постепенным повышением дозы. При бронхоспастическом синдроме назначают препараты селективного действия (атенолол, надолол).
- Противопаркинсонические. В лечении паркинсонического тремора рук используют весь спектр специфических медикаментов. Если симптомы плохо реагируют на действие леводопы, схему терапии дополняют агонистами дофаминовых рецепторов (прамипексолом, пирибедилом), препаратами амантадина. В резистентных случаях иногда помогает клозапин.
- Противоэпилептические. Активность центральных осцилляторов может быть уменьшена противосудорожными средствами. При треморе рук чаще всего назначают примидон, габапентин, топирамат. Возможной эффективностью при корковых и мозжечковых видах дрожания обладают клоназепам, карбамазепин.
Для устранения отдельных видов тремора необходима нормализация эндокринно-обменных процессов, ликвидация инфекционных факторов. При отравлениях проводят интенсивную детоксикационную терапию инфузионными растворами, сорбентами, антидотами. Физические способы коррекции включают применение ортезов, ограничивающих движения кистью, лечебной гимнастики, массажа. На ранних стадиях минимизировать дискомфорт позволяют авторучки и столовые приборы с толстыми рукоятками.
Хирургическое лечение
Пациентам с выраженным тремором, плохо поддающимся фармакотерапии, предлагают провести хирургическое вмешательство. Стереотаксические операции показаны при очаговой патологии ЦНС, представлены криоталамотомией и другими вариантами деструкции таламических ядер. Подавить дрожание помогает глубокая электростимуляция базальных ганглиев. Устранить непосредственную причину тремора можно удалением объемных образований, ликвидацией последствий черепно-мозговых травм.
Лечение тремора в Израиле — Медицинский центр Шиба
Другим вариантом является глубокая стимуляция головного мозга (DBS). В то время как при глубокой стимуляции головного мозга существует не так много побочных эффектов, как при таламотомии, она по-прежнему связана с хирургическим вмешательством. Для того, чтобы направить тепло в области, вызывающие эссенциальный тремор глубоко в мозг помещаются электроды. К недостаткам можно отнести инвазивную операцию и необходимость регулярной замены батареи.
Недавно медицинские исследования предоставили еще одну возможность лечения — терапия фокусированным ультразвуком (ФУЗ). Лечение фокусированным ультразвуком одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, но по-прежнему доступно только в очень немногих учреждениях США. Медицинский центр имени Хаима Шибы предлагает пациентам, страдающим от ЭТ это современное лечение с его многочисленными преимуществами.
Во-первых, ФУЗ — неинвазивный метод лечения. Не требуются никакие электроды или хирургическое вмешательство. Доктор Саймон Исраэли -Корн, специалист по двигательным расстройствам и врач-специалист в отделении Неврологии Медицинского центра имени Хаима Шибы кратко описывает процедуру:
«Пациент видит нож только когда ему бреют голову».
ФУЗ использует фокусированные ультразвуковые волны для точной абляции или уничтожения желаемой области главного мозга. Это позволяет контролировать ЭТ без риска заражения и не требует хирургического вмешательства. Как сказал доктор Исраэли -Корн: «Это довольно футуристическое и удивительное зрелище».
Кроме того, ФУЗ выполняется с помощью визуального контроля МРТ. Обе эти технологии не производят излучения, в отличие от компьютерной томографии и рентгеновских лучей. Это еще больше снижает риск для пациента.
Для терапии ФУЗ не существует никаких возрастных ограничений. К каждому пациенту применяется индивидуальный подход. Несмотря на то, что лечение с помощью ФУЗ может не подойти каждому пациенту, этот новый вид терапии дает надежду миллионам людей, страдающим от эссенциального тремора.
Коварный мозг. Почему гибнут «черные» нейроны и как это остановить
https://ria.ru/20200611/1572643126.html
Коварный мозг. Почему гибнут «черные» нейроны и как это остановить
Коварный мозг. Почему гибнут «черные» нейроны и как это остановить — РИА Новости, 11.06.2020
Коварный мозг. Почему гибнут «черные» нейроны и как это остановить
В мире, по разным данным, от десяти до шестнадцати миллионов человек страдают болезнью Паркинсона, и ВОЗ прогнозирует, что к середине века этот показатель как… РИА Новости, 11.06.2020
2020-06-11T08:00
2020-06-11T08:00
2020-06-11T17:00
наука
сша
тайвань
воз
российская академия наук
здоровье
дальний восток
биология
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/07e4/05/0e/1571456949_0:0:1440:810_1920x0_80_0_0_67ebf7bc435b36961f201d818ef78899.jpg
МОСКВА, 11 июн — РИА Новости, Татьяна Пичугина. В мире, по разным данным, от десяти до шестнадцати миллионов человек страдают болезнью Паркинсона, и ВОЗ прогнозирует, что к середине века этот показатель как минимум удвоится. Патология развивается незаметно долгие годы, затем быстро прогрессирует, сокращая продолжительность жизни. Этот недуг неизлечим, поэтому крайне важно диагностировать его как можно раньше.Нейроны и дофаминВ среднем мозге есть группа нейронов, богатых темным пигментом нейромеланином, — черная субстанция. Их отростки достигают других отделов мозга, в первую очередь стриатума (полосатого тела). Здесь они выделяют дофамин — сигнальную молекулу, регулирующую работу мышц. Если его синтез и обмен в норме, мышцы своевременно сокращаются и расслабляются, нет — их тонус повышен.Гибель нейронов в черной субстанции ведет к постоянной нехватке дофамина и, как следствие, тяжелому нарушению двигательной функции — болезни Паркинсона. Ее симптомы — проблемы с координацией, скованность движений, замедленность, сутулость, тремор конечностей.Заболевание быстро прогрессирует, лечению не поддается, заместительная терапия лишь временно улучшает состояние. Человек постепенно превращается в инвалида, его ждет преждевременная смерть. Болезнью Паркинсона страдали многие известные люди — в том числе американский боксер Мухаммед Али, советский актер Михаил Ульянов, папа римский Иоанн Павел II. Недавно об этом диагнозе сообщил британский рок-певец Оззи Осборн.Сложности ранней диагностикиНекоторые признаки болезни Паркинсона проявляются за несколько лет до явного нарушения движений. Пропадает обоняние, в фазе быстрого сна человек сбрасывает предметы с тумбочки, задевает спящего рядом, может свалиться с верхней полки в поезде. Каждый из этих симптомов характерен для множества патологий, но в совокупности они указывают на скрытое течение болезни Паркинсона (домоторную фазу).Уточнение диагноза занимает несколько месяцев или даже лет. В спорных случаях прибегают к позитронно-эмиссионной (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОФЭКТ).»Вводим в организм радиоизотопные препараты, они включаются в метаболизм нейронов, синтезирующих дофамин. Сканируем мозг и смотрим, как идет синтез. Эти методы позволяют поставить диагноз за несколько лет до двигательных нарушений», — рассказывает профессор, член-корреспондент РАН Сергей Иллариошкин, руководитель отдела исследований мозга Научного центра неврологии.Правда, сделать ПЭТ и ОФЭКТ удается очень редко: эти процедуры главным образом предназначены для онкологии. Более доступны транскраниальная сонография (УЗИ головного мозга) и МРТ на аппаратах с высокой интенсивностью магнитного поля, тоже фиксирующие признаки деградации черной субстанции. Однако у всей нынешней диагностики болезни Паркинсона общая проблема — она эффективна только в сочетании с клиническими симптомами.Как любая нейродегенеративная патология, связанная с гибелью определенной группы нейронов, болезнь Паркинсона очень коварна. Все начинается в относительно молодом возрасте и медленно развивается долгие годы, не давая о себе знать. Виной тому — исключительная пластичность мозга. Чтобы компенсировать потерю нервных клеток, оставшиеся работают активнее — больше генерируют дофамина, нейроны-мишени становятся чувствительнее к нему, и только когда все возможности исчерпаны, нервная система выходит из строя с очевидными симптомами.»Клиника возникает после гибели 50-55% клеток в черной субстанции. Лечить уже поздно. Поэтому и превентивная терапия, такая как антиоксиданты и прочее, неэффективна. Ее надо применять, пока погибло не больше 15-20% нейронов. Но как распознать патологию на этой стадии? Отсюда идея биомаркеров — веществ в организме, указывающих на патогенный процесс или предрасположенность к нему задолго до клинических симптомов», — объясняет профессор.РНК как биомаркеры «Одна из серьезных проблем любой нейродегенеративной патологии в том, что для исследования доступна, по сути, только кровь пациентов. Конечно, много работ с мозгом умерших, но искать там маркеры ранней стадии заболевания не очень правильно после многих лет болезни, ее активного лечения, на фоне других частых, характерных для пожилого возраста заболеваний — сердечно-сосудистых, рака», — говорит доктор биологических наук Петр Сломинский, заведующий лабораторией молекулярной генетики наследственных болезней в Институте молекулярной генетики РАН.Его группа ищет в крови пациентов молекулы — предвестники болезни Паркинсона: микро-РНК, мРНК.»Гибель нейронов в черной субстанции сопровождают выраженные изменения в экспрессии генов, и мы предполагаем, что то же самое происходит в клетках крови. Гипотеза основана на том, что в лимфоцитах периферической крови экспрессируется ряд генов, связанных с обменом дофамина», — уточняет ученый.Расчет на то, что гематоэнцефалический барьер — условная граница, запрещающая обмен веществами между мозгом и остальным организмом, — не такой уж непроницаемый и деградация черной субстанции как-то отзовется в периферической крови. Задача — определить группу генов, которые по-разному действуют у больных и здоровых, сравнив их транскриптом — всей совокупностью РНК клеток.»Для такого исследования особенно подходят образцы крови людей на самой начальной стадии заболевания — до лечения, возможно, влияющего на экспрессию генов. Поэтому пробы берут у пациентов с диагнозом «предполагаемая болезнь Паркинсона» и, через несколько месяцев, — у тех, кому диагноз подтвердили», — продолжает он.Чтобы создать полноценную панель биомаркеров, нужно много образцов. Идеально было бы наблюдать большую группу людей, регулярно тестировать, выявлять группы риска и потом сравнивать с теми, у кого диагностируют болезнь, а это один процент среди лиц старше 60 лет, независимо от места проживания, этнического происхождения. Поэтому исследование должно быть длительным — необходимо следить за состоянием человека как минимум несколько лет.Проблема еще и в том, что анализы микро-РНК и мРНК пока неудобны для профилактического скрининга в клинических лабораториях. Требуется ПЦР, а это время, достаточно дорогое оборудование, трудоемкие процедуры. Надежда на то, что когда специфичные для болезни Паркинсона молекулы найдут, появятся и доступные методы их исследования — с учетом того, какой мощный рывок происходит сейчас по экспресс-тестам РНК-содержащих вирусов.Хор генетических мутацийВ мозге много белка альфа-синуклеина, который участвует в обмене сигналами между нервными клетками, но все его функции не до конца понятны. В здоровых нейронах этот белок, отработав, разрушается, при патологии же накапливается, его длинные нити — фибриллы слипаются в конгломераты (тельца Леви) и становятся токсичными. Мутация в гене альфа-синуклеина приводит к одной из наследственных форм болезни Паркинсона.Примерно в одном случае из десяти у этой патологии генетические причины. Чаще всего это мутации в генах LRRK2 или PARK8, кодирующих соответственно белки дардарин и паркин. Они вовлечены в многие биохимические процессы в разных типах клеток, но почему-то сбой в них оборачивается образованием телец Леви и гибелью в первую очередь дофаминергических нейронов в черной субстанции.»Очевидно, белок альфа-синуклеин важен для патологии, но в нем ли первопричина? Есть заболевания, когда он тоже откладывается, например слабоумие с тельцами Леви, — вступает в разговор доктор биологических наук Мария Шадрина, коллега и соавтор Сломинского. — Тут немало параллелей с болезнью Альцгеймера, которая встречается несколько чаще, чем Паркинсона. Там также гибнут нейроны определенного типа, холинергические в гиппокампе, а в мозге накапливается белок бета-амилоид. И эта болезнь скрытно развивается много лет, прежде чем у человека ослабеют память и другие когнитивные функции».В гипотезах, объясняющих возникновение обеих болезней, недостатка нет. Это и нейровоспаление, запускаемое перенесенной в молодости вирусной инфекцией, и нейротоксины в окружающей среде, например гербициды, и модный сейчас микробиом кишечника, который подозревают в порче альфа-синуклеина.Проверить все это в эксперименте не так-то просто. Грызуны — излюбленные лабораторные модели биологов — не болеют Паркинсоном.»Чтобы имитировать болезнь, мыши вводят токсин и уже через шесть часов наблюдают гибель нейронов в черной субстанции, резкое снижение дофамина. У человека эта стадия длится десятки лет. С другой стороны, на грызунах можно промоделировать наследственные формы заболевания, введя в геном мутации», — поясняет Сломинский.Эксперимент с близнецамиСейчас ученым представился уникальный шанс — среди пациентов на Дальнем Востоке нашли троих с монозиготными близнецами, не болеющими болезнью Паркинсона.»Они росли вместе, живут в одном регионе, работа не связана с токсинами. ДНК идентичные, так что если и есть генетическая предрасположенность, то на нее наложились другие факторы», — говорит Мария Шадрина.Задача — проанализировать транскриптом близнецов, найти гены, которые экспрессируются у них по-разному, установить регулирующие их микро-РНК и связать с болезнью Паркинсона. Однако вопрос о первопричинах патологии остается открытым.»Одно из объяснений — митохондриальный геном, который передается от матери. У близнецов он разный. Митохондрии размножаются в клетке простым делением и быстро мутируют. Как раз изменение в энергетике клетки, за которую отвечают митохондрии, — один из признаков болезни Паркинсона, — приводит пример Сергей Иллариошкин. Он не исключает и того, что у второго близнеца болезнь проявится позднее. — Мы можем проверить его на ПЭТ, сделать ЭЭГ-видеополисомнографию, чтобы посмотреть реакции в фазе быстрого сна, оценить структуру нигросомы (скопления дофаминовых нейронов) по данным 3-Тесла МРТ в новом режиме. Не исключено, что болезнь уже развивается. Такие примеры есть». Как растят нейроныПлюрипотентные стволовые клетки также позволяет исследовать болезнь Паркинсона. Фактически это зародыши, способные превратиться в любой вид зрелых клеток, в том числе нейроны.Раньше стволовые клетки брали из абортивного материала, плаценты. Теперь, благодаря открытию японского ученого Синьи Яманаки, их можно получить из ткани взрослого человека. Надо немного похимичить в лаборатории, чтобы искусственно состарить, и пожалуйста — зрелые нейроны в чашке Петри. Других вариантов взять их у живого пациента нет.»Мы создали первую в России коллекцию клеточных линий от пятидесяти пациентов с болезнью Паркинсона. От трех уже есть индуцированные плюрипотентные стволовые клетки. Имеются и трансгенные нейроны, в ДНК которых с помощью системы CRISPR-Cas9 вставили биосенсоры. Они подсвечивают разные процессы на клеточном уровне, например накопление активных форм кислорода», — рассказывает Сергей Медведев из лаборатории эпигенетики развития Института цитологии и генетики СО РАН.Вместе с коллегами из Новосибирского института органической химии им. Н. Н. Ворожцова и Международного томографического центра СО РАН они на таких искусственных нейронах черной субстанции испытают потенциальные лекарства, замедляющие их гибель, ищут генетические факторы болезни и биомаркеры.Нагрузочный тест»Еще ни одного человека не вылечили от болезни Паркинсона. Мы не можем остановить гибель нейронов, потому что не знаем причины. А их может быть огромное количество. Стратегия борьбы направлена на раннюю диагностику и превентивную нейропротекторную терапию, чтобы максимально замедлить процесс. Идеально, если порог гибели нейронов, при котором проявляются клинические симптомы, — это потеря 70-80 процентов дофамина, наступит в возрасте 120-150 лет. Человек будет болеть, но качество жизни останется приемлемым», — рассуждает академик Михаил Угрюмов, заведующий лабораторией нервных и нейроэндокринных регуляций Института биологии развития имени Н. К. Кольцова РАН.В его лаборатории получают мышей с самой ранней стадией болезни Паркинсона. Затем в их крови ищут совпадения с потенциальными биомаркерами, обнаруженными в крови пациентов с подтвержденным диагнозом.»Известны десятки биомаркеров и ни одного специфичного, поскольку находим их и при других заболеваниях. В любом случае нужно использовать набор маркеров, но даже по ним диагноз все равно не будет окончательным», — отмечает исследователь.Он предлагает создать нагрузочный тест для выявления болезни. В психиатрии и неврологии этот подход не используют, а в других областях медицины — вполне. Например, есть тест толерантности к глюкозе при диагностике сахарного диабета.Ученые уже подобрали вещество, которое блокирует синтез дофамина в мозге и дозу, временно усиливающую симптомы при патологии, без побочных эффектов. Эксперименты на мышах прошли успешно, теперь вместе коллегами из Тайваня исследователи готовят испытания на приматах.»Есть основания считать, что эта диагностика будет специфична», — подчеркивает академик.Неудача клеточных технологийВ отличие от клеток кожи или крови, нейроны в головном мозге не возобновляются. Они образуются у эмбриона в возрасте от восьми до 15 недель. По мере старения организма гибнут: в среднем каждые десять лет мозг лишается четырех процентов нервных клеток.При нейродегенеративном заболевании, по неизвестным пока причинам, скорость гибели нейронов увеличивается в разы. И хотя в гиппокампе и стриатуме есть стволовые клетки-предшественники, доказать, что они замещают погибшие, не удалось.В начале 1990-х с развитием клеточных технологий возникла идея пересаживать пациентам донорские здоровые нейроны.»Шведский профессор Андрес Бьорклунд провел эксперименты на мышах, у которых нейротоксинами вызывали болезнь Паркинсона. Однако пересаженные от здорового животного нейроны погибали. Тогда он пересадил больным грызунам нейроны от эмбриона, и у них восстановилось поведение. Это был триумф», — вспоминает Михаил Угрюмов.На этой волне Бьорклунд запустил в ЕС программу клинических испытаний клеточных технологий для лечения болезни Паркинсона. В ней участвовали шесть стран. Угрюмов руководил научной группой из России. Всего у нас выполнили 13 операций по пересадке нейронов.»Брали абортивный материал, вырезали ту область мозга, где должны были сформироваться дофаминергические нейроны, делали суспензию и вводили пациенту туда, где был дефицит дофамина. Операция нетравматичная, под местной анестезией. За десять лет во всех европейских странах — участницах консорциума собрали большой материл. Состояние пациентов улучшалось, но через полгода болезнь возвращалась», — говорит ученый.В США получили те же результаты. Усовершенствование клеточных технологий ситуацию не изменило.»Везде применяют одну методологию: испытывают терапию на грызунах, потом на людях. Картина общая: стопроцентный успех на животных, никакого стойкого эффекта на людях», — резюмирует академик.Мозг человека слишком сложно устроен, полагает он. Нейроны нельзя пересадить в черную субстанцию, где для них подходящая окружающая среда, потому что во взрослом мозге они не смогут прорасти в другой отдел. Поэтому их имплантируют сразу туда, где требуется дофамин, — в стриатум.Мозг мыши залит разными сигнальными веществами, все нейроны работают в этом коктейле. У человека нейроны специализированы, у них свои сигнальные вещества, причем доставка их должна быть направленной. Нейрон управляется не по всей поверхности, а в точках — синаптических контактах. И каждый связан с десятью-пятнадцатью тысячами других строго определенных нейронов. Все это должна заново сформировать клетка, которую пересадили. В ближайшие лет пятьдесят, по мнению Михаила Угрюмова, эта задача, скорее всего, неразрешима.
https://ria.ru/20200121/1563686276.html
https://ria.ru/20180411/1518342108.html
https://ria.ru/20200605/1572536474.html
https://ria.ru/20200514/1571367164.html
https://ria.ru/20191122/1561496320.html
https://ria.ru/20200526/1572006965.html
https://ria.ru/20200112/1563266949.html
сша
тайвань
дальний восток
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/07e4/05/0e/1571456949_180:0:1260:810_1920x0_80_0_0_abdde4f94106d6b2c6b1a05f7ecbcd11.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
сша, тайвань, воз, российская академия наук, здоровье, дальний восток, биология, генетика, болезнь паркинсона
МОСКВА, 11 июн — РИА Новости, Татьяна Пичугина. В мире, по разным данным, от десяти до шестнадцати миллионов человек страдают болезнью Паркинсона, и ВОЗ прогнозирует, что к середине века этот показатель как минимум удвоится. Патология развивается незаметно долгие годы, затем быстро прогрессирует, сокращая продолжительность жизни. Этот недуг неизлечим, поэтому крайне важно диагностировать его как можно раньше.Нейроны и дофамин
В среднем мозге есть группа нейронов, богатых темным пигментом нейромеланином, — черная субстанция. Их отростки достигают других отделов мозга, в первую очередь стриатума (полосатого тела). Здесь они выделяют дофамин — сигнальную молекулу, регулирующую работу мышц. Если его синтез и обмен в норме, мышцы своевременно сокращаются и расслабляются, нет — их тонус повышен.
Гибель нейронов в черной субстанции ведет к постоянной нехватке дофамина и, как следствие, тяжелому нарушению двигательной функции — болезни Паркинсона. Ее симптомы — проблемы с координацией, скованность движений, замедленность, сутулость, тремор конечностей.
Заболевание быстро прогрессирует, лечению не поддается, заместительная терапия лишь временно улучшает состояние. Человек постепенно превращается в инвалида, его ждет преждевременная смерть. Болезнью Паркинсона страдали многие известные люди — в том числе американский боксер Мухаммед Али, советский актер Михаил Ульянов, папа римский Иоанн Павел II. Недавно об этом диагнозе сообщил британский рок-певец Оззи Осборн.Сложности ранней диагностики
Некоторые признаки болезни Паркинсона проявляются за несколько лет до явного нарушения движений. Пропадает обоняние, в фазе быстрого сна человек сбрасывает предметы с тумбочки, задевает спящего рядом, может свалиться с верхней полки в поезде. Каждый из этих симптомов характерен для множества патологий, но в совокупности они указывают на скрытое течение болезни Паркинсона (домоторную фазу).
Уточнение диагноза занимает несколько месяцев или даже лет. В спорных случаях прибегают к позитронно-эмиссионной (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОФЭКТ).
«Вводим в организм радиоизотопные препараты, они включаются в метаболизм нейронов, синтезирующих дофамин. Сканируем мозг и смотрим, как идет синтез. Эти методы позволяют поставить диагноз за несколько лет до двигательных нарушений», — рассказывает профессор, член-корреспондент РАН Сергей Иллариошкин, руководитель отдела исследований мозга Научного центра неврологии.
21 января 2020, 18:15КультураУ Оззи Осборна диагностировали болезнь ПаркинсонаПравда, сделать ПЭТ и ОФЭКТ удается очень редко: эти процедуры главным образом предназначены для онкологии. Более доступны транскраниальная сонография (УЗИ головного мозга) и МРТ на аппаратах с высокой интенсивностью магнитного поля, тоже фиксирующие признаки деградации черной субстанции. Однако у всей нынешней диагностики болезни Паркинсона общая проблема — она эффективна только в сочетании с клиническими симптомами.
Как любая нейродегенеративная патология, связанная с гибелью определенной группы нейронов, болезнь Паркинсона очень коварна. Все начинается в относительно молодом возрасте и медленно развивается долгие годы, не давая о себе знать. Виной тому — исключительная пластичность мозга. Чтобы компенсировать потерю нервных клеток, оставшиеся работают активнее — больше генерируют дофамина, нейроны-мишени становятся чувствительнее к нему, и только когда все возможности исчерпаны, нервная система выходит из строя с очевидными симптомами.
«Клиника возникает после гибели 50-55% клеток в черной субстанции. Лечить уже поздно. Поэтому и превентивная терапия, такая как антиоксиданты и прочее, неэффективна. Ее надо применять, пока погибло не больше 15-20% нейронов. Но как распознать патологию на этой стадии? Отсюда идея биомаркеров — веществ в организме, указывающих на патогенный процесс или предрасположенность к нему задолго до клинических симптомов», — объясняет профессор.
РНК как биомаркеры
«Одна из серьезных проблем любой нейродегенеративной патологии в том, что для исследования доступна, по сути, только кровь пациентов. Конечно, много работ с мозгом умерших, но искать там маркеры ранней стадии заболевания не очень правильно после многих лет болезни, ее активного лечения, на фоне других частых, характерных для пожилого возраста заболеваний — сердечно-сосудистых, рака», — говорит доктор биологических наук Петр Сломинский, заведующий лабораторией молекулярной генетики наследственных болезней в Институте молекулярной генетики РАН.
Его группа ищет в крови пациентов молекулы — предвестники болезни Паркинсона: микро-РНК, мРНК.
«Гибель нейронов в черной субстанции сопровождают выраженные изменения в экспрессии генов, и мы предполагаем, что то же самое происходит в клетках крови. Гипотеза основана на том, что в лимфоцитах периферической крови экспрессируется ряд генов, связанных с обменом дофамина», — уточняет ученый.
11 апреля 2018, 08:00НаукаЛишенные «гормона счастья»: что известно о болезни ПаркинсонаРасчет на то, что гематоэнцефалический барьер — условная граница, запрещающая обмен веществами между мозгом и остальным организмом, — не такой уж непроницаемый и деградация черной субстанции как-то отзовется в периферической крови. Задача — определить группу генов, которые по-разному действуют у больных и здоровых, сравнив их транскриптом — всей совокупностью РНК клеток.
«Для такого исследования особенно подходят образцы крови людей на самой начальной стадии заболевания — до лечения, возможно, влияющего на экспрессию генов. Поэтому пробы берут у пациентов с диагнозом «предполагаемая болезнь Паркинсона» и, через несколько месяцев, — у тех, кому диагноз подтвердили», — продолжает он.
Чтобы создать полноценную панель биомаркеров, нужно много образцов. Идеально было бы наблюдать большую группу людей, регулярно тестировать, выявлять группы риска и потом сравнивать с теми, у кого диагностируют болезнь, а это один процент среди лиц старше 60 лет, независимо от места проживания, этнического происхождения. Поэтому исследование должно быть длительным — необходимо следить за состоянием человека как минимум несколько лет.
Проблема еще и в том, что анализы микро-РНК и мРНК пока неудобны для профилактического скрининга в клинических лабораториях. Требуется ПЦР, а это время, достаточно дорогое оборудование, трудоемкие процедуры. Надежда на то, что когда специфичные для болезни Паркинсона молекулы найдут, появятся и доступные методы их исследования — с учетом того, какой мощный рывок происходит сейчас по экспресс-тестам РНК-содержащих вирусов.
5 июня 2020, 18:00НаукаУченые обосновали необходимость еще одного теста при COVID-19Хор генетических мутаций
В мозге много белка альфа-синуклеина, который участвует в обмене сигналами между нервными клетками, но все его функции не до конца понятны. В здоровых нейронах этот белок, отработав, разрушается, при патологии же накапливается, его длинные нити — фибриллы слипаются в конгломераты (тельца Леви) и становятся токсичными. Мутация в гене альфа-синуклеина приводит к одной из наследственных форм болезни Паркинсона.
Примерно в одном случае из десяти у этой патологии генетические причины. Чаще всего это мутации в генах LRRK2 или PARK8, кодирующих соответственно белки дардарин и паркин. Они вовлечены в многие биохимические процессы в разных типах клеток, но почему-то сбой в них оборачивается образованием телец Леви и гибелью в первую очередь дофаминергических нейронов в черной субстанции.
«Очевидно, белок альфа-синуклеин важен для патологии, но в нем ли первопричина? Есть заболевания, когда он тоже откладывается, например слабоумие с тельцами Леви, — вступает в разговор доктор биологических наук Мария Шадрина, коллега и соавтор Сломинского. — Тут немало параллелей с болезнью Альцгеймера, которая встречается несколько чаще, чем Паркинсона. Там также гибнут нейроны определенного типа, холинергические в гиппокампе, а в мозге накапливается белок бета-амилоид. И эта болезнь скрытно развивается много лет, прежде чем у человека ослабеют память и другие когнитивные функции».
В гипотезах, объясняющих возникновение обеих болезней, недостатка нет. Это и нейровоспаление, запускаемое перенесенной в молодости вирусной инфекцией, и нейротоксины в окружающей среде, например гербициды, и модный сейчас микробиом кишечника, который подозревают в порче альфа-синуклеина.
Проверить все это в эксперименте не так-то просто. Грызуны — излюбленные лабораторные модели биологов — не болеют Паркинсоном.
«Чтобы имитировать болезнь, мыши вводят токсин и уже через шесть часов наблюдают гибель нейронов в черной субстанции, резкое снижение дофамина. У человека эта стадия длится десятки лет. С другой стороны, на грызунах можно промоделировать наследственные формы заболевания, введя в геном мутации», — поясняет Сломинский.
Эксперимент с близнецами
Сейчас ученым представился уникальный шанс — среди пациентов на Дальнем Востоке нашли троих с монозиготными близнецами, не болеющими болезнью Паркинсона.
«Они росли вместе, живут в одном регионе, работа не связана с токсинами. ДНК идентичные, так что если и есть генетическая предрасположенность, то на нее наложились другие факторы», — говорит Мария Шадрина.
Задача — проанализировать транскриптом близнецов, найти гены, которые экспрессируются у них по-разному, установить регулирующие их микро-РНК и связать с болезнью Паркинсона. Однако вопрос о первопричинах патологии остается открытым.
«Одно из объяснений — митохондриальный геном, который передается от матери. У близнецов он разный. Митохондрии размножаются в клетке простым делением и быстро мутируют. Как раз изменение в энергетике клетки, за которую отвечают митохондрии, — один из признаков болезни Паркинсона, — приводит пример Сергей Иллариошкин. Он не исключает и того, что у второго близнеца болезнь проявится позднее. — Мы можем проверить его на ПЭТ, сделать ЭЭГ-видеополисомнографию, чтобы посмотреть реакции в фазе быстрого сна, оценить структуру нигросомы (скопления дофаминовых нейронов) по данным 3-Тесла МРТ в новом режиме. Не исключено, что болезнь уже развивается. Такие примеры есть».
14 мая 2020, 08:00НаукаПерезагрузка организма. Как одним уколом вернуть здоровьеКак растят нейроны
Плюрипотентные стволовые клетки также позволяет исследовать болезнь Паркинсона. Фактически это зародыши, способные превратиться в любой вид зрелых клеток, в том числе нейроны.
Раньше стволовые клетки брали из абортивного материала, плаценты. Теперь, благодаря открытию японского ученого Синьи Яманаки, их можно получить из ткани взрослого человека. Надо немного похимичить в лаборатории, чтобы искусственно состарить, и пожалуйста — зрелые нейроны в чашке Петри. Других вариантов взять их у живого пациента нет.«Мы создали первую в России коллекцию клеточных линий от пятидесяти пациентов с болезнью Паркинсона. От трех уже есть индуцированные плюрипотентные стволовые клетки. Имеются и трансгенные нейроны, в ДНК которых с помощью системы CRISPR-Cas9 вставили биосенсоры. Они подсвечивают разные процессы на клеточном уровне, например накопление активных форм кислорода», — рассказывает Сергей Медведев из лаборатории эпигенетики развития Института цитологии и генетики СО РАН.
Вместе с коллегами из Новосибирского института органической химии им. Н. Н. Ворожцова и Международного томографического центра СО РАН они на таких искусственных нейронах черной субстанции испытают потенциальные лекарства, замедляющие их гибель, ищут генетические факторы болезни и биомаркеры.
Нагрузочный тест
«Еще ни одного человека не вылечили от болезни Паркинсона. Мы не можем остановить гибель нейронов, потому что не знаем причины. А их может быть огромное количество. Стратегия борьбы направлена на раннюю диагностику и превентивную нейропротекторную терапию, чтобы максимально замедлить процесс. Идеально, если порог гибели нейронов, при котором проявляются клинические симптомы, — это потеря 70-80 процентов дофамина, наступит в возрасте 120-150 лет. Человек будет болеть, но качество жизни останется приемлемым», — рассуждает академик Михаил Угрюмов, заведующий лабораторией нервных и нейроэндокринных регуляций Института биологии развития имени Н. К. Кольцова РАН.
В его лаборатории получают мышей с самой ранней стадией болезни Паркинсона. Затем в их крови ищут совпадения с потенциальными биомаркерами, обнаруженными в крови пациентов с подтвержденным диагнозом.
«Известны десятки биомаркеров и ни одного специфичного, поскольку находим их и при других заболеваниях. В любом случае нужно использовать набор маркеров, но даже по ним диагноз все равно не будет окончательным», — отмечает исследователь.
Он предлагает создать нагрузочный тест для выявления болезни. В психиатрии и неврологии этот подход не используют, а в других областях медицины — вполне. Например, есть тест толерантности к глюкозе при диагностике сахарного диабета.
Ученые уже подобрали вещество, которое блокирует синтез дофамина в мозге и дозу, временно усиливающую симптомы при патологии, без побочных эффектов. Эксперименты на мышах прошли успешно, теперь вместе коллегами из Тайваня исследователи готовят испытания на приматах.
«Есть основания считать, что эта диагностика будет специфична», — подчеркивает академик.
22 ноября 2019, 23:51НаукаУченые назвали новую причину болезни ПаркинсонаНеудача клеточных технологий
В отличие от клеток кожи или крови, нейроны в головном мозге не возобновляются. Они образуются у эмбриона в возрасте от восьми до 15 недель. По мере старения организма гибнут: в среднем каждые десять лет мозг лишается четырех процентов нервных клеток.
При нейродегенеративном заболевании, по неизвестным пока причинам, скорость гибели нейронов увеличивается в разы. И хотя в гиппокампе и стриатуме есть стволовые клетки-предшественники, доказать, что они замещают погибшие, не удалось.
В начале 1990-х с развитием клеточных технологий возникла идея пересаживать пациентам донорские здоровые нейроны.
«Шведский профессор Андрес Бьорклунд провел эксперименты на мышах, у которых нейротоксинами вызывали болезнь Паркинсона. Однако пересаженные от здорового животного нейроны погибали. Тогда он пересадил больным грызунам нейроны от эмбриона, и у них восстановилось поведение. Это был триумф», — вспоминает Михаил Угрюмов.
На этой волне Бьорклунд запустил в ЕС программу клинических испытаний клеточных технологий для лечения болезни Паркинсона. В ней участвовали шесть стран. Угрюмов руководил научной группой из России. Всего у нас выполнили 13 операций по пересадке нейронов.
26 мая 2020, 14:36НаукаУченые из стволовых клеток вырастили мозг человеческого эмбриона«Брали абортивный материал, вырезали ту область мозга, где должны были сформироваться дофаминергические нейроны, делали суспензию и вводили пациенту туда, где был дефицит дофамина. Операция нетравматичная, под местной анестезией. За десять лет во всех европейских странах — участницах консорциума собрали большой материл. Состояние пациентов улучшалось, но через полгода болезнь возвращалась», — говорит ученый.
В США получили те же результаты. Усовершенствование клеточных технологий ситуацию не изменило.
«Везде применяют одну методологию: испытывают терапию на грызунах, потом на людях. Картина общая: стопроцентный успех на животных, никакого стойкого эффекта на людях», — резюмирует академик.
Мозг человека слишком сложно устроен, полагает он. Нейроны нельзя пересадить в черную субстанцию, где для них подходящая окружающая среда, потому что во взрослом мозге они не смогут прорасти в другой отдел. Поэтому их имплантируют сразу туда, где требуется дофамин, — в стриатум.
Мозг мыши залит разными сигнальными веществами, все нейроны работают в этом коктейле. У человека нейроны специализированы, у них свои сигнальные вещества, причем доставка их должна быть направленной.
Нейрон управляется не по всей поверхности, а в точках — синаптических контактах. И каждый связан с десятью-пятнадцатью тысячами других строго определенных нейронов. Все это должна заново сформировать клетка, которую пересадили. В ближайшие лет пятьдесят, по мнению Михаила Угрюмова, эта задача, скорее всего, неразрешима.
12 января 2020, 08:00НаукаЕшь и умней. Какая пища нравится мозгу и от какой он страдаетУЗ«5-Я ГОРОДСКАЯ КЛИНИЧЕСКАЯ БОЛЬНИЦА» — Болезнь Паркинсона: уникальные технологии диагностики и лечения
Болезнь Паркинсона до сих пор считается одним из загадочных заболеваний современности. Дело в том, что до сих пор не изобретено средство, которое бы полностью помогало излечиться, как нет и методов профилактики болезни Паркинсона. Белорусские медики не только используют самые современные методы в лечении этого заболевания, но в нашей копилке немало и значимых открытий.
Программно-аппаратный комплекс на основе акселерометрии.
При возникновении у пациента тремора (дрожания), очень важно установить правильно диагноз, ведь тремор может быть паркинсонический, эссенциальный, дистонический. Он может сопутствовать заболеваниям щитовидной железы, нарушению обмена веществ. Так что от правильной постановки диагноза зависит и лечение, которое совершенно разное при разных видах тремора.
Акселерометрия основана на измерении ускорения тремора конечностей. Когда человек дрожит, имеет место ускорение. На руку, ногу или голову пациента, где есть тремор, крепится датчик и происходит регистрация и обработка сигнала. Сигнал попадает в персональный компьютер и с помощью специально пакета с математическими формулами выводится на экран монитора. Происходит определение частоты и амплитуды дрожания, количества высокочастотных спектров в треморе. Данная информация помогает определить вид дрожания.
Этот аппарат используется при диагностике заболевания, когда еще трудно только по клиническим показаниям выявить этиологическую причину болезни и определить причину тремора.
Диагностика, и лечение тремора при помощи программно-аппаратный комплекса на основе акселерометрии.
В мире существуют аналоги нашего аппарата, но применяется он в основном для диагностики, в лечебных целях мы применили его впервые. Это инновационная разработка белорусских медиков, которую мы провели на базе УЗ «5-я городская клиническая больница».
В основе методики лечения — метод биологической обратной связи. Человек видит информацию об отклонении конечности при дрожании, слышит ее звуковую характеристику и усилием воли может активировать те нервные центры, которые отвечают за антитремоногенную систему — направлены на внутреннее подавление генератора дрожания. Ряд занятий с помощью этого аппарата формирует у человека произвольный контроль над тремором: человек упражняет те центры, которые ответственны за подавление дрожания, а те центры, которые отвечают за возникновения тремора, наоборот подавляются. В данном случае речь идет не о полном излечении, скорее тренировке способностей контролировать себя, так называемой гимнастике для мозга.
Описаны случаи, когда человек в самом начале болезни самостоятельно может подавлять дрожание, но по мере развития заболевания такие способности теряются. Мы предлагаем способ тренировки тех систем, которые помогают контролировать тремор.
Кроме этого, наш коллектив начал работать над использованием акселерометрии в экспертных целях для оценки качества лечения пациента. Датчик можно вешать пациенту на сутки и отслеживать, как меняется амплитуда дрожания и подавляет ли назначенный препарат тремор.
Новая диагностика лечения тремора.
Необходимость контроля над болезнью Паркинсона очень остро стоит для нашей республики, как, впрочем, и для других стан мира, ввиду старения населения, поскольку паркинсонизм — это возрастозависимое заболевание. Возник вопрос, как можно использовать достижения науки и техники в повседневной жизни человека. Пробные разработки (основанные на применении датчиков-акселерометров) шли на Западе, поэтому решено было внедрить производство такого рода аппарата на территории нашей республики.
Следует заметить, что использование метода биологически обратной связи активно ведется для лечения различных расстройств нервной системы: эпилепсии, артериальной гипертензии, вегетативных расстройств. Но для лечения тремора таких наработок не было. Мы начали пробовать, были получены отличные результаты.
Первые признаки заболевания болезнью Паркинсона. Что же должно насторожить?
Все случаи развития острого одностороннего дрожания у человека должны не просто насторожить, это показания для незамедлительного вызова скорой помощи.
С чего начинается лечение.
Лечение пациентов с тремором разделяется на лечение пациентов с уже установленным диагнозом и лечение пациентов впервые обратившихся. Во втором случае проводим комплексный клинический осмотр. Необходим и биохимический анализ крови, поскольку есть виды тремора, которые развиваются в силу нарушения обмена веществ, функции щитовидной железы, поэтому нужно исключить данную патологию.
По статистике, болезнью Паркинсона страдают около одного процента населения, около десяти процентов — эссенциальным тремором. Правда, известны случаи, когда заболевание может начаться как эссенциальный тремор, а через десять лет могут присоединиться нейродегенеративные изменения и развивается болезнь Паркинсона. В каждом конкретном случае диагностика причины тремора должна проводиться под строгим присмотром врача. Очень важен комплексный подход, использование лабораторных и инструментальных данных, оценка состояния головного мозга.
Обследование на нашем аппарате проводится уже после комплекса исследований. Когда определена этиологическая причина тремора, тогда мы пытаемся воздействовать на эту причину с помощью препаратов. Назначение препарата, как и его дозировка, строго индивидуальны и назначаются в каждом конкретном случае.
Есть ли методы профилактики болезни Паркинсона?
К большому сожалению, профилактики болезни Паркинсона не существует. Болезнь Паркинсона возникает из-за нарушения выработки дофамина — нейромедиатора, вещества, которое служит для передачи импульсов в головном мозге. Это ведет к нарушению функций клеток в отделах мозга, отвечающих за движения. В результате у больных возникают непроизвольный тремор (дрожание в конечностях), заторможенность, затруднения при ходьбе и трудности при глотании.
Проблема болезни состоит в том, что ее клинические симптомы появляются лишь на поздних стадиях, когда у пациента погибло уже 60 процентов нейронов в определенной области мозга, отвечающей за двигательные функции. До этого мозг с их потерей справляется самостоятельно.
Перепрограммировать нервную систему невозможно. Обратный процесс запустить уже нельзя. Необходим пожизненный прием препаратов нейропротекторного ряда.
Конечно, человечество пытается найти лекарство от болезни Паркинсона: в некоторых клиниках идет испытание различных генных технологий, ведется трансплантация стволовых клеток. Но эти методы примеряются пока лишь в единичных случаях и говорить о том, что мы приблизились к излечению данного заболевания, увы, не приходится.
Второе неврологическое отделение УЗ «5-ой городской клинической больницы» г. Минска принимает пациентов с общими неврологическими заболеваниями, исключая инсульты и спинномозговые травмы. Врачи — специалисты занимаются диагностикой и лечением пациентов с различными видами дистонии, болезнью Паркинсона, Альцгеймера, когнитивными расстройствами, аутоиммунными заболеваниями, которые сопровождаются судорожным синдромом, двигательными нарушениями и умственными расстройствами.
Хотим обратить внимание, что в случае любого проявления слабости и онемения в руках и ногах, необходимо немедленно обращаться к врачу.
Ведь бывает так: сначала слабость в ногах, а потом эта слабость распространяется все выше, но пациенты не спешат вызывать скорую, ждут дома несколько дней. Поэтому поступают к нам уже с дыхательными нарушениями, и спасти таких пациентов практически невозможно.
Для пациента с неврологическими заболеваниями очень важно подобрать клинику, где ему могут оказать квалифицированную помощь, и специалиста, который будет его вести и проводить постоянные наблюдения. Наш коллектив — это высококвалифицированные врачи, которые грамотно и своевременно проведут диагностику и назначат лечение.
Тремор конечностей — обзор
Тремор
Тремор является наиболее распространенным из всех непроизвольных движений и определяется как непроизвольные ритмические колебания части тела. Он может быть физиологическим (нормальным) или патологическим и характеризуется частотой, амплитудой и распределением, а также положением, в котором он возникает. Тремор легче всего классифицировать как тремор покоя или действия.
Некоторые формы тремора вызываются главным образом центральным осциллятором, как при эссенциальном треморе, а другие, такие как физиологический тремор, имеют в основном механическое происхождение.Центральный тремор возникает в мозжечково-таламокортикальном и дентаторуброоливарном путях с плохо изученным вкладом контуров базальных ганглиев. Тремор покоя характерен для паркинсонизма , который сам по себе может быть вторичным по разным причинам. Такой тремор покоя часто сопровождается ригидностью, брадикинезией или постуральной нестабильностью, но может возникать изолированно. Механические толчки уменьшаются по амплитуде и частоте с нагрузкой, тогда как центрально генерируемые треморы уменьшаются только по амплитуде.
Инсульт
Тремор может возникнуть в результате инсульта. Чаще всего поражаются таламус, средний мозг, руберо-оливковый тракт и тракты мозжечка. Тремор конечностей может возникать при поражении коры головного мозга. 5
Лекарства
Лекарства могут вызывать весь спектр подтипов тремора (покой, постуральный или кинетический), хотя постуральный тремор является наиболее распространенным (таблица 58-4). 118 Тремор намерения относится к подтипу кинетического тремора, который становится более заметным по мере приближения конечности к цели.Обычно используемые лекарства, такие как адренергические агонисты, включая все β-агонисты, литий, кофеин, кортикостероиды, трициклические антидепрессанты, циклоспорин и избыток щитовидной железы, обычно вызывают постуральный тремор. Допаминергические и противосудорожные препараты также вызывают усиленный физиологический тремор. Тремор, вызванный действием лития или вальпроевой кислоты, присутствует в состоянии покоя и усиливается в зависимости от положения тела или действий. Антиаритмический амиодарон может вызывать постуральный и конечный двигательный тремор у 20–30 процентов пациентов.Центральные холинергические агонисты, такие как никотин, антихолинэстеразы и аминопропанолы, также обладают треморгеном.
Таблица 58-4. Лекарственные средства и токсины, вызывающие тремор
| Наркотики или токсины | Кинетический или постуральный тремор | Намеренный тремор | Тремор покоя | ||||
|---|---|---|---|---|---|---|---|
| Противосудорожные средства | Карбамазепин, фелбамат, ламотриджин, ламотриджин вигабатрин | — | Вальпроат | ||||
| Антидепрессанты и стабилизаторы настроения | Амитриптилин, литий, ИМАО, СИОЗС, вальпроат | Литий | Литий, СИОЗС, вальпроат | ||||
| Противоинфекционные препараты | imВидарабин | Триметоприм-сульфаметоксазол, амфотерицин | |||||
| Агонисты β-адренорецепторов | Сальбутамол, салметерол | Сальбутамол, салметерол | |||||
| Сердечные препараты | Амиодарон | Амиодарон | 39 Химиотерапия | Цитарабин, ифосфамид, такромил, винкристин | Цитарабин, ифосфамид | Талидомид | |
| Препараты, блокирующие дофамин и -эплецитные препараты | Циннаризин, галоперидол40, тетокеридазин 900, тетокеридазин 900, тетокеридазин 39 метоклопрамид, нейролептики (например,g., галоперидол, тиоридазин), резерпин, тетрабеназин | ||||||
| Рекреационные агенты | Кокаин, этанол, МДМА, никотин | — | Кокаин, этанол, МДМА, MPTP | ||||
| Гормональное лечение | Кальцитонин , тироксин, (медрокси) прогестерон, тамоксифен | Эпинефрин | (Медрокси) прогестерон | ||||
| Иммунодепрессанты | Циклоспорин, такролимус, интерферон-α | Циклоспорин | , такролимус | , такролимус , циклоспорин , такролимус , свинец, ртуть— | Свинец, марганец, ртуть | ||
| Разные агенты | Метоклопрамид, циметидин, теофиллин, кофеин | — | Метоклопрамид | Метанол | Токсины|||
| Синдромы отмены | Каннабис , этанол | — | — |
MAOI, ингибитор моноаминоксидазы; МДМА, метилендиоксиметамфетамин; MPTP, 1-метил-4-фенил-1,2,3,6-тетрагидропридин; СИОЗС, селективный ингибитор обратного захвата серотонина.
Центральная моноаминергическая стимуляция нейролептиками, фенилэтиламинами и индолами может привести к паркинсоническому тремору покоя и постуральному тремору. В частности, тремор наблюдается при злокачественном нейролептическом синдроме и серотониновом синдроме (см. С. 1191). Препараты, блокирующие дофаминовые рецепторы, и средства, истощающие дофамин, такие как тетрабеназин и резерпин, также могут вызывать тремор покоя.
Токсины и рекреационные агенты
Различные токсины вызывают тремор непосредственно или как часть абстинентного синдрома (Таблица 58-4).Тремор может возникать при острой интоксикации кокаином и сохраняется у лиц, страдающих кокаиновой, алкогольной и опиатной зависимостью, в течение месяцев после последнего употребления; По сообщениям, тремор покоя чаще встречается у тех, кто ранее употреблял кокаин. 34 Состояния отмены алкоголя и других наркотиков усиливают, иногда асимметрично, постуральный физиологический тремор, который со временем уменьшается, но его можно лечить пропранололом или бензодиазепинами. Однако намеренный тремор при хроническом злоупотреблении алкоголем является результатом повреждения мозжечка алкоголем.При употреблении каннабиса симптомы отмены могут возникать уже через 7 дней использования и включать тремор, раздражительность, беспокойство, анорексию, лихорадку и другие симпатические эффекты. 34
Интоксикация тяжелыми металлами и органическими соединениями может вызвать тремор покоя или действия, а улучшение после вывода токсина зависит от тяжести и продолжительности воздействия.
Нарушения обмена веществ
Практически любое нарушение обмена веществ может быть связано с тремором.Тиреотоксикоз является наиболее распространенным, вызывающим усиленный физиологический тремор. Он поражает любую возрастную группу и поддается лечению основного заболевания, но его также можно уменьшить с помощью пропранолола. Тремор является одним из первых и наиболее распространенных признаков гипогликемии и может наблюдаться при некетотической гипергликемии наряду с миоклонусом, хореей и дистонией. При почечной недостаточности постуральный тремор и тремор действия часто проявляются до развития астериксиса и могут предвещать энцефалопатию. Тремор при болезни Вильсона может быть постуральным, кинетическим или в покое.Также происходит более грубое движение верхней конечности (тремор «биение крыльев»). 21 Он присутствует в проксимальных отделах рук и иногда в голове в плоскости сгибания-разгибания и возникает из-за патологических процессов таламокапсулярной и мозжечковой систем. Хелатотерапия и трансплантация печени могут обратить невропатологический процесс вспять, но эффективного симптоматического лечения не существует. 21 Гемохроматоз связан с тремором, паркинсонизмом и деменцией из-за отложений железа в базальных ганглиях; прогрессирование можно предотвратить с помощью флеботомии или трансплантации печени. 119 Вариегатная порфирия и гиперадренергическое состояние, связанное с феохромоцитомой, также могут вызывать тремор, как и повреждение полосатого тела на фоне гипоксически-ишемической энцефалопатии. 6
Гипомагниемия и гипокальциемия могут приводить к тремору, подергиванию мышц и раздражительности, а тяжелый, связанный с движением, дистальный тремор хлопанья может возникать при гиперкальциемии из-за гиперпаратиреоза. Сообщалось о треморе при гипонатриемии и ее коррекции. 120 Тяжелый дефицит витамина E может вызывать тремор в дополнение к спиноцеребеллярным проявлениям и периферической невропатии, а тремор может реагировать на добавление витамина E. 121 У младенцев дефицит витамина B 12 может вызвать синдром генерализованного тремора и умственную отсталость, которые частично обратимы при приеме добавок, хотя ненормальные движения могут временно усиливаться при лечении до исчезновения. 80
Инфекции
Вирусные энцефалиты, вероятно, являются наиболее частыми инфекциями, вызывающими тремор (Таблица 58-2). Генерализованный тремор также описан при полиовирусной инфекции, энцефалите Сент-Луиса и ромбэнцефалите, который иногда осложняет ящур (из-за энтеровируса 71).Респираторно-синцитиальный вирусный энцефалит 122 и эпидемический паротит 102 со склонностью к мозжечку, проявляется интенционным тремором и атаксией. Эховирусный 21 энцефалит 123 и японский энцефалит 124 приводят к тремору через базальные ганглии и поражение мозжечка. Связанный с опоясывающим герпесом васкулит, поражающий средний мозг, может привести к ипсилатеральному мозжечковому синдрому с интенционным тремором. 125 Врожденная цитомегаловирусная инфекция и краснуха 126 и клещевой менингоэнцефалит у взрослых 127 приводят к длительной неврологической дисфункции, включая тремор.Энцефалопатия, иногда проявляющаяся при лихорадке Ласса, может сопровождаться тремором, судорогами и комой. 128 Поражение менингоэнцефалита флавивирусами может вызывать тремор в дополнение к типичной геморрагической лихорадке денге. 129 Похожая картина наблюдается при боливийской геморрагической лихорадке, вызванной вирусом Мачупо (семейство Arenaviridae), который реагирует на рибавирин. 130
Нарушения тремора редко возникают на ранних стадиях ВИЧ-инфекции, но встречаются у 5–44% людей с ВИЧ-ассоциированной деменцией.Тремор может быть частью паркинсонического синдрома или возникать изолированно. Обычно присутствует симметричный постуральный тремор, но может присутствовать компонент покоя; кинетические компоненты редки. Тремор Холмса (рубральный), в котором присутствуют покой, постуральный и кинетический компоненты, был зарегистрирован при СПИДе и часто является результатом оппортунистических инфекций, таких как туберкулез или токсоплазмоз. Помимо лекарственного тремора от препаратов, блокирующих дофамин, таких как нейролептики и противорвотные средства, у больных СПИДом может развиться обратимый покой или постуральный тремор от триметоприм-сульфаметоксазола. 131 Лечение тремора при ВИЧ-инфекции зависит от этиологии; лекарственный тремор и вторичный тремор по отношению к оппортунистической инфекции могут быть обратимыми. 27
Тремор встречается у 17 процентов пациентов с туберкулезным менингитом 108 и у 30 процентов пациентов с тубуркулемами 109 и обычно имеет постуральную разновидность. Он может реагировать на противотуберкулезную терапию в течение нескольких недель; в противном случае можно рассмотреть симптоматическое лечение.
Выздоровление от Plasmodium falciparum малярия иногда сопровождается кортикостероидной энцефалопатией с постуральным тремором, мозжечковой атаксией, миоклонусом, судорогами и моторной афазией. 132 При нейроцистицеркозе наиболее частыми двигательными расстройствами являются тремор и паркинсонизм. 38 Тремор также наблюдается при брюшном тифе вместе с измененными привычками кишечника. 133 Сообщалось об одностороннем постуральном, кинетическом и треморе Холмса при таламическом токсоплазмозе у ВИЧ-инфицированных пациентов. 134
Иммунные расстройства
Волчанка ЦНС может включать тремор среди многих своих особенностей. Макроглобулинемия Вальденстрема связана с асимметричным тремором и периферической невропатией. 135 Вовлечение базальных ганглиев и ствола мозга при синдроме Бехчета может привести к постуральному тремору, пирамидным и экстрапирамидным проявлениям. 52 Тремор может возникать как осложнение целиакии. 56
При энцефалопатии Хашимото, при которой часто встречаются миоклонус и судороги, у 80 процентов пациентов наблюдается постуральный тремор. 136 У пациентов старше 50 лет с дегенерацией мозжечка этиология около половины — паранеопластическая. Преднамеренный тремор, атаксия и дизартрия особенно связаны с антителами против Yo при гинекологическом раке и антителами против Hu при мелкоклеточном раке легких. 137
Некоторые иммуноопосредованные полинейропатии, особенно те, которые связаны с моноклональной гаммопатией IgM, сопровождаются преобладающим дистальным действием и постуральным тремором. В недавнем исследовании случай-контроль у 29 процентов субъектов с моноклональной гаммаопатией IgM неустановленной значимости был тремор по сравнению с 9 процентами контрольной группы; из 60 пациентов с тремором у 49 наблюдались постуральный и кинетический тремор, у 8 — тремор покоя, а у 3 — смешанный тремор покоя и действия. 138 Тремор иногда реагирует на иммуносупрессивную терапию или пропранолол.Постуральный и кинетический тремор может следовать за синдромом Гийена-Барре и возникать при хронической воспалительной демиелинизирующей полинейропатии. 139
Другие причины тремора
Церебральное облучение и лечение гамма-ножом редко вызывают постуральный тремор или тремор Холмса. 140 Постуральный и намеренный тремор может развиться во время компрессии во время погружений на глубину более 100 метров как часть неврологического синдрома высокого давления. 115 Обычно он восстанавливается после декомпрессии, но иногда сохраняется в течение нескольких месяцев.
Подход к диагностике
Быстрое начало (от нескольких дней до месяцев) тремора нетипично для эссенциального тремора, но может возникать, когда лекарственное средство вызвано или связано с основным заболеванием. Если лекарство или токсин, вызывающее нарушение, не обнаружено, скрининговые исследования крови должны включать определение концентрации электролитов и глюкозы, а также функциональные тесты щитовидной железы, почек и печени. Тестирование сывороточного кортизола, паратиреоидного гормона и церулоплазмина; 24-часовая экскреция меди с мочой; в отдельных случаях также могут потребоваться токсикологические анализы.МРТ головного мозга может потребоваться для исключения структурных причин, особенно когда есть другие неврологические признаки или тремор асимметричный.
Лечение
Во всех случаях тремора следует искать и лечить лежащее в основе заболевание, пока предполагается симптоматическое лечение. Тремор действия, и особенно усиленный физиологический тремор, обычно реагирует на адренергическую блокаду или примидон. Также можно использовать другие агенты, включая алпразолам, атенолол, габапентин, сотолол и топирамат.Другие методы лечения, демонстрирующие некоторую пользу, включают надолол, нимодипин, клоназепам, ботулинический токсин А, глубокую стимуляцию мозга, таламотомию и таламотомию с гамма-ножом. 141 Прегабалин иногда помогает. 139 Тремор покоя лечится холинолитиками, амантадином и дофаминергическими препаратами; Стимуляция глубокого мозга бледного шара или субталамического ядра может использоваться у пациентов с тяжелым тремором, который невосприимчив к лекарствам. 142
Тремор мозжечка лечить труднее всего, и только иногда улучшается с помощью описанных выше методов лечения. 143 Тремор Холмса (рубральный) плохо поддается лечению, но иногда улучшается с помощью леводопы, агонистов дофамина, тригексифенидила или некоторых лекарств, используемых для лечения эссенциального тремора; в других случаях может потребоваться глубокая стимуляция мозга. 143
Эссенциальный тремор — лечение в клинике Мэйо
Эссенциальная помощь при треморе в клинике Мэйо
Врачи клиники Мэйо являются экспертами в диагностике и лечении эссенциального тремора.Они будут работать с вашим лечащим врачом, чтобы помочь скоординировать ваше лечение, и могут предложить вам глубокую стимуляцию мозга, если у вас сильный тремор.
Ваша команда по уходу в клинике Mayo
Опыт
Врачи клиники Майо, прошедшие подготовку в области заболеваний головного мозга и нервной системы (неврологи), ежегодно лечат более 2000 человек с эссенциальным тремором.
Командный подход
НеврологиMayo Clinic работают с врачами, прошедшими нервную хирургию (нейрохирурги), и другими специалистами, чтобы оценить и лечить ваше состояние.
Индивидуальный подход
ВрачиMayo Clinic работают с вами, чтобы разработать для вас наиболее подходящее лечение. Эссенциальный тремор невозможно вылечить, но врачи помогут вам справиться с вашим состоянием.
Скоординированный уход
Ваш специалист клиники Mayo будет работать с вашим основным врачом, чтобы координировать ваше лечение.
Экспертиза и рейтинги
Клиника Мэйо в Рочестере, Миннесота., и клиника Мэйо в Джексонвилле, штат Флорида, вошли в число лучших больниц для неврологии и нейрохирургии по версии U.S. News & World Report. Клиника Мэйо в Фениксе / Скоттсдейле, штат Аризона, получила высокую оценку в области неврологии и нейрохирургии по версии U.S. News & World Report. Детский центр клиники Мэйо в Рочестере признан больницей №1 в Миннесоте и пяти штатах штата Айова, Миннесота, Северная Дакота, Южная Дакота и Висконсин, согласно рейтингу US News & World Report за 2021-2022 годы «Лучшие детские больницы». рейтинги.
Узнайте больше об опыте и рейтингах отделений нейрохирургии и неврологии Mayo Clinic.
опыта
- опыта. Врачи клиники Мэйо, прошедшие подготовку в области заболеваний головного мозга и нервной системы (неврологи), хирургии нервной системы (нейрохирурги) и других областей, сотрудничают для оказания вам медицинской помощи. Ежегодно специалисты клиники Мэйо лечат более 2000 человек с эссенциальным тремором.
- Руководители научных исследований. Специалисты Mayo Clinic по двигательным расстройствам изучают новые возможности диагностики и лечения эссенциального тремора и других двигательных нарушений.
Расположение, проезд и проживание
Mayo Clinic имеет крупные кампусы в Фениксе и Скоттсдейле, штат Аризона; Джексонвилл, Флорида; и Рочестер, штат Миннесота. Система здравоохранения клиники Мэйо имеет десятки отделений в нескольких штатах.
Для получения дополнительной информации о посещении клиники Мэйо выберите свое местоположение ниже:
Расходы и страхование
Mayo Clinic работает с сотнями страховых компаний и является поставщиком услуг внутри сети для миллионов людей.
В большинстве случаев клиника Мэйо не требует направления к врачу. Некоторые страховщики требуют направления или могут иметь дополнительные требования для определенного медицинского обслуживания. Приоритет всех посещений определяется медицинской потребностью.
Узнайте больше о приемах в клинику Мэйо.
Пожалуйста, свяжитесь со своей страховой компанией, чтобы подтвердить медицинское страхование и получить необходимое разрешение до вашего визита. Часто номер службы поддержки вашего страховщика напечатан на обратной стороне вашей страховой карты.
Дополнительная информация о выставлении счетов и страховании:
Клиника Майо в Аризоне, Флориде и Миннесоте
Система здравоохранения клиники Мэйо
23 января 2019 г.
Тремор верхних конечностей | Медицинский журнал Австралии
История Роберта
Роберт, 66-летний мужчина, обратился к терапевту с 6-месячным анамнезом тремора левой руки. Больше всего он замечал тремор в состоянии покоя, и не особенно заметно, когда он использовал руку.Однако он заметил, что его рука стала менее ловкой, и у него возникли проблемы с застегиванием пуговиц. Тремор был более очевиден, когда он нервничал или находился под давлением. Он также заметил некоторые трудности с входом и выходом из машины и переворачиванием в постели. Его жена отметила, что за последние 2 года его осанка стала более сутулой.
На конкретном допросе Роберт сообщил, что его обоняние ухудшилось на несколько лет. Его жена сообщила, что у него был тревожный сон с яркими сновидениями, во время которых он кричал и метался.Во время некоторых из этих снов он невольно ударил ее.
При осмотре у Роберта было довольно неподвижное лицо с небольшими спонтанными морганиями. Когда он ходил, была заметна асимметрия в движении его руки, а в его неподвижной левой руке стал очевиден тремор. Когда он поворачивался, он имел тенденцию останавливаться и делать несколько шагов, при этом его плечи и бедра во время поворота оставались в одной плоскости. Когда он сел, через несколько секунд у него появилась дрожь в левой руке. У него было умеренное повышение мышечного тонуса левой верхней конечности, которое было постоянным во всем диапазоне движений («жесткость ведущей трубы») с наложенными регулярными вариациями («жесткость зубчатого колеса»).Когда он несколько раз постукивал пальцами левой руки, первоначальные движения были относительно нормальными, но затем движения распадались на движения небольшой амплитуды, которые казались неуклюжими и трудными. Его глаза двигались нормально. У него была нормальная сила, его сухожильные рефлексы были симметричными и нормальными, и у него были реакции подошвенных сгибателей. Результаты сенсорного исследования были нормальными. Его артериальное давление было 170/90 мм рт.ст. в положении лежа и 150/80 мм рт.ст.
Подход к проблемеТремор — частый симптом у пациентов среднего и старшего возраста.Дифференциальный диагноз включает первичные неврологические расстройства, наиболее частыми из которых являются эссенциальный тремор (ЭТ), болезнь Паркинсона (БП) и тремор, вызванный другими заболеваниями или лекарствами (вставка 1). В случае Роберта ряд дополнительных признаков указывает на вероятный диагноз БП (вставка 2).
Характеристики двигательного расстройства TremorНекоторые особенности состояния Роберта типичны для паркинсонического тремора. Этот тип тремора характерен асимметричным и наиболее очевидным в покое, но может также сохраняться (хотя обычно с меньшей амплитудой), когда пораженная конечность поднимается против силы тяжести.Паркинсонический тремор обычно ослабевает или исчезает во время движения конечностей, например, теста «палец к носу» или при изменении позы; затем он снова появляется через короткий промежуток времени (вновь возникающий тремор). Таким образом, он известен как покой, постуральный и повторно возникающий тремор. Паркинсонический тремор обычно проявляется в пораженной руке во время ходьбы. Асимметричный тремор покоя и хороший ответ на леводопу являются наиболее специфическими диагностическими признаками патологически доказанной БП, хотя около 30% пациентов с БП не имеют тремора при обращении.У пациентов без тремора обычно наблюдаются симптомы брадикинезии.
Напротив, тремор ET влияет на обе верхние конечности более или менее симметрично и представляет собой постуральный и активный (кинетический) тремор, который присутствует, когда конечность поднимается против силы тяжести и во время движения, и отсутствует или уменьшается в состоянии покоя. Хотя тремор ЭТ может быть асимметричным, он не односторонний, как это обычно бывает при ранней БП. Тремор головы и голоса обычны для ET, но не для PD; при БП может наблюдаться тремор губ, подбородка или языка.
Различие между PD и ET не всегда однозначно. Пациентам с тремор-доминантным подтипом БП, который имеет грубый тремор в состоянии покоя, часто ошибочно диагностируют ЭТ. При тремор-доминантном БП клиническое течение доброкачественное; имеется небольшая двигательная инвалидность, ригидность или брадикинезия, а тремор относительно невосприимчив к леводопе (лишая клинициста одной из ключевых характеристик, помогающих поставить точный диагноз). Диагностировать БП помогают дополнительные к описанным выше клинические признаки, такие как наличие лицевой гипомимии или асимметричного движения руки при ходьбе.
Другой причиной тремора верхних конечностей, который встречается реже, чем PD и ET, является дистонический тремор взрослых. Как и при БП, дистонический тремор может быть односторонним или асимметричным и может возникать в покое, во время определенных поз и во время действия. Полезными указателями на диагностику дистонического тремора являются особенности положения или задачи, а также другие особенности дистонии, такие как неправильное положение пораженной конечности. Кроме того, у пациентов с дистоническим тремором отсутствуют другие признаки БП, такие как декрементальная брадикинезия, гипосмия и расстройство поведения во сне с быстрым движением глаз (RBD).1,2
Другие двигательные симптомыКлиницисты должны узнать о симптомах брадикинезии, поражающей конечности, таких как трудности с повторяющимися или вращательными движениями (например, чистка зубов, мытье волос) и тонкими скоординированными движениями (например, почерк, застегивание пуговиц). Также полезно спросить о симптомах, указывающих на нарушение осевых движений, таких как трудности при вставании со стула, выходе из машины или переворачивании в постели. Эти симптомы убедительно свидетельствуют о паркинсоническом расстройстве.Помимо тремора, основные клинические диагностические признаки при осмотре включают уменьшение спонтанных движений лица и мигания, что придает взгляду выражение лица. Мышечный тонус повышен в конечностях и туловище. Брадикинезия проявляется в уменьшении амплитуды повторяющихся движений постукивания пальцами. Также может наблюдаться гипокинетическая походка с короткими шагами и уменьшенным махом руки на пораженной стороне. Во время ходьбы в пораженной верхней конечности может снова появиться тремор покоя.
Некоторые красные флажки в анамнезе пациента и обследовании (вставка 3) должны вызывать сомнения в диагнозе БП и предлагать альтернативный диагноз, такой как множественная системная атрофия или прогрессирующий надъядерный паралич (вставка 4).Наличие таких красных флажков должно побудить к обращению к неврологу для дальнейшего обследования и обследования.
Немоторные симптомыНемоторные симптомы важны для диагностики тремора у пациента. Немоторные симптомы, включая запор, сексуальную дисфункцию, RBD, гипосмию, депрессию и тревогу, обычно предшествуют моторным симптомам БП. Они также могут сами по себе составлять важную причину инвалидности.
RBD характеризуется потерей нормальной мышечной атонии во время сна с быстрым движением глаз, что заставляет пациента «разыгрывать» сны, что может привести к движениям, которые травмируют пациента и его партнера по постели.По крайней мере, у 40% пациентов с идиопатической RBD развивается нейродегенеративное расстройство в среднем через 11–12 лет после начала RBD.4,5 Это чаще всего БП, множественная системная атрофия или деменция с тельцами Леви (синуклеинопатии).
Другие вопросы, которые следует задать пациенту с треморомПри сборе анамнеза также необходимо выяснить, заметил ли пациент реакцию тремора на алкоголь. ЭТ, особенно если она относительно легкая, обычно уменьшается после приема алкоголя, тогда как при БП такой реакции не наблюдается.Дистонический тремор также может быть зависимым от алкоголя.1
Пациентов с тремором также следует спросить, есть ли у них в семейном анамнезе тремор, который присутствует как минимум в 60% случаев ЭТ. Однако семейный анамнез тремора не позволяет однозначно отличить ЭТ от БП, поскольку спорадическая ЭТ является обычным явлением, а БП может быть семейной.
Роль визуализацииДиагноз БП является клиническим. Он основан на наличии типичных симптомов и признаков, реакции на терапию и исключении других причин.Пациентам с типичными клиническими проявлениями и отсутствием красных флажков визуализация головного мозга не требуется. У пациентов с красными флажками, которые не типичны для БП, следует использовать магнитно-резонансную томографию (МРТ) головного мозга для поиска радиологических свидетельств таких состояний, как множественная системная атрофия, прогрессирующий надъядерный паралич и сосудистый паркинсонизм.
Когда начинать лечениеНи один из доступных в настоящее время лекарств от болезни Паркинсона однозначно не замедляет прогрессирование болезни.По этой причине лечение БП традиционно откладывалось до тех пор, пока симптомы не повлияли на качество жизни пациента, хотя в настоящее время это оспаривается аргументами в пользу более раннего симптоматического лечения.
Клинические данные, данные визуализации и невропатологические данные показывают, что скорость прогрессирования БП на ранних стадиях болезни выше, чем на поздних стадиях болезни.6,7 Раннее дофаминергическое лечение БП постулируется для уменьшения дисфункции базальных ганглиев, которая связана с ухудшением двигательных симптомов.8 Некоторые исследования показали, что раннее лечение леводопой, агонистами дофамина (например, ропиниролом, прамипексолом) и ингибитором моноаминоксидазы разагилином может оказывать благотворное воздействие на болезнь 9-12
Накапливаются данные о пользе физических упражнений и физиотерапии при БП. В двух недавних исследованиях пациенты с болезнью Паркинсона, которые участвовали в программе физических упражнений в течение 3-6 месяцев, продемонстрировали улучшение управляющих когнитивных функций по сравнению с контрольной группой.13,14 Кроме того, физиотерапия может улучшить осевую двигательную функцию, включая равновесие, осанку и походку. за счет увеличения выработки эндогенного дофамина, вызванного физической нагрузкой.15 Соответственно, пациентов с БП следует поощрять к регулярным физическим упражнениям.
Выбор первоначального симптоматического леченияПервоначальное симптоматическое лечение должно быть индивидуальным с учетом возраста пациента, образа жизни, тяжести двигательных симптомов, уровня инвалидности, сопутствующих заболеваний и ожиданий от лечения. Кроме того, подтип и клиническое проявление БП (например, молодое начало, доминантный тремор, акинетическая ригидность или постуральная нестабильность и нарушение походки у пожилых пациентов) могут влиять на первоначальный подход к терапии.Для обсуждения всех этих вопросов перед принятием решения о начальном симптоматическом лечении могут потребоваться две или три консультации.
Леводопа с ингибитором допа-декарбоксилазы (леводопа плюс карбидопа или леводопа плюс бенсеразид) является наиболее мощной и эффективной лекарственной терапией для лечения моторных симптомов БП (степень доказательности A), и практически всем пациентам в конечном итоге потребуется леводопа. Тем не менее, в последние годы начальная терапия БП является предметом бурных дискуссий.Это было вызвано опасениями, что у большинства пациентов, принимающих леводопу, через несколько лет разовьются колебания двигательной реакции на леводопу. Пациент может заметить снижение двигательной активности через несколько часов после приема дозы леводопы, что известно как феномен «окончания приема» или «истощения». Примерно в то же время хореиформные непроизвольные движения обычно возникают через 1-2 часа после приема леводопы (дискинезии пиковых доз). Считается, что двигательные колебания и дискинезии являются результатом снижения способности полосатого тела накапливать дофамин в сокращающейся популяции пресинаптических нигростриатных нейронов и короткого периода полужизни в плазме леводопы, обеспечивающего пульсирующую (нефизиологическую) стимуляцию дофаминовых рецепторов полосатого тела.Более молодые пациенты (менее 60 лет на момент постановки диагноза) подвергаются большему риску развития серьезных двигательных флуктуаций 16, что может быть связано с более длительной продолжительностью заболевания с большим истощением нигростриатных нейронов и тенденцией более молодых пациентов использовать большие дозы лекарств. Высказывалась также озабоченность по поводу токсичности леводопы и ее потери эффективности со временем, хотя нет никаких доказательств, подтверждающих любую точку зрения.17 Наконец, раннее лечение агонистами дофамина (в виде монотерапии или в сочетании с леводопой) связано с более низкой частотой встречаемости моторные колебания и дискинезии в краткосрочной и среднесрочной перспективе по сравнению с монотерапией леводопой (степень доказательности A).Однако первоначальное лечение не оказывает значительного влияния на долгосрочную двигательную функцию18.
Из-за более низкого краткосрочного и среднесрочного риска двигательных флуктуаций агонист дофамина предпочтительнее в качестве начального лечения для пациентов моложе 70 лет с последующим добавлением леводопы в зависимости от симптомов (обычно в течение 2 лет). У пожилых пациентов леводопа часто является лучшим выбором для начального лечения из-за более высокого риска побочных эффектов от агонистов дофамина у пожилых пациентов (например, постуральная гипотензия, делирий и галлюцинации) и большего улучшения двигательной функции от леводопы.Леводопа следует вводить медленно и использовать в минимальной эффективной дозе. Поскольку моторное улучшение после начала терапии леводопой может развиваться в течение нескольких недель, дальнейшая оценка и любое увеличение дозы должны происходить как минимум примерно через 3 месяца. Следует избегать частых изменений времени приема лекарств и доз, а также не рекомендовать дополнительные дозы. Двигательные колебания и дискинезии более распространены, когда дозы леводопы превышают 500–600 мг / день10, и примечательно, что опубликованная частота двигательных колебаний основана на исследованиях, проведенных в эпоху, когда обычно использовались более высокие дозы леводопы.Соответственно, желательно как можно дольше удерживать дозу леводопы менее 600 мг / сут. На практике это означает использование комбинации агониста дофамина и леводопы и поддержание доз обоих на максимально низком уровне. Возможно, что в будущем частота серьезных двигательных флуктуаций будет ниже, поскольку более широко используются схемы с более низкими дозами леводопы.
Осложнения медикаментозной терапииПобочные эффекты являются важным фактором при выборе лечения ранней БП.
Постуральная гипотензия, делирий и сонливостьВсе дофаминергические препараты могут вызывать дозозависимую тошноту, постуральную гипотензию, делирий и сонливость. Они чаще встречаются с агонистами дофамина, чем с леводопой, и ограничивают дозу, которую можно использовать.
Поведенческие расстройстваВ последнее время внимание было сосредоточено на поведенческих расстройствах, которые возникают у 15% пациентов с БП, которые лечатся высокими дозами дофаминергических препаратов.19,20 Наиболее распространенными являются расстройства контроля над импульсами, которые включают патологическое пристрастие к азартным играм. , гиперсексуальность, компульсивные покупки и переедание.Риск этих заболеваний повышается у пациентов, получающих агонисты дофамина отдельно или в комбинации с леводопой.
PundingPunding — поразительное осложнение дофаминергической терапии. Это относится к повторяющимся и бесцельным двигательным действиям, таким как сбор и перестановка предметов, а также разборка и повторная сборка оборудования. Чрезмерное увлечение хобби — в том числе чрезмерное использование Интернета в ущерб сну, еде и другим повседневным действиям — также представляет собой форму критики.Частота пандинга у пациентов с БП не ясна, но считается, что оно встречается реже, чем расстройства контроля над импульсами.19 Пациентов, которые начинают дофаминергическую терапию (особенно терапию агонистами дофамина), следует предупреждать о риске импульсивного и компульсивного поведения, и как их, так и их семьи следует попросить сообщать о любых доказательствах такого поведения.
Синдром дисрегуляции дофаминаЕще одним осложнением дофаминергической терапии является синдром дисрегуляции дофамина (DDS), который относится к привычному применению допаминергических препаратов в дозах, превышающих предписанные и необходимых для лечения двигательных симптомов.Это, по-видимому, менее распространено, чем расстройства контроля над импульсами, и встречается примерно у 4% пациентов, лечившихся от БП.19 У пациентов с ДДС использование лекарств, по-видимому, в большей степени продиктовано повышением настроения, вызванным приемом лекарств, и желанием избежать дисфорического состояния. эффекты снижения уровней лекарств в периоды «выключения» (т.е. периоды, когда симптомы болезни Паркинсона не контролируются должным образом), а не двигательная функция.
Фибротические реакцииПо возможности следует назначать агонисты дофамина, не относящиеся к спорыньи (например, прамипексол, ротиготин), а не агенты спорыньи (например, бромокриптин, перголид, каберголин) из-за небольшого риска фиброзных реакций (например, плевропульмональных, забрюшинных). и фиброз сердечного клапана), связанный с последним.
Лечение двигательных колебаний и дискинезийУ пациентов, получающих леводопу, симптомы истощения обычно купируются путем сочетания леводопы с дополнительными дофаминергическими препаратами, такими как ингибитор катехол-O-метилтрансферазы (например, энтакапон), агонист дофамина или моноаминоксидаза. Ингибитор B (например, селегилин) (уровень доказательности A для всех трех). Препараты леводопы с медленным высвобождением, принимаемые перед сном, могут быть полезны для лечения симптомов истощения, возникающих в ночное время и при пробуждении, но они оказались неудовлетворительными для дневного применения из-за различной абсорбции.Разделение суточной дозы леводопы на более мелкие, более частые аликвоты и / или использование диспергируемых составов леводопы может ускорить абсорбцию и помочь облегчить симптомы истощения. Апоморфин, инъекционный агонист дофамина, можно вводить с перерывами подкожно для облегчения периодов потери трудоспособности.
Когда моторная реакция на лекарство неоптимальна, пациентам можно посоветовать избегать приема лекарств во время приема пищи, содержащей белок, поскольку аминокислоты конкурируют с леводопой за перенос через гематоэнцефалический барьер.
Дополнительные варианты лечения пациентов с тяжелыми двигательными колебаниями и дискинезиямиДля большинства пациентов с БП правильно подобранный режим приема пероральных препаратов обеспечивает адекватный контроль двигательных симптомов. Цель состоит в том, чтобы обеспечить регулярный, стабильный и непрерывный уровень дофаминергической стимуляции с минимальным количеством изменений, избегая бустерных доз. Однако, если двигательные колебания и дискинезии становятся серьезными или если пероральные препараты плохо переносятся, существует ряд других вариантов, включая непрерывную дофаминергическую стимуляцию и глубокую стимуляцию мозга.
Непрерывная дофаминергическая стимуляцияВариантами непрерывной дофаминергической стимуляции являются инфузия апоморфина и энтеральная инфузия геля леводопа – карбидопа. Инфузия апоморфина приводит к значительному сокращению ежедневного перерыва и уменьшению тяжести дискинезий (степень доказательности C) .21 Снижение дискинезий особенно заметно у пациентов, у которых терапия леводопой снижена или прекращена.21 В одном исследовании 70% пациентов пациенты с БП, которым была начата инфузия апоморфина, смогли отменить другие дофаминергические препараты и лечить их с помощью монотерапии апоморфином в течение длительного времени.21 Однако в другом исследовании сообщалось о гораздо более низком уровне (3%) достижения монотерапии апоморфином и 40% случаев прекращения лечения (во многих случаях из-за побочных эффектов, таких как кожные реакции, седативный эффект и спутанность сознания) .22
Инфузия кишечного геля леводопа-карбидопа непосредственно в тощую кишку дает более стабильные уровни леводопы в плазме, чем при прерывистом пероральном приеме.23 Кишечная инфузия леводопы также приводит к значительному сокращению времени простоя, со стабильным или сниженным уровнем дискинезии (уровень доказательности B) .24 Инфузия кишечного геля леводопа – карбидопа начинается в стационарных условиях с помощью назодуоденального зонда, а скорость инфузии титруется в соответствии с терапевтическими потребностями. Когда достигается оптимальный моторный ответ, для непрерывной инфузии вводится чрескожная гастростомическая трубка с внутренней трубкой тощей кишки. Пациенты, получающие апоморфин и кишечную инфузию леводопы-карбидопы, должны находиться под наблюдением в специализированной клинике PD опытной многопрофильной командой, включая медсестру-специалист по PD.
Стимуляция глубокого мозгаСтимуляция глубокого мозга субталамического ядра или внутреннего бледного шара играет важную роль в лечении БП. Пациенты, у которых леводопа дает отличные двигательные преимущества, но у которых развиваются двигательные флуктуации и дискинезии в результате длительного приема леводопы, являются хорошими кандидатами на глубокую стимуляцию мозга, так же как и пациенты с тремором, который не поддается лечению. Глубокая стимуляция головного мозга значительно сокращает время простоя, а
значительно сокращает
тремор и дискинезия (степень доказательности B).25Преимущества глубокой стимуляции головного мозга в снижении тремора, времени бездействия, двигательных колебаний и дискинезии сохраняются в течение 10 лет наблюдения26,27. Однако со временем наблюдается некоторое снижение объективных показателей двигательной функции. Это снижение, по-видимому, связано в первую очередь с прогрессированием тех областей двигательной функции, которые не реагируют на глубокую стимуляцию головного мозга, таких как остановка походки в состоянии приема лекарств, постуральная нестабильность и падения26-28
Тщательный отбор пациентов имеет решающее значение для успеха глубокой стимуляции мозга.Плохо справляются пациенты со значительными расстройствами настроения или когнитивной дисфункцией. Тяжелая постуральная нестабильность, падения и замерзание походки в состоянии приема лекарств обычно не устраняются после глубокой стимуляции мозга и фактически могут усугубляться.28 Улучшение качества жизни после глубокой стимуляции мозга значительно выше у пациентов моложе 65 лет по сравнению с пациентами старшего возраста, несмотря на аналогичную двигательную пользу.29 Это, по-видимому, связано с большей частотой у пожилых пациентов когнитивной дисфункции, постуральной нестабильности и дисфункции походки.29 Эти проблемы не уменьшаются после глубокой стимуляции мозга и являются основной причиной плохого качества жизни.
Факт или вымысел?
Факт: это правда, что практически всем пациентам с болезнью Паркинсона в конечном итоге потребуется леводопа.
Художественная литература: Неправда, что леводопа токсична и со временем теряет эффективность при болезни Паркинсона.
Финал Диагноз
Паркинсон болезнь
Роберту был поставлен диагноз «болезнь Паркинсона» при первом посещении невролога.Обсуждение было сосредоточено на том, следует ли начинать прием лекарств немедленно или подождать, пока не возникнут другие проблемы, приводящие к потере трудоспособности. Роберт чувствовал, что его симптомы не были достаточно серьезными, чтобы немедленно начать регулярное лечение. Ему было рекомендовано поддерживать физическую активность и регулярно заниматься спортом. Ему также было предложено связаться с его местной ассоциацией PD за информацией и поддержкой. Для получения авторитетной и основанной на фактах информации о PD был рекомендован веб-сайт WE MOVE (https://www.wemove.org/par), связанный с международным обществом по борьбе с расстройствами движения.
Шесть месяцев спустя Роберт почувствовал, что его состояние ухудшилось, и захотел начать лечение. Его невролог прописал прамипексол пролонгированного действия, начиная с 0,375 мг в день и увеличивая до 0,75 мг в день через 1 месяц. При последующем осмотре он сообщил о значительном уменьшении тремора. Единственным побочным эффектом, о котором он сообщил, было возможное легкое усиление сонливости. Он не сообщал о каких-либо симптомах дисфункции контроля над импульсами.
Через год после начала приема прамипексола (и через 18 месяцев после первого посещения) Роберт сообщил, что его тремор усиливается.Он также заметил ухудшение маневренности левой руки, замедление его ходьбы и большие трудности при вставании со стула и переворачивании в постели. Леводопа-карбидопа (100 мг леводопы плюс 25 мг карбидопы, три раза в день) была добавлена к схеме приема прамипексола, что положительно повлияло на эти симптомы.
Год спустя (два с половиной года после его первого визита) Роберт сообщил, что он заметил, что польза от таблеток леводопа-карбидопа, как правило, исчезает задолго до того, как должна была наступить следующая доза.Поэтому его терапия была изменена с леводопа-карбидопа на леводопа-карбидопа-энтакапон (100 мг леводопы плюс 25 мг карбидопы плюс 200 мг энтакапона три раза в день), что привело к значительному улучшению его состояния. Его терапия прамипексолом была продолжена. Каждые 6 месяцев его наблюдает невролог.
1 Дифференциальный диагноз тремора и ситуации, при которых он возникает
-
Паркинсонический тремор (покой, постуральный, рецидивирующий)
-
Эссенциальный тремор (постуральный, действие)
-
Тремор, вызванный лекарствами, который может быть вызван вальпроатом, антидепрессантами, нейролептиками, противорвотными средствами, литием, кортикостероидами, циклоспорином, адренергическими средствами, теофиллином и кофеином
-
Дистонический тремор (осанка, действие, покой, для выполнения конкретной задачи)
-
Мозжечок (поза, действие, намерение)
-
Тремор Холмса (среднего или рубрального) (покой, поза, действие, намерение)
-
Синдром хрупкой Х-ассоциированной треморной атаксии (покой, поза, действие, намерение)
-
Отмена препарата
-
Тиреотоксикоз
-
Гипогликемия
-
Метаболические энцефалопатии
-
Психогенный тремор
2 Указатели на вероятный диагноз болезни Паркинсона у пациента с тремором верхних конечностей
3 Тревожные признаки, которые нетипичны для болезни Паркинсона и требуют обследования неврологом3
-
Острое начало симптомов
-
Быстрое прогрессирование симптомов
-
Раннее падение
-
Симметрия клинических признаков
-
Ранние вегетативные симптомы
-
Паралич вертикального взора
-
Ранние когнитивные нарушения
-
Плохой ответ на леводопу
4 Акинетические ригидные синдромы, которые следует учитывать у пациента с паркинсонизмом и признаками красного флага, которые нетипичны для болезни Паркинсона
-
Множественная системная атрофия
-
Прогрессирующий надъядерный паралич
-
Кортикобазальная дегенерация
-
Деменция с тельцами Леви
-
Фронтальная ишемия белого вещества (болезнь Бинсвангера)
-
Паркинсонический тремор, вызванный лекарствами
-
Токсичность (например, марганец, окись углерода, МФТП [1-метил-4-фенил-1,2,3,6-тетрагидропиридин])
-
Прионная болезнь
Тремор
Определение
Тремор — наиболее распространенное двигательное расстройство.В 1817 году Джеймс Паркинсон охарактеризовал тремор в своем эссе о дрожащем параличе как «непроизвольное дрожание частей, не находящихся в действии». 1
Тремор определяется как ритмичное непроизвольное колебательное движение части тела, возникающее изолированно или как часть клинического синдрома. В клинической практике характеристика тремора важна для этиологического рассмотрения и лечения. Распространенные типы включают тремор покоя, постуральный тремор, кинетический тремор, тремор для выполнения конкретной задачи и тремор намерения.
Тремор покоя возникает, когда часть тела находится в полном покое против силы тяжести. Амплитуда тремора уменьшается при произвольной деятельности. Примеры тремора в состоянии покоя приведены во вставке 1. Постуральный тремор возникает при сохранении положения против силы тяжести и усиливается при движении. Действие или кинетический тремор возникает во время произвольного движения. Во вставке 2 приведены примеры постурального тремора и тремора движения. Тремор, связанный с заданием, возникает во время определенного действия. Примером этого типа является первичный тремор письма.Намеренный (или терминальный) тремор проявляется как заметное увеличение амплитуды тремора во время конечной части целевого движения. Примеры намеренного тремора включают тремор мозжечка и тремор рассеянного склероза.
| Вставка 1: Примеры тремора покоя |
|---|
| Лекарственный паркинсонизм (нейролептики, метаклопромид и фенотиазины) |
| Длительный эссенциальный тремор |
| Болезнь Паркинсона |
| Синдромы Паркинсона плюс (тремор покоя встречается реже) |
| Болезнь Вильсона |
© 2002 Фонд клиники Кливленда.
| Вставка 2: Примеры постурального тремора и двигательного тремора |
|---|
| Эссенциальный тремор (преимущественно постуральный) |
| Нарушения обмена веществ (тиреотоксикоз, феохромоцитома, гипогликемия) |
| Паркинсонизм, индуцированный лекарственными средствами (литий, амиодарон, агонисты β-адренорецепторов) |
| Токсины (синдром отмены алкоголя, тяжелые металлы) |
| Невропатический тремор (невропатия) |
© 2002 Фонд клиники Кливленда.
Back to Top
Распространенность
Показатели распространенности различаются в зависимости от типа тремора. Эссенциальный тремор — наиболее распространенная форма с частотой от 0,4% до 5,6%. 2 Семейный анамнез положительно идентифицируется примерно у 60% пациентов, а тип наследования является аутосомно-доминантным. Возраст начала эссенциального тремора имеет два пика: в раннем возрасте и в более старших возрастных группах.
Тремор при болезни Паркинсона обычно возникает в покое, но у некоторых пациентов присутствуют компоненты постурального тремора и тремора действия. Согласно Янковичу и его коллегам, 3 постуральный тремор у пациентов с болезнью Паркинсона можно отличить от эссенциального тремора, наблюдая за латентным периодом, который представляет собой временной интервал, начинающийся с принятия вытянутой позы и заканчивающийся началом тремора. Он обозначил это как эмерджентный тремор и отмечает, что латентность появления тремора при болезни Паркинсона (около 9 секунд) значительно больше, чем латентность эссенциального тремора (около 1-2 секунд).
Обследования населения по болезни Паркинсона в различных географических регионах мира показали широкий диапазон показателей распространенности. Для белых в Европе и Северной Америке коэффициент распространенности с поправкой на возраст колеблется от 56 до 234 на 100 000 по сравнению с диапазоном от 14 до 148 на 100 000 в Азии.
В начало
Патофизиология
Четыре основных механизма связаны с возникновением тремора. 4-6 Вероятно, что сочетание этих механизмов вызывает тремор при различных заболеваниях. Механические колебания конечности могут возникать в определенном суставе; этот механизм применяется в случаях физиологического тремора. Рефлекторное колебание вызывается афферентными путями мышечного веретена и отвечает за более сильный тремор за счет синхронизации. Этот механизм является возможной причиной тремора при гипертиреозе или других токсических состояниях. Центральные осцилляторы — это группы клеток центральной нервной системы, присутствующие в таламусе, базальных ганглиях и нижних оливках.Эти клетки обладают способностью многократно стрелять и вызывать тремор. Паркинсонический тремор может происходить из базальных ганглиев, а эссенциальный тремор может происходить из нижних олив и таламуса. Нарушение работы мозжечка может вызывать тремор. Исследования с помощью позитронно-эмиссионной томографии показали активацию мозжечка практически при всех формах тремора. 7
В начало
Признаки и симптомы
Тремор можно классифицировать по клиническому и этиологическому признаку.Признаки и симптомы зависят от типа и причины тремора.
Физиологический тремор
Физиологический тремор — это мелкий тремор очень низкой амплитуды (6–12 Гц), который едва заметен невооруженным глазом. Он присутствует у каждого нормального человека при сохранении позы или движения. Результаты неврологического обследования пациентов с физиологическим тремором обычно нормальны.
Усиленный физиологический тремор
Усиленный физиологический тремор — это высокочастотный видимый тремор с низкой амплитудой, который возникает в основном при сохранении определенной позы.Лекарства и токсины вызывают эту форму тремора. Предполагаемый механизм — механическая активация на мышечном уровне. Признаки и симптомы токсичности лекарств или других побочных эффектов могут присутствовать или отсутствовать. Симптомы тремора могут улучшиться после прекращения приема возбудителей.
Эссенциальный тремор
Эссенциальный тремор — наиболее частая форма всех двигательных нарушений. Классический эссенциальный тремор — это преимущественно постуральный тремор или тремор действия, и обычно у пациента имеется положительный семейный анамнез тремора.Употребление алкоголя часто временно уменьшает тремор. Другие сопутствующие симптомы могут включать легкое затруднение походки, и как группа пациентов с эссенциальным тремором наблюдается повышенная потеря слуха по сравнению с контрольной группой или пациентами с болезнью Паркинсона. Степень нарушения слуха коррелирует с тяжестью тремора (таблица 1). 8
Таблица 1: Характеристики тремора Паркинсона по сравнению с эссенциальным тремором
| Характеристика | Тремор Паркинсона | Эссенциальный тремор |
|---|---|---|
| Тип тремора | Тремор покоя | Постуральный тремор и активный тремор |
| Возраст | Пожилой возраст (> 60 лет) | Все возрастные группы |
| Семейная история | Обычно отрицательное | Положительно у> 60% пациентов |
| Спирт | Не выгодно | Выгодное |
| Начало тремора | Односторонний | Двусторонний |
| Мышечный тонус | Жесткость зубчатого колеса | Нормальный |
| Выражение лица | Уменьшено | Нормальный |
| Походка | Уменьшение поворота рычага | Нормальный |
| Задержка тремора | Дольше: 8-9 сек | Короче: 1-2 секунды |
Тремор Паркинсона
Тремор Паркинсона — это низкочастотный тремор покоя, обычно определяемый как тремор, вызывающий катание таблеток.У некоторых пациентов также наблюдается постуральный тремор и тремор действия. Тремор Паркинсона обычно возникает в сочетании с другими симптомами, такими как микрография, медлительность (брадикинезия) и ригидность. Обычно семейный анамнез тремора Паркинсона отсутствует, а употребление алкоголя не снижает подвижность (см. Таблицу 1).
Тремор мозжечка
Мозжечковый тремор — это низкочастотный (<4 Гц) интенционный тремор, который обычно возникает односторонне. Распространенными причинами являются рассеянный склероз, инсульт и травма мозжечка.Могут присутствовать признаки и симптомы дисфункции мозжечка, включая атаксию, дисметрию, дисдиадохокинезию и дизартрию.
Тремор Холмса
Тремор Холмса или рубральный тремор обозначает комбинацию тремора покоя, осанки и действия, вызванного поражением среднего мозга вблизи красного ядра. 5 Этот вид тремора нерегулярный и низкочастотный (4,5 Гц). Могут присутствовать признаки атаксии и слабости. К частым причинам относятся нарушения мозгового кровообращения и рассеянный склероз с возможной задержкой начала тремора и возникновения поражений от 2 недель до 2 лет.
Тремор, вызванный лекарствами
Типы тремора, вызываемого лекарствами, включают усиленный физиологический тремор, тремор покоя и тремор действия. Признаки и симптомы тремора, вызванного приемом лекарств, зависят от применяемого препарата и от предрасположенности пациента к его побочным эффектам. Некоторые препараты вызывают экстрапирамидные побочные эффекты, проявляющиеся в виде брадикинезии, ригидности и тремора. В таблице 2 перечислены препараты, которые могут вызывать тремор, а также типы тремора и неврологические симптомы, которые они вызывают. Тремор снова появляется у пациентов с болезнью Альцгеймера, получавших ингибиторы холинэстеразы, подтверждая наблюдение, что антихолинергические агенты очень эффективны в облегчении тремора при болезни Паркинсона. 9
Таблица 2: Тремор, вызванный лекарствами, и соответствующие неврологические признаки
| Лекарство или класс наркотиков | Тип тремора | Неврологические признаки |
|---|---|---|
| Амиодарон | Постуральный | Редко паркинсонизм |
| Бронходилататоры | Постуральный, действие | Нет |
| Литий | Отдых, поза, действие | Экстрапирамидальный |
| метоклопрамид | Отдых, постуральный | Экстрапирамидальный |
| Нейролептики | Отдых, постуральный | Экстрапирамидальный |
| Теофиллин | Постуральный | Нет |
| Вальпроат | Постуральный | Редко паркинсонизм |
© 2002 Фонд клиники Кливленда.
Тремор, вызванный системным заболеванием
Тремор, вызванный системным заболеванием, обычно возникает, когда пациент двигается или принимает определенное положение. Сопутствующие симптомы включают астериксис, изменения психического статуса и другие признаки системного заболевания. Среди наиболее частых причин — такие заболевания, как тиреотоксикоз и печеночная недостаточность, а также белая горячка и отмена лекарств.
Психогенный тремор
Психогенный тремор может поражать любую часть тела, но чаще всего он поражает конечности.Обычно тремор возникает внезапно и начинается с необычной комбинации тремора позы, движения и покоя. Психогенный тремор уменьшается при отвлечении внимания и связан с множеством других психосоматических жалоб. 9
Ортостатический тремор
Ортостатический тремор считается разновидностью эссенциального тремора. Этот тип тремора возникает в ногах сразу же после вставания и облегчается в положении сидя. Ортостатический тремор обычно высокочастотный (14-18 Гц), и никаких других клинических признаков или симптомов нет.
В начало
Диагностика
Диагностическая оценка пациента с тремором должна включать тщательный сбор анамнеза, клиническое обследование (включая оценку тремора) и дифференциальный диагноз.
Критерии
Исследовательская группа по исследованию тремора предложила рабочее определение эссенциального тремора для научных исследований. 10
Определенный эссенциальный тремор — это постуральный тремор в руках, который усиливается во время действия при отсутствии каких-либо состояний или лекарств, которые, как известно, вызывают усиленный физиологический тремор, и при отсутствии мозжечковых симптомов и признаков, а также при отсутствии болезни Паркинсона и дистонии.Тремор головы может присутствовать или отсутствовать.
Вероятный эссенциальный тремор — постуральный тремор в руках без усиления во время действия при отсутствии каких-либо состояний или лекарств, которые, как известно, вызывают усиленный физиологический тремор, и при отсутствии мозжечковых симптомов и признаков, а также при отсутствии болезни Паркинсона и дистонии. Тремор голоса и головы или шеи возникает при отсутствии каких-либо состояний или лекарств, которые, как известно, вызывают усиленный физиологический тремор, и при отсутствии мозжечковых симптомов и признаков, а также при отсутствии болезни Паркинсона и дистонии.
Возможный эссенциальный тремор — это постуральный тремор в руках и тремор действия в руках при отсутствии каких-либо состояний или лекарств, которые, как известно, вызывают усиленный физиологический тремор, и при отсутствии мозжечковых симптомов и признаков, но при наличии болезни Паркинсона и дистонии .
История болезни
История болезни должна содержать подробные сведения о начале тремора, продолжительности, тяжести, пораженной области, активирующих факторах, успокаивающих факторах, влиянии алкоголя, семейном анамнезе и сопутствующих симптомах.
Клиническое обследование
Клиническое обследование должно определить рейтинг и частоту тремора. Также следует обследовать пациента в покое, при принятии различных положений и при движении. Также важно исследование походки, мышечного тонуса, мимики и ловкости, особенно для дифференциации эссенциального тремора от болезни Паркинсона. Тремор в каждой пораженной части тела можно оценить как покой, кинетический или постуральный по шкале, разработанной Финдли и его коллегами, следующим образом: 11
- Нет тремора
- Легкий тремор
- Умеренный тремор (
- Выраженный тремор (экскурсия 2-4 см)
- Сильный тремор (экскурсия> 4 см)
Лабораторная работа
Большинству пациентов с тремором лабораторное обследование не требуется.Тест на функцию щитовидной железы помогает исключить гипертиреоз у пациентов с признаками заболевания щитовидной железы и тремора, особенно у пациентов с постуральными и активными типами. У молодых пациентов (моложе 40 лет) с признаками паркинсонизма и тремора для исключения болезни Вильсона необходимо определение содержания меди в сыворотке крови, церулоплазмина сыворотки, суточной концентрации меди в моче и исследования с помощью щелевой лампы. Чтобы исключить системные причины тремора, такие как гипогликемия, заболевание печени, электролитный дисбаланс или злоупотребление наркотиками, необходимо назначить соответствующие тесты.Некоторым пациентам требуется магнитно-резонансная томография или компьютерная томография головного мозга, если тремор острый, прогрессирование быстрое и признаки мозжечка предполагают инсульт, демиелинизирующее заболевание или структурное поражение. Тремор также можно проанализировать и диагностировать с помощью акселерометров и записей поверхностной электромиограммы.
Дифференциальная диагностика
Дифференциальный диагноз тремора включает миоклонус, клонус, астериксис и частичную континуальную эпилепсию.Миоклонус — это нерегулярные или ритмичные короткие мышечные сокращения, которые могут имитировать тремор. Электрофизиологический анализ с помощью электромиограммы или электроэнцефалограммы (ЭЭГ), а также обратное усреднение помогают поставить диагноз. Клонус — это ритмичное движение вокруг суставов, которое стимулируется рефлексом растяжения. Пассивное растяжение увеличивает клонус, но не тремор, помогая отличить клонус от тремора. Астериксис — это разновидность миоклонии, которая может вызывать тремор конечностей. Астериксис можно отличить от тремора по нерегулярным движениям.Кроме того, на электромиограмме наблюдаются паузы более 200 мсек. Парциальная эпилепсия континуума может вызывать ритмические подергивания в конечностях. Клинический анамнез, подтверждающий эпилепсию, и показания ЭЭГ, показывающие аномальные всплески, помогают указать правильный диагноз.
В начало
Лечение и результаты
Эссенциальный тремор и тремор Паркинсона
Эссенциальный тремор — это медленно прогрессирующее заболевание, для которого не существует профилактической терапии.В некоторых случаях лечение не требуется, особенно когда нетрудоспособность минимальна или риски от приема лекарств перевешивают их преимущества. Варианты лечения эссенциального тремора включают фармакологические подходы и хирургическое лечение. Физические и психологические меры, такие как биологическая обратная связь и методы релаксации, могут быть полезны в управлении легким тремором.
Болезнь Паркинсона — нейродегенеративное заболевание, которое клинически проявляется тремором в покое одной или нескольких конечностей различной степени в сочетании с ригидностью и брадикинезией.Профилактическая или нейропротекторная терапия недоступна. Легкий тремор в состоянии покоя без отключения двигательных симптомов не требует лечения. Доступен широкий спектр вариантов лечения тремора при болезни Паркинсона, включая пероральные препараты, инъекции ботулотоксина и операции по глубокой стимуляции мозга.
Фармакологическое лечение
Лечение эссенциального тремора обычно начинается с монотерапии примидоном или пропранололом. Дозировки постепенно увеличиваются для достижения оптимального ответа.Если контроль тремора остается недостаточным при увеличении доз монотерапии, может быть назначена комбинированная терапия. Для подходящих кандидатов, у которых фармакологическая терапия неадекватна, могут быть рассмотрены локальные инъекции ботулинического токсина.
Антагонист β-адренорецепторов пропранолол (индерал) используется для лечения эссенциального тремора. Приблизительно от 60% до 70% пациентов замечают уменьшение амплитуды тремора при терапии. Пропранолол наиболее эффективен при треморе верхних конечностей и менее эффективен при треморе головы и голоса.Противопоказания включают сердечную недостаточность, нарушения сердечной проводимости, астму и диабет. Побочные эффекты включают снижение толерантности к физическим нагрузкам, утомляемость, брадикардию и периферическую вазоконстрикцию. Пропранолол не следует прекращать внезапно из-за возможной рикошетной гипертензии.
Пропранолол следует начинать с 40 мг два раза в день для лечения эссенциального тремора. Дозировку можно постепенно увеличивать до 120–320 мг / день один раз в день или в несколько приемов. Дозы выше 320 мг / день не доказали свою эффективность.Другие бета-блокаторы, используемые при лечении эссенциального тремора, включают атенолол, метопролол, тимолол и надолол; однако они не так эффективны, как пропранолол.
Примидон (Мизолин) — структурный аналог фенобарбитала. Препарат снижает амплитуду тремора на 60-70%. Хотя терапия примидоном снижает тремор рук, тремор головы, голоса и других областей улучшается в меньшей степени. Начальная доза примидона должна быть низкой (12,5-25 мг), принимать перед сном и постепенно увеличиваться до тех пор, пока не будет достигнуто уменьшение тремора.Максимальная дозировка составляет 750 мг / сут в три приема. Примидон немного более эффективен, чем терапия бета-адреноблокаторами. Побочные эффекты включают тошноту, рвоту, седативный эффект, головокружение, атаксию и головную боль. Эти побочные эффекты можно предотвратить, если начинать терапию с низких доз.
Если монотерапия примидоном или пропранололом не приносит результатов, эти два агента могут использоваться в комбинации. Примидон можно постепенно повышать до диапазона от 150 до 250 мг / день.Пропранолол можно постепенно увеличивать в течение нескольких недель до 240 мг / день или до 320 мг / день.
Ингибиторы карбоангидразы ацетазоламид и метазоламид эффективны у некоторых пациентов с эссенциальным тремором, особенно с тремором головы. Однако побочные эффекты являются обычными, включая головные боли, седативный эффект, спутанность сознания, депрессию, парестезии и желудочно-кишечные расстройства. Двойные слепые испытания этих агентов не продемонстрировали доказанной эффективности по сравнению с плацебо.
Бензодиазепины, такие как диазепам, алпразолам и клоназепам, улучшают тремор у некоторых пациентов с эссенциальным тремором. Однако преимущества, связанные с терапией бензодиазепинами у этих пациентов, могут быть частично связаны с его анксиолитическим действием. Побочные эффекты включают чрезмерный седативный эффект. Был опробован ряд других агентов, но они показали непостоянную эффективность при лечении эссенциального тремора. В двойных слепых контролируемых исследованиях габапентин оказался не более эффективным, чем плацебо. В небольших испытаниях блокаторы кальциевых каналов нимодипин и никардипин показали некоторые перспективы; однако миртазапин (Ремерон) не показал устойчивых преимуществ.
Ботулинический токсин типов A и B использовался для лечения дистонии и спастичности и в настоящее время используется в качестве терапевтического средства для отдельных пациентов с тремором. Ботулинический токсин действует посредством пресинаптического ингибирования высвобождения ацетилхолина в нервно-мышечном соединении. Открытые и двойные слепые исследования продемонстрировали эффективность ботулотоксина типа А при лечении тремора конечностей, головы, голоса, неба и других видов тремора. 12,13 Роль противоэпилептических препаратов в лечении эссенциального тремора продолжает развиваться; габапентин (нейронтин) является наиболее изученным.
Тремор при болезни Паркинсона обычно улучшается при приеме дофаминергических и холинолитических препаратов. Антихолинергические средства включают тригексифенидил, бензтропин и проциклидин. Комбинация дофаминергических средств и холинолитиков эффективна при болезни Паркинсона с преобладанием тремора. Однако побочные эффекты холинолитической терапии, такие как сухость во рту, нечеткое зрение, затрудненное мочеиспускание и спутанность сознания, могут ограничивать использование этих агентов. Эти препараты следует избегать у пожилых пациентов, и прием лекарств следует прекращать постепенно, чтобы избежать сильного обратного эффекта на тремор.
Дофаминергические препараты являются основой лечения тремора при болезни Паркинсона. Во вставке 3 перечислены дофаминергические агенты, используемые для лечения заболевания, и основные побочные эффекты, которые они могут вызвать.
| Вставка 3: Дофаминергические препараты, используемые для лечения тремора при болезни Паркинсона и их побочных эффектов |
|---|
| Амантадин |
|
| Carbidopa, Леводопа |
|
| перголид |
|
| Прамипексол |
|
| Ропинирол |
|
© 2002 Фонд клиники Кливленда.
Хирургическое лечение
Для пациентов с тяжелым, инвалидизирующим, рефрактерным к лекарствам эссенциальным тремором хирургическое вмешательство является разумным вариантом лечения. Хирургическое лечение включает абляционную терапию посредством стереотаксической таламотомии или хронической таламической стимуляции глубокого мозга. Вентральное промежуточное ядро таламуса — лучшая мишень как для абляционной, так и для глубокой стимуляции мозга. Противопоказания к хирургическому лечению эссенциального тремора включают нестабильные соматические заболевания, затрудненное глотание и выраженные когнитивные проблемы.
Точно так же при болезни Паркинсона тремор значительно улучшается после операции по глубокой стимуляции субталамического ядра. Хотя эти хирургические методы широко доступны, их следует использовать с осторожностью и только после исчерпания всех возможных вариантов фармакологического лечения.
Менее распространенные формы тремора можно лечить, как указано во вставке 4. 14
| Вставка 4: Лечение менее распространенных форм тремора |
|---|
| Тремор мозжечка |
|
| Дистонический тремор |
|
| Усиленный физиологический тремор |
| Ортостатический тремор |
|
© 2002 Фонд клиники Кливленда.
Фармакологическую терапию следует первоначально рассматривать при менее распространенных формах тремора, таких как усиленный физиологический тремор, дистонический тремор, ортостатический тремор и тремор мозжечка. Если медикаментозное лечение не дает результатов, при определенных типах тремора следует рассмотреть возможность операции по глубокой стимуляции головного мозга.
Сводка
- Тремор — наиболее распространенное двигательное расстройство.
- Характеризуется ритмичным непроизвольным колебательным движением части тела.
- Нарушение работы мозжечка может вызывать тремор. Исследования с помощью позитронно-эмиссионной томографии показали активацию мозжечка практически при всех формах тремора.
- Тремор можно классифицировать по клиническому и этиологическому признаку. Это может произойти в состоянии покоя (болезнь Паркинсона) или при осанке и движении (эссенциальный тремор).
- Дифференциальный диагноз тремора включает миоклонус, клонус, астериксис и частичную континуальную эпилепсию.
- Лечение включает фармакологическую терапию и глубокую стимуляцию мозга.
Back to Top
Рекомендуемая литература
- Финдли Л.Дж. Классификация тремора. J Clin Neurophysiol 1996; 13: 122–132.
- ван ден Ноорт С.Эссенциальный тремор. N Engl J Med 2002; 346: 709–710.
В начало
Список литературы
- Паркинсон Дж. Очерк дрожащего паралича. Лондон: Уиттингем и Роуленд; 1817.
- Финдли Л.Дж., Коллер WC. Эссенциальный тремор: обзор. Неврология 1987; 37: 1194–1197.
- Jankovic J, Schwartz KS, Ondo W. Повторно возникающий тремор болезни Паркинсона. J Neurol Neurosurg Psychiatry 1999; 67: 646–650.
- Elble RJ. Патофизиология тремора. В: Watts RL, Koller WC, eds. Расстройства движения: неврологические принципы и практика. Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл; 1997: 405–417.
- Deuschl G, Krack P, Lauk M, Timmer J. Клиническая нейрофизиология тремора. J Clin Neurophysiol 1996; 13: 110–121.
- Elble RJ. Центральные механизмы тремора. J Clin Neurophysiol 1996; 13: 133–144.
- Уиллс AJ, Jenkins IH, Thompson PD, Findley LJ, Brooks DJ. Красная ядерная и мозжечковая активация, но не оливковая активация, связанная с эссенциальным тремором: позитронно-эмиссионное томографическое исследование. Ann Neurol 1994; 36: 636–642.
- Ондо В.Г., Саттон Л., Дат Вуонг К., Лай Д., Янкович Дж. Нарушение слуха при эссенциальном треморе. Неврология 2003; 61: 1093–1097.
- Эмре М., Арсланд Д., Альбанезе А. и др. Ривастигмин при деменции, связанной с болезнью Паркинсона. N Engl J Med 2004; 351: 2509–2518.
- Коллер В., Ланг А., Ветере-Оверфилд Б. и др. Психогенный тремор. Неврология 1989; 39: 1094–1099.
- Финдли Л.Дж., Коллер В.К., Де Витт П. и др. Классификация и определение тремора. В: Лорд Уолтон из Детчанта, изд. Показания и клиническое значение терапии ботулотоксином. Лондон: Королевское общество медицины Press; 1993: 22–23.
- Bain PG, Findley LJ, Atchison P, et al. Оценка тяжести тремора. J Neurol Neurosurg Psychiatry 1993; 56: 868–873.
- Янкович Дж., Шварц К., Клеменс В., Асвад А., Мордаунт Дж. Рандомизированное двойное слепое плацебо-контролируемое исследование для оценки ботулотоксина типа А при эссенциальном треморе рук. Mov Disord 1996; 11: 250–256.
- Wissel J, Masuhr F, Schelosky L, Ebersback G, Poewe W. Количественная оценка лечения ботулотоксином у 43 пациентов с тремором головы. Mov Disord 1997; 12: 722–726.
В начало
границ | Ортезы для подавления тремора для верхней конечности: современные разработки и будущие задачи
1.Введение
Неврологические расстройства в настоящее время являются ведущей причиной инвалидности во всем мире. Среди неврологических расстройств, изученных в Глобальном исследовании бремени болезней, травм и факторов риска (ГББ) 2015 года, болезнь Паркинсона была самой быстрорастущей по распространенности, инвалидности и смертности. В 2016 году во всем мире болезнь Паркинсона была диагностирована у 6,1 миллиона человек (Dorsey et al., 2018). Болезнь Паркинсона — это хроническое, медленно прогрессирующее дегенеративное заболевание центральной нервной системы, которое характеризуется наличием тремора в покое, ригидности, акинезии и постуральной нестабильности (Rocon and Pons, 2011).Патологический тремор характеризуется непроизвольным ритмичным сокращением мышц, приводящим к сотрясениям в одной или нескольких частях тела (Anouti and Koller, 1995). Тремор является наиболее распространенным двигательным расстройством у взрослых и может быть следствием неврологического заболевания или употребления наркотиков (Jankovic and Stanley, 1980; Deuschl et al., 1998; Bhidayasiri, 2005; Elble et al., 2013). Эссенциальный тремор (ЭТ) и болезнь Паркинсона (БП) — два наиболее распространенных состояния, вызывающих тремор в верхней конечности и чаще всего поражающих руки (Raethjen et al., 2000; Elble and Deuschl, 2011). Хотя тремор не опасен для жизни, он может расстраивать и даже выводить из строя, вызывая серьезные трудности при выполнении повседневных дел (Национальный институт неврологических расстройств и инсульта, 2020).
Патологический тремор верхней конечности можно разделить на два основных типа: тремор покоя (или статический) и тремор действия. Тремор покоя возникает, когда часть тела расслаблена и полностью поддерживается против силы тяжести. Обычно он усиливается умственным стрессом или движением другой части тела и уменьшается произвольным движением пораженной части тела (Bhidayasiri, 2005).Большинство тремора — это тремор действия, который возникает при произвольном сокращении мышцы. Тремор действия можно подразделить на постуральный, изометрический и кинетический (Crawford and Zimmerman, 2011). Постуральный тремор присутствует при сохранении позы против силы тяжести. Изометрический тремор возникает при сокращении мышц о жесткий неподвижный объект. Кинетический тремор связан с любым произвольным движением и включает намеренный тремор, который возникает при целенаправленном движении (Deuschl et al., 1998). В то время как тремор в состоянии покоя является кардинальным признаком у пациентов с БП, тремор действия в верхней (ых) конечности (ах) является основным симптомом ЭТ, особенно кинетический тремор (Cohen et al., 2003; Jankovic, 2008; Thenganatt and Louis, 2012). .
Фармацевтические препараты — одно из наиболее часто используемых средств против тремора при БП и ЭТ. К сожалению, он неэффективен при лечении тремора и имеет серьезные побочные эффекты. Например, тремор не контролируется эффективно или адекватно примерно у 25% пациентов (Gallego et al., 2010). Побочные эффекты от лекарств включают аллергические реакции, тошноту, проблемы с сердцем, снижение количества лейкоцитов и т. Д. (Matsumoto et al., 2013). В результате более половины людей прекращают лечение из-за побочных эффектов или отсутствия эффективности (Diaz and Louis, 2010; O’Connor and Kini, 2011). Использование электрической стимуляции определенной части мозга (Deep Brain Stimulation, DBS) стало одним из наиболее эффективных методов лечения большинства треморов. Например, в то время как эффективность медикаментозного лечения по снижению тремора составляет от 23 до 59% для БП (Koller, 1986), эффективность составляет 90% для метода DBS (Elble and Deuschl, 2011).Однако DBS является инвазивным лечением и сопряжено с риском хирургических осложнений (имплантация электродов в мозг) (Katayama et al., 2005; Hariz et al., 2008).
Учитывая недостатки традиционных методов лечения тремора (например, отсутствие эффективности, побочные эффекты от лекарств, потенциальные риски хирургического вмешательства на головном мозге), существует значительная потребность в эффективных, неинвазивных методах лечения тремора. Последние подходы включают проект EU TREMOR, который направлен на применение выборочных биомеханических нагрузок через многоканальный массив FES для компенсации тремора, не препятствуя произвольным движениям пользователя (Pons, 2011).В предыдущих исследованиях также сообщалось о перспективности использования FES с обратной связью для активации треморогенных мышц в противофазе, чтобы противодействовать тремору (Elek and Prochazka, 1989; Javidan et al., 1990). Однако основные проблемы, такие как смещение электродов FES из-за движений и мышечного утомления, должны быть решены для длительного использования устройств FES (Tepavac and Schwirtlich, 1997). Группа доказательной медицины Общества двигательных расстройств также рекомендовала упражнения и физиотерапию в качестве эффективной альтернативы традиционным методам лечения тремора (Fox et al., 2011). Краткосрочные и, в меньшей степени, долгосрочные преимущества физиотерапевтических вмешательств при лечении тремора у пациентов с БП были продемонстрированы в последние десятилетия (Allen et al., 2011; Shen et al., 2016). Кроме того, недавние исследования продемонстрировали эффективность метода биомеханической нагрузки с использованием носимых ортезов для подавления тремора (Adelstein and Rosen, 1981; Rocon et al., 2005; Kazi et al., 2010; Taheri et al., 2013; Zhou et al. ., 2017). Такие устройства обычно содержат усовершенствованные алгоритмы обработки сигналов для оценки произвольных и треморных движений с помощью биомеханических датчиков [e.g., суставные углы, ускорение, сила взаимодействия, поверхностная электромиография (пЭМГ) и механизм подавления, который генерирует механические нагрузки для ослабления треморных движений].
В этой обзорной статье мы суммируем современное состояние носимых ортезов для верхних конечностей для подавления тремора. Резюме включает в себя как механическую разработку, так и стратегии управления. Этот обзор также направлен на выявление ограничений существующих ортезов при лечении тремора и обсуждение потенциальных направлений исследований для улучшения дизайна и разработки в будущем.
2. Методы
2.1. Методы поиска и ключевые слова
Мы следовали «Предпочтительным элементам отчетности для систематических обзоров и метаанализа» (PRISMA) для поиска и отбора соответствующих исследований в этой обзорной статье. Подробности блок-схемы PRISMA показаны на рисунке 1. Чтобы систематически подойти к этапу идентификации , мы написали скрипт Python и использовали NCBI Entrez API для поиска литературы. Количество исследований было ограничено 200 пунктами и принимались только исследования за последние 50 лет.Ключевые слова поиска были применены для запроса данных из баз данных PMC и PubMed: («управление тремором» ИЛИ «патологический тремор» ИЛИ «оценка тремора» ИЛИ «эссенциальный тремор» ИЛИ «патологический тремор» ИЛИ «подавление тремора» ИЛИ «лечение тремора» »ИЛИ« подавление тремора ») И (экзоскелет ИЛИ ортез ИЛИ« вспомогательный робот »ИЛИ« вспомогательное устройство ») НЕ (« электрическая стимуляция »[название] ИЛИ« хирургический »[название] ИЛИ« рассеянный склероз »[название]) . Мы выполнили запрос и выявили 87 статей 15 мая 2020 года.Дополнительные записи были получены из других баз данных и поисковой системы (например, Google Scholar, IEEE) с использованием тех же ключевых слов. Дубликаты и исследования, не соответствующие критериям включения (см. Ниже), были исключены. Два составителя обзора получили и просмотрели полные тексты остальных соответствующих исследований и сравнили результаты. В случае разногласий решающее значение имеет последний рецензент (TPL).
Рисунок 1 . Блок-схема PRISMA метода отбора статей.
2.2. Критерии отбора исследований
Критерии включения исследования в обзор следующие:
• Экзоскелет или ортезы верхних конечностей
• Пассивный или активный ортез для подавления тремора
• Носимые устройства для подавления тремора на уровне опорно-двигательного аппарата
• Носимые ортезы для подавления тремора
• Лечение тремора контролировалось исключительно использованием ортезов верхних конечностей без фармакологического лечения.
Критерии исключения:
• Фиксированный / заземленный экзоскелет верхней конечности
• Экзоскелет нижних конечностей
• Функциональная электрическая стимуляция (FES) для подавления тремора
• Лечение тремора без биомеханической нагрузки [например, глубокая стимуляция мозга (DBS), лекарства, хирургия].
2.3. Извлечение данных
Остальные исследования, которые соответствуют всем критериям включения в раздел 2.2 и имеют право на полнотекстовый доступ, будут дополнительно проанализированы.Мы извлекли следующую информацию из каждого исследования:
• Механизмы подавления
Типы механизмов (т.е. пассивный, полуактивный, активный), которые были реализованы для подавления треморных движений (подробности в разделе 3.1)
• Степени свободы (DOF) и вес ортезов
степеней свободы представляют собой количество суставов верхних конечностей, в которых непроизвольные движения подавляются ортезом. Вес ортеза является решающим фактором, влияющим на удобство использования и функциональность ортеза, а также на приемлемость для пользователей.В этом обзоре веса внешних систем, которые не используются пользователями, например, источника питания от батареи, не были включены.
• Эффективность подавления тремора
Эффективность рассчитывалась путем сравнения измерений тремора с подавлением ортеза и без него. Метрики сравнения могут быть как в частотной, так и во временной области. Значения эффективности были преобразованы в процент (%) для сравнения в различных исследованиях. Три различных типа экспериментальных установок включают (1) стендовые испытания без участия людей, (2) здоровые люди и (3) испытуемые с тремором.
• Измерения тремора
Тип датчиков, которые использовались для измерения физиологических и биомеханических данных пользователя. Например, инерциальный измерительный блок (IMU), датчики силы, sEMG и т. Д.
• Алгоритмы оценки произвольных и треморных движений
Методы и алгоритмы обработки сигналов для выделения треморных движений из произвольных.
2.4. Степени свободы (DOF) верхней конечности человека
Кинематическая модель верхней конечности (без учета степеней свободы кисти) имеет семь степеней свободы: сгибание / разгибание плеча, приведение / отведение плеча, внутреннее / внешнее вращение плеча, сгибание / разгибание локтя (EFE), пронация / супинация предплечья. (FPS), сгибание / разгибание запястья (WFE) и радиальное / локтевое отклонение запястья (WRU).Степень свободы плечевого сустава не была указана в этой обзорной статье, поскольку ни одно из выявленных исследований не рассматривало подавление тремора для этого сустава. Иллюстрация движений верхней конечности человека (7 степеней свободы) показана на рисунке 2.
3. Результаты
Мы применили блок-схему PRISMA для просмотра записей, загруженных из PubMed, PMC и других ресурсов (например, IEEE, Google Scholar), и получили 19 статей, соответствующих критериям включения и полнотекстового поиска. Результаты показаны в таблице 1, а ортезы для подавления тремора сгруппированы по механизму подавления.В частности, светло-коралловый, светло-голубой и светло-серый фоновые цвета представляют активный, полуактивный и пассивный ортезы соответственно.
Таблица 1 . Ортезы на верхние конечности для подавления тремора.
3.1. Механизмы подавления
Биомеханическую нагрузку с использованием носимых ортезов для подавления тремора можно разделить на три типа в зависимости от механизма подавления: пассивные, полуактивные и активные системы. В пассивной системе используются амортизаторы, прикрепленные к пораженной тремором верхней конечности для подавления тремора.Полуактивная система оценивает уровень тремора на основе измерений датчиков и использует эту информацию для подавления движений, обновляя импеданс системы. Полуактивный механизм также подавляет тремор, поглощая энергию. В то время как пассивный и полуактивный механизмы ослабляют тремор, поглощая энергию, активный механизм может активно обеспечивать движение в противоположном направлении, чтобы ограничить тремор.
На рисунке 3 показан прогресс в развитии различных типов механизмов подавления.Большинство носимых ортезов для подавления тремора являются активными с распространенностью 47%. За последние 10 лет активные системы подавления тремора привлекают все большее внимание исследовательских групп по всему миру. Электрические двигатели постоянного тока и серводвигатели в основном используются в активных устройствах в качестве приводов, которые приводят в движение суставы верхних конечностей через коробку передач или систему кабельной передачи. Среди активных устройств WOTAS (носимый ортез для оценки и подавления тремора) был первым разработанным и наиболее известным ортезом для подавления тремора верхних конечностей (Rocon et al., 2007). Разработка WOTAS проводилась в рамках проекта «Динамически реагирующее вмешательство для подавления тремора» (DRIFTS) (Manto et al., 2004). WOTAS был разработан с тремя основными целями: мониторинг, диагностика и проверка необоснованных стратегий уменьшения тремора (Rocon et al., 2005). Полуактивный механизм составляет 31% устройств, рассмотренных в данной обзорной статье (таблица 1). Полуактивные механизмы в основном основаны на магнитореологической (MR) жидкости для создания демпфирующей силы (Loureiro et al., 2005; Case et al., 2015; Йи и др., 2019; Захеди и др., 2020). При воздействии магнитного поля вязкость МР-жидкости может модулироваться напряженным магнитным полем. Жидкость MR недавно вызвала повышенный интерес в области носимых экзоскелетов из-за ее свойства высокого отношения прочности к весу (Perry et al., 2007). Полуактивные носимые устройства с жидкостными амортизаторами MR можно рассматривать как многообещающие решения для подавления тремора (Tsang et al., 2006). Пассивные механизмы покрывают последние 21% носимых ортезов.Вязкий пучок, разработанный Котовским и др. в 1998 году было первое пассивное устройство, разработанное для подавления тремора (Котовский и Розен, 1998). Регулируемый пассивный ортез (TAPO) — последнее устройство в этой категории (Fromme et al., 2020). Fromme et al. разработал этот ортез на основе воздухонаполненной конструкции и получил очень компактное и легкое устройство (33 г).
Рисунок 3 . Различные механизмы подавления (пассивный, полуактивный и пассивный) носимых ортезов для подавления тремора.
3.2. Степени свободы и вес носимых ортезов
На рис. 4A показаны веса и степени свободы полуактивных и активных устройств для подавления тремора. Большинство ортезов (54,5%) поддерживают только одну глубину резкости. Ортезы с двумя степенями свободы и тремя степенями свободы составляют 33 и 18% соответственно. Среди ортезов с одной степенью свободы четыре из шести были разработаны для поддержки контроля тремора в локтевом суставе (EFE) (Ando et al., 2010; Herrnstadt and Menon, 2012; Matsumoto et al., 2013; Herrnstadt et al., 2019), а другие были разработаны для подавления движений WFE (Zhou et al., 2017; Yi et al., 2019). Интересно, что все ортезы с двумя степенями свободы являются полуактивными и поддерживают контроль тремора в лучезапястном суставе (WFE и WUD) (Huen et al., 2016; Wang et al., 2019; Zahedi et al., 2020). Ортезы с тремя степенями свободы, показанные на рисунке 4A, включают WOTAS и носимые перчатки для подавления тремора (WTSG). В то время как WOTAS обеспечивает подавление тремора в локтевом (EFE), предплечье (FPS) и запястье (WFE) (Rocon and Pons, 2011), WTSG был разработан для подавления тремора в запястье (WFE), пальцах и суставах большого пальца (Zhou и другие., 2018).
Рисунок 4. (A) Обзор веса и количества степеней свободы для полуактивных и активных ортезов. Заштрихованная серая область представляет системы, вес которых превышает 850 г. (B, C) Гистограммы весов в зависимости от различных механизмов подавления и суставов, соответственно. Планки погрешностей представляют собой одно стандартное отклонение.
Наиболее распространенными степенями свободы для подавления являются WFE и EFE, которые можно найти в ~ 64% и 45% ортезов соответственно.Подавление тремора в суставах пальцев и пальцев рук доступно только в 9% ортезов. Не найдено ни одной системы, которая бы подавляла только тремор для WUD. Хотя механизмы подавления тремора в WFE могут быть полуактивными или активными, все механизмы EFE активны, за исключением ортеза EFB, который использует электромагнитный тормоз для демпфирования движения. Активные ортезы для контроля тремора EFE обычно приводятся в действие мощными двигателями постоянного тока.
Обычно вес ортеза увеличивается пропорционально количеству подавляемых степеней свободы.В таблице 1 показан большой разброс веса ортезов для подавления тремора: от 33 г [TAPO, пассивное устройство, заполненная воздухом структура (Fromme et al., 2020)] до 1600 г [Ортез для подавления тремора (TSO), активный, Двигатель постоянного тока (Herrnstadt et al., 2019)]. Средний вес ортеза 456 (± 409 г). Многоканальный мехатронный разветвитель (MMS), разработанный Zhou et al. (2017) — самый компактный и легкий активный ортез, обнаруженный в этом исследовании. Это устройство весит около 129 г, питается от небольшого двигателя постоянного тока мощностью 2 Вт и использует кабели для передачи данных.Заштрихованная область на Рисунке 4A иллюстрирует ортезы, которые из-за их большого веса (> 800 г) затрудняют выполнение повседневных дел. В частности, вес в заштрихованной области составляет 850 г [WOTAS, активный, двигатель постоянного тока (Rocon and Pons, 2011)], 942 г [EFB, полуактивный, электромагнитный тормоз (Herrnstadt and Menon, 2012)] и 1600 г. [TSO, активный двигатель постоянного тока (Herrnstadt et al., 2019)].
Вес ортеза зависит не только от количества степеней свободы, но и от типа механизмов подавления тремора (т.е.е., пассивный, полуактивный, активный). На рис. 4В показаны значения весов для различных типов механизмов подавления. Пассивные ортезы имеют наименьший средний вес 191 (± 137 г), за ними следуют полуактивные ортезы со средним весом 486 (± 395 г). Активные ортезы самые тяжелые, их средний вес составляет 561 (± 467 г). Вес ортезов также различается в зависимости от типа подавляемой глубины резкости. На рис. 4С показан средний вес ортезов, которые были разработаны специально для подавления локтя или запястья.Средний вес ортеза для подавления тремора в лучезапястном суставе составляет 237 (± 152 г), в диапазоне от 33 до 485 г. Это значение примерно в два раза больше в ортезе, поддерживающем только локтевой сустав. В частности, средний вес ортезов, поддерживающих локтевой сустав, составляет 821 (± 586 г), в диапазоне от 330 до 1600 г.
3.3. Эффективность подавления тремора с помощью носимых ортезов
Экспериментальные установки для оценки эффективности ортеза по подавлению тремора можно разделить на три группы: стендовые испытания (без участия человека), здоровые люди и люди с треморными расстройствами.В установке для стендовых испытаний создается отдельная система, которая подключается к носимому ортезу. Треморные движения моделируются путем воспроизведения различных типов тремора (например, PD, ET) из доступных наборов клинических данных. Например, набор данных Timmer et al. (2000), включая данные о треморном движении от десяти пациентов (5 PD, 5 ET), использовались в нескольких исследованиях для стендовых испытаний. Треморное движение также можно смоделировать, определив его амплитуду и доминирующие частоты (например, 3–12 Гц) и вызвав его с помощью генератора сигналов.В экспериментальной установке, в которой участвуют здоровые люди, не имевшие в анамнезе неврологических заболеваний и патологического тремора, испытуемых проинструктировали самостоятельно инициировать тремор, размахивая запястьем с определенной частотой (Yi et al., 2019; Zahedi et al., 2020 ). Непроизвольная стимуляция тремора у здоровых людей также может быть вызвана с помощью FES. Параметры управления FES могут быть установлены для стимуляции тремора на разных частотах (например, 3 и 5 Гц для тремора PD и ET соответственно) (Takanokura et al., 2011). Наконец, экспериментальная установка с людьми, пораженными тремором (нарушенными), набрала субъектов, у которых был диагностирован патологический тремор (например, PD, ET).
На рис. 5А показана эффективность различных ортезов. Эффективность рассчитывалась путем сравнения биомеханических данных (например, углов суставов, скорости, ускорения, сил взаимодействия, пЭМГ) в двух условиях: с подавлением тремора с помощью ортезов и без него. Сравнение может быть выполнено с использованием показателей в частотной области [e.g., спектральная плотность мощности (PSD), частоты доминирующих гармоник] или во временной области [например, амплитуды, среднеквадратичное значение (RMS)]. Значения эффективности на рисунке 5 были преобразованы в проценты (%) для сравнения в различных исследованиях. Большинство ортезов (77%) на Рисунке 5 были протестированы на людях. Только два полуактивных (Case et al., 2015; Zamanian and Richer, 2019) и один активный ортез (Zhou et al., 2018) были оценены с помощью стендовых испытаний. Все пассивные устройства, обнаруженные в этом обзоре, выполняли оценку подавления тремора на людях (Takanokura et al., 2011; Fromme et al., 2020). Средняя эффективность подавления тремора с использованием носимых ортезов составляет 83 (± 13%). Самая низкая эффективность составляет 60% (экзоскелет для подавления тремора запястья (WTSE), протестирован на пяти здоровых людях) (Yi et al., 2019), а самая высокая эффективность составляет 98% (DVB, протестировано с 1 ET) (Loureiro et al. , 2005).
Рисунок 5. (A) Эффективность ортопедических аппаратов, подавляющих тремор, при различных типах экспериментальных установок (стендовые испытания, здоровые и ослабленные). Размер круга представляет количество участников. (B, C) Гистограммы эффективности против экспериментальных настроек и механизмов подавления, соответственно. Планки погрешностей представляют собой одно стандартное отклонение.
На рис. 5В показаны гистограммы эффективности при различных экспериментальных условиях. Среди этих установок стендовые испытания показывают наивысшую эффективность подавления тремора и наименьшее отклонение 95 (± 5%). С другой стороны, наименьшее значение эффективности и наибольшее отклонение обнаружено при тестировании со здоровыми людьми 70 (± 12%).Средняя эффективность ортезов у пациентов с тремором составила 86 (± 8%). Эффективность подавления тремора также варьировалась в зависимости от различных типов механизмов подавления тремора (рис. 5C). Активные ортезы имеют наибольшую среднюю эффективность и наименьшее отклонение 83 (± 8%), за ними следуют полуактивные ортезы со средней эффективностью 77 (± 19%). Пассивные ортезы имеют самую низкую среднюю эффективность 75 (± 12%).
3.4. Измерения тремора и алгоритмы оценки треморных движений
У людей с патологическим тремором деятельность верхних конечностей состоит из произвольных и треморных движений.Чтобы оптимизировать эффективность подавления тремора в полуактивном или активном ортезе, требуется интуитивно понятный контроллер, который подавлял бы только тремор, не влияя на произвольные движения (Taheri et al., 2014). Проблемы при разработке таких контроллеров включают, но не ограничиваются этим, оценку патологического тремора с высокой точностью и надежностью с помощью носимых датчиков. Кроме того, ожидается, что контроллер будет поддерживать свою производительность в реальном времени с минимальными временными задержками.
3.4.1. Характеристики паркинсонического и эссенциального тремора
Оптимизация контроля тремора с помощью вспомогательного ортеза требует понимания характеристик патологического тремора. Произвольные и треморные движения обычно характеризуются своим частотным содержанием. Выдающуюся частоту сотрясений можно было увидеть и приблизительно оценить невооруженным глазом. Однако для более точной количественной оценки требуются измеренные данные (например, sEMG, датчик силы, IMU) и надлежащие методы обработки сигналов.Предыдущие исследования показали, что произвольные движения для большинства видов повседневной жизни (ADL) имеют частотный спектр ниже 2 Гц (Mann et al., 1989,?; Rocon et al., 2007; Gallego et al., 2009). Между тем, как сообщается, спектральная энергия патологических сотрясений сосредоточена в диапазоне 3–12 Гц (Stiles, Randall, 1967; Elble, Randall, 1978; Anouti and Koller, 1995; Deuschl et al., 1998; Charles et al. , 1999; Ang et al., 2001; Loureiro et al., 2005; Engin, 2007; Heldman et al., 2011).В некоторых недавних исследованиях сообщалось о различных результатах, в которых паркинсонический тремор (PD) и эссенциальный тремор (ET) содержат частоты от 3,5 до 17,3 Гц (Taheri et al., 2013; Zhou et al., 2016). Несмотря на консенсус относительно частотного диапазона патологического тремора, сложно провести различие между PD и ET-тремором (Puschmann and Wszolek, 2011; Thenganatt and Louis, 2012). Исследование Zhang et al. с 45 пациентами (25 PD и 20 ET) показали значительное перекрытие между частотой тремора в группе PD (4-6 Гц) и в группе ET (5-8 Гц) (Zhang et al., 2017). Burne et al. провели количественный анализ данных ускорения и пЭМГ у 42 пациентов с тремором (22 PD и 20 ET) и сообщили об аналогичных результатах. Например, это исследование показало, что более 95% группы пациентов с БП имели частоты в узком диапазоне 4–6 Гц, а 95% пациентов с ЭТ находились в диапазоне 5–8 Гц.
Предыдущие исследования также сообщили об аналогичных частотных диапазонах, связанных с тремором частичных разрядов; например, (4–6 Гц) (Cooper and Rodnitzky, 2000), (3,5–6 Гц) (Smaga, 2003) и (3–5 Гц) (Puschmann and Wszolek, 2011).Однако частотная полоса тремора ET варьируется в разных исследованиях. Хотя Джавидан и др. (1992) показали относительно узкую полосу частот (5–8 Гц) для тремора ET, Cooper и Rodnitzky (2000) и Elble (2000) сообщили о полосе частот тремора ET при (4–12 Гц) и (3–11 Гц). , соответственно. Сообщалось также о треморе ЭТ в полосе частот (4–10 Гц) (Ando et al., 2010; Puschmann, Wszolek, 2011; Matsumoto et al., 2013; Hassan et al., 2016).
3.4.2. Алгоритмы для оценки произвольных и треморных движений в реальном времени
Метод моделирования тремора должен уметь извлекать произвольные движения и количественно определять треморные движения (т.е., как по амплитуде, так и по частоте) с минимальной задержкой по времени. Алгоритмы извлечения тремора могут включать в себя один или несколько этапов. Рокон и Понс (2011) разработали двухэтапную модель экстракции тремора, которая проиллюстрирована на рисунке 6. При двухэтапном моделировании первая стадия отвечает за оценку волевых движений по физиологическим входным сигналам, а вторая стадия характеризует треморные движения.
Рисунок 6 . Двухэтапное моделирование тремора. Произвольное движение в низкочастотном диапазоне оценивается на этапе 1.Впоследствии стадия 2 будет характеризовать треморные движения (то есть амплитуду и частоту) после вычитания произвольных движений из исходных движений.
Сводка датчиков и алгоритмов в ортезах для подавления тремора приведена в таблице 2. Большинство ортезов (92%) измеряли произвольные и / или треморные движения с помощью биомеханических датчиков (например, IMU, датчик силы). Только одна система от Ando et al. (2010) использовали поверхностную ЭМГ для удаления тремора.
Алгоритмы произвольной оценки и оценки тремора.
Рисунок 7 показывает, что большинство алгоритмов оценки тремора на 85% состоят из одноступенчатой. В одноступенчатом методе алгоритм фильтрации может использоваться для извлечения произвольного движения [например, фильтр Калмана, фильтр нижних частот (LPF), кратковременное преобразование Фурье (STFS) / нейронная сеть с временной задержкой (TDNN)] или треморное движение [например, фильтр высоких частот (HPF), полосовой фильтр (BPF), взвешенный частотный линейный сумматор Фурье (WFLC), адаптивная оценка частоты (AFE)].BPF и AFE — два наиболее распространенных метода, которые составляют 38 и 15% алгоритмов извлечения тремора соответственно. Частоты среза, используемые в BPF, составляют (2–14 Гц) (Yi et al., 2019; Zahedi et al., 2020).
Рисунок 7 . Алгоритмы извлечения произвольных и треморных движений. STFT, Кратковременное преобразование Фурье; LPF, фильтр нижних частот; BPF, полосовой фильтр; HPF, фильтр высоких частот; WFLC, взвешенный частотный линейный сумматор Фурье; AFE, Адаптивная оценка частоты.
Двухэтапные методы составляют 15% алгоритмов и используются в таких системах, как WOTAS (Rocon et al., 2007) и Double Viscous Beam (DVB) (Loureiro et al., 2005). На первом этапе для оценки произвольного движения использовался алгоритм фильтра Бенедикта-Борднера. В этом алгоритме реализованы уравнения оценки и фильтрации, чтобы отфильтровать тремор и уменьшить фазовые задержки, вносимые процессом фильтрации. На втором этапе был применен алгоритм WFLC для оценки параметров тремора, включая как амплитуду, так и изменяющуюся во времени частоту треморного движения.
4. Выводы
Результаты нашего обзора показывают эффективность метода биомеханической нагрузки с использованием тремороподавляющих ортезов при подавлении тремора. Несмотря на то, что были продемонстрированы многообещающие результаты, существующие системы остаются громоздкими и тяжелыми. Эти ограничения значительно снижают удобство использования и износостойкость ортезов и создают значительные препятствия для принятия пользователями. Ортезы для подавления тремора требуют алгоритмов управления, способных обнаруживать тремор с высокой точностью и минимальной задержкой по времени для интуитивного взаимодействия.Однако проблемы, связанные с разработкой интуитивного управления ортопедическими ортезами для подавления тремора, полностью не решены. Кроме того, остаются нерешенными серьезные проблемы, связанные с переводом этих систем для клинического или домашнего использования. Большинство устройств, представленных в этом обзоре, были оценены только в лабораторных условиях и не являются коммерчески доступными. Поэтому мы предлагаем дальнейшие исследования, направленные на улучшение удобства использования и носки ортезов (например, компактных, легких, эстетичных и мягких).Кроме того, необходимо удовлетворить потребности в интуитивно понятных и гибких пользовательских интерфейсах управления (т. Е. В интерфейсе нейронной машины). Кроме того, необходимо решить нетехнические проблемы (например, стоимость устройства, соответствие нормативным требованиям, страховое возмещение), чтобы сделать технологию более доступной.
4.1. Потребность в легких, мягких ортезах для подавления тремора
Ортезы для подавления тремора на основе пассивных и полуактивных механизмов ослабляют тремор за счет использования амортизаторов или регулировки импеданса демпфера, прикрепленного к верхней конечности.Об эффективности пассивных и полуактивных ортезов сообщалось в предыдущих исследованиях (Deuschl et al., 1998; Kotovsky and Rosen, 1998; Fromme et al., 2019). Однако эти системы не только подавляют тремор, но также оказывают сопротивление и ограничивают произвольные движения. Еще одним недостатком пассивного механизма является то, что он не может адаптироваться к изменениям динамики тремора. Присущие пассивным и полуактивным механизмам ограничения могут быть устранены с помощью активных механизмов. В частности, активные ортезы предназначены для обеспечения движений, противоположных треморным движениям, без подавления произвольных движений.Подавление тремора с использованием активных механизмов является наиболее распространенным подходом (Fromme et al., 2019). Наши результаты на Рисунке 3B также показывают, что активные ортезы составляют 47% устройств, за ними следуют полуактивные (31%) и пассивные ортезы (21%). Двумя основными препятствиями, препятствующими применению активных ортезов, являются размер и вес устройств. В среднем, активный ортез подавления тремора примерно в три раза тяжелее пассивного. Средний вес активных и пассивных ортезов составляет 561 ± 467 и 191 ± 137 г соответственно (рис. 3В).Следовательно, при использовании активного ортеза пользователь будет обременен дополнительной нагрузкой на руку 18 ± 15% (данные о массах сегментов человеческого тела из De Leva, 1996). Громоздкое и тяжелое носимое устройство может вызвать мышечную усталость (Rocon et al., 2014), дискомфорт и, скорее всего, будет отвергнуто пользователями. Исследование Rocon et al. (2012) также сообщили, что пациенты с тремором не рассматривали громоздкие экзоскелеты как решение своей проблемы из-за возможности социальной изоляции.
Хотя биомеханическая нагрузка с использованием активных ортезов продемонстрировала превосходную эффективность подавления, остаются серьезные проблемы (т.е., компактная конфигурация, легкая, эстетичная и мягкая структура). На Рисунке 3 показано, что большинство современных ортезов для подавления тремора работает от двигателей постоянного тока (87,5%). Хотя двигатели постоянного тока экономичны и просты в управлении, они обычно тяжелые и жесткие. Самые тяжелые ортезы, показанные на Рисунке 4, приводятся в действие двигателями постоянного тока (TSO: 1600 г, WOTAS: 850 г). Сведение к минимуму веса ортеза для подавления тремора, в котором используется традиционный двигатель постоянного тока, является сложной задачей, особенно для системы, подавляющей тремор в локтевом суставе.Минимальная система только с одним двигателем постоянного тока и трансмиссией, разработанная Ando et al. для подавления тремора в локтевом суставе весит примерно 330 г (Ando et al., 2010). Последние достижения в области мягких приводов и искусственных мышц могут быть многообещающими решениями для разработки компактного и легкого ортеза для подавления тремора. Например, исследователи уделяют большое внимание пневматическим искусственным мышцам (PAM) (Yang et al., 2019). ПАМ могут быть легкими, компактными и использовать гибкие материалы.Они обеспечивают естественное взаимодействие человека и машины и широко используются в носимых вспомогательных устройствах (Dzahir and Yamamoto, 2014). Одним из недостатков является то, что для PAM требуется внешний воздушный компрессор, который может быть тяжелым и шумным. Другие искусственные мышцы на основе интеллектуальных материалов, которые являются легкими, мягкими и бесшумными, также могут быть жизнеспособными решениями (Lee et al., 2017; Mirvakili and Hunter, 2018). Искусственные мышцы могут приводиться в действие на основе термически чувствительных методов [например, сплавов с памятью формы (SMA)], электрически чувствительных методов (например.ж, диэлектрические эластомеры, электроактивные полимеры) и химически чувствительные методы (например, гидрогели) (Bar-Cohen et al., 2017; Dong et al., 2018). Swallow и Siores (2009) представили концептуальный дизайн с использованием пьезоэлектрических волоконных композитов (PFC) для создания механически мягкой, легкой перчатки, которую можно было бы носить для подавления тремора.
4.2. Потребность в интуитивно понятном нейро-машинном интерфейсе
Интуитивно понятный и гибкий пользовательский интерфейс управления играет решающую роль в разработке высокофункционального ортеза для подавления тремора.К сожалению, этот интерфейс все еще отсутствует и остается одной из самых больших проблем в этой области. Результаты из таблицы 2 показывают, что 92% ортезов измеряли произвольные и / или треморные движения с помощью биомеханических датчиков (например, IMU, датчика силы). Внутренняя проблема биомеханических датчиков заключается в том, что они могут измерять движения только после выполнения моторных команд, что приводит к значительным временным задержкам в управлении по замкнутому контуру носимого ортеза. Об этой задержке сообщалось примерно через 100 мс после начала тремора (Yi et al., 2019; Захеди и др., 2020). Задержка во вспомогательных роботах влияет на интуитивное управление, снижает комфорт пользователя и снижает общую производительность. Например, в то время как средняя эффективность ортезов, подавляющих тремор, была очень высокой при лабораторных испытаниях и составляла 95 ± 5% (рис. 5), значения были значительно ниже, когда участвовали люди (70 ± 12%). Чтобы максимизировать потенциальные преимущества ортезов, подавляющих тремор, требуется усовершенствованный нейронный интерфейс и структура управления, способная прогнозировать двигательные команды, а не реагировать на двигательные команды.В частности, пЭМГ можно использовать в качестве неинвазивного интерфейса для захвата мышечной активности верхней конечности. Нейронный интерфейс и контроль на основе ЭМГ были продемонстрированы для управления носимыми экзоскелетами (Kiguchi et al., 2007; Fleischer and Hommel, 2008; Artemiadis and Kyriakopoulos, 2010; Pau et al., 2012) и протезами нижних конечностей ( Au et al., 2008; Ha et al., 2010; Hargrove et al., 2015). Кроме того, было показано, что пЭМГ более информативна, чем датчики движения, и может использоваться для управления протезом в реальном времени (Zhang and Huang, 2012).В недавних исследованиях изучалась возможность использования сигналов ЭМГ для извлечения сигналов тремора из произвольных команд (Ando et al., 2012; Matsumoto et al., 2012a, 2017). Предыдущие исследования показали, что сигналы тремора модулируются в ЭМГ как мультипликативный шум вместо аддитивного шума (Journee, 1983). Эта характеристика представляет собой серьезные проблемы для извлечения тремора в реальном времени с использованием сигналов ЭМГ, и эти проблемы еще не решены (Matsumoto et al., 2012a, b, 2017).
Усовершенствованный нейронный интерфейс, использующий неинвазивную электроэнцефалографию (ЭЭГ), может быть жизнеспособным решением для оптимизации интуитивного управления и повышения эффективности ортезов, подавляющих тремор.Несмотря на то, что ни в одном из ортезов в этом обзоре не использовалась неинвазивная ЭЭГ в качестве нейронного интерфейса (таблица 2), потенциал ЭЭГ в оценке и контроле тремора был исследован Rocon et al. (2010). В их исследовании система интерфейса мозг-компьютер (BCI) на основе ЭЭГ была разработана для расшифровки треморной двигательной активности и предоставления управляющих сигналов высокого уровня для управления системой FES для подавления треморных движений. Система BCI может обеспечить прямое управление вспомогательными устройствами через немышечную связь для людей с двигательными нарушениями.В недавних исследованиях сообщается о возможности использования ИМК на основе неинвазивной ЭЭГ для обнаружения двигательного намерения (He et al., 2014; Kwak et al., 2015) и прогнозирования непрерывных движений в суставах (Bradberry et al., 2010; Presacco et al., 2012; Robinson et al., 2015; Bhagat et al., 2016; Luu et al., 2016, 2017a, b; Nakagome et al., 2020). Дальнейшие направления исследований по оптимизации управления ортезами для подавления тремора могут включать мультимодальный нейронно-машинный интерфейс (NMI), основанный на слиянии сигналов ЭЭГ и ЭМГ.Нейронные сигналы в гибридном НМИ будут дополнять друг друга и, возможно, обеспечивать более быструю и точную оценку произвольных и треморных движений.
4.3. Коммерческие задачи
Хотя исследования и разработки в области ортезов, подавляющих тремор, показали многообещающие результаты, и было разработано и испытано множество устройств, применение этих систем для клинического или домашнего использования ограничено. Насколько нам известно, ни одно из устройств, представленных в этом обзоре, в настоящее время или не поступало в продажу.Необходимо надлежащим образом идентифицировать и решать как технические, так и нетехнические проблемы, такие как внедрение технологий, доступность, стоимость, оценка и смягчение рисков. Внедрение этой технологии может быть усилено за счет повышения удобства ношения, удобства использования и функциональности. В частности, носимый ортез должен быть легким, механически гибким, удобным для ношения, визуально привлекательным и удобным, чтобы пользователи могли с уверенностью носить их для ADL. Кроме того, необходимы клинические оценки для подтверждения долгосрочных преимуществ биомеханической нагрузки при лечении тремора с использованием роботизированных ортезов.
Для обеспечения безопасности и эффективности медицинский экзоскелет должен соответствовать обширным государственным постановлениям, касающимся проектирования, разработки, производства, программного обеспечения, маркировки и маркетинга продуктов. В США носимые ортезы с электроприводом могут регулироваться как медицинские устройства в соответствии с Федеральным законом о пищевых продуктах, лекарствах и косметических средствах или Законом FD&C, который реализуется и обеспечивается FDA. Согласно правилам FDA, медицинское устройство классифицируется на класс I, класс II или класс III в зависимости от степени риска, связанного с устройством.Хотя правила могут повлечь дополнительные расходы и снизить доступность, они имеют решающее значение для обеспечения безопасности конечных пользователей. Стоимость владения экзоскелетом с электроприводом по-прежнему невероятно высока, включая, помимо прочего, стоимость устройства, нормативные расходы, а также сервисное и техническое обслуживание. Производство медицинского устройства остается дорогостоящим из-за небольших объемов производства, ограниченного числа контрактных производителей с опытом работы в отрасли медицинских устройств и недостаточного количества сертифицированных сторонних поставщиков, которые могут соответствовать требованиям надлежащей производственной практики FDA для медицинских устройств.Затраты на регулирование могут существенно возрасти, если медицинское изделие классифицируется как класс II — со специальными средствами контроля или без них — или как класс III. Дополнительные расходы могут включать необходимые клинические испытания, более обширные механические и электрические испытания, тестирование программного обеспечения и другие расходы. Специальные меры контроля медицинских устройств включают (1) биосовместимость, (2) электромагнитную совместимость, электрическую безопасность, тепловую безопасность, механическую безопасность, (3) валидацию программного обеспечения, (4) геометрию и состав материала, (5) различные доклинические испытания производительности. , (6) клинические испытания, (7) программа обучения и (8) маркировка для врача и пользователя (более подробную информацию см. В Управлении по санитарному надзору за качеством пищевых продуктов и медикаментов, 2014 г.).
Еще одна коммерческая задача для успешного проникновения медицинского экзоскелета на рынок — страховое покрытие. Производители медицинских устройств (например, ReWalk, Myomo) в значительной степени полагаются на источники платежей из частных планов страхования, государственных программ, таких как Департамент по делам ветеранов (VA), Medicare и Medicaid, а также других сторонних плательщиков. К сожалению, получение и поддержание адекватного страхового покрытия или компенсации за медицинский экзоскелет является сложной задачей. Во-первых, рынок медицинских экзоскелетов остается относительно новым и недоказанным.Единая политика покрытия и возмещения расходов на медицинские экзоскелеты с электроприводом пока недоступна для сторонних плательщиков в США. Более того, методы контроля затрат сторонних плательщиков сложны и потенциально ограничивают сумму, которую они могут быть готовы платить за клиническое обучение с использованием медицинского экзоскелета, если они вообще обеспечивают покрытие.
Заявление о доступности данныхОригинальные материалы, представленные в исследовании, включены в статью / дополнительные материалы, дальнейшие запросы можно направлять соответствующим авторам.
Авторские взносы
TL внесла свой вклад в обзор литературы, сборники соответствующих статей, анализ и интерпретацию данных и черновик рукописи. HN отредактировал рукопись и утвердил окончательную версию. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы хотели бы поблагодарить Дэвида Эгурена за его корректуру и конструктивные отзывы о рукописи.
Сокращения
ADL, повседневная деятельность; AFE, адаптивная оценка частоты; BCI, интерфейс мозг-компьютер; BPF, полосовой фильтр; DBS, глубокая стимуляция мозга; DOF, степени свободы; ДРИФТЫ, динамически реагирующее вмешательство для подавления тремора; ДВБ, балка двойной вязкости; ЭЭГ, электроэнцефалография; EFE, сгибание / разгибание локтя; FDA, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов; ФЭС — функциональная электростимуляция; FPS, пронация / супинация предплечья; HPF, фильтр высоких частот; IMU, инерциальный измерительный блок; ФНЧ, фильтр нижних частот; MMS, многоканальный мехатронный разветвитель; MR, магнитореологический; НМИ, нейро-машинный интерфейс; ПАМ, пневматические искусственные мышцы; PFC, композиты с пьезоэлектрическим волокном; PRISMA, предпочтительные элементы отчетности для систематических обзоров и метаанализа; PSD, спектральная плотность мощности; RMS, среднеквадратичное значение; пЭМГ, поверхностная электромиография; SMA, сплавы с памятью формы; STFS, кратковременное преобразование Фурье; ТАПО, регулируемый пассивный ортез; TDNN, нейронная сеть с временной задержкой; TSO, ортез подавляющий тремор; В.А., по делам ветеранов; WFE, сгибание / разгибание запястья; WFLC, линейный сумматор Фурье с взвешенными частотами; WOTAS, носимый ортез для оценки и подавления тремора; WRU, лучевая / локтевая девиация запястья; WTSE, экзоскелет для подавления тремора запястья; WTSG, носимая перчатка для подавления тремора.
Список литературы
Адельштейн Б. Д. и Розен М. Дж. (1981). «Влияние механического сопротивления на ненормальный интенционный тремор», в Bioengineering (Нью-Брансуик, Нью-Джерси: Эльзевир), 205–209. DOI: 10.1016 / B978-0-08-027207-8.50047-3
CrossRef Полный текст | Google Scholar
Аллен Н. Э., Шеррингтон К., Пол С. С. и Каннинг К. Г. (2011). Равновесие и падения при болезни Паркинсона: метаанализ влияния физических упражнений и двигательных тренировок. Mov. Дисорд . 26, 1605–1615. DOI: 10.1002 / mds.23790
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Андо Т., Ватанабэ М., Нисимото К., Мацумото Ю., Секи М. и Фуджи М. Г. (2012). Экзоскелетный локтевой робот с миоэлектрическим управлением для подавления эссенциального тремора: извлечение сгибательных движений в локтевом суставе с помощью stfts и tdnn. Дж. Робот. Механизм . 24, 141–149. DOI: 10.20965 / jrm.2012.p0141
CrossRef Полный текст | Google Scholar
Андо, Т., Ватанабэ М., Секи М. и Фуджи М. Г. (2010). «Миоэлектрический управляемый экзоскелетный робот для подавления эссенциального тремора: извлечение сгибания локтя с помощью STFT», в Тезисы Международной конференции по передовой мехатронике: к эволюционному слиянию информационных технологий и мехатроники: ICAM 2010.5 (Toyonaka: Японское общество механиков Инженеры), 756–761. DOI: 10.1299 / jsmeicam.2010.5.756
CrossRef Полный текст | Google Scholar
Анг, В. Т., Ривьер, К.Н., и Хосла П. К. (2001). «Разработка и реализация активного подавления ошибок в ручных микрохирургических инструментах», в материалах Proceedings 2001 IEEE / RSJ International Conference on Intelligent Robots and Systems. Расширение социальной роли робототехники в следующем тысячелетии (Кат. № 01Ch47180) , Vol. 2 (Мауи, Гавайи, Гавайи: IEEE), 1106–1111.
Google Scholar
Анути А. и Коллер В. К. (1995). Нарушения тремора. Диагностика и лечение. West. J. Med .162: 510.
Google Scholar
Артемиадис, П. К., Кириакопулос, К. Дж. (2010). Управление манипулятором робота на основе emg с использованием низкоразмерных вложений. IEEE Trans. Робот . 26, 393–398. DOI: 10.1109 / TRO.2009.2039378
CrossRef Полный текст | Google Scholar
Ау, С., Берникер, М., и Херр, Х. (2008). Протез голеностопного сустава с приводом для облегчения ходьбы по ровной поверхности и при спуске по лестнице. Нейронная сеть . 21, 654–666. DOI: 10.1016 / j.neunet.2008.03.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бар-Коэн, Ю., Кардосо, В., Рибейро, К., и Лансерос-Мендес, С. (2017). «Электроактивные полимеры в качестве исполнительных механизмов», в Advanced Piezoelectric Materials (Elsevier), 319–352. DOI: 10.1016 / B978-0-08-102135-4.00008-4
CrossRef Полный текст | Google Scholar
Бхагат, Н.А., Венкатакришнан, А., Абибуллаев, Б., Арц, Э. Дж., Йозбатиран, Н., Бланк, А.А., и др. (2016). Разработка и оптимизация интерфейса мозг-машина (ИМТ) на основе ЭЭГ с экзоскелетом верхней конечности для выживших после инсульта. Фронт. Neurosci . 10: 122. DOI: 10.3389 / fnins.2016.00122
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брэдберри, Т. Дж., Джентили, Р. Дж., И Контрерас-Видаль, Дж. Л. (2010). Восстановление трехмерных движений рук по неинвазивным электроэнцефалографическим сигналам. Дж. Neurosci . 30, 3432–3437. DOI: 10.1523 / JNEUROSCI.6107-09.2010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Буки, Э., Кац, Р., Zacksenhouse, M., and Schlesinger, I. (2018). Вибробраслет: пассивный поглотитель для уменьшения тремора предплечья. Med. Биол. Англ. Вычислить . 56, 923–930. DOI: 10.1007 / s11517-017-1742-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кейс Д., Тахери Б. и Ричер Э. (2015). «Активное управление носимым роботизированным ортезом MR для подавления патологического тремора», в конференции Dynamic Systems and Control Conference , Vol. 57267 (Колумбус, Огайо: Американское общество инженеров-механиков), V003T42A004.DOI: 10.1115 / DSCC2015-9874
CrossRef Полный текст | Google Scholar
Чарльз П. Д., Эспер Г. Дж., Дэвис Т. Дж., Мачюнас Р. Дж. И Робертсон Д. (1999). Классификация тремора и информация о лечении. Am. Fam. Phys . 59: 1565.
PubMed Аннотация | Google Scholar
Коэн, О., Пуллман, С., Юревич, Э., Уотнер, Д., и Луис, Э. Д. (2003). Тремор покоя у пациентов с эссенциальным тремором: распространенность, клинические корреляты и электрофизиологические характеристики. Архив. Neurol . 60, 405–410. DOI: 10.1001 / archneur.60.3.405
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кроуфорд, П. Ф. III., И Циммерман, Э. Э. (2011). Дифференциация и диагностика тремора. Am. Fam. Phys . 83, 697–702.
Google Scholar
Диас, Н. Л., и Луис, Э. Д. (2010). Исследование моделей использования лекарств среди пациентов с эссенциальным тремором: специалисты по двигательным расстройствам и неврологи общего профиля. Parkinsonism Relat. Дисорд . 16, 604–607. DOI: 10.1016 / j.parkreldis.2010.07.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Донг Т., Чжан Х. и Лю Т. (2018). Искусственные мышцы для носимой помощи и реабилитации. Фронт. Сообщить. Technol. Электрон. Eng . 19, 1303–1315. DOI: 10.1631 / FITEE.1800618
CrossRef Полный текст | Google Scholar
Дорси, Э. Р., Эльбаз, А., Николс, Э., Абдаллах, Ф., Абделалим, А., Adsuar, J. C., et al. (2018). Глобальное, региональное и национальное бремя болезни Паркинсона, 1990–2016 гг .: систематический анализ исследования глобального бремени болезней, 2016 г. Lancet Neurol . 17, 939–953. DOI: 10.1016 / S1474-4422 (18) 30295-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дзахир, М.А.М., Ямамото, С. (2014). Последние тенденции в роботизированных реабилитационных ортезах для нижних конечностей: схема управления и стратегия для тренажеров ходьбы с пневматическим приводом от мышц. Робототехника 3, 120–148. DOI: 10.3390 / robotics3020120
CrossRef Полный текст | Google Scholar
Эльбл Р., Бейн П., Джо ао Форджаз М., Хаубенбергер Д., Теста К., Гетц К. Г. и др. (2013). Отчет рабочей группы: шкалы для скрининга и оценки тремора: критика и рекомендации. Mov. Дисорд . 28, 1793–1800. DOI: 10.1002 / mds.25648
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Элек Дж., Прочазка А.(1989). Ослабление тремора запястья человека с помощью электростимуляции мышц с обратной связью. Физиологический журнал . 414: P17.
Энгин М. (2007). Система регистрации и анализа тремора человека. Измерение 40, 288–293. DOI: 10.1016 / j.measurement.2006.05.015
CrossRef Полный текст | Google Scholar
Флейшер, К., Хоммель, Г. (2008). Интерфейс человека и экзоскелета с использованием электромиографии. IEEE Trans. Робот . 24, 872–882.DOI: 10.1109 / TRO.2008.926860
CrossRef Полный текст | Google Scholar
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов Х. С. (2014). Медицинское оборудование; приборы физической медицины; классификация силового экзоскелета. Окончательный заказ. Fed. Реестр . 80: 9600.
Google Scholar
Фокс, С. Х., Каценшлагер, Р., Лим, С. Ю., Равина, Б., Сеппи, К., Коэльо, М., и др. (2011). Обновленный обзор доказательной медицины общества двигательных расстройств: методы лечения двигательных симптомов болезни Паркинсона. Mov. Дисорд . 26, S2 – S41. DOI: 10.1002 / mds.23829
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фромме, Н. П., Камензинд, М., Ринер, Р., Росси, Р. М. (2019). Потребность в механически и эргономически улучшенных ортезах для подавления тремора для верхней конечности: систематический обзор. J. Neuroeng. Rehabil . 16:93. DOI: 10.1186 / s12984-019-0543-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фромме, Н.П., Камензинд, М., Ринер, Р., Росси, Р. М. (2020). Дизайн легкого пассивного ортеза для подавления тремора. J. Neuroeng. Rehabil . 17, 1–15. DOI: 10.1186 / s12984-020-00673-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гальего, Дж., Рокон, Э., Роа, Дж., Морено, Дж., Кутсу, А., и Понс, Дж. Л. (2009). Об использовании инерциальных единиц измерения для количественной оценки амплитуды и частоты патологического тремора в реальном времени. Proc. Chem .1, 1219–1222. DOI: 10.1016 / j.proche.2009.07.304
CrossRef Полный текст | Google Scholar
Гальего, Дж. А., Рокон, Э., и Понс, Дж. Л. (2010). «Оценка мгновенных параметров тремора для подавления тремора на основе FES», в 2010 Международная конференция IEEE по робототехнике и автоматизации (Анкоридж, AK: IEEE), 2922–2927. DOI: 10.1109 / ROBOT.2010.5509663
CrossRef Полный текст | Google Scholar
Гопура, Р., Кигучи, К. (2009). «Механические конструкции активных роботов-экзоскелетов верхних конечностей: современное состояние и трудности проектирования», в , 2009 г. Международная конференция IEEE по реабилитационной робототехнике, (Кобе: IEEE), 178–187.DOI: 10.1109 / ICORR.2009.5209630
CrossRef Полный текст | Google Scholar
Ха, К. Х., Варол, Х. А., и Гольдфарб, М. (2010). «Миоэлектрический контроль силового коленного протеза для произвольных движений во время занятий без нагрузки», на ежегодной международной конференции 2010 г. по инженерии в медицине и биологии IEEE (Буэнос-Айре: IEEE), 3515–3518. DOI: 10.1109 / IEMBS.2010.5627736
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харгроув, Л.Дж., Янг, А. Дж., Саймон, А. М., Фей, Н. П., Липшуц, Р. Д., Финукейн, С. Б. и др. (2015). Интуитивное управление протезом ноги с электроприводом во время передвижения: рандомизированное клиническое испытание. JAMA 313, 2244–2252. DOI: 10.1001 / jama.2015.4527
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хариц, М. И., Ренкрона, С., Куинн, Н. П., Спилман, Дж. Д., и Венсинг, К. (2008). Многоцентровое исследование глубокой стимуляции мозга при болезни Паркинсона: независимая оценка нежелательных явлений, о которых сообщалось через 4 года. Mov. Дисорд . 23, 416–421. DOI: 10.1002 / mds.21888
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хассан, А., Альског, Дж. Э., Мацумото, Дж. Й., Милбер, Дж. М., Бауэр, Дж. Х. и Уилкинсон, Дж. Р. (2016). Ортостатический тремор: клинические, электрофизиологические и лечебные данные у 184 пациентов. Неврология 86, 458–464. DOI: 10.1212 / WNL.0000000000002328
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Он, Ю., Натан К., Венкатакришнан А., Ровекамп Р., Бек К., Оздемир Р. и др. (2014). «Интегрированный нейро-роботизированный интерфейс для реабилитации после инсульта с использованием экзоскелета нижней конечности с питанием от nasa x1», , 2014, 36-я ежегодная международная конференция Общества инженеров в медицине и биологии IEEE, (Чикаго: IEEE), 3985–3988.
PubMed Аннотация | Google Scholar
Heldman, D. A., Jankovic, J., Vaillancour, D. E., Prodoehl, J., Elble, R.J., и Giuffrida, J.П. (2011). Количественная оценка эссенциального тремора во время повседневной деятельности. Parkinsonism Relat. Дисорд . 17, 537–542. DOI: 10.1016 / j.parkreldis.2011.04.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Herrnstadt, G., McKeown, M. J., and Menon, C. (2019). Управление моторизованным ортезом для следования волевым движениям локтя: тесты с людьми с патологическим тремором. J. Neuroeng. Rehabil . 16:23. DOI: 10.1186 / s12984-019-0484-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Herrnstadt, G., и Менон, К. (2012). Двухпозиционный ортез для подавления тремора с электромагнитным тормозом. Внутр. J. Mech. Англ. Механизм . 1, 7–24. DOI: 10.11159 / ijmem.2013.002
CrossRef Полный текст | Google Scholar
Herrnstadt, G., and Menon, C. (2016). Произвольно-управляемое движение на основе допуска с подавлением тремора с регулируемой скоростью. IEEE / ASME Trans. Механизм . 21, 2108–2119. DOI: 10.1109 / TMECH.2016.2555811
CrossRef Полный текст | Google Scholar
Хуэн, Д., Лю Дж. И Ло Б. (2016). «Интегрированный носимый робот для подавления тремора с распознаванием контекста», , 2016 г., 13-я Международная конференция IEEE по переносным и имплантируемым телесным сенсорным сетям (BSN), (Сан-Франциско, Калифорния: IEEE), 312–317. DOI: 10.1109 / BSN.2016.7516280
CrossRef Полный текст | Google Scholar
Jankovic, J. (2008). Болезнь Паркинсона: клиника и диагностика. J. Neurol. Нейрохирург. Психиатрия 79, 368–376. DOI: 10.1136 / jnnp.2007.131045
CrossRef Полный текст | Google Scholar
Джавидан М., Элек Дж. И Прочазка А. (1990). Снижение тремора с помощью функциональной электростимуляции. Неврология 40: 369.
Джавидан М., Элек Дж. И Прочазка А. (1992). Ослабление патологического тремора функциональной электростимуляцией II: клиническая оценка. Ann. Биомед. Eng . 20, 225–236. DOI: 10.1007 / BF02368522
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Журни, Х.(1983). Демодуляция амплитудно-модулированного шума: математическая оценка демодулятора для ЭМГ патологического тремора. IEEE Trans. Биомед. Eng . 30, 304–308. DOI: 10.1109 / TBME.1983.325120
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Катаяма Ю., Кано Т., Кобаяши К., Осима Х., Фукая К. и Ямамото Т. (2005). Разница в хирургических стратегиях между таламотомией и таламической стимуляцией глубокого мозга для контроля тремора. J. Neurol .252, iv17 – iv22. DOI: 10.1007 / s00415-005-4005-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кази, С., Ас’Арри, А., Заин, М., Майлах, М., и Хусейн, М. (2010). Экспериментальная реализация умной перчатки с пьезоэлектрическим приводом для контроля тремора рук. WSEAS Trans. Syst. Контроль 5, 443–453.
Google Scholar
Кигучи, К., Имада, Ю., и Лиянаге, М. (2007). «Нейро-нечеткое управление на основе ЭМГ экзоскелета с усилением верхних конечностей 4DoF», 2007 29-я ежегодная международная конференция Общества инженеров в медицине и биологии IEEE (Лион: IEEE), 3040–3043.DOI: 10.1109 / IEMBS.2007.4352969
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коллер, В. К. (1986). Фармакологическое лечение паркинсонического тремора. Архив. Neurol . 43, 126–127. DOI: 10.1001 / archneur.1986.00520020020009
CrossRef Полный текст | Google Scholar
Котовский, Дж., И Розен, М. Дж. (1998). Переносной ортез для подавления тремора. J. Rehabil. Res. Dev . 35, 373–387.
Google Scholar
Квак, Н.С., Мюллер К. Р. и Ли С. В. (2015). Система управления экзоскелетом нижних конечностей, основанная на устойчивых визуальных вызванных потенциалах. J. Neural Eng . 12: 056009. DOI: 10.1088 / 1741-2560 / 12/5/056009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, К., Ким, М., Ким, Ю. Дж., Хонг, Н., Рю, С., Ким, Х. Дж. И др. (2017). Обзор мягкого робота. Внутр. J. Control Autom. Syst . 15, 3–15. DOI: 10.1007 / s12555-016-0462-3
CrossRef Полный текст | Google Scholar
Лоурейро, Р.К., Белда-Лоис, Дж. М., Лима, Э. Р., Понс, Дж. Л., Санчес-Лакуэста, Дж. Дж. И Харвин, В. С. (2005). «Подавление тремора верхней конечности при ADL с помощью ортеза, включающего управляемый привод двойного вязкого пучка», на 9-й Международной конференции по реабилитационной робототехнике, , 2005. ICORR 2005 (Чикаго: IEEE), 119–122. DOI: 10.1109 / ICORR.2005.1501065
CrossRef Полный текст | Google Scholar
Луу, Т. П., Брантли, Дж. А., Накагоме, С., Чжу, Ф., и Контрерас-Видаль, Дж.Л. (2017а). Электрокортикальные корреляты ходьбы человека по ровной поверхности, наклону и лестнице. PLoS ONE 12: e0188500. DOI: 10.1371 / journal.pone.0188500
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Луу, Т. П., Хе, Ю., Браун, С., Накагоме, С., и Контрерас-Видаль, Дж. Л. (2016). Адаптация походки к визуальным кинематическим возмущениям с использованием замкнутого интерфейса мозг-компьютер в реальном времени для аватара виртуальной реальности. J. Neural Eng . 13: 036006. DOI: 10.1088 / 1741-2560 / 13/3/036006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Луу Т. П., Накагоме С., Хе Ю. и Контрерас-Видаль Дж. Л. (2017b). Интерфейс мозг-компьютер на основе ЭЭГ в реальном времени с виртуальным аватаром усиливает участие коры головного мозга в ходьбе человека по беговой дорожке. Sci. Репутация . 7, 1–12. DOI: 10.1038 / s41598-017-09187-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Манн, К. А., Вернер, Ф. В., и Палмер, А. К.(1989). Анализ частотного спектра движения запястья для повседневной деятельности. J. Orthop. Res . 7, 304–306. DOI: 10.1002 / jor.1100070219
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Манто, М., Рокон, Э., Понс, Дж., Дэвис, А., Уильямс, Дж., Бельда-Лоис, Дж. М. и др. (2004). Активный ортез для контроля тремора верхних конечностей: проект смещения (динамически реагирующее вмешательство для подавления тремора). EURO-ATAXIA Newsl . 26, 2–6.
Мацумото Ю., Секи М., Андо Т., Кобаяши Ю., Иидзима Х., Нагаока М. и др. (2012a). «Анализ сигналов ЭМГ пациентов с эссенциальным тремором с акцентом на изменение частоты тремора», на ежегодной международной конференции 2012 г. Общества инженеров в медицине и биологии IEEE (Сан-Диего: IEEE), 2244–2250. DOI: 10.1109 / EMBC.2012.6346409
CrossRef Полный текст | Google Scholar
Мацумото, Ю., Секи, М., Андо, Т., Кобаяши, Ю., Иидзима, Х., Nagaoka, M., et al. (2012b). «Фильтр на основе частоты тремора для выявления произвольных движений пациентов с эссенциальным тремором», , 2012 4-я Международная конференция IEEE RAS и EMBS по биомедицинской робототехнике и биомехатронике (BioRob), (Рим: IEEE), 1415–1422. DOI: 10.1109 / BioRob.2012.62
CrossRef Полный текст | Google Scholar
Мацумото Ю., Секи М., Андо Т., Кобаяши Ю., Накашима Ю., Иидзима Х. и др. (2013). Разработка экзоскелета для поддержки движений при приеме пищи у пациентов с эссенциальным тремором. Дж. Робот. Механизм . 25, 949–958. DOI: 10.20965 / jrm.2013.p0949
CrossRef Полный текст | Google Scholar
Мацумото Ю., Секи М., Накашима Ю., Андо Т., Кобаяши Ю., Иидзима Х. и др. (2017). Алгоритм демодуляции сигнала электромиограммы, модулированного эссенциальным тремором. ROBOMECH J . 4:15. DOI: 10.1186 / s40648-017-0082-6
CrossRef Полный текст | Google Scholar
Накагоме, С., Луу, Т. П., Хе, Ю., Равиндран, А. С., и Контрерас-Видаль, Дж.Л. (2020). Эмпирическое сравнение нейронных сетей и алгоритмов машинного обучения для декодирования походки ЭЭГ. Sci. Репутация . 10: 4372. DOI: 10.1038 / s41598-020-60932-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Национальный институт неврологических расстройств и инсульта (2020). Tremor Fact Sheet . Национальный институт неврологических расстройств и инсульта.
О’Коннор, Р. Дж., И Кини, М. У. (2011). Немедикаментозные и нехирургические вмешательства при треморе: систематический обзор. Parkinsonism Relat. Дисорд . 17, 509–515. DOI: 10.1016 / j.parkreldis.2010.12.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
По, Дж. У., Се, С. С., Пуллан, А. Дж. (2012). Нервно-мышечный интерфейс: создание модели локтевого сустава человека на основе ЭМГ. IEEE Trans. Биомед. Eng . 59, 2586–2593. DOI: 10.1109 / TBME.2012.2206389
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перри, Дж. К., Розен, Дж., и Бернс, С. (2007). Конструкция экзоскелета с приводом от верхних конечностей. IEEE / ASME Trans. Механизм . 12, 408–417. DOI: 10.1109 / TMECH.2007.
4
CrossRef Полный текст | Google Scholar
Пресакко А., Форрестер Л. В. и Контрерас-Видаль Дж. Л. (2012). Расшифровка кинематики внутри конечностей и между конечностями во время ходьбы по беговой дорожке на основе сигналов электроэнцефалографии (ЭЭГ) скальпа. IEEE Trans. Neural Syst. Rehabil. Eng . 20, 212–219. DOI: 10.1109 / TNSRE.2012.2188304
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Raethjen, J., Lindemann, M., Schmaljohann, H., Wenzelburger, R., Pfister, G., and Deuschl, G. (2000). Множественные осцилляторы вызывают паркинсонический и эссенциальный тремор. Mov. Дисорд . 15, 84–94. DOI: 10.1002 / 1531-8257 (200001) 15: 1 <84 :: AID-MDS1014> 3.0.CO; 2-K
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Робинсон, Н., Гуан, К., Винод, А. (2015). Адаптивная оценка траектории движения руки в системе интерфейса мозг-компьютер на основе ЭЭГ. Дж.Neural Eng . 12: 066019. DOI: 10.1088 / 1741-2560 / 12/6/066019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рокон, Э., Бельда-Лоис, Дж., Руис, А., Манто, М., Морено, Дж. К., и Понс, Дж. Л. (2007). Разработка и проверка реабилитационного роботизированного экзоскелета для оценки и подавления тремора. IEEE Trans. Neural Syst. Rehabil. Eng . 15, 367–378. DOI: 10.1109 / TNSRE.2007.
7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рокон, Э., Gallego, J., Barrios, L., Victoria, A., Ibánez, J., Farina, D., et al. (2010). «Мультимодальное BCI-опосредованное FES подавление патологического тремора», Ежегодная международная конференция инженеров IEEE в медицине и биологии, 2010 г. (Буэнос-Айрес: IEEE), 3337–3340. DOI: 10.1109 / IEMBS.2010.5627914
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рокон, Э., Гальего, Дж., Белда-Лоис, Дж., И Понс, Дж. Л. (2014). «Вспомогательная робототехника как альтернативное лечение тремора», в ROBOT2013: Первая Иберийская конференция по робототехнике (Мадрид: Springer), 173–179.DOI: 10.1007 / 978-3-319-03413-3_12
CrossRef Полный текст | Google Scholar
Рокон, Э., Гальего, Дж. Б., Бельда-Лоис, Дж. М., Бенито-Леон, Дж., И Понс, Дж. Л. (2012). Биомеханическая нагрузка как альтернативное лечение тремора: обзор двух подходов. Тремор Другой гиперкинет. Mov . 2: 02-77-495-1. DOI: 10.5334 / tohm.107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рокон, Э., и Понс, Дж. Л. (2011). Экзоскелеты в реабилитационной робототехнике: подавление тремора , Vol.69. Спрингер.
Google Scholar
Рокон, Э., Руис, А., Понс, Дж. Л., Бельда-Лоис, Дж. М., и Санчес-Лакуэста, Дж. (2005). «Реабилитационная робототехника: носимый экзоскелет для оценки и подавления тремора», в Трудах Международной конференции по робототехнике и автоматизации 2005 г. IEEE (Барселона: IEEE), 2271–2276. DOI: 10.1109 / ROBOT.2005.1570451
CrossRef Полный текст | Google Scholar
Шен, X., Вонг-Ю, И.С., и Мак, М.К. (2016). Влияние упражнений на падение, равновесие и походку при болезни Паркинсона: метаанализ. Neurorehabil. Ремонт нейронов 30, 512–527. DOI: 10.1177 / 1545968315613447
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смага, С. (2003). Тремор. Am. Fam. Phys . 68, 1545–1552.
Google Scholar
Swallow, L., и Siores, E. (2009). Подавление тремора с помощью интеллектуальных систем из текстильного волокна. J. Fiber Bioeng.Сообщите . 1, 261–266. DOI: 10.3993 / jfbi03200902
CrossRef Полный текст | Google Scholar
Тахери Б., Кейс Д. и Ричер Э. (2013). Надежный контроллер для подавления тремора на уровне опорно-двигательного аппарата запястья человека. IEEE Trans. Neural Syst. Rehabil. Eng . 22, 379–388. DOI: 10.1109 / TNSRE.2013.2295034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тахери Б., Кейс Д. и Ричер Э. (2014). Адаптивное подавление тяжелого патологического тремора методом оценки крутящего момента. IEEE / ASME Trans. Механизм . 20, 717–727. DOI: 10.1109 / TMECH.2014.2317948
CrossRef Полный текст | Google Scholar
Таканокура М., Сугахара Р., Мияке Н., Исигуро К., Муто Т. и Сакамото К. (2011). «Ортезы для верхних конечностей с воздушными заслонками для подавления патологического тремора при повседневной деятельности», в ISB Conference (Брюссель).
Тенганатт, М.А., Луис, Э.Д. (2012). Отличие эссенциального тремора от болезни Паркинсона: прикроватные тесты и лабораторные исследования. Эксперт Rev. Neurother . 12, 687–696. DOI: 10.1586 / ern.12.49
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тиммер Дж., Хойсслер С., Лаук М. и Люкинг К. Х. (2000). Патологические треморы: детерминированный хаос или нелинейные стохастические осцилляторы? Хаос 10, 278–288. DOI: 10.1063 / 1.166494
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цанг, Х., Су, Р., и Чандлер, А. (2006). Упрощенные модели обратной динамики для жидкостных демпферов MR. Eng. Struct . 28, 327–341. DOI: 10.1016 / j.engstruct.2005.06.013
CrossRef Полный текст | Google Scholar
Ван Дж., Барри О., Курдила А. Дж. И Виджаян С. (2019). «О динамике и контроле полного экзоскелета запястья для облегчения тремора», в Dynamic Systems and Control Conference , Vol. 59155 (Парк-Сити: Американское общество инженеров-механиков), V002T27A008. DOI: 10.1115 / DSCC2019-9118
CrossRef Полный текст | Google Scholar
Ян Х.Д., Гречек Б. Т., Асбек А. Т. (2019). Моделирование и анализ пневматической искусственной мышцы большого смещения со встроенным зондированием. Фронт. Робот. AI 5: 136. DOI: 10.3389 / frobt.2018.00136
PubMed Аннотация | CrossRef Полный текст | Google Scholar
И, А., Захеди, А., Ван, Ю., Тан, У. X., и Чжан, Д. (2019). «Новая система экзоскелета на основе магнитореологической жидкости для подавления тремора в суставах запястья», в , 2019 IEEE 16-я Международная конференция по реабилитационной робототехнике (ICORR) (Торонто; Онтарио, Калифорния: IEEE), 1115–1120.DOI: 10.1109 / ICORR.2019.8779363
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Заманян А. Х., Ричер Э. (2019). Адаптивный режекторный фильтр для подавления патологического тремора с использованием линейного двигателя с постоянными магнитами. Мехатроника 63: 102273. DOI: 10.1016 / j.mechatronics.2019.102273
CrossRef Полный текст | Google Scholar
Чжан Ф. и Хуанг Х. (2012). Выбор источника для распознавания намерений пользователя в реальном времени в отношении произвольного управления протезами ног. IEEE J. Biomed. Информ по здоровью . 17, 907–914. DOI: 10.1109 / JBHI.2012.2236563
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, Дж., Син, Ю., Ма, X., и Фэн, Л. (2017). Дифференциальная диагностика болезни Паркинсона, эссенциального тремора и усиленного физиологического тремора с помощью тремор-анализа ЭМГ. Болезнь Паркинсона . 2017: 1597907. DOI: 10.1155 / 2017/1597907
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжоу, Ю., Дженкинс, М. Э., Найш, М. Д., Трейос, А. Л. (2016). «Измерение и анализ паркинсонического тремора рук», в , 2016 IEEE-EMBS International Conference on Biomedical and Health Informatics (BHI) (Las Vegas, NV: IEEE), 414–417. DOI: 10.1109 / BHI.2016.7455922
CrossRef Полный текст | Google Scholar
Чжоу Ю., Дженкинс М. Э., Найш М. Д. и Трейос А. Л. (2018). «Разработка носимых перчаток для подавления тремора», , 2018, 7-я Международная конференция IEEE по биомедицинской робототехнике и биомехатронике (Biorob), (Enschede: IEEE), 640–645.DOI: 10.1109 / BIOROB.2018.8487197
CrossRef Полный текст | Google Scholar
Чжоу Ю., Найш М. Д., Дженкинс М. Э. и Трейос А. Л. (2017). Разработка и проверка новой мехатронной системы передачи для носимого устройства подавления тремора. Робот. Auton. Syst . 91, 38–48. DOI: 10.1016 / j.robot.2016.12.009
CrossRef Полный текст | Google Scholar
Тремор — Неврологический институт и специализированные центры
Тремор обычно классифицируют по его внешнему виду, причине или происхождению.Некоторые из наиболее известных форм тремора с их симптомами включают следующее:
Эссенциальный тремор (иногда называемый доброкачественным эссенциальным тремором) является наиболее распространенной из форм аномального тремора. Хотя у некоторых людей тремор может быть легким и непрогрессирующим в течение длительного периода времени, у других тремор медленно прогрессирует, начиная с одной стороны тела, но затрагивая обе стороны в течение нескольких лет. Чаще всего поражаются руки, но также могут быть поражены голова, голос, язык, ноги и туловище, обычно в меньшей степени, чем руки.Тремор рук обычно проявляется как тремор действия. Тремор головы можно рассматривать как движение «да-да» или «нет-нет». Эссенциальный тремор может сопровождаться легким нарушением походки. Частота тремора может уменьшаться с возрастом, но его тяжесть может увеличиваться, влияя на способность человека выполнять определенные задачи или повседневную деятельность. Повышенные эмоции, стресс, лихорадка, физическое истощение или низкий уровень сахара в крови могут вызвать тремор и / или усилить их тяжесть. Начало чаще всего встречается после 40 лет, хотя симптомы могут появиться в любом возрасте.Это может произойти у более чем одного члена семьи. Дети родителей, страдающих эссенциальным тремором, имеют 50-процентную вероятность унаследовать это состояние. Вариант гена LINGO1 был идентифицирован как ген риска, хотя не все люди с эссенциальным тремором несут этот вариант, который также может присутствовать у людей без эссенциального тремора. Хотя в течение многих лет считалось, что эссенциальный тремор не связан с какой-либо известной патологией, недавние исследования показывают, что у людей с эссенциальным тремором наблюдается легкая дегенерация определенных частей мозжечка.
Паркинсонический тремор вызывается повреждением структур головного мозга, контролирующих движения. Этот тремор, который обычно проявляется как тремор покоя, может возникать как отдельный симптом или проявляться при других расстройствах и часто является первым симптомом болезни Паркинсона (более 25 процентов пациентов с болезнью Паркинсона имеют тремор сопутствующего действия). Тремор, который классически рассматривается как раскатывание таблеток руками, которое также может влиять на подбородок, губы, ноги и туловище, может заметно усиливаться из-за стресса или эмоций.Паркинсонический тремор обычно возникает после 60 лет. Движение начинается в одной конечности или на одной стороне тела и обычно прогрессирует, охватывая и другую сторону.
Дистонический тремор встречается у людей любого возраста, страдающих дистонией , двигательным расстройством, при котором устойчивые непроизвольные сокращения мышц вызывают скручивание и повторяющиеся движения и / или болезненные и ненормальные позы или положения, такие как скручивание шеи ( кривошея) или писчая судорога.Дистонический тремор может поражать любую мышцу тела и чаще всего наблюдается, когда пациент находится в определенном положении или движется определенным образом. Характер дистонического тремора может отличаться от эссенциального тремора. Дистонический тремор возникает нерегулярно и часто может купироваться полным отдыхом. Прикосновение к пораженной части тела или мышце может уменьшить тяжесть тремора. Тремор может быть первым признаком дистонии, локализованной в определенной части тела.
Тремор мозжечка — это медленный тремор конечностей, который возникает в конце целенаправленного движения ( намеренный тремор ), например, при попытке нажать кнопку или прикоснуться пальцем к кончику носа.Мозжечковый тремор вызывается поражением или повреждением мозжечка в результате инсульта, опухоли или заболевания, такого как рассеянный склероз или какое-либо наследственное дегенеративное заболевание. Это также может быть результатом хронического алкоголизма или чрезмерного употребления некоторых лекарств. При классическом треморе мозжечка поражение одной стороны мозга вызывает тремор на той же стороне тела, который усиливается при направленном движении. Повреждение мозжечка также может вызывать тремор «взмахивающего крылом», называемый рубрал или тремор Холмса — сочетание покоя, действия и постурального тремора.Тремор часто наиболее заметен, когда пострадавший активен или сохраняет определенную позу. Тремор мозжечка может сопровождаться дизартрией (проблемами речи), нистагмом (быстрыми непроизвольными движениями глаз), проблемами походки и постуральным тремором туловища и шеи.
Психогенный тремор (также называемый функциональным тремором) может проявляться как любая форма тремора. Характеристики этого вида тремора могут различаться, но обычно включают внезапное начало и ремиссию, повышенную заболеваемость стрессом, изменение направления тремора и / или пораженных частей тела, а также значительное снижение или исчезновение треморной активности, когда человек отвлекается.Многие люди с психогенным тремором страдают конверсионным расстройством (определяемым как психологическое расстройство, которое вызывает физические симптомы) или другим психическим заболеванием.
Ортостатический тремор характеризуется ритмичными мышечными сокращениями, которые возникают в ногах и туловище сразу после вставания. Человек обычно воспринимает ортостатический тремор как неустойчивость, а не как настоящий тремор. Из-за высокой частоты тремора его часто нельзя увидеть, но иногда его можно услышать, если приложить стетоскоп к мышцам бедра.Никаких других клинических признаков или симптомов нет, и шаткость исчезает, когда человек садится, поднимается с земли или начинает ходить.
Физиологический тремор встречается у каждого нормального человека. Он редко виден глазом и может усиливаться сильными эмоциями (такими как беспокойство или страх), физическим истощением, гипогликемией, гипертиреозом, отравлением тяжелыми металлами, стимуляторами, отменой алкоголя, кофеином или лихорадкой. Это может произойти во всех произвольных группах мышц и может быть обнаружено, если вытянуть руки и положить лист бумаги поверх рук. Усиленный физиологический тремор — это усиление физиологического тремора до более видимых уровней. Обычно это вызвано не неврологическим заболеванием, а реакцией на определенные лекарства, отменой алкоголя или заболеваниями, включая сверхактивную щитовидную железу и гипогликемию. Обычно это обратимо после устранения причины.
Тремор может быть также результатом других заболеваний.
Алкоголизм, чрезмерное употребление алкоголя, или отмена алкоголя может убить определенные нервные клетки, что приводит к тремору, особенно в руке.(И наоборот, небольшое количество алкоголя может даже помочь уменьшить эссенциальный тремор, но механизм этого неизвестен. Врачи могут использовать небольшие количества алкоголя для диагностики определенных форм тремора, но не в качестве обычного лечения этого состояния. )
Тремор при периферической невропатии может возникать, когда нервы, питающие мышцы тела, травмированы в результате травмы, болезни, аномалии центральной нервной системы или в результате системных заболеваний.Периферическая невропатия может поражать все тело или определенные области, например, руки, и может прогрессировать. В результате потеря чувствительности может проявляться как тремор или атаксия (неспособность координировать произвольные движения мышц) пораженных конечностей и проблемы с походкой и равновесием. Клинические характеристики могут быть аналогичны тем, которые наблюдаются у людей с эссенциальным тремором.
Симптомов болезни Паркинсона | Stanford Health Care
Каковы симптомы болезни Паркинсона?
Симптомы болезни Паркинсона у разных людей различаются.Они также меняются по мере прогрессирования болезни. Симптомы, которые у одного человека появляются на ранних стадиях болезни, у другого могут появиться позже — или не появиться вовсе.
Симптомы чаще всего возникают в возрасте от 50 до 60 лет. Они развиваются медленно. Они часто остаются незамеченными для семьи, друзей и даже для человека, у которого они есть.
Заболевание вызывает двигательные симптомы и немоторные симптомы. Двигательные симптомы связаны с тем, как вы двигаетесь. Самый частый из них — тремор.
Тремор и другие двигательные симптомы
Тремор или дрожь, часто в руке, руке или ноге, возникает, когда вы бодрствуете, сидите или стоите на месте (тремор покоя).Становится лучше, когда вы двигаете этой частью тела.
- Тремор часто является первым симптомом, который замечают люди с болезнью Паркинсона или члены их семей.
- Сначала тремор может появиться только в одной руке или ноге или только на одной стороне тела. Тремор также может затронуть подбородок, губы и язык.
- По мере прогрессирования болезни тремор может распространяться на обе стороны тела. Но в некоторых случаях тремор остается только с одной стороны.
Эмоциональное и физическое напряжение делает тремор более заметным.Сон, полное расслабление и намеренное движение или действие обычно уменьшают или останавливают тремор.
Тремор — один из наиболее частых признаков болезни Паркинсона. Но не у всех с тремором есть болезнь Паркинсона. В отличие от тремора, вызванного болезнью Паркинсона, тремор, вызванный другими состояниями, проходит лучше, когда ваша рука или кисть не движется, и усиливается, когда вы пытаетесь пошевелить ими.
Наиболее частой причиной непаркинсонического тремора является эссенциальный тремор. Это излечимое заболевание, которое часто ошибочно диагностируется как болезнь Паркинсона.
Помимо тремора, к наиболее частым симптомам относятся:
- Скованность мышц (ригидность) и боли в мышцах.
-
Один из наиболее распространенных ранних признаков болезни Паркинсона — это уменьшение размаха руки на одну сторону при ходьбе. Это вызвано жесткими мышцами. Жесткость также может влиять на мышцы ног, лица, шеи или других частей тела. Это может вызвать чувство усталости и боли в мышцах.
- Слабость мышц лица и горла.
-
Говорить и глотать может стать труднее.Вы можете подавиться, кашлять или пускать слюни. Речь становится мягче и однообразнее. Потеря подвижности мускулов лица может вызвать неподвижное, пустое выражение лица, которое часто называют «маской Паркинсона».
- Проблемы с ходьбой и равновесием.
-
Человек с этим заболеванием, скорее всего, будет делать маленькие шаги и шаркать, ставя ноги близко друг к другу. Человек может немного наклониться вперед в талии и с трудом повернуться. Проблемы с равновесием и осанкой могут стать причиной частых падений.
