Хронический эрозивный серопозитивный артрит у больной хроническим гепатитом С | Ananjeva
1. <div><p>Т.М.Игнатова, З.Г.Апросина, В.В.Серов и соавт. Внепеченочные проявления хронической HCV — инфекции. Росс, мед.жур., 2001, 2, 13-18</p><p>Arnett F.C., Edworth S.М., Bloch D.A. et al. The American Rheumatism Association 1987 revised criteria for classification of rheumatoid arthritis. Arhtr. Rheum., 1988, -31,-315-324</p><p>Buskila D. Hepatitis C-assosiated arthritis. Curr. Opin. Rheumatol., 2000, 12, 295-299</p><p>oshi S., Kuczynski М., Heathcote E.J. Symptomatic and virological response to antiviral therapy in hepatitis С associated with extrahepatic complication of cryoglobulinemia. Dig.Dis.Sci., 2007, 52, 9, 24102417</p><p>Lovy M.R., Starkebaum G., Uberoi S. Hepatitis С infection presenting with rheumatic manifestations: mimic of rheumatoid arthritis.

Болезни костно-мышечной системы и соединительной ткани | ||
M05 Серопозитивный ревматоидный артрит M05.0 Синдром Фелти M05.1 Ревматоидная болезнь легкого (j99.0) M05.2 Ревматоидный васкулит M05.3 Ревматоидный артрит с вовлечением др. органов и систем M05.8 Другие серопозитивные ревматоидные артриты M05.9 Серопозитивный ревматоидный артрит неуточненный M06 Другие ревматоидные артриты M06. M06.1 Болезнь Стилла, развившаяся у взрослых M06.2 Ревматоидный бурсит M06.3 Ревматоидный узелок M06.4 Воспалительная полиартропатия M06.8 Другие уточненные ревматоидные артриты M06.9 Ревматоидный артрит неуточненный | Минздрав России 2018 | |
M08.1 Юношеский анкилозирующий спондилит | Минздрав России 2021 | |
M08.0 Юношеский (ювенильный) ревматоидный артрит (РФ+ и РФ-) M08.3 Юношеский (ювенильный) полиартрит (серонегативный) M08.4 Пауциартикулярный юношеский (ювенильный) артрит | Минздрав России 2016 | |
M10.0 Идиопатическая подагра M10.1 Свинцовая подагра M10.2 Лекарственная подагра M10.3 Подагра, обусловленная нарушением почечной функции M10.4 Другая вторичная подагра M10.9 Подагра неуточненная | Минздрав России 2018 | |
Клинические рекомендации «Узелковый полиартериит. Ювенильный полиартериит» Ювенильный полиартериит» | М30.0 Узелковый полиартериит М30.2 Ювенильный полиартериит | Минздрав России 2018 |
| Клинические рекомендации «Слизисто-кожный лимфонодулярный синдром [кавасаки] у детей» | M30.3 Слизисто-кожный лимфонодулярный синдром [Кавасаки] | Минздрав России 2016 |
M31.3 Гранулематоз Вегенера | Минздрав России 2016 | |
M31.4 Синдром дуги аорты (Такаясу) | Минздрав России 2016 | |
М33.0 Юношеский дерматомиозит | Минздрав России 2016 | |
M34.9 Системный склероз неуточненный | Минздрав России 2017 | |
M35.2 Болезнь Бехчета | Минздрав России 2018 | |
M81.0 Постменопаузный остеопороз. M81.8 Другие остеопорозы. | Минздрав России 2021 | |
| Клинические рекомендации «Патологические переломы, осложняющие остеопороз» | M80. M80.2 остеопороз с патологическим переломом, вызванный обездвиженностью M80.3 постхирургический остеопороз с патологическим переломом, вызванный нарушением всасывания в кишечнике M80.4 лекарственный остеопороз с патологическим переломом M80.5 идиопатический остеопороз с патологическим переломом M80.8 другой остеопороз с патологическим переломом M80.9 остеопороз с патологическим переломом неуточненный | Минздрав России 2018 |
| Азатиоприн |
Таб. 50 мг: 50 шт. |
|||
| Аира корневища |
|
|||
| Аира корневища |
 №: ЛП-002181
от 15.08.13
Дата перерегистрации: 06.11.18 №: ЛП-002181
от 15.08.13
Дата перерегистрации: 06.11.18
|
|||
| Аира корневища |
Корневища измельченные: пачки 50 г рег. №: Р N001719/01 от 07.10.08 Дата перерегистрации: 22.06.18 |
|||
| Аира корневища |
 5 г: фильтр-пакеты 10 или 20 шт.
рег. №: Р N002292/01
от 28.04.08
Дата перерегистрации: 23.04.20 5 г: фильтр-пакеты 10 или 20 шт.
рег. №: Р N002292/01
от 28.04.08
Дата перерегистрации: 23.04.20
|
|||
| Аира корневища |
Сырье растительное измельченное 35 г: пачки рег. №: ЛС-001938 от 05.12.11 |
|||
| Аира корневища |
Сырье растительное измельченное 50 г: пачки рег. №: ЛСР-005111/10
от 01.06.10 №: ЛСР-005111/10
от 01.06.10
|
|||
| Аира корневища |
Сырье растительное измельченное: 40, 50, 75 и 100 г; 0.3, 0.5, 1, 5, 10, 15, 20, 25, 30, 35, 40, 50 кг, пачки рег. №: Р N000470/02 от 02.06.08 |
|||
| Аира корневища |
Сырье растительное измельченное: 50 г или 75 г пачки рег. №: ЛП-000563
от 14.07.11 №: ЛП-000563
от 14.07.11
|
|||
| Аира корневища |
Сырье растительное измельченное: пачки 50, 75 или 100 г рег. №: ЛП-000813 от 06.10.11 |
|||
| Аира корневища |
Сырье растительное-порошок 1. |
|||
| Аира корневища |
Сырье растительное-порошок 1.5 г: фильтр-пакеты 10 или 20 шт. рег. №: ЛП-000984 от 18.10.11 |
|||
| Аира корневища |
Сырье растительное-порошок 1. |
|||
| Аира корневища |
Сырье растительное-порошок 1.5 г: фильтр-пакеты 10 шт. рег. №: ЛС-001939 от 02.12.11 |
|||
| Аира корневища |
Сырье растительное-порошок 1. |
|||
| Актемра® |
Концентрат д/пригот. р-ра д/инфузий 80 мг/4 мл: фл. 1 шт. рег. №: ЛСР-003012/09 от 16.04.09 Дата перерегистрации: 06.09.17Концентрат д/пригот. р-ра д/инфузий 200 мг/10 мл: фл. Концентрат д/пригот. р-ра д/инфузий 400 мг/20 мл: фл. 1 шт. рег. №: ЛСР-003012/09 от 16.04.09 Дата перерегистрации: 06.09.17 |
|||
| Актемра® |
Р-р д/п/к введения 162 мг/0.9 мл: шприц-тюбики 4 шт. рег. №: ЛП-003186
от 08.09.15 №: ЛП-003186
от 08.09.15
|
|||
| Акупан®-Биокодекс |
Р-р д/инъекц. 20 мг/2 мл: амп. 5 шт. рег. №: ЛП-000181 от 20.01.11 Дата перерегистрации: 02.02.18 |
Произведено и расфасовано: DELPHARM TOURS (Франция) Выпускающий контроль качества: BIOCODEX (Франция) или ОРТАТ (Россия) | ||
| Алгезир Ультра |
Таб. |
|||
| Аленталь® |
Крем д/наружн. прим. 1.5%: туба 20 г, 30 г или 50 г рег. №: ЛП-006774 от 11.02.21 |
|||
| Аленталь® |
Таб. |
|||
| Амбениум® парентерал |
Р-р д/в/м введения 373.4 мг/2мл+3.75 мг/2 мл: 2 мл амп. 1, 3, 5 или 10 шт. рег. №: ЛП-006040 от 15.01.20 |
|||
| АМБЕНИУМ®-ТРИВИУМ® |
Мазь д/наружн. |
|||
| Амелотекс® |
Р-р д/в/м введения 10 мг/1 мл: амп. 1.5 мл 3, 5, 6, 10 или 20 шт. рег. №: ЛСР-004199/08 от 30.05.08 Дата перерегистрации: 15.05.20 |
|||
| Амелотекс® |
Супп. Супп. ректальные 15 мг: 1, 3, 5, 6, 9, 10 или 12 шт. рег. №: ЛП-002780 от 19.12.14 Дата перерегистрации: 20.12.19 |
|||
| Амелотекс® |
Сусп. д/приема внутрь 7.5 мг/5 мл: фл. 100 мл в компл. |
|||
| Амелотекс® |
Таб. 7.5 мг: 10 или 20 шт. рег. №: ЛСР-007059/09 от 07.09.09 Дата перерегистрации: 23.09.19Таб. |
|||
| Амоксициллин Экобол® |
Таб. 250 мг: 10 или 20 шт. рег. №: ЛСР-001568/08 от 14.03.08 Дата перерегистрации: 01.12.16 |
|||
| Амоксициллин Экобол® |
Таб. |
|||
| Ампициллин |
Порошок д/пригот. р-ра д/в/в и в/м введен. 500 мг: фл. 1 или 50 шт. рег. №: ЛС-002726 от 30.11.11 |
|||
| Ампициллин |
Порошок д/пригот. |
|||
| Ампициллин |
Порошок д/пригот. р-ра д/в/в и в/м введен.250 мг: фл. 1, 10 или 50 шт. рег. №: ЛС-000658 от 01.06.10 |
|||
| Адвил |
Таб. |
|||
| Адвил |
Таб., покр. пленочной обол., 400 мг: 2, 4, 8, 10 и 40 шт. рег. №: ЛСР-000824/08 от 18.02.08 |
|||
| Адвил для детей |
Сусп. |
Произведено: FAMAR LYON (Франция) | ||
| Адвил Максимум |
Капс. |
|||
| Актасулид |
Таб. |
|||
| Альдоспрей |
Аэрозоль д/наружн. прим. 10%: баллон 90 г рег. №: П N014359/01-2002 от 02.10.02 |
|||
| Амбене |
Р-р д/в/м введения А и В 2 мл/1 мл: 2-камерный шприц 3 шт. Р-р д/в/м введения А и В в двойных амп. 2 мл/1 мл: комплекты 6 шт. рег. №: П N012045 от 08.12.06 |
Произведено: MERCKLE (Германия) | ||
| Амелотекс® |
Таб. Таб. 15 мг: 10 или 20 шт. рег. №: ЛСР-007059/09 от 07.09.09 Дата перерегистрации: 31.08.10 |
|||
Серопозитивный и серонегативный варианты гранулематоза с полиангиитом: влияние АНЦА на клиническую картину и прогноз заболевания. Клиническая фармакология и терапия
Материалы и методы
В ретроспективное исследование были включены 112 пациентов с ГПА. Типирование и количественное определение антител к цитоплазме нейтрофилов (АНЦА) проводили методом иммуноферментного анализа (ИФА). У 59 из них были выявлены АНЦА к протеиназе-3 (ПР3), у 17 – к миелопероксидазе (МПО), у 4 – оба типа АНЦА, в то время как у 32 больных АНЦА не определялись. Медиана продолжительности наблюдения составила 75,5 [44,5;124] месяца. У всех больных рассчитывали Бирмингемский индекс активности васкулита (BVAS v.3) на момент установления диагноза и индекс повреждения (VDI) к концу наблюдения.
Медиана продолжительности наблюдения составила 75,5 [44,5;124] месяца. У всех больных рассчитывали Бирмингемский индекс активности васкулита (BVAS v.3) на момент установления диагноза и индекс повреждения (VDI) к концу наблюдения.
Группы пациентов с серопозитивным и серонегативным вариантами ГПА были сопоставимы по половому и возрастному составу. Локальную форму ГПА у пациентов с серонегативным вариантом заболевания диагностировали значительно чаще, чем у больных с серопозитивным ГПА (59,4% и 11,3%, соответственно; p
АНЦА-ассоциированные васкулиты (ААВ) – это системные иммуновоспалительные заболевания, характеризующиеся поражением
сосудов преимущественно мелкого калибра, а также присутствием в сыворотке антинейтрофильных цитоплазматических
антител (АНЦА). Выделяют три основные нозологические формы ААВ: гранулематоз с полиангиитом (ГПА), микроскопический
полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА). У пациентов с ГПА чаще определяются АНЦА,
специфичные к протеиназе-3 (ПР-3), а при МПА и ЭГПА – к миелопероксидазе (МПО), хотя частота выявления двух типов
антител варьируется в широких пределах в зависимости от региона. Например, в России МПО-АНЦА имелись только у 7%
больных ГПА [1], а в Китае – у 70,9% [2].
Выделяют три основные нозологические формы ААВ: гранулематоз с полиангиитом (ГПА), микроскопический
полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА). У пациентов с ГПА чаще определяются АНЦА,
специфичные к протеиназе-3 (ПР-3), а при МПА и ЭГПА – к миелопероксидазе (МПО), хотя частота выявления двух типов
антител варьируется в широких пределах в зависимости от региона. Например, в России МПО-АНЦА имелись только у 7%
больных ГПА [1], а в Китае – у 70,9% [2].
Несмотря на высокую частоту выявления АНЦА, а также их потенциальное влияние на течение заболевание, наличие этих
аутоантител формально не входит в критерии классификации ААВ [3,4]. Кроме того, у части больных ААВ, подтвержденным
при гистологическом исследовании, АНЦА не определяются (АНЦА-отрицательный, или серонегативный вариант ААВ).
Соответственно, отсутствие АНЦА не противоречит существующим классификационным критериям ААВ [5]. Точно оценить долю
серонегативных ААВ не представляется возможным, так она зависит от надежности используемых методов определения АНЦА. По данным разных исследователей, частота серонегативных вариантов ААВ составляет от 20% [6] до 30% [7] среди всех
трех ААВ. Она выше всего при ЭГПА, в то время как при МПА в большинстве случаев удается выявить АНЦА.
По данным разных исследователей, частота серонегативных вариантов ААВ составляет от 20% [6] до 30% [7] среди всех
трех ААВ. Она выше всего при ЭГПА, в то время как при МПА в большинстве случаев удается выявить АНЦА.
Различные исследователи пытались установить связь между отсутствием АНЦА и клиническими особенностями течения ААВ. Было показано, что для серонегативных форм характерно развитие ограниченных, или так называемых “локальных», форм заболевания [8-12]. Например, J. Damoiseaux и соавт. после многократного серологического исследования диагностировали серонегативный ГПА у 12 пациентов; у всех заболевание характеризовалось формированием локализованного поражения [8]. Тем не менее, проблема серонегативных вариантов ААВ остается мало изученной. Ситуацию усугубляет тот факт, что в большинстве крупных клинических исследований отсутствие АНЦА рассматривалось как критерий исключения.
Целью исследования было сравнение особенностей течения и исходов ГПА у пациентов с серопозитивным (с антителами как к ПР3, так и к МПО) и серонегативным вариантами васкулита.
Материалы и методы
В ретроспективное исследование включали больных с достоверным диагнозом ГПА, установленным в соответствии с классификационными критериями Американской коллегии ревматологов [5], а также алгоритмом Евро пейского агентства по лекарственным средствам (EMA) [4, 13].
Количественное определение АНЦА проводили методом антиген-специфического иммуноферментного анализа (ИФА) (верхняя граница нормы 5 ЕД/мл). Пациентов считали серопозитивными при наличии ПР3-АНЦА и/или МПО-АНЦА в концентрации >5 ЕД/мл, серонегативными – при содержании АНЦА ≤5 ЕД/мл.
Активность заболевания в дебюте оценивали с помощью Бирмингемского индекса активности васкулита (Birmin gham Vasculitis Activity Score, BVAS v.3). У всех пациентов оценивали также индекс повреждения (Vasculitis Damage Index, VDI) в конце наблюдения, который отражает степень необратимого поражения органов и систем [14, 15].
Статистическая обработка результатов проводилась с использованием пакета программ SPSS Statistics 23 (IBM, США). Для исследования достоверности различий по качественным параметрам применяли точный критерий Фишера. Нормальность распределения количественных показателей проверяли при помощи критерия ШапироУилка. Для оценки достоверности отличий количественных параметров между двумя группами при распределении, отличающемся от нормального, результаты представляли в виде медианы (Ме) с интерквартильным размахом [25 перцентиль;75 перцентиль] и применяли критерий МаннаУитни. Различия между группами считали статистически значимыми при p<0,05.
Результаты
В исследование были включены 112 больных ГПА, в том числе 37 мужчин и 75 женщин). Медиана возраста составила 45 [31;55] лет, а медиана длительности наблюдения – 75,5 [44,5;124,0] мес. Серопозитивный ГПА диагностировали у 80 (71,4%) пациентов: у 59 из них определялись ПР3-АНЦА, у 17 – МПО-АНЦА, у 4 – АНЦА обоих типов. У 32 (28,6%) больных наблюдался серонегативный вариант ГПА. У всех этих пациентов диагноз ААВ был установлен на основании характерных клинических данных и подтвержден при гистологическом исследовании.
Группы пациентов с серопозитивным и серонегативным вариантами ГПА были сопоставимы по полу и возрасту (табл. 1). Длительность наблюдения была несколько выше у серопозитивных пациентов, однако разница между группами не достигла статистической значимости.
Клинические особенности ААВ. Наличие АНЦА ассоциировалось c более частым развитием генерализованной формы заболевания с поражением верхних дыхательных путей, легких и почек (табл. 1). Локальную форму ГПА, напротив, значительно чаще диагностировали в группе пациентов, у которых отсутствовали АНЦА (59,4% против 11,3%). Наиболее частым локальным вариантом ГПА в обеих группах была псевдоопухоль орбиты, доля которой среди всех локальных вариантов составила 78,5%. Частота общих симптомов, а также поражения суставов, кожи и нервной системы достоверно не отличалась между группами больных серопозитивным и серонегативным ГПА.
| Показатели | Серопозитивный ГПА (n=80) |
Серонегативный ГПА (n=32) |
p |
|---|---|---|---|
| Примечание. СКФ – скорость клубочковой фильтрации, рассчитанная по формуле CKD-EPI, БПГН – быстропрогрессирующий гломерулонефрит, ЦНС – центральная нервная система, ПНС – периферическая нервная система | |||
| Мужчины, n (%) | 27 (33,7) | 10 (31,2) | 1,0 |
| Возраст дебюта, годы | 43,5 [29;55] | 49,5 [36;56] | 0,33 |
| Длительность наблюдения, мес | 78,0 [53;124] | 57,5 [34;114] | 0,052 |
| Индекс BVAS в начале заболевания | 18,5 [11;25] | 6,0 [4;9] | <0,00001 |
| Неспецифические проявления, n (%) | 65 (81,3) | 30 (93,8) | 0,14 |
| Индекс VDI в конце периода наблюдения | 6,0 [4;9 | 3,0 [2;4] | <0,00001 |
| Локальная форма ГПА, n (%) | 9 (11,3) | 19 (59,4) | <0,00001 |
| Поражение верхних дыхательных путей, n (%) | 78 (97,5) | 22 (68,8) | 0,00001 |
| Поражение легких, n (%) | 61 (77,2) | 10 (31,3) | 0,00001 |
| Легочное кровотечение, n (%) | 28 (35,4) | 1 (3,1) | 0,00023 |
| Поражение почек, n (%) | 54 (67,5) | 5 (15,6) | <0,00001 |
| Расчетная СКФ в дебюте, мл/мин/1,73 м2 | 72,8 [33,2;91,5] | 79,3 [69,2;92,6] | 0,13 |
| Уровень креатинина в дебюте, мкмоль/л | 89,0 [74,3;168,0] | 75,0 [68,0;86,6] | 0,0007 |
| БПГН, n (%) | 14 (17,5) | 0 | 0,0096 |
| Терминальная почечная недостаточность, n (%) | 6 (8,3) | 1 (3,2) | 0,67 |
| Артрит, n (%) | 15 (19,2) | 3 (16,7) | 0,26 |
| Поражение ЦНС, n (%) | 1 (1,3) | 0 | 1,0 |
| Поражение ПНС, n (%) | 18 (22,5) | 3 (9,4) | 0,18 |
| Псевдоопухоль орбиты, n (%) | 29 (36,7) | 26 (81,3) | 0,00002 |
| Поражение кожи, n (%) | 23 (28,8) | 4 (12,5) | 0,09 |
| Гемоглобин, г/л | 110,5 [97;125] | 136,0 [129;142] | <0,00001 |
| Обострение в первый год после достижения ремиссии, n (%) | 32 (44,4) | 16 (51,6) | 0,53 |
| Смерть, n (%) | 4 (5,1) | 0 | 0,58 |
| Терапия, n (%) | |||
| циклофосфамид | 70 (87,5) | 16 (50,0) | 0,00009 |
| ритуксимаб | 25 (31,2) | 9 (28,1) | 0,82 |
|  азатиоприн | 47 (63,5) | 12 (44,4) | 0,11 |
|  метотрексат | 22 (29,7) | 10 (35,7) | 0,63 |
Индекс BVAS в начале заболевания был значительно выше у пациентов с серопозитивным вариантом ГПА и составил в среднем 18,5 (p<0,00001). Индекс VDI в конце периода наблюдения также был достоверно выше у серопозитивных пациентов (p<0,00001).
Развитие жизнеугрожающих проявлений заболевания, в том числе быстропрогрессирующего гломерулонефрита (БПГН) и диффузного альвеолярного кровотечения (ДАК), наблюдалось почти исключительно у серопозитивных пациентов (табл. 1). Показатели функции почек также были хуже у пациентов с серопозитивным вариантом ГПА. В то же время концентрация гемоглобина в дебюте заболевания у серопозитивных пациентов была достоверно ниже, чем у пациентов без АНЦА (табл. 1).
Лекарственная терапия. Частота назначения ритуксимаба, азатиоприна и метотрексата у больных серопозитивным и серонегативным ГПА отличалась незначительно. В то же время циклофосфамид для индукции ремиссии значительно чаще применяли у серопозитивных пациентов (табл. 1).
Обострения и исходы. Частота возникновения обострений в течение первого года после достижения ремиссии была сходной в обеих группах, составив в среднем 48%.
В группе больных серонегативным ГПА не было зафиксировано ни одного смертельного исхода, в то время как в группе сравнения умерли 4 больных. Тем не менее, выживаемость достоверно не отличалась между группами.
Почечная выживаемость также была недостоверно выше в группе серонегативных пациентов: прогрессирование почечной недостаточности до терминальной стадии отмечено у 1 (3,2%) и 6 (8,3%) пациентов с серонегативным и серопозитивным ГПА, соответственно (разница не достигла статистической значимости).
Обсуждение
В многочисленных зарубежных и отечественных клинических исследованиях было продемонстрировано, что серотип АНЦА (наличие антител к ПР3 или МПО) достоверно ассоциировано с особенностями течения и исходов ААВ [16-19]. В связи с этим неоднократно предлагалось отказаться от существующей классификации ААВ и выделять два типа системного васкулита в зависимости от типа циркулирующих антител, т.е. ПР3АНЦА- и МПО-АНЦА-позитивный варианты [7]. Применение метода полногеномного поиска ассоциаций (genome-wide association studies, GWAS) подтвердило наличие более тесной ассоциации определенных генов с типом АНЦА, а не клиническими синдромами, на основании которых выделяют различные нозологические формы ААВ [20,21]. Тем не менее, на практике попрежнему используется “старая» классификация ААВ, предполагающая выделение ГПА, МПА и ЭГПА, однако в диагнозе целесообразно указывать наличие/отсутствие АНЦА и их тип.
В то же время, проблема серонегативных вариантов ААВ, при которых не определяются ПР3-АНЦА или МПО-АНЦА, недостаточно освещена в современной научной литературе. Большой интерес представляет работа E. Miloslavsky и соавт. [22], которые анализировали ПР3-АНЦА-позитивных и серонегативных пациентов с ГПА, принимавших участие в клинических исследованиях WGET и RAVE. Отсутствие АНЦА в циркуляции ассоциировалось с женским полом и меньшим значением индекса BVAS в начале заболевания, в первую очередь из-за более низкой частоты поражения почек (20% против 62% среди пациентов с серопозитивным ГПА). В то же время достоверных различий индекса VDI между двумя группами не выявили. У пациентов с серонегативным ГПА чаще диагностировали рецидивирующее течение заболевания на момент включения в исследование, в то время как общая частота обострений за время наблюдения была сопоставимой с таковой у ПР3-АНЦА-позитивных пациентов. Следует отметить, что авторы проанализировали только 15 пациентов с серонегативным вариантом ГПА, а длительность наблюдения ограничивалась 18 мес. При этом сравнение клинических показателей и течения болезни проводилось только с ПР3-АНЦА-позитивными пациентами, а пациенты с МПО-АНЦА не были включены в исследование.
В нашем исследовании была установлена достоверная связь между наличием АНЦА и более высокой частотой развития генерализованных форм ГПА, в том числе с поражением почек и легких. При этом в исследовании Е. Miloslavsky и соавт. подобная взаимосвязь была установлена только для почечного поражения. Случаи развития БПГН и ДАК мы наблюдали практически исключительно у серопозитивных пациентов. Вероятно, высокая частота жизнеугрожающих осложнений объясняет и более частое применение циклофосфамида для индукции ремиссии у пациентов этой группы. В свою очередь, отсутствие АНЦА в сыворотке было ассоциировано с локальным вариантом ГПА, что согласуется с данными, полученными в нескольких ранее опубликованных российских и зарубежных исследованиях [8-12]. Псевдоопухоль орбиты была самым распространенным вариантом поражения при локальной форме, что также согласуется с полученными ранее данными [23]. В отличие от Е. Miloslavsky и соавт., мы не выявили преобладания женщин среди пациентов с серонегативным ГПА. Достоверно более высокие значения индексов BVAS и VDI у серопозитивных пациентов коррелируют с вовлечением большего числа органов и систем при данном типе заболевания. Сходная закономерность в отношении BVAS была отмечена и в работе Е. Miloslavsky и соавт., хотя последние не выявили существенных различий индекса VDI между двумя группами, что может объясняться меньшей длительностью наблюдения.
Общая и почечная выживаемость в нашем исследовании были несколько выше у пациентов с серонегативным ГПА, что также согласуется с меньшей степенью выраженности клинических проявлений по сравнению с таковой у серопозитивных пациентов. Однако поскольку эти параметры достоверно не отличались между группами, а частота обострений в первый год после индукции ремиссии была сходной у больных серонегативным и серопозитивным ГПА, мы не можем рассматривать отсутствие АНЦА в качестве предиктора лучшей выживаемости или меньшего риска развития рецидивов. Возможно, это связано с тем, что при отсутствии яркой клинической картины у серонегативных пациентов увеличивается время до установления диагноза, а для индукции ремиссии назначается менее активная иммуносупрессивная терапия, что может способствовать более высокому риску ранних обострений, частота которых была сопоставимой с таковой у серопозитивных пациентов.
Важным ограничением в диагностике ААВ является технический аспект определения антител в сыворотке крови, так как результаты тестирования АНЦА во многом зависят от достоверности используемых лабораторных методов. Золотым стандартом выявления АНЦА сегодня считают антиген-специфический ИФА, позволяющий определить содержание ПР3-АНЦА и МПО Постановка реакции непрямой иммунофлюоресценции (НИФ) перед проведением антиген-специфического ИФА не является обязательным этапом определения АНЦА при подозрении на ААВ [8], хотя необходимо учитывать возможность ложноотрицательных результатов этого метода исследования [24,25]. Соответственно, при отрицательном результате антиген-специфического ИФА могут быть использованы метод НИФ [26], а также ИФА-тесты второго и третьего поколений (capture и anchor) [27]. Стандарти зованное и качественное выполнение лабораторных тестов позволяет избежать гипердиагностики серонегативных форм ААВ.
Заключение
Результаты нашего исследования позволяют сделать вывод о том, что серонегативный вариант ГПА ассоциирован с локальной формой заболевания и менее выраженными клиническими проявлениями, однако частота обострений была сопоставимой с таковой при серопозитивном варианте. Вероятно, это объясняется тем, что больные серопозитивным ГПА достоверно чаще получали более мощную индукционную иммуносупрессивную терапию, прежде всего циклофосфамидом, которая позволяет значительно улучшить течение ААВ, в том числе с угрожающими жизни проявлениями, такими как БПГН и ДАК.
Серопозитивный ревматоидный артрит — МКБ 10 код M05
Ниже приведён список действующих веществ, относящихся к коду M05 МКБ-10 (наименования фармакологических групп и перечень торговых названий, связанных с этим кодом).
Фармакологическая группа: Иммунодепрессанты
Фармакологическая группа: Иммунодепрессанты
Фармакологическая группа: Прочие иммуномодуляторы
Фармакологическая группа: Регуляторы аппетита
Фармакологическая группа: Прочие ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства
Фармакологическая группа: НПВС — Пиразолоны
Фармакологическая группа: НПВС — Производные уксусной кислоты и родственные соединения
Фармакологическая группа: Прочие ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства
Фармакологическая группа: Прочие ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства
Фармакологическая группа: Прочие ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства
Фармакологическая группа: НПВС — Производные уксусной кислоты и родственные соединения
Фармакологическая группа: НПВС — Производные уксусной кислоты и родственные соединения
Фармакологические группы: Антиагреганты, НПВС — Производные салициловой кислоты
Фармакологические группы: Антиагреганты, НПВС — Производные салициловой кислоты
Фармакологическая группа: НПВС — Производные салициловой кислоты в комбинации с другими препаратами
Фармакологическая группа: Иммунодепрессанты
Фармакологическая группа: Местнораздражающие средства
Фармакологическая группа: Местнораздражающие средства в комбинации с другими препаратами
Фармакологическая группа: НПВС — Производные салициловой кислоты в комбинации с другими препаратами
Фармакологическая группа: Местнораздражающие средства в комбинации с другими препаратами
Фармакологическая группа: Глюкокортикостероиды
Фармакологическая группа: Глюкокортикостероиды в комбинации с другими препаратами
Фармакологическая группа: Глюкокортикостероиды в комбинации с другими препаратами
Фармакологическая группа: Диуретики
Фармакологическая группа: Прочие иммуномодуляторы
Фармакологические группы: Местные анестетики в комбинации с другими препаратами, Глюкокортикостероиды в комбинации с другими препаратами
Фармакологические группы: Прочие синтетические антибактериальные средства, Иммунодепрессанты
Фармакологические группы: Офтальмологические препараты, Глюкокортикостероиды
Фармакологическая группа: НПВС — Производные пропионовой кислоты
Фармакологические группы: Офтальмологические препараты, НПВС — Производные уксусной кислоты и родственные соединения
Фармакологические группы: Ингибиторы протонного насоса в комбинации с другими препаратами, НПВС — Производные уксусной кислоты и родственные соединения в комбинации с другими препаратами
Фармакологические группы: Витамины и витаминоподобные средства в комбинации с другими препаратами, НПВС — Производные уксусной кислоты и родственные соединения в комбинации с другими препаратами
Фармакологическая группа: Дерматотропные средства
Фармакологическая группа: НПВС — Производные пропионовой кислоты
Фармакологические группы: НПВС — Производные уксусной кислоты и родственные соединения, Офтальмологические препараты
Фармакологические группы: Противовирусные средства (исключая ВИЧ), Интерфероны
Фармакологическая группа: Местнораздражающие средства в комбинации с другими препаратами
Фармакологическая группа: НПВС — Производные пропионовой кислоты
Фармакологические группы: НПВС — Бутилпиразолидины, Препараты, влияющие на обмен мочевой кислоты
Фармакологическая группа: Общетонизирующие средства и адаптогены
Фармакологические группы: Прочие ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства, Желчегонные средства и препараты желчи, Коагулянты (в том числе факторы свёртывания крови), гемостатики
Фармакологические группы: Регенеранты и репаранты, Прочие ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства
Фармакологическая группа: Иммунодепрессанты
Фармакологическая группа: НПВС — Оксикамы
Фармакологическая группа: Прочие ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства
Фармакологическая группа: Местнораздражающие средства
Фармакологическая группа: НПВС — Оксикамы в комбинации с другими препаратами
Фармакологическая группа: Глюкокортикостероиды
Фармакологическая группа: Антиметаболиты
Фармакологическая группа: НПВС — Фенаматы
Фармакологическая группа: Прочие ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства
Фармакологическая группа: НПВС — Производные пропионовой кислоты
Фармакологическая группа: Прочие ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства
Фармакологическая группа: Прочие ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства
Фармакологическая группа: Местнораздражающие средства в комбинации с другими препаратами
Фармакологические группы: Витамины и витаминоподобные средства, Прочие гиполипидемические средства, Антиагреганты
Фармакологические группы: Детоксицирующие средства, включая антидоты, Иммунодепрессанты
Фармакологическая группа: Местнораздражающие средства
Фармакологическая группа: НПВС — Оксикамы
Фармакологическая группа: Глюкокортикостероиды
Фармакологическая группа: Глюкокортикостероиды
Фармакологическая группа: Иммунодепрессанты
Фармакологическая группа: НПВС — Производные уксусной кислоты и родственные соединения
Фармакологическая группа: Местнораздражающие средства
Фармакологическая группа: НПВС — Производные пропионовой кислоты
Фармакологическая группа: НПВС — Производные уксусной кислоты и родственные соединения
Фармакологическая группа: Иммунодепрессанты
Фармакологическая группа: Иммунодепрессанты
Фармакологическая группа: Глюкокортикостероиды
Фармакологическая группа: НПВС — Бутилпиразолидины
Фармакологическая группа: НПВС — Производные пропионовой кислоты
Фармакологическая группа: Алкилирующие препараты
Фармакологические группы: Иммунодепрессанты, Прочие синтетические антибактериальные средства
Фармакологическая группа: НПВС — Коксибы
Фармакологическая группа: Иммунодепрессанты
Фармакологическая группа: Алкилирующие препараты
Фармакологическая группа: Иммунодепрессанты
Фармакологическая группа: НПВС — Производные уксусной кислоты и родственные соединения
Фармакологическая группа: НПВС — Коксибы
Фармакологическая группа: НПВС — Фенаматы
Фармакологическая группа: Местнораздражающие средства
Если вам предстоит вакцинация против новой коронавирусной инфекции.
В поликлиниках Пермского края началась вакцинация для профилактики новой коронавирусной инфекции. Мы ответим на самые часто возникающие вопросы об этом.
Чем является вакцина против коронавируса? Чаще всего эту вакцину называют «Спутник», это — коммерческое название, а вот официально она называется вакцина «Гам-КОВИД-Вак». Вакцина изловлена без использования патогенного для человека нового коронавируса и состоит из двух компонентов: компонент I — хорошо известный нам аденовирусный вектор на основе аденовируса человека, несущий ген белка S вируса SARS-CoV-2 так называемого 26 серотипа и компонент II – вектор на основе аденовируса 5 серотипа, несущий ген белка S вируса SARS-CoV-2.
Что такое аденовирусный вектор? Вирусы это неклеточные инфекционные агенты, способные воспроизводится только внутри настоящей клетки. Для проникновения внутрь клетки вирусы выработали специализированные механизмы, благодаря которым происходит инфицирование здоровой клетки, а вирус при этом получает возможность эффективно транспортировать свой геном в клетку, которую заражают. Принципиальное отличие вирусного вектора от полноценного вируса в том, что у него искусственно удалена часть генома, а оставшаяся часть «встроена» в уже давно и хорошо известный вирус. Удаляется та часть генома, которая критически важна для последующего воспроизводства вируса. Такой вирус эффективно инфицирует клетки, но в дальнейшем ему необходим вспомогательный вирус – вот почему и создан т.н. компонент II.
Чем процесс инфицирования аденовирусным вектором отличается от инфицирования обычным вирусом? Аденовирусные векторы были созданы в 1970 годах и к сегодняшнему дню технология создания вакцин на их основе хорошо известна. а результаты прогнозируемы. Вектор оказывает минимальное воздействие на физиологические процессы в клетке, поэтому после выполнения прививки пациенты отмечают появление признаков отдаленно напоминающих заболевание. Вирусный вектор вакцины «Спутник» модифицирован для нацеливания на определенный тип клеток, таким типом является клетки эпителия дыхательных путей и желудочно-кишечного тракта.
Как выглядит вакцина «Гам-КОВИД-Вак»? Вакцина поступает в медицинские организации в замороженном виде и хранится при температуре ниже минус 18 градусов. Перед инъекцией флаконы размораживаются при комнатной температуре до получения однородной жидкости белесоватого или светло-желтого цвета. Однократная доза вакцины, обоих компонентов, для каждого пациента составляет полмиллилитра. Эта доза может быть одной в ампуле или во флаконе емкостью три миллилитра, рассчитанной на шесть инъекций.
Необходим ли осмотр врача-терапевта перед вакцинацией? Да, прием и осмотр врач терапевта обязательны в день вакцинации. Доктор проведет вам общий осмотр и измерение температуры тела. Вы получите на руки информационный материал и должны будете заполнить анкету пациента и инфомировнное согласие. Вакцинация бесплатная и добровольная.
Кому могут отказать в прививке «Гам-КОВИД-Вак»? Вакцинация не проводится пациентам с температурой тела выше 37 гр. С. Если пациент контактировал с больными инфекционными заболеваниями или имеет симптомы заболевания в течение последних двух недель будет проведено исследование методом ПЦР (мазок на коронавирус). В прививке будет отказано тем, кто переболел новой коронавирусной инфекцией. Не допускаются к вакцинированию пациенты с перенесенными тяжелыми аллергическими реакциями, беременные и в периоде грудного вскармливания, лица до 18-ти лет. С осторожностью вакцинация проводится тем, кто болен аутоиммунными заболеваниями (системная красная волчанка, ревматоидный артрит, сахарный диабет 1 типа и др.)
Как выполняется прививка? Прививка выполняется медицинской сестрой прививочного кабинета. Каждая доза вводимой вакцины набирается индивидуально и ставится внутримышечно в верхнюю треть наружной поверхности плеча. При невозможности введения в эту область разрешается введение вакцины в наружную поверхность бедра.
Как проходит наблюдение за теми, кто получил первый компонент «Гам-КОВИД-Вак»? После инъекции вы должны будете остаться в поликлинике не менее чем на полчаса. После инъекции информация о проведенной процедуре будет внесена в Вашу амбулаторную карту и специальный регистр вакцинированных от COVID-19. Ожидаемой реакцией на прививку следует считать незначительный подъем температуры тела, незначительная общая слабость, головные боли, снижение аппетита.
Когда проводится второй этап вакцинации? Вторая инъекция вакцины выполняется строго на 21-ый день, т.н. компонентом II в дозе полмиллитра. Все, что касалось первого этапа вакцинирования в полной мере относится и ко второму.
Как можно оценить эффективность вакцинирования? Возможно определение уровня иммуноглобулинов М и G, но не ранее чем через 42 дня после первого этапа вакцинации.
Как узнать о начале вакцинации? Сейчас в поликлиниках формируются планы по вакцинации «Гам-КОВИД-Вак», которые будут реализованы по мере поступления вакцины. Всю информацию можно узнавать в регистратурах поликлиник.
Диагностика ревматоидного артрита и артропатий
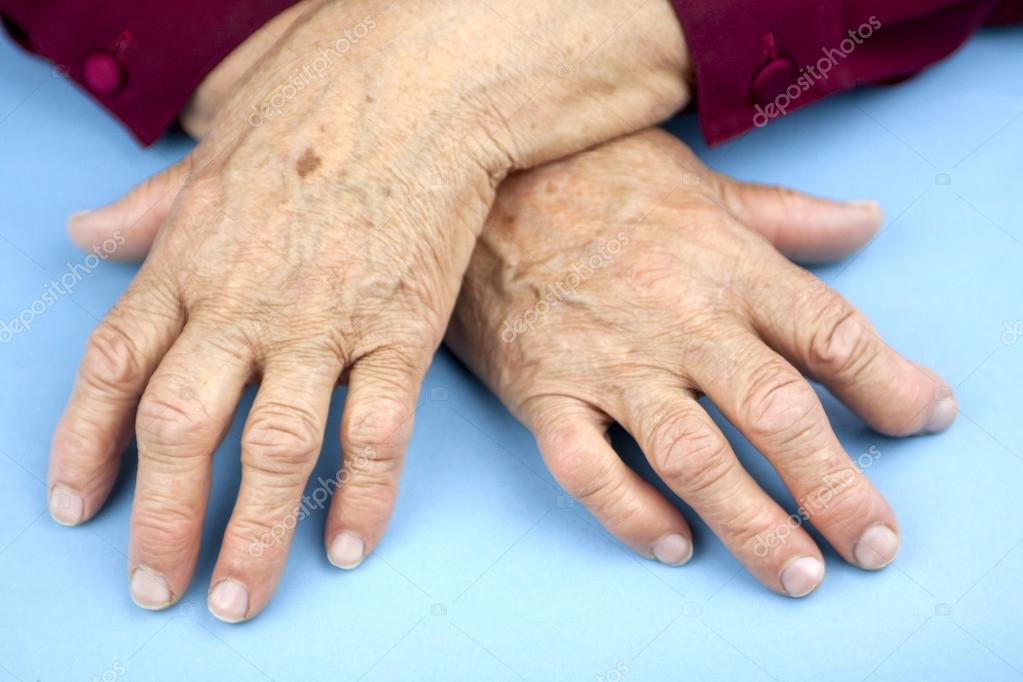
Ревматоидный артрит (РА) представляет собой наиболее частое воспалительное заболевание суставов. В северо-европейской популяции его встречаемость достигает более 1%. Ревматоидный артрит представляет собой системное аутоиммунное заболевание, основным признаком которого является воспаление синовиальных оболочек суставов. В отсутствии специфической терапии он характеризуется неумолимым прогрессирующим течением, хотя периоды ярких клинических проявлений чередуются с периодами относительного улучшения. Последствиями ревматоидного артрита является деградация суставного хряща, с последующей эрозией кости, приводящие к значительному разрушению сустава с потерей его функции. Кроме клиники деформирующего артрита, у 20% больных отмечаются внесуставные проявления заболевания.
Иммунологическое обследование особенно актуально на ранних стадиях болезни, когда серологическое обследование явлется единственным доступным методом объективизации клинических предположений Часто нетипичная клиническая картина в начале заболевания, например олигоартрит и отсутствие костных эрозий, несмотря на длительность жалоб пациента, а также тот факт, что применение активной терапии в дебюте заболевания может замедлить быстрое развитие деформаций суставов, делают лабораторные тесты чрезвычайно ценным инструментом дифференциальной диагностики в дебюте РА. Важно подчеркнуть, что корректный диагноз РА, поставленный на раннем этапе является основной проведения эффективной иммуносупрессивной терапии.
Ревматоидный фактор.
Дешевизна и доступность определения ревматоидного фактора (РФ) делают его первым серологическим тестом в обследовании пациентов с заболеваниями суставов. Выявление РФ в клинических лабораториях основано на использовании методов латекс-агглютинации и турбидиметрии. Хотя турбидиметрия представляет более чувствительный метод, однако ее сравнительно высокая чувствительность снижает специфичность обследования. Считаем целесообразным использовать в качестве скрининга латексный метод определения РФ, что значительно удешевляет обследование больных. При этом чувствительность латексного теста должна составлять не более 20-25 МЕ/мл. Положительные результаты латексных тестов может быть подтвержден количественными турбидиметрическими методами.Дополнительным методом серологической диагностики ревматоидного артрита является определение ревматоидного фактора (РФ) класса IgA, методом иммуноферментного анализа.
Отсутствие РФ при первом обследовании не исключает диагноза серонегативного РА. Однократное определение РФ на ранней стадии РА, принесшее отрицательный результат, недостаточно для того чтобы исключить ранний РА. Если диагноз РА подозревается или даже клинически подтвержден при отрицательном результате теста по определению РФ, требуются повторное определения его титра через 12 месяцев для определения серопозитивной формы этого заболевания. Этот срок приблизительно соответствует времени обновления пула плазматических клеток, способных синтезировать аутоантитела. Если же будет получен положительный результат, то нет реальных предпосылок повторять определение РФ с течением времени, если только не проводится биологическая терапия. В случае длительной ремиссии заболевания титры РФ снижаются ниже детектируемых. Надо отметить, что большое время полужизни сывороточного иммуноглобулина, а также постоянство иммунных ответов не позволяет использовать серологические маркеры для мониторинга течения заболевания, поэтому для мониторинга рекомендуется использовать острофазовые реактанты (СОЭ и/или СРБ), а также маркеры деструкции костной и хрящевой ткани.
Антицитруллиновые антитела.
В диагностике раннего РА необходимо всегда дополнять выявление РФ выявлением антицитруллиновых антител (АЦА). Среди антицитруллиновых антител наилучшими клинико-лабораторными параметрами обладают антитела к циклическому цитруллиновому пептиду (АЦЦП/anti-CCP) и антитела к модифицированному цитруллиннированному виментину (АМЦВ/anti-MCV) .
Наибольшей чувствительностью при обследовании пациентов всех категорий обладает совместное выявление ревматоидного фактора и антител к модифицированному цитруллинированному виментину (АМЦВ/MCV) — скрининг ревматоидного артрита. АМЦВ/MCV более чувствительный маркер ревматоидного артрита и чаще отмечается у пациентов РА серонегативных по ревматоидному фактору. При использовании сочетания РФ и анти-MCV у 85-95% больных РА удается выявить, по крайней мере, одну из разновидностей этих антител, а отсутствие всех маркеров свидетельствует об исключении диагноза РА на любом этапе этого заболевания.
Благодаря высокой специфичности наилучшими параметрами для ранней диагностики обладают антитела к циклическому цитруллиновому петиду( АЦЦП/ССР), так как их выявление имеет высокий фактор риска, т.е. его обнаружение повышает вероятность заболевания в 15 раз и обладает очень высоким предсказательным значением положительного результата. Рекомендуется использовать определение АЦЦП при проведении дифференциального диагноза ревматоидного артрита и других ревматических заболеваний (СКВ, псориатического артрита и других сернегативных артропатий, подагры).
Для оценки прогноза мы используем выявление антикератиновых антител (АКА). Ряд исследований, проведенных в нашей лаборатории, указывает на то, что АКА предсказывают развитие деструктивного процесса в суставах и пациенты с высокими титрами АКА требуют более активной иммуносупрессивной терапии. Высокоспецифическим маркером РА являются антиперинуклеарные антитела, также относящиеся к группе АЦА, выявляемые с помощью непрямой иммунофлюоресценции на субстрате пищевода крысы.
HLA генотипирование при ревматоидном артрите.
Нужно отметить, что РА ассоциирован с определенными аллелями HLA. HLA гены являются частью главного комплекса гистосовместимости и принимают активное участие в формировании иммунного ответа. Эти гены представлены в организме в гаплоидном наборе и, соответственно, могут являться гомо- или гетерозиготой. Для ранней диагностики РА необходимо выявление генов локуса HLA-DRB1. Наиболее значимыми среди них являются гены из групп DRB1*01 и DRB1*04, т.к. в экспрессированных молекулах содержат SE (общий эпитоп), презентирующий циклический цитруллинированный пептид клеткам иммунной системы. У больных РА, несущих гены группы DRB1*01, а именно аллельный ген DRB1*01:01, который составляют 86% от аллельной группы чаще развивается серопозитивный РА с быстрой деструкцией суставов. Наличие этого гена в геноме обязательно, однако недостаточно для развития серопозитивного РА у человека. Группа аллельных генов HLA-DRB1*01 отмечается у 29% пациентов с серопозитивным РА, сопровождающимся антителами к цитруллированным антигенам и ревматоидному фактору.
Степень деструкции хряща.
Определение концентрации хрящевого олигомерного белка (СОМР) позволяет оценить степень деструкции хряща. Сывороточная концентрация СОМР может использоваться как ранний и перспективный маркер ремоделирования суставного хряща. Высокие концентрации COMP указывают на быструю деструкцию хрящевой ткани при остеартрите и других хронических артритах. Исследование уровня СОМР следует использовать при мониторинге эффективности терапии ревматоидного артрита и остеоартроза. Одновременное определение маркеров хрящевой деструкции и воспаления позволяет проводить адаптировать терапию заболеваний суставов с учетом варианта поражения и скорости разрушения суставного хряща.
В качестве дифференциального диагноза диагноза РА часто рассматриваются серонегативные спондилоартропатии.
Серонегативные спондилоартропатии.
Антиген HLAB27 встречается у большинства лиц заболевших серонегативными спондилоартропатями. Эта разнородная группа заболеваний, в которую входят: анкилозирующий споднилит, псориатический артрит, реактивный артрит, синдром Рейтера, артрит при воспалительных заболеваниях кишечника, рецидивирующем увеите, ювенильном ревматоидном артрите. В клинической симптоматике всех этих заболеваний отмечается артрит периферических суставов и суставов осевого скелета, кроме того при этих заболеваниях обычно не находят ревматоидный фактор и другие аутоантитела, именно последний феномен позволяет назвать их «серонегативными». Совокупная встречаемость этих заболеваний в популяции составляет около 0,5%, что позволяет отнести их к часто встречающимся аутоиммунным заболеваниям.
Продукты генов системы HLA (человеческие лейкоцитарные антигены), расположенной на 6 хромосоме, захватывают и представляют чужеродные антигены в иммунной системе, что приводит к запуску специфических иммунных ответов. Гены этой системы отличаются разнообразием, что обеспечивает контроль всех иммунных ответов, в том числе аутоиммунных. Причиной индукции ряда аутоиммунных заболеваний являются определенные аллели (варианты) генов системы HLA, которые перекрестно презентируют экзогенные анитигены аутореактивным лимфоцитам.
Роль молекулы HLAB27 в патогенезе серонегативных спондилоартропатий окончательно не установлена. Основной гипотезой является «молекулярная мимикрия» антигенов, в результате которой молекулы HLA-B27 извращенно презентируют антигены ряда бактерий желудочно-кишечного или урогенитального трактов с развитием аутоиммунной реакции. Существует несколько аллельных изоформ HLAB27, однако все они с равной степенью связаны с серонегативными спондилоартропатиями.
Кристаллопатии и подагра.
Нарушение обмена пуриновых оснований в организме при подагре приводит к повышению содержания мочевой кислоты в крови и синовиальной жидкости. Острый приступ подагрического артрита сопровождается кристаллизацией солей с образованием кристаллов моноурата натрия. Прямое обнаружение кристаллов возможно при проведении исследования суставной жидкости. Тонкие игловидные кристаллы моноурата натрия могут быть расположены внутри и внеклеточно. При исследовании в поляризованном свете они могут быть идентифицированы благодаря характерному отрицательному двойному лучепреломлению.
Другой формой микрокристаллического артрита является псевдоподагра, которая сопровождается формированием кристаллов пирофосфата кальция. Кристаллы образуются под действием фермента нуклеозидтрифосфат пирофосфорилазы, который при остеоартрозе синтезируется в суставном хряще. В отличии от моноурата натрия, кристаллы пирофосфота кальция при пирофосфатной артропатии, толще и короче, ромбовидной формы и обладают положительным двойным лучепреломлением.
Документы
Серопозитивный и серонегативный ревматоидный артрит (РА)
РесурсСеропозитивный или серонегативный — это термин, используемый для описания наличия в вашей крови ревматоидного фактора (RF) и анти-CCP (или ACPA); два белка чаще встречаются у людей с
РаспечататьВведение
Диагноз любого заболевания обычно продвигается по четко определенному пути, который состоит из трех частей: история жалобы, анализы крови и, как правило, визуализация (рентген или сканирование).«Серопозитивный / серонегативный» — термин, обозначающий результаты анализов крови.
Что такое серопозитивный / серонегативный?
В ходе анализа крови, назначенного врачом для постановки диагноза ревматоидный артрит (РА), в крови проверяется наличие двух белков. Один из них называется ревматоидным фактором (РФ). Это очень старое, но испытанное и проверенное исследование, которое впервые было внедрено в ревматологию в 1940-х годах. Другой тест называется anti-CCP (или ACPA) и является более новым.Anti-CCP более чувствителен, чем RF, и может появиться намного раньше в ходе RA.
Что означают результаты теста?
Наличие любого из этих тестов может указывать на наличие RA. Однако серопозитивность — это только один из нескольких критериев, которые делают диагноз РА вероятным (некоторые другие критерии описаны в следующем разделе). Если присутствуют другие критерии диагноза, то серопозитивность является дополнительным решающим фактором.Положительный тест на анти-КПК незначительно сильнее положительного радиочастотного теста для постановки диагноза.
Означает ли положительный ревматоидный фактор или анти-ЦКП, что у вас должен быть РА?
Положительный результат теста на РФ или анти-КПК не означает, что у вас РА. Должны присутствовать и другие признаки, такие как симптомы боли и отека в суставах, поражение многих суставов воспалением, утренняя скованность суставов в течение более 45 минут, рентгеновское свидетельство характерного повреждения костей в суставах и внесуставных суставах. особенности RA (имеются в виду особенности, которые находятся вне суставов), такие как узелки.Другие анализы крови, обычно используемые перед диагностикой, включают СОЭ и СРБ, которые измеряют степень воспаления в суставах. Дополнительную информацию об исследованиях крови можно найти в нашей статье «Лабораторные тесты, используемые для диагностики и мониторинга ревматоидного артрита».
Сообщает ли мне этот тест, насколько серьезным может быть мой артрит?
Как правило, пациенты с серопозитивной реакцией на РФ и / или анти-ЦЦП с большей вероятностью имеют более тяжелый РА, но ни один из этих тестов не может точно предсказать будущее течение болезни у отдельного пациента.
Какие различия существуют между серопозитивными и серонегативными людьми?
Помимо серопозитивных пациентов с большей вероятностью развития более серьезного заболевания, у них также больше шансов иметь внесуставные осложнения (такие как узелки и васкулит — дополнительную информацию см. В отдельных статьях NRAS), чем у серонегативных пациентов. Пациенты, серонегативные по RF и анти-CCP, могут иметь разные формы воспалительного артрита, например, артрит, связанный с псориазом, или спондилоартропатию.
Влияет ли это на лекарства, которые подойдут мне?
Хотя эффективность большинства лекарств от РА не зависит от того, является ли кто-либо серопозитивным или серонегативным, данные свидетельствуют о том, что пациенты, которые являются серонегативными как по РФ, так и по анти-ЦЦП, не реагируют на ритуксимаб так же хорошо, как пациенты, которые являются серопозитивными по одному или обоим. .
Обновлено: 04.02.2019
Следующий отзыв: 01.02.2022
Подробнее
-
Что такое РА?
→Ревматоидный артрит — это аутоиммунное заболевание, а это означает, что такие симптомы, как боль и воспаление, вызваны иммунной системой, атакующей суставы.
Серопозитивный ревматоидный артрит: обзор и многое другое
Ревматоидный артрит (РА) — это хроническое, часто пожизненное аутоиммунное заболевание, которое в первую очередь поражает суставы. Наиболее распространенным типом РА является серопозитивный РА, когда у человека с РА обнаруживаются антитела к антициклическому цитруллинированному пептиду (анти-ЦЦП) и / или к ревматоидному фактору (РФ), которые могут идентифицировать заболевание.
Высокие уровни одного или обоих связаны с воспалением и повышением тяжести заболевания.По определению, у людей с серонегативным РА нет определяемых уровней анти-ЦЦП или РФ.
Серопозитивный РА не означает, что вы должны терять всякую надежду. Многие из текущих вариантов лечения могут позволить людям с РА — независимо от типа РА — замедлить прогрессирование болезни и наслаждаться хорошим качеством жизни.
RF и белки анти-CCP
Значительное количество людей с РА являются серопозитивными. Развитие РА, его тяжесть и серопозитивность зависят от ревматоидного фактора и белков против ЦЦП.Процент людей с РА, у которых будет положительный результат теста на ревматоидный фактор, составляет 70–90%.
RF — это белковые антитела, вырабатываемые иммунной системой, которые связаны с воспалением суставов. Высокие уровни RF обычно связаны с такими состояниями, как РА, но также встречаются и при других хронических заболеваниях. RF также может быть обнаружен у здоровых людей, а у людей с РА могут быть нормальные / отрицательные уровни RF.
Напротив, анти-CCP более специфичен для РА и может проявиться за много лет до того, как у вас появятся симптомы.Подобно RF-белкам, антитела против CPP связаны с воспалением в суставах и могут даже способствовать прямой атаке на ткани суставов. Сравнительное исследование, проведенное в 2014 году, показало, что антитела против CCP у 69% людей с РА.
Конкретные причины РА неизвестны, хотя исследователи предполагают, что РА связан с комбинацией генетических факторов и факторов окружающей среды. Наследственность серопозитивного РА составляет от 40 до 65%.
Серопозитивные симптомы РА
РА имеет определенный набор симптомов, связанных с ним, и они будут появляться и исчезать на протяжении всей вашей жизни.У вас будут периоды, когда активность заболевания и симптомы будут высокими, — так называемые обострения, — и периоды ремиссии, когда вы будете испытывать лишь несколько симптомов или совсем их не чувствовать.
Специфические симптомы РА могут включать:
- Боль и припухлость суставов, особенно кистей и стоп
- Несколько пораженных суставов
- Симметричная боль в суставах — поражены одни и те же суставы с обеих сторон тела.
- Скованность по утрам, которая длится 30 и более минут
- Ухудшение хряща и кости на рентгеновских снимках
- Развитие ревматоидных узелков — твердых комков под кожей возле суставов
Другие симптомы РА, которые также наблюдаются при других аутоиммунных заболеваниях и подобных состояниях, включают:
- Хроническая усталость
- Депрессия
- Анемия
- Мышечные боли
Исследование показывает, что у людей с серопозитивным РА симптомы обычно более тяжелые, чем у серонегативных, хотя это относится не ко всем.Результаты лечения могут быть не такими положительными, как при серонегативном РА.
У людей с серопозитивным РА выше вероятность развития осложнений заболевания, включая ревматоидный васкулит (воспаление кровеносных сосудов) и ревматоидное заболевание легких. У них также выше риск сопутствующих заболеваний РА, таких как сердечно-сосудистые заболевания и депрессия.
Руководство по обсуждению с врачом по ревматоидному артриту
Получите наше руководство для печати к следующему визиту к врачу, которое поможет вам задать правильные вопросы.
Отправить руководство по электронной почтеОтправить себе или любимому человеку.
Зарегистрироваться
Это руководство для обсуждения с доктором отправлено на адрес {{form.email}}.
Произошла ошибка. Пожалуйста, попробуйте еще раз.
Серопозитивный по сравнению с серонегативным
По данным Американского колледжа ревматологии, количество людей, страдающих РА, в США составляет около 1,3 миллиона человек. На самом деле это число не изменилось, но изменилось то, что количество людей с серопозитивным РА сократилось.
Анализ клиники Мэйо за 2019 год, опубликованный в журнале Annals of the Rheumatic Diseases, показывает, что с 1985 по 1994 год только 12 из каждых 100000 человек с РА были серонегативными (RF-отрицательными). А с 2005 по 2014 год это число выросло до 20 на каждые 100 000 человек.
Люди с серонегативным RA будут отрицательными на RF и анти-CCP белки. Их диагностируют на основании других критериев РА, таких как опухшие суставы и рентгенологические изменения суставов.
Исследование, опубликованное в 2016 году журналом Rheumatology , показывает, что 38% процентов людей с диагнозом РА являются серонегативными. Иногда люди с серонегативным РА остаются серопозитивными, особенно те, у кого чрезвычайно низкий уровень РФ или анти- КПК ..
Здесь исследователи обнаружили, что серонегативный RA может влиять на запястья, лодыжки и крупные суставы, в то время как серопозитивный RA не вызывает такого же разрушения этих суставов. Серопозитивный RA все еще может вызывать повреждение суставов и инвалидность, но серонегативный RA, похоже, влияет на определенные суставы чаще.
Многие эксперты считают, что у людей с серопозитивным РА симптомы заболевания более тяжелые. Однако некоторые случаи серонегативного ревматоидного артрита могут быть тяжелыми, как показано в отчете 2015 BMC Musculoskeletal Disorders .
Исследователи пришли к выводу, что необходимы дальнейшие исследования, чтобы лучше понять отдаленные результаты как серонегативного, так и серопозитивного РА. Кроме того, сравнительное исследование 2018 года, опубликованное PLoS One , показывает, что по сравнению с людьми с серопозитивным РА, люди с серонегативным РА начинают с более тяжелыми симптомами, но лучше реагируют на терапию.Кроме того, как серонегативный, так и серопозитивный типы могут иметь схожие рентгенологические повреждения.
Исследователи также отметили, что люди с серонегативным РА лучше реагируют на лечение, чем люди с серопозитивным РА, что может дать некоторое представление о том, почему у них может быть более тяжелое заболевание.
Лечение
Независимо от того, какой у вас тип РА, варианты лечения будут одинаковыми. Лечение будет направлено на снятие боли и воспаления и предотвращение повреждения суставов.Для обоих типов РА лечение включает комбинацию лекарств, изменение образа жизни, дополнительные методы лечения и хирургическое вмешательство.
Лекарство
Ваш врач может назначить одно или несколько из следующих лекарств, чтобы помочь справиться с вашими симптомами:
Изменения образа жизни
Образ жизни, такой как диета и упражнения, могут помочь вам справиться с серопозитивным РА. Соблюдение противовоспалительной диеты может помочь вам уменьшить количество обострений РА. Здоровая диета также может снизить риск других заболеваний, особенно тех, которые считаются сопутствующими РА.
Упражнения помогут сохранить подвижность суставов и укрепить мышцы. Спросите своего врача, как можно безопасно включить упражнения в свой план лечения РА.
Также рекомендуется не курить с RA. Курение связано с более тяжелым заболеванием при РА и может снизить эффективность некоторых методов лечения, которые вы принимаете для лечения РА. Это особенно важно для людей с серопозитивным РА, потому что они не реагируют на лечение, независимо от того, курят они или нет.
Дополнительные методы лечения
Ваш врач может порекомендовать вам физиотерапию и трудотерапию, чтобы научить вас упражнениям, которые помогут сохранить подвижность и гибкость суставов. Ваш терапевт также может посоветовать способы выполнения повседневных задач, которые не оказывают большого давления на ваши суставы.
Эрготерапевт может посоветовать вспомогательные устройства, чтобы вы не подвергали болезненные боли суставам. Сюда входят такие вещи, как трость, крючки для пуговиц, которые помогут вам одеться, или ричер, который поможет вам хватать предметы, не дотянувшись до них.
Хирургия
Если лекарства не могут предотвратить или замедлить повреждение костей и суставов, ваш врач может предложить операцию. Хирургия может помочь восстановить способность использовать сустав, уменьшить боль и улучшить функцию.
Слово Verywell
Серопозитивный ревматоидный артрит неизлечим, но эффективное лечение означает, что вы по-прежнему можете наслаждаться хорошим качеством жизни. Вам следует обратиться к врачу, как только вы начнете испытывать симптомы РА.Ранняя диагностика и лечение потенциально могут означать меньшее количество заболеваний суставов и снижение прогрессирования заболевания.
Сравнение серонегативного и серопозитивного ревматоидного артрита по некоторым клиническим характеристикам
Цель этого исследования — провести научный сравнительный анализ серонегативного и серопозитивного ревматоидного артрита (РА) с учетом некоторых клинических характеристик. Исследуемая группа состояла из серонегативных пациентов с РА с титрами ниже 1:64, определенными тестом Роуза-Ваалера, в то время как контрольную группу составили серопозитивные пациенты с РА с титрами 1:64 и выше.Все обследуемые принадлежали ко 2-му и 3-му функциональным классам согласно критериям ARA, были в возрасте от 25 до 60 лет (Xb = 49,96), с длительностью заболевания 1-27 лет (Xbox = 6,41). В дебюте заболевания наиболее часто поражались пястно-фаланговые (MCP) и проксимальные межфаланговые (PIP) суставы кистей рук, почти одинаково представленные в отношении серологического статуса и пола. При обследовании у серопозитивных пациентов чаще отмечалось воспаление периферических суставов кисти и стопы, но статистически значимым было только наличие ПИП кистей (chi2 = 15.63, р <0,01). Колени, голеностопные суставы и локти чаще поражались у серопозитивных пациентов, тогда как плечево-лопаточные, тазобедренные и крестцово-подвздошные суставы чаще поражались у серонегативных пациентов, но без значительной статистической разницы в отношении серологического статуса. Наличие пораженного PIP рук (chi2 = 9,96, p <0,01) и коленей (chi2 = 4,17, p <0,05) в зависимости от пола было статистически значимым у серопозитивных пациентов женского пола, а также наличие пораженного PIP руки (chi2 = 6.08, p <0,05) и шейных позвонков (chi2 = 6,00, p <0,05) у серопозитивных пациентов мужского пола. Были некоторые различия между группами в отношении пола в плюснефаланговых суставах (MTP), PIP стопы и других суставах, но без какой-либо статистической значимости. В обеих подгруппах статистически значимое преобладание было обнаружено в пораженном втором (chi2 = 20,85, p <0,01) и третьем (chi2 = 15,70, p <0,01) пальцах на уровне PIP рук и третьем пальце (chi2 = 6,52, p <0,05). уровня МКП.Указанные параметры не показали значительной статистической разницы в отношении серологического статуса и пола. У большинства пациентов имелись 1-4 деформации. В серопозитивной группе преобладали контрактуры коленного сустава, например выворот стопы, в то время как серонегативная группа имела больше деформаций типа «лебединая шея». Указанные параметры не показали значительной статистической разницы в отношении серологического статуса и пола. Увеличение продолжительности заболевания привело к увеличению количества деформаций, и эта разница была статистически значимой (t = 5.92, р <0,01). Линейная корреляция между этими двумя параметрами дала высокий положительный результат в целом (r = 0,49, p <0,01) и для групп отдельно, но без существенной статистической разницы в отношении серологического статуса. Длительность заболевания по типу деформаций была разной в обеих подгруппах: при более длительной продолжительности болезни преобладала «петля» со статистически значимой разницей у серопозитивных пациентов (t = 2,10, p <0,05), тогда как «петля» была преобладающей. отклонение малоберцовой кости »было преобладанием у серонегативных пациентов (t = 2.64, р <0,01).
Что такое двойной серопозитивный РА | ORENCIA® (абатацепт)
Ревматоидный артрит у взрослых (РА): ORENCIA ® (абатацепт) отпускается по рецепту. лекарство, которое уменьшает признаки и симптомы у взрослых с умеренной и тяжелой РА, включая тех, кому не помогли другие лекарства от РА.ОРЕНСИЯ может предотвратить дальнейшее повреждение ваших костей и суставов и может помочь ваша способность выполнять повседневные действия. Взрослым можно применять ORENCIA. отдельно или с другими препаратами для лечения РА, кроме ингибиторов Янус-киназы (JAK) или биологические модифицирующие заболевание противоревматические препараты (bDMARD), такие как опухоль антагонисты фактора некроза (TNF).
Одновременное применение ORENCIA с другими мощными иммунодепрессантами [например, bDMARD, Ингибиторы JAK] не рекомендуется.
Полиартикулярный юношеский идиопатический артрит (пЮИА): ОРЕНЦИЯ снижает признаки и симптомы у пациентов в возрасте 2 лет и старше с умеренным и тяжелый полиартикулярный ЮИА.ORENCIA можно использовать отдельно или с метотрексатом. (MTX).
Одновременное применение ORENCIA с другими мощными иммунодепрессантами [например, bDMARD, Ингибиторы JAK] не рекомендуется.
Псориатический артрит у взрослых (ПсА): ORENCIA ® (абатацепт) отпускается по рецепту. лекарство, уменьшающее признаки и симптомы у взрослых с активным псориазом. артрит (ПсА).У взрослых ORENCIA можно использовать отдельно или с другими препаратами для лечения ПсА.
Одновременное применение ORENCIA с другими мощными иммунодепрессантами [например, bDMARD, Ингибиторы JAK] не рекомендуется.
Клиническое ведение серонегативного и серопозитивного ревматоидного артрита: сравнительное исследование
Abstract
И ревматоидный фактор (RF), и антициклические цитруллинированные пептидные антитела (ACPA) связаны с плохими радиологическими результатами у пациентов с ревматоидным артритом (RA).В целом считается, что пациенты с РА, положительные по RF или ACPA (SPRA), имеют агрессивное течение болезни по сравнению с пациентами с серонегативным RA (SNRA). Однако связь между серопозитивностью и другими показателями тяжести заболевания, помимо радиологического результата, является спорной. В этом исследовании мы стремились сравнить клинические проявления и результаты лечения пациентов с SNRA и SPRA. В общей сложности был идентифицирован 241 пациент с диагнозом РА, ранее не получавшим БПРП, по критериям Американского колледжа ревматологии (ACR) 1987 года или критериям ACR / Европейской лиги против ревматизма (EULAR) 2010 года (40 с SNRA и 201 с SPRA).Мы исследовали показатели активности заболевания, включая СОЭ, СРБ, ВАШ пациента, 28 болезненных / опухших суставов (28 TJC, 28 SJC) и DAS28, а также радиологические исходы на исходном уровне, через 1 и 2 года после обычного лечения DMARD. Возраст, пол и продолжительность заболевания были одинаковыми между SNRA и SPRA. Однако исходные 28 TJC (4,7 ± 2,9 против 3,3 ± 2,7, p = 0,004), 28 SJC (4,3 ± 3,0 против 2,9 ± 2,3, p = 0,001) и DAS28 (5,1 ± 1,0 против 4,7 ± 1,0, p = 0,043) компоненты были значительно выше в SNRA, чем в SPRA.За 2 года аналогичного лечения БПВП все показатели активности заболевания значительно улучшились в обеих группах. Сравнение между популяциями, сопоставленными по исходной активности заболевания, показало, что ΔDAS28 через 1 год был выше в SNRA, чем в SPRA (-2,84 ± 1,32 против -3,70 ± 1,29, p = 0,037) в популяции с высокой активностью заболевания (DAS28-СОЭ> 5,1). ). Рентгенологические исходы на исходном уровне и через 1-2 года наблюдения были одинаковыми между двумя группами. В заключение, пациенты с SNRA проявляли более активное заболевание на исходном уровне, но показали лучший ответ на лечение по сравнению с SPRA.SNRA не является доброкачественным подтипом РА.
Образец цитирования: Choi S-T, Lee K-H (2018) Клиническое ведение серонегативного и серопозитивного ревматоидного артрита: сравнительное исследование. PLoS ONE 13 (4): e0195550. https://doi.org/10.1371/journal.pone.0195550
Редактор: Такума Като, Мие Дайгаку, ЯПОНИЯ
Поступила: 1 декабря 2017 г .; Дата принятия: 23 марта 2018 г .; Опубликовано: 6 апреля 2018 г.
Авторские права: © 2018 Choi, Lee.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Авторы не получали специального финансирования на эту работу.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Ревматоидный фактор (RF) — это аутоантитела, которые впервые были обнаружены при ревматоидном артрите (RA) и использовались в диагностике RA. В последнее время большое внимание привлекли антициклические цитруллинированные пептидные антитела (ACPA) как ценные маркеры в диагностике и прогнозировании прогноза РА [1]. Он так же чувствителен, как РФ, но гораздо более специфичен, чем РФ, в диагностике РА [2]. Кроме того, он играет важную роль в патогенезе РА и в значительной степени связан с рентгенологическим прогрессированием [3].В этом смысле RF и ACPA считаются плохими прогностическими маркерами РА и используются в качестве доказательства для обоснования интенсивного лечения серопозитивных пациентов с РА (SPRA) [4]. Однако неясно, проявляют ли пациенты с SPRA худшее течение заболевания по сравнению с пациентами с серонегативным RA (SNRA) по другим показателям активности заболевания, кроме радиологического исхода. В исследованиях сообщалось о большей тяжести заболевания и нарушении функции у пациентов с СПРА как во время проявления заболевания, так и после лечения модифицирующими заболевание противоревматическими препаратами (DMARD) [5, 6].Напротив, в других исследованиях сообщалось, что пациенты с SNRA имели более тяжелую воспалительную активность по сравнению с SPRA, оцениваемым клинически и с помощью ультразвука [7], и что пациенты с SNRA показали худший рентгенологический результат по сравнению с SPRA [8]. Это расхождение может быть связано с различиями в отобранных популяциях пациентов, критериях включения и показателях активности заболевания среди исследований. В этом исследовании мы изучили и сравнили клинические проявления и результаты лечения пациентов с диагнозом SPRA и SNRA в реальных условиях.
Материалы и методы
Исследуемая популяция
Мы идентифицировали в общей сложности 241 пациента с РА, ранее не получавшим БПВП, с диагнозом «РА», который был поставлен в соответствии с критериями Американского колледжа ревматологов (ACR) 1987 г. [9] или критериями ACR / Европейской лиги против ревматизма (EULAR) 2010 г. [10], которые посещали ревматологию. клиника в больнице университета Чунг-Анг в Сеуле, Корея и больнице Ильсан университета Донгук в Кояне, Корея, с марта 2011 г. по май 2017 г. Из анализа были исключены пациенты со следующими состояниями: 1) пациенты моложе 18 лет; 2) пациенты, которые уже принимали БПВП на момент первого визита; и 3) пациенты с недифференцированным артритом, не отвечающие критериям РА 1987 или 2010 года.После поиска в электронных медицинских картах мы нашли в общей сложности 624 пациента с кодами по МКБ-10 для РА. Среди этих пациентов 260 проходили терапию БПВП во время первого визита, у 80 был диагностирован недифференцированный артрит, а у 43 не был диагностирован воспалительный артрит. Из оставшихся 241 пациента 40 были отрицательными как по РФ, так и по ACPA (группа SNRA), а 201 был положительным по RF или ACPA (группа SPRA). Блок-схема этого исследования представлена на рис. 1. Все пациенты лечились обычными DMARD ревматологами в каждой больнице.
Сбор данных
Данные пациентов с SNRA и SPRA сравнивались следующим образом: 1) исходные характеристики пациентов, такие как возраст, пол и продолжительность симптомов; 2) показатели активности заболевания, включая скорость оседания эритроцитов (СОЭ), С-реактивный белок (СРБ), количество опухших и болезненных суставов в 28 суставах (28 SJC и 28 TJC соответственно), долю пациентов с показателем активности заболевания — 28 с Ремиссия СОЭ (DAS28-СОЭ) (DAS28 <2,6) и DAS28-СОЭ, измеренные на исходном уровне, через 1 и 2 года после лечения БПВП.В случае DAS28-ESR также были получены различия от исходного уровня до 1 и 2 лет; 3) рентгенографическая оценка суставов на исходном уровне на предмет сужения суставной щели или эрозии кости и определение прогресса пациента радиологически путем сравнения исходных и последующих рентгенограмм в имеющихся случаях; 4) подробный рецепт на лекарства.
Статистический анализ
Используя SPSS версии 20.0 (IBM Corp., Армонк, Нью-Йорк, США), мы использовали независимый двухвыборочный t-критерий для сравнения непрерывных переменных с нормальным распределением.U-критерий Манна-Уитни использовался для сравнения непрерывных переменных с ненормальным распределением. Тест хи-квадрат использовался для оценки связи между категориальными переменными. Показатели активности заболевания, оцененные за двухлетний период, сравнивались с помощью линейной смешанной модели. Во всех анализах значение p <0,05 считалось статистически значимым.
Этика
Это исследование было одобрено институциональным наблюдательным советом (IRB) больницы Ильсан университета Донгук и университетской больницы Чунг-Анг.Информированное согласие было отклонено IRB из-за ретроспективного характера этого исследования.
Результаты
Исходная характеристика пациента
Как показано в таблице 1, пациенты с SPRA и SNRA были схожи по возрасту, полу и продолжительности заболевания, хотя пациенты с SNRA имели более короткую продолжительность заболевания. RF и ACPA были положительными более чем у 95% пациентов с SPRA.
В то время как большинство пациентов с СПРА (200/201) соответствовали критериям 2010 года для РА, большинство пациентов с СПРА (39/40) были диагностированы в соответствии с критериями 1987 года.Активность заболевания измеряется на исходном уровне, 28 TJC (4,7 ± 2,9 против 3,3 ± 2,7, p = 0,004), 28 SJC (4,3 ± 3,0 против 2,9 ± 2,3, p = 0,001) и DAS28-ESR (5,1 ± 1,0 против 4,7 ± 1,0, p = 0,043) были значительно выше у пациентов с SNRA по сравнению с пациентами с SPRA. Этот результат стал более заметным, когда эти значения сравнивались между пациентами с SNRA, удовлетворяющими критериям ACR / EULAR 2010 г., и пациентами с SPRA (таблица 2)
.Таблица 2. Сравнение подгрупп исходной активности заболевания среди пациентов с SNRA, сгруппированных в соответствии с различными диагностическими критериями (критерии ACR 1987 vs.2010 ACR / EULAR критерии) и пациентов с SPRA.
https://doi.org/10.1371/journal.pone.0195550.t002
Более того, уровни CRP были значительно выше в SNRA, удовлетворяющем критериям 2010 года. Напротив, не было значительных различий в исходных показателях активности заболевания среди пациентов с SNRA, удовлетворяющих только критериям ACR 1987 года, и пациентов с SPRA (таблица 2). Сравнение пациентов с SNRA, удовлетворяющих только критериям 1987 года, и пациентов, удовлетворяющих критериям 2010 года, показало аналогичные результаты, демонстрирующие более активное заболевание у пациентов, соответствующих критериям ACR / EULAR 2010 года (данные не показаны).
Исходы лечения
За два года лечения БПВП все показатели активности заболевания значительно улучшились по сравнению с исходным уровнем в двух группах (таблица 3 и рис. 2).
Рис. 2. Показатели активности заболевания (СОЭ, СРБ, 28TJC, 28SJC и DAS28-СОЭ) улучшились в обеих группах за 2 года лечения БПВП.
Ящичковые диаграммы для каждого показателя активности заболевания на исходном уровне, через 1 год и 2 года после него отображаются для каждой группы (SNRA и SPRA). Все показатели улучшились по сравнению с исходным уровнем в обеих группах после лечения БПВП.DMARD: модифицирующий заболевание противоревматический препарат, СОЭ: скорость оседания эритроцитов, СРБ: С-реактивный белок, TJC: количество болезненных суставов, SJC: количество опухших суставов, DAS28-СОЭ: оценка активности заболевания 28 СОЭ.
https://doi.org/10.1371/journal.pone.0195550.g002
Хотя исходная активность заболевания была выше в группе SNRA, пациенты с SNRA показали лучший ответ на лечение (ΔDAS28 от исходного уровня через 1 год в SNRA -2,9 ± 1,2 по сравнению с SPRA -2,2 ± 1,8, p = 0.002), которые дали аналогичные результаты лечения в 2 группах в конце периода наблюдения. Чтобы скорректировать различную исходную активность заболевания в обеих группах, сравнение ΔDAS28 в популяциях, сгруппированных по исходной активности заболевания, определенной по шкале DAS28-СОЭ (высокая активность заболевания> 5,1, умеренная> 3,2, ≤5,1, низкая ≥2,6, ≤3,2 ) также был исполнен. В популяции с высокой активностью заболевания [n = 90 (SPRA 72, SNRA 18)], ΔDAS28 через 1 год был значительно выше у пациентов с SNRA по сравнению с пациентами с SPRA (SPRA vs.SNRA -2,84 ± 1,32 против -3,70 ± 1,29, p = 0,037), тогда как в популяции с умеренной активностью заболевания [n = 138 (SPRA 116, SNRA 22)] показало только тенденцию к увеличению у пациентов с SNRA (SPRA vs. SNRA — 1,97 ± 0,95 против -2,40 ± 0,85, p = 0,097). Сравнение среди популяции с низкой активностью заболевания было невозможно, потому что ни один из пациентов с SNRA не был с низкой активностью заболевания. Межгрупповые различия за 2 года не были значимыми в значениях СОЭ, СРБ и DAS28, в то время как значимые для 28 TJC ( p = 0.019) и 28 SJC ( p = 0,014). Частота ремиссии DAS28-ESR была одинаковой между двумя группами (1 год: SNRA 21/29 (72,4%) по сравнению с SPRA 95/158 (60,1%), p = 0,298, 2 года: SNRA 14/19 (73,7%) ) против 67/113 (59,3%), р = 0,311). Рентгенологические результаты, оцениваемые с помощью простых рентгенограмм пораженных суставов на исходном уровне и при последующем наблюдении, также были схожими. Не было обнаружено значительных различий между двумя группами в отношении доли пациентов с сужением или эрозией суставной щели на исходном уровне (SNRA 5/21 (23.8%) по сравнению с SPRA 48/182 (26,4%), p = 1,0) и в доле пациентов с радиологическим прогрессированием (SNRA 1/4 (25%) по сравнению с SPRA 23/51 (45,1%), p = 0,624, интервал наблюдения SNRA 26,7 ± 19,0 по сравнению с SPRA 34,6 ± 18,8, p = 0,423).
Подробная информация о лечении РА
Мы исследовали детали лечения БПВП, чтобы определить, приводили ли подобные результаты к аналогичному лечению (таблица 4).
Доля пациентов, которым была начата комбинированная терапия БПВП, начальная доза преднизолона и общее количество использованных БПВП были одинаковыми в обеих группах.Кроме того, обе группы достигли своей первой ремиссии при одинаковых дозах и продолжительности лечения метотрексатом. Доля пациентов, принимавших биологические агенты, и скорость снижения дозы преднизолона через 1 и 2 года существенно не различались между двумя группами.
Обсуждение
Это исследование продемонстрировало, что пациенты с SNRA проявляли более активное заболевание при поступлении, с лучшим ответом на лечение DMARD по сравнению с пациентами SPRA. Обычное лечение БПВП дало аналогичные результаты в 2 группах.В это исследование были включены пациенты из клинической практики ревматологии. Мы не оговаривали каких-либо критериев включения, однако мы отбирали только пациентов, ранее не получавших DMARD, которые впоследствии получали лечение в соответствии с текущими согласованными рекомендациями по лечению РА. Мы считаем, что это исследование демонстрирует реальные клинические проявления и результаты лечения как SNRA, так и SPRA.
В этом исследовании пациенты с SNRA проявляли более активное заболевание на исходном уровне по сравнению с пациентами с SPRA.Частично это можно объяснить тем фактом, что 99,5% пациентов с СПРА соответствовали критериям 2010 ACR / EULAR, тогда как только 27,5% пациентов с СПРА соответствовали. Критерии ACR / EULAR 2010 года придают большое значение серологическим маркерам для выявления пациентов с РА на ранней стадии заболевания. Следовательно, серопозитивным пациентам с поражением только одного или двух суставов можно было поставить диагноз РА на основании критериев ACR / EULAR 2010 года, даже если они не соответствовали критериям ACR 1987 года. Это подтверждается выводом нашего исследования о том, что количество опухших и болезненных суставов было значительно больше у пациентов с SNRA, соответствующих критериям 2010 года, по сравнению с пациентами с SPRA.В соответствии с нашими результатами, Nordberg и др. Сообщили, что пациенты с SNRA показали большую воспалительную активность по сравнению с пациентами с SPRA, и эти различия отражают большее количество пораженных суставов, необходимых для пациентов с SNRA, чтобы соответствовать критериям ACR / EULAR 2010 [7]. Barra и др. Также сообщили, что пациенты с серонегативным артритом проявляли большую тяжесть активности заболевания по сравнению с серопозитивными пациентами [11]. Напротив, несколько предыдущих исследований, в которых сообщалось о подобном или более тяжелом заболевании у пациентов с СПРА [5, 12, 13], что частично может быть связано с различиями в характеристиках когорты, из которой были набраны пациенты.
Существенная разница в доле пациентов, соответствующих каждому критерию классификации (критерии ACR 1987 г. и критерии ACR / EULAR 2010 г.) между пациентами с SNRA и SPRA, подчеркивает ценность обоих критериев при диагностике РА, особенно у серонегативных пациентов. Хотя критерии ACR / EULAR 2010 года позволяют раннее выявление и диагностику РА в ходе заболевания, они в значительной степени зависят от серологии и могут не выявить некоторых серонегативных пациентов, как показано в этом исследовании. Этот результат может также побудить врачей первичного звена чаще направлять серонегативных пациентов с тяжелым заболеванием, одновременно направляя серопозитивных пациентов, независимо от тяжести заболевания [14].
пациентов с SNRA, особенно с высокой исходной активностью заболевания, показали лучший ответ на лечение с большим снижением значений DAS28-ESR по сравнению с пациентами с SPRA, что согласуется с предыдущими исследованиями [5, 12, 13]. Этот результат можно объяснить продолжительностью заболевания у пациентов с SNRA в этом исследовании, которая была численно короче, чем у пациентов с SPRA, хотя и не была статистически значимой. Хорошо известно, что ранняя диагностика и лечение связаны с хорошими результатами лечения РА.
Радиологические исходы на исходном уровне и при последующем наблюдении были одинаковыми между двумя группами в этом исследовании. Хотя последующие рентгенограммы были получены только у нескольких пациентов в этом исследовании, пациенты с SPRA и SNRA показали сходные радиологические повреждения на исходном уровне. Это говорит о том, что пациенты с SNRA, если их не лечить должным образом, могут иметь такой же риск эрозивного заболевания, как и пациенты с SPRA. В соответствии с этим выводом, в нескольких недавних исследованиях сообщалось, что пациенты с SNRA имели сходное или даже более эрозивное заболевание на исходном уровне по сравнению с пациентами с SPRA [7, 11], в то время как несколько более ранних исследований сообщали о связи серопозитивности с эрозивным заболеванием [5, 12, 13] , 15].
Хотя пациенты с SNRA показали лучший ответ на лечение в этом исследовании, у них было более активное заболевание и сопоставимые радиологические повреждения на исходном уровне по сравнению с пациентами с SPRA. Кроме того, обе группы получали аналогичное лечение и достигли аналогичных результатов через 1 и 2 года независимо от статуса аутоантител. Следовательно, SNRA не может быть доброкачественным подтипом RA, по крайней мере, на ранней стадии заболевания, и важно не недооценивать клиническое бремя SNRA, несмотря на недавние рекомендации по лечению, оправдывающие более раннее интенсивное лечение пациентов с SPRA по сравнению с пациентами с SNRA [16].
У нашего исследования есть несколько ограничений. Во-первых, это исследование было ретроспективным по своей природе с риском систематической ошибки отбора. Во-вторых, количество пациентов с SNRA было сравнительно небольшим из-за небольшой доли SNRA при РА. Однако доля пациентов с SNRA среди пациентов с РА в этом исследовании была аналогична доле пациентов с SNRA в целом, что позволяет предположить, что это исследование отражает реальный сценарий. Наконец, рентгенограммы не оценивались с помощью утвержденного и стандартного метода, потому что рентгенограммы обычно делались только в пораженных суставах.Во многих случаях отсутствовали рентгенограммы, необходимые для стандартных инструментов оценки, таких как шкала Шарпа ван дер Хейде. Последующие рентгенограммы были доступны только у нескольких пациентов, что может увеличить риск систематической ошибки и снизить возможность обобщения.
Заключение
Пациенты с SNRA имеют более активное заболевание и аналогичные рентгенологические повреждения при обращении по сравнению с пациентами с SPRA. Хотя пациенты с SNRA показали лучший ответ на лечение, врачи должны знать о значительном клиническом бремени SNRA, особенно в начале заболевания.
Ссылки
- 1. Уайтинг П.Ф., Смидт Н., Стерн Дж. А., Харборд Р., Бертон А., Берк М. и др. Систематический обзор: точность антител к цитруллинированным пептидам для диагностики ревматоидного артрита. Ann Intern Med. 2010. 152: 456–64. pmid: 20368651
- 2. Finckh A, Liang MH. Антициклические цитруллинированные пептидные антитела в диагностике ревматоидного артрита; байес рассеивает дымку. Ann Intern Med. 2007. 146: 816–7. pmid: 17548414
- 3.Meyer O, Labarre C, Dougados M, Goupille P, Cantagrel A, Dobois A, et al. анализы антицитруллинированных белков / пептидных антител при раннем ревматоидном артрите для прогнозирования пятилетних радиографических повреждений. Ann Rheum Dis. 2003. 62: 120–6. pmid: 12525380
- 4. Смолен Дж. С., Ландеве Р., Бридвелд ФК, Буч М., Бурместер Дж., Дукадос М. и др. Рекомендации EULAR по лечению ревматоидного артрита с помощью синтетических и биологических противоревматических препаратов, модифицирующих болезнь: обновление 2013 г.Энн Рум Дис, 2014; 73: 492–509. pmid: 24161836
- 5. Фаррагер Т.М., Лант М., Плант Д., Банн Д.К., Бартон А., Симмонс Д.П. Преимущество раннего лечения пациентов с воспалительным полиартритом антителами к циклическому цитруллинированному пептиду по сравнению с пациентами без антител. Arthritis Care Res (Хобокен). 2010; 62: 664–75.
- 6. Katchamat W, Koolvisoot A, Aromdee E, Chiowchanwesawakit P, Muengchan C. Связь ревматоидного фактора и антител к цитруллинированному пептиду с прогрессированием заболевания и результатами лечения у пациентов с ревматоидным артритом.Rheumatol Int. 2015; 35: 1693–9. pmid: 253
- 7. Nordberg LB, Lilegraven S, Lie E, Aga AB, Olsen IC, Hammer HB, et al. Пациенты с серонегативным РА имеют более выраженную воспалительную активность по сравнению с пациентами с серопозитивным РА в исходной когорте пациентов, ранее не получавших БПВП, классифицированных в соответствии с критериями ACR / EULAR 2010 года. Ann Rheum Dis. 2017; 76: 341–5. pmid: 27094444
- 8. Хэн Ю., Чжоу В., Чжан З.Л. Сравнительное исследование разнообразия клинических признаков между серонегативными и серопозитивными пациентами с ревматоидным артритом.Rheumatol Int 2012; 32: 3897–901. pmid: 22198665
- 9. Арнетт Ф.К., Эдворти С.М., Блох Д.А., МакШейн Д.Д., Фрис Дж.Ф., Купер Н.С. и др. Американская ассоциация ревматизма 1987 г. пересмотрела критерии классификации ревматоидного артрита. Rheum артрита. 1988. 31: 315–24. pmid: 3358796
- 10. Алетаха Д., Неоги Т., Силман А.Дж., Фуновиц Дж., Фелсон Д.Т., Бингхэм СО 3-й и др. Критерии классификации ревматоидного артрита 2010 года: совместная инициатива Американского колледжа ревматологии / Европейской лиги против ревматизма.Arthritis Rheum, 2010; 62: 2569–81. pmid: 20872595
- 11. Барра Л., Папа Дж. Э., Орав Дж. Э., Буар Дж., Харауи Б., Хитчон С. и др. Прогноз серонегативных пациентов в большой проспективной когорте пациентов с ранним воспалительным артритом. J Rheumatol. 2014; 41: 2361–9. pmid: 25274884
- 12. Kastbom A, Strandberg G, Lindroos A, Skogh T. Тест на антитела к CCP позволяет прогнозировать заболевание в течение 3 лет при раннем ревматоидном артрите (шведский проект TIRA). Энн Рум Дис 2004; 63: 1085–9.pmid: 15308517
- 13. Форслинд К., Альмен М., Эберхард К., Хафстром И., Свенссон Б., Исследовательская группа БАРФОТ. Прогнозирование радиологического исхода при раннем ревматоидном артрите в клинической практике: роль антител к цитруллинированным пептидам (анти-ЦЦП). Энн Рум Дис 2004; 63: 1090–5. pmid: 15308518
- 14. Миллер А., Махтани К.Р., Уотерфилд М.А., Тиммс А., Мисбах С.А., Лукмани Р.А. Полезен ли ревматоидный фактор в первичной медико-санитарной помощи? Ретроспективное кросс-секционное исследование. Clin Rheumatol 2013; 32: 1089–93.pmid: 23515604
- 15. Нелл В.П., Махольд К.П., Штамм Т.А., Эберл Г., Хайнцль Х., Уффманн М. и др. Профилирование аутоантител как инструмент ранней диагностики и прогноза ревматоидного артрита. Энн Рум Дис 2005; 64: 1731–6. pmid: 15878904
- 16. Smolen JS, Landewe R, Bijlsma J, Burmmester G, Chatzidionysiou K, Dougados M, et al. Рекомендации EULAR по лечению ревматоидного артрита с помощью синтетических и биологических противоревматических препаратов, модифицирующих болезнь: обновление 2016 г.Ann Rheum Dis. 2017; 76: 960–77. pmid: 28264816
Серонегативный ревматоидный артрит: что нужно знать
2. Наличие или отсутствие RF или ACPA не влияет на диагноз РА
Тестирование на ревматоидный фактор у людей с подозрением на ревматоидный артрит было популяризировано в 1960-х годах, и Специалисты до сих пор не до конца понимают точную связь между этими факторами и развитием болезни. RF может быть положительным при нескольких заболеваниях, таких как гепатит C, эндокардит и множественная миелома.
«Ревматоидный фактор явно играет роль в том, насколько серьезным может быть ревматоидный артрит», — говорит Джон Дж. Куш, доктор медицины, профессор внутренней медицины и ревматологии Юго-западного медицинского центра Юго-Западного университета в Далласе. Другой анализ крови проверяет ACPA, который может быть более тесно связан с развитием заболевания, чем RF. Исследование, опубликованное в журнале Autoimmunity Reviews в июле 2016 года, показало, что антитела к ACPA представляют собой независимый фактор риска развития РА. Наличие ACPA предполагает наличие генетического фактора риска заболевания, но не обязательно, чтобы какое-либо антитело присутствовало в крови для диагностики серонегативного РА.
СВЯЗАННЫЙ: 6 фактов о ревматоидном артрите, которые сложно объяснить или понять
3. Серонегативный РА стал более распространенным в последние годы
Согласно CreakyJoints, поддержке, обучению, защите и защите интересов Организация для людей, живущих с артритом и ревматическими заболеваниями, большинство пациентов с ревматоидным артритом являются серопозитивными. Но хотя у вас гораздо меньше шансов получить диагноз серонегативного типа заболевания, согласно исследованию, опубликованному в мартовском выпуске Annals of the Rheumatic Diseases , эти цифры растут.Между 1985 и 1994 годами только 12 из 10 000 человек с РА были серонегативными. В период с 2005 по 2014 год это число увеличилось до 20 из 10 000.
4. Люди с серонегативным РА часто имеют разные симптомы
Общепринято считать, что у серопозитивных пациентов симптомы более тяжелые, но недавние исследования показывают, что разница между двумя формами заболевания может быть больше связана с суставами. пострадали, чем с серьезностью симптомов РА. В отчете, опубликованном в июне 2016 года в журнале BMC Musculoskeletal Disorders , было обнаружено, что необходимы дальнейшие исследования, чтобы лучше понять долгосрочные результаты пациентов с серонегативным РА.«Мой опыт показывает, что, хотя симптомы схожи, серонегативных пациентов лечить труднее», — говорит Винисиус Домингес, доктор медицины, ревматолог из Дейтона-Бич, Флорида, и медицинский советник CreakyJoints.
5. Серонегативный RA может стать серопозитивным в будущем
Маркеры ревматоидного артрита со временем могут измениться с отрицательных на положительные, поскольку у многих людей с серонегативным ревматоидным артритом начинают вырабатываться антитела к RF или ACPA.«Это случается, но не так часто», — говорит доктор Домингес. Доктор Куш говорит, что у людей с серонегативным ревматоидным артритом может развиться RF или ACPA в течение первых двух лет после постановки диагноза.
СВЯЗАННЫЙ: Развенчание мифов о ревматоидном артрите
6. Серонегативный ревматоидный артрит не нуждается в лечении иначе, чем серопозитивный
Доступные варианты лечения не различаются независимо от того, какая форма заболевания у вас имеют.«Независимо от того, поставлен ли вам отрицательный или положительный диагноз, будьте агрессивны в лечении и опережайте болезнь», — советует Куш. В любом случае цель лечения — уменьшить боль и замедлить или предотвратить прогрессирование. «Целью является как можно более ранняя ремиссия», — говорит он.
Стандартная медикаментозная терапия на ранних стадиях заболевания включает нестероидные противовоспалительные препараты, такие как ибупрофен (Адвил или Мотрин) или Целебрекс (целекоксиб) для облегчения симптомов, а также класс препаратов, известных как противоревматические препараты, модифицирующие заболевание (DMARD), которые могут помогает изменить течение болезни, — говорит Домингес.БПВП включают метотрексат (Trexall, Rheumatrex, Otreup, Resuvo) и гидроксихлорохин (Plaquenil). В более тяжелых случаях могут быть прописаны более сильные препараты, известные как биопрепараты.
7. Серонегативный RA не может быть правильным диагнозом
Согласно Cush и Domingues, небольшой процент людей с серонегативной формой RA будет хорошо лечиться и войдет в ремиссию, а у других будет тяжелое заболевание. и требуются лекарства. А третьи не поддаются традиционному лечению, возможно, потому, что у них вообще нет РА.Состояние спондилоартрита, которое часто поражает позвоночник, иногда ошибочно принимают за серонегативный ревматоидный артрит.
8. Новые симптомы могут изменить диагноз
В конце концов, у людей с серонегативным заболеванием может быть диагностировано совсем другое заболевание, по данным Arthritis Foundation. Если, скажем, у человека с диагнозом серонегативный РА появляется кожная сыпь, его диагноз может измениться на псориатический артрит. Другие изменения или новые результаты анализов могут привести к новому диагнозу хронической подагры или остеоартрита.«Самое важное при посещении ревматолога — это определить, есть ли у вас воспалительный артрит или механический артрит, при этом для его лечения мало что можно сделать», — говорит Домингес.
9. Невозможно предсказать будущую тяжесть серонегативного RA
Прогнозирование того, как какое-либо заболевание может прогрессировать, чрезвычайно сложно. Независимо от того, поставлен ли вам серонегативный или серопозитивный диагноз, нет определенных ожиданий относительно того, как та или иная форма заболевания будет проявляться у человека.«Неважно, какой у вас тип, поскольку вы относитесь к ним одинаково», — говорит Домингес.
СВЯЗАННЫЙ: 5 предупреждающих знаков об ухудшении ревматоидного артрита
10. Серонегативный РА иногда связан с более высоким уровнем воспаления, чем серопозитивный
В европейском исследовании 234 человек, у которых были оба типа Согласно исследованию, опубликованному в январе 2017 года в журнале Annals of the Rheumatic Diseases , ревматоидный артрит, симптомы которого наблюдались менее двух лет, у пациентов с серонегативным RA был более высокий уровень воспаления и больше поражений суставов.
Сравнение течения заболевания у пациентов с серонегативным и серопозитивным ревматоидным артритом, удовлетворяющих критериям классификации ACR / EULAR 2010 г., в условиях «лечение до цели»: 2-летние данные исследования ARCTIC
Ключевые сообщения
Что уже известно о эта тема?
-
Серонегативный ревматоидный артрит (РА) считается менее тяжелым заболеванием, чем серопозитивный РА, с меньшим радиографическим повреждением.
-
Недавние исследования показывают, что применение критериев классификации РА 2010 г., в которых большое внимание уделяется серологическому статусу, приводит к более высокой воспалительной активности у серонегативных пациентов по сравнению с серопозитивными пациентами на момент постановки диагноза.
Что добавляет это исследование?
-
Активность заболевания, частота ремиссий и рентгенологическое прогрессирование были сходными у пациентов с серонегативным и серопозитивным РА через 2 года наблюдения.
-
Ответ на лечение у серонегативных пациентов был медленнее, чем у серопозитивных, хотя все пациенты лечились по одному и тому же алгоритму.
Как это может повлиять на клиническую практику?
Введение
Ревматоидный артрит (РА) — это аутоиммунное заболевание суставов, потенциально приводящее к инвалидности.1 РА в настоящее время классифицируется как серопозитивный или серонегативный в зависимости от наличия или отсутствия ревматоидного фактора (RF) и антицитруллинированных белковых антител (ACPA), и серологический статус стал важным для диагностики, прогнозирования и принятия решений о лечении. Считалось, что серонегативный РА представляет собой менее тяжелую подгруппу заболевания, чем серопозитивный РА, с меньшими рентгенографическими повреждениями. 2–6 Было высказано предположение, что серонегативных пациентов следует лечить менее агрессивно, чем серопозитивных пациентов, что также отражено в обновленной версии 2016 г. Рекомендации по лечению Европейской лиги против ревматизма (EULAR).7 8
Внедрение критериев классификации РА, разработанных Американским колледжем ревматологов (ACR) / EULAR 2010 г., переопределило популяцию пациентов, включая классификацию серонегативных пациентов. Ранний РА, отвечающий новым критериям классификации, мы обнаружили, что серонегативные пациенты имели заметно более высокую воспалительную активность на момент постановки диагноза по сравнению с серопозитивными пациентами.10 Основываясь на данных последующего наблюдения в этой когорте, мы стремились изучить течение заболевания у серонегативных пациентов с ранним РА, удовлетворяющих критериям 2010 ACR / EULAR, по сравнению с серопозитивными пациентами.
Методы
Пациенты и дизайн исследования
Пациенты с РА, соответствующие критериям классификации ACR / EULAR 2010 года, были включены в исследование ARCTIC (идентификатор ClinicalTrials.gov NCT01205854) .11 Все пациенты имели длительность симптомов менее 2 лет и ранее не получали DMARD. с показанием к лечению БПАРП.Мы стратифицировали пациентов как серопозитивные (RF + (IgM или IgA), ACPA + или оба) или серонегативные (как RF–, так и ACPA–). Пациенты были рандомизированы 1: 1 в соответствии со стратегией лечения и назначения с ультразвуковым исследованием или без него для принятия решения о лечении и совместных инъекциях во время последующего наблюдения. В обеих руках применялся один и тот же алгоритм эскалации DMARD, а воспаленные суставы лечили внутрисуставными глюкокортикоидами (триамцинолон гексацетонид). Пациенты были обследованы при 13 посещениях в течение 24 месяцев. Данные из двух стратегических групп были объединены и проанализированы вместе для текущего исследования, так как клинические и рентгенологические результаты были схожими в двух стратегических группах через 2 года.11 Исследование было одобрено региональным этическим комитетом, и все пациенты предоставили письменное информированное согласие.
Сбор данных
Сбор данных включал демографические данные, скорость оседания эритроцитов (мм / час), C-реактивный белок (мг / л), суставной индекс Ричи, количество опухших суставов (SJC), общую оценку пациента и врача. активность заболевания по визуальным аналоговым шкалам 0–100 мм, показатели исходов, сообщаемые пациентом, и рентгенограммы рук и ног, которые оценивались в соответствии с модифицированной шкалой Sharp по шкале Ван дер Хейде двумя независимыми читателями, не имеющими отношения к личности пациента и клинической информации.Был рассчитан показатель активности заболевания (DAS) 12.
Ультразвуковые исследования были выполнены обученными ревматологами в соответствии с утвержденной полуколичественной системой оценки 0–3 для шкалы серого и энергетического допплера.13 Были включены 32 сустава, дающие диапазоны от 0 до 96 для шкалы серого и энергетического допплера.
Сыворотки были собраны в биобанке, а RF и ACPA были проанализированы в той же лаборатории с помощью твердофазного иммуноферментного анализа ELISA и флуоресцентного иммуноферментного анализа, соответственно.Положительный тест определялся как любое значение ≥10 МЕ / мл для ACPA и ≥25 МЕ / мл для РФ.
Статистический анализ
Непрерывные переменные представлены как средние (SD) или медианы (25–75 процентиль) в соответствии с распределением. Дихотомические переменные представлены в виде частот и процентов. На исходном уровне и через 24 месяца наблюдения показатели активности заболевания сравнивали между группами с использованием t-критерия независимых выборок, U-критерия Манна-Уитни или критерия χ², в зависимости от ситуации. Мы также сравнили изменение этих показателей между группами по сравнению с исходным уровнем.Измерения активности заболевания на исходном уровне и через 24 месяца наблюдения также сравнивались между серонегативными пациентами и подгруппами серопозитивных пациентов (одиночные ACPA +, одиночные RF + и двойные положительные пациенты).
Рентгенологическое прогрессирование, DAS, SJC44 и результаты ультразвукового исследования с течением времени сравнивались между серонегативными и серопозитивными пациентами с помощью линейных моделей смешанных эффектов со случайным перехватом для пациента, чтобы учесть зависимости внутри пациента. Мы использовали надежные оценки дисперсии для оценок ультразвукового исследования и рентгенологического прогрессирования из-за асимметричного распределения.Наконец, мы сравнили частоту ответа и ремиссии по серологическому статусу через 3, 6, 12 и 24 месяца, используя тесты χ2. Мы также оценили ответ на лечение в моделях логистической регрессии с хорошим / умеренным ответом EULAR через 3 и 6 месяцев как зависимые переменные и серологический статус (серонегативный / серопозитивный) на исходном уровне SJC44, исходный DAS, исходный суставной индекс Ричи, пол и возраст как независимые переменные. Мы провели тот же анализ с ответом ACR 50 через 3 и 6 месяцев в качестве зависимых переменных.
Статистические тесты были двусторонними и p <0.05 считались статистически значимыми. Трое серонегативных и 23 серопозитивных пациента не явились на 24-месячный визит, пропущенные значения были вменены, как описано в другом месте.11 Статистический анализ проводился с использованием Stata 14.
Результаты
Пациенты
Изначально в ARCTIC были включены 238 пациентов. испытание; 230 из них посетили контрольные визиты и, таким образом, были включены в текущее исследование; 34 пациента (15%) оказались серонегативными. В серонегативных / серопозитивных группах средний возраст (SD) составлял 55 лет.4 (15,7) / 50,8 (13,2) года (p = 0,07), средняя (стандартное отклонение) продолжительность заболевания составила 7,7 (6,8) / 7,0 (5,1) месяцев (p = 0,46), и 56% / 62% составляли женщины (p = 0,48). ).
Тяжесть заболевания
Исходно показатели активности заболевания были выше у серонегативных пациентов по сравнению с серопозитивными пациентами.10 Серонегативные пациенты имели значительно большее снижение показателей активности заболевания (DAS, количество опухших суставов, общий балл врача и результаты ультразвукового исследования), что приводило к при контрольном наблюдении через 24 месяца различий между группами не было.Наблюдалась тенденция к большему количеству рентгенологических повреждений у серонегативных пациентов по сравнению с серопозитивными пациентами как на исходном уровне, так и через 24 месяца (таблица 1).
Измерения активности и тяжести заболевания на исходном уровне и через 24 месяца наблюдения также сравнивались между серонегативными пациентами и подгруппами серопозитивных пациентов (одиночные ACPA +, одиночные RF + и двойные положительные пациенты). Эти анализы существенно не изменили результаты. Исходно у RF-положительных (ACPA-отрицательных) и серонегативных (как ACPA, так и RF-отрицательных) пациентов были одинаковые уровни воспалительной активности, однако небольшое количество пациентов в этой подгруппе затрудняет интерпретацию (онлайн-дополнительная таблица 1).
Таблица 1Измерения активности и тяжести заболевания на исходном уровне и в течение 24 месяцев наблюдения по сравнению с серологическим статусом
В течение первых 6 месяцев после начала DMARD количество опухших суставов и DAS были выше у серонегативных пациентов по сравнению с серопозитивными пациентами. Начиная с шестого месяца, они были одинаковыми во всех группах (рис. 1A, B). Через 1 и 2 года результаты ультразвукового исследования статистически значимо не различались между группами (рис. 1C, D). Рентгенологическое прогрессирование было одинаковым между группами (рис. 1E, F).
Рисунок 1(A – F) Измерения активности заболевания и рентгенологического прогрессирования 0–24 месяцев у серонегативных и серопозитивных пациентов. (A – E) График полей за 24 месяца для DAS, SJC44, оценки энергетического допплера УЗИ, оценки серой шкалы УЗИ и рентгенологического прогрессирования. Столбцы представляют 95% доверительных интервалов. (F) График кумулятивной вероятности изменения между исходным уровнем и 24 месяцами по модифицированной шкале Ван дер Хейде. DAS — Оценка активности заболевания; SJC, количество опухших суставов.
Частота ответа и ремиссии
Через три месяца после начала лечения частота ответа и ремиссии была ниже у серонегативных пациентов, и 6% серонегативных пациентов (2/34) находились в булевой ремиссии ACR / EULAR по сравнению с 30% серопозитивных пациентов ( 58/196) (р = 0.004). Начиная с 6 месяцев и далее показатели ответа и ремиссии были одинаковыми между группами. Через 6 месяцев наблюдения 32% серонегативных (11/34) и 35% серопозитивных пациентов (69/196) находились в булевой ремиссии ACR / EULAR (p = 0,75) (таблица 2). Анализы, скорректированные с учетом возраста, пола, исходного уровня DAS, исходного уровня SJC44 и исходного суставного индекса Ричи, показали, что серопозитивность была связана с достижением ответа на лечение через 3 месяца, как для ответа ACR 50 (OR 3,8 (1,5–9,8)), так и для хорошего / умеренного ответа EULAR (ИЛИ 3.9 (1,4 11,2)). Серологический статус не позволял прогнозировать ответ на лечение через 6 месяцев. Более высокий исходный уровень DAS был связан с ответом на лечение через 6 месяцев, но не через 3 месяца (данные не показаны).
Таблица 2Ответ на лечение через 3 и 6 месяцев и частота ремиссии через 3, 6, 12 и 24 месяца
Лечение
Лечение было одинаковым во всех группах во время исследования, с аналогичными показателями серонегативных и серопозитивных пациентов, получавших монотерапию метотрексатом, втрое. терапия и биологическое лечение через 6 месяцев и 24 месяца (данные не показаны).Наблюдалась тенденция к более высокому уровню биологического лечения у серонегативных пациентов на 6-месячном визите, поскольку 11,8% серонегативных пациентов (4/34) получали биологическое лечение по сравнению с 5,1% серопозитивных пациентов (10/196, стр. = 0,13).
Обсуждение
В этом последующем исследовании пациентов с ранним РА, классифицированных в соответствии с критериями ACR / EULAR 2010 года, активность заболевания через 2 года лечения от лечения до целевой терапии была аналогичной у серонегативных и серопозитивных пациентов, несмотря на заметно большее количество воспалительных процессов. активность и тенденция к большему количеству радиографических повреждений у серонегативных пациентов на исходном уровне.Ответ на лечение был несколько медленнее у серонегативных пациентов, а рентгенологическое прогрессирование было одинаковым у серонегативных и серопозитивных пациентов. Наши результаты показывают, что у пациентов с РА, классифицированных в соответствии с новыми критериями, серонегативный РА не является легкой формой заболевания и требует интенсивной целевой терапии, аналогичной лечению серопозитивного РА.
Несколько исследований пациентов, классифицированных в соответствии с критериями РА 1987 года, показывают, что серонегативные пациенты имеют менее тяжелое течение болезни с меньшими рентгенологическими повреждениями, чем серопозитивные пациенты.2–6 14 Исследования также показали более высокую воспалительную активность у серопозитивных пациентов, при этом меньшее количество пациентов достигло ремиссии, 4 14 15, хотя данные несколько противоречивы 6 16 17 Имеется очень ограниченная информация о течении заболевания у серонегативных пациентов, классифицированных в соответствии с 2010 г. критерии. Одно недавно опубликованное исследование с участием пациентов с РА, удовлетворяющих критериям 2010 года, показало, что результаты, сообщаемые пациентами, включая физическое функционирование и ограничения на работе, были аналогичными у пациентов с положительным и отрицательным по АСРА после 4 лет наблюдения.18 Это соответствует результатам нашего исследования, в котором у серонегативных пациентов не было менее тяжелого течения заболевания, чем у серопозитивных пациентов, с аналогичными показателями ремиссии и аналогичным рентгенографическим прогрессированием в течение 2 лет. В нашем исследовании наблюдалась тенденция к большему количеству радиографических повреждений у серонегативных пациентов по сравнению с серопозитивными пациентами как на исходном уровне, так и через 24 месяца. Численные различия, возможно, не достигли статистической значимости из-за небольшого числа пациентов в серонегативной группе.
Целью критериев классификации ACR / EULAR 2010 RA было повышение чувствительности для пациентов с ранним заболеванием.Однако небольшое количество серонегативных пациентов, включенных в исследование ARCTIC, и, в среднем, высокая воспалительная активность у серонегативных пациентов на исходном уровне, указывают на то, что повышенная чувствительность может быть ограничена пациентами с серопозитивным заболеванием.
При включении пациентов в исследование ARCTIC использовались критерии классификации РА ACR / EULAR 2010. В то время критерии эрозии еще не были определены, и пациенты, которые в остальном не соответствовали критериям, могли быть включены, если бы мы применили опубликованные позже критерии эрозии.20 Однако недавно опубликованное исследование показало, что клиническое и рентгенологическое течение у пациентов с отрицательным результатом ACR / EULAR 2010, получавших лечение, не зависело от наличия эрозий при постановке диагноза.21
Исследования показали, что пациенты, которые не получают значительного ответа на лечение в течение 3 месяцев, имеют низкую вероятность достижения ремиссии в течение 6 месяцев22. улучшение активности заболевания более чем на 50% через 3 месяца после начала лечения.8 В нашем исследовании ответ на лечение через 3 месяца был лучше у серопозитивных, чем у серонегативных пациентов, тогда как количество пациентов в ремиссии в конце исследования было одинаковым во всех группах. Это наблюдение может указывать на то, что серонегативные пациенты могут хорошо реагировать на стратегии лечения до достижения цели, даже если первоначальный ответ на лечение задерживается по сравнению с серопозитивными пациентами.
Серонегативный RA считается менее тяжелым заболеванием, чем серопозитивный RA.2–6 Это предположение могло бы привести к менее интенсивному лечению серонегативных пациентов при обычном уходе. Наши результаты подчеркивают, что как пациенты с серонегативным, так и серопозитивным RA должны получать интенсивную терапию DMARD, направленную на достижение цели. Обновленные рекомендации по лечению EULAR более или менее совпадают с протоколом лечения в исследовании ARCTIC, что увеличивает обобщаемость наших результатов.
Ограничением нашего исследования является небольшое количество включенных серонегативных пациентов, что ограничивает статистическую мощность.Сильные стороны нашего исследования включают обширный сбор данных с рентгенографическими и ультразвуковыми исследованиями всех пациентов. Насколько нам известно, это первое исследование, посвященное изучению течения серонегативного РА в первичной когорте пациентов, ранее не получавших БПВП, классифицированных в соответствии с критериями ACR / EULAR 2010 года.
В заключение, пациенты с серонегативным РА, классифицированные в соответствии с критериями ACR / EULAR 2010 года, хорошо отвечают на современные стратегии лечения, но серонегативный РА не является легкой формой заболевания и требует такой же интенсивной целевой терапии, как серопозитивный РА.
Выражение признательности
Авторы выражают благодарность пациентам за участие в этом исследовании и исследователям ARCTIC: Халварду Фремстаду, Тор Магне Мэдланд, Эсу Ставланд Лексберг, Хильде Хаукеланд, Эрику Рёдеванду, Кристиану Хёйли, Хильде Стрей, Анне Линдтер Нораас, Магнар Солдал, Гуннштейн Бакланд.

 0 Серонегативный ревматоидный артрит
0 Серонегативный ревматоидный артрит 1 остеопороз с патологическим переломом после удаления яичников
1 остеопороз с патологическим переломом после удаления яичников
 5 г: фильтр-пакеты 10 или 20 шт.
5 г: фильтр-пакеты 10 или 20 шт. 5 г: фильтр-пакеты 10 шт.
5 г: фильтр-пакеты 10 шт. 5 г: фильтр-пакеты 10, 20, 24, 30 и 50 шт.
5 г: фильтр-пакеты 10, 20, 24, 30 и 50 шт. 1 шт.
1 шт. , покр. пленочной оболочкой, 275 мг: 5 шт.
, покр. пленочной оболочкой, 275 мг: 5 шт. , покр. пленочной оболочкой, 100 мг: 20 или 60 шт.
, покр. пленочной оболочкой, 100 мг: 20 или 60 шт.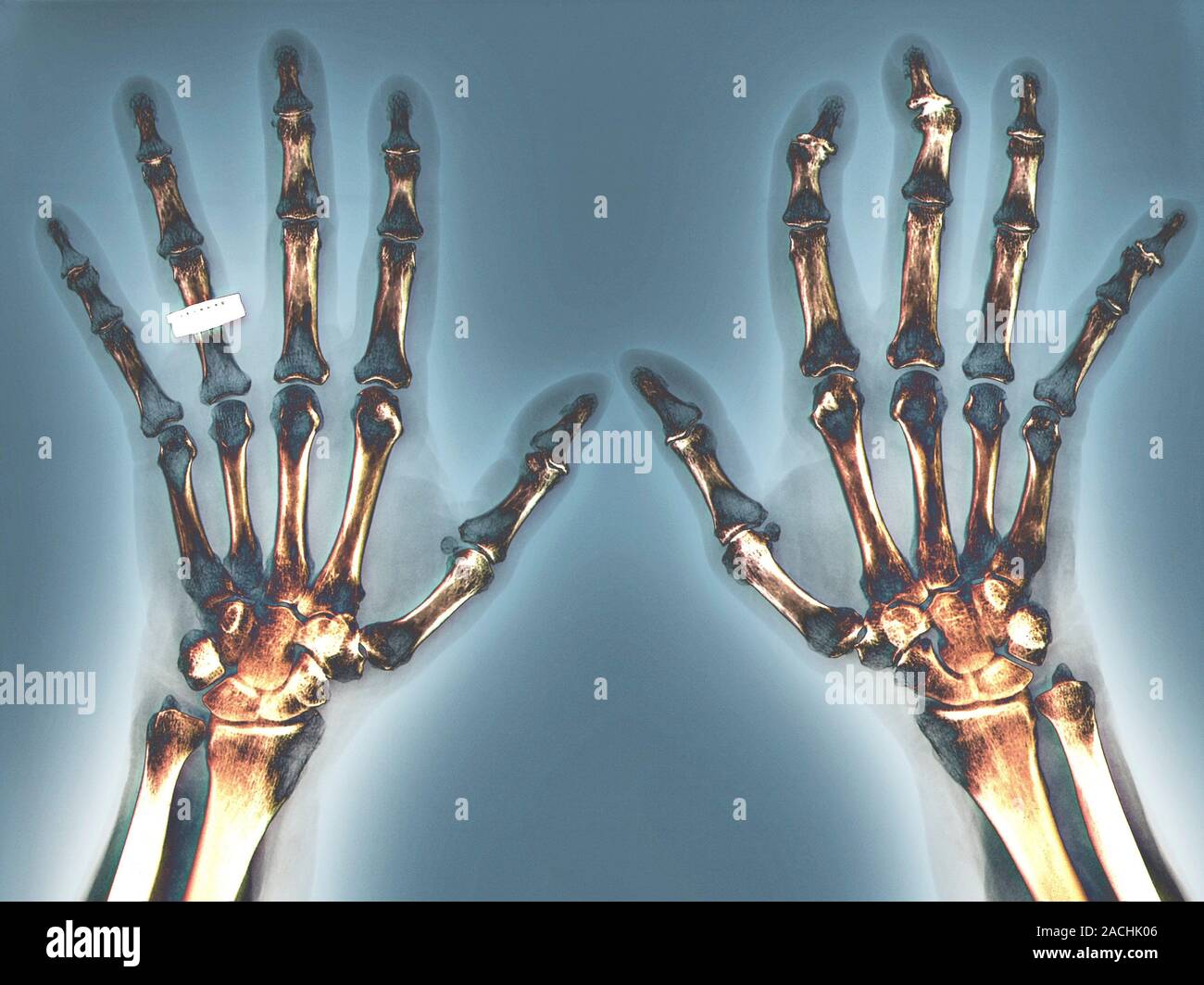 прим. 5%: тубы, 20 г, 25 г, 30 г, 50 г, 75 г или 100 г; банка 20 г
прим. 5%: тубы, 20 г, 25 г, 30 г, 50 г, 75 г или 100 г; банка 20 г ректальные 7.5 мг: 1, 3, 5, 6, 9, 10 или 12 шт.
ректальные 7.5 мг: 1, 3, 5, 6, 9, 10 или 12 шт.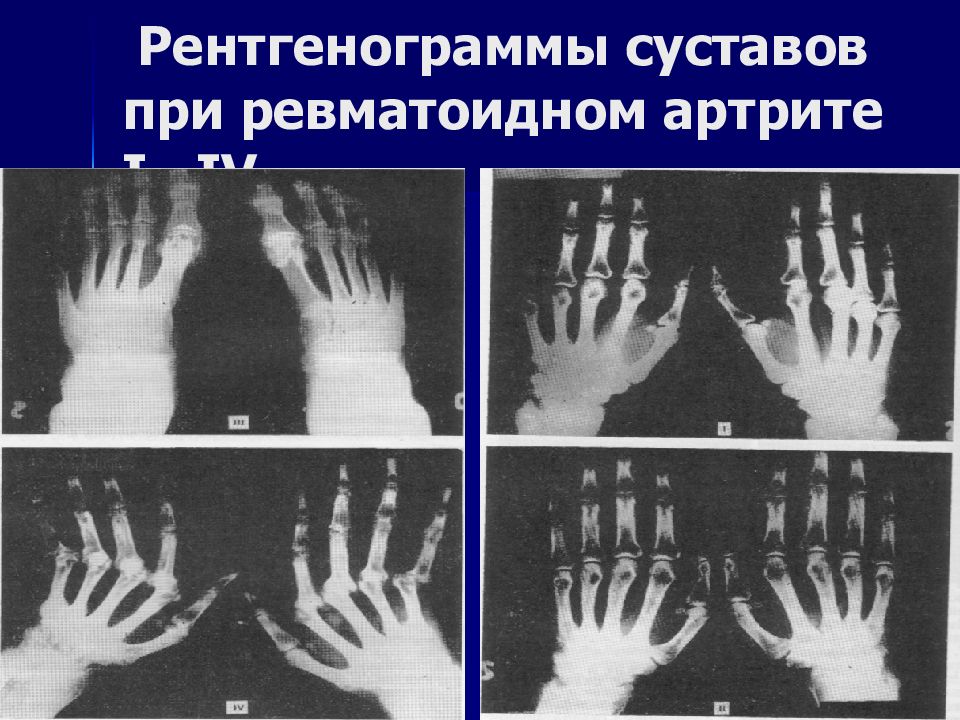 с мерн. ложкой
с мерн. ложкой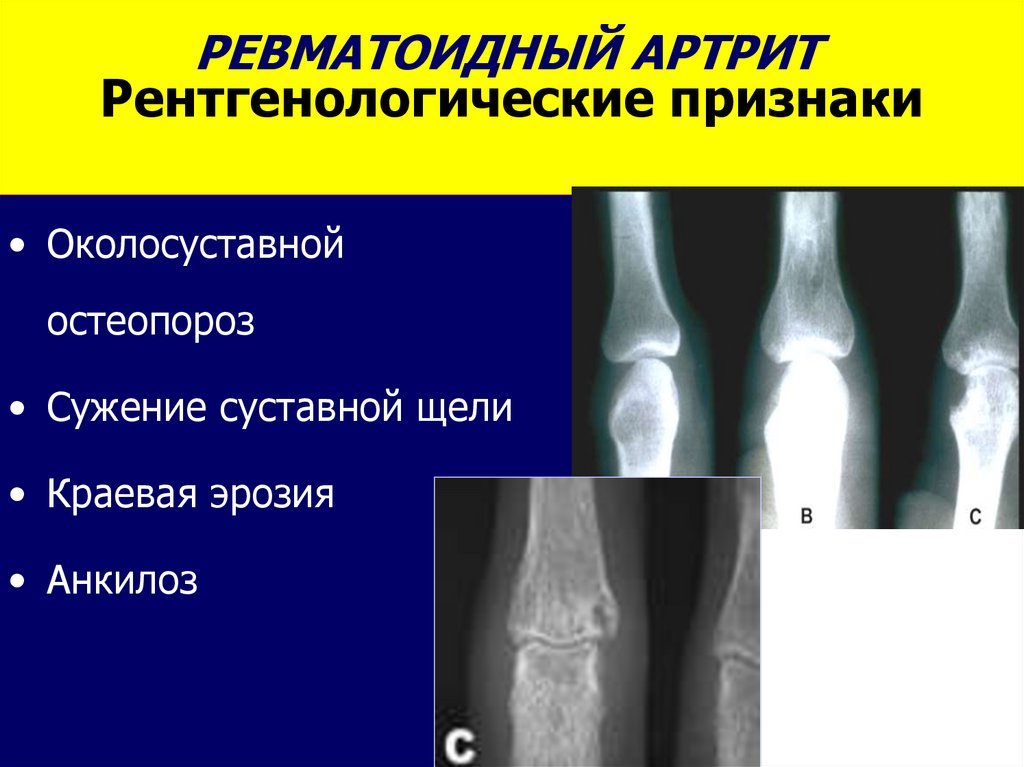 15 мг: 10 или 20 шт.
15 мг: 10 или 20 шт. 500 мг: 10 или 20 шт.
500 мг: 10 или 20 шт.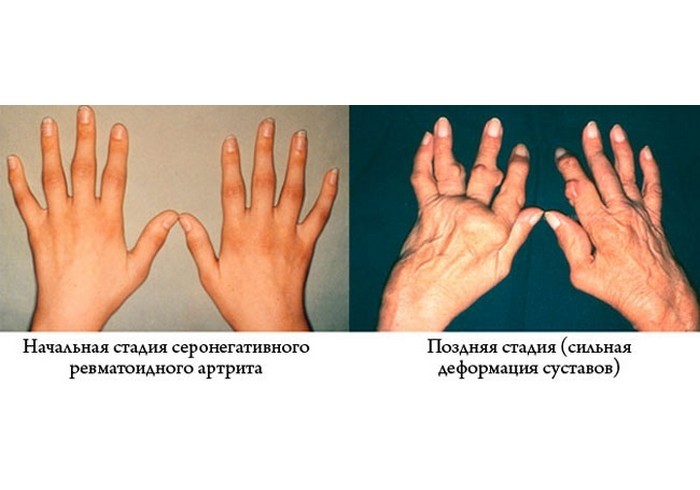 р-ра д/в/в и в/м введен. 500 мг: фл. 1, 10 или 50 шт.
р-ра д/в/в и в/м введен. 500 мг: фл. 1, 10 или 50 шт. шипучие 400 мг: 2, 8, 10 или 20 шт.
шипучие 400 мг: 2, 8, 10 или 20 шт.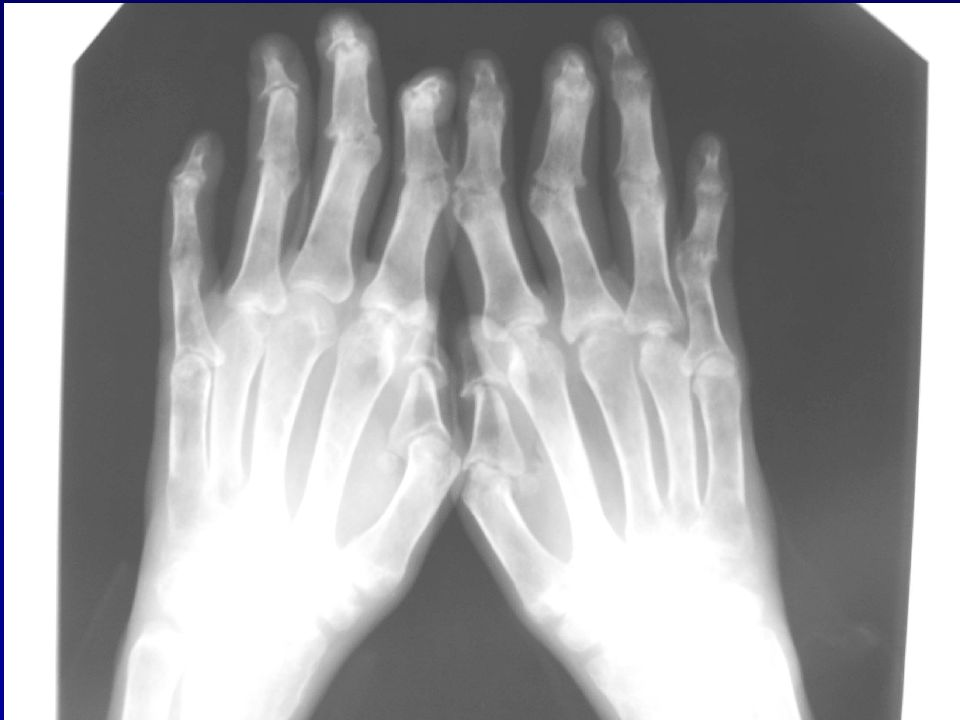 д/приема внутрь (клубничная) 100 мг/5 мл: 200 мл фл.
д/приема внутрь (клубничная) 100 мг/5 мл: 200 мл фл. 400 мг: 2, 4, 8, 10 и 40 шт.
400 мг: 2, 4, 8, 10 и 40 шт. 100 мг: 20 шт.
100 мг: 20 шт. в компл. с иглой одноразовой, салфеткой и пластырем
в компл. с иглой одноразовой, салфеткой и пластырем 7.5 мг: 10 или 20 шт.
7.5 мг: 10 или 20 шт.