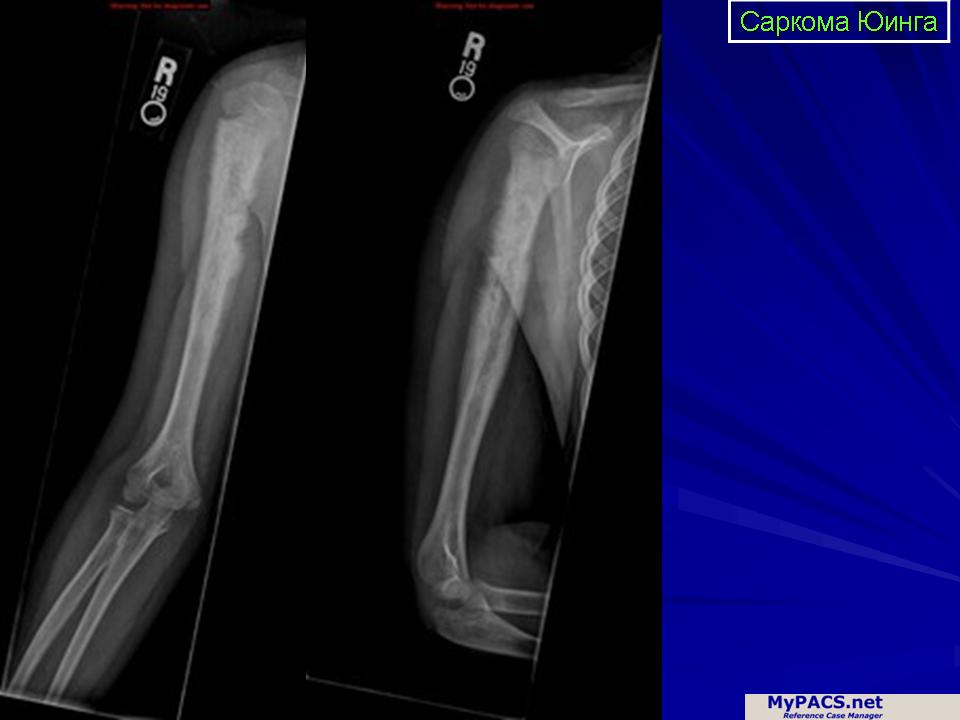
Саркома Юинга (краткая информация)
Саркома Юинга — это злокачественная опухоль, которой могут заболеть дети и подростки. В этом тексте Вы получите важную информацию о болезни, о её формах, как часто ею заболевают дети и почему, какие бывают симптомы, как ставят диагноз, как лечат детей и какие у них шансы вылечиться от этой формы рака.
автор: Maria Yiallouros, erstellt am: 2009/02/12, редактор: Dr. Natalie Kharina-Welke, Разрешение к печати: Prof. Dr. med. Uta Dirksen, Prof. Dr. md. U. Creutzig, Переводчик: Dr. Natalie Kharina-Welke, Последнее изменение: 2019/10/29 doi:10.1591/poh.patinfo.ewing.kurz.20101215
Что такое саркома Юинга?
Саркома Юинга – это злокачественная солидная опухоль. Чаще всего она вырастает в костях. Реже она может вырастать в мягких тканях, то есть в соединительных тканях, в жировых, мышечных, или в тканях периферических нервов. Болезнь была названа по имени нью-йоркского исследователя рака Джеймса Юинга (1866-1943), который впервые описал эту опухоль в 1920 году.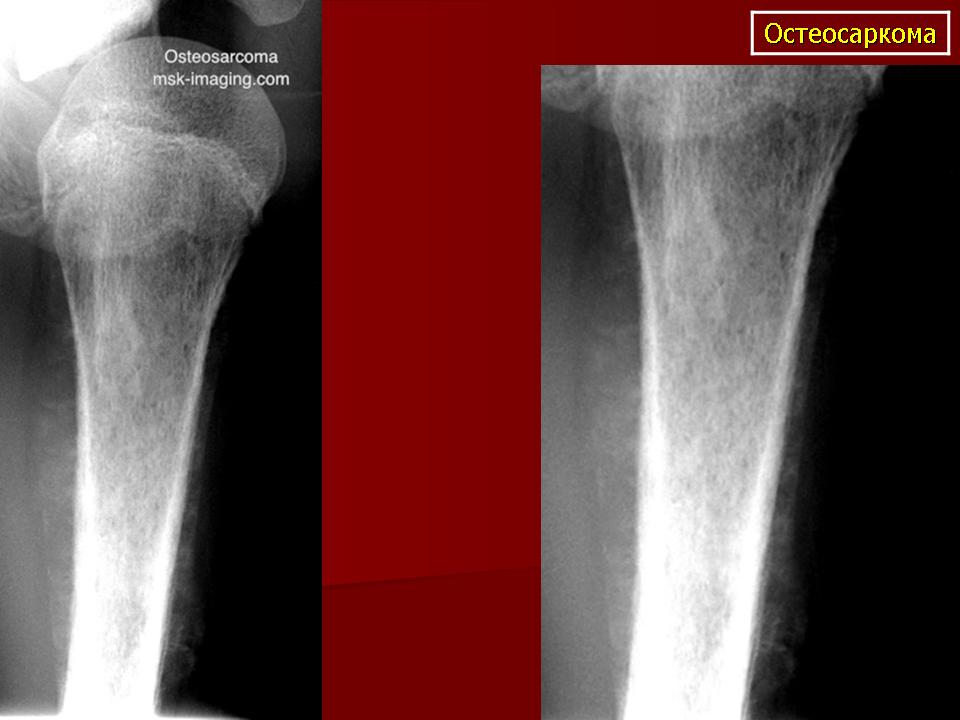
Существует целое семейство опухолей саркомы Юинга. В него входят, например, классическая саркома Юинга (в зарубежной литературе принято сокращённое обозначение EWS) и периферические примитивные нейроэктодермальные опухоли (в зарубежной литературе их обозначают PPNET или pPNET; на русском языке можно встретить сокращение ППНЭО, не путать с ПНЭО, опухолями головного мозга). Чаще всего саркомы Юинга растут и дают метастатзы настолько быстро, что без эффективного лечения эта болезнь смертельна.
Как часто у детей встречается саркома Юинга?
Саркомы Юинга встречаются редко. В Германии из 1.000.000 детей в возрасте до 15 лет заболевают 3 ребёнка в год (по статистике всех детей в Германии это около 40 заболевших детей в год). Из 1.000.000 подростков и молодёжи в возрасте от 15 до 25 лет в год заболевает около 2,4 человек.
Больше половины всех заболевших – это дети и подростки в возрасте между 10 и 20 годами.
Где и как вырастает саркома Юинга?
В принципе в любой кости может появиться саркома Юинга. Чаще всего опухоль вырастает в тазовых костях, далее по частоте появления следуют длинные трубчатые кости бедра и голени, и затем идут рёбра.
Опухоль может разрастаться и внутри кости, в которой они появилась, и в мягких тканях вокруг кости. В редких случаях саркома Юинга вырастает сразу в мягких тканях [мягкие ткани], то есть опухоли нет в кости. В этом случае специалисты говорят о внекостной саркоме Юинга (также используется термин экстраоссальная саркома Юинга).
Саркомы Юинга растут быстро и очень рано дают метастазы. Примерно у четверти заболевших детей во время диагностики уже есть метастазы, которые видны на снимках.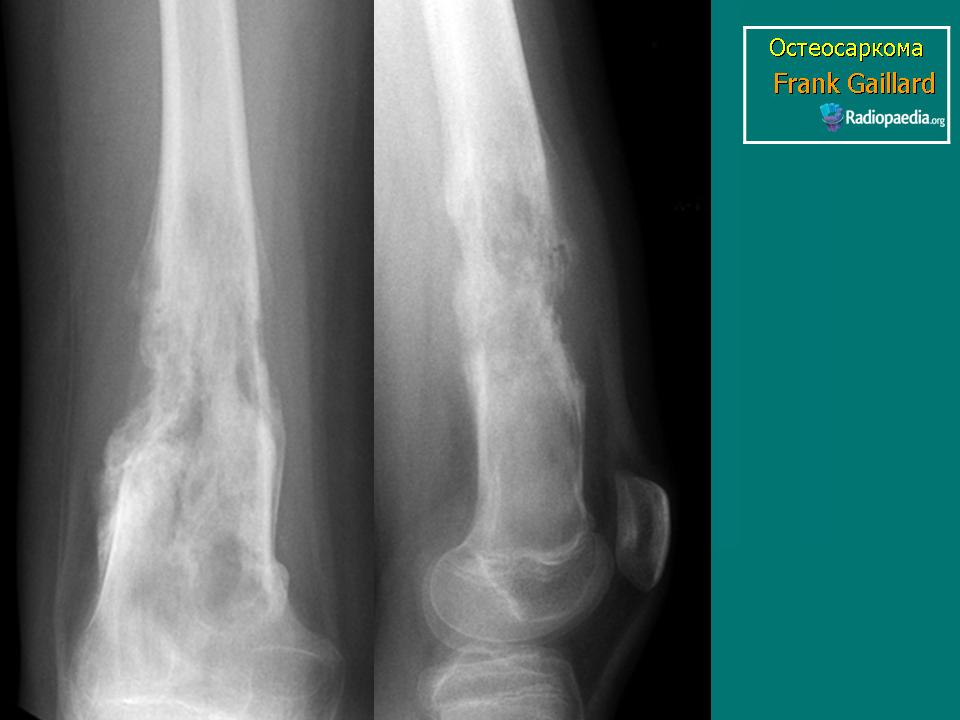 Чаще всего они бывают в лёгких, но их также находят и в костях, и в костном мозге [костный мозг]. Кроме этого почти у всех детей есть так называемые микрометастазы. Это такие самые мельчайшие метастазы, которые не способна увидеть никакая визуальная диагностика.
Чаще всего они бывают в лёгких, но их также находят и в костях, и в костном мозге [костный мозг]. Кроме этого почти у всех детей есть так называемые микрометастазы. Это такие самые мельчайшие метастазы, которые не способна увидеть никакая визуальная диагностика.
Какие бывают виды опухоли? Что мы знаем о её микроскопических (гистологических) особенностях?
Саркомы Юинга относятся к примитивным [примитивный] злокачественным опухолям. До сих пор точно не известно, какая именно клетка начинает мутировать и в результате начинает вырастать эта опухоль. Современные исследования говорят о том, что клетки саркомы Юинга вырастают из незрелых (или на языке специалистов недифференцированных) клеток ткани, это так называемые мезенхимальные стволовые клетки.
Понять, заболел ли ребёнок саркомой Юинга, или другой злокачественной опухолью, которая тоже состоит из недифференцированных опухолевых клеток (например, это могут быть нейробластома, медуллобластомы, неходжкинские лимфомы, саркомы мягких тканей и ретинобластома), можно только проведя гистологический анализ и специальные молекулярно-генетические [молекулярно-генетический] исследования. Так как все эти виды рака встречаются достаточно редко, то такую диагностику, как правило, способны выполнить только специализированные лаборатории.
Так как все эти виды рака встречаются достаточно редко, то такую диагностику, как правило, способны выполнить только специализированные лаборатории.
В зависимости от микроскопических (гистологических) особенностей опухолевой ткани, а также от того, в каком именно месте выросла опухоль, в семействе сарком Юинга выделяют следующие типы:
- классическая сарокма Юинга (в западной литературе принято сокращение EWS)
- периферическая примитивная нейроэктодермальная опухоль (на русском языке может называться ППНЭО, в зарубежных источниках принято сокращение PPNET или pPNET)
- опухоль Аскина (опухоли грудной стенки)
- внекостная саркома Юинга
Почему дети заболевают саркомой Юинга?
Никто точно не знает, почему дети заболевают саркомой Юинга. Ни какие-то внешние факторы воздействия на организм (например, когда ребёнок ранее получал лучевую терапию [облучение]), ни какие-то наследственные генетические [генетический] факторы (наследственная предрасположенность) не имеют большого значения.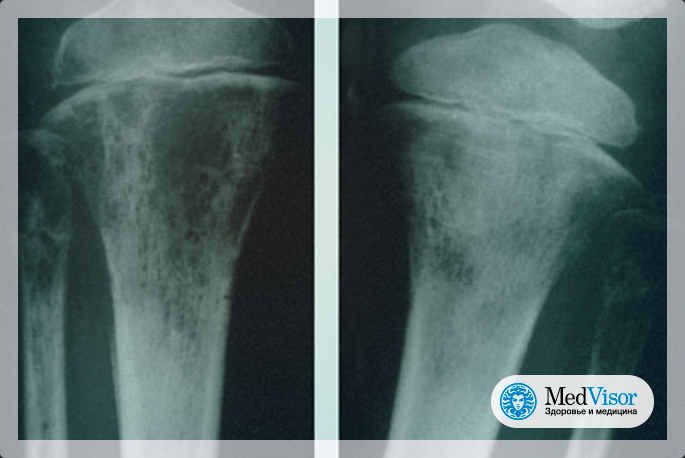
Известно, что у раковых клеток саркомы Юинга есть определённые хромосомные изменения. Эти изменения всегда затрагивают определённый ген на 22-ой хромосоме. Этот ген так и называется ген саркомы Юинга (также можно встретить его друое название EWS-ген). В результате, когда изменения приводят к генной поломке, это приводит к тому, что здоровая клетка становится раковой. Но принципиально все такие генные изменения, которые нашли в ткани опухоли, не передаются по наследству.
Какие бывают симптомы болезни?
Наиболее часто встречающимся симптомом, который появляется из-за саркомы Юинга, являются боли и припухлость в том, месте, где растёт опухоль.
Боли появляются спонтанно. Обычно болеть начинает тогда, когда ребёнок что-то делает с физической нагрузкой. Но часто эти боли ночью полностью не уходят. Чем больше растёт опухоль, то кроме болей у ребёнка становится видна припухлость, либо если припухлость ещё не видна, её уже можно прощупать.
Но так как саркомы Юинга могут вырастать практически в любой кости и в мягких тканях, то в каждом отдельном случае другие симптомы могут сильно отличаться. Например, если опухоль растёт в области позвоночника или периферических нервов [периферическая нервная система], то у ребёнка в первую очередь могут появиться такие отклонения как потеря двигательной способности (паралич). Если опухоль растёт в тазовых костях, или в районе груди, или же в бедренных костях, то очень долгое время она не даёт каких-то явных симптомов и остаётся незамеченной.
Примерно у трети заболевших детей, у которых появляются такие общие симптомы как повышение температуры, болезненное самочувствие, общая усталость и утомляемость, они начинают худеть, болезнь может находиться уже на поздней стадии.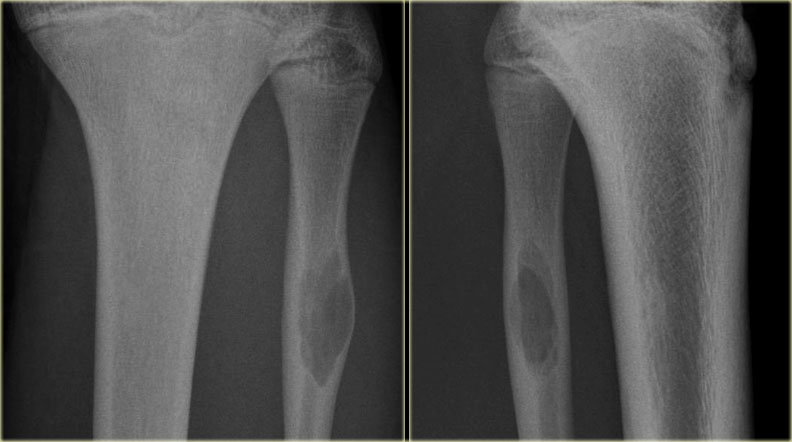 С того момента, когда у ребёнка появились первые симптомы, до того времени, когда ему поставили точный диагноз, может пройти от несколких недель до нескольких месяцев.
С того момента, когда у ребёнка появились первые симптомы, до того времени, когда ему поставили точный диагноз, может пройти от несколких недель до нескольких месяцев.
Те симптомы у детей и подростков, о которых мы здесь пишем, не обязательно говорят о том, что у ребёнок заболел саркомой Юинга или каким-то другим раком костей. Тем не менее, если у ребёнка или у подростка появляются боли в костях, мы обязательно рекомендуем обратиться к опытному педиатру и выполнить полную диагностику. Чтобы точно быть уверенным в том, что это не онкология.
Как ставят диагноз саркома Юинга?
Если педиатр (или другой специалист) подозревает из истории болезни ребёнка (анамнез) и по результатам наружного осмотра [наружный осмотр] злокачественную опухоль костей, то врач направляет ребёнка в клинику, которая специализируется на лечении рака у детей и подростков (детский онкологический центр/ клиника детской онкологии и гематологии).
Потому что, если подозревают такую опухоль, то полное обследование проводят специалисты разного профиля.
Какая необходима визуальная диагностика (диагностика по снимкам)?
Если подозревают рак костей, то чаще всего уже на рентгеновских снимках видны изменения, типичные для болезни. Подозрение на злокачественную опухоль костей чаще всего подтверждают рентгеновские снимки. Дополнительно с помощью таких методов диагностики по снимкам как магнитно-резонансная томография (МРТ) и/или компьютерная томография (КТ) можно точно оценить размер опухоли, где именно она выросла, а также увидеть границы опухоли с соседними структурами (например, с мышцами и сухожилиями, или суставными сумками).
Также на этих снимках можно хорошо рассмотреть близко расположенные метастазы, так называемые „прыгающие“ метастазы ( на языке специалистов „скип“-метастазы). Снимки МРТ (по сравнению со снимками КТ) дают более точную информацию о том, есть ли опухоль внутри костного мозга и в мягких тканях. Поэтому на этапе начальной диагностики врачи предпочитают работать с ними, а также с рентгеновскими снимками костей.
Как исследуют ткань опухоли?
Чтобы окончательно подтвердить диагноз саркомы Юинга, обязательно берут образец опухолевой ткани (биопсия), который исследуют разные специалисты. Биопсию должны выполнять только те специалисты, которые потом будут делать операцию саркомы, или у которых есть опыт оперировать саркомы. Потому что от того, как сделали биопсию, зависит дальнейшая операция. Любая биопсия сначала открывает доступ к самой опухоли. Если этот доступ был запланирован и выполнен неправильно, то это ведёт к дальнейшим проблемам в лечении. В худшем случае к тому, что запланированную дальнейшую операцию придётся выполнять гораздо в большем объёме, чем это было бы нужно изначально.
Как ищут метастазы?
Чтобы найти метастазы, делают рентгеновские снимки и компьютерную томографию лёгких, а также сцинтиграфию [сцинтиграфия] костей.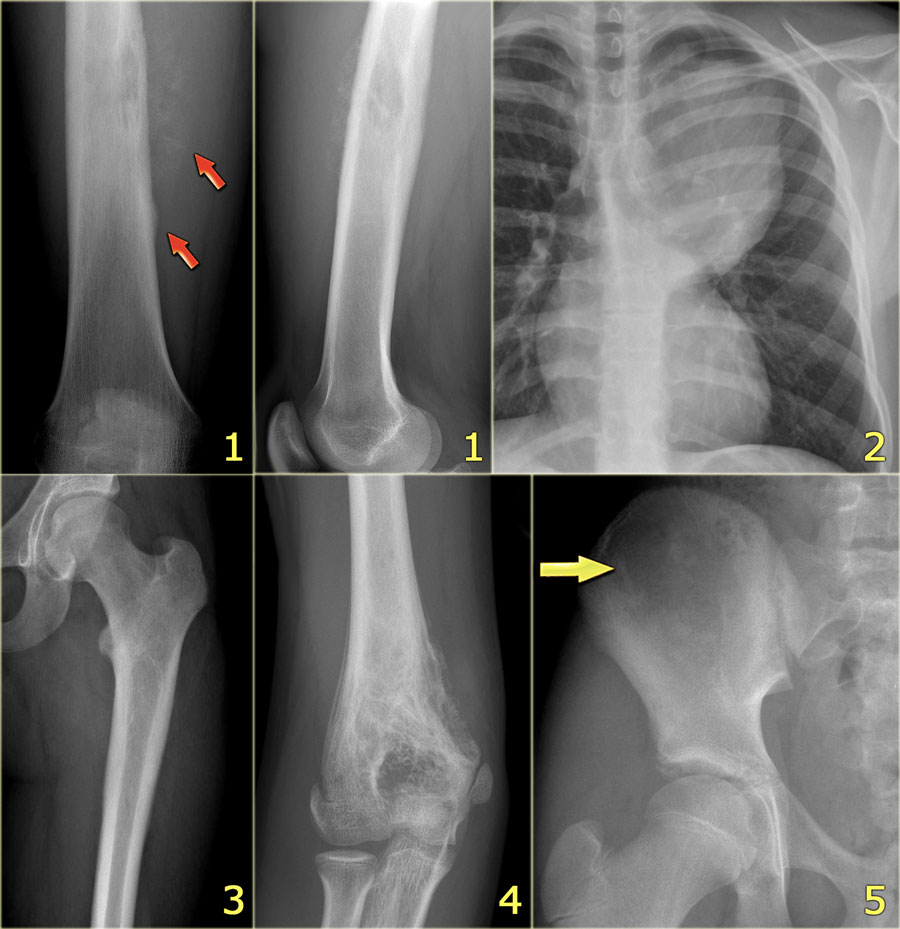 В некоторых случаях также могут помочь снимки ПЭТ (позитронно-эмиссионная томография). Чтобы выяснить, попали раковые клетки в костный мозг, или нет, необходимо также сделать пункцию костного мозга. В зависимости от каждого конкретного случая болезни и от того, как проходит лечение, могут потребоваться дополнительные исследования и анализы.
В некоторых случаях также могут помочь снимки ПЭТ (позитронно-эмиссионная томография). Чтобы выяснить, попали раковые клетки в костный мозг, или нет, необходимо также сделать пункцию костного мозга. В зависимости от каждого конкретного случая болезни и от того, как проходит лечение, могут потребоваться дополнительные исследования и анализы.
Исследования и анализы до курса лечения: До начала лечения у детей проверяют, как работает сердце (эхокардиограмма – ЭхоКГ), проверяют слух (аудиометрия), почки и лёгкие, а также делают разные анализы крови. Если во время лечения наступают какие-то изменения, то их обязательно сравнивают с начальными результатами обследования. В зависимости от этого тактика лечения может корректироваться.
Результаты всей диагностики должны показать, какая именно опухоль появилась у ребёнка, где именно она выросла и насколько опухоль уже успела разойтись по организму. По этим результатам составляют максимально возможный индивидуальный план лечения ребёнка (врачи называют его риск-адаптированное лечение.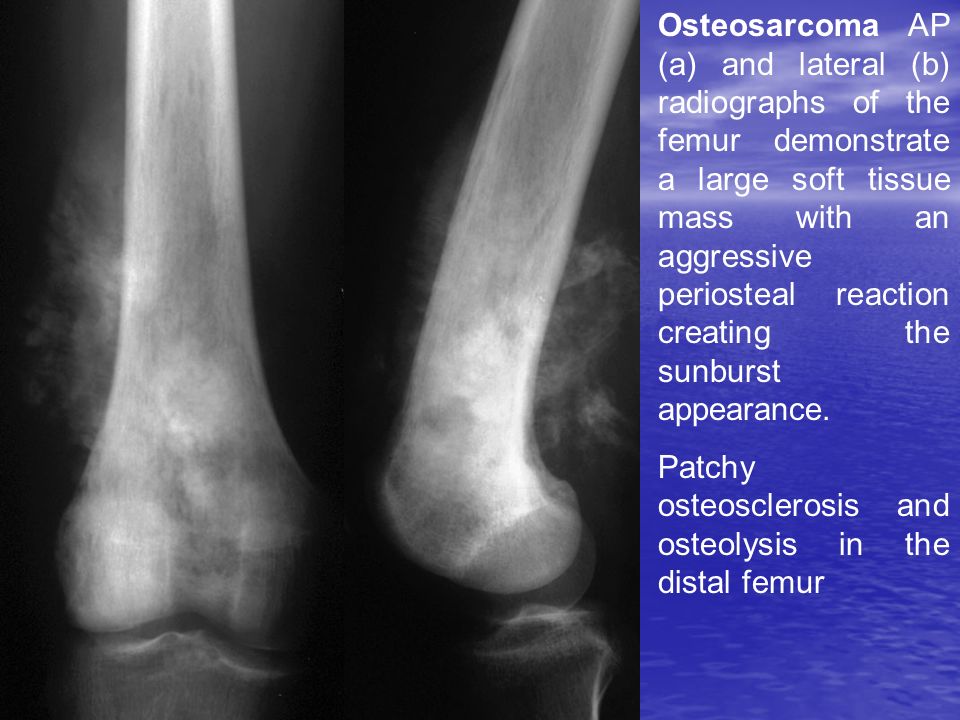
Как составляют план лечения?
После того, как поставили окончательный диагноз, врачи составляют план лечения. Специалисты, которые ведут ребёнка, составляют индивидуальную программу лечения (т.н. риск-адаптированное лечение), в которой учитываются определённые моменты. Их называют факторами риска (прогностические факторы), и от них зависит прогноз болезни.
Важные прогностические факторы у детей с саркомой Юинга – это конкретный тип опухоли, где именно она выросла и насколько она уже успела разойтись по организму (то есть находится ли саркома только в одном месте, или она уже дала метастазы). Ответы на эти вопросы даёт та диагностика, о которой мы рассказали выше. Также большое значение имеет то, насколько опухоль можно удалить хирургическим путём (то есть полностью, или нет), и как болезнь отвечает на химиотерапию [химиотерапия].
Всё это учитывается, когда врачи составляют план лечения. Его цель – получить максимально эффективные результаты лечения.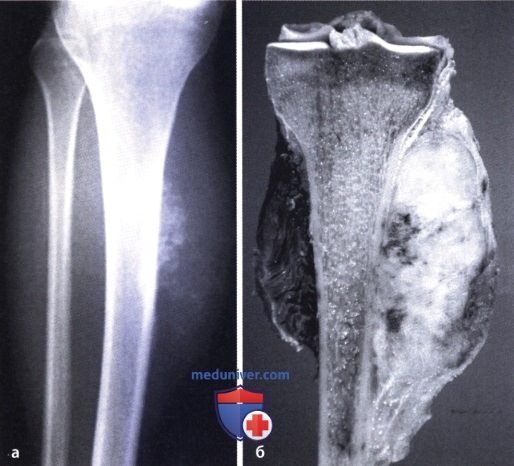
Как лечат саркому Юинга?
Лечение детей с саркомой Юинга состоит из операции [операция] и/или лучевой терапии [облучение] (эти виды лечения называются на языке специалистов локальной терапией), а также из курсов химиотерапии [химиотерапия]. Курсы химиотерапии выполняют потому, что в прошлом, когда детей только оперировали и облучали, то врачи убирали таким образом только саму опухоль. Но потом почти у всех детей появлялись метастазы. Поэтому нужен такой вид лечения, который будет действовать на весь организм, а не только на какой-то конкретный участок. Обычно локальную терапию делают между двумя блоками химиотерапии. В общей сложности курс лечения длится приблизительно от 10 до 12 месяцев.
Лечение делится на несколько этапов:
Этап химиотерапии до начала локальной терапии
Лечение начинается с курса интенсивной химиотерапии, который длится несколько недель. Этот курс также называют индукционной химиотерапией.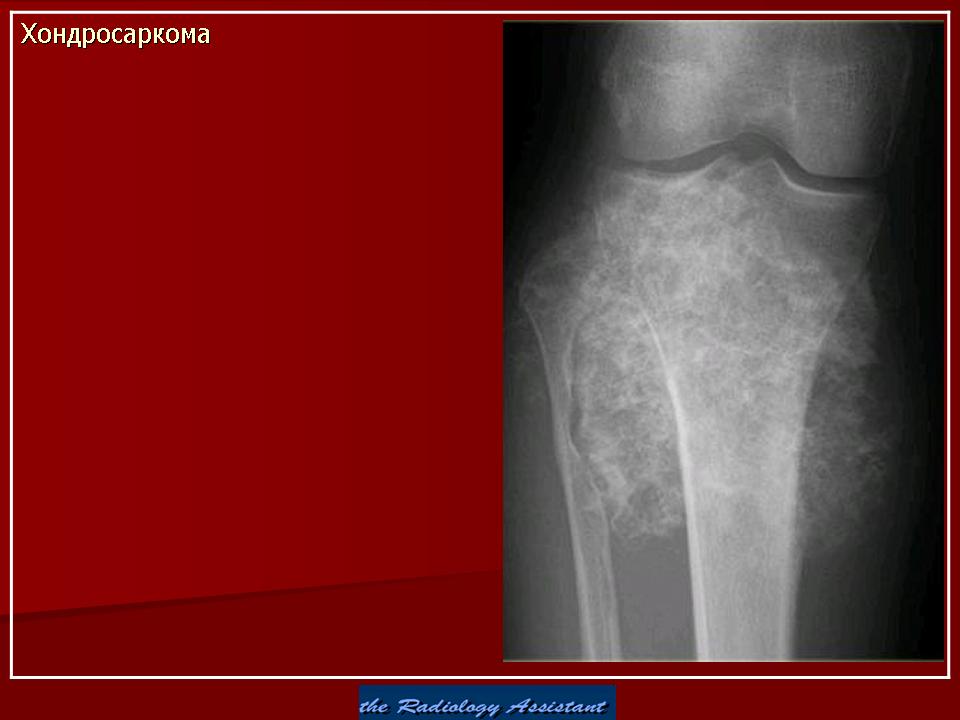 Его цель – уменьшить размер опухоли и количество метастазов, если они видны на снимках, а также убить возможные метастазы, которые не видны. Это помогает сделать операцию более щадящей и более безопасной, и одновременно максимально эффективной. Кроме того химиотерапия способна убивать даже самые маленькие, ещё невидимые микрометастазы, и таким образом блокировать дальнейший рост опухоли.
Его цель – уменьшить размер опухоли и количество метастазов, если они видны на снимках, а также убить возможные метастазы, которые не видны. Это помогает сделать операцию более щадящей и более безопасной, и одновременно максимально эффективной. Кроме того химиотерапия способна убивать даже самые маленькие, ещё невидимые микрометастазы, и таким образом блокировать дальнейший рост опухоли.
Чтобы убить по возможности все раковые клетки, используют комбинацию из нескольких препаратов. Эти медикаменты задерживают рост клеток (цитостатики). Они уже доказали свою наибольшую эффективность у детей с саркомой Юинга. В первую очередь это такие препараты, как винкристин, ифосфамид, доксорубицин (= адриамицин) и этопозид.
Дети получают цитостатики в виде инфузии [инфузия] в течении нескольких блоков. Блок длится несколько дней. В это время дети лежат в больнице. В перерывах между курсами/блоками химиотерапии их обычно отпускают домой. Только если у ребёнка появляются тяжёлые побочные эффекты (осложнения), его снова кладут в больницу (стационарное лечение).
Локальная терапия
NЕщё когда не закончились полностью блоки химиотерапии, или самое позднее сразу после химиотерапии начинают локальную терапию. Её предпочтительным видом является операция. Цель операции – по-возможности полностью удалить опухоль. Однако часто полностью удалить опухоль невозможно. Потому что она выросла в таком месте, которое является функционально важной частью тела, то есть без него невозможна нормальная работа организма. Поэтому дополнительно необходимо делать лучевую терапию. В некоторых случаях врачи вместо операции вынуждены идти только на лучевую терапию. Как оба эти виды лечения могут сочетаться друг с другом и в каком объёме они будут проводиться, зависит от каждой индивидуальной ситуации. Поэтому врачи в каждом конкретном случае принимают максимально оптимальное решение для ребёнка.
Специалисты, которые отвечают за лечение ребёнка, проинформируют семью, какая именно операция будет выполняться, как это будет происходить, или расскажут о том, как будет проходить этап облучения. Если опухоль выросла на руках, или на ногах, то сегодня прогресс в лечении конечностей позволяет делать органосберегающие операции. А дополнительное лечение курсами химиотрапии и/или лучевой терапии позволяет отказаться от ампутации.
Если опухоль выросла на руках, или на ногах, то сегодня прогресс в лечении конечностей позволяет делать органосберегающие операции. А дополнительное лечение курсами химиотрапии и/или лучевой терапии позволяет отказаться от ампутации.
Сразу после операции патомофолог исследует саму опухоль. Он должен оценить, как опухоль ответила на курсы химиотерапии. Для этого он смотрит, сколько живых раковых клеток ещё осталось в опухоли. Если их меньше 10 %, то врачи говорят о хорошем ответе на лечение. А если их 10% и больше, то специалисты говорят о плохом ответе на лечение. Если во время постановки диагноза у ребёнка уже были метастазы, то их по-возможности также пролечивают локально, как и саму опухоль (на языке специалистов первичная опухоль). То есть их удаляют во время операции и/или облучают.
Этап химиотерапии после локальной терапии
После локальной терапии продолжается химиотерапия. Этот этап называется консолидирующая химиотерапия. Насколько курсы химиотерапии будут интенсивными, зависит от того, как болезнь отвечала на химиотерапию до локального лечения, а также какой был размер начальной опухоли в момент постановки диагноза, и были ли у ребёнка метастазы в тот период времени.
Насколько курсы химиотерапии будут интенсивными, зависит от того, как болезнь отвечала на химиотерапию до локального лечения, а также какой был размер начальной опухоли в момент постановки диагноза, и были ли у ребёнка метастазы в тот период времени.
Если был хороший ответ, или начальная опухоль была маленького размера (то есть объём опухоли был меньше 200 мл), то также, как и на первом этапе, ребёнок несколько раз получает блоки химиотерапии из нескольких цитостатиков. Обычно это комбинации из таких препаратов как винкристин, актиномицин D и циклофосфамид, или комбинация из винкристина, актиномицина D и ифосфамида.
Если на этапе индукционной химиотерапии был плохой ответ, или начальная опухоль была большого размера (то есть объём опухоли был больше 200 мл), то по исследовательскому протоколу по саркоме Юинга рекомендуется высокодозная химиотерапия и сразу же за ней трансплантация костного мозга. Исследователи изучают полученные результаты и сравнивают их с теми, когда пациенты получали курсы стандартной химиотерапии.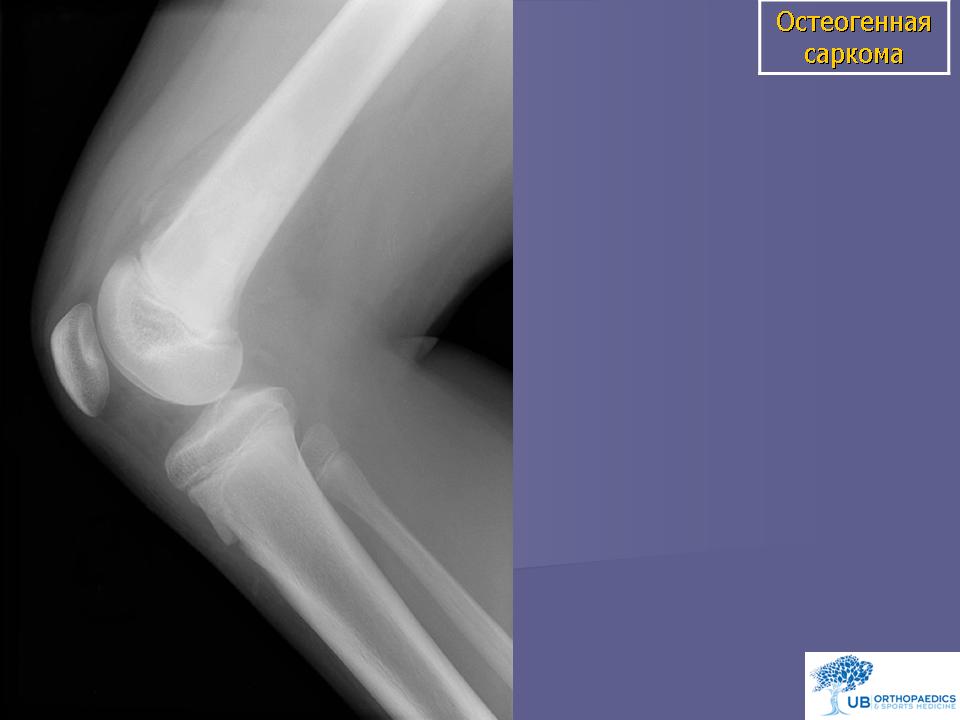 Этот принцип интенсивного лечения также рекомендуется детям, у которых на момент диагноза уже были метастазы.
Этот принцип интенсивного лечения также рекомендуется детям, у которых на момент диагноза уже были метастазы.
В некоторых случаях сразу после курсов химиотерапии или после курсов высокодозной химиотерапии детям дополнительно назначают лучевую терапию.
Как лечат рецидивы
Хотя методы лечения саркомы Юинга стали лучше и результаты выше, тем не менее у 30-40% детей обнаруживают рецидив. У детей с рецидивом прогноз хуже. Сегодня для них пока нет стандартной терапии. В зависимости от конкретной ситуации лечить рецидив могут курсами химиотерапии из нескольких препаратов, облучением, хирургическим путём, или же комбинируют эти виды лечения. Иногда врачи рассматривают также возможности высокодозной химиотерапии.
Если по результатам лечения видно, что невозможно полностью вылечить ребёнка, то на первый план выходит сохранение качества жизни. Врачи выполняют, например, обезболивающую терапию и поддерживают определённые функции организма (паллиативная терапия). Исследовательские протоколы работают над тем, как можно повысить шансы на выздоровление этих пациентов. По этим протоколам, например, детям дают новые медикаменты и проверяют их эффективность.
Исследовательские протоколы работают над тем, как можно повысить шансы на выздоровление этих пациентов. По этим протоколам, например, детям дают новые медикаменты и проверяют их эффективность.
По каким протоколам лечат детей?
В мире во всех крупных лечебных центрах детей и подростков с саркомой Юинга и ППНЭО лечат по стандартизированным протоколам. В Германии такие программы/ протоколы лечения называются исследования оптимизации терапии. По ним лечат всех заболевших детей. Это клинические исследования, они контролируются. Их цель – увеличивать эффективность лечения (медики говорят о долговременной выживаемости). Одновременно они стремятся снижать осложнения от лечения и отдалённые последствия на организм ребёнка.
В Германии детей с болезнями из семейства саркомы Юинга (саркома Юинга, ППНЭО, опухоль Аскина, саркома мягких тканей) лечат по международному протоколу EWING 2008. По этому исследовательскому протоколу работают многочисленные детские клиники и детские онкологические центры по всей Германии, а также клиники других европейских стран, США, Австралии и Новой Зеландии. Центральный исследовательский офис немецкой группы находится в клинике детской и подростковой медицины при университете г. Мюнстер (руководитель: профессор др. мед. Хериберт Юргенс).
Центральный исследовательский офис немецкой группы находится в клинике детской и подростковой медицины при университете г. Мюнстер (руководитель: профессор др. мед. Хериберт Юргенс).
Какие шансы вылечиться от саркомы Юинга?
У детей и подростков с саркомой Юинга прогноз болезни зависит от нескольких причин. Главными из них являются: где именно выросла опухоль, какого она размера, насколько болезнь успела распространиться по организму к моменту постановки диагноза и как опухоль ответила на курс химиотерапии [химиотерапия] до операции.
За последние десятилетия результаты лечения саркомы Юинга достигли большого прогресса. Этого удалось достичь благодаря тому, что лечение стало комбинированным, были введены более интенсивные курсы химиотерапии, и всех заболевших детей стали лечить по единым протоколам (исследования оптимизации терапии).
Ещё в 1960-ые годы, когда детей лечили либо только лучевой терапией, либо операцией, выживало менее 10%.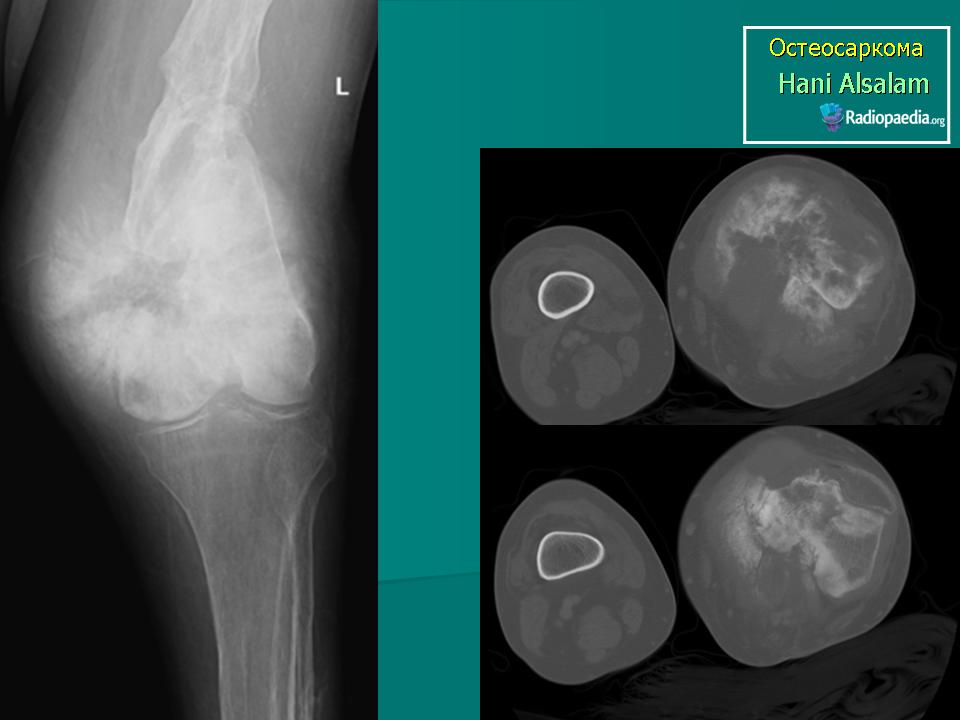 Сегодня, когда детей лечат комбинацией разных видов лечения (локальное лечение + химиотерапия), в среднем вылечивают около 65% детей, у которых в диагностике на снимках не было метастазов [метастазы]. О благоприятном прогнозе обычно говорят, если опухоль была полностью удалена хирургическим путём и болезнь хорошо отвечала на курс химиотерапии.
Сегодня, когда детей лечат комбинацией разных видов лечения (локальное лечение + химиотерапия), в среднем вылечивают около 65% детей, у которых в диагностике на снимках не было метастазов [метастазы]. О благоприятном прогнозе обычно говорят, если опухоль была полностью удалена хирургическим путём и болезнь хорошо отвечала на курс химиотерапии.
У детей, у которых в момент диагноза уже есть метастазы, прогноз в целом неблагоприятный даже несмотря на то, что они получают более интенсивные курсы химиотерапии (из них 5-летней выживаемости достигает в среднем около 25%). У детей с единичными метастазами в лёгких, которые можно хирургически удалить, шансы вылечиться выше, чем у детей с метастазами в костях или в костном мозге [костный мозг]. Также неблагоприятным является прогноз у тех детей, у которых болезнь возвращается, то есть наступает рецидив. Современные исследовательские протоколы стремятся найти новые подходы в лечении, чтобы улучшить шансы на выздоровление в том числе и этих пациентов.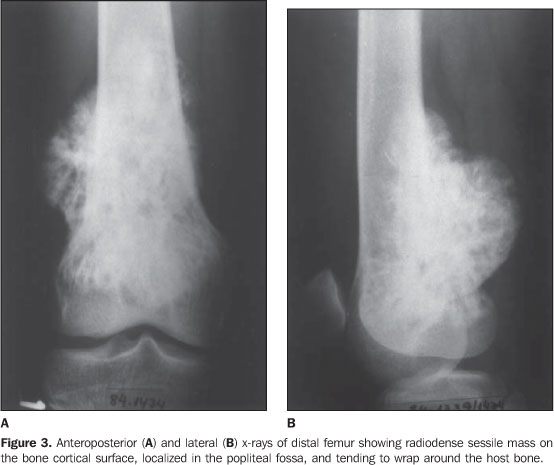
Необходимое замечание: когда мы называем проценты выздоровевших детей, это значит, что мы даём только точную статистику по этой форме рака у детей. Но никакая статистика не может предсказать, выздоровеет конкретный ребёнок, или нет. Сам термин «выздоровление» надо понимать прежде всего как «отсутствие опухоли». Потому что современные методы лечения могут обеспечивать долговременное отсутствие злокачественной опухоли. Но у них есть нежелательные побочные эффекты и поздние осложнения. Поэтому детям после лечения нужна интенсивная реабилитация. Также им нужна ещё долгое время помощь от специалистов в онкоортопедии.
Список литературы:
- Juergens C, Weston C, Lewis I, Whelan J, Paulussen M, Oberlin O, Michon J, Zoubek A, Jürgens H, Craft A: Safety assessment of intensive induction with vincristine, ifosfamide, doxorubicin, and etoposide (VIDE) in the treatment of Ewing tumors in the EURO-E. W.
 I. N.G. 99 clinical trial. Pediatric blood & cancer 2006, 47: 22 [PMID: 16572419]
JüR2006
I. N.G. 99 clinical trial. Pediatric blood & cancer 2006, 47: 22 [PMID: 16572419]
JüR2006 - Kaatsch P, Spix C: German Childhood Cancer Registry — Jahresbericht / Annual Report 2015 (1980-2014). Institut für Medizinische Biometrie, Epidemiologie und Informatik (IMBEI), Universitätsmedizin der Johannes Gutenberg-Universität Mainz 2015 [URI: https://www.kinderkrebsregister.de/ dkkr/ ergebnisse/ jahresbericht/ jahresbericht-2015.html] KAA2015a
- Dirksen U, Jürgens H: Ewing-Sarkome des Kindes- und Jugendalters. S1-Leitlinie der Gesellschaft für Pädiatrische Onkologie und Hämatologie (GPOH) AWMF online 2014 [URI: https://www.awmf.org/ uploads/ tx_szleitlinien/ 025-006l_S1_Ewing_Sarkome_Kinder_Jugendliche_2014-06-abgelaufen.pdf] DIR2014
- Haeusler J, Ranft A, Boelling T, Gosheger G, Braun-Munzinger G, Vieth V, Burdach S, van den Berg H, Jürgens H, Dirksen U: The value of local treatment in patients with primary, disseminated, multifocal Ewing sarcoma (PDMES).
 Cancer 2010, 116: 443 [PMID: 19924786]
HAE2010
Cancer 2010, 116: 443 [PMID: 19924786]
HAE2010 - Burkhardt B, Reiter A, Landmann E, Lang P, Lassay L, Dickerhoff R, Lakomek M, Henze G, von Stackelberg A: Poor outcome for children and adolescents with progressive disease or relapse of lymphoblastic lymphoma: a report from the berlin-frankfurt-muenster group. Journal of clinical oncology 2009, 27: 3363 [PMID: 19433688] BUR2009
- Wagner LM, McAllister N, Goldsby RE, Rausen AR, McNall-Knapp RY, McCarville MB, Albritton K: Temozolomide and intravenous irinotecan for treatment of advanced Ewing sarcoma. Pediatric blood & cancer 2007, 48: 132 [PMID: 16317751] WAG2007
- Gerth HU, Juergens KU, Dirksen U, Gerss J, Schober O, Franzius C: Significant benefit of multimodal imaging: PET/CT compared with PET alone in staging and follow-up of patients with Ewing tumors. Journal of nuclear medicine : official publication, Society of Nuclear Medicine 2007, 48: 1932 [PMID: 18006618] GER2007
- Germeshausen M, Skokowa J, Ballmaier M, Zeidler C, Welte K: G-CSF receptor mutations in patients with congenital neutropenia.
 Current opinion in hematology 2008, 15: 332 [PMID: 18536571]
GER2007
Current opinion in hematology 2008, 15: 332 [PMID: 18536571]
GER2007 - Bernstein M, Kovar H, Paulussen M, Randall RL, Schuck A, Teot LA, Jürgens H: Ewing’s sarcoma family of tumors: current management. The oncologist 2006, 11: 503 [PMID: 16720851] BER2006
- Hunold A, Weddeling N, Paulussen M, Ranft A, Liebscher C, Jürgens H: Topotecan and cyclophosphamide in patients with refractory or relapsed Ewing tumors. Pediatric blood & cancer 2006, 47: 795 [PMID: 16411206] HUN2006
- Hawkins DS, Schuetze SM, Butrynski JE, Rajendran JG, Vernon CB, Conrad EU 3rd, Eary JF: [18F]Fluorodeoxyglucose positron emission tomography predicts outcome for Ewing sarcoma family of tumors. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2005, 23: 8828 [PMID: 16314643] HAW2005
- Dirksen U, Poremba C, Schuck A: Knochentumoren des Kindes-und Jugendalters. Der Onkologe 2005, 10: 1034 DIR2005
- Niemeyer C, Kontny U: Tumoren der Ewing-Sarkom-Familie, in: Gutjahr P (Hrsg.
 ): Krebs bei Kindern und Jugendlichen. Deutscher Ärzte-Verlag Köln 5. Aufl. 2004, 491 [ISBN: 3769104285]
NIE2004
): Krebs bei Kindern und Jugendlichen. Deutscher Ärzte-Verlag Köln 5. Aufl. 2004, 491 [ISBN: 3769104285]
NIE2004 - Schuck A, Ahrens S, Paulussen M, Kuhlen M, Konemann S, Rube C, Winkelmann W, Kotz R, Dunst J, Willich N, Jürgens H: Local therapy in localized Ewing tumors: results of 1058 patients treated in the CESS 81, CESS 86, and EICESS 92 trials. Int J Radiat Oncol Biol Phys 2003, 55: 168 [PMID: 12504050] SCh3003g
- Paulussen M, Frohlich B, Jürgens H: Ewing tumour: Incidence, prognosis and treatment options. Paediatr Drugs 2001, 3: 899 [PMID: 11772151] PAU2001c
Саркома мягких тканей – причины, симптомы, стадии и лечение саркомы в клинике ЕМС в Москве
Лечение сарком мягких тканей и остеосарком в EMC проводится междисциплинарной командой специалистов, включающей в себя медицинских онкологов, радиологов, хирургов-ортопедов со специализацией в онкологии, патоморфологов и реабилитологов. План лечения пациента с диагнозом саркома разрабатывается на онкологическом консилиуме. Врачи Института онкологии EMC специализируются на лечении редких видов онкологических заболеваний с использованием современных методов хирургического лечения, лучевой и химиотерапии.
План лечения пациента с диагнозом саркома разрабатывается на онкологическом консилиуме. Врачи Института онкологии EMC специализируются на лечении редких видов онкологических заболеваний с использованием современных методов хирургического лечения, лучевой и химиотерапии.
Саркомы представляют собой редкую и разнородную группу злокачественных опухолей: менее 1% всех злокачественных новообразований у взрослых и около 12% случаев рака у детей. Приблизительно 80% сарком образуются из мягких тканей, остальные – из костной ткани.
Наиболее распространенные подтипы сарком мягких тканей у взрослых:
-
гастроинтестинальные стромальные опухоли (ГИСО, ГИСТ).
-
липосаркома
-
лейомиосаркома
-
недифференцированная плеоморфная саркома
- недифференцированная саркома мягких тканей и др.
Важно различать виды сарком, как с точки зрения прогноза, так и с точки зрения различий в лечении.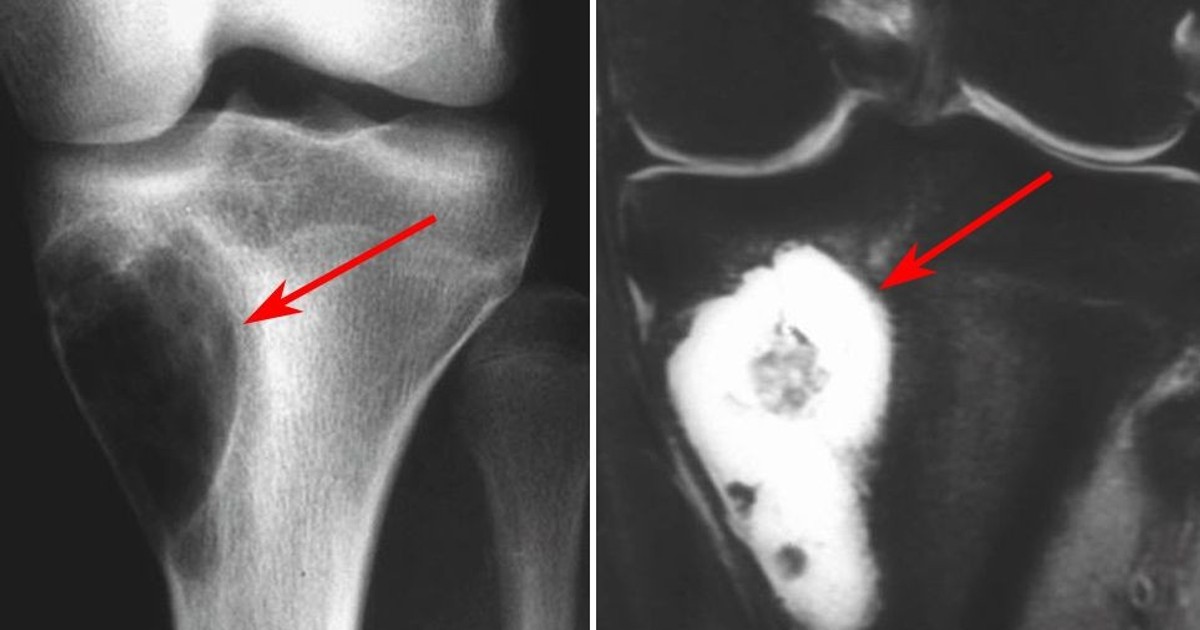 Это особенно важно для педиатрических опухолей, которые развиваются у взрослых, таких как рабдомиосаркома (РМС). Как эмбриональные, так и альвеолярные РМС более восприимчивы к химиотерапии и имеют лучший прогноз, чем многие типы сарком мягких тканей у взрослых. Тем не менее, плеоморфные РМС имеют относительно неблагоприятный прогноз, по сравнению с другими подтипами РМС. Такие опухоли преобладают у взрослых, и исходы при данном виде саркомы хуже, чем у детей.
Это особенно важно для педиатрических опухолей, которые развиваются у взрослых, таких как рабдомиосаркома (РМС). Как эмбриональные, так и альвеолярные РМС более восприимчивы к химиотерапии и имеют лучший прогноз, чем многие типы сарком мягких тканей у взрослых. Тем не менее, плеоморфные РМС имеют относительно неблагоприятный прогноз, по сравнению с другими подтипами РМС. Такие опухоли преобладают у взрослых, и исходы при данном виде саркомы хуже, чем у детей.
Этиология и патогенез
Почти во всех случаях саркомы возникают первично, а не развиваются из доброкачественных поражений. В большинстве случаев точная этиология неясна, но определено есть несколько сопутствующих или предрасполагающих факторов.
К ним относятся:
-
генетическая предрасположенность (например, синдром Ли Фраумени, нейрофиброматоз I типа, ретинобластома)
-
воздействие лучевой терапии или химиотерапии
-
химические канцерогены
-
лимфедема (отек мягких тканей пораженной области)
-
вирус иммунодефицита человека (ВИЧ) и вирус герпеса 8 типа (при саркоме Капоши)
Симптомы сарком мягких тканей
Наиболее частой жалобой при саркомах мягких тканей является постепенно увеличивающееся в размерах безболезненное объемное образование.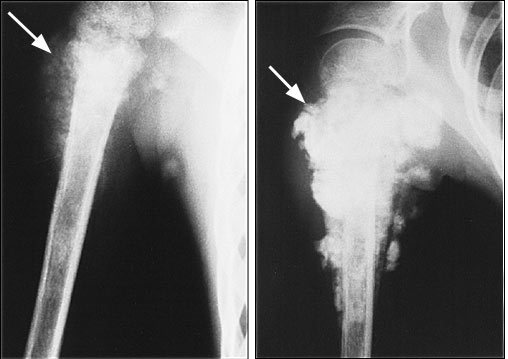 Опухоли могут достигать достаточно больших размеров, особенно в области бедра и забрюшинном пространстве. Некоторые пациенты жалуются на боль или симптомы, связанные со сдавлением объемным образованием, включая парестезии или отек конечности. В редких случаях у пациентов наблюдаются общие симптомы: лихорадка или снижение массы тела.
Опухоли могут достигать достаточно больших размеров, особенно в области бедра и забрюшинном пространстве. Некоторые пациенты жалуются на боль или симптомы, связанные со сдавлением объемным образованием, включая парестезии или отек конечности. В редких случаях у пациентов наблюдаются общие симптомы: лихорадка или снижение массы тела.
Саркомы мягких тканей могут развиваться в любой части тела, но чаще всего на конечностях.
По данным Американской коллегии хирургов локализация сарком мягких тканей распределяется следующим образом:
-
Бедро, ягодицы и паховая область – 46%
-
Верхние конечности – 13%
-
Туловище – 18%
-
Забрюшинное пространство – 13%
-
Голова и шея – 9%
Наличие отдаленных метастазов на момент первичного установления диагноза наблюдается нечасто, но более вероятно при крупных, глубоких саркомах высокой степени злокачественности.
Распространение в регионарные лимфоузлы при саркомах мягких тканей встречается редко.
Наиболее высокий риск метастазирования в лимфоузлы характерен для рабдомиосаркомы, синовиальной саркомы, эпителиоидной саркомы, светлоклеточной саркомы и сосудистых сарком (включая ангиосаркомы).
Рецидив после лечения саркомы мягких тканей может быть как локальным, так и в виде метастазирования. В 70-80 % метастазирование происходит в легкие.
Факторы прогноза при саркоме мягких тканей
Наиболее важными прогностическими факторами являются гистологическая оценка, размер опухоли и стадия на момент постановки диагноза.
В исследовании, проведенном Memorial Sloan Kettering Cancer Center (MSKCC) с использованием классификации злокачественных новообразований TNM, 5-летние показатели безрецидивной выживаемости для I, II и III стадии заболеваний составили 86, 72 и 52% соответственно.
Диагностика сарком мягких тканей
Первоначальная оценка пациента с подозрением на саркому мягких тканей начинается со сбора анамнеза.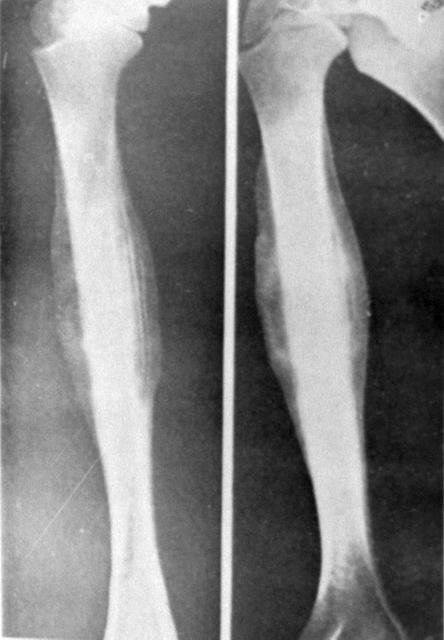 Устанавливается скорость роста опухоли и наличие симптомов, позволяющих предположить нейроваскулярное нарушение. При физическом обследовании уделяется особое внимание размеру и глубине расположения опухоли, ее связи с окружающими структурами, наличию сопутствующего отека или признаков вовлечения нервов.
Устанавливается скорость роста опухоли и наличие симптомов, позволяющих предположить нейроваскулярное нарушение. При физическом обследовании уделяется особое внимание размеру и глубине расположения опухоли, ее связи с окружающими структурами, наличию сопутствующего отека или признаков вовлечения нервов.
Нередко диагноз саркомы мягких тканей устанавливают поздно. Пациенты часто откладывают обращение за медицинской помощью, поскольку опухоль безболезненна.
Частичное иссечение опухоли до направления к специалисту может привести к появлению отдаленных метастазов и необходимости расширенной повторной резекции. Диагностическая биопсия, проведенная несоответствующим образом, может помешать последующему проведению хирургической резекции, косметическому восстановлению, или привести к необходимости более масштабного хирургического вмешательства. Поэтому рекомендовано как можно раньше обратиться в специализированное медицинское учреждение.
Диагностическое обследование опухолей мягких тканей включает в себя:
-
Магнитно-резонансную топографию (МРТ) при опухолях конечностей, туловища, области головы и шеи или компьютерную топографию (КТ) при опухолях брюшной полости и забрюшинного пространства
-
Толстоигольную биопсию с последующим морфологическим исследованием, если это технически выполнимо.
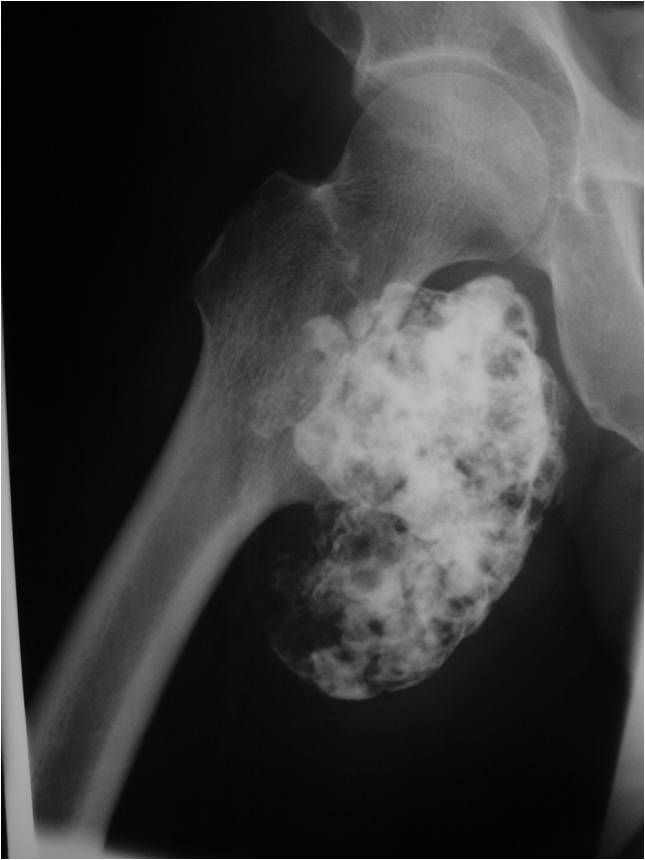 Если требуется открытая (инцизионная) биопсия, она должна быть тщательно спланирована и выполнена хирургом, который будет проводить тотальную резекцию.
Если требуется открытая (инцизионная) биопсия, она должна быть тщательно спланирована и выполнена хирургом, который будет проводить тотальную резекцию.
Морфологическое исследование образцов, подозрительных на саркомы мягких тканей, проводится в собственной гистологической лаборатории EMC. При необходимости материалы биопсии могут быть пересмотрены в лабораториях клиник-партнеров EMC в Израиле, Германии или США.
Как только диагноз саркомы мягких тканей подтвержден, проводится исследование органов грудной клетки всем пациентам, чтобы проверить наличие метастазов в легких. У пациентов с высоким риском метастазирования в легкие (опухоли >5 см, глубоко расположенные или имеющие среднюю или высокую степень злокачественности) используется КТ. При круглоклеточных/миксоидных липомах рекомендуется также КТ брюшной полости и таза, поскольку часто встречаются внелегочные метастазы в брюшной полости и забрюшинном пространстве.
Исследование с визуализацией головного мозга предлагается пациентам с ангиосаркомой и альвеолярной саркомой мягких тканей, поскольку эти опухоли характеризуются высокой склонностью к метастазированию в центральную нервную систему.
В повседневной практике позитронно-эмиссионная топография (ПЭТ) или ПЭТ/КТ для первичной оценки стадии при впервые установленном диагнозе саркомы мягких тканей не проводится. ПЭТ или сканирование с галлием может быть значимым у пациентов с нейрофиброматозом в качестве вспомогательного метода дифференциальной диагностики.
Лечение сарком мягких тканей
В большинстве случаев лечение сарком комбинированное. На выбор метода лечения влияет размер и расположение опухоли, степень злокачественности, а также распространенность процесса.
Хирургия как единственный метод лечения может применяться только в том случае, если опухоль высокодифференцированная и возможно ее радикальное удаление.
Хирургическое лечение сарком мягких тканей
Хирургическая резекция первичной опухоли является основным компонентом лечения практически всех пациентов с саркомами мягких тканей конечностей. У большинства пациентов возможна резекция опухоли с адекватными границами резекции, и этот метод позволяет сохранить функцию конечности; небольшой подгруппе пациентов может потребоваться первичная ампутация.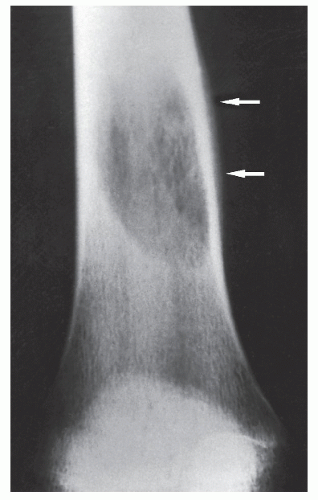
Резекция должна проводиться с захватом тканей, выходящих за пределы псевдокапсулы опухоли, если таковая есть, до достижения визуально здоровой, не вовлеченной в процесс ткани. Повреждение опухоли (т.е. рассечение опухоли или резекция, после которой остается макроскопический или микроскопический остаточный фрагмент опухоли) связано с более высокой частотой местного рецидива, даже если проводится лучевая терапия (ЛТ). Границы резекции служат наиболее важным показателем, который влияет на местный контроль опухоли.
Лучевая терапия сарком мягких тканей
Применение лучевой терапии в сочетании с резекцией снижает необходимость в ампутации и увеличивает вероятность удаления саркомы при сохранении функции конечности. В большинстве случаев сочетание операции с сохранением конечности и лучевой терапии обеспечивает лучший местный контроль.
Послеоперационная лучевая терапия значительно повлияла на частоту сохранения конечностей при саркомах мягких тканей конечностей.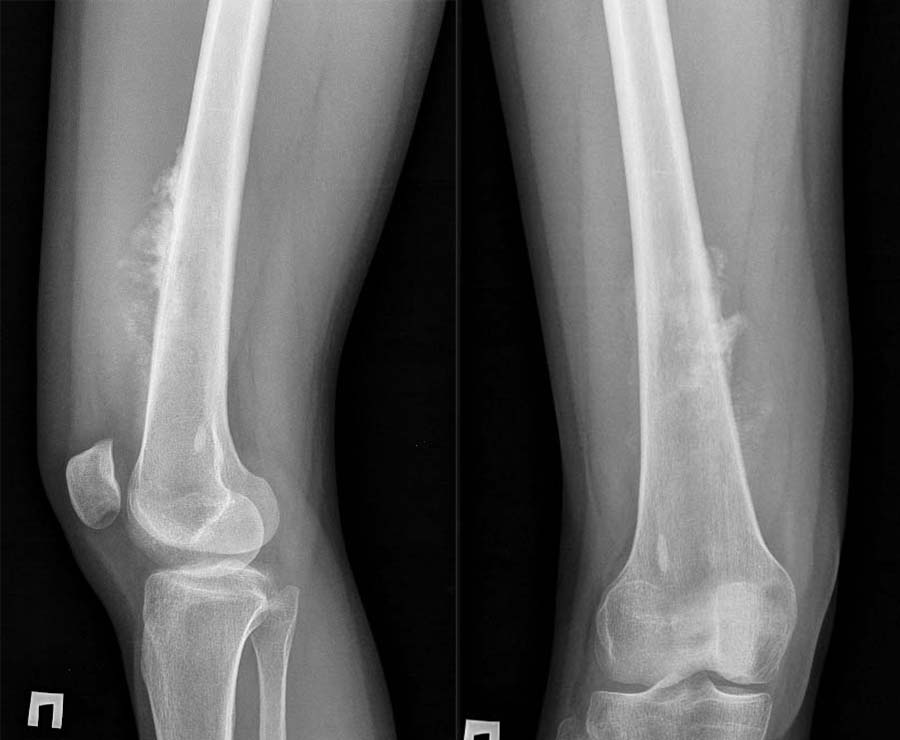 В 1970-е годы примерно половине пациентов с СМТ конечностей проводилась ампутация. С развитием лучевой терапии частота ампутаций сократилась почти до 1% без ощутимого снижения общей выживаемости.
В 1970-е годы примерно половине пациентов с СМТ конечностей проводилась ампутация. С развитием лучевой терапии частота ампутаций сократилась почти до 1% без ощутимого снижения общей выживаемости.
Метастазы саркомы. Химиотерапия.
Хирургическая резекция при метастатическом процессе обеспечивает долгосрочную безрецидивную выживаемость и, возможно, излечение у отдельных пациентов, у большинства из которых имеются изолированные метастазы в легких. Однако большинству пациентов с метастатическими саркомами мягких тканей химиотерапия назначается в качестве паллиативного лечения с целью уменьшения общего объема опухоли, уменьшения симптомов, улучшения качества жизни и увеличения выживаемости.
Естественное течение заболевания у пациентов с нерезектабельным метастатическим заболеванием может быть различным и в большей степени зависит от биологических особенностей опухоли, а не от лечения. У некоторых пациентов с бессимптомным нерезектабельным заболеванием низкой степени злокачественности может быть рациональным наблюдение за пациентом без активной химиотерапии. И, наоборот, у пациентов с опухолью высокой степени злокачественности, чувствительной к химиотерапии, такой как синовиальная саркома или липосаркома, может быть предпочтительным раннее начало комбинированной химиотерапии.
И, наоборот, у пациентов с опухолью высокой степени злокачественности, чувствительной к химиотерапии, такой как синовиальная саркома или липосаркома, может быть предпочтительным раннее начало комбинированной химиотерапии.
Что такое саркомы | Университетская клиника г. Фрайбурга
Диагноз по всем саркомам ставится на основании гистологического исследования ткани, образец которой берется посредством биопсии. При подозрении на саркому, забор пробы ткани проводится только врачами, имеющими опыт лечения сарком. Симптомы сарком могут быть следующие: на начальной стадии это часто – безболезненные местные опухания. И только позднее, в связи с вытесняющим ростом опухоли, могут возникнуть ограничения функций и болевые ощущения. Снижение веса тела, как правило, возникает на прогрессирующей стадии опухоли. Саркомы, находящиеся в брюшной области, часто дают симптомы слишком поздно. При наличии опуханий и симптомов, необходимо сделать визуализацию опухоли, лучше всего – с помощью МРТ, а уже после этого — биопсию.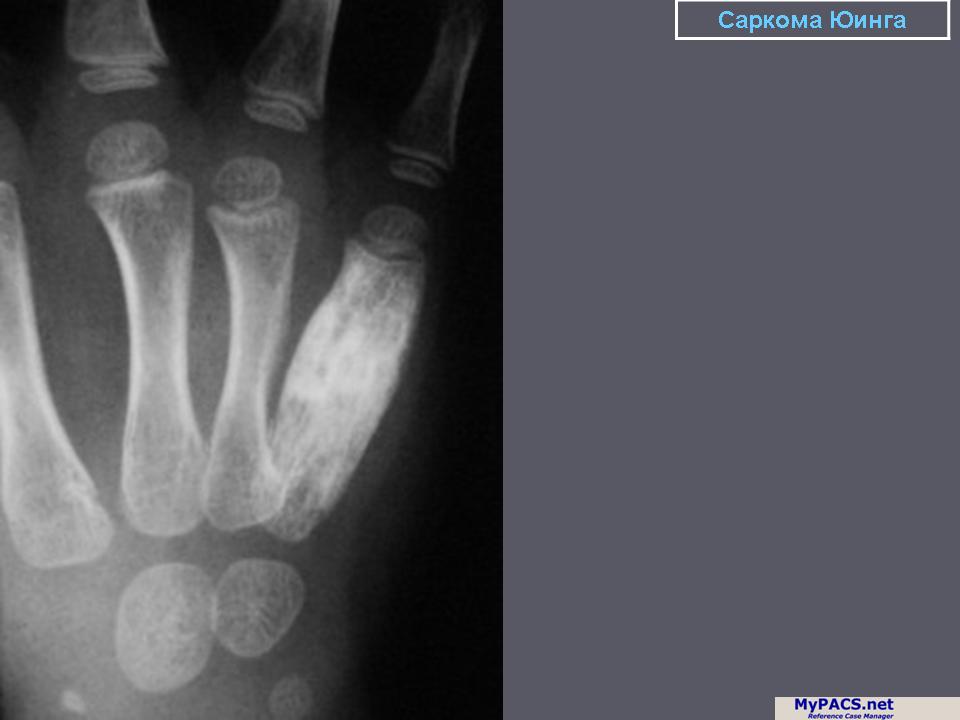 В зависимости от результатов исследования мягких тканей, проводятся последующие обследования, чтобы исключить наличие метастазов.
В зависимости от результатов исследования мягких тканей, проводятся последующие обследования, чтобы исключить наличие метастазов.
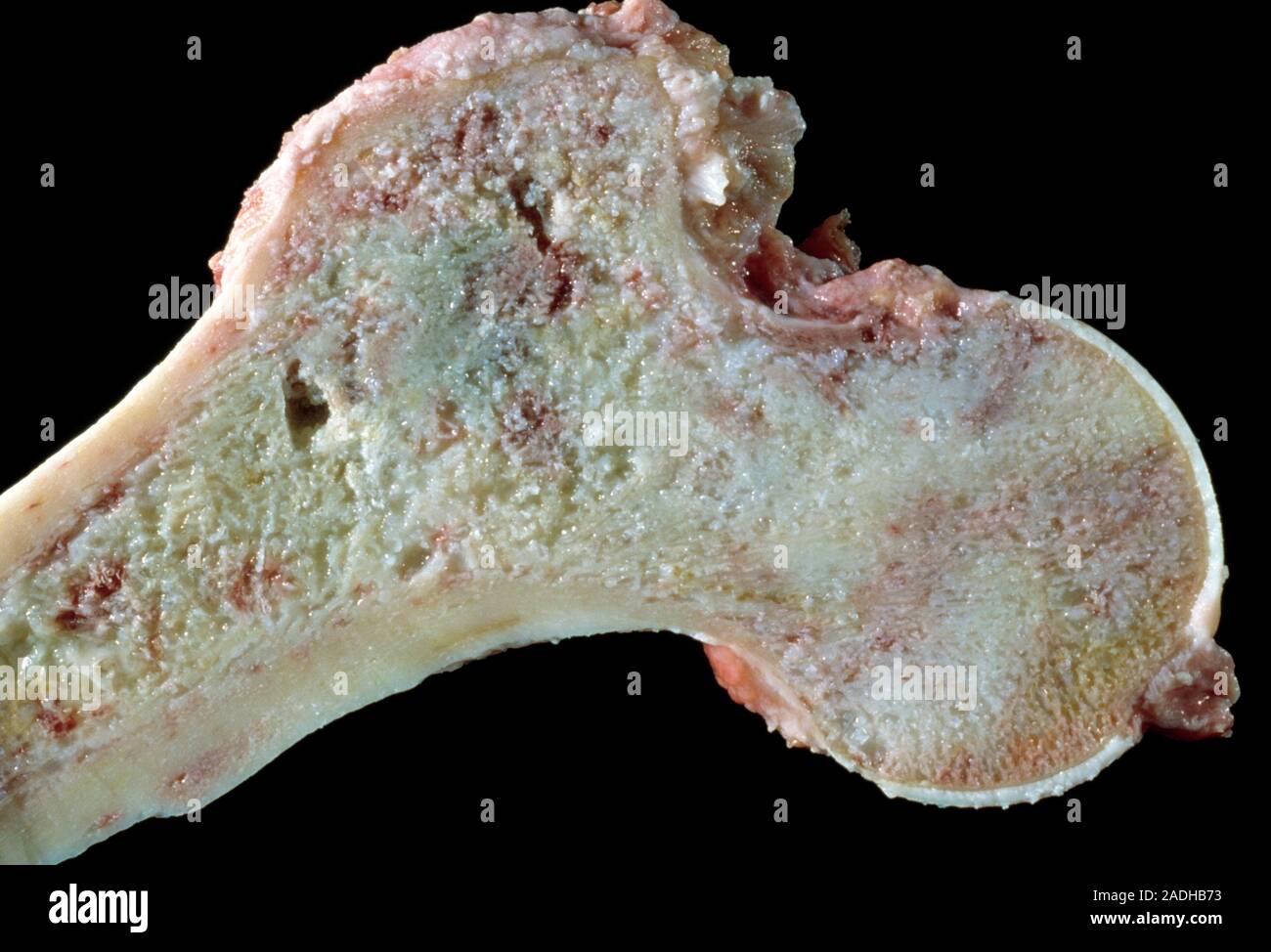
Остеосаркома также, сначала проявляет себя в виде опуханий, затвердеваний, перегрева и болей. В связи с вытесняющим ростом опухоли также могут возникнуть ограничения функций органов. Для подтверждения диагноза также служит биопсия, но до ее взятия следует сделать визуализацию опухоли. Часто, первым средством диагностики является обычный рентгеновский снимок, который затем дополняется снимком МРТ. После подтверждения диагноза делаются другие обследования, чтобы исключить наличие метастазов (рентген и КТ грудной клетки, сонография брюшной полости, сцинтиграфия костей скелета с применением 3-фазной цифровой техники, редко – ангиография). Поскольку при остеосаркоме, как правило, всегда проводится химиотерапия, следует сделать соответствующие обследования функций органов (эхо сердца, ЭКГ, функции почек, тест на слух).
При саркоме Эвинга также могут возникнуть местные боли, опухания, затвердения, перегрев, симптомы вытеснения с возможными нарушениями функций органов. И в этом случае следует подтвердить диагноз после визуализации, путем получения пробы ткани (биопсии) для дальнейшего исследования. Поскольку и в этих случаях всегда проводится химиотерапия, следует сделать соответствующие обследования функции органов, как при остеосаркоме.
И в этом случае следует подтвердить диагноз после визуализации, путем получения пробы ткани (биопсии) для дальнейшего исследования. Поскольку и в этих случаях всегда проводится химиотерапия, следует сделать соответствующие обследования функции органов, как при остеосаркоме.
Рак языка — ДЗМ
Представляет собой не самую частую форму среди онкологических заболеваний, но все же, он встречается достаточно регулярно, занимая большую часть случаев среди рака полости рта.
Рак языка — это опухоль злокачественного типа, основой образования которой являются клетки эпителия слизистой языка. Заболевание характеризуется диффузным или локальным типом уплотнения тканей органа, папилломатозными выростами, образованными на поверхности языка, а также язвами.
Вероятность возникновения рака языка с разной локализацией повышается с возрастом. Большинство лечащихся от этого заболевания людей мужчины от 40 и до 60 лет. После 80 лет — это заболевание редко начинает первоначально развиваться.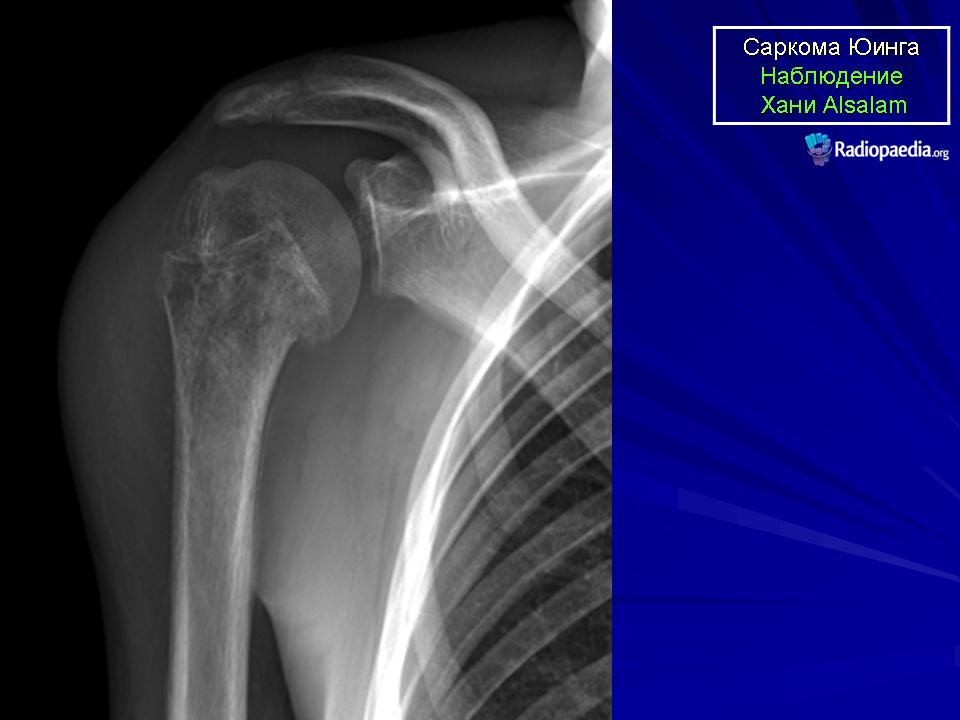 Имеются данные о выявлении рака языка и у маленьких детей, хотя для этого возраста эта патология не характерна.
Имеются данные о выявлении рака языка и у маленьких детей, хотя для этого возраста эта патология не характерна.
Причины и факторы риска.
Среди причин развития рака языка ведущее значение отводится внешним неблагоприятным факторам:
- Многолетнее курение и употребление алкогольных напитков. Сочетание двух данных факторов повышает вероятность злокачественного новообразования в ротовой полости в несколько раз: алкоголь значительно усиливает канцерогенные свойства табачных смесей.
- Хроническое механическое травмирование языка: ношение некачественно установленных протезов, при травмировании слизистого слоя краем отломленного зуба, регулярном прикусывании органа.
- Профессиональные вредности — работа с солями тяжелых металлов, продуктами нефтяной промышленности.
- Постоянное употребление слишком горячих, обжигающих слизистую оболочку языка блюд, постоянное употребление острых специй.
- Хроническое воспаление ротовой полости – стоматит, гингивит, гиперкератические формы системной красной волчанки, красный плоский лишай.
Выделяют и некоторые предраковые заболевания, при развитии которых риск образования злокачественной опухоли языка возрастает в несколько раз. К этим болезням относят:
- Болезнь Боуэна – образование одиночного пятна на языке, его поверхность гладкая. Очаг может западать или на его месте образуется эрозия (фото).
- Лейкоплакия – участок постоянного воспаления, может выглядеть как пятно беловатого цвета или разрастающаяся постепенно бородавка. Подобные изменения имеют тенденцию к ороговению.
Классификация рака языка.
Рак языка разделяют по его локализации в органе, форме, характеру роста и по гистологическому строению.
По локализации (расположению):
- Рак тела языка. Выявляется эта локализация примерно у 70% больных, обычно при таком расположении опухоль затрагивает боковые поверхности органа или его срединную часть.
- Рак корня языка выявляется в 20% случаев. Данная локализация также обозначается как рак ротоглотки. Возникновение злокачественных опухолей в задней половине ротовой полости всегда отличается более агрессивным течением.
- Раковое образование, локализующееся снизу языка. Обнаруживается в 10% случаев.
(рак корня языка)
По форме рак языка подразделяется на:
- Язвенную форму. На языке образуется язва, имеющая неровные и чаще кровоточащие края. Изъязвления затрагивают нижнюю часть языка и его середину.
- Инфильтративную форму. У пациента в толще языка можно пропальпировать бугристый, плотный комок – инфильтрат. Слизистый слой над уплотнением истонченный, при этой форме рака выражен болевой синдром. Инфильтрат в большинстве случаев образуется на кончике языка и в его задней части.
- Папиллярная форма выставляется, когда над языком в разных его отделах из слизистого слоя вырастает опухоль на тонкой или толстой ножке. Этот вид злокачественного новообразования характеризуется медленным ростом и обычно он затрагивает боковые части языка.
(начальная стадия папиллярной формы рака языка)
По характеру роста рак языка может быть:
- Экзофитной опухолью. При этом злокачественное новообразование растет в ротовую полость.
- Эндофитной опухолью. Расположение образования ограничено толщей органа.
Клинические проявления.
В развитии рака языка выделяют три стадии его формирования:
- начальную стадию,
- развитую
- запущенную.
Начальная стадия. Ей присуще малосимптомное течение, которое может быть незаметным для пациента. Первая стадия проявляется образованием на языке особых папиллярных выростов или же белесоватых пятен, которые часто путают с обычным налетом. Кроме того, могут образовываться локальные уплотнения, покраснения, которые появляются сразу на боковой части языка. Также может происходить увеличение подчелюстных лимфатических узлов.
Как правило, на начальной стадии не возникает болевой синдром, однако в редких случаях он может наблюдаться. Если боль всё же характерна для начальной стадии, то обычно она не имеет четкой локализации, поэтому часто воспринимается как кариес, периодонтит, глоссит, пульпит, травматическая глоссалгия или хронический тип тонзиллита.
Развитая стадия — выражена различной симптоматикой. Часто она сопровождается характерными болями самой разной интенсивности. Боль может быть разной локализации и иметь, так называемую, разлитую природу. Случается, что болевой синдром может переходить в другие области ротовой полости или даже в ухо.
При раздражении слизистой рта продуктами некроза может повышаться слюноотделение, а из-за распада опухоли у больных возникает неприятный запах изо рта. На этой стадии возникают сложности при глотании, больной ощущает онемение языка. Кроме болевых ощущений при глотании, могут наблюдаться трудности речи или произношения отдельных звуков.
Клинические проявления в соответствии с формой рака:
- Папиллярная — представлена в виде плотного выроста, расположенного над поверхностью слизистой, покрытой бляшкообразными или папиллярными наростами.
- Язвенная — встречается среди больных не так часто, почти в 2 раза реже папиллярной. Ей присуща язвенная поверхность, окруженная валиком, которая время от времени увеличивается в своих размерах. На первых этапах развития такой форме не будет характерна болезненность. Только спустя время, когда опухоль достигнет определенных размеров, будет выражена боль и характерная кровоточивость. Если язва инфицирована или к ней присоединилось дополнительное воспаление, тогда рак может маскироваться, что затрудняет его диагностику.
- Инфильтративная — будет отличаться стремительным ростом опухоли, направленным в толщу языка, что проявляется его уплотнением. Такой форме характерен диффузный характер. Распространяться она может на весь язык, приводя к плохой подвижности языка. Глубочайшие щелевидные язвы будут характерны для инфильтративно-язвенной формы рака языка.
Запущенная стадия. Характерно агрессивное течение и очень быстрый рост опухоли, который сопровождается еще и разрушением близ лежащих тканей, а также метастазированием в область региональных лимфоузлов (подбородочных, шейных, подчелюстных). Метастазы на данной стадии рака языка могут быть в легких, печени или головном мозге.
Общие симптомы наличия онкологического процесса:
- ощущение слабости,
- чувство хронической усталости,
- потеря аппетита,
- снижение массы тела,
- появление нарушения работы внутренних органов.
Диагностика.
Бессимптомное течение рака языка на ранней стадии не позволяет своевременно выявить заболевание.
Как правило, изменение слизистой на начальной стадии, выявленное при обычном осмотре или же при лечении кариеса, может не быть воспринято существенно, а принято за обычное травмирование, но никак не за рак. По этой же причине многие случаи рака языка могут быть диагностированы только на второй или третьей стадии.
Первичную диагностику, а именно осмотр и пальпацию новообразования, проводит онколог. Точный диагноз будет установлен только после полученных и изученных данных цитологического исследования мазка, взятого с поверхности такой язвы, а также после проведенного гистологического изучения опухоли посредством проведенной биопсии.
С целью выяснения того, насколько проросла опухоль внутрь органа и/или других структур ротовой полости (определение распространенности онкологического процесса) применяют методы инструментальной визуализации: УЗИ мягких тканей, рентгенографию, КТ лицевого черепа и ортопантомографию (рентгенологическое исследование, позволяющее получать развёрнутое изображение всех зубов с челюстями, прилежащими отделами лицевого скелета).
Для диагностики наличия метастазов рака языка используют: биопсию лимфатических узлов, МРТ и КТ головного мозга, рентгенографию органов грудной клетки, УЗИ печени или сцинтиграфии скелета.
! Дифференциальная диагностика рака языка должна быть проведена с доброкачественной опухолью языка, одной из форм первичного сифилиса, туберкулезной язвой и лейкоплаксией.
Лечение.
Комбинированное — лучевая терапия, оперативное и химиотерапевтическое.
Лучевая терапия.Как правило, проводится и до операции, и после. Осуществляется лучевая терапия двумя способами: дистанционно или методом внутритканевого облучения. Что касается последнего, то облучают первым делом первичный очаг и область метастазирования. Если опухоль большого размера, то это, как и инфильтративный рост, считается показанием для проведения сочетанного типа химиолучевой терапии.
Паллиативный вид лучевой терапии сочетают с химиотерапией среди пациентов с отдаленными метастазами.
Оперативное лечение.Проводится с целью ликвидации опухоли. Хирургическое лечение будет включать резекцию языка или проведение глоссэктомии. Если рак уже пророс в мягкую ткань вплоть до дна ротовой полости, захватив костные структуры, тогда операция будет сопровождаться резекцией пораженных тканей или челюстной кости.
Пластическая хирургияВ дальнейшие периоды послеоперационного восстановления могут быть применены методы пластической хирургии с целью возвращения утраченных структур челюстно-лицевой области. Если произошло метастазирование рака языка в лимфоузлы, тогда они должны быть тоже удалены.
Профилактика.
- Профилактические меры для предотвращения рака языка заключаются в
- Проведении самостоятельных осмотров ротовой полости и языка
- Прохождении профилактических осмотров у специалистов
- отказе от вредных привычек (в отказе от приема алкоголя и курения)
- ликвидации причин, спровоцировавших травмирование слизистой оболочки языка — хорошая обработка пломб после их установки, правильный подбор и установка зубных протезов, а также лечение зубных сколов
- Проведении гигиены полости рта также является важной профилактической мерой.
Рак кости — цены на лечение, симптомы и диагностика рака кости в Москве
Особенности заболевания
Само название «рак кости» не совсем точное, так как костная ткань является разновидностью соединительной. Исходя из этого, новообразования называются саркомами. Различают первичный (встречается достаточно редко) и вторичный рак, который развивается из метастазов опухолей других органов.
Выделяют несколько основных видов рака кости:
- хондросаркома – самый распространенный тип первичного костного рака, развивающийся из хрящевой ткани;
- остеосаркома, развивающаяся из клеток – предшественников костной, хрящевой, мышечной и других тканей;
- хордома – медленно растущая опухоль, локализующаяся в основании черепа и в позвоночнике;
- недифференцированная плейоморфная саркома высокой степени, местом локализации которой являются ноги, руки, челюсть.
Также выделяют несколько типов редких опухолей:
- фибросаркому, формирующуюся из мягких соединительных тканей и локализующуюся в основном в ногах;
- саркому Юинга, диагностируемую преимущественно у молодых людей и подростков;
- ангиосаркому – агрессивный тип опухоли, областью локализации которой являются кости ног и таза.
В соответствии с международной системой разработана классификация патологии в зависимости от стадийности:
- 1 стадия, на которой опухоль не выходит за пределы кости, не метастазирует и не поражает лимфоузлы;
- 2 стадия характеризуется малигнизацией клеток новообразования, но оно всё ещё не выходит за пределы кости;
- 3 стадия, на которой опухоль поражает несколько участков кости;
- 4 стадия – прорастание опухоли в соседние с костью ткани и образование метастазов.
Факторы риска возникновения рака кости
По мнению учёных, причинами развития злокачественных опухолей являются мутации ДНК. В результате определённых процессов активизируются онкогены и подавляются гены, препятствующие росту раковых клеток. Иногда мутации происходят из-за наследственной предрасположенности, но в большинстве случаев – это результат травм или воздействия каких-либо факторов.
Факторы риска, увеличивающие вероятность развития онкопатологии:
- стресс;
- частые механические травмы костей;
- воздействие радиации;
- перенесённая лучевая терапия по поводу других онкологических заболеваний;
- наследственные заболевания;
- болезнь Педжета;
- плохая экологическая обстановка в локации постоянного проживания.
Симптомы рака кости
На ранних стадиях заболевания симптомы практически не проявляются. Единственное, что может беспокоить пациента, боль в кости или в суставе. Сначала она ощущается только при надавливании, но по мере роста опухоли начинает беспокоить постоянно. Болевые ощущения усиливаются во время физической активности.
Другие симптомы, которые могут указывать на развитие патологического процесса:
- отечность в области поражения;
- чрезмерная жёсткость в суставе или мягкость кости;
- деформация кости;
- необъяснимый перелом;
- потеря чувствительности в поражённой конечности;
- появление хромоты, ограничения в подвижности;
- слабость, быстрая утомляемость;
- повышенная температура.
Появление одного или нескольких симптомов не означает, что у пациента развивается онкопатология. Но это повод обратиться за консультацией к специалисту. Важно понимать, что эффективность лечения на ранних стадиях намного выше. Поэтому необходимо проходить ежегодные скрининговые исследования CheckUp.
Возможные варианты диагностики рака кости
Костную онкопатологию достаточно трудно диагностировать, диагноз ставится после получения результатов комплексного обследования. Сначала врач собирает анамнез на основании осмотра пациента и опроса о жалобах. Далее назначаются дополнительные исследования:
- рентгенография для выявления аномалий и повреждений в структуре кости;
- анализы крови и мочи для оценки общего состояния здоровья;
- КТ, МРТ для визуализации изменений в структуре костей, которые остались невидимыми на рентгенографии;
- ПЭТ-сканирование, позволяющее выявить следы онкопатологии в костях;
- биопсия – забор образцов ткани поражённой кости для развёрнутого исследования.
Биопсия может быть сделана через тонкую иглу во время КТ или через хирургический разрез под общей анестезией. При подозрении на саркому Юинга предварительно проводится генетический анализ на определение специфического маркера заболевания.
Возможные варианты лечения рака кости
Для лечения патологии применяются разные методики:
- хирургическое лечение;
- лучевая терапия;
- химиотерапия;
- таргетная терапия;
- иммунотерапия.
План лечения разрабатывается индивидуально, с учётом типа опухоли, стадийности, общего состояния здоровья пациента. В большинстве случаев проводится хирургическая операция. Золотой стандарт современной хирургии – выполнение органосохраняющих операций, поэтому применяются щадящие методики. Задача оперативного вмешательства – удалить опухоль и прилегающие к ней здоровые ткани. Для восстановления повреждённой области используется костный цемент или же проводится пересадка костной ткани из других участков тела.
Лучевая и химиотерапия могут назначаться в качестве самостоятельного лечения или в комбинации с операцией. В основе методов – подавление роста раковых клеток. Таргетная терапия применяется для лечения неоперабельных и устойчивых к химиотерапии опухолей.
В процессе реабилитации применяется физиотерапия, помогающая восстановить прежний объём движений и выносливость. Так как рак кости склонен к рецидивированию, пациентам, перенесшим удаление опухоли, необходимо периодически проходить рентгенографическое обследование.
Советы по профилактике рака кости
Специальной профилактики рака костей не существует. Единственный общий метод профилактики раковых заболеваний — ежегодное профилактическое обследование (CheckUp). Также следует избегать попадания в организм радионуклидных веществ, при наличии доброкачественных новообразований необходимо постараться минимизировать воздействие ионизирующего излучения.
Саркома костей
Наверняка Вы задаётесь вопросом: что же теперь делать?
Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать».
Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни. Мы поможем вам справиться с болезнью и будем идти с Вами рука об руку через все этапы вашего лечения.
Что такое саркома костей?
Филиалы и отделения, где лечат саркомы костейМНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
ВведениеОпухоли костей – это обобщающее понятие, которое включает в себя все доброкачественные и злокачественные новообразования, поражающие скелет человека.
Скелет — совокупность костей человеческого организма. Служит опорой мягким тканям, точкой приложения мышц, вместилищем и защитой внутренних органов. Скелет взрослого человека состоит из 205—207 костей. Почти все они объединяются в единое целое с помощью суставов, связок и других соединений.
Статистика саркомы костей (эпидемиология)Первичные злокачественные опухоли костей составляют 0,001% от всех впервые выявленных злокачественных новообразований. В России заболеваемость первичными злокачественными опухолями костей составляет 1,03 случая на 100 тыс. населения, что соответствует данным по заболеваемости в других странах.
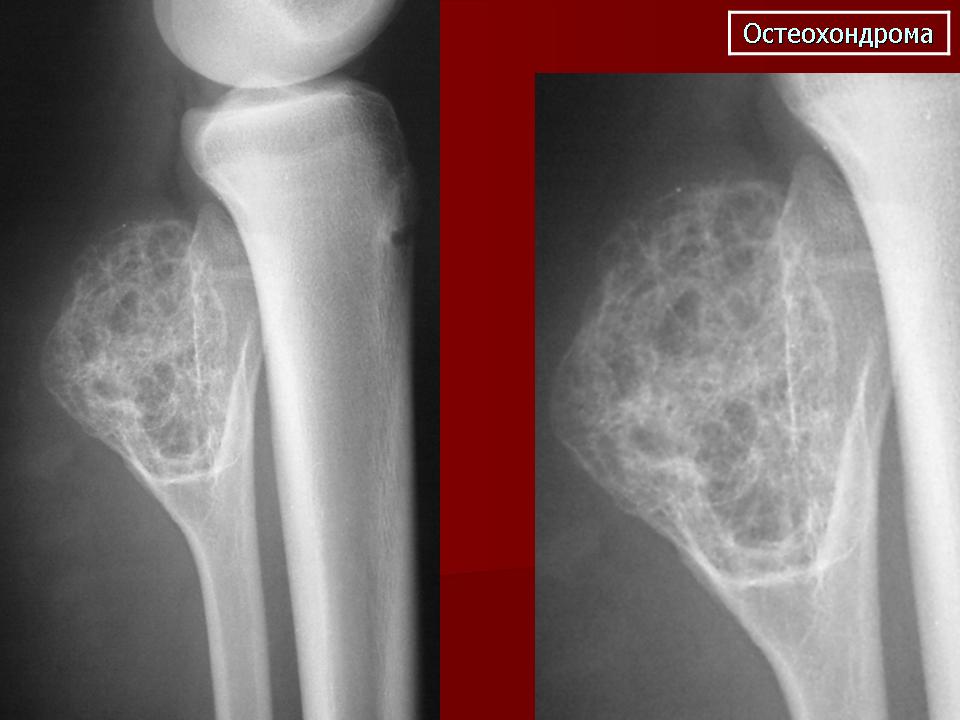
Морфологическая классификация опухолей костей:-
Доброкачественные опухоли костей
- Остеома
- Остеоид — остеома
- Остеохондрома
- Хондрома.
-
2. Злокачественные опухоли костей
- Злокачественная фиброзная гистиоцитома
- Остеосаркома
- Саркома Юинга;
- Хондросаркома.
- Метастазы в кости опухолей различных локализаций
- Пограничные опухоли костей – Гигантоклеточная опухоль.
Клиническая классификация TNM
Т — первичная опухоль
Тх — оценка первичной опухоли невозможна.
Т0 — первичная опухоль не обнаружена.
Т1 — опухоль размером до 8 см в наибольшем измерении.
Т2 — опухоль размером более 8 см в наибольшем измерении.
Т3 — множественные опухоли в кости первичного очага.
N — регионарные лимфатические узлы
Nx — состояние регионарных лимфатических узлов оценить невозможно.
N0 — метастазов в регионарных лимфатических узлах нет.
N1 — метастазы в регионарных лимфатических узлах имеются.
М — отдаленные метастазы
Мх — наличие отдаленных метастазов оценить невозможно.
М0 — отдаленных метастазов нет.
M1 — наличие отдаленных метастазов:
М1а — метастазы в легкие;
M1b — метастазы иной локализации.
G — гистопатологическая дифференцировка
Gх — степень дифференцировки не может быть установлена.
G1 — высокая степень дифференцировки.
G2 — средняя степень дифференцировки.
G3 — низкая степень дифференцировки.
G4 — недифференцированные опухоли.
Боль – самый ранний признак. Для начала болезни характерна тупая, ноющая боль без четкой локализации в кости. Дальнейшее развитие заболевания приводит к появлению невыносимо сильной боли, пик приходится на ночное время, не купируется обычными анальгетиками. У более чем половины пациентов на месте роста опухоли пальпируется припухлость по плотности мягче костной ткани. Пораженная конечность отекшая, может быть покраснение кожи.
Причины возникновения саркомы костей и факторы рискаК факторам риска развития сарком костей можно отнести предшествующую лучевую терапию, состояние иммунодефицита, болезнь Педжета, болезнь Олье, доброкачественные опухолевые поражения кости так же могут приводить к злокачественной трансформации. Однако, у большинства пациентов специфических этиологических факторов не выявляется.
Диагностика саркомы костей·Для верификации онкопроцесса поразившего кость и определения дальнейшей тактики лечения, необходимо определить гистологический тип опухоли. “Золотым стандартом” — является выполнение трепан-биопсии либо открытой биопсии.
·Компьютерная томография легких. Наиболее часто саркомы костей метастазируют в легкие, а разряжающая возможность флюорографии и рентгеновского исследования невелика, поэтому пациентам с саркомами костей необходимо выполнение компьютерной томографии органов грудной клетки.
·Компьютерная томография или магнитно-резонансная томография первичного очага опухоли. Эти исследования позволяют адекватно оценить распространенность опухолевого процесса, прилежание опухоли к магистральным сосудисто-нервным структурам, степень вовлечения прилежащих мягких тканей.
·Ультразвуковое исследование брюшной полости, печени, прилежащих зон регионарного лимфооттока. Саркомы костей редко метастазируют в печень и регионарные лимфотические коллекторы (3-5%) и наличие метастазов в них является неблагоприятным прогностическим фактором, однако проводить исследование этих областей так же необходимо.
·Сцинтиграфия костей. Второй по частоте развития метастазов сарком костей точкой являются кости, поэтому проведение сцинтиграфии для таких пациентов обязательно.
·Так же необходимо диагностировать и вовремя назначить коррегириующую терапию сопутствующих хронических либо впервые выявленных заболеваний – сахарный диабет, различные кардиальные патологии, нарушения дыхания, нарушения работы почек и прочие.
Лечение саркомы костейВ первую очередь следует рассматривать возможность выполнения органосохранных операций. Главным условием операбельности пациентов является радикальность и абластичность удаления опухоли, что гарантирует отсутствие местного рецидива.
Сотрудники ФГБУ «НМИЦ радиологии» Минздрава России владеют всеми современными методиками органосохранной хирургии опорно – двигательного аппарата:
· Эндопротезирование онкологическим эндопротезом плечевого сустава.
· Эндопротезирование онкологическим эндопротезом тазобедренного сустава.
· Эндопротезирование онкологическим эндопротезом коленного сустава.
· Тотальное эндопротезирование бедренной кости.
· Модульное эндопротезирование вертлужной впадины после удаления опухолей костей таза.
· Эндопротезирование тел позвонков на всех уровнях позвоночного столба.
· Эндопротезирование онкологическим эндопротезом лучезапястного сустава.
· Эндопротезирование онкологическим эндопротезом локтового сустава.
· Реконструкция удаленных фрагментов костей при помощи ауто/аллопластики.
· Резекция костей плечевого пояса (лопатка, ключица).
· Резекции ребер и грудной стенки.
· Использование собственной кости пациента для замещения дефекта после операции.
· Вертебропластика.
· Онкологическое эндопротезирование, металлолстеосинтез.
· Расширенные операции при массивных опухолях плечевого пояса (межлопаточно-грудная ампутация).
При невозможности выполнения органосохранных операций необходимо выполнение калечащих операций в радикальном объеме. Ампутация или экзартикуляция конечности выполняются в следующих случаях:
- обширное первично-множественное распространение опухоли;
- вовлечение в опухолевый процесс магистрального сосудисто-нервного пучка.
- технически исключающий проведение реконструктивно-пластического этапа операции;
- прогрессирование на фоне предоперационной химиотерапии;
- отказ пациента от органосохранной операции;
- жизненные показания к экстренной хирургии – распад опухоли, кровотечения.
Так же в клинической практике лечения злокачественных поражений костей применятся лучевая и химиотерапия.
Осложнения противоопухолевого лечения саркомы костей и их коррекцияОдним из главных типов осложнений после выполненных операций являются инфекционные и механические. Данные проблемы являются актуальными не только, для онкоортопедии но и для классической травматологии — ортопедии. Разработаны и внедрены алгоритмы по борьбе с данными типами осложнений.
Особенности реабилитации после лечения саркомы костейРеабилитация пациентов, которым было проведено хирургическое лечение по поводу опухолевого поражения костей в нашем отделении – является одной из приоритетных задач для врачей нашего центра. Этот процесс включает себя большое количество специалистов: онкологов, врачей ЛФК, неврологов и даже психологов. Хорошее психоэмоциональное состояние пациента, является одним из главных факторов для более быстрой реабилитации больного. Для каждого пациента подбирается индивидуальный план реабилитационных мероприятий. Как правило на 2-3 сутки после операции пациент встает на ноги и начинает получать минимальные нагрузки. C каждым днем нагрузка увеличивается, под чутким контролем врачей. В большинстве случаев пациент, получивший у нас лечение, покидает нас на своих ногах и с огромной мотивацией на быстрое выздоровление.
Прогноз заболевания саркомы костейВажно понимать, что течение болезни индивидуально и не всегда возможно предугадать его течение. Оно может благоприятным или неблагоприятным, но бывают исключения из правил, как их плохих, так и из хороших. Неблагоприятными факторами, которые могут влиять на выживаемость являются: высокая степень злокачественности, размеры первичной опухоли, локализация опухоли в костях таза и позвоночнике, слабая реакция опухоли не проводимую химиотерапию, выраженная сопутствующая патология. При проведении правильного лечения общая пятилетняя выживаемость больных с высокозлокачественными саркомами костей составляет до 75%. При опухолях низкой степени злокачественности она выше и может достигать 90%.
Филиалы и отделения, в которых лечат саркомы костейФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, лекарственного и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Хирургическое отделение онкологической ортопедии МНИОИ им. П. А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России
Контакты: (495) 150 11 22
Отделение комбинированного лечения опухолей костей, мягких тканей и кожи МРНЦ имени А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделения: Александр Александрович Курильчик
Контакты: 8 (484) 399 31 30
Рак желудка: описание заболевания | Клиника Рассвет
Рак желудка — злокачественное образование слизистой оболочки желудка, находящееся на 6 месте в структуре заболеваемости онкологическими заболеваниями в России (в 2017 г. в РФ раком желудка заболело 37291 человек).
Рак желудка обычно развивается в клетках, которые вырабатывают слизистый секрет, эти клетки расположены в слизистой оболочке желудка. Этот тип рака называется аденокарцинома.
За последние несколько десятилетий заболеваемость раком желудка снижается во всем мире. В то же время, рак в области, где верхняя часть желудка (кардия) встречается с нижним отделом пищевода, становится гораздо более распространенным заболеванием.
Эта область желудка называется гастроэзофагеальным переходом. А рак в этой зоне – гастроэзофагеальным раком.
Какие симптомы у рака желудка?
Признаки и симптомы гастроэзофагеального рака и рака желудка:
- Чувство вздутия после еды
- Чувство сытости после приема небольшого количества пищи
- Сильная, постоянная изжога
- Выраженные, частые желудочные расстройства
- Необъяснимая, стойкая тошнота
- Боль в животе
- Частая рвота, обычно связанная с приемом пищи
- Непреднамеренная потеря веса
- Усталость
Когда стоит обратиться к врачу?
Если у вас есть признаки и симптомы, которые вас беспокоят, запишитесь на прием к врачу. В клинике Рассвет работает мультидисциплинарная команда высококвалифицированных специалистов — гастроэнтерологов, терапевтов, диетологов, к которым вы можете обратиться за помощью.
Врач сначала изучит более распространенные причины этих признаков и симптомов, а при выявлении опухолевого процесса направит на консультацию к врачу-онкологу клиники Рассвет.
Причины рака желудка
Рак возникает тогда, когда количество приобретенных мутаций в ДНК определенной популяции клеток, вызванных различными причинами, позволяет им бесконтрольно делиться и «прятаться» от иммунной системы.
Накапливающиеся раковые клетки образуют опухоль, которая способна проникать в близлежащие структуры. Раковые клетки могут отделяться от опухоли и распространяться по всему телу. Это называется метастазирование.
Несмотря на то, что основная причина развития рака желудка до сих пор не ясна, есть четкие представления о факторах риска и предрасполагающих факторах.
В последние годы набирает обороты доказательная база связи рака желудка с инфицированностью бактерией Helicobacter pillory, которая часто вызывает хронический гастрит и язвенную болезнь желудка.
Существует доказанная связь между диетой с высоким содержанием соленой и копченой пищи и раком, расположенным в основной части (теле) желудка. По мере расширения использования холодильной техники для сохранения пищевых продуктов во всем мире снизились показатели заболеваемости раком желудка.
Факторы риска
Основными факторами риска развития кардиоэзофагиального рака являются ГЭРБ и ожирение в анамнезе.
Факторы, повышающие риск заболевания раком тела желудка, включают:
- Диета с высоким содержанием соленой и копченой пищи
- Диета с низким содержанием фруктов и овощей
- Случаи рака желудка в семье
- Инфекция Helicobacter pylori
- Длительно существующее воспаление желудка
- Пернициозная (В12) анемия
- Курение
- Полипы желудка
Рекомендации врачей клиники Рассвет по профилактике рака желудка
До конца остается невыясненным, какой именно ключевой фактор вызывает гастроэзофагеальный рак или рак тела желудка, поэтому его невозможно предотвратить. Но Вы можете предпринять меры для снижения риска развития этого грозного заболевания.
Для этого необходимо внести небольшие изменения в вашу повседневную жизнь:
- Контролируйте свой вес. При наличии признаков ожирения проконсультируйтесь с диетологом по вопросам изменения пищевого поведения.
- Постарайтесь быть физически активными большую часть дней в неделе. Регулярные физические упражнения связаны со снижением риска заболевания раком желудка.
- Ешьте больше фруктов и овощей. Старайтесь ежедневно добавлять в рацион больше фруктов и овощей. Важно не только количество, но и разнообразие, доказано, что употребление в течение дня 5 и более видов овощей и/или фруктов значительно снижает риск рака желудка.
- Уменьшите потребление соленой и копченой пищи.
- Откажитесь от курения. Если куришь — бросай. Если не куришь — не начинай. Курение повышает риск заболевания не только раком желудка, но и многих других видов рака. Бросить курить самостоятельно может быть очень сложно, вы можете обратиться к врачам клиники Рассвет, вам предоставят практические советы и информацию о существующих медикаментах, позволяющих облегчить отказ от курения.
Диагностика рака желудка
Исследования и процедуры, используемые для диагностики гастроэзофагеального рака и рака тела желудка, включают следующее:
ЭГДС – это эзофагогастродуоденоскопия, исследование, при котором с помощью маленькой видеокамеры производится осмотр слизистых оболочек пищевода, желудка, двенадцатиперстной кишки.
Во время этого исследования с помощью специальной видеокамеры врач осматривает слизистые оболочки и ищет признаки опухолевого процесса. При обнаружении подозрительных участков проводится забор кусочка ткани для анализа, это биопсия.
Биопсия ткани крайне важна, так как ткань подвергается современной патоморфологической диагностике, с проведением гистологического, а в ряде случаев иммуногистохимического и молекулярно–генетического исследования — это позволяет поставить правильный диагноз и назначить лечение.
Эндоскопическая ультрасонография – это ультразвуковое исследование, которое выполняется специальным датчиком, встроенным в эндоскоп, то есть исследование делается непосредственно стенки желудка. Это необходимо для оценки истинной глубины прорастания, чего не видно другими методами, для выделения пациентов, которым может быть выполнена эндоскопическая резекция слизистой с диссекцией подслизистого слоя – современный миниинвазивный вид лечения раннего (только!) рака желудка.
Лучевая диагностика. Для выявления рака желудка используются такие методы, как компьютерная томография (КТ) и специальный вид рентгеновского исследования – ренгеноскопия с контрастированием, когда пациент проглатывает специальное ренгенконтрастное вещество, которое позволяет выявить опухолевые изменения. Это исследование позволяет оценить проходимость пищевода и желудка, что особенно актуально при явлениях стеноза – затруднения прохождения пищи и воды через суженный из-за опухолевого роста просвет желудка.
Дополнительные исследования, необходимые для определения распространенности опухолевого процесса. Они могут включать КТ и МРТ других отделов организма для исключения отдаленного метастазирования. Определение стадии развития рака необходимо врачу для выбора наиболее подходящего для вас лечения.
Радионуклидное исследование, которое может быть выполнено при появившихся болях в костях – остеосцинтиграфия, позволяющая оценить поражение костей скелета.
Для определения стадии рака используются следующие методики и процедуры:
- Лучевая диагностика, которая включает методики, компьютерную томографию, магнитно-резонансную томографию, позитронно-эмиссионную томографию (ПЭТ).
- Для оценки общего состояния пациента обязательно применяются различные клинические анализы крови.
- Диагностическая операция. Если другими методиками невозможно достоверно установить распространенности опухолевого процесса, врач может порекомендовать операцию для поиска признаков того, что рак распространился за пределы пищевода или желудка, в грудной или брюшной полости. Такая операция обычно проводится лапароскопически. Это означает, что хирург делает несколько небольших разрезов, через которые в живот вводится специальная камера, которая передает изображения на монитор в операционной.
В зависимости от ситуации могут использоваться и другие методы.
Стадии рака желудка
Выделяют следующие стадии аденокарциномы желудка или пищевода:
- I стадия. На этом этапе опухоль ограничивается слизистой оболочкой, которая покрывает внутреннюю часть пищевода или желудка.
- II стадия. Рак на этом этапе распространился глубже, прорастая в более глубокий мышечный слой пищевода или стенки желудка. Рак может распространиться и на лежащие рядом с желудком лимфатические узлы, это регионарные метастазы.
- III стадия. На данном этапе рак может распространиться через все слои пищевода или желудка и распространиться на соседние структуры. Или это может быть опухоль меньшего размера, которая более широко распространилась на лимфатические узлы.
- IV стадия. Она указывает на то, что рак распространился на отдаленные участки тела и имеются отдаленные метастазы.
Как лечить рак желудка
В клинике Рассвет для лечения злокачественных опухолей желудка применяется тактика мультидисциплинарного подхода с обсуждением сложных случаев на консилиуме с привлечением хирурга, химиотерапевта и радиотерапевта.
У нас есть все необходимое для проведения химиотерапии по российским и западным протоколам, проведения сопроводительной терапии и при необходимости маршрутизации пациента на другие методы лечения.
Автор:
Стадии остеосаркомы
После того, как кому-то поставят диагноз остеосаркома, врачи попытаются выяснить, распространилась ли она, и если да, то как далеко. Этот процесс называется staging . Этап описывает, сколько рака находится в организме. Это помогает определить, насколько серьезен рак и как лучше его лечить. Врачи также используют стадию рака, когда говорят о статистике выживаемости.
Стадия остеосаркомы определяется на основании результатов физического осмотра, визуализационных тестов и любых выполненных биопсий, которые описаны в разделе «Тесты на остеосаркому».
Локализованный против метастатического
Врачи используют официальные системы стадирования (см. Ниже) для подробного описания степени остеосаркомы. (Система стадирования — это стандартный способ описания степени рака.) Но, пытаясь определить наилучшее лечение, врачи часто используют более простую систему, которая разделяет остеосаркомы на 2 основные группы: локализованные и метастатический .
Локализованная остеосаркома
Локализованная остеосаркома наблюдается только в кости, в которой она началась, и, возможно, в тканях рядом с костью, таких как мышцы, сухожилия или жир.
Около 4 из 5 остеосарком оказываются локализованными, когда они впервые обнаруживаются. Но даже когда визуализирующие исследования не показывают, что рак распространился на отдаленные районы, вероятно, будут очень небольшие области распространения рака, которые невозможно обнаружить с помощью тестов. Вот почему химиотерапия является важной частью лечения большинства остеосарком. Если этого не сделать, рак с большей вероятностью вернется после операции.
Врачи делят локализованные остеосаркомы на 2 группы:
- Резектабельные остеосаркомы — это те, при которых вся видимая опухоль может быть удалена (резецирована) хирургическим путем.
- Неоперабельная (или неоперабельная ) остеосаркома не может быть удалена полностью хирургическим путем.
Метастатическая остеосаркома
Метастатическая остеосаркома явно распространилась на другие части тела. Чаще всего он распространяется на легкие, но также может распространяться на другие кости, мозг или другие органы.
Примерно 1 из 5 остеосарком распространилась уже на момент постановки первого диагноза. Эти виды рака сложнее лечить, но некоторые из них можно вылечить, если удастся удалить метастазы хирургическим путем.Показатель излечения от этих видов рака заметно улучшается, если также проводится химиотерапия.
Система стадирования опухолей опорно-двигательного аппарата (MSTS)
Системой, обычно используемой для определения стадии остеосаркомы, является система MSTS, также известная как система Enneking . Он основан на 3 ключевых элементах информации:
- Опухоль степени (G) , которая является показателем вероятности ее роста и распространения в зависимости от того, как она выглядит под микроскопом. Опухоли бывают либо низкой (G1), либо высокой (G2) степени.Опухолевые клетки низкой степени злокачественности больше похожи на нормальные клетки и с меньшей вероятностью будут быстро расти и распространяться, в то время как опухолевые клетки высокой степени злокачественности выглядят более аномальными.
- Протяженность первичной опухоли (T) , которая классифицируется как внутрикомпартментная (T1), что означает, что она в основном осталась внутри кости, или экстракомпартментная (T2), что означает, что она распространилась за пределы кости в другие соседние области. конструкции.
- Если опухоль имеет метастазов (M) , это означает, что она распространилась на другие области, либо на близлежащие лимфатические узлы (скопления клеток иммунной системы размером с боб), либо на другие органы.Опухоли, которые не распространились на лимфатические узлы или другие органы, считаются M0, а опухоли, которые распространились, — M1.
Эти факторы объединены, чтобы дать общую стадию с использованием римских цифр от I до III. Стадии I и II подразделяются на A для внутрикомпартментных опухолей и B для экстракомпартментных опухолей.
| Этап |
Марка |
Опухоль |
Метастазы |
| IA |
G1 |
T1 |
M0 |
| IB |
G1 |
T2 |
M0 |
| IIA |
G2 |
T1 |
M0 |
| IIB |
G2 |
T2 |
M0 |
| III |
G1 или G2 |
T1 или T2 |
M1 |
Итого:
- Локализованные опухоли низкой степени злокачественности относятся к I стадии.
- Локализованные опухоли высокой степени злокачественности относятся к стадии II.
- Метастатические опухоли (независимо от степени) III стадии.
Промежуточная система TNM
Другой системой, которая иногда используется для определения стадии рака костей (включая остеосаркомы), является система TNM Американской объединенной комиссии по раку (AJCC). Эта система основана на 4 ключевых элементах информации:
- T описывает размер основной (первичной) опухоли и если она появляется в разных областях кости.
- N описывает степень распространения на близлежащие (регионарные) лимфатические узлы . Опухоли костей редко распространяются на лимфатические узлы.
- M указывает, имеет ли рак метастазы (распространились) в другие органы тела. (Наиболее частые места распространения — легкие или другие кости.)
- G обозначает класс опухоли , который описывает, как клетки выглядят под микроскопом. Опухолевые клетки низкой степени злокачественности больше похожи на нормальные клетки и с меньшей вероятностью будут быстро расти и распространяться, в то время как опухолевые клетки высокой степени злокачественности выглядят более аномальными.
Числа после T, N, M и G дают более подробную информацию о каждом из этих факторов.
После определения категорий T, N и M и степени рака кости информация объединяется в общую стадию. Эти этапы (которые отличаются от этапов системы MSTS) описываются римскими цифрами от I до IV (от 1 до 4) и иногда разделяются дальше. Для получения более подробной информации о системе определения стадии рака костей AJCC TNM см. Стадии рака костей.
Стадия остеосаркомы может сбивать с толку. Если у вас есть какие-либо вопросы о стадии рака, попросите члена бригады по лечению рака объяснить вам это так, как вы понимаете.
Понимание стадии и степени рака кости
Руководства по стадированию, разработанные Американским объединенным комитетом по раку (AJCC), часто используются для определения стадии рака костей и позволяют врачам передавать друг другу важную информацию о раке стандартизированным способом.Стадии рака костей делятся на четыре категории:
T (опухоль): Это описывает размер исходной опухоли.
N (узел): Указывает, присутствует ли рак в лимфатических узлах.
M (метастаз): Это относится к тому, распространился ли рак на другие части тела.
После присвоения оценки TNM рак кости будет классифицирован по одной из следующих стадий:
Стадия I (рак кости 1 стадии): Раковые клетки все еще локализуются в кости, и опухоль считается низкосортной.Рак кости I стадии делится на две подкатегории:
- Стадия IA: эти раковые образования размером менее 8 см.
- Стадия IB: опухоль больше 8 см или может быть обнаружена в нескольких местах одной и той же кости.
Стадия II (рак кости 2 стадии): Эти виды рака все еще локализуются в кости, но считаются высокозлокачественными. Рак кости II стадии делится на две подкатегории:
- Стадия IIA: опухоль меньше 8 см.
- Стадия IIB: опухоль больше 8 см.
Стадия III (рак кости 3 стадии): Первичный рак кости на этой стадии все еще локализуется в кости, но он высокозлокачественный и распространился на несколько мест внутри одной кости.
Стадия IV (рак кости 4 стадии): Рак кости IV стадии является наиболее распространенной формой заболевания. На стадии IV рак распространился за пределы кости на другие части тела. В случае рака кости при определении стадии также учитывается, насколько ненормально клетки выглядят под микроскопом (степень).Рак кости на стадии IV может быть любым Tor N, что означает, что опухоль может быть любого размера и могла прорасти в лимфатические узлы. Рак может быть разделен на стадию IVA или IVB:
.- Стадия IVA: рак также распространился на легкое (легкие).
- Стадия IVB: рак распространился на лимфатические узлы или опухоль любого размера и степени распространилась на другой орган, кроме легкого. Специалисты по раку костей обычно классифицируют стадии рака кости на локализованные и метастатические. Рак кости IV стадии аналогичен метастатическому раку.
Подробнее о онкопедической ортопедии
Следующая тема: Как диагностируется рак кости?
Рак кости (саркома кости): симптомы и признаки
НА ЭТОЙ СТРАНИЦЕ: Вы узнаете больше об изменениях тела и других вещах, которые могут сигнализировать о проблеме, которая может потребовать медицинской помощи. Используйте меню для просмотра других страниц.
Люди с саркомой костей могут испытывать следующие симптомы или признаки. Иногда у людей с саркомой кости нет ни одного из этих изменений.Или причиной симптома может быть другое заболевание, не являющееся раком.
Когда костная опухоль растет, она давит на здоровую костную ткань и может разрушить ее, что вызывает следующие симптомы:
-
Боль. Самые ранние симптомы саркомы кости — боль и припухлость в месте локализации опухоли. Поначалу боль может приходить и уходить. Позже он может стать более серьезным и устойчивым. Боль может усиливаться при движении, а в соседних мягких тканях может появиться опухоль.Боль может не исчезать и возникать во время отдыха или ночью. Большинство сарком костей у детей появляются вокруг колен и могут быть ошибочно диагностированы как «боль роста», что приводит к задержке постановки диагноза. Узнайте больше о раке и боли.
-
Припухлость и жесткость суставов. Опухоль, которая возникает рядом с суставом или в суставе, может вызвать опухание сустава, его болезненность или жесткость. Это означает, что у человека может быть ограниченный и болезненный диапазон движений.
-
Лимпинг. Если кость с опухолью сломается или сломается в ноге, это может привести к выраженной хромоте. Хромота обычно является признаком более поздней стадии саркомы кости.
-
Другие, менее частые симптомы. Редко у людей с саркомой костей могут быть такие симптомы, как лихорадка, общее плохое самочувствие, потеря веса и анемия, то есть низкий уровень эритроцитов.
Если вас беспокоят какие-либо изменения, которые вы испытываете, проконсультируйтесь с врачом. В дополнение к другим вопросам ваш врач спросит, как долго и как часто вы испытываете этот симптом (ы).Это поможет выяснить причину проблемы, которая называется диагностикой.
Если рак диагностирован, облегчение симптомов остается важной частью лечения и лечения рака. Это может называться паллиативной или поддерживающей терапией. Часто его начинают вскоре после постановки диагноза и продолжают на протяжении всего лечения. Обязательно поговорите со своим лечащим врачом о симптомах, которые вы испытываете, включая любые новые симптомы или изменение симптомов.
Следующий раздел в этом руководстве — Диагностика .В нем объясняется, какие тесты могут потребоваться, чтобы узнать больше о причине симптомов. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Саркома Юинга у взрослых | Johns Hopkins Medicine
Саркома Юинга — это тип рака костей или мягких тканей, который в основном встречается у детей и молодых людей. Часто обнаруживаются в длинных костях тела, симптомы включают боль, отек и жар.
Что такое саркома Юинга?
Саркома Юинга — это рак, который возникает в основном в костях или мягких тканях.Хотя саркома Юинга может развиваться в любой кости, она чаще всего встречается в тазобедренных костях, ребрах или длинных костях (например, бедренной кости (бедренной кости), большеберцовой кости (большеберцовой кости) или плечевой кости (кости плеча)). Он также может поражать мышцы и мягкие ткани вокруг опухоли. Клетки саркомы Юинга также могут метастазировать (распространяться) в другие части тела, включая костный мозг, легкие, почки, сердце, надпочечники и другие мягкие ткани.
Под микроскопом клетки саркомы Юинга кажутся маленькими, круглыми и синими.
Саркома Юинга получила свое название от доктора Джеймса Юинга, доктора, который впервые описал опухоль в 1920-х годах.
Кто заболевает саркомой Юинга?
Являясь вторым по распространенности типом рака костей, поражающим детей и молодых людей, на него приходится около 1 процента всех онкологических заболеваний у детей. Ежегодно в США около 225 детей и подростков заболевают саркомой Юинга.
Хотя саркома Юинга может возникнуть в любое время в детстве, чаще всего она развивается в период полового созревания, когда кости быстро растут.Саркома Юинга чаще всего встречается у детей в возрасте от 10 до 20 лет. Мужчины болеют чаще, чем женщины. Этот тип рака редко встречается у детей афроамериканского, африканского и китайского происхождения.
Саркома Юинга — очень редкая форма рака у взрослых.
Что вызывает саркому Юинга?
Точная причина саркомы Юинга до конца не выяснена. Исследователи не смогли определить факторы риска или меры профилактики саркомы Юинга. Однако исследователи обнаружили хромосомные изменения в ДНК клетки, которые могут привести к образованию саркомы Юинга.Эти изменения не передаются по наследству. Они развиваются у детей без видимой причины после рождения.
В большинстве случаев изменения связаны с слиянием генетического материала между хромосомами 11 и 22. Когда определенная часть хромосомы 11 помещается рядом с геном EWS на хромосоме 22, ген EWS «включается». Эта активация приводит к чрезмерному росту клеток и, в конечном итоге, к развитию рака. Реже происходит обмен ДНК между хромосомой 22 и другой хромосомой, что приводит к включению гена EWS.Точный механизм остается неясным, но это важное открытие привело к улучшениям в диагностике саркомы Юинга.
Каковы симптомы саркомы Юинга?
Пациенты с саркомой Юинга могут испытывать различные симптомы. К наиболее частым симптомам относятся следующие:
- Боль в области опухоли
- Отек и / или покраснение вокруг опухоли
- Лихорадка
- Похудание и снижение аппетита
- Усталость
- Паралич и / или недержание мочи (если опухоль находится в области позвоночника)
- Симптомы, связанные с сдавлением нерва опухолью (например,g., онемение, покалывание или паралич)
Симптомы саркомы Юинга могут напоминать другие заболевания или проблемы. Всегда консультируйтесь с врачом для постановки диагноза.
Как диагностируется саркома Юинга?
В дополнение к полной истории болезни и физическому обследованию, диагностические тесты помогают подтвердить наличие опухоли, а также предоставляют подробную информацию об опухоли, которая может помочь онкологам определить лучший подход к лечению. Диагностические тесты для саркомы Юинга могут включать следующее:
- Тесты множественной визуализации :
- Рентген.Этот диагностический тест использует невидимые лучи электромагнитной энергии для получения изображений внутренних тканей, костей и органов на пленке.
- Радионуклидное сканирование костей. Для начала в тело пациента вводят небольшое количество радиоактивного красителя, которое абсорбируется костной тканью. Снимки кости делаются специальной камерой и используются для обнаружения опухолей и аномалий костей.
- Магнитно-резонансная томография (МРТ). Эта диагностическая процедура использует комбинацию больших магнитов, радиочастот и компьютера для получения подробных изображений органов и структур внутри тела.Этот тест часто проводят, чтобы увидеть, распространилась ли опухоль на близлежащие мягкие ткани.
- Компьютерная томография (КТ или CAT). Эта процедура диагностической визуализации использует комбинацию рентгеновских лучей и компьютерных технологий для получения горизонтальных или осевых изображений (часто называемых срезами) тела. Компьютерная томография показывает подробные изображения любой части тела, включая кости, мышцы, жир и органы. Хотя компьютерная томография более детализирована, чем обычная рентгенография, она обычно менее детализирована, чем МРТ.
- Позитронно-эмиссионная томография (ПЭТ). Для этого теста в кровоток вводят глюкозу (сахар) с радиоактивными метками. Ткани, которые используют глюкозу больше, чем нормальные ткани (например, опухоли), могут быть обнаружены с помощью сканирующего устройства. ПЭТ-сканирование можно использовать для поиска небольших опухолей или проверки эффективности лечения известной опухоли.
- Анализы крови , включая биохимический анализ крови
- Биопсия опухоли .Во время этой процедуры образцы тканей удаляются (с помощью иглы или во время операции) из тела и исследуются под микроскопом, чтобы определить, присутствуют ли раковые или другие аномальные клетки.
- Аспирация / биопсия костного мозга . Эта процедура включает удаление небольшого количества жидкости и ткани костного мозга, обычно из части бедренной кости, чтобы увидеть, распространился ли рак на костный мозг.
Саркома Юинга трудно отличить от других подобных опухолей.Диагноз часто ставится путем исключения всех других распространенных солидных опухолей и использования генетических исследований.
Как лечится саркома Юинга?
Команда по лечению рака разрабатывает конкретные планы лечения на основе следующего:
- Возраст пациента, общее состояние здоровья и история болезни
- Место и степень заболевания
- Толерантность пациента к определенным лекарствам, процедурам или методам лечения
- Ожидания от течения болезни
- Мнение или предпочтение пациента и / или родителей
В зависимости от стадии опухоли лечение может включать следующее:
- Операция по удалению опухоли
- Химиотерапия
- Лучевая терапия
- Ампутация пораженной руки или ноги
- Протезирование и обучение (при ампутации)
- Резекция при метастазах (e.г., легочная резекция раковых клеток легкого)
- Реабилитация (например, физиотерапия и трудотерапия и психосоциальная адаптация)
- Поддерживающая терапия при побочных эффектах лечения
- Антибиотики для профилактики и лечения инфекций
- Постоянное наблюдение для определения реакции пациента на лечение, выявления рецидивов заболевания и управления поздними эффектами лечения
Поскольку саркома Юинга редко встречается у взрослых, подробности лечения, описанные в следующих разделах, обычно применимы к детям.Лечение саркомы Юинга у взрослых может включать изменения, особенно с химиотерапией, поскольку дети гораздо более терпимы к химиотерапевтическим препаратам.
Примитивные нейроэктодермальные опухоли (ПНЭО) — очень редкие, молекулярно-связанные опухоли, которые часто возникают вне кости и лечатся так же, как саркома Юинга.
Перед лечением саркомы Юинга
Перед началом лечения большинству пациентов потребуется стадирование опухоли. Как правило, стадия опухоли Юинга включает в себя следующее:
- Компьютерная томография грудной клетки для исключения поражения легких
- МРТ пораженного участка
- Сканирование кости или ПЭТ
- Биопсия костного мозга
Все лечение саркомы Юинга начинается с химиотерапии
После определения стадии рака уход за пациентом берет на себя бригада педиатрических онкологов, которая будет проводить химиотерапию.Всем пациентам с саркомой Юинга требуется химиотерапия в качестве начальной фазы терапии для уменьшения первичной или основной опухоли. Даже если другие аспекты лечения различаются — например, способ удаления опухоли или местного лечения — химиотерапия всегда является первым шагом. Это связано с тем, что врачи рассматривают саркому Юинга как местное и системное заболевание. Химиотерапия используется для лечения любых потенциальных метастазов (распространения) в легкие, что довольно часто, но очень поддается лечению. Мультимодальный подход используется даже в том случае, если болезнь локализована только на момент постановки диагноза.
Первый набор химиотерапевтических препаратов для лечения саркомы Юинга часто включает винкристин, доксорубицин (адриамицин) и циклофосфамид (VAC). После выздоровления от первого набора препаратов могут быть назначены ифосфамид и этопозид (IE).
Как и большинство других онкологических заболеваний у детей, Детская онкологическая группа определяет протоколы лечения саркомы Юинга. Большинство онкологических центров следует установленным протоколам.
Операция или лучевая терапия для лечения опухоли
После начальной химиотерапии для уменьшения опухоли пациенты получают еще одно МРТ и компьютерную томографию грудной клетки для восстановления опухоли.
Если опухоль находится в рабочем состоянии, пациенту обычно проводят резекцию (операцию). Обычно, если рак можно удалить, рекомендуется хирургическое вмешательство в качестве альтернативы облучению, которое может вызвать серьезные побочные эффекты, особенно у маленьких детей.
Если опухоль неоперабельна, может потребоваться облучение. Хирургическое вмешательство не рекомендуется в следующих случаях:
- Опухоль находится в месте, где маловероятно, что все опухолевые клетки могут быть удалены (например,г., позвоночник)
- Последствия хирургического вмешательства (например, паралич или ампутация) могут значительно повлиять на качество жизни пациента
- Существует высокий риск того, что функции некоторых частей тела (например, таза или запястья) невозможно восстановить.
Иногда требуется и хирургическое вмешательство, и лучевая терапия. После удаления опухоли патолог исследует опухоль и ищет отрицательный край на удаленной ткани. Отрицательный край указывает на то, что часть ткани вокруг опухоли не содержит живых раковых клеток.При обнаружении живых клеток в качестве последующего лечения требуется облучение. Опухоли Юинга обычно очень чувствительны к радиации.
Дополнительная химиотерапия
Еще один курс химиотерапии проводится после операции или лучевой терапии для уничтожения опухолевых клеток, которые могли распространиться на другие части тела.
Таргетная терапия
Исследователи работают над поиском новых и улучшенных способов лечения всех видов рака, включая саркому Юинга. Несмотря на некоторый прогресс, целевые методы лечения, такие как иммунотерапия, считаются экспериментальными для пациентов с саркомой Юинга.Врачи могут найти возможные альтернативы пациентам с рецидивирующей или запущенной саркомой Юинга, которые уже исчерпали традиционные методы лечения.
Геномное секвенирование можно использовать для поиска лекарства, которое уже одобрено FDA для лечения опухолей с определенными биомаркерами (характеристики, которые могут указывать на то, что опухоль является хорошей мишенью для определенного вида терапии). Можно рассмотреть даже препараты, которые ранее не использовались для лечения саркомы Юинга.
Также могут быть доступны клинические испытания.Ваш врач может предоставить информацию об открытых исследованиях в вашем онкологическом центре или других центрах по всей стране.
Какой вид последующего ухода требуется после лечения саркомы Юинга?
Пациенты с саркомой Юинга будут проходить рентгеновское обследование исходной опухоли каждые три-шесть месяцев в течение трех-пяти лет. Точно так же пациенты будут регулярно проходить компьютерную томографию легких и периодическое сканирование костей для выявления рецидива как можно раньше.
До конца жизни пациенты будут ежегодно проходить рентгенографию области первоначальной опухоли для наблюдения за любыми реконструктивными устройствами и заживлением конечности.Могут быть предложены упражнения для улучшения функции пораженной конечности.
Каков долгосрочный прогноз для пациентов с саркомой Юинга?
По данным Американского онкологического общества, общая пятилетняя выживаемость при локализованной саркоме Юинга составляет 70 процентов. У пациентов с метастатическим заболеванием пятилетняя выживаемость составляет от 15 до 30 процентов.
Неизвестно, переносят ли взрослые с саркомой Юинга так же хорошо, как и дети с этим заболеванием. Некоторые исследования показали, что это не так.Однако эти исследования подверглись критике за то, что в них использовались более низкие дозы химиотерапии, чем у детей. Другие исследования показали, что при агрессивном лечении взрослые могут действовать так же хорошо, как и дети. Проблема с агрессивным лечением состоит в том, что взрослые тела не могут выдерживать те же дозы химиотерапевтических препаратов, что и дети.
Факторы, которые могут повлиять на прогноз
Как и в случае любого рака, прогноз и долгосрочное выживание могут сильно различаться от человека к человеку.Поскольку каждый человек уникален, ваше лечение и прогноз будут основаны на вашем уникальном состоянии здоровья и потребностях. Индивидуальный прогноз пациента при саркоме Юинга во многом зависит от следующего:
- Степень заболевания
- Размер и расположение опухоли
- Наличие или отсутствие метастазов
- Ответ опухоли на терапию
- Возраст пациента и общее состояние здоровья (дети часто лучше реагируют на лечение, чем взрослые)
- Толерантность пациента к определенным лекарствам, процедурам или методам лечения
- Новые разработки в лечении
По сравнению с более мелкими опухолями, большие опухоли труднее удалить, и у них больше возможностей для развития микрометастазов.Под микрометастазом понимается рак, распространившийся на другие части тела, как опухоли, которые слишком малы, чтобы их можно было обнаружить.
Оперативная медицинская помощь и агрессивная терапия помогают обеспечить наилучший прогноз. Также важен постоянный последующий уход.
Поздние эффекты лечения
У человека, который лечился от саркомы Юинга в детстве или подростковом возрасте, могут развиться последствия для здоровья, которые называются поздними эффектами, через месяцы или годы после окончания лечения. Тип поздних эффектов, которые развиваются у выжившего, зависит от локализации опухоли и метода лечения.
Поздние эффекты могут включать проблемы с сердцем и легкими, эмоциональные трудности и трудности в обучении, проблемы роста и вторичные злокачественные новообразования, связанные с химиотерапией или облучением. Например, у детей, лечившихся от саркомы Юинга, риск развития солидных опухолей или лейкемии в более позднем возрасте выше, чем у средней популяции.
Некоторые виды лечения могут впоследствии повлиять на фертильность. Если этот побочный эффект будет постоянным, это приведет к бесплодию (невозможности иметь детей). И мужчины, и женщины могут быть затронуты проблемами фертильности.
Рецидив саркомы Юинга
Если саркома Юинга рецидивирует, это обычно происходит в течение нескольких лет лечения. Около 30 процентов пациентов будут иметь рецидивы в течение первых пяти лет.
Когда рак рецидивирует, его становится намного труднее лечить. Те же химиотерапевтические препараты, которые использовались во время первоначального лечения, нельзя использовать снова из-за опасений токсичности. Как правило, рецидив саркомы Юинга побуждает врачей изучить нетрадиционные или новые варианты лечения.По мере развития таргетной и иммунотерапевтической терапии есть надежда, что прогноз рецидивирующей саркомы Юинга улучшится.
Тип, симптомы, этапы и лечение
Обзор
Что такое саркома?
Саркома — это тип опухоли, которая развивается в соединительной ткани, такой как кости, хрящи или мышцы.Злокачественные саркомы очень редки (1% всех злокачественных новообразований у взрослых и около 15% злокачественных новообразований у детей). Ежегодно в Соединенных Штатах диагностируется приблизительно от 14 000 до 15 000 сарком (3 000 сарком костей и от 11 000 до 12 000 сарком мягких тканей).
Саркомы появляются в организме в следующем процентном соотношении:
- 40% возникают в нижних конечностях;
- 15% в верхних конечностях;
- 30% в области туловища / грудной стенки / брюшной полости;
- 15% в области головы и шеи.
Условия, которые можно принять за опухоль
Многие состояния можно принять за опухоли. У всех бывают случайные шишки и шишки, и важно уметь отличать опухоли, которые могут быть злокачественными, и те, которые возникают из-за травм, врожденных новообразований или нормального процесса старения. Например, в скелете стрессовые переломы, хронические инфекции и доброкачественные опухоли костей могут оказаться злокачественными.
Какие виды саркомы?
Опухоли костей
Доброкачественные опухоли костей
Доброкачественные (доброкачественные) опухоли опорно-двигательного аппарата встречаются даже чаще, чем злокачественные.
Общие типы доброкачественных опухолей включают:
- Остеохондромы.
- Аневризматические кисты костей.
- Простые кисты костей.
- Фиброзная дисплазия.
- Гистиоцитоз клеток Лангерганса.
- Неокостеневшие фибромы.
Кроме того, доброкачественные опухоли костей могут быть связаны с семейными состояниями или синдромами, такими как MHE (множественный наследственный экзостоз), болезнь Олли, болезнь Маффуччи или синдром МакКьюна-Олбрайта.
Более агрессивные доброкачественные опухоли костей, такие как гигантоклеточная опухоль или хондромиксоидные фибромы, обычно требуют хирургического вмешательства.В этих случаях такие методы, как синтетические заменители костного трансплантата, используются для восстановления, а не для удаления кости. Такие препараты, как деносумаб или доксициклин, также используются для лечения определенных опухолей.
Злокачественные опухоли костей
Хотя опухоли костей являются редким типом рака (примерно 3000 случаев в год в США), существует множество различных типов.
Распространенные типы злокачественных опухолей костей:
Более одной трети сарком костей диагностируется у пациентов в возрасте до 35 лет; многие диагностируются у детей.
Метастатические опухоли костей
В отличие от первичной саркомы кости (рак, который начинается с в кости), метастатический рак кости начинается в другом месте (например, в органе) и распространяется с по кость. Этот рак проявляется во многих формах, чаще всего это рак щитовидной железы, легких, почек, груди или простаты.
Когда рак из отдаленного органа распространяется на скелет, он может создать структурные проблемы в кости, которые могут привести к усилению боли и ухудшению функционирования.
Опухоли мягких тканей
Доброкачественные опухоли мягких тканей
Доброкачественные опухоли мягких тканей очень распространены (менее 5% всех обнаруженных шишек или шишек являются злокачественными). Многие из этих опухолей можно регулярно контролировать, но некоторые необходимо удалять хирургическим путем. Некоторые доброкачественные опухоли, такие как десмоидные опухоли, могут потребовать лечения от бригад медицинской онкологии, радиационной онкологии или интервенционной радиологии, которые работают в тесном сотрудничестве.
К наиболее распространенным типам доброкачественных опухолей мягких тканей относятся:
- Десмоидные опухоли.
- Большие артериовенозные мальформации.
- Липомы (жировые опухоли).
- Пигментный виллонодулярный синовит.
- Schwannomas.
- Синовиальный хондроматоз.
Злокачественные опухоли мягких тканей
Саркомы мягких тканей начинаются в мышцах или других соединительных тканях тела. В отличие от опухолей костей, большинство сарком мягких тканей встречается у взрослых, хотя некоторые типы, такие как рабдомиосаркома, чаще встречаются у детей.
Некоторые из наиболее распространенных типов сарком мягких тканей:
- Десмопластические мелкоклеточные опухоли.
- Желудочно-кишечная стромальная опухоль (ГИСО).
- Лейомиосаркома.
- Липосаркома.
- Злокачественная опухоль оболочки периферических нервов.
- Рабдомиосаркома.
- Синовиальная саркома.
- Недифференцированная плеоморфная саркома.
Саркомы мочеполовой системы
Саркомы мочеполовой системы — это редкие раковые (злокачественные) опухоли, которые развиваются в половых органах или мочевыводящих путях.Саркомы мочеполовой системы составляют менее 5% от всех типов сарком и чаще развиваются у детей, чем у взрослых. Обычно они развиваются в:
- Мочевой пузырь
- Почка
- Мочеточники (трубки, отводящие мочу из почек в мочевой пузырь)
- Уретра (трубка, по которой моча выводится из мочевого пузыря за пределы тела)
- Мужская репродуктивная система (простата, яички и половой член)
- Влагалище
В целом в США ежегодно выявляется 14 000 новых случаев сарком.Ни одно исследование не показало, сколько из этих случаев влияет на мочеполовую систему. Однако саркомы мочевого пузыря являются наиболее распространенным типом сарком мочеполовой системы.
Саркомы мочевого пузыря, как правило, образуются в области между отверстиями мочеточников и уретрой. Но они также могут развиваться во всей области мочевого пузыря.
Как и в случае с другими типами сарком, причины возникновения сарком мочеполовой системы неясны. Следующие факторы могут повысить риск развития сарком в целом:
- Воздействие определенных химических веществ, таких как феноксиуксусная кислота в гербицидах и хлорфенолы в консервантах для древесины
- Воздействие более высоких доз радиации
- Длительные инфекции мочевого пузыря
- Прием некоторых обезболивающих в течение длительного времени
- Определенные наследственные заболевания и хромосомные мутации, такие как синдром Хиппеля-Линдау и нейрофиброматоз
- Курение
Нет четких симптомов, связанных с саркомой мочеполовой системы на ранних стадиях.Однако на ощупь можно почувствовать безболезненное образование. По мере того, как опухоль становится больше и давит на близлежащие нервы, вы начнете ощущать некоторую боль или болезненность.
Симптомы более крупных сарком мочеполовой системы включают:
- Кровь в моче (гематурия) или нарушение мочеиспускания
- Язвы, выделения или изменения кожи в области мочеполовых органов
Из всех типов сарком мочеполовой системы саркомы мочевого пузыря, как правило, лучше переносятся лечением. Наличие крови в моче делает возможным раннее выявление сарком мочевого пузыря.Общая выживаемость пациента с любой саркомой зависит от типа, местоположения, размера и стадии опухоли.
Симптомы и причины
Каковы симптомы саркомы?
Симптомы сарком различны. Например, на ранних стадиях некоторые саркомы могут не вызывать заметных симптомов.Саркомы могут проявляться в виде безболезненного образования под кожей. Другие саркомы могут образовываться в брюшной полости и могут не вызывать симптомов, пока не станут очень большими и не давят на какой-либо орган.
Другие саркомы могут проявляться в виде длительной боли в костях или опухоли в руке или ноге, усиливающейся ночью, или в виде снижения подвижности.
Симптомы саркомы, которые необходимо исследовать, — это образования, увеличивающиеся в размерах, безболезненные образования, которые стали болезненными, или образования размером больше мяча для гольфа (около пяти сантиметров).
Что касается детей, то ребенку, у которого боль в костях не проходит сама по себе и которая возникла не в результате травмы, следует обследовать с помощью визуализирующего теста.
Диагностика и тесты
Как диагностируется саркома?
Диагностика саркомы может быть сложной задачей.Часто на образце ткани проводятся специальные тесты, чтобы определить точный тип саркомы, поскольку существует более 50 известных подтипов саркомы, многие из которых могут потребовать особых вариантов лечения.
Чтобы диагностировать саркому, врач начнет с тщательного сбора анамнеза и медицинского осмотра. При постановке диагноза врач также может использовать определенные тесты. К ним относятся:
- Рентген : Будет сделан рентгеновский снимок для выявления аномальных образований на костях.
- Компьютерная томография (КТ) : Компьютерная томография использует компьютеры для объединения множества рентгеновских изображений в поперечные сечения внутренней части тела.
- Магнитно-резонансная томография (МРТ) : МРТ использует большой магнит, радиоволны и компьютер для создания четких изображений тела. Его можно заказать для получения более четких изображений, если рентгеновский снимок не соответствует норме.
- Сканирование костей : В этом тесте используется небольшое количество радиоактивного материала, введенного в организм для выявления заболеваний костей, таких как рак.
- ПЭТ-сканирование : В этом тесте используется специальный индикатор глюкозы, который концентрируется в раковых клетках и показывает области тела, где уровень глюкозы выше нормы, что позволяет предположить наличие быстрорастущей опухоли.
- Биопсия : Это процедура, при которой кусок ткани из пораженного участка удаляется, чтобы его можно было изучить на предмет наличия раковых клеток под микроскопом.
Какие стадии саркомы?
Одна из самых больших проблем при диагностике рака заключается в том, не распространился ли рак за пределы своего первоначального местоположения.Чтобы определить это, врач присваивает вашему диагнозу номер (от 1 до 4). Чем выше число, тем больше рак распространился по вашему телу. Это называется «постановкой». Эта информация нужна врачу, чтобы спланировать ваше лечение.
Следующие критерии стадирования применимы только к саркоме костей и мягких тканей.
Стадии саркомы мягких тканей:
- Этап 1: Этап 1 разделен на этапы 1A (меньше пяти сантиметров) и 1B (больше пяти сантиметров).
- Стадия 2: Стадия 2 подразделяется на стадии 2A (меньше пяти сантиметров) и 2B (больше пяти сантиметров) для сарком мягких тканей головы и шеи, конечностей (рук и ног), желудочно-кишечного тракта и забрюшинного пространства ( часть тела за животом).
- Стадия 3: Стадия 3 делится на 3A или 3B в зависимости от размера опухоли, поражения лимфатических узлов или степени (в зависимости от типа саркомы мягких тканей).
- Стадия 4 (метастатическая): Опухоль распространилась на лимфатические узлы конечностей или другие части тела (например, легкие).
Стадии саркомы кости:
- Этап 1: Этап 1 разделен на этапы 1A (меньше восьми сантиметров) и 1B (больше восьми сантиметров).
- Стадия 2: Стадия 2 подразделяется на стадии 2A (меньше восьми сантиметров) и 2B (больше восьми сантиметров) для сарком головы и шеи, конечностей (рук и ног), желудочно-кишечного тракта и забрюшинного пространства (часть тело за животом).
- Стадия 3: Стадия 3 делится на 3A или 3B в зависимости от размера опухоли, поражения лимфатических узлов или степени (в зависимости от типа саркомы кости).
- Стадия 4 (метастатическая): Опухоль распространилась на лимфатические узлы конечностей или другие части тела
(например, легкие).
Ведение и лечение
Как лечат саркомы?
Саркомы лечат специалисты, в зависимости от того, где находится саркома.В более крупных медицинских центрах саркомы лечат бригада медперсонала, включая хирургов, радиологов, медицинских онкологов (онкологов), онкологов-радиологов, патологов, педиатров (для лечения онкологических заболеваний у детей), психологов и социальных работников.
Наиболее распространенными формами лечения саркомы являются хирургическое вмешательство, лучевая терапия и химиотерапия.
Хирургия
Большинство опухолей удаляются хирургическим путем. Это лечение часто сочетается с лучевой терапией, чтобы предотвратить возвращение саркомы.
При хирургическом удалении опухоли цель состоит в том, чтобы свести к минимуму риск повторного появления или распространения саркомы в том же месте. Для этого хирург удаляет опухоль с помощью широкого местного иссечения, оставляя по краям край здоровой («отрицательной») ткани — это означает, что вся опухоль удаляется, не оставляя никаких очевидных или микроскопических заболеваний. Цель состоит в том, чтобы сохранить как можно больше нормальной анатомии. Иногда искусственные имплантаты или кость, взятые из другой части тела или донорской ткани, могут использоваться для замены кости, удаленной во время операции.
Спасение конечностей
Хотя полное удаление опухоли жизненно важно, восстановление области не менее важно. Спасение конечностей (спасение / сохранение руки или ноги) в сложных опухолевых ситуациях может иметь разные формы и включает такие методы, как использование металлических заменителей для реконструкции сустава, донорская кость для восстановления костных дефектов или даже кость, взятая из другой части сустава. тело для замены кости, удаленной во время операции.
Несмотря на возрастающие способности к спасению конечностей, иногда самым безопасным или лучшим вариантом является ампутация пораженной конечности, что может быть очень трудным решением.
Радиация
Лучевая терапия — это форма лечения рака, при которой используются высокоэнергетические рентгеновские лучи для уничтожения раковых клеток при минимальном повреждении здоровых клеток. Лучевая терапия может быть внутренней (помещается в тело) или внешней (доставляется аппаратом вне тела). Высокие дозы излучения доставляются в районы, подверженные риску, в то время как дозы для нормальных тканей сводятся к минимуму, чтобы снизить риск побочных эффектов.
В некоторых случаях, которые не распространились, можно использовать другой вид излучения, называемый брахитерапией.Брахитерапия может проводиться двумя способами: интраоперационная лучевая терапия (во время операции) и интерстициальная брахитерапия, которая проводится через серию катетеров (пластиковых трубок) после операции. Облучение также можно использовать для пациентов с распространившейся саркомой (метастатическое заболевание).
Побочные эффекты лучевой терапии включают:
Химиотерапия
Химиотерапия — это использование лекарств для уничтожения или замедления роста быстро размножающихся раковых клеток.Эти лекарства часто вводятся внутривенно (через иглу в кровеносный сосуд) и могут иметь серьезные побочные эффекты. Химиотерапия часто назначается перед операцией, чтобы уменьшить опухоль.
Побочные эффекты химиотерапии включают:
- Тошнота и рвота.
- Выпадение волос.
- Потеря аппетита.
- Низкий показатель крови.
- Усталость.
- Язвы во рту.
Термическая абляция
Иногда доброкачественные опухоли костей (e.g., остеоид-остеома) или саркомы могут быть нагреты или заморожены для разрушения массы. Интервенционный радиолог выполняет эту процедуру, используя управляемую визуализацию (например, помещая датчик для замораживания ткани с помощью компьютерной томографии).
Остеосаркома: мультидисциплинарный подход к диагностике и лечению
1. Landis SH, Мюррей Т, Болден С, Wingo PA. Статистика рака, 1999. CA Cancer J Clin . 1999. 49 (1): 18–31….
2. Марков Р.К., Майк V, СП Хаджак, Левин А.Г., Hutter RV. Остеогенная саркома в возрасте до двадцати одного года. Обзор ста сорока пяти оперативных дел. J Bone Joint Surg [Am] . 1970; 52: 411–23.
3. МакКенна Р.Дж., Швинн С.П., Скоро KY, Хигинботэм Н. Саркомы остеогенного ряда (остеосаркома, фибросаркома, хондросаркома, паростеальная остеосаркома, саркомы, возникающие в аномальной кости): анализ 552 случаев. J Bone Joint Surg [Am] . 1966. 48 – A: 1–26.
4. Дорфман Х.Д., Черняк Б. Общие соображения. В: Опухоли костей. Сент-Луис: Мосби, 1998: 1–33.
5. Баччи Г., Picci P, Феррари S, Руджиери П., Casadei R, Тиэнги А, и другие. Первичная химиотерапия и отсроченное хирургическое вмешательство при неметастатической остеосаркоме конечностей. Результаты у 164 пациентов, которым до операции вводили высокие дозы метотрексата, а затем цисплатин и доксорубицин. Рак . 1993; 72: 3227–38.
6. Баччи Г., Феррари S, Меркури М, Лонги А, Капанна Р, Тиэнги А, и другие. Неоадъювантная химиотерапия остеосаркомы конечностей — предварительные результаты 4-го исследования Риццоли. Акта Онкол . 1998. 37: 41–8.
7. Fuchs N, Белак СС, Эплер Д, Бьелинг П., Деллинг G, Корхольц Д, и другие. Отдаленные результаты протокола интенсивной комбинированной химиотерапии и хирургии остеосаркомы конечностей COSS-86 совместной немецко-австрийско-швейцарской группы по изучению остеосаркомы. Энн Онкол . 1998; 9: 893–9.
8. Бикелс Дж., Елинек Б.М., Шмуклер Б.М., Нефф РС, Малавар ММ. Биопсия опухолей опорно-двигательного аппарата. Текущие концепции. Clin Orthop Rel Res . 1999; 368: 212–9.
9. Huth JF, Eilber FR. Особенности рецидивов после резекции остеосаркомы конечности. Стратегии лечения метастазов. Arch Surg . 1989. 124: 122–126.
10.Мейерс PA, Хеллер Г, Хили JH, Huvos A, Яблочно-белый А, Вс М, и другие. Остеогенная саркома с клинически определяемыми метастазами при первичном обращении. Дж. Клин Онкол . 1993; 11: 449–53.
11. Баччи Г, Picci P, Брикколи А, Авелла М, Феррари S, Фемино FP, и другие. Остеосаркома конечности с метастазами при поступлении: результаты достигнуты у 26 пациентов, получавших комбинированную терапию (первичная химиотерапия с последующей одновременной резекцией первичных и метастатических очагов). Тумори . 1992; 78: 200–6.
12. Bohndorf K, Райзер М, Лохнер Б, Feaux de Lacroix W, Стейнбрих В. Магнитно-резонансная томография первичных опухолей и опухолевидных поражений костей. Скелетная радиология . 1986; 15: 511–7.
13. Сундарам М., Макгуайр MH, Гербольд ДР. Магнитно-резонансная томография остеосаркомы. Скелетная радиология . 1987; 16: 23–9.
14. Белли Л, Scholl S, Ливартовский А, Эшби М, Паланги Т, Левассер П., и другие.Резекция легочных метастазов при остеосаркоме. Ретроспективный анализ 44 пациентов. Рак . 1989; 63: 2546–50.
15. Менендес Л.Р., Фиделер Б.М., Мирра Дж. Сканирование с таллием-201 для оценки остеосаркомы и саркомы мягких тканей. Исследование оценки и предсказуемости гистологического ответа на химиотерапию. J Bone Joint Surg [Am] . 1993; 75: 526–31.
16. Чжуан В.П., Бенджамин Р, Яффе Н, Уоллес С, Аяла АГ, Мюррей Дж, и другие.Рентгенологические и ангиографические изменения остеосаркомы после внутриартериальной химиотерапии. AJR . 1982; 139: 1065–9.
17. Enneking WF, Спаниер СС, Гудман М.А. Система для хирургической стадии саркомы опорно-двигательного аппарата. Клин Ортоп . 1980; 153: 106–20.
18. Ссылка МП, Гоорин А.М., Miser AW, Грин АА, Пратт CB, Беласко Ж.Б., и другие. Влияние адъювантной химиотерапии на безрецидивную выживаемость пациентов с остеосаркомой конечности. N Engl J Med . 1986; 214: 1600–6.
19. Эккардт Дж. Дж., Эйльбер FR, Дори Ф.Дж., Mirra JM. UCLA имеет опыт спасения конечностей при злокачественных опухолях. Ортопедия . 1985; 8: 612–21.
20. Яффе Н, Смит Э, Абельсон ХТ, Frei E 3d. Остеогенная саркома: изменение характера легочных метастазов при адъювантной химиотерапии. Дж. Клин Онкол . 1983; 1: 251–4.
21.Провизор AJ, Эттингер LJ, Нахман Ж.Б., Крайло MD, Маклей Дж. Т., Юнис Э.Дж., и другие. Лечение неметастатической остеосаркомы конечности предоперационной и послеоперационной химиотерапией: отчет Детской онкологической группы. Дж. Клин Онкол . 1997. 15: 76–84.
22. Розен Г, Капаррос Б, Huvos AG, Кослов С, Ниренберг А, Какавио А, и другие. Предоперационная химиотерапия остеосаркомы: выбор послеоперационной адъювантной химиотерапии на основе ответа первичной опухоли на предоперационную химиотерапию. Рак . 1982; 49: 1221–39.
23. Винклер К., Берон Г, Деллинг G, Heise U, Кабиш Х, Purfurst C, и другие. Неоадъювантная химиотерапия остеосаркомы: результаты рандомизированного совместного исследования (COSS-82) с химиотерапией спасения на основе гистологического ответа опухоли. Дж. Клин Онкол . 1988. 6: 329–37.
24. Саймон М.А., Ашлиман М.А., Томас Н, Mankin HJ. Лечение остеосаркомы дистального конца бедренной кости по сравнению с ампутацией конечностей. J Bone Joint Surg [Am] . 1986; 68: 1331–7.
25. Rougraff BT, Саймон М.А., Kneisl JS, Гринберг ДБ, Mankin HJ. Спасение конечности по сравнению с ампутацией при остеосаркоме дистального конца бедренной кости. Долгосрочное онкологическое, функциональное исследование и исследование качества жизни. J Bone Joint Surg [Am] . 1994. 76: 649–56.
26. Henshaw RM, Бикелс Дж, Malawer MM. Модульная эндопротезная реконструкция при дефектах скелета нижних конечностей: онкологические и реконструктивные показания. Семин Артропластика . 1999; 10: 180–7.
27. Руберт С.К., Малавер М.М., Kellar KL. Модульное эндопротезирование проксимального отдела плечевой кости: показания, хирургическая техника и результаты. Семин Артропластика . 1999; 10: 142–53.
28. Малавер М.М., Чжоу Л.Б. Выживаемость протезов и клинические результаты с использованием протезов большого сегмента при лечении сарком кости высокой степени злокачественности. J Bone Joint Surg [Am] .1995; 77: 1154–65.
29. Каваи А, Muschler GF, Lane JM, Отис JC, Хили Дж. Х. Протезирование коленного сустава после резекции злокачественной опухоли дистального отдела бедренной кости. Среднесрочные и долгосрочные результаты. J Bone Joint Surg [Am] . 1998. 80: 636–47.
Остеосаркома (рак кости у детей)
Остеосаркома — наиболее распространенная злокачественная (раковая) опухоль костей у детей, подростков и молодых людей, но все же это редкое заболевание.Этот рак костей ежегодно поражает около 400 детей в возрасте до 20 лет в Соединенных Штатах.
Остеосаркома чаще всего встречается у детей и молодых людей в возрасте от 10 до 20 лет и часто во время скачка роста. Это чаще встречается у мальчиков, чем у девочек.
Остеосаркома — это рак костей, что означает, что он может распространяться на другие органы или ткани тела, чаще всего начиная с легких.
Причина остеосаркомы неизвестна, но генетика может играть важную роль.
Симптомы остеосаркомы зависят от размера и расположения костной опухоли, а также от возраста и общего состояния здоровья вашего ребенка.
Симптомы вашего ребенка могут включать:
- Боль, скованность или болезненность в месте опухоли
- Боль, которая со временем становится все хуже и может иррадиировать наружу от опухоли
- Боль, пробуждающая ребенка от крепкого сна
- Отек или образование вокруг пораженной кости
- Снижение моторики; в том числе трудности с ходьбой или хромота
- Слабые кости, которые могут привести к перелому
- Усталость
- Похудание
- Анемия
Остеосаркомы, расположенные рядом со спинным мозгом, могут вызывать боль в спине, которая распространяется через руки или ноги.
Многие симптомы остеосаркомы можно легко игнорировать, как обычные боли роста у детей, поэтому регулярные осмотры и направления к специалистам чрезвычайно важны. Своевременная диагностика и выявление рака имеют решающее значение для успешного лечения.
Если вашего ребенка направили к ортопеду или онкологу, диагностическое обследование вашего ребенка начнется с тщательного сбора анамнеза и медицинского осмотра. Также может быть проведено подробное неврологическое обследование.Это включает в себя серию вопросов и тестов для проверки функции мозга, спинного мозга и нервов вашего ребенка.
В детской больнице Филадельфии (CHOP) клинические эксперты используют различные диагностические тесты для диагностики опухолей, в том числе:
- Рентгеновские снимки, дающие изображения костей.
- Магнитно-резонансная томография (МРТ), которая использует комбинацию больших магнитов, радиочастоты и компьютера для получения подробных изображений органов, мягких тканей, мышц, связок и других структур внутри тела.Ваш ребенок не подвергается воздействию радиации во время МРТ.
- Компьютерная томография (КТ), которая использует комбинацию рентгеновских лучей и компьютерных технологий для исследования костей и других областей, таких как легкие, и дает изображения поперечного сечения («срезы») тела.
- EOS imaging — технология визуализации, позволяющая создавать трехмерные модели из двух плоских изображений. В отличие от компьютерной томографии, изображения EOS делаются, когда ваш ребенок находится в вертикальном или стоячем положении, что позволяет улучшить диагностику благодаря положению с опорой на вес.
- Радиоизотопное сканирование костей , которое может помочь найти области аномального роста.
- Позитронно-эмиссионная томография (ПЭТ), при которой в вену вводят радиоактивный сахар и сканер для получения подробных компьютерных снимков участков тела.
- Анализы крови , которые могут помочь определить использование и эффективность лекарств, биохимические заболевания и функцию органов.
- Игольная биопсия — это процедура, при которой врач вводит небольшую иглу через кожу в очаг поражения, чтобы взять небольшой образец аномальной ткани.Ткань исследуется для подтверждения диагноза.
Помимо диагностики конкретного типа рака, который может быть у вашего ребенка, эти тесты также помогут определить размер и расположение опухоли, а также стадию рака. Вся эта информация имеет решающее значение при выборе наилучшего лечения для вашего ребенка.
Существует множество вариантов лечения рака костей и мягких тканей. Некоторым детям потребуется сочетание этих методов лечения. В CHOP специалисты программы по лечению опухолей костей и мягких тканей используют командный подход к лечению.Ортопеды, онкологи и другие специалисты сотрудничают, чтобы предоставить вашему ребенку индивидуальный уход и наилучшие возможные результаты.
Нашу программу возглавляют Кристи Л. Вебер, доктор медицины, и Александр Аркадер, доктор медицины, всемирно известные хирурги, специализирующиеся на лечении опухолей костей и мягких тканей, хирургии с сохранением конечностей и реконструктивной хирургии.
В отличие от доброкачественных опухолей опорно-двигательного аппарата, для которых может потребоваться только «осторожное ожидание», чтобы увидеть, развивается ли боль или дисфункция, злокачественные опухоли костей требуют активного лечения.
Химиотерапия
Лечение остеосаркомы всегда включает химиотерапию. Химиотерапия относится к лекарствам, которые помогают бороться с раком. Это лекарство можно давать перед операцией, после операции или одновременно. Это помогает нацеливаться на первичную опухоль, а также на любые раковые клетки, которые, возможно, уже распространились, но еще не были обнаружены.
В большинстве случаев химиотерапия проводится вашему ребенку через имплантируемый венозный порт в груди. Этот порт остается на месте во время терапии и помогает ребенку избежать многократных уколов иглой.
Хирургия
Операция по лечению остеосаркомы преследует две цели:
- Удалить опухоль
- Для восстановления функции на месте опухоли
Ротационная пластика при остеосаркоме
Около 90 процентов детей с остеосаркомой можно вылечить с помощью щадящей хирургии конечностей (также известной как спасение конечностей) и реконструктивной хирургии. Хирурги CHOP регулярно проводят эти сложные операции и постоянно работают над улучшением результатов лечения детей с наиболее трудно поддающимися лечению опухолями.
Операции по сохранению конечностей выполняются под общим наркозом. Он включает в себя вырезание опухоли и окружающего ее края здоровой ткани. В зависимости от размера и расположения опухоли, а также возраста и стадии роста вашего ребенка хирурги могут использовать различные реконструктивные методы для восстановления функций организма вашего ребенка.
В реконструкцию могут входить:
- Замена сустава, если остеосаркома вашего ребенка расположена на колене, бедре или плече или рядом с ним.Если ваш ребенок все еще растет, можно использовать модифицированную замену сустава, которую можно расширять по мере роста вашего ребенка.
- Аллотрансплантат (трупная кость), если опухоль вашего ребенка находится в середине кости руки или ноги. Эта замещающая кость служит структурным наполнителем, придавая конечности вашего ребенка больше прочности и долговечности, поскольку его собственная кость растет вокруг нее.
- Бесплатная васкуляризованная трансплантация малоберцовой кости, если у вашего ребенка опухоль находится в бедренной кости. Эта процедура включает перемещение одной кости из голени вашего ребенка для замены больной бедренной кости.Это может быть сделано вместе с аллотрансплантатом или вместе с ним.
Примерно в 10 процентах случаев — из-за размера или расположения опухоли — остеосаркома не может быть удалена с помощью операции с сохранением конечностей. В этих редких ситуациях существует два хирургических варианта:
- Ампутация пораженной конечности.
- Функциональная ампутация (ротационная пластика). Детская больница Филадельфии — одна из очень немногих больниц, предлагающих эту сложную операцию, при которой лодыжка принимает на себя функцию колена.Дети могут вернуться к активному образу жизни и иметь почти нормальное функционирование.
После операции по поводу остеосаркомы ваш ребенок должен оставаться в больнице от двух до пяти дней.
Хирургическая безопасность
Хотя операция по поводу злокачественных опухолей очень эффективна, мы понимаем, что любая операция может стать стрессом для детей и семей. В CHOP мы предлагаем множество ресурсов о том, как подготовить вашего ребенка к операции и чего ожидать во время операции.
Кроме того, мы применяем множество передовых методов до, во время и после операции, чтобы снизить риск заражения и улучшить исход вашего ребенка.Дополнительные сведения о протоколах безопасности в Детской больнице Филадельфии см. В разделе «Безопасность в хирургии».
Лучевая терапия
В редких случаях лучевая терапия может быть вариантом лечения остеосаркомы. Лучевая терапия использует волны высокой энергии, такие как рентгеновские лучи, для уничтожения или уменьшения раковых клеток.
Протонная терапия остеосаркомы
Детская больница Филадельфии в сотрудничестве с Penn Medicine также предлагает протонную терапию детям в Центре протонной терапии Робертса.
Протонная терапия — это инновационная форма лучевой терапии, которая доступна только в некоторых больницах по всей стране. Самым большим преимуществом протонной терапии является то, что она передает большую часть своей энергии в очень узкое поле в месте расположения опухоли, что делает ее менее опасной для окружающей здоровой ткани.
Если операция была проведена, ваш ребенок будет осмотрен хирургом через 1-2 недели после операции, затем снова через три и шесть месяцев после операции. Если вашему ребенку была проведена реконструктивная операция, ему может потребоваться долгосрочное наблюдение для наблюдения за заменой сустава, аллотрансплантатом или трансплантацией малоберцовой кости.Детям, которым была сделана ампутация конечности или ротационная пластика, необходимо будет оснастить протезом и внести обычные изменения по мере роста.
Настоятельно рекомендуется проводить регулярный мониторинг со стороны обученных врачей, чтобы отслеживать возможное повторение роста и контролировать любые побочные эффекты лечения.
Остеосаркома может рецидивировать даже после успешного лечения, поэтому вашему ребенку важно регулярно посещать врача, особенно если вы замечаете какие-либо повторяющиеся симптомы.
Во время последующих посещений рекомендуется делать рентген и другие диагностические исследования места опухоли, чтобы внимательно следить за здоровьем вашего ребенка, проверять реконструкцию и убедиться, что нет рецидива.
Последующее наблюдение, постоянная поддержка и услуги доступны в нашем основном кампусе и во всей сети CHOP Care Network. Наша команда стремится к сотрудничеству с родителями и лечащими врачами, чтобы обеспечить вашему ребенку наиболее актуальную, всестороннюю и специализированную помощь.
Если ваш ребенок нуждается в постоянном наблюдении до зрелого возраста, он может продолжать посещать тех же врачей, которые лечили его. Программа CHOP по лечению опухолей костей и мягких тканей тесно сотрудничает с Penn Medicine.Для семей, которые живут далеко и нуждаются в постоянном наблюдении, наши клинические специалисты помогут вашему ребенку перейти на уход для взрослых рядом с домом.
