Остеосаркома (остеогенная саркома)
Что такое остеосаркома?
Кости содержат несколько типов клеток. Остеобласты ответственны за образование основы костей, а именно, соединительной ткани и неорганических веществ (минералов), которые обеспечивают прочность костей.
Остеокласты помогают регулировать уровень неорганических веществ в крови, влияя на отложение и удаление этих веществ из костей, что дает возможность костям сохранять необходимую форму. Костный мозг, имеющийся в некоторых костях, содержит жировые, а самое главное, гематопоэтические клетки, производящие различные клетки крови.
Различают плоские и длинные трубчатые кости. Плоские кости помогают защищать от повреждений головной мозг и органы грудной полости, живота и таза. Например, кости черепа и грудина относятся к плоским костям, а кости верхних и нижних конечностей — к длинным трубчатым костям.
Остеосаркома является наиболее часто встречающейся опухолью костей.
Как и другие злокачественные опухоли, остеосаркома может распространяться на близлежащие ткани (мышцы, сухожилия, жировую ткань), а также через кровоток в другие кости, легкие и другие внутренние органы.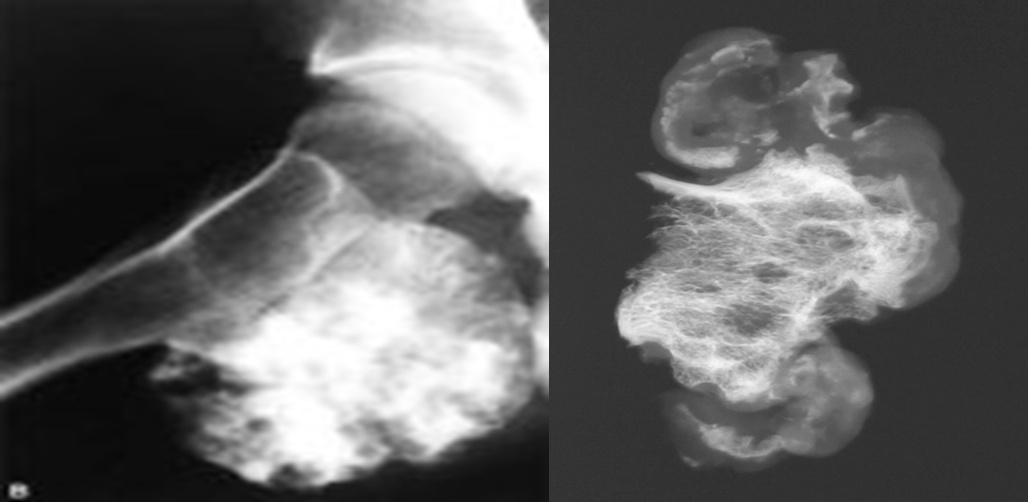
Чаще всего остеосаркома возникает на концевых частях длинных трубчатых костей, особенно в области коленных суставов. 80% остеосарком у детей и подростков развивается именно в этих областях. Второй по частоте локализацией остеосарком является верхний отдел плечевой кости. Однако остеосаркома может возникнуть в любой кости, включая кости таза и челюсть.
Не все злокачественные опухоли костей являются остеосаркомами. Саркома Юинга является второй по частоте злокачественной опухолью у детей и подростков. Другие опухоли обычно выявляются у взрослых и очень редко у детей. К ним относятся хондросаркома, возникающая из хряща, и злокачественная фиброзная гистиоцитома.
К доброкачественным опухолям костей относятся остеомы, хондромы, остеохондромы, эозинофильные гранулемы, фибромы, ксантомы, гигантоклеточные опухоли и лимфангиомы.
Различают несколько подтипов остеосарком с различным прогнозом заболевания.
Выделяют остеосаркомы низкой, промежуточной и высокой степенью злокачественности.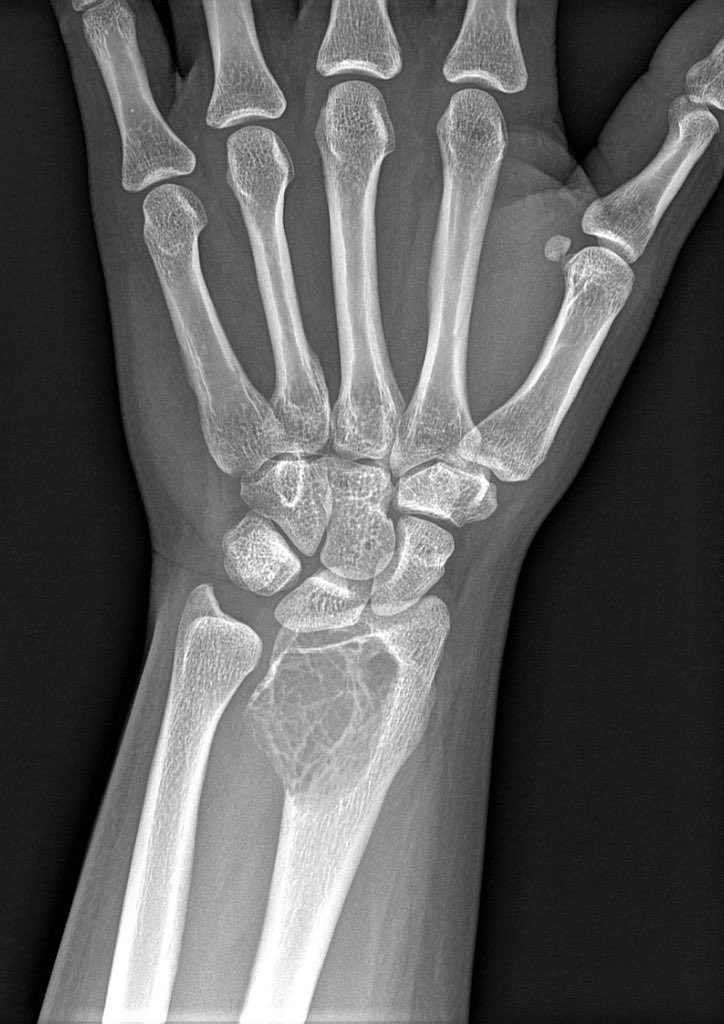
Среди остеосарком высокой степени злокачественности обнаруживают остеобластические, хондробластические, фибробластические, смешанные, мелкоклеточные и телангиэктатические варианты.
Периостальный вариант относится к остеосаркомам промежуточной степени злокачественности, в параостальный и интрамедуллярный варианты — к остеосаркомам низкой степени злокачественности.
Степень злокачественности остеосарком определяет прогноз заболевания.
Так, после полного удаления остеосаркомы низкой степени злокачественности обычно не требуется химиотерапия и исход заболевания благоприятный.
При остеосаркомах высокой степени злокачественности необходимо применение как оперативного вмешательства, так и химиотерапии. Исход заболевания у больных с остеосаркомами промежуточной степени злокачественности непостоянен.
Большинство остеосарком у детей относится к опухолям высокой степени злокачественности.
Как часто встречается остеосаркома?
Ежегодно в среднем в мире регистрируется 2-3 случая заболевания на 1 млн.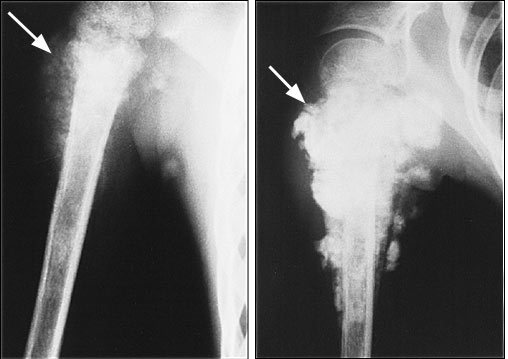 населения.
населения.
В США диагностируется около 900 новых случаев остеосарком в год. Опухоли несколько чаще встречаются у лиц мужского пола по сравнению с женским.
Наиболее часто заболевают подростки и молодые люди в возрасте от 10 до 23 лет, хотя остеосаркома может возникнуть в любом возрасте.
Факторы риска развития остеосаркомы
Возраст и рост.
Облучение костей. У людей, перенесших лучевую терапию по поводу другой опухоли, имеется повышенный риск развития постлучевой остеосаркомы. Перенесенное облучение в молодом возрасте, а также высокие дозы лучевой терапии (свыше 60 грей), повышают риск возникновения остеосаркомы.
Рентгеновские лучи, примененные с диагностической целью, практически не влияют на риск развития остеосаркомы.
Некоторые заболевания костей. У детей и подростков с некоторыми заболеваниями костей имеется повышенный риск возникновения остеосаркомы при достижении взрослого возраста.
Болезнь Педжета является доброкачественным, но предопухолевым заболеванием, при котором поражается одна или несколько костей. Обычно заболевание возникает в возрасте старше 50 лет. В 5-10% случаев при тяжелом течении болезни Педжета развиваются костные саркомы, причем, как правило, остеосаркомы.
Остеохондромы относятся к доброкачественным опухолям костей и хряща. При наличии множественных наследственных остеохондром риск развития остеосаркомы повышен. Чем больше у больного остеохондром, тем выше риск возникновения остеосаркомы.
Наследственные опухолевые синдромы. У детей с некоторыми наследственными опухолевыми синдромами имеется повышенный риск развития остеосаркомы.
У людей с синдромом Ли-Фраумени повышен риск возникновения рака молочной железы, надпочечника, опухолей головного мозга, остеосаркомы и других опухолей.
Ретинобластома относится к редким опухолям глаза у детей. В 40% случаев ретинобластомы являются наследственными. У детей с такими опухолями риск возникновения остеосаркомы повышен. В случае проведения лучевой терапии на область глаза повышается риск развития остеосаркомы костей черепа.
Возможно ли предотвратить возникновение остеосаркомы?
Отказ от некоторых привычек может привести к предотвращению многих видов злокачественных опухолей у взрослых.
Однако таким путем предотвратить возникновение злокачественных опухолей, включая остеосаркому, у детей в настоящее время нельзя.
Диагностика остеосаркомы
Необходимо помнить, что чем раньше установлен диагноз остеосаркомы, чем лучше прогноз (исход) заболевания.
Боль в пораженной кости является наиболее частой жалобой больного. Поначалу боль не постоянна и обычно усиливается по ночам. В случае поражения нижней конечности физическая нагрузка приводит к усилению боли и появлению хромоты.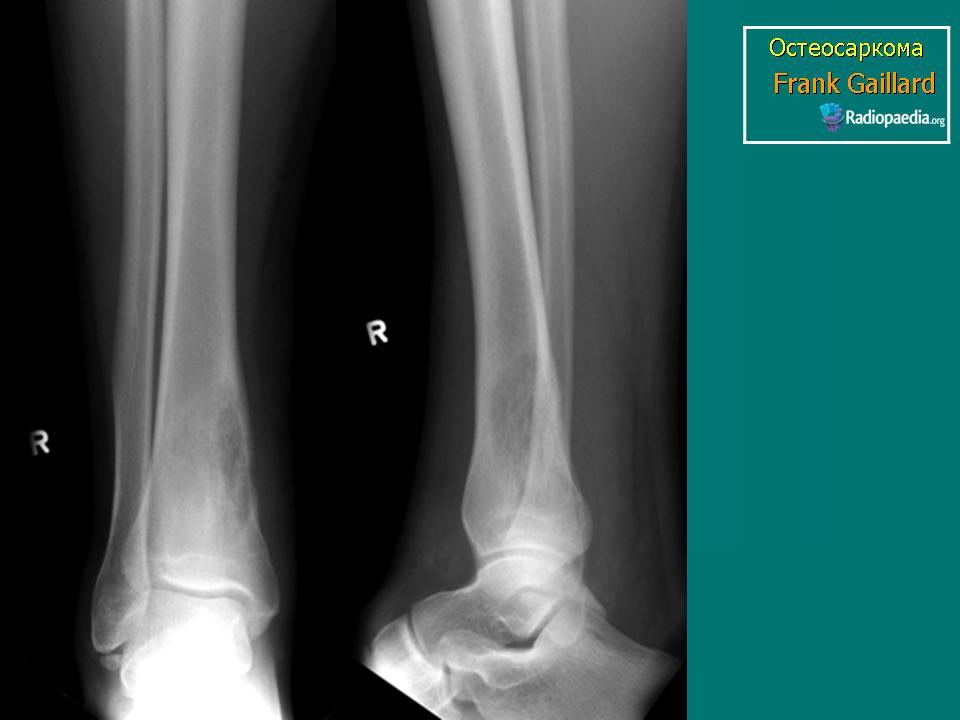
Хотя остеосаркома делает кость менее прочной, однако переломы встречаются редко. Телангиэктатические остеосаркомы являются редким вариантом опухоли, но в 30% случаев приводят к перелому кости.
В норме в молодом возрасте боль и припухлость являются частым явлением, поэтому во многих случаях диагноз остеосаркомы устанавливается поздно.
Рентгенография костей позволяет установить диагноз остеосаркомы, однако необходимо микроскопическое подтверждение с помощью биопсии опухоли.
Компьютерная томография (КТ) наряду с внутривенным контрастированием позволяет получить детальную структуру кости и определить объем поражения (близлежащих мышц, жировой ткани и пр.) и выбрать участок биопсии кости.
КТ также дает возможность обнаружить метастазы в легких.
С помощью магнитно-резонансной томографии (МРТ) более детально изучаются мягкие ткани, опухоль и костный мозг.
Радионуклидное сканирование костей проводится с помощью технеция-99. В результате этого исследования можно выявить поражение других костей и легочной ткани.
Стадирование остеосаркомы
Под стадированием подразумевается определение степени распространения процесса
Принципиально остеосаркомы подразделяются на локализованные и метастатические.
При локализованной остеосаркоме поражена только кость и прилежащие ткани, включая мышцы, сухожилия и т.д.
В случае метастатической остеосаркомы имеется множественное поражение костей, легких (85%). Кроме того, возможно вовлечение головного мозга и других внутренних органов.
У больных с метастазами прогноз хуже, чем у пациентов с локализованным процессом. Однако в случае хирургического удаления метастазов и проведения химиотерапии прогноз улучшается.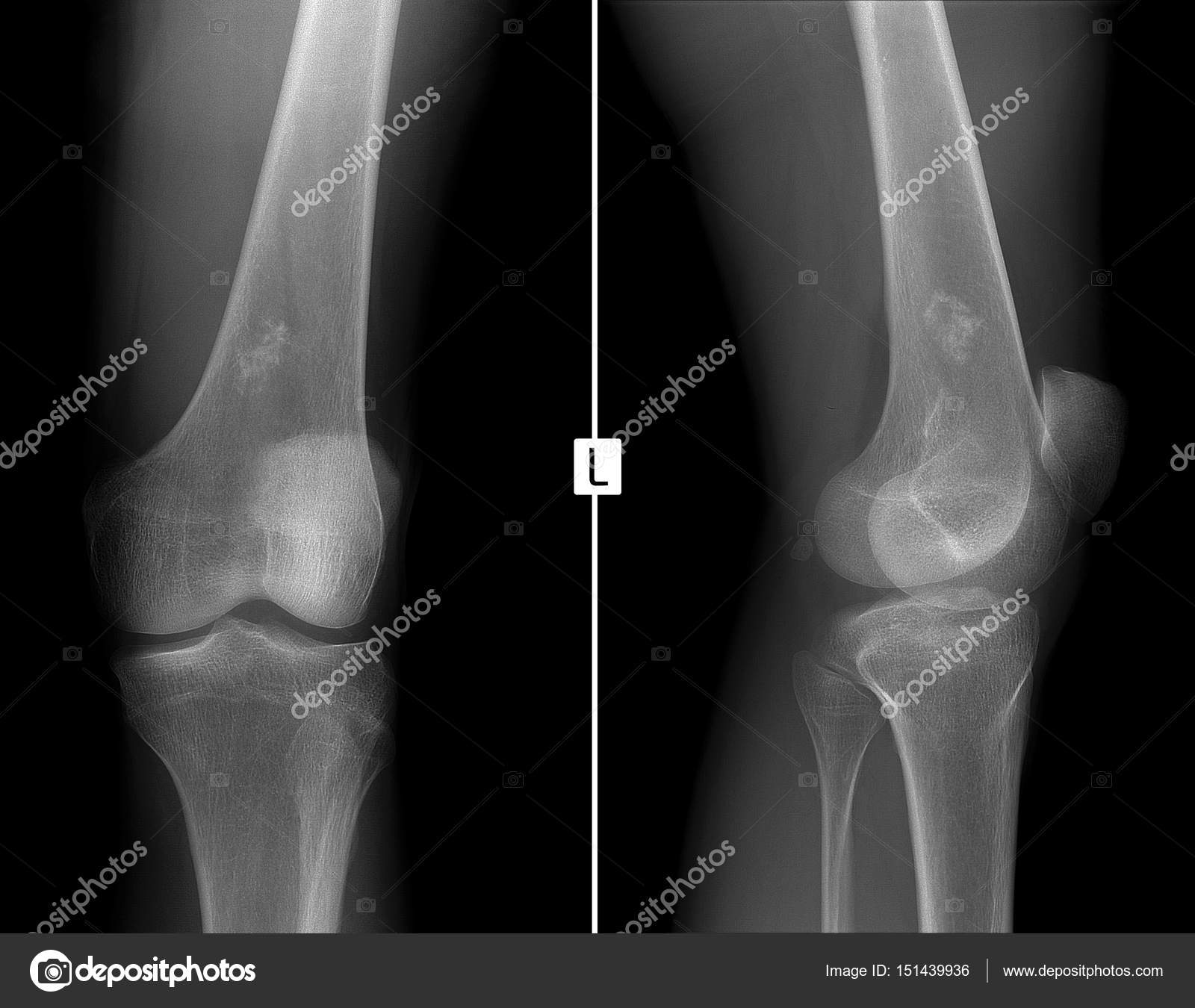
Лечение остеосаркомы
За последние 30 лет достигнуты существенные успехи в лечении остеосаркомы. В 60-е годы единственным методом лечения была ампутация конечности. В зависимости от стадии заболевания выживаемость больных в течение 2 лет колебалась от 5 до 20%. С момента внедрения эффективной химиотерапии появилась возможность применять ее до и после операции, причем в ряде случаев удавалось избежать ампутации конечности.
В настоящее время 5-летняя выживаемость больных с локализованной остеосаркомой превышает 70%. Выживаемость больных с чувствительными к химиотерапии опухолями варьирует в пределах 80-90%.
После обследования больного и уточнения стадии остеосаркомы разрабатывается план лечения. Следует иметь в виду, что в связи с редкостью остеосарком лечение нужно проводить только в специализированных отделениях, имеющих достаточный опыт.
У больных с локализованной, но неудалимой остеосаркомой после химиотерапии, прогноз заболевания обычно неблагоприятный. К этой категории относятся больные с остеосаркомами основания черепа, позвоночника и костей таза.
К этой категории относятся больные с остеосаркомами основания черепа, позвоночника и костей таза.
Хирургическое лечение может заключаться как в удалении опухоли и сохранении конечности, так и в ампутации конечности. Операцию с сохранением конечности удается выполнить в 50-80% случаев, хотя в ряде случаев позднее приходиться прибегать к ампутации.
Для некоторых больных ампутация является единственным видом возможной операции.
Это относится к больным с обширным распространением опухоли в окружающие ткани, прорастанием сосудов и нервов. После протезирования такие пациенты имеют возможность ходить уже через 3-6 месяцев после ампутации.
Хирургическое удаление метастазов применяется у больных с поражением легочной ткани. При этом учитываются количество, размер и расположение метастазов, а также эффективность химиотерапии.
Химиотерапия относится к системным методам лечения.
Введенный в организм противоопухолевый препарат поступает в кровоток и достигает опухолевые клетки, разрушая их.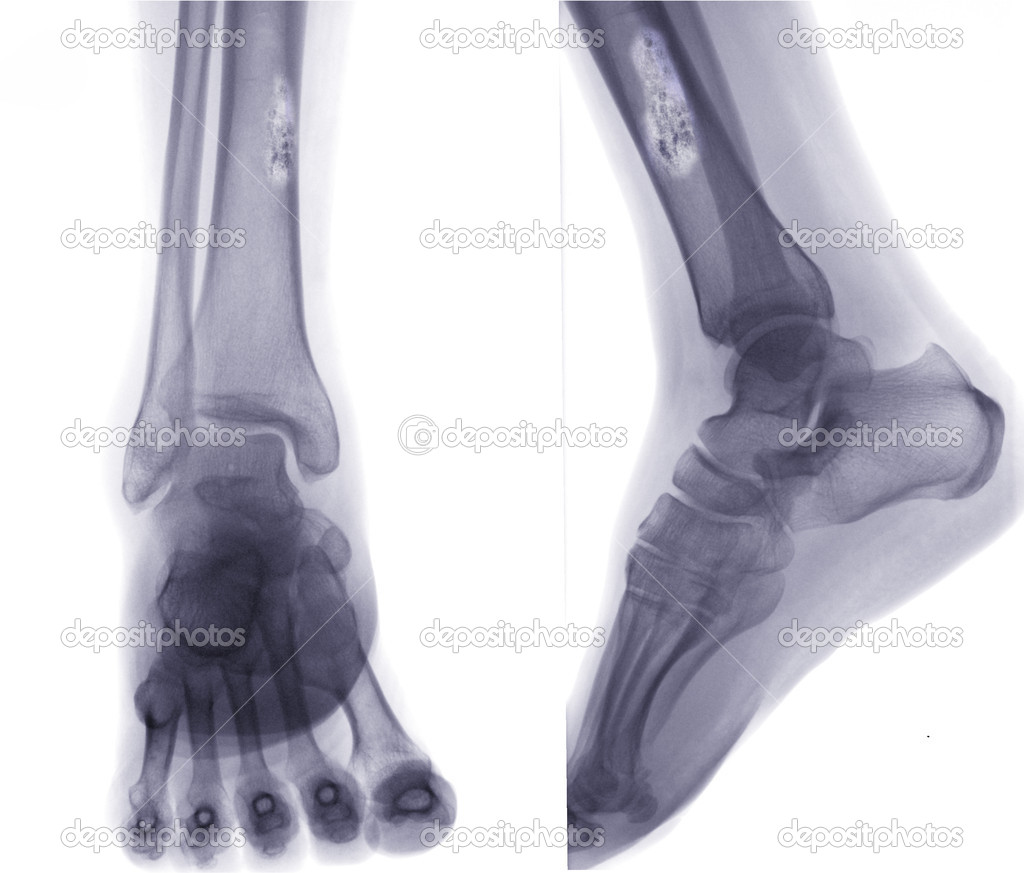 В большинстве случаев больные остеосаркомой получают химиотерапию до или после операции.
В большинстве случаев больные остеосаркомой получают химиотерапию до или после операции.
При этом применяют следующие препараты: метотрексат в высоких дозах в сочетании с лейковорином, который нейтрализует препарат и предотвращает побочные эффекты, доксорубицин (адриамицин), цисплатин, карбоплатин, этопозид, ифосфамид, циклофосфамид.
Химиотерапия приводит к уничтожению опухолевых клеток.
Однако при этом повреждаются и нормальные клетки. Выраженность побочных эффектов зависит от типа препарата, дозы и длительности применения.
Из временных побочных эффектов следует отметить тошноту, рвоту, ухудшение или потерю аппетита, выпадение волос, образование язв во рту, нарушение менструального цикла, геморрагический цистит, нарушение функции почек, печени и сердца. Повреждение клеток костного мозга может сопровождаться присоединением инфекций и кровотечений.
В редких случаях химиотерапия повышает вероятность возникновения вторых опухолей, например, лейкоза, однако следует иметь в виду, что значение химиотерапии при остеосаркоме превышает риск вторых опухолей.
Лучевая терапия
Для лечения больных с остеосаркомой используют наружное облучение с применением лучей или частиц высоких энергий.
Однако этот вид терапии играет ограниченную роль при остеогенной саркоме. Он может быть эффективным у больных после неполного удаления опухоли. Кроме того, лучевая терапия применяется для борьбы с болью и у пациентов в случае рецидива (возврата) опухоли после операции.
Что происходит после окончания лечения?
После завершения лечения больной находится под наблюдением врачей и проходит периодическое обследование: рентгенографию и КТ грудной клетки, сканирование костей, эхокардиограмму, ЭКГ, аудиограмму.
В течение первого года больной посещает врача обычно каждые 2 месяца. Это позволяет своевременно выявлять побочные эффекты и осложнения и проводить соответствующее лечение, а также на ранних этапах диагностировать рецидив (возврат) опухоли.
Психологические аспекты при лечении остеосаркомы
Большинство случаев остеосарком возникает в подростковом возрасте — самом чувствительном периоде жизни человека.
Все это откладывает глубокий отпечаток на жизнь больного, в том числе на возможность посещать школу, заниматься спротом, работой и другой деятельностью. Особенно сложным периодом является первый год лечения.
Помощь членов семьи, друзей, медицинского персонала и психолога могут оказать положительное влияние на больного остеосаркомой.
Полезным может оказаться и беседы с больными, уже перенесшими лечения по поводу такого же заболевания.
Остеохондрома (костно-хрящевой экзостоз) — доброкачественный дефект нарушения развития кости, обычно в области эпифизарной пластинки роста. В основном локализуется первоначально в метафизах длинных костей конечностей, однако по мере роста скелета смещается в сторону диафиза, но может располагаться также в костях таза, рёбрах, позвонках, лопатке, суставных концах ключицы. Наиболее часто встречающееся доброкачественное заболевание скелета, составляет около 20% всех первичных опухолей скелета. В основном обнаруживается у детей и подростков (наиболее часто во втором десятилетии жизни), рост остеохондромы прекращается ко времени созревания скелета, но иногда продолжается и после закрытия зоны роста. В 70% случаев солитарные остеохондромы выявляют у больных в возрасте моложе 30 лет. Остеохондрома развивается из метафизарной кортикальной пластинки и её ось направлена в сторону от ближайшего сустава. Остеохондроматоз (множественная экзостозная хондродисплазия) — наследственное заболевание, наследуется по аутосомно-доминантному типу, чаще у больных моложе 20 лет.
В основном обнаруживается у детей и подростков (наиболее часто во втором десятилетии жизни), рост остеохондромы прекращается ко времени созревания скелета, но иногда продолжается и после закрытия зоны роста. В 70% случаев солитарные остеохондромы выявляют у больных в возрасте моложе 30 лет. Остеохондрома развивается из метафизарной кортикальной пластинки и её ось направлена в сторону от ближайшего сустава. Остеохондроматоз (множественная экзостозная хондродисплазия) — наследственное заболевание, наследуется по аутосомно-доминантному типу, чаще у больных моложе 20 лет.
Клиническая картина. Симптомы зависят от локализации и размера экзостоза.
Рентгенологически — контуры подлежащей кортикальной и губчатой кости переходят непосредственно в контуры остеохондромы; хрящевая шапочка обычно рентгенопрозрачна, но иногда содержит очаги кальцификации; граница кальцификации в хрящевом покрытии и в теле остеохондромы чётко различима.
Патоморфология.
Макроскопия. Остеохондрома представляет собой губчатую кость с тонким кортикальным слоем, поверхность которой покрыта хрящом (обычно толщиной менее 1 см), напоминающим суставной; размеры образования от 2 до 12 см и более; может быть на ножке или с широким основанием прикрепления; хрящевое покрытие не отделено от подлежащей кости субхондральной замыкательной пластинкой.
Микроскопия. Хрящевое покрытие в виде гиалинового хряща с беспорядочно расположенными хондроцитами неравномерной величины, но без ядерного атипизма и двуядерных клеток. Хрящевая шапочка ограничена хорошо определяемым перихондрием, отделяющим её от прилежащих мягких тканей. В зрелой остеохондроме пожилых пациентов может отсутствовать хрящевая шапочка. В большинстве остеохондром толщина шапочки — 0,5–1,5 см; при толщине хрящевого покрытия более 2 см можно заподозрить наличие вторичной хондросаркомы.
Дифференциальная диагностика. Паростальная костно-хрящевая пролиферация, паростальная остеосаркома, хондросаркома на почве озлокачествления остеохондромы.
Лечение. В большинстве случаев осуществляется наблюдение за патологическим очагом. Если появляется болевой синдром или развиваются выраженные деформации скелета, производится иссечение экзостоза у его основания с полным удалением хрящевой шапочки.
Исход благоприятный, при оперативном лечении перихондриум, покрывающий экзостоз, должен быть удалён, иначе возможен рецидив. Озлокачествление: солитарных форм — менее чем в 1% случаев, превращается в хондросаркому, фибросаркому. Особенно увеличен риск озлокачествления у больных с множественными остеохондромами. Озлокачествление вероятно при внезапном усилении роста экзостоза, увеличении его диаметра более 5 см, толщины хрящевого покрытия более 1 см.
Органосохранные операции при остеосаркоме у животных
Что такое остеосаркома?
Остеосаркома или остеогенная саркома (рак кости) представляет собой самую распространенную и наиболее злокачественную опухоль кости поражающую собак крупных и гигантских пород, а также встречающуюся у кошек.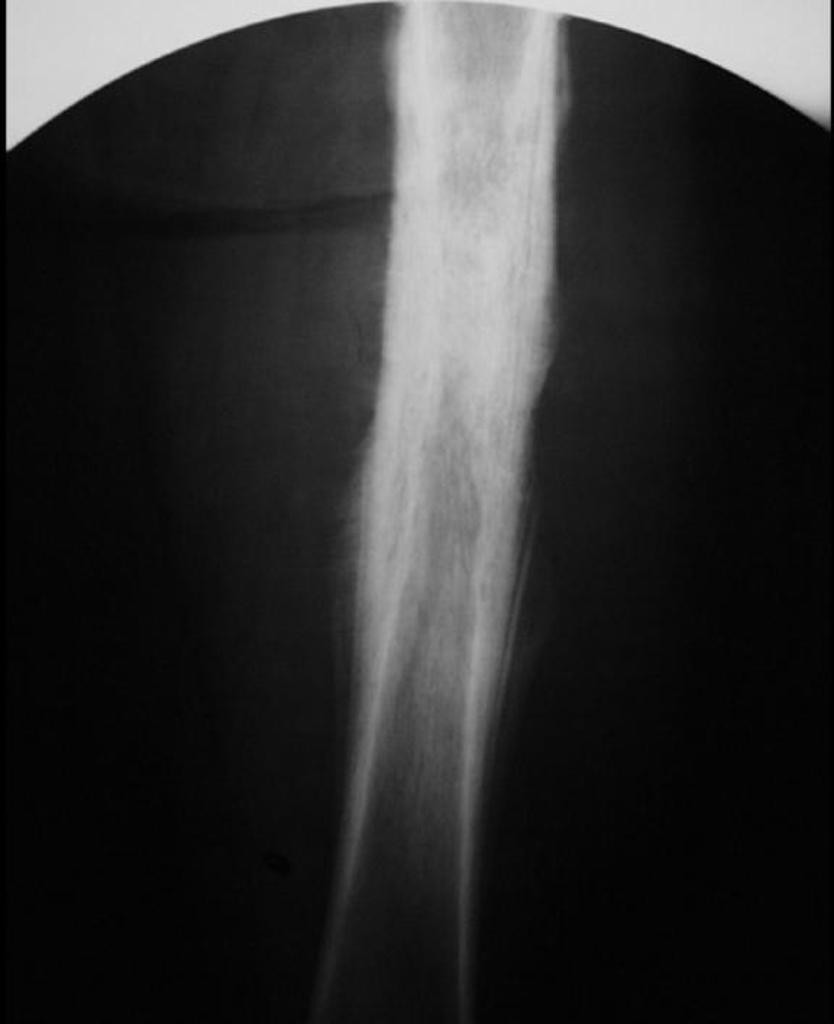 По статистике около 90 % опухолей костей являются злокачественными. Около 85% из них составляет остеосаркома. Данная опухоль быстро метастазирует в другие органы (часто в легкие) и требует своевременной диагностики и комплексного лечения. Остеосаркома может поражать как взрослых собаки так и молодых собак (встречается с 18 до 24 месяцев). Наиболее часто поражается нижняя треть лучевой кости, однако поражена может быть любая кость скелета (Рис.1, 2 ).
По статистике около 90 % опухолей костей являются злокачественными. Около 85% из них составляет остеосаркома. Данная опухоль быстро метастазирует в другие органы (часто в легкие) и требует своевременной диагностики и комплексного лечения. Остеосаркома может поражать как взрослых собаки так и молодых собак (встречается с 18 до 24 месяцев). Наиболее часто поражается нижняя треть лучевой кости, однако поражена может быть любая кость скелета (Рис.1, 2 ).
Рис. 1. Наиболее частые места поражения трубчатых костей остеосаркомой.
Рис. 2. Рентген грудной конечности собаки с остеогенной саркомой нижней трети лучевой кости (отмечено звездочкой).
Какие симптомы при остеосаркоме конечностей?
Наиболее частый симптом — хромота разной степени выраженности, от легкой (незначительная) до тяжелой, когда собака совсем не пользуется лапой (Рис. 3). Часто хромота периодическая на протяжении 1-2-х месяцев, а затем переходит в постоянную.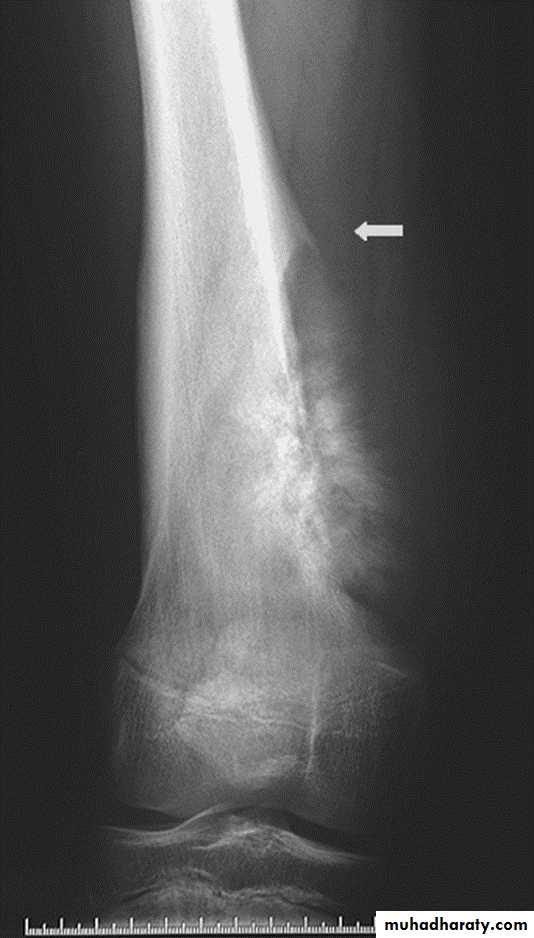 Иногда можно заметить отек, припухлость или увеличение конечности в размере (Рис. 4). Также в редких случаях может произойти так называемый «патологический перелом» который происходит при незначительных нагрузках (на прогулке) и связан с разрушением большей части пораженной кости (Рис. 5).
Иногда можно заметить отек, припухлость или увеличение конечности в размере (Рис. 4). Также в редких случаях может произойти так называемый «патологический перелом» который происходит при незначительных нагрузках (на прогулке) и связан с разрушением большей части пораженной кости (Рис. 5).
Рис. 3. Хромота по типу висячей конечности (полное отсутствие опороспособности) у собаки с остеосаркомой до опеарации.
Рис. 4. Отек конечности в области предплечья у собаки с остеосаркомой локтевой кости.
Рис. 5. Компьютерная томограмма грудной конечности пациента с патологическим переломом на фоне остеосаркомы плечевой кости.
Как поставить диагноз? Какое обследование нужно пройти?
Первоначально, для постановки диагноза требуется: история болезни, ортопедическое обследование пациента, рентгенологическое исследование пораженной конечности в 2-х плоскостях и рентген грудной клетки (не менее 2-х проекций).
Прогноз в виде продолжительности жизни пациента зависит от стадии болезни, а это определяется наличием или отсутствием отдаленных метастазов. Для более точной диагностики и выявления метастазов, альтернативной рентгеновским снимкам может быть компьютерная томография всего пациента с выполнением онкологического поиска (Рис. 6). Так как компьютерная томография выполняется под седацией для уменьшения рисков анестезии может потребоваться преданестезиологическое обследование которое включает: клинический, биохимический анализы крови, УЗИ сердца (преданестезиологическое обследование) и УЗИ брюшной полости.
Если метастазов обнаружено не было, тогда может быть рассмотрена органосохранная операция как альтернатива полной ампутации конечности.
Рис. 6. Компьютерная томография всей собаки (онкологический поиск).
Какие могут быть варианты лечения?
После прохождения полной диагностики и отсутствии доказательств наличия метастазов могут быть рекомендованы: органосохранная хирургия + химиотерапия или ампутация + химиотерапия. До недавнего времени методом лечения была тотальная ампутация пораженной конечности. Только эта процедура могла избавить животное от мучительных болей. Но сегодня в нашей клинике возможно проведение органосохранных операций.
До недавнего времени методом лечения была тотальная ампутация пораженной конечности. Только эта процедура могла избавить животное от мучительных болей. Но сегодня в нашей клинике возможно проведение органосохранных операций.
Ампутация или нет? Что такое органосохранная операция?
Органосохранная хирургия представляет собой удаление пораженной опухолью части кости с замещением дефекта каким-либо имплантатом. При такой операции конечность сохраняется (Рис. 7).
Рис. 7. Схематичное изображение принципа органосохранной хирургии.
На сегодняшний день в нашей клинике используется наиболее передовая методика органосохранной хирургии, рекомендуемая европейским онкологическим ветеринарным обществом. Перед операцией выполняется компьютерная томография всего пациента для исключения метастазов. Затем под контролем КТ берется трепанобиопсия для подтверждения диагноза (Рис.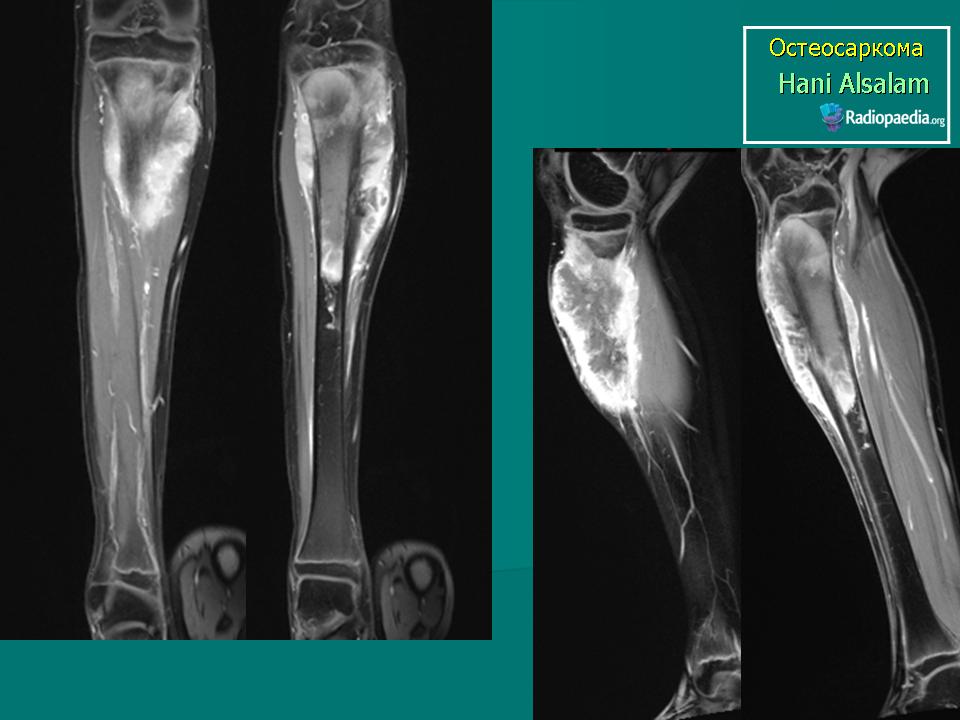 8).
8).
Рис. 8. Компьютерная томография собаки (онкологический поиск) с одномоментным выполнением (за один наркоз) трепанобиопсии кости. Диагноз: остеосаркома локтевой кости.
Для того чтобы провести подобную операцию в нашей клинике, впервые в России стали использовать 3D принтеры для создания и дальнейшей печати полной копии пораженной конечности, для планирования хода операции на основании данных компьютерной томографии (3D моделирование) (Рис.9, 10).
Рис. 9. Создание 3D модели кости собаки с остеосаркомой с помощью компьютерного томографа.
Рис. 10. Пластиковая 3D копия пораженной конечности напечатанная с помощью 3D принтера для предоперационного планирования.
После удаления части кости на ее место устанавливается индивидуально подобранный имплантат (специальная титановая пластина с повышенной степенью прочности) в сочетании с костным цементом, который заполняет недостающую часть кости (Рис. 11). Именно имплантаты в последующем и будут являться опорой для кости. Подбор имплантов очень важен так как они должны обладать достаточной прочностью и поэтому наши врачи одни из первых в России стали использовать современные LCP имплантаты (блокируемые пластины и блокируемые гвозди) (Рис.12, 13, 14).
Рис. 11.
Рис.12.
Рис.13.
Рис.14.
При поражении локтевой кости мы также впервые в России использовали блокируемый штифт (гвоздь). Данная техника позволяет уже через 24 часа после операции полноценно пользоваться конечностью (Рис. 15).
Рис. 15. Рентген грудной конечности пациента с остеосаркомой средней трети локтевой кости (область разрушения кости отмечена желтыми стрелками).
Компьютерная томография грудных конечностей этого же пациента.
3D моделирование: Компьютерная томография грудных конечностей с сочетанной КТ-биопсией кости.
Видео. Опороспособность пациента через 24 часа после органосохранной хирургии по поводу остеосаркомы локтевой кости (описано выше). Выполнена постановка блокируемого стержня.
Видео. Органосохранная хирургия при остеосаркоме предплечья у собаки с замещением костного дефекта индивидуальным эндопротезом, изготовленным методом 3D печати. Результат через 6 месяцев.
Использование блокируемых имплантов, на сегодняшний день, является одним из наиболее надежных способов фиксации костей у людей в мировой ортопедии.
Таким образом, после операции функция конечности и сама конечность сохраняется и позволяет животному вести прежний, активный образ жизни как до болезни.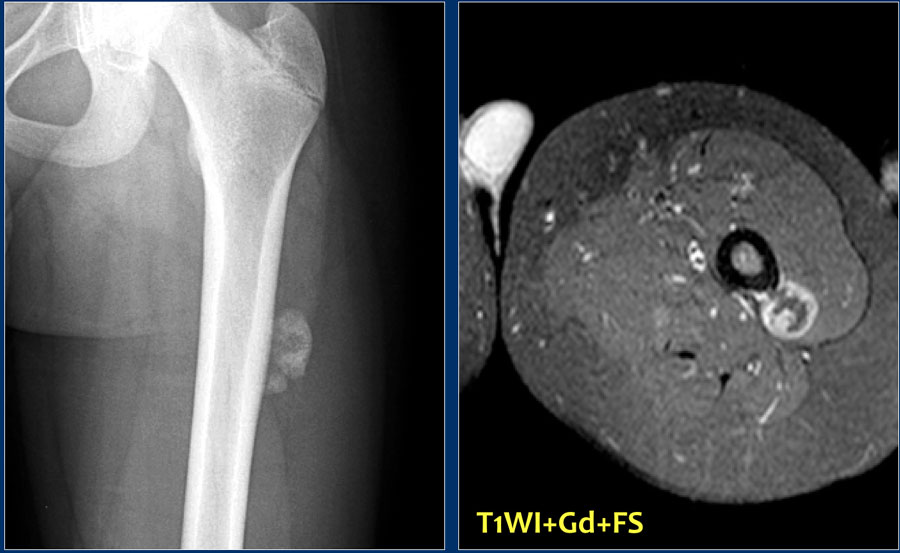
Органосохранная хирургия в сочетании с химиотерапией на сегодняшний день является стандартом в лечении остеосаркомы во всем мире и выполняется в нашей клинике. Операция может быть выполнена в большинстве случаев если нет отдаленных метастазов и не выявлен патологический перелом.
Осложнения которые могут возникнуть после операции: инфицирование, перелом имплантата, перелом кости, рецидив опухоли (опухоль распространяется далее по кости), некроз области мягких тканей, кожи и длительная хромота.
Какой прогноз?
Наиболее короткий период жизни отмечается при отсутствии какого-либо лечения (до 3-х месяцев) так как разрушение кости прогрессирует, что доставляет животному страдания в виде постоянной боли.
Наиболее длительный период жизни может быть у пациентов при комбинированном лечении (хирургия + химотерапия).
При выполнении только одной ампутации без применения химиотерапии, длительность жизни не превышает 4-6 месяцев и по некоторым данным метастазирование отмечается в течении 119-175 дней.
Существуют ли альтернативы полной ампутации конечности?
На сегодняшний в клинике «Бэст» разработан инновационный метод протезирования с использованием вживляемых в кость протезов после перенесенной ампутации конечностей (методика «Чрескожное остеоинтегрируемое протезирование конечностей протезами SerGoFIX™» (Рис. 16).
Рис. 16. а) Пациент после ампутации по поводу синовиальной саркомы сапястья.
Рис. 16. б) Установка протеза SerGoFIX™.
Рис. 16. в) Примерка первого прототипа внешнего протеза.
Видео. Чрескожное остеоинтегрируемое протезирование конечностей после ампутации протезами SerGoFIX™.
Наша клиника является второй в мире, где выполняется данная операция собакам и кошкам.
Данная операция является альтернативой полной ампутации и может быть использована в случаях поражение нижних частей конечности, области фаланг пальцев, опухолей мягких тканей области пясти / запястья.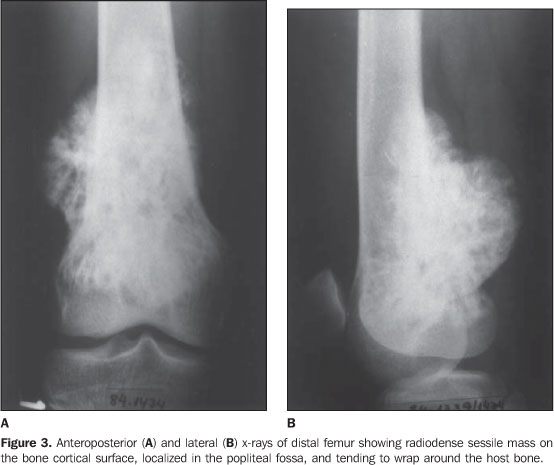 Суть операции сводится к тому, что в остаток части конечности (культи) вживляется индивидуальный протез, который изготовлен на основании данных компьютерной томографии и к нему крепится сама искусственная лапа (фото). В результате кость и кожа срастается вместе с протезом, а конечность воспринимается животным как собственная.
Суть операции сводится к тому, что в остаток части конечности (культи) вживляется индивидуальный протез, который изготовлен на основании данных компьютерной томографии и к нему крепится сама искусственная лапа (фото). В результате кость и кожа срастается вместе с протезом, а конечность воспринимается животным как собственная.
Таким образом наши Врачи обладают достаточным опытом, чтобы помочь Вашему питомцу и выбрать для него лучший вариант лечения.
Остеосаркома: врачи, клиники, цены | Russian Hospitals
3 стадии остеосарком
В отличие от других видов сарком, остеосаркома имеет не четыре, а три стадии:
- I стадия — опухоль не вышла за границы кости, метастазов нет
- II стадия — опухоль распространилась на органы и ткани рядом с костью
- III стадия — метастазы есть в ближайших и отдаленных органах
На III стадии боли становятся невыносимыми, появляются вторичные опухоли в легких и головном мозге. 5-летняя выживаемость после лечения — 70%, во многих случаях можно избежать ампутации конечности. Прогноз зависит от места, где образовалась опухоль, насколько она распространилась и от степени злокачественности. Очень важно, как отвечает опухоль на лечение препаратами химиотерапии.
5-летняя выживаемость после лечения — 70%, во многих случаях можно избежать ампутации конечности. Прогноз зависит от места, где образовалась опухоль, насколько она распространилась и от степени злокачественности. Очень важно, как отвечает опухоль на лечение препаратами химиотерапии.
Лечение остеосарком: химиотерапия и операция
При остеосаркоме нужно хирургическое вмешательство, чтобы удалить опухоль, и химиотерапия до и после операции. Это нужно для того, чтобы уменьшить размер первичного очага опухоли, подавить микроскопические метастазы в легких, оценить, как отвечает опухоль на лечение препаратами химиотерапии. Обязательно нужна операция: если можно избежать ампутации, то удаляют часть кости, которую заменяют на имплантат. После операции опять следует курс химиотерапии, чтобы подавить оставшиеся клетки опухоли.
В каких случаях невозможно избежать ампутации?
Органосохраняющую операцию невозможно применить, если опухоль сильно увеличилась в размерах и проросла в мягкие ткани, при патологическом переломе и при прорастании опухоли в сосудисто-нервный пучок. Если появились метастазы, то органосохраняющая операция все равно возможна. Операция с сохранением конечности возможна более, чем у 80% пациентов.
Если появились метастазы, то органосохраняющая операция все равно возможна. Операция с сохранением конечности возможна более, чем у 80% пациентов.
Лучевая терапия применяется лишь в тех случаях, когда опухоль неоперабельна или состояние пациента не позволяет провести операцию. Остеосаркома плохо поддается воздействию ионизирующего излучения.
Где найти клинику для лечения остеосаркомы?
Несмотря на то, что остеосаркома очень агрессивная злокачественная опухоль, которая стремительно распространяется в органы и ткани, новые подходы к лечению, когда операция дополняется химиотерапией, позволяют побороться за жизнь пациента даже тогда, когда появились метастазы в легких.
На портале RussianHospitals представлены клиники, со специализацией на лечение остеосаркомы в России. Для того, чтобы связаться с клиникой, сделайте 3 несложных шага:
- Выберите клинику на RussianHospitals
- Заполните форму обращения и загрузите свои медицинские документы
- Получите ответ от клиники
«Говорю ей — живем! И мы обе плачем.
 Для меня это история души». Как онколог, пережившая рак, помогает своим пациентам | Громадское телевидение
Для меня это история души». Как онколог, пережившая рак, помогает своим пациентам | Громадское телевидениеАлександре Васильченко поставили диагноз остеосаркома в подростковом возрасте. Ее жизнь врачи спасли. Когда лечение было закончено, она решила — после школы будет поступать в медицинский институт. И хотя поначалу документы отказывались принимать из-за диагноза, она своего добилась. И вот уже 3,5 года работает клиническим онкологом и химиотерапевтом в одной из киевских клиник.
4 февраля, в День всемирной борьбы против рака, hromadske рассказывает историю Александры — о ее детских переживаниях и грозившей ампутации руки, об огромном желании жить в моменты, когда смерть совсем рядом, о том, как ее опыт теперь помогает понимать и поддерживать своих пациентов, и о том, почему не надо бояться диагноза «рак».
Диагноз, буллинг, кавалер и пиво для лейкоцитов
Мне было 12 лет. Беззаботное детство. Как-то у меня начала болеть рука. Бегала — упала, ну, болит и болит. Потом я стала просыпаться по ночам, прислонялась к холодной стенке, так становилось легче. Но в какой-то момент поняла — надо говорить маме и папе. Мне сделали рентген, отправили в Институт ортопедии в Киеве. Врачи сказали: «Девочка неактивная, наросла надкостница, надо почистить и все пройдет». Но родители решили проконсультироваться еще у кого-нибудь. И вот нас направили в Институт рака, там сделали биопсию образования, через неделю стоял диагноз — остеосаркома, злокачественная опухоль кости. Началось полуторагодовое лечение, которого даже врагу не пожелаешь. Особенно тяжело пришлось родителям, я-то была в полубессознательном состоянии — эти капельницы, бесконечная рвота, слабость. Родители буквально за год оба поседели. Мне удалили плечевую кость и заменили ее на протез.
Потом я стала просыпаться по ночам, прислонялась к холодной стенке, так становилось легче. Но в какой-то момент поняла — надо говорить маме и папе. Мне сделали рентген, отправили в Институт ортопедии в Киеве. Врачи сказали: «Девочка неактивная, наросла надкостница, надо почистить и все пройдет». Но родители решили проконсультироваться еще у кого-нибудь. И вот нас направили в Институт рака, там сделали биопсию образования, через неделю стоял диагноз — остеосаркома, злокачественная опухоль кости. Началось полуторагодовое лечение, которого даже врагу не пожелаешь. Особенно тяжело пришлось родителям, я-то была в полубессознательном состоянии — эти капельницы, бесконечная рвота, слабость. Родители буквально за год оба поседели. Мне удалили плечевую кость и заменили ее на протез.
Александра Васильченко
Фото:Александр Хоменко/hromadske
У нас в отделении было 60 детей и 2-3 медсестры. Мама выполняла роль и медсестры, и мамы, и подружки, она все время была рядом. А еще — папа и сестра, и пара друзей, которым родители, видимо, объяснили, что меня надо поддерживать. А вот когда я приезжала в школу на 2-3 дня, надо мной издевались. Дети не понимали, почему я в 12 лет — лысая девочка, к тому же, мне назначили гормональную терапию, я была круглая, с растяжками. Именно пубертат, когда девочка хочет чувствовать себя красивой, нравиться мальчикам и ходить на свидания, у меня был ужас.
А вот когда я приезжала в школу на 2-3 дня, надо мной издевались. Дети не понимали, почему я в 12 лет — лысая девочка, к тому же, мне назначили гормональную терапию, я была круглая, с растяжками. Именно пубертат, когда девочка хочет чувствовать себя красивой, нравиться мальчикам и ходить на свидания, у меня был ужас.
В больнице были новые друзья. Периодически они умирали. Утром я собиралась идти играть с кем-то в карты, а мама мне говорила — ну, ночью умерла.
Думаю, я достойно переносила лечение. Тяжелее всего было привыкнуть к тому, что я больше не могу ходить в школу, не могу нормально есть, меня все время тошнит. Поначалу даже стоял вопрос об ампутации руки. К этому надо было привыкнуть, как и к тому, что вот она — смерть, совсем близко. Сразу после постановки диагноза родители мне сказали, что болезнь смертельная, а лечение будет очень тяжелым.
У меня был очень классный врач, постоянно на позитиве: у меня выпадали волосы — он вместе со мной их доставал; у меня маленькие тромбоциты — он мне на носу делал синяк. Спустя 15 лет он все еще хранит эти фотографии, на которых у меня синий нос.
Спустя 15 лет он все еще хранит эти фотографии, на которых у меня синий нос.
Когда лечение закончилось, я год ни с кем не выходила на связь. Общалась только с доктором. А потом поняла, что было немало и прикольных историй. Например, ходило поверье, что при низких лейкоцитах помогает пиво, и вот в 12 лет ты вместе с 30-ю другими детьми наливаешь себе пива, а оно ж мерзкое в таком возрасте, но зато весело, кураж несется. У меня даже был кавалер, очень симпатичный мальчик. Правда, с одной ногой, но меня это никак не смущало, я — лысая и толстая, мы были прекрасной парой. Все были на позитиве. А если страдать с утра до ночи, такой настрой приводит к тому, что ребенок быстро умирает.
Врач vs домохозяйка, и ремиссия как чудо
Когда я вернулась в школу и все наладилось, начала думать, кем бы я хотела быть. И поняла, что буду или супер домохозяйкой, или супер врачом. Про домохозяйку думала, потому что была не уверена в себе. В школе нам внушали, что в медицинский поступить невозможно. Думала: не поступлю — придется замуж выходить.
Думала: не поступлю — придется замуж выходить.
Но я поступила, хотя когда пришла с документами, мне сказали — мы вас не возьмем, потому что у вас была остеосаркома. И отправили меня на какую-то спецкомиссию. Я пришла туда и спросила: что со мной не так? Когда футболка прикрывает шрам, понять, что со мной что-то не так, очень сложно. Мне говорят: ну ты же понимаешь, что никаких поблажек не будет? Я отвечаю: так я не прошу поблажек, я поступаю на обычных условиях, чтобы учиться.
И они разрешили.
fullscreenАлександра в детстве во время лечения от рака
Я видела себя врачом, понимала, что есть должок. Ведь я живу, и это не потому, что такая хорошая, а потому что есть люди, которые учились, работали надо мной и спасали. Я подживаю в долг. И я должна его возвращать. Вселенной, Богу, людям. Как мне помогли, так я сейчас помогаю людям и кайфую от этого, это наполняет смыслом мою жизнь.
Я всегда думала, что онкология — это супер интересно, она пересекается со всеми системами, опухоли такие хитрые, ты постоянно пытаешься их подловить, повлиять на них. Когда вижу, как плачут от счастья, вижу хорошие результаты лечения, это кайф.
Когда вижу, как плачут от счастья, вижу хорошие результаты лечения, это кайф.
Поначалу хотела быть детским онкологом, но не получилось, я поняла, что выгорю буквально через год. И не из-за детей. Частной детской онкологии у нас нет, а в государственной есть иерархия, это нормально, но мне хотелось быстрого развития. Поэтому я ушла во взрослую онкологию.
Есть одна история, которая стала для меня чудом. У меня была пациентка, моя одногодка, диагноз — саркома Юинга. Ее неправильно поначалу повели, вылез рецидив. Мы начали довольно агрессивное лечение, прошли тяжелую химиотерапию, удалили новообразование, облучили. И вот появляются метастазы. Когда я увидела заключение КТ, мне в обморок хотелось упасть. Да, такое бывает, но у меня была саркома, здесь саркома, мне так хотелось эту историю превратить в чудо. И мы попробовали все, что могли. А потом стали просто наблюдать. Проходит какое-то время, она чувствует себя хорошо. Делаем КТ — метастазы не растут. И в какой-то момент я понимаю, что наверное это не метастазы.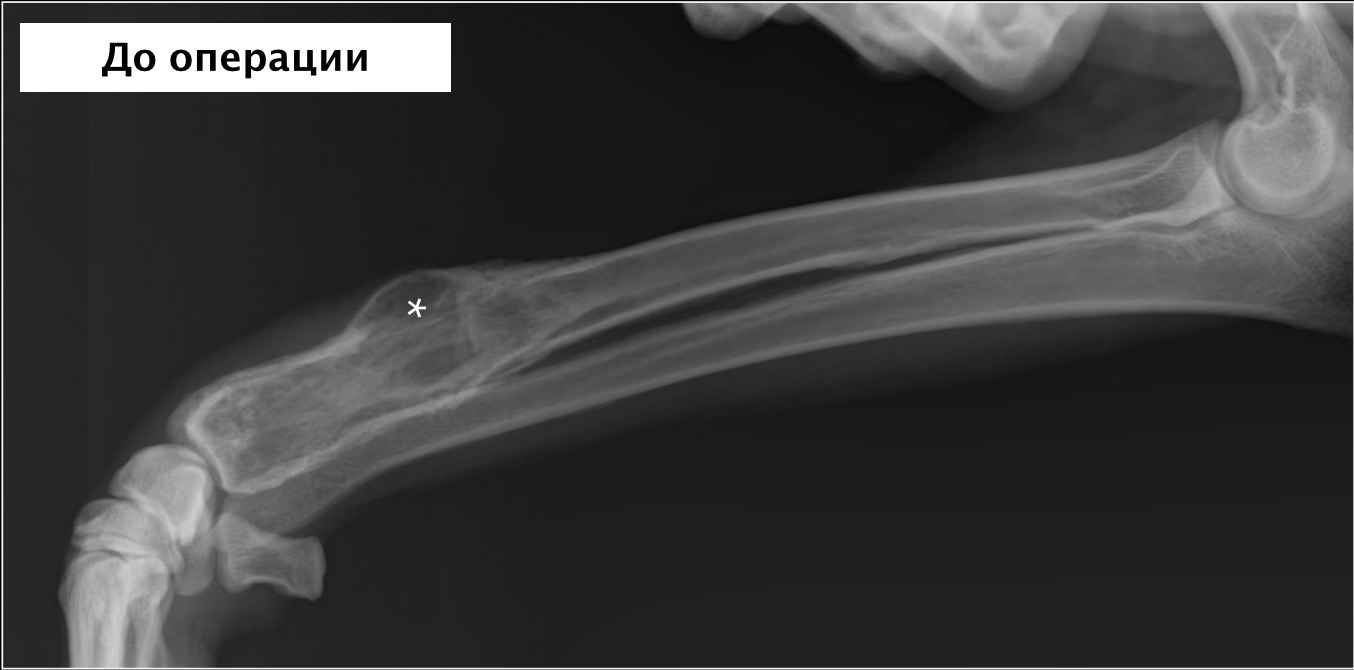 Созываю консилиум. Оказывается, что это грибковая пневмония. Ее часто путают с метастазами. Когда диагноз рак, все подозрительное в организме могут принять за метастазы.
Созываю консилиум. Оказывается, что это грибковая пневмония. Ее часто путают с метастазами. Когда диагноз рак, все подозрительное в организме могут принять за метастазы.
Я звоню пациентке и говорю — живем! Она плачет, я плачу. Для меня это история души.
fullscreenАлександра Васильченко
Фото:Александр Хоменко/hromadske
Большой теннис, онкохирургия и «мальчики» за 80 лет
Замены протеза у меня после операции так и не было, в Украине это сделать не смогут, а поехать за границу у меня пока нет времени. Рука беспокоит, болит, у меня на тумбочке всегда лежат таблетки, бывает, ночью глаза открыла — выпила таблетку на автомате. Но я хожу в спортзал, играю в большой теннис, поднимаю штангу, это как вызов. В лучшие времена приседала со штангой 80 кг. Да, у меня протез, но это никак не должно меня ограничивать.
Во время лечения мне сказали, что я не смогу родить, это из-за препаратов, которые мне давали. Но когда поняла, что можно, ходила и говорила себе — давай рожать! И когда с первого раза забеременела, подумала: о, и здесь все получилось.
Теперь я бы хотела освоить онкохирургию, чтобы делать небольшие манипуляции. Я хожу в операционную, учусь. Я химиотерапевт, но чтобы поставить порт, мне нужно знать, как.
Бывали ли ошибки в моей практике? Мое главное правило — не навредить. Если есть хоть малейшее сомнение, я высосу мозг коллегам, пока не пойму, что иду в правильную сторону. Но я еще слишком молодой врач, чтобы принимать глобальные решения самостоятельно.
Да, неприятные ситуации были, но зачастую из-за того, что родственникам пациента надо согнать на ком-то злость. Бывало, что и полицию вызывали, и судмедэксперт приезжал. Но есть диагноз, никто никаких ложных надежд не давал, я не говорю, что у нас тут есть чудо метод, и мы вас вылечим. Я всегда говорю объективно.
Увы, есть такие люди, которые решают не лечить своих родных. Они просят, чтобы я отправила пациента домой. Не видят смысла [в лечении]. Я им говорю — нет, свою ответственность несите сами, я лечить могу. В такие моменты вспоминаю, как у меня умирал папа, не от онкологии, но я помню, что хотела еще день, еще час с ним! Я всю больницу на уши подняла! И когда вижу, что отказываются… Думаю: ну вы же могли еще полгода, год сидеть с этим человеком за одним столом, общаться. О таком тяжело говорить.
Мой опыт [лечения] очень помогает понять пациента. Когда мне говорят — во рту ничего не чувствую… Я вспоминаю себя и заканчиваю их предложение своими словами, их это впечатляет. Конечно, я не начинаю прием со слов «У меня тоже была злокачественная опухоль, поэтому вам надо лечиться у меня». Кому-то я этого вообще не рассказываю, но кому-то это нужно. Ведь психологический момент для пациента — один из самых важных.
Бывает, звоню на КТ (компьютерная томография, — ред.), говорю, что надо записать мальчика, меня спрашивают — сколько ребенку лет? Я отвечаю: 82. У меня все мальчики и девочки, хотя конечно с каждым — свой стиль общения. С кем-то надо соблюдать субординацию, с кем-то можно по-дружески.
Я доступна пациенту 24/7, мне могут и в 5 утра позвонить, и я только за, потому что лучше они не будут ждать, пока доктор отдохнет, а я потом это буду выгребать неделю. Но бывает, когда чувствую — все. Тогда сажусь в машину, уезжаю на день, подышу другим воздухом, посмотрю в другую сторону, мне становится очень грустно, понимаю, что пора работать и чувствовать себя нужной. Для меня главные точки компенсации — это спорт, это сын, это хороший результат КТ.
Страх перед раком и скрининг как привычка
Как убедить людей не бояться обследований? Дело в том, что возраст, когда уже нужно делать скрининги, сильно сдвинулся, у меня есть пациенты от 24 до 27 лет, которые не должны входить в фазу постоянного онкоскрининга. Но они приходят, и даже не с первой стадией. Это первое. Поэтому не надо сидеть до 30 лет и думать, что с нами ничего не случится.
Второе — если вам не первую неделю лечат диарею, вы должны понимать, что простое заболевание должно пройти через 2-3 дня. Так что берем себя в руки и идем ко второму, к третьему врачу. Если вам плохо, а вам предлагают успокоительные, но легче не становится, идите к четвертому врачу. Такие пациенты слышат свой организм, понимают — что-то не так.
И третье — не надо бояться. Онкология, рак — это ужасные слова, все сразу думают — надо писать завещание и думать, на кого дачу переписать. Если вы не пришли вовремя, то вылечить не получится, однако у нас есть ресурс, чтобы продлить жизнь максимально долго. Но сегодня рак лечится, и если прийти вовремя, вы будете жить долго и счастливо.
слушайте также
У динозавра диагностировали рак редкого типа
Палеонтологи и врачи объединились, чтобы поставить диагноз динозавру, жившему 76 миллионов лет назад. В результате у древнего ящера было диагностировано онкологическое заболевание, причём впервые такая диагностика выполнялась на клеточном уровне. Это исследование поможет лучше понять как образ жизни динозавров, так и эволюционные корни рака.
Достижение описано в научной статье, опубликованной в журнале Lancet Oncology.
Учёных заинтересовала странная форма малоберцовой кости динозавра Centrosaurus apertus возрастом 76–77 миллионов лет. Считалось, что это след плохо сросшегося перелома, но эксперты усомнились в этом и заподозрили злокачественную опухоль.
Команда, в которую входили как палеонтологи, так и медики, подошла к диагностике примерно так же, как если бы «пациент» был человеком. Сначала исследователи сделали компьютерную томографию окаменелости. Затем они изучили тонкие среды кости на клеточном уровне с помощью микроскопа. Специалисты сравнили пробы с образцами здоровой кости C. apertus, а также человеческой костной ткани, поражённой раковой опухолью.
Учёные пришли к выводу, что ящер страдал от остеосаркомы – редкой и агрессивной формы рака кости. У людей диагностируется 3–4 таких случая на миллион в год.
Кость динозавра была поражена редкой злокачественной опухолью. Перевод Вести.Ru.
Это не первый случай обнаружения раковых опухолей у динозавров. Однако впервые такая диагностика была выполнена на клеточном уровне. Кроме того, никогда ещё у мезозойских гигантов не обнаруживалась остеосаркома.
«Мы демонстрируем первое в своём роде несомненное свидетельство запущенного рака кости у рогатого динозавра возрастом 76 миллионов лет. Это весьма захватывающе», – отмечает соавтор статьи Рианна Кроутер (Rhianne Crowther) из Трентского университета в Канаде.
Остеосаркома – малоизученный вид рака. Мы мало знаем о её причинах, генетических факторах и эволюционной истории. Теперь по крайней мере известно, что от этого недуга страдали динозавры, приходящиеся человеку весьма и весьма дальними родственниками. Значит, губительный недуг возник ещё до разделения наших эволюционных линий.
Новые данные интересны и учёным, реконструирующим повседневность мезозойских рептилий. Так, обнаруженная опухоль была достаточно развитой, чтобы мучить животное и мешать ему нормально ходить. Тем не менее ящер погиб не в зубах хищника, а во время наводнения вместе со всем своим стадом. Значит, стадный образ жизни обеспечивал достаточную защиту даже больным особям.
Авторы отмечают, что в музейных коллекциях может храниться ещё множество окаменелостей со следами онкологических и иных заболеваний. Они ждут своих дотошных исследователей.
К слову, ранее Вести.Ru рассказывали о раковой опухоли у «дедушки черепах» возрастом 240 миллионов лет. Также мы писали об онкологических заболеваниях древних гомининов. А ещё учёные обнаружили, что собаки, попавшие в Америку из Сибири, принесли с собой заразную форму рака.
Опубликованы результаты нового метода лечения остеосаркомы у собак — Новости Видаль
Грейхаунд Руби (на фото) – одна из многих собак, у которых была диагностирована остеосаркома, и её жизнь удалось продлить с помощью экспериментального метода лечения в Колледже ветеринарной медицины Университета Миссури (MU).
Исследовательская группа, возглавляемая сотрудниками факультета онкологии докторами Джеффри Брайаном и Брайаном Флеснером, изучает возможность применения персонализированного лечения рака кости.
В частности, исследователи работают с ELIAS Animal Health для создания вакцин с использованием собственной опухоли больной собаки. Вакцина вводится пациенту для стимуляции противоопухолевых лимфоцитов, которые затем собираются, размножаются вне организма и в дальнейшем вводятся пациенту.
По словам доктора Брайана, учёные подвергают лимфоциты воздействию химикатов, которые заставляют их атаковать клетки-мишени, а затем переливают их обратно в кровь пациента. Это приводит к гибели раковых клеток.
Процесс, который длится приблизительно семь-восемь недель, нацелен на определённые раковые клетки и позволяет избежать токсических побочных эффектов химиотерапии. В дальнейшем результаты лечения могут быть использованы для будущих клинических испытаний средств от рака у человека. Исследователи утверждают, что Руби, прошедшая экспериментальное лечение более трёх лет назад, является живым примером потенциала новой вакцины. Когда ей впервые поставили диагноз остеосаркома, жить ей оставалось менее года, и её владельцам сказали, что собаке придётся пройти несколько циклов химиотерапии вместе с ампутацией поражённой раком конечности.
Доктор Брайан говорит, что информация, полученная в ходе исследования, успехи и неудачи, уже может очень пригодиться в будущем, когда эта методика будет изучаться для применения на людях. Кроме того, учёные надеются расширить число видов рака, которые можно лечить таким способом.
Источник
Лечение рака кости (остеосаркома или остеогенная саркома)
Что такое остеосаркома?
Остеосаркома — это форма рака, которая возникает внутри кости. В отличие от многих состояний, обозначенных как «рак кости», которые на самом деле являются раком, который возникает в других органах (например, груди, простате или легких), а затем распространяется на костную ткань (известный как вторичный рак кости), остеосаркома является злокачественным новообразованием самой кости. (также известный как первичный рак кости).
Раковые клетки при остеосаркоме (также иногда называемой остеогенной саркомой) производят незрелую и нефункциональную форму костного остеоида, который проникает в нормальную костную ткань и замещает ее. Присутствие этого аномального костного матрикса помогает в постановке диагноза как при рентгенографии, так и при патологическом исследовании клеток в лаборатории.
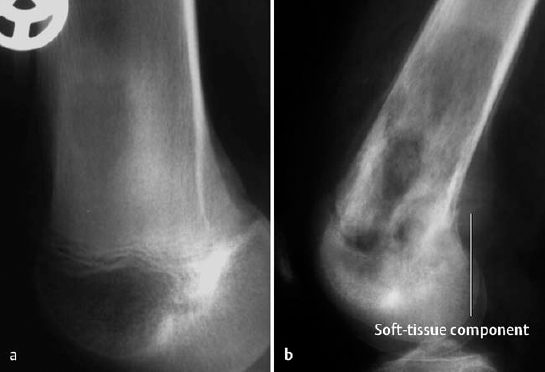
Рентгеновский снимок остеосаркомы дистального отдела лучевой кости (верхняя часть большей из двух костей предсердия).
Кто заболевает остеосаркомой?
Классическая остеосаркома диагностируется у детей, подростков и подростков.Однако у пожилых людей также может развиться форма заболевания. Когда пожилым людям ставят диагноз остеосаркома, это часто связано с другими заболеваниями, такими как болезнь Педжета, или случаями, когда участок тела ранее лечился лучевой терапией.
Каковы симптомы остеосаркомы?
Основным симптомом остеосаркомы обычно является боль около сустава (чаще всего колена), которая не проходит при отдыхе или обезболивании.Боль обычно усиливается со временем и усугубляется ударной нагрузкой (например, бегом) или, иногда, просто нагрузкой на конечность.
Как диагностируется остеосаркома?
Рентген — это первый шаг в постановке диагноза. При подозрении на остеосаркому рекомендуется направить пациента к врачу, специализирующемуся на ортопедической онкологии, для дополнительных анализов, включая биопсию.
Онколог-ортопед назначит МРТ подозрительного участка кости.Эти расширенные изображения помогут врачу выполнить биопсию костного поражения. Биопсия — это хирургическая процедура, при которой берут образец или сердцевину кости, которая может быть дополнительно исследована патологом под микроскопом.
Когда будет поставлен диагноз остеосаркома, будут выполнены дальнейшие визуальные исследования, чтобы определить, распространился ли рак в других частях тела.
Рентгеновский снимок биопсии дистального отдела бедренной кости (нижняя часть бедра).На этом изображении костный зажим удаляет часть поражения для отправки на лабораторное исследование.
Как лечится остеосаркома?
Лечением остеосаркомы занимается бригада врачей под руководством онколога и хирурга-ортопеда. Онколог назначает химиотерапевтическое лечение заболевания, которое показано при большинстве форм остеосаркомы. Хирург-ортопед выполняет удаление опухоли и реконструкцию конечности.Существует множество вариантов хирургического лечения, поэтому важно, чтобы и пациент, и семья внесли значительный вклад в определение наилучшего подхода. Новые методы восстановления пораженной кости с использованием собственной живой кости пациента возможны во многих случаях, даже во время химиотерапии.
После начальной химиотерапии и хирургических процедур пациент находится под наблюдением в течение долгого времени для выявления рецидива заболевания. Хотя любой диагноз рака меняет жизнь пациента и его семьи, остеосаркома поддается лечению, и многие пациенты излечиваются от болезни.
Назад в игру Истории пациентов
Лечение остеосаркомы (PDQ®) — Версия для пациентов — Национальный институт рака
О PDQ
Запрос данных врача (PDQ) — это обширная база данных по раку Национального института рака (NCI). База данных PDQ содержит резюме последней опубликованной информации о профилактике, обнаружении, генетике, лечении, поддерживающей терапии, а также дополнительной и альтернативной медицине.Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке. Версии для пациентов написаны на понятном нетехническом языке. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке.
PDQ — это услуга NCI. NCI является частью Национальных институтов здравоохранения (NIH). NIH — это центр биомедицинских исследований при федеральном правительстве. Обзоры PDQ основаны на независимом обзоре медицинской литературы.Это не политические заявления NCI или NIH.
Цель этого обзора
В этом обзоре информации о раке PDQ содержится текущая информация о лечении остеосаркомы и недифференцированной плеоморфной саркомы (UPS) (ранее называемой злокачественной фиброзной гистиоцитомой [MFH]) кости. Он предназначен для информирования и помощи пациентам, семьям и лицам, осуществляющим уход. Он не дает официальных руководящих принципов или рекомендаций для принятия решений в отношении здравоохранения.
Рецензенты и обновления
Редакционные коллегии составляют сводки информации о раке PDQ и поддерживают их в актуальном состоянии.Эти советы состоят из экспертов в области лечения рака и других специальностей, связанных с раком. Резюме регулярно пересматриваются, и в них вносятся изменения при появлении новой информации. Дата в каждой сводке («Обновлено») — это дата самого последнего изменения.
Информация в этом обзоре пациента была взята из версии для медицинских работников, которая регулярно пересматривается и обновляется по мере необходимости редакционной коллегией PDQ по лечению педиатрии.
Информация о клиническом испытании
Клиническое испытание — это исследование, призванное ответить на научный вопрос, например, лучше ли одно лечение, чем другое.Испытания основаны на прошлых исследованиях и на том, что было изучено в лаборатории. Каждое испытание отвечает на определенные научные вопросы, чтобы найти новые и более эффективные способы помощи больным раком. Во время клинических испытаний лечения собирается информация об эффектах нового лечения и о том, насколько хорошо оно работает. Если клинические испытания покажут, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным». Пациенты могут захотеть принять участие в клиническом исследовании.Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Клинические испытания можно найти в Интернете на сайте NCI. Для получения дополнительной информации позвоните в Информационную службу рака (CIS), контактный центр NCI, по телефону 1-800-4-CANCER (1-800-422-6237).
Разрешение на использование данного обзора
PDQ является зарегистрированным товарным знаком. Содержимое документов PDQ можно свободно использовать как текст. Его нельзя идентифицировать как сводную информацию о раке NCI PDQ, если не отображается вся сводка и не обновляется регулярно.Тем не менее, пользователю будет разрешено написать предложение, например: «В сводке информации о раке PDQ NCI о профилактике рака груди указываются риски следующим образом: [включить выдержку из резюме]».
Лучше всего процитировать это резюме PDQ:
Редакционная коллегия PDQ® Pediatric Treatment. PDQ Лечение остеосаркомы. Бетесда, Мэриленд: Национальный институт рака. Обновлено <ММ / ДД / ГГГГ>. Доступно по адресу: https://www.cancer.gov/types/bone/patient/osteosarcoma-treatment-pdq. Дата обращения <ММ / ДД / ГГГГ>.[PMID: 26389380]
Изображения в этом резюме используются с разрешения автора (ов), художника и / или издателя только для использования в обзорах PDQ. Если вы хотите использовать изображение из сводки PDQ и не используете все сводки, вы должны получить разрешение от владельца. Он не может быть предоставлен Национальным институтом рака. Информацию об использовании изображений в этом обзоре, а также многих других изображений, связанных с раком, можно найти в Visuals Online. Visuals Online — это коллекция из более чем 3000 научных изображений.
Заявление об ограничении ответственности
Информация, содержащаяся в этих сводках, не должна использоваться для принятия решений о страховом возмещении. Более подробную информацию о страховом покрытии можно найти на сайте Cancer.gov на странице «Управление онкологическими услугами».
Свяжитесь с нами
Более подробную информацию о том, как связаться с нами или получить помощь на веб-сайте Cancer.gov, можно найти на нашей странице «Свяжитесь с нами для получения помощи». Вопросы также можно отправить на Cancer.gov через электронную почту веб-сайта.
Что следует знать об остеосаркоме (раке костей) у собак | Передовая лучевая терапия для лечения рака собак и кошек
Варианты лечения остеосаркомы у собак
Поскольку опухоли остеосаркомы настолько агрессивны, ампутация пораженной конечности с последующей химиотерапией для лечения метастазов является наиболее распространенным методом лечения.Хотя ампутация — не лучший вариант для всех домашних животных, в остальном здоровые собаки могут вполне нормально функционировать с тремя ногами. Операция по сохранению конечностей — при которой опухоль удаляется, а кость заменяется другой костью (либо от вашего питомца, либо из банка костей) — может быть вариантом в зависимости от местоположения опухоли и от того, является ли она относительно небольшой в месте расположения опухоли. время постановки диагноза. Однако частота осложнений для этого типа хирургии, особенно инфекции, относительно высока. Когда операция невозможна из-за локализации опухоли, может быть полезно стереотаксическое излучение (SRS / SRT) .Это также может быть альтернативой ампутации для собак, у которых остеосаркома не разрушила большую часть кости. Этот продвинутый, высокоточный вид лучевой терапии фокусирует высокие дозы радиации на повреждение и уничтожение клеток остеосаркомы. Последующая химиотерапия все еще необходима. Основное преимущество SRS / SRT заключается в том, что он доставляет высокие дозы радиации с точностью до миллиметра. Это означает:
- Максимальный ущерб опухоли и минимальный побочный ущерб здоровым тканям около
- Меньшее количество сеансов лечения по сравнению с традиционно фракционированной лучевой терапией (CFRT) — пациентам требуется всего 1-3 сеанса, что означает меньшее количество анестезиологических вмешательств, меньший риск и меньшее нарушение вашего графика
- Возможность более быстрого восстановления с меньшим количеством побочных эффектов
- Способность лечить опухоли, ранее считавшиеся неизлечимыми, с помощью радиации
- Онкологи-радиологи PetCure Oncology имеют опыт использования SRS / SRT для лечения собак с остеосаркомой
Паллиативное лечение , которое помогает вашему питомцу чувствовать себя комфортнее, но не лечит, может включать в себя обычную лучевую терапию и лекарства для уменьшения боли.
Остеосаркома: предпосылки, патофизиология, этиология
Маруланда Г.А., Хендерсон Э.Р., Джонсон Д.А., Летсон Г.Д., Чеонг Д. Варианты ортопедической хирургии для лечения первичной остеосаркомы. Борьба с раком . 2008 15 января (1): 13-20. [Медлайн]. [Полный текст].
Vander Griend RA. Остеосаркома и ее варианты. Ортоп Клин Норт Ам . 1996, 27 июля (3): 575-81. [Медлайн].
Пельтье LF.Опухоли костей и мягких тканей. Ортопедия: история и иконография . Сан-Франциско: Норман Паблишинг; 1993. 264-91.
Кампаначчи М. Предисловие. Опухоли костей и мягких тканей: клинические характеристики, визуализация, патология и лечение . 2-е изд. Нью-Йорк: Спрингер-Верлаг; 1999.
Weis LD. Распространенные злокачественные опухоли костей: остеосаркома. Саймон М.А., Спрингфилд Д., ред. Хирургия опухолей костей и мягких тканей .Филадельфия: Липпинкотт-Рэйвен; 1998. 265-74.
Горлик Р., Джейнвей К., Марина Н. Остеосаркома. Pizzo PA, Poplack DG, ред. Принципы и практика детской онкологии . 7-е изд. Филадельфия: Вольтерс Клувер; 2016. 876-97.
Arceci RJ, Weinstein HJ. Неоплазия. Макдональд М.Г., Сешия ММК, ред. Неонатология Эйвери: патофизиология и лечение новорожденных . 7-е изд. Филадельфия: Вольтерс Клувер; 2016. 1048-60.
Ким С.Ю., Хельман Л.Дж. Стратегии изучения новых подходов к исследованию и лечению остеосаркомы. Cancer Treat Res . 2010. 152: 517-528. [Медлайн].
Кларк Дж. К., Дасс Ч. Р., Чунг П. Ф. Обзор клинических и молекулярных прогностических факторов при остеосаркоме. J Cancer Res Clin Oncol . Март 2008 г., 134 (3): 281-97. [Медлайн].
Pochanugool L, Subhadharaphandou T, Dhanachai M, et al.Факторы прогноза среди 130 пациентов с остеосаркомой. Clin Orthop Relat Res . 1997 Декабрь 345: 206-14. [Медлайн].
Tsuchiya H, Tomita K. Прогноз остеосаркомы, вылеченной хирургической операцией по спасению конечностей: десятилетнее межгрупповое исследование в Японии. JPN J Clin Oncol . 1992 22 октября (5): 347-53. [Медлайн].
Тейлор В.Ф., Айвинс Дж.С., Унни К.К. и др. Прогностические переменные при остеосаркоме: мультиинституциональное исследование. Национальный институт рака .1989, 4 января. 81 (1): 21-30. [Медлайн].
Hudson M, Jaffe MR, Jaffe N, et al. Детская остеосаркома: терапевтические стратегии, результаты и прогностические факторы, основанные на 10-летнем опыте. Дж. Клин Онкол . 1990 г. 8 (12): 1988-97. [Медлайн].
Meyer WH, Schell MJ, Kumar AP, et al. Торакотомия при метастатической остеосаркоме в легкие. Анализ прогностических показателей выживаемости. Рак . 1987 15 января. 59 (2): 374-9.[Медлайн].
Ян Дж., Ян Д., Когделл Д., Ду Х, Ли Х, Панг Й и др. Амплификация гена APEX1 и сверхэкспрессия его белка при остеосаркоме: корреляция с рецидивом, метастазированием и выживаемостью. Technol Cancer Res Treat . 2010 апр. 9 (2): 161-9. [Медлайн].
Кубиста Б., Клинглмюллер Ф., Бильбан М., Пфайффер М., Ласс Р., Гиуреа А. и др. Анализ микроматрицы идентифицирует различные профили экспрессии генов, связанные с гистологическим подтипом остеосаркомы человека. Инт Ортоп . 2011 марта. 35 (3): 401-11. [Медлайн].
Mirabello L, Troisi RJ, Savage SA. Заболеваемость остеосаркомой и выживаемость с 1973 по 2004 год: данные Программы эпиднадзора, эпидемиологии и конечных результатов. Рак . 2009 г., 1. 115 (7): 1531-43. [Медлайн].
Punzalan M, Hyden G. Роль физиотерапии и трудотерапии в реабилитации детей и подростков с остеосаркомой. Cancer Treat Res . 2010. 152: 367-84. [Медлайн].
Song WS, Kong CB, Jeon DG, Cho WH, Kim MS, Lee JA и др. Прогноз остеосаркомы конечностей у пациентов в возрасте 40-60 лет: когортное исследование в одном институте. евро J Surg Oncol . 2010 май. 36 (5): 483-8. [Медлайн].
Bu J, Li H, Liu LH, Ouyang YR, Guo HB, Li XY и др. Сверхэкспрессия P16INK4a и выживаемость у пациентов с остеосаркомой: метаанализ. Инт Дж. Клин Эксперт Патол . 2014. 7 (9): 6091-6. [Медлайн]. [Полный текст].
Ma W, Zhang X, Chai J, Chen P, Ren P, Gong M. Циркулирующий miR-148a является важным диагностическим и прогностическим биомаркером для пациентов с остеосаркомой. Биол опухолей . 2014 Декабрь 35 (12): 12467-72. [Медлайн].
Чжао В., Сюй Х. Высокая экспрессия TRPM8 предсказывает плохой прогноз у пациентов с остеосаркомой. Онкол Летт . 2016 12 августа (2): 1373-1379.[Медлайн].
Ким М.С., Ли SY, Чо WH и др. Исходный размер опухоли позволяет прогнозировать гистологический ответ и выживаемость у пациентов с локализованной остеосаркомой. 1: J Surg Oncol . 2008 12 февраля. 97 (5): 456-61. [Медлайн].
Кубо Т., Фурута Т., Йохан М.П., Адачи Н., Очи М. Анализ наклона динамической магнитно-резонансной томографии для оценки химиотерапевтического ответа остеосаркомы или саркомы Юинга: систематический обзор и метаанализ. Скелетный радиол .2016 Сентябрь 45 (9): 1235-42. [Медлайн].
Enneking WF, Spanier SS, Goodman MA. Система для хирургической стадии саркомы опорно-двигательного аппарата. Clin Orthop Relat Res . 1980 ноябрь-декабрь. 153: 106-20. [Медлайн].
Enneking WF, Spanier SS, Goodman MA. Обзор текущих концепций. Хирургическая стадия саркомы опорно-двигательного аппарата. J Bone Joint Surg Am . 1980 сентябрь 62 (6): 1027-30. [Медлайн]. [Полный текст].
Boriani S, Weinstein JN, Biagini R.Первичные опухоли костей позвоночника. Терминология и хирургическая стадия. Позвоночник . 1997 1 мая. 22 (9): 1036-44. [Медлайн].
Hart RA, Boriani S, Biagini R, Currier B, Weinstein JN. Система хирургического стадирования и лечения опухолей позвоночника. Исследование клинических результатов гигантоклеточных опухолей позвоночника. Позвоночник . 1997, 1 августа, 22 (15): 1773-82; обсуждение 1783. [Medline].
Winkelmann WW. Ротационная пластика. Ортоп Клин Норт Ам .1996, 27 июля (3): 503-23. [Медлайн].
[Руководство] Руководство NCCN по клинической практике в онкологии. Рак кости. Версия 1.2020. Национальная всеобъемлющая онкологическая сеть. Доступно на https://www.nccn.org/professionals/physician_gls/pdf/bone.pdf. 12 августа 2019 г .; Доступ: 1 июля 2020 г.
[Рекомендации] Casali PG, Bielack S, Abecassis N, Aro HT, Bauer S, Biagini R, et al. Костные саркомы: Руководство по клинической практике ESMO-PaedCan-EURACAN по диагностике, лечению и последующему наблюдению. Энн Онкол . 2018 г., 1. 29 (Приложение_4): iv79-iv95. [Медлайн]. [Полный текст].
Оттавиани Г., Роберт Р.С., Хью В.В., Джаффе Н. Функциональные, психосоциальные и профессиональные результаты у длительно переживших остеосаркомы нижних конечностей: ампутация против спасения конечности. Cancer Treat Res . 2010. 152: 421-36. [Медлайн].
Джейнвей К.А., Гриер HE. Последствия медикаментозной терапии остеосаркомы: обзор редких случаев острой токсичности и поздних эффектов. Ланцет Онкол . 2010 июл.11 (7): 670-8. [Медлайн].
Blattmann C, Oertel S, Schulz-Ertner D, Rieken S, Haufe S, Ewerbeck V и др. Нерандомизированное исследование терапии для определения безопасности и эффективности лучевой терапии тяжелыми ионами у пациентов с неоперабельной остеосаркомой. BMC Рак . 2010 марта 12, 10:96. [Медлайн]. [Полный текст].
Vos HI, Coenen MJ, Guchelaar HJ, Te Loo DM. Роль фармакогенетики в лечении остеосаркомы. Наркотики Сегодня . 2016 21 ноября (11): 1775-1786. [Медлайн].
Ян JZ, Ma SR, Rong XL, Zhu MJ, Ji QY, Meng LJ и др. Характеристика подлиний остеосаркомы с множественной лекарственной устойчивостью и молекулярные механизмы устойчивости. Мол Мед Реп . 2016 14 октября (4): 3269-76. [Медлайн].
Xiao X, Wang W, Wang Z. Роль химиотерапии при метастатической, рецидивирующей и рефрактерной остеосаркоме. Детские лекарства .2014 16 декабря (6): 503-12. [Медлайн].
Марина Н.М., Смеланд С., Белак С.С., Бернштейн М., Йович Г., Крайло М.Д. и др. Сравнение MAPIE и MAP у пациентов с плохим ответом на предоперационную химиотерапию по поводу недавно диагностированной остеосаркомы высокой степени (EURAMOS-1): открытое международное рандомизированное контролируемое исследование. Ланцет Онкол . 2016 17 октября (10): 1396-1408. [Медлайн]. [Полный текст].
Mankin HJ, Lange TA, Spanier SS.Опасности биопсии у пациентов со злокачественными первичными опухолями костей и мягких тканей. J Bone Joint Surg Am . 1982 Октябрь 64 (8): 1121-7. [Медлайн]. [Полный текст].
Манкин HJ, Манкин CJ, Саймон MA. Еще раз об опасностях биопсии. Члены Общества опухолей опорно-двигательного аппарата. J Bone Joint Surg Am . 1996 май. 78 (5): 656-63. [Медлайн].
Крейг Ф.С. Биопсия тела позвонка. J Bone Joint Surg Am . 1956 Янв.38-А (1): 93-102. [Медлайн]. [Полный текст].
Рак костей — ACCO
Остеосаркома и саркома Юинга — самые распространенные злокачественные новообразования костных тканей у детей. Остеосаркома, наиболее распространенная из двух типов, обычно проявляется в костях вокруг колена. Саркома Юинга может поражать кости таза, бедра, плеча или ребер.
Остеосаркома
Остеосаркома — это тип рака кости, который начинается в клетках, образующих кость. Остеосаркома чаще всего возникает в длинных костях рук и ног.
Остеосаркома — опухоль кости, которая возникает преимущественно у подростков и молодых людей. Наши кости бывают двух основных типов: «плоские» и «длинные». Плоские кости помогают защитить мозг и органы; длинные кости поддерживают ноги и руки. Остеосаркома обычно развивается по краям длинных костей, в «метафизе» — так называют отрастающие концы кости. Большинство этих опухолей развиваются на концах длинных костей, образующих колено. Второе наиболее частое место возникновения этих опухолей — концы кости плеча рядом с плечом.Их также можно найти в других местах, например, в тазе, плече и черепе.
Классификация опухолей костей Всемирной организации здравоохранения (ВОЗ) разделяет остеосаркомы на центральные (мозговые) и поверхностные (периферические) опухоли и выделяет ряд подтипов в каждой группе.
Лечение остеосаркомы
Остеосаркома лечится хирургическим путем и мультиагентной химиотерапией. Очень важно, чтобы пациентов обследовал онколог-ортопед, знакомый с хирургическим лечением остеосаркомы.Эта оценка (включая визуализационные исследования) должна быть выполнена до первичной биопсии, поскольку неудачная биопсия может поставить под угрозу процедуру сохранения конечностей.
Пациентам с остеосаркомой следует, по возможности, хирургическое удаление опухоли. Тип операции зависит от ряда факторов, таких как сохранение конечностей или замена протезами, которые необходимо оценивать на индивидуальной основе. Химиотерапия может включать высокие дозы метотрексата, доксорубицина, циклофосфамида, цисплатина, ифосфамида, этопозида и карбоплатина.
Семейство опухолей саркомы Юинга (EFT)
Эвинг — вторая по распространенности злокачественная опухоль костей у детей, составляющая 10-15% всех случаев рака костей у детей. Опухоли Юинга имеют характерные маленькие круглые синие клетки. Семейство опухолей Юинга включает:
- Опухоль кости Юинга или саркома кости Юинга
- Внекостная опухоль Юинга (опухоль вне кости)
- Примитивная нейроэктодермальная опухоль (PNET)
- Опухоль Аскина (PNET грудной стенки).
Опухоли семейства Юинга чаще всего встречаются у подростков. Это может произойти в любой кости тела, но чаще всего встречается в тазу, бедре, голени, плече и ребре. Доктор Джеймс Юинг, описавший опухоль в 1920-х годах, отличил опухоль от остеосаркомы на том основании, что она поддается лучевой терапии.
- Дополнительная информация о Ewing’s на веб-сайте NCI — обратите внимание, что вы можете переключаться между версиями «Health Professional» и «Patient».
Лечение опухолей семейства саркомы Юинга
Семейство опухолей Юинга лечится с помощью многоагентной химиотерапии, лучевой терапии и / или хирургического удаления первичной опухоли. Химиотерапия может включать винкристин, доксорубицин и циклофосфамид, заменяемые ифосфамидом и этопозидом.
Важно, чтобы пациенты Юинга сразу же после постановки диагноза осматривались специалистами из всех областей, включая радиологов, химиотерапевтов, патологов, хирургов или онкологов-ортопедов, а также онкологов-радиологов.Как и при остеосаркоме, необходим командный подход, особенно если запланированы процедуры сохранения конечностей.
Клинические испытания рака костей можно найти, выполнив поиск в базе данных клинических испытаний на веб-сайте NCI. Следуйте этим указаниям:
- Начать со страницы поиска клинических испытаний NCI.
- Выберите тип рака: «Семейство опухолей Юинга» или «остеосаркома»
- У вас будет больше вариантов выбора (например, тип рака и тип исследования). Выберите подходящие ответы и нажмите поиск.
Симптомы рака костей
Симптомы могут включать:
- боль в кости (наиболее частый симптом)
- жесткость, припухлость или болезненность вокруг кости или сустава
- помеха нормальному движению
- слабые кости, приводящие к переломам
- утомляемость, лихорадка, похудание, анемия
Боль в костях — самый частый симптом. Иногда на кости можно почувствовать шишку или опухоль будет мешать нормальным движениям.Часто случается, что ребенок травмируется во время игры, и боль сохраняется еще долго после того, как травма должна была зажить. Родители предполагают, что боль вызвана переломом кости, и отводят ребенка к врачу для обследования, и на рентгеновском снимке обнаруживается опухоль кости.
Статистика
Остеосаркома:
- встречается в основном у подростков и молодых людей
- 5% онкологических заболеваний у детей
- наиболее часто встречается в костях вокруг колена
- около 60% пациентов имеют долгосрочную выживаемость без болезней (отчет AYA SEER, 2000)
Семейство опухолей Юинга:
- чаще всего встречается во втором десятилетии жизни
- 4% онкологических заболеваний у детей
- заболеваемость у мальчиков немного выше, чем у девочек
- около 60% пациентов имеют долгосрочную выживаемость без болезней (отчет AYA SEER, 2000)
ресурсов
Сайты
Списки поддержки по электронной почте
ACOR: пед-онк и список сарком (acor.требуется вход в организацию)
Рак кости — Диагностика — NHS
Если вы испытываете боль в костях, ваш терапевт спросит о ваших симптомах и осмотрит пораженный участок, прежде чем решить, нужно ли вам делать какие-либо дополнительные тесты.
Они осмотрят опухоль или уплотнения и спросят, есть ли у вас проблемы с перемещением пораженного участка.
Они могут спросить, какой тип боли вы испытываете — постоянная она или приходит и уходит, и не усугубляет ли что-нибудь.
После осмотра вас могут направить на рентген пораженного участка, чтобы выявить проблемы с костями.
Если рентген показывает аномальные области, вас направят к хирургу-ортопеду (специалисту по костным заболеваниям) или специалисту по раку костей для дальнейшего обследования.
Рентгеновские снимки
Рентген — это процедура, при которой радиация используется для получения изображений внутренней части тела. Это особенно эффективный способ исследования костей.
Рентгеновские лучи часто позволяют обнаружить повреждение костей, вызванное раком, или новую кость, которая растет из-за рака.
Они также могут определить, вызваны ли ваши симптомы чем-то другим, например сломанной костью (переломом).
Если рентгеновский снимок предполагает, что у вас может быть рак кости, вас следует направить в специализированный центр, специализирующийся на диагностике и лечении этого состояния.
Поскольку рак костей встречается редко, существует небольшое количество специализированных центров, поэтому вам, возможно, придется выезжать за пределы вашего района для консультации и лечения.
Биопсия
Самый точный способ диагностики рака кости — взять образец пораженной кости и отправить его в лабораторию для исследования. Это называется биопсией.
Биопсия может точно определить, какой у вас тип рака кости и какой он степени.
Биопсия может быть выполнена двумя способами:
- Биопсия стержневой иглой выполняется под наркозом (в зависимости от того, где расположена кость, это может быть местный или общий наркоз).В кость вводится тонкая игла, с помощью которой удаляется образец ткани.
- Открытая биопсия проводится под общим наркозом. Хирург делает разрез в пораженной кости, чтобы взять образец ткани.
Вам может потребоваться открытая биопсия, если результаты биопсии стержневой иглой неубедительны.
Дополнительные испытания
Если результаты биопсии подтверждают или предполагают рак кости, вероятно, вам придется провести дополнительные тесты, чтобы оценить, насколько далеко распространился рак.
МРТ
МРТ использует сильное магнитное поле и радиоволны для получения детальных изображений костей и мягких тканей.
МРТ — эффективный способ оценки размера и распространения любой раковой опухоли в костях или вокруг них.
КТ
КТ включает серию рентгеновских снимков и использование компьютера для их повторной сборки в подробное трехмерное (3-D) изображение вашего тела.
КТ часто используется, чтобы проверить, распространился ли рак на легкие.С этой целью также можно сделать рентген грудной клетки.
Сканирование костей
Сканирование костей может дать более подробную информацию о внутренней части ваших костей, чем рентген. Во время сканирования костей в вены вводится небольшое количество радиоактивного материала.
Аномальные участки кости будут поглощать материал быстрее, чем нормальная кость, и будут отображаться на сканировании как «горячие точки».
Биопсия костного мозга
Если у вас есть тип рака кости, называемый саркомой Юинга, вам может быть назначен тест, называемый биопсией костного мозга, чтобы проверить, распространился ли рак на костный мозг (ткань внутри ваших костей).
Во время теста в кость вводят иглу, чтобы взять образец костного мозга. Это может быть сделано под местной или общей анестезией.
Постановка и сортировка
После того, как эти тесты будут завершены, можно будет сказать вам, на какой стадии и какой степени находится рак кости. Стадия — это описание того, насколько далеко распространился рак, а градация — это описание того, насколько быстро рак может распространяться в будущем.
В широко распространенной в Великобритании системе определения стадии рака кости используются 3 основных стадии:
- 1-я стадия — рак низкой степени злокачественности и не распространился за пределы кости
- 2-я стадия — рак все еще не распространяется за пределы кости, но имеет высокую степень
- стадия 3 — рак распространился на другие части тела, такие как легкие
Большинство случаев рака костей 1 стадии и некоторых случаев рака костей 2 стадии есть хорошие шансы на выздоровление.
К сожалению, рак кости 3 стадии лечить труднее, хотя лечение может облегчить симптомы и замедлить распространение рака.
Как справиться с диагностикой
Сказать, что у вас рак костей, может быть неприятным и пугающим опытом.
Получение таких новостей может расстроить в любом возрасте, но может быть особенно трудным, если вы все еще в подростковом возрасте или если вы являетесь родителем ребенка, которому только что сказали, что у него рак костей.
Эти типы чувств могут вызывать значительный стресс и беспокойство, что в некоторых случаях может вызвать депрессию.
Если вы думаете, что у вас депрессия, ваш терапевт может оказаться хорошим человеком, с которым можно поговорить о поддержке и, возможно, лечении.
Если вам нужна дополнительная информация, вам может быть полезно обратиться в Фонд исследования рака костей, ведущую благотворительную организацию Великобритании для людей, страдающих раком костей.
Если вы подросток, вы можете обратиться в Teenage Cancer Trust, благотворительную организацию для подростков и молодых людей, страдающих раком.
Последняя проверка страницы: 20 июня 2021 г.
Срок следующей проверки: 20 июня 2024 г.
Дифференциация остеосаркомы таза и саркомы Юинга с помощью радиомического анализа на основе Т2-взвешенных изображений и Т1-взвешенных изображений с контрастным усилением
Объектив . Чтобы определить, можно ли дифференцировать остеосаркому (OS) и саркому Юинга (EWS) таза на основе МРТ с помощью радиомического анализа. Материалы и методы . В этом исследовании 3.Ретроспективно были проанализированы данные магнитного резонанса (МР) 0 T 66 пациентов (40 мужчин и 26 женщин, средний возраст лет) с патологически подтвержденным OS или EWS таза (35 с OS и 31 с EWS), взятые с апреля 2013 г. по декабрь 2017 г. . Т2-взвешенные насыщенные жиром (T2-FS) и контрастно-усиленные T1-взвешенные (CET1) изображения сегментировались вручную и извлекались признаки изображения. Тест независимой выборки, тест Спирмена и метод оператора наименьшей абсолютной усадки и выбора (LASSO) использовались для выбора наиболее полезных функций из исходного набора данных.Эффективность радиомного анализа исследовали с помощью анализа площади под кривой рабочей характеристики приемника (ROC) (AUC). Результаты . 385 начальных характеристик были извлечены из данных MR T2-FS и CET1. Девять функций из T2-FS и 7 функций из CET1 были отобраны с помощью метода LASSO. Радиомный анализ для дифференциации OS и EWS таза на основе изображений T2-FS и CET1 с использованием вышеупомянутых выбранных функций достиг значений AUC 0,881 (95% доверительный интервал (ДИ): 0.799–0,963) и 0,765 (95% ДИ: 0,652–0,878) соответственно. Заключение . Рентгенологический анализ показал возможность дифференцировать OS от EWS таза, при этом T2-FS продемонстрировал лучшую диагностическую ценность. Дифференцировать ОС от EWS таза с помощью нашего многопараметрического радиомического анализа на основе МРТ может до операции повысить точность диагностики и внести большой вклад в планирование терапии.
1. Введение
Остеосаркома (OS) является наиболее частой первичной злокачественной опухолью кости у детей и молодых людей, хотя она имеет особое бимодальное возрастное распределение во втором десятилетии жизни и в позднем взрослом возрасте [1].OS имеет склонность к метафизарным частям длинных костей, таким как бедренная, большеберцовая и плечевая кость [2]. Саркома Юинга (EWS) — это саркома высокой степени злокачественности, возникающая как в скелетной, так и внескелетной локализации; это третья по частоте первичная саркома кости после OS и хондросаркомы [3]. Более того, EWS встречается преимущественно в костях конечностей и таза у детей и подростков. OS и EWS таза имеют много общих характеристик и особенностей по сравнению с теми, которые возникают в других частях тела.Учитывая более глубокое расположение в теле, чем в конечностях, злокачественные новообразования таза обычно крупнее при диагностике, что значительно влияет на лечение и, как следствие, на исход. В настоящее время большинство институтов лечат пациентов с OS и EWS с помощью неоадъювантной химиотерапии с последующей обширной хирургической резекцией опухоли. Тем не менее, предоперационное лечение отличается, при котором дополнительная адъювантная химиотерапия обычно применяется к тяжелой ОС, тогда как лучевая терапия используется при EWS [1].Из-за различных стратегий лечения существует необходимость в ранней дифференциальной диагностике. Для постановки точного диагноза необходима биопсия, хотя она не может преодолеть ее инвазивность, ошибку выборки и возможное распространение опухоли. Неинвазивный надежный метод визуализации, который помогает отличить ОС от EWS, необходим в качестве дополнительного дифференцированного метода.
Благодаря превосходному разрешению мягких тканей, магнитно-резонансная томография (МРТ) в настоящее время становится предпочтительным инструментом для диагностики, определения стадии и мониторинга поражений, происходящих из костей и мягких тканей, поскольку она может точно продемонстрировать степень и размер опухоль.Учитывая, что такие костные поражения незаметно видны в жировом костном мозге на T1-взвешенных последовательностях, T2-взвешенные жиронасыщенные (T2-FS) последовательности и T1-взвешенные последовательности с контрастным усилением (CET1) имеют более высокую чувствительность при отображении морфологии поражения и окружающей среды. с участием структур. Было разработано множество передовых методов и последовательностей, которые могут помочь в диагностике опухолей как костных, так и мягких тканей [4, 5]; однако они могут иногда не обеспечивать четкой дифференциации, особенно для ОС и EWS из-за их клинического и морфологического сходства.
Появление радиомики предоставляет новые методы дифференциации, определения стадии, мониторинга опухолей и даже выявления генетических факторов опухолей. Радиомика значительно расширила сферу применения традиционной медицинской визуализации в клинической онкологии, в отличие от того, чтобы сосредоточиться только на морфологии, как раньше. Радиомика предполагает, что медицинские изображения содержат много жизненно важной базовой патофизиологической информации, преобразовывая их в полезные многомерные данные, которые могут быть коррелированы с клиническими исходами и для дальнейшего использования в поддержке принятия клинических решений [6].В последние годы радиомика в основном использовалась в онкологии для определения стадии злокачественных опухолей [7], прогнозирования метастазов в лимфатические узлы [8, 9], прогноза опухоли [10], прогнозирования ответа на лечение [11] или даже прогнозирования рака. фенотип [12, 13].
В настоящем исследовании мы впервые стремимся предварительно оценить возможность радиомного анализа дифференцировать ОС от EWS таза.
2. Материалы и методы
2.1. Популяция исследования
В этом институциональном обзоре и ретроспективном исследовании, одобренном советом, осознанное согласие было отклонено.Клиническая и патологическая база данных была проанализирована для идентификации пациентов, и критерии включения были следующими: (а) пациенты, перенесшие гистологическую биопсию или резекцию опухоли с опухолевыми тканями таза, которые были патологически подтверждены как OS или EWS, (b) пациенты, которые прошли МРТ в нашем институте (включая T2-FS и CET1), и (c) данные МРТ, полученные с использованием той же системы от того же поставщика (для минимизации различий в качестве изображения и интенсивности сигнала). Критерии исключения были следующими: (а) низкое качество изображения, включая очевидные артефакты, (б) коварные поражения, которые плохо отображались на полученных изображениях, и (в) отсутствующие изображения или соответствующие последовательности.Клинические данные (возраст, пол и т. Д.) Были получены путем изучения медицинских записей. После соблюдения этих критериев набор данных исследования 66 пациентов (40 мужчин и 26 женщин, возраст 10–87 лет, средний возраст) с апреля 2013 г. по декабрь 2017 г. был завершен. Эти 66 гистологически подтвержденных случаев включали 35 подтвержденных OS и 31 подтвержденный EWS. В таблице 1 перечислены характеристики пациентов в этом исследовании. Мы определили первичные опухоли как места поражения больших поражений, которые включают более одного участка.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Примечание: a = -test; b = критерий хи-квадрат. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.2. MR Data Acquisition
МРТ-изображения были получены с использованием сканера Discovery MR750 3,0 T (GE Healthcare, Милуоки, Висконсин, США) с восьмиканальной катушкой с фазированной решеткой для приема сигнала. Изображения были получены с помощью спинового эхо и Т1-взвешенного трехмерного градиентного эхо-сигнала с использованием 2-точечного метода разделения жира / воды по Диксону (LAVA FLEX).В каждое исследование были включены последовательность T2-FS и последовательность CET1. Другие последовательности, такие как T1-взвешенные изображения, насыщенные жиром, и общие T1-взвешенные и T2-взвешенные изображения без жирового насыщения, были исключены для анализа из-за несовершенства ретроспективных данных. Внутривенное введение представляло собой инъекцию гадодиамида (Omniscan®, GE Healthcare, Ирландия) с использованием протокола дозирования в зависимости от веса (0,1 ммоль / л на кг веса тела), скорость инъекции составляла 2,5 мл / с. Все параметры последовательности описаны в таблице 2.Все данные МРТ были получены из системы архивации изображений и связи (PACS) нашего института и сохранены в формате DICOM для дальнейшего анализа.
| ||||||||||||||||||||||||||||||||||||||
2.3. Предварительная обработка МР-изображений
Перед радиомным анализом все изображения были перенесены в программное обеспечение itk-SNAP (версия 3.6.0, https://www.itksnap.org/) для сегментации. Все очаги были сегментированы вручную рентгенологом с опытом диагностики МРТ более 7 лет. Другого радиолога с более чем 10-летним опытом МРТ-диагностики попросили подтвердить точность сегментации.Два радиолога внесли поправку в случае разногласий по поводу конкретной сегментации изображения после обсуждения. Определение области интереса, включая всю опухоль, перитуморальный отек и периостальные реакции, выполнялось на одном изображении каждой последовательности. Выбранный срез или изображение продемонстрировали максимальный переднезадний диаметр поражения.
2.4. Извлечение радиомных признаков
Функции визуализации были извлечены с использованием программного обеспечения Analysis Kit (A.K., GE Healthcare) из данных T2-FS и CET1 с вручную сегментированными областями интереса.Статистический анализ использовался для извлечения радиомных признаков, которые включали особенности гистограммы, особенности форм-фактора, особенности Haralick [14], особенности матрицы взаимодействия на уровне серого (GLCM) (смещение 1/4/7) [14] и уровни серого. функции матрицы длин серий (GLRLM) (смещение 1/4/7, [15–17]). Некоторые характеристики представлены в таблице 3.
| ||||||||||||||||||||||||||
| Примечание: GLCM = матрица взаимодействия на уровне серого; GLRLM = матрица длин серий на уровне серого. | ||||||||||||||||||||||||||
2.5. Метод выбора характеристик
Мы использовали критерий независимой выборки, тест Спирмена и метод LASSO для выбора наиболее полезных функций, связанных с дифференциацией ОС и EWS из исходного набора данных [19]. Значение 0,05 считалось статистически значимым в тесте независимой выборки и в тесте Спирмена. Принцип выбора признаков методом LASSO заключается в ограничении некоторых коэффициентов признаков до нуля путем настройки параметра.Тогда площадь под кривой рабочих характеристик приемника (AUC) может быть получена в сравнении с log () с помощью десятикратной перекрестной проверки. Преимущество метода LASSO заключается в том, что он позволяет анализировать большое количество радиомных особенностей с более редкими образцами [20]. Результат, полученный с помощью LASSO, обычно надежен и легко интерпретируется.
2.6. Статистический анализ
Мы использовали программное обеспечение R (R Foundation for Statistical Computing, Вена, Австрия. URL: https://www.R-project.org) для выполнения статистического анализа.Пакет «glmnet» использовался для логистической регрессии LASSO. Значение 0,05 считалось статистически значимым.
3. Результаты
3.1. Извлечение / выбор радиомных признаков
Блок-схема исследования представлена на рисунке 1. Всего 385 начальных признаков были извлечены из исходных данных МРТ. Они были разделены на пять типов, включая функции гистограммы (), функции форм-фактора (), функции Haralick (), функции GLCM (смещение 1/4/7) () и функции GLRLM (смещение 1/4/7) (). .С помощью теста независимой выборки, теста Спирмена и метода LASSO были выбраны потенциальные предикторы, как описано в таблице 4 (а).
| (a) Количество радиомных элементов, выбранных различными методами | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Мы в основном сосредоточились на анализе объектов, извлеченных с помощью метода LASSO, поскольку количество объектов, извлеченных двумя другими методами, было относительно большим, что усложняло дальнейший анализ. Из них, используя метод LASSO, мы выбрали девять функций из изображений T2-FS и семь функций из изображений CET1, которые были наиболее эффективными для различения между ОС и EWS (рис. 2). Результат выбора показан в Таблице 4 (б). 3.2. Дифференцированная производительностьЧувствительность и специфичность различия между OS и EWS с использованием данных из T2-FS и CET1 показаны в таблице 5. Радиомные модели, основанные на изображениях T2-FS и CET1, достигли значений AUC 0,881 (95% ДИ). : 0,799-0,963) и 0,765 (95% ДИ: 0,652-0,878), соответственно, с помощью теста ДеЛонга, которые показаны на рисунке 3.
4. ОбсуждениеВ этой статье мы оценили способность нашей недавно созданной радиомной модели, основанной на использовании многопараметрических данных МРТ, помочь отличить ОС от EWS таза.Мы оценили 16 признаков, которые были извлечены и отобраны с помощью метода LASSO. Наша радиомная модель дала благоприятные результаты и представляет собой новый метод различения ОС и EWS. AUC была высокой как для T2-FS, так и для CET1. Высокая специфичность была достигнута при использовании данных как из T2-FS, так и CET1 (82,9% и 100% соответственно), а чувствительность также была высокой из T2-FS (74,2%). Вкратце, мы полагаем, что методология, разработанная в данной работе, может служить надежным дополнительным инструментом для дифференциации ОС от EWS. Предоперационное различие между OS и EWS таза сложно для клинической практики, хотя оно может быть выполнено с использованием клинических данных, таких как возраст, пол и других дополнительных исследований, таких как медицинские изображения. OS — наиболее распространенная первичная злокачественная опухоль кости, которая возникает из примитивных мезенхимальных клеток, образующих кость. Он имеет бимодальное возрастное распределение, то есть в подростковом и старшем возрасте соответственно. OS таза встречается редко и составляет только около 8% всех участков [21].EWS костей представляет собой третье по распространенности первичное злокачественное новообразование костей, которое по распространенности превышает только OS и хондросаркома. Пик заболеваемости приходится на второе десятилетие жизни. Что касается локализации опухоли, EWS обычно наблюдается в диафизе длинных костей и таза, хотя наиболее частым местом по-прежнему являются конечности, которые очень похожи на OS [22]. И OS, и EWS демонстрируют агрессивные черты при рентгенографии, что отражает их высокую степень злокачественности. Доступны многие общие характеристики визуализации, такие как разрушение кости с поеданием молью до проницаемого рисунка, различное количество минерализованного остеоида, различные типы периостальной реакции и масса прилегающих мягких тканей [23, 24].Среди методов визуализации обычно используется МРТ. Замещение костного мозга и разрушение коры можно было более четко увидеть на МРТ с неоднородной интенсивностью сигнала. Он обеспечивает отличный контраст тканей, который намного лучше, чем компьютерная томография (КТ) и обычная рентгенография; однако он не мог четко различать ОС и EWS из-за наложения характеристик изображения и местоположения опухоли. Например, большинство случаев ОС малых клеток (подтип ОС) обладают рентгенологическими особенностями, включая литическую деструкцию кости, массу мягких тканей и периостальную реакцию, которые также часто наблюдаются в случаях EWS.Более того, обе их клетки маленькие и имеют круглые гиперхроматические ядра; они могут быть ошибочно приняты друг за друга даже при гистологическом анализе [25]. Были исследованы некоторые расширенные последовательности для дифференциальной диагностики, такие как диффузионно-взвешенная визуализация (DWI) [4] и интравоксельное некогерентное движение (IVIM) [26]. Однако способность различать не вызывает нареканий. Радиомика — это новая методология, в которой используются расширенные функции визуализации для дифференциации, определения стадии, мониторинга опухолей и даже выявления генетики опухолей.По сравнению с традиционными методами радиологической диагностики, радиомика может предоставить обширную информацию и улучшить воспроизводимость диагностики. Таким образом, сочетание радиомики с традиционными протоколами МРТ заслуживает ожидания, потому что оно может развиться в модель, которая ослабит зависимость пользователя от интерпретации, поскольку диагностическая точность сильно зависит от опыта радиолога. Поэтому мы решили оценить эффективность дифференциации с помощью радиомного анализа. Значение радиомики изучается в течение последнего десятилетия.Предыдущие исследования в основном были сосредоточены на создании радиомической номограммы для определения стадии злокачественных опухолей [7], прогнозировании метастазов в лимфатические узлы [8, 9], прогнозе опухоли [10], прогнозировании ответа на лечение [11] или даже прогнозировании рака. фенотип [12, 13]. Насколько нам известно, это исследование является первым, в котором делается попытка использовать радиомику для дифференциации этих двух костных злокачественных опухолей. Приложение, которое мы использовали, представляет собой зрелую платформу, и радиомные функции, которые оно предоставляет, могут описывать интенсивность сигнала, морфологические характеристики и информацию о текстуре поражений, тем самым, возможно, представлять информацию о поражениях всесторонне.Как было продемонстрировано, радиомика может указать дополнительную информацию о биологии опухоли, чем морфология изображений. Например, в таблице 4 сильные ассоциации выделения высокого уровня серого, извлеченные из набора данных T2-FS, могут быть объяснены тем фактом, что пациенты обладают большой и нерегулярной высокой интенсивностью сигнала на T2-взвешенных изображениях во внутренней части опухолей. , скорее всего, представляющие некротические области. Присутствие этих внутренних, длинных нерегулярных областей сигнала Т2 предполагает, что опухоль быстро увеличивается в размерах и, скорее всего, является ОС. Для большинства онкологических МР-исследований в нашем институте использовались T2-FS и CET1. T2-FS может эффективно отображать границы поражений и до определенной степени демонстрировать общую клеточную плотность поражений, тогда как CET1 может описывать васкуляризацию поражений, отражать степень злокачественности и различать некроз и солидные опухоли. Более того, предыдущие исследования, в которых такие последовательности использовались для радиомного анализа, дали благоприятные результаты [27, 28]. Таким образом, мы создали нашу модель, используя эти две последовательности.Основываясь на наших результатах, свойства, полученные от T2-FS, работают лучше, чем от CET1, с более высокими AUC и чувствительностью, что, возможно, приносит пользу пациентам, страдающим аллергией на контрастные вещества. Мы предположили, что особенности первого порядка, выбранные в модели T2-FS, оценивают гетерогенность внутри очага поражения, тем самым учитывая патологические характеристики, которые важны для различения OS и EWS. Выбор в основном признаков более высокого порядка демонстрирует, что неоднородность текстуры в различных пространственных направлениях описывала классификацию поражения. В целом, было обнаружено, что методология, предложенная в этой работе, обладает высоким потенциалом для различения ОС и EWS. Однако у него также есть некоторые ограничения. Во-первых, его ретроспективный характер сравнительно снижает уровень доказательности. Мы проанализировали только T2-FS и CET1 из-за этой природы, потому что большое количество неполных сканирований не содержало других расширенных последовательностей, таких как DWI. Относительно небольшой набор данных был еще одним ограничением, и для создания более надежной модели требуется большая когорта пациентов.Мы исключили много данных, потому что часть пациентов с OS или EWS таза не проходили МРТ с контрастным усилением по некоторым причинам, таким как клаустрофобия, плохая комплаентность и потенциальная аллергия на контрастные вещества. Кроме того, некоторые клинические характеристики пациентов неполны, поэтому нам пришлось исключить эту часть. Таким образом, к сожалению, от многовариантных номограмм для определения рад-баллов отказались. Более того, чтобы свести к минимуму вариации изображения, многие элементы данных, выполняемые в разных 3-х системах, были оставлены.Во многих опубликованных радиомных исследованиях пациенты разделились на обучающий набор и набор для валидации, чтобы проверить работоспособность установленной модели. Однако из-за небольшого набора данных от этого метода пришлось отказаться. Тем не менее, использовать подход для сбора такого масштаба данных в одном учреждении было непросто из-за относительно низкой заболеваемости обоими заболеваниями, особенно только с поражениями таза. Дальнейшие исследования предполагают повышение производительности за счет использования изображений других модальностей, таких как КТ, простые пленки или некоторые другие многопараметрические МРТ-изображения, путем проведения проспективного многоцентрового тщательно разработанного исследования для решения вышеупомянутых проблем.Кроме того, в определенной степени использование двумерной сегментации опухоли вручную (ROI была нарисована только на самой большой площади поперечного сечения всего поражения) вместо автоматического / полуавтоматического трехмерного метода может повлиять на окончательный результат анализа радиомных признаков. Некоторые особенности, такие как объем поражения и неравномерность, не могли быть извлечены для дальнейшего анализа. Однако из-за сильной стабильности выбранных нами радиомных характеристик разницу можно не учитывать. Более того, ручная сегментация опухолей опытными исследователями применялась во многих предыдущих исследованиях и дала отличные результаты [29–31].В будущих исследованиях следует использовать автоматически компьютеризированный метод сегментации опухоли с высокой надежностью. 5. ВыводыНасколько нам известно, в литературе нет ранее опубликованных исследований, в которых использовался бы радиомный анализ, чтобы отличить ОС от EWS. В нашем исследовании мы определили, что есть многообещающие возможности для различения ОС и EWS с помощью нашего многопараметрического радиомного анализа на основе МРТ. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
