34. Мышечные релаксанты в анестезиологии.
Для
уменьшения токсичности общего анестетика
дополнительно используют препараты из
других групп (нейролептики, миорелаксанты).
Миорелаксанты (курареподобные вещества)
-препараты, изолированно выключающие
напряжение мускулатуры за счет блокады
нервно-мышечной передачи. Миорелаксанты
применяют со следующими целями: 1)
расслабление мускулатуры при наркозе,
что способствует уменьшению дозы
анестетика и глубину наркоза; 2) как
следствие блокады нервно-мышечной
передачи импульса — использование ИВЛ;
3) для снятия судорог, мышечного гипертонуса
и др. Отсутствие или резкое снижение
мышечного тонуса — обязательный компонент
для обеспечения обезболивания при
полостных операциях. Следует помнить
о том, что введение миорелаксантов
обязательно ведет к прекращению работы
дыхательной мускулатуры и прекращению
спонтанного дыхания, что требует
проведения ИВЛ.
35. Нейролептанальгезия. Аспекты применения.
Нейролептанальгезия(НЛА)
— метод внутривенной анальгезии,
основанный на комбинированном применении
мощного нейролептика дроперидола и
наркотического аналгетика фентанила.
Преимуществом метода является своеобразное
действие на ЦНС, характеризующееся
быстрым наступлением безразличия к
окружающему, отсутствием двигательного
беспокойства, снижением выраженности
вегетативных и метаболических реакций
на хирургическую агрессию. НЛА обычно
выступает в качестве компонента
комбинированного наркоза или в сочетании
с местной анестезией. Наиболее часто
НЛА проводится на фоне ИВЛ закисью
азота.
36. Регионарные методы анестезии (определение, классификация, показания к применению).
Регионарные методы анестезии характеризуются достижением эффекта обезболивания, выключением проводимости в конкретном нерве или сплетении нервов, с сохранением сознания и дыхания больного. Регионарная анестезия класс:
-проводниковая–
блок. передачи импульса на ур ствола
нерва или нерв.сплетений-эпидуральная
– блок передачи импульса на ур корешков
спинномозговых нервов путем введение
анестетика в ЭПИДУРАЛЬНОЕ
пространство.-спинальная
– блок передачи импульса на ур корешков
спинномозговых нервов путем введение
анестетика в СУБДУРАЛЬНОЕ
пространство.-плексусная
— осуществляемое
путем введения раствора анестетика в
зону нервного сплетения.
передачи импульса на ур ствола
нерва или нерв.сплетений-эпидуральная
– блок передачи импульса на ур корешков
спинномозговых нервов путем введение
анестетика в ЭПИДУРАЛЬНОЕ
пространство.-спинальная
– блок передачи импульса на ур корешков
спинномозговых нервов путем введение
анестетика в СУБДУРАЛЬНОЕ
пространство.-плексусная
— осуществляемое
путем введения раствора анестетика в
зону нервного сплетения.
Общепринятыми
показаниями для регионарной анестезии
являются:
•
интраоперационная анальгезия;
•
послеоперационное обезболивание;
•
лечение хроническое нейропатической
боли, а также боли, связанной со
злокачественными опухолями;
•
проведение превентивной анальгезии
(вероятность возникновения послеоперационного
хронического болевого синдрома будет
гораздо меньшей, если эпидуральная
анестезия будет начала за сутки до
проведения эндопротезирования коленного
сустава, или вероятность возникновения
фантомных болей будет меньшей, когда
эпидуральная анестезия начинается до,
а не после ампутации пораженной
конечности).
Современные миорелаксанты эффективное анестезиологическое обеспечение
Иследованием яда кураре занимался известный французский физиолог Клод Бернар, в опытах на животных он доказал, что кураре действует периферически, не затрагивая центральную нервную систему. Со временем был найден и первый антагонист кураре ингибитор холинэстеразы эзерин.
Производные кураре (миорелаксанты) в сочетании с обезболивающими средствами и наркотическими анальгетиками применяются во время проведения хирургических операций. Они обеспечивают полное расслабление мышц, прекращают собственное дыхание больного, что требует проведения искусственной вентиляции легких (ИВЛ).
С развитием анестезиологического обеспечения требования к мышечным релаксантам становились все жестче. Сегодня идеальный миорелаксант должен обеспечивать выраженное действие, заключающееся в быстром наступлении блокады нервно-мышечной передачи, иметь короткую продолжительность действия (управляемость), не кумулироваться в организме больного и не иметь отрицательного воздействия на сердечно-сосудистую систему, а при введении не должен стимулировать выброс гистамина. Этим требованиям в полной мере соответствуют миорелаксанты Норкурон и Эсмерон, производимые компанией «Органон Эйдженсиз Б.В.» (Нидерланды).
Феликс Семенович Глумчер, доктор медицинских наук, профессор, заведующий кафедрой анестезиологии и реанимации НМУ им.
Группа препаратов, которые относятся к мышечным релаксантам, в основном производные яда кураре, очень широко применяются в анестезиологической практике, так как большинство хирургических, акушерских, гинекологических операций проводятся с применением мышечной релаксации. Эти препараты вызывают расслабление мышц, в том числе дыхательных, что диктует необходимость проведения искусственной вентиляции легких.
В Украине сегодня применяются два миорелаксанта: деполяризующий Дитилин и недеполяризирующий Ардуан. При использовании Дитилина развивается большое количество побочных эффектов, таких как мышечные боли, фибрилляция мышц после операции, повышение внутричерепного и внутриглазного давления, длительное восстановление нервно-мышечной проводимости при дефиците псевдохолинэстеразы. Эти миорелаксанты относятся к препаратам высокого риска у тяжелых больных, так как вызывают серьезные нарушения электролитного баланса, особенно в миокарде, вследствие чего повышается вероятность развития тяжелых аритмий, поэтому сейчас Дитилин применяется только при интубации трахеи.
В мире широко применяют большое количество миорелаксантов, в том числе фирмы «Органон»: это недеполяризующие миорелаксанты средней длительности действия Норкурон (векурония бромид) и Эсмерон (рокурония бромид). К преимуществам Эсмерона можно отнести быстрое наступление миорелаксации (в течение 60-90 секунд), достаточной для выполнения интубации трахеи. Кроме того, препарат лишен отрицательных качеств Дитилина. Эсмерон можно использовать не только для интубации, но и для поддержания наркоза. После операции даже у тяжелых больных с заболеваниями легких, нарушениями нервно-мышечной проводимости быстро восстанавливается спонтанное дыхание, что позволяет рано их экстубировать, что значительно улучшает течение послеоперационного периода.
У больных с тяжелой миастенией и дыхательной недостаточностью во время проведения торакальных операций применение деполяризующих миорелаксантов сопряжено с высоким риском развития осложнений, период восстановления спонтанного дыхания значительно удлиняется. При использовании Эсмерона у больного быстрее восстанавливается самостоятельное дыхание, поэтому его можно считать препаратом выбора у данной категории больных.
Олег Анатольевич Лоскутов, кандидат медицинских наук, ведущий научный сотрудник Института сердечно-сосудистой хирургии им. Н. М. Амосова АМН Украины
Среди врожденных пороков развития пороки сердца занимают третье место после аномалий опорно-двигательного аппарата и функциональных нарушений центральной нервной системы. Однако в структуре летальности они находятся на первом месте и встречаются с частотой 8 10 случаев на 1000 новорожденных.
Однако в структуре летальности они находятся на первом месте и встречаются с частотой 8 10 случаев на 1000 новорожденных.
Единственно эффективным методом, спасающим жизнь этих пациентов, является своевременная хирургическая коррекция порока.
Несмотря на достижения в технике проведения искусственного кровообращения, успехи анестезиологического обеспечения и усовершенствование методик регуляции основных жизненно важных функций организма, масштабы отрицательного воздействия при кардиохирургических операциях, особенно у детей, остаются значительными.
Это в большей мере относится к раннему послеоперационному периоду. Поэтому любые факторы, которые могут спровоцировать развитие постоперационных осложнений, должны быть сведены к минимуму. Одним из них является продленная искусственная вентиляция легких (ИВЛ). В литературе указывается на взаимосвязь между частотой осложнений раннего послеоперационного периода и продолжительностью ИВЛ у пациентов раннего детского возраста.
В настоящее время тактика анестезиологического обеспечения и взгляды на вопросы продолжительности ИВЛ при кардиохирургических операциях претерпели значительные изменения. Это связано, прежде всего, с внедрением нового поколения гипнотиков, наркотических анальгетиков и мышечных релаксантов. T. L. Higgins описал концепцию оптимального «экстубационного окна», или периода, в котором риск развития как ранних, так и поздних послеоперационных осложнений минимален. Это «окно» находится в промежутке между вторым и шестым послеоперационными часами. Данные разработки легли в основу так называемого протокола «fast track», по которому экстубация пациента производится в течение первых шести часов после операции в палате интенсивной терапии.
В проведенных на базе нашей клиники исследованиях показано, что при использовании миорелаксанта Норкурон (векурония бромид) клиническая продолжительность действия препарата и индекс восстановления мышечной активности были меньше, чем у Ардуана (пипекурония бромида) на 71,4% и 44% соответственно.
У больных, которые были экстубированы в первые шесть часов после операции, биохимические показатели газов крови были удовлетворительными, отсутствовал метаболический или дыхательный ацидоз, что свидетельствовало о полном восстановлении функции дыхания у обследованных пациентов. Это позволило внедрить протокол «fast track» при кардиохирургических операциях у пациентов младшей возрастной группы.
Таким образом с внедрением в анестезиологическую практику препарата Норкурон появилась возможность ранней безопасной экстубации пациентов с тяжелой кардиологической патологией, что позволило снизить риск развития послеоперационных осложнений, связанных с длительным нахождением больных на искусственной вентиляции легких.
Комментирует специалист по миорелаксантам компании «Органон Эйдженсиз Б.В.» Андрей Левин.
История компании «Органон» неразрывно связана с историей развития анестезиологии.
Первый препарат из группы миорелаксантов, синтезированный сотрудниками компании в 1968 году, назывался Павулон (панкурониум бромид). Этот препарат стал первым в группе аминостероидных недеполяризующих миорелаксантов, создание его было огромным шагом вперед для своего времени, так как он обладал высокой эффективностью и значительно меньшим количеством побочных эффектов, чем его предшественники.
Этот препарат стал первым в группе аминостероидных недеполяризующих миорелаксантов, создание его было огромным шагом вперед для своего времени, так как он обладал высокой эффективностью и значительно меньшим количеством побочных эффектов, чем его предшественники.
С развитием анестезиологии возрастали требования к препаратам, которые применялись для проведения анестезиологического пособия. Что касается миорелаксантов при синтезе новых молекул была поставлена задача создать препарат с быстрым началом действия, стремительным разрешением нейро-мышечного блока, минимальным количеством побочных эффектов. Folders (1957) кратко и точно изложил требования к «идеальному миорелаксанту» короткодействующий недеполяризующий сукцинилхолин, метаболизм которого не приводит к нежелательным эффектам.
Препарат Норкурон (векурония бромид), синтезированный компанией «Органон» в 1983 году, в значительной мере отвечает этим требованиям быстрое начало действия препарата позволяет применять его для интубации, хорошие и отличные условия для выполнения которой развиваются уже через 90-120 секунд после введения. Опыт применения Норкурона у более чем 40 млн. пациентов во всем мире подтвердил высокую безопасность и малое количество побочных эффектов, в частности минимальный выброс гистамина, практически полное отсутствие влияния на сердечно-сосудистую систему, внутричерепное, внутриглазное давление. Но, в первую очередь, препарат заслужил настоящую любовь анестезиологов в связи с очень высокой управляемостью. Выраженная зависимость длительности действия от введенной дозы, отсутствие кумуляции, стремительное разрешение нейро-мышечного блока в течение 13-15 минут, после окончания клинического эффекта, не зависящее от длительности анестезиологического пособия, позволило Норкурону стать одним из самых популярных миорелаксантов в мире.
Опыт применения Норкурона у более чем 40 млн. пациентов во всем мире подтвердил высокую безопасность и малое количество побочных эффектов, в частности минимальный выброс гистамина, практически полное отсутствие влияния на сердечно-сосудистую систему, внутричерепное, внутриглазное давление. Но, в первую очередь, препарат заслужил настоящую любовь анестезиологов в связи с очень высокой управляемостью. Выраженная зависимость длительности действия от введенной дозы, отсутствие кумуляции, стремительное разрешение нейро-мышечного блока в течение 13-15 минут, после окончания клинического эффекта, не зависящее от длительности анестезиологического пособия, позволило Норкурону стать одним из самых популярных миорелаксантов в мире.
Однако прогресс не стоит на месте, и в 1994 году впервые появился препарат, приближающийся к «идеальному миорелаксанту» ЭСМЕРОН (рокурония бромид). По данным Morgan (1996), рокурония бромид (Эсмерон) в дозе 0,9-1,2 мг/кг единственный недеполяризующий миорелаксант, который начинает действовать так же быстро, как сукцинилхолин, что делает его препаратом выбора для быстрой последовательной индукции.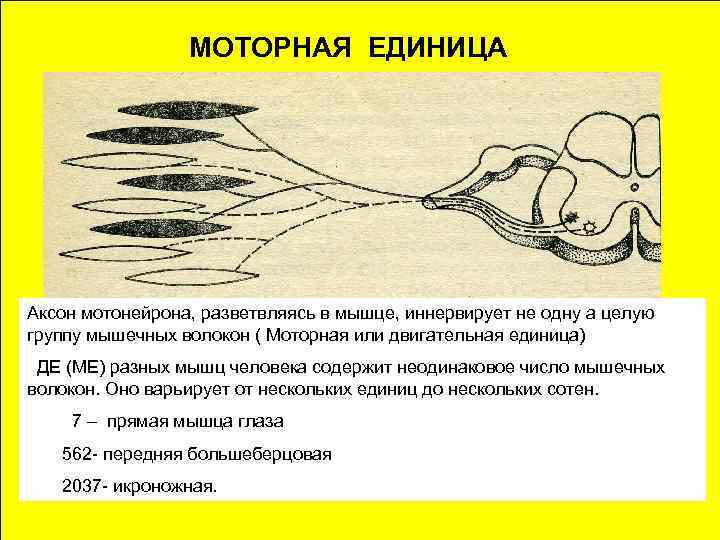 При этом очень важно, что метаболизм Эсмерона, практически не приводит ни к каким нежелательным последствиям.
При этом очень важно, что метаболизм Эсмерона, практически не приводит ни к каким нежелательным последствиям.
Во всем мире препараты компании «Органон» Павулон, Норкурон, Эсмерон занимают 54% рынка миорелаксантов (по данным IMS G-10, 2002). Очень радует то обстоятельство, что украинские анестезиологи получили возможность использовать в своей практике современный препарат Норкурон. В ближайшее время в Украине появится один из лучших миорелаксантов препарат Эсмерон. Научный отдел компании «Органон» в настоящий момент проводит очень интересные исследования препаратов, применяемых в анестезиологии. Будем надеяться, что в ближайшее время появятся новые препараты, открывающие новые возможности в анестезиологии.
СТАТТІ ЗА ТЕМОЮ
26. 09.2021
Кардіологія
Мілдронат® – наднозологічний препарат для коморбідних пацієнтів
09.2021
Кардіологія
Мілдронат® – наднозологічний препарат для коморбідних пацієнтів
Проблема мультиморбідності й коморбідності набуває все більшої актуальності, що підтверджується зростанням числа пацієнтів із ≥5 супутніми хворобами за 10-річний період на 16%. Коморбідні патології часто спостерігаються серед осіб із серцево-судинними захворюваннями (ССЗ), зокрема у представників молодших вікових груп. Ведення коморбідних пацієнтів передбачає високу частоту призначення комбінованого лікування для досягнення цільових показників за кожним із наявних захворювань, що зумовлює необхідність одночасного застосування значної кількості препаратів. Для розв’язання проблеми поліпрагмазії одним із перспективних напрямів може стати так звана наднозологічна фармакотерапія.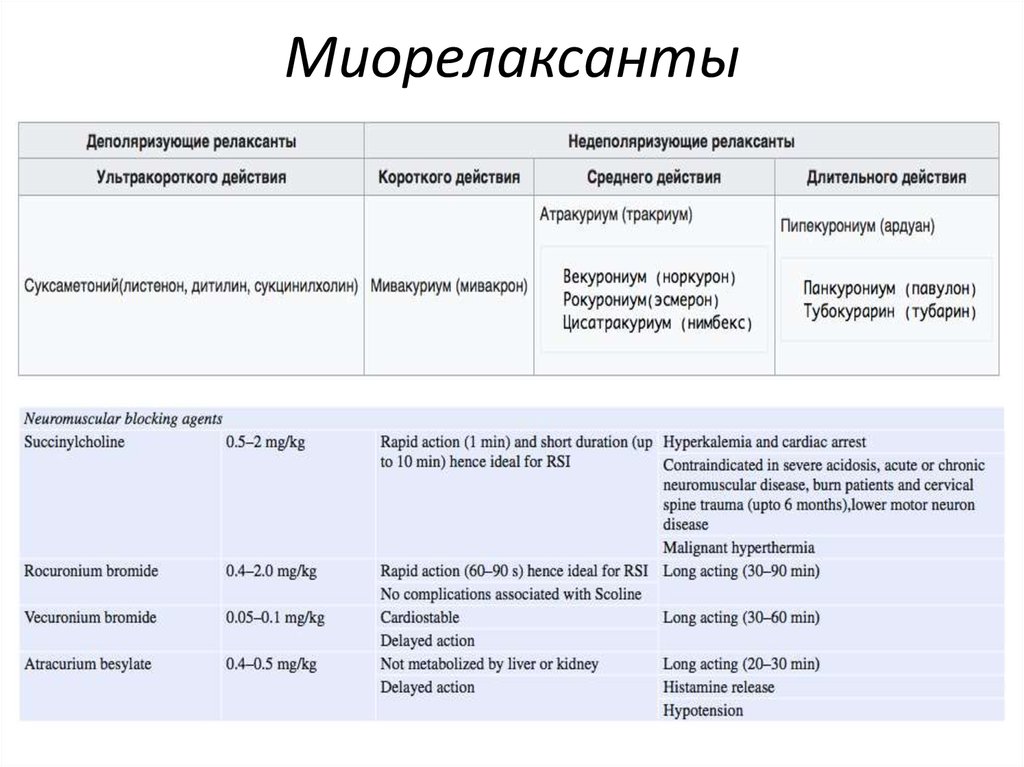 …
…
Ожиріння – поширене хронічне захворювання, що має прогресуючий і рецидивуючий перебіг. Воно чинить суттєвий негативний вплив на якість життя пацієнтів, підвищує ризик довгострокових клінічних ускладнень, зокрема серцево-судинних (СС). Особи, які страждають на ожиріння, нерідко стикаються зі стигматизацією, що призводить до збільшення захворюваності та смертності незалежно від ваги та індексу маси тіла (ІМТ). Торік було розроблено канадські рекомендації на основі сучасних досягнень в епідеміології, патофізіології, діагностиці, профілактиці та лікуванні осіб з ожирінням, а також експертних суджень та досвіду хворих. При цьому акцент було зроблено на важливості поліпшення здоров’я та якості життя пацієнта, а не лише зниження ваги, а також зазначено важливість зниження ризиків, асоційованих з ожирінням. Пропонуємо до вашої уваги ключові положення даних рекомендацій.
…
Торік було розроблено канадські рекомендації на основі сучасних досягнень в епідеміології, патофізіології, діагностиці, профілактиці та лікуванні осіб з ожирінням, а також експертних суджень та досвіду хворих. При цьому акцент було зроблено на важливості поліпшення здоров’я та якості життя пацієнта, а не лише зниження ваги, а також зазначено важливість зниження ризиків, асоційованих з ожирінням. Пропонуємо до вашої уваги ключові положення даних рекомендацій.
…
2.2.3. Мышечные релаксанты . Ветеринарная анестезиология
Для мышечной релаксации, обеспечивающей иммобилизацию животных при оперативных вмешательствах, длительное время применяли препараты, основным фармакологическим действием которых был гипнотический (эфир, барбитураты, фторотан), анальгетический (кетамин, буторфанол) или нейроплегический (седативные, производные бензодиазепинов) эффекты. Хорошая миорелаксация достигается введением больших доз этих препаратов, что ведет к неуправляемости компонентами общей анестезии (угнетению дыхания, саливации, другим побочным эффектам) и к осложнениям в послеоперационный период.
Хорошая миорелаксация достигается введением больших доз этих препаратов, что ведет к неуправляемости компонентами общей анестезии (угнетению дыхания, саливации, другим побочным эффектам) и к осложнениям в послеоперационный период.
Мышечные релаксанты периферического действия
Классическая миорелаксация обеспечивается миорелаксантами периферического действия. Они обеспечивают управляемость только одним компонентом – расслаблением мышц. Мышечные релаксанты периферического действия препятствуют нервно-мышечной передаче в скелетной мускулатуре. Применение миорелаксантов периферического действия сопровождается параличом диафрагмы и вспомогательной дыхательной мускулатуры, поэтому всегда необходимо проведение искусственной вентиляции легких. Блокада после введения недеполяризующих миорелаксантов периферического действия достигается посредством прекращения выработки антихолинэстеразы. Перед применением антихолинэстеразных препаратов необходимо всегда давать антихолинэргические средства. Это позволит избежать мускариноподобных побочных эффектов неостигмина, таких как брадикардия, гипотензия или саливация.
Это позволит избежать мускариноподобных побочных эффектов неостигмина, таких как брадикардия, гипотензия или саливация.
В любом случае мышечные релаксанты могут применяться у животных только при выключенном сознании.
Согласно механизму действия различают две группы периферических миорелаксантов:
Антидеполяризующие (недеполяризующие, конкурентные) мышечные релаксанты действуют путем блокады никотиноподобных холинорецепторов на двигательном окончании, деполяризации постсинаптической мембраны посредством ацетилхолина и никотина. В ветеринарной анестезиологии применяются такие препараты этой группы, как атракуриум, векурониум, панкурониум. Сравнительная характеристика свойств этих трех медикаментов приведена в табл. 10.
Таблица 10
Сравнительная характеристика свойств недеполяризующих мышечных релаксантов периферического действия
Применяя любой миорелаксант периферического действия, необходимо осознавать, что релаксированное животное должно находиться под ИВЛ и при этом непросто оценить действительную глубину анестезии у животного. Чтобы иметь возможность оценить глубину анестезии, необходимо регулярно проводить измерение ЧСС и АД. Нельзя забывать, что мышечные релаксанты не вызывают ни аналгезии, ни потери сознания. При использовании миорелаксантов без анестетиков животные находятся в полном сознании и чувствительны к боли, но при этом не могут двигаться. Для выполнения условий, гарантирующих адекватную глубину анестезии, применение миорелаксантов у животного целесообразно в следующих ситуациях.
Чтобы иметь возможность оценить глубину анестезии, необходимо регулярно проводить измерение ЧСС и АД. Нельзя забывать, что мышечные релаксанты не вызывают ни аналгезии, ни потери сознания. При использовании миорелаксантов без анестетиков животные находятся в полном сознании и чувствительны к боли, но при этом не могут двигаться. Для выполнения условий, гарантирующих адекватную глубину анестезии, применение миорелаксантов у животного целесообразно в следующих ситуациях.
Если характер операции (например, диафрагмальная грыжа) требует проведения ИВЛ и животное дышит вопреки работе дыхательного аппарата, то асинхронное аппарату движение грудной клетки неприятно для хирурга и создает большую нагрузку на кровообращение животного.
При переломах, репозиция при которых вследствие мышечной контрактуры затруднена, применение миорелаксантов обеспечивает полную миорелаксацию всех мышц и облегчает репозицию.
Внутриглазные операции требуют центрального, полностью спокойного положения глазного яблока. Это достигается только применением миорелаксантов периферического действия.
Это достигается только применением миорелаксантов периферического действия.
В ситуациях, когда надо быть полностью уверенным в релаксации пациента, в сосудистой хирургии и микрохирургии, когда защитное движение пациента в ходе операции может иметь роковые последствия.
Деполяризующие релаксанты вызывают более продолжительную и стойкую деполяризацию, чем ацетилхолин. К этой группе препаратов относится сукцинилхолин (дитилин, листенон), который оказывает быстрое и кратковременное действие, кумулятивным эффектом не обладает.
После внутривенного введения в среднем через 10 – 20 с у животных отмечается последовательная фибрилляция мимической мускулатуры шеи, конечностей, туловища, межреберных мышц и диафрагмы. У животных с хорошо развитой мускулатурой эти фибрилляции проявляются в виде судорожных движений. Еще через 20 – 40 с фибрилляция прекращается, наступает полное расслабление скелетной мускулатуры и выключение дыхания – апноэ. Полное расслабление (релаксация) мышц длится 3 – 7 мин.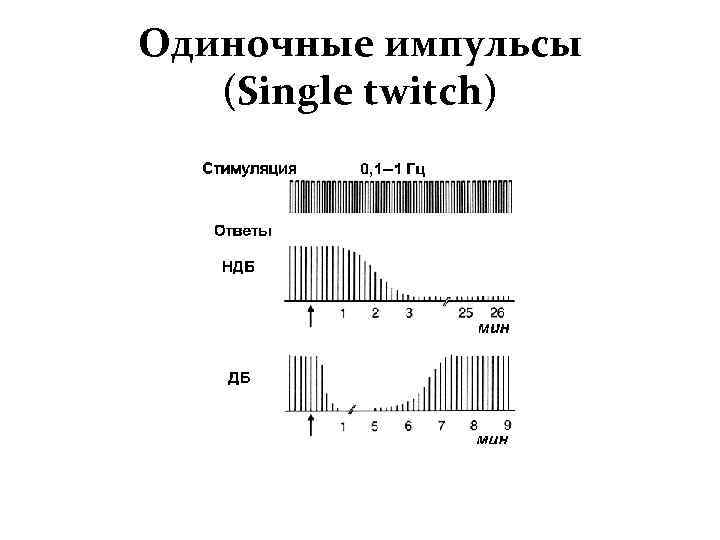 Затем быстро в течение 60 – 90 с восстанавливается мышечный тонус и восстанавливается самостоятельное дыхание.
Затем быстро в течение 60 – 90 с восстанавливается мышечный тонус и восстанавливается самостоятельное дыхание.
Мышечные релаксанты центрального действия
Мышечные релаксанты центрального действия приводят к расслаблению скелетной мускулатуры. Они отличаются от миорелаксантов периферического действия тем, что действуют на рецепторы в ЦНС, а не на двигательные окончания. Местом воздействия препаратов данной группы являются центры, ответственные за регуляцию мышечного тонуса. Характерным для мышечных релаксантов центрального действия является то, что они прежде всего подавляют полисинаптические рефлексы. Кроме того, они ведут к зависимой от дозы седации. Дыхание не угнетается (или угнетается в очень незначительной степени) и, как правило, можно обойтись без ИВЛ. Часто применяемыми в ветеринарной медицине миорелаксантами центрального действия являются гуаифенезин и бензодиазепины.
Гуаифенезин комбинируется у лошадей и жвачных с кетамином или барбитуратами ультракороткого действия, часто применяется на этапе введения в общую анестезию. Это позволяет уменьшить потребность в анестетиках без выраженных побочных действий на сердечно-сосудистую и дыхательную систему. Очень благоприятной является комбинация кетамина и гуаифенезина. При использовании гуаифенезина в концентрации выше 5 % возникает опасность гемолиза. Введение гуаифенезина чаще приводит к развитию тромбофлебита, чем применение всех других седативных анестетиков.
Это позволяет уменьшить потребность в анестетиках без выраженных побочных действий на сердечно-сосудистую и дыхательную систему. Очень благоприятной является комбинация кетамина и гуаифенезина. При использовании гуаифенезина в концентрации выше 5 % возникает опасность гемолиза. Введение гуаифенезина чаще приводит к развитию тромбофлебита, чем применение всех других седативных анестетиков.
Бензодиазепины применяются у старых мелких животных с ухудшенным общим состоянием для предоперационной седации. У здоровых животных бензодиазепины могут вызвать противоположную реакцию (например, собаки становятся агрессивными, лошадь не может больше стоять) и в таких случаях не применяются. Бензодиазепины являются средством выбора у животных с эпилепсией или другими болезнями, сопровождающимися судорогами. Когда судороги не удается устранить бензодиазепинами, тогда применяются барбитураты.
Таким образом, применение миорелаксантов допустимо только на фоне седативного и гипнотического средств.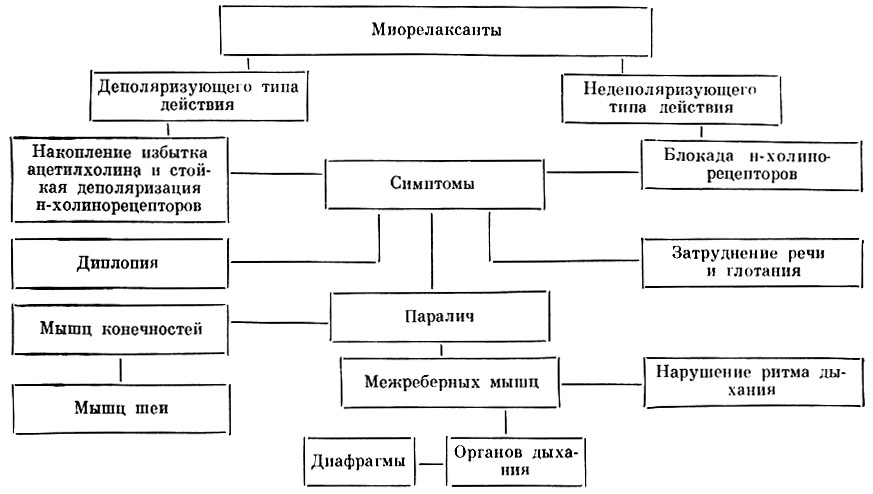 После введения мышечных релаксантов должна быть начата искусственная вентиляция легких. Компенсация дыхания должна продолжаться до полного восстановления самостоятельного дыхания.
После введения мышечных релаксантов должна быть начата искусственная вентиляция легких. Компенсация дыхания должна продолжаться до полного восстановления самостоятельного дыхания.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРесМышечные релаксанты увеличивают риск возникновения легочных осложнений.
Для некоторых операций мышцы должны быть расслаблены специальными медикаментами в дополнение к наркозу. Тем не менее, это увеличивает риск осложнений легких, что подтвердило международное исследование под руководством Департамента анестезиологии и интенсивной терапии в Klinikum Rechts Der Isar.
Исследование собрало данные из 28 стран.
Анестезирующие препараты делают пациентов бессознательными и не чувствуют боли. Это не означает, однако, что их мышцы полностью неподвижны: они могут двигаться непроизвольно, ставя под угрозу прогресс и успех операции. «Чтобы этого избежать, мы можем временно парализовать наши мышцы с помощью миорелаксантов. Эти препараты особенно важны, когда операция проводится в брюшной или грудной полости», — говорит профессор Манфред Блобнер из отдела анестезиологии и медицины интенсивной терапии.
Это исследование собрало данные у 22 803 пациентов в 211 клинике в 28 европейских странах и финансировалось Европейским обществом анестезиологии (ЕКА).
Первоначальные результаты были опубликованы в журнале The Lancet Respiratory Medicine. Они подтверждают феномен, о котором уже говорилось ранее: если во время анестезии используются миорелаксанты, риск некоторых осложнений, влияющих на легкие и дыхательные пути, значительно возрастает. Наиболее распространенными осложнениями были снижение способности легких поглощать кислород (5,2%) и респираторные или легочные инфекции (2,5%).
«Мышечные релаксанты сделали операции значительно более безопасными и эффективными с момента их введения», — говорит профессор Блобнер. «На протяжении десятилетий мы постоянно улучшали как лекарства, так и его администрирование. Многие процедуры не были бы возможны без мышечных релаксантов. Тем не менее, полученные результаты поднимают новые вопросы».
Блобнер и его соавторы планируют продолжить исследования, чтобы разобраться в механизмах, лежащих в основе осложнений. «Основываясь на наших результатах, мы уже советуем анестезиологам при небольших операциях, которые не требуют расслабления мышц, отказаться от миорелаксантов и вместо интубации трахеи использовать ларингеальную маску,» говорит профессор Блобнер.
Сравнение двух мышечных релаксантов, рокурония и сукцилинхолина, используемых для облегчения быстрого последовательного проведения интубации
Вопрос обзора
Какой препарат (рокуроний или сукцинилхолин) лучше обеспечивает отличные условия для быстрого введения дыхательной трубки пациентам всех возрастов в плановой и экстренной ситуациях?
Актуальность
В чрезвычайных ситуациях, некоторые люди нуждаются в общей анестезии с эндотрахеальной трубкой (трубка, помогает им дышать). Важно иметь быстродействующие лекарственные средства, что позволит врачам выполнить эту процедуру быстро и безопасно. В настоящее время в качестве лекарственного средства для расслабления мышцы наиболее часто используется сукцинилхолин. Сукцинилхолин является быстродействующим, его действие продолжается всего несколько минут, что особенно желательно в этой обстановке. Тем не менее, некоторые люди не могут использовать это лекарственное средство, так как оно может привести к серьезному дисбалансу электролитов, поэтому эффективное лечение без этих побочных эффектов было бы предпочтительнее. Одна из возможных альтернатив — лекарственное средство рокуроний, мышечный релаксант с меньшим числом побочных эффектов, но большей длительности действия. Этот обзор сравнивает качество условий интубации (легкость, с которой врачи могут быстро и безопасно ввести эндотрахеальную трубку) при использовании рокурония и сукцинилхолина во всех возрастных группах и при различных клинических ситуациях.
Характеристика исследований
Мы включили в обзор контролируемые испытания с 1966 по февраль 2015 года с участниками всех возрастов, нуждающихся в быстрой интубации с помощью рокурония и сукцинилхолина. Минимальная доза рокурония была 0,6 мг/кг, сукцинилхолина — 1 мг/кг. Мы объединили результаты 50 исследований, в общей сложности 4 151 участник, чтобы сравнить эффективность сукцинилхолина и рокурония в отношении влияния на условия интубации. О выраженных побочных эффектах при использовании препаратов не сообщалось.
Основные результаты
Мы обнаружили, что рокуроний менее эффективен, чем сукцинилхолин, для создания оптимальных (отличных) и приемлемых условий интубации. Поэтому рокуроний следует использовать только в качестве альтернативы сукцинилхолина, когда известно, что сукцинилхолин не должен использоваться и ожидается более длительная интубация.
Качество доказательств
Уровень доказательств умеренного качества из-за несовершенства дизайна исследований и различий методов, используемых в испытаниях.
Мышечные релаксанты их роль в современной анестезиологии. Мышечные релаксанты:классификация, механизм действия, препараты. Механизм действия миорелаксантов
Мышечные релаксанты или миорелаксанты — это препараты, приводящие к расслаблению поперечно-полосатых мышц.
Классификация миорелаксирующих веществ.
Общепринятой является классификация, в которой миорелаксанты разделяют на центральные и периферические. Механизм действия этих двух групп различается уровнем воздействия на синапсы. Центральные мышечные релаксанты влияют на синапсы спинного и продолговатого мозга. А периферические — непосредственно на синапсы, передающие возбуждение мышце. Кроме вышеперечисленных групп существует классификация, разделяющая миорелаксанты в зависимости от характера воздействия.
Центральные миорелаксанты не получили распространения в анестезиологической практике практике. А вот препараты периферического действия активно применяются для расслабления скелетной мускулатуры.
Выделяют:
- деполяризующие миорелаксанты;
- антидеполяризующие миорелаксанты.
Существует также классификация по длительности действия:
- ультракороткие — действуют 5-7 минут;
- короткие — менее 20 минут;
- средние — менее 40 минут;
- длительного действия — более 40 минут.
Ультракороткими являются деполяризующие миорелаксанты: листенон, сукцинилхолин, дитилин. Препараты короткого, среднего и длительного действия в основном недеполяризующие миорелаксанты. Короткодействующие: мивакуриум. Среднего действия: атракуриум, рокурониум, цисатракуриум. Длительного действия: тубокурорин, орфенадрин, пипекуроний, баклофен.
Механизм действия миорелаксантов.
Недеполяризующие миорелаксанты еще называют недеполяризующими или конкурентными. Это название полностью характеризует их механизм действия. Миорелаксанты недеполяризующего типа конкурируют с ацетилхолином в синаптическом пространстве. Они тропны к одним и тем же рецепторам. Но ацетилхолин под воздействием холинэстеразы в считанные милисекунды разрушается. Поэтому он неспособен конкурировать с мышечными релаксантами. В результате такого действия ацетилхолин не способен воздействовать на постсинаптическую мембрану и вызвать процесс деполяризации. Цепь проведения неврно-мышечного импульса прерывается. Мышца не возбуждается. Чтобы прекратить блокаду и восстановить проводимость нужно ввести антихолинэстеразные препараты, например, прозерин или неостигмин. Эти вещества разрушат холинэстеразу, ацетилхолин не будет распадаться и сможет конкурировать с миорелаксантами. Предпочтение будет отдаваться естественным лигандам.
Механизм действия деполяризующих мышечных релаксантов заключается в создании стойкого деполяризующего эффекта, длящегося около 6 часов. Деполяризованная постсинаптическая мембрана неспособна принимать и проводить нервные импульсы, цепь передачи сигнала мышце прерывается. В данной ситуации использование антихолинэстеразных препаратов в качестве антидота будет ошибочным, так как накапливающийся ацетилхолин будет вызывать дополнительную деполяризацию и усиливать нейромышечную блокаду. Деполяризующие релаксанты имеют в основном ультракороткое действие.
Иногда миорелаксанты сочетают в себе действия деполяризующих и конкурентных групп. Механизм этого явления неизвестен. Предполагают, антидеполяризующие миорелаксанты имеют последействие, при котором мышечная мембрана приобретает стойкую деполяризацию и становится нечувствительной на некоторое время. Как правило — это препараты более длительного действия
Применение миорелаксантов.
Первыми миорелаксантами были алкалоиды некоторых растений, или кураре. Затем появились их синтетические аналоги. Не совсем правильно называть все мышечные релаксанты курареподобными веществами, так как механизм действия некоторых синтетических препаратов отличается от такового у алкалоидов.
Основной областью применения мышечных релаксантов стала анестезиология. В настоящее время клиническая практика не может обойтись без них. Изобретение этих веществ позволило вделать огромный скачок в области анестезиологии. Миорелаксанты позволили снизить глубину наркоза, лучше контролировать работу систем организма, создали условия для внедрения эндотрахеального наркоза. Для большинства операций основным условием является хорошее расслабление поперечно-полосатых мышц.
Влияние миорелаксантов на работу систем организма зависит от селективности воздействия на рецепторы. чем селективней препарат, тем меньше побочных действий со стороны органов он вызывает.
В анестезиологии применяются следующие мышечные релаксанты: сукцинилхолин, дитилин, листенон, мивакуриум, цисатракуриум, рокуроний, атракурий, тубокурарин, мивакуриум, пипекуроний и другие.
Кроме анестезиологии миорелаксанты нашли применение в травматологии и ортопедии для расслабления мышц при вправлении вывиха, перелома, а также при лечении заболеваний спины, связочного аппарата.
Побочные действия релаксантов.
Со стороны сердечно-сосудистой системы миорелаксанты могут вызывать учащение пульса и подъем давления. Сукцинилхолин имеет двоякое действие. Если доза малая, он вызывает брадикардию и гипотонию, если большая — противоположные эффекты.
Релаксанты деполяризующего типа могут приводить к гиперкалиемии, если уровень калия у пациента изначально был повышен. Это явление встречается у пациентов с ожогами, большими травмами, кишечной непроходимостью, столбняком.
В послеоперационном периоде нежелательными эффектами являются длительная мышечная слабость и боли. Это объясняется сохраняющейся деполяризацией. Длительное восстановление дыхательной функции может быть связано, как с действием мышечных релаксантов, так и с гипервентиляцией, обструкцией дыхательных путей или передозировкой декураризирующих препаратов (неостигмина).
Сукцинилхолин способен повышать давление в желудочках мозга, внутри глаза, в черепной коробке. Поэтому его применение в соответствующих операциях ограничено.
Миорелаксанты деполяризующего типа в сочетании с препаратами для общего наркоза могут вызывать злокачественное повышение температуры тела. Это жизнеугрожающее состояние, которое сложно купировать.
Основные названия препаратов и их дозы.
Тубокурарин. Доза тубокурарина, используемая для наркоза 0,5-0,6 мг/кг. Вводить препарат нужно медленно, в течение 3-х минут. Во время операции дробно вводят поддерживающие дозы по 0,05 мг/кг. Это вещество является натуральным алкалоидом кураре. Имеет тенденцию к снижению давления, в больших дозах вызывает значительную гипотензию. Антидотом Тубокурарина является Прозерин.
Дитилин. Этот препарат относится к релаксантам деполяризующего типа. Имеет короткое, но сильное действие. Создает хорошо контралируемое расслабление мышц. Основные побочные эффекты: длительно апное, подъем АД. Специфического антидота не имеет. Аналогичное действие имеют препараты листенон , сукцинилхолин , миорелаксан .
Диплац ин. Неполяризующий миорелаксант. Действует около 30 минут. Доза, достаточная для одной операции — 450-700 мг. Никакие существенные побочные эффекты при его применении не наблюдались.
Пипекуроний. Доза для наркоза составляет 0,02 мг/кг. Действует длительно, в течение 1.5 часов. В отличие от остальных препаратов является более селективным и не действует на сердечно-сосудистую систему.
Эсмерон (рокуроний). Доза для интубации 0,45-0,6 мг/кг. Действует до 70 минут. Болюсные дозы во время операции 0,15 мг/кг.
Панкуроний . Известен под названием Павулон. Доза, достаточная, для введения в наркоз 0,08-0,1 мг/кг. Поддерживающая доза 0,01-0,02 мг/кг вводится каждые 40 минут. Имеет множественные побочные эффекты сос тороны сердечно-сосудистой системы, так как является неселективным препаратом. Может вызывать аритмию, гипертонию, тахикардию. Значительно влияет на внутриглазное давление. Может использоваться для операций Кесарева сечения, так как плохо проникает через плаценту.
Все эти препараты используются исключительно анестезиологами-реаниматологами при наличии специализированной дыхательной аппаратуры!
Эти препараты — практически обязательный элемент комбинированной анестезии. С их помощью расслабление мышц достигается не опасным увеличением концентрации ингаляционных анестетиков, а перерывом импульса с нерва на мышцу . Существуют 4 типа мышечных релаксантов: деполяризующие, конкурентные, смешанные и центральные. Последние два типа в клинике применяют очень редко.
Деполяризующие мышечные релаксанты (дитилин, листенон) вызывают стойкую деполяризацию концевой пластины нервно-мышечного синапса. В результате этого после кратковременного возбуждения (фибрилляции) наступает полное расслабление поперечно-полосатых мышц длительностью 3-5 мин. В условиях общей анестезии время действия деполяризующих миорелаксантов удлиняется .
Механизм действия конкурентных мышечных релаксантов (тубарин, ардуан, норкурон) принципиально иной. Он основан на их способности препятствовать взаимодействию ацетилхолина с рецепторами нервно-мышечного синапса. В результате этого деполяризация концевой пластины синапса становится невозможной и наступает стойкая релаксация скелетных мышц продолжительность 40-60 мин.
Обеспечивая расслабление мышц, миорелаксанты позволяют проводить более поверхностную анестезию, осуществлять ИВЛ во время операции, создавая хирургу наилучшие условия для выполнения самых сложных оперативных вмешательств .
Дополнительные препараты . В ходе анестезии и операции возникает необходимость использовать методы, позволяющие активно влиять на некоторые функции организма. Так, управляемая гипотония, достигаемая при введении короткодействующих ганглиоблокаторов (арфонад, гигроний), позволяет снизить системное АД, уменьшить кровопотерю из операционной раны, улучшить микроциркуляцию. Таким же эффектом обладает и ингаляционный анестетик фторотан.
С помощью инфузионной терапии можно изменять по показаниям объём циркулирующей плазмы, влиять на уровень осмотического и онкотического давления, изменять концентрацию электролитов в плазме крови, воздействовать на реологию крови .
ИВЛ не просто берёт на себя функции аппарата внешнего дыхания. Она улучшает газообмен за счёт увеличения функциональной ёмкости лёгких, уменьшает энергозатраты на работу дыхания. Изменяя параметры вентиляции, становится возможным активно влиять на рСО 2 , КОС, тонус сосудов, а следовательно, и на кровоснабжение тканей.
Комбинация средств для анестезии: транквилизаторов, нейролептиков, анальгетиков, анестетиков, мышечных релаксантов — и средств и методов, активно влияющих на функции органов и систем организма, и определяет понятие — современной комбинированной анестезии .
Существует множество комбинаций. Вместе с тем целесообразно использовать «стандартные», опробованные практикой сочетания препаратов для анестезии, которые определяют понятия «вид анестезии» и «метод анестезии».
Различают комбинированную ингаляционную общую анестезию, базис-анестезию, нейролептанальгезию, атаральгезию, центральную анальгезию. Комбинированная анестезия лежит в основе таких методов, как управляемая гипотония (гипертензия) и искусственная гипотермия (гипертермия).
2240 0
Миорелаксанты — тубокурарин, диплацин, парамион, флакседил, дитилин, прокуран и другие — блокируют передачу нервных импульсов с двигательного нерва на поперечнополосатую мышцу, вызывая расслабление скелетной мускулатуры, в том числе дыхательной, вплоть до апноэ. Скелетная мускулатура в зависимости от дозы и индивидуальных особенностей раненого расслабляется в определенной последовательности.
Первыми парализуются мышцы шеи и конечностей, затем брюшного пресса, реберные и, наконец, диафрагма. Однако у некоторых людей даже при небольшой дозе релаксанта может сразу наступить расслабление всей мускулатуры. Кроме того, расслабление мышц конечностей и брюшного пресса при сохраненном самостоятельном дыхании вовсе не означает, что дыхательные мышцы остались вне действия релаксанта. Функция их неминуемо страдает, что ведет к нарушению газообмена.
Поэтому без проведения вспомогательного или управляемого дыхания миорелаксанты применять нельзя.
При достаточном обеспечении газообмена эти препараты, парализуя скелетную мускулатуру, ие оказывают никакого отрицательного влияния на функции других органов и систем.
Все миорелаксанты выпускаются в виде ампулированных порошков или водных растворов, длительно сохраняющих активность; вводят их внутривенно. Только дитилин в растворе теряет активность, поэтому для длительного хранения его выпускают в виде амиулированного порошка по 0,1; 0,25; 0,5; 1,0, который перед употреблением растворяют в стерильной дистиллированной воде или в физиологическом растворе.
Для расслабления мышц конечностей и брюшного пресса достаточно 100 мг диплацина, 6—8 мг парамиона, 2—3 мг прокурана, 20—25 мг дитилина. При этом вентиляция легких уменьшается на 40—50%, что требует вспомогательного дыхания. При проведении последнего анестезист старается попасть в такт естественному дыханию наркотизируемого, увеличивая объем вдоха сдавленней мешка наркозного апарата.
Однако вспомогательное дыхание менее эффективно, чем искусственное. Поэтому при возможности следует применять искусственную вентиляцию легких, для чего динлацип вводят в дозе 360—380 мг, а парамион—в дозе 14—16 мг.
Действие этих препаратов в указанных дозах длится 40—50 мин. При необходимости продления релаксации мышц повторные дозы диплацина и парамиона уменьшают вдвое и втрое. Наиболее соответствует военно-полевым условиям дитилин. Его для длительного расслабления мускулатуры применяют в виде фракционных введений по 100—200 мг.
Полное расслабление мускулатуры после введения дитилина наступает через 30—40 сек и длится 7—15 мин. Доза прокурана составляет 6 8 мг, при этом апноэ сохраняется в течение 20—25 мин.
Действие релаксантов после наркоза можно считать полностью прекратившимся после того, как больной может по просьбе врача произвольно изменить частоту и глубину дыхания, пожать руку, приподнять голову. Если после наркоза с миорелаксантами у больного остается гипопноэ, то следует на фоне продолжающегося искусственного дыхания произвести так называемую декураризацию.
Для этого внутривенно вводят 0,5—1,0 мг атропина и после появления тахикардии тоже внутривенно, но очень медленно вводят 1,5—2,5 мг прозерина (3,0—5,0 мл 0,05%-ного раствора). При выраженном урежении пульса и обильной саливации быстро повторяют внутривенную инъекцию атропина в половинной дозе.
Описанная декураризация эффективна как после применения антидеполяризующих релаксантов — диплацина и парамиона, так и при гипопноэ после наркоза с нрокураном и дитилином. Прозерин на фоне действия атропина эффективно устраняет гипопное, вызванное «двойным блоком» или «второй фазой» действия прокурана и дитилина.
Миорелаксанты, вызывая расслабление мышц, облегчают работу хирурга, создают условия для менее травматичного проведения оперативного вмешательства. Они ослабляют рефлекторные реакции, идущие по соматическим путям, и вызывают слабое торможение в ганглиях вегетативной нервной ситемы, что повышает устойчивость оперируемого к шоку. Наркоз при этом можно вести на поверхностном (наиболее безопасном) уровне.
Миорелаксанты у раненых на этапах медицинской эвакуации при обязательном вспомогательном или искусственном дыхании можно применять в следующих случаях:
1) для облегчения интубации после вводного наркоза тиопентал-натрием, гексеналом, фторотаном, эфиром, закисью азота;
2) с целью обеспечить наиболее совершенный поверхностный наркоз при малом потреблении основного наркотического вещества и для повышения устойчивости оперируемого к шоку;
3) для расслабления мышц при эндотрахеальном наркозе во время операций: а) на органах брюшной и грудной полостей, б) на конечностях для облегчения репозиции костных отломков и вправлении вывихов;
4) для выключения естественного дыхания при необходимости применения искусственной вентиляции легких как метода лечения дыхательной недостаточности и терминальных состояний.
А.Н. Беркутов
Еще в XVI в. стало известно, что южноамериканские индейцы используют для охоты и войны отравленные стрелы, яд которых — кураре — вызывает смерть из-за паралича дыхательных мышц.
После того, как в 1942 г. Гарольд Гриффит опубликовал результаты применения очищенного экстракта кураре во время анестезии, миорелаксанты быстро завоевали достойное место в арсенале анестезиологов и реаниматологов.
Открытие действующего начала кураре тубокурарина оказало огромное влияние на развитие анестезиологии и хирургии и позволило изучить механизм нейро-мышечной передачи.
Миорелаксанты — это препараты, блокирующие нейромышечную передачу. Используются они для проведения контролируемой механической вентиляции легких, создания условий для работы хирургической бригады, особенно при операциях на органах груди и живота, для уменьшения внутричерепной гипертензии, снижения потребления кислорода, устранения дрожи, обеспечения неподвижности при некоторых диагностических манипуляциях, купирования судорожного синдрома и в ряде других случаев.
Все блокаторы нейро-мышечной передачи по своей химической структуре похожи на ацетилхолин. Так, например, сукцинилхолин фактически состоит из 2-х молекул ацетилхолина (слайд). Недеполяризующие релаксанты скрывают свою подобную ацетилхолину структуру в виде кольцевых систем 2-х типов — изохинолиновой и стероидной (слайд). Наличие одного или двух четвертичных атомов азота у всех блокаторов нейро-мышечной передачи делает эти препараты плохо растворимыми в липидах, что предотвращает их попадание в ЦНС.
Все блокаторы нейро-мышечной передачи высокополярны и неактивны при пероральном приеме. Их вводят только внутривенно.
Таблица 1(слайд).
По механизму действия миорелаксанты подразделяют на 2 класса: деполяризующие и недеполяризующие. Кроме того, миорелаксанты делят по продолжительности действия (слайд, таблица).
Таблица 2
Классификация миорелаксантов по механизму и длительности действия
Для того, чтобы разобраться с механизмом действия и применением современных миорелаксантов вспомним сначала, как осуществляется нейро-мышечная передача.
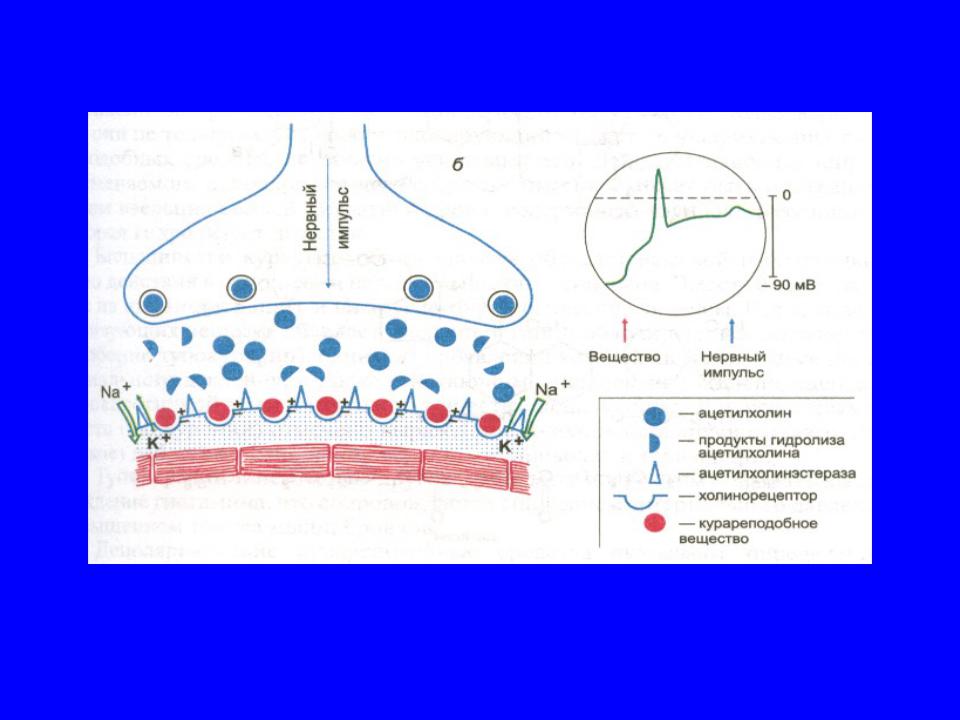
На слайде представлена схематическая структура нейро-мышечного синапса. На подходе к мышечному волокну аксон теряет миелиновую оболочку и разветвляется на множество конечных веточек (терминалей). Поверхность каждой такой веточки, непосредственно прилежащая к мышце, называется пресинаптической мембраной и вместе с так называемой концевой пластинкой (участком мышечного волокна в месте контакта с нервным окончанием) образует нейро-мышечный синапс.
Терминаль нерва содержит большое количество митохондрий и везикул с медиатором ацетилхолином. Между пре- и постсинаптическими мембранами находится пространство, заполненное гелем и называемое синаптической щелью.
Мембрана концевой пластинки (постсинаптическая мембрана) образует множественные складки. На постсинаптической мембране находятся н-холинорецепторы. Постсинаптическая мембрана в покое поляризована. Разница потенциалов наружной и внутренней поверхности мембраны (потенциал покоя) составляет 90 мВ.
Процесс нейро-мышечной передачи выглядит следующим образом. Приходящее по аксону возбуждение в виде потенциала действия активирует кальциевые каналы, способствуя вхождению кальция внутрь нервного волокна. Повышение концентрации кальция внутри терминали нерва приводит к слиянию везикулярной мембраны с мембраной нервного окончания и выбросу ацетилхолина из везикул в синаптическую щель. Далее ацетилхолин связывается с холинорецепторами постсинаптической мембраны, что приводит к открытию ионных каналов и переходу по градиенту концентрации Na и Ca внутрь клетки и выходу К из клетки. Быстрое перемещение Na внутрь клетки вызывает деполяризацию мембраны (за счет уменьшения отрицательного заряда внутренней поврехности мембраны), а возникший потенциал концевой пластинки при определенном количестве связанных с ацетилхолином рецепторов достигает такой величины, что распространяется на соседние участки мышечного волокна в виде потенциала действия, приводя к сокращению мышцы.
Ацетилхолин же быстро гидролизуется специфическим ферментом ацетилхолинэстеразой на холин и уксусную кислоту. Молекулы фермента фиксированы в концевой пластинке в непосредственой близости от холинорецепторов.
Освобожденная от ацетилхолина концевая пластинка переходит в свое прежнее состояние. Каналы закрываются, электролиты возвращаются к своим прежним уровням за счет активного транспорта. Мышца расслабляется. После кратковременного рефрактерного периода, во время которого восстанавливается потенциал покоя, мембрана вновь становится готова реагировать на поступление в синаптическую щель очередной порции ацетилхолина, а мышца — реагировать на приходящий потенциал действия сокращением.
Теперь можно поговорить и о механизме действия разных групп миорелаксантов.
А. Недеполяризующие релаксанты.
В низких дозах они действуют на никотиновые рецепторы как конкурентные антагонисты ацетилхолина. В больших дозах некоторые из препаратов этой группы проникают непосредственно в поры ионных каналов, еще больше ослабляя нейро-мышечную передачу. Кроме того, недеполяризующие миорелаксанты могут блокировать пресинаптические каналы, затрудняя транспорт ацетилхолина из нервных окончаний в синаптическую щель. Важным следствием конкурентности их действия является способность ингибиторов холинэстеразы уменьшать или даже полностью прекращать блокаду.
Б. Деполяризующие миорелаксанты.
Действуют в 2 фазы. Первая — деполяризующая, связана с действием сукцинилхолина, аналогичным ацетилхолину, с деполяризацией концевой пластинки. Более того, сукцинилхолин может проникать в ионные каналы, вызывая в них “мерцающие” изменения проводимости.
Для поддержания мышечного сокращения необходимы продолжающееся поступление потенциалов концевой пластинки с формированием серии потенциалов действия на миоците. Для формирования очередного потенциала концевой пластинки она должна сначала реполяризоваться, а затем вновь деполяризоваться. Поскольку сукцинилхолин не гидролизуется в синапсе быстро, рецепторы остаются блокированными, повторные импульсы с концевой пластинки не поступают, мышечное волокно реполяризуется, развивается миорелаксация. Этому же способствует и проникновение препарата непосредственно в каналы.
Кроме того, существует гипотеза, согласно которой на мембране миоцита вокруг концевой пластинки возникает невозбудимая зона, что препятствует распространению возбуждения даже при поступлении импульсов с холинорецепторов (десенсибилизация, 2-я фаза блока). Это наблюдается при введении большой дозы сукцинилхолина.
Следует подчеркнуть, что полностью механизм действия миорелаксантов не выяснен до сих пор. Исследования, начатые Г. Гриффитом в 1942 г., продолжаются.
Как указывалось выше, миорелаксанты в силу своей химической структуры неспособны проникать в ЦНС, поэтому влияния на ее функции не оказывают. Необходимо еще раз подчеркнуть, что препараты данной группы не вызывают ни анестезию, ни анальгезию, ни сон.
На сердечно-сосудистую систему миорелаксанты действуют по-разному. Так векуроний, пипекуроний, доксакурий и рокуроний практически не вызывают изменений ее функций.
Для уменьшения токсичности общего анестетика дополнительно используют препараты из других групп (нейролептики, миорелаксанты). Миорелаксанты (курареподобные вещества) -препараты, изолированно выключающие напряжение мускулатуры за счет блокады нервно-мышечной передачи. Миорелаксанты применяют со следующими целями: 1) расслабление мускулатуры при наркозе, что способствует уменьшению дозы анестетика и глубину наркоза; 2) как следствие блокады нервно-мышечной передачи импульса — использование ИВЛ; 3) для снятия судорог, мышечного гипертонуса и др. Отсутствие или резкое снижение мышечного тонуса — обязательный компонент для обеспечения обезболивания при полостных операциях. Следует помнить о том, что введение миорелаксантов обязательно ведет к прекращению работы дыхательной мускулатуры и прекращению спонтанного дыхания, что требует проведения ИВЛ. По механизму действия выделяют антидеполяризующие (павулон, тубокурарин, диплацин) и деполяризующие (дитилин, листенон, миорелаксин) миорелаксанты, по длительности действия — короткие (дитилин, листенон) и длительные (павулон, тубокурарин). После окончания операции для ликвидации действия миорелаксантов вводят прозерин, являющийся антихолинэстеразным препаратом (декураризация).
35. Нейролептанальгезия. Аспекты применения.
Нейролептанальгезия(НЛА) — метод внутривенной анальгезии, основанный на комбинированном применении мощного нейролептика дроперидола и наркотического аналгетика фентанила. Преимуществом метода является своеобразное действие на ЦНС, характеризующееся быстрым наступлением безразличия к окружающему, отсутствием двигательного беспокойства, снижением выраженности вегетативных и метаболических реакций на хирургическую агрессию. НЛА обычно выступает в качестве компонента комбинированного наркоза или в сочетании с местной анестезией. Наиболее часто НЛА проводится на фоне ИВЛ закисью азота. Показания к проведению: продолжительные тяжелые операции на всех отделах грудной и брюшной полостей, в особенности на сердце, крупных сосудах, а также нейрохирургические вмешательства повышенной травматичности; операции повышенного риска у больных в тяжелом состоянии, пожилом возрасте, с сопутствующей патологией; выполнение специальных операций, требующих постоянного контакта хирурга с больным (отология, нейрохирургия и др.). Абсолютные противопоказания к НЛА встречаются только в акушерско-гинекологической клинике при кесаревом сечении до момента извлечения плода. Относительные противопоказания к НЛА имеются при заболеваниях экстрапирамидной системы, при бронхиальной астме, у наркоманов.
36. Регионарные методы анестезии (определение, классификация, показания к применению).
Регионарные методы анестезии характеризуются достижением эффекта обезболивания, выключением проводимости в конкретном нерве или сплетении нервов, с сохранением сознания и дыхания больного. Регионарная анестезия класс:
Проводниковая– блок. передачи импульса на ур ствола нерва или нерв.сплетений-эпидуральная – блок передачи импульса на ур корешков спинномозговых нервов путем введение анестетика в ЭПИДУРАЛЬНО Е пространство.-спинальная – блок передачи импульса на ур корешков спинномозговых нервов путем введение анестетика в СУБДУРАЛЬНОЕ пространство.-плексусная — осуществляемое путем введения раствора анестетика в зону нервного сплетения.
Общепринятыми показаниями для регионарной анестезии являются: интраоперационная анальгезия; послеоперационное обезболивание; лечение хроническое нейропатической боли, а также боли, связанной со злокачественными опухолями; проведение превентивной анальгезии (вероятность возникновения послеоперационного хронического болевого синдрома будет гораздо меньшей, если эпидуральная анестезия будет начала за сутки до проведения эндопротезирования коленного сустава, или вероятность возникновения фантомных болей будет меньшей, когда эпидуральная анестезия начинается до, а не после ампутации пораженной конечности).
Анестезиология в отделении анестезиологии, реанимации и интенсивной терапии, стационар ЕМС в Москве
В ЕМС работает опытная команда анестезиологов. Весь процесс подготовки пациента к операции организован таким образом, чтобы минимизировать риск осложнений. Обязательной является консультация анестезиолога за несколько дней до операции. Пациент рассказывает об имеющихся изменениях здоровья, сопутствующих заболеваниях, аллергических реакциях, перенесенных ранее операциях. Анестезиолог оценивает результаты анализов, дополнительных методов исследования, обсуждает с пациентом планируемый вид анестезии, при необходимости назначает консультации специалистов, например, кардиолога при сложных проблемах с сердечно-сосудистой системой. С анестезиологом обязательно нужно обсудить принимаемые лекарства, некоторые из них необходимо отменить перед операцией. Утром в день операции анестезиолог обязательно еще раз встретится с пациентом, узнает самочувствие, настроение, ответит на возникшие вопросы. Анестезиолог внимательно сопровождает пациента в течение всего периода от подачи в операционную до перевода в стационар после операции.
В операционной медсестра-анестезистка подключает к пациенту монитор, который в заданном режиме в течение всей операции контролирует артериальное давление, электрокардиограмму, пульс, содержание кислорода в организме, частоту и объем дыхания пациента. При необходимости может контролироваться глубина сна пациента и степень мышечного расслабления. Врач-анестезиолог оценивает все жизненно важные параметры пациента, следит, чтобы пациенту не было больно, рассчитывает дозу и кратность введения различных лекарств.
Анестезия (наркоз или обезболивание) – это временная утрата чувствительности, в том числе и болевой, под действием различных медикаментов. Анестезия — важная составляющая оперативного вмешательства, во время операции она обеспечивает полное отсутствие ощущения боли. Анестезия проводится с высочайшей степенью ответственности.
Методы анестезии
Общая анестезия
Во время наркоза сон пациента поддерживается постоянным точно дозированным введением снотворных препаратов внутривенно (через установленный перед операцией пластиковый внутривенный катетер) или ингаляционно (вдыханием через маску). Отсутствие боли обеспечивают анальгетики, которые также вводятся в течение всей операции.
Дыхание пациента во время общей анестезии может быть самостоятельным, но чаще всего поддерживается с помощью дыхательных аппаратов, «подстраивающихся» под ритм и глубину дыхания человека. Во время коротких и несложных операций анестезиолог использует ларингеальную маску, через которую пациент дышит смесью кислорода, воздуха и анестетических газов. При более длительных операциях, требующих полного мышечного расслабления, где применяются мышечные релаксанты, проводится эндотрахеальный наркоз. Под медикаментозным сном пациенту в дыхательные пути вводится термопластическая трубка со специальной манжетой, которая полностью защищает легкие и позволяет проводить искусственную вентиляцию.
У пациентов с сопутствующими заболеваниями сердечно-сосудистой системы во время анестезии вводятся необходимые лекарства, поддерживающие работу сердца или нормализующие артериальное давление. У пациентов с сахарным диабетом контролируется уровень сахара в крови. При необходимости во время операции за короткое время может быть лабораторно исследован любой параметр.
Регионарная анестезия
Позволяет обезболивать отдельные зоны тела. Наиболее известны спинальная и эпидуральная анестезии, когда небольшим количеством местного анестетика блокируется проведение болевых и двигательных нервных импульсов нижней части тела. Под этим видом анестезии выполняется большинство операций на нижних конечностях. Для пациентов старших возрастных групп эта анестезия является альтернативным методом при протезировании коленных и тазобедренных суставов.
Регионарная анестезия применяется также при операциях на верхних конечностях. С помощью специального прибора точно определяется расположение нервного сплетения (в области шеи, подмышечной области или отдельных нервов на предплечье и кисти) и вводится местный анестетик. Через 20-30 минут рука теряет чувствительность и способность двигаться.
Блокада нервов длится 2-3 часа, затем постепенно восстанавливаются все обычные ощущения. Во время действия регионарной анестезии может поддерживаться легкий медикаментозный сон, исключающий «присутствие» пациента на операции. Этот вопрос обязательно обсуждается на консультации с анестезиологом перед операцией. По желанию пациента снотворные препараты не будут вводиться, и он сможет наблюдать за ходом операции на мониторе, не испытывая при этом никаких неприятных ощущений.
Регионарная анестезия также применяется для обезболивания в послеоперационном периоде, наиболее часто при операциях в области колена, голени, стопы, обеспечивая отсутствие боли на 8-12 часов.
Местная анестезия
В настоящее время применяется только при небольших операциях на поверхности тела. Разновидность местной анестезии – аппликационная, когда мазь с анестетиком наносится на кожу, и через 30-40 минут появляется возможность безболезненно производить пункцию вен для забора анализов крови.
Риски анестезии
Анестезия – безопасная манипуляция, но как и все медицинские процедуры имеет определенные риски. Осложнения, опасные для жизни (остановка сердца, дыхания, тяжелые аллергические реакции), наблюдаются крайне редко.
Однако риск при проведении анестезии считается повышенным, если:
-
У пациента есть какое-либо хроническое заболевание (гипертоническая болезнь, ишемическая болезнь сердца, астма, сахарный диабет и т.д.). Если эти заболевания хорошо компенсированы, риск повышается незначительно.
-
У пациента есть аллергия на какие-либо лекарственные препараты
-
Пациент курит, употребляет алкоголь и наркотики
-
Пациент невнимательно отнесся к рекомендациям по подготовке к операции и анестезии, например, не выдержал нужный временной интервал по ограничению в приеме пищи, либо не согласовал с анестезиологом прием своих лекарств.
Опасности при проведении общей анестезии
Во время общей анестезии защитные рефлексы угнетаются, поэтому существует опасность попадания желудочного содержимого в дыхательные пути, что может быть опасно для жизни. В связи с этим в течение 6 часов до начала операции нельзя употреблять пищу, а за 4 часа до операции не рекомендуется пить воду, жевать жевательную резинку, курить. Если пациент не следовал данному правилу, то в целях его безопасности операция откладывается или отменяется.
Важно сообщить анестезиологу о шатающихся зубах или съемных зубных протезах, так как во время эндотрахеального наркоза при постановке интубационной трубки есть возможность повреждения зубов или голосовых связок.
В редких случаях в раннем послеоперационном периоде может наблюдаться тошнота и рвота, что связано с индивидуальной реакцией на препараты для анестезии.
Во время наркоза снижен тонус мышц, поэтому при длительных операциях возможны так называемые позиционные сдавления нервов, что может привести к длящемуся до нескольких недель снижению чувствительности в какой-либо части тела.
Опасности при проведении регионарной анестезии
При снижении артериального давления, появлении головокружения, тошноты, затрудненного дыхания при проведении спинальной или эпидуральной анестезии сразу же сообщите об этом анестезиологу или медсестре. Специалисты примут необходимые меры для улучшения вашего состояния.
После операции, проведенной под спинальной или эпидуральной анестезией, в течение нескольких часов сохраняется снижение чувствительности в нижних конечностях. Также может быть затруднено опорожнение мочевого пузыря, при необходимости в мочевой пузырь вводят катетер.
После спинальной анестезии может возникнуть головная боль. Это редкое осложнение может потребовать нескольких дней постельного режима и приема обезболивающих препаратов.
Беседа с анестезиологом
Проведению анестезии всегда предшествует беседа с анестезиологом. Если у Вас есть вопросы, обязательно задайте их во время этой беседы! Вам выдадут анкету, где необходимо точно и подробно отметить все данные о состоянии Вашего здоровья, ранее перенесенных и имеющихся заболеваниях и применяемых в настоящее время лекарственных препаратах. Также необходима информация о ранее перенесенных операциях, возможной аллергии на лекарственные препараты и Ваших привычках (занятиях спортом, курении, употреблении алкоголя и т.д.). До операции Вы должны подписать форму согласия на операцию и проведение анестезии.
Подготовка к операции
-
Перед хирургическим вмешательством и анестезией
-
Предупредите врача обо всех изменениях здоровья, в частности для женщин – о начале менструации или о возможной беременности
-
Откажитесь от приема алкоголя и курения за 12 часов до визита в клинику
-
Подготовьтесь к возможной госпитализации на срок более суток.
В день операции
-
Не принимайте еду за 6 часов и напитки за 4 часа до операции
-
Не используйте косметику, лак для ногтей, контактные линзы. Накрашенные или искусственные ногти могут затруднять работу накладываемого на палец датчика слежения за кислородом
-
Принимайте назначенные анестезиологом лекарства не более, чем с одним глотком воды
-
Утром в день операции примите душ
-
В клинику следует прийти в указанное в направлении время
-
Непосредственно перед операцией необходимо переодеться в специальное белье, выданное Вам медсестрой
-
Снимите и отдайте медицинской сестре в отделении все украшения и кольца, очки, контактные линзы и съемные зубные протезы
-
Непосредственно перед операцией посетите туалет
-
При необходимости возьмите с собой в операционную слуховой аппарат или ингалятор, применяемый при астме.
После операции
-
Восстановление после анестезии происходит в послеоперационной палате, где медицинский персонал наблюдает за дыханием, пульсом, артериальным давлением, болевыми ощущениями. При необходимости вводятся обезболивающие препараты и подается кислород. Если Вам была проведена спинальная анестезия, то контролируется также восстановление подвижности и чувствительности в нижних конечностях. В палату стационара Вы будете переведены только после пробуждения при условии удовлетворительного состояния.
-
В зависимости от сложности операции может потребоваться послеоперационное лечение в отделении интенсивной терапии.
-
После операции в области раны может возникнуть боль. Для ее предотвращения или лечения Вам будут вводиться обезболивающие лекарства. У разных людей даже при одинаковых операциях интенсивность болевых ощущений может сильно отличаться. Сильная боль способствует нарушению сна, вызывает страх и раздражительность. Чем быстрее будет достигнут контроль над болью, тем быстрее Вы восстановитесь после перенесенной операции. Не надо терпеть боль! Если Вы почувствовали боль, сообщите об этом медицинской сестре.
-
Даже если операция проводится амбулаторно, и уже вечером Вы сможете уехать домой, покинуть клинику можно только с разрешения анестезиолога или хирурга. Необходимо, чтобы Вас сопровождал кто-то из друзей или близких (для детей сопровождающим не может быть человек, управляющий автомобилем). Все специальные рекомендации будут даны Вам перед выпиской из клиники.
В первые сутки после операции не рекомендуется:
-
Принимать алкоголь, снотворные или психотропные вещества, переедать вечером после операции
-
Управлять автомобилем или пользоваться другими потенциально опасными устройствами
-
Находиться в местах, требующих повышенного внимания, принимать важные решения
-
Оставаться в одиночестве в первые сутки после операции.
Противопоказания к анестезии
Врач не имеет право отказать пациенту в анестезии при проведении оперативного вмешательства.
Для каждого планового вмешательства есть определенный перечень видов анестезии, которые можно использовать. Вид анестезии для каждого пациента определяется во время консультации с анестезиологом перед операцией. Только оценив состояние пациента, сопутствующие заболевания, лекарственные препараты, которые он принимает, анестезиолог может сделать вывод о том, какая именно анестезия подходит конкретному пациенту при конкретной операции. Врач-анестезиолог совместно с пациентом составляет индивидуальный план анестезии.
Если у пациента в прошлом проявлялись аллергические реакции на лидокаин или новокаин, ему проведут анестезию с использованием других препаратов. Так же предварительно может быть рекомендована консультация аллерголога и проведение аллергопроб.
Противопоказания к общей анестезии:
— Тяжелое состояние пациента, когда риск анестезии может оказаться выше риска самой операции. Это может быть недавно перенесенный инфаркт миокарда, тяжелая сердечная или дыхательная недостаточность, недавно перенесенные операции.
— Анатомические особенности пациента (слишком высокий вес, короткая шея).
В этих случаях анестезиолог совместно с хирургом определяют, какое анестезиологическое пособие подойдет данному пациенту.
Противопоказания к регионарной анестезии (спинальная, эпидуральная):
— отказ самого пациента;
— инфекционный процесс в месте укола;
— татуировка в месте укола – относительное противопоказание; в ряде случаев можно ввести анестезию в другом месте или под другим углом.
Отсрочить проведение анестезии и самой операции врачам придётся в случаях:
— В случае общей анестезии — если пациент не выполнил рекомендации об отказе от приема пищи и жидкости перед операцией.
— В случае регионарной анестезии — если пациент недавно принял антикоагулянтный препарат (разжижающий кровь), и он продолжает действовать. Тогда проведение анестезии возможно только после того, как закончится действие текущей дозы препарата.
Благодаря новым технологиям и современным протоколам проведения анестезии НЕ являются противопоказаниями:
— активное кровотечение,
— тяжелый инфекционный процесс (сепсис),
— сердечно-сосудистые заболевания.
Показания к проведению манипуляций под медикаментозным сном в дополнение к местной анестезии:
— тяжелое психоэмоциональное состояние,
— поздний возраст и сопутствующие заболевания,
— детский возраст.
мышечных релаксантов во время анестезии могут увеличить риск послеоперационных легочных осложнений.
Нервно-мышечные блокаторы или миорелаксанты часто используются в хирургии для предотвращения движения мышц, когда пациент находится без сознания. Недавнее исследование показало, что использование нервно-мышечных блокаторов во время общей анестезии связано с повышенным риском послеоперационных легочных осложнений.
Нервно-мышечные блокаторы или миорелаксанты часто используются в хирургии для предотвращения движения мышц, когда пациент находится без сознания.Недавнее исследование показало, что использование нервно-мышечных блокаторов во время общей анестезии связано с повышенным риском послеоперационных легочных осложнений.
Исследование, также называемое ПОПУЛЯРНЫМ, включало набор пациентов из 211 больниц в 28 европейских странах, которые получали общую анестезию для любой внутрибольничной процедуры, кроме кардиохирургии. Исследователи также собрали характеристики пациентов, хирургические и анестезиологические данные, а также обзор карты при выписке.В течение 3 дней после операции каждый пациент, включенный в исследование, прошел послеоперационное физикальное обследование для оценки неблагоприятных легочных явлений.
«Эти препараты особенно необходимы при операциях на груди или животе пациента. Они также используются для защиты голосовых связок от травм, когда в дыхательные пути помещается трубка для обеспечения искусственной вентиляции », — сказал Манфред Блобнер, доктор медицины, председатель руководящего комитета POPULAR, анестезиолог в Клинике анестезиологии и интенсивной терапии Технического университета Мюнхена. , говорится в сообщении.
Согласно исследованию, первичным результатом исследования была частота послеоперационных легочных осложнений с момента окончания операции до 28-го дня после операции. Был проведен логистический регрессионный анализ, скорректированный с учетом хирургических факторов и дооперационного физического состояния пациентов.
«Важно отметить, что нервно-мышечные блокаторы сделали операции значительно безопаснее и эффективнее с момента их появления несколько десятилетий назад», — пояснил Блобнер. «Мы постоянно совершенствуем как лекарства, так и используемые методы.Без них многие операции были бы невозможны. Тем не менее, результаты POPULAR вызывают важные вопросы ».
В период с 16 июня 2014 г. по 29 апреля 2015 г. были собраны данные о 22 803 пациентах. Результаты показали, что использование нервно-мышечных блокаторов было связано с увеличением частоты послеоперационных легочных осложнений у пациентов, перенесших общую анестезию. Кроме того, согласно результатам, использование нервно-мышечного мониторинга и введение реверсивных препаратов не было связано со снижением риска послеоперационных легочных осложнений.
В исследовании подчеркивается, что анестезиологи должны уравновесить потенциальную пользу и риск послеоперационных легочных осложнений, прежде чем использовать нервно-мышечные блокаторы.
«Основываясь на наших результатах, мы полагаем, что пациентам, подвергающимся незначительным хирургическим процедурам, которые не обязательно требуют нервно-мышечных блокаторов, может быть полезно их избегать», — заключил Блобнер. «Использование таких устройств, как ларингеальные маски для анестезии, вместо трахеальных трубок, проходящих мимо голосовых связок, также может оказаться полезным.”
Ссылка
Kirmeier E, Eriksson LI, Lewald H, et al. Легочные осложнения после анестезии после использования миорелаксантов (ПОПУЛЯРНЫЕ): многоцентровое проспективное обсервационное исследование. [опубликовано в сети 14 сентября 2018 г.]. Ланцет Респир Мед . DOI: 10.1016 / S2213-2600 (18) 30294-7.
Миорелаксанты в нейрохирургической анестезии: критическое приложение: Европейский журнал анестезиологии
Использование миорелаксантов является широко распространенной практикой в общей анестезии и обычно рекомендуется в протоколах анестезии, разработанных для нейрохирургии.Однако в то время, когда руководящие принципы и стандартные рекомендации регулярно ставятся под сомнение, необходимо пересмотреть обоснование использования миорелаксантов в нейрохирургической анестезии. Нейрохирургия значительно изменилась за последние годы, от традиционных трепанаций черепа к малоинвазивным методам и функциональным процедурам [1] . Нейроанестезия также претерпела значительные изменения, благодаря новым летучим агентам, лекарствам короткого действия и новым методам введения, таким как инфузии с контролируемой целью.Пришло время нейроанестезиологам, столкнувшимся с этими важными изменениями, поставить под сомнение свою ритуальную практику. Зачем использовать миорелаксанты при нейрохирургической анестезии? Есть ли причины не использовать их? Оказывают ли эти препараты специфическое воздействие на центральную нервную систему? Если показаны миорелаксанты, что будет определять выбор и правильную практику в отношении их конкретных побочных эффектов и потенциальных взаимодействий у нейрохирургических пациентов?
Использовать или не применять миорелаксанты
В основном, три основные причины использования миорелаксантов во время анестезии, предназначенные для общей хирургии, включают обеспечение отличных условий интубации, контроль механической вентиляции легких и облегчение работы хирурга.Эндотрахеальную интубацию можно легко выполнить без миорелаксантов, хотя иногда за счет гемодинамических изменений [2] . Искусственную вентиляцию легких можно легко контролировать во время анестезии без миорелаксантов. Наконец, внутри черепа нет мышц, которые можно было бы парализовать, чтобы улучшить работу нейрохирурга. С другой стороны, многие нейрохирургические процедуры не требуют применения миорелаксантов или даже противопоказывают их использование. Современные нейрохирургические методы отдают предпочтение минимально инвазивной хирургии, эндоскопии, стереотаксическим подходам и функциональным процедурам.Сохранение или восстановление функции мозга стало основной задачей нейрохирургической практики. Например, особые методы мониторинга, такие как моторно-вызванные потенциалы, рекомендуются при хирургии опухолей, расположенных в моторных областях коры или спинного мозга. В хирургии спинного мозга регистрация интраоперационных моторизованных потенциалов после электрической стимуляции спинного мозга возможна в условиях контролируемой нервно-мышечной блокады [3] . Постоянная степень нервно-мышечной блокады даже считается полезной для устранения двигательной активности пациента, которая может мешать хирургическому вмешательству, и для минимизации колебаний амплитуды вызванных ответов [3] .Что касается кортикальных моторно-вызванных потенциалов, частичная нервно-мышечная блокада не снижает латентный период, но может уменьшить амплитуду транскраниальных магнитно-моторно-вызванных ответов [4,5] . Однако интраоперационный мониторинг моторных вызванных ответов на прямую электрическую стимуляцию коры головного мозга в отсутствие нервно-мышечной блокады оказался выполнимым и надежным методом [6] . Интраоперационный мониторинг лицевого нерва во время операции на мостомозжечковом углу возможен при контролируемой нервно-мышечной блокаде [7] , но недавно сообщалось, что эти условия отрицательно влияют на послеоперационную функцию лицевого нерва [8] .Поскольку некоторая степень нервно-мышечной блокады может поставить под сомнение надежность электрофизиологического ответа во время операции и, следовательно, исход пациента, ее рекомендация в качестве стандарта анестезиологической техники в некоторых конкретных нейрохирургических процедурах представляется сомнительной. Краниотомия в сознании при хирургии эпилепсии или хирургии с участием красноречивой коры головного мозга, а также любая хирургическая процедура, проводимая у пациентов с седативным действием, очевидно, исключают использование миорелаксантов. Таким образом, появляется все больше свидетельств того, что некоторые традиционные и современные нейрохирургические методы не требуют или даже не исключают использования миорелаксантов в клинической анестезии.
Новый взгляд на классические концепции
В течение многих лет миорелаксанты считались неотъемлемой частью режима нейрохирургической анестезии, главным образом потому, что считалось, что они улучшают хирургические условия, не причиняя вреда мозгу. Нейрохирургические преимущества, ожидаемые от нервно-мышечной блокады, двояки: предотвращение кашля, движений и их потенциально пагубных последствий; и снижение внутричерепного давления за счет снижения внутригрудного и центрального венозного давления.Отсутствие какого-либо вредного воздействия объясняется тем фактом, что обычно считается, что миорелаксанты не проникают через гематоэнцефалический барьер и, следовательно, оказывают только косвенное воздействие на центральную нервную систему.
Отсутствие кашля и движений не обязательно гарантирует стабильное внутричерепное давление и расслабление мозга. Действительно, повышение внутричерепного давления, связанное с интубацией трахеи, может быть результатом гемодинамических модификаций, вызванных стимуляцией симпатической нервной системы.Хотя нервно-мышечная блокада может подавить кашель, она не гарантирует гемодинамической стабильности, которая сильно зависит от соответствующего уровня обезболивания и анестезии [2,9] . Движения, которые происходят во время операции в ответ на вредную стимуляцию, являются непроизвольными движениями отдергивания, возникающими в результате рефлексов спинного мозга. По словам Ланье и его коллег, повышение внутричерепного давления, которое сопровождает движения у интубированных пациентов, может возникать из-за двух дополнительных факторов: пассивной закупорки церебральных сосудов и активной церебральной вазодилатации [10] .Пассивный венозный застой отражает повышение центрального венозного давления, которое можно снизить, приподняв голову. Активная цереброваскулярная дилатация коррелирует с электромиографической активностью и опосредуется восходящими нервными путями, которые передают проприоцептивную информацию [10] . Если внутричерепная реакция устраняется миорелаксантами, она также в значительной степени и в первую очередь зависит от уровня обезболивания и анестезии. С другой стороны, хотя миорелаксанты снижают внутричерепное давление за счет снижения внутригрудного и центрального венозного давления, расслабление мозга может быть достигнуто с помощью различных лекарств и методов в отсутствие нервно-мышечной блокады.
Другое распространенное предположение, которое заслуживает переоценки, состоит в том, что недеполяризующие нервно-мышечные блокирующие препараты — из-за их высокой ионизации — не проникают через гематоэнцефалический барьер и оказывают лишь косвенное воздействие на центральную нервную систему. Фактически, тубокурарин был обнаружен в спинномозговой жидкости пациентов после однократной внутривенной инъекции [11] . Векуроний, атракурий и лауданозин, основной метаболит атракурия, также были обнаружены в спинномозговой жидкости у пациентов с сепсисом или субарахноидальным кровоизлиянием [12-15] .Таким образом, несколько сообщений свидетельствуют о том, что миорелаксанты действительно проникают через гематоэнцефалический барьер, по крайней мере, при определенных условиях, и могут напрямую влиять на центральную нервную систему. Сообщалось, что эти агенты вызывают вегетативную дисфункцию, слабость, длительную нервно-мышечную блокаду, судороги и гибель нейронов [16-20] . Похоже, что миорелаксанты могут иметь возбуждающее действие на центральную нервную систему, которое может быть результатом их взаимодействия с никотиновыми ацетилхолиновыми рецепторами мозга [21] .Было показано, что панкуроний и векуроний, но не атракуриум и лауданозин, вызывают повышение внутриклеточного кальция в кортикальных срезах, чему препятствуют низкие концентрации тубокурарина и фенитоин [21] . Chiodini и его коллеги сообщили, что атракурий и лауданозин, в отличие от панкурония и векурония, усиливают возбуждающую передачу и блокируют ингибирующую γ-аминомасляную кислоту A -опосредованные синаптические ответы в срезах гиппокампа [22] .Недавно они продемонстрировали, что атракурий и лауданозин взаимодействуют с разными типами нейрональных никотиновых рецепторов ацетилхолина в клинически значимых концентрациях [23] .
Факторы, влияющие на выбор миорелаксанта
Выбор миорелаксанта обычно определяется тремя типами факторов: абсолютными критериями идеального миорелаксанта, причиной, по которой требуется расслабление мышц, и некоторыми соображениями, связанными с пациентом и патологией.Абсолютные критерии идеального нервно-мышечного блокирующего препарата в основном включают недеполяризующий механизм действия, быстрое начало, короткую или промежуточную продолжительность действия, отсутствие органозависимого метаболизма или отсутствие метаболизма вообще, отсутствие кумулятивного эффекта, отсутствие необходимости в антагонизме или некоторая возможность «обратить вспять», отсутствие побочных эффектов и низкая стоимость. Согласно тому, что обсуждалось ранее, облегчение интубации трахеи, вероятно, является одной из основных причин использования миорелаксантов в нейрохирургической анестезии.В этой ситуации степень опасности, риск аспирации содержимого желудка и ожидание сложных условий интубации будут определять выбор миорелаксанта. Наконец, конкретные критерии, относящиеся к нейрохирургической анестезии, относятся к отсутствию взаимодействия с метаболизмом мозга, электрической активностью коры, церебральной гемодинамикой и внутричерепным давлением, а также с патологией пациента и терапевтическими средствами. Помимо потенциального возбуждающего эффекта, две основные проблемы миорелаксантов при нейрохирургической анестезии включают их влияние на церебральную гемодинамику и внутричерепное давление, а также специфические фармакодинамические изменения, связанные с патологией пациента и противосудорожной терапией.
Повышенная чувствительность к сукцинилхолину и некоторая степень устойчивости к недеполяризующим миорелаксантам довольно часто встречаются у нейрохирургических пациентов. Эти модификации могут отражать патологию, связанную с активацией рецепторов ацетилхолина, или могут наблюдаться у пациентов, получающих хроническую противосудорожную терапию. Повышение регуляции рецепторов ацетилхолина встречается при синдромах денервации, возникающих в результате прямых мышечных повреждений и повреждений нижних или верхних мотонейронов, но также может быть связано с иммобилизацией и атрофией [24] .С другой стороны, большинство противосудорожных средств обладают пре- и постсинаптическими эффектами, аналогичными недеполяризующим миорелаксантам [25] . Ингибируя пресинаптическое высвобождение ацетилхолина, уменьшая посттетаническую потенциацию и уменьшая потенциал концевой пластинки, они имитируют состояние хронической химической денервации, связанной с пролиферацией рецепторов ацетилхолина. Повышение регуляции в результате поражения верхних мотонейронов является обширным, тогда как реакция на противосудорожные препараты считается умеренной из-за слабого воздействия этих препаратов на нервно-мышечный переход [26] .В дополнение к фармакодинамическому механизму, резистентность к недеполяризующим миорелаксантам, вызванная хронической противосудорожной терапией, также может быть объяснена фармакокинетическими соображениями, которые включают как повышенный метаболизм в печени, так и клиренс за счет индукции специфических ферментов в системе цитохрома P450, а также повышенный связывание миорелаксантов с плазмой α 1 -кислый гликопротеин [27-30] . Было показано, что фенитоин и карбамазепин уменьшают высвобождение ацетилхолина в нервно-мышечном соединении и вызывают дозозависимое ингибирование потенциала концевой пластинки [31,32] .Эти эффекты имитируют состояние денервации, связанное с умеренной активацией рецепторов ацетилхолина, и подтверждают фармакодинамическую гипотезу. Напротив, Platt и Thackray показали, что чрезмерное повышение уровня калия в сыворотке после сукцинилхолина не происходит у пациентов с продемонстрированной резистентностью к векуронию при хронической терапии фенитоином, предполагая, что усиление регуляции рецепторов ацетилхолина является маловероятным механизмом [33] . Другой аргумент, подтверждающий фармакокинетический механизм, заключается в том, что карбамазепин и фенитоин являются мощными индукторами ферментов, метаболизирующих печень, и повышают плазменные уровни белков-реагентов острой фазы, которые являются сайтами связывания многих лекарств, включая миорелаксанты [27-30,34] .Было высказано предположение, что связывание с белками объясняет устойчивость крыс к атракурию [35] . Клиренс векурония увеличился вдвое у пациентов с эпилепсией, получающих хроническую терапию карбамазепином, по сравнению с контрольной группой [36] . Однако простой взаимосвязи между концентрацией фенитоина и индукцией цитохрома P450 или α 1 -кислого гликопротеина не обнаружено [29] . По словам Ханса и его коллег, индукция ферментов играет важную роль в ускоренном восстановлении после паралича недеполяризующими миорелаксантами у пациентов, получающих противосудорожную терапию, но нет корреляции между степенью резистентности и уровнем противосудорожных препаратов в плазме [37 ] .В настоящее время феномен устойчивости к недеполяризующим миорелаксантам у пациентов, получающих хроническую противосудорожную терапию, хорошо известен, но относительный вклад двух гипотетических механизмов, вовлеченных в этот процесс, еще предстоит выяснить.
Какой миорелаксант выбрать нейрохирургическим пациентам?
Сукцинилхолин в основном используется для облегчения интубации трахеи. Его обычно выбирают в экстренных ситуациях из-за его характеристик и потенциальных побочных эффектов, и обычно считается, что он увеличивает церебральный кровоток и внутричерепное давление.Предлагаемый механизм для этого увеличения — церебральный возбуждающий эффект, вызываемый активностью мышечного веретена, которая возникает в результате деполяризации нервно-мышечного соединения [38] . Повышение внутричерепного давления после введения сукцинилхолина наблюдалось у пациентов, находящихся под легким наркозом, и его можно предотвратить с помощью внутривенного введения лидокаина [39] , глубокой анестезии и дефасцикулирующей дозы недеполяризующих миорелаксантов [40,41] . Более того, некоторые исследования не продемонстрировали каких-либо значительных изменений церебрального перфузионного давления, внутричерепного давления и корковой электрической активности после введения сукцинилхолина пациентам с травмами головы на ИВЛ [42,43] .Также сообщалось, что влияние ларингоскопии и интубации трахеи на внутричерепное давление намного превышает влияние сукцинилхолина [42,44] . Следовательно, хотя есть абсолютные противопоказания к применению сукцинилхолина в анестезиологической практике, это лекарство не следует отменять в экстренных ситуациях, связанных с проходимостью дыхательных путей из-за проблем с внутричерепным давлением [42] . Другая потенциальная проблема заключается в том, что активация рецепторов ацетилхолина может быть ответственной за высвобождение калия и длительную нервно-мышечную блокаду после введения сукцинилхолина [45] .После травмы эта повышенная чувствительность к сукцинилхолину может начаться примерно через 3-4 дня после денервации, если поражено достаточное количество мышц, и достигает опасного уровня через 7-8 дней [46] . Феномен повышения регуляции считается более обширным, когда он возникает в результате повреждений и травм верхних мотонейронов, чем когда он возникает в ответ на хронические противосудорожные препараты [26] . Кроме того, недавно сообщалось, что основной причиной гиперкалиемии, вызванной сукцинилхолином, и остановки сердца является острый рабдомиолиз, а не повышенная регуляция. [47] .
Атракуриум, цисатракуриум, векуроний и рокуроний — недеполяризующие миорелаксанты средней продолжительности действия, которые можно использовать в нейрохирургической анестезии. Было показано, что цисатракурий, вводимый внутривенно болюсно, взрослым нейрохирургическим пациентам, находящимся на ИВЛ, приводит к меньшим церебральным и сердечно-сосудистым побочным эффектам по сравнению с эквипотентной дозой атракурия [48] . Векуроний и рокуроний не оказывают какого-либо влияния на внутричерепное давление, церебральное перфузионное давление и среднее артериальное давление у нейрохирургических пациентов, находящихся на ИВЛ, хотя рокуроний может спровоцировать небольшое, клинически не значимое увеличение частоты сердечных сокращений. [49] .Феномен устойчивости, наблюдаемый при синдромах денервации, может касаться всех недеполяризующих миорелаксантов независимо от их фармакологического семейства, но на практике это сопротивление варьируется в зависимости от степени усиления рецепторов ацетилхолина. Пациентам, страдающим очаговыми или полушарными поражениями, рекомендуется контролировать нервно-мышечную функцию на здоровой стороне, чтобы надлежащим образом оценить степень мышечного паралича и избежать переоценки потребности в лекарствах.Устойчивость к недеполяризующим миорелаксантам у пациентов, получающих хроническую противосудорожную терапию, наблюдалась с метокурином [30,50] , панкуронием [51] , векуронием [33,52,53] , доксакурием [54]. , пипекуроний [37,55] и рокуроний [56-59] . Сообщалось, что у атракурия более короткая продолжительность действия при эпилепсии, чем у неэпилептических пациентов [60] , в то время как хроническая терапия карбамазепином не влияет на время его начала и продолжительность действия [61] .Что касается цисатракурия, было показано, что начало и продолжительность нервно-мышечной блокады не зависят от противосудорожной терапии, но скорость выздоровления значительно выше [62] . Явление резистентности, по-видимому, меньше у атракуриума и цисатракурия, чем у стероидных недеполяризующих миорелаксантов, что способствует фармакокинетическому механизму. Тем не менее, объяснение, вероятно, не является исключительно фармакокинетическим, и относительная важность факторов может различаться в зависимости от основной патологии, продолжительности и типа противосудорожной терапии, а также задействованного миорелаксанта, включая его собственный метаболизм.Нейроанестезиологи должны иметь в виду, что фармакодинамика всех миорелаксантов может быть существенно изменена у нейрохирургических пациентов и что соответствующий мониторинг нервно-мышечной передачи является обязательным при точной оценке их эффекта на нервно-мышечном соединении.
Выводы
Использование миорелаксантов в нейрохирургической анестезии в основном регулируется неспецифическими показаниями. Если эти агенты могут быть полезны в определенных ситуациях, они также могут быть нежелательными или даже противопоказанными при других обстоятельствах, а иногда и неэффективными при обычных дозах.Основные преимущества миорелаксантов заключаются в том, что они облегчают интубацию трахеи и избегают последствий кашля и движений для внутричерепной динамики. Если расслабление мышц может помочь улучшить внутричерепные условия, это не освобождает анестезиологов от предоставления соответствующей анестезии и обезболивания, которые являются определяющими факторами расслабления мозга. Польза миорелаксантов должна быть сбалансирована с их потенциальным возбуждающим действием на центральную нервную систему, поскольку они действительно преодолевают гематоэнцефалический барьер при определенных обстоятельствах.Выбор миорелаксанта для нейрохирургической анестезии будет зависеть от причины, требующей расслабления мышц. За исключением экстренных ситуаций предпочтение отдается недеполяризующим препаратам короткой или средней продолжительности действия. Фармакодинамический профиль этих препаратов может быть изменен при синдромах денервации и у пациентов, находящихся на хронической противосудорожной терапии. Эти модификации поддерживают соответствующий мониторинг нервно-мышечной передачи, чтобы избежать переоценки требований к лекарствам и правильно оценить их влияние на нервно-мышечную функцию.
Список литературы
1. Дюрье М. Изменения в нейрохирургии: значение для нейроанестезии. Cur Opin Anaesthesiol 2001; 14: 467-468. 2. Стивенс Дж. Б., Уитли Л. Интубация трахеи у пациентов амбулаторной хирургии: использование ремифентанила и пропофола без миорелаксантов. Anesth Analg 1998; 86: 45-49. 3. Адамс Д.К., Эмерсон Р.Г., Хейер Э.Дж., и др. Мониторинг интраоперационных моторных вызванных потенциалов в условиях контролируемой нервно-мышечной блокады. Anesth Analg 1993; 77: 913-918. 4. Sloan TB, Erian R. Влияние нервно-мышечной блокады, вызванной векуронием, на корковые моторные вызванные потенциалы. Анестезиология 1993; 78: 966-973. 5. Sloan TB, Erian R. Влияние нервно-мышечной блокады, вызванной атракурием, на корковые моторно-вызванные потенциалы. Anesth Analg 1993; 76: 979-984. 6. Мартенс де Нордхаут А., Борн Дж. Д., Ханс П., Ремакл Дж. М., Делвейд П. Дж.Интраоперационная локализация первичной моторной коры с помощью одиночных электрических раздражителей. J Neurol Neurosurg Psychiatry 1996; 60: 442-444. 7. Леннон Р.Л., Хоскинг М.П., Даубе-младший, Велна Дж.О. Влияние частичной нервно-мышечной блокады на интраоперационную электромиографию у пациентов, перенесших резекцию акустических неврином. Anesth Analg 1992; 75: 729-733. 8. Чан К.Л., Чан МТВ, Гин Т., Лам М.К., Тонг М. Совместима ли нервно-мышечная блокада низкого уровня с интраоперационным мониторингом лицевого нерва? J Neurosurg Anesth 2001; 13: 375.9. Модика П.А., Темпельхофф Р. Внутричерепное давление во время индукции анестезии и интубации трахеи с подавлением импульса ЭЭГ, индуцированного этимидатом. Can J Anaesth 1992; 39: 236-241. 10. Ланье В.Л., Альбрехт Р.Ф. II, Лайццо П.А. Расхождение внутричерепного и центрального венозного давления у собак с легкой анестезией и интубацией трахеи, которые двигаются в ответ на вредный раздражитель. Анестезиология 1996; 84: 605-613.11. Маттео Р.С., Пуа Е.К., Хамбатта Х.Дж., Спектор С. Уровни d-тубокурарина в спинномозговой жидкости у человека. Анестезиология 1977; 46: 396-399. 12. Сегредо В., Маттей М.А., Шарма М.Л., Груенке Л.Д., Колдуэлл Дж. Э., Миллер Р.Д. Длительная нервно-мышечная блокада после длительного приема векурония у двух пациентов в критическом состоянии. Анестезиология 1990; 72: 566-570. 13. Эддлстон Дж. М., Харпер Н. Дж., Поллард Б. Дж., Эдвардс Д., Гвиннатт С. Л..Концентрации атракурия и лауданозина в спинномозговой жидкости и плазме при внутричерепных операциях. Br J Anaesth 1989; 63: 525-530. 14. Fahey MR, Canfell PC, Taboada T, Hosobuchi Y, Miller RD. Концентрация лауданозина в спинномозговой жидкости после введения атракурия. Br J Anaesth 1990; 64: 105-106. 15. Tassonyi E, Fuchs-Buder T., Chiodini FC, et al. Концентрация атракурия в спинномозговой жидкости у нейрохирургических пациентов. Br J Anaesth 1997; 78: A246. 16. Дашейфф Р.М. d-Тубокурарин вызывает гибель нейронов при введении непосредственно в мозг крысы. Exp Neurol 1985; 89: 172-188. 17. Goonewardene TW, Sentheshanmuganathan S, Kamalanathan S, Kanagasunderam R. Случайная субарахноидальная инъекция галламина. Отчет о болезни. Br J Anaesth 1975; 47: 889-893. 18. Месри С., Барадаран Дж. Случайная интратекальная инъекция триэтиодида галламина. Анестезия 1974; 29: 301-304. 19. Педуто В.А., Гунги П., Ди Мартино М.Р., Наполеоне М. Случайная субарахноидальная инъекция панкурония. Anesth Analg 1989; 69: 516-517. 20. Szenohradszky J, Trevor AJ, Bickler P, et al. Воздействие интратекальных миорелаксантов на центральную нервную систему у крыс. Anesth Analg 1993; 76: 1304-1309. 21. Cardone C, Szenohradszky J, Yost S, Bickler PE.Активация ацетилхолиновых рецепторов мозга нервно-мышечными блокаторами. Возможный механизм нейротоксичности. Анестезиология 1994; 80: 1155-1161. 22. Chiodini FC, Tassonyi E, Fuchs-Buder T., Fathi M, Bertrand D, Muller D. Эффекты нервно-мышечных блокаторов на передачу возбуждения и ингибирование, опосредованное гамма-аминомасляной кислотой A в срезе гиппокампа крысы. Анестезиология 1998; 88: 1003-1013. 23.Chiodini F, Charpantier E, Muller D, Tassonyi E, Fuchs-Buder T, Bertrand D. Блокада и активация никотиновых ацетилхолиновых рецепторов нейронов человека атракурием и лауданозином. Анестезиология 2001; 94: 643-651. 24. Мартин Дж. А., Уайт Д. А., Гронерт Г. А., Яффе Р. С., Уорд Дж. М.. Повышающая и понижающая регуляция ацетилхолиновых рецепторов скелетных мышц. Воздействие на нервно-мышечные блокаторы. Анестезиология 1992; 76: 822-843. 25.Рейнс А., Штандерт Ф.Г. Пре- и постсинаптические эффекты дифенилгидантоина на нервно-мышечном соединении камбаловидной мышцы кошки. J Pharmacol Exp Ther 1966; 153: 361-366. 26. Мелтон А. Т., Антонини Дж. Ф., Гронерт Г. А.. Длительная продолжительность приема сукцинилхолина у пациентов, получающих противосудорожные препараты: доказательства умеренной активации рецепторов ацетилхолина? Can J Anaesth 1993; 40: 939-942. 27. Кунцман Р. Лекарства и индукция ферментов. Annu Rev Pharmacol 1969; 9: 21-36. 28. Нейшн Р.Л., Эванс А.М., Милн Р.В. Фармакокинетические лекарственные взаимодействия с фенитоином (часть II). Clin Pharmacokinet 1990; 18: 131-150. 29. Abramson FP, Lutz MP. Влияние дозировки фенитоина на индукцию гликопротеина альфа-1-кислоты и клиренс антипирина у собак. Eur J Drug Metab Pharmacokinet 1986; 11: 135-143. 30.Ким С.С., Арнольд Ф.Дж., Итани М.С., Мартин Дж.А. Снижение чувствительности к метокурину во время длительной терапии фенитоином может быть связано с изменением связывания с белками и рецепторами ацетилхолина. Анестезиология 1992; 77: 500-506. 31. Alderdice MT, Trommer BA. Дифференциальные эффекты противосудорожных средств фенобарбитала, этосуксимида и карбамазепина на нервно-мышечную передачу. J Pharmacol Exp Ther 1980; 215: 92-96. 32.Гейдж П.В., Лонерган М., Торда Т.А. Пресинаптические и постсинаптические депрессивные эффекты фенитоина натрия в нервно-мышечном соединении. Br J Pharmacol 1980; 69: 119-121. 33. Platt PR, Thackray NM. Фенитоин-индуцированная устойчивость к векуронию. Anaesth Intensive Care 1993; 21: 185-191. 34. Кремер Дж. М., Уилтинг Дж., Янссен Л. Х. Связывание лекарств с гликопротеином альфа-1-кислоты человека при здоровье и болезнях. Pharmacol Rev 1988; 40: 1-47.35. Гарсия Э., Кальво Р., Родригес-Сасиайн Дж. М., Хименес Р., Трокониз И.Ф., Суарес Э. Устойчивость к атракурию у крыс с экспериментальным воспалением: роль связывания с белками. Acta Anaesthesiol Scand 1995; 39: 1019-1023. 36. Alloul K, Whalley DG, Shutway F, Ebrahim Z, Varin F. Фармакокинетическое происхождение индуцированной карбамазепином резистентности к нервно-мышечной блокаде векурония у анестезированных пациентов. Анестезиология 1996; 84: 330-339.37. Hans P, Ledoux D, Bonhomme V, Brichant JF. Влияние уровня антиконвульсантов в плазме на нервно-мышечную блокаду, вызванную пипекуронием: предварительные результаты. J Neurosurg Anesthesiol 1995; 7: 254-258. 38. Lanier WL, Iaizzo PA, Milde JH. Церебральная функция и афферентная активность мышц после внутривенного введения сукцинилхолина у собак, анестезированных галотаном: эффекты предварительной обработки дефаскикулирующей дозой панкурония. Анестезиология 1989; 71: 87-95.39. Хэмилл Дж. Ф., Бедфорд Р. Ф., Уивер округ Колумбия, Колохан А. Р.. Лидокаин перед интубацией трахеи: внутривенно или ларинготрахеально? Анестезиология 1981; 55: 578-581. 40. Минтон, доктор медицины, Гросслайт К., Стирт Дж., Бедфорд РФ. Повышение внутричерепного давления из-за сукцинилхолина: профилактика предварительной недеполяризующей блокадой. Анестезиология 1986; 65: 165-169. 41. Стирт Дж. А., Гросслайт К. Р., Бедфорд Р. Ф., Воллмер Д.«Дефасцикуляция» метокурином предотвращает вызванное сукцинилхолином повышение внутричерепного давления. Анестезиология 1987; 67: 50-53. 42. Коварик В.Д., Майберг Т.С., Лам А.М., Матисен Т.Л., Винн Х.Р. Сукцинилхолин не изменяет внутричерепное давление, скорость мозгового кровотока или электроэнцефалограмму у пациентов с неврологической травмой. Anesth Analg 1994; 78: 469-473. 43. Браун М.М., Парр М.Дж., Манара А.Р. Влияние суксаметония на внутричерепное давление и церебральное перфузионное давление у пациентов с тяжелыми травмами головы после тупой травмы. евро J Anaesthesiol 1996; 13: 474-477. 44. Burney RG, Winn R. Повышенное давление спинномозговой жидкости во время ларингоскопии и интубации для индукции анестезии. Anesth Analg 1975; 54: 687-690. 45. Гронерт Г.А., Хи Р.А. Патофизиология гиперкалиемии, вызванной сукцинилхолином. Анестезиология 1975; 43: 89-99. 46. Джон Д.А., Тоби Р.Э., Гомер Л.Д., Райс К.Л. Начало гиперкалиемии, вызванной сукцинилхолином, после денервации. Анестезиология 1976; 45: 294-299. 47. Gronert GA. Остановка сердца после сукцинилхолина: смертность выше при рабдомиолизе, чем при активации рецепторов. Анестезиология 2001; 94: 523-529. 48. Schramm WM, Papousek A, Michalek-Sauberer A, Czech T., Illievich U. Церебральные и сердечно-сосудистые эффекты цисатракурия и атракурия у нейрохирургических пациентов. Anesth Analg 1998; 86: 123-127.49. Шрамм В.М., Штрассер К., Бартунек А., Гилли Х., Списс С.К. Влияние рокурония и векурония на внутричерепное давление, среднее артериальное давление и частоту сердечных сокращений у нейрохирургических пациентов. Br J Anaesth 1996; 77: 607-611. 50. Орнштейн Э, Маттео Р.С., Янг В.Л., Диас Дж. Устойчивость к нервно-мышечной блокаде, вызванной метокурином, у пациентов, получающих фенитоин. Анестезиология 1985; 63: 294-298. 51.Хики Д.Р., Сангван С., Беван Дж. Фенитоин-индуцированная устойчивость к панкуронию. Использование настоя атракурия в ведении нейрохирургического больного. Анестезия 1988; 43: 757-759. 52. Орнштейн Э, Маттео Р.С., Шварц А.Е., Сильверберг П.А., Янг В.Л., Диас Дж. Влияние фенитоина на величину и продолжительность нервно-мышечной блокады после атракурия или векурония. Анестезиология 1987; 67: 191–196. 53. Whalley DG, Ebrahim Z.Влияние карбамазепина на дозозависимую зависимость векурония. Br J Anaesth 1994; 72: 125-126. 54. Орнштейн Э, Маттео Р.С., Вайнштейн Дж. А., Халеви Дж. Д., Янг В. Л., Абу-Дония М. М.. Ускоренное восстановление после нервно-мышечной блокады, вызванной доксакуриумом, у пациентов, получающих хроническую противосудорожную терапию. J Clin Anesth 1991; 3: 108-111. 55. Джеллиш В.С., Модика П.А., Темпельхофф Р. Ускоренное выздоровление от пипекурония у пациентов, получавших хроническую противосудорожную терапию. J Clin Anesth 1993; 5: 105-108. 56. Дриссен JJ, Робертсон EN, Booij LH, Vree TB. Ускоренное выздоровление и избавление от рокурония у пациента с терминальной почечной недостаточностью, получающего хроническую противосудорожную терапию с вальпроатом натрия и примидоном. Br J Anaesth 1998; 80: 386-388. 57. Spacek A, Nickl S, Neiger FX, et al. Усиление нервно-мышечной блокады, вызванной рокуронием, с помощью остро вводимого фенитоина. Анестезиология 1999; 90: 1551-1555. 58. Сориано С.Г., Каус С.Дж., Салливан Л.Дж., Мартин Дж.А. Начало и продолжительность действия рокурония у детей, получающих хроническую противосудорожную терапию. Педиатр Анаест 2000; 10: 133-136. 59. Hernandez-Palazon J, Tortosa JA, Martinez-Lage JF, Perez-Ayala M. Нервно-мышечная блокада, вызванная рокурониумом, нарушается хронической терапией фенитоином. J Neurosurg Anesthesiol 2001; 13: 79-82.60. Tempelhoff R, Modica PA, Jellish WS, Spitznagel EL. Устойчивость к нервно-мышечной блокаде, вызванной атракуриумом, у пациентов с трудноизлечимыми судорожными расстройствами, получавших противосудорожные препараты. Anesth Analg 1990; 71: 665-669. 61. Спейсек А., Нейгер Ф.Х., Списс С.К., Кресс Х.Г. На нервно-мышечную блокаду, вызванную атракуриумом, не влияет хроническая противосудорожная терапия карбамазепином. Acta Anaesthesiol Scand 1997; 41: 1308-1311.62. Koenig MH, Edwards LT. Цисатракуриум-индуцированная нервно-мышечная блокада у нейрохирургических пациентов, леченных противосудорожными препаратами. J Neurosurg Anesthesiol 2000; 12: 314-318.Продолжительность анестезии перед инъекцией миорелаксанта влияет на уровень паралича | Анестезиология
Рекомендации по ДОЗИРОВКЕ для нервно-мышечных блокаторов основаны на исследованиях зависимости реакции от дозы. Известно, что на взаимосвязь «доза-ответ» влияет несколько факторов, таких как характер и продолжительность нервной стимуляции, продолжительность стабилизации контрольных ответов и присутствие ингаляционных агентов.1 Для этой цели золотым стандартом считается период в несколько минут стабильной анестезии для обеспечения стабилизации сигнала с помощью тиопентала или пропофола и закиси азота. 1 Предполагается, что продолжительность анестезии (, т. Е. , для стабилизации сигнала) и введение закиси азота не влияют на нервно-мышечный переход. Однако это предположение не было подтверждено на людях.
Миорелаксанты, используемые для облегчения интубации трахеи, обычно вводятся сразу после индукции анестезии, а не после нескольких минут анестезии.Начальная доза для обеспечения глубокого паралича, необходимого для интубации трахеи, оценивается в 2-3 раза превышающей ED 95 , измеренную в области приводящего большого пальца, и эти измерения выполняются после нескольких минут анестезии. 2 Потребность в большой дозе интубации обычно объясняется повышенной дозой, необходимой для блокирования мышц гортани, по сравнению с приводящей глоткой. 3Kirkegaard-Nielsen et al. 4 продемонстрировал, что доза рокурония, которая дает 95% вероятность успешной интубации через 60 с, равна 1.04 мг / кг, что более чем в 3 раза превышает ED 95 в области аддуктора большого пальца (0,3 мг / кг). 5 Совсем недавно Plaud et al. 6 продемонстрировал, что оценка блокады приводящей мышцы гортани может быть получена количественно путем измерения акселеромиографического ответа на мышце corrugator supercilii. Закись азота рекомендуется как часть анестетика для измерения доза-эффект, 1 но исследования показали, что он усиливает нейромышечную блокаду векурония 7 и сукцинилхолина 8.
Следовательно, важно определить влияние продолжительности анестезии перед введением миорелаксантов, с закисью азота или без нее (N 2 O), на реакцию на эти препараты. Это исследование было разработано для измерения начала и интенсивности нервно-мышечной блокады, вызванной мивакуриумом, как в мышцах, приводящих большой палец, так и в мышцах corrugator supercilii сразу после индукции анестезии, через 15 минут анестезии без N 2 O и после такой же продолжительности. анестезии с N 2 О.
Исследование было одобрено Комитетом по научным обзорам Госпитального центра Монреаля и Комитетом по этике исследований (Монреаль, Квебек, Канада). Тридцать пациентов с физическим статусом I Американского общества анестезиологов в возрасте 18–56 лет были включены в исследование после получения информированного согласия. Пациентам были назначены плановые и негеморрагические операции (небольшие ортопедические процедуры или диагностические гинекологические лапароскопии).У всех пациентов не было сердечно-сосудистых, печеночных, почечных или нервно-мышечных заболеваний. Они не принимали никаких препаратов, предположительно влияющих на нервно-мышечную передачу или сердечно-сосудистую систему. Критерии исключения включали в себя гастроэзофагеальный рефлюкс в анамнезе, предполагаемое нарушение дыхательных путей, подозрение на аллергию на миорелаксанты и массу тела более 120% от идеальной. По прибытии в операционную в правую переднекубитальную ямку поместили внутривенный катетер для введения жидкости и лекарств.Неинвазивно контролировали пульсоксиметрию, электрокардиограмму и артериальное давление. Через 3 мин преоксигенацию через анестезию с лицевой маской индуцировали 40 мкг / кг альфентанила и 2,5 мг / кг пропофола через 30 с. Затем поддерживали анестезию 10 мг · кг -1 · ч -1 пропофола и 1,0 O 2 или 10 мг · кг -1 · ч -1 пропофола и 0,7 N 2 O. –0,3 O 2 . Скорость инъекции пропофола регулировали для поддержания гемодинамической стабильности, определяемой как относительное отклонение на 20% от контрольного значения ( e.грамм. , до введения анестезии) среднего артериального давления. Дыхательные пути ларингеальной маски вводили под глубокой анестезией без помощи нервно-мышечных блокирующих препаратов. Легкие вентилировались механически, чтобы поддерживать давление углекислого газа в конце выдоха в пределах 35–40 мм рт. Внутреннюю температуру контролировали и поддерживали на нормальном уровне. 9 Через 10 мин непрерывная инфузия пропофола снизилась до 8 мг · кг -1 · ч -1 . 10
Пациенты были случайным образом разделены на три группы.В группе А (n = 10) пациенты получали мивакурий 0,1 мг / кг сразу после потери сознания. Потеря сознания определялась как невосприимчивость к вербальным и тактильным раздражителям. 11 В группе B (n = 10) пациенты получали мивакурий 0,1 мг / кг через 15 мин стабильной анестезии только пропофолом. В группе C (n = 10) пациенты получали мивакуриум в дозе 0,1 мг / кг после 15 минут стабильной анестезии пропофолом и N 2 О. На рисунке 1 показана процедура анестезии и время введения мивакурия для каждой группы.
Рис. 1. Время проведения анестезии и введения мивакурия. Время в минутах. A, B или C обозначают группу A, B или C.
Рис. 1. Время проведения анестезиологической процедуры и инъекции мивакурия. Время в минутах. A, B или C обозначают группу A, B или C.
Нервно-мышечный мониторинг был установлен до индукции анестезии.Поверхностные электроды помещали над левой височной ветвью лицевого нерва в наружной части надбровной дуги для стимуляции надбровных дуг. 6 Еще одна пара электродов накладывалась на левый локтевой нерв на запястье, чтобы получить реакцию приводящего большого пальца. Вызванные реакции на большом пальце и в надсушках морщин измеряли с помощью акселеромиографов TOF-Guard ® (Organon-Teknika, Fresnes, France). Каждый зонд помещали на дистальную вентральную часть большого пальца левой руки и на внутреннюю половину левой надбровной дуги (corrugator supercilii) перед введением анестезии.Оба нерва стимулировали сверхмаксимально с помощью последовательной стимуляции (четыре импульса длительностью 0,2 мс, с частотой 2 Гц, длительностью 2 с) каждые 15 с. Типичная сила тока составляла 20 мА для лицевого нерва и 40 мА для локтевого нерва. Из-за слабого отклика надтипа гофроагрегата сигнал от датчика ускорения был усилен в 5 раз. Базовое измерение нервно-мышечной реакции было получено сразу после потери ресничного рефлекса в каждой группе и состояло только из двух последовательностей из четырех стимуляций для обеих мышц.Чтобы избежать мешающего эффекта различной продолжительности базовой стимуляции на нервно-мышечную блокаду, стимуляцию снова начинали только при инъекции мивакурия. Нервно-мышечный мониторинг продолжали до достижения максимальной нервно-мышечной блокады первого сокращения (Т1) в обеих мышцах, что определялось тремя равными последовательными Т1.
Все нервно-мышечные параметры были определены в соответствии с «надлежащей клинической исследовательской практикой в фармакодинамических исследованиях нервно-мышечных блокаторов».«1 Время задержки представляло собой интервал между введением рокурония и первым уменьшением T1. Если была достигнута субмаксимальная нервно-мышечная блокада (T1 <95%), время начала определялось как время, прошедшее между началом инъекции миорелаксанта и первым из трех последовательных T1 с той же амплитудой. Если максимальная депрессия T1 составляла от 95 до 100%, время начала определялось как время до 95% депрессии T1.
Характеристики пациентов представлены в таблице 1.Все были женщинами. Три группы существенно не различались по возрасту, весу или росту. Среднее время (диапазон) до потери сознания составляло 44 (21–65), 47 (25–70) и 43 (20–63) секунды в группах A, B и C соответственно. Динамика нервно-мышечной блокады аддуктора большого пальца и надстройки мускулатуры показана на рисунках 2 и 3, соответственно. Максимальная нервно-мышечная блокада была значительно меньше, когда мивакуриум вводили сразу после индукции (группа A), чем в группах B и C, как на приводящую мышцу большого пальца, так и на мышцы надбровной мышцы (таблицы 2 и 3).При той же продолжительности анестезии введение закиси азота (C) увеличивало максимальную блокаду по сравнению с группой B в обеих мышцах, но разница достигла статистической значимости только для приводящей мышцы большого пальца (таблицы 2 и 3). После 0,1 мг / кг мивакурия время для достижения максимальной нервно-мышечной блокады в мышцах, приводящих большой палец и надциркульных мышцах, не различалось в трех группах (таблицы 2 и 3, фиг. 2 и 3).
Таблица 1.Характеристики пациента
Значения выражены как среднее ± стандартное отклонение (диапазон). Нет различий между каждой группой по возрасту, весу и росту (односторонний дисперсионный анализ, все переменные имеют нормальное распределение).
Рис. 2. Характеристики начала (средний% T1 в зависимости от времени) после 0,1 мг / кг мивакурия на аддукторном поллице. Мивакуриум вводили либо сразу после потери сознания (группа А; сплошная линия), либо через 15 минут стабильной анестезии пропофол-кислородом 1.0 (группа B; пунктирная линия) или пропофол-закись азота 0,7-кислород 0,3 (группа C; пунктирная линия). Точки на каждой линии представляют слева направо T1 и время до последнего 100% значения (запаздывание), T1 и время до 50, 75, 95 и 100% максимальной блокады, соответственно.
Рис. 2. Характеристики начала (средний% T1 в зависимости от времени) после 0,1 мг / кг мивакурия на аддукторном поллице. Мивакуриум вводили либо сразу после потери сознания (группа А; сплошная линия), либо через 15 минут стабильной анестезии пропофол-кислородом 1.0 (группа B; пунктирная линия) или пропофол-закись азота 0,7-кислород 0,3 (группа C; пунктирная линия). Точки на каждой линии представляют слева направо T1 и время до последнего 100% значения (запаздывание), T1 и время до 50, 75, 95 и 100% максимальной блокады, соответственно.
Рис. 3. Характеристики начала (средний% T1 в зависимости от времени) после 0,1 мг / кг мивакуриума на supercilii corrugator. Мивакуриум вводили либо сразу после потери сознания (группа А; сплошная линия), либо через 15 минут стабильной анестезии пропофол-кислородом 1.0 (группа B; пунктирная линия) или пропофол-закись азота 0,7-кислород 0,3 (группа C; пунктирная линия). Точки на каждой линии представляют слева направо T1 и время до последнего 100% значения (запаздывание), T1 и время до 50, 75, 95 и 100% максимальной блокады, соответственно.
Рис. 3. Характеристики начала (средний% T1 в зависимости от времени) после 0,1 мг / кг мивакурия в надстройках гофрировки. Мивакуриум вводили либо сразу после потери сознания (группа А; сплошная линия), либо через 15 минут стабильной анестезии пропофол-кислородом 1.0 (группа B; пунктирная линия) или пропофол-закись азота 0,7-кислород 0,3 (группа C; пунктирная линия). Точки на каждой линии представляют слева направо T1 и время до последнего 100% значения (запаздывание), T1 и время до 50, 75, 95 и 100% максимальной блокады, соответственно.
Таблица 2. Время начала и максимальная блокада после 0,1 мг / кг мивакурия на Adductor Pollicis
Значения выражены как среднее ± стандартное отклонение; медиана (диапазон).Время задержки и время начала не различались между тремя группами: P = 0,896 и 0,525, соответственно.
* P <0,001 по сравнению с группами B и C (критерий Стьюдента-Ньюмана-Кеулса после одностороннего дисперсионного анализа рангов Краскела-Уоллиса).
† P <0,001 по сравнению с группой C (критерий Стьюдента-Ньюмана-Кеулса после одностороннего дисперсионного анализа рангов Краскела-Уоллиса).
Таблица 3.Время наступления и максимальная блокада после 0,1 мг / кг мивакурия на Corrugator Supercilii
Значения выражены как среднее ± стандартное отклонение; медиана (диапазон). Время начала заболевания в трех группах не различалось: P = 0,373.
* P = 0,014 по сравнению с в группе B (критерий Стьюдента-Ньюмана-Кеулса после одностороннего дисперсионного анализа рангов Краскела-Уоллиса).
† P <0,001 по сравнению с группами B и C (критерий Стьюдента-Ньюмана-Кеулса после одностороннего дисперсионного анализа рангов Краскела-Уоллиса).
Внутри каждой группы не было обнаружено различий во времени задержки между adductor pollicis и corrugator supercilii (таблицы 2 и 3). Тем не менее, время начала было короче в надбровных дугах, чем в аддукторах, для трех групп ( P <0,001). Максимальная нервно-мышечная блокада была меньше в области corrugator supercilii, чем в мышцах adductor pollicis в группах A, B и C, но достигла статистической значимости только в группах A и C ( P <0.001).
Это исследование показывает, что продолжительность анестезии перед инъекцией миорелаксанта увеличивает вызванную мивакурием нервно-мышечную блокаду. Это наблюдалось как на приводящей большой мышце, так и на мышцах надбровных дуг. Добавление закиси азота к пропофолу дополнительно увеличивает степень паралича аддуктора большого пальца при введении мивакурия после 15 минут стабильной анестезии.
Характер и продолжительность стимуляции нерва могут влиять на время начала в области приводящего большого пальца 13–15, поэтому обе эти переменные были одинаковыми (последовательность из четырех каждые 15 с) для приводящего большого пальца и верхних валиков гофрировки.Во всех трех группах количество стимуляций перед введением мивакуриума было одинаковым. Руководящие принципы надлежащей клинической практики в фармакодинамических исследованиях нервно-мышечных блокаторов 1, где рекомендуется период стабилизации сигнала, не могли быть соблюдены здесь, потому что гипотеза требовала, чтобы мивакуриум вводился сразу после индукции, чтобы имитировать клиническую практику. Однако всех пациентов лечили одинаково, с одним и тем же типом стимуляции, с одинаковым интервалом между стимуляциями и с одинаковым количеством стимуляций перед инъекцией релаксанта.
В этом исследовании наблюдали за двумя мышцами, adductor pollicis и corrugator supercilii, чтобы исключить какой-либо эффект, специфичный для adductor pollicis. Для обеих мышц использовался один и тот же метод нервно-мышечного мониторинга (, например, , акселеромиография). Обе мышцы вели себя одинаково, то есть блокада сразу после введения анестезии была меньше, чем через 15 мин. Во всех группах блокада в области надциркуляционной мышцы была меньше, чем у приводящей мышцы большого пальца (таблицы 2 и 3), что в соответствии с предыдущим исследованием 6, где рокуроний использовался в качестве миорелаксанта.Было обнаружено, что течение блокады схожи в надцирно-гофре и аддукторных мышцах гортани, 6 поэтому разумно предположить, что результаты этого исследования могут быть применимы к мышцам гортани. Corrugator supercilii не следует путать с orbicularis oculi. Несмотря на анатомическую близость, блокада orbicularis oculi больше и продолжительность меньше, чем у corrugator supercilii. 6
Эффект закиси азота на нервно-мышечную блокаду не определен, 1 но зарегистрировано усиление нейромышечной блокады, вызванной векурония-7 и сукцинилхолином.Настоящее исследование подтверждает эти результаты для мивакуриума, поскольку максимальная блокада приводящего большого пальца в группе B была значительно меньше, чем в группе C (таблица 2, фиг. 2). Разница не была значимой для corrugator supercilii (таблица 3, рис. 3), вероятно, из-за большей вариабельности и небольшого количества пациентов. Различия в средней максимальной блокаде составляли 15 и 12% в мышцах приводящей мышцы и надциркульной мускулатуры, соответственно, что согласуется с 20% -ным увеличением активности векурония, связанного с закисью азота, сообщенным Fiset et al. 6 Основным различием между этими двумя исследованиями было время воздействия закиси азота 5 против 15 мин. При моделировании (программа Gas Man ® , версия 2.1.1, Understanding Anesthesia Uptake and Distribution, под редакцией Philip JH, Chestnut Hill, MA, Med Man Simulations) насыщенность мышечной ткани закисью азота составляла всего 0,1 и 0,3 от псевдоплато в исследовании Fiset и в нашем, соответственно. Это указывает на то, что усиление закиси азота в нервно-мышечном соединении маловероятно.Таким образом, эффект закиси азота лучше всего объясняется изменением доставки лекарства из-за гемодинамических изменений.
Гемодинамические эффекты внутривенных анестетиков влияют на время наступления. Снижение сердечного выброса 17,18 и / или увеличение мышечного кровотока 18,19 может увеличить максимальную нервно-мышечную блокаду. Усиленная нервно-мышечная блокада, наблюдаемая после 15 минут стабильной анестезии одним пропофолом, может быть результатом снижения сердечного выброса и увеличения периферической вазодилатации.20 Недавно было обнаружено, что сердечный выброс влияет на фармакокинетико-фармакодинамические отношения рокурония. 17 Вопреки тому, что можно было предположить, снижение сердечного выброса обычно снижает дозу, необходимую для данного эффекта, из-за более высокого и широкого пика начальной концентрации. 21Mivacurium, введенный при индукции, может вызвать меньшую блокаду, поскольку он вводится до того, как проявятся депрессивные гемодинамические эффекты пропофола. Для подтверждения этого предположения необходимы фармакокинетико-фармакодинамические анализы.
Mivacurium был выбран для этого исследования, потому что условия интубации, указанные при 0,15 мг / кг, то есть вдвое больше ED 95 0,07–0,08 мг / кг 12, намного хуже, чем ожидалось. Была выбрана доза 0,1 мг / кг, поскольку ожидалось, что она обеспечит приблизительно 95–100% нервно-мышечную блокаду аддуктора pollicis с помощью О-опиоидной анестезии N 2 . 22 Если, как ожидалось, эффект был меньше сразу после индукции анестезии и в области приводящей мышцы, максимальная блокада, вероятно, была бы в диапазоне 1–95%, и ее можно было бы измерить.Среднее значение 99%, полученное при взводе аддуктора, совместимо с ED 95 между 0,07 и 0,08 мг / кг, как сообщалось в других исследованиях. 12
Исследование включало введение однократной дозы вместо проведения исследования полной доза-эффект. Выбранная доза 0,1 мг / кг должна была дать измеримую степень блокады, то есть во всех ситуациях избегали значений 0% и 100%. Хотя точное значение ED 95 не может быть получено, оценки могут быть сделаны при опросе приводящих мышц.В группе B (анестезия без N 2 O) средний блок составил 84% после 0,1 мг / кг. Отсюда следует, что без N 2 O ED 95 (доза, дающая в среднем 95% блокировку) превышает 0,1 мг / кг. Когда мивакуриум вводят сразу после потери сознания, средняя максимальная блокада составляет 76% в области приводящей мышцы. Это указывает на еще больший ED 95 . Если предположить, что коэффициент наклона кривых доза-реакция равен 4, то ED 95 в области аддуктора может быть приблизительно 0.14 мг / кг во время анестезии без N 2 O и 0,16 мг / кг сразу после индукции анестезии, что выше принятых значений 0,07–0,08 мг / кг, полученных при стабильной анестезии с N 2 O.
Исследование проводилось на двух мышцах, расположенных в двух разных местах, чтобы исключить какое-либо локальное влияние, например кровоток, на приводящий большой палец. Кроме того, особое значение имеет corrugator supercilii, поскольку он является хорошим индикатором блокады гортани.6 Во всех трех группах настоящего исследования блокада была заметно меньше в области corrugator supercilii, чем в adductor pollicis, а длительность анестезии увеличивала блокаду обеих мышц. Максимальная блокада составляла только 30% в надбровных дугах сразу после индукции анестезии, что позволяет предположить, что ED 50 превышает 0,10 мг / кг, а ED 95 еще больше. Это объясняет, почему высокий процент отличных условий интубации не достигается, если доза мивакуриума не достигает 0.25 мг / кг.
Сделан вывод о том, что продолжительность анестезии перед инъекцией мивакуриума имеет большое влияние на уровень паралича как в области приводящей мышцы большого пальца, так и в области надбровных дуг. Закись азота также усиливает нервно-мышечную блокаду приводящей мышцы. Эти результаты имеют большое значение. Исследования «доза-реакция», проведенные под стабильной анестезией N 2 O-опиоидами, вероятно, занижают ED 95 , применяемую сразу после индукции.Это объясняет, по крайней мере частично, почему может потребоваться многократное введение ED 95 в аддукторный поллизис под стабильной анестезией пропофол-опиоид-N 2 O для получения отличных условий интубации.
требований к мышечным релаксантам при радикальной ретропубической простатэктомии | Анестезиология
НЕДЕПОЛЯРИЗИРУЮЩИЕ миорелаксанты обычно используются во многих процедурах в современной анестезиологической практике.Показания для их использования значительно расширились по сравнению с первоначальной целью обеспечения адекватной мышечной релаксации для облегчения хирургического вмешательства для выбранных хирургических процедур. В частности, они часто используются для обеспечения неподвижности пациента вместо более высоких доз общих анестетиков и, действительно, могут быть эффективны для этой цели. Однако, как и любое лекарство, их использование сопряжено с риском. Помимо различного воздействия некоторых агентов на другие системы органов при кратковременном применении, длительные эффекты в послеоперационном периоде могут привести к легочным осложнениям.1 Кроме того, случаи интраоперационной осведомленности имели место у пациентов, получающих миорелаксанты, которые не могут двигаться в ответ на хирургическую стимуляцию. 2,3 Некоторые исследователи полагают, что для минимизации возможности осознания следует избегать мышечного паралича, кроме случаев крайней необходимости. 4,5
Таким образом, кажется важным определить четкие показания к применению этих агентов. Однако имеется на удивление мало информации о фактических требованиях к этим агентам для обеспечения адекватного хирургического воздействия для таких процедур, как внутрибрюшная хирургия.Хотя нет никаких сомнений в том, что фармакологический паралич может устранить тонус мышц живота, неясно, требуется ли паралич в повседневной практике для обеспечения адекватных хирургических условий у пациентов, которые получают адекватную анестезию с использованием современных методов. Сами по себе летучие анестетики вызывают расслабление мышц. 6 Есть также свидетельства того, что у животных, подвергнутых адекватной анестезии, лапаротомия фактически подавляет активацию брюшных мышц, 7 — действие, которое должно способствовать хирургическому вмешательству. Если многим пациентам без миорелаксантов могут быть обеспечены адекватные хирургические условия, их обычное применение может быть не показано.
Целью данного исследования было проверить гипотезу о том, что векуроний снижает частоту возникновения неприемлемых операционных условий, по оценке хирургов, у пациентов, перенесших радикальную позадилонную простатэктомию (RRP), которые получают анестезию изофлураном и фентанилом. Эта гипотеза была проверена с использованием рандомизированного слепого плацебо-контролируемого дизайна. Вторичной целью было определение частоты, с которой можно было достичь адекватных хирургических условий без использования миорелаксантов у этих пациентов.
Протокол исследования был одобрен наблюдательным советом учреждения (клиника Мэйо, Рочестер, Миннесота), и от зарегистрированных пациентов было получено письменное информированное согласие. В исследуемую популяцию входили пациенты мужского пола, с физическим статусом I или II Американского общества анестезиологов, в возрасте от 18 до 70 лет, которым была назначена РРП. Пациенты были исключены, если у них были противопоказания к любому элементу протокола анестезиологического исследования ( e.грамм. , злокачественная гипертермия в анамнезе).
После включения в исследование пациенты были случайным образом распределены в одну из двух терапевтических групп с использованием компьютерной схемы рандомизации. Бригада анестезиолога, состоящая из врача-анестезиолога или сертифицированной медсестры-анестезиолога и лечащего анестезиолога, отвечала за клиническое лечение пациента в течение периода исследования. Эта команда и весь другой персонал, оказывающий клиническую помощь, включая хирургов, не знали о групповом назначении на протяжении всего исследования.Бригада анестезиологов несла основную ответственность за безопасность пациентов и могла принять решение о прекращении участия пациента в исследовании в любое время. Второй анестезиолог выполнял функции исследователя.
Примененыстандартных мониторов, получен внутривенный доступ. Все пациенты получали преоксигенацию перед индукцией, которая выполнялась фентанилом 3–5 мкг / кг, затем тиопенталом натрия 4 мг / кг и 1.5 мг / кг сукцинилхолина для облегчения интубации трахеи. После интубации легкие механически вентилировали смесью воздух: кислород 50:50. Пациенты были вентилированы для достижения целевого парциального давления углекислого газа в конце выдоха менее 30 мм рт. Ст., Чтобы минимизировать спонтанное движение диафрагмы. Изофлуран вводили в концентрации на вдохе, достаточной для достижения концентрации в конце выдоха, равной 1 минимальной альвеолярной концентрации (1,2%) к моменту разреза, и для поддержания, по крайней мере, этой концентрации на протяжении всей процедуры.Также поддерживалась непрерывная инфузия фентанила в количестве 2 мкг · кг -1 · ч -1 . Снижение систолического артериального давления более чем на 30% ниже предоперационных значений или менее 90 мм рт.ст. лечилось жидкими болюсными дозами 250 мл кристаллоида и / или 10 мг эфедрина внутривенно. После разреза концентрация изофлурана может быть скорректирована по усмотрению анестезиолога с целью поддержания концентрации в конце выдоха не менее 1,2%. Пациенты, у которых была выраженная гемодинамическая или двигательная реакция на хирургический стимул, лечились дополнительными болюсными дозами фентанила (1 мкг / кг) и / или повышением вдыхаемой концентрации изофлурана по усмотрению анестезиологической бригады.
После интубации исследователь прикрепил тензодатчик (Grass FT-03, Quincy, MA) к большому пальцу правой руки, чтобы измерить силовую реакцию мышцы adductor policis в ответ на максимальную стимуляцию локтевого нерва в соответствии со стандартными методами. 8 Ответ на стандартную последовательность из четырех (TOF) стимулов (2 Гц) регистрировался с 1-минутными интервалами на протяжении всей процедуры. И бригада анестезиологов, и бригада хирургов не заметили этой оценки, закрыв руку.Во всех случаях к моменту хирургического разреза кожи (не менее 15 мин после интубации) присутствовали четыре сильных подергивания, что указывает на исчезновение эффекта сукцинилхолина.
После разреза брюшной фасции через разрез по нижней средней линии, исследователь попросил хирурга дать оценку операционного поля с использованием числовой шкалы 1–4. Поле степени 1 (отлично) — это поле, при котором нижняя часть живота расслаблена, и хирургическое вмешательство было легко выполнено.Поле степени 2 (хорошо) — это поле, при котором расслабление живота и хирургическое вмешательство были адекватными, но не оптимальными. Поле степени 3 (приемлемое) — это поле, в котором получить экспозицию было умеренно сложно, но приемлемо. Поле степени 4 (плохое) — это поле, в котором хирургическое вмешательство было неприемлемо для хирурга из-за тонуса мышц живота или диафрагмы.
После этой оценки операционного поля пациенту была введена болюсная доза физиологического раствора (0.1 мл / кг, группа плацебо) или векурония (0,1 мг / кг, группа векурония) исследователем (рис. 1). Через пять минут после введения этой болюсной дозы исследователь попросил хирурга еще раз оценить операционное поле и начал инфузию физиологического раствора или векурония. Для векурония начальная доза составляла 1 мкг · кг -1 · мин -1 и титровалась для достижения одного подергивания или менее в ответ на стимуляцию TOF, состояние, которое, как считается, обеспечивает адекватное хирургическое расслабление мышц в соответствии со стандартной практикой.8 Для нормального физиологического раствора исследователь произвольно корректировал скорость инфузии для имитации титрования. Затем хирурга попросили оценить операционное поле с 15-минутными интервалами.
Рис. 1. Протокол исследования. TOF = поезд из четырех человек; NMB = нервно-мышечная блокада; PACU = отделение постанестезии. «Оценка 4» относится к оценке хирургической области хирургами.
Рис. 1. Протокол исследования. TOF = поезд из четырех человек; NMB = нервно-мышечная блокада; PACU = отделение постанестезии.«Оценка 4» относится к оценке хирургической области хирургами.
Если хирургическое поле было признано неприемлемым (состояние 4 степени) в любое время после введения болюсной дозы исследуемого препарата, лечение пациента считалось неудачным. Если пациент находился в группе плацебо, вводили болюсную дозу спасающего векурония 0,1 мг / кг, а через 5 мин инфузию физиологического раствора меняли на инфузию векурония.Если процедура длилась примерно 30 минут или меньше, пациент получал 0,05 мг / кг, и инфузия не начиналась. Если пациент находился в группе векурония, исследователь подтвердил наличие адекватного расслабления (одно или меньшее количество подергиваний в ответ на стимуляцию TOF) и, при необходимости, увеличил скорость инфузии векурония для достижения этого. Пациенту также давали 0,1 мл / кг физиологического раствора.
Инфузия фентанила была прекращена за 30 минут до предполагаемого завершения процедуры.Инфузия векурония или физиологического раствора была прекращена в начале фасциального закрытия. После полного закрытия фасции пациенты получали 0,07 мг / кг неостигмина с 0,02 мг / кг гликопирролата (группа векурония) или эквивалентный объем физиологического раствора (группа плацебо). Хирургов попросили дать окончательную оценку поля во время закрытия фасции. Прекращение приема изофлурана тогда оставалось на усмотрение бригады анестезиологов. Исследователь проинформировал бригаду анестезиологов, что перед экстубацией наблюдалась нормальная реакция TOF.Сроки экстубации, перевода в постанестезиологическое отделение (PACU) и PACU-ведение пациента были на усмотрение бригады анестезиологов. В PACU оценка боли была получена либо при поступлении, либо тогда, когда пациент мог впервые ответить, используя стандартную визуальную аналоговую шкалу. Отмечены эпизоды рвоты в течение первых 4 ч после экстубации.
Было рандомизировано 124 пациента (62 векурония, 62 плацебо).Из этих включенных пациентов четверо были исключены после рандомизации, но до введения исследуемого препарата: двое из-за интраоперационных нарушений протокола (введение анестезиологической бригадой наркотиков, отличных от фентанила, перед хирургическим разрезом), один пациент, которому RRP не проводился после лапаротомия из-за ранее недиагностированного метастатического заболевания и у одного пациента, у которого были неожиданно затруднены дыхательные пути и потребовались длительные попытки интубации. Таким образом, в анализ были включены 120 пациентов (59 векуроний, 61 плацебо).
Характеристики пациентов существенно не различались между двумя группами (таблица 1). Процедурные характеристики, такие как парциальное давление углекислого газа в конце выдоха, изофлуран в конце выдоха, общая доза фентанила и общая доза эфедрина, использовавшаяся у тех пациентов, которые в этом нуждались (34 [56%] и 35 [59%] пациентов в группе плацебо и vecuronium группы, соответственно) существенно не различались между группами (таблица 2).Время анестезии и время от закрытия кожных покровов до поступления в палату восстановления не различались между группами (таблица 2).
Таблица 1. Характеристики пациента
Таблица 2. Процедурные характеристики
Значения являются средними ± стандартное отклонение.
* Характеристика измерялась при открытии фасции, через 5 минут после введения исследуемого препарата и каждые 15 минут после этого до момента закрытия фасции.Данные были проанализированы с использованием среднего измерения за этот период времени для каждого пациента. † Данные отсутствовали для одного пациента в группе плацебо и трех пациентов в группе векурония. ‡ Эфедрин вводили 34 пациентам, получавшим плацебо, и 35 пациентам с векуронием. Информация об общей дозе отсутствовала для 1 из 35 пациентов с векуронием, которым вводили эфедрин. § Время анестезии определялось от введения анестетика до закрытия кожного покрова. ∥ Время появления определялось от завершения закрытия кожных покровов до поступления в отделение постанестезии и включало время, необходимое для экстубации трахеи и рентгенологического исследования брюшной полости; данные отсутствовали по одному пациенту плацебо и трем пациентам с векуронием.
CO 2 = диоксид углерода.
Частота неудач лечения составила 17 из 61 (27,9%; 95% ДИ, 17,2–40,8%) для пациентов, получавших плацебо, по сравнению с 1 из 59 (1,7%; 95% ДИ, <0,1–9,1%) для пациентов, получавших векуроний. ( P <0,001). Пятнадцать пациентов, у которых в группе плацебо было определено неэффективное лечение, получили спасительный векуроний после того, как хирург счел хирургическое поле плохим.Считалось, что еще два пациента в группе плацебо потерпели неудачу в лечении. Один пациент испытал временную полевую оценку 4 степени, которая разрешилась к удовлетворению хирурга до того, как можно было назначить спасительный векуроний, и не получил векуроний. Еще один пациент в группе плацебо развил гипотензию после хирургического кровотечения. По запросу клинической анестезиологической бригады, назначение лечения пациенту было раскрыто, и дальнейшие данные по этому пациенту не собирались.Бригада анестезиологов решила ввести цисатракуриум и дополнительные наркотики, снизить концентрацию изофлурана во вдыхаемом воздухе и успешно выполнила объемную реанимацию с упакованными эритроцитами. Этот пациент, единственный, кому потребовалось переливание эритроцитов, был классифицирован как испытавший неэффективность лечения для целей анализа данных.
В целом, 38 из 61 пациента (62,3%; 95% ДИ 49,0–74,4) в группе плацебо и 52 из 59 пациентов (88.1%; 95% ДИ, 77,1–95,1) в группе векурония получили максимальные полевые оценки ≤ 2 (, т.е. , от хорошего до отличного) при каждой оценке на протяжении всей процедуры (рис. 2). Для 15 пациентов в группе плацебо, получавших спасительный векуроний, при первой оценке хирургического поля после введения векурония (в то время, когда ответ на стимуляцию TOF отсутствовал), 8 имели полевой рейтинг 1, 6 имели полевой рейтинг 2, а полевой рейтинг 1 — 3. Таким образом, у некоторых из этих пациентов были менее чем оптимальные условия, даже когда они были полностью парализованы.
Рис. 2. Распределение максимального поля рейтинга, зарегистрированного после фасциального разреза в ходе операции для каждого пациента. Оценка поля регистрировалась с 5-минутными интервалами после введения исследуемого препарата и каждые 15 минут после этого до закрытия фасции. Полевая оценка 4 была присвоена одному пациенту плацебо, который был классифицирован как неэффективный из-за интраоперационных событий, отличных от неадекватного операционного поля, как описано в тексте.Для пациентов, у которых лечение не было неудачным, представленные данные соответствуют максимальному зарегистрированному полевому рейтингу.
Рис. 2. Распределение максимального поля рейтинга, зарегистрированного после фасциального разреза в ходе операции для каждого пациента. Оценка поля регистрировалась с 5-минутными интервалами после введения исследуемого препарата и каждые 15 минут после этого до закрытия фасции. Полевая оценка 4 была присвоена одному пациенту плацебо, который был классифицирован как неэффективный из-за интраоперационных событий, отличных от неадекватного операционного поля, как описано в тексте.Для пациентов, у которых лечение не было неудачным, представленные данные соответствуют максимальному зарегистрированному полевому рейтингу.
Распределение полевых оценок при каждой оценке приведено в таблице 3. Средний полевой рейтинг во время фасциального разреза (до введения векурония или плацебо) существенно не отличался между группами (2,4 ± 1,0 [среднее значение ± стандартное отклонение] и 2,1 ± 1,0 для групп плацебо и векурония соответственно), хотя 11 из 61 пациента (18%) в группе плацебо по сравнению с 5 из 59 пациентов (9%) в группе векурония в это время имели полевую оценку 4 степени ( P = 0.18). В группе плацебо у 7 из этих 11 пациентов (64%) не было лечения, 5 из которых получали спасительный векуроний при сохранении состояний 4 степени, оцениваемых через 5 минут после фасциального разреза. Единственному неэффективному лечению в группе векурония была присвоена полевая оценка 4 во время фасциального разреза, который сохранялся в течение 20 минут после введения векурония, несмотря на отсутствие подергивания в ответ на стимуляцию TOF. В целом, для 17 пациентов с плацебо, у которых лечение было неэффективным, среднее время от фасциального разреза до неудачи составило 17 минут.
Таблица 3. Сводка полевых оценок
Значения представляют собой процентную долю каждой группы пациентов в каждый конкретный момент времени, получивших полевые оценки (1–4), которым вводили «спасательный» векуроний с момента фасциального вскрытия (предыдущее спасение) или для которых полевые оценки не были получены из-за закрытия (отсутствия) фасции.
* Полевая оценка не была получена в это время ни у одного пациента, которому только что вводили «спасательный» векуроний.
В послеоперационном периоде не было существенной разницы между группами по оценке боли или частоте рвоты (таблица 4). Других послеоперационных осложнений у пациентов не было.
Таблица 4. Послеоперационные оценки
* Группы лечения сравнивали с использованием критерия суммы рангов для непрерывных переменных и точного критерия Фишера для категориальных переменных.† Боль оценивалась при поступлении в отделение PACU с помощью визуальной аналоговой шкалы. Информация о боли отсутствовала для двух пациентов с плацебо и трех пациентов с векуронием, которые были слишком сонными, чтобы их можно было оценить. ‡ Двум из шести пациентов в группе плацебо, у которых возникла рвота, вводили «спасательный» векуроний. § Послеоперационные осложнения включают повторную интубацию, аспирацию, гипоксемию, непреодолимую боль, трудноизлечимую тошноту или рвоту, госпитализацию в отделение интенсивной терапии и смерть.
PACU = отделение постанестезии.
Мы подтвердили гипотезу о том, что векуроний снижает частоту неприемлемых операционных условий у пациентов, подвергающихся РРП и находящихся под наркозом изофлураном и фентанилом. Тем не менее, хорошие или отличные хирургические условия на протяжении процедуры были достигнуты примерно у двух третей пациентов даже без использования миорелаксантов.
В своем классическом обзоре методов мониторинга нервно-мышечной функции Ali и Savarese 8 заявили, что подавление на 90–95% однократной реакции на супрамаксимальную стимуляцию локтевого нерва обеспечивает удовлетворительное хирургическое расслабление во время анестезии закисью азота.Из ссылок, предоставленных в поддержку этого утверждения, только одна исследует этот вопрос напрямую. de Jong 9 обследовал 25 взрослых пациентов, перенесших внутрибрюшную операцию под наркозом с помощью закиси азота и галотана в трахее на «умеренных и легких хирургических уровнях». Как и в нашем протоколе, хирургическое поле оценивалось в отсутствие миорелаксантов после фасциального разреза, а затем после дополнительного введения сукцинилхолина, тубокурарина или галламина. Хирурги не были ослеплены относительно приема лекарств.Они обнаружили, что расслабление мышц живота, по оценке хирургов, увеличивается с увеличением доз релаксанта. Расслабление коррелировало с реакцией электромиографа на стимуляцию периферических нервов. Важно отметить, что, как это было принято в ту эпоху, пациенты дышали спонтанно до введения миорелаксантов, а затем оказывалась вспомогательная вентиляция после подавления дыхательных усилий. Анестезия галотаном вызывает значительную фазовую экспираторную активность в мышцах живота, 10,11 активность, которая может помешать хирургическому вмешательству.Действительно, из других работ, относящихся к этому периоду, очевидно, что одним из основных эффектов расслабления на электромиограмме брюшных мышц является устранение этой фазовой активности выдыхательных мышц, действие, которое также может быть выполнено с помощью гипервентиляции (которую мы использовали в нашем исследовании). 12 Тоническая активация мышц брюшного пресса также наблюдалась во время легкой анестезии, поддерживаемой закисью азота и дополнительным прерывистым тиопенталом, активация, которая усиливается при хирургической стимуляции и устраняется миорелаксантами.13 Однако тоническая активация не наблюдалась во время анестезии, вызванной летучими веществами. Эти результаты показывают, что экстраполяция рекомендаций относительно степени паралича, необходимого для адекватных условий работы, основанных на этих ранних исследованиях, на текущую практику, в которой используются различные препараты, часто с контролируемой вентиляцией, которая устраняет дыхательные движения, должна выполняться с осторожностью.
В нашем исследовании мы попытались предоставить аналогичный анестетик двум группам во всех отношениях, за исключением использования векурония, чтобы мы могли оценить его влияние на хирургические условия как независимый фактор.Такие показатели, как концентрация изофлурана, доза фентанила и начальная послеоперационная боль, действительно были сопоставимы между группами. Однако, хотя это и не является статистически значимым, наблюдалась тенденция к увеличению доли пациентов в группе плацебо с состояниями 4 степени на фасциальном разрезе, что мы можем объяснить только вариабельностью между пациентами, поскольку анестезиологическое обеспечение в двух группах было идентично таковому. эта точка. Поскольку многим из этих пациентов в группе плацебо в конечном итоге потребовался спасительный векуроний, этот фактор может смещать наши результаты в сторону переоценки пользы векурония.Тем не менее, векуроний значительно увеличил долю пациентов, у которых, по крайней мере, адекватная (≤ 3 степень) оценка хирургического поля поддерживалась на протяжении всей процедуры, с 72% (группа плацебо) до 98%. Интересно, что несколько пациентов, получавших векуроний (34%), по-прежнему оценивались как имеющие менее чем отличное (степень 1) состояние, предполагая, что факторы, помимо мышечного тонуса, могут способствовать субоптимальному хирургическому вмешательству.
Хотя и не является неожиданным, что миорелаксант может улучшить хирургическое поле, большинство пациентов в группе плацебо сохраняли без него хорошие или отличные условия (полевой рейтинг ≤ 2).Это поднимает клинический вопрос о рисках и преимуществах рутинного приема миорелаксантов пациентам, перенесшим абдоминальные операции, такие как RRP. Гарольд Гриффит, один из пионеров в исследовании этих препаратов, выразил озабоченность по поводу их использования в качестве замены адекватной анестезии, заявив, что парализующие агенты «… не должны использоваться без разбора, потому что неопытный анестезиолог слишком неэффективен, чтобы получить адекватное расслабление мышц с помощью обычные процедуры ». 4 Риски релаксантов в некоторой степени зависят от конкретного препарата, но включают воздействие на другие системы органов, например, сердечно-легочные эффекты, вторичные по отношению к высвобождению гистамина, продуцируемого некоторыми лекарствами, неполное послеоперационное снятие блокады, 1,14 и нарушение важный клинический признак неадекватной анестезии ( i.е. , движение пациента). Остаточный паралич остается серьезной проблемой даже при использовании хотя бы одного члена нового поколения препаратов короткого действия (мивакуриум). 15 Недавний анализ данных закрытых претензий показал, что использование миорелаксантов является независимым фактором риска для заявлений об интраоперационной осведомленности по сравнению с другими типами заявлений 2a. Вывод, который предполагает, но не доказывает, что их использование может увеличить риск осведомленности. . 5 Также существуют опасения относительно возможных осложнений, возникающих из-за препаратов, применяемых для отмены миорелаксантов, таких как учащение послеоперационной рвоты.Однако, как и другие исследователи (17,18), мы не нашли доказательств того, что использование реверсивных препаратов увеличивало частоту рвоты.
Хотя наше исследование показывает, что многим пациентам не требуются миорелаксанты для достижения адекватных хирургических операционных условий, миорелаксанты могут принести пользу, если их использование может минимизировать неблагоприятные последствия других лекарств, применяемых в периоперационном периоде. Например, паралич может позволить использовать более низкие дозы общих анестетиков, что может ускорить выздоровление и избежать побочных эффектов этих агентов, таких как сердечно-сосудистая депрессия.Действительно, примерно половине пациентов в нашем исследовании потребовались небольшие дозы вазопрессоров, обычно перед хирургическим разрезом. Таким образом, рассмотрение этих факторов также должно быть сбалансировано с риском самих миорелаксантов. Надежные оценки этого риска в клинической практике недоступны, но частота значительных нежелательных явлений, связанных с миорелаксантами, вероятно, достаточно мала, и для окончательного ответа на этот вопрос потребуется крупное клиническое исследование.Анализ затрат и выгод, связанных с использованием релаксантов, выходит за рамки нашего исследования, но будет представлять интерес как тема будущих исследований.
Эти результаты следует экстраполировать на другие параметры с осторожностью. Каждая конкретная хирургическая процедура и каждый отдельный хирург предъявляют свои собственные требования к адекватным условиям работы. Мы выбрали исследование RRP, потому что в нашем учреждении эта процедура выполняется с использованием стандартной хирургической техники, имеет умеренную продолжительность и связана с низкой частотой значительных интраоперационных осложнений, таких как кровотечение, требующее переливания крови (1 из 120 пациентов в нашей серии). .Эти особенности могут не быть характерными для RRP, выполняемого в других учреждениях. Другие факторы, такие как пол пациента и связанные с ним различия в мышечной массе, также могут иметь значение. Для некоторых хирургических процедур риск вызвать хирургическую травму при любом движении может диктовать рутинное использование этих агентов. Наши результаты следует интерпретировать как демонстрацию в конкретных хирургических условиях того, что, хотя миорелаксанты значительно снижают частоту неприемлемых оценок хирургического поля, адекватные операционные условия могут быть получены у многих пациентов без миорелаксантов.Эти данные предполагают, что анестезиологи должны, по крайней мере, рассмотреть вопрос о том, следует ли использовать миорелаксанты регулярно в некоторых процедурах или может быть более подходящим более избирательное применение при наличии неадекватных хирургических условий. Чтобы этот подход был успешным, необходимо поддерживать хорошее общение между анестезиологом и хирургом.
Авторы благодарят наших коллег по урологии за участие, в том числе докторов наук.Дэвиду Э. Паттерсону, Джозефу В. Сегура, Майклу Л. Блюту и Деборе Дж. Лайтнер, клиника Мэйо, Рочестер, Миннесота, и Полу Деккеру, клиника Мэйо, за экспертную помощь в анализе данных.
Рекомендации по миорелаксантам и анестезии
https://doi.org/10.1016/j.accpm.2020.01.005Получить права и содержаниеАннотация
Цели
Обеспечить обновление французских рекомендаций 1999 года по « Muscle релаксанты и реверсивная анестезия », был созван консенсусный комитет из шестнадцати экспертов.Официальная политика декларирования и мониторинга конфликтов интересов (COI) была разработана в самом начале процесса и применялась на протяжении всего процесса. Весь процесс разработки рекомендаций проводился независимо от какого-либо промышленного финансирования (например, фармацевтических препаратов, медицинских устройств). От авторов требовалось следовать правилам системы классификации рекомендаций, оценки, разработки и оценки (GRADE®) для оценки качества доказательств, на которых основывались рекомендации. Были подчеркнуты потенциальные недостатки сильных рекомендаций, основанных на доказательствах низкого качества.Некоторые рекомендации остались без оценки.
Методы
Группа сосредоточилась на восьми вопросах: (1) При отсутствии сложных критериев вентиляции маски, необходимо ли проверять возможность вентиляции через лицевую маску перед инъекцией миорелаксанта? Нужно ли использовать миорелаксанты для облегчения вентиляции маски? (2) Необходимо ли использование миорелаксантов для облегчения интубации трахеи? (3) Необходимо ли использование миорелаксантов для облегчения введения надгортанного аппарата и лечения связанных с этим осложнений? (4) Необходимо ли контролировать нервно-мышечную блокаду для обеспечения проходимости дыхательных путей? (5) Необходимо ли использование миорелаксантов для облегчения интервенционных процедур, и если да, то какие? (6) Необходим ли интраоперационный мониторинг нервно-мышечной блокады? (7) Каковы стратегии профилактики и лечения остаточной нервно-мышечной блокады? (8) Каковы показания и меры предосторожности для использования миорелаксантов и антивозрастных средств в особых группах населения (например,грамм. электросудорожная терапия, пациенты с ожирением, дети, нервно-мышечные заболевания, почечная / печеночная недостаточность, пациенты пожилого возраста)? Все вопросы были сформулированы с использованием модели «Население, вмешательство, сравнение и результат» (PICO) для клинических вопросов и составлены профили доказательств. Затем результаты анализа литературы и рекомендации были оценены с помощью системы GRADE®.
Результаты
Обобщения, подготовленные комиссией SFAR по руководству, привели к 31 рекомендации по миорелаксантам и антивозрастным средствам в анестезии.Из этих рекомендаций одиннадцать имеют высокий уровень доказательности (УРОВЕНЬ 1 ±), а двадцать — низкий уровень доказательности (УРОВЕНЬ 2 ±). По пяти вопросам не удалось дать никаких рекомендаций с использованием системы GRADE®, а по двум из этих вопросов были даны мнения экспертов. После двух раундов обсуждения и внесения поправок было достигнуто полное согласие по всем рекомендациям.
Заключение
Между экспертами существует существенное согласие относительно многих сильных рекомендаций по улучшению практики использования миорелаксантов и антагонистов во время анестезии.В частности, Французское общество анестезии и интенсивной терапии (SFAR) рекомендует использовать устройство для контроля нервно-мышечной блокады на протяжении всей анестезии.
Ключевые слова
Миорелаксанты
Reversal
Neuromuscular
Мониторинг
Обновление экспертных рекомендаций
Рекомендуемые статьиЦитирующие статьи (0)
© 2020 Авторы. Опубликовано Elsevier Masson SAS от имени Société française d’anesthésie et de réanimation (Sfar).
Рекомендуемые статьи
Ссылки на статьи
Релаксанты скелетных мышц — Knowledge @ AMBOSS
Последнее обновление: 19 августа 2021 г.
Резюме
Релаксанты скелетных мышц — это препараты, которые блокируют нервно-мышечные соединения (НМС) путем связывания с ацетилхолином (ACh ) рецепторы, расположенные на нем. Этот процесс приводит к параличу всех скелетных мышц, начиная с мелких мышц лица и в последнюю очередь парализуя диафрагму. Сукцинилхолин, единственный деполяризующий препарат, блокирующий НМС, связывается с рецепторами ACh и вызывает длительную деполяризацию моторной концевой пластинки, что приводит к вялому параличу.Недеполяризующие препараты, блокирующие НМС, связываются с рецепторами ACh и предотвращают деполяризацию моторной концевой пластинки (блок деполяризации). Эти препараты подразделяются на препараты короткого, среднего и длительного действия. В зависимости от продолжительности действия препараты, блокирующие НМС, являются полезными дополнениями к анестетикам и поэтому используются для интубации гортани, искусственной вентиляции легких или интраоперационной релаксации скелетных мышц. Все препараты, блокирующие НМС, вызывают остановку дыхания (апноэ), парализуя диафрагму и межреберные мышцы, что требует искусственной вентиляции легких у пациентов.Сукцинилхолин является известным триггером злокачественной гипертермии, а также может вызывать гиперкалиемию, послеоперационную мышечную боль и сердечную аритмию. Недеполяризующие препараты, вызывающие высвобождение гистамина (атракуриум) или обладающие симпатомиметическими свойствами (панкуроний), могут вызывать бронхоспазмы и тахикардию. Пациенты, получавшие препараты, блокирующие НМС, должны находиться под наблюдением либо клинически (например, способность поднимать голову / ноги или открывать глаза), либо с помощью стимулятора периферических нервов для оценки степени паралича скелетных мышц.Антагонисты недеполяризующих препаратов (неостигмин, пиридостигмин, сугаммадекс) используются для реверсии блока НМС. Неадекватное обращение может вызвать респираторные осложнения. У сукцинилхолина нет специфического антагониста.
Обзор
| Обзор блокаторов ННС | |||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Деполяризующие блокаторы ННС (деполяризующие миорелаксанты) | |||||||||||||||||||||||||||||
| Механизм действия | Начало | Продолжительность | 902Устранение Дополнительные соображения | ||||||||||||||||||||||||||
| Сукцинилхолин [1] |
| ||||||||||||||||||||||||||||
| Недеполяризующие блокаторы НМС (недеполяризующие миорелаксанты) | |||||||||||||||||||||||||||||
| Короткого действия | Мивакурий | Мивакуриум | 38 | 38 | |||||||||||||||||||||||||
| Промежуточного действия | Рокуроний [3] [4] |
|
| ||||||||||||||||||||||||||
Векуроний | | | | | | | | | | | | | | | | | | | | | | Атракурий | |
|
| |||||
| Cisatracurium [7] | Long- |
|
| ||||||||||||||||||||||||||
| Тубокурарин |
|
|
| ||||||||||||||||||||||||||
Фармакодинамика
Деполяризующие и недеполяризующие мышечные рецепторы они не нацелены на вегетативные рецепторы Nn.
Паралич поражает в первую очередь мелкие мышцы лица, прогрессирует до конечностей и туловища и в последнюю очередь поражает межреберные мышцы и диафрагму.
Ссылки: [8] [9] [10] [11]
Побочные эффекты
Ссылки: [8] [9] [11] [14] [15] [16] [17] [18] [19] ]
Мы перечисляем наиболее важные побочные эффекты.Выбор не исчерпывающий.
Показания
Каталожные номера: [20]
Мониторинг
- Пациенты, получившие блокаторы НМС, должны находиться под наблюдением.
- Клиническая оценка: способность пациента самопроизвольно открывать глаза, поднимать голову / ноги или наличие спонтанной вентиляции помогает определить степень паралича
-
Нервно-мышечный мониторинг: объективно определяет степень паралича мышц с помощью стимулятора периферических нервов
- Метод: последовательность четырех ответов
- Интерпретация
- 0 подергиваний указывает на глубокую блокаду СМС
- 1-2 подергивания указывают на частичный блок.
- 1 подергивание на каждый электрический стимул указывает на отсутствие блока НМС.
- Неадекватное обращение (послеоперационная остаточная нервно-мышечная слабость) может привести к обструкции верхних дыхательных путей (слабость глоточных мышц) и недостаточной вентиляции
Список литературы
- Хлорид сукцинилхолина. https://www.drugs.com/monograph/succinylcholine-chloride.html . Обновлено: 1 января 2018 г.Доступ: 7 марта 2018 г.
- МИВАКРОН (мивакурия хлорид) раствор для инъекций.
- Рокурония бромид. https://www.drugs.com/ppa/rocuronium-bromide.html . Обновлено: 18 февраля 2017 г. Доступ: 18 февраля 2017 г.
- Райт П.М., Колдуэлл Дж. Э., Миллер Р. Д.. Начало и продолжительность воздействия рокурония и сукцинилхолина на приводящую мышцу большого пальца и приводящую мышцу гортани у людей, находящихся под наркозом. Анестезиология . 1994; 81 год (5): с.1110-1115.
- Сингх Д., Сивашанмугам Т., Кумар Х., Наг К., Партасарати С., Шетти А. Сугаммадекс: революционный препарат в нервно-мышечной фармакологии. Anesth Essays Res . 2013; 7 (3): с.302. DOI: 10.4103 / 0259-1162.123211. | Открыть в режиме чтения QxMD
- Кунджаппан В.Е., Браун Э.М., Александр Г.Д. Быстрая индукция последовательности с использованием векурония. Анест Анальг .1986; 65 (5): с.503-6.
- Препарат Нимбекс (цисатракурия безилат для инъекций). https://www.rxlist.com/nimbex-drug.htm#description . . Дата обращения: 18 февраля 2021 г.
- Нервно-мышечные блокаторы. https://www.pharmacology2000.com/Central/NMJ/NMJobj1.htm . Обновлено: 18 февраля 2017 г. Доступ: 18 февраля 2017 г.
- Харви Р.А., Чампе ПК, Финкель Р., Кларк М.А., Кубедду LX. Иллюстрированные обзоры Липпинкотта: фармакология . Липпинкотт Уильямс и Уилкинс ; 2008 г.
- Naguib M, Brull SJ. Сугаммадекс: новый селективный связывающий релаксант. Эксперт Рев Клин Фармакол . 2009; 2 (1): с.37-53. DOI: 10.1586 / 17512433.2.1.37. | Открыть в режиме чтения QxMD
- Аппиа-Анкам Дж., Хантер Дж. М.. Фармакология нервно-мышечных блокаторов. Contin Educ Anaesth Crit Care Pain .2004; 4 (1): стр.2-7. DOI: 10.1093 / bjaceaccp / mkh002. | Открыть в режиме чтения QxMD
- Кулькарни Л., Саникоп С., Шилпа Х., Винаян А. Анестезиологическое обеспечение пациента с рассеянным склерозом. Индийский журнал анестезии . 2011; 55 (1): с.64. DOI: 10.4103 / 0019-5049.76598. | Открыть в режиме чтения QxMD
- Чанди Т., Нандакумар А., Темпи С., Дэвид Д. Анестезиологическое лечение пациента с боковым амиотрофическим склерозом при трансуретральной резекции опухоли мочевого пузыря. Индийский журнал анестезии . 2013; 57 год (2): с.197. DOI: 10.4103 / 0019-5049.111863. | Открыть в режиме чтения QxMD
- . Дефицит псевдохолинэстеразы. Дефицит псевдохолинэстеразы . Нью-Йорк, штат Нью-Йорк: WebMD. https://emedicine.medscape.com/article/247019-overview . Обновлено: 26 сентября 2016 г. Дата обращения: 18 февраля 2017 г.
- Naguib M, Magboul MM. Побочные эффекты нервно-мышечных блокаторов и их антагонистов. Сейф с наркотиками . 1998; 18 (2): стр.99-116.
- Хаггинс Р.М., Кеннеди В.К., Мелрой М.Дж., Толлертон Д.Г. Остановка сердца из-за гиперкалиемии, вызванной сукцинилхолином. Am J Health Syst Pharm . 2003; 60 (7): с.694-697.
- Микин Г.Х. Нервно-мышечные блокаторы у младенцев и детей. Contin Educ Anaesth Crit Care Pain . 2007; 7 (5): с.143-147. DOI: 10.1093 / bjaceaccp / mkm032.| Открыть в режиме чтения QxMD
- Мосс Дж. Миорелаксанты и высвобождение гистамина. Acta Anaesthesiol Scand Suppl . 1995; 106 : стр.7-12.
- Фармакология миорелаксантов и их антагонистов.
- Tietze KJ. Использование нервно-мышечных блокирующих препаратов у тяжелобольных пациентов. В: Сообщение TW, под ред. Дата обновления . Уолтем, Массачусетс: UpToDate. https://www.uptodate.com/contents/use-of-neuromuscular-blocking-medications-in-critically-ill-patients .Последнее обновление: 25 октября 2016 г. Дата обращения: 18 февраля 2017 г.
Мышечные релаксанты и осложнения после анестезии — Просмотр полного текста
Миорелаксанты являются неотъемлемой частью современной анестезии. Они оптимизируют условия интубации, уменьшают травмы гортани и улучшают условия работы. Недостатком является возможное фармакологическое (расслабляющее мышцы) действие этих препаратов после окончания операции (то есть послеоперационная остаточная кураризация: PORC). PORC — серьезное осложнение после общей анестезии.По сообщениям, около 30% всех пациентов, получавших миорелаксанты, проявляют признаки ПОРК по прибытии в отделение постанестезиологической помощи. PORC включает в себя риск нарушения послеоперационной мелкой моторики и координационных навыков с возможным нарушением глотания глоточного секрета с повышенным риском аспирации после экстубации. Возможными пагубными последствиями этого могут быть пневмония, бронхит, инфаркт миокарда, сердечная недостаточность, инсульт или повторная операция. В пилотном исследовании мы смогли определить критерии клинической оценки для оценки риска аспирации у пациентов, которые теперь являются частью постанестезиологической оценки каждого пациента.
К сожалению, существует серьезная ошибка, связанная с невозможностью четко идентифицировать PORC. Хотя объективный нервно-мышечный мониторинг является золотым стандартом для измерения нервно-мышечной передачи во время анестезии, клинические признаки использовались для выявления мышечной слабости в послеоперационном периоде. Одной из причин такой практики является различное действие миорелаксантов на разные группы мышц, демонстрируя, что нервно-мышечный мониторинг недостаточно чувствителен для обнаружения симптомов PORC в глоточных мышцах.Эта ситуация может привести к редкому использованию устройств нервно-мышечного мониторинга и может способствовать уменьшению использования миорелаксантов в клинической анестезии.
В этом многоцентровом эпидемиологическом исследовании по всей Германии мы хотели бы оценить, влияет ли использование миорелаксантов или признаки их длительного действия после окончания операции / анестезии (PORC) на дальнейшее пребывание в больнице. послеоперационная заболеваемость и смертность. Отбор проб в 8 немецких больницах должен определить количество пациентов с клинически значимыми признаками мышечной слабости на момент прибытия в отделение постанестезиологической помощи.Поэтому форма ввода данных была разработана руководителями и субисследователями 8 участвующих в исследовании больниц. Эта форма для ввода данных позволяет персоналу отделения постанестезиологической помощи получать и документировать остаточные нервно-мышечные блокады. Выборка будет сделана в 8 участвующих больницах в течение 21 рандомизированного рабочего дня в течение 24 часов. Для выявления потенциальных факторов риска послеоперационной резидуальной кураризации также регистрируются известные предикторы нервно-мышечной блокады покоя.Известными предикторами являются, например: тип и количество миорелаксанта, продолжительность операции и анестезии, хирургическая процедура, возраст пациентов, техника анестезии, антагонизация миорелаксанта или нервно-мышечный мониторинг. Кроме того, документируется прогресс пациентов в отделении постанестезиологической помощи.
После 28-дневного исхода пациентов заполняется вторая форма для ввода данных, которая включает экономические аспекты здоровья. Сообщается об осложнениях, продолжительности пребывания в отделении интенсивной терапии и в больнице, а также об оставшихся повреждениях здоровья на момент выписки.Чтобы оценить значимость PORC, данные пациентов с PORC сравнивают с данными пациентов без PORC. Эти пациенты набираются в течение первого периода сбора данных в постанестезиологическом отделении. Контроль для любого пациента с PORC — это следующий, кто прибывает в отделение постанестезиологической помощи без PORC.
