Хирургическая профилактика меланомы кожи
Романова О.А., Артемьева Н.Г.
ЗАО Центральная поликлиника Литфонда, Москва
Контакты: Романова О.А.
Цель: изучить ближайшие и отдаленные результаты лечения больных раком желчного пузыря.
В статье представлены данные сопоставления клинических признаков удаленных диспластических невусов с результатами гистологического исследования.
Материалы и методы
Диспластическиий невус (лентигинозная меланоцитарная дисплазия, ЛМД) является предшественником поверхностно распространяющейся меланомы кожи. Профессор З.В. Гольберт в 1982 г. выделила 3 степени развития ЛМД и показала, что 3-я степень развития ЛМД приближается к картине меланомы insitu. В целях профилактики меланомы мы стали предлагать больным иссечение имеющихся диспластических невусов.
С 2009 по 2012 г. были иссечены 43 пигментных образования, которые были расценены как диспластические невусы.
Результаты
При гистологическом исследовании удаленных пигментных образований в 6 наблюдениях выявлен внутридермальный невус, в 8 – смешанный невус, в 28 – ЛМД, в т. ч. 1 степени – 10, 1-2 степени – 4, 2 степени – 6, 2-3 степени – 1. В 7 наблюдениях степень развития лентигинозной меланоцитарной дисплазии не указана. У одного пациента выявлена меланома
При сопоставлении клинических признаков удаленных диспластических невусов с морфологической картиной установлено, что выраженность клинических признаков невуса (асимметрия формы, неровности границ, неравномерная окраска) соответствовала степени развития ЛМД.
Выводы
Наиболее важными признаки развития ЛМД – изменения размеров, формы или окраски невуса за последние несколько месяцев или лет, а также появление диспластического невуса на неизмененной коже и дальнейшее его развитие у лиц старше 17 лет, что является показанием для иссечения диспластического невуса в целях профилактики меланомы.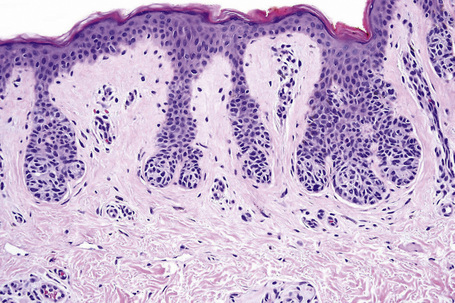
Данный объем операции будет достаточным для полного излечения выявленной при гистологическом исследовании поверхностно распространяющейся меланомы 1–2 уровней инвазии толщиной менее 0,1 см («тонкой» меланомы). Гистологическое исследование удаленного невуса должен проводить патоморфолог, имеющий достаточный опыт исследования меланоцитарных образований, чтобы установить степень ЛМД и возможный переход ЛМД в меланому. При отказе больного от операции необходимо осматривать диспластические невусы 1 раз в 6–12 мес.
Ключевые слова: лентигинозная меланоцитарная дисплазия; диспластический невус; поверхностно распространяющаяся меланома.
Среди разнообразных пигментных образований, встречающихся у лиц белой расы, большинство составляют доброкачественные невоклеточные невусы, которые проходят этапы развития от пограничного к смешанному и внутридермальному невусу, подвергаясь с возрастом инволюции [8]. Но есть и другие меланоцитарные образования – диспластические невусы, которым инволюция не свойственна. Эти пигментные образования способны трансформироваться в меланому.
Но есть и другие меланоцитарные образования – диспластические невусы, которым инволюция не свойственна. Эти пигментные образования способны трансформироваться в меланому.
Впервые меланотические образования, способные трансформироваться в меланому, были описаны W.H. Clark с соавт. в 1978 г. [5]. При обследовании больных наследственной меланомой и их родственников авторы выявили особые невусы, которые гистологически представляли собой атипическую меланоцитарную гиперплазию, лимфоидную инфильтрацию, нежную фиброплазию и новообразованные кровеносные сосуды. Был документально зафиксирован переход этих невусов в меланому у 2 больных. Наличие множества особых невусов у больных меланомой кожи и их родственников авторы обозначили как «В-К моль синдром» (по начальным буквам 2 больных, у которых наблюдалось развитие меланомы из этих невусов). Они делают вывод, что невусы этого синдрома гистогенетически являются предшественниками некоторых наследственных меланом.
Со слов авторов, термином меланоцитарная дисплазия они обозначают ситуацию, когда отдельные меланоциты или их небольшие группы имеют некоторые структурные черты злокачественных меланоцитов, тенденция развития которых пока не ясна. Авторы проводят аналогию с дисплазией шейки матки, когда очаги эпителиальных клеток имеют признаки злокачественности, но могут оставаться вялотекущими, регрессировать или прогрессировать в явный рак.
Авторы проводят аналогию с дисплазией шейки матки, когда очаги эпителиальных клеток имеют признаки злокачественности, но могут оставаться вялотекущими, регрессировать или прогрессировать в явный рак.
В 1980 г. D.E. Elder с соавт. [6], продолжая иcследования W.H. Clark, выявили невусы с меланоцитарной дисплазией у больных спорадической меланомой. В 5 наблюдениях спорадической меланомы они обнаружили остаточные элементы меланоцитарной дисплазии в первичной опухоли. Авторы подчеркнули, что невусы В-К моль синдрома и невусы с меланоцитарной дисплазией у больных спорадической меланомой были идентичны и назвали их «диспластическими невусами». Авторы показали, что диспластический невусный синдром, как и наследственный «В-К синдром», является фактором риска развития меланомы кожи.
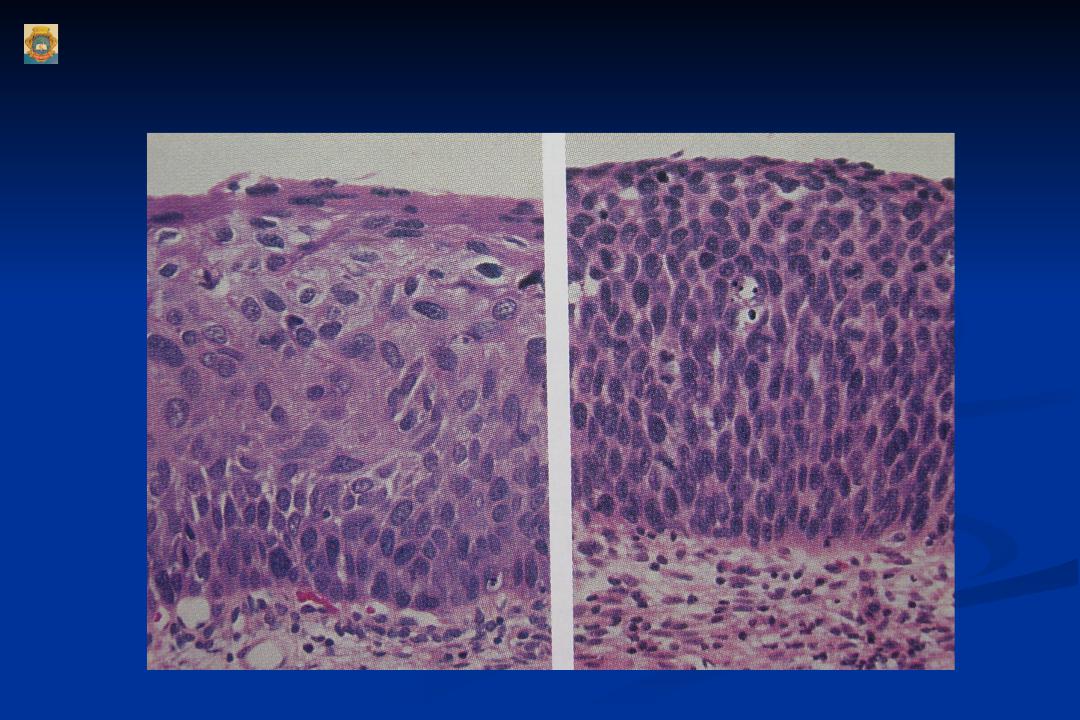
При гистологическом исследовании диспластических невусов эти авторы обнаружили 2 типа нарушения роста внутриэпидермальных меланоцитов. Наиболее частый тип – лентигинозная меланоцитарная дисплазия – наблюдался во всех диспластических образованиях и напоминал изменения, происходящие в  Второй тип нарушений роста – эпителиоидно-клеточная меланоцитарная дисплазия – был найден в 2 образованиях в дополнение к лентигинозной дисплазии. Этот тип роста напоминал классическую поверхностно распространяющуюся меланому.
Второй тип нарушений роста – эпителиоидно-клеточная меланоцитарная дисплазия – был найден в 2 образованиях в дополнение к лентигинозной дисплазии. Этот тип роста напоминал классическую поверхностно распространяющуюся меланому.
В 1982 г. профессор МНИОИ им. П.А. Герцена З.В. Гольберт, расценивая лентигинозную меланоцитарую дисплазию (ЛМД) как вариант меланоза Дюбрея, аналогично стадиям развития этого заболевания [1] выделила 3 степени развития ЛМД [2]. При 1 степени отмечалось увеличение числа меланоцитов в базальном слое эпидермиса и некоторая их атипия (атипия расположения, увеличение размеров, укрупнение ядра, в отдельных клетках – гиперхромия, полиморфизм ядер).
При 2 степени имелась более выраженная пролиферация меланоцитов, местами полностью замещающих базальный ряд кератиноцитов, и нарастание признаков их анаплазии. Для этой стадии характерны наличие удлиненных акантотических тяжей и склонность меланоцитов собираться в группы и скопления, особенно в акантотических тяжах, что создавало их колбообразное утолщение.
Эта картина приближается к картине меланомы in situ. З.В. Гольберт подчеркивала, что отличительной особенностью всех образований типа ЛМД, как и меланозы Дюбрея, является лимфо-плазмоцитарная инфильтрация подлежащей дермы. С самого начала пролиферации меланоцитов, еще без заметных признаков их атипии и анаплазии, имелись реактивная лимфо-плазмоклеточная инфильтрация и ангиоматоз в основе дермы, указывающие на уже существующий очаг пролиферации меланоцитов [2].
Клинически диспластический невус имеет сходство с пограничным невусом, однако есть и отличия [3, 8]. Так, диспластический невус представляет собой гладкое пигментное пятно, в то время как пограничный несколько возвышается над уровнем кожи. Последний чаще имеет правильную форму (круглую или овальную), в то время как диспластический часто бывает неправильной формы.
Диспластические невусы, наоборот, продолжают появляться до самой старости [8]. На рисунках 1–6 представлены диспластические невусы, а также поверхностно распространяющаяся меланома 1–2 уровней инвазии, развившаяся из диспластического невуса.
Рис. 1. Диспластический невус (коричневого цвета)
грудной стенки
Рис. 2. Папиломатозный невус (розового цвета)
Рис. 3. Диспластический невус
молочной железы
Рис. 4. Диспластический невус
левого предплечья
Рис. 5а,б. Диспластический невус
левого плеча
Рис. 5а
Рис.
 5б
5б
Рис. 6а,б. Поверхностно распространяющаяся меланома 1–2 уровней инвазии,
развившаяся на фоне диспластического невуса.
Рис. 6а
Рис. 6б
Окончательный диагноз диспластического невуса устанавливают только при гистологическом исследовании. В связи с определенными трудностями дифференциальной диагностики невоклеточного и диспластического невусов исследование должен проводить патоморфолог, имеющий достаточный опыт диагностики меланоцитарных образований.
Осматривая больных в хирургическом отделении Центральной поликлиники Литфонда, мы обнаруживали диспластические невусы у 5–10% здоровых лиц. Клинически мы выделили 2 варианта диспаластических невусов.
В первом варианте (этих пациентов было меньше) диспластические невусы появлялись в подростковом возрасте, и после 17–20 лет количество их оставалось неизменным Носители этих невусов были, как правило, белокожие, плохо загорающие лица, со светлыми или рыжими волосами, со светлыми глазами. Диспластические невусы у этих пациентов были крупные (0,5–1,0 см в диаметре), располагались как на открытых, так и на закрытых участках тела (ягодицы, живот), часто сочетались с папилломатозными невусами.
Диспластические невусы у этих пациентов были крупные (0,5–1,0 см в диаметре), располагались как на открытых, так и на закрытых участках тела (ягодицы, живот), часто сочетались с папилломатозными невусами.
Цвет невусов у одного и того же больного мог варьировать от розового до темно-коричневого, иногда наблюдалась пестрая окраска: темные участки на розовом или светло-коричневом фоне. Из анамнеза следовало, что невусы нередко имели также близкие родственники, т. е. они были наследственными.
Подобная картина была описана W.H. Clark с соавт. [5] и D.E. Elder с соавт. [6] как «диспластический невусный синдром». После периода полового созревания новые невусы в этой группе больных не появлялись. Это можно объяснить тем, что белокожие люди ограничивали свое пребывание на солнце, т. к. быстро обгорали, а также были информированы о вредном воздействии ультрафиолетового облучения.
Во втором варианте в подростковом возрасте диспластические невусы были немногочисленны, большинство из них появлялись в дальнейшей жизни и были связаны с длительным пребыванием на солнце.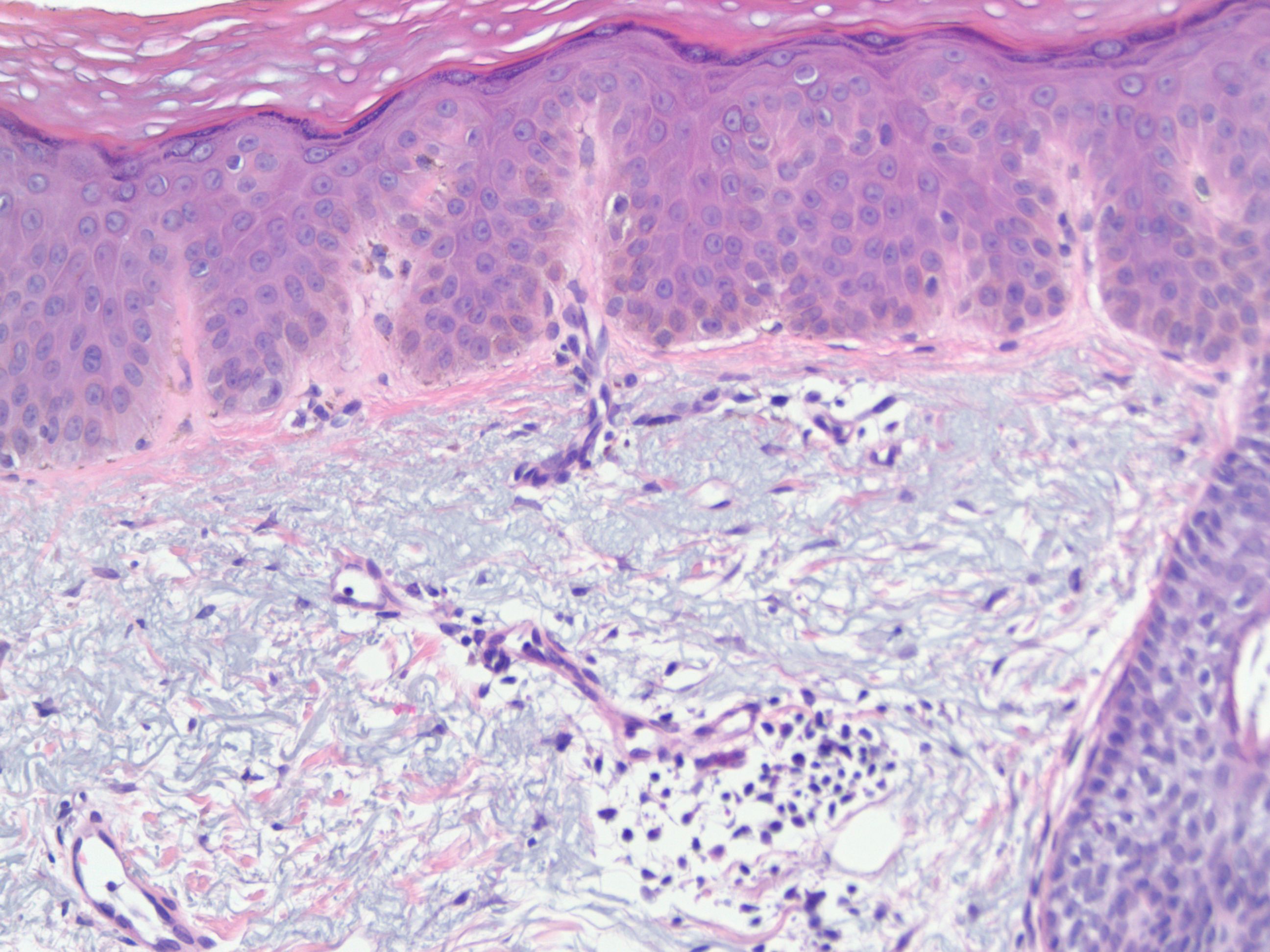 Диспластические невусы в этом варианте были мелкие (от 0,1 до 0,4 см в диаметре), многочисленные, правильной округлой формы, однородной окраски.
Диспластические невусы в этом варианте были мелкие (от 0,1 до 0,4 см в диаметре), многочисленные, правильной округлой формы, однородной окраски.
У белокожих блондинов невусы были светло-коричневого, у русых – коричневого и темно-коричневого цветов. Наибольшее их количество располагалось на открытых участках тела: лице, шее, верхних конечностях, верхней половине туловища (у женщин – по типу «широкого декольте»).
Диспластические невусы часто сочетались с множественными веснушками и пигментными пятнами типа «лентиго», которые также располагались на открытых участках тела.
Появление диспластических невусов в результате солнечного воздействия указывает на их сходство с меланозом Дюбрея. Морфологически сходство лентигинозной меланоцитарной дисплазии с меланозом Дюбрея отметила З.В. Гольберт [2].
О влиянии солнечной радиации на возникновение поверхностно распространяющейся меланомы кожи сообщают многие исследователи.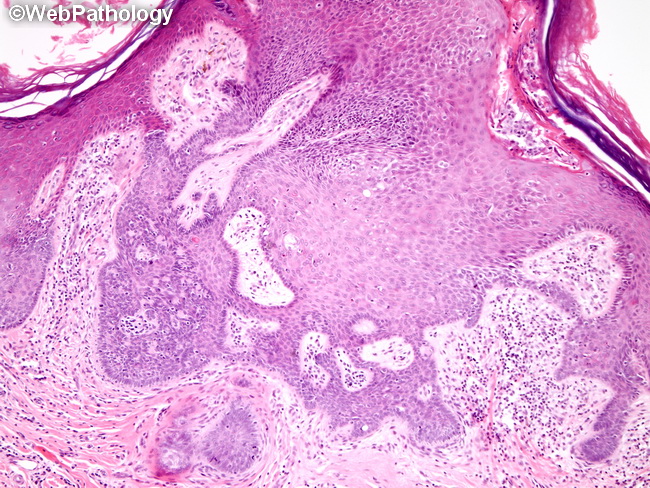 Так, К.А. Кларк из Стэндфордского университета и Калифорнийского центра по предотвращению рака сообщила, что молодые жительницы богатых районов на 70% чаще остальных страдали от меланомы.
Так, К.А. Кларк из Стэндфордского университета и Калифорнийского центра по предотвращению рака сообщила, что молодые жительницы богатых районов на 70% чаще остальных страдали от меланомы.
Это объясняют тем, что молодые состоятельные женщины часто проводят каникулы в тропических странах или посещают солярии, однако у них есть страховка, что влияет на показатели выявления опухоли на ранней стадии.
Учитывая тот факт, что появление диспластических невусов и дальнейшее развитие ЛМД стимулируется ультрафиолетовым облучением, мы всем больным с диспластическими невусами рекомендовали ограничить время пребывания на солнце с 11 до 15 часов, защищать кожу туловища и конечностей одеждой, использовать головной убор, солнцезащитные кремы.
Материалы и методы
В целях предупреждения перехода диспластического невуса в меланому мы стали предлагать пациентам иссечение невусов, которые имели признаки выраженной лентигинозной меланоцитарной дисплазии, для проведения гистологического исследования.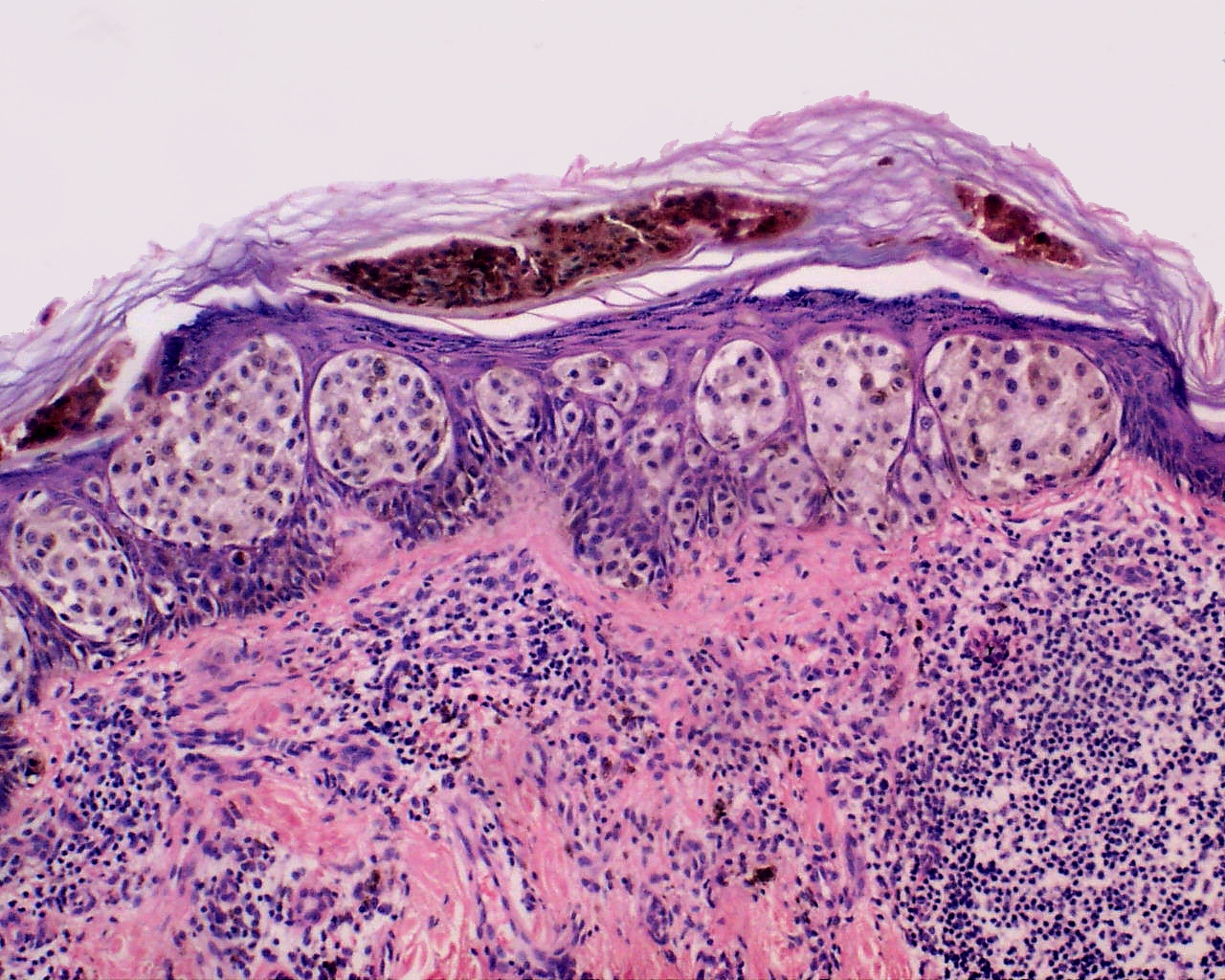
Исходя из опыта предыдущих лет, выбирали для иссечения невусы, которые представляли собой пигментные пятна, не возвышающиеся над поверхностью или возвышающиеся не более чем на 0,1 см, имеющие неправильную форму (в виде ромба, треугольника, капли, полулуния и пр.), неравномерную окраску, неровные края.
Показанием к иссечению служили также изменения невуса за последние 1–5 лет или появление невуса на неизмененной коже и дальнейший его рост. Осмотр невусов проводили при хорошем освещении, без применения диагностического оборудования. Чтобы уточнить характер изменений невуса, тщательно собирали анамнез, задавая наводящие вопросы.
Дерматоскоп применяли при необходимости дифференцировать невус от немеланоцитарных образований кожи – кератомы, гемангиомы, дерматофибромы и др.
Нередко больные воздерживались от операции, поскольку невус их не беспокоил: зуда, воспаления, болезненности они не отмечали. Таким пациентам мы назначали осмотр через 6 мес. При обнаружении изменений невуса за этот период повторно предлагали операцию, при отсутствии изменений–- дальнейшее наблюдение.
Таким пациентам мы назначали осмотр через 6 мес. При обнаружении изменений невуса за этот период повторно предлагали операцию, при отсутствии изменений–- дальнейшее наблюдение.
Иссечение невусов производили в амбулаторных условиях, под местной анестезией, отступя от видимых границ 0,4–0,5 см. Наименьшие размеры образований составляли 0,3 см, наибольшие – 1,2 см. Гистологическое исследование проводили в Городской клинической больнице № 52, а с 2010 г. – в Клинико-диагностическом отделении ОАО «Медицина», при необходимости препараты консультировали в МНИОИ им. П.А. Герцена.
Результаты
С 2009 по 2012 г. были иссечены 43 пигментных образования у больных с клиническим диагнозом диспластический невус. При гистологическом исследовании в 6 наблюдениях выявлен внутридермальный невус, в 8 – смешанный невус, в 28 – ЛМД, т. е. диспластический невус, в одном – поверхностно распространяющаяся меланома 1 уровня инвазии, развившаяся на фоне ЛМД 3 степени.
Из 28 морфологически подтвержденных диспластических невусов они были удалены у 22 пациентов, в т. ч. у одного – 4, у одного – 3, у одного – 2, у 19 – по одному невусу. У одной пациентки из 22 кроме диспластического невуса была также удалена меланома.
При гистологическом исследовании в 10 наблюдениях из 28 была установлена 1 степень развития лентигинозной меланоцитарной дисплазии, в 4 – 1–2 степень, в 6 – 2 степень, в 1 – 2–3 степень, в 7 степень развития ЛМД не указана. В одного пациента выявлена поверхностно распространяющаяся меланомы 1 уровня инвазии, развившаяся на фоне ЛМД 3 степени.
По возрасту 22 пациента распределились следующим образом: 20–29 лет – 6 человек, 30–39 лет – 10, 40–49 лет – 4, 50–59 лет – 0, 60–69 лет – 2. Женщин было 18, мужчин – 4. Контингент поликлиники составляют в основном лица женского пола, молодого и зрелого возраста, что и отразилось на половом и возрастном составе оперированных больных. Возраст пациентки с удаленной меланомой – 49 лет.
Возраст пациентки с удаленной меланомой – 49 лет.
Поводом для обращения к онкологу у 5 пациентов были изменение невуса или появление его на неизмененной коже, при этом никаких субъективных ощущений в области невуса не отмечалось. У 9 пациентов диспластические невусы выявлены при профилактическом осмотре онкологом, хирургом или дерматологом, 8 человек (в т. ч. пациентка с меланомой), были направлены терапевтом в связи с наличием множественных невусов. Таким образом, у большинства больных диспластические невусы выявлены при профилактическом осмотре кожных покровов.
Диспластические невусы локализовались на шее у 1 пациента, плече – у 2, предплечье – у 1, бедре – у 4, голени – у 3, спине – у 4, поясничной области – у 3, грудной стенке – у 2, брюшной стенке – у 8. Меланома локализовалась в области предплечья.
В 25 наблюдениях форма удаленных образований была неправильной, напоминала треугольник, полулуние, ромб, в 3 – правильной (округлая или овальная).
Размеры пигментных образований были следующие: 0,3 см в наибольшем измерении – 2 наблюдения, 0,4 см – 6, 0,5 см – 5, 0,6 см – 2, 0,7 см – 6, 0,8 – 1, 1,0–1,2 см – 6. Меланома имела размеры 0,5 х 0,4 см.
Окраска диспластических невусов в 25 наблюдениях была равномерной, цвет от коричневого до темно-коричневого и черного. Невусы светло-коричневого цвета иссечению не подлежали. Неравномерная окраска отмечалась в 3 наблюдениях, когда один край или одна половины невуса были темнее другой. У всех з больных при гистологическом исследовании выявлена 2 степень развития ЛМД. Меланома имела неоднородную окраску коричневого цвета.
Неровные края диспластического невуса (волнистые или зубчатые) отмечены у 3 пациентов из 28. При гистологическом исследовании у всех 3 установлена ЛМД 2 степени развития.
Изменение диспластического невуса отмечено у 4 больных: у 2 – за последние 8–12 мес., у 2 – за последние 2 и 5 лет. Локализация невусов в местах, доступных для самонаблюдения (средняя треть плеча, нижняя треть голени, брюшная стенка), была у 3 пациентов. Эти больные заметили изменения невуса и обратились по этому поводу к врачу.
Локализация невусов в местах, доступных для самонаблюдения (средняя треть плеча, нижняя треть голени, брюшная стенка), была у 3 пациентов. Эти больные заметили изменения невуса и обратились по этому поводу к врачу.
У пациентки с невусом поясничной области изменения выявлены онкологом при динамическом наблюдении. Гистологическое исследование у одного больного выявило 2 степень развития ЛМД, еще у одного – 2–3 степень. В одном наблюдении отмечена «выраженная лентигинозная меланоцитарная дисплазия» без указания степени.
Появление диспластического невуса на неизмененной коже отметили 4 пациента. Пигментные образования у них локализовались на передней поверхности шеи, в нижней трети плеча, в области предплечья, на брюшной стенке, т. е. в местах, доступных для самонаблюдения.
Гистологическое исследование у одного больного выявило ЛМД 2 степени, у одном – 2–3 степени, у 2 степень ЛМД не указана.
Таким образом, при сопоставлении клинических данных с результатами гистологического исследования установлено, что выраженность клинических признаков диспластического невуса соответствует степени развития ЛМД. Наиболее важными признаками развития ЛМД являются: асимметрия окраски, когда одна половина невуса темнее другой, неровные краев, (волнистые, зубчатые), а также изменения невуса за последние несколько месяцев или лет, или появление невуса на неизмененной коже и дальнейший его рост у лиц старше 17 лет.
Наиболее важными признаками развития ЛМД являются: асимметрия окраски, когда одна половина невуса темнее другой, неровные краев, (волнистые, зубчатые), а также изменения невуса за последние несколько месяцев или лет, или появление невуса на неизмененной коже и дальнейший его рост у лиц старше 17 лет.
Диспластические невусы с перечисленными признаками подлежат иссечению в целях предупреждения дальнейшего развития ЛМД. В некоторых случаях удаление диспластического невуса может явиться ранней диагностикой и излечением поверхностно-распространяющейся меланомы.
Приводим клинические наблюдения.
При профилактическом осмотре у пациента 62 лет обнаружен невус на боковой поверхности шеи размером 0,8 х 0,5 см, неравномерной окраски: нижняя половина – светло-коричневого цвета, верхняя — коричневого. Со слов больного, невус появился 8 мес. назад. Гистологическое исследование удаленного невуса выявило ЛМД 2 степени.
Пациентка 39 лет обратилась по поводу невуса в области брюшной стенки черного цвета, размером 0,4 х 0,4 см.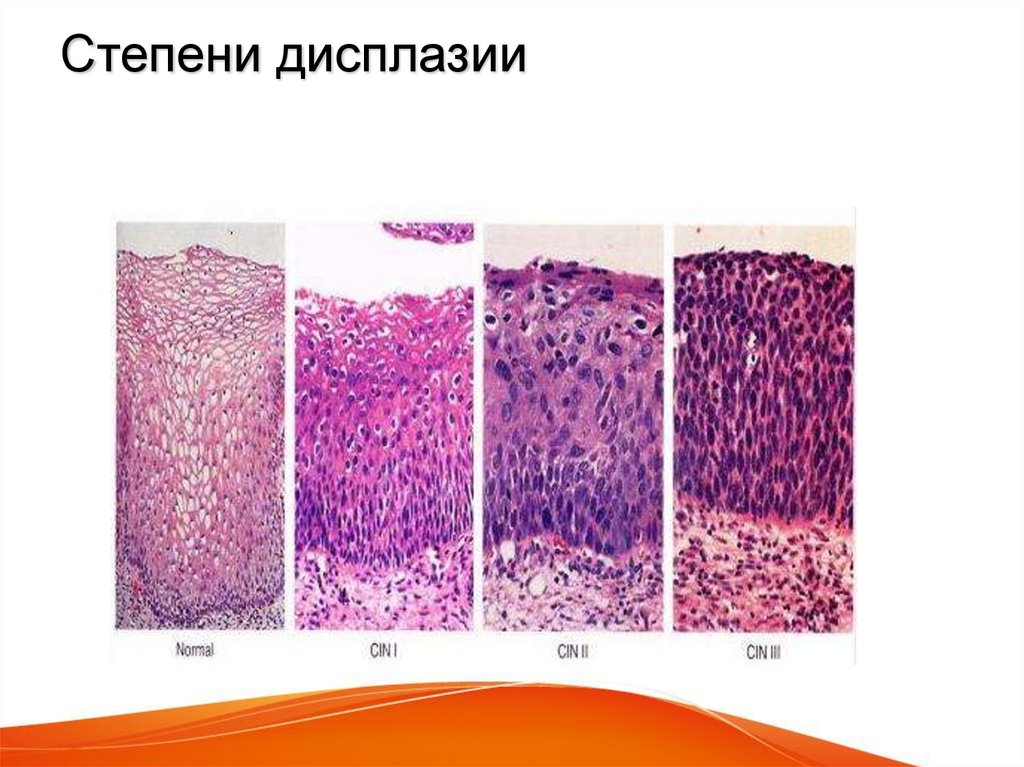 Невус появился на неизмененной коже 5 лет назад. Гистологическое исследование удаленного невуса выявило ЛМД 2–3 степени.
Невус появился на неизмененной коже 5 лет назад. Гистологическое исследование удаленного невуса выявило ЛМД 2–3 степени.
Пациентка 37 лет, обратилась по поводу невуса в надлобковой области 1,0 х 1,0 см, коричневого цвета, более темной окраски у правого края. Со слов больной, невус в течение последних 2–3 лет увеличился в размерах. При гистологическом исследовании удаленного невуса выявлена ЛМД 2 степени.
Пациентка 29 лет, обратилась по поводу невуса в области левого плеча, 0,4 х 0,3 см, окраска которого изменилась в течение последнего года: на фоне розового цвета появился участок коричневого цвета. При гистологическом исследовании первоначально была установлена меланома 1–2 уровней инвазии, однако при пересмотре препарата в МНИОИ им. П.А. Герцена диагноз меланомы не подтвердился, установлен диагноз: диспластический невус с выраженной ЛМД.
Пациентка 49 лет, обратилась по поводу множественных пигментных невусов.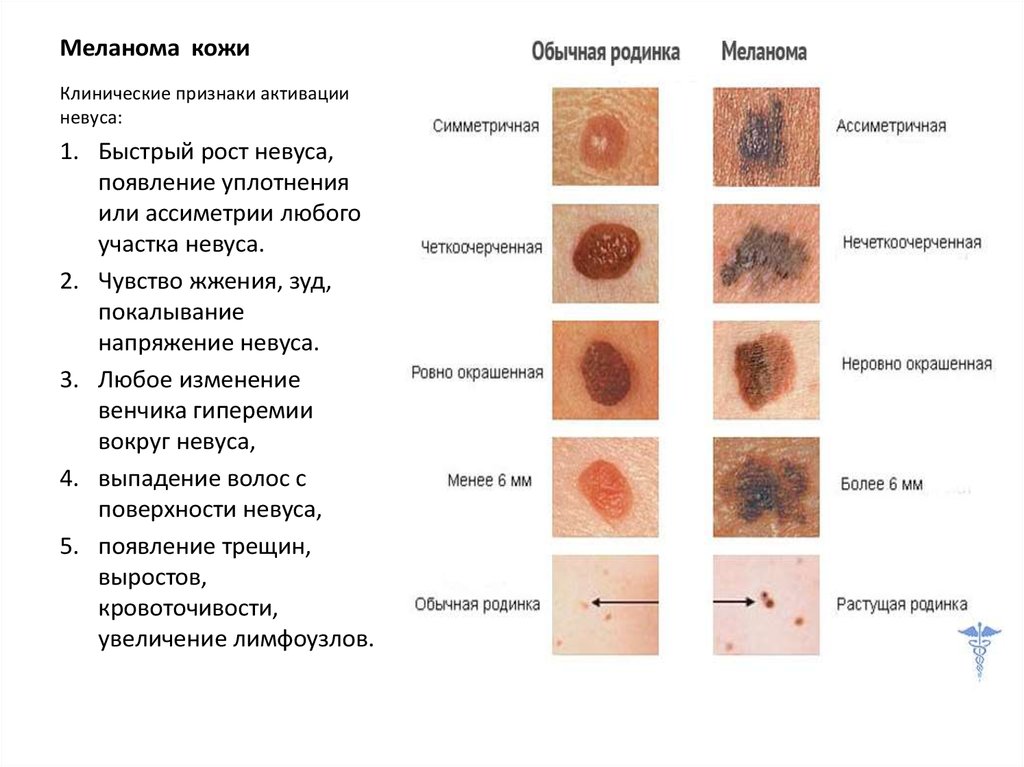 При осмотре: на туловище и конечностях – множественные мелкие диспластические невусы коричневого цвета от 0,2 до 0,5 см диаметре, однородной окраски. В средней трети правого предплечья обнаружен слегка возвышающийся невус телесного цвета, к которому примыкает и частично располагается на его поверхности пигментное пятно неправильной формы, темно-коричневого цвета, 0,5 х 0,4 см. Образование иссечено, отступя от видимых границ 0,4 см.
При осмотре: на туловище и конечностях – множественные мелкие диспластические невусы коричневого цвета от 0,2 до 0,5 см диаметре, однородной окраски. В средней трети правого предплечья обнаружен слегка возвышающийся невус телесного цвета, к которому примыкает и частично располагается на его поверхности пигментное пятно неправильной формы, темно-коричневого цвета, 0,5 х 0,4 см. Образование иссечено, отступя от видимых границ 0,4 см.
При гистологическом исследовании в ГКБ № 52 выявлена меланома с инвазией в ретикулярный слой дермы (3 уровень инвазии). Препарат пересмотрен в МНИОИ им. П.А. Герцена патоморфологом к.м.н. Ягубовой Э.А. Было сделано заключение: на фоне смешанного невуса имеется лентигинозная меланоцитарная дисплазия 3 степени с микрофокусом поверхностно распространяющейся неизъязвленной пигментной меланомы 1 уровня инвазии по Кларку, с минимальной (в пределах плоскоэпителиального покрова ) толщиной по Бреслау.
Таким образом, у больной была диагностирована меланома insitu. При осмотре пациентки через 1 год у нее был удален диспластический невус левой голени с ЛМД 1–2 степени развития. Пациентка осмотрена через 3,5 года после удаления меланомы, признаков рецидива не выявлено.
При осмотре пациентки через 1 год у нее был удален диспластический невус левой голени с ЛМД 1–2 степени развития. Пациентка осмотрена через 3,5 года после удаления меланомы, признаков рецидива не выявлено.
Наши наблюдения показали также, что установить степень лентигинозной меланоцитарной дисплазии и выявить ее переход в поверхностно-распространяющуюся меланому может только опытный патоморфолог. При гистологическом исследовании нередко выявляется сочетание смешанного или внутридермального невуса с лентигинозной меланоцитарной дисплазией, что также представляет трудности для патоморфолога. Клинически подобное сочетание представляет собой папилломатозный невус, на котором располагается, или к которому примыкает пятно темно-коричневого цвета, неправильной формы.
Как показали наши исследования, большинство диспластических невусов, подлежащих удалению, были обнаружены при профилактическом осмотре онкологом, хирургом или дерматологом. Чтобы повысить выявляемость диспластических невусов, необходимо чтобы все практические врачи — терапевты, хирурги, гинекологи, и узкие специалисты обращали внимание на пигментные образования кожи.
Выявление диспластических невусов будет способствовать их своевременному удалению, что позволит снизить высокую смертность от меланомы кожи. По данным J.F. Аitken с соавт., проведенный в Австралии осмотр кожных покровов (скрининг) в 2000–2003 гг. позволил увеличить количество выявляемых «тонких» меланом, т. е. меланом на ранней стадии развития и снизить смертность от этого заболевания [4].
Больным следует также рекомендовать периодический самостоятельный осмотр имеющихся невусов, чтобы во-время заметить изменение размеров, формы или окраски невуса. A. Sapadin с соавт. справедливо отмечают, что у большинства пациентов имеется неправильное представление о невусах, имеющих высокий риск перехода в меланому. Необходимо разъяснять больным, что плоские пигментные невусы более опасны в этом плане, чем возвышающиеся [7], и если они соответствуют критериям АВСD (А – асимметрия, В – неровные края, С – неравномерная окраска, D – размер более 0,6 см ), необходимо обратиться к специалисту.
Выводы
1. Иссечение диспластического невуса с признаками выраженной лентигинозной меланоцитарной дисплазии является профилактикой, а в некоторых случаях – ранней диагностикой и излечением поверхностно распространяющейся меланомы.
2. Диспластический невус с выраженной лентигинозной меланоцитарной дисплазией имеет неправильную форму, неровные края, асимметричную окраску. Наиболее важным признаком развития лентигинозной меланоцитарной дисплазии следует считать замеченные за последние несколько месяцев или лет изменения невуса или появление невуса на неизмененной коже и его дальнейший рост у лиц старше 17 лет. Указанные признаки являются показанием к иссечению невуса для гистологического исследования. При отказе пациента от операции необходимо наблюдать больных 1 раз в 6–12 мес. При наличии изменений невуса за этот период показано его иссечение, при отсутствии изменений – дальнейшее наблюдение.
3. Иссечение диспластического невуса, представляющего собой пигментное пятно, возвышающееся над уровнем кожи не более чем на 0,1 см, следует производить, отступя от видимых границ 0,4–0,5 см. Такое иссечение при выявлении поверхностно распространяющейся меланомы 1–2 уровня инвазии будет достаточным для полного излечения заболевания.
Иссечение диспластического невуса, представляющего собой пигментное пятно, возвышающееся над уровнем кожи не более чем на 0,1 см, следует производить, отступя от видимых границ 0,4–0,5 см. Такое иссечение при выявлении поверхностно распространяющейся меланомы 1–2 уровня инвазии будет достаточным для полного излечения заболевания.
4. Гистологическое исследование диспластических невусов должен проводить опытный патоморфолог, способный отличить диспластический невус от пограничного и смешанного, определить степень лентигинозной меланоцитарной дисплазии и дать правильное заключение об уровне инвазии при обнаружении поверхностно распространяющейся меланомы.
5. Чтобы выявлять диспластические невусы, подлежащие удалению, необходимо, чтобы терапевты, хирурги, гинекологи, а также узкие специалисты при осмотре кожных покровов пациента обращали внимание на пигментные образования кожи и своевременно направляли больных к онкологу.
6. Больным с множественными диспластическими невусами необходимо рекомендовать избегать длительного пребывания на солнце, защищать кожу от солнца одеждой, пользоваться солнцезащитными кремами, а также посещать врача 1 раз в год и периодически осматривать имеющиеся пигментные невусы, чтобы своевременно заметить изменения размеров, формы, цвета или краев пигментного образования.
Больным с множественными диспластическими невусами необходимо рекомендовать избегать длительного пребывания на солнце, защищать кожу от солнца одеждой, пользоваться солнцезащитными кремами, а также посещать врача 1 раз в год и периодически осматривать имеющиеся пигментные невусы, чтобы своевременно заметить изменения размеров, формы, цвета или краев пигментного образования.
Литература/References
- Гольберт З.В. Гистогенез, гистология, классификация пигментных (меланоцитарных) опухолей кожи. В кн.: Пигментные опухоли человека. Серия Онкология. Том 7. Под общей ред. А.И. Шнирельмана. М.: ВИНИТИ, 1975.
- Гольберт З.В., Червонная Л.В., Клепиков В.А., Романова О.А. Лентигинозная меланоцитарная дисплазия как предшественник развития злокачественной меланомы. Архив патологии 1982; 12: 36–41.
- Романова О.А. Ранняя диагностика и профилактика меланомы кожи: Руководство–атлас. М.:МИА, 2012; 20–25.
- Aitken JF, Elwood M, Baade PD, Youl P, English D.
 Clinical whole-body examination reduces the incidence of thick melanomas. Intern J Cancer 2010; 126(2): 450–8.
Clinical whole-body examination reduces the incidence of thick melanomas. Intern J Cancer 2010; 126(2): 450–8. - Clark WH, Reimer RR, Greene M, Ainsworth AM, Mastrangelo MJ. Origin of familial malignant melanomas from heritable melanocytic lesions. The B–K mole syndrom. Arch Dermatol 1978; 114(5): 732–9.
- Elder DE, Leonardi J, Goldman J, Goldman SC, Greene MH, Clark WH. Displastic nevus syndrome. A phenotypic association of sporadic cutaneous melanoma. Cancer 1980; 8.
- Saparadin A, Bronstein M, Saparadin S. Prevalence of patient misperceptions regarding melanoma. Dermatology 2012; 66(4, suppl. 1): AB–147.
- Фицпатрик Т., Джонсон Р., Вульф К., Полано М., Сюрмонд Д. Диспластический невус. Дерматология: Атлас–справочник, 1999; 190–4.
- Мерта Дж. Справочник врача общей практики. Глава 97. Пигментные образования. Пер. с англ. Италия: Мак-Гроу-хилл Либри, 1998.
Эксцизионная биопсия диспластического невуса в условиях районной поликлиники – путь к раннему выявлению меланомы кожи
Журнал «Стационарозамещающие технологии: Амбулаторная хирургия» №3–4/2020
DOI: 10. 21518/1995-1477-2020-3-4-66-72
21518/1995-1477-2020-3-4-66-72
Н.Г. Артемьева, ORCID: 0000-0001-7996-0415, О.А. Романова*, ORCID: 0000-0003-2381-6478, Центральная поликлиника Литфонда; 125319, Россия, Москва, ул. 1-я Аэропортовская, д. 5
Введение. В России отмечается высокая смертность от меланомы кожи – 2,5 на 100 000 населения при заболеваемости 7,7 на 100 000 населения, т. е. умирает каждый третий заболевший. В зарубежных странах – в США, Австралии смертность от меланомы составляет 10–15%. Данная статистика объясняется тем, что пациенты в ранней стадии заболевания к врачам не обращаются, поскольку опухоль в начальной стадии не беспокоит больного и напоминает обычную родинку.
Цель исследования – подтвердить целесообразность удаления прогрессирующего диспластического невуса (ЛМД 3-й ст.) в целях профилактики и ранней диагностики меланомы кожи.
Материалы и методы. В хирургическом отделении ЗАО «Центральная поликлиника Литфонда» с 2009 г. по март 2020 г. авторы удалили 180 пигментных образований с клиническим диагнозом «прогрессирующий диспластический невус». Больные были направлены в хирургическое отделение терапевтами, дерматологами и другими специалистами поликлиники. После консультации онколога под местной анестезией выполнялась эксцизионная биопсия невуса.
по март 2020 г. авторы удалили 180 пигментных образований с клиническим диагнозом «прогрессирующий диспластический невус». Больные были направлены в хирургическое отделение терапевтами, дерматологами и другими специалистами поликлиники. После консультации онколога под местной анестезией выполнялась эксцизионная биопсия невуса.
Результаты. При гистологическом исследовании выявлено 29 (16%) диспластических невусов с ЛМД 3-й ст. и 18 (10%) ранних меланом.
Выводы. Если эксцизионная биопсия диспластического невуса станет рутинной в практике поликлинического хирурга, то это приведет к увеличению ранней выявляемости меланомы и значительно уменьшит смертность от этого заболевания. При эксцизионной биопсии авторы рекомендуют отступление от границ образования 0,5–1,0 см, поскольку клинически отличить прогрессирующий диспластический невус от ранней меланомы не представляется возможным.
Для цитирования: Артемьева Н.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Excisional biopsy of a dysplastic nevus in a district polyclinic is a path to early detection of skin melanoma
Nadezhda G. Artemeva, ORCID: 0000-0001-7996-0415, Olga A. Romanova*, ORCID: 0000-0003-2381-6478, Central Polyclinic of Literary Fund; 5, 1st Аeroportovskaya St., Moscow, 125319, Russia
Introduction. Russia has a high mortality rate of cutaneous melanoma – 2.5 per 100,000 population whereas the incidence rate is 7.7 per 100,000 population, i.e. one in every three patients dies. In the foreign countries (the USA, Australia), melanoma mortality rate is 10-15%. Such high rates are explained by the fact that patients with early-stage disease do not seek medical advice, as in early stages a tumour does not cause inconvenience to a patient and looks like an ordinary mole.
Such high rates are explained by the fact that patients with early-stage disease do not seek medical advice, as in early stages a tumour does not cause inconvenience to a patient and looks like an ordinary mole.
The purpose of the study was to confirm the advisability of removing a progressive dysplastic nevus (grade 3 lentiginous melanocytic dysplasia) with a view to prevent and make early diagnosis of cutaneous melanoma.
Materials and methods. The authors removed 180 pigmented lesions that were clinically diagnosed as a progressive dysplastic nevus in the Surgery Department of Central Polyclinic of Literary Fund from 2009 to March 2020. The patients were referred to the Surgery Department by physicians, dermatologists and other specialists of the polyclinic. Following an oncologist consultation, excisional biopsy of a nevus was performed under local anesthesia.
Results. Histological examination revealed 29 (16%) dysplastic nevi with grade 3 LMD and 18 (10%) early-stage melanomas.
Histological examination revealed 29 (16%) dysplastic nevi with grade 3 LMD and 18 (10%) early-stage melanomas.
Conclusions. If excisional biopsy of a dysplastic nevus becomes routine in Ambulatory Surgery practice, it will increase the early diagnosis of melanoma and significantly reduce mortality rates of this disease. For excisional biopsy, the authors recommend to excise at a distance of 0.5 to 1.0 cm from the lesion boundaries, since it is not possible to clinically distinguish a progressive dysplastic nevus from early melanoma.
For citation: Artemeva N.G., Romanova O.A. Excisional biopsy of a dysplastic nevus in a district polyclinic is a path to early detection of skin melanoma. Ambulatornaya khirurgiya = Ambulatory Surgery (Russia). 2020;(3-4):66-72. (In Russ.) https://doi.org/10.21518/1995-1477-2020-3-4-66-72
Conflict of interest: the authors declare no conflict of interest.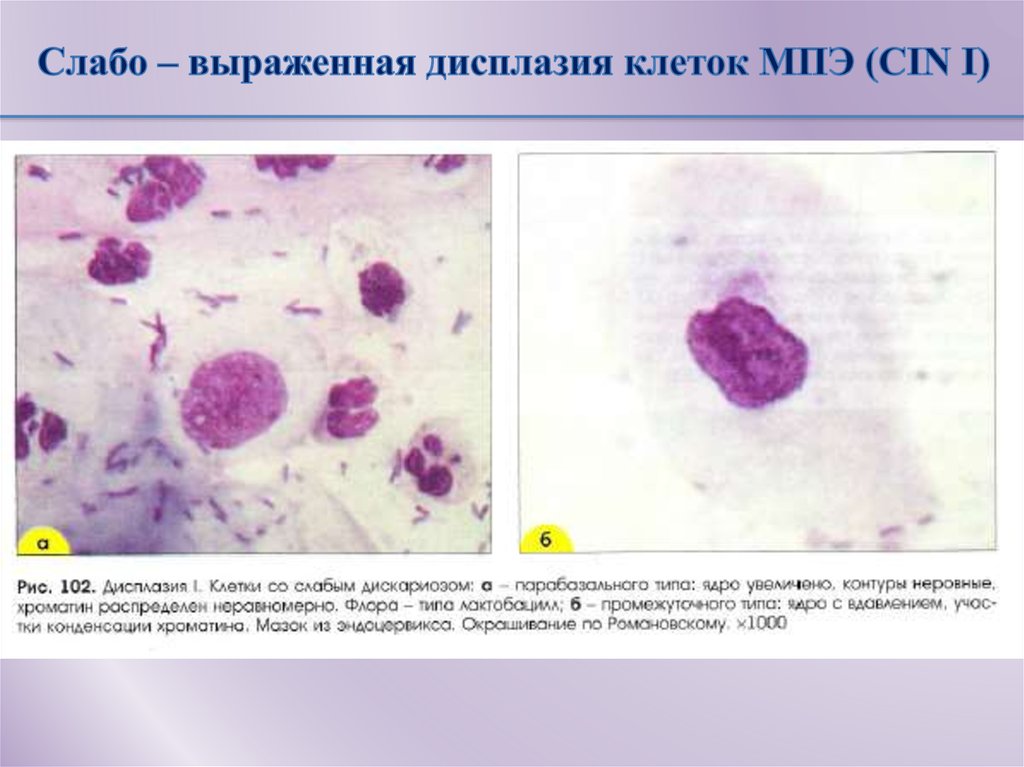
Введение
В 1969 г. W.H. Clark выделил 3 основные формы меланомы кожи, которые отличаются характером развития, темпом прогрессирования и прогнозом [1]. Узловая форма, которая составляет 20% опухолей, отличается быстрым ростом и плохим прогнозом, 2 другие формы – лентиго-меланома и поверхностно-распространяющаяся меланома имеют 2 фазы развития – фазу горизонтального и вертикального роста. Диагностика меланомы в фазе горизонтального роста обеспечивает излечение в 90–98% случаев, наступление 2-й фазы резко ухудшает прогноз. Лентиго-меланома развивается на фоне меланоза Дюбрея и имеет длительную фазу горизонтального роста 15–20 лет (злокачественное лентиго). Поверхностно-распространяющаяся меланома возникает на фоне диспластического невуса или на неизмененной коже, фаза горизонтального роста у нее намного короче – от нескольких месяцев до 5–10 лет.
Актуальность проблемы
В России отмечается высокая смертность от меланомы кожи – 2,5 на 100 000 населения при заболеваемости 7,7 на 100 000 населения, то есть умирает каждый третий заболевший [2]. В зарубежных странах – в США, Австралии смертность от меланомы составляет 10–15% [3]. Такая ситуация объясняется тем, что пациенты в ранней стадии заболевания к врачам не обращаются, поскольку опухоль в начальной стадии не беспокоит больного и напоминает обычную родинку. Поводом для обращения к врачу является, как правило, изъязвление и кровотечение опухоли, что свидетельствует о поздней стадии заболевания. Ранняя меланома должна выявляться врачом активно, при эксцизионной биопсии подозрительного пигментного образования, которое выявляется врачом при осмотре кожи больных, обратившихся по поводу различных заболеваний. Поверхностно-распространяющаяся меланома, которая имеет фазу горизонтального роста, составляет 60–70% меланом и может развиваться как на неизмененной коже, так и на фоне диспластического невуса.
В зарубежных странах – в США, Австралии смертность от меланомы составляет 10–15% [3]. Такая ситуация объясняется тем, что пациенты в ранней стадии заболевания к врачам не обращаются, поскольку опухоль в начальной стадии не беспокоит больного и напоминает обычную родинку. Поводом для обращения к врачу является, как правило, изъязвление и кровотечение опухоли, что свидетельствует о поздней стадии заболевания. Ранняя меланома должна выявляться врачом активно, при эксцизионной биопсии подозрительного пигментного образования, которое выявляется врачом при осмотре кожи больных, обратившихся по поводу различных заболеваний. Поверхностно-распространяющаяся меланома, которая имеет фазу горизонтального роста, составляет 60–70% меланом и может развиваться как на неизмененной коже, так и на фоне диспластического невуса.
Диспластический невус (невус Кларка, лентигинозная меланоцитарная дисплазия) – это приобретенное меланоцитарное образование, которое отличается от обычного невуса наличием пролиферативной активности незрелых меланоцитов, что может привести к развитию меланомы. Диспластический невус впервые бал описан W.H. Clark et al. в 1978 г. [4]. Авторы документально показали переход данного невуса в меланому. В 1980 г. D.E. Elder ввел понятие лентигинозная меланоцитарная дисплазия (ЛМД), что является синонимом диспластического невуса [5]. Подобные невусы были описаны нами в 1982 г. в статье «Лентигинозная меланоцитарная дисплазия как предшественник злокачественной меланомы» [6]. В данной статье профессор МНИОИ им. П.А. Герцена З.В. Гольберт впервые выделила 3 степени ЛМД и показала, что 3-я степень дисплазии приближается к картине меланомы in situ. В настоящее время зарубежные авторы выделяют легкую, умеренную и тяжелую меланоцитарную дисплазию (mild, moderate, severe) [7]. Высокий риск развития меланомы на фоне тяжелой меланоцитарной дисплазии в настоящее время отмечают многие авторы [8–11].
Диспластический невус впервые бал описан W.H. Clark et al. в 1978 г. [4]. Авторы документально показали переход данного невуса в меланому. В 1980 г. D.E. Elder ввел понятие лентигинозная меланоцитарная дисплазия (ЛМД), что является синонимом диспластического невуса [5]. Подобные невусы были описаны нами в 1982 г. в статье «Лентигинозная меланоцитарная дисплазия как предшественник злокачественной меланомы» [6]. В данной статье профессор МНИОИ им. П.А. Герцена З.В. Гольберт впервые выделила 3 степени ЛМД и показала, что 3-я степень дисплазии приближается к картине меланомы in situ. В настоящее время зарубежные авторы выделяют легкую, умеренную и тяжелую меланоцитарную дисплазию (mild, moderate, severe) [7]. Высокий риск развития меланомы на фоне тяжелой меланоцитарной дисплазии в настоящее время отмечают многие авторы [8–11].
Цель исследования – определить выявляемость диспластического невуса с тяжелой меланоцитарной дисплазией (ЛМД 3-й ст.) и ранней меланомы при эксцизионной биопсии пигментных образований с клиническим диагнозом «прогрессирующий диспластический невус».
Материалы и методы
В хирургическом отделении ЗАО «Центральная поликлиника Литфонда» мы с 2009 г. удаляем пигментные образования с клиническим диагнозом «прогрессирующий диспластический невус», что обозначает тяжелую меланоцитарную дисплазию (3-я ст.). Диспластические невусы находят врачи первичного контакта – терапевты, дерматологи и другие специалисты поликлиники при осмотре кожных покровов пациента и направляют его к онкологу. При установлении диагноза «прогрессирующий диспластический невус» пациент направляется к хирургу для выполнения эксцизионной биопсии. Диагноз устанавливается на основании клинико-анамнестических данных, т. е. по признакам ABCDE: неправильная форма невуса (А), неровные края (В), неоднородная окраска (С), диаметр более 0,4 см (D), изменение невуса (E) [12–14]. Эти признаки видны на рис. 1–4.
Рисунок 1. Диспластический невус грудной стенки у женщины 45 лет с лентигинозной меланоцитарной дисплазией 2-й ст.
Рисунок 2. Поверхностно-распространяющаяся меланома брюшной стенки у женщины 34 лет
Рисунок 3. Лентигинозный невус поясничной области у мужчины 77 лет, с очаговой лентигинозной меланоцитарной дисплазией 3-й ст.
Рисунок 4. Меланома in situ на фоне диспластического невуса у женщины 35 лет
В литературе отмечено, что при малых размерах пигментного образования признаки ABCD могут отсутствовать [15, 16]. В этих случаях решающую роль играет признак E – изменение невуса. На рис. 5 и 6 представлено пигментное образование без явных признаков ABCD, однако из анамнеза было известно, что оно существовало длительно, а в последний месяц значительно увеличилось.
Рисунок 5, 6. Меланома правой голени у мужчины 34 лет, 2-й уровень инвазии по Кларку, толщина по Бреслоу 0,75 мм
На рис. 7 также представлено образование без явных признаков ADCD, однако оно появилось 3 мес. назад на неизмененной коже и быстро увеличилось. Эксцизионная биопсия невусов выполняется под местной анестезией, иссекается лоскут кожи с подкожной клетчаткой до фасции, отступление от видимых границ составляет 0,5–1,0 см. Гистологическое исследование проводится в ОАО «Медицина», все препараты диспластических невусов и меланом консультируются в МНИОИ им. П.А. Герцена к.м.н. Э.А. Ягубовой.
Рисунок 7. Поверхностно-распространяющаяся меланома левого предплечья 0,4 см в диаметре у женщины 52 лет
Результаты
Всего с 2009 г. по март 2020 г. было удалено 180 образований с клиническим диагнозом «прогрессирующий диспластический невус». При гистологическом исследовании в 134 случаях выявлен диспластический невус. В 29 случаях установлена тяжелая меланоцитарная дисплазия (ЛМД 3-й ст.), таким образом, диагноз «прогрессирующий диспластический невус» был подтвержден в 16%. В 18 случаях выявлена ранняя меланома, что составило 10%. В 7 случаях из 18 установлена меланома in situ, в остальных – ранняя инвазивная меланома, толщиной по Бреслоу – 1 мм и менее, с уровнем инвазии по Кларку 2–3. В 8 случаях из 18 (44%) установлено развитие меланомы на фоне ЛМД, т. е. из диспластического невуса.
Обсуждение результаты
В наших наблюдениях отмечен довольно высокий процент выявляемости диспластического невуса с тяжелой меланоцитарной дисплазией и ранней меланомы при удалении образований с клиническим диагнозом «прогрессирующий диспластический невус». Это говорит о том, что выявление диспластических невусов врачом первичного контакта с последующей эксцизионной биопсией в хирургическом отделении может значительно повысить раннюю выявляемость меланомы. К такому же выводу в настоящее время приходит ряд отечественных авторов [17, 18]. Мы полагаем, что следует значительно увеличить число эксцизионных биопсий диспластических невусов, выполняемых хирургами поликлиник. Для этого необходимо, чтобы все врачи первичного звена при осмотре больных обращали внимание на пигментные невусы с признаками ABCDE и направляли пациентов к хирургу для выполнения эксцизионной биопсии. Удаление диспластических невусов должно стать рутинным в практике поликлинического хирурга, который должен удалять 20–30 диспластических невусов в год. При удалении диспластического невуса хирургам необходимо иметь ввиду, что прогноз меланомы определяется толщиной опухоли, определяемой при гистологическом исследовании, которая измеряется не в сантиметрах, как при других опухолях, а в миллиметрах. Так, при толщине опухоли 1 мм и менее пятилетняя выживаемость составляет 95–98%, при толщине 3 мм и более – 40–50%. Учитывая вышесказанное, хирург, удаляя диспластический невус, должен убедиться, что пигментное пятно не возвышается над уровнем кожи более чем на 1 мм. В этом случае при выявлении меланомы опухоль будет иметь толщину 1 мм и менее, что определяет хороший прогноз. Если пальпаторно установлено, что диспластический невус возвышается над уровнем кожи более чем на 0,1 см, необходимо направлять пациента к онкологу, так как при выявлении меланомы опухоль будет иметь толщину 2–4 мм и потребует дополнительного лечения. В зарубежной практике при выполнении эксцизионной биопсии диспластического невуса рекомендовано отступать от видимых границ образования 0,2–0,3 см, а при выявлении меланомы производить реоперацию [19].
Некоторые авторы считают, что реоперацию необходимо производить также и при тяжелой меланоцитарной дисплазии, если имеется положительный край резекции [20]. В случае выявления меланомы in situ ВОЗ считает радикальным отступ от границ образования 0,5 см, при удалении ранней инвазивной меланомы – 1,0 см. Многие авторы отмечают, и мы с ними согласны, что отличить прогрессирующий диспластический невус от ранней меланомы, даже при использовании дерматоскопии, не представляется возможным, точный диагноз устанавливается только при эксцизионной биопсии [10, 19]. Учитывая этот факт, мы считаем предпочтительным отступ от границ образования не менее 0,5 см, а в ряде случаев 1,0 см, чтобы не потребовалась реоперация при выявлении инвазивной меланомы.
В наших исследованиях у 17 больных меланомой из 18 образование было иссечено с отступом 1,0 см, в одном случае – 0,5 см, после чего больной с ранней инвазивной меланомой был направлен к онкологу по месту жительства (рис. 5, 6) После проведенной консультации в онкодиспансере реоперация не была рекомендована. Пациент наблюдается 4,5 года без признаков заболевания. На рис. 1, 3 представлены пигментные образования, которые были иссечены с отступом 1,0 см, при гистологическом исследовании выявлены диспластические невусы 2-й и 3-й ст. дисплазии (рис. 1, 3), меланома in situ (рис. 4) и ранняя инвазивная меланома (рис. 2, 7). В случае обнаружения диспластического невуса (рис. 1, 3) такой отступ не требовался, однако после предупреждения, что при меньшем отступе может потребоваться реоперация в случае обнаружения меланомы, больные давали согласие на отступ 1,0 см. Необходимо отметить, что гистологическое исследование удаленного диспластического невуса должен проводить патоморфолог с достаточным опытом диагностики меланоцитарных образований, так как отличить тяжелую меланоцитарную дисплазию (3-й ст.) от меланомы in situ представляет определенные трудности [21, 22]. Следует подчеркнуть, что установление 3-й ст. ЛМД является важным для клинициста, поскольку свидетельствует о высоком риске развития опухоли у данного пациента.
Заключение
Наш десятилетний опыт эксцизионной биопсии диспластических невусов в хирургическом отделении Центральной поликлиники Литфонда показывает, что выявление прогрессирующих диспластических невусов в поликлинике врачом первичного контакта с последующей эксцизионной биопсией в хирургическом отделении приводит не только к профилактике, но и к раннему выявлению меланомы. Распространение этой практики по всей России позволит снизить смертность от меланомы кожи в нашей стране до уровня зарубежных стран. Эксцизионная биопсия диспластического невуса в поликлинике должна стать рутинной практикой поликлинического хирурга. Чем больше будет выполнено эксцизионных биопсий диспластических невусов, тем больше будет выявлено ранних меланом.
Список литературы / References
- Clark W.H., From L., Bernardino E., Mihm C.M. The histogenesis and Biologic Behavior of Primary Human Malignant Melanoma of Skin. Cancer Research. 1969;29(3):705-726. Available at: https://cancerres.aacrjournals.org/content/29/3/705.full-text.2. pdf.
- Каприн А.Д., Старинский В.В., Петрова Г.В. (ред.) Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М.; 2019. 250 с. Available at: https://glavonco.ru/cancer_register/Забол_2018_Электр.pdf.
- Меланома. В: Усатине Р.П., Смит М.A., Мэйе Э.Дж., Шамли Х., Тайсингер Дж. Атлас-справочник практикующего врача. Дерматология. М.: Изд-во Панфилова; БИНОМ. Лаборатория знаний; 2012. 536 с.
- Clark W.H., Reimer R.R., Greene M., Ainsworth A.M., Mastrangelo M.J. Origin of Familial Malignant Melanomas from Heritable Melanocytic Lesions. “The B-K mole Syndrom”. Arch Dermatol. 1978;114(5):732-739. Available at: https://pubmed.ncbi.nlm.nih.gov/646394
- Elder D.E., Goldman L.I., Goldman S.C., Green N.M., Clark W.H. Jr. Displastic nevus syndrome: A phenotypic assotiation of sporadic cutaneous melanoma. Cancer. 1980;46(8):1787-1794. https://doi.org/10.1002/1097-0142(19801015)46:8<1787::aidcncr2820460816>3.0.co;2-s.
- Гольберт З.В., Червонная Л.В., Клепиков В.А., Романова О.А. Лентигинозная меланоцитарная дисплазия как предшественник развития злокачественной меланомы. Архив патологии. 1982;(12):36-41.
- Hale C.S. Dysplastic nevus. PathologyOutlines.com. 2020. Available at: https://www.pathologyoutlines.com/topic/skintumormelanocyticdysplasticnevus.html.
- Меньшикова Н.В., Шишкина Ю.В., Григоренко А.А., Макаров И.Ю., Левченко Н.Р., Ефимцева А.Ф. и др. Лентигиозная меланоцитарная дисплазия. В: Клиническая и патоморфологическая диагностика редко встречающихся повреждений и заболеваний. Случаи из практики. Благовещенск; 2015.
- Артамонова И.И., Малютина Е.В. Клинико-морфологические особенности невусов. Известия Российской Военно- медицинской академии. 2019;1(S1):16-18. Режим доступа: https://elibrary.ru/item.asp?id=38164229.
- Damjanov I., Dotlic´ S., Fenderson B.A., Gatalica Z., Morovic A., Nola M. What are dysplastic nevi? In: Damjanov I. (ed.) Pathology Secrets. 3rd ed. Mosby; 2009. https://doi.org/10.1016/B978-0-323-05594-9.X0001-3.
- Hurt M.A., Weedon D. Weedon D. Weedon’s Skin Pathology. 3rd ed. London: Churchill Livingstone Elsevier; 2010. Dermatol Pract Concept. 2012;2(1):79-82. https://doi.org/10.5826/dpc.0201a15.
- Романова О.А., Артемьева Н.Г. Хирургическая профилактика меланомы кожи. Онкохирургия. 2013;(3):12-18. Режим доступа: https://oncosurgery.oncology.ru/archive/2013/03/3.htm.
- Романова О.А., Артемьева Н.Г., Ягубова Э.А., Рудакова И.М., Марычева В.Н., Вещевайлов Э.А. Тактика ведения пациента с диспластическим невусом. Клиническая дерматология и венерология. 2015;14(2):92-97. https://doi.org/10.17116/klinderma201514292-97.
- Романова О.А., Артемьева Н.Г., Солохина М.Г., Марычева В.Н., Вещевайлов А.А., Купчиков С.А. Клинико-морфологические параллели в диагностике прогрессирующего диспластического невуса и ранней меланомы кожи. Онкология. Журнал им. П.А. Герцена. 2019;(1):26-31. https://doi.org/10.17116/onkolog2019801126.
- Сергеев Ю.Ю., Мордовцева В.В. Опыт диагностики меланомы кожи диаметром менее 6 мм. Клиническая дерматология и венерология 2018;17(4):97-105. https://doi.org/10.17116/klinderma20181704197.
- Соколова А.В., Малишевская Н.П. Ошибки в диагностике меланоцитарных новообразований кожи. Современные проблемы науки и образования. 2018;(2). Режим доступа: https://science-education.ru/ru/article/view?id=27502.
- Гаранина О.Е., Лебедева О.Е., Шливко И.Ф., Клеменова И.А., Донченко Е.В., Дардык М.В. и др. Ранняя диагностика злокачественных новообразований кожи: новый взгляд на решение проблемы. Клиническая дерматология и венерология. 2018;17(5):101-108. https://doi.org/10.17116/klinderma/201817051101.
- Эберт М.А., Гафтон Г.И., Зиновьев Г.В., Гафтон И.Г. Современный взгляд на диагностику меланомы кожи. Вопросы онкологии. 2019;65(5):638-644. Режим доступа: https://elibrary.ru/item.asp?id=41271925.
- Диспластический невус. В: Усатине Р.П., Смит М.A., Мэйе Э.Дж., Шамли Х., Тайсингер Дж. Атлас-справочник практикующего врача. Дерматология. М.: Изд-во Панфилова; БИНОМ. Лаборатория знаний; 2012. 536 с.
- Reddy K.K., Farber M.J., Bhavan J., Geronemus R.G., Rogers G.S. Atypical (dysplastic) nevi. Outcomes of surgical excision and association with melanoma. JAMA Dermatol. 2013;149(8):924-934. https://doi.org/10.1001/jamadermatol.2013.4440.
- Червонная Л.В. Пигментные опухоли кожи. М.: ГЭОТАР-Медиа; 2016. 81 с.
- Gerami P. 31 — Clinical, Dermoscopic, Pathologic and Molecular Correlation. In: Busam K., Gerami P., Scolyer R. Pathology of Melanocytic Tumors. Elsevier; 2019, pp. 374-384. https://doi.org/10.1016/B978-0-323-37457-6.00031-6.
Невус или меланома?
Как уже говорилось, новообразования кожи должны быть предметом повышенного внимания и онкологической настороженности.
Если гистологическое исследование выявляет злокачественные процессы, пациент направляется на лечение к онкологу. Медицинская статистика свидетельствует, что ранняя диагностика способна предотвратить фатальное развитие этих процессов.
Главное — вовремя заметить
Пигментные образования кожи, имеющие вид коричневых пятен и бляшек, иначе говоря, родинки, специалисты именуют невусами (еще о проблемах гиперпигментации кожи — далее, стр. 27). Чаще представляющие собой доброкачественные опухоли, невусы образуются из меланоцитов — клеток, вырабатывающих меланин. Невусы можно отнести к так называемым визуальным опухолям, поскольку их возникновение, рост и внешние трансформации происходят на глазах у пациента. Именно поэтому очень важно предельно внимательно отнестись к появлению такого образования, правильно интерпретировать изменения уже существующего, чтобы вовремя обратиться к специалисту и не оказаться перед грозным диагнозом — меланома.
Меланома — довольно редкая опухоль кожи, которая, как и невусы, возникает из меланоцитов, но относится к категории злокачественных. Широко распространенное мнение о ее фатальности связано, несомненно, с поздней диагностикой. Изъязвление, некроз по поверхности бляшковидного образования, кровоточивость, появление мелких узелков в коже по периферии, — именно эти внешние признаки, характерные для поздних стадий развития заболевания, обычно и описывает учебная литература. При том, что ранние признаки меланомы хорошо известны, на них, к сожалению, не всегда обращается должное внимание пациента и врача.
Специалисты отмечают, что для благоприятного прогноза нужна не только своевременная диагностика, но и выявление так называемых предмеланомных процессов. Далеко не все невусы имеют риск по малигнизации, т. е. трансформации в меланому, фоном для ее возникновения служат лишь некоторые невусы особых гистологических форм.
В косметологические учреждения наиболее часто обращаются пациенты со вполне доброкачественными пигментными опухолями кожи меланоцитарного генеза, относящимися к категории невусов. Пятна и бляшки, относящиеся к этой категории невусов, могут быть различного размера и окраски — от светло-желтого до черного; известны также экзофитные образования в виде полипов. Внешние проявления невусов связаны, как правило, с гистологическими вариантами их строения.
Лентигинозная меланоцитарная дисплазия
Мы остановимся на наиболее опасной разновидности невусов, на фоне которых может возникнуть злокачественная меланома. К подобной группе риска относятся диспластичные невусы, или лентигинозная меланоцитарная дисплазия (ЛМД).
Диспластичный невус, как следует из названия (дис — нарушение, плазия — созревание), — атипичное образование, результат нарушения созревания клетки. Речь идет об увеличении ядер, изменении ядерно-цитоплазматического соотношения, клеточном полиморфизме.
В настоящее время уже достаточно данных, чтобы считать, что злокачественные опухоли не возникают de novo, т. е. в неизмененных тканях; фоновым изменением при малигнизации клеток является в первую очередь дисплазия клеток.
Пятна ЛМД выявляются в молодом и среднем возрасте, носят обычно множественный характер, но могут встречаться и единично. Способность озлокачествляться в меланому в 30—45% случаев через сравнительно короткий (от 3 до 9 лет) промежуток времени с момента возникновения — один из поводов особого внимания специалистов.
Пятна лентигинозной меланоцитарной дисплазии, как правило, плоские или слегка возвышающиеся над поверхностью кожи, имеют округлую форму, довольно четкие границы, окраску от коричневого до черного цвета, достигают в диаметре от 5 до 12 мм (синдром крупных атипичных невусов) и отличаются отсутствием волос. Располагаются они преимущественно на спине, плечах, ногах, реже — на ягодицах и руках, изредка — на слизистых оболочках.
В клинической диагностике лентигинозной меланоцитарной дисплазии эффективно использование лупы или дерматоскопа. При подобном исследовании выявляется некоторая неоднородность окраски в виде множества точек, сливающихся и укрупняющихся на отдельных участках. При нарастании выраженности дисплазии отмечаются очаги слабой депигментации и усиление пестроты окрашивания пятна, можно также обнаружить блеск. При первичном осмотре важное значение имеет не только дифференциальная диагностика лентигинозной меланоцитарной дисплазии с другими вариантами невусов, но и диагностика начала возможной малигнизации.
Ранними признаками развития меланомы на фоне лентигинозной меланоцитарной дисплазии являются:
- ощущения зуда и распирания в области пятна;
- сферическое выбухание пятна или его участков над поверхностью кожи;
- натяжение, блеск, потеря кожного рисунка над выступающими участками;
- изменение окраски;
- появление припухлого, розоватого венчика вокруг пятна.
При гистологическом исследовании характерным признаком ЛМД в первую очередь является дисплазия меланоцитов; при этом обязательны еще два признака — реактивные изменения эпидермиса и реакция дермы. При диагнозе ЛМД в гистологическом заключении должна быть обязательно установлена степень выраженности дисплазии — это необходимо для того, чтобы определить степень риска трансформации в меланому.
В зависимости от количества и локализации диспластичных меланоцитов выделяют 3 степени лентигинозной меланоцитарной дисплазии:
- Меланоциты расположены цепочкой в отдельных базальных отделах эпидермиса.
- Меланоциты формируются в виде сот.
- Меланоциты, сливаясь, занимают нижние отделы эпидермиса.
При третьей степени ЛМД диагностику заболевания облегчает знание его отличительного признака — отсутствие распространения меланоцитов в верхние отделы эпидермиса.
Тактика лечения
На основании приведенных клинико-морфологических особенностей ЛМД авторами статьи проводилась диагностика и лечение этой патологии. Обратившись к результатам исследований, проведенных за последние три года в Институте пластической хирургии и косметологии МЗ РФ, можно сообщить: лентигинозная меланоцитарная дисплазия была выявлена у 60 пациентов, у двоих было удалено по два пятна ЛМД. У трех пациентов на фоне лентигинозной меланоцитарной дисплазии была обнаружена меланома I—II уровня инвазии (т. е. проникновения злокачественных клеток вглубь тканей) по Кларку. В 18 случаях выявлялась комбинация ЛМД с различными типами невусов — смешанным, внутридермальным, Шпиц-невусом и гигантским врожденным невусом.
В случаях лентигинозной меланоцитарной дисплазии врачебная тактика была следующей:
- При обнаружении пятна, подозрительного по ЛМД, проводился тщательный осмотр всего кожного покрова, так как при данной патологии характерна множественность проявления.
- Удаление пятна осуществлялось преимущественно хирургическим методом в пределах здоровых тканей, отступая от образования не менее 0,3—0,5 см.
- гистологическое исследование.
- При установлении диагноза пациент был информирован о характере заболевания и его особенностях. Было рекомендовано наблюдение за кожным покровом на предмет появления новых пятен ЛМД.
Отметим, что, несмотря на возможность неблагоприятного развития лентигинозной меланоцитарной дисплазии и ее преобразования в меланому, большинство наблюдений, проведенных в Институте пластической хирургии и косметологии МЗ РФ, указывают на возможность доброкачественного развития ЛМД с формированием структур безобидного внутридермального невуса или его других вариантов.
Риск последующего развития меланомы кожи при невусах с умеренной дисплазией после тотальной биопсии, но при положительном гистологическом анализе краев иссечения
Риск последующего развития меланомы кожи при невусах с умеренной дисплазией после тотальной биопсии, но при положительном гистологическом анализе краев иссечения
История недели
Опубликовано на канале Дерматология
Перевод Ю.Н. Вьюнкова
Скан журнала / Исследование · 24 октября 2018 года
Риск последующего развития меланомы кожи при невусах с умеренной дисплазией после тотальной биопсии, но при положительном гистологическом анализе краев иссечения
Журнал JAMA Dermatology
КЛЮЧЕВЫЕ МОМЕНТЫ
Это многоцентровое ретроспективное когортное исследование включало 467 невусов с умеренной дисплазией после тотальной биопсии ( бритвенная эксцизия, панч-биопсия, elliptical excision) без остаточной пигментации но с наличием позитивных краев при гистопатологическом исследовании. После среднего периода наблюдения в 6.9 лет в месте биопсии не было отмечено случаев развития МК. У 100 пациентов (22,8%) отмечалось развитие первичной МК на другом участке тела из другого диспластического невуса. Предшествующая меланома кожи у пациента и подтвержденный гистологически невус с умеренной дисплазией с гистологически позитивными краями независимо ассоциировались с последующим развитием МК на другом участке кожи.
Маловероятно развитие меланомы кожи на месте невуса с умеренной дисплазией с гистологически позитивными краями, и наблюдение является разумным подходом к ведению пациентов с таким поражением. Результаты, указывающие на повышенный риск развития МК на другом участке кожи, еще больше подтвердили необходимость регулярного осмотра кожи у пациентов с двумя или более биоптированными диспластическиеми невусами (включая один с умеренной дисплазией).
– Caroline K. Crabtree, MD
абстракт
Данный абстракт доступен на сайте издателя
АКТУАЛЬНОСТЬ
Существует мало данных для руководства по лечению невусов с умеренной дисплазией после эксцизионнной биопсии без остаточной клинической пигментации но с гистологически позитивными краями (здесь и далее обозначается невусы с умеренной дисплазией и гистологически позитивными краями).
ЦЕЛЬ
Определить результаты и риски развития последующей меланомы кожи (МК) после невусов с умеренной дисплазией с гистологически позитивными краями при наблюдении в течение 3 и более лет.
ДИЗАЙН, МЕСТО ПРОВЕДЕНИЯ И УЧАСТНИКИ
Было проведено многоцентровое (9 университетских дерматологических центров в США) ретроспективное когортное исследование с участием пациентов в возрасте 18 лет и старше. У участников исследования были диагностированы невусы с умеренной дисплазией и гистологически позитивными краями, при этом наблюдение осуществлялось в течение 3 и более лет подряд; сбор данных проводился в период с 1 января 1990 года по 31 августа 2014 года. Проводился анализ записей относительно демографических данных пациентов, типа биопсии, выявленных патологий, а также развития последующей МК в месте биопсии или где-либо еще на теле. Точный критерий Фишера и вариационный анализ использовались для оценки однофакторной ассоциации с риском последующего развития МК, в дополнение к многофакторным регрессионным логистическим моделям. Для подтверждения гистологической градации каждый участок исследования представлял по 5 случайных репрезентативных наборов слайдов для централизованного дерматопатологического обзора. Статистический анализ проводился с 1 октября 2017 года по 22 июня 2018 года.
ОСНОВНЫЕ КРИТЕРИИ ЭФФЕКТИВНОСТИ
Развитие МК в месте биопсии или где-либо на теле, где ранее были невусы с умеренной дисплазией и гистологически позитивными краями.
РЕЗУЛЬТАТЫ
Всего была проведена оценка 467 невусов с умеренной дисплазией с гистологически позитивными краями у 438 пациентов (193 женщины и 245 мужчин; средний [СО] возраст 46,7 [16,1] лет). Ни в одном случае развитие МК не произошло в месте биопсии, при этом среднее время наблюдения составило 6.9 (3.4) года. Однако у 100 пациентов (22.8%) отмечено развитие МК на другом участке тела. Результаты многофакторных анализов выявили, что анамнез МК в значительной мере ассоциировался с риском последующего развития МК на другом участке (отношение рисков, 11.74; 95% ДИ, 5.71-24.15; P < .001), как в случае с ранее биоптированными диспластическими невусами (отношение рисков, 2.55; 95% ДИ, 1.23-5.28; P = .01). Результаты централизованного дерматопатологического обзора выявили совпадение в 35 из 40 случаев (87.5%). В трех из 40 случаев (7.5%) в невусах определялись высокая степень дисплазии, из них один был интерпретирован как меланома in situ. После 5 лет наблюдения у этого пациента не наблюдается рецидива или данных за развитие МК.
ВЫВОДЫ И ЗНАЧИМОСТЬ
Результаты данного исследования позволяют предположить, что тщательное наблюдение с рутинным осмотром кожи является разумным подходом к ведению невусов с умеренной дисплазией с гистологически позитивными краями. Однако наличие 2 и более биоптированных диспластических невусов (при умеренной дисплазии в одном из них), по-видимому, ассоциируется с повышением риска последующего развития МК на отдельном участке.
Дерматологические теги
— Хирургия в дерматологии
— Дерматопатология
— Общая дерматология
— Лекарственная дерматология
— Меланоцитарный невус и новообразование
Авторское право © 2018 Эльзевир Инк. Все права защищены.
Дополнительная информация
Цитирование статьи
Журнал JAMA Dermatology
Риск последующего развития меланомы кожи при невусах с умеренной дисплазией после эксцизионной биопсии, но при положительном гистологическом анализе краев иссечения
JAMA Dermatol 2018 Oct 10;[предварительная электонная публикация], CC Kim, EG Berry, MA Marchetti, SM Swetter, G Lim, D Grossman, C Curiel—Lewandrowski, EY Chu, ME Ming, K Zhu, M Brahmbhatt, V Balakrishnan, MJ Davis, Z Wolner, N Fleming, LK Ferris, J Nguyen, O Trofymenko, Y Liu, SC Chen
Из MEDLINE®/PubMed®, базы данных Национальной Медицинской Библиотеки США.
https://www.practiceupdate.com/c/74782/3/4/?elsca1=emc_enews_top-10&elsca2=email&elsca3=practiceupdate_derma&elsca4=dermatology&elsca5=newsletter&rid=NTU2MjE4MDgyOTQS1&lid=10332481
Синхронно развившиеся узловая меланома и лентигинозная меланоцитарная дисплазия
Опубликовано AlexGetman в пт., 23/12/2016 — 17:17.
Общие клинические характеристики пациентаКлинический диагноз:
Узловая меланома кожи спины pT4N0M0, IIB St, 3 клиническая группа. Диспластический невус кожи лобной области (лентигинозная меланоцитарная дисплазия 2 степени). Состояние после хирургического лечения. Гистология и фото препаратовРезультаты гистологического исследования
Гистопатологическое заключение:
См прикрепленный снимок
Фото гистологических срезов:
Обратился на прием в начале декабря 2016 г. с жалобами на наличие родимых пятен на коже спины, на воспалительные явления в одной из родинок, на кровоточивость её. Пигментные образования на коже появляются в течение жизни, активно не изменяются, не беспокоят (если не травмируются). Не обследовался, за медицинской помощью не обращался. Воспалительные явления в родинке на спине и кровоточивость беспокоили в течение 2-х недель (это и явилось причиной обращения внимания на опухоль). Родственный анамнез по меланоме и другим ЗНО кожи не отягощен. В личном анамнезе — неоднократные солнечные ожоги.
На момент обращения: периферические лимфатические узлы не увеличены. На коже шеи и туловища (преимущественно на спине) — большое количество себорейных кератом от 0,3 до 1,5 см в диаметре, с различной степенью выраженности кератинизации. В поясничной области слева имеется экзофитное округлое безболезненное упругое фиолетово-коричневое образование 1,2 см в диаметре, с изъязвлением по верхнему краю опухоли и наличием толстой геморрагической корки на поверхности язвы. Дерматоскопия — картина узловой меланомы кожи с изъязвлением: образование меланоцитарное, асимметричное (асимметрия 2 балла), полихромное. Большое количество атипичных фиолетово-коричневых глобул по периферии сочетается с бело-голубой вуалью и гомогенно пигментированными участками, изъязвлением в центральной части опухоли. В центре опухоли имеется скопление точечных сосудов. На коже в лобной области (граница с волосистой частью головы) — неравномерно окрашенное (пятнистого типа) коричневое плоское образование 1,3 см в диаметре, с темным серо-коричневым очагом по нижнему краю. Дерматоскопия: образование меланоцитарное, асимметрия 2 балла, полихромное. По крам очага поражения имеются островки атипичной пигментной сети. В центральной части — обширные участки гомогенного окрашивания молочно-розового и розово-коричневого цвета. По нижнему краю имеется крупноая гиперпигметированная область с зернистой серо-черной пигментацией, формирующей кольцевидно-зернистые структуры. Данная дерматоскопическая картина может говорить о наличии лентигомеланомы.
По результатам осмотра установлен диагноз: Мультифокальная меланома кожи (?): узловая меланома кожи поясничной области с изъязвлением; лентигомеланома (?) кожи волосистой части головы. 2 клиническая группа. Пациенту после дообследования (по данным рентгеновского исследования органов грудной полости, УЗИ органов брюшной полости и периферических лимфатических узлов признаков Mts не выявлено) произведено широкое иссечение опухоли кожи поясничной области и иссечение образования на коже в лобной области. Учитывая результат патогистологического исследования запланировано проведение КТ головного мозга и ПЭТ КТ всего тела. Рейтинг:Средний рейтинг: 5 (20 votes)
О важности ранней диагностики меланомы кожи
В общей структуре злокачественных новообразований меланома кожи составляет 1–4 %. Беларусь входит в группу стран с относительно невысокими показателями заболеваемости данной патологией. Однако по темпам прироста заболеваемости за последние 10 лет меланома кожи занимает второе место (+51,4 %) после рака предстательной железы. С 2000 по 2019 год число ежегодно выявляемых случаев меланомы в нашей стране увеличилось с 420 до 1 029 (почти в 2,5 раза).
ОПУХОЛЬ С КРАЙНЕ ВЫСОКОЙ СТЕПЕНЬЮ ЗЛОКАЧЕСТВЕННОСТИ
Меланома — злокачественная опухоль нейроэктодермального происхождения, исходящая из меланоцитов. Меланома кожи (МК) характеризуется крайне высокой степенью злокачественности и необычайно большой энергией метастазирования, которое происходит лимфогенным, гематогенным и лимфогематогенным путем. При этом метастазы МК могут быть иногда единственным или первым проявлением опухолевого процесса (от 2 % до 20 %).
Опухоль может развиваться в любой области тела, но излюбленной ее локализацией у женщин является туловище и нижние конечности, а у мужчин — туловище и верхние конечности.
Одной из характерных черт заболеваемости МК является более быстрый ее рост среди городских жителей, высокая доля лиц, заболевающих в трудоспособном возрасте, и более высокий риск для женщин в молодом и среднем возрасте по сравнению с мужским населением. Заболевшие МК примерно на 10 лет моложе других онкологических пациентов. Средний возраст пациентов на момент постановки диагноза — 55 лет. Крайне редко меланома развивается у детей.
Локализованную форму МК (1–2-я стадия) диагностируют примерно в 80–85 % случаев, меланому с метастазами в регионарных лимфатических узлах в 10–15 %. В 3–5 % случаев выявляется первично-диссеминированная опухоль.
ПРОГНОЗ И ВЫЖИВАЕМОСТЬ
При выявлении МК без метастазов прогноз зависит главным образом от толщины опухоли по Бреслоу, уровня инвазии по Кларку и изъязвления, отражающих потенциал ее агрессивности, о чем свидетельствует высокий процент возврата болезни после проведенного лечения у пациентов с безметастатическими формами. Примерно в 40 % случаев после радикальной операции появляются регионарные и отдаленные метастазы (иногда через много лет после завершения лечения). По сводным данным, пятилетняя выживаемость при толщине меланомы менее 1 мм превышает 90 %, а при толщине более 4 мм составляет всего 45–63 %.
В то же время МК не является болезнью с однозначно плохим прогнозом. Стойкое излечение после радикальной операции при 1-й стадии может быть достигнуто у 80–90 % пациентов.
ФАКТОРЫ РИСКА
К известным факторам риска развития МК относятся: первый и второй фототипы кожи, избыточная инсоляция и солнечные ожоги, особенно в детском возрасте (риск развития меланомы после трех и более солнечных ожогов увеличивается в 2,5–6,3 раза), меланома в анамнезе, атипические невусы, наличие более 100 любых меланоцитарных невусов.
В 5–14 % случаев МК является наследственным заболеванием, обусловленным изменениями в генах, в частности герминальными мутациями в генах регуляции клеточного цикла CDKN2A и CDK4, а также в других генах.
СВЯЗЬ С НАЛИЧИЕМ НЕВУСОВ
МК может возникать как из меланоцитарных невусов и меланоза Дюбрея (синонимы: меланотическая веснушка Гетчинсона, лентиго злокачественное, меланоз предраковый ограниченный), так и de novo (на визуально неизмененной коже). В целом с меланоцитарными невусами ассоциировано около 20–30 % всех случаев МК. Риск ее развития из меланоцитарных невусов зависит от возраста и варьирует от 1:200 000 (у лиц моложе 40 лет) до 1:33 000 (у лиц старше 69 лет). Меланома может развиваться из любых меланоцитарных невусов, но более часто из больших врожденных и атипических (диспластических невусов).
Диспластический меланоцитарный невус (невус Кларка, атипичный невус, лентигинозная меланоцитарная дисплазия). Это вариант приобретенного меланоцитарного невуса с клиническими и морфологическими признаками атипии. Клинические и патоморфологические признаки диспластического меланоцитарного невуса коррелируют далеко не всегда. Поэтому при наличии только клинических признаков используют термин «клинически атипичный невус». Диспластические меланоцитарные невусы бывают одиночными и множественными.
Рисунок 1.Средние их размеры превышают таковые обычных приобретенных невусов (более 5 мм). Диспластический невус характеризуется неравномерной пигментацией (центр одного цвета, края — другого) с широкой вариацией цвета (от светло-серого до темно- коричневого и розового). Форма новообразования неправильная (овоидная), поверхность, как правило, плоская, контуры нечеткие с размытым краем (см. рис. 1).
Большинство диспластических невусов появляются до начала полового созревания. Наблюдаемая частота в популяции составляет 2–8 %. Диспластические невусы являются наиболее частыми потенциальными предшественниками меланомы и клиническими маркерами высокого риска ее развития. Потенциальный риск МК при наличии 1–5 диспластических меланоцитарных невусов увеличивается в 3,8 раза, а при 6 или более — в 6,8 раза.
Синдром дисплаcтического невуса характеризуется сочетанием большого количества меланоцитарных невусов (50–100 и более), некоторые из них имеют клинические и морфологические характеристики диспластических невусов.
Синдром дисплаcтического невуса и семейная меланома обусловлены мутациями различных генов, чаще всего 1р36 или 9р21, причем клоны мутантных меланоцитов могут активизироваться под действием УФО, которое способствует промоции клеточных альтераций в генетически «инициированных» меланоцитах и в нормальной коже, приводя к формированию новых диспластических невусов, трансформации существующих в МК или развитию опухоли de novo.
Синдром дисплаcтического невуса может быть спорадическим и унаследованным. При наследственном характере синдрома, в случае если среди родственников первой степени родства имелись случаи МК, используется термин FAMM-синдром (Famial Atypic Mole Melanoma Syndrome). По данным WHOMP (World Health Organisation Melanoma Program), развитие МК в диспластическом невусе отмечается в 35 % случаев у пациентов с FAMM-синдромом и в 17 % — со спорадическими диспластическими невусами.
Рисунок 2. Типичный невус Шпиц (эпителиоидный и/или веретеноклеточный невус) клинически представляет собой розовую плотную, хорошо ограниченную опухоль без роста волос диаметром до 1 см (см. рис. 2). Локализуется главным образом на голове и шее (более 50 %) и конечностях. Новообразования наиболее часто диагностируются в детском возрасте. Невусы Шпиц нередко требуют проведения дифференциальной диагностики с другими беспигментными новообразованиями кожи, включая беспигментную МК.
Рисунок 3.Невус Рида выявляется обычно в возрасте от 6 до 17 лет. Может локализоваться на любом участке кожного покрова, но чаще на нижних конечностях (50 %), реже на туловище (27 %) и верхних конечностях (18 %). Отличительной чертой большинства поражений является однородная темная окраска — черная (46 %), темно-коричневая (30 %). Возможны оттенки серого и синего (см. рис. 3).
Меланоз Дюбрея является облигатным предмеланомным заболеванием кожи. Поражение диагностируется преимущественно у пожилых людей. Заболевание начинается с появления на коже небольшого коричневого пятна, медленно распространяющегося по периферии, которое может достигать размеров 6 см и более. Характерной особенностью является неравномерная окраска, наличие участков от светло-коричневого до синевато-черного цвета. Вначале пятно с неровными краями не возвышается над поверхностью кожи, не уплотнено, рельеф кожи не изменен. Внешний вид его нередко напоминает рисунок географической карты.
В последующем на поверхности могут появляться небольшие папулы и бляшки. Поражается в большинстве случаев кожа щек, носогубных складок, носа, лба, шеи. Частота развития МК достигает 30–80 % с инкубационным периодом от 3 до 20 лет.
КЛИНИЧЕСКАЯ ДИАГНОСТИКА
Клинические проявления МК очень многообразны. На момент самостоятельного обращения пациентов размеры опухоли чаще всего не превышают 1–3 см в наибольшем измерении. Форма новообразования может быть плоской, узловой, бугристой, полусферической (существенно реже грибовидной), консистенция — чаще всего плотной, поверхность — блестящей, мокнущей, легко кровоточащей или покрытой корочками и изъязвлениями.
Пигментация равномерная или пятнистая, цвет коричневый, черный, синий, серый, розовый, красно-розовый, фиолетовый или фиолетово-розовый, причем в пределах одной и той же опухоли может быть несколько цветовых сочетаний. Весьма достоверные признаки МК: появление новых «дочерних» узелковых или пигментных включений рядом с новообразованием. Основными клиническими типами МК являются: узловая, поверхностно-распространяющаяся, злокачественная лентиго-меланома и акральная меланома.
Рисунок 4. Медленно растущее пятно неправильных очертаний, черного и темно-коричневого цвета с очагами регрессии. Опухоль на передней поверхности грудной стенки появилась около 3 лет назадПоверхностно-распространяющаяся меланома составляет 50–70 % всех МК (см. рис. 4). Опухоль развивается одинаково часто как на неизмененной коже, так и из пигментного невуса. Представляет собой бляшку неправильной конфигурации с фестончатым контуром, нередко с очагами регрессии и мозаичной окраски. Биологический потенциал злокачественности в фазе радиального роста относительно низок, опухоль может не метастазировать в течение нескольких лет. Однако в последующем на плоском новообразовании появляется узел, свидетельствующий о наступлении фазы вертикального роста и высокой вероятности развития как регионарных (лимфогенных), так и отдаленных (гематогенных) метастазов.
Рисунок 5. Пигментированный быстрорастущий узел с неравномерной преимущественно темной окраской. Опухоль на спине появилась около 6 месяцев назадУзловая меланома составляет 20–30 % всех МК (см. рис. 5). Клинически представляет собой пигментированный узел, реже полиповидное образование на коже. Пациенты отмечают быстрое, в течение нескольких месяцев, удвоение размеров новообразования, его раннее изъязвление и кровоточивость.
Рисунок 6. Быстрорастущий розоватого цвета узел с несколькими участками пигментации. Опухоль на спине появилась около 6 месяцев назад.Около 5 % узловых меланом не имеют пигмента и представляют собой достаточно быстро растущую розоватого цвета опухоль (см. рис. 6). Узловые формы МК, особенно изъязвленные, характеризуются крайне агрессивным течением.
Меланома типа злокачественного лентиго составляет около 15 % всех МК. В типичных случаях диагностируется у пожилых людей на коже лица и шеи в виде пятна или плоской бляшки неправильных очертаний, черно-коричневого цвета. Визуально опухоль напоминает поверхностно-распространяющуюся форму, но характеризуется длительной фазой радиального роста (до 10 и более лет).
Рисунок 7. Темно-коричневое пятно асимметричной формы с участками регрессии. Опухоль на подошве стопы появилась около 1,5 года назадАкральная лентигинозная меланома чаще развивается у пожилых пациентов и составляет около 10 % всех МК. Это особая форма меланомы, возникающая на ладонях, подошвах, ногтевом ложе. Для ранней акральной меланомы характерна радиальная фаза роста, во время которой опухоль представляет собой темно-коричневое, черно- синее или черное пятно, окрашенное почти равномерно. Наиболее часто опухоль развивается на коже стоп (см. рис. 7).
Рисунок 8. Пигментированные полоски под ногтевой пластиной и распространение пигментации на кожу ногтевого валика и кончика пальца. Опухоль появилась около 2 лет назад.Около 15–20 % акральных лентигинозных меланом составляет подногтевая меланома (см. рис. 8). Примерно в 1/3 случаев подногтевая меланома изначально проявляется возникновением пигментированных полосок под ногтевой пластиной, с последующим ее отторжением и изъязвлением ногтевого ложа.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Для дифференциальной диагностики МК и меланоцитарных невусов наиболее часто используются две оценочные системы, включающие алгоритм ABCDE и семиточечную систему Glasgow.
Правило АВСDЕ включает оценку пигментного новообразования кожи по четырем основным критериями и дополнительного критерия E (внешние изменения новообразования, оцениваемые пациентом и врачом). Семиточечная система Glasgow включает оценку по семи признакам (3 главных и 4 малых). *Наличие трех и более признаков указывает на высокую вероятность злокачественного характера пигментного новообразования.
Диагностическая чувствительность и специфичность при применении вышеуказанных систем варьируют от 60 % до 90 %. Наибольшие затруднения при их использовании связаны с неполным набором вышеуказанных признаков, а иногда и с невозможностью визуально их оценить в связи с небольшими размерами новообразования. Повысить точность неинвазивной диагностики в этих случаях позволяет выполнение дермоскопии.
ВОЗМОЖНОСТИ ПРОФИЛАКТИКИ
В настоящее время нет абсолютно надежных методов первичной и вторичной профилактики МК. Единственным фактором риска развития МК, на который можно повлиять, является ультрафиолетовое излучение. Вторичная профилактика связана не с «профилактическим» удалением всех меланоцитарных невусов, а с хорошей подготовкой врачей в области диагностики ранней МК и меланомоопасных новообразований кожи, внедрением в широкую практику дермоскопии и своевременным адекватным хирургическим удалением меланоцитарных новообразований с обязательным последующим гистологическим исследованием.
КЛИНИЧЕСКИЕ СЛУЧАИ
ПИГМЕНТНЫЙ (МЕЛАНОЦИТАРНЫЙ) НЕВУСНовообразование на животе у женщины 25 лет
— А Форма симметричная
— B Контуры ровные
— C Цвет равномерный -D Размеры 5 мм
— Е Существует в течение пяти лет без существенной тенденции к увеличению
Новообразование на передней грудной стенке у мужчины 43 лет
МЕЛАНОМА+ А Форма асимметричная
+ B Контуры прерывистые, фестончатые
+ C Неодинаковый цвет разных частей новообразования
+ D Размеры 20 мм (>6 мм)
+ Е Увеличивается в размерах в течение трех лет (6 месяцев назад на плоском пятне появился экзофит розоватого цвета)
Меланома Фото
Тут буду выкладывать фото меланомы, присланные читателями блога. В принципе, конечно можно просто «натырить» фото из инета, но думаю, что гораздо полезнее и познавательнее будет привязывать фотографию к конкретному случаю — вот что нашли и вот чем все закончилось. Фотки есть в соответствующих постах, но такой формат, как мне кажется, более удобен для восприятия.
Смысл такой — если вы обнаружили на своем горячо любимом теле нечто похожее, следует экстренно это самое тело переместить в кабинет онколога (хотя бы в поликлинику), либо дерматолога. Помните пожалуйста, что основной составляющей успеха лечения меланомы является раннее обнаружение болячки!
МЕЛАНОМА ФОТО
0. Меланома на спине.
Диагноз: РФ — T2M0N0
Израиль — Бреслоу 0,9 мм. Кларк III, 3 митоза
Удалена в 2011г. По состоянию на 2021г полет нормальный и если вы видите обновления на сайте, значит я жив — здоров. Дядя Вадик.
Лечение меланомы. Часть I
1. Меланома на руке фото.
Диагноз: Т1аN0M0. Толщина по Бреслоу 0,55 мм.
Все лечение проводилось в Израиле в 2014г.
В 2021г у пациента все нормально.
Лечение меланомы. Биопсия сторожевых лимфоузлов. Отзыв
2. Меланома. Фото. Бреслоу 0,68 мм. Кларк IV
Консультация и пересмотр гистологии в Израиле. 2014-2015г
Меланома и беременность
3. Меланома на бедре. Фото
Диагноз: T3aN0M0 2 стадия, по Кларку 2, Бреслоу 2 мм.
К этому фото отзыва нет (и будет ли, не известно). Фотография сделана дерматоскопом.
4. Меланома на бедре.
Диагноз: Кларк 3, инвазия по Бреслоу 2мм (после ревизии гистологии в Израиле, 1,2 мм). На фото, результат удаления и предпосылки к дальнейшей обширной пластической операции.
Меланома. Лечение в Израиле. Отзыв. Май 2014 . Отзыв обновлен в январе 2021
5. Меланома на стопе.
Диагноз: IIа стадия – pT3aN0M0R0, 5 уровень инвазии по Кларк, толщина по Бреслоу 4мм ( после ревизии в Израиле 4 по Кларк). На фото, меланома до и после операции.
Лечение меланомы в РФ и Израиле. Отзыв. Фото
Сентябрь 2014 — ноябрь 2020г.
6. Меланома на плече. Фото.
Диагноз: Т3bN0(0/7)M0, Бреслоу 3,9 , с фокальным изъязвлением.
Лечение меланомы. Кейтруда. Рассказ. Фото
2012-2014г
7. Метастаз меланомы в паховой области
Меланома без выявленного первичного очага TxN2M1. Фото.
8.
А вот на этом фото просто невус.Было подозрение , что это меланома, но гистологическое исследование показало обратное:
9. Меланома на бедре. Серия фото.
Диагноз: 0.75 мм, уровень 2 по Кларку. Число митозов: 4 /кв. мм.
Лечение в Израиле. Меланома. Биопсия сторожевых лимфоузлов
10. Меланома на шее.
Диагноз: Узловая меланома, 6 мм, pt4a, уровень инвазии по Кларку — IV, без изъявления, в краях все чисто, 6 митозов на 1 мм.
Лечение меланомы в Израиле. Биопсия сторожевых лимфоузлов. Отзыв. Цены. Фото.
11. Меланома животе. Фото
Диагноз: Меланома, 1,8 мм, 4 уровня по Кларку, 9 митозов на кв/мм.
Данный случай еще и связан с беременностью пациентки. Лечение в Израиле.Биопсия сторожевых лимфоузлов. Отзыв
12. Меланома на руке.
Диагноз: Узловая меланома Т2аN0M0,st.1b, который после поездки в Израиль превратился в Т3аN1aM0, ибо был обнаружен метастаз в сторожевом лимфоузле.
Лечение меланомы в Израиле. Биопсия сторожевых лимфоузлов. Отзыв.
13. Смешанный пигментный невусА вот это новообразование на фото, оказалось не меланомой, а выяснилось, что это смешанный пигментный невус с лентигиозной меланоцитарной дисплазией 2 ст. в сочетании с внутридермальным абсцессом.
14. Меланома на груди.
Толщина 7 мм. Митотический индекс 8 митозов на кв/мм. Проведена сентинель биопсия. Обнаружен метастаз 0,9 мм.
Лечение меланомы в Израиле. Отзыв. Цены. Фото
15.
Меланома на плечес диагнозом Меланома кожи левой дельтовидной области T2aN0M0 IIA стадия. Гистологическое заключение: Меланома без изъязвления 2мм, II уровень инвазии по Кларку, без признаков агнио- и периневральной инвазии. Выраженное количество опухольассоциированных лимфоцитов.
16.
Меланома на спинес диагнозом Узловая меланома кожи, толщина по Бреслоу 4.25, 4 уровень инвазии, 11 митозов . Сопутствующее заболевание — гемофилия. Фото родинки нет. Только результаты операции.
Лечение меланомы в Израиле. Рассказ. + фото результатов
17.
Не меланома, но смешанный невус с участком десмопластического голубого невусаТакие штуки надо удалять, ибо можно запросто проворонить «тот самый момент»
Асимметричный невус. Как не попасть на лечение в Израиль
18.
Еще не меланома. Невус на веке 1,5 х 3 см. Удаление и пластика в ИзраилеИнтересный отзыв и результат операции
Лечение в Израиле. Удаление родинки. Отзыв
19.
Меланома на плече с признаками регресса. Фото.Отзыв о лечении в Израиле. При проведении биопсии сторожевых лимфоузлов, выявлено три сторожевых л/у. Все чистые.
20.
Беспигментная меланома2 мм Бреслоу (изначально 4 мм), Кларк III. Выполнена биопсия сторожевых лимфоузлов. Оперировал профессор Хаим Гутман
Лечение меланомы. Латвия-Израиль. Фото беспигментной меланомы
21.
Беспигментная меланома, или нет? Гистологическая эпопея
22. Меланома
Бреслоу 0.5, Кларк 2, без изъязвления, 1 митоз. Фото
Очень интересный рассказ с точки зрения пропаганды (даже уникальный, я бы сказал).
Меланома и беременность. Очередная история
23. Меланома на плече. Фото.
Бреслоу 4.5, Кларк 4, 1 митоз.
Рассказ о лечении появится позже. Цитата «Она была чуть бледнее и не такой выпуклой, покраснела после того, как в больнице нам сделали цитологию. Родинки или ещё чего-то в этом месте не было. Больше было похоже на бледный прыщ.». История лечения в Израиле тут
24. Подногтевая меланома.
Бреслоу 7, Кларк III, Фото
Про то , как была обнаружена меланома, как лечилась и что происходит на сегодняшний день. Про стандартные ошибки гистологии и прочее, и прочее, и прочее.
Подногтевая меланома (фото). История,3 операция, гистология, адъювантная терапия
25. Подногтевая меланома. Фото начала и результата операции.
Бреслоу 1,25, Кларк IV.
Подногтевая меланома. Выявление, развитие, результат. Фото
26.
Беспигментная меланома на пальце ноги. ФотоМай 2017
Два дерматолога назначили две разных мази, и теперь она выглядит так ( октябрь 2017).
27 Подозревали меланому, а оказался:
Комбинированный папилломатозый невус с очаговой лентигинозной меланоцитарной дисплазией 1ст.
28 Меланома и дерматофиброма. Фото.Очень наглядно показано, что самостоятельно вам не удастся отличить злокачественное новообразование от доброкачественного.
29. Фото меланомы на спине
.Бреслоу 0,6 без митозов.
Биопсия сторожевых лимфоузлов не показана. История: Лечение в Израиле. Удаление родинок
30. Десмопластическая меланома. Фото
На фотографии прям жировик, а на деле:
Смешанная десмопластическая меланома без митоза с типичным эпителиоидным компонентном 5 митозов/мм2, V степень по Кларку, толщина по Бреслоу — 7мм.
История: Редкая меланома или история одного жировичка
31. Меланома на коленке. Длиннющий рассказ, много фото.
Меланома, толщина 0,8, Кларк III. Проведена биопсия сторожевых лимфоузлов. Метастазов не обнаружено.
История: Лечение меланомы в Израиле
2016-2021гг все хорошо
32. Подозревали кератому, а оказался плоскоклеточный рак кожи. Фото.
Кератома , или история одного прыщика. О том, как важно делать гистологическое исследование.
33. Фото меланомы in situ
Отзыв о лечении в Израиле. Скорее даже не о лечении, а о приключениях.
34. Меланома на ноге. Фото. Бреслоу 22 мм, Кларк V.
Лечение меланомы в России. 4 истории
34А. Меланома на пояснице. Фото. Гистология
Бреслоу 1 мм, Кларк III. Описание в посте у фотографии №34
35. Клетка меланомы выявленная в лимфоузле. Фото.
Бреслоу 4 мм, Кларк III. Лечение в Израиле. Одна клетка меланомы , или зачем проводить биопсию сторожевых лимфоузлов
36. Фото меланомы на ягодице.
Брелоу 0,7 мм, инвазия по Кларк III . Митозов нет, изъязвления нет, периневральной и внутрисосудистой инвазии нет. Меланома. И снова гистология
37. Меланома. Фото блоков и стекол.
Вот так выглядит меланома подготовленная для гистологического исследования
38. Фото злокачественной меланомы на спине
Злокачественная меланома возникшая в невусе с тяжелой дисплазией. Фаза радиального роста. Бреслоу 0,12 мм , Кларк II. — это уже результат пересмотра в Израиле. Диагноз в Киеве — Бреслоу 0,35 мм Кларк II.
39. Меланома на плече. Фото.
Росла в течении 36 лет и активизировалась после того, как пациентка попала в аварию и сорвала ее. Меланома, или история эволюции родинки
40. Плоскоклеточный рак кожи. Фото.
На первый взгляд — это самая что ни на есть меланома. Но первое впечатление обманчиво. Это плоскоклеточный рак кожи (плоскоклеточная карцинома). Гистологически подтверждено
41. Фото меланомы со странной гистологией
Меланома, поверхностно распространяющаяся форма, инвазия I по Кларку.
При пересмотре гистологии в Москве выяснилось, что это пограничный веретеноклеточный невус Рида
42. Метастаз меланомы. Фото.
Результат невыполненной вовремя биопсии сторожевых лимфоузлов. /vse/nabolelo/melanoma-istorii/melanoma-recidiv-v-limfouzly-klinicheskij-sluchaj/
43. Меланома не спине. Фото
Пигментная эпителиоидно-клеточная меланома без изъязвления. Бреслоу менее 1 мм, Кларк III, 3-4 митоза на кв/мм.
44. Меланома на лодыжке. Фото
Бреслоу 0,6 мм, Кларк IV, два митоза на кв мм.
45. Фото меланомы на запястье
Бреслоу 1,5 мм, Кларк II, радиальная фаза роста, 1 митоз на кв мм
46. Меланома на коже грудной клетки справа. Фото
Гистология (конец 2019г) . Узловая меланома с изъязвлением, с прорастанием в сосочково-ретикулярный слой дермы по Кларку. Толщина по Бреслоу в документе отсутствует.
47. Меланома на ухе (на ушной раковине). Фото
Удаление меланомы и биопсия сторожевых лимфоузлов в Израиле.
Толщина по Бреслоу 0,65 .
Лечение меланомы в Израиле отзыв . Первый отзыв 2020 года
48. Меланома. Метастаз в послеоперационный рубец. Фото
Результат прекращения действия таргетной терапии (Тафинлар+Мекинист)
49. Меланома на виске (височной области). Фото
Фото самой меланомы и рубец от первичного иссечения. Домашняя гистология: 0,7 Бреслоу, II Кларк, без изъязвления и митозов. Пересмотр в Израиле 0,8 Бреслоу и III-IV Кларк.
Меланома на виске. Лечение в Израиле
50. Меланома. Подкожные метастазы меланомы . Фото
Удалена родинка без гистологии. Результаты на фото и в коротком рассказе
51. Думал меланома, а оказался голубой невус. Фото
Комбинированный двухкомпонентный меланоцитарный невус кожи левой кисти, представленный ассоциацией голубого невуса и сложного юнкционально-дермального невуса.
52. Меланома на животе. Фото
Меланома на правой боковой поверхности живота. Толщина по Бреслоу 0,8 мм, Кларк III. митозов, изъязвления нет.
53. Фото меланомы на бедре
На фото видим сложный невус, в котором, как выяснили в Израиле, имеется совсем небольшая область (2 мм) , с уже начавшей развиваться меланомой. Читаем тут: Меланома. История
54. Меланома на руке. Фото.
- Удалена родинка без гистологии
- Через два месяца на месте удаления появляется черное пятно
- Удаление и гистология — меланома Бреслоу 1,1 , Кларк IV, 1 митоз кв/мм
- Широкое иссечение в Израиле и биопсия сторожевых лимфоузлов
История: Зачем нужна гистология доброкачественной родинки
55. Меланома на бедре. Фото
Апрель 2020г . Менее 0,8 мм по Бреслоу. Больше инфы нет. Отправлена на пересмотр в Израиль
Продолжение :
Лентигинозная меланома | DermNet NZ
Автор: Hon A / Prof Amanda Oakley, дерматолог, Гамильтон, Новая Зеландия, 2013 г.
Объявление
Рак кожи
Приложение для самостоятельного обследования кожи и раннего обнаружения . Подробнее.
Текст: Мийскин
Что такое лентигинозная меланома?
Лентигинозная меланома — это медленно прогрессирующий вариант меланомы, обнаруживаемый на поврежденной солнцем коже туловища и конечностей.
Лентигинозная меланома обычно диагностируется, когда злокачественные клетки находятся in situ, и считается, что у нее низкий риск инвазивной меланомы. Этот тип меланомы только недавно был классифицирован как отличный от меланомы, распространяющейся по поверхности, и злокачественного лентиго (меланомы).
Кто заболевает лентигинозной меланомой?
Риск лентигинозной меланомы связан с повреждением солнцем. Таким образом, лентигинозная меланома чаще встречается у работников на открытом воздухе, у пожилых людей и связана с солнечным повреждением и немеланомным раком кожи.Хотя это часто происходит у людей с очень светлой кожей (фототип кожи 1 и 2), это также может происходить у тех, кто довольно легко загорает (фототип 3). Редко бывает у коричневой или черной кожи (фототип 4–6).
Лентигинозная меланома чаще встречается у мужчин, чем у женщин. Большинство пациентов со злокачественным лентиго старше 40 лет, а максимальный возраст диагноза — от 60 до 80 лет.
В отличие от меланомы, распространяющейся по поверхности, злокачественное лентиго не связано с количеством меланоцитарных невусов (родинок) или атипичных невусов.
Как выглядит лентигинозная меланома?
Лентигинозная меланома представляет собой медленно растущее или изменяющееся пятно обесцвеченной кожи. Сначала он часто напоминает обычные веснушки или коричневые пятна (лентигины). Со временем он становится более отчетливым, часто увеличиваясь до нескольких сантиметров за несколько лет или даже десятилетий. Как и другие плоские формы меланомы, ее можно распознать по правилу ABCDE: асимметрия, нерегулярность границ, изменение цвета, большой диаметр и эволюция.
Характеристики лентигинозной меланомы включают:
- Большой размер:> 6 мм и часто несколько сантиметров в диаметре на момент постановки диагноза
- Неправильная форма
- Различная пигментация — цвета могут включать светло-коричневый или коричневый, темно-коричневый, розовый, красный или белый
- Гладкая поверхность.
- Расположение на туловище и конечностях
Лентигинозная меланома
Следующие особенности очень подозрительны для инвазивной меланомы.
- Утолщение части поражения
- Увеличение количества цветов, особенно синего или черного
- Изъязвление или кровотечение
- Зуд или покалывание
Что является причиной лентигинозной меланомы?
Лентигинозная меланома — это разрастание злокачественных пигментных клеток (меланоцитов) вдоль базального слоя эпидермиса.Предшественником поражения является атипичное солнечное лентиго или лентигинозный / узловой невус. Что заставляет клетки становиться злокачественными, неизвестно, но генетические мутации могут начаться в примитивных стволовых клетках.
Солнечное повреждение приводит к определенной степени иммунной толерантности, позволяя аномальным клеткам беспрепятственно расти.
Какие тесты нужно сделать?
Точная диагностика лентигинозной меланомы имеет важное значение. В клинической диагностике помогает дерматоскопия, а в некоторых центрах — конфокальная микроскопия.
Другие тесты не нужны большинству пациентов, но тем, у кого инвазивная меланома толщиной более 1 мм, можно посоветовать пройти визуализационные исследования, биопсию лимфатических узлов и анализы крови.
Разрабатываются новые тесты для определения специфических генетических мутаций лентигинозной меланомы, которые могут послужить основой для будущей таргетной терапии.
Дерматоскопия
Дерматоскопия (также называемая дерматоскопией) или использование дерматоскопа дерматологом или другим врачом, обученным его использованию, может быть очень полезной для отличия лентигинозной меланомы от других типов поражения кожи.Однако дерматоскопический вид ранней лентигинозной меланомы бывает трудно отличить от других пигментных поражений, особенно лентигинозного невуса у пожилых людей.
Диагностическое иссечение
Если поражение кожи клинически подозрительно на злокачественное лентиго, его лучше всего вырезать (эксцизионная биопсия) с краем 2–3 мм. Частичная биопсия менее точна, чем полная эксцизионная биопсия, поскольку одна небольшая биопсия может пропустить злокачественный очаг.
Патологическая диагностика меланомы и ее предшественников может быть очень сложной.Сообщается, что некоторые поражения, клинически типичные для лентигинозной меланомы, показывают только гнезда соединительных меланоцитов, другие имеют критерии для диагностики меланомы in situ, а некоторые показывают инвазивный рак.
Гистологические признаки лентигинозной меланомы включают гиперплазию эпидермиса (как при солнечном лентиго), очаговые соединительные гнезда атипичных меланоцитов и могут включать пагетоидное распространение (отдельные меланоциты в верхних областях эпидермиса). Лентигинозную меланому бывает трудно отличить от атипичного лентигинозного узлового невуса, при котором архитектурная и цитологическая атипия менее выражена, а пагетоидное распространение отсутствует.
Отчет о патологии
Отчет патолога должен включать макроскопическое описание образца и меланомы (невооруженным глазом) и микроскопическое описание. При инвазивной меланоме следует сообщить о следующих особенностях.
- Диагностика первичной меланомы
- Толщина по Бреслоу с точностью до 0,1 мм
- Кларк уровень вторжения
- Поля иссечения, т. Е. Нормальная ткань вокруг опухоли
- Скорость митоза — мера того, насколько быстро клетки пролиферируют
- Есть ли изъязвление
Отчет может также включать комментарии о типе клеток и характере их роста, инвазии кровеносных сосудов или нервов, воспалительной реакции, регрессе и о том, есть ли связанное с этим заболевание in-situ.
Что такое толщина Бреслоу?
Толщина Бреслоу указывается для инвазивных меланом. Он измеряется по вертикали в миллиметрах от верхней части зернистого слоя (или основания поверхностной язвы) до самой глубокой точки поражения опухолью. Это сильный предсказатель исхода; чем толще меланома, тем больше вероятность метастазирования (распространения).
Каков уровень вторжения Кларка?
Уровень Кларка указывает анатомическую плоскость вторжения.
| Уровень | Характеристики |
|---|---|
| Уровень 1 | Меланома in situ |
| Уровень 2 | Меланома вторглась в сосочковый слой дермы |
| Уровень 3 | Меланома заполнила сосочковый слой дермы |
| Уровень 4 | Меланома проникла в ретикулярную дерму |
| Уровень 5 | Меланома проникла в подкожную ткань |
Чем глубже уровень Кларка, тем выше риск метастазирования (вторичного распространения).Это полезно для прогнозирования исхода при тонких опухолях и менее полезно для более толстых по сравнению со значением толщины Бреслоу.
Как лечится лентигинозная меланома?
Лентигинозная меланома подлежит хирургическому удалению. Это означает его вырезание и устранение дефекта. Это можно сделать, просто закрыв рану и зашив ее, но когда это сложно, может потребоваться создание лоскута или кожного трансплантата. Эти последние процедуры могут быть отложены на несколько дней в ожидании отчета о гистопатологии, подтверждающего полное удаление меланомы.
Вторая процедура часто назначается для удаления края здоровой ткани в зависимости от того, остается ли она на месте (5–10 мм) или стала инвазивной (10–20 мм или более).
Стадия
Стадия меланомы означает выяснение того, распространилась ли меланома из своего первоначального места в коже. Большинство специалистов по меланоме обращаются к руководящим принципам определения стадии кожной меланомы Американского объединенного комитета по раку (AJCC) (2009). По сути, это этапы:
| Этап | Характеристики |
|---|---|
| Этап 0 | Меланома in situ, включая злокачественное лентиго |
| 1 этап | Тонкая меланома <2 мм толщиной |
| 2 этап | Толстая меланома> 2 мм толщиной |
| 3 этап | Меланома распространяется с поражением местных лимфатических узлов |
| 4 этап | Обнаружены отдаленные метастазы |
Каковы перспективы?
Лентигинозная меланома in situ не опасна; он становится потенциально опасным для жизни только в том случае, если внутри него развивается инвазивная меланома.
Долгосрочное наблюдение включает осмотр обработанной области и полное обследование кожи для выявления новых проблемных очагов. Если поражение было инвазивным, следует также исследовать регионарные лимфатические узлы. Может быть целесообразно провести биопсию любого поражения, возникающего внутри или поблизости от места иссечения.
Риск распространения (метастатической меланомы) инвазивной меланомы зависит от нескольких факторов, но главным из них является толщина меланомы на момент ее хирургического удаления.
В рекомендациях Австралии и Новой Зеландии по меланоме (2008) сообщается, что метастазы редки для меланом <0.Толщиной 75 мм, а риск образования опухолей толщиной 0,75–1 мм составляет около 5%. По данным Американского объединенного комитета по раку (AJCC), риск неуклонно увеличивается с увеличением толщины, поэтому 10-летняя выживаемость составляет около 50%.
с исторической точки зрения к управлению в современную эпоху
Ключевые моменты
-
Эту область можно проследить до трех основополагающих статей, опубликованных в конце 1970-х годов
-
Были описаны атипичные невусы в семьях, склонных к меланоме, и дали разные «синдромные» названия
Коули 17 в 1952 году приписывают первое описание семейной меланомы, основанное на случаях кожной меланомы у отца и двух из трех его детей.Последующие сообщения о семьях, склонных к меланоме, поступали в 1960-х и начале 1970-х годов. 18, 19 Однако концепция DN и ее связи с меланомой возникла в результате клинических наблюдений за невусами в нескольких семьях, склонных к меланоме, в конце 1970-х и начале 1980-х годов. Сначала дерматопатолог Уоллес Х. Кларк и его коллеги из Пенсильванского университета описали характерные невусы у 37 пациентов из шести семей меланомы с «синдромом BK Mole» (B и K были первыми буквами имен двух «необычайно полезных» пациентов) . 6 Во-вторых, Генри Т. Линч из Университета Крейтона и его коллеги сообщили о подобном фенотипе невуса в семье, склонной к меланоме. 20 Эти фенотипические «синдромы» были названы соответственно синдромом B-K родинки и синдромом семейной атипичной множественной меланомы (FAMMM). В-третьих, Дэвид Элдер и его коллеги из Пенсильванского университета придумали термин «синдром диспластического невуса» (DNS) с семейными и спорадическими вариантами. 21 Таким образом, в течение трех лет было дано три разных названия для описания фенотипов невусов в семьях, склонных к меланоме.Эти три «синдрома», описанные в этих статьях, будут обсуждаться более подробно, поскольку они представляют собой генезис концепции DN и истоки противоречий, окружающих эти поражения, а также вводят вопросы номенклатуры, которые сохранялись с 1978 г. по настоящее время. настоящее время.
В первоначальном отчете Кларка, 6 авторы собрали шесть семей, склонных к меланоме, в общей сложности 69 членов в трех или четырех поколениях, 25 из которых имели кожную меланому. Из этих 25 пациентов 17 были клинически обследованы, и было сочтено, что 15 из них страдали синдромом BK Mole.’Эти пациенты были клинически определены как имеющие от менее 10 до более чем 100 невусов, показывающих изменчивость размера (от 5 до 15 мм в диаметре), границы и цвета. Гистологически невусы были определены как атипичные меланоцитарные гиперплазии с мезенхимальными изменениями в сосочковом слое дермы и лимфоцитарным инфильтратом. Было заявлено, что термин «атипичная меланоцитарная гиперплазия является синонимом меланоцитарной дисплазии»… определяется как «отдельные меланоциты или небольшие скопления меланоцитов, которые имеют некоторые структурные особенности злокачественных меланоцитов, но чей потенциал развития в очевидную меланому неясен.Ситуация в точности аналогична дисплазии шейки матки и старческому кератозу: очаги плоскоклеточных клеток, которые имеют некоторые структурные особенности злокачественности, но могут оставаться вялыми, полностью регрессировать или прогрессировать до очевидной карциномы ».
В отчете Линча, 20 описана одна семья, подверженная раку и меланоме, состоящая из пяти поколений. У четырех человек развилась меланома, у трех из них были атипичные и многочисленные (> 200) невусы. Они предположили, что «наблюдение меланомы в сочетании с характерным кожным фенотипом, характеризующимся множественными большими родинками неправильной формы, окрашенными в красновато-коричневый или розовый цвет, с признаками утечки пигмента и с очевидным аутосомно-доминантным типом наследования, может представлять собой новый семейный синдром.Ссылаясь на статью Кларка, которая была опубликована несколькими месяцами ранее, они добавили: «Мы считаем, что наш более описательный термин« синдром семейной атипичной множественной родинки »… является гораздо более значимым термином, чем синдром« BK Mole ». Мы считаем, что наш термин предоставит врачам лучшую основу для признания и понимания генетического значения этого недавно описанного синдрома ».
В статье Элдера, 21 , как отмечалось выше, вводится термин DNS и постулируется существование спорадических и семейных вариантов.Авторы сообщили о 79 пациентах с первичной кожной меланомой, но без семейного анамнеза меланомы. Фотографии всего тела этих пациентов были проанализированы ретроспективно, и пациенты были разделены на группы. В группе I (пять пациентов) не было других идентифицируемых невусов или пигментных поражений, в то время как в группе IIA (восемь пациентов) было несколько небольших поражений на ягодицах диаметром <3 мм, а в группе IIB (семь пациентов) - от 2 до 5. более крупные поражения ягодиц (0,5–1,5 см).У этих пациентов также были поражения в других местах, и фотографии предполагали, что многие из них были подозрительными, поэтому у всех, кроме одного, были взяты биопсии дополнительных поражений. Было подсчитано, что каждый из этих пациентов имел в среднем по 26 невусов. Из 13 дополнительных выполненных биопсий одна показала вторую первичную меланому, три были ничем не примечательными меланоцитарными невусами и девять продемонстрировали «микроскопическую атипию, подобную той, которая описана при семейном синдроме B-K родинки». Группа III была самой многочисленной, в нее вошли 59 пациентов, у которых был обнаружен «нормальный» паттерн невусов.Никаких дополнительных биопсий этих поражений не проводилось. Элдер и его коллеги также расширили гистологические особенности DN, включая «ядерный плеоморфизм и гиперхроматизм с воспалительным ответом лимфоцитов и связанной с ним фиброплазией». Описаны два типа дисплазии: дисплазия эпителиоидных клеток и лентигинозная меланоцитарная дисплазия. Дисплазия эпителиоидных клеток состояла из эпителиоидных клеток с пыльным пигментом, выступающих ядрышек, латерального слияния и плеоморфизма гнезд и клеток невуса, имеющих небольшие гиперхорматические ядра, расположенные в сосочковом слое дермы.Лентигинозная меланоцитарная дисплазия была описана как имеющая выраженный артефакт цитоплазматической ретракции, нерегулярный (не вложенный) базальный рост меланоцитов, который был узловым без дермального компонента. В этой статье также предполагалось, что DN являются предшественниками меланомы, на основании дисплазии, обнаруженной под микроскопом.
Эти три статьи легли в основу множества последующих исследований, посвященных DN, их роли в гистогенезе меланомы и разногласиям по поводу их диагностики и лечения.
Мой подход к атипичным меланоцитарным поражениям
Abstract
Гистологическая оценка меланоцитарных невусов составляет значительную часть ежедневной нагрузки дерматопатолога. Хотя они могут быть иссечены по косметическим причинам, большинство встречающихся поражений клинически атипичны и их берут на биопсию или иссекают, чтобы исключить меланому. Хотя диспластические невусы встречаются чаще всего, цитологическая атипия может быть признаком нескольких других меланоцитарных поражений, включая невусы генитального типа, акральные невусы, рецидивирующие невусы и невусы новорожденных или детей.Поскольку больший упор делается на косметические результаты, и из-за постоянно растущей рабочей нагрузки, для лечения и диагностики атипичных невусов были внедрены несколько «более быстрых и менее травмирующих» методов, включая биопсию с ударом, бритьем и совком. Основным ограничением всех этих альтернатив является то, что часто только часть поражения доступна для гистологической оценки, и поэтому слишком часто в отчете патологоанатома содержится рекомендация по полному удалению, чтобы можно было изучить остаточное поражение.Полное или обширное иссечение всех клинически атипичных невусов позволяет провести гистологическую оценку всего поражения и в большинстве случаев избавляет пациента от необходимости дальнейшего хирургического вмешательства.
Ключевые слова: Невус шпица, метод биопсии, дисплазия de novo, диспластический невус, меланома
Меланоцитарная патология — одно из наиболее сложных направлений хирургической патологии. Проблемы делятся на две широкие категории, а именно: распознавание редких, но характерных объектов и гораздо более распространенная проблема — где разместить необычное поражение в спектре меланоцитарных поражений.Большое количество меланоцитарных поражений попадает в пограничную зону, которая может нервировать даже самых опытных патологоанатомов. Эти общие и неприятные диагностические проблемы и являются предметом настоящего обзора.
К ним относятся:
-
митотическая активность в, казалось бы, банальном невусе
-
клональный невус
-
меланома, возникающая в невусе и невоидная меланома
-
наивный невус
-
Naevus
-
Naevus
900plastic -
атипичный акральный невус
-
неонатальный невус
-
меланоцитарные пролиферации с пагетоидным распространением.
генитальный невус
Митотически активные невусы
И патологоанатом, и дерматопатолог ежедневно сталкиваются с обычными приобретенными внутрикожными и сложными невусами. Обычно такие невусы митотически неактивны. Однако иногда, особенно после особенно энергичных поисков, обнаруживается митотическая фигура. Проблема в том, как с этим бороться. Следует ли игнорировать это, искать больше или бросаться на иммуногистохимию? Не должно вызывать удивления случайное обнаружение митотической фигуры в растущем сложном невусе.
Есть четыре основных момента:
-
Митоз является спорадическим и случайным в доброкачественном невусе и поэтому не оказывает клинического воздействия.
-
Митоз указывает на лежащий в основе «клональный» компонент.
-
Митоз присутствует в условиях меланомы, возникающей в обычном приобретенном невусе.
-
Само поражение представляет собой невоидную меланому.
В общем, обнаружение митотической фигуры должно побудить к поиску дополнительных митозов и тщательной оценке архитектурных и цитоморфологических особенностей.Если идентифицирован только один митоз, а невус симметричен, созревает с глубиной и лишен плеоморфизма или выступающих ядрышек, то можно не принимать во внимание митотическую фигуру (рис. 1). Предыдущая травма невуса иногда может приводить к случайному митозу поверхностного кожного компонента (рецидивирующий невус).
Банальный кожный невус с единственной митотической фигурой. Ядра однородные.
«Большое количество меланоцитарных поражений попадает в пограничную область, которая может нервировать даже самых опытных патологов»
Клональные невусы
Редко, иначе банальные невусы могут содержать очаговый пигментированный атипичный эпителиоидный компонент, внутри которого могут быть очень редкие митозы. быть идентифицированным.Болл и Голиц назвали их «клональными невусами». 1 В клинических условиях обычно возникает новая темная область внутри невуса. В верхней половине невуса находится небольшая дискретная совокупность эпителиоидных клеток с пыльным меланиновым пигментом, которые цитологически отличаются от остальной части невуса (рис. 2). Меланофаги внутри и вокруг агрегата являются обычными и вносят вклад в более темную область, которая оценивается клинически. Существует некоторое морфологическое совпадение между клональным невусом и перевернутым невусом типа А и глубоко проникающим невусом.Клональный невус отличается от этих двух последних поражений расположением агрегата в верхней части дермы. Для уверенного исключения меланомы, возникающей в сочетании с невусом, может потребоваться либеральное обследование на нескольких уровнях (см. Ниже).
(A, B) Клональный невус. Обратите внимание на отчетливую популяцию бледно окрашенных клеток невуса и заметных меланофагов в ретикулярной дерме.
Меланома, возникающая в невусе, и меланома невуса
Меланома, возникающая в невусе, отличается от клонального невуса несколькими способами.Меланома обычно демонстрирует инфильтративный или, чаще, расширяющийся паттерн роста (рис. 3) (трансформация внутри очага поражения) по сравнению с хорошо вложенной конфигурацией клонального невуса. Меланомы стирают окружающий невус, тогда как клональное поражение обычно не затрагивает окружающий невус. В целом меланома имеет более многочисленные митозы и большую цитологическую атипию (с выступающими ядрышками) (рис. 4), в отличие от редких митозов и легкой цитологической атипии клонального невуса.
Меланома (левая часть поля), возникающая в результате врожденного невуса на коже черепа.
(A) Увеличенное изображение ограниченного расширяющегося опухолевого узла (слева). (B) Обратите внимание на большие везикулярные ядра, выступающие ядрышки и митозы.
Как правило, обычные невусы поддаются диагностике при малой мощности; Тем не менее, важно исключить возможность возникновения меланомы наивной ткани. Это редкий вариант, имитирующий доброкачественные невусы, и его трудно распознать; правильный диагноз часто ставится только ретроспективно, после того, как у пациента развились метастазы. Zembowicz и др. недавно рассмотрели особенности наэвоидной меланомы. 2 При малом увеличении невоидная меланома может иметь бородавчатую 3 или узелковую архитектуру и проявлять другие черты обычного банального невуса, включая очертание и, по крайней мере, относительную симметрию (рис. 5). Наэвоидная меланома лишена заметной соединительной активности и пагетоидного распространения, обычно связанного с поверхностной распространяющейся меланомой. Обычный внутрикожный невус «созревает» (то есть происходит общее уменьшение размера гнезда, а также размера клеток и ядер с увеличением глубины). При беглом осмотре может показаться, что наэвоидная меланома созревает с глубиной, но при более внимательном рассмотрении выясняется, что клетки в основании поражений аналогичны по размеру клеткам поверхностного кожного компонента. 4 Только при более высоком увеличении можно оценить тонкие отличительные характеристики невозной меланомы. К ним относятся монотонная популяция маленьких круглых клеток с выступающими ядрышками и от нескольких до многочисленных митозов (рис. 6). Другие признаки, которые могут присутствовать, включают некроз отдельных клеток и атипичные митозы.
Наевоидная меланома из груди молодой женщины. Пунктирные области с большим увеличением показаны на рис. 6.
(A, B) Ядра кажутся мягкими и совершенно банальными.Однако обратите внимание на множественные митозы.
«Только при более высоком увеличении можно оценить тонкие отличительные характеристики наэвоидной меланомы»
В руках опытного патолога гистологических признаков обычно достаточно, чтобы классифицировать поражение как наевоидную меланому; однако иммуногистохимия может быть ценным дополнением в сложных случаях. В невусах менее 5% клеток экспрессируют Ki-67 (MIB-1), и большинство реактивных клеток присутствует в поверхностной дерме. 5 В меланоме реактивные клетки MIB-1 более многочисленны и распределены на всех уровнях дермального компонента (рис. 7). Важное предостережение заключается в том, что лимфоциты, гистиоциты и иногда эндотелиальные клетки также могут быть MIB-1-положительными, и поэтому необходимо учитывать морфологию клеток, чтобы определить, действительно ли иммунореактивные клетки являются меланоцитами. Дифференциальное окрашивание также можно увидеть с HMB-45 6 и циклином D1 7 ; банальные невусы проявляют реактивность в отношении этих иммуномаркеров в поверхностном кожном компоненте.Окрашивание HMB-45 и циклина-1 при меланоме наблюдается по всему дермальному компоненту (в различной степени). Однако следует отметить, что не все невусы или меланомы окрашиваются HMB-45. Кроме того, необходимо помнить, что циклин D1 является ядерным антигеном; следовательно, цитоплазматическая реактивность не информативна.
Этот препарат MIB-1 поступает из участков, обозначенных пунктиром на рис. 5.
Шпиц невус
Шпиц невус — доброкачественные меланоцитарные образования, состоящие из крупных эпителиоидных и / или веретенообразных меланоцитов с обильной эозинофильной цитоплазмой.Большинство этих поражений возникает у детей, и их можно с уверенностью диагностировать. Хотя они были описаны для всех возрастных групп, следует проявлять большую осторожность при постановке этого диагноза у пожилых людей; с возрастом увеличивается вероятность ошибочно принять меланому за невус шпица. 8 Критерии отличия меланомы от невуса шпица не всегда надежны, особенно у пожилых пациентов. Сообщается, что поражения с признаками невуса шпица дали метастазы и привели к смерти. 9, 10
«С возрастом вероятность ошибочно принять меланому за невус шпица»
Повреждения, которые отклоняются от установленных критериев и увеличивают неопределенность относительно их биологического потенциала, называются «атипичными шпицами». naevus »или« спицоидная опухоль с неопределенным биологическим потенциалом ». К сожалению, некоторые патологи склонны применять эти термины к гистологически доброкачественным невусам шпица в целях безопасности (либо безопасность пациента, либо патолог считает, что такая терминология снижает его / ее собственный медицинско-правовой риск), потенциально подвергая пациента ненужному широкому иссечению. или биопсия сторожевого узла.Напротив, поражение, которое некоторые сочтут явной меланомой, может быть «понижено» до промежуточного поражения из-за молодого возраста пациента. 11 Знание о том, что случайные пациенты с поражениями, диагностированными как невусы шпица (даже экспертами), имеют плохие результаты, еще больше усугубляет диагностическую неопределенность. Несмотря на недостатки таких терминов, как «атипичный невус шпица» и «шпиццеидная опухоль с неопределенным биологическим потенциалом», следует признать, что не все шпицеподобные опухоли, особенно у взрослых, можно точно классифицировать, и их использование иногда неизбежно.
Важна оценка атипичных признаков у шпицеподобных поражений (таблица 1). С особой осторожностью следует рассматривать чрезмерную митотическую активность, глубокие митозы, атипичные митозы, явное отсутствие созревания и «толкающую», а не инфильтративную нижнюю границу (рис. 8 и 9). Монс проиллюстрировал поражения у детей препубертатного возраста с силуэтом, напоминающим невусы шпица, которые при более внимательном рассмотрении демонстрируют злокачественные черты. 11 Изъязвление не является общепринятым признаком невуса шпица, хотя истинное изъязвление следует отличать от травматического изъязвления, которое проявляется паракератозом, кровотечением и чешуйчатой коркой.Меланоцитарные поражения со шпицеподобными чертами у взрослых, особенно если они присутствуют на спине у мужчин и на ногах у женщин, требуют тщательного обследования для исключения меланомы.
Атипичный невус шпица показан при сканирующем увеличении.
(A) Изображение средней мощности на рис. 8, показывающее большие гнезда на глубокой окраине. (B) Множественные митозы присутствовали на всех уровнях невуса.
Таблица 1
Некоторые сообщили об атипичных особенностях, наблюдаемых у шпица «naevi»
| Клинический размер больше 1.0 мм 12, 13 |
| Неполное созревание 12– 16 |
| Глубокие кожные митозы 13, 14, 15, 14, 15, 12, 13 |
| Ядерный плеоморфизм / гиперхроматизм 12, 14 |
| Фокальный листоподобный рост 13, 14 |
| Обилие плазматических клеток в очаге воспаления 15, 16 |
| Толщина (8 мм) 13, 15 |
| Распространение в подкожную ткань 164 9024 9024 |
| Толкающая основа 16 |
| Очаговые некротические меланоциты 16 |
| Глубокая пигментация 10, 16 |
| Деструкция коллагена 12 |
| Выраженное пагетоидное распространение без эпидермального гиперкератоза 12 |
| 1424 9024 9024 9024 9024, лимфатическое распространение 17 |
Как и в случае невозной меланомы, профиль иммуногистохимических пятен иногда помогает в диагностически сложных случаях.К часто используемым иммуномаркерам относятся HMB-45, MIB-1, циклин D1 и p53. HMB-45 окрашивает большинство невусов шпица, обычно стратифицированным образом, маркируя преимущественно соединительные и верхние кожные компоненты, с уменьшением количества реактивных клеток с глубиной. 6 Напротив, меланомы показывают пятнистое или диффузное окрашивание по всему поражению. Однако, как это часто бывает с иммуногистохимическими окрашиваниями, этот метод не является надежным; Сообщалось, что у некоторых шпицев нет пятен по всему кожному компоненту. 18
Spitz naevi демонстрируют в среднем ядерную маркировку 4% клеток MIB-1, тогда как более 9–25% клеток являются положительными в большинстве меланом. 19 У Spitz naevi положительные ядра обычно сконцентрированы на поверхности, хотя разбросанные клетки могут быть обнаружены по всему поражению. 5 Напротив, меланома показывает общее неравномерное распределение окрашивающих MIB-1 клеток, хотя экспрессия обычно наблюдается в основании поражения.Небольшой процент как меланом, так и невусов шпица будет демонстрировать более низкую и более высокую пролиферативную активность, что подчеркивает важность корреляции иммуногистохимических результатов с морфологическим контекстом и клиническими условиями. Следует иметь в виду, что выраженная реактивность может наблюдаться в лимфоцитах, сопровождающих воспаленные невусы шпица. Следовательно, необходимо проявлять осторожность, чтобы отличить иммунореактивность лимфоцитов от меланоцитов.
Циклин D1 иногда дает положительный эффект при самых поверхностных аспектах сложных невусов и очень положительный при меланомах.Spitz naevi может быть положительным на циклин D1; однако, как и в случае с MIB-1, окрашивание имеет зональный характер, при этом большинство положительных клеток находится в поверхностной дерме. 7 Зональный рисунок окрашивания не является признаком меланомы.
«Прогресс в молекулярных методах, вероятно, предоставит более точный инструмент для улучшенной характеристики шпицеподобных поражений»
Белок p53 обычно отрицательный у Spitz naevi, но показывает положительное ядерное окрашивание в большинстве узловых меланом. 20, 21
Прогресс в молекулярных методах, вероятно, предоставит более точный инструмент для улучшенной характеристики шпицеподобных поражений. Недавно увеличение 11p, сопровождающееся мутациями в HRAS, было зарегистрировано у некоторых шпиц-невусов, но не у меланомы. 22, 23 Эти невусы были больше и толще и демонстрировали отличительные характеристики, такие как более крупные клетки с ядерным плеоморфизмом, отличные от прототипных невусов шпица.
Как и в случае других меланоцитарных поражений, следует избегать постановки диагноза на основании неполной биопсии, особенно такой, которая не позволяет исследовать всю толщину поражения на предмет созревания и глубоких кожных митозов.Твердый диагноз патолог должен поставить только после того, как будет обследовано все поражение.
Диспластический невус
Диспластический невус — это поражение, которое имеет промежуточные гистологические признаки между банальным общим невусом и меланомой. Несколько групп продемонстрировали молекулярные различия между банальными невусами, диспластическими невусами и меланомой, подтверждая точку зрения, что диспластические невусы являются частью биологического спектра, который показывает прогрессирование до меланомы (всесторонний обзор Хусейна и Вуда 24 ).Они являются маркером повышенного риска меланомы (степень которого зависит от клинических условий — общее количество родинок, семейный анамнез и т. Д.) И, в некоторых случаях, являются предшественниками меланомы.
Природа генетического дефекта (CDKN2A, CDK4 или ни один из них), по-видимому, не влияет на клинические или гистологические проявления диспластического невуса или меланомы в семьях с синдромом диспластического невуса. 25 Кроме того, нет значительных гистологических различий между спорадическими и семейными диспластическими невусами. 26 Следовательно, значение диспластического невуса для данного пациента зависит от клинического контекста.
Диспластические невусы демонстрируют совокупность архитектурных и цитологических особенностей, которые отличают их от других невусов и, как правило, от меланомы. В согласованном заявлении, опубликованном Национальным институтом здравоохранения в 1992 г., для постановки диагноза диспластического невуса требуется только архитектурное расстройство (а не цитологическая атипия). 27 Однако, по нашему мнению, цитологическая атипия также должна присутствовать в соответствии с согласованной статьей Clark et al . 28 Определение Национального института здравоохранения в остальном слишком широкое, и существует значительный риск включения в эту категорию большинства невусов, диспластических или иных. Фактически, незначительный элемент архитектурного нарушения или небольшой очаг легкой цитологической атипии можно найти у большинства невусов, если поискать достаточно внимательно. Но это не обязательно означает диагноз диспластического невуса.
Диспластические невусы имеют выраженный лентигинозный компонент, асимметричны, плохо очерчены и, если они составные, имеют переходное плечо (определяемое как внутриэпидермальный компонент, выходящий за пределы дермального компонента) (рис. 10).Мы классифицируем поражения как имеющие легкую, среднюю или тяжелую цитологическую атипию (таблица 2; рис. 11). Цитологическая атипия при диспластическом невусе обычно случайна и неоднородна, с атипичными клетками на фоне клеток с минимальной атипией или без нее. Наличие монотонной популяции сильно атипичных клеток (в одной области или по всему поражению) вызывает беспокойство при меланоме.
Диспластический невус с хорошо развитым плечом с левой стороны.
(A) Пыльный пигмент — типичный признак диспластического невуса.(B) Легкая цитологическая атипия с увеличенными гиперхроматическими ядрами. (C) Умеренная цитологическая атипия с очаговой миграцией вверх в диспластическом невусе. (D) Диспластический невус с выраженной цитологической атипией и выступающими ядрышками.
Таблица 2
Классификация диспластических невусов
| Параметр | Легкая | Умеренная | Тяжелая |
| Размер ядра | ядро 905 902 905 кератоид 2 или более ядер кератиноцитов|||
| Ядерный плеоморфизм | Легкий | Умеренный | Тяжелый |
| Хроматин | Гиперхроматический | Гиперхроматический или везикулярный | 905 Отсутствует или маленький Выраженный и увеличенный |
| Цитоплазма | Обычно небольшая, но иногда обильная с пыльной пигментацией | Обычно небольшая, но иногда обильная с пыльной пигментацией | Часто обильная |
adher000 e к стандартной рекомендации по краям 5 мм для всех сильно атипичных невусов, которые включают край »
Хотя оценка атипии основана на цитоморфологии, архитектура поражения способствует общей оценке невуса. 30 Например, образование мостовидных протезов (слияние меланоцитов между соседними ребрами сетчатки) является критерием, используемым при диагностике диспластического невуса. Его наличие или отсутствие не влияет на цитологическую оценку поражения. Тем не менее, сливное соединение с участием трех или более смежных ребер ретейнера может вызывать беспокойство при меланоме. Точно так же эрозия дермоэпидермального перехода может быть поводом для беспокойства. Ограниченная миграция меланоцитов в нижние слои эпидермиса (пагетоидное распространение) допустима при диспластических невусах; однако распространения большого количества меланоцитов или распространения в верхний остистый слой нет, и это вызывает подозрение на меланому.В этих примерах архитектурный беспорядок влияет на общую оценку.
Мы не включаем рекомендации по лечению слабоатипичных диспластических невусов, которые, по-видимому, полностью иссечены или локально присутствуют на краях. Мы предлагаем умеренное повторное удаление диспластических невусов с умеренной атипией, которая простирается до края. Если край существенно поражен, необходимо рекомендовать полное иссечение, особенно у пациентов старше 30 лет. 31 Мы придерживаемся стандартной рекомендации о пределах 5 мм для всех сильно атипичных невусов, затрагивающих край.Мы включаем в наши отчеты измерение с точностью до предела для сильно атипичных невусов, которые полностью иссечены.
Почему на самом деле мы классифицируем цитологическую атипию диспластических невусов? Если мы примем, что диспластические невусы, демонстрирующие различные степени атипии, образуют континуум риска прогрессирования меланомы, важная роль заключается в передаче информации клиницисту, указывающей, насколько близок конкретный невус к меланоме in situ. В одном исследовании Pozo и др. выполнили критический анализ 15 гистологических переменных, чтобы оценить надежность классификации. 26 Сильно атипичные диспластические невусы надежно отличались от невусов с легкой или умеренной атипией; однако не было последовательно воспроизводимых признаков, которые могли бы надежно дифференцировать легкую и умеренную атипию. Основываясь на полученных данных, они предложили двухуровневую систему классификации (низкая и высокая) для классификации диспластических невусов.
Есть ли биологические доказательства в пользу двухклассной системы по сравнению с трехбалльной системой? Представляет ли невус с атипией средней степени больший риск, чем с атипией легкой степени? Оба могут вызвать меланому, но неясно, что одно хуже другого.Есть некоторые свидетельства того, что существуют генетические различия между степенями. Анализируя микросателлитные изменения как маркер генетической нестабильности в генах, связанных с меланомой (среди прочего, 1p и 9p), Hussein и др. обнаружили микросателлитную нестабильность как в диспластических неви, так и в меланоме, но не в банальных невусах. 32 Кроме того, существует значительная корреляция между частотой микросателлитной нестабильности и степенью атипии диспластических невусов.В частности, распространенность микросателлитной нестабильности была намного выше у невусов, отнесенных к категории умеренных и тяжелых, по сравнению с невосприимчивыми к легким, что позволяет предположить, что существует рациональная молекулярная основа для двухуровневой диагностической системы.
«Существует значительная корреляция между частотой микросателлитной нестабильности и степенью атипии диспластических невусов»
Важно отметить, что не все цитологически атипичные невусы являются диспластическими невусами.Например, генитальные невусы, акральные невусы и невусы новорожденных или детей могут иметь цитологическую атипию, но они не относятся к категории диспластических невусов. Точно так же банальные невусы могут иногда показывать очаги цитологической атипии.
Атипичный меланоцитарный невус генитального типа
Хотя случайные атипичные невусы из промежности являются диспластическими, другие попадают в категорию атипичных меланоцитарных невусов генитального типа. Чаще всего они наблюдаются у пациентов женского пола, обычно у молодых женщин, но иногда они наблюдаются у детей.Для них характерна бородавчатая архитектура. Крупные соединительные гнезда, окруженные хорошо развитым ретракционным артефактом, являются диагностическим признаком (рис. 13). Они могут демонстрировать выраженную цитологическую атипию (рис. 14) и случайные кожные митозы, но не демонстрируют архитектуру диспластического невуса. Хотя фиброз кожи часто является признаком этих поражений, эозинофильная и пластинчатая фиброплазия отсутствуют.
Атипичный генитальный невус с цитологической атипией.
Атипичный акральный невус с большими расширяющимися овальными соединительными гнездами.
Подобные поражения могут встречаться на других участках изгиба, включая пупок, пах, субмаммарную область и подмышечные впадины — отсюда их альтернативные названия — невусы изгиба и невусы молочной линии.
Биологический потенциал этих тревожных поражений плохо документирован, а их гистология часто вызывает тревогу. Поэтому важно отметить, что меланома вульвы в значительной степени является заболеванием пожилых людей и что эти атипичные невусы чаще всего возникают у молодых.
В соответствии с нашей политикой, повторное иссечение поражений, присутствующих на краях, является целесообразным при диспластическом невусе с такой же степенью атипии.
Атипичные акральные невусы
Атипичные акральные невусы характеризуются аномальной архитектурой и цитологической атипией, и их можно спутать с диспластическими невусами. У них обычно есть переходное плечо, а гнезда часто расположены внутри супрапапиллярных пластинок в дополнение к боковым сторонам сетки, что придает поражению неорганизованный вид. Эккриновые потовые протоки также часто поражаются. Цитологическая атипия — обычное явление, и у многих невусов присутствует центральное пагетоидное распространение.Полезной гистологической подсказкой является наличие больших овальных вертикально ориентированных соединительных гнезд, окруженных артефактом ретракции (рис. 14 и 15). Отсутствуют лентигинозная архитектура диспластических невусов, лимфоцитарная инфильтрация, недержание пигмента и фиброз кожи.
Атипичный акральный невус. (A) Изображение с большим увеличением, показывающее артефакт ретракции. (B) Обратите внимание на цитологическую атипию и распространение пагетоидов.
В некоторых случаях бывает трудно отличить от меланомы, особенно в старших возрастных группах.В целом, однако, эпидермис при меланоме часто демонстрирует нерегулярный акантоз, а степень атипии гораздо более выражена. При акральных атипичных невусах распространение пагетоидов ограничено центральной частью невуса, а атипия дермы и значительная митотическая активность не характерны. Если есть какие-либо сомнения, целесообразно повторное удаление для обеспечения полного удаления.
Неонатальные невусы
Неонатальные невусы и невусы у детей также могут быть проблематичными, особенно если возраст пациента неизвестен.Пагетоидное распространение и цитологическая атипия являются обычными явлениями, иногда могут наблюдаться кожные митозы. Меланома в детском возрасте встречается редко, но встречается редко. По нашему опыту, основанному на большом количестве направлений, диагностика меланомы у детей редко бывает сложной; эти поражения обычно имеют черты, похожие на меланому у взрослых. По сравнению с неонатальными или детскими невусами, плеоморфизм, как правило, более выражен, митозы часто заметны и присутствуют на всей толщине опухоли, и часто наблюдается расширенный характер роста.Точно так же серьезно нарушается созревание с глубиной, и может присутствовать некроз.
Меланоцитарная пролиферация с пагетоидным распространением
Использование термина «пагетоид» для описания разброса меланоцитов по всем уровням эпидермиса, первоначально возникшего в результате болезни Педжета сосков, и впоследствии было применено к поверхностной распространяющейся меланоме. Этот паттерн имеет значительное количество немеланоцитарных имитаторов (таблица 3). Каждое из немеланоцитарных образований часто можно отличить по морфологии, но для окончательного диагноза иногда требуется иммуногистохимия.Кроме того, наличие пагетоидных клеток должно побудить к тщательному поиску соседней кожной карциномы или более отдаленной опухоли происхождения.
Таблица 3
Немеланоцитарные причины распространения пагетоидов в эпидермисе
| Болезнь Педжета | |
| Экстрамаммарная болезнь Педжета | |
| Плоскоклеточная карцинома 904 Bowenoid 9042 9042 Bowenoid 9042 Пагетоидный актинический кератоз 33 | |
| Гистиоцитоз из клеток Лангерганса 34 | |
| Эккринная порокарцинома 35 | |
| Сальная клеточная карцинома | 4 Клеточно-клеточная карцинома / Карцинома из клеток Меркеля 36, 37 |
|---|---|
| Внутриэпидермальные мононуклеарные клетки / Микроабсцесс из клеток Лангерганса | |
| Метастатическая карцинома из отдаленной первичной опухоли | |
Обычно мы встречаем узловые меланоцитарные пролиферативные поражения без связанного невуса или значительного вложенного компонента. Эти поражения были названы Mihm и соавторами «внутриэпидермальной эпителиоидной меланоцитарной дисплазией de novo». 43 Они состоят из плохо выраженной лентигинозной пролиферации эпителиоидных меланоцитов разного размера и переменного пагетоидного распространения (рис. 16). У них отсутствует клеточная плотность и атипия, которых можно было бы ожидать от полностью развившейся меланомы in situ.Тем не менее, мы рассматриваем их как потенциальные предшествующие поражения, которые могут представлять развивающуюся меланому in situ, и рекомендуем их полное удаление.
Дисплазия De novo, проявляющаяся атипичными эпителиоидными меланоцитами с очень редкими супрабазальными формами. Это важное предшествующее поражение, которое необходимо полностью удалить.
Клинические аспекты, включая аспекты лечения
Перед постановкой диагноза невуса или меланомы необходимо рассмотреть несколько важных клинических особенностей: продолжительность поражения, предыдущая биопсия / травма (например, экскориация) на этом участке, недавний солнечный ожог / пребывание на солнце, личный анамнез предыдущей меланомы, семейный анамнез меланомы и возраст пациента.Сайт также является важным фактором. Атипичное поражение на спине у мужчины или на икре женщины всегда следует рассматривать как потенциальную меланому, пока не будет подтверждено иное. К сожалению, предоставляемая клиническая информация часто ограничивается «поражением на ноге». При столкновении с атипичным поражением необходим телефонный звонок клиницисту для выяснения клинического контекста.
«Атипичное поражение на спине мужчины или теленка женщины всегда следует рассматривать как потенциальную меланому, пока не будет подтверждено иное»
Возраст пациента имеет особое значение.Геллер и его коллеги проанализировали данные за 2002 год, опубликованные Национальным центром статистики здравоохранения США, и показали, что у мужчин и женщин в возрасте 45 лет и старше по-прежнему наблюдается рост заболеваемости и смертности от меланомы 44 . Особому риску подвержены мужчины в возрасте 65 лет и старше; в этой группе смертность от меланомы увеличилась на 157%, а заболеваемость меланомой — в пять раз с 1969 по 1999 год. Хотя заболеваемость меланомой увеличивалась у обоих полов во всех возрастных группах, темпы роста были ниже у мужчин и женщин в возрасте от 20 до 20 лет. 44 года, и смертность за тот же период времени в этой возрастной группе фактически снизилась.
Патолог должен сообщить о продолжительности поражения и его стабильности размера, формы и цвета. Большинство меланом возникает de novo, тогда как только 25% развиваются в связи с уже существующим невусом. 45 Новое меланоцитарное поражение вызывает тревогу у 60-летнего ребенка, но вряд ли так у 6-летнего. Недавнее пребывание на солнце (загар / солнечный ожог в области биопсии невуса) может повлиять на «активность» и появление новых невусов. 46
Информация о предыдущей биопсии или травме невуса также важна для отличия рецидивирующего явления невуса от меланомы.В сложных случаях всегда полезно пересмотреть предыдущую патологию. Даже незначительная травма, например, от экскориации, может вызвать цитологические и кожные изменения, которые могут имитировать меланому или регресс.
В связи с тем, что большее внимание уделяется косметическим результатам, и из-за постоянно растущей рабочей нагрузки, для лечения и диагностики атипичных невусов был введен ряд «более быстрых и менее травматичных» методов, включая нанесение удара, бритье и «совковое бритье». биопсии. Основным ограничением этих альтернатив является то, что часто только часть поражения доступна для гистологического исследования, что не позволяет провести окончательную оценку (рис. 17).Коэн и др. обнаружили остаточный невус в 24,9% повторных иссечений атипичных меланоцитарных невусов, которые первоначально были биопсированы либо методом бритья, либо ударом. 47 Особенно досадным ограничением биопсий после бритья и перфорации является то, что они часто содержат только центральную часть поражения, а область контакта между меланоцитарным поражением и нормальной кожей отсутствует. Это проблематично, поскольку достоверная оценка архитектуры (наличие или отсутствие ограниченности и симметрии) невозможна.Биопсии бритья, в которых исследуется только поверхностный аспект поражения, не позволяют оценить созревание.
Диспластический невус, показывающий атипию соединительных и дермальных компонентов с вовлечением краев, покрытых чернилами.
Поверхностная биопсия после бритья часто не позволяет точно оценить уровень Кларка и толщину опухоли меланом; эта неопределенность может привести к рекомендации к биопсии сторожевого лимфатического узла.
Полное иссечение скальпелем всех клинически атипичных невусов позволяет провести гистологическую оценку всего поражения и для большинства образцов избавляет пациента от необходимости дальнейшего хирургического вмешательства.Если бы мы смогли убедить наших коллег-клиницистов полностью удалить клинически атипичные невусы, уход за пациентами можно было бы улучшить, и многие из наших диагностических проблем стали бы в значительной степени академическими.
Лучшей и наиболее практичной иллюстрацией необходимости достижения клинически чистого края 2 мм является диспластический невус. В сложных диспластических невусах соединительный компонент часто выходит за пределы нижележащего дермального компонента («плеча») и проходит через несколько гребней ретейна. Это соответствует клиническому виду центральной папулы с блеклыми краями, которые сливаются с нормальной кожей.Чтобы гарантировать полное удаление, эти поражения должны быть иссечены с клинически чистыми краями 2 мм, чтобы гарантировать полное иссечение сужающегося соединительного компонента. В исследовании Коэна остаточный невус чаще ассоциировался с перфорацией, чем с биопсией после бритья, вероятно, потому, что «плечо» более эффективно иссекается при биопсии после бритья. Кроме того, недавнее исследование Барра и его коллег задокументировало, что 35,9% атипичных невусов демонстрируют вариации степени атипии от одной области к другой. 31 Таким образом, клиницист, который не полностью исследует диспластический невус с легкой атипией, которая распространяется до краев, не может быть уверен в том, что остаточное поражение не более высокой степени. В статье Коэна и соавторов , одно поражение (у пожилого пациента) имело меланому в образце повторного удаления. Представляется разумным, что стандарт лечения должен быть изменен на достижение четких клинических границ 2 мм для любых родинок, обозначенных как клинически атипичные. Полное первичное иссечение избавляет пациентов от процедуры повторного иссечения, а также снижает риск рецидива.Мы считаем, что эксцизионная биопсия с помощью скальпеля — безусловно лучший подход при лечении клинически атипичных / диспластических невусов.
«Полное иссечение скальпелем всех клинически атипичных невусов позволяет провести гистологическую оценку всего поражения и для большинства образцов избавляет пациента от необходимости дальнейшего хирургического вмешательства». клинический размер и анатомическое расположение часто не позволяют проводить эксцизионную биопсию.В таких случаях необходимы множественные пункционные биопсии различных регионов или, в качестве альтернативы, веретенообразная биопсия после разреза, поскольку одиночная биопсия может не отражать наихудшую область поражения в 40% случаев. 48
Помимо потенциального риска, который представляет для пациента частичная биопсия, стоит также помнить о возможности судебного разбирательства. Когда мы получаем частичную биопсию диспластических невусов, мы, как правило, довольно тупо рекомендуем полное и адекватное повторное удаление и часто указываем точную границу в миллиметрах.Некоторые дерматологи считают, что мы без надобности связываем им руки; мы придерживаемся противоположной точки зрения, потому что именно мы в конечном итоге понесем вину, если что-то пойдет не так!
В заключение, остерегайтесь атипичных невусов; у них может быть меланома. Сообщая о неви, не игнорируйте тот, который выглядит немного странно или бросается в глаза. Возможно, он пытается вам что-то сказать! Не сообщайте о меланоцитарных поражениях в конце дня, придерживайтесь себорейного кератоза и эпидермоидных кист. Наконец, иногда может спасти вторая пара глаз или даже третья.
Лентигинозная меланома: гистологическая картина меланомы, которую нужно отличать от лентигинозного невуса
Атипичная лентигинозная пролиферация меланоцитов у пожилых пациентов продолжает создавать диагностическую дилемму с поражениями, которые можно классифицировать как диспластический невус, атипичный соединительный невус 882 или в стадии развития) и предраковый меланоз. 1 Спектр лентигинозных меланоцитарных поражений варьируется от доброкачественных до атипичных и злокачественных (Таблица 2) и включает доброкачественные лентигинозные невусы, которые характеризуются удлинением ребер ретейна с небольшими гнездами меланоцитов, расположенными на концах сетчатки.Часто сопровождается легким лимфогистоцитарным инфильтратом с недержанием пигмента, и эти поражения могут развиться из простого лентиго. Отдельные меланоциты не демонстрируют цитологической атипии. В отличие от лентигинозных невусов, атипичный (диспластический) лентигинозный невус у пожилых людей демонстрирует нерегулярную систему сетчатых гребней с гнездами и одиночными меланоцитами, неравномерно распределенными в сетчатом эпидермисе. В супрапапиллярных пластинках присутствует очаговый сплошной рост меланоцитов и присутствует очаговая атипия, характеризующаяся более крупными нерегулярными гиперхроматическими ядрами.Может присутствовать переход в меланому in situ , характеризуемый изменениями, обычно наблюдаемыми при злокачественном лентиго. 2
Таблица 2 Характерные гистологические особенности лентигинозных меланоцитарных пораженийНа первый взгляд наши случаи имели общие гистологические данные с лентигинозными невусами (сохранение повторного эпидермиса с гнездами меланоцитов на концах ретенции) и атипичными лентигинозными невусами (сохранение лентигинозных невусов). retiform эпидермис и лентигинозное распространение атипичных меланоцитов).Однако наши случаи характеризовались сплошным ростом атипичных меланоцитов, охватывающих все поражение, подобно пролиферации, наблюдаемой в меланомах с лентигинозной пролиферацией узлов (тип лентиго злокачественного, акрально-лентигинозный тип и лентигинозный тип слизистой оболочки). 3, 4, 5, 6 В отличие от акральной и лентигинозной меланомы слизистых оболочек, все наши случаи были локализованы на голове и шее, туловище и руке, и, гистологически, наблюдалось сохранение ретиформного эпидермиса и отсутствие выраженного солнечного эластоза. , в отличие от злокачественного лентиго.Иммуногистохимические окрашивания для Mitf и Mart-1 были полезны для выявления обширной пролиферации базальных меланоцитов, а также очагов пагетоидов, распространяемых меланоцитами, которые трудно идентифицировать на окрашенных H- и E срезах. Взятые вместе, наши случаи имели признаки атипичных лентигинозных невусов (сохранение ретиформной архитектуры эпидермиса) и злокачественного лентиго (сплошной рост атипичных меланоцитов). Основываясь на биологическом поведении и этих совпадающих гистологических данных, мы полагаем, что наши поражения представляют собой вариант злокачественного лентиго, хотя и с сохранением повторной формы эпидермиса.
Биологически поражения в нашей серии, по-видимому, сохранялись и прогрессировали, если их не лечить. Этот курс был очевиден по нашим трем индексным случаям (пациенты 3, 11 и 12), первоначальные биопсии которых были интерпретированы как атипичные лентигинозные соединительные невусы, для которых не применялась дополнительная терапия. Поражения сохранялись и постепенно увеличивались, что привело к полному удалению через 16 месяцев, 3 года, 3 года и 10 месяцев соответственно. Распознавание этой модели пролиферации в образцах биопсии побудило нас порекомендовать повторное удаление нашим последующим 13 пациентам с аналогичными результатами в повторно вырезанных образцах.Хотя только два из наших 16 случаев имели инвазивный компонент, соответствующий уровню II по Кларку, что указывает на то, что эти поражения обладают способностью проникать в дерму, время для приобретения этих свойств может быть увеличено и может объяснить их сохранение как меланомы в радиальной фазе роста. аналогичен естественной биологии классического злокачественного лентиго.
Среди меланоцитарных поражений, изученных у пожилых людей, наиболее распространенным был дермальный невус, 7, 8, 9 , а с приобретенными невусами с соединительным компонентом наблюдалось быстрое снижение наличия соединительного компонента с увеличением возраст, при этом менее 10% пациентов в возрасте старше 60 лет имеют узловой компонент. 10 В этой группе пациентов с соединительным компонентом существовала отдельная категория поражений с перекрывающимися гистологическими признаками солнечного лентиго и атипичной пролиферации меланоцитов, и та же самая база данных использовалась для анализа невусов у пациентов старше 40 лет. 11 Повреждения демонстрировали непрерывный спектр, напоминающий старческое лентиго с пятнистой соединительной активностью, до поражений с наложенной атипичной лентигинозной меланоцитарной пролиферацией, граничащей со злокачественной меланомой in situ .Термин «пигментированный лентигинозный невус с атипией» использовался для обозначения поражений, граничащих с меланомой in situ . Kossard et al 2 описали аналогичные поражения, которые они назвали лентигинозным диспластическим невусом у пожилых людей, и поражения обычно были связаны с переходом в злокачественную меланому in situ (обычно как lentigo maligna). 12 Weedon 1 считает, что это недооцененное клинико-патологическое заболевание, которое в прошлом классифицировалось как диспластический невус, атипичный соединительный невус, меланома in situ (ранняя или развивающаяся) и предраковый меланоз.
Точная классификация атипичных лентигинозных меланоцитарных поражений остается диагностической дилеммой. Это исследование представляет собой попытку определить подмножество поражений у пожилых пациентов, которые, по нашему мнению, являются меланомой с лентигинозным типом роста и, скорее всего, являются разновидностью злокачественного лентиго. Мы основываем наши выводы на их биологическом поведении, которое сохраняется и прогрессирует, если его не лечить, и гистологически на широте поражения с сливающимся ростом атипичных меланоцитов вдоль дермоэпидермального соединения, хотя и с сохранением сетчатого эпидермиса.В двух случаях наблюдалось прогрессирование инвазивной меланомы.
В заключение мы представляем 16 пожилых пациентов с меланомой в радиальной фазе роста, гистологическая картина которых внешне напоминает лентигинозный или диспластический невус. Возраст пациента, центральное анатомическое расположение и наличие сплошного роста меланоцитов вдоль дермоэпидермального соединения помогут в правильном диагнозе и соответствующем хирургическом удалении этих поражений. Основная цель этого исследования — повысить осведомленность о том, что при ограниченных биопсиях, демонстрирующих вышеуказанные клинико-патологические данные, рекомендуется полное удаление этих поражений для дальнейшей оценки.
Загадка «диспластического невуса»: взгляд назад, взгляд вперед — FullText — Dermatopathology 2018, Vol. 5, № 2
Введение
Термин диспластический невус происходит от греческого (dys = аномальный) и (Plasis = рост) и был придуман для описания отдельного объекта, несущего в своем названии потенциальный вред хозяину [1]. В 1992 г. Консенсусная конференция Национального института здоровья предложила заменить термин «невус с архитектурным нарушением с цитологической атипией и без нее» [2].Однако старая терминология продолжает широко использоваться. Путем включения диспластического невуса в качестве промежуточного меланоцитарного поражения в гистологический морфобиологический спектр доброкачественных и злокачественных поражений было сочтено, что была создана диагностическая «зона комфорта», в которой диагностическая неопределенность со стороны патолога может, в свою очередь, гарантировать повторное удаление опухоли. поражение врачом [3, 4].
Гистопатологические критерии
Всемирная организация здравоохранения (ВОЗ) в 1991 г. определила диспластический невус как гистологическое образование, которое отличается от обычных невусов, и для диагноза требуются оба из двух основных критериев (базилярная пролиферация атипичных меланоцитов с расширением трех ретрансляций). гребней за пределами дермального компонента; организация пролиферации в структуре лентигинозных или эпителиоидных клеток) и по крайней мере два из второстепенных критериев (ламеллярный или концентрический эозинофильный фиброз; неоваскуляризация; воспалительная реакция; слияние ретиновых гребней) [5].Университет Дьюка добавил трехуровневую классификацию цитологической атипии на легкую, среднюю и тяжелую. Это было основано на размере ядра, морфологии, эухроматизме, выпуклости ядрышек, а также на диаметре клеток по сравнению с базальными кератиноцитами [6] (рис. 1). Проблемы возникают при постановке диагноза диспластического невуса с тяжелой атипией, что таит в себе риск неправильной диагностики меланомы in situ [7].
Рис. 1.
Диспластический невус. a Достаточно четко очерченная лентигинозная и вложенная меланоцитарная пролиферация, простирающаяся на три выступа ретейна за пределы дермального компонента (исходное увеличение × 40). b Поражение демонстрирует удлинение и слияние сетчатых гребней, концентрическую и пластинчатую папиллярную фиброплазию дермы, пятнистый инфильтрат лимфоидных клеток и редкие меланофаги (исходное увеличение × 100). c Цитологическая атипия от легкой до умеренной (исходное увеличение × 200).
Проблемы диагностической воспроизводимости
Патологоанатомы полагаются на визуальную интерпретацию при диагностике меланоцитарных поражений. Однако среди патологов есть большие различия, особенно в диапазоне от диспластических невусов с умеренной атипией до ранней меланомы; такие критерии не воспроизводимы и не точны [8].Это связано с частично совпадающими морфологическими особенностями, присущими обычным невусам и меланоме [7], что делает интерпретацию диспластических невусов кумберсом. Дальнейшая сложность возникает, когда диспластический невус соседствует с ранней меланомой in situ, и возникает вопрос, могут ли они представлять собой часть морфобиологического континуума или нет (Рис. 2, 3). В конечном счете, классификация атипии (легкая, умеренная, тяжелая) очень субъективна с низким уровнем согласия между наблюдателями [9].
Рис. 2.
Удаление диспластического невуса, диагностированного клинически и дерматоскопически. a Сканирующее увеличение, показывающее хорошо разграниченную пролиферацию меланоцитов в центре образца (исходное увеличение × 20). b – d При большем увеличении поражение проявляет черты диспластического невуса с умеренной атипией (исходное увеличение b × 100, c × 200, d × 400).
Рис. 3.
Область, прилегающая к диспластическому невусу с меланомой in situ. a Сканирующее увеличение того же гистологического среза, что и на рисунке 2, демонстрирующее потерю ретейджеров с истончением эпидермиса и папиллярный фиброз кожи, что указывает на возможную регрессию (исходное увеличение × 40). b , c При большем увеличении наблюдается нерегулярная пролиферация лентигинозных и вложенных меланоцитов с разбросанными лимфоцитами и меланофагами с папиллярным фиброзом кожи, распространяющаяся до периферического края (исходное увеличение × 200). d Более глубокие участки периферического края дополнительно раскрывают атипичные внутриэпидермальные меланоциты меланомы in situ. Во многих оцениваемых срезах инвазивный компонент выявлен не был (исходное увеличение × 400).
New Genetic Insights
Были предприняты многочисленные исследования для определения молекулярных особенностей, отличающих диспластические невусы от обычных невусов и меланомы [1]. В попытке преодолеть ограничения, связанные с низким соглашением между наблюдателями при диагностике диспластических невусов, было проведено исследование, чтобы оценить, являются ли морфологические особенности диспластических невусов генетически обусловленными и может ли морфология быть отражением генетических изменений с конечным результатом. риск прогрессирования меланомы [10].Shain et al. [10] показали, что существует последовательность генетических изменений во время развития меланомы, и что те меланоцитарные поражения с одним или несколькими патогенными изменениями, такие как диспластические невусы, в своей эволюционной модели попадают в категорию «промежуточных».
Споры о повторной эксцизии
Учитывая вышеизложенные соображения, гистопатологический диагноз диспластического невуса влияет на ведение пациента. Хотя общепризнано, что слабо атипичные диспластические невусы, не похожие на меланому, не требуют дальнейшего лечения [7], недавние исследования показали низкую частоту рецидивов диспластических невусов с умеренной атипией и положительными гистологическими краями [9, 11] и диспластических невусов. с тяжелой атипией [12], что позволяет предположить, что повторное удаление может не потребоваться [9, 11, 12].Другие выступают за предварительную политику четких границ при повторном удалении диспластических невусов с краевой биопсией 2,0 мм [13] или с полным удалением бритья с чистыми краями [14]. Также было высказано предположение, что использование гистологического метода диагностики диспластических невусов без градации может снизить частоту иссечения [15].
Тем не менее, объективная интерпретация диспластического невуса с тяжелой атипией на световом микроскопическом уровне все еще остается сложной задачей, учитывая его пограничную морфологию, потенциально представляющую ранний аналог морфобиологического континуума с меланомой [4, 16].
Заключение
Есть надежда, что последние достижения в области генетики прольют свет на знания о диспластическом невусе и разрешат его морфологическую загадку, отличающую его от меланомы. Неполностью иссеченные диспластические невусы с умеренной и тяжелой архитектурной и цитологической атипией при соответствующей клинико-патологической корреляции лучше всего лечить полным повторным удалением.
Заявление об этике
Автор не имеет никаких этических конфликтов, которые следует раскрывать.
Заявление о раскрытии информации
Автор не заявляет о конфликте интересов.
Список литературы
- Даффи К., Гроссман Д: Диспластический невус: от исторической точки зрения к управлению в современную эпоху: Часть I.Исторические, гистологические и клинические аспекты. J Am Acad Dermatol 2012; 67: 1.e1–1.e16; quiz 1.e17–1.e18.
- Консенсусная конференция NIH. Диагностика и лечение ранней меланомы. JAMA 1992; 268: 1314–1319.
- Киттлер Х., Чандл П. Диспластический невус: почему от этого термина следует отказаться в дерматоскопии.Дерматол Клин 2013; 31: 579–588, viii.
- Rosendahl CO, Grant-Kels JM, Que SK: Диспластический невус: факт и вымысел. J Am Acad Dermatol 2015; 73: 507–512.
- Клементе C, Кокран AJ, Elder DE, Levene A, MacKie RM, Mihm MC, Rilke F, Cascinelli N, Fitzpatrick TB, Sober AJ: Гистопатологический диагноз диспластических невусов: согласие между патологами, созванное Программой по меланоме Всемирной организации здравоохранения.Hum Pathol 1991; 22: 313–319.
- Shea CR, Vollmer RT, Prieto VG: Корреляция архитектурного расстройства и цитологической атипии в (диспластических) меланоцитарных невусах Кларка. Hum Pathol 1999; 30: 500–505.
- Даффи К., Гроссман Д: Диспластический невус: с исторической точки зрения к управлению в современную эпоху: Часть II.Молекулярные аспекты и клиническое ведение. J Am Acad Dermatol 2012; 67: 19.e1–19.e12; викторина 19.e31–19.e32.
- Элмор Дж. Г., Барнхилл Р. Л., Элдер Д. Е., Лонгтон Г. М., Пепе М. С., Райш Л. М., Карни П. А., Титус Л. Дж., Нельсон Г. Д., Онега Т., Тостесон А. Н., Вайншток М. А., Кнезевич С. Р., Пипкорн М. В.: Диагноз патологами инвазивной меланомы и меланоцитов. распространение: точность наблюдателя и исследование воспроизводимости.BMJ 2017; 357: j2813.
- Хискокс Б., Хардин М.Р., Оренго И.Ф., Розен Т., Мир М., Диван А.Х .: Рецидив умеренно диспластических невусов с положительными гистологическими краями. J Am Acad Dermatol 2017; 76: 527–530.
- Shain AH, Yeh I, Kovalyshyn I, Sriharan A, Talevich E, Gagnon A, Dummer R, North J, Pincus L, Ruben B, Rickaby W, D’Arrigo C, Robson A, Bastian BC: генетическая эволюция меланомы от предшествующие поражения.N Engl J Med 2015; 373: 1926–1936.
- Хискокс Б., Хардин М.Р., Оренго И.Ф., Розен Т., Мир М., Диван А.Х .: Ответ: нужно ли реэкцизировать невусы средней степени диспластичности с положительными гистологическими краями? J Am Acad Dermatol 2017; 77: e85.
- Engeln K, Peters K, Ho J, Jedrych J, Winger D, Ferris LK, Patton T: Диспластические невусы с тяжелой атипией: отдаленные результаты у пациентов с повторным удалением и без него.J Am Acad Dermatol 2017; 76: 244–249.
- Терушкин В., Нг Э., Штейн Дж., Кац С., Коэн Д. Е., Михан С., Польски Д.: проспективное исследование, оценивающее полезность 2-мм биопсийного края для полного удаления гистологически атипичных (диспластических) невусов. J Am Acad Dermatol 2017; 77: 1096–1099.
- Магари А: Диспластические (или атипичные) невусы с атипией средней или тяжелой степени с четкими краями на образцах для снятия бритья, скорее всего, полностью иссечены. J Cutan Med Surg 2017; 21: 42–47.
- Lozeau DF, Farber MJ, Lee JB: Несоответствующий гистологический подход к (диспластическим) невусам Кларка: потенциал для снижения скорости удаления.J Am Acad Dermatol 2016; 74: 68–74.
- Кокерелл К.Дж.: Контрапункт: «диспластический» невус: во что я верю и во что не верю. J Am Acad Dermatol 2015; 73: 515–517.
Автор Контакты
Екатерина М.Стефанато, доктор медицины, FRCPath
Отделение дерматопатологии, Институт дерматологии Святого Иоанна
Больница Святого Томаса, Вестминстер Бридж-роуд
Лондон SE1 7EH (Великобритания)
Электронная почта [email protected]
Подробности статьи / публикации
Получено: 6 февраля 2018 г.
г.
Принято: 20 февраля 2018 г.
Опубликовано онлайн: 20 апреля 2018 г.
Дата выпуска: апрель — июньКоличество страниц для печати: 5
Количество рисунков: 3
Количество столов: 0
eISSN: 2296-3529 (онлайн)Для дополнительной информации: https: // www.karger.com/DPA
Лицензия открытого доступа / Дозировка лекарств / Заявление об ограничении ответственности
Эта статья находится под международной лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 (CC BY-NC-ND). Использование и распространение в коммерческих целях, а также любое распространение измененных материалов требует письменного разрешения. Дозировка лекарственного средства: авторы и издатель приложили все усилия для обеспечения того, чтобы выбор и дозировка лекарств, указанные в этом тексте, соответствовали текущим рекомендациям и практике на момент публикации.Однако ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство. Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Атипичные родинки: диагностика и лечение
1. Консенсусная конференция NIH.Диагностика и лечение ранней меланомы. JAMA . 1992; 268 (10): 1314–1319 ….
2. Eckerle Mize D, Bishop M, Resse E, Sluzevich J. Синдром семейной атипичной множественной меланомы родинок. В: Ригерт-Джонсон Д.Л., Бордман Л.А., Хефферон Т. и др., Ред. Раковые синдромы. Бетесда, штат Мэриленд: Национальный центр биотехнологической информации; 2009.
3. Фридман Р.Дж., Фарбер MJ, Варича М.А., Папатазис N, Миллер М.К., Heilman ER. «Диспластический» невус. Клин Дерматол . 2009. 27 (1): 103–115.
4. Шефер Т., Меркл Дж. Клемм Э, Wichmann HE, Кольцо J; KORA Study Group. Эпидемиология невусов и признаки старения кожи у взрослого населения в целом: результаты исследования KORA 2000. J Invest Dermatol . 2006. 126 (7): 1490–1496.
5. Ху С, Пармет Y, Аллен Дж., и другие. Неравенство в меланоме: анализ тенденций заболеваемости меланомой и стадии диагностики среди белых, латиноамериканцев и чернокожих во Флориде. Арка Дерматол . 2009. 145 (12): 1369–1374.
6. Рухани П., Ху С, Кирснер RS. Меланома у латиноамериканцев и чернокожих американцев. Борьба с раком . 2008. 15 (3): 248–253.
7. Гандини С., Сера F, Каттаруцца М.С., и другие. Мета-анализ факторов риска меланомы кожи: I. Общие и атипичные невусы. Eur J Cancer . 2005. 41 (1): 28–44.
8. Cyr PR. Атипичные родинки. Врач Фам . 2008. 78 (6): 735–740.
9. Маргуб А.А., Копф А.В., Ригель Д.С., и другие. Риск кожной злокачественной меланомы у пациентов с «классическим» синдромом атипичных родинок. Исследование случай-контроль. Арка Дерматол . 1994; 130 (8): 993–998.
10. Naeyaert JM, Брочез Л. Клиническая практика. Диспластические невусы. N Engl J Med . 2003. 349 (23): 2233–2240.
11. Halpern AC, Guerry D 4-й, Старейшина DE, Трок B, Синнестведт М, Хамфрис Т.Естественное течение диспластических невусов. J Am Acad Dermatol . 1993. 29 (1): 51–57.
12. Даффи К., Гроссман Д. Диспластический невус: с исторической точки зрения к управлению в современную эпоху: часть I. Исторические, гистологические и клинические аспекты. J Am Acad Dermatol . 2012; 67 (1): 1.e1–1.e16.
13. Ригель Д.С., Руссак Дж., Фридман Р. Эволюция диагностики меланомы: 25 лет после ABCD. CA Cancer J Clin .2010. 60 (5): 301–316.
14. Даффи К., Гроссман Д. Диспластический невус: с исторической точки зрения к управлению в современную эпоху: часть II. Молекулярные аспекты и клиническое ведение. J Am Acad Dermatol . 2012; 67 (1): 19.e1–19.e12.
15. Whited JD, Гричник Ю.М. Рациональное клиническое обследование. У этого пациента родинка или меланома? JAMA . 1998. 279 (9): 696–701.
16. Область действия A, Дуза ЮЗ, Халперн AC, и другие.Знак «Гадкий утенок»: соглашение между наблюдателями. Арка Дерматол . 2008. 144 (1): 58–64.
17. Balk SJ; Совет по гигиене окружающей среды; Раздел по дерматологии. Ультрафиолетовое излучение: опасность для детей и подростков. Педиатрия . 2011; 127 (3): e791 – e817.
18. Зеленый AC, Уильямс GM, Логан В, Strutton GM. Уменьшение количества меланомы после регулярного использования солнцезащитных кремов: последующее рандомизированное исследование. Дж. Клин Онкол . 2011. 29 (3): 257–263.
19. Каст А.Е., Армстронг Б.К., Гумас С, и другие. Использование солярия в подростковом и раннем взрослом возрасте связано с повышенным риском развития меланомы в раннем возрасте. Инт Дж. Рак . 2011. 128 (10): 2425–2435.
20. Лазович Д, Фогель Р.И., Бервик М., Weinstock MA, Андерсон К.Э., Warshaw EM. Загар в помещении и риск меланомы: исследование случай-контроль в популяции с высоким уровнем облучения. Биомаркеры эпидемиологии рака Предыдущая . 2010. 19 (6): 1557–1568.
21. Мойер В.А. Поведенческое консультирование для предотвращения рака кожи: рекомендация Целевой группы по профилактическим услугам США. Энн Интерн Мед. . 2012. 157 (1): 59–65.
22. Скрининг на рак кожи: рекомендация Целевой группы по профилактическим услугам США. Энн Интерн Мед. . 2009. 150 (3): 188–193.
23. Weinstock MA, Рисика П.М., Мартин Р.А., и другие.Раннее выявление меланомы при тщательном самообследовании кожи: рандомизированное исследование «Check It Out». Am J Prev Med . 2007. 32 (6): 517–524.
24. Карли П., Де Джорджи V, Палли Д, и другие.; Итальянская многопрофильная группа по меланоме. Обнаружение дерматологом и самообследование кожи связаны с более тонкими меланомами: результаты опроса Итальянской многопрофильной группы по меланоме. Арка Дерматол .2003. 139 (5): 607–612.
25. Альтамура Д, Аврамидис М, Menzies SW. Оценка оптимального интервала и чувствительности краткосрочного последовательного цифрового дерматоскопического мониторинга для диагностики меланомы. Арка Дерматол . 2008. 144 (4): 502–506.
26. Tripp JM, Копф А.В., Маргуб А.А., Барт RS. Лечение диспластических невусов: опрос сотрудников Американской академии дерматологии. J Am Acad Dermatol .2002. 46 (5): 674–682.
27. Маргуб А.А., Усатин РП, Хаймс Н. Дерматоскопия для семейного врача. Врач Фам . 2013. 88 (7): 441–450.
28. Салерни Г, Каррера С, Ловатто L, и другие. Преимущества фотографии всего тела и цифровой дерматоскопии («двухэтапный метод цифрового наблюдения») в ранней диагностике меланомы у пациентов с высоким риском меланомы. J Am Acad Dermatol .2012; 67 (1): e17 – e27.
29. Ng PC, Барзилай Д.А., Исмаил С.А., Аверитте Р.Л. Младший, Gilliam AC. Оценка инвазивной кожной меланомы: репрезентативна ли исходная биопсия окончательной глубины? J Am Acad Dermatol . 2003. 48 (3): 420–424.
30. Пикетт Х. Бритье и делать биопсию при поражениях кожи. Врач Фам . 2011; 84 (9): 995–1002.
31. Goodson AG, Флорелл С.Р., Буше К.М., Гроссман Д.Низкая частота клинических рецидивов после биопсии доброкачественных или умеренно диспластических меланоцитарных невусов. J Am Acad Dermatol . 2010. 62 (4): 591–596.
32. Хокер Т.Л., Алихан А, Comfere NI, Питерс М.С. Благоприятные отдаленные результаты у пациентов с гистологически диспластическими невусами, которые приближаются к границе образца. J Am Acad Dermatol . 2013. 68 (4): 545–551.
33. Редди К.К., Фарбер MJ, Бхаван Дж, Геронемус Р.Г., Роджерс Г.С.Атипичные (диспластические) невусы: результаты хирургического удаления и связь с меланомой. JAMA Dermatol . 2013. 149 (8): 928–934.
Прогностическая ценность положительных границ при диагностической биопсии диспластических невусов
Диспластические невусы (DN) являются частыми и противоречивыми, и лучший выбор для лечения DN после постановки диагноза не всегда очевиден. Наличие положительных границ, обнаруженных при диагностической биопсии, используется многими дерматологами при принятии решения о повторном иссечении этих поражений.Чтобы количественно оценить прогностическую ценность положительных полей в диагностической биопсии DN, мы выполнили обзор и анализ соответствия между гистологическими данными биопсий и их последующими иссечениями. Было проанализировано в общей сложности 122 отчета о патологии из диагностической биопсии DN с клетками невуса, присутствующими на краю ткани. В этой выборке было выполнено 68 иссечений после биопсии. Отчеты об эксцизионной патологии были рассмотрены на предмет наличия остаточных или рецидивирующих клеток невуса.Остаточные клетки невуса были описаны в 29 из 63 доступных отчетов об эксцизионной патологии, что свидетельствует о положительной прогностической ценности (PPV) положительных полей в диагностической биопсии DN 46,0%. Мы представляем это значение вместе с PPV из очень немногих существующих аналогичных исследований. Количественная прогностическая ценность положительных пределов при диагностической биопсии является полезной информацией для поставщиков медицинских услуг, которые должны принимать решения относительно лучших вариантов лечения для пациентов с DN. Низкий PPV положительной маржи является дополнительным доказательством того, что DN средней степени тяжести или меньше можно просто контролировать.
1. Введение
Диспластические невусы (DN) являются обычным явлением, но их поведение и биология противоречивы. Оптимальный выбор для лечения ДН после постановки диагноза не всегда очевиден. Наличие положительных границ, обнаруженных при диагностической биопсии, как указано в отчетах о патологии, используется многими дерматологами при принятии решения о повторном иссечении этих поражений [1]. Однако нередко после выполнения последующего иссечения в иссеченной ткани не обнаруживаются остаточные клетки невуса.Это неожиданно с учетом изначально положительного диагностического запаса. Степень соответствия диагностической биопсии положительным краям ткани и их последующему удалению может быть определена количественно и представлена как прогностическая ценность положительного результата (PPV).
До сих пор эта метрика оценивалась лишь в нескольких исследованиях. В некоторых случаях PPV рассчитывается непосредственно авторами исследования. В других случаях мы рассчитывали PPV, используя данные, представленные авторами. Ниже приведены результаты пяти известных исследований, в которых PPV положительных границ в диагностических биопсиях DN был рассчитан или может быть рассчитан с использованием данных исследования.До сих пор ни одна статья или обзор не включали все эти данные и не стандартизировали их с помощью PPV.
В ретроспективном исследовании Maghari обнаружил, что из 236 биопсий после бритья, показывающих DN с умеренной или тяжелой атипией и положительными краями, 136 оказались положительными на остаточные или рецидивирующие клетки невуса при иссечении [2]. Это показывает, что PPV составляет 44,9%.
Исследование Reddy et al. обнаружили, что при повторном иссечении 127 биоптатов с положительным краем в 42 были обнаружены клетки невуса, демонстрируя PPV 33% [3].
Strazzula et al. обнаружили, что после 405 биопсий с положительным краем, 90 повторных эксцизий содержали клетки невуса, PPV 18,2%. Они изложили свои выводы, заявив, что «гистопатологический результат от повторного иссечения маржи с умеренной и умеренной DN является низким, а преимущество обеспечения полного очищения невуса может не компенсировать потенциальный риск для пациента и затраты, связанные с дополнительной процедурой [4]. ] ».
Согласно данным, представленным Cohen et al., Когда один боковой край диагностической биопсии был положительным, PPV равнялось 24.Было продемонстрировано 0%. Когда оба боковых диагностических поля были положительными, PPV увеличивался до 39,7% [5].
Совсем недавно Duncan et al. сообщили о PPV 29,41% в DN с умеренной атипией или выше [6].
В нашем исследовании мы количественно оцениваем PPV положительных границ в диагностических биопсиях DN путем ретроспективного обзора и анализа соответствия между гистологическими данными биопсии и последующими иссечениями в нашей собственной популяции пациентов. Мы представляем этот PPV в сравнении и в дополнение к пяти вышеупомянутым исследованиям.
Количественная оценка PPV положительных границ в диагностических биопсиях DN и представление этой информации с результатами других исследований предоставят поставщикам больше информации при принятии решений о лечении своих пациентов с подтвержденной биопсией и положительной маржей DN.
2. Материалы и методы
Используя метод, одобренный институциональным наблюдательным советом, записи диагностической биопсии и гистопатологии из местной дерматологической практики были проанализированы на предмет наличия DN.
Методы диагностики и лечения DN в этой практике обычно включали диагностическую биопсию после бритья с целью удаления всего видимого поражения с последующим возможным иссечением. Решение об удалении после биопсии определялось как степенью меланоцитарной атипии, так и наличием клеток невуса на краю диагностического образца, как указано в отчете о патологии. DN с легкой атипией, как правило, не иссекали, и их рецидив контролировали клинически.Иссечение в этой группе проводилось для поражений, которые казались особенно опасными с клинической точки зрения, несоразмерными их микроскопическому диагнозу. DN с умеренной атипией, как правило, иссекали, если при начальной биопсии обнаруживались положительные края, и в противном случае контролировали. DN с тяжелой атипией иссекали независимо от состояния края биопсии.
Обработка и разделение образцов биопсии были выполнены сторонней частной дерматопатологической группой с использованием обычного метода приготовления хлеба.Каждый из дерматопатологов, читающих слайды по этой практике, обычно комментировал состояние краев биоптатов пигментных поражений.
В общей сложности 122 диагностических биопсии DN с клетками невуса, присутствующих на краю ткани, взятых в период с 1 января по 31 декабря 2017 г., были доступны для анализа. В этой выборке было выполнено 68 иссечений после биопсии. Гистопатологические данные начальной биопсии указывали на степени цитологической атипии, включая легкую или легкую, легкую-умеренную, среднюю, средне-тяжелую, тяжелую и другие.В категории «другое» конкретная степень атипии не упоминалась, вместо этого использовались такие термины, как «необычная цитологическая атипия», «с атипичными признаками» или просто «атипичный».
Эксцизионная согласованность с исходной биопсией была определена путем обзора отчетов по эксцизионной гистопатологии. Если в иссеченной ткани сообщалось о наличии клеток невуса, удаление считалось совпадающим с положительной по краю биопсией и, таким образом, считалось истинно положительным (TP). Если о клетках невуса не сообщалось, биопсия и иссечение считались несогласованными и, следовательно, ложноположительными (FP).После количественной оценки результатов TP и FP, PPV был рассчитан следующим образом:
В двух отчетах об эксцизиях также были обнаружены несоответствующие диагнозы по сравнению с их соответствующими диагностическими биопсиями. Одна биопсия, которая первоначально была отмечена как умеренная DN, после иссечения была отмечена как умеренно-тяжелая. Другая биопсия, первоначально описанная как умеренная DN, после иссечения была описана как злокачественная меланома in situ.
3. Результаты и обсуждение
Клетки остаточного невуса были описаны в 29 из 63 имеющихся отчетов об эксцизионной патологии.Это иллюстрирует PPV положительных границ при диагностической биопсии DN 46,0%. Это значение аналогично результатам Maghari (44,9%) [2] и выше, чем у Reddy et al. (33,0%) [3], Cohen et al. (31,2%) [5], Duncan et al. (29,4%) [6], а Strazzula et al. (18,2%) [4] (Рисунок 1).
PPV также анализировался отдельно для каждой степени тяжести DN с остаточными клетками невуса, обнаруживаемыми при иссечении в 50,0% случаев DN легкой степени (2 полных иссечения), 28,6% случаев DN легкой-умеренной степени (7 полных иссечений), 42.9% DN средней степени (28 полных иссечений), 66,7% DN средней и тяжелой степени (6 полных иссечений), 50,0% тяжелых DN (6 полных иссечений) и 50,0% другой или неуточненной атипии (14 полных иссечений) (рис. 2). Наиболее эффективны данные для невусов с умеренной диспластичностью, поскольку это была самая большая выборка.
Основная причина низкого PPV положительных полей в диагностической биопсии DN и несоответствия между диагностической биопсией и результатами эксцизионных исследований требует дальнейшего изучения.Возможно, воспалительный ответ после биопсии может способствовать растворению или затемнению любых остаточных клеток невуса. Другое объяснение может заключаться в том, что непораженные ткани могут непропорционально сжиматься по сравнению с тканью, в которой присутствуют клетки невуса, что приводит к положительным результатам диагностики. Blasdale et al. описали сокращение ткани гистологического края вырезок базальноклеточной карциномы и сообщили, что свободная от опухоли ткань претерпевала непропорционально высокую скорость усадки по сравнению с пораженной опухолью кожей, в результате чего пораженные клетки выглядели ближе к границе, чем они были на самом деле [7] .
Поскольку протокол гистопатологического анализа иссечений DN не требует срезов ткани до истощения, возможно, что остаточные клетки невуса в иссеченных образцах могут быть пропущены. Мы признаем, что ограничением нашего исследования была невозможность выполнить повторные срезы на образцах иссеченных тканей для обзора и подтверждения первоначального отчета. Мы также признаем ограниченное возможное исследование границы при диагностической биопсии. Дальнейшие исследования могут быть проведены с включением второго обзора тканей дерматопатологами, чтобы определить, действительно ли дальнейшее секционирование влияет на результаты.
4. Выводы
В октябре 2018 года Подкомитет по пигментным поражениям Рабочей группы по профилактике меланомы опубликовал результаты, касающиеся риска меланомы при умеренной DN при эксцизионной биопсии, но с положительными гистологическими границами и без последующего повторного удаления [8]. Всего было изучено 467 DN средней степени тяжести с положительными гистологическими границами от 438 пациентов, из них ни один случай не развился в меланому кожи на участках биопсии со средним сроком наблюдения 6.9 лет. Они также сообщили, что частота клинических рецидивов пигментации на участке биопсии составляет 1,2%. Было опубликовано консенсусное заявление о том, что наблюдение может быть разумным вариантом при неполном удалении DN средней степени без клинической остаточной пигментации [9].
В другом крупномасштабном ретроспективном когортном исследовании Fleming et al. предоставили доказательства в пользу клинического наблюдения подтвержденной биопсией легкой или умеренной DN с положительными гистологическими границами. Их данные включали 304 наблюдаемых DN со средним периодом наблюдения 5.5 лет. Из 304 наблюдаемых DN только у 10 возникли рецидивы (3,3%), и только у 1 пациента (0,33%) развилась меланома после эксцизионной диагностической биопсии [10].
Наше исследование демонстрирует низкий PPV положительных границ в диагностических биопсиях DN и согласуется с рекомендацией Подкомитета по пигментным поражениям о том, что DN средней степени тяжести или менее можно контролировать клинически. Наши результаты могут быть использованы вместе с их утверждением в качестве доказательства, чтобы помочь поставщикам услуг определить лучший план лечения для своих пациентов.В частности, наше исследование предоставляет дополнительные доказательства к выводу о том, что полностью биопсийно-положительный DN средней степени тяжести можно безопасно контролировать, поскольку мощность нашего набора данных была наибольшей для группы средней степени тяжести. В этой группе мы наблюдали PPV на уровне 42,9%, что указывает на то, что более половины иссечений после биопсии не показали признаков остаточных клеток невуса. Даже с положительным отклонением от первоначального диагноза медработники должны руководствоваться клинической оценкой при рассмотрении вопроса о лечении, особенно когда можно безопасно избежать хирургического вмешательства.
Добавление наших результатов к результатам других исследований увеличивает объем знаний о DN и позволяет дерматологам улучшить клиническое ведение. Мы надеемся, что количественная оценка прогностической ценности положительных пределов при биопсии DN поможет в процессе принятия решений при рассмотрении вариантов лечения, и это исследование может стать источником информации для медицинских работников. Когда рассматривается низкий риск рецидива или трансформации наряду с низким PPV диагностической биопсии с положительным краем, мы считаем, что многие постбиопсийные иссечения DN могут быть отложены, если они признаны клинически целесообразными, независимо от состояния края.
