Народные средства от метастаз в позвоночнике
Данный отдел человеческого организма считается наиболее уязвимым к развитию вторичной онкологии. Данная патология отнимет много времени на свое лечение и оно не всегда будет успешным. Но если во время определить неприятные проявления, то народные средства при метастазах в позвоночнике могут быть достаточно эффективными.
Лечение метастаз народными средствами. Купить эффективный курс лечения
Метастазы в позвоночник
Этот процесс считается вторичным и говорит об образовании злокачественных опухолей, которые проникают в позвонки и опоясывают анатомические структуры. В данном случае больному стоит учесть, что причина его появления может быть опухоль, которая локализуется в другом месте. Наиболее часто такими местами поражения могут быть: молочная и предстательные железы, легкие. Наиболее часто страдают поясничная и грудная часть скелета.
В основном терапия направлена на подавлении большинства неприятных симптомов, улучшить качество жизни и продлить ее хоть на некоторое время. Лечение народными средствами метастазов в позвоночнике несет в себе такие задачи:
- предотвращение компрессии спинного мозга,
- снижение болевого синдрома,
- поддержание неврологической деятельности,
- избежание позвоночного коллапса.
Основными симптомами данного заболевания считают:
- тупые местные боли в проекции пораженной части, ее часто приписывают остеохондрозу,
- разрушение тел позвонков,
- парезы, параличи,
- расстройство стула и мочеиспускания.
О том, какие симптомы при метастазах в позвоночнике встречаются, часто зависит от отдела, который поврежден. Но в основном они несут в себе неврологический характер.
Народные средства для устранения метастаз
Довольно часто врачи советуют использовать нетрадиционные методы лечения в комплексе с традиционной терапией. Они помогут не только усилить действие лекарственных препаратов, но и способствовать укреплению всего организма в общем. Вот самые основные средства, которые используют для улучшения ситуации.
Настойка ореха
Разрежьте на части плоды грецкого ореха. Наполните ими литровую банку на 70%. Далее до верха наполните керосином. Храните 15 суток. После отведенного времени процеживать содержимое не стоит. Принимайте на протяжении месяца по чайной ложке дважды в сутки в соединении с чаем. Оно поможет нормализовать аппетит, препятствует развитию и распространению пораженных клеток, уменьшает их агрессивность. Нельзя использовать лицам, у которых наблюдается проблема с желудочно-кишечным трактом, а также сердечная недостаточность.
Купить настойку грецкого ореха можно у нас
Настойка чистотела
Также положительный эффект оказывает лечение метастазов в позвоночнике народными средствами на основе чистотела. Для приготовления чудодейственных средств стоит выкопать кусты сразу с кореньями. Хорошо промойте их и высушите на открытом воздухе. После перекрутите все на мясорубке. Отожмите жидкость. На литр полученного сока введите 250 мл спирта. Давать настаиваться не нужно. Пейте по ложке перед каждым приемом пищи. Длительность лечения составляет 10 дней. После сделайте такой же перерыв и снова при необходимости возобновите прием. Оно поможет устранить болевые ощущения.
Для приготовления чудодейственных средств стоит выкопать кусты сразу с кореньями. Хорошо промойте их и высушите на открытом воздухе. После перекрутите все на мясорубке. Отожмите жидкость. На литр полученного сока введите 250 мл спирта. Давать настаиваться не нужно. Пейте по ложке перед каждым приемом пищи. Длительность лечения составляет 10 дней. После сделайте такой же перерыв и снова при необходимости возобновите прием. Оно поможет устранить болевые ощущения.
Купить настойку чистотела можно у нас
Настойка болиголова
Неплохое действие оказывает на метастазы такое растение как болиголов. Эта ядовитая трава используется в виде листьев и соцветий. Для его использования при данном недуге стоит измельченную смесь поместить, в сложенную в несколько слоев марлю, и приложить к поврежденному участку на 3 часа. Повторять такую процедуру нужно несколько раз в день. Такие манипуляции способствуют подавлению патологических клеток, снимают интоксикацию организма, которая возникает из-за продуктов после распада опухоли, ускоряет процессы естественной регенерации здоровых тканей.
Купить настойку болиголова можно у нас
Настойка алоэ
Возьмите 300 мл свежего сока трехлетнего алоэ, который не нужно поливать перед срезом неделю. После введите 100 мл сока подорожника, 200 мл лимонного сока, 300 г цветочного меда, 0,5 л коньяка, по 100 мл настойки корней и травы герани красной, травы ряски, чистотела, цветков календулы. Потребуется еще 100 г черной глины, а также 100 мл «Бефунгина» и 50 мл настойки полыни.
Соедините все компоненты и дайте постоять 2 недели в комнате. Принимать по столовой ложке трижды в день за четверть часа до еды. Курс продолжается до тех пор, пока не кончится средство. Неплохих результатов можно добиться если в год проводить 2 таких курса.
Купить настойку алоэ можно у нас
Настойка чаги
Возьмите стакан высушенного и измельченного гриба чаги. Залейте 3 стаканами холодной воды и настаивайте 4 часа. Процедите и храните при комнатной температуре. Жмых от него нужно залить 5 стаканами кипящей воды и настоять еще 2 суток. После процедите и смешайте оба настоя. Пейте по 200 мл трижды в день за полчаса до еды.
Процедите и храните при комнатной температуре. Жмых от него нужно залить 5 стаканами кипящей воды и настоять еще 2 суток. После процедите и смешайте оба настоя. Пейте по 200 мл трижды в день за полчаса до еды.
Купить чагу можно у нас
Овсяный отвар
Довольно часто наличие лечение метастаз в позвоночнике народными средствами проводят применением некоторых специальных средств. Специалисты рекомендуют принимать отвары из льняного семени, а также облепиховое масло. рацион необходимо обогатить кашами, зеленью, свежими соками, овощами и фруктами. Приготовить отвар из овса совсем не сложно. Для этого необходимо промыть стакан неочищенных зерен от шелухи и сварить его в литре воды. Выдерживайте на огне около 1,5 часа. Дайте настоять ночь, а утром процедите. Пейте небольшими глотками на протяжении дня.
Помните, что самостоятельное применение любых средств может навредить организму.
Метастазы в лимфоузлы брюшной полости, забрюшинного пространства и малого таза
Лимфоузлы брюшной полости и забрюшинного пространства и малого таза — лечение распространенного рака
В случае, если опухоль не была обнаружена на ранней стадии, она начинает свое распространение в другие части организма.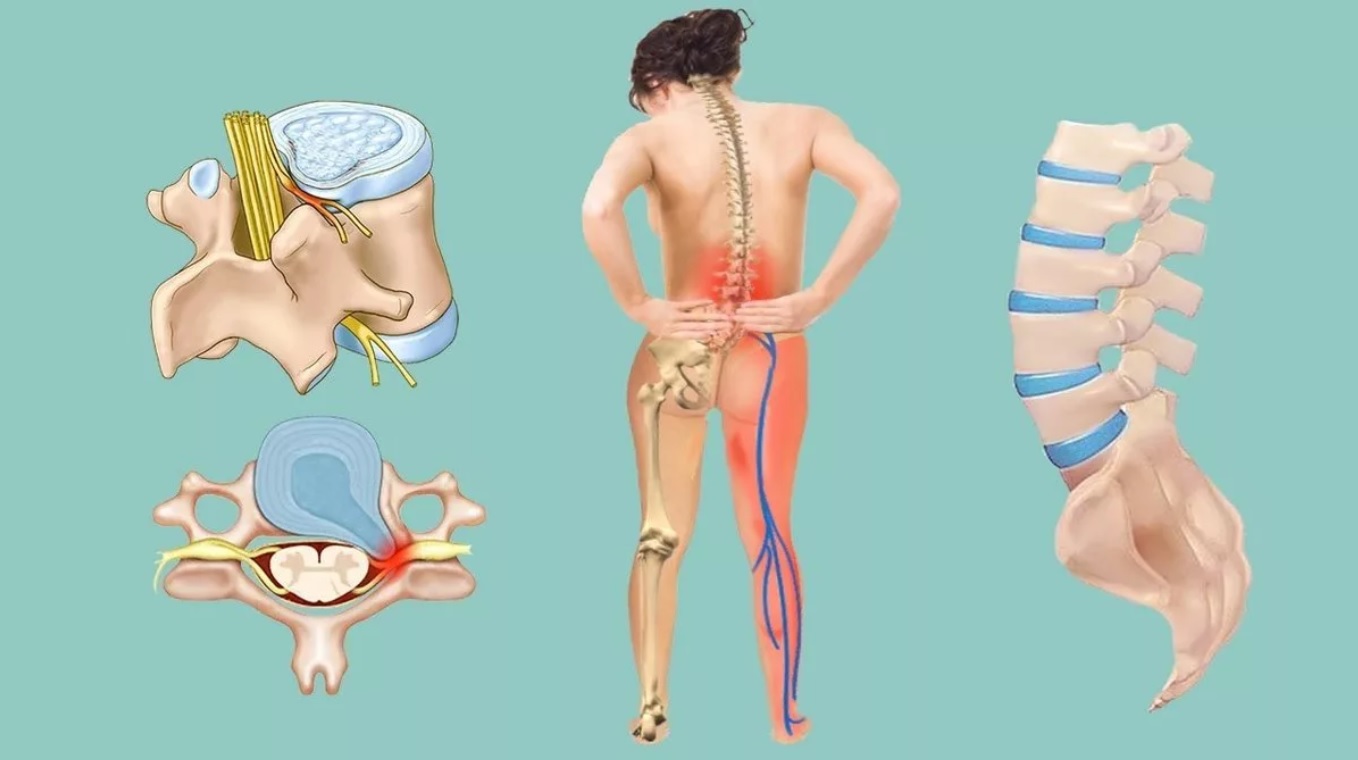 Одной их наиболее частых «мишеней» метастазирования становятся лимфоузлы. При этом большинство злокачественных опухолей органов брюшной полости дают метастазы в близлежащие отделы лимфатической системы.
Одной их наиболее частых «мишеней» метастазирования становятся лимфоузлы. При этом большинство злокачественных опухолей органов брюшной полости дают метастазы в близлежащие отделы лимфатической системы.
А это значит, что с высокой долей вероятности пациенту, одновременно с лечением первичной опухоли предстоит лечение метастазов в лимфоузлы брюшной полости, забрюшинного пространства и малого таза. В современных условиях тактика лечения предусматривает одновременное лечение первичной опухоли и метастазов в лимфоузлы КиберНожом (радиохирургия), либо хирургическое удаление пораженных лимфоузлов (если проводилось хирургическое лечение первичной опухоли), а также лучевую терапию пораженных лимфоузлов, либо тех, на которые с высокой долей вероятности мог распространиться опухолевый процесс. Также в качестве лечения метастазов (в том числе и в лимфоузлы) широко применяется 
Сочетанное лечение метастазов в лимфоузлы
Традиционно, локальное распространение клеток первичной опухоли в в близко расположенные лимфоузлы встречается довольно часто. В случае, если выбор методом радикального лечения была избрана хирургия, пациенту рекомендовано удаление близлежащих лимфоузлов. Если лимфоузлы поражены отдаленными метастазами (лимфогенное метастазирование), их хирургическое лечение (второе хирургическое вмешательство) может быть затруднено ввиду тяжести состояния пациента либо большого объема требуемого вмешательства.
В случае наличия множественных метастазов пациенту показана химиотерапия, а для лечения единичных метастазов в мировой практике широко применяется высокоточная лучевая терапия IMRT. Также, лучевая терапия комбинируется с хирургическим лечением первичной опухоли, после которого большинство мировых протоколов предусматривают облучение ложа удаленной опухоли и лимфоузлов.
Метастазы в лимфоузлы брюшной полости и забрюшинного пространства, план лучевой терапии IMRT на современном линейном ускорителе
Лечение метастазов в лимфатическую систему на КиберНоже
Радиохирургическая система КиберНож — самый эффективный метод борьбы с метастазами рака
Во многих случаях для того, чтобы провести лечение метастазов в лимфоузлы не обязательно применять хирургическое вмешательство, которое связано с необходимостью проведения наркоза, повреждением здоровых тканей во время доступа к метастазу, а также восстановительным периодом на время заживления.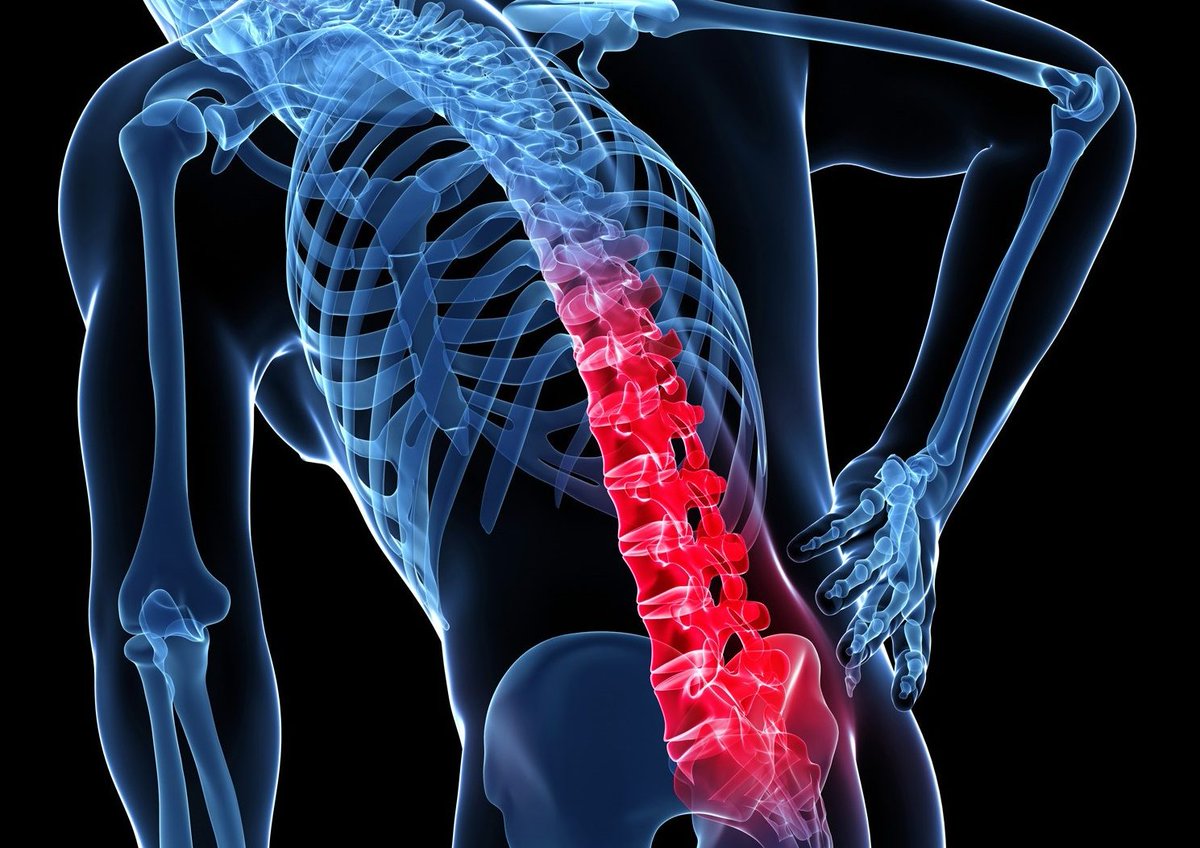
Однозначной рекомендации том, что любой метастаз в лимфоузел подлежит лечению на КиберНоже, не существует. В ряде случаев лечение метастазов в лимфоузлы брюшной полости, забрюшинного пространства и малого таза большей эффективности можно добиться радикальным лечением на высокоточном линейном ускорителе (IMRT). Поэтому, как и любое другие лечение, радиохирургия на КиберНоже для метастазов в лимфоузлы назначается после проведения междисциплинарного консилиума, на котором врачи различных специализаций рассматривают все аспекты конкретного случая с тем, чтобы определить максимально эффективную схему лечения.
Если пациенту показана радиохирургия на КиберНоже, проводится предварительное планирование, во время которого на основание данных КТ- и МРТ-диагностики будет создана объемная модель взаимного расположения пораженного лимфатического узла, окружающих его здоровых тканей, а также будет учтены расположенные вблизи структуры организма, в которые недопустима подача ионизирующего излучения.
Во время каждого из сеансов лечения (фракций) КиберНож на основании плана лечения подаст множество одиночных пучков ионизирующего излучения, на пересечении которых будет сформирована зона высокой дозы, отвечающая форме и объему метастаза в лимфатический узел. Кроме того, лечение метастазов на КиберНоже может включаться в состав фракции (сеанса) по лечению первичной опухоли или других метастазов.
Как правило, стоимость лечения на КиберНоже ниже, чем при хирургическом вмешательстве, т.к. нет необходимости в наркозе и восстановительном периоде.
Диагностика
Компьютерная томография (КТ) не всегда позволяет дифференцировать метастазы и неизмененную ткань лимфатических узлов. Магнитно-резонансная томография (МРТ) имеет небольшое преимущество перед КТ, потому что МРТ позволяет с большей точностью определять стадию опухолевого процесса органов малого таза.
Что такое метастазы и откуда они берутся?
У значительного числа больных при росте опухоли, которая не получила достаточного или своевременного лечения, в близлежащих и удаленных органах появляются метастазы — вторичные опухолевые узлы. Лечение метастазов проходит легче, когда они имеют небольшие объемы, но микрометастазы и циркулирующие опухолевые клетки, часто не обнаруживаются доступными способами диагностики.
Лечение метастазов проходит легче, когда они имеют небольшие объемы, но микрометастазы и циркулирующие опухолевые клетки, часто не обнаруживаются доступными способами диагностики.
Метастазы могут возникать в виде единичных узлов (единичные метастазы), но могут быть и множественными. Это зависит от особенностей самой опухоли и стадии ее развития.
Различают следующие пути метастазирования раковых опухолей: лимфогенный, гематогенный и смешанный.
- лимфогенные — когда опухолевые клетки, проникнув в лимфатический узел, с током лимфы проходят в ближайшие (регионарные) либо отдаленные лимфоузлы. Раковые опухоли внутренних органов: пищевода, желудка, толстой кишки, гортани, шейки матки нередко направляют опухолевые клетки данным путем в лимфатические узлы.
- гематогенные — когда раковые клетки, проникая в кровеносный сосуд, с током крови проходят в иные органы (легкие, печень, кости скелета и т.
 д.). Данным путем появляются метастазы от раковых опухолей лимфатической и кроветворной ткани, саркомы, гипернефромы, хорионэпителиомы.
д.). Данным путем появляются метастазы от раковых опухолей лимфатической и кроветворной ткани, саркомы, гипернефромы, хорионэпителиомы.
Лимфатические узлы брюшной полости подразделяются на пристеночные и внутренностные:
- пристеночные (париетальные) узлы концентрируются в поясничной области. Среди них выделяют левые поясничные лимфатические узлы, к которым относятся латеральные аортальные, предаортальные и постаортальные узлы, промежуточные поясничные узлы, располагающиеся между воротной и нижней полой венами; и правые поясничные узлы, включающие в себя латеральные кавальные, предкавальные и посткавальные лимфатические узлы.
- внутренностные (висцеральные) узлы располагаются в несколько рядов. Часть их располагается на пути лимфы от органов по ходу крупных внутренностных сосудов и их ветвей, остальные собираются в области ворот паренхиматозных органов и около полых органов.
Лимфа от желудка поступает в левые желудочные узлы, располагающиеся в области малой кривизны желудка; левые и правые желудочно-сальниковые узлы, залегающие в области большой кривизны желудка; печеночные узлы, следующие вдоль печеночных сосудов; панкреатические и селезеночные узлы, находящиеся в воротах селезенки; пилорические узлы, направляющиеся по ходу желудочно-двенадцатиперстно-кишечной артерии; и в кардиальные узлы, образующие лимфатическое кольцо кардии.
При раковых опухолях в брюшной полости (желудка) и полости малого таза (яичника) возникает диссеминация процесса по брюшине в форме мелких «пылевых» метастазов с развитием геморрагического выпота — асцита.
Метастатический рак яичника может возникать из любого органа, пораженного раком, но чаще всего наблюдается при раке желудка, откуда опухолевые клетки заносятся либо током крови, либо ретроградно по лимфатическим путям (опухоль Крукенберга). Метастатический рак яичника обладает быстрым ростом и более злокачественным течением. Чаще поражаются оба яичника. Опухоль рано переходит на брюшину малого таза, образуя множественные бугристые опухолевые узлы.
При метастазировании раков яичника в различные органы на первом месте стоят метастазы в брюшину, на втором месте – в забрюшинные лимфатические узлы, затем – большой сальник, подвздошные лимфатические узлы, печень, малый сальник, второй яичник, плевру и диафрагму, лимфатические узлы брыжейки, брыжейку топкой кишки, параметральную клетчатку, паховые лимфатические узлы, легкие, селезенку, матку, шейные лимфатические узлы, почки, надпочечники, пупок.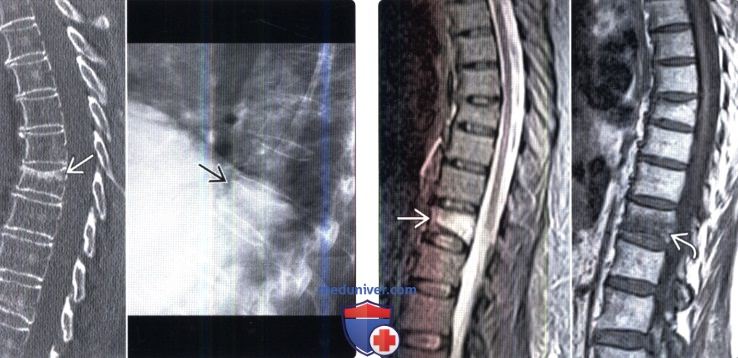
лечение, лучевая терапия, химиотерапия, прогноз.
Метастазы в костях среди всех прочих локализаций вторичных злокачественных новообразований имеют самый благоприятный прогноз в отношении продолжительности жизни заболевшего. Процесс лечения иногда растягивается на годы, а при раке молочной и предстательной желёз – на десятилетие. Влияние костных поражений на качество жизни не столь позитивно, именно они обуславливают тот тяжелый и плохо поддающийся коррекции болевой синдром, который так пугает пациентов и их близких. Однако, наш опыт показывает, что метастазы в костях хорошо поддаются лечению. Хирург-онколог, Сергеев Петр Сергеевич
Какие злокачественные заболевания осложняются
метастазами в костях
Практически все злокачественные новообразования могут дать метастазы в костную систему, но более всего присущи раку молочной и предстательной железы, реже – раку легких и органов желудочно-кишечного тракта, очень нечасто развиваются при опухолях яичников и головного мозга. Замечено, что при метастазировании только в кости скелета, даже многоочаговом, но без поражения других органов и систем, у пациента гораздо выше вероятность прожить несколько лет, чем при метастазах в легкие, а тем более печень и головной мозг. Костные поражения трудно лечатся, эффект зачастую ограничивается стабилизацией опухолевой деструкции – разрушения кости, тем не менее, при умелом лечении это «замирание» рака может продолжаться несколько лет.
Замечено, что при метастазировании только в кости скелета, даже многоочаговом, но без поражения других органов и систем, у пациента гораздо выше вероятность прожить несколько лет, чем при метастазах в легкие, а тем более печень и головной мозг. Костные поражения трудно лечатся, эффект зачастую ограничивается стабилизацией опухолевой деструкции – разрушения кости, тем не менее, при умелом лечении это «замирание» рака может продолжаться несколько лет.
Какие кости поражаются при раке
Принципиально возможно развитие метастаза в любой кости скелета, но чаще всего опухолевые клетки задерживаются в костях с лучшим кровоснабжением, где всегда есть достаточное питание для продолжения неуправляемого деления. Очень редко метастазы образуются в мелких косточках кисти и стопы, но часты в обильно пронизанных сосудистой сетью костях таза, позвонках и ребрах, нередко поражают кости черепа, за исключением лицевого скелета. Наибольшую опасность для пациента несёт опухолевое поражение позвонков и трубчатых костей конечностей, когда в месте деструкции при обычной нагрузке случается перелом, лишающий возможности двигаться, а при патологическом переломе шейного позвонка высока вероятность паралича из-за сдавления спинного мозга отломками разрушенной опухолью кости.
Какими бывают метастазы в костях
Раковые клетки разрушают ткань кости, вызывая её деструкцию, которая может проявляться как разрежением костной ткани с образованием бескостных участков, так и увеличением патологической, гораздо менее прочной и чётко структурированной костной массы.
- Деструкция с «разъеданием» костной структуры на рентгенограммах выглядит как дефект – «дырка», такой вариант метастазирования называют остеолитическим, что буквально означает «съеденная кость».
- При утолщении кости за счёт опухоли рентгенограмма выявляет «плюс ткань», тогда говорят об остеопластическом метастазировании.
- Как правило, у больного встречаются оба вида метастазов с превалированием одного из вариантов, в большинстве случаев остеолитического.
По распространённости выделяют:
- множественные – более десятка вовлечённых в процесс костей, но также обозначается и обширное метастатическое поражение только одной кости;
- единичные – до десяти очагов или не более десятка патологически изменённых костей;
- солитарный – единственный очаг.

Диагностика метастазов в костях
До «эры визуализации» деструктивные изменения скелета выявляли при рентгенологическом обследовании и остеосцинтиграфии – изотопном исследовании. Остеосцинтиграфия очень чувствительна, она обнаруживает крохотные опухолевые образования, не видимые на рентгенограммах, поэтому и сегодня она актуальна и обязательна для каждого онкологического пациента.
Рентгенография способна обнаружить очаг более сантиметра, КТ высокочувствительна, но уступает МРТ при необходимости параллельной визуализации прилежащих к кости мягких тканей и суставов. Наилучшая диагностика – ПЭТ и МРТ или КТ. Остеосцинтиграфия признана стандартным методом скрининга – диагностика для 100% больных раком, по местам накопления изотопа в виде «горячих точек» выполняется прицельное рентгенологическое или визуализирующее исследование – МРТ или КТ.
Динамическое наблюдение за течением метастазирования и оценка результатов лечения должны осуществляться одним способом, на одном аппарате и, желательно, одним и тем же специалистом. Если до начала терапии не удалось выполнить МРТ, а было сделано только КТ, то и оценивать итоги терапии надо по КТ
Если до начала терапии не удалось выполнить МРТ, а было сделано только КТ, то и оценивать итоги терапии надо по КТ
Клинические проявления метастазов в кости
В начальной стадии костное метастазирование проявляется болевым синдромом только у каждого шестого онкологического больного, у абсолютного большинства вначале процесса нет никаких признаков. Боль появляется при проникновении раковых клеток в обильно иннервированную покровную костную ткань – надкостницу, внутри кости нервных окончаний почти нет, поэтому и боли не бывает.
Считается, что остеолитические очаги чаще вызывают боли, а остеопластические протекают без симптомов, но могут проявляться выбуханием – «наростом» в месте поражения.
Неблагоприятное осложнение опухолевого поражение кости – патологический перелом в месте деструкции:
- Часто переломы позвонков без существенного смещения происходят незаметно для больного и выявляются при рентгенологическом обследовании.

- Шейные позвонки при переломе могут защемить спинной мозг, вызывая разнообразные нарушения двигательной активности.
- Не остаются незамеченными для пациента переломы конечностей, особенно бедра или плеча, сопровождающиеся усилением боли в месте деструкции и нарушением движений.
- Переломы ребер могут проявиться клиникой межреберной невралгии.
- Кости таза преимущественно ломаются в области лона или вертлужной впадины, как правило, боли невысокой интенсивности, но существенно изменяется походка.
Химиотерапия при метастазах в костях
Преимущественно при костных поражениях используют лекарственный метод – химиотерапию или гормонотерапию, для минимизации возможных осложнений в виде переломов и повышения концентрации кальция в крови дополнительно вводят бисфосфонаты. Бисфосфонаты помогают уменьшить болевой синдром.
Химиотерапия проводится длительно, частые контрольные обследования нецелесообразны, поскольку костная ткань на месте уничтоженной опухоли растет очень медленно. Практически всегда при химиотерапии достигается хороший обезболивающий эффект. При интенсивном болевом синдроме зону деструкции можно облучить, в обязательном порядке лучевой терапии подлежит метастазирование в шейные позвонки, что снижает вероятность перелома.
Операция при метастазах в костях
Хирургическое лечение при метастазировании в скелет преследует одну из двух целей:
- Радикальная операция — полное удаление раковых очагов;
- Паллиативная операция -восстановление функции кости после перелома.
Радикальное лечение возможно при отсутствии первичного рака и одиночном метастатическом поражении скелета. После стабилизации роста солитарного – единственного костного метастаза, с помощью курсов химиотерапии, ставится вопрос об оперативном лечении. Как правило, таким способом лечат поражения конечностей.
Сегодня есть возможность заменить протезом пораженные кости верхних и нижних конечностей, но чаще к операции прибегают при патологическом переломе, когда из-за обширной опухолевой деструкции маловероятно восстановление костной целостности. Операция сложная, требующая плановой подготовки, в том числе и нескольких предварительных курсов химиотерапии и долгого лекарственного лечения после операции.
Операция сложная, требующая плановой подготовки, в том числе и нескольких предварительных курсов химиотерапии и долгого лекарственного лечения после операции.
Такие вмешательства выполняются специальной бригадой, владеющей навыками онкологов и травматологов-ортопедов, в специальной операционной, оснащенной рентгеновским оборудованием, но лучше – КТ-установкой. Опухоль разрушает не только кость, но и прорастает в окружающие мягкие ткани – мышцы, сухожилия и суставы, очень важно для будущего восстановления удалить всё поражённое раком, поэтому во время оперативного вмешательства возникает необходимость уточнения объективной реальности с помощью высокоточной КТ.
Современная онкологическая помощь требует высокоточного оборудования для диагностики, дорогостоящих лекарств и, обязательно, опытных специалистов, владеющих инновационными хирургическими методиками. Правильное лечение должен подбирать консилиум из нескольких специалистов, владеющих разными методами терапии. Мы подскажем, где это уже делается на высоком уровне и с хорошими результатами.
Мы подскажем, где это уже делается на высоком уровне и с хорошими результатами.
Крупный успех в лечении меланомы на поздней стадии — выживает более половины пациентов
Автор фото, Getty Images
В лечении одной из самых страшных раковых опухолей — меланомы — достигнут большой успех.
Десять лет назад всего один из 20 пациентов, которому диагностировали меланому на поздней стадии, выживал в течение пяти лет. Большинство умирали в течение нескольких месяцев после постановки диагноза.
Теперь, по данным британских врачей, 52% пациентов с таким диагнозом имеют шанс прожить по крайней мере пять лет, благодаря иммунотерапии.
Насколько опасна меланома?
Меланома — пятый по распространенности вид рака в Британии. От неё гибнет около 2300 человек в год.
Если диагноз ставится на раннем этапе заболевания, шансы на выживание высоки.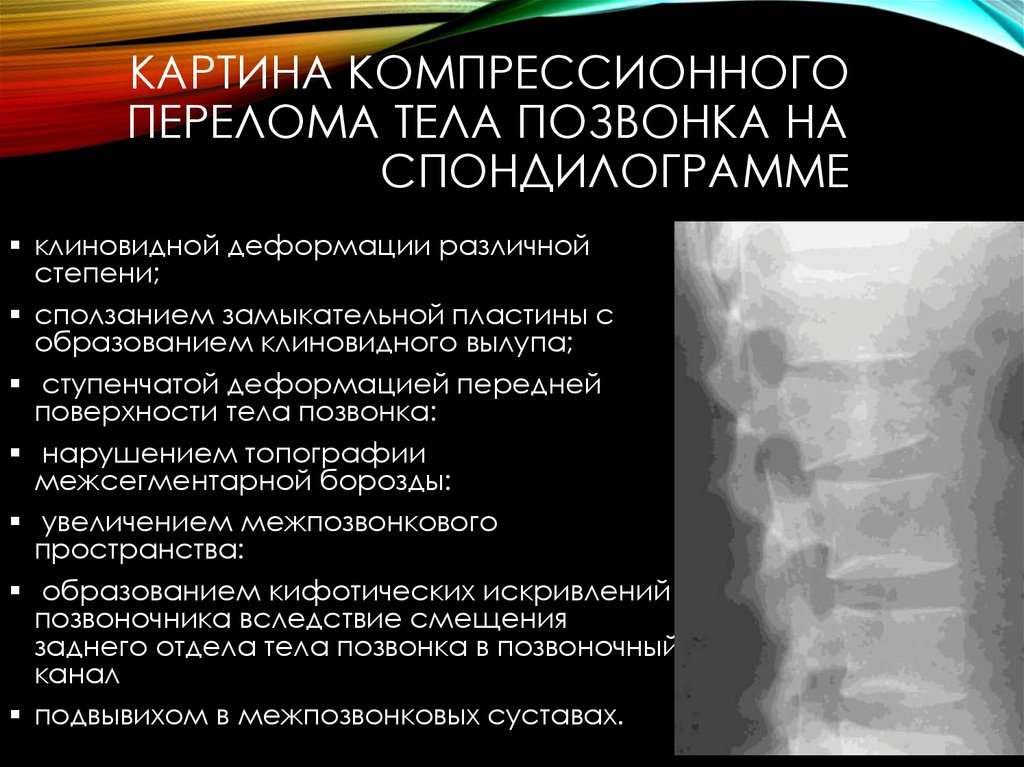 Однако если к моменту обнаружения рак начал агрессивно распространяться в организме пациента и образовывать метастазы, смерть наступала в течение в течение 6-9 месяцев после постановки диагноза.
Однако если к моменту обнаружения рак начал агрессивно распространяться в организме пациента и образовывать метастазы, смерть наступала в течение в течение 6-9 месяцев после постановки диагноза.
«В прошлом метастазирующая меланома считалась неизлечимым заболеванием, — говорит профессор Джеймс Ларкин, консультант медицинского управления Ройял Марсден. — Онкологи считали меланому особым видом рака, который было невозможно лечить на стадии образования метастаз».
Что показали клинические испытания?
В клинических испытаниях, которые проходили в течение пяти лет в британских больницах, приняли участие 945 пациентов с меланомой четвертой стадии.
Треть из них получала ниволумаб, треть — ипилимумаб, а еще трети вводились оба лекарства.
Спустя пять лет врачи проанализировали выживаемость пациентов.
Оказалось, что выжили:
- 26% больных, получавших ипилимумаб
- 44% больных, получавших ниволумаб
- 52% больных, получавших и тот и другой препарат
«Мы были поражены столь быстрым прогрессом в течение такого короткого времени, — рассказывает профессор Ларкин. — Речь идет о самой необычной трансформации в лечении вида рака, который до этого считался самым трудно излечимым онкологическим заболеванием».
— Речь идет о самой необычной трансформации в лечении вида рака, который до этого считался самым трудно излечимым онкологическим заболеванием».
Результаты клинических испытания были доложены на заседании Европейского общества медицинской онкологии и опубликованы в журнале New England Journal of Medicine.
Свидетельства пациентов
Автор фото, Pam Smith
Подпись к фото,Пам Смит: я могла никогда не увидеть своих внуков
67 летняя Пам Смит, проходившая лечение в больнице города Танбридж-Уэллс, была включена в программу испытаний в январе 2014 года.
Она была в отчаянии, узнав, что ее рак является неизлечимым. У нее не было никаких шансов выжить, если бы не новые методы лечения, говорит Пам.
В течение четырех месяцев каждые две недели ей вводили препараты, но лекарства вызвали у нее такие сильные побочные эффекты в форме диареи, что лечение пришлось прекратить.
Однако ее опухоль сократилась вдвое и перестала расти. По словам Пам, она прекрасно себя чувствует.
По словам Пам, она прекрасно себя чувствует.
«Я могла никогда не увидеть своих внуков, — говорит она. — Прошло уже больше пяти лет с момента диагноза, и моему внуку исполнилось шесть лет».
Можно ли считать результат полным излечением?
В случае рака всегда трудно говорить о полном излечении, но ремиссия в течение пяти лет является крупным достижением.
Некоторые из пациентов, которые принимают эти препараты, находятся в полной ремиссии и сканирование не выявляет у них патологий.
Другие, подобно Пам, имеют опухоли, но те не проявляют признаков роста.
Из всех выживших пациентов три четверти больше не нуждаются в приеме антираковых препаратов.
Иммунотерапия доказывает свою эффективность
Обычно наша иммунная система самостоятельно ищет в организме мутировавшие клетки и разрушает их, не давая им размножаться. Однако раковые клетки нашли способ обходить эту естественную защиту, что позволяет опухоли быстро расти.
Лауреаты Нобелевской премии по медицине 2018 года американец Джеймс Аллисон и японец Тасуку Хондзё научились обманывать раковые клетки и не давать им блокировать иммунную реакцию. Это произвело настоящую революцию в терапии и легло в основу нового класса лекарственных препаратов.
Пока что у этих лекарств немало побочных эффектов, однако они доказали свою эффективность в борьбе с онкологией. Иногда удается вылечить даже пациентов на поздней стадии рака, которых ранее считали неизлечимыми.
Как насчет побочных симптомов?
Да, новые препараты воздействуют на всю иммунную систему человека и могут вызывать такие побочные эффекты как усталость, воспаления кожи и диарею.
Иногда побочные эффекты оказываются настолько серьезными, что пациент, подобно Пам Смит, не может пройти полный курс лечения.
Однако даже кратковременное лечение, как оказалось, оказывает длительное благотворное воздействие на иммунную систему и на общее состояние больных.
Это сильно отличает иммунотерапию от других методов лечения, например, химиотерапии, которая перестает действовать при прекращении приема препаратов.
В то же время следует учитывать, что воздействие на иммунную систему может приводить к тому, что побочные эффекты могут проявляться и в дальнейшем.
Насколько доступны новые лекарства?
Результаты этого клинического испытания привели к тому, что новые иммунопрепараты начинают применяться по всему миру.
Государственная служба здравоохранения Британии необычно быстро одобрила применение новых препаратов. Теперь ими лечат и другие виды рака — легких и почек.
симптомы и лечение народными средствами в домашних условиях
Рак кожи: симптомы, лечение
Знали ли Вы, что рак кожи является одним из самых часто диагностируемых онкологических заболеваний? В США он встречается чаще, чем рак молочной железы, предстательной железы, легких и толстой кишки вместе взятые. И с каждым годом количество диагнозов только растет.
И с каждым годом количество диагнозов только растет.
Данные статистики могут быть пугающими, однако рак кожи может быть диагностирован на ранних этапах, если знать его симптомы. Ниже мы поговорим о признаках заболевания, способах профилактики и лечения. Вы также узнаете об изменениях в образе жизни и питании, которые помогут укрепить здоровье и избежать/побороть рак кожи.
Что такое рак кожи?
Рак кожи — это аномально быстрый рост клеток кожи. Заболевание подразделяют на три главных типа:
- Базальноклеточная карцинома
- Плоскоклеточная карцинома
- Меланома
Базальноклеточная карцинома (БКК) — самая распространенная форма рака кожи. БКК появляется на внешнем слое кожи и часто сопровождается такими симптомами, как открытые язвы, покраснения, блестящие шишки или шрамы. Она редко метастазирует (распространяется) за пределы первоначального места образования опухоли.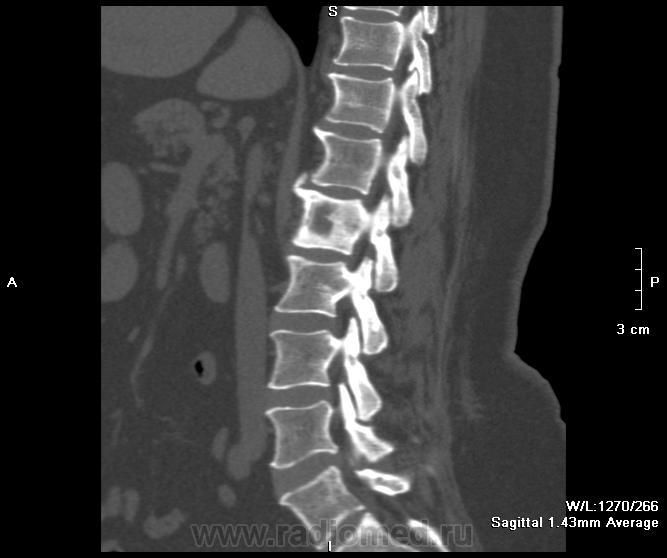 Тем не менее новообразование является злокачественным, и если Вы подозреваете у себя БКК, Вам следует незамедлительно обратиться к врачу. Источники говорят о том, что каждый год этот диагноз слышат несколько миллионов человек.
Тем не менее новообразование является злокачественным, и если Вы подозреваете у себя БКК, Вам следует незамедлительно обратиться к врачу. Источники говорят о том, что каждый год этот диагноз слышат несколько миллионов человек.
Плоскоклеточная карцинома (ПКК) появляется, когда аномальные клетки начинают бесконтрольно расти в верхних слоях кожи. К симптомам ПКК относятся открытые язвы, чешуйчатые покраснения и характерные наросты с углублением в центре. Заболевание может вызвать кровотечения или образование корок. Если ПКК не лечит, то она может привести к смерти. В США каждый год ПКК диагностируется у более одного миллиона человек, при этом умирает около 8 800 человек.
Меланома — менее распространенное заболевание, однако оно самое опасное. Фонд по борьбе с раком кожи США говорит о меланоме следующее: «Эти раковые новообразования появляются, когда невосстановленная ДНК повреждает клетки кожи…вызывает мутации (генетические дефекты), которые приводят к быстрому размножению клеток кожи и формированию злокачественных опухолей». В США меланома каждый год убивает более 10 000 человек.
В США меланома каждый год убивает более 10 000 человек.
Для меланомы характерны следующие симптомы: шишки или пятна, которые напоминают родинки и имеют коричневый или черный цвет. Они также могут быть синими, розовыми, красными белыми и даже сливаться по цвету с кожей. Меланома поддается ранней диагностике и лечению. В противном случае она может прогрессировать и метастазировать в другие части тела, затрудняя лечение и повышая риск летального исхода.
Симптомы
Помимо внешних изменений кожи, существует также пять ключевых признаков (ABCDE), которые помогут распознать рак кожи. Врачи рекомендуют проводить регулярный самостоятельный осмотр, принимая во внимание следующие симптомы:
А (асимметрия): если Вы нарисуете воображаемую линию посередине родинки или повреждения, и половинки не симметричны, то образование может быть злокачественным.
B (граница): неагрессивные родинки, как правило, имеют гладкие правильные границы. Граница родинки на ранней стадии меланомы неровная.
Граница родинки на ранней стадии меланомы неровная.
С (цвет): меланома может быть разных цветов, например, черного, коричневого, бежевого, красного и других. Незлокачественная родинка или новообразование, как правило, имеет один цвет.
D (диаметр): незлокачественные формы рака кожи обычно не более 0,6 см в диаметре. Меланомы больше, поэтому следите за крупными родинками.
Е (изменения): если Вы заметили, что родинка меняет цвет, размер или форму или начинает кровоточить, чесаться, покрываться коркой, немедленно обратитесь к врачу.
Не все виды рака можно идентифицировать по правилу ABCDE. Важно следить за всеми новыми образованиями на Вашей коже и консультироваться со специалистом по поводу любой подозрительной родинки, веснушки или пятна.
Также следует обратиться к врачу, если Вы заметили у себя следующие симптомы:
- Пигментные пятна или образования, которые растут за пределы своих границ; они красные, набухшие и не поддаются лечению.

- Шишка или родинка очень чувствительна, болит или чешется.
- Родинка меняет форму, покрывается коркой, кровоточит.
Факторы риска
Рак кожи может появиться на любом ее участке, но, как правило, он появляется в местах, чаще других подверженных воздействию солнечного света: на лице, шее и руках.
К факторам риска развития рака кожи относятся:
- Воздействие солнечного света и искусственных УФ-лучей (например, в солярии) в течение долгого периода времени.
- Светлый тип внешности:
- светлая кожа, которая быстро обгорает и плохо загорает.
- голубые или зеленые глаза.
- рыжие или светлые волосы.
- Наличие актинического кератоза, типа возможного предракового поражения.
- Прохождение лучевой терапии.
- Ослабленный иммунитет.
- Генетическая предрасположенность.
- Воздействие мышьяка.
Среди других общих факторов риска развития рака кожи:
- Воздействие токсинов и химических веществ из окружающей среды
- Использование токсичный косметических средств, средств для уборки и солнцезащитных кремов
- Алкоголь
- Курение
- Плохое питание
- Сидячий образ жизни
- Недостаток витамина D (избыток, как и недостаток солнечного света, как источника витамина D, может пагубно сказаться на Вашем здоровье)
- Некоторые вирусы и бактерии
Диагностика
Для диагностики рака кожи врач может предложить провести осмотр или биопсию:
- Осмотр: врач или медсестра осмотрят кожу на наличие необычных пятен или шишек, их цвет, размер, форму.
- Биопсия: образование или его часть удаляется и изучается под микроскопом на наличие признаков рака. Существует четыре типа биопсии кожи:
- Скарификационная биопсия: часть образования срезается с помощью стерильного лезвия.

- Щипковая биопсия: образец материала на исследование берется с помощью специальных щипцов.
- Инцизионная биопсия: на анализ берется часть образования.
- Эксцизионная биопсия: удаляется все образование целиком.
Метастазы и распространение рака
Рак распространяется, или метастазирует, в следующие области организма:
- Ткани: раковые клетки распространяются из опухоли в соседние ткани.
- Лимфатическая система: раковые клетки из опухоли попадают в лимфатическую систему и через нее в другие части тела.
- Кровь: раковые клетки, попадая в кровоток, распространяются по телу.
Для определения наличия метастаз используются три основных метода диагностики:
- КТ (компьютерная томография)
- МРТ (магнитно-резонансная томография)
- Биопсия лимфатических узлов
Стадии
Рак классифицируется на стадии от 0 до 4. Стадия рака зависит от нескольких факторов: размера опухоли и степени распространения раковых клеток. Так, при стадии 0 рак локализован самим новообразованием (карцинома in situ). Каждая последующая стадия указывает на увеличение размера опухоли и наличие метастаз. На 4 стадии рак уже метастазировал во многие области организма и тяжело поддается лечению. Это последняя стадия заболевания.
Стадия рака зависит от нескольких факторов: размера опухоли и степени распространения раковых клеток. Так, при стадии 0 рак локализован самим новообразованием (карцинома in situ). Каждая последующая стадия указывает на увеличение размера опухоли и наличие метастаз. На 4 стадии рак уже метастазировал во многие области организма и тяжело поддается лечению. Это последняя стадия заболевания.
Стадии меланомы
Что касается рака кожи, то здесь учитывается наличие рака на веках или других областях, а также является ли он меланомой или нет (БКК, ПКК).
Стандартное лечение
Метод лечения во многом зависит от следующих факторов:
- Стадия рака
- Тип рака
- Размера опухоли и пораженной части тела
- Является ли рак агрессивным (как быстро раковые клетки делятся и распространяются)
- Состояние здоровья и возраст больного
К стандартным методам лечения рака кожи относятся:
Хирургическая операция: тип операции зависит от вида, стадии и местоположения новообразования.
Лучевая терапия: лучевая терапия, или радиотерапия, использует облучение для уничтожения и уменьшения раковой опухоли. Она может вызвать такие побочные эффекты, как раздражение на коже, повреждение слюнных желез, рвоту, потерю волос и некоторые другие, к зависимости от места воздействия.
Химиотерапия: химиотерапия использует лекарственные препараты для борьбы с раковыми клетками и облегчения симптомов. Однако она очень токсична и может вызвать тяжелые побочные эффекты, например, тошноту, рвоту, потерю волос и повреждение здоровых клеток вместе с раковыми.
Таргетная терапия: таргетная терапия является формой химиотерапии, но она способна влиять на определенные аспекты раковых клеток. Иногда таргетная терапия используется отдельно или в сочетании с другими формами химиотерапии. Она также может вызвать побочные эффекты, в том числе изменение состояния кожи и волос.
Фотодинамическая терапия: эта терапия используется для лечения рака кожи, поверхности внутренних органов и полостей. Этот метод лечения сочетает в себе фотосенсибилизирующее химическое вещество и специальный тип активирующего света для уничтожения раковых клеток. Фотодинамическая терапия приводит к повышенной чувствительности глаз и кожи к свету в течение шести недель после лечения, а также может вызвать ряд побочных действий, в том числе кашель, боль в животе и проблемы с глотанием.
Этот метод лечения сочетает в себе фотосенсибилизирующее химическое вещество и специальный тип активирующего света для уничтожения раковых клеток. Фотодинамическая терапия приводит к повышенной чувствительности глаз и кожи к свету в течение шести недель после лечения, а также может вызвать ряд побочных действий, в том числе кашель, боль в животе и проблемы с глотанием.
Иммунотерапия: как можно понять из названия, этот метод лечения использует иммунную систему больного для борьбы с раком. Некоторые виды иммунотерапии называются биологической терапией, в некоторых случаях она работает лучше других методов. Иммунотерапия может быть использована для лечения меланомы.
Стандартные методы лечения рака кожи
Если по какой-то причине стандартные методы лечения оказались неэффективны или невозможны, пациенты могут принять участие в клинических испытаниях новых методов лечения. Они находятся на стадии изучения, однако могут быть эффективны в борьбе с тяжелыми формами рака и привести к появлению новых принятых методов.
Натуральная терапия
Учитывая тяжелые побочные эффекты, которые может вызвать стандартная терапия, мы рекомендуем попробовать естественные методы лечения рака кожи. Их можно использовать как отельно, так и в сочетании со стандартной терапией. Натуральные методы лечения поддерживают организм в процессе лечения и облегчают протекание тяжелой болезни. Ниже мы поговорим о средствах, которые могут оказывать терапевтический эффект и облегчать симптомы рака кожи.
Экстракт баклажана — исследование, опубликованное британскими учеными в «Международном Журнале Дерматологии», показывает, что крем с 0,005-процентной концентрацией соласодиновых гликозидов, соединений, присутствующих в баклажане, является безопасным и эффективным средством лечения кератоза и ранней стадии базальноклеточной и плоскоклеточной карцином.
Масла ладана и мирра — мирра всегда использовалась для лечения самых разнообразных заболеваний. Было время, когда она была также ценна, как и золото!
На данный момент проведено недостаточно исследований свойств мирра. Однако в 2013 году ученые обнаружили, что влияние масел ладана и мирра на клеточные линии базальноклеточной карциномы (А549) способствует апоптозу, гибели раковых клеток. Результаты, безусловно, многообещающие, но требуются дальнейшего исследования.
Однако в 2013 году ученые обнаружили, что влияние масел ладана и мирра на клеточные линии базальноклеточной карциномы (А549) способствует апоптозу, гибели раковых клеток. Результаты, безусловно, многообещающие, но требуются дальнейшего исследования.
Масло мирра перед применением следует смешать с маслом-основой, например, маслом кокоса, жожоба, миндаля или виноградной косточки. Масло ладана можно применять непосредственно на кожу как эфирное масло или мазь для снятия симптомов рака кожи.
Способы справиться с симптомами рака кожи
Снижение токсинов и поиск более полезных альтернатив
- Хорошо фильтруйте воду. Вода из-под крана содержит токсичные химические соединения (хлор, фтор, мышьяк).
- Избавьтесь от токсичных веществ и продуктов и замените их более безопасной альтернативой.
- Пользуйтесь натуральными или органическими средствами для уборки и косметикой (без содержания лаурилсульфата натрия, пропиленгликоля и других веществ).
 Лучше всего приготовить их дома самостоятельно. Так Вы сможете контролировать содержание загрязняющих веществ.
Лучше всего приготовить их дома самостоятельно. Так Вы сможете контролировать содержание загрязняющих веществ. - Гуляйте! Проводите больше времени на свежем воздухе, а физические упражнения укрепят Ваше здоровья и улучшат самочувствие. Не забывайте соблюдать все рекомендации с учетом состояния здоровья, носите солнцезащитные очки и одежду, закрывающую тело.
Очищение
Убирая в доме или саду, не забывайте и об очищении организма и печени. Это поможет избавиться от накопившихся раздражителей, нормализовать работу желудочно-кишечного тракта и облегчить симптомы рака кожи. Корректируя рацион питания, прислушайтесь к себе, так как очищение может повлечь за собой побочные эффекты, например, симптомы гриппа. Они возникают в результате выведения токсинов. В любом случае, если вы испытываете головные боли, тошноту, симптомы гриппа, проконсультируйтесь с врачом и ограничьте потребление очищающих средств. Если Вы проходите противораковую терапию, которая дается организму очень тяжело, то перед очищением организма мы советуем обратиться к врачу за рекомендациями.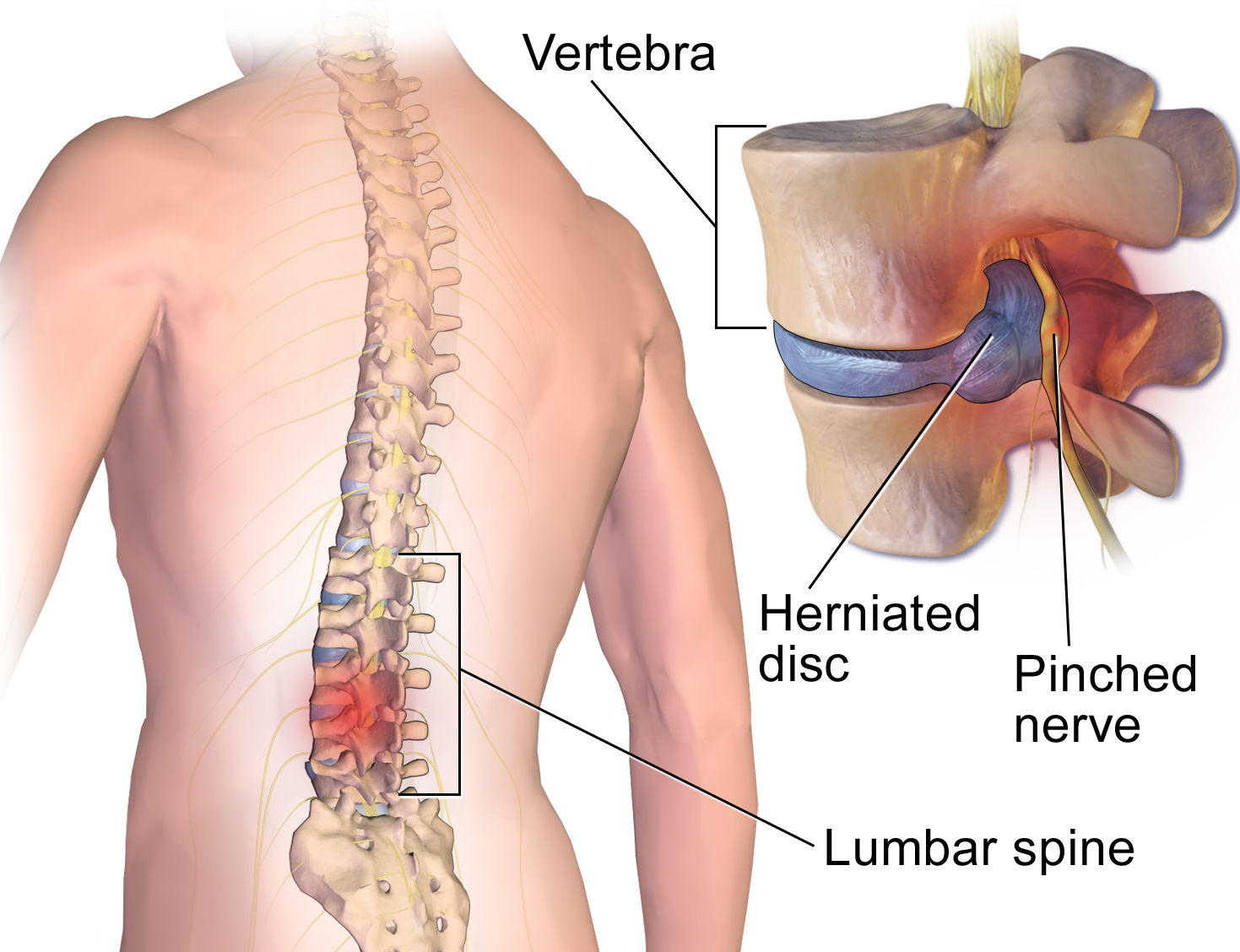
Противораковые продукты
- Зеленые листовые овощи, богатые витаминами, минералами и шпинатом (капуста кале, шпинат).
- Полезный белок (органическое мясо, яйца, дикая рыба, орехи и семена).
- Продукты, которые содержат большое количество полезных жирных кислот (авокадо, оливковое масло холодного отжима, кокосовое масло, топленое масло).
- Продукты с высоким содержанием антиоксидантов (ягоды, орехи пекан, грецкие орехи, артишоки, гвоздика, какао в умеренных количествах, чеснок).
- Мед манука. Исследование, опубликованное в журнале «Evidence-based Complementary and Alternative Medicine» говорит о том, что «мед может стать мощным противораковым агентом, работающим в нескольких направлениях».
Остановите свой выбор на органических и необработанных продуктах. Избегайте потребления аллергенов, и посоветуйтесь со специалистом, который подберет наиболее удобный способ перехода за здоровую пищу.
Вредные продукты
Поскольку рак развивается в кислой и токсичной среде, необходимо отказаться от любых продуктов, провоцирующих воспаление. Исключите обработанные продукты, рафинированные масла, сахар (в том числе сиропы и сахарозаменители), фастфуд и ограничьте потребление продуктов с высоким содержанием омега-6.
Также следует отказаться от соевых продуктов, глютена, трансжиров, жареных блюд, мясных полуфабрикатов и продуктов, содержащих консерванты и нитраты.
Пищевые добавки против симптомов рака кожи
Витамин D — витамин D, а особенно в форме витамина D3, очень важен для работы иммунной системы.
Панкреатические ферменты — эти ферменты важны для контроля воспаления, поддержания кровообращения, укрепления иммунитета и предотвращения онкологических заболеваний.
Пробиотики — пробиотики поддерживают здоровую микрофлору в кишечнике. Продукты и пищевые добавки с высоким содержанием пробиотиков укрепляют иммунитет и улучшают пищеварение.
Куркума — куркума, а точнее вещество куркумин в его составе, обладает множеством полезных свойств. К ним относится укрепление иммунной системы и помощь в лечении рака.
Предостережения
Посоветуйтесь со специалистом перед тем, как начать делать физические упражнения или менять свой рацион питания, особенно если вы проходите стандартную противораковую терапию, страдаете какими-либо заболеваниями, беременны или кормите грудью.
Финальные выводы
- Существует три основных типа рака: базальноклеточная карцинома, плоскоклеточная карцинома и меланома.
- Следите за подозрительными родинками и образованиями у себя на коже. Обратитесь к врачу, если они имеют необычный цвет, размер или форму.
- Диагностика рака кожи проходит с помощью нескольких методов, в том числе биопсии.
- Лечение зависит от типа, расположения и стадии рака.
- Натуральная терапия и коррекция образа жизни помогут облегчить симптомы рака кожи.

Вы можете оставить заявку на плановую госпитализацию на нашем сайте и мы свяжемся с Вами.
Метастазы в головном мозге — Brainlab
Запись текста документального фильма
Brain Metastases: A Documentary
Механизм развития и перспективные методы лечения
Что такое метастазы в головном мозге?
Дэвид Эндрюс, врач: Рак. Страшнейшая болезнь. Ужасный недуг, лекарство от которого еще не найдено. Однако сегодня мы, бесспорно, находимся на одной из самых динамичных и многообещающих стадий поисков его лечения.
Бренда Винченц-Смит: Я чувствовала, что с моей правой грудью что-то не так. Оказалось, что у меня рак молочной железы. Я перенесла семь месяцев химиотерапии, мастэктомию, облучение. Наконец все признаки болезни исчезли. Онколог предложил мне пройти сканирование мозга, потому что я не делала этого с самой постановки диагноза, когда мне делали ПЭТ. У меня нашли три опухоли.
Дуайт Херон, врач: Метастазы в головном мозге — это скопление раковых клеток, которые мигрировали из другой части тела, где они появились изначально. Из-за них возникают сильные отеки. Отеки и давление на мозг вызывают неврологические симптомы и могут привести к смерти, если их должным образом не лечить.
Из-за них возникают сильные отеки. Отеки и давление на мозг вызывают неврологические симптомы и могут привести к смерти, если их должным образом не лечить.
Бренда Винченц-Смит: Моя первая мысль была: «Ну ладно, и что дальше? Каким будет качество моей жизни?» На самом деле, я уже была готова к смерти.
Вероника Чанг, врач: Это приводит в ужас. Пациенты боятся, что скоро умрут. Они боятся лечения, которое мы можем им предложить.
Дуглас Кондзиолка, врач: Несколько лет назад мы провели исследование. Я попытался спрогнозировать, как долго проживет каждый из моих пациентов. Мы поделились этими данными с 17 самыми уважаемыми врачами в мире. Это было удивительно. Оказалось, что врачи не в состоянии определить, кто победит болезнь, несмотря ни на что, а для кого борьба будет безуспешной. Возможно, мы не так уж хорошо можем предсказать, сколько времени отведено людям.
Вероника Чанг, врач: Мы обязательно найдем лекарство от рака, но пока этого не произошло, мы хотим, чтобы люди могли жить с раком, а не доживать свои дни.
Дуайт Херон, врач: Благодаря радиохирургии мы можем лечить даже самые глубокие и труднодоступные опухоли, почти не нанося вреда организму. Лечение настолько точное, что не имеет значительных побочных эффектов.
Дуглас Кондзиолка, врач: Это произвело революцию в нейрохирургии и радиационной онкологии. До этого приходилось выбирать между открытой хирургией и облучением всей головы и нельзя было облучать только образования.
Дэвид Эндрюс, врач: Преимущество радиохирургии заключается в том, что, фокусируя облучение, мы ограждаем окружающие структуры мозга от радиационного поражения.
Дуглас Кондзиолка, врач: Пациенты удивляют нас. Они живут дольше, они побеждают болезнь. Мы наблюдаем случаи выздоровления, которые не наблюдали никогда раньше.
Дэвид Эндрюс, врач: Мы можем с высокой долей уверенности утверждать, что удалим раковую опухоль в мозге и вернем вас к вашей обычной жизни.
Как и почему возникают метастазы в головном мозге?
Дэвид Роберж, врач: Есть разные виды опухолей головного мозга.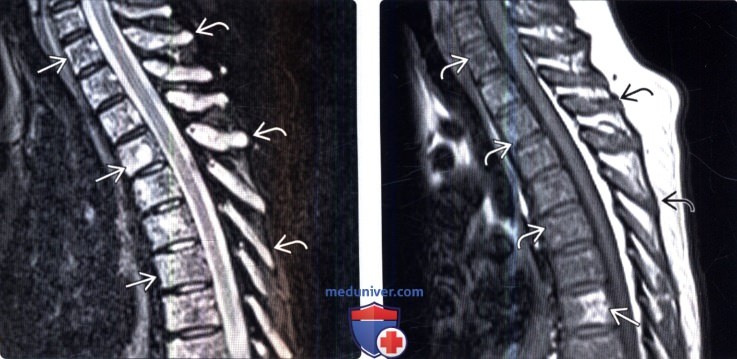 Выделяют первичный рак мозга, то есть опухоль, изначально развившуюся в мозге, что на самом деле редкость. Также есть метастатический рак мозга, который встречается в пять раз чаще. Особенностью раковой опухоли является ее способность распространяться по всему телу. Так, опухоль может образоваться в молочной железе, по достижении определенного размера мутировать, в результате ее клетка может отделиться и попасть в кровь, а затем в мозг. Она укореняется там и образует другие опухоли. Это и есть метастазирование.
Выделяют первичный рак мозга, то есть опухоль, изначально развившуюся в мозге, что на самом деле редкость. Также есть метастатический рак мозга, который встречается в пять раз чаще. Особенностью раковой опухоли является ее способность распространяться по всему телу. Так, опухоль может образоваться в молочной железе, по достижении определенного размера мутировать, в результате ее клетка может отделиться и попасть в кровь, а затем в мозг. Она укореняется там и образует другие опухоли. Это и есть метастазирование.
Орин Блох, врач: Мозг защищен от возбудителей инфекций, токсинов и других веществ, которые могут присутствовать в крови, гематоэнцефалическим барьером. Рак способен проникать сквозь этот барьер, и у некоторых видов рака механизм проникновения лучше, чем у других. Так, большинство наблюдаемых нами метастатических опухолей возникают из-за рака легких, рака молочной железы, меланомы и рака яичка. Если удалить одну из таких метастатических опухолей из мозга хирургическим путем и посмотреть на нее под микроскопом, она будет похожа на рак из первоисточника. Например, метастазы рака молочной железы выглядят как патологическая ткань молочной железы, а не ткань мозга. Эти клетки создают шарообразное скопление, которое является раком, но не является частью мозга. Они как плохие соседи, так сказать.
Например, метастазы рака молочной железы выглядят как патологическая ткань молочной железы, а не ткань мозга. Эти клетки создают шарообразное скопление, которое является раком, но не является частью мозга. Они как плохие соседи, так сказать.
Дуглас Кондзиолка, врач: Наша цель — обнаруживать подобные опухоли как можно раньше, потому что по мере их роста шансы на успех лечения снижаются. Обычно при использовании радиохирургии риск дальнейшего развития опухоли головного мозга снижается примерно на 85 %. Но как довести этот показатель до 95 %, 98 %, 99 %? Для этого важно как можно раньше выявлять опухоли, а значит, периодически нужно проводить сканирование мозга. Если пропустить момент образования опухоли, она вырастет, и это порой вызывает неврологические симптомы, которых можно было бы избежать.
Каковы возможные варианты лечения?
Химиотерапия
Орин Блох, врач: Обычно, когда у вас диагностируют метастатический рак или рак, распространяющийся по всему телу, вам назначают системную химиотерапию, при которой используемый препарат должен убивать раковые клетки во всем теле. Но такой препарат не попадает в мозг из-за гематоэнцефалического барьера.
Но такой препарат не попадает в мозг из-за гематоэнцефалического барьера.
Дэвид Эндрюс, врач: Противораковый препарат должен иметь сильный эффект, но так как сквозь гематоэнцефалический барьер проникает только небольшая его часть, химиотерапия существенно затрудняется.
Орин Блох, врач: Поэтому опухоли в мозге необходимо лечить как образования, полностью отделенные от опухолей в других частях тела.
Дэвид Эндрюс, врач: Таким образом, инструменты, доступные для лечения метастазов в мозге, — это облучение и хирургия.
Дуглас Кондзиолка, врач: В отдельных случаях выполняется оценка и тестирование разных протоколов исследований и медикаментозного лечения. Мы надеемся, что любое полученное медикаментозное лечение приносит пользу организму, особенно в аспекте предотвращения появления опухолей в будущем.
Лучевая терапия всего головного мозга
Дуайт Херон, врач: Облучение всего головного мозга полностью соответствует своему названию. Мы облучаем весь мозг радиацией.
Дэвид Роберж, врач: Методика традиционной радиотерапии неизменна уже много лет: каждый день дается небольшая доза радиации, и это повторяется пять дней в неделю в течение семи или восьми недель. При этом многие здоровые клетки получают такую же дозу радиации, как и раковые, но здоровые клетки быстрее восстанавливаются между процедурами облучения. Если вы проходите процедуру сегодня, а следующую через 24 часа, здоровые клетки восстановятся быстрее, чем раковые.
Эрик Чанг, врач: К сожалению, если пациенту диагностировали метастазы в головном мозге, многие из этих опухолей не обнаруживаются с помощью МРТ или других доступных методов лучевой диагностики. И они могут увеличиваться. Некоторые называют это «эффектом одуванчика». Когда вы дуете на одуванчик, все семена разлетаются. Так же происходит и с первичным раком в организме: у раковых клеток есть возможность распространиться и прорасти в разных областях головного мозга. Лучевая терапия всего головного мозга используется для того, чтобы удалить не только видимые метастазы, но и микроскопические, которых пока не видно.
Дэвид Роберж, врач: Облучение начали применять почти 100 лет назад, и это был очень важный шаг в лечении рака. Для некоторых людей это оптимальная терапия, но у нее много побочных эффектов. Почти все пациенты чувствуют утомление, иногда даже изнеможение. У них выпадают волосы. Может возникнуть воспаление уха, и иногда это приводит к потере слуха. Иногда облучение вызывает тошноту. Но больше всего пациентов и врачей беспокоит то, что облучение может повлиять на память, концентрацию внимания и другие функции мозга.
Орин Блох, врач: Лучевая терапия всего головного мозга оказывает разрушительное воздействие на когнитивные функции. Мы воздействуем на области, где формируются новые воспоминания, гиппокамп, а также все взаимосвязи между различными частями мозга, которые критически важны для памяти и мыслительной деятельности более высокого уровня. Нельзя подвергать такой объем тканей мозга токсическому воздействию радиации и ожидать, что последствий не будет. Поэтому в поисках метода лечения рака или, по крайней мере, его долговременного подавления, позволяющего продлить жизнь пациентов на многие годы, нам нужно задуматься, каким будет качество их жизни. А качество жизни начинается здесь.
Стереотаксическая радиохирургия
Дуайт Херон, врач: Благодаря современным технологиям визуализации, которые позволяют увидеть самые крошечные опухоли внутри мозга, мы можем избежать облучения всего головного мозга и лечить эти опухоли с помощью радиохирургии.
Говард Чандлер, врач: Стереотаксическая радиохирургия — это метод точной доставки облучения в конкретную точку внутри головы.
Дуайт Херон, врач: Принцип заключается в том, что вы разрушаете опухоли внутри тела с точностью лезвия ножа. Опухоль уничтожается глубоко внутри тела, почти как если ее вырезать, только используется неинвазивный способ.
Дэвид Роберж, врач: Радиохирургические устройства обычно имеют точность до миллиметра. И с той же точностью мы можем обнаружить местоположение опухоли на МРТ- или КТ-снимке, так что эта точность вполне близка к необходимой.
Говард Чандлер, врач: Это оборудование использует несколько пучков излучения, которые сходятся в одной точке. Я говорю пациентам, что это очень похоже на увеличительное стекло и листок. Если поместить листок под солнечные лучи, он не загорится сам по себе, но если взять линзу и направить малую дозу солнечной энергии в одну точку, она прожжет в листке дыру. Примерно так работает оборудование стереотаксической радиохирургии.
Дэвид Роберж, врач: Излучение поступает со всех направлений и фокусируется в одной точке. Но область вокруг этой точки почти не облучается, и поражается именно опухоль.
Дэвид Эндрюс, врач: Метастазы — одни из немногих очагов поражения в головном мозге, которые можно полностью устранить с помощью облучения. Огромное преимущество радиохирургии заключается в том, что она позволяет не прерывать системного лечения, в то время как пациент, проходящий лучевую терапию всего мозга, должен приостановить стандартное лечение.
Какие бывают типы стереотаксической радиохирургии?
Гамма-нож
Дуглас Кондзиолка, врач: Гамма-нож — первая стационарная специализированная радиохирургическая система.
Вероника Чанг, врач: Облучение гамма-ножом — это однодневная процедура.
Дуглас Кондзиолка, врач: Они приходят в больницу рано утром. Мы даем им немного успокоительного. Мы очищаем кожу, и я ввожу небольшое количество местного анестетика в лоб и затылок перед тем, как установить то, что я называю направляющим устройством стереотаксической рамы. Это похоже на кольцо с маленькими штырями, которые мы прикрепляем к голове в онемевших зонах. Пациент находится в нем во время процедуры. Направляющее устройство стереотаксической рамы предотвращает движения головой. Второе, что делает рама, — это фактически создает GPS-устройство для головы, чтобы мы знали местонахождение опухоли внутри мозга с математической точки зрения: точные координаты в трехмерном пространстве.
Дуайт Херон, врач: В гамма-ноже 192 источника, и все они сфокусированы в одной точке пространства.
Дуглас Кондзиолка, врач: Каждое из облучающих устройств по-разному создает подобный конформный план неправильной формы. В гамма-ноже используются так называемые изоцентры или порции радиации. Каждая порция похожа на шар. Чтобы получить неправильную форму, можно сделать серию шаров, которые математически объединяются в трех измерениях для создания нужной формы. После этого группа выбирает дозу радиации, которая лучше всего подходит для данной опухоли в данном месте у данного пациента. При этом необходимо учитывать множество факторов: проводилось ли облучение ранее, размер опухоли, ее местоположение, есть ли другие варианты лечения на случай, если этот не сработает, есть ли риски и как ими можно управлять.
Вероника Чанг, врач: После завершения процедуры мы снимаем головную раму, накладываем повязки на места, где были установлены штифты, перебинтовываем голову и пациент почти сразу идет домой.
Линейные ускорители
Дэвид Эндрюс, врач: Для стереотаксического облучения также используются линейные ускорители. Используемые в них ускоренные электроны сталкиваются с мишенью из тяжелого металла, в результате чего образуются фотоны высокой энергии.
Джеймс Робар, доктор наук: Когда они замедляются, они испускают рентгеновское излучение, но не такое, которое используется, например, для флюорографии. Это излучение почти в 100 раз сильнее. Такое рентгеновское излучение предназначено для уничтожения раковых клеток. Появление линейных ускорителей открыло доступ к огромному числу новых методов лечения. Мы смогли направлять радиационные пучки под разными углами и перекрывать их. Нам даже не нужно подавать все пучки одновременно. Биологический эффект облучения аддитивен, даже если подавать эти пучки последовательно. И это довольно быстро. Подача всей серии пучков и полной дозы облучения занимает от 15 минут до получаса.
В чем разница между безрамным облучением и процедурой с использованием рамы?
Орин Блох, врач: Преимущество радиохирургии с использованием рамы состоит в том, что пациент жестко зафиксирован на столе. Благодаря этому гарантируется неподвижность пациента, а определить мишень можно с высокой точностью. В безрамной радиохирургии используются термопластические маски, которые изготавливают индивидуально для каждого пациента. Для этого пластик нагревают, придают ему форму и после этого охлаждают, чтобы он стал жестким. Как и рама, маска удерживает пациента на столе, но все же допускает микродвижения на один-два миллиметра. Это намного удобнее, чем жесткая фиксация на столе, но потенциально может привести к ошибкам.
Тимоти Зольберг, доктор наук: Существуют безрамные технологии, позволяющие отслеживать поверхность тела пациента и на основе этих данных триангулировать находящуюся внутри тела мишень, которую невозможно увидеть.
Джеймс Робар, доктор наук: Технологии оптического отслеживания поверхности тела хорошо подходят для лечения рака некоторых локализаций, например в молочной железе. При лечении опухолей мозга пространственная точность важнее, чем при лечении любой другой части тела. На чувствительность отслеживания может влиять даже цвет кожи. Кроме того, кожа может сдвинуться, деформироваться, растянуться. В этом главное ограничение метода сопоставления поверхностей. Чтобы компенсировать ограниченную точность сопоставления поверхностей, можно добавить вокруг облучаемой опухоли дополнительный зазор. Мы стремимся сделать эти зазоры как можно меньше, поскольку такое расширение мишени означает намеренное облучение здоровой ткани мозга. К примеру, возьмем вторичные метастазы в мозге по 15 мм в диаметре. Если добавить зазор, который составляет всего 2 мм, мы практически удвоим объем опухоли, который нужно облучить. Чего бы нам действительно хотелось, так это иметь средства для более наглядного мониторинга фактического расположения опухоли.
Тимоти Зольберг, доктор наук: Благодаря безрамной технологии под контролем визуализации, например с помощью ExacTrac, можно в режиме реального времени увидеть, куда направлен пучок. Таким образом, можно постоянно следить за пациентом. Если он по какой-то причине начал двигаться, кашлять или вздрогнул, вы это заметите и сможете скорректировать процедуру.
Орин Блох, врач: Если к термопластической маске добавить визуализацию и корректировку микродвижений, можно достигнуть того же уровня точности, что и при использовании рамы. Это можно сделать с помощью такой системы, как ExacTrac. В ней используется встроенная рентгеновская визуализация и роботизированное перемещение стола, которые позволяют производить небольшие корректировки положения пациента с учетом любого его движения.
Говард Чандлер, врач: Исходя из моего опыта лечения сотен пациентов с использованием как рамы, так и безрамных технологий, безрамная иммобилизация более удобна и для пациента, и для специалиста. Для пациентов это значит, что не нужно терпеть болезненную анестезию и принимать успокоительное, не нужно терпеть дискомфорт от ношения рамы в течение всего дня лечения. Они обездвижены, только когда находятся на столе во время облучения.
Дэвид Роберж, врач: Не имеет значения, проводится ли одна процедура, три или пять. Можно достигать такой же точности и выполнять любое количество процедур, лучше всего подходящее для пациента и лечения его опухоли.
Технология CyberKnife
Дуайт Херон, врач: CyberKnife — это небольшой роботизированный линейный ускоритель, который позволяет проводить лучевую терапию с дозой гораздо меньшей мощности. Он работает по узловой схеме и поэтому перемещается из одного положения в следующее и так далее. Без лишних перемещений. Зачастую это позволяет создавать качественно схожие планы облучения. То есть, если необходимо доставить дозу в 18 греев в небольшую опухоль, то будь это гамма-нож, система Novalis или система CyberKnife — подойдет любая. Принципиальное различие в способе распределения дозы и ее доставки. И также в скорости. Продолжительность процедуры исключительно важна. Как и система Novalis, CyberKnife использует стереоскопическую визуализацию, которая позволяет визуализировать пациента и контролировать его правильное положение на протяжении всего курса облучения.
Многолепестковый коллиматор
Говард Чандлер, врач: Следующим шагом в развитии технологий формирования пучка являются микромноголепестковые коллиматоры. В основе этой технологии лежит факт, что не все опухоли имеют правильную круглую форму. Круговой пучок идеально подходит для сферической мишени, но если представить, например, хот-дог, то он будет круглой формы в одной проекции, но вытянутой в другой.
Джеймс Робар, доктор наук: Многолепестковый коллиматор позволяет подстраивать эти формы в зависимости от проекции опухоли. Мы не можем использовать магниты для управления рентгеновским излучением или использовать линзы, например оптические. Нам нужно просто заблокировать области, куда не должны попадать рентгеновские лучи, и создать отверстие, куда они должны проходить.
Говард Чандлер, врач: В микромноголепестковых коллиматорах несколько лепестков закрывают часть пучка, чтобы он по форме точно соответствовал опухоли. Контур пучка точно совпадает с краем опухоли на данной проекции. И все это производится во время процедуры, пока пучок движется по дуге облучения вокруг опухоли.
Джеймс Робар, доктор наук: Если управление лепестками осуществляется динамически, можно менять интенсивность излучения, испускаемого линейным ускорителем.
Говард Чандлер, врач: Я считаю, что разработка микромноголепесткового коллиматора — самый большой успех в радиохирургии в мое время. Он позволяет более точно и стабильно доставлять дозу непосредственно в мишень, что снижает облучение здоровых тканей мозга вокруг опухоли.
Облучение нескольких метастазов
Дэвид Эндрюс, врач: Пусть даже пациенту назначено 36 часов радиохирургии, не важно. Благодаря поразительным технологиям линейных ускорителей мы можем выполнить облучение десяти метастазов в кратчайшие сроки — всего за полчаса.
Тимоти Зольберг, доктор наук: Применяемый сегодня метод лечения множественных метастазов заключается в том, чтобы облучать один метастаз за другим, и, безусловно, можно так и делать. С помощью гамма-ножа это традиционно делается на линейном ускорителе. Облучается метастаз за метастазом, и процедура занимает 15–20 минут для каждого. Если у пациента 12 метастазов, приходится облучать его в течение трех, а то и четырех часов.
Дэвид Роберж, врач: Это не так актуально, когда речь идет о двух или трех опухолях. Но если необходимо облучить 10 или 15 опухолей, крайне неудобно облучать их по одной за раз. Гораздо проще использовать технологию, с помощью которой можно облучить все сразу.
Тимоти Зольберг, доктор наук: Исторически сложилось, что планирование облучения выполняется вручную и зависит от знаний и опыта физика, сидящего за компьютером. Все делается вручную, шаг за шагом, пока не получается план. Не самый лучший план, поскольку вы знаете, что могли бы потратить немного больше времени и получить лучший результат. Но этот план клинически приемлем, и нет причин его переделывать, поскольку есть компьютеры, которые оптимизируют его автоматически.
Джеймс Робар, доктор наук: Новые подходы позволяют облучать все метастазы с использованием единого изоцентра. Одним из таких методов является дуговая терапия с объемной модуляцией. Поворачивая гантри линейного ускорителя, можно создавать отверстия очень сложной формы для облучения сразу всех метастазов. В зависимости от ориентации микромноголепесткового коллиматора может быть сложно создать две отдельные апертуры без создания между ними области, которую облучать нежелательно.
Новое программное обеспечение для облучения множественных метастазов
Джеймс Робар, доктор наук: Набирает популярность еще один метод, в котором используется иной подход для выбора групп метастазов в головном мозге и их облучения за один поворот гантри. Допустим, у пациента семь метастазов в головном мозге. Данный алгоритм оценивает эти метастазы и решает, что три из семи можно облучить с использованием одной дуги гантри, а затем для второго поворота гантри алгоритм может выбрать оставшиеся четыре метастаза. Такое решение будет принято, чтобы подвергнуть облучению как можно меньший объем здоровой ткани мозга.
Почему иногда необходимо проводить несколько сеансов радиохирургии?
Дуайт Херон, врач: Все чаще мы сталкиваемся с более сложными во всех отношениях и более крупными опухолями, а также опухолями, которые расположены очень близко к критическим структурам, таким как перекрест зрительных нервов, ствол головного мозга или один из основных черепно-мозговых нервов. Использовать одну фракцию было бы нежелательно, это было бы чревато слишком серьезными побочными эффектами. И сегодня благодаря современным технологиям, переставляемым рамам, визуализационному контролю и возможности регулировать интенсивность пучка радиации мы можем доставлять эффективную дозу облучения, разбивая ее на более мелкие фракции. Это называется «гипофракционирование». Например, для самых маленьких опухолей можно подать 21 или 24 грея. И это доза излучения в одной фракции. Но для опухоли размером три сантиметра мы используем гораздо более низкую дозу — 16 греев. Звучит странно, ведь в большой опухоли больше клеток, которые нужно уничтожить. Тогда почему мы используем более низкую дозу? Дело в том, что, если мы попытаемся подать 24 греев на трехсантиметровую опухоль, побочные эффекты, а именно отек и некроз, то есть омертвение тканей мозга, будут чрезвычайно тяжелыми.
Дэвид Роберж, врач: В промежутках между процедурами здоровая ткань мозга может восстанавливаться. Между процедурами некоторые участки опухоли, которые были более устойчивы к радиации, например потому, что получали недостаточно кислорода, могут получить больше кислорода и стать более чувствительными к облучению.
Дуайт Херон, врач: Всем клеткам в организме нужен кислород, а клеткам опухоли требуется еще больше кислорода, потому что они очень быстро растут. Фактически их рост может опережать кровоснабжение. И когда они опережают кровоснабжение, их называют гипоксическими. В центре опухоли мало кислорода. Именно поэтому эффективнее подавать меньшую дозу радиации, но в нескольких фракциях. От этого опухоль уменьшается, и та часть, которая была гипоксической, получает больше крови. По мере дальнейшего сокращения ее кровоснабжение увеличивается, поэтому облучение становится более эффективным. Становится больше кислорода, а значит, и больше свободных радикалов для уничтожения раковых клеток. В результате эффективность лечения повышается.
Дэвид Роберж, врач: Для некоторых крупных опухолей, возможно, будет эффективнее проводить три или пять процедур вместо одной. К тому же, если есть система, которая позволяет ничего не прикручивать к голове пациента, выбор оптимального варианта облучения опухоли становится шире. Если это три процедуры, мы сделаем три облучения. Если одна процедура, мы сделаем одно облучение. Качество и точность будут одинаковыми.
Почему лучевая терапия всего головного мозга до сих пор применяется?
Эрик Чанг, врач: Практика лучевой терапии всего головного мозга очень прочно укоренилась в сознании многих онкологов-радиологов, и это неизменно уже очень много лет.
Дэвид Эндрюс, врач: Лучевая терапия без фокусирования наносит ущерб окружающей ткани.
Дуайт Херон, врач: Зачем продолжать использовать технологии и метод облучения, которые приводят к развитию серьезных, долгосрочных, необратимых побочных эффектов, таких как потеря памяти и деменция, когда тщательно продуманный клинический подход в радиохирургии в сочетании с внимательным последующим наблюдением позволяет получить идентичные результаты. Мне кажется вопиющим, что страховые компании отказывают в хороших методах лечения. Одной из причин, почему лучевая терапия всего головного мозга так популярна, является то, что даже в центрах с необходимыми специалистами и возможностями для проведения радиохирургии пациенты получают отказ.
Эрик Чанг, врач: Если начать лечение пациента с радиохирургии, это не значит, что дополнительные методы лечения исключаются. Лучевую терапию всего головного мозга можно провести позже, если это будет необходимо. Я считаю, что лучевая терапия всего головного мозга всегда будет занимать определенное место в лечении метастатических заболеваний мозга, но я также думаю, что популярность этого метода будет постепенно сходить на нет из-за пациентов с более сложными случаями метастазирования.
Что я могу сделать как пациент для поддержания наилучшего качества жизни?
Дэвид Роберж, врач: Если назначить пациенту радиохирургическое лечение и не наблюдать его после процедуры, вероятность образования новых метастазов в мозге, к сожалению, составляет примерно 50/50. И если не наблюдать пациентов, то единственными причинами для повторной встречи будут ухудшение их состояния и поступление в реанимацию. Но если приглашать их на прием каждые несколько месяцев и делать МРТ, вы можете обнаружить новые метастазы, пока их размер не превышает нескольких миллиметров. Вы можете удалить их до того, как они станут представлять проблему. Зачастую пациентов даже с прогрессирующим раком и метастазированием в головном мозге можно спасти, если контролировать ситуацию, выявлять метастазы и облучать их, пока они малы.
Дуглас Кондзиолка, врач: Фактически на этом этапе мониторинг рака схож с ведением хронических заболеваний, для которых необходимо периодически сдавать анализы. Как и для поддержания здоровья других органов, ПЭТ-сканирование, периодические КТ-сканирования нужны и для головного мозга.
Орин Блох, врач: Если вы заметили пару сорняков в саду, вы можете пойти и вырвать эти сорняки либо перекопать весь газон. Но могут остаться два или три сорняка, которых вы не заметили. Если они вырастут, вы можете просто вырвать их позже.
Почему иногда необходимо хирургическое лечение?
Орин Блох, врач: Конечно, пациенты хотели бы избежать операции. Перспектива, что вам вскроют черепную коробку и будут копаться в вашем мозге, очень пугает.
Дуглас Кондзиолка, врач: Если опухоль большая и имеет клинические проявления, вызывая невыносимые головные боли, частые судороги или проблемы с равновесием, и ее расположение подходит для хирургического удаления, может быть показано удаление этой опухоли оперативным путем, чтобы уменьшить давление на мозг. Многие пациенты благодарны за такое решение. Когда я объясняю, что это самый быстрый способ улучшить их самочувствие, их это радует. Вот когда мы задумываемся об операции: когда это отвечает нуждам пациента.
Орин Блох, врач: Как только мы удаляем опухоль, отек начинает спадать, поэтому после удаления метастазов в головном мозге пациентам становится лучше уже на следующий день после операции. Мы используем минимально инвазивный способ: делаем небольшие краниотомии непосредственно над местом вмешательства. В современных условиях для этого мы используем технологию, называемую интраоперационной нейронавигацией. С ее помощью мы можем рассчитать кратчайшее расстояние от поверхности черепа до опухоли и сделать наименьшее отверстие из возможных.
Почему иногда нужны и хирургические операции, и радиохирургия?
Орин Блох, врач: При хирургическом вмешательстве невозможно гарантировать 100%-ное удаление опухоли. Порой, даже если мы удалили все, что можно увидеть на МРТ, мы знаем, что остались микроскопические клетки. Данные ясно показывают, что результаты лечения улучшаются, если в области, где была удалена опухоль, провести радиохирургию. Облучение радиацией до хирургической операции — это очень любопытная идея, которая начинает вызывать все больший интерес. Концепция заключается в том, что, если облучить опухоль радиацией до того, как сделать операцию, облучение начнет убивать клетки опухоли. Поэтому когда мы приступаем к операции по удалению опухоли, большая ее часть уже мертва, а клетки, которые попадают в ткани во время операции, уже не смогут распространиться и образовать новые опухоли. Когда облучение радиацией выполняется до операции, гораздо проще очертить контуры опухоли и точно понять, где граница между нею и здоровой тканью мозга.
Как выбрать самое лучшее и самое подходящее отделение терапии?
Тимоти Зольберг, доктор наук: Радиохирургия — это все еще новое направление. Двадцать лет — довольно небольшой срок. Стандарты медицинского обслуживания включают довольно много доступных процедур.
Дэвид Роберж, врач: Радиохирургия весьма быстро развивается. И это палка о двух концах, поскольку радиохирургию, особенно метастазов в мозге, теперь можно пройти в сравнительно небольших клиниках со стандартным оборудованием для лучевой терапии. Но качество лечения в таких условиях может существенно отличаться от качества лечения в крупных учреждениях, в которых есть устройства, предназначенные для радиохирургии. Для пациента и даже для меня сложно с порога определить, насколько такие клиники квалифицированы для радиохирургии.
Тимоти Зольберг, доктор наук: Честно говоря, нет никаких гарантий, что не будет проблем. Novalis Certified — единственная в мире программа, которая предполагает наличие независимой группы специалистов. Они могут прийти, посмотреть на вашу практику и подтвердить, что вы выполняете стереотаксическую радиохирургию на высоком уровне с клинической точки зрения, с технической точки зрения, с точки зрения физики и гарантируете качество всех своих услуг. Это очень важный показатель.
Как будет развиваться лечение метастатического рака головного мозга в будущем?
Элизабет Уилсон, CEO: В вопросах лечения метастатического рака и метастазов в головном мозге в частности мы только в начале пути. Ценность этого фильма заключается в том, что к его созданию привлекается Американская ассоциация онкологии головного мозга. Он служит нашей миссии. Если люди поймут, что у них достаточно времени для осознания своей опухоли, осознания своего диагноза, достаточно времени для того, чтобы изучить возможные варианты лечения, то улучшится и ход лечения, и его результат. Я думаю, это и есть путь реализации миссии нашей организации.
Орин Блох, врач: Если лечение токсично и приведет к снижению когнитивных способностей, пациенты не смогут наслаждаться годами жизни, которые мы подарим им с помощью новых методов лечения. Поэтому в современных условиях при лечении больных раком необходимо учитывать и качество жизни, которую им предстоит прожить.
Вероника Чанг, врач: Мы хотим, чтобы люди продолжали жить, работать и делать все, что для них важно.
Дуайт Херон, врач: Радиохирургия является неотъемлемой частью новейших методик лечения рака.
Бренда Винченц-Смит: Знаете, я больше не думаю о смерти. Правда. Я считаю, это показатель.
Дэвид Эндрюс, врач: Если мы можем продлить жизнь пациента хоть ненадолго, он сможет воспользоваться возможностями лечения, которые станут доступны в будущем. Возможностями, которых не было, например, еще три года назад. Это дает пациентам реальную надежду.
Орин Блох, врач: Технологии достигли уровня, когда мы можем улучшать самочувствие пациентов и зачастую даже излечивать интракраниальные заболевания. Большинство пациентов с раком, у которых нашли метастазы в головном мозге, осознают, что окончательный прогноз зависит от того, что происходит с раком в остальных частях тела. Будущее для этих людей действительно светлое, потому что наши системные методы лечения постоянно совершенствуются, а процент выживания намного выше, чем когда-либо в прошлом. Я считаю, что в будущем рак перестанет считаться смертельной болезнью и станет просто хроническим заболеванием.
|
перспективный метод лечения метастазов в кости
Bonekey Rep. 2014; 3: 599.
Патрисия Хуарес
1 Отделение эндокринологии, Медицинский факультет, Университет Индианы — Университет Пердью в Индианаполисе, Индианаполис, Индиана, США
2 Отдел биомедицинских разработок, Центр научных исследований и высшего образования of Ensenada (CICESE), Энсенада, Нижняя Калифорния, Мексика
1 Отделение эндокринологии, Медицинский факультет, Университет Индианы — Университет Пердью в Индианаполисе, Индианаполис, Индиана, США
2 Отдел биомедицинского развития, Центр научных исследований Исследования и высшее образование Энсенада (CICESE), Энсенада, Нижняя Калифорния, Мексика
a Отдел биомедицинских разработок, Центр научных исследований и высшего образования Энсенада (CICESE), Carretera Ensenada-Tijuana 3918, Ensenada, CP 22860 Нижняя Калифорния, Мексика.E-mail: [email protected]Поступила в редакцию 22 мая 2014 г .; Принято 10 сентября 2014 г.
Abstract
Метастазы в кости — очень частое осложнение запущенных форм рака, и это неизлечимая болезнь. Современные методы лечения, одобренные для лечения метастазов в кости, задерживают возникновение событий, связанных со скелетом, и могут продлить жизнь пациента на несколько лет.Однако они не излечивают или не вызывают регресса установленных метастазов в кости, и после продолжительного лечения появляются новые побочные эффекты. Таким образом, остро необходимы новые методы лечения. Имеются убедительные доказательства доклинических исследований in vitro, и in vivo, , которые поддерживают использование соединений, полученных из растений, для лечения нескольких форм рака, включая метастазы в кости. Более 25% лекарств, используемых в течение последних 20 лет, были получены непосредственно из растений, а еще 25% — это химически измененные натуральные продукты.Тем не менее, только 5–15% из 250 000 высших растений когда-либо были исследованы на предмет биологически активных соединений. Растет интерес к изучению противоопухолевых препаратов с относительно низкими побочными эффектами, нацеленных на определенные ключевые сигнальные пути, контролирующие образование и прогрессирование метастазов рака. Следовательно, необходимы дальнейшие исследования для выявления новых природных соединений с высокой эффективностью в профилактике и лечении рака. Были опубликованы обширные обзоры агентов растительного происхождения и их использования при раке, но ни одного, когда дело доходит до лечения метастазов в кости.Лишь некоторые из этих соединений были оценены для лечения метастазов в кости; здесь мы описываем некоторые из наиболее известных, которые могут скоро попасть в клинику.
Растения как источник лекарств от рака
Лекарственные растения веками использовались в качестве традиционных методов лечения многих болезней человека в нескольких частях мира. Они также сыграли важную роль в качестве источника эффективных противораковых агентов. Более 60% используемых в настоящее время противоопухолевых агентов получают из природных источников, таких как растения, морские организмы и микроорганизмы.1
Противораковые препараты, полученные из растений, которые в настоящее время используются в клинической практике, можно разделить на четыре основных класса соединений: алкалоиды барвинка (или Catharanthus), эпиподофиллотоксины, таксаны и камптотецины2. Поиск противораковых средств, полученных из растений, начался в 1950-х годах. с открытием и разработкой алкалоидов барвинка и выделением цитотоксических подофиллотоксинов. Алкалоиды барвинка винбластин и винкристин были выделены из мадагаскарского барвинка ( Catharanthus roseus или Vinca rosea ).Эти алкалоиды и их полусинтетические производные блокируют митоз на стадии метафазы, вызывая апоптоз клеток, и они уже более 40 лет используются для лечения лейкозов, лимфом, саркомы Капоши (СК) и рака яичек, груди и легких2,3. Подофиллотоксины были выделены из смолы Podophylum peltatum , и они также блокируют митоз во время метафазы, ингибируя апоптоз, вызывающий полимеризацию тубулина. Однако их использование в клинике не удалось из-за серьезных побочных эффектов.Дальнейшие исследования привели к разработке полусинтетических производных подофиллотоксинов, таких как этопозид и тенипозид, которые ингибируют каталитическую активность топоизомеразы II ДНК, вызывая необратимые разрывы в ДНК и апоптоз. Этопозид и тенипозид используются для лечения лимфом, а также острого лейкоза и мелкоклеточного рака легких, яичек, яичников и мочевого пузыря4. В 1960 году Национальный институт рака США (NCI) инициировал обширную программу сбора растений, ведущую к открытие многих новых хемотипов, включая таксаны и камптотецины.Таксаны выделены из Taxus brevifolia и других хвойных растений из рода Taxus . Они стабилизируют микротрубочки, подавляя их деполимеризацию в тубулин, что приводит к гибели клеток. Таксаны использовались для лечения рака яичников, метастатического рака молочной железы и легких и KS.2,5 Камптотецины — это алкалоиды, выделенные из Campthotheca acuminate , Ophiorrhiza pumila или Mapia foethida . Камптотецин ингибирует ДНК-топоизомеразу I.Полусинтетические аналоги камптотецина топотекан и иринотекан находятся в клиническом применении. Топотекан используется для лечения рака яичников и мелкоклеточного рака легких, тогда как иринотекан используется для лечения колоректального рака.2,5
В настоящее время Отделение натуральных продуктов, являющееся частью терапевтической программы развития в NCI, сотрудничает с агентствами по всему миру для сбора тысяч растений и морских организмов для извлечения и проверки противоопухолевых свойств экстрактов.NCI также привержен делу сохранения биологического разнообразия. На сегодняшний день фитохимически исследовано только 1% из ~ 500 000 видов растений во всем мире.6 Таким образом, вполне вероятно, что многие новые биоактивные соединения ждут своего открытия и разработки для лечения таких патологий, как метастазы в кости.
Метастазы в кости
Метастазы в кости являются частым осложнением рака и могут возникать у 80% пациентов с распространенным раком груди или простаты.7 Последствия метастазов в кости часто разрушительны. Как только опухоли метастазируют в кость, они становятся неизлечимыми и вызывают сильную боль, переломы, компрессию спинномозгового нерва и паралич.8 Опухолевые клетки в кости выделяют множество остеолитических факторов, которые стимулируют резорбцию кости, высвобождая факторы роста из костного матрикса, которые, в свою очередь, стимулируют опухоль. рост и дальнейшее разрушение костей. Это приводит к установлению цикла прямой связи, который отвечает за рост опухоли и поражение костей.9 Разнообразие проостеолитических факторов, секретируемых раковыми клетками, делает маловероятным, что методы лечения, направленные на единственный фактор, будут эффективными для лечения метастазов в кости. В настоящее время антирезорбтивные препараты, такие как бисфосфонаты, являются стандартом лечения пациентов, страдающих скелетными осложнениями и метастатическим раком в кости.10 Бисфосфонаты связываются с костью и ингибируют опосредованную остеокластами резорбцию кости, тем самым предотвращая высвобождение всех различных факторов роста. содержится в костном матриксе.Кроме того, бисфосфонаты подавляют адгезию, миграцию, инвазию и пролиферацию опухолевых клеток и вызывают гибель клеток в широком диапазоне клеточных линий in vitro .11 Следовательно, бисфосфонаты снижают опухолевую нагрузку на скелет во множестве моделей in vivo груди, простаты и легких. метастазирование рака в кость.12 Однако эффективность бисфосфонатов у пациентов более ограничена, и они связаны с серьезными побочными эффектами, такими как остеонекроз челюсти, а также нефротоксичность.13,14 Поэтому крайне важно определить новые терапевтические агенты, которые будут действовать. (i) более эффективен при лечении метастазов в кости, (ii) может предотвращать метастазы в кости и (iii) обладает низкой токсичностью и ограниченными побочными эффектами.
Удивительно, но среди большого количества сообщенных противораковых агентов растительного происхождения только четыре соединения (плюмбагин (5-гидрокси-2-метил-1,4-нафтохинон), хонокиол (3 ‘, 5-ди- (2-пропенил) ) -1,1′-бифенил-2,2’-диол), куркуминоид и галофугинон (7-бром-6-хлор-3- [3 — [(2 r , 3 s ) -3-гидрокси -2-пиперидил] -2-оксопропил] -4 (3 H ) -хиназолинон)) были протестированы при метастазах в кости, и только два из них (куркуминоиды и галофугинон) в настоящее время проходят клинические испытания на различные виды рака, но не при метастазах в кости.Здесь мы рассмотрим свойства этих соединений и их влияние на метастазирование в кости. Мы также включаем описание ресвератрола (3,4 ‘, 5-тригидрокси- транс -стильбен), многообещающего природного агента с высоким потенциалом для лечения рака и метастазов.
Plumbagin
Plumbagin получают из корня Plumbago zeylanica , также известного как Chitrak, аюрведического растения (индуистская традиционная медицина) (). Семейство Plumbaginaceae встречается в полузасушливых регионах Средиземноморского бассейна и Центральной Азии.В Соединенных Штатах он встречается на побережье Тихого океана и растет во Флориде и от Техаса до Аризоны. Было показано, что плюмбагин проявляет широкий спектр фармакологических свойств, включая антиоксидантное, противовоспалительное, противораковое, антибактериальное и противогрибковое действие. Эти свойства реализуются посредством различных механизмов, включая преобразователь сигнала и активацию активатора транскрипции 3 (STAT3), 15 индукцию экспрессии p53 и N-концевой киназы c-Jun в клетках немелкоклеточного рака легкого человека, 16 ингибирование путь ядерного фактора-κB (NF-κB) / Bcl-212 и подавляя экспрессию хемокинового рецептора CXCR4.17
Таблица 1
Противоопухолевые препараты растительного происхождения в доклинических и клинических исследованиях для лечения рака и метастазов в кости
Противоопухолевые эффекты плюмбагина были показаны при нескольких раковых заболеваниях, включая плоскоклеточный. клеточная карцинома 18, лейкемия19 и миелома15, а также рак груди, 17,20 яичников, 21 рак поджелудочной железы, 22 легких, 23 печени24 и рак шейки матки.25
В костях клетки рака груди увеличивают резорбцию кости за счет продуцирующих факторов, таких как паращитовидная железа белок, связанный с гормонами (PTHrP) и интерлейкины, которые стимулируют остеобласты и увеличивают выработку активатора рецептора лиганда NF-κB (RANK) (RANKL).RANKL, взаимодействующий со своим рецептором RANK в предшественниках остеокластов, активирует сигнальный путь NF-κB, индуцирующий остеокластогенез.26 Различные опухолевые клетки могут также продуцировать RANKL, непосредственно вызывая остеокластогенез.27 Таким образом, селективная модуляция оси RANK / RANKL используется для лечения рака. индуцированная потеря костной массы и связанные с костями заболевания, такие как остеопороз.
При метастазах в кости, Sung et al. 28 продемонстрировал, что плюмбагин модулирует передачу сигналов RANK / RANKL, остеокластогенез и остеолиз, вызванный раком груди.В моноцитах мышей, используемых в качестве предшественников остеокластов, плюмбагин подавлял активацию NF-κB, индуцированную RANKL, посредством последовательного ингибирования активации киназы IκBα, фосфорилирования IκBα и деградации IκBα. Плумбагин также подавлял дифференцировку клеток макрофага RAW264.7 в остеокласты, индуцированную RANKL или клетками рака груди человека (MDA-MB-231 и MCF-7) или клетками множественной миеломы человека (U266) .28 У мышей, несущих метастазы в кости, вызывали путем внутрисердечной инокуляции клеток рака молочной железы MDA-MB-231 обработка плюмбагином (2 мг / кг -1 ) путем внутрибрюшинной инъекции пять раз в неделю в течение 28 дней уменьшала размер и количество остеолитических повреждений.28 Анализ микрокомпьютерной томографии проксимального отдела большеберцовой кости показал, что лечение плюмбагином сохраняет объем кости и значительно увеличивает объем губчатой кости. 28 Эти результаты предполагают, что плюмбагин может эффективно отменять передачу сигналов RANKL и уменьшать развитие метастазов в кости.
Несмотря на положительные эффекты плюмбагина против некоторых видов рака и метастазов в кости, эта молекула еще не была протестирована в клинических испытаниях, что может быть частично связано с некоторыми из его побочных эффектов.Токсичность Plumbagin была оценена на грызунах. Побочные эффекты были дозозависимыми и включали диарею, кожную сыпь и гепатотоксичность.29 Кроме того, самки крыс, получавших плюмбагин, не могли забеременеть, а беременные крысы с большей вероятностью прервали беременность при приеме плюмбагина.30 Дальнейшие исследования, чтобы охарактеризовать степень токсичности плюмбагина. нужны эффекты.
Honokiol
Honokiol — это биоактивный натуральный продукт, полученный из Magnolia spp. Род Magnolia распространен по всему миру, главным образом в Восточной и Юго-Восточной Азии.Экстракты семян магнолии использовались в традиционной медицине Китая и Японии для лечения пищеварительных, анксиолитических и аллергических заболеваний.31
Хонокиол — это относительно небольшой полифенол, который взаимодействует с белками клеточной мембраны через водородные связи и гидрофобные взаимодействия (32) .32 Хонокиол нацелен на множество путей, вовлеченных в многочисленные физиологические процессы, включая развитие, дифференцировку, иммунитет, метаболизм и рак.33 Некоторые из генных мишеней являются факторами транскрипции, такими как NF-κB и STAT3, которые повышают экспрессию белков, участвующих в апоптоз.33 И NF-κB, и STAT3 также участвуют в регуляции индуцируемого гипоксией фактора альфа 1α и фактора роста эндотелия сосудов (VEGF), участвующих в инвазии и ангиогенезе. 34 Хонокиол способствует апоптозу многих линий раковых клеток человека, включая плоскоклеточный рак легкого. клетки (CH-27 и HL-60), клетки рака толстой кишки (COLO 205), клетки рака печени (HepG2) и клетки рака груди и простаты.35 Хонокиол также обладает противовоспалительным действием, поскольку снижает экспрессию медиаторов воспаления, воспалительных процессов. гены и пролиферация лимфоцитов, индуцированная липополисахаридом.36
При метастазах в кости, Shigemura et al. 36 тестировали эффекты хонокиола отдельно и в комбинации с доцетакселом, таксаном второго поколения, который в настоящее время используется в терапии метастатического рака простаты на ксенотрансплантатах опухоли предстательной железы человека в большеберцовой кости мышей. 36 Хонокиол индуцировал апоптоз андроген-зависимого человека. и -независимые клетки рака простаты, а также костного мозга, эндотелиальных клеток и стромальных клеток простаты, происходящих из костного мозга, через активация каспазы-3, -8 и -9 в зависимости от дозы и времени.Противоопухолевые эффекты хонокиола отдельно или в комбинации с доцетакселом были оценены in vivo на мышах, несущих опухоли из клеток рака простаты C4-2 и получавших хонокиол (100 мг / кг -1 в день) отдельно или в комбинации с доцетакселом ( 5 мг кг -1 в неделю) в течение 6 недель. Рост опухоли и реакцию на терапию определяли с помощью сывороточного простатоспецифического антигена (ПСА), рентгенологического и гистоморфометрического анализа. Сывороточный PSA был значительно снижен во всех обработанных группах по сравнению с контрольными мышами.Группа комбинированного лечения имела более низкий уровень ПСА в сыворотке по сравнению с одним доцетакселом, хотя разница не была статистически значимой. Обработка хонокиолом подавляла рост клеток C4-2, введенных в кости мышей, а комбинация с доцетакселом усиливала уменьшение опухоли и увеличение кортикального слоя кости по сравнению с контрольной группой. Иммуногистохимический анализ опухоли большеберцовой кости мышей показал, что обработка гонокиолом плюс доцетакселом заметно снижает пролиферацию клеток и плотность сосудов, а также увеличивает апоптоз по сравнению с мышами, получавшими носитель.36 Эти результаты предполагают, что хонокиол является многообещающей молекулой, которую можно использовать в качестве адъювантной терапии в сочетании с низкими дозами доцетаксела для лечения гормонорезистентного рака простаты и его метастазов в кости. Хонокиол хорошо переносится и имеет низкую токсичность. Однако побочные эффекты хонокиола включают антитромботические эффекты, которые могут вызвать кровотечение, особенно у пациентов с гемофилией.32
Несмотря на потенциальные преимущества хонокиола отдельно или в сочетании с другими противораковыми препаратами, клинические испытания пока не проводятся.
Куркуминоиды
Куркума ( Curcuma longa ) — корневищное травянистое растение семейства имбирных с юго-востока Индии и Азии. Куркума использовалась в Индии для приготовления пищи и в аюрведической медицине для лечения различных распространенных заболеваний, включая расстройство желудка, дизентерию, язвы, желтуху, артрит, растяжения, раны, угри, кожные и глазные инфекции37. Активным компонентом куркумы является куркумин, который обладает разнообразными фармакологическими эффектами, включая противовоспалительное, антиоксидантное, антипролиферативное и антиангиогенное действие.Куркумин ((1 E , 6 E ) -1,7-бис- (4-гидрокси-3-метоксифенил) -1,6-гептадиен-3,5-дион) представляет собой бис-α, β-ненасыщенный β-дикетон. Он растворим в дихлорметане, хлороформе, метаноле, этилацетате, диметилсульфоксиде и ацетоне, но нерастворим в воде () .38 В нескольких исследованиях описан антиканцерогенный эффект куркумина, применяемого отдельно или в сочетании с химиотерапией для лечения нескольких видов рака, включая плоскоклеточный рак головы. клеточная карцинома и рак груди, толстой кишки, яичников, поджелудочной железы и мочевого пузыря.39 Эти противораковые свойства объясняются его воздействием на различные биологические пути. Куркумин подавляет клеточный цикл и экспрессию гена-супрессора опухоли p53 и различных факторов транскрипции (таких как Nrf2 и NF-κB) путем модуляции воспалительных сигнальных каскадов и индуцирует апоптоз. Куркуминоиды также могут регулировать экспрессию генов с помощью эпигенетических механизмов. Модификации гистонов являются одними из наиболее важных эпигенетических изменений и, изменяя экспрессию генов, могут увеличивать риск рака.Куркумин является ингибитором гистоновых деацетилаз и вызывает апоптоз многочисленных линий раковых клеток путем ингибирования ацетилирования гистона и p53 посредством специфического ингибирования p300 / CBP.40 Кроме того, куркумин подавляет остеокластогенез, индуцированный RANKL, посредством ингибирования активации NF-κB. .41 Куркумин также блокирует секрецию PTHrP опухолевидными синовиоцитами, выделенными из суставов пациентов с ревматоидным артритом, которые могут вызвать потерю костной массы. 42
Wright et al. 42 продемонстрировал эффекты куркумина на секрецию PTHrP и на мышиной модели метастазов рака груди в кости.Куркумин ингибировал секрецию PTHrP, индуцированную фактором роста опухоли — β (TGF-β) в клетках рака молочной железы человека MDA-MB-231, и снижал уровни фосфорилирования Smad2 / 3 и Ets-1, протоонкогена, необходимого для активации Промотор PTHrP от Smads.42 In vivo , лечение мышей с метастазами в кости, вызванными клетками MDA-MB-231, куркумином (25 или 50 мг / кг -1 через день) в течение 21 дня уменьшало количество остеокластов на границе опухоль-кость и размер остеолитических поражений.Однако лечение куркумином не уменьшало рост ксенотрансплантатов в жировой подушке молочной железы, что позволяет предположить, что эффекты куркумина специфичны для костного микроокружения.42
На сегодняшний день куркумин завершил несколько клинических испытаний фазы I для оценки его эффектов при различных патологиях, включая множественная миелома и рак прямой кишки, поджелудочной железы, груди и простаты. При запущенном колоректальном раке 15 пациентов с прогрессирующим колоректальным раком, резистентным к стандартной химиотерапии, принимали капсулы с куркумином (0.45–3,6 г в сутки на срок до 4 месяцев). Уровни куркумина и его метаболитов в плазме, моче и кале анализировали с помощью жидкостной хроматографии высокого давления и масс-спектрометрии. В крови пациентов измеряли активность глутамин S -транферазы и уровни M 1 G, маркера образования ДНК. Ежедневная доза куркумина в 3,6 г генерировала определяемые уровни соединения и конъюгатов в плазме и моче, а также вызывала ингибирование продукции простагландина E 2 (PGE 2 ) в лейкоцитах крови, измеренных ex vivo .43 Прием 0,5–3,6 г в день на срок до 4 месяцев был связан с легкой диареей как его единственной очевидной токсичностью. Клиническое испытание фазы IIa куркумина для профилактики колоректальной неоплазии было проведено у 44 курильщиков с восемью или более аберрантными криптофокусами (ACF) при скрининговой эндоскопии. Действие перорального куркумина (2–4 г в день) на проканцерогенные эйкозаноиды PGE 2 и 5-гидроксиэйкозатетраеновую кислоту (5-HETE) оценивали в течение 30 дней с помощью жидкостной хроматографии. Вторичные конечные точки включали общее количество ACF и оценку пролиферации в нормальной слизистой оболочке с использованием маркера пролиферации Ki-67.Ни одна из доз куркумина не уменьшала PGE 2 , 5-HETE или Ki-67, но наблюдалось значительное снижение количества ACF на 40% у пациентов, получавших дозу 4 г. Куркумин хорошо переносился в обеих дозах.44
При запущенном раке поджелудочной железы куркумин был признан безопасным и хорошо переносимым в клинических испытаниях фазы II, в которых 25 пациентов получали 8 г куркумина в день перорально до прогрессирования заболевания. О токсичности, связанной с приемом куркумина, у пациентов не сообщалось.Подавление экспрессии NF-κB, циклооксигеназы-2 (ЦОГ-2) и pSTAT3 в мононуклеарных клетках периферической крови пациентов наблюдалось после приема куркумина.45 Кроме того, комбинация куркумина с гемцитабином (химиотерапевтический препарат) на поздних стадиях поджелудочной железы рак оценивался в исследовании фазы II.46 Семнадцать пациентов, включенных в исследование, получали 8 г куркумина перорально в день в течение 4 недель; гемцитабин вводили в дозе 1000 мг м (-2 ) три раза в неделю внутривенно.Девять процентов обследованных пациентов показали частичный ответ. Куркумин в дозе 8 г в день в комбинации с гемцитабином хорошо переносился, но эффективность комбинаций казалась умеренной.46
При раке груди доцетаксел — ингибитор микротрубочек — обычно использовался в качестве единственного средства для лечения метастатическое заболевание. Переносимость комбинации доцетаксела и куркумина у пациентов с запущенным и метастатическим раком молочной железы оценивалась в исследовании фазы I.47 В это исследование были включены четырнадцать пациентов, которым вводили 100 мг куркумина -2 в виде 1-часовой внутривенной инфузии каждые 3 недели в течение шести циклов. Куркумин давали перорально, начиная с 0,5 г в день в течение 7 дней подряд в цикле, и увеличивали его до тех пор, пока не возникла ограничивающая дозу токсичность. Рекомендуемая доза куркумина составляла 6 г в день в течение 7 дней подряд каждые 3 недели в сочетании со стандартной дозой доцетаксела.47 Другие клинические испытания все еще продолжаются, чтобы проверить влияние куркумина на болезнь Альцгеймера и радиационно-индуцированный рак груди.
Несмотря на фармакологическую безопасность и эффективность, куркумин еще не одобрен в качестве терапевтического средства. Это может быть связано с одним из его ограничений: плохой биодоступностью. Во-первых, куркумин плохо усваивается; он также быстро метаболизируется и быстро выводится.42 Поэтому были разработаны новые методы улучшения доставки куркумина, которые сейчас проходят испытания на пациентах, включая включение в липосомы или мицеллы.
Ресвератрол
Ресвератрол — это полифенольный антиоксидант, который вырабатывается в различных растениях в ответ на экологический стресс и патогенные атаки ().Ресвератрол был обнаружен в более чем 70 видах растений, включая виноград, ягоды, сливы и арахис.48 Было показано, что он подавляет пролиферацию и индуцирует апоптоз широкого спектра раковых клеток, включая меланому и молочную железу, простату, поджелудочную железу и другие. рак легких.49 В доклинических исследованиях на животных было установлено, что ресвератрол оказывает положительное влияние на различные модели рака и других заболеваний, таких как диабет, артрит, нейродегенеративные и легочные заболевания, а также потеря костной массы.50 In vivo исследования мышей с опухолями молочной железы, индуцированными DMBA (диметилбенз [ a ] антрацен), показали, что добавление ресвератрола в рацион снижает частоту и количество опухолей.51 Лечение ресвератролом снижает в опухолях экспрессию COX-2 , матриксная металлопротеиназа ( MMP-9 ) и NF-κB гены, связанные с ростом и инвазией опухоли. Комбинация ресвератрола с изофлавоном сои, генистеином, была более эффективной, чем любое лечение по отдельности, в уменьшении множественности опухоли.52 В модели ксенотрансплантата у голых мышей ресвератрол подавлял рост опухоли MDA-MB-231, увеличивая апоптоз и снижая ангиогенез .53 В модели рака простаты с использованием трансгенных мышей TRAMP лечение ресвератролом показало противоопухолевую активность за счет увеличения экспрессия рецептора эстрогена-β и за счет снижения уровней инсулиноподобного фактора роста-I.54 Sheth et al. 55 показали, что ресвератрол снижает жизнеспособность и инвазивность клеток PC-3 M-MM2 in vitro и их рост при подкожном введении мышам.Профиль массива микроРНК клеток PC-3 M-MM2, обработанных ресвератролом, показал, что ресвератрол снижает экспрессию miR-21,55, микроРНК, которая, как обнаружено, активируется при ряде видов рака, включая рак простаты. модель рака простаты с ксенотрансплантатом снижает рост опухоли PC-3 M-MM2 и уровни miR-21 в опухолях. Ресвератрол также снижает способность этих клеток метастазировать в легкие.55
Ресвератрол подавляет рост миеломных клеток (RPMI 8226 и OPM-2) in vitro , вызывая их апоптоз.Кроме того, ресвератрол снижает экспрессию рецептора RANK и активацию NF-κB в первичных моноцитах человека ex vivo . Следовательно, ресвератрол предотвращал дифференцировку первичных моноцитов человека в остеокласты, а также их резорбцию, о чем свидетельствует уменьшение ямок резорбции на срезах дентина ex vivo ,57. Кроме того, ресвератрол также оказывает влияние на остеобласты. Когда клетки hMSC-TERT, полученные из мезенхимальных стволовых клеток костного мозга человека, обрабатывали ресвератролом, наблюдалась повышенная экспрессия маркеров остеобластов остеокальцина и остеопонтина.Кроме того, ресвератрол усиливал действие 1,25 (OH) 2 D 3 и индуцировал синергетическое увеличение остеокальцина и остеопонтина. Дополнительные исследования показали, что модификации формулы ресвератрола могут повысить его эффективность. Хотя эти новые аналоги не ингибировали пролиферацию миеломных клеток in vitro , они были до 5000 раз более эффективны в подавлении дифференцировки остеокластов и способствовании созреванию остеобластов. Поскольку в настоящее время не существует эффективных методов лечения для увеличения костеобразования, эти аналоги ресвератрола могут быть особенно полезны для лечения пациентов, страдающих от потери костной массы или низкой костной массы.58
Кроме того, Castillo-Pichardo et al. 59 показали, что полифенолы, извлеченные из красного вина, подавляют рост опухолей в жировой подушке молочной железы мышей, а также развитие метастазов в кости и печень. Эти полифенолы винограда включают такие молекулы, как ресвератрол, кверцетин и катехин, которые составляют около 70% полифенолов в красном вине. Было показано, что они являются наиболее эффективными противоопухолевыми соединениями в красном вине.60 Комбинированные полифенолы винограда индуцировали апоптоз раковых клеток и были более эффективны, чем каждое соединение по отдельности, для ингибирования пролиферации клеток, прогрессирования клеточного цикла и миграции клеток MDA-MB-435 клеток in vitro .59 Кроме того, комбинированные полифенолы винограда подавляли спонтанное развитие метастазов в кости, печень и легкие от флуоресцентного метастатического варианта MDA-MB-435 в кости при инокулировании в жировую подушку молочной железы.59 Хотя это исследование было хорошо проведено, эти результаты необходимо уточнить нюансы, так как остается неясным, от какой формы рака произошли клетки MDA-MD-435.
В настоящее время в Национальном институте здравоохранения проводится несколько клинических испытаний фазы I и фазы II ресвератрола, в основном при сердечно-сосудистых заболеваниях и диабете.Что касается рака, то недавно завершилось клиническое испытание фазы I по изучению фармакологии ресвератрола и его метаболитов у пациентов с колоректальным раком.61 Двадцать пациентов лечили ресвератролом в дозе 0,5 или 1,0 г перед хирургической резекцией. Ресвератрол хорошо переносился, и для достижения антиканцерогенного эффекта были рекомендованы суточные дозы 0,5 или 1,0 г.61 Несмотря на эти интересные результаты, в настоящее время нет клинических испытаний, посвященных влиянию ресвератрола на метастазы в кости.
Галофугинон
Галофугинон представляет собой молекулу, полученную из фебрифугина, природного алкалоида, используемого в традиционной китайской медицине для лечения малярии (). Галофугинон специфически снижает синтез коллагена I типа и обладает антифибротическим, антиангиогенным и антипролиферативным действием.62 Результаты обширных исследований на животных моделях показали, что галофугинон может быть эффективным для лечения рака и фиброзных заболеваний. Галофугинон снижает рост клеток из глиомы 63, мочевого пузыря62 и гепатоцеллюлярной карциномы, 64 опухоли Вильмса, 65 головного мозга, 66 поджелудочной железы67 и рака простаты68 и метастазов в кости из меланомы.69
Галофугинон завершил фазу I клинического исследования у пациентов с развитыми солидными опухолями.70 В этом исследовании 24 пациента с запущенными солидными опухолями лечились возрастающими дозами галофугинона в диапазоне от 0,5 до 3,5 мг в день один или два раза в день перорально. . Максимально переносимая доза составляла 3,5 мг в сутки при тошноте, рвоте и утомляемости. Рекомендуемая доза для постоянного приема составляла 0,5 мг в день при пероральном приеме один раз в день.70 Кроме того, клинические испытания фазы II для местного применения галофугинона при СКВ, связанной со СПИДом, проводились у 26 пациентов в течение 12 недель два раза в день. .71 KS-ответ измеряли локально в поражениях, обработанных галофугиноном, а также экспрессию мРНК коллагена I типа. Экспрессию MMP-2, VEGF и KSHV-LANA (ядерный антиген, связанный с латентным вирусом герпеса, ассоциированный с саркомой Капоши) оценивали иммуногистохимическим методом в залитых парафином биоптатах. Обработка галофугиноном подавляла коллаген I типа в поражениях саркомы KS, но не влияла на MMP-2. У некоторых пациентов наблюдались замедленные противоопухолевые эффекты; однако этому исследованию не хватало статистической мощности, чтобы сделать окончательные выводы об эффективности галофугинона.71
Точный механизм действия галофугинона все еще остается неясным, и галофугинон может воздействовать на несколько сигнальных путей. Галофугинон ингибирует индуцированное TGF-β фосфорилирование белков Smad2 / 3 и увеличивает экспрессию Smad7.72 Кроме того, галофугинон модулирует пути PI3K / Akt и MAPK / ERK, вызывая ингибирование фосфорилирования Smad3.73 В моделях фиброза поджелудочной железы и острого промиелоцита у мышей. лейкоз, лечение галофугиноном увеличивало N-концевое фосфорилирование киназы c-Jun, подавляя передачу сигналов TGF-β и пролиферацию клеток.74 Галофугинон активирует путь аминокислотного голодания in vivo и предотвращает дифференцировку Т-хелперных клеток 17-го типа. 75
В последние годы наша группа исследовала эффекты галофугинона на доклинических моделях костей. метастаз. Недавно мы опубликовали эффекты галофугинона на метастазирование в кости из меланомы.69 Галофугинон ингибировал передачу сигналов TGF-β в клетках меланомы, что продемонстрировано (i) дозозависимым снижением TGF-β —-ответного (CAGA) 9 промотор; (ii) ингибирование фосфорилирования Smad2 / 3, индуцированное TGF-β; (iii) индукция экспрессии Smad7 галофугиноном; и (iv) ингибирование TGF-β-регулируемых генов PTHrP , CTGF , CXCR4 и IL-11 , которые кодируют прометастатические и остеолитические факторы, необходимые для установления и развития метастазов в кости.76 Галофугинон ингибировал пролиферацию клеток меланомы и индуцировал апоптоз in vitro в зависимости от дозы и времени. В модели метастазов в кости у мышей системное лечение галофугиноном уменьшало образование и прогрессирование метастазов меланомы в кости. Гистоморфометрия показала, что галофугинон снижает количество остеокластов на границе опухоль-кость, что может быть связано со снижением экспрессии проостеолитических генов раковыми клетками или из-за прямого действия галофугинона на остеокласты и их предшественники.
Галофугинон также уменьшал метастазирование меланомы в мозг, показывая, что его эффекты не ограничиваются метастазами в кости, в отличие от эффектов других ингибиторов передачи сигналов TGF-β. Таким образом, галофугинон является новым многообещающим препаратом, который можно быстро использовать в клинике для лечения пациентов со злокачественной меланомой и связанными с ней метастазами в кости и другие органы.
Заключение
Современные методы лечения костных метастазов улучшают скелетную болезненность, но не могут вылечить или вызвать регресс уже установленных костных метастазов.Следовательно, необходимы более эффективные методы лечения. Лекарственные растения веками использовались для лечения различных заболеваний, и на их основе было разработано большое количество современных лекарств. Из нынешних противоопухолевых препаратов, имеющихся в продаже в Соединенных Штатах Америки, 60% имеют естественное происхождение. Однако изучение и разработка молекул растительного происхождения — долгий и медленный процесс, и лишь небольшая часть богатого разнообразия растений, существующих на этой планете, была изучена на предмет их фармакологических свойств.Одним из преимуществ использования природных соединений для лечения рака является то, что они являются многоцелевыми агентами. Они могут блокировать более одного сигнального пути. Кроме того, молекулы растительного происхождения можно использовать в сочетании с другими терапевтическими агентами для повышения эффективности лечения и снижения вероятности развития устойчивости к лечению. Таким образом, открытие новых природных соединений, эффективных против резистентных опухолей, является важной стратегией улучшения лечения рака, требующей большего внимания.
Сноски
Автор заявляет об отсутствии конфликта интересов.
Ссылки
- Newman DJ, Cragg GM, Holbeck S, Sausville EA. Натуральные продукты и их производные, поскольку они приводят к мишеням пути клеточного цикла при химиотерапии рака. Цели лекарств от рака Curr 2002; 2: 279–308. [PubMed] [Google Scholar]
- Балунас MJ, Kinghorn AD. Открытие лекарств из лекарственных растений. Life Sci 2005; 78: 431–441. [PubMed] [Google Scholar]
- van Der Heijden R, Jacobs DI, Snoeijer W., Hallard D, Verpoorte R.Алкалоиды Catharanthus : фармакогнозия и биотехнология. Curr Med Chem 2004. 11: 607–628. [PubMed] [Google Scholar]
- Gordaliza M, Castro MA, del Corral JM, Feliciano AS. Противоопухолевые свойства подофиллотоксина и родственных ему соединений. Curr Pharm Des 2000; 6: 1811–1839. [PubMed] [Google Scholar]
- Оберлис Н.Х., Кролл ди-джей. Камптотецин и таксол: исторические достижения в исследовании натуральных продуктов. Джей Нат Прод 2004. 67: 129–135. [PubMed] [Google Scholar]
- Паломбо EA.Фитохимические вещества из традиционных лекарственных растений, используемых при лечении диареи: механизмы действия и влияние на функцию кишечника. Phytother Res 2006; 20: 717–724. [PubMed] [Google Scholar]
- Рудман Г.Д. Механизмы костного метастазирования. N Engl J Med 2004; 350: 1655–1664. [PubMed] [Google Scholar]
- Манди GR. Метастаз в кости: причины, последствия и терапевтические возможности. Нат Рев Рак 2002; 2: 584–593. [PubMed] [Google Scholar]
- Weilbaecher KN, Guise TA, McCauley LK.Рак до костей: смертельное влечение. Нат Рев Рак 2011; 11: 411–425. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ибрагим А., Шер Н., Уильямс Дж., Шридхара Р., Ли Н., Чен Дж. et al. Резюме одобрения золедроновой кислоты для лечения множественной миеломы и метастазов рака в кости. Clin Cancer Res 2003; 9: 2394–2399 2003. [PubMed] [Google Scholar]
- Clezardin P. Потенциальные противораковые свойства бисфосфонатов: выводы из доклинических исследований. Противораковые агенты Med Chem 2012; 12: 102–113.[PubMed] [Google Scholar]
- Clezardin P, Fournier P, Boissier S, Peyruchaud O. In vitro и in vivo противоопухолевые эффекты бисфосфонатов. Curr Med Chem 2003. 10: 173–180. [PubMed] [Google Scholar]
- Woo SB, Hellstein JW, Kalmar JR. Повествовательный [исправленный] обзор: бисфосфонаты и остеонекроз челюстей. Энн Интерн Мед 2006. 144: 753–761. [PubMed] [Google Scholar]
- Перацелла М.А., Марковиц Г.С. Нефротоксичность бисфосфонатов. Почка Int 2008. 74: 1385–1393.[PubMed] [Google Scholar]
- Сандур С.К., Пандей М.К., Сун Б., Аггарвал Б.Б. 5-Гидрокси-2-метил-1,4-нафтохинон, аналог витамина K3, подавляет путь активации STAT3 за счет индукции протеинтирозинфосфатазы, SHP-1: потенциальная роль в хемосенсибилизации. Мол Рак Res 2010. 8: 107–118. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hsu YL, Cho CY, Kuo PL, Huang YT, Lin CC. Плумбагин (5-гидрокси-2-метил-1,4-нафтохинон) индуцирует апоптоз и остановку клеточного цикла в клетках A549 за счет накопления p53 посредством фосфорилирования c-Jun Nh3-терминальной киназой по серину 15 in vitro и in vivo. .J Pharmacol Exp Ther 2006; 318: 484–494. [PubMed] [Google Scholar]
- Ману К.А., Шанмугам М.К., Раджендран П., Ли Ф., Рамачандран Л., Хей Х.С. et al. Плумбагин подавляет инвазию и миграцию клеток рака груди и желудка, подавляя экспрессию хемокинового рецептора CXCR4. Молочный рак 2011; 10: 107. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sand JM, Bin Hafeez B, Jamal MS, Witkowsky O, Siebers EM, Fischer J et al. Плумбагин (5-гидрокси-2-метил-1,4-нафтохинон), выделенный из Plumbago zeylanica , подавляет вызванное ультрафиолетовым излучением развитие плоскоклеточного рака.Канцерогенез 2012; 33: 184–190. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sun J, McKallip RJ. Лечение плюмбагином приводит к апоптозу лейкозных клеток человека K562 за счет увеличения ROS и повышенной экспрессии рецептора TRAIL. Leuk Res 2011; 35: 1402–1408. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Padhye S, Dandawate P, Yusufi M, Ahmad A., Sarkar FH. Перспективы лечебных свойств плюмбагина и его аналогов. Med Res Rev 2012; 32: 1131–1158. [PubMed] [Google Scholar]
- Sinha S, Pal K, Elkhanany A, Dutta S, Cao Y, Mondal G et al. Плумбагин подавляет онкогенез и ангиогенез клеток рака яичников in vivo . Int J Рак 2013; 132: 1201–1212. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Chen CA, Chang HH, Kao CY, Tsai TH, Chen YJ. Плумбагин, выделенный из Plumbago zeylanica , вызывает гибель клеток через апоптоз в клетках рака поджелудочной железы человека. Панкреатология 2009; 9: 797–809. [PubMed] [Google Scholar]
- Shieh JM, Chiang TA, Chang WT, Chao CH, Lee YC, Huang GY et al. Плумбагин ингибирует TPA-индуцированную экспрессию MMP-2 и u-PA за счет снижения связывающей активности NF-kappaB и AP-1 через сигнальный путь ERK в клетках рака легкого человека A549. Mol Cell Biochem 2010; 335: 181–193. [PubMed] [Google Scholar]
- Hafeez BB, Zhong W, Fischer JW, Mustafa A, Shi X, Meske L et al. Плумбагин, лекарственное растение ( Plumbago zeylanica ) -производный 1,4-нафтохинон, ингибирует рост и метастазирование клеток М-люциферазы рака предстательной железы человека PC-3 в модели ортотопических мышей с ксенотрансплантатом.Мол Онкол 2013; 7: 428–439. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Srinivas P, Gopinath G, Banerji A, Dinakar A, Srinivas G. Плумбагин индуцирует активные формы кислорода, которые опосредуют апоптоз в клетках рака шейки матки человека. Мол карциног 2004. 40: 201–211. [PubMed] [Google Scholar]
- Фарруджа А.Н., Аткинс Г.Дж., То LB, Пан Б., Хорват Н., Костакис П. et al. Активатор рецептора экспрессии ядерного фактора-лиганда kappaB клетками миеломы человека опосредует образование остеокластов in vitro и коррелирует с разрушением костей in vivo .Рак Res 2003; 63: 5438–5445. [PubMed] [Google Scholar]
- Бхатиа П., Сандерс М.М., Хансен М.Ф. Экспрессия активатора рецептора ядерного фактора-каппаВ обратно коррелирует с метастатическим фенотипом при карциноме молочной железы. Clin Cancer Res 2005. 11: 162–165. [PubMed] [Google Scholar]
- Сунг Б., Ойаджоби Б., Аггарвал Б.Б. Плумбагин подавляет остеокластогенез и снижает остеолитические метастазы в кости у мышей, вызванные раком груди, за счет подавления передачи сигналов RANKL. Мол Рак Тер 2012; 11: 350–359.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sandur SK, Ichikawa H, Sethi G, Ahn KS, Aggarwal BB. Плумбагин (5-гидрокси-2-метил-1,4-нафтохинон) подавляет активацию NF-kappaB и регулируемые NF-kappaB генные продукты посредством модуляции активации киназы p65 и IkappaBalpha, что приводит к усилению апоптоза, индуцированного цитокинами и химиотерапевтическими агентами. J Biol Chem 2006; 281: 17023–17033. [PubMed] [Google Scholar]
- Kini DP, Pandey S, Shenoy BD, Singh UV, Udupa N, Umadevi P et al. Противоопухолевое и противозачаточное действие препаратов с контролируемым высвобождением плюмбагина. Индийский J Exp Biol 1997. 35: 374–379. [PubMed] [Google Scholar]
- Маруяма Ю., Курибара Х., Морита М., Юдзурихара М., Вайнтрауб С.Т. Идентификация магнолола и гонокиола как анксиолитических агентов в экстрактах сайбоку-то, восточного фитотерапевтического средства. Джей Нат Прод 1998. 61: 135–138. [PubMed] [Google Scholar]
- Woodbury A, Yu SP, Wei L, Garcia P. Нейромодулирующие эффекты гонокиола: обзор. Фронт Neurol 2013; 4: 130.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гривенников С.И., Карин М. Опасные связи: сотрудничество STAT3 и NF-kappaB и перекрестные помехи при раке. Фактор роста цитокинов Rev 2010; 21: 11–19. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Bollrath J, Greten FR. Пути IKK / NF-kappaB и STAT3: центральные сигнальные узлы в опосредованном воспалением продвижении опухоли и метастазировании. EMBO Rep 2009. 10: 1314–1319. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Линь С.И., Лю Дж.Д., Чанг Х.С., Йе С.Д., Линь СН, Ли В.С.Магнолол подавляет пролиферацию культивируемых клеток рака толстой кишки и печени человека, подавляя синтез ДНК и активируя апоптоз. J Cell Biochem 2002; 84: 532–544. [PubMed] [Google Scholar]
- Shigemura K, Arbiser JL, Sun SY, Zayzafoon M, Johnstone PA, Fujisawa M et al. Хонокиол, натуральный растительный продукт, подавляет метастатический рост клеток рака простаты человека. Рак 2007; 109: 1279–1289. [PubMed] [Google Scholar]
- Аггарвал Б.Б., Сунг Б. Фармакологические основы роли куркумина при хронических заболеваниях: старинная специя с современными целями.Тенденции Pharmacol Sci 2009. 30: 85–94. [PubMed] [Google Scholar]
- Нагпал М., Суд С. Роль куркумина в системном здоровье и здоровье полости рта: обзор. J Nat Sci Biol Med 2013; 4: 3–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сингх С. От экзотических специй до современных наркотиков? Клетка 2007. 130: 765–768. [PubMed] [Google Scholar]
- Wilken R, Veena MS, Wang MB, Srivatsan ES. Куркумин: обзор противораковых свойств и терапевтической активности при плоскоклеточном раке головы и шеи.Молочный рак 2011; 10: 12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Bharti AC, Takada Y, Aggarwal BB. Куркумин (диферулоилметан) ингибирует активатор рецептора индуцированной лигандом NF-каппа B активации NF-каппа B в предшественниках остеокластов и подавляет остеокластогенез. J Immunol 2004. 172: 5940–5947. [PubMed] [Google Scholar]
- Райт Л. Е., Фрай Дж. Б., Люкефар А. Л., Тиммерманн Б. Н., Мохаммад К. С., Гиз Т. А. et al. Куркуминоиды блокируют передачу сигналов TGF-бета в клетках рака груди человека и ограничивают остеолиз на мышиной модели метастазов рака груди в кости.Джей Нат Прод 2013; 76: 316–321. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шарма Р.А., Стюард В.П., Гешер А.Дж. Фармакокинетика и фармакодинамика куркумина. Adv Exp Med Biol 2007; 595: 453–470. [PubMed] [Google Scholar]
- Carroll RE, Benya RV, Turgeon DK, Vareed S, Neuman M, Rodriguez L et al. Фаза IIa клинических испытаний куркумина для профилактики колоректальной неоплазии. Cancer Prev Res (Phila) 2011; 4: 354–364. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dhillon N, Aggarwal BB, Newman RA, Wolff RA, Kunnumakkara AB, Abbruzzese JL et al. Фаза II испытания куркумина у пациентов с распространенным раком поджелудочной железы. Clin Cancer Res 2008; 14: 4491–4499. [PubMed] [Google Scholar]
- Канаи М., Йошимура К., Асада М., Имаидзуми А., Судзуки К., Мацумото С. et al. Исследование фазы I / II химиотерапии на основе гемцитабина плюс куркумин для пациентов с гемцитабин-резистентным раком поджелудочной железы. Рак Chemother Pharmacol 2011. 68: 157–164. [PubMed] [Google Scholar]
- Bayet-Robert M, Kwiatkowski F, Leheurteur M, Gachon F, Planchat E, Abrial C et al. Фаза I исследования повышения дозы доцетаксела плюс куркумин у пациентов с запущенным и метастатическим раком молочной железы. Рак Biol Ther 2010; 9: 8–14. [PubMed] [Google Scholar]
- Баур Дж. А., Синклер Д. А.. Терапевтический потенциал ресвератрола: данные in vivo . Nat Rev Drug Discov 2006; 5: 493–506. [PubMed] [Google Scholar]
- Сайко П., Сакмари А., Джегер В., Секерес Т. Ресвератрол и его аналоги: защита от рака, ишемической болезни сердца и нейродегенеративных заболеваний или просто причуда? Mutat Res 2008; 658: 68–94.[PubMed] [Google Scholar]
- Бишай А. Профилактика и лечение рака ресвератролом: от исследований на грызунах до клинических испытаний. Cancer Prev Res (Phila) 2009; 2: 409–418. [PubMed] [Google Scholar]
- Банерджи С., Буэсо-Рамос С., Аггарвал Б.Б. Подавление 7,12-диметилбенз ( a ) антрацен-индуцированного канцерогенеза молочной железы у крыс ресвератролом: роль ядерного фактора-каппаB, циклооксигеназы 2 и матриксной металлопротеиназы 9. Cancer Res 2002; 62: 4945–4954. [PubMed] [Google Scholar]
- Whitsett T, Carpenter M, Lamartiniere CA.Ресвератрол, но не EGCG, в рационе подавляет вызванный DMBA рак молочной железы у крыс. J Carcinog 2006; 5: 15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гарвин С., Оллингер К., Даброзин С. Ресвератрол индуцирует апоптоз и ингибирует ангиогенез в ксенотрансплантатах рака груди человека in vivo . Рак латыш 2006; 231: 113–122. [PubMed] [Google Scholar]
- Harper CE, Patel BB, Wang J, Arabshahi A, Eltoum IA, Lamartiniere CA. Ресвератрол подавляет прогрессирование рака простаты у трансгенных мышей.Канцерогенез 2007; 28: 1946–1953. [PubMed] [Google Scholar]
- Sheth S, Jajoo S, Kaur T., Mukherjea D, Sheehan K, Rybak LP et al. Ресвератрол снижает рост и метастазирование рака простаты, ингибируя путь Akt / MicroRNA-21. PLoS ONE 2012; 7: e51655. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Selcuklu SD, Donoghue MT, Spillane C. miR-21 как ключевой регулятор онкогенных процессов. Биохим Соц Транс 2009; 37: (Часть 4): 918–925. [PubMed] [Google Scholar]
- Буасси П., Андерсен Т.Л., Абдалла Б.М., Кассем М., Плеснер Т., Делесс Дж. М..Ресвератрол подавляет рост миеломных клеток, предотвращает образование остеокластов и способствует дифференцировке остеобластов. Рак Res 2005; 65: 9943–9952. [PubMed] [Google Scholar]
- Куписевич К., Буасси П., Абдалла Б.М., Хансен Ф. Д., Эрбен Р. Г., Савуре Дж. Ф. et al. Возможности аналогов ресвератрола в качестве антагонистов остеокластов и промоторов остеобластов. Calcif Tissue Int 2010. 87: 437–449. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Castillo-Pichardo L, Martinez-Montemayor MM, Martinez JE, Wall KM, Cubano LA, Dharmawardhane S.Подавление роста опухоли молочной железы и метастазов в кости и печень диетическими полифенолами винограда. Clin Exp Метастаз 2009. 26: 505–516. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Хакимуддин Ф., Палият Дж., Меклинг К. Селективная цитотоксичность флавоноидной фракции красного винограда в отношении клеток MCF-7. Лечение рака груди Res 2004. 85: 65–79. [PubMed] [Google Scholar]
- Патель К. Р., Браун В. А., Джонс Д. Д., Бриттон Р. Г., Хемингуэй Д., Миллер А. С. et al. Клиническая фармакология ресвератрола и его метаболитов у больных колоректальным раком.Рак Res 2010; 70: 7392–7399. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Elkin M, Miao HQ, Nagler A, Aingorn E, Reich R, Hemo I. et al. Галофугинон: мощный ингибитор критических этапов развития ангиогенеза. FASEB J 2000; 14: 2477–2485. [PubMed] [Google Scholar]
- Абрамович Р., Дафни Х., Ниман М., Наглер А., Пайнс М. Подавление неоваскуляризации и роста опухоли и облегчение заживления ран с помощью галофугинона, ингибитора синтеза коллагена I типа.Неоплазия 1999; 1: 321–329. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Nagler A, Ohana M, Shibolet O, Shapira MY, Alper R, Vlodavsky I. et al. Подавление роста гепатоцеллюлярной карциномы у мышей алкалоидом кокцидиостатом галофугиноном. Eur J Рак 2004. 40: 1397–1403. [PubMed] [Google Scholar]
- Pinthus JH, Sheffer Y, Nagler A, Fridman E, Mor Y, Genina O et al. Ингибирование прогрессирования ксенотрансплантата опухоли Вильмса галофугиноном сопровождается активацией экспрессии гена WT-1.Дж Урол 2005; 174: (Часть 2): 1527–1531. [PubMed] [Google Scholar]
- Абрамович Р., Ицик А., Харел Х, Наглер А., Влодавский И., Сигал Т. Галофугинон подавляет ангиогенез и рост в имплантированной модели метастатической опухоли головного мозга крысы — исследование МРТ. Неоплазия 2004. 6: 480–489. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Spector I, Honig H, Kawada N, Nagler A, Genin O, Pines M. Ингибирование активации звездчатых клеток поджелудочной железы галофугиноном предотвращает развитие опухоли ксенотрансплантата поджелудочной железы.Поджелудочная железа 2010; 39: 1008–1015. [PubMed] [Google Scholar]
- Гавиш З., Пинтус Дж. Х., Барак В., Рамон Дж., Наглер А., Эшхар З. et al. Подавление роста ксенотрансплантатов рака простаты галофугиноном. Простата 2002. 51: 73–83. [PubMed] [Google Scholar]
- Хуарес П., Мохаммад К.С., Инь Дж. Дж., Фурнье П. Г., МакКенна Р. К., Дэвис Х. У. et al. Галофугинон подавляет образование и прогрессирование метастазов меланомы в кости. Рак Res 2012. 72: 6247–6256. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Де Йонге MJ, Dumez H, Verweij J, Yarkoni S, Snyder D, Lacombe D et al. Фаза I и фармакокинетическое исследование галофугинона, производного хиназолинона для перорального применения, у пациентов с запущенными солидными опухолями. Eur J Рак 2006; 42: 1768–1774. [PubMed] [Google Scholar]
- Кун Х. Б., Финглтон Б., Ли Дж. Й., Гейер Дж. Т., Сезарман Э., Париз Р. А. et al. Фаза II исследования злокачественных новообразований, вызванных СПИДом, галофугинона для местного применения при саркоме Капоши, связанной со СПИДом. Синдр иммунодефицита J Acquir 2011; 56: 64–68. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Xavier S, Piek E, Fujii M, Javelaud D, Mauviel A, Flanders KC et al. Улучшение радиационно-индуцированного фиброза: ингибирование передачи сигналов трансформирующего фактора роста-бета галофугиноном. J Biol Chem 2004; 279: 15167–15176. [PubMed] [Google Scholar]
- Roffe S, Hagai Y, Pines M, Halevy O. Галофугинон ингибирует фосфорилирование Smad3 через пути PI3K / Akt и MAPK / ERK в мышечных клетках: влияние на слияние мышечных трубок. Exp Cell Res 2010; 316: 1061–1069. [PubMed] [Google Scholar]
- de Figueiredo-Pontes LL, Assis PA, Santana-Lemos BA, Jacomo RH, Lima AS, Garcia AB et al. Галофугинон оказывает антипролиферативное действие при остром промиелоцитарном лейкозе, модулируя сигнальный путь трансформирующего фактора роста бета. PLoS ONE 2011; 6: e26713. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sundrud MS, Koralov SB, Feuerer M, Calado DP, Kozhaya AE, Rhule-Smith A et al. Галофугинон подавляет дифференцировку клеток Th27, активируя реакцию аминокислотного голодания. Наука 2009. 324: 1334–1338. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kang Y, Siegel PM, Shu W, Drobnjak M, Kakonen SM, Cordon-Cardo C et al. Мультигенная программа, опосредующая метастазирование рака груди в кость. Раковая клетка 2003; 3: 537–549. [PubMed] [Google Scholar]
Лечение, осложнения и исходы метастатического поражения позвоночника: от Патчелла до PROMIS
Чтобы понять методы лечения метастазов в позвоночник, нужно понимать преимущества и ограничения медицинского лечения, лучевой терапии и хирургическое лечение. На практике эти методы чаще всего используются вместе, а не по отдельности.
Медицинское обслуживание
Химиотерапия обычно используется для длительного контроля метастазов в позвоночнике. Его реже используют в качестве монотерапии, за исключением случаев, когда метастазы возникают из очень чувствительных к химиотерапии опухолей, таких как лимфома, семинома или нейробластома. Чаще химиотерапия используется в качестве адъювантной терапии с лучевой терапией (ЛТ) или с операцией плюс ЛТ. Конкретный используемый химиотерапевтический агент зависит от гистологии и других характеристик опухоли (4-6).
Кортикостероиды также являются основой лечения метастазов в позвоночник и, как считается, помогают облегчить вазогенный отек и уменьшить воспаление, что особенно полезно при метастазах, вызывающих компрессию спинного мозга (7).Более того, стероиды могут оказывать прямое цитотоксическое действие на определенные гематологические злокачественные новообразования (миелому и лимфому) и, иногда, на рак груди (5,6). Точных рекомендаций по применению стероидов при метастазах в позвоночник не существует; дозировка обычно определяется на индивидуальной основе. Прошлые испытания рекомендовали как использование минимально возможных доз стероидов, так и лечение высокими дозами стероидов (особенно, когда лечение также включает ЛТ) (5,7). Временные улучшения в передвижении могут наблюдаться после начала приема стероидов, и некоторые пациенты могут продолжать принимать стероиды в течение длительного времени для уменьшения боли (6,7).
Лучевая терапия
Традиционно лучевая терапия была основным методом лечения метастазов в позвоночник. Даже сегодня, когда появляется все больше данных, подтверждающих важность хирургического вмешательства как части лечения, лучевая терапия остается важнейшим компонентом общего алгоритма лечения. Основная цель лучевой терапии, как правило, заключается в уменьшении боли при метастазах, хотя ее также можно использовать для достижения местного контроля для лечения или предотвращения неврологических последствий сдавления спинного мозга (6,8).
ЛТ можно вводить с помощью традиционной дистанционной лучевой терапии (ДЛТ), стереотаксической лучевой терапии тела (SBRT) или стереотаксической радиохирургии позвоночника (SRS), в зависимости от целей лечения пациента или других специфических для пациента факторов (4,5 , 8).
ДЛТ, наиболее распространенная форма лучевой терапии, обычно является первой линией лечения метастазов в позвоночник. Единая стандартная доза облучения окончательно не установлена и часто зависит от радиочувствительности подтипа опухоли. Наиболее распространены режимы 8 Гр для одной фракции, 20 Гр для 5 фракций и 30 Гр для 10 фракций (8). Прошедшие испытания, посвященные изучению эффективности многокомпонентного RT с более высокими дозами по сравнению с . однократная ЛТ с низкой дозой дала смешанные результаты.В метаанализе 25 исследований RT для выявления метастазов в кости Chow et al. (9) не обнаружил значительных различий в степени обезболивания между режимами однократной лучевой терапии 8 Гр и многократной фракцией 20–30 Гр, хотя частота повторного лечения была выше в группе однократной фракции. Многофракционная ЛТ с более высокими дозами может дать лучшие результаты по сравнению с однократной ЛТ с низкой дозой, но это также зависит от гистологии опухоли (4,8). ДЛТ в дозе 30 Гр в 10 фракциях может обеспечить эффективный локальный контроль некоторых метастазов, таких как лимфома, миелома, рак груди, рак простаты и герминома (8).Таким образом, такой протокол обычно используется при метастазах в позвоночник. Однако для радиорезистентных опухолей, таких как саркомы, колоректальный рак, злокачественная меланома и почечно-клеточная карцинома, показатели местного контроля не достигают 50% при этой дозировке (8). В отношении этих опухолей появляется все больше данных о том, что более высокие дозы облучения, например 40 Гр на 20 фракций, могут дать лучшие показатели контроля (4,8).
SBRT и SRS — это более новые целевые методы лучевой терапии, которые могут фокусировать большее количество радиации на опухоли, одновременно снижая радиационную токсичность для окружающих тканей (10,11).SBRT можно давать в 2–5 долях; SRS часто назначается однократно. Идеальная доза облучения и график для SBRT и SRS менее согласованы по сравнению с EBRT. Тем не менее, поскольку эти формы лучевой терапии могут доставлять более концентрированную дозу радиации, их количество может быть в три раза выше, чем при ДЛТ, что приводит к улучшению местного контроля (4,10,11). Действительно, по сравнению с ДЛТ, эта более высокая достижимая доза облучения делает этот метод ЛТ менее зависимым от радиочувствительности / радиорезистентности опухоли, чтобы облегчить бремя болезни (4).Вопрос о том, когда использовать SBRT или SRS вместо EBRT в качестве лечения первой линии, активно исследуется. Также изучается роль лучевой терапии тяжелыми частицами, такой как протонная лучевая терапия или терапия ионами углерода при метастазах в позвоночник. По этой теме необходимо значительно больше исследований, но предполагаемые преимущества такой лучевой терапии будут сродни SBRT или SRS (более высокие дозы облучения с меньшим повреждением окружающих тканей) (12).
Хирургия
Хирургия теперь признана неотъемлемым компонентом лечения метастазов в позвоночник.Его можно использовать по нескольким причинам: для устранения неврологических симптомов сдавления спинного мозга, для стабилизации нестабильности позвоночника, для уменьшения боли, для удаления эпидуральной опухоли перед SBRT или SRS и для обеспечения гистологического диагноза опухоли (см., Например) (4, 6).
Предоперационная полноразмерная и грудная латеральная плоская пленка (A), сагиттальная МРТ T2 (B, слева), аксиальная МРТ T2 (B, правая верхняя часть) и аксиальная КТ (B, правая нижняя часть), а также послеоперационная AP и латеральная полная Простые снимки длины (C) 47-летней женщины с метастатическим раком груди.У пациента компрессионный перелом T10 с компрессией спинного мозга, что привело к боли в средней части спины и грудной миелопатии. Была проведена операция по декомпрессии спинного мозга и стабилизации для уменьшения боли.
Новый акцент на важности хирургии метастазов в позвоночник появился в последние 10–15 лет после плодотворного исследования 2005 г., проведенного Patchell et al. (3), в котором представлены данные проспективного рандомизированного контролируемого исследования, подтверждающие использование декомпрессивной хирургии для таких пациентов.В этом исследовании пациенты с метастазами в позвоночник были рандомизированы для получения хирургического вмешательства (n = 50) с последующей лучевой терапией или только лучевой терапии (n = 51). Статистически значимая разница в средней выживаемости наблюдалась между двумя группами: пациенты, перенесшие операцию с последующей лучевой терапией, выжили 126 дней по сравнению со 100 днями в группе, получавшей только лучевую терапию (P = 0,033). Кроме того, неврологическое функционирование, как определено по шкалам ASIA и Frankel, сохранялось в среднем в течение 566 дней в группе хирургии и лучевой терапии против .72 дня в группе, получавшей только RT (P = 0,001 для ASIA и P = 0,0006 для Frankel). Способность ходить была значительно продлена у пациентов, перенесших операцию и лучевую терапию, а не только лучевую терапию (122 против .13 дней; P = 0,003), и большее количество пациентов, которые не могли передвигаться в начале исследования, восстановили способность ходить после хирургия и лучевая терапия по сравнению только с лучевой терапией (62% и 19% соответственно; P = 0,01). Воздержание было значительно более длительным (P = 0,016) и значительно меньшими дозами кортикостероидов (P = 0.0093) и опиоидные анальгетики (P = 0,002) требовались в группе, перенесшей операцию. Операция не привела к длительной госпитализации. Несмотря на критику в отношении того, что из исследования были исключены высокочувствительные опухоли и низкий уровень охвата, оно предоставило убедительные доказательства преимуществ хирургического вмешательства. Действительно, из-за заметно лучших результатов в хирургической группе это исследование было прервано досрочно.
Следуя Патчеллу et al. существует множество литературы, иллюстрирующей аналогичные преимущества хирургии (6,13-22).Исследование Ibrahim et al. (18) помогли подтвердить результаты исследования Патчелла. В этом проспективном исследовании изучались результаты у 223 пациентов, перенесших операцию с лучевой терапией и / или химиотерапией или без нее по поводу метастазов эпителиального происхождения в позвоночник. После операции средняя выживаемость составила 11,7 месяцев, у 71% пациентов уменьшилась боль, у 53% восстановилось или сохранилось передвижение, а у 39% восстановилось удержание мочи. Как отметили авторы, эти результаты выгодно отличались от наиболее положительных результатов лечения пациентов, получавших только лучевую терапию (23).Фаликов и др. (16) в исследовании 85 пациентов, перенесших операцию по поводу метастазов в позвоночник, пришел к выводу, что операция привела к статистически значимому снижению уровня боли (P <0,00001) и улучшению качества жизни, о котором сообщали пациенты, через 6 недель (P = 0,017). ), 3 месяца (P = 0,039) и 6 месяцев (P = 0,013) с низким уровнем осложнений. Thomas et al. (24) использовал данные исследования Patchell и изучил экономическую эффективность операции и лучевой терапии по сравнению с одной лучевой терапией при метастазах в позвоночник.Эти исследователи определили, что операция в сочетании с лучевой терапией была рентабельной как с точки зрения затрат на дополнительный день передвижения, так и с точки зрения затрат на увеличенный год жизни.
Хотя хирургическое вмешательство в настоящее время является ключевым аспектом лечения метастазов в позвоночник, одно только хирургическое вмешательство почти всегда оказывается паллиативным. Выбор операции должен зависеть от целей пациента в отношении лечения, количества и расположения метастазов и других индивидуальных характеристик пациента (4-6,22). Для достижения оптимальных результатов хирургическое вмешательство должно быть выполнено как можно скорее после диагностики метастазов (25).Поскольку ее преимущества не сразу проявляются, операция наиболее эффективна, когда ожидаемая продолжительность жизни пациента превышает 8–12 недель и когда риски перевешиваются потенциальными улучшениями (6,26). Иногда было показано, что агрессивная резекция метастазов посредством резекции en bloc позволяет достичь высоких показателей локального контроля, но это не полностью исключает возможность появления метастазов в будущем и является наиболее эффективным для пациентов с единичным метастазом (4-6,21). Более того, у многих пациентов есть нестабильность позвоночника, плохой неврологический статус или цели лечения, которые позволяют избежать резекции en bloc , и эти процедуры сопровождаются относительно высокой заболеваемостью (6,21).Если резекция en bloc невозможна (5,19,27), можно использовать дебулкинг (когда опухоль резецируется частями) или паллиативный (когда цель состоит в первую очередь в уменьшении компрессии спинного мозга). Стабилизация может выполняться для устранения нестабильности позвоночника с декомпрессией или без нее. Для долгосрочной стабилизации часто используются инструменты, так как часто высока вероятность того, что позвоночник не срастется должным образом вокруг участков метастазов из-за больших разрывов в костных структурах, местного разрушения кости опухолью и лучевой терапии и / или системной терапии. , которые могут помешать процессу синтеза (см. например).Мы выступаем за использование костного трансплантата или заменителя костного трансплантата для содействия сращению, потому что слияние возможно у этих пациентов, несмотря на неблагоприятные обстоятельства.
Предоперационный снимок бокового плана и T1 МРТ (A), латеральная и корональная компьютерная томография (B), а также послеоперационные AP и боковые плоские снимки 66-летнего мужчины с метастатическим раком мочевого пузыря, у которого были затрудненное дыхание и прогрессирующий уровень C5 слабость после 3 дней XRT. Большой разрыв в передней кости, литическая опухоль и XRT могут способствовать снижению вероятности слияния у этого пациента.XRT, рентгеновская техника.
Цементное наращивание тел позвонков также продемонстрировало свою эффективность, особенно у пациентов с опухолями переднего отдела позвоночника (4-6,19). Использование цемента с помощью винтов с отверстиями является новой тенденцией, которая может оказаться столь же полезной для механического укрепления спинномозговых конструкций в кости, которая была патологически ослаблена опухолью (28,29). Декомпрессия позвоночника может осуществляться через передний или задний доступ, при этом в литературе нет единого мнения о том, какой из подходов лучше (13,30).Недавно было показано, что малоинвазивная хирургия позвоночника является безопасным и эффективным методом декомпрессии и стабилизации позвоночника, который может улучшить функциональные результаты и качество жизни (31-33).
Поскольку хирургическое вмешательство само по себе, вероятно, не решит достаточного количества опухолевой нагрузки, оно часто используется в сочетании с пред- и / или послеоперационной лучевой терапией. Исследования показывают, что интервал между операцией и лучевой терапией должен составлять 1-2 недели как до, так и после операции, чтобы избежать послеоперационных осложнений (34,35).
Разделительная хирургия — это новый подход, при котором выполняется декомпрессия позвоночника для создания благоприятного отверстия в опухоли, через которое SBRT или SRS могут доставить более целевую дозу радиации (8,30,36). Существует ряд подходов, которые можно использовать для хирургии отделения, но транспедикулярный доступ представляется безопасным и наиболее универсальным методом для широкого диапазона локализаций опухоли (4). Показания к послеоперационной лучевой терапии все еще остаются предметом дискуссий (37).Предыдущий анализ полезности затрат, проведенный Furlan et al. (38) пришел к выводу, что, хотя операция в сочетании с лучевой терапией была дороже, эта комбинация также давала лучшие результаты по сравнению с одной лучевой терапией.
Кифопластика или вертебропластика — более консервативные методы лечения, которые могут использоваться в первую очередь для снятия боли после компрессионных переломов. Эти методы лечения также могут помочь обеспечить стабильность позвоночника в условиях литического метастатического заболевания, особенно у пациентов с передней нестабильностью позвоночника и тех, кто подвергается лучевой терапии (19).
Альтернативные варианты лечения рака позвоночника в Мексике
О раке позвоночника
Рак позвоночника — это скопление аномальных клеток, которые образуют злокачественные опухоли спинного мозга и позвонков. Крайне редко злокачественные опухоли возникают в спинном мозге. Большинство из них — это метастатические или вторичные раковые заболевания, распространившиеся на эту область.
Где находится рак позвоночника?
Спинной мозг соединяется с головным мозгом и имеет пучки длинных нервных волокон, которые посылают сигналы, управляющие телом.Опухоли позвоночника обычно отличаются от онкологических больных детей до взрослых больных раком. Они возникают в разных областях, возникают из других типов клеток и могут потребовать альтернативного лечения. В обоих случаях рак никогда не распространяется из этих участков ткани.
Существуют ли разные типы рака позвоночника?
Существует несколько различных типов рака позвоночника, в том числе:
- Глиомы — Опухоли, начинающиеся в глиальных клетках.
- Астроцитомы — Опухоли, которые растут в глиальных клетках определенного типа, называемых астроцитами.
- Олигодендроглиомы — Опухоли, которые начинаются в глиальных клетках головного мозга и называются олигодендроцитами.
- Эпендимомы — Опухоли в эпендимных клетках, выстилающих желудочки.
- Менингиомы — Рак, который начинается в слое тканей (мозговых оболочек), окружающих головной и спинной мозг.
- Медуллобластомы — Рак, который возникает в нейроэктодермальных клетках мозжечка.
Статистика рака позвоночника
Менее 1% всех людей разовьется рак позвоночника в сочетании с образованием метастатических опухолей позвоночника.Основываясь на клинических исследованиях и испытаниях, Американское онкологическое общество оценивает, что примерно у 24 000 американцев диагностирована злокачественная опухоль спинного или головного мозга.
Причины и факторы риска
В отличие от других форм рака, метастатические опухоли в позвоночный канал редко возникают или усугубляются действиями или поведением человека. Факторы риска включают:
- Облучение — Обычно лучевая терапия предназначена для лечения другой формы рака.
- Семейный анамнез — Рак позвоночника, хотя и редко, может передаваться в семейный генетический пул.
- Болезнь фон Гиппеля-Линдау — Люди с этим заболеванием предрасположены к развитию как доброкачественных, так и злокачественных опухолей.
- Синдромы — Синдром Ли-Фраумени, синдром Горлина, синдром Тюрко и синдром Каудена увеличивают риск опухолей, возникающих на позвоночнике и позвоночнике.
Раннее обнаружение раковых клеток, диагностика и определение стадии
Признаки и симптомы рака малого позвоночника
Симптомы рака головного и спинного мозга обычно связаны с внутричерепным давлением.Хотя они могут варьироваться в зависимости от пациента, признаки и симптомы, о которых вам следует знать, включают:
- Проблемы с балансом
- Изменение поведения
- Затуманенное зрение
- Кома
- Сонливость
- Головная боль
- Тошнота
- Изменение личности
- Изъятия
- Рвота
Различные стадии рака позвоночника
Поскольку опухоли спинного мозга никогда не распространяются, они не разделяют стадию других видов рака.Вместо этого существуют факторы, которые онкологи будут учитывать при лечении рака, в том числе:
- Возраст пациента
- Насколько сильно опухоль влияет на физическую активность, функцию мозга и качество жизни
- Тип опухоли
- Уровень опухоли
- Имеются ли в опухолевых клетках генетические мутации
- Расположение опухоли и размер опухоли по данным компьютерной томографии
Альтернативные / естественные варианты лечения рака позвоночника
Сегодня в центре внимания исследований в области лечения рака отходит от традиционных методов лечения к альтернативным методикам.В отличие от химиотерапии, доз облучения или даже минимально инвазивной хирургии, наши онкологи предлагают планы нехирургического лечения, чтобы предотвратить дальнейшее повреждение организма. В Центре терапии иммунитета мы лечим наших пациентов с помощью тщательно разработанного плана альтернативных методов лечения, которые призваны укрепить иммунную систему и помочь организму в борьбе с этими безжалостными раковыми клетками. В отличие от химиотерапии, эти методы лечения не разрушают организм.
Доктор Баутиста начинает с консультации с пациентами.Он проводит тщательный анализ, а затем составляет индивидуальный план лечения, основанный на вашем типе рака, признаках, симптомах и многом другом. После этого пациентам назначается врач, который ежедневно встречается с ними, чтобы контролировать эффективность лечения и соответствующим образом корректировать процессы, чтобы качество их жизни оставалось приоритетом даже в борьбе с опухолевыми клетками.
В ITC мы стремимся предоставить нашим пациентам безопасный и естественный способ эффективно бороться с раком. Если у вас или у кого-то, кого вы любите, рак позвоночника, мы рекомендуем вам обратиться к врачу и назначить консультацию.
Вместе мы победим.
Источники:
Используемые нами методы лечения
Доктор Карлос Баутиста является сертифицированным врачом. Он получил медицинскую степень в Автономном университете Нижней Калифорнии и имеет более чем 20-летний опыт работы в области альтернативной медицины для лечения рака, аутоиммунных заболеваний, хронических дегенеративных заболеваний и инфекционных заболеваний. Он открыл Центр иммунотерапии в 2007 году с целью оказания высококачественной медицинской помощи более чем 5000 пациентам.
В Центре терапии иммунитета наша цель — предоставлять объективную, обновленную и основанную на исследованиях информацию по всем темам, связанным со здоровьем. Эта статья основана на научных исследованиях и / или других научных статьях. Вся информация была проверена и проверена доктором Карлосом Баутистой, сертифицированным врачом Центра иммунной терапии. Вся информация, опубликованная на сайте, должна проходить тщательную проверку для обеспечения точности. Эта статья содержит проверенные источники со всеми ссылками, гиперссылками для читателя.
границ | Клиническая терапия метастатических опухолей позвоночника
Введение
Эпидемиология
Позвоночник как часть скелетной системы является наиболее частым местом метастатических опухолей (1). Чаще всего поражается грудной отдел позвоночника, за ним следуют поясничный отдел позвоночника и шейный отдел позвоночника (2). Большинство патологических переломов позвонков происходит в T6 – L4, за которыми следуют T11 – L1. Следует отметить, что переломы шейного отдела позвоночника встречаются реже (3). Метастатические опухоли позвоночника (MST) подразделяются на три категории: интрамедуллярные, интрадурально-экстрамедуллярные и экстрадуральные опухоли в зависимости от их анатомического расположения.Экстрадуральные опухоли составляют 90–95% MST (4). Самый высокий известный уровень заболеваемости MST зарегистрирован у пациентов в возрасте 40–65 лет. Это наблюдение может быть связано с высоким риском рака в этом возрасте (5). Различные типы первичного рака часто метастазируют в позвоночник, включая груди (21%), легкие (14%), простату (8%) и почки (5%) (6). Гистопатологические исследования показали, что частота MST у пациентов с распространенным раком составляла 30–90%. Примечательно, что частота метастазов в кости увеличивается параллельно с наблюдаемым увеличением выживаемости пациентов (7).
Клинические симптомы и принципы лечения MST
Как указывалось ранее в этой статье, MST в основном происходит в экстрадуральном компартменте (8). Эти опухоли вызывают ряд клинических симптомов, заметно ухудшающих качество жизни пациентов (9). Во-первых, боль является характерной чертой опухолей позвоночника из-за удлинения позвоночника и расширения эпидурального венозного сплетения спинного мозга (10). Боль различной степени отмечается у подавляющего большинства пациентов (≤ 90%) (11). Во-вторых, развитие MST приводит к компрессии нервных структур, вызывая нарушение моторной, сенсорной и сфинктерной функций (10, 11).Средняя выживаемость пациентов с MST составляет 7 месяцев, тогда как у пациентов с эпидуральным распространением — 3-6 месяцев (12). Такая короткая продолжительность жизни приводит к тому, что пациенты подходят для режимов паллиативного лечения, а не противоопухолевой терапии. Основная цель лечения MST — восстановить или сохранить нервную функцию, облегчить боль и сохранить или повысить стабильность позвоночника.
Таким образом, принятие решения о лечении играет важную роль в терапии MST.Система NOMS, модифицированные баллы токухаси, баллы SINS и баллы томита — все это хорошо зарекомендовавшие себя и часто используются для установления прогноза.
Система принятия решений NOMS включает неврологические, онкологические, механические и системные аспекты. Кроме того, применялись традиционное внешнее лучевое облучение, стереотаксическая радиохирургия позвоночника, малоинвазивные и открытые хирургические вмешательства (13, 14). Короче говоря, неврологические соображения — это оценка степени эпидуральной компрессии спинного мозга, миелопатии или функциональной радикулопатии.Соображения онкологии основаны на ожидаемом ответе опухоли и длительности ответа на существующие методы лечения. Механическая нестабильность — это отдельный вопрос для рассмотрения патологических переломов и лечения. Системные соображения должны оценивать переносимость пациентов и общую ожидаемую выживаемость пациентов, основанную на степени заболевания и злокачественности опухоли, к методу лечения, основанному на системных заболеваниях (15).
Парадигма NOMS объединяет мультимодальную терапию для формирования структуры принятия решений, которая включает контрольные точки принятия решений в терапию MST.Принимая во внимание чувствительность опухоли к радиации и степень распространения эпидуральной анестезии, можно определить наилучшие потребности в лучевой терапии и хирургической декомпрессии. Механическая стабильность позвоночника и учет системных заболеваний дополнительно помогают определить необходимость и возможность хирургического вмешательства (13, 14). Более того, другие баллы для оценки прогностической эффективности метастатического заболевания позвоночника включают модифицированные баллы токухаши, баллы SINS и баллы tomita (16).В целом, эти четыре метода играют важную роль в принятии решения о лечении MST. Гибкий выбор этих методов — залог хорошего прогноза для пациентов (17).
В этом систематическом обзоре мы резюмируем доступные в настоящее время варианты лечения и достижения в области хирургического лечения, минимально инвазивной терапии (MIT), лучевой терапии и системной терапии для ведения пациентов с MST (рис. 1).
Рисунок 1 . Местоположение и текущие варианты лечения MST.MST, метастатические опухоли позвоночника.
Хирургический менеджмент
Хирургическое лечение по-прежнему играет важную роль у пациентов с трудноизлечимой болью, прогрессирующим неврологическим повреждением, нестабильностью позвоночника, неудачей лучевой и химиотерапии и высокой вероятностью излечения (18). Здесь мы представляем четыре хирургических метода, в том числе открытую хирургию, хирургию позвоночника с минимальным доступом (MASS), чрескожную фиксацию транспедикулярных винтов (PPSF), торакоскопическую хирургию с помощью видео (VATS). При выборе хирургических методов следует руководствоваться принципом индивидуального лечения и уделять большое внимание качеству жизни пациентов.
Открытая хирургия
До появления лучевой терапии ламинэктомия была наиболее часто используемым методом декомпрессии позвоночника. Посредством ламинэктомии с задним доступом, декомпрессия спинного мозга теоретически снижает нагрузку на спинной мозг и снимает повреждение нервов. Наиболее частыми участками поражения из-за MST являются тела позвонков и ножки (19). Следовательно, удаление этих прикреплений позвоночника еще больше ухудшает стабильность позвоночника, что приводит к плохому результату хирургического вмешательства.Примечательно, что этот результат может быть даже хуже, чем эффективность, наблюдаемая после консервативного лечения. Таким образом, от открытой хирургии отказались, и лучевая терапия стала предпочтительным вариантом лечения MST (12, 20). Последующее развитие хирургических методов и модифицированных инструментов для декомпрессии позвоночника улучшило ограничения открытой хирургии, обеспечив стабильность позвоночника. Кроме того, развитие передних доступов к позвоночнику позволило существенно отделить опухоль от тела позвонка, что привело к улучшению неврологических результатов.
Исследования, проведенные Patchell et al. (21) продемонстрировали явное преимущество хирургического лечения в том, что пациенты остаются или даже восстанавливаются в амбулаторных условиях. В настоящее время хирургическое вмешательство остается первым методом лечения для многих пациентов со спинальными эпидуральными метастазами. Кроме того, сочетание хирургического вмешательства с лучевой терапией значительно улучшает прогноз пациентов.
Видеоассистированная торакоскопическая хирургия
VATS широко используется в кардиоторакальной хирургии, и его преимущества были продемонстрированы (22).Ограниченное повреждение грудной клетки и четкие изображения расположения опухолей, связанные с этим подходом, делают VATS подходящим вариантом для лечения MST. Следует отметить, что его преимущества становятся более очевидными при применении к верхнему грудному отделу позвоночника (рис. 2) (23, 24).
Рисунок 2 . Лечение с ВАТС (25). 41-летняя женщина обратилась с жалобой на аномальную тень на апикальной части правого легкого и двигательную слабость внутренней мышцы правой руки. При обследовании обнаружена гантельная опухоль правого нервного корешка Т1, распространяющаяся на отверстие и паравертебральную область.Из-за симптоматики пациентке была проведена ВАТС вместе с задней операцией на позвоночнике. Первоначально был выполнен передний релиз с использованием VATS в левом боковом положении. Во время операции на заднем отделе позвоночника после VATS была подтверждена реакция на интраоперационную стимуляцию нервного корешка T1 дистальнее опухоли. Поэтому энуклеацию опухоли проводили с использованием операционного микроскопа, чтобы сохранить функцию внутренней мышцы. (A, B) Изображения магнитно-резонансной томографии, показывающие наличие гантельной опухоли у правого нервного корешка T1, простирающейся до отверстия и паравертебральной области. (C) Опухоль во время ВАТС. (D) Опухоль после переднего выхода окружающих органов. (E) Частичная костотрансверсэктомия была выполнена после VATS. (F) Предыдущий VATS обеспечивал подвижность опухоли в положении лежа. Опухоль была перемещена на поверхность осторожным обращением. ВАТС, видеоассистированная торакоскопическая хирургия.
В 2008 г. Kan et al. (26) изучали пять пациентов с MST, которым было выполнено удаление опухоли с помощью минимально инвазивного торакоскопического доступа.У всех пациентов боль и неврологический дефицит значительно уменьшились в течение 4–6 месяцев наблюдения. Однако Хуанг и др. (27) указали на 12% частоту чрезмерного кровотечения среди 41 пациента с MST, получавших торакоскопическую корпэктомию. Это открытие предполагает, что такой подход может быть связан со значительным риском кровотечения.
К сожалению, эндоскопические методы сложны с технической точки зрения и не нашли широкого применения в современной хирургии позвоночника. Таким образом, кривая обучения может быть крутой.В настоящее время эти методы более применимы к заднему доступу для лечения пациентов с MST.
Хирургия позвоночника с минимальным доступом
MASS включает в себя меньшие разрезы и использование операционного микроскопа для увеличения поля зрения. Этот доступ подходит для хирургии заднего отдела позвоночника (28). Эндоскопическая хирургия показала превосходство над MASS в лечении MST. Однако он не используется широко из-за высоких технических трудностей, большой продолжительности операции, чрезмерного кровотечения и трудностей в достижении гемостаза во время операции.Таким образом, МАСС привлек внимание хирургов. В MASS нет необходимости в специализированном дорогостоящем оборудовании. Этот простой в освоении метод позволяет безопасно диссоциировать сосудисто-нервную структуру и сократить время операции (т.е. декомпрессии и восстановления стабильности) (29).
Huang et al. (30) сравнили MASS (29 пациентов) со стандартной торакотомией (17 пациентов) при лечении грудной MST. Результаты показали, что терапевтические эффекты, наблюдаемые в двух группах, были одинаковыми.Примечательно, что послеоперационная частота пребывания в отделении интенсивной терапии в группах MASS и стандартной торакотомии составила 6,9 и 88% соответственно. Эти результаты показали, что MASS полезен при лечении пациентов с MST, особенно с точки зрения снижения потребности в послеоперационном пребывании в отделении интенсивной терапии. Кроме того, Payer et al. (31) сообщили о 37 пациентах, которым была выполнена корпэктомия из переднего доступа с минимальным доступом, в том числе 11 пациентов с опухолями позвонков. Клинические результаты были благоприятными, незначительное кровотечение и отсутствие неврологического ухудшения.Также Chou et al. (32) проиллюстрировали мини-открытый способ выполнения грудопоясничной корпэктомии в технологическом аспекте. В заключение, MASS может быть замечательной альтернативой торакоскопическим или эндоскопическим процедурам.
Чрескожная фиксация транспедикулярного винта
В открытой хирургии традиционные подходы к установке винтов требуют отделения поверхности позвоночника от мышц и тканей, что приводит к обширным травмам тканей и чрезмерной кровопотере (33). Развитие технологии PPSF заметно улучшило терапевтический эффект.Этот подход широко используется для лечения пациентов с переломами позвонков без повреждения подлежащей мышцы. Применение рентгеновских изображений и проводников облегчает эффективное размещение винтов (34). Кроме того, PPSF показал обнадеживающие результаты в лечении патологических переломов, вызванных метастатическими опухолями позвоночника. Этот подход — в сочетании с PVP, когда это возможно — может одновременно повысить стабильность позвоночника и контролировать прогрессирование опухоли, фиксируя верхние и нижние тела одного / двух позвонков сломанного центра (35).
Moussazadeh et al. оценили 44 последовательных пациента с MST, которым была выполнена чрескожная фиксация позвоночника посредством увеличения цемента тела позвонка. Эта технология обеспечивает ожидаемую стабильность позвоночника с меньшей кровопотерей, умеренным уровнем осложнений и сокращением времени для пациентов, возвращающихся к онкологическому лечению. Исследователи предположили, что PPSF — это возможный хирургический подход для пациентов с механической нестабильностью, вызванной MST (36). Тем не менее, эта технология не подходит для пациентов с длительной выживаемостью и сложной позвоночной нестабильностью (37).
В результате из-за продолжительного выживания и осложнений, связанных с нестабильностью позвоночника у пациентов с MST, имеющихся исследований клинических исходов, связанных с PPSF, недостаточно. Для подтверждения преимуществ этой технологии необходимы дальнейшие исследования. В качестве важного дополнения к MIT в ведении пациентов с MST, долгосрочное клиническое применение PPSF в сочетании с другими методами лечения заслуживает изучения.
Минимально инвазивная терапия
Хотя первоначально MIT использовался для лечения дегенеративных заболеваний позвоночника, в настоящее время он широко используется против MST.Пациенты с MST страдают от осложнений, недоедания, сильной боли, ослабленной иммунной системы и ограниченной продолжительности жизни. Для этих пациентов основными задачами являются восстановление после операции и возвращение к онкологическому лечению. Для лечения MST были разработаны различные формы MIT, включая методы увеличения цемента, радиочастотную абляцию (RFA), чрескожную криоабляцию и имплантацию лучистых семян (5, 29, 38).
Методы MIT были связаны с быстрым восстановлением — за счет уменьшения разрушения мягких тканей — уменьшением интраоперационной кровопотери и короткой госпитализацией.Кроме того, они продемонстрировали обнадеживающие результаты — сравнимые с результатами, полученными после открытой операции — с точки зрения купирования боли и улучшения неврологического статуса (39, 40). Кроме того, MIT связан с низким уровнем инфицирования по сравнению с открытым хирургическим вмешательством (41). Тем не менее, недавний обзор литературы вызвал сомнения относительно полезности MIT из-за низкого качества и отсутствия сильных рекомендаций (42).
Напротив, ограниченное количество исследователей и исследователей продолжают поддерживать использование агрессивных операций (например,g., вертебрэктомия), особенно при лечении метастазов в щитовидную железу и солитарных почечных клеток в позвоночнике (43). Кроме того, возможности MIT для лечения шейного отдела позвоночника ограничены. Таким образом, открытая хирургия остается золотым стандартом в этой области. Таким образом, лишь несколько технологических инноваций привлекли значительное внимание в этой области. Тем не менее, MIT продолжает занимать важное место в лечении MST благодаря своим преимуществам. Кроме того, лечащие врачи и пациенты также могут быть более склонны рекомендовать / принимать MIT.
Методы увеличения цемента
Техники увеличения цемента включают чрескожную вертебропластику (PVP) и чрескожную баллонную кифопластику (PKP) (44). ПВП выполняется с использованием мощного цемента, и сила инъекции полиметилметакрилата (ПММА) должна превышать местное давление губчатой кости тела позвонка (45). Требуется постоянное наблюдение, чтобы предотвратить утечку костного цемента. PKP был разработан для поднятия замыкательной пластинки путем введения надувного баллона в сжатое тело позвонка (рис. 3).Это достигается за счет создания внутри тела позвонка камеры низкого давления, заполненной цементом. Недавно установка расширяемой клетки также показала удовлетворительные результаты у пациентов с MST (рис. 4) (46).
Рисунок 3 . Лечение ПКП (47). 58-летняя женщина с неуточненной митохондриальной патологией и переломом L1 позвонка в анамнезе, перенесшая кифопластику. После падения обратилась с жалобами на боли в поясничной области. Ей лечили PKP, послеоперационное течение оставалось без особенностей. (A) Компьютерная томография, показывающая перелом L2 с деформацией как в сагиттальной, так и в коронарной плоскостях. (B) Послеоперационное сканирование, показывающее коррекцию как в сагиттальной, так и в коронарной плоскостях. ПКП, чрескожная баллонная кифопластика.
Рисунок 4 . Лечение с помощью расширяемой клетки (39). 32-летняя женщина обратилась с жалобой на боль в пояснице и слабость в ногах> 3 недель. (A, B) Изображения магнитно-резонансной томографии, показывающие одиночное поражение L2, вызывающее сжатие окружного конского хвоста. (C) Интраоперационная фотография, показывающая разрез по средней линии с круговой декомпрессией и вертебрэктомией. Отображаются распакованные нервные корешки L3 (стрелка). (D) Интраоперационная фотография, показывающая реконструкцию тела позвонка с помощью расширяющейся кейджа (стрелка). (E) Интраоперационная фотография, показывающая закрытие раны по средней линии и чрескожную фиксацию на два уровня выше и ниже вертебрэктомии. (F) Послеоперационная рентгенограмма.
Облегчение боли — основная цель методов увеличения цемента.Механизм уменьшения боли включает химическую токсичность, эффект термического некроза и механическую стабильность сломанного тела позвонка. В настоящее время считается, что стабильность механики тела позвонка является основным механизмом формирования тела позвонка для снятия боли (47, 48). В обзоре предыдущей литературы Hadjipavlou et al. показали, что степень облегчения боли при опухолях позвонков составила 75,9–92,5% и 75,6–98,2% для PVP и PKP, соответственно (49). Более того, не было значительной разницы между двумя подходами с точки зрения уменьшения боли.Кроме того, было показано, что оба метода эффективно предотвращают возникновение осложнений и продлевают жизнь пациентов (50, 51).
В настоящее время наиболее часто используемым цементом является ПММА, смешанный с глушителем (52). Передовые методы, такие как аугментация и имплантаты с радиочастотной направленностью, улучшили применение ПММА (53, 54). Кальцийфосфатный цемент — как синтетический костный трансплантат — в последнее время привлек большое внимание благодаря своим многочисленным преимуществам, таким как остеокондуктивность и возможность инъекций.Кроме того, он позволяет добавлять в материалы лекарственные препараты и активное вещество из-за его внутренней пористости и низкотемпературной реакции затвердевания (52). Кроме того, рентгеноконтрастный силиконовый полимер может использоваться в качестве замены костного цемента, обеспечивая более длительное время работы и жесткость (55).
Методы увеличения цемента широко распространены благодаря их широкому применению, отличному обезболивающему эффекту и высокой эффективности. Однако их влияние на подавление опухоли ограничено, и риск утечки костного цемента, ведущего к нарушению неврологической функции, остается высоким.Поэтому мы считаем, что комбинированная терапия может быть наиболее подходящим подходом для решения этих проблем.
Радиочастотная абляция
В предыдущие 5–10 лет РЧА использовалась как альтернатива паллиативному лечению MST (56). Помещая радиочастотный электрод в опухоль, эта технология вызывает тепловое повреждение опухолевой ткани вокруг электрода, что приводит к разрушению опухолевых клеток посредством коагуляционного некроза (57, 58).
Хотя РЧА может эффективно облегчить боль у пациентов с MST, она не может улучшить функцию нервов или предотвратить патологические переломы.Zheng et al. (59) комбинировали РЧА с ПКП для лечения 38 тел позвонков 26 пациентов. Результаты показали, что у всех пациентов наблюдалось заметное облегчение боли.
Недавно Rosian et al. (60) выполнили систематический обзор с участием 583 пациентов из девяти исследований для оценки клинической эффективности и безопасности РЧА — в большинстве случаев в сочетании с вертебропластикой ( n = 437) — у пациентов с MST. Результаты показали, что у всех пациентов наблюдалось статистически значимое облегчение боли через 1 и 3 месяца.Цель этого лечения — паллиативное; таким образом, только в двух исследованиях представлены данные, касающиеся смертности. Кроме того, ни в одном из девяти исследований не наблюдалось серьезных осложнений после лечения. Эти данные демонстрируют, что РЧА играет важную роль в уменьшении боли и улучшении качества жизни.
Кроме того, РЧА является альтернативным лечением, которое может эффективно облегчить боль у пациентов с метастатическими опухолями позвонков, которые не подходят для лучевой терапии или химиотерапии.Однако ограниченные данные, доступные в настоящее время, затрудняют оценку применимости RFA. В последующих исследованиях следует изучить количество костного цемента, повысить точность положения инъектора и обеспечить строгий контроль критериев включения для дальнейшего определения эффективности и безопасности комбинированной терапии РЧА.
Лучевая терапия
В предыдущие десятилетия были отмечены успехи в развитии лучевой терапии для лечения пациентов с MST (61).Несмотря на значительный прогресс в хирургическом лечении и химиотерапии, лучевая терапия остается основой лечения MST. В многочисленных исследованиях лучевая терапия продемонстрировала значительный эффект в отношении облегчения боли, местного контроля опухолей и неврологического восстановления (62–64).
С развитием новых технологий и устройств, лечение MST с помощью лучевой терапии также претерпело изменения. Использование традиционной дистанционной лучевой терапии (CEBRT) постепенно отменялось из-за ее ограничений.Спинальная стереотаксическая радиохирургия (SSRS) и брахитерапия — недавние достижения в лечении пациентов с MST. Эти методы безопасно обеспечивают более высокие дозы облучения и в настоящее время преобладают в этих условиях.
Традиционная дистанционная лучевая терапия
Ранее CEBRT была основным методом лечения опухолей позвоночника. При таком подходе облучение обычно доставляется в дозе 30 Гр на 10 фракций (65, 66). Сообщается, что опухоли с высокой радиочувствительностью (например, лимфома и миелома) и промежуточные радиочувствительные опухоли (например,g., грудь, простата и легкие) чувствительны к CEBRT. Однако некоторые солидные опухоли (например, гепатоцеллюлярная карцинома, почечно-клеточная карцинома, саркома и меланома) не реагируют на CEBRT (66, 67).
Для уменьшения возможных ошибок лечения поле излучения CEBRT должно включать нормальные ткани вокруг целевой области, обычно в диапазоне 1-2 см. Это приводит к ограниченной дозировке и возникновению токсичности для окружающих тканей (68). Это привело к развитию лучевой терапии с модуляцией интенсивности, модель доставки излучения которой определяется путем критически важной оптимизации и моделирования лечения.Таким образом, максимальная доза облучения фокусируется на целевой области, при этом снижается доза, вводимая в спинной мозг. Тем не менее, чувствительность спинного мозга к радиации продолжает ограничивать безопасную дозу, получаемую с помощью этой технологии (69).
Спинальная стереотаксическая радиохирургия
SSRS — это недавно разработанный подход к лучевой терапии, который постепенно становится лучшим терапевтическим методом по сравнению с CEBRT для лечения пациентов с MST. Высоко конформная гипофракционированная внешняя лучевая лучевая терапия в сочетании с визуализацией в реальном времени позволяет подавать излучение с исключительной точностью и точностью, одновременно гарантируя воздействие на окружающие ткани безопасной дозой даже для целей, расположенных близко к спинному мозгу ( 70).
Исследования показали, что облучение опухолей, обработанных высокой дозой на фракцию (т. Е. 10 Гр / фракция), может убить опухолевые клетки и разрушить новообразованные сосудистые сети опухоли, которые особенно чувствительны к ионизирующему излучению. Это указывает на то, что способность SSRS доставлять высокие дозы облучения приводит к обширной гибели опухолевых клеток (71). Кроме того, небольшое количество фракций, необходимых для доставки дозы в SSRS (т. Е. 1–3 фракции против 10–20 фракций для CEBRT), было связано с улучшением соблюдения пациентом режима лечения.
Преимущества SSRS привели к развитию «сепарационной хирургии», которая требует циркулярной декомпрессии эпидуральной опухоли для образования промежутка между опухолью и спинным мозгом (72). Laufer et al. провели ретроспективный обзор 186 пациентов, и результаты показали, что операция разделения с последующим адъювантным SSRS для оставшейся опухоли применима для контроля стойких местных опухолей. В этой серии пациентов через 1 год скорость локального прогрессирования опухоли варьировала (4–22%) в зависимости от послеоперационной дозы облучения.Кроме того, не было обнаружено существенной разницы в скорости местного прогрессирования между монофракционированными SSRS и низкодозными гипофракционированными SSRS (73).
Краткое изложение исследований, в которых оценивали SSRS для лечения MST, представлено в таблице 1. Хотя недавние исследования показали, что SSRS обеспечивает устойчивый клинический эффект и высокую частоту местного контроля, текущие исследования ограничиваются ретроспективным анализом проспективных баз данных. Отсутствуют рандомизированные контролируемые испытания, чтобы продемонстрировать превосходство SSRS над другими методами в лечении MST и продвинуть процесс стандартизации (82).Кроме того, необходимы дальнейшие исследования для оптимизации стандарта применения дозы для SSRS.
Таблица 1 . Избранные исследования стереотаксической радиохирургии позвоночника в лечении метастатических опухолей позвоночника.
Брахитерапия
Имплантируя источник излучения непосредственно в место опухоли, брахитерапия может доставить чрезвычайно высокие дозы радиации при сохранении нормальных тканей. В последние годы достижения в лучевой терапии улучшили возможности и возможности применения брахитерапии (83).Спинальная брахитерапия обычно используется в качестве альтернативного лечения для пациентов, которые не переносят другие методы лечения, или в качестве адъювантного лечения в сочетании с другими методами лечения (84). Лечение имплантации семян 125 I под компьютерной томографией, показавшее благоприятные клинические исходы, является наиболее часто используемым методом лечения MST (85).
Недавно Zuckerman et al. (84) провели систематический обзор с участием 370 пациентов с метастатическими заболеваниями позвоночника из 15 исследований.В этих исследованиях брахитерапия использовалась для лечения пациентов, которые не прошли предыдущую терапию и не переносили открытую операцию или дальнейшее лечение. Все исследования, в которых оценивалась оценка боли, сообщали о значительном улучшении контроля боли после брахитерапии. Кроме того, сообщалось о нескольких осложнениях.
Спинальная брахитерапия является вариантом лечения MST из-за ее преимуществ (например, облегчение боли, улучшение неврологической функции и оптимизация местного контроля опухоли).Однако для окончательного вывода необходимо провести дальнейшие исследования этой важной процедуры.
Системная терапия
Системная терапия используется для ослабления симптомов, вызванных опухолями позвоночника. Он состоит из гормональной терапии, химиотерапии и приема лекарств (например, кортикостероидов, бисфосфонатов и деносумаба). Выбор лекарств зависит от клинических симптомов пациента и типа опухоли.
Гормональная терапия
Как правило, большинство метастатических опухолей простаты и груди чувствительны к гормональной терапии.Гормональная блокада, хотя и не является цитотоксической, оказывает ингибирующее действие на прогрессирование опухолей. Использование ингибиторов рецепторов эстрогена (например, тамоксифена) и селективных ингибиторов рецепторов эстрогена (например, фулвестранта) возможно для лечения рака груди (86). Что касается рака простаты, андрогенная депривация широко применяется в качестве паллиативного лечения выбора (87).
Химиотерапия
Контроль стабильности метастазов в позвоночник основан на системной химиотерапии, которая может проводиться как монотерапия или комбинированная терапия.Этот вариант характеризуется отсроченной эффективностью и ограниченной функцией. Следовательно, он чаще всего используется в качестве адъювантной терапии у пациентов с MST или в качестве альтернативного варианта после неэффективности начальной гормональной терапии (88). Химиотерапия может быть методом выбора для пациентов с несмежными метастатическими областями распространения или для тех, кто не подходит для хирургического вмешательства из-за других осложнений.
Обнадеживает тот факт, что создание иммунотерапии рака произвело революцию в парадигме лечения рака, направленной на активацию и стимулирование врожденных иммунологических систем для косвенного подавления опухоли.Обладая меньшим количеством побочных эффектов и превосходным потенциалом применения, иммунотерапия рака снижает зависимость лечения опухолей от традиционных методов лечения, таких как хирургия, химиотерапия и лучевая терапия (89). Иммунотерапия рака подразделяется на пять основных классов: терапия блокадой иммунных контрольных точек (ICB), терапия цитокинами, стимулирующими лимфоциты, адоптивная терапия Т-клетками, агонистические антитела против костимулирующих рецепторов и противораковые вакцины (89). ICB-терапия на сегодняшний день является наиболее изученной категорией иммунотерапии (90).Молекулы иммунных контрольных точек цитотоксического Т-лимфоцитарного антигена-4 (CTLA-4) и белка запрограммированной гибели клеток 1 (PD-1) достигли особого внимания благодаря своим мощным иммуномодулирующим эффектам, действуя как негативные регуляторы активации Т-клеток.
Несмотря на значительный прогресс, достигнутый в иммунотерапии, перед клиническим воплощением этих инновационных методов лечения все еще существует множество проблем, таких как ограниченный терапевтический эффект и неопределенная доза применения. Чтобы реализовать применение этих терапевтических агентов более безопасным и контролируемым способом, срочно необходимы новые стратегии иммунотерапии рака.В последнее время для улучшения иммунного ответа и противоопухолевого эффекта были разработаны различные биоматериалы, включая наночастицы, имплантируемые каркасы из биоматериалов, каркасы из биоматериалов для инъекций (91). Стратегии доставки с использованием этих материалов постоянно развиваются, чтобы вызвать мощные терапевтические иммунные реакции с меньшей системной токсичностью (89). В частности, многие исследования продемонстрировали, что сочетание иммунотерапии с другими традиционными методами лечения, включая химиотерапию, фототерапию и лучевую терапию, может давать синергетический эффект и улучшать терапевтическую эффективность злокачественных новообразований (92).Усиленный иммунный ответ обычно достигается за счет гибели иммуногенных клеток (ICD), вызванной традиционными методами лечения. Кроме того, многие биоматериалы, которые могут напрямую вызывать иммунные ответы, также были широко изучены и показали многообещающие клинические эффекты.
Кортикостероиды
Кортикостероиды являются основой дополнительной терапии пациентов с болью, связанной с метастазами в позвонках и острой нейродегенерацией. Способность кортикостероидов облегчать боль и отек спинного мозга объясняется их противовоспалительным действием (93).Клинические эффекты этих агентов были продемонстрированы в экспериментальных исследованиях на животных, что свидетельствует о значительном улучшении двигательной функции (94).
Однако неврологические улучшения наблюдаются только в первые 2 недели лечения кортикостероидами. Следовательно, их долгосрочная польза недостаточна. Более того, лечение высокими дозами кортикостероидов обычно связано с серьезными системными побочными эффектами (например, периферическими отеками, гипергликемией, инфекциями, проксимальной миопатией и гастритом).Из-за отсутствия улучшения выживаемости и развития тяжелых побочных эффектов в текущие рекомендации не включено использование кортикостероидов в лечении MST (95).
В будущем использование нанотехнологий может уменьшить возникновение побочных эффектов при сохранении лечебного эффекта. Следовательно, необходимы дальнейшие исследования для оценки оптимальной дозы кортикостероидов в этой ситуации.
Бисфосфонаты и деносумаб
Бисфосфонаты широко используются для лечения гиперкальциемии и профилактики осложнений, связанных с метастатическими опухолями позвоночника, таких как патологические переломы и компрессия спинного мозга.Прикрепляясь к поверхности кости, бисфосфонаты подавляют активность остеокластов, что приводит к снижению абсорбции костной ткани и связанному с опухолью остеолизу. Кроме того, было показано, что бисфосфонаты обладают антиангиогенезным и противоопухолевым действием (96, 97).
Недавнее исследование, проведенное Wilson et al. отметили, что частота переломов и время первого перелома были заметно уменьшены у пациентов с раком груди, получавших золедронат — бисфосфонат третьего поколения.Более того, 5-летняя частота переломов у пациентов снизилась до нормального уровня (98).
Деносумаб представляет собой моноклональное антитело к активатору рецептора лиганда NF-κB (RANK-L), который играет важную роль в образовании и дифференцировке остеокластов. Следовательно, деносумаб предотвращает комбинацию RANKL и активатора рецептора NF-κB (RANK), ингибируя разрушение кости (99).
Недавно Zhang et al. провели сравнительное исследование, показавшее, что деносумаб имеет преимущества по сравнению сзоледронат в снижении частоты событий, связанных со скелетом, у пациентов с метастазами в кости. Кроме того, подкожная инъекция деносумаба превосходит внутривенное введение золедроната с точки зрения почечной токсичности (100).
Заключение
MST продолжает негативно влиять на качество жизни пациентов. В настоящее время основные методы лечения MST включают хирургическое лечение, MIT, лучевую терапию и системную терапию.
Что касается хирургического лечения, то, несмотря на недостатки, такие как нестабильность позвоночника и плохой хирургический результат открытого хирургического вмешательства, он продемонстрировал явное преимущество в улучшении амбулаторного лечения пациентов.Удовлетворительный прогноз после открытой операции зависит от комбинации с лучевой терапией и другими методами лечения. Кроме того, с развитием эндоскопических методов и устройств для фиксации позвоночника, VATS, MASS и PPSF достигли прочных клинических преимуществ. Тем не менее, в настоящее время хирургическое поле VATS остается ограниченным. Кроме того, этот технически сложный метод требует сложного обучения и связан со значительным риском кровотечения. Считается, что безопасность этого метода улучшится с развитием хирургических методов и инструментов.Что касается PPSF, имеющихся исследований, посвященных изучению комбинации лучевой терапии и методов увеличения цемента с ней, недостаточно. Для подтверждения преимуществ этой технологии необходимы дальнейшие исследования.
Для Массачусетского технологического института, разработки материалов для костного цемента и оборудования RFA позволили хирургам более адекватно декомпрессировать спинной мозг и повысить стабильность позвоночника, что привело к обнадеживающим клиническим результатам. Таким образом, в предыдущие несколько десятилетий переход в лечении пациентов с MST от агрессивной открытой хирургии (т.е., спондилэктомия) в MIT. Однако в настоящее время этот подход имеет ряд ограничений. Что касается методов увеличения цемента, то ингибирование опухолей по-прежнему ограничено, в то время как риск утечки костного цемента высок. Использование комбинированной терапии может быть предпочтительным выбором для решения этой проблемы. Что касается РЧА — альтернативного метода обезболивания, — имеющиеся в настоящее время ограниченные данные затрудняют оценку его применимости. В настоящее время это только один из первых вариантов лечения первичного рака печени.Необходимы дальнейшие исследования для определения подходящей дозировки костного цемента, точности положения инъектора и критериев включения. Кроме того, успешные операции требуют значительного рентгеновского излучения для обеспечения точного позиционирования, что приводит к повреждению пациентов и хирургов. Таким образом, современное оборудование / устройства (например, технология O-образной дуги и интраоперационная компьютерная томография) необходимы для повышения точности и уменьшения ущерба, вызванного радиацией.
Основываясь на улучшении методов визуализации и целенаправленной лучевой терапии, SSRS произвела революцию в лечении MST.Однако радиорезистентность остается препятствием для постоянного контроля над опухолью. Кроме того, не следует упускать из виду высокий риск компрессионных переломов позвонков, сопровождающихся высокой дозой на фракцию. Хотя недавние исследования показали, что SSRS обеспечивает устойчивый клинический эффект, необходимы дальнейшие исследования для определения оптимальной популяции и оптимизации стандарта применения дозы.
Кроме того, инновации в системной терапии (например, деносумаб) внесли свой вклад в улучшение лечения рака, улучшение местного контроля и сокращение событий, связанных со скелетом.Однако возможности клинического применения ограничиваются развитием тяжелых побочных эффектов и устойчивости к лекарствам. В будущем изучение новых иммунотерапевтических методов с использованием биоматериалов станет многообещающим и интересным направлением исследований. Несмотря на множество препятствий, мы можем предвидеть, что глубокое клиническое улучшение может принести пользу здоровью человека в ближайшем будущем. Кроме того, использование нанотехнологий может также помочь уменьшить возникновение побочных эффектов при сохранении лечебного эффекта.
Улучшенный системный контроль опухолей, доступность различных вариантов хирургического лечения и разработка инновационных методов лечения сделали пациентам более широкий выбор. Кроме того, пациенты с MST характеризуются сложными симптомами или проблемами лечения, требующими комплексного и многопрофильного лечения. Требуются дополнительные усилия для оказания надлежащей помощи при ведении таких пациентов. В целом, успешное лечение зависит от комбинации хирургического вмешательства, MIT, лучевой терапии и системной терапии.При постоянных усилиях и комбинированной терапии качество жизни пациентов с MST будет продолжать улучшаться.
Авторские взносы
JL написал рукопись, обработал данные и провел поиск в литературе. CF выполнила концептуализацию, формальный анализ и наблюдение. WW, FX, YW и YL внесли свой вклад в написание рукописей и рисунки. Все авторы внесли существенный вклад в окончательную рукопись и одобрили окончательную версию.
Финансирование
Работа была поддержана Национальным фондом естественных наук Китая (гранты №51873207, 51803006, 51673190, 51603204, 51673187 и 51520105004), Национальная программа ключевых исследований и разработок Китая (грант № 2016YFC1100701) и Ассоциация содействия инновациям молодежи Китайской академии наук (грант № 2019005).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Сокращения
CEBRT, традиционная внешняя лучевая терапия; МАССА, хирургия позвоночника с минимальным доступом; MIT, малоинвазивная терапия; MST, метастатические опухоли позвоночника; ПКП, чрескожная баллонная кифопластика; ПММА, полиметилметакрилат; PPSF, чрескожная фиксация транспедикулярными винтами; ПВП, чрескожная вертебропластика; RANK, активатор рецептора NF-κB; RANK-L, активатор рецептора лиганда NF-κB; РЧА, радиочастотная абляция; SSRS, стереотаксическая радиохирургия позвоночника; ВАТС, видеоассистированная торакоскопическая хирургия.
Список литературы
1. Манабэ Дж., Кавагути Н., Мацумото С., Танизава Т. Хирургическое лечение метастазов в кости: показания и результаты. Int J Clin Oncol. (2005) 10: 103–11. DOI: 10.1007 / s10147-005-0478-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Климо П., Шмидт М. Хирургическое лечение метастазов в позвоночник. Онколог. (2004) 9: 188–96. DOI: 10.1634 / теонколог.9-2-188
CrossRef Полный текст | Google Scholar
8.Reilly MK, Sugrue G, Byrne D, MacMahon P. Комбинированные интрамедуллярные и интрадуральные экстрамедуллярные метастазы в позвоночник при злокачественной меланоме. Отчеты о делах BMJ . (2017) 2017: bcr-2017-220031. DOI: 10.1136 / bcr-2017-220031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Зак Л., Цванг Л., Алезра Д., Бен Аюн М., Харел Р. Терапия с объемной модулированной дугой для радиохирургии позвоночника. Превосходное планирование и проведение лечения по сравнению со статической лучевой терапией с модуляцией интенсивности луча. BioMed Res Int. (2016) 2016: 6805979. DOI: 10.1155 / 2016/6805979
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Ди Перна Дж., Кофано Ф., Мантовани С., Баделлино С., Маренго Н., Аджелло М. и др. Сепарационная хирургия при метастатической эпидуральной компрессии спинного мозга: качественный обзор. Журнал костной онкологии. (2020) 25: 100320. DOI: 10.1016 / j.jbo.2020.100320
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11.Табуре Э., Каувин С., Фуэнтес С., Эстерни Б., Адетчесси Т., Салем Н. и др. Переоценка систем оценки и прогностических факторов метастатической компрессии спинного мозга. Spine J. (2015) 15: 944–50. DOI: 10.1016 / j.spinee.2013.06.036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Коул Дж. С., Патчелл Р. А.. Метастатическая эпидуральная компрессия спинного мозга. Lancet Neurol. (2008) 7: 459–46. DOI: 10.1016 / S1474-4422 (08) 70089-9
CrossRef Полный текст | Google Scholar
14.Laufer I, Rubin DG, Lis E, Cox BW, Stubblefield MD, Yamada Y, et al. Структура NOMS: подход к лечению метастатических опухолей позвоночника. Онколог. (2013) 18: 744–51. DOI: 10.1634 / теонколог.2012-0293
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Муссазаде Н., Лауфер И., Ямада Ю., Бильски М.Х. Разделительная хирургия метастазов в позвоночник: влияние радиохирургии позвоночника на цели хирургического лечения. Борьба с раком. (2014) 21: 168–74.DOI: 10.1177 / 107327481402100210
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Амелот А., Кристини Дж., Салауд С., Молес А., Хамель О., Моро П. и др. Общая выживаемость при метастазах миеломы позвоночника: трудности прогнозирования с помощью прогностических баллов. Позвоночник. (2017) 42: 400–6. DOI: 10.1097 / BRS.0000000000001766
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Армстронг В., Шен Н., Мадхаван К., Ванни С. Систематический обзор вмешательств и результатов при метастазах рака легких в позвоночник. J Clin Neurosci. (2019) 62: 66–71. DOI: 10.1016 / j.jocn.2019.01.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Lin P, Hsu F-M, Chen Y, Xiao F. Неоадъювантная стереотаксическая лучевая терапия для лечения метастазов в позвоночник. J Spine Neurosurg. (2018) 17. DOI: 10.4172 / 2325-9701.1000298
CrossRef Полный текст | Google Scholar
21. Патчелл Р.А., Тиббс П.А., Регин В.Ф., Пейн Р., Сарис С., Крисцио Р.Дж. и др. Прямая декомпрессивная хирургическая резекция при лечении компрессии спинного мозга, вызванной метастатическим раком: рандомизированное исследование. Ланцет. (2005) 366: 643–48. DOI: 10.1016 / S0140-6736 (05) 66954-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Аллен М.С., Дешам С., Трастек В.Ф., Пайролеро ПК. Видеоассистированная торакальная хирургия. Труды клиники Мэйо. (1995) 70: 811. DOI: 10.4065 / 70.8.811
CrossRef Полный текст | Google Scholar
23. Мак MJ, Реган JJ, McAfee PC, Picetti G, Бен-Ишай A, Acuff TE. Видеоассистированная торакальная хирургия переднего доступа к грудному отделу позвоночника. Ann Thorac Surg. (1995) 59: 1100–6. DOI: 10.1016 / 0003-4975 (95) 00112-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Ландрено Р.Дж., Мак М.Дж., Хазелригг С.Р., Доулинг Р.Д., Акуфф Т.Э., Маги М.Дж. и др. Видеоассистированная торакальная хирургия: основные технические концепции и стратегии межреберного доступа. Ann Thorac Surg. (1992) 54: 800–7. DOI: 10.1016 / 0003-4975 (92)
-G
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25.Ohya J, Miyoshi K, Kitagawa T., Sato Y, Maehara T., Mikami Y. Комбинированная видео-ассистированная торакальная хирургия и хирургия заднего отдела позвоночника для лечения гантельной опухоли первого корешка грудного нерва. Asian Spine J. (2015) 9: 595–9. DOI: 10.4184 / asj.2015.9.4.595
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Питер К., Меик Х.С. Минимально инвазивный торакоскопический доступ для передней декомпрессии и стабилизации метастатического поражения позвоночника. Нейрохирургический центр FOC .(2008) 25: E8. DOI: 10.3171 / FOC / 2008/25/8 / E8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Хуан Т.Дж., Хсу RWW, Сум CW, Лю ХП. Осложнения при торакоскопической хирургии позвоночника. Эндоскопическая хирургия. (1999) 13: 346–50. DOI: 10.1007 / s004649
7
CrossRef Полный текст | Google Scholar
29. Кумар Н., Малхотра Р., Зау А.С., Махараджан К., Нареш Н., Кумар А. и др. Эволюция стратегии лечения метастатического заболевания позвоночника: методы, развивающиеся в настоящее время. Europ J Surg Oncol. (2017) 43: 1784–801. DOI: 10.1016 / j.ejso.2017.05.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Хуан Т.Дж., Сюй В-ВР, Ли И-И, Ченг Х. Операция на позвоночнике с минимальным доступом (MASS) при лечении метастазов в грудном отделе позвоночника. Позвоночник . (2006) 31: 1860–3. DOI: 10.1097 / 01.brs.0000225995.56028.46
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Bailey RS, Puryear A. Достижения в области малоинвазивных методов в детской ортопедии: чрескожная фиксация переломов позвоночника. Orthop Clin North Am. (2020) 51: 339–43. DOI: 10.1016 / j.ocl.2020.02.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Моббс Р.Дж., Парк А., Махарадж М., Фан К. Результаты чрескожной фиксации транспедикулярных винтов при травмах и опухолях позвоночника. J Clin Neurosci. (2016) 23: 88–94. DOI: 10.1016 / j.jocn.2015.05.046
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Муссазаде Н., Рубин Д.Г., Маклафлин Л., Лис Э., Бильски М.Х., Лауфер И.Чрескожная фиксация транспедикулярного винта коротким сегментом с наращиванием цемента при нестабильности позвоночника, вызванной опухолью. Spine J. (2015) 15: 1609–17. DOI: 10.1016 / j.spinee.2015.03.037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Schwab JH, Gasbarrini A, Cappuccio M, Boriani L, De Iure F, Colangeli S, et al. Минимально инвазивная задняя стабилизация улучшила показатели ходьбы и боли у пациентов с плазмоцитомами и / или метастазами позвоночника. Int J Surg Oncol. (2011) 2011: 239230. DOI: 10.1155 / 2011/239230
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Бурасса-Моро Э, Верстег А., Москвен Э, Чарест-Морин Р., Флексман А., Эйлон Т. и др. Саркопения, но не слабость, позволяет прогнозировать раннюю смертность и нежелательные явления после экстренной хирургической операции по поводу метастатического поражения позвоночника. Spine J. (2020) 20: 22–31. DOI: 10.1016 / j.spinee.2019.08.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39.Рао П.Дж., Тайапаран Г.К., Фэрхолл Д.М., Моббс Р.Дж. Малоинвазивные методы чрескожной фиксации при метастатическом поражении позвоночника. Orthop Surg. (2014) 6: 187–195. DOI: 10.1111 / OS.12114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Hansen-Algenstaedt N, Kwan MK, Algenstaedt P, Chiu CK, Viezens L, Chan TS, et al. Сравнение минимально инвазивной хирургии и традиционной открытой хирургии у пациентов с метастазами в позвоночник: проспективное исследование с подобранной оценкой предрасположенности. Позвоночник. (2017) 42: 789–7. DOI: 10.1097 / BRS.0000000000001893
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Смит З.А., Ян И., Горгульо А., Рафаэль Д., Де Саллес AAF, Khoo LT. Новые методы малоинвазивного лечения и лечения опухолей грудного отдела позвоночника. J. Neuro-Oncol. (2012) 107: 443–55. DOI: 10.1007 / s11060-011-0755-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Цукерман С.Л., Лауфер И., Сахгал А., Ямада Ю.Дж., Шмидт М.Х., Чоу Д. и др.Когда меньше значит больше. Показания к методам MIS и сепарационной хирургии при метастатическом поражении позвоночника. Позвоночник . (2016) 41: S246–3. DOI: 10.1097 / BRS.0000000000001824
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Рори Дж. П., Стивен М. С., Гудвин С. Р., Нэнси А. Б., Али Б., Тимоти Ф. У. и др. Факторы, связанные с улучшением выживаемости после операции по поводу метастазов почечно-клеточной карциномы в позвоночник. Нейрохирург Фокус ФОК . (2016) 41: E13. DOI: 10,3171 / 2016.5.FOCUS16145
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Schroeder JE, Ecker E, Skelly AC, Kaplan L. Увеличение объема цемента при опухолях позвоночника: систематический обзор, сравнивающий вертебропластику и кифопластику. Уход за позвоночником на основе фактических данных J. (2011) 2: 35–43. DOI: 10.1055 / с-0031-1274755
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Savage JW, Schroeder GD, Anderson PA. Вертебропластика и кифопластика в лечении компрессионных переломов позвонков, вызванных остеопорозом. JAAOS. (2014) 22: 653–64. DOI: 10.5435 / JAAOS-22-10-653
CrossRef Полный текст | Google Scholar
47. Себаали А., Ризкаллах М., Бачур Ф., Аталлах Ф., Моро П.Е., Маалуф Г. Чрескожное наращивание цемента при остеопоротических переломах позвонков. EFORT Open Rev. (2017) 2: 293–9. DOI: 10.1302 / 2058-5241.2.160057
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Lv Y, Li A, Zhou F, Pan X, Liang F, Qu X, et al. Новый композитный костный цемент на основе ПММА с пониженным потенциалом термического некроза. Интерфейсы приложения ACS Mater. (2015) 7: 11280–5. DOI: 10.1021 / acsami.5b01447
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Эдидин А.А., Онг К.Л., Лау Э., Шмир Дж., Кемнер Дж. Э., Курц С.М. Анализ экономической эффективности лечения компрессионных переломов позвонков. Политика здравоохранения Appl Health Econ. (2012) 10: 273–84. DOI: 10.2165 / 11633220-000000000-00000
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50.Далинка М.К., Кесслер Х., Вайс М. Рентгенографическая оценка травмы позвоночника. Emerg Med Clin North Am. (1985) 3: 475–90. DOI: 10.1016 / S0733-8627 (20) 30950-0
CrossRef Полный текст | Google Scholar
51. Герлинг М.С., Юбэнкс Д.Д., Патель Р., Уанг П.Г., Болман Х.Х., Ан Н.Ю. Цементное наращивание рефрактерных остеопоротических компрессионных переломов позвонков: анализ выживаемости. Позвоночник. (2011) 36: E1266–9. DOI: 10.1097 / BRS.0b013e31820a0b3f
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52.Ginebra M-P, канал C, Espanol M, Pastorino D, Montufar EB. Кальций-фосфатные цементы как материалы для доставки лекарств. Adv Drug Del Rev. (2012) 64: 1090–110. DOI: 10.1016 / j.addr.2012.01.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Бертуччи Ф., Финетти П., Моннер А., Перро Д., Шевро С., Ле Сесн А. и др. Экспрессия PARP1 в саркомах мягких тканей является фактором плохого прогноза и новой потенциальной терапевтической мишенью. Mol Oncol. (2019) 13: 1577–88.DOI: 10.1002 / 1878-0261.12522
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Вестерманн Л., Эйзель П., Саймонс М., Заргуни К. Радиочастотное увеличение позвонков: клинический случай пациента с 7 остеопоротическими переломами позвонков в варианте несовершенного остеогенеза. Корпус Rep Orthop. (2017) 2017: 71
