Предопухолевая патология молочной железы | Компендиум — справочник лекарственных препаратов
Дольковая (лобулярная) неоплазия молочной железы
Наиболее сложным в патологической анатомии является вопрос дифференциальной диагностики гиперпластических процессов, которые возникают на фоне гормональной стимуляции, прежде всего гиперэстрогении, и начальных форм РМЖ.
Дольковая неоплазия наиболее часто развивается у женщин в предменопаузальный период (в возрасте 45–47 лет) и составляет 1–3,8% всех эпителиальных патологических процессов молочной железы. В 0,5–4% материала биопсий, взятых по поводу доброкачественных заболеваний молочной железы, выявляют дольковую неоплазию разной степени дифференцировки. В 85% случаев дольковая неоплазия возникает мультицентрично и в 30–67% — билатерально.
Для лобулярной неоплазии характерна пролиферация мелкого эпителия, расположенного в просвете долек, со слабым межклеточным соединением, с педжетоидной реакцией или без нее. Происходит дольковая неоплазия из эпителия концевой (терминальной) протоково-дольковой единицы молочной железы.
Может быть смешанный тип, представленный сочетанием в разной пропорции клеток типа А и В.
Термины «атипическая дольковая неоплазия» и «рак in situ» используют, чтобы подчеркнуть их важное прогностическое значение и для указания степени атипии клеток в очаге поражения. Однако известны публикации, свидетельствующие об отсутствии разницы клинического течения атипической дольковой неоплазии и рака in situ, а также разницы в прогнозе дальнейшего развития на их фоне инвазивного рака [203, 204].
Согласно Классификации РМЖ ВОЗ (2003) рекомендуется пользоваться термином «дольковая неоплазия», подразделяя ее на три степени и термин «дольковый рак in situ».
Деление на степени дифференцировки дольковой неоплазии происходит в зависимости от выраженности клеточного полиморфизма, наличия некрозов, признаков атипии и количества митозов.
Легкая степень дольковой неоплазии (первая степень неоплазии) характеризуется сохранением альвеолярной архитектоники, пролиферацией в одной или нескольких дольках мелких мономорфных эпителиальных клеток, слабо сцепленных между собой (клетки типа А). Как правило, клетки в очаге пролиферации имеют округлое, нечетко отграниченное ядро и скудную цитоплазму. Некрозы, митозы и кальцинаты редки. Иногда отмечают очаги пролиферации и полиморфизма клеток, появляются скопления крупных клеток, но эти признаки представлены незначительно. В единичных дольках могут быть признаки апокриновой неоплазии (фото 3).
Фото 3. Легкая степень дольковой неоплазии. Общее строение дольки сохранено, однако количество долек значительно увеличено, отмечается выработка секрета, эпителий мелкий мономорфный. Гематоксилин-эозин, х 100
Умеренная дольковая неоплазия (вторая степень неоплазии) характеризуется нарастанием полиморфизма эпителия долек, появлением большего количества крупных клеток с неправильной формой ядра и обильной цитоплазмой, отмечают единичные митозы и отдельные перстневидные клетки. Миоэпителиальные клетки чаще располагаются вдоль базальной мембраны, но могут вытесняться из обычного места расположения и примешиваться к эпителиальному пролиферату. Базальная мембрана сохранна на всем протяжении (фото 4, 5).
Миоэпителиальные клетки чаще располагаются вдоль базальной мембраны, но могут вытесняться из обычного места расположения и примешиваться к эпителиальному пролиферату. Базальная мембрана сохранна на всем протяжении (фото 4, 5).
Фото 4. Умеренная степень дольковой неоплазии. Отмечается пролиферация и формирование многорядного эпителия, очаги секреции. Гематоксилин-эозин, х 200
Фото 5. Умеренная степень дольковой неоплазии. Эпителий полиморфный, формирует сосочки, миоэпителиальные клетки местами вытесняют эпителиальные. Гематоксилин-эозин, х 400
Тяжелая дольковая неоплазия (третья степень неоплазии) представлена в основном полиморфными клетками, заполняющими почти полностью просвет долек, чаще, чем в предыдущей стадии, выявляют митозы, в том числе атипические митозы, очаги некроза (фото 6). Данную дольковую неоплазию трудно дифференцировать от рака in situ. Основное отличие тяжелой дольковой неоплазии и рака in situ в том, что последний представлен малигнизированным эпителием, по клеточному составу не отличается от долькового рака и характеризуется сохранной базальной мембраной.
Фото 6. Тяжелая степень дольковой неоплазии. Дольки расширены, просвет полностью заполнен эпителиальными клетками. Гематоксилин-эозин, х 100
Фото 7. Дольковый рак in situ. Атипичные клетки заполняют просвет долек. Гематоксилин-эозин, х 100
Фото 8. Дольковый рак in situ. Видны микроочаги некроза в опухолевом инфильтрате. Гематоксилин-эозин, х 100
Фото 9. Простая протоковая гиперплазия. Некоторые протоки расширены в виде кист, в отдельных протоках видны признаки апокриновой секреции, однако общее строение протоков сохранено. Гематоксилин-эозин, х 100
Для описания атипической дольковой неоплазии часто используют термин «дольковый рак in situ». Все эти процессы имеют один морфологический код в Международном классификаторе онкологических заболеваний — 8520/2.
Рак in situ часто ассоциирован с микроинвазивным раком в окружающих участках, поэтому его исследование требует особой ответственности и внимания при установлении диагноза.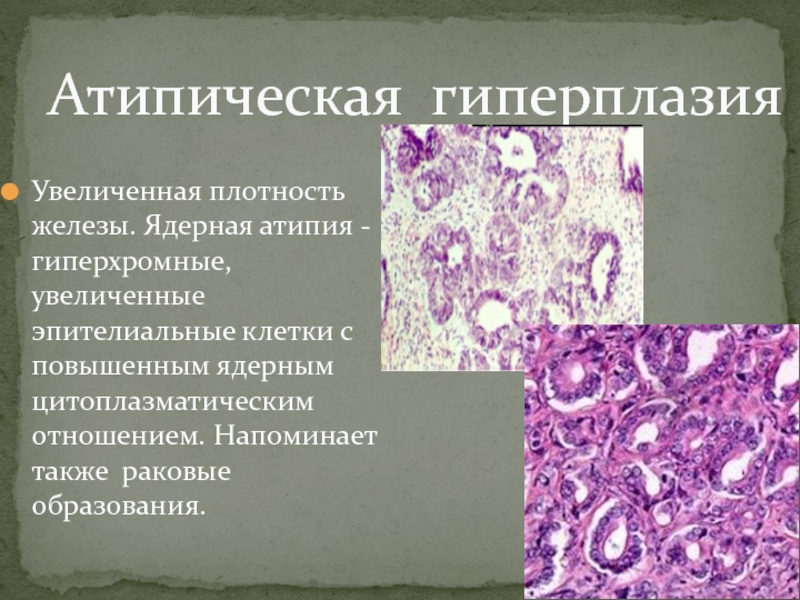 Необходимо изучить большое количество срезов и края резекции. В сложных случаях для исключения инвазивного рака необходимо исследовать базальную мембрану для выявления ее целостности и доказать отсутствие нарушения миоэпителиального слоя и базальной мембраны.
Необходимо изучить большое количество срезов и края резекции. В сложных случаях для исключения инвазивного рака необходимо исследовать базальную мембрану для выявления ее целостности и доказать отсутствие нарушения миоэпителиального слоя и базальной мембраны.
Важным условием диагностики дольковой неоплазии является отсутствие инвазии опухолевыми клетками базальной мембраны. Для исключения инвазии применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
Рецепторы эстрогена по данным большинства авторов и нашим наблюдениям выявляют в 60–90% случаев долькового рака in situ, а рецепторы прогестерона редко. В низкодифференцированном дольковом раке in situ может быть определена экспрессия HER2/neu и белка p53, однако это нетипично для данной патологии.
Типичным для дольковой неоплазии тяжелой степени и рака in situ является отсутствие экспрессии цитокератина СК 5/7 и E—cadherin.
Но цитокератин высокой молекулярной массы (HMW CK 34BE12) присутствует в цитоплазме клеток долькового рака in situ. Это является важным дифференциальным признаком для диагностики протокового и долькового рака.
Это является важным дифференциальным признаком для диагностики протокового и долькового рака.
Через довольно длительный промежуток времени у некоторых женщин на фоне рака in situ возникают инвазивные формы рака, но следует отметить, что дольковый рак in situ не обязательно является предраком инфильтративных форм.
Внутрипротоковые пролиферативные поражения
Существуют два классификационных подхода к оценке эпителиальных пролиферативных поражений протоков. Касательно молочной железы одновременно используют две классификационные схемы.
| Традиционная терминология (классификация ВОЗ) | Терминология DIN |
|
Простая протоковая гиперплазия |
Простая протоковая гиперплазия |
|
Слабо выраженная протоковая атипия |
Протоковая интраэпителиальная неоплазия Grade1А |
|
Атипическая протоковая гиперплазия |
Протоковая интраэпителиальная неоплазия Grade1В |
|
Протоковый рак in situ Grade1 |
Протоковая интраэпителиальная неоплазия Grade1С |
|
Протоковый рак in situ Grade2 |
Протоковая интраэпителиальная неоплазия Grade2 |
|
Протоковый рак in situ Grade3 |
Протоковая интраэпителиальная неоплазия Grade3 |
Левый столбик отражает взгляды большинства экспертов ВОЗ, терминологию, представленную справа, используют преимущественно в Северной Америке.
Нам кажется, что классификация ВОЗ более отражает сущность опухолевой трансформации, кроме того эта схема более воспроизводима и более наглядна для восприятия в реальных практических условиях.
Традиционно внутрипротоковую пролиферацию разделяют на простую протоковую гиперплазию, атипическую протоковую гиперплазию и рак in situ. Однако сложилось так, что группа рак in situ оказалась гетерогенной, в нее вошли процессы, имеющие различное клиническое проявление, различную гистологическую структуру, различные биологические маркеры и генетические аномалии.
Популяционный маммологический скрининг требует выделения патологических состояний, имеющих чрезвычайно высокий риск развития инвазивного рака молочной железы. Результаты дальнейших клинических исследований показали, что различные внутрипротоковые пролиферации с различной частотой переходят в рак in situ и инвазивный рак. Так, риск развития инвазивного РМЖ из простой протоковой гиперплазия составляет 1,5%, из атипической протоковой гиперплазии 4–5% и рака in situ 8–10% [1].
Термин «интраэпителиальная неоплазия» широко используют для описания патологии не только молочной железы, но и предстательной железы, шейки матки.
При этом независимо от органа поражения очень трудно провести грань между атипической гиперплазией и раком in situ. Для этого используют особенности морфологического строения, подсчет количества митозов, наличие некрозов, но в основном признаки цитологической и тканевой атипии.
Простая (обычная) протоковая гиперплазия часто возникает на фоне мастопатии и выглядит как пролиферация эпителия с признаками некоторого полиморфизма внутри протоков. Протоки располагаются неравномерно, их размеры разные. Характерно изменение нормальной структуры протоков, формирование расширенных, неправильной формы протоков вокруг долек нормального строения. Протоки ветвятся в виде ручейков от центра участка гиперплазии к периферии. Клеточные пролифераты могут формировать солидные участки, криброзные структуры, мостики.
Клеточный состав пролифератов полиморфный. Причем необходимо отметить, что полиморфизм клеток неопухолевый. Эпителий протоков, несмотря на различный размер ядер и разную выраженность цитоплазмы, имеет зрелый вид. Полиморфизм клеток формируется за счет наличия эпителия, находящегося в функционально различном состоянии. В одном протоке могут отмечать клетки с выраженными признаками секреции (часто эти клетки находятся в центре протока), а также с признаками пролиферации (чаще возле базальной мембраны). Эпителиальные клетки могут формировать 2–4 слоя. Следует отметить, что общее строение протоков сохранено, имеется четкая базальная мембрана, слой миоэпителиальных клеток. Возможны очаги апокриновой метаплазии. Наличие такого разнообразия типов клеток является характерным для этого вида гиперплазии. Не исключается наличие микрокальцинатов и некрозов. В случаях отсутствия истинной атипии клеток эти признаки не должны склонить патолога в сторону диагноза «атипическая гиперплазия» или «рак in situ». Следует отметить, что некрозы и микрокальцинаты часто имитируют рак in situ.
Причем необходимо отметить, что полиморфизм клеток неопухолевый. Эпителий протоков, несмотря на различный размер ядер и разную выраженность цитоплазмы, имеет зрелый вид. Полиморфизм клеток формируется за счет наличия эпителия, находящегося в функционально различном состоянии. В одном протоке могут отмечать клетки с выраженными признаками секреции (часто эти клетки находятся в центре протока), а также с признаками пролиферации (чаще возле базальной мембраны). Эпителиальные клетки могут формировать 2–4 слоя. Следует отметить, что общее строение протоков сохранено, имеется четкая базальная мембрана, слой миоэпителиальных клеток. Возможны очаги апокриновой метаплазии. Наличие такого разнообразия типов клеток является характерным для этого вида гиперплазии. Не исключается наличие микрокальцинатов и некрозов. В случаях отсутствия истинной атипии клеток эти признаки не должны склонить патолога в сторону диагноза «атипическая гиперплазия» или «рак in situ». Следует отметить, что некрозы и микрокальцинаты часто имитируют рак in situ. Решающее значение в установлении диагноза имеют цитологические признаки истинной атипии (фото 10).
Решающее значение в установлении диагноза имеют цитологические признаки истинной атипии (фото 10).
Фото 10. Простая протоковая гиперплазия. Участок апокриновой метаплазии. Гематоксилин-эозин, х 100
Фото 11. Протоковая неоплазия со слабо выраженной атипией. Гематоксилин-эозин, х 100
Критерии простой протоковой гиперплазии
Цитологические. Вариабельность форм ядер с гиперхромными округлыми и овальными ядрышками, ассиметричными нуклеолами.
Гистологические. Эпителиальные клетки имеют тенденцию к беспорядочному расположению в протоках, отмечается вариабельность расстояния между ядрами, ориентация клеток нарушена, их цитоплазма нечетко очерчена, часто выявляют секрецию.
Интерцеллюлярные расстояния отличаются по размеру и форме, часто отмечают щелеподобные структуры.
Иммуногистохимическое исследование подтверждает мозаичность различных паттернов клеток. Часть клеток экспрессирует цитокератин высокой молекулярной массы (СК HMW), таких как СК 5/10/14. Отмечается высокая экспрессия E—cadherin. Количество клеток, имеющих рецептор эстрогена, выше, чем в нормальной ткани молочной железы. Cyclin D1 выявлен в 11–19% случаев простой протоковой гиперплазии [1].
Отмечается высокая экспрессия E—cadherin. Количество клеток, имеющих рецептор эстрогена, выше, чем в нормальной ткани молочной железы. Cyclin D1 выявлен в 11–19% случаев простой протоковой гиперплазии [1].
Риск развития инвазивного рака из простой протоковой гиперплазии составляет 2,6% за период наблюдения около 14 лет. Следует отметить, что такой процент инвазивного рака на фоне атипической протоковой гиперплазии формируется за 8,3 года [61]. В другом исследовании указывается, что в 4% случаев простая протоковая гиперплазия транформировалась в инвазивный РМЖ за 15 лет наблюдения [62]. Однако риск развития рака на фоне этой гиперплазии значительно ниже, чем при других вариантах гиперплазий.
Обычная протоковая гиперплазия является одним из морфологических проявлений гормональных изменений в организме женщины.
Морфофункциональные изменения, возникающие в различные периоды менструального цикла и беременности, могут симулировать обычную протоковую гиперплазию, поэтому патологоанатом должен иметь информацию о состоянии женщины, ее возрасте, наличии эндокринных и гинекологических заболеваний. Обязательно следует выдерживать сроки взятия биопсии или проведения операции в соответствии с менструальным циклом.
Обязательно следует выдерживать сроки взятия биопсии или проведения операции в соответствии с менструальным циклом.
Протоковая неоплазия со слабо выраженной атипией
В данном варианте протоковой неоплазии по сравнению с предыдущим более выражена пролиферация эпителия, клетки формируют в протоке от 1 до 3–5 рядов, более существенно проявление атипии клеток. Папиллярные, криброзные, солидные пролифераты отсутствуют. Часто отмечают секрецию эпителия (цитоплазма клеток становится обильной светлой пенистой, ядро расположено ассиметрично, ближе к базальному краю) и секрет в просвете протоков (фото 12–14). Возможны микрокальцинаты. Морфологическая картина при этой патологии соответствует протоковой интраэпителиальной неоплазии Grade1А.
Фото 12. Протоковая неоплазия со слабо выраженной атипией. Гематоксилин-эозин, х 200
Фото 13. Протоковая неоплазия со слабо выраженной атипией. Эпителий протоков формируют микропапиллярные структуры и сосочки. Гематоксилин-эозин, х 200
Фото 14. Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами. Гематоксилин-эозин, х 200
Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами. Гематоксилин-эозин, х 200
Риск развития инвазивного рака на фоне простой протоковой атипии выше, чем на фоне простой протоковой гиперплазии.
Атипическая протоковая гиперплазия
Это заболевание характеризуется более выраженной пролиферацией эпителия, усилением признаков клеточного полиморфизма и появлением атипии разной степени выраженности. Заболевание характеризуется умеренным риском развития инвазивного рака молочной железы.
В протоках отмечают равномерное распределение мономорфных клеток с округлым ядром. Эпителиальные клетки формируют папиллярные структуры, солидные группы, пучки, аркады, криброзные структуры внутри протоков. Морфологическая картина соответствует протоковой интраэпителиальной неоплазии Grade1В, местами протоки похожи на рак in situ G-1. Для атипической протоковой гиперплазии обязательны участки простой протоковой гиперплазии. Для исключения рака in situ общим требованием является взятие на исследование ткани через каждый 1 мм и исследование серийных срезов гистологического блока.
Микрокальцинаты могут отсутствовать, быть представленными фокально или на большом протяжении. Это не является ведущим фактором для установления диагноза (фото 15–19).
Фото 15. Атипическая протоковая гиперплазия. Некроз и кальцинаты в протоках. Гематоксилин-эозин, х 200
Фото 16. Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами, формирует криброзные структуры, слева отмечается очаг некроза, во многих протоках явления секреции. Гематоксилин-эозин, х 200
Фото 17. Атипическая протоковая гиперплазия. Атипичный эпителий в протоках формирует солидные пласты, однако нет инвазии стромы. Гематоксилин-эозин, х 200
Фото 18. Тот же участок. Видны атипичные клетки с гиперхромными ядрами, нет инвазии стромы. Гематоксилин-эозин, х 400
Фото 19. Экспрессия гладкомышечного актина (клон HHF35, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB.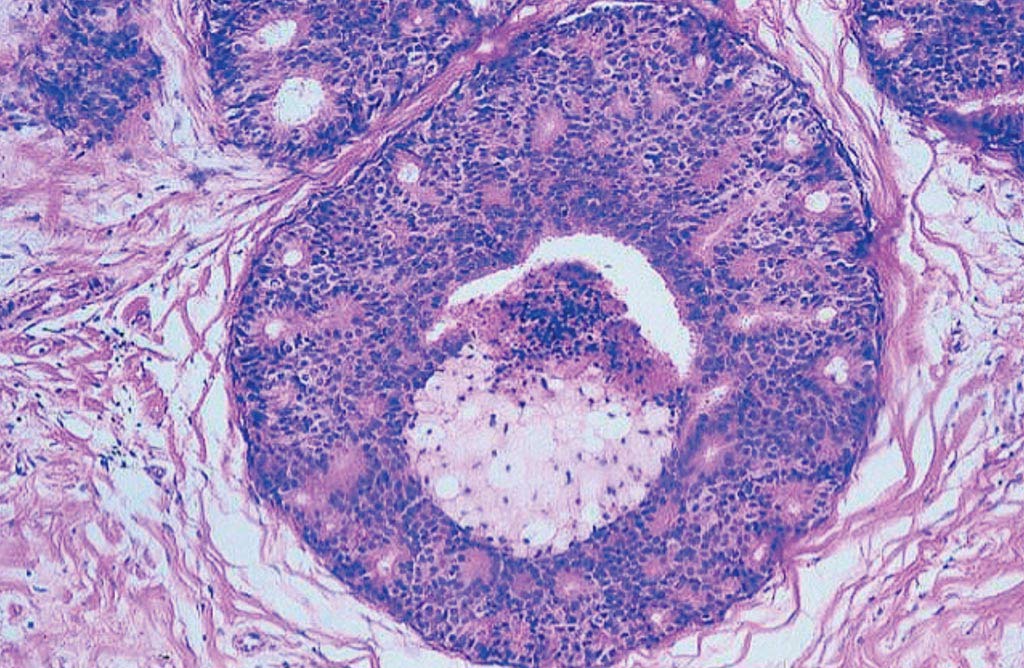 Миоэпителиальные клетки в виде непрерывной линии вдоль базальной мембраны. х 200
Миоэпителиальные клетки в виде непрерывной линии вдоль базальной мембраны. х 200
Рецепторы эстрогена и прогестерона выявляют в большом количестве клеток, белок ERBB2 экспрессируется крайне редко, экспрессия этого белка более характерна для рака in situ. Белок р53 не выявляют как в атипической протоковой гиперплазии, так и раке in situ. Однако экспрессия Cyclin D1 выявлена в 27–57% случаев атипической протоковой гиперплазии. Около 90% случаев атипической протоковой гиперплазии не имеют экспрессии цитокератина высокого молекулярного веса (СК HMW), таких как СК 5/10/14, поэтому их можно использовать для дифференциальной диагностики с простой протоковой гиперплазией [1].
Атипическая протоковая гиперплазия имеет довольно высокий риск развития инвазивного РМЖ. По данным различных авторов инвазивный рак развивается в 3,7–22% случаев атипической протоковой гиперплазии [66, 67].
Важнейшим отличительным признаком любой формы протоковой интраэпителиальной неоплазии является наличие непрерывной базальной мембраны и слоя миоэпителиальных клеток. В зависимости от степени протоковой интраэпителиальной неоплазии количество эпителиальных клеток отличается.
В зависимости от степени протоковой интраэпителиальной неоплазии количество эпителиальных клеток отличается.
Наиболее важная и сложная задача патологоанатома — не пропустить инвазию опухолевыми клетками базальной мембраны. Эта задача может быть выполнена только в результате кропотливого исследования большого количества срезов, отбора наиболее подозрительных на малигнизацию участков и проведения дополнительных методов окраски базальной мембраны и миоэпителиальных клеток. Неоценимую помощь в этом оказывает иммуногистохимический метод исследования. Для маркировки миоэпителиальных клеток мы часто применяем антитела к гладкомышечному актину, которые дают четкое окрашивание, и реакция легко воспроизводима.
Внутрипротоковая папиллома
Эти образования возможны в любом месте в пределах системы протоков от соска до терминальной дольково-протоковой единицы. Бывают доброкачественные варианты (внутрипротоковая папиллома), атипические (атипическая папиллома) и злокачественные (внутрипротоковый папиллярный рак).
Среди внутрипротоковых папиллом в зависимости от локализации выделяют центральные и периферические варианты. Центральная внутрипротоковая папиллома — это одиночное образование, располагающееся, как правило, в субареолярной зоне, часто в кистозно-расширенном протоке. Периферические внутрипротоковые папилломы чаще множественные. Большинство исследователей считают, что одиночные внутрипротоковые папилломы не имеют тенденции к малигнизации. Множественные папилломы, особенно в периферических отделах дольково-протоковой системы, склонны к озлокачествлению. Большие затруднения возникают при диагностике центральных внутрипротоковых папиллом, так как они могут клинически сопровождаться кровянистыми выделениями из соска [5].
Диагностика папиллом включает обязательно маммографию, ультразвуковое исследование (УЗИ), а также цитологическое исследование выделений из соска.
Внутрипротоковая папиллома — округлое образование с четкой границей размером 3–4 см, но возможны процессы, занимающие несколько сантиметров в диаметре. Внутрипротоковая папиллома представлена сосочковыми разрастаниями, состоящими из фиброваскулярной ножки, покрытой эпителием и миоэпителием (фото 20). Часто отмечают апокринизацию эпителия [5].
Внутрипротоковая папиллома представлена сосочковыми разрастаниями, состоящими из фиброваскулярной ножки, покрытой эпителием и миоэпителием (фото 20). Часто отмечают апокринизацию эпителия [5].
Фото 20. Внутрипротоковая папиллома. Гематоксилин-эозин, х 200
Фото 21. Внутрипротоковая папиллома. Видны отдельные сосочки с фиброзной стромой и однорядной эпителиальной выстилкой. Гематоксилин-эозин, х 200
Фото 22. Периферическая внутрипротоковая папиллома. Гематоксилин-эозин, х 200
Фото 23. Атипическая внутрипротоковая папиллома. Сосочки имеют грубоволокнистую соединительнотканную основу, миоэпителиальный компонент и один или несколько слоев эпителиальных клеток с гиперхромными ядрами. Гематоксилин-эозин, х 200
Термин «папилломатоз» молочной железы эксперты ВОЗ рекомендуют избегать и использовать термин «множественные внутрипротоковые папилломы».
Все внутрипротоковые папилломы имеют общий морфологический код в Международном классификаторе онкологических заболеваний — 8503/0.
Центральная внутрипротоковая папиллома
Составляет 10% всех доброкачественных поражений молочной железы. Чаще выявляют у женщин среднего возраста (40–50 лет). Пальпаторные поражения — это округлые образования с четко ограниченными контурами, имеется связь с расширенным крупным протоком. Пункционная биопсия позволяет получить серозное содержимое. Размер, как правило, большой, от 3–4 мм до нескольких сантиметров.
Гистологическое строение центральной и периферической внутрипротоковой папилломы одинаковое. Однако, учитывая большие размеры центральной папилломы, в ней можно отметить участки двух видов: протоковый и папиллярный. Папиллярные образования представлены фиброваскулярной ножкой, покрытой двумя слоями эпителия. Протоковый компонент имеет строение описанных выше протоковых гиперплазий. Опухоли, в которых преобладает протоковый компонент и склероз стромы, обычно называют «склерозирующая папиллома».
В центральных внутрипротоковых папилломах могут быть представлены участки пролиферации миоэпителия, апокринизация эпителия, плоскоклеточная, хрящевая и костная метаплазия, внутрипротоковая пролиферация эпителия, воспалительная инфильтрация. Отсутствие клеточной атипии, инвазии стромы позволит диагностировать центральную внутрипротоковую папиллому. Особенно кропотливой работы требуют папилломы с участками, имитирующими микроинвазию. Большую помощь в таких случаях оказывает иммуногистохимическое исследование компонентов базальной мембраны и миоэпителия. Чаще для этих целей применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
Отсутствие клеточной атипии, инвазии стромы позволит диагностировать центральную внутрипротоковую папиллому. Особенно кропотливой работы требуют папилломы с участками, имитирующими микроинвазию. Большую помощь в таких случаях оказывает иммуногистохимическое исследование компонентов базальной мембраны и миоэпителия. Чаще для этих целей применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
Периферическая внутрипротоковая папиллома
В отличие от центральной внутрипротоковой папилломы, эта опухоль развивается у женщин более молодого возраста. Клиническое течение чаще протекает скрыто. Большие размеры папиллом могут пальпироваться. Маммография выявляет чаще множественные узловые образования с четкими контурами, возможны микрокальцинаты.
Характерный мультицентричный рост периферической внутрипротоковой папилломы может быть на фоне внутрипротоковой гиперплазии, карциномы in situ или инвазивного рака.
Термин «микропапиллома» применяют к малым формам периферической внутрипротоковой папилломы. Часто микропапилломы выявляют в больших фокусах аденоза молочной железы.
Часто микропапилломы выявляют в больших фокусах аденоза молочной железы.
Атипическая внутрипротоковая папиллома
Эта форма внутрипротоковой папилломы выделена из-за ее важного прогностического значения, поскольку именно на фоне атипической внутрипротоковой папилломы чаще возникают инвазивные карциномы.
В отличие от описанных выше папиллом, атипическая внутрипротоковая папиллома характеризуется ядерной атипией, часто многорядностью эпителия, наличием солидных участков с некрозами, могут быть небольшие участки высокодифференцированной карциномы in situ. Если участки рака в папилломе значительные (до 90% площади), то к этой опухоли применим термин «внутрипротоковый папиллярный рак». Характерной особенностью этого рака является отсутствие инвазии опухолевых клеток через базальную мембрану в окружающую строму. Кроме исследования большого количества срезов опухоли, исключить очаги инвазии помогает имуногистохимическое исследование с антителами к коллагену IV типа и гладкомышечному актину, а также отсутствие лимфогистиоцитарной инфильтрации в строме вокруг папилломы.
Внутрипротоковый папиллярный рак лишен (почти на всем протяжении) миоэпителиального клеточного слоя и характеризуется пролиферацией атипичного эпителия (фото 24). Часто бывает мультицентричный рост.
Фото 24. Внутрипротоковый папиллярный рак. Часть сосочков не имеет соединительной ткани в своей основе и состоит из атипичных эпителиальных клеток. Гематоксилин-эозин, х 400
Эта опухоль имеет свой морфологический код в Международном классификаторе онкологических заболеваний — 8503/2.
Предопухолевая патология молочной железы | Компендиум — справочник лекарственных препаратов
Дольковая (лобулярная) неоплазия молочной железы
Наиболее сложным в патологической анатомии является вопрос дифференциальной диагностики гиперпластических процессов, которые возникают на фоне гормональной стимуляции, прежде всего гиперэстрогении, и начальных форм РМЖ.
Дольковая неоплазия наиболее часто развивается у женщин в предменопаузальный период (в возрасте 45–47 лет) и составляет 1–3,8% всех эпителиальных патологических процессов молочной железы. В 0,5–4% материала биопсий, взятых по поводу доброкачественных заболеваний молочной железы, выявляют дольковую неоплазию разной степени дифференцировки. В 85% случаев дольковая неоплазия возникает мультицентрично и в 30–67% — билатерально.
В 0,5–4% материала биопсий, взятых по поводу доброкачественных заболеваний молочной железы, выявляют дольковую неоплазию разной степени дифференцировки. В 85% случаев дольковая неоплазия возникает мультицентрично и в 30–67% — билатерально.
Для лобулярной неоплазии характерна пролиферация мелкого эпителия, расположенного в просвете долек, со слабым межклеточным соединением, с педжетоидной реакцией или без нее. Происходит дольковая неоплазия из эпителия концевой (терминальной) протоково-дольковой единицы молочной железы. Выраженность атипии, степень пролиферации, количество атипических митозов зависят от степени дифференцировки неоплазии. Выделяют два типа клеток дольковой неоплазии: тип А и тип В. Тип А состоит из мономорфных эпителиальных клеток, тип В — из крупных полиморфных клеток с выраженными признаками атипии. Хотя клетки крупные, они гораздо мельче эпителия протоков.
Может быть смешанный тип, представленный сочетанием в разной пропорции клеток типа А и В.
Термины «атипическая дольковая неоплазия» и «рак in situ» используют, чтобы подчеркнуть их важное прогностическое значение и для указания степени атипии клеток в очаге поражения. Однако известны публикации, свидетельствующие об отсутствии разницы клинического течения атипической дольковой неоплазии и рака in situ, а также разницы в прогнозе дальнейшего развития на их фоне инвазивного рака [203, 204].
Однако известны публикации, свидетельствующие об отсутствии разницы клинического течения атипической дольковой неоплазии и рака in situ, а также разницы в прогнозе дальнейшего развития на их фоне инвазивного рака [203, 204].
Согласно Классификации РМЖ ВОЗ (2003) рекомендуется пользоваться термином «дольковая неоплазия», подразделяя ее на три степени и термин «дольковый рак in situ».
Деление на степени дифференцировки дольковой неоплазии происходит в зависимости от выраженности клеточного полиморфизма, наличия некрозов, признаков атипии и количества митозов.
Легкая степень дольковой неоплазии (первая степень неоплазии) характеризуется сохранением альвеолярной архитектоники, пролиферацией в одной или нескольких дольках мелких мономорфных эпителиальных клеток, слабо сцепленных между собой (клетки типа А). Как правило, клетки в очаге пролиферации имеют округлое, нечетко отграниченное ядро и скудную цитоплазму. Некрозы, митозы и кальцинаты редки. Иногда отмечают очаги пролиферации и полиморфизма клеток, появляются скопления крупных клеток, но эти признаки представлены незначительно. В единичных дольках могут быть признаки апокриновой неоплазии (фото 3).
Фото 3. Легкая степень дольковой неоплазии. Общее строение дольки сохранено, однако количество долек значительно увеличено, отмечается выработка секрета, эпителий мелкий мономорфный. Гематоксилин-эозин, х 100
Умеренная дольковая неоплазия (вторая степень неоплазии) характеризуется нарастанием полиморфизма эпителия долек, появлением большего количества крупных клеток с неправильной формой ядра и обильной цитоплазмой, отмечают единичные митозы и отдельные перстневидные клетки. Миоэпителиальные клетки чаще располагаются вдоль базальной мембраны, но могут вытесняться из обычного места расположения и примешиваться к эпителиальному пролиферату. Базальная мембрана сохранна на всем протяжении (фото 4, 5).
Фото 4. Умеренная степень дольковой неоплазии. Отмечается пролиферация и формирование многорядного эпителия, очаги секреции. Гематоксилин-эозин, х 200
Фото 5. Умеренная степень дольковой неоплазии. Эпителий полиморфный, формирует сосочки, миоэпителиальные клетки местами вытесняют эпителиальные. Гематоксилин-эозин, х 400
Эпителий полиморфный, формирует сосочки, миоэпителиальные клетки местами вытесняют эпителиальные. Гематоксилин-эозин, х 400
Тяжелая дольковая неоплазия (третья степень неоплазии) представлена в основном полиморфными клетками, заполняющими почти полностью просвет долек, чаще, чем в предыдущей стадии, выявляют митозы, в том числе атипические митозы, очаги некроза (фото 6). Данную дольковую неоплазию трудно дифференцировать от рака in situ. Основное отличие тяжелой дольковой неоплазии и рака in situ в том, что последний представлен малигнизированным эпителием, по клеточному составу не отличается от долькового рака и характеризуется сохранной базальной мембраной.
Фото 6. Тяжелая степень дольковой неоплазии. Дольки расширены, просвет полностью заполнен эпителиальными клетками. Гематоксилин-эозин, х 100
Фото 7. Дольковый рак in situ. Атипичные клетки заполняют просвет долек. Гематоксилин-эозин, х 100
Фото 8. Дольковый рак in situ. Видны микроочаги некроза в опухолевом инфильтрате. Гематоксилин-эозин, х 100
Гематоксилин-эозин, х 100
Фото 9. Простая протоковая гиперплазия. Некоторые протоки расширены в виде кист, в отдельных протоках видны признаки апокриновой секреции, однако общее строение протоков сохранено. Гематоксилин-эозин, х 100
Для описания атипической дольковой неоплазии часто используют термин «дольковый рак in situ». Все эти процессы имеют один морфологический код в Международном классификаторе онкологических заболеваний — 8520/2.
Рак in situ часто ассоциирован с микроинвазивным раком в окружающих участках, поэтому его исследование требует особой ответственности и внимания при установлении диагноза. Необходимо изучить большое количество срезов и края резекции. В сложных случаях для исключения инвазивного рака необходимо исследовать базальную мембрану для выявления ее целостности и доказать отсутствие нарушения миоэпителиального слоя и базальной мембраны.
Важным условием диагностики дольковой неоплазии является отсутствие инвазии опухолевыми клетками базальной мембраны. Для исключения инвазии применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
Для исключения инвазии применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
Рецепторы эстрогена по данным большинства авторов и нашим наблюдениям выявляют в 60–90% случаев долькового рака in situ, а рецепторы прогестерона редко. В низкодифференцированном дольковом раке in situ может быть определена экспрессия HER2/neu и белка p53, однако это нетипично для данной патологии.
Типичным для дольковой неоплазии тяжелой степени и рака in situ является отсутствие экспрессии цитокератина СК 5/7 и E—cadherin.
Но цитокератин высокой молекулярной массы (HMW CK 34BE12) присутствует в цитоплазме клеток долькового рака in situ. Это является важным дифференциальным признаком для диагностики протокового и долькового рака.
Через довольно длительный промежуток времени у некоторых женщин на фоне рака in situ возникают инвазивные формы рака, но следует отметить, что дольковый рак in situ не обязательно является предраком инфильтративных форм.
Внутрипротоковые пролиферативные поражения
К ним относят простую протоковую гиперплазию, гиперплазию со слабо выраженной пролиферацией эпителия, атипическую протоковую гиперплазию и протоковый рак in situ (трех степеней дифференцировки).
Существуют два классификационных подхода к оценке эпителиальных пролиферативных поражений протоков. Касательно молочной железы одновременно используют две классификационные схемы.
| Традиционная терминология (классификация ВОЗ) | Терминология DIN |
|
Простая протоковая гиперплазия |
Простая протоковая гиперплазия |
|
Слабо выраженная протоковая атипия |
Протоковая интраэпителиальная неоплазия Grade1А |
|
Атипическая протоковая гиперплазия |
Протоковая интраэпителиальная неоплазия Grade1В |
|
Протоковый рак in situ Grade1 |
Протоковая интраэпителиальная неоплазия Grade1С |
|
Протоковый рак in situ Grade2 |
Протоковая интраэпителиальная неоплазия Grade2 |
|
Протоковый рак in situ Grade3 |
Протоковая интраэпителиальная неоплазия Grade3 |
Левый столбик отражает взгляды большинства экспертов ВОЗ, терминологию, представленную справа, используют преимущественно в Северной Америке.
Нам кажется, что классификация ВОЗ более отражает сущность опухолевой трансформации, кроме того эта схема более воспроизводима и более наглядна для восприятия в реальных практических условиях.
Традиционно внутрипротоковую пролиферацию разделяют на простую протоковую гиперплазию, атипическую протоковую гиперплазию и рак in situ. Однако сложилось так, что группа рак in situ оказалась гетерогенной, в нее вошли процессы, имеющие различное клиническое проявление, различную гистологическую структуру, различные биологические маркеры и генетические аномалии.
Популяционный маммологический скрининг требует выделения патологических состояний, имеющих чрезвычайно высокий риск развития инвазивного рака молочной железы. Результаты дальнейших клинических исследований показали, что различные внутрипротоковые пролиферации с различной частотой переходят в рак in situ и инвазивный рак. Так, риск развития инвазивного РМЖ из простой протоковой гиперплазия составляет 1,5%, из атипической протоковой гиперплазии 4–5% и рака in situ 8–10% [1].
Термин «интраэпителиальная неоплазия» широко используют для описания патологии не только молочной железы, но и предстательной железы, шейки матки.
При этом независимо от органа поражения очень трудно провести грань между атипической гиперплазией и раком in situ. Для этого используют особенности морфологического строения, подсчет количества митозов, наличие некрозов, но в основном признаки цитологической и тканевой атипии.
Простая (обычная) протоковая гиперплазия часто возникает на фоне мастопатии и выглядит как пролиферация эпителия с признаками некоторого полиморфизма внутри протоков. Протоки располагаются неравномерно, их размеры разные. Характерно изменение нормальной структуры протоков, формирование расширенных, неправильной формы протоков вокруг долек нормального строения. Протоки ветвятся в виде ручейков от центра участка гиперплазии к периферии. Клеточные пролифераты могут формировать солидные участки, криброзные структуры, мостики.
Клеточный состав пролифератов полиморфный. Причем необходимо отметить, что полиморфизм клеток неопухолевый. Эпителий протоков, несмотря на различный размер ядер и разную выраженность цитоплазмы, имеет зрелый вид. Полиморфизм клеток формируется за счет наличия эпителия, находящегося в функционально различном состоянии. В одном протоке могут отмечать клетки с выраженными признаками секреции (часто эти клетки находятся в центре протока), а также с признаками пролиферации (чаще возле базальной мембраны). Эпителиальные клетки могут формировать 2–4 слоя. Следует отметить, что общее строение протоков сохранено, имеется четкая базальная мембрана, слой миоэпителиальных клеток. Возможны очаги апокриновой метаплазии. Наличие такого разнообразия типов клеток является характерным для этого вида гиперплазии. Не исключается наличие микрокальцинатов и некрозов. В случаях отсутствия истинной атипии клеток эти признаки не должны склонить патолога в сторону диагноза «атипическая гиперплазия» или «рак in situ». Следует отметить, что некрозы и микрокальцинаты часто имитируют рак in situ.
Причем необходимо отметить, что полиморфизм клеток неопухолевый. Эпителий протоков, несмотря на различный размер ядер и разную выраженность цитоплазмы, имеет зрелый вид. Полиморфизм клеток формируется за счет наличия эпителия, находящегося в функционально различном состоянии. В одном протоке могут отмечать клетки с выраженными признаками секреции (часто эти клетки находятся в центре протока), а также с признаками пролиферации (чаще возле базальной мембраны). Эпителиальные клетки могут формировать 2–4 слоя. Следует отметить, что общее строение протоков сохранено, имеется четкая базальная мембрана, слой миоэпителиальных клеток. Возможны очаги апокриновой метаплазии. Наличие такого разнообразия типов клеток является характерным для этого вида гиперплазии. Не исключается наличие микрокальцинатов и некрозов. В случаях отсутствия истинной атипии клеток эти признаки не должны склонить патолога в сторону диагноза «атипическая гиперплазия» или «рак in situ». Следует отметить, что некрозы и микрокальцинаты часто имитируют рак in situ. Решающее значение в установлении диагноза имеют цитологические признаки истинной атипии (фото 10).
Решающее значение в установлении диагноза имеют цитологические признаки истинной атипии (фото 10).
Фото 10. Простая протоковая гиперплазия. Участок апокриновой метаплазии. Гематоксилин-эозин, х 100
Фото 11. Протоковая неоплазия со слабо выраженной атипией. Гематоксилин-эозин, х 100
Критерии простой протоковой гиперплазии
Цитологические. Вариабельность форм ядер с гиперхромными округлыми и овальными ядрышками, ассиметричными нуклеолами.
Гистологические. Эпителиальные клетки имеют тенденцию к беспорядочному расположению в протоках, отмечается вариабельность расстояния между ядрами, ориентация клеток нарушена, их цитоплазма нечетко очерчена, часто выявляют секрецию.
Интерцеллюлярные расстояния отличаются по размеру и форме, часто отмечают щелеподобные структуры.
Иммуногистохимическое исследование подтверждает мозаичность различных паттернов клеток. Часть клеток экспрессирует цитокератин высокой молекулярной массы (СК HMW), таких как СК 5/10/14. Отмечается высокая экспрессия E—cadherin. Количество клеток, имеющих рецептор эстрогена, выше, чем в нормальной ткани молочной железы. Cyclin D1 выявлен в 11–19% случаев простой протоковой гиперплазии [1].
Отмечается высокая экспрессия E—cadherin. Количество клеток, имеющих рецептор эстрогена, выше, чем в нормальной ткани молочной железы. Cyclin D1 выявлен в 11–19% случаев простой протоковой гиперплазии [1].
Риск развития инвазивного рака из простой протоковой гиперплазии составляет 2,6% за период наблюдения около 14 лет. Следует отметить, что такой процент инвазивного рака на фоне атипической протоковой гиперплазии формируется за 8,3 года [61]. В другом исследовании указывается, что в 4% случаев простая протоковая гиперплазия транформировалась в инвазивный РМЖ за 15 лет наблюдения [62]. Однако риск развития рака на фоне этой гиперплазии значительно ниже, чем при других вариантах гиперплазий.
Обычная протоковая гиперплазия является одним из морфологических проявлений гормональных изменений в организме женщины.
Морфофункциональные изменения, возникающие в различные периоды менструального цикла и беременности, могут симулировать обычную протоковую гиперплазию, поэтому патологоанатом должен иметь информацию о состоянии женщины, ее возрасте, наличии эндокринных и гинекологических заболеваний. Обязательно следует выдерживать сроки взятия биопсии или проведения операции в соответствии с менструальным циклом.
Протоковая неоплазия со слабо выраженной атипией
В данном варианте протоковой неоплазии по сравнению с предыдущим более выражена пролиферация эпителия, клетки формируют в протоке от 1 до 3–5 рядов, более существенно проявление атипии клеток. Папиллярные, криброзные, солидные пролифераты отсутствуют. Часто отмечают секрецию эпителия (цитоплазма клеток становится обильной светлой пенистой, ядро расположено ассиметрично, ближе к базальному краю) и секрет в просвете протоков (фото 12–14). Возможны микрокальцинаты. Морфологическая картина при этой патологии соответствует протоковой интраэпителиальной неоплазии Grade1А.
Фото 12. Протоковая неоплазия со слабо выраженной атипией. Гематоксилин-эозин, х 200
Фото 13. Протоковая неоплазия со слабо выраженной атипией. Эпителий протоков формируют микропапиллярные структуры и сосочки. Гематоксилин-эозин, х 200
Фото 14. Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами. Гематоксилин-эозин, х 200
Риск развития инвазивного рака на фоне простой протоковой атипии выше, чем на фоне простой протоковой гиперплазии.
Атипическая протоковая гиперплазия
Это заболевание характеризуется более выраженной пролиферацией эпителия, усилением признаков клеточного полиморфизма и появлением атипии разной степени выраженности. Заболевание характеризуется умеренным риском развития инвазивного рака молочной железы.
В протоках отмечают равномерное распределение мономорфных клеток с округлым ядром. Эпителиальные клетки формируют папиллярные структуры, солидные группы, пучки, аркады, криброзные структуры внутри протоков. Морфологическая картина соответствует протоковой интраэпителиальной неоплазии Grade1В, местами протоки похожи на рак in situ G-1. Для атипической протоковой гиперплазии обязательны участки простой протоковой гиперплазии. Для исключения рака in situ общим требованием является взятие на исследование ткани через каждый 1 мм и исследование серийных срезов гистологического блока.
Микрокальцинаты могут отсутствовать, быть представленными фокально или на большом протяжении. Это не является ведущим фактором для установления диагноза (фото 15–19).
Фото 15. Атипическая протоковая гиперплазия. Некроз и кальцинаты в протоках. Гематоксилин-эозин, х 200
Фото 16. Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами, формирует криброзные структуры, слева отмечается очаг некроза, во многих протоках явления секреции. Гематоксилин-эозин, х 200
Фото 17. Атипическая протоковая гиперплазия. Атипичный эпителий в протоках формирует солидные пласты, однако нет инвазии стромы. Гематоксилин-эозин, х 200
Фото 18. Тот же участок. Видны атипичные клетки с гиперхромными ядрами, нет инвазии стромы. Гематоксилин-эозин, х 400
Фото 19. Экспрессия гладкомышечного актина (клон HHF35, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Миоэпителиальные клетки в виде непрерывной линии вдоль базальной мембраны. х 200
Рецепторы эстрогена и прогестерона выявляют в большом количестве клеток, белок ERBB2 экспрессируется крайне редко, экспрессия этого белка более характерна для рака in situ. Белок р53 не выявляют как в атипической протоковой гиперплазии, так и раке in situ. Однако экспрессия Cyclin D1 выявлена в 27–57% случаев атипической протоковой гиперплазии. Около 90% случаев атипической протоковой гиперплазии не имеют экспрессии цитокератина высокого молекулярного веса (СК HMW), таких как СК 5/10/14, поэтому их можно использовать для дифференциальной диагностики с простой протоковой гиперплазией [1].
Атипическая протоковая гиперплазия имеет довольно высокий риск развития инвазивного РМЖ. По данным различных авторов инвазивный рак развивается в 3,7–22% случаев атипической протоковой гиперплазии [66, 67].
Важнейшим отличительным признаком любой формы протоковой интраэпителиальной неоплазии является наличие непрерывной базальной мембраны и слоя миоэпителиальных клеток. В зависимости от степени протоковой интраэпителиальной неоплазии количество эпителиальных клеток отличается.
Наиболее важная и сложная задача патологоанатома — не пропустить инвазию опухолевыми клетками базальной мембраны. Эта задача может быть выполнена только в результате кропотливого исследования большого количества срезов, отбора наиболее подозрительных на малигнизацию участков и проведения дополнительных методов окраски базальной мембраны и миоэпителиальных клеток. Неоценимую помощь в этом оказывает иммуногистохимический метод исследования. Для маркировки миоэпителиальных клеток мы часто применяем антитела к гладкомышечному актину, которые дают четкое окрашивание, и реакция легко воспроизводима.
Внутрипротоковая папиллома
Эти образования возможны в любом месте в пределах системы протоков от соска до терминальной дольково-протоковой единицы. Бывают доброкачественные варианты (внутрипротоковая папиллома), атипические (атипическая папиллома) и злокачественные (внутрипротоковый папиллярный рак).
Среди внутрипротоковых папиллом в зависимости от локализации выделяют центральные и периферические варианты. Центральная внутрипротоковая папиллома — это одиночное образование, располагающееся, как правило, в субареолярной зоне, часто в кистозно-расширенном протоке. Периферические внутрипротоковые папилломы чаще множественные. Большинство исследователей считают, что одиночные внутрипротоковые папилломы не имеют тенденции к малигнизации. Множественные папилломы, особенно в периферических отделах дольково-протоковой системы, склонны к озлокачествлению. Большие затруднения возникают при диагностике центральных внутрипротоковых папиллом, так как они могут клинически сопровождаться кровянистыми выделениями из соска [5].
Диагностика папиллом включает обязательно маммографию, ультразвуковое исследование (УЗИ), а также цитологическое исследование выделений из соска.
Внутрипротоковая папиллома — округлое образование с четкой границей размером 3–4 см, но возможны процессы, занимающие несколько сантиметров в диаметре. Внутрипротоковая папиллома представлена сосочковыми разрастаниями, состоящими из фиброваскулярной ножки, покрытой эпителием и миоэпителием (фото 20). Часто отмечают апокринизацию эпителия [5].
Фото 20. Внутрипротоковая папиллома. Гематоксилин-эозин, х 200
Фото 21. Внутрипротоковая папиллома. Видны отдельные сосочки с фиброзной стромой и однорядной эпителиальной выстилкой. Гематоксилин-эозин, х 200
Фото 22. Периферическая внутрипротоковая папиллома. Гематоксилин-эозин, х 200
Фото 23. Атипическая внутрипротоковая папиллома. Сосочки имеют грубоволокнистую соединительнотканную основу, миоэпителиальный компонент и один или несколько слоев эпителиальных клеток с гиперхромными ядрами. Гематоксилин-эозин, х 200
Термин «папилломатоз» молочной железы эксперты ВОЗ рекомендуют избегать и использовать термин «множественные внутрипротоковые папилломы».
Все внутрипротоковые папилломы имеют общий морфологический код в Международном классификаторе онкологических заболеваний — 8503/0.
Центральная внутрипротоковая папиллома
Составляет 10% всех доброкачественных поражений молочной железы. Чаще выявляют у женщин среднего возраста (40–50 лет). Пальпаторные поражения — это округлые образования с четко ограниченными контурами, имеется связь с расширенным крупным протоком. Пункционная биопсия позволяет получить серозное содержимое. Размер, как правило, большой, от 3–4 мм до нескольких сантиметров.
Гистологическое строение центральной и периферической внутрипротоковой папилломы одинаковое. Однако, учитывая большие размеры центральной папилломы, в ней можно отметить участки двух видов: протоковый и папиллярный. Папиллярные образования представлены фиброваскулярной ножкой, покрытой двумя слоями эпителия. Протоковый компонент имеет строение описанных выше протоковых гиперплазий. Опухоли, в которых преобладает протоковый компонент и склероз стромы, обычно называют «склерозирующая папиллома».
В центральных внутрипротоковых папилломах могут быть представлены участки пролиферации миоэпителия, апокринизация эпителия, плоскоклеточная, хрящевая и костная метаплазия, внутрипротоковая пролиферация эпителия, воспалительная инфильтрация. Отсутствие клеточной атипии, инвазии стромы позволит диагностировать центральную внутрипротоковую папиллому. Особенно кропотливой работы требуют папилломы с участками, имитирующими микроинвазию. Большую помощь в таких случаях оказывает иммуногистохимическое исследование компонентов базальной мембраны и миоэпителия. Чаще для этих целей применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
Периферическая внутрипротоковая папиллома
В отличие от центральной внутрипротоковой папилломы, эта опухоль развивается у женщин более молодого возраста. Клиническое течение чаще протекает скрыто. Большие размеры папиллом могут пальпироваться. Маммография выявляет чаще множественные узловые образования с четкими контурами, возможны микрокальцинаты.
Характерный мультицентричный рост периферической внутрипротоковой папилломы может быть на фоне внутрипротоковой гиперплазии, карциномы in situ или инвазивного рака.
Термин «микропапиллома» применяют к малым формам периферической внутрипротоковой папилломы. Часто микропапилломы выявляют в больших фокусах аденоза молочной железы.
Атипическая внутрипротоковая папиллома
Эта форма внутрипротоковой папилломы выделена из-за ее важного прогностического значения, поскольку именно на фоне атипической внутрипротоковой папилломы чаще возникают инвазивные карциномы.
В отличие от описанных выше папиллом, атипическая внутрипротоковая папиллома характеризуется ядерной атипией, часто многорядностью эпителия, наличием солидных участков с некрозами, могут быть небольшие участки высокодифференцированной карциномы in situ. Если участки рака в папилломе значительные (до 90% площади), то к этой опухоли применим термин «внутрипротоковый папиллярный рак». Характерной особенностью этого рака является отсутствие инвазии опухолевых клеток через базальную мембрану в окружающую строму. Кроме исследования большого количества срезов опухоли, исключить очаги инвазии помогает имуногистохимическое исследование с антителами к коллагену IV типа и гладкомышечному актину, а также отсутствие лимфогистиоцитарной инфильтрации в строме вокруг папилломы.
Внутрипротоковый папиллярный рак лишен (почти на всем протяжении) миоэпителиального клеточного слоя и характеризуется пролиферацией атипичного эпителия (фото 24). Часто бывает мультицентричный рост.
Фото 24. Внутрипротоковый папиллярный рак. Часть сосочков не имеет соединительной ткани в своей основе и состоит из атипичных эпителиальных клеток. Гематоксилин-эозин, х 400
Эта опухоль имеет свой морфологический код в Международном классификаторе онкологических заболеваний — 8503/2.
Предопухолевая патология молочной железы | Компендиум — справочник лекарственных препаратов
Дольковая (лобулярная) неоплазия молочной железы
Наиболее сложным в патологической анатомии является вопрос дифференциальной диагностики гиперпластических процессов, которые возникают на фоне гормональной стимуляции, прежде всего гиперэстрогении, и начальных форм РМЖ.
Дольковая неоплазия наиболее часто развивается у женщин в предменопаузальный период (в возрасте 45–47 лет) и составляет 1–3,8% всех эпителиальных патологических процессов молочной железы. В 0,5–4% материала биопсий, взятых по поводу доброкачественных заболеваний молочной железы, выявляют дольковую неоплазию разной степени дифференцировки. В 85% случаев дольковая неоплазия возникает мультицентрично и в 30–67% — билатерально.
Для лобулярной неоплазии характерна пролиферация мелкого эпителия, расположенного в просвете долек, со слабым межклеточным соединением, с педжетоидной реакцией или без нее. Происходит дольковая неоплазия из эпителия концевой (терминальной) протоково-дольковой единицы молочной железы. Выраженность атипии, степень пролиферации, количество атипических митозов зависят от степени дифференцировки неоплазии. Выделяют два типа клеток дольковой неоплазии: тип А и тип В. Тип А состоит из мономорфных эпителиальных клеток, тип В — из крупных полиморфных клеток с выраженными признаками атипии. Хотя клетки крупные, они гораздо мельче эпителия протоков.
Может быть смешанный тип, представленный сочетанием в разной пропорции клеток типа А и В.
Термины «атипическая дольковая неоплазия» и «рак in situ» используют, чтобы подчеркнуть их важное прогностическое значение и для указания степени атипии клеток в очаге поражения. Однако известны публикации, свидетельствующие об отсутствии разницы клинического течения атипической дольковой неоплазии и рака in situ, а также разницы в прогнозе дальнейшего развития на их фоне инвазивного рака [203, 204].
Согласно Классификации РМЖ ВОЗ (2003) рекомендуется пользоваться термином «дольковая неоплазия», подразделяя ее на три степени и термин «дольковый рак in situ».
Деление на степени дифференцировки дольковой неоплазии происходит в зависимости от выраженности клеточного полиморфизма, наличия некрозов, признаков атипии и количества митозов.
Легкая степень дольковой неоплазии (первая степень неоплазии) характеризуется сохранением альвеолярной архитектоники, пролиферацией в одной или нескольких дольках мелких мономорфных эпителиальных клеток, слабо сцепленных между собой (клетки типа А). Как правило, клетки в очаге пролиферации имеют округлое, нечетко отграниченное ядро и скудную цитоплазму. Некрозы, митозы и кальцинаты редки. Иногда отмечают очаги пролиферации и полиморфизма клеток, появляются скопления крупных клеток, но эти признаки представлены незначительно. В единичных дольках могут быть признаки апокриновой неоплазии (фото 3).
Фото 3. Легкая степень дольковой неоплазии. Общее строение дольки сохранено, однако количество долек значительно увеличено, отмечается выработка секрета, эпителий мелкий мономорфный. Гематоксилин-эозин, х 100
Умеренная дольковая неоплазия (вторая степень неоплазии) характеризуется нарастанием полиморфизма эпителия долек, появлением большего количества крупных клеток с неправильной формой ядра и обильной цитоплазмой, отмечают единичные митозы и отдельные перстневидные клетки. Миоэпителиальные клетки чаще располагаются вдоль базальной мембраны, но могут вытесняться из обычного места расположения и примешиваться к эпителиальному пролиферату. Базальная мембрана сохранна на всем протяжении (фото 4, 5).
Фото 4. Умеренная степень дольковой неоплазии. Отмечается пролиферация и формирование многорядного эпителия, очаги секреции. Гематоксилин-эозин, х 200
Фото 5. Умеренная степень дольковой неоплазии. Эпителий полиморфный, формирует сосочки, миоэпителиальные клетки местами вытесняют эпителиальные. Гематоксилин-эозин, х 400
Тяжелая дольковая неоплазия (третья степень неоплазии) представлена в основном полиморфными клетками, заполняющими почти полностью просвет долек, чаще, чем в предыдущей стадии, выявляют митозы, в том числе атипические митозы, очаги некроза (фото 6). Данную дольковую неоплазию трудно дифференцировать от рака in situ. Основное отличие тяжелой дольковой неоплазии и рака in situ в том, что последний представлен малигнизированным эпителием, по клеточному составу не отличается от долькового рака и характеризуется сохранной базальной мембраной.
Фото 6. Тяжелая степень дольковой неоплазии. Дольки расширены, просвет полностью заполнен эпителиальными клетками. Гематоксилин-эозин, х 100
Фото 7. Дольковый рак in situ. Атипичные клетки заполняют просвет долек. Гематоксилин-эозин, х 100
Фото 8. Дольковый рак in situ. Видны микроочаги некроза в опухолевом инфильтрате. Гематоксилин-эозин, х 100
Фото 9. Простая протоковая гиперплазия. Некоторые протоки расширены в виде кист, в отдельных протоках видны признаки апокриновой секреции, однако общее строение протоков сохранено. Гематоксилин-эозин, х 100
Для описания атипической дольковой неоплазии часто используют термин «дольковый рак in situ». Все эти процессы имеют один морфологический код в Международном классификаторе онкологических заболеваний — 8520/2.
Рак in situ часто ассоциирован с микроинвазивным раком в окружающих участках, поэтому его исследование требует особой ответственности и внимания при установлении диагноза. Необходимо изучить большое количество срезов и края резекции. В сложных случаях для исключения инвазивного рака необходимо исследовать базальную мембрану для выявления ее целостности и доказать отсутствие нарушения миоэпителиального слоя и базальной мембраны.
Важным условием диагностики дольковой неоплазии является отсутствие инвазии опухолевыми клетками базальной мембраны. Для исключения инвазии применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
Рецепторы эстрогена по данным большинства авторов и нашим наблюдениям выявляют в 60–90% случаев долькового рака in situ, а рецепторы прогестерона редко. В низкодифференцированном дольковом раке in situ может быть определена экспрессия HER2/neu и белка p53, однако это нетипично для данной патологии.
Типичным для дольковой неоплазии тяжелой степени и рака in situ является отсутствие экспрессии цитокератина СК 5/7 и E—cadherin.
Но цитокератин высокой молекулярной массы (HMW CK 34BE12) присутствует в цитоплазме клеток долькового рака in situ. Это является важным дифференциальным признаком для диагностики протокового и долькового рака.
Через довольно длительный промежуток времени у некоторых женщин на фоне рака in situ возникают инвазивные формы рака, но следует отметить, что дольковый рак in situ не обязательно является предраком инфильтративных форм.
Внутрипротоковые пролиферативные поражения
К ним относят простую протоковую гиперплазию, гиперплазию со слабо выраженной пролиферацией эпителия, атипическую протоковую гиперплазию и протоковый рак in situ (трех степеней дифференцировки).
Существуют два классификационных подхода к оценке эпителиальных пролиферативных поражений протоков. Касательно молочной железы одновременно используют две классификационные схемы.
| Традиционная терминология (классификация ВОЗ) | Терминология DIN |
|
Простая протоковая гиперплазия |
Простая протоковая гиперплазия |
|
Слабо выраженная протоковая атипия |
Протоковая интраэпителиальная неоплазия Grade1А |
|
Атипическая протоковая гиперплазия |
Протоковая интраэпителиальная неоплазия Grade1В |
|
Протоковый рак in situ Grade1 |
Протоковая интраэпителиальная неоплазия Grade1С |
|
Протоковый рак in situ Grade2 |
Протоковая интраэпителиальная неоплазия Grade2 |
|
Протоковый рак in situ Grade3 |
Протоковая интраэпителиальная неоплазия Grade3 |
Левый столбик отражает взгляды большинства экспертов ВОЗ, терминологию, представленную справа, используют преимущественно в Северной Америке.
Нам кажется, что классификация ВОЗ более отражает сущность опухолевой трансформации, кроме того эта схема более воспроизводима и более наглядна для восприятия в реальных практических условиях.
Традиционно внутрипротоковую пролиферацию разделяют на простую протоковую гиперплазию, атипическую протоковую гиперплазию и рак in situ. Однако сложилось так, что группа рак in situ оказалась гетерогенной, в нее вошли процессы, имеющие различное клиническое проявление, различную гистологическую структуру, различные биологические маркеры и генетические аномалии.
Популяционный маммологический скрининг требует выделения патологических состояний, имеющих чрезвычайно высокий риск развития инвазивного рака молочной железы. Результаты дальнейших клинических исследований показали, что различные внутрипротоковые пролиферации с различной частотой переходят в рак in situ и инвазивный рак. Так, риск развития инвазивного РМЖ из простой протоковой гиперплазия составляет 1,5%, из атипической протоковой гиперплазии 4–5% и рака in situ 8–10% [1].
Термин «интраэпителиальная неоплазия» широко используют для описания патологии не только молочной железы, но и предстательной железы, шейки матки.
При этом независимо от органа поражения очень трудно провести грань между атипической гиперплазией и раком in situ. Для этого используют особенности морфологического строения, подсчет количества митозов, наличие некрозов, но в основном признаки цитологической и тканевой атипии.
Простая (обычная) протоковая гиперплазия часто возникает на фоне мастопатии и выглядит как пролиферация эпителия с признаками некоторого полиморфизма внутри протоков. Протоки располагаются неравномерно, их размеры разные. Характерно изменение нормальной структуры протоков, формирование расширенных, неправильной формы протоков вокруг долек нормального строения. Протоки ветвятся в виде ручейков от центра участка гиперплазии к периферии. Клеточные пролифераты могут формировать солидные участки, криброзные структуры, мостики.
Клеточный состав пролифератов полиморфный. Причем необходимо отметить, что полиморфизм клеток неопухолевый. Эпителий протоков, несмотря на различный размер ядер и разную выраженность цитоплазмы, имеет зрелый вид. Полиморфизм клеток формируется за счет наличия эпителия, находящегося в функционально различном состоянии. В одном протоке могут отмечать клетки с выраженными признаками секреции (часто эти клетки находятся в центре протока), а также с признаками пролиферации (чаще возле базальной мембраны). Эпителиальные клетки могут формировать 2–4 слоя. Следует отметить, что общее строение протоков сохранено, имеется четкая базальная мембрана, слой миоэпителиальных клеток. Возможны очаги апокриновой метаплазии. Наличие такого разнообразия типов клеток является характерным для этого вида гиперплазии. Не исключается наличие микрокальцинатов и некрозов. В случаях отсутствия истинной атипии клеток эти признаки не должны склонить патолога в сторону диагноза «атипическая гиперплазия» или «рак in situ». Следует отметить, что некрозы и микрокальцинаты часто имитируют рак in situ. Решающее значение в установлении диагноза имеют цитологические признаки истинной атипии (фото 10).
Фото 10. Простая протоковая гиперплазия. Участок апокриновой метаплазии. Гематоксилин-эозин, х 100
Фото 11. Протоковая неоплазия со слабо выраженной атипией. Гематоксилин-эозин, х 100
Критерии простой протоковой гиперплазии
Цитологические. Вариабельность форм ядер с гиперхромными округлыми и овальными ядрышками, ассиметричными нуклеолами.
Гистологические. Эпителиальные клетки имеют тенденцию к беспорядочному расположению в протоках, отмечается вариабельность расстояния между ядрами, ориентация клеток нарушена, их цитоплазма нечетко очерчена, часто выявляют секрецию.
Интерцеллюлярные расстояния отличаются по размеру и форме, часто отмечают щелеподобные структуры.
Иммуногистохимическое исследование подтверждает мозаичность различных паттернов клеток. Часть клеток экспрессирует цитокератин высокой молекулярной массы (СК HMW), таких как СК 5/10/14. Отмечается высокая экспрессия E—cadherin. Количество клеток, имеющих рецептор эстрогена, выше, чем в нормальной ткани молочной железы. Cyclin D1 выявлен в 11–19% случаев простой протоковой гиперплазии [1].
Риск развития инвазивного рака из простой протоковой гиперплазии составляет 2,6% за период наблюдения около 14 лет. Следует отметить, что такой процент инвазивного рака на фоне атипической протоковой гиперплазии формируется за 8,3 года [61]. В другом исследовании указывается, что в 4% случаев простая протоковая гиперплазия транформировалась в инвазивный РМЖ за 15 лет наблюдения [62]. Однако риск развития рака на фоне этой гиперплазии значительно ниже, чем при других вариантах гиперплазий.
Обычная протоковая гиперплазия является одним из морфологических проявлений гормональных изменений в организме женщины.
Морфофункциональные изменения, возникающие в различные периоды менструального цикла и беременности, могут симулировать обычную протоковую гиперплазию, поэтому патологоанатом должен иметь информацию о состоянии женщины, ее возрасте, наличии эндокринных и гинекологических заболеваний. Обязательно следует выдерживать сроки взятия биопсии или проведения операции в соответствии с менструальным циклом.
Протоковая неоплазия со слабо выраженной атипией
В данном варианте протоковой неоплазии по сравнению с предыдущим более выражена пролиферация эпителия, клетки формируют в протоке от 1 до 3–5 рядов, более существенно проявление атипии клеток. Папиллярные, криброзные, солидные пролифераты отсутствуют. Часто отмечают секрецию эпителия (цитоплазма клеток становится обильной светлой пенистой, ядро расположено ассиметрично, ближе к базальному краю) и секрет в просвете протоков (фото 12–14). Возможны микрокальцинаты. Морфологическая картина при этой патологии соответствует протоковой интраэпителиальной неоплазии Grade1А.
Фото 12. Протоковая неоплазия со слабо выраженной атипией. Гематоксилин-эозин, х 200
Фото 13. Протоковая неоплазия со слабо выраженной атипией. Эпителий протоков формируют микропапиллярные структуры и сосочки. Гематоксилин-эозин, х 200
Фото 14. Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами. Гематоксилин-эозин, х 200
Риск развития инвазивного рака на фоне простой протоковой атипии выше, чем на фоне простой протоковой гиперплазии.
Атипическая протоковая гиперплазия
Это заболевание характеризуется более выраженной пролиферацией эпителия, усилением признаков клеточного полиморфизма и появлением атипии разной степени выраженности. Заболевание характеризуется умеренным риском развития инвазивного рака молочной железы.
В протоках отмечают равномерное распределение мономорфных клеток с округлым ядром. Эпителиальные клетки формируют папиллярные структуры, солидные группы, пучки, аркады, криброзные структуры внутри протоков. Морфологическая картина соответствует протоковой интраэпителиальной неоплазии Grade1В, местами протоки похожи на рак in situ G-1. Для атипической протоковой гиперплазии обязательны участки простой протоковой гиперплазии. Для исключения рака in situ общим требованием является взятие на исследование ткани через каждый 1 мм и исследование серийных срезов гистологического блока.
Микрокальцинаты могут отсутствовать, быть представленными фокально или на большом протяжении. Это не является ведущим фактором для установления диагноза (фото 15–19).
Фото 15. Атипическая протоковая гиперплазия. Некроз и кальцинаты в протоках. Гематоксилин-эозин, х 200
Фото 16. Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами, формирует криброзные структуры, слева отмечается очаг некроза, во многих протоках явления секреции. Гематоксилин-эозин, х 200
Фото 17. Атипическая протоковая гиперплазия. Атипичный эпителий в протоках формирует солидные пласты, однако нет инвазии стромы. Гематоксилин-эозин, х 200
Фото 18. Тот же участок. Видны атипичные клетки с гиперхромными ядрами, нет инвазии стромы. Гематоксилин-эозин, х 400
Фото 19. Экспрессия гладкомышечного актина (клон HHF35, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Миоэпителиальные клетки в виде непрерывной линии вдоль базальной мембраны. х 200
Рецепторы эстрогена и прогестерона выявляют в большом количестве клеток, белок ERBB2 экспрессируется крайне редко, экспрессия этого белка более характерна для рака in situ. Белок р53 не выявляют как в атипической протоковой гиперплазии, так и раке in situ. Однако экспрессия Cyclin D1 выявлена в 27–57% случаев атипической протоковой гиперплазии. Около 90% случаев атипической протоковой гиперплазии не имеют экспрессии цитокератина высокого молекулярного веса (СК HMW), таких как СК 5/10/14, поэтому их можно использовать для дифференциальной диагностики с простой протоковой гиперплазией [1].
Атипическая протоковая гиперплазия имеет довольно высокий риск развития инвазивного РМЖ. По данным различных авторов инвазивный рак развивается в 3,7–22% случаев атипической протоковой гиперплазии [66, 67].
Важнейшим отличительным признаком любой формы протоковой интраэпителиальной неоплазии является наличие непрерывной базальной мембраны и слоя миоэпителиальных клеток. В зависимости от степени протоковой интраэпителиальной неоплазии количество эпителиальных клеток отличается.
Наиболее важная и сложная задача патологоанатома — не пропустить инвазию опухолевыми клетками базальной мембраны. Эта задача может быть выполнена только в результате кропотливого исследования большого количества срезов, отбора наиболее подозрительных на малигнизацию участков и проведения дополнительных методов окраски базальной мембраны и миоэпителиальных клеток. Неоценимую помощь в этом оказывает иммуногистохимический метод исследования. Для маркировки миоэпителиальных клеток мы часто применяем антитела к гладкомышечному актину, которые дают четкое окрашивание, и реакция легко воспроизводима.
Внутрипротоковая папиллома
Эти образования возможны в любом месте в пределах системы протоков от соска до терминальной дольково-протоковой единицы. Бывают доброкачественные варианты (внутрипротоковая папиллома), атипические (атипическая папиллома) и злокачественные (внутрипротоковый папиллярный рак).
Среди внутрипротоковых папиллом в зависимости от локализации выделяют центральные и периферические варианты. Центральная внутрипротоковая папиллома — это одиночное образование, располагающееся, как правило, в субареолярной зоне, часто в кистозно-расширенном протоке. Периферические внутрипротоковые папилломы чаще множественные. Большинство исследователей считают, что одиночные внутрипротоковые папилломы не имеют тенденции к малигнизации. Множественные папилломы, особенно в периферических отделах дольково-протоковой системы, склонны к озлокачествлению. Большие затруднения возникают при диагностике центральных внутрипротоковых папиллом, так как они могут клинически сопровождаться кровянистыми выделениями из соска [5].
Диагностика папиллом включает обязательно маммографию, ультразвуковое исследование (УЗИ), а также цитологическое исследование выделений из соска.
Внутрипротоковая папиллома — округлое образование с четкой границей размером 3–4 см, но возможны процессы, занимающие несколько сантиметров в диаметре. Внутрипротоковая папиллома представлена сосочковыми разрастаниями, состоящими из фиброваскулярной ножки, покрытой эпителием и миоэпителием (фото 20). Часто отмечают апокринизацию эпителия [5].
Фото 20. Внутрипротоковая папиллома. Гематоксилин-эозин, х 200
Фото 21. Внутрипротоковая папиллома. Видны отдельные сосочки с фиброзной стромой и однорядной эпителиальной выстилкой. Гематоксилин-эозин, х 200
Фото 22. Периферическая внутрипротоковая папиллома. Гематоксилин-эозин, х 200
Фото 23. Атипическая внутрипротоковая папиллома. Сосочки имеют грубоволокнистую соединительнотканную основу, миоэпителиальный компонент и один или несколько слоев эпителиальных клеток с гиперхромными ядрами. Гематоксилин-эозин, х 200
Термин «папилломатоз» молочной железы эксперты ВОЗ рекомендуют избегать и использовать термин «множественные внутрипротоковые папилломы».
Все внутрипротоковые папилломы имеют общий морфологический код в Международном классификаторе онкологических заболеваний — 8503/0.
Центральная внутрипротоковая папиллома
Составляет 10% всех доброкачественных поражений молочной железы. Чаще выявляют у женщин среднего возраста (40–50 лет). Пальпаторные поражения — это округлые образования с четко ограниченными контурами, имеется связь с расширенным крупным протоком. Пункционная биопсия позволяет получить серозное содержимое. Размер, как правило, большой, от 3–4 мм до нескольких сантиметров.
Гистологическое строение центральной и периферической внутрипротоковой папилломы одинаковое. Однако, учитывая большие размеры центральной папилломы, в ней можно отметить участки двух видов: протоковый и папиллярный. Папиллярные образования представлены фиброваскулярной ножкой, покрытой двумя слоями эпителия. Протоковый компонент имеет строение описанных выше протоковых гиперплазий. Опухоли, в которых преобладает протоковый компонент и склероз стромы, обычно называют «склерозирующая папиллома».
В центральных внутрипротоковых папилломах могут быть представлены участки пролиферации миоэпителия, апокринизация эпителия, плоскоклеточная, хрящевая и костная метаплазия, внутрипротоковая пролиферация эпителия, воспалительная инфильтрация. Отсутствие клеточной атипии, инвазии стромы позволит диагностировать центральную внутрипротоковую папиллому. Особенно кропотливой работы требуют папилломы с участками, имитирующими микроинвазию. Большую помощь в таких случаях оказывает иммуногистохимическое исследование компонентов базальной мембраны и миоэпителия. Чаще для этих целей применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
Периферическая внутрипротоковая папиллома
В отличие от центральной внутрипротоковой папилломы, эта опухоль развивается у женщин более молодого возраста. Клиническое течение чаще протекает скрыто. Большие размеры папиллом могут пальпироваться. Маммография выявляет чаще множественные узловые образования с четкими контурами, возможны микрокальцинаты.
Характерный мультицентричный рост периферической внутрипротоковой папилломы может быть на фоне внутрипротоковой гиперплазии, карциномы in situ или инвазивного рака.
Термин «микропапиллома» применяют к малым формам периферической внутрипротоковой папилломы. Часто микропапилломы выявляют в больших фокусах аденоза молочной железы.
Атипическая внутрипротоковая папиллома
Эта форма внутрипротоковой папилломы выделена из-за ее важного прогностического значения, поскольку именно на фоне атипической внутрипротоковой папилломы чаще возникают инвазивные карциномы.
В отличие от описанных выше папиллом, атипическая внутрипротоковая папиллома характеризуется ядерной атипией, часто многорядностью эпителия, наличием солидных участков с некрозами, могут быть небольшие участки высокодифференцированной карциномы in situ. Если участки рака в папилломе значительные (до 90% площади), то к этой опухоли применим термин «внутрипротоковый папиллярный рак». Характерной особенностью этого рака является отсутствие инвазии опухолевых клеток через базальную мембрану в окружающую строму. Кроме исследования большого количества срезов опухоли, исключить очаги инвазии помогает имуногистохимическое исследование с антителами к коллагену IV типа и гладкомышечному актину, а также отсутствие лимфогистиоцитарной инфильтрации в строме вокруг папилломы.
Внутрипротоковый папиллярный рак лишен (почти на всем протяжении) миоэпителиального клеточного слоя и характеризуется пролиферацией атипичного эпителия (фото 24). Часто бывает мультицентричный рост.
Фото 24. Внутрипротоковый папиллярный рак. Часть сосочков не имеет соединительной ткани в своей основе и состоит из атипичных эпителиальных клеток. Гематоксилин-эозин, х 400
Эта опухоль имеет свой морфологический код в Международном классификаторе онкологических заболеваний — 8503/2.
Вопросы-ответы | страница 1
Вопросов: 124
Здравствуйте, Дмитрий Андреевич. У меня уплотнение на груди, прошла врача онколога, назначили пункцию. Прошла цитологическое обследование, пункцию брали из молочной железы.результат исследования обнаружены пласты нейтрофилов, макрофаги, лемфоциты, аморфный клеточный детрит. О чем это может говорить? Заранее спасибо Вам.
Вопрос # 41985 | Тема: Цитологическое исследование | 04.04.2019 | БелгородЗдравствуйте, Анна. Вероятно, в молочной железе происходит воспалительный процесс. Чтобы судить о ситуации, надо смотреть вас, видеть результаты УЗИ.
После цитологического обследования получен результат.Как можно его расшифровать.В полученном материале обнаружены эритроциты,небольшое количество бесструктурного вещества,одиночные скопления клеток уплощенного кубического эпителия.
Вопрос # 41955 | Тема: Цитологическое исследование | 02.04.2019 | НижневартовскЗдравствуйте, Анжела. Данное исследование скорее соответствует фиброаденоме — доброкачественной опухоли молочной железы. Надо смотреть вас, смотреть результаты УЗИ молочных желез, маммографии, если таковые выполнялись. В любом случае вам надо ориентироваться на мнение лечащего врача.
Подскажите пожалуйста, что означает диагноз цитологического исследования биопсия молочной железы, в материале обнаружены кровь, жир! На УЗИ многокамерный жидкостное образование с признаками кровотока, имеющее четкие неровные контуры размером 10 на 17мм
Вопрос # 41905 | Тема: Цитологическое исследование | 30.03.2019 | КазаньЗдравствуйте, Наталья. Данное исследование я бы расценил как неинформативное. По поводу новообразования в молочной железе — надо смотреть вас, возможно, потребуется выполнение оперативного вмешательства с целью удаления данной опухоли и проведения гистологического исследования. В любом случае вам надо ориентироваться на мнение лечащего врача.
Добрый день. Не могу попасть ко врачу, сдавала цитологию пришёл результат: В полученном материале- бесструктурное вещество, эритроциты, элементы жировой ткани, единичные группы эпителия м/ж без атипии
Вопрос # 41764 | Тема: Цитологическое исследование | 19.03.2019 | ЕкатеринбургЗдравствуйте, дублирую вопрос так как не уверена что он к вам отправлен. У меня гипоэхогенное аваскулярное образование с четкими контурами 22*15мм. Предположили фиброаденому. Цитология такая: в представленном материале кровь.единичные группы эпителия молочной железы с пролиферацией, без атипии. Скажите насколько все опасно в моем случае? Если есть пролиферация значит это рак или предрак?
Вопрос # 41770 | Тема: Цитологическое исследование | 19.03.2019 | МоскваДобрый день. Подскажите, пришёл цитологический анализ при пункции молочной железы: кровь, жир, единичные фиброциты. Что это ?
Вопрос # 41639 | Тема: Цитологическое исследование | 14.03.2019 | КраснодарДобрый день! Подскажите, пожалуйста, что означают результаты цитологии. К врачу только через неделю. «В мазке-отпечатке из соска левой молочной железы обнаружены эритроциты, бесструктурное вещество, единичные клетки типа молозивных телец, единичные клетки протокового эпителия. Клеточный состав скудный». О чем это свидетельствует? Жалобы на периодические кратковременные жгучие ощущения, по УЗИ кисты. Очень переживаю.
Вопрос # 41604 | Тема: Цитологическое исследование | 11.03.2019 | Россия, МоскваДобрый день. Помогите расшифровать пункцию мж:на фоне эритроцитов встречаются группы и клетки апокринной выстелки кисты. А типичные клетки не обнаружены. Заключение киста мж. Это нормально? Что значит апокринный клетки? Это не предрак? Очень боюсь, помогите.
Вопрос # 41542 | Тема: Цитологическое исследование | 06.03.2019 | МоскваЗдравствуйте, Виктория. Нет, о предраковом состоянии в данном заключении речи не идет.
Добрый день. Помогите, пожалуйста, расшифровать результаты цитологических исследований выделений из молочных желез. Правая МЖ: материал представлен гомогенным веществом, каплями липидов, роговыми чешуйками плоского эпителия. Левая МЖ: материал представлен плотным гомогенным веществом, каплями липидов, немногочисленными элементами воспаления, роговыми чешуйками плоского эпителия, группами клеток протоков ого эпителия. В левой подмышечной впадине увеличен до 14 мм лимфатический узел. По УЗИ под вопросом фиброаденома правой и левой МЖ.
Вопрос # 41299 | Тема: Цитологическое исследование | 13.02.2019 | Россия Нижний НовгородЗдравствуйте, Екатерина. Данные цитологических исследований я бы расценил как неинформативные. Чтобы определиться с тактикой лечения в вашем случае, надо смотреть вас, смотреть результаты всех исследований.
Добрый день, помогите расшифровать цитологическое заключение: В полученном материале обнаружены эритроциты, скопления клеток с признаками гиперплазии. Цитограмма фиброаденомы. Локализация: Пунктат левой молочной железы
Вопрос # 41287 | Тема: Цитологическое исследование | 12.02.2019 | МоскваЗдравствуйте, Артем. Речь идет о фиброаденоме — доброкачественной опухоли молочной железы. Фиброаденома не перерождается в рак. Обычно показанием к удалению фиброаденомы является быстрый рост опухоли, подозрение на рак молочной железы, канцерофобия или пожелание женщины, а также косметический дефект. В любом случае вам надо ориентироваться на мнение лечащего врача.
Рак молочной железы
Подробнее о болезни
Структуру грудных желез составляет три типа ткани — жировая, железистая и соединительная. Злокачественное новообразование, возникает именно в железистой ткани. Занимает одно из первых мест по распространенности среди онкологических патологий у женщин. Может поражать и мужчин, но крайне редко. На долю представителей сильной половины, приходится менее 1% от всего числа заболевших.
Преимущественно, опухоли образуются из долей грудной железы (инвазивная лобулярная карцинома) или клеток молочного протока (протоковая карцинома). Выделяют следующие стадии заболевания:
Современные методы диагностики способны обнаруживать злокачественное образование на первоначальной стадии. А это означает — болезнь можно полностью победить. Все, что нужно женщинам — пройти ежегодное профилактическое обследование молочных желез! Записаться на консультацию к специалистам GMS Hospital можно онлайн или по телефону.
Зачем нужна операция
Рак груди возникает так же, как и любые иные злокачественные опухоли. Одна или несколько клеток железистого эпителия, подвергшихся мутации, начинают быстро делиться. Сформированное новообразование обладает способностями прорастать в близлежащие ткани, а также формировать вторичные опухоли (метастазы). Избавиться от злокачественного образования можно лишь хирургическим путем. Оперативное вмешательство обязательно сопровождается противоопухолевой терапией (гормональной, лучевой, таргентной, химиотерапией).
Почему выбирают нас
В хирургическом центре GMS Hospital для лечения рака груди применяется комплексный подход, оптимально сочетающий оперативные, радиотерапевтические и химиотерапевтические методики. Консилиум опытных специалистов, предложит пациентке тот вариант лечения, который в данном клиническом случае обеспечит максимальный результат — как терапевтический, так и эстетический.
Врачи GMS Hospital отдают предпочтение ограносохраняющим хирургическим методам, но в ряде случаев избежать мастэктомии (полного удаления молочной железы) невозможно. Терапевтическая тактика, объем и технология хирургического вмешательства, зависят от стадии болезни, размеров образования, распространенности злокачественного процесса, наличия метастазов и других факторов.
Западные стандарты лечения(evidence-based medicine)
Непрерывное повышениеквалификации персонала
Регулярное взаимодействиес ведущими российскими и зарубежными медицинскими учреждениями
Современное медицинское оборудованиеи передовые методики диагностики и лечения
Единый стандарт обслуживания Мы работаем круглосуточно24 / 7 / 365
Причины болезни
Несмотря на то, что данный тип злокачественных опухолей изучен лучше других, о точных причинах развития болезни и сегодня ведутся жаркие споры. Существует ряд предрасполагающих агентов, которые могут стать спусковым крючком для мутации клеток и их аномального разрастания:
- Генетические причины — трансформации в генах BRCA1 и BRCA2 увеличивают риск заболеть раком груди на 45–65%.
- Возраст — заболевание чаще диагностируется у людей старше 50 лет.
- Бесплодие или поздние роды (старше 35 лет).
- Наличие в анамнезе мастопатий.
- Гормональные нарушения.
- Травмы молочной железы.
- Вредные привычки — алкоголь, курение.
- Избыточный вес.
- Сахарный диабет.
- Постоянные стрессы, депрессия.
Однако, от подобного диагноза не застрахованы женщины, которые не входят ни в одну из вышеперечисленных групп риска.
Признаки и симптомы
Коварство болезни в том, что на ранней стадии онкология себя ничем не проявляет. Но существуют признаки, характерные для злокачественной опухоли, возникновение которых должно насторожить. Запишитесь на консультацию к врачу, если вы заметили даже один из следующих симптомов:
- Появление в молочной железе уплотнений.
- Грудь изменила форму.
- Кожа на груди сморщилась или втянулась.
- Появление сыпи, покраснения, эрозии на ограниченном участке кожи.
- Боль и дискомфорт в грудной железе.
- Из сосков появились выделения.
- Припухлость или втяжение соска.
- Венозный рисунок стал более выраженным.
- Увеличились лимфоузлы в подмышечной впадине или появилось уплотнение.
Любые изменения в грудных железах — серьезный повод для обращения к доктору. Запись на консультацию к маммологу-онкологу осуществляется круглосуточно, на сайте или по телефону.
Диагностика
Обследование по поводу злокачественных опухолей в центре хирургии GMS проводится с применением современных методик. Диагностические мероприятия начинают с мануального обследования груди. При наличии каких-либо подозрений на опухолевый процесс, назначаются:
Какие методы лечения используются
Схема лечения злокачественного процесса, напрямую зависит от стадии болезни, чувствительности атипичных клеток к гормонам, темпов роста и строения образования, общего состояния здоровья. В хирургическом центре GMS Hospital к лечению болезни подходят комплексно, то есть, оптимально сочетая хирургические, лучевые и химиотерапевтические методы. Активно применяется таргетная и гормональная терапия (при определенных формах злокачественных образований, чувствительных к гормонам).
Вариант оперативного вмешательства подбирается в зависимости от стадии, объема новообразования. Если злокачественный процесс был обнаружен рано и не успел распространиться, предпочтение отдается органосохраняющим техникам — лампэктомии. Хирург удаляет полностью опухоль и частично окружающие ее здоровые ткани. К таким радикальным методам, как мастэктомия, прибегают, если:
- Образование проросло в грудную стенку, кожу железы.
- Опухоль имеет достаточно большой размер.
- Злокачественный процесс распространился по всей груди.
До и\или после хирургического лечения проводится химиотерапия. Цель предоперационной химиотерапии — уменьшение размеров первичного образования. Постоперационная химиотерапия назначается с целью предотвращения метастазирования в будущем или уничтожения уже имеющихся метастазов
Лучевая терапия назначается в следующих случаях:
- В качестве профилактики после оперативного вмешательства.
- В качестве симптоматической терапии при неоперабельных опухолях (паллиативное лечение).
- Как симптоматическое лечение при наличии отдаленных метастаз и осложнений (болях, сдавлении головного или спинного мозга).
Если клетки опухоли имеют рецепторы HER2, проводится таргетная терапия — применяются специальные препараты, блокирующие активность этого рецептора. Для лечения гормончувствительных образований, используют гормональную терапию. Совокупность находящихся в арсенале наших специалистов методик лечения рака груди, позволяет добиваться стойкой ремиссии болезни и значительного улучшения качества жизни пациентов. Однако, необходимо помнить, что результативность терапии полностью зависит от того, насколько своевременно она была начата.
Профилактика
Единственный действенный метод профилактики рака молочной железы — регулярное самообследование груди и осмотры маммолога (1 раз в год). Важное значение имеет здоровый образ жизни и умение эффективно избавляться от последствий стрессов и негативных эмоций.
Генетический маркер риска онкологических заболеваний дает возможность распознавать предрасположенность к образованию рака молочной железы. Это анализ на наличие трансформаций в генах BRCA1, GSTМ1, BRCA2, NBN, CHEK2. В рамках исследования определяется 10 самых часто встречаемых дефектов в этих генах. Выявление генных аномалий у здоровых женщин, в случае развития болезни, позволяет своевременно ее диагностировать и предупредить тяжелые последствия. Получить более подробную информацию можно на консультации онколога GMS Hospital. Запишитесь на прием уже сегодня, онлайн или по телефону.
Пункция молочной железы — Вопрос маммологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 72 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, подолога, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.52% вопросов.
Оставайтесь с нами и будьте здоровы!
Группы клеток кубического эпителия — Вопрос маммологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 72 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, подолога, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.52% вопросов.
Оставайтесь с нами и будьте здоровы!
Эпителий молочного протока высокого риска — Просмотр полного текста
Справочная информация:
Рак груди — наиболее распространенное злокачественное новообразование у женщин, ежегодно встречающееся у более чем 230 000 женщин в Соединенных Штатах.
Подавляющее большинство рака груди возникает в единственном слое эпителиальных клеток, выстилающих протоковую / дольчатую систему протоков грудного молока. Предраковые изменения, которые происходят в трансформированном эпителии, недостаточно изучены: однако было идентифицировано несколько цитологических или гистологических изменений, которые связаны с повышенным риском рака груди, включая протоковую или дольчатую гиперплазию, гиперплазию с атипией и дольчатую или протоковую карциному. на месте.
Выявление цитологических или гистологических аномалий эпителиальных клеток молочной железы является важным компонентом оценки риска.
Цель:
Основные цели:
Определить частоту и характер цитологических изменений протоковых эпителиальных клеток молочной железы с высоким риском в образцах, собранных путем промывания протоков молочной железы, и определить, отличаются ли эти цитологические результаты от результатов у здоровых женщин-добровольцев, не входящих в группу повышенного риска для груди. рак.
С помощью эндоскопии протока молочной железы охарактеризовать эпителий и архитектуру протока молочной железы высокого риска и сопоставить эти результаты с цитологическими данными, указанными в вышеприведенном абзаце.
Определить общий характер экспрессии генов эпителиальных клеток молочной железы высокого риска из молочной железы высокого риска и отличается ли он от такового эпителиальных клеток молочной железы здоровых женщин-добровольцев, не подверженных повышенному риску рака молочной железы. Профиль экспрессии гена будет определяться микрочипом кДНК и подтверждаться RT-PCR.
Право на участие:
Право на участие лиц из группы высокого риска будет включать:
Женщины с односторонним инвазивным или неинвазивным (DCIS) раком груди эпителиального происхождения.
Женщины без рака груди, но с индексом Гейл> 1,67 процента или совокупным пожизненным риском, превышающим или равным удвоенному общему популяционному риску, соответствующему возрасту и расе.
Женщины, которые, как известно, являются носителями мутации BRCA1 / 2 или других наследственных генов.
Женщины с цитологическими или гистологическими признаками гиперплазии протоков, атипичной гиперплазии протоков или лобулярной карциномы in situ.
Женщины могут находиться в пременопаузе или постменопаузе. Постменопаузальный период определяется отсутствием менструального цикла не менее 12 месяцев.
Женщины в постменопаузе, которые ранее перенесли гистерэктомию без овариэктомии, должны иметь уровень ФСГ в сыворотке> 40 МЕ / мл и уровень эстрадиола в сыворотке <40 пг / мл для документального подтверждения статуса в постменопаузе.
Право на набор обычных волонтеров будет включать:
Женщины в пременопаузе или постменопаузе с индексом риска модели Гейл <1.67 процентов, и без совокупного риска в течение жизни, превышающего или равного удвоенному общему популяционному риску, соответствующему возрасту и расе.
Женщины, которые ранее перенесли гистерэктомию без овариэктомии, должны иметь уровень ФСГ в сыворотке> 40 МЕ / мл и уровень эстрадиола в сыворотке <40 пг / мл для документирования постменопаузального статуса.
На обеих грудях не должно быть подозрительных участков при физическом осмотре, а для женщин старше 30 лет — при маммографии. В анамнезе не должно быть атипичной гиперплазии, инвазивной карциномы или карциномы in situ.
Обе группы должны иметь приемлемое количество лейкоцитов и тромбоцитов.
Дизайн:
Эпителиальные клетки протоков молочной железы будут собираться путем промывания протоков молочной железы из (а) груди у женщин с повышенным риском рака груди и (б) груди здоровых женщин-добровольцев, не подверженных повышенному риску рака груди.
Образцы эпителиальных клеток протоков будут проанализированы цитологически на предмет наличия гиперплазии, атипии или изменений in situ.
Эндоскопия протока молочной железы будет выполняться пациентам с раком груди и здоровым добровольцам с цитологической атипией при промывании протоков, чтобы определить архитектурные изменения протоков, связанные с повышенным риском рака груди, и обеспечить корреляцию с цитологической атипией.
Профиль экспрессии генов нормальных эпителиальных клеток протоков и клеток высокого риска будет изучен с помощью микроматрицы кДНК для определения изменений в экспрессии генов, связанных с повышенным риском рака груди.
Дополнительные эксперименты по молекулярному профилированию, которые будут проводиться по мере доступности лаважных клеток, включают секвенирование всего экзома ДНК, сравнительную геномную гибридизацию (CGH), массивы протеомных лизатов ткани и идентификацию стволовых клеток молочной железы.
Всего будут изучены 104 субъекта из группы высокого риска и 110 нормальных добровольцев, примерно поровну разделенных между женщинами в пременопаузе и постменопаузе.
Гиперплазия груди (протоковая или дольчатая)
Гиперплазия также известна как гиперплазия эпителия или пролиферативное заболевание груди.Это чрезмерный рост клеток, выстилающих протоки или молочные железы (дольки) внутри груди.
Гиперплазия протоков (также называемая гиперплазией эпителия протоков ) — это чрезмерный рост клеток, выстилающих маленькие трубки (протоки) внутри груди, в то время как дольковая гиперплазия — это чрезмерное разрастание клеток, выстилающих молочные железы (дольки). Проточная и дольчатая гиперплазия возникают примерно с одинаковой скоростью и примерно одинаково влияют на риск рака груди.
Гиперплазия часто описывается как обычная или атипичная в зависимости от того, как клетки выглядят под микроскопом.
- При обычной гиперплазии клетки выглядят очень близко к нормальным.
- При атипичной гиперплазии (или гиперплазии с атипией) клетки более искажены. Это может быть либо атипическая гиперплазия протоков (ADH) , либо атипичная дольчатая гиперплазия (ALH) .
Диагностика
Гиперплазия обычно не вызывает ощущения шишки, но может вызвать изменения, которые можно увидеть на маммограмме.Диагноз ставится на биопсии. (Для удаления небольшого кусочка ткани, проверенного в лаборатории, можно использовать полую иглу. Или может быть сделана операция по удалению аномальной ткани груди.)
Как гиперплазия влияет на риск рака груди?
Гиперплазия может повлиять на ваш риск рака груди, но насколько сильно зависит от его типа:
- Легкая гиперплазия обычного типа: Не увеличивает риск рака груди.
- Умеренная или гиперплазия обычного типа (без атипии), также известная как обычная гиперплазия: Риск рака груди примерно в 1,5–2 раза выше, чем у женщины без аномалий груди.
- Атипичная гиперплазия (АДГ или АЛГ): Риск рака груди примерно в 4–5 раз выше, чем у женщин без аномалий груди. Более подробную информацию об отчетах о патологии, показывающих атипичную гиперплазию, можно найти в Understanding Your Pathology Report: Atypical Hyperplasia .
Лечение
Большинство типов обычной гиперплазии не требует лечения. Но если при игольной биопсии обнаруживается атипичная гиперплазия (АДГ или АЛГ), с помощью операции можно удалить больше ткани груди вокруг нее, чтобы убедиться, что поблизости нет ничего более серьезного, например рака. (Это более вероятно рекомендуется для ADH, чем для ALH.)
Снижение риска рака груди или его раннее обнаружение
Атипичная гиперплазия (АДГ или АЛГ) связана с более высоким риском рака груди.Несмотря на то, что у большинства женщин с атипичной гиперплазией рак груди не разовьется, все же важно поговорить с врачом о своем риске и о том, какие варианты лечения лучше всего подходят для вас.
Варианты для женщин с высоким риском рака груди из-за атипичной гиперплазии могут включать:
Отчет о вашей патологии: атипичная гиперплазия (груди)
При проведении биопсии груди взятые образцы были изучены под микроскопом врачом-специалистом, имеющим многолетнюю подготовку, под названием патолог .Патологоанатом отправляет вашему врачу отчет с диагнозом для каждого взятого образца. Информация в этом отчете будет использована для управления вашим лечением. Следующие вопросы и ответы призваны помочь вам понять медицинский язык, который вы можете найти в отчете о патологии при биопсии груди, такой как игольная биопсия или эксцизионная биопсия.
При игольчатой биопсии игла используется для взятия образца из аномальной области. При эксцизионной биопсии удаляется вся аномальная область, часто вместе с некоторыми окружающими нормальными тканями.Иссеченная биопсия очень похожа на операцию по сохранению груди, называемую лампэктомией.
Что означает гиперплазия?
Нормальная грудь состоит из протоков (крошечных трубок), которые заканчиваются группой мешочков, называемых дольками. Гиперплазия — это термин, используемый, когда в протоках и / или долях груди наблюдается рост клеток, не являющихся злокачественными. В норме протоки и дольки выстланы 2 слоями клеток. Гиперплазия означает, что клеток больше, чем обычно, и они больше не выстраиваются только в 2 слоя.Если под микроскопом рост выглядит как нормальный образец, гиперплазию можно назвать обычным . Некоторые новообразования выглядят более ненормально, и их можно назвать атипичной гиперплазией (см. Ниже).
Двумя основными типами гиперплазии груди являются протоковая гиперплазия и дольковая гиперплазия . То, что делает гиперплазию протоковой или дольчатой, больше зависит от того, как клетки выглядят под микроскопом, а не от того, возникает ли гиперплазия в протоках или дольках.
Что означает, если в моем отчете упоминается Е-кадгерин?
Е-кадгерин — это тест, который патолог может использовать, чтобы определить, является ли гиперплазия протоковой или дольчатой. (Клетки атипичной лобулярной гиперплазии (АЛГ) обычно отрицательны на Е-кадгерин.) Если в вашем отчете не упоминается Е-кадгерин, это означает, что этот тест не нужен для определения того, какой у вас тип гиперплазии.
Что означает, если в моем отчете говорится об атипичной гиперплазии протоков (АДГ)?
При ADH характер роста клеток является ненормальным и имеет некоторые (но не все) особенности протоковой карциномы in-situ (которая является предраком).Это означает, что ADH еще не является предраком, хотя он связан с повышенным риском заболеть раком груди в дальнейшем.
Если АДГ обнаруживается при игольчатой биопсии, обычно необходимо удалить больше ткани в этой области, чтобы убедиться, что в груди нет ничего более серьезного. Удаляемая ткань исследуется под микроскопом, и если ничего более серьезного не обнаружено, никакого другого лечения не требуется. Затем пациентка проходит обследование груди и визуализацию груди, например, маммографию.
Если при эксцизионной биопсии обнаружен АДГ, дополнительное хирургическое лечение не требуется, но врач может порекомендовать принимать лекарства, которые помогут снизить риск рака груди.
Какое значение имеет атипичная лобулярная гиперплазия (АЛГ)?
ALH — это также аномальный рост клеток в долях груди, связанный с повышенным риском рака груди. Если ALH обнаруживается при игольчатой биопсии, неясно, что лучше всего делать — некоторые врачи считают, что нужно сделать больше операций, чтобы убедиться, что поблизости нет ничего более серьезного, в то время как другие врачи думают, что это так. достаточно, чтобы следить за пациентом с помощью физических осмотров и визуализационных тестов (например, маммографии).Если при иссечении (лампэктомии) обнаруживается АЛГ, пациенты чаще всего наблюдаются без дальнейшего лечения, но ваш врач может порекомендовать принимать лекарства, чтобы снизить риск рака груди.
Что означает, если в моем отчете упоминаются специальные тесты, такие как высокомолекулярный цитокератин (HMWCK), CK903, CK5 / 6, p63, мышечный специфический актин, тяжелая цепь гладкомышечного миозина, кальпонин или кератин?
Это специальные тесты, которые патолог иногда использует для постановки правильного диагноза различных поражений груди.Независимо от того, упоминаются ли в вашем отчете эти тесты или нет, это не влияет на точность вашего диагноза.
Что это значит, если в моем отчете также используются следующие термины: обычная гиперплазия протоков, аденоз, склерозирующий аденоз, лучевой рубец, сложное склерозирующее поражение, папилломатоз, папиллома, апокринная метаплазия, кисты, изменение столбчатых клеток, коллагенозный сферулез, эктазия протока , фиброзно-кистозные изменения, атипия плоского эпителия или столбчатые изменения с выступающими апикальными мордами и выделениями (CAPSS)?
Все это термины для обозначения доброкачественных (незлокачественных) изменений, которые патолог может увидеть под микроскопом.Они не важны, если их увидеть на образце биопсии, который содержит АДГ или АЛГ.
Что означает, если в моем отчете упоминаются микрокальцификаты или кальцификаты?
Микрокальцификаты или кальцификаты — это отложения кальция, которые можно обнаружить как в незлокачественных, так и в раковых поражениях груди. Их можно увидеть как на маммограммах, так и под микроскопом. Поскольку определенные кальцификаты обнаруживаются в областях, пораженных раком, их присутствие на маммограмме может привести к биопсии этой области.Затем, когда биопсия будет сделана, патолог осматривает удаленную ткань, чтобы убедиться, что она содержит кальцификаты. Если кальцификаты есть, лечащий врач знает, что при биопсии взят образец правильного участка (аномальный участок с кальцификациями, который был замечен на маммограмме).
Протоковые подходы к оценке и ведению женщин с высоким риском развития рака груди | Исследование рака молочной железы
Кришнамурти С., Снейдж Н., Ордонез Н.Г., Хант К.К., Курер Х.М.: характеристика пенистых ячеек в жидкости, отсасываемой из сосков.Diagn Cytopathol. 2002, 27: 261-264. 10.1002 / dc.10155.
CAS Статья PubMed Google Scholar
King BL, Crisi GM, Tsai SC, Haffty BG, Phillips RF, Rimm DL: Иммуноцитохимический анализ клеток груди, полученных промыванием протоков. Рак. 2002, 96: 244-249. 10.1002 / cncr.10719.
Артикул PubMed Google Scholar
Форд Д., Истон Д. Ф., Страттон М., Народ С., Голдгар Д., Девили П., Бишоп Д. Т., Вебер Б., Ленуар Дж., Чанг-Клод Дж., Соболь Х, Тир, доктор медицины, Струвинг Дж., Арасон А., Scherneck S, Peto J, Rebbeck TR, Tonin P, Neuhausen S, Barkardottir R, Eyfjord J, Lynch H, Ponder BA, Gayther SA, Zelada-Hedman M: анализ генетической гетерогенности и пенетрантности генов BRCA1 и BRCA2 в семьях рака груди .Консорциум по связям с раком груди. Am J Hum Genet. 1998, 62: 676-689. 10.1086 / 301749.
CAS Статья PubMed PubMed Central Google Scholar
Берч Дж. М., Хартли А. Л., Трикер К. Дж., Проссер Дж., Конди А., Келси А. М., Харрис М., Джонс PH, Бинчи А., Кроутер D. Распространенность и разнообразие конституциональных мутаций гена p53 среди 21 Li- Семьи фраумени. Cancer Res. 1994, 54: 1298-1304.
CAS PubMed Google Scholar
Liaw D, Marsh DJ, Li J, Dahia PL, Wang SI, Zheng Z, Bose S, Call KM, Tsou HC, Peacocke M, Eng C, Parsons R: мутации зародышевой линии гена PTEN при болезни Каудена, унаследованной груди и синдром рака щитовидной железы. Нат Жене. 1997, 16: 64-67. 10.1038 / ng0597-64.
CAS Статья PubMed Google Scholar
Meijers-Heijboer H, van den Ouweland A, Klijn J, Wasielewski M, de Snoo A, Oldenburg R, Hollestelle A, Houben M, Crepin E, Veghel-Plandsoen M, Elstrodt F, van Duijn C, Бартельс К., Мейерс С., Шютте М., Макгаффог Л., Томпсон Д., Истон Д., Содха Н., Сил С., Барфут Р., Мэнджон Дж., Чанг-Клод Дж., Экклс Д., Илес Р., Эванс Д. Г., Хоулстон Р., Мердей В., Народ С, Перец Т., Пето Дж., Фелан С., Чжан Х.Х., Сабо С., Девили П., Голдгар Д., Футреал П.А., Натансон К.Л., Вебер Б., Рахман Н., Страттон М.Р.: Восприимчивость к раку груди с низкой пенетрантностью из-за CHEK2 ( *) 1100delC у не носителей мутаций BRCA1 или BRCA2.Нат Жене. 2002, 31: 55-59. 10.1038 / ng879.
CAS Статья PubMed Google Scholar
Brose MS, Rebbeck TR, Calzone KA, Stopfer JE, Nathanson KL, Weber BL: оценка риска рака для носителей мутации BRCA1, выявленных в программе оценки риска. J Natl Cancer Inst. 2002, 94: 1365-1372. 10.1093 / jnci / 94.18.1365.
CAS Статья PubMed Google Scholar
Томпсон Д., Истон Д. Ф.: Заболеваемость раком у носителей мутации BRCA1. J Natl Cancer Inst. 2002, 94: 1358-1365. 10.1093 / jnci / 94.18.1358.
CAS Статья PubMed Google Scholar
Гарбер Дж. Э., Гольдштейн А. М., Кантор А. Ф., Дрейфус М. Г., Фраумени Дж. Ф., Ли Ф. П.: Последующее исследование двадцати четырех семей с синдромом Ли-Фраумени. Cancer Res. 1991, 51: 6094-6097.
CAS PubMed Google Scholar
Brekelmans CT, Seynaeve C, Bartels CC, Tilanus-Linthorst MM, Meijers-Heijboer EJ, Crepin CM, van Geel AA, Menke M, Verhoog LC, van den Ouweland A, Obdeijn IM, Klijn JG: Эффективность эпиднадзора за раком груди в Носители мутации гена BRCA1 / 2 и женщины с высоким семейным риском. J Clin Oncol. 2001, 19: 924-930.
CAS Статья PubMed Google Scholar
Kuhl CK, Schmutzler RK, Leutner CC, Kempe A, Wardelmann E, Hocke A, Maringa M, Pfeifer U, Krebs D, Schild HH: МРТ-обследование груди у 192 женщин, которые оказались носителями или предположительно являются носителями ген предрасположенности к раку груди: предварительные результаты.Радиология. 2000, 215: 267-279.
CAS Статья PubMed Google Scholar
Клаус Е.Б., Риш Н., Томпсон В.Д .: Генетический анализ рака груди в исследовании рака и стероидных гормонов. Am J Hum Genet. 1991, 48: 232-242.
CAS PubMed PubMed Central Google Scholar
Гейл М.Х., Бринтон Л.А., Байар Д.П., Корл Д.К., Грин С.Б., Шайрер С., Малвихилл Дж.Дж .: Прогнозирование индивидуальной вероятности развития рака груди для белых женщин, которые проходят ежегодное обследование.J Natl Cancer Inst. 1989, 81: 1879-1886. 10.1093 / jnci / 81.24.1879.
CAS Статья PubMed Google Scholar
Антониу А.С., Фароа П.Д., Макмаллан Дж., Дэй Н.Э., Страттон М.Р., Пето Дж., Пондер Б.Дж., Истон Д.Ф.: Комплексная модель семейного рака молочной железы, включающая BRCA1, BRCA2 и другие гены. Br J Рак. 2002, 86: 76-83. 10.1038 / sj.bjc.6600008.
CAS Статья PubMed PubMed Central Google Scholar
Fisher B, Costantino JP, Wickerham DL, Redmond CK, Kavanah M, Cronin WM, Vogel V, Robidoux A, Dimitrov N, Atkins J, Daly M, Wieand S, Tan-Chiu E, Ford L, Wolmark N: Тамоксифен для профилактика рака молочной железы: отчет об исследовании P-1 Национального проекта хирургических адъювантных заболеваний груди и кишечника. J Natl Cancer Inst. 1998, 90: 1371-1388. 10.1093 / jnci / 90.18.1371.
CAS Статья PubMed Google Scholar
Powles T, Eeles R, Ashley S, Easton D, Chang J, Dowsett M, Tidy A, Viggers J, Davey J: Промежуточный анализ заболеваемости раком груди в рандомизированном исследовании химиопрофилактики тамоксифена в Королевской больнице Марсдена .Ланцет. 1998, 352: 98-101.
CAS Статья PubMed Google Scholar
Veronesi U, Maisonneuve P, Costa A, Sacchini V, Maltoni C, Robertson C, Rotmensz N, Boyle P: Профилактика рака груди с помощью тамоксифена: предварительные результаты итальянского рандомизированного исследования среди женщин, перенесших гистерэктомию. Итальянское исследование по профилактике тамоксифена. Ланцет. 1998, 352: 93-97.
CAS Статья PubMed Google Scholar
Кузик Дж., Форбс Дж., Эдвардс Р., Баум М., Коуторн С., Коутс А., Хамед А., Хауэлл А., Поулз Т.: Первые результаты Международного исследования по вмешательству при раке молочной железы (IBIS-I): рандомизированное профилактическое исследование. Ланцет. 2002, 360: 817-824. 10.1016 / S0140-6736 (02) 09962-2.
CAS Статья PubMed Google Scholar
Папаниколау Г.Н., Холмквист Д.Г., Бадер Г.М., Фальк Е.А.: Эксфолиативная цитология молочной железы человека и ее значение в диагностике рака и других заболеваний груди.Рак. 1958, 11: 377-409. 10.1002 / 1097-0142 (195803/04) 11: 2 <377 :: AID-CNCR2820110223> 3.0.CO; 2-A.
CAS Статья PubMed Google Scholar
Сарториус О.В., Смит Х.С., Моррис П., Бенедикт Д., Фризен Л.: Цитологическая оценка молочной жидкости при обнаружении заболеваний молочной железы. J Natl Cancer Inst. 1977, 59: 1073-1080.
CAS Статья PubMed Google Scholar
Wynder EL, Lahti H, Laakso K, Cheng SL, DeBevoise S, Rose DP: аспираты жидкости груди из сосков и эпидемиология заболеваний груди. Рак. 1985, 56: 1473-1478. 10.1002 / 1097-0142 (19850915) 56: 6 <1473 :: AID-CNCR2820560642> 3.0.CO; 2-M.
CAS Статья PubMed Google Scholar
Sauter ER, Babb J, Daly M, Engstrom PF, Ehya H, Malick J, Diamandis E: Производство простат-специфического антигена в женской груди: связь с прогестероном.Биомаркеры эпидемиологии рака Пред. 1998, 7: 315-320.
CAS PubMed Google Scholar
Sauter ER, Ross E, Daly M, Klein-Szanto A, Engstrom PF, Sorling A, Malick J, Ehya H: аспирационная жидкость из сосков: многообещающий неинвазивный метод определения клеточных маркеров риска рака груди . Br J Рак. 1997, 76: 494-501.
CAS Статья PubMed PubMed Central Google Scholar
Wrensch MR, Petrakis NL, Gruenke LD, Ernster VL, Miike R, King EB, Hauck WW: Факторы, связанные с получением аспирата жидкости из сосков: анализ 1428 женщин и обзор литературы. Лечение рака груди Res. 1990, 15: 39-51. 10.1007 / BF01811888.
CAS Статья PubMed Google Scholar
Петракис Н.Л .: Физиологические, биохимические и цитологические аспекты аспирата жидкости из сосков. Лечение рака груди Res. 1986, 8: 7-19.10.1007 / BF01805919.
CAS Статья PubMed Google Scholar
Krishnamurthy S, Sneige N, Thompson PA, Marcy SM, Singletary SE, Cristofanilli M, Hunt KK, Kuerer HM: Цитология аспирата сосков при карциноме молочной железы. Рак. 2003, 99: 97-104. 10.1002 / cncr.10958.
Артикул PubMed Google Scholar
King EB, Chew KL, Petrakis NL, Ernster VL: Цитология аспирата сосков для исследования предшественников рака груди.J Natl Cancer Inst. 1983, 71: 1115-1121.
CAS PubMed Google Scholar
Дули В.К., Люнг Б.М., Веронези У., Каззанига М., Элледж Р.М., О’Шонесси Дж. А., Курер Х.М., Хунг Д.Т., Хан С.А., Филипс Р.Ф., Ганц П.А., Эухус Д.М., Эссерман Л.Дж., Хафти Б.Г., King BL, Kelley MC, Anderson MM, Schmit PJ, Clark RR, Kass FC, Anderson BO, Troyan SL, Arias RD, Quiring JN, Love SM, Page DL, King EB: Промывание протоков для выявления клеточной атипии у женщин при высоких температурах риск рака груди.J Natl Cancer Inst. 2001, 93: 1624-1632. 10.1093 / jnci / 93.21.1624.
CAS Статья PubMed Google Scholar
Лав С.М., Барский С.Г. Эндоскопия молочного протока для изучения стадий рака груди. Ланцет. 1996, 348: 997-999. 10.1016 / S0140-6736 (96) 04145-1.
CAS Статья PubMed Google Scholar
Дули В.К .: Обычная оперативная эндоскопия груди во время лампэктомии.Энн Сург Онкол. 2003, 10: 38-42. 10.1245 / АСО.2003.03.030.
Артикул PubMed Google Scholar
Пейдж Д.Л., Дюпон В.Д., Роджерс Л.В., Радос М.С.: Атипичные гиперпластические поражения женской груди. Долгосрочное последующее исследование. Рак. 1985, 55: 2698-2708. 10.1002 / 1097-0142 (19850601) 55:11 <2698 :: AID-CNCR2820551127> 3.0.CO; 2-A.
CAS Статья PubMed Google Scholar
Dupont WD, Parl FF, Hartmann WH, Brinton LA, Winfield AC, Worrell JA, Schuyler PA, Plummer WD: Риск рака груди, связанный с пролиферативным заболеванием груди и атипичной гиперплазией. Рак. 1993, 71: 1258-1265. 10.1002 / 1097-0142 (19930215) 71: 4 <1258 :: AID-CNCR2820710415> 3.0.CO; 2-I.
CAS Статья PubMed Google Scholar
Wrensch MR, Petrakis NL, King EB, Miike R, Mason L, Chew KL, Lee MM, Ernster VL, Hilton JF, Schweitzer R: Заболеваемость раком груди у женщин с аномальной цитологией в аспиратах жидкости из сосков. .Am J Epidemiol. 1992, 135: 130-141.
CAS Статья PubMed Google Scholar
Wrensch MR, Petrakis NL, Miike R, King EB, Chew K, Neuhaus J, Lee MM, Rhys M: Риск рака груди у женщин с аномальной цитологией в аспиратах жидкости из сосков. J Natl Cancer Inst. 2001, 93: 1791-1798. 10.1093 / jnci / 93.23.1791.
CAS Статья PubMed Google Scholar
Fabian CJ, Kimler BF, Zalles CM, Klemp JR, Kamel S, Zeiger S, Mayo MS: Краткосрочное прогнозирование рака груди с помощью цитологии случайной периареолярной тонкоигольной аспирации и модели риска Гейл. J Natl Cancer Inst. 2000, 92: 1217-1227. 10.1093 / jnci / 92.15.1217.
CAS Статья PubMed Google Scholar
Foretova L, Garber JE, Sadowsky NL, Verselis SJ, Li FP: Простатспецифический антиген в аспирате соска [письмо]. Ланцет.1996, 347: 1631-10.1016 / S0140-6736 (96) -4.
CAS Статья PubMed Google Scholar
Mitchell G, Sibley PE, Wilson AP, Sauter E, A’Hern R, Eeles RA: Простатоспецифический антиген в аспирационной жидкости сосков: вариабельность менструального цикла и корреляция с сывороточным антигеном простаты. Tumor Biol. 2002, 23: 287-297. 10.1159 / 000068568.
CAS Статья PubMed Google Scholar
Sauter ER, Daly M, Linahan K, Ehya H, Engstrom PF, Bonney G, Ross EA, Yu H, Diamandis E: Уровни простат-специфического антигена в аспирате жидкости из сосков коррелируют с риском рака груди. Биомаркеры эпидемиологии рака Пред. 1996, 5: 967-970.
CAS PubMed Google Scholar
Zhao Y, Verselis SJ, Klar N, Sadowsky NL, Kaelin CM, Smith B, Foretova L, Li FP: Карциноэмбриональный антиген сосковой жидкости и простатоспецифический антиген в раковых и здоровых молочных железах.J Clin Oncol. 2001, 19: 1462-1467.
CAS Статья PubMed Google Scholar
Kuerer HM, Thompson PA, Krishnamurthy S, Fritsche HA, Marcy SM, Babiera GV, Singletary SE, Cristofanilli M, Sneige N, Hunt KK: высокая и дифференциальная экспрессия внеклеточного домена HER-2 / neu на двусторонней основе. протоковая жидкость от женщин с односторонним инвазивным раком груди. Clin Cancer Res. 2003, 9: 601-605.
CAS PubMed Google Scholar
Коннолли Дж. М., Роуз Д. П.: Белки, подобные эпидермальному фактору роста, в грудной жидкости и материнском молоке. Life Sci. 1988, 42: 1751-1756. 10.1016 / 0024-3205 (88)
-0.CAS Статья PubMed Google Scholar
Ганн П., Чаттертон Р., Фогельсонг К., Дюпюи Дж., Эллман А.: Митогенные факторы роста в молочной жидкости, полученные от здоровых женщин: оценка биологических и внешних источников изменчивости. Биомаркеры эпидемиологии рака Пред.1997, 6: 421-428.
CAS PubMed Google Scholar
Hsiung R, Zhu W, Klein G, Qin W., Rosenberg A, Park P, Rosato E, Sauter E: Высокие уровни основного фактора роста фибробластов в жидкости аспирата сосков коррелируют с раком груди. Рак J. 2002, 8: 303-310. 10.1097 / 00130404-200207000-00006.
Артикул PubMed Google Scholar
Лю Ю, Ван Дж. Л., Чанг Х., Барски С.Х., Нгуен М.: Диагностика рака груди с помощью сосковой жидкости bFGF [письмо].Ланцет. 2000, 356: 567-10.1016 / S0140-6736 (00) 02587-3.
CAS Статья PubMed Google Scholar
Маннелло Ф., Себастьяни М.: Зимографические анализы и измерение матриксной металлопротеиназы-2 и -9 в жидкостях аспирата сосков. Clin Chem. 2003, 49: 1546-1550. 10.1373 / 49.9.1546.
CAS Статья PubMed Google Scholar
Botti C, Pescatore B, Mottolese M, Sciarretta F, Greco C, Di Filippo F, Gandolfo GM, Cavaliere F, Bovani R, Varanese A, Cianciulli AM: Частота аневзомии хромосом 1 и 17 при раке груди и прилегающие ткани: межфазное цитогенетическое исследование.J Am Coll Surg. 2000, 190: 530-539. 10.1016 / S1072-7515 (00) 00252-0.
CAS Статья PubMed Google Scholar
Фем Т., Моррисон Л., Сабуриан Х., Хайнан Л., Такер Т., Ур Дж .: Модели анэусомии для трех хромосом в отдельных клетках опухолей рака молочной железы. Лечение рака груди Res. 2002, 75: 227-239. 10.1023 / А: 10190758.
CAS Статья PubMed Google Scholar
Рока С., Фигл М., Зойер Н., Филипитс М., Шустер Р., Штайнер Б., Якес Р., Хубер Х, Драх Дж .: Анеуплоидия хромосомы 8, обнаруженная с помощью интерфазной флуоресценции, гибридизация in situ является повторяющейся находкой при первичном и метастатическом раке молочной железы. . Лечение рака груди Res. 1998, 48: 125-133. 10.1023 / А: 1005937305102.
CAS Статья PubMed Google Scholar
Tagawa Y, Yasutake T, Ikuta Y, Oka T., Terada R: Числовые аберрации хромосомы 8 при инвазивной протоковой карциноме II стадии: корреляция с исходом для пациента и плохим прогнозом.Med Oncol. 2003, 20: 127-136. 10.1385 / МО: 20: 2: 127.
Артикул PubMed Google Scholar
King BL, Tsai SC, Gryga ME, D’Aquila TG, Seelig SA, Morrison LE, Jacobson KK, Legator MS, Ward DC, Rimm DL, Phillips RF: обнаружение хромосомной нестабильности при парной хирургии груди и образцы протокового лаважа с помощью межфазной флуоресценции in situ гибридизации. Clin Cancer Res. 2003, 9: 1509-1516.
CAS PubMed Google Scholar
Ямамото Д., Сендзаки Х., Накагава Х., Окугава Х., Гондо Х., Танака К. Обнаружение хромосомной анеусомии с помощью флуоресцентной гибридизации in situ у пациентов с выделениями из сосков. Рак. 2003, 97: 690-694. 10.1002 / cncr.11091.
Артикул PubMed Google Scholar
Evron E, Umbricht CB, Korz D, Raman V, Loeb DM, Niranjan B, Buluwela L, Weitzman SA, Marks J, Sukumar S: потеря экспрессии циклина D2 в большинстве случаев рака молочной железы связана с промотор гиперметилирования.Cancer Res. 2001, 61: 2782-2787.
CAS PubMed Google Scholar
Сирчия С.М., Фергюсон А.Т., Сирони Е., Субраманян С., Орланди Р., Сукумар С., Сакки Н.: Доказательства эпигенетических изменений, влияющих на состояние хроматина промотора бета2 рецептора ретиноевой кислоты в клетках рака молочной железы. Онкоген. 2000, 19: 1556-1563. 10.1038 / sj.onc.1203456.
CAS Статья PubMed Google Scholar
Evron E, Dooley WC, Umbricht CB, Rosenthal D, Sacchi N, Gabrielson E, Soito AB, Hung DT, Ljung B, Davidson NE, Sukumar S: обнаружение клеток рака груди в проточной жидкости лаважа с помощью специфичной для метилирования ПЦР. Ланцет. 2001, 357: 1335-1336. 10.1016 / S0140-6736 (00) 04501-3.
CAS Статья PubMed Google Scholar
Paweletz CP, Trock B, Pennanen M, Tsangaris T, Magnant C, Liotta LA, Petricoin EF: Протеомные паттерны жидкостей аспирата из сосков, полученные с помощью SELDI-TOF: потенциал новых биомаркеров для помощи в диагностике груди рак.Маркеры Дис. 2001, 17: 301-307.
CAS Статья PubMed Google Scholar
Sauter ER, Zhu W, Fan XJ, Wassell RP, Chervoneva I., Du Bois GC: Протеомный анализ аспиратной жидкости из сосков для обнаружения биологических маркеров рака груди. Br J Рак. 2002, 86: 1440-1443. 10.1038 / sj.bjc.6600285.
CAS Статья PubMed PubMed Central Google Scholar
Курер Х.М., Голдкнопф И.Л., Фриче Х., Кришнамурти С., Шета Э.А., Хант К.К.: Идентификация различных паттернов экспрессии белка в двусторонних парных парных образцах протоковой жидкости молочной железы от женщин с односторонней инвазивной карциномой молочной железы. Открытие высокопроизводительных биомаркеров. Рак. 2002, 95: 2276-2282. 10.1002 / cncr.10974.
CAS Статья PubMed Google Scholar
Варнум С.М., Ковингтон С.С., Вудбери Р.Л., Петритис К., Кангас Л.Дж., Абдулла М.С., Паундс Дж. Г., Смит Р.Д., Зангар Р.С.: Протеомная характеристика аспирационной жидкости из сосков: идентификация потенциальных биомаркеров рака груди.Лечение рака груди Res. 2003, 80: 87-97. 10.1023 / А: 102447
CAS Статья PubMed Google Scholar
% PDF-1.4 % 38 0 объект > / OCGs [41 0 R] >> / Страницы 34 0 R / Тип / Каталог >> эндобдж 40 0 объект > / Шрифт >>> / Поля [] >> эндобдж 35 0 объект > поток 2021-12-08T23: 09: 21-08: 002005-07-30T18: 56: 49 + 05: 302021-12-08T23: 09: 21-08: 00uuid: 746e15e7-3a20-4ddd-824a-4a13f2e9cceeuuid: ce051a88- 1dd1-11b2-0a00-9000d8abddffapplication / pdf конечный поток эндобдж 34 0 объект > эндобдж 42 0 объект > / Font> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5> / T1_6 58 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Rotate 0 / Type / Страница >> эндобдж 1 0 объект > / Font> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5> / T1_6> / T1_7> / T1_8> / T1_9 58 0 R >> / ProcSet [/ PDF / Text / ImageB / ImageC] / Свойства> / XObject >>> / Повернуть 0 / Тип / Страница >> эндобдж 7 0 объект > / Font> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5> / T1_6> / T1_7 58 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Rotate 0 / Тип / Страница >> эндобдж 12 0 объект > / Font> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5> / T1_6 58 0 R >> / ProcSet [/ PDF / Text / ImageB / ImageC] / Properties> / XObject >>> / Rotate 0 / Тип / страница >> эндобдж 20 0 объект > / Font> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5> / T1_6> / T1_7 58 0 R >> / ProcSet [/ PDF / Text / ImageB / ImageC] / Свойства> / XObject >>> / Повернуть 0 / Тип / Страница >> эндобдж 26 0 объект > / Font> / T1_1> / T1_2> / T1_3 58 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Rotate 0 / Type / Page >> эндобдж 55 0 объект > / ProcSet [/ PDF / Text / ImageC] / XObject >>> / Type / Page >> эндобдж 69 0 объект [75 0 R 76 0 R 77 0 R 78 0 R 79 0 R] эндобдж 70 0 объект > поток q 537.609375 0 0 78.0513611 37.1953125 665.9486389 см / Im0 Do Q BT / T1_0 1 Тс 10 0 0 10 190.36972 549.99982 тм (1998; 7: 37-42.) Tj / T1_1 1 Тс -15.83697 0 Тд (Биомаркеры эпидемиологии рака Назад \ 240) Tj / T1_0 1 Тс 0 1 ТД (\ 240) Tj 0 1.00001 TD (П. А. Томпсон, Ф. Ф. Кадлубар, С. М. Вена и др.) Т. Дж. / T1_2 1 Тс 0 1 ТД (\ 240) Tj / T1_3 1 Тс 18 0 0 18 32 589,99994 тм (рак груди.) Tj Т * (ДНК ткани-мишени для молекулярно-эпидемиологических исследований) Tj Т * (Отслоившиеся эпителиальные клетки протоков в грудном молоке человека: источник) Tj ET 32 495 548 35 рэ 0 0 мес. S BT / T1_0 1 Тс 11 0 0 11 122.94202 502,99997 тм (\ 240) Tj / T1_3 1 Тс -7,55696 1 тд (Обновленная версия) Tj ET BT / T1_2 1 Тс 10 0 0 10 143 494,99994 тм (\ 240) Tj / T1_0 1 Тс 18.73297 1 тд () Tj 0 0 1 рг -18.73297 0 Тд (https://cebp.aacrjournals.org/content/7/1/37)Tj 0 г 0 1.00001 TD (См. Самую последнюю версию этой статьи по адресу:) Tj ET BT / T1_2 1 Тс 10 0 0 10 32 474,99997 тм (\ 240) Tj 0 1 ТД (\ 240) Tj ET BT / T1_2 1 Тс 10 0 0 10 32 454,99997 тм (\ 240) Tj Т * (\ 240) Tj ET BT / T1_2 1 Тс 10 0 0 10 32 434,99997 тм (\ 240) Tj Т * (\ 240) Tj ET 32 320 548 115 пере 0 0 мес. S BT / T1_0 1 Тс 11 0 0 11 122.94202 402.99997 тм (\ 240) Tj / T1_3 1 Тс -5.66901 1 тд (Оповещения по электронной почте) Tj ET BT / T1_0 1 Тс 10 0 0 10 297,49969 415 тм (относится к этой статье или журналу.) Tj 0 0 1 рг -15.44997 0 Тд (Подпишитесь, чтобы получать бесплатные уведомления по электронной почте) Tj ET BT 0 г / T1_0 1 Тс 11 0 0 11 122.94202 369.99994 тм (\ 240) Tj / T1_3 1 Тс -6.38997 1 тд (Подписки) Tj 0,556 1,00001 тд (Отпечатки и) Tj ET BT / T1_0 1 Тс 10 0 0 10 143 372,99994 тм (\ 240) Tj 13.46497 1 тд (.) Tj 0 0 1 рг -6.85098 0 Тд ([email protected]) Tj 0 г -6.61399 0 Тд (Отделение) Tj 0 1.00001 TD (Чтобы заказать перепечатку статьи или подписаться на журнал, свяжитесь с нами \ t Публикации AACR) Tj ET BT / T1_0 1 Тс 11 0 0 11 122.94202 347.99997 тм (\ 240) Tj / T1_3 1 Тс -5.66901 1 тд (Разрешения) Tj ET BT / T1_0 1 Тс 10 0 0 10 143 319,99988 тм (\ 240) Tj 0 1 ТД (Сайт с правами человека.) Tj 0 1.00001 TD (Нажмите «Запросить разрешения», чтобы перейти на страницу защиты авторских прав \ Центр Рэнси \ (CCC \)) Tj 18.73297 1 тд (.) Tj 0 0 1 рг -18.73297 0 Тд (https://cebp.aacrjournals.org/content/7/1/37)Tj 0 г 0 1 ТД (Чтобы запросить разрешение на повторное использование всей или части этой статьи, используйте это li \ nk) Tj ET BT / T1_0 1 Тс 9 0 0 9 237.15349 11 тм (8 декабря 2021 г. \ 251 1998 г. Американская ассоциация исследований рака. \ ) Tj 0 0 1 рг -9.89297 0 Тд (cebp.aacrjournals.org) Tj 0 г -8.11398 0 Td (Скачано с) Tj ET конечный поток эндобдж 74 0 объект > / Filter / FlateDecode / Height 223 / Length 108147 / Name / X / Subtype / Image / Type / XObject / Width 1536 >> stream H ꏙ YŻw`D | # drY.s9 «8G
Полярность клеток, эпителиально-мезенхимальный переход и экспрессия гена решения клеточной судьбы при протоковой карциноме in situ
Утрата идентичности эпителиальных клеток и приобретение мезенхимальных свойств являются ранними событиями в неопластическая трансформация клеток молочной железы.Мы исследовали паттерн экспрессии выбранной панели генов, связанных с полярностью клеток и комплексом апикального соединения или участвующих в TGF- β -опосредованном эпителиально-мезенхимальном переходе и выборе клеточной судьбы в серии DCIS и соответствующих нормальных, соответствующих пациенту. ткань. Кроме того, мы сравнили профиль гена DCIS с профилем атипичной гиперплазии протоков (ADH) у того же пациента. Статистический анализ выявил «ядро» генов, дифференциально экспрессируемых в обоих предшественниках по отношению к соответствующей нормальной ткани, в основном связанное с терминально дифференцированным люминальным эстроген-зависимым фенотипом, что согласуется с моделью, согласно которой ER-положительный инвазивный рак молочной железы происходит от ER. -положительные клетки-предшественники и с аутокринной выработкой эстрогенов посредством превращения андрогенов.Хотя предварительные, настоящие результаты обеспечивают транскриптомное подтверждение того, что, по крайней мере, для группы генов, рассматриваемых в настоящем исследовании, ADH и DCIS являются частью онкогенного многоступенчатого процесса и в значительной степени вызывают необходимость регуляции, возможно, с использованием ингибиторов ароматазы, внутриопухолевых и / или циркулирующая концентрация биологически активных андрогенов у пациентов с DCIS, чтобы своевременно препятствовать выработке аномальных эстрогенов и блокировать индуцированную эстрогенами пролиферацию клеток.
1. Введение
Протоковая карцинома in situ (DCIS), также известная как внутрипротоковая карцинома, является наиболее распространенным типом неинвазивного рака груди у женщин [1].С середины 1970-х годов заболеваемость DCIS резко возросла, в первую очередь из-за внедрения рентгенографического скрининга на инвазивную карциному. В настоящее время на него приходится примерно 25% вновь диагностированных случаев рака груди [1].
DCIS является необязательным предшественником инвазивного рака груди, и по этой причине некоторые члены консенсусной конференции DCIS Национальных институтов здравоохранения США в 2009 году предложили удалить слово «карцинома» из термина DCIS [2]. Тем не менее, экспериментальные исследования показали присутствие клеток-предшественников карциномы в поражениях DCIS [3–5], а клинические данные указывают на то, что примерно в 50% случаев при отсутствии лечения развивается инвазивный рак груди [6, 7].В результате злокачественная природа DCIS остается дискуссионной, в первую очередь из-за ограниченных знаний о возникновении и развитии DCIS. Фактически, в то время как несколько полногеномных исследований сравнивали генные профили DCIS и инвазивного рака груди, очень мало исследований изучали и распознавали молекулярные изменения, которые характеризуют DCIS по отношению к нормальной ткани [8–11].
DCIS определяется как аномальная пролиферация трансформированных эпителиальных клеток молочной железы в закрытой среде протока, вероятно, в ответ на изменения микросреды, включая гипоксию и недостаток питательных веществ [4, 12].Среди процессов, затронутых на ранней стадии во время трансформации клеток молочной железы, особое значение имеют те, которые участвуют в установлении и поддержании идентичности эпителиальных клеток и тканевой специфичности. Фактически, эпителиальные клетки молочной железы характеризуются асимметричным распределением цитоплазматических и мембранных белков, называемым апикобазолатеральной клеточной полярностью, необходимой для правильной межклеточной адгезии и формирования эпителиального слоя. В результате перехода эпителия в мезенхиму (EMT) во время неопластической трансформации полярность клеток и морфология эпителия рано теряются поляризованными, и неподвижные эпителиальные клетки приобретают фибробластоподобную морфологию и повышают подвижность клеток [13].
Процесс ЕМТ может быть индуцирован множеством сигнальных путей, среди которых основным и наиболее хорошо охарактеризованным является путь с участием трансформирующего фактора роста- β (TGF- β ). TGF- β представляет собой многофункциональный цитокин и мощный опухолевый супрессор, который определяет многие аспекты физиологии и гомеостаза эпителиальных клеток молочной железы [14]. В ненормальных условиях микросреды; однако некоторые эпителиальные клетки молочных желез могут приобретать устойчивость к TGF- β , обходить его цитостатический эффект и подавлять опухолевую активность, а также активировать EMT [15, 16].
Недавние исследования продемонстрировали, что EMT может генерировать клетки со стволовыми свойствами, особенно в переходном компартменте эпителиальных клеток молочной железы [17, 18]. Следовательно, взаимосвязь между EMT (опосредованная TGF- β ), нарушение механизмов, подчиненных клеточной полярности и контролю адгезии, и приобретение свойств, подобных стволовым, можно предположить уже в DCIS [19, 20].
Воспользовавшись единственным набором данных микрочипов, общедоступным на веб-сайте ArrayExpress, мы исследовали паттерн экспрессии выбранной панели генов, участвующих в TGF- β -опосредованной ЕМП или связанных с идентичностью эпителиальных клеток (т.e., полярность клеток и комплекс апикального соединения) и решение судьбы клетки в серии DCIS и соответствующего согласованного с пациентом гистологически нормального (HN) эпителия [11]. Поскольку профиль экспрессии всего гена подобранной пациенту атипичной протоковой гиперплазии (ADH) также был доступен, мы дополнительно сравнили профили DCIS и ADH, чтобы проверить гипотезу, согласно которой прогрессирование рака молочной железы является многоступенчатым процессом, включающим континуум изменений от нормального фенотипа. через гиперпластические поражения, карциному in situ и инвазивную карциному [21].
2. Материалы и методы
2.1. Материалы
Как сообщалось в исходной статье [11], подходящие для пациентов образцы (HN, ADH и DCIS) были выделены с помощью микродиссекции с помощью лазерного захвата из хирургических образцов 12 предоперационных нелеченных пациентов с ER-положительной (иммуногистохимической оценкой) спорадической грудью. рак. Экспрессию генов определяли с использованием Affymetrix Human Genome HG-U133A GeneChip; соответствующий набор данных микрочипа был общедоступен на веб-сайте ArrayExpress (https: // www.ebi.ac.uk/arrayexpress/) с регистрационным номером E-GEOD-16873.
2.2. Выбор гена
Чтобы выбрать панель генов, специфически вовлеченных в TGF- β -активированную EMT, комплекс клеточной полярности и апикального соединения, а также определение судьбы клетки, мы объединили Gene Ontology (https://www.geneontology.org ) и информации о PubMed (https://www.ncbi.nlm.nih.gov). Кроме того, поскольку раковые клетки часто увеличивают аутокринную продукцию TGF- β для активации ангиогенеза в ответ на недостаток кислорода и питательных веществ [14], мы также включили некоторые гены, кодирующие факторы, вызывающие ангиогенез.В целом был установлен набор из 199 генов, эволюционно консервативных у Homo sapiens (см. Дополнительную таблицу 1, доступную на сайте doi 10.1155 / 2012/984346). Однако, поскольку 27 генов не имели соответствующих наборов зондов на GeneChip HG-U133A, набор генов фактически состоял из 172 элементов, 33 из которых участвовали в активации EMT [13-15, 21-23], 75 участвовали в полярности клеток. и сборка апикального соединения [24–26], 36 участвует в решении клеточных судеб и в поддержании состояния самообновления в опухолегенных взрослых тканях [27–29], 28 участвует в передаче сигналов гормона и стероида [30–32], ангиогенезе активации [33, 34] или используются в качестве люминальных и базальных маркеров [35–38].Эти 172 гена соответствуют 339 наборам зондов Affymetrix, что подтверждается системой GeneAnnot v2.0 (https://bioinfo2.weizmann.ac.il/geneannot/), которая дополнительно предоставляет нам информацию о качестве каждого набора зондов в с точки зрения оценки чувствительности и специфичности [39] (см. Приложение).
2.3. Статистический анализ
Поскольку некоторые гены распознаются более чем одним набором зондов, каждый из которых характеризуется индивидуальной специфичностью и чувствительностью, которые по-разному влияют на значение экспрессии гена, среднее значение экспрессии гена было рассчитано после взвешивания каждого набора зондов для его собственная оценка чувствительности и специфичности.В частности, каждое значение выражения (уже преобразованное в логарифм 2 в исходном наборе данных) умножалось на полусумму оценок чувствительности и специфичности соответствующего набора зондов. Учитывая дизайн исследования выборок, подобранных для пациентов, все статистические анализы были выполнены с учетом регрессионной модели для повторных измерений со случайным эффектом, а дифференциальная экспрессия генов оценивалась с помощью t -теста по коэффициентам регрессии. Для корректировки множественного тестирования использовался коэффициент ложного обнаружения (FDR) [40].
Чтобы подтвердить скрытые переменные, объясняющие корреляции генов, факторный анализ был применен [41] в следующих трех сравнениях: DCIS и парный ADH, DCIS и парный HN, а также ADH и парный HN. Количество удерживаемых факторов было выбрано в соответствии с тестом на осыпи [42]. Для облегчения интерпретации факторов применялась ротация варимакс. Значения нагрузки ниже 0,3 не учитывались.
Все анализы были выполнены с использованием программного обеспечения с открытым исходным кодом R 2.11.1, пакета HDMD (https: // www.R-project.org).
3. Результаты и обсуждение
Гены, обнаруженные по-разному экспрессируемые () между DCIS и NH или ADH и NH, представлены в таблице 1. В частности, было обнаружено, что 47 из 172 выбранных генов по-разному экспрессируются между DCIS и NH (11 с оценкой ) и 28 были обнаружены по-разному экспрессируются между ADH и NH (только один с оценкой). Примечательно, что 24 из 28 генов, которые, как было обнаружено, по-разному экспрессировались между ADH и NH, были по-разному экспрессированы (аналогичным образом) также между DCIS и NH.Сохранение этого «ядра» генов, дисрегулируемых одинаковым образом в обоих предшественниках инвазивного рака груди, по-видимому, подтверждает гипотезу о том, что ADH является прямым предшественником DCIS. Фактически, в соответствии с предложенным многоэтапным процессом, DCIS показал увеличенное количество генов, дифференциально экспрессируемых по отношению к ADH.
Жирным шрифтом выделены гены с оценкой FDR <0,01. | Что касается нормальной ткани, как DCIS, так и ADH показали сверхэкспрессию ESR1 , кодирующего рецептор эстрогена; CD24, кодируют муцин-подобную молекулу клеточной адгезии, положительно ассоциированную с терминально дифференцированным люминальным фенотипом [43, 44]; GATA3, кодирует фактор транскрипции, участвующий в морфогенезе молочных желез [35, 36]; CLDN7 , EPCAM, и TJP3 , кодирование компонентов с плотным соединением; CDC42 и TIAM1 , кодирующие два небольших члена семейства GTPase, участвующих в клеточной полярности и формировании комплекса апикального соединения.Одновременно оба предшественника рака молочной железы показали недостаточную экспрессию гена EGFR , экспрессия которого обычно отрицательно связана с экспрессией ESR1 , KRT5 , KRT14, и KRT17 , все они кодируют базисные фенотипы цитокератинов. . В целом, этот паттерн экспрессии ясно указывает на то, что DCIS и ADH оба характеризуются терминально дифференцированным люминальным фенотипом. Поскольку все образцы были получены от пациентов с ER-положительной карциномой протоков, можно предположить гипотезу о том, что установление эстроген-зависимого фенотипа в ответ на эстрогены, присутствующие в микросреде, должно быть очень ранним событием в канцерогенном процессе.Такой вывод согласуется с моделью развития рака груди, предложенной Dontu et al. [45], согласно которым ER-положительные раковые образования должны происходить из временно амплифицируемых ER-положительных клеток-предшественников. Ускользнув от контроля пролиферации в результате генетических и эпигенетических изменений в генах, участвующих в решении судьбы клетки, эти ER-положительные клетки-предшественники должны генерировать клетки, конститутивно экспрессирующие рецептор эстрогена. После установления в ADH этот терминально дифференцированный люминальный фенотип, по-видимому, консолидируется в DCIS, что демонстрируется присутствием среди генов, исключительно экспрессируемых в DCIS, KRT18, KRT19, (кодирует некоторые люминально-ассоциированные цитокератины) и DLG1, DLG3, и MPP5 (кодирование некоторых компонентов комплекса полярности ячейки) . В отношении обоих предшественников опухоли гистологически нормальная ткань экспрессировала гены, кодирующие некоторые факторы транскрипции, участвующие в EMT ( SNAI2 и TGFBR3 ) и решении судьбы клетки ( FOXC1 и JAG2), и стволовости -связанные функции ( ABCG2 ). Это открытие является более очевидным, учитывая, что 47 генов, дифференциально экспрессируемых между DCIS и нормальной тканью, среди которых мы обнаружили некоторые другие гены, участвующие в TGF- β -опосредованной EMT ( AKT3, ID4 и TGFBR2 ), и клеточной судьбе. Решение и самообновление ( НОЧ5 и ПРОМ1 ). Столь очевидно парадоксальное открытие, то есть положительная связь между гистологически нормальными тканями и генами, связанными с EMT и стволовостью (более вероятно, ожидаемыми в трансформированных тканях), неудивительна, поскольку мы наблюдали подобное поведение в серии независимых случаев, состоящих из первичный рак молочной железы и соответствующая соответствующая пациенту нормальная ткань (представленная статья) и в нормальной плевре в отношении мезотелиомы плевры [46]. В соответствии с физиологическим ремоделированием молочных желез, такие находки должны поддерживать постоянство резидентных стволовых / предшественников клеток в нормальной ткани [47, 48]. Факторный анализ, примененный для исследования латентных переменных, внутренне связанных с выбранными 172 генами, подтвердил эти выводы и выявил некоторые другие интересные взаимосвязи. В соответствии с результатами, полученными с помощью парного теста t , факторный анализ показал, что в обоих прекурсорах (рис. 1 (а) для DCIS и рис. 2 (а) для ADH) первый фактор (F1) в основном характеризовался генами. связаны с эстроген-зависимым эпителиальным фенотипом.Фактически, среди генов с положительным значением нагрузки на F1 мы обнаружили те, которые кодируют гормональные стероидные рецепторы ( AR и ESR1 ) и транскрипционный коактиватор для рецепторов стероидных и ядерных гормонов ( NCOA1 ), для плотных ( Компоненты соединения EPCAM, MAGI1, MAGI2, MPDZ, TJP1, TJP2 и TJP3 ) и адгезивов ( CTNND1, PFN1 и PVRL2 ), а также для малых членов семейства GTPase, участвующих в процессах поляризации эпителиальных клеток ( ). RHOA ).Кроме того, мы обнаружили некоторые гены, связанные с решением клеточной судьбы: BMI-1, , кодирующий члена группы Polycomb, необходимый для поддержания транскрипционно репрессивного состояния многих генов на протяжении всего эмбрионального развития [49] и дифференцировки взрослых тканей, включая молочную железу. [50]; FDZ4 и FDZ6 , два члена семейства frizzled генов, участвующих в передаче сигналов β -catenin и межклеточной передаче информации полярности в дифференцированных тканях [51]. Кроме того, , в соответствии с мнением о том, что пути передачи сигналов ER α и TGF- β являются основными регуляторами во время развития молочной железы [52], мы обнаружили гены, кодирующие рецептор TGF- β ( TGFBR3) или для белков, участвующих в канонических ( ID1, SMAD2 и SMAD4 ) и неканонических ( PTEN , RHOA и ROCK1 ) путях TGF- β [15, 16]. Наконец, вероятно, связанное с адаптацией DCIS и ADH к гипоксическому стрессу, вызванному дисбалансом между пролиферацией клеток и поставкой кислорода, мы также обнаружили JAM2, JAM3, VEGFA , VEGFB, и VEGFC, все задействованные гены. в пролиферации эндотелиальных клеток. Второй фактор (F2), идентифицированный с помощью факторного анализа (Рисунок 1 (b) для DCIS и Рисунок 2 (b) для ADH), наоборот, характеризовался положительным значением нагрузки нескольких генов, кодирующих мезенхимальные маркеры ( EGF, EGFR, KRT5, KRT6B, KRT14 и KRT17 ) и отрицательное значение нагрузки GATA3, гена, кодирующего фактор транскрипции, управляющий люминальным морфогенезом молочной железы [35, 36]. Кроме того, F2 характеризовался присутствием некоторых генов, кодирующих белки, играющие критическую роль в решении клеточной судьбы и обновлении клеток ( ALDh2A3, FOXC1, NOTCh3, PROM1, и SOX9 ) [53]. Примечательно, что применительно к подгруппе ADH факторный анализ идентифицировал CYP19A1 как включенный в панель генов, характеризующих первый фактор . Этот ген кодирует цитохром P450 (более известный как ароматаза), фермент, который катализирует превращение циркулирующего ростендиона в эстрон или тестостерона в эстрадиол, и его присутствие должно поддерживать гипотезу об очень ранней активации аутокринной продукции эстрогена. Кроме того, сопутствующее присутствие CYP19A1, AR , ESR1, и NCOA1 должно обеспечить транскриптомное подтверждение клинических данных о том, что высокий уровень андрогенов может оказывать пагубное влияние на канцерогенез и прогрессирование молочной железы из-за постоянной местной продукции эстрогенов, которая постоянно стимулирует пролиферацию эпителиальных клеток [54–56]. Применительно к подгруппе DCIS факторный анализ, по-видимому, указывает на консолидацию такой зависимости от эстрогена, о чем свидетельствует дополнительное присутствие PGR , гена, кодирующего рецептор прогестерона и экспрессия которого находится под эстрогенным контролем. 4. ВыводыВыяснение начальных этапов туморогенеза груди имеет первостепенное значение для возможности даже ранней диагностики и, следовательно, адекватной стратегии лечения, направленной на предотвращение злокачественной трансформации пренеопластических изменений.Это особенно важно для DCIS из-за его высокой заболеваемости [1] и возможности развития инвазивного рака груди при отсутствии лечения [6, 7]. Накопленные к настоящему времени экспериментальные данные ясно показали, что в основе неопластической трансформации эпителиальных клеток молочной железы лежит потеря идентичности апикобазальных эпителиальных клеток и приобретение функциональной морфологии мезенхимы. Поэтому мы исследовали паттерн экспрессии выбранной панели генов, связанных с идентичностью эпителиальных клеток (т.е., полярность клеток и комплекс апикального соединения) или вовлечены в TGF- β -опосредованную EMT и решение клеточной судьбы в серии DCIS и соответствующей подобранной пациенту нормальной ткани. Кроме того, мы сравнили профиль DCIS с профилем подобранного пациентом ADH, чтобы исследовать гипотезу, согласно которой прогрессирование рака молочной железы представляет собой многоступенчатый процесс, включающий континуум изменений от нормального фенотипа до гиперпластических поражений, карциномы in situ и инвазивной карциномы [21]. . Статистический анализ, кажется, поддерживает эту гипотезу, потому что он идентифицировал «ядро» генов, в основном связанных с терминально дифференцированным люминальным фенотипом и дифференциально экспрессируемых в обоих предшественниках по отношению к соответствующей нормальной ткани.Примечательно, что эти изменения в экспрессии генов не приводят к прогрессирующему мезенхимальному переходу, а скорее к терминально дифференцированному люминальному фенотипу, что согласуется с моделью, согласно которой ER-положительный инвазивный рак молочной железы происходит из ER-положительных клеток-предшественников [45]. Конститутивная экспрессия ER должна делать клетки, образующие ADH и DCIS, способными использовать пролиферативный стимул, индуцированный эстрогенами, тогда как установление аутокринной продукции эстрогенов посредством превращения андрогенов должно обеспечивать дополнительное селективное преимущество.Пагубный эффект такой постоянной стимуляции эстрогенами должен быть подтвержден наблюдением, что у всех пациентов, включенных в настоящее исследование, развилась инвазивная ER-положительная карцинома протоков. Экспериментальные доказательства, подтверждающие гипотезу о том, что превращение андрогенов может быть вовлечено в развитие DCIS, и прогрессирование было предоставлено недавним исследованием, в котором внутриопухолевая концентрация эстрадиола и 5 α -дигидротестостерона (DHT) и экспрессия некоторых полов Ферменты, продуцирующие стероиды, включая ароматазу, оценивались на образцах DCIS [57].Исследование ясно продемонстрировало, что уровень экспрессии ароматазы был значительно выше при DCIS по сравнению с неопухолевой тканью, что свидетельствует о самоподдерживающемся процессе, принятом DCIS. В совокупности все эти результаты обеспечивают транскриптомное подтверждение того, что, по крайней мере для группы генов, рассматриваемых в настоящем исследовании, ADH и DCIS являются частью онкогенного многоступенчатого процесса и в значительной степени вызывают необходимость регулирования, возможно, с использованием ингибиторов ароматазы, внутриопухолевая и / или циркулирующая концентрация биологически активных андрогенов у пациентов с DCIS для своевременного предотвращения аномальной продукции эстрогенов и блокирования эстроген-индуцированной пролиферации клеток [58]. Нет сомнений в том, что настоящее исследование in silico страдает ограничением, общим для большинства исследований, касающихся профиля экспрессии генов, то есть отсутствием проверки на уровне белка модуляций, наблюдаемых на уровне мРНК. Фактически, хорошо известно, что уровни транскриптов мРНК не всегда отражают экспрессию белка. Однако иммуногистохимические данные, представленные в The Human Protein Atlas, в значительной степени подтверждают различную экспрессию генов, которую мы наблюдали между гистологически нормальной и злокачественной тканью.Например, когда мы рассмотрели 11 генов с оценкой (таблица 1, выделенная жирным шрифтом), мы обнаружили, что экспрессия белка нормальной молочной железы (железистой клетки) и ткани рака молочной железы в основном соответствовала дифференциальной экспрессии мРНК, которую мы наблюдали в нашем наборе данных, что делает наши предварительные выводы более надежны и заслуживают дальнейшего расследования. Вклад автораД. Корадини и П. Боракки внесли равный вклад в эту статью. Дополнительные материалыВ таблице 1 перечислены 199 генов, выбранных для исследования. Таблица 2: перечислены 339 наборов зондов Affymetrix, соответствующих 172 генам, включенным в исследование.
Сравнительная характеристика клеток стромы и протокового эпителия при хроническом панкреатите и протоковой аденокарциноме поджелудочной железыAbstractАденокарцинома протока поджелудочной железы (PDAC) характеризуется обширной стромой, которая также присутствует при хроническом панкреатите (ХП).С помощью иммуногистохимии строма CP и PDAC была всесторонне проанализирована и сопоставлена с изменениями, связанными с эпителием / карциномой, и клинико-патологическими характеристиками пациентов. Хотя не было значительных различий между CP и PDAC в отношении распределения CD3 + T-клеток и α-SMA + фибробластов, пропорции CD4 + и CD8 + T-клеток были значительно ниже, а количество регуляторных T-клеток CD25 + (CD4 +) и FoxP3 + (CD4 +) было больше. в PDAC по сравнению с CP. Макрофаги были более распространены при ХП, но более локализованы в клетках карциномы в PDAC, как и γδ-Т-клетки.Связанная с протоком экспрессия FoxP3 и L1CAM увеличивалась от CP к PDAC, тогда как экспрессия виментина была одинаково высокой при обоих заболеваниях. Более того, стромальные и эпителиальные компартменты хорошо дифференцированных опухолей и CP имеют значительное сходство, тогда как умеренно и низкодифференцированные опухоли значительно отличаются от тканей CP. Анализ 27 параметров в рамках каждого заболевания поджелудочной железы выявил значительную корреляцию между i) CD4 + и FoxP3 + CD4 + Т-клетками с экспрессией FoxP3 в клетках PDAC, ii) фибробластами α-SMA + с экспрессией и пролиферацией L1CAM в клетках PDAC, iii) экспрессией CD3 и CD8. с экспрессией γδ-TCR при обоих заболеваниях поджелудочной железы и iv) макрофагами CD68 + и CD163 + с экспрессией виментина в клетках PDAC.Высокая экспрессия FoxP3, виментина и L1CAM в клетках PDAC, а также связанная с опухолью локализация макрофагов, как правило, коррелировали с более высокой степенью злокачественности опухоли. Многофакторный анализ выживаемости показал, что более молодой возраст на момент операции является положительным прогностическим маркером для пациентов с PDAC с наиболее часто оперируемой стадией заболевания T3N1M0. В целом это исследование выявило несколько взаимосвязей между стромой и эпителиальными / карциномными клетками в PDAC, но также и в CP, что в свете предыдущих экспериментальных данных убедительно подтверждает мнение о том, что воспалительная строма вносит вклад в связанные со злокачественными новообразованиями изменения уже в клетках-предшественниках во время CP. Образец цитирования: Helm O, Mennrich R, Petrick D, Goebel L, Freitag-Wolf S, Röder C, et al. (2014) Сравнительная характеристика клеток стромы и протокового эпителия при хроническом панкреатите и протоковой аденокарциноме поджелудочной железы. PLoS ONE 9 (5): e94357. https://doi.org/10.1371/journal.pone.0094357 Редактор: Золтан Ракончай, Университет Сегеда, Венгрия Поступила: 13 декабря 2013 г .; Одобрена: 13 марта 2014 г .; Опубликовано: 5 мая 2014 г. Авторские права: © 2014 Helm et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Финансирование: «Эта работа была поддержана кластером передового опыта« Воспаление на интерфейсах », финансируемым Deutsche Forschungsgemeinschaft (DFG), и Кильским консорциумом рака поджелудочной железы, финансируемым DFG (DK, DW, HK, HS, SS) . Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.” Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует. ВведениеАденокарцинома протока поджелудочной железы (PDAC) является 4 -й наиболее смертельной опухолевой болезнью с общей 5-летней выживаемостью ~ 2% [1]. Это обычно диагностируется на поздней стадии, что ограничивает лечебные терапевтические возможности <20% пациентов. Кроме того, большинство пациентов с PDAC не реагируют на лучевую или химиотерапию, что еще больше ухудшает прогноз пациента [2].Таким образом, улучшение диагностики на ранней стадии заболевания, а также варианты лечения по-прежнему крайне необходимы. В обоих случаях идентификация надежных биомаркеров имеет решающее значение, позволяя отличить PDAC от других доброкачественных заболеваний поджелудочной железы, с одной стороны, и прогнозировать / улучшать терапевтические реакции, с другой стороны. Были идентифицированы различные предшествующие поражения, которые могут вызывать PDAC. Помимо внутрипротоковых папиллярных муцинозных новообразований (IPMN), муцинозных кистозных новообразований (MCN) и атипичных плоских поражений (AFL), интраэпителиальные неоплазии поджелудочной железы (PanIN) являются наиболее частыми и лучше всего охарактеризованными предвестниками PDAC [3].PanINs обнаруживают протоковый фенотип, что подчеркивает точку зрения, что PDAC происходит из протокового эпителия. Поскольку PDAC характеризуется обширной десмопластической реакцией, составляющей до 80% всей массы опухоли, микросреда опухоли рассматривается как многообещающая цель для улучшения диагностики и лечения PDAC. Строма PDAC состоит из внеклеточного матрикса, фибробластов, миофибробластов и различных иммунных клеток [4], [5]. Интересно, что хронический панкреатит (ХП), который считается фактором высокого риска развития PDAC, также демонстрирует обширный стромальный ответ [4], [5].Предыдущие отчеты продемонстрировали, что популяция опухолеспецифических, неопухолевых стромальных клеток очень вариабельна и создает иммуносупрессивную и способствующую опухоли среду для опухолевых клеток PDAC [4], [5]. Большое количество миофибробластов (определяется с помощью α-SMA), M2-макрофагов (определяется с помощью CD163 или CD204), регуляторных Т-клеток (T-regs определяется с помощью FoxP3 или CD25) и клеток Th3 (определяется с помощью GATA-3 + ). было обнаружено, что обычно коррелирует с прогрессированием опухоли, снижением выживаемости пациентов и худшим прогнозом [6] — [13].Более того, недавнее исследование показало, что стромальный состав CD4 + Т-клеток высокий / CD8 + Т-клетки высокий / T-reg низкий и M1-макрофаги высокий / M2-макрофаги низкий коррелирует с более длительной выживаемостью [ 13]. Помимо популяций антиген-ограниченных Т-клеток, γδ-Т-клетки представляют собой многообещающую популяцию Т-клеток в терапии рака из-за их способности эффективно убивать опухолевые клетки без ограничения HLA [14], [15]. Однако мало что известно об их присутствии и роли во время разработки PDAC. Повышающая регуляция молекулы адгезии L1CAM (CD171) связана с эпителиально-мезенхимальным переходом (EMT), который также характеризуется повышающей регуляцией мезенхимальных белков, таких как виментин [16] — [18]. Экспрессия L1CAM увеличивается во время прогрессирования PDAC в эпителии протоков [16], [19], [20] и коррелирует с плохим прогнозом пациентов с PDAC [21]. Подчеркивая свою протуморигенную функцию, L1CAM индуцирует онкогенность клеток эпителия протоков поджелудочной железы (HPDE) человека, миграцию, устойчивость к апоптозу и метастазирование клеток HPDE и PDAC in vitro и in vivo [16], [19], [22] и участвует в обогащении T-reg в тканях PDAC (неопубликованные наблюдения). Помимо его экспрессии в T-reg и временно в активированных CD4 + T-хелперных клетках, фактор транскрипции вилки 3 (FoxP3) также был обнаружен в различных опухолевых клетках, например колоректальный рак и PDAC [23] — [25]. В PDAC связанная с опухолью экспрессия FoxP3 была связана с иммуносупрессивной функцией in vitro [23], но анализ ее влияния на прогрессирование PDAC еще не завершен. При колоректальном раке высокая экспрессия FoxP3 в опухолях уже была связана с плохим прогнозом [24]. Основываясь на наших глубоких экспериментальных данных, указывающих на связь между связанными с опухолью L1CAM и FoxP3 и стромальными клетками поджелудочной железы, в этом исследовании сравнивалась иммуногистохимическая экспрессия L1CAM и FoxP3 в эпителии протоков поджелудочной железы (с акцентом на PanIN как наиболее частое поражение-предшественник) и стромальный состав тканей ЦП и ПДАК. Более того, чтобы получить более полное представление о сложном взаимодействии эпителий / карцинома-строма, была определена взаимосвязь 27 параметров.Наконец, прогностическое влияние этих параметров было проанализировано в группе пациентов с PDAC с наиболее часто оперируемой стадией заболевания T3N1M0. Материалы и методыЗаявление об этикеИсследование было одобрено этическим комитетом университетской клиники Шлезвиг-Гольштейн, а также университетской клиники Тюбингена (номер ссылки: D430 / 09 и 470 / 210BO1). Письменное информированное согласие было получено от всех пациентов. Пациенты и тканиТкани поджелудочной железы были получены от пациентов во время операции.Консервация тканей PDAC и гистопатологическая диагностика проводились в Институте патологии UKSH Campus Kiel, в то время как консервация тканей CP и их диагностика проводились в Институте патологии Тюбингенского университета. Чтобы определить прогностические переменные для наиболее частой стадии опухоли, в исследование были включены только пациенты с PDAC с опухолевым заболеванием, имеющим патологическую стадию T3N1M0. Характеристики пациентов приведены в Таблице 1 . Помимо определенной стадии заболевания T3N1M0, выбор тканевых блоков был основан исключительно на присутствии опухолевых клеток в тканях PDAC.Выбор тканей CP был основан на наличии повреждений PanIN. ИммуногистохимияДля иммуногистохимии использовали фиксированные формалином и залитые парафином срезы. Окрашивание на CD3 (клон SP7, Fisher / Thermo Scientific, Schwerte, Германия), CD4 (клон 4B12, Leica Novocastra, Wetzlar, Германия), CD8 (клон C8 / 144B, Dako Cytomation, Гамбург, Германия), CD25 (клон 4C9, Leica Novocastra), CD163 (клон 10D6, Leica Novocastra), Ki67 (клон SP6, Fisher / Thermo Scientific), виментин (клон Vim3B4, Dako Cytomation) и альфа-актин гладких мышц (α-SMA) (клон 1A4, Fisher / Thermo Scientific) выполнялась в Институте патологии с использованием рутинной автоматизированной процедуры.Окрашивание L1CAM выполняли, как описано ранее [19], [20], [26]. Для окрашивания FoxP3 (клон hFoxy, ebioscience, Франкфурт, Германия), TCR γδ (клон γ3.20, Thermo Scientific, Dreieich, Германия) и HLA-DR (CR3 / 43, Zytomed, Bargteheide, Германия) дополнительно обрабатывали срезы. как описано ранее [19], [20]. Вкратце, первичные антитела использовали в следующих предварительно титрованных концентрациях (FoxP3: 20 мкг / мл в PBS / 0,3% Triton-X100; TCR γδ: 3 мкг / мл; HLA-DR: 1,02 мкг / мл) и инкубировали 30 мин при комнатная температура (RT).Обнаружение первичных антител выполняли с использованием EnVision-HRP (Dako, Гамбург, Германия) в течение 30 мин при комнатной температуре. Визуализацию проводили с использованием субстрата AEC Substrate (Dako) в течение 2–10 мин. После окончательной промывки в PBS срезы окрашивали в Mayer’s Haemalaun (AppliChem, Дармштадт, Германия) в течение 2 минут. После промывания в воде в течение 10 мин покровные стекла фиксировали глицериновым желатином Кайзера (Waldeck, Мюнстер, Германия). Для отрицательного контроля использовали соответствующие контрольные антитела изотипа, не обнаружившие окрашивания. ОценкаОкрашенные срезы оценивали дважды слепым методом, оценивая интенсивность окрашивания, отражающую интенсивность экспрессии (выраженную как интенсивность) и степень распределения (выраженную как% -положительность всего среза). В случае двух несовпадающих результатов срезы дополнительно оценивались вторым исследователем. В тканях CP и PDAC все параметры, связанные с протоковыми клетками, в основном основаны на оценке PanIN, в тканях PDAC — на оценке опухолевых клеток Стромальный компартмент в тканях CP и PDAC был определен как вся площадь образца поджелудочной железы, исключая ацинарные клетки, эпителиальные / опухолевые клетки, лимфатическая ткань и кровеносные сосуды.Система оценки для каждой переменной объяснена и перечислена в таблице 2 , 3 , 4 . Оценка срезов проводилась с использованием микроскопа Axioplan 2.0 (Zeiss, Jena, Germany). Снимки были сделаны с помощью микроскопа Keyence BZ9000 (Keyence, Ной-Изенбург, Германия). Статистический анализВсе результаты были разделены на категории и выражены как абсолютные и относительные частоты, которые сравнивались между группами с помощью критерия хи-квадрат.Связь между параметрами, относящимися к стромальному и протоковому эпителию, в тканях поджелудочной железы у пациентов с ХП и пациентов с PDAC была проанализирована и протестирована с помощью теста хи-квадрат. Кривые выживаемости оценивались по методу Каплана-Мейера, а возможные факторы влияния определялись с помощью лог-рангового теста. Все тесты были на уровне значимости 5% без поправки на множественное тестирование. Статистический анализ проводился с использованием SPSS 17.0. РезультатыСравнение эпителиальных / опухолевых компартментов стромы и протоков в CP и PDACСначала мы исследовали клеточный состав стромального и протокового эпителиального / опухолевого компартмента в 15 CP и 42 PDAC, используя маркеры, перечисленные в Table 5 .В стромальном компартменте CD3 +, CD4 + и CD8 + Т-клетки были значительно более многочисленными в CP по сравнению с PDAC ( Таблица 5, , Рисунок 1, + 2 ). Хотя CP демонстрируют большее количество CD4 + Т-клеток, доля CD25 + и Foxp3 + клеток в этой популяции Т-клеток, указывающая на регуляторные Т-клетки (T-regs), была заметно выше в PDAC, чем в CP (58% с оценкой 2 по сравнению с 20–26. % со счетом 2 соответственно). Напротив, стромальные γδ-Т-клетки были обнаружены на более высоких уровнях (2 балла) в 80% CP, но только в 50% PDAC.Более того, γδ-Т-клетки внутри или рядом с протоковым / опухолевым эпителием были локализованы в 67% CP, а также у 44% пациентов с PDAC ( Рисунок 3, + 4 ). Кроме того, γδ-Т-клетки более интенсивно накапливались в протоковом / опухолевом эпителии у пациентов с PDAC по сравнению с пациентами с ХП ( Рисунок 3 + 4 ). Подобно результатам для γδ-Т-клеток, CD68-положительные макрофаги были обнаружены в более высоких количествах (2 балла) в 80% CP, но только в 50% PDAC ( Рисунок 3, + 4 ).Интересно, что распределение макрофагов значительно различается: в то время как макрофаги в целом были равномерно распределены в строме и близко к протокам поджелудочной железы в CP, макрофаги CD68 + преимущественно располагались рядом с опухолевыми клетками более чем в 50% PDAC. Аналогичное наблюдение было сделано для CD163, маркера M2-макрофагов. HLA-DR, маркер для M1-макрофагов, также был более распространен в CP (86%) по сравнению с PDAC (59%). Поскольку HLA-DR был обнаружен в областях с большим количеством макрофагов CD163 +, это приводит к предположению, что макрофаги могут иметь общие M1- и M2-характеристики одновременно.Однако в PDAC макрофаги HLA-DR + были равномерно распределены по всей опухоли и не обогащались вблизи опухолевых клеток (фиг. 3 , + 4 ). В отличие от Т-клеток и макрофагов, фибробласты и преимущественно миофибробласты (α-SMA , высокие + клетки) имели тенденцию накапливаться в большем количестве в PDAC по сравнению с CP (61% против 40% с оценкой 2 для фибробластов и 42% против 20%). с оценкой 2 для миофибробластов соответственно) ( Рисунок 3 + 4 ). Рис. 1. Иммуногистохимическая характеристика стромального компартмента в тканях CP и PDAC. Репрезентативные окрашивания показывают распределение CD3, CD8, CD4, CD25 и FoxP3 в стромальных клетках, расположенных в строме поджелудочной железы, удаленных (стромальных) или в непосредственной близости от протоковых эпителиальных / карциномных клеток (эпителиальных) в тканях CP и PDAC. Увеличение × 200. https://doi.org/10.1371/journal.pone.0094357.g001 Рисунок 2. Иммуногистохимическая характеристика стромального компартмента в тканях CP и PDAC. Репрезентативные окрашивания показывают распределение CD3, CD8, CD4, CD25 и FoxP3 в стромальных клетках, расположенных в строме поджелудочной железы, удаленных (стромальных) или в непосредственной близости от протоковых эпителиальных / карциномных клеток (эпителиальных) в тканях CP и PDAC. Увеличение × 800. https://doi.org/10.1371/journal.pone.0094357.g002 Рис. 3. Иммуногистохимическая характеристика стромального компартмента в тканях CP и PDAC. Репрезентативные окрашивания показывают распределение γδ-TCR, CD68, CD163, HLA-DR и α-SMA в стромальных клетках, расположенных в строме поджелудочной железы, удаленных (стромальных) или в непосредственной близости от протокового эпителия / клеток карциномы (эпителиальных) в CP. и ткани PDAC.Увеличение × 200. https://doi.org/10.1371/journal.pone.0094357.g003 Рис. 4. Иммуногистохимическая характеристика стромального компартмента в тканях CP и PDAC. Репрезентативные окрашивания показывают распределение γδ-TCR, CD68, CD163, HLA-DR и α-SMA в стромальных клетках, расположенных в строме поджелудочной железы, удаленных (стромальных) или в непосредственной близости от протокового эпителия / клеток карциномы (эпителиальных) в CP. и ткани PDAC. Увеличение × 800. https: // doi.org / 10.1371 / journal.pone.0094357.g004 Сравнение протоковых эпителиальных клеток в CP с клетками карциномы в PDAC ( Таблица 5, , Рисунок 5 ) показало, что клетки карциномы проявляют значительно повышенную пролиферативную активность, на что указывает: более высокий процент клеток карциномы Ki67 + по сравнению с эпителиальными клетками протоков в ХП. Более того, экспрессия FoxP3 в эпителии протоков уже присутствовала в 80% CP, хотя и только в нескольких клетках (% клеток с оценкой 1) и с низкой экспрессией (оценка по интенсивности 1).Напротив, экспрессия FoxP3 была заметно увеличена в клетках карциномы, обнаруживаемых при балле 2 в 60% (% клеток) и 80% (интенсивность), соответственно. Иммуноокрашивание EMT-ассоциированного L1CAM показало, что> 60% эпителия протока поджелудочной железы в CP экспрессировали L1CAM (% клеток с оценкой 2), в то время как в PDAC примерно 50% опухолевых клеток характеризовались аналогичной оценкой экспрессии. Однако интенсивность экспрессии L1CAM была заметно выше в PDAC (50% с оценкой 2), чем в тканях CP (13% с оценкой 2).Экспрессия виментина как еще один индикатор индукции ЕМТ в эпителиальных клетках протоков уже обнаруживалась в 47% тканей ЦП и аналогичным образом экспрессировалась в клетках карциномы в тканях PDAC. Рисунок 5. Иммуногистохимическая характеристика эпителия протока в тканях CP и PDAC. Репрезентативные окрашивания представляют распределение Ki67, FoxP3, L1CAM и виментина в протоковых эпителиальных / карциномных клетках (эпителиальных) в тканях CP и PDAC. Увеличение × 200 и × 800. https://doi.org/10.1371/journal.pone.0094357.g005 В совокупности наши результаты показывают заметные различия между стромой CP и PDAC. Таким образом, десмопластическая строма PDAC содержит меньшее количество CD8 + и γδ-T-клеток, но большее количество T-reg по сравнению с CP. Эти данные подтверждают гипотезу о том, что стромальный компартмент претерпевает фундаментальные изменения во время прогрессирования инвазивного PDAC, характеризующегося приобретением иммуносупрессивных свойств.Интересно, что связанная с протоками экспрессия FoxP3 и L1CAM, оба обнаруживаемые уже в CP, были значительно повышены в PDAC. Это наблюдение вместе с тем фактом, что экспрессия виментина уже была обильной в протоковом эпителии PanINs при CP, также предполагает, что связанные со злокачественными новообразованиями изменения также могут начинаться во время CP. Сравнение стромального и протокового эпителиального / опухолевого компартментов в CP и PDAC с учетом степени злокачественности опухолиЧтобы выяснить, связана ли дедифференцировка опухолевых клеток с изменениями в стромальном компартменте, стромальный и эпителиальный компартмент в тканях CP сравнивали с таковыми в тканях PDAC с учетом степени опухоли.Подробные результаты каждого отдельного сравнения представлены в таблицах S1, S2, S3 . Как суммировано в Таблица 6 , хорошо дифференцированные (G1) опухоли значительно отличались от тканей CP только количеством CD4 + Т-клеток (код C), которые уже были в меньшем количестве в тканях PDAC, и экспрессия L1CAM (P2) уже повышена в PDAC. клеток по сравнению с эпителием протока в тканях ХП. Напротив, умеренно (G2) и низкодифференцированные (G3) опухоли значительно различались по большему количеству параметров от тканей CP.Более подробно, количество CD8 + T-клеток (B) было значительно снижено в опухолях G3, но не в опухолях G2 и G1, в то время как количество CD25 + (CD4 +) T-клеток уже было увеличено в опухолях G2. Различия относительно количества и локализации макрофагов (h2, h3, I1, I2), а также пролиферации (N) и экспрессии FoxP3 (O1 + O2) также были очевидны в опухолях G2. Напротив, не удалось определить никаких значительных различий в отношении количества CD3 + Т-клеток, γδ-Т-клеток, фибробластов α-SMA и экспрессии виментина.В целом эти данные предполагают, что не только эпителиальный / опухолевый, но и стромальный компартмент в хорошо дифференцированных (G1) PDAC все еще имеет большее сходство с таковыми в тканях CP, чем опухоли G2 и G3, подвергшиеся дедифференцировке. Таблица 6. Результаты статистического сравнения параметров стромальных и протоковых / опухолевых клеток в тканях поджелудочной железы пациентов с ХП и пациентов с хорошо (G1), умеренно (G2) и низкодифференцированным (G3) PDAC. https: // doi.org / 10.1371 / journal.pone.0094357.t006 Взаимосвязь между параметрами стромального и протокового эпителия в тканях поджелудочной железы пациентов с ХПЗатем мы проверили гипотезу о том, коррелирует ли экспрессия стромальных маркеров в CP друг с другом и с эпителиальными маркерами неопухолевого эпителия протока поджелудочной железы и поражениями PanIN, соответственно (, таблица 7, ). Можно отметить следующие наиболее поразительные взаимосвязи, в основном показывающие статистическую значимость.Коды соответствующих переменных, используемых в таблицах, указаны в скобках. i) Низкая экспрессия FoxP3 (O1 + O3) и L1CAM (P1 + P3) в эпителии протоков коррелировала с преобладанием CD4 + Т-клеток над CD8 + Т-клетками (D) и наоборот. iii) макрофаги CD68 + и CD163 + коррелировали относительно их пропорции (h2 и I1), а также их локализации в ткани (h3, I2). Последнее применимо также к макрофагам HLA-DR + (K2). iv) Макрофаги HLA-DR + не показали предпочтительной локализации в тканях CP (K1 + K2).Однако при большем количестве эти клетки преимущественно локализуются вблизи эпителия протоков (K1 + K3). v) Низкое количество миофибробластов (L2) коррелировало с низкой экспрессией FoxP3 (O1) и, как правило, коррелировало с экспрессией L1CAM в протоках поджелудочной железы (P1 + P3). Напротив, большое количество миофибробластов имеет тенденцию коррелировать с высокой экспрессией L1CAM в эпителии протоков (P1 + P3). vi) Наконец, высокий балл FoxP3 (O3) был связан с высоким баллом L1CAM (P3) в эпителии протоков в тканях CP. Взаимосвязь между стромальными и связанными с карциномой параметрами в тканях поджелудочной железы у пациентов с PDACЗатем мы проверили гипотезу, коррелирует ли экспрессия маркеров десмопластической стромы в PDAC друг с другом и с клетками карциномы (, таблица 8, ). Можно отметить следующие наиболее поразительные взаимосвязи, в основном показывающие статистическую значимость. Коды соответствующих переменных, используемых в таблицах, указаны в скобках. i) Большое количество CD3 + Т-клеток (A) было связано с большим количеством CD8 + (B) и CD4 + (C) Т-клеток.Преобладание CD8 + T-клеток над CD4 + T-клетками (D) было связано с большим количеством FoxP3 + (CD4 +) T-клеток (F), в то время как низкое количество CD8 + T-клеток (B) не было связано с большим количеством HLA-DR + макрофагов ( K1), ни с их локализацией, связанной с опухолью (K3). Напротив, ткани с высоким процентом связанных с опухолью макрофагов HLA-DR + (K3) характеризовались высоким количеством CD25 + (CD4 +) Т-клеток (E). Аналогичная тенденция, хотя и не значимая, наблюдалась для макрофагов CD68 +, расположенных в непосредственной близости к клеткам карциномы (h4), а также к Т-клеткам FoxP3 + (CD4 +) (F).ii) Когда CD4 + Т-клетки (C) сильно накапливались в строме, эти клетки демонстрировали преобладание над CD8 + T-клетками (D) и наоборот. Кроме того, высокое количество CD4 + Т-клеток (C) коррелировало с низким показателем CD25 + (CD4 +) (E) и FoxP3 + (CD4 +) (F) T-клеток, и наоборот. iii) Низкое количество CD4 + (C), но высокое количество FoxP3 + (CD4 +) Т-клеток (F) было связано с высокой экспрессией FoxP3 в опухолевых клетках (O1). iv) Процент и интенсивность FoxP3 (O1 – O3) положительно коррелировали с экспрессией L1CAM (P1 + P2) в опухолевых клетках.Более того, высокий процент опухолевых клеток FoxP3 + (O1) имел тенденцию коррелировать с более высокой оценкой (S). v) Процент (h2) и локализация (h3) макрофагов CD68 + положительно коррелировали как с макрофагами CD163 + (I1, I2), так и с локализацией макрофагов HLA-DR + (K2). Высокое количество макрофагов CD68 + (h2) было связано с большим количеством макрофагов CD163 + (I1). При малых количествах макрофаги CD68 + (h2) и CD163 + (I1) преимущественно локализовались вблизи опухолевых клеток, в то время как при более высоких количествах обе популяции макрофагов были равномерно распределены по тканям, соответственно (h3, I2).Более того, когда только небольшое количество макрофагов CD68 + было локализовано в непосредственной близости от опухолевых клеток (h4), эти макрофаги редко экспрессировали HLA-DR (K3). vi) Связанная с опухолью локализация макрофагов CD68 + (h3) и CD163 + (I2) была связана с большим количеством миофибробластов (L2). vii) Напротив, низкое количество фибробластов (L1) коррелировало с повышенным процентом клеток карциномы Ki67 + (N), а также с высоким накоплением CD3 + (A) и CD4 + (C) Т-клеток. Не было обнаружено корреляции с присутствием CD8 + (B), CD25 + (CD4 +) (E) или FoxP3 + (CD4 +) (F).Соответственно, преобладание CD8 + над CD4 + Т-клетками (D) было обнаружено по тренду при наличии большого числа фибробластов (L1). viii) Высокое содержание фибробластов (L1) в строме опухоли коррелировало с повышенной экспрессией L1CAM в клетках карциномы (P2), а высокое количество макрофагов CD68 + (h2) и CD163 + (I1) коррелировало с повышенной экспрессией виментина в опухолевых клетках (R ). ix) Наконец, локализация макрофагов CD68 + (h3) и CD163 + (I2) рядом с клетками карциномы, а также высокая экспрессия FoxP3 (O2), L1CAM (P3) и виментина (R), соответственно, имели тенденцию быть связаны с более высокой оценкой (S). Взаимосвязь между стромальным и протоковым эпителием / связанными с карциномой γδ-Т-клетками в тканях поджелудочной железы пациентов с ХП и ОАППоскольку присутствие γδ-Т-клеток вообще редко исследовалось в тканях CP и PDAC, в данном исследовании был проведен более подробный анализ этих клеток (система оценок см. , таблица 9, ). Как показано в таблице 10 , γδ-Т-клетки располагались в той же области стромы и протокового / опухолевого эпителия, что и CD3- и CD8-положительные Т-клетки при обоих заболеваниях поджелудочной железы.Кроме того, γδ-Т-клетки более интенсивно накапливались в злокачественном эпителии и строме рядом с опухолевыми клетками в PDAC, тогда как в тканях CP γδ-Т-клетки были распределены по всему стромальному компартменту ( Таблица 10, , Рисунок 3 + 4 ). Корреляция параметров стромы и карциномы с выживаемостью пациентаНаконец, мы исследовали взаимосвязь между параметрами стромы и карциномы и выживаемостью пациентов.В отличие от предыдущих отчетов, это исследование предназначалось для оценки корреляции этих параметров с выживаемостью пациентов с наиболее часто оперируемой стадией заболевания, а именно стадией опухоли T3, узловым статусом N1 и отсутствием отдаленных метастазов (M0). Только более высокий возраст на момент постановки диагноза / операции может быть значительно коррелирован с более коротким временем выживания (, рис. 6A, ). Кроме того, более высокое количество CD3 + Т-клеток (, фиг. 6B, ), а также низкая экспрессия FoxP3 (, фиг. 6C, ) и L1CAM (, фиг. 6D, ) в клетках карциномы, как правило, коррелировали с более продолжительным выживанием пациентов. Рис. 6. Корреляция параметров стромы и карциномы с выживаемостью пациента. Кривые Капплана-Мейера показывают влияние ( A ) возраста на момент операции, ( B ) CD3 + клеток / строму, ( C ) экспрессии FoxP3 в опухолевых клетках (интенсивность) и ( D ). ) Экспрессия L1CAM в опухолевых клетках (% клеток) при выживаемости пациентов со стадией T3N1M0. Под каждым графиком изображены числа, подверженные риску. https://doi.org/10.1371 / journal.pone.0094357.g006 ОбсуждениеИ CP, и PDAC характеризуются обширной и уникальной стромальной реакцией, которая, по-видимому, способствует развитию опухоли у первых и прогрессированию вторых [4], [5], [12], [13], [27] ]. Глубокие экспериментальные данные in vitro, и in vivo, подчеркивают роль стромальных клеток в инициации и прогрессировании PDAC [22], [28] — [30]. Используя эндогенную модель мышей PDAC, Rhim et al. показали, что воспаление может индуцировать эпителиально-мезенхимальный переход (ЭМП) эпителиальных клеток протоков поджелудочной железы, тем самым способствуя инвазии и диссеминации клеток еще до образования первичных опухолей [31].Соответственно, наши собственные исследования продемонстрировали роль миофибробластов в повышающей регуляции L1CAM (как части EMT) не только в PDAC, но уже и в нетрансформированных клетках протока поджелудочной железы (HPDE), обеспечивая инвазивный и устойчивый к апоптозу фенотип [16]. , [19], [22]. Кроме того, была продемонстрирована роль макрофагов в индукции ЭМП в опухолевых клетках поджелудочной железы [32], [33]. Подобно FoxP3 [23], ассоциированная с опухолевыми клетками экспрессия L1CAM, как было показано, наделяет иммуносупрессивные функции CD4 + T-клеткам in vitro (неопубликованные наблюдения).Основываясь на этих данных, это исследование было направлено на всесторонний анализ корреляции между стромальными клетками (Т-клетки, макрофаги, миофибробласты) и маркером протоковых / карциномных клеток (пролиферация, экспрессия FoxP3, L1CAM и виментина) в CP и PDAC, а также прогностическое значение этих переменных для лучшей интеграции экспериментальных данных, полученных в исследованиях in vitro, и in vivo, . Большое количество стромальных клеток, таких как регуляторные Т-клетки, макрофаги и миофибробласты, уже коррелировали с короткой выживаемостью пациентов с PDAC [7], [8], [10], [12], [13].Однако все эти исследования проводились с неоднородной когортой пациентов, например включая стадии опухоли от Т1 до Т4. Напротив, наше исследование предназначалось для проверки прогностической значимости различных переменных, связанных со стромой и опухолью, у пациентов с PDAC с определенной, наиболее часто оперируемой стадией опухоли T3N1M0. Только возраст до 65 лет на момент операции достоверно коррелировал с более длительным сроком жизни пациентов. Кроме того, высокие уровни CD3, но низкие уровни FoxP3 и L1CAM в опухолевых клетках, как правило, коррелировали с улучшением выживаемости пациентов, что согласуется с предыдущими отчетами, демонстрирующими высокую связанную с опухолью экспрессию FoxP3 и L1CAM в качестве отрицательного прогностического маркера [21], [21] [ 24].Таким образом, это исследование предполагает, что ни одна из определенных переменных не является подходящим прогностическим маркером у пациентов с этой запущенной стадией заболевания. Чтобы подтвердить этот вывод, необходим дальнейший анализ более крупных когорт пациентов. Можно также предположить, могут ли стромальный состав и маркеры, обнаруженные в этом исследовании, быть более подходящими для прогнозирования терапевтических ответов, как это было показано для пациентов с раком груди [34]. Анализ экспрессии генов уже показал, что стромальный компартмент в CP заметно отличается от такового в PDAC [35].В целом, настоящее исследование обнаружило четкие различия в составе стромы в тканях поджелудочной железы у пациентов с ХП и PDAC, хотя были проанализированы и другие маркеры. Более того, в нашем исследовании сравнивались стромальные и эпителиально-опухолевые параметры в тканях CP и PDAC с учетом статуса дифференцировки (степени) опухолей. Хотя наше исследование включало только определенное количество случаев, этот анализ ясно показывает, что хорошо дифференцированные опухоли все еще имеют несколько общих черт с тканями CP, тогда как умеренно и низкодифференцированные опухоли значительно отличаются от тканей CP.В то время как в тканях ЦП обнаружено более высокое количество CD4 + Т-клеток и макрофагов, ткани PDAC характеризовались более высоким содержанием регуляторных Т-клеток и, соответственно, миофибробластов. Более подробно, большее количество CD4 +, CD8 + и стромальных γδ-Т-клеток, но меньшее количество регуляторных Т-клеток и миофибробластов присутствовало в CP по сравнению с PDAC. Параллельное окрашивание CD3 и CD8 в последовательных срезах показало, что γδ Т-клетки были расположены в той же области стромы или эпителия протоков, что и CD3- и CD8-положительные клетки в тканях CP.Различная стромальная локализация γδ-Т-клеток в PDAC по сравнению с пациентами с ХП может быть объяснена изменениями стромального состава во время прогрессирования до инвазивного PDAC (см. Выше). Более того, в отличие от пациентов с PDAC, γδ-Т-клетки накапливались в лимфоидных фолликулах пациентов с ХП, что свидетельствует о привлечении γδ-Т-клеток к месту воспаления, тогда как γδ-Т-клетки у пациентов с PDAC были мобилизованы на место опухоли (данные не показано). Присутствие γδ-Т-клеток в строме, прилегающей к опухолевым клеткам, и их локализация в злокачественном эпителии пациентов с PDAC демонстрируют, что γδ-Т-клетки инфильтрируются в PDAC.Хотя γδ-Т-клетки имеют низкую частоту в периферической крови, а также в исследуемых тканях, γδ-Т-клетки накапливаются в протоковом эпителии пациентов с PDAC рядом с опухолевыми клетками. Такое накопление γδ-Т-клеток в PDAC подчеркивает важную роль γδ-Т-клеток в иммунном ответе против PDAC. Однако их активность, по-видимому, подавляется ярко выраженным иммуносупрессивным микроокружением в PDAC. Регуляторные Т-клетки, известные своей иммуносупрессивной функцией [4], соответственно были более многочисленны в PDAC, чем в CP.Кроме того, миофибробласты также вносят свой вклад в иммуносупрессивную микросреду, выделяя, например, высокие количества TGF-β1 [4], как правило, более распространены в PDAC, чем в тканях CP. Таким образом, эффективной стратегией повышения активности γδ-Т-клеток и, вероятно, преодоления иммуносупрессии стромального состава может быть использование усилителя цитотоксичности γδ-Т-клеток [36]. Кроме того, могут оказаться полезными стратегии по устранению или подавлению регуляторных Т-клеток и миофибробластов. В отличие от регуляторных Т-клеток и миофибробластов, в макрофагах было больше CP, чем в PDAC, независимо от их фенотипа, характеризующегося высокой экспрессией M1-родственного HLA-DR или M2-родственного CD163.Интересно, что CP не только значительно отличались от тканей PDAC в отношении количества макрофагов, как это наблюдалось для γδ-T-клеток. Распределяясь по строме в ЦП, макрофаги преимущественно располагались в непосредственной близости от опухолевых клеток в тканях PDAC. Более того, эта локализация, связанная с опухолью, была связана с повышенной экспрессией виментина в опухолевых клетках, более высоким содержанием миофибробластов и более высокой степенью классификации. Накопление миофибробластов, в свою очередь, коррелировало с повышенной экспрессией L1CAM в протоковых и опухолевых клетках, что подтверждает экспериментальные данные о роли макрофагов и миофибробластов в индукции ЭМП путем активации виментина и L1CAM в протоковых клетках и клетках PDAC [16], [33], [37] ].Недавно было показано, что не только макрофаги с противовоспалительным фенотипом (например, характеризующиеся экспрессией CD163), которые, как предполагается, обладают протанкогенной активностью, способствуют ЕМП в предраковых и злокачественных эпителиальных клетках протоков поджелудочной железы, но также и провоспалительные. макрофаги (например, характеризующиеся высокой экспрессией HLA-DR) [33]. Взятые вместе эти данные нашей группы, вышеупомянутые результаты Rhim et al. [31] и данные этого исследования, есть убедительные доказательства того, что макрофаги играют центральную роль в индукции EMT и дедифференцировке эпителиальных клеток протоков поджелудочной железы.Учитывая тот факт, что макрофаги в большом количестве присутствуют в тканях CP и все еще проявляют более провоспалительные свойства, индукции EMT могут способствовать провоспалительные медиаторы уже в поражениях CP и / или PanIN. Соответственно, L1CAM, как и виментин, уже значительно экспрессировались в эпителиальных клетках протоков в тканях CP, что подчеркивает экспериментальные данные, показывающие, что воспаление способствует EMT в предраковых клетках / клетках-предшественниках [16], [31]. В отличие от L1CAM, роль связанной с опухолью экспрессии FoxP3 в развитии PDAC менее известна.Это исследование демонстрирует, что FoxP3 уже экспрессируется в эпителии протоков в тканях CP, хотя и в меньшей степени, чем в PDAC. Подобно L1CAM, низкая экспрессия FoxP3 коррелировала с низким количеством CD3 + Т-клеток и миофибробластов в CP и, соответственно, уровень экспрессии FoxP3 положительно коррелировал с экспрессией L1CAM в протоках поджелудочной железы. Предварительные результаты показывают, что активация L1CAM зависит от FoxP3 (неопубликованные наблюдения). Это также может указывать на роль FoxP3 в EMT, что подтверждается открытием, что высокая экспрессия FoxP3 была связана с более высокой степенью классификации у пациентов с PDAC.В соответствии с предыдущими открытиями, предполагающими иммуносупрессивную роль FoxP3 в клетках PDAC [23], высокая экспрессия FoxP3 в опухолевых клетках была связана с низким количеством CD4 + Т-клеток, но повышенным количеством регуляторных Т-клеток, как это было обнаружено FoxP3 + Т-клетками. В совокупности это исследование выявило четкие количественные и качественные различия в стромальном составе, а также в фенотипе протоковых и опухолевых клеток в CP и PDAC, соответственно. Более того, наше исследование показывает, что дедифференцированные, но недостаточно дифференцированные опухоли явно отличаются от тканей CP на основе маркеров, проанализированных в этом исследовании.Таким образом, чтобы выявить достоверные маркеры для надежного распознавания CP и особенно хорошо дифференцированных опухолей, было бы разумно провести скрининг большего числа случаев. Мы осознаем тот факт, что объяснительная сила исследования была бы выше с большей когортой, однако было обнаружено несколько взаимосвязей между стромой и протоковыми / карциномными клетками, которые в свете уже опубликованных экспериментальных данных in vitro, и доклинических исследований [ 31] решительно поддерживают точку зрения, что воспалительная строма вносит вклад в связанные со злокачественными новообразованиями изменения, такие как EMT, уже в предраковых клетках / клетках-предшественниках во время CP. БлагодарностиАвторы благодарят Сандру Крюгер, Дагмар Лейснер и Майке Витт-Рамдохр за отличную техническую помощь. Вклад авторовЗадумал и спроектировал эксперименты: HHO DW SS. Выполнял эксперименты: OH RM DP LG HS C. Röcken. Проанализированы данные: OH RM DP LG SFW HHO DW SS. Предоставленные реагенты / материалы / инструменты анализа: К. Рёдер, Х. К., К. Рёкен, Б. С., ДК, HS. Написал статью: C. Röcken HHO DW SS. Ссылки
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
