Дисплазия шейки матки 2 степени – лечение за 1 процедуру и БЕЗ ОПЕРАЦИИ!
Афанасьев Максим Станиславович. Д.м.н., профессор, онколог, хирург, онкогинеколог, гинеколог-иммунолог, эксперт по лечению дисплазии и рака шейки и тела матки.
Дисплазия шейки матки – грозное и, увы, распространённое женское заболевание. Откройте любой гинекологический форум и вы увидите, что каждый третий вопрос о том, как лечить дисплазию и можно ли надеяться на благоприятный прогноз. Этот материал я написал с целью развеять укоренившиеся заблуждения по поводу дисплазии шейки матки 2 степени – как избыточно оптимистичные, так и необоснованно негативные. В своей статье я постараюсь ответить на все вопросы. Вы узнаете способы лечения дисплазии шейки матки 2 степени и опасность выжидательной тактики применительно к этому диагнозу. При этом я не буду призывать вас делать операцию.
Уже более 15 лет я занимаюсь патологией шейки матки, последние 8 лет практикую лечение предраковых состояний безоперационным методом фотодинамической терапии.
Что такое дисплазия шейки матки 1-2 степени и чем она опасна?
Дисплазия — это процесс на слизистой, при котором эпителий цервикального канала и влагалищной части шейки матки заменяется нетипичными клетками.
Этот процесс в 99 % случаев запускается после инфицирования папилломавирусом так называемого высокого онкогенного риска 16, 18, 31, 33, 35, 45 или 66 серотипов. ДНК вируса встраивается в ДНК клетки эпителия и вызывает в ней многочисленные негативные изменения. Накопление повреждений приводит к прогрессированию заболевания и вызывает со временем перерождение клеток в злокачественные.
Курение, неблагоприятная наследственность, снижение иммунитета, агрессивная городская среда и другие факторы уменьшают сопротивляемость организма, облегчают вирусу его разрушительную работу и ускоряют этот процесс.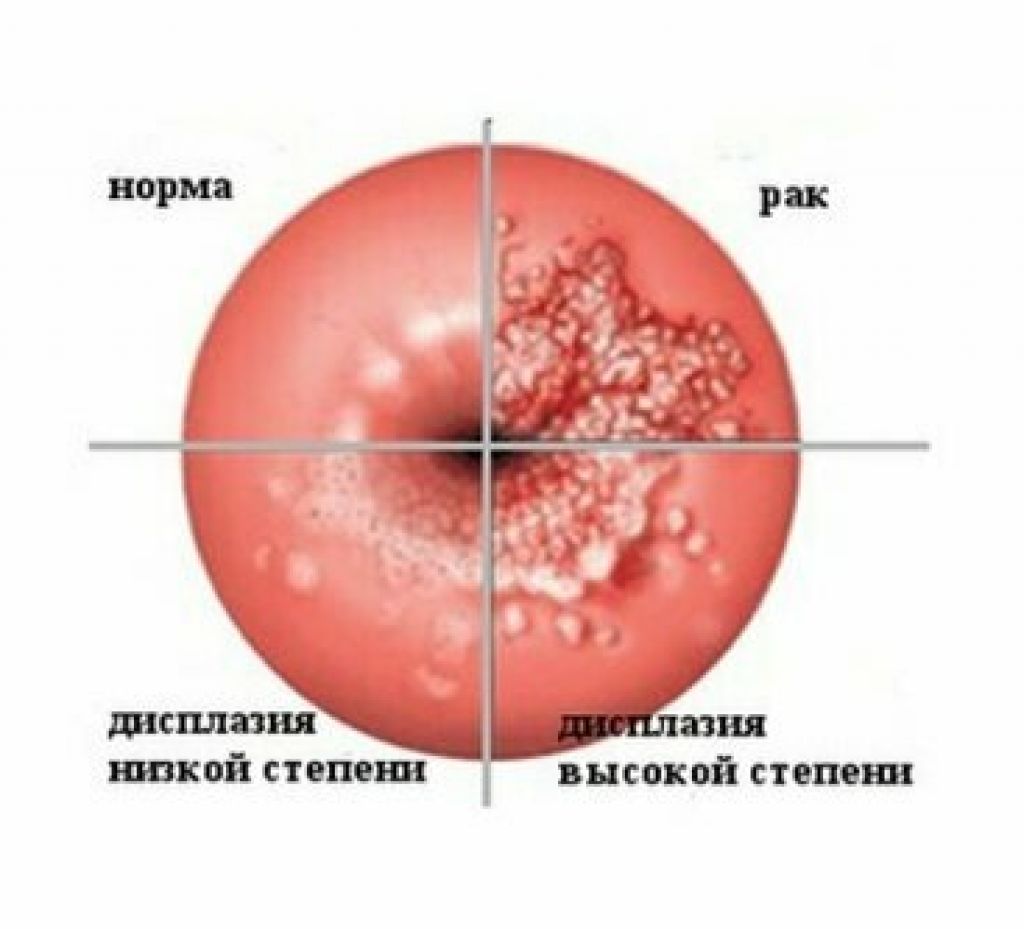
По какой-то причине до сих пор эффективной считается консервативное медикаментозное лечение дисплазии второй степени иммуномодуляторами. В литературе для терапевтов-гинекологов поощряется также тактика полного отказа от лечения: в ожидании самопроизвольного выздоровления женщину рекомендуют регулярно наблюдать и держать тем самым развитие процесса под контролем. Считается, что от момента появления первых симптомов дисплазии развитие рака шейки матки занимает 3 — 5 лет. Что дисплазия эпителия 1 2 степени в течение 1 — 2 лет никак не прогрессирует, а в 30% случаев происходит самоизлечение. Согласно данным медицинской литературы, в случае прогрессирования переход между степенями занимает от 1 года до 2.
Ничуть не умаляя достоинств иммуномодуляторов и тактики наблюдения, хочу со всей ответственностью заявить, что ситуация на сегодняшний день кардинально отличается от описываемой в учебниках. В своей практике я всё чаще наблюдаю недостоверность этих данных и значительное укорочение промежутков перехода дисплазии между стадиями. Самое страшное последствие диспластических изменений – это рак. Наблюдение и медикаментозное лечение дисплазии 2 и 3 степени приводят к печальным последствиям. Ко мне приходят пациентки, которые регулярно наблюдаются у гинеколога по поводу дисплазии, когда неопасный на первый взгляд процесс всего за 6 месяцев переходит в инвазивный рак. В последнем случае единственное возможное лечение – полное удаление матки и яичников по жизненным показаниям и лучевая терапия.
У этого явления две причины. С одной стороны сам вирус папилломы становится все более агрессивным. С другой стороны – врачи женских консультаций не всегда адекватно оценивают тяжесть дисплазии и связанные с нею риски. Поэтому при выделении в анализах ВПЧ 16, 18, 31, 33, 35, 45, 66 серотипов или подозрении на дисплазию я рекомендую получить консультацию узкого специалиста –
С другой стороны – врачи женских консультаций не всегда адекватно оценивают тяжесть дисплазии и связанные с нею риски. Поэтому при выделении в анализах ВПЧ 16, 18, 31, 33, 35, 45, 66 серотипов или подозрении на дисплазию я рекомендую получить консультацию узкого специалиста –
О чём говорит диагноз CIN шейки матки 1 2 степени?
В международной классификации применяются иные термины, некоторые из них прижились и у нас.
| Таблица соответствия разных классификаций неопластических заболеваний шейки матки | ||
| LSIL | CIN I | дисплазия 1 степени |
| HSIL | CIN II | дисплазия 2 степени |
| дисплазия 3 степени рак in situ | ||
| инвазивный рак | рак | инвазивный рак |
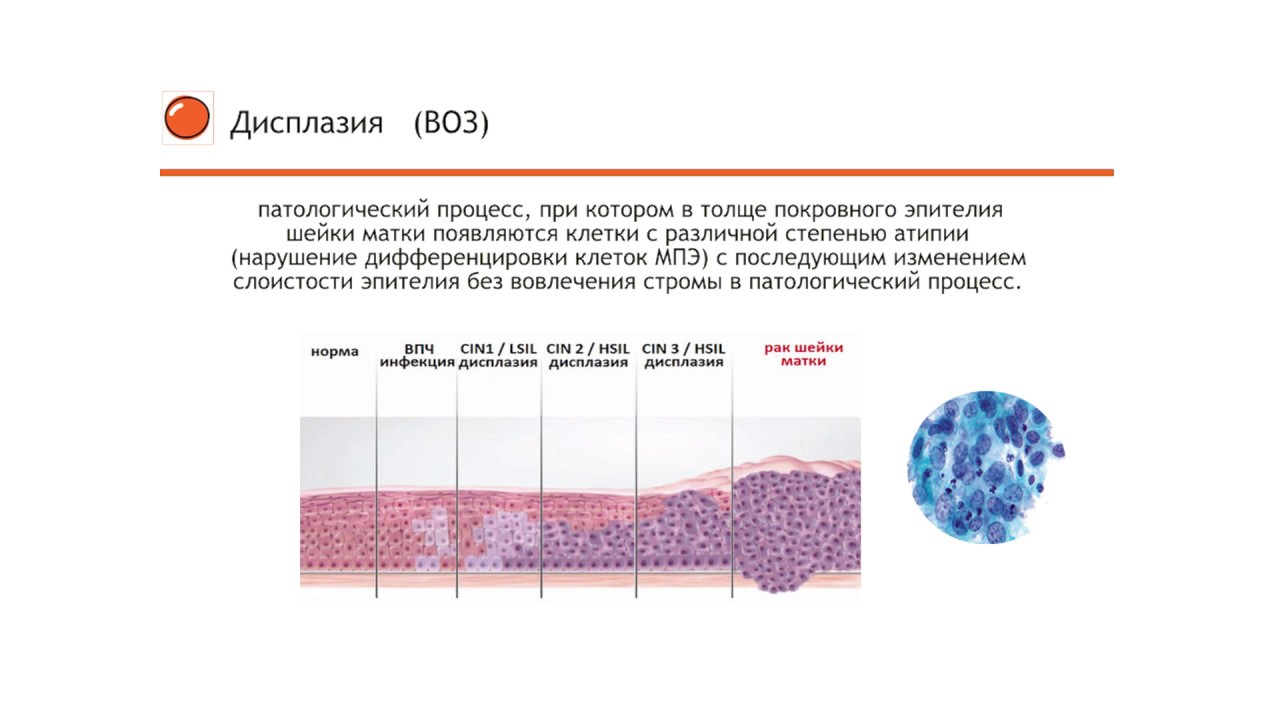
Дисплазия CIN 2 шейки матки расшифровывается как цервикальная интраэпителиальная неоплазия и означает умеренную степень поражения слизистой. CIN 3 — третью, тяжёлую степень поражения и рак ин ситу, то есть без прорастания в окружающие ткани. Между тем в последней международной классификации 2012 года нет разделения на вторую и третью степени дисплазии. Сегодня выделяют только легкую степень LSIL и тяжелую – HSIL. LSIL (low grade squamous intraepithelial lesion) означает лёгкую дисплазию 1 степени, HSIL (high grade squamous intraepithelial lesion) соответствует дисплазии 2–3 степени. В данной классификации дисплазия 2 и 3 объединены, так как они обладают высоким потенциалом к перерождению и требуют одинакового подхода к лечению. Введением новой классификации медицинские круги фактически подтверждают серьезную опасность дисплазии второй степени.
CIN 3 — третью, тяжёлую степень поражения и рак ин ситу, то есть без прорастания в окружающие ткани. Между тем в последней международной классификации 2012 года нет разделения на вторую и третью степени дисплазии. Сегодня выделяют только легкую степень LSIL и тяжелую – HSIL. LSIL (low grade squamous intraepithelial lesion) означает лёгкую дисплазию 1 степени, HSIL (high grade squamous intraepithelial lesion) соответствует дисплазии 2–3 степени. В данной классификации дисплазия 2 и 3 объединены, так как они обладают высоким потенциалом к перерождению и требуют одинакового подхода к лечению. Введением новой классификации медицинские круги фактически подтверждают серьезную опасность дисплазии второй степени.
Как диагностируется дисплазия
У заболевания отсутствуют видимые симптомы, поэтому для своевременной диагностики необходим осмотр врача-гинеколога один раз в год. Это может быть ваш участковый врач. Но ни гинекологический мазок, ни УЗИ не помогают в выявлении предраковых заболеваний шейки матки. Запомните стандартный международный алгоритм:
Это может быть ваш участковый врач. Но ни гинекологический мазок, ни УЗИ не помогают в выявлении предраковых заболеваний шейки матки. Запомните стандартный международный алгоритм:
- Цитология – исследование соскоба с шейки матки методом жидкостного цитологического исследования.
- Кольпоскопия – осмотр шейки матки под микроскопом.
- Биопсия шейки матки и гистологическое исследование биопата (гистология, или патоморфологическое исследование).
- Новый метод диагностики патологических изменений на шейке матки – флюоресцентная диагностика.
Если диагноз «дисплазия эпителия 1 2 степени» подтверждается, то с этого самого момента вы должны начать посещать онкогинеколога 1 раз в 6 – 12 месяцев. В своей практике я придерживаюсь максимально щадящего подхода, особенно по отношению к нерожавшим женщинам. Биопсия шейки матки при дисплазии 2 степени представляется мне необоснованно травматичной процедурой. Поэтому я строюсь избегать ее и для диагностики использую комплекс из трех современных методов. Жидкостное цитологическое исследование с видео кольпоскопией и флюоресцентной диагностикой позволяет мне не проводить биопсию и ставить при этом правильный диагноз.
Поэтому я строюсь избегать ее и для диагностики использую комплекс из трех современных методов. Жидкостное цитологическое исследование с видео кольпоскопией и флюоресцентной диагностикой позволяет мне не проводить биопсию и ставить при этом правильный диагноз.
Особенности течения заболевания сегодня
Для удобства приведу свои наблюдения в виде списка.
- За всю свою практику я не встречал ни одного случая самоизлечения с диагнозом «дисплазия шейки матки 1-2 степени».
- Дисплазия и рак встречаются даже у молодых нерожавших девушек и женщин 25-39 лет и протекают бессимптомно.
- Вирус папилломы человека стал более агрессивным. После постановки диагноза «дисплазия 1» и до диагноза «инвазивный рак шейки матки» может пройти всего год. К сожалению, терапевты-гинекологи не информируют своих пациенток об опасности дисплазии и, соответственно, не направляют за профессиональной консультацией к онкогинекологу.
- Каждый этап лечения делает вирус все более резистентным.
 Так, 2–3 конизации приводят к феноменальной устойчивости вируса и невосприимчивости его к другим методам лечения. Соответственно, в этом случае здоровье женщины приходится сохранять удалением матки.
Так, 2–3 конизации приводят к феноменальной устойчивости вируса и невосприимчивости его к другим методам лечения. Соответственно, в этом случае здоровье женщины приходится сохранять удалением матки.
Устаревшие методы лечения дисплазии 2 степени
Видео научного доклада с конференции в г. Астрахань
Пограничная дисплазия между 2 и 3 степенью является прямым показанием
- Она психологически тяжело переносится.
- Требует длительного восстановления.
- Чревата осложнениями – от кровотечения до снижения и полной потери репродуктивной функции – впоследствии наблюдаются как серьезные затруднения с зачатием, так и с возможностью вынашивания плода.

- Самый главный недостаток конизации как метода лечения в том, что он не устраняет причину заболевания – вирус папилломы человека. Даже при высокой конизации пораженный вирусом эпителий сохраняется в верхних отделах цервикального канала шейки матки.
- Назначенные после конизации методы коррекции иммунитета не оказывают прямого влияния на папилломавирус. Поэтому говорить об окончательном излечении после конизации не приходится.
- Конизация имеет высокий процент рецидивов. По разным официальным данным в течение года дисплазия «возвращается» у 50-70% пролеченных женщин.
- Рецидив всегда сопровождается усугублением диагноза: дисплазия второй степени переходит в третью, третья – в рак ин ситу шейки матки.
- На фоне рецидива требуются повторная конизация.
- Часто повторная конизация невозможна, тогда выполняется ампутация шейки матки.
Давайте поподробнее остановимся на некоторых моментах. Шейка матки — это защитный барьер между внутренней средой организма и внешней средой. Операция конизации и тем более ампутации приводит к тому, что этот барьер становится несостоятельным. Для сравнения представьте себе окно, выходящее на оживленную улицу. Окно закрыто – в помещении всё нормально: шум, пыль и холод остаются снаружи. Но стоит открыть окно – и всё тут же проникает внутрь. Так же и в случае, если удаляют шейку матки. У оперированных женщин чаще наблюдаются воспалительные заболевания. Снижаются шансы забеременеть и родить самостоятельно. Так как шейка матки после операции становится короче, часто она не выдерживает тяжесть плода и после 16 недели произвольно раскрывается. Так как цервикальный канал после конизации заживает с формированием рубца, шейка в родах раскрывается недостаточно и не может обеспечить прохождение ребёнка по родовым путям.
Операция конизации и тем более ампутации приводит к тому, что этот барьер становится несостоятельным. Для сравнения представьте себе окно, выходящее на оживленную улицу. Окно закрыто – в помещении всё нормально: шум, пыль и холод остаются снаружи. Но стоит открыть окно – и всё тут же проникает внутрь. Так же и в случае, если удаляют шейку матки. У оперированных женщин чаще наблюдаются воспалительные заболевания. Снижаются шансы забеременеть и родить самостоятельно. Так как шейка матки после операции становится короче, часто она не выдерживает тяжесть плода и после 16 недели произвольно раскрывается. Так как цервикальный канал после конизации заживает с формированием рубца, шейка в родах раскрывается недостаточно и не может обеспечить прохождение ребёнка по родовым путям.
Конизация не может считаться эффективным методом лечения дисплазии, так как помогает всего в 30% случаев. Часть шейки матки с изменёнными клетками удаляется, но вирус остаётся в цервикальном канале и активно начинает новую экспансию. В 70% случаев он вызывает рецидив всего через год после операции.
В 70% случаев он вызывает рецидив всего через год после операции.
Современное лечение дисплазии шейки матки 2 степени не требует операции
Медикаментозные и хирургические методы при дисплазии неэффективны и не приводят к выздоровлению. Что предлагаю я?
Современный терапевтический метод фотодинамической терапии (ФДТ) лишен всех недостатков предыдущих методов, обеспечивает 95% выздоровление уже после первого сеанса и является гарантией против развития рецидивов в дальнейшем.Я работаю в этом направлении уже более восьми лет – провожу лечение дисплазии и других вирус-ассоциированных заболеваний: лейкоплакии, эктропиона, папиллом. Лечу рак шейки матки до 2 стадии включительно. Конечно же, при онкологическом процессе требуется не один сеанс, но факт остаётся фактом — избавиться от начальной стадии рака можно, не прибегая к операции.
95% положительных результатов и отсутствие рецидива на протяжении 8 лет наблюдения говорят сами за себя.
В чём заключается фотодинамическая терапия
Лечение основано на действии лазерного луча и протекает в несколько этапов.
- Процедура начинается с внутривенного введения фотосенсибилизатора Фотодитазина или Ревиксана за 2 часа до сеанса ФДТ. Это вещество, которое избирательно накапливается в диспластически изменённых и воспаленных клетках шейки матки.
- При помощи специальных световодов по особой, разработанной мной методике, я облучаю шейку матки и полость цервикального канала. На каждом этапе я индивидуально подбираю необходимую дозу света для достижения адекватного фотодинамического эффекта.
- Под действием лазерного луча фотосенсебилизатор вступает в химическую реакцию с кислородом с выделением так называемого активного синглетного кислорода и других токсических продуктов, которые механически разрушают больные клетки. Но на этом его действие не заканчивается. Кислород сам по себе является агрессивной средой для вируса папилломы и других инфекции и уничтожает их.

- На здоровые клетки свет воздействия не оказывает и никак их не повреждает.
- Через некоторое время после сеанса запускаются иммунные механизмы — происходит атака атипичных клеток и продуктов их распада.
Избавляясь от вирусной и бактериальной инфекции, я устраняю саму первопричину заболевания и предотвращаю его рецидив. Лечение умеренной дисплазии 2 степени проводится в условиях операционной под общим наркозом. Хотя процедура и считается относительно безболезненной, для достижения максимального эффекта требуется абсолютная неподвижность, которая недостижима, если пациентка испытывает дискомфорт, жжение и покалывание. Кроме того, я стараюсь оградить пациенток от любых неприятных ощущений.
Как происходит заживление
Спустя 6–7 недель после сеанса фотодинамической терапии слизистая заживает без рубцов. Очаговая дисплазия 2 степени устраняется, на ее месте формируется здоровая ткань. В последующем я провожу 3-кратный контрольный осмотр с интервалом в три месяца, на каждом осмотре выполняю кольпоскопию и жидкостную цитологию. После лечения поддерживаю обратную связь со всеми пациентками.
После лечения поддерживаю обратную связь со всеми пациентками.
Беременность при дисплазии 2 степени
Очаговая дисплазия 1-2 степени на фоне беременности не требует никаких активных действий и агрессивного лечения. Показано только наблюдение у онкогинеколога. На тактику ведения беременности заболевание не влияет – правда, в определённых случаях рекомендуется выбрать оперативную тактику родорозрешения путём операции Кесарева сечения. Лечится женщина только после рождения ребёнка.
Я должен обратить ваше внимание, что даже успешное лечение CIN 2 шейки матки не является гарантией против повторного заражения вирусом папилломы человека в будущем. Поэтому следует очень внимательно относиться к выбору полового партнёра и обязательно пользоваться презервативами.
Дисплазия плоского эпителия 2 степени – то состояние постоянно висящего над головой дамоклова меча, от которого лучше один раз пролечиться и избавить себя от рисков озлокачествления на всю оставшуюся жизнь. Фотодинамическая терапия – это высокотехнологичный метод нового поколения. Фактически, в нем реализована мечта всех врачей о лечении, которое воздействует только на болезнь и никак не затрагивает здоровые ткани.
Фотодинамическая терапия – это высокотехнологичный метод нового поколения. Фактически, в нем реализована мечта всех врачей о лечении, которое воздействует только на болезнь и никак не затрагивает здоровые ткани.
Чтобы узнать, показано ли вам безоперабельное лечение шейки матки методом ФДТ, высылайте результаты своих анализов на e-mail: [email protected] или записывайтесь на прием по телефону 8 (800) 555-77-26 в Москве.
Прием ведет Афанасьев Максим Станиславович, онколог, доктор медицинских наук, профессор и член ученого совета Первого МГМУ им. И.М. Сеченова МЗ РФ, хирург, онкогинеколог, гинеколог-иммунолог, эксперт по лечению дисплазии и рака шейки матки.
Симптомы, разновидности и эффективное лечение дисплазии шейки матки
По статистике каждая третья женщина сталкивается с дисплазией. Опасность заболевания заключается в бессимптомном течении на ранних стадиях. Регулярное посещение гинеколога — лучший способ обнаружить болезнь на ранних сроках. Ведь лечение дисплазии легкой степени происходит намного быстрее, чем лечение ее более тяжелых стадий.
Ведь лечение дисплазии легкой степени происходит намного быстрее, чем лечение ее более тяжелых стадий.
Что же такое дисплазия шейки матки?
Или по-другому «цервикальная интраэпителиальная неоплазия» — это изменения слизистой (патологические) на клеточном уровне. Другими словами, “дисплазия” — предраковое состояние. И чем раньше она диагностируется — тем меньше риск развития онкологии.
Очаг заболевания образуется на границе цервикального канала и шейки матки. Самая частая причина заболевания — вирус папилломы человека. Как будет проходить лечение дисплазии шейки матки — медикаментозно или хирургическим путем решает врач после диагностики и сбора анамнеза пациента. Чтобы вовремя диагностировать малейшие изменения и выявить заболевание на ранних стадиях — женщинам после 30, рекомендуется проводить плановый скрининг раз в году.
Группа риска — женщины репродуктивного возраста.
Какие симптомы у заболевания?
Цервикальная интраэпителиальная неоплазия страшна тем, что без посещения гинеколога, женщина может узнать о болезни, на последних, запущенных стадиях.
Если же пациент отмечает появление таким симптомов как:
- вагинальные жжение и зуд;
- болевые ощущения во время полового акта;
- хронический вагинит;
- кровь после осмотра у гинеколога;
- боль, сопровождающаяся развитием аднексита;
- неприятный запах и цвет выделений.
Значит речь может идти о второй и третьей стадии недуга. Заболевание может быстро прогрессировать в онко.
Каким образом лечить дисплазию шейки матки — в домашних условиях, или в клинике — решает лечащий врач.
Разновидности болезни:
Диагностирование дисплазии происходит через забор тканей с поверхности шейки. Они исследуются на содержание нетипичных клеток. В зависимости от их количества различают:
1 степень
Практически не диагностируется при осмотре и во многих случаях проходит сама по себе. Врач может отметить, что слизистая поменяла цвет или структуру и отправить на дополнительные исследования.
Лечение легкой дисплазии шейки матки.
При обнаружении у молодой здоровой женщины дисплазии шейки матки 1 степени лечение, как правило, не требуется. Пациентка должна посещать врача с контрольным осмотром каждые 3-6 месяцев, со свежими результатами колькоскопии и цитологии. Лечение слабой дисплазии шейки матки может содержать рекомендации по приему витамин и противовирусных препаратов.
2 степень
Это наиболее диагностируемая степень заболевания. Происходят изменения тканей шейки матки. Они видны при осмотре и распространяются на большую часть эпителиального пласта, но могут указывать и на любую другую гинекологическую проблему: кандидоз или вагинит. Поэтому всегда нужны дополнительные анализы: колькоскопия, биопсия и цитология.
Протокол лечения дисплазии шейки матки 2 степени зависит от наличия детей, репродуктивных планов и истории болезни пациентки. Для женщин, с положительным ВПЧ, которые старше двадцати четырех лет рекомендуется конизация шейки матки или удаление очага током.
3 степень
Глубокое распространение патологического процесса — тяжелая форма недуга. Не нужно впадать в панику, при диагностировании. Конечно, борьба с недугом будет отличаться от лечения дисплазии шейки матки 1 степени. Но все поправимо, если вовремя начать лечение.
Не нужно впадать в панику, при диагностировании. Конечно, борьба с недугом будет отличаться от лечения дисплазии шейки матки 1 степени. Но все поправимо, если вовремя начать лечение.
Методы лечения дисплазии шейки матки 1 степени и более тяжелых ее видов
Выбор методов лечения зависит от размера очагов дисплазии, от степени ее развития, анамнеза пациентки, ее возраста, ее планов на репродукцию. Иногда хватает лечения дисплазии шейки матки препаратами, а иногда нужно срочно оперировать.
1) медикаментозное лечение дисплазии шейки матки
Лечение дисплазии шейки матки первой степени может осуществляться с помощью лекарств. Иммуномодуляторы, интерфероны, витамины, микроэлементы назначаются с целью укрепить иммунитет, чтобы помочь организму бороться с вирусами.
2) Хирургическое лечение
Хоть лечение дисплазии шейки матки без операции возможно, но иногда посещения хирурга не избежать. Вторая и третья степень болезни практически всегда заканчиваются хирургическим вмешательством. Это может быть: криодеструкция (удаление очага азотом), конизация шейки матки, диатермокоагуляция (разрушение током), лазеровапоризация (разрушение лазером), радиоволновая деструкция.
Это может быть: криодеструкция (удаление очага азотом), конизация шейки матки, диатермокоагуляция (разрушение током), лазеровапоризация (разрушение лазером), радиоволновая деструкция.
3) Альтернативное лечение дисплазии шейки матки
Речь идет о вакцине. Конечно, она не дает стопроцентных гарантий: не защищает от возникновения дисплазии, от развития рака. Задача вакцины — сформировать иммунитет к ВПЧ, которые способны спровоцировать онко. С помощью него снижается вероятность как развития дисплазии, так и ее перерождения. Самым оптимальным возрастом для вакцинирования от ВПЧ являются промежутки 10-14 и 18-25 лет.
Если проведенные манипуляции по лечению дисплазии были неэффективны (или невозможны), то женщине могут удалить шейку матки.
Последние статьи
Чем отличается дисплазия от рака шейки матки
Онкологические заболевания шейки матки занимают второе место среди всех опухолей у женщин по распространенности. Их отличием является тот факт, что причина развития таких новообразований точно известна – вирус папилломы человека (ВПЧ). Своевременная диагностика рака шейки матки играет решающую роль выборе адекватной тактики лечения и в общем прогнозе по заболеванию.
Их отличием является тот факт, что причина развития таких новообразований точно известна – вирус папилломы человека (ВПЧ). Своевременная диагностика рака шейки матки играет решающую роль выборе адекватной тактики лечения и в общем прогнозе по заболеванию.
Развитие опухоли происходит в несколько стадий, и ключевым моментом является наличие фазы длительных предраковых состояний, так называемых дисплазий. Итак, рассмотрим, чем отличается дисплазия от рака шейки матки по симптомам и как она диагностируется и классифицируется.
Причины и факторы риска
Как уже было указано, основной причиной развития рака шейки матки является ВПЧ. Однако, этот вирус присутствует у 90% здоровых женщин в виде бессимптомного носительства. Почему же он может быть неопасным, а иногда может приводить к развитию грозных опухолей?
Дело в том, что существует десятки штаммов ВПЧ и лишь некоторые из них обладают высокоонкогенным статусом – например, 16, 18, 31 штаммы. Кроме этого, Наличие даже опасной разновидности вируса в организме не гарантирует развитие рака или диспластических процессов. Но, если есть провоцирующие факторы риска, вероятность заболеть растет. К ним относятся:
Но, если есть провоцирующие факторы риска, вероятность заболеть растет. К ним относятся:
- большое количество половых партнеров;
- инфекционные процессы в мочеполовой системе;
- травмы шейки матки в анамнезе;
- гиперэстрогения разного генеза.
Все эти факторы могут с высокой долей вероятности приводить к развитию дисплазии шейки матки, а затем и раку.
Морфология и патофизиология
Дисплазия представляет собой нарушение строения, деления и функционирования эпителиальных клеток шейки матки. Морфологически это чаще всего проявляется утратой нормальной формы и строения клетки. Она может удлинняться или деформироваться, у клетки появляется несколько ядер, а делиться она начинает с нарушениями.
Это еще не раковые клетки, когда происходит полное перерождение. При превращении в злокачественные, клетки полностью теряют свою естественную функцию, и начинают бесконтрольно делиться.
Однако, наличие дисплазии тканей, особенно запущенных степеней практически со 100% вероятностью свидетельствует о том, что рано или поздно клетки начнут превращаться в атипические.
Классификация и стадирование
У дисплазии есть несколько стадий и разновидностей, которые меняются по мере развития патологических процессов в эпителиальном слое шейки матки. Так, по старой классификации 1968 года Richart выделялось 3 степени дисплазии клеток – CIN 1, CIN 2 и CIN 3.
По новой пересмотренной классификации ВОЗ 1982 года выделяют также 3 стадии:
- легкую,
- умеренную,
- тяжелую
Тяжелая степень дисплазии и стадия CIN 3 соответствуют облигатном предраку или даже, как иногда его принято называть “рак in situ”. Предраковые состояния характеризуются тем, что со 100% вероятностью развиваются в злокачественную опухоль.
Диагностика патологий шейки матки
Диагностические меры для выявления дисплазии или рака сводятся к двум основным методам – определение наличия ВПЧ с помощью ДНК-теста и так называемый мазок на цитологию по Папаниколау. Правда, следует отметить, что оба эти теста далеки от идеала в плане информативности и достоверности.
Например, при выявлении ВПЧ, даже онкогенного типа, речь не идет о наличии диспластических процессов или рака в шейке матки. Тем не менее, наличие вируса дает много дополнительной информации.
Мазок по Папаниколау является золотым стандартом в мире онкогинекологии. Принцип метода состоит в том, что у женщины на гинекологическом осмотре берется материал из шейки с помощью специальной щеточки. После этого мазок направляется на цитологический анализ в лабораторию.
В мазке по морфологии клеток определяется стадия дисплазии, предрак или рак. Однако, и здесь в 15-25% возможна ошибка при постановке диагноза. В случае дисплазии 1 или 2 степени врач рекомендует лечение.
На данный момент разрабатываются специфические исследования, которые лишены недостатков ДНК-теста и мазка Папаниколау. Речь идет о новых эпигенетических тестах, которые будут со 100% точность определять степень клеточной дисплазии или атипии.
Профилактика
На сегодняшний день в развитых государствах (например, Израиль, Австралия) проводится тотальная вакцинация женщин от вируса папилломы человека. Это является 100% эффективным способом профилактики дисплазии и рака шейки матки. Так, Австралия прогнозируемо станет первым в мире государством, где рак шейки матки удастся полностью побороть.
Это является 100% эффективным способом профилактики дисплазии и рака шейки матки. Так, Австралия прогнозируемо станет первым в мире государством, где рак шейки матки удастся полностью побороть.
Второстепенными методами профилактики являются:
- соблюдение культуры половой жизни,
- грамотная гормональная контрацепция,
- регулярные гинекологические скрининги и осмотры,
- отказ от вредных привычек.
Плоскоклеточное интраэпителиальное поражение высокой степени — StatPearls
Непрерывное обучение
Плоскоклеточное интраэпителиальное поражение высокой степени (HSIL) включает в себя образования, ранее называвшиеся цервикальной интраэпителиальной неоплазией (CIN) 2, CIN3, умеренной и тяжелой дисплазией in situ и карциномы in situ. HSIL представляет собой плоскоклеточную аномалию, связанную с вирусом папилломы человека (ВПЧ). Хотя не все HSIL прогрессируют до рака, HSIL считается предраковым поражением и поэтому обычно лечится агрессивно. В этом упражнении рассматривается оценка плоских интраэпителиальных поражений высокой степени и роль межпрофессиональной группы в лечении этого состояния.
В этом упражнении рассматривается оценка плоских интраэпителиальных поражений высокой степени и роль межпрофессиональной группы в лечении этого состояния.
Целей:
-
Определите причину плоскоклеточных интраэпителиальных поражений высокой степени.
-
Опишите гистологические критерии плоскоклеточных интраэпителиальных поражений высокой степени.
-
Краткое описание лечения плоскоклеточных интраэпителиальных поражений высокой степени.
-
Объясните ключевую роль, которую межпрофессиональная группа играет в общении и сотрудничестве, чтобы облегчить быструю оценку и лечение плоскоклеточных интраэпителиальных поражений высокой степени и тем самым улучшить результаты для пораженных пациентов.
Введение
Плоскоклеточное интраэпителиальное поражение высокой степени (HSIL) — это плоскоклеточная аномалия, связанная с вирусом папилломы человека (HPV). Он включает ранее использовавшиеся термины CIN2, CIN3, умеренную и тяжелую дисплазию и карциному in situ. Эта текущая терминология для HSIL была введена Bethesda System for Reporting Cervical Cytology (TBS) для цитологических образцов в 1988 году и с тех пор была принята для гистологических образцов Конференцией по стандартизации нижней аногенитальной плоскоклеточной терминологии (LAST) [1] и Всемирным сообществом. Организация здравоохранения (ВОЗ) в 2012 и 2014 годах соответственно.Хотя не все HSIL разовьются до рака, это считается предраковым поражением и поэтому обычно лечится агрессивно. Хотя HSIL может поражать различные участки кожи и слизистых оболочек аногенитального тракта, это резюме будет сосредоточено на шейном HSIL
Он включает ранее использовавшиеся термины CIN2, CIN3, умеренную и тяжелую дисплазию и карциному in situ. Эта текущая терминология для HSIL была введена Bethesda System for Reporting Cervical Cytology (TBS) для цитологических образцов в 1988 году и с тех пор была принята для гистологических образцов Конференцией по стандартизации нижней аногенитальной плоскоклеточной терминологии (LAST) [1] и Всемирным сообществом. Организация здравоохранения (ВОЗ) в 2012 и 2014 годах соответственно.Хотя не все HSIL разовьются до рака, это считается предраковым поражением и поэтому обычно лечится агрессивно. Хотя HSIL может поражать различные участки кожи и слизистых оболочек аногенитального тракта, это резюме будет сосредоточено на шейном HSIL
Этиология
Научные исследования установили, что HPV является основным этиологическим агентом в патогенезе дисплазии шейки матки и карциномы. ВПЧ представляет собой двухцепочечный ДНК-вирус без оболочки из семейства Papillomaviridae.Существует более 150 генотипов ВПЧ, 40 из которых, как известно, могут инфицировать аногенитальный тракт. Эти 40 человек разделены на группы высокого и низкого риска на основании доказательств их онкогенного потенциала. ВПЧ16 и ВПЧ18 являются генотипами высокого риска, обнаруженными более чем в 70% случаев HSIL и плоскоклеточного рака шейки матки. В отличие от плоскоклеточных интраэпителиальных поражений низкой степени злокачественности (LSIL), которые представляют собой преходящие инфекции HPV, которые излечиваются в течение двух-пяти лет и имеют низкий риск злокачественности, HSIL связаны с устойчивой инфекцией и повышенным риском прогрессирования инвазивного рака, особенно если хроническая инфекция относится к генотипу высокого риска, например, HPV16 и / или HPV 18.[2]
Эти 40 человек разделены на группы высокого и низкого риска на основании доказательств их онкогенного потенциала. ВПЧ16 и ВПЧ18 являются генотипами высокого риска, обнаруженными более чем в 70% случаев HSIL и плоскоклеточного рака шейки матки. В отличие от плоскоклеточных интраэпителиальных поражений низкой степени злокачественности (LSIL), которые представляют собой преходящие инфекции HPV, которые излечиваются в течение двух-пяти лет и имеют низкий риск злокачественности, HSIL связаны с устойчивой инфекцией и повышенным риском прогрессирования инвазивного рака, особенно если хроническая инфекция относится к генотипу высокого риска, например, HPV16 и / или HPV 18.[2]
Эпидемиология
Поскольку HSIL вызывается инфекцией ВПЧ, он чаще встречается у женщин со специфическими генетическими и поведенческими факторами, повышающими их риск заражения ВПЧ. Распространенность ВПЧ наиболее высока у молодых сексуально активных женщин, затем постепенно снижается до наступления менопаузы, а некоторые исследования показывают небольшое увеличение после менопаузы. Считается, что это снижение в среднем возрасте является результатом эффективного иммунного ответа после воздействия ВПЧ, а также вероятности меньшего воздействия вируса ВПЧ.Состояние с ослабленным иммунитетом, например, после трансплантации и у ВИЧ-инфицированных лиц, увеличивает риск стойкой инфекции и развития плоскоклеточного интраэпителиального поражения у пациента. Исследования указывают на более молодой возраст коитархе, а количество сексуальных партнеров увеличивает риск заражения ВПЧ, а также более позднюю половую жизнь. Беспорядочные половые связи между мужчинами также являются одним из факторов, а также использование презервативов и обрезание, поскольку оба фактора значительно снижают риск заражения ВПЧ. Женщины, практикующие секс с женщинами, также имеют повышенный риск неоплазии шейки матки.Повторнородящие женщины, особенно старше 7 лет, также подвержены повышенному риску. Существует сильная связь между курением и неоплазией шейки матки, независимо от статуса ВПЧ, предположительно из-за присутствия канцерогенов в цервикальной слизи. Некоторые гаплотипы HLA класса II, особенно HLA B * 07 + HLA-DQB1 * 302, имеют положительную связь с SIL и инвазивным раком, что свидетельствует о том, что гаплотип может влиять на презентацию антигена HPV и иммунный ответ. Было обнаружено, что другие гаплотипы HLA класса II обладают защитным действием.Использование оральных контрацептивов может несколько повысить риск неоплазии шейки матки у пациента, хотя исследования не подтвердились. [3] [4] [5]
Патофизиология
Геном ВПЧ включает ранние гены (E1, E2, E4, E5, E6, E7), участвующие в регуляции вегетативной и пролиферативной фаз жизненного цикла вируса. , поздние гены (L1, L2), которые кодируют белки капсида, и некодирующую длинную контрольную область (LCR), участвующую в репликации вируса и регуляции транскрипции.ВПЧ инфицирует базальные эпителиальные клетки зоны трансформации после проникновения через микро-ссадины. Класс рецепторов клеточной поверхности кератиноцитов, называемых гепарансульфат-протеогликанами (HSPG), считается начальными рецепторами вируса, прикрепляющимися к L1 капсида и вызывающими конформационные изменения и последующее расщепление L2. Вирусный геном медленно интернализуется в течение 12 часов посредством клатрина или кавеол-опосредованного эндоцитоза. Проникновение вирусного генома в ядро происходит через разрывы ядерной мембраны.Затем начинается вирусная репликация. Когда базальные клетки созревают и достигают окончательно дифференцированного слоя эпителия, происходит экспрессия капсидных белков L1 и L2, что обеспечивает сборку вирусных частиц, которые отслаиваются вместе с мертвыми плоскоклеточными клетками, что позволяет продолжить передачу и инфицирование вируса. Это обычный жизненный цикл большинства генотипов ВПЧ. Однако было показано, что типы ВПЧ высокого риска, особенно ВПЧ16, часто интегрируют свой геном в геном человека. Интеграция была предложена в качестве раннего этапа перехода от LSIL к HSIL.Он включает в себя вирусные онкопротеины E6 и E7, поддерживающие двухцепочечные точки разрыва в ДНК хозяина путем ослабления ответа на повреждение ДНК (DDR), участвующего в восстановлении таких разрывов, так что вирусный геном может интегрироваться в этих точках разрыва. Известно, что онкобелок ВПЧ E6 высокого риска мешает p53, клеточному белку-супрессору опухоли, необходимому для восприятия механизма репарации эксцизией оснований и восстановления окислительного повреждения, индуцируя усиленную протеасомозависимую деградацию p53. Онкобелок ВПЧ E7 высокого риска инактивирует членов семейства белков-супрессоров опухоли ретинобластомы (Rb).Ретинобластома связана с фактором транскрипции E2F. Инактивация Rb разъединяет E2F, тем самым позволяя ему активировать гены, необходимые для входа в S-фазу и прогрессирования. Вышеупомянутые взаимодействия E6 и E7 — это всего лишь проблески того, как эти онкобелки взаимодействуют с различными белками в ядре. По сути, сверхэкспрессия E6 / E7 вызывает нарушение регуляции клеточного цикла. Исследования показывают, что интеграция также вызывает изменения экспрессии генов-хозяев, усиливая онкогены и нарушая работу генов-супрессоров опухолей.Поскольку геном ВПЧ является двухцепочечным и интегрирован в геном хозяина, он эффективно уклоняется от иммунного ответа, ведущего к стойкой инфекции. Также было показано, что эпигенетическая модификация различных генов и изменения в экспрессии miRNA играют роль в канцерогенезе. В отношении молекулярного патогенеза неоплазии шейки матки еще многое предстоит выяснить. [2]
Гистопатология
Диагностика HSIL по цитологии требует соблюдения определенных критериев. Клетки мельче с меньшей зрелостью цитоплазмы, чем у LSIL.Иногда цитоплазма может быть плотно ороговевшей. Клетки HSIL встречаются по отдельности, а также в виде листов или синцитиальных агрегатов. Хотя размер самого ядра варьируется, клетки должны иметь высокое ядерно-цитоплазматическое соотношение. Ядра часто бывают гиперхромными, но могут быть от нормо- до гиперхроматических. Хроматин может быть от равномерно распределенного и мелкого до крупнозернистого. Контуры ядер должны быть явно неправильными, с заметными углублениями и / или бороздками. Ядрышки обычно не являются признаком HSIL, хотя их можно увидеть, когда HSIL затрагивает эндоцервикальные железы.
Гистологические критерии HSIL превышают степень и степень ядерной атипии, допустимые для диагностики LSIL, и включают меньшее созревание, более высокое ядерно-цитоплазматическое отношение, снижение организации от нижних слоев незрелых клеток к поверхностным зрелым слоям (потеря полярность), большей степени ядерного плеоморфизма, сильно нерегулярных ядерных контуров, повышенного митотического индекса и аномальных митотических фигур, особенно в более поверхностных слоях эпителия. CIN3 должен иметь атипию на всю толщину.Столкнувшись с непростой биопсией, когда патолог обсуждает доброкачественные имитации HSIL, такие как незрелая метаплазия или атипичная атрофия, использование биомаркера p16 может помочь их различить, поскольку p16 показывает интенсивное и непрерывное окрашивание в HSIL и предполагает инфицирование типом ВПЧ высокого риска. [6] [7]
Анамнез и физикальное состояние
Женщины с подтвержденным биопсией HSIL, вероятно, будут иметь в анамнезе несколько факторов риска, связанных с инфекцией ВПЧ, положительный тест на ВПЧ и / или анамнез аномальных мазков Папаниколау.Аномальные кольпоскопические находки, характерные для изменений высокой степени, включают плотный ацетобелый эпителий, быстрое появление ацетобеления, скрепленные отверстия крипт, грубую мозаику, грубую пунктуацию, резкую границу, знак внутренней границы и знак гребня. Знак внутренней границы — это когда есть четко обозначенная ацетобелая область внутри менее непрозрачной ацетобелой области. Признаком гребня является наличие толстых выступов непрозрачного ацетобелого эпителия, неравномерно растущего в пределах чешуйчато-столбчатого перехода.[8] [9]
Оценка
Текущие рекомендации Американского конгресса акушеров и гинекологов (ACOG) по скринингу рака шейки матки у женщин зависят от возраста, ВИЧ-инфекции / иммунодефицита и статуса беременности. Скрининг следует начинать в возрасте 21 года. Женщины в возрасте от 21 до 29 лет должны проходить цитологический скрининг каждые три года. Женщины в возрасте от 30 до 65 лет должны проходить цитологический скрининг и совместное тестирование на ВПЧ каждые пять лет или только цитологическое исследование каждые три года. В зависимости от используемого теста на ВПЧ, тест предоставит объединенные результаты для подтипов ВПЧ высокого риска и / или результаты отдельных генотипов для ВПЧ 16 и 18.Риск HSIL у пациента с положительным результатом теста на ВПЧ и аномальным мазком Папаниколау составляет примерно 20% и увеличивается до 33%, если ВПЧ положительный результат более чем одного посещения. [10]
Папаниколау (Пап-тест) является предпочтительным начальным методом скрининга на неоплазию шейки матки. Это выполняется путем открытия влагалищного канала с помощью зеркала, полной визуализации шейки матки, использования цервикальной метлы или шпателя для отшелушивания клеток из зоны трансформации и переноса клеток либо в жидкий консервант (цитология на жидкой основе), либо непосредственно на предметное стекло микроскопа. (обычная цитология).Патология обрабатывает образцы в соответствии с типом теста, который они получают.
Американское общество кольпоскопии и патологии шейки матки публикует рекомендации по ведению женщин на основе результатов их мазка Папаниколау и теста на ВПЧ. Женщинам в возрасте от 21 до 24 лет после цитологического диагноза HSIL рекомендуется кольпоскопия. Женщинам в возрасте старше 24 лет также следует сделать кольпоскопию, хотя лечение с помощью иссечения допустимо. Около 60% женщин с цитологическим исследованием HSIL будут иметь как минимум CIN 2 при биопсии, примерно у 2% — инвазивный рак, хотя последний более вероятен у пожилых женщин.У женщин старше 30 лет 5-летний риск рака шейки матки после постановки диагноза HSIL составляет 8%. Биопсии, взятые при кольпоскопии, исследуются гистологически. [11]
Лечение / ведение
Женщинам в возрасте от 21 до 24 лет с цитологическим исследованием HSIL рекомендуется пройти кольпоскопию. Если CIN2 или выше не диагностируется при биопсии, пациенту рекомендуется проводить цитологическое обследование и кольпоскопию каждые шесть месяцев в течение 24 месяцев, если ее обследования адекватны и не выявляют плоскоклеточных интраэпителиальных поражений или, самое большее, LSIL.Если в это время будет обнаружено цитологическое исследование HSIL или кольпоскопическое поражение высокой степени, следует взять биопсию. У пациентов, у которых цитология HSIL сохраняется в течение 24 месяцев, но при биопсии не обнаружено высокозлокачественных поражений, рекомендуется диагностическая эксцизионная процедура. Если кольпоскопия неадекватна, CIN3 определяется при биопсии или CIN2 или CIN2-3 сохраняется в течение 24 месяцев, то рекомендуется диагностическая эксцизионная процедура. Если при биопсии указан CIN2, рекомендуется наблюдение в течение 12 месяцев с использованием цитологии и кольпоскопии каждые шесть месяцев.Это связано с тем, что CIN2 имеет более высокий уровень регрессии и меньший риск развития рака, чем CIN3, особенно у молодых женщин. Если у пациента два последовательных отрицательных результата цитологического исследования и нет доказательств кольпоскопической патологии, через год рекомендуется провести совместный тест. В случае отрицательного результата рекомендуется повторное тестирование через три года. Если какой-либо из совместных тестов не соответствует норме, рекомендуется кольпоскопия.
Беременным женщинам, у которых установлено цитологическое исследование HSIL, не следует подвергать эксцизионному лечению; допустима только кольпоскопия.Если будет установлен гистологический диагноз поражения высокой степени, ей могут проводиться дополнительные цитологические и кольпоскопические исследования каждые 12 недель. Если результаты цитологического исследования позволяют предположить инвазивный рак или если кольпоскопический вид поражений ухудшается, рекомендуется повторная биопсия. Также считается приемлемым отложить повторное обследование до тех пор, пока пациентка не достигнет, по крайней мере, шести недель после родов. Диагностическая эксцизионная процедура рекомендуется только в том случае, если есть опасения по поводу инвазивного рака.
Для женщин старше 24 лет без особых обстоятельств и с результатом теста Папаниколау HSIL рекомендуется либо немедленное эксцизионное вмешательство, либо кольпоскопия, независимо от результатов совместного тестирования на ВПЧ.Если кольпоскопическое исследование неадекватно, рекомендуется диагностическая эксцизионная процедура. Если кольпоскопия удовлетворительна и HSIL (CIN2, CIN3 или CIN2-3) подтвержден при биопсии, абляция зоны трансформации или иссечение считается приемлемым. Однако допустимо только диагностическое иссечение, если кольпоскопия неадекватна или эндоцервикальный выскабливание показывает поражение высокой степени.
После того, как пациентка получит лечение, независимо от возраста, рекомендуется провести совместное тестирование на ВПЧ через 12 и 24 месяца после лечения.Если оба отрицательные, ее можно пройти повторно через 3 года. Если результат теста отрицательный, она может вернуться к обычному скринингу как минимум в течение следующих 20 лет. Отклонение от нормы результатов теста должно привести к кольпоскопии с забором эндоцервикального материала. [10] [11]
Дифференциальный диагноз
Состояния, которые могут быть ошибочно приняты за HSIL при биопсии, включают раннюю инвазивную карциному, атрофию, плоскоклеточную метаплазию, переходную метаплазию и реактивную атипию.
Прогноз
HSIL связаны с персистирующей инфекцией и повышенным риском прогрессирования инвазивного рака, особенно если персистирующая инфекция относится к генотипу высокого риска, например, HPV16 и / или HPV 18.
Сдерживание и обучение пациентов
Обучение пациентов факторам риска заражения ВПЧ, а также безопасным сексуальным практикам в целом может снизить риск инфекции ВПЧ.
Вакцины были разработаны против типов HPV16 и 18 с высоким риском, а также против типов HPV6 и 11. Они эффективны для предотвращения начальной, а также постоянной инфекции и связанных с ними SIL. Поскольку большинство поражений высокой степени ассоциированы с ВПЧ16, предполагается, что вакцинация может снизить частоту HGSIL / CIN2 / CIN3 до 87%, хотя это еще предстоит подтвердить в общей популяции.[12]
Улучшение результатов команды здравоохранения
Одна из наиболее важных функций межпрофессиональной группы медсестер и клиницистов — информировать пациентов о факторах риска заражения ВПЧ, а также о безопасных сексуальных практиках, которые могут снизить риск ВПЧ. инфекционное заболевание. Скоординированный командный подход к обучению улучшит результаты лечения пациентов и снизит заболеваемость. [Уровень V]
Рисунок
Плоскоклеточное интраэпителиальное поражение шейки матки высокой степени (HSIL).Высокое ядерно-цитоплазматическое соотношение, ядерные аномалии дисплазии высокой степени. Сравните с нормальным размером ядра плоских клеток окружающих клеток. Пап-пятно, 40x. Внесено (подробнее …)
Рисунок
Плоское интраэпителиальное поражение высокой степени (HSIL). Повышенное ядерное / цитоплазматическое соотношение с умеренными и тяжелыми диспластическими особенностями ядерной мембраны. Окраска Папаниколау 40x. Предоставлено Fabiola Farci, MD
Ссылки
- 1.
- Darragh TM.ПОСЛЕДНИЙ проект и итоги диагностики. Цитопатология. 2015 декабрь; 26 (6): 343-5. [PubMed: 26767600]
- 2.
- Сенапати Р., Сенапати Н.Н., Двибеди Б. Молекулярные механизмы опосредованного ВПЧ неопластического прогрессирования. Заражение агентурным раком. 2016; 11:59. [Бесплатная статья PMC: PMC5123406] [PubMed: 27933097]
- 3.
- Ades S, Koushik A, Duarte-Franco E, Mansour N, Arseneau J, Provencher D, Gilbert L, Gotlieb W., Ferenczy A, Coutlée F, Роджер М., Франко Э., Исследовательская группа по биомаркерам риска рака шейки матки (BCCR).Выбранные аллели и гаплотипы HLA I и II классов и риск интраэпителиальной неоплазии шейки матки высокой степени. Int J Cancer. 15 июня 2008 г .; 122 (12): 2820-6. [PubMed: 18351579]
- 4.
- Kjellberg L, Hallmans G, Ahren AM, Johansson R, Bergman F, Wadell G, Angström T, Dillner J. Курение, диета, беременность и использование оральных контрацептивов как факторы риска для цервикального интра -эпителиальная неоплазия по отношению к инфекции вируса папилломы человека. Br J Рак. 2000 апр; 82 (7): 1332-8. [Бесплатная статья PMC: PMC2374476] [PubMed: 10755410]
- 5.
- Кокер А.Л., Сандерс Л.С., Бонд С.М., Герасимова Т., Пириси Л. Гормональные и барьерные методы контрацепции, развитие онкогенных вирусов папилломы человека и плоскоклеточного интраэпителиального поражения шейки матки. J Womens Health Gend Based Med. 2001 июн; 10 (5): 441-9. [PubMed: 11445043]
- 6.
- Соломон Д., Дэйви Д., Курман Р., Мориарти А., О’Коннор Д., Прей М., Рааб С., Шерман М., Уилбур Д., Райт Т., Янг Н., Члены группы форума . Bethesda 2001 Workshop. Система Bethesda 2001: терминология для представления результатов цитологии шейки матки.ДЖАМА. 2002 24 апреля; 287 (16): 2114-9. [PubMed: 11966386]
- 7.
- Хорн Л.С., Райхерт А., Остер А., Арндал С.Ф., Магистр М.Дж., Риддер Р., Рассмуссен О.Ф., Бьелкенкранц К., Кристиансен П., Эк М., Лори Т., Сковлунд В.Р., Рюдигер Т., Schneider V, Schmidt D. Иммуноокрашивание для p16INK4a, используемое в качестве конъюнктивного инструмента, улучшает согласие между наблюдателями при гистологическом диагнозе цервикальной интраэпителиальной неоплазии. Am J Surg Pathol. 2008 Апрель; 32 (4): 502-12. [PubMed: 18223479]
- 8.
- Sláma J.[Новые кольпоскопические признаки — гребневой знак и внутренняя кайма]. Ceska Gynekol. 2012 февраль; 77 (1): 22-4. [PubMed: 22536636]
- 9.
- Vercellino GF, Erdemoglu E, Chiantera V, Vasiljeva K, Drechsler I., Cichon G, Schneider A, Böhmer G. Действительность кольпоскопического критерия внутренней границы, гребня и тряпичного знака для выявления интраэпителиальной неоплазии шейки матки высокой степени. Obstet Gynecol. 2013 Март; 121 (3): 624-631. [PubMed: 23635627]
- 10.
- Massad LS, Einstein MH, Huh WK, Katki HA, Kinney WK, Schiffman M, Solomon D, Wentzensen N, Lawson HW., Конференция по рекомендациям консенсуса ASCCP 2012 г. 2012 г. обновлено согласованное руководство по ведению скрининговых тестов на аномальный рак шейки матки и его предшественников. Obstet Gynecol. 2013 Апрель; 121 (4): 829-846. [PubMed: 23635684]
- 11.
- Бентли Дж., ИСПОЛНИТЕЛЬНЫЙ СОВЕТ ОБЩЕСТВА КАНАДСКИХ КОЛПОСКОПИСТОВ. СПЕЦИАЛЬНЫЕ УЧАСТНИКИ. Кольпоскопическое лечение патологических цитологических и гистологических исследований шейки матки. J Obstet Gynaecol Can. 2012 декабрь; 34 (12): 1188-1202. [PubMed: 23231803]
- 12.
- Kops NL, Hohenberger GF, Bessel M, Correia Horvath JD, Domingues C, Kalume Maranhão AG, Alves de Souza FM, Benzaken A, Pereira GF, Wendland EM. Знания о ВПЧ и вакцинации среди молодых взрослых мужчин и женщин: результаты национального опроса. Papillomavirus Res. 2019 июн; 7: 123-128. [Бесплатная статья PMC: PMC6426699] [PubMed: 30885798]
Проблемы с мазком Папаниколау — Аномальный результат мазка Папаниколау — Аномальный результат теста мазка Папаниколау — Доктор Метава — Госфорд Северный Сидней Австралия — Доктор Метава
Мазок Папаниколау — это скрининговый тест на проверьте, не произошли ли аномальные изменения в клетках шейки матки.Шейка матки — это самая нижняя часть матки, которая соединяет матку с влагалищем. Мазок Папаниколау также называется мазком из шейки матки. Слой клеток, называемых плоскоклеточными клетками, покрывает внешнюю поверхность шейки матки. Слой клеток, называемых железистыми клетками, выстилает эндоцервикальный канал. Эти два типа клеток встречаются в «зоне трансформации», которая обычно находится снаружи шейки матки, но может быть и внутри эндоцервикального канала. При взятии мазка Папаниколау врач аккуратно соскабливает клетки с этих участков.Затем клетки готовят на предметном стекле микроскопа для исследования в лаборатории патологии. Обследование позволит определить, являются ли клетки нормальными или ненормальными. Лечение для удаления аномальных клеток на шейке матки в большинстве случаев:
- приводит к росту здоровых клеток, а
- значительно снижает риск рака шейки матки.
Без лечения существует риск того, что аномальные клетки могут перерасти в рак шейки матки. Регулярные мазки Папаниколау важны, потому что рост предраковых клеток на поверхности шейки матки обычно не вызывает боли или других физических симптомов.Мазок Папаниколау — единственный способ обнаружить предраковые клетки.
Аномальный мазок Папаниколау
При исследовании мазка Папаниколау можно увидеть различные изменения в клетках. Важные изменения называются «дисплазией». Дисплазия — это аномальное изменение размера и формы клеток. Дисплазия — это не рак, но тяжелая дисплазия может перерасти в рак в течение длительного, но непредсказуемого периода времени, если ее не лечить. Для развития большинства видов рака шейки матки требуются годы. Дисплазия клеток на поверхности шейки матки классифицируется как легкая, умеренная или тяжелая.
Более распространенным термином, который сейчас используется для описания аномальных клеток шейки матки, является «цервикальная интраэпителиальная неоплазия» или CIN. Интраэпителиальный означает «внутри ткани», а «неоплазия» означает новый рост (аномальных) клеток. CIN-1 — дисплазия легкой степени. CIN-2 — умеренная дисплазия. CIN-3 — тяжелая дисплазия. CIN-1 возникает из-за заражения ВПЧ (вирусом папилломы человека). Из каждых 10 случаев заражения ВПЧ восемь проходят без лечения в течение 12 месяцев. Помимо изменений CIN, часто наблюдаются и другие незначительные отклонения.Они часто требуют последующего наблюдения, но не обязательно означают, что развиваются предраковые изменения ».
Плоскоклеточные и гладкоклеточные аномалии
Два типа клеток в шейке матки могут развиваться аномальные изменения. Чаще всего поражаются плоскоклеточные клетки. Гораздо реже встречаются аномалии железистых клеток.
- Плоскоклеточные аномалии — Большинство аномалий, обнаруженных в мазке Папаниколау, умирают от инфекции ВПЧ. На ранних стадиях инфекции ВПЧ на шейке матки не вызывает никаких признаков или симптомов.Инфекция ВПЧ обычно излечивается собственной иммунной системой, причем 80% инфекций излечиваются за 12 месяцев. Аномалии классифицируются следующим образом:
- Возможный LSIL (плоскоклеточное интраэпителиальное поражение низкой степени): Иногда мазок Папаниколау показывает возможные изменения низкой степени, но точная причина остается неопределенной. Эти атипичные клетки могут быть вызваны воспалением тканей, изменениями, вызванными ВПЧ, или инфекцией каким-либо другим микроорганизмом (бактериями, вирусами, грибами или дрожжами). Обычно состояние со временем улучшается.Женщине обычно рекомендуют сдать еще один мазок Папаниколау через 12 месяцев. Если изменения не исчезнут, врач может порекомендовать кольпоскопию.
- LSIL (плоскоклеточное интраэпителиальное поражение низкой степени): Этот отчет о мазке Папаниколау предполагает, что есть определенные изменения, обычно связанные с инфекцией ВПЧ. Эти изменения могут быть названы только HPV, или могут присутствовать другие клетки, которые называются CIN-1. 80% этих аномалий LSIL проходят в течение 12 мес. Если это первый раз, когда на шейке матки обнаруживаются аномальные клетки, ваш врач порекомендует вам пройти повторный анализ мазка Папаниколау через 12 месяцев.Если изменения все еще присутствуют через 12 месяцев, врач порекомендует вам сделать кольпоскопию. Если вам больше 30 лет и вы не проходили нормальный мазок Папаниколау в предыдущие два-три года, ваш врач может порекомендовать повторный тест Папаниколау через 6 месяцев или направить вас на кольпоскопию. Если диагноз патологии низкой степени подтвержден, вам НЕ потребуется никакого лечения, а просто наблюдение с регулярным взятием мазка Папаниколау каждый год, пока патология не исчезнет.
- Возможный HSIL (плоскоклеточное интраэпителиальное поражение высокой степени): Этот отчет о мазке Папаниколау означает, что патолог не уверен в точной аномалии, но подозревает, что это может быть HSIL (аномалия высокой степени), такая как CIN-2 или ЦИН-3.Ваш врач направит вас на кольпоскопию.
- HSIL (плоскоклеточное интраэпителиальное поражение высокой степени): Этот мазок означает, что очень вероятно, что на шейке матки присутствует патология высокой степени. Ваш врач направит вас на кольпоскопию.
- Рак: Этот отчет о мазке означает, что в мазке есть клетки, которые могут быть связаны с наличием рака шейки матки. Ваш врач направит вас на кольпоскопию, которую часто проводит онколог-гинеколог, который является специалистом по уходу за женщинами с раком шейки матки.
- Аномалии железистых клеток: Это необычные изменения в клетках шейки матки. Женщин с такими клеточными изменениями рекомендуется направлять на кольпоскопию, поскольку для последующего наблюдения сложнее полагаться на мазки Папаниколау. На основании результатов кольпоскопии или биопсии ваш врач может посоветовать вам чаще делать мазки Папаниколау или проводить лечение для удаления аномальной клетки.
Цервикальная интраэпителиальная неоплазия (CIN-1 / HPV)
Незначительные изменения размера, формы и количества цервикальных клеток называются CIN-1 или легкой дисплазией.Почти все патологии низкой степени (CIN-1) исчезнут без лечения, так как они вызваны инфекцией ВПЧ. Лечение этой аномалии больше не рекомендуется, поскольку вред перевешивает пользу. У небольшого числа женщин патология слабой степени сохраняется или редко прогрессирует до полноценного изменения. После постановки диагноза CIN-1 / HPV женщине обычно советуют сдавать мазок Папаниколау у своего терапевта каждый год, пока результаты мазка Папаниколау не вернутся к норме. У небольшого числа женщин незначительные изменения могут сохраняться из-за продолжающейся инфекции ВПЧ.В этой ситуации женщине следует ежегодно сдавать мазок Папаниколау, пока он не вернется к норме. Если развивается серьезная патология, ей следует сделать кольпоскопию.
Аномалии высокой степени CIN-2 и CIN-3
Могут присутствовать предраковые клетки, которые сильно отличаются от нормальных клеток. Они описываются как умеренная дисплазия (CIN-2) или тяжелая дисплазия (CIN-3).
Предраковые изменения затрагивают только клетки поверхностного слоя шейки матки. Эти клетки с большей вероятностью станут злокачественными и проникнут в более глубокие слои шейки матки, если их не лечить.Если в мазке Папаниколау обнаруживаются аномалии высокой степени, женщине рекомендуется сделать кольпоскопию и биопсию. Если диагноз CIN-2 или CIn-3 подтвержден, рекомендуется лечение для удаления аномальных клеток. Хотя не все CIN-2 и CIn-3 разовьются до рака, невозможно предсказать, какая аномалия исчезнет. Поэтому рекомендуется лечить все CIN-2 и CIN-3, за исключением определенных обстоятельств. Опасно оставлять без лечения CIN-2 и CIN-3. Если в течение длительного периода аномальные клетки распространяются глубже в шейку матки или в другие ткани или органы, заболевание называется раком шейки матки и требует более агрессивного лечения.Поражения высокой степени злокачественности (CIN-3) обычно превращаются в рак через много лет.
Кольпоскопия
Кольпоскопия — это визуальный осмотр шейки матки для выявления предраковых изменений. Процедура обычно проводится в кабинете врача. Женщину просят раздеться ниже пояса и лечь на специально сконструированную кушетку, поддерживающую ее ноги. Как и в мазке Папаниколау, вставляется зеркало, чтобы влагалище оставалось открытым, чтобы шейка матки была видна четко. Врач использует кольпоскоп (увеличительный инструмент, похожий на бинокль с прикрепленной лампой) для осмотра шейки матки.Кольпоскоп вводится не во влагалище, а только в зеркало. Шейка матки окрашивается слабой уксусной кислотой (уксусом), из-за которой патологические клетки становятся белыми; можно использовать как йод, так и уксусную кислоту. Полученный образец может помочь врачу решить, является ли это поражением высокой или низкой степени злокачественности. Важно сообщить врачу, если у вас когда-либо была аллергическая реакция на йод. Ваш врач может взять небольшой образец ткани (биопсию) из любой ненормальной области. На область биопсии можно нанести специальный раствор, чтобы остановить кровотечение.Если была взята биопсия, у вас может возникнуть некоторая боль или дискомфорт, аналогичный менструальным спазмам, которые можно лечить обезболивающим. Затем биопсия отправляется в лабораторию патологии для диагностики. Результаты обычно сообщаются примерно через неделю. После биопсии у вас незначительное кровотечение и небольшие выделения из влагалища на срок до недели. Избегайте секса, тампонов или ванн (вместо этого принимайте душ) в течение недели, чтобы шейка матки зажила.
Лечение дисплазии
Если результаты кольпоскопии и биопсии указывают на серьезную аномалию (CIN-2 или CIN3), ваш врач порекомендует лечение для удаления аномальных клеток.Лечение также может быть рекомендовано при стойких патологиях низкой степени тяжести. Эффективны несколько методов лечения, описанных ниже. Лучшее лечение для вас будет зависеть от типа и степени тяжести аномальных клеток.
Иссечение проволочной петли — Иссечение проволочной петли также известно как LEEP (процедура электрохирургического удаления петли) или LLETZ (удаление большой петли зоны трансформации). Полукруглая проволочная петля используется для удаления части шейки матки, содержащей предраковые изменения.Многие врачи предпочитают удаление проволочной петли другим методам, потому что удаленная ткань не разрушается, и ее можно отправить в лабораторию патологии для исследования. Иссечение проволочной петли часто предпочтительнее, когда в эндоцервикальном канале присутствуют аномальные клетки. Используя проводную петлю, можно:
- Подтвердить, полностью ли удалены аномальные ячейки, и
- Определить тип имеющейся аномалии.
Во время процедуры вставляется зеркало, открывающее влагалище и позволяющее четко видеть шейку матки.Раствор слабой уксусной кислоты (уксуса) и / или йода наносится на поверхность шейки матки, чтобы сделать участки с аномальными клетками более заметными. Чтобы вызвать онемение шейки матки, вводят местный анестетик. Затем слои аномальных клеток отрезаются от шейки матки тонкой проволочной петлей, через которую проходит электрический ток. Диатермия используется для остановки любого значительного кровотечения. Процедура занимает около 15-30 минут и обычно проводится в дневном процедурном центре. Вскоре после процедуры появляются кровянистые выделения коричневого или черного цвета.Кровянистые выделения могут появиться в течение 2–4 недель после этого, а иногда и дольше. Спазмы и боль внизу живота могут сохраняться в течение одного-двух дней после процедуры. Большинство женщин могут вернуться к нормальной деятельности в течение 2-3 дней.
Коническая биопсия — Конусная биопсия обычно проводится, когда:
- Результаты мазка Папаниколау показывают аномальные изменения в железистых клетках
- Аномальные клетки находятся в эндоцервикальном канале, или
- Предполагается ранний рак
Коническая биопсия представляет собой операцию, при которой конусообразный или цилиндрический участок шейки матки, содержащий аномальные клетки, удаляется с помощью лазера или скальпеля (биопсия холодного конуса).Может потребоваться дневное или ночное пребывание в больнице. Биопсия конуса может быть сделана, поскольку диагностика обычно лечит проблему одновременно. После введения общей анестезии ноги пациента помещают в опоры, а нижнюю половину тела накрывают стерильными простынями. (в некоторых случаях для опорожнения мочевого пузыря может быть введен мочевой катетер). После окрашивания шейки матки йодом для окрашивания аномальных клеток врач делает круговой разрез в шейке матки, чтобы охватить аномальные области, и удаляет конусообразный цилиндрический клин ткани.Эта ткань отправляется в лабораторию патологии, где она исследуется. Оперированный участок прижигают или наносят раствор, чтобы остановить кровотечение. Для закрытия раны могут быть наложены швы. В это время может быть проведено эндоскопическое исследование матки (гистероскопия). После биопсии конуса избегайте тяжелой физической работы и расслабьтесь в течение нескольких дней. После лечения у вас могут возникнуть боли в животе. Наличие прозрачных или окрашенных кровью выделений из влагалища в течение 6 недель является нормальным явлением. Если вы сделали биопсию конуса и позже забеременели, сообщите об этом своему врачу.В редких случаях шейка матки может быть ослаблена биопсией конуса, и ваш врач может принять особые меры предосторожности во время вашей беременности.
Гистерэктомия
Гистерэктомия редко используется для лечения дисплазии шейки матки. В некоторых случаях, однако, это может быть рассмотрено, если другие проблемы имеют сексистский характер, в том числе:
- Другие гинекологические состояния (например, выпадение матки, миома или обильное менструальное кровотечение)
- Результаты биопсии конуса указывают на то, что CIN-2 или CIN- 3 слишком обширен, чтобы его можно было удалить другими методами, описанными выше.
- Избегайте секса, чтобы снизить риск заражения.
- Используйте гигиенические салфетки, а не тампоны.
- Если есть кровотечение или кровянистые выделения, избегайте ванн, спа и общественных бассейнов; душ вместо этого.
Последующее наблюдение
Любая оставшаяся болезнь обычно выявляется в течение первого или двух лет после лечения. Иногда ваше лечение подтверждает, что на самом деле у вас не было аномалии высокой степени (CIN-2 или CIN-3), а было аномалии низкой степени (только CIN-1 или HPV). В этой ситуации вам следует пройти контрольную кольпоскопию у гинеколога через 4-6 месяцев после лечения, когда будет взят мазок Папаниколау. Если мазок Папаниколау нормальный, вам будет рекомендовано сдавать еще один мазок Папаниколау через год, и если это нормально, вы можете сдавать мазки Папаниколау каждые 2 года.
После лечения аномалии высокой степени (CIN-2 или CIN-3) вам необходимо сделать кольпоскопию и взять мазок Папаниколау примерно через 4-6 месяцев после лечения. Если мазок нормальный или низкий, вам следует обратиться к терапевту через 6 месяцев (через 12 месяцев после лечения), когда будут выполнены мазок Папаниколау и тест на ВПЧ. Эти тесты следует повторить через год (через 245 месяцев после лечения). Как только у вас будут нормальные результаты в течение 2 лет подряд, вы можете вернуться к обычному тестированию мазка Папаниколау. Если ваш мазок Папаниколау показывает незначительные изменения или тест на ВПЧ положительный, вам следует продолжить обследование ОБОИХ из этих яичек у терапевта, пока оба не вернутся к норме.Если какой-либо последующий мазок Папаниколау показывает сильные изменения или у вас развивается аномальное вагинальное кровотечение, вам следует обратиться к врачу.
БРОСИТЬ КУРИТЬ: Очень важно бросить курить навсегда.
Возможные осложнения леченияЛазерное лечение, удаление проволочной петли, диатермия и конусная биопсия являются относительно безопасными процедурами, но имеют риски.
Иссечение проволочной петлей, лазерное лечение и конусная биопсия:- Кровоизлияние: из каждых 100 женщин, проходящих лечение, примерно у 5 женщин может быть кровотечение, достаточно сильное, чтобы потребовать госпитализации для наблюдения, тампонирования влагалища, наложения швов или, в редких случаях, крови переливание.
- Инфекция: примерно у 5 из каждых 100 пролеченных женщин может развиться инфекция матки или шейки матки. Обычно это лечится антибиотиками.
- Стеноз шейки матки (сужение): редко отверстие эндоцервикального канала может сужаться, что приводит к болезненным менструациям, трудностям при родах или фертильности
- Несостоятельность шейки матки: шейка матки после конусной биопсии или проволочной петли может быть ослаблен, увеличивая риск позднего выкидыша или преждевременных родов.
- В редких случаях может произойти повреждение кишечника или мочевого пузыря.
- LEEP или LLETZ: ожоги могут возникать в верхней части влагалища и вульвы.Обычно они безболезненны и хорошо заживают без осложнений.
Влияние лечения на беременность
Лечение для удаления аномальных клеток шейки матки не влияет на способность большинства женщин забеременеть. Однако это может повлиять на способности некоторых женщин. Биопсия конуса может стать проблемой для будущих беременностей. В редких случаях шейка матки может ослабнуть, что увеличивает риск выкидыша или раннего начала родов. Если вы позже забеременеете, вашему акушеру, возможно, придется наложить шов на шейку матки, чтобы укрепить ее, чтобы эндоцервикальный канал оставался закрытым на протяжении всей беременности.Биопсия конуса также может повредить шейку матки, и она не откроется во время родов. Если вам делали конусную биопсию, сообщите об этом своему врачу, чтобы шейка матки тщательно контролировалась во время беременности и родов.
Дистресс
Для некоторых женщин обследования, лечение и обсуждение предраковых клеток могут быть особенно неприятными. Наличие инфекции ВПЧ также может вызывать беспокойство. Возможно, вам будет полезно поговорить со своим врачом, партнером или друзьями о том, как вы себя чувствуете.
Спонтанная регрессия дисплазии шейки матки высокой степени: влияние типа вируса папилломы человека и фенотипа HLA
Реферат
Цель: Стойкая инфекция онкогенными вирусами папилломы человека (ВПЧ) играет центральную этиологическую роль в развитии плоскоклеточного рака шейки матки и их предшественников, интраэпителиальных новообразований шейки матки (ЦИН).Мы провели проспективное наблюдательное когортное исследование, в котором оценивали известные, поддающиеся количественной оценке прогностические переменные клинического поведения у женщин с поражениями шейки матки высокой степени.
Дизайн эксперимента: В нашу когорту исследования вошли здоровые женщины с поражением шейки матки высокой степени (CIN2 / 3) с остаточными видимыми поражениями после кольпоскопической биопсии. Мы проспективно наблюдали за 100 женщинами за 15 недель до стандартной резекции. Типирование HPV было выполнено с использованием ПЦР и метода обнаружения блоттинга обратной линии.
Результаты: Частота спонтанной гистологической регрессии, определяемая как (CIN1 или меньше при резекции), составила 28%. Общий уровень инфицирования ВПЧ составил 100%. ВПЧ16 был выявлен в 68% поражений. Женщины с только HPV16 имели значительно меньшую вероятность регресса по сравнению с женщинами с типами HPV, отличными от HPV16 (отношение шансов, 0,342; 95% доверительный интервал, 0,117-0,997; P = 0,049). В когорте только с ВПЧ16 пациенты, имевшие аллель HLA * A201 , имели аналогичные результаты с теми, кто не носил А201.Однако среди пациентов с типами HPV, отличными от HPV16, взаимодействие аллелей HLA * A201 было значительным; пациенты с HLA * A201 имели наименьшую вероятность выздоровления.
Выводы: Поражения CIN2 / 3, связанные с одним ВПЧ16, значительно реже разрешаются спонтанно, чем поражения, вызванные другими типами. Взаимодействие между типом HPV, типом HLA и скоростью регрессии подтверждает роль HLA-ограниченных HPV-специфических иммунных ответов в определении исхода заболевания.
Хроническая инфекция с высоким риском или онкогенный тип вируса папилломы человека (ВПЧ) необходима, но недостаточна для развития большинства плоскоклеточных карцином шейки матки и их предшественников, цервикальной интраэпителиальной неоплазии (CIN; ссылка 1). Поражения CIN1, CIN2 и CIN3 представляют собой спектр заболеваний. Поражения низкой степени злокачественности, или CIN1, представляют собой хроническую инфекцию ВПЧ, при которой ДНК ВПЧ является эписомальной и происходит выработка и выделение интактных вирионов. У иммунокомпетентных женщин многие поражения низкой степени или CIN1, тем не менее, в конечном итоге регрессируют без вмешательства (1, 2).Сообщаемые показатели регресса составляют до 58% в течение 24 месяцев (3). Очень небольшой процент (~ 2%) будет прогрессировать до поражений высокой степени.
Напротив, считается, что большинство поражений высокой степени или CIN2 / 3 с большей вероятностью сохранятся, чем регрессируют. Однако сообщаемые показатели спонтанной регрессии варьируют от 6% до 50%, в зависимости от диагностических критериев и продолжительности наблюдения (4). Риск прогрессирования инвазивного рака через 24 месяца у женщин с поражениями высокой степени составляет от ~ 1% до 2%.
Механизмы, с помощью которых разрешаются интраэпителиальные поражения, связанные с ВПЧ, недостаточно изучены.В качестве прелюдии к интервенционным клиническим испытаниям у женщин с подтвержденным биопсией CIN2 / 3 мы провели проспективное наблюдательное когортное исследование, в котором оценивали известные, поддающиеся количественной оценке прогностические переменные у иммунокомпетентных женщин с подтвержденным биопсией CIN2 / 3 в течение периода наблюдения перед рутинным терапевтическим удалением. Наша цель состояла в том, чтобы оценить скорость спонтанного регресса после диагностической биопсии у иммунокомпетентных женщин и изучить клинические, иммунологические и вирусологические различия между женщинами, у которых болезнь регрессировала, и женщинами, у которых болезнь не регрессировала.Тщательная характеристика поражений, которые могут регрессировать без вмешательства, имеет решающее значение для разработки интервенционных исследований в этой популяции пациентов.
Материалы и методы
Дизайн исследования. Мы проспективно пригласили женщин, которые были направлены в Службу кольпоскопии Джонса Хопкинса для оценки мазка Папаниколау (Пап) высокого качества, для участия в протоколе обсервационного исследования перед стандартной терапевтической хирургической резекцией гистологически подтвержденных поражений шейки матки высокой степени.Обращались ко всем женщинам, направленным для оценки мазка Папаниколау высокого качества, за исключением (а) беременных, (б) иммунодефицитных или (в) известных случаев злоупотребления активными веществами, что исключает соблюдение режима последующего наблюдения. Пациенты, оцениваемые в этом анализе, имели CIN2 / 3, подтвержденную кольпоскопически направленной биопсией, и имели видимые поражения после диагностической биопсии. Мы выбрали гистологический диагноз CIN2 / 3 в качестве нашего критерия входа в отличие от цитологического диагноза, потому что воспроизводимость гистологических диагнозов CIN2 / 3 значительно более надежна, чем воспроизводимость цитологических диагнозов поражений высокой степени (5, 6).
Субъектам задавали стандартные вопросы о демографических и поведенческих факторах, включая сообщенное начало половой жизни, количество партнеров на протяжении всей жизни, историю болезней, передаваемых половым путем, курение табака и использование противозачаточных средств. Первичным результатом этого анализа было сохранение CIN2 / 3 по сравнению с регрессией, определяемой как CIN1 или меньше, при резекции через 15 недель.
Субъекты прошли однократный интервальный визуальный кольпоскопический осмотр на 8 неделе. Во время этого визита был взят мазок из шейки матки для типирования на ВПЧ.Во время терапевтического иссечения конуса зоны трансформации на 15 неделе был взят третий цервикальный мазок для типирования ВПЧ и были получены кольпографы.
В период с марта 2000 г. по июнь 2004 г. в общей сложности 187 субъектов, направленных на оценку мазка Папаниколау высокого качества, были набраны для проверки на участие в исследовании. Среди женщин, подписавших согласие на скрининг, 65 из 187 (34,8%) не имели подтвержденного биопсией CIN2 / 3. Эта цифра соответствует положительной прогностической ценности цитологических скрининговых диагнозов, обнаруженной в крупных исследованиях (5, 6).Общие диагнозы у женщин с высокой степенью направленности Пап, у которых не было подтвержденных биопсией поражений, включали низкоуровневые поражения, атрофию и атипичную незрелую метаплазию. Другие причины отказа от включения в исследование включали интервальную беременность ( n = 3), диагноз аденокарциномы in situ при биопсии ( n = 2), несоблюдение режима лечения ( n = 16) и интервальный инфаркт миокарда ( n = 1). ).
На сегодняшний день в общей сложности 100 женщин с подтвержденным биопсией CIN2 / 3 завершили последующее наблюдение с резекцией конечной точки.Все кольпоскопические исследования проводил один гинеколог (C.L.T.). Диагностическая биопсия была взята из наиболее аномальных участков при первом посещении, а мазок из шейки матки был взят для типирования ВПЧ. Кольпоскопия проводилась путем помещения двустворчатого зеркала во влагалище и непосредственной визуализации шейки матки. Промывка разбавленной уксусной кислотой (1%) была нанесена на шейку матки, а зеленый светофильтр использовался для выявления ацетобелых поражений и аномальных сосудистых паттернов. Была проведена однократная пункционная биопсия наиболее аномальной области.Непосредственно перед терапевтической резекцией ткани снова была проведена кольпоскопия. Гистологические образцы считывались в обычном порядке. Гистологическая оценка дисплазии была основана на стандартных критериях CIN1, CIN2 и CIN3. Весь гистологический материал был повторно рассмотрен вторым патологоанатомом-гинекологом без указания личности пациента и истории болезни. Типирование ВПЧ было обнаружено в образцах мазков из шейки матки с помощью ПЦР и блоттинга с обратной линией (7). HLA-типирование было выполнено на лимфоцитах периферической крови в лаборатории иммуногенетики Джона Хопкинса.Аллели HLA идентифицировали гибридизацией специфичных для последовательности олигонуклеотидных зондов с геномной ДНК человека, выделенной из цельной крови. Типирование на основе последовательностей с высоким разрешением было выполнено для экзонов 2, 3 и 4 локуса HLA-A; Локус HLA-B 2, 3 и 4; и локусы Cw 2 и 3. Типирование с промежуточным разрешением было выполнено для локусов HLA класса II DRB1 и DQB1 .
Типирование вируса папилломы человека: Обработка образцов. Аликвоты по сто микролитров исходного образца мазка в стандартной транспортной среде Digene были удалены и добавлены к 10 мкл 10-кратного буфера для разложения [1 моль / л Трис-HCl (pH 7.5), 0,5 моль / л ЭДТА, 1% лаурет-12 и 4 мг / мл протеиназы К]. После встряхивания образец + буфер для разложения инкубировали при 65 ° C в течение 1 часа. После тепловой инактивации протеазы при 95 ° C в течение 10 минут гидролизат смешивали с холодным раствором для осаждения (0,825 моль / л ацетата аммония и 83,5% этанола), и ДНК осаждали в течение ночи при -30 ° C. ДНК осаждали при 15000 об / мин в течение 30 минут при 4 ° C, супернатант удаляли и осадок сушили в течение 30 минут при 42 ° C. Образцы ресуспендировали в 50 мкл LoTE [1 ммоль / л Трис + 0.5 ммоль / л ЭДТА (pH 7,5)]. Контроли экстракции были включены в каждую партию обработки от 30 до 40 образцов. Они включали контроль высокой экстракции, состоящий из 1,25 × 10 5 клеток SiHa и 1,0 × 10 6 клеток K562 на мл стандартной транспортной среды; контроль с низкой экстракцией, состоящий из 5,0 × 10 3 клеток SiHa и 1,0 × 10 6 клеток K562 на мл стандартной транспортной среды; и отрицательный контроль экстракции, состоящий из 1,0 × 10 6 клеток на мл стандартной транспортной среды.Аликвоту 100 мкл каждого контроля экстракции обрабатывали с каждой партией.
Генотипирование вируса папилломы человека. Аликвоту 5 мкл каждого образца ДНК амплифицировали с использованием консенсусных праймеров PGMY09 / 11 L1, а определение генотипа 27 распространенных генитальных типов ВПЧ проводили с помощью блот-гибридизации с обратной линией, как описано ранее (7, 8). Реагенты PGMY / linear array были любезно подарены компанией Roche Molecular Systems, Inc. (Плезантон, Калифорния).
Количественное определение HPV16. Все анализы были выполнены с использованием системы определения последовательностей ABI 5700. HPV16 был количественно определен с использованием методов Taqman PCR, как описано ранее (9). По существу, 2,5 мкл экстрагированной ДНК, контрольной ДНК или воды (без контроля матрицы) добавляли к 47,5 мкл мастер-смеси, содержащей 1 × буфер для ПЦР [10 ммоль / л Трис-HCl (pH 8,0) + 50 ммоль / л KCl. ]; По 200 мкмоль / л каждого dATP, dGTP, dCTP и dTTP; Зонд Такмана 0,1 мкмоль / л; 0,2 мкмоль / л каждого праймера; 4 ммоль / л MgCl 2 ; и 5 единиц ДНК-полимеразы AmpliTaq Gold.Образцы амплифицировали с использованием следующего теплового профиля: 50 ° C в течение 2 минут, 95 ° C в течение 12 минут и 50 циклов при 95 ° C в течение 15 секунд и 55 ° C в течение 30 секунд. После амплификации используется программное обеспечение для обнаружения ABI 5700 Sequence Detection System путем ручного выбора порога на основе наблюдаемых кривых роста.
Мы также стремились контролировать вариабельность выборки путем нормализации вирусной нагрузки HPV16 по общему количеству обработанной ДНК человека. Используя аликвоту каждого образца объемом 2,5 мкл, мы также амплифицировали с использованием методов ПЦР в реальном времени Taqman эндогенный ретровирус человека (ERV-3), который предположительно присутствует в двух копиях на диплоидную клетку (10).Вкратце, 2,5 мкл образца ДНК добавляли к 47,5 мкл мастер-смеси, содержащей 1 × буфер для ПЦР [10 ммоль / л Трис-HCl (pH 8,0) + 50 ммоль / л KCl]; По 200 мкмоль / л каждого dATP, dGTP, dCTP и dTTP; Зонд Такмана 0,25 мкмоль / л; 0,4 мкмоль / л каждого праймера; 4 ммоль / л MgCl 2 ; и 5 единиц ДНК-полимеразы AmpliTaq Gold. Образцы амплифицировали с использованием следующего теплового профиля: 95 ° C в течение 10 минут и 50 циклов: 95 ° C в течение 15 секунд и 60 ° C в течение 30 секунд.
Тесты HPV16 и ERV-3 количественно определяли неизвестные образцы на основе кривой внешнего стандарта, амплифицированной в каждом анализе.Для HPV16 эта стандартная кривая была построена из серии разведений плазмиды HPV16 на фоне 50 нг / мкл плацентарной ДНК человека. Для ERV-3 очищенную ДНК человека из диплоидной линии клеток легких человека CCD-18Lu (ATCC CCL 205) серийно разводили до фона 50 нг / мкл ДНК спермы лосося (Invitrogen, San Diego, CA). Наклон и пересечение лог-линейного графика стандартного количества копий и C t использовались для оценки неизвестного количества копий на основе измеренного C t для каждого неизвестного.Нормализованная вирусная нагрузка представлена как общее количество копий HPV16 на 1000 эквивалентов клеток (ERV-3 копии / 2 для учета диплоидного генома).
Этот протокол был одобрен Наблюдательным советом больницы Джонса Хопкинса. Информированное согласие было получено от каждого пациента. Эти расследования были проведены в соответствии с принципами, закрепленными в Хельсинкской декларации.
Статистические методы. Первичным статистическим результатом исследования была спонтанная регрессия поражений, определяемая как CIN1 или менее через 15 недель.Мы сравнили характеристики женщин, у которых наблюдался спонтанный регресс поражений в течение периода исследования, с женщинами, у которых было хроническое заболевание. Результат CIN при резекции был взят как дихотомическая переменная. Его одномерная связь с другими категориальными факторами (например, типированием ВПЧ) оценивалась в таблицах сопряженных обстоятельств, с помощью оценочных отношений шансов (OR) и статистикой χ 2 . Непрерывно распределенные предикторы у пациентов, которые регрессировали, по сравнению с теми, у кого нет (например, возраст), сравнивали с использованием средних значений и тестов t .Чтобы учесть влияние нескольких предикторов одновременно на результат, использовались модели многомерной логистической регрессии. Во всех случаях результатом было регресс поражения по сравнению с сохранением. Все модели включали время, измеренное от постановки диагноза до хирургической резекции в месяцах в качестве предиктора. Чтобы проверить связь переменных-предикторов с результатом, для построения модели использовалась пошаговая процедура обратного исключения. Все переменные-кандидаты были введены в модель, и статистически незначимые (и / или клинически слабые) факторы были удалены из модели по одному с повторной оценкой OR, доверительных интервалов (CI) и значений P на каждом этапе.Все пропорции даны с точным биномиальным доверительным интервалом 95%.
Результаты
Характеристики пациентов. Субъекты были набраны в среднем через 1 месяц после направления на основании их индексного патологического диагноза мазка Папаниколау при их первоначальном обращении к специалисту для кольпоскопической оценки патологического мазка Папаниколау. Клинические характеристики 100 субъектов с полным набором тканей для диагностической биопсии / терапевтической резекции показаны в таблице 1.Средний возраст составлял 29,7 года (медиана 26,5 года; диапазон 18-67 лет). Средняя четность составила 1,76 (диапазон 0-11). Среднее количество зарегистрированных сексуальных партнеров в течение всей жизни составило 8,1 (диапазон от 1 до 50). Этническое распределение включало 26 (26%) афроамериканцев, трех (3%) латиноамериканцев, 67 (67%) белых и четырех (4%) азиатов. Сообщенный анамнез текущего курения табака был получен от 42 (42%). Средний интервал от биопсии до резекции составил 123,8 дня (медиана — 110,0 дней). Эта когорта отражает этническое и демографическое распределение женщин с ВПЧ нижних отделов половых путей, обращенных в наше учреждение.
Таблица 1.Клиническая характеристика женщин с CIN2 / 3
Гистологические результаты. Мы сравнили клинические, гистологические и вирусологические характеристики в этой когорте из 100 женщин (таблица 2). Общая частота спонтанной гистологической регрессии, определяемая как CIN1 или меньше во время конизации, составляла 28%. Не было значительной разницы в возрасте, времени до резекции или использовании гормональных контрацептивов у женщин, у которых болезнь регрессировала по сравнению с теми, у которых болезнь не регрессировала.В настоящее время потребление табака было немного, но не значительно выше среди женщин с хроническим заболеванием, чем среди женщин, у которых болезнь регрессировала.
Таблица 2.Характеристики пациента: спонтанный регресс в сравнении с хроническим заболеванием
Типирование вируса папилломы человека. Распространенность ВПЧ в этой когорте составляла 100% и 98% для типов высокого риска (16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 , и W13b). ВПЧ16 обнаружен у 68%.Либо HPV16, либо другие типы, связанные с HPV16 (31, 33, 35, 52 и 58), были обнаружены у 81 из 100 (81%).
В подмножестве когорты, у которой была инфекция ВПЧ16 на момент включения в исследование ( n = 52), мы обнаружили, что коинфекция с другими типами на момент включения в исследование была обычным явлением (33%). Мы также обнаружили, что новые инфекции в течение периода наблюдения были обычным явлением (32,7%), и что устранение типов ВПЧ в течение периода наблюдения также было обычным явлением (38,5%; данные не показаны).
Количественное определение вирусной нагрузки HPV16 у этих пациентов в продольных образцах позволило предположить пороговый эффект.Пациенты, у которых количественная вирусная нагрузка упала ниже 1000 копий на 1000 эквивалентов клеток к 15-й неделе посещения, в целом, излечили свои поражения. Напротив, пациенты, у которых вирусная нагрузка увеличилась за период наблюдения, особенно до высоких уровней, не очистили свои поражения (рис. 1; количественная вирусная нагрузка HPV16 с течением времени).
Рис. 1.Серийные мазки из шейки матки были получены от пациентов с поражениями, связанными с ВПЧ16. Посещение 1, скрининговое посещение; визит 2, неделя 8; визит 3, неделя 15 (лечебная резекция зоны трансформации).С помощью количественной ПЦР и праймеров для HPV16E6 и нормализации до ERV-3 были оценены серийные цервикальные мазки. Количественная вирусная нагрузка ВПЧ16 на шейку матки с течением времени у пациентов, чьи поражения спонтанно разрешились в течение 15-недельного окна наблюдения ( вверху ). Пациенты, у которых поражения не регрессировали ( нижних ).
В окне наблюдения исследования спонтанная регрессия произошла у 9 из 44 (20,5%) женщин с единичной инфекцией ВПЧ16 (таблица 3).Напротив, у женщин, инфицированных типами, отличными от типа 16, скорость спонтанного регресса составила 12 из 33 (36,4%). У женщин, инфицированных как HPV16, так и хотя бы одним другим типом HPV, спонтанная регрессия произошла у 7 из 24 (29,2%). В целом эффект однотипной инфекции, вызванной одним ВПЧ16, привел к 3-кратному снижению вероятности регресса заболевания в течение периода исследования по сравнению с женщинами, у которых были поражения, не связанные с ВПЧ16 (ОШ, 0,34; 95% ДИ, 0,117-0,997. ; P = 0.05; Таблица 4).
Таблица 3.Паттерны ВПЧ-инфекции: спонтанная регрессия по сравнению с персистирующим заболеванием
Таблица 4.Многопараметрическая логистическая регрессия для разрешения поражения
Скорость регресса поражения у пациентов с инфекциями, связанными с типами HPV16 (31, 33, 35, 52 и 58; 26%), была очень близка к той, которую мы наблюдали в группе, получавшей только HPV16. Напротив, скорость регресса у пациентов, у которых были инфекции HPV, которые не были связаны с HPV16 или HPV16, составила 61.5%. Поражения, не связанные с ВПЧ16 или связанными с ВПЧ16 типами, имели значительно большую вероятность исчезновения, чем поражения, связанные с ВПЧ16 ( P = 0,04).
HLA typing. Типирование HLA класса I было выполнено в этой когорте. Распределение аллелей было похоже на то, что наблюдается в общей популяции. В нашем исследовании 30% пациентов имели аллель HLA * A201 . У женщин с однотипной инфекцией только HPV16 наличие аллеля HLA * A201 не оказало значительного влияния на скорость регресса.Напротив, в группе пациентов с инфекциями с типами HPV, отличными от HPV16, наблюдалось значительное взаимодействие с HLA * A201 . В частности, женщины с поражениями высокой степени не-HPV16, несущие аллель HLA * A201 , имели в 3 раза меньше шансов излечить свои поражения, чем те, у которых не было HLA * A201 (14,3% против 42,3%). Мы исследовали взаимодействие между наличием или отсутствием HPV16 и HLA * A201 с использованием многомерной логистической модели, скорректированной по времени от постановки диагноза до хирургической резекции (таблица 4).Аллель HLA * A201 был отрицательно связан с регрессом поражения у женщин с поражениями, вызванными типами HPV, отличными от типа 16 или типов, связанных с HPV16 (OR, 0,03; 95% ДИ, <0,001 до 1,034; P = 0,05) .
Обсуждение
В этом анализе мы сравнили клинические, вирусологические и гистологические характеристики пациентов с подтвержденным биопсией CIN2 / 3 в течение короткого периода наблюдения перед стандартной терапевтической резекцией. Мы обнаружили, что общий уровень спонтанной регрессии составляет 28% в течение 15-недельного окна.У женщин с CIN2 / 3, ассоциированным с инфекцией HPV16, вероятность регресса поражения была значительно ниже, чем у остальной когорты. Тем не менее, у пациентов с ВПЧ-16, у которых излечились поражения в целом, вирусная нагрузка на ВПЧ-16 была ниже, чем у тех, кому не удалось устранить поражения. Более того, у тех, кто действительно разрешил свои поражения, вирусная нагрузка снизилась в течение периода наблюдения, в отличие от пациентов, которые не разрешили свои поражения. Наконец, взаимодействие хозяина HLA класса I типа с идентифицированными типами ВПЧ увеличивало эффект инфекции ВПЧ на порядок, подтверждая гипотезу о том, что эффективность презентации вирусных антигенов, ограниченных классом I MHC, играет важную роль в развитии болезни. исход.
Сильные стороны этого исследования включают его перспективный дизайн, гистологический диагноз CIN2 / 3 в качестве критерия входа, вирусологические данные, а также стандартизацию кольпоскопии и гистопатологического обзора. Однако относительно небольшой размер выборки ( n = 100), а также наше неполное понимание потенциального влияния биопсии на поведение поражения ограничивают интерпретацию наших данных.
Влияние диагностической биопсии на естественное течение CIN2 / 3 может объяснить расхождение между нашими наблюдениями и данными нескольких крупных исследований, основанных только на цитологической диагностике, поскольку местный ответ на диагностическую биопсию может сильно отличаться от ответа на цитологический мазок, атравматичный и неинвазивный.ВПЧ поражает базальный клеточный слой плоского эпителия слизистой оболочки шейки матки без нарушения базальной мембраны. Последующее производство чужеродных или вирусных белков происходит по мере созревания клеток и происходит в самом поверхностном слое эпителия. Таким образом, вирусные антигены высвобождаются в условиях естественного старения и десквамации эпителия и поэтому не обязательно представляются иммунной системе хозяина в контексте второго сигнала или опасности. Следовательно, помимо уменьшения размера поражения, диагностическая биопсия может выявить достаточно местную репаративную или воспалительную среду, так что вирусные антигены, ранее не обнаруженные, могут быть представлены в условиях, достаточных для индукции эффективного иммунного ответа и последующего устранения поражения.
Holowaty et al., Например, в крупном когортном исследовании женщин с дисплазией средней степени тяжести обнаружили скорость регресса в 6,9% за 2 года (2). Это исследование было основано только на цитологическом диагнозе и не было связано с диагностической биопсией. В нашей группе пациентов 65 из 187 (34,8%) женщин, направленных для оценки цитологического исследования высокой степени, не имели гистологически подтвержденных поражений высокой степени. Народ и др. наблюдали за когортой из 70 236 женщин, также используя цитологические диагнозы для определения конечной точки прогрессирования карциномы in situ или хуже (11).Опять же, поскольку не было гистологического подтверждения, эти результаты трудно экстраполировать, чтобы сравнить их клиническую значимость с результатами в нашей когорте.
Наблюдаемая скорость спонтанного регресса CIN2 / 3 после биопсии в этой когорте находится в пределах диапазона, наблюдаемого в группах контроля / плацебо опубликованных интервенционных клинических испытаний в аналогичных когортах пациентов (таблица 5; ссылки 12–14). Однако ни одно из этих исследований не включало корреляцию между типами ВПЧ.
Таблица 5.Клинические характеристики подтвержденного биопсией CIN2 / 3
Предыдущие исследования оценивали риск возникновения интраэпителиальных поражений при стойких инфекциях ВПЧ (15–17). В частности, было показано, что продолжительность инфицирования ВПЧ 16 типа больше, чем другими типами ВПЧ (1). Ho et al. оценили естественное течение инфекции ВПЧ в когорте студенток колледжа. Эти авторы обнаружили, что множественная инфекция повышает риск стойкой инфекции ВПЧ в 4 раза в возрасте> 6 месяцев.Однако этот эффект был отмечен у женщин без побочных эффектов. Они обнаружили, что стойкая инфекция одними и теми же типами ВПЧ, особенно типами высокого риска, представляет наивысший риск последующих интраэпителиальных поражений. Связь в нашей когорте между женщинами с единичной инфекцией ВПЧ16 и стойкими установленными поражениями высокой степени может отражать неспособность этих женщин вылечить стойкую инфекцию ВПЧ16 в первую очередь. Коинфекция с другими типами ВПЧ может вызвать иммунный ответ, способный разрешить установленное поражение, независимо от типа ВПЧ, вызвавшего его.
Мы сделали предположение, что у пациентов, инфицированных только одним подтипом HPV, CIN2 / 3 возник из этого подтипа HPV. Интеграция вирусной ДНК в геном клетки-хозяина — редкое событие; цервикальные поражения высокой степени злокачественности считаются клональными процессами (18, 19). Наши данные согласуются с более ранними отчетами, описывающими инфекции множественными типами ВПЧ как у женщин с нормальной цитологией, так и у женщин с гистологическим CIN (20–23). В исследовании ALTS, например, Sherman et al.сообщили, что около 50% поражений CIN2 и CIN3 были связаны с множественными онкогенными типами ВПЧ. Наше исследование предполагает, что инфекция HPV16, по сравнению с другими типами HPV, продолжает оказывать неблагоприятный эффект при установленном поражении высокой степени.
Классический подход к определению наличия иммунологического компонента в исходе заболевания — поиск ассоциаций со специфическими аллелями HLA. Поэтому мы первоначально оценили, повлияло ли на естественную регрессию присутствие или отсутствие наиболее распространенного аллеля HLA класса I ( A201 ), экспрессируемого примерно половиной населения.Мы обнаружили, что, в то время как экспрессия HLA-A201 имела относительно небольшой эффект на регресс в поражениях HPV16 +, она проявляла выраженный эффект в поражениях, отличных от HPV16. HLA-A2 + пациенты с поражениями, отличными от HPV16 +, имели в 30 раз меньшую вероятность естественного регресса, чем пациенты с HLA-A2- с HPV16. Специфическая роль ограниченных MHC класса I иммунных ответов в естественном регрессе установленных, но предраковых поражений ВПЧ шейки матки еще не выяснена. Самый простой механизм — это механизм «Ir-гена», в котором определенные аллели HLA не могут эффективно презентовать пептиды.Относительно небольшой размер белков E6 и E7 действительно может обеспечивать ограниченное количество эпитопов, доступных для презентации. Применение этой модели к текущему набору данных предполагает, что эволюционное давление на менее онкогенные типы ВПЧ (то есть не-HPV16) должно было заключаться в устранении эпитопов E6 и E7, эффективно представленных общими аллелями HLA, такими как HLA-A201 . В то время как сообщения о связи между цервикальным заболеванием ВПЧ и гаплотипами HLA не были последовательными, все больше доказательств подтверждают усиление понижающей модуляции механизма презентации антигена MHC класса I с прогрессированием предраковых поражений.Об ассоциации аллелей HLA (I и II) и аномальной презентации антигена HLA класса I сообщалось при других хронических вирусных инфекциях человека, таких как гепатиты B и C (24, 25). Было показано, что отдельные супертипы HLA связаны с различными клиническими ответами на ВИЧ-инфекцию (26). Взятые вместе, появляющиеся данные об ассоциации аллелей HLA и понижающей модуляции презентации антигена предоставляют доказательства компонента распознавания Т-клеток в исходе предракового заболевания шейки матки, связанного с ВПЧ.
Другие иммунологические механизмы также должны быть рассмотрены помимо простой HLA-ограниченной модели презентации антигена. Фактически, механизм гена Ir предсказывает, что неудачный ответ (то есть отсутствие регрессии) является рецессивным. Однако большинство пациентов с HLA-A201 гетерозиготны по этому локусу, что позволяет предположить, что снижение скорости регрессии у HLA-A201 + индивидуумов с поражениями, не связанными с HPV16, обусловлено доминирующим эффектом. Этот доминирующий эффект может быть связан с образованием регуляторных Т-клеток.Обычно считается, что регуляторные Т-клетки являются CD4 + и, следовательно, не распознают HLA-A201; однако недавно были описаны регуляторные Т-клетки CD8 + (27–29). Ясно, что будет важно идентифицировать эпитопы ВПЧ, которые естественным образом процессируются у пациентов, и генерировать Т-клеточные линии и клоны, выращенные у регрессирующих и не регрессирующих пациентов. Наконец, необходимо также учитывать роль экспрессии аллеля HLA в ответах естественных киллеров на инфицированные ВПЧ клетки из-за способности определенных аллелей класса I ингибировать ответы естественных киллеров через рецепторы суперсемейства иммуноглобулинов, ингибирующие киллеры.Недавно сообщалось, что соответствие между конкретными аллелями HLA C и гаплотипами рецепторов-киллеров влияет на исход инфекции HCV (30). Роль естественных киллерных реакций в контроле предраковых поражений ВПЧ еще не оценена, но требует серьезного изучения. Прямая доступность поражений шейки матки, вызванных ВПЧ +, предлагает уникальные возможности для анализа фенотипа и функции популяций лимфоцитов, непосредственно проникающих в регрессирующие и не регрессирующие поражения.
В то время как колебания местной гуморальной иммунологической среды в шейке матки колеблются в зависимости от менструального цикла, беременности и использования гормональных контрацептивов были описаны (31, 32), мы не наблюдали никакого влияния текущего использования оральных контрацептивов на скорость спонтанного регресса. .Однако, как отмечалось выше, размер нашей выборки относительно невелик, а 15-недельное окно наблюдения очень короткое; следовательно, будут очевидны только большие эффекты.
Известно, что курение табака увеличивает риск дисплазии шейки матки в зависимости от дозы, от низкосортных поражений до явного инвазивного рака (15, 33–39). Никотин и метаболиты никотина были обнаружены в цервикальном секрете курящих женщин (40–43). Мы наблюдали незначительную тенденцию в нашей когорте к повышенному риску стойких заболеваний среди женщин, которые в настоящее время курили.
Продолжительность наблюдения в этом исследовании была мотивирована озабоченностью по поводу безопасности пациентов. Риск прогрессирования инвазивного заболевания в выбранный период времени (15 недель) считался практически нулевым. Основываясь на наших наблюдениях, а также на наблюдениях других, можно привести аргумент в пользу более длительного периода исследования дизайна (12, 13, 44). Тем не менее, такие исследования требуют тщательного отбора пациентов, регулярного кольпоскопического наблюдения и агрессивных усилий, чтобы гарантировать, что пациенты не потеряны для последующего наблюдения до того, как будет проведена окончательная терапия.
Соответствующие промежуточные конечные точки имеют решающее значение для дизайна интервенционных исследований у пациентов с прединвазивным заболеванием. На сегодняшний день достаточно подтверждены только цитологические и гистопатологические диагнозы, чтобы их можно было использовать в качестве конечных точек (45). Использование других биологических маркеров и новых технологий неинвазивной визуализации остается экспериментальным. Чтобы их можно было использовать в качестве потенциальных промежуточных конечных точек, они должны быть поддающимися количественной оценке, воспроизводимостью и показывать корреляцию с известными биологическими переменными ВПЧ.Мы обнаружили, что количественная вирусная нагрузка HPV16 в мазках из шейки матки коррелировала с клиническим поведением. Этот показатель должен быть дополнительно оценен в будущих интервенционных исследованиях. В ближайшем будущем кольпоскопическая биопсия ткани остается золотым стандартом конечной точки для разработки и анализа интервенционных исследований в этой популяции женщин.
Это проспективное обсервационное исследование было разработано для оценки спонтанного регресса подтвержденного биопсией CIN2 / 3 за короткий период времени.В этом исследовании мы обнаружили, что общая скорость спонтанного регресса CIN2 / 3 составила 28%. Мы обнаружили, что скорость регресса поражения была сильно обратно пропорциональна инфицированию HPV16 и что аллель HLA * A201 был связан с персистированием заболевания. Если наши результаты будут подтверждены на более крупном наборе данных, то в будущих интервенционных испытаниях на женщинах с CIN 2/3 может потребоваться стратификация по ВПЧ, а также по аллелям HLA, чтобы учесть разные скорости спонтанной регрессии.
Благодарности
Мы благодарим Аттилу Лоринца (Digene, Gaithersburg, MD) за наборы для сбора образцов для тестирования на ВПЧ; Джанет Кернегей и Шон Бойл (Roche Molecular Systems, Плезантон, Калифорния) за реагенты для типирования ВПЧ; и доктору Чарльзу Дрейку за критический обзор этой статьи.
Сноски
-
Грантовая поддержка: Грант Фонда реституции сигарет Мэриленда (Медицинские учреждения Джонса Хопкинса) и награда CA85437 Национального института рака K23 (C.Л. Тримбл).
-
Расходы на публикацию этой статьи были частично покрыты за счет оплаты страницы. Таким образом, данная статья должна быть помечена как реклама в соответствии с 18 U.S.C. Раздел 1734 исключительно для указания этого факта.
-
- Принято 15 апреля 2005 г.
- Получено 16 декабря 2004 г.
- Исправление получено 12 марта 2005 г.
Ссылки
- ↵
Ho GY, Bierman R, Beardsley L, Chang CJ, Burk RD.Естественное течение цервиковагинальной папилломавирусной инфекции у молодых женщин. N Engl J Med 1998; 338: 423–8.
- ↵
Holowaty P, Miller AB, Rohan T, To T. Естественная история дисплазии шейки матки. J Natl Cancer Inst 1999; 91: 252–8.
- ↵
Melnikow J, Nuovo J, Willan AR, Chan BK, Howell LP. Естественная история плоскоклеточных интраэпителиальных поражений шейки матки: метаанализ. Акушерский гинекол 1998; 92: 727–35.
- ↵
Насиелл К., Насиелл М., Вацлавинкова В. Поведение при дисплазии шейки матки средней степени тяжести при длительном наблюдении. Obstet Gynecol 1983; 61: 609–14.
- ↵
Stoler MH, Schiffman M. Воспроизводимость цитологических и гистологических интерпретаций шейки матки между наблюдателями: реалистичные оценки из исследования ASCUS-LSIL Triage Study. JAMA 2001; 285: 1500–5.
- ↵
Woodhouse SL, Stastny JF, Styer PE, Kennedy M, Praestgaard AH, Davey DD.Вариабельность между наблюдателями в подклассификации плоскоклеточных интраэпителиальных поражений: результаты программы межлабораторных сравнений Колледжа американских патологов в цервиковагинальной цитологии. Arch Pathol Lab Med, ноябрь 1999 г .; 123: 1079–84.
- ↵
Gravitt PE, Peyton CL, Apple RJ, Wheeler CM. Генотипирование 27 типов вируса папилломы человека с использованием продуктов консенсусной ПЦР L1 методом одиночной гибридизации методом блоттинга обратной линии. J Clin Microbiol 1998; 36: 3020-7.
- ↵
Gravitt PE, Peyton CL, Alessi TQ и др. Улучшенная амплификация генитальных вирусов папилломы человека. J Clin Microbiol 2000; 38: 357–61.
- ↵
Gravitt PE. Воспроизводимость количественного определения вирусной нагрузки HPV16 и HPV18 с использованием ПЦР-анализов Taqman в реальном времени. Дж. Вирол Методы 2003; 112: 23–33.
- ↵
Юань С.К., Майли В., Уотерс Д. Количественная оценка человеческих клеток с использованием ПЦР-анализа ERV-3 в реальном времени.J Virol Methods, февраль 2001 г .; 91: 109–17.
- ↵
Narod SA, Thompson DW, Jain M, Wall C, Green LM, Miller AB. Дисплазия и естественная история рака шейки матки: первые результаты когортного исследования в Торонто. Eur J Cancer 1991; 27: 1411–6.
- ↵
Фоллен М., Аткинсон Э. Н., Шоттенфельд Д. и др. Рандомизированное клиническое испытание 4-гидроксифенилретинамида для лечения плоскоклеточных интраэпителиальных поражений шейки матки высокой степени.Clin Cancer Res 2001; 7: 3356–65.
- ↵
Meyskens FL Jr, Surwit E, Moon TE и др. Усиление регресса цервикальной интраэпителиальной неоплазии II (умеренная дисплазия) при местном применении all- trans -retinoic acid: рандомизированное исследование. J Natl Cancer Inst 1994; 86: 539–43.
- ↵
Киф К.А., Шелл М.Дж., Брюэр С.и др. Рандомизированное двойное слепое исследование фазы III с использованием пероральных добавок β-каротина для женщин с интраэпителиальной неоплазией шейки матки высокой степени.Эпидемиологические биомаркеры рака. Пред. 2001; 10: 1029–35.
- ↵
Moscicki AB, Hills N, Shiboski S и др. Риски инфицирования вирусом папилломы человека и развития плоских интраэпителиальных поражений низкой степени у молодых женщин. JAMA 2001; 285: 2995–3002.
-
Kjaer S. Типичная персистенция вируса папилломы человека высокого риска (ВПЧ) как индикатор плоскоклеточных интраэпителиальных поражений шейки матки высокой степени у молодых женщин: проспективное исследование на популяционной основе.BMJ 14 сентября 2002 г., 325: 572–8.
- ↵
Dalstein V, Riethmuller D, Pretet JL, et al. Устойчивость и наличие ВПЧ высокого риска являются прогностическими факторами развития поражений шейки матки высокой степени: продольное французское когортное исследование. Int J Cancer, 1 сентября 2003 г .; 106: 396–403.
- ↵
Эномото Т., Хаба Т., Фуджита М. и др. Клональный анализ плоских внутриэпителиальных поражений шейки матки высокой степени.Int J Cancer 1997; 73: 339–44.
- ↵
Park TW, Richart RM, Sun XW, Wright TC Jr. Связь между типом вируса папилломы человека и клональным статусом плоскоклеточных интраэпителиальных поражений шейки матки. J Natl Cancer Inst 1996; 88: 355–8.
- ↵
Herrero R, Hildesheim A, Bratti C, et al. Популяционное исследование папилломавирусной инфекции и неоплазии шейки матки в сельских районах Коста-Рики. J Natl Cancer Inst, 15 марта 2000 г .; 92: 464–74.
-
Якобс М.В., Уолбумерс Дж. М., Снайдерс П. Дж. И др. Распределение 37 мукозотропных типов ВПЧ у женщин с цитологически нормальными мазками из шейки матки: возрастные закономерности для типов высокого и низкого риска. Int J Cancer 15 июля 2000 г .; 87: 221–7.
-
Molano M, Posso H, Weiderpass E и др. Распространенность и детерминанты инфекции ВПЧ среди колумбийских женщин с нормальной цитологией. Br J Cancer 29 июля 2002 г .; 87: 324–33.
- ↵
Шерман М.Э., Ван С.С., Уиллер С.М. и др. Детерминанты вирусной нагрузки папилломы человека среди женщин с гистологической цервикальной интраэпителиальной неоплазией 3: доминирующее влияние окружающих поражений низкой степени злокачественности. Эпидемиологические биомаркеры рака до октября 2003 г .; 12: 1038–44.
- ↵
Alric LFM, Izopet J, Vinel J, et al. Гены класса II главного комплекса гистосовместимости влияют на исход инфекции вирусом гепатита С.Гастроэнтерология 1997; 113: 1675–81.
- ↵
Thio CL, Thomas DL, Karacki P, et al. Комплексный анализ HLA-антигенов I и II классов и хронической вирусной инфекции гепатита B. J Virol, ноябрь 2003 г.; 77: 12083–7.
- ↵
Trachtenberg E, Korber B, Sollars C, et al. Преимущество редкого супертипа HLA в прогрессировании ВИЧ-инфекции. Нат Мед, июль 2003 г .; 9: 928–35.
- ↵
Сарантопулос С., Лу Л., Кантор Х.Ограничение Qa-1 супрессорных Т-клеток CD8 +. Дж. Клин Инвест, ноябрь 2004 г .; 114: 1218–21.
-
Кумар В. Гомеостатический контроль иммунитета с помощью TCR-пептид-специфичных Treg. Дж. Клин Инвест, ноябрь 2004 г .; 114: 1222–6.
- ↵
Цзян Х., Чесс Л. Интегрированный вид субпопуляций супрессорных Т-клеток в иммунорегуляции. Дж. Клин Инвест, ноябрь 2004 г .; 114: 1198–208.
- ↵
Khakoo SI, Thio CL, Martin MP и др.Гены рецепторов, ингибирующих HLA и NK-клетки, при лечении вирусной инфекции гепатита С. Science 6 августа 2004 г .; 305: 872–4.
- ↵
Brabin L. Взаимодействие женской гормональной среды, предрасположенность к вирусным инфекциям и прогрессирование заболевания. Уход за больными СПИДом ЗППП 2002; 16: 211–21.
- ↵
Франклин РД, Куттех WH. Характеристика иммуноглобулинов и цитокинов в цервикальной слизи человека: влияние экзогенных и эндогенных гормонов.J Reprod Immunol 1999; 42: 93–106.
- ↵
Илитало Н., Соренсен П., Йозефссон А. и др. Курение и оральные контрацептивы как факторы риска рака шейки матки in situ . Int J Cancer 1999; 81: 357–65.
-
Winkelstein W Jr Курение и рак шейки матки — текущее состояние: обзор. Am J Epidemiol 1990; 131: 945–57; обсуждение 958–60.
-
Szarewski A, Jarvis MJ, Sasieni P, et al.Влияние отказа от курения на размер поражения шейки матки. Ланцет 1996; 347: 941–3.
-
Szarewski A, Maddox P, Royston P, et al. Влияние отказа от курения на клетки Лангерганса и лимфоциты шейки матки. BJOG 2001; 108: 295–303.
-
Морено В., Бош FX, Муньос Н. и др. Влияние оральных контрацептивов на риск рака шейки матки у женщин с папилломавирусной инфекцией: многоцентровое исследование IARC «случай-контроль».Ланцет 2002; 359: 1085–92.
-
Gram IT, Остин Х., Стальсберг Х. Курение сигарет и частота цервикальной интраэпителиальной неоплазии III степени и рака шейки матки. Am J Epidemiol 1992; 135: 341–6.
- ↵
Ho GY, Kadish AS, Burk RD и др. ВПЧ 16 и курение сигарет как факторы риска интраэпителиальной неоплазии шейки матки высокой степени. Int J Cancer 1998; 78: 281–5.
- ↵
Eppel W, Worda C, Frigo P, Manavi M, Czerwenka K.Влияние котинина на экспрессию интерлейкина 6 у курильщиков с пренеоплазией шейки матки. Acta Obstet Gynecol Scand 2000; 79: 1105–11.
-
McCann MF, Irwin DE, Walton LA, Hulka BS, Morton JL, Axelrad CM. Никотин и котинин в слизи шейки матки курильщиков, пассивных курильщиков и некурящих. Эпидемиологические биомаркеры рака до 1992 г .; 1: 125–9.
-
Poppe WA, Peeters R, Daenens P, Ide PS, Van Assche FA.Табакокурение и шейка матки: котинин в крови, моче и цервикальной жидкости. Gynecol Obstet Invest 1995; 39: 110–4.
- ↵
Prokopczyk B, Cox JE, Hoffmann D, Wagoner SE. Выявление специфических для табака канцерогенов в слизи шейки матки курильщиков и некурящих. J Natl Cancer Inst 1997; 89: 868–73.
- ↵
Bell MC, Crowley-Nowick P, Bradlow HL, et al. Плацебо-контролируемое испытание индол-3-карбинола в лечении CIN.Гинеколь Онкол 2000; 78: 123–9.
- ↵
Фоллен М., Шоттенфельд Д. Биомаркеры суррогатных конечных точек и их модуляция в исследованиях химиопрофилактики шейки матки. Рак 2001; 91: 1758–76.
Эпителиальная дисплазия — обзор
Патологические признаки
Эндоскопически GED может казаться в целом нормальным или показывать нарушения слизистой оболочки, такие как бляшки, узелки, полипы, эрозии, язвы, 390 и рубцы на слизистой оболочке 381 с диффузными воспалительными изменениями или без них. 389 , 423 Полиповидные диспластические поражения часто ошибочно принимают за спорадическую аденому желудка, но наличие хронического гастрита с IM в фоновой слизистой оболочке является ключом к истинной природе новообразования.
GED характеризуется сочетанием цитологической и архитектурной атипии. Различают два общих гистологических подтипа. Аденоматозная (или кишечная) дисплазия , названная так из-за сходства с аденомами толстой кишки, является более частым типом.Микроскопически аденоматозная дисплазия характеризуется наличием переполненных канальцевых желез, выстланных атипичными столбчатыми клетками с перекрывающимися мелкоядерными, гиперхроматическими ядрами, псевдостратификацией и незаметными ядрышками. 425 Второй, менее распространенный гистологический вариант, названный некоторыми авторитетными специалистами фовеолярной (желудочного типа) дисплазией (или типом II), развивается в неметапластическом эпителии желудка. 425 Микроскопически фовеолярная дисплазия состоит из эпителия фовеолярного типа с цитологической и архитектурной атипией.Фовеолы различаются по размеру и форме, иногда со складками сосочков и зазубринами в просвете. Диспластические клетки обычно имеют кубовидную или низкоколончатую форму, содержат прозрачную или эозинофильную цитоплазму и показывают округлые или овальные везикулярные ядра с ядрышками. Другие общие цитологические признаки, которые более выражены при аденоматозном GED, включают истощение муцина, скученность, потерю полярности, усиление митозов, ядерный плеоморфизм и отсутствие поверхностного созревания. Между двумя разными подтипами GED существуют генетические различия. 426–428
Аденоматозную и фовеолярную (желудочного типа) дисплазию также можно различить на основе их муцинового фенотипа. Например, аденоматозный тип в большинстве случаев экспрессирует MUC2 и CD10. Напротив, фовеолярный (желудочный) тип чаще всего экспрессирует MUC5AC, но не CD10. Однако случаются гибридные случаи. 426
В клинической практике чаще всего используется двухуровневая система оценок GED (низкая и высокая оценка) (Таблица 12-9). 389 393 425 429–432 Этот метод классификации GED оказался более воспроизводимым, чем трехуровневая система, состоящая из легкой, средней и тяжелой степени. 371 Он также предоставляет клинически значимый метод стратификации риска, который используется для принятия решений о лечении. 433
Низкосортный GED характеризуется эпителием, который либо не имеет, либо демонстрирует минимальные архитектурные искажения (рис. 12-60). Клетки демонстрируют атипию от легкой до умеренной, они плотно упакованы и имеют ядра, которые обычно ограничены базальной половиной цитоплазмы клетки. 371,433–435 Дисплазия высокой степени характеризуется эпителием с цитологическими и архитектурными изменениями, такими как скученность, ветвление и почкование (рис.12-61). Внутрипросветный некротический мусор обычно присутствует при дисплазии высокой степени (см. Рис. 12-61). 436 Клетки при дисплазии высокой степени обычно имеют кубовидную форму, а не столбчатую, и имеют высокое соотношение ядра к цитоплазме. Часто встречаются крупные и неправильные ядра со слипшимся хроматином и выступающими ядрышками. Митозы более многочисленны, а атипичные митозы более заметны по сравнению с дисплазией низкой степени. 371 , 433 , 435 Диспластические ядра часто распространяются в просвет клеточной цитоплазмы, и ядерная полярность обычно хотя бы частично, если не полностью, теряется.
Несмотря на попытки Всемирной организации здравоохранения заменить термин GED на желудочная интраэпителиальная неоплазия (низкой или высокой степени), термин дисплазия остается прочно закрепленным в клинической практике и в опубликованной литературе. 437
Существуют известные расхождения в интерпретации дисплазии между японскими и западными патологоанатомами. Например, неинвазивные внутрислизистые неопластические поражения с клеточной и архитектурной атипией высокой степени часто называются японскими патологами внутрислизистой карциномой , тогда как те же самые поражения обычно интерпретируются западными патологами как дисплазия высокой степени (рис.12-62). В ответ на различия в интерпретации была разработана схема консенсуса (т. Е. Венская классификация). 438 В Венской системе классификации, которая также основана на последствиях лечения, предраковые поражения высокой степени, но без инвазии собственной пластинки, и инвазивные аденокарциномы, ограниченные собственной пластинкой (внутрислизистые аденокарциномы), считаются единой неопластической категорией, потому что оба обычно поддаются эндоскопической резекции слизистой оболочки.
Пищевод Барретта (с дисплазией или без нее)
При биопсии пищевода с помощью эндоскопа взятые образцы были изучены под микроскопом врачом-специалистом, имеющим многолетнюю подготовку, по имени патолог . Патологоанатом отправляет вашему врачу отчет с диагнозом для каждого взятого образца. Информация в этом отчете будет использоваться для управления вашим лечением. Приведенные ниже вопросы и ответы помогут вам понять медицинский язык, который вы можете найти в отчете о патологии по результатам биопсии.
Что означает GEJ?
Пищевод — трубчатый орган, соединяющий ротовую полость с желудком. Место, где пищевод встречается с желудком, называется желудочно-пищеводным соединением , или GEJ .
Что означает, если в моем отчете упоминаются термины Барретта, бокаловидные клетки или кишечная метаплазия?
Внутренняя оболочка пищевода известна как слизистая оболочка . Его называют плоскоклеточной слизистой оболочкой , когда верхний слой состоит из плоских клеток.Плоские клетки — это плоские клетки, которые при рассмотрении под микроскопом выглядят как рыбья чешуя. Большая часть пищевода выстлана плоской слизистой оболочкой.
Бокаловидные клетки обычно выстилают кишечник, а не пищевод. Когда бокаловидные клетки обнаруживаются в месте, где они не должны находиться, например в слизистой оболочке пищевода, это называется кишечной метаплазией . Кишечная метаплазия может развиться в любом месте, где обычно находится плоская слизистая оболочка. Когда кишечная метаплазия замещает плоскоклеточную слизистую пищевода, она называется пищеводом Барретта .
Что вызывает пищевод Барретта?
Пищевод Барретта возникает, когда хронический или длительный рефлюкс (регургитация) содержимого желудка в пищевод повреждает нормальную внутреннюю оболочку пищевода. Этот процесс обычно занимает много лет. (Заброс содержимого желудка в пищевод иногда называют гастроэзофагеальной рефлюксной болезнью или ГЭРБ . Это может вызвать изжогу.)
Связан ли пищевод Барретта с повышенным риском рака?
Да.Пациенты с пищеводом Барретта имеют более высокий риск рака пищевода. Однако большинство людей с пищеводом Барретта не болеют раком.
Что, если в моем отчете упоминается пищевод Барретта и дисплазия?
Иногда клетки пищевода Барретта становятся более аномальными. Это называется дисплазией . Дисплазия — это предраковое состояние. Хотя клетки ненормальны, они не могут распространяться на другие участки. Это состояние поддается лечению. Дисплазию часто делят на 2 степени в зависимости от того, насколько аномальные клетки выглядят под микроскопом: низкую и высокую.(Это обсуждается более подробно позже.)
Что делать, если в моем отчете будет отрицательный результат на дисплазию?
Это означает, что в ваших биоптатах нет предраковых (предраковых) изменений.
Если в моем отчете говорится, что есть неопределенные для дисплазии изменения в пищеводе Барретта, что это означает?
Это означает, что ваша биопсия показала пищевод Барретта, который содержит некоторые аномальные клетки, но недостаточно аномальные, чтобы считать их дисплазией. Часто у людей с такими изменениями наблюдается сильный рефлюкс, который раздражает клетки пищевода, так что под микроскопом они выглядят ненормально.
Если в моем отчете говорится, что в пищеводе Барретта есть неопределенные изменения в отношении дисплазии, заболею ли я раком?
Люди с пищеводом Барретта с неопределенными для дисплазии изменениями имеют небольшое повышение риска рака пищевода, но у большинства из них этот рак не развивается.
Какое наблюдение необходимо при неопределенных изменениях в отношении дисплазии?
Если у вас есть эти результаты, ваш врач может попросить вас вернуться для повторной эндоскопии и дополнительных биопсий в течение 3–6 месяцев после увеличения приема лекарств для лечения рефлюкса.Однако графики наблюдения могут быть разными, поэтому вам следует обсудить с врачом, что лучше для вас.
Если в моем отчете говорится, что в пищеводе Барретта имеется дисплазия легкой степени, что это означает?
Дисплазия низкой степени означает, что некоторые клетки выглядят ненормально, если смотреть под микроскопом. Эти клетки могут в чем-то очень похожи на раковые, но, в отличие от рака, они не способны распространяться по всему телу. Это очень ранняя форма предрака пищевода.
Если в моем отчете будет указано, что в пищеводе Барретта имеется дисплазия низкой степени, заболею ли я раком?
Люди с дисплазией пищевода Барретта низкой степени имеют повышенный риск рака пищевода, но у большинства из них этот рак не развивается.
Какое наблюдение необходимо при дисплазии легкой степени в пищеводе Барретта?
Ваш врач может захотеть сделать еще одну эндоскопию, чтобы получить больше биопсий пищевода, чтобы убедиться, что у вас нет чего-то худшего.Кроме того, ваш врач может попросить отправить ваши образцы эксперту для изучения их под микроскопом
.Ваш врач, вероятно, порекомендует какое-либо лечение для удаления аномальной области (обычно для удаления как области пищевода Барретта, так и дисплазии). Вам следует обсудить варианты лечения со своим врачом.
Если в моем отчете говорится, что в пищеводе Барретта имеется дисплазия высокой степени, что это означает?
Дисплазия высокой степени означает, что некоторые клетки, содержащиеся в области пищевода Барретта, выглядят очень ненормально под микроскопом.Это более поздняя стадия предрака пищевода, чем дисплазия низкой степени.
Если в моем отчете будет указано, что в пищеводе Барретта имеется дисплазия высокой степени, заболею ли я раком?
Люди с дисплазией пищевода Барретта высокой степени имеют высокий риск заболеть раком пищевода.
Какое наблюдение необходимо при дисплазии пищевода Барретта высокой степени?
Ваш врач может захотеть повторить эндоскопию, чтобы сделать больше биопсий, чтобы убедиться, что у вас еще нет рака, который не был обнаружен в первый раз.Ваш врач может попросить отправить ваши слайды биопсии другому патологу для получения второго мнения относительно клеток на ваших слайдах.
Поскольку дисплазия высокой степени напрямую связана с раком, ваш врач порекомендует какое-либо лечение дисплазии. Разных пациентов можно лечить по-разному, поэтому обсудите варианты лечения со своим врачом. Большинство процедур можно проводить, не удаляя пищевод.
Что означает, если в моем отчете указано, что у меня также есть воспаление?
Раздражение пищевода и воспаление может вызывать ряд различных факторов, включая кислотность желудочного сока, травмы от приема лекарств и инфекции.Ваш врач будет работать с вами, чтобы найти причину раздражения и лечить ее. Это может помочь предотвратить более серьезные проблемы.
Отрицательный показатель LEEP у пациентов с дисплазией высокой степени
«Мой LEEP был отрицательным, но у моего пациента была дисплазия высокой степени. Я пропустил это? » Распространенный вопрос среди медиков. Даже самое консервативное иссечение в офисе непросто — и мысль о том, что процедура может быть выполнена без необходимости или, возможно, оставить остаточную дисплазию без лечения, расстраивает и огорчает.С другой стороны, подтверждение первоначального диагноза посредством идентификации ранее диагностированных HSIL / CIN 2/3 в шейном LEEP обеспечивает уверенное ощущение закрытия как для врача, так и для пациента.
Согласно литературным данным, отрицательный LEEP после биопсии с диагнозом HSIL (CIN 2+) встречается в 14-17% случаев 1 . Если предположить, что зона трансформации иссечена надлежащим образом, это может быть вызвано двумя причинами:
- Полное удаление новообразования путем биопсии
- Разрушение или регресс дисплазии вследствие постбиопсийного воспаления
Данные об отрицательном LEEP и дисплазии высокой степени
В недавней статье 2 была предпринята попытка подтвердить реальную частоту отрицательного LEEP и изучить клиническое значение.Было отобрано 378 пациентов, перенесших процедуру LEEP, 306 из которых имели подтвержденный биопсией диагноз CIN 2+. Всего было выявлено:
- 76% пациентов имели остаточный HSIL / CIN 2+ по шкале LEEP
- 24% пациентов показали CIN 1 или отрицательные результаты в образце LEEP
Повторяемость HSIL / CIN 2+ после LEEP была следующей:
- 13% пациентов с HSIL / CIN 2+ в LEEP имели рецидив заболевания
- 10% пациентов без HSIL / CIN 2+ в LEEP имели рецидив заболевания
Другие исследования 3 показывают аналогичную картину рецидивов, но с более высокой частотой рецидивов:
- 27% рецидивов у пациентов с остаточным HSIL / CIN 2+ по шкале LEEP
- Рецидив 24% в группе пациентов без остаточного HSIL / CIN 2+ в LEEP.
(Важно отметить, что нет статистической разницы между этими парами частоты рецидивов.)
Короче говоря, основываясь на этих результатах, пациенты с остаточными HSIL / CIN 2+ и отрицательными (без остаточных) LEEP должны наблюдаться аналогичным образом. Приблизительно 10-25% LEEP, выполняемых для диагностики HSIL / CIN 2+, покажут рецидив поражения высокой степени во время последующего наблюдения, независимо от наличия дисплазии в образце иссечения (при условии адекватного иссечения зоны трансформации. ).Может быть рассмотрено последующее цитологическое исследование шейки матки через шесть месяцев после процедуры (позволяющее ослабить воспаление) с одновременным тестированием на ВПЧ. В этом плане тестирования пациент может дать более обнадеживающее подтверждение своего диагноза с течением времени, и соответствующий план лечения может быть лучше применен.
В PathAdvantage мы относимся к вашим пациентам как к нашим пациентам. Узнайте больше о различиях PathAdvantage.
Библиография
- Отрицательная биопсия конуса: переоценка. Diakomanolis E, Haidopoulos D, Chatzipapas I., Rodolakis A, Stefanidis K, Markaki S. 2003, J Reprod Med, стр. 617-621.
- Результат электрохирургической конической биопсии с отрицательной петлей после диагноза плоскоклеточного интраэпителиального поражения высокой степени злокачественности; Частота и клиническое значение. . Witt BL, Factor RE, Jarboe EA, Layfield LJ. 2012, Arch Pathol Lab Med, стр. 1259-1261.
- Клиническое значение электрохирургической конической биопсии с отрицательной петлей при дисплазии высокой степени. Livasy CA, Moore DT, Van Le L. 2004, Obstet Gynecol, стр. 250-254.
Адъювантная вакцинация против ВПЧ снижает риск рецидива дисплазии шейки матки высокой степени
13 апреля 2020
Читать 3 мин.
Источник / Раскрытие информацииОпубликовано:
Источник: Лихтер К. и др.Abstract 120. Представлено: Ежегодное собрание Общества гинекологических онкологов; 28-31 марта 2020 г. (виртуальная встреча).
Раскрытие информации: Левинсон не сообщает о раскрытии соответствующей финансовой информации. Пожалуйста, смотрите аннотацию для раскрытия финансовой информации всех других авторов.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписывайся Нам не удалось обработать ваш запрос. Пожалуйста, попробуйте позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
Кимберли Л. Левинсон
Согласно результатам системного обзора и метаанализа, представленных в виртуальном ежегодном обществе гинекологических онкологов, женщины, получившие вакцину против ВПЧ после хирургического иссечения по поводу дисплазии шейки матки высокой степени, имели более низкий риск рецидива, чем женщины, получившие только плацебо или хирургическое вмешательство. Встреча.
«Наши результаты важны, потому что они предполагают, что существует значительная связь с вакцинацией против ВПЧ во время хирургической резекции дисплазии и снижение риска рецидива», Kimberly L. L e vinson , MD , , директор отделения гинекологической онкологии Медицинской школы Университета Джона Хопкинса, сообщил Healio. «Рецидивирующая дисплазия шейки матки вызывает беспокойство по нескольким причинам. Одна из проблем связана с прогрессированием инвазивного рака.[Вакцинация против ВПЧ] также может иметь значительную клиническую пользу, поскольку женщинам с рецидивирующим заболеванием требуется множество обследований и процедур, многие из которых можно предотвратить или уменьшить, снизив риск рецидива ».
Левинсон и его коллеги объединили данные шести исследований, опубликованных в период с 1990 по 2019 год, которые включали 2984 женщины с цервикальной интраэпителиальной неоплазией 1 степени или выше, CIN степени 2 или выше или CIN, связанной с ВПЧ 16/18.
Исследователи сравнили частоту рецидивов у 1360 женщин, получивших вакцинацию против ВПЧ после хирургического удаления от рецидивирующей дисплазии шейки матки, с таковой у 1624 женщин, получивших только плацебо или хирургическое вмешательство.Срок наблюдения составил от 6 до 48 месяцев.
Женщины, получившие вакцину против ВПЧ после хирургического удаления по поводу дисплазии шейки матки высокой степени, имели более низкий риск рецидива, чем женщины, получившие только плацебо или только хирургическое вмешательство
В целом, 3,3% (n = 99) женщин испытали рецидив CIN степени 2 или выше. Однако риск оказался ниже среди женщин, получивших адъювантную вакцинацию против ВПЧ (1,7% против 4,7%; ОР = 0,34; 95% ДИ 0,22–0,55). Исследователи также наблюдали более низкий риск рецидива среди вакцинированных женщин с CIN степени 1 или выше (6.3% против 9,7%; RR = 0,67; 95% ДИ 0,52-0,85).
Среди четырех исследований, в которых оценивали рецидив поражений, специфичных для штаммов ВПЧ 16/18, девять (0,9%) вакцинированных женщин и 26 (2%) невакцинированных женщин испытали рецидивы ЦИН, ассоциированных с ВПЧ 16/18 2 степени.
Более того, у 49 женщин развился рецидив CIN, ассоциированный с ВПЧ 16/18, степени 1, в том числе 11 (1,1%), которым была проведена адъювантная вакцинация, и 38 (3,1%), не получивших вакцинацию.
Исследователи наблюдали статистически значимое общее снижение риска рецидивирующих поражений 2 степени CIN, связанных с ВПЧ 16/18 (RR = 0.41; 95% ДИ, 0,2-0,85) и поражения 1 степени по CIN (ОР = 0,35; 95% ДИ, 0,18-0,67).
«В настоящее время проводятся два крупных рандомизированных контролируемых испытания, которые должны помочь лучше понять преимущества адъювантной вакцины против ВПЧ в этих условиях», — сказал Левинсон Healio. «Наша группа сильно заинтересована в профилактике и лечении рака шейки матки, и мы продолжим проводить обширные исследования в этой области». — по Дженнифер Саутхолл
Артикул:
Lichter K, et al.Abstract 120. Представлено: Ежегодное собрание Общества гинекологических онкологов; 28-31 марта 2020 г. (виртуальная встреча).
Раскрытие информации s : Левинсон не сообщает о раскрытии соответствующей финансовой информации. Пожалуйста, смотрите аннотацию для раскрытия финансовой информации всех других авторов.
Перспектива
Вернуться к началуАмелия Джерниган, Мэриленд
Дисплазия шейки матки высокой степени является прединвазивным заболеванием шейки матки.К сожалению, когда у женщин наблюдается рецидив дисплазии шейки матки, им часто приходится рассматривать повторные процедуры на шейке матки. Кольпоскопия, биопсия и повторные цервикальные тесты связаны с финансовыми затратами, физическим дискомфортом, стрессом и эмоциональными страданиями. Диагностические эксцизионные процедуры часто являются диагностическими и терапевтическими, но сопряжены с риском потенциальных будущих беременностей и часто становятся технически сложными по мере их повторения. Эффективная адъювантная терапия минимизирует риски и затраты на диагностические и терапевтические процедуры, необходимые для обследования и лечения женщин с этими рецидивами.
Вакцина против ВПЧ широко задокументирована как безопасная и эффективная стратегия предотвращения дисплазии шейки матки и рака шейки матки, а также других видов рака. Он настоятельно рекомендуется женщинам и мужчинам в возрасте от 9 до 26 лет и одобрен FDA для лиц в возрасте до 45 лет.
Лихтер и его коллеги собрали и проанализировали шесть исследований, в которых сравнивали только хирургическое удаление или после адъювантной вакцинации против ВПЧ. У женщин, получивших адъювантную вакцинацию против ВПЧ, вероятность рецидива была значительно ниже, чем у невакцинированных.Аналогичное снижение риска рецидива наблюдалось при рассмотрении рецидивирующей дисплазии низкой степени (CIN1 + или хуже) и при рассмотрении только дисплазии шейки матки, связанной с ВПЧ 16 и 18.
Эти данные свидетельствуют о терапевтическом эффекте адъювантной вакцинации против ВПЧ после эксцизионных процедур для лечения дисплазии шейки матки высокой степени. Несмотря на то, что существует руководство по вакцинации против ВПЧ в целевых группах — даже если известно, что у них в анамнезе была инфекция ВПЧ или заболевания, связанные с ВПЧ, — эти данные опровергают любые сомнения, которые у кого-либо могли возникнуть в отношении вакцинации женщин, которые уже подвергались воздействию ВПЧ.В отличие от других болезней, таких как ветряная оспа, при которой вакцинация не требуется, если вы подверглись заражению и избавились от инфекции, вакцинация против ВПЧ может помочь организму избавиться от инфекции, с которой ему трудно избавиться самостоятельно.
Амелия Джерниган, Мэриленд
Центр медицинских наук ЛГУ
Раскрытие информации: Джерниган не сообщает о раскрытии соответствующей финансовой информации.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.
