Синдром Паркса-Вебера-Рубашова Лечение Киев
Врожденные ангиодисплазии (синдром Паркса-Вебера-Рубашова) — наиболее частый порок развития периферических сосудов. Характеризуются наличием патологических соустий (фистул) между артериями и венами.
Артериовенозные соустья часто бывают множественными, имеют разнообразный калибр и форму. В зависимости от диаметра различают макрофистулы, заметные невооруженным глазом, и микрофистулы, которые выявляются только при микроскопическом исследовании тканей конечности.
Патологические соустья чаще располагаются в зоне бедренной, ветвей подколенной артерии, а также по ходу большеберцовых артерий. Интенсивный сброс артериальной крови через артерио-венозные свищи ведет к повышению давления крови в венах.
Из-за повышенной функциональной нагрузки изменяется гистологическая структура венозной стенки. Происходит утолщение ее мышечной оболочки и формирование внутренней эластической мембраны («артериализация» вены).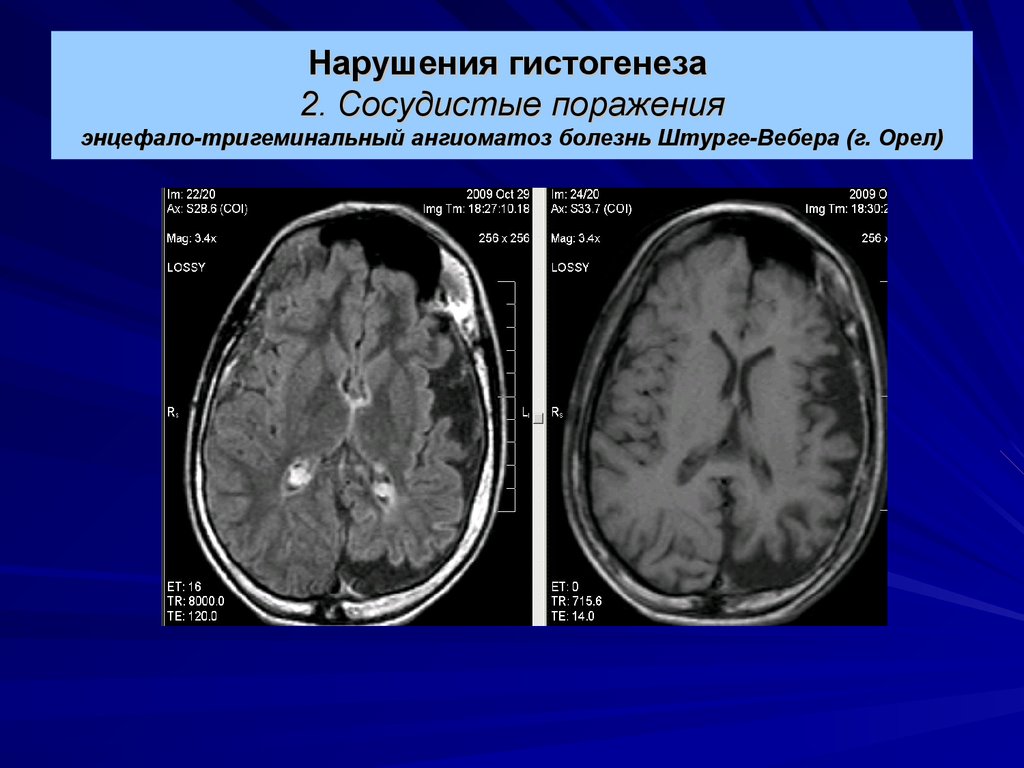
Значительная часть артериальной крови при наличии свищей поступает в венозное русло, минуя капиллярную сеть, поэтому возникает тяжелое кислородное голодание в тканях и нарушаются обменные процессы. Из-за венозной гипертензии усиливается нагрузка на сердце, что постепенно приводит к расширению его границ и сердечной декомпенсации.
Клиника и диагностика: клиническая симптоматика обусловлена нарушениями регионарного кровообращения и центральной гемодинамики.
Конечность удлинена на 3-8 см, мягкие ткани ее гипертрофированы. Удлинение конечности обусловлено продуктивной перестройкой костной ткани из-за усиленной васкуляризации эпифизарных линий.
Характерно наличие варикозно расширенных поверхностных вен на нижней или верхней конечности. Их появление связано с высокой венозной гипертензией вследствие заброса крови из артерии. Стенки вен плотноэластической консистенции, с трудом сжимаемые. Расширенные вены не исчезают после придания конечности возвышенного положения.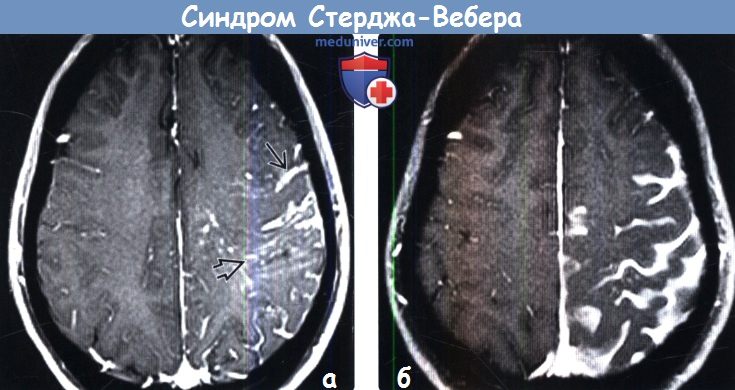
Рука, приложенная к месту проекции артериовенозного соустья, ощущает вибрацию (симптом «кошачьего мурлыкания»). При аускультации в этой области выслушивают непрерывный систоло-диастолический шум, усиливающийся в момент систолы.
Наиболее ранний и постоянный симптом заболевания — повышение температуры кожи конечности, особенно значительное над местом расположения артериовенозных соустий. Разница в температуре симметричных участков непораженной и пораженной конечности достигает 4-8°.
Нарушения микроциркуляции, связанные с регионарными гемодинамическими расстройствами, в ряде случаев приводят к образованию язв и некрозов дистальных отделов конечностей. Из язв часто возникают повторные обильные кровотечения, приводящие к тяжелой анемии. Нередко бывает гипертрихоз и гипергидроз.
Ряд клинических симптомов связан с изменениями центральной гемодинамики. При значительной венозной гипертензии увеличивается нагрузка на правые отделы сердца, следствием ее являются гипертрофия сердечной мышцы, увеличение ударного и минутного объема сердца Однако по мере прогрессирования заболевания сократительная функция сердца начинает ослабевать, происходит миогенная дилатация сердца с расширением его полостей Развивается сердечная недостаточность, проявляющаяся одышкой, сердцебиениями, отеками, застойной печенью, асцитом, анасаркой. Для врожденных артериовенозных свищей характерно урежение пульса, наступающее после пережатия приводящей артерии. Реографическая кривая, записанная с сегмента конечности, где расположены артериовенозные соустья, характеризуется высокой амплитудой, отсутствием дополнительных зубцов на катакроте, увеличением реографического индекса. В дистальных сегментах конечности амплитуда кривой, напротив, снижена. Артериализация венозной крови ведет к увеличению насыщения ее кислородом, содержание которого в расширенных венах увеличивается на 20-30%.
Для врожденных артериовенозных свищей характерно урежение пульса, наступающее после пережатия приводящей артерии. Реографическая кривая, записанная с сегмента конечности, где расположены артериовенозные соустья, характеризуется высокой амплитудой, отсутствием дополнительных зубцов на катакроте, увеличением реографического индекса. В дистальных сегментах конечности амплитуда кривой, напротив, снижена. Артериализация венозной крови ведет к увеличению насыщения ее кислородом, содержание которого в расширенных венах увеличивается на 20-30%.
Наиболее важным методом диагностики врожденных артериовенозных свищей является ангиография. Различают прямые и косвенные ангиографические признаки артериовенозных свищей Наличие на ангиограммах контрастированного соустья или сосудистой полости, сообщающейся с артерией и веной, относят к прямым признакам. Косвенно о наличии свища свидетельствуют одновременное контрастирование артерий и вен, расширение просвета приводящей артерии, обеднение сосудистого рисунка дистальнее расположения артериовенозного свища.
Лечение: хирургическое, заключается в перевязке патологических соустий между магистральными артериями и венами, либо эндоваскулярная эмболизация.
Однако в ряде случаев даже перевязка нескольких крупных соустий не гарантирует хороших результатов, так как в пораженной конечности остаются множественные микрофистулы, являющиеся причиной рецидивов. Тем больным, у которых изменения конечности настолько велики, что функция ее полностью утрачена и такая операция практически бесперспективна, производят ампутацию конечности.
СЛУЧАЙ СИНДРОМА ПАРКСА ВЕБЕРА-РУБАШОВА | Журнал Гродненского государственного медицинского университета
Pokrovskij AV, editor. Klinicheskaia angiologia. Moskva:Medicine; 2004. Vol. 1. 808 p. (Russian).
Dan VN, Sapelkin SV. Angiodisplasii (vrogdennie poroki razvitia sosydov). Moskva: Verdana; 2008. 200 p.(Russian).
Parkes WF. Angioma formation in connection with hypertrophy of limbs and hemihypertrophy. Brit. J. Derm. Syph. 1907;19:231-237.
Brit. J. Derm. Syph. 1907;19:231-237.
Sachin K, Rashmi S, Manish S, Siddhartha W, Uday L. Haemangiomas and venous malformations of the head and neck: A retrospective analysis of endovascular management in 358 patients. Indian J. Plast. Surg. 2013;46(1):109-116. doi: 10.4103/0970-0358.113727.
Ruggieri M, Pavone V, Polizzi A, Falsaperla R, Fichera M, Pavone P. Klippel-Trenaunay syndrome in a boy with concomitant ipsilateral overgrowth and undergrowth. Am. J. Med. Genet. Part A. 2014;164A(5):1262-1267. doi: 10.1002/ajmg.a.36414.
Chernuha LM, Kachirova EV, Todosev AV. Klassifikacionnye strategicheskie podhody v lechenii vrozhdennyh sosudistyh mal’formacij. Vzgljad sosudistogo hirurga [Classification strategic approaches in the treatment of congenital vascular malformations: A view of a vascular surgeon]. Novosti hirurgii. 2015;23(5):539-551. doi: 10.18484/2305-0047.2015.5.539. (Russian).
Belov S. Anatomopathological classification of congenital vascular defects. Semin. Vase. Surg. 1993;6(4):219-224.
Semin. Vase. Surg. 1993;6(4):219-224.
Ek ET, Suh N, Carlson MG. Vascular anomalies of the hand and wrist. J. Am. Acad. Orthop. Surg. 2014;22(6):352-360. doi: 10.5435/JAAOS-22-06-352.
Jabіecki J, Elsaftawy A, Kaczmarzyk J, Kaczmarzyk L. Surgical treatment of hemangiomas and arteriovenous malformations in upper extremity. Pol. Przegl. Chir. 2013;85(3):107-113. doi: 10.2478/pjs-2013-0019.
Popel GA. Diagnostica i chirurgicheskoe lechenie angiodisplasii narugnoi lokalisacii. Novosti hirurgii. 2014;22(5):601-610. (Russian).
Chernuha LM, Guch AA, Artemenko MO, Vlajkov GG, Gomoljako IV, Zadorozhnaja TD, Todosev EV. Sovremennye podhody v diagnostike i hirurgicheskom lechenii venoznyh form vrozhdennyh sosudistyh malformacij nizhnih konechnostej. Novosti hirurgii. 2011;19(4):48-54. (Russian).
Laroche JP, Becker F, Khau-Van-Kien A, Baudoin P, Brisot D, Buffler A, Coupé M, Jurus C, Mestre S, Miserey G, Soulier-Sotto V, Tissot A, Viard A, Vignes S, Quéré I. Quality standards for ultrasonographic assessment of peripheral vascular malformations and vascular tumors. Report of the French society for vascular medicine. J. Mal. Vasc. 2013;38(1):29-42. doi: 10.1016/j.jmv.2012.11.005.
Quality standards for ultrasonographic assessment of peripheral vascular malformations and vascular tumors. Report of the French society for vascular medicine. J. Mal. Vasc. 2013;38(1):29-42. doi: 10.1016/j.jmv.2012.11.005.
Loose D. Surgical management of venous malformations. Phlebology. 2007;22(6):276-282.
Candamourty R, Venkatachalam S, Babu MR, Reddy VK. Low flow vascular malformation of the buccal mucosa treated conservatively by sclerotherapy (3% sodium tetradecyl sulfate). J. Nat. Sci. Biol. Med. 2012;3(2):195-198.
doi: 10.4103/0976-9668.101921.
Случай синдрома Паркса вебера-рубашов Текст научной статьи по специальности «Клиническая медицина»
УДК 616.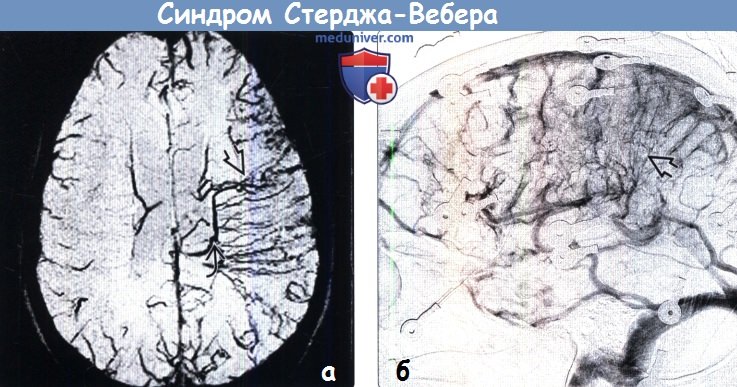
СЛУЧАЙ СИНДРОМА ПАРКСА ВЕБЕРА-РУБАШОВА
Иоскевич Н. Н. ([email protected]), 2Ждонец С. В. ([email protected]), 2Пакульневич Ю. Ф. ([email protected]), 2Корело С. И. ([email protected]) 1УО «Гродненский государственный медицинский университет», Гродно, Беларусь 2УЗ «Гродненская областная клиническая больница», Гродно, Беларусь
В статье представлен клинический случай врожденной артериовенозной дисплазии — синдрома Паркса Вебера-Рубашова правой нижней конечности. Описаны особенности его клинической картины и трудности диагностики. Подчеркивается, что синдром Паркса Вебера-Рубашова относится к редко встречаемым врожденным заболеваниям сосудистой системы, в ряде случаев с отсутствием типичных для него клинических проявлений и сочетающийся с другой патологией вен. Оптимальным методом диагностики данного синдрома является рентгеноконтрастная артериография.
Ключевые слова: синдром Паркса Вебера-Рубашова, венозные ангиодисплазии, артериовенозные фистулы, операция разобщения артериовенозных свищей.
Синдром Паркса Вебера относится к группе венозных ангиодисплазий — врожденных пороков развития периферической сосудистой системы, характеризующихся наличием капиллярных мальформаций и артериовенозных фистул.
Первые упоминания об артериовенозных фистулах встречаются в литературе XVIII в. и связаны с именем J. Hunter (1737 г.) [1]. В 1907 г. П. Вебер (P. F. Weber) опубликовал свои данные, объединив описанный ранее синдром Клиппель-Треноне и все заболевания со сходными признаками в одну группу. В 1918 г. автор установил у части таких пациентов наличие артериовенозных аневризм [2, 3, 4, 5].
 Сброс артериальной крови через артериовенозные свищи обуславливает повышение давления крови в венах, постепенно увеличивает нагрузку на сердце с его расшире-
Сброс артериальной крови через артериовенозные свищи обуславливает повышение давления крови в венах, постепенно увеличивает нагрузку на сердце с его расшире-
нием и декомпенсацией сердечной деятельности
[9].
Окончательно причины развития синдрома Паркса Вебера-Рубашова не установлены. Ряд авторов рассматривают его как результат мутаций в гене RASA1, который кодирует белок p120-RasGAP, участвующий в передаче химических сигналов из внеклеточного пространства к ядру клетки. Вместе с тем, каким именно образом эти изменения приводят к специфическим сосудистым аномалиям у лиц с синдромом Паркса Вебера-Рубашова, не установлено [1].
Клиническая симптоматика заболевания представлена удлинением нижней конечности и гипертрофией ее мягких тканей, наличием вари-козно-расширенных поверхностных вен на конечности, нередко пульсирующих. У пациентов отмечается повышение температуры кожи пораженной конечности. Над местом расположения артериовенозных соустий при аускультации выслушивается непрерывный систоло-диасто-лический шум [10, 11, 12]. Нарушения микроциркуляции, связанные с регионарными гемо-динамическими расстройствами, в большинстве случаев приводят к образованию кровоточащих язв и некрозов в дистальных отделах конечностей. Нередко отмечается гипертрихоз и гипергидроз на стопе и голени [1, 6, 13].
У пациентов отмечается повышение температуры кожи пораженной конечности. Над местом расположения артериовенозных соустий при аускультации выслушивается непрерывный систоло-диасто-лический шум [10, 11, 12]. Нарушения микроциркуляции, связанные с регионарными гемо-динамическими расстройствами, в большинстве случаев приводят к образованию кровоточащих язв и некрозов в дистальных отделах конечностей. Нередко отмечается гипертрихоз и гипергидроз на стопе и голени [1, 6, 13].
Лечение синдрома Паркса Вебера-Рубашова хирургическое и заключается в разобщении ар-териовенозных свищей или их эндоваскулярной эмболизации. Однако в ряде случаев даже перевязка нескольких крупных соустий не гарантирует хороших результатов, так как в пораженной конечности остаются множественные микрофистулы, являющиеся причиной рецидивов, что требует поиска новых способов их лечения [9, 11, 14, 15].
В рассматриваемом случае пациент Т. 2 см. Несмотря на проводимые регулярные перевязки с разными препаратами (хлор-гексидин, мазь солкосерил), этот дефект постепенно увеличивался в размерах. Через 2 месяца от момента травмы правой голени дополнительно образовалась язва на передней поверхности нижней трети голени. С диагнозом: 187.0. Пост-тромбофлебитический синдром, стадия декомпенсации венозной гемодинамики, трофические язвы правой голени, пациент лечился амбулатор-но и стационарно по месту жительства, где ему дважды с интервалом в 2 месяца выполнялась безуспешная аутодермопластика язв. Ввиду безуспешности проводимого лечения пациент был консультирован сосудистым хирургом, который рекомендовал выполнение УЗИ сосудов нижних конечностей. При его выполнении установлено наличие расширения ствола большой подкожной вены (БПВ) на голени, больше выраженное в ее средней трети. Глубокие вены прослеживались на всем протяжении с состоятельным клапанным аппаратом. Для дообследования и лечения пациент был госпитализирован в отделение гнойной хирургии УЗ «ГОКБ».
2 см. Несмотря на проводимые регулярные перевязки с разными препаратами (хлор-гексидин, мазь солкосерил), этот дефект постепенно увеличивался в размерах. Через 2 месяца от момента травмы правой голени дополнительно образовалась язва на передней поверхности нижней трети голени. С диагнозом: 187.0. Пост-тромбофлебитический синдром, стадия декомпенсации венозной гемодинамики, трофические язвы правой голени, пациент лечился амбулатор-но и стационарно по месту жительства, где ему дважды с интервалом в 2 месяца выполнялась безуспешная аутодермопластика язв. Ввиду безуспешности проводимого лечения пациент был консультирован сосудистым хирургом, который рекомендовал выполнение УЗИ сосудов нижних конечностей. При его выполнении установлено наличие расширения ствола большой подкожной вены (БПВ) на голени, больше выраженное в ее средней трети. Глубокие вены прослеживались на всем протяжении с состоятельным клапанным аппаратом. Для дообследования и лечения пациент был госпитализирован в отделение гнойной хирургии УЗ «ГОКБ». 3×0,5 см. Трофическая язва несколько меньших размеров (2x4x0,5 см) локализуется на передней поверхности нижней трети голени. Язвенные дефекты с участками некроза по краям, покрыты фибрином. Кожные покровы в окружности язв ма-церированы. Выставлен предварительный диагноз: 177.3 Мышечная и соединительнотканная дисплазия артерий: артериовенозные свищи правой голени (синдром Паркса Вебера-Рубашова), трофические язвы правой голени. Пациенту выполнено УЗИ органов брюшной полости. Печень — размеры не увеличены, контуры ровные, эхоструктура однородная, мелкозернистая, эхогенность паренхимы в норме, очаговых образований нет. Брюшной отдел аорты — на уровне бифуркации 17 мм. Желчный пузырь не увеличен, стенки не уплот-
3×0,5 см. Трофическая язва несколько меньших размеров (2x4x0,5 см) локализуется на передней поверхности нижней трети голени. Язвенные дефекты с участками некроза по краям, покрыты фибрином. Кожные покровы в окружности язв ма-церированы. Выставлен предварительный диагноз: 177.3 Мышечная и соединительнотканная дисплазия артерий: артериовенозные свищи правой голени (синдром Паркса Вебера-Рубашова), трофические язвы правой голени. Пациенту выполнено УЗИ органов брюшной полости. Печень — размеры не увеличены, контуры ровные, эхоструктура однородная, мелкозернистая, эхогенность паренхимы в норме, очаговых образований нет. Брюшной отдел аорты — на уровне бифуркации 17 мм. Желчный пузырь не увеличен, стенки не уплот-
нены. Внутрипеченочные протоки не расширены. Поджелудочная железа по форме и размерам сохранена, контуры ровные, эхоструктура однородная, эхогенность в норме. Вирсунгов проток не расширен. Произведена бедренная пункционная рентгеноконтрастная артериогра-фия справа. Установлено, что артерии правой нижней конечности без стенозирования. На голени определяется артериовенозный сброс в ее верхней и средней трети из задней большебер-цовой артерии (ЗББА) в БПВ. Глубокие вены голени не контрастируются. Учитывая жалобы, анамнез заболевания, результаты физикально-го осмотра, лабораторных и инструментальных методов обследования, выставлен клинический диагноз: 177.3. Мышечная и соединительнотканная дисплазия артерий: артериовенозные свищи правой голени (синдром Паркса Вебера-Рубашо-ва), трофические язвы правой голени. Пациент оперирован.
Установлено, что артерии правой нижней конечности без стенозирования. На голени определяется артериовенозный сброс в ее верхней и средней трети из задней большебер-цовой артерии (ЗББА) в БПВ. Глубокие вены голени не контрастируются. Учитывая жалобы, анамнез заболевания, результаты физикально-го осмотра, лабораторных и инструментальных методов обследования, выставлен клинический диагноз: 177.3. Мышечная и соединительнотканная дисплазия артерий: артериовенозные свищи правой голени (синдром Паркса Вебера-Рубашо-ва), трофические язвы правой голени. Пациент оперирован.
В ходе операции из типичного медиального доступа выделена ЗББА в средней и нижней трети правой голени. На этом уровне между берцовыми венами и ЗББА обнаружены, пересечены и перевязаны 4 артериовенозные фистулы диаметром до 2 мм и 6 артериовенозных фистул меньшего диаметра. Обнаружены также две фистулы в диаметре до 3 мм между ЗББА и БПВ в верхней и нижней трети голени. Все фистулы взяты на зажимы, пересечены и перевязаны (скелетиза-ция ЗББА на протяжении 20 см).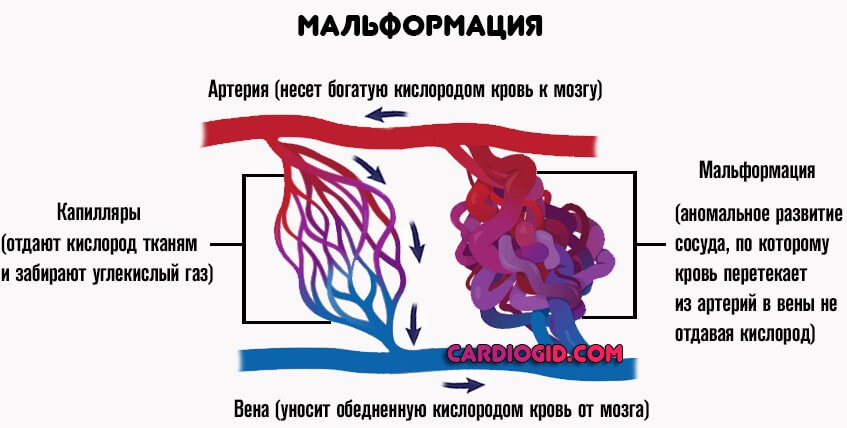 При дальнейшей ревизии в нижней трети голени в проекции медиально расположенной трофической язвы обнаружен крупный венозный перфорант диаметром 1.5 см между одной из задних больше-берцовых вен и БПВ, проходящей в области дна язвы. Произведена его субфасциальная перевяз-
При дальнейшей ревизии в нижней трети голени в проекции медиально расположенной трофической язвы обнаружен крупный венозный перфорант диаметром 1.5 см между одной из задних больше-берцовых вен и БПВ, проходящей в области дна язвы. Произведена его субфасциальная перевяз-
Рисунок. — Операция открытого разобщения артериовенозных фистул и венозного перфоранта: выделение задней большеберцо-вой артерии (1), артериовенозных свищей (2) и венозного перфоранта (3)
ка с удалением ствола БПВ на бедре и голени по Троянову-Тренделенбургу-Бэбкоку. Гемостаз. Послойный шов раны. Асептические повязки. Эластическое бинтование нижней конечности.
В послеоперационном периоде пациенту проводилось общепринятое консервативное лечение (антибиотикотерапия — гентамицин; ненаркотический анальгетик — кеторолаг; венотоник — венолекс; дезагрегант — аспикард — в терапевтических дозах; местное использование медицинского эластического трикотажа; перевязки; ФТЛ; ЛФК).
К моменту завершения раннего послеоперационного периода отмечено заживление трофической язвы, расположенной на передней поверхности нижней трети правой голени. Трофическая язва на медиальной поверхности правой голени уменьшилась более чем на 50%. Пациент выписан на амбулаторное лечение в удовлетворительном состоянии.
При контрольном осмотре через 3 и 6 месяцев установлено исчезновение чувства тяжести и распирания в правой голени после физиче-
ской нагрузки и полное заживление трофических язв. Пациент вернулся к активной трудовой деятельности.
Выводы
1. Синдром Паркса Вебера — Рубашова — редкое заболевание, протекающее в большинстве случаев с клинической симптоматикой, сходной с клинической картиной декомпенсированной хронической венозной недостаточности вследствие варикозной болезни и/или посттромбофле-битического синдрома, ведущим методом дифференциальной диагностики которых является бедренная рентгеноконтрастная ангиография.
2. Возможно сочетание врожденных артерио-венозных свищей с функционирующими перфо-рантами между глубокой и поверхностной венозными системами нижних конечностей.
3. Операцией выбора в данном клиническом случае синдрома Паркса Вебера-Рубашова с хорошими отдаленными результатами стало открытое разобщение артериовенозных соустий.
Литература
1. Клиническая ангиология : в 2 т. / под ред. А. В. Покровского. — Москва : Медицина, 2004. -Т. 1. — 808 с.
2. Дан, В. Н. Ангиодисплазии (врожденные пороки развития сосудов) / В. Н. Дан, C. B. Сапелкин. — Москва : Вердана, 2008. — 200 с.
3. Parkes, W. F. Angioma formation in connection with hypertrophy of limbs and hemihypertrophy / W.![]() F. Parkes // Brit. J. Derm. Syph. — 1907. — N 19. — P. 231-237.
F. Parkes // Brit. J. Derm. Syph. — 1907. — N 19. — P. 231-237.
4. Haemangiomas and venous malformations of the head and neck: A retrospective analysis of endovascular management in 358 patients / K. Sachin [et al.] // Indian J. Plast. Surg. — 2013. — Vol. 46, N 1. — P. 109-116. — doi: 10.4103/0970-0358.113727.
5. Klippel-Trenaunay syndrome in a boy with concomitant ipsilateral overgrowth and undergrowth / M. Ruggieri [et al.] // Am. J. Med. Genet. Part A. — 2014. — Vol. 164A, N 5. — P. 1262-1267. — doi: 10.1002/ajmg.a.36414.
6. Чернуха, Л. М. Классификационные стратегические подходы в лечении врожденных сосудистых мальфор-маций. Взгляд сосудистого хирурга / Л. М. Чернуха, Е. В. Каширова, А. В. Тодосьев // Новости хирургии. — 2015. — Т. 23, № 5. — С. 539-551. — doi: 10.18484/23050047.2015.5.539.
7. Belov, S. Anatomopathological classification of congenital vascular defects / S. Belov // Semin. Vase. Surg. — 1993. -Vol. 6, N 4. — P. 219-224.
Belov, S. Anatomopathological classification of congenital vascular defects / S. Belov // Semin. Vase. Surg. — 1993. -Vol. 6, N 4. — P. 219-224.
8. Ek, E. T. Vascular anomalies of the hand and wrist / E. T. Ek, N. Suh, M. G. Carlson // J. Am. Acad. Orthop. Surg. — 2014. — Vol. 22, N 6. — P. 352-360. — doi: 10.5435/ JAAOS-22-06-352.
9. Surgical treatment of hemangiomas and arteriovenous malformations in upper extermity / J. Jabiecki [et al.] // Pol. Przegl. Chir. — 2013. — Vol. 85, N 3. — P. 107-113. -doi: 10.2478/pjs-2013-0019.
10. Попель, Г. А. Диагностика и хирургическое лечение ангиодисплазий наружной локализации / Г. А. Попель // Новости хирургии. — 2014. — Т. 22, № 5. — С. 601-610.
11. Современные подходы в диагностике и хирургическом лечении венозных форм врожденных со-
судистых мальформаций нижних конечностей / Л. Endovasc Surg. — 2006. — Vol. 32, N 1. -P. 101-106. — doi: 10.1016/j.ejvs.2006.01.004.
Endovasc Surg. — 2006. — Vol. 32, N 1. -P. 101-106. — doi: 10.1016/j.ejvs.2006.01.004.
14. Loose, D. Surgical management of venous malformations / D. Loose // Phlebology. — 2007. — Vol. 22, N 6. -P. 276-282.
15. Low flow vascular malformation of the buccal mucosa treated conservatively by sclerotherapy (3% sodium tetradecyl sulfate) / R. Candamourty [et al.] // J. Nat. Sci. Biol. Med. — 2012. — Vol. 3, N 2. — P. 195-198. — doi: 10.4103/0976-9668.101921.
References
1. Pokrovskij AV, editor. Klinicheskaia angiologia. Moskva: Medicine; 2004. Vol. 1. 808 p. (Russian).
2. Dan VN, Sapelkin SV. Angiodisplasii (vrogdennie poroki razvitia sosydov). Moskva: Verdana; 2008. 200 p. (Russian).
3. Parkes WF. Angioma formation in connection with hypertrophy of limbs and hemihypertrophy. Brit. J. Derm. Syph. 1907;19:231-237.
Parkes WF. Angioma formation in connection with hypertrophy of limbs and hemihypertrophy. Brit. J. Derm. Syph. 1907;19:231-237.
4. Sachin K, Rashmi S, Manish S, Siddhartha W, Uday L. Haemangiomas and venous malformations of the head and neck: A retrospective analysis of endovascu-lar management in 358 patients. Indian J. Plast. Surg. 2013;46(1):109-116. doi: 10.4103/0970-0358.113727.
5. Ruggieri M, Pavone V, Polizzi A, Falsaperla R, Fichera M, Pavone P. Klippel-Trenaunay syndrome in a boy with concomitant ipsilateral overgrowth and undergrowth. Am. J. Med. Genet. Part A. 2014;164A(5):1262-1267. doi: 10.1002/ajmg.a.36414.
6. Chemuha LM, Kachirova EV, Todosev AV. Klassifikacionnye strategicheskie podhody v lechenii vrozhdennyh sosudistyh mal’formacij. Vzgljad sosudisto-go hirurga [Classification strategic approaches in the treatment of congenital vascular malformations: A view of a vascular surgeon]. Novosti hirurgii. 2015;23(5):539-551. doi: 10.18484/2305-0047.2015.5.539. (Russian).
Novosti hirurgii. 2015;23(5):539-551. doi: 10.18484/2305-0047.2015.5.539. (Russian).
7. Belov S. Anatomopathological classification of congenital vascular defects. Semin. Vase. Surg. 1993;6(4):219-224.
8. Ek ET, Suh N, Carlson MG. Vascular anomalies of the hand and wrist. J. Am. Acad. Orthop. Surg. 2014;22(6):352-360. doi: 10.5435/JAA0S-22-06-352.
9. Jabiecki J, Elsaftawy A, Kaczmarzyk J, Kaczmarzyk L. Surgical treatment of hemangiomas and arteriovenous malformations in upper extremity. Pol. Przegl. Chir. 2013;85(3):107-113. doi: 10.2478/pjs-2013-0019.
10. Popel GA. Diagnostica i chirurgicheskoe lechenie an-giodisplasii narugnoi lokalisacii. Novosti hirurgii. 2014;22(5):601-610. (Russian).
11. Chernuha LM, Guch AA, Artemenko MO, Vlajkov GG, Gomoljako IV, Zadorozhnaja TD, Todosev EV. Sovremennye podhody v diagnostike i hirurgicheskom le-
Sovremennye podhody v diagnostike i hirurgicheskom le-
chenii venoznyh form vrozhdennyh sosudistyh malforma-cij nizhnih konechnostej. Novosti hirurgii. 2011;19(4):48-54. (Russian).
12. Laroche JP, Becker F, Khau-Van-Kien A, Baudoin P, Brisot D, Buffler A, Coupé M, Jurus C, Mestre S, Miserey G, Soulier-Sotto V, Tissot A, Viard A, Vignes S, Quéré I. Quality standards for ultrasonographic assessment of peripheral vascular malformations and vascular tumors. Report of the French society for vascular medicine. J. Mal. Vasc. 2013;38(1):29-42. doi: 10.1016/j.jmv.2012.11.005.
13. Kim JY, Kim DI, Do YS, Lee BB, Kim YW, Shin SW, Byun HS, Roh HG, Choo IW, Hyon WS, Shim JS, Choi JY. Surgical treatment for congenital arteriovenous malformations: 10 years’ experience. Eur. J. Vase. Endovasc Surg. 2006;32(1):101-106. doi: 10.1016/j.ejvs.2006. 01.004.
01.004.
14. Loose D. Surgical management of venous malformations. Phlebology. 2007;22(6):276-282.
15. Candamourty R, Venkatachalam S, Babu MR, Reddy VK. Low flow vascular malformation of the buccal mucosa treated conservatively by sclerotherapy (3% sodium tetra-decyl sulfate). J. Nat. Sci. Biol. Med. 2012;3(2):195-198. doi: 10.4103/0976-9668.101921.
CLINICAL CASE OF PARKES-WEBER-RUBASHOV SYNDROME
loskevich N. N, 2Zhdonec S. V, 2Pakulnevich U. F, 2Korelo S. I.
1 Educational Institution «Grodno State Medical University», Grodno, Belarus 2Healthcare Institution «Grodno Regional Clinical Hospital», Grodno, Belarus
A clinical case of one variant of congenital venous angiodysplasia — Parkes Weber-Rubashov syndrome of the right lower extremity is presented in the article. The features of its clinical presentation and diagnosis difficulties are described. The analysis of the scientific data and own clinical observation showed that Parkes Weber-Rubashov syndrome belongs to the rare congenital disease of the vascular system, in some cases with the absence of typical clinical manifestations and combination with other disorders of the venous system. The best methodfor diagnosing the syndrome is radiopaque arteriography. The separation of the patent’s arteriovenous fistulas is justified as a radical method of its surgical treatment.
The features of its clinical presentation and diagnosis difficulties are described. The analysis of the scientific data and own clinical observation showed that Parkes Weber-Rubashov syndrome belongs to the rare congenital disease of the vascular system, in some cases with the absence of typical clinical manifestations and combination with other disorders of the venous system. The best methodfor diagnosing the syndrome is radiopaque arteriography. The separation of the patent’s arteriovenous fistulas is justified as a radical method of its surgical treatment.
Keywords: Parkes Weber-Rubashov syndrome, venous angiodysplasias, arteriovenous fistulas, operation of separation ofpatent’s arteriovenous fistulas.
Поступила: 07.03.2017 Отрецензирована: 07.06.2017
Синдром Паркса-Вебера-Рубашова — БГМУ
 ..
..
Выраженность указанных изменений зависит от количества и размеров артериовенозных свищей, места их локализации. Это накладывает свой отпечаток и на течение заболевания: медленное или быстрое прогрессирование. Каждой из симптомов врожденных артериовенозных свищей имеет свои проявления.
Расширение вен незначительно выражено в начальной стадии заболевания и при небольшом артериовенозном сбросе. Извитые вены легко сжимаются при пальпации, однако при прекращении давления образуются вновь. В ряде случаев отмечается их пульсация. При поднятии конечности интенсивность наполнения вен не изменяется. У некоторых больных со значительным артериовенозным сбросом наблюдается пульсация приводящей артерии.
Систолодиастолический шум хорошо приводится по сосудам и костям, но в отдалении от области свища он ослабевает. Точка максимальной интенсивности сосудистого шума и дрожания соответствует месту расположения патологического соустья, иногда наиболее расширенному участку приводящей артерии. У больных с артериовенозными свищами определяется и симптом Добровольской.
У больных с артериовенозными свищами определяется и симптом Добровольской.
Гипертрофия конечностей проявляется их удлинением и увеличением объема. Разница в длине пораженной и непораженной конечностей при синдроме Паркса-Вебера-Рубашова достигает 8-10 см. В основе гигантизма конечности лежат повышенная васкуляризация зон роста кости — эпифизарных линий, увеличение давления крови вокруг эпифизарного хряща и стимулирование периостальной оссификации. В течении синдрома удлинение конечности является наиболее ранним признаком заболевания, что проявляется вначале своеобразной подпрыгивающей походкой, затем хромотой и искривлением позвоночника.
Повышение кожной температуры над местом локализации артериовенозных свищей — наиболее ранний и постоянный признак синдрома Паркса-Вебера-Рубашова. Оно обусловлено поступлением артериальной крови в венозную систему и замедлением венозного оттока. В симметричных участках непораженной и пораженной конечностей разница в температуре составляет 3 — 8 °С и больше.
Трофические нарушения дистальных отделов конечности отличаются постоянным прогрессированием, устойчивостью к консервативному лечению. Трофические язвы нередко осложняются кровотечением, не останавливающимся при наложении давящей повязки. Пигментные пятна имеют разные размеры, могут быть одиночными и множественными.
Изменения в центральной гемодинамике при врожденных аневризмах аналогичны нарушениям сердечной деятельности у больных с травматическими артериовенозными свищами. В начальном периоде заболевания отмечается гипертрофия миокарда, увеличение ударного и минутного объема сердца. Затем развивается сердечная недостаточность с легочной гипертензией.
Прогноз при синдроме Паркса-Вебера-Рубашова неблагоприятный. При отсутствии квалифицированной хирургической помощи больные умирают от сердечной декомпенсации, гангрены конечностей и других осложнений заболевания.
Диагностика. Диагностика синдрома Паркса-Вебера-Рубашова не вызывает трудностей. В сложных ситуациях диагноз заболевания подтверждается определением насыщения кислородом венозной крови, изменением венозного давления в пораженной конечности, которая характеризуется периодами повышения и снижения, что соответствует фазам систолы и диастолы сердечных сокращений.
В сложных ситуациях диагноз заболевания подтверждается определением насыщения кислородом венозной крови, изменением венозного давления в пораженной конечности, которая характеризуется периодами повышения и снижения, что соответствует фазам систолы и диастолы сердечных сокращений.
При артериографическом исследовании определяются прямые и косвенные признаки врожденных аневризм. К прямым признакам относятся:
– контрастирование сосудистой полости, сообщающейся с артериями и веной;
– контрастирование артериовенозной фистулы.
Косвенные признаки:
– заполнение контрастным веществом множественных сосудистых полостей, имеющих вид «снежных пятен» или несуществующей в норме пятнистой сети сосудов;
– четкое контрастирование расширенной и извитой приводящей артерии;
– нечеткое заполнение контрастным веществом дистальных. отделов артерии;
отделов артерии;
– одновременное контрастирование артерий и вен.
Дифференциальная диагностика синдрома Паркса-Вебера-Рубашова. Артериовенозные свищи наиболее часто дифференцируют с истинным (врожденным) гигантизмом, нейрофиброматозом Реклингхаузена и акромегалией. Отличительной чертой указанных заболеваний является отсутствие расширения подкожных вен, сосудистого шума и симптома дрожания. В венозной крови определяется нормальное содержание кислорода. Болезнь Реклингхаузена сопровождается выраженной деформацией костей и их искривлением. Для акромегалии характерно увеличение лишь мелких костей дистальных отделов конечности после завершения процесса окостенения ростковых хрящей. Одновременно у больных с акромегалией увеличиваются части лица — нос, язык, нижняя челюсть. Параллельно наблюдаются нервно-психические расстройства и нарушения обмена веществ.
Гипертрофия пораженной конечности, пигментные пятна, варикозное расширение век отмечаются и при синдроме Клиппеля — Треноне, характеризующемся частичной или полной непроходимостью магистральных вен. Вместе с тем у больных с данным синдромом отсутствует пульсация поверхностных вен, нет сосудистых симптомов, не повышается парциальное напряжение кислорода в венозной крови. При ангиографическом исследовании устанавливают частичную или полную непроходимость магистральных вен.
Вместе с тем у больных с данным синдромом отсутствует пульсация поверхностных вен, нет сосудистых симптомов, не повышается парциальное напряжение кислорода в венозной крови. При ангиографическом исследовании устанавливают частичную или полную непроходимость магистральных вен.
Врожденные артериовенозные свищи дифференцируются и с обширными гемангиомами, которые также нередко сопровождаются гипертрофией мягких тканей, удлинением конечности, повышением температуры кожи в области локализации гемангиомы. Артериальные гемангиомы могут пульсировать, над ними иногда определяется симптом «кошачьего мурлыканья». Однако поверхностно расположенные кавернозные гемангиомы имеют мягкую консистенцию, легко сжимаются. Глубокие гемангиомы иногда прорастают в мышцы и кости, сдавливают нервные стволы, что сопровождается появлением в пораженной конечности боли. Гемангиомы, расположенные в толще кожи и подкожной клетчатки, часто осложняются сильным кровотечением. Главное отличие врожденных гемангиом от аригериовенозных свищей заключается в отсутствии артериального сброса крови.
Лечение. Единственным радикальным способом лечения больных с синдромом Паркса-Вебера -Рубашова является хирургическое вмешательство. Его объем заключается в ревизии сосудов и полном разобщении патологических соустий (скелетезации артерий и вей). Однако эффект от выполняемой операции может быть получен только при одиночных и ограниченных артериовенозных сообщениях. Оставление неперевязанными даже незначительного количества артериовенозных фистул сопровождается рецидивом заболевания. В случае обширного или множественного поражения, сочетающегося с наличием длительно незаживающих язв, повторных кровотечений, гангрены и декомпенсации сердечной деятельности, показано выполнение ампутаций конечности (нередко высокой).
Паллиативные операции в виде перевязки приводящей магистральной артерии, наложения множественных прошивных швов (типа Клаппа) недостаточно эффективны, так как таят в себе опасность усугубления нарушения регионарной гемодинамики.
Перспективным методом лечения больных синдромов Паркса-Вебера-Рубашова является селективная рентгеноэндоваскулярная окклюзия артерий, участвующих в артериовенозном сбросе. Рентгеноэндоваскулярная окклюзия может выполняться и в комбинации со скелетизацией артерий и вен.
Рентгеноэндоваскулярная окклюзия может выполняться и в комбинации со скелетизацией артерий и вен.
В послеоперационном периоде больные должны находиться под постоянным диспансерным наблюдением в целях своевременного выявления рецидива заболевания.
Поделиться ссылкой:
Похожее
Хронический абсцесс легкого у пациента с синдромом Клиппеля – Треноне – Вебера – Рубашова | Скорняков С.Н., Сабадаш Е.В., Медвинский И.Д., Бердников Р.Б., Хольный П.М., Дьячков И.А., Николаева М.О., Щиголев М.И., Масютина Д.Д., Иванчикова Е.Д.
В статье представлен клинический случай хронического абсцесса легких у пациента с синдромом Клиппеля – Треноне – Вебера – Рубашова, который является уникальным примером сочетания синдрома врожденной ангиодисплазии и хронического абсцесса легкого.
Введение
Синдром Клиппеля – Треноне – Вебера – Рубашова (СКТВР) — врожденная ангиодисплазия периферических сосудов с формированием патологических артериовенозных соустий, наличие которых обусловливает нарушение кровотока по магистральным венам пораженной конечности и как следствие — развитие варикозной трансформации поверхностных вен верхних и/или нижних конечностей с неуклонно прогрессирующим течением [1–6].По данным литературы, в основе заболевания предполагается роль нарушения эмбриогенеза с дисплазией глубокой венозной системы, однако наследственный фактор в развитии СКТВР играет незначительную роль. В структуре причин, нарушающих отток крови по глубоким венам, как правило, выделяют аплазию или гипоплазию вен, сдавление вен эмбриональными тяжами или артериальными сосудами, врожденное недоразвитие клапанного аппарата с расширением просвета глубоких вен. Патологические врожденные артериовенозные фистулы-шунты неизменно приводят к варикозному расширению вен, артериовенозные соустья усиливают венозный отток и тем самым увеличивают минутный объем сердца, вызывают его перегрузку и в зависимости от локализации шунта, длительности его существования и калибра измененных артерий приводят к гипертрофии сердца и сердечно-сосудистой недостаточности. В дальнейшем наблюдается снижение артериального и повышение венозного давления, уменьшение общего периферического сопротивления. За счет артериовенозного сброса происходит повышение содержания кислорода в венозной крови, что является одним из наиболее выраженных и постоянных симптомов артерио венозных фистул [2, 3, 6].
Для СКТВР характерна классическая триада симптомов: кожные ангиомы, расширение поверхностных вен, гипертрофия пораженной конечности (синдром Клиппеля – Треноне). Кроме того, может иметь место наличие артериовенозных анастомозов (синдром Паркса – Вебера) [1, 4]. Ряд авторов указывают на высокий процент распространенности таких системных проявлений СКТВР, как висцеромегалия и ангиоматоз висцеральных органов, гемангиомы желудочно-кишечного тракта, мочевой системы, добавочные крупные сосуды, аневризмы почечных артерий, гемангиомы почек, таза, матки [4, 5–7]. СКТВР обладает разнообразием клинических проявлений, что обусловливает необходимость мультидисциплинарного подхода к лечению заболевания с участием специалистов различных профилей (хирургов, педиатров, дерматологов, врачей лучевой диагностики) [1–4, 8]. В подавляющем большинстве случаев применяется этапное хирургическое лечение, зачастую травматичное и приводящее к большому количеству осложнений, по данным литературы, в 7,4–20% случаев (кровотечения, трофические язвы, гипертрофические и келлоидные рубцы). Частота послеоперационных рецидивов достигает 30–48% [2, 7, 9–11].
Клинический случай
В туберкулезное легочно-хирургическое отделение Уральского научно-исследовательского института фтизиопульмонологии 17 апреля 2017 г. поступил пациент П., 46 лет, с жалобами на периодический кашель с выделением светлой мокроты, одышку при умеренной физической нагрузке (вынужденная остановка при ходьбе на 2–3-лестничном пролете), множественные телеангиоэктазии латеральной, задней шейных, дельтовидной, грудной, локтевой областей слева.История болезни.
В 2003 г. при прохождении обследования (подготовка к плановому оперативному лечению по поводу СКТВР) по результатам обзорной рентгенографии органов грудной клетки (ОГК) впервые диагностирован поликистоз нижней доли левого легкого. За медицинской помощью пациент не обращался. В октябре 2016 г. заболел остро, когда на фоне фебрильной лихорадки появился продуктивный кашель с отделением небольшого количества гнойной мокроты с геморрагическим компонентом (прожилки крови). В последующие дни стал отмечать усиление кашля по ночам при положении на правом боку. Выраженность кашлевого синдрома значительно снижалась при положении на левом боку и в дневное время суток. Самостоятельно не лечился, за медицинской помощью по-прежнему не обращался. В ноябре 2016 г. отметил некоторое улучшение в виде урежения ночных приступов кашля. В январе 2017 г. состояние вновь ухудшилось, появились выраженная общая слабость, снижение толерантности к физическим нагрузкам, кровохарканье. После обращения за медицинской помощью был обследован. По данным мультиспиральной компьютерной томографии (КТ) ОГК и КТ с внутривенным контрастным усилением диагностировано разрушенное левое легкое на фоне поликистозного поражения. Рекомендовано плановое оперативное лечение в объеме пульмонэктомии слева.
В анамнезе. В детстве на фоне интенсивных физических нагрузок (занимался спортивной греблей) было отмечено появление и медленное прогрессирование следующих симптомов: нарушение местной терморегуляции, периодические ноющие боли и варикозная деформация поверхностных вен левой верхней конечности (рис. 1). Диагностирована врожденная ангиодисплазия. После отказа от занятий спортом прогрессирование клинических проявлений заболевания замедлилось. В 2003 г. по поводу СКТВР было выполнено разобщение артериовенозных соустий левой верхней конечности. Впоследствии и по настоящее время синдром проявляется в виде редких эпизодов спонтанно возникающих непродолжительных ноющих болей в левой верхней конечности, особенно в указательном пальце, продолжительностью около 10 мин. Продолжительность периодов бессимптомного течения может достигать нескольких месяцев, чаще 4–6 нед.
Прочие сопутствующие заболевания. С детства отмечает частые острые респираторные вирусные инфекции, бронхиты. Гипертоническая болезнь II стадии.
Семейный анамнез отягощен по заболеваниям сердечно-сосудистой системы.
При поступлении: общее состояние удовлетворительное. Телосложение гиперстеническое. Кожные покровы физиологической окраски. На коже левых латеральной, задней шейных областей располагается телеангиоэктатический сосудистый невус («винный» невус) неправильной формы, 4–6 см в диаметре, не возвышающийся над поверхностью кожи, а также множественные телеангиоэктазии дельтовидной, частично грудной и локтевой областей слева (рис. 2). Щитовидная железа не увеличена. Дыхание через нос свободное. Грудная клетка правильной формы. Обе половины ее одинаково участвуют в акте дыхания. Перкуторно над легкими справа: ясный легочной звук, слева: в верхних отделах коробочный, в нижних — тимпанит. В правом легком дыхание везикулярное, в левом выслушиваются разнокалиберные влажные хрипы. ЧДД — 16 в минуту. Границы сердца не смещены, не расширены. Тоны сердца ясные, ритм правильный, шумы отсутствуют. ЧСС — 89 в минуту, АД — 125/80 мм рт. ст. Пульс — 89 уд/мин, ритмичный, нормального наполнения и напряжения. Живот правильной формы, пальпаторно мягкий, безболезненный во всех отделах. Нижний край печени выше края реберной дуги. Поясничные области визуально и пальпаторно не изменены. Симптомы поколачивания отрицательные с обеих сторон. Дизурии нет. Очаговой неврологической симптоматики нет.
При обследовании: в общем анализе крови: лейкоциты — 9,8×109/л, эритроциты — 5,55×1012/л, тромбоциты — 263×109/л, гемоглобин — 143 г/л, гематокрит 43,1%, СОЭ —13 мм/ч. Общий анализ мочи: удельный вес — 1,030 г/л, рН — 5,0, уробилиноген — 3 мг/дл. Биохимия крови: глюкоза — 4,5 ммоль/л, общий белок — 73,4 г/л, альбумин — 39,6 г/л, АСТ — 19,0 Ед/л, АЛТ — 55,8 Ед/л, мочевина — 7,2 ммоль/л. Коагулограмма: тромбоциты — 450×109/л, активированное частичное тромбопластиновое время — 29,2 с, протромбиновое время — 13,3 с, международное нормализованное отношение — 1,26 (удлинение коагуляции по внешнему пути).
ФГДС: варикозно расширенные вены нижней трети пищевода II–III степени. ЭКГ: синусовая тахикардия до 90 уд/мин. Метаболические нарушения, неполная блокада правой ножки пучка Гиса. Дуплексное сканирование вен верхних конечностей с цветным картированием: поверхностные и глубокие вены правой верхней конечности проходимы. Посттромботическая болезнь левой верхней конечности, реканализация срединной подкожной вены, частичная реканализация латеральной подкожной вены в области локтевого сгиба, без флотации. Варикозная трансформация латеральной подкожной, срединной подкожной, лучевой, локтевой вен слева. КТ ОГК с внутривенным контрастным усилением: в паренхиме правого легкого очаговых и фокусных изменений нет. В левом легком во всех сегментах, преимущественно в нижней доле, определяются множественные крупные и средних размеров округлые полости (кисты, буллы), разделенные тонкими септами. Некоторые полости (в задних и нижних отделах) с жидкостью, дренируются соответствующими бронхами. Артерии левого легкого деформированы, сближены и расположены по контуру кист по касательной. Оставшаяся паренхима избыточно воздушна, сосудистый рисунок обеднен. Свободного выпота в плевральных полостях нет. Ствол легочной артерии не расширен. Костные элементы и мягкие ткани грудной стенки не изменены. Заключение: кистозно-буллезная трансформация паренхимы левого легкого (рис. 3).
Осмотр офтальмолога: пигментный невус сетчатки левого глаза.
Предоперационный диагноз: разрушенное левое легкое. Поликистоз левого легкого (?). Абсцесс левого легкого с пневмонией (?).
15.05.17 пациенту была выполнена пульмонэктомия слева.
Интраоперационно: плевральная полость свободна, грубые рубцовые сращения в задних отделах и над диафрагмой. Легкое выделено из сращений остро-тупо. Легкое практически полностью выполнено кистами: воздушными и наполненными (напряженными). Элементы корня легкого обработаны раздельно: поочередно перевязаны и дважды прошиты легочная артерия, верхняя и нижняя легочные вены (DSTSeries™ TA™, typeTA30V3S, Covidien, NewHaven, CT, USA, 6 шт.). Культя главного бронха мобилизована до бифуркации, произведена ее реампутация на уровне 2–3-го полукольца. Культя ушита вручную узловыми швами атравматично проленом 3/0 по Суиту с шагом 1–1,5 мм. Дренаж. Послойные швы.
Послеоперационный период протекал гладко. Проведен курс антибактериальной профилактики гнойных осложнений. По дренажам из плевральной полости в 1-е сутки после операции выделилось 250 мл серозно-геморрагической жидкости, в течение 2-х дней после операции количество отделяемого в сутки уменьшилось до 100 мл, сброса воздуха по плевральному дренажу и явлений подкожной эмфиземы не отмечалось. На 3-и сутки после операции дренаж удален с подпусканием воздуха в плевральную полость. Операционная рана зажила первичным натяжением.
Патогистологическое исследование № 459/17. Практически всю нижнюю долю занимает гигантская полость многокамерного строения, с кожистой стенкой, заполненная большим количеством зеленоватых масс. Стенка полости 3-слойная: гнойно-некротический слой с большим количеством нейтрофилов, слой грануляционной ткани неспецифического вида, широкий фиброзный слой. Вокруг большое количество гемосидерофагов интраальвеолярно, участки организации, бронхоэктазы. В легочной ткани также определяются гемосидерофаги интраальвеолярно, имеется утолщение и перекалибровка сосудов с резким утолщением их стенки и сужением просвета. По линии резекции — склероз стенки бронха. Окраска по Цилю — Нильсену отрицательная.
Заключение: гигантский многокамерный хронический абсцесс в нижней доле левого легкого в активной фазе гнойного воспаления. Гемосидероз легкого (кровохарканье в анамнезе) (рис. 4).
При контрольном осмотре через 1 мес.: жалобы на умеренные боли в области торакотомного разреза (рубец без признаков воспаления), температура тела в норме. Обзорная рентгенография ОГК: слева — остаточная полость частично заполнилась гомогенным содержимым. Других дополнительных затемнений и уровней жидкости нет; справа — очаговых и фокусных изменений нет.
Через 6 мес. после оперативного вмешательства состояние удовлетворительное, никаких жалоб пациент не предъявляет. При рентгенографии ОГК: слева — остаточная полость полностью заполнилась гомогенным содержимым, справа — очаговых и фокусных изменений нет.
Заключение
Приведенный клинический случай является уникальным примером сочетания синдрома врожденной ангиодисплазии и хронического абсцесса легкого. Поражение паренхимы легкого, вероятно, обусловило длительное бессимптомное прогрессирование кистозной гипоплазии левого легкого. На фоне вовлечения в процесс нижнедолевого бронха нарушения мукоцилиарного клиренса и кинетики бронхов достигли критических значений с последующей их колонизацией неспецифической микрофлорой, при этом заболевание манифестировало в виде острого абсцесса легкого с полным разрушением его паренхимы и последующей хронизацией процесса. Таким образом, данный процесс можно рассматривать как вариант системного проявления СКТВР.В пользу предположения о сосудистом генезе поражения паренхимы легкого говорят данные: патоморфологического исследования (перекалибровка сосудов с резким утолщением их стенки и сужением просвета), КТ-исследования (артерии левого легкого деформированы, сближены и расположены по контуру кист по касательной). Кроме того, обращает на себя внимание локализация изменений: левосторонняя — наружных проявлений СКТВР и кистозно-буллезная трансформация паренхимы только левого легкого. В пользу того, что хронический абсцесс развился именно на фоне кистозной гипоплазии, свидетельствуют его гигантский многокамерный характер, локализация в нижней доле левого легкого (расположение наиболее выраженного кистозного изменения легочной паренхимы). Наличие в легочной ткани гемосидерофагов свидетельствует о выраженном внутрилегочном кровотечении, вызванном разрушением большого количества кистозных полостей.
В доступной литературе мы не встретили каких-либо упоминаний, подтверждающих нашу гипотезу.
Важно отметить, что пациенты с СКТВР редко попадают в поле зрения врача-пульмонолога или торакального хирурга, а приведенный клинический случай является наглядной иллюстрацией возможного легочного проявления врожденной ангиодисплазии. Такие клинические проявления СКТВР, как эпизоды кашля с мокротой и кровохарканье, долгое время не оценивались специалистами как клинически значимые, поскольку не сопровождались изменениями лабораторных показателей, наличием проявлений, характерных для интоксикационного синдрома. Но при более детальном обследовании пациента выявлен патологический процесс, который явился абсолютным показанием для плановой пульмонэктомии.
.
Клинический случай редкой наследственной патологии — синдром Клиппеля — Треноне — Вебера — Рубашова в практике врача-педиатра
Статья опубликована на с. 117-122
Синдром Клиппеля — Треноне — Вебера — Рубашова благодаря многообразию клинических проявлений интересует специалистов разных профилей — хирургов, педиатров, дерматологов, рентгенологов. Полисимптомность заболевания обусловливает множество различных названий, отражающих его те или иные клинические проявления и этиопатогенетические свойства. Синонимы заболевания — остеогипертрофический варикозный невус, ангиоостеогипертрофия, гипертрофическая гемангиэктазия, сосудисто-костная дизэмбриопатия, шестой факоматоз, частичный гигантизм сосудистой системы.
Клиппель и Треноне в 1900 г., Паркс Вебер в 1907 г. описали синдром, характеризующийся односторонним врожденным пороком развития артерио-венозной системы, лимфатических сосудов и вторичными остеогипертрофическими изменениями в одной, реже — в двух конечностях. Вебер в 1918 г. обратил внимание на существование при данном синдроме артериовенозных фистул. Большой вклад в изучение данного синдрома внес также С.М. Рубашов, который уточнил патогенез и клинику этого заболевания.
Сущность синдрома заключается в нарушении кровотока по магистральным венам пораженной конечности. Затруднение оттока крови по глубоким венам может быть вызвано аплазией или гипоплазией вены, сдавливанием вен эмбриональными тяжами, артериальными сосудами, врожденным недоразвитием клапанного аппарата глубоких вен и расширением их просвета. В патогенезе синдрома предполагается роль нарушения эмбриогенеза с дисплазией глубокой венозной системы. Нельзя исключить и вероятность механических повреждений в эмбриональном периоде. Между тем заболевание иногда встречается у родственников, среди которых преобладают женщины. Не всегда передается доминантным путем, окончательных данных о типе наследования синдрома не получено. Болезнь наблюдается спорадически, редко — с полным набором симптомов. Риск наследственной передачи, по мнению многих исследователей, ничтожен. Классическая триада симптомов — кожные ангиомы, расширение поверхностных вен, гипертрофия пораженной конечности — обозначается как синдром Клиппеля — Треноне, а наличие еще и артериовенозных анастомозов типично для синдрома Паркса Вебера.
Клинические симптомы отмечаются при рождении. Родители обращают внимание на сосудистые пятна на коже конечности ребенка после рождения. Гемангиомы бывают единичные или множественные; капиллярные, кавернозные, кистозные; различающиеся по размерам и локализации (на любой части тела, но чаще всего на голенях, ягодицах, животе, нижней части туловища). Преобладает одностороннее поражение. Описана гиперпигментация кожи, могут наблюдаться аномалии пигментации в виде пигментных и ахромичных невусов, телеангиэктазии, мраморная кожа. Ангиома обычно видна уже при рождении ребенка (в единичных случаях проявляется в раннем детском возрасте) в виде обширного пятнистого телеангиэктатического сосудистого невуса (пламенеющий, или «винный», невус), в 50 % случаев — кавернозного, расположенного по всей длине одной из нижних конечностей. Немногочисленные рассеянные участки поражения могут быть на коже туловища, значительно реже гемангиома локализуется на верхней конечности. Цвет ангиомы может варьировать от бледно-красного до интенсивно-пурпурного. Ткани пораженной конечности (как мягкие, так и костные) гипертрофируются за счет интенсивной васкуляризации. Пораженная конечность или ее часть удлинена и обычно быстрее растет за счет костной гипертрофии в длину, а также утолщена за счет гипертрофии мягких тканей в условиях повышенного кровоснабжения. Возможны также деформация суставов, утолщение или дистрофия мышцы. В некоторых случаях наступает не гипертрофия, а атрофия костей и мягких тканей конечности. Глубокая венозная сеть может быть плохо развитой или отсутствовать. Нередки трофические язвы, отек подкожной клетчатки. Варикозное расширение вен пораженной конечности становится выраженным в юношеском возрасте и может сопровождаться тромбофлебитом поверхностных вен, возможны кровотечения, развитие гангрены. Нижние конечности поражаются в 2 раза чаще, чем верхние, причем поражаются преимущественно дистальные части конечностей.
В типичных случаях на одной из нижних конечностей, реже — на верхней, виден телеангиэктатический невус различной величины в сочетании с варикозным расширением вен и артериовенозными анастомозами на пораженной стороне, что в большинстве случаев приводит к парциальному гигантизму больной конечности. Тяжесть течения заболевания зависит от распространенности кожных и сосудистых поражений, а также от степени гипертрофии конечности. Удлинение конечности вызывает ее искривление. Возможны другие аномалии развития: полидактилия, синдактилия, макродактилия, диспропорциональная длина пальцев, олигодактилия. У ряда больных могут наблюдаться сколиоз, вывих тазобедренного сустава и такие диспластические симптомы, как врожденная косолапость, деформации коленных суставов, spina bifida.
Патологические врожденные артериовенозные фистулы-шунты неизменно приводят к появлению варикозных вен и отражаются на состоянии гемодинамики. Артериовенозные соустья усиливают венозный отток и тем самым увеличивают минутный объем сердца, вызывают его перегрузку и в зависимости от локализации шунта, длительности его существования и величины артерии иногда приводят к гипертрофии сердца и выраженной сердечной недостаточности. Они ведут к снижению артериального и повышению венозного давления, уменьшению общего периферического сопротивления и укорочению времени кровообращения. За счет артериовенозного сброса происходит повышение содержания кислорода в венозной крови, что является одним из наиболее выраженных и постоянных симптомов артериовенозных фистул. Течение заболевания неуклонно прогрессирующее.
Различают также абортивные варианты синдрома: без сосудистых невусов, без гипертрофии костей или без варикозно расширенных сосудов. Возможны также «перекрещенные» формы, при которых ангиомы кожи выражены на одной конечности, а варикозное расширение — на другой.
Черепно-лицевые аномалии включают асимметричную гипертрофию лица, микро- и макроцефалию, интракраниальные кальцификаты, гипертрофию тканей орбиты. Наблюдаются глаукома, катаракта, колобома и гетерохромия радужки, ангиоматоз глазного дна. Встречаются висцеромегалия, гемангиомы желудочно–кишечного тракта, мочевой системы, добавочные крупные сосуды, аневризмы почечных артерий, гемангиомы почек, таза, матки, ангиоматоз висцеральных органов, варикозные расширения вен легкого, пороки развития висцеральных вен, которые могут быть причиной кровотечений.
Диагноз ставят на основании клинической картины, данных ультразвукового дуплексного сканирования и флебоангиографического исследования. Ультразвуковое, артерио- и флеболимфографическое исследования позволяют дифференцировать эти пороки развития. Функциональная флебоманометрия при синдроме Клиппеля — Треноне регистрирует высокое венозное давление, не изменяющееся как в горизонтальном, так и в вертикальном положении больного. Артериальное давление в большинстве случаев отчетливо понижено. Рентгенологически выявляют утолщение кортикального слоя костей пораженной конечности и остеопороз, что приводит к деформации конечности, образование в костях округлых полостей, расширение гаверсовых каналов, образование узур в компактном костном веществе. Изменения на рентгенограммах костей пораженной конечности обусловлены давлением расширенных сосудов.
Дифференциальную диагностику проводят с болезнью Штурге — Вебера, Гиппеля — Линдау, Клиппеля — Фейля, Пари — Ромберга, Мильроя, лимфедемой; синдромом Протея; Маффуччи, Бина, нейрофиброматозом I типа и другими пороками развития сосудистой системы.
Лечение синдрома Клиппеля — Треноне — Вебера — Рубашова малоперспективно, и только при агенезии небольших сегментов магистральных вен возможны пластические восстановительные операции. Хирургическое лечение заключается в пересечении и перевязке артериовенозных соустьев между крупными артериями и венами, а при наличии множественных артериоловенулярных фистул — в перевязке приводящего артериального сосуда после тщательного флебографического исследования. Однако перевязка магистральных артерий может сопровождаться некрозом дистальных отделов конечности. Некоторые авторы предлагают проведение люмбальной симпатэктомии, удаление варикозно расширенных вен, лучевую терапию кавернозных гемангиом. Хирургическое вмешательство на костной системе — укорачивающая остеотомия или фиксация костного трансплантата в метафизе для предотвращения дальнейшего роста костей — осуществляется после предварительного устранения тяжелых нарушений со стороны сосудов и мягких тканей. Прогноз неблагоприятный вследствие нарастающей сердечно-сосудистой недостаточности и лимфостаза.
В связи с редкостью данной патологии приводим собственное клиническое наблюдение. Ребенок С., 23.03.2006 года рождения, поступил 08.11.2013 г. в инфекционное отделение городской детской клинической больницы (ГДКБ) № 5 г. Донецка с жалобами на повышение температуры тела до 39 °C, вялость, кашель, насморк. Болеет 3-и сутки, участковым врачом направлен в стационар в связи с подозрением на пневмонию.
При поступлении в отделение 08.11.13 г. состояние ребенка расценено как состояние средней тяжести, температура тела на момент поступления 37,2 °С; ЧСС — 106 в мин., ЧД — 28 в мин. Правильного телосложения, достаточного питания. Кожные покровы бледные, на коже левой верхней конечности, слева в верхних отделах груди и спины — обширная гемангиома. Левая верхняя конечность значительно теплее на ощупь, не разгибается в полном объеме в локтевом суставе (до угла 120°), длиннее правой на 4 см, толще на 3,5 см, левая кисть значительно увеличена в размере. Носовое дыхание затруднено. Слизистая небных дужек гиперемирована. Определяется укорочение перкуторного звука в нижних отделах грудной клетки справа. Аускультативно дыхание жесткое, справа в нижних отделах — ослабленное, сухие свистящие хрипы и крупнопузырчатые влажные хрипы единичные с обеих сторон, справа в нижних отделах выслушиваются влажные мелкопузырчатые хрипы. Отмечается умеренно выраженный сердечный горб. Смещение левой границы относительной сердечной тупости на 2 см кнаружи от левой среднеключичной линии. Тоны сердца приглушены, ритмичные, ЧСС — 100 в минуту, систолический шум в I и V точках. Живот мягкий, доступен глубокой пальпации, печень на 1 см ниже реберного края, умеренно положительны пузырные знаки, селезенка в подреберье.
Обследован: 1. Анализ крови общий от 09.11.13 г.: эритроциты — 4,56 • 1012/л, гемоглобин — 126 г/л, гематокрит — 37 %, лейкоциты — 10 • 109/л, палочкоядерные — 30 %, сегментоядерные — 60 %, лимфоциты — 8 %, моноциты — 2 %, тромбоциты — 227 • 109/л, СОЭ — 28 мм/ч. Анализ крови общий от 16.11.13 г.: эритроциты — 4,52 • 1012/л, гемоглобин — 126 г/л, гематокрит — 37 %, лейкоциты — 5,7 • 109/л, эозинофилы — 3 %, палочкоядерные — 8 %, сегментоядерные — 40 %, лимфоциты — 44 %, моноциты — 5 %, тромбоциты — 277 • 109/л, СОЭ — 14 мм/ч. 2. Фибриноген — 2,25 г/л; свертываемость по Сухареву — 3–4 минуты. 3. Биохимическое исследование крови: мочевина — 6,9 ммоль/л, креатинин — 0,058 мкмоль/л, билирубин общий — 14 мкмоль/л, непрямой — 11 мкмоль/л, прямой — 3 мкмоль/л, АСТ — 58,6 Ед/л (при норме < 36,0), АЛТ — 35,1 Ед/л (при норме < 29,0), К+ — 4,4 ммоль/л, Nа+ — 130,6 ммоль/л, Са — 2,65 ммоль/л. 4. Анализ мочи — норма. 5. УЗИ печени, селезенки, почек — в пределах нормы, УЗИ желчного пузыря — эхо–признаки наличия деформации желчного пузыря. 6. Рентгенография органов грудной клетки от 08.11.13 г. — правосторонняя пневмония.
В отделении пролечен по поводу внебольничной правосторонней пневмонии, ДН 1, ДЖВП, сопутствующий диагноз — синдром Клиппеля — Треноне — Вебера — Рубашова. ВПС, состояние после эндоваскулярного закрытия ОАП. Проведенная терапия — цефтриаксон, сумамед, виферон, инспирон, аскарил, линекс, лактомун, лазорин, тантум верде, холосас, нурофен.
Особый интерес представляет анамнез жизни ребенка, диагностика синдрома Клиппеля — Треноне — Вебера — Рубашова.
Анамнез жизни: ребенок от 1-й беременности (37–38 недель). Во время беременности мать перенесла ОРВИ в 16 недель, преэклампсию средней степени, угрозу прерывания беременности в 28 недель. Воздействия вредных факторов окружающей среды во время беременности не отмечено. Обследование на ТОRСН-инфекции — отрицательно. Роды I, срочные, нормальные. Состояние при рождении удовлетворительное. Оценка по шкале Апгар 8–9 баллов, масса тела при рождении 3650 г, длина 53 см. В родильном доме выслушивался интенсивный систолический шум на верхушке сердца, распространяющийся на всю предсердную область. Заподозрен врожденный порок сердца (ВПС): открытый артериальный проток (ОАП), открытое овальное окно (ООО). На спине слева, плече, левой руке выявлена обширная капиллярная, частично кавернозная гемангиома с явлениями лимфостаза. В 2 месяца (25.05.06) осмотрен детским хирургом ГДКБ № 5: выявлена обширная гемангиома по типу «винного» пятна грудной стенки слева, спины и левого плеча, с явлениями лимфостаза в верхней конечности. В 6 месяцев (22.09.06) осмотрен детским хирургом: у ребенка парциальный гигантизм левой верхней конечности на почве порока развития сосудов — лимфогемангиоматоз с явлениями ангиоматозного невуса. 22.09.06 г. проведена рентгенография костей предплечья: определяется утолщение и деформация левой лучевой кости в средней и дистальной трети с очагами склероза и остеопороза. Локтевая кость утолщена в дистальном эпифизе и средней трети, очаги разрежения костной структуры без периостальных реакций.
Ребенок осмотрен детским ортопедом областной травматологической больницы. На рентгенограммах костей левого и правого предплечий: кости левого предплечья увеличены в размере, деформированы, особенно дистальный отдел лучевой кости, выраженный мягкотканный компонент, по-видимому, болезнь Олье.
Часто болел ОРВИ. Грудное вскармливание до 1 года 2 месяцев. Профилактические прививки по календарю. Наблюдался по месту жительства в поликлинике ГДКБ № 5.
ЭхоКГ 07.05.08 г. (2 года): ВПС, ОАП (d = 0,25 см), умеренная дилатация левых камер сердца, давление в легочной артерии (ЛА) 22,8 мм рт.ст., фракция выброса (ФВ) 67 %. ЭхоКГ 04.10.10 г. (4,5 года): ВПС, ОАП (d = 0,42 см), дилатация левых камер сердца, давление в ЛА 38 мм рт.ст., ФВ 68 %. Осмотрен детским кардиохирургом Института неотложной и восстановительной хирургии (ИНВХ) 04.10.10 г. (4,5 года): у ребенка ВПС, ОАП, НК 1. Рекомендовано оперативное лечение в плановом порядке с учетом сопутствующей патологии, предпочтительно эндоваскулярным способом. Из семейного анамнеза следует отметить, что у матери и бабушки по линии матери ВПС, ООО. С 25 по 28 октября 2010 г. находился в отделении детской кардиохирургии ИНВХ, где было проведено эндоваскулярное закрытие открытого артериального протока спиралью Flipper, результат операции признан удовлетворительным. Осмотрен 18.07.11 г. в ИНВХ в отделении неотложной и восстановительной хирургии сосудов: синдром Клиппеля — Треноне — Вебера — Рубашова левой руки, ХВН 2-й степени, рекомендовано эластическое бинтование руки, консультация в г. Киеве. Обследован в г. Киеве, Академии медицинских наук Украины, Государственном институте хирургии и трансплантологии им. академика А.А. Шалимова. Ультразвуковая допплероскопия: левая верхняя конечность — определяется ускорение кровотока по пальцевым, ладонным артериям, артериям предплечья, плеча, подмышечной артерии. Подключичные артерии: диаметр d — 0,38 см, s — 1,1 см, пиковая систолическая скорость кровотока ПСС: d — 0,88 м/с, s — 1,3 м/с, слева определяется снижение индекса резистентности сосудов R до 0,83. Подключичные вены: d — 0,52 см, s — неравномерно расширена, d макс. — 1,1 см. Мелкие артериовенозные (АV) соустья на левой верхней конечности, крупных АV–соустьев не выявлено. Реография верхних конечностей: Наблюдается резкое повышение пульсового кровенаполнения левой верхней конечности с асимметрией D < S в 2,7 раза, на уровне предплечья D < S в 2,6 раза, на уровне кисти D < S в 2,8 раза на фоне артериальной гиперемии и сниженного венозного оттока. Периферическое сопротивление сосудов верхних конечностей умеренно повышено.
Электромиография (ЭМГ): снижение биоэлектрической активности мышц левой верхней конечности с асимметрией по передней и средней порциям дельтовидной мышцы плеча D > S на 75 %, по двуглавой мышце плеча — D > S на 75 %, по трехглавой — D > S на 50 %, по сгибателям и разгибателям — D > S на 75 %, по тенору и гипотенору — D > S на 100 %. Хронаксиметрия: снижение нервно–мышечной возбудимости по левому лучевому нерву в 1,3 раза, реакция при раздражении типичная.
Ребенок нуждается в дальнейшем оперативном лечении.
Выводы
Синдром Клиппеля — Треноне — Вебера — Рубашова представляет значительные трудности не только для диагностики, но и для лечения, является разновидностью системных дисплазий и заслуживает внимания как одно из многочисленных наследственных заболеваний, поражающих различные ткани организма. Синдром Клиппеля — Треноне — Вебера — Рубашова — редко встречающаяся наследственная патология, которая является достаточно тяжелой в отношении качества жизни ребенка. Поэтому знание клинических проявлений, дифференциальная диагностика и выбор тактики ведения данного тяжелого контингента больных приобретают особое значение для врачей всех уровней оказания медицинской помощи.
признаки, причины и методы лечения
В структуре врождённых болезней кровеносной системы, не касающихся непосредственно сердца, наиболее распространены сосудистые патологии, затрагивающие артериальную и венозную системы конечностей. Чаще других среди всех ангиодисплазий встречается синдром Паркса-Вебера-Рубашова.
Аномалия характеризуется наличием соустий между венами и артериями. Фистулы могут быть множественными, локализуются чаще всего на нижних конечностях: в ветвях подколенной, в бедренной или большеберцовой артериях. Патология нарушает естественное сообщение крови в сосудах, ведёт к кислородному голоданию тканей, изменению процессов метаболизма, повышению нагрузки на сердце и вызывает ряд иных отклонений.
Классификация и характерные признаки
Синдром Паркса-Вебера – заболевание врождённое, но не передающееся по наследству. Патологии одинаково подвержены представители обоих полов.
В норме в период внутриутробного развития до определённого момента вены и артерии не разделены на функциональные единицы и не обособлены. Сброс крови, идущей по артериям, в венозную систему на этом этапе является физиологичным процессом. По мере роста плода происходит дифференциация кровеносных сосудов, развивается капиллярная система. Именно капилляры становятся связующим звеном между артериями и венами.
В ходе дальнейшего развития прямое сообщение редуцируется, но в ряде случаев связи между артериями и венами остаются. Такое патологическое соустье иначе называют фистула, свищ или шунт.
Обычно соустья локализуются на конечностях, чаще – на нижних, могут также располагаться в мягких тканях туловища, головы и шеи.
Типология предполагает разделение патологических изменений по нескольким признакам, первый из них – степень близости сосудов. Такая классификация подразумевает два вида аномальных соустий:
- Прямая артериовенозная фистула – непосредственное соединение вены и артерии, которые находятся максимально близко друг к другу. Такой тип патологии считается наиболее опасным для здоровья и жизни человека, поскольку на его фоне может развиться хроническая сердечная недостаточность.
- Непрямая. Характеризуется наличием у пациента аневризматического мешка (полости) между сообщающимися сосудами.
Другой классификационный признак характеризует место расположения и число фистул, такое разделение предполагает следующие виды заболевания:
- Локализованный. У пациента диагностируется единичная фистула. Часто такая аномалия сопровождается пороками других жизненно важных органов.
- Генерализированный. Такой тип характеризуется наличием нескольких свищей на большом участке.
По признаку величины соустий различают микро- и макрофистулы. Первые могут быть обнаружены только в процессе микроскопического исследования тканей, вторые видны невооружённым глазом.
Наличие патологического соустья чревато опасными последствия:
- Нарушается тканевое строение стенок вен. Это происходит вследствие того, что сосуд выполняет несвойственную ему работу. Мышечная оболочка вены утолщается, появляется эластическая внутренняя мембрана.
- Ткани испытывают гипоксию, что связано со сбросом артериальной крови сразу в венозное русло.
- Метаболизм в тканях нарушается из-за недостатка кислорода.
- Давление в венах патологически повышено, что приводит к увеличению нагрузки на сердце, как результат наступает декомпенсация главного органа сердечно-сосудистой системы.
Синдром Вебера-Рубашова бывает выражен разной степенью тяжести. Это зависит от формы заболевания, локализации свищей и индивидуальных особенностей организма человека. Общие симптомы таковы:
- Варикозная болезнь, поражающая подкожные вены.
- Вибрация сосудов в месте соустья.
- Повышение температуры кожи в месте локализации фистулы, особенно непосредственно над ней. Разница температур на аналогичных участках поражённой и здоровой конечностей может достигать восьми градусов.
- Увеличение поражённой болезнью конечности в размерах. Длина ноги, в которой располагаются сочленённые сосуды, может на 5–10 сантиметров превышать длину здоровой конечности. Хромота, сколиоз – частые признаки патологии.
- Язвы и некрозы кистей, стоп поражённых конечностей. Вызваны нарушением нормального движения крови по кровяному руслу, расстройствами микроциркуляции.
Причины возникновения
Отклонения в формировании артерий в период внутриутробного развития возникают на 4-й – 5-й неделях гестации. Нарушения формирования вен – между пятой и восьмой неделями. Предполагается, что появление патологических соустий может происходить на пятой – седьмой неделях беременности при наличии неблагоприятных для эмбриона условий.
Факторами, которые могут повлечь аномалии строения сосудистой системы, считаются:
- Курение, прием наркотических веществ, злоупотребление алкоголем во время беременности, в частности, на ранних сроках.
- Вирусные заболевания, перенесённые женщиной в период вынашивания ребёнка: корь, краснуха, грипп.
- Радиационное воздействие.
- Приём препаратов с тератогенным действием.
Описываемый синдром представляет собой патологию врождённую, но не все из диагностированных фистул являются таковыми. У взрослого человека соустья могут появиться в результате травмы, хирургического вмешательства, опухоли головного мозга. Такие шунты рассматриваются как самостоятельные явления и не относятся к синдрому, причины которого кроются в образе жизни беременной женщины.
Диагностика и лечение
Диагностика заболевания предполагает сочетание нескольких методов обследования пациента. Среди них:
- Физикальная диагностика. Осмотр выявляет гипертрофию поражённой конечности, варикозное расширение вен, пульсацию и вибрацию сосудов. При выслушивании регистрируется непрерывный систоло-диастолический шум, усиливающийся в момент систолы.
- Контрастная рентгенография. Фотоснимки показывают наличие и локализацию фистул.
- Магнитно-резонансная и компьютерная ангиография. Наиболее информативны при диагностировании ангиодисплазий.
- Ультразвуковая допплерография. Позволяет увидеть нарушения кровотока в сосудах.
Традиционная терапия
Эффективным методом лечения синдрома является хирургическое воздействие. В ходе операции патологические соустья могут быть удалены, перевязаны либо закупорены. Оперативное лечение проводят в раннем детском возрасте, пока ещё не произошли необратимые изменения тканей и органов.
До проведения операции могут быть прописаны средства симптоматического лечения: ангиопротекторы, противосудорожные, обезболивающие.
Народные средства
Средства народной медицины неэффективны в борьбе с патологией. В качестве дополнительной к традиционной терапии после консультации с врачом могут быть применены средства, способствующие нормализации деятельности сердечно-сосудистой системы.
Рекомендации по профилактике
Прогноз при отсутствии лечения неблагоприятный. Декомпенсация и сердечная недостаточность как результат патологических соустий приводят к инвалидности. В связи с этим беременным женщинам рекомендуется придерживаться таких рекомендаций по профилактике:
- Предупреждение вирусных заболеваний, своевременное их лечение.
- Отказ от курения, употребления алкоголя и наркотических веществ.
- Недопущение радиационного и других видов вредного воздействия на организм беременной.
Загрузка…Синдром Паркса-Вебера-Рубашова – тяжёлая врождённая сосудистая патология. Своевременная диагностика и раннее оперативное лечение обеспечивают пациенту выздоровление, отсутствие хирургического вмешательства влечёт за собой инвалидность.
Синдром Паркса-Вебера
Обзор
Синдром Паркеса-Вебера — это состояние, характеризующееся чрезмерным разрастанием конечностей, капиллярными мальформациями (винные пятна) и диффузными артериовенозными мальформациями. Это может повлиять на руки или ноги. В долгосрочной перспективе заболевание может быть связано с сердечной недостаточностью из-за отвода крови из артерий в вены.
Симптомы / История болезни
В раннем детстве у пациента может наблюдаться чрезмерное развитие в длине и окружности, связанное с разрастанием костной ткани пораженной конечности.Это проявляется в сочетании с красными или пурпурными отметинами на коже, крупными венами, теплом и припухлостью пораженной конечности. Если не выявить и не лечить должным образом, у пациента могут развиться симптомы сердечной недостаточности.
Диагностика
Диагноз в основном ставится клинически на основании наличия разросшейся конечности, связанной с винными пятнами на коже, набухшими и пульсирующими венами, артериовенозными мальформациями и отеком. Также могут присутствовать венозные мальформации.
Первоначальная оценка может быть выполнена с помощью ультразвуковой допплерографии, но дальнейшие анатомические детали обычно получают с помощью магнитно-резонансной томографии (МРТ) или компьютерной томографии (КТ).Инвазивные исследования, такие как ангиограммы, в основном проводятся, когда есть возможность одновременного лечения.
Несмотря на то, что генетическое тестирование обычно не проводится, оно может выявить мутацию RASA1, которая, как было установлено, участвует в развитии заболевания у некоторых пациентов.
Лечение
Целью лечения в подавляющем большинстве случаев является контроль сосудистых мальформаций, улучшение качества жизни и уменьшение возможных осложнений заболевания за счет использования компрессионного белья, изменения образа жизни и предотвращения травм пораженного участка.Эмболизация, использование стентов и / или хирургическая резекция артериовенозных мальформаций являются наиболее часто используемыми вариантами терапии. Пациентам также могут потребоваться ортопедические вмешательства при несоответствии длины конечностей. Пациентам с синдромом Паркса-Вебера обязательно пройти обследование многопрофильной командой.
Собака лечит редкое врожденное заболевание своего хозяина Синдром Паркса Вебера
Эта собака помогает залечивать открытые раны своему хозяину, страдающему редким врожденным заболеванием.
Молодой пуодл лечит свою хозяйку, нежно надавливая головой или лапами на ее раны.
Радуйтесь, ибо закончился великий овощной кризис 2017 годаШинейд Эллис из Торонто страдает синдромом Паркса-Вебера — исключительно редким заболеванием, которое приводит к появлению большого количества аномальных кровеносных сосудов.
В результате правая нога Шинейд почти вдвое больше ее левой, а 25-летняя женщина страдает от постоянной боли, учащенного сердцебиения, различных инфекций и язв, и до недавнего времени у нее была открытая болезненная рана справа. стопа более десяти лет.
С тех пор, как ее собака Паддингтон, служебная собака, обучалась в компании Thames Center Service Dogs, жизнь Шинед полностью изменилась.
Собака оказывает давление, чтобы залечить раны своего хозяина (Изображение: Обслуживает) Паддингтон оказывает давление на стопу Шинейд (фото: Caters)Пудель использует метод, называемый терапией глубоким давлением, чтобы залечить рану на своей стопе, регулярно оказывая давление на эту область.
Школьники засняли драку с украденными швабрами посреди улицыШинейд сказала: «Мое состояние влияет на всю правую сторону моего тела, в основном от пояса.Я болею с рождения, но мне поставили правильный диагноз только два года назад.
«Я часто страдаю от язв и самопроизвольных кровотечений, у меня была открытая рана на правой ноге более десяти лет и инфекция после заражения. Врачи пробовали пересадку кожи, различные методы лечения и повязки, но ничего не помогло.
«Я получил Паддингтона, когда ему было всего девять недель. Его сразу привлекла эта область на моей ступне, и он начал естественно лежать на ней. Я думаю, он слышал, как течет артериальная кровь, и был привлечен к ней.
Паддингтон у Шинейд с девяти недель (фото: Caters) Паддингтон может залечивать открытые раны своего владельца, страдающего редким врожденным заболеванием (Изображение: Обслуживающие).«Центр научил Паддингтона использовать голову или лапы, чтобы оказывать давление на подобные области. Они научили его проводить терапию глубоким давлением по запросу ».
Педо пробовался в X Factor, пока полиция преследовала его за изнасилование девушки 10 лет‘Ни я, ни моя семья, ни моя команда врачей никогда не думали, что он, делая это, вылечит мою ногу, но это произошло из-за комбинации давления, которое является теплым, приспосабливающимся и неограничивающим, как обычно бывает с компрессионным бельем — по крайней мере мой опыт.’
Паддингтон, который должен закончить свое служебное обучение в апреле, также помогает Шинейд справиться с ее беспокойством и помогает студентке выбраться наружу, помогая ей удерживать равновесие, несмотря на увеличенную ногу.
Шинейд добавила: «Изначально я выбрала Паддингтона, потому что у него есть родинка — пятно белого меха на правой ступне — точно так же, как и рана на моей правой ноге. Это просто должно было быть.
«Он перевернул мою жизнь, и теперь я не могу без него».
Шинейд Эллис и Паддингтон (Изображение: Caters)Подробнее: World
Элизабет Бейкер, директор центра служебных собак Темзы, сказала: «Мы учим собак сердечному ритму и частоте сердечных сокращений, проигрывая им записи сердечных сокращений.
«Мы ускоряем и замедляем запись и учим собак распознавать изменение скорости с помощью какого-либо действия, например, подталкивания или возбуждения. Затем мы вознаграждаем их за такое поведение.
«Затем мы учим их лежать на коленях человека или обучаем их делать терапию глубоким давлением по требованию, относящуюся к конкретным частям тела.
«Пудели идеально подходят для подобных ситуаций, потому что стандартные пудели теряют меньше, чем другие породы».
Если вы хотите помочь Паддингтону стать квалифицированной служебной собакой, посетите страницу Gofundme Шинейд здесь.
Шинейд говорит, что ее жизнь изменилась с тех пор, как завела собаку (фото: Caters).Получите всю необходимую информацию последние новости, приятные истории, аналитика и многое другое
генетических синдромов от Нимы Резаи | ISBN 978-3-030-38378-7 | Fachbuch online kaufen
Генетика Хромосомные дефекты
Мутации одного гена
Аутосомно-доминантный
Аутосомно-рецессивный
Х-сцепленное наследование
Y-сцепленное
Митохондриальное
Геномное импринтирование
Мультифакторная ДНК МультифакторОкружающая среда
Инфекции
Токсины
Лекарства и лекарственные препараты
Радиация
Нутритивная недостаточность
Раздел 2: Врожденные синдромы Классификация: системные Специфические Нормальные особенности синдромы
Хромосомный синдром
синдром (мужской синдром XX)Слуховые аурикулярные синдромы
Велокардиофациальный синдром
Ушно-слуховые-офтальмоскелетно-мышечные синдромы
Гемифациальная микросомия
Сердечно-сосудистые синдромы 9000a5
da синдром
Синдром удлиненного интервала QT (LQTS)
Синдром Тауссига – Бинга
Сердечно-сосудистые, желудочно-кишечные и легочные синдромы
Синдром гетеротаксии
Сердечно-сосудистый, желудочно-кишечный и почечный синдром (синдром Милллера 100005) Синдром Алагона
: Q44.7)
Сердечно-сосудистые, кожно-мышечно-скелетные синдромы
Синдром извитости артерий
Сердечно-сосудистые, кожно-офтальмологические, легочно-урогенитальные синдромы
Синдром LEOPARD
Сердечно-сосудисто-кожно-костно-мышечный синдром
Асимметричное плачущее лицо (ACF) (кардиофациальный синдром Кейлера, частичный односторонний парез лица)
Кардиофациальный синдром (синдром Кейлера)
Синдром конотрункальной аномалии лица (CTAF)
Сердечно-сосудистый, эндокринно-неврологический синдром
Кардиоваскулярно-эндокринно-неврологический синдром Гематолого-неврологические синдромыСкелетные и сердечные пороки развития — синдром тромбоцитопении
Сердечно-сосудистые-неврологические синдромы
Синдром Эронду – Саймет
Микроцефалия-кардиомиопатия
Синдром Ла-
Сенсорно-сердечно-сосудистые синдромы Синдром Нге-Нильсена (JLNS)
Черепно-лицевые синдромы
Синдром макростомии Аблефарон
Синдром Холла 1
Синдром Хьюза (синдром акромегалоидной внешности (AFA))
Синдром Кеппена-Любинского
синдром Кеппена-ЛюбинскогоСиндром Кеппена-Любинского
Синдром Пьера Робина (PRS)
Синдром Рейна (RNS) (остеосклеротическая дисплазия костей)
Черепно-лицевой, ушной и слуховой синдромы
Синдром Абруццо – Эриксона
Синдром Пьера Робина (Вайссенбахера) 9000 (синдром Вейссенблера) -Аурикулоокулярарные синдромы
Жабрно-окуло-лицевой (BOFS) синдром (BOFS)
Синдром Берри (нижнечелюстно-лицевой дизостоз (MFD))
Черепно-лицевой-сердечно-сосудистый синдром
-кожно-черепно-сердечно-сосудистый синдром Неврологические синдромыСиндром делеции хромосомы 9p
C онгенитальный гипертрихоз-остеохондродисплазия-кардиомегалия синдром
синдром макияжа Кабуки (синдром Ниикава-Куроки)
черепно-лицевой, сердечно-сосудистый, кожный, скелетно-мышечный, неврологический, урогенитальный синдром
-Неврологические синдромыСиндром Голаби-Ито-Холла
Черепно-лицевые, сердечно-сосудистые, желудочно-кишечные, неврологические и почечные синдромы
Немецкий синдром (синдром триметадиона плода)
Краниофациальный синдром
0005 9000 Хромно-лицевой 9000-хромососудистый синдром 9000 Хромно-лицевой 9000-хромосомный 9000-хромосомный 9000-хромососудистый синдром 000 Хромно-лицевой 9000-хромососудистый синдром синдром делецииСиндром дупликации хромосомы 12q
Синдром дупликации хромосомы 12q
Трисомия хромосомы 15
Синдром Хо – Кауфмана – Мкалистера
Остеопатия полосатая с черепным склерозом (болезнь Фэйрбанка, синдром Вурхоува
) 9000 05
Черепно-лицевой, сердечно-сосудистый, костно-мышечный, неврологический синдромы
Синдром делеции хромосомы 8q
Синдром трисомии хромосомы 9
Синдром дупликации хромосомы 9q синдром (FHS)
Синдром Гамеля
Синдром Хантера-Фрейзера
Нейрофациодигиторенальный (NFDR) синдром
Синдром Нунана (синдром Тернера)
Синдром пилотто
Синдром Шпринцена
Мышечно-сосудисто-сосудистый синдромы
Синдром дупликации хромосомы 11q (синдром Якобсена)
Черепно-лицевой, сердечно-сосудистый, скелетно-мышечный, неврологический, глазной синдромы
Синдром дупликации хромосомы 10p
Тер Хаара, сердечно-сосудистый синдром
Мышечно-сосудистый синдром eletal-Неврологические-легочно-почечные синдромы
Синдром дупликации хромосомы 10q
Синдром делеции 20p хромосомы
Краниофациально-сердечно-сосудисто-скелетно-неврологические-почечные синдромы
Синдром
хромосомы
Дупликация хромосомыСиндром хромосомной тетраплоидии
Синдром Истмана-Бикслера (лицево-кардиоренальный синдром)
Черепно-лицевой, сердечно-сосудистый, скелетно-мышечный, неврологический, урогенитальный синдромы
Синдром дупликации хромосомы 2q 7000
000 Синдром дупликации хромосомы 9000 000 Синдром дупликации хромосомы000 Синдром дупликации хромосомы синдром
Синдром тетрасомии хромосомы 9p
Синдром хромосомы 10 кольца
Синдром дупликации хромосомы 10p / делеции 10q
Синдром дупликации хромосомы 14q
Синдром моносомы 21 хромосомы 900 05
Синдром Харрода
Черепно-лицевой, сердечно-сосудистый, скелетно-мышечно-мочеполовый синдромы
Трисомия хромосомы 2
Черепно-лицевой, сердечно-сосудисто-неврологические синдромы
Кардиофациально-кожно-неврологический синдром
Кардиофациально-кожно-хромосомный синдром
000 Хромосомный синдром000 Хромосомный синдром
000 Синдром дупликации 20q
Синдром Вильямса (WMS, WS) (синдром Бойрен, синдром Фанкони-Шлезингера)
Краниофациальный, сердечно-сосудистый, неврологический и слуховой синдромы
Синдром делеции хромосомы 6p
Краниофациальный синдром, сердечно-сосудисто-сосудистый
Дупликация 9q / синдром делеции 9p хромосомыЧерепно-лицевой, сердечно-сосудистый, неврологический, желудочно-кишечный и почечный синдромы
Трисомия по хромосоме 18 (синдром Эдвардса)
Черепно-лицевой, сердечно-сосудистый, неврологический,
хромосомный синдромы синдром делецииЧерепно-лицевой, сердечно-сосудистый, неврологический, гематологический и легочный синдромы
Трисомия по хромосоме 21
Черепно-лицевой, сердечно-сосудистый, неврологический, костно-мышечный, офтальмологический, офтальмологический, скелетно-мышечный, дупликационный синдром
000
000 Хромосомный синдром 9000 Сердечно-сосудистые, неврологические, скелетно-мышечные, аурикулоокулярно-урогенитальные синдромы
Рекомбинантный синдром хромосомы 8
Черепно-лицевой, сердечно-сосудистый, неврологический, почечный синдромы
Хромосомный 4p делеционный синдром (синдром Вольфиана-Хиршххала) -Урогенитально-слуховые синдромы
ЗАРЯД (колобома-болезнь сердца-атрезия хоан-задержка умственного развития и роста-генитальная гипоплазия-аномалии уха-глухота) ассоциация или синдром
Черепно-лицевой-сердечно-сосудистый-неврологический-урогенитальный синдромы
Синдром трисомии ома 13 (синдром Бартолина-Патау)
Черепно-лицевой, сердечно-сосудистый, почечно-мочеполовой синдромы
Синдром Потоцкого-Шаффера (PSS)
Черепно-лицевой-кожный-эндокринно-офтальмологический синдром
-кожно-кожно-офтальмологический синдром
-кожно-тестовый синдром
Синдром Лабанда
Черепно-лицевой, кожно-мышечно-скелетный синдромы
Окружные кожные складки-синдром психомоторной задержки
Кранио-лентикуло-шовная дисплазия (синдром Бояджиева-Ябса-
-Вильямс-скелетно-скелетно-мышечный синдром-Crani-Skull-
)
Кожно-черепной синдром
-Урогенитальные синдромыСиндром Дубовица
Черепно-лицевой, кожно-мышечно-скелетно-неврологический синдромы
Синдром Коффина-Лоури (СЛС) (синдром Коффина 2)
Синдром краниофронтоназальной системы, ретрансляции мозгового кровообращения, ретрансляции костного мозга
дисплазия-рыхлый скелет при синдромеГирсутизм-скелетная дисплазия-синдром умственной отсталости
Гипертрихоз-грубое лицо-брахидактилия-ожирение-синдром умственной отсталости
Синдром Ленца-Маевского (краниотубулярная дисплазия-задержка роста скелета-умственная отсталость) )
Синдром Лизона
Макроцефалия-капиллярная мальформация (M-CM)
Синдром Поллитта
Черепно-лицевой-кожно-скелетно-неврологический-офтальмологический синдром
Х-хромосомный синдром Конради – Хюнермана
Х-хромосомный синдром Хюнермана X-сцепленный Кожно-неврологические синдромы
Синдром дупликации хромосомы 8p
Синдром 17-го кольца хромосомы
Замедление роста, глазные аномалии, микроцефалия, брахидактилия, олигофрения (GOMBO) синдром
, аномалии скелета, ретардирование черепа, аномалии скелета, кожные аномалии ) синдром
Синдром триходентальной дисплазии, микроцефалии, умственной отсталости
Черепно-лицевой, кожный, неврологический и почечный синдромы
Синдром Сая 1
Черепно-лицевой, кожный, неврологический, скелетно-лицевой, урогенитальный синдром
Синдром мышечного кольца
Синдром дермато-когтевого-слезного зуба
Синдром Адамса-Оливера
Синдром отведенного большого пальца (синдром Кристиана 1)
Синдром приведенного большого пальца (синдром Гарейса-Мейсона)
Синдром Энтли-Бикслера
Синдром Аперта
Синдром Баллера-Герольда (BGS)
Синдром Карпентера
Синдром Кателя – Манцке
Синдром делеции хромосомы 17q
Синдром Эскобара (синдром множественного птеригиума)
Синдром Фэрбэнка-Китса (остеоглофоническая дисплазия 9000 (SPP 9000) SPОндилярные изменения-аномалия NAsal- STRIated-MEtaphyses))
Фетальный вальпроатный синдром (FVS)
Синдром Фримена-Шелдона (FSS) (синдром Виндмилла-Фейна-Хэнда)
Гелеофизическая дисплазия
Синдром Херста
Синдром Джексона 9-Вейссдона -микроцефалия-синдром низкого роста
Синдром Нагера
Орофациодигитальный (OFD) синдром V (синдром Терстона)
Орофациодигитальный (OFD) синдром X
Орофациодигитальный (OFD) синдром XI
Синдром Otopalatodigital
Otopalatodigital синдром
1
Синдром Рападилино
Синдром Сэтре-Чотцена (SCS)
Синдром Скотта
Синдром Симпсона-Голаби-Бемеля (SGB) (SGBS) (синдром Бульдога)
Синдром Снайдера-Робинсона (SRS)
Тайвань отопалатодигитальный (OPD) синдром I)
Синдром Уивера
Черепно-лицевой-скелетно-скелетно-эндокринные синдромы
Синдром дупликации хромосомы 9p e
Синдром делеции 10p хромосомы
Черепно-лицевой-опорно-двигательный-эндокринно-гематологические синдромы
Синдром Ван Гетема
Черепно-лицевой-мышечно-скелетно-неврологический синдром 300050005
-делеционный синдром 0005 -делеционный синдромСиндром делеции хромосомы 7q
Синдром инвертированной дупликации хромосомы 8p
Синдром дупликации хромосомы 8q
Синдром дупликации 12p хромосомы
Синдром дупликации 12p хромосомы
Синдром кольца хромосомы 14
Синдром
делеции хромосомы
0004 Синдромделеции хромосомы
18-кольцевой синдром
Синдром делеции 18p хромосомы
Синдром делеции 21q хромосомы
Синдром моносомы 22 хромосомы
Синдром диплоидной / триплоидной хромосомы
Хромосома XXXXX s синдром (пентасомия хромосомы X)
Синдром Костелло
Эдинбургский синдром мальформации
Лицевая дисморфия-гиперрастяжимость суставов-клинодактилия-задержка роста-задержка умственного развития
Фетальный аминоптериновый синдром
синдром фетального аминоптерина. Синдром Флоттинг-Харбора (FHS) (синдром Пеллетье-Лейсти)Синдром Фонтейна (синдром эктродактили-мандибуло-лицевого дизостоза)
Синдром Холла-Риггса
Синдром KBG
Синдром Келли (синдром микроцефально-цифровых аномалий
0004) Синдром менингоцелеСиндром Ленца-Маевского
Макроцефалия, лицевые аномалии, синдром непропорционального высокого роста, умственная отсталость
Синдром Мардена-Уокера (MWS)
Меркаптолактат-цистеиновая дисульфидурия 5000-короткая форма дисульфидурии (9000-0005000-короткая дисульфидурия) синдром отличительного лица e
Микроцефалия — легкая умственная отсталость — низкий рост — синдром аномалий скелета
Окуло-аурикуловертебральная (OAV) дисплазия (синдром Франческетти-Гольденхара, синдром Гольденхара (GS))
Синдром Орофациодигитала (OFD), синдром Джурофациоидигитала (OFD) VI ( Синдром Варади-Паппа)
Орофациодигитальный (OFD) синдром I (синдром Горлина 1, синдром Папийона-Леажа и Псома)
Орофациодигитальный (OFD) синдром II (синдром Мора)
Синдром Пфайффера 2
Синдром Пфайффера 3
-Синдром Роджерса-Данкса (PRDS)Pterygium colli-Умственная отсталость-синдром цифровых аномалий
Лучевые дефекты-треугольное лицо-телекант-разреженные волосы-карликовость-синдром умственной отсталости
Синдром Робертса (RS) (Аппельт-Геркен- Синдром Ленца)
Сан-Паулу Синдром MCA / MR
Синдром Сай-Мейера
Синдром SC фокомелии
Синдром Смита-Файнмана-Майерса (SFMS)
Так синдром Тоса (синдром Нево)
Синдром Шпринцена-Гольдберга
Спинальная мышечная атрофия-микроцефалия-синдром умственной отсталости
Спондиломета-эпифизарная дисплазия-синдром крайне низкого роста
Спондилометафизарная дисплазия II
Синдром Уивера-Вильямса
Синдром Видеманна-Раутенштрауха (WR)
Висконсинский синдром
Синдром Вудса
Синдром Зерреса
Черепно-лицевой, скелетно-мышечно-скелетно-мышечный синдром 9000-слуховой 9000-слуховой Аурикулоокулярные синдромы
Синдром Джене-Видеманна
Краниофациально-скелетно-неврологические-эндокринные синдромы
Синдром делеции хромосомы Xq
Синдром Чадли 1
Синдром Джоэдли
-Близзона е-психическая недостаточность-гипогонадизм-микропенис-контрактуры пальцев-расщелина губы-неба синдромЧерепно-лицевой-скелетно-неврологический-желудочно-кишечный синдромы
Синдром Опица-Кавеггиа (синдром Келлера)
Кранио-скелетно-костно-мышечный синдром
синдром (синдром Норио, синдром Пеппера)Черепно-лицевой, скелетно-мышечный, неврологический, офтальмологический синдромы
Трисомический синдром по хромосоме 8
Черепно-лицевой дисморфизм-отсутствие мозолистого тела-радужная оболочка-колобома-синдром
-синдром дисплазииСиндром дисплазии
Синдром Халлерманна-Штрейфа (HSS) (дисцефалия Франсуа)
Орофациодигитальный (OFD) синдром VIII
Орофациодигитальный синдром (OFD) IX
Псевдопрогерия / синдром Галлермана-Стрейффа (PHS)
Липидермия-микрофтальмия -синдром умственной отсталости
Расщепленная стопа-микрофт Халмия-расщелина губы / нёбо-синдром умственной отсталости
синдактилия-катаракта-синдром умственной отсталости
Черепно-лицевой, скелетно-мышечный, неврологический, офтальмологический, желудочно-кишечные синдромы
Синдром Карри-Джонса
-нервно-мышечный синдром -Мышечно-скелетно-неврологические-почечные синдромы
Синдром дефицита дистальных конечностей-умственная отсталость
Черепно-лицевой-мышечно-скелетно-неврологический-почечно-урогенитальный синдром
Синдром Мальпуека
Кранилофациально-краниально-лицевой синдром -глухота-крипторхизм-синдром умственной отсталости
Синдром дупликации хромосомы 2p
Синдром 15-го кольца хромосомы
Синдром тетрасомии хромосомы 21q
Синдром триплоидии хромосомы
Синдром инверсии хромосомы 9000
5
Синдром Рудигера
Синдром Рувалькабы
Синдром Виттвера
Черепно-лицевой-скелетно-мышечно-офтальмологические синдромы
Синдром Миллера (синдром Джинни-Видемана)
Орофациодигитальный (OFD) синдром
— Желудочно-кишечные синдромы
Синдром Айдахо
Черепно-лицевой, скелетно-мышечно-легочный синдромы
Синдром Фринса 3
Синдром Пойнтера
Черепно-лицевой, скелетно-мышечный, легочно-скелетно-легочный синдром
0005-слуховой 9 -0005 Синдром КалаброЧерепно-лицевой-мышечно-скелетно-почечный синдромы
Синдром Галлоуэя-Мовата
Черепно-лицевой-скелетно-почечный-урогенитальный синдромы Хромосомный синдром 18p-тетрасомии
Мышечно-лицевой синдром
синдром ребенкаСиндром эктродактилии-эктодермальной дисплазии-расщепления (EEC) (синдром Рюдигера 1)
Генитально-пателлярный синдром
Подколенный птеригиальный синдром (PPS)
Черепно-лицевой-птеригиальный синдром 9000-неврологический синдром 9000-хорезийный синдром 9000
Синдром Брукса
Церебро-окуло-назальный синдром
Синдром тетрасомии хромосомы 5p
Синдром 6-го кольца хромосомы
Синдром дупликации хромосомы 6q
Синдром дупликации хромосомы 7
Синдром делеции
Синдром делеции Синдром тетрасомии хромосомы 12p (синдром Паллистера-Киллиана)Синдром дупликации хромосомы 13q
Синдром делеции хромосомы 15q
Синдром делеции хромосомы 16q
Синдром делеции хромосомы 18q
Синдром дупликации хромосомы
синдром некоторой делеции 22q
Синехии с расщелиной неба и боковых синехий (CPLS)
Фетальный алкогольный синдром (FAS)
Изотретиноиновый синдром плода
Ганглиозидоз GM1, тип I (синдром псевдогурлероза Каффи
, тип)
Синдром Хайда-Форстера
Синдром яремного отверстия (синдром Верне)
Окулоцереброфациальный синдром Кауфмана
Синдром Миклесона
Синдром Питта-Хопкинса
Синдром псевдотоксоплазмоза
— Синдром ретроспективного синдрома Смита- Синдром ретроспективного синдрома Смита- (SMS)Синдром Ториелло-Кэри
Черепно-лицевой-неврологический-слуховой синдром
Синдром микроцефалии-глухоты
Черепно-лицевой-неврологический-аурикулоокулярный синдромы
Хромосомно-9000-синдром
—
-хромосомный 9000-хромосомный делеционный синдром 3q 2)
Микрофон Роцефалия-гипергонадотропный гипогонадизм-синдром низкого роста
Синдром Рамона
Черепно-лицевой-неврологический-желудочно-кишечный синдромы
Синдром Циммермана – Лабанда (ZLS)
Краниофациальный-9000-иммунологический синдром
0004-иммунологический синдромСиндром Чианкетти
Кранио-окулофронтоназальная мальформация
Черепно-лицевой-неврологический-офтальмологический-слуховой синдромы
Синдром Файн-Любинского
Краниофациальный-тороидальный синдром 9-0005-Офтальмологический
Синдром дупликации хромосомы 16p
Черепно-лицевой-неврологический-сенсоневрально-урологический синдромы
Синдром Юберга-Марсиди (JMS)
Черепно-лицевой-неврологический-урогенитальный синдромы
Хромосомный синдром
-дупликации
Хромосома 3-дупликация ионный синдром
Синдром хрупкости хромосомы X (синдром Эскаланте, синдром Мартина-Белла (МБС), синдром Ренпеннинга 2)
Синдром МакДермот-Винтера
Краниофациально-офтальмологические синдромы
Синдром Крузмикона
Краниофациальный синдром
Синдром Регенбогена-Доннаи (лицево-окулоакустико-почечный (FOAR) синдром)Черепно-лицевой-окулярно-мочеполовой
Хромосомный синдром дупликации 22q
Черепно-лицевой-урогенитальный синдром
