Arpimed
Если Вы беременны, планируете забеременеть или кормите грудью обратитесь за советом к Вашему лечащему врачу или фармацевту, прежде чем принимать любые препараты.
Если Ваш лечащий врач предупредил, что у Вас непереносимость к некоторым видам сахаров, свяжитесь с Вашим лечащим врачом, прежде чем принимать данный препарат, поскольку он содержит лактозу.
Как принимать Фолиевую кислоту
Следует всегда принимать Фолиевую кислоту в точности так, как предписано Вашим лечащим врачом. Если у Вас есть сомнения, Вы должны проконсультироваться с врачом или фармацевтом.
Проглатывайте таблетки, запивая водой.
Дозирование
Взрослые (включая пожилых людей):
- Для лечения фолиеводефицитной анемии: 5 мг в день (5 таблеток по 1 мг) в течение 4 месяцев, которая может быть увеличена до максимум 15 мг в день.
- Для предотвращения дефицита фолиевой кислоты, вызванного некоторыми препаратами:
- Для предотвращения дефицита фолиевой кислоты, вызванного длительным разрушением эритроцитов (гемолитической анемией) или почечным диализом: 5 мг (5 таблеток по 1 мг) каждые 1 — 7 дней.
- Для предотвращения развития дефектов нервной трубки плода (например, расщепление позвоночника) у женщин с повышенным риском его развития у плода: 5 мг (5 таблеток по 1 мг) за день до предполагаемой беременности, продолжить в течение первого триместра беременности.
- Для лечения дефицита фолиевой кислоты во время беременности: 5 мг (5 таблеток по 1 мг) в день продолжить до рождения ребенка.
Дети:
Для маленьких детей рекомендуется использовать более удобную лекарственную форму препарата.
- Для лечения фолиеводефицитной анемии: Дети 1-18 лет: 5 мг в день (5 таблеток по 1 мг) в течение 4 месяцев.

- Для лечения гемолитической анемии и метаболических расстройств: Дети 1-12 лет: 2.5 мг — 5 мг 1 раз в день (2.5 — 5 таблеток по 1 мг).
Дети 12-18 лет: 5 мг — 10 мг 1 раз в день (5 — 10 таблеток по 1 мг).
- Для предотвращения дефицита фолиевой кислоты при почечном диализе: Дети 1-12 лет: 250 мкг/кг массы тела (максимум до 10 мг) (до 10 таблеток по 1 мг) в день.
Дети 12-18 лет: 5 — 10 мг (5 — 10 таблеток по 1 мг) в день.
Если Вы (или кто-то другой) одновременно приняли большое количество таблеток, или если Вы думаете, что Ваш ребенок случайно проглотил таблетки, немедленно свяжитесь с сотрудниками скорой помощи ближайшей больницы или сообщите Вашему врачу.
Если Вы забыли принять Фолиевую кислоту
Если Вы забыли принять очередную дозу препарата, примите ее как только вспомните, затем примите следующую дозу в обычное рекомендованное время. Не принимайте двойную дозу, чтобы возместить пропущенный прием.
Не принимайте двойную дозу, чтобы возместить пропущенный прием.
МЕТОТРЕКСАТ ОРІОН инструкция UA/7608/01/01 (24616) Оріон Корпорейшн
Действующее вещество: метотрексат;
1 таблетка содержит 2,5 мг или 10 мг метотрексата эквивалент метотрексата безводного;
Вспомогательные вещества: лактозы моногидрат, крахмал кукурузный, крахмал прежелатинизированный, полисорбат 80, целлюлоза микрокристаллическая, магния стеарат.
Лекарственная форма. Таблетки.
Основные физико-химические свойства:
- таблетки по 2,5 мг: желтого цвета, круглые, выпуклые, без оболочки, с надписью «М 2,5» с одной стороны;
- таблетки по 10 мг: желтого цвета, капсуловидной формы, без оболочки, с насечкой и надписью «М 10» с одной стороны.
Фармакотерапевтическая группа.
Антинеопластические средства. Антиметаболиты. Структурные аналоги фолиевой кислоты. Код АТХ L01В А01.
Код АТХ L01В А01.
Фармакологические свойства.
Фармакодинамика.
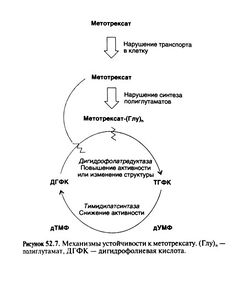
Метотрексат (4-амино-10-метилфолиевая кислота) — это антагонист фолиевой кислоты, ингибирующий восстановление фолиевой кислоты и рост клеток ткани. Метотрексат конкурентно угнетает фермент дигидрофолатредуктазу, предотвращая восстановление дигидрофолата до тетрагидрофолата, который необходим для синтеза ДНК и репликации клеток. В результате полиглютамации метотрексата, вызванной энзимом фолилполиглютамилатом, продолжительность цитотоксического эффекта действующего вещества в клетке увеличивается. Метотрексат является фазоспецифическим веществом, основное действие которого направлено на S-фазу митоза клеток. Как правило, наиболее эффективно он действует на активно пролиферирующие ткани, такие как злокачественные клетки, костный мозг, клетки плода, эпителий кожи, слизистую оболочку ротовой полости и кишечника, а также клетки мочевого пузыря. Поскольку пролиферация злокачественных клеток выше, чем большинства нормальных клеток, метотрексат может замедлять пролиферацию злокачественных клеток, не вызывая при этом необратимых поражений нормальной ткани.
Фармакокинетика.
Эффект перорально принятого метотрексата зависит от величины дозы. Пиковые концентрации в сыворотке крови достигаются в пределах 1-2 часов. Обычно доза метотрексата 30 мг/м2 или меньше абсорбируется быстро и полностью. Абсорбция доз, превышающих 80 мг/м2, неполная.
Приблизительно половина абсорбированного метотрексата обратимо связывается с белками сыворотки крови, однако легко распределяется в ткани. Выведение осуществляется по трехфазной схеме. В первой фазе метотрексат распределяется в организме, во второй — происходит почечная экскреция, и в третьей он попадает в энтерогепатическое кровообращение. Экскретируется преимущественно почками.
Приблизительно 41% дозы выводится в неизмененном виде с мочой в пределах первых 6 часов, 90% — за 24 часа. При нарушении почечной функции концентрация метотрексата в сыворотке крови и тканях может быстро увеличиться.
Клинические характеристики.
Показания.
Активный ревматоидный артрит у взрослых.
Распространенный хронический псориаз, особенно у пожилых пациентов и инвалидов, в случае недостаточной эффективности других видов терапии.
Острый лимфоцитарный лейкоз (поддерживающая терапия).
Противопоказания.
Значительные нарушения функции печени.
Значительные нарушения функции почек.
Ранее диагностированные патологические изменения клеток крови, в частности гипоплазия костного мозга, лейкопения, тромбоцитопения или выраженная анемия.
Алкоголизм.
Тяжелые, острые или хронические инфекции, иммунодефицитные состояния.
Беременность и период кормления грудью.
Повышенная чувствительность к действующему веществу или к какому-либо из вспомогательных веществ.
Вакцинация живыми вакцинами противопоказана в период лечения метотрексатом.
Язвы ротовой полости или желудочно-кишечного тракта.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий.
После абсорбции метотрексат частично связывается с альбумином сыворотки крови. Определенные лекарственные средства (например салицилаты, сульфонамиды, фенитоин, некоторые антибиотики, такие как пеницилины, тетрациклины, хлорамфеникол, ципрофлоксацин и цефалотин) уменьшают это связывание. В таких случаях при совместном применении может повыситься токсичность метотрексата. Поскольку пробенецид и слабые органические кислоты, например петлевые диуретики, а также пиразолы снижают канальцевую секрецию, нужно быть осторожным при применении этих лекарственных средств вместе с метотрексатом.
Необходимо избегать применения в комбинации с метотрексатом других потенциально нефро- и гепатотоксических средств (например сульфасалазин, лефлуномид, алкоголь). Следует быть особенно внимательными при наблюдении за пациентами, которые лечатся метотрексатом в комбинации с азатиоприном или ретиноидами.
Одновременное применение метотрексата и лефлуномида может увеличить риск панцитопении.
НПВС не следует применять до или одновременно с высокой дозой метотрексата. Есть сообщения, что комбинированное применение некоторых НПВС и высоких доз метотрексата повышает концентрацию метотрексата в сыворотке крови, желудочно-кишечную и гематологическую токсичность. При применении меньших доз метотрексата эти лекарственные средства, как было обнаружено в ходе исследований на животных, снижают канальцевую секрецию препарата и повышают его токсичность. Однако пациенты, которые страдают ревматоидным артритом, обычно хорошо переносили дополнительную терапию НПВС. Дозы метотрексата, которые применяются для лечения ревматоидного артрита (7,5 мг/неделю), не намного ниже тех, которые применяются для лечения псориаза. Более высокие дозы могут повлечь неожидаемую токсичность.
Витаминные препараты, которые содержат фолиевую кислоту или ее производные, могут изменить реакцию на метотрексат.
Есть сообщения, что триметоприм/сульфаметоксазол в единичных случаях повышал супрессию костного мозга из-за повышенного антифолатного эффекта.
Сообщалось о супрессии костного мозга и снижении концентрации фолатов при сопутствующем применении триамтерена и метотрексата.
Есть сообщение, что сопутствующее применение метотрексата и омепразола продлевает выведение метотрексата почками. При сопутствующем применении ингибиторов протонной помпы, таких как омепразол или пантопарзол, может возникнуть их взаимодействие.
Метотрексат может снижать клиренс теофиллина. Следует следить за концентрацией теофиллина при его применении в комбинации с метотрексатом.
Метотрексат повышает уровень меркаптопурина в плазме крови. При сопутствующем применении метотрексата и меркаптопурина может потребоваться коррекция дозы.
Вакцинация живыми вакцинами во время терапии метотрексатом противопоказана из-за угрозы тяжелых и летально опасных инфекций.
Цитотоксические препараты могут уменьшать всасывание фентоина, что может снижать эффективность фентоина и повышать риск приступов. Влияние фентоина на печеночный метаболизм может уменьшать эффективность цитотоксических препаратов или увеличивать токсичность.
Циклоспорин может потенцировать силу действия и токсический эффект метотрексата. Сопутствующее применение этих препаратов связано с риском иммуносупрессии и лимфопролиферации.
Особенности применения.
Метотрексат может назначать только врач с опытом проведения терапии антиметаболитами.
Одновременное применение гепатотоксических или гематотоксических противоревматических препаратов, таких как лефлуномид, не рекомендуется.
Были зарегистрированы летальные случаи острого и хронического интерстициального пневмонита, ассоциируемого с эозинофилией. Типичные симптомы: одышка, кашель (особенно сухой, непродуктивный) и лихорадка. Пациенты должны быть проинформированы о возможном пневмоните и обязательном немедленном обращении к врачу при возникновении стойкого кашля или одышки.
Если у пациента есть пульмонологические симптомы, лечение метотрексатом следует прекратить для исключения инфекции. Если есть подозрение, что заболевание легких вызвано метотрексатом, следует начать лечение кортикостероидами.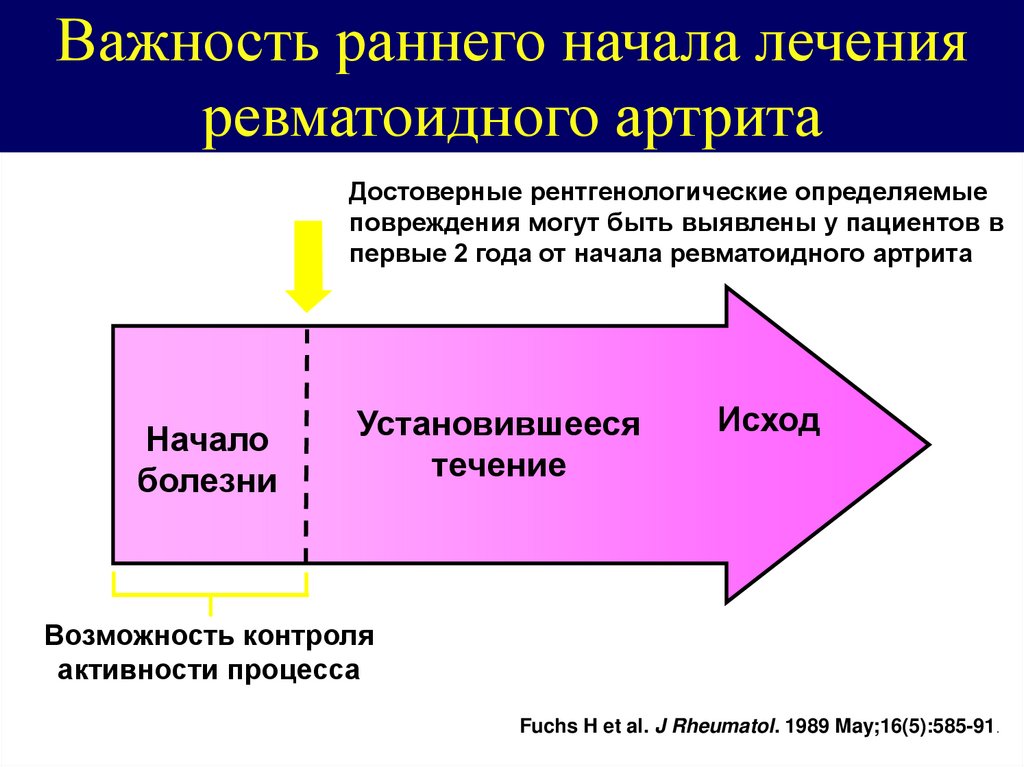 Лечение метотрексатом следует прекратить.
Лечение метотрексатом следует прекратить.
Лечение псориаза метотрексатом следует ограничить и применять при тяжелом, неконтролируемом и истощающем псориазе, который не дает достаточного ответа на другие виды лечения. Применение метотрексата следует начинать только после подтверждения диагноза с помощью биопсии и/или после консультации с дерматологом.
При лечении псориаза метотрексатом были зарегистрированы летальные случаи.
Следует с большой осторожностью применять метотрексат пациентам с инфекциями, язвой желудка или двенадцатиперстной кишки, язвенным колитом или истощением, пациентам очень молодого или преклонного возраста. Если в процессе лечения возникла глубокая лейкопения, возможна угроза бактериальной инфекции.
Перед началом терапии метотрексатом врач должен сообщить пациенту о возможных тяжелых, даже летальных токсических реакциях, которые ассоциируются с терапией метотрексатом. Пациентам следует рассказать о симптомах интоксикации и посоветовать им немедленно обратиться к врачу при их появлении.
Во время терапии следует тщательным образом следить за состоянием пациентов, которые лечатся метотрексатом.
Пациентам также следует отметить важность регулярных контрольных обследований и лабораторных анализов.
При возникновении побочных реакций следует снизить дозу лекарственного средства или прекратить лечение. Кроме того, следует рассмотреть необходимость применения кальция фолината и/или периодического гемодиализа с диализатором с высокой интенсивностью потока.
Диарея и афтозный стоматит являются распространенными токсическими реакциями, при их появлении лечение следует прекратить из-за риска развития геморрагического энтерита или летально опасной перфорации кишечника.
Пациента следует четко проинформировать о том, что при лечении псориаза и ревматоидного артрита препарат следует применять 1 раз на неделю. Врач, если считает нужным, может указать в рецепте день недели, когда следует принимать препарат. Пациент должен осознать, насколько важно придерживаться приема препарата 1 раз на неделю, а неправильное ежедневное применение может привести к тяжелым токсическим реакциям.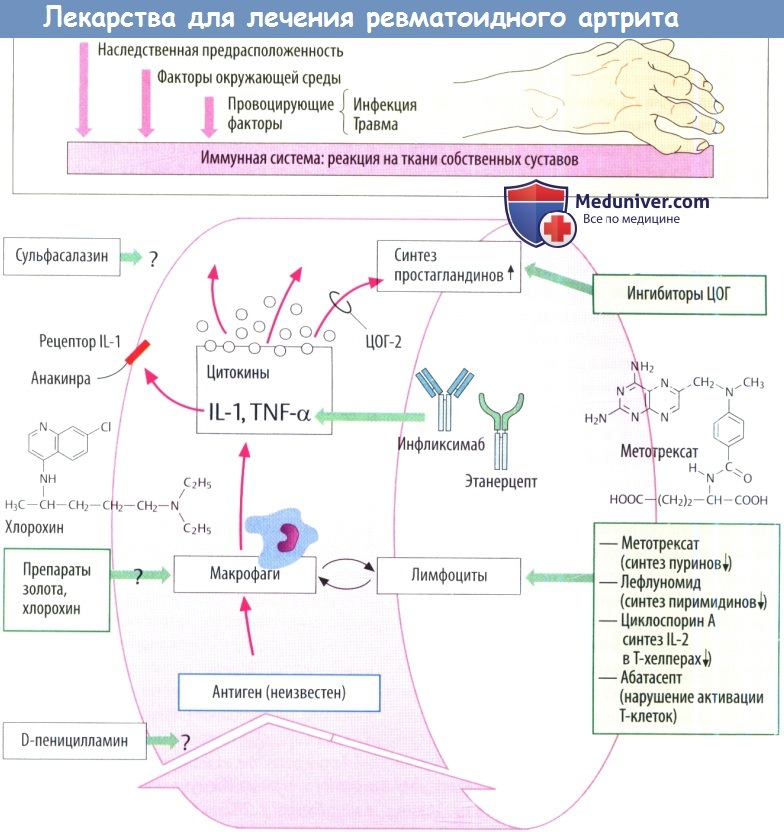
В начале лечения следует провести такие обследования: развернутый анализ крови, исследования функции печени и почек, рентгенологическое обследование органов грудной клетки. При лечении ревматоидного артрита и псориаза рекомендуется проводить такие контрольные тесты: гематологические обследования 1 раз в месяц, проверка функции печени и почек с интервалом 1-3 месяца. При значительном снижении количества лейкоцитов или тромбоцитов лечение следует немедленно прекратить. Пациент должен сообщить о других симтомах, которые указывают на наличие инфекции. Любые инфекции необходимо вылечить до начала терапии метотрексатом.
При лечении онкологического заболевания контрольные обследования следует проводить чаще. При наличии риска значительного повышения концентрации метотрексата в плазме крови, например, из-за высокой дозы или обезвоживания, гематологические обследования и проверку функции печени и почек, при необходимости следует проводить чаще. Во время терапии высокими дозами метотрексата следует также проверять щелочность мочи.
Выведение метотрексата снижено у пациентов с недостаточностью почечной функции, асцитом или плевральным выпотом. Эти пациенты нуждаются в особенно тщательном мониторинге, им может понадобиться снижение дозы метотрексата или прекращение терапии метотрексатом. Плевральный выпот и асцит должны быть дренированы до начала лечения метотрексатом.
При долговременном лечении пациентов с ревматоидным артритом или псориазом следует обращать внимание на повышенный риск повреждения печени. Метотрексат может оказывать гепатотоксическое воздействие, но обычно только после длительного применения. Были зафиксированы случаи атрофии, жировой дегенерации, некроза, цирроза и перипортального фиброза печени. К факторам риска тяжелого поражения печени относятся заболевания печени в анамнезе, завышенные показатели печеночных проб, употребление алкоголя. Из-за гепатотоксического действия метотрексата следует по возможности избегать других гепатотоксичных средств во время лечения. Следует избегать или резко снизить употребление алкоголя.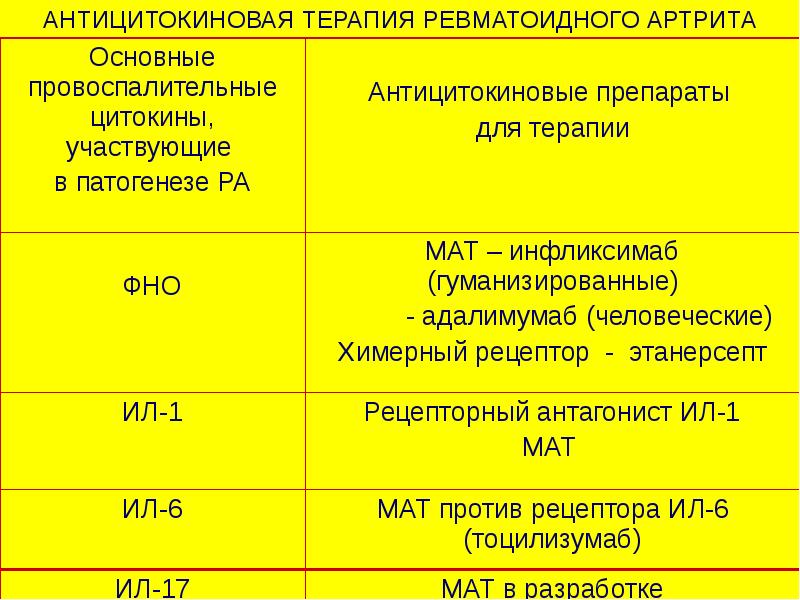 Риск токсического воздействия на печень повышен у больных, которые применяют инсулин.
Риск токсического воздействия на печень повышен у больных, которые применяют инсулин.
Исследование функций печени.
Особое внимание следует обратить на признаки поражения печени. Лечение не следует начинать или необходимо прекратить начатое лечение при отклонении от нормы уровня печеночных проб или биопсии печени.
Функции печени обычно нормализуются в течение 2 недель, после чего можно рассмотреть продолжение терапии. Биопсия печени является единственным надежным методом определения степени поражения печени, и ее результат следует принять во внимание во время принятия решения о лечении.
Мониторинг уровня сывороточных печеночных ферментов.
Кратковременное повышение уровня печеночных ферментов в 2-3 раза по сравнению с верхним пределом нормы было зафиксировано у 13-20% пациентов. Если уровень печеночных ферментов неоднократно повышается, следует уменьшить дозу или прекратить лечение. Необходимо следить за уровнем печеночных ферментов, особенно у пациентов, которые одновременно принимают другие гепатотоксические или миелотоксические средства (например лефлуномид).
Пациенты с риском нарушения функций печени.
Первичные факторы риска: избыточное употребление алкоголя, неоднократное повышение уровня печеночных ферментов, нарушения функции печени в анамнезе, в том числе хронический, аутоиммунный или вирусный гепатит, наследственные нарушения функции печени.
Вторичные факторы риска: сахарный диабет, ожирение, влияние гепатотоксических агентов в анамнезе.
Так как небольшое количество пациентов прекращает лечение по различным причинам после 2-4 месяцев терапии, пациентам с высоким риском следует провести первую биопсию в течение 3-6 месяцев после начала лечения.
Биопсия печени рекомендуется на протяжении лечения пациентам с повышением лабораторных показателей (АСТ или АЛТ более чем в 2 раза). Эта рекомендация также касается пациентов без склонности к нарушениям функции печени.
Биопсия печени не обязательна в следующих случаях: преклонный возраст, острое течение болезни, противопоказания к биопсии (нарушение сердечной функции, изменения показателей свертывания крови), ожидаемо короткая продолжительность жизни.
Необходимость биопсии печени следует оценивать в каждом конкретном случае и придерживаться национальных рекомендаций.
Почки.
Метотрексат преимущественно выделяется почками. Следует тщательным образом следить за функцией почек во время и после лечения. Нарушение функции почек возможно в результате значительного накопления метотрексата или даже повреждения почек. Следует быть осторожными при почечной недостаточности.
Дозу метотрексата следует уменьшить для пациентов с почечной недостаточностью. Высокие дозы могут привести к осаждению метотрексата или его метаболитов в почечных канальцах. Рекомендованными профилактическими мероприятиями являются достаточная гидратация и алкализация мочи до уровня рН 6,5-7 с внутривенным или оральным применением бикарбоната натрия (5×625 мг в таблетках каждые 3 часа) или ацетазоламида (500 мг внутрь 4 раза в сутки).
Значительная почечная недостаточность является противопоказанием к терапии метотрексатом.
Иммунная система.
Поскольку метотрексат влияет на иммунную систему, он может изменить реакцию на вакцинацию и результаты иммунологических тестов. Во время терапии следует избегать вакцинации живыми вакцинами.
Иммуносупрессивный эффект метотрексата следует учесть, если пациенту необходимо сохранение иммунного ответа.
Особое внимание следует уделять в случаях неактивных хронических инфекций (таких как опоясывающий лишай, туберкулез, гепатит В или С) из-за возможности их потенциальной активации.
У пациентов с опухолями, которые быстро растут, терапия метотрексатом может спровоцировать синдром «распада опухоли».
У пациентов, которые применяют низкие дозы метотрексата, могут возникнуть злокачественные лимфомы. В таких случаях лечение следует прекратить. Если лимфома не исчезает, следует начать цитостатическую терапию.
Сопутствующее применение метотрексата и радиотерапии может повысить риск некроза мягких тканей и костей.
Так как случаи энцефалопатии/лейкоэнцефалопатии имели место у онкологических больных, получавших метотрексат, это не исключает возникновения таких случаев у пациентов, принимающих метотрексат по показаниям отличных от раковых.
Терапия высокими дозами метотрексата должна сопровождаться применением фолината кальция. Во время применения фолината кальция, гидратации и алкализации мочи у пациента необходимо постоянно контролировать потенциальные токсические эффекты и выведение метотрексата.
Терапию фолинатом кальция следует прекратить при концентрации метотрексата в сыворотке крови ниже 5×10-8 M. При повышении концентрации креатинина в сыворотке крови дозу фолината кальция следует увеличить.
Серьезные побочные эффекты и летальные случаи были зарегистрированы при одновременном приеме метотрексата и нестероидных противовоспалительных средств (НПВС).
При лечении метотрексатом ревматоидного артрита можно продолжать лечение ацетилсалициловой кислотой и НПВС, а также небольшими дозами стероидов. Однако следует учитывать, что сопутствующее применение НПВС и метотрексата может составлять повышенный риск развития токсичности. Для пациентов с терапевтической реакцией на лечение метотрексатом дозу стероидов можно постепенно снижать.
Взаимодействие между метотрексатом и другими противоревматическими средствами, такими как золото, пенициламин, гидроксихлорохин, сульфасалазин или другими цитотоксическими средствами изучено не полностью, а их совместное применение может повысить риск частоты побочных реакций.
Одновременное применение метотрексата с антагонистами фолатов, такими как триметоприм, сульфаметоксазол, в редких случаях может повлечь острую мегалобластную панцитопению.
При острой интоксикации, вызванной метотрексатом, может потребоваться терапия фолиевой кислотой.
Метотрексат может вызывать побочные реакции со стороны мочевыводящей системы, такие как цистит и гематурия.
Мужчин и женщин, которые лечатся метотрексатом, следует проинформировать о неблагоприятном действии препарата на репродуктивную систему. Были зарегистрированы пороки развития яйцеклеток и спермы, олигоспермия, нарушение менструального цикла и бесплодие.
Метотрексат может вызвать снижение фертильности, олигоспермию, расстройства менструального цикла и аменорею в течение лечения и на короткий период после прекращения терапии. Был обнаружен тератогенный эффект метотрексата; это обусловливало эмбриотоксический эффект, спонтанный аборт, внутриутробную гибель плода и/или врожденные пороки развития плода. Метотрексат не показан женщинам репродуктивного возраста, если нет соответствующих доказательств, что польза применения ожидаемо превышает потенциальный риск. Метотрексат не следует назначать при псориазе беременным женщинам.
Был обнаружен тератогенный эффект метотрексата; это обусловливало эмбриотоксический эффект, спонтанный аборт, внутриутробную гибель плода и/или врожденные пороки развития плода. Метотрексат не показан женщинам репродуктивного возраста, если нет соответствующих доказательств, что польза применения ожидаемо превышает потенциальный риск. Метотрексат не следует назначать при псориазе беременным женщинам.
Мужская фертильность.
Метотрексат может быть генотоксическим. Мужчины, которые принимают метотрексат, должны использовать контрацептивные средства, поскольку было обнаружено, что метотрексат увеличивает количество дефектных сперматозоидов. Следует избегать оплодотворения на протяжении как минимум 6 месяцев после лечения. В случае приема высоких доз метотрексата для лечения рака рекомендуемый период контрацепции составляет 2 года.
Так как метотрексат может привести к тяжелым и необратимым патологическим изменениям образования спермы, мужчинам следует узнать о возможностях консервации спермы до начала лечения.
Репродуктивный риск, вызванный лечением, необходимо обсудить с пациентами репродуктивного возраста.
Препарат содержит лактозу. Пациентам с редкой наследственной непереносимостью галактозы, лактазной недостаточностью Лаппа или мальабсорбцией глюкозы-галактозы не следует применять это лекарственное средство.
Во время лечения метотрексатом необходимо избегать чрезмерного употребления напитков, содержащих кофеин и теофиллин (кофе, сладкие напитки, содержащие кофеин, черный чай).
Применение в период беременности или кормления грудью.
Период беременности.
Применение метотрексата противопоказано в период беременности. Есть данные о тератогенном влиянии на человека и несколько видов животных (пороки развития лицевой части черепа, сердечно-сосудистой системы и конечностей). У женщин репродуктивного возраста беременность следует исключить надлежащими методами, такими как тест на беременность, до начала лечения метотрексатом.
Пациентам, которые лечатся метотрексатом, следует посоветовать применять надежную контрацепцию во время терапии и на протяжении по меньшей мере 6 месяцев после ее завершения. В случае приема высоких доз метотрексата для лечения рака период избегания беременности должен составлять 2 года. Женщины репродуктивного возраста должны быть детально проинформированы о риске для плода, если они забеременеют во время лечения метотрексатом.
В случае приема высоких доз метотрексата для лечения рака период избегания беременности должен составлять 2 года. Женщины репродуктивного возраста должны быть детально проинформированы о риске для плода, если они забеременеют во время лечения метотрексатом.
Однако если пациентка забеременела в течение этого времени, ее следует проинформировать о рисках и потенциальном влиянии на развитие ребенка. Также она должна получить генетическую консультацию.
Поскольку метотрексат может быть генотоксическим, женщинам, планирующим беременность, следует получить генетическую консультацию до начала лечения.
Период кормления грудью.
Кормление грудью противопоказано при терапии метотрексатом, поскольку метотрексат проникает в грудное молоко и может вызвать интоксикацию у младенца.
Следует прекратить кормить грудью до начала лечения.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Во время лечения метотрексатом могут возникнуть симптомы со стороны центральной нервной системы, такие как повышенная утомляемость и головокружение, которые могут влиять на способность управлять автотранспортом или работать со сложными механизмами.
Способ применения и дозы.
Таблетки глотать не разжевывая за 1 час до или через 1,5-2 часа после приема пищи.
Таблетку по 10 мг можно разделить на равные дозы.
Лечение препаратом должно осуществляться под наблюдением врача-онколога, дерматолога или ревматолога, а также терапевта.
Дозы при ревматоидном артрите и псориазе.
Псориаз. Рекомендованная начальная доза — 7,5 мг в неделю однократно или в виде разделенных доз (3 раза по 2,5 мг с интервалами 12 часов).
Ревматоидный артрит. Рекомендованная начальная доза — 7,5 мг 1 раз в неделю.
Терапевтический эффект обычно отмечается уже в первые 6 недель лечения, после чего состояние пациентов продолжает улучшаться еще 12 и более недель. Если через 6-8 недель терапии признаков улучшения, а также признаков токсических эффектов нет, дозу можно постепенно увеличивать на 2,5 мг в неделю.
Обычно оптимальная недельная доза составляет 7,5-15 мг. Не следует превышать максимальную дозу 20 мг. Если после 8 недель лечения максимальной дозой эффекта нет, метотрексат следует отменить. В случае достижения терапевтического эффекта продолжают лечение в минимальных эффективных дозах. Оптимальная продолжительность терапии метотрексатом пока не определена, однако предварительные данные свидетельствуют о сохранении первоначального эффекта в течение не менее 2 лет в случае продолжения поддерживающей терапии. После прекращения лечения метотрексатом симптомы болезни могут возвращаться через 3-6 недель.
Не следует превышать максимальную дозу 20 мг. Если после 8 недель лечения максимальной дозой эффекта нет, метотрексат следует отменить. В случае достижения терапевтического эффекта продолжают лечение в минимальных эффективных дозах. Оптимальная продолжительность терапии метотрексатом пока не определена, однако предварительные данные свидетельствуют о сохранении первоначального эффекта в течение не менее 2 лет в случае продолжения поддерживающей терапии. После прекращения лечения метотрексатом симптомы болезни могут возвращаться через 3-6 недель.
Дозы при злокачественных онкологических заболеваниях.
Метотрексат можно применять перорально в дозе до 30 мг/м2 поверхности тела. Высшие дозы необходимо вводить парентерально. При поддерживающей терапии острого лимфолейкоза метотрексат применять детям перорально в дозах до 20 мг/м2 поверности тела в неделю в сочетании с внутривенным и интратекальным введением для профилактики поражения центральной нервной системы.
Лечение пациентов с нарушениями функции почек.
Метотрексат необходимо с осторожностью назначать пациентам с нарушениями функции почек. Дозы корректировать в зависимости от клиренса креатинина (при клиренсе > 50 мл/минуту снижать дозу нет необходимости, при клиренсе 20-50 мл/мин дозу снижать на 50%, а при клиренсе < 20 мл/минуту метотрексат не назначать).
Лечение пациентов с нарушениями функции печени.
Метотрексат назначать с большой осторожностью (в случае крайней необходимости) пациентам со значительными нарушениями функции печени (имеющимися или в анамнезе, особенно вызванными злоупотреблением алкоголем). Метотрексат противопоказано применять при уровне билирубина > 85,5 мкмоль/л.
Лечение пациентов пожилого возраста.
Поскольку с возрастом ухудшается функция печени и почек, а также снижаются резервы фолатов, целесообразно снижение доз для пациентов пожилого возраста.
Дети.
Препарат применять детям, больным острым лимфоцитарным лейкозом (в качестве поддерживающей терапии).
Передозировки.
Случаи передозировки, в том числе летальные, были зарегистрированы, когда метотрексат ошибочно принимали 1 раз в сутки вместо 1 раза в неделю. В таком случае обычно сообщали о гематологических и гастроэнтеральных симптомах.
Основная мишень метотрексата — органы кроветворения.
Фолинат кальция эффективно нейтрализирует прямое гематотоксическое действие метотрексата. Парентеральную терапию фолинатом кальция следует начинать не позже чем через 1 час после применения метотрексата. Доза фолината кальция должна быть, по меньшей мере, такой же, как и доза метотрексата, принятая пациентом.
При значительной передозировке необходима гидратация и алкализация мочи для предупреждения осаждения метотрексата и/или его метаболитов в почечных канальцах. Как было обнаружено, гемодиализ или перитонеальный диализ не влияет на выведение метотрексата. И наоборот, эффективный клиренс метотрексата был достигнут с помощью периодического гемодиализа с диализатором с высокой интенсивностью потока.
Для определения эффективной дозы фолината кальция и длительности терапии необходим контроль концентрации метотрексата в сыворотке крови.
Побочные реакции.
Обычно частота и тяжесть побочных реакций зависят от величины дозы, частоты и способа применения и длительности лечения.
При возникновении побочных реакций следует снизить дозу или прекратить терапию и прибегнуть к необходимым терапевтическим мерам, например применить кальция фолинат.
Наиболее распространенными побочными реакциями, вызванными метотрексатом, являются супрессия костного мозга, которая проявляется как лейкопения, и повреждение слизистой оболочки: язвенный стоматит, тошнота и другие желудочно-кишечные расстройства. Эти побочные реакции обычно являются обратимыми и исчезают приблизительно через 2 недели после снижения разовой дозы метотрексата или увеличения интервала между приемами и/или применения фолината кальция. К другим часто возникающим побочным реакциям относятся, например, недомогание, повышенная утомляемость, приступы холода и жара, головокружение и снижение иммунитета.
Метотрексат может вызвать синдром лизиса опухоли у пациентов с постоянно растущей опухолью.
Метотрексат вызывает побочные реакции чаще всего при высоких и часто повторяющихся дозах, например, при лечении онкологических заболеваний. Побочные реакции, о которых сообщали при применении метотрексата, приведены ниже в соответствии с системами органов. Частота возникновения побочных реакций имеет следующую классификацию: часто (> 1/100 и < 1/10), нечасто (> 1/1000 и < 1/100), редко (> 1/10000 и < 1/1000), очень редко (< 1/10000, включая отдельные сообщения).
Инфекции и инвазии.
Часто: инфекционные заболевания.
Нечасто: оппортунистические инфекции.
Редко: опоясывающий лишай, сепсис.
Доброкачественные, злокачественные и неопределенные новообразования (включая кисты и полипы).
Нечасто: лимфома1.
Со стороны кроветворной и лимфатической системы.
Часто: лейкопения.
Нечасто: супрессия костного мозга, тромбоцитопения, анемия.
Очень редко: гипогаммаглобулинемия.
Со стороны иммунной системы.
Нечасто: реакции анафилактического типа.
Со стороны эндокринной системы.
Редко: сахарный диабет.
Психические расстройства.
Редко: депрессия, спутанность сознания.
Со стороны нервной системы.
Часто: головная боль, головокружение, повышенная утомляемость.
Редко: гемипарез.
Очень редко: раздражительность, дизартрия, афазия, летаргия.
Со стороны органов зрения.
Очень редко: конъюнктивит, нечеткость зрения.
Со стороны сердечно-сосудистой системы.
Нечасто: носовое кровотечение.
Редко: артериальная гипотензия, тромбоэмболия.
Очень редко: перикардиальный выпот, перикардит, васкулит.
Со стороны органов дыхания.
Нечасто: пневмонит, интерстициальный пневмонит (может быть летальным), интерстициальный/легочный фиброз.
Редко: одышка.
Очень редко: пневмония, вызванная Pnevmocysta carinii, хроническое интерстициальное обструктивное заболевание легких, плеврит, сухой кашель.
Со стороны пищеварительного тракта2.
Часто: стоматит, анорексия, тошнота, рвота, диарея.
Редко: гингивит, фарингит, желудочно-кишечные язвы (включая язвы в ротовой полости) и кровотечение, энтерит.
Очень редко: гематемезис.
Со стороны гепатобилиарной системы.
Часто: повышенные концентрации трансаминаз.
Редко: гепатотоксичность, перипортальний фиброз, цирроз печени, острый гепатит.
Со стороны кожи и подкожной клетчатки.
Часто: эритематозная сыпь, алопеция.
Нечасто: зуд, синдром Стивенса-Джонсона, токсический эпидермальный некролиз.
Редко: фотогиперчувствительность, акне, депигментация, крапивница, мультиформная эритема, болезненность псориатических поражений, изъязвление кожи.
Очень редко: телеангиоэктазии, фурункулез, кровоизлияния в кожу.
Со стороны скелетно-мышечной системы и соединительной ткани.
Редко: остеопороз, артралгия, миалгия, увеличение ревматоидных узлов.
Со стороны почек и мочеиспускательной системы.
Нечасто: почечная недостаточность, нефропатия.
Очень редко: дизурия, азотемия, цистит, гематурия.
Со стороны репродуктивной системы и молочных желез.
Нечасто: изъязвление влагалища.
Редко: снижение либидо, импотенция, нарушение менструального цикла.
Очень редко: образование дефектных яйцеклеток или сперматозоидов, временная олигоспермия, бесплодие, влагалищное кровотечение, гинекомастия.
1 Могут быть обратимыми.
2 Тяжелые побочные реакции со стороны пищеварительного тракта часто требуют уменьшения дозы.
Язвенный стоматит и диарея требуют прекращения терапии метотрексатом из-за возможности развития язвенного энтерита и перфорации кишечника, которая может привести к летальному исходу.
Также сообщали о таких побочных реакциях, однако их частота неизвестна: панцитопения, агранулоцитоз, сепсис, приводящий к летальному исходу, выкидыш, нарушение внутриутробного развития плода, повышенный риск токсических реакций (некроз мягких тканей, остеонекроз) во время радиотерапии, эозинофилия, альвеолит, конвульсии, тампонада сердца, плевральный выпот, печеночная недостаточность, гиперпигментация ногтей, острая форма паранихии.
Состояние псориатических поражений может ухудшиться при одновременном влиянии метотрексата и ультрафиолетового излучения.
Срок годности.
3 года.
Условия хранения.
Хранить в оригинальной упаковке для защиты от действия света при температуре не выше 25 °C, в недоступном для детей месте.
Упаковка. По 30 или 100 таблеток во флаконе; по 1 флакону в картонной коробке.
Категория отпуска. По рецепту.
Производитель.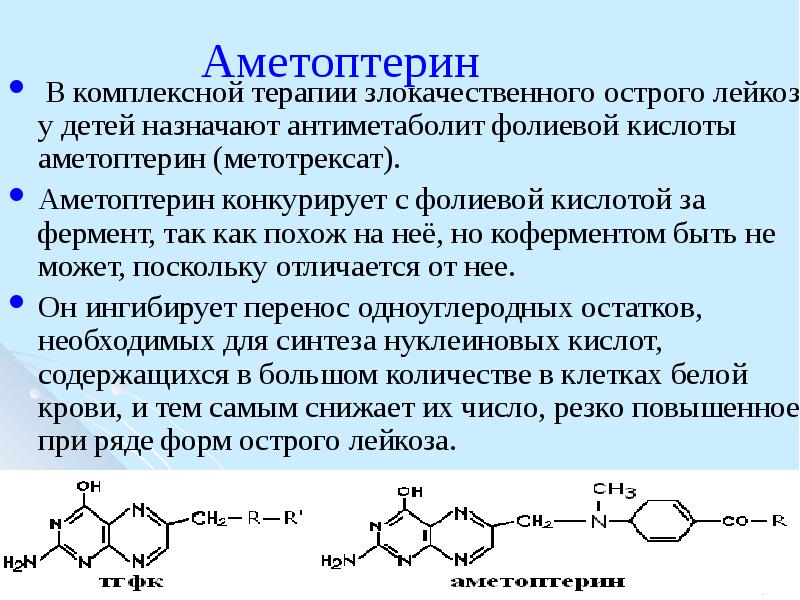 Орион Корпорейшн/Orion Corporation.
Орион Корпорейшн/Orion Corporation.
Местонахождение производителя и адрес места осуществления его деятельности. Орионинтие 1, 02200 Эспоо, Финляндия/Orionintie 1, 02200 Espoo, Finland.
Производитель. Орион Корпорейшн/Orion Corporation.
Местонахождение производителя и адрес места осуществления его деятельности. Тенгстроминкату 8, 20360 Турку, Финляндия/Tengstrominkatu 8, 20360 Turku, Finland.
Лечение ревматоидного артрита | РевмаКлиник
Данная информация дана для осознанного подхода пациентов к лечению, повышения приверженности к лечению.
Дозы и выбор препарата строго контролируются врачом.
Лечение стандартными базисными препаратами.
Метотрексат (МТ) — препарат «первой линии» лечения РА с доказанной эффективностью и безопасностью.
Лечение МТ следует начинать с дозы 10-15 мг/неделю с увеличением по 5 мг каждые 2-4 недели до 20-30 мг/неделя в зависимости от эффективности и переносимости. Длительность лечения определяется индивидуально, типичная продолжительность «курса» лечения одним препаратом составляет 2–3 года и более. В случае неудовлетворительной переносимости и эффективности метотрексата при приеме внутрь за счет диспепсии, препарат может быть назначен парентерально (одна внутримышечная инъекция в неделю).
Длительность лечения определяется индивидуально, типичная продолжительность «курса» лечения одним препаратом составляет 2–3 года и более. В случае неудовлетворительной переносимости и эффективности метотрексата при приеме внутрь за счет диспепсии, препарат может быть назначен парентерально (одна внутримышечная инъекция в неделю).
В начале лечения или при увеличении дозы МТ, определение АЛТ/АСТ, креатинина, общий анализ крови необходимо проводить каждые 1 −1,5 месяца до достижения стабильной дозы МТ, затем — каждые 3 месяца;
Лечение МТ следует прервать при повышении концентрации АЛТ/АСТ > 3 верхней границы нормы. Возобновить лечение в более низкой дозе после нормализации показателей.
На фоне лечения МТ обязателен прием не менее 5 мг фолиевой кислоты в неделю
При наличии противопоказаний (или плохой переносимости) для назначения МТ, следует назначить лефлуномид, сульфасалазин.
Генно-инженерные биологические препараты
Такие препараты рекомендуются при недостаточной эффективности (умеренная/высокая активность заболевания) базисной терапии стандартными базисными препаратами, которые должны применяться в адекватных дозах в течение
> 3х месяцев.
Нестероидные противовоспалительные препараты.
Для торможения воспалительной реакции врач назначает нестероидные противовоспалительные препараты (целебрекс). НПВП сочетают противовоспалительный, обезболивающий и жаропонижающий эффект, действуют на симптомы заболевания, но не тормозят прогрессирование болезни.
Глюкокортикостероиды.
Эти препараты обладают противовоспалительным действием, оказывают быстрый и ярко выраженный эффект в отношении клинических и лабораторных проявлений воспаления.
Глюкокортикостероиды(ГК) при данном заболевании применяются системно и локально.
Для системного применения показан основной метод лечения — назначение низких доз внутрь (преднизолон — до 10 мг/сут, метилпреднизолон — до 8 мг/сут) на длительный период при высокой воспалительной активности.
Для лечения тяжелых системных проявлений ревматоидного артрита (выпотной серозит, гемолитическая анемия, кожный васкулит, лихорадка и др. ) могут применяться средние и высокие дозы ГК внутрь (15 мг/сут и более, обычно 30–40 мг/сут в пересчете на преднизолон), а также пульс-терапия ГК — внутривенное введение высоких доз метилпреднизолона (250–1000 мг) или дексаметазона (40–120 мг).
) могут применяться средние и высокие дозы ГК внутрь (15 мг/сут и более, обычно 30–40 мг/сут в пересчете на преднизолон), а также пульс-терапия ГК — внутривенное введение высоких доз метилпреднизолона (250–1000 мг) или дексаметазона (40–120 мг).
Продолжительность лечения определяется временем, необходимым для купирования симптоматики, и составляет обычно 4–6 нед, после чего осуществляется постепенное ступенчатое снижение дозы с переходом на лечение низкими дозами ГК.
Для локального применения ГК назначаются в качестве дополнительного метода купирования обострений ревматоидного артрита и не могут служить заменой системной терапии. Для введения в сустав, либо для околосуставного введения применяют дипроспан.
При достижении стойкой ремиссии продолжительностью не менее 6 месяцев может быть рекомендована постепенная отмена НПВП и затем ГК (с соблюдением существующих рекомендаций по снижению дозы). После отмены ГК и НПВП возможно постепенное тщательно контролируемое прекращение лечения генно-инженерными препаратами. При сохранении стабильной ремиссии как совместное решение ревматолога и пациента возможно снижение дозы и постепенная отмена базисной терапии. В случае недостаточной стабильности ремиссии базисную терапию назначают неопределенно долго, в том числе пожизненно.
При сохранении стабильной ремиссии как совместное решение ревматолога и пациента возможно снижение дозы и постепенная отмена базисной терапии. В случае недостаточной стабильности ремиссии базисную терапию назначают неопределенно долго, в том числе пожизненно.
Скачать
фолиевая кислота для терапии — австралийский врач
Хотя добавление фолиевой кислоты считалось безопасным, растет опасение, что это может повысить риск рака. В Норвегии, где пища не обогащена фолиевой кислотой, два рандомизированных контролируемых испытания выявили повышенную заболеваемость раком среди пациентов, принимающих добавки для вторичной профилактики сердечно-сосудистых событий. В норвежском исследовании витаминов (NORVIT) и в западно-норвежском исследовании витаминов группы B (WENBIT) участвовали 6837 норвежцев, принимавших дополнительно фолиевую кислоту 800 мкг / день, витамин B 12 и витамин B 6 в различных комбинациях.У тех, кто принимал фолиевую кислоту в среднем 39 месяцев, с последующим наблюдением после исследования в течение 38 месяцев, наблюдалось увеличение заболеваемости раком (коэффициент риска 1,2) и смертности (коэффициент риска 1,38). Преобладающим раком был рак легких. 11
Преобладающим раком был рак легких. 11
Другие обсервационные исследования показали эффекты, зависящие от источника: фолиевая кислота в пище является защитной, в то время как добавки фолиевой кислоты вредны или не влияют на риск рака. 12 Шведское исследование показало, что риск рака поджелудочной железы снижается за счет диеты, богатой фолиевой кислотой, но не за счет пищевых добавок. 13
Доза и время приема добавок фолиевой кислоты относительно развития предраковых поражений могут иметь значение, но механизм, с помощью которого добавка может способствовать развитию рака, неизвестен. 14 После анализа риска Научный консультативный комитет Великобритании по питанию счел, что, несмотря на неопределенность, обязательное обогащение муки поддерживалось с мерами контроля, ограничивающими чрезмерное потребление фолиевой кислоты. 15
Нет доказательств того, что добавление фолиевой кислоты снижает риск колоректального рака, рака груди или простаты. Некоторые опубликованные исследования предполагают повышенный риск рака груди, простаты, колоректального рака и эндометрия при приеме добавок фолиевой кислоты.
Некоторые опубликованные исследования предполагают повышенный риск рака груди, простаты, колоректального рака и эндометрия при приеме добавок фолиевой кислоты.
Рак груди
Наблюдательное исследование показало, что прием фолиевой кислоты в дозе не менее 400 мкг / день приводит к 20% увеличению риска рака груди. 16 Тем не менее, исследование сердечно-сосудистой системы женских антиоксидантов и фолиевой кислоты не выявило связи с раком груди. 17 Аналогичным образом, другое исследование не обнаружило связи с раком груди, когда добавка фолиевой кислоты составляла 200 мкг / день или меньше. 18
Колоректальный рак
Рандомизированное контролируемое исследование профилактики колоректального рака у генетически предрасположенных пациентов обнаружило, что фолиевая кислота в дозе 1 мг / день в течение шести лет не предотвращала рецидив колоректальной аденомы. Однако он сообщил о повышенном на 67% риске прогрессирующих поражений со злокачественным потенциалом и о двукратном повышении риска наличия трех аденом.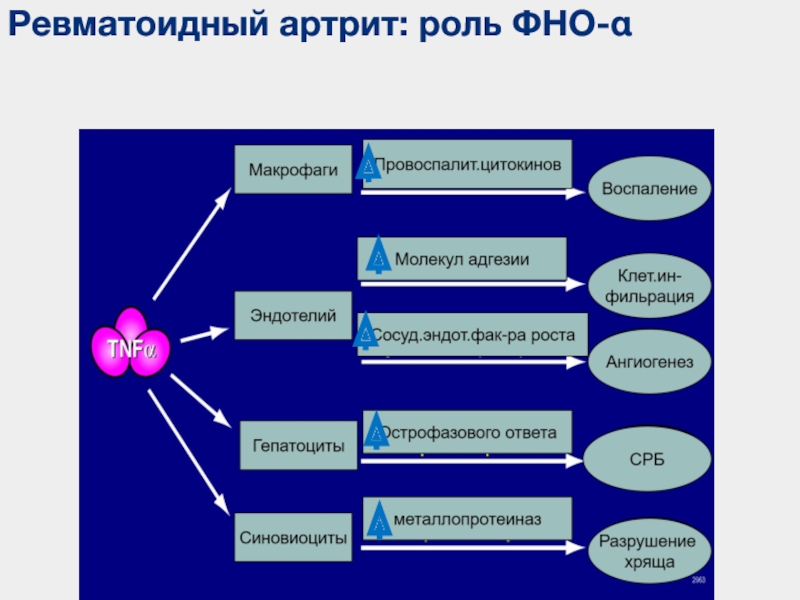 19
19
Ежедневная доза менее 200 мкг рекомендуется людям с колоректальными аденомами в анамнезе и лицам старше 50 лет из-за повышенного риска развития колоректального рака после этого возраста. 15
Рак простаты
Был проведен метаанализ 10 рандомизированных контролируемых испытаний перорального приема фолиевой кислоты в дозе не менее 400 мкг / день. Это показало небольшое, но значительное увеличение заболеваемости раком простаты по сравнению с контрольной группой. 12
Противовоспалительные механизмы метотрексата при ревматоидном артрите
Метотрексат при ревматоидном артрите
Метотрексат (МТ) — аналог фолиевой кислоты, первоначально синтезированный в 1940-х годах и разработанный для ингибирования дигидрофолатредуктазы.1 Восстановленный фолат (тетрагидрофолат) является проксимальным донором одиночного углерода в нескольких реакциях, участвующих в путях синтеза de novo пуриновых и пиримидиновых предшественников ДНК и РНК, необходимых для пролиферации клеток. Кроме того, тетрагидрофолат играет роль во второй важной биохимической стадии: метионин-гомоцистеиновый цикл, который необходим для обеспечения метильной группы для нескольких последующих реакций, таких как метилирование ДНК, белков РНК и других. Таким образом, метотрексат широко используется для лечения опухолевых заболеваний.В 1951 г. обоснование введения метотрексата для лечения ревматоидного артрита (РА) состояло в том, что он подавлял пролиферацию лимфоцитов и других клеток, ответственных за воспаление в суставе. в начале 1980-х годов, когда было сообщено о нескольких неконтролируемых исследованиях3-8
Кроме того, тетрагидрофолат играет роль во второй важной биохимической стадии: метионин-гомоцистеиновый цикл, который необходим для обеспечения метильной группы для нескольких последующих реакций, таких как метилирование ДНК, белков РНК и других. Таким образом, метотрексат широко используется для лечения опухолевых заболеваний.В 1951 г. обоснование введения метотрексата для лечения ревматоидного артрита (РА) состояло в том, что он подавлял пролиферацию лимфоцитов и других клеток, ответственных за воспаление в суставе. в начале 1980-х годов, когда было сообщено о нескольких неконтролируемых исследованиях3-8
Наконец, в четырех хорошо спланированных слепых плацебо-контролируемых исследованиях, опубликованных в 1984 и 1985 годах, было представлено использование метотрексата в лечении РА.9–12
Первые показания к применению метотрексата при ревматических заболеваниях были впервые представлены в большом обзоре в 1984 году.13 Из значительного опыта, полученного за последние 15 лет, несколько линий доказательств ясно показывают, что метотрексат действует не просто как цитотоксическое (антипролиферативное) средство. агент для клеток, ответственных за воспаление суставов при РА.14 На самом деле, было бы трудно понять, как лекарство, уменьшающее воспаление, предотвращая пролиферацию иммунных клеток, может работать в эффективных концентрациях только очень короткое время и один раз. неделя.Кроме того, быстрая клиническая ремиссия и кратковременное влияние на реактанты острой фазы, наблюдаемые при введении низких доз метотрексата у большинства пациентов с РА, а также быстрое обострение болезни после отмены препарата позволяют предположить, что механизм действия низкие дозы метотрексата могут быть более противовоспалительными, чем антипролиферативными (иммунодепрессивными) .15 , 16
Недавно было показано, что метотрексат обладает множеством противовоспалительных эффектов.17 Несмотря на то, что немногие исследования предполагают какое-либо специфическое влияние метотрексата на количество или функцию Т-клеток у пациентов с РА, метотрексат действительно оказывает явное ингибирующее действие in vivo и in vivo. vitro на нейтрофилы и особенно на моноциты / макрофаги, которые, как полагают, играют центральную роль в патофизиологии РА и воспалительном синовите.17-23
Эти и другие отдельные линии доказательств подтверждают мнение о том, что альтернативные механизмы ответственны за противоревматические / противовоспалительные эффекты метотрексата, которые будут рассмотрены здесь.
Клеточные эффекты метотрексата
МТХ представляет собой аналог фолиевой кислоты с аминогруппой (NH 2 ), метильной группой (CH 3 ) и полностью окисленным птеридиновым кольцом, что делает молекулу неактивной в качестве кофактора1.
После введения метотрексат доставляется в клетки так же, как парентеральные фолаты; 3–12% гидроксилируется в печени и циркулирует в виде 7-OH-MTX.24
Внеклеточный метотрексат доставляется в клетку рецепторами фолиевой кислоты (FRα, FRβ). После этого часть внутриклеточного метотрексата и 7-OH-MTX метаболизируется до полиглутаматов (MTX-glu) таким же образом, как и встречающиеся в природе фолаты.25 MTX-glu представляет собой долгоживущие производные, которые у крыс могут быть обнаружены в коже для в течение двух недель после однократного приема препарата.
Поскольку существует латентный период в несколько недель, прежде чем эффекты метотрексата будут оценены у пациентов с РА, внутриклеточные производные метотрексата-глю могут быть действительно активными противовоспалительными агентами.
MTX связывает дигидрофолатредуктазу (DHFR) с высоким сродством. MTX-glu связывает DHFR и имеет довольно высокое сродство к ферментам, которые требуют кофакторов фолиевой кислоты, включая тимидилатсинтетазу (TS) и 5-аминоимидазол-4-карбоксамид рибонуклеотид (AICAR) трансформилазу. Ингибирование TS, индуцированное метотрексатом, препятствует синтезу ДНК в активно делящихся клетках, а увеличение ферментной системы AICAR, которая играет ключевую роль в метаболизме пуринов в клетке, приводит к усиленному высвобождению аденозина в кровь.23 , 27 , 28
Фактически, ряд противовоспалительных эффектов, оказываемых метотрексатом, по-видимому, связан с увеличением внеклеточного аденозина и его взаимодействием со специфическими рецепторами клеточной поверхности с последующим ингибированием, таким как выработка интерлейкина 8 (IL8) мононуклеарными клетками периферической крови ( PBMC), секреция IL6 моноцитами человека, синтез лейкотриена B4 в нейтрофилах и снижение экспрессии гена синовиальной коллагеназы. , 29
Эффекты метотрексата через аденозин-индуцированную иммуносупрессию
Метотрексат обычно блокирует тетрагидрофолат-зависимые стадии клеточного метаболизма.Поскольку тетрагидрофолат и полиглутамилпроизводные тетрагидрофолата участвуют в биосинтезе пурина, может возникнуть несколько последствий, которые приведут к перепроизводству аденозина. В биосинтезе пурина две стадии зависят от тетрагидрофолата (рис. 1А). Существует преобладание опосредованного метотрексатом ингибирования второго фермента формилтрансферазы AICAR по сравнению с первым ферментом формилтрансферазой GAR (рис. 1A) .27 , 30
Рисунок 1Увеличение аденозина под действием метотрексата и последующая иммуносупрессия через аденозиновые рецепторы.(A) MTX ингибирует как преобразование GAR → FGAR, так и AICAR → FAICAR. Однако подавление второго шага сильнее, что приводит к накоплению AICAR. (B) Накопленный AICAR ингибирует AMP-дезаминазу и аденозиндезаминазу (ADA), что увеличивает аденозин-5′-P и аденозин (C). (D) Внутриклеточное накопление аденозин-5′-P и аденозина приводит к увеличению этих соединений во внеклеточном пространстве. Здесь аденозин-5′-P превращается в аденозин, который связывается со специфическими подтипами рецепторов A1, A2a и A2b (E).Вероятно, будет преобладание пути рецептора A2, что приведет к увеличению циклического аденозинмонофосфата (цАМФ) в клетке (F). (G) увеличение цАМФ приводит к иммуносупрессии. AMP = аденозин-5′-монофосфат; MTX = метотрексат.
Таким образом, произойдет относительное увеличение AICAR (рис. 1A). Сам по себе AICAR ингибирует важные этапы разложения аденозин-5′-P и аденозина под действием AMP-дезаминазы и аденсозиндезаминазы (ADA) соответственно (рис. 1B).
Ингибирование деградации этих двух внутриклеточных соединений приводит к увеличению внутриклеточного (рис. 1C) и внеклеточного аденозина-5′-P и аденозина (рис. 1D).27 На поверхности различных типов иммунокомпетентных клеток экто-5′-нуклеотидаза (CD73) превращает аденозин-5′-P в аденозин (рис. 1D) .31 , 32 Этот поверхностный фермент может регулироваться несколькими иммунными медиаторами, такими как интерлейкин 4 (IL4) и интерферон γ (IFNγ), которые снижают активность экто-5′-нуклеотидазы на PBMC.33 , 34 С другой стороны, сообщалось, что IL1 и фактор некроза опухоли (TNF) увеличивают активность этого фермента.35 Таким образом, местное микроокружение определяет активность этого фермента.
Внеклеточный аденозин может связываться с семью трансмембранными поверхностными рецепторами аденозина типов A1, A2α, A2β, A3, которые были обнаружены на многих различных типах клеток (рис. 1E) 17.
Порядок ранжирования аффинности связывания аденозина с этими подтипами рецепторов: A1> A2a> A2b.36 Рецептор аденозина A1 связан с белком Gα i / o , а рецепторы A2a и A2b связаны с Gα S. (рис. 1). Лигирование рецепторов А1 снижает внутриклеточный циклический аденозинмонофосфат (цАМФ) (рис. 1), тогда как связывание аденозина с рецепторами А2 увеличивает внутриклеточный цАМФ (рис. 1).Если бы пути через два разных подтипа рецептора A1 или A2a / b были функционально интактными, можно было бы ожидать преобладания пути A1 из-за более высокого сродства аденозина к подтипу рецептора A1. Это приведет к снижению цАМФ (рис. 1). Однако низкие дозы метотрексата оказывают противовоспалительное действие, индуцируя внеклеточный аденозин, который действует преимущественно через рецепторы A2a (14). , 17 , 37 , 38
Таким образом, кажется, что передача сигналов рецептора A1 отключена. Подобные эффекты были описаны в провоспалительной ситуации, когда путь через два рецептора смещен на Gα S (рис. 1F), что приводит к увеличению цАМФ.39
Кроме того, было показано, что цитокины могут активировать регуляцию подтипа рецептора A2, что может быть другим механизмом сдвига путей к Gα S , а не к Gα i / o .40 , 41 Неоднократно было показано, что увеличение цАМФ приводит к иммуносупрессии за счет ингибирования фагоцитоза, ингибирования секреции TNF, IFNγ, IL2, IL12, экспрессии HLA и многих других.42-47
Для аденозина через связывание с рецептором A2 было специально показано, что это вещество ингибирует пролиферацию лимфоцитов и продукцию TNF, IL8 и IL12.29 , 48 , 49 С другой стороны, аденозин через связывание с рецептором A2 увеличивает секрецию IL6 и IL10. , 51 Связывание аденозина с рецепторами A3 приводит к ингибированию секреции TNF, IL12 и IFNγ.52 , 53 В заключение, связывание аденозина с рецепторами A2 и A3 приводит к благоприятной ситуации, которая, вероятно, является одним из важных противовоспалительных механизмов действия метотрексата.
Влияние метотрексата на пролиферацию и апоптоз иммунных / воспалительных клеток
Недавние данные уже предполагают, что нарушение клеточного цикла, вызванное обработкой высокими дозами метотрексата, может быть начальным этапом апоптотической последовательности умирающих клеток и может объяснять антипролиферативные эффекты препарата.54 Участие системы рецептор / лиганд APO-1 / Fas (CD95) в индуцированном метотрексатом апоптозе было недавно идентифицировано в лейкозных клетках с пиком апоптоза между 24 и 48 часами.55
Кроме того, было обнаружено, что метотрексат заметно подавляет спонтанную пролиферацию клеток монобластного лейкоза U937 in vitro и индуцирует быструю экспрессию рецептора апоптоза CD95 также в присутствии 1,25-ОН-холекальциферола.56 Результаты другого недавнего исследования, согласуются с этими последними исследованиями и, по-видимому, предполагают, что промежуточные концентрации метотрексата (50 мкг / мл), полученные в сыворотке после лечения низкими дозами, могут вызывать как значительное ингибирование роста клеток, так и апоптоз, по крайней мере, в моноцитарных незрелых клетках (THP -1 клеточная линия) 57 (фиг. 2A).Для пролиферации клеток были подтверждены самые низкие концентрации метотрексата in vitro (от 5 до 500 нг / мл) как неэффективные.54 В этом исследовании не было получено значительного воздействия на пролиферацию синовиальных макрофагов при концентрации метотрексата 50 мкг / мл (достижимой в сыворотка с обработкой низкими дозами метотрексата при РА) .57
Рисунок 2Противовоспалительное действие, оказываемое низкими дозами метотрексата на уровне синовиальной ткани при РА. (A) Метотрексат снижает рост моноцитарных клеток и увеличивает их апоптоз. (B) Метотрексат снижает секрецию IL1 и IL6 и увеличивает продукцию IL1ra.В то же время MTX увеличивает экспрессию генов IL4 и IL10 и снижает экспрессию генов провоспалительных цитокинов Th2 (IL2 и IFNγ). (C) Метотрексат, по-видимому, косвенно ингибирует синтез ЦОГ-2 и хемотаксис нейтрофилов. (D) МТХ оказывает косвенное ингибирующее действие (посредством модуляции цитокинов) на продукцию синовиальной металлопротеиназы (ММП) и стимулирует их ингибиторы (ТИМП) (Е). MTX = метотрексат; IL1ra = антагонист рецептора интерлейкина-1; IFNγ = интерферон γ; СОХ-2 = циклооксигеназа-2; ММП = металлопротеиназа; ТИМП = тканевой ингибитор металлопротеиназы.
Объяснение отсутствия модулирующей активности метотрексата in vitro на рост синовиальных макрофагов и апоптоз, как уже было обнаружено для циклоспорина А, может заключаться в том, что метотрексат влияет только на незрелые дифференцирующиеся моноциты, а не на недифференцированные клетки (т.е. макрофаги соответственно) .58 , 59 Таким образом, эти данные свидетельствуют о том, что метотрексат может ингибировать рекрутирование незрелых и воспалительных моноцитов в участки воспаления и может снизить выживаемость этих клеток в воспаленной синовиальной ткани.57 год
В недавней статье исследовалось, связаны ли другие иммуносупрессивные свойства лечения низкими дозами метотрексата с апоптозом.
Исследование показало, что активированные Т-клетки периферической крови человека претерпевают апоптоз, индуцированный метотрексатом, который полностью устраняется добавлением фолиновой кислоты. Апоптоз активированных Т-клеток не требовал взаимодействия между CD95 (APO-1 / Fas) и его лигандом, и высвобождение аденозина составляло лишь небольшую часть этой активности метотрексата. Наконец, активация in vitro периферической крови, взятой у пациентов с РА после инъекции метотрексата, привела к апоптозу.18
Однако несколько исследований недавно показали, что низкие дозы метотрексата могут вызывать антипролиферативные эффекты на иммунные клетки из-за ингибирования дигидрофолатредуктазы и фолат-зависимого трансметилирования как механизмов, независимых от апоптоза.
Недавнее исследование показало, что пациенты с РА, получавшие метотрексат, экспрессировали низкие концентрации циркулирующих пуринов и пиримидинов, что приводило к снижению доступности синтеза ДНК и РНК и пролиферации клеток60.
Ингибирование мононуклеотидных предшественников нуклеиновой кислоты, особенно на стадии метилирования dUMP в dTMP с помощью тимидилатсинтазы, представляет собой еще одну причину нарушения синтеза ДНК и ингибирования пролиферации клеток, участвующих в воспалительном процессе в суставах.
Недавняя работа подтвердила, что низкие концентрации метотрексата ингибируют in vitro активность тимидилатсинтазы в человеческих РВМС.61
Как уже говорилось вначале, трудно связать наблюдаемые изменения уровней пурина и пиримидина непосредственно с фармакокинетикой метотрексата, поскольку клиренс метотрексата из крови происходит быстро. Следовательно, метаболические эффекты метотрексата можно объяснить преимущественно его полиглутамированными производными, которые образуются и накапливаются внутри клеток. Производные полиглутамата метотрексата могут влиять на метаболизм пурина и пиримидина и объяснять долгосрочные антипролиферативные эффекты при РА после лечения низкими дозами метотрексата один раз в неделю.62
В заключение, противовоспалительное действие метотрексата на клетки, ответственные за воспаление суставов при РА, может быть, по крайней мере частично, связано с антипролиферативными механизмами и механизмами, связанными с апоптозом.
Влияние метотрексата на моноцитарные и лимфоцитарные цитокины и их ингибиторы
Рассмотрение IL1 и TNFα, которые являются цитокинами, играющими центральную роль в воспалительном процессе и которые в основном продуцируются моноцитами / макрофагами на уровне синовиальной ткани RA, на ранней стадии исследования показали, что метотрексат подавляет выработку IL1 in vivo и ex vivo.20 , 63
Позднее было высказано предположение, что метотрексат напрямую препятствует связыванию IL1 с его рецептором и, таким образом, ингибирует клеточные ответы на IL1. 64 В качестве альтернативы, метотрексат за счет увеличения аденозина и связывания с рецепторами A3 может стимулировать антагонист рецептора IL1. (IL1ra) транскрипция и предположительно ее продукция. Недавние исследования, похоже, подтверждают эту возможность, поскольку было показано, что лечение метотрексатом вызывает менее воспалительный тип циркулирующих моноцитов у пациентов с РА, получавших низкие дозы, путем ингибирования секреции IL1 и IL8 и, параллельно, индукции IL1ra (рис. 2B). ).65 , 66
Более недавнее исследование, по-видимому, подтверждает возможные противовоспалительные эффекты метотрексата, опосредованные IL1ra, по крайней мере, на моноциты, поскольку значительное увеличение IL1ra было обнаружено при обработке низкими дозами культивированных человеческих моноцитарных клеток THP-1.57
Эффекты явно зависели от дозы и постепенно уменьшались с самыми низкими концентрациями метотрексата через 24 часа, в то время как наличие устойчивого состояния (через 48, 72 и 96 часов) указывало также на эффекты, зависящие от времени. Интересно, что высокие дозы метотрексата, как было обнаружено, вызывают значительное снижение IL1ra в культивируемых клетках THP-1 по сравнению с необработанными контрольными клетками; это снижение, вероятно, было связано с повреждением клеток (апоптозом).57 год
Моноциты продуцируют большее количество IL1, чем IL1ra, тогда как макрофаги продуцируют в основном IL1ra в культурах in vitro.67 Последние результаты подтверждают эти данные, поскольку было обнаружено, что базальная продукция IL1ra значительно выше из необработанных синовиальных макрофагов RA, чем из необработанных моноцитарных клеток THP-1. 0,57
Фактически, созревание в макрофаги моноцитов, которые входят в синовиальную ткань RA, характеризуется различными фенотипическими и функциональными изменениями, которые, по-видимому, включают более высокую продукцию IL1ra.68 , 69
Избыток продукции IL1ra происходит при активном RA, о чем свидетельствуют очень высокие уровни белка, обнаруженного в синовиальной жидкости пациентов с RA, даже несмотря на то, что продукция IL1ra в синовиальной ткани RA может быть недостаточной для подавления провоспалительные эффекты местного продуцируемого IL1.70
Ранее сообщенное исследование показало значительное увеличение IL1ra при обработке низкими дозами MTX культивированных моноцитарных клеток THP-1, тогда как MTX не смог изменить уровни IL1ra, продуцируемые культивированными синовиальными макрофагами RA.57 год
Недавно было также показано, что аденозин ингибирует экспрессию TNFα в моноцитарной клеточной линии и что моноциты высвобождают аденозин после лечения метотрексатом.52 , 71
Кроме того, недавние исследования показали как позднюю регуляцию синтеза растворимого рецептора TNFα (sTNFR p75) с помощью PBMC после 24 часов лечения метотрексатом, так и индуцированное метотрексатом увеличение sTNFR p75 из культивированных клеток монобластного лейкоза, что позволяет предположить дополнительные анти- воспалительный механизм через ингибирование эффектов TNFα.56
Краткосрочные противовоспалительные эффекты метотрексата могут включать ингибирование секреции IL6 культивированными моноцитами человека и, в ходе лечения RA, снижение продукции IL6, что может коррелировать с улучшением биологических параметров активности заболевания.29 , 72 , 73
Оказалось, что трудно изучать цитокины преимущественно лимфоцитарного происхождения при РА, такие как IL4, IL10, IL2 и IFNγ, потому что они слабо экспрессируются и продуцируются в синовиальной ткани RA.Однако в недавнем исследовании с использованием амплификации гена с помощью обратной транскриптазно-полимеразной цепной реакции влияние метотрексата на экспрессию генов этих цитокинов было проанализировано в МКПК пациентов с РА.74 Исследование показало, что под действием метотрексата in vitro наблюдается была увеличена экспрессия гена IL4 с помощью PBMC, стимулированных фитогемагглютинином, у пациентов с RA. Кроме того, MTX увеличивал экспрессию гена IL10 в тех же клетках. Повышенная экспрессия IL4 и IL10, двух взаимодействующих цитокинов с противовоспалительными свойствами, может частично объяснить эффективность метотрексата при РА (рис. 2B).75 Более того, действие метотрексата снижает экспрессию IL2 и гена IFNγ в PBMC пациентов с RA.
Это снижение индуцированной метотрексатом экспрессии генов IL2 и IFNγ (фенотип Th3) может быть вторичным по отношению к действию IL4 и IL10, которые ингибируют активность лимфоцитов фенотипа Th276.
В заключение, лечение метотрексатом при РА, по-видимому, снижает выработку провоспалительных моноцитарных / макрофагических цитокинов (IL1, IL6 и TNFα), по крайней мере, для увеличения экспрессии генов противовоспалительных цитокинов Th3 (IL4 и IL10) и для снижения экспрессии генов провоспалительных цитокинов Th2 (IL2 и IFNγ), что приводит к противовоспалительным эффектам.
Воздействие метотрексата на циклооксигеназы и липоксигеназу
Простагландины и лейкотриены активно участвуют в воспалительной реакции. В частности, простагландины являются важными медиаторами разрушения суставов при РА. В недавнем исследовании изучалось влияние метотрексата на метаболизм циклооксигеназы (ЦОГ) путем оценки синтеза простагландина E 2 (PGE 2 ) в культивируемых ревматоидных синовиоцитах человека.77 Результаты показали дозозависимое снижение индуцированного IL1 PGE . 2 культивируемыми синовиоцитами RA, что определяли обработкой MTX, тогда как инкубация MTX не влияла на экспрессию мРНК COX-1 и COX-2.77
В более позднем исследовании влияние метотрексата на активность ЦОГ-1 (тромбоксан В 2 ) и ЦОГ-2 (PGE 2 ) оценивали в цельной крови пациентов с РА, получавших метотрексат.78 Интересно, что ЦОГ- 2 активность была снижена в плазме пациентов с РА, получавших метотрексат, по сравнению со здоровым контролем. Ингибирование активности ЦОГ-2 было также обнаружено при совместной инкубации крови нормальных доноров с сывороткой пациентов с РА, получавших лечение метотрексатом. Однако прямое действие метотрексата на любой из ферментов было исключено.78
Ингибирующий эффект, оказываемый метотрексатом на хемотаксис нейтрофилов, обнаруженный в синовиальной жидкости пациентов с РА, может дополнительно определять снижение концентрации СОХ в воспалительных суставах (рис. 2С) .79
Лейкотриен LTB4 представляет собой продукт 5-липоксигеназы, который также может стимулировать выработку Т-клетками IL2 и IFNγ. Было обнаружено, что метотрексат снижает как синтез LTB4 нейтрофилами, так и общую концентрацию LTB4 в плазме у пациентов с РА, получающих еженедельно 10 мг метотрексата.80 Возможные фармакокинетические и клинические проблемы после совместного приема метотрексата, особенно при высокой еженедельной поддерживающей дозе ( но не в 7.5 мг) и нестероидные противовоспалительные препараты были предложены / наблюдались в связи с их конкуренцией за выведение почечными канальцами или нарушение метаболизма в печени.81 , 82
Однако недавнее исследование не обнаружило значительного влияния на фармакокинетику метотрексата у пациентов с РА, оценивая совместное применение метотрексата и специфического ингибитора ЦОГ-2.83 В заключение следует отметить, что в основном непрямое ингибирование, оказываемое низкими дозами метотрексата на циклооксигеназу и Продукты липоксигеназы вполне могут объяснить ее противовоспалительное действие, наблюдаемое при РА.
Действие метотрексата на металлопротеиназы и их ингибиторы
Считается, что разрушение суставов при РА частично связано с повышенным синтезом и активностью протеолитических ферментов, высвобождаемых активированными воспалением клетками, и представляет собой дополнительную причину хронического воспаления.
Раннее исследование показало, что метотрексат заметно снижает активность нейтрального металлоколлагенолитического фермента (NMCE), а также уровни NMCE в синовиальной и хрящевой тканях у пациентов с РА, получавших метотрексат, по сравнению с контрольной группой, не получавшей лечения.84
Кроме того, ретроспективный анализ образцов, полученных во время операции по замене сустава, показал, что синовиальная ткань у пациентов с РА, получавших метотрексат, имела меньший фиброз, чем у пациентов, получавших другие препараты, что дополнительно предполагает влияние метотрексата на уменьшение продукция протеиназы.85
В недавнем исследовании с помощью гибридизации in situ были проанализированы уровни информационной РНК (мРНК) коллагеназы, стромелизина и тканевого ингибитора металлопротеиназы-1 (ТИМП-1) на замороженных срезах синовиальной ткани пациентов с РА до и после лечения низкие дозы метотрексата (фиг.2D).86 Результаты показали значительное снижение экспрессии гена коллагеназы после лечения метотрексатом, тогда как уровни мРНК ТИМП-1 и стромелизина не изменились. Кроме того, метотрексат не изменял уровни коллагеназы или мРНК ТИМП-1 на фибробластоподобных синовиоцитах, обработанных метотрексатом, после воздействия ИЛ1.86
Кто-то может возразить, что снижение протеиназы, вероятно, вызвано одновременным опосредованным MTX понижающей регуляцией IL1, который индуцирует протеиназы в синовиальных фибробластах87 (рис. 2E). Следовательно, регуляция цитокинов кажется вероятной прямой причиной модуляции гена протеиназы, и предполагалось, что эффекты метотрексата на металлопротеиназы и их уровни ингибиторов представляют собой косвенный эффект, а не прямое влияние на экспрессию генов из-за связанного с метотрексатом изменения синовиальной оболочки. цитокиновая среда.86 , 88 Более недавнее исследование подтвердило влияние лечения низкими дозами метотрексата на уровни металлопротеиназы-1 (MMP-1) и TIMP-1 путем анализа исходных и четырехмесячных образцов синовиальной ткани, полученных от пациентов с РА.79
В этом исследовании снова было обнаружено значительное снижение отношения MMP-1 / TIMP-1 в синовиальной ткани пациентов, получавших метотрексат; снижение было связано со снижением уровней MMP-1, в то время как уровни TIMP-1 были относительно неизменными (рис. 2E).79
Наконец, другой недавний анализ показал, как ex vivo, так и in vitro, что усиление продукции TIMP-1 PBMC пациентов с РА и здоровых субъектов после лечения метотрексатом было связано с одновременным усилением высвобождения IL6.89 Эти последние результаты, по-видимому, подтверждают, что прямая регуляция цитокинов метотрексатом, вероятно, является косвенной причиной модуляции генов протеиназ и их ингибиторов, наблюдаемой у пациентов с РА после лечения метотрексатом.86
Перспективы и выводы
Низкие дозы метотрексата при лечении РА, по-видимому, оказывают противовоспалительное действие, действуя на разных уровнях патофизиологического каскада.Прямое ингибирующее действие на пролиферацию и индукцию апоптоза в клетках, участвующих в иммунной / воспалительной реакции, несомненно, представляет собой первый шаг вмешательства.
Однако сообщаемое ингибирование как моноцитарных, так и лимфоцитарных провоспалительных цитокинов, участвующих в ревматоидном синовите, по-видимому, играет ключевую роль в устойчивом противовоспалительном действии, оказываемом низкими дозами метотрексата.
Фактически, как снижение количества продуктов циклооксигеназа / липоксигеназа, так и снижение соотношения протеиназа / ТИМП-1, по-видимому, косвенно связаны с более ранней регуляцией цитокинов, определяемой лечением метотрексатом пациентов с РА.
Знания об основных механизмах действия метотрексата могут помочь объяснить проблему пациентов с РА, которые не отвечают на лечение или не поддаются лечению. Недавнее исследование показало, что экспрессия рецептора фолиевой кислоты β (FRβ) избирательно увеличивается в синовиальных макрофагах RA, и предполагает, что метотрексат транспортируется внутри клетки через FRβ.
Однако это исследование in vitro и другое недавнее исследование in vivo показали, что совместное введение метотрексата и фолиевой кислоты снижает клеточное поглощение и увеличивает общий клиренс метотрексата соответственно.91 Кроме того, недавнее исследование с учетом некоторых клинических переменных показало, что пациенты с РА, получавшие метотрексат без добавления фолиевой кислоты, имели значительно более низкую активность заболевания, чем контрольная группа, получавшая одновременно метотрексат и фолиевую кислоту.92 Однако авторы пришли к выводу, что добавление фолиевой кислоты кислота к метотрексату предотвратила некоторые побочные эффекты, даже с небольшой потерей эффективности. Следовательно, как уже предполагалось, совместное введение метотрексата и фолиевой кислоты может представлять возможную причину устойчивости к метотрексату при лечении РА и, по-видимому, связано с их конкуренцией за абсорбцию.93 Большинство исследований предлагают отложить введение фолатов, чтобы избежать влияния на противовоспалительные эффекты метотрексата. 93-96
Исследования показывают, что аденозин отвечает за противовоспалительное действие метотрексата, но недавнее исследование модели РА с адъювантным артритом показало обратное противовоспалительное действие антагонистов аденозиновых рецепторов, таких как теофиллин и кофеин.97 Фактически, частое употребление кофеина или теофиллина может представлять собой дополнительную причину снижения ответа на низкие дозы метотрексата при РА, как недавно было подтверждено.98
В заключение следует отметить, что противовоспалительные эффекты лечения низкими дозами метотрексата при РА представляют собой биологическую и клиническую реальность.99 Противовоспалительная активность метотрексата представляет собой дополнительную важную поддержку для его длительного использования, в частности, при комбинированном лечении с другими противоревматическими препаратами. препараты планируется.
Рекомендации по применению метотрексата при ревматоидном артрите: увеличение и уменьшение дозы и способы введения
ВведениеПравильное использование модифицирующих заболевание противоревматических препаратов (DMARD) улучшило прогноз РА на основании их раннего применения и постановки конкретной терапевтической цели, направленной на достижение ремиссии или минимально возможной степени воспалительной активности.1–3 В этом смысле EULAR рекомендует начинать лечение DMARD сразу после постановки диагноза RA4.
Метотрексат (MTX) уже более 20 лет используется для лечения ревматоидного артрита. Особенности, которые делают метотрексат в качестве БПРП первого выбора, связаны с его низкой ценой, его благоприятным профилем безопасности, замедлением рентгенологического прогрессирования, клиническим опытом с высокой частотой ответа, непрерывностью лечения, доступностью и универсальностью доз и способов введения.Таким образом, после постановки диагноза заболевания он назначается в качестве лечения первой линии для лечения раннего и четко определенного РА, как рекомендовано различными обществами4–6, а также подходит в качестве базового лекарственного средства для комбинированной терапии7
Однако клиническая практика в нашей стране сильно различается в отношении начальной дозы, скорости и характера эскалации дозы, выбора путей введения и дозирования с одновременным применением фолиевой кислоты или фолиевой кислоты у пациентов с РА.Это связано с тем, что клиническая практика не может быть четко подтверждена соответствующими клиническими испытаниями.
Целью данного исследования является выработка рекомендаций для принятия решений при лечении РА у взрослых с помощью метотрексата, основанных на научных данных.
Материалы и методыДля подготовки консенсусного документа группа экспертов, которые разработали рекомендации (ER), состояла из 11 ревматологов из больниц Испанской национальной системы здравоохранения. ER работала в соответствии с методологической базой, изложенной в Плане качества Министерства здравоохранения в его справочном документе «Разработка руководств по клинической практике в национальной системе здравоохранения».8
Работа неотложной помощи в контексте использования метотрексата в лечении РА у взрослых была проведена с использованием структурированной методологии участия, в которой члены неотложной помощи определили 3 основных блока: (а) критерии показаний; (б) начальная доза и способ введения, а также изменения во время лечения; (c) критерии изменения дозы и отмены метотрексата. Для решения клинических вопросов был создан подробный указатель, к которому они позже применили методологию PICO, чтобы облегчить и управлять процессом поиска литературы и последующей разработки конкретных рекомендаций, разработанных в ответ на каждую поднятую проблему.Систематический обзор литературы использовался в качестве основного источника исходного запроса, клинических испытаний, когортных исследований, протоколов, обзорных статей и клинических руководств. Критерии фильтрации и пределы поиска были установлены панелью ER. Целью всего этого было сделать возможным обновленное и критическое прочтение ключевых аспектов имеющихся научных данных. Поиск статей, опубликованных с 1995 года, проводился как на английском, так и на испанском языках в таких базах данных, как PubMed, Cochrane Bookseller, База данных Trip и выдержки из конгрессов Испанского общества ревматологов (2005–2012), Европейская лига против ревматизма. (2012) и Американского колледжа ревматологии (2010–2011), а также в последнем обновлении таблиц данных метотрексата для пероральных и парентеральных препаратов (рис.1).
Первоначальный результат поиска дал 1241 статью. Соответствующие статьи отбирались в 2 этапа. В первом приоритет отдается заголовкам и рефератам (177), а во втором — консенсусным заявлениям, конкретным систематическим обзорам и самым последним статьям (46). Панель скорой помощи сочла необходимым в очень конкретных случаях дополнительный поиск в определенных областях терапевтической помощи, которые не были достаточно определены в первоначальной стратегии поиска (таблица 1). Из-за преобладания обзорных статей и клинических руководств, ссылки на сводный отчет литературы были расширены до 182 ссылок.
Классификация уровней доказательности (LE) и степени рекомендации (DR) была проведена на основе системных критериев Шотландской межвузовской сети рекомендаций (SIGN) 9 тем, в которых использовались диагностические критерии «Оксфордского центра доказательств медицины» (CMBE) . Для рекомендаций, которые уже имели NE и / или в других предыдущих документах, сохраняются оригиналы DR, со ссылкой на них в каждом случае.
Краткое изложение доказательств было оценено на совместной классной сессии, на которой было предложено 37 рекомендаций и 14 доказательств.Этот документ был отправлен членам ER для их индивидуальной оценки и голосования по их согласию, чтобы рассматривать эти рекомендации как соответствующие ответы на поставленные клинические вопросы. Наконец, 12 рекомендаций достигли согласия (A) более 70% были признаны подтвержденными официальными рекомендациями.
РезультатыНа основе поиска литературы и упомянутых статей, приоритезованных членами ER, был разработан этот документ, содержащий ответы на поставленные клинические вопросы, с целью уменьшить вариабельность использования метотрексата при лечении РА у взрослых.Здесь представлены 12 рекомендаций, которые достигли большего согласия среди членов комиссии ER. Из них 10 имеют свою научную основу в 28 цитируемых источниках, а 2 соответствуют рекомендациям, основанным на опыте и экспертном мнении группы ER.
Какую дозу метотрексата следует начинать при лечении ревматоидного артрита?Известно, что эффективность метотрексата зависит от дозы. Результаты некоторых исследований показывают, что начальная доза 7,5 мг / неделя часто была неэффективной, и во многих случаях требовалось ее увеличение через 6 недель.10,11 Кроме того, начальная доза 12,5–20 мг в неделю была более эффективной, чем 5–7,5 мг в неделю, без каких-либо различий в безопасности. 12 Таким образом, некоторые эксперты рекомендуют минимальную начальную дозу не менее 10 мг в неделю, хотя Сложнее прийти к соглашению о том, что рекомендовать в качестве оптимальной начальной дозы. Однако систематический обзор13 защищает оптимальную начальную дозу 10–15 мг / нед перорально с учетом конкретных характеристик каждого пациента. На основании этих данных рекомендуется доза не ниже 10 мг в неделю; но также могут быть рассмотрены более низкие дозы в зависимости от обстоятельств пациента (сопутствующие заболевания, низкий вес, возраст, функция почек, печень).
Рекомендация 1. При РА начальная доза метотрексата должна быть не менее 10 мг / нед. C [Shekelle], 15 A: 82%).
Через какой путь введения следует вводить метотрексат вначале?Выбор первоначального пути введения может быть согласован между врачом и пациентом. Обычно пациент предпочитает пероральный путь введения.Различные исследования показывают, что относительная биодоступность метотрексата перорально по сравнению с метотрексатом, вводимого внутримышечно, является хорошей при низких дозах, но снижается при более высоких дозах (таблица 1) .16–18 Учитывая, что взаимосвязь между биодоступностью при пероральном приеме и парентеральной дозой составляет 1 для общих доз 7,5. мг, она становится 0,85 (диапазон 0,77–0,93), когда общая доза достигает 10–15 мг, и снижается до 0,64 (диапазон 0,21–0,94) при дозах 15–20 мг. Следовательно, доза менее 20 мг / неделю, простота использования и низкая стоимость перорального метотрексата позиционирует его как предпочтительный путь введения при RA14; однако после 15 мг / неделю нет доказательств того, что пероральный путь лучше, чем парентеральный.
Тем не менее, существуют ситуации, в которых парентеральный путь следует рассматривать как путь выбора с самого начала: пациенты с полипрагмазией, имеющие избыточный вес или ожирение (поскольку вводимые дозы выше), низкая комплаентность в зависимости от предпочтений пациента для уменьшения определенных желудочно-кишечных трактов. побочные эффекты или во избежание ошибок при приеме лекарств. Кроме того, экспериментальные данные, по-видимому, указывают на то, что подкожное (п / к) начало особенно полезно у пациентов с активным длительным заболеванием (DAS 28 ≥ 4) .19
Рекомендация 2: Пациентам с РА рекомендуется начинать лечение метотрексатом. предпочтительно пероральным путем.Тем не менее, следует рассмотреть возможность подкожного или внутримышечного введения у пациентов с плохой комплаентностью, недостаточной эффективностью или желудочно-кишечными 14 побочными эффектами (уровень доказательности 4 [SIGN], 9 DR: D [SIGN], 9 A: 91%).
Когда клиницисту следует изменить способ введения? Переход с перорального на подкожныйНекоторые исследования показали, что при переходе на инъекции следует учитывать пациентов с плохой комплаентностью, недостаточной эффективностью и / или побочными эффектами со стороны желудочно-кишечного тракта (когда метотрексат вводился перорально). 23, потому что могут быть достигнуты лучшие результаты и эффективность.Было доказано, что переход на п / к пероральный у пациентов с отсутствием ответа или токсичности оказался полезным, при этом ответы на 30% выше по критериям ACR20.19 Кроме того, это изменение у пациентов с неадекватным ответом может быть рентабельным, поскольку оно может предотвратить или отсрочить терапию биологическими агентами.23–25
Рекомендация 3: У пациентов с РА, принимающих метотрексат перорально, имеющиеся данные оправдывают переход на подкожный путь введения, когда отсутствие терапевтического ответа выражается против активности заболевания или желудочно-кишечного тракта. присутствует токсичность или терапевтическая неэффективность, поскольку подкожное введение связано с лучшим ответом на лечение25 (УД: 4 [ЗНАК], 9 DR: D [ЗНАК], 9 А: 100%).
Рекомендация 4: Его лучшая экономическая эффективность в исследованиях свидетельствует о целесообразности перехода от перорального введения метотрексата к парентеральному у пациентов с неадекватным ответом, поскольку данные показывают, что это предотвращает или задерживает последующую терапию биологическими агентами23,25,26 (LE : 4 [ЗНАК], 9 DR: D [ЗНАК], 9 A: 82%).
Переход с подкожного перорального введенияПричины перехода с подкожного введения на пероральный: непереносимость подкожного введения, предпочтения пациентов, снижение дозы до менее 7.5 мг или терапевтическая неудача.
Кроме того, было замечено, что если после перехода на пероральный прием с п / к, кто-то хочет вернуться к п / к, частота ответа может быть ниже по сравнению с первой партией парентерального метотрексата. 19,21
Рекомендация 5: Некоторые Критерии клинической помощи могут оправдать изменение пути введения метотрексата с п / к перорально у пациентов с РА: предпочтения пациентов, непереносимость п / к пути введения, снижение дозы до уровней
мг / неделю или низкая комплаентность14 (уровень доказательности 4, [SIGN ], 9 DR: D / √ [ЗНАК], 9 A: 82%).Как следует увеличить дозу метотрексата? Схема и время действияНекоторые исследования показывают, что начальные дозы 25 мг в неделю перорально или терапевтические стратегии быстрого повышения начальной дозы с 5 мг в месяц до 25–30 мг в неделю связаны с большей эффективностью; хотя и с повышенной токсичностью по сравнению с начальными схемами приема 5–15 мг / неделя или стратегиями медленного увеличения дозировки 5 мг / 3 месяца12, 27,28. Эти результаты подтверждают, что достижение высоких доз (25–30 мг / неделя) за короткий период времени эффективен, но может вызвать больше побочных эффектов.13 Следует также отметить, что другие исследования с более агрессивными стратегиями по сравнению с обычными моделями увеличения не показали статистически значимых различий в терапевтическом ответе.29,30
Более того, в диапазоне доз 2,5–30 мг / неделю метотрексата легко получить достигают титрования дозы с небольшим шагом 2,5 мг, предлагая даже новые препараты для парентерального введения. Они полезны при проблемах с переносимостью из-за быстрого увеличения дозы из-за недостаточной эффективности перорального препарата.31,32
После оценки этих доказательств группа экспертов утвердила 2 рекомендации:
Рекомендация 6: После определения начальной дозы метотрексата, если адекватный ответ у пациентов с РА не достигнут, приступите к быстрому увеличению дозы до 15–20 или даже 25 мг в неделю примерно за 8 недель. Перед увеличением дозы следует установить клинико-терапевтический 4-недельный период наблюдения с предыдущей дозой, чтобы определить, эффективна она или нет.В случае недостаточного клинического ответа рекомендуется повышать дозу на 2,5–5 мг каждые 2–6 недель, в зависимости от тяжести заболевания, до максимум 25 мг еженедельно24 (уровень доказательности 5 [Оксфорд], 33 DR: D [Оксфорд], 33 A : 100%).
Если после 8 недель приема высокой дозы метотрексата ответа не наблюдается, лечение следует прекратить, как указано во вкладыше по метотрексату.
Как врачу следует снизить дозу метотрексата? Схема, время и способ введенияИз-за нехватки доказательств, касающихся снижения дозы метотрексата, эксперты согласились разработать свои собственные рекомендации.Целью уменьшения масштаба является достижение минимальной эффективной дозы для поддержания полной ремиссии (DAS 282.6).
Рекомендация 7. Уменьшение масштаба рекомендуется, когда полная ремиссия сохраняется в течение определенного периода времени, в зависимости от дозы:
мг / нед. Снижение дозы начнется при устойчивой ремиссии в течение как минимум 6–12 месяцев (уровень доказательности 4 [ ЗНАК] 9, DR: D / √ [ЗНАК] 9, A: 91%).Рекомендация 8: У пациентов с РА в качестве общего руководства по уменьшению MTX рекомендуется снижение в 2 раза.Следует принимать 5–5 мг каждые 3–6 месяцев (УД: 4 [ЗНАК], 9 ДР: Д / √ [ЗНАК], 9 А: 91%).
Как упоминалось выше, предыдущие исследования19 показывают последствия, которые могут возникнуть в результате изменения способа введения. Таким образом, согласовано, что:
Рекомендация 9: Мы рекомендуем отслеживать пациента во время принятия решения (УД: 4 [ЗНАК], 9 DR: D / √ [ЗНАК], 9 A: 100%).
Однако дозы ниже 15 мг подходят для перорального лечения. Таким образом, согласовано:
Рекомендация 10: При дозах
мг считается целесообразным обеспечить переход с подкожно на пероральный, за исключением случаев предшествующей непереносимости перорального приема или подозрений на улучшение эффективности, связанной с пероральным приемом. к способу введения (LE: 4 [SIGN], 9 DR: D / √ [SIGN], 9 A: 91%).Однако при уменьшении масштаба при смене парентерального на пероральное введение может потребоваться увеличение пероральной дозы до 2,5–5 мг / нед по сравнению с парентеральной дозой для поддержания эффективности лечения.
Каковы рекомендации по оценке и мониторингу для пациентов с ревматоидным артритом, получающих метотрексат?Интенсивный мониторинг воспалительной активности и безопасности лечения РА на ранних стадиях его развития связан с лучшими результатами в ремиссии и контролем активности воспалительного заболевания.13,34,35 Из рекомендаций ACR36 относительно соответствующей периодичности наблюдения за этими пациентами Visser et al.13 установили параметры для обзора лечения, а также его периодичность, хотя для последнего имеется меньше доказательств.
Рекомендация 11: Чтобы инициировать процесс увеличения дозы метотрексата, аналитический контроль АЛТ с / без АСТ, креатинина и общего анализа крови следует проводить каждый месяц или полтора до достижения стабильной дозы. С клинической и терапевтической точки зрения мониторинг рекомендуется каждые 1–3 месяца с мониторингом возможных побочных эффектов и изменений факторов риска при каждом посещении13 (уровень доказательности 4 [Оксфорд], 33 DR: C [Оксфорд], 33 A: 91% ).
Какие добавки с фолиевой кислотой должны быть у пациентов с ревматоидным артритом, леченных метотрексатом?Метотрексат уменьшает воспаление за счет механизма, связанного с метаболизмом фолиевой кислоты. У некоторых людей, принимающих метотрексат, может наблюдаться дефицит фолиевой кислоты, поэтому добавление фолиевой кислоты или фолиевой кислоты может улучшить переносимость и безопасность метотрексата (язвы в полости рта, желудочно-кишечные расстройства, диарея, гематологические нарушения, повышение уровня трансаминаз). Фолиевую или фолиновую кислоту вводят в виде одной таблетки по 5 мг в неделю, разделяя лекарство по крайней мере на один день относительно введения метотрексата.37,38
Регулярный прием добавок фолиевой / фолиновой кислоты обычно не влияет на эффективность метотрексата, хотя данные одного исследования показывают, что использование этих добавок может привести к небольшому увеличению дозы метотрексата для поддержания эффективности39.
Рекомендация 12: Пациентам с РА, получавшим метотрексат, рекомендуется введение 5 мг фолиевой или фолиновой кислоты в неделю, разделив прием этой кислоты от метотрексата на 24 часа 24 часа (уровень доказательности 1a / 1b [Shekelle], 15 DR: A [ Шекель], 15 А: 100%).
ОбсуждениеЭтот консенсус был достигнут с целью облегчить принятие решений в клинической практике врачей, участвующих в ведении пациентов с РА, получающих метотрексат, краеугольный камень лечения РА. Оптимизация — это процесс, используемый для модификации системы с целью повышения ее эффективности за счет использования доступных ресурсов. Это явно было целью нашего консенсуса, пытаясь поднять профиль клинического использования этого препарата.
Основываясь на предыдущих клинических вопросах, мы нашли доказательства, доступные в отношении начальной дозы метотрексата, 10,19–26 пути введения (и возможной возможности обмена) 14,19, терапевтического масштабирования, 12,14,24,27, 28,31,32,35 и оптимальное наблюдение за пациентом с помощью метотрексата.13,36 Основываясь на этих отчетах, группа экспертов сделала соответствующие рекомендации, подчеркнув такие вопросы, как то, кто должен начинать прием полных доз и быстро сокращать дозу, чтобы быстро получить контроль над болезнью. Мы также подчеркиваем полезность правильной оценки пути введения, всегда адаптируясь к индивидуальным характеристикам и клиническому статусу заболевания.
В заключение, в этой статье даются некоторые рекомендации по ведению метотрексата у пациентов с РА, особенно в процессе снижения дозы, что может облегчить принятие клинических решений и стандартизировать различные способы дальнейших действий.
Этическая ответственность Защита людей и животныхАвторы заявляют, что в данном исследовании не проводились эксперименты на людях или животных.
Конфиденциальность данныхАвторы заявляют, что они следовали протоколам своего рабочего места по публикации данных о пациентах, и все пациенты, включенные в исследование, получили достаточную информацию и дали письменное информированное согласие на участие в исследовании.
Право на неприкосновенность частной жизни и информированное согласиеАвторы заявляют, что в этой статье не приводятся данные о пациентах.
ФинансированиеИсследование было проведено за счет неограниченного гранта, предоставленного.
Конфликт интересовДоктор Хесус Торнеро Молина получил платежи за исследовательские проекты и конференции от компаний Abbvie, Gebro, Pfizer и Roche.
Д-р Джорди Карбонелл заявляет, что имеет консультативный контракт с Gebro.
Остальные авторы заявляют, что у них нет конфликта интересов по поводу статьи.
(PDF) Добавки фолиевой кислоты и лечение метотрексатом при ревматоидном артрите: обзор
Общая токсичность опосредуется различными метаболическими путями.
Фолиновая кислота не более эффективна, чем фолиевая кислота, в предотвращении побочных эффектов, связанных с
метотрексатом, может снизить эффективность метотрексата в определенных обстоятельствах
и стоит дороже. В качестве полностью восстановленного фолата
, который обходит дигидрофолатредуктазу, фолиновая кислота сохраняет роль
в лечении острой гематологической токсичности и передозировки метотрексатом
.
Согласно имеющимся данным, фолиевая кислота повышает частоту продолжения приема метотрексата
без снижения эффективности.Он практически не имеет побочных эффектов и стоит недорого (примерно 2 р в неделю в
UK) [39]. Новые данные о риске сердечно-сосудистых заболеваний у
пациентов с воспалительными заболеваниями и о потенциале снижения этого риска на
при добавлении фолиевой кислоты дают
дополнительный импульс для рассмотрения фолиевой кислоты у всех
пациентов, принимающих метотрексат.
Мы предлагаем регулярно назначать добавки фолиевой кислоты
всем пациентам, получающим метотрексат для лечения РА.Доза
5 мг, вводимая один раз в неделю перорально, вероятно, будет достаточной, хотя
нет данных, сравнивающих относительную пользу еженедельного и
ежедневного приема фолиевой кислоты. Необходимы дальнейшие исследования для
, чтобы предоставить доказательства выбора дозы, частоты и времени. Маловероятно, что время приема фолиевой кислоты
по отношению к метотрексату
повлияет на снижение побочных эффектов. В большинстве исследований
избегали введения фолиевой кислоты в тот же день, что и метотрексат.Чтобы свести к минимуму путаницу пациентов и повысить приверженность к лечению,
предложили единообразный и прагматичный подход к обеспечению
добавками фолиевой кислоты.
Мы рекомендуем однократную дозу 5 мг фолиевой кислоты один раз в неделю
, принимаемую утром после дня приема метотрексата.
Если побочные эффекты все еще возникают, можно рассмотреть вопрос о повышении дозы до 10 мг
в неделю.
Ожидаются результаты крупных проспективных исследований, оценивающих влияние добавок фолиевой кислоты
на сердечно-сосудистый риск.Все более заметная роль метотрексата
в лечении РА,
как отдельно, так и в сочетании с другими методами лечения, подчеркивает важность любой стратегии, которая может улучшить переносимость.
Авторы заявили об отсутствии конфликта интересов.
Список литературы
1. Кронштейн Б.Н. Молекулярная терапия. Метотрексат и механизм его действия
. Arthritis Rheum 1996; 39: 1951–60.
2. Губнер Р., Август С., Гинзберг В.Терапевтическое подавление реактивности тканей
. II. Эффект аминоптерина при ревматоидном артрите и псориазе
. Am J Med Sci 1951; 221: 176–82.
3. Morgan SL, Baggott JE, Vaughn WH et al. Влияние добавок фолиевой кислоты
на токсичность низких доз метотрексата
у пациентов с ревматоидным артритом. Arthritis Rheum 1990; 33:
9–18.
4. Хоффмайстер Р. Метотрексат при ревматоидном артрите. Артрит
Реум 1972; 15: 114.
5. Фелсон Д. Т., Андерсон Дж. Дж., Минан РФ. Использование компромиссов краткосрочной эффективности /
токсичности для выбора препаратов второго ряда при ревматоидном артрите.
Метаанализ опубликованных клинических испытаний. Arthritis Rheum
1992; 35: 1117–25.
6. Genestier L, Paillot R, Quemeneur L, Izeradjene K, Revillard JP.
Механизмы действия метотрексата. Иммунофармакология
2000; 47: 247–57.
7. Кронштейн Б.Н., Эберле М.А., Грубер Х.Э., Левин Р.И.Метотрексат
подавляет функцию нейтрофилов, стимулируя высвобождение аденозина из
клеток соединительной ткани. Proc Natl Acad Sci USA 1991; 88: 2441–5.
8. Аларкон Г.С., Трейси И.К., Блэкберн В.Д. мл. Метотрексат в лечении ревматоидного артрита
. Токсические эффекты как основной фактор, ограничивающий длительное лечение
. Arthritis Rheum 1989; 32: 671–6.
9. Ортис З., Ши Б., Суарес-Алмазор М.Э., Мохер Д., Уэллс Г.А., Тагвелл П.
Эффективность фолиевой кислоты и фолиевой кислоты в снижении токсичности метотрексата
желудочно-кишечного тракта при ревматоидном артрите.Метаанализ
рандомизированных контролируемых исследований. J Rheumatol 1998; 25: 36–43.
10. Morgan SL, Baggott JE, Vaughn WH et al. Добавление
фолиевой кислоты во время терапии метотрексатом при ревматоидном артрите.
Двойное слепое плацебо-контролируемое исследование. Ann Intern Med
1994; 121: 833–41.
11. Weinblatt ME, Fraser P. Повышенный средний корпускулярный объем как показатель
гематологической токсичности при терапии метотрексатом.
Arthritis Rheum 1989; 32: 1592–6.
12. Грифит С.М., Фишер Дж., Кларк С. и др. Нужны ли пациенты с ревматоидным артритом
, установленным на метотрексате и 5 мг фолиевой кислоты в день,
для продолжения приема добавок фолиевой кислоты в долгосрочной перспективе? Ревматология
2000; 39: 1102–9.
13. Стюарт К.А., Маккензи А.Х., Клаф Д.Д., Уилке В.С. Добавки фолиевой кислоты
при ревматоидном артрите, леченном метотрексатом,
пациента. Semin Arthritis Rheum 1991; 20: 332–8.
14. Национальные рекомендации по мониторингу препаратов второго ряда.
Лондон: Британское общество ревматологов, 2000.
15. Рекомендации по мониторингу лекарственной терапии ревматоидного артрита.
Специальный комитет по клинической практике Американского колледжа ревматологов
Руководства. Arthritis Rheum 1996; 39: 723–31.
16. van Ede AE, Laan RF, Rood MJ et al. Влияние добавок фолиевой или фолиевой кислоты
на токсичность и эффективность метотрексата при ревматоидном артрите
: 48-недельное многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование
.Arthritis Rheum 2001;
44: 1515–24.
17. Suzuki Y, Uehara R, Tajima C et al. Повышение уровня аминотрансфераз в сыворотке крови на
при лечении ревматоидного артрита с низкой дозой метотрексата
. Факторы риска и реакция на фолиевую кислоту. Scand J
Rheumatol 1999; 28: 273–81.
18. van Ede AE, Laan RF, Blom HJ et al. Мутация C677T в гене метилентетрагидрофолатредуктазы
: генетический фактор риска повышения ферментов печени, связанного с
метотрексатом, у
пациентов с ревматоидным артритом.Arthritis Rheum 2001; 44: 2525–30.
19. Morgan SL, Baggott JE, Alarcon GS, Koopman WJ. Добавление фолиевой кислоты и
фолиевой кислоты во время терапии низкими дозами метотрексата
при ревматоидном артрите: комментарий к статье van Ede et al.
Arthritis Rheum 2002; 46: 1413–4.
20. Strand V, Cohen S, Schiff M. et al. Лечение активного ревматоидного артрита
леуномидом по сравнению с плацебо и метотрексатом.
Леюномид Группа исследователей ревматоидного артрита.Arch Intern
Med 1999; 159: 2542–50.
21. Эмери П., Бредвельд Ф. К., Леммель Е. М. и др. Сравнение эффективности и безопасности
леуномида и метотрексата для лечения ревматоидного артрита
. Ревматология 2000; 39: 655–65.
22. Strand V, Morgan SL, Baggott JE, Alarcon GS. Добавление фолиевой кислоты
и эффективность метотрексата: комментарий к статьям
Schiff, Emery et al. И др. Arthritis Rheum 2000; 43: 2615–6.
23. Джойс Д.А., Уилл Р.К., Хоффман Д.М., Лэйнг Б., Блэкборн С.Дж.
Обострение ревматоидного артрита у пациентов, получавших метотрексат
после введения фолиновой кислоты. Энн Рум Дис
1991; 50: 913–4.
24. Эндресен Г.К., Хасби Г. Прием фолиевой кислоты во время лечения метотрексатом
пациентов с ревматоидным артритом. Обновление
и предложения по руководству. Scand J Rheumatol
2001; 30: 129–34.
Ревматология
Ключевые сообщения
Добавление метотрексата с фолиевой кислотой
улучшает переносимость.
Пять миллиграммов фолиевой кислоты
следует ввести утром после приема метотрексата.
Не было доказано, что добавка фолиевой кислоты
снижает эффективность метотрексата при РА.
Фолиевая кислота компенсирует повышение уровня гомоцистеина в плазме
, связанное с лечением метотрексатом —
, и может снизить риск сердечно-сосудистых заболеваний
при РА.
270 С. Л. Уиттл и Р. А. Хьюз
гостем 23 октября 2012 г. https://rheumatology.oxfordjournals.org / Загружено с
Руководство для семейных врачей по мониторингу метотрексата
1. Ward JR. Исторический взгляд на использование метотрексата для лечения ревматоидного артрита. Дж. Ревматол . 1985; 12 (прил. 12) 3–6 ….
2. Кремер JM. Исторический обзор лечения ревматоидного артрита с акцентом на метотрексат. Дж. Ревматол . 1996; 44: 34–7.
3. Моховой РБ. Альтернативные фармакотерапии стероидозависимой астмы. Сундук . 1995; 107: 817–25.
4. Фиган Б.Г., Рочон Дж. Федорак Р.Н., Ирвин Э.Дж., Дикий G, Сазерленд L, и другие. Метотрексат для лечения болезни Крона. Исследователи Североамериканской исследовательской группы Крона. N Engl J Med . 1995; 332: 292–7.
5. Лиман Л.М., Wendland CL. Шейная внематочная беременность. Диагностика с помощью эндовагинального ультразвукового исследования и успешного лечения метотрексатом. Арка Фам Мед . 2000; 9: 72–7.
6. Марин МГ. Низкие дозы метотрексата позволяют избежать применения стероидов у пациентов с астматической зависимостью от стероидов: метаанализ. Сундук . 1997; 112: 29–33.
7. Cash JM, Klippel JH. Лекарственная терапия второй линии при ревматоидном артрите. N Engl J Med . 1994; 330: 1368–75.
8. Руководство по мониторингу лекарственной терапии ревматоидного артрита. Специальный комитет Американского колледжа ревматологии по клиническим руководствам. Революционный артрит . 1996; 39: 723–31.
9. Morgan SL, Бэгготт Дж. Э., Вон WH, Остин Дж. С., Вейч Т.А., Ли Джи, и другие. Добавление фолиевой кислоты во время терапии ревматоидным артритом метотрексатом. Двойное слепое плацебо-контролируемое исследование. Энн Интерн Мед. . 1994; 121: 833–41.
10. Комб Б, Дидри С, Гутьеррес М, Анайя Дж. М., Сани Дж. Обострение нодулеза и системных проявлений на фоне терапии ревматоидным артритом метотрексатом. евро J Med . 1993; 2: 153–6.
11. Уокер А.М., Funch D, Дрейер Н.А., Толман К.Г., Кремер Дж. М., Аларкон GS, и другие. Детерминанты серьезного заболевания печени у пациентов, получающих низкие дозы метотрексата по поводу ревматоидного артрита. Революционный артрит . 1993; 36: 329–35.
12. Кремер Ю.М., Аларкон GS, Лайтфут RW, Вилкенс РФ, Furst DE, Уильямс HJ, и другие.Метотрексат при ревматоидном артрите. Предлагаемые рекомендации по мониторингу токсичности для печени. Американский колледж ревматологии. Революционный артрит . 1994; 37: 316–28.
13. Roenigk HH, Ауэрбах Р., Майбах H, Вайнштейн Г, Лебволь М. Метотрексат при псориазе: консенсусная конференция. J Am Acad Dermatol . 1998. 38: 478–85.
14. Sinclair RD, Ротштейн H, Клемменс Л, Прентис Д, Роде J, Брин К.Гепатотоксичность метотрексата и роль рутинной биопсии печени: коллективное мнение [Письмо]. Австралас Дж. Дерматол . 1995; 36: 228–9.
15. Аларкон GS, Кремер Дж. М., Макалузо М, Weinblatt ME, Пушка GW, Палмер В.Р., и другие. Факторы риска повреждения легких, вызванного метотрексатом, у пациентов с ревматоидным артритом. Многоцентровое исследование методом случай-контроль. Группа по изучению метотрексата и легких. Энн Интерн Мед. .1997; 127: 356–64.
16. Карсон К.В., Пушка GW, Эггер MJ, Уорд-младший, Клегг Д.О. Заболевания легких во время лечения ревматоидного артрита низкими дозами метотрексата в пульсе. Революционный артрит . 1987. 16: 186–95.
17. McKenna KE, Берроуз Д. Легочная токсичность у пациента с псориазом, получающего терапию метотрексатом. Клин Эксп Дерматол . 2000; 25: 24–7.
18. Джундт Дж. У., Браун Б.А., Fiocco GP, Стил А.Д., Мок Д.Сравнение биодоступности метотрексата в низких дозах: раствор для приема внутрь, таблетка для приема внутрь, подкожное и внутримышечное введение. Дж. Ревматол . 1993; 20: 1845–189.
19. Красная книга. Монтваль, штат Нью-Джерси: экономика медицины; Oxford: Blackwell Science, 2000.
Опасный для жизни некроз слизистой оболочки желудочно-кишечного тракта во время лечения метотрексатом ревматоидного артрита — FullText — Case Reports in Gastroenterology 2013, Vol. 7, № 3
Абстрактные
Метотрексат (МТ), антагонист фолиевой кислоты, широко используется при лечении новообразований, псориаза и ревматоидного артрита.Несмотря на свою эффективность, метотрексат иногда находит ограниченное применение из-за его побочных эффектов, включая почечную или печеночную недостаточность, токсичность для костного мозга и повреждение слизистой оболочки желудочно-кишечного тракта. Кишечный мукозит, кровотечение и пептические язвы являются хорошо известными желудочно-кишечными побочными эффектами метотрексата, хотя случаи смертельного некроза слизистой оболочки, вызванного метотрексатом, крайне редки. Здесь мы сообщаем о случае 82-летней японской женщины, у которой через 8 лет лечения низкими дозами метотрексата (8 мг / неделя) развился тяжелый некроз слизистой оболочки желудочно-кишечного тракта.В тесте стимуляции лимфоцитов лекарственным средством метотрексат показал сильную положительную реакцию с индексом стимуляции 443% по сравнению с нормальным контролем. Врачи должны знать о потенциальных побочных эффектах, вызванных лекарственными средствами, у пациентов с хроническими заболеваниями, которые принимают лекарства в течение длительного времени.
© 2013 S. Karger AG, Базель
Введение
Метотрексат (MTX) — хорошо известное иммунодепрессивное средство, относящееся к модифицирующим болезнь противоревматическим препаратам (DMARD), и оно широко используется для лечения новообразований, псориаза и ревматоидного артрита (RA).Несколько контролируемых исследований продемонстрировали полезность прерывистой терапии низкими дозами метотрексата у пациентов с РА, и метотрексат используется в качестве средства первой линии из-за его ограниченной токсичности [1,2]. Побочные эффекты метотрексата, такие как почечная или печеночная недостаточность, токсичность для костного мозга и повреждение слизистой оболочки желудочно-кишечного тракта, могут быть связаны с максимальной дозировкой, и многих из них часто можно избежать путем снижения дозы или комбинированного применения метотрексата и фолиевой кислоты [3] . Однако даже низкие дозы метотрексата могут вызывать серьезные побочные эффекты, такие как острый пневмонит [4] и лейкоэнцефалопатия [5].Кишечный мукозит, кровотечение и пептические язвы являются другими хорошо известными желудочно-кишечными побочными эффектами метотрексата, хотя смертельный некроз слизистой оболочки, вызванный метотрексатом, встречается крайне редко. Здесь мы сообщаем о случае тяжелого желудочно-кишечного некроза, вызванного длительным лечением низкими дозами метотрексата. Это состояние было диагностировано на основании клинического течения и лабораторных данных, включая результаты теста стимуляции лимфоцитов лекарственными средствами (DLST).
История болезни
82-летняя женщина была направлена в нашу больницу с запором и болями в нижней части живота через 3 дня после приема последней дозы метотрексата.Ей был поставлен диагноз РА в возрасте 74 лет, и она получала нестероидные противовоспалительные препараты (НПВП; локсопрофен натрия гидрат 180 мг / день), преднизолон (4-6 мг / день) и низкие дозы метотрексата (8 мг. /неделя). При первом посещении нашей больницы физикальное обследование показало полноту и небольшую болезненность внизу живота. Анализы крови показали, что у нее была анемия (гемоглобин [Hb] 10,0 г / дл) и легкое воспаление (количество лейкоцитов [WBC] и уровни С-реактивного белка [CRP] составляли 18 600 / мкл и 0.95 мг / дл соответственно). Количество тромбоцитов было 388000 / мкл, а биохимическое обследование не показало значительных отклонений от нормы. Компьютерная томография брюшной полости показала небольшое утолщение нисходящей стенки толстой кишки и отсутствие органических образований, напоминающих новообразования. Эндоскопия нижних отделов желудочно-кишечного тракта показала петехии слизистой оболочки в нисходящей кишке, и было предположено, что у пациента колит, вызванный закупоркой каловых масс (рис. 1). Ее симптомы сразу же исчезли, как только она исполнилась дефекации после приема слабительного.Антибиотики не применялись. Для обеспечения покоя кишечника был начат прием энтеральных питательных веществ и парентеральное питание.
Рис. 1
Изображения, полученные при первом посещении. a Эндоскопия нижних отделов желудочно-кишечного тракта, показывающая петехии слизистой оболочки нисходящей кишки. b Компьютерная томография брюшной полости показывает небольшое утолщение нисходящей стенки толстой кишки.
Через девять дней после первого посещения пациентка снова пожаловалась на тошноту, эпигастралгию и чувство распирания живота.На следующий день у нее поднялась температура (38,6 ° C) и появился язвенный мукозит полости рта. Лабораторное исследование показало количество лейкоцитов 900 / мкл, уровень Hb 7,6 г / дл, количество тромбоцитов 120 000 / мкл и уровень CRP 14,45 мг / дл. Эндоскопия верхних отделов желудочно-кишечного тракта показала тяжелый некроз слизистой оболочки, покрывающий большую площадь (почти всю окружность) нижнего отдела пищевода, линейный эрозивный гастрит и множественные язвы двенадцатиперстной кишки. Снова была выполнена эндоскопия нижних отделов желудочно-кишечного тракта, и по всей окружности нисходящей кишки наблюдался некроз слизистой с слущиванием (рис.2а-г). Компьютерная томография с контрастным усилением показала утолщение стенки по всей окружности нижней части пищевода и нисходящей кишки с умеренным плевральным выпотом. Микроскопическое исследование биоптатов пищевода и нисходящей кишки также выявило некротизированную слизистую. При анализе фекальных культур, проведенном в то же время, был обнаружен метициллин-резистентный Staphylococcus aureus (MRSA), но не Clostridium difficile или Candida albicans .Начато лечение гранулоцитарным колониестимулирующим фактором и эмпирическими антибиотиками. Через одиннадцать дней после первого посещения у пациента развилась панцитопения; количество лейкоцитов было 400 / мкл, Hb — 6,1 г / дл, а количество тромбоцитов — 59000 / мкл. Наблюдались тяжелое воспаление и повреждение почек (CRP 27,99 мг / дл; азот мочевины крови 84 мг / дл; уровень креатинина 1,18 мг / дл). Переливание крови и внутривенное введение меропенема, ванкомицина, гамма-глобулина, рекомбинантного растворимого тромбомодулина человека и ингибитора протонной помпы были начаты при панцитопении и инфекции.Спасение лейковорина также было начато с внутривенного болюсного введения 3 мг каждые 8 ч, поскольку предполагалось участие метотрексата. Однако, поскольку общее состояние пациента не улучшилось сразу, была проведена непрерывная гемодиафильтрация волокнами с иммобилизованным полимиксином B. Через 2 дня терапии по очистке крови общее состояние пациента постепенно улучшилось.
Рис. 2
Эндоскопические изображения до терапии и контрольные снимки. Изображения перед терапией: a Пищевод.Некроз всей слизистой оболочки нижнего отдела пищевода. b Желудок. Линейные эрозии от антрального отдела к телу. c Двенадцатиперстная кишка. Множественные язвы двенадцатиперстной кишки в луковице. d Нисходящая ободочная кишка. Некроз всей слизистой оболочки с слущиванием. Последующие изображения: e Esophagus. Некроз слизистой улучшился, но стеноз остался. f Желудок. Признаков повреждения слизистой оболочки нет. г Двенадцатиперстная кишка. Язвы имеют тенденцию к заживлению. h Нисходящая ободочная кишка.Некроз слизистой улучшился, но стеноз остался.
DLST проводился для метотрексата, НПВП и преднизолона. Метотрексат показал сильную положительную реакцию с индексом стимуляции 443% по сравнению с нормальным контролем без лекарств. Пациентка возобновила пероральный прием через 30 дней после первого посещения, но у нее развилась рубцовая стриктура пищевода и толстой кишки (рис. 2e-h). Поэтому ей потребовалась баллонная дилатация, дважды для пищевода и один раз для нисходящей кишки. Она была выписана из нашей больницы через 15 недель после госпитализации (рис.3).
Рис. 3
Клиническое течение больного. CTRX = цефтриаксон; MEPM = меропенем; VCM = ванкомицин; G-CSF = колониестимулирующий фактор гранулоцитов; rTM = рекомбинантный растворимый тромбомодулин человека; LV = лейковорин; ВВИГ = внутривенный иммуноглобулин; ПК = концентрат тромбоцитов; ПКР = концентрат эритроцитов; PMX = волокна с иммобилизованным полимиксином B; CHDF = непрерывная гемодиафильтрация.
Выводы
Повреждения слизистой оболочки желудочно-кишечного тракта (т. Е. Эрозии, язвы и перфорации), вызванные стероидами, НПВП и БПВП, часто встречаются у пациентов с РА.Хотя перфорации являются типичными тяжелыми желудочно-кишечными осложнениями, Curtis et al. [6] сообщили, что частота перфораций составляет около 0,1% у пациентов с РА. Использование метотрексата, особенно низких доз метотрексата, не является независимым фактором риска перфорации кишечника и считается относительно безопасным лечением. Однако сообщалось о фатальных побочных эффектах метотрексата, таких как токсический эпидермальный некролиз [7], аплазия костного мозга [8] и пневмония [9]. Что касается желудочно-кишечного тракта, сообщалось, что даже при низких дозах 5 мг / м 2 метотрексат может вызывать иммунодепрессивные эффекты, которые могут привести к опасным для жизни осложнениям из-за бактериальной инфекции [10].
В данном случае было сочтено, что дополнительное осложнение энтерита, вызванного MRSA, привело к тяжелому клиническому течению. Однако поражение слизистой оболочки желудочно-кишечного тракта целиком нельзя объяснить только наличием MRSA-энтерита. Возможно, что инфекция вызвала системный воспалительный синдром или тромботическую микроангиопатию, но вряд ли причина будет простой патофизиологической, поскольку одновременно развилось множественное поражение органов. Таким образом, предполагается, что желудочно-кишечный мукозит, вызванный метотрексатом, развивается в зависимости от состояния пациента.Патогенетический механизм, лежащий в основе этого мукозита, остается неизвестным, но в качестве причин можно рассматривать иммунный ответ и повышенную концентрацию в крови. Хронический запор у пожилых женщин вызывает задержку парентерального лекарства в желудочно-кишечном тракте. Концентрация в крови может быстро увеличиваться, если абсорбционная способность улучшается из-за отсутствия дефекации и голодания. Кроме того, длительный прием препаратов может вызвать аллергические реакции и вызвать повреждение слизистой оболочки.
DLST — это тест in vitro, используемый для выявления аллергических реакций IV типа на лекарства; таким образом, он безопасен и полезен в качестве вспомогательного диагностического инструмента [11].В данном случае невозможно было измерить концентрацию метотрексата в сыворотке крови. Однако тест на пролиферацию лимфоцитов подтвердил иммунный ответ на метотрексат, учитывая клиническое течение пациента.
Насколько нам известно, ни в одном исследовании не изучались результаты DLST против тяжелого повреждения слизистой оболочки желудочно-кишечного тракта, вызванного метотрексатом. Ведение данного случая было успешным, так как пациент прошел лечение после быстрой идентификации лекарственного средства с использованием DLST и проведения интенсивной терапии.
Врачи должны знать о потенциальных побочных эффектах, вызванных лекарственными препаратами, у пациентов с хроническими заболеваниями, принимающих лекарства в течение длительного времени. Кроме того, необходимы дальнейшие исследования безопасного использования метотрексата и патогенетического механизма, лежащего в основе лекарственного иммунного ответа.
Вклад авторов
Т. Цукада принимал участие в лечении пациента, собирал подробности болезни, проводил поиск литературы и составлял рукопись. Т. Накано участвовал в лечении больного и помогал составить рукопись.В лечении больного принимали участие Т. Мията и С. Сасаки. Все авторы прочитали и одобрили окончательную рукопись.
Заявление о раскрытии информации
Авторы заявляют, что у них нет конфликта интересов или конкурирующих интересов.
Список литературы
- Bologna C, Viu P, Picot MC и др.: Долгосрочное наблюдение за 453 пациентами с ревматоидным артритом, получавшими метотрексат: открытое ретроспективное обсервационное исследование.Br J Rheumatol 1997; 36: 535-540.
- Кремер Дж. М., Рассел А. С., Эмери П. и др.: Долгосрочная безопасность, эффективность и ингибирование рентгенологического прогрессирования при лечении абатацептом у пациентов с ревматоидным артритом и неадекватным ответом на метотрексат: 3-летние результаты исследования AIM.Энн Рум Дис 2011; 70: 1826-1830.
- Hoekstra M, van Ede AE, Haagsma CJ и др.: Факторы, связанные с токсичностью, конечной дозой и эффективностью метотрексата у пациентов с ревматоидным артритом. Энн Рум Дис 2003; 62: 423-426.
- Hargreaves MR, Mowat AG, Benson MK: Острый пневмонит, связанный с лечением ревматоидного артрита низкими дозами метотрексата: отчет о пяти случаях и обзор опубликованных отчетов.Торакс 1992; 47: 628-633.
- Мацуда М., Кишида Д., Киношита Т. и др.: Лейкоэнцефалопатия, вызванная низкими дозами метотрексата у пациента с ревматоидным артритом. Intern Med 2011; 50: 2219-2222.
- Curtis JR, Xie F, Chen L, et al: Частота перфораций желудочно-кишечного тракта среди пациентов с ревматоидным артритом.Arthritis Rheum 2011; 63: 346-351.
- Primka EJ 3rd, Camisa C: Метотрексат-индуцированный токсический эпидермальный некролиз у пациента с псориазом. J Am Acad Dermatol 1997; 36: 815-818.
- Copur S, Dahut W., Chu E, et al: Аплазия костного мозга и сильная кожная сыпь после однократного приема низкой дозы метотрексата.Противораковые препараты 1995; 6: 154-157.
- Ridley MG, Wolfe CS, Mathews JA: Опасный для жизни острый пневмонит во время лечения ревматоидного артрита низкими дозами метотрексата: отчет о болезни и обзор литературы. Энн Рум Дис 1988; 47: 784-788.
- Nanke Y, Kotake S, Akama H и др.: Панцитопения и колит с Clostridium difficile у пациента с ревматоидным артритом, принимающего метотрексат, антибиотики и нестероидные противовоспалительные препараты.Clin Rheumatol 2001; 20: 73-75.
- Arai Y, Arihiro S, Ide D и др.: Острый панкреатит из-за pH-зависимого месалазина, который возник в ходе язвенного колита. Case Rep Gastroenterol 2011; 5: 610-616.
Автор Контакты
Томоя Цукада
Отделение гастроэнтерологической хирургии, Университет Канадзавы
13-1 Такара-мати, Канадзава, Исикава 920-8641 (Япония)
Электронная почта tkd_tmy @ nifty.com
Подробности статьи / публикации
Предварительный просмотр первой страницы
Опубликовано онлайн: 6 ноября 2013 г.
Дата выпуска: сентябрь — декабрь
Количество страниц для печати: 6
Количество рисунков: 3
Количество столов: 0
eISSN: 1662-0631 (онлайн)
Для дополнительной информации: https: // www.karger.com/CRG
Лицензия открытого доступа / Дозировка лекарства / Отказ от ответственности
Лицензия открытого доступа: это статья в открытом доступе под лицензией Creative Commons Attribution-NonCommercial 3.0 Unported (CC BY-NC) (www.karger.com/OA-license), применимой к онлайн-версии только статья. Распространение разрешено только в некоммерческих целях.
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Обзор клинического применения и побочных эффектов метотрексата в офтальмологии
Метотрексат (МТ) — аналог фолиевой кислоты, широко используемый против ряда заболеваний, включая злокачественные новообразования и аутоиммунные расстройства.Его высокое соотношение цены и эффективности также нашло широкое применение в офтальмологии. С другой стороны, хотя метотрексат обладает превосходной фармакологической эффективностью, побочные эффекты, связанные с метотрексатом, при клиническом применении, которые варьируются от пациента к пациенту, не являются незначительными. Нет сравнительно систематического обзора побочных эффектов, связанных с метотрексатом, и его факторов риска. Целью этого обзора было выявить новые клинические подходы к метотрексату и его побочные эффекты, чтобы предоставить ученым-офтальмам справочную информацию по клиническому применению метотрексата.
1. Введение
Метотрексат (MTX) — это метаболит антифолата, который ингибирует синтез, репарацию и клеточную репликацию ДНК. Впервые он был использован в качестве одного из основных средств лечения детской лейкемии [1, 2]. Согласно предыдущим исследованиям, метотрексат также использовался для лечения ревматоидного артрита (РА) и псориаза в качестве противовоспалительного и иммуномодулирующего средства [3], поскольку метотрексат может не только оптимизировать эффективность противоревматических препаратов, модифицирующих биологическое заболевание (БПВП) [4, 5], но также достигаются терапевтические цели за счет более низких доз по сравнению с другими традиционными синтетическими БПВП [5].На рисунке 1 показан путь фолиевой кислоты в синтезе ДНК, клеточный путь метотрексата и то, как метотрексат работает внутри клетки. В то время как немедленные и низкие дозы метотрексата используются для лечения незлокачественных и иммуноопосредованных заболеваний, высокие дозы метотрексата (HD-MTX, более 500 мг / м 2 в неделю) широко используются для лечения злокачественных новообразований. До сих пор HD-MTX (с лучевой терапией или без нее) по-прежнему является основой большинства современных схем химиотерапии [6], а также для профилактики рецидива лимфомы системной / центральной нервной системы (ЦНС) в дозе 3 г / м 2. 2 в неделю [7].
Метотрексат также широко применяется при офтальмологических заболеваниях как системном, так и местном уровнях. В недавно опубликованных статьях больше внимания уделяется новым клиническим применениям, способам введения и недавно обнаруженным побочным эффектам, которые являются предметом настоящего обзора.
2. Клиническое применение в офтальмологии
Как один из известных препаратов, сберегающих кортикостероиды, метотрексат широко используется для лечения переднего, промежуточного, заднего или панувеита; склерит; пемфигоид слизистой оболочки глаза [8], а также прогрессирующая пролиферативная диабетическая ретинопатия [9].Однако последующие исследования показали, что метотрексат работает со значительной разницей в оценках эффективности в зависимости от анатомической локализации воспаления [10], причем успех лечения чаще всего достигается у пациентов с передним увеитом и склеритом [11]. При лечении неинфекционного внутриглазного воспаления пероральное и внутривенное введение являются наиболее распространенными путями с обычным диапазоном доз от 7,5 до 25 мг в неделю. Типичная наблюдаемая доза составляла 12,5 мг / нед [12, 13], что соответствует диапазону низких доз метотрексата. Среднее время достижения успеха лечения, определяемое как контроль воспаления с возможностью снижения дозы кортикостероидов до 10 мг или менее в день, колеблется от 4.От 5 до 9 месяцев для метотрексата [14, 15].
Интравитреальная инъекция метотрексата с или без системной химиотерапии и лучевой терапии уже использовалась для лечения пациентов с первичной внутриглазной лимфомой [7, 16–19]. По данным Larkin et al. [20] интравитреальное введение метотрексата может привести к ремиссии у части пациентов с первичной внутриглазной лимфомой. Что особенно примечательно, так это то, что хотя метотрексат проявляет медленное начало эффекта, когда он использовался для лечения внутриглазной лимфомы с помощью интравитреальной инъекции, он продлевал местную ремиссию глазного заболевания даже при агрессивно растущей опухоли [16].Таким образом, это было принято в качестве относительно первого выбора для лечения рецидивирующей внутриглазной лимфомы [17], хотя лечение первичной внутриглазной лимфомы не имеет твердого обоснования из-за ограниченного количества ретроспективных и проспективных серий случаев [21]. Местное лечение с помощью внутриглазной инъекции обеспечивает постоянную терапевтическую концентрацию метотрексата для снижения системных побочных эффектов, связанных с метотрексатом [19]. Поэтому стоит попробовать внутриглазную инъекцию метотрексата, особенно при односторонних заболеваниях глаз.
3. Новые подходы к применению MTX
3.1. Метотрексат, применяемый против снижения роста эпителия
Предыдущие исследования уже продемонстрировали безопасность интравитреального метотрексата [18]. Он использовался для лечения внутриглазной лимфомы и пролиферативной витреоретинопатии из-за его антипролиферативных свойств [22]. Существует новое применение интравитреального метотрексата для лечения рецидивирующего разрастания эпителия, которое не лечится хирургическими или медикаментозными методами. Lambert et al. [23] вводили интравитреальный метотрексат пациентам с рефрактерной пролиферативной мембраной после операции по удалению катаракты, в то время как мембранный пилинг и эндолазерное лечение оказались безуспешными.Инъекцию метотрексата вводили отдельно на основании предыдущих протоколов и предполагаемого периода полувыведения лекарств в полости стекловидного тела. Всего после 12 инъекций рецидива мембран не было. Этот случай предполагает, что интравитреальный метотрексат играет роль в лечении от разрастания эпителия.
3.2. Метотрексат, используемый при традиционных терапевтически резистентных заболеваниях
В целом терапия противоваскулярным фактором роста эндотелия (анти-VEGF) значительно улучшила прогноз неоваскулярной возрастной дегенерации желтого пятна (НАМД).Однако все еще есть пациенты, которые остаются невосприимчивыми к терапии анти-VEGF, которая называется устойчивой к лечению НАМД. Поскольку есть доказательства того, что метотрексат оказывает влияние на прерывание каскада ангиогенеза на различных уровнях [24], Kurup et al. предложили интравитреальный метотрексат пациентам, рефракционным к стандартной терапии анти-VEGF [25]. Несмотря на то, что это использовалось не по назначению, острота зрения пациентов улучшилась при последующем посещении, в то время как обследования с помощью офтальмологической визуализации показали значительное уменьшение кистозного отека желтого пятна.Таким образом, пациенты, которые невосприимчивы к традиционной терапии анти-VEGF, могут получить пользу от интравитреальной инъекции метотрексата.
Не только такой подход. Халил и др. [26] один раз в месяц вводили 400 мкг мкг / 0,1 мл метотрексата в стекловидное тело 20 взрослым пациентам с болезнью Бехчета (BD), страдающим от BD-ассоциированного глазного воспаления с поражением заднего сегмента. Их результаты доказывают, что интравитреальный метотрексат улучшает остроту зрения, уменьшает проявления заднего сегмента, связанные с болезнью Бехчета, и позволяет снизить потребление кортикостероидов и иммунодепрессантов [26].Эти результаты также поддержали Тейлора и его сотрудников, которые провели испытания на 15 пациентах с односторонним увеитом и / или кистозным отеком желтого пятна [27]. Их клинические испытания показывают, что интравитреальный метотрексат может помочь пациентам с вовлечением заднего сегмента, связанным с увеитом, восстановить нормальную анатомическую структуру, а затем сократить иммуносупрессивную терапию.
4. Фармакогенетика MTX
Благодаря молекулярному секвенированию и высокопроизводительной технологии теперь можно точно и быстро обнаруживать большое количество генетических полиморфизмов [28].Исследователи уделяют больше внимания фармакогенетике, изучению генетических полиморфизмов ферментов, метаболизирующих лекарства, и трансляции наследственных различий в различия в эффектах лекарств [29]. Также известно, что гены, кодирующие транспортные белки и метаболизирующие ферменты для метотрексата, содержат функционально значимые SNP. SNP могут влиять на эффективность метотрексата и были предложены в качестве потенциальных факторов риска повышенной токсичности метотрексата даже в схемах с низкими дозами на основании предыдущих исследований [30].
Исследования фармакогенетики метотрексата можно разделить на генетические полиморфизмы, влияющие на транспорт метотрексата, и SNP, которые влияют на ферменты клеточного пути метотрексата [29].
После приема MTX попадает в клетку посредством активного транспорта, который опосредуется пониженным переносчиком фолиевой кислоты 1 (RFC1). Потеря экспрессии гена RFC1 может привести к эффектам поглощения и внутриклеточных уровней метотрексата. Был предложен G80A SNP RFC1 [31], оказывающий понижающий [32] или повышающий [33, 34] эффект на внутриклеточный уровень метотрексата.Следовательно, следует учитывать значительную связь между SNP RFC1 и токсичностью метотрексата. Chango et al. утверждают, что эти SNP сильно влияют на общие побочные эффекты, связанные с метотрексатом, приводя к изменению клеточной концентрации метотрексата, но не влияют на эффективность метотрексата [35]. Однако некоторые исследователи утверждают, что эти SNP не имеют определенного эффекта [36]. Таким образом, остается спорным вопрос о том, влияют ли SNP RFC1 на транспорт MTX. Кроме того, был изучен Р-гликопротеин, мембранный переносчик, который влияет на расположение и биодоступность метотрексата [37].Полагают, что SNP ABCB1, включая SNP C3435T и SNP C1236T, влияют на экспрессию P-гликопротеина [38]. Gervasini et al. предполагают, что SNP C1236T ABCB1 влияет на вводимые дозы метотрексата и частоту гематологической токсичности [28]. Однако, как и в случае с SNP G80A, существуют споры о влиянии этих SNP, поскольку разные исследования дали разные результаты [29].
Метаболизирующие ферменты также подвергались анализу, учитывая критическую роль переносчиков в утилизации метотрексата и его активных продуктов, а также в метаболизме фолиевой кислоты.Фармакогенетика метотрексата в основном сосредоточена на SNP в гене MTHFR. Настоящее исследование показывает, что генетические полиморфизмы метаболического пути фолиевой кислоты и переносчиков метотрексата влияют на токсичность, но не на эффективность лечения низкими дозами метотрексата у пациентов с аутоиммунными заболеваниями [39]. Например, известно, что C677T и A1298C в гене MTHFR приводят к более низкой активности фермента [39]. Windsor и соавторы сообщили, что MTHFR A1298C и C677T были связаны с нефротоксичностью и анемией, связанной с метотрексатом [40].Эти SNP могут быть связаны со снижением активности метилентетрагидрофолатредуктазы, повышенным уровнем гомоцистеина в плазме и измененным распределением фолиевой кислоты [41]. Таким образом, пациенты с этим генотипом были более уязвимы к потенциальной токсичности, вызванной метотрексатом, поскольку указанные выше реакции могут приводить к более медленному метаболизму фолиевой кислоты и более медленному восстановлению клеток [42]. Weisman et al. использовали одномерную логистическую регрессию, чтобы выявить, что MTHFR C677T также увеличивает возникновение побочных эффектов в центральной нервной системе, проявляющихся в виде головной боли и летаргии [43].Однако Lambrecht et al. утверждал, что MTHFR C667T не является прогностическим фактором токсичности [42]. Berkani et al. не обнаружили связи между полиморфизмом A1298C и токсичностью метотрексата [44]. Интересно, что Grabar et al. заявили, что пациенты с генотипом MTHFR 1298C имеют более низкий риск токсичности метотрексата, чем носители аллеля MTHFR 1298A [39].
На сегодняшний день исследования фармакогенетики метотрексата продолжаются. Было обнаружено, что все большее количество SNP, возможно, связано с эффективностью и токсичностью метотрексата.Недавно обнаруженные генотипы включают C347G в ATIC и повторение 5′-UTR из 28 пар оснований и делецию 3′-UTR длиной 6 пар оснований в TYMS, которые могут влиять как на эффективность, так и на токсичность MTX; аналогичным образом факторы, которые могут влиять на токсичность, связанную с метотрексатом, — это, например, A2756G при MS и A66G при MTRR [29, 39, 45, 46]. Гены и их SNP, которые могут быть связаны с эффектами и побочными эффектами метотрексата, суммированы в таблице 1. Растущие данные свидетельствуют о том, что один генетический фактор вряд ли может адекватно предсказать эффективность и токсичность метотрексата при полигенных заболеваниях, таких как РА и аутоиммунное заболевание глаз.Учитывая влияние метотрексата на несколько метаболических путей, комплексное исследование генотипов с множественным риском поможет предсказать эффективность метотрексата и выявить пациентов, у которых могут быть побочные эффекты от введения метотрексата.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В совокупности эффективность и токсичность метотрексата могут оставаться связанными с генетическими маркерами у пациентов.Таким образом, хотя этот вопрос остается спорным, разумно полагать, что фармакогенетика может предсказать, кто подвергается риску побочных эффектов, связанных с метотрексатом, и может помочь в максимальном увеличении соотношения польза / риск метотрексата.
5. Побочные эффекты метотрексата
Ограничивающая дозу токсичность метотрексата в основном включает гепатотоксичность и нефротоксичность [56–59], но часто сообщается о смертности из-за пневмонита или вторичных инфекций [60].
Некоторые эксперты подразделяют легочные осложнения, связанные с приемом метотрексата, на воспалительные, инфекционные и лимфопролиферативные [61].По мнению авторов, все побочные эффекты, связанные с метотрексатом, можно разделить на эти три категории в соответствии с фармакологическими эффектами метотрексата.
Основные побочные эффекты метотрексата связаны с антагонизмом фолиевой кислоты и в первую очередь влияют на высокопролиферативные ткани, такие как костный мозг и слизистую оболочку желудочно-кишечного тракта [62]. Учитывая иммуносупрессивный эффект метотрексата, панцитопения была одним из наиболее частых случаев тяжелой токсичности метотрексата [30]. Между тем, риск развития инфекционного процесса увеличивается на протяжении всего лечения, и тяжесть инфицированного заболевания будет ухудшаться [63, 64], включая обычные бактериальные инфекции, высыпания опоясывающего герпеса и оппортунистические инфекции.Согласно предыдущим исследованиям, риск выше, чем при применении других антиревматических небиологических препаратов (БПВП), влияющих на заболевание.
Во-вторых, МТХ действует как гаптен [65] и, вероятно, напрямую реагирует с нуклеофильными группами, присутствующими в белках, т.е. соединяется с эндогенным белком [66, 67]. Таким образом, белковые аддукты действуют как антигенный сигнал, направляя эффекторное плечо иммунного ответа [68]. Спровоцированные иммунные ответы чаще всего представляют собой реакции типа I (гиперчувствительность немедленного типа) и типа III (иммунный комплекс) [66].Гиперчувствительный пневмонит — наиболее частое, тяжелое и непредсказуемое осложнение, летальность которого достигает почти 25% [69].
Более того, несколько исследований показали, что длительное использование метотрексата может привести к лимфопролиферативным расстройствам (LPD) как в узловых, так и в дополнительных узловых участках, таких как кожа, легкие, эпифаринкс, щитовидная железа, носовая полость, селезенка и другие узлы. почки, особенно у пациентов с положительной реакцией на ВЭБ [70–73]. Сообщаемая частота положительных результатов на ВЭБ у пациентов с ДП, ассоциированными с метотрексатом, составляет 27–50% [74].Хотя механизм возникновения полностью не изучен, считается, что сочетание иммунодефицита и иммуносупрессивного действия метотрексата вовлечено в патогенез связанных с метотрексатом LPD. Всемирная организация здравоохранения (ВОЗ) классифицирует LPD, ассоциированные с метотрексатом, как лимфоидные новообразования, как ятрогенные, так и связанные с иммунодефицитом [73, 75]. ДП, ассоциированные с метотрексатом, часто имеют спонтанную ремиссию, которая, как правило, завершается в течение 4 недель после прекращения приема метотрексата [74].Но есть несколько сообщений, показывающих, что лимфоидные новообразования возникают даже после прекращения приема метотрексата [76].
5.1. Влияние способов введения
Обычно побочные эффекты метотрексата зависят от способа введения. Дозозависимые [77] желудочно-кишечные побочные эффекты являются наиболее частыми побочными эффектами при пероральном введении метотрексата, поскольку пероральный прием является наиболее распространенным методом доставки [56, 57, 77, 78]. Более 90% метотрексата выводится через почечную систему; таким образом, нефротоксичность, связанная с метотрексатом, распространена среди пациентов, принимающих метотрексат.К счастью, разрешение обычно наступает после прекращения терапии и лечения высокими дозами кортикостероидов [79]. Следовательно, для достижения лечения с меньшими побочными эффектами необходимы соответствующий способ введения и доза метотрексата. Во время лечения имеет значение наблюдение за общим состоянием пациентов.
Побочные эффекты интравитреальных инъекций метотрексата возникают только внутри глаза, включая гиперемию, кератопатию, катаракту, иридоциклит, кровоизлияние в стекловидное тело, отслоение сетчатки, макулопатию и эндофтальмит [80].
Разделение доз метотрексата вместо внутривенного введения — это новая попытка избежать побочных эффектов, связанных с метотрексатом. Метотрексат разделяется и назначается дважды или трижды в неделю для достижения более высокой биодоступности и лучшего клинического ответа [81, 82], что дает нам новый метод перорального введения метотрексата с меньшими побочными эффектами.
5.2. Безопаснее ли использование метотрексата в низких дозах?
На основании наблюдения клинических случаев побочные эффекты, которые могут привести к отмене метотрексата, редки во время типичного офтальмологического лечения из-за более низкой необходимой дозы метотрексата [30].Применение режима низких доз метотрексата также стало одним из основных методов лечения различных иммуноопосредованных заболеваний из-за его эффективности и приемлемого профиля безопасности, поскольку токсичность, связанная с большинством низких доз метотрексата, была описана в отчетах о случаях и относительно малая серия корпусов [30].
Однако, хотя он хорошо переносится и в основном обратим, даже режим низких доз метотрексата может привести к клинически значимой токсичности со значительным уровнем смертности (около 25% согласно когортному исследованию Кивити) [30].Серьезные побочные эффекты, связанные с низкими дозами метотрексата, включают серьезные осложнения со стороны центральной нервной системы [83], мукозит, поражение легких, гепатотоксичность [84] и миелосупрессию.
5.3. Безопасен ли метотрексат для беременных и плодов?
Как один из жирорастворимых и низкомолекулярных препаратов, метотрексат может легко переноситься через плацентарную мембрану во время беременности и отрицательно влиять на плод [85]. Кроме того, для выведения метотрексата из тканей плода может потребоваться больше времени [86].
Что касается фармакогенетики, мутации, вызванные метотрексатом, приводят к серьезному снижению экспрессии ферментов фолиевой кислоты и азотистых оснований, которые имеют решающее значение для клеточного гомеостаза [87]. На практике метотрексат влиял на формирование бластоцисты и вызывал дисморфические признаки и неврологические дефекты на ранних сроках беременности, что в некоторых случаях приводило к порокам развития [88]. Множественные врожденные аномалии наблюдались после еженедельного лечения метотрексатом в дозе 10 мг в течение первых 3 месяцев беременности [89], даже после гибели плода [85].Verberne et al. рассмотрели случаи врожденных аномалий после внутриутробного воздействия метотрексата и доказали, что некоторые врожденные аномалии, такие как микроцефалия, краниосиностоз, тетралогия Фалло, атрезия легочного клапана, дефекты редукции конечностей и синдактилия, действительно являются частью «синдрома метотрексата плода» [90 ]. Введение метотрексата в детстве также может вызывать такие проявления, как дефект зрения [91] и синдром Смита-Магениса [43] у пациентов со специфическими мутациями. Таким образом, следует проявлять особую осторожность в отношении беременных пациенток и особенно детей.
5.4. Факторы риска побочных эффектов, связанных с метотрексатом
Наиболее частыми фактами риска побочных эффектов, вызванных метотрексатом, являются пожилой возраст (возраст> 75 лет) и основное заболевание, включая почечную и / или печеночную недостаточность и заболевания легких, особенно пациенты с хроническим гепатитом В и сахарный диабет [92–96]. Пациенты, употреблявшие алкоголь в анамнезе, могут иметь более высокий риск фиброза печени и гепатотоксичности, вызванных введением метотрексата, при потреблении алкоголя> 100 г в неделю [97].Кроме того, в исследованиях были описаны ранее существовавшая гипоальбуминемия и предыдущее использование любого из DMARD и ингибиторов протонной помпы, повышающих частоту побочных эффектов, вызванных метотрексатом [92, 94]. Более того, прием препаратов, которые могут взаимодействовать с метотрексатом одновременно, также может быть опасным; эти препараты включают салицилаты, котримоксазол, хлорамфеникол, сульфаниламиды, циклоспорин и пириметамин [96]. Хотя не было обнаружено значительного защитного эффекта от приема фолиевой кислоты в отношении токсичности, связанной с метотрексатом [98], дефицит фолиевой кислоты является еще одной причиной побочных эффектов, основанной на клинических случаях [30].Heidari et al. обнаружили, что введение метотрексата повышает уровень АФК в почках, снижает антиоксидантную способность тканей, увеличивает перекисное окисление липидов и истощает запасы глутатиона в почках. Данные их исследований показывают, что метотрексат вызывал повреждение тканей и дисфункцию органов из-за окислительного стресса. Поэтому они предположили, что пациенты с ранее существовавшими митохондриальными дефектами могут быть уязвимы к поражению почек, вызванному метотрексатом [99].
Использование высоких доз метотрексата (HD-MTX) также является фактором риска побочных эффектов.Фиброз печени, индуцированный метотрексатом, с большей вероятностью станет морфологически очевидным при высоких кумулятивных дозах, возможно, значительно превышающих 3000–4000 мг [97, 100]; а побочные эффекты, вызванные применением омепразола в прошлом, были обнаружены у онкологических больных, получавших лечение HD-MTX [94].
Распределение метотрексата in vivo также играет роль в побочных эффектах, связанных с метотрексатом. Поскольку метотрексат имеет тенденцию накапливаться во внесосудистом отделе, пациентам с плевральным выпотом, асцитом и массивным отеком следует проявлять особую осторожность из-за риска токсичности из-за реабсорбции внесосудистой жидкости [101].
Еще один заслуживающий внимания фактор риска — УФ. Сообщалось о феномене УФ-воспоминания, также известном как УФ-реактивация, связанная с метотрексатом [102, 103]. Это реактивность участков солнечных ожогов в течение 3–10 дней после лечения метотрексатом [103, 104]. Согласно Адамсу и соавторам, это явление могло быть связано с иммунным ответом на неконтролируемое воспаление, вызванное солнечным ожогом, вызванное метотрексатом [104]. Пациенты, которые ранее страдали солнечными ожогами, заслуживают более подробного наблюдения при необходимости метотрексата.
5.5. Необходимы ли добавки фолиевой кислоты для офтальмологических пациентов?
Для предотвращения побочных эффектов, связанных с метотрексатом, в клинике принято принимать фолиевую кислоту [в виде фолиевой кислоты (FA) или фолиновой кислоты (FLA)] [46, 105, 106]. Однако не существует последовательных и основанных на доказательствах рекомендаций по добавлению фолиевой кислоты офтальмологическим пациентам.
Фолат и фолиевая кислота играют важную роль в синтезе de novo пуринов и тимидилата, которые необходимы для репликации и репарации ДНК [96]. Funk и соавторы обнаружили значительное снижение концентрации циркулирующего фолиевой кислоты у 47% пациентов, получавших лечение метотрексатом [107].Пациенты, получавшие высокие дозы метотрексата (HD-MTX), регулярно получали добавку фолиевой кислоты для уменьшения побочных эффектов, связанных с HD-метотрексатом [108–110]. После систематического обзора литературы по терапии HD-MTX и добавкам фолиевой кислоты Van der Beek et al. [111] обнаружили более низкую частоту побочных эффектов, связанных с метотрексатом, в схемах с более высокими кумулятивными дозами и более ранним введением добавок фолиевой кислоты в аналогичных исследованиях дозировки HD-метотрексата. Также изучается добавление фолиевой кислоты пациентам, принимающим низкие дозы метотрексата.Ортис и др. [105] доказали защитный эффект добавок фолиевой кислоты, проведя Кокрановский обзор с участием более 600 пациентов, принимавших низкие дозы метотрексата. До сих пор было доказано, что добавление фолиевой кислоты предотвращает и улучшает эффекты, связанные с метотрексатом, включая желудочно-кишечные, респираторные и неврологические побочные эффекты [96, 112]. Mori et al. подтвердили защитный эффект, продемонстрировав, что пациенты, получавшие низкие дозы метотрексата без добавок фолиевой кислоты, были значительно связаны с развитием миелосупрессии и панцитопении [113].
Однако предварительное исследование Арабеловича и соавторов показало значительное увеличение необходимой дозы метотрексата [114], поскольку продукты из зерна злаков, обогащенные фолиевой кислотой, были полностью внедрены в США и Канаде [115]. Это дало нам понять, что прием высоких доз фолиевой кислоты может повлиять на эффективность метотрексата.
Аль-Дабаг и др. обнаружили, что снижение эффективности метотрексата нельзя игнорировать, в то время как добавление фолиевой кислоты действительно привело к значительному снижению связанных побочных эффектов [116].Salim et al. заявили об уменьшающемся влиянии противовоспалительного эффекта метотрексата и приема фолиевой кислоты, проведя двойное слепое клиническое испытание [117]. Chladek et al. провел открытое двустороннее перекрестное исследование, подтверждающее вышеприведенное мнение [118]. Кроме того, из-за неравномерного распределения фолиевой кислоты и метотрексата в органах и тканях [119] прекращение приема метотрексата более распространено в связи с некоторыми побочными эффектами, связанными с метотрексатом, в офтальмологической клинике [112], чем при приеме более высоких доз фолиевой кислоты.
Нет офтальмологических исследований, демонстрирующих защитное действие добавок фолиевой кислоты. Таким образом, хотя добавление фолиевой кислоты широко используется среди пациентов, получающих низкие дозы метотрексата [120, 121], необходимость и стандартизованная дозировка добавок фолиевой кислоты у конкретных пациентов [122], а также взаимодействие метотрексата и фолиевой кислоты по-прежнему требуют дальнейшего изучения. исследования.
6. Обсуждение
Метотрексат, как один из альтернативных фармакологических стероидсберегающих иммунодепрессантов, становится все более популярным в качестве предпочтительного лечения некоторых аутоиммунных состояний, требующих длительной иммуносупрессии [123].Низкие дозы метотрексата обладают противовоспалительными и иммуномодулирующими свойствами за счет повышения уровней внутриклеточного и внеклеточного аденозина [124], что является основой офтальмологического лечения метотрексатом. Стандартизованное и рекомендуемое назначение офтальмологического метотрексата — один раз в неделю, начиная с дозы 7,5 мг и увеличивая каждые 4–8 недель до 25–30 мг в неделю при необходимости [125, 126]. Пациентам с недостаточным ответом только на метотрексат добавляли циклоспорин с азатиоприном или без него [127].
Чтобы избежать побочных эффектов, в офтальмологической клинике постепенно используются разделенные дозы введения метотрексата и добавление фолиевой кислоты. Назначение 5–10 мг добавок фолиевой кислоты играет важную роль в обеспечении безопасности метотрексата [128], но более высокая доза применяется реже, даже с более высокой дозой метотрексата [129]. Большинству пациентов не требуется профилактический прием фолиевой кислоты [130]. Существуют также исследования, подтверждающие, что доза рыбьего жира 0,5 мл / 100 г или выше так же эффективна, как и фолиевая кислота, по терапевтическому потенциалу в предотвращении потери костной массы во время химиотерапии метотрексатом [131].При некоторых стойких и / или смертельных побочных эффектах прекращение приема метотрексата подействует немедленно.
В связи с увеличением продолжительного использования метотрексата важно контролировать результаты анализа крови пациентов, в том числе рутинный анализ крови и функции печени и почек. Поскольку панцитопения может быть поздним проявлением [98], повышение уровня мочевины, креатинина, аминотрансфераз и альбумина, а также нарушение электролитов может привести к побочным эффектам со стороны печени и почек, связанным с метотрексатом [99]. Уровень метотрексата в плазме не является надежным предиктором нежелательных явлений при терапии метотрексатом [132].Напротив, уровни циркулирующего фолата и распределение фолиевой кислоты и полиглутамата чувствительно изменяются при воздействии метотрексата и поступлении экзогенного фолата [133] и могут использоваться в качестве биомаркера эффективности метотрексата [107]. Следует отметить, что, поскольку период полураспада эритроцитов составляет примерно 120 дней, результаты исследований крови могут отражать статус как до лечения, так и после лечения, которые необходимо тщательно анализировать [99].
Было проведено множество исследований, чтобы доказать, что метотрексат может использоваться как хорошо переносимый, безопасный и эффективный препарат первой линии.
