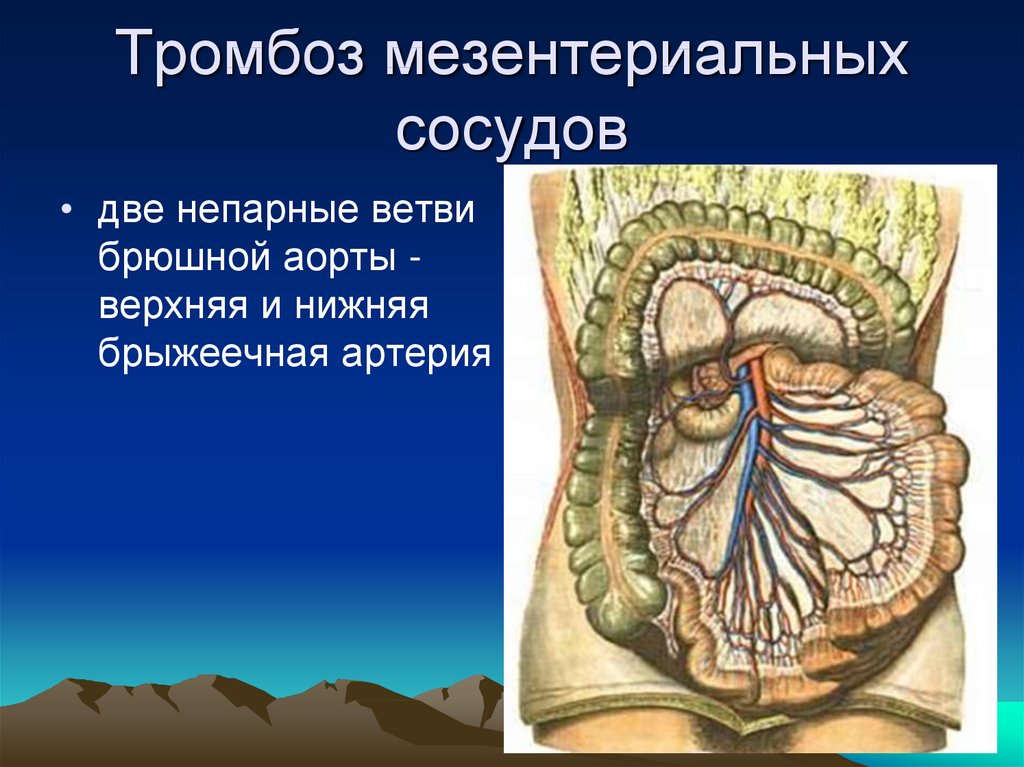
Мезентериальный тромбоз сосудов кишечника — причины, симптомы, лечение, острый, мкб-10
Мезентериальный тромбоз кишечника – это патология, которая характеризуется закупоркой сосудов, снабжающих кровью брыжейку. Брыжейкой называют «мешок», в котором располагается часть внутренних органов человека.
Поскольку через мезентерий проходит множество сосудов, которые обеспечивают кровью еще и кишечник, тромбоз одного или нескольких сосудов приведет к тому, что у пациента разовьется ишемия кишечника, а возможно и инфаркт.
Часто развитие этой патологии приводит к летальному исходу, особенно если поражает пациентов пожилого возраста.
- Вся информация на сайте носит ознакомительный характер и НЕ ЯВЛЯЕТСЯ руководством к действию!
- Поставить ТОЧНЫЙ ДИАГНОЗ Вам может только ВРАЧ!
- Убедительно просим Вас НЕ ЗАНИМАТЬСЯ самолечением, а записаться к специалисту!
- Здоровья Вам и Вашим близким!
Лечение этого заболевания осложняется длительным бессимптомным течением, что сильно отличает тромбоз мезентериальных сосудов от того же инфаркта миокарда, который легко заподозрить по симптомам.
Стоит отметить, что тромбоз никак не проявляет себя клинически в большинстве случаев, пока проходимость сосуда составляет минимум половину от нормального объема. Однако, как только тромб заполняет более ¾ сосуда – возникают первые симптомы.
Если пациент своевременно не обращается за помощью, то прогрессирующая патология быстро приводит к некротическим изменениям кишки.
В большинстве случаев поражения затрагивают верхнюю артерию брыжейки, которая кровоснабжает большую часть кишечника. Ее поражение ведет к наиболее тяжелым последствиям.
Классификация
Код заболевания по МКБ-10 К55.0.
Патологию принято классифицировать по трем основным группам:
| Мезентеральный инфаркт острого течения | В большинстве случаев поражается верхняя брыжеечная артерия, причем в большинстве случаев причина не в тромбозе, а в эмболии, жалобы пациентов обычно подходят под картину «острого живота». |
| Облитерация хронического типа | Чаще характеризуется окклюзией или облитерацией чревного ствола, верхней брыжеечной артерии, реже встречается окклюзия основного ствола нижней брыжеечной артерии. |
| Мезентеральная ишемия неокклюзивного типа | Встречается в 50% случаев. |
| Тромбоз мезентеральных вен | Возникает довольно редко. |
Причины
Наиболее частая причина тромбоза этого типа – длительно текущий атеросклероз, лечение которого не проводилось или проводилось недостаточно полноценно.
Механизм прост: в одном из сосудов начинает формироваться холестериновая бляшка, которая рано или поздно закупоривает просвет сосуда полностью, перекрывая кровоток. Участок кишки, к которому не поступает кровь, начинает необратимо изменяться, и изменения берут свое начало от слизистой оболочки.
По мере прогрессирования патологических процессов стенка кишки истончается и, как исход, содержимое оказывается в брюшной полости. Итогом служит перитонит.
Итогом служит перитонит.
Другая причина развития патологии – гиперкоагуляция крови, при которой кровь сворачивается внутри сосуда. Происходит это из-за нарушения баланса между свертывающей и противосвертывающей системами.
При этом гиперкоагуляция может носить как врожденный, так и приобретенный характер.
Причиной развития болезни также может быть повреждение эндотелия сосудов, из-за которого в кровоток в избытке попадают вещества, запускающие процессы свертываемости крови.
Наиболее часто повреждение эндотелия развивается из-за химиотерапии по поводу опухолевых процессов, оперативных вмешательств, травм.
Частая причина развития тромбоза – это также застойные явления, которые формируются из-за неправильного образа жизни или длительной вынужденной неподвижности пациента.
Другими причинами могут быть:
- воспалительные патологии брюшной полости;
- травмы, мешающие нормальной циркуляции крови;
- эндокардит;
- инфаркт миокарда.

Отсюда вы сможете подробно узнать описание тромбоза центральной вены сетчатки.
Симптомы мезентериальный тромбоза
Первым признаком патологии может стать появление болевого синдрома, который развивается в нижней части живота слева. Часто пациенты, чтобы избежать усиления болевых симптомов, стараются не двигаться, укладываясь перед этим на спину и сгибая ноги к животу. Так боль облегчается.
У половины пациентов отмечаются приступы тошноты и рвоты в самом начале заболевания. Иногда патологию сопровождает жидкий стул с примесью крови.
По мере прогрессирования заболевания к клинической картине присоединяются следующие симптомы:
- живот вздувается;
- в кишечнике перестает определяться перистальтика;
- стул и газы отходят со значительной задержкой;
- рвота учащается;
- язык становится сухим.

Заболевание обычно имеет очень бурное начало, помимо болей можно определить беспокойное состояние пациента, его нервозность. Если у пациента определяется кровавый стул, с диагнозом необходимо быть осторожным.
Часто стул при тромбозе напоминает таковой при дизентерии, что приводит к неправильной постановке диагноза и выбору неправильной тактики лечения.
Сроки смерти от мезентериального тромбоза при неоказании помощи составляют около двух суток.
Диагностика
Диагностировать мезентериальный тромбоз до госпитализации пациента в стационар обычно довольно сложно, но облегчить диагностический поиск может тот факт, что эта патология часто сопровождает сердечнососудистые заболевания, поэтому сочетание клиники патологий сердца и сосудов и жалоб на боль в животе, тошноту, рвоту и кровавый стул должны натолкнуть на мысль о диагнозе.
Если пациенту проводить пальцевое ректальное исследование, то в ряде случаев перчатка окажется испачканной кровью.
Рентген органов брюшной полости способен указать на диагноз только в том случае, если патология находится на финальной стадии. При этом будут определятся петли тонкого кишечника в чрезмерно раздутой форме, а также раздутый начальный отдел толстой кишки.
Главным исследованием является латероскопия, при которой делают рентгеновский снимок в положении больного лежа на боку.
Обращают внимание на следующие детали:
- если раздутые петли кишки не изменяют положения при повороте пациента с боку на бок, то непроходимость механическая;
- если петли двигаются при изменении положения больного, то непроходимость паралитическая, и это, вероятно, тромбоз.
Диагностическую ценность представляет также селективная ангиография.
Дифференциальная
Тромбоз и эмболия сосудов мезентерии обычно мало чем отличаются по симптоматике. Если речь идет о тромбозе, то пациент может указывать на локализацию боли в области пупка или в эпигастрии. Боль также может разливаться по всему животу. При эмболии боль, скорее всего, будет справа в подвздошной области из-за закупорки подвздошно-ободочной артерии.
Боль также может разливаться по всему животу. При эмболии боль, скорее всего, будет справа в подвздошной области из-за закупорки подвздошно-ободочной артерии.
- язвы желудка и двенадцатиперстной кишки;
- кишечной непроходимости механического типа;
- аппендицита;
- обострений панкреатита и холецистита.
В редких случаях картина мезентериального тромбоза может наблюдаться при инфаркте миокарда с абдоминальной симптоматикой. В этом случае большое диагностическое значение играют исследования электрокардиографического типа.
В любом случае, больного с подобными жалобами в обязательном порядке госпитализируют в хирургическое отделение.
Лечение

После установки диагноза лучше всего прибегать к хирургическому купированию этой патологии. Консервативная терапия эффективности не дает.
Оперативное вмешательство по поводу мезентериального тромбоза всегда ведется под эндотрахеальным наркозом.
Если патология еще не привела к некротическим изменениям в стенке кишечника, то используют одно из следующих вмешательств:
| Эндартерэктомия | Очищение сосудистого русла от атеросклеротической бляшки. |
| Тромбэктомия | Удаление тромба, перекрывшего кровоток в сосуде. |
Также может осуществляться протезирование пораженной артерии брыжейки.
Если процесс уже прошел стадию некротических изменений в кишечнике, то единственный выход – удаление части кишечника. В ряде случаев вмешательство этого типа позволяет сохранить больному жизнь.
Из консервативной терапии в до- и послеоперационный период возможно использование следующих средств:
| Антикоагулянты | Вводят пациенту парентерально (при этом необходимо контролировать лабораторные показатели крови), наиболее часто используется Гепарин. |
| Дезагреганты | Препараты данной группы вводятся парентерально. |
При несвоевременном оказании медицинской помощи мезентериальный тромбоз приводит к смерти пациента.
Тромбоз мезентериальных сосудов код по мкб 10
Рубрика МКБ-10: K55.0
Содержание
Определение и общие сведения [ править ]
Синонимы: инфаркт кишечника, мезентериальный тромбоз, острая мезентериальная ишемия, острое нарушение брыжеечного кровообращения, острые сосудистые болезни кишечника.
Это группа сходных по течению и прогнозу патологических состояний, обусловленных нарушениями кровотока в артериальном, венозном или микроциркуляторном русле брыжеечных сосудов. Данная патология относится к разряду тяжелейших заболеваний, с которыми приходится сталкиваться хирургу в своей практической деятельности, и сопровождается в настоящее время крайне высокой летальностью (67-92%). Неудовлетворительные результаты лечения обусловлены, в первую очередь, поздней диагностикой и неадекватной хирургической тактикой.
Острые нарушения мезентериального кровообращения чаще встречаются у пациентов пожилого и старческого возраста. Хотя средний возраст больных составляет около 70 лет, это не исключает возможность развития заболевания и у молодых людей. Доля умерших от инфаркта кишечника в возрасте до 40 лет составляет около 10%, причём половина умерших моложе 30 лет. Среди больных заметно преобладают женщины. В последние годы острые нарушения мезентериального кровообращения стали встречаться чаще, что связано как с увеличением продолжительности жизни людей, так и с распространением врождённых и приобретённых тромбофилических состояний.
Этиология и патогенез [ править ]
Среди практических хирургов до настоящего времени бытует два мифа относительно острых нарушений мезентериального кровообращения. Первый: «Такое заболевание существует, но встречается оно крайне редко». Второй: «Если у больного развился мезентериальный тромбоз, то шансов на выздоровление практически нет». Обе точки зрения, безусловно, имеют определённые основания, однако далеко не всегда соответствуют действительности.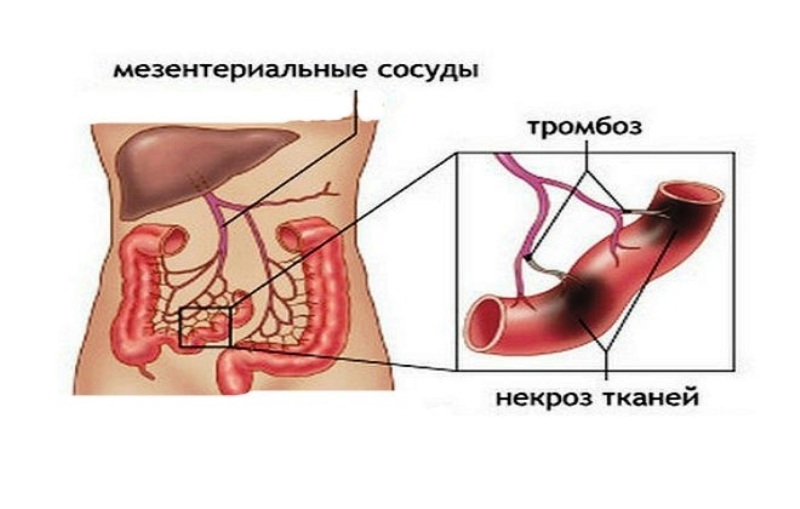
Число умерших от инфаркта кишечника превышает число летальных исходов от такого распространённого заболевания, как острый аппендицит. К этим цифрам необходимо приплюсовать благоприятные исходы лечения и случаи наступившей спонтанно или под действием консервативной терапии компенсации или субкомпенсации мезентериального кровотока и тогда становится ясно, что эта патология вовсе не относится к разряду казуистических.
Возникновение инфаркта кишечника связано с окклюзией магистральных брыжеечных артерий и вен, а также нарушениями на уровне микроциркуляторного русла при проходимых мезентериальных сосудах в результате резкого снижения перфузии кишечной стенки вследствие различных причин. Среди больных с развившемся инфарктом кишечника доля больных с окклюзионными нарушениями мезентериального кровообращения составляет около 90%. Наиболее часто наблюдают эмболии, артериальный тромбоз, реже — тромбоз брыжеечных вен. Необходимо учитывать, что истинная частота неокклюзионных нарушений значительно выше 10%, однако у данной категории больных на фоне интенсивной терапии по поводу различных иных тяжёлых заболеваний часто наступает компенсация мезентериального кровотока без нарушений жизнеспособности кишечника, в связи с чем верификация истинной распространённости данного вида патологии затруднена.
Окклюзионные нарушения мезентериального кровообращения
а) Эмболия мезентериальных артерий встречается наиболее часто. Основные заболевания, при которых происходит формирование тромбоэмболов в левых отделах сердца и аорте — врождённые и приобретённые пороки сердца, инфаркт миокарда, нарушения сердечного ритма, аневризмы сердца и аорты, атеросклеротические поражения сердца и сосудов. Эмболии мезентериальных артерий нередко сопровождаются эмболиями других артерий большого круга кровообращения, что значительно ухудшает прогноз лечения.
Инфаркт кишечника чаще всего развивается при эмболии устья или ствола верхней брыжеечной артерии. Большая частота эмболии верхней брыжеечной артерии по сравнению с нижней (в 20-40 раз) объясняется более высоким расположением сосуда, острым углом отхождения от аорты, большим диаметром просвета. Безусловно, эмболия нижней брыжеечной артерии встречается чаще, чем диагностируется, но проходит незамеченной вследствие компенсации кровотока через хорошие коллатеральные связи с системами верхней брыжеечной и внутренних подвздошных артерий.
б) Тромбоз мезентериальных артерий по частоте занимает второе место после эмболий. Тромбоз может локализоваться на одном или нескольких уровнях артериальной системы брыжейки. Сосудистая операция выполнима лишь при поражении на уровне ствола верхней брыжеечной артерии.
в) Сдавление (прорастание) мезентериальных артерий и вен злокачественными опухолями с последующим тромбозом наблюдают при метастазах рака желудка или поджелудочной железы в корень брыжейки.
г) Сочетанная окклюзия артерий и вен кишечника наблюдается при травме с их отрывом или при прошивании обоих сосудов, а также при относительно больших сроках заболевания, когда к окклюзии артерии или вены присоединяется вторичный тромбоз другого сосуда.
Неокклюзионные нарушения мезентериального кровообращения
При неокклюзионных нарушениях мезентериального кровотока расстройства микроциркуляции в кишечнике возникают первично и бывают связаны с целым рядом патогенетических факторов. Первостепенное значение при этом имеют падение перфузионного давления и ангиоспазм.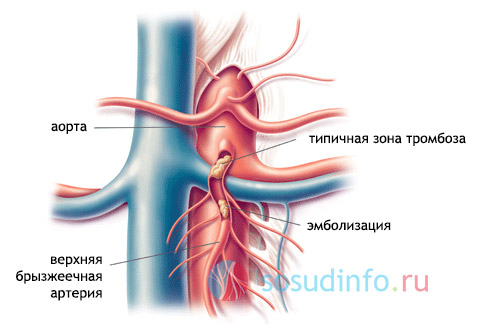 Давление в мезентериальных артериях резко снижается в результате малого сердечного выброса и выраженной артериальной гипотензии, особенно при стенозе устья верхней брыжеечной артерии. Комбинация факторов, приводящих к неокклюзионному инфаркту кишечника, может быть самой разнообразной.
Давление в мезентериальных артериях резко снижается в результате малого сердечного выброса и выраженной артериальной гипотензии, особенно при стенозе устья верхней брыжеечной артерии. Комбинация факторов, приводящих к неокклюзионному инфаркту кишечника, может быть самой разнообразной.
Клинические проявления [ править ]
Клинические признаки в первую очередь зависят от вида нарушения мезентериального кровообращения, распространённости поражения и стадии заболевания. Наиболее яркую и характерную клиническую картину наблюдают при острых нарушениях артериального мезентериального кровообращения, особенно при эмболии, которую и считают самой частой причиной заболевания.
Начало заболевания характеризуется внезапным, неожиданным для больного появлением сильных, нестерпимых болей в животе. Эти боли возникают без каких-либо продромальных проявлений, на фоне вполне удовлетворительного самочувствия. В анамнезе у таких пациентов обычно имеется эмбологенное заболевание сердца. Наиболее жестокие боли характерны для начала заболевания в стадии ишемии, которая длится около 6 ч.
Боли в животе — основной и наиболее яркий симптом заболевания. Обращают внимание крайне беспокойное поведение больного, стоны, крики, мольбы о помощи. Больного сложно даже просто осмотреть, он мечется, подтягивает ноги к животу, принимает коленно-локтевое положение. Кожные покровы становятся бледными, выступает холодный пот, на лице — гримаса ужаса. Для заболевания характерна выраженная тахикардия. При аритмиях дефицит пульса достигает 50-60 в минуту. АД повышается на 30-40 мм рт.ст. (симптом Блинова). Подобная реакция особенно характерна для эмболии ствола верхней брыжеечной артерии. У больных с острым инфарктом миокарда заболевание, напротив, может начинаться с коллапса.
Интенсивность болей сравнима с болевым синдромом при странгуляционной кишечной непроходимости. Характерной особенностью болей в этот период служит отсутствие обезболивающего эффекта даже от морфина. Тяжесть состояния в этот период определяется в основном болевым шоком и гемодинамическими нарушениями. Для стадии ишемии характерна локализация болей в эпигастральной области, что связано с раздражением солнечного и верхнебрыжеечного сплетений.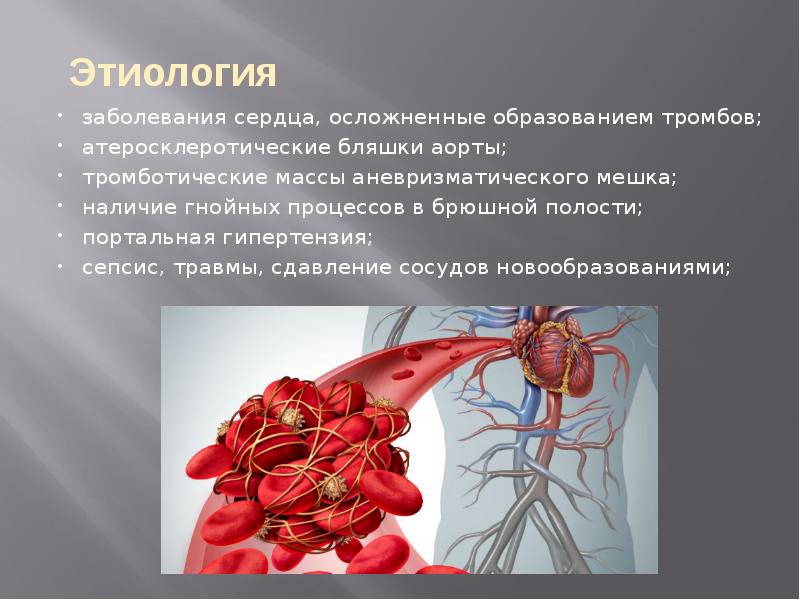 В последующем боли перемещаются в район месторасположения поражённой кишки. Несоответствие между выраженным болевым синдромом и отсутствием перитониальной симптоматики очень часто выступает на этой стадии предпосылкой для диагностических ошибок.
В последующем боли перемещаются в район месторасположения поражённой кишки. Несоответствие между выраженным болевым синдромом и отсутствием перитониальной симптоматики очень часто выступает на этой стадии предпосылкой для диагностических ошибок.
При ограниченных поражениях кишечника острота болевого синдрома может быть выражена в меньшей степени, поведение больных более спокойное.
Другой характерный симптом — ишемическое опорожнение кишечника. В самом начале заболевания рефлекторно возникают одно-двукратная рвота желудочным содержимым и жидкий стул за счёт спастического сокращения кишечной трубки в ответ на острую ишемию. У ряда больных в стадии ишемии отмечают длительный понос, что приводит к диагностическим ошибкам. В каловых массах через несколько часов от начала заболевания появляется кровянистая слизь, напоминающая малиновое желе. Симптом наиболее выражен в стадии инфаркта.
В стадии инфаркта (обычно она начинается спустя 6-12 ч от начала заболевания и продолжается в течение 12-24 ч) боли несколько уменьшаются вследствие некротических изменений в стенке кишки и гибели болевых рецепторов. Поведение больных становится более спокойным, проходит чувство страха. Появляется лёгкая эйфория, обусловленная развивающейся интоксикацией. В рвотных массах и стуле наблюдают примесь крови. АД нормализуется, пульс, наоборот, учащается. Число лейкоцитов повышается до 20-40×109/л.
Поведение больных становится более спокойным, проходит чувство страха. Появляется лёгкая эйфория, обусловленная развивающейся интоксикацией. В рвотных массах и стуле наблюдают примесь крови. АД нормализуется, пульс, наоборот, учащается. Число лейкоцитов повышается до 20-40×109/л.
В стадии перитонита начинают преобладать боли по всему животу. Они усиливаются при перемене положения тела, кашле, пальпации, что связано с развитием воспалительных изменений в брюшной полости. В отличие от стадии ишемии и инфаркта болевые ощущения уменьшаются при назначении наркотиков. Общее состояние больных резко ухудшается в связи с резко выраженным эндотоксикозом, обезвоживанием, нарушениями водно-электролитного баланса, развитием метаболического ацидоза. Больные адинамичны, у некоторых появляется бред. Рвотные массы приобретают неприятный гнилостный запах. Наступает задержка стула и газов.
Острые сосудистые болезни кишечника: Диагностика [ править ]
Объективные симптомы при исследовании живота
В первые часы заболевания живот не вздут, конфигурация его не изменена, брюшная стенка участвует в акте дыхания. Симметричное вздутие живота возникает в поздней стадии заболевания — при развитии перитонита.
Симметричное вздутие живота возникает в поздней стадии заболевания — при развитии перитонита.
Для стадии ишемии, особенно в первые часы заболевания, характерно отсутствие болезненности при глубокой пальпации живота. В стадии инфаркта выраженная пальпаторная болезненность наблюдается у всех больных. Обращает внимание несоответствие зоны болезненности локализации спонтанных болей в животе. В стадии перитонита преобладают боли по всему животу, болезненность определяется уже при поверхностной пальпации.
Особенностью клинического проявления перитонита при острых нарушениях мезентериального кровообращения считают более позднее, по сравнению с другими формами вторичного перитонита, возникновение симптома Щёткина- Блюмберга. Именно поэтому диагностику нельзя строить только на наличии этого признака. Мышечное напряжение локализуется вначале соответственно месту поражения кишечника или внизу живота. Следует помнить, что перитонит у таких больных обычно имеет распространённый характер, так как поражаются большие участки кишечника, а процесс деструкции протекает быстро. Поэтому локальные проявления перитонита не отражают в должной мере его распространённость.
Поэтому локальные проявления перитонита не отражают в должной мере его распространённость.
В стадии инфаркта диагностируют патогномоничный для заболевания симптом Мондора, который заключается в пальпации умеренно болезненного инфильтрата мягкоэластической консистенции без чётких границ. Симптом обусловлен резким отёком поражённой инфарктом кишки и брыжейки. Определение симптома Мондора в правой подвздошной области может явиться причиной ошибочного диагноза аппендикулярного инфильтрата.
В начале заболевания может определяться обычная или даже усиленная перистальтика, что свидетельствует о жизнеспособности кишечника. Однако в дальнейшем она очень скоро ослабевает. На стадии гангрены кишечника характерный признак — полное отсутствие кишечных шумов, при этом над брюшной полостью выслушиваются сердечные тоны.
В стадии инфаркта начинает определяться притупление в отлогих местах живота, где скапливается выпот.
Большое значение имеет пальцевое ректальное исследование, при котором можно обнаружить кровянистые выделения.
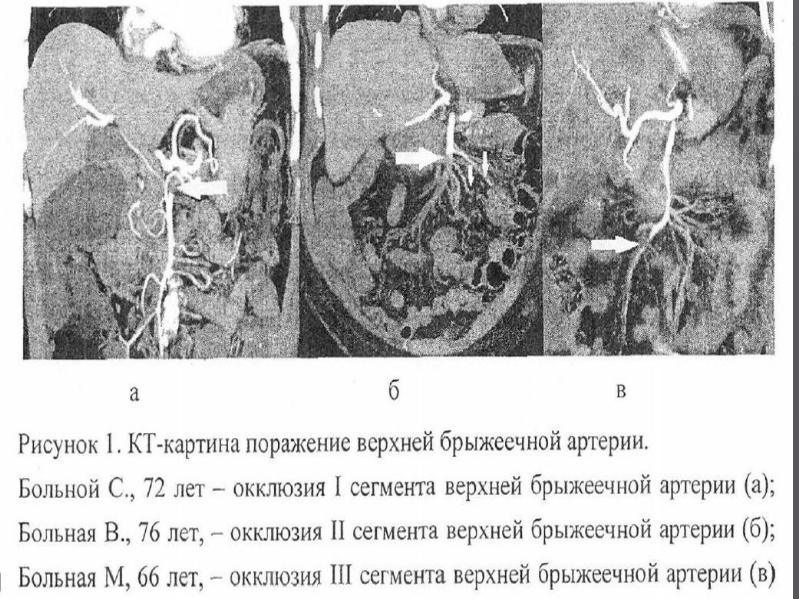
Ангиографическое исследование — специфический и наиболее объективный метод диагностики данного заболевания. Необходимую информацию получают с помощью аортографии в двух проекциях (прямой и боковой) с последующей селективной мезентерикографией. Наличие дефектов контрастирования и отсутствие заполнения ствола и ветвей мезентериальных артерий подтверждают диагноз вне зависимости от стадии заболевания. Окклюзия сосуда может быть выявлена ещё до развития инфаркта кишечника. Выделяют артериальную, капиллярную и венозную фазы прохождения контрастного вещества через сосудистое русло брыжейки и кишечной стенки. Каждая из них даёт определённую информацию и важна в диагностике различных видов нарушений мезентериального кровообращения. Существует возможность сделать заключение о жизнеспособности стенки кишки. Метод высокоинформативен, но, к сожалению, использование его в экстренных ситуациях возможно только в специализированных лечебных учреждениях.
Лапароскопия может быть проведена практически в каждом хирургическом стационаре, но из этого не следует, что она всегда необходима при подозрении на данное заболевание. Нет никакой необходимости прибегать к эндоскопии, когда диагноз перитонита не вызывает сомнений. В такой ситуации его причина должна быть уточнена во время экстренного хирургического вмешательства. Применение лапароскопии оправдано, если у хирурга имеются сомнения в необходимости неотложной лапаротомии.
Нет никакой необходимости прибегать к эндоскопии, когда диагноз перитонита не вызывает сомнений. В такой ситуации его причина должна быть уточнена во время экстренного хирургического вмешательства. Применение лапароскопии оправдано, если у хирурга имеются сомнения в необходимости неотложной лапаротомии.
Другие современные методы исследования, такие как УЗИ, КТ, МРТ, а также обзорная рентгенография органов брюшной полости, несмотря на возможность выявления отдельных диагностически значимых признаков, в основном могут быть использованы для исключения иной ургентной абдоминальной патологии.
При невозможности использовать специальные методы диагностики и обоснованном подозрении на острое нарушение мезентериального кровообращения показана диагностическая лапаротомия.
Дифференциальный диагноз [ править ]
Острые сосудистые болезни кишечника: Лечение [ править ]
Лечение острых нарушений мезентериального кровообращения в подавляющем большинстве случаев предполагает проведение экстренного хирургического вмешательства, которое должно быть предпринято, как только установлен диагноз или возникло обоснованное подозрение на это заболевание. Только активная хирургическая тактика даёт реальные шансы на спасение жизни больных. Консервативные методы лечения должны использоваться в сочетании с оперативными, дополняя, но ни в коем случае не заменяя их. Терапевтические и реанимационные мероприятия, проводимые в ситуациях, когда возможно развитие неокклюзионных нарушений мезентериального кровотока, эффективны лишь до появления клинической симптоматики со стороны органов брюшной полости и могут рассматриваться только в качестве профилактических мероприятий.
Только активная хирургическая тактика даёт реальные шансы на спасение жизни больных. Консервативные методы лечения должны использоваться в сочетании с оперативными, дополняя, но ни в коем случае не заменяя их. Терапевтические и реанимационные мероприятия, проводимые в ситуациях, когда возможно развитие неокклюзионных нарушений мезентериального кровотока, эффективны лишь до появления клинической симптоматики со стороны органов брюшной полости и могут рассматриваться только в качестве профилактических мероприятий.
Оперативное вмешательство должно решать следующие задачи:
1) восстановление мезентериального кровотока;
2) удаление нежизнеспособных участков кишечника;
3) борьбу с перитонитом.
Характер и объём хирургического вмешательства в каждом конкретном случае определяются рядом факторов: механизмом нарушения мезентериального кровообращения, стадией заболевания, локализацией и протяжённостью поражённых участков кишечника, общим состоянием больного, хирургическим оснащением и опытом хирурга. Все виды операций сводятся к трём подходам:
Все виды операций сводятся к трём подходам:
— комбинации этих способов.
Очевидно, что сосудистые операции наиболее целесообразны. Речь, как правило, идёт о вмешательстве на верхней брыжеечной артерии. Восстановление кровотока по мезентериальным артериям в течение первых 6 ч с момента окклюзии обычно приводит к предотвращению гангрены кишечника и восстановлению его функций. Однако и при поступлении больного в более поздние сроки, когда наступают необратимые изменения более или менее протяжённого участка кишечника, помимо его удаления может понадобиться операция на мезентериальных сосудах для восстановления кровотока в пока ещё жизнеспособных его отделах. Вот почему в большинстве случаев приходится сочетать сосудистые операции и резекционные вмешательства.
Профилактика [ править ]
Предотвратить возникновение тромбоэмболий артериального русла кишечника можно путём своевременного хирургического лечения аортальных и митральных пороков сердца, адекватной антиаритмической терапии и длительным применением непрямых антикоагулянтов у пациентов с постоянной формой мерцательной аритмии. Профилактика атеротромбоза заключается в постоянном приёме дезагрегантных средств. Для предупреждения венозного мезентериального тромбоза необходимо выявлять и коррегировать тромбофилические состояния.
Профилактика атеротромбоза заключается в постоянном приёме дезагрегантных средств. Для предупреждения венозного мезентериального тромбоза необходимо выявлять и коррегировать тромбофилические состояния.
Прочее [ править ]
Острые нарушения мезентериального кровообращения, протекающие с декомпенсацией кровотока, без оперативного лечения заканчиваются смертью больных. До 75% больных погибают на 1-4-е сут с момента начала заболевания. В основном это больные с эмболиями, артериальным тромбозом и неокклюзионными видами нарушения мезентериального кровообращения, в более поздние сроки — больные с венозным тромбозом.
Результаты оперативного лечения всё ещё далеки от удовлетворительных. Даже в крупных клиниках летальность составляет 67% и выше. Лучшие результаты получены после сосудистых операций в первые часы заболевания — до 75% выздоровевших. Оптимизм внушает факт постоянного улучшения с течением времени непосредственных результатов лечения.
В отдалённом послеоперационном периоде снижение массы тела отмечают около трети пациентов, синдром короткой кишки — около 20%. У остальных на фоне диеты и поддерживающей ферментной терапии наступает компенсация пищеварения. Выживаемость через 2 года составляет около 70%, через 5 лет — 50%. Причина летальных исходов в этом периоде — в основном сердечно-сосудистые заболевания. Длительный приём непрямых антикоагулянтов (варфарин и др.) в профилактических дозах улучшает отдалённые результаты.
У остальных на фоне диеты и поддерживающей ферментной терапии наступает компенсация пищеварения. Выживаемость через 2 года составляет около 70%, через 5 лет — 50%. Причина летальных исходов в этом периоде — в основном сердечно-сосудистые заболевания. Длительный приём непрямых антикоагулянтов (варфарин и др.) в профилактических дозах улучшает отдалённые результаты.
Включены:
- эмболический
- тромботический
Исключены: эмболия и тромбоз артерии:
- базилярной (I63.0-I63.2, I65.1)
- сонной (I63.0-I63.2, I65.2)
- мозговой (I63.3-I63.5, I66.9)
- коронарной (I21-I25)
- брыжеечной (K55.0)
- прецеребральной (I63.0-I63.2, I65.9)
- легочной (I26.-)
- почечной (N28.0)
- ретинальной (h44.-)
- позвоночной (I63.0-I63.2, I65.0)
- осложняющие:
- аборт, внематочную или молярную беременность (O00-O07, O08.2)
- беременность, роды и послеродовой период (O88.
 -)
-)
Основной причиной заболевания является атеросклеротическое поражение нижней брыжеечной артерии у пожилых лиц, страдающих атеросклерозом.
Основным предрасполагающим фактором служит анатомическая особенность отхождения этой артерии под острым углом от аорты.
Многие заболевания и патологические состояния потенциально могут стать причиной мезентериальной ишемии:
- Гипоперфузия (например, в результате сердечной недостаточности).
- Эмболическая окклюзия.
- Артериальный тромбоз.
- Венозный тромбоз.
- Васкулиты крупных сосудов (артериит Такаясу, гигантоклеточный артериит).
- Васкулиты сосудов среднего калибра (узелковый полиартериит и синдром Кавасаки).
- Васкулиты мелких сосудов (микроскопический полиартериит (полиангиит), гранулематоз Вегенера, Чарджа – Стросса синдром, болезнь Шенлейна – Геноха, системная красная волчанка ), ревматоидный васкулит, болезнь Бехчета).
- Облитерирующий тромбангиит.
- Диссеминированное внутрисосудистое свёртывание (ДВС-синдром).

- Состояние гиперкоагуляции.
- Серповидно-клеточная анемия.
- Расслоение аорты.
- Хирургические вмешательства на брюшной части аорты или резекция участка толстой кишки.
- Транслюмбальная аортография.
- Кардиохирургические вмешательства.
- Трансплантация печени.
- Кишечная непроходимость (особенно в результате ущемления в грыже).
- Карцинома толстой кишки.
- Травма (в том числе химическая, радиационная).
- Использование некоторых лекарственных средств (дигиталис, норадреналин, псевдоэфедрин, алкалоиды спорыньи, оральные контрацептивы, эстрогены, различные диуретики, антигипертензивные препараты, НПВП, лекарственные средства, применяемые в химиотерапии, паклитаксел, мелоксикам, кокаин).
- Наличие артериовенозных свищей между брыжеечными артериями и венами.
В ряде случаев причина ишемического колита остаётся неустановленной (идиопатический ишемический колит).
- Патогенез ишемического колита
Ишемический колит возникает вследствие недостаточного поступления артериальной крови к толстой кишке (чаще — к левой половине, особенно в области селезёночного изгиба). Высокая уязвимость кровообращения кишки в данной области вызвана стыком бассейна верхней и нижней брыжеечных артерий.
Высокая уязвимость кровообращения кишки в данной области вызвана стыком бассейна верхней и нижней брыжеечных артерий.
Ишемическое поражение ободочной кишки имеет, как правило, сегментарный характер. При этом чаще всего имеется поражение сегмента на протяжении, скачкообразное поражение встречается редко.
Прямая кишка, имеющая обильное кровоснабжение, чрезвычайно редко подвержена ишемическим поражениям.
- Морфологические изменения в толстой кишке
В поражённых сегментах толстой кишки наблюдается острое воспаление с изъязвлением слизистой или без такового. Язвы, как правило, поверхностные и имеют линейную форму.
Патологические изменения слизистой представлены широким спектром проявлений. Ишемия в течение минуты может не отражаться на архитектонике желез, но в то же самое время наблюдаются патологические изменения в собственной пластинке в виде капилляростаза с кровоизлияниями или без таковых, отёка и воспалительно-клеточной инфильтрации.
При колите лёгкой степени наблюдается ишемической природы некроз поверхностных слоёв слизистой оболочки. В случаях более выраженного ишемического поражения наблюдается структурный некроз слизистой и её внешний вид претерпевает значительные изменения. Зачастую на слизистой оболочке образуются псевдомембранозные наложения, состоящие из фибрина, слизи и клеточного детрита. По мере слущивания некротизированных эпителиальных клеток обнажаются крипты и строма, а также может образовываться воспалительная грануляционная ткань. Основания язв представлены грануляционной тканью с расширенными капиллярами.
В случаях более выраженного ишемического поражения наблюдается структурный некроз слизистой и её внешний вид претерпевает значительные изменения. Зачастую на слизистой оболочке образуются псевдомембранозные наложения, состоящие из фибрина, слизи и клеточного детрита. По мере слущивания некротизированных эпителиальных клеток обнажаются крипты и строма, а также может образовываться воспалительная грануляционная ткань. Основания язв представлены грануляционной тканью с расширенными капиллярами.
Главным гистологическим признаком острого ишемического поражения является расширение подслизистого слоя с наличием кровоизлияний и отёка. Изменения в подслизистом слое являются причиной полиповидных выпячиваний, которые при рентгенологическом исследовании обусловливают симптом «отпечатка большого пальца».
Мышечный слой относительно устойчив к ишемии. Однако при гангренозной форме ишемического колита поражаются все слои кишечной стенки.
Клиника и осложнения
Клиническая картина ишемического колита зависит от степени нарушения кровообращения в стенке толстой кишки.
- Основные клинические проявления ишемического колита
Для ишемического колита характерно развитие ряда клинических симптомов, интенсивность которых колеблется в широких пределах. Основными симптомами ишемического колита являются:
Боли в животе наблюдается у 100% пациентов. Локализация болей зависит от локализации пораженного сосуда, кровоснабжающего определённый участок толстой кишки. Только у 1/3 больных боль локализуется в одной анатомической зоне, у 2/3 одновременно возникают боли в нескольких анатомических областях. Основная локализация болей – левая подвздошная область, левое подреберье, нижние отделы живота, реже в подложечной области или в области пупка. У 2/3 наблюдается иррадиация болей в различные области тела (на заднюю поверхность тела, межлопаточную, подлопаточную, поясничную область, шею, затылок, пояснично–крестцовую область).
По характеру боли могут быть: приступообразными, постоянными с периодическим приступообразным усилением и непроходящими.
В транзиторной стадии заболевания эквивалентом боли чаще всего является чувство тяжести в эпигастральной или другой области. С усилением циркуляторных расстройств появляются схваткообразные боли, при прогрессировании заболевания (стенозирующая форма) боли приобретают постоянный ноющий характер, нарастают постепенно по интенсивности.
Интенсивность болей варьирует в широких пределах. Как правило, постоянные боли носят тупой, ноющий характер, а усиление или возникновение приступов острых, интенсивных, режущих болей связано с воздействием провоцирующих факторов и зависит от степени нарушения кровоснабжения толстой кишки.
Факторы, провоцирующие появление болей в животе:
- Боль чаще появляется при физической или связанной с процессами пищеварения нагрузке (по аналогии с коронарной недостаточностью или перемежающейся хромотой), что связано с недостаточным притоком крови к органам пищеварения в период их максимальной нагрузки. Физические перегрузки, провоцирующие возникновение абдоминальных болей, могут быть следующими: поднятие тяжестей, длительный физический труд, особенно в наклонном положении, быстрая ходьба.
- Боли усиливаются или появляются обычно через 15–20 мин после еды, стихают через 1–2 часа, связаны с количеством принимаемой пищи, иногда с ее характером (у многих больных отмечается непереносимость холодной, острой или сладкой пищи, молока, клетчатки).
- Боли провоцирует длительная задержка стула.
- Беременность является фактором, провоцирующим появление болей в животе при ишемическом колите.
- У некоторых больных болевой синдром возникает ночью, что связано с перераспределением крови по сосудистым бассейнам в положении лежа.
Встречается у 50% больных ишемическим колитом. Возникает вследствие нарушения секреторной и абсорбционной функции толстой кишки и проявляется диспептическими явлениями.
Наблюдается метеоризм, отрыжка, рвота, чувство быстрой насыщаемости, неустойчивый стул (диарея, чередующаяся с запорами) или нарушение эвакуаторной функции толстой кишки с упорными запорами, нередко — урчание в кишечнике. При относительной компенсации мезентериального кровообращения преобладает дисфункция толстой кишки: метеоризм, аэроколия, запор, неустойчивый стул. При гемодинамически значимых стенозах нижней брыжеечной артерии развиваются упорные запоры, кишечные кровотечения, признаки частичной кишечной непроходимости, нередко присоединяется недостаточность сфинктеров заднего прохода, ослабление мышц мочевого пузыря.
Обострения ишемического колита могут сопровождаться нерезко выраженными признаками раздражения брюшины, рвотой, диареей.
Этот симптом особенно часто проявляется в поздней стадии заболевания. Похудание связано с сознательным отказом больного от приема пищи в связи со страхом перед возникновением болей в животе после еды (ситофобия), а также с нарушением секреторной и абсорбционной функции толстой кишки в результате ее ишемии.
У 92,3% пациентов снижена работоспособность, наблюдается общая слабость, быстрая утомляемость, возникающая к вечеру или сразу после болевого приступа. Нейровегетативные расстройства связаны с изменениями гемодинамики, сопровождают боли в животе. Могут быть головные боли, головокружения, обмороки, сердцебиения, повышенное потоотделение, плохая переносимость тепла, зябкость.
- Осложнения ишемического колита
- При выраженном ишемическом поражении толстой кишки в ней могут сформироваться стриктуры, что может спровоцировать развитие кишечной непроходимости.
- При гангренозной форме ишемического колита возможно развитие перфорации (редко).
- На фоне ишемического колита возможно развитие воспалительного полипоза, пиоколона и токсического мегаколона. Однако эти осложнения очень редки.
Нарушение мезентериального кровообращения как проблема неотложной практики
Нарушения мезентериального кровообращения — многообразные по своим клиническим проявлениям патологические состояния, варьирующие по симптоматике от незначительных расстройств, вызывающих дискомфортные явления со скудной клинической симптоматикой, до острых нарушений с тяжелейшим течением и высочайшей летальностью, которая, по данным различных авторов, достигает 50–100 %.
Учитывая демографические изменения, происходящие в обществе (старение населения), а также параллельный процесс «омоложения» сосудистой патологии, обусловленный многими факторами, следует констатировать, что данная проблема актуальна. Связано это в первую очередь с возрастающим количеством пациентов с подобной патологией, а также нерешенными проблемами диагностики и лечения.
Обращаясь к историческим этапам изучения данной патологии, следует отметить, что с конца XIX века от первого анатомического наблюдения тромбоза брыжеечной артерии Tiedemann в 1843 году и описания кишечного инфаркта, которое сделал Virchov в 1847 году, до середины прошлого столетия описывались единичные случаи подобной патологии, а патологическая физиология происходящих нарушений изучалась в острых экспериментах. В дальнейшем отмечается увеличение числа именно клинических случаев, связанное с ростом заболеваемости и прогрессом в диагностике. Проблема из теоретической перешла в практическую плоскость.
Здесь уместно остановиться на том, что в силу инерции мышления некоторое время хирурги склонны были относить данную патологию к острой непроходимости кишечника, считая ее одной из динамических форм. Однако еще в 1903 году А.А. Кадьян в своей работе «Повреждения и хирургические заболевания кишок и брыжейки» обращал внимание врачей на то, что при всей клинической схожести данных патологий закупорка сосудов брыжейки все же является самостоятельным заболеванием, требующим отличных подходов к диагностике и лечению. В настоящее время данная патология признана самостоятельным заболеванием, имеющим свою рубрику в МКБ 10-го пересмотра. Это отличие принципиально, поскольку акцентирует внимание врача на сосудистой проблеме, и вмешательство должно быть осуществлено на сосудистом русле в первую очередь и лишь дополнено вмешательством на кишечной трубке.
Относительно подходов к терапии нужно отметить, что еще в 1939 году Murray, MacKenzie предлагали применение гепарина при мезентериальном тромбозе. Идея эмболэктомии принадлежит В.Г. Цеге-Мантейфелю, который высказал ее в 1913 году. А первое успешное извлечение эмбола при закупорке верхней брыжеечной артерии выполнил Steward в 1951 году.
Этиология и патогенез заболевания
По этиологическим моментам и реализующимся патогенетическим механизмам в упрощенном восприятии острую мезентериальную ишемию можно разделить на три принципиально различных типа:
1. Тромботический развивается в результате острого артериального тромбоза проксимального сегмента сосуда (наиболее часто устья верхней брыжеечной артерии) на фоне сердечной недостаточности, гиперкоагуляции, полицитемии, травмы, панкреатита, приема оральных противозачаточных препаратов или опухолевых процессов.
2. Эмболический развивается вследствие окклюзии, вызванной смещением с током крови эмболов, первоночально возникающих проксимально (на фоне мерцания предсердий, ИБС, пристеночного тромбоза ЛЖ после инфаркта, расстройств коагуляции, аневризмы аорты). Эмболы склонны к фрагментации и смещению в дистальные сегменты сосуда, вызывая сегментарный тип прерывистой ишемии.
3. Неокклюзивный чаще всего развивается на фоне резкого снижения системного кровотока, обусловленного мезентериальным атеросклерозом, низким сердечным выбросом, спазмом брыжеечных сосудов, гиповолемией (как результат шока, сепсиса, дегидратации, аритмии).
Возможна и комбинация этих факторов, развивающаяся на фоне предшествующего тяжелого заболевания.
В дальнейшем в зависимости от выделяемых трех вариантов течения (1 — с компенсацией кровотока, 2 — с субкомпенсацией кровотока, 3 — с декомпенсацией кровотока) реализуются последовательно три патогенетические стадии — ишемия, инфаркт, перитонит. Некоторыми авторами выделяется стадия функциональной кишечной непроходимости.
В стадии ишемии полностью или практически полностью прекращается кровоток в стенке кишечника, при этом токсические продукты не попадают в системный кровоток и клиника обусловлена в основном рефлекторными реакциями. В стадии инфаркта в кишечной стенке начинаются процессы деструкции, продолжающиеся до самой смерти, кишечная стенка постепенно теряет свои защитные свойства и начинается процесс транслокации бактерий из просвета кишечной трубки, в результате процесс переходит в третью стадию — перитонит.
Частота встречаемости
По литературным данным, удельный вес пациентов с нарушением мезентериального кровообращения в структуре госпитализированных в хирургические стационары в 60–70-е годы прошлого столетия составлял от 0,1 до 0,39 %. При этом многие авторы отмечают постоянный рост числа пациентов с подобной патологией. В ХГКБСНМП мы также прослеживаем подобную тенденцию. Нашло подтверждение в наших наблюдениях и положение о превалировании в структуре заболевших пациентов женщин, и о преимущественно пожилом возрасте больных (табл. 1).
Клинические проявления, симптоматика и течение нарушений мезентериального кровообращения
На ранних этапах развития заболевания пациент жалуется на сильные боли в животе, а объективных данных при этом немного — это уже повод подумать об остром нарушении мезентериального кровообращения. Но этот симптом — выраженные, порой характеризуемые как нестерпимые боли в животе и при этом мягкий, малоболезненный живот — достаточно частый, по данным литературы и по нашим собственным наблюдениям. Следует добавить, что при этом пациенты нередко связывают возникновение болей с приемом пищи, иногда с физической нагрузкой. Одна из пациенток указывала, что нестерпимые, жгучие боли в околопупочной области возникли у нее при внутривенном введении верапамила, применявшегося с целью купирования аритмии. Такое острое начало отмечалось в подавляющем большинстве наблюдений, однако встречалось и постепенное развитие болей и (крайне редко, возможно, из-за недостаточного внимания опрашивающего) двухэтапное развитие болей. Из жалоб обращают на себя внимание тошнота и рвота, иногда с примесью крови. В отличие от кишечной непроходимости значительно чаще у пациентов отмечается жидкий стул. «Малиновое желе» отмечается достаточно редко и на поздних стадиях развития заболевания (начиная с развития инфаркта кишечной трубки).
При объективном исследовании чаще всего живот бывает симметрично поддут, участвует в акте дыхания, мягкий (!) и малоболезненный. На более поздних стадиях, при развитии инфаркта кишечника, может определяться симптом Кадьяна — Мондора — пальпируемое болезненное тестоватое опухолевидное образование, малосмещаемое, обусловленное отеком кишки и брыжейки. Прогрессирование процесса приводит к появлению классической перитонеальной симптоматики.
При аускультации перистальтика резко угнетена, порой перистальтические шумы полностью отсутствуют. Перкуторно определяется достаточно пестрая картина: участки тимпанита (который не такой звонкий, как при механической непроходимости) чередуются с участками притупления перкуторного звука, достаточно рано, порой через 3–4 часа от начала заболевания, появляется притупление в отлогих местах живота.
Диагностика
Лабораторные показатели при данном заболевании весьма неспецифичны, и хотя большинство авторов указывают на высокий лейкоцитоз, с выраженным сдвигом формулы, в наших наблюдениях лейкоцитоз варьировал от нормальных цифр до высоких. Какой-либо отчетливой закономерности не прослеживается, за исключением лишь того факта, что при прогрессировании процесса лейкоцитоз нарастает. Зарубежные руководства указывают на повышение уровня лактата в сыворотке крови (подобный показатель имеет 100% чувствительность при 40% специфичности).
Визуализационные методы исследования, применяющиеся при данной патологии:
— обзорная рентгенография живота — специфической рентгенсимптоматики, по-видимому, не существует, хотя ряд авторов акцентирует внимание на симптоме безгазового живота, когда наблюдаются диффузное матовое затемнение при малом или практически полностью отсутствующем количестве газов в кишечнике, ригидность и утолщение кишечной стенки. Однако этот симптом характерен для стадии инфаркта и перитонита и возникает достаточно поздно. Как характерный признак терминальной стадии рассматривается наличие пузырьков газа в стенке кишки. Подчеркнем, что в наших условиях выявить его не удалось ни в одном из исследований. Следует отметить, что исследование ЖКТ с контрастированием путем проведения пассажа водной взвеси сульфата бария малоинформативно, дает определенную задержку во времени;
— ультразвуковое исследование, выявляющее неспецифические признаки, в основном характеризующие утолщение кишечной стенки и наличие свободной жидкости в брюшной полости. Однако отличить ишемию от воспалительной инфильтрации практически невозможно. В литературе описаны случаи выявления тромбоза брыжеечных вен и окклюзии брыжеечной артерии при выполнении цветного дуплексного сканирования, и данная методика позиционируется как единственный ультразвуковой метод, позволяющий это сделать. Но, к сожалению, клиника не располагает подобной аппаратурой, а при проведении черно-белого сканирования в режиме реального времени выявить подобную патологию не удалось ни разу;
— компьютерная томография — чувствительность этого метода изучена на данный момент недостаточно, но характерные признаки (включая газ в брыжейке и стенке кишечной трубки) выявляются хорошо;
— ангиография — не обладая собственным оборудованием для проведения данного исследования, считаем необходимым согласиться, что именно она в состоянии дать окончательный ответ о возможном виде и уровне окклюзии мезентериального кровообращения, при этом большинство авторов считают необходимым выполнение ее во фронтальной и боковой проекциях для детализации локализации поражения;
— лапароскопия — метод может служить как диагностике (при подозрении на нарушение мезентериального кровообращения), так и уточнению распространенности и давности процесса с целью уяснения операбельности ситуации. Имеются достаточно четкие лапароскопические признаки патологии, а именно: изменение цвета петель кишечника, отсутствие пульсации краевых сосудов. Меняется и сосудистый рисунок стенки кишки: если в норме он имеет поперечный характер, то с развитием патологии этот рисунок исчезает и появляется большее число сосудов, ориентированных по ходу кишки. В стадии инфаркта стенка кишки красная, отечная. В терминальных стадиях появляется характерный выпот. Имеющаяся в клинике операционная видоэндоскопическая стойка позволяет после введения дополнительного манипулятора более детально осмотреть кишечник и принять решение об операбельности ситуации. В последние 1–2 года метод вытесняет диагностическую лапаротомию. Относительными противопоказаниями к наложению карбоксиперитонеума считаем лишь выраженное вздутие петель кишечника, перенесенные ранее обширные лапаротомии и крайне тяжелое состояние пациента.
Принципиальные подходы к лечению
Принципиальными подходами к терапии остаются мероприятия, направленные на устранения основных звеньев патогенеза. Применение фибринолитических средств при мезентериальном венозном тромбозе в идеале показано на догоспитальном этапе, но, к сожалению, поскольку именно на этом этапе патология остается нераспознанной, применить их не представляется возможным. Необходимо возмещение внутрисосудистого объема жидкости и улучшение реологических свойств крови путем внутривенной инфузии; коррекция предрасполагающих факторов и развивающихся осложнений, например артериальной гипотонии, должна проходить без применения вазопрессоров, способных усугубить ишемию. Показано и превентивное введение антибиотиков, эффективных в отношении грамотрицательной флоры. При проведении ангиографии целенаправленно может быть применен спазмолитик, например папаверин, особенно эффективный при неокклюзирующем поражении, эффективность внутриартериального тромболизиса находится на стадии изучения.
Попытки неоперативного лечения оправданы при отсутствии перитонеальной симптоматики. При этом делается акцент на том, что, в отличие от кишечной непроходимости, предоперационная подготовка должна быть принципиально минимизирована во времени, поскольку задержка с восстановлением перфузии лишь утяжеляет состояние пациента, способствуя прогрессированию некроза.
В настоящее время радикальными пособиями признаны лишь операции на сосудистом русле, устраняющие эмболизацию либо тромбоз, с резекцией (или без нее при отсутствии показаний) нежизнеспособной части кишечника. Одна лишь резекция измененных сегментов кишечной трубки зачастую проблемы не решает, эффективна лишь при дистальных локализациях поражения, когда окклюзированный участок сосудистого русла попадает в резецированный препарат. Однако, к сожалению, при отсутствии подготовленных сосудистых хирургов, при поздней (свыше 24 часов) госпитализации больных в подавляющем большинстве случаев операций на брыжеечных артериях в клинике не выполнялось. До 95 % лапаротомий составляют диагностические и эксплоративные вмешательства, констатирующие лишь неоперабельность ситуации. Выполненные резекции лишь в незначительном числе случаев привели к выздоровлению пациентов. Наиболее частой причиной неудач становился продолженный тромбоз. Однако при этом не было отмечено функционально нерадикальных вмешательств, когда оставшегося сегмента тонкой кишки недостаточно для выполнения пищеварительной функции и требуется длительное (порой постоянное) полное парентеральное питание.
Результаты представлены в табл. 2.
Проблемные и нерешенные вопросы
На наш взгляд проблема, связанная с данной патологией, многоплановая и лежит в нескольких плоскостях. Во-первых, рост сердечно-сосудистой патологии при отсутствии медицинской культуры населения и спорадическом, проводимом без должного врачебного контроля лечении приводит (на фоне изменившегося рациона) к росту осложненного ее течения, в том числе и к тромбоэмболиям. Кстати, это наглядно демонстрирует и рост цереброваскулярной патологии. Но это плоскость глобальная — общемедицинская. Локальные же аспекты характеризуются в первую очередь проблемой диагностики на раннем этапе, а для этого на догоспитальном этапе должна быть соответствующая настороженность персонала «первой линии». На госпитальном этапе — наличие соответствующего оборудования и подготовленных специалистов с возможностью круглосуточного, безотлагательного проведения таких исследований (ангиография, лапароскопия). В плане лечения стоит проблема определения хирургической радикальности резекций (при которой пациент выживает в раннем послеоперационном периоде, но при этом обречен на пожизненное парентеральное питание, что практически невозможно в нашей экономической ситуации) и физиологической радикальности резекций (с достаточным для пищеварения сохраненным сегментом кишки). Эта проблема смещается в плоскость этико-правовую — стоит ли выполнять хирургически радикальные резекции, если отказ от них фактически граничит с пассивной эвтаназией, а выполнение обрекает больного на муки, а семью на непосильные затраты. Необходимым условием прогресса в лечении данной патологии в клинике следует считать подготовку хирургов, которые при наличии соответствующего инструментария и условий в состоянии выполнить вмешательства на сосудах с целью восстановления перфузии ишемизированной кишки.
Тромбоз воротной вены — причины, симптомы, диагностика и лечение
Тромбоз воротной вены – это полная или частичная окклюзия ствола воротной вены и ее ветвей тромботическими массами. Патология проявляется абдоминальным синдромом, рвотой, диареей, признаками портальной гипертензии (асцит, спленомегалия, расширение венозных коллатералей), осложняется кровотечением из верхних отделов пищеварительного тракта, инфарктом кишечника и другими состояниями. Основу диагностики составляют методы визуализации – УЗДС, МР- и КТ-ангиография, венография пораженных участков. Лечебная тактика предполагает антикоагулянтную терапию, тромболизис, хирургическую коррекцию.
Общие сведения
Тромбоз воротной вены (пилетромбоз) считается достаточно редким явлением, риск возникновения которого не превышает 1% в общей популяции. Его распространенность среди пациентов с циррозом печени варьируется от 0,6 до 26%, что, по-видимому, связано с различием в критериях выборки и диагностических методах. Заболевание называют причиной 5–10% случаев портальной гипертензии у жителей развитых стран и до 40% – в азиатском регионе (из-за более высокой частоты инфекционной патологии). Распространенность первичного тромбоза у взрослых и детей одинакова. Гендерных отличий в развитии болезни не выявлено, кроме цирротической обструкции, чаще диагностируемой у мужчин.
Тромбоз воротной вены
Причины
Заболевание имеет мультифакторную природу. Тромбоз развивается под влиянием системных и локальных нарушений, участвующих в повреждении сосудистой стенки, усилении коагуляции, замедлении венозного кровотока. Среди наиболее значимых причин отмечают следующие:
- Цирроз печени. Является основным этиологическим фактором, составляя 24–32% случаев тромботической окклюзии. Вероятность тромбоза повышается на поздних стадиях болезни, при необходимости трансплантации органа. Переход цирроза в гепатоцеллюлярную карциному увеличивает частоту внепеченочных пилетромбозов.
- Новообразования. Злокачественные новообразования печеночного или панкреатического происхождения являются причиной 21–24% случаев тромбоза. Развитие патологии опосредовано компрессией или прямой опухолевой инвазией, сопутствующей гиперкоагуляцией, гормональными сдвигами.
- Тромбофилии. Системные нарушения вызваны врожденными дефектами коагуляции – генетическими мутациями (фактора V Лейдена, протромбина, ингибитора активатора плазминогена), дефицитом протеинов C и S, антитромбиновой недостаточностью. К приобретенным факторам относят хроническую миелопролиферативную патологию, антифосфолипидный синдром, пароксизмальную ночную гемоглобинурию.
- Воспалительные заболевания. Патологический процесс может возникать на фоне абдоминальной воспалительной патологии (панкреатита, холецистита, гепатита), инфекционных заболеваний (малярии, брюшного тифа, амебиаза). У детей и новорожденных половина случаев тромбоза приходится на долю омфалита, пупочного сепсиса, аппендицита.
- Травмы и оперативные вмешательства. Воротная вена подвергается повреждению при травмах живота и хирургических вмешательствах на органах брюшной полости (спленэктомии, холецистэктомии, трансплантациии печени). Патология возникает после портосистемного шунтирования, тонкоигольной аспирационной биопсии печени, склеротерапии вен пищевода.
К другим факторам риска тромбоза воротной вены относят беременность, прием пероральных контрацептивов, гиперхолестеринемию. Отмечена роль внутрибрюшной аденопатии, синдрома системного воспалительного ответа. В детском возрасте окклюзия возникает при врожденных аномалиях сосудистой системы (дефектах межжелудочковой и межпредсердной перегородок, деформации полой вены) и желчевыводящих путей. Причина 10–30% тромботических стенозов остается невыясненной.
Патогенез
Исходя из современных представлений, пилетромбоз является результатом системных коагулопатий (наследственных, приобретенных) и действия локальных факторов. Повреждение стенки сосуда опухолью, инвазивными процедурами или травмами характеризуется выработкой цитокинов, активацией тромбоксана A2 и тромбина, усилением адгезии и агрегации тромбоцитов. Венозный застой при наружной компрессии сопровождается гипоксией эндотелия, накоплением активированных факторов свертывания. Все это запускает формирование пристеночного кровяного сгустка с дальнейшим его увеличением.
Сосудистая окклюзия сопровождается портальной гипертензией, что ведет к изменению системной и внутриорганной гемодинамики. Печень теряет около 2/3 своего кровоснабжения, но это компенсируется дилатацией печеночной артерии и быстрым развитием сети коллатералей. Вокруг тромбированной вены формируется кавернома, а сама она превращается в фиброзный тяж. Новообразованные сосуды расположены в пределах желчных протоков и пузыря, поджелудочной железы, антрального отдела желудка, двенадцатиперстной кишки.
Патогенез тромбоза при печеночном циррозе до конца не ясен. Важное значение отводят портальной гипертензии с замедлением кровотока по воротной вене, периферическому лимфангииту, перипортальному фиброзу. Системное шунтирование крови провоцирует гемосидероз, гепатоциты в зонах гипоперфузии подвергаются апоптозу. В тонком и толстом кишечнике выше уровня окклюзии определяются застойные явления, в желудке – гастропатия. Брыжеечная ишемия может привести к переходу тромботического процесса на мезентериальные сегменты.
Классификация
Формальной классификации тромбоза воротной вены не существует. Согласно клиническим рекомендациям по портальной гипертензии, при постановке диагноза учитывают участок тромбоза и его проявления, наличие и характер основного заболевания, степень окклюзии (частичную, полную), вовлеченность внепеченочных сегментов. В зависимости от локализации тромба различают несколько форм патологии:
- Стволовая (трункулярная). Участок окклюзии расположен в стволе воротной вены, дистальнее слияния селезеночной и верхней мезентериальной. Возникает первично или путем распространения из корешкового сегмента.
- Радикулярная (корешковая). Характеризуется поражением корешковых ветвей – селезеночной вены и брыжеечных сосудов.
- Терминальная. Пилетромбоз распространяется на внутрипеченочные разветвления и капилляры, сопровождаясь мелкими или развитыми коллатералями.
Представленная классификация позволяет оценить последствия тромботической обструкции и трудоспособность пациента. При поражении сначала интерстициальных сосудов, а затем крупных стволов констатируют восходящий (первичный) процесс. Мезентериальный тромбоз, возникающий из-за обструкции воротной или селезеночной вен, называют нисходящим (вторичным). В клинической флебологии также различают острую, подострую и хроническую стадии, последовательно сменяющие друг друга.
Симптомы
Клиническая картина тромбоза воротной вены определяется происхождением, степенью, протяженностью, локализацией, темпами нарастания окклюзии, выраженностью коллатералей. Частичное тромбирование протекает бессимптомно, выявляясь лишь при инструментальной диагностике, полной обструкции (90–100% просвета) присуще бурное развитие за несколько суток. Подострая форма прогрессирует на протяжении 4–6 недель, а хронический процесс характеризуется медленным нарастанием симптоматики (от нескольких месяцев до года).
Стволовой тромбоз
Острый стволовой пилетромбоз проявляется резкими болями в правом подреберье и эпигастрии, сочетающимися с метеоризмом, частой рвотой, диареей (нередко с примесью крови). Быстро нарастают признаки портальной гипертензии – расширение подкожных, пищеводных, геморроидальных вен, асцит. Зачастую выявляют желтуху, недостаточность печеночной функции. Общее состояние пациентов быстро становится тяжелым, что в основном обусловлено рецидивирующими кровотечениями из желудочно-кишечного тракта.
Радикулярный тромбоз
Радикулярный тромбоз на уровне селезеночного сегмента начинается остро, с боли в левом подреберье, кровавой рвоты и дегтеобразного стула. Увеличение селезенки и субфебрильная лихорадка сочетаются с обычными размерами печени. В подостром периоде постепенно нарастают спленомегалия, асцит, расширяется венозная сеть на животе. Терминальная форма патологии выявляется только при распространенном поражении – у таких пациентов обычно определяют увеличенную селезенку, широкие подкожные коллатерали.
Хронический тромбоз
Хронический пилетромбоз не имеет специфических проявлений. Отсутствие аппетита и общая слабость – иногда единственные симптомы болезни. У большинства пациентов выявляют подкожные анастомозы, умеренный асцит. В 20–40% случаев патология манифестирует кровотечением из варикозных расширений пищевода. Вялотекущие варианты тромбоза воротной вены характеризуются нерезким болевым синдромом, субфебрилитетом, чувствительностью печении при пальпации. Отмечаются спленомегалия с признаками гиперспленизма, тяжестью в подреберье, исхуданием.
Осложнения
Наиболее опасное следствие острой окклюзии мезентериальных сосудов – инфаркт кишечника с развитием перитонита и полиорганной недостаточности (характерно для 5% случаев). Большинство осложнений длительного пилетромбоза обусловлено портальной гипертензией. Расширение пищеводных вен у многих пациентов сопровождается кровотечением, риск которого в 100 раз выше при циррозе печени. Выраженное портосистемное шунтирование приводит к печеночной энцефалопатии, вторичным изменениям в желчевыводящих путях (портальной билиопатии, холангиопатии). При сохраняющихся факторах риска тромбозы могут рецидивировать, осложняться эмболизацией.
Диагностика
Отсутствие специфических признаков тромбоза, необходимость определения предпосылок, уровня, степени и последствий поражения создают потребность в комплексном обследовании пациента. Основой диагностической программы выступают методы инструментальной визуализации:
- УЗАС воротной вены. Обладая высокой специфичностью (60–100%), признано методом выбора при первичной диагностике. УЗДС определяет неоднородный очаг повышенной эхогенности с нечеткими контурами, частично или полностью перекрывающий сосудистый просвет. Допплеровское картирование дает возможность выявить отсутствие кровотока в вене и ее притоках, наличие портосистемных шунтов, каверноматозную трансформацию.
- КТ и МР-ангиография сосудов. КТ с контрастированием дает точную информацию о состоянии венозных стенок, протяженности тромбированных участков, наличии перивисцеральных коллатералей, варикозных вен в забрюшинном пространстве. Магнитно-резонансную ангиографию используют для выяснения состоятельности портального кровотока, оценки просвета шунтов – ее результаты более надежны, чем УЗДС.
- Портальная венография. Используется в случаях, когда неинвазивными методами подтвердить или исключить тромботическое поражение не удается. Контрастная венография выявляет не только стенозы, но и дефекты наполнения от сдавления извне. Однако при установленной проходимости сосуда в ней нет необходимости.
Проводя диагностику пилетромбоза, врачи-флебологи обращают внимание на показатели коагулограммы (увеличение фибриногена, протромбинового индекса, замедление времени свертывания крови), низкий уровень антитромбина. Выявить варикозно-расширенные вены пищевода позволяет ФГДС, исключить цирроз удается благодаря эластографии и биопсии печени. Дифференциальная диагностика осуществляется с печеночным шистосомозом, тромбозом нижней полой вены, сдавливающим перикардитом, рестриктивной кардиомиопатией.
Лечение тромбоза воротной вены
Задачами лечебной коррекции являются восстановление проходимости сосуда, предотвращение прогрессирования патологии, устранение осложнений венозной гипертензии. Исходя из остроты процесса, возраста пациента, этиологических и прочих факторов, применяют комбинацию консервативных и радикальных методов:
- Антикоагулянтная терапия. Является лучшим способом для реканализации венозного просвета, но единого мнения о ее применении нет. Длительность лечения антикоагулянтами (низкомолекулярными гепаринами, пероральными средствами) у лиц с острым пилетромбозом составляет от 3 до 6 месяцев, а при хроническом решается в индивидуальном порядке.
- Введение тромболитиков. Регионарный тромболизис (введение стрептокиназы, альтеплазы, тенектеплазы) транспеченочным или трансъюгулярным доступом позволяет обеспечить реканализацию, избежав побочных эффектов антикоагулянтной терапии. При острой тотальной или субтотальной окклюзии может выполняться системный тромболизис.
- Хирургические методы. При неэффективности консервативных мероприятий операцией выбора является дистальное спленоренальное шунтирование. В условиях нарушенной проходимости селезеночного участка накладывают мезентерикопортальный или мезентерикокавальный анастомоз с применением сосудистых протезов.
Варикозные расширения пищевода лечат с помощью лигирования, эндоскопической склеротерапии. В ургентных ситуациях при кровотечении могут производить операции азигопортального разобщения (гастротомию с прошиванием нижней трети пищевода, деваскуляризацию желудка). Тяжелый гиперспленизм требует спленэктомии.
Прогноз и профилактика
В целом прогноз при заболевании относительно благоприятный. Сгустки могут подвергаться асептическому аутолизу, организации, васкуляризации. Десятилетняя выживаемость для взрослых достигает 60%, а общий уровень смертности составляет менее 10%. При наличии цирроза и злокачественных новообразований прогноз ухудшается. Иногда тромбы превращаются в эмболы, становятся источником сепсиса. Но своевременное и интенсивное лечение приводит к реканализации сосуда, что сопровождается полным клиническим выздоровлением. Профилактика рецидивов проводится путем назначения антикоагулянтов.
Острый мезентериальный тромбоз — презентация онлайн
1. Острый мезентериальный тромбоз.
Подготовил: Карабешкин Дмитрий Иванович,7 группа IV курс Лечебного факультета.
Архангельск, 2017
2. «Закупорка брыжеечных сосудов – одно из тех состояний, диагноз невозможен, прогноз безнадежен, а лечение почти бесполезно» (А.
«Закупорка брыжеечных сосудов – одно из тех состояний,диагноз невозможен, прогноз безнадежен, а лечение почти бесполезно»
(А. Коккинз, 1921).
На фото:
Рудольф Людвиг Карл Вирхов
(1821—1902)
•МКБ10: K55.0
•Острая мезентериальная ишемия – внезапная
острая артериальная или венозная окклюзия
или снижение кровотока в пределах
мезентериального кровообращения.
(ESTES: acute mesenteric ischaemia, 2016)
•Мезентериальный тромбоз — это острое
нарушение кровообращения в брыжеечных
сосудах, возникающее вследствие эмболии или
тромбоза брыжеечных артерий и вен.
4. Актуальность
o Удельный вес от всех хирургических заболеваний:• В 60–70-е — до 0,39 %,
• В настоящее время — до 7,6%
o Верный диагноз лишь в 18-45% случаев
o Летальность 67– 97%.
o Атеросклеротические поражения БА у 80% больных с ИБС, ГБ,
церебральным атеросклерозом
o 17,5% лиц старше 65 летнего возраста имеют клинические
проявления хронической абдоминальной ишемии
5. Факторы риска
• Тромбофилия• Злокачественные опухоли
• Пожилой возраст
• Артериальная гипертензия и сахарный диабет
• Цирроз печени, опухоли сердца и органов брюшной
полости
• Перитонит, травмы живота, абдоминальные
хирургические вмешательства.
6. Виды нарушений мезентериального кровообращения по Савельеву
Окклюзионные1.
2.
3.
4.
5.
6.
7.
Неокклюзионные 13%
(NOMI).
Эмболия 44% (ЕАМI)
1. С неполной окклюзией
артерий
Тромбоз артерий 33% (ТАМI)
2. Ангиоспастическая
Тромбоз вен 10% (ВАМI)
Прикрытие устья артерий со стороны
3. Связанная с централизацией
аорты за счет атеросклероза и тромбоза
гемодинамики
Окклюзия артерий в результате
расслоения стенок аорты
Сдавление(прорастание)сосудов
опухолями
Перевязка сосудов
7. Особенности мезентериального кровоснабжения
8. Локализация тромба в стволе ВБА:
СегментыПрогноз
Ветви ВБА
Локализация тромба в стволе ВБА:
I
Тотальное поражение ТНК + слепая + правая
половина ОК
Могут сохраниться проксимальный участок ТНК
до 15 см + слепая + восходящая ОК
Некроз дистальной части ТНК, слепой и
проксимальной части восходящей ОК.
Из ТНК сохраняется проксимальные 1-2м
II
III
Некроз подвздошной кишки
Возможна компенсация артериального
кровотока во всей ТНК
Зон Сегмент
а
Проксимальнее первой
I крупной ветви (нижняя
панкреато-дуоденальная а.)
II
III
IV
Между нижней панкреатодуоденальной и срединной
ободочной артерией
Дистальнее срединной
ободочной артерии
Сегментарные ветви
Степень Категория
ишемии
Максимальна
я
I
Средняя
II
III
IV
Пораженные сегменты
кишки
Тощая, подвздошная,
восходящая
подвздошная кишка
Крупный сегмент
тонкой кишки и/или
восходящей
подвздошной кишки
Минимальна Небольшой сегмент
я
тонкой кишки и/или
восходящей
подвздошной кишки
Отсутствие
Отсутствует ишемия
11. Течение мезентериального тромбоза
1. Фаза компенсацииВозможно восстановление функций без последствий.
2. Фаза субкомпенсации
Приводит к язве кишечника, энтеритам, колитам.
3. Фаза декомпенсации (быстро/медленно прогр.)
Приводит к инфаркту кишечника, распространенному
гнойному перитониту, тяжелому абдоминальному
хирургическому сепсису.
12. Стадии мезентериального тромбоза
1. Ишемии(геморрагическогопропитывания)
2. Инфаркта
3. Перитонита
13. Стадия ишемии
6-12 часов• Интенсивные боли, обычно в эпигастрии,
не купируются наркотическими анальгетиками,
купируются спазмолитиками.
• Рвота желудочным содержимым, с примесью крови.
• Тромбогенные/эмбологенные паталогии в анамнезе.
Триада по
A.Klass, 1957
• Симптом Блинова — повышение АД на 60-80 мм рт. ст. вследствие
окклюзии ствола ВБА
• «Pain out of proportion» — Несоответствие интенсивности боли
физикальным данным при осмотре живота
17. Стадия инфаркта
12-24 часа• Боли несколько уменьшаются
• Легкая эйфория
• Артериальное давление нормализуется,
• Пульс учащается.
• Число лейкоцитов повышается до 20-40×10 9/л.
• Симптом «ишемического опорожнения кишечника»
• Выделения из прямой кишки по типу малинового желе.
• симптом Мондора — пальпаторно: инфильтрат мягкоэластической
консистенции без четких границ
19. Стадия перитонита
18-36 часов• Боли усиливаются при движении — адинамия
• Ухудшение общего состояния
(эндотоксикоз, обезвоживание, дисбаланс электролитов,
метаболический ацидоз, лактат сыворотки крови выше 2,6 ммоль/л)
• Бред
• Мышечное напряжение стенок живота
• Симптом Щеткина-Блюмберга, однако позже, чем при других формах
вторичного перитонита
• Кровянистые выделения при ректальном исследовании
20. Специальные методы исследования
1.Лабораторные исследования2.Ангиография
3.Рентгеноскопия
4.МРТ, КТ
5.Узи брюшной полости/дуплексное сканирование
6.Лапароскопия
7.Диагностическая лапаротомия
21. Лабораторные исследования
• лейкоцитоз,• гемоконцентрация;
• гиперкоагуляция;
• метаболический ацидоз.
• Лактат сыворотки крови выше 2,6 ммоль/л
• повышение уровня Д-димеров;
• биохимический анализ крови – повышение уровня
мочевины, креатинина,амилазы, АСТ;
Ультразвуковые методы
У большинства больных:
• гиперпневматизация
• большое количество жидкости в желудке
• утолщение кишечной стенки.
Дуплексное сканирование – если нет пневматоза
кишечника позволяет выявить ОМИ у порядка 42,3%
пациентов. Radonak J. и соавт. (2010)
Обзорная
рентгенография
брюшной полости
1).Утолщение кишечной стенки
2).Отек и деструкция
слизистой оболочки кишки
3).Интрамуральный газ
4).Гиперпневматизация
кишечника
5).Реже — уровни жидкости.
Ангиография
• аортография
• селективная мезентерикография
Ищем дефекты контрастирования ВБА с отсутствием
наполнения её ствола или ветвей
Опеделяем локализацию, вид и протяженность
Нарушения кровообращения, а также состояние
коллатерального кровотока.
Компьютерная томография (КТ)
дилатированные кишечные петли,
утолщение стенки кишки,
пневматоз,
внутристеночный газ кишечника,
жидкость в брюшной полости
МКСТ – в 78% наблюдений установлен правильный
диагноз. (W. Park et al., 2002)
МРА не уступает МСКТ.
Тромбоз ВБА
(просвет артерии
гиподенсивный
за счет тромбоза)
30. Стратегия
Только хирургическое лечение.1.восстановление мезентериального кровотока
2.удаление нежизнеспособных участков кишки
3.борьба с перитонитом
31. Хирургическое лечение
1. Срединная лапаротомия2. Ревизия (оценка жизнеспособности) кишечника
3. Ревизия магистральных мезентериальных сосудов
(пальпаторно)
4. Восстановление мезентериального кровотока
5. Резекция кишечника, наложение анастомоза
6. Санация, дренирование брюшной полости
32. Интраоперационная оценка жизнеспособности кишечника
• метод Керте (цвет, перистальтика и пульсация)• Обкладывание кишки салфетками с горячим физиологическим
раствором с введением в брыжейку 0,25% р-р новокаина.
• пигментная вазоскопия (1% метиленовый синий, через 10-15 мин.)
• трансиллюминационная вазоскопия
• полярографический метод
• пульсоксиметрия
• Неспецифические методы (рН, энзиматические маркеры ,
локальная термометрия)
Доступы к ВБА
Передний
Задний
Находим ВБА:
область. соединения брыжейки тонкой кишки
и брыжейки поперечной ободочной кишки,
в месте её пересечения с 12-ти перстной кишкой.
а
б
б
Определение пульсации ствола ВБА и интестинальных артерий (а),
определение пульсации I сегмента ствола ВБА (б).
тромб
37. При резекции кишечника принято оставлять: 40 см от патологической зоны и 20 см от дистальной части кишки.
38. Минимум при резекции:
• 100 см для терминальной еюностомии,• 65 см для еюноколоанастомоза,
• 35 см для еюноилеоанастомоза
с сохранением илеоцекальной
области.
39. Послеоперационный период
• 1. Коррекция расстройств гемодинамики (адекватное ОЦК,реополиглюкин, низкомолекулярные гепарины)
• 2.Нормализация газообмена, часто ИВЛ
• 3. Инфузионная терапия
• 4. Профилактика и лечение ОПН
• 5.Рациональное применение антибактериальных препаратов
(метронидазол , цефтриаксон)
• 7.Лечение пареза кишечника
Прогноз для жизни: 30-дневная летальность 85-100%
55% при сосудистых реконструкциях.
40. О тромбозе мезентериальных вен:
• 5-15% от всех мезентериальных тромбозов, летальность: 20-50%• Восходящий первичный и Нисходящий вторичный
• Острая, подострая и хроническая формы
• Боль нарастает постепенно, боли постоянные, тупые. Задержка стула, газов.
• Повреждения не более 1м в области подвздошной, слепой, сигмовидной
кишки, ободочной кишки.
• Возможно
консервативное лечение
41. Спасибо за внимание!
Тромбоз брыжеечной вены
Реферат
Тромбоз брыжеечной вены все чаще рассматривается как причина ишемии брыжейки. Острый тромбоз обычно проявляется болью в животе и хроническим типом с признаками портальной гипертензии. КТ брюшной полости с контрастным усилением достаточно точна для диагностики и дифференциации двух типов тромбоза брыжеечных вен. Протромботическое состояние, гематологические злокачественные новообразования и местные воспалительные состояния брюшной полости являются частыми предрасполагающими условиями.За последнее десятилетие мутация JAK-2 (янус-киназа 2) стала точным биомаркером для диагностики миелопролиферативного новообразования, важной причины тромбоза брыжеечных вен. Антикоагулянтная терапия является методом выбора при остром тромбозе брыжеечных вен. Другой вариант — тромболизис с использованием системного или транскатетерного пути. Пациентам с перитонеальными признаками или невосприимчивыми к начальным мерам необходимо хирургическое обследование. Все более частое выявление тромбоза брыжеечных вен и использование антикоагулянтов для лечения привело к снижению потребности в хирургическом вмешательстве с улучшением выживаемости.
Ключевые слова: тромбоз брыжеечных вен, портальная гипертензия, тромбоз
Сокращения: MVT, тромбоз брыжеечных вен; TIPS, трансъюгулярный внутрипеченочный портосистемный шунт; PVT, тромбоз воротной вены; JAK2, janus kinase 2
Брыжеечный венозный тромбоз (МВТ) — редкая причина ишемии брыжейки, составляющая 5–15% случаев. 1 Впервые он был описан как отдельная причина ишемии брыжейки Уорреном и Эберхардом.Это может быть острое заболевание с болями в животе или хроническое с признаками портальной гипертензии. В редких случаях это может быть диагностировано как случайная находка при компьютерной томографии брюшной полости. Причины MVT включают протромботические состояния, травмы и внутрибрюшные инфекции. Достижения в области радиологии и антикоагуляции привели к улучшению диагностики и результатов. 2
Брыжеечное кровообращение
Кровоток к кишечнику начинается от верхней брыжеечной артерии, которая выходит из брюшной аорты.Он обеспечивает ветви поджелудочной железы и двенадцатиперстной кишки; три ветви к проксимальному отделу ободочной кишки и оканчиваются прямыми артериями, кровоснабжающими тощую кишку и подвздошную кишку. Венозная кровь сначала стекает в прямые вены, которые затем образуют подвздошно-ободочную, среднюю и правую колические вены, которые вместе образуют верхнюю брыжеечную вену, которая, в свою очередь, встречается с селезеночной веной, образуя воротную вену. Нижняя часть пищевода и верхняя часть малой кривизны стекает через левую желудочную вену непосредственно в воротную вену в месте ее образования, а кровь из дна желудка стекает через короткие вены в селезеночную вену.Венозный возврат левой толстой кишки проходит через нижнюю брыжеечную вену, которая соединяется с селезеночной веной.
Острый тромбоз брыжеечных вен
Заболеваемость и этиология
Частота ПМК увеличилась с улучшением методов диагностики, что привело к увеличению числа случаев, диагностированных случайно. Заболеваемость в период с 1970 по 1982 год оценивалась как 2 на 100 000 по сравнению с 2,7 на 100 000 в период с 2000 по 2006 год. 3 MVT составляют 6–9% всех случаев острой ишемии брыжейки и 1/1000 случаев госпитализации в отделения неотложной помощи. 4 Средний возраст пациентов на момент обращения составляет 45–60 лет с небольшим преобладанием мужчин и женщин.
Протромботические состояния, хирургическое вмешательство, воспалительные заболевания кишечника и злокачественные новообразования являются общими факторами риска развития ПМК. Тромбоз более крупных дистальных частей брыжеечной вены в основном вторичен по отношению к местным факторам, таким как злокачественные новообразования, панкреатит и инфекция, и связан с тромбозом воротной вены, в то время как тромбоз, исходящий из прямой вены и приводящий к изолированному тромбозу MVT, чаще всего связан с до протромботического состояния.
Первичные или идиопатические ПМК составляют 21–49% случаев и зависят от глубины оценки. 2,5–7 Доля пациентов с идиопатическими случаями уменьшается при более тщательном обследовании. 8 Злокачественные новообразования, включая миелопролиферативные новообразования, являются наиболее частой формой протромботических нарушений, связанных с MVT. 4 Мутация JAK2 V617 была ранее изучена и была обнаружена связь между наличием мутации и MVT, у 17 пациентов из 99 с MVT была обнаружена мутация, и ни у одного из них не было других протромботических рисков, у 7 из них было миелопролиферативное заболевание. ; а из оставшихся 10 пациентов у двоих был диагностирован миелофиброз, а у одного была диагностирована истинная полицитемия при последующем наблюдении после исследования. 9 Использование оральных контрацептивов среди молодых женщин составляет 9–18%. 10,11 Согласно ретроспективному анализу, 4 из 12 пациентов, у которых не было выявленной гиперкоагуляции, использовали оральные контрацептивы. 12 Дефицит антитромбина III, протеина S и протеина C связан с MVT. По оценкам, это заболевание разовьется у 4–10% этих пациентов. 13 В другом исследовании пациентов с ПМК по сравнению со здоровыми людьми был обнаружен значительно более высокий тромбофильный генотип.Генотип метилентетрагидрофолатредуктазы TT677 присутствовал в 6 (50%), фактор V Лейдена — в 3 (25%), а протромбиновый переход G20210A — в 3 (25%). Комбинированные мутации присутствовали у 4 (33%) пациентов. Частым фактором риска является интраабдоминальная хирургия, особенно спленэктомия. 4,6 MVT и тромбоз воротной вены чаще встречаются у пациентов с циррозом, особенно на поздних стадиях заболевания. Сообщается, что распространенность тромбоза воротной вены у пациентов, включенных в список для трансплантации печени, достигает 15%.Частично это может быть связано с нарушением кровотока в воротной вене и прокоагулянтным дисбалансом, связанным с циррозом печени. 14 Гипергомоцистеинемия вместе с мутацией метилентетрагидрофолатредуктазы C677T вызывает общую предрасположенность как к артериальному, так и к венозному тромбозу; его роль в MVT ранее была изучена в исследовании случай-контроль, и была обнаружена связь с MVT. 15
Размер и степень венозного тромбоза в значительной степени влияют на исход, клиническую картину и вероятность инфаркта кишечника.Инфаркт кишечника в основном требует вовлечения венозных аркад и прямых сосудов, что, в свою очередь, вызывает полную венозную окклюзию. 3,8,16 Артериальный вазоспазм и тромбоз также могут быть основным фактором, приводящим к распространению ишемии и инфаркта кишечника. 17
Клиническая картина
Наиболее частым симптомом острой ПМК является боль в животе, которая возникает в 91–100% случаев, тошнота, рвота и мелена также являются общими симптомами. 16 Продолжительность симптомов более 1,5–2 дней более чем в 75% случаев. 3,16,18 Обычно боль в животе не соответствует результатам физического осмотра. 3,8 Хотя мелена, гематемезис или гематохезия встречаются только примерно в 15% случаев, скрытая кровь присутствует в 50% случаев. 8,17 Лихорадка и перитонеальные признаки указывают на прогрессирование инфаркта, а гипотензия с систолическим артериальным давлением менее 90 мм рт.ст. вместе с образованием асцита связана с плохим прогнозом. 17
Диагноз
Хотя между артериальной и венозной ишемией брыжейки есть тонкие различия, можно клинически дифференцировать эти два состояния (). Пациенты с фибрилляцией предсердий или сердечными заболеваниями в анамнезе более склонны к артериальной ишемии, в то время как личный или семейный анамнез тромбоза глубоких вен увеличивает подозрение на MVT. Физические данные и тяжесть ишемии плохо коррелируют. Было показано, что болезненность отскока не является точным признаком для диагностики инфаркта кишечника, а также не коррелирует с тяжестью ишемии. 5,19,20 Лабораторные исследования обычно не помогают в диагностике MVT. Уровень лактата в сыворотке часто изначально не коррелирует с инфарктом кишечника; и в то время, когда присутствует лактоацидоз, он является поздним по ходу болезни, и к этому моменту смертность уже составляет 75%. Лейкоцитоз и гемоконцентрация — частые признаки при MVT. 4 Обычные снимки часто бывают отрицательными и используются в основном для исключения других причин боли в животе; Результаты, предполагающие ишемию кишечника, вызванную MVT, включают отпечатки большого пальца, которые представляют собой полупрозрачные углубления в просвете кишечника, вторичные по отношению к отеку, воздух в кишечнике (Pneumatosis Intestinalis), воздух в воротной вене и свободный воздух в брюшной полости можно увидеть, но обычно это поздние выводы.
Таблица 1
Сравнение острого брыжеечного венозного тромбоза и острой артериальной ишемии брыжейки.
| Фактор риска | Острый внутрибрюшной процесс | Фибрилляция предсердий | |
| Тромбофилия | Кардиомиопатия и ХСН | ||
| Злокачественные новообразования | Циркулярная болезнь сердца | ||
| История ТГВ | Отсутствует | Присутствует в 20-40% | |
| CT | Диагностика только в 40-50% | Более чем в 90% | |
| Ангиограмма | Диагностика в большинстве случаев | Только в 50–60% | |
| Острое предлежание | В большинстве случаев | Может быть подострым или хроническим | |
| Инфаркт кишечника | Вероятно, если не пройдет через 12 часов | Не обычно, если диагностирован и AC начато | |
| Лечение | Эмболэктомия или ИА папаверин | 9009 3 Антикоагуляция, возможный тромболизис, системный или направленный||
| Необходимость хирургического вмешательства | Частая | Менее вероятна, если AC начата рано | |
| Переход от ишемии к норме | Резкий | Постепенно | |
| Смертность | Более часто | Реже при наличии КТ и АС. | |
| Хроничность | Редко | Может возникнуть при портальной гипертензии и варикозном расширении вен. |
КТ с контрастированием является предпочтительным методом диагностики.Увеличение использования компьютерной томографии при болях в животе в отделениях неотложной помощи связано с сокращением времени до постановки диагноза с 1 недели до 1 дня. 2 Дефект наполнения брыжеечной вены — наиболее частая находка у пациентов с МВТ. Утолщение стенки кишечника, кишечный пневматоз, газ в воротной вене и стойкое усиление стенки кишечника предполагают ишемию стенки кишечника. 11,21,22 Хотя эти данные специфичны, но их чувствительность низкая при диагностике инфаркта кишечника и трансмурального некроза. 23 Допплеровский ультразвук можно использовать у постели больного, и он может продемонстрировать тромб, и хотя он специфичен, он зависит от оператора и не так чувствителен, как КТ и МРТ. Изолированный МВТ без тромбоза воротной вены сложнее диагностировать с помощью КТ, чувствительность которого составляет всего 67%. 16 Ядерная сцинтиангиография является диагностической в 75% случаев, но широко не применяется. Ангиография — это инвазивная диагностическая и терапевтическая мера, которая предназначена для случаев с высокой вероятностью предварительного тестирования и недиагностической КТ / МРТ или случаев, когда планируются инвазивные терапевтические меры. 24
После подтверждения MVT показано, как диагностировать основную этиологию. Перед началом антикоагулянтной терапии следует тщательно отбирать образцы крови, особенно для диагностики протромботических состояний. Тестирование на мутацию JAK2 важно для диагностики миелопролиферативных новообразований, включая истинную полицитемию, эссенциальную тромбоцитемию и миелофиброз. Тестирование на мутацию JAK2 заменило биопсию костного мозга в качестве начального скринингового метода диагностики миелопролиферативных новообразований. 25 Гипергомоцистеинемия, дефицит протеина C или S, мутация гена протромбина и дефицит антитромбина III — это другие расстройства, которые следует учитывать.
Лечение
Цели лечения — реканализация, предотвращение распространения тромбоза, который может привести к обострению ишемии кишечника, а в долгосрочной перспективе — предотвратить рецидивы.
Поддерживающее лечение
Обезболивание, восполнение жидкости и электролитов и покой кишечника следует начинать при остром поступлении.Назогастральная интубация может быть инициирована при поступлении в случае необходимости в случаях кишечной непроходимости, вздутия живота и трудноизлечимой тошноты и рвоты. Поддерживающее лечение также включает переливание крови пациентам с кровотечением. Использование антибиотиков не было связано с улучшением смертности или более коротким пребыванием в больнице, хотя, если у пациента есть перфорация, сепсис, вторичный по отношению к бактериальной транслокации или септический тромбофлебит, следует назначить соответствующие антибиотики. 24
Антикоагуляция
Антикоагулянтную терапию нефракционированным или низкомолекулярным гепарином следует начинать сразу после постановки диагноза даже во время операции или при наличии кровотечения, поскольку это значительно улучшает выживаемость. 4,8,10,26 Антикоагуляция привела к реканализации у большинства пациентов в одном исследовании (более 80%), если она была начата на ранних стадиях, и эта полная реканализация была связана с менее обширным заболеванием. 12 В другом исследовании частота реканализации при антикоагуляции была ниже примерно на 30% в воротной вене и до 61% при тромбозе верхней брыжеечной вены. 27 После острой фазы и за исключением необходимости немедленного хирургического вмешательства, следует поддерживать антикоагулянтную терапию, чтобы предотвратить рецидив тромбоза. 10 Продолжительность 3–6 месяцев для пациентов с обратимыми причинами, такими как травмы, инфекции или панкреатит, рекомендуется с индивидуальной оценкой рисков и преимуществ. Пожизненная антикоагуляция должна рассматриваться в случаях со стойким состоянием гиперкоагуляции, необратимым системным состоянием или идиопатическими случаями. Поддержание антикоагуляции может быть достигнуто с помощью варфарина, нацеленного на международное нормализованное соотношение 2–3, хотя это требует частого мониторинга, и следует уделять внимание межлекарственным взаимодействиям, которые связаны с метаболическим путем P450. 28–30 Другой вариант — использование фиксированной дозы новых прямых ингибиторов тромбина и фактора Ха. Преимущества включают меньшее количество взаимодействий и отсутствие необходимости в частом мониторинге.
Кровотечение из-за антикоагуляции все еще рассматривается в долгосрочной перспективе, хотя риск невелик (10%). Наиболее частым местом кровотечения является желудочно-кишечный тракт, 16,31 , и для пациентов, у которых развивается варикозное расширение вен, предпочтительна профилактика кровотечений с помощью бета-блокаторов, поскольку перевязка может вызвать образование язв и кровотечение.
Варианты интервенционной радиологии
Пациенты с сохраняющимися симптомами, усиливающейся болью в животе через 48–72 ч после начала антикоагуляции или развитием признаков перитонита, и которые не подходят для хирургического вмешательства, могут рассматриваться в качестве вариантов интервенционной радиологии (). Большинство опубликованных данных по интервенционному радиологическому лечению ПМК взяты из клинических случаев и небольших серий случаев. Хотя системное внутривенное введение tPA было успешно использовано, во многих недавних исследованиях использовались транскатетерные пути. 32,33 В одном ретроспективном исследовании 20 пациентов с острой ПМК получали интервенционное радиологическое лечение через бедренную артерию для доступа к брыжеечной артерии или бедренной вене для доступа к брыжеечной вене или трансъюгулярной вене или комбинированный подход с хорошим ответом на лечение, но, с повышенным риском осложнений, в основном кровотечений, которые часто требовали переливания крови. 34 Аналогичным образом, в другом исследовании внутрисосудистая тромболитическая терапия использовалась у 12 пациентов с полным ответом у 3, частичным ответом у 4 и кровотечением, связанным с обширной процедурой, у 6 пациентов с летальным исходом у двух пациентов. 35 В другом исследовании сообщалось о его применении у 11 пациентов (6 послеоперационных) и в среднем через 10 дней после начала MVT. Пациентам с высоким риском кровотечения, особенно пациентам, находящимся в ближайшем послеоперационном периоде, и пациентам со злокачественными новообразованиями, выполнялась механическая тромбэктомия, чтобы уменьшить продолжительность тромболизиса. Это исследование, наряду с другими описаниями случаев, показало хорошие результаты при использовании транскатетерного тромболизиса. 36–38
Алгоритм ведения острого и хронического тромбоза брыжеечных вен.МВТ: тромбоз брыжеечных вен; EVL: эндоскопическая перевязка варикозно расширенных вен; BB: бета-адреноблокаторы; СОВЕТЫ: Трансъюгулярный внутрипеченочный портосистемный шунт.
Трансъюгулярный внутрипеченочный портосистемный шунт (TIPS) может использоваться для MVT с обоснованием создания системы низкого давления, которая работает как вакуум фрагментов сгустка и повышает эффективность тромболизиса в случае острого тромбоза. Использование TIPS было связано с немедленным улучшением симптомов и успешной реканализацией у 83% пролеченных пациентов. 39 Два случая, один с обширным тромбозом воротной, брыжеечной и селезеночной вены, а другой — с тромбозом брыжеечной и воротной вены, имели благоприятные исходы с TIPS. 40 Ретроспективное исследование 20 пациентов с тромбозом воротной вены (PVT) показало высокий уровень успеха в случаях непостеризированного PVT и было эффективным в предотвращении кровотечения из варикозно расширенных вен и рецидивирующего асцита. 41 Другой проспективный анализ 9 пациентов с PVT показал частоту осложнений до 22% при 11% летальности. 42 Легочная эмболия вызывает беспокойство; однако ни в одном центре клинически значимых тромбоэмболий не наблюдалось. 40
Хирургия
Пациентам с сохраняющимися или ухудшающимися симптомами, а также пациентам с явной перфорацией или признаками перитонита может потребоваться хирургическое вмешательство. Хирургическая резекция некротизированного кишечника и анастомоза — стандартная процедура. Гепарин следует вводить во время операции, а поскольку спазм артериальных сосудов является важным механизмом ишемии, следует рассмотреть возможность назначения папаверина во время операции. 17 Сообщалось также о введении tPA через оперативно размещенные катетеры, которые, наряду с гепаринизацией и папаверином, могут предотвратить распространение инфаркта. 43 Два метода помогли ограничить объем первоначальной резекции и синдром короткой кишки как осложнение обширной резекции; один был подходом второго взгляда, 18 другой был использованием метода Доплера и флуоресцеина для оценки жизнеспособности кишечника. В предыдущем проспективном исследовании флуоресцеин был лучшим методом определения жизнеспособности с последующим клиническим заключением, которое было лучше, чем допплерография. 44
Исходы
В целом исходы при тромбозе брыжеечных вен лучше, чем при артериальном тромбозе, со смертностью 44% по сравнению с 66–89% соответственно. 45 Улучшение методов диагностики и терапии привело к улучшению результатов, и недавние отчеты показывают, что уровень смертности составляет 10–20% (). Основная причина тромбоза, вторичный синдром короткой кишки после операции и рецидив тромбоза — это три основных фактора, влияющих на исход.Рецидив чаще всего возникает в первые 30 дней после обращения. Сообщается о показателях 0–25%, которые могут быть снижены до 0–3% у пациентов, продолжающих принимать антикоагулянты. 46,47 Кровотечение, вызванное антикоагулянтами, встречается нечасто, встречается в 10% случаев и чаще всего возникает из желудочно-кишечного тракта. Если кровотечение не внутричерепное, антикоагулянтная терапия редко приводит к смерти.
Таблица 2
Лечение и исход пациентов с тромбозом брыжеечных вен: данные опубликованных обсервационных исследований.
| Автор (год) | N | FU (лет) | Лечение (%) | Выживаемость (%) | |||||
|---|---|---|---|---|---|---|---|---|---|
| Операция | Инфаркт | Инфаркт | Инфаркт Bleed | Рецидив d | Кратковременный | Общий | |||
| Abdu (1986) | 372 | NA | NA | NA | NA | NA | NA | NA | NA |
| Гарвард (1989) | 16 | 2.75 | 31 | 25 | 100 | NA | NA | 81 | NA |
| Rhee (1994) | 72 | 1,6 | 64 | NA | 62 | NA | 36 (25) | ||
| Condat (2000) a | 33 | 2,5 | 6 | 12 | 93 | 6 | 13 (0) | 100 | 97 |
| Мораш (2001) | 31 | 4.75 | 32 | NA | 72 | NA | NA | 77 | 68 |
| Брюно (2001) b | 26 | 4,25 | 50 | NA | 50 | NA | NA | 81 | 77 |
| Кумар (2003) a | 69 | NA | 44 | NA | 91 | 1 | 6 | NA | NA |
| Чжан (2004) b | 41 | 2.75 | NA | NA | NA | NA | 3 (0) | 78 | 73 |
| Grisham (2005) | 23 | NA | 17 | NA | 100 | NA | NA | NA | 93 |
| Амарапуркар (2007) | 28 | 4,2 | 36 | 29 | 75 | 13 | 22 (22) | 84 | 81 |
| Амитрано (2007) c | 121 | 3.5 | 26 | 28 | NA | 15 | 11 | 95 | 90 |
| Acosta (2008) | 51 | NA | 25 | NA | NA | NA | NA | 80 | 67 |
| Abu-Daff (2009) | 31 | 5 | 77 | NA | NA | NA | NA | 87 | 68 |
| Alvi ( 2009) | 20 | 23 | 40 | NA | 85 | NA | NA | 80 | NA |
| Dentali (2009) | 77 | 3 | NA | NA | 46 | NA | 6 | 100 | 94 |
| Cendese (2009) | 9 | 2.25 | 55 | 5 | 100 | NA | NA | 100 | 89 |
| Thatipelli (2010) | 76 | 2,25 | NA | NA | 54 | 18 | 40 | NA | 75 |
| Plessier (2010) a | 55 | 1 | NA | 2 | 95 | 8 | NA | 100 | 98 |
Хронический тромбоз брыжеечных вен
Хронический MVT — редкое заболевание, на которое приходится 20-40% случаев MVT. 16,46 Проявление обычно отличается от острой ПМК, поскольку у пациентов наблюдаются нечеткие абдоминальные симптомы или признаки портальной гипертензии и кровотечения из варикозно расширенных вен, если тромбоз распространяется на воротную вену.
Клинические особенности
Обширное поражение верхней брыжеечной вены, воротной вены и селезеночной вены часто вызывает стойкую боль в животе, связанную со значительным отеком кишечника, иногда также приводя к мальабсорбции. Часть этих пациентов находится на длительном полном парентеральном питании.У некоторых пациентов развивается портальная гипертензивная холангиопатия, имитирующая первичный склерозирующий холангит. Это вызвано отеком и наличием коллатеральных сосудов вокруг желчных протоков, что приводит к обструкции и холангиту. MRCP является диагностическим, хотя ERCP и лечение имеет высокий риск кровотечения, учитывая риск повреждения одного из коллатеральных кровеносных сосудов.
Лечение
Обычно болезнь диагностируется как случайная находка при компьютерной томографии брюшной полости. Компьютерная томография является диагностической с чувствительностью> 90%, хотя оценки ультразвуковой допплерографии и МРТ отсутствуют.Дифференциация от острой MVT основана на наличии коллатералей и каверномы у пациентов с хроническим заболеванием. Лечение направлено на антикоагулянтную терапию и предотвращение кровотечений. 48 Пациенты с изолированной хронической ПМК получают антикоагулянтную терапию. Пациенты с сопутствующим ПВТ подвержены риску развития портальной гипертензии и кровотечения из варикозно расширенных вен. Это лечится как любой пациент с варикозным расширением вен пищевода, включая первичную профилактику, контроль активного кровотечения и предотвращение повторного кровотечения ().Пациенты с холангиопатией могут осложняться стриктурами и / или желчными камнями. ЭРХПГ для диагностики или в терапевтических целях, включая сфинктеротомию или эндоскопическое стентирование, следует проводить осторожно, чтобы избежать вторичного кровотечения из венозных коллатералей вокруг желчных протоков. Некоторым пациентам может потребоваться хирургическая гепатикоеюностомия для лечения желчных осложнений. 49
Хронический ПМК в целом имеет благоприятный прогноз с выживаемостью 1–5 лет в диапазоне от 78 до 83%.Основной причиной смерти в этой популяции было кровотечение из варикозно расширенных вен, злокачественное новообразование, сепсис, декомпенсированное заболевание печени, а затем ишемия кишечника.
Резюме
MVT — редкая, но важная причина ишемии кишечника. Причины включают местные факторы и протромботические состояния. Наиболее частым проявлением является боль в животе, и при достаточном подозрении КТ брюшной полости является диагностической. Лечение в основном медикаментозное с использованием антикоагулянтов, если диагноз поставлен даже при наличии кровотечения или необходимости хирургического вмешательства.Продолжительность лечения зависит от наличия идентифицируемого обратимого фактора риска, и в этом случае антикоагулянтная терапия может применяться в течение 3–6 месяцев. В противном случае следует рассмотреть возможность бессрочной антикоагуляции. Операция требуется при трансмуральном инфаркте и при наличии перитонеальных признаков. Исход в основном определяется основным протромботическим состоянием, рецидивом тромбоза и развитием синдрома короткой кишки.
Введение
ВведениеБольшое количество исследований показало корреляцию между увеличением сердечно-сосудистых заболеваний и дефицитом тестостерона [1, 2].Было продемонстрировано, что половые гормоны регулируют функцию сосудов, поскольку депривация половых гормонов изменяет высвобождение, функцию и клеточные сигнальные пути эндотелиальных факторов, что может привести к дисфункции сосудов. Таким образом, предыдущие исследования нашей исследовательской группы показали, что орхидэктомия увеличивала продукцию АФК [3, 4] и высвобождение простаноидов [5-7], в то время как продукция оксида азота [8] и антиоксидантная способность [9-10] были снижены.
Повышенный окислительный стресс был связан с развитием сердечно-сосудистых заболеваний [11, 12].Так, окислительное повреждение клеточных мембран и ферментов активными формами кислорода и азота (ROS / RNS) было описано при сердечно-сосудистых заболеваниях [13].
Окислительная модификация холестерина клеточных мембран с помощью ROS / RNS приводит к образованию продуктов окисления холестерина (COP), также называемых оксистеринами. КС также могут образовываться в результате ферментативного окисления и / или абсорбции из пищи [14–16]. Независимо от источника, COP обладают способностью вызывать нарушение тонкой структуры, нарушение целостности, текучести и проницаемости, а также потерю функциональности биомембраны [17, 18].
Кроме того, оксистерины участвуют в патогенезе различных заболеваний, включая сердечно-сосудистые заболевания, рак, неврологические расстройства и старение [19–22]. КС способны преобразовывать липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП) в проатерогенные и провоспалительные формы. Оксистерины могут также вызывать прооксидантные, провоспалительные и цитотоксические реакции в различных типах клеток сосудистой стенки, включая эндотелиальные клетки [23], гладкомышечные клетки [24-25], фибробласты [26], моноциты и макрофаги [27]. ].Исходя из таких данных, COP были предложены в качестве потенциальных биомаркеров для неинвазивных исследований окислительного стресса in vivo [28].
Различные исследования показали, что потребление полиненасыщенных жирных кислот омега-3 (ПНЖК), таких как эйкозапентаеновая кислота (ЭПК) и докозагексаеновая кислота (ДГК), может снизить риск развития сердечно-сосудистых заболеваний [29, 30]. Сообщалось об антитромботическом, противовоспалительном и вазопротекторном эффектах ПНЖК на сердечно-сосудистую систему [31, 32].Антиоксидантные свойства DHA также были продемонстрированы, поскольку она снижает образование ROS и связывает свободные радикалы, предотвращая окисление тканей [33–35].
Поскольку сообщалось, что нехватка половых гормонов увеличивает окислительный стресс и сосудистое воспаление, ухудшающие факторы, которые могут привести к развитию сердечно-сосудистых заболеваний, возможно, что образование оксистеринов в стенке артерий может быть изменено потерей функции гонад. С другой стороны, ПНЖК омега-3 могут действовать как кардиозащитное средство при образовании оксистерина, вызванном орхидэктомией.Таким образом, цель настоящего исследования состояла в том, чтобы определить влияние орхидэктомии на образование основных оксистеринов, признанных продуктами автоокисления холестерина [36] (7α-гидроксихолестерин, 7β-гидроксихолестерин, 7-кетохолестерин, 5,6α-эпоксихолестерин, 5,6β-эпоксихолестерин, холестанетриол и 25-гидроксихолестерин) в артериальной стенке аорты и брыжеечной артерии, а также возможный профилактический эффект диеты с добавкой DHA на формирование COP.
Результаты Масса тела животного. Животные оставались здоровыми и вели себя одинаково хорошо на протяжении всего эксперимента.Перед введением экспериментальных диет (контрольных или DHA) оценивали массу тела в четырех группах животных, при этом статистических различий между группами не было (таблица 2). Средняя прибавка в весе к концу 8 недель экспериментальной диеты была одинаковой для всех экспериментальных групп, что согласуется с нашими ранее опубликованными данными [9].
10.1371 / journal.pone.0185805.t002 Таблица 2| Масса тела (г) | ||
|---|---|---|
| Группа животных | Перед диетой | После диеты |
| C Контроль | 418,5 ± 11 | 463 ± 10 * |
| C DHA | 385,1 ± 12 | 435 ± 19 * |
| ORX Control | 384,6 ± 13 | 437 ± 12 * |
| ORX DHA | 409.2 ± 16 | 423,4 ± 16 * |
Значения являются средними ± SEM. Количество животных в группе, n = 5.
* Обозначает различия с соответствующими группами до диет.
Содержание холестерина в аортеОрхидэктомия значительно повысила уровень холестерина в ткани аорты по сравнению с контрольной группой, получавшей контрольную диету (рис. 1). Диета с добавлением ДГК вызвала значительное снижение уровня холестерина в аорте у орхидэктомированных животных.Образцы от контрольных крыс, получавших диету с добавлением DHA, показали уровни, аналогичные тем, которые были обнаружены у контрольных крыс, получавших контрольную диету.
10.1371 / journal.pone.0185805.g001 Рис.Графическое представление концентрации холестерина и COPs (7α-OH, 7β-OH, 7-KC, 5,6β-E, 5,6α-E, 25-OH, CT и общих COP) в мкг / г липидов в аорте кольца от контрольных (C) и орхидэктомированных (ORX) крыс, получавших контрольную диету или диету с добавлением DHA.Данные сравнивали с использованием однофакторного дисперсионного анализа с последующим множественным сравнительным тестом Тьюки. Значения являются средними ± SEM. Количество животных, n = 5. * Обозначает p <0,05 по сравнению с контрольной группой, получавшей контрольную диету. + Обозначает p <0,05 по сравнению с крысами, подвергнутыми орхидэктомии, получавшими контрольную диету.
Общие уровни COP значительно увеличились в группе орхидэктомированных и снизились у орхидэктомированных животных, получавших диету с добавкой DHA (рис. 1). Добавка DHA не изменяла статистически общего содержания COP у контрольных крыс.
В соответствии с вышеуказанной тенденцией, орхидэктомия вызвала значительное увеличение концентрации исследуемых КС в сегментах аорты: 7α-гидроксихолестерин (7α-OH), 7β-гидроксихолестерин (7β-OH), 7-кетохолестерин (7-KC), 5,6β-эпоксихолестерин (5,6β-E), 5,6α-эпоксихолестерин (5,6α-E), 25-гидроксихолестерин (25-OH) и холестанетриол (CT) (рис. 1).
Диета с добавлением ДГК снижала уровни COP в ткани аорты орхидэктомированных крыс, за исключением 7β-ОН, который не достиг статистической разницы (рис. 1).Однако DHA-диета для контрольных животных имела тенденцию к увеличению концентрации всех анализируемых COP.
Соотношение концентраций проанализированных COP по отношению к общему количеству COP было одинаковым в разных группах, включенных в это исследование. CT был наиболее распространенным COP (примерно 30% от общего количества COP), за ним следовали 7β-OH (примерно 20% от общего числа COP), 7α-OH (примерно 18%), 5,6β-E (примерно 12 %). 7-KC был выше в обеих группах, подвергнутых орхидэктомии (получавших контрольную диету и диету с добавлением DHA), соотношение оставалось выше контрольных групп примерно на 10%.8–10%. Доля 5,6α-E была одинаковой во всех группах и составляла около 50%. 5% от общего числа практикующих сообществ. 25-ОН не мог быть обнаружен у контрольных крыс, получавших контрольную диету, а для других групп этот КПД был обнаружен в очень малых концентрациях (≤1%).
Содержание холестерина в брыжеечной артерииСодержание холестерина в брыжеечной артерии было значительно увеличено при орхидэктомии, а диета с добавлением DHA значительно снизила эти уровни (рис. 2). DHA-диета для контрольных крыс не влияла статистически на содержание холестерина в ткани брыжеечной артерии (рис. 2).
10.1371 / journal.pone.0185805.g002 Рис.Графическое представление концентрации Chol и COP (7α-OH, 7β-OH, 7-KC, 5,6β-E, 5,6α-E, 25-OH, CT и общих COP) в мкг / г липидов в брыжеечной кольца артерий от контрольных (C) и орхидэктомированных (ORX) крыс, получавших контрольную диету или диету с добавлением DHA. Данные сравнивали с использованием однофакторного дисперсионного анализа с последующим множественным сравнительным тестом Тьюки.Значения являются средними ± SEM. Количество животных, n = 5. * Обозначает p <0,05 по сравнению с контрольной группой, получавшей контрольную диету. + Обозначает p <0,05 по сравнению с крысами, подвергнутыми орхидэктомии, на контрольной диете.
Аналогичные результаты наблюдались для содержания COP в брыжеечной артерии по сравнению с результатами, обнаруженными в аорте этих животных. Общее содержание COP значительно увеличилось в образцах от орхидэктомированных животных по сравнению с остальными группами. Контрольные животные, получавшие контрольную диету, а также животные, получавшие диету с добавлением DHA, показали аналогичные уровни COP.Опять же, добавка DHA снижала содержание COP у орхидэктомированных животных (рис. 2).
Орхидэктомия значительно увеличила содержание 7α-OH, 7β-OH, 7-кето, 5,6β-E, 5,6α-E, 25-OH и CT (рис. 2) по сравнению с остальными группами, включенными в исследование. . Как видно на фиг. 2, содержание 25-ОН у контрольных крыс, получавших контрольную диету, не было обнаружено. То же самое произошло с 7-KC, который был обнаружен только в минимальных количествах в группе орхидэктомии, тогда как он практически отсутствовал в ткани брыжеечной артерии в других группах.
В брыжеечных артериях орхидэктомированных животных, получавших диету с добавлением DHA, концентрация COP значительно снизилась, за исключением 7β-OH, аналогично тому, что обнаружено в ткани аорты (рис. 2). Добавка DHA у контрольных животных имела тенденцию к снижению концентрации всех проанализированных COP (7α-OH, 7β-OH, 7-KC, 5,6β-E, 5,6α-E, 25-OH и CT), в отличие от наблюдается в аорте.
Что касается распределения содержания КС в ткани брыжеечной артерии, КТ была самой распространенной КС (ок.30%), за которыми следуют 7α-OH и 7β-OH, которые показали аналогичные пропорции между одними и теми же группами, около 20% от общего числа COP. Следующим по пропорции идет 5,6β-E, представляющий ок. 15% от общего числа COP, с немного большей долей в контрольной группе (19%). 5,6α-E составляет около 10% от общего числа COP, снижаясь до 6% у орхидэктомированных животных, получавших диету с добавлением DHA. 25-ОН практически отсутствовал, так как не мог быть обнаружен. В случае 7-KC он был обнаружен только в группе орхидэктомии в очень низких концентрациях.
ОбсуждениеЭто исследование впервые показывает, что потеря функции гонад вызывает увеличение образования COP как в аорте, так и в стенке брыжеечной артерии. Также продемонстрировано профилактическое действие диеты с добавлением DHA на формирование COPs, вызванное орхидэктомией. Эти результаты согласуются с ранее опубликованными данными как о влиянии орхидэктомии, так и о полезной роли диеты с добавлением ДГК.
Что касается результатов, конкретно связанных с орхидэктомией, мы ранее сообщали, что потеря гонадной функции у крыс вызвала гиперпродукцию АФК в аорте [3] и брыжеечной артерии [4], а также к увеличению содержания холестерина в сыворотке крови. ЛПНП-холестерин и триглицериды [9].Известно, что холестерин, внедренный в липидный бислой из клеточных мембран, склонен к окислению под действием ROS [41, 42], что может объяснить повышенное образование COPs, происходящих из процессов автоокисления, описанных в этой работе. Однако нельзя исключить окисление во время обработки образца, несмотря на использование BHT (0,05%). Аналогичным образом, важно учитывать, что может существовать преобразование в ПС, отличные от проанализированных. Хорошо известно, что предпочтительный сайт окисления холестерина высокореактивными частицами находится в С7, имеющем относительно слабую связь углерод-водород.Более того, уникальная двойная связь холестерина между атомами углерода 5 и 6 представляет собой уязвимое место для окисления свободными радикалами. Наиболее распространенными неферментативными продуктами окисления холестерина, присутствующими в большинстве тканей, являются 7α-OH, 7β-OH, 7-KC, 5,6α-E и 5,6β-E, соответственно [43, 44], индуцированные ROS и RNS. [45], что согласуется с результатами текущего исследования, за исключением 7-KC, который был обнаружен только в брыжеечных артериях орхидэктомированных крыс. CT является одним из наиболее распространенных оксистеринов, получаемых из холестерина путем окисления с образованием 5,6α-E и 5,6β-E в качестве промежуточных продуктов [46].Очень низкие уровни обнаружения 25-ОН можно объяснить его главным образом ферментативным происхождением, поскольку этот оксистерин обычно не считается значительным продуктом автоокисления холестерина. Кроме того, сообщаемые уровни 25-ОН в большинстве тканей чрезвычайно низкие [36]. Определение содержания COP может варьироваться в зависимости от методов экстракции и / или измерения, хотя сообщалось об очень низких уровнях COP в физиологических условиях [47]. В этом смысле содержание 7-KC, 7α-OH и 5,6α-E, относящееся к общему холестерину, о котором сообщалось в настоящем исследовании, было сходным с таковым, описанным в аорте [48] и коронарных артериях человека [49].Однако относительное содержание 7-KC, 7α-OH, 7β-OH, 5,6α-E и 5,6 β-E, обнаруженное в нашем исследовании, выше, чем описанное в аорте и сонной артерии человека [49, 50].
С другой стороны, известно, что COPs запускают окислительный стресс, увеличивая образование супероксид-аниона [51, 52] и подавляя экспрессию / активацию Nrf2 [53]. В соответствии с этими результатами, многие исследования сообщили об увеличении COP уровни в мембранах клеток, подверженных окислительному стрессу, как это было обнаружено у пациентов с сахарным диабетом [54], гиперлипидемией [28], хроническими воспалительными процессами и хронической почечной недостаточностью [55].В этом отношении механизмы клиренса оксистерина, вероятно, менее эффективны в таких ситуациях [44], как это наблюдалось у орхидэктомированных крыс, у которых антиоксидантная активность была снижена [9]. Zhang et al. [56] продемонстрировали, что кастрация снижает ферментативную антиоксидантную активность (СОД и глутатионпероксидаза) и повышает уровень малонового диальдегида, индикатора перекисного окисления липидов. Напротив, другие исследования показали, что кастрация не увеличивает перекисное окисление липидов [57]. Эти расхождения можно объяснить различиями в использованных моделях животных, поскольку период поддержания гонадэктомии определяет индуцированные изменения [8, 58].Однако важно подчеркнуть, что экспериментальная модель, использованная в этом исследовании, такая же, как и в наших двух предыдущих исследованиях [9, 10], и предоставляет релевантную информацию о ключевой роли COPs в модификациях факторов, вызванных орхидэктомией. , в дополнение к АФК, которые регулируют функцию сосудов.
Выше упоминалось, что различные факторы риска сердечно-сосудистых заболеваний, такие как гипертриглицеридемия, гипертония, диабет, ожирение и избыточный вес, связаны с содержанием COP в сыворотке крови человека [15].В соответствии с этими результатами, COPs индуцировали повышение артериального давления, триацилгицеринов в сыворотке, а также индекса телесного жира у крыс Wistar [59]. С другой стороны, индукция артериальной гипертензии у кроликов путем коарктации аорты показала увеличение содержания COP как в плазме, так и в ткани аорты [60]. Кроме того, Ares et al. [61] указали, что COPs способствуют стимуляции MAPK в клетках гладких мышц аорты человека, что может частично объяснять активацию пути синалинга MAPK, о которой сообщается при гипертензии после трансактивации рецептора тирозинкиназы [62].В связи с этим наша группа описала активацию путей MAPK и AKt в мезентериальных артериях орхидэктомированных крыс, в которых участвовала трансактивация EGFR [8]. В этом контексте эти результаты могут указывать на то, что увеличение образования COP может участвовать в структурных изменениях, вызванных орхидэктомией, которые в долгосрочной перспективе могут привести к развитию гипертензии, как это происходит у старых орхидэктомированных крыс.
Помимо этих эффектов, COP изменяют синтез простагландинов и стимулируют агрегацию тромбоцитов, важный процесс, способствующий развитию атеросклероза и тромбоза [42].Точно так же разные COPs индуцировали экспрессию COX-2 [63] и высвобождение простагландина E 2 [64] и простагландина J 2 [65], что считается провоспалительным явлением. Соответственно, было описано, что орхидэктомия также приводит к провоспалительной среде за счет увеличения продукции простаноидов в аорте [6, 8, 9] и брыжеечных артериях [7, 8, 10] крыс, что, скорее всего, является следствием повышенного окислительного стресса. в условиях эксперимента.
Оксид азота также является важной молекулой для сосудистой функции, и было описано ингибирование эндотелиальной NO-синтазы COP [52, 66], что также согласуется с уменьшением образования NO, наблюдаемым в аорте [9] и брыжеечной артерии. [10] от орхидэктомированных крыс.Несмотря на то, что снижение выработки NO с помощью COP кажется очевидным, исследования, посвященные влиянию COP на функцию сосудов, показали противоречивые результаты, поскольку ингибирование [67, 68] или отсутствие модификации [69, 70] эндотелиально-зависимой вазодилатации на 7 Сообщалось о -KC и 7α-OH-холестерине. В нашей экспериментальной модели орхидэктомия не влияла на ацетилхолин-индуцированный ответ в аорте или брыжеечной артерии, поскольку фактор / механизмы, кроме NO, одновременно работают для поддержания надлежащей функции [4, 7].
Эти результаты можно резюмировать в том, что орхидэктомия вызвала усиление окислительного стресса и противовоспалительных медиаторов, а также ухудшение липидного профиля, которое сопровождается увеличением образования COP. Интересно, что холестанетриол — самый распространенный КС во всех образцах, особенно в артериях от орхидэктомированных крыс, — считается одним из наиболее цитотоксических оксистеринов в различных клеточных линиях, таких как клетки гладкой мускулатуры аорты кролика [71], L-клетки мыши [72]. ], Фибробласты легких V79 китайского хомячка [26], моноцитарные клетки человека (U937), клетки аденокарциномы толстой кишки (CaCo-2) и клетки гепатомы печени (HepG2) [73].Однако важно указать на цитотоксические эффекты, сообщаемые для различных КС, кроме холестанетриола, также в различных клеточных линиях, связанных с сосудистой и нервной системами, которые вносят вклад в патогенез сердечно-сосудистой [52, 74] и нейродегенеративной [19, 20]. болезни.
Было высказано предположение, что образование некоторых оксистеринов может быть уменьшено в присутствии антиоксидантов [43] за счет поглощения ROS. Например, добавление витамина E пациентам с диабетом может снизить уровни 7-KC и 7β-OH [75].Аналогичным образом, Uemura et al. [76] обнаружили, что апоптоз, индуцированный 7β-ОН и 7-KC в эндотелиальных клетках сосудов, предотвращается α-токоферолом. DHA проявляет мощные антиоксидантные свойства, которые снижают избыточную продукцию ROS в эндотелиальных клетках [77] и повышают общий антиоксидантный статус [78]. Недавно была продемонстрирована способность DHA предотвращать гиперпродукцию АФК и оксиапоптофагию, индуцированную 7KC, 7β-OH и 24-OH в олигодендроцитах [79]. Де Медина и др. [80] обнаружили, что DHA ингибирует активность холестерин-5,6-эпоксидгидролазы, которая катализирует превращение 5,6α-E и 5,6β-E в его продукт CT, который оказывает важные цитотоксические эффекты.Кроме того, DHA проявляет защитное действие в отношении гибели клеток, вызванной COPs [33]. Эти результаты согласуются с нашими выводами, поскольку диета с добавлением DHA для орхидэктомированных крыс предотвращала рост образования COP, вызванного орхидемтомией. Таким образом, уровни COP были близки к уровням, измеренным у контрольных крыс, получавших контрольную диету. Интересно, что диета с добавкой DHA восстанавливала повышенное содержание COP, вызванное орхидэктомией, точно так же, как она восстанавливает липидный профиль, а окислительно-восстановительный и воспалительный статус изменялись в этом конкретном состоянии [9,10].Эти результаты согласуются с кардиозащитными эффектами DHA, о которых широко сообщается благодаря его противовоспалительной [31] и антиоксидантной активности [33–35]. Недавно сообщалось, что DHA, одна из основных жирных кислот средиземноморской диеты, ослабляет токсическое действие 7-KC на микрогиальные клетки [81]. Исходя из всей этой информации, пищевые привычки человека заслуживают важного рассмотрения, и соблюдение средиземноморской диеты может предотвратить последствия повышенного окислительного стресса, который возникает в различных физиопатологических ситуациях.Однако, похоже, что-то другое происходит с диетой, дополненной DHA, по сравнению с контрольными животными, у которых наблюдалась тенденция к увеличению содержания COP в аорте крысы. Этот результат согласуется с предыдущим сообщением, в котором участие вазодилататоров простаноидов в Ach-индуцированном ответе в аорте контрольных крыс было переключено на вазоконстрикторы после диеты с добавлением DHA [9]. В целом, эти результаты показывают, что добавка DHA оказывает кардиопротекторное действие, особенно при патологических состояниях, что кажется разумным, поскольку гомеостатические механизмы работают для поддержания надлежащей функции у здоровых субъектов без каких-либо пищевых добавок.
Таким образом, мы описываем здесь пагубные эффекты, вызванные недостатком половых гормонов в повышении перекисного окисления липидов, предоставляя новую информацию о повреждении липидных компонентов, ответственных за поддержание мембранных свойств и клеточной передачи сигналов в различных путях, участвующих в сосудистой функции аорта и брыжеечная артерия, уже опубликованы [9,10]. Также показано профилактическое действие диеты с добавкой ДГК на перекисное окисление липидов, что способствует поддержанию сосудистого гомеостаза.В этом отношении важно отметить, что результаты, наблюдаемые в брыжеечной артерии, вместе с результатами, относящимися к вазомоторной функции [10], имеют особое значение, поскольку это сосудистое русло играет важную роль в контроле периферического сосудистого сопротивления и, следовательно, в регулирование артериального давления. Настоящие результаты демонстрируют интерес к проведению клинических исследований с DHA у пациентов с пониженным уровнем половых гормонов (пожилые пациенты и / или пациенты с раком простаты, проходящие терапию по депривации андрогенов), у которых проявляются факторы риска сердечно-сосудистых заболеваний.
Острая мезентериальная ишемия: история вопроса, анатомия, патофизиология
Sachs SM, Morton JH, Schwartz SI. Острая брыжеечная ишемия. Хирургия . 1982 Октябрь 92 (4): 646-53. [Медлайн].
Cokkinis AJ. Наблюдения за брыжеечным кровообращением. Дж Анат . 1930, январь, 64: 200-205. [Медлайн].
Mamode N, Pickford I, Leiberman P. Неспособность улучшить исход при острой брыжеечной ишемии: семилетний обзор. евро J Surg . 1999 Март 165 (3): 203-8. [Медлайн].
Альперн М.Б., Глейзер Г.М., Фрэнсис И.Р. Ишемический или инфаркт кишечника: результаты КТ. Радиология . 1988, январь, 166 (1, часть 1): 149-52. [Медлайн].
Kim MY, Suh CH, Kim ST, Lee JH, Kong K, Lim TH, et al. Магнитно-резонансная томография ишемии кишечника, вызванной перевязкой верхней брыжеечной артерии и вены на модели кошки. J Comput Assist Tomogr . 2004 март-апрель.28 (2): 187-92. [Медлайн].
Kozuch PL, Brandt LJ. Обзорная статья: диагностика и лечение мезентериальной ишемии с акцентом на фармакотерапию. Aliment Pharmacol Ther . 2005 г., 1. 21 (3): 201-15. [Медлайн].
Aksu C, Demirpolat G, Oran I, Demirpolat G, Parildar M, Memis A. Имплантация стента при хронической ишемии брыжейки. Acta Radiol . 2009 июл.50 (6): 610-6. [Медлайн].
Loffroy R, Steinmetz E, Guiu B, Molin V, Kretz B, Gagnaire A, et al.Роль эндоваскулярной терапии при хронической ишемии брыжейки. Банка J Гастроэнтерол . 2009 Май. 23 (5): 365-73. [Медлайн]. [Полный текст].
Penugonda N, Gardi D, Schreiber T. Чрескожное вмешательство при стенозе верхней брыжеечной артерии у пожилых пациентов. Клин Кардиол . 2009 Май. 32 (5): 232-5. [Медлайн].
Mitchell EL, Chang EY, Landry GJ, Liem TK, Keller FS, Moneta GL. Дуплексные критерии стеноза нативной верхней брыжеечной артерии переоценивают стеноз стенозированной верхней брыжеечной артерии. J Vasc Surg . 2009 Август 50 (2): 335-40. [Медлайн].
Sivamurthy N, Rhodes JM, Lee D, Waldman DL, Green RM, Davies MG. Эндоваскулярная реваскуляризация по сравнению с открытой реваскуляризацией брыжейки: немедленные преимущества не приравниваются к краткосрочным функциональным результатам. Дж. Ам Колл Сург . 2006 июн. 202 (6): 859-67. [Медлайн].
Бертран X, Мухарт Дж, Планас Р., Реал М.И., Рибера Дж. М., Кабре Э и др. Окклюзия верхней брыжеечной артерии у пациента с истинной полицитемией: разрешение с помощью чрескожной транслюминальной ангиопластики. Энн Гематол . 1996 Февраль 72 (2): 89-91. [Медлайн].
Шутс И.Г., Леви М.М., Рикерс Дж.А., Ламерис Дж.С., ван Гулик TM. Тромболитическая терапия острой окклюзии верхней брыжеечной артерии. J Vasc Interv Radiol . 2005 16 марта (3): 317-29. [Медлайн].
Финк С., Чаудхури Т.К., Дэвис Х.Х. Заявления об острой брыжеечной ишемии и злоупотреблении служебным положением. South Med J . 2000 Февраль 93 (2): 210-4. [Медлайн].
Rosenblum JD, Boyle CM, Schwartz LB.Брыжеечное кровообращение. Анатомия и психология. Surg Clin North Am . 1997 Apr. 77 (2): 289-306. [Медлайн].
Boley SJ. Циркуляторные реакции на резкое снижение кровотока в верхней брыжеечной артерии. Физиолог . 1969. 12: 180.
[Директива] ЧЛЕНЫ ПИСАТЕЛЬНОЙ ГРУППЫ 2011, ЧЛЕНЫ ПИСЬМЕННОГО КОМИТЕТА 2005, ЧЛЕНЫ РАБОЧЕЙ ГРУППЫ ACCF / AHA. 2011 ACCF / AHA Специальное обновление Руководства по ведению пациентов с заболеванием периферических артерий (Обновление Руководства 2005 г.): отчет Фонда Американского колледжа кардиологов / Целевой группы Американской кардиологической ассоциации о практических рекомендациях. Тираж . 2011 г. 1. 124 (18): 2020-45. [Медлайн]. [Полный текст].
Чанг Р. У., Чанг Дж. Б., Лонго В.Е. Обновленная информация о лечении ишемии брыжейки. Мир J Гастроэнтерол . 2006 28 мая. 12 (20): 3243-7. [Медлайн].
Леунг Д.А., Шнайдер Э., Кубик-Хуч Р., Маринчек Б., Пфамматтер Т. Острая ишемия брыжейки, вызванная спонтанным изолированным расслоением верхней брыжеечной артерии: лечение чрескожной установкой стента. евро Радиол . 2000. 10 (12): 1916-9. [Медлайн].
Миямото Н., Сакураи Ю., Хироками М., Такахаши К., Нисимори Н., Цудзи К. и др. Эндоваскулярное размещение стента при изолированном спонтанном расслоении верхней брыжеечной артерии: отчет о случае. Радиат Мед . 2005 23 ноября (7): 520-4. [Медлайн].
Ko GJ, Han KJ, Han SG, Hwang SY, Choi CH, Gham CW, et al. [Случай спонтанного расслоения верхней брыжеечной артерии, леченный чрескожной установкой стента]. Корейский J Гастроэнтерол . 2006 Февраль 47 (2): 168-72. [Медлайн].
Casella IB, Bosch MA, Sousa WO Jr. Изолированное спонтанное расслоение верхней брыжеечной артерии, обработанное чрескожной установкой стента: отчет о клиническом случае. J Vasc Surg . 2008, январь 47 (1): 197-200. [Медлайн].
Cappell MS. Кишечная (брыжеечная) васкулопатия. I. Острая верхняя брыжеечная артериопатия и венопатия. Гастроэнтерол Clin North Am .1998 27 декабря (4): 783-825, vi. [Медлайн].
Boley SJ, Brandt LJ, Sammartano RJ. История ишемии брыжейки. Эволюция диагностики и лечения. Surg Clin North Am . 1997 апр. 77 (2): 275-88. [Медлайн].
Лю Джей Джей, Ардольф Дж. Суматриптан-связанная ишемия брыжейки. Энн Интерн Мед. . 2000, 4 апреля, 132 (7): 597. [Медлайн].
Абу-Дафф С., Абу-Дафф Н., Аль-Шахед М. Мезентериальный венозный тромбоз и факторы, связанные со смертностью: статистический анализ с пятилетним наблюдением. J Гастроинтест Сург . 2009 июл.13 (7): 1245-50. [Медлайн].
Endress C, Gray DG, Wollschlaeger G. Ишемия и перфорация кишечника после употребления кокаина. AJR Am J Roentgenol . 1992 июл. 159 (1): 73-5. [Медлайн].
Sudhakar CB, Al-Hakeem M, MacArthur JD, Sumpio BE. Мезентериальная ишемия, вызванная злоупотреблением кокаином: сообщения о случаях заболевания и обзор литературы. Ам Дж. Гастроэнтерол . 1997 июн.92 (6): 1053-4. [Медлайн].
Bech FR. Синдромы компрессии чревной артерии. Surg Clin North Am . 1997 апр. 77 (2): 409-24. [Медлайн].
Tseng YC, Tseng CK, Chou JW, Lai HC, Hsu CH, Cheng KS, et al. Редкая причина ишемии брыжейки: синдром компрессии чревной оси. Медицинский работник . 2007. 46 (15): 1187-90. [Медлайн].
Санчес Л.Д., Трейси Дж. А., Беркофф Д., Педроса И. Ишемический колит у марафонцев: обзор случаев заболевания. J Emerg Med . 2006 Апрель 30 (3): 321-6. [Медлайн].
Agaoglu N, Türkyilmaz S, Ovali E, Uçar F, Agaoglu C. Распространенность протромботических нарушений у пациентов с острой ишемией брыжейки. Мир J Surg . 2005 29 сентября (9): 1135-8. [Медлайн].
Альви А.Р., Хан С., Ниази С.К., Гулам М., Биби С. Острый тромбоз брыжеечных вен: улучшенный результат с ранней диагностикой и своевременной антикоагулянтной терапией. Int J Surg .2009 июн. 7 (3): 210-3. [Медлайн].
Джи М., Юн С.Н., Ли В., Чан С., Пак С.Х., Ким Д.Й. и др. Дефицит белка S с мутацией гена PROS1 у пациента с тромбозом мезентериальных вен после тотальной колэктомии. Фибринолиз свертывания крови . 2011 22 октября (7): 619-21. [Медлайн].
Кумар С., Сарр М.Г., Камат П.С. Тромбоз брыжеечных вен. N Engl J Med . 2001 декабрь 6. 345 (23): 1683-8. [Медлайн].
Абду Р.А., Захур Б.Дж., Даллис Д.Дж.Тромбоз брыжеечных вен — 1911-1984 гг. Хирургия . 1987 апр. 101 (4): 383-8. [Медлайн].
Harward TR, Green D, Bergan JJ, Rizzo RJ, Yao JS. Тромбоз брыжеечных вен. J Vasc Surg . 1989 февраля, 9 (2): 328-33. [Медлайн].
Джеймс А.В., Рабл С., Вестфален А.К., Фогарти П.Ф., Посселт А.М., Кампос Г.М. Портомезентериальный венозный тромбоз после лапароскопической операции: систематический обзор литературы. Arch Surg .2009 июнь 144 (6): 520-6. [Медлайн].
Ван М.К., Линь Х.Й., Го Л.П., Лю Ф.Й., Дуань Ф., Ван З.Дж. Острый обширный тромбоз воротной и брыжеечной вен после спленэктомии: лечение интервенционным тромболизисом с трансъюгулярным доступом. Мир J Гастроэнтерол . 2009, 28 июня, 15 (24): 3038-45. [Медлайн]. [Полный текст].
Стаму К.М., Тутузас К.Г., Кекис П.Б., Накос С., Гафу А., Манурас А. и др. Проспективное исследование частоты и факторов риска постспленэктомического тромбоза воротной, брыжеечной и селезеночной вен. Arch Surg . 2006 июль 141 (7): 663-9. [Медлайн].
Ван М.К., Лю Ф.Й., Дуань Ф., Ван З.Дж., Сон П., Фан КС. Острый симптоматический тромбоз брыжеечных вен: лечение катетер-направленным тромболизисом трансъюгулярным внутрипеченочным путем. Визуализация брюшной полости . 2011 Август, 36 (4): 390-8. [Медлайн]. [Полный текст].
Swartz DE, Felix EL. Острый тромбоз брыжеечных вен после лапароскопического желудочного обходного анастомоза по Ру. ЖСЛС .2004 апр-июн. 8 (2): 165-9. [Медлайн]. [Полный текст].
Cappell MS. Кишечная (брыжеечная) васкулопатия. II. Ишемический колит и хроническая ишемия брыжейки. Гастроэнтерол Clin North Am . 1998 Dec. 27 (4): 827-60, vi. [Медлайн].
Ha C, Magowan S, Accortt NA, Chen J, Stone CD. Риск артериальных тромботических явлений при воспалительном заболевании кишечника. Ам Дж. Гастроэнтерол . 2009 июнь 104 (6): 1445-51. [Медлайн].
Вокурка Дж., Олейник Дж., Едличка В., Веселы М, Черник Дж., Пасека Т.Острая брыжеечная ишемия. Гепатогастроэнтерология . 2008 июл-авг. 55 (85): 1349-52. [Медлайн].
Талларита Т., Одерич Г.С., Маседо Т.А., Гловички П., Мисра С., Дункан А.А. и др. Повторные вмешательства при рестенозе стента у пациентов, леченных по поводу атеросклеротической болезни брыжеечной артерии. J Vasc Surg . 2011 ноябрь 54 (5): 1422-1429.e1. [Медлайн].
Cardin F, Fratta S, Perissinotto E, Casarrubea G, Inelmen EM, Terranova C, et al.Клиническая корреляция заболеваний мезентериальных сосудов у пожилых пациентов. Старение Clin Exp Res . 2012 июн.24 (3 доп.): 43-6. [Медлайн].
Di Fabio F, Obrand D, Satin R, Gordon PH. Внутрибрюшная венозная и артериальная тромбоэмболия при воспалительном заболевании кишечника. Диск прямой кишки . 2009 Февраль 52 (2): 336-42. [Медлайн].
Cardin F, Fratta S, Perissinotto E, Casarrubea G, Inelmen EM, Terranova C. Клиническая корреляция заболеваний мезентериальных сосудов у пожилых пациентов. Старение Clin Exp Res . 2012 июн.24 (3 доп.): 43-6. [Медлайн].
Хуанг Х. Х., Чанг Ю. С., Йен Д. Ф., Као В. Ф., Чен Дж. Д., Ван Л. М. и др. Клинические факторы и исходы у пациентов с острой ишемией брыжейки в отделении неотложной помощи. Дж. Чин Мед Ассо . 2005 июл.68 (7): 299-306. [Медлайн].
Safioleas MC, Moulakakis KG, Papavassiliou VG, Kontzoglou K, Kostakis A. Острая брыжеечная ишемия, смертельное заболевание с катастрофическим исходом. Vasa . 2006 май. 35 (2): 106-11. [Медлайн].
Шутс И.Г., Коффеман Г.И., Легемат Д.А., Леви М, ван Гулик ТМ. Систематический обзор выживаемости после острой брыжеечной ишемии в зависимости от этиологии заболевания. Br J Surg . 2004, январь, 91 (1): 17–27. [Медлайн].
Boley SJ, Sprayregen S, Veith FJ, Siegelman SS. Агрессивный рентгенологический и хирургический подход к острой ишемии брыжейки. Сург Анну . 1973 г.5: 355-78. [Медлайн].
Klempnauer J, Grothues F, Bektas H, Pichlmayr R. Отдаленные результаты после операции по поводу острой ишемии брыжейки. Хирургия . 1997 г., 121 (3): 239-43. [Медлайн].
Boley SJ, Sprayregan S, Siegelman SS, Veith FJ. Первые результаты агрессивного рентгенологического и хирургического подхода к острой ишемии брыжейки. Хирургия . 1977 декабрь 82 (6): 848-55. [Медлайн].
Nonthasoot B, Tullavardhana T, Sirichindakul B, Suphapol J, Nivatvongs S.Острая брыжеечная ишемия: все еще высокий уровень смертности в эпоху круглосуточной доступности ангиографии. J Med Assoc Thai . 2005 сентябрь 88 Дополнение 4: S46-50. [Медлайн].
Мюррей М.Дж., Гонзе М.Д., Новак Л.Р., Кобб С.Ф. Уровень D (-) — лактата в сыворотке как средство диагностики острой ишемии кишечника. Am J Surg . 1994 июн. 167 (6): 575-8. [Медлайн].
Lange H, Jäckel R. Полезность концентрации лактата в плазме при диагностике острых заболеваний брюшной полости. евро J Surg . 1994 июн-июл. 160 (6-7): 381-4. [Медлайн].
Ланге Х., Тойвола А. [Предупреждающие сигналы при острых абдоминальных расстройствах. Лактат — лучший маркер ишемии брыжейки]. Lakartidningen . 1997 14 мая. 94 (20): 1893-6. [Медлайн].
Курт Ю., Акин М.Л., Демирбас С., Улуутку А.Х., Гульдерен М., Авсар К. и др. D-димер в ранней диагностике острой ишемии брыжейки вторичной артериальной окклюзии у крыс. Eur Surg Res .2005 июль-авг. 37 (4): 216-9. [Медлайн].
Acosta S, Nilsson TK, Bjorck M. Предварительное исследование D-димера как возможного маркера острой ишемии кишечника. Br J Surg . 2001 Март 88 (3): 385-8. [Медлайн].
Altinyollar H, Boyabatli M, Berberoglu U. D-димер как маркер для ранней диагностики острой ишемии брыжейки. Тромб Рес . 2006. 117 (4): 463-7. [Медлайн].
Acosta S, Nilsson TK, Björck M.Исследование D-димера у пациентов с подозрением на острую тромбоэмболическую окклюзию верхней брыжеечной артерии. Br J Surg . 2004 г., август 91 (8): 991-4. [Медлайн].
Кларк Р.А., Галлант TE. Острая брыжеечная ишемия: ангиографический спектр. AJR Am J Roentgenol . 1984 Март 142 (3): 555-62. [Медлайн].
NAITOVE A, WEISMANN RE. ПЕРВИЧНЫЙ МЕЗЕНТЕРИЧЕСКИЙ ВЕНОЗНЫЙ ТРОМБОЗ. Энн Сург . 1965 Apr, 161: 516-23. [Медлайн].[Полный текст].
Кауфман С.Л., Харрингтон Д.П., Сигельман СС. Эмболизация верхней брыжеечной артерии: неотложная ангиография. Радиология . 1977 Сентябрь 124 (3): 625-30. [Медлайн].
Беттгер Т., Шефер В., Вебер В., Юнгингер Т. [Значение предоперационной диагностики при окклюзии мезентериальных сосудов. Перспективное исследование. Langenbecks Arch Chir . 1990. 375 (5): 278-82. [Медлайн].
Boos S. [Ангиография брыжеечной артерии 1976-1991.Изменение показаний при нарушении брыжеечного кровообращения?]. Радиолог . 1992 апр. 32 (4): 154-7. [Медлайн].
Черни М., Трубель В., Клэйс Л., Шеуба С., Хук И., Прагер М. и др. [Острая брыжеечная ишемия]. Zentralbl Chir . 1997. 122 (7): 538-44. [Медлайн].
Brandt LJ, Boley SJ. Технический обзор AGA по кишечной ишемии. Американская желудочно-кишечная ассоциация. Гастроэнтерология . 2000 Май.118 (5): 954-68. [Медлайн].
Savassi-Rocha PR, Veloso LF. Лечение эмболии верхней брыжеечной артерии фибринолитическим агентом: клинический случай и обзор литературы. Гепатогастроэнтерология . 2002 сентябрь-октябрь. 49 (47): 1307-10. [Медлайн].
Заявление о медицинской позиции Американской гастроэнтерологической ассоциации: рекомендации по ишемии кишечника. Гастроэнтерология . 2000 Май. 118 (5): 951-3. [Медлайн].
Хортон К.М., Фишман Е.К.Мультидетекторная рядная КТ мезентериальной ишемии: можно ли ?. Рентгенография . 2001 ноябрь-декабрь. 21 (6): 1463-73. [Медлайн].
Cikrit DF, Harris VJ, Hemmer CG, Kopecky KK, Dalsing MC, Hyre CE и др. Сравнение спиральной компьютерной томографии и артериографии для оценки почечных и висцеральных артерий. Анн Васк Сург . 1996 10 марта (2): 109-16. [Медлайн].
Zeman RK, Silverman PM, Vieco PT, Costello P. КТ-ангиография. AJR Am J Roentgenol .1995 ноябрь 165 (5): 1079-88. [Медлайн].
Aschoff AJ, Stuber G, Becker BW, Hoffmann MH, Schmitz BL, Schelzig H, et al. Оценка острой мезентериальной ишемии: точность двухфазной мультидетекторной КТ-ангиографии брыжейки. Визуализация брюшной полости . 2009 май-июнь. 34 (3): 345-57. [Медлайн].
Kirkpatrick ID, Kroeker MA, Greenberg HM. Двухфазная КТ с КТ-ангиографией брыжейки в оценке острой ишемии брыжейки: начальный опыт. Радиология . 2003 Октябрь 229 (1): 91-8. [Медлайн].
Wiesner W. [Является ли мультидетекторная компьютерная томография в настоящее время основным методом диагностики при диагностической визуализации острой ишемии кишечника?]. Praxis (Берн 1994) . 30 июля 2003 г. 92 (31-32): 1315-7. [Медлайн].
Vogelzang RL, Gore RM, Anschuetz SL, Blei AT. Тромбоз внутренних вен: КТ-диагностика. AJR Am J Roentgenol . 1988 Янв.150 (1): 93-6. [Медлайн].
Barmase M, Kang M, Wig J, Kochhar R, Gupta R, Khandelwal N. Роль мультидетекторной КТ-ангиографии в оценке подозреваемой ишемии брыжейки. евро J Радиол . 2011 декабрь 80 (3): e582-7. [Медлайн].
Тамбурая А.Л. Ведение острой мезентериальной ишемии: рекомендуемая стратегия вводит в заблуждение. BMJ . 16 августа 2003 г. 327 (7411): 396; ответ автора 396. [Medline]. [Полный текст].
Ward D, Vernava AM, Kaminski DL, Ure T., Peterson G, Garvin P и др.Улучшение результатов за счет выявления неокклюзионной ишемии брыжейки высокого риска, агрессивного повторного исследования и отсроченного анастомоза. Am J Surg . 1995 Dec. 170 (6): 577-80; обсуждение 580-1. [Медлайн].
Grieshop RJ, Dalsing MC, Cikrit DF, Lalka SG, Sawchuk AP. Острый тромбоз брыжеечных вен. Пересмотрено во времена диагностической ясности. Am Surg . 1991 сентябрь 57 (9): 573-7; Обсуждение 578. [Медлайн].
Йона Дж., Cummins GM Jr, руководитель HB, Govostis MC.Рецидивирующий первичный тромбоз мезентериальных вен. JAMA . 4 марта 1974 г. 227 (9): 1033-5. [Медлайн].
Acosta S, Ogren M, Sternby NH, Bergqvist D, Björck M. Мезентериальный венозный тромбоз с трансмуральным инфарктом кишечника: популяционное исследование. J Vasc Surg . 2005, январь, 41 (1): 59-63. [Медлайн].
Герберт Г.С., Стил С.Р. Острая и хроническая ишемия брыжейки. Surg Clin North Am . 2007 Октябрь 87 (5): 1115-34, ix.[Медлайн].
Hansen KJ, Deitch JS. Трансаортальная брыжеечная эндартерэктомия. Surg Clin North Am . 1997 апр. 77 (2): 397-407. [Медлайн].
Маруданаягам Р., Сайед С., Наср Х., Фокс А. Результат после реваскуляризации брыжеечной артерии при хронической ишемии брыжейки. Минерва Чир . 2011 Апрель 66 (2): 101-6. [Медлайн].
Gagnière J, Favrolt G, Alfidja A, Kastler A, Chabrot P, Cassagnes L, et al.Острая тромботическая ишемия брыжейки: первичное эндоваскулярное лечение у восьми пациентов. Cardiovasc Intervent Radiol . 2011 Октябрь 34 (5): 942-8. [Медлайн].
Харник И.Г., Брандт Л.Дж. Тромбоз брыжеечных вен. Vasc Med . 2010 октября 15 (5): 407-18. [Медлайн].
Такахаши Н., Куроки К., Янага К. Чрескожная чреспеченочная механическая тромбэктомия при остром тромбозе брыжеечных вен. Дж. Эндоваск Тер .2005 12 августа (4): 508-11. [Медлайн].
Hladík P, Raupach J, Lojík M, Krajina A, Voboril Z, Jon B, et al. Лечение острого тромбоза / ишемии брыжейки транскатетерной тромбоаспирацией. Хирургия . 2005, январь, 137 (1): 122-3. [Медлайн].
Томас Р.М., Ахмад С.А. Ведение острого послеоперационного тромбоза воротной вены. J Гастроинтест Сург . 2010 марта, 14 (3): 570-7. [Медлайн].