5.1. Диагностика и лечение варикотромбофлебитаФлебологический Центр «Антирефлюкс»
<img src=»/upload/medialibrary/a9a/a9ad9dd4689bded2b8c113413d5e2656.jpg» title=»Рис. 5.1. Тромбофлебит притоковбольшой подкожной вены на голени» border=»0″ align=»middle» alt=»Рис. 5.1. Тромбофлебит притоковбольшой подкожной вены на голени»>Рис. 5.1. Тромбофлебит притоков большой подкожной вены на голени
<img src=»/upload/medialibrary/d26/d263372b417b4ea744108cd1f2a54ea5.jpg» title=»Рис. 5.2. Тромбоз БПВс распространениемтромба через СФС» border=»0″ align=»middle» alt=»Рис. 5.2. Тромбоз БПВс распространениемтромба через СФС» srcset=»/upload/medialibrary/d26/d263372b417b4ea744108cd1f2a54ea5-320×234.jpg 320w,/upload/medialibrary/d26/d263372b417b4ea744108cd1f2a54ea5-360×264.jpg 360w,/upload/medialibrary/d26/d263372b417b4ea744108cd1f2a54ea5.jpg 396w»>Рис. 5.2. Тромбоз БПВ с распространением тромба через СФС
Лечение
Тактика лечения зависит от причины и локализации тромбофлебита.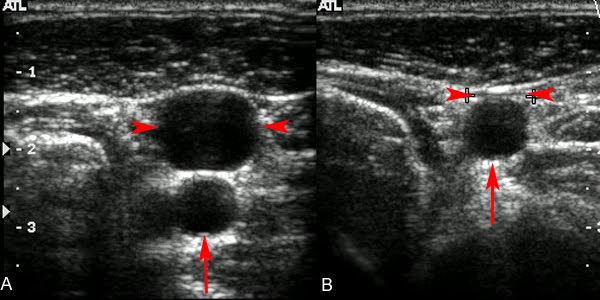 Основные цели лечения варикотромбофлебита — уменьшение явлений острого воспаления и предотвращение потенциально опасных осложнений, таких как тромбоз глубоких вен и ТЭЛА. Консервативное лечение варикотромбофлебита включает активный режим, эластическую компрессию нижних конечностей, местную и системную фармакотерапию. Антикоагулянты в лечебных дозах показаны больным, у которых произошел переход тромба на глубокую венозную систему. При выраженном болевом синдроме целесообразно использование нестероидных противовоспалительных средств (НПВС) внутрь в течение 5—7 дней. Местное лечение включает холод, препараты, содержащие гепарин, компрессы с НПВС. Показаниями к хирургическому лечению является локализация тромбофлебита в проксимальных отделах подкожных вен, распространение тромбоза из дистальных отделов на проксимальный сегмент, несмотря на проводимую терапию (восходящий тромбофлебит), распространение тромбоза через соустья или перфорантные вены на глубокую венозную систему. Основным видом хирургического лечения является кроссэктомия и, при необходимости, тромбэктомия из магистральных вен.
Основные цели лечения варикотромбофлебита — уменьшение явлений острого воспаления и предотвращение потенциально опасных осложнений, таких как тромбоз глубоких вен и ТЭЛА. Консервативное лечение варикотромбофлебита включает активный режим, эластическую компрессию нижних конечностей, местную и системную фармакотерапию. Антикоагулянты в лечебных дозах показаны больным, у которых произошел переход тромба на глубокую венозную систему. При выраженном болевом синдроме целесообразно использование нестероидных противовоспалительных средств (НПВС) внутрь в течение 5—7 дней. Местное лечение включает холод, препараты, содержащие гепарин, компрессы с НПВС. Показаниями к хирургическому лечению является локализация тромбофлебита в проксимальных отделах подкожных вен, распространение тромбоза из дистальных отделов на проксимальный сегмент, несмотря на проводимую терапию (восходящий тромбофлебит), распространение тромбоза через соустья или перфорантные вены на глубокую венозную систему. Основным видом хирургического лечения является кроссэктомия и, при необходимости, тромбэктомия из магистральных вен. Некоторые авторы при развитии тромбоза подкожных вен на фоне варикозной болезни рекомендуют одновременное выполнение радикальной флебэктомии.
Некоторые авторы при развитии тромбоза подкожных вен на фоне варикозной болезни рекомендуют одновременное выполнение радикальной флебэктомии.
Таблица 5.1. Лечебная тактика при тромбозе подкожных вен нижних конечностей (согласно российским клиническим рекомендациям по диагностике, лечению и профилактике венозных тромбоэмболических осложнений, утвержденным советом экспертов в 2009 г.)
<img src=»/upload/medialibrary/7ba/7ba41718898380fa67017a3b4c4c2307.png» title=»5_1.png» border=»0″ align=»middle» alt=»5_1.png» srcset=»/upload/medialibrary/7ba/7ba41718898380fa67017a3b4c4c2307-320×366.png 320w,/upload/medialibrary/7ba/7ba41718898380fa67017a3b4c4c2307-360×412.png 360w,/upload/medialibrary/7ba/7ba41718898380fa67017a3b4c4c2307.png 588w»>%PDF-1.6 % 1 0 obj > endobj 4 0 obj /ModDate (D:20160429154443+03’00’) /Subject >> endobj 2 0 obj > stream application/pdf
ТРОМБОЗ ГЛУБОКИХ ВЕН: СИМПТОМЫ И ЛЕЧЕНИЕ
При постановке диагноза недостаточно указать «венозный тромбоз конечностей».
Мы поговорили с доктором Paolo Carlo Righini, ангиохирургом отделения Сосудистой хиругрии Научно-Исследовательского Клинического Института Policlinico San Donato, о том, что такое тромбоз вен, об его симптомах и лечении.
ЧТО ТАКОЕ ТРОМБОЗ ГЛУБОКИХ И ПОВЕРХНОСТНЫХ ВЕН?
«Прежде всего, необходимо различать функции поверхностной и глубокой венозных систем в теле человека.
Глубокая венозная система отвечает за возврат венозный крови к сердцу и центру тела. Поверхностная венозная система отвечает за то, чтобы венозная кровь самой поверхностной части возвращалась к глубокому венозному кровообращению и, следовательно, к правым камерам сердца.»
ТРОМБОФЛЕБИТ ИЛИ ТРОМБОЗ ПОВЕРХНОСТНЫХ ВЕН
«Тромбоз поверхностных вен — это патологическое состояние, которое чаще поражает нижние конечности.
Например, при общеизвестном варикозном расширении вен кровь течет медленнее, стенки сосудов имеют повреждения, обнажающие молекулы клеточной адгезии, которые могут способствовать развитию протромботических состояний.
Среди последствий тромбоза поверхностных вен:
- образование тромба;
- воспаление подкожно-жировой клетчатки около вены.
При тромбофлебите поверхностный слой кожи становится красным».
Наиболее часто вовлеченны следующие сосуды:
-
вены ног,
-
большая подкожная вена,
-
малая подкожная вена,
-
поверхностные коллатеральные вены,
-
медиальная подкожная вена руки,
-
головная вена.
Причины
«Тромбофлебит может быть результатом инсульта, травмы или продолжительного во времени усилия.
Встречаются случаи тромбоза поверхностных вен среди здоровых пациентов. Например, среди участников марафона, что является интенсивной и повторяющейся нагрузкой.
Кроме того, тромбоз верхних конечностей может быть результатом взятия крови, что можно решить припомощи применения гепариновых мазей и / или введения под кожу низкомолекулярного гепарина.
Все поверхностные тромбофлебиты не вызывают беспокойства, поскольку поверхностная венозная система — это вспомогательная система и при присутствии тромба на небольшом участке вены, он не расценивается каксерьезное заболевание,» — рассказывает доктор Righini.
ТРОМБОЗ ГЛУБОКИХ ВЕН
Однако, при образовании сгустка крови в вене, которая является частью венозной системы нижних конечностей, то есть по ней происходит циркуляция крови от стопы к сердцу, мы говорим о тромбозе глубоких конечностей.
-
большеберцовые вены,
-
икроножные вены,
-
подколенную вену,
-
поверхностную бедренную вену,
-
глубокую бедренную вену,
-
общую бедренную вену.
Также возможен тромбоз подвздошных вен, которые расположены в брюшной полости, и тромбоз систем нижней полой вены или верхней полой вены, которые переносят кровь к сердцу из нижней или верхней части тела, соответственно.
Симптомы и причины
«Образование сгустка в вышеперечисленных венах манифестируется по-другому и несет с собой более серьезную клиническую картину, чем тромбофлебит. При ТГВ конечностей у пациента будет наблюдаться отек и жар».
Причины ТГВ могут быть разными и не связанными с травмой:
-
Новообразования.
 Некоторые образования связаны с протромботическим статусом, которыйувеличивает вероятность образования тромбов;
Некоторые образования связаны с протромботическим статусом, которыйувеличивает вероятность образования тромбов; -
Тромбофилия. Это врожденное патологическое состояние, характеризующееся нарушением системы свёртываемости крови, при котором наблюдаются такие патологии как Лейденовская мутация, дефицит протеина С или протеина S, Волчаночный антикоагулянт, которые также затрагивают людей молодого возраста;
-
Обширное абдоминальное, ортопедическое, гинекологическое хирургическо вмешательсво или любая другая причина длительного постельного режима. Когда мы находимся движении, наши мышцы и вены сокращаются, что способствует венозному возврату и оттоку венозной крови. Продолжительный постельный режим снижает венозный возврат крови и, у предрасположенных лиц, способствует образованию тромбоза глубоких вен, в следствие чего необходима профилактика гепарином. Наибольшим риском является перемещение, что может привести к тромбоэмболии легочной артерии.
-
Электрофизиологические процедуры по установке дефибрилляторов / кардиостимуляторов. Данные процедуры включают введение катетеров в подключичную вену и в редких случаях могут способствовать образованию тромбов у предрасположенных субъектов, особенно при процедурах реимплантации или замены ранее имплантированных катетеров.
ДИАГНОЗ
«Тромбоз глубоких вен возникает при наличии трех факторов:
- изменение скорости кровотока,
- повреждение эндотелия (аномалия внутренней поверхности сосуда),
- гиперкоагуляции (присуща для триады Вирхова).
У пациентов наблюдается отек и болезненность конечности, а также повышенная температура тела.
С помощью эхококкордоплера можно проверить кровоток в вене и ее сжимаемость (ультразвуковое сжатие — CUS).
В случае, если сжатие вены не происходит, есть риск присутствия тромба.
Кроме того, для пациентов с нарушениями свертываемости крови и с тромбофилией, которые состоят в родстве с людьми с генетическими мутациями или с новообразованиями, необходимо сдать биохимический анализ крови.
В случае возникновения отека необходимо немедленно выполнить венозный эхококкордоплер и проверить наличие в крови D-димера. D-димер — это белок, отсутствие которого априори исключает наличие тромбоза глубоких вен. С другой стороны, его присутствие не обязательно указывает на ТГВ, за исключением чрезвычайно высоких показателей и типовых клинических признаков».
При воспалении поверхностных вен, как при тромбофлебите, распознать патологию проще:
«Венозный сгусток возможно определить на ощупь, он твердый и болезненный при пальпации. На коженаблюдается покраснение, ткани вокруг пораженной вены становятся твердыми».

ПРОФИЛАКТИКА И ЛЕЧЕНИЕ
При своевременной диагностике, венозный тромбоз (даже глубоких вен) не является комплексной патологией.
«Благодаря антикоагулянтной терапии (препараты NAO и TAO) сгустки крови растворяются и снижается риск появления тромбоза глубоких вен или тромбоэмболии легочной артерии. Кроме того, использованиекомпрессионных эластичных чулок снижает риск образования тромбов, их перемещения и появления отеков».
Наличие варикозного расширения вен является фактором риска развития тромбофлебита. Заключает доктор Righini:
«При наличии варикозного расширения вен, необходимо получить консультацию у ангиохирурга и пройти ультразвуковую допплерографию. Кроме того, для профилактики развития патологий необходимо носить компрессионные эластичные чулки, принимать венотонизирующие препараты по предписанию врача, и, при необходимости, сделать операцию по удалению варикозных вен».

Date: 03.06.2021
Translation and editing: Viktoryia Luhakova
ГКБ-24 :: Отделения :: Хирургический профиль :: Флебология :: Методы лечения варикозной болезни :: Комбинированная флебэктомия :: Подробное описание оперативных вмешательств
Подробное описание оперативных вмешательств
В зависимости от цели и уровня вмешательства этапы оперативного пособия можно разделить на группы, приведенные ниже. Полный объем вмешательства (комбинированная флебэктомия), а также технические решения определяются индивидуально в зависимости от формы, стадии и распространенности патологического процесса. Операция осуществляется под регионарной анестезией (спинальной, при которой пациент находится в сознании или спит под действием седативных препаратов) или под тумесцентной анестезией (разновидность местной инфильтрационной, при которой специальный раствор медикаментов нагнетается в виде водяной подушки вокруг удаляемой вены). Регионарную анестезию используют в основном в стационарах, она является наиболее безопасным методом обезболивания и позволяет пациенту активизироваться через 2-3 часа после операции. Тумесцентная анестезия находит применение в амбулаторной практике, так как позволяет сразу встать и уйти домой после операции.
Регионарную анестезию используют в основном в стационарах, она является наиболее безопасным методом обезболивания и позволяет пациенту активизироваться через 2-3 часа после операции. Тумесцентная анестезия находит применение в амбулаторной практике, так как позволяет сразу встать и уйти домой после операции.
Операции на сафено-феморальном соустье
Рефлюкс крови через сафено-феморальное соустье в ствол большой подкожной вены (БПВ) или в ее притоки является ведущим механизмом развития и прогрессирования варикозной болезни и встречается у 90% всех пациентов. Поэтому его ликвидация является основным этапом хирургического лечения.
Классической операцией в этом случае является приустьевая перевязка с пересечением большой подкожной вены у места ее впадения в общую бедренную вену с перевязкой всех ее основных притоков — кроссэктомия (верхняя или проксимальная кроссэктомия).
Кроссэктомия выполняется из небольшого разреза 4-6 см. Обычно хирурги используют паховый доступ — разрез в глубине паховой складки кнутри от точки пульсации бедренной артерии.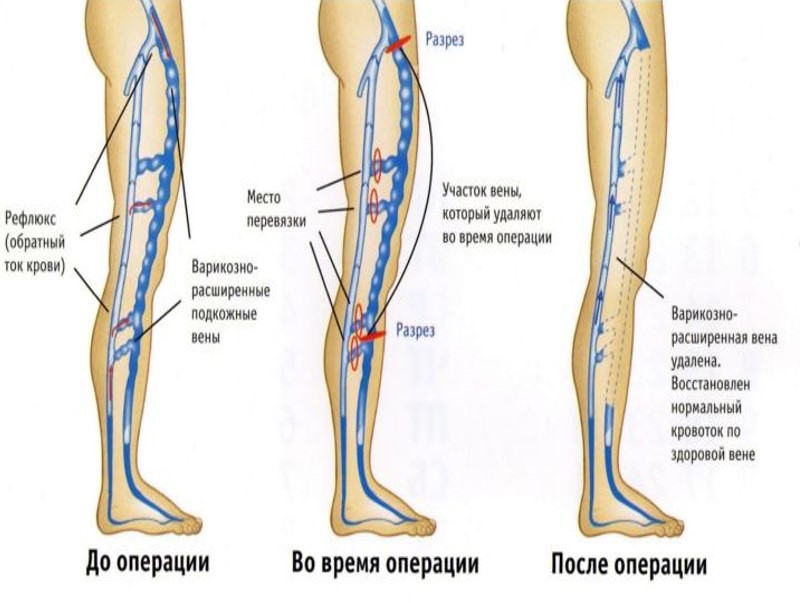 Подобный разрез позволяет адекватно обнажить приустьевой отдел большой подкожной вены и все ее притоки, к тому же он обладает хорошим косметическим эффектом. Операцию завершают наложением косметического шва, в результате чего формируется нежный практически незаметный рубчик. В некоторых случаях может быть выбран надпаховый (выше складки) или подпаховый (ниже складки) разрез, однако они обладают меньшей косметичностью и могут приводить к образованию более грубых рубцов.
Подобный разрез позволяет адекватно обнажить приустьевой отдел большой подкожной вены и все ее притоки, к тому же он обладает хорошим косметическим эффектом. Операцию завершают наложением косметического шва, в результате чего формируется нежный практически незаметный рубчик. В некоторых случаях может быть выбран надпаховый (выше складки) или подпаховый (ниже складки) разрез, однако они обладают меньшей косметичностью и могут приводить к образованию более грубых рубцов.
Ход операции: рассекается кожа и подкожная клетчатка, выделяется ствол БПВ до места его впадения в бедренную вену, одновременно с этим выделяются из окружающих тканей и перевязываются основные притоки (обычно их не меньше пяти). БПВ пересекается и перевязывается у устья с оставлением культи не длиннее 0,5 см. Сегмент БПВ иссекается в переделах раны. При необходимости из этого разреза выполняются другие этапы операции (стриппинг). На рану накладываются швы. Снятие швов производят на 6-7 сутки.
Операция на сафено-поплитеальном соустье.
Рефлюкс в малую подкожную вену (МПВ) через сафено-поплителаьное соустье встречается значительно реже и вносит незначительный вклад в развитие варикозной болезни (порядка 10% всех случаев). Это связано с тем, что типичное соустье между МПВ и подколенной веной встречается лишь у четверти людей. Однако при обнаружении такого рефлюкса, требуется хирургическая коррекция. Операция (нижняя или дистальная кроссэктомия) заключается в перевязке ствола МПВ непосредственно у ее устья с лигированием основных притоков, наиболее важным из которых является вена Джиакомини, обеспечивающая сообщение с БПВ. Разрез 3-5 см производится в подколенной области. Ход операции мало отличается от верхней кроссэктомии, за исключением несколько большей травматичности — рассекается поверхностный листок собственной фасции, в дупликатуре которой находится ствол МПВ. В связи с этим, а также с функциональной активностью области, швы снимают лишь на 10-12 сутки.
Удаление ствола большой подкожной вены (стриппинг).

В большинстве случаев варикозной болезни ствол большой подкожной вены демонстрирует несостоятельность клапанов и варикозную трансформацию с наличием вертикального сброса крови (сверху вниз), что диктует необходимость его удаления. Эта операция носит название сафенэктомия или стриппинг. Раньше хирурги в большинстве случаев удаляли весь ствол БПВ на протяжении от паха до лодыжки, однако последние исследования показывают, что лишь у 15% пациентов БПВ имеет признаки трансформации на голени, у остальных же 75% ствол на голени не вовлечен в патологический процесс. В таких случаях принято удалять ствол БПВ до уровня верхней трети голени, что носит название — короткий стриппинг. Это вмешательство может быть выполнено с использованием разнообразных методик:
Удаление ствола большой подкожной вены зондом Бебкокка — является самой первой зондовой методикой удаления БПВ, которая до сих пор находит широкое применение и свою научно обоснованную нишу (до этого практиковали удаление вены через один большой или множество маленьких разрезов, что оказалось весьма болезненно для пациентов). Принцип метода заключается в использовании специального жесткого зонда (металлического жгута) с оливой (широким навершием), обладающей режущей кромкой, которая острым путем выделяет вену из окружающих тканей (образно говоря, «выгрызает»). Операция осуществляется из двух разрезов: первый в паху (разрез после кроссэктомии), второй — на уровне верхней трети голени (короткий стриппинг) или на уровне внутренней лодыжки (тотальный стриппинг). При этом хирург выделяет ствол БПВ на соответствующем уровне (голень или лодыжка), перевязывает дистальную порцию, вводит в просвет вены зонд и проводит его на всем протяжении до появления головки с другого конца вены (направление введения зонда сверху-вниз или снизу-вверх выбирается индивидуально), фиксирует на конце зонда оливу и, прикладывая тянущее усилие, постепенно удаляет вену на ее протяжении. Стриппинг по Бебкокку является наиболее надежным и радикальным способом удаления ствола БПВ. В тоже время методика сопровождается достаточно выраженным повреждением окружающих тканей, кровотечением во время операции, развитием обширных кожных и подкожных кровоизлияний в послеоперационном периоде, а также несет риск развития воспалительных осложнений (инфильтраты, нагноения по ходу удаленной вены) и чувствительных расстройств по внутренней поверхности бедра и голени (снижение чувствительности, возникновение неприятных ощущений в виде ползанья мурашек и пр.
Принцип метода заключается в использовании специального жесткого зонда (металлического жгута) с оливой (широким навершием), обладающей режущей кромкой, которая острым путем выделяет вену из окружающих тканей (образно говоря, «выгрызает»). Операция осуществляется из двух разрезов: первый в паху (разрез после кроссэктомии), второй — на уровне верхней трети голени (короткий стриппинг) или на уровне внутренней лодыжки (тотальный стриппинг). При этом хирург выделяет ствол БПВ на соответствующем уровне (голень или лодыжка), перевязывает дистальную порцию, вводит в просвет вены зонд и проводит его на всем протяжении до появления головки с другого конца вены (направление введения зонда сверху-вниз или снизу-вверх выбирается индивидуально), фиксирует на конце зонда оливу и, прикладывая тянущее усилие, постепенно удаляет вену на ее протяжении. Стриппинг по Бебкокку является наиболее надежным и радикальным способом удаления ствола БПВ. В тоже время методика сопровождается достаточно выраженным повреждением окружающих тканей, кровотечением во время операции, развитием обширных кожных и подкожных кровоизлияний в послеоперационном периоде, а также несет риск развития воспалительных осложнений (инфильтраты, нагноения по ходу удаленной вены) и чувствительных расстройств по внутренней поверхности бедра и голени (снижение чувствительности, возникновение неприятных ощущений в виде ползанья мурашек и пр.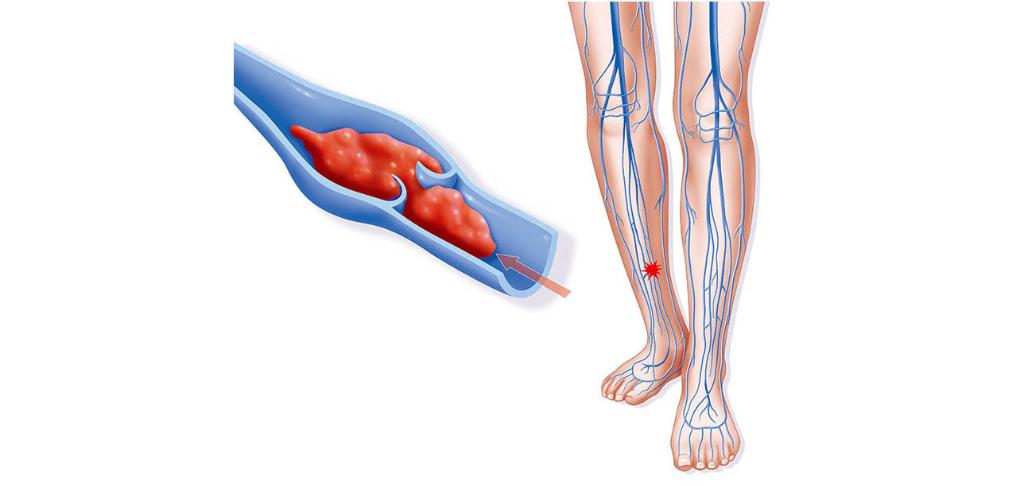 ), в связи с повреждением проходящего рядом с веной нерва. На сегодняшний день он рекомендуется в лишь случаях значительно выраженной варикозной трансформации (запущенный варикоз), когда требуется радикальное удаление всего ствола БПВ.
), в связи с повреждением проходящего рядом с веной нерва. На сегодняшний день он рекомендуется в лишь случаях значительно выраженной варикозной трансформации (запущенный варикоз), когда требуется радикальное удаление всего ствола БПВ.
Инвагинационный (инверсионный) стриппинг — это удаление ствола БПВ с помощью специального зонда, который тупым путем выделяет вену из окружающих тканей (путем ее выворачивания наизнанку — инвагинации, и постепенного отрыва), что обеспечивает меньшую травматичность и хороший косметический результат. На сегодня инвагинационный стриппинг является основным методом частичного удаления БПВ. Способ заключается в применении особого тонкого жесткого металлического зонда (PIN-зонд, PIN-стриппер), который вместо оливы имеет специальное отверстие для фиксации нити. При PIN-стриппинге требуется один разрез в паху (после кроссэктомии), зонд с фиксированной на нем нитью проводится по просвету всего удаляемого сегмента и через небольшой прокол на голени выводится наружу.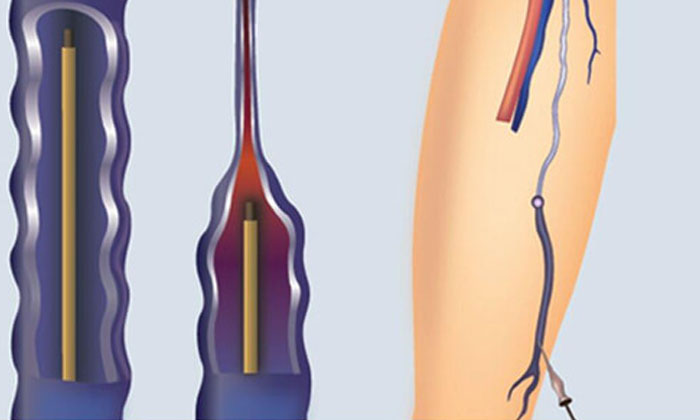 В области головки зонда вену рассекают, нить выводят через отверстие и завязывают на вене. Таким образом, усилия хирурга через фиксированную нить передаются на вену, вызывая ее выворачивание и удаление. Через прокол на голени вена легко извлекается. Главным достоинством PIN-стрипинга является отсутствие полноценного разреза (а, значит, и швов) на голени, что улучшает эстетический результат операции. В целом инвагинационная сафенэктомия ассоциируется с меньшим травмированием тканей, незначительным риском развития осложнений, лучшим косметическим эффектом (небольшие кровоизлияния), отсутствием чувствительных расстройств.
В области головки зонда вену рассекают, нить выводят через отверстие и завязывают на вене. Таким образом, усилия хирурга через фиксированную нить передаются на вену, вызывая ее выворачивание и удаление. Через прокол на голени вена легко извлекается. Главным достоинством PIN-стрипинга является отсутствие полноценного разреза (а, значит, и швов) на голени, что улучшает эстетический результат операции. В целом инвагинационная сафенэктомия ассоциируется с меньшим травмированием тканей, незначительным риском развития осложнений, лучшим косметическим эффектом (небольшие кровоизлияния), отсутствием чувствительных расстройств.
Помимо удаления ствола большой подкожной вены существует альтернативная методика выключения ее из кровообращения — облитерация, т.е. стимулирование слипания стенок вены и превращения ее в беспросветный соединительнотканный тяж. Облитерация на сегодняшний день реализуется тремя основными способами: склерооблитерация (вариант склеротерапии), лазерная коагуляция и радиочастотная коагуляция .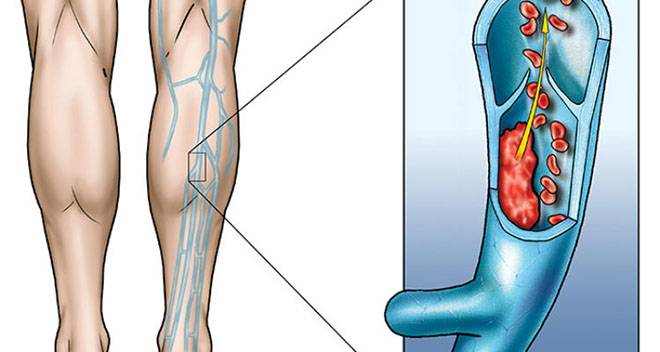 При этом две последние методики относятся к числу малоинвазивных и выполняются без разреза в паху.
При этом две последние методики относятся к числу малоинвазивных и выполняются без разреза в паху.
Интраоперационная стволовая катетерная склерооблитерация — это разновидность склеротерапии, которая выполняется во время оперативного вмешательства на стволе большой подкожной вены. Суть катетерной склерооблитерации заключается во введении в просвет вены специального длинного катетера (тонкой трубки) с множеством отверстий по бокам, по которому подают флебосклерозант (вещество, вызывающее разрушение внутренней оболочки вены и стимулирующее ее слипание), с последующей незамедлительной эластической компрессией. Катетер может вводиться как со стороны разреза в паху, так из дополнительного разреза в области внутренней лодыжки, но обязательно после выполнения кроссэктомии. Катетерная склерооблитерация является завершающим этапом операции и осуществляется после ликвидации рефлюксов и удаления варикозных вен, перед ее началом ушивают все раны (кроме той, через которую введен катетер). Во время склерооблитерации хирург вводит склерозант в просвет вены и одновременно потягивает катетер на себя, освобожденные участки вены подвергаются незамедлительной компрессии — сначала руками, а затем накладываются силиконовые подушечки и эластический бинт. Главным условием успеха является тщательная круглосуточная компрессия на срок не менее 7 суток. Основным достоинством склерооблитерации является крайне низкая травматичность (не повреждаются окружающие вену ткани, нервы, нет кровоизлияний), что определяет хороший косметический эффект, быструю реабилитацию и более раннее восстановление трудоспособности пациентов. Главный недостаток метода связан с сохранением ствола БПВ и риском восстановления кровотока по нему (по статистике восстановление просвета вены и кровотока обнаруживается при УЗИ у 20-60% пациентов за период до 3-х лет), что может привести к возврату заболевания. Осложнения склерооблитерации типичны для склеротерапии (воспалительная реакция, тромбофлебит, тромбоз, аллергические реакции, некрозы — встречаются редко, наиболее типичными являются формирование «жгута» и гиперпигментации по ходу вены, доставляющие дискомфорт). Ограничения применения склерооблитерации связаны с необходимостью тщательной компрессии вены, поэтому она не проводится при выраженной варикозной трансформации (расширение вены больше 8-10 мм, выраженная извитость, наличие крупных притоков и широких перфорантных вен на бедре), при высокой ригидности венозной стенки (что определяется при УЗИ), а также при конусовидной форме бедра, которая препятствует хорошей фиксации эластического бинта.
Главным условием успеха является тщательная круглосуточная компрессия на срок не менее 7 суток. Основным достоинством склерооблитерации является крайне низкая травматичность (не повреждаются окружающие вену ткани, нервы, нет кровоизлияний), что определяет хороший косметический эффект, быструю реабилитацию и более раннее восстановление трудоспособности пациентов. Главный недостаток метода связан с сохранением ствола БПВ и риском восстановления кровотока по нему (по статистике восстановление просвета вены и кровотока обнаруживается при УЗИ у 20-60% пациентов за период до 3-х лет), что может привести к возврату заболевания. Осложнения склерооблитерации типичны для склеротерапии (воспалительная реакция, тромбофлебит, тромбоз, аллергические реакции, некрозы — встречаются редко, наиболее типичными являются формирование «жгута» и гиперпигментации по ходу вены, доставляющие дискомфорт). Ограничения применения склерооблитерации связаны с необходимостью тщательной компрессии вены, поэтому она не проводится при выраженной варикозной трансформации (расширение вены больше 8-10 мм, выраженная извитость, наличие крупных притоков и широких перфорантных вен на бедре), при высокой ригидности венозной стенки (что определяется при УЗИ), а также при конусовидной форме бедра, которая препятствует хорошей фиксации эластического бинта.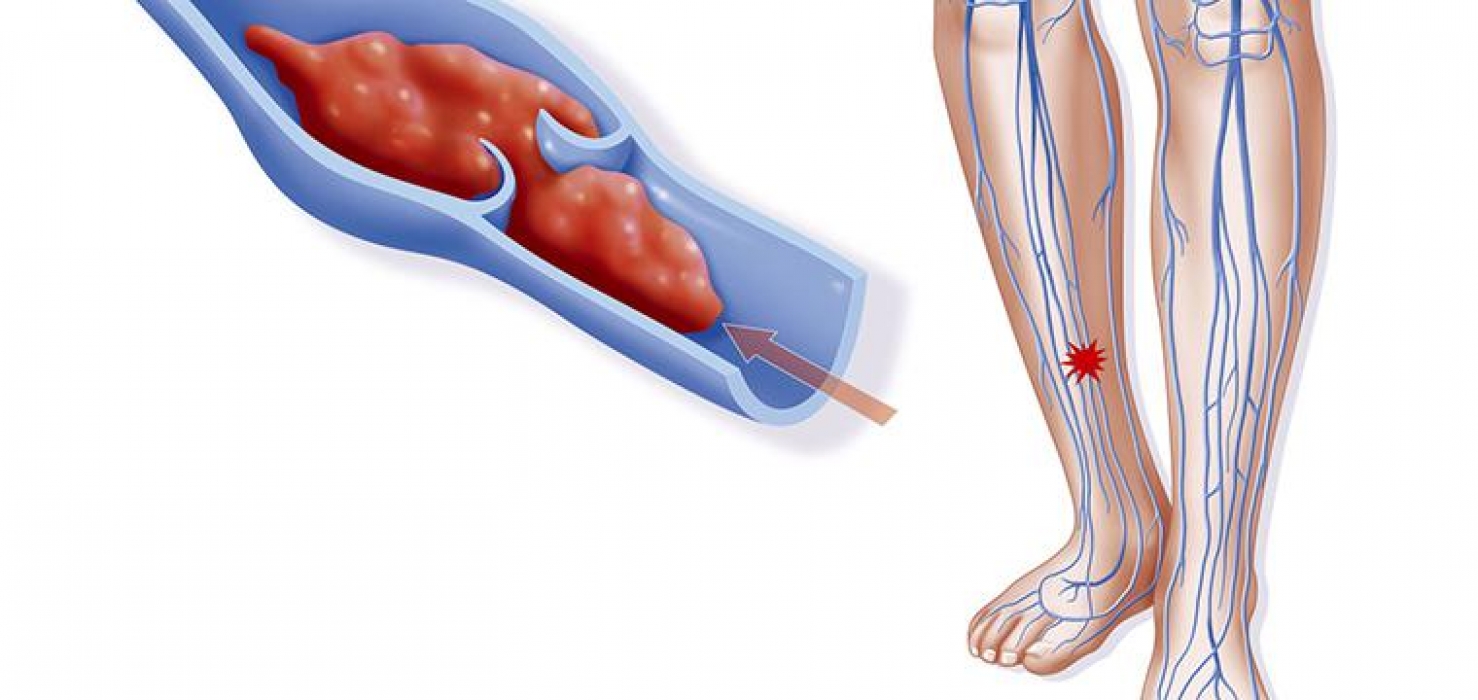
Удаление ствола малой подкожной вены может быть выполнено с использованием тех же средств, что применяют для удаления БПВ. Все операции выполняются через разрез в подколенной области после приустьевой перевязки МПВ.
Ликвидация перфорантного сброса
Несостоятельность клапанов перфорантных вен вносит значительный вклад в развитие и прогрессирование варикозной болезни и встречается у 12-75% пациентов, причем частота ее выявления прямо пропорциональна выраженности трофических расстройств (практически у всех больных с трофическими язвами обнаруживаются несостоятельные перфоранты в зоне язвы). Существует два основных метода ликвидации перфорантного сброса: эпифасциальная и субфасциальная перевязка перфорантов. Градацией является собственная фасция голени или бедра, которая не рассекается в первом случае и рассекается во втором (собственная фасция — выраженное соединительнотканное образование, образующее футляр для всех мышц нижней конечности).
Эпифасциальная перевязка перфорантов (надфасциальная — т.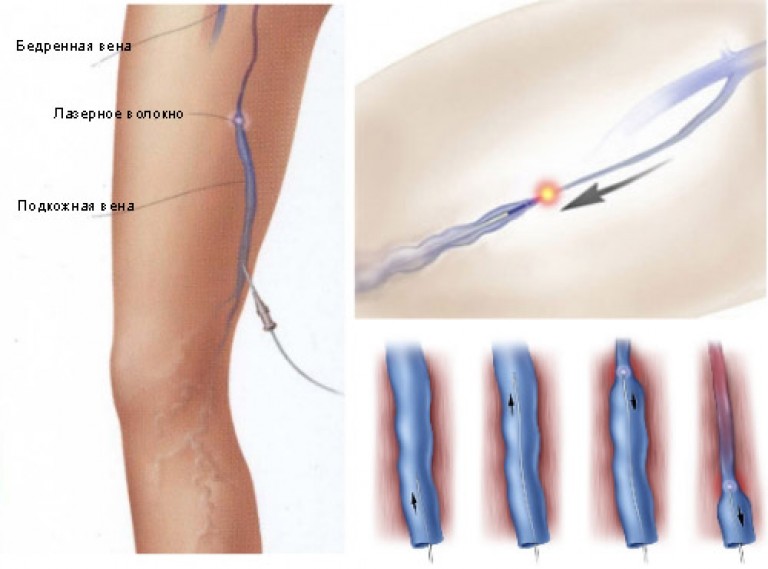 е. над собственной фасцией) показана при отсутствии выраженных трофических расстройств и может быть выполнена из мини-доступа (минифлебэктомия) или из небольшого разреза (по Коккету). Перфорантные вены небольшого диаметра (до 5 мм) могут быть удачно разобщены с системой подкожных вен через миниатюрные проколы размером до 1 мм при использовании специального набора инструментов (минифлебэктомия — см. далее), при этом наложение швов не требуется и рубцов не остается. Крупные перфоранты (диаметром более 5 мм) требуют полноценного разреза длиной 1-2 см с последующим наложением швов (перевязка по Коккету). Главным условием удачной ликвидации перфорантного сброса является тщательная маркировка всех несостоятельных вен при ультразвуковом ангиосканировании непосредственно перед операцией. Это также позволяет улучшить косметические результаты, так как разрез проводится точно в зоне локализации неполноценной вены.
е. над собственной фасцией) показана при отсутствии выраженных трофических расстройств и может быть выполнена из мини-доступа (минифлебэктомия) или из небольшого разреза (по Коккету). Перфорантные вены небольшого диаметра (до 5 мм) могут быть удачно разобщены с системой подкожных вен через миниатюрные проколы размером до 1 мм при использовании специального набора инструментов (минифлебэктомия — см. далее), при этом наложение швов не требуется и рубцов не остается. Крупные перфоранты (диаметром более 5 мм) требуют полноценного разреза длиной 1-2 см с последующим наложением швов (перевязка по Коккету). Главным условием удачной ликвидации перфорантного сброса является тщательная маркировка всех несостоятельных вен при ультразвуковом ангиосканировании непосредственно перед операцией. Это также позволяет улучшить косметические результаты, так как разрез проводится точно в зоне локализации неполноценной вены.
Субфасциальная перевязка перфорантов (подфасциальная — т.е. под собственной фасцией) показана при наличии трофических расстройств (липодерматосклероз, индуративный целлюлит, трофическая язва), так как в подобных случаях разрезы кожи и манипуляции в зоне трофических нарушений сопровождаются риском развития послеоперационных осложнений (плохое заживление раны, некрозы, нагноения). Субфасциальная перевязка может осуществляться открытым способом (по Линтону, по Фельдеру в модификации Савельева-Константиновой) либо эндоскопическим способом.
Открытая перевязка является весьма травматичным вмешательством, т.к. подразумевает разрез длиной до 20-30 см по внутренней (операция Линтона — на сегодняшний день не применяется) или задней (операция Фельдера-Савельева-Константиновой) поверхности голени. При этом рассекается кожа, подкожная клетчатка и собственная фасция, которая тупым и острым путем широко отслаивается от подлежащих мышц, под ней обнаруживают несостоятельные перфоранты, которые на зажимах пересекают и перевязывают. Швы после операции снимают на 7-10 сутки. Такой вид вмешательства сопровождается достаточно высоким риском развития осложнений (гематомы, инфильтраты, нагноения и некрозы, лимфоистечение) и не может быть применен при открытой трофической язве.
Эндоскопическая диссекция перфорантов является универсальной методикой, позволяющей ликвидировать перфорантный сброс при минимальной травме тканей, манипулируя при этом вне зоны трофических расстройств. Для эндоскопической диссекции требуется специальное оборудование — эндоскоп с набором эндоскопических инструментов. Разрез при подобном вмешательстве проводится выше зоны трофических нарушений и имеет длину 2-3 см. Через него под собственную фасцию голени вводится видеоэндоскоп (тонкий металлический тубус с источником света и камерой на конце, имеющий канал для введения инструментов), позволяющий хирургу глазом увидеть все перфорантные вены, оценить их расположение и анатомию. Небольшие перфоранты коагулируются (прижигаются) с использованием биполярного коагулятора, на широкие перфоранты накладывают металлическую скобу (клипируют) и пересекают. На рану накладывают швы, которые снимают на 6-7-е сутки. Эндоскопическую диссекцию рекомендуется применять во всех случаях выявления перфорантного рефлюкса на фоне трофических расстройств, особенно при наличии открытой трофической язвы и мультиперфорантного сброса (обнаружение 3-х и более несостоятельных перфорантных вен). Частота осложнений после эндоскопического вмешательства на порядок ниже, чем после открытой субфасциальной перевязки.
Устранение варикозного синдрома
Второй задачей оперативного пособия при варикозной болезни является устранение варикозно трансформированных вен — притоков БПВ и МПВ. Это имеет как косметическое (улучшение внешнего вида), так и патогенетическое значение (уменьшение объема венозного русла нижних конечностей, что способствует улучшению венозного оттока, коррекции имеющихся функциональных нарушений и обратному развитию симптомов венозной недостаточности). Для удаления варикозных вен было предложено множество способов.
В некоторых клиниках до сих пор практикуется методика Нарата — удаление вен через небольшие разрезы (1-2 см), осуществляемые через каждые 5-10 см вдоль всей проекции вены. Для этого перед операцией в вертикальном положении тела варикозную вену маркируют трудносмывающимся веществом (бриллиатновая зелень), т.к. в положении лежа большинство варикозных вен спадается. Далее хирург через каждые 5-10 см делает небольшие разрезы, через которые выделяет фрагменты вены, и вена перевязывается и пересекается максимально ближе к другому разрезу. После мобилизации вены со стороны двух разрезов она легко извлекается из клетчатки с помощью прямого зажима. Главным недостатком метода Нарата является наличие большого числа разрезов и низкий косметический результат. На сегодняшний день методика отошла в прошлое в связи с появлением более приемлемых альтернатив.
Минифлебэктомия — удаление варикозно измененных притоков через миниатюрные проколы, не требующие наложения швов и заживающие практически без рубца, с использованием специального набора инструментов. На современном этапе развития флебологии минифлебэктомия является ведущей методикой устранения варикозного синдрома, которая по косметическому эффекту ничуть не уступает своей альтернативе — компрессионной склеротерапии, однако требует меньших материальных и временных затрат (пациент полностью избавляется от заболевания в течение одной операции). При минифлебэктомии предварительно маркированные вены удаляют через маленькие проколы кожи (1-2 мм!), производимые специальным скальпелем. Сначала хирург при помощи шпателя очищает вену от окружающей клетчатки, далее при помощи крючка (диссектора) подцепляет вену и вытягивает через прокол, захватывая ее при этом специальным маленьким зажимом (москит). Далее вена пересекается на зажимах, головной отрезок, выключенный из кровотока предыдущими этапами комбинированной флебэктомии (стриппингом, перевязкой перфорантов), удаляется путем накручивания на зажим, а оставшаяся часть удаляется из следующего прокола. Также методика минифлебэктомии применяется для ликвидации перфорантного сброса при отсутствии трофических расстройств — при перфорантных венах небольшого диаметра достаточно просто удалить подкожные притоки в зоне проекции перфоранта, чтобы выключить его из кровообращения и вызвать последующую облитерацию.
Состояние проксимальной части тромба при варикофлебите большой подкожной вены
ЖУРНАЛ «АНГИОЛОГИЯ И СОСУДИСТАЯ ХИРУРГИЯ» •
2014 • ТОМ 20 • №4
Цуканов Ю.Т., Цуканов А.Ю., Николайчук А.И.
Кафедра хирургических болезней и урологии ПДО, Омская государственная медицинская академия, Омск, Россия.
Цель. Оценка состояния проксимальной части тромба БПВ у больных с варикофлебитом при дуплексном сканировании вен.
Материал и методы. Обследовано 40 больных с острым варикофлебитом БПВ: мужчин – 11 (27,5%), женщин – 29 (72,5%) в возрасте 29–78 лет (в среднем – 53,5 лет). При ДС вен определяли: локализацию и распространенность тромбоза; наличие свободной части; плотность и конфигурацию контура проксимальной части тромба; проксимальный уровень воспаленной стенки вены и воспаленной паравазальной клетчатки.
Результаты и обсуждение. На голени воспаление клинически локализовалось у 12 (30%) человек, на бедре – у 10 (25%), на голени и бедре – у 18 (45%) пациентов. По данным ДС, из 28 (70%) человек с воспалением на бедре у 9 (22,5%) пациентов верхний край тромба находился в нижней трети бедра, у 11 (27,5%) – в средней трети, у 8 (20%) – в верхней трети. У 29 (72,5%) больных тромб не имел свободной части, у 11 (27,5%) – выявлена флотирующая часть протяженностью 1,0–10 см (в среднем 3,58 см). Частота флотирующих тромбов определяется диаметром тромбированного сосуда: при бедренной локализации флотирующая часть была у 9 (22,5%) пациентов, при берцовой – у 2 (5%). Отчетливый край проксимального контура имелся у 30 (75%) больных, нечеткий, размытый контур – у 10 (25%). У 8 (20%) человек проксимальная часть тромба по плотности не отличалась от его тела. У 3 (7,5%) больных она приближалась к плотности крови. В большинстве случаев (60%) проксимальная часть носила ячеистый характер с чередованием участков различной плотности. Толщина измененной паравазальной клетчатки составила 7–20 мм (в среднем 8,68 мм). Граница тромба у 36 (90%) пациентов располагалась проксимальнее воспаления стенки и паравазальной клетчатки на 4,0–60,0 см (в среднем 6,0 см). Это демонстрирует, что клинические симптомы вызывают флебит и паравазальный целлюлит.
Заключение. Детализация проксимальной части тромба у больных с варикофлебитом БПВ при ДС позволяет точно оценивать его состояние: оценка плотности и конфигурации более детально характеризуют степень зрелости проксимальной части тромба. Плотность тромба, сопоставимая с плотностью жидкой крови, в сочетании с продолженной свободной его частью может делать риск миграции тромба высоким.
КЛЮЧЕВЫЕ СЛОВА: тромбоз большой подкожной вены, варикофлебит, варикозная болезнь вен, дуплексное сканирование вен, проксимальная часть тромба.
Стр. 54-61
« Назад
Тромбофлебиты поверхностных вен: диагностика и лечение
Данный вид патологии является весьма распространенным заболеванием венозной системы, с которым сталкивается врач любой специальности.
В настоящее время в медицинской практике также часто пользуются такими терминами, как флеботромбоз и варикотромбофлебит. Все они правомерны для использования, но при этом следует учитывать следующие моменты. Флеботромбоз рассматривается, как остро возникшая непроходимость вены в результате гиперкоагуляции, которая является ведущим механизмом. Но при этом через 5–10 дней возникший тромб вызывает реактивное воспаление окружающих вену тканей с развитием флебита, то есть происходит трансформация флеботромброза в тромбофлебит.
Термин «варикотромбофлебит» четко указывает фактически на исходную причину тромбоза, возникающего на фоне уже имевшегося у больного варикозного расширения вен.
Перечисленная выше патология венозной системы в подавляющем числе клинических случаев встречается в системе большой и значительно реже – в системе малой подкожной вены.
Тромбофлебиты вен на верхних конечностях встречаются крайне редко, и в основном провоцирующими факторами их возникновения являются многократные пункции для введения лекарственных средств или длительное нахождение катетера в поверхностной вене.
Особо следует обратить внимание на пациентов со спонтанно возникающими тромбами на верхних и нижних конечностях, не связанных с ятрогенным воздействием. В подобных случаях явления тромбофлебита можно заподозрить, как проявление паранеопластической реакции, обусловленной наличием у пациента онкологической патологии, требующей проведения углубленного многопланового обследования.
Тромбообразование в системе поверхностных вен провоцируют те же факторы, которые вызывают тромбоз глубокой венозной системы нижних конечностей. К ним относятся: возраст старше 40 лет, наличие варикознорасширенных вен, онкозаболевания, тяжелые расстройства сердечно–сосудистой системы (сердечная декомпенсация, окклюзии магистральных артерий), гиподинамия после тяжелых операций, явления гемипареза, гемиплегия, ожирение, обезвоживание, банальные инфекции и сепсис, беременность и роды, прием пероральных противозачаточных препаратов, травма конечностей и оперативные вмешательства в зоне прохождения венозных стволов.
Тромбофлебит может развиться в любом отделе поверхностной венозной системы, с наиболее частой локализацией на голени в верхней или средней трети, а также нижней трети бедра. Подавляющее число случаев тромбофлебита (до 95–97%) отмечено в бассейне большой подкожной вены (Кабиров А.В. с соавт., Клецкин А.Э. с соавт., 2003 г.).
Дальнейшее развитие тромбофлебита фактически может идти в двух вариантах:
1. Относительно благоприятное течение заболевания, на фоне проводимого лечения происходит стабилизация процесса, тромбообразование прекращается, явления воспаления стихают и начинается процесс организации тромба с последующей реканализацией соответствующего отдела венозной системы. Но это нельзя считать излечением, т.к. всегда происходит повреждение исходно измененного клапанного аппарата, что в дальнейшем усугубляет клиническую картину хронической венозной недостаточности.
Также возможны клинические случаи, когда фиброзноизмененный тромб плотно облитерирует вену и ее реканализация становится невозможной.
2. Наиболее неблагоприятный и опасный вариант в плане развития осложнений местного характера – восходящий тромбоз по ходу большой подкожной вены до овальной ямки или переход тромботического процесса через вены–коммуниканты на глубокую венозную систему голени и бедра.
Главной опасностью течения заболевания по второму варианту является угроза развития такого осложнения, как эмболия легочной артерии (ТЭЛА), источником которой может быть флотирующий тромб из системы малой или большой подкожной вены, а также вторично возникший тромбоз глубоких вен нижних конечностей.
Судить о частоте тромбофлебита среди населения достаточно сложно, но если принять за основу положение, что среди госпитализированных в хирургические отделения больных с данной патологией более 50% имели варикозное расширение вен, то с учетом миллионов больных с данной патологией в стране эта цифра выглядит весьма впечатляюще и проблема приобретает большое медико–социальное значение.
Возраст пациентов колеблется от 17 до 86 лет и даже старше, а средний возраст составляет 40–46 лет, то есть трудоспособный контингент населения.
Учитывая тот факт, что при тромбофлебите поверхностных вен общее состояние пациента и самочувствие, как правило, не страдают и остаются вполне удовлетворительными, то это создает у больного и его родственников иллюзию относительного благополучия и возможности разнообразных методов самолечения.
В результате такое поведение больного приводит к поздней обращаемости для оказания квалифицированной медицинской помощи, и часто хирург сталкивается уже с осложненными формами этой «простой» патологии, когда имеет место высокий восходящий тромбофлебит или тромбоз глубоких вен конечности.
Клиническая картина
Клиническая картина заболевания носит достаточно типичный характер в виде локальной болезненности в проекции подкожных вен на уровне голени и бедра с вовлечением в процесс тканей, окружающих вену, вплоть до развития резкой гиперемии этой зоны, наличия уплотнений не только вены, но и подкожной клетчатки. Чем протяженнее зона тромбоза, тем более выражены болевые ощущения в конечности, что вынуждает пациента ограничить ее движение. Возможны гипертермические реакции в виде озноба и повышение температуры до 38–39°С.
Довольно часто провоцирующим моментом для возникновения тромбофлебита становится даже банальное острое респираторное заболевание, особенно у пациентов, имеющих варикозное расширение вен нижних конечностей.
Осмотр производится всегда с двух сторон – от стопы до паховой зоны. Обращается внимание на наличие или отсутствие патологии венозной системы, характер изменения окраски кожных покровов, локальную гиперемию и гипертермию, отечность конечности. Выраженная гиперемия типична для первых дней заболевания, она постепенно уменьшается к концу первой недели.
При локализации тромбофлебита в малой подкожной вене, местные проявления выражены в меньшей степени, чем при поражении ствола большой подкожной вены, что обусловлено особенностями анатомии. Поверхностный листок собственной фасции голени, покрывающий вену, препятствует переходу воспалительного процесса на окружающие ткани. Самым важным моментом является выяснение срока появления первых симптомов заболевания, быстроты их нарастания и предпринимались ли пациентом попытки медикаментозного воздействия на процесс.
Так, по данным А.С. Котельникова с соавт. (2003 г.), нарастание тромба в системе большой подкожной вены идет до 15 см в сутки. Важно помнить о том, что почти у трети больных с восходящим тромбозом большой подкожной вены истинная верхняя граница его расположена на 15–20 см выше уровня, определяемого по клиническим признакам (В.С. Савельев, 2001 г.), то есть этот факт должен учитывать каждый хирург, консультируя больного с тромбофлебитом вены на уровне бедра, чтобы не произошла неоправданная задержка операции, направленной на предотвращение ТЭЛА.
Также следует признать нецелесообразным локальное введение анестетиков и антивоспалительных средств в зону тромбированной вены на бедре, так как, купируя боль, это не предотвращает нарастание тромба в проксимальном направлении. Клинически эту ситуацию контролировать становится трудно, а дуплексное сканирование реально пока может использоваться только в очень крупных лечебных учреждениях.
Дифференциальный диагноз следует проводить с рожистым воспалением, лимфангиитом, дерматитами различной этиологии, узловой эритемой.
Инструментальная и лабораторная диагностика
Очень длительное время диагноз тромбофлебит поверхностных вен ставился врачом на основании только клинических симптомов заболевания, так как фактически отсутствовали неинвазивные методы характеристики венозного кровотока. Внедрение в практику ультразвуковых методов диагностики открыло новый этап изучения данной распространенной патологии. Но клиницист обязан знать, что среди ультразвуковых методов диагностики венозного тромбоза определяющая роль отводится дуплексному сканированию, так как только с его помощью можно определить четкую границу тромбоза, степень организации тромба, проходимость глубоких вен, состояние коммуникантов и клапанного аппарата венозной системы. К сожалению, высокая стоимость этой аппаратуры пока резко ограничивает ее практическое использование в поликлинических и стационарных условиях.
Данное исследование показано в первую очередь больным с подозрением на эмбологенный тромбоз, то есть когда имеется переход тромба из поверхностной венозной системы в глубокую через сафено–феморальное или сафено–поплитеальное соустье.
Исследование может проводиться в нескольких проекциях, что значительно повышает его диагностическую ценность.
Флебографическое исследование
Показание к нему резко сужено. Необходимость его выполнения возникает лишь в случае распространения тромба из большой подкожной вены на общую бедренную и подвздошную вену. Причем данное исследование производится только в тех случаях, когда результаты дуплексного сканирования сомнительны и затруднена их трактовка.
Лабораторные методы диагностики
В обычном клиническом анализе крови обращается внимание на уровень лейкоцитоза и уровень СОЭ.
Желательно исследование С–реактивного белка, коагулограммы, тромбэластограммы, уровня протромбинового индекса и других показателей, характеризующих состояние свертывающей системы. Но объем этих исследований порой ограничивается возможностями лабораторной службы медицинского учреждения.
Лечение
Одним из важных моментов, определяющих исход заболевания и даже судьбу больного, является выбор тактики оптимального варианта лечения больного.
При локализации тромбофлебита на уровне голени больной может проходить лечение амбулаторно, находясь под постоянным контролем хирурга. В этих условиях необходимо объяснить больному и его родственникам, что в случае появления признаков распространения тромбоза на уровень бедра может потребоваться госпитализация больного в хирургический стационар. Задержка госпитализации чревата развитием осложнений, вплоть до возникновения ТЭЛА.
В тех случаях, когда тромбофлебит на уровне голени, леченный в течение 10–14 дней, не поддается регрессу, также должен стоять вопрос о госпитализации и более интенсивной терапии заболевания.
Одним из главных вопросов в лечении больных тромбофлебитом поверхностных вен является обсуждение необходимости соблюдения пациентом строгого постельного режима.
В настоящее время признанным фактом является то, что строгий постельный режим показан только больным, у которых уже были клинические признаки ТЭЛА или есть четкие клинические данные и результаты инструментального исследования указывают на эмбологенный характер тромбоза.
Двигательная активность больного должна быть ограничена только выраженной физической нагрузкой (бег, подъем тяжестей, выполнение какой–либо работы, требующей значительного мышечного напряжения конечностей и брюшного пресса).
Общие принципы лечения тромбофлебита поверхностных вен
Эти принципы являются действительно общими как для консервативного, так и оперативного лечения данной патологии. Главными задачами лечения этих пациентов являются:
· Максимально быстро воздействовать на очаг тромбоза и воспаления для предотвращения дальнейшего его распространения.
· Попытаться предупредить переход тромботического процесса на глубокую венозную систему, что значительно повышает риск развития ТЭЛА.
· Лечение должно являться надежным методом профилактики повторных тромбозов венозной системы.
· Методика лечения не должна быть строго фиксированной, так как она определяется в первую очередь характером происходящих изменений на конечности в ту или иную сторону. То есть вполне логичным является переход или дополнение одного метода лечения другим.
Безусловно, консервативное лечение показано абсолютному большинству больных с «низкими» поверхностными тромбофлебитами подкожных вен.
Еще раз следует подчеркнуть, что разумная двигательная активность больного улучшает функцию мышечной помпы, главной определяющей в обеспечении венозного оттока в системе нижней полой вены.
Применение наружной компрессии (эластический бинт, гольфы, колготки) в острой фазе воспаления могут вызвать определенный дискомфорт, поэтому этот вопрос должен решаться строго индивидуально.
Достаточно спорным является вопрос о применении антибиотиков у данной категории больных. Врач должен помнить о возможных осложнениях данной терапии (аллергические реакции, непереносимость, провокация гиперкоагуляции крови). Также далеко не однозначно решается вопрос о целесообразности использования антикоагулянтов (особенно прямого действия) у этого контингента больных.
Врач обязан помнить, что применение гепарина уже через 3–5 дней может вызвать у пациента тромбоцитопению, а уменьшение количества тромбоцитов более чем на 30% требует прекращения терапии гепарином. То есть возникают трудности контроля за гемостазом, особенно в амбулаторных условиях. Поэтому более целесообразным является использование низкомолекулярных гепаринов (далтепарин, надропарин, эноксапарин), так как они крайне редко вызывают развитие тромбоцитопении и не требуют такого тщательного контроля за свертывающей системой. Положительным является тот факт, что эти препараты можно вводить больному 1 раз в сутки. На курс лечения достаточно 10 инъекций, а затем больной переводится на антикоагулянты непрямого действия.
В последние годы для лечения этих больных появились мазевые формы гепарина (лиотон–гель, Гепатромбин). Главным их достоинством являются достаточно высокие дозы гепарина, которые подводятся непосредственно к очагу тромбоза и воспаления.
Особо следует отметить целенаправленное действие на зону тромбофлебитических изменений препарата Гепатромбин («Хемофарм»–Югославия), выпускаемого в виде мази и геля.
В отличие от лиотона он содержит в 2 раза меньше гепарина, но дополнительные компоненты – аллантоин и декспантенол, входящие в состав мази и геля «Гепатромбин», а также эфирные масла сосны, входящие в состав геля, оказывают выраженное противовоспалительное действие, уменьшают явления кожного зуда и локальной боли в зоне тромбофлебита. То есть способствуют купированию основных симптомов тромбофлебита. Препарат Гепатромбин обладает сильным антитромботическим действием.
Местно его применяют, нанося слой мази на пораженные участки 1–3 раза в день. При наличии язвенной поверхности мазь наносится в виде кольца шириной до 4 см по периметру язвы. Хорошая переносимость препарата и многоплановость воздействия его на патологический очаг ставит данное лекарство на первый план в лечении больных тромбофлебитом как в амбулаторных условиях, так и при лечении в стационарах. Гепатромбин может применяться в комплексе консервативного лечения или как средство, направленное на купирование воспаления венозных узлов, после выполненной операции Троянова–Тренделенбурга, как метод подготовки ко второму этапу операции.
В комплекс консервативного лечения больных должны входить нестероидные противовоспалительные препараты, также обладающие обезболивающим действием. Но клиницист должен помнить о соблюдении крайней осторожности при назначении этих средств пациентам, имеющим заболевания желудочно–кишечного тракта (гастриты, язвенная болезнь) и почек.
Хорошо зарекомендовали себя в лечении данной патологии уже хорошо известные врачам и пациентам флеботоники (рутозид, троксерутин, диосмин, гингко–билоба и другие) и дезагреганты (ацетилсалициловая кислота, пентоксифиллин). В тяжелых случаях при обширных флебитах показаны внутривенные трансфузии реополиглюкина по 400–800 мл в/в от 3 до 7 дней с учетом кардиального статуса больного из–за опасности гиперволемии и угрозы развития отека легких.
Системная энзимотерапия на практике имеет ограниченное применение ввиду высокой стоимости препарата и очень длительного курса лечения (от 3 до 6 месяцев).
Хирургическое лечение
Основным показанием к оперативному лечению тромбофлебита, как уже ранее указывалось, является нарастание тромба по ходу большой подкожной вены выше средней трети бедра или наличие тромба в просвете общей бедренной или наружной повздошной вены, что подтверждено флебографически или дуплексным сканированием. К счастью, последнее осложнение встречается не так часто, всего лишь у 5% больных с восходящим тромбофлебитом (И.И. Затевахин с соавт., 2003 г.). Хотя отдельные сообщения свидетельствуют о значительной частоте данного осложнения, достигающего даже 17% у этого контингента больных (Н.Г. Хорев с соавт., 2003 г.).
Методы анестезии – возможны разные варианты: местная, проводниковая, перидуральная анестезия, внутривенный, интубационный наркоз.
Определенное значение имеет положение больного на операционном столе – ножной конец стола должен быть опущен.
Общепризнанной операцией при восходящем тромбофлебите большой подкожной вены является операция Троянова–Тренделенбурга.
Хирургический доступ, применяемый большинством хирургов, является довольно типичным – косой разрез ниже паховой складки по Червякову или самой паховой складке. Но при этом важно учитывать главный клинический момент: если есть инструментальные данные или клинические признаки перехода тромба в просвет общей бедренной вены, то более целесообразно применить вертикальный разрез, обеспечивающий контроль за тромбированной большой подкожной веной и стволом общей бедренной вены, когда требуется порой ее пережатие на момент тромбэктомии.
Некоторые технические особенности операции:
1. Обязательное выделение, пересечение и перевязка ствола большой подкожной вены в области ее устья.
2. При вскрытии просвета большой подкожной вены и обнаружении в ней тромба, выходящего за уровень остиального клапана, больной должен сделать задержку дыхания на высоте вдоха при операции под местной анестезией (или это делает анестезиолог при других видах наркоза).
3. Если тромб «не рождается самостоятельно», то через сафено–феморальное соустье осторожно вводят балонный катетер на высоте вдоха и выполняется тромбэктомия. Проверяется ретроградный кровоток из подвздошной вены и антеградный из поверхностной бедренной вены.
4. Культя большой подкожной вены обязательно прошивается и перевязывается, она должна быть короткой, так как слишком длинная культя – «инкубатор» для возникновения тромбоза, что создает угрозу развития ТЭЛА.
В порядке обсуждения вариантов этой рутинной операции следует обратить внимание на то, что некоторые хирурги предлагают при операции Троянова–Тренделенбурга выполнять тромбэктомию из большой подкожной вены, а затем вводить в нее склерозант. Целесообразность такой манипуляции вызывает сомнение.
Второй этап операции – удаление тромбированных варикозных узлов и стволов производится по индивидуальным показаниям в сроки от 5–6 дней до 2–3 месяцев по мере купирования локального воспаления, во избежание нагноения ран в послеоперационном периоде, особенно при трофических расстройствах кожи.
При выполнении второго этапа операции хирург обязательно должен выполнить перевязку перфорантных вен после предварительной тромбэктомии, что улучшает процессы заживления.
Все конгломераты варикозных узлов подлежат удалению во избежание развития в дальнейшем грубых трофических расстройств.
Оперативным лечением данного контингента больных занимается очень широкий круг хирургов общего профиля и ангиохиругов. Кажущаяся простота лечения порой приводит к тактическим и техническим ошибкам. Поэтому данная тематика практически постоянно присутствует на научных конференциях.
Литература:
1. Затевахин И.И. с соавторами. «Ангиология и сосудистая хирургия» №3 (приложение) 2003 г, стр. 111–113.
2. Кабиров А.В. с соавторами. «Ангиология и сосудистая хирургия» №3 приложение 2003, стр. 127–128.
3. Клецкин А.Е. с соавторами. «Ангиология и сосудистая хирургия» №3 (приложение) 2003 г, стр. 161–162.
4. Котельников А.С. с соавторами. «Ангиология и сосудистая хирургия» №3 (приложение) 2003 г, стр. 168–169.
5. Ревской А.К. «Острый тромбофлебит нижних конечностей» М.Медицина 1976 г.
6. Савельев В.С. «Флебология» 2001 г.
7. Хорев Н.Г. «Ангиология и сосудистая хирургия» №3 (приложение) 2003 г, стр. 332–334.
Рецидивирующий тромбоз митрального клапана биопротеза, леченный антикоагулянтами
Отчеты о случаях
. 2020 декабрь; 37 (12): 2134-2138. DOI: 10.1111 / echo.14909. Epub 2020 27 октября.Принадлежности Расширять
Принадлежности
- 1 Департамент медицины, отделение кардиологии, Медицинский центр по делам ветеранов, Вест-Роксбери, Массачусетс, США.
- 2 Отделение медицины, Отделение кардиологии, Сердечно-сосудистый центр Бригама и Женской больницы, Бостон, Массачусетс, США.
- 3 Гарвардская медицинская школа, Бостон, Массачусетс, США.
Элемент в буфере обмена
Отчеты о случаях
Робин Фернандес и др.Эхокардиография. 2020 декабрь
Показать детали Показать вариантыПоказать варианты
Формат АннотацияPubMedPMID
.2020 декабрь; 37 (12): 2134-2138. DOI: 10.1111 / echo.14909. Epub 2020 27 октября.Принадлежности
- 1 Департамент медицины, отделение кардиологии, Медицинский центр по делам ветеранов, Вест-Роксбери, Массачусетс, США.
- 2 Отделение медицины, Отделение кардиологии, Сердечно-сосудистый центр Бригама и Женской больницы, Бостон, Массачусетс, США.
- 3 Гарвардская медицинская школа, Бостон, Массачусетс, США.
Элемент в буфере обмена
Полнотекстовые ссылки Опции CiteDisplayПоказать варианты
Формат АннотацияPubMedPMID
Абстрактный
Тромбоз биопротезного клапана (ДПЖК) встречается чаще, чем считалось ранее, и, вероятно, о нем не сообщается.BPVT можно точно диагностировать с помощью визуализации сердца и успешно лечить антикоагулянтами, что предотвращает повторную операцию. Настоящим мы сообщаем о случае рецидива BPVT в митральном положении, успешно вылеченном антикоагулянтами, вместе с обзором литературы.
Ключевые слова: антикоагулянтная терапия; дисфункция биопротезного клапана; тромбоз биопротезного клапана.
© 2020 Wiley Periodicals LLC.
Похожие статьи
-
Тяжелый стеноз биопротезного клапана из-за позднего тромбоза клапана.
Хегде С., Рахбан Й., Агнихотри А., Майский М. Hegde S, et al. J Card Surg. 2020 ноя; 35 (11): 3150-3152. DOI: 10.1111 / jocs.14973. Epub 2020 16 сен. J Card Surg. 2020. PMID: 32939834
-
Рецидивирующий тромбоз клапана биопротеза — следует ли рассматривать длительную антикоагулянтную терапию?
Йонг М.С., Грант Р., Саксена П., Ядав С.Yong MS, et al. Heart Lung Circ. 2018 июн; 27 (6): e70-e72. DOI: 10.1016 / j.hlc.2017.11.013. Epub 2017 11 декабря. Heart Lung Circ. 2018. PMID: 29277547
-
Долгосрочные результаты антикоагуляции при тромбозе биопротезного клапана.
Петреску И., Эгбе А.С., Ионеску Ф., Нкомо В.Т., Гризон К.Л., Пислару С., Пелликка П.А., Коннолли Х.М., Пислару С.В. Петреску I и др.J Am Coll Cardiol. 2020 3 марта; 75 (8): 857-866. DOI: 10.1016 / j.jacc.2019.12.037. J Am Coll Cardiol. 2020. PMID: 32130920
-
Тромболитическая терапия позднего тромбоза биопротеза митрального клапана: атипичные диагностические эхокардиографические особенности и обзор литературы.
Лаксман З., Кейн Г.К., Мерфи Дж. Лаксман З. и др. J Heart Valve Dis.2008 ноя; 17 (6): 670-3. J Heart Valve Dis. 2008 г. PMID: 19137800 Рассмотрение.
-
Субклинический биопротезный тромбоз аортального клапана: клинические и трансляционные последствия.
Янагава Б., Мазине А., Бхатт Д.Л., Клавель М.А., Коте Н., Чима А.Н., Пибарот П., Верма С. Янагава Б. и др. Curr Opin Cardiol. 2017 Март; 32 (2): 137-146. DOI: 10.1097 / HCO.0000000000000373. Curr Opin Cardiol.2017 г. PMID: 28030440 Рассмотрение.
использованная литература
ССЫЛКИ
-
- Пури Р., Аффре В., Родес-Кабау Дж. Тромбоз биопротезного клапана. J Am Coll Cardiol. 2017; 69 (17): 2193-2211.
-
- Эгбе А.С., Пислару С.В., Пелликка П.А. и др.Тромбоз клапана биопротеза против структурной недостаточности: клинические и эхокардиографические предикторы. J Am Coll Cardiol. 2015; 66 (21): 2285-2294.
-
- Нисимура Р.А., Отто С.М., Боноу Р.О. и др. Обновление рекомендаций AHA / ACC от 2014 г. по ведению пациентов с клапанной болезнью сердца, сфокусированное на 2017 г.J Am Coll Cardiol. 2017; 70 (2): 252-289.
-
- Баумгартнер Х., Фальк В., Бакс Дж. Дж. И др. Руководство ESC / EACTS по ведению пороков сердца, 2017 г. Eur Heart J. 2017; 38 (36): 2739-2791.
-
- Бутнару А., Шахин Дж., Цивони Д. и др. Диагностика и лечение раннего сбоя биопротеза в положении митрального клапана из-за тромбообразования.Am J Cardiol. 2013; 112 (9): 1439-1444.
Показать все 10 ссылок
Типы публикаций
- Научно-исследовательская поддержка, N.I.H., заочная форма
Условия MeSH
- Антикоагулянты / терапевтическое применение
- Биопротез * / побочные эффекты
- Протез клапана сердца * / побочные эффекты
- Митральный клапан / диагностическая визуализация
- Тромбоз * / диагностическая визуализация
- Тромбоз * / медикаментозная терапия
цитировать
КопироватьФормат: AMA APA ГНД NLM
Тромбоз биопротезного клапана — ScienceDirect
https: // doi.org / 10.1016 / j.jacc.2017.02.051Получить права и содержаниеРеферат
Тромбоз биопротезного клапана (BPV) считается относительно редким клиническим заболеванием. Тем не менее, более недавний анализ, включающий более систематическое последующее эхокардиографическое наблюдение, появление технологий транскатетерного сердечного клапана (THV) в сочетании с высокочувствительной природой 4-мерной компьютерной томографии для обнаружения субклинических тромбов как при хирургической имплантации, так и при THVs, привело к огромный интерес к этой области, проливающий новый свет на его истинную распространенность и клиническую значимость.Среди клиницистов продолжаются дебаты относительно клинической значимости субклинического тромбоза BPV и ценности эмпирических пероральных антикоагулянтов после имплантации BPV. Более того, в настоящее время не существует систематических перспективных данных относительно оптимального подхода к лечению у реципиентов THV. Авторы предоставляют обзор клинического и субклинического спектра тромбоза BPV хирургического и THV, описывают его диагностические проблемы, резюмируют его патофизиологическую основу и обсуждают различные терапевтические варианты, которые появляются, особенно в быстро расширяющейся области имплантации THV.
Ключевые слова
4-х мерная компьютерная томография
протез клапана сердца
хирургическое протезирование аортального клапана
тромбоэмболия
тромболитическая терапия
транскатетерная замена аортального клапана активирована
Активированное протезирование аортального клапана
Сокращения биопротезирования
клоскопирование Биопротез0003 тромбоз клапана
DAPTдвойная антитромбоцитарная терапия
HALTутолщение гипоаттенуированной створки
NOACновый пероральный антикоагулянт
PPMнесоответствие между протезом и пациентом
SAVRхирургическая замена аортального клапана 9000EEcphater
TAVRтранскрипция клапана
транскатетерный клапан сердца
TTEтрансторакальная эхокардиография
Рекомендуемые статьи Цитирующие статьи (0)
© 2017 Фонд Американского колледжа кардиологов.Опубликовано Elsevier.
Рекомендуемые статьи
Цитирующие статьи
Реферат 12262: Клинические и эхокардиографические предикторы тромбоза биопротезного клапана
Предпосылки: Тромбоз биопротезного клапана (ДПЖК) считается редкостью; это может быть связано с тем, что его часто не распознают. Нашей целью было определить клинические характеристики BPVT и сформулировать диагностическую модель BPVT.
Методы: Пациенты, которым требуется повторное хирургическое вмешательство после первоначальной имплантации биопротезного клапана (BPV), были идентифицированы по базе данных патологии Mayo Clinic.Случаи BPVT были сопоставлены 2: 1 с дегенерированным, нетромбированным BPV. Многомерная линейная логистическая регрессия и рабочая характеристика приемника были использованы для формулировки диагностической модели для BPVT.
Результаты: В период с 1997 по 2013 гг. Было выявлено 46 случаев ДПЖТ (возраст = 63 ± 15, мужчины = 68%; аортальный = 29, митральный = 9, трикуспидальный = 7, легочные = 1) и 92 контрольных группы, соответствующие возрасту , пол и положение протеза. BPVT присутствовала в 11,6% из 397 эксплантов и привела к операции значительно раньше, чем дегенерация (медиана 24 против 108 месяцев, соответственно, p <0.001). Тридцать (65%) всех BPVT произошли через 12 месяцев после имплантации. Предикторами ДПЖТ было увеличение на 50% среднего эхо-допплеровского градиента от исходного уровня в течение 5 лет (отношение шансов [OR] 12,7), пароксизмальная фибрилляция предсердий (OR 5,19), субтерапевтическое INR (OR 7,37), увеличение толщины бугров (OR 12,2), и аномальная подвижность бугров (OR: 6,94). Наличие всех 5 диагностических признаков было прогностическим признаком BPVT с чувствительностью 76%, специфичностью 93%, прогностической ценностью 85% и отрицательной прогностической ценностью 89%, AUC = 0.91, P <0,0001.
Заключение: ДПЖТ, требующие повторной операции, встречаются более чем у 10% пациентов, получающих ДПЖ, и могут возникать через несколько лет после операции. Сочетание клинических и эхокардиографических характеристик позволяет надежно диагностировать ДПЖТ. Крайне важно рассмотреть диагноз ДПЖТ до направления на повторную операцию, поскольку терапия АВК может обратить вспять дисфункцию ДПЖ и предотвратить повторную операцию.
Условные обозначения к рисунку: (A) Частота тромбоза BPVT (B) Отсутствие дисфункции BPV (C) Кривая ROC для прогнозирования BPVT
Медицина | Бесплатный полнотекстовый | «Сказка о двух городах»: лечение антикоагулянтами у пациентов с фибрилляцией предсердий и протезами клапанов в эпоху прямых пероральных антикоагулянтов
1.Пролог
В 1859 году Чарльз Диккенс написал «Повесть о двух городах», исторический роман, действие которого происходит в Лондоне и Париже во время Французской революции, переходного периода от монархического древнего режима к новой форме правления. В медицине, сейчас, как и тогда, с внедрением в клиническую практику новых терапевтических возможностей управления антикоагулянтами наступает новая эра, но контрасты все еще присутствуют. Даже в тех областях применения, в которых новые антикоагулянты превосходят старые молекулы (профилактика тромбозов при фибрилляции предсердий и системной тромбоэмболии), ощущение комфорта, создаваемое десятилетиями клинического опыта исторических антикоагулянтов, по-прежнему противоречит потенциальным возможностям. широкое использование новых терапевтических возможностей, поощряемое их благоприятным исходом с точки зрения эффективности и безопасности.
Более того, древний режим пероральных антагонистов витамина К (VKA) все еще доминирует в управлении антикоагулянтами при замене протезного клапана. Тем не менее, некоторые новые данные, похоже, могут способствовать возможной революции в этом контексте.
2. Введение
Протезирование клапана представляет собой исторический и эффективный терапевтический подход для улучшения симптомов и результатов у пациентов с пороком клапанов сердца (VHD) [1]. Однако его эффективность уравновешивается осложнениями, частота и тяжесть которых зависят от типа и положения клапана, а также от других факторов риска, специфичных для пациента.Тромбоэмболические осложнения относятся к числу потенциальных осложнений, связанных с протезированием, особенно на ранних этапах после имплантации клапана [2]. Биологические протезные клапаны, механические протезные клапаны и, в последнее время, транскатетерный биологический протез клапана представляют собой варианты, доступные в случае изначально пораженных или пораженных сердечных клапанов. Решение об использовании одного из этих протезов клапанов зависит от возраста пациента, точного баланса между факторами тромбоэмболии и кровотечения и решения пациента [3].Долгосрочная антикоагулянтная терапия исторически основывалась на пероральных АВК [4]. Эти агенты использовались в течение некоторого времени, за эти десятилетия накопились надежные данные и клинический опыт. По этим причинам, несмотря на многочисленные важные ограничения, врачи по-прежнему уверены в их использовании. Новые пероральные антикоагулянты прямого действия представляют собой селективные агенты, включая прямой тромбин или фактор IIa (дабигатран) и ингибиторы фактора Ха (апиксабан, ривароксабан, эдоксабан). В метаанализе, включая пациентов во всех регистрационных испытаниях, эти агенты продемонстрировали превосходство над варфарином (основным агентом АВК) в профилактике инсульта и системной эмболии при неклапанной фибрилляции предсердий [5,6].DOAC имеют несколько фармакокинетических преимуществ по сравнению с VKA: фиксированная доза, позволяющая избежать необходимости мониторинга лекарств, быстрое начало действия и короткий период полураспада, что ограничивает их действие в течение короткого времени, небольшое взаимодействие с пищей и лекарствами, что делает их использование проще и безопаснее. Эти характеристики делают DOAC привлекательными для VKA при длительной антикоагулянтной терапии пациентов с протезами клапанов. Однако в настоящее время данные, показывающие чистую пользу DOAC в управлении антикоагулянтами протезного клапана, все еще отсутствуют.Недавно в позиционном документе Европейской ассоциации сердечного ритма (EHRA) [7] о антитромботической терапии при фибрилляции предсердий (ФП) была предложена новая категоризация ВБС в зависимости от типа использования пероральных антикоагулянтов. Учитывая, что термины «клапанная» и «неклапанная» ФП как устаревшие, функциональная классификация EHRA (оцениваемый ревматический или искусственный сердечные клапаны) предлагает различие в форме типа 1, которая относится к пациентам с ФП с VHD, нуждающимся в терапии АВК (умеренная — до тяжелого митрального стеноза ревматического происхождения) и формы 2 типа, которая относится к пациентам с ФП с VHD, нуждающимся в терапии VKA или DOAC (регургитация сердечного клапана, стеноз аорты, стеноз трикуспидального клапана, стеноз легочной артерии, стеноз митрального клапана легкой степени, восстановление митрального клапана, вмешательство трансаортального клапана и замена клапана биопротезом).Однако такая категоризация противоречит цели обзора, а именно изучению возможности использования DOAC даже в формах EHRA типа 1, которым эти агенты в настоящее время противопоказаны. : у пожилых людей [8], у онкологических больных [9,10] и в реальной жизни [11,12]. Более того, как в реальных исследованиях [13], так и в основных исследованиях, DOAC показали, что они хорошо переносятся с низкими показателями отмены. Перипроцедурная и длительная антикоагулянтная терапия у пациентов с ФП, подвергающихся интервенционным процедурам, представляет собой одну из важнейших глав, связанных с использованием антикоагулянтов.Многочисленные клинические испытания изучали использование отдельных препаратов в различных сценариях и нашли отражение в недавних совместных согласованных документах различных научных сообществ (антитромботическое лечение при транскатетерной замене или восстановлении клапана [14], чрескожные коронарные вмешательства [15,16], электрофизиологические процедуры [17] и кардиоверсия ФП [18]). Появляются последние данные, анализирующие клинические характеристики DOAC у реальных пациентов, перенесших интервенционные процедуры.Доказано, что DOAC, также в реальных данных, эффективны и безопасны во многих сценариях (например, при электрической кардиоверсии ФП [19], а также в популяции с высоким риском тромбоэмболии и геморрагии [20]), подтверждая данные получены в результате специализированных испытаний. И наоборот, реальные данные о ведении антикоагулянтной терапии у пациентов, перенесших хирургические или чрескожные клапанные вмешательства, все еще отсутствуют.4. Выводы
Что касается всех огромных преобразований, происходящих в истории человечества, всегда существует контраст между силами перемен, которые обещают революционизировать предыдущий статус-кво, и силами реакции, которые противостоят им с уверенностью. накопленные годами.
Революция, обещанная новыми пероральными антикоагулянтами прямого действия в лечении антикоагулянтной терапии у пациентов, перенесших замену клапана, вероятно, останется безрезультатной: несколько клинических испытаний, сравнивающих DOAC с варфарином, показали, что они увеличивают риск общей смертности. тромбоэмболические события и кровотечение у пациентов с MPV. Более того, одно клиническое испытание с одним DOAC не представляет надежных и четких доказательств для отказа от терапевтической стратегии.Кроме того, мы должны учитывать, что не все DOAC одинаковы по эффективности для разных показаний. Таким образом, длительная антикоагулянтная терапия с применением АВК по-прежнему обязательна при замене механического клапана.
Даже после транскатетерной замены аортального клапана DOAC не продемонстрировали преимущества перед варфарином в плане снижения риска тромбоэмболических кровотечений. Однако сопутствующее присутствие как тромбоэмболических, так и геморрагических факторов риска, а также отсутствие надежных данных затрудняют определение наилучшей антитромботической стратегии в этих условиях.
У пациентов с ДПЖ некоторые наблюдения, полученные в результате субанализа данных основных исследований, обнадеживают. Однако из-за отсутствия специальных двойных слепых исследований, посвященных сопоставлению DOAC и VKA с точки зрения эффективности и безопасности, мало доказательств применения DOAC в клинической практике у пациентов с биопротезными клапанами.
Новая вычислительная модель для прогнозирования риска тромбоза в биопротезных транскатетерных аортальных клапанах
Вернуться к программе 2017
Новая вычислительная модель для прогнозирования риска тромбоза в биопротезных транскатетерных аортальных клапанах
Rajat Mittal 1 , Jung Hee Seo 1 , Kourosh Shoele 1 2, Jon Resar.
1 Университет Джона Хопкинса, Балтимор, Мэриленд, США, 2 Госпиталь Джона Хопкинса, Балтимор, Мэриленд, США.
Предпосылки: Транскатетерная замена аортального клапана (TAVR) появилась как альтернатива хирургической замене аортального клапана у пациентов с тяжелым аортальным стенозом, которые в противном случае считаются неоперабельными или подверженными высокому операционному риску. Одним из значительных преимуществ биопротезных клапанов (включая TAV) перед механическими клапанами является гораздо меньшая частота тромбоза клапана.Это связано с тем, что биопротезные клапаны имитируют морфологию естественных клапанов и создают трансклапанные гемодинамики с низким напряжением сдвига, застоя и градиентами давления, которые аналогичны тем, которые соответствуют естественным клапанам. Однако недавние исследования на основе компьютерной томографии показали более высокую, чем ожидалось, частоту уменьшения движения створок (RLM) у нескольких типов биопротезов, включая Portico, Edwards Sapien XT, Sapien 3 и CoreValve. Терапевтическая антикоагуляция решает состояние, предполагая, что основной причиной RLM является тромбоз створки.Тромбоз клапана, вероятно, инициируется специфическими факторами, связанными с имплантацией и последующим функционированием TAVR, и усиливается сопутствующими протромботическими заболеваниями пациента. Однако вышеперечисленные исследования недостаточно эффективны для проведения дифференциального анализа и поэтому не дают представления о возможных причинных механизмах.
Методы: Новый подход к мультифизическому компьютерному моделированию, который объединяет гемодинамику, динамику створок и биохимию коагуляции, используется для исследования влияния позиционирования и ориентации клапана на динамику створок, транскалапанную гемодинамику и тромбообразование.В этом методе динамика BPV и транскалапанная гемодинамика решаются с помощью моделирования взаимодействия потока и структуры (FSI), и они связаны с биохимической моделью тромбоза, которая состоит из каскада коагуляции, активации тромбоцитов и полимеризации фибрина. Моделирование использовалось для оценки влияния ориентации клапана на риск тромбоза. Модели для конкретных пациентов выводятся из данных компьютерной томографии.
Results: Результаты моделирования показывают, что ориентация клапана относительно синусов аорты заметно изменяет время пребывания крови в синусах и, таким образом, влияет на риск тромбоза.
Выводы: Мультифизическая вычислительная модель, разработанная здесь, обеспечивает мощное средство оценки риска тромбоза клапана, связанного с TAV.
Вернуться в программу 2017 года Вариабельность результатов гемодиализного сосудистого доступа на
л.н. — Полный текст
Дисфункция сосудистого доступа при гемодиализе продолжает оставаться основным источником заболеваемости и смертности у пациентов с ТПН1. После публикации рекомендаций по обеспечению качества результатов диализа эндоваскулярные вмешательства постепенно вытеснили хирургические вмешательства в качестве основного метода лечения дисфункционального диализного доступа2.Хотя чрескожная транслюминальная ангиопластика (ЧТА) может обеспечить высокий уровень успеха, рецидивный стеноз и тромбоз обычно неизбежны3, 4. В результате требуются повторные вмешательства, которые ложатся значительным финансовым бременем на систему здравоохранения. Гиперплазия интимы в вене оттока является наиболее частой причиной дисфункции сосудистого доступа5. Тромбоз может развиться вторично по отношению к стенозу оттока вен, но он также может развиваться без анатомических аномалий6.
Тромбоз — наиболее частая причина недостаточности вторичного сосудистого доступа (т.е., нарушение функционирования сосудистого доступа) и связано со стенозом просвета в 60-80% случаев. Однако, поскольку от 20% до 40% случаев тромбоза доступа происходит в отсутствие стеноза, и поскольку не все стенозирующие тромбозы доступа приводят к тромбозу доступа, другие факторы должны способствовать тромбозу доступа.7 Среди других факторов, состояния с низким потоком крови, вторичные по отношению к низкому АД, имеют были предложены для ускорения тромбоза доступа. Эти предполагаемые причины тромбоза доступа имеют интуитивный смысл, но лишь немногие исследования действительно изучали эти факторы систематическим образом.
Связь между артериальным давлением и тромбозом доступа сложна. Этому вопросу посвящено очень мало исследований. В отличие от населения в целом, артериальное давление не связано линейно с неблагоприятными исходами у гемодиализных пациентов. Традиционно высокое кровяное давление является хорошо известным фактором риска гиперплазии и тромбоза интимы. Тем не менее, более низкое АД может также привести к снижению кровотока в доступе, что, как было показано, независимо предсказывает последующий тромбоз доступа.9 В дополнение к статическому компоненту артериального давления, вариабельность артериального давления (BPV) тесно связана с неблагоприятными исходами у пациентов с сосудистым заболеванием или с риском развития сосудистого заболевания, чем « обычное » АД.10 Они могут играть причинную роль в прогрессировании органа. повреждение и запуск сосудистых событий. ДПВ подразделяется на долгосрочное или краткосрочное в зависимости от временного интервала, в течение которого оно рассматривается.11 Долгосрочное ДПЖ обычно измеряется как ДПЖ между посещениями и может рассматриваться с интервалами в дни, недели или месяцы.У диализных пациентов долгосрочное ДПД обычно определяется на основе измерений АД, сделанных в начале лечения гемодиализом (интердиализное ДПЖ). Кратковременное АД обычно измеряется амбулаторным мониторингом АД или в течение определенных кратковременных интервалов. Среди диализных пациентов кратковременное ДПЖ можно рассматривать с точки зрения вариабельности, имевшей место во время лечения гемодиализом (интрадиализное ДПЖ).
4 Известно, что вариабельность АД увеличивается у пациентов с ХПН.12 Среди пациентов, находящихся на гемодиализе, потенциальные причины высокой вариабельности АД, такие как дисфункция барорецепторов, жесткость аорты и вариации внутрисосудистого объема, а также вероятные исходы, такие как церебральные мелкие нарушения. сосудистые заболевания, кровоизлияние в мозг и внезапная сердечная смерть увеличиваются по сравнению с населением в целом.13, 14 Следовательно, повышенная вариабельность АД может служить потенциальным объяснением тромбоза доступа у пациентов, находящихся на гемодиализе. В настоящее время только одно исследование Cheung et al. Сосредоточено на влиянии вариабельности АД. Более низкое САД до и после диализа связано с более высокой частотой тромбоза доступа, что согласуется с предыдущими исследованиями.15, 16 Что еще более важно, интрадиализная гипотензия также является фактором риска тромбоза доступа и может составлять от 20% до 40 % случаев без явных структурных отклонений.16 Тем не менее, большинство тромботических событий доступа не происходило во время сеанса диализа. Осталось неясным, является ли междиализная вариабельность АД также фактором риска тромбоза сосудистого доступа. Ответ на эти вопросы имеет терапевтическое значение, поскольку достижение рекомендованного целевого АД у диализных пациентов может быть связано с более высокими показателями интер- или интрадиализной гипотензии.17 Соответственно, мы стремились изучить влияние интрадиализного BPV, междиализная BPV и внутридиализная гипотензия при тромбозе гемодиализного сосудистого доступа.Мы также стремились оценить детерминанты BPV у гемодиализных пациентов, включая прием лекарств, слабость, жидкостный статус и вегетативную функцию. Также будет оценено влияние вегетативной функции и слабости на исходы сосудистого доступа и сердечно-сосудистых событий.
Том 111, №3, сентябрь 2018 г.
История болезни Silveira et al. Частичный разрыв сосочковой мышцы и ранний тяжелый обструктивный тромбоз биопротезного клапана Arq Bras Cardiol. 2018; 111 (3): 430-433 1.Фигерас Дж., АлькальдеО, Баррабес Дж. А., Серра В., Альгерсуари Дж., Кортаделлас Дж. И др. Изменение показателей госпитальной летальности у 425 пациентов с острым инфарктом миокарда с подъемом сегмента ST и разрывом сердца более 30 лет. Циркуляция. 2008. 118 (25): 2783–9. 2. Баума В., Вейд-ден Хамер И.Дж., Коэн Б.М., Куиджпрс М., Натур Э., Эразмус М.Э. и др. Долгосрочная выживаемость после операции на митральном клапане по поводу разрыва папиллярной мышцы после инфаркта миокарда. J Cardiothorac Surg. 27 января 2015; 10:11. 3. Чарнеки А., Такрар А., Фанг Т., Литвин М., Ахмаде Р., Паско Е. и др.Острая тяжелая митральная регургитация: рассмотрение архитектуры папиллярных мышц. Кардиоваск Ультразвук. 18 января 2008 г .; 6: 5. 4. Соховски Р.А., Чан К.Л., Асках К., Бедард П. Сравнение точности чреспищеводной и трансторакальной эхокардиографии для выявления пролапса митрального клапана с разрывом сухожильных хорд (цепной митральной створки). Am J Cardiol, 1991; 67 (15): 1251-5. 5. Хэвинс Дж., Лик С., Бур П., Арора Х., Ахмад М. Трехмерная чреспищеводная эхокардиография в реальном времени при частичном разрыве заднемедиальной папиллярной мышцы.Эхокардиография. 2013; 30 (6): E179-E81. 6. Кальво Ф. Е., Фигерас Дж., Кортаделлас Дж., Солер Дж. Тяжелая митральная регургитация, осложняющая острый инфаркт миокарда. Клинические и ангиографические различия между пациентами с разрывом сосочковой мышцы и без него. Eur Heart J. 1997; 18 (10): 1606–10. 7. Крист Г., Сиострзонек П., Маурер Г., Баумгартенр Х. Частичный разрыв сосочковой мышцы, осложняющий острый инфаркт миокарда. Диагностика с помощью многоплоскостной трансэзофагеальной эхокардиографии. Eur Heart J. 1995; 16 (11): 1736–8.8. Оливер Дж. М., Галлог П., Гонсалес А., Домингес Ф. Дж., Гамалло С., Меса Дж. М.. Биопротезный тромбоз митрального клапана: клинический профиль, чреспищеводные эхокардиографические особенности и наблюдение после антикоагулянтной терапии. J Am Soc Echocardiogr. 1996. 9 (5): 691–9. 9. Egbe AC, Pislaru SV, Pellikka PA, Poterucha JT, Schaff HV, Malozewski JJ, et al. Тромбоз клапана биопротеза против структурной недостаточности: клинические и эхокардиографические предикторы. J Am Coll Cardiol. 2015; 66 (21): 2285–94. 10. Lengyel M, Fuster V, Keltai M, Roudaut R, Schulte HD, Seward JB, et al.Рекомендации по лечению тромбоза левого протезного клапана: роль тромболитической терапии. Консенсусная конференция по тромбозу протезного клапана. J Am Coll Cardiol. 1997. 30 (6): 1521–6. Сложность ссылок. 8 Его диагностика остается сложной задачей из-за общего отсутствия осведомленности об этом состоянии. Для диагностики полезно сочетание клинических и эхокардиографических характеристик. Конкретные предрасполагающие факторы к BPVT включают низкий сердечный выброс, дилатацию левого предсердия, предшествующие тромбоэмболические события в анамнезе, фибрилляцию предсердий и гиперкоагуляцию.Признаками этого состояния следует считать впервые возникшие симптомы острой сердечной недостаточности, прогрессирующую одышку, новое тромбоэмболическое событие и регресс симптомов сердечной недостаточности с помощью антикоагулянтной терапии. Некоторые эхокардиографические признаки подтверждают диагноз BPVT, например: прямая визуализация тромбоза клапана, как в описанном случае; увеличение среднего градиента на 50% по сравнению с послеоперационной оценкой; увеличенная толщина бугорка (> 2 мм), особенно в нижнем отделе BPV; аномальная подвижность листочков; регресс аномалий BPV с помощью антикоагулянтов, обычно в течение 1–3 месяцев после их начала или уменьшение движения створок при компьютерной томографии сердца.8,9 Оптимальное лечение BPVT остается предметом дискуссий. Стратегия зависит от клинической картины, гемодинамического статуса пациента, наличия обструкции BPV и расположения клапана. Обычные варианты лечения включают хирургическое вмешательство, фибринолиз и антикоагулянтную терапию, но антикоагулянтная терапия в сочетании с хирургическим вмешательством остается основой лечения. 10 Хотя независимость от длительной антикоагуляции является преимуществом замены клапана биопротезом, случаи, подобные описанному нами, подчеркивают важность рассмотрения этого состояния даже у пациентов без значительных факторов риска, у которых симптомы сердечной недостаточности проявляются сразу после замены клапана.После операции пациенты должны быть классифицированы в соответствии с риском, и, возможно, следует рассмотреть возможность длительной антикоагуляции для пациентов с высоким риском, а также периодической эхокардиографической оценки биологических протезов клапанов. В обоих описанных в этом случае осложнениях эхокардиографическая характеристика с помощью 2D / 3D изображений была важна для постановки правильного диагноза и для определения курса лечения. Этот случай иллюстрирует два необычных сердечных механических осложнения, характерных для их ассоциации у одного и того же пациента.Несмотря на различную патофизиологию, оба состояния представляют собой сердечные приступы, требующие повышенного подозрения и точного диагноза. Визуализация сердечно-сосудистой системы является чрезвычайно ценным вспомогательным методом в условиях интенсивной терапии. Точное распознавание частичного разрыва папиллярной мышцы (иногда пропущенный диагноз) и ранний обструктивный тромбоз биопротезного клапана позволили провести быструю и успешную хирургическую коррекцию этих состояний, что значительно повлияло на здоровье и выздоровление пациента.Вклад авторов Концепция и дизайн исследования: Silveira I, Oliveira M; Написание рукописи: Silveira I, Oliveira M, Gomes C; Критический пересмотр рукописи с точки зрения интеллектуального содержания: Gomes C, Cabral S, Luz A, Torres S. Возможный конфликт интересов О потенциальном конфликте интересов, относящемся к этой статье, не сообщалось.
