Перелом костей — Официальный сайт ФГБУЗ КБ №85 ФМБА России
Что такое перелом кости
Перелом кости (Fracturae — лат.) — это нарушение анатомической целостности кости полное или частичное, сопровождающееся повреждением окружающих кость мягких тканей и нарушением функции поврежденного сегмента.
Причины перелома
Переломы костей возникают в большинстве случаев при воздействии на кость сил превышающих ее прочностные характеристики. Чем прочнее кость, тем больше сила должна применяться чтобы произошел перелом. На прочность костной ткани влияет ее строение. В нормальных условиях кость человека довольно прочный орган, способный выдерживать значительные нагрузки.
Однако достаточно часто встречаются состояния при которых костная ткань становится менее прочной. Это наблюдается у женщин в постменопаузальном периоде, когда у некоторых развивается остеопороз. У больных с заболеваниями почек, с нарушением минерального обмена.
| закрытый перелом | открытый перелом |
Симптомы переломов
Возникший в результате травмы перелом кости, как правило, характеризуется наличием определенных типичных диагностических признаков. Для большинства переломов это:
- боль,
- деформация,
- отек,
- патологическая подвижность,
- крепитация костных отломков,
- нарушение функции.
Классификация переломов
увеличенное изображение
поверхности перелома
- Среди переломов в зависимости от возникновения различают травматические переломы (произошедшие в результате травмы) и патологические (при отсутствии травмы или адекватного воздействия на кость).

- По времени прошедшему с момента перелома выделяют:
- свежие переломы (до 3-х недель с момента травмы)
- застарелые переломы (более 3-х недель с момента травмы),
- несросшиеся переломы (переломы превышающие срок среднефизиологического сращения для данной кости),
- ложные суставы (состояние несращения кости в срок, превышающий 2 среднефизиологических срока сращения для данной кости).
- В зависимости от сообщения костных отломков с внешней средой различают открытые и закрытые переломы.
- По анатомической локализации (для длинных костей) — перелом
- проксимального конца
- тела (диафиза)
- дистального конца
- По отношению к суставам — внутрисуставные и внесуставные.
- По распространению линии перелома: полный перелом и неполный.
- По характеру повреждений: изолированный перелом, множественный, сочетанный.

- В зависимости от наличия смещения — со смещением или без смещения;
- По линии перелома различают простые (поперечные, косые, вколоченные) и сложные (оскольчатые, фрагментарные и т.д.).
Такая детальная характеристика переломов необходима для определения тактики лечения больного и дальнейшего прогноза.
Диагностика переломов
Очень важно правильно поставить диагноз больному с подозрением на перелом кости, так как от правильной интерпретации диагноза зависит и последующее лечение больного, а следовательно и его судьба. Поэтому таких пациентов в идеале должен обследовать врач специалист — врач-травматолог.
Для диагностики переломов костей используются методы клинического и инструментального обследования. К первым относится: осмотр больного, сравнение поврежденных сегментов с неповрежденными, измерение и др., пальпация (ощупывание), иногда перкуссия (простукивание), определение функции поврежденного сегмента, проверка объема движений в суставах, определение мышечной силы, проверка чувствительности, кровоснабжения в поврежденном сегменте и др.
Инструментальными методами для диагностики переломов костей в большинстве случаев являются рентгенологические. В некоторых случаях при необходимости более детальной визуализации используется компьютерная томография, ядерно-магнитная томография и др.
Анализ данных обследования и их интерпретацию должен выполнять только врач специалист. Сам по себе «рентгеновский снимок» — бесполезный кусок пленки в несведущих руках!
Распространенность переломов костей и результаты их лечения в Украине (клинико-эпидемиологическое исследование)
м
н
но недопустимый исход — увеличение
сроков консолидации в каждом третьем
случае (32,7% пострадавших). Для опти-
мизации репаративного остеогенеза при-
менение медикаментозной остеотропной
терапии является обязательным компо-
нентом комплексного лечения.
В целом, в группе пациентов, прини-
мавших Остеогенон, сокращение сроков
консолидации переломов костей верхней
и нижней конечностей при острой травме
составило до 2,6 недель, костей тулови-
ща – до 3,1 недели по сравнению с препа-
ратами кальция. При лечении пациентов с
При лечении пациентов с
замедленным сращением сокращение
сроков консолидации переломов костей
на фоне Остеогенона составило до 3,9
недель при переломах костей верхней и
нижней конечностей, костей туловища —
до 4,2 недели по сравнению с препара-
тами кальция. Полученные нами данные
согласуются с результатами исследования
С.С. Родионовой и соавт. (2001) [4].
Несмотря на наличие убедительных
данных, свидетельствующих о положи-
тельном влиянии препарата Остеогенон
на процессы репаративного остеогене-
за, для подтверждения выявленной за-
кономерности необходимо проведение
двойного слепого плацебо-контролиру-
емого исследования.
Выявленные факты говорят о необхо-
димости внедрения в практику стандартов
комплексного лечения больных с травмой
опорно-двигательной системы, повышения
квалификации медицинского персона-
ла, улучшения материально-технической
базы, создания сети реабилитационных
центров и клиник, выработки и внедрения
в практику схем остеотропной терапии.
Л И Т Е Р А Т У Р А
1. Реброва, О.Ю. Статистический анализ меди-
цинских данных. Применение пакета прикладных
программ STATISTICA [Текст] / О.Ю. Реброва. – М.,
2002. – 312 с.
2. Волошин, В.П. Эндопротезирование тазобедрен-
ного сустава в условиях дефицита костных струк-
тур вертлужной впадины [Текст] / В.П. Волошин, Г.А.
Оноприенко, Д.В. Мартыненко // Хирургия. Журн.
имени Н.И. Пирогова. – 2008. – № 8. – С. 52–56.
3. Объем исследований и лечебно-профилактичес-
кой помощи ортопедо-травматологическим боль-
ным в поликлиниках [Текст] / В.И. Гонгальский [и
др.] // Ведомственная инструкция МЗ УССР, 1987 г.
4. Опыт применения остеогенона в травматоло-
гии и орто педии [Текст] / С.С. Родионова [и др.] //
Вестн. травматол. и ортопед. им. Н.Н. Приорова. –
2001. – № 4. – С. 41–46.
Материал предоставлен
представительством
АО «Euromedex France»
(Французская Республика)
в Республике Беларусь
Поступила 27. 05.2011 г.
05.2011 г.
сравнению с препаратами кальция при
лечении пациентов как с острой трав-
мой, так и с замедлением процессов
сращения. Эта тенденция прослежива-
ется для всех локализаций, но больше
выражена в тех случаях, когда длитель-
ность периода сращения составляет 10
недель и более.
Проведенные исследования также
включали оценку переносимости пре-
парата Остеогенон. Для анализа были
взяты анкеты, где врачом сделаны какие-
либо отметки в графе «Переносимость»,
т.е. отмечено отсутствие любых нежела-
тельных реакций или описан побочный
эффект. Анализ отобранных 1384 анкет,
принятых для данной части исследова-
ния за 100%, показал отсутствие побоч-
ных эффектов у 1358 пациентов (98,13%
случаев), их наличие (метеоризм, тошно-
та) – у 26 человек (1,87%). Ни в одном из
случаев развития побочных эффектов не
возникло необходимости прервать курс
остеотропной терапии.
Заключение
Основной задачей лечения пациен-
та с повреж дением опорно-двигатель-
ной системы является восстановление
свойств костной ткани в зоне поврежде-
ния и функций поврежденного сегмен та.
Проведенное исследование, выполнен-
ное на основании анализа 2358 анкет, в
которых были проанализированы 2819
переломов, позволило выявить ряд про-
блем, решение которых могло бы улуч-
шить результаты лечения пациентов с
переломами костей. По нашим данным,
в первые сутки после травмы обрати-
лись за квалифициро ванной помощью
79,8% пациентов с переломами костей,
что отражается на длительности лече-
ния и, следовательно, на его качестве.
Обеспечение возможности обращения
пострадавших за ква лифицированной
помощью в первые сутки после травмы
снизит количество случаев с поздней диа-
гностикой и несвоевременным началом
адекват ного лечения.
Информированность о наиболее
часто встре чающихся переломах спо-
собствует возможности планировать
коечный фонд и загруженность койки
в стационаре. Так, по нашим данным,
Так, по нашим данным,
наиболее частыми переломами явля-
ются: среди костей верхней конечнос-
ти — переломы лучевой кости, среди
костей нижней конечности — перело-
мы большеберцовой кости, среди пе-
реломов костей туловища — переломы
позвонков. Тот факт, что в 59,8% слу-
чаев лечение переломов проведено
консервативными методами, требует
дальнейшего анализа. Такие данные
могут быть следствием либо высоко-
го профессионализма медицинского
персо нала, либо дефицитом обору-
дования, инструмента рия и фиксато-
ров. Кроме того, нами отмечено, что
в 11,2% случаев была использована
дополнительная гипсовая иммобили-
зация на период более 2 недель после
операции, что может свидетельство-
вать о нестабильной фиксации фраг-
ментов.
Общеизвестно, что восстановление
функции поврежденного сегмента воз-
можно только при комплексном под-
ходе к лечению переломов. Поэтому
Поэтому
недопустимым следует считать отсут-
ствие физиотерапевтического лечения
в 58,3% случаев, а ЛФК – у 74% па-
циентов.
Все перечисленные особенности ле-
чебного процесса обусловили логичный,
Проблемы общественного здоровья
и реформирование здравоохранения
Локализация переломов
Группа сравнения
Остеогенон –
препарат
кальция
Остеогенон – без
остеотропной
терапии
Консолидация в обычные сроки (разница между группами сравнения в неделях)
Верхние конечности 1,2–2,5 1,1–2,0
Нижние конечности 0,9–2,6 0,5–2,5
Кости туловища 1,2–3,1 0,6–3,1
Замедление сроков консолидации (разница между группами сравнения в неделях)
Верхние конечности 0,1–3,3 0,1–3,0
Нижние конечности 0,9–3,9 0,4–5,7
Кости туловища 1,8–4,2 —
Таб л и ца 15 Результаты сравнительного анализа уменьшения
длительности сроков консолидации
в зависимости от вида остеотропной терапии
Сроки сращения переломов (таблица)
Страницы: 1 2Лечебные мероприятия при переломах состоят из репозиции (см.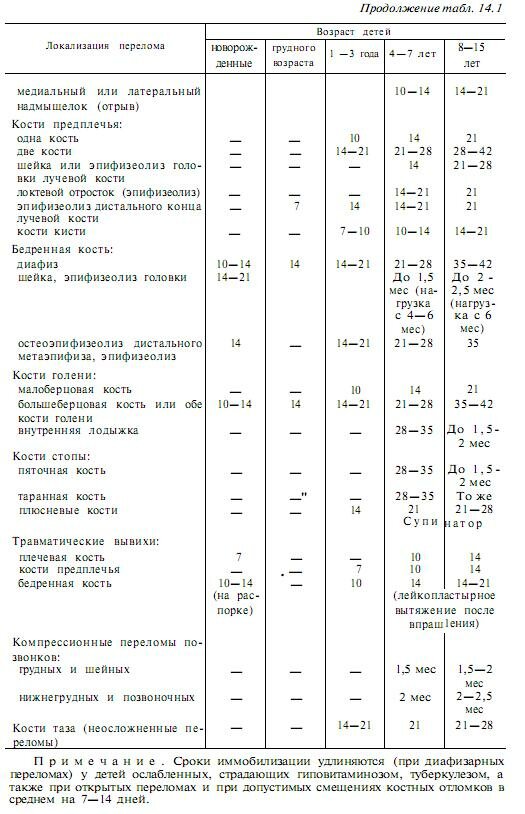
Репозиция и фиксация отломков кости могут быть произведены с помощью консервативных или оперативных методов лечения. Консервативное лечение переломов костей проводится как в амбулаторных, так и стационарных условиях в зависимости от характера перелома, оперативное — только в больнице. Оба метода имеют одинаково широкое распространение в травматологической практике и применяются по четким показаниям в каждом отдельном случае.
Рис. 5. Гипсовая повязка
Репозиция отломков при консервативном лечении может быть произведена вручную или с помощью механической тяги, одномоментно или в течение длительного времени (см. Вытяжение). Во всех случаях одномоментное сопоставление отломков следует делать с наркозом или местной анестезией (введение в гематому между отломками 20—40 мл 2% раствора новокаина). Наступающее после анестезии расслабление мускулатуры облегчает репозицию. Достигнув удовлетворительного стояния отломков, накладывают гипсовую повязку (рис. 5), на которую наносят схему перелома, даты повреждения, наложения и предполагаемого снятия гипсовой повязки.
Продолжительность иммобилизации гипсовой повязкой зависит от локализации перелома, характера смещения отломков, способа лечения, возраста больного и некоторых других причин. После наступления сращения отломков, подтвержденного рентгенологически, гипсовую повязку снимают и назначают гимнастику, массаж. Средние сроки сращения переломов и восстановления функции поврежденной конечности при консервативном лечении представлены в таблице.
Сроки сращения переломов (таблица)
| Локализация | Сроки сращения * | |
| Ключица | 4—6 недель | |
| тело | 4 недели | |
| шейка | 6—8 недель | |
| Плечо | диафиз, шейка | 8—10 недель |
| эпифиз | 10—12 недель | |
| Предплечье | обе кости | 10—14 недель |
| одна кость | 6 недель | |
| Кисть | ладьевидная | 8—12 недель |
| пястные кости, фаланги | 4—6 недель | |
| Тела позвонков | 4—6 недель | |
| Ребра | 4 недели | |
| Таз, со смещением половины таза вверх | 4—6 месяцев | |
| Таз, только лобковая или седалищная кость | 1,5—2 месяца | |
| Бедро | шейка | 6—8 месяцев |
| диафиз | 5—6 месяцев | |
| мыщелки | 3—3,5 месяца | |
| Голень | мыщелки | 2—3 месяца |
| диафиз | 5 месяцев | |
| лодыжки | 2—3 месяца | |
| Стопа | пяточная кость | 2,5—3,5 месяца |
| таранная | 3. 5 месяца 5 месяца |
|
| кости плюсны, фаланги | 4—6 недель | |
* Сроки сокращаются в молодом возрасте, в пожилом — увеличиваются.
Сокращение сроков иммобилизации приводит к различного рода осложнениям — несращению отломков, искривлениям оси конечности, при чрезмерно длительной иммобилизации возникают контрактуры (см.) суставов, стойкая мышечная атрофия.
Сращение (консолидация) переломов определяется клиническими и рентгенологическими признаками. Клинически отмечается отсутствие патологической подвижности в месте бывшего перелома. Рентгенологически сращение отломков характеризуется костной мозолью, спаивающей концы отломков (рис. 4). Процесс формирования костной мозоли длительный, и рентгенологически структура мозоли в течение долгого времени отличается от концов отломков, которые она соединяет. В некоторых неблагоприятных случаях процессы мозолеобразования нарушаются с замедлением консолидации или формированием ложного сустава (см. ).
).
Переломы — Лечение — Персональный сайт врача ортопеда-травматолога Дедова Сергея Юрьевича
ЛЕЧЕНИЕ ПЕРЕЛОМОВ
В травматологическом отделении проводится лечение переломов различной локализации. В травматологии существует 2 вида лечения переломов: консервативное и оперативное.
Консервативное лечение:
Для иммобилизации переломов в клинике широко применяются полимерные синтетические гипсовые повязки (RHENA-CAST, SCOTCT—CAST, SOFT-CAST). Данный «пластиковый гипс» является весомой альтернативой обыкновенным гипсовым повязкам, обладает не только прочной фиксацией, но и очень удобен для пациента в использовании.
Преимущества полимерной гипсовой повязки:
Очень надежная фиксация
- Гораздо легче и тоньше, чем обычный гипс.
- Не размокает, можно принимать душ, плавать.
- Нет повреждения кожи под гипсом.
- Не загрязняется во время ношения.
- Различные цвета (синий, красный, белый). Выбор цвета — по желанию пациента.
Но не каждый перелом можно вылечить «гипсом». На сегодняшний день во всем мире проводятся различные виды оперативного лечения костной травмы.
Оперативное лечение переломов костей:
Остеосинтез – это операция, при которой отломки поврежденной кости собираются и фиксируются в правильном положении с помощью различных фиксаторов (пластины, штифты, спицы, винты и т.п.).
Большинство фиксаторов изготовлено из титанового сплава, основными свойствами которого являются прочность и инертность титана по отношению к тканям человека, т.е. химическая и биологическая переносимость и отсутствие отторжения.
|
перелом хирургической шейки левой плечевой кости |
остеосинтез титановой блокируемой пластиной и винтами |
Этот метод лечения является основным при лечении длинных трубчатых костей, а зачастую, и единственно возможным, например, если перелом внутрисуставной.
Современные методы остеосинтеза обеспечивают быстрое сращение переломов, короткий период реабилитации после травмы и сокращение срока постельного режима.
|
перелом 5 плюсневой кости левой стопы со смещением отломков |
остеосинтез титановым компрессионным канюлированным винтом |
BUMIN HOSPITAL GROUP
Даже при легких случаях перелома костей,
лечиться у врачей специалистов.
Что такое травмы и переломы
Это – состояние возникающие повреждением непрерывности костей при несчастных случаях или за счет воздействия
внешней физической силы и протекает в виде трещин или переломов.
При переломах может возникнуть повреждения нервов и сосудов и более серьезных осложнений,
поэтому даже при легких случаях переломов необходимо обязательное лечение у специалистов.
ПАЛАТА ЭКСТРЕННОЙ ПОМОЩИ БОЛЬНИЦЫ БУМИН, ОБОРУДОВАНЫ ВСЕМИ АППАРАТАМИ ДЛЯ ОКАЗАНИЯ ЭКСТРЕННОЙ ПОМОЩИ И
В ЛЮБОЕ ВРЕМЯ МОЖЕМ ОКАЗЫВАТЬ КВАЛИФИЦИРОВАННУЮ ПОМОЩЬ ПРИ РАЗЛИЧНЫХ ПЕРЕЛОМАХ.
ТРАВМАТОЛОГИЧЕСКИЙ ЦЕНТР
Типы переломов и лечебный процесс
- Не осложненный перелом: переломы костей и трещины.
- Осложненный перелом: сочетание перелома с повреждением других тканей тела.
-
01
Неотложная помощь.
Вопросы возникают при повреждении окружающей ткани за счет перелома (нервы, мышцы, сосуды, сухожилие).
 При повреждении нерва удлиняется сроки лечения, при тяжелом повреждении может закончиться инвали
дизацией пациента. Очень важно, при переломах нельзя двигать поврежденной конечностью. Обычно
накладываются шины, но во время накладывания шины могут ухудшить состояния больного, поэтому лучше
вызвать машину скорой помощи.
При повреждении нерва удлиняется сроки лечения, при тяжелом повреждении может закончиться инвали
дизацией пациента. Очень важно, при переломах нельзя двигать поврежденной конечностью. Обычно
накладываются шины, но во время накладывания шины могут ухудшить состояния больного, поэтому лучше
вызвать машину скорой помощи. -
02
Лечение перелома костей.
При переломах необходимо сопоставить отломки в правильном положении и необходимо добиться восстановления функций пораженного органа, близкой к норме, чтобы пациент мог вести прежний образ жизни.
 При переломах в
зависимости возраста больного, состояния, тяжести переломов, повреждения окружающей ткани, осложнения
лечение могут быть от легких способов до открытого вправления и остеосинтеза.
При переломах в
зависимости возраста больного, состояния, тяжести переломов, повреждения окружающей ткани, осложнения
лечение могут быть от легких способов до открытого вправления и остеосинтеза. -
03
Реабилитация.
После сращения перелома снимается гипсовые повязки или шины, начинается занятие упражнения суставами, с целью восстановления утраченных функций, дополнительно назначается физиолечение. Самое важное – это пациентам необходимо самостоятельно активно заниматься лечебной физкультурой, лучше после прогревания теплом и легкого массажа, Можно заниматься упражнением суставов в горячей воде.

Восстановление после перелома плеча — схемы и методики
Описание реабилитации. Методики и сроки восстановления.
Перелом плеча: реабилитация
Плечевой сустав представляет собой подвижное сочленение, образованное лопаткой и плечевой костью. Перелом плечевого сустава — это фактически ни что иное, как внутрисуставной перелом плечевой кости, а точнее перелом ее надбугорковой части. Часто пациенты путают понятие перелома плеча, когда речь идет все же о зоне, находящейся вне полости сустава. Перелом плечевого сустава — травма не частая, несмотря на возрастающий травматизм в мире, тем не менее, требует особых подходов при лечении и реабилитации, настолько часты различные осложнения.
Реабилитация: описание
Причинами, приводящие к переломам, служат сильные травмы и удары, приходящиеся как непосредственно в область сустава, так и косвенно (например, падение на вытянутую руку). Нередко перелом плечевого сустава сопровождается сочетанными повреждениями и переломами в других локализациях. Часто сильное отягчающее воздействие оказывает остеопороз, т. е. размягчение костной ткани. При таком заболевании кости слабеют, и им не требуется столь значимого удара для перелома. Следует сказать, что реабилитация переломов плечевого сустава при остеопорозах, иных дистрофических заболеваниях отягощена, не редко требуются полноценные месячные курсы с дополнительным приемом медикаментозных средств.
Нередко перелом плечевого сустава сопровождается сочетанными повреждениями и переломами в других локализациях. Часто сильное отягчающее воздействие оказывает остеопороз, т. е. размягчение костной ткани. При таком заболевании кости слабеют, и им не требуется столь значимого удара для перелома. Следует сказать, что реабилитация переломов плечевого сустава при остеопорозах, иных дистрофических заболеваниях отягощена, не редко требуются полноценные месячные курсы с дополнительным приемом медикаментозных средств.
Перелом плечевого сустава бывает открытым и закрытым. Последний прогностически намного благоприятнее. Исходя из сути терминологии, открытые переломы сопровождаются зиянием наружу костных отломков, и как следствие, полости сустава. Моментально присоединяется инфекция, делая восстановительное лечение весьма затруднительным процессом. Также при открытых переломах нередко образуются большие дефекты в кости, требующие проведения сложной реконструктивно-пластической хирургии.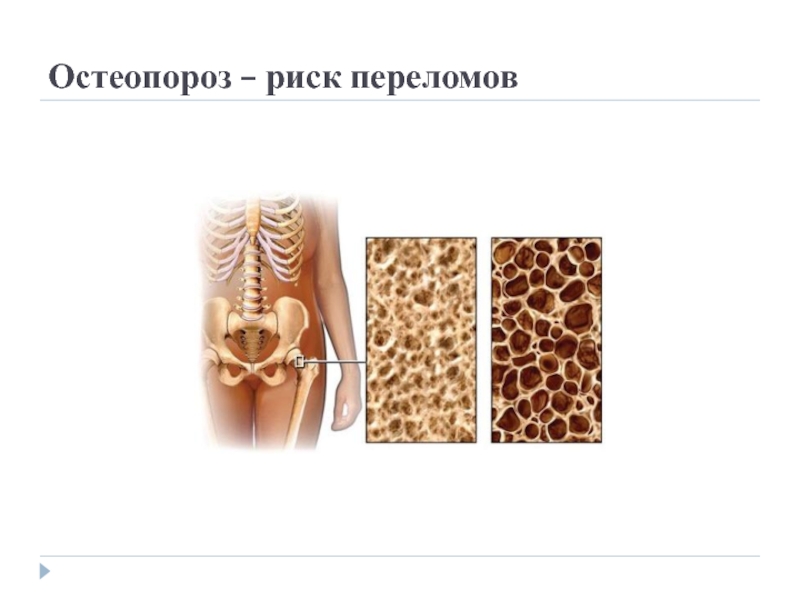
Запишитесь на приём и получите исчерпывающую консультацию от врача травматолога-ортопеда, врача спортивной медицины Ондар Темира Евгеньевича:
Сроки реабилитации
Восстановления целости кости зависит от целого ряда как общих, так и ряда местных факторов. Среди факторов общих — стоит назвать возраст больного человека, его физическое и конечно нервно-психическое состояние, имеет значение конституция человека, насколько хорошо функционирует его эндокринная система, обмен веществ и т. д. Среди местных факторов называют сопоставление костных отломков, достаточное ли кровоснабжение. Также следует учитывать данные рентгенологического исследования и клинические данные о функциональной выносливости сращенной кости. Если был открытый перелом, то следует учесть наличие инфекции. Все эти факторы могут значительно увеличить сроки реабилитации, которые могут исчисляться месяцами и даже годами!
Средние сроки сращения костей при переломах фаланг, ребер и пястных костей составляет около 3-х недель, при переломе ключицы за 4-е недели, запястья и предплюсны, плюсны, плеча и предплечья — за 2,5 месяца, голени — за 3 месяца, бедра — за 4 месяца, шейки бедра — за 6 месяцев. ЛФК назнеачается уже с 10–14 дня после перелома в виде пассивных упражнений, и активная реабилитация продолжается примерно месяц-полтора после иммобилизации (снятии фиксирующей повязки). То есть, если грубо обобщить сроки, то в зависимости от типа перелома, его тяжести и места перелома реабилитация составляет от 1 месяца до 1 года.
ЛФК назнеачается уже с 10–14 дня после перелома в виде пассивных упражнений, и активная реабилитация продолжается примерно месяц-полтора после иммобилизации (снятии фиксирующей повязки). То есть, если грубо обобщить сроки, то в зависимости от типа перелома, его тяжести и места перелома реабилитация составляет от 1 месяца до 1 года.
Методика реабилитации
- Корректировка питания. Это первое, с чего начинают восстановление, так как при для роста здоровой костной ткани необходимы аминокислоты, антиоксиданты, витамины и минералы. Аминокислоты, необходимые организму в период реабилитации после переломов — это аргинин, пролин, глицин и глютамин. Это одни их важных составляющих белков, образующих костную массу. Именно поэтому необходимо увеличить в своем рационе потребление белков на 10–20 мг в день. Антиоксиданты обладают свойством уменьшать воспаления, не замедляя при этом процесс заживления тканей. Это витамин С, витамины D, К и В6. Эти витамины выполняют функции катализаторов химических реакций, протекающих во время заживления переломов.
 Такие минералы, как цинк, медь, кальций, фосфор и кремний тоже крайне необходимы для нормального восстановления костной ткани. Итак, в рационе должны присутствовать молочные продукты (молоко, сыр, творог, сметана, кефир и простокваша), блюда, содержащие натуральный желатин (мармелад, фруктовые желе, заливное, студень), антиоксиданты (фрукты, овощи и орехи).
Такие минералы, как цинк, медь, кальций, фосфор и кремний тоже крайне необходимы для нормального восстановления костной ткани. Итак, в рационе должны присутствовать молочные продукты (молоко, сыр, творог, сметана, кефир и простокваша), блюда, содержащие натуральный желатин (мармелад, фруктовые желе, заливное, студень), антиоксиданты (фрукты, овощи и орехи). - Иммобилизация сустава, конечности. В случае возникновения подвижности (при неправильной фиксации конечности) нарушается кровоснабжение, увеличивается период сращения костной ткани.
-
Физиопроцедуры. Важно провести как минимум два курса физиопроцедур — в период иммобилизации конечности, и сразу после снятия повязки/гибса. Физиотерапия направлена на воздействие окружающих тканей с целью исключить атрофию мышц, уменьшить отек, увеличить кровообращение и уменьшить болевые ощущения. Цель проведения процедур сразу после снятия повязки — дать нагрузку на мышечные ткани, подготовив конечность к дальнейшей работе в зале ЛФК.

- ЛФК. Упражнения необходимо начинать через 10–14 дней после наложения повязки. Сначало это пассивная гимнастика, а потом и активная с дальнейшим увеличением нагрузки. Задачи ЛФК — восстановить объем движения поврежденной конечности, вернуть эластичность тканей, укрепить мышечный аппарат.
- Массаж. Является важным компонентом в период реабилитации и он может быть проведен в несколько курсов с целью предотвращения контрактуры, уменьшения отека и быстрейшего сращения костной ткани за счет увеличения кровообращения!
В любом случае перелома очень важно сразу начинать реабилитационные мероприятия, так как есть риск развития контрактуры и уменьшения объема движения в суставах, особенно это касается переломов лодыжек и кисти, то есть тех суставах, которые состоят из мелких костей.
Записаться на консультацию можно по телефону +7 (495) 477-55-40 или через онлайн-форму обратной связи.
Спортивно-реабилитационный центр «Новый Шаг»:
мы будем счастливы вернуть вам радость активной жизни!
Современный метод лечения костей у детей и взрослых
Дудкин Владимир Семенович
Травматолог-ортопед, заведующий отделением ОТО АОДКБ
Современный динамичный стиль жизни является источником тяжелых, высокоэнергетичных травм.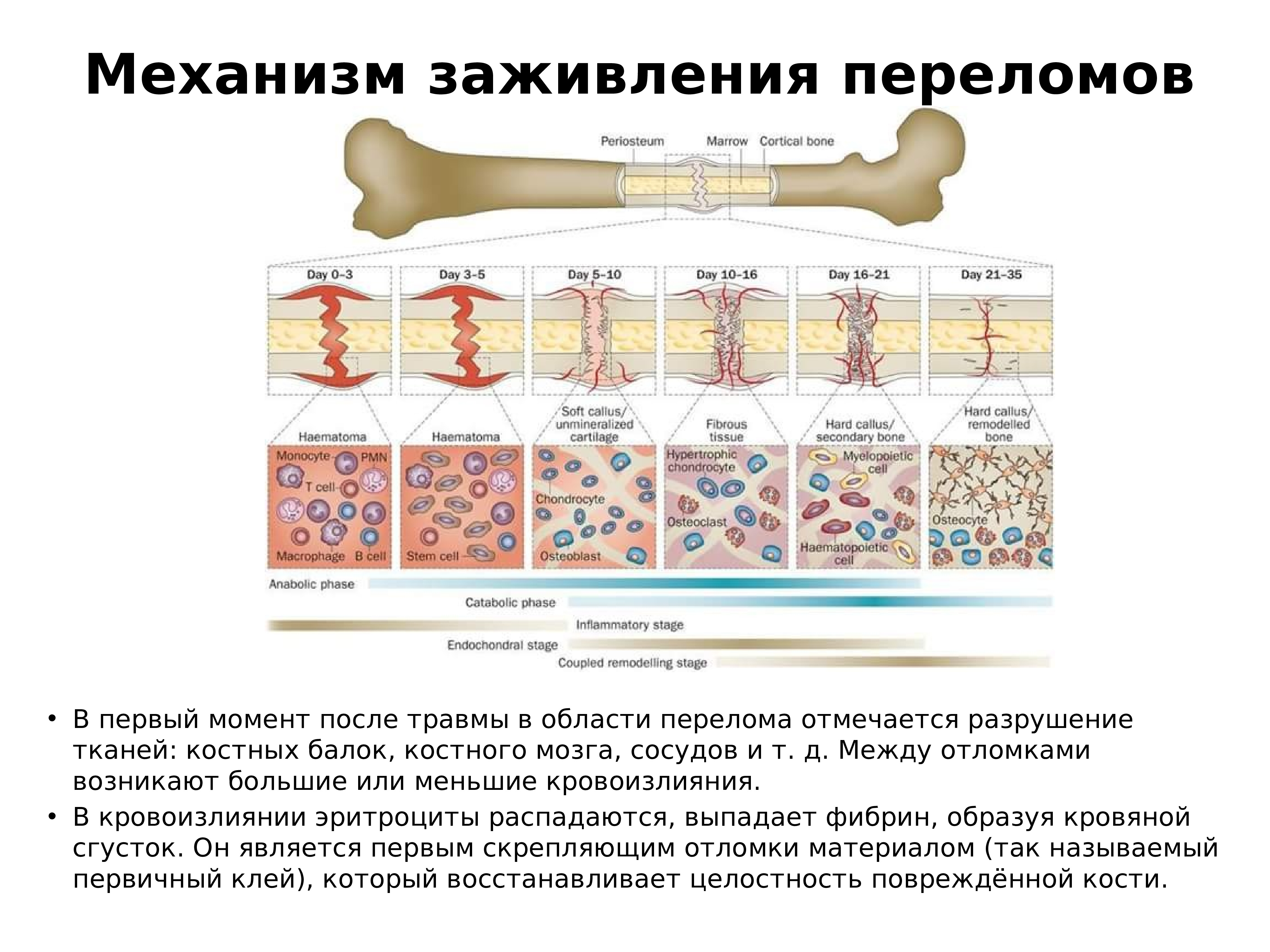 Автомобильные аварии, экстремальный отдых и спорт (горные лыжи, сноуборд и другие) привели к тому, что травматология вышла на третье место среди заболеваний.
Автомобильные аварии, экстремальный отдых и спорт (горные лыжи, сноуборд и другие) привели к тому, что травматология вышла на третье место среди заболеваний.
К качеству лечения травм сейчас предъявляются новые требования. Это сокращение сроков реабилитации и возможность скорейшего возвращения пациента к привычному образу жизни.
Уже третий год в Амурской областной детской клинической больнице применяется современный высокоэффективный метод лечения переломов костей у детей и взрослых. Метод лечения с помощью стержневой интрамедуллярной системы (meteizeau система).
Для того чтобы разобраться в чем суть данного метода давайте вспомним что такое скелетное вытяжение или как говорят по-простому пациенты «лежать на вытяжке». Кто это испытал или видел – впечатление и зрелище незабываемое.
Пациент в течение длительного времени находится в «подвешенном состоянии», не имея возможности перевернуться, встать и самостоятельно справить свои естественные нужды. В отчаяние от такой ситуации приходят взрослые, понимающие необходимость лечения, не говоря о детях для которых такое положение становится просто трагедией. Пациент может находится в таком состоянии, в зависимости от сложности перелома до двух месяцев.
В отчаяние от такой ситуации приходят взрослые, понимающие необходимость лечения, не говоря о детях для которых такое положение становится просто трагедией. Пациент может находится в таком состоянии, в зависимости от сложности перелома до двух месяцев.
Современная методика позволяет избежать скелетного вытяжения и зафиксировать перелом с помощью новой интрамедуллярной стержневой системы.
Суть оперативного метода
Для фиксации переломов используются стрежни, изготавливаемые из специальной, холоднокатаной стали, которая обеспечивает высокое механическое сопротивление и упругость. Этот материал был предпочтен титану (титан был признан слишком пластичным). Острию стержня умышленно придали такую форму, чтобы можно было использовать как тупую, так и острую его часть в зависимости от направления и назначения.
Металлоконструкция вводится в костномозговой канал (внутрь кости). Операция относится к категории малоинвазивных (малотравматичных). Современная техника позволяет произвести введение при минимальном разрезе кожного покрова не более 1-2 см.
После выздоровления – при сращивании перелома и полном восстановлении функций конечности стержни удаляются через 2-3 месяца также малоинвазивным оперативным путем через небольшой разрез 1-2 см.
Преимущества метода:
- отсутствие повреждения надкостницы;
- небольшая продолжительность операции;
- малая травматичность; минимальная кровопотеря;
- выписка из больницы на 4-6 день после операции;
- возможность давать нагрузки поломанной конечности в ранние сроки, при незаконченном сращении перелома – раннее восстановление трудоспособности;
- вероятность нарушения роста кости, и вторичных смещений сведена к минимуму;
- минимальный косметический дефект.
- В большинстве случаев не требуется дополнительная фиксация гипсом.
В каких случаях возможно применение данного метода оперативного лечения:
Данная методика оперативного лечения подходит для детей с самого их рождения, но не во всех случаях подходит для взрослых.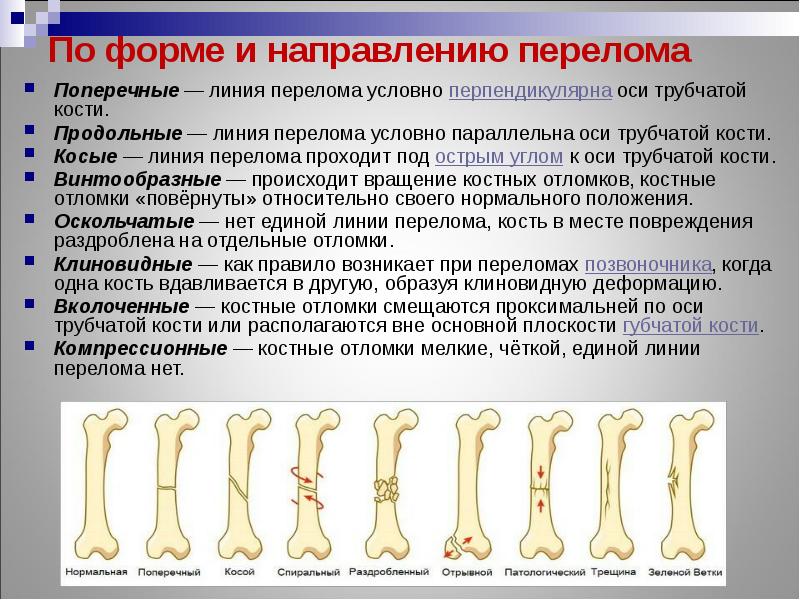 Для лучшего понимания того, где данная методика применима для взрослых давайте рассмотрим таблицу.
Для лучшего понимания того, где данная методика применима для взрослых давайте рассмотрим таблицу.
| показания | дети | подростки | взрослые |
| Фиксация переломов верхних конечностей | методика применима | методика применима | методика применима |
| Фиксация переломов нижних конечностей. | методика применима | методика применима | методика применима у людей с небольшой комплекцией |
| Фиксация переломов бедра. | методика применима | методика применима | методика применима у людей с небольшой комплекцией |
Для детей быстрое выздоровление важный фактор, помогающий им избежать психологических травм и дающий возможность вернуться к обычному ритму жизни.
Для пациентов трудоспособного возраста – зачастую единственная возможность сохранить рабочее место. Для пациентов пенсионного возраста качественно выполненная малотравматичная фиксация перелома и реабилитация, начатая в ранние сроки, является единственной возможностью избежать тяжелых гипостатических осложнений (пневмоний, пролежней и других).
Для пациентов пенсионного возраста качественно выполненная малотравматичная фиксация перелома и реабилитация, начатая в ранние сроки, является единственной возможностью избежать тяжелых гипостатических осложнений (пневмоний, пролежней и других).
График рентгенологических особенностей заживления переломов у детей раннего возраста
Задача: Датировка переломов существенно влияет на решения по защите детей. Ввиду недостатка первичных доказательств, подтверждающих датировку переломов у детей, мы изучили ключевые радиологические особенности заживления переломов и их сроки.
Материалы и методы:
Цифровые рентгенограммы детей младше 72 месяцев со случайными переломами длинных костей в известное время были независимо проанализированы тремя детскими радиологами, не знавшими возраст переломов.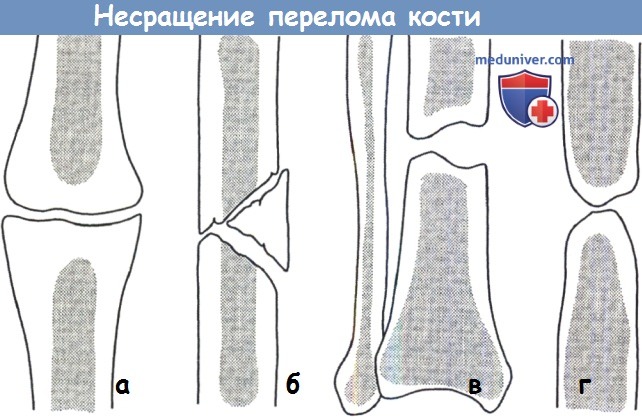 Были оценены шесть рентгенологических признаков заживления перелома: отек мягких тканей, периостальная реакция, мягкая мозоль, твердая мозоль, мостовидное соединение и ремоделирование. Согласие между наблюдателями оценивалось с помощью каппа-анализа.
Были оценены шесть рентгенологических признаков заживления перелома: отек мягких тканей, периостальная реакция, мягкая мозоль, твердая мозоль, мостовидное соединение и ремоделирование. Согласие между наблюдателями оценивалось с помощью каппа-анализа.
Полученные результаты:
Было изучено двести двадцать восемь снимков 82 переломов у 63 детей (средний возраст 4,8 года). Набухание мягких тканей было выявлено двумя или более рентгенологами в 59% рентгенограмм на 1-2 день после переломов, после чего его распространенность резко снизилась.Надкостничная реакция впервые была замечена на 5-й день и присутствовала в 62% пленок, полученных между 15 и 35 днями после перелома. Мягкая мозоль впервые была замечена на 12-й день и преобладала у 41% в период между 22 и 35 днями. Твердые мозоли и образование мостовидных протезов начались на 19-й день, а через 36 дней их распространенность увеличилась до 60%..png) Ремоделирование наблюдалось только при переломах возрастом 45 дней и старше. Общий балл по шкале Каппа составлял от 0,55 до 0,80, с большей согласованностью при отсутствии гипсовой повязки.
Ремоделирование наблюдалось только при переломах возрастом 45 дней и старше. Общий балл по шкале Каппа составлял от 0,55 до 0,80, с большей согласованностью при отсутствии гипсовой повязки.
Заключение: Результаты этого исследования показывают, что переломы у детей раннего возраста можно классифицировать как острые (<1 недели), недавние (8-35 дней) или старые (≥ 36 дней) на основании наличия шести ключевых рентгенологических признаков в сочетании. .Кроме того, хорошее согласие между наблюдателями предполагает, что эти результаты воспроизводимы.
| Перелом возникает, когда нарушается целостность кости и нарушается местное кровоснабжение. Если вышележащие мягкие ткани также травмированы, заживление перелома может быть задержано или нарушено, особенно в анатомических областях с ослабленной сосудистой сетью, таких как диафиз большеберцовой кости. ВоспалениеНачинается сразу после повреждения кости с образованием местной гематомы или фибринового сгустка. Там, где разрушение сосуда привело к ишемии, происходит локальная гибель клеток — обычно на самых концах сломанной кости.В течение следующих нескольких дней эта область инфильтрируется воспалительными клетками и характеризуется локальным отеком и теплом. Воспалительные клетки высвобождают лизосомальные ферменты и другие медиаторы, которые привлекают плюрипотентные клетки в эту область; они также действуют для удаления некротической ткани. Появляются фибробласты, мезенхимальные клетки и клетки-остеопрогениторы, которые могут трансформировать близлежащие ткани. Перелом болезненный и на этом этапе может быть очень подвижным для физического осмотра. Воспаление достигает пика через 48 часов после перелома. Перелом болезненный и на этом этапе может быть очень подвижным для физического осмотра. Воспаление достигает пика через 48 часов после перелома.РемонтВосстановительная фаза начинается через несколько дней после травмы с появлением мезенхимальных клеток, способных дифференцироваться в фибробласты, хондробласты и остеобласты. Фаза ремонта длится несколько месяцев; его можно разделить на две отдельные фазы: формирование мягкой и твердой костной мозоли.
РемоделированиеРемоделирование — это процесс, при котором кость удаляется небольшими приращениями, а затем заменяется новой костью.После перелома реконструкция может продолжаться месяцами или даже годами. Скелет взрослого человека постоянно обновляется со скоростью 10-18% в год. Скорость ремоделирования ускоряется у детей и во время заживления переломов. Ремоделирование не только является неотъемлемой частью заживления переломов, но и играет важную роль в гомеостазе кальция. Во время фазы ремоделирования тканая кость превращается в пластинчатую кость, и костномозговой канал восстанавливается. Во время этой фазы кость реагирует на характеристики нагрузки в соответствии с законом Вольфа.Некоторая угловая деформация может исправиться на этой стадии у детей, у которых остается достаточный рост (до 5 ° в год роста). |
Заживление переломов костей: клеточная терапия при отсроченных сращениях и несращениях
https://doi.org/10.1016/j.bone.2014.07.033Получить права и контентОсновные моменты
- •
-
Мы рассмотрели текущие концепции нарушение заживления переломов костей в несращениях.
- •
-
Атрофические несращения костей трудно зажить из-за клеточной недостаточности.
- •
-
Растворы для клеточной терапии предоставляют МСК, предназначенные для усиления остеогенеза и заживления.
- •
-
Мы рассматриваем клинические данные, недостаточные для доказательства улучшения заживления кости с помощью МСК.
- •
-
Для подтверждения или опровержения роли МСК требуется больше и более качественных клинических испытаний.
Реферат
Нарушение заживления переломов костей, связанное с механическими проблемами, в значительной степени исправлено за счет достижений в лечении переломов.Улучшение протоколов, более строгий контроль времени и функций, а также эволюция оборудования и хирургической техники способствовали лучшему прогнозу даже при сложных переломах. Однако атрофическое несращение сохраняется в клинических случаях, когда по разным причинам остеогенная способность нарушена. В этом случае лучшее понимание основных механизмов восстановления и увеличения костей может дать представление о текущих и будущих возможностях. Среди них клеточная терапия особенно направлена на исправление этого недостаточного остеогенеза.Однако запуск безопасных и эффективных методов клеточной терапии все еще требует значительного объема исследований, особенно клинических испытаний. В этом обзоре будут представлены текущие клинические испытания увеличения заживления костей на основе клеточной терапии, с опытом, предоставленным проектом REBORNE, а также с учетом результатов клинических испытаний передовых методов лечения, проводимых под руководством исследователей. Эта статья является частью специального выпуска «Стволовые клетки и кости».
Ключевые слова
Заживление костей
Несращение
Клеточная терапия
Клинические испытания
МСК
Рекомендуемые статьиЦитирующие статьи (0)
Copyright © 2014 Авторы.Опубликовано Elsevier Inc.
Рекомендуемые статьи
Цитирующие статьи
Оптимальное время для инъекции костных мезенхимальных стволовых клеток для заживления перелома на мышиной модели | Исследования и терапия стволовыми клетками
Животные
Все эксперименты проводились в соответствии с международными правилами по уходу и использованию лабораторных животных и были одобрены Комитетом по этике Главного госпиталя Народно-освободительной армии Китая (Китай, Пекин, район Хайдянь, дорога Фусин , Нет.28). Все операции проводились под общим наркозом, и все усилия были направлены на то, чтобы минимизировать страдания. Взрослых мышей-самцов C57BL / 6 (возраст 8-10 недель) были приобретены в Центре экспериментальных животных Военно-медицинского института (Пекин). Животных содержали в среде с регулируемым освещением и температурой и имели свободный доступ к пище и воде.
RFP-BMSC
C57BL / 6 мышиные мезенхимальные стволовые клетки / красный флуоресцентный белок (RFP-BMSC, каталожный № MUBMX-01201, Cyagen Bioscience, Гуанчжоу, Китай) культивировали в среде DMEM с добавлением 10% фетальной бычьей сыворотки, пенициллин (100 Ед / мл) и стрептомицин (100 мг / мл) при 37 ° C во влажной атмосфере, содержащей 5% CO 2 .Как правило, питательную среду меняли каждые 3 дня. Перед инъекцией клетки переваривали трипсином, промывали сбалансированным солевым раствором Хэнка, центрифугировали и разводили в PBS перед инъекцией. RFP-BMSC между пассажами 3 и 4 использовались во всех экспериментах.
Дизайн исследования
-
1.
Мы разделили 126 мышей C57BL / 6 на следующие три группы лечения: (1) BMSC — получали физиологический раствор (0.5 мл) инъекция в хвостовую вену за 30 минут до инъекции RFP-BMSC (1 × 10 6 / 0,5 мл), (2) AMD3100 — инъекция AMD3100 (0,01 мМ / 0,5 мл) за 30 минут до RFP-BMSC (1 × 10 6 / 0,5 мл) инъекции и (3) Контроль — получили две инъекции физиологического раствора (0,5 мл) с интервалом 30 минут. Инъекции производили на 1-й день ( n = 48), 7-й день ( n = 48) или 14-й день ( n = 30) после перелома. Образцы трещин были собраны на 7, 14, 28 и 42 дни после перелома и зафиксированы.
-
2.
Каллусы от дополнительных 15 мышей с переломом бедренной кости, которым не вводили BMSC, были собраны на 3, 7, 14, 21 и 28 дни после перелома, и были проанализированы уровни следующих хемокинов миграции МСК: SDF-1, трансформирующий фактор роста β1. (TGF-β1) и хемоаттрактантный белок 3 моноцитов (MCP-3).
-
3.
На 42-й день после перелома мозоли собирали у 15 мышей в трех группах лечения, которым инъецировали на 7-й день после перелома, и с помощью вестерн-блоттинга определяли уровни белка следующих факторов, связанных с остеогенезом: костный морфогенетический белок 2 (BMP2 ), TGF-β1 и фактор роста эндотелия сосудов (VEGF).
Хирургия
После того, как была введена общая анестезия, правая нога была стерилизована.Была разрезана передняя часть колена по средней линии, и игла диаметром 0,5 мм, сплющенная для предотвращения облитерации эндостальной выстилки, была ретроградно вставлена вверх по правой бедренной кости. Кончик иглы был утоплен в дистальном отделе бедренной кости, чтобы не мешать движению коленного сустава. Разрез промыли и зашили. Правая бедренная кость была сломана у 120 мышей с использованием груза весом 200 г, упавшего на 20 см, который вдавил тупую гильотину на 1 мм (половина диаметра бедренной кости) для получения стандартизированного закрытого диафизарного перелома.Marturano JE et al. [9] сообщили о модели перелома, и автор доказал, что вероятность успеха достигает 92,5%. Сразу после перелома сделали рентгеновские снимки. Мышам вводили внутримышечную инъекцию анальгетика (0,05 мг / кг бупренорфина в день) в течение 3 дней и позволяли неограниченно переносить вес и активность клетки. Животных умерщвляли асфиксией CO 2 , если не указано иное.
Сбор образцов
Мышей, которым инъецировали в дни 1 и 7 после перелома, умерщвляли с использованием камеры CO 2 на 14 и 42 дни, в то время как мышей, которым инъецировали на 14 день, умерщвляли через 42 дня после перелома.Интрамедуллярную иглу удаляли из правой бедренной кости каждой мыши.
Анализ флуоресцентной визуализации
Для флуоресцентной визуализации использовалась система визуализации LB 983 NC100 Night OWL (Berthold Technologies, Германия). Поскольку трудно обнаружить флуоресценцию под глубокими мышцами, бедренная кость была удалена вместе с контрлатеральной бедренной костью в качестве контроля на 7, 14, 28 и 42 дни после перелома. Образцы были немедленно визуализированы при эмиссии 600 нм и возбуждении 530 нм с использованием группы обработки AMD3100 в качестве положительного контроля.Сигнал флуоресценции в интересующей области [10], измеренный как интегрированные фотоны в секунду / см 2 / стерадиан, был нормализован путем деления фонового сигнала в аналогичной интересующей области на противоположной интактной бедренной кости.
Micro-CT
Кости разморозили при комнатной температуре и удалили лишнюю ткань. Бедренные кости были выровнены вертикально на пенополистироле, чтобы кости оставались стабильными и разделенными. Образцы сканировали с разрешением 20 мкм, временем экспозиции 2000 с, углом приращения 0,5 и 80 кВ и 450 мкА с помощью сканера Micro-CT (система RS-9; MicroView 2.1, GE Healthcare, Онтарио, Канада). Область сканирования была отрегулирована вручную, чтобы включить только костную мозоль и кортикальный слой кости, непосредственно прилегающие к костной мозоли, в 400 срезах.
Оценка в 3D
В данных микро-КТ изображения, представляющих интерес, была каллус, участок среднего диафиза длиной 6 мм (250 срезов). Интересующий объем был определен вручную с помощью процесса сегментации изображения. Для 2D-томограмм (поперечные срезы костной мозоли) через каждые 10 срезов внешняя граница костной мозоли и периостальная поверхность исходной коры определялась вручную, а для определения границ костной мозоли и коры на промежуточных томограммах использовалась линейная интерполяция.Интересующий объем был определен как область, заключенная этими двумя контурами на всех серийных томограммах. Таким образом, эта процедура исключила ранее существовавшую кортикальную кость и объем костномозгового канала из анализа (рис. 2D). Для объема исследуемой области были определены количественно следующие параметры: общий объем (TV), объем кости (BV), объемная доля кости (BV / TV) (означает каллус / общий объем) и минеральная плотность кости (BMD).
Механическое тестирование
На 42-й день пять образцов из каждой экспериментальной группы были случайным образом отобраны для биомеханического тестирования трехточечного изгиба, как описано ранее [11].Кость загружали в систему ELF 5100 на основе электроизоляции (Bose Corp., Framingham, MA, https://www.bose-electroforce.com) со скоростью смещения 0,3 мм / мин до тех пор, пока не наблюдалось разрушение кости. Кривая силы-смещения использовалась для расчета максимальной нагрузки, максимальных радиальных градусов, упругих радиальных градусов и жесткости с использованием программного обеспечения WinTest Control [12].
Количественная ОТ-ПЦР
РНКэкстрагировали из мозолей перелома на 3-й день и на 1, 2, 3 и 4 недели после перелома и транскрибировали в кДНК с помощью ReverTrace qPCR RT Master Mix (TOYOBO Life Science).Реакции RT-PCR с SYBR Green Real-time PCR Master Mix-Plus (TOYOBO Life Science) проводили в трех экземплярах с использованием системы StepOne Real-Time PCR System (Applied Biosystems, Карлсбад, Калифорния, США). Параметры цикла включали начальную инкубацию при 95 ° C в течение 60 секунд, затем 40 циклов при 95 ° C в течение 15 секунд, 58 ° C в течение 15 секунд и 72 ° C в течение 45 секунд. ПЦР-амплификация кДНК для хемокинов SDF-1, TGF-β1 и MCP-3 с использованием наборов праймеров, специфичных для мыши, из таблицы 1 (SBS Genetech, Пекин). Экспрессию GAPDH использовали в качестве контроля нормализации.Метод 2 -ΔΔCt использовали для оценки относительных уровней экспрессии.
Таблица 1 Список праймеров, используемых для q-RT ПЦРВестерн-блоттинг
Вестерн-блоттинг выполняли, как описано ранее [13]. Вкратце, каллусы измельчали в жидком азоте и инкубировали с буфером для лизиса RIPA (P0013B, Beyotime Institute of Biotechnology, Шанхай) при 4 ° C в течение 30 минут с встряхиванием каждые 5 минут. Затем образцы центрифугировали 10 мин при 14000 об / мин при 4 ° C.Денатурированные белки разделяли с помощью SDS-PAGE и переносили на PVDF-мембрану, которую блокировали 5% обезжиренным молоком в 1 × трис-буферном физиологическом растворе Tween-20 (TBST, Applygen Technologies, Пекин). Затем мембрану инкубировали с первичным антителом (анти-BMP2, анти-TGF-β1, анти-VEGF или анти-β-актином (все от Abcam, Массачусетс, США)), а затем козьим антителом, конъюгированным с пероксидазой хрена. вторичные антитела IgG мыши (Институт биотехнологии Beyotime, Шанхай). Затем мембрану экспонировали с пленкой Kodak Biomax-Ml (Eastman Kodak Co., СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ). Сигналы количественно оценивали с помощью денситометрии.
Гистологическая оценка
Образцы из трех лечебных групп, инъецированные на 7-й день, были оценены гистологически на 14-й и 42-й дни после перелома. Для гистологического исследования кости фиксировали в 10% параформальдегиде. Образцы были полностью декальцинированы в 14% w / v этилендиаминтетрауксусной кислоты (ЭДТА), замененной три раза в неделю в течение 4 недель [14]. После декальцификации деминерализованные бедренные кости подверглись парафиновой заливке и серийным сечениям с интервалами 5 мкм.Для гистологического анализа выполняли стандартное окрашивание гематоксилином и эозином (H&E) и трихромом по Массону. Изображения были получены с использованием микроскопа Olympus BX51, оснащенного камерой DP71 (Токио, https://cn.olympus.com/).
Статистический анализ
Данные выражены как среднее ± стандартное отклонение. Статистический анализ проводился с использованием однофакторного дисперсионного анализа и теста наименьшей значимой разницы с использованием программного обеспечения SPSS 13.0 (SPSS Inc., Чикаго, Иллинойс). P <0,05 считалось показателем статистической значимости.
Улучшенное заживление переломов у пациентов с сопутствующей черепно-мозговой травмой: доказано или нет?
За последние 3 десятилетия научные данные подтверждают связь между черепно-мозговой травмой (ЧМТ) и ускоренным заживлением перелома. Многочисленные клинические и доклинические исследования показали усиленное образование костной мозоли и увеличенный объем костной мозоли у пациентов, соответственно, крыс с сопутствующей ЧМТ. Со временем в фокусе внимания оказались различные вещества (цитокины, гормоны и т. Д.), Чтобы прояснить взаимосвязь между ЧМТ и заживлением переломов.До сих пор механизм, лежащий в основе этих отношений, полностью не выяснен, и в литературе не удалось достичь консенсуса относительно того, какое вещество играет ключевую роль. В этом обзоре мы дадим обзор текущих концепций и мнений по этой теме, опубликованных за последнее десятилетие, и обсудим как клинические, так и патофизиологические теории.
1. Введение
1.1. Краткое содержание обзора
За последние 3 десятилетия было опубликовано множество исследований, которые либо поддерживают, либо отвергают гипотезу об усиленном развитии костной мозоли и заживлении переломов у пациентов с сочетанной черепно-мозговой травмой (ЧМТ).Исследования по развитию гетеротопических оссификаций у пациентов с параличом идут еще дальше. Первые исследования по этой теме, посвященные вопросу о том, влияет ли на заживление перелома сопутствующая ЧМТ, были опубликованы в начале 1960-х годов. Несмотря на эту историю исследований, до сих пор нет убедительных доказательств того, существует ли связь между ЧМТ и усиленным образованием костной мозоли. Более того, патофизиологическая подоплека этих явлений в литературе не выяснена. Первый обзор по этим вопросам был опубликован Морли и его коллегами в 2005 г. [1].Они изучили литературу по этой теме до 2001 года, но не нашли однозначного ответа на свой главный вопрос, приводит ли черепно-мозговая травма к ускоренному заживлению перелома. Цель нашего обзора — оценить текущее состояние знаний и собрать обновленную информацию по этой теме. Доказательства взаимосвязи между ЧМТ и заживлением перелома могут быть важны в качестве основы для дальнейших исследований, чтобы прояснить механизм нормального и патологического заживления переломов.
2. Методы
Следующие критерии были использованы для определения правомочности исследования для включения в этот обзор.Был проведен поиск литературы в Medline, Embase и Cochrane для исследований, опубликованных с января 2001 г. по декабрь 2012 г. по теме заживления переломов у субъектов с сопутствующей черепно-мозговой травмой. Следующие поисковые термины использовались в различных комбинациях: «травма головы», «черепно-мозговая травма», «церебральная травма», «заживление перелома», «заживление кости», «псевдоартроз» и «окостенение суставов». Поиск ограничивался рукописями на английском, немецком или голландском языках. Письма в редакцию и истории болезни были исключены.Ссылки на избранные исследования также искались для статей, которые могли быть пропущены при электронном поиске.
2.1. Выбор исследования
Название и аннотации всех выявленных исследований () были изучены одним рецензентом (Мартин Хофман). Затем вся статья была получена и оценена на пригодность двумя авторами (Мартейн Хофман и Филипп Коббе). Любой вопрос, касающийся права на учебу, решался путем обсуждения со старшим автором (Ханс-Кристоф Папе).В результате появилось 26 статей, которые не вошли в обзор Морли и его коллег. В 13 статьях описывались клинические исследования, из которых 6 были проспективными, а 7 — ретроспективными когортными исследованиями. Еще тринадцать исследований были доклиническими («in vitro» / «in vivo»), включая один обзор.
3. Заживление перелома
Заживление перелома происходит либо путем прямого внутримембранного заживления, либо за счет непрямого внутримембранного и эндохондрального заживления. Непрямое заживление перелома — наиболее распространенная форма, которую можно разделить на несколько этапов (рис. 1).Первая стадия, названная стадией воспаления , начинается с перелома и может длиться около 5 дней. На этой стадии гематома перелома организует и образует связь между фрагментами перелома. Эта гематома состоит из клеток крови, мезенхимальных стволовых клеток, фибробластов, остеокластов, остеобластов, цитокинов, факторов роста и других гормонов.
Вторая стадия называется стадией образования мягкой (или мостовидной) костной мозоли и длится 2-3 недели. Фибробласты внутри грануляционной гематомы откладывают фиброхрящевую и хрящевую ткань, которая образует слабый мост между фрагментами перелома.Продолжительность третьей стадии заживления перелома, стадии формирования твердой (или медуллярной) костной мозоли , зависит от анатомического места перелома и занимает от 6 до 12 недель. На этой стадии хрупкая мостиковая мозоль расширяется до твердой каллуса за счет отложения минералов. На последней стадии ремоделирования , которая может длиться до 5 лет после травмы, происходит адаптация кости по закону Вольфа. Этот закон объясняет, что в ответ на внешнюю нагрузку кость будет восстановлена до своей первоначальной формы, включая резорбцию кости остеокластами и образование новой кости остеобластами.
В острой воспалительной реакции заживления переломов участвуют цитокины, такие как фактор некроза опухоли α (TNF- α ), интерлейкин-1 (IL-1) и интерлейкин-6 (IL-6). . TNF- α действует как провоспалительный медиатор и хемотаксический агент. Кроме того, он усиливает остеогенную дифференцировку мезенхимальных стволовых клеток (МСК) [2]. TNF- α достигает пика примерно через 24 часа и возвращается к исходному уровню примерно через 72 часа после травмы [3]. IL-1 продуцируется в острой фазе макрофагами в двухфазном режиме.ИЛ-1 индуцирует продукцию ИЛ-6 остеобластами, образование хрящевой каллуса и ангиогенез [2, 4, 5].
IL-6, который активен только в острой фазе, также усиливает ангиогенез, продукцию фактора роста эндотелия сосудов (VEGF-) и дифференциацию остеобластов и кластеров [6].
После черепно-мозговой травмы уровни цитокинов повышаются как в спинномозговой жидкости, так и в сыворотке крови. Хотя группа Косманна обнаружила примерно в 10-100 раз более высокий уровень посттравматических уровней ИЛ-6 и ИЛ-8 в спинномозговой жидкости по сравнению с плазмой [7-10], неясно, вызван ли этот градиент быстрым периферический метаболизм в печени [11] или изначально более высокая локальная продукция в микроглии, астроцитах и макрофагах [10, 12].Кроме того, нет исследований, подтверждающих прямую корреляцию между повышенным уровнем цитокинов и улучшенным заживлением переломов или образованием костной мозоли.
Незаменимым для заживления переломов является привлечение скелетных стволовых клеток из окружающих тканей к месту перелома. Скелетные стволовые клетки — это мезенхимальные стволовые клетки, которые могут дифференцироваться в типы скелетных клеток, включая остеобласты, хондроциты, адипоциты, фибробласты и адвентициальные ретикулярные клетки [13].Эти скелетные стволовые клетки выполняют три основные функции: они функционируют как центры передачи сигналов, они обеспечивают поддерживающее микроокружение для гемопоэза, а также стабилизируют и поддерживают синусоидальную сеть в месте перелома. Хотя механизм рекрутирования этих клеток все еще неясен, недавнее мнение состоит в том, что фактор-1, производный стромальных клеток, и его ось CXCR-4 рецептора, связанного с G-белком (ось SDF-1 / CXCR-4), играют роль важная роль [14–16]. Другие концепции рекрутирования приписывают роль трансформирующему фактору роста- β (TGF- β ), костным морфогенетическим белкам (BMP), инсулиноподобному фактору роста-1 (IGF-1), клеточному ретинол-связывающему белку 1 ( CRBP-1), фактор, стимулирующий остеобласты (OSF-1), и индуцируемый гипоксией фактор-1 α (HIF-1 α ) [10].
Вслед за активностью МСК в месте перелома возникает другой иммунологический каскад, в котором суперсемейство трансформирующего фактора роста- β (TGF- β ), особенно TGF- β 2, TGF- β 3 , GDF-5, BMP-5 и BMP-6, по-видимому, участвуют [17, 18]. TGF- β стимулирует рост клеток остеобластического происхождения и действует как хемоаттрактант для остеобластов. Другой предполагаемой функцией TGF- β является увеличение эндогенной продукции морфогенов, таких как морфогенетические белки костей [19].Как члены суперсемейства TGF- β , три члена подсемейства BMP усиливают рост костей в периферических местах, то есть BMP-2, BMP-4 и OP-1 (ранее BMP-7) [20–22] . Работа Спектора и его коллег показывает, что эти три BMP экспрессируются как на ранних, так и на поздних стадиях заживления и ремоделирования кости, и как только сформировалась зрелая кость, концентрация BMP снова нормализуется [23].
Реваскуляризация места перелома и костной мозоли регулируется ангиопоэтин-зависимым путем, при котором первое прорастание сосудов происходит из существующих сосудов надкостницы.Однако основная часть реваскуляризации регулируется путем VEGF, который трансформирует бессосудистый хрящевой матрикс в васкуляризованную костную ткань [24]. При трансформации мягкой костной мозоли в твердую, семейство белков Wnt модулирует дифференцировку МСК в клон остеобластов, а затем и формирование остеобластов. Другой каскад иммунных факторов, таких как макрофагальный колониестимулирующий фактор (M-CSF), активатор рецептора ядерного фактора, лиганда каппа B (RANKL), остеопротегерин (OPG) и TNF- α , запускает резорбцию хряща и конверсия в кальцифицированной костной ткани [25].
Последняя стадия ремоделирования при заживлении перелома регулируется IL-1, TNF- α и некоторыми BMP, особенно BMP-2, а также давлением, прикладываемым к кристаллической среде [26].
4. Черепно-мозговая травма
Прогноз черепно-мозговой травмы зависит как от первичного, так и от вторичного повреждения головного мозга. В момент первоначального травматического воздействия на нейрокраниум и ткань головного мозга возникает первичная травма головного мозга, которая состоит из сотрясения мозга, ушиба, срезания, разрывов и растяжения аксонов [27].В случаях тяжелого первичного повреждения головного мозга, при котором происходит поражение нейронов, аксонов и клеток микроглии, уровень смертности очень высок.
Вследствие первичного повреждения отложенный комплексный иммунологический, биохимический и физиологический патомеханизм, который продолжается от нескольких дней до недель, приводит к вторичному повреждению головного мозга [27–29]. Это вторичное повреждение головного мозга является многофакторным процессом, который вызывается и находится под влиянием различных процессов, таких как эксайтотоксичность, воспаление, отек, гибель клеток, митохондриальное повреждение, истощение запасов магния, выработка свободных радикалов и повреждение гематоэнцефалического барьера [27, 28, 30].
4.1. Эксайтотоксичность
После первичного и вторичного повреждения головного мозга эксайтотоксичность возникает в результате разрушения нейронов, нагруженных возбуждающими нейротрансмиттерами [28, 31]. Из этих высвобождаемых нейротрансмиттеров глутамат является наиболее заметным нейромедиатором в головном мозге. Эта секреция глутамата начинается через несколько минут после первичной травмы, достигает пика примерно через 10 минут после травмы и остается увеличенной в течение нескольких дней [31]. Через этот разряд глутамата инициируется саморазрушающий каскад путем притока кальция, за которым следует перегрузка кальцием, что приводит к стимуляции кальций-зависимых ферментов, таких как протеазы, липазы и эндонуклеазы [27].
4.2. Воспаление
Обычно после травмы, классической или нейрогенной, следует каскад воспаления и нарушение регуляции иммунной системы, что отрицательно влияет на неврологическое повреждение [28]. Происходят цитотоксические и воспалительные явления с инфильтрацией лейкоцитов, макрофагов, лимфоцитов и естественных клеток-киллеров. Существует множество медиаторов, влияющих на воспалительный процесс после ЧМТ. Среди прочего, это компоненты комплемента, хемокины и цитокины [32].
Система комплемента активируется после ЧМТ за счет пассивной утечки через поврежденный ГЭБ или за счет внутримозгового синтеза [33–35]. В качестве «первой линии защиты» эта система способствует воспалению путем привлечения провоспалительных молекул, фагоцитоза, апоптоза и повреждения ГЭБ.
Другими важными провоспалительными модуляторами являются хемокины. Эти связывающие гепарин белки, которые продуцируются воспалительными клетками, способствуют проникновению лейкоцитов в травмированную ткань мозга и тем самым усиливают воспалительную реакцию после ЧМТ.
Существует также много цитокинов, которые играют провоспалительную роль в процессе после ЧМТ. В результате высвобождения нейропептидов из сенсорных нейронов в случае нейрогенного воспаления, экстравазации плазмы, вазодилатации и гиперчувствительности нейронов [36] наиболее заметными вовлеченными нейропептидами являются члены семейства брадикининов и тахикининов, из которых CGRP (ген кальцитонина) -связанный пептид) и вещество P являются наиболее заметными показателями [37].
Однако несколько исследований за последнее десятилетие приписывают двойную роль некоторым медиаторам, предполагая провоспалительный и противовоспалительный эффект в воспалительном процессе после ЧМТ.Эта двойная роль часто демонстрируется зависящими от времени провоспалительными и противовоспалительными характеристиками различных иммуномодуляторов, таких как IL-1, IL-6, TNF- α и хемокин (особенно фракталкин (CX 3 ). CL 1 )) [38–41].
Для TNF- α , который, по-видимому, синтезируется в самой ткани мозга в качестве эндогенного ответа на ЧМТ в первые несколько часов, такая двойная функция продемонстрирована в нескольких исследованиях [39, 41–43]. Эти исследования демонстрируют раннюю провоспалительную (1-2 дня) и позднюю противовоспалительную (2-4 недели) роль TNF- α .TNF- α увеличивает проницаемость сосудов, что приводит к набуханию ткани мозга и инфильтрации лейкоцитов. Он также вызывает некроз и апоптоз через внутриклеточные пути и активирует воспалительный медиатор анафилатоксин (C5a) в нейронах [44].
Важная роль в воспалении после ЧМТ отводится семейству интерлейкинов-1. IL-1 вызывает апоптоз нейронов и VEGF, важный медиатор для возникновения посттравматического отека. Точный эффект ИЛ-1, нейротоксический или нейропротекторный, зависит от среды, в которой находится этот цитокин.Кроме того, IL-18 повысил концентрацию в спинномозговой жидкости после TBI [45], и, ингибируя как IL-1, так и IL-18, вторичное повреждение головного мозга после TBI могло быть уменьшено [41]. Двойная роль семейства интерлейкинов показывает провоспалительную фазу в первые часы и дни после ЧМТ, за которой следует фаза репарации, продолжающаяся от нескольких дней до месяцев [46].
Также IL-6, который продуцируется нейронами и макрофагами сразу после ЧМТ (через 1 час после травмы), может способствовать воспалительной реакции, но также обладает противовоспалительным действием [42, 43].Эти противовоспалительные эффекты усиливаются способностью IL-6 ингибировать синтез TNF- α , индуцировать фактор роста нервов (NGF), способствовать выживанию и дифференцировке нейронов и противодействовать N -метил-D-аспартату. опосредованная токсичность [42]. Другим аспектом IL-6 как агониста VEGF является его способность усиливать ангиогенез и реваскуляризацию и тем самым способствовать восстановлению тканей мозга [47–50].
TGF- β , который увеличивается в первые дни после травмы, может продуцироваться практически всеми клетками центральной нервной системы (ЦНС).Этот фактор роста противодействует процессу воспаления, подавляя высвобождение ИЛ-1, TNF-, α , IFN-, γ (интерферон-, γ ), кислородных радикалов, экспрессии антигена MHC класса II, активации Т-клеток и пролиферация различных клеток [51–55]. Напротив, хемотаксическая функция TGF- β приводит к инвазии лейкоцитов и отложению внеклеточного матрикса (ECM) и образованию рубцовой ткани. Эти последние функции являются более провоспалительными [56, 57].
4.3. Отек
Хотя многие факторы влияют на заболеваемость и смертность, степень отека мозга, по-видимому, является главным предиктором функционального исхода после ЧМТ [37, 41, 58]. После ЧМТ выявляются две формы отека. Вазогенный отек, который вызывается экстравазией жидкости из сосудистой сети, возникает рано после травмы и связан с повышенной проницаемостью ГЭБ. Последующий цитотоксический отек возникает из-за осмотического сдвига внеклеточной жидкости во внутриклеточный компартмент.Последние формируются как нейротоксические свойства и составляют большую часть мозга после ЧМТ [37, 59]. Ключевыми игроками в развитии постинюрального отека являются аквапорины (AQP), матриксные металлопротеиназы (MMP) и вазоактивные агенты. Экспрессия нескольких AQP, которые являются интегральными мембранными белками, активируется после TBI и способствует формированию отека [60]. ММП представляют собой цинк-зависимые эндопептидазы, участвующие в процессе ремоделирования тканей после различных патологических состояний. Регуляция экспрессии ММР сложна, и в случаях нарушения регуляции, вызванного ЧМТ, инсультом или нейродегенерацией, выявляется синаптическая потеря и разрушение ГЭБ, что вызывает вазогенный отек и последующую гибель клеток [61–64].Наиболее важные вазоактивные агенты являются членами семейств брадикининов и тахикининов и образуются в процессе нейрогенного воспаления. В частности, считается, что вещество P усиливает образование отеков [37].
В случае образования посттравматического отека набухание клеток и паренхимы приводит к повышению внутричерепного давления (ВЧД) с последующим снижением церебрального перфузионного давления (ЦПД). Со временем может произойти грыжа ствола мозга [37].
4.4. Смерть клеток
Смерть клеток после ЧМТ происходит в первые 24 часа, прежде всего в результате некроза, при котором происходит набухание митохондрий и других органелл и последующая дегенерация мембран. В последующие дни гибель клеток также происходит через апоптоз, при котором происходит конденсация и фрагментация ДНК, сжатие клеток и окончательное образование апоптотических телец [65]. Еще одним осложняющим фактором является то, что ингибирование одного механизма гибели клеток может усугубить другой механизм гибели клеток и наоборот [66, 67].
Кроме того, помимо высвобождения множества провоспалительных модуляторов каскадом нейрогенного воспаления, как описано выше, апоптотические и некротические клетки высвобождают множество цитотоксических цитокинов, факторов роста и интерлейкинов, что приведет к порочному кругу воспаления и гибели клеток. которая может длиться месяцами после первоначальной травмы [41, 42, 68].
4.5. Повреждение митохондрий
Мозг и нервные ткани требуют большого количества энергии, и поэтому митохондрии имеют огромное значение для выживания этих тканей.Тяжелые повреждения митохондрий могут вызвать разрушительные изменения митохондриального дыхания, дыхательного сопряжения и производства энергии [69–71].
4.6. Истощение запасов магния
Универсальным аспектом повреждения центральной нервной системы (ЦНС) является уменьшение внутриклеточного свободного магния, который обычно играет решающую роль в нормальном функционировании клеток, регулируя многочисленные физиологические и биохимические процессы внутри клетки [72]. Магний является необходимым кофактором во всех реакциях производства и потребления энергии, и более 300 ферментов, участвующих в этих процессах, зависят от магния [27].Помимо этих эффектов на ферменты, на целостность плазматической мембраны и активность ионных каналов также влияет магний [73].
4.7. Производство свободных радикалов
В процессе окислительного метаболизма свободные радикалы образуются как обычные побочные продукты. Производство этих высокореактивных молекул значительно усиливается при травмах [74–76]. Белки, ДНК и липиды могут быть повреждены высокими концентрациями этих свободных радикалов, что приводит к гибели клеток через апоптоз [77].
4.8. Повреждение гематоэнцефалического барьера
Если ЧМТ высвобождает церебральный медиатор, влияющий на заживление костей, он должен пересечь гематоэнцефалический барьер (ГЭБ). ГЭБ образован нервно-сосудистой единицей, соединением цереброваскулярных эндотелиальных клеток, перицитов, астроцитов и базальной пластинки [78]. ГЭБ строго регулирует обмен веществ между плазмой и церебральным интерстицием [32]. После ЧМТ происходит двухфазное нарушение ГЭБ с повышенной проницаемостью вначале с максимумом через 4–6 ч после травмы, за которым следует временное восстановление и длительный период повышенной проницаемости [37, 79, 80].И маленькие, и большие молекулы способны преодолевать этот барьер внутри и вокруг места повреждения [81]. Восстановление ГЭБ длится примерно от 4 часов для больших молекул до примерно 4-7 дней для маленьких молекул [37, 81]. На проницаемость ГЭБ влияет множество факторов. Вначале нарушение вызвано механической силой, но в более позднем течении ЧМТ за влияние на ГЭБ отвечают другие медиаторы, такие как VEGF, ангиопоэтины, IL-1 β , IL-8, TNF- α. , активные формы кислорода, кинины, гистамины, оксид азота, эластаза и матриксная металлопротеиназа (ММП) [82–90].Кроме того, на эту проницаемость также влияет гипоксия после ЧМТ, в основном примерно через 6 часов после травмы, и она может задержать восстановление ГЭБ до 72 часов [91].
5. Обзор литературы
Когда мы рассматриваем все исследования по теме ЧМТ и заживления костей за последние десятилетия, более 50 различных клеток, гормонов, факторов роста, цитокинов, хемокинов и т.д. в нескольких случаях есть многообещающие результаты (таблица 1).
| ||||||||||||||||||||||||||
За последнее десятилетие было проведено 26 исследований по этой теме после публикации Морли и его коллег. Около 50% этих исследований [92–98, 101–107] находят доказательства повышенного образования костной мозоли в случаях сопутствующей ЧМТ; другие исследования неубедительны.
Есть только 7 из этих исследований, которые также постулируют возможный рабочий механизм этой корреляции. Это исследования, на которых мы остановимся в нашем обзоре (таблица 2).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
5.1. Мезенхимальные стволовые клетки человека (hMSC)
Kanczler и Oreffo подчеркивают важность ангиогенеза в сочетании с остеогенезом для оптимизации роста костей [108].При заживлении перелома ангиогенез предшествует остеогенезу. Xiao и его коллеги показали, что стромальные стволовые клетки костного мозга (BMSCs) обладают возможностью экспрессировать как BMP-2, так и VEGF, и поэтому эти мезенхимальные стволовые клетки усиливают заживление переломов более явно по сравнению с добавлением какого-либо одного фактора [109]. Также Ямада и его коллеги подтверждают важность комбинации остеогенных и ангиогенных факторов в регенерации кости. Они обнаружили, что смесь богатой тромбоцитами плазмы и мезенхимальных стволовых клеток может вызвать лучшую регенерацию кости с хорошей васкуляризацией [110].В каскаде после переломов важную роль играют мезенхимальные стволовые клетки. Эти МСК происходят из костного мозга, надкостницы и т. Д. И возникают в случае перелома, чтобы мигрировать к месту перелома в ответ на BMPs, высвобождаемые из поврежденного костного матрикса [111, 112].
В месте перелома эти МСК продуцируют разные белки, и эти белки могут дифференцировать мезенхимальные стволовые клетки, в свою очередь, для ускорения процесса заживления перелома [23].
Как мультипотентные клетки, МСК могут дифференцироваться в разные мезенхимальные клоны, которые поддерживают формирование различных тканей, таких как кости, хрящи, жир, сухожилия, мышцы и строма костного мозга [110, 113].
Эта дифференциация происходит под влиянием разных факторов. Помимо белков, поступающих из мезенхимальных стволовых клеток, как описано выше, Боес и его коллеги предполагают влияние неизвестных факторов, выделяемых поврежденной тканью мозга, которые проявляют свой пролиферативный эффект, специфичный для мезенхимальных стволовых клеток [92]. В своем анализе in vitro они показали, что сыворотка крыс с переломом и сопутствующей ЧМТ стимулировала мультипотентную линию мезенхимальных стволовых клеток (C3h20T-клетки) для пролиферации на значительно более высоком уровне (), что привело к увеличению количества клеток на 76%. группу переломов / ЧМТ по сравнению с группой только переломов.Они также исследовали остеобластные (MC3T3-14-клетки) и фибробластные (NIH 3T3-клетки) линии клеток, но здесь они не обнаружили никакой разницы в скорости пролиферации [92]. Боес и его коллеги сравнили мозоль у крыс с переломом бедренной кости с сопутствующей ЧМТ и без сопутствующей ЧМТ. Было показано, что через 21 день костная мозоль в группе с ЧМТ и переломом уменьшилась в диаметре (), но она значительно жестче (0,306 Н / мм по сравнению с 0,120 Н / мм;), чем в группе только с переломом. Прочность на кручение была одинаковой в обеих группах (258.4 Нм по сравнению с 231,4 Нм; ) [92].
Группа Кадоша и Гаучи исследовала линию фетальных мезенхимальных стволовых клеток остеобластов человека (клетки hFOB1.19) на ранней стадии ее дифференцировки [94, 95]. В более раннем исследовании они увидели, что спинномозговая жидкость пациентов с черепно-мозговой травмой обладает остеоиндуктивным потенциалом, и поэтому ожидали, что любой остеоиндуктивный фактор в сыворотке крови пациентов с черепно-мозговой травмой будет оказывать стимулирующее действие на hFOB1.19 клеток in vitro [114, 115]. Этот потенциал достигает максимума уже через 6 часов после травмы, он остается на том же уровне в течение примерно 3 дней и снижается примерно через 1 неделю [94]. Они также наблюдали повышенную скорость пролиферации остеобластов, подвергшихся воздействию сывороток пациентов с ЧМТ в течение первой недели после травмы [94].
Временное окно этого эффекта, возможно, объясняется травматическим разрывом гематоэнцефалического барьера, что приводит к утечке спинномозговой жидкости и восстановлению гематоэнцефалического барьера примерно через 1 неделю.Еще одно объяснение снижения остеоиндуктивного потенциала через 1 неделю — снижение выработки остеогенных факторов поврежденным мозгом [94, 95].
Другим результатом, о котором сообщила группа Кадоша и Гаучи, была повышенная экспрессия гена маркера дифференцировки остеобластов в сыворотке крови пациентов с повреждением головного мозга, таких как ALP, CATK, RUNX-2, фактор, стимулирующий колонию макрофагов, и SP-7. [95, 116, 117].
В клинической части своего исследования Gautschi и его коллеги наблюдали в группе ЧМТ и переломов у 41 пациента.7% случаев, клинические и рентгенологические доказательства образования гипертрофической костной мозоли. Ни в одном из случаев в группе только с переломами не развилась гипертрофическая костная мозоль. Более того, Cadosch и его коллеги обнаружили положительную корреляцию между соотношением каллусов и пролиферацией клеток hFOB1.19. Напротив, они обнаружили обратную корреляцию между временем сращения перелома и соотношением каллусов, а также между шкалой комы Глазго (GCS) и соотношением каллусов [95].
В недавнем исследовании Янга и его коллег in vitro были отмечены повышенные уровни арахидоновой кислоты (АК) в сывороточных метаболитах крыс после ЧМТ.Они показали, что в присутствии арахидоновой кислоты на экспрессию и пролиферацию костного гамма-карбоксиглутаматного белка (BGLAP или остеокальцина) положительно влияет и, таким образом, увеличивается пролиферация линии остеобластических клеток мыши MC3T3-E1. Они предполагают ключевую роль арахидоновой кислоты в процессе усиленного образования каллуса у крыс с ЧМТ [98].
5.2. Лептин и CGRP
При метаболическом, воспалительном и нейроэндокринном стрессовом ответе, возникающем после ЧМТ, уровни лептина, гормона, полученного из жировой ткани, в сыворотке крови значительно повышаются [93].На уровень лептина также влияют различные цитокины и гормональные факторы, но точный путь того, как лептин влияет на формирование кости, полностью не изучен. Предполагается, что провоспалительный цитокин IL-1 быстро увеличивается после травмы головного мозга, и это может вызывать повышение уровня лептина в сыворотке [118, 119].
Более того, Wei и его коллеги [93] обнаружили положительную корреляцию между концентрацией лептина в сыворотке и объемом образования костной мозоли у пациентов с переломом и черепно-мозговой травмой.Лептин может влиять на метаболизм костей двумя путями. В первом центральном пути лептин проявляет свой антиостеогенный эффект за счет увеличения симпатической активности, контролируемой гипоталамусом. Во втором периферическом пути лептин оказывает противоположное действие и способствует минерализации костей и дифференцировке остеобластов в остеоциты [93]. Они предложили несколько путей повышения уровня лептина в сыворотке крови. Во-первых, мобилизация свободных жирных кислот в результате гиперметаболизма у пациентов с черепно-мозговой травмой приводит к повышению уровня лептина в сыворотке по механизму нейроэндокринной обратной связи [120].Во-вторых, гипоксия, вызванная респираторным дистресс-синдромом у взрослых или воспалительной реакцией легких у травмированных пациентов, увеличивает экспрессию лептина в адипоцитах [121]. Наконец, высвобождение костного мозга на концах перелома, содержащего в основном гемопоэтические клетки, индуцирует доставку лептина на тканевом уровне [122]. Кроме того, сложный нейроэндокринный воспалительный ответ после ЧМТ с высвобождением множества цитокинов и гормонов влияет на выработку и уровни лептина.
Wei и его коллеги показали, что концентрация лептина в сыворотке крови достигает значительного повышения уровня только с 4-й по 12-ю неделю после травмы.Это можно объяснить тем, что в остром посттравматическом периоде стрессовая реакция увеличивает симпатический отток, что снижает экспрессию лептина и секрецию адипоцитами. Секреция лептина адипоцитами также снижается из-за состояния натощак пациента с травмой в острой посттравматической стадии. После начального посттравматического периода периферический эффект увеличения лептина может перевесить симпатическое ингибирование лептина на формирование кости [123, 124].
Результаты Вэй и его коллег подтверждают концепцию Рейнера и Трейхурна в 2001 г. и Такеда и его коллег в 2002 г. о том, что повреждение гипоталамуса может привести к дополнительной периферической секреции лептина, что, в свою очередь, может ослабить антиостеогенные эффекты лептина через потеря симпатического ингибирования лептина, что способствует усиленной регенерации костей, наблюдаемой у крыс с переломами и ЧМТ [93].
В своей оценке образования костной мозоли Wei и его коллеги показали значительно увеличенный объем костной мозоли у крыс с ЧМТ и переломом по сравнению с крысами с переломом только с 4-й по 8-ю неделю после травмы. Это увеличение спадает через 12 недель после травмы, но при гистологическом анализе они все еще могут подтвердить образование более толстой пластинчатой кости в группе с ЧМТ и переломом через 12 недель после травмы [93].
Другой возможный механизм действия лептина на заживление переломов — через пептид, связанный с геном кальцитонина (CGRP).Чжан и его коллеги [125] показали в 2011 году, что периферическое введение лептина облегчает повреждение головного мозга, вызванное травмой, за счет стимулирования экспрессии CGRP, улучшения регионального мозгового кровотока и уменьшения объема локального инфаркта и неврологического дефицита. Кроме того, лептин также стимулировал экспрессию bcl-2 и подавлял каспазу-3 in vivo и vitro после повреждения. Введение CGRP (8-37), антагониста рецептора CGRP, частично устраняет положительные эффекты лептина и восстанавливает нормальные уровни экспрессии bcl-2 и каспазы-3 в нейронах, что указывает на то, что лептино-индуцированная защита нейронов снижается. коррелировал с выпуском CGRP.
Результаты Сонг и его коллег показали in vivo значительно повышенную концентрацию CGRP у крыс с переломом бедренной кости и сопутствующей черепно-мозговой травмой. Эти концентрации были обнаружены как в мозговой ткани, так и в мышечной ткани, окружающей перелом. Они пришли к выводу, что существует взаимность между черепно-мозговой травмой и ускоренным заживлением переломов, и предположили, что CGRP продуцируется тканью мозга. Этот вывод был основан на наблюдении, что CGRP экспрессируется в коре головного мозга и вокруг места перелома в группе с ЧМТ и переломом, а не в группе только с переломом [97].
В своем микро-КТ-анализе образования костной мозоли они наблюдали значительное увеличение минеральной плотности костной ткани (BMD) и минерального содержания костной ткани (BMC) в новообразованной костной мозоли в группе с ЧМТ и переломами по сравнению с группой только с переломами в группе переломов. 4-я неделя после травмы. То же измерение на 8-й неделе после травмы показало, что BMD была безразличной, а BMC была значительно ниже в группе только с переломами по сравнению с группой TBI и переломов. По словам Сонга и его коллег, это свидетельствует о более раннем заживлении перелома в случаях сопутствующей ЧМТ [97].
В 2000 году Гарсиа-Кастеллано и его коллеги [126] уже подтвердили сильное влияние CGRP на ангиоэктазию капилляров, что, как обсуждалось ранее, чрезвычайно важно для ускорения образования кости. Согласно Zhang и соавторам [96] CGRP может выполнять эту гемангиэктазическую роль в месте перелома из-за аксоплазматического транспорта CGRP из центральной нервной системы.
6. Обсуждение
В течение многих лет врачи заявляют, исходя из своего клинического опыта, что образование костной мозоли / гетеротопическая оссификация и заживление переломов ускоряются у пациентов с сопутствующей черепно-мозговой травмой.Однако эти утверждения не основаны на убедительных доказательствах в соответствии с литературой, потому что уровень доказательств во всех этих клинических исследованиях не очень высок.
До обзора Morley et al. [1] в 2005 г. было проведено всего 5 клинических исследований, в которых были обнаружены доказательства усиленного образования костной мозоли у пациентов с ЧМТ. Эти исследования включали одно проспективное исследование [99] и 4 ретроспективных исследования [100, 127–129].
За последнее десятилетие было опубликовано шесть клинических исследований, в которых были обнаружены доказательства ускоренного образования костной мозоли или заживления перелома у пациентов с ЧМТ и сопутствующими переломами.Пять из них были проспективными исследованиями с подобранным контролем [94, 95, 98, 102, 103] со средней популяцией пациентов 65,2 (диапазон 28-86) пациентов, а одно исследование было ретроспективным исследованием с подобранным контролем [101] с популяция пациентов 67 пациентов.
В период до 2003 года было проведено 4 клинических исследования, которые возражали против этого клинического опыта, поскольку эти исследования не обнаружили значительных различий в формировании костной мозоли или заживлении переломов между пациентами с черепно-мозговой травмой и без нее.Из этих 4 исследований есть только одно проспективное исследование с подобранным контролем [130], но с 8 пациентами, что, скорее, представляет собой серию случаев. Остальные 3 исследования являются ретроспективными [131–133], из которых только одно исследование является сопоставимым контролем.
За последнее десятилетие не было опубликовано исследований, опровергающих это усиленное образование костной мозоли у пациентов с сопутствующей ЧМТ, но здесь необходимо учитывать предвзятость публикации.
Когда мы рассматриваем исследования, демонстрирующие механизм действия на усиленное образование костной мозоли у пациентов с сопутствующей ЧМТ, в последнее десятилетие можно выделить два основных направления.
Первое основное направление представлено в 4 [92, 94, 95, 98] из 7 рассмотренных статей и ставит в центр внимания мезенхимальные стволовые клетки / скелетные стволовые клетки человека.
В исследовании Boes et al. [92] исследовали взрослых крыс в возрасте 7–9 месяцев. Черепно-мозговую травму назначали, когда животные демонстрировали признаки нормального выздоровления после перенесенного перелома бедренной кости и последующего остеосинтеза, но время между нанесением двух повреждений не упоминалось.Тот факт, что ЧМТ и перелом не вводятся одновременно, как в случае с нормальными пациентами с травмой, может быть смешивающим фактором.
Биомеханический анализ и анализ пролиферации клеток in vitro были выполнены через 21 день после травмы. Этот момент времени является очень ранним, поскольку известно, что полное восстановление механических свойств сломанной бедренной кости у крыс занимает около 4 недель у молодых и около 12 недель у взрослых крыс [134]. Тем не менее, они уже обнаружили значительную повышенную жесткость места перелома в группе перелома и ЧМТ по сравнению с группой только с переломом.Вероятно, это могло бы быть еще более отчетливым на более поздней стадии заживления перелома. Boes et al. [92] пришли к выводу, что уменьшение диаметра костной мозоли в группе перелома и ЧМТ противоречит концепции о том, что ЧМТ увеличивает эндохондральную оссификацию, и они предполагают, что переломы уже перешли в фазу ремоделирования. Что касается ранней временной точки, в которую проводятся эти исследования, это, на наш взгляд, не противоречит вышеупомянутой концепции, поскольку заживление перелома еще не завершилось, а фаза ремоделирования, вероятно, еще не началась.
Кроме того, увеличение пролиферации линии мезенхимальных стволовых клеток C3h20 на 76% является впечатляющим результатом исследовательской группы, которая связывает это усиление с еще неизвестным растворимым фактором из поврежденной нервной ткани. Хотя группа Boes et al. [92] не смогли показать увеличенную пролиферацию более продвинутой линии остеобластических клеток (MC3T3-14), группа Yang et al. наблюдали повышенную пролиферацию более дифференцированной линии остеобластических клеток MC3T3-E1.Следует отметить, что анализ проводился с сывороткой крыс с ЧМТ, взятой только в один момент времени, то есть через 24 часа после травмы. В процессе заживления кости первые несколько дней в основном определяются фазой воспаления, в которой остеобласты могут играть второстепенную роль.
Результаты клинической части исследования Gautschi et al. [94] убедительны с> 40% образования гипертрофической костной мозоли в группе с ЧМТ и переломами по сравнению с группой только с переломами, хотя исследуемые группы довольно малочисленны (соотв.а также ). Они ссылаются на доклинические исследования Boes et al. [92], Mandelin et al. [116] и Camozzi et al. [117], в которых найдено доказательство наличия мозговых факторов с митогенным и остеогенным действием на стромальные стволовые клетки и молекулярных механизмов сывороток от пациентов с повреждениями головного мозга, которые опосредуют митогенный эффект на клетки-остеопрогениторы. Cadosch et al. подтверждают эти выводы, потому что они обнаруживают отрицательную линейную зависимость между соотношением GCS и каллуса на одном сайте и временем до сращения и соотношением каллуса на другом участке [95].Доказательство сокращения времени до сращения у пациентов с сопутствующей ЧМТ является решающим в отличие от многих других исследований, потому что время сращения было конечной точкой в их исследовании и было определено двумя независимыми слепыми радиологами.
В своем анализе пролиферации клеток с первичными остеобластами человека они собрали остеобласты у 20 пациентов, у которых был проведен остеосинтез. В какое время были выполнены эти остеосинтеза и из какой группы были взяты эти образцы, не описано.Как следствие, остается неясным, стимулировались ли эти остеобласты в организме пациентов перед забором. Они также показывают, что остеоиндуктивный эффект сыворотки от пациентов с ЧМТ на линию hFOB-клеток увеличивается с 6 часов после травмы до 3 дней после травмы. Этот эффект исчезает примерно через 1 неделю. Это может означать, что этот эффект действует как триггер для усиленного образования костной мозоли. Пока не решено, начинается ли образование костной мозоли раньше или развивается с большей скоростью.
В другом исследовании Cadosch et al. [104], повышенная пролиферация длится еще дольше до последнего измерения через 168 ч после травмы.
Поскольку период наблюдения в обоих исследованиях длился только 1 неделю после травмы, неясно, вернется ли этот остеоиндуктивный эффект к нормальному уровню после этой недели или он будет иметь такие же колебания, как несколько цитокинов в их двойной функции, с дополнительным эффектом. позже в процессе заживления перелома. Тот факт, что нарушение ГЭБ длится около одной недели и, следовательно, утечка влияющих факторов, производимых поврежденной тканью мозга, будет продолжаться в течение этого периода, может быть подтверждением выводов Gautschi и Cadosch [94, 95, 104].
Gautschi et al. [94] демонстрируют интересный паттерн экспрессии маркеров остеобластов (щелочная фосфатаза (ALP), связанный с runt фактор транскрипции 2 (RUNX-2), катепсин K (CATK) и сериновая протеаза 7 (SP 7)), измеренный с помощью экспрессия мРНК в клетках hFOB. Экспрессия ALP и RUNX-2 значительно повышена в группе TBI и TBI и переломов по сравнению с группой только с переломами, а экспрессия SP 7 и CATK значительно повышена только в TBI и группе переломов по сравнению с TBI и переломами. только группа.Это может означать, что экспрессия SP 7 и CATK даже более специфична для взаимосвязи между TBI и улучшенным заживлением переломов, чем экспрессия ALP и RUNX.
Более того, тот факт, что результаты публикаций Gautschi и Cadosch [94, 95, 104] очень похожи, следует рассматривать с точки зрения того, что оба исследования принадлежат одной и той же группе исследователей.
Второй мейнстрим представлен Wei et al. [93], Zhang et al. [96], а также Ян и др. [106], и они сосредоточены на роли лептина и CGRP в заживлении переломов у пациентов с ЧМТ.
В исследовании Wei et al. [93], который связывает уровни лептина в сыворотке и экспрессию лептина в каллусных клетках с повышенным образованием костной мозоли, они предполагают связь между повреждением гипоталамуса и сниженным ингибированием периферической секреции лептина и повышенным образованием костной мозоли. Такое повышение уровня лептина достигается только через 4 недели после травмы. В отличие от исследований мезенхимальных стволовых клеток Cadosch и Gautschi [94, 95, 104], Wei et al. [93] продлили временной интервал их гистоморфологического и гистохимического анализа до 12 недель после травмы.Учитывая процесс заживления перелома у взрослых крыс, это лучше, чем период продолжительностью всего 1 неделя.
Zhang et al. [96] показали связь между повышенным уровнем лептина и повышенной экспрессией CGRP и его гемангиэктазической ролью в месте перелома.
Song et al. подтвердили эти результаты и нашли доказательства корреляции между повышенной тенденцией к заживлению переломов вследствие черепно-мозговой травмы и высоким CGRP. Они обнаружили более высокий уровень CGRP в головном мозге и мышцах крыс с черепно-мозговой травмой и предполагают, что этот CGRP продуцируется тканями мозга [97].
Согласно их анализу образования костной мозоли с помощью микро-КТ, Song et al. пришли к выводу, что у крыс с сопутствующей ЧМТ заживление перелома происходит раньше, чем в группе только с переломами. Это более раннее заживление появляется в их популяции примерно на 4-й неделе после травмы, и хотя эти эксперименты проводятся на взрослых крысах, это кажется слишком ранним для полностью развитого образования костной мозоли [134].
Еще одно важное открытие Zhang et al. заключается в том, что разные типы нервных повреждений по-разному влияют на заживление переломов.То есть повреждение периферического нерва в сочетании с переломами может замедлить процесс заживления, а повреждение центрального нерва в сочетании с переломами может ускорить скорость заживления. Эта повышенная скорость заживления, а также воспалительная реакция после повреждения центральной нервной системы более интенсивны и отчетливы для повреждений спинного мозга, чем повреждения головного мозга [68, 96], что может иметь значение для будущих исследований.
6.1. Перспективы на будущее
Основное доказательство ускоренного заживления переломов у пациентов с сопутствующей ЧМТ еще не подтверждено крупными проспективными клиническими исследованиями.Если это явление может быть доказано, возникает интересный вопрос, является ли этот механизм клеточным или гормональным.
Важным для будущих исследований является то, что временной ход активации медиатора после ЧМТ будет выяснен, как это сделано Доннелли и Поповичем для повреждения спинного мозга [68]. Поскольку остеоиндуктивная реакция после травмы спинного мозга более выражена по сравнению с реакцией после ЧМТ, было бы интересно посмотреть на ускоренное образование костной мозоли у пациентов с травмой спинного мозга.
В случае мезенхимальных / скелетных стволовых клеток, а также гормонального каскада, важно смотреть на колебания и влияние на процесс заживления перелома в течение более длительного периода, чем 1 неделя после травмы. Более того, идея о том, что усиленное образование костной мозоли у пациентов с переломами и сопутствующей ЧМТ является не чем иным, как формой гетеротопической оссификации, которая также поддерживается, но не подтверждается несколькими авторами и исследованиями последних десятилетий. Это также может быть интересной точкой отсчета для дальнейших исследований.
7. Выводы
В 2005 году Морли и его коллеги пришли к выводу, что в то время нельзя было ответить на вопрос, приводит ли черепно-мозговая травма к ускоренному сращению перелома. Сегодня, более чем через три десятилетия после первых публикаций по этому вопросу, все опубликованные после 2005 года статьи сходятся во мнении, что черепно-мозговая травма действительно ускоряет заживление переломов. Однако большая часть исследований по этой теме — это доклинические (in vitro / in vivo) исследования, которые действительно находят некоторые доказательства определенных механизмов, но клинические исследования с относительно небольшими популяциями до сих пор не могут подтвердить гипотезу ускоренного заживления переломов в пациенты с ЧМТ.Более того, в последнее десятилетие невозможно исключить возможность предвзятости публикации.
Более того, выяснение очень сложного механизма усиленного образования костной мозоли у пациентов с ЧМТ все еще находится в зачаточном состоянии. Также в последние годы очень мало раскрыто сложного механизма, посредством которого цитокины, хемокины, гормоны и факторы роста влияют на сигнальный путь, ведущий к ускоренному заживлению переломов.
Исследования, обсуждаемые в этом обзоре, показывают, что как сыворотка, так и спинномозговая жидкость (CSF) пациентов с переломами и сопутствующей ЧМТ обладают остеоиндуктивным потенциалом.В литературе также существует консенсус в отношении того, что эти остеоиндуктивные факторы высвобождаются из поврежденного мозга и распространяются по телу и в область перелома.
В литературе, опубликованной после обзора Morley et al., Есть два основных направления, которые приписывают ключевые роли в сложном механизме усиленного образования каллуса для мезенхимальных стволовых клеток с одной стороны и оси лептин-CGRP с другой стороны.
Тем не менее, поскольку образование костной мозоли происходит из сложного многофакторного каскада, возможно, что все описанные факторы играют свою роль в этом феномене.
По нашему мнению, в первую очередь эти результаты должны стать стимулом для разработки большого проспективного клинического исследования для подтверждения или опровержения гипотезы об ускоренном заживлении переломов у пациентов с сопутствующей ЧМТ. Исследование патофизиологической взаимосвязи между ЧМТ и образованием костной мозоли также должно быть разработано, чтобы выявить возможные пути этой предполагаемой принадлежности.
Аббревиатуры
| AAA: | Арахидоновая кислота | |||||
| BBB: | Гематоэнцефалический барьер | |||||
| BGLAP: | Костная гамма-карбоксиглутамат 9036 | BMD: | Минеральная плотность костной ткани | |||
| BMP: | Костные морфогенетические белки | |||||
| BMSCs: | Стромальные стволовые клетки костного мозга | |||||
| CGRP: | CN-генетический пептид : | Центральная нервная система | ||||
| CRBP-1: | Клеточный ретинол-связывающий белок 1 | |||||
| ЦСЖ: | Цереброспинальная жидкость | |||||
| C5a: | Анафилатоксин | 9036 | Анафилатоксин | |||
| ECM: | Внеклеточный матрикс | |||||
| GCS: | Шкала комы Глазго | |||||
| h: | Часы | |||||
| HIF-1 α : | Индуцибельный фактор гипоксии-1 α | |||||
| IL: | Интерлейкин | |||||
| IL-1: | Интерлейкин-1 | |||||
| IL-6: | Интерлейкин-6 | |||||
| IFN: | ||||||
| M-CSF: | Макрофагальный колониестимулирующий фактор | |||||
| ММП: | Матричные металлопротеиназы | |||||
| МСК: | Мезенхимальные стволовые клетки | |||||
| Мезенхимальные стволовые клетки | ||||||
| N | NN | OPG: | Остеопротегерин | |||
| OSF-1: | Фактор, стимулирующий остеобласты | |||||
| RANKL: | Рецептор ac тиватор ядерного фактора каппа B лиганд | |||||
| SDF-1: | Фактор-1, полученный из стромальных клеток | |||||
| SP-7: | Белок Osterix | |||||
| TBI: | Черепно-мозговая травма | TGF- β : | Трансформирующий фактор роста — β | |||
| TNF- α : | Фактор некроза опухоли- α | |||||
| VEGF: | VEGF: | сосудистый рост | VEGF: | Вт: | недель. |
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Общие принципы лечения переломов: история вопроса, патофизиология, этиология
Лидгрен Л. Десятилетие костей и суставов 2000-2010 гг. Bull World Health Organ . 2003. 81 (9): 629. [Медлайн]. [Полный текст].
Гаити. Всемирная организация здравоохранения. Доступно по адресу https://www.who.int/hac/crises/hti/en/. Доступ: 18 марта 2020 г.
Guzman J, Hurwitz EL, Carroll LJ, Haldeman S, Côté P, Carragee EJ, et al. Новая концептуальная модель боли в шее: связь между началом, течением и лечением: Целевая группа по проблемам боли в шее и связанных с ней заболеваний на десятилетие костей и суставов 2000-2010 гг. J Manipulative Physiol Ther . 2009 г., 32 февраля (2 приложение): S17-28. [Медлайн].
Ханда Р., Али Калла А., Маалуф Г. Остеопороз в развивающихся странах. Лучшая практика Res Clin Rheumatol .2008 22 августа (4): 693-708. [Медлайн].
Укрепление законодательства о безопасности дорожного движения: практическое и справочное руководство для стран. Всемирная организация здравоохранения. Доступно по адресу https://apps.who.int/iris/bitstream/10665/85396/1/9789241505109_eng.pdf. 2013; Доступ: 18 марта 2020 г.
Бакли Р., Моран С., Апиваттхакул Т., ред. АО Принципы управления трещинами . 3-е изд. Нью-Йорк: Тиме; 2017.
Szczêsny G, Interewicz B, Swoboda-Kopeć E, Olszewski WL, Górecki A, Wasilewski P.Бактериология костной мозоли закрытых переломов большеберцовой и бедренной костей. J Травма . 2008 окт.65 (4): 837-42. [Медлайн].
Фермер ME, Белый LR, Brody JA, Bailey KR. Расовые и половые различия в частоте переломов шейки бедра. Am J Public Health . 1984 декабрь 74 (12): 1374-80. [Медлайн]. [Полный текст].
Loder RT. Влияние сахарного диабета на заживление закрытых переломов. Clin Orthop Relat Res . 1988 июл.(232): 210-6. [Медлайн].
Giannoudis PV, MacDonald DA, Matthews SJ, Smith RM, Furlong AJ, De Boer P. Несращение диафиза бедренной кости. Влияние расширительных и нестероидных противовоспалительных средств. J Bone Joint Surg Br . 2000 июл.82 (5): 655-8. [Медлайн]. [Полный текст].
Kwiatkowski TC, Hanley EN Jr, Ramp WK. Курение сигарет и его ортопедические последствия. Am J Orthop (Бель Мид, штат Нью-Джерси) . 1996 25 сентября (9): 590-7.[Медлайн].
Эрнандес-Авила М., Кольдиц Г.А., Штампфер М.Дж., Рознер Б., Шпайзер ИП, Виллетт В. Кофеин, умеренное употребление алкоголя и риск переломов бедра и предплечья у женщин среднего возраста. Ам Дж. Клин Нутр . 1991 июль 54 (1): 157-63. [Медлайн].
Боттланг М., Фицпатрик, округ Колумбия, Клаас Л., Андерсон Д. Д.. Биомеханика переломов и фиксация переломов. Торнетта П. III, Риччи В.М., Острум Р.Ф., Маккуин М.М., Макки, доктор медицины, Корт-Браун С.М., ред. Переломы Роквуда и Грина у взрослых . 9 изд. Филадельфия: Вольтерс Клувер; 2020. Глава 1.
Schmeling GJ, Schwab JP. Уход за политравмой. Последствия травм головы и сроки скелетной фиксации. Clin Orthop Relat Res . 1995 Сентябрь 318: 106-16. [Медлайн].
Моллитт DL. Инфекционный контроль: как избежать неизбежного. Surg Clin North Am . 2002 апр. 82 (2): 365-78. [Медлайн].
Стил Б., Серота А, Хелфет Д.Л., Петерсон М., Лайман С., Лейн Дж. М..Дефицит витамина D: частое явление при переломах как с высокой, так и с низкой энергией. HSS J . 2008 Сентябрь 4 (2): 143-8. [Медлайн].
EVANS FG. Связь физических свойств кости с переломами. Instr Course Lect . 1961.18: 110-21. [Медлайн].
Поллак А.Н., Фике Дж. Р., Ранения конечностей во время войны III Модераторы сессии. Травмы конечностей войны: проблемы в окончательной реконструкции. J Am Acad Orthop Surg .2008 16 ноября (11): 628-34. [Медлайн].
Corso P, Finkelstein E, Miller T, Fiebelkorn I, Zaloshnja E. Заболеваемость и пожизненные затраты травм в США. Inj Назад . 2006 12 августа (4): 212-8. [Медлайн]. [Полный текст].
Беверидж М., Ховард А. Бремя ортопедических заболеваний в развивающихся странах. J Bone Joint Surg Am . 2004 августа 86 (8): 1819-22. [Медлайн].
Стюарт К.А., Гроен Р.С., Камара ТБ, Фарахзад М.М., Самай М., Кэссиди Л.Д. и др.Травматические травмы в развивающихся странах: отчет общенационального перекрестного исследования Сьерра-Леоне. JAMA Surg . 2013 май. 148 (5): 463-9. [Медлайн].
Azar FM, Beaty JH, Canale ST, ред. Оперативная ортопедия Кэмпбелла . 13-е изд. Филадельфия: Эльзевьер; 2017.
Корт-Браун С., Маккуин М., Торнетта П. Травма. Schepsis AA, Busconi BD, Tornetta P, Einhorn TA, ред. Спортивная медицина (серия «Основы ортопедической хирургии») .Филадельфия: Липпинкотт Уильямс и Уилкинс; 2006.
Busse JW, Morton E, Lacchetti C, Guyatt GH, Bhandari M. Текущее лечение переломов диафиза большеберцовой кости: обзор 450 канадских хирургов-ортопедов-травматологов. Acta Orthop . 2008 Октябрь 79 (5): 689-94. [Медлайн].
Gjertsen JE, Engesaeter LB, Furnes O, Havelin LI, Steindal K, Vinje T. и др. Норвежский регистр переломов бедра: опыт первых двух лет и 15 576 операций, о которых было сообщено. Acta Orthop . 2008 Октябрь 79 (5): 583-93. [Медлайн].
Паркер МДж. Базы данных для аудита перелома бедра. Acta Orthop . 2008 Октябрь 79 (5): 577-9. [Медлайн].
Холт Г., Смит Р., Дункан К., Финлейсон Д. Ф., Грегори А. Ранняя смертность после хирургической фиксации переломов бедра у пожилых людей: анализ данных шотландского аудита переломов бедра. J Bone Joint Surg Br . 2008 Октябрь 90 (10): 1357-63. [Медлайн].
Американский колледж хирургов. Продвинутая система жизнеобеспечения при травмах для врачей (ATLS): Учебное пособие для учащихся . 10-е изд. Чикаго: Американский колледж хирургов; 2018.
Папе Х.С., Халвачизаде С., Линен Л., Велмахос Г.Д., Бакли Р., Джаннудис П.В. Сроки оказания помощи при серьезном переломе у пациентов с политравмой — обновленная информация о принципах, параметрах и стратегиях на 2020 год. Травма . 2019 Октябрь 50 (10): 1656-1670. [Медлайн]. [Полный текст].
Моран Д.С., Исраэль Э., Эванс Р.К., Янович Р., Константини Н., Шабшин Н. и др.Модель прогнозирования стрессовых переломов у девушек-новобранцев во время базовой подготовки. Медико-спортивные упражнения . 2008, 40 ноября (11 приложение): S636-44. [Медлайн].
Gustilo RB, Merkow RL, Templeman D. Ведение открытых переломов. J Bone Joint Surg Am . 1990 Февраль 72 (2): 299-304. [Медлайн].
Brumback RJ, Jones AL. Согласие между наблюдателями в классификации открытых переломов большеберцовой кости. Результаты опроса двухсот сорока пяти хирургов-ортопедов. J Bone Joint Surg Am . 1994 августа 76 (8): 1162-6. [Медлайн].
Tscherne H, Oestern HJ. [Новая классификация повреждений мягких тканей при открытых и закрытых переломах]. Unfallheilkunde . 1982 Март 85 (3): 111-5. [Медлайн].
von Volkmann R. Verletzungen und krannkheiten der bewwgungsorgane. Pitha FJ, Billroth T, ред. Handbuch der Allegemeinen und Speziellen Chirurgie . Штутгарт: Verlag von Ferdinand Enke; 1872 г.Том 2: 234-920.
Bryant LR, Song WS, Banks KP, Bui-Mansfield LT, Bradley YC. Сравнение только планарной сцинтиграфии и ОФЭКТ для первоначальной оценки стрессового перелома шейки бедренной кости. AJR Am J Roentgenol . 2008 Октябрь 191 (4): 1010-5. [Медлайн].
Ян Х.Л., Ван Г.Л., Ниу Г.К., Лю Дж.Й., Хилтнер Э., Мэн Б. и др. Использование МРТ для определения болезненных позвонков, подлежащих лечению кифопластикой при многоуровневых компрессионных переломах позвонков: проспективное исследование. J Int Med Res . 2008 сен-окт. 36 (5): 1056-63. [Медлайн].
Макманус Дж. Г., Мортон М. Дж., Кристал С. С., МакАртур Т. Дж., Хелфенстайн Дж. С., Маснери Д. А. и др. Использование ультразвука для оценки уменьшения острых переломов в условиях оказания неотложной помощи. Am J Disaster Med . 2008 июл-авг. 3 (4): 241-7. [Медлайн].
Rang M. Детские переломы . 2-е изд. Филадельфия: Дж. Б. Липпинкотт; 1983.
Ly TV, Swiontkowski MF.Лечение переломов шейки бедра у молодых людей. J Bone Joint Surg Am . 2008 Октябрь 90 (10): 2254-66. [Медлайн].
[Рекомендации] Брокс В.Т., Робертс К.С., Таксали С., Райт Д.Г., Викстед Дж. Дж., Табб С.С. и др. Научно обоснованное руководство Американской академии хирургов-ортопедов по лечению переломов бедра у пожилых людей. J Bone Joint Surg Am . 2015 г. 15 июля. 97 (14): 1196-9. [Медлайн].
Бхандари М. Доказательная ортопедия .Хобокен, Нью-Джерси: Уайли-Блэквелл; 2012.
Rodriguez L, Jung HS, Goulet JA, Cicalo A, Machado-Aranda DA, Napolitano LM. Протокол, основанный на фактических данных, для профилактического применения антибиотиков при открытых переломах: улучшенное назначение антибиотиков без увеличения показателей инфицирования. J Trauma Acute Care Surg . 2014 сентябрь 77 (3): 400-7; обсуждение 407-8; викторина 524. [Medline].
Zimmerli W, Trampuz A, Ochsner PE. Инфекции протезов суставов. N Engl J Med .14 октября 2004 г. 351 (16): 1645-54. [Медлайн].
Мошефф Р. Открытые переломы. Бакли Р., Моран С., Апиваттхакул Т., ред. АО Принципы управления трещинами . 3-е изд. Нью-Йорк: Тиме; 2017. Том 1: 331-56.
[Рекомендации] Британская ассоциация хирургов-ортопедов и Британские пластические и эстетические хирурги Стандарты аудита при травмах — открытых переломах. Британская ассоциация хирургов-ортопедов. Доступно на https://www.boa.ac.uk/wp-content/uploads/2017/12/BOAST-Open-Fractures.pdf. Декабрь 2017 г .; Доступ: 2 апреля 2018 г.
O’Toole RV, Andersen RC, Vesnovsky O, Alexander M, Topoleski LD, Nascone JW, et al. Преимущество стопорных винтов при пластинчатой фиксации переломов диафиза плечевой кости? Биомеханический анализ синтетической и трупной кости. J Orthop Trauma . 2008 ноябрь-декабрь. 22 (10): 709-15. [Медлайн].
Wagner F, Frigg R, ред. АО Руководство по лечению переломов: внутренние фиксаторы .Нью-Йорк: Тиме; 2006.
Theocharopoulos N, Perisinakis K, Damilakis J, Papadokostakis G, Hadjipavlou A, Gourtsoyiannis N. Профессиональное облучение от обычных рентгеноскопических проекций, используемых в ортопедической хирургии. J Bone Joint Surg Am . 2003 сентябрь 85 (9): 1698-703. [Медлайн].
Lambotte A. L’intervention operatoire dans les нынешние и старые переломы. Релтер Л.Ф., изд. Переломы . Брюссель: Анри Ламертин; 1907 г.
Робертс К.С., Папе Х.С., Джонс А.Л., Малкани А.Л., Родригес Дж.Л., Джаннудис П.В. Ортопедия с контролем повреждений: развивающиеся концепции лечения пациентов, перенесших ортопедические травмы. Instr Course Lect . 2005. 54: 447-62. [Медлайн].
Bone LB, Johnson KD, Weigelt J, Scheinberg R. Ранняя и отсроченная стабилизация переломов бедренной кости. Проспективное рандомизированное исследование. J Bone Joint Surg Am . 1989 Март.71 (3): 336-40. [Медлайн].
[Рекомендации] Ганди Р.Р., Овертон Т.Л., Овертон Э.Р., Лау Б., Валлиер Н.А., Роуз Т. и др. Оптимальные сроки стабилизации перелома бедренной кости у пациентов с политравмой: Практическое руководство Восточной ассоциации хирургии травм. J Trauma Acute Care Surg . 2014 ноябрь 77 (5): 787-795. [Медлайн].
Krettek C, Schandelmaier P, Miclau T., Tscherne H. Минимально инвазивный чрескожный остеосинтез пластины (MIPPO) с использованием DCS при переломах проксимального и дистального отделов бедренной кости. Травма . 1997. 28 (приложение 1): A20-30. [Медлайн].
[Рекомендации] Кеарон С., Акл Э.А., Орнелас Дж., Блайвас А., Хименес Д., Боунамо Х. и др. Антитромботическая терапия при ВТЭ: руководство CHEST и отчет экспертной комиссии. Сундук . 2016 Февраль 149 (2): 315-352. [Медлайн]. [Полный текст].
Madsen JL. Костная ОФЭКТ / КТ обнаружение секвестра в хронически инфицированном несращении большеберцовой кости. Clin Nucl Med . 2008 окт.33 (10): 700-1. [Медлайн].
Tu YK, Chen AC, Chou YC, Ueng SW, Ma CH, Yen CY. Лечение перелома и несращения ладьевидной кости — применение канюлированных винтов 3,0 мм и васкуляризированных костных трансплантатов на ножке. Травма . 2008 г., 39, Дополнение 4: 96-106. [Медлайн].
(PDF) Связь между временем инфузии золедроновой кислоты и заживлением перелома бедра
В исследовании HORIZON-RFT 2127 пациентов с переломом бедра
были рандомизированы на i.v. ZOL или плацебо и, следовательно,
предоставили возможность изучить влияние ZOL на
частоту отсроченного заживления перелома бедра в контролируемых условиях
. Поскольку субъекты получали свое лекарство в течение периода 90-
дней после восстановления перелома, мы также смогли изучить
влияние времени инфузии на исходы заживления перелома
. Другие сильные стороны исследования включают перспективное,
слепое решение о заживлении перелома.Мы не обнаружили повышенного риска замедленного заживления перелома
при применении ZOL, даже
, когда препарат вводился в течение 2 недель после первичного перелома бедра
. В то время как верхний 95% ДИ нашей оценки включает
возможность клинически важного повышенного риска
отсроченного заживления с ZOL (OR, 1,17; 95% CI, 0,72–1,90),
— большое и значительное преимущество ZOL как в вторичной
снижение переломов, так и смертность, вероятно, перевешивают эту меньшую вероятность повреждения
.С другой стороны, логистическая регрессионная модель
показала, что отсроченное заживление переломов на
значительно увеличилось у пациентов, получавших неселективные
НПВП, добавив новую информацию к этому спорному вопросу
.
У нашего исследования есть несколько ограничений. Во-первых, формы истории болезни
не были разработаны для отражения типа первоначального хирургического восстановления
, выполненного на указательном переломе бедра, и, таким образом,
, мы не смогли исключить из анализа тех, кто прошел артропластику бедра
.Это, вероятно, объясняет наблюдаемую нами на
более низкую частоту отсроченного заживления по сравнению с
с предыдущими сообщениями [9,14]. Во-вторых, не существует
общепринятых критериев для диагностики отсроченного заживления перелома бедра
, и существуют значительные различия в том, как хирурги-ортопеды
оценивают и контролируют заживление перелома
[29–31]. Таким образом, мы использовали комбинацию
клинических симптомов и рентгенологических данных для вынесения решения о
отсроченном заживлении с целью стандартизации диагноза
в различных исследовательских центрах.В-третьих, мы не оценили качество первичного хирургического вмешательства
из-за отсутствия утвержденной рейтинговой системы
[30]. Однако
различий в хирургическом восстановлении вряд ли повлияют на наши результаты, поскольку исследование было блочно-рандомизировано по
центрам, так что один хирург будет иметь равное количество
пациентов в группе вмешательства и в контрольной группе. и мы
скорректировали для географического региона, чтобы смягчить любые системные различия в периоперационном ведении.Аналогичным образом,
тип хирургического вмешательства был определен оперирующим хирургом
, который не знал о назначении лечения.
В-четвертых, наши данные не позволяют нам прокомментировать влияние
предыдущего, длительного использования бисфосфонатов на заживление переломов
, поскольку субъекты
ранее подвергались воздействию этих агентов или не имели их.
Таким образом, лечение ZOL после восстановления перелома бедра
не приводит к существенной задержке заживления перелома, даже
, когда препарат вводится в ближайшем послеоперационном периоде
.Пациентов можно лечить от остеопороза с помощью ежегодной инфузии
ZOL 5 мг после восстановления перелома бедра
без дополнительных осложнений и затрат в размере
отсроченного заживления перелома.
Благодарности Авторы благодарят Викранта Паллапоту (MSCD-
Индия, Новартис) и Холли Гилберт-Джонс (BioScience Communica-
) за их помощь в редактировании.
Конфликт интересов Д-р Колон-Эмерик работает консультантом в
Novartis и Amgen.Доктор Нордслеттен не имеет конфликта интересов. Доктор
Олсон не имеет конфликта интересов. У доктора Мейджора нет конфликта интересов
. Доктор Боонен получил финансирование исследований и консультационные услуги
от Novartis. Доктор Хентдженс не имеет конфликта интересов. Доктор
Мезенбринк является сотрудником Novartis и владеет акциями компании
. Доктор Магазинер работает консультантом в компаниях Novartis, Eli Lilly
и Amgen, а также имеет гранты на исследования от Novartis и Merck.Доктор
Адачи работает консультантом / советником для Amgen, Astra Zeneca, Eli
Lilly, Glaxo Smith Kline (GSK), Merck, Novartis, Nycomed, Pfizer,
Procter & Gamble, Roche, Sanofi-Aventis, Servier , Wyeth, Bristol-
Myers Squibb. Доктор Лайлс работает консультантом в Novartis, Procter &
Gamble, Merck, Amgen, Kirin Pharmaceutical, GTx, Lilly, GSK,
Bone Medical Ltd., Wyeth and Osteologix и получает поддержку исследований
от Novartis, Alliance. для улучшения здоровья костей и Amgen.
Доктор Хилдструп является консультантом компаний Novartis, Nycomed, Unilabs
и Amgen. Буччи-Рехтвег является сотрудником Novartis и владеет
акций компании. Доктор Рекнор работает консультантом / советником в
Roche, GSK, Lilly, Procter & Gamble, Merck, Novartis, Amgen, NPS
и Zelos.
Ссылки
1. Magaziner J, Lydick E, Hawkes W., Fox KM, Zimmerman SI,
Epstein RS, Hebel JR (1997) Избыточная смертность, связанная с переломом бедра
у белых женщин в возрасте 70 лет и старше.Am J Public
Health 87: 1630–1636
2. Melton LJ III (2003) Неблагоприятные исходы остеопоротических переломов
в общей популяции. J Bone Miner Res 18: 1139–1141
3. Колон-Эмерик С., Кучибхатла М., Пипер С., Хоукс В., Фредман
Л., Магазинер Дж., Циммерман С., Лайлс К.В. (2003). Перелом шейки бедра и риск последующих переломов: данные двух продольных исследований
. Osteoporos Int 14: 879–883
4. Лайлс К.В., Колон-Эмерик С.С., Магазинер JS, Адачи Дж.Д., Пипер
CF, Маутален С., Хилдструп Л., Рекнор С., Нордслеттен Л., Мур
КА, Лавеккья Zhang J, Mesenbrink P, Hodgson PK, Abrams
K, Orloff JJ, Horowitz Z, Eriksen EF, Boonen S (2007)
Золедроновая кислота и клинические переломы и смертность после перелома бедра
.N Engl J Med 357: 1799–1809
5. Fleisch H (2001) Можно ли давать бисфосфонаты пациентам с переломами
? J Bone Miner Res 16: 437–440
6. Odvina CV, Zerwekh JE, Rao DS, Maalouf N, Gottschalk FA, Pak
CY (2005) Сильно подавленный обмен костной ткани: потенциальное осложнение
терапии алендронатом. J Clin Endocrinol Metab
90: 1294–1301
7. Цао Й, Мори С., Машиба Т., Уэстмор М.С., Ма Л., Сато М.,
Акияма Т., Ши Л., Комацубара С., Миямото К., Норимацу Х
(2002) Ралоксифен, эстроген и алендронат по-разному влияют на процессы
заживления переломов у овариэктомированных крыс.

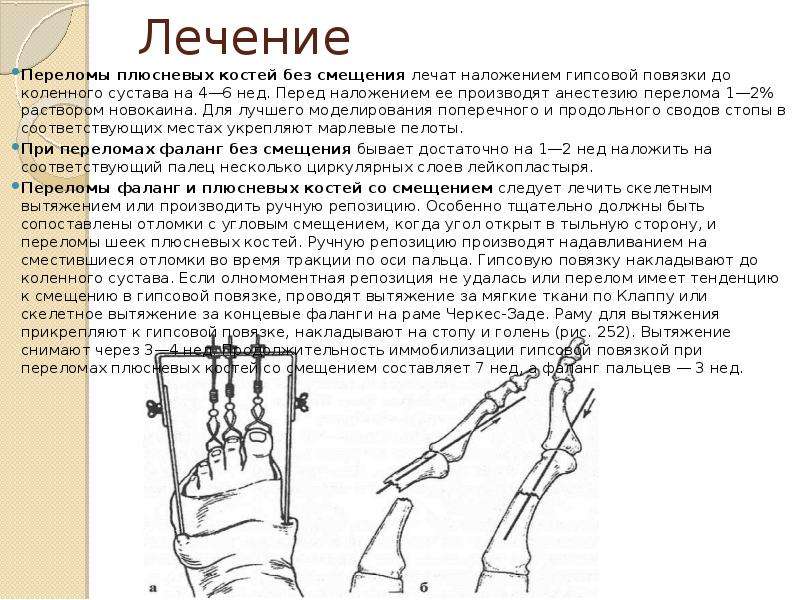 Кость уникальна своей способностью к самовосстановлению.Заживление происходит за счет реактивации эмбриологических процессов, в результате чего образуется кость, а не рубец. Заживление перелома можно описать тремя концептуальными этапами. Понимание сроков и механизмов, связанных с каждым этапом, важно при планировании лечения перелома. Стадии:
Кость уникальна своей способностью к самовосстановлению.Заживление происходит за счет реактивации эмбриологических процессов, в результате чего образуется кость, а не рубец. Заживление перелома можно описать тремя концептуальными этапами. Понимание сроков и механизмов, связанных с каждым этапом, важно при планировании лечения перелома. Стадии: