7 эффективных способов избавиться от плесени в квартире или доме
Плесень, не самое приятное соседство. Никто не застрахован от ее появления. Она становится источником неприятного запаха, аллергии и даже некоторых заболеваний. Сегодня мы расскажем причины ее возникновения, а также эффективные методы борьбы с ней.
Виды плесени
Перейдем сразу к делу:
- Вид белой плесени
Многие ее видели и знают как она выглядит. Земля, в которую посажены домашние растения, от избытка влажности выделяет пары. Появляется белый налет, он и является плесенью. Для человека не опасен, только если у вас нет особой чувствительности и не появится аллергия.
- Вид зеленой плесени
Такой вид наблюдают на остатках пищи, которая находится в замкнутом пространстве. Например в контейнере. Также ее встречают на строительном кирпиче. Зеленая плесень, попавшая в желудок вызывает разные виды заболеваний и отравление.
- Вид черной плесени
Самый опасный вид. Она появляется на стенах, потолке, напольном покрытии. Поражает разные виды поверхностей. Если ее оставить и ничего не делать появятся проблемы со сном, плесень вызовет головокружение, астму, головную боль и даже повысит температуру человека. Самые опасные последствия, это дерматит, рак легких, пневмония и бронхит.
- Вид синей плесени
Такой вид замечают на деревянной поверхности. Это может быть паркетное покрытие пола, рама картины и мебель. Она вылезает из под слоя краски и выглядит как темный синеватый налет.
- Вид гнилой плесени
Также поражает деревянные поверхности. Ее цветовая палитра многогранна. От серого до бурого оттенков. Дерево при этом трескается и становится легче.
Никто не застрахован от плесени. Отделочные материалы не дают гарантию, что она не появится у вас никогда. Плесень выглядит некрасиво. Кроме этого она опасна для здоровья, поэтому как только вы увидели ее появление — приступайте к ее истреблению.
Плесень выглядит некрасиво. Кроме этого она опасна для здоровья, поэтому как только вы увидели ее появление — приступайте к ее истреблению.
Почему появляется плесень
Для победы над плесенью необходимо установить причину ее появления. Ведь ее споры находятся в любом помещении, а если ей создаются благоприятные условия она начинает оживать и разрастаться.
Итак, перейдем к делу.
- Высокая влажность в сочетании со слабой вентиляцией. Часто зоной поражения становятся кухни и ванные комнаты, по понятным причинам.
- Стены, которые промерзли.
- Протечка воды из водопроводных труб
- Грунтовая влажность
- Негерметичная крыша в доме
- Помещение, которое редко отапливается
При появлении плесени появляется “грязный” тяжелый аромат, который знаком каждому. Важно не только избавиться от такого налета, но и предупредить причину ее появления.
Чек-лист по устранению плесени в квартире
- Убрать плесень скребком
- Обработать поверхность специальным составом
- Вещи, которые сильно поражены — выбрасываем
- Проводим профилактику возникновения, то есть создаем благоприятные условия для себя и плохие условия для появления плесени.
Методы борьбы с плесенью
Есть два варианта. Народные средства и химические, которые можно купить в магазине. Эффективность примерно одинаковая, поэтому рассмотрим эти способы подробнее.
Антисептическая грунтовка для борьбы с плесенью
Это средство продается в магазине и представлено широкой линейкой товаров. Вам остается только выбрать. Оно отлично борется с плесенью и является самым эффективным средством в войне с ней. Достаточно просто нанести его на очищенную от грибка поверхность. Важный нюанс. На зараженной поверхности не должно быть и намека на плесень, а для этого ее нужно тщательно очистить. Даже если она проникла в глубокие слои отделки. После обработки приступайте к дальнейшей отделке поверхности.
Даже если она проникла в глубокие слои отделки. После обработки приступайте к дальнейшей отделке поверхности.
Отбеливатель для борьбы с плесенью
Прекрасно борется с грибком на гладких поверхностях. Дерево, ГКЛ и другие пористые поверхности не стоит обрабатывать этим средством. Это просто не эффективно. Также обращайте внимание на то, что отбеливатель съедает не только грибок, но и цвет отделки, а также ее структуру.
Обрабатывать поверхность с помощью отбеливателя следует в перчатках. Иначе это средство заодно “съест” и ваши руки. Разведите его с водой в пропорциях 1/10. После этого просто нанесите его на подготовленную и очищенную от плесени, поверхность.
Уксус для борьбы с плесенью
Прекрасное народное средство, которое эффективно борется с разными видами плесени. Уксус безопасен для здоровья человека, так как его пары не токсичны. С помощью распылителя нанесите уксус на поверхность, с которой предварительно удалили все поражения. Иногда требуется повторная обработка с перерывом в 7 дней.
Перекись водорода для борьбы с плесенью
Принцип действия такой же. Эффективно борется с плесенью. Так же как и отбеливатель, “съедает” цвет отделки. Просто распылите его на чистый участок, который вы очистили от грибка.
Нашатырный спирт для борьбы с плесенью
Его разводят с водой в соотношении 1/1. Наносят на поверхность и через час смывают. После этого проветривают комнату. Его используют только на гладких материалах. На пористых он придаст больше сил и энергии грибку, так как поможет воде проникнуть глубже в свою структуру. Никогда не используйте его вместе с отбеливателем. При их смешении образуются токсичные пары, которые не доставляют пользы вашему здоровью.
Пищевая сода для борьбы с плесенью
Безопасный и самый простой метод борьбы с плесенью. В стакан с водой добавьте чайную ложку соды. Этим раствором обработайте чистую поверхность. Через час смойте влажной тряпкой. Готово.
Совет: сода прекрасный профилактический способ от появления плесени.
Поэтому до конца с поверхности можете не смывать.
Бура для борьбы с плесенью
Это вещество разводят с водой в следующих пропорциях: 1 стакан порошка на 2,5 литра воды. Готовый раствор наносят щеткой с железной щетиной. Так вы одновременно чистите грибок и вбиваете сразу эффективное средство для борьбы с ним. Перед обработкой рекомендуется пропылесосить пораженный участок, чтобы в последствии меньше спор плесени попало к вам в дыхательные пути.
Сильное средство против грибка от Nail Tek
Болезни кожи стоп, ладоней и ногтей, это деликатная и достаточно актуальная тема для многих. Грибок провоцирует появление неприятного запаха и влияет на эстетический вид ног, рук и ногтевой пластины. Оставлять эту проблему без лечения ни в коем случае нельзя, необходимо как можно быстрее вооружаться противогрибковым средством.
Сильное средство против грибка
Эффективный метод лечения грибка без рецепта врача.
В состав средства Nail Tek MAXIMUM STRENGTH ANTI-FUNGAL против грибка входит самая распространенная противогрибковая формула, доступно в продаже без рецепта врача, зарекомендовав себя как отличное средство в борьбе против ногтевого грибка.
Maximum Strength Anti-fungal расфасован так, что его хватает для одного человека. Средство в салоне открывает мастер, покрывает ногти клиента и остальную упаковку отдает клиенту домой, для продолжения ежедневного лечения ногтей против грибка. Чтобы полностью ликвидировать инфекцию, средство необходимо использовать каждый день, пока не используете всю бутылочку
Противогрибковое средство Nail Tek Maximum Strength Anti-fungal в отличие от других видов апликаторв накладывается слой на слой.
Нанесение кисточкой это самый эффективный метод воздействия противогрибковых средств.
1. Короткая кисточка позволяет средству проникнуть глубже в верхние слои ногтя и в инфицированные ткани вокркуг него. Средство проникает непосредственно туда, где находится и развивается грибковая инфекция.
2. Короткая кисточка обеспечивает прямое попадание средства на пораженную грибком зону.
3. Благодаря короткой кисточке средство расходуется меньше.
4. Использование кисточки предохраняет средство от загрезнения.
Это, утвержденное медиками средство убивает грибок, ликвидируя его рост и предотвращает репродукцию инферкции.
Указания:
Вымыть и высушить пороженную инфекцией зону, нанести средство, повторить дважы в день.
Анти-плесень. Средство против плесени и грибка. Чистящие средства от плесени.
Чаще всего она появляется в ванных комнатах, на балконах, стенах квартир первых и последних этажей, в подвалах и чердачных помещениях. Налет черного или зеленого цвета портит эстетичность помещения и разрушает структуру покрытий. Но главное, он несет значительный вред здоровью. Из-за плесени возникают аллергические реакции, болезни дыхательной системы, кожи, глаз и ротовой полости; жильцы часто страдают от респираторных заболеваний.
Из-за плесени возникают аллергические реакции, болезни дыхательной системы, кожи, глаз и ротовой полости; жильцы часто страдают от респираторных заболеваний.
Методы борьбы с плесенью
Убрать налет с поверхности можно с помощью народных методов. Необходимые средства для удаления плесени доступны и есть почти в каждом доме, но применять их следует с большой осторожностью: из-за резкого запаха и химических составляющих они могут вызвать негативную реакцию организма и ухудшение самочувствия. Кроме того, каждый способ подходит только для определенных поверхностей:
- Отбеливатель – влияет на цвет изделий, поэтому применяется исключительно для керамики и стекла. После распыления помещение нужно долго проветривать, так как токсичные вещества способны нанести вред легким. Такой способ имеет непродолжительный эффект, поэтому в скором времени потребуется проводить повторную обработку.
- Жидкое мыло или стиральный порошок – подходит для гладких поверхностей, на пористых дает кратковременный и малоэффективный результат.

- Масло чайного дерева (раствор 2 ч.л. и 2 стакана воды) – неплохое средство против плесени и грибка, но ядовито для домашних питомцев.
- Аммиак (раствор с водой 1:1) – только для гладких стен, не эффективен на деревянных, каменных и пористых поверхностях. Токсичен и опасен для здоровья, применять осторожно и в небольших количествах, при распылении следует надевать защитную маску. Данное средство поможет справиться с плесенью только при длительном воздействии: раствор необходимо оставить на обрабатываемом участке минимум на 2-4 часа.
Чтобы не рисковать здоровьем и гарантированно удалить грибок с любой поверхности, лучше воспользоваться специализированным средством, таким как «Анти-плесень Удаление и профилактика» израильского бренда BAGI.
Анти-плесень Bagi: быстрый и длительный результат
Концентрированная пена BAGI – это эффективное средство от плесени и грибка, которое моментально очищает поверхность, убирая не только видимые следы, но и споры. Обладает следующими преимуществами:
Обладает следующими преимуществами:
- Препятствует возвращению плесневого налета в течение минимум одного месяца;
- Дезинфицирующий компонент обеззараживает и освежает помещение;
- Экономичный расход: одного флакона хватает на долгое время;
- Благодаря пенной консистенции, отлично удерживается на вертикальных поверхностях, поэтому очень удобно использовать средство от плесени на окнах, стенах и душевых кабинах.
Пена выпускается в удобном флаконе, защищенном от случайного распыления.
Как предотвратить повторное появление плесени
Чтобы после обработки грибок снова не появился, необходимо позаботиться о принятии следующих мер:
- Так как одна из причин сырости – плохая теплоизоляция, важно подумать об утеплении помещения, в особенности, если пораженные стены выходят на улицу. Загерметизируйте трещины возле окон.
- Часто мойте стены в ванной с помощью моющих средств и протирайте их насухо.
- Обеспечьте хорошую вентиляцию в помещениях с повышенной влажностью.

- Держите двери душевой кабины открытыми и давайте ей хорошо просохнуть.
Если придерживаться этих советов, чистящие средства от плесени будет необходимо использовать гораздо реже.
Агенты биологической борьбы с грибками для комплексного управления Culicoides spp. (Diptera: Ceratopogonidae) домашнего скота
Влияние грибка на личинок и взрослых особей
Culicoides мошек in vitro и in vivo Значения LC 50 , оцененные по сравнению с личинок Culicoides , составили 2692 мг и 383712 мг (10 8 900 КОЕ / г) для B. bassiana и M. anisopliae , соответственно, путем нанесения пробитных линий (Таблицы- и; Рисунки- и).Данные показали, что грибковое заражение личинок Culicoides привело к гибели, и поэтому количество личинок постоянно показывало тенденцию к снижению, хотя ежедневно добавлялись новые личинки, вылупившиеся из яиц, отложенных мошками Culicoides . Однако через 7 дней после заражения количество личинок возобновлялось до исходного количества, наблюдаемого в день 0, и оба гриба оказались эффективными в течение максимум 7 дней, что потребовало их применения без применения. Гибель личинок Culicoides в результате заражения B.bassiana показала зеленоватую окраску в середине тела, тогда как голова и хвост показали интенсивные черноватые изменения () по сравнению с нормальной текстурой тела личинок (). Заражение M. anisopliae привело к гибели личинок Culicoides с зеленоватой и черноватой окраской тела (рисунки- и), а также к полному разрушению и десквамации кишечного канала.
Гибель личинок Culicoides в результате заражения B.bassiana показала зеленоватую окраску в середине тела, тогда как голова и хвост показали интенсивные черноватые изменения () по сравнению с нормальной текстурой тела личинок (). Заражение M. anisopliae привело к гибели личинок Culicoides с зеленоватой и черноватой окраской тела (рисунки- и), а также к полному разрушению и десквамации кишечного канала.
Таблица 2
LC 50 значений различных биопестицидов, используемых против личинок Culicoides , и их сравнение со значениями LD 50 у крыс.
| BCA | LC 50 мг / л | LD 50 значение для крыс | Замечания в контексте LD 50 |
|---|---|---|---|
B. bassiana (Bv) * bassiana (Bv) * | 2692 мг (10 8 КОЕ / г) | B. bassiana штамм HF23 в дозе 4,05 × 10 9 КОЕ / животное [28]. B. bassiana штаммы ATCC-74040 [29]: Острая токсичность и патогенность: Инфективность при пероральном введении крысы: LD50> 1.9 × 10 8 КОЕ / животное; нет доказательств токсичности, патогенности или инфекционности. Споры все еще обнаруживаются в фекалиях на 14 день. Острая интратрахеальная / ингаляционная токсичность у крыс: LD 50 > 2,5 × 10 9 КОЕ / животное; исходное снижение массы тела, местные обратимые признаки воспаления легких. Нет доказательств патогенности или инфекционности. Очистка легочной ткани завершилась к 15-му дню после введения дозы. Острая внутривенная / внутрибрюшинная токсичность у крыс: LD 50 > 2.0 × 10 7 КОЕ; нет доказательств токсичности (назальная секреция в 1-й день), патогенности или инфекционности.  Клиренс в крови завершен на 2 день после введения дозы Клиренс в крови завершен на 2 день после введения дозы | На основании (а) значений LD 50 и оценочных исследований различных штаммов этих двух грибов, которые доказали их эффективность против двукрылых вредителей [1-11,28-30], (б) широкое использование двух грибов против вредителей сельскохозяйственных культур и (в), таким образом, хорошее знакомство фермеров с этими грибами, настоящее исследование рекомендует их использование в программе IPM против Culicoides spp. |
| M. anisopliae (Mt) * | 3837 мг (10 8 КОЕ / г) | LD 50 острый пероральный прием, крысы> 2000 мг / кг; LD 50 острая кожная, крысы> 2000 мг / кг, внутрибрюшинная инъекция, переносится крысами (5 × 10 9 спор / кг массы тела), LC 50 острая ингаляционная токсичность 4,85 мг, раздражение кожи, не вызывает раздражения у кроликов [30 ] |
Таблица-3
Уравнения регрессии пробита для грибковых BCA против личинок Culicoides spp.
| BCA | Уравнение регрессии | Предел начала отсчета | ||
|---|---|---|---|---|
| | ||||
| Нижний | Верхний | |||
| Bv | PROBIT (p) = Intercept (2.694) + B (3.694) + B (3.694) + B (3.69866) ) × X (логарифм концентрации) | 2.824 | 4.908 | |
| Mt | PROBIT (p) = Intercept (1. 975) + 975) + B (3.582) × X (log концентрации) | 2.504 | 4.660 | |
Пробит линия для личинок Beauveria bassiana против личинок Culicoides .
Личинки Culicoides погибли из-за заражения Beauveria bassiana (× 50).
Нормальный труп личинок Culicoides (контроль) (× 50).
Личинки Culicoides погибли из-за Metarhizium anisopliae (× 50).
Личинки Culicoides погибли из-за Metarhizium anisopliae (× 50).
Пробит линия на Metarhizium anisopliae против личинок Culicoides .
В испытании «А» смерть взрослых особей Culicoides была вызвана обоими грибами в течение 24-48 часов, в то время как гибель мошек в контроле наблюдалась через 96 часов, а после смерти рост грибов очень хорошо наблюдался на участке. мертвые трупы инфицированных мошек (рисунки -).Присмотревшись к рисункам, он показал, что до 11-17 дней после заражения трупы в контрольной группе не имели роста грибов, в отличие от этого, на 11 день (рисунки и) и на 17 день после заражения (рисунки- и) обработанные грибком трупы показали обширный рост грибка. Результаты испытания «B» показали, что мошки, собранные с обработанного квадрата, погибли в течение 24-48 часов по сравнению с 96 часами в контрольной и мертвые трупы из обработанных групп, после инкубации в течение 8-15 дней при комнатной температуре и относительной влажности 75% показали огромный рост грибок, что доказывает, что оба гриба обладают способностью вызывать инфекцию при существующем уровне влажности.Однако крупномасштабные моделируемые исследования не могли быть проведены, потому что после заражения мошками, когда они летают, дальнейшая судьба инфекции не может быть установлена.
Culicoides peregrinus нормальный труп (контроль) на 11-е сутки PI (× 50).
Culicoides peregrinus рост Metarhizium anisopliae на 11-е сутки PI (× 50).
Culicoides peregrinus рост Beauveria bassiana на 11-е сутки PI (× 50).
Culicoides peregrinus нормальный труп (контроль) на 17-е сутки PI (× 50).
Culicoides peregrinus рост Metarhizium anisopliae на 17-е сутки PI (× 50).
Culicoides peregrinus рост Beauveria bassiana на 17-е сутки PI (× 50).
Целью настоящего исследования не было сравнение эффективности двух изученных грибов, и данные не были получены для этого контекста, но в целом можно предположить, что в преобладающих условиях окружающей среды в регионе Маратвада (Парбхани) штата Махараштра, М.anisopliae оказался сравнительно лучшим выбором с точки зрения смертности личинок и роста грибка в организме взрослых мошек. Место настоящего исследования, регион Маратвада расположен между 17 ° 35’N-20 ° 40’N широты и 70 ° 40′-78 ° 15 ‘восточной долготы, MSL — 40,9 м, в зоне плато Декан, в основном это интенсивный аграрный регион. . Климатологически это было отнесено к категории полузасушливых на ежегодной основе. От влажного до перувлажного в сезон дождей, от субгумидного до полузасушливого зимой и засушливого в летний сезон.Соответствующая картина распределения годовых осадков (500-1100 мм) составляет 75-85, 10-15 и 6-10% соответственно. Период влажных муссонов (23-44 недели, 4 -е, июня — 4 -е ноября) чередуется с продолжительной холодной зимой без дождя (недели 45-9, 5 -е, ноября-4 -е марта). Минимальная температура колеблется от 12 ° C до 18 ° C, а максимальная от 40 ° C до 45 ° C наблюдается летом (недели 10-22, 5 -е марта-3 -е июня), имея заметные временные и пространственные изменчивость, типичная характеристика полузасушливого климата [14].
. Климатологически это было отнесено к категории полузасушливых на ежегодной основе. От влажного до перувлажного в сезон дождей, от субгумидного до полузасушливого зимой и засушливого в летний сезон.Соответствующая картина распределения годовых осадков (500-1100 мм) составляет 75-85, 10-15 и 6-10% соответственно. Период влажных муссонов (23-44 недели, 4 -е, июня — 4 -е ноября) чередуется с продолжительной холодной зимой без дождя (недели 45-9, 5 -е, ноября-4 -е марта). Минимальная температура колеблется от 12 ° C до 18 ° C, а максимальная от 40 ° C до 45 ° C наблюдается летом (недели 10-22, 5 -е марта-3 -е июня), имея заметные временные и пространственные изменчивость, типичная характеристика полузасушливого климата [14].
Энтомопатогенные грибы широко распространены по всему царству грибов, хотя большинство из них встречается в группе Deuteromycotina и Zygomycotina , из которых M. anisopliae и B. используется как грибковый биопестицид в больших масштабах. Механизм действия на генерализованную линию грибов против насекомых был описан Геттелем и Инглисом [15]. Согласно их исследованию, наиболее распространенный путь вторжения хозяина — через внешние покровы (контакт с конидиоспорами, т.э., конидии). Хотя возможно заражение через пищеварительный тракт. Конидии прикрепляются к кутикуле, прорастают и проникают в кутикулу с помощью ферментативной деградации и давления зародышевой трубки [16,17]. Попав в гемоцель, мицелий разрастается по всему хозяину, образуя тела гиф, называемые бластоспорами. Смерть насекомого часто происходит из-за сочетания действия грибковых токсинов, физического препятствия кровообращению, истощения питательных веществ и / или вторжения в органы. После смерти хозяина гифы обычно выходят из трупа, и при подходящих абиотических условиях на внешней стороне хозяина образуются конидии.Затем они разносятся ветром или водой. Инфекция также может передаваться через дыхательную систему [18].
используется как грибковый биопестицид в больших масштабах. Механизм действия на генерализованную линию грибов против насекомых был описан Геттелем и Инглисом [15]. Согласно их исследованию, наиболее распространенный путь вторжения хозяина — через внешние покровы (контакт с конидиоспорами, т.э., конидии). Хотя возможно заражение через пищеварительный тракт. Конидии прикрепляются к кутикуле, прорастают и проникают в кутикулу с помощью ферментативной деградации и давления зародышевой трубки [16,17]. Попав в гемоцель, мицелий разрастается по всему хозяину, образуя тела гиф, называемые бластоспорами. Смерть насекомого часто происходит из-за сочетания действия грибковых токсинов, физического препятствия кровообращению, истощения питательных веществ и / или вторжения в органы. После смерти хозяина гифы обычно выходят из трупа, и при подходящих абиотических условиях на внешней стороне хозяина образуются конидии.Затем они разносятся ветром или водой. Инфекция также может передаваться через дыхательную систему [18]. После инфицирования образуются свободно плавающие дрожжеподобные тела гиф, которые распространяются по гемоцелю [19]. Аналогичным образом, данные также показывают, что значения LC 50 обоих грибов и соответствующие им значения LD 50 указывают на их безопасность и поэтому могут быть рекомендованы для индукции в программах IPM.
После инфицирования образуются свободно плавающие дрожжеподобные тела гиф, которые распространяются по гемоцелю [19]. Аналогичным образом, данные также показывают, что значения LC 50 обоих грибов и соответствующие им значения LD 50 указывают на их безопасность и поэтому могут быть рекомендованы для индукции в программах IPM.
Не будет вырываться из контекста, чтобы рассмотреть способ действия и эффективность обоих грибов, оцененных различными авторами против личинок комаров, как подробно описано Scholte et al .[20] со ссылкой на настоящее исследование.
B. bassiana
Сухой конидиальный порошок при высыпании на поверхность воды в местах размножения комаров, конидии являются гидрофобными, поэтому плавают на поверхности воды, а личинки комаров, контактирующие с поверхностью, питаются, главным образом, на конце сифона, блокируют дыхание и тем самым убивает личинок. У взрослых конидий проникает через дыхальца, прорастает, проникает в стенки трахеи и впоследствии считается, что они выделяют токсин, убивающий взрослых особей [21]. Последующие исследования токсинов этого рода подтвердили, что это боверицин, бассианин, бассианолид, боверолиды и тенеллин из B. bassiana , [22]. Hart и MacLeod [23], которые зафиксировали прорастание конидий Beauveria , описали потребность как RH выше 94%, однако инфекция, по-видимому, не зависит от температуры [16]. В лабораторных испытаниях против взрослых особей Culex tarsalis, Culex pipiens , Aedes aegypti, Ochlerotatus sierrensis, Ochlerotatus nigromaculis (Ludlow) и Anopheles albimanus , конидии B.bassiana вызвала 100% смертность в течение 5 дней после воздействия [21]. Срезы инфицированных взрослых, фиксированные и погруженные в парафин сразу после смерти, выявили некоторое количество мицелия в областях, окружающих основные стволы трахеи. Из этих наблюдений [21] пришли к выводу, что конидии, по-видимому, проникают через дыхальца, прорастают, вторгаются в стенки трахеи и впоследствии, как полагают, выделяют токсин, убивающий взрослых особей.
Последующие исследования токсинов этого рода подтвердили, что это боверицин, бассианин, бассианолид, боверолиды и тенеллин из B. bassiana , [22]. Hart и MacLeod [23], которые зафиксировали прорастание конидий Beauveria , описали потребность как RH выше 94%, однако инфекция, по-видимому, не зависит от температуры [16]. В лабораторных испытаниях против взрослых особей Culex tarsalis, Culex pipiens , Aedes aegypti, Ochlerotatus sierrensis, Ochlerotatus nigromaculis (Ludlow) и Anopheles albimanus , конидии B.bassiana вызвала 100% смертность в течение 5 дней после воздействия [21]. Срезы инфицированных взрослых, фиксированные и погруженные в парафин сразу после смерти, выявили некоторое количество мицелия в областях, окружающих основные стволы трахеи. Из этих наблюдений [21] пришли к выводу, что конидии, по-видимому, проникают через дыхальца, прорастают, вторгаются в стенки трахеи и впоследствии, как полагают, выделяют токсин, убивающий взрослых особей.
В свете этих наблюдений можно констатировать, что грибковая инфекция, изучаемая против мошек Culicoides , по-видимому, приводит к аналогичному типу патогенеза.Когда грибок применяли в местах покоя Culicoides , они подхватили инфекцию, возможно, через лапки, и смерть наступила в течение 24 часов с обильным ростом грибка на теле через 10 дней (рисунки и). Таким образом, распыление грибка B. bassiana на места покоя Culicoides может быть эффективным способом биологической борьбы с взрослыми мошками Culicoides . Beauveria — один из наиболее часто выделяемых энтомогенных родов грибов и имеет космополитическое распространение, хотя у этого рода очень широкий круг хозяев [24].В трех небольших экспериментах на открытом воздухе с конидиями B. bassiana через 2 недели было обнаружено снижение на 82, 95 и 69% на личинках и куколках C. pipiens [21]. Аналогичные результаты были получены в отношении сокращения личинок Culicoides при внесении грибов B. bassiana в дренажные каналы в настоящем полевом исследовании (). Несмотря на стабильные результаты, полученные в лаборатории, полевые результаты были расплывчатыми и противоречивыми. Два недостатка B.bassiana , упомянутые в литературе: (1) Восприимчивые виды были подвержены заражению только вскоре после линьки. Если инфекция произошла незадолго до линьки, мицелий был потерян во время линьки, (2) проблема, связанная с использованием конидий, заключается в том, что они не имеют остаточного эффекта. Они прорастают в местах обитания комаров, даже если они не контактируют с личинками. В ходе полевых испытаний настоящего проекта также выяснилось, что грибок нуждается в естественном применении без значительного остаточного эффекта (максимум до 7 дней).
bassiana в дренажные каналы в настоящем полевом исследовании (). Несмотря на стабильные результаты, полученные в лаборатории, полевые результаты были расплывчатыми и противоречивыми. Два недостатка B.bassiana , упомянутые в литературе: (1) Восприимчивые виды были подвержены заражению только вскоре после линьки. Если инфекция произошла незадолго до линьки, мицелий был потерян во время линьки, (2) проблема, связанная с использованием конидий, заключается в том, что они не имеют остаточного эффекта. Они прорастают в местах обитания комаров, даже если они не контактируют с личинками. В ходе полевых испытаний настоящего проекта также выяснилось, что грибок нуждается в естественном применении без значительного остаточного эффекта (максимум до 7 дней).
M. anisopliae
Согласно Бусиасу и Пендленду [25], гриб имеет широкий спектр хозяев, включая паукообразных и пять отрядов насекомых. У наземных насекомых жизненный цикл начинается с того, что конидии прикрепляются к кутикуле хозяина, образуя аппрессорий, за которым следует штифт для проникновения в кутикулу. После попадания в гемоцель образуются гифы, которые производят и выделяют токсины, убивая хозяина в течение 4-16 дней. Эти выделяемые токсины представляют собой деструксины, сваинсинон и цитохалазин С [22].Если условия теплые и влажные, конидиеносцы прорастут через кутикулу и покроют насекомое конидиями. В местах размножения, если конидии наносятся на поверхность воды, личинки контактируют с конидиями через периспиракулярные клапаны во время забора воздуха. Грибок прорастает и проникает в дыхательный сифон, блокируя дыхательный механизм [26,27]. Закупорка дыхалец обычно приводит к смерти до того, как происходит значительное вторжение в гемоцель, поэтому формирование тела гиф минимально.Оптимальная температура роста для большинства штаммов — 27-28 ° C, относительная влажность 92% [16]. Согласно литературным данным, M. anisopliae имеет несколько характеристик, которые делают его интересным в качестве средства борьбы с микробными комарами. Его преимущество заключается в том, что он не прорастает в среде комара до фактического контакта с хозяином и его последующего сохранения в окружающей среде, а также тот факт, что его эффект не ограничивается периодами линьки хозяина, в результате чего этот гриб воспринимается как по сравнению с Б.
После попадания в гемоцель образуются гифы, которые производят и выделяют токсины, убивая хозяина в течение 4-16 дней. Эти выделяемые токсины представляют собой деструксины, сваинсинон и цитохалазин С [22].Если условия теплые и влажные, конидиеносцы прорастут через кутикулу и покроют насекомое конидиями. В местах размножения, если конидии наносятся на поверхность воды, личинки контактируют с конидиями через периспиракулярные клапаны во время забора воздуха. Грибок прорастает и проникает в дыхательный сифон, блокируя дыхательный механизм [26,27]. Закупорка дыхалец обычно приводит к смерти до того, как происходит значительное вторжение в гемоцель, поэтому формирование тела гиф минимально.Оптимальная температура роста для большинства штаммов — 27-28 ° C, относительная влажность 92% [16]. Согласно литературным данным, M. anisopliae имеет несколько характеристик, которые делают его интересным в качестве средства борьбы с микробными комарами. Его преимущество заключается в том, что он не прорастает в среде комара до фактического контакта с хозяином и его последующего сохранения в окружающей среде, а также тот факт, что его эффект не ограничивается периодами линьки хозяина, в результате чего этот гриб воспринимается как по сравнению с Б. bassiana , что делает этот гриб очень многообещающим средством борьбы [24]. Один недостаток, упомянутый в литературе в отношении использования M. anisopliae для борьбы с комарами, заключается в том, что конидии не образуются на погруженных в воду личинках убитых грибов, и, следовательно, требуются затопленные выбросы. Возможно, это могло быть причиной того, что конидии не могут образовываться на мертвых личинках Culicoides , и, следовательно, в настоящем исследовании также было сочтено необходимым высвобождение грибка на дренажные каналы через 7 дней PI ().
bassiana , что делает этот гриб очень многообещающим средством борьбы [24]. Один недостаток, упомянутый в литературе в отношении использования M. anisopliae для борьбы с комарами, заключается в том, что конидии не образуются на погруженных в воду личинках убитых грибов, и, следовательно, требуются затопленные выбросы. Возможно, это могло быть причиной того, что конидии не могут образовываться на мертвых личинках Culicoides , и, следовательно, в настоящем исследовании также было сочтено необходимым высвобождение грибка на дренажные каналы через 7 дней PI ().
Агенты биологической борьбы с грибками для комплексного управления Culicoides spp. (Diptera: Ceratopogonidae) домашнего скота
Влияние грибка на личинок и взрослых особей
Culicoides мошек in vitro и in vivo Значения LC 50 , оцененные по сравнению с личинок Culicoides , составили 2692 мг и 383712 мг (10 8 900 КОЕ / г) для B. bassiana и M. anisopliae , соответственно, путем нанесения пробитных линий (Таблицы- и; Рисунки- и).Данные показали, что грибковое заражение личинок Culicoides привело к гибели, и поэтому количество личинок постоянно показывало тенденцию к снижению, хотя ежедневно добавлялись новые личинки, вылупившиеся из яиц, отложенных мошками Culicoides . Однако через 7 дней после заражения количество личинок возобновлялось до исходного количества, наблюдаемого в день 0, и оба гриба оказались эффективными в течение максимум 7 дней, что потребовало их применения без применения. Гибель личинок Culicoides в результате заражения B.bassiana показала зеленоватую окраску в середине тела, тогда как голова и хвост показали интенсивные черноватые изменения () по сравнению с нормальной текстурой тела личинок (). Заражение M. anisopliae привело к гибели личинок Culicoides с зеленоватой и черноватой окраской тела (рисунки- и), а также к полному разрушению и десквамации кишечного канала.
anisopliae , соответственно, путем нанесения пробитных линий (Таблицы- и; Рисунки- и).Данные показали, что грибковое заражение личинок Culicoides привело к гибели, и поэтому количество личинок постоянно показывало тенденцию к снижению, хотя ежедневно добавлялись новые личинки, вылупившиеся из яиц, отложенных мошками Culicoides . Однако через 7 дней после заражения количество личинок возобновлялось до исходного количества, наблюдаемого в день 0, и оба гриба оказались эффективными в течение максимум 7 дней, что потребовало их применения без применения. Гибель личинок Culicoides в результате заражения B.bassiana показала зеленоватую окраску в середине тела, тогда как голова и хвост показали интенсивные черноватые изменения () по сравнению с нормальной текстурой тела личинок (). Заражение M. anisopliae привело к гибели личинок Culicoides с зеленоватой и черноватой окраской тела (рисунки- и), а также к полному разрушению и десквамации кишечного канала.
Таблица 2
LC 50 значений различных биопестицидов, используемых против личинок Culicoides , и их сравнение со значениями LD 50 у крыс.
| BCA | LC 50 мг / л | LD 50 значение для крыс | Замечания в контексте LD 50 |
|---|---|---|---|
| B. bassiana (Bv) * | 2692 мг (10 8 КОЕ / г) | B. bassiana штамм HF23 в дозе 4,05 × 10 9 КОЕ / животное [28]. B. bassiana штаммы ATCC-74040 [29]: Острая токсичность и патогенность: Инфективность при пероральном введении крысы: LD50> 1.  9 × 10 8 КОЕ / животное; нет доказательств токсичности, патогенности или инфекционности. Споры все еще обнаруживаются в фекалиях на 14 день. 9 × 10 8 КОЕ / животное; нет доказательств токсичности, патогенности или инфекционности. Споры все еще обнаруживаются в фекалиях на 14 день. Острая интратрахеальная / ингаляционная токсичность у крыс: LD 50 > 2,5 × 10 9 КОЕ / животное; исходное снижение массы тела, местные обратимые признаки воспаления легких. Нет доказательств патогенности или инфекционности. Очистка легочной ткани завершилась к 15-му дню после введения дозы. Острая внутривенная / внутрибрюшинная токсичность у крыс: LD 50 > 2.0 × 10 7 КОЕ; нет доказательств токсичности (назальная секреция в 1-й день), патогенности или инфекционности. Клиренс в крови завершен на 2 день после введения дозы | На основании (а) значений LD 50 и оценочных исследований различных штаммов этих двух грибов, которые доказали их эффективность против двукрылых вредителей [1-11,28-30], (б) широкое использование двух грибов против вредителей сельскохозяйственных культур и (в), таким образом, хорошее знакомство фермеров с этими грибами, настоящее исследование рекомендует их использование в программе IPM против Culicoides spp. |
| M. anisopliae (Mt) * | 3837 мг (10 8 КОЕ / г) | LD 50 острый пероральный прием, крысы> 2000 мг / кг; LD 50 острая кожная, крысы> 2000 мг / кг, внутрибрюшинная инъекция, переносится крысами (5 × 10 9 спор / кг массы тела), LC 50 острая ингаляционная токсичность 4,85 мг, раздражение кожи, не вызывает раздражения у кроликов [30 ] |
Таблица-3
Уравнения регрессии пробита для грибковых BCA против личинок Culicoides spp.
| BCA | Уравнение регрессии | Предел начала отсчета | ||
|---|---|---|---|---|
| | ||||
| Нижний | Верхний | |||
| Bv | PROBIT (p) = Intercept (2. 694) + 694) + B (3.694) + B (3.694) + B (3.69866) ) × X (логарифм концентрации) | 2.824 | 4.908 | |
| Mt | PROBIT (p) = Intercept (1.975) + B (3.582) × X (log концентрации) | 2.504 | 4.660 | |
Пробит линия для личинок Beauveria bassiana против личинок Culicoides .
Личинки Culicoides погибли из-за заражения Beauveria bassiana (× 50).
Нормальный труп личинок Culicoides (контроль) (× 50).
Личинки Culicoides погибли из-за Metarhizium anisopliae (× 50).
Личинки Culicoides погибли из-за Metarhizium anisopliae (× 50).
Пробит линия на Metarhizium anisopliae против личинок Culicoides .
В испытании «А» смерть взрослых особей Culicoides была вызвана обоими грибами в течение 24-48 часов, в то время как гибель мошек в контроле наблюдалась через 96 часов, а после смерти рост грибов очень хорошо наблюдался на участке. мертвые трупы инфицированных мошек (рисунки -).Присмотревшись к рисункам, он показал, что до 11-17 дней после заражения трупы в контрольной группе не имели роста грибов, в отличие от этого, на 11 день (рисунки и) и на 17 день после заражения (рисунки- и) обработанные грибком трупы показали обширный рост грибка. Результаты испытания «B» показали, что мошки, собранные с обработанного квадрата, погибли в течение 24-48 часов по сравнению с 96 часами в контрольной и мертвые трупы из обработанных групп, после инкубации в течение 8-15 дней при комнатной температуре и относительной влажности 75% показали огромный рост грибок, что доказывает, что оба гриба обладают способностью вызывать инфекцию при существующем уровне влажности. Однако крупномасштабные моделируемые исследования не могли быть проведены, потому что после заражения мошками, когда они летают, дальнейшая судьба инфекции не может быть установлена.
Однако крупномасштабные моделируемые исследования не могли быть проведены, потому что после заражения мошками, когда они летают, дальнейшая судьба инфекции не может быть установлена.
Culicoides peregrinus нормальный труп (контроль) на 11-е сутки PI (× 50).
Culicoides peregrinus рост Metarhizium anisopliae на 11-е сутки PI (× 50).
Culicoides peregrinus рост Beauveria bassiana на 11-е сутки PI (× 50).
Culicoides peregrinus нормальный труп (контроль) на 17-е сутки PI (× 50).
Culicoides peregrinus рост Metarhizium anisopliae на 17-е сутки PI (× 50).
Culicoides peregrinus рост Beauveria bassiana на 17-е сутки PI (× 50).
Целью настоящего исследования не было сравнение эффективности двух изученных грибов, и данные не были получены для этого контекста, но в целом можно предположить, что в преобладающих условиях окружающей среды в регионе Маратвада (Парбхани) штата Махараштра, М. anisopliae оказался сравнительно лучшим выбором с точки зрения смертности личинок и роста грибка в организме взрослых мошек. Место настоящего исследования, регион Маратвада расположен между 17 ° 35’N-20 ° 40’N широты и 70 ° 40′-78 ° 15 ‘восточной долготы, MSL — 40,9 м, в зоне плато Декан, в основном это интенсивный аграрный регион. . Климатологически это было отнесено к категории полузасушливых на ежегодной основе. От влажного до перувлажного в сезон дождей, от субгумидного до полузасушливого зимой и засушливого в летний сезон.Соответствующая картина распределения годовых осадков (500-1100 мм) составляет 75-85, 10-15 и 6-10% соответственно. Период влажных муссонов (23-44 недели, 4 -е, июня — 4 -е ноября) чередуется с продолжительной холодной зимой без дождя (недели 45-9, 5 -е, ноября-4 -е марта). Минимальная температура колеблется от 12 ° C до 18 ° C, а максимальная от 40 ° C до 45 ° C наблюдается летом (недели 10-22, 5 -е марта-3 -е июня), имея заметные временные и пространственные изменчивость, типичная характеристика полузасушливого климата [14].
anisopliae оказался сравнительно лучшим выбором с точки зрения смертности личинок и роста грибка в организме взрослых мошек. Место настоящего исследования, регион Маратвада расположен между 17 ° 35’N-20 ° 40’N широты и 70 ° 40′-78 ° 15 ‘восточной долготы, MSL — 40,9 м, в зоне плато Декан, в основном это интенсивный аграрный регион. . Климатологически это было отнесено к категории полузасушливых на ежегодной основе. От влажного до перувлажного в сезон дождей, от субгумидного до полузасушливого зимой и засушливого в летний сезон.Соответствующая картина распределения годовых осадков (500-1100 мм) составляет 75-85, 10-15 и 6-10% соответственно. Период влажных муссонов (23-44 недели, 4 -е, июня — 4 -е ноября) чередуется с продолжительной холодной зимой без дождя (недели 45-9, 5 -е, ноября-4 -е марта). Минимальная температура колеблется от 12 ° C до 18 ° C, а максимальная от 40 ° C до 45 ° C наблюдается летом (недели 10-22, 5 -е марта-3 -е июня), имея заметные временные и пространственные изменчивость, типичная характеристика полузасушливого климата [14].
Энтомопатогенные грибы широко распространены по всему царству грибов, хотя большинство из них встречается в группе Deuteromycotina и Zygomycotina , из которых M. anisopliae и B. используется как грибковый биопестицид в больших масштабах. Механизм действия на генерализованную линию грибов против насекомых был описан Геттелем и Инглисом [15]. Согласно их исследованию, наиболее распространенный путь вторжения хозяина — через внешние покровы (контакт с конидиоспорами, т.э., конидии). Хотя возможно заражение через пищеварительный тракт. Конидии прикрепляются к кутикуле, прорастают и проникают в кутикулу с помощью ферментативной деградации и давления зародышевой трубки [16,17]. Попав в гемоцель, мицелий разрастается по всему хозяину, образуя тела гиф, называемые бластоспорами. Смерть насекомого часто происходит из-за сочетания действия грибковых токсинов, физического препятствия кровообращению, истощения питательных веществ и / или вторжения в органы. После смерти хозяина гифы обычно выходят из трупа, и при подходящих абиотических условиях на внешней стороне хозяина образуются конидии.Затем они разносятся ветром или водой. Инфекция также может передаваться через дыхательную систему [18]. После инфицирования образуются свободно плавающие дрожжеподобные тела гиф, которые распространяются по гемоцелю [19]. Аналогичным образом, данные также показывают, что значения LC 50 обоих грибов и соответствующие им значения LD 50 указывают на их безопасность и поэтому могут быть рекомендованы для индукции в программах IPM.
После смерти хозяина гифы обычно выходят из трупа, и при подходящих абиотических условиях на внешней стороне хозяина образуются конидии.Затем они разносятся ветром или водой. Инфекция также может передаваться через дыхательную систему [18]. После инфицирования образуются свободно плавающие дрожжеподобные тела гиф, которые распространяются по гемоцелю [19]. Аналогичным образом, данные также показывают, что значения LC 50 обоих грибов и соответствующие им значения LD 50 указывают на их безопасность и поэтому могут быть рекомендованы для индукции в программах IPM.
Не будет вырываться из контекста, чтобы рассмотреть способ действия и эффективность обоих грибов, оцененных различными авторами против личинок комаров, как подробно описано Scholte et al .[20] со ссылкой на настоящее исследование.
B. bassiana
Сухой конидиальный порошок при высыпании на поверхность воды в местах размножения комаров, конидии являются гидрофобными, поэтому плавают на поверхности воды, а личинки комаров, контактирующие с поверхностью, питаются, главным образом, на конце сифона, блокируют дыхание и тем самым убивает личинок. У взрослых конидий проникает через дыхальца, прорастает, проникает в стенки трахеи и впоследствии считается, что они выделяют токсин, убивающий взрослых особей [21].Последующие исследования токсинов этого рода подтвердили, что это боверицин, бассианин, бассианолид, боверолиды и тенеллин из B. bassiana , [22]. Hart и MacLeod [23], которые зафиксировали прорастание конидий Beauveria , описали потребность как RH выше 94%, однако инфекция, по-видимому, не зависит от температуры [16]. В лабораторных испытаниях против взрослых особей Culex tarsalis, Culex pipiens , Aedes aegypti, Ochlerotatus sierrensis, Ochlerotatus nigromaculis (Ludlow) и Anopheles albimanus , конидии B.bassiana вызвала 100% смертность в течение 5 дней после воздействия [21]. Срезы инфицированных взрослых, фиксированные и погруженные в парафин сразу после смерти, выявили некоторое количество мицелия в областях, окружающих основные стволы трахеи. Из этих наблюдений [21] пришли к выводу, что конидии, по-видимому, проникают через дыхальца, прорастают, вторгаются в стенки трахеи и впоследствии, как полагают, выделяют токсин, убивающий взрослых особей.
У взрослых конидий проникает через дыхальца, прорастает, проникает в стенки трахеи и впоследствии считается, что они выделяют токсин, убивающий взрослых особей [21].Последующие исследования токсинов этого рода подтвердили, что это боверицин, бассианин, бассианолид, боверолиды и тенеллин из B. bassiana , [22]. Hart и MacLeod [23], которые зафиксировали прорастание конидий Beauveria , описали потребность как RH выше 94%, однако инфекция, по-видимому, не зависит от температуры [16]. В лабораторных испытаниях против взрослых особей Culex tarsalis, Culex pipiens , Aedes aegypti, Ochlerotatus sierrensis, Ochlerotatus nigromaculis (Ludlow) и Anopheles albimanus , конидии B.bassiana вызвала 100% смертность в течение 5 дней после воздействия [21]. Срезы инфицированных взрослых, фиксированные и погруженные в парафин сразу после смерти, выявили некоторое количество мицелия в областях, окружающих основные стволы трахеи. Из этих наблюдений [21] пришли к выводу, что конидии, по-видимому, проникают через дыхальца, прорастают, вторгаются в стенки трахеи и впоследствии, как полагают, выделяют токсин, убивающий взрослых особей.
В свете этих наблюдений можно констатировать, что грибковая инфекция, изучаемая против мошек Culicoides , по-видимому, приводит к аналогичному типу патогенеза.Когда грибок применяли в местах покоя Culicoides , они подхватили инфекцию, возможно, через лапки, и смерть наступила в течение 24 часов с обильным ростом грибка на теле через 10 дней (рисунки и). Таким образом, распыление грибка B. bassiana на места покоя Culicoides может быть эффективным способом биологической борьбы с взрослыми мошками Culicoides . Beauveria — один из наиболее часто выделяемых энтомогенных родов грибов и имеет космополитическое распространение, хотя у этого рода очень широкий круг хозяев [24].В трех небольших экспериментах на открытом воздухе с конидиями B. bassiana через 2 недели было обнаружено снижение на 82, 95 и 69% на личинках и куколках C. pipiens [21]. Аналогичные результаты были получены в отношении сокращения личинок Culicoides при внесении грибов B. bassiana в дренажные каналы в настоящем полевом исследовании (). Несмотря на стабильные результаты, полученные в лаборатории, полевые результаты были расплывчатыми и противоречивыми. Два недостатка B.bassiana , упомянутые в литературе: (1) Восприимчивые виды были подвержены заражению только вскоре после линьки. Если инфекция произошла незадолго до линьки, мицелий был потерян во время линьки, (2) проблема, связанная с использованием конидий, заключается в том, что они не имеют остаточного эффекта. Они прорастают в местах обитания комаров, даже если они не контактируют с личинками. В ходе полевых испытаний настоящего проекта также выяснилось, что грибок нуждается в естественном применении без значительного остаточного эффекта (максимум до 7 дней).
bassiana в дренажные каналы в настоящем полевом исследовании (). Несмотря на стабильные результаты, полученные в лаборатории, полевые результаты были расплывчатыми и противоречивыми. Два недостатка B.bassiana , упомянутые в литературе: (1) Восприимчивые виды были подвержены заражению только вскоре после линьки. Если инфекция произошла незадолго до линьки, мицелий был потерян во время линьки, (2) проблема, связанная с использованием конидий, заключается в том, что они не имеют остаточного эффекта. Они прорастают в местах обитания комаров, даже если они не контактируют с личинками. В ходе полевых испытаний настоящего проекта также выяснилось, что грибок нуждается в естественном применении без значительного остаточного эффекта (максимум до 7 дней).
M. anisopliae
Согласно Бусиасу и Пендленду [25], гриб имеет широкий спектр хозяев, включая паукообразных и пять отрядов насекомых. У наземных насекомых жизненный цикл начинается с того, что конидии прикрепляются к кутикуле хозяина, образуя аппрессорий, за которым следует штифт для проникновения в кутикулу. После попадания в гемоцель образуются гифы, которые производят и выделяют токсины, убивая хозяина в течение 4-16 дней. Эти выделяемые токсины представляют собой деструксины, сваинсинон и цитохалазин С [22].Если условия теплые и влажные, конидиеносцы прорастут через кутикулу и покроют насекомое конидиями. В местах размножения, если конидии наносятся на поверхность воды, личинки контактируют с конидиями через периспиракулярные клапаны во время забора воздуха. Грибок прорастает и проникает в дыхательный сифон, блокируя дыхательный механизм [26,27]. Закупорка дыхалец обычно приводит к смерти до того, как происходит значительное вторжение в гемоцель, поэтому формирование тела гиф минимально.Оптимальная температура роста для большинства штаммов — 27-28 ° C, относительная влажность 92% [16]. Согласно литературным данным, M. anisopliae имеет несколько характеристик, которые делают его интересным в качестве средства борьбы с микробными комарами. Его преимущество заключается в том, что он не прорастает в среде комара до фактического контакта с хозяином и его последующего сохранения в окружающей среде, а также тот факт, что его эффект не ограничивается периодами линьки хозяина, в результате чего этот гриб воспринимается как по сравнению с Б.
После попадания в гемоцель образуются гифы, которые производят и выделяют токсины, убивая хозяина в течение 4-16 дней. Эти выделяемые токсины представляют собой деструксины, сваинсинон и цитохалазин С [22].Если условия теплые и влажные, конидиеносцы прорастут через кутикулу и покроют насекомое конидиями. В местах размножения, если конидии наносятся на поверхность воды, личинки контактируют с конидиями через периспиракулярные клапаны во время забора воздуха. Грибок прорастает и проникает в дыхательный сифон, блокируя дыхательный механизм [26,27]. Закупорка дыхалец обычно приводит к смерти до того, как происходит значительное вторжение в гемоцель, поэтому формирование тела гиф минимально.Оптимальная температура роста для большинства штаммов — 27-28 ° C, относительная влажность 92% [16]. Согласно литературным данным, M. anisopliae имеет несколько характеристик, которые делают его интересным в качестве средства борьбы с микробными комарами. Его преимущество заключается в том, что он не прорастает в среде комара до фактического контакта с хозяином и его последующего сохранения в окружающей среде, а также тот факт, что его эффект не ограничивается периодами линьки хозяина, в результате чего этот гриб воспринимается как по сравнению с Б. bassiana , что делает этот гриб очень многообещающим средством борьбы [24]. Один недостаток, упомянутый в литературе в отношении использования M. anisopliae для борьбы с комарами, заключается в том, что конидии не образуются на погруженных в воду личинках убитых грибов, и, следовательно, требуются затопленные выбросы. Возможно, это могло быть причиной того, что конидии не могут образовываться на мертвых личинках Culicoides , и, следовательно, в настоящем исследовании также было сочтено необходимым высвобождение грибка на дренажные каналы через 7 дней PI ().
bassiana , что делает этот гриб очень многообещающим средством борьбы [24]. Один недостаток, упомянутый в литературе в отношении использования M. anisopliae для борьбы с комарами, заключается в том, что конидии не образуются на погруженных в воду личинках убитых грибов, и, следовательно, требуются затопленные выбросы. Возможно, это могло быть причиной того, что конидии не могут образовываться на мертвых личинках Culicoides , и, следовательно, в настоящем исследовании также было сочтено необходимым высвобождение грибка на дренажные каналы через 7 дней PI ().
Агенты биологической борьбы с грибками для комплексного управления Culicoides spp. (Diptera: Ceratopogonidae) домашнего скота
Влияние грибка на личинок и взрослых особей
Culicoides мошек in vitro и in vivo Значения LC 50 , оцененные по сравнению с личинок Culicoides , составили 2692 мг и 383712 мг (10 8 900 КОЕ / г) для B. bassiana и M. anisopliae , соответственно, путем нанесения пробитных линий (Таблицы- и; Рисунки- и).Данные показали, что грибковое заражение личинок Culicoides привело к гибели, и поэтому количество личинок постоянно показывало тенденцию к снижению, хотя ежедневно добавлялись новые личинки, вылупившиеся из яиц, отложенных мошками Culicoides . Однако через 7 дней после заражения количество личинок возобновлялось до исходного количества, наблюдаемого в день 0, и оба гриба оказались эффективными в течение максимум 7 дней, что потребовало их применения без применения. Гибель личинок Culicoides в результате заражения B.bassiana показала зеленоватую окраску в середине тела, тогда как голова и хвост показали интенсивные черноватые изменения () по сравнению с нормальной текстурой тела личинок (). Заражение M. anisopliae привело к гибели личинок Culicoides с зеленоватой и черноватой окраской тела (рисунки- и), а также к полному разрушению и десквамации кишечного канала.
anisopliae , соответственно, путем нанесения пробитных линий (Таблицы- и; Рисунки- и).Данные показали, что грибковое заражение личинок Culicoides привело к гибели, и поэтому количество личинок постоянно показывало тенденцию к снижению, хотя ежедневно добавлялись новые личинки, вылупившиеся из яиц, отложенных мошками Culicoides . Однако через 7 дней после заражения количество личинок возобновлялось до исходного количества, наблюдаемого в день 0, и оба гриба оказались эффективными в течение максимум 7 дней, что потребовало их применения без применения. Гибель личинок Culicoides в результате заражения B.bassiana показала зеленоватую окраску в середине тела, тогда как голова и хвост показали интенсивные черноватые изменения () по сравнению с нормальной текстурой тела личинок (). Заражение M. anisopliae привело к гибели личинок Culicoides с зеленоватой и черноватой окраской тела (рисунки- и), а также к полному разрушению и десквамации кишечного канала.
Таблица 2
LC 50 значений различных биопестицидов, используемых против личинок Culicoides , и их сравнение со значениями LD 50 у крыс.
| BCA | LC 50 мг / л | LD 50 значение для крыс | Замечания в контексте LD 50 |
|---|---|---|---|
| B. bassiana (Bv) * | 2692 мг (10 8 КОЕ / г) | B. bassiana штамм HF23 в дозе 4,05 × 10 9 КОЕ / животное [28]. B. bassiana штаммы ATCC-74040 [29]: Острая токсичность и патогенность: Инфективность при пероральном введении крысы: LD50> 1.  9 × 10 8 КОЕ / животное; нет доказательств токсичности, патогенности или инфекционности. Споры все еще обнаруживаются в фекалиях на 14 день. 9 × 10 8 КОЕ / животное; нет доказательств токсичности, патогенности или инфекционности. Споры все еще обнаруживаются в фекалиях на 14 день. Острая интратрахеальная / ингаляционная токсичность у крыс: LD 50 > 2,5 × 10 9 КОЕ / животное; исходное снижение массы тела, местные обратимые признаки воспаления легких. Нет доказательств патогенности или инфекционности. Очистка легочной ткани завершилась к 15-му дню после введения дозы. Острая внутривенная / внутрибрюшинная токсичность у крыс: LD 50 > 2.0 × 10 7 КОЕ; нет доказательств токсичности (назальная секреция в 1-й день), патогенности или инфекционности. Клиренс в крови завершен на 2 день после введения дозы | На основании (а) значений LD 50 и оценочных исследований различных штаммов этих двух грибов, которые доказали их эффективность против двукрылых вредителей [1-11,28-30], (б) широкое использование двух грибов против вредителей сельскохозяйственных культур и (в), таким образом, хорошее знакомство фермеров с этими грибами, настоящее исследование рекомендует их использование в программе IPM против Culicoides spp. |
| M. anisopliae (Mt) * | 3837 мг (10 8 КОЕ / г) | LD 50 острый пероральный прием, крысы> 2000 мг / кг; LD 50 острая кожная, крысы> 2000 мг / кг, внутрибрюшинная инъекция, переносится крысами (5 × 10 9 спор / кг массы тела), LC 50 острая ингаляционная токсичность 4,85 мг, раздражение кожи, не вызывает раздражения у кроликов [30 ] |
Таблица-3
Уравнения регрессии пробита для грибковых BCA против личинок Culicoides spp.
| BCA | Уравнение регрессии | Предел начала отсчета | ||
|---|---|---|---|---|
| | ||||
| Нижний | Верхний | |||
| Bv | PROBIT (p) = Intercept (2. 694) + 694) + B (3.694) + B (3.694) + B (3.69866) ) × X (логарифм концентрации) | 2.824 | 4.908 | |
| Mt | PROBIT (p) = Intercept (1.975) + B (3.582) × X (log концентрации) | 2.504 | 4.660 | |
Пробит линия для личинок Beauveria bassiana против личинок Culicoides .
Личинки Culicoides погибли из-за заражения Beauveria bassiana (× 50).
Нормальный труп личинок Culicoides (контроль) (× 50).
Личинки Culicoides погибли из-за Metarhizium anisopliae (× 50).
Личинки Culicoides погибли из-за Metarhizium anisopliae (× 50).
Пробит линия на Metarhizium anisopliae против личинок Culicoides .
В испытании «А» смерть взрослых особей Culicoides была вызвана обоими грибами в течение 24-48 часов, в то время как гибель мошек в контроле наблюдалась через 96 часов, а после смерти рост грибов очень хорошо наблюдался на участке. мертвые трупы инфицированных мошек (рисунки -).Присмотревшись к рисункам, он показал, что до 11-17 дней после заражения трупы в контрольной группе не имели роста грибов, в отличие от этого, на 11 день (рисунки и) и на 17 день после заражения (рисунки- и) обработанные грибком трупы показали обширный рост грибка. Результаты испытания «B» показали, что мошки, собранные с обработанного квадрата, погибли в течение 24-48 часов по сравнению с 96 часами в контрольной и мертвые трупы из обработанных групп, после инкубации в течение 8-15 дней при комнатной температуре и относительной влажности 75% показали огромный рост грибок, что доказывает, что оба гриба обладают способностью вызывать инфекцию при существующем уровне влажности. Однако крупномасштабные моделируемые исследования не могли быть проведены, потому что после заражения мошками, когда они летают, дальнейшая судьба инфекции не может быть установлена.
Однако крупномасштабные моделируемые исследования не могли быть проведены, потому что после заражения мошками, когда они летают, дальнейшая судьба инфекции не может быть установлена.
Culicoides peregrinus нормальный труп (контроль) на 11-е сутки PI (× 50).
Culicoides peregrinus рост Metarhizium anisopliae на 11-е сутки PI (× 50).
Culicoides peregrinus рост Beauveria bassiana на 11-е сутки PI (× 50).
Culicoides peregrinus нормальный труп (контроль) на 17-е сутки PI (× 50).
Culicoides peregrinus рост Metarhizium anisopliae на 17-е сутки PI (× 50).
Culicoides peregrinus рост Beauveria bassiana на 17-е сутки PI (× 50).
Целью настоящего исследования не было сравнение эффективности двух изученных грибов, и данные не были получены для этого контекста, но в целом можно предположить, что в преобладающих условиях окружающей среды в регионе Маратвада (Парбхани) штата Махараштра, М. anisopliae оказался сравнительно лучшим выбором с точки зрения смертности личинок и роста грибка в организме взрослых мошек. Место настоящего исследования, регион Маратвада расположен между 17 ° 35’N-20 ° 40’N широты и 70 ° 40′-78 ° 15 ‘восточной долготы, MSL — 40,9 м, в зоне плато Декан, в основном это интенсивный аграрный регион. . Климатологически это было отнесено к категории полузасушливых на ежегодной основе. От влажного до перувлажного в сезон дождей, от субгумидного до полузасушливого зимой и засушливого в летний сезон.Соответствующая картина распределения годовых осадков (500-1100 мм) составляет 75-85, 10-15 и 6-10% соответственно. Период влажных муссонов (23-44 недели, 4 -е, июня — 4 -е ноября) чередуется с продолжительной холодной зимой без дождя (недели 45-9, 5 -е, ноября-4 -е марта). Минимальная температура колеблется от 12 ° C до 18 ° C, а максимальная от 40 ° C до 45 ° C наблюдается летом (недели 10-22, 5 -е марта-3 -е июня), имея заметные временные и пространственные изменчивость, типичная характеристика полузасушливого климата [14].
anisopliae оказался сравнительно лучшим выбором с точки зрения смертности личинок и роста грибка в организме взрослых мошек. Место настоящего исследования, регион Маратвада расположен между 17 ° 35’N-20 ° 40’N широты и 70 ° 40′-78 ° 15 ‘восточной долготы, MSL — 40,9 м, в зоне плато Декан, в основном это интенсивный аграрный регион. . Климатологически это было отнесено к категории полузасушливых на ежегодной основе. От влажного до перувлажного в сезон дождей, от субгумидного до полузасушливого зимой и засушливого в летний сезон.Соответствующая картина распределения годовых осадков (500-1100 мм) составляет 75-85, 10-15 и 6-10% соответственно. Период влажных муссонов (23-44 недели, 4 -е, июня — 4 -е ноября) чередуется с продолжительной холодной зимой без дождя (недели 45-9, 5 -е, ноября-4 -е марта). Минимальная температура колеблется от 12 ° C до 18 ° C, а максимальная от 40 ° C до 45 ° C наблюдается летом (недели 10-22, 5 -е марта-3 -е июня), имея заметные временные и пространственные изменчивость, типичная характеристика полузасушливого климата [14].
Энтомопатогенные грибы широко распространены по всему царству грибов, хотя большинство из них встречается в группе Deuteromycotina и Zygomycotina , из которых M. anisopliae и B. используется как грибковый биопестицид в больших масштабах. Механизм действия на генерализованную линию грибов против насекомых был описан Геттелем и Инглисом [15]. Согласно их исследованию, наиболее распространенный путь вторжения хозяина — через внешние покровы (контакт с конидиоспорами, т.э., конидии). Хотя возможно заражение через пищеварительный тракт. Конидии прикрепляются к кутикуле, прорастают и проникают в кутикулу с помощью ферментативной деградации и давления зародышевой трубки [16,17]. Попав в гемоцель, мицелий разрастается по всему хозяину, образуя тела гиф, называемые бластоспорами. Смерть насекомого часто происходит из-за сочетания действия грибковых токсинов, физического препятствия кровообращению, истощения питательных веществ и / или вторжения в органы. После смерти хозяина гифы обычно выходят из трупа, и при подходящих абиотических условиях на внешней стороне хозяина образуются конидии.Затем они разносятся ветром или водой. Инфекция также может передаваться через дыхательную систему [18]. После инфицирования образуются свободно плавающие дрожжеподобные тела гиф, которые распространяются по гемоцелю [19]. Аналогичным образом, данные также показывают, что значения LC 50 обоих грибов и соответствующие им значения LD 50 указывают на их безопасность и поэтому могут быть рекомендованы для индукции в программах IPM.
После смерти хозяина гифы обычно выходят из трупа, и при подходящих абиотических условиях на внешней стороне хозяина образуются конидии.Затем они разносятся ветром или водой. Инфекция также может передаваться через дыхательную систему [18]. После инфицирования образуются свободно плавающие дрожжеподобные тела гиф, которые распространяются по гемоцелю [19]. Аналогичным образом, данные также показывают, что значения LC 50 обоих грибов и соответствующие им значения LD 50 указывают на их безопасность и поэтому могут быть рекомендованы для индукции в программах IPM.
Не будет вырываться из контекста, чтобы рассмотреть способ действия и эффективность обоих грибов, оцененных различными авторами против личинок комаров, как подробно описано Scholte et al .[20] со ссылкой на настоящее исследование.
B. bassiana
Сухой конидиальный порошок при высыпании на поверхность воды в местах размножения комаров, конидии являются гидрофобными, поэтому плавают на поверхности воды, а личинки комаров, контактирующие с поверхностью, питаются, главным образом, на конце сифона, блокируют дыхание и тем самым убивает личинок. У взрослых конидий проникает через дыхальца, прорастает, проникает в стенки трахеи и впоследствии считается, что они выделяют токсин, убивающий взрослых особей [21].Последующие исследования токсинов этого рода подтвердили, что это боверицин, бассианин, бассианолид, боверолиды и тенеллин из B. bassiana , [22]. Hart и MacLeod [23], которые зафиксировали прорастание конидий Beauveria , описали потребность как RH выше 94%, однако инфекция, по-видимому, не зависит от температуры [16]. В лабораторных испытаниях против взрослых особей Culex tarsalis, Culex pipiens , Aedes aegypti, Ochlerotatus sierrensis, Ochlerotatus nigromaculis (Ludlow) и Anopheles albimanus , конидии B.bassiana вызвала 100% смертность в течение 5 дней после воздействия [21]. Срезы инфицированных взрослых, фиксированные и погруженные в парафин сразу после смерти, выявили некоторое количество мицелия в областях, окружающих основные стволы трахеи. Из этих наблюдений [21] пришли к выводу, что конидии, по-видимому, проникают через дыхальца, прорастают, вторгаются в стенки трахеи и впоследствии, как полагают, выделяют токсин, убивающий взрослых особей.
У взрослых конидий проникает через дыхальца, прорастает, проникает в стенки трахеи и впоследствии считается, что они выделяют токсин, убивающий взрослых особей [21].Последующие исследования токсинов этого рода подтвердили, что это боверицин, бассианин, бассианолид, боверолиды и тенеллин из B. bassiana , [22]. Hart и MacLeod [23], которые зафиксировали прорастание конидий Beauveria , описали потребность как RH выше 94%, однако инфекция, по-видимому, не зависит от температуры [16]. В лабораторных испытаниях против взрослых особей Culex tarsalis, Culex pipiens , Aedes aegypti, Ochlerotatus sierrensis, Ochlerotatus nigromaculis (Ludlow) и Anopheles albimanus , конидии B.bassiana вызвала 100% смертность в течение 5 дней после воздействия [21]. Срезы инфицированных взрослых, фиксированные и погруженные в парафин сразу после смерти, выявили некоторое количество мицелия в областях, окружающих основные стволы трахеи. Из этих наблюдений [21] пришли к выводу, что конидии, по-видимому, проникают через дыхальца, прорастают, вторгаются в стенки трахеи и впоследствии, как полагают, выделяют токсин, убивающий взрослых особей.
В свете этих наблюдений можно констатировать, что грибковая инфекция, изучаемая против мошек Culicoides , по-видимому, приводит к аналогичному типу патогенеза.Когда грибок применяли в местах покоя Culicoides , они подхватили инфекцию, возможно, через лапки, и смерть наступила в течение 24 часов с обильным ростом грибка на теле через 10 дней (рисунки и). Таким образом, распыление грибка B. bassiana на места покоя Culicoides может быть эффективным способом биологической борьбы с взрослыми мошками Culicoides . Beauveria — один из наиболее часто выделяемых энтомогенных родов грибов и имеет космополитическое распространение, хотя у этого рода очень широкий круг хозяев [24].В трех небольших экспериментах на открытом воздухе с конидиями B. bassiana через 2 недели было обнаружено снижение на 82, 95 и 69% на личинках и куколках C. pipiens [21]. Аналогичные результаты были получены в отношении сокращения личинок Culicoides при внесении грибов B. bassiana в дренажные каналы в настоящем полевом исследовании (). Несмотря на стабильные результаты, полученные в лаборатории, полевые результаты были расплывчатыми и противоречивыми. Два недостатка B.bassiana , упомянутые в литературе: (1) Восприимчивые виды были подвержены заражению только вскоре после линьки. Если инфекция произошла незадолго до линьки, мицелий был потерян во время линьки, (2) проблема, связанная с использованием конидий, заключается в том, что они не имеют остаточного эффекта. Они прорастают в местах обитания комаров, даже если они не контактируют с личинками. В ходе полевых испытаний настоящего проекта также выяснилось, что грибок нуждается в естественном применении без значительного остаточного эффекта (максимум до 7 дней).
bassiana в дренажные каналы в настоящем полевом исследовании (). Несмотря на стабильные результаты, полученные в лаборатории, полевые результаты были расплывчатыми и противоречивыми. Два недостатка B.bassiana , упомянутые в литературе: (1) Восприимчивые виды были подвержены заражению только вскоре после линьки. Если инфекция произошла незадолго до линьки, мицелий был потерян во время линьки, (2) проблема, связанная с использованием конидий, заключается в том, что они не имеют остаточного эффекта. Они прорастают в местах обитания комаров, даже если они не контактируют с личинками. В ходе полевых испытаний настоящего проекта также выяснилось, что грибок нуждается в естественном применении без значительного остаточного эффекта (максимум до 7 дней).
M. anisopliae
Согласно Бусиасу и Пендленду [25], гриб имеет широкий спектр хозяев, включая паукообразных и пять отрядов насекомых. У наземных насекомых жизненный цикл начинается с того, что конидии прикрепляются к кутикуле хозяина, образуя аппрессорий, за которым следует штифт для проникновения в кутикулу. После попадания в гемоцель образуются гифы, которые производят и выделяют токсины, убивая хозяина в течение 4-16 дней. Эти выделяемые токсины представляют собой деструксины, сваинсинон и цитохалазин С [22].Если условия теплые и влажные, конидиеносцы прорастут через кутикулу и покроют насекомое конидиями. В местах размножения, если конидии наносятся на поверхность воды, личинки контактируют с конидиями через периспиракулярные клапаны во время забора воздуха. Грибок прорастает и проникает в дыхательный сифон, блокируя дыхательный механизм [26,27]. Закупорка дыхалец обычно приводит к смерти до того, как происходит значительное вторжение в гемоцель, поэтому формирование тела гиф минимально.Оптимальная температура роста для большинства штаммов — 27-28 ° C, относительная влажность 92% [16]. Согласно литературным данным, M. anisopliae имеет несколько характеристик, которые делают его интересным в качестве средства борьбы с микробными комарами. Его преимущество заключается в том, что он не прорастает в среде комара до фактического контакта с хозяином и его последующего сохранения в окружающей среде, а также тот факт, что его эффект не ограничивается периодами линьки хозяина, в результате чего этот гриб воспринимается как по сравнению с Б.
После попадания в гемоцель образуются гифы, которые производят и выделяют токсины, убивая хозяина в течение 4-16 дней. Эти выделяемые токсины представляют собой деструксины, сваинсинон и цитохалазин С [22].Если условия теплые и влажные, конидиеносцы прорастут через кутикулу и покроют насекомое конидиями. В местах размножения, если конидии наносятся на поверхность воды, личинки контактируют с конидиями через периспиракулярные клапаны во время забора воздуха. Грибок прорастает и проникает в дыхательный сифон, блокируя дыхательный механизм [26,27]. Закупорка дыхалец обычно приводит к смерти до того, как происходит значительное вторжение в гемоцель, поэтому формирование тела гиф минимально.Оптимальная температура роста для большинства штаммов — 27-28 ° C, относительная влажность 92% [16]. Согласно литературным данным, M. anisopliae имеет несколько характеристик, которые делают его интересным в качестве средства борьбы с микробными комарами. Его преимущество заключается в том, что он не прорастает в среде комара до фактического контакта с хозяином и его последующего сохранения в окружающей среде, а также тот факт, что его эффект не ограничивается периодами линьки хозяина, в результате чего этот гриб воспринимается как по сравнению с Б. bassiana , что делает этот гриб очень многообещающим средством борьбы [24]. Один недостаток, упомянутый в литературе в отношении использования M. anisopliae для борьбы с комарами, заключается в том, что конидии не образуются на погруженных в воду личинках убитых грибов, и, следовательно, требуются затопленные выбросы. Возможно, это могло быть причиной того, что конидии не могут образовываться на мертвых личинках Culicoides , и, следовательно, в настоящем исследовании также было сочтено необходимым высвобождение грибка на дренажные каналы через 7 дней PI ().
bassiana , что делает этот гриб очень многообещающим средством борьбы [24]. Один недостаток, упомянутый в литературе в отношении использования M. anisopliae для борьбы с комарами, заключается в том, что конидии не образуются на погруженных в воду личинках убитых грибов, и, следовательно, требуются затопленные выбросы. Возможно, это могло быть причиной того, что конидии не могут образовываться на мертвых личинках Culicoides , и, следовательно, в настоящем исследовании также было сочтено необходимым высвобождение грибка на дренажные каналы через 7 дней PI ().
Агенты биологической борьбы с грибками для комплексного управления Culicoides spp. (Diptera: Ceratopogonidae) домашнего скота
Влияние грибка на личинок и взрослых особей
Culicoides мошек in vitro и in vivo Значения LC 50 , оцененные по сравнению с личинок Culicoides , составили 2692 мг и 383712 мг (10 8 900 КОЕ / г) для B. bassiana и M. anisopliae , соответственно, путем нанесения пробитных линий (Таблицы- и; Рисунки- и).Данные показали, что грибковое заражение личинок Culicoides привело к гибели, и поэтому количество личинок постоянно показывало тенденцию к снижению, хотя ежедневно добавлялись новые личинки, вылупившиеся из яиц, отложенных мошками Culicoides . Однако через 7 дней после заражения количество личинок возобновлялось до исходного количества, наблюдаемого в день 0, и оба гриба оказались эффективными в течение максимум 7 дней, что потребовало их применения без применения. Гибель личинок Culicoides в результате заражения B.bassiana показала зеленоватую окраску в середине тела, тогда как голова и хвост показали интенсивные черноватые изменения () по сравнению с нормальной текстурой тела личинок (). Заражение M. anisopliae привело к гибели личинок Culicoides с зеленоватой и черноватой окраской тела (рисунки- и), а также к полному разрушению и десквамации кишечного канала.
anisopliae , соответственно, путем нанесения пробитных линий (Таблицы- и; Рисунки- и).Данные показали, что грибковое заражение личинок Culicoides привело к гибели, и поэтому количество личинок постоянно показывало тенденцию к снижению, хотя ежедневно добавлялись новые личинки, вылупившиеся из яиц, отложенных мошками Culicoides . Однако через 7 дней после заражения количество личинок возобновлялось до исходного количества, наблюдаемого в день 0, и оба гриба оказались эффективными в течение максимум 7 дней, что потребовало их применения без применения. Гибель личинок Culicoides в результате заражения B.bassiana показала зеленоватую окраску в середине тела, тогда как голова и хвост показали интенсивные черноватые изменения () по сравнению с нормальной текстурой тела личинок (). Заражение M. anisopliae привело к гибели личинок Culicoides с зеленоватой и черноватой окраской тела (рисунки- и), а также к полному разрушению и десквамации кишечного канала.
Таблица 2
LC 50 значений различных биопестицидов, используемых против личинок Culicoides , и их сравнение со значениями LD 50 у крыс.
| BCA | LC 50 мг / л | LD 50 значение для крыс | Замечания в контексте LD 50 |
|---|---|---|---|
| B. bassiana (Bv) * | 2692 мг (10 8 КОЕ / г) | B. bassiana штамм HF23 в дозе 4,05 × 10 9 КОЕ / животное [28]. B. bassiana штаммы ATCC-74040 [29]: Острая токсичность и патогенность: Инфективность при пероральном введении крысы: LD50> 1.  9 × 10 8 КОЕ / животное; нет доказательств токсичности, патогенности или инфекционности. Споры все еще обнаруживаются в фекалиях на 14 день. 9 × 10 8 КОЕ / животное; нет доказательств токсичности, патогенности или инфекционности. Споры все еще обнаруживаются в фекалиях на 14 день. Острая интратрахеальная / ингаляционная токсичность у крыс: LD 50 > 2,5 × 10 9 КОЕ / животное; исходное снижение массы тела, местные обратимые признаки воспаления легких. Нет доказательств патогенности или инфекционности. Очистка легочной ткани завершилась к 15-му дню после введения дозы. Острая внутривенная / внутрибрюшинная токсичность у крыс: LD 50 > 2.0 × 10 7 КОЕ; нет доказательств токсичности (назальная секреция в 1-й день), патогенности или инфекционности. Клиренс в крови завершен на 2 день после введения дозы | На основании (а) значений LD 50 и оценочных исследований различных штаммов этих двух грибов, которые доказали их эффективность против двукрылых вредителей [1-11,28-30], (б) широкое использование двух грибов против вредителей сельскохозяйственных культур и (в), таким образом, хорошее знакомство фермеров с этими грибами, настоящее исследование рекомендует их использование в программе IPM против Culicoides spp. |
| M. anisopliae (Mt) * | 3837 мг (10 8 КОЕ / г) | LD 50 острый пероральный прием, крысы> 2000 мг / кг; LD 50 острая кожная, крысы> 2000 мг / кг, внутрибрюшинная инъекция, переносится крысами (5 × 10 9 спор / кг массы тела), LC 50 острая ингаляционная токсичность 4,85 мг, раздражение кожи, не вызывает раздражения у кроликов [30 ] |
Таблица-3
Уравнения регрессии пробита для грибковых BCA против личинок Culicoides spp.
| BCA | Уравнение регрессии | Предел начала отсчета | ||
|---|---|---|---|---|
| | ||||
| Нижний | Верхний | |||
| Bv | PROBIT (p) = Intercept (2.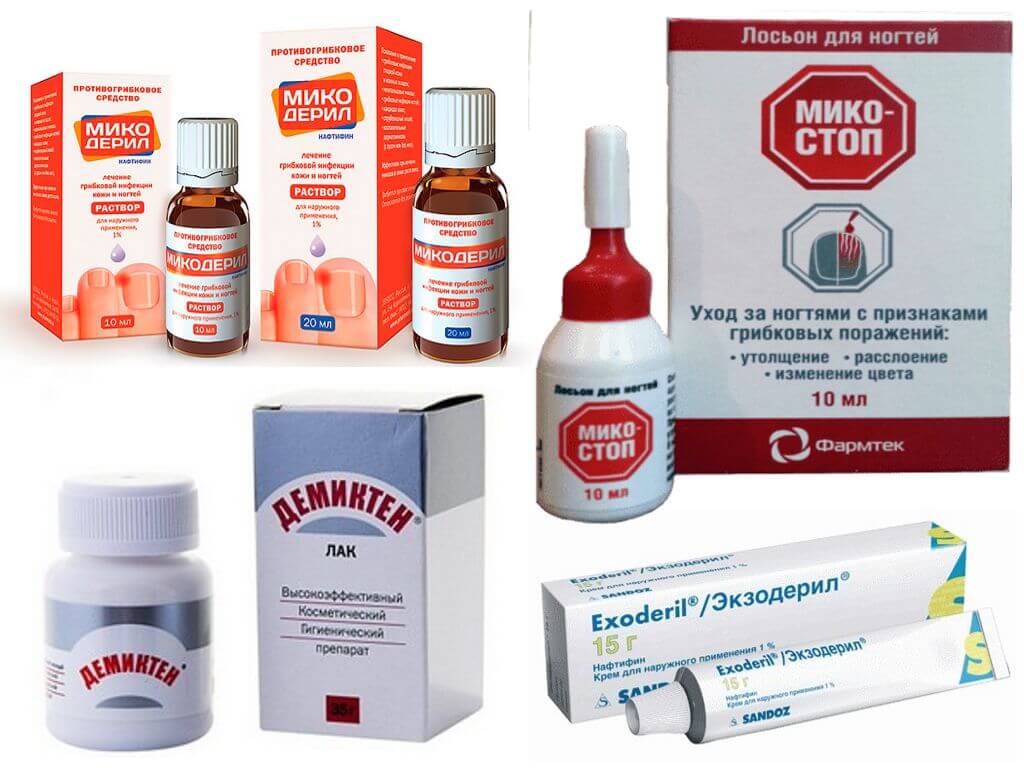 694) + 694) + B (3.694) + B (3.694) + B (3.69866) ) × X (логарифм концентрации) | 2.824 | 4.908 | |
| Mt | PROBIT (p) = Intercept (1.975) + B (3.582) × X (log концентрации) | 2.504 | 4.660 | |
Пробит линия для личинок Beauveria bassiana против личинок Culicoides .
Личинки Culicoides погибли из-за заражения Beauveria bassiana (× 50).
Нормальный труп личинок Culicoides (контроль) (× 50).
Личинки Culicoides погибли из-за Metarhizium anisopliae (× 50).
Личинки Culicoides погибли из-за Metarhizium anisopliae (× 50).
Пробит линия на Metarhizium anisopliae против личинок Culicoides .
В испытании «А» смерть взрослых особей Culicoides была вызвана обоими грибами в течение 24-48 часов, в то время как гибель мошек в контроле наблюдалась через 96 часов, а после смерти рост грибов очень хорошо наблюдался на участке. мертвые трупы инфицированных мошек (рисунки -).Присмотревшись к рисункам, он показал, что до 11-17 дней после заражения трупы в контрольной группе не имели роста грибов, в отличие от этого, на 11 день (рисунки и) и на 17 день после заражения (рисунки- и) обработанные грибком трупы показали обширный рост грибка. Результаты испытания «B» показали, что мошки, собранные с обработанного квадрата, погибли в течение 24-48 часов по сравнению с 96 часами в контрольной и мертвые трупы из обработанных групп, после инкубации в течение 8-15 дней при комнатной температуре и относительной влажности 75% показали огромный рост грибок, что доказывает, что оба гриба обладают способностью вызывать инфекцию при существующем уровне влажности. Однако крупномасштабные моделируемые исследования не могли быть проведены, потому что после заражения мошками, когда они летают, дальнейшая судьба инфекции не может быть установлена.
Однако крупномасштабные моделируемые исследования не могли быть проведены, потому что после заражения мошками, когда они летают, дальнейшая судьба инфекции не может быть установлена.
Culicoides peregrinus нормальный труп (контроль) на 11-е сутки PI (× 50).
Culicoides peregrinus рост Metarhizium anisopliae на 11-е сутки PI (× 50).
Culicoides peregrinus рост Beauveria bassiana на 11-е сутки PI (× 50).
Culicoides peregrinus нормальный труп (контроль) на 17-е сутки PI (× 50).
Culicoides peregrinus рост Metarhizium anisopliae на 17-е сутки PI (× 50).
Culicoides peregrinus рост Beauveria bassiana на 17-е сутки PI (× 50).
Целью настоящего исследования не было сравнение эффективности двух изученных грибов, и данные не были получены для этого контекста, но в целом можно предположить, что в преобладающих условиях окружающей среды в регионе Маратвада (Парбхани) штата Махараштра, М. anisopliae оказался сравнительно лучшим выбором с точки зрения смертности личинок и роста грибка в организме взрослых мошек. Место настоящего исследования, регион Маратвада расположен между 17 ° 35’N-20 ° 40’N широты и 70 ° 40′-78 ° 15 ‘восточной долготы, MSL — 40,9 м, в зоне плато Декан, в основном это интенсивный аграрный регион. . Климатологически это было отнесено к категории полузасушливых на ежегодной основе. От влажного до перувлажного в сезон дождей, от субгумидного до полузасушливого зимой и засушливого в летний сезон.Соответствующая картина распределения годовых осадков (500-1100 мм) составляет 75-85, 10-15 и 6-10% соответственно. Период влажных муссонов (23-44 недели, 4 -е, июня — 4 -е ноября) чередуется с продолжительной холодной зимой без дождя (недели 45-9, 5 -е, ноября-4 -е марта). Минимальная температура колеблется от 12 ° C до 18 ° C, а максимальная от 40 ° C до 45 ° C наблюдается летом (недели 10-22, 5 -е марта-3 -е июня), имея заметные временные и пространственные изменчивость, типичная характеристика полузасушливого климата [14].
anisopliae оказался сравнительно лучшим выбором с точки зрения смертности личинок и роста грибка в организме взрослых мошек. Место настоящего исследования, регион Маратвада расположен между 17 ° 35’N-20 ° 40’N широты и 70 ° 40′-78 ° 15 ‘восточной долготы, MSL — 40,9 м, в зоне плато Декан, в основном это интенсивный аграрный регион. . Климатологически это было отнесено к категории полузасушливых на ежегодной основе. От влажного до перувлажного в сезон дождей, от субгумидного до полузасушливого зимой и засушливого в летний сезон.Соответствующая картина распределения годовых осадков (500-1100 мм) составляет 75-85, 10-15 и 6-10% соответственно. Период влажных муссонов (23-44 недели, 4 -е, июня — 4 -е ноября) чередуется с продолжительной холодной зимой без дождя (недели 45-9, 5 -е, ноября-4 -е марта). Минимальная температура колеблется от 12 ° C до 18 ° C, а максимальная от 40 ° C до 45 ° C наблюдается летом (недели 10-22, 5 -е марта-3 -е июня), имея заметные временные и пространственные изменчивость, типичная характеристика полузасушливого климата [14].
Энтомопатогенные грибы широко распространены по всему царству грибов, хотя большинство из них встречается в группе Deuteromycotina и Zygomycotina , из которых M. anisopliae и B. используется как грибковый биопестицид в больших масштабах. Механизм действия на генерализованную линию грибов против насекомых был описан Геттелем и Инглисом [15]. Согласно их исследованию, наиболее распространенный путь вторжения хозяина — через внешние покровы (контакт с конидиоспорами, т.э., конидии). Хотя возможно заражение через пищеварительный тракт. Конидии прикрепляются к кутикуле, прорастают и проникают в кутикулу с помощью ферментативной деградации и давления зародышевой трубки [16,17]. Попав в гемоцель, мицелий разрастается по всему хозяину, образуя тела гиф, называемые бластоспорами. Смерть насекомого часто происходит из-за сочетания действия грибковых токсинов, физического препятствия кровообращению, истощения питательных веществ и / или вторжения в органы. После смерти хозяина гифы обычно выходят из трупа, и при подходящих абиотических условиях на внешней стороне хозяина образуются конидии.Затем они разносятся ветром или водой. Инфекция также может передаваться через дыхательную систему [18]. После инфицирования образуются свободно плавающие дрожжеподобные тела гиф, которые распространяются по гемоцелю [19]. Аналогичным образом, данные также показывают, что значения LC 50 обоих грибов и соответствующие им значения LD 50 указывают на их безопасность и поэтому могут быть рекомендованы для индукции в программах IPM.
Не будет вырываться из контекста, чтобы рассмотреть способ действия и эффективность обоих грибов, оцененных различными авторами против личинок комаров, как подробно описано Scholte et al .[20] со ссылкой на настоящее исследование.
B. bassiana
Сухой конидиальный порошок при высыпании на поверхность воды в местах размножения комаров, конидии являются гидрофобными, поэтому плавают на поверхности воды, а личинки комаров, контактирующие с поверхностью, питаются, главным образом, на конце сифона, блокируют дыхание и тем самым убивает личинок. У взрослых конидий проникает через дыхальца, прорастает, проникает в стенки трахеи и впоследствии считается, что они выделяют токсин, убивающий взрослых особей [21].Последующие исследования токсинов этого рода подтвердили, что это боверицин, бассианин, бассианолид, боверолиды и тенеллин из B. bassiana , [22]. Hart и MacLeod [23], которые зафиксировали прорастание конидий Beauveria , описали потребность как RH выше 94%, однако инфекция, по-видимому, не зависит от температуры [16]. В лабораторных испытаниях против взрослых особей Culex tarsalis, Culex pipiens , Aedes aegypti, Ochlerotatus sierrensis, Ochlerotatus nigromaculis (Ludlow) и Anopheles albimanus , конидии B.bassiana вызвала 100% смертность в течение 5 дней после воздействия [21]. Срезы инфицированных взрослых, фиксированные и погруженные в парафин сразу после смерти, выявили некоторое количество мицелия в областях, окружающих основные стволы трахеи. Из этих наблюдений [21] пришли к выводу, что конидии, по-видимому, проникают через дыхальца, прорастают, вторгаются в стенки трахеи и впоследствии, как полагают, выделяют токсин, убивающий взрослых особей.
В свете этих наблюдений можно констатировать, что грибковая инфекция, изучаемая против мошек Culicoides , по-видимому, приводит к аналогичному типу патогенеза.Когда грибок применяли в местах покоя Culicoides , они подхватили инфекцию, возможно, через лапки, и смерть наступила в течение 24 часов с обильным ростом грибка на теле через 10 дней (рисунки и). Таким образом, распыление грибка B. bassiana на места покоя Culicoides может быть эффективным способом биологической борьбы с взрослыми мошками Culicoides . Beauveria — один из наиболее часто выделяемых энтомогенных родов грибов и имеет космополитическое распространение, хотя у этого рода очень широкий круг хозяев [24].В трех небольших экспериментах на открытом воздухе с конидиями B. bassiana через 2 недели было обнаружено снижение на 82, 95 и 69% на личинках и куколках C. pipiens [21]. Аналогичные результаты были получены в отношении сокращения личинок Culicoides при внесении грибов B. bassiana в дренажные каналы в настоящем полевом исследовании (). Несмотря на стабильные результаты, полученные в лаборатории, полевые результаты были расплывчатыми и противоречивыми. Два недостатка B.bassiana , упомянутые в литературе: (1) Восприимчивые виды были подвержены заражению только вскоре после линьки. Если инфекция произошла незадолго до линьки, мицелий был потерян во время линьки, (2) проблема, связанная с использованием конидий, заключается в том, что они не имеют остаточного эффекта. Они прорастают в местах обитания комаров, даже если они не контактируют с личинками. В ходе полевых испытаний настоящего проекта также выяснилось, что грибок нуждается в естественном применении без значительного остаточного эффекта (максимум до 7 дней).
M. anisopliae
Согласно Бусиасу и Пендленду [25], гриб имеет широкий спектр хозяев, включая паукообразных и пять отрядов насекомых. У наземных насекомых жизненный цикл начинается с того, что конидии прикрепляются к кутикуле хозяина, образуя аппрессорий, за которым следует штифт для проникновения в кутикулу. После попадания в гемоцель образуются гифы, которые производят и выделяют токсины, убивая хозяина в течение 4-16 дней. Эти выделяемые токсины представляют собой деструксины, сваинсинон и цитохалазин С [22].Если условия теплые и влажные, конидиеносцы прорастут через кутикулу и покроют насекомое конидиями. В местах размножения, если конидии наносятся на поверхность воды, личинки контактируют с конидиями через периспиракулярные клапаны во время забора воздуха. Грибок прорастает и проникает в дыхательный сифон, блокируя дыхательный механизм [26,27]. Закупорка дыхалец обычно приводит к смерти до того, как происходит значительное вторжение в гемоцель, поэтому формирование тела гиф минимально.Оптимальная температура роста для большинства штаммов — 27-28 ° C, относительная влажность 92% [16]. Согласно литературным данным, M. anisopliae имеет несколько характеристик, которые делают его интересным в качестве средства борьбы с микробными комарами. Его преимущество заключается в том, что он не прорастает в среде комара до фактического контакта с хозяином и его последующего сохранения в окружающей среде, а также тот факт, что его эффект не ограничивается периодами линьки хозяина, в результате чего этот гриб воспринимается как по сравнению с Б.bassiana , что делает этот гриб очень многообещающим средством борьбы [24]. Один недостаток, упомянутый в литературе в отношении использования M. anisopliae для борьбы с комарами, заключается в том, что конидии не образуются на погруженных в воду личинках убитых грибов, и, следовательно, требуются затопленные выбросы. Возможно, это могло быть причиной того, что конидии не могут образовываться на мертвых личинках Culicoides , и, следовательно, в настоящем исследовании также было сочтено необходимым высвобождение грибка на дренажные каналы через 7 дней PI ().
Друзья и враги общественного здравоохранения
Abstract
Грибковые заболевания недооцениваются во всем мире, но представляют собой существенную угрозу для некоторых видов растений и животных, а также для здоровья населения. Рост населения мира повлек за собой рост спроса на сельское хозяйство в последние десятилетия. Соответственно, во всем мире было давление, чтобы найти средства для улучшения качества и урожайности сельскохозяйственных культур. Противогрибковые агенты широко используются в качестве альтернативы для лечения грибковых заболеваний, поражающих несколько сельскохозяйственных культур.Однако нерегулируемое использование противогрибковых средств может поставить под угрозу общественное здоровье. Применение фунгицидов в сельском хозяйстве должно строго регулироваться, чтобы гарантировать токсикологическую безопасность коммерческих пищевых продуктов. В этом обзоре обсуждается использование противогрибковых средств в сельском хозяйстве во всем мире, необходимость разработки новых противогрибковых средств и совершенствование правил, касающихся использования противогрибковых средств.
Ключевые слова: Противогрибковые агенты, фунгициды, сельское хозяйство, химиоинформатика
1. Введение
Существует более 99 000 известных видов грибов, включая плесень, дрожжи, грибы и полипы [1,2].Грибы могут расти почти во всех средах обитания, включая почву, воздух, моря, реки, а также на органических веществах, включая пищу, и других организмах, таких как растения, животные и даже кожа человека [3]. Помимо болезней, грибки оказывают на общество несколько значительных воздействий. Они используются для производства продуктов питания, а также для приготовления фармацевтических препаратов, сельскохозяйственных целей и разложения органических веществ [4].
Среди тысяч охарактеризованных видов грибов лишь несколько сотен являются инфекционными и вызывают заболевания у человека [5].Иммунная система здорового человека имеет несколько эффективных механизмов выявления, контроля и устранения грибковых инфекций. Однако при патологических состояниях, включая синдром приобретенного иммунодефицита (СПИД), туберкулез, сахарный диабет и рак, или при повышенном физиологическом стрессе, например, во время трансплантации органов, введения кортикостероидов и химиотерапии [6,7], существует риск развития грибковых заболеваний. число заболеваний, связанных с инфекциями, значительно увеличивается. [8] Среди инфекционных видов грибов Aspergillus spp., Candida spp., Cryptococcus spp. И Pneumocystis jirovecii являются возбудителями основных микозов у человека [9,10]. Кроме того, растет частота инфекций, вызываемых Zygomycetes , Fusarium и Scedosporium [11,12]. Недавние глобальные оценки выявили около 3 000 000, 250 000, 700 000 и 223 100 случаев хронического легочного аспергиллеза, инвазивного аспергиллеза, инвазивного кандидоза и криптококкового менингита среди больных СПИДом [13].Более того, уровень смертности, связанной с инвазивными грибковыми инфекциями, составляет> 50% даже при лечении противогрибковыми препаратами, возможно, из-за поздней диагностики инфекций и выявления возбудителей грибков [3,11].
Трудно разработать новые фунгициды с идеальными характеристиками, включая эффективность широкого спектра действия, повышенную биодоступность, а также минимальную токсичность и побочные эффекты, из-за сходства между клетками грибов и млекопитающих, например, в путях биосинтеза и организации хроматина ДНК [ 6,14].Следовательно, разработка лекарств против инвазивных грибковых патогенов идет медленно. Он начался в 1950-х годах с одобрения полиенового амфотерицина B дезоксихолата, за которым последовала разработка пиримидинового аналога флукоцитозина в 1960-х, азолов в 1970-х и эхинокандинов в 2000-х [15]. Грибы имеют пластичный геном и быстро размножаются [16]. В дополнение к этим свойствам, более широкое использование профилактических противогрибковых средств и эмпирической и направленной терапии увеличило количество устойчивых к лекарствам патогенных штаммов грибов [17].Более того, противогрибковые препараты, используемые в сельском хозяйстве, могут служить движущей силой окружающей среды для развития устойчивых к лекарствам штаммов грибов [18]. Для уменьшения развития лекарственной устойчивости грибов на полях рекомендуется использовать смесь противогрибковых средств с различными механизмами действия [16,17]. Таким образом, цель настоящего обзора — обсудить использование противогрибковых средств в сельском хозяйстве, их корреляцию с развитием устойчивых к лекарствам штаммов грибов, а также последствия нерегулируемого использования противогрибковых препаратов для здоровья населения.
2. Сельскохозяйственные фунгициды
Сельскохозяйственные пестициды — это химические вещества, которые используются для уничтожения вредителей сельскохозяйственных культур или подавления роста или вредного воздействия этих организмов [19]. Среди различных классов пестицидов фунгициды включают физические, химические или биологические агенты, предназначенные для борьбы с грибковыми микроорганизмами [20]. Они широко используются в сельскохозяйственных системах для борьбы с болезнями и сохранения урожайности и качества сельскохозяйственных культур [21]. История сельскохозяйственного сектора сформирована постоянными проблемами в отношении повышения производительности и, следовательно, предложения для удовлетворения растущих потребностей в потреблении и, следовательно, спроса [20].Повышенная потребность в урожайности была решена в основном за счет искоренения вредителей с помощью пестицидов [22]. По данным Продовольственной и сельскохозяйственной организации Объединенных Наций (FAOSTAT), основными культурами, производимыми в мире в период с 2013 по 2017 год, были зерновые (особенно фуражные, кукуруза, рис и пшеница), сахарный тростник, основные овощи и фрукты, а также растения. выращивают ради корней и клубней () [23]. В этот период африканский континент был основным производителем зерновых и корнеплодов / клубней, средний годовой объем производства которых составлял 5 млн тонн (80.4%) и примерно 7 млн тонн (71,7%) соответственно. Основным сельскохозяйственным продуктом в Азии в тот же период был рис со среднегодовым производством 668 млн тонн, что соответствует 90,4%. Китай, Индия и Индонезия показали самую высокую производительность сельского хозяйства среди азиатских стран [23]. На американских континентах было высокое производство сои (88,2%), сахарного тростника (54,8%) и кукурузы (50,4%). Например, в среднем только США производили 363 и 108 млн тонн кукурузы и сои соответственно в год.Основным сельскохозяйственным продуктом Бразилии в этот период был сахарный тростник со среднегодовым производством 756 млн тонн. Кроме того, он был вторым и третьим по величине производителем сои и кукурузы соответственно [23].
Годовое мировое производство основных сельскохозяйственных культур в 2013–2017 гг. (Источник: FAOSTAT. Www.fao.org. Дата обращения: 6 ноября 2018 г.).
Грибковые фитопатогены, поражающие сельскохозяйственные культуры, приводят к снижению их качества и продуктивности [24]. Они действуют как угроза для сельскохозяйственных культур [25] через различные механизмы патогенеза, которые ставят под угрозу иммунную систему растений () [24].Использование фунгицидов против грибковых заболеваний растений улучшает урожайность, качество и срок хранения [21,26]. Некоторые примеры противогрибковых средств включают бензимидазолы, дитиокарбаматы, стробилурины и азолы [26], причем азолы, особенно триазолы, широко используются в различных областях [27].
Таблица 1
Некоторые важные грибковые патогены и связанные с ними болезни сельскохозяйственных культур.
| Грибковый патоген | Зерновые культуры | Заболевание | Потери урожая (%) |
|---|---|---|---|
| Botrytis cinerea | Фрукты и декоративные цветы [28] | Серая гниль [28] | |
| Blumeria graminis | Пшеница и ячмень [28] | Милдью злаков [28] | 18% потенциальная и 13% де-факто потеря зерна при текущем контроле болезни [30] |
| Colletotrichum spp. | Фрукты и овощи [28] | Потери> 80% в тропических, субтропических и средиземноморских регионах [31] | |
| Cladosporium fulvum | Помидор [32] | Плесень листьев томата [32] | Потеря 10–25% в обычные годы [33] |
| Fusarium spp. | Сухая гниль клубней [34] | Потери урожая до 25%.Во время хранения> 60% клубней могут быть инфицированы [35] | |
| Fusarium graminearum | Злаки [28] | Фузариоз головы; Фузариоз уха или головная парша [28] | В Китае потеря 5–10%. В Европе и Южной Америке до 50–60% и 70% потерь [30] |
| Magnaporthe oryzae | Рис [28] | Обработка риса [28] | Потери варьируются от 10% до 35% в зависимости от сорта и условий окружающей среды [25] |
| Mycosphaerella graminicola | Пшеница [28] | Пятна Septoria tritici [28] | Потеря до 30–50% [25] |
| Puccinia spp. | Ржавчина [28] | Потеря 70% [36] | |
| Phakopsora pachyrhizi | Соя [36] | Ржавчина [36] | Потери до 70% [36] |
| Pytophtora infestans | Картофель [34] | Фитофтороз [34] | Потеря 16% [34] |
| Rhizoctonia solani | Язвы на стебле и черный налёт [34] | Потеря 30% [34] | |
| Sporisorium scitamineum | Сахарный тростник [37] | Сахарный тростник [37] | Потеря до 62% [38] |
| Ustilago Maydis | Кукуруза [28] | Кукурузная головня [28] | Потери до 20% [36] |
Первое соединение с фунгицидными свойствами было описано Бенедиктом Прево в 1807 году, когда он обнаружил, что прорастание спор из Tilletia caries подавлялась добавлением кусков металлической меди в почву [39].В начале 20 века был синтезирован первый органический фунгицид — ртутьорганическое соединение. Дальнейшие исследования в этом направлении привели к коммерциализации нескольких фунгицидов, таких как 2-метоксиэтилсиликат и 2-гидроксифенилртуть, которые эффективны против грибов, таких как Fusarium spp. и Dreschlera spp. [40].
В последние годы сельскохозяйственный сектор столкнулся с рядом проблем, связанных со снижением урожайности из-за вредителей, болезней и абиотических стрессов [41].Кроме того, согласно оценкам, к 2050 году население мира вырастет примерно на 30%, что потребует инвестиций для увеличения сельскохозяйственного производства и производительности [23]. Следовательно, необходимо использование эффективных фунгицидов для защиты сельскохозяйственных культур от болезней как во время крупномасштабного сельскохозяйственного производства, так и на послеуборочных стадиях [42].
Мировое использование пестицидов значительно увеличилось в 2012–2016 годах, пик пришелся на 2014 год. В этот период наибольшее использование пестицидов было в Азии, в среднем 2 млн тонн (52%), за ней следует Америка со средним показателем. использование 1 млн тонн (32.7%), Европа — 477 тыс. Тонн (11,6%), Африка — 95 тыс. Тонн (2,3%) и Океания — приблизительно 55 тыс. Тонн (1,4%) (). Бразилия использовала наибольшее количество фунгицидов [23], за ней следуют Италия, Испания, Франция, Колумбия, Соединенные Штаты Америки, Мексика, Япония, Турция и Украина [23]. Данные Национального союза производителей продукции для защиты растений (SINDIVEG) показали, что в 2016 году фунгициды стали наиболее коммерциализируемой категорией продуктов в Бразилии, составляя 33% от общего рынка [43].
Использование пестицидов в мире в 2012–2016 гг. (Источник: FAOSTAT. Www.fao.org. Доступно: 17 декабря 2018 г.).
2.1. Использование противогрибковых агентов в сельском хозяйстве представляет потенциальную угрозу для здоровья человека
Различные научные исследования, проведенные в конце 1950-х и начале 1960-х годов, показали, что сельскохозяйственные пестициды могут угрожать здоровью человека в долгосрочной перспективе [44]. Эти угрозы проистекают из воздействия пестицидов на потребителей и работников при контакте, вдыхании или проглатывании продуктов питания или воды, загрязненных пестицидами [20].Сообщалось о побочных эффектах такого воздействия, включая эндокринные, иммунологические, неврологические и канцерогенные проблемы, а также преждевременные роды [44].
Помимо проблем со здоровьем, чрезмерное использование пестицидов также может вызвать проблемы с окружающей средой; накопление пестицидов в окружающей среде нарушает экологический баланс и вызывает патогенную устойчивость к пестицидам [45,46]. Таким образом, применение фунгицидов в сельском хозяйстве должно строго регулироваться, чтобы гарантировать, что коммерческие продукты питания безопасны для употребления и несут незначительный риск острой токсичности из-за переходящего остатка [42].
2.2. Устойчивость к противогрибковым препаратам
Устойчивость к грибкам — это наследственная характеристика грибов, которая развивается в результате естественного отбора грибов [47]. Селективное давление, оказываемое на грибы при воздействии фунгицида, «отбирает» один или несколько штаммов, которые проявляют устойчивость к этому фунгициду или имеют «фенотип устойчивости к фунгицидам» [48,49]. Таким образом, эти штаммы могут выживать и воспроизводиться в присутствии этого фунгицида [48]. Биологические факторы, способствующие распространению устойчивых к фунгицидам грибковых патогенов, включают короткий жизненный цикл, обильное спороношение и распространение спор на большие расстояния [50].В дополнение к этим факторам, которые присущи видам грибов, развитие устойчивости к фунгицидам зависит от того, как фунгицид используется [51]. Существует четыре основных механизма развития устойчивости к грибкам: (i) изменения целевого белка из-за мутаций, (ii) активация целевого белка, (iii) снижение эффективной концентрации лекарственного средства, в основном из-за развития процессов оттока, и ( iv) детоксикация метаболическими ферментами, приводящая к разложению фунгицида [14,21,52].Возможные механизмы развития устойчивости к различным противогрибковым препаратам обобщены в [16]. Ниже рассматриваются наиболее важные и часто используемые в сельском хозяйстве противогрибковые препараты.
Таблица 2
Основные классы противогрибковых препаратов и механизмы развития устойчивости к ним.
| Класс противогрибковых | Механизм действия | Примеры противогрибковых препаратов | Примеры резистентных видов грибов | Механизм резистентности |
|---|---|---|---|---|
| Метилбензимидазола 66 карбамат | 914 Подавляет сборку микроканалов бензимидазола , карбендазим, флубендазол [54] | Botrytis cinerea , Venturia inaequalis [55,56] | Точечная мутация в гене β-тубулина [56,57] | |
| Ингибитор сукцинатдегидрогеназы | Ингибитор сукцинатдегидрогеназы путем связывания с сайтом связывания убихинона в комплексе II митохондрий [58] | Карбоксин, беноданил, флутоланил, фенфуран, флуксаприроксад, флуксипирам, тифлузамид, фураметпир [59] | Botrytaria 0003, Alternate 0003, Alternate 0003 Didymella brioniae , Podosphaeera xanthii , Corynespora ca ssiicola [60,61,62,63] | Мутации в гене сукцинатдегидрогеназы (аминокислотная замена h357L или h357Y) [58,62] |
| Анилинопиримидин | Ингибирование синтеза метионина и секреции гидролитических ферментов [64] | Ципродинил, мепанипирим и пириметанил [65] | Botrytis cinerea , Venturia inaequalis , Oculimacula spp.[66,67,68] | Этот механизм не совсем понятен; было предложено задействовать избыточное производство транспортеров ABC (АТФ-связывающей кассеты) или модификацию сайтов-мишеней [69] |
| Ингибитор Qo | Блокирует производство энергии грибами посредством ингибирования митохондриального дыхания путем связывания с сайтом Qo комплекса III [70] | Азоксистробин, мандестробин, пираклостробин, крезоксим-метил, димоксистробин, фамоксадон, флуоксастробин, фенамидон, пирибенкарб [65] | Erysiphe necator , 0003 Erysiphe necator , oubraiso, , , Pyrenophora teres , Pythium aphanidermatum , Pyrenophora tritici-repentis [65] | Точечные мутации в митохондриальном гене цитохрома b ( cyt b ) (G143A, G70137129) |
| Морфолин | Ингибирование синтеза эргостерина путем блокирования ∆14-редуктазы и ∆8-∆7-изомеразы [6] | Альдоморф, фенпропиморф, додеморф, тридеморф [65] | Пониженная чувствительность к мучнистой росе [16] | Неизвестно [16] |
| Азол | Подавление синтеза эргостерина путем ингибирования 14α-деметилазы [12] | 914 окспоконазола, трифлумизол, диниконазол, эпоксиконазол, флутриафол [65]Zymoseptoria tritici , вентурии неравных , Penicillium digitatum , Cercospora beticola , Monilinia fructicola , Brumeriela jaapii , ботритис серого , Penicillium digitatum , Zymoseptoria tritici [71,72] | Мутации в cyp51, активация cyp51 и генов, кодирующих мембранные транспортеры [72] |
2.2.1. Метилбензимидазолкарбамат (МБК)
МБК или бензимидазол представляет собой гетероциклическое соединение и бензопроизводное имидазола [73]. Описанный в 1969 году, он проявляет несколько видов биологической активности, в том числе антипаразитарную, противогельминтную, противовирусную и противоопухолевую активность [74]. С момента своего открытия бензимидазол широко использовался в растениеводстве [75] в качестве инновационного фунгицида с системной лечебной активностью, позволяющей увеличивать интервалы между последовательными опрыскиваниями [65].Этот противогрибковый агент ингибирует сборку микротрубочек, в основном за счет связывания со свободными мономерами β-тубулина в сайте связывания колхицина [53,76]. Подавление образования микротрубочек, в свою очередь, нарушает деление клеток и может привести к их гибели [75].
Проблемы, связанные с устойчивостью к бензимидазолу, возникли вскоре после его появления на рынке. Впервые обнаружен у Botrytis spp. в 1971 г. резистентность к бензимидазолу была зарегистрирована примерно у 115 видов грибов [77].Механизм устойчивости к этому классу фунгицидов заключается в генерации точечных мутаций в гене β-тубулина [57]. Первое сообщение о такой мутации было опубликовано в 1992 году Koenraadt et al. которые показали преобразование в кодоне 198 β-тубулина Venturia inaequalis . Этот кодон кодирует аланин в белке β-тубулина обычного штамма, глутаминовую кислоту в штамме, чувствительном к МБК, лизин в штамме с высокой устойчивостью к МБС и глицин в штамме со средней устойчивостью к МБС. Другая мутация была обнаружена в кодоне 200 штамма со средней устойчивостью, который генерирует фенилаланин вместо тирозина [56].Кроме того, в полевых изолятах описаны мутации в кодонах 6, 50, 167 и 240, которые могут привести к устойчивости к бензимидазолу [57].
2.2.2. Ингибитор сукцинатдегидрогеназы (SDHI)
Карбоксин, SDHI поколения I, был первым фунгицидом этого класса. Он был представлен на рынке в 1966 году [59] и нацелен на патогены базидиомицетов [21]. SDHI поколения II, включая боскалид, флуксаприроксад и флуксипирам, проявляют высокую противогрибковую активность в отношении зерновых, фруктовых деревьев, овощей и полевых культур [62].Этот класс противогрибковых средств подавляет дыхание грибов, блокируя сайт связывания убихинона (Q-сайт) в комплексе II митохондрий [61].
SDHI проявляют активность широкого спектра, но их интенсивное применение, вероятно, вызывает давление отбора, ведущее к развитию устойчивых штаммов патогенов [59]. Поскольку этот класс фунгицидов включает одноцентровые ингибиторы, FRAC (Комитет по борьбе с устойчивостью к фунгицидам) классифицировал их как представляющие средний – высокий риск появления устойчивых штаммов [65].Интересно, что есть сообщения об ассоциации между устойчивостью к карбоксину и боскалидам и мутациями в гене сукцинатдегидрогеназы [62]. Наиболее частыми мутациями являются замены h357L и h357Y, которые заменяют остаток гистидина в положении 257 (сайт связывания убихинона) гена сукцинатдегидрогеназы на лейцин и тирозин, соответственно [58,62]. Botrytis cinerea , Alternaria alternate , Didymella brioniae , Podosphaeera xanthii и Corynespora cassiicola являются примерами грибов, которые, как сообщается, устойчивы к SHDI [62].
2.2.3. Анилинопиримидин (AP)
Анилинопиримидин (AP) был представлен на рынке между 1992 и 1995 годами и используется против аскомицетов [68]. К этой группе фунгицидов относятся ципродинил, мепанипирим и пириметанил [65]. Этот класс фунгицидов используется для борьбы с серой гнилью, вызываемой B. cinerea во фруктах, овощах и декоративных цветах, а также для борьбы с паршой яблони, вызываемой Venturia inaequalis [68].
Механизм действия AP включает ингибирование синтеза метионина и секреции гидролитических ферментов (протеаз, целлюлаз, кутиназ и липаз) [64].Считается, что он представляет собой умеренный риск развития резистентности [65]. Устойчивость к AP была обнаружена у B. cinerea , V. inaequalis и Oculimacula spp. [51]. Среди них AP-устойчивые штаммы B. cinerea были зарегистрированы на нескольких европейских виноградниках [55]. Низкие концентрации АР использовали для ингибирования удлинения трубки и роста мицелия штаммов B. cinerea дикого типа . Однако со временем появились AP-устойчивые штаммы B. cinerea Ani R1, Ani R2 и Ani R3.Эти штаммы демонстрируют значительную степень устойчивости к АР, причем Ani R1 показывает устойчивость от умеренной до высокой на всех стадиях, а Ani R2 и Ani R3 проявляют устойчивость только на стадии элонгации зародышевой трубки [55]. Возможным механизмом, посредством которого штаммы Ani R2 и Ani R3 сопротивляются активности AP, может быть энергозависимый отток (ABC-переносчик) фунгицида [69]. Сообщалось о мутациях в сайтах-мишенях AP в Ani R1 [69]; однако необходимы дополнительные исследования для определения молекулярных механизмов, лежащих в основе устойчивости к AP у этого штамма [68,69].
2.2.4. Ингибитор Qo (QoI)
QoI также называют «стробилурином», потому что этот класс фунгицидов был получен из природного соединения под названием стробилурин A, продуцируемого грибами (базидиомицетами) из рода Strobilurus [78,79]. Этот класс природных соединений нестабилен в присутствии света и, следовательно, бесполезен для борьбы с болезнями сельскохозяйственных культур [79]. Однако модификации, внесенные в химическую структуру одного из этих соединений, привели к созданию фотостабильной версии с противогрибковой активностью, что позволило стробилурину выйти на рынок в 1996 г. [78,79].В настоящее время на рынке доступно 18 фунгицидов этого класса с различными химическими группами в своей структуре, включая метоксиакрилаты, метоксиацетамид, метоксикарбаматы, оксиминоацетаты, оксиминоацетамиды, аксазолидиноны, дигидродиоксазины, имидазолиноны и безилкарбаматы [51, 65], все имеют общий механизм действия.
Название «QoI» возникло из-за того, что этот класс фунгицидов ингибирует связывание в сайте Qo (окисление хинола) комплекса III (ферментный комплекс цитохрома bc 1 ) во время дыхания митохондрий [80].Таким образом, перенос электронов между цитохромами b и c не происходит, блокируя окисление НАДФН (никотинамидадениндинуклеотида) и производство АТФ (аденозинтрифосфата) [79,81]. QoIs обладают быстрым действием, поскольку недостаток энергии в грибковых клетках влияет на процесс прорастания спор и подвижность зооспор [80]. Этот класс обладает активностью широкого спектра действия против грибов, включая аскомицеты, базидиомицеты и оомицеты [65], и используется для обработки нескольких сельскохозяйственных культур, инфицированных этими грибами.Несмотря на эти особенности, QoI классифицируется FRAC как класс фунгицидов с высоким риском развития устойчивости к грибам [51]. Основной механизм устойчивости грибов к этому классу включает точечные мутации в гене митохондриального цитохрома b ( cyt b ) [57], которые приводят к изменению аминокислотной последовательности белка, препятствуя связыванию с ним фунгицидов [80]. Следующие трехточечные мутации были описаны как причина развития устойчивых фенотипов: замена аланина на глицин в положении 143 (G143A), лейцин на фенилаланин в положении 129 (F129L) и аргинин на глицин в положении 137 (G137R). [70].Эти три мутации приводят к разной степени устойчивости к QoI; G143A связан с высокой устойчивостью, а F129L и G137R связаны с умеренной устойчивостью [70]. Сообщается, что по крайней мере 20 патогенов обладают устойчивостью к QoI во всем мире [82]. Среди описанных QoI-устойчивых грибов Erysiphe necator , Pseudopernospora cubensis, и V. inaequalis несут мутацию G143A [83], тогда как Pyrenophora solani , Pyrenophora aphan40003 и Pyrenophora teres несут мутацию. F129L, а Pyrenophora tritici-repentis несет мутацию G137R [65].
2.2.5. Морфолин
Морфолин представляет собой органическое соединение с гетероциклическим кольцом, содержащим кислород и азот, и обладает различными биологическими эффектами, такими как антипаразитарные, противораковые, противовоспалительные, противомалярийные и противогрибковые эффекты [84]. Его противогрибковое действие было описано в 1965 году, и додеморф, тридеморф, альдиморф и фенпропиморф являются одними из представителей этого класса противогрибковых [65].
Морфолины — системные фунгициды, используемые для борьбы с мучнистой росой и болезнями листьев злаков [85].Класс проявляет свою противогрибковую активность за счет ингибирования двух ферментов, участвующих в синтезе эргостерола: ∆14-редуктазы и ∆8-∆7-изомеразы [6]. FRAC классифицирует морфолины как представляющие умеренный риск развития резистентности [51]. Хотя были сообщения о снижении чувствительности мучнистой росы к этому классу фунгицидов, механизм, лежащий в основе этой устойчивости, остается неизвестным [16].
2.3. Устойчивость Aspergillus к азолам: значение для клиники и полей
Изменения в целевых белках были продемонстрированы для нескольких фунгицидов, включая азолы, основной класс противогрибковых средств, используемых для сельскохозяйственных культур [16].Азолы обычно распыляют на полях для борьбы с ржавчиной и плесенью, поражающей фрукты, овощи, зерновые и другие культуры [86,87]. Азолы имеют синтетическое происхождение и циклическую структуру, как имидазолы и триазолы [12]. Их механизм действия включает нарушение ферментативной активности ланостерин 14α-деметилазы (также известной как CYP51), члена семейства ферментов P450. Этот фермент превращает ланостерин в эргостерин, который является важным компонентом клеточной мембраны грибов и способствует ее текучести и целостности, а также эффективному функционированию мембраносвязанных ферментов.Ингибирование активности CYP51 приводит к накоплению деметилированного ланостерина с токсической скоростью, нарушая динамику и стабильность клеточной стенки. Следовательно, рост и репликация грибов подавляются [12,26,27,88]. Азолы широко используются, поскольку они недорогие, обладают широким спектром действия и эффективны против грибковых заболеваний растений. Кроме того, эти фунгициды используются в зерновых и травяных средах в период до и после сбора урожая для предотвращения заражения дрожжами (например, Candida spp., Thrichosporon penicillatum и Cryptococcus spp.) И мицелиальных грибов (таких как Aspergillus spp., Fusarium spp. И Alternaria spp.) [87]. Однако чрезмерное использование азолов приводит к загрязнению почвы, воздуха и растений, главным образом из-за их липофильных свойств, что приводит к их абсорбции почвой и органическими веществами. Азолы обладают высокой стабильностью и могут оставаться практически неизменными в окружающей среде и в продуктах питания в течение нескольких месяцев [87,89].
Устойчивость грибов к азолам может быть обусловлена различными факторами. Мутации в cyp51A могут снижать сродство кодируемого белка к его ингибиторам, а активация этого гена увеличивает отток азола за счет активации мембранных транспортеров [72]. У полевых изолятов наиболее частой причиной устойчивости к азолам были мутации в cyp51A [71,72]. Zymoseptoria tritici содержит> 30 модификаций в cyp51A [71]. Такие виды, как V.inaequalis , Penicillium digitatum , Cercospora beticola , Monilinia fructicola и Blumeriella jaapii связаны с резистентностью к азолам, вызванной усилением промотора cyp51A в результате вставки гена разного размера в 72 раза. Транспортеры оттока, такие как транспортеры АТФ-связывающей кассеты (ABC) и транспортеры главного фасилитатора суперсемейства (MFS), могут снижать концентрацию азола в клетках грибов. Среди полевых изолятов грибов этот тип устойчивости отмечен для B.cinerea , Penicillium digitatum и Zymoseptoria tritici [71].
Широкое использование азолов в сельском хозяйстве может влиять на фитопатогены, имеющие медицинское значение [26]. Следовательно, у грибов, вызывающих серьезные микозы человека, также может развиться устойчивость к азолам [26,87]. Некоторые заболевания человека вызываются грибами, которые выживают в различных средах и пищевых продуктах, например Coccidioides , Histoplasma , Aspergillus и Cryptococcus [87]. Aspergillus fumigatus , сапрофитный гриб, который может жить в почве, производит споры, которые переносятся по воздуху и могут попадать в дыхательные пути человека. Приобретенная устойчивость A. fumigatus к широко используемым противогрибковым препаратам может быть связана с широким применением фунгицидов [90,91]. В клинике у пациентов, получавших долгосрочную азольную терапию против аспергиллеза, наблюдалась резистентность A. fumigatus , главным образом потому, что азолы являются препаратами первого выбора, используемыми для лечения этого грибкового заболевания [92].Однако несколько случаев устойчивости к A. fumigatus имели место у пациентов, которые никогда не получали азолы; таким образом, была выдвинута гипотеза, что могут быть другие источники воздействия грибов с приобретенной устойчивостью к азолам, такие как сельскохозяйственные культуры [93].
Snelders et al. (2008) сообщили о такой связи между устойчивостью к азолам A. fumigatus и воздействием окружающей среды [94]. Они исследовали распространенность устойчивости к интраконазолу у 1912 клинических изолятов A.fumigatus , собранный у 1219 пациентов в Университетском медицинском центре в Неймегене в течение 12 лет, и сравнен с клиническими изолятами из больниц в разных городах. Они подтвердили, что среди образцов, обработанных интраконазолом, была широко распространена устойчивость к азолам, причем 94% устойчивых изолятов несли мутации cyp51A . Поскольку передача инфекции Aspergillus от человека к человеку не является обычным явлением, аналогичная мутация TR 34 / L98H у неродственных пациентов указывает на участие факторов окружающей среды.Например, возможно, что модифицированные конидии разошлись по воздуху и, следовательно, вызвали инфекцию [94].
Основной механизм, лежащий в основе устойчивости к азолам, приобретенной у A. fumigatus , включает точечные мутации или активацию cyp51A (14α-деметилазы в A. fumigatus ) [95]. Сообщалось, что несколько точечных мутаций в cyp51a , таких как G54, M220, G448S, G138, P216 и F219, придают устойчивость к азолам A.fumigatus [93,96]. Кроме того, полиморфизмы, приводящие к аминокислотным мутациям, такие как F46Y, M172V, N248T, D255E и E427K, уже были связаны с устойчивостью к азолам A. fumigatus [95]. Было обнаружено, что тандемные вставки (всего 46 п.н.) в промоторной области cyp51a и замена тирозина 121 на фенилаланин и треонина 289 на аланин (TR 46 / Y121F / T289A) связаны с устойчивостью к вориконазолу. Кроме того, последовательность из 53 пар оснований, вставленная тандемом в промоторную область, коррелировала с устойчивостью к азолам.Мутация TR 34 / L98H, которая приводит к сверхэкспрессии cyp51A , является основной мутацией, связанной с устойчивостью A. fumigatus к азолам [94,95]. Резистентность к азолам среди клинических изолятов Aspergillus fumigatus была продемонстрирована в недавнем исследовании [97]. В этом отчете три изолята с устойчивостью к итраконазолу несли различные мутации cyp51A . Один из этих изолятов содержал мутацию M220K, а второй демонстрировал мутацию G54 в дополнение к модификации в промоторе cyp51A .Третий изолят имел интеграцию тандемного повтора из 34 пар оснований (TR34) в промоторной области гена и замену L98H (замена лейцина 98 гистидином).
Феномен устойчивости к азолам A. fumigatus широко распространен и был зарегистрирован на Ближнем Востоке, в Азии, Африке, Австралии, Северной Европе и Южной Америке [98]. Пока не ясно, где и когда возник этот механизм сопротивления; однако было высказано предположение, что это, вероятно, связано с общим предковым геном, поскольку среди неродственных A.fumigatus [98]. Важно подчеркнуть, что примерно 70% пациентов с азолустойчивым аспергиллезом вообще не получали азолотерапию [98,99]. Meireles et al. [100] оценили изменение клинической противогрибковой чувствительности Aspergillus flavus в ответ на азольные и бензимидазольные фунгициды [100]. Они показали, что воздействие азолов на Aspergillus flavus изменило чувствительность гриба к противогрибковым препаратам итраконазол, вориконазол и позаконазол, что свидетельствует о развитии резистентных фенотипов и представляет собой первый отчет о противогрибковой резистентности, вызванной воздействием азола.Dos Reis et al. [101] исследовали ген mshA Aspergillus fumigatus MSh3 mismatch repair (MMR) и его влияние на вирулентность и эволюцию устойчивости к азолам [101]. Мутантный штамм mshA A. fumigatus показал значительно сниженную вирулентность в модели инвазивного легочного аспергиллеза на мышах с нейтропенией. Кроме того, мутантный штамм продемонстрировал быстрое приобретение вирулентности и высокий уровень устойчивости к позаконазолу.
В этом контексте программы общественного здравоохранения по надзору за грибковыми заболеваниями должны осуществляться на практике, потому что чрезмерное использование азола в полевых условиях уже наносит вред в клинических условиях [94].Азолы — это первая линия лечения инфекции Aspergillus . Поскольку заболевания, вызываемые этим видом грибов, включая инвазивный аспергиллез, аллергические проявления и хронические легочные заболевания, могут поражать большое количество людей, приобретение грибами устойчивости к азолам приведет к увеличению смертности из-за инфекций Aspergillus во всем мире [17,102] .
3. Новые противогрибковые стратегии
Химический контроль важен для поддержания надежных и хороших урожаев [103].Для сохранения имеющихся на рынке фунгицидов и защиты новоприбывших требуются дальнейшие исследования наряду с расширением сотрудничества между отраслями промышленности и регулирующими органами [51]. Однако поиск новых фунгицидов был затруднен из-за повышенной устойчивости к грибковым патогенам [104]. Осведомленность об экологической безопасности породила общественный спрос на эффективные и безопасные противогрибковые средства биологической борьбы, которые являются экономически, экологически и социально устойчивыми [105]. Нанотехнология возникла как новая область исследований в нынешнем столетии и позволяет использовать наночастицы и наноматериалы для защиты сельскохозяйственных культур от грибковых патогенов [106].В этом отношении наночастицы меди привлекают все большее внимание, поскольку их антимикробная активность известна с древних времен [107,108]. Впервые медь была использована в сельском хозяйстве в 1761 году, когда было обнаружено, что замачивание семян в слабом растворе сульфата меди подавляло рост грибов, присутствующих в семенах [109]. С тех пор соединения меди широко используются в сельском хозяйстве, например, в противогрибковых [110] или противомикробных целях [111,112].
Kanhed et al.показали, что наночастицы меди проявляют многообещающую противогрибковую активность против фитопатогенных грибов. Они также заметили, что эти наночастицы проявляют лучшую противогрибковую активность, чем бавистин, который является коммерчески используемым фунгицидом. Следовательно, наночастицы меди могут быть использованы в сельском хозяйстве в качестве новой противогрибковой стратегии для борьбы с грибковыми патогенами растений [106].
Помимо металлических наночастиц, наночастицы хитозана были предложены в качестве потенциальных биопестицидов против грибковых инфекций [113].Противогрибковая активность наночастиц в сельском хозяйстве изучена недостаточно; однако некоторые исследования были сосредоточены на использовании низких концентраций наночастиц с низкой токсичностью в сельскохозяйственном секторе [114]. Servin et al. (2015), а также Дитта и Аршад (2016) продемонстрировали, что наноматериалы могут подавлять болезни растений, повышать урожайность сельскохозяйственных культур и обеспечивать растения более питательными веществами, чем удобрения [115, 116].
Некоторые растения с древних времен использовались для терапевтического и профилактического лечения некоторых инфекционных заболеваний.Некоторые хорошие фунгициды на натуральной основе показали многообещающую противогрибковую активность и должны стать хорошей альтернативой борьбе с грибковыми патогенами в сельском хозяйстве. Летучие компоненты из Origanum onites были оценены на предмет их противогрибковой активности против патогенов Phomopsis obscurans , Fusarium oxysporum , Colletotrichum разновидностей и Botrytis cinerea [117]. Таким образом, лучшее понимание естественных фунгицидных стратегий и их влияния на растительно-грибковые взаимодействия могло бы снизить использование пестицидов в сельском хозяйстве.
Недавно Hao et al. (2017) проанализировали противогрибковую активность наночастиц оксида железа (Fe 2 O 3 ), оксида меди (CuO) и оксида титана (TiO 2 ) и трех углеродных наноматериалов, многостенных углеродных нанотрубок (MWCNTs). , фуллерен (C60) и восстановленный оксид графена (rGO) против грибка B. cinerea [114]. Грибок поражает фрукты, овощи и декоративные растения [118]. У растений, таких как розы, он вызывает серую гниль, которая приводит к потере примерно 30% урожайности растений в год [119].В ходе экспериментов in vitro и in vivo Hao et al. (2017) обнаружили, что каждый из трех вышеупомянутых углеродных наноматериалов подавлял инфекцию B. cinerea у роз в концентрации 200 мг / л. Этот ингибирующий эффект возникает из-за взаимодействия углеродных наноматериалов и спор грибов, приводящего к агрегации спор и, таким образом, подавлению их прорастания. Как и в случае наночастиц Fe 2 O 3 и CuO, углеродные наноматериалы показали значительные противогрибковые эффекты даже при концентрациях 50 мг / л.Хотя наночастицы TiO 2 не проявляли явных эффектов, наблюдалось уменьшение количества образованных ими мицелл по сравнению с контролем. Таким образом, это исследование продемонстрировало противогрибковую активность углеродных наноматериалов и металлических наночастиц в B. cinerea и подчеркнуло, что применение наночастиц должно быть тщательно оценено из-за их потенциальной токсичности и рисков для окружающей среды [114].
На сегодняшний день разработаны различные стратегии для снижения устойчивости к противогрибковым препаратам в сельскохозяйственных условиях при одновременном содействии разработке новых противогрибковых агентов [16].В настоящее время обработка комбинаторными фунгицидами является одной из стратегий, используемых для замедления устойчивости к противогрибковым препаратам [120, 121]. Кроме того, исследования в области синтетической биологии и эпигеномики позволили разработать новые противогрибковые агенты, основанные на подходах к интерференции РНК [122], таких как двунаправленный перенос миРНК растений-грибов, для борьбы с патогенами, в том числе B cinerea [123]. Такие подходы к разработке новых противогрибковых стратегий являются многообещающими и потенциально трансформирующими [16].
3.1. Эндофитные грибы в сельском хозяйстве
В последние десятилетия поиск альтернативных методов борьбы с болезнями в сельском хозяйстве приобретает все большее значение, поскольку некоторые грибковые патогены приобрели противогрибковую устойчивость, а некоторые синтетические химические вещества были запрещены как загрязняющие и токсичные [124]. Последние достижения показали, что использование микроорганизмов, в основном бактерий и грибов, в качестве агентов биологической борьбы было выгодным для борьбы с болезнями и вредителями, повышая урожайность сельскохозяйственных культур [125,126].
Эндофитные грибы были изучены как альтернативное и устойчивое средство превращения природных соединений в растениях-хозяевах в противогрибковые соединения, которые эффективны не только против патогенов человека, но и против фитопатогенов [127]. Эндофитные микроорганизмы обнаруживаются у чрезвычайно важных видов растений [124] и могут быть классифицированы как компетентные, необязательные, обязательные, условно-патогенные или пассивные, в зависимости от их воздействия на растения [128,129,130,131]. В последнее время они привлекли к себе особое внимание из-за преимуществ, которые эти микроорганизмы могут давать своим хозяевам в виде пестицидов, помогая росту и выживанию растений и повышая их устойчивость к экстремальным температурам и засухе, а также удаляя загрязняющие вещества из почвы [132 ]. Trichoderma spp. связаны с почвой и включают некоторые важные виды, такие как T. hamatum , T. harzianum , T. polysporum и T. viride , которые являются важными агентами биоконтроля грибков в растениях [133, 134]. Многие виды Trichoderma используются для борьбы с почвенными грибковыми патогенами и некоторыми фолликулярными патогенами [135, 136]. Основные преимущества этого типа агентов биоконтроля заключаются в том, что они легко адаптируются к различным условиям окружающей среды, проявляют толерантность к определенным фунгицидам, обладают разнообразными механизмами действия и простыми требованиями к питанию и быстро растут [124, 137].
Другой полезный подход с участием эндофитных грибов заключается в использовании ими производства биоактивных вторичных метаболитов, которые представляют собой группу микроорганизмов, способных синтезировать новые соединения [138], которые могут воздействовать на патогены и вредители растений [139]. Deshmukh et al. (2018) описали несколько метаболитов, продуцируемых эндофитными грибами из лекарственных растений, и их потенциал в качестве противогрибковых агентов [127]. Например, склеродермия A и B и тритерпеноид ланостан продуцируются эндофитным грибом базидиомицетом, связанным с растением Eucalyptus grandis , и эти соединения были идентифицированы как потенциальные фунгициды против Candida albicans , C.tropicalis , C. crusei и C. parapsiosis . Склеродермия B показала лучшую противогрибковую активность против всех этих видов грибов, чем склеродермия A или тритерпеноид ланостан [140].
Виды Xylaria , связанные с растением Azadirachta indica из Китая, являются источником новых биоактивных соединений, некоторые из которых обладают фармакологическими свойствами, необходимыми для открытия лекарств [141], проявляя противогрибковую активность против C.albicans , Aspergillus niger и Fusarium avenaceum [127 142]. Было показано, что гриб Mycosphaerella , который является эндофитом растения Eugenia bimarginata из Бразилии, продуцирует две эйкозаноидные кислоты, обладающие противогрибковой активностью против C. neoformans и C. gattii [143]. Липопептид криптокандина выделен из гриба Cryptosporiopsis quercina , произрастающего на древесных породах в Европе.Это соединение активно против нескольких грибов, патогенных против растений, в том числе грибов вида B. cinerea [144], и связано с некоторыми антимикотическими соединениями, такими как эхинокандины и пневмокандины () [145].
Таблица 3
Продукция вторичных метаболитов эндофитными грибами и их потенциал в качестве противогрибковых агентов.
| Эндофитные грибы | Растение | Метаболиты | Противогрибковые действия |
|---|---|---|---|
| Базидиомицетовый гриб [140] | Eucalyptus grandis 9ano0004 [140] | Amp; Candida albicans C.tropicalis C. grusei C. parapsiosis [140] | |
| Xylaria spp. [141] | Azadirachta indica [127,142] | Биоактивные соединения [141] | C. albicans Aspergillus niger Fusarium avenaceum [127,142] 47 |
| Eugenia bimarginata [143] | Эйкозаноидные кислоты [143] | Cryptococcus neoformans C.gattii [143] | |
| Cryptosporiopsis quercina [144] | Порода древесины в Европе [144] | Липопептид криптокандина [144] | Botrytis cinerea [144] были использованы для идентификации и характеристики генетических элементов и метаболитов, участвующих во взаимодействиях между растениями и эндофитными микроорганизмами [146]. Для того чтобы эти эндофитные микроорганизмы продавались как успешные агенты биоконтроля, должны быть соблюдены определенные критерии в отношении простоты их применения и распространения среди сельскохозяйственных культур, не вызывая каких-либо побочных эффектов.Такие микробы обладают широким спектром эффективных способов действия и ни при каких обстоятельствах не вызывают симптомов или каких-либо побочных эффектов у своих хозяев [124]. Таким образом, эта область исследований требует дальнейшего изучения, поскольку еще предстоит открыть и охарактеризовать множество эндофитных микроорганизмов [124]. 3.2. Хемоинформатические подходы к получению новых фунгицидовМетаболомические подходы позволяют охарактеризовать метаболиты организма в определенное время [147].Он направлен на идентификацию химических соединений с низким молекулярным весом в биологических системах и, в сочетании с другими мультиомными технологиями, может использоваться для исследования и характеристики микробных взаимодействий [148]. Наиболее часто используемые методы исследования метаболизма и структурного выяснения соединений в микробной метаболомике — это ядерный магнитный резонанс (ЯМР) и масс-спектрометрия (МС), в дополнение к методам разделения МС, таким как газовая хроматография – МС (ГХ-МС), жидкостная хроматография — МС (ЖХ-МС) и капиллярный электрофорез — МС (КЭ-МС) [148,149]. ЯМР-методы быстрые и простые, могут быть высокопроизводительными и требуют минимального количества пробы. Однако основным ограничением этих методов является их низкая чувствительность (от микромолярного до наномолярного диапазона) [150, 151] и высокая стоимость. В качестве альтернативы, платформы MS обеспечивают высокопроизводительное точное определение массы и выяснение структуры, обеспечивая более высокую чувствительность (от фемтомолярного до аттомолярного) при применении вместе с методами разделения и могут снизить затраты в зависимости от требуемой степени разрешения [148,151].Из-за огромного количества производимых соединений и сложности метаболизма маловероятно, что один метод сгенерирует профиль метаболита, но использование нескольких аналитических инструментов и методов может обеспечить более широкий охват, выявить биомаркеры и оценить токсичность, эффективность и эффективность лекарств. селективность против различных патогенных грибов [150,152]. Наряду с этими технологиями были разработаны вычислительные алгоритмы для извлечения данных из полученных спектральных шумов, выполнения статистического анализа и идентификации исследуемых соединений.Кроме того, обработанные данные могут быть наложены на метаболические пути и смоделированы для прогнозирования результатов биологических экспериментов, хотя они могут потребовать вычислительных ресурсов [148, 149]. Эти новейшие методы позволяют идентифицировать изменения в ответ на раздражители и новые метаболиты с потенциальной антимикробной активностью. Их изменение может привести к уникальному инструменту, полезному для разработки лекарств, направленных на сокращение использования пестицидов при сохранении урожайности сельскохозяйственных культур [153,154].Когда разработка таких естественных биоактивных метаболитов недостаточна для создания новых противомикробных агентов, следует применять другие подходы, такие как рациональный дизайн. В общем, рациональные конструкции используют существующие знания о структуре молекулы или реакции интереса, сочетая вычислительные инструменты и структурные знания [155]. Существует два основных хемоинформатических подхода к получению новых фунгицидов или других биоактивных соединений: разработка лекарств на основе структуры и на основе лигандов [156].Первый основан на знаниях о трехмерной структуре или создании моделей гомологии, основанных на биологических рецепторах, тогда как последний полагается на знания о других молекулах, которые связываются с рецептором-мишенью [156,157]. Высокопроизводительный скрининг библиотек молекул продвинул открытия новых лекарств. Этот отбор основан на количественных отношениях структура – деятельность (QSAR) и количественных отношениях структура – свойство (QSPR). Оба метода создают вычислительные модели, которые могут предсказывать биологическую активность и другие свойства лекарства на основе молекулярной структуры целевого соединения.Эти модели снижают частоту неудач при нацеливании лекарств, устраняя соединения с ранее предсказанной токсичностью или плохими фармакокинетическими параметрами, оптимизируя исследования и снижая связанные с этим затраты. Однако модели трудно получить, и их необходимо дополнять другими методами, такими как молекулярное моделирование, распознавание образов, машинное обучение или искусственный интеллект [158]. Кроме того, моделирование молекулярной динамики также является универсальным вычислительным методом для изучения биологических молекул, вносящим большой вклад в разработку рационального дизайна на нескольких уровнях.Его комбинация с другими методами, такими как расчет свободной энергии стыковки и связывания молекул, важна для выяснения взаимодействий лиганд-рецептор, тем самым направляя рациональное исследование [159]. иллюстрирует схематический процесс получения новых кандидатов в лекарства. Использование метагеномики в разработке новых лекарственных препаратов-кандидатов. Левый путь иллюстрирует оценку метаболитов для выявления биоактивных или токсичных молекул, на которые накладываются метаболические пути и выбранный кандидат в лекарство.Правильный путь иллюстрирует скрининг молекулярной библиотеки, используемый для создания вычислительных моделей и расчета стыковки или свободной энергии, ведущей к производству кандидата на лекарство. Использование методов «омики» и других вычислительных методов, интегрированных с экспериментальными методами, позволило искать, предсказывать и предлагать новые биоактивные молекулы и кандидаты в лекарственные препараты, такие как агрохимические фунгициды, экономя время и ресурсы и, таким образом, становясь альтернатива для снижения потерь урожая и преодоления проблемы устойчивости к противогрибковым препаратам [156,160,161]. Агент биоконтроля — обзорВыбор, оценка и доставка агентов микробного биоконтроляДля выбора агентов микробного биоконтроля использовалось несколько подходов, и ни одна система, по-видимому, не была более успешной, чем другая. Один из подходов заключался в выделении потенциальных микробных антагонистов из предполагаемой среды использования, такой как почвы, семена или корни. Это основано на предпосылке, что любой антагонист будет экологически адаптирован к этой среде и сможет выживать и проявлять активность при повторном применении в качестве агента биоконтроля.Другой подход заключался в выделении антагонистов из почв, подавляющих конкретный патоген. Этот подход был использован для выделения Streptomyces griseoviridis , агента биоконтроля для борьбы с Fusarium и Pythium spp. инфекции декоративных растений и овощей. Он также используется для изоляции непатогенного Fusarium oxysporum , эффективного средства биоконтроля против Fusarium увядания сладкого картофеля и томатов.В качестве альтернативы, пропагулы или мицелий патогенов помещали в почву в качестве приманки, из которой были изолированы антагонисты. В этом случае антагонисты могут атаковать патоген и адаптироваться к среде, в которой патоген активен. Эта процедура была использована для получения антагонистов из склероций нескольких патогенов, включая виды Sclerotinia и Sclerotium . После получения коллекции антагонистов их проверяют на воспроизводимую активность биоконтроля.Обычно это включает в себя биологический анализ, который пытается до некоторой степени воспроизвести условия, при которых необходим биоконтроль. Поскольку это часто включает скрининг многих сотен изолятов, он обычно включает в себя какую-либо форму биоанализа проростков, проводимого в контролируемых условиях. Успешные изоляты из первичных фильтров затем подвергаются более строгой оценке и последующим крупномасштабным испытаниям в теплице или в полевых условиях. После того, как агент биоконтроля продемонстрировал воспроизводимую активность в серии скрининговых испытаний, необходимо рассмотреть методы производства, составления и применения инокулята в зависимости от культуры, болезни и среды использования.Производство подходящего количества жизнеспособных и активных клеток, спор или биомассы является первым шагом в этой процедуре. Наиболее часто используемый метод — это жидкое брожение с использованием ряда различных и часто недорогих субстратов, таких как патока, пивные дрожжи и кукурузный настой. Жидкие ферментации имеют то преимущество, что позволяют контролировать питательные вещества, pH, температуру и другие параметры окружающей среды, что может помочь оптимизировать производство биомассы, количество и качество спор, а также снизить загрязнение.Альтернативным методом является ферментация твердого субстрата с использованием ряда сельскохозяйственных отходов, в том числе порошка люцерны, жмыха сахарного тростника, опилок, различных зерен, отрубей и торфа. Разработаны различные способы доставки агентов биоконтроля. Выбор метода для конкретного агента во многом зависит от природы агента биоконтроля, целевого патогена, целевой культуры и метода ее выращивания. Способы включают жидкие составы агента биоконтроля, которые вносятся в почву или среду выращивания в виде полива, опрыскивания или орошения.Это обычное дело с бактериальными агентами биоконтроля. Например, продукт для биоконтроля Spotless на основе Pseduomonas aureofaciens для борьбы с болезнями дерна доставляется через орошение. Другие методы включают включение агента биоконтроля в различные виды составов гранул, которые можно добавлять в почву во время посадки или до нее, или нанесение агента биоконтроля на семена перед посадкой с использованием специальных процедур нанесения покрытия на семена или гранулирования. % PDF-1.7 % 2288 0 объект > эндобдж xref 2288 160 0000000016 00000 н. 0000004598 00000 н. 0000004835 00000 н. 0000004880 00000 н. 0000004918 00000 н. 0000005266 00000 н. 0000005382 00000 п. 0000005498 00000 п. 0000005614 00000 н. 0000005729 00000 н. 0000005845 00000 н. 0000005961 00000 н. 0000006079 00000 п. 0000006186 00000 п. 0000006292 00000 н. 0000006400 00000 н. 0000006485 00000 н. 0000006570 00000 н. 0000006655 00000 н. 0000006739 00000 н. 0000006823 00000 н. 0000006907 00000 н. 0000006991 00000 н. 0000007075 00000 п. 0000007159 00000 н. 0000007243 00000 н. 0000007326 00000 н. 0000007409 00000 н. 0000007492 00000 н. 0000007575 00000 н. 0000007658 00000 н. 0000007741 00000 н. 0000007825 00000 н. 0000007908 00000 н. 0000007991 00000 н. 0000008074 00000 н. 0000008157 00000 н. 0000008240 00000 п. 0000008323 00000 п. 0000008406 00000 п. 0000008489 00000 н. 0000008572 00000 н. 0000008656 00000 н. 0000008739 00000 н. 0000008823 00000 н. 0000008907 00000 н. 0000008989 00000 н. 0000009072 00000 н. 0000009154 00000 н. 0000009236 00000 п. 0000009317 00000 п. 0000009402 00000 п. 0000009487 00000 н. 0000009572 00000 н. 0000009684 00000 п. 0000009720 00000 н. 0000009864 00000 н. 0000009939 00000 н. 0000009975 00000 н. 0000010349 00000 п. 0000010838 00000 п. 0000011091 00000 п. 0000011449 00000 п. 0000011900 00000 п. 0000012425 00000 п. 0000012504 00000 п. 0000013298 00000 п. 0000013541 00000 п. 0000013875 00000 п. 0000014367 00000 п. 0000014908 00000 н. 0000015833 00000 п. 0000016094 00000 п. 0000016462 00000 п. 0000016879 00000 п. 0000017081 00000 п. 0000017149 00000 п. 0000017314 00000 п. 0000018117 00000 п. 0000018496 00000 п. 0000018776 00000 п. 0000019602 00000 п. 0000019751 00000 п. 0000019946 00000 п. 0000020108 00000 п. 0000020406 00000 п. 0000020599 00000 н. 0000020656 00000 п. 0000021412 00000 п. 0000022153 00000 п. 0000022754 00000 п. 0000023169 00000 п. 0000024452 00000 п. 0000027798 00000 н. 0000028823 00000 п. 0000032357 00000 п. 0000034132 00000 п. 0000036190 00000 п. 0000036572 00000 п. 0000039364 00000 н. 0000039662 00000 п. 0000039753 00000 п. 0000039864 00000 н. 0000040397 00000 п. 0000040514 00000 п. 0000046777 00000 п. 0000046818 00000 п. 0000047356 00000 п. 0000047474 00000 п. 0000055361 00000 п. 0000055402 00000 п. 0000055465 00000 п. 0000055543 00000 п. 0000055602 00000 п. 0000055663 00000 п. 0000055809 00000 п. 0000055913 00000 п. 0000056017 00000 п. 0000056178 00000 п. 0000056334 00000 п. 0000056464 00000 н. 0000056612 00000 п. 0000056805 00000 п. 0000056968 00000 п. 0000057125 00000 п. 0000057279 00000 н. 0000057409 00000 п. 0000057560 00000 п. 0000057714 00000 п. 0000057842 00000 п. 0000057996 00000 п. 0000058202 00000 п. 0000058320 00000 п. 0000058458 00000 п. 0000058580 00000 п. 0000058698 00000 п. 0000058836 00000 п. 0000058958 00000 п. 0000059066 00000 н. 0000059196 00000 п. |
