причины, симптомы, диагностика и методы лечения на сайте «Альфа-Центр Здоровья»
Это структурные изменения клеток эпителия на шейке матки. Признаки дисплазии шейки матки чаще обнаруживают после 35 лет, однако риск есть в любом возрасте. Заболевания опасно появлением злокачественных новообразований, поэтому иногда встречается упоминание как предраковое состояние.
Причины и симптомы дисплазии шейки матки
Основная причина – инфицирование папилломавирусом человека (ВПЧ), а точнее двумя из его двухсот видов (16 и 18 типы), опасными появлением онкологических новообразований. Инфицирование происходит через незащищенный половой контакт. Риски столкнуться с симптомами дисплазии шейки матки увеличиваются при:
- незащищенных контактах с несколькими партнерами;
- низком иммунитете;
- травмах, гинекологических инфекциях;
- ранних родах (до 17), при 3-х и более беременностях;
- гормональных нарушениях;
- хронических болезнях, неправильном питании;
- курении.
Признаки дисплазии шейки матки могут не проявляться годами. Состояние прогрессирует, а женщина без визита к гинекологу не подозревает об опасности. Настораживающие симптомы дисплазии шейки матки появляются при запущенном процессе:
- тянущие боли, дискомфорт в нижней частей живота;
- выделения;
- субфебрильная температура тела;
- жалобы на ухудшение самочувствия.
Степень заболевания классифицируется по количеству измененных клеток в эпителии:
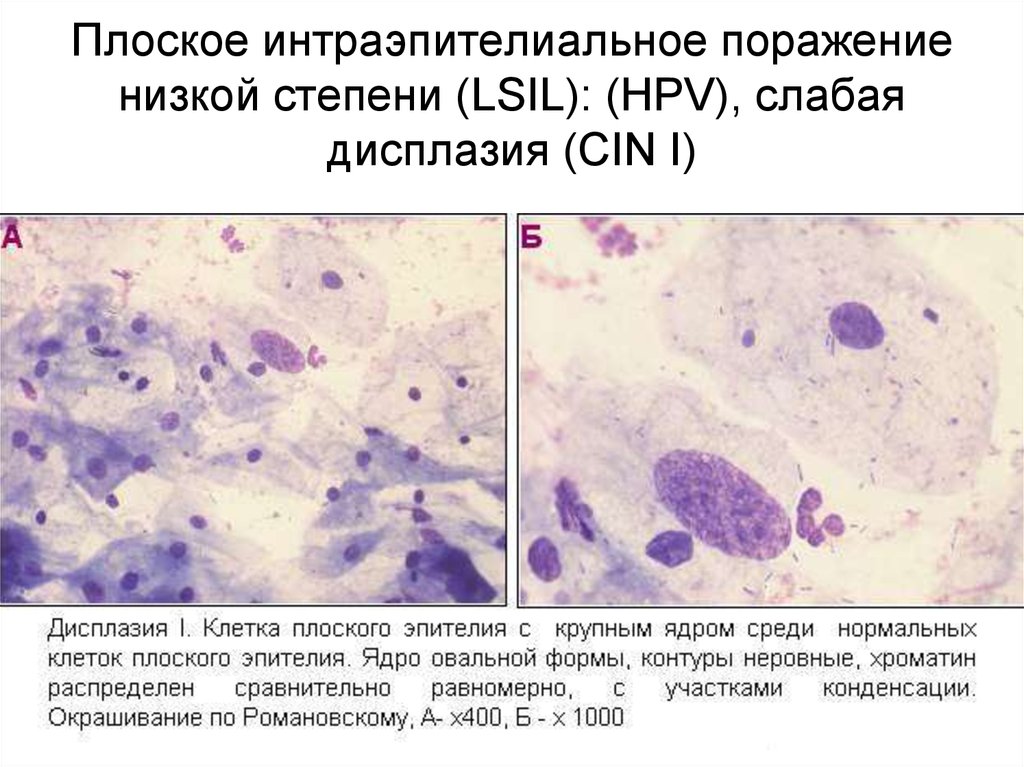
- слабая – менее трети эпителиального слоя содержат патологию;
- средняя – поражена половина глубины слизистой;
- тяжелая – процесс затронул 2/3 слоя эпителия или больше.
Как лечить дисплазию шейки матки
Подтвердить диагноз можно после:
- гинекологического осмотра с кольпоскопией;
- лабораторных анализов – ПАП-мазка (исследование количества клеток под микроскопом), теста на онкомаркеры;
- УЗИ.
Методика лечения дисплазии шейки матки учитывает стадию развития изменений, возраст пациента, другие факторы.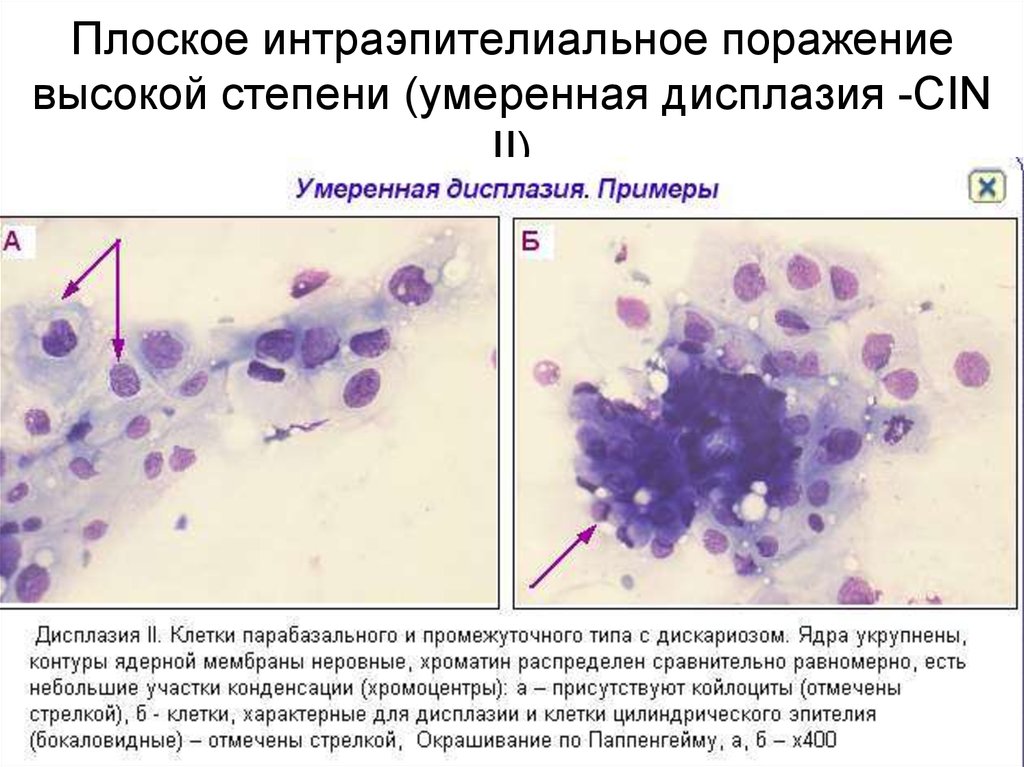 На первой степени рекомендована периодическая (2-3 раза в год) проверка динамики изменений. В 70% случаев в молодом возрасте все нормализуется само. При этом лечат выявленные болезни репродуктивной системы, укрепляют иммунитет. На второй и третьей стадиях ожидать, что все пройдет само не стоит, поэтому переходят к решительным действиям. Терапия проводится хирургическими методами:
На первой степени рекомендована периодическая (2-3 раза в год) проверка динамики изменений. В 70% случаев в молодом возрасте все нормализуется само. При этом лечат выявленные болезни репродуктивной системы, укрепляют иммунитет. На второй и третьей стадиях ожидать, что все пройдет само не стоит, поэтому переходят к решительным действиям. Терапия проводится хирургическими методами:
- прижиганием током;
- лазерной деструкцией;
- криохирургией;
- радиоволновой терапией.
В крайних случаях удаляют часть шейки матки или ее целиком. Основные осложнения – травматичность, риск образования рубцов, что опасно невынашиванием беременности и плохим раскрытием шейки в родах.
Народных методов, которыми лечат дисплазию шейки матки, с доказанной эффективностью нет. Тампоны, спринцевания дополнительно травмируют слизистую и могут усугубить ее состояние.
Лечение дисплазии шейки матки предусматривает профилактические меры, чтобы предотвратить рецидивы. Это вакцинация от ВПЧ, предохранение при случайных связях, ежегодное посещение гинеколога, укрепление иммунитета. Дисплазия – не приговор, при раннем выявлении, терапии женщина сможет сохранить здоровье и иметь детей.
Это вакцинация от ВПЧ, предохранение при случайных связях, ежегодное посещение гинеколога, укрепление иммунитета. Дисплазия – не приговор, при раннем выявлении, терапии женщина сможет сохранить здоровье и иметь детей.
Дисплазия шейки матки — лечение и симптомы, диагностика дисплазии шейки матки в Москве, Клинический Госпиталь на Яузе
Предлагаем вам пройти диагностику и лечение дисплазии шейки матки в Клиническом госпитале на Яузе. В соответствии с мировыми стандартами мы применяем только проверенные и хорошо зарекомендовавшие себя методы (минимально агрессивное хирургическое лечение с помощью лазерной, радиоволновой или электрической коагуляции), что обеспечивает полную безопасность и эффективность лечения. Кроме того, все процедуры предельно комфортны для пациента, а риск осложнений сведен к минимуму.
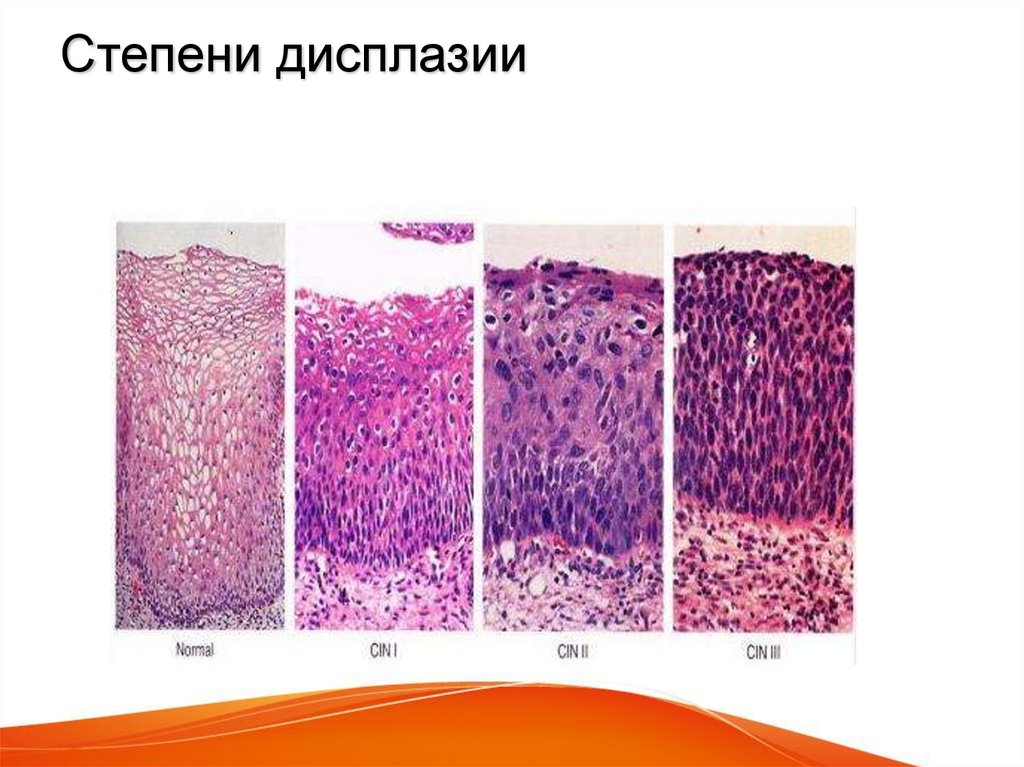
Дисплазия шейки матки (интраэпителиальная неоплазия шейки матки, CIN — Cervical Intraepithelial Neoplasia) — предраковое изменение эпителия шейки матки.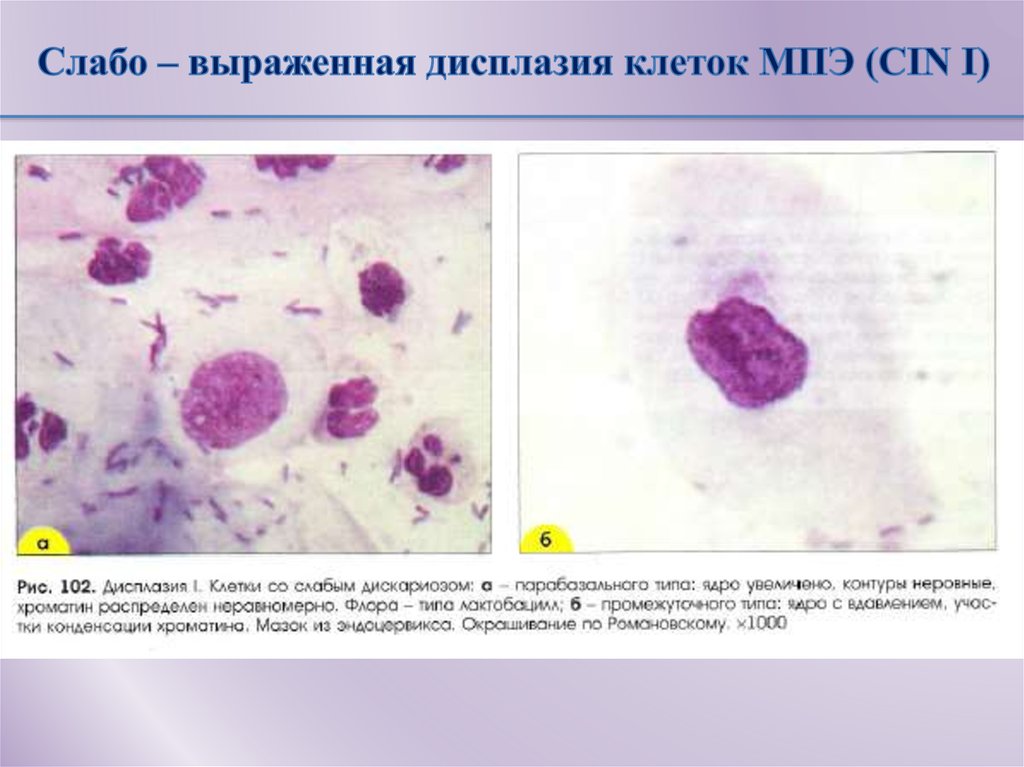
Согласно международной классификации, в соответствии с глубиной поражения многослойного плоского эпителия различают следующие стадии дисплазии:
- легкая дисплазия, CIN 1
- умеренная дисплазия, CIN 2
- тяжелая дисплазия, CIN 3
При дисплазии первой степени (CIN 1) в строении клеток базального слоя происходят незначительные изменения, которые затрагивают не более трети толщины эпителия. Если поражается половина эпителиального слоя, а именно его нижняя и средняя части, то можно диагностировать умеренную дисплазию, CIN 2. Тяжелая дисплазия CIN 3 характеризуется изменениями во всех слоях эпителия, что выражается в появлении патологических митозов и гиперхромных ядер клеток.
Записаться к гинекологу
Причины дисплазии шейки матки
Главной причиной развития цервикальных неоплазий является инфицирование вирусом папилломы человека (ВПЧ), который передается половым путем. Инфекция вызывает патологические изменения в строении клеток, чему также способствуют иммунодефицит, гормональные нарушения хронические воспаления половых органов, травмы шейки матки.
Симптомы дисплазии шейки матки
Дисплазия шейки матки обычно протекает бессимптомно и может быть выявлена при обследовании.
Диагностика дисплазии шейки матки в Клиническом госпитале на Яузе
Специалисты Клинического госпиталя на Яузе диагностируют заболевание путем цитологического исследования, ПЦР-исследования ДНК вируса папилломы и кольпоскопии с прицельной биопсией.
Цитологический анализ мазка шейки матки позволяет определить степень поражения шейки матки в соответствии с классификации Бетесда. В нашей клинике проводится жидкостная цитология, которая обеспечивает получение наиболее точных результатов. Кроме того при взятии мазка мы проводим ПЦР-исследование ДНК. Заметим, что сочетание этих двух методов обладает большой информативностью. При наличии ВПЧ рекомендуется пройти исследование с помощью визуализации шейки матки под большим увеличением – кольпоскопию — для выявления точного места поражения и проведения прицельной биопсии из этого участка.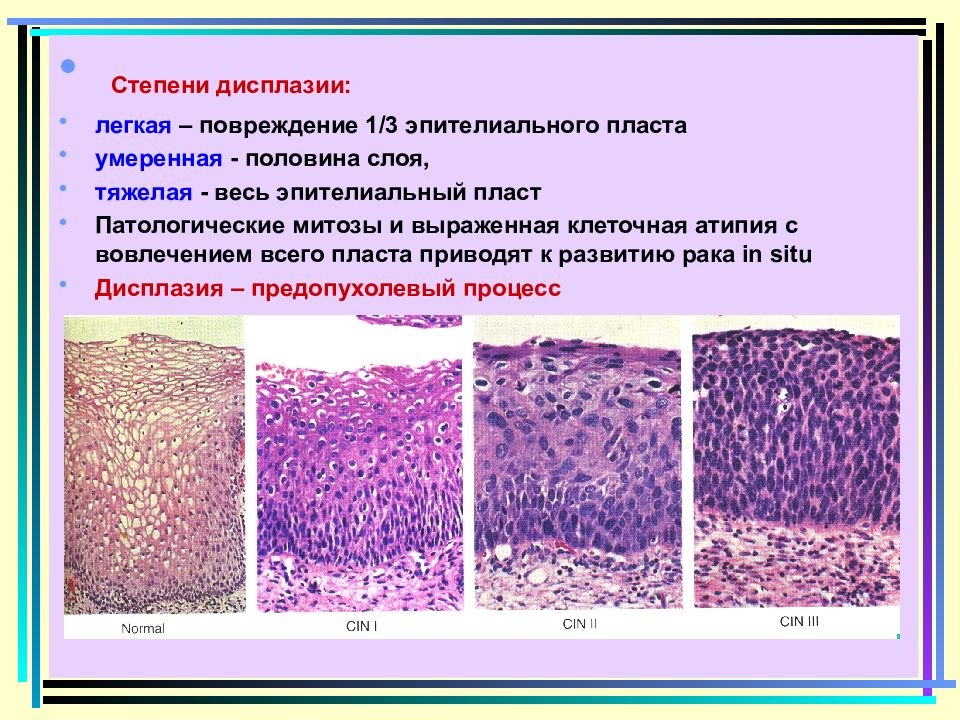
Записаться на прием
Лечение дисплазии шейки матки в Клиническом госпитале на Яузе
По результатам диагностики врач определяет тактику лечения. Специалисты Клинического госпиталя на Яузе, прошедшие многолетнюю специализацию по диагностике и лечению заболеваний шейки матки, проводят лечение в соответствии с международными стандартами.
Следует понимать, что прогрессированию заболевания и развитию злокачественного процесса могут способствовать как неоправданные медицинские вмешательства, так и запоздалая диагностика. Легкая дисплазия не требует вмешательства, она проходит самостоятельно. Если заболевание перешло в умеренную или тяжелую стадию, мы применяем минимально агрессивное хирургическое лечение с помощью лазерной, радиоволновой или электрической коагуляции. В каждом отдельном случае специалист выбирает способ лечения в соответствии индивидуальными показаниями.
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
Северо-Западный центр малоинвазивной гинекологии
ЧТО ТАКОЕ ДИСПЛАЗИЯ ШЕЙКИ МАТКИ, И КАК ЕЕ ЛЕЧИТЬ?
Говоря о заболеваниях шейки матки, хочется внести ясность в некоторые основополагающие термины. Зачастую на приеме пациентку спрашивают: «Были ли у Вас какие-то операции?». После получения отрицательного ответа, задается еще один вопрос: «Шейку матки когда-нибудь лечили?». В 80% случаев женщины отвечают: «Да, давно уже эрозию прижигала».
Что же такое «эрозия» и почему к лечению этого состояния так легкомысленно относятся?
Во-первых, здесь имеет место неточность в самом названии заболевания. Оно максимально упрощается, чтобы женщине проще было его запомнить. Эрозией в большинстве случаев называются следующие состояния: эктопия и эктропион.
Что же такое «эктопия»? Шейку матки покрывают 2 типа эпителиев (клеток), различающихся по виду, функциям и расположению.
Первый тип – многослойный плоский эпителий, он представлен несколькими рядами клеток, различающихся по степени зрелости.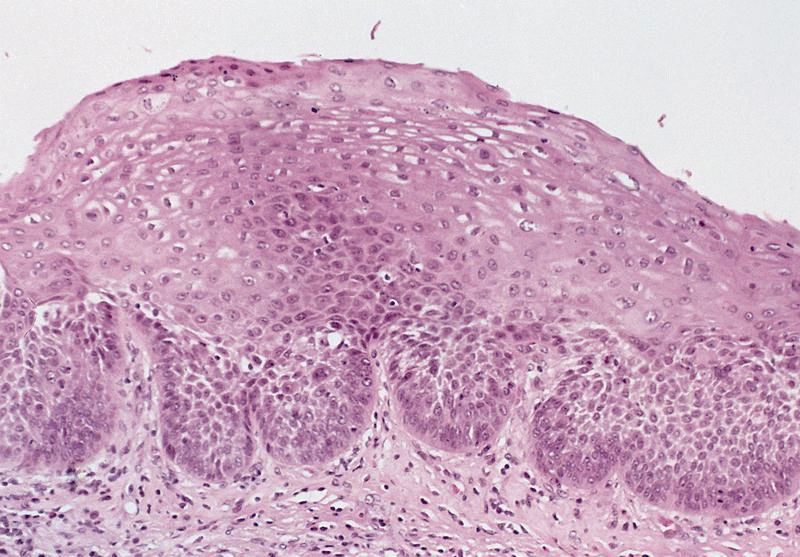 Поверхностные клетки этого эпителия постоянно слущиваются (отпадают), унося с собой прикрепившиеся патогены (вирусы, бактерии). Таким образом, одна из основных задач этих клеток – защита шейки матки от болезнетворных воздействий.
Поверхностные клетки этого эпителия постоянно слущиваются (отпадают), унося с собой прикрепившиеся патогены (вирусы, бактерии). Таким образом, одна из основных задач этих клеток – защита шейки матки от болезнетворных воздействий.
Схема многослойного плоского эпителия
Второй тип – цилиндрический эпителий, покрывающий внутреннюю часть шейки матки – цервикальный канал. Его основная задача – продуцировать слизь, которая в зависимости от дня менструального цикла либо помогает сперматозоидам проникнуть в полость матки, либо, наоборот, препятствует этому процессу. Данная слизь также защищает вышерасположенную полость матки от проникновения болезнетворных бактерий.
Схема однослойного цилиндрического эпителия
Вернемся к нашему вопросу. Что же такое «эктопия»? Это состояния неправильного расположения внутреннего, цилиндрического, эпителия. Он «выходит» на поверхность шейки матки. Считается, что в норме до 25 лет этот эпителий может находиться снаружи, такое состояние называется «физиологической эктопией».
«Эктропион» — это выворот слизистой цервикального канала наружу, с появлением цилиндрического эпителия на поверхности влагалищной части шейки матки. Эктропион также бывает врожденным, но чаще носит посттравматический характер – развивается после родов, абортов.
«Эрозия» шейки матки – это состояние, при котором эпителий, покрывающий влагалищную часть шейки отсутствует, представляя собой раневую поверхность.
Все мы в детстве срывали корочки с ран на коленках, при этом мы видели ямку, лишенную эпителия, красного цвета (за счет поверхностно расположенных сосудов). Состояние этой ранки напоминает состояние шейки матки при эрозии. Если имеет место истинная эрозия, то лечение направлено на ускорение роста клеток — заживления (антибактериальные мази; свечи и мази, способствующие регенерации и др. ).
).
А чем же опасны эктопия и эктропион? Сами по себе они не представляют опасности для здоровья женщины, беспокоя, в основной, обильными выделениями. Однако мы не зря уделили внимание различиям в эпителиях влагалищной части шейки матки и цервикального канала. Цилиндрические клетки цервикального канала представляют собой один слой, в результате чего являются более уязвимыми для инфекционных агентов. Наиболее грозным из них является –
Именно этот вирус признан основной причиной развития рака шейки матки, занимающего на сегодняшний день первое место в России по причинам смертности у молодых женщин. Проникая в клетку ВПЧ начинает размножаться и обеспечивать себя необходимым для жизни «строительным материалом» — белками.
Эти специфические белки нарушают функцию структур клеток, задача которых контролировать «поведение» клетки и предотвращать ее опухолевое перерождение. В результате клетка, в которой поселился вирус, постепенно приобретает черты опухолевой – развивается дисплазия.
В результате клетка, в которой поселился вирус, постепенно приобретает черты опухолевой – развивается дисплазия.
Термин «дисплазия» в переводе с греческого обозначает «неправильное развитие». В зависимости от того, как много клеток поверхностного многослойного и цилиндрического эпителия видоизменились под действием вируса дисплазия бывает 3 степеней тяжести: легкая (CIN I), умеренная (CIN II) и тяжелая (CINIII). Наши зарубежные коллеги для того, чтобы подчеркнуть высокий риск развития онкологического процесса, назвали это состояние не «дисплазией», а «неоплазией» — цервикальной интраэпителиальной неоплазией (Cervical Intraepithelial Neoplasia, CIN). Таким образом, «Дисплазия» = «Неоплазия» = CIN.
Диагностика дисплазии
Диагноз дисплазии шейки матки выставляется после получения заключения мазка на онкоцитологию, взятого с поверхности шейки матки и из цервикального канала.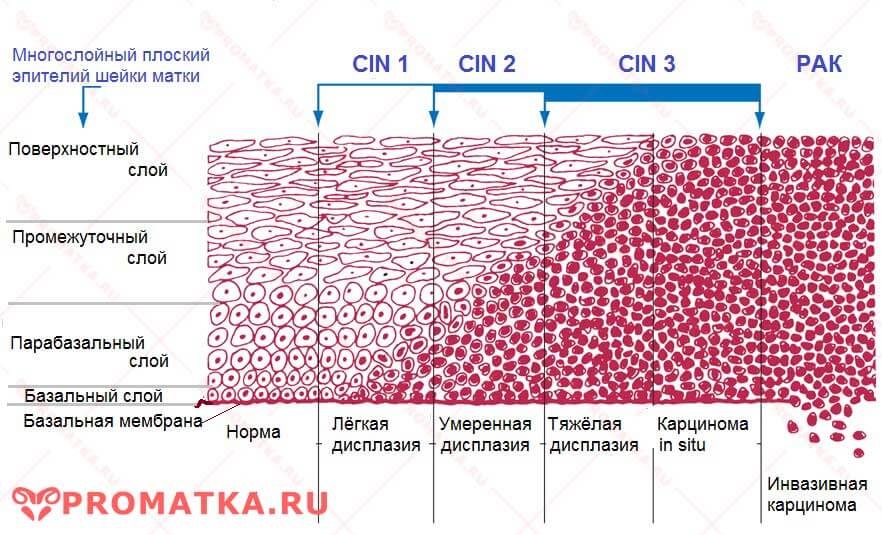 Именно цитология в нашей стране является скрининговым методом выявления дисплазии. В некоторых странах диагностика этого состояния начинается с забора мазка на ВПЧ.
Именно цитология в нашей стране является скрининговым методом выявления дисплазии. В некоторых странах диагностика этого состояния начинается с забора мазка на ВПЧ.
Заподозрить дисплазию шейки матки можно при выполнении расширенной кольпоскопии – рассмотрения влагалищной части шейки матки после обработки растворами (уксусной кислоты и раствора Люголя).
Кольпоскоп Проба с уксусной кислотой Проба с раствором Люголя «Золотым стандартом» (методом, позволяющим наиболее четко определить диагноз) является – биопсия шейки матки под кольпоскопическим контролем с исследованием гистологии (т.е. строения) наиболее измененной зоны шейки матки.
Итак, диагностика дисплазии шейки матки включает в себя:
- Мазок с поверхности шейки матки и цервикального канала (экзо-/эндоцервикс) на онкоцитологию,
- Мазок на ВПЧ,
- Расширенную кольпоскопию,
- Биопсию шейки матки (по показаниям).
Особенности диагностики дисплазии и интерпретации заключений различных исследований являются темой для отдельной беседы, которая также будет опубликована. Именно правильная диагностика позволяет своевременно провести исчерпывающее лечение дисплазии и предотвратить развитие инвазивного рака шейки матки у более, чем 90% пациенток.
Лечение дисплазии шейки матки
Прежде чем говорить о методах лечения дисплазии, хочется указать на еще один важный аспект: особенностью дисплазии шейки матки является – мозаичность процесса. То есть, у одной и той же женщины на шейки матки могут быть изменения, характерные как для легкой дисплазии (CIN I), так и для тяжелой (CIN III). Диагноз выставляется по наиболее тяжелой из найденных степеней.
По данным научной литературы, легкая дисплазия (CIN I) может регрессировать, т.е. проходить самостоятельно у большого количества пациенток. Поэтому зачастую предлагается наблюдать за состоянием шейки матки с регулярной оценкой онкоцитологии и ВПЧ. Однако, если в течение 2 лет наблюдения процесс не произошло элиминации ВПЧ (вирус продолжает определяться/увеличивается его количество), а по результатам онкоцитологии определяется дисплазия – это показание для биопсии и дальнейшего лечения.
Однако, если в течение 2 лет наблюдения процесс не произошло элиминации ВПЧ (вирус продолжает определяться/увеличивается его количество), а по результатам онкоцитологии определяется дисплазия – это показание для биопсии и дальнейшего лечения.
Если легкая дисплазия имеет определенный процент самостоятельного излечения, то этот процент гораздо ниже в случае умеренной дисплазии. При тяжелой степени самостоятельный регресс практически не встречается, более того, CIN II и III склонны к дальнейшему прогрессированию в рак на месте (Са in situ), а также инвазивный рак шейки матки. В связи с этим на сегодняшний день по результатам онкоцитологии выделяют только 2 состояние – легкую степень дисплазии (LSIL) и тяжелую (HSIL).
Обращаем Ваше внимание !!! В категорию HSIL входят состояния, включающие как умеренную и тяжелую степени дисплазии, так и рак на месте (Ca in situ).
Лечение дисплазии должно начинаться с биопсии шейки матки. Данный этап необходим для оценки того вида лечебного воздействия, которое мы можем производить на шейку матки, а также для составления индивидуального плана наблюдения пациентки после лечения.
Данный этап необходим для оценки того вида лечебного воздействия, которое мы можем производить на шейку матки, а также для составления индивидуального плана наблюдения пациентки после лечения.
В случае если имеет место эктопия шейки матки в сочетании с легкой степенью дисплазии (CIN I, LSIL) могут выполняться деструктивные методы лечения. Их цель – разрушить патологические клетки, инициировать возникновение той самой «корочки», под которой шейка матки заживет, покрывшись «правильными» клетками. На сегодняшний день выполняются следующие деструктивные виды лечения:
- Лазерная вапоризация шейки матки
- Радиоволновая аблация шейки матки
- Криодеструкция (редко).
Если выявлена тяжелая дисплазия шейки матки (CIN II-III, HSIL), лечение НЕ может быть деструктивным! В противном случае, мы получим зажившую и визуально ничем не смущающую шейку матки, под новым эпителием которой может прогрессировать дисплазия и развиваться инвазия.
В случае тяжелой дисплазии необходимо выполнение эксцизионных методов, то есть методов, направленных на всех патологических тканей или наиболее измененных тканей. Принцип этого подхода формулируется как «see and treat» — «смотри и лечи». При удалении тканей мы получаем информации о степени тяжести процесса (диагностика) и одновременно удаляем патологические клетки, содержащие ВПЧ. Зачастую при не очень распространенных процессах радиоволновой петлевой биопсии может быть достаточно как для диагностики, так и для лечения. Именно поэтому в нашем центре мы отдаем предпочтение этому виду биопсии. Среди эксцизионных методов лечения шейки матки выделяют:
- Ножевую конизацию
- Радиоволновую конизацию
- Радиоволновую петлевую эксцизию
- Радиоволновую кони-биопсию шейки матки.
Состояние шейки матки после радиоволновой кони-биопсии
Состояние шейки матки после радиоволновой петлевой эксцизии
Фотодинамическая терапия шейки матки (ФДТ)
На сегодняшний день набирает популярность фотодинамическая терапия (ФДТ) в лечении дисплазии шейки матки. Суть метода заключается в введении внутривенно раствора фотосенсибилизатора (вещества, обладающего повышенной флуоресценцией), через 2,5-3 часа после которого производится воздействие лазером определенной волны на шейку матки (бесконтактно). В течение 2,5-3 часов после внутривенного введения происходит накопление фотосенсебилизатора (ФС) в измененных клетках шейки матки, а также окружающих их сосудах. При воздействии лазером происходит фотохимическая реакция между ним и введенным ФС, в результате происходят:
Суть метода заключается в введении внутривенно раствора фотосенсибилизатора (вещества, обладающего повышенной флуоресценцией), через 2,5-3 часа после которого производится воздействие лазером определенной волны на шейку матки (бесконтактно). В течение 2,5-3 часов после внутривенного введения происходит накопление фотосенсебилизатора (ФС) в измененных клетках шейки матки, а также окружающих их сосудах. При воздействии лазером происходит фотохимическая реакция между ним и введенным ФС, в результате происходят:- выделение активных форм кислорода, убивающих накопивший ФС клетки и рядом расположенные клетки,
- сужение и тромбоз сосудов, накопивших ФС, в результате чего клетки погибают от недостатка кровоснабжения.
Результатом ФДТ шейки матки является некроз (смерть) части клеток, накопивших ФС, а также находящихся рядом с ними. На следующий день после ФДТ на шейке матки образуется корочка, аналогичная образующей при деструктивных методах, однако глубина воздействия в данном случае оказывается большей, нежели при воздействии лазером или радиоволной. Под этой корочкой шейка матки заживает и покрывается «правильным» эпителием.
Под этой корочкой шейка матки заживает и покрывается «правильным» эпителием.
Противопоказаниями к ФДТ являются:
- аллергические реакции на морепродукты
- наличие общих острых заболеваний
- наличие острых/обострения хронических заболеваний печени, почек
- беременность/период лактации.
Особенности проведения процедуры:
Фотосенсибилизатор может накапливаться не только в шейке матки, но и в других органах и тканях. И вступать в реакцию с лучами солнечного света. Наиболее уязвимыми в этом случае являются сетчатка глаз и кожа – могут развиваться реакции фоточувствительности, ожоги. В связи с этим пациентки после начала введения фотосенсибилизатора и на протяжении последующих суток должны носить солнцезащитные очки, а также избегать повышенной инсоляции, носить одежду минимизирующие воздействие солнечных лучей на открытые участки кожи.
!!! Обращаем Ваше внимание: ФДТ при диспластических заболеваниях шейки матки должна выполняться только после корректной биопсии и получения гистологического заключения о степени тяжести процесса !!!
При получении данных за инвазивный процесс пациентка направляется на консультацию к онкологу!
В отделении восстановления репродуктивного здоровья (гинекологическое отделение №2) Клиники высоких медицинских технологий СПбГУ фотодинамическая терапия (ФДТ) при вирусассоциированной (ВПЧ) тяжелой дисплазии и Ca in situ выполняется бесплатно, в рамках квот.
Необходимо понимать, что ни один из методов не гарантирует 100% эффективность, особенно, если ВПЧ продолжает определяться после лечения. В этом случае возможен рецидив заболевания. Так же, описаны отдаленные рецидивы – через много лет после периода «полного благополучия».
Таким образом, независимо от вида лечения дисплазии шейки матки в течение первых 3 лет необходимо наблюдение с оценкой онкоцитологии и ВПЧ не менее 2 раз в год. Дальнейшее диспансерное наблюдение проводится ежегодно на протяжении не менее 20 лет.
Дальнейшее диспансерное наблюдение проводится ежегодно на протяжении не менее 20 лет.
Автор статьи: Шаповалова Екатерина Андреевна, врач акушер-гинеколог отделения восстановления репродуктивного здоровья.
Получить консультацию и определить индивидуальную тактику лечения заболевания шейки матки можно, записавшись на консультацию к гинекологам нашего отделения по следующим контактам:
Электронная почта: [email protected]Телефон: +7 (812) 676-25-67
Дисплазия шейки матки. Онкология
Врачи не считают эту патологию раком, но относят к предраковым состояниям. Это означает, что без правильного лечения возможна трансформация изменившихся клеток в злокачественную опухоль. В редких случаях дисплазия исчезает без лечения. Заболевание диагностируют в любом возрасте.
Причины дисплазии шейки матки
Основной причиной считают инфицирование вирусом папилломы человека, ВПЧ. Вирус имеет множество подтипов – около 200, часть из них обладает канцерогенными свойствами. 16 и 18 подтипы вызывают 70% предраковых и раковых заболеваний шейки матки, другие штаммы – генитальные бородавки или кондиломы. Заражение ВПЧ происходит только половым путем. Риск инфицирования повышен в следующих случаях:
16 и 18 подтипы вызывают 70% предраковых и раковых заболеваний шейки матки, другие штаммы – генитальные бородавки или кондиломы. Заражение ВПЧ происходит только половым путем. Риск инфицирования повышен в следующих случаях:
- начало половой жизни до 18 лет
- роды до 16 лет
- большое количество сексуальных партнеров
- заболевания, связанные со снижением иммунитета (ВИЧ, сахарный диабет)
- использование лекарств, подавляющих иммунитет
- отказ от презервативов. Этот способ предохранения не может полностью защитить от заражения вирусами, тем не менее, снижает риск инфицирования.
- курение.
Методы диагностики дисплазии шейки матки
Самым простым и информативным тестом считают Пап-мазок. Анализ имеет и другие названия: Пап-тест, мазок на цитологию, мазок на атипичные клетки, мазок Папаниколау. Врач-гинеколог берет мазок с поверхности шейки матки во время осмотра, это безболезненная процедура. Затем врач-лаборант исследует под микроскопом форму, размер, количество, расположение, состав клеток. Исследование нужно проводить ежегодно, начиная с 18 лет.
Исследование нужно проводить ежегодно, начиная с 18 лет.
Т.к. некоторые штаммы ВПЧ считают канцерогенными, проводят исследование мазка из влагалища на обнаружение ДНК этих возбудителей. Исследование выполняют методом полимеразной цепной реакции (ПЦР), делают качественный анализ с типированием. Исследование на онкогенные вирусы обязательно у женщин старше 30 лет и в том случае, если есть невыраженные изменения в Пап-тесте. Определение уровня антител к вирусам в крови не информативно.
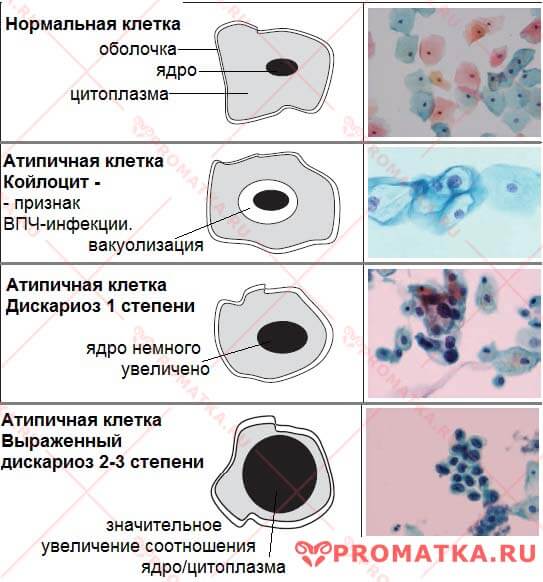
При обнаружении атипичных клеток в Пап-тесте проводят биопсию. Для этого во влагалище вводят оптическую систему – кольпоскоп. Она помогает врачу увидеть наиболее измененные участки и взять фрагмент ткани. По результатам исследования биоптата дисплазия – ее еще называют цервикальной интраэпителиальной неоплазией (CIN) – может быть сгруппирована по категориям.
Виды дисплазии шейки матки
Виды заболевания определяют при цитологическом исследовании. Пап-тест выявляет плоскоклеточное (сквамозное) интраэпителиальное поражение.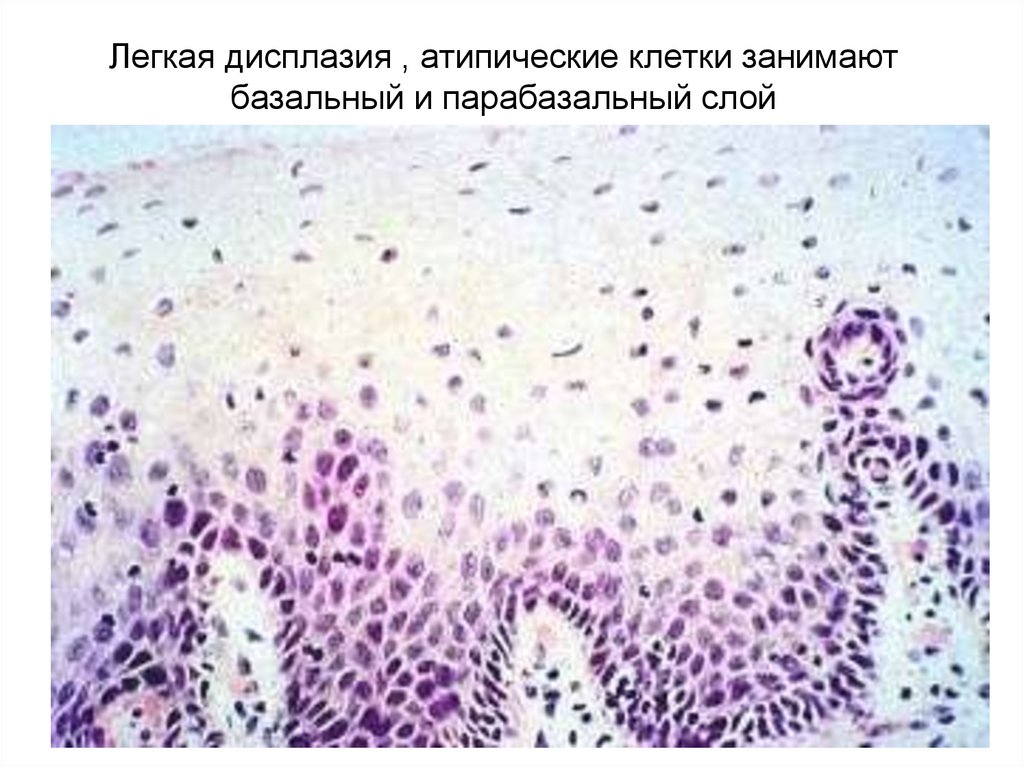 Результаты теста могут быть описаны несколькими способами:
Результаты теста могут быть описаны несколькими способами:
- изменения низкой степени
- изменения высокой степени
- возможно, злокачественные клетки
- наличие атипичных железистых клеток
- наличие атипичных клеток плоского эпителия.
Степени дисплазии
Во время исследования биоптата дисплазия может быть сгруппирована по категориям:
- 1 степень дисплазии (CIN I)
- 2 степень дисплазии (CIN II)
- 3 степень дисплазии (CIN III)
Некоторые специалисты выделяют 4 степень, которая представляет собой атипию.
Дисплазия шейки матки 1 степени (слабая)
Легкая дисплазия. Изменения только нижнего слоя эпителия затрагивают не более ⅓ его толщины.
Дисплазия шейки матки 2 степени (умеренная)
Изменения выражены умеренно. Поражения занимают до ⅔ всего эпителиального слоя.
Дисплазия шейки матки 3 степени (тяжелая)
Значительно выраженные изменения вплоть до появления начальных признаков карциномы. Поражен эпителий во всех слоях, но выхода за пределы базальной мембраны нет.
Поражен эпителий во всех слоях, но выхода за пределы базальной мембраны нет.
Симптомы дисплазии шейки матки
В подавляющем большинстве случаев никаких симптомов заболевания нет. Именно поэтому врачи настаивают на регулярном гинекологическом осмотре.
Лечение дисплазии шейки матки
Зависит от степени дисплазии, возраста женщины, репродуктивных планов. Без лечения возможна трансформация дисплазии в рак.
Лечение дисплазии шейки матки 1 степени
При этой патологии врач обычно занимает выжидательную позицию, так как возможно самоизлечение. Если есть хламидиоз, трихомониаз или гонорея, лечат от них. Через 3-6 месяцев мазок повторяют. В случае, если изменения не исчезли, или есть ухудшение по данным микроскопии, начинают терапию.
Лечение дисплазии шейки матки 2 и 3 степени
В этом случае заболевание обычно не проходит само. Лечение проводят различными хирургическими методами.
Хирургическое лечение дисплазии шейки матки
Возможны следующие способы:
- криохирургия (замораживание)
- лазеротерапия
- петлевая электроэксцизия шейки матки
- операция конизации, т.
 е.удаление измененных тканей с помощью скальпеля
е.удаление измененных тканей с помощью скальпеля - гистерэктомия, т.е. удаление матки с шейкой (проводится редко).
Дисплазия шейки матки и беременность
В настоящее время врачи делают все возможное, чтобы женщина с патологией шейки матки могла родить здорового ребенка. При выявлении дисплазии 2-3 степени пораженную ткань удаляют, и пациентка наблюдается у онкогинеколога. Беременность возможна не ранее, чем через 6 месяцев после операции.
В очень серьезных случаях, например, когда планируют гистерэктомию, рекомендуют консультацию по поводу суррогатного материнства.
Наблюдение и профилактика дисплазии шейки матки
В настоящее время проводят вакцинацию с целью защиты от инфицирования самыми опасными штаммами ВПЧ. Используют вакцины “Гардасил” (четырехвалентная, содержит белки ВПЧ типов 6,11,16,18), “Церварикс” (двухвалентная, типы 16, 18). Презерватив не считают надежной защитой от вируса папилломы человека, так как вирусы могут находиться на незащищенных латексом участках наружных половых органов. Поэтому прививка показана не только женщинам, которые могут заболеть, но и мужчинам-переносчикам вируса. Наибольший эффект у женщин и мужчин вакцинация дает в возрасте от 9 до 26 лет. По данным некоторых клинических исследований вакцина у женщин работает, если вводить ее до 45 лет. Инфицирование от прививки невозможно, потому что она содержит не живые вирусы, а только их белки. Также нет данных о серьезных побочных эффектах, т.е. мифы о бесплодии после введения вакцин против ВПЧ не подтверждены фактами. Нужно знать, что полностью защитить от дисплазии прививки не могут.
Поэтому прививка показана не только женщинам, которые могут заболеть, но и мужчинам-переносчикам вируса. Наибольший эффект у женщин и мужчин вакцинация дает в возрасте от 9 до 26 лет. По данным некоторых клинических исследований вакцина у женщин работает, если вводить ее до 45 лет. Инфицирование от прививки невозможно, потому что она содержит не живые вирусы, а только их белки. Также нет данных о серьезных побочных эффектах, т.е. мифы о бесплодии после введения вакцин против ВПЧ не подтверждены фактами. Нужно знать, что полностью защитить от дисплазии прививки не могут.
Профилактика дисплазии включает еще несколько простых рекомендаций:
- не курить
- начинать половую жизнь в возрасте 18 лет или старше
- практиковать безопасные сексуальные контакты с использованием презерватива
- поддерживать моногамные отношения.
Если Пап-тест выявил изменения, то его повторяют через 6-12 месяцев. При отрицательных результатах Пап-теста и теста на ВПЧ – через три года.
Дисплазия шейки матки 1 степени
Термин «дисплазия» объединяет целую группу патологических процессов, которые протекают в эпителиальном слое шейки матки. Клетки слизистой при этом состоянии теряют способность к созреванию и дифференцировке (специализации) и приобретают признаки атипии. При дисплазии шейки матки 1 степени лечение может привести к регрессу этой патологии. На последующих стадиях заболевание переходит в группу предраковых состояний.
Особенности и симптомы патологии
Дисплазия 1 (легкой) степени характеризуется малым количеством атипичных клеток, которые занимают лишь треть эпителиального пласта, и может пройти само по себе, даже если ее не лечить. Базальный (нижний) слой эпителия на начальной стадии патологии не изменен, но анализы чаще всего показывают наличие в крови папилломавируса, который может проявлять онкогенную активность.
Как правило, пациентки не предъявляют жалоб, которые бы указали на возможную дисплазию шейки матки в первой стадии развития. Но женщина может обратиться к врачу с симптомами сопутствующего этому состоянию воспалительного процесса, такими как:
Но женщина может обратиться к врачу с симптомами сопутствующего этому состоянию воспалительного процесса, такими как:
- выделения из влагалища патологического характера;
- жжение, зуд в области половых органов;
- кровотечения после сексуального контакта.
Иногда пациентку приводят к гинекологу боли, которые она испытывает во время месячных, и попутно с другими проблемами может выявиться легкая дисплазия шейки матки (1 степени).
Диагностика заболевания
Во время гинекологического осмотра обнаружить это заболевание на ранней стадии невозможно, так как внешних признаков оно не имеет. Но врач может отметить настораживающие изменения цвета и структуры слизистой оболочки шейки.
Чаще всего эта патология обнаруживается при комплексном гинекологическом обследовании, после получения данных лабораторной и инструментальной диагностики. К таким исследованиям относятся:
- расширенная кольпоскопия.
 Изображение шейки увеличивается в 10-15 раз, для оценки состояния эпителия проводятся специальные пробы;
Изображение шейки увеличивается в 10-15 раз, для оценки состояния эпителия проводятся специальные пробы; - ПАП-тест. Производится забор материала для обнаружения клеточной атипии;
- ПЦР-анализ. Выявляется наличие инфекции, в частности вируса папилломы человека (ВПЧ).
Проведение этих исследований дает возможность обнаружить дисплазию и сопутствующие ей инфекции на самой ранней стадии.
Лечение дисплазии шейки матки 1 степени
При обнаружении у молодой здоровой женщины дисплазии 1 степени лечение, как правило, не требуется, так как в этом случае патология может иметь хороший прогноз. Но пациентке рекомендуется каждые три-шесть месяцев проходить гинекологические осмотры, кольпоскопию и цитологическое исследование.
При выявлении ВПЧ назначается противовирусная и иммуномодулирующая терапия. Если обнаруживаются фоновые заболевания, от них также необходимо пролечиться. При переходе дисплазии во вторую стадию патологический очаг прижигают.
Преимущества лечения в клинике Елены Малышевой
В нашем медицинском центре созданы все условия для точной диагностики и лечения заболеваний шейки матки, включая дисплазию. Основные преимущества клиники:
- высокий профессионализм докторов;
- применение самых современных методов распознавания и лечения дисплазии;
- теплое отношение к пациентам.
Записывайтесь на прием к гинекологу клиники на сайте или по телефону (3412) 52-50-50. При заказе обратного звонка мы как можно быстрее свяжемся с вами сами.
Забота о себе сейчас – залог вашего здоровья в будущем!
⚕️Дисплазия шейки матки:симптомы, лечение и профилактика — Клиника ISIDA Киев, Украина
Вильга Ирина Николаевна
Акушер-гинеколог
04 февраля 2015
Дисплазия обычно не влияет ни на беременность и роды, ни на качество интимной жизни. Однако при обнаружении этого заболевания шейки матки врач бьет тревогу и предлагает пациентке срочно пройти курс лечения. Почему? К сожалению, это состояние опасно перерождением клеток в злокачественные — развитием рака.
Однако при обнаружении этого заболевания шейки матки врач бьет тревогу и предлагает пациентке срочно пройти курс лечения. Почему? К сожалению, это состояние опасно перерождением клеток в злокачественные — развитием рака.
Что такое дисплазия шейки матки?
В основе этого состояния лежат изменения в особых базальных клетках эпителия (слоя, выстилающего поверхность шейки матки). Это приводит к последующим нарушениям их созревания и строения. Различают три степени дисплазии: легкую, среднюю и тяжелую. В первом случае поражаются начальные слои эпителия. При средней степени затрагиваются более глубокие слои. И тяжелая степень может уже сопровождаться атипией клеток — началом перерождения. Здесь уже необходима консультация гинеколога-онколога.
Важно! «Легкая» степень – вовсе не означает, что на нее можно махнуть рукой, ведь если вовремя не начать лечение, есть риск развития рака шейки матки.
У кого чаще встречается?
Раньше считалось: заболеваний шейки матки – удел более зрелых женщин. Увы, теперь дисплазии значительно «помолодели»: и встречаются даже у 20-летних.
Увы, теперь дисплазии значительно «помолодели»: и встречаются даже у 20-летних.
Каковы причины возникновения дисплазии шейки матки?
Это и раннее начало половой жизни, и «сексуальное разнообразие» — смена половых партнеров, и инфекции, передающиеся половым путем. К такому разладу также приводит нездоровый образ жизни: курение, применение гормональных оральных контрацептивов (КОКов) и, к сожалению, гормональные сбои. Но важнейшую роль в развитии и дисплазии, и рака шейки матки играет ВПЧ (вирус паппиломы человека).
Какие признаки?
Чаще всего дисплазия никак не дает о себе знать. Но если есть инфекционные заболевания, возможны слизистые выделения со специфическим цветом, запахом — и даже кровяные. Однако поскольку в большинстве случаев эта болезнь протекает бессимптомно, единственный способ ее своевременно обнаружить – регулярный осмотр у гинеколога — 1 раз в год.
Как обнаружить?
Наряду с осмотром врача и сдачей анализов на цитологию клиника ISIDA предлагает и кольпоскопию — прогрессивный метод диагностики состояний шейки матки, влагалища и наружных половых органов. Он позволяет с высочайшей точностью определить даже небольшие пораженные участки. Колькоспоп состоит из бинокулярной оптической системы с осветлителем, что дает возможность увеличения в 10-30 раз! Плюс цветные фильтры для более точной оценки состояния эпителия, и фотоаппарат. Это очень точный прибор.
Он позволяет с высочайшей точностью определить даже небольшие пораженные участки. Колькоспоп состоит из бинокулярной оптической системы с осветлителем, что дает возможность увеличения в 10-30 раз! Плюс цветные фильтры для более точной оценки состояния эпителия, и фотоаппарат. Это очень точный прибор.
Можно ли беременеть при дисплазии?
При беременности такие состояния могут прогрессировать. Поэтому не стоит следовать «мудрым» советам подруг, мол: «Родишь – и все пройдет». Необходимо сначала пройти лечение, а затем планировать материнство.
Методы лечения?
Курс подбирается индивидуально. Прежде всего, это медикаментозное лечение, терапия сопутствующих заболеваний – инфекций, нормализация гормонального статуса.
Если очаг дисплазии не уходит, рекомендуется операция. Это может быть криодеструкция – метод локального воздействия низких температур на пораженные участки. Либо лазерная вапаризация – испарение патологического очага при помощи лазера. Но золотой европейский стандарт – это эксцизия (она же биопсия или вулканизация), то есть удаление пораженной зоны электроножом либо электропетлей. Именно этот метод применяется в клинике ISIDA.
Именно этот метод применяется в клинике ISIDA.
Зона здоровья
Период реабилитации у каждой женщины, конечно, свой. Но чаще всего разрешается беременеть уже через 2-3 месяца после операции. Естественно, врач проводит контроль состояния шейки матки, чтобы убедиться: все в порядке.
Что делать с дисплазией шейки матки?
Дисплазия шейки матки – явление распространенное. Но еще чаще встречается эктопия цилиндрического эпителия (она же – «эрозия»). Это перемещение слизистой оболочки цервикального канала на влагалищную часть шейки матки. Но сам эпителий абсолютно нормальный: сохраняется его строение, созревание, дифференцировка, гибель. Доказано, что «эрозия» никогда не перерождается. Прижигать ее нельзя — это осложняет диагностику возможных нехороших изменений на шейке матки в дальнейшем. Поэтому, если обнаружена эктопия и у женщины нет жалоб и инфекций, тактика следующая: регулярное наблюдение у врача.
Мера профилактики заболевания
Рак шейки матки занимает второе место после онкозаболевания молочных желез. Профилактика его развития – вакцинация против высокоонкогенных типов ВПЧ 16 и 18. Это вакцины церварикс и гардосил. Во многих странах такой метод включен в государственную программу. В Украине эта мера носит рекомендательный характер. В клинике ISIDA советуют проводить ее девочкам, а также женщинам, у которых была обнаружена дисплазия (конечно, после лечения).
Профилактика его развития – вакцинация против высокоонкогенных типов ВПЧ 16 и 18. Это вакцины церварикс и гардосил. Во многих странах такой метод включен в государственную программу. В Украине эта мера носит рекомендательный характер. В клинике ISIDA советуют проводить ее девочкам, а также женщинам, у которых была обнаружена дисплазия (конечно, после лечения).
Программа «Здоровье шейки матки» — это полный спектр инструментальных и лабораторных исследований, необходимых для оценки состояния шейки матки.
Дисплазия шейки матки — лечение всех стадий, диагностика, профилактика. — Клиника «Доктор рядом»
Если у вас совпадает больше 80% перечисленных симптомов, то настоятельно рекомендуем вам обратиться к врачу за консультацией.
Дисплазия шейки матки – довольно распространенное заболевание в гинекологии, во время которого клетки слизистой оболочки маточной шейки меняют свою структуру, утолщаются, разрастаются, происходит созревание и отторжение эпителия. Появление нетипичных клеток происходит в поверхностных и глубоких эпителиальных слоях шейки матки, в отличие от эрозии шейки матки. Данный патологический процесс относится к предраковым состояниям, развитие дисплазии при отсутствии должного лечения с большой долей вероятности приведет к раку. Но если диагностировать и осуществить лечение дисплазии шейки матки на ранней стадии, онкологического риска можно избежать.
Появление нетипичных клеток происходит в поверхностных и глубоких эпителиальных слоях шейки матки, в отличие от эрозии шейки матки. Данный патологический процесс относится к предраковым состояниям, развитие дисплазии при отсутствии должного лечения с большой долей вероятности приведет к раку. Но если диагностировать и осуществить лечение дисплазии шейки матки на ранней стадии, онкологического риска можно избежать.
Причины возникновения дисплазии шейки матки
Данным заболеванием чаще всего страдают женщины, находящиеся в детородном возрасте – от 25 до 35 лет. К основным факторам, провоцирующим развитие заболевания, относятся:
-
вирус папилломы человека – онкогенные типы ВПЧ-16 и ВПЧ-18 в 95-98% случаев провоцируют развитие патологического процесса. Вследствие активности вируса осуществляется пролиферация клеток базального и парабазального слоев, клетки, затронутые вирусом, разрастаются и оказываются в верхних слоях эпителия, где происходит размножение вирусных клеток.

-
иммунодефицитные состояния, возникающие вследствие влияния на иммунную реактивность различных хронических заболеваний, медикаментозных средств, стрессовых ситуаций, несбалансированного питания;
-
активное и пассивное курение – риск появления дисплазии шейки матки возрастает в четыре раза;
-
вагиниты, вагинозы, кольпиты, эктопия и эрозия маточной шейки, лейкоплакия вульвы;
-
раннее начало половой жизни и роды – в возрасте до 16 лет;
-
беспорядочная половая жизнь, отказ от использования средств контрацепции, особенно презервативов;
-
большое количество абортов;
-
нарушение гормонального фона вследствие возникновения беременности, менопаузы, применения оральных контрацептивов и гормональных медикаментозных средств;
-
возникновение травматических повреждений шейки матки в процессе родовой деятельности и иных случаях;
-
дефицит ряда витаминов – А, С, β-каротина.
Симптомы
Как правило, дисплазия шейки матки не проявляется самостоятельными клиническими признаками. Примерно у 10% пациенток наблюдается скрытое течение болезни. Но при тяжелых стадиях заболевания возможно возникновение периодических болевых ощущений внизу живота. Чаще всего происходит присоединение микробных. В этом случае проявляется симптоматика кольпита либо цервицита – появление зуда, жжения, выделений из половых органов нехарактерного цвета, запаха, консистенции. После интимной близости, применения тампонов выделения могут быть кровянистыми. Обычно, дисплазия шейки матки сопутствует таким болезням, как хламидиоз, гонорея, образование остроконечных кондилом во влагалище, на вульве, коже ануса.
Развитие болезни может протекать длительное время и регрессировать самостоятельно после того, как было осуществлено лечение воспалительных заболеваний. Но в большинстве случаев происходит активное развитие дисплазии.
Способы диагностирования
При отсутствии ярко выраженных клинических признаков диагностика дисплазии шейки матки осуществляется с применением лабораторных, клинических и инструментальных методик, к которым относятся:
-
проведение осмотра шейки матки посредством влагалищных зеркал. Таким образом возможно заметить клинические проявления дисплазии – изменение цвета слизистой, наличие блеска в области наружного зева, пятен, разрастания эпителия шейки;
-
проведение простой и расширенной кольпоскопии – осмотра маточной шейки с помощью кольпоскопа. Данное оптическое устройство способно увеличивать изображение более чем в десять раз. В то же время проводятся диагностические пробы – шейка матки покрывается раствором уксусной кислоты и Люголя;
-
проведение гистологического исследования образцов ткани. При обнаружении в процессе кольпоскопии участков эпителия, которые вызывают опасения и свидетельствуют о развитии дисплазии шейки матки, осуществляется биопсия, и полученный биоптат направляется на гистологическое исследование, которое является наиболее информативной диагностической методикой и дает
-
осуществление цитологического исследования мазка Папаниколау (ПАП-тест) – под микроскопом исследуется количество, размер, форма, расположение атипичных клеток, которые были получены при взятии мазка с различных участков поверхности шейки. Также ПАП-тест позволяет заметить клетки, свидетельствующие о наличии вируса папилломы человека, которые имеют сморщенные ядра и ободок;
-
применение иммунологических методов ПЦР, которые позволяют выявить наличие вируса папилломы человека, определить вирусную нагрузку и штаммы. От того, присутствуют ли онкогенные типы ВПЧ, зависят методы, направленные на лечение дисплазии шейки матки.
Виды и степени дисплазии шейки матки
Вид определяется, исходя из результатов гистологического исследования. ПАП-мазок способствует выявлению плоскоклеточного интраэпителиального поражения. Различается несколько стадий патологического процесса:
-
низкая степень изменений;
-
высокая степень изменений;
-
вероятность наличия онкологического процесса;
-
присутствие атипичных железистых клеток;
-
присутствие атипичных клеток плоского эпителия.
При проведении гистологического исследования согласно классификации ВОЗ выявляется три степени дисплазии шейки матки, разделяющиеся по тяжести поражения:
-
1 степень CIN1 (легкая), характеризующаяся нормальным расположением поверхностного и промежуточного слоев плоского эпителия, изменения проникают на глубину до одной трети эпителия, в анализах выявляются дискератоз и койлоцитоз;
-
2 степень CIN2 (умеренная), при которой поражение затрагивает от одной трети до двух третей толщины слоев плоского эпителия, выявляются прогрессирующие морфологические клеточные изменения;
-
3 степень CIN3 (тяжелая), при крайней степени поражения именуемая неинвазивным раком – максимально глубокое распространение патологического процесса, поражение затрагивает от двух третей слизистой оболочки шейки матки, выявляются значительные структурные изменения, патологический клеточный митоз, гиперхромные ядра большого размера в клетках, измененные клетки обнаруживаются только в слизистой оболочке, распространение на близлежащие ткани, мышцы и сосуды не прослеживается.
Лечение дисплазии шейки матки
При выборе методов лечения в обязательном порядке должен учитываться ряд факторов – возраст пациентки, степень развития дисплазии, размеры участка с патологическими изменениями, наличие сопутствующих заболеваний, желание женщины выносить и родить ребенка в будущем.
Лечение дисплазии 1 и 2 степени курирует врач-гинеколог. Лечением тяжелой формы занимается гинеколог-онколог с применением оперативных методов терапии. Если пациентка находится в возрасте менее двадцати лет, в организме отсутствует вирус папилломы человека, дисплазия не распространяется на цервикальный канал, эпителий шейки матки поражен по точечному типу, возможна выжидательная тактика. В этом случае лечение дисплазии шейки матки 1 степени не осуществляется, врач наблюдает за состоянием пациентки и степенью прогрессирования заболевания.
На сегодняшний день для лечения дисплазии применяются медикаментозный и хирургический методы терапии.
Медикаментозное лечение дисплазии шейки матки
Лечение умеренной стадии может осуществляться с помощью лекарств. Обычно применяются иммуномодуляторы, интерфероны и индукторы интерферонов, антибиотические средства – такие как Азитромицин в таблетках, Доксициклин в капсулах, противовоспалительные препараты, свечи, способствующие восстановлению эпителиальной структуры шейки матки и влагалищной микрофлоры, различные комплексные витамины.
Хирургическое лечение дисплазии шейки матки
Решение об оперативном вмешательстве применяется после того, как два раза был получен положительный результат анализа на дисплазию. Перед началом хирургического лечения проводится противовоспалительная терапия для осуществления санации очага поражения. После ее окончания возможно уменьшение либо полное исчезновение измененного участка. Обычно операция назначается на первую фазу менструального цикла – с шестого по десятый дни, если в матке и влагалище не обнаруживается наличие воспалительного процесса и отсутствует беременность. Для хирургического лечения дисплазии шейки матки применяются:
-
лазерная хирургия (вапоризация, прижигание, конизация посредством лазерного луча) – в процессе оперативного вмешательства осуществляется воздействие лазерного луча низкой интенсивности на очаги дисплазии, в результате чего происходит их нагревание и разрушение с последующим образованием некроза;
-
криохирургия (холодовая деструкция, криодеструкция, криоконизация) – очаг ликвидируется посредством локального замораживания пораженных тканей с помощью жидкого азота, закиси азота, двуокиси углерода;
-
петлевая эксцизия шейки матки – процесс иссечения измененной ткани шейки матки нагретой тонкой петлей из нержавеющей стали либо вольфрама разнообразной формы (квадратной, полукруглой, треугольной – конизация или конусовидная эксцизия). Данный метод применяется с использованием электрохирургических устройств, которые генерируют постоянное низкое напряжение, передающееся на проволочную петлю, предназначенную для иссечения измененной ткани;
-
радиоволновая хирургия – быстрый и безболезненный способ оперативного вмешательства, при котором происходит стимуляция внутренней энергии атипичных клеток посредством радиоволн, в результате чего они разрушаются;
-
удаление шейки – данная методика применяется, если нет возможности осуществления прочих способов лечения либо они оказались неэффективны.
Профилактика дисплазии шейки матки
Через три-четыре месяца после проведенного лечения осуществляется первый контроль – у пациентки берут ПАП-мазок, впоследствии эта процедура будет повторяться ежеквартально в течение года. В целях профилактики дисплазии шейки матки и возникновения рецидивов заболевания рекомендуется:
-
использовать барьерные методы контрацепции, особенно при отсутствии постоянного полового партнера;
-
свести к минимуму или полностью отказаться от курения;
-
своевременно проводить санацию всех инфекционных очагов;
-
уделять внимание питанию – оно должно быть сбалансированным, с наличием необходимых витаминов и микроэлементов, особенно желательно присутствие в рационе селена и витаминов групп А и В;
-
регулярное (не реже одного-двух раз в год) прохождение профилактических осмотров у гинеколога с взятием и цитологическим исследованием соскобов/мазков с шейки матки.
Эпителиальная дисплазия полости рта
Iran J Med Sci. 2014 сен; 39 (5): 406–417.
, DDS, MS, 1 , DDS, MS, 2 , DDS, MS, 2 и, DDS 3Samaneh Shirani
1 Кафедра патологии полости рта и челюстно-лицевой патологии, Исламский университет Азад Хорасгун, Исфахан, Иран;
Неда Каргахи
2 Кафедра патологии полости рта и челюстно-лицевой патологии, Исфаханский университет медицинских наук, Исфахан, Иран;
Сайед Мохаммад Разави
2 Кафедра патологии полости рта и челюстно-лицевой области, Исфаханский университет медицинских наук, Исфахан, Иран;
Солмаз Хомайони
3 Кафедра патологии полости рта, Исфаханский университет медицинских наук, Исфахан, Иран
1 Кафедра стоматологической и челюстно-лицевой патологии, Исламский университет Азад в Хорасгун, Исфахан, Иран;
2 Кафедра оральной и челюстно-лицевой патологии, Исфаханский университет медицинских наук, Исфахан, Иран;
3 Кафедра патологии полости рта, Исфаханский университет медицинских наук, Исфахан, Иран
Для корреспонденции: Самане Ширани, DDS, MS; Кафедра стоматологической и челюстно-лицевой патологии, Школа стоматологии, Исламский университет Азад в Хорасгун, Исфахан, Иран Тел. / Факс: +98 311 6644780 Электронная почта: shiranisamaneh @ yahoo.com [email protected]
Поступила в редакцию 8 мая 2013 г .; Пересмотрено 23 июля 2013 г .; Принято 1 сентября 2013 г.
Авторские права © 2014: Иранский журнал медицинских наук Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (https://creativecommons.org/licenses/by/3.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинальная работа правильно процитировано. Эта статья цитировалась в других статьях в PMC.Abstract
Среди поражений полости рта мы встречаем серию злокачественных поражений эпителия, которые проходят клинические и гистопатологические процессы для диагностики.Выявление этих процессов вместе со знанием этиологии этих поражений очень важно для профилактики и раннего лечения. Дисплазия — это этап, предшествующий формированию плоскоклеточного рака в очагах поражения, которые могут стать причиной дисплазии. Выявлению этиологических факторов, клинических и гистопатологических методов посвящено много статей. В этой статье представлен обзор различных статей, описывающих дисплазию полости рта, новые клинические методы выявления поражений и иммуногистохимические исследования, предлагающие различные маркеры для более точной идентификации таких поражений.В этой статье также кратко анализируются новые методы лечения, такие как тканевая инженерия.
Ключевые слова: Дисплазия, Обзор, Иран
Введение
На слизистой оболочке рта мы можем встретить некоторые эпителиальные или мезенхимальные поражения. Согласно эпидемиологическим исследованиям, поражение эпителия может быть причиной большинства злокачественных новообразований. Клиницистам необходимо знать, как превратить злокачественное поражение в карциному. 1 , 2 Осведомленность об эпидемиологии рака полости рта, особенно плоскоклеточного рака, может обеспечить эффективные и соответствующие планы лечения, снижение смертности и повышение качества жизни.Плоскоклеточная карцинома (SCC) является наиболее распространенным поражением среди других злокачественных новообразований полости рта в эпидемиологических исследованиях.
Идрис и др. в Судане сообщалось о 66,5% распространенности ПКР среди злокачественных новообразований. 3 В 2007 году Разави и др. заявили, что эпителиальные злокачественные новообразования были наиболее распространенными поражениями (63%), и сообщили о распространенности ПКР в Исфахане 54,5%. 4 Поскольку некоторые ученые считают, что ранняя диагностика поражений важна как для профилактики, так и для лечения рака полости рта, было проведено множество клинических, гистологических и цитологических исследований.В то время как немногие из них сосредоточены на клинической оценке различных методов диагностики поражений, немногие другие рекомендуют современные цитологические методы, используемые в генетике. Несмотря на доступность таких современных методов, патологи утверждают, что микроскопическое изображение биопсии делает диагностику более точной и чувствительной. 5 — 7
Сначала определение нескольких терминов
Предраковые поражения; Код относится к ткани с доброкачественным морфологическим изменением, имеющей высокий потенциал превращения в злокачественную опухоль.
Потенциал злокачественной трансформации; Код относится к возникновению злокачественного или предракового состояния на начальной или конечной стадии. Диспластические изменения являются одним из признаков предраковых поражений, которые можно наблюдать с гистопатологической точки зрения, особенно на эпителии. Хотя последние разработки в области медицины 8 — 10 рекомендуют консервативные методы, для дальнейшей оценки необходимы дополнительные исследования. Диспластические эпителиальные поражения имеют клинические характеристики предраковых поражений, подобных карциноме.Распознавание таких изменений жизненно важно для предотвращения изменений карциномы. 10 Предраковые поражения, такие как лейкоплакия, эритроплация, кератоз бездымного табака, фиброз слизистой оболочки полости рта, плоский лишай, Condylom Acominatum, перевернутая папиллома шнайдера, актинический кератоз, кратко обсуждаются ниже. 7 , 10 , 11
Лейкоплакия: Белый налет или пятно без какого-либо клинического или патологического сходства с другими поражениями.Этот термин является полностью клиническим и не включает гистопатологические изменения ткани. Диспластический эпителий или инвазивная карцинома наблюдается только в 5-25% образцов биопсии. Этиологией лейкоплакии обычно являются табак, алкоголь, сангвинария, ультрафиолетовое излучение, травмы и такие микроорганизмы, как палладий трепонема, Candida albicans и вирус папилломы. Это поражение в основном наблюдается у людей моложе сорока лет и чаще встречается у мужчин. Хотя киноварь, слизистая оболочка щеки и десна являются наиболее частыми локализацией лейкоплакии; поражения, расположенные на губах, языке и дне полости рта, с 90% вероятностью представляют диспластические или карциномные изменения.
Клинический процесс лейкоплакии описан ниже:
Тонкая лейкоплакия проявляется в виде бело-серого или серого налета и может иметь вид трещин и морщин.
Толстая лейкоплакия — это белый налет с очевидной толщиной, кожистым пальпатором и многочисленными глубокими трещинами.
Узловая / железистая лейкоплакия более выраженная, с большим количеством неровностей поверхности.
Верроциформная лейкоплакия имеет острые или тупые выступы.
Пролиферативная веррукозная лейкоплакия — это тип высокого риска с множественными кератотическими бляшками и шероховатыми выступами на поверхности.
Гистопатологическим признаком лейкоплакии является утолщение кератинового слоя эпителия (гиперкератоз) с утолщенным слоем спинномозговых оболочек (акантоз) или без него. Некоторые демонстрируют атрофию эпителия. В соединительной ткани наблюдаются различные воспалительные клетки. Большинство поражений не демонстрируют дисплазии при биопсии, за исключением 5-25%, если исследованы все участки полости рта. Эти диспластические явления, если они существуют, обычно начинаются в базилярном и парабазилярном эпителии 7 , 10 , 12 — 15 , как показано на рис.
Лейкоплакия представляет собой белый налет или пятно без какого-либо клинического или патологического сходства с другими поражениями.
Эритроплакия: Это поражение определяется как красное пятно, которое не может быть клинически и патологически диагностировано как любое другое поражение. Явные диспластические изменения и карцинома in situ или инвазивная плоскоклеточная карцинома присутствуют почти во всех истинных поражениях. Этиология эритроплакии неизвестна, но предполагается, что она схожа с этиологией инвазивной плоскоклеточной карциномы.Хотя эритроплакия встречается редко, вероятно возникновение тяжелой дисплазии во время биопсии или дальнейших злокачественных новообразований. Эритроплакия чаще всего встречается у взрослых людей среднего возраста без определенных гендерных пристрастий. Дно рта, язык и мягкое небо являются частыми участками поражения, в которых поражение демонстрирует хорошо разграниченное эритематозное пятно с мягкой и бархатистой текстурой. Гистопатологический признак выявляет тяжелую эпителиальную дисплазию, карциному in situ и инвазивную плоскоклеточную карциному в 90% случаев.Существует атрофический эпителий с недостаточной выработкой кератина, особенно в сочетании с тонкостью эпителия, позволяющей лежащему под ним микроваскуляру приобретать красный цвет. Как показано на, соединительная ткань часто демонстрирует хроническое воспаление. 7 , 10 , 16 — 19
Эритроплакия определяется как красное пятно, которое не может быть диагностировано как любое другое поражение клинически и патологически.
Табак без табака: Поражение проявляется в виде тонкого бело-серого или белого налета на слизистой оболочке при прямом контакте с нюхательным или жевательным табаком с нечеткой границей и небольшой эритемой. Если это происходит, кератоз от бездымного табака проявляется через пять лет. Он становится постоянным, если не избегать ежедневного контакта с табаком. Некоторые белые поражения становятся более толстыми, приобретают кожный или узловатый вид. С точки зрения гистопатологии видны гиперкератинизированный и сквамозный сквамозный эпителий с или без клеточной вакуолизации или отека богатых гликогеном клеток.Шеврон паракератина можно увидеть как заостренные выступы над или внутри поверхностных эпителиальных клеток. Дисплазия, если она существует, имеет умеренную форму при этом поражении (). 7 , 10 , 20 — 23
Табачный пластырь без смокинга выглядит как характерный тонкий бело-серый или белый налет на слизистой оболочке при прямом контакте с нюхательным или жевательным табаком.
Подслизистый фиброз: Это хроническое прогрессирующее рубцевание с предраковым состоянием высокого риска, которое было связано с размещением «паана» во рту.Его особенность — жесткость слизистой оболочки различной интенсивности, вызванная фибробластической гиперплазией и модификацией поверхностной соединительной ткани. Дефицит питания и генетические факторы увеличивают риск фиброза, а контакт с табаком считается основной причиной изменения эпителия и канцерогенеза. Нарушение гемостатического равновесия между синтезом и дегенерацией, вызванное арекой, является его патогенезом. «Ион» меди в «орехах» ареки увеличивает активность лизилоксидазы, что приводит к нерегулируемой выработке коллагена.Поражение в основном поражает молодых людей, и наиболее пораженными участками являются слизистая оболочка щек, ретромолярная область и мягкое небо. Отложение логова и гиперваскулярного коллагена в соединительной ткани с различным количеством хронических воспалительных клеток видно по его гистопатологическим особенностям. Дисплазия эпителия отмечена в 10–15% биоптатов (). 7 , 10 , 24 — 28
Клинические проявления подслизистого фиброза. Особенностью является жесткость слизистой оболочки различной степени выраженности.
Красный плоский лишай: Хроническое дерматологическое заболевание часто поражает слизистую ротовой полости без какой-либо специфической этиологии, включая лекарственные препараты, гепатит С и нервозность. Это часто встречается у взрослых среднего возраста и связано с иммунологическими нарушениями. Ретикулярный тип встречается чаще, чем эрозивная форма, и поражает слизистую оболочку задней части щеки с двух сторон с появлением переплетающихся белых линий. Другие сайты, которые могут быть затронуты: боковой и спинной язык, десна, нёбо и красная кайма.Клиническая картина при эрозивном типе — атрофическая, эритематозная с центральным изъязвлением и мелкими периферическими белыми радиационными стерами. Гистопатологические особенности включают различные степени ортокератоза и паракератоза, помимо толщины остистого слоя. Ретейные гребни приобретают гиперпластический и зубчатый рисунок. Очевидна дегенерация базальных клеток наряду с интенсивной полосой инфильтрированных Т-лимфоцитов. Злокачественные изменения планов лишайников спорны, но если возникают диспластические изменения, они будут умеренными (). 7 , 10 , 29 — 31
Клинические проявления ретикулярного типа красного плоского лишая встречаются чаще и затрагивают заднюю слизистую оболочку щеки с двух сторон с появлением пересекающихся белых линий.
Инвертированная папиллома Шнайдера: Это наиболее распространенная папиллома придаточных пазух носа, которая в основном наблюдается у взрослых людей среднего возраста. Односторонняя заложенность носа наряду с болью, носовыми кровотечениями и гнойными выделениями являются симптомами.Его внешний вид представляет собой мягкий, розовый или коричневый, полиповидный или узловатый нарост с гистологическими особенностями пролиферации плоских клеток в подслизистую строму. Базальная мембрана остается неповрежденной, очевидны диспластические изменения различной степени. Очевидная гиперплазия и гиперкератоз в базальном слое и высокий митотический индекс сделали плохой прогноз (). 7 , 10 , 32 — 36
Клинические признаки перевернутой папилломы Шнайдера — мягкое, розовое и полиповидное образование.
Актинический кератоз: Поражение представляет собой обычное предраковое заболевание кожи, вызванное кумулятивным ультрафиолетовым излучением солнца на открытой коже. Актинический хейлоз — это тип, при котором он поражает киноварь нижней губы и часто встречается у взрослых белых мужчин. Это поражение также называют губой фермера или губой моряка. Сниженный иммунитет и длительное пребывание на солнце являются его основными причинами. Клинические признаки — атрофическая нижняя губа, отличающаяся гладкой поверхностью и бледными пятнами.При прогрессирующих поражениях; шероховатые чешуйчатые участки развиваются в более сухой части киновари, что похоже на поражения лейкоплакией. Атрофический многослойный плоский эпителий с замечательной продукцией кератина и различной степенью дисплазии виден по гистопатологическим признакам. Кроме того, в подлежащей соединительной ткани присутствуют легкие хронические воспалительные клетки и солнечный эластоз (). 7 , 10 , 37 — 40
Клиническим признаком актинического кератоза является атрофическая нижняя губа с гладкой поверхностью и бледными пятнами.
Каковы клинические признаки диспластического поражения и достаточно ли для диагностики диспластического поражения или необходимости биопсии?
Наблюдение за белым кератотическим поражением неизвестной или сходной с злокачественной этиологией этиологии предполагает возможность диспластических изменений. В 1876 году венгерский дерматолог обнаружил лейкоплакию. 41 Швиммер заметил, что 80% лейкоплакии являются предраковыми, а вероятность злокачественного новообразования увеличивается на 3% в год у взрослых старше 35 лет. 42 В ходе дальнейших исследований был сделан вывод, что каждое белое кератотическое поражение не обязательно имеет потенциал злокачественности из-за их реакции на функции сохранения слизистой оболочки. На семинаре 7 патологи представили следующее кератотическое поражение как имеющее высокий потенциал злокачественных и диспластических изменений; лишайники, бездымный табак, альвеолярный кератоз и другие подобные поражения лейкоплакии. Вероятность диспластических изменений выше при более толстых и гранулярных поражениях.Кроме того, наличие красных пятен в белых поражениях определяет более высокую заболеваемость злокачественными новообразованиями. Утверждается, что многоочаговая лейкоплакия имеет высокий потенциал злокачественности. Предполагается, что другие поражения слизистой оболочки, включая красное поражение, такое как лейкоплакия, составляют от 5 до 25% дисплазии. Аналогичная вероятность для случая эритроплакии составляет 90% (). 10
Таблица 1
Сравнение возможности диспластических изменений в поражениях полости рта — вероятность дисплазии при диспластических поражениях
| Пролиферативная веррукозная лейкоплакия | ****** | при обратном курении | ***** |
|---|---|---|
| Эритроплакия | ***** | |
| Фиброзная слизь из полости рта с лейкоплакией | ***** | |
| Гранулярная *** лейкоплакия | *||
| Кератоз гортани | *** | |
| Актинический хейлит | *** | |
| Сифилитический глоссит с дорсальной лейкоплакией | *** | Гладкая|
| Кератоз бездымного табака | ** | |
| Plammer V болезнь инсона | * | |
| Красный плоский лишай, эрозивная форма | * | |
| Гладкая тонкая лейкоплакия | +/- | |
| Врожденный дискератоз | ||
| Красная волчанка | ? | |
| Буллезный эпидермолиз | ? | |
| Синдром Кларка-Хоуэла-Эванса | ? |
Вероятность злокачественного новообразования при диспластических поражениях легкой или средней степени составляет от 4 до 11% и от 2 до 35% при тяжелых диспластических изменениях.Также было исследовано, что предраковое поражение длится примерно до 3 лет, чтобы превратиться в рак ротовой полости. В нескольких исследованиях оценивалась возможность и способность злокачественных изменений, но они не могли быть идентифицированы или подтверждены с уверенностью. 43 — 46 Определение влияния молекулярных факторов может помочь в определении и открытии терапевтических методов. Многие ученые приложили немало усилий для определения гистопатологической этиологии этих изменений.Результаты показали, что некоторые маркеры и гистопатологические элементы имеют значение. Исследование Razavi et al. продемонстрировали, что васкуляризация с помощью VEGF играет первостепенную роль в прогрессировании дисплазии и карциномы из нормальной слизистой оболочки. 47 Лектин — это маркер мембранного белка, который прикрепляется к углеводам мембраны и выполняет функцию в клеточной мембране. Доказано, что лектин играет важную роль в развитии рака полости рта, груди и мозга. Мутация в гене лектина изменяет клеточные мембраны и приводит к метастазированию опухолевых клеток. 48 — 51 Исследование Сильвермана пришло к выводу, что 36% лейкоплакии заканчивается злокачественным новообразованием. 7-50% тяжелых диспластических поражений, 3-30% умеренных диспластических поражений и менее 5% легких диспластических поражений способны превратиться в злокачественные новообразования. 52 — 55 Многие патологи считают, что диспластические изменения носят временный характер как начальная стадия перехода в злокачественное новообразование, а легкая дисплазия может привести к серьезной дисплазии. 56
Какая гистопатологическая характеристика диспластического поражения является наиболее важным фактором в диагностике и прогнозе?
Диспластические изменения, если они возникают, затрагивают базальный и парабазальный эпителий.Чем больше возникает диспластических изменений, тем более необычный эпителий распространяется по всему эпителию. Слова «легкая», «умеренная» и «тяжелая» используются для описания степени дисплазии. 10
Легкая дисплазия относится к изменениям, ограниченным базальным или парабазальным слоем ().
Гистопатологическое исследование легкой дисплазии описывает изменения базального или парабазального слоя (A: увеличение × 100, B: увеличение × 400).
Умеренная дисплазия охватывает базальный слой до середины зернистого слоя ().
Гистопатологическое открытие умеренной дисплазии описывает изменения от базального слоя к середине зернистого слоя (A: увеличение × 100, B: увеличение × 400).
Сильная дисплазия описывает изменения от базального слоя к верхнему и среднему слою эпителия ().
Гистопатологическое открытие тяжелой дисплазии описывает изменения от базального слоя к верхнему и среднему слою эпителия (A: увеличение × 100, B: увеличение × 400).
Карцинома in situ определяется как дисплазия, затрагивающая базальный слой на поверхности слизистой оболочки, которая может распространяться через проток одной слюнной железы, особенно если она расположена в полости рта.Дело в том, что при карциноме in situ базальный слой не поврежден и здоров (). 57 , 58 , 59
Гистопатологическое обнаружение карциномы in situ определяется как дисплазия, затрагивающая базальный слой поверхности слизистой оболочки (A: увеличение × 100, B: увеличение × 400).
Так что же это за диспластические изменения?
Они делятся на два общих типа:
Изменения сотовой связи
Специфические изменения отдельных эпителиальных клеток важны для определения эпителиальной дисплазии. 57 — 59 Клетки и ядра приобретают более примитивный вид, похожий на таковые у базальных клеток с увеличенными ядрами (ядерная гиперплазия), темными ядрами (гиперхроматизм), часто увеличенными эозинофильными ядрышками (выступающие ядрышки) и с повышенное ядерно-цитоплазматическое соотношение. 57 , 58 , 5 Эти клетки также показывают повышенную клеточную плотность. Такие изменения не являются исключительными для канцерогенеза, поскольку они могут наблюдаться в реактивном эпителии или эпителии, подверженном влиянию различных системных изменений.Проточная цитометрия и визуальная цитометрия значительно расширяют возможности патолога для оценки ядерных изменений, связанных с возможным развитием рака. 57 — 59
Часто наблюдается повышение митотической активности диспластического эпителия, но это также наблюдается во многих реактивных поражениях. Множественные митотические фигуры (аномальные митозы) также могут быть определены в необычном расположении других слоев эпителия. 57 — 59
Изменения и появление тканей
-
-Большинство предраковых поражений полости рта проявляют гиперкератоз и акантоз, диспластические поражения могут быть как атрофическими, так и акантотическими 57 , 58 , 59
-
-Изменения в зрелости от базального клеточного слоя до плоскоклеточного, морфологические изменения диспластического эпителия — потеря стратификации (потеря поляризации). 57 — 59
-
-Гиперплазия базальных клеток, как обсуждалось выше, имеет большое значение для диагностики, а также для определения степени дисплазии. 57 — 59
-
— Карцинома in situ
-
— Застой клеток
-
-Этот дискератоз может быть представлен индивидуально ороговевшими клетками или плотными концентрическими кольцами уплощенных кератиноцитов (эпителиальный жемчуг ) . 57 — 59
-
-Нодулярные, выпуклые или слезообразные ретейджи и чрезвычайно удлиненные сетчатые отростки (каплевидные сетчатые отростки) вызывают беспокойство независимо от их размера, особенно если видны вторичные выступы или узелки, выходящие из базального слоя и ответвляющиеся под разными углами в собственная пластинка и сосочки соединительной ткани. 57 — 59
Системы классификации диспластических поражений
Изобретены четыре системы классификации диспластических поражений:
Интраэпителиальное новообразование полости рта (OIN) ()
Таблица 2
| Система OIN | Нет дисплазии | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| н / д | Легкая дисплазия | ||||||||||
| OIN 1 | Умеренная дисплазия | ||||||||||
| OIN 2 | Северная дисплазия 3 | Нет дисплазии |
Классическая гортанная система ()
Таблица 3
| Классическая гортанная система | |
|---|---|
| 1 степень | Кератоз гортани |
| 2 степень | Кератоз с дисплазией |
| 3 степень | Карцинома3 на месте |
| Любляна система | |
|---|---|
| Степень 1 | Простая гиперплазия |
| Степень 2 | Базальная / парабазальная гиперплазия |
| Степень 3 |
Классическая оральная система (ВОЗ 2005) () . 60
Таблица 5
| Классическая оральная система (ВОЗ 2005) |
|---|
| Нет дисплазии |
| Легкая дисплазия |
| Умеренная дисплазия |
| Серьезная дисплазия | Диагностика клинически? Проведено несколько исследований с определенными рекомендациями и методами.Однако их специфичность и чувствительность не так надежны, как биопсия и гистологический метод. Вот некоторые из этих методов: Щеточная биопсия: Этот метод основан на мазке Папаниколау, также известном как оральный CDx-тест. Если возможно, щеткой с щетиной смазывают очаг поражения и его базальный слой. Образец переносят на предметное стекло и окрашивают аналогично методу Пап. Возможное злокачественное новообразование устанавливается при соблюдении одного из следующих показаний; полиморфизм увеличенные ядрышки, темное и увеличенное ядро. 61 — 64 Жидкостная цитология: , по-видимому, основана на щеточной биопсии с большим количеством сохраняющих клеток и морфологий. В этой методике используется процедура седиментации, при которой удаляются воспалительные клетки и клетки крови. Специфичность и чувствительность этого теста выше с меньшим количеством ложных +/- результатов, что позволяет проводить иммуногистологические и молекулярные исследования. Этот метод применим, когда биопсия сомнительна (т. Е. Используется при пограничных поражениях). 65 — 68 Толуидиновый синий: Промытая слизистая оболочка подвергается воздействию уксусной кислоты, а затем толуидиновому синему окрашивает клеточную ДНК, что делает возможным наблюдение диспластических изменений. В этом тесте могут быть получены более ложные + результаты из-за разрушенных клеток в результате травмы или воспаления. Показанием к этой методике является карцинома in situ, эритроплакия и поиск места для биопсии. 69 — 72 Методика Vizilite: подозрительная слизистая оболочка оценивается синим светом, который используется в стоматологии, или химическими излучающими трубками в темном помещении после воздействия уксусной кислоты.Необычная слизистая оболочка выглядела бы как темные зоны. Слабость этого теста — его ложные + результаты и преувеличенная дисплазия при лукоэдеме и поражениях бездымным табаком. 7 , 73 — 75 Оральная автофлуоресценция : Флуоресцентный свет используется для диагностики находящихся под угрозой локализации поражений и подходит для «кератотических» и сосудистых поражений. Флуоресцентный свет с длиной волны 400–460 нм в темном помещении может определять опасные зоны как «синие», «зеленые и черные» или «черные и черные».Это может быть связано с уменьшением активности FAD и NADH, которые могут поглощать флуоресцентный свет. Например, при лейкоплакии с дисплазией количество черных пятен составляет 3-4, но в том же поражении без дисплазии будет 0-1. Слабым местом этого теста, как и предыдущего метода, является его низкая специфичность и чувствительность. 7 , 76 — 78 Иммуногистологический метод и использование мононуклеарных антител против специфических маркеров диспластических клеток могут обеспечить более высокую надежность.Процент положительных результатов определяет тип и тяжесть дисплазии. Рекомендуемые маркеры: DOK, 79 Rab11a, 80 P53, 81 POE9n, 82 Bcl2, 83 и CD44. 84 Как можно предотвратить прогрессирование диспластического поражения в злокачественное новообразование после постановки диагноза? Нужно лечение или нет?Это будет по-другому и зависит от поражения и плана лечения. Устранение привычного состояния, которое является причиной проблемы, уместно, но в настоящее время медицинская наука рекомендует использовать лечение стволовыми клетками.В соответствующем исследовании сообщается о количестве образцов легкой, средней и тяжелой диспластики, обработанных стволовыми клетками, с убедительными результатами. Слизистая оболочка приобрела способность вырабатывать нормальные кератины со зрелостью и функционированием. Использование нового метода в диагностике и лечении диспластических поражений является многообещающим даже при высокой вероятности возвращения злокачественных новообразований. 85 — 87 Тканевая инженерия слизистой оболочки полости рта: Тканевая инженерия определяется как «понимание принципов роста тканей и их применение для производства функциональной замещающей ткани для клинического использования. 88 Ткань, созданная в слизистой оболочке рта, может заменить дефекты мягких тканей в полости рта. 89 Эти дефекты можно разделить на две основные категории; дефекты, связанные с зубами (рецессия десен) и дефекты, не связанные с зубами (дефекты, вызванные truma, хроническая инфекция или дефекты, вызванные раком полости рта). 90 Обычным подходом к замене поврежденной слизистой оболочки полости рта является использование трансплантатов и культивированных эпителиальных клеток. 89 Тканевая инженерия слизистой оболочки рта состоит из двух методов; Слизистая оболочка ротовой полости, модифицированная частичной толщиной, и слизистая оболочка полости рта, созданная на полную толщину тканиМетод частичной толщины позволяет получать эпителиальные клетки для замены диспластической слизистой оболочки полости рта. 89 В этом методе используется один тип слоя ячеек, который может быть однослойным или многослойным. Однослойный эпителий использует реакцию на раздражители, такие как механический стресс, добавление фактора роста и радиационное повреждение. 91 Эти многослойные эпителиальные клетки проявляют признаки дифференцировки, такие как образование базальной мембраны и кератинизация. 92 С развитием тканевой инженерии в качестве альтернативного подхода была разработана тканевая слизистая оболочка ротовой полости полной толщины. 92 Этот метод является лучшим моделированием ситуации in vivo, поскольку он учитывает анатомическую структуру нативной слизистой оболочки полости рта. Основная цель полнослойной техники — напоминание нормальной слизистой оболочки полости рта. Для получения наилучших результатов важными факторами являются подтип и происхождение фибробластов и кератиноцитов (используемых в тканевой инженерии слизистой оболочки полости рта). Фибробласты обычно берут из дермы кожи или слизистой оболочки полости рта. 92 Кератиноциты можно выделить из разных областей ротовой полости (неба или десен). 92 Время является важным параметром при использовании фибробластов и кератиноцитов, так как функционирование этих клеток со временем ухудшается. 92 Пересаженные клетки должны адаптироваться к новой среде и правильно функционировать. 92 Существует риск потери трансплантированной ткани, если клетки не адаптируются должным образом. Эта адаптация проходит более плавно, когда клетки донорской ткани напоминают клетки нативной ткани. 92 ЗаключениеВсе исследователи в целом признают тот факт, что в большинстве случаев карциномы в полости рта наблюдаются значительные изменения до достижения такого состояния.Таким образом, диспластические поражения с микроскопическими характеристиками имеют высокий потенциал риска трансформации в злокачественные новообразования. Следовательно, необходимо рассмотреть соответствующие диагностические процедуры (например, биопсию) для каждого подозрительного диспластического поражения в полости рта. Конфликт интересов: Не объявлен. Ссылки1. Jahanshahi GH. Справочник по дифференциальной диагностике поражений полости рта. 3-е изд. Исфахан: Исфаханский университет медицинских наук; 2005. С.244–7. [Google Scholar] 2. Ho MW, Risk JM, Woolgar JA, Field EA, Field JK, Steele JC и др. Клинические детерминанты злокачественной трансформации при дисплазии эпителия полости рта. Oral Oncol. 2012; 48: 969–76. PubMed PMID: 22579265. [PubMed] [Google Scholar] 3. Идрис А.М., Ахмед Х.М., Мухтар Б.И., Гадир А.Ф., эль-Бешир Э.И. Описательная эпидемиология новообразований полости рта в Судане 1970-1985 гг. И роль тоумбака. Int J Cancer. 1995; 61: 155–8. DOI: 10.1002 / ijc.20202. PubMed PMID: 7705940. [PubMed] [Google Scholar] 4.Разави С.М., Саджад С. Эпидемиологическое исследование орального и периорального рака в Исфахане. Журнал стоматологических исследований. 2007; 4: 18–25. [Google Scholar] 5. Мишра М., Моханти Дж., Сенгупта С., Трипати С. Эпидемиологическое и клинико-патологическое исследование лейкоплакии полости рта. Индийский J Dermatol Venereol Leprol. 2005. 71: 161–5. PubMed PMID: 16394403. [PubMed] [Google Scholar] 6. Мараки Д., Беккер Дж., Бокинг А. Цитологическая и ДНК-цитометрическая очень ранняя диагностика рака полости рта. J Oral Pathol Med. 2004. 33: 398–404. DOI: 10.1111 / j.1600-0714.2004.0235.x. PubMed PMID: 15250831. [PubMed] [Google Scholar] 7. Люмерман Х., Фридман П., Керпель С. Дисплазия эпителия полости рта и развитие инвазивной плоскоклеточной карциномы. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1995; 79: 321–329. DOI: 10.1016 / S1079-2104 (05) 80226-4. PubMed PMID: 7621010. [PubMed] [Google Scholar] 8. Ранняя диагностика и профилактика рака полости рта и предрака: отчет Симпозиума III. Adv Dent Res. 1995; 9: 134–7. PubMed PMID: 7546134. [PubMed] [Google Scholar] 9.Букет J.E., Speight PM, Farthing PM. Эпителиальная дисплазия слизистой оболочки полости рта. Проблемы диагностики и особенности прогноза. Текущая диагностическая патология. 2006; 12: 11–21. [Google Scholar] 10. Невилл Б.В., Day TA. Рак полости рта и предраковые поражения. CA Cancer J Clin. 2002; 52: 195–215. [PubMed] [Google Scholar] 11. Крамер И. Р., Лукас Р. Б., Пиндборг Дж. Дж., Собин Л. Х. Определение лейкоплакии и родственных поражений: помощь в исследованиях предрака полости рта. Oral Surg Oral Med Oral Pathol. 1978; 46: 518–39. PubMed PMID: 280847.[PubMed] [Google Scholar] 12. ван дер Ваал I, Шепман К. П., ван дер Мей Э. Х., Смеле Л. Е.. Оральная лейкоплакия: клинико-патологический обзор. Oral Oncol. 1997; 33: 291–301. DOI: 10.1016 / S1368-8375 (97) 00002-X. PubMed PMID: 9415326. [PubMed] [Google Scholar] 13. Харма М.Ю., Таракджи Б. Современные данные по диагностике и лечению пролиферативной веррукозной лейкоплакии. Ann Saudi Med. 2012; 32: 412–4. di: 10.5144 / 0256-4947.2012.412. PubMed PMID: 22705614. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Waldron CA, Shafer WG.Повторное посещение лейкоплакии. Клинико-патологическое исследование 3256 лейкоплакий полости рта. Рак. 1975; 36: 1386–92. PubMed PMID: 1175136. [PubMed] [Google Scholar] 15. Bánóczy J. Оральная лейкоплакия и другие белые поражения слизистой оболочки полости рта, связанные с дерматологическими заболеваниями. Дж. Кутан Патол. 1983; 10: 238–56. PubMed PMID: 6350389. [PubMed] [Google Scholar] 16. Вилла А, Вилла С, Абати С. Рак полости рта и эритроплакия полости рта: обновленная информация и значение для клиницистов. Ост Дент Дж. 2011; 56: 253–6. DOI: 10.1111 / j.1834-7819.2011.01337.x. PubMedPMID: 21884139. [PubMed] [Google Scholar] 17. Хосни Е.С., Салум Ф.Г., Керубини К., Юргель Л.С., Фигейредо М.А. Эритроплакия полости рта и крапчатая лейкоплакия: ретроспективный анализ 13 случаев. Браз Дж Оториноларингол. 2009; 75: 295–9. PubMed PMID: 19575119. [PubMed] [Google Scholar] 18. Граевски С., Гронеберг Д. Лейкоплакия и эритроплакия — два предшествующих очага поражения. Ларингориноотология. 2009; 88: 666–72. PubMed PMID: 19813163. [PubMed] [Google Scholar] 19. Рейхарт PA, Филипсен HP.Эритроплакия полости рта — обзор. Oral Oncol. 2005. 41: 551–61. PubMed PMID: 15975518. [PubMed] [Google Scholar] 20. Саммерлин Д. Д., Дунипас А., Поттер Р. Гистологические эффекты бездымного табака и алкоголя на слизистой оболочке и органах сирийского хомяка. J Oral Pathol Med. 1992; 21: 105–8. PubMed PMID: 1583594. [PubMed] [Google Scholar] 21. Boffetta P, Aagnes B, Weiderpass E, Andersen A. Употребление бездымного табака и риск рака поджелудочной железы и других органов. Int J Cancer. 2005; 114: 992–5. DOI: 10.1002 / ijc.20811. PubMED PMID: 15645430. [PubMed] [Google Scholar] 22. Шам А.С., Чунг Л.К., Джин Л.Дж., Корбет Э.Ф. Влияние табака на здоровье полости рта. Hong Kong med J. 2003; 9: 271–7. PubMed PMID: 125. [PubMed] [Google Scholar] 23. Рэй А., МакГирт В.Ф. Употребление бездымного табака связано с раком полости рта. Заболеваемость, лечение, исход. Arch Otolaryngol Head Neck Surg. 1993; 119: 929–33. DOI: 10.1001 / archotol.1993.01880210017002. PubMed PMID: 8357593. [PubMed] [Google Scholar] 24. Kuo MY, Chen HM, Hahn LJ, Hsieh CC, Chiang CP.Биосинтез коллагена в культурах фибробластов орального подслизистого фиброза человека. J Dent Res. 1995; 74: 1783–8. DOI: 10.1177 / 00220345950740111101. PubMed PMID: 8530741. [PubMed] [Google Scholar] 25. Ранганатан К., Деви М.Ю., Джошуа Э., Киранкумар К., Сарасвати Т.Р. Подслизистый фиброз полости рта: исследование случай-контроль в Ченнаи, Южная Индия. J Oral Pathol Med. 2004. 33: 274–7. DOI: 10.1111 / j.0904-2512.2004.00116.x. PubMed PMID: 15078487. [PubMed] [Google Scholar] 26. Джейкоб Б.Дж., Стрейф К., Томас Дж., Рамадас К., Мэтью Б., Чжан З.Ф. и др.Бетель без табака как фактор риска предраковых заболеваний полости рта. Oral Oncol. 2004. 40: 697–704. DOI: 10.1016 / j.oraloncology.2004.01.005. PubMed PMID: 15172639. [PubMed] [Google Scholar] 27. Тилакаратне В.М., Клиниковски М.Ф., Саку Т., Петерс Т.Дж., Варнакуласурия С. Подслизистый фиброз полости рта: обзор этиологии и патогенеза. Oral Oncol. 2006; 42: 561–8. DOI: 10.1016 / j.oraloncology.2005.08.005. PubMed PMID: 16311067. [PubMed] [Google Scholar] 28. Cox SC, Walker DM. Подслизистый фиброз полости рта. Обзор. Ост Дент Дж.1996; 41: 294–9. DOI: 10.1111 / j.1834-7819.1996.tb03136.x. PubMed PMID: 8961601. [PubMed] [Google Scholar] 29. Гонсалес-Молес М.А., Скалли К., Джилл-Монтайя Дж. Красный плоский лишай полости рта: противоположность злокачественной трансформации. Oral Dis. 2008; 14: 229–43. PubMed PMID: 18298420. [PubMed] [Google Scholar] 30. Sugerman PB, Savage NW. красный плоский лишай полости рта: случаи, диагностика, лечение. Ост Дент Дж. 2002; 47: 290–7. PubMed PMID: 12587763. [PubMed] [Google Scholar] 31. Mattsson U, Jontell M, Holmstrup P. Красный плоский лишай и злокачественная трансформация: оправдан ли отзыв пациентов? Crit Rev Oral Bio Med.2002; 13: 390–6. DOI 10.1177 / 154411130201300503. PubMed PMID: 12393758. [PubMed] [Google Scholar] 32. Врабец Д.П. Инвертированная папиллома Шнайдера: 25-летнее исследование. Ларингоскоп. 1994; 104: 582–605. DOI: 10.1002 / lary.5541040513. PubMed PMID: 8189990. [PubMed] [Google Scholar] 33. Нуделл Дж., Чиоси С., Томпсон Л.Д. Карцинома экс-шнайдерова папиллома (злокачественная трансформация): клинико-патологическое и иммунофенотипическое исследование 20 случаев в сочетании с всесторонним обзором литературы. Голова Шея Патол.2014; 8: 269–86. DOI: 10.1007 / s12105-014-0527-7. PubMed PMID: 24519376; PubMed PMCID: PMC4126921. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Weber RS, Shillitoe EJ, Robbins KT, Luna MA, Batsakis JG, Donovan DT, et al. Распространенность вируса папилломы человека в перевернутых папилломах носа. Arch Otolaryngol Head Neck Surg. 1988. 114: 23–6. DOI: 10.1001 / archotol.1988.01860130027009. PubMed PMID: 2825730. [PubMed] [Google Scholar] 35. Астор ФК, Донеган Дж.О., Глюкман Дж.Л. Необычные анатомические проявления инвертирующей папилломы.Head Neck Surg. 1985; 7: 243–5. DOI: 10.1002 / hed.28309. PubMed PMID: 3972603. [PubMed] [Google Scholar] 36. Майерс Э. Н., Шрамм В. Л. младший, Барнс Э. Л. мл. Управление перевернутой папилломой носа и придаточных пазух носа. Ларингоскоп. 1981; 91: 2071–84. DOI: 10.1288 / 00005537-198112000-00009. PubMed PMID: 7321725. [PubMed] [Google Scholar] 37. Salasche SJ. Эпидемиология актинических кератозов и плоскоклеточного рака. J Am Acad Dermatol. 2000; 42: 4–7. DOI: 10.1067 / mjd.2000.103342. PubMed PMID: 10607349.[PubMed] [Google Scholar] 38. Марки VJ. Старческий кератоз. Предраковое поражение кожи. Otolaryngol Clin North Am. 1993; 26: 23–35. PubMed PMID: 8433840. [PubMed] [Google Scholar] 39. Акерман А.Б., Монс Дж. М.. Солнечный (актинический) кератоз — плоскоклеточный рак. Br J Dermatol. 2006; 155: 9–22. DOI: 10.1111 / j.1365-2133.2005.07121.x. PubMed PMID: 16792746. [PubMed] [Google Scholar] 40. Roewert-Huber J, Stockfleth E, Kerl H. Патология и патобиология актинического (солнечного) кератоза — обновленная информация. Br J Dermatol.2007; 2: 18–20. doi 10.1111 / j.1365-2133.2007.08267.x. PubMed PMID: 18067626. [PubMed] [Google Scholar] 41. Wall LR, Ward EC, Cartmill B, Hill AJ. Физиологические изменения механизма глотания после (химио) лучевой терапии рака головы и шеи: систематический обзор. Дисфагия. 2013; 28: 481–493. DOI: 10.1007 / s00455-013-9491-8. PubMed PMID: 24078216. [PubMed] [Google Scholar] 42. Хейзел О.Г., Чарльз Г.В., Даймонд Л.Е. Leukoplakia buccalis. Arch Derm Syphilol. 1950; 61: 781–91. DOI: 10.1001 / archderm.1950.01530120072006. PubMed PMID: 15411218. [PubMed] [Google Scholar] 43. Дионн К.Р., Варнакуласурия С., Бинти Заин Р., Чеонг СК. Потенциально злокачественные заболевания полости рта: современная практика и будущие направления в клинике и лаборатории. Int J Cancer. 2014 [Epub перед печатью]. DOI: 10.1002 / ijc.28754. PubMed PMID: 24482244. [PubMed] [Google Scholar] 44. Напье СС, Спейт П.М. Естественная история потенциально злокачественных поражений и состояний полости рта: обзор литературы. J Oral Path Med.2008; 37: 1–10. DOI: 10.1111 / j.1600-0714.2007.00579.x. PubMed PMID: 18154571. [PubMed] [Google Scholar] 45. Сюэ СС, Ван WC, Чен СН, Лин СС, Чен Ю.К., Линь Л.М. Злокачественная трансформация у 1458 пациентов с потенциально злокачественным поражением слизистой оболочки полости рта: последующее исследование, проведенное в больнице Тайваня. J Oral Pathol Med. 2007; 36: 25–9. PubMed PMID: 17181738. [PubMed] [Google Scholar] 46. Warakulasariya S, Bouquot JE, Reibel J, Dabelsteen E. Системы классификации оральной эпителиальной дисплазии: прогностическая ценность, полезность, слабые места и возможности для улучшения.J Oral Pathol Med. 2008. 37: 127–33. PubMed PMID: 18251935. [PubMed] [Google Scholar] 47. Разави С.М., Торабиния Н., Тахририан Д. Экспрессия VEGF в нормальных и диспластических слизистых оболочках и SCC с использованием иммуногистохимии. Журнал Исфаханской стоматологической школы. 2012; 8: 36–44. [Google Scholar] 48. Ремани П., Бхаттатири В.Н., Бинду Л., Чандралекха Б., Виджаякумар Т., Наир М.К. Корреляция связывания лектина с метастазами в лимфатические узлы при раке полости рта. Oral Oncol. 1997; 33: 19–22. DOI: 10.1016 / S0964-1955 (96) 00044-9.PubMed PMID: 9192548. [PubMed] [Google Scholar] 49. Саку Т., Окабе Х. Дифференциальные связывания лектинов в нормальном и предраковом эпителии и плоскоклеточном раке слизистой оболочки полости рта. J Oral Pathol Med. 1989; 18: 438–45. DOI: 10.1111 / j.1600-0714.1989.tb01340.x. PubMed PMID: 2481735. [PubMed] [Google Scholar] 50. Джин Ю.Т., Линь Л.М. Паттерны связывания лектина в плоском эпителии при экспериментально индуцированной карциноме буккального мешка хомяка. J Oral Pathol Med. 1989; 18: 446–50. DOI: 10.1111 / j.1600-0714.1989.tb01341.Икс. PubMed PMID: 2514262. [PubMed] [Google Scholar] 51. Пиллаи К.Р., Ремани П., Каннан С., Суджатан К., Мэтью Б., Виджаякумар Т. и др. Лектиновая гистохимия предраковых и злокачественных поражений полости рта: корреляция паттерна связывания JFL и PNA с прогрессированием опухоли. Eur J Cancer B Oral Oncol. 1996; 32: 32–7. DOI: 10.1016 / 0964-1955 (95) 00051-8. PubMed PMID: 8729616. [PubMed] [Google Scholar] 52. Букет JE, Фартинг PM, Speight PM. Патология рака полости рта и предрака. Текущая диагностическая патология.1996. 3: 165–176. [Google Scholar] 53. Джонсон Н.В., Джаясекара П., Амарасингхе А.А. Плоскоклеточный рак и предшествующие поражения ротовой полости: эпидемиология и этиология. Периодонтол 2000. 2011; 57: 19–37. DOI: 10.1111 / j.1600-0757.2011.00401.x. PubMed PMID: 21781177. [PubMed] [Google Scholar] 54. van der Waal I. Потенциально злокачественные заболевания полости рта: можно ли предсказать и предотвратить злокачественную трансформацию? Med Oral Patol Oral Cir Bucal. 2014; 19: e386–90. DOI: 10.4317 / medoral.20205. PubMed PMID: 24 2; PubMed PMCID: PMC4119315.[Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Варнакуласурия С., Райбель Дж., Буквот Дж., Дабелстин Э. Системы классификации дисплазии орального эпителия: прогностическая ценность, полезность, слабые места и возможности для улучшения. J Oral Pathol Med. 2008. 37: 127–33. DOI: 10.1111 / j.1600-0714.2007.00584.x. PubMed PMID: 18251935. [PubMed] [Google Scholar] 56. Нисикава Т., Вада С., Вато М., Цуцуи Дж., Нисимура Ю., Мацуока К. и др. Клеточная кинетика и распределение лектинов при карциноме ротовой полости хомяка. J Oral Pathol Med.1994; 23: 17–22. DOI: 10.1111 / j.1600-0714.1994.tb00248.x. PubMed PMID: 8138976. [PubMed] [Google Scholar] 57. Люмерман Х., Фридман П., Керпель С. Дисплазия эпителия полости рта и развитие инвазивной плоскоклеточной карциномы. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1995; 79: 321–329. DOI: 10.1016 / S1079-2104 (05) 80226-4. PubMed PMID: 7621010. [PubMed] [Google Scholar] 58. Букет J.E., Speight PM, Farthing PM. Эпителиальная дисплазия слизистой оболочки полости рта. Проблемы диагностики и особенности прогноза. Текущая диагностическая патология.2006; 12: 11–21. [Google Scholar] 59. Pindborg JJ, Reibel J, Holmstrup P. Субъективность в оценке дисплазии эпителия полости рта, карциномы in situ и начальной карциномы. J Oral Pathol. 1985; 14: 698–708. DOI: 10.1111 / j.1600-0714.1985.tb00549.x. PubMed PMID: 3932623. [PubMed] [Google Scholar] 60. Feller L, Kramer B, Raubenheimer EJ, Lemmer J. Дисплазия эмали с синдромом гамартоматозной атипичной фолликулярной гиперплазии (EDHFH): предполагаемые патогенные механизмы. SADJ. 2008; 63: 102–5. PubMed PMID: 18561809.[PubMed] [Google Scholar] 61. Mehrotra R, Gupta DK. Захватывающие новые достижения в диагностике рака полости рта: пути к раннему выявлению. Голова Шея Онкол. 2011; 3:33. DOI: 10.1186 / 1758-3284-3-33. PubMed PMID: 21798030; PubMed Central PMCID: PMC3170277. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Bhoopathi V, Mascarenhas AK. Эффективность челюстно-лицевой хирургии по сравнению с щеточной биопсией OralCDx в диагностике диспластических поражений полости рта. J Oral Maxillofac Surg. 2011; 69: 428–31. DOI: 10.1016 / j.joms.2010.05.040. PubMed PMID: 21122966.[PubMed] [Google Scholar] 63. Bhoopathi V, Kabani S, Mascarenhas AK. Низкая положительная прогностическая ценность биопсии ротовой полости при обнаружении диспластических поражений полости рта. Рак. 2009; 115: 1036–40. doi 10.1002 / cncr.24089. PubMed PMID: 1 | 0. [PubMed] [Google Scholar] 73. Лейн П.М., Гилхули Т., Уайтхед П., Цзэн Х., Пох С.Ф., Нг С. и др. Простое устройство для прямой визуализации флуоресценции тканей ротовой полости. J Biomed Opt. 2006; 11: 024006. DOI: 10,1117 / 1,2193157. PubMed PMID: 16674196. [PubMed] [Google Scholar] 74. Sharma N, Mubeen Отсутствие инвазивного диагностического инструмента для раннего выявления дисплазии эпителия полости рта.J Clin Exp Dent. 2011; 3: 184–8. [Google Scholar] 75. Аван К.Х., Морган П.Р., Варнакуласурия С. Использование хемилюминесценции (ViziLite ™) при обнаружении потенциально злокачественных заболеваний полости рта и доброкачественных кератозов. J Oral Pathol Med. 2011; 40: 541–4. PubMed PMID: 21615500. [PubMed] [Google Scholar] 76. Аван К.Х., Морган П.Р., Варнакуласурия С. Оценка системы визуализации на основе автофлуоресценции (VELscope ™) при обнаружении потенциально злокачественных заболеваний полости рта и доброкачественных кератозов. Oral Oncol. 2011; 47: 274–7.PubMed PMID: 21396880. [PubMed] [Google Scholar] 77. Koch FP, Kaemmerer PW, Biesterfeld S, Kunkel M, Wagner W. Эффективность автофлуоресценции для выявления подозрительных поражений полости рта — проспективное слепое клиническое испытание. Clin Oral Investig. 2011; 15: 975–82. DOI: 10.1007 / s00784-010-0455-1. PubMed PMID: 20714910. [PubMed] [Google Scholar] 78. Бец С.С., Мельманн М., Рик К., Степп Х., Греверс Г., Баумгартнер Р. и др. Автофлуоресцентная визуализация и спектроскопия нормальной и злокачественной слизистой оболочки у пациентов с раком головы и шеи.Лазеры Surg Med. 1999; 25: 323–34. PubMed PMID: 10534749. [PubMed] [Google Scholar] 79. Чанг С.Е., Фостер С., Беттс Д., Марнок В.Е. DOK, клеточная линия, полученная из диспластической слизистой оболочки полости рта человека, демонстрирует частично трансформированный незлокачественный фенотип. Int J Cancer. 1992; 52: 896–902. DOI: 10.1002 / ijc.20612. PubMed PMID: 1459732. [PubMed] [Google Scholar] 80. Голденринг-младший, Рэй Г.С., Ли-младший. Rab11 при дисплазии эпителия Барретта. Yale J Biol Med. 1999; 72: 113–20. PubMed PMID: 10780572; PubMed Central PMCID: PMC2579020.[Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Вебер А., Беллманн У., Бутц Ф., Виттекинд С., Таннапфель А. Экспрессия p53 и его гомологов в первичных и рецидивирующих плоскоклеточных карциномах головы и шеи. Int J Cancer. 2002; 99: 22–8. DOI: 10.1002 / ijc.10296. PubMed PMID: 11948487. [PubMed] [Google Scholar] 82. Польковски В., ван Ланшот Дж. Дж., Тен Кейт Ф. Дж., Баак Дж. П., Титгат Г. Н., Обертоп Х. и др. Значение p53 и Ki67 как маркеров опухолевой прогрессии в последовательности дисплазия-карцинома Барретта.Surg Oncol. 1995; 4: 163–71. DOI: 10.1016 / S0960-7404 (10) 80021-0. PubMed PMID: 7582189. [PubMed] [Google Scholar] 83. Сингх BB, Чендлер FW младший, Whitaker SB, Forbes-Nelson AE. Иммуногистохимическая оценка онкопротеина bcl-2 при дисплазии и карциноме полости рта. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998. 85: 692–8. DOI: 10.1016 / S1079-2104 (98) -3. PubMed PMID: 9638703. [PubMed] [Google Scholar] 84. Далли А.Дж., Абдулмаджид А.А., Аптон З., Фарах CS. Органотипическая культура нормальных, диспластических и плоскоклеточных линий клеток ротовой полости, происходящих от карциномы, выявляет потерю пространственной регуляции CD44 и p75 NTR при злокачественных новообразованиях.J Oral Pathol Med. 2013; 42: 37–46. PubMed PMID: 22643025. [PubMed] [Google Scholar] 85. Габаллах К., Костя Д.Е., Хиллс А., Голлин С.М., Харрисон П., Партридж М. Тканевая инженерия дисплазии полости рта. J Pathol. 2008; 215: 280–9. DOI: 10.1002 / путь.2360. PubMed PMID: 16 4. [PubMed] [Google Scholar] 86. Костя Д.Е., Цинкаловский О., Винтермир О.К., Йоханнесен А.С., Маккензи И.К. Раковые стволовые клетки — новые и потенциально важные мишени для терапии плоскоклеточного рака полости рта. Oral Dis. 2006; 12: 443–54.DOI: 10.1111 / j.1601-0825.2006.01264.x. PubMed PMID: 16 4. [PubMed] [Google Scholar] 87. Оливейра Л. Р., Джеффри С. С., Рибейро-Сильва А. Стволовые клетки при раке груди человека. Histol Histopathol. 2010; 25: 371–85. PubMed PMID: 20054808. [PubMed] [Google Scholar] 88. Якобсен К., Соренсен Я.А., Кассем М., Тигесен Т.Х. Мезенхимальные стволовые клетки в реконструктивной хирургии полости рта: систематический обзор литературы. J Oral Rehabil. 2013; 40: 693–706. DOI: 10.1111 / joor.12079. PubMed PMID: 23834336. [PubMed] [Google Scholar] 89.Чой Дж. Х., Гимбл Дж. М., Ли К., Марра К. Г., Рубин Дж. П., Ю Дж. Дж. И др. Инженерия жировой ткани для регенерации мягких тканей. Tissue Eng Часть B Ред. 2010; 16: 413–26. DOI: 10.1089 / ten.teb.2009.0544.PubMed PMID: 20166810; PubMed Central PMCID: PMC2946881. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Scheller EL, Krebsbach PH, Kohn DH. Тканевая инженерия: современное состояние реабилитации полости рта. J Oral Rehabil. 2009; 36: 368–89. DOI: 10.1111 / j.1365-2842.2009.01939.x. PubMed PMID: 19228277; PubMed Central PMCID: PMC2744808.[Бесплатная статья PMC] [PubMed] [Google Scholar] 91. Альсберг Э., Хилл Э., Муни Диджей. Инженерия черепно-лицевой ткани. Crit Rev Oral Biol Med. 2001; 12: 64–75. DOI: 10.1177 / 10454411010120010501. PubMed PMID: 11349963. [PubMed] [Google Scholar] 92. Мохарамзаде К., Брук И.М., Ван Норт Р., Скатт А.М., Торнхилл М.Х. Слизистая оболочка полости рта с тканевой инженерией: обзор научной литературы. J Dent Res. 2007. 86: 115–24. DOI: 10.1177 / 154405 Плоскоклеточная дисплазия — это микроскопическое изменение плоскоклеточного эпителия, при котором повышается риск прогрессирования плоскоклеточного рака.Плоскоклеточная дисплазия может проявляться в виде клинически идентифицируемых поражений, что позволяет своевременно обнаруживать и наблюдать. Макроскопические поражения, которые могут содержать дисплазию, включают лейкоплакию (белое пятно), эритроплакию (красное пятно) и пятнистые поражения. Эритроплакия и пятнистые поражения демонстрируют более сильную связь с микроскопической дисплазией по сравнению с лейкоплакией. Микроскопически диспластический эпителий показывает как цитологическую, так и архитектурную атипию (рис. 2.1). Часто наблюдаются изменчивость размера ядер и значительно увеличенные ядра.Ядра могут иметь неправильный контур с гиперхроматическим грубым хроматином или везикулярным хроматином. Кератиноциты демонстрируют архитектурную неупорядоченность с неравномерным созреванием. Истинную дисплазию иногда трудно отличить от реактивной атипии, особенно при наличии острого воспаления, язвы или инфекции. В области головы и шеи ороговевающая плоскоклеточная дисплазия является наиболее распространенным типом дисплазии. Система классификации использует схему классификации дисплазии, установленную для неороговевающего эпителия нижних половых путей.Поскольку дисплазия возникает в базальном слое эпителия и распространяется по мере прогрессирования на верхние эпителиальные слои, в схеме легкая дисплазия классифицируется как поражение только нижней трети эпителия, умеренная дисплазия — как распространение на среднюю треть, а тяжелая — как поражение. дисплазия как распространение на поверхностную треть эпителия. Хотя эта система оценок хорошо работает при некератинизирующей дисплазии, она, по-видимому, несколько проблематична при ороговевшей дисплазии. В отличие от некератинизирующей дисплазии, полное вовлечение эпителия дисплазией не требуется для инвазии в ороговевшие поражения (см.рис.2.1D), так как хорошо известно, что инвазивная карцинома может развиться даже тогда, когда дисплазия присутствует только в базальных слоях. Чтобы правильно передать переменные факторы риска, практикующие патологоанатомы часто классифицируют дисплазию, включая степень цитологической атипии и архитектурную атипию в традиционную трехуровневую систему оценки, при этом результат является несколько субъективным, что приводит к умеренному или плохому меж- и внутреннему наблюдению. воспроизводимость. 3-5 Бинарная система оценки, различающая дисплазию только низкой и высокой степени, демонстрирует большую воспроизводимость по сравнению с трехуровневой оценкой и поэтому настоятельно рекомендуется. 6,7 Несмотря на несовершенство системы, классификация дисплазии в настоящее время является лучшим предиктором прогрессирования рака. Кератотический эпителий с дисплазией в целом несет в 3-5 раз повышенный риск развития рака по сравнению с кератозом без дисплазии. 8 Тяжелая дисплазия имеет приблизительно 30% -ный риск прогрессирования до рака по сравнению с 6% -ным риском прогрессирования дисплазии легкой степени. Иногда может регрессировать легкая и даже умеренная дисплазия.Помимо морфологической оценки, биомаркеры для прогнозирования генеза рака плоского эпителия привлекли значительный исследовательский интерес, 9,10 , но в настоящее время ни один из них не подходит для клинической практики. Бронхиальные базальные клетки обычно были круглыми или овальными и прикреплялись к базальной мембране в один слой. Ядра обычно были равны и никогда не превышали 1.В 5 раз больше диаметра нормального малого лимфоцита в состоянии покоя. Столбчатые эпителиальные клетки располагались на слое базальных клеток вертикально по направлению к просветной поверхности слизистой оболочки бронхов. Между ними были вкраплены несколько клеток, содержащих интрацитоплазматический муцин. Ширина ядра нормальной столбчатой клетки овальной формы приблизительно равна диаметру ядра нормальной базальной клетки. В проксимальной доле бронха столбчатые клетки располагались псевдостратифицированным образом, до трех слоев клеток.В сегментарных и более дистальных субсегментарных бронхах столбчатые клетки часто располагались в виде монослоя. Нормальные базальные клетки и столбчатые клетки были морфологически различимы, имели тонкий ядерный хроматин и незаметные ядрышки (рис. 1). Нормальный бронхиальный эпителий (H&E, × 200). Дисплазия бронхиального эпителия была идентифицирована на основании ядерной атипии и неправильного расположения клеток. Ядерная атипия распознавалась по: увеличенному диаметру ядра (или ядерной ширине столбчатой / овальной клетки), достигающей, по крайней мере, двойного диаметра нормального малого лимфоцита в состоянии покоя; повышенные нуклео-цитоплазматические соотношения; неровности ядерных очертаний; темный или грубо неровный ядерный хроматин; и одно или несколько выступающих ядрышек.Под диспластическим эпителием наблюдались фиброзная гиперплазия и неоваскуляризация. Однако увеличение количества диспластических клеток и количества клеточных слоев не всегда было связано со степенью дисплазии бронхиального эпителия. Основываясь на морфологических особенностях, дисплазия бронхиального эпителия может быть разделена на дисплазию базальных клеток, дисплазию столбчатых клеток, дисплазию бронхиального эпителия с переходной дифференцировкой (дисплазия бронхиального эпителия TD-типа) и плоскоклеточная дисплазия. Нормальные базальные клетки были заменены диспластическими базальными клетками с круглым, овальным или неправильным внешним видом, без межклеточных мостиков и дифференцировки в сторону столбчатых бронхиальных клеток, плоскоклеточного расслоения и кератинизации (рис. 2). Группы диспластических клеток были неоднородными. Базально-клеточная дисплазия низкой степени. Увеличенные ядра имели диаметр более чем вдвое больше, чем небольшой покоящийся лимфоцит, и имели явные ядрышки и ядерный хроматин.Столбчатые эпителиальные клетки присутствовали на просветной поверхности диспластических базальных клеток (H&E, × 200). Бронхиальная столбчато-клеточная дисплазия была локализована на слое базальных клеток, и клетки имели столбчатый или овальный контур. Они появлялись либо в виде бородавчатого рисунка без стромальных ножек, либо в виде плоского поражения с увеличенными слоями эпителиальных клеток пораженной слизистой оболочки (Рисунок 3), либо в виде решетчатого рисунка (Рисунок 4). Внутрицитоплазматический муцин присутствовал в некоторых диспластических столбчатых клетках. Столбчато-клеточная дисплазия низкой степени с очаговой дисплазией высокой степени. Виден внутриклеточный муцин. Под диспластическими столбчатыми клетками был виден единственный слой базальных клеток (H&E, × 200). Дисплазия столбчатых клеток, крибриформная структура с инфильтрацией нескольких воспалительных клеток (H&E, × 200). Эта модель дисплазии бронхиального эпителия проявляла некоторые, но не все, морфологические особенности базально-клеточного, столбчато-клеточного и / или плоского эпителия и, по-видимому, находилась в морфологическом переходе между ними — отсюда был введен термин дисплазия бронхиального эпителия с переходной дифференцировкой (дисплазия бронхиального эпителия TD-типа).Диагноз был поставлен, когда бронхиальный эпителий демонстрировал дисплазию на всю толщину с гомогенной цитологической морфологией по всему эпителию без межклеточных мостиков или с очаговыми межклеточными мостами без плоского расслоения и ороговения (рисунки 5 и 6). Обычно псевдомногослойные или многослойные структуры часто встречаются в тех примерах с межклеточными мостиками (рис. 7). Диспластические клетки были столбчатыми, овальными или круглыми. В некоторых клетках присутствовали внутриклеточные муциновые вакуоли. Дисплазия бронхиального эпителия TD-типа низкой степени (H&E, × 200). Дисплазия бронхиального эпителия TD-типа высокой степени (H&E, × 200). Дисплазия бронхиального эпителия TD-типа, низкой степени злокачественности, с разбросанными диспластическими клетками высокой степени злокачественности. Межклеточные мосты присутствовали, но плоское расслоение отсутствовало (H&E, × 200). Плоская дисплазия (рис. 8) была идентифицирована по критериям, описанным в классификации ВОЗ для опухолей легких и плевры. 18 Однако мы обнаружили, что небольшая часть плоскоклеточной дисплазии демонстрирует выраженную атипию, но с небольшим увеличением количества клеток и слоев. Плоскоклеточная дисплазия. Слева — дисплазия низкой степени, справа — дисплазия высокой степени (H&E, × 200). Для описанных выше поражений была принята двухуровневая система классификации — дисплазия низкой и высокой степени, основанная на степени ядерной атипии и неравномерности расположения клеток. Дисплазия низкой степени выражалась только в легкой или умеренной ядерной атипии с умеренно нерегулярным расположением клеток: увеличенные ядра менее чем в два раза больше диаметра нормальной эпителиальной клетки (или ширины столбчатой / овальной клетки), плеоморфизм от легкой до умеренной с плотным хроматин и незаметные ядрышки (рис. 2, 3, 4, 5 и 7). Дисплазия высокой степени проявляется выраженной ядерной атипией и очень неупорядоченным расположением клеток. Диаметр ядер был вдвое или больше нормального значения.Диспластические клетки имели очевидный ядерный плеоморфизм, грубый хроматин и выраженные и / или множественные ядрышки (рис. 6). Клетки дисплазии высокой степени злокачественности появлялись в виде кластеров или были разбросаны по области дисплазии низкой степени злокачественности (Рисунки 3 и 7). В случае плоскоклеточной дисплазии слабая степень была подтверждена, когда диспластические клетки были ограничены нижней половиной пораженного эпителия (см. Левую часть рисунка 8), тогда как дисплазия высокой степени была подтверждена, когда почти вся толщина эпителия была подтверждена. плоский эпителий был вовлечен диспластическими клетками (см. правую часть рисунка 8).Соответственно, дисплазия низкой степени была обнаружена в 75 случаях, а дисплазия высокой степени — в 25. Тканевые блоки, показывающие обширную и высокую степень дисплазии бронхиального эпителия в первом разделе, были использованы для последующих иммуногистохимических исследований. Приблизительно 15-20 гистологических срезов были повторно вырезаны последовательно из каждого из выбранных блоков ткани. Один из них был окрашен гематоксилином и эозином и исследован под микроскопом, чтобы подтвердить наличие вышеупомянутых классических диспластических поражений.Пациенты с незначительной дисплазией бронхиального эпителия или без нее были исключены из иммунопрофиля. В результате этой процедуры было доступно 53 гистологических среза из 26 образцов легких для иммуногистохимического исследования. Каждый раздел содержал по крайней мере один из вышеупомянутых классических типов дисплазии бронхиального эпителия. Нормальный бронхиальный эпителий между очагами диспластии обеспечивал контрольную ткань для нормальных базальных клеток и столбчатых клеток. Кроме того, были выбраны два случая нормального эпителия пищевода, чтобы обеспечить нормальный контроль плоского эпителия.Иммуногистохимическая экспрессия каждого из вышеупомянутых антител, особенно Ki-67 и p53, определялась наличием однозначно положительно окрашивающих клеток, независимо от их количества. Нормальные эпителиальные клетки бронхов и плоский эпителий показали типичные паттерны иммуноокрашивания: базальные клетки положительны на CK17, столбчатые клетки положительны на CK7, 8 и 18, а плоскоклеточные клетки положительны на CK10 / 13. Иммуноокрашивание диспластического эпителия было по существу аналогично таковому у нормальных контролей, но показало некоторые изменения в том, что дисплазия базальных клеток была фокально положительной для CK10 / 13, а плоскоклеточная дисплазия была фокально положительной для CK17 и иногда положительной для CK8 и 18.Однако некоторые диспластические эпителиальные клетки бронхов были отрицательными по соответствующим специфическим маркерам даже для всех указанных выше CK. Иммуноокрашивание было неоднородным при дисплазии эпителия бронхов TD-типа. Некоторые из этих поражений были положительными для отдельных членов семейства CK (CK10 / 13, 17, 7, 8 или 18), а некоторые — положительными для всех из них (Рисунки 9 и 10). Были разные степени окрашивания, и в тех диспластических очагах, показывающих иммунореактивность в отношении нескольких CK, разные клетки окрашивались на разные CK. CK10 / 13 Иммуноокрашивание бронхиальной эпителиальной дисплазии TD-типа. Поверхностные плоские клетки показали сильное положительное окрашивание на CK10 / 13, что указывало на плоскоклеточную дифференцировку, в то время как другие клетки показали слабое положительное окрашивание на CK10 / 13 (Envision ™, × 200). Иммуноокрашивание CK8 бронхиальной эпителиальной дисплазии TD-типа. Фигура показывает положительную реакцию от слабой до промежуточной для CK8 (то же поле, что и на рисунке 9) (Envision ™, × 200). Все типы дисплазии эпителия бронхов были отрицательными по TTF-1, SPA, CgA и Syn. p53 и Ki-67 было идентифицировано при различных типах дисплазии бронхиального эпителия (рисунки 11 и 12, таблица 1). Иммуноокрашивание Ki-67 было более распространенным и имело более сильную окраску, чем p53. Уровень экспрессии Ki-67 был значительно выше, чем у р53 (тест МакНемара, P = 0,013) (таблица 2). Bcl-2 экспрессируется только в 46,2% нормальных базальных клеток (12/26) и редко экспрессируется в других типах нормального и диспластического бронхиального эпителия. Иммуноокрашивание Ki-67 дисплазии бронхиального эпителия (Envision ™, × 400). Иммуноокрашивание p53 дисплазии бронхиального эпителия (Рисунки 11 и 12 взяты из той же области и того же поражения. Обратите внимание, что p53-положительных клеток меньше, чем Ki-67-положительных клеток) (Envision ™, × 400 ). Типы дисплазии бронхиального эпителия, выявленные в настоящем исследовании, представлены в таблице 3.Различные типы и степени дисплазии бронхиального эпителия могут быть обнаружены в одном и том же бронхе или в одном и том же гистологическом срезе. Поражения одного и того же или разных типов дисплазии бронхиального эпителия иногда отделялись друг от друга участками нормального бронхиального эпителия, а иногда они были смежными без нормальной промежуточной ткани. В таких случаях один очаг дисплазии переходил в другой. Интересно, что дисплазия бронхиального эпителия высокой степени обычно наблюдалась в случаях обширной дисплазии низкой степени.В остальном дисплазия высокой степени была редкостью. С учетом этих результатов и для анализа корреляции степени дисплазии бронхиального эпителия и бронхогенной карциномы, случаи в этом исследовании были разделены на три группы в зависимости от степени и степени дисплазии бронхиального эпителия. Группа I имела нормальный бронхиальный эпителий с простой гиперплазией или без нее, а иногда и с небольшими очагами дисплазии слабой степени.Группа II имела бронхиальный эпителий с обширной дисплазией низкой степени (без каких-либо очагов дисплазии высокой степени) или имела очаги дисплазии низкой степени с небольшими группами клеток (несколько или десятки), показывающими дисплазию высокой степени. Группа III имела обширную дисплазию низкой степени плюс различные очаги дисплазии высокой степени. Здесь обширная дисплазия низкой степени была определена, когда по крайней мере 40% исследованных слайдов показывали дисплазию и что более 20% слайдов с дисплазией занимали 1/3 большей части внутренней окружности бронхов.В этом исследовании 39 случаев были отнесены к группе I, 50 случаев — к группе II и 25 случаев — к группе III. Частота дисплазии бронхиального эпителия с бронхогенной карциномой была значительно выше, чем с BAC. Степень дисплазии бронхиального эпителия также положительно коррелировала с заболеваемостью бронхогенной карциномой и MPLC (Таблица 4). Но никакой корреляции гистологических типов между дисплазией бронхиального эпителия и бронхогенной карциномой не было выявлено. Дисплазия бронхиального эпителия часто наблюдалась в сегментарных и субсегментарных бронхах, особенно в проксимальных областях. Дисплазия также была обнаружена в долевых бронхах, бронхах и бронхиолах, но частота в этих областях была намного ниже, чем в сегментарных и субсегментарных бронхах. Расположение и степень дисплазии бронхиального эпителия не были связаны с расстоянием от первичной карциномы легкого. Тезисы: ПРИНЯТО: КЛИНИЧЕСКИЕ ВИГНЕТТЫ / СЛУЧАЙНЫЕ СЛУЧАИ — ПИЩЕВОД Hallowell, David M. BA 1 Джеффри Джилл, доктор медицины 2 1 Медицинский колледж Морсани Университета Южной Флориды, Тампа, Флорида; 2 Больница Джеймса А. Хейли VA, Тампа, Флорида В США аденокарцинома пищевода представляет собой подавляющее большинство случаев рака пищевода.Эта форма рака, которой, вероятно, предшествовала дисплазия Барретта, обычно возникает в дистальных отделах пищевода. Гораздо реже плоскоклеточный рак развивается в средней и верхней части пищевода и все чаще ассоциируется с вирусом папилломы человека (ВПЧ). Мы представляем необычный случай плоской интраэпителиальной неоплазии высокой степени, обнаруженной на стыке GE у пациента с дисплазией пищевода Барретта в анамнезе, который ранее лечился с помощью радиочастотной абляции (РЧА). 70-летний мужчина с историей пищевода Барретта с 1990 года, гранулярно-клеточной опухолью дистального отдела пищевода, удаленной в 2013 году, и РЧА дистального отдела пищевода в апреле 2015 года с последующими стриктурами, представленными на ФГДС с расширением.Было отмечено, что сужение в соединении GE было стабильным по результатам предыдущих эндоскопий, а дилатация была выполнена с хорошим результирующим разрывом слизистой оболочки. Соединение GE было рыхлым и узловатым, и была проведена биопсия. При патологии были выявлены фрагменты пищевода Барретта без дисплазии, но, кроме того, на плоской слизистой оболочке наблюдалась гиперплазия и выраженная цитологическая атипия и койлоцитарные изменения с выраженным острым воспалением. Ki-67 показал окрашивание ядер по всей толщине диспластического плоского эпителия, в то время как окрашивание p53 было редким и слабым.p16 показал положительный результат, подобный блоку, а иммуногистохимическое окрашивание на ВПЧ показало положительное ядерное окрашивание диспластического плоского эпителия. Эти данные указывают на диагноз: ВПЧ-положительная плоскоклеточная интраэпителиальная неоплазия высокой степени. ЭУЗИ подтвердило, что поражение ограничено слизистой оболочкой и никаких подозрительных соседних лимфатических узлов не отмечено. В настоящее время пациенту назначена ФГДС с повторной биопсией по сравнению с эндоскопической резекцией слизистой оболочки. Этот случай представляет собой уникальное проявление плоской интраэпителиальной неоплазии.Поражение возникает не только в дистальном отделе пищевода, но и у пациента с предшествующим заболеванием пищевода Барретта, получавшим РЧА. Это ставит под вопрос, может ли предшествующее лечение РЧА способствовать плоскоклеточной дисплазии. Это также демонстрирует важность наблюдения после РЧА с тщательным эндоскопическим обследованием и при необходимости прицельной биопсией дистального отдела пищевода. Дисплазия шейки матки — это аномальное изменение клеток шейки матки.Ранние изменения, называемые врачами низкосортными поражениями, могут сохраняться и перерасти в высокозлокачественные поражения, которые могут привести к раку шейки матки. Незначительно аномальные клетки шейки матки обычно исчезают сами по себе. И дисплазию шейки матки, и рак шейки матки можно лучше всего лечить, если они обнаружены на ранней стадии. Вирус, передающийся половым путем, называемый ВПЧ (вирус папилломы человека), вызывает большинство дисплазий шейки матки и все виды рака шейки матки. Дисплазия шейки матки часто встречается у ВИЧ-инфицированных людей с шейкой матки. Однако среди ВИЧ-положительных людей, живущих в странах с высоким уровнем дохода и получающих регулярное гинекологическое наблюдение и уход, рак шейки матки встречается нечасто. Слова, которые мы здесь используем — CATIE стремится использовать язык, который подходит каждому. Люди используют разные термины для описания своих гениталий. В этом тексте для описания гениталий используются медицинские термины, такие как влагалище и пенис. Цисгендеры и человек часто могут идентифицировать себя с этими терминами. Некоторые трансгендеры ii могут использовать другие термины, например, переднее отверстие и без бретелек. CATIE признает и уважает то, что люди используют слова, которые им наиболее удобны. Ключевые сообщения о ВПЧ для клиентов доступны здесь. Шейка матки — это отверстие матки (матки), которое ведет во влагалище. Шейку матки можно нащупать кончиком пальца во влагалище. При дисплазии шейки матки аномальные клетки развиваются на поверхности шейки матки. Эти аномальные клетки называются повреждениями. Поражения при дисплазии шейки матки могут регрессировать, (что означает, что они уменьшаются и могут даже исчезнуть), сохраняться (поражения остаются, но не изменяются) или прогрессируют до , превращаясь в высокосортное поражение или рак шейки матки. Рак шейки матки — это аномальный рост клеток шейки матки. Через несколько лет аномальные поражения шейки матки могут постепенно перерасти в рак. 1–3 Дисплазия и рак шейки матки связаны с очень распространенным вирусом, который называется вирусом папилломы человека (ВПЧ). Существует более 100 штаммов ВПЧ, около 40 из которых могут передаваться половым путем. Некоторые штаммы вызывают бородавки, в том числе остроконечные кондиломы (аномальные разрастания на коже), некоторые приводят к раку гениталий или ануса, кишечника или легких, горла и рта.Некоторые из них не имеют известного эффекта. Иммунная система помогает защитить от развития дисплазии шейки матки и рака. Люди, чья иммунная система ослаблена лекарствами для трансплантации или такими заболеваниями, как ВИЧ, подвергаются большему риску заражения ВПЧ, дисплазии шейки матки и рака шейки матки. Женщины и трансгендерные мужчины, инфицированные ВИЧ, подвергаются более высокому риску, и этот риск, по-видимому, увеличивается по мере снижения числа CD4. Хотя ВПЧ необходим для рака шейки матки, другие факторы способствуют развитию дисплазии шейки матки и рака.С этим состоянием связано курение сигарет. Вызывающие рак химические вещества в сигаретном дыме концентрируются в жидкостях шейки матки, и они могут повлиять на здоровье клеток шейки матки, увеличивая риск того, что эти клетки станут ненормальными. Наличие в прошлом инфекции, передаваемой половым путем (ИППП), многократная беременность или неправильное питание также могут увеличить риск дисплазии шейки матки и рака. Поскольку ВПЧ передается половым путем, наличие нескольких сексуальных партнеров увеличивает риск контакта человека с этим вирусом.Однако даже люди, у которых мало партнеров, по-прежнему подвержены риску заражения ВПЧ. 3–6 Обычно симптомы дисплазии шейки матки отсутствуют. Остроконечные кондиломы являются признаком того, что кто-то подвергся воздействию определенных типов ВПЧ, которые отличаются от типов, которые с наибольшей вероятностью могут привести к дисплазии шейки матки и раку. Важно отметить, что люди могут быть заражены ВПЧ и не иметь остроконечных кондилом или каких-либо других симптомов. Точно так же часто отсутствуют физические симптомы рака шейки матки, особенно на ранних стадиях.На поздних стадиях рака шейки матки может наблюдаться боль в животе или пояснице, боль или кровотечение при вагинальном половом акте, необычные выделения из влагалища или кровотечение между менструациями. 2,3 Регулярные осмотры органов малого таза, включая мазки Папаниколау и ВПЧ, могут помочь диагностировать или контролировать ВПЧ, дисплазию шейки матки или рак. Чтобы сделать мазок Папаниколау, врач вводит крошечную щеточку и небольшой деревянный шпатель во влагалище и проводит ими по шейке матки, чтобы освободить и собрать клетки.Клетки размазывают на предметном стекле, которое отправляют в лабораторию для исследования. Пап-тест помогает выявить аномальные клетки. Людям с ВИЧ тесты Папаниколау обычно проводятся дважды в течение первого года после постановки диагноза ВИЧ, а затем один раз в год, если первые два теста показали нормальные результаты. Тем не менее, многие врачи с ВИЧ-положительными людьми на их лечении рекомендуют делать мазок Папаниколау каждые шесть месяцев. Хотя мазки Папаниколау полезны, они могут давать «ложноотрицательные» результаты. Другими словами, лаборатория может сообщить результат теста как «нормальный», если действительно есть изменения в клетках шейки матки.Это причина того, что тестирование на ВПЧ все чаще используется в дополнение к Пап-тестам. Для тестирования на ВПЧ врачи могут собрать небольшое количество жидкости из шейки матки и проверить ее на наличие ВПЧ. Многие врачи рекомендуют людям с шейкой матки, у которых недавно был диагностирован ВИЧ, пройти кольпоскопию. Кольпоскоп — это микроскоп, который изучает влагалище, открытое зеркалом, и позволяет врачу визуально исследовать шейку матки. Перед установкой кольпоскопа шейку матки слегка промывают слабым раствором уксуса.Раствор уксуса позволяет аномальным клеткам более четко выделяться на фоне окружающей ткани. При проведении кольпоскопии врач проводит биопсию (удаление крошечного кусочка ткани из шейки матки), а иногда и эндоцервикальный выскабливание (соскоб ткани с шейки матки). Эта процедура может быть болезненной или вызывать судороги. Образец биопсии позволяет лаборантам изучить ткань и подтвердить состояние ткани шейки матки. Пап-тесты проводятся семейными врачами и гинекологами в рамках регулярной медицинской помощи.Однако кольпоскопия и биопсия в основном, но не исключительно, выполняются гинекологами. ВИЧ-положительный человек с признаками аномалий шейки матки, влагалища или вульвы также должен пройти аноскопию или визуальный осмотр заднего прохода и анального канала с помощью микроскопа, аналогичного кольпоскопу. Это связано с тем, что изменения клеток, вызванные ВПЧ, также могут происходить в анусе и приводить к анальной дисплазии. 1,7 Результаты анализов на дисплазию шейки матки можно описать множеством медицинских терминов. Вот некоторые из наиболее распространенных результатов тестов: Если кому-то поставлен диагноз ВПЧ, уведомление партнера не требуется в качестве меры общественного здравоохранения, в отличие от диагноза хламидиоза, гонореи, сифилиса или ВИЧ. 3,6,8,9 Лечение дисплазии шейки матки и рака варьируется от одного человека к другому, в зависимости от расположения и размера поражения или рака, а также от того, является ли поражение низкой или высокой степени или распространился ли рак на другие части тела. Желает ли человек забеременеть, также влияет на решения о лечении. Людей с раком шейки матки могут направить к гинекологу-онкологу или онкологу — врачу, специализирующемуся на лечении рака. Есть несколько способов лечения дисплазии шейки матки: Есть несколько вариантов лечения, если рак подтвержден: Хотя дисплазию шейки матки и рак можно успешно лечить, ВИЧ-положительные люди подвергаются высокому риску повторного появления этого рака. Важно проводить последующее лечение с помощью регулярных мазков Папаниколау и кольпоскопии каждые три-шесть месяцев. 10 Поскольку ВИЧ и ВПЧ передаются половым путем, ВИЧ-положительные люди часто одновременно инфицированы обоими этими вирусами. ВИЧ ослабляет иммунную систему, и у ВИЧ-инфицированных часто встречается дисплазия шейки матки. Прием АРТ (антиретровирусная терапия ВИЧ) может снизить выработку ВИЧ, улучшить количество клеток CD4 и значительно снизить риск развития многих заболеваний, связанных со СПИДом. АРТ не может предотвратить рак шейки матки.Однако при регулярных гинекологических осмотрах и мазках Папаниколау исследования показали, что рак шейки матки не часто встречается у этих людей в странах с высоким уровнем доходов. 11 Практика более безопасного секса с использованием презервативов или занятия сексом без проникновения могут помочь снизить риск заражения ВПЧ. Однако презервативы не устраняют полностью риск передачи ВПЧ, поскольку вирус может присутствовать на коже, не покрытой презервативом. Презервативы также снижают риск других ИППП, способствующих развитию дисплазии и рака.Отказ от курения может помочь снизить риск дисплазии шейки матки и рака. Три вакцины против генотипов ВПЧ доступны в Канаде. Гардасил разрешен к применению «женщинам и мужчинам в возрасте от 9 до 26 лет». Он защищает от ВПЧ типов 16 и 18, которые вызывают примерно 70% случаев рака шейки матки, а также от ВПЧ типов 6 и 11, которые не вызывают рака, но вызывают примерно 90% бородавок на или вокруг гениталий и ануса. Гардасил 9 защищает от ВПЧ типов 6, 11, 16 и 18, а также от типов 31, 33, 45, 52 и 58, которые также могут вызывать рак.Церварикс разрешен для использования только «женщинам в возрасте от 10 до 25 лет». Он защищает только от ВПЧ 16 и 18 типов. В клинических испытаниях цисгендеров и девочек и молодых женщин вакцины обеспечивали очень высокий уровень — более 90% — защиты от осложнений, таких как дисплазия шейки матки и ануса, а также остроконечные кондиломы, связанные с целевыми генотипами ВПЧ. Показатели защитного действия сохранялись не менее 10 лет после вакцинации в некоторых испытаниях. Чтобы любая вакцина подействовала, необходимо ввести три дозы в течение шести месяцев. Вакцины не обеспечивают защиты от вируса папилломы человека, которым уже инфицированы люди, но обеспечивают отличную защиту от вируса папилломы человека, которому человек еще не подвергался. Кроме того, вакцины , а не , показали свою эффективность для лечения установленной инфекции ВПЧ и не одобрены в Канаде для такого использования. Следует избегать приема гардасила и церварикса беременным. Гардасил можно назначать кормящим грудью, тогда как Церварикс следует использовать во время кормления грудью только тогда, когда возможные преимущества перевешивают возможные риски. Важно помнить, что даже если кто-то получил одну из вакцин, он защищен только от вызывающих рак типов ВПЧ, охватываемых вакциной, которую он получил. Регулярные медицинские осмотры с осмотром органов малого таза и скринингом на рак шейки матки с тестами Папаниколау для женщин и трансмужчин в возрасте от 20 лет, а также тестирование на вирусы, начиная с 30 лет, по-прежнему необходимы, чтобы помочь всем людям, независимо от их ВИЧ-статуса, снизить риск рака шейки матки и следите за признаками дисплазии шейки матки и рака. 1,3,5,12–15 Дисплазия шейки матки — это , а не рак, но ее необходимо лечить, чтобы предотвратить ее перерастание в рак. Рак шейки матки — серьезное заболевание, особенно для ВИЧ-инфицированных. Чем раньше он будет обнаружен, тем больше шансов на успешное лечение. Риск заражения ВПЧ, развития дисплазии шейки матки и рака шейки матки можно снизить на: Сноски i Цисгендер — лицо, чья гендерная идентичность совпадает с полом, назначенным им при рождении ii Трансгендер — общий термин, который описывает людей с различной гендерной идентичностью и гендерными выражениями, которые не соответствуют стереотипным представлениям о том, что значит быть девушкой / женщиной или мальчиком / мужчиной в обществе. (Определения взяты из Создание аутентичных пространств: набор инструментов для гендерной идентичности и гендерного самовыражения для поддержки реализации институциональных и социальных изменений , опубликовано The 519, Торонто, Онтарио.) Список литературы Кредиты Этот информационный бюллетень был разработан в сотрудничестве с Советом по сексуальной информации и просвещению Канады (SIECCAN). Плоскоклеточный рак полости рта (OSCC) — это высокоагрессивный рак, который ассоциируется с плохой 5-летней выживаемостью пациентов.Лечение заболевания дополнительно осложняется трудностью прогнозирования предраковых тканей, которые будут прогрессировать до OSCC, и высокой частотой рецидивов после хирургической резекции. Здесь мы оценили экспрессию оральных эпителиальных маркеров E-cadherin, EMP1 и 5T4 и проинвазивных белков N-кадгерина с использованием полностью охарактеризованных антител и количественной иммунофлуоресцентной микроскопии в нормальной ткани (NT), фиброэпителиальном полипе (FEP), низкой степени злокачественности. дисплазия (LGD), дисплазия высокой степени (HGD), биопсии T1 OSCC и T4 OSCC.Снижение экспрессии E-кадгерина было связано с биопсиями FEP, LGD и HGD, демонстрируя, что потеря E-кадгерина является ранним событием в аномальном эпителии и происходит в отсутствие переключения E- на N-кадгерин, последний из которых был только наблюдается в Т4 OSCC. Кроме того, потеря E-кадгерина и EMP1 является индикатором LGD (p = 0,0006), а потеря E-кадгерина, EMP1 и 5T4 — индикатором HGD (p = 0,0006). Паттерны экспрессии E-кадгерина, EMP1 и N-кадгерина могут предсказать аномальный эпителий в биоптатах LGD, HGD, T1 и T4 OSCC (значение z = 0 для всех степеней заболевания) и позволили классифицировать LGD (z = 1.47), биопсии HGD (z = 2,138), T1 (z = 1,05) и T4 OSCC (z = 1,49). Следовательно, эти маркеры предоставляют полезные средства для прогнозирования аномального эпителия при биопсии пациента. Линейная регрессия и анализ коэффициента детерминации выявили положительную корреляцию с переходом заболевания NT> LGD> HGD, но низкую корреляцию с предполагаемым переходом заболевания HGD> T1 OSCC> T4 OSCC. Кроме того, экспрессия E-кадгерина, EMP1, 5T4 и N-кадгерина в патологически нормальных границах хирургической безопасности биопсий пациентов с LGD, HGD и T1 OSCC выявила значительные различия с NT, и использование пределов безопасности или FEP в качестве контроля для « нормальной ткани ». Ошибки II типа во всех когортах пациентов.Эта работа составляет основу для дальнейшего исследования роли потери E-кадгерина в аномальном эпителии и для разработки автоматизированных анализов для использования в диагностике рака. Образец цитирования: Abdalla Z, Walsh T, Thakker N, Ward CM (2017) Потеря эпителиальных маркеров является ранним событием при дисплазии полости рта и наблюдается в пределах безопасности диспластической биопсии и биопсии T1 OSCC. PLoS ONE 12 (12):
e0187449.
https://doi.org/10.1371/journal.pone.0187449 Редактор: Нильс Кордес, Технический университет Дрездена, ГЕРМАНИЯ Поступила: 3 февраля 2017 г .; Принята к печати: 18 октября 2017 г .; Опубликован: 7 декабря 2017 г. Авторские права: © 2017 Abdalla et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией. Финансирование: Эта работа была поддержана грантами Совета по исследованиям биотехнологии и биологических наук Соединенного Королевства (BB / K020277 / 1) и Совета по инженерным и физическим наукам (EP / H046070 / 1) Кристоферу М. Уорду. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи. Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует. Плоскоклеточная карцинома полости рта (OSCC) является наиболее распространенным раком полости рта, составляющим не менее 90% таких злокачественных новообразований, и ассоциируется с низкой 10-летней выживаемостью по сравнению с другими видами рака. Дисплазия орального эпителия, как полагают, является одной из популяций предшественников, из которых возникает OSCC, со скоростью трансформации между 0.3 и 17,5% [1], в зависимости от исследуемой популяции [2–5]. Механизм, с помощью которого нормальный эпителий полости рта становится диспластическим и трансформируется в OSCC, не совсем понятен, и текущая стратегия лечения заключается в резекции пораженной ткани, чтобы оставить свободный от болезни край не менее 5 мм [6]. Однако OSCC и дисплазия связаны с высокой частотой рецидивов в исходном месте или рядом с ним, даже в гистологически и клинически нормальной ткани, что приводит к предложению теории полевой канцеризации [7] и многоочагового потенциала роста раковых клеток [8, 9].Сообщалось о некоторых генетических и молекулярных изменениях в «нормальной слизистой оболочке» за пределами границ резекции опухоли, при этом сообщалось о мутации гена p53 [10–12] в слизистой оболочке, прилегающей к опухоли и предраковому поражению. Shaw et al (2013) [13] недавно сообщили, что значительная часть хирургических краев OSCC демонстрирует аномальное метилирование CpG-островков [13], хотя результаты не были прогностическими, что свидетельствует о явной необходимости исследования эпителиального фенотипа в тканях, связанных с тканями. с генезисом OSCC. Изменения клеточной адгезии необходимы для нормального эмбрионального развития, но могут вызывать значительные дефекты в архитектуре ткани и могут привести к развитию рака и метастазированию опухолевых клеток в сформировавшийся эпителий [14]. Понимание аномалий, связанных с предраковыми поражениями, может позволить расширить знания об их потенциальном переходе в опухоли и может привести к идентификации биомаркеров, которые могут предсказать поражения с высоким риском перехода опухоли и наличие аномальных клеток в гистологически нормальных хирургических краях.Было проведено много работ по использованию E-кадгерина в качестве маркера дисплазии / прогрессирования опухоли при OSCC, однако выводы из этих исследований различаются, а изучение экспрессии в предраковых тканях ограничено. Исследования показали высокие уровни экспрессии E-cadherin на плазматической мембране нормального эпителия полости рта и, как правило, снижение экспрессии наблюдается в диспластической ткани и OSCC [15-17]. В то время как некоторые сообщения предполагают, что экспрессия E-cadherin является полезным биомаркером злокачественной трансформации [18], Sridvevi et al [19] недавно пришли к выводу, что E-cadherin является сомнительным прогностическим маркером.Эти различные результаты, вероятно, отражают метод анализа экспрессии белка и антитела, используемые для обнаружения антигена. Интересно, что многие исследования не характеризуют антитела, используемые для идентификации маркеров, и во многих анализах используются субъективные методы для оценки уровней экспрессии маркеров. Следовательно, существует потребность в дополнительных маркерах для определения аномальных эпителиальных клеток и разработки автоматизированных систем для количественного определения их экспрессии. Ранее мы показали, что ингибирование E-кадгерина в эмбриональных стволовых клетках (ESC) вызывает мезенхимальный фенотип, повышенную клеточную пролиферацию и измененную глобальную экспрессию транскриптов в отсутствие характерного события эпителиально-мезенхимального перехода (EMT) [20–23] . Кроме того, потеря функции E-cadherin в ESCs также приводит к изменению локализации белков клеточной поверхности, таких как онкофетальный антиген 5T4, эпителиальный мембранный белок-1 (EMP1) и CD44 [20,21,23,24].Таким образом, мы предположили, что потеря E-кадгерина будет ранним событием, связанным с аномальным ростом эпителиальных клеток (то есть дисплазией), потенциально приводящим к преимуществу роста клеток в отсутствие маркеров EMT, таких как N-кадгерин [23 ]. В этом исследовании мы оценили экспрессию и локализацию E-кадгерина, EMP1, 5T4, N-кадгерина и CD44 в нормальной ткани, фиброэпителиальном полипе, дисплазии низкой степени, дисплазии высокой степени, биопсии T1 OSCC и T4 OSCC с использованием полностью охарактеризованных биоптатов. антитела и иммунофлуоресцентная микроскопия для определения клеточной локализации и количественной пространственно-временной экспрессии. Биопсии пациентов были хирургически вырезаны ретроспективно у 10 пациентов с фиброэпителиальными полипами, 20 пациентов с дисплазией низкой степени, 16 пациентов с дисплазией высокой степени, 5 пациентов с T1 OSCC и 10 пациентов с OSCC T4. Все биопсии были предоставлены в виде срезов 4 мкм на предметных стеклах, покрытых обезьянами, из залитых парафином блоков из отделения патологии больницы Святой Марии, Манчестер, Великобритания. Исследование было рассмотрено и одобрено Комитетом по этике Манчестерского университета в соответствии с заявкой 08 / h2006 / 21 Национальной службы этики исследований (NRES) перед началом исследования.Патологическое стадирование образцов было выполнено зарегистрированным патологом в отделении патологии больницы Святой Марии. Пять образцов «нормальных» срезов ткани языка были приобретены у AMS Biotechnology (Абингдон, Великобритания), а семь срезов — у Abcam Plc (Кембридж, Великобритания). Экспрессия маркеров в хирургических краях образцов LGD, HGD и T1 OSCC была выполнена на биоптатах, которые показали нормальную гистологию и четкий запас хирургической безопасности. Из 20 биопсий LGD, 16 HGD и 5 T1 OSCC всего 9, 7 и 5 биопсий показали гистологически нормальную ткань в пределах хирургической безопасности, соответственно, и были использованы для дальнейшего исследования. 1 x 10 7 клеток лизировали с использованием буфера для анализа радиоиммунопреципитации (RIPA) (0,1 мл 50 мМ Трис, pH 8,0, 150 мМ NaCl, 1% NP-40, 0,5% дезоксихолата натрия и 0,1% SDS; Sigma -Aldrich, Дорсет, Великобритания), содержащий ингибитор коктейля протеаз (Roche Applied Science, Сассекс, Великобритания). Образцы инкубировали на льду в течение 30 минут перед центрифугированием при 14000 g в течение 5 минут, остатки клеток удаляли, а клеточный лизат хранили при -80 ° C перед использованием.10 мкл клеточного лизата смешивали 1: 1 с 2x буфером Лэммли, разделяли с помощью SDS-PAGE и переносили на нитроцеллюлозную мембрану Hybond-ECL (Amersham biosciences, Бакс, Великобритания) с использованием блоттера Trans blot SD (Biorad, Хартфордшир, Великобритания). Мембрану инкубировали с соответствующими первичными и вторичными (-HRP) антителами, разведенными в блокирующем буфере (5% сухого молока в TBS), подвергали воздействию реагента для обнаружения ECL (GE Healthcare, Bucks, UK) и визуализировали с помощью авторадиографической пленки, вручную проявленной с помощью Kodak GBX. решения для разработчиков и закрепителей (Sigma Aldrich). Слайды погружали в ксилол на 2 × 5 мин для депарафинизации и переносили в 100% этанол на 2 × 5 мин для регидратации. Слайды погружали в 3% перекись водорода в метаноле на 20 минут и промывали фосфатно-солевым буфером (PBS) на качалке платформы в течение 5 минут. Слайды блокировали 1% козьей сывороткой / 0,1% BSA в PBS в увлажненной камере в течение 30 минут при комнатной температуре. Срезы инкубировали в течение ночи при 4 ° C в первичных антителах, разбавленных блокирующей сывороткой (все разведения 1: 100).Срезы дважды промывали PBS на платформе-качалке в течение 5 минут и инкубировали с меченным AlexorFlour 488 вторичным антителом (все 1: 500 в блокирующей сыворотке) в течение 1 часа в темноте при комнатной температуре. Затем предметные стекла промывали 3 раза PBS, закрепляли с помощью DAPI Vectorshield (Vector, Peterborough, UK) и изображений TIF, полученных на флуоресцентном микроскопе Leica DM5000 B (Milton Keynes, UK). Изображения TIF были загружены непосредственно в ImageJ, и был проведен количественный анализ экспрессии, как описано в инструкциях по адресу https: // imagej.nih.gov/ij/docs/guide/user-guide.pdf. Весь эпителий был оценен на предмет FEP, дисплазии и хирургических полей, а также репрезентативных областей, захваченных (увеличение x400) для количественного анализа. Для T1 и T4 OSCC, где эпителий отсутствовал или присутствовал ограниченный, всю биопсию оценивали при малом увеличении (увеличение x100) на предмет экспрессии маркеров, и репрезентативные области от поверхности до глубоко инвазивного фронта опухоли собирали для количественного анализа. Экспрессия E-кадгерина, EMP-1, 5T4, N-кадгерина и CD44 считалась положительной, если локализовалась на поверхности клетки (так называемая мембранная экспрессия (m)) или проявляла мембранную и цитоплазматическую (m / c) экспрессию.Экспрессия маркеров считалась отрицательной, если они локализованы в цитоплазме, ядре (n) или околоядерных областях клетки или если не наблюдалась реактивность (-ve). Все образцы были дополнительно оценены с помощью двойного слепого анализа репрезентативных флуоресцентных изображений тремя сотрудниками лаборатории Ward. Статистический анализ экспрессии отдельных маркеров внутри и между биопсиями выполнялся с использованием программного обеспечения SPSS, за исключением случаев, указанных ниже. Статистическая значимость была установлена на уровне p <0.05. Коэффициент детерминации был рассчитан в Microsoft Excel путем нанесения среднего и стандартного отклонения значений IF для каждого маркера. Биномиальное значение z рассчитывали с помощью SPSS путем сравнения с клиническим диагнозом для каждой биопсии. p-значение биномиального z-значения было рассчитано с помощью Graphpad (https://www.graphpad.com/quickcalcs/pvalue1.cfm), где p <0,05 представляет собой статистически значимое отклонение от клинического диагноза. Все антитела, использованные в этом исследовании, были оценены на реактивность с помощью вестерн-блоттинга в соответствующих клеточных лизатах и подтверждена на реактивность в залитых парафином биопсийных срезах перед анализом (рис. 1).Антитело против E-кадгерина 610181 (BD Biosciences) продемонстрировало реактивность с одной полосой ~ 120 кДа посредством вестерн-блот-анализа в общих лизатах клеток A549 (рис. 1A (i)) и предоставило четкие доказательства локализации плазматической мембраны в биопсии здоровых оральный эпителий (NT; рис. 1A (ii)) с помощью иммунофлуоресцентной микроскопии. Экспрессия EMP1 оценивалась с использованием ab173224 (Abcam Plc) в лизатах цельных клеток MCF7 с использованием вестерн-блоттинга и показывала полосы при ~ 36 кДа и ~ 55 кДа (рис. 1B (i)). Множественные полосы для белка EMP1 являются обычными [25, 26] и часто зависят от ткани, потенциально представляя димер / тримеризацию белка и / или измененные паттерны гликозилирования.Локализация белка EMP1 на клеточной поверхности была очевидна при биопсии здорового эпителия с использованием анализа иммунофлуоресцентной микроскопии (рис. 1B (ii)). Антиген 5T4 оценивали с помощью ab134162 (Abcam Plc) в вестерн-блот-анализе полных клеточных лизатов Bicr56, показывая единственную полосу при ~ 75 кДа (рис. 1C (i)). Локализация 5T4 в плазматической мембране была очевидна с использованием иммунофлуоресцентного микроскопического анализа биопсии здорового орального эпителия (рис. 1C (ii)). Антитело к N-кадгерину ab76057 (Abcam Plc) продемонстрировало реактивность с одной полосой ~ 120 кДа посредством вестерн-блот-анализа в общих клеточных лизатах A549 (рис. 1D (i)) и продемонстрировало локализацию плазматической мембраны в биопсии T4 OSCC с использованием иммунофлуоресценции. микроскопия (рис. 1D (ii)).Антитело к CD44 ab40983 (Abcam, Plc) продемонстрировало реактивность с одной полосой ~ 80 кДа по данным вестерн-блоттинга в общих лизатах из клеток MB-MDA-231 (рис. 1E (i)) и локализации плазматической мембраны в биопсии здорового человека. оральный эпителий с использованием анализа иммунофлуоресцентной микроскопии (рис. 1E (ii)). Однако паттерны экспрессии CD44 не выявили какой-либо статистической значимости ни в одной из групп пациентов (точный критерий Фишера и односторонний анализ ANOVA) и в дальнейшем в этом исследовании не оцениваются.Все данные, относящиеся к экспрессии CD44 в биопсиях пациентов, содержатся в Таблице 1A и в разделе «Вспомогательная информация». Рис. 1. Характеристика антител, использованных в этом исследовании. (a) E-кадгерин, (b) EMP1, (c) 5T4, (d) N-кадгерин и (e) экспрессия CD44, оцененная с использованием (i) вестерн-блоттинга и (ii) анализа иммунофлуоресцентной микроскопии. Антитело против E-кадгерина 610181 (BD Biosiences, Великобритания), оцененное с использованием лизатов клеток A549 и биопсии нормального эпителия полости рта; Антитело против EMP1 ab173224 (Abcam Plc, Великобритания), оцененное с использованием лизатов клеток MCF7 и биопсии нормального эпителия полости рта; Антитело против 5Т4 ab134162 (Abcam Plc, Великобритания) оценивали с использованием лизатов клеток BicR56 и биопсии нормального эпителия полости рта; Антитело против N-кадгерина ab76057 (Abcam Plc, Великобритания) оценивали с использованием лизатов клеток A549 и биопсии T4 OSCC; Антитело к CD44 ab40983 (Abcam Plc, Великобритания) оценивали с использованием лизатов клеток MB-MDA-231 и биопсии нормального эпителия полости рта.На вставках показано соответствующее окрашивание антител к отрицательному контролю. Окрашивание зеленым антигеном; Синий показывает ядерное окрашивание DAPI.
https://doi.org/10.1371/journal.pone.0187449.g001 Экспрессия E-кадгерина, EMP1, 5T4, N-кадгерина и CD44 была разделена на плазматическую мембрану (рис. 2A; m), плазматическую мембрану / цитоплазматическую (рис. 2B; m / c), цитоплазматическую (рис 2C; c), ядерная (рис. 2D; n) и перинуклеарная (рис. 2E; pn) локализация.Локализация белка была подтверждена с помощью анализа ImageJ, который позволил различить границы, описанные выше, демонстрируя доказательство принципа автоматического анализа экспрессии и локализации маркеров в биоптатах (рис. 2A (ii) –2F (ii)). Интенсивность флуоресценции окрашивания мембран определяли с помощью ImageJ (рис. 2G), и для каждого образца регистрировали среднюю интенсивность ± стандартное отклонение. Сравнение ядерной и периъядерной экспрессии маркеров не выявило существенных различий между NT, FEP, LGD, HGD, T1 OSCC и T4 OSCC и далее не рассматривается (все p> 0.05 ANOVA). Рис. 2. Определение клеточной локализации и интенсивности флуоресценции экспрессии маркеров в биоптатах эпителия полости рта. Определяли локализацию на клеточной поверхности (a), клеточную поверхность и цитоплазматическую локализацию (b), цитоплазматическую локализацию (c), ядерную локализацию (d), периядерную локализацию (e) и отсутствие экспрессии (f) индивидуальных белковых маркеров. с использованием (i) анализа иммунофлуоресцентной микроскопии и (ii) локализации клеток, подтвержденной с помощью приложения «Plot Profile» в программном обеспечении ImageJ.Белые линии на изображениях в (i) представляют область, используемую для анализа профиля графика, показанного в (ii). (g) (i) Пример мембранной локализации экспрессии маркера в программе ImageJ и (ii) количественная оценка интенсивности флуоресценции с использованием приложения «Find Maxima» в программе ImageJ.
https://doi.org/10.1371/journal.pone.0187449.g002 Е-кадгерин экспрессировался на плазматической мембране во всех биоптатах нормального орального эпителия (12/12; таблица 1А), причем 2/12 биопсий демонстрировали как мембранную, так и цитоплазматическую экспрессию (таблица S1).EMP1 и 5T4 экспрессировались на плазматической мембране в 11/12 биоптатах (таблица 1A), при этом большинство образцов экспрессировали только экспрессию плазматической мембраны (таблица S1). Реактивность плазматической мембраны N-кадгерина отсутствовала в 11/12 биоптатах (таблица 1A), при этом 7/12 образцов демонстрировали только цитоплазматическую локализацию (таблица S1). E-кадгерин, EMP1 и 5T4 демонстрируют статистически значимое повышение уровней флуоресценции по сравнению с N-кадгерином (Таблица 1B; p <0,001), следовательно, нормальный оральный эпителий связан с экспрессией E-кадгерина, EMP1 и 5T4 на плазматической мембране и отсутствием N -кадгерин. Таблица 1. Экспрессия маркеров и интенсивность флуоресценции в биоптатах орального эпителия. (a) Экспрессия на клеточной поверхности E-кадгерина, EMP1, 5T4, N-кадгерина и CD44 в биоптатах, использованных в этом исследовании. (b) Показания интенсивности флуоресценции из анализа иммунофлуоресцентной микроскопии в NT, FEP, LGD, HGD, T1 OSCC и T4 OSCC и их экспрессия в этих биоптатах (односторонний ANOVA).
https://doi.org/10.1371/journal.pone.0187449.t001 Биопсия фиброэпителиального полипа изначально предназначалась для использования в качестве дополнительных примеров нормального эпителия полости рта.Однако в 4/10 биоптатах отсутствовала экспрессия E-кадгерина (таблица 1А), а в 4/6 оставшихся биопсий обнаружена локализация белка как на клеточной поверхности, так и в цитоплазме (таблица S2). По сравнению с биопсией NT, экспрессия E-кадгерина была значительно снижена в образцах FEP и была связана с большой величиной эффекта Hedges г (таблица 2A; p = 0,029, г 0,98). Экспрессия EMP1, 5T4 и N-кадгерина не была статистически значимой по сравнению с нормальным эпителием (Таблица 2A). Однако двухфакторный анализ ANOVA показал статистически значимую разницу во всех экспрессиях маркеров между NT и FEP (Таблица 2A; p = 0.0037). Следовательно, хотя биопсия FEP не имела каких-либо патологических признаков, отсутствие E-кадгерина в 40% биопсий предполагает наличие аномалии в эпителии. Таблица 2. Сравнение экспрессии маркеров в аномальной ткани по сравнению с нормальным эпителием. (a) Экспрессия E-кадгерина, EMP1, 5T4 и N-кадгерина в биоптатах FEP, LGD, HGD, T1 OSCC и T4 OSCC по сравнению с нормальной тканью (NT). (b) Экспрессия E-кадгерина, EMP1, 5T4 и N-кадгерина в биоптатах FEP, LGD, HGD, T1 OSCC и T4 OSCC по сравнению с предполагаемой линейной зависимостью FEP> LGD> HGD> T1 OSCC> T4 OSCC.(c) Проверка гипотезы предполагаемой линейной связи NT> LGD> HGD и предполагаемого линейного перехода HGD> T1 OSCC> T4 OSCC. Серые прямоугольники показывают статистически значимые результаты.
https://doi.org/10.1371/journal.pone.0187449.t002 Во всех биопсиях с дисплазией низкой степени не обнаружено экспрессии E-кадгерина на плазматической мембране (таблицы 1 и 2; таблица S3). EMP1 также показал статистически значимую потерю окрашивания плазматической мембраны в 15/20 биоптатах (p = 0.006, FEP по сравнению с NT; Таблицы 1 и 2). Хотя экспрессия 5T4 была обнаружена на плазматической мембране в 12/20 образцах, этот результат не был значимым по сравнению с NT (таблицы 1 и 2). Экспрессия N-кадгерина была обнаружена в 2/20 биоптатах, что не было статистически значимым по сравнению с нормальной тканью (таблицы 1 и 2). Двусторонний анализ ANOVA показал статистически значимое различие во всех экспрессиях маркеров между NT и LGD (таблица 2A; p <0,0001). Таким образом, биопсия с дисплазией низкой степени выраженности лишена экспрессии E-кадгерина на плазматической мембране, демонстрирует статистически значимое снижение реактивности EMP1 и не обнаруживает каких-либо значительных изменений в экспрессии 5T4 или N-кадгерина. Во всех биопсиях при дисплазии высокой степени не обнаружено экспрессии E-кадгерина на плазматической мембране (таблицы 1 и 2; таблица S4; p = <0,000001 по сравнению с NT; таблица 2). EMP1 показал статистически значимую потерю окрашивания плазматической мембраны в 14 из 16 биопсий (p = 0,00005 по сравнению с NT; таблицы 1 и 2), а 5T4 отсутствовал в плазматической мембране в 12 из 16 биопсий (p = 0,0006 по сравнению с NT; Таблицы 1 и 2).Экспрессия N-кадгерина на плазматической мембране наблюдалась в 4/16 биоптатах, хотя этот результат не был статистически значимым по сравнению с нормальной тканью (таблицы 1 и 2). Двусторонний анализ ANOVA показал статистически значимое различие во всех экспрессиях маркеров между NT и HGD (таблица 2A; p <0,0001). Таким образом, биопсии с высокой степенью дисплазии лишены экспрессии E-кадгерина на плазматической мембране, демонстрируют статистически значимое снижение реактивности EMP1 и 5T4, но не обнаруживают каких-либо изменений в экспрессии белка N-кадгерина по сравнению с NT. Были оценены только пять биопсий T1 OSCC, поэтому при интерпретации результатов этих образцов требуется некоторая степень осторожности. В 4/5 биоптатах отсутствовала экспрессия E-кадгерина на плазматической мембране (таблицы 1 и 2; таблица S5; p = 0,002 по сравнению с NT), и во всех биоптатах отсутствовала локализация EMP1 на плазматической мембране (таблицы 1 и 2; таблица S5; p = 0,001, по сравнению с NT). Локализация 5T4 в плазматической мембране была обнаружена в 3/5 биоптатов (p> 0.05 по сравнению с NT), а N-кадгерин отсутствовал во всех пяти биопсиях (p> 0,05 по сравнению с NT). Двусторонний анализ ANOVA показал статистически значимое различие во всех экспрессиях маркеров между NT и T1 OSCC (таблица 2A; p <0,0001). Таким образом, несмотря на небольшое количество образцов, в биоптатах T1 OSCC отсутствует экспрессия на плазматической мембране EMP1, N-кадгерина и, в основном, E-кадгерина, и не наблюдается каких-либо статистически значимых изменений экспрессии белка 5T4 или N-кадгерина по сравнению с NT. В биопсиях 9/10 T4 OSCC отсутствовала экспрессия E-кадгерина и EMP1 на плазматической мембране (таблицы 1 и 2, таблица S6; p = 0,00002 и 0,0003 соответственно по сравнению с NT). Локализация 5T4 в плазматической мембране была обнаружена в 50% образцов (p> 0,05 по сравнению с NT; Таблица 2B), а N-кадгерин был обнаружен на плазматической мембране 6/10 биопсий (Таблицы 1 и 2; p = 0,02, по сравнению с NT). Следовательно, биоптаты T4 OSCC лишены экспрессии E-кадгерина и EMP1 на плазматической мембране в 90% биопсий и демонстрируют локализацию белка N-кадгерина в плазматической мембране в 60% случаев.Однако не наблюдалось статистически значимой разницы в экспрессии белка 5T4 по сравнению с NT. Двусторонний анализ ANOVA показал статистически значимую разницу во всех экспрессиях маркеров между NT и T4 OSCC (таблица 2A; p <0,0001). Таким образом, по сравнению с биопсией NT FEP связан с отсутствием экспрессии E-кадгерина, LGD связан с потерей экспрессии E-кадгерина и EMP1, а HGD связан с отсутствием E-кадгерина, EMP1 и 5T4 в отсутствие увеличения Маркер ЕМТ N-кадгерин (Таблица 2А).Это показывает, что потеря целостности эпителия является ранним событием, связанным с FEP и оральной дисплазией, и что это происходит в отсутствие переключения E- на N-кадгерин [27]. По сравнению с биопсией NT, T1 OSCC демонстрирует потерю E-кадгерина, а EMP1 и T4 OSCC связаны с отсутствием E-кадгерина и EMP1 и увеличением экспрессии N-кадгерина (Таблица 2A). Двусторонний анализ ANOVA NT, FEP, LGD, HGD, T1 и T4 OSCC показал, что потеря E-кадгерина сама по себе является ранним маркером перехода NT> FEP, потеря E-кадгерина и EMP1 является индикатором предполагаемого FEP> LGD перехода, потеря E-cadherin, EMP1 и 5T4 свидетельствует о переходе LGD> HGD и усилении N-кадгерина, маркера перехода T1> T4 OSCC (Таблица 2B).Однако комбинированная экспрессия маркеров не могла различать LGD> HGD, предполагаемый переход HGD> T1 OSCC или T1> T4 OSCC (Таблица 2B; двусторонний дисперсионный анализ ANOVA p> 0,05). Следовательно, большинство изменений в экспрессии маркеров, за исключением N-кадгерина, происходят на стадии HGD болезни и впоследствии мало изменяются. Принято считать, что OSCC возникает как линейный переход от предраковых поражений, таких как HGD, однако частота перехода от дисплазии> OSCC находится в диапазоне от 0.От 3 до 17,5%, что позволяет предположить некоторую степень неопределенности в отношении точного механизма туморогенеза OSCC. Noutomi et al (2006) [28] показали, что OSCC может возникать в результате дисплазии различными генетическими путями, предполагая, что могут происходить множественные переходные события. Линейная регрессия и анализ коэффициента детерминации использовались для проверки гипотезы о линейном переходе от HGD> T1 OSCC> T4 OSCC (Таблица 2C). Предполагаемый переход NT> LGD> HGD показал положительную корреляцию для E-кадгерина (r 2 = 0.89; p = 0,0027), EMP1 (r 2 = 0,966; p = 0,00008) и 5T4 (r 2 = 0,953; p = 0,0002), но не для N-кадгерина (r 2 = 0,432; p = 0,345) . Напротив, предполагаемый линейный переход HGD> T1 OSCC> T4 OSCC не был статистически значимым ни для одного из маркеров. Экспрессия E-кадгерина, EMP1, 5T4 и N-кадгерина оценивалась в хирургической грани биопсий LGD, HGD и T1 OSCC, которые показали нормальную гистологию и четкий запас хирургической безопасности (таблица 3A и таблица S7).Из 20 биопсий LGD, 16 HGD и 5 T1 OSCC всего 9, 7 и 5 биопсий показали гистологически нормальную ткань в пределах хирургической безопасности, соответственно, и были использованы для дальнейшего исследования. E-кадгерин экспрессировался на плазматической мембране 6/9 границ LGD (LGD-M; p = 0,063 по сравнению с NT), 2/7 границ HGD (HGD-M; p = 0,002) и 2/5 T1 OSCC. поля (T1-M; p = 0,015) (Таблица 3B). Экспрессия EMP1 и N-кадгерина существенно не различалась ни при одном из типов заболевания по сравнению с NT (Таблица 3B).5T4 значительно отличался по границам LGD и HGD по сравнению с NT (Таблица 3B). Однако сравнение всех маркеров, выраженных в LGD-M, HGD-M и T1 OSCC-M, выявило статистическую значимость для всех образцов по сравнению с NT (Таблица 3B; двусторонний дисперсионный анализ ANOVA). Таблица 3. Экспрессия маркеров в пределе хирургической безопасности LGD, HGD и T1 OSCC. (a) Экспрессия на клеточной поверхности E-кадгерина, EMP1, 5T4 и N-кадгерина в пределах хирургической безопасности биопсий LGD, HGD и T1 OSCC. (b) Экспрессия маркеров в границах хирургической безопасности LGD, HGD и T1 OSCC по сравнению с нормальной тканью.(c) Экспрессия маркеров в пределах хирургической безопасности LGD, HGD и T1 OSCC по сравнению с соответствующими образцами биопсии. (d) Статистическая значимость дисплазии низкой степени (LGD), дисплазии высокой степени (HGD) и T1 OSCC при использовании здорового эпителия полости рта (NT), фиброэпителиального полипа или соответствующих хирургических полей в качестве здорового контроля. Серые прямоугольники показывают статистически значимые результаты.
https://doi.org/10.1371/journal.pone.0187449.t003 Сравнение экспрессии маркера хирургического края с соответствующими биопсиями LGD, HGD или T1 OSCC показало статистически значимое различие в экспрессии E-кадгерина при LGD и LGD- M и снижение экспрессии EMP1 в HGD по сравнению с HGD-M и T1 OSCC по сравнению с T1 OSCC-M (таблица 3C).Это показывает, что использование границ безопасности в качестве представления нормального эпителия полости рта недооценивает статистическую значимость во всех образцах и вводит ошибки типа II для E-кадгерина в HGD и T1 OSCC и для 5T4 в HGD (Таблица 3D). Точно так же использование биопсии FEP в качестве положительного эпителиального контроля также недооценивает статистическую значимость во всех образцах и вводит ошибку типа II для экспрессии E-кадгерина в T1 OSCC (Таблица 3D). На основании статистического анализа экспрессии маркеров нормальный эпителий был классифицирован как Ecad + / EMP + / 5T4 + / Ncad —, аномальный эпителий (e.г. FEP) как Ecad — / EMP + / 5T4 + / Ncad — , LGD как Ecad — / EMP — / 5T4 + / Ncad — , HGD — как Таблица 4. Сводная информация об экспрессии маркеров в здоровом, патологическом и больном эпителии. Экспрессия маркера, используемая для классификации нормальной ткани (NT), фиброэпителиального полипа (FEP), дисплазии низкой степени (LGD), дисплазии высокой степени (HGD), T1 OSCC и T4 OSCC. https://doi.org/10.1371/journal.pone.0187449.t004 ОбсуждениеOSCC является наиболее распространенным раком полости рта и ассоциируется с более низкой 5-летней выживаемостью по сравнению со многими другими видами рака.Заболевание дополнительно усугубляется трудностью прогнозирования предраковых аномальных тканей, которые будут прогрессировать до ОСК, и высокой частотой рецидивов после хирургической резекции последнего. В настоящее время механизм перехода от нормальной ткани к дисплазии / OSCC неуловим, а скорость преобразования от 0,3 до 17,5% для дисплазии в OSCC [1] предполагает значительную гетерогенность между популяциями пациентов. Следовательно, методы, которые могут обнаруживать аномальные ткани в полости рта до образования OSCC, позволят дополнительно изучить биологические и эпидемиологические аспекты этого заболевания и могут помочь в выяснении молекулярных механизмов, связанных с онкогенезом OSCC. Наше исследование показывает, что панель маркеров может быть использована для оценки состояния эпителия тканей полости рта, включая E-кадгерин, EMP1, 5T4 и N-кадгерин. E-кадгерин представлял собой наиболее чувствительный из этих маркеров с точки зрения высокой экспрессии в нормальной ткани и отсутствовал на ранних стадиях, связанных с аномальным эпителием. Предыдущие исследования продемонстрировали смешанные результаты с использованием потери экспрессии E-кадгерина в качестве раннего маркера аномального эпителия [18,19]. В этом исследовании мы использовали антитело, распознающее внутриклеточный домен E-кадгерина, поскольку эта область функционирует как в структурном связывании актина, так и в передаче клеточных сигналов.Кроме того, внеклеточный домен E-кадгерина склонен к расщеплению с помощью MMP, в результате чего образуется растворимый фрагмент 80 кДа, который впоследствии может связываться с клеточным белком E-кадгерина, нарушая передачу сигналов и целостность эпителия. Как показано, цитоплазматический эпитоп E-кадгерина быстро теряется из диспластической ткани и значительной части биоптатов FEP, и поэтому представляет собой чувствительный метод обнаружения аномалий в биоптатах эпителиальной ткани. Кроме того, это демонстрирует, что потеря E-кадгерина является ранним событием, происходящим в аномальном эпителии полости рта.Мы предполагаем, что неоднозначные результаты других исследований экспрессии маркера E-кадгерина представляют собой использование не охарактеризованных антител и / или антител, которые распознают эпитопы во внеклеточном домене E-кадгерина. Интересно, что переключение E- на N-cadherin не наблюдалось ни в одной из диспластических биопсий или биопсий T1 OSCC, в которых отсутствовала экспрессия E-cadherin. Переключение E- на N-кадгерин связано с повышенной подвижностью и инвазией эпителиальных клеток во время развития эмбриона и метастазирования опухолевых клеток [24].Повышенная экспрессия N-cadherin наблюдалась только в биоптатах OSCC на стадии T4, что согласуется с исследованием Zhou et al (2015) [27], где экспрессия виментина была связана только с метастатическим OSCC. Это демонстрирует, что EMT является поздним событием, связанным с OSCC, и что потеря только E-cadherin недостаточна для индукции EMT in vivo , как мы ранее сообщали об эмбриональных стволовых клетках [20]. Эти результаты подтверждают нашу ранее опубликованную гипотезу DENT о роли E-кадгерина в раннем онкогенезе [23].Нелинейная тенденция наблюдалась для предполагаемого перехода от HGD> T1 OSCC> T4 OSCC, в то время как NT> LGD> HGD демонстрировала статистически значимое линейное прогрессирование. Эти результаты предполагают, что предполагаемый переход HGD> T1 OSCC может не произойти, что OSCC T1 происходит из субпопуляции диспластических клеток или что реэпителизация необходима для перехода от HGD к раку. Использование экспрессии маркеров E-кадгерина, EMP1 и N-кадгерина позволило предсказать аномальный эпителий во всех патологически аномальных биопсиях.Кроме того, болезненные состояния можно было предсказать по крайней мере в 75% образцов. Следовательно, использование E-кадгерина, EMP1 и N-кадгерина может предоставить полезные средства для прогнозирования патологических и патологических состояний эпителия при биопсии, а добавление дополнительных маркеров к этой панели может позволить повысить способность распознавания и прогнозирования. Однако потребуется дальнейший анализ, чтобы подтвердить эту классификацию при несвязанной дисплазии полости рта и биопсии SCC. Этот метод также предсказал аномальный эпителий на краях LGD, HGD и T1 OSCC, что может объяснить высокую частоту рецидивов, связанную с этим заболеванием.Статистический анализ экспрессии маркеров в пораженной ткани по сравнению с «здоровым» пределом безопасности недооценил статистическую значимость во всех образцах и привел к ошибкам типа II. Кроме того, использование биопсий FEP в качестве «здорового» контроля также занижало статистическую значимость во всех образцах и вносило ошибку типа II для экспрессии 5T4 при HGD. Следовательно, биопсии тканей, используемые в качестве здоровых контрольных образцов при сравнении биопсий больных, могут иметь заметное влияние на статистический анализ и должны быть оценены на наличие здорового эпителия перед использованием. Вспомогательная информацияS1 Таблица. Локализация и экспрессия E-кадгерина, EMP1, 5T4, N-кадгерина и CD44 в биоптатах нормальной ткани.Столбец «Классификация» показывает прогнозируемое состояние биопсии (нормальная ткань — NT; аномальное — A) с использованием таблицы классификации маркеров, представленной в таблице 4. Столбцы «Прогноз заболевания» показывают прогнозируемую степень поражения биопсии с использованием классификации маркеров. в таблице 4 (Ecad / EMP / 5T4 / Ncad) или с использованием E-кадгерина, EMP1 и N-кадгерина (Ecad / EMP / Ncad).«A» отображается там, где невозможно было спрогнозировать оценку. Z-значение и соответствующее p-значение показаны для каждого прогноза столбца по сравнению с клиническим диагнозом (то есть всем NT). https://doi.org/10.1371/journal.pone.0187449.s001 (TIF) S2 Стол. Локализация и экспрессия E-кадгерина, EMP1, 5T4, N-кадгерина и CD44 в биоптатах фиброэпителиального полипа.Столбец «Классификация» показывает прогнозируемое состояние биопсии (нормальная ткань — NT; аномальная — A) с использованием таблицы классификации маркеров, представленной в таблице 4.Столбцы «Прогноз заболевания» показывают прогнозируемую степень заболевания при биопсии с использованием таблицы классификации маркеров, представленной в таблице 4 (Ecad / EMP / 5T4 / Ncad), или с использованием E-кадгерина, EMP1 и N-кадгерина (Ecad / EMP / Ncad). «A» отображается там, где невозможно было спрогнозировать оценку. Z-значение и соответствующее p-значение показаны для каждого прогноза столбца по сравнению с клиническим диагнозом. https://doi.org/10.1371/journal.pone.0187449.s002 (TIF) S3 Таблица. Локализация и экспрессия E-кадгерина, EMP1, 5T4, N-кадгерина и CD44 в биоптатах с дисплазией низкой степени.Столбец «Классификация» показывает прогнозируемое состояние биопсии (нормальная ткань — NT; аномальное — A) с использованием таблицы классификации маркеров, представленной в таблице 4. Столбцы «Прогноз заболевания» показывают прогнозируемую степень поражения биопсии с использованием классификации маркеров. в таблице 4 (Ecad / EMP / 5T4 / Ncad) или с использованием E-кадгерина, EMP1 и N-кадгерина (Ecad / EMP / Ncad). «A» отображается там, где невозможно было спрогнозировать оценку. Z-значение и соответствующее p-значение показаны для каждого прогноза столбца по сравнению с клиническим диагнозом. https://doi.org/10.1371/journal.pone.0187449.s003 (TIF) S4 Таблица. Локализация и экспрессия E-кадгерина, EMP1, 5T4, N-кадгерина и CD44 в биоптатах с дисплазией высокой степени.Столбец «Классификация» показывает прогнозируемое состояние биопсии (нормальная ткань — NT; аномальное — A) с использованием таблицы классификации маркеров, представленной в таблице 4. Столбцы «Прогноз заболевания» показывают прогнозируемую степень поражения биопсии с использованием классификации маркеров. в таблице 4 (Ecad / EMP / 5T4 / Ncad) или с использованием E-кадгерина, EMP1 и N-кадгерина (Ecad / EMP / Ncad).«A» отображается там, где невозможно предсказать. Z-значение отображается для каждого прогноза столбца. «A» отображается там, где невозможно было спрогнозировать оценку. Z-значение и соответствующее p-значение показаны для каждого прогноза столбца по сравнению с клиническим диагнозом. https://doi.org/10.1371/journal.pone.0187449.s004 (TIF) S5 Таблица. Локализация и экспрессия E-кадгерина, EMP1, 5T4, N-кадгерина и CD44 в биоптатах T1 OSCC.Столбец «Классификация» показывает прогнозируемое состояние биопсии (нормальная ткань — NT; аномальная — A) с использованием таблицы классификации маркеров, представленной в таблице 4.Столбцы «Прогноз заболевания» показывают прогнозируемую степень заболевания при биопсии с использованием таблицы классификации маркеров, представленной в таблице 4 (Ecad / EMP / 5T4 / Ncad), или с использованием E-кадгерина, EMP1 и N-кадгерина (Ecad / EMP / Ncad). «A» отображается там, где невозможно было спрогнозировать оценку. Z-значение и соответствующее p-значение показаны для каждого прогноза столбца по сравнению с клиническим диагнозом. https://doi.org/10.1371/journal.pone.0187449.s005 (TIF) S6 Таблица. Локализация и экспрессия E-кадгерина, EMP1, 5T4, N-кадгерина и CD44 в биоптатах T4 OSCC.Столбец «Классификация» показывает прогнозируемое состояние биопсии (нормальная ткань — NT; аномальное — A) с использованием таблицы классификации маркеров, представленной в таблице 4. Столбцы «Прогноз заболевания» показывают прогнозируемую степень поражения биопсии с использованием классификации маркеров. в таблице 4 (Ecad / EMP / 5T4 / Ncad) или с использованием E-кадгерина, EMP1 и N-кадгерина (Ecad / EMP / Ncad). «A» отображается там, где невозможно было спрогнозировать оценку. Z-значение и соответствующее p-значение показаны для каждого прогноза столбца по сравнению с клиническим диагнозом. https://doi.org/10.1371/journal.pone.0187449.s006 (TIF) S7 Таблица. Локализация и экспрессия E-кадгерина, EMP1, 5T4, N-кадгерина и CD44 в хирургическом крае дисплазии низкой степени, дисплазии высокой степени и биопсии T1 OSCC.Столбец «Классификация» показывает прогнозируемое состояние биопсии (нормальная ткань — NT; аномальное — A) с использованием таблицы классификации маркеров, представленной в таблице 4. Столбцы «Прогноз заболевания» показывают прогнозируемую степень поражения биопсии с использованием классификации маркеров. в таблице 4 (Ecad / EMP / 5T4 / Ncad) или с использованием E-кадгерина, EMP1 и N-кадгерина (Ecad / EMP / Ncad).«A» отображается там, где невозможно предсказать. Z-значение и соответствующее p-значение показаны для каждого прогноза столбца по сравнению с клиническим диагнозом (то есть всем NT). https://doi.org/10.1371/journal.pone.0187449.s007 (TIF) БлагодарностиЭта работа была поддержана грантами Исследовательского совета Соединенного Королевства в области биотехнологии и биологических наук (BB / K020277 / 1) и Исследовательского совета инженерных и физических наук (EP / H046070 / 1). Ссылки
p16 как диагностический маркер неоплазии шейки матки: исследование 796 архивных образцов тканевым микрочипом | Диагностическая патологияBosch FX, Lorincz A, Munoz N, Meijer CJ, Shah KV: Причинная связь между вирусом папилломы человека и раком шейки матки. J Clin Pathol. 2002, 55 (4): 244-265. PubMed Central CAS Статья PubMed Google Scholar de Villiers EM, Gissmann L, zur Hausen H: Молекулярное клонирование вирусной ДНК из генитальных бородавок человека. J Virol. 1981, 40 (3): 932-935. PubMed Central CAS PubMed Google Scholar Дерст М., Гиссманн Л., Икенберг Х., цур Хаузен Х: ДНК вируса папилломы из карциномы шейки матки и ее распространенность в образцах биопсии рака из разных географических регионов. Proc Natl Acad Sci USA. 1983, 80 (12): 3812-3815. 10.1073 / pnas.80.12.3812. PubMed Central CAS Статья PubMed Google Scholar zur Hausen H: Папилломавирусные инфекции — основная причина рака человека. Biochim Biophys Acta. 1996, 1288 (2): F55-78. PubMed Google Scholar Mantovani F, Banks L: Белок вируса папилломы человека E6 и его вклад в злокачественное прогрессирование.Онкоген. 2001, 20 (54): 7874-7887. 10.1038 / sj.onc.1204869. CAS Статья PubMed Google Scholar Southern SA, Herrington CS: Нарушение контроля клеточного цикла вирусами папилломы человека с особым упором на карциному шейки матки. Int J Gynecol Cancer. 2000, 10 (4): 263-274. 10.1046 / j.1525-1438.2000.010004263.x. Артикул PubMed Google Scholar Като Дж., Мацусим Х., Хиберт С. В., Эвен М. Е., Шерр С. Дж.: Прямое связывание циклина D с продуктом гена ретинобластомы (pRb) и фосфорилирование pRb с помощью циклин D-зависимой киназы CDK4. Genes Dev. 1993, 7 (3): 331-342. 10.1101 / gad.7.3.331. CAS Статья PubMed Google Scholar zur Hausen H: Папилломавирусы и рак: от фундаментальных исследований до клинического применения. Нат Рев Рак. 2002, 2 (5): 342-350. 10.1038 / nrc798. CAS Статья PubMed Google Scholar Сано Т., Ояма Т., Кашивабара К., Фукуда Т., Накадзима Т.: Статус экспрессии белка p16 связан с онкогенным потенциалом вируса папилломы человека при поражениях шейки матки и половых органов. Am J Pathol. 1998, 153 (6): 1741-1748. PubMed Central CAS Статья PubMed Google Scholar Сакагути М., Фуджи И, Хирабаяси Х, Юн Х. Э., Комото Й, Оуэ Т, Кусафука Т, Окада А, Мацуда Х: обратно коррелированная экспрессия белка p16 и Rb при немелкоклеточном раке легких: иммуногистохимическое исследование. Int J Cancer. 1996, 65 (4): 442-445. 10.1002 / (SICI) 1097-0215 (19960208) 65: 4 <442 :: AID-IJC8> 3.0.CO; 2-X. CAS Статья PubMed Google Scholar Kamb A, Gruis NA, Weaver-Feldhaus J, Liu Q, Harshman K, Tavtigian SV, Stockert E, Day RS, Johnson BE, Skolnick MH: регулятор клеточного цикла, потенциально участвующий в генезе многих типов опухолей .Наука. 1994, 264 (5157): 436-440. 10.1126 / science.8153634. CAS Статья PubMed Google Scholar Нобори Т., Миура К., Ву DJ, Лоис А., Такабаяши К., Карсон Д.А.: Делеции гена ингибитора циклин-зависимой киназы-4 при множественных раковых заболеваниях человека. Природа. 1994, 368 (6473): 753-756. 10.1038 / 368753a0. CAS Статья PubMed Google Scholar Окамото А., Деметрик Д. Д., Спилларе Е. А., Хагивара К., Хусейн С. П., Беннет В. П., Форрестер К., Гервин Б., Серрано М., Бич Д.Х.: Мутации и измененная экспрессия p16INK4 при раке человека. Proc Natl Acad Sci USA. 1994, 91 (23): 11045-11049. 10.1073 / пнас.91.23.11045. PubMed Central CAS Статья PubMed Google Scholar Tam SW, Shay JW, Pagano M: Дифференциальная экспрессия и регуляция клеточного цикла циклин-зависимого ингибитора киназы 4 p16Ink4.Cancer Res. 1994, 54 (22): 5816-5820. CAS PubMed Google Scholar Milde-Langosch K, Hagen M, Bamberger AM, Loning T: Экспрессия и прогностическое значение регуляторных белков клеточного цикла, Rb, p16MTS1, p21WAF1, p27KIP1, циклин E и циклин D2 при раке яичников . Int J Gynecol Pathol. 2003, 22 (2): 168-174. 10.1097 / 00004347-200304000-00009. Артикул PubMed Google Scholar Murphy N, Ring M, Killalea AG, Uhlmann V, O’Donovan M, Mulcahy F, Turner M, McGuinness E, Griffin M, Martin C: p16INK4A как маркер дискариоза шейки матки: CIN и cGIN в биопсиях шейки матки и мазках ThinPrep . J Clin Pathol. 2003, 56 (1): 56-63. 10.1136 / jcp.56.1.56. PubMed Central CAS Статья PubMed Google Scholar Клаес Р., Фридрих Т., Спитковский Д., Риддер Р., Руди В., Петри Ю., Далленбах-Хелльвег Г., Шмидт Д., фон Кнебель Дёбериц М.: Сверхэкспрессия p16 (INK4A) как специфического маркера диспластической и опухолевые эпителиальные клетки шейки матки.Int J Cancer. 2001, 92 (2): 276-284. 10.1002 / ijc.1174. CAS Статья PubMed Google Scholar Dray M, Russell P, Dalrymple C, Wallman N, Angus G, Leong A, Carter J, Cheerala B: p16 (INK4a) как дополнительный маркер интраэпителиальных поражений шейки матки высокой степени. I: Опыт с плоскоклеточными поражениями при 189 последовательных биопсиях шейки матки. Патология. 2005, 37 (2): 112-124. 10.1080 / 00313020500058607. CAS Статья PubMed Google Scholar Agoff SN, Lin P, Morihara J, Mao C, Kiviat NB, Koutsky LA: экспрессия p16 (INK4a) коррелирует со степенью неоплазии шейки матки: сравнение с экспрессией Ki-67 и обнаружение ВПЧ высокого риска типы. Мод Pathol. 2003, 16 (7): 665-673. 10.1097 / 01.MP.0000077518.78046.0C. Артикул PubMed Google Scholar Negri G, Vittadello F, Romano F, Kasal A, Rivasi F, Girlando S, Mian C, Egarter-Vigl E: экспрессия p16INK4a и риск прогрессирования интраэпителиальной неоплазии низкой степени злокачественности шейки матки. Арка Вирхова. 2004, 445 (6): 616-620. 10.1007 / s00428-004-1127-9. Артикул PubMed Google Scholar Ариас-Пулидо Х., Пейтон С.Л., Хосте Н.Е., Варгас Х., Уиллер С.М.: Интеграция вируса папилломы человека типа 16 в карциному шейки матки in situ и в инвазивный рак шейки матки.J Clin Microbiol. 2006, 44 (5): 1755-1762. 10.1128 / JCM.44.5.1755-1762.2006. PubMed Central CAS Статья PubMed Google Scholar Кононен Дж., Бубендорф Л., Каллиониеми А., Барлунд М., Шрамл П., Лейтон С., Торхорст Дж., Михатч М.Дж., Заутер Г., Каллиониеми О.П.: Тканевые микроматрицы для высокопроизводительного молекулярного профилирования образцов опухолей. Nat Med. 1998, 4 (7): 844-847. 10.1038 / нм0798-844. CAS Статья PubMed Google Scholar Camp RL, Charette LA, Rimm DL: Валидация технологии тканевых микрочипов при карциноме молочной железы. Lab Invest. 2000, 80 (12): 1943-1949. 10.1038 / labinvest.3780204. CAS Статья PubMed Google Scholar Тауфик Эль-Манси М., Уильямс АР: Валидация технологии тканевых микрочипов с использованием аденокарциномы шейки матки и ее предшественников в качестве модельной системы. Int J Gynecol Cancer. 2006, 16 (3): 1225-1233. 10.1111 / j.1525-1438.2006.00570.x. CAS Статья PubMed Google Scholar Леонг А.С.: Количественное определение в иммуногистологии: факт или вымысел? Обсуждение переменных, влияющих на результаты. Appl Immunohistochem Mol Morphol. 2004, 12 (1): 1-7. Артикул PubMed Google Scholar Ostor AG: Естественная история цервикальной интраэпителиальной неоплазии: критический обзор.Int J Gynecol Pathol. 1993, 12 (2): 186-192. 10.1097 / 00004347-199304000-00018. CAS Статья PubMed Google Scholar Fakhry C, Westra WH, Li S, Cmelak A, Ridge JA, Pinto H, Forastiere A, Gillison ML: Повышение выживаемости пациентов с плоскоклеточной карциномой головы и шеи, положительной на вирус папилломы человека, в проспективном клиническом исследовании . J Natl Cancer Inst. 2008, 100 (4): 261-269. 10.1093 / jnci / djn011. CAS Статья PubMed Google Scholar Licitra L, Perrone F, Bossi P, Suardi S, Mariani L, Artusi R, Oggionni M, Rossini C, Cantu G, Squadrelli M: Вирус папилломы человека высокого риска влияет на прогноз у пациентов с хирургически пролеченным плоскоклеточным раком ротоглотки. J Clin Oncol. 2006, 24 (36): 5630-5636. 10.1200 / JCO.2005.04.6136. CAS Статья PubMed Google Scholar Smeets SJ, Hesselink AT, Speel EJ, Haesevoets A, Snijders PJ, Pawlita M, Meijer CJ, Braakhuis BJ, Leemans CR, Brakenhoff RH: новый алгоритм для надежного обнаружения вируса папилломы человека в парафиновой голове и образец рака шеи. |
