Основные показатели качества воды — техническая информация
Мутность и прозрачность
Мутность – показатель качества воды, обусловленный присутствием в воде нерастворенных и коллоидных веществ неорганического и органического происхождения. Причиной мутности поверхностных вод являются илы, кремниевая кислота, гидроокиси железа и алюминия, органические коллоиды, микроорганизмы и планктон. В грунтовых водах мутность вызвана преимущественно присутствием нерастворенных минеральных веществ, а при проникании в грунт сточных вод – также и присутствием органических веществ. В России мутность определяют фотометрическим путем сравнения проб исследуемой воды со стандартными суспензиями. Результат измерений выражают в мг/дм3 при использовании основной стандартной суспензии каолина или в ЕМ/дм3 (единицы мутности на дм3) при использовании основной стандартной суспензии формазина. Последнюю единицу измерения называют также Единица Мутности по Формазину (ЕМФ) или в западной терминологии FTU (Formazine Turbidity Unit).
ВОЗ по показаниям влияния на здоровье мутность не нормирует, однако с точки зрения внешнего вида рекомендует, чтобы мутность была не выше 5 NTU (нефелометрическая единица мутности), а для целей обеззараживания – не более 1 NTU.
Мера прозрачности – высота столба воды, при которой можно наблюдать опускаемую в воду белую пластину определенных размеров (диск Секки) или различать на белой бумаге шрифт определенного размера и типа (шрифт Снеллена).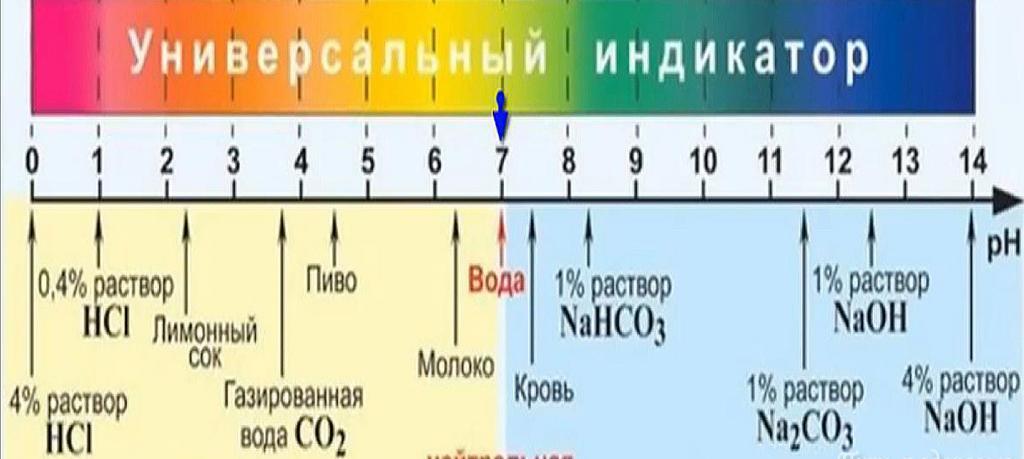 Результаты выражаются в сантиметрах.
Результаты выражаются в сантиметрах.
Характеристика вод по прозрачности (мутности)
|
Прозрачность |
Еденица измерения, см |
|
Средней мутности |
|
Цветность
Цветность – показатель качества воды, обусловленный главным образом присутствием в воде гуминовых и фульфовых кислот, а также соединений железа (Fe3+). Количество этих веществ зависит от геологических условий в водоносных горизонтах и от количества и размеров торфяников в бассейне исследуемой реки. Так, наибольшую цветность имеют поверхностные воды рек и озер, расположенных в зонах торфяных болот и заболоченных лесов, наименьшую – в степях и степных зонах.
Цветность измеряется в градусах платино-кобальтовой шкалы и колеблется от единиц до тысяч градусов – Таблица 2.
Характеристика вод по цветности
|
Цветность |
Еденица измерения, градус платино-кобальтовой шкалы |
|
Очень высокая |
Вкус и привкус
Вкус воды определяется растворенными в ней веществами органического и неорганического происхождения и различается по характеру и интенсивности. Различают четыре основных вида вкуса: соленый, кислый, сладкий, горький. Все другие виды вкусовых ощущений называются привкусами (щелочной, металлический, вяжущий и т.п.). Интенсивность вкуса и привкуса определяют при 20 °С и оценивают по пятибалльной системе, согласно ГОСТ 3351-74*.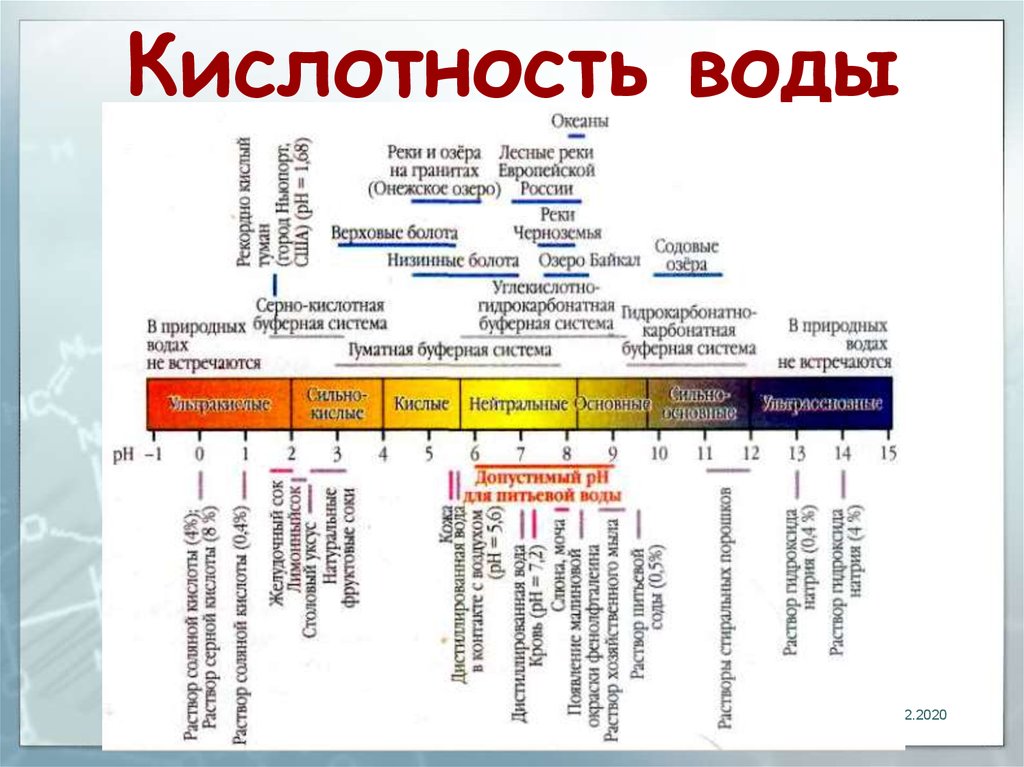
Качественную характеристику оттенков вкусовых ощущений – привкуса – выражают описательно: хлорный, рыбный, горьковатый и так далее. Наиболее распространенный соленый вкус воды чаще всего обусловлен растворенным в воде хлоридом натрия, горький – сульфатом магния, кислый – избытком свободного диоксида углерода и т.д. Порог вкусового восприятия соленых растворов характеризуется такими концентрациями (в дистиллированной воде), мг/л: NaCl – 165; CaCl2 – 470; MgCl2 – 135; MnCl2 – 1,8; FeCl2 – 0,35; MgSO4 – 250; CaSO4 – 70; MnSO4 – 15,7; FeSO4 – 1,6; NaHCO3 – 450.
По силе воздействия на органы вкуса ионы некоторых металлов выстраиваются в следующие ряды:
O катионы: Nh5+ > Na+ > K+; Fe2+ > Mn2+ > Mg2+ > Ca2+;
O анионы: ОН- > NO3- > Cl- > HCO3- > SO42- .
Характеристика вод по интенсивности вкуса
|
Интенсивность вкуса и привкуса |
Характер появления вкуса и привкуса |
Оценка интенсивности, балл |
|
Нет |
Вкус и привкус не ощущаются |
0 |
|
Очень слабая |
Вкус и привкус не ощущаются потребителем, но обнаруживаются при лабораторном исследовании |
1 |
|
Слабая |
Вкус и привкус замечаются потребителем, если обратить на это его внимание |
2 |
|
|
Вкус и привкус легко замечаются и вызывают неодобрительные отзывы о воде |
3 |
|
Отчетливая |
Вкус и привкус обращают на себя внимание и заставляют воздержаться от питья |
4 |
|
Очень сильная |
Вкус и привкус настолько сильные, что делают воду непригодной к употреблению |
5 |
Запах
Запах – показатель качества воды, определяемый органолептическим методом с помощью обоняния на основании шкалы силы запаха.
Следует также указывать группу запаха по следующей классификации:
По характеру запахи делят на две группы:
- естественного происхождения (живущие и отмершие в воде организмы, загнивающие растительные остатки и др.)
- искусственного происхождения (примеси промышленных и сельскохозяйственных сточных вод).
Запахи второй группы (искусственного происхождения) называют по определяющим запах веществам: хлорный, бензиновый и т.д.
Запахи естественного происхождения
|
Обозначение запаха |
Характер запаха |
Примерный род запаха |
|
А |
Ароматический |
огуречный, цветочный |
|
Б |
Болотный |
илистый, тинистый |
|
Г |
Гнилостный |
фекальный, сточный |
|
Д |
Древесный |
запах мокрой щепы, древесной коры |
|
З |
Землистый |
прелый, запах свежевспаханной земли, глинистый |
|
П |
Плесневый |
затхлый, застойный |
|
Р |
Рыбный |
запах рыбьегожира, рыбный |
|
С |
Сероводородный |
запах тухлых яиц |
|
Т |
Травянистый |
запах скошенной травы, сена |
|
Н |
Неопределенный |
Запахи естественного происхождения, не попадающие под предыдущие определения |
Интенсивность запаха по ГОСТ 3351-74* оценивают в шестибальной шкале – см.
 следующую страницу.
следующую страницу. Характеристика вод по интенсивности запаха
|
Интенсивность запаха |
Характер появления запаха |
Оценка интенсивности, балл |
|
Нет |
Запах не ощущаются |
0 |
|
Очень слабая |
Запах не ощущаются потребителем, но обнаруживаются при лабораторном исследовании |
1 |
|
Слабая |
Запах замечаются потребителем, если обратить на это его внимание |
2 |
|
Заметная |
Запах легко замечаются и вызывают неодобрительные отзывы о воде |
3 |
|
Отчетливая |
Запах обращают на себя внимание и заставляют воздержаться от питья |
4 |
|
Очень сильная |
Запах настолько сильные, что делают воду непригодной к употреблению |
5 |
Водородный показатель (рН)
Водородный показатель (рН) — характеризует концентрацию свободных ионов водорода в воде и выражает степень кислотности или щелочности воды (соотношение в воде ионов Н+ и ОН- образующихся при диссоциации воды) и количественно определяется концентрацией ионов водорода pH = — Ig [H+]Если в воде пониженное содержание свободных ионов водорода (рН>7) по сравнению с ионами ОН-, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН<7)- кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
Определение pH выполняется колориметрическим или электрометрическим методом. Вода с низкой реакцией рН отличается коррозионностью, вода же с высокой реакцией рН проявляет склонность к вспениванию.
В зависимости от уровня рН воды можно условно разделить на несколько групп:
Характеристика вод по рН
|
Тип воды |
Величина рН |
|
сильнокислые воды |
|
|
слабокислые воды |
|
|
нейтральные воды |
|
|
слабощелочный воды |
|
|
щелочные воды |
|
|
сильнощелочные воды |
Контроль над уровнем рН особенно важен на всех стадиях водоочистки, так как его «уход» в ту или иную сторону может не только существенно сказаться на запахе, привкусе и внешнем виде воды, но и повлиять на эффективность водоочистных мероприятий.
Обычно уровень рН находится в пределах, при которых он непосредственно не влияет на потребительские качества воды. Так, в речных водах pH обычно находится в пределах 6.5-8.5, в атмосферных осадках 4.6-6.1, в болотах 5.5-6.0, в морских водах 7.9-8.3. Поэтому ВОЗ не предлагает какой-либо рекомендуемой по медицинским показателям величины для рН. Вместе с тем известно, что при низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, способна вызывать раздражение глаз и кожи. Именно поэтому для питьевой и хозяйственно-бытовой воды оптимальным считается уровень рН в диапазоне от 6 до 9.
Кислотность
Кислотностью называют содержание в воде веществ, способных вступать в реакцию с гидроксид-ионами (ОН-). Кислотность воды определяется эквивалентным количеством гидроксида, необходимого для реакции.
Кислотность воды определяется эквивалентным количеством гидроксида, необходимого для реакции.В обычных природных водах кислотность в большинстве случаев зависит только от содержания свободного диоксида углерода. Естественную часть кислотности создают также гуминовые и другие слабые органические кислоты и катионы слабых оснований (ионы аммония, железа, алюминия, органических оснований). В этих случаях pH воды не бывает ниже 4.5.
В загрязненных водоемах может содержаться большое количество сильных кислот или их солей за счет сброса промышленных сточных вод. В этих случаях pH может быть ниже 4.5. Часть общей кислотности, снижающей pH до величин < 4.5, называется свободной.
Жесткость
Общая (полная) жесткость – свойство, вызванное присутствием растворенных в воде веществ, в основном — солей кальция (Ca2+) и магния (Mg2+), а также других катионов, которые выступают в значительно меньших количествах, таких как ионы: железа, алюминия, марганца (Mn2+) и тяжелых металлов (стронций Sr2+, барий Ba2+).
Но общее содержание в природных водах ионов кальция и магния несравнимо больше содержания всех других перечисленных ионов – и даже их суммы. Поэтому под жесткостью понимают сумму количеств ионов кальция и магния – общая жесткость, складывающаяся из значений карбонатной (временной, устраняемой кипячением) и некарбонатной (постоянной) жесткости. Первая вызвана присутствием в воде гидрокарбонатов кальция и магния, вторая наличием сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов.
В России жесткость воды выражают в мг-экв/дм3 или в моль/л.
Карбонатная жесткость (временная) – вызвана присутствием растворенных в воде бикарбонатов, карбонатов и углеводородов кальция и магния. Во время нагревания бикарбонаты кальция и магния частично оседают в растворе в результате обратимых реакций гидролиза.
Некарбонатная жесткость (постоянная) – вызывается присутствием растворенных в воде хлоридов, сульфатов и силикатов кальция (не растворяются и не оседают в растворе во время нагревания воды).
Характеристика вод по значению общей жесткости
|
Группа вод |
Еденица измерения, ммоль/л |
|
Средней жесткости |
|
|
Очень жесткая |
Щелочность
Щелочностью воды называется суммарная концентрация содержащихся в воде анионов слабых кислот и гидроксильных ионов (выражена в ммоль/л), вступающих в реакцию при лабораторных исследованиях с соляной или серной кислотами с образованием хлористых или сернокислых солей щелочных и щелочноземельных металлов.Различают следующие формы щелочности воды: бикарбонатная (гидрокарбонатная), карбонатная, гидратная, фосфатная, силикатная, гуматная – в зависимости от анионов слабых кислот, которыми обусловливается щелочность. Щелочность природных вод, рН которых обычно < 8,35, зависит от присутствия в воде бикарбонатов, карбонатов, иногда и гуматов. Щелочность других форм появляется в процессах обработки воды. Так как в природных водах почти всегда щелочность определяется бикарбонатами, то для таких вод общую щелочность принимают равной карбонатной жесткости.
Щелочность природных вод, рН которых обычно < 8,35, зависит от присутствия в воде бикарбонатов, карбонатов, иногда и гуматов. Щелочность других форм появляется в процессах обработки воды. Так как в природных водах почти всегда щелочность определяется бикарбонатами, то для таких вод общую щелочность принимают равной карбонатной жесткости.
Железо, марганец
Железо, марганец — в натуральной воде выступают преимущественно в виде углеводородов, сульфатов, хлоридов, гумусовых соединений и иногда фосфатов. Присутствие ионов железа и марганца очень вредит большинству технологических процессов, особенно в целлюлозной и текстильной промышленности, а также ухудшает органолептические свойства воды.Кроме того, содержание железа и марганца в воде может вызывать развитие марганцевых бактерий и железобактерий, колонии которых могут быть причиной зарастания водопроводных сетей.
Хлориды
Хлориды – присутствие хлоридов в воде может быть вызвано вымыванием залежей хлоридов или же они могут появиться в воде вследствие присутствия стоков. Чаще всего хлориды в поверхностных водах выступают в виде NaCl, CaCl2 и MgCl2, причем, всегда в виде растворенных соединений.
Чаще всего хлориды в поверхностных водах выступают в виде NaCl, CaCl2 и MgCl2, причем, всегда в виде растворенных соединений. Соединения азота
Соединения азота (аммиак, нитриты, нитраты) – возникают, главным образом, из белковых соединений, которые попадают в воду вместе со сточными водами. Аммиак, присутствующий в воде, может быть органического или неорганического происхождения. В случае органического происхождения наблюдается повышенная окисляемость.Нитриты возникают, главным образом, вследствие окисления аммиака в воде, могут также проникать в нее вместе с дождевой водой вследствие редукции нитратов в почве.
Нитраты — это продукт биохимического окисления аммиака и нитритов или же они могут быть выщелочены из почвы.
Сероводород
Сероводород придает воде неприятный запах, приводит к развитию серобактерий и вызывает коррозию. Сероводород, преимущественно присутствующий в подземных водах, может быть минерального, органического или биологического происхождения, причем в виде растворенного газа или сульфидов. То, под каким видом проявляется сероводород, зависит от реакции pH:
То, под каким видом проявляется сероводород, зависит от реакции pH:O при pH < 5 имеет вид h3S;
O при pH > 7 выступает в виде иона HS-;
O при pH = 5 : 7 может быть в виде, как h3S, так и HS-.
воде. Они поступают в воду вследствие вымывания осадочных горных пород, выщелачивания почвы и иногда вследствие окисления сульфидов и серы – продуктов расклада белка из сточных вод. Большое содержание сульфатов в воде может быть причиной болезней пищеварительного тракта, а также такая вода может вызывать коррозию бетона и железобетонных конструкций.
Двуокись углерода
Двуокись углерода (CO2) – в зависимости от реакции pH воды может быть в следующих видах:Сероводород придает воде неприятный запах, приводит к развитию серобактерий и вызывает коррозию. Сероводород, преимущественно присутствующий в подземных водах, может быть минерального, органического или биологического происхождения, причем в виде растворенного газа или сульфидов. То, под каким видом проявляется сероводород, зависит от реакции pH:
- при pH < 5 имеет вид h3S;
- при pH > 7 выступает в виде иона HS-;
- при pH = 5 : 7 может быть в виде, как h3S, так и HS-.

Сульфаты
Сульфаты (SO42-) – наряду с хлоридами являются наиболее распространенными видами загрязнения в воде. Они поступают в воду вследствие вымывания осадочных горных пород, выщелачивания почвы и иногда вследствие окисления сульфидов и серы – продуктов расклада белка из сточных вод. Большое содержание сульфатов в воде может быть причиной болезней пищеварительного тракта, а также такая вода может вызывать коррозию бетона и железобетонных конструкций.Двуокись углерода
Двуокись углерода (CO2) – в зависимости от реакции pH воды может быть в следующих видах:- pH < 4,0 – в основном, как газ CO2;
- pH = 8,4 – в основном в виде иона бикарбоната НСО3- ;
- pH > 10,5 – в основном в виде иона карбоната CO32-.
Агрессивная двуокись углерода – это часть свободной двуокиси углерода (CO2), которая необходима для удержания растворенных в воде углеводородов от разложения. Она очень активна и вызывает коррозию металлов. Кроме того, приводит к растворению карбоната кальция СаСО3 в строительных растворах или бетоне и поэтому ее необходимо удалять из воды, предназначенной для строительных целей.
 При оценке агрессивности воды, наряду с агрессивной концентрацией двуокиси углерода, следует также учитывать содержание солей в воде (солесодержание). Вода с одинаковым содержанием агрессивного CO2, тем более агрессивна, чем выше ее солесодержание.
При оценке агрессивности воды, наряду с агрессивной концентрацией двуокиси углерода, следует также учитывать содержание солей в воде (солесодержание). Вода с одинаковым содержанием агрессивного CO2, тем более агрессивна, чем выше ее солесодержание. Растворенный кислород
Поступление кислорода в водоем происходит путем растворения его при контакте с воздухом (абсорбции), а также в результате фотосинтеза водными растениями. Содержание растворенного кислорода зависит от температуры, атмосферного давления, степени турбулизации воды, минерализации воды и др. В поверхностных водах содержание растворенного кислорода может колебаться от 0 до 14 мг/л. В артезианской воде кислород практически отсутствует.Относительное содержание кислорода в воде, выраженное в процентах его нормального содержания и называется степенью насыщения кислородом. Этот параметр зависит от температуры воды, атмосферного давления и уровня минерализации. Вычисляется по формуле: M = (ax0,1308×100)/NxP, где
М – степень насыщения воды кислородом, %;
а – концентрация кислорода, мг/дм3;
Р – атмосферное давление в данной местности, МПа.
N – нормальная концентрация кислорода при данной температуре и общем давлении 0,101308 МПа, приведенная в следующей таблице:
Растворимость кислорода в зависимости от температуры воды
|
Температура воды, °С |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
80 |
100 |
|
мг О2/дм3 |
14,6 |
11,3 |
9,1 |
7,5 |
6,5 |
5,6 |
4,8 |
2,9 |
0,0 |
Окисляемость
Окисляемость – это показатель, характеризующий содержание в воде органических и минеральных веществ, окисляемых сильным окислителем. Окисляемость выражается в мгO2 необходимого на окисление этих веществ, содержащихся в 1 дм3 исследованной воды.
Окисляемость выражается в мгO2 необходимого на окисление этих веществ, содержащихся в 1 дм3 исследованной воды.Различают несколько видов окисляемости воды: перманганатную (1 мг KMnO4 соответствует 0,25 мг O2), бихроматную, иодатную, цериевую. Наиболее высокая степень окисления достигается бихроматным и иодатным методами. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах – как правило, бихроматную окисляемость (называемую также ХПК – химическое потребление кислорода). Окисляемость является очень удобным комплексным параметром, позволяющим оценить общее загрязнение воды органическими веществами. Органические вещества, находящиеся в воде весьма разнообразны по своей природе и химическим свойствам. Их состав формируется как под влиянием биохимических процессов протекающих в водоеме, так и за счет поступления поверхностных и подземных вод, атмосферных осадков, промышленных и хозяйственно-бытовых сточных вод. Величина окисляемости природных вод может варьироваться в широких пределах от долей миллиграммов до десятков миллиграммов О2 на литр воды.
Поверхностные воды имеют более высокую окисляемость, а значит в них содержится высокие концентрации органических веществ по сравнению с подземными. Так, горные реки и озера характеризуются окисляемостью 2-3 мг О2/дм3, реки равнинные – 5-12 мг О2/дм3, реки с болотным питанием – десятки миллиграммов на 1 дм3.
Подземные же воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграмма О2/дм3 (исключения составляют воды в районах нефтегазовых месторождений, торфяников, в сильно заболоченных местностях, подземных вод северной части РФ).
Электропроводность
Электропроводность – это численное выражение способности водного раствора проводить электрический ток. Электрическая проводимость природной воды зависит в основном от степени минерализации (концентрации растворенных минеральных солей) и температуры. Благодаря этой зависимости, по величине электропроводности можно с определенной степенью погрешности судить о минерализации воды. Такой принцип измерения используется, в частности, в довольно распространенных приборах оперативного измерения общего солесодержания (так называемых TDS-метрах).
Дело в том, что природные воды представляют собой растворы смесей сильных и слабых электролитов. Минеральную часть воды составляют преимущественно ионы натрия (Na+), калия (K+), кальция (Ca2+), хлора (Cl–), сульфата (SO42–), гидрокарбоната (HCO3–).
Этими ионами и обуславливается в основном электропроводность природных вод. Присутствие же других ионов, например трехвалентного и двухвалентного железа (Fe3+ и Fe2+), марганца (Mn2+), алюминия (Al3+), нитрата (NO3–), HPO4–, h3PO4– и т.п. не столь сильно влияет на электропроводность (конечно при условии, что эти ионы не содержатся в воде в значительных количествах, как например, это может быть в производственных или хозяйственно-бытовых сточных водах). Погрешности же измерения возникают из-за неодинаковой удельной электропроводимости растворов различных солей, а также из-за повышения электропроводимости с увеличением температуры. Однако, современный уровень техники позволяет минимизировать эти погрешности, благодаря заранее рассчитанным и занесенным в память зависимостям.
Электропроводность не нормируется, но величина 2000 мкС/см примерно соответствует общей минерализации в 1000 мг/л.
Окислительно-восстановительный потенциал (редокс-потенциал, Eh)
Окислительно-восстановительный потенциал (мера химической активности) Eh вместе с рН, температурой и содержанием солей в воде характеризует состояние стабильности воды. В частности этот потенциал необходимо учитывать при определении стабильности железа в воде. Eh в природных водах колеблется в основном от -0,5 до +0,7 В, но в некоторых глубоких зонах Земной коры может достигать значений минус 0,6 В (сероводородные горячие воды) и +1,2 В (перегретые воды современного вулканизма).Подземные воды классифицируются:
- Eh > +(0,1–1,15) В – окислительная среда; в воде присутствует растворенный кислород, Fe3+, Cu2+, Pb2+, Mo2+ и др.
- Eh – 0,0 до +0,1 В – переходная окислительно-восстановительная среда, характеризуется неустойчивым геохимическим режимом и переменным содержанием кислорода и cероводорода, а также слабым окислением и слабым восстановлением разных металлов;
- Eh < 0,0 – восстановительная среда; в воде присутствуют сероводород и металлы Fe2+, Mn2+, Mo2+ и др.

Зная значения рН и Eh, можно по диаграмме Пурбэ установить условия существования соединений и элементов Fe2+, Fe3+, Fe(ОН)2, Fe(ОН)3, FeСО3, FeS, (FeOH)2+.
Статья на тему «снижение щелочности воды — вынужденная необходимость»
По своей природе щелочность воды может быть нескольких типов: гидратная, бикарбонатная и карбонатная. В естественных источниках (подземных или поверхностных) щелочность воды зависит от наличия в ней гидрокарбонатов магния и кальция. Уровень щелочности определяется по количеству кислоты, которая необходима для ее снижения. При эксплуатации отопительных систем снижение щелочности воды необходимо по многим причинам. Самое главное повышенное содержание гидрокарбонатов плохо сказывается на оборудовании, а, следовательно, и изготовленной на нем продукции. Повышенная щелочность подразумевает излишнее содержание входящих в реакцию с кислотами ионов, в частности гидрокарбонатов (их содержание является наиболее нежелательным). Сумма слабокислотных анионов и гидроксильных ионов, содержащихся в воде, определяют щелочность воды. Эти ионы и анионы могут быть карбонатными, бикарбонатными, органическими и угольными. Существует несколько методов водоочистки для снижения щелочности .
Сумма слабокислотных анионов и гидроксильных ионов, содержащихся в воде, определяют щелочность воды. Эти ионы и анионы могут быть карбонатными, бикарбонатными, органическими и угольными. Существует несколько методов водоочистки для снижения щелочности .
Решения BWT для промышленной и бытовой очистки воды:
Обратный осмос как способ уменьшения щелочности
Такой метод по праву считается наиболее эффективным. При его применении значительно уменьшается концентрация в воде щелочных анионов, и в это же время снижается минерализация воды. Для снижения щелочности используют Na-Cl-ионирование, которое заключается в использовании анионита в Cl-форме и катионита Na-форме для очистки воды. Данный способ снижения щелочности воды уменьшает также и солесодержание. Хотя установки с обратным осмосом воды являются универсальными, необходимо использовать их только самого лучшего качества. В противном случае, при использовании недостаточно технологичных или несовершенных конструкций, выгода от них будет перекрываться повышением расходов на эксплуатацию и обслуживание оборудования, к тому же намного быстрее будут выходить из строя мембранные элементы таких установок.
Катионирование воды
Такой метод осуществляется с применением слабокислотного катионита, который имеет водородную форму. H-Na-катионирование может осуществляться последовательно или параллельно. Помимо этого Н-катионирование может проходить с голодной регенерацией при использовании сильно- или слабокислотного катионита, также Н-катионирование может осуществляться с нейтрализацией. Фильтры водоочистки по снижению щелочности, основанные на данном методе, помимо прочего уменьшают жесткость и снижают содержание бикарбонатов в воде, а также совершается неполная деминерализация, нормализуется минеральный состав (изменяется содержание отдельных химических соединений), происходит отклонение рН в сторону кислотности. Они используются для производства воды для центрального теплоснабжения, котловой или технологической воды. Их основным преимуществом является относительная дешевизна в процессе эксплуатации.
Восстановление раствором соляной кислоты
Этот способ осуществляется при помощи введения в воду неконцентрированного раствора серной, соляной или какой-либо другой кислоты. По-другому такой процесс еще называют подкислением воды. Процесс снижения щелочности осуществляется с применением аппарата пропорционального дозирования и добавлением необходимого объема раствора кислоты. Процесс восстановления протекает следующим образом: катионит проходит через слабый раствор кислоты, который впоследствии пропускают через анионит. Полученная таким образом вода становится деминерализованной. Анионит, который перешел в Cl-форму, промывают раствором едкого натра.
По-другому такой процесс еще называют подкислением воды. Процесс снижения щелочности осуществляется с применением аппарата пропорционального дозирования и добавлением необходимого объема раствора кислоты. Процесс восстановления протекает следующим образом: катионит проходит через слабый раствор кислоты, который впоследствии пропускают через анионит. Полученная таким образом вода становится деминерализованной. Анионит, который перешел в Cl-форму, промывают раствором едкого натра.
Так как вода в природе по своим показателям неодинакова, то огромную роль играет снижение щелочности воды для получения необходимого результата. Какой бы способ не использовался, общим является конечный результат. Остаточная щелочность должна варьировать в пределах 0,2-0,8 мг-экв/кг. Для нормального функционирования теплообменников, отсутствия выпадения осадков и наличия минимальной коррозийной активности качество используемой воды должно поддерживаться в определенных пределах, особенно это касается таких показателей как карбонатная жесткость, щелочность и рН. Вода, которая используется в пищевой промышленности (к примеру, производство ликероводочной продукции) также должна иметь определенный уровень щелочности.
Вода, которая используется в пищевой промышленности (к примеру, производство ликероводочной продукции) также должна иметь определенный уровень щелочности.
Статья на тему «снижение щелочности воды, бытовой и промышленной»
Сегодня перед системами водоподготовки и водоочистки очень остро стоит задача — снижение щелочности воды. Данная операция очень актуальна, поскольку высокая щелочность воды, используемой для подпитки котлов, является довольно неприятным моментом. Под высокой щелочностью подразумевают большую концентрацию в воде ионов, взаимодействующих с сильной кислотой.
При этом самые неприятные моменты возникают тогда, когда в воде наблюдается большая концентрация карбонатов. Щелочность воды определяется суммой гидроксильных ионов и слабокислотных анионов, содержащихся в воде — органических, угольных, карбонатных и бикарбонатных ионов.
Решения BWT для промышленной и бытовой очистки воды:
В настоящее время различают несколько видов щелочности — гидратная, карбонатная и бикарбонатная. Определить уровень щелочности можно по тому количеству кислоты, которое потребуется для снижения ее в одном литре воды. Обычно в воде из природных источников щелочность определяется наличием в ней гидрокарбонатов магния и кальция.
Определить уровень щелочности можно по тому количеству кислоты, которое потребуется для снижения ее в одном литре воды. Обычно в воде из природных источников щелочность определяется наличием в ней гидрокарбонатов магния и кальция.
Снижение щелочности воды оказывается полезным в тех ситуациях, когда осуществляется обработка системы центрального водоснабжения, а также во время реагентной обработки сточных вод. Если вода будет использоваться в ирригационных установках для полива посевных площадей, то также необходимо предварительно определить уровень щелочности, и при необходимости принять меры к ее снижению.
Было время, когда многие специалисты считали, что высокая щелочность полезна для здоровья человека и не предпринимали никаких мер для ее снижения. Считалось, что таким образом можно предотвратить онкологические заболевания. А в Японии употребление высокощелочной воды даже рекомендовалось Министерством здравоохранения, так как ионизированная щелочная вода считалась отличным лекарственным средством. Однако в настоящее время многие специалисты в области медицины изменили свое мнение на прямо противоположное, и считают, что снижение щелочности воды является обязательным условием ее употребления, так как в противном случае она становится опасной для здоровья.
Однако в настоящее время многие специалисты в области медицины изменили свое мнение на прямо противоположное, и считают, что снижение щелочности воды является обязательным условием ее употребления, так как в противном случае она становится опасной для здоровья.
Употребление высокощелочной воды оправдано в тех случаях, когда человек страдает повышенной кислотностью, а если ее будет употреблять здоровый человек, то такая вода может нанести ему вред. Дело заключается в том, что она приводит к ослаблению функционирования желудка, в частности, приводит к снижению фермента пепсина. А это очень плохо, поскольку пепсин является очень важным элементом — он нейтрализует бактерии, которые проникают в человеческий организм из окружающей атмосферы. Следовательно, если не принимать меры к снижению щелочности воды, то это может спровоцировать различные заболевания.
Для эффективного снижения щелочности воды используются специальные установки, которые снижают содержание бикарбонатов и делают воду более мягкой. В основном такие установки используются для водоподготовки централизованных систем горячего и холодного водоснабжения, для снижения щелочности котловой воды и для производства качественной воды для пищевых, фармацевтических и других производств.
В основном такие установки используются для водоподготовки централизованных систем горячего и холодного водоснабжения, для снижения щелочности котловой воды и для производства качественной воды для пищевых, фармацевтических и других производств.
Водоочистные установки, с помощью которых осуществляется снижение щелочности воды, обеспечивают две стадии обработки — предварительную очистку и окончательную, когда происходит обработка ионами. Для того чтобы осветлить воду используют метод коагуляции — из воды удаляют коллоидные и грубодисперсные примеси. Одновременно с этим пытаются достичь снижения щелочности воды, ее умягчения и удалить из нее кремнекислые соединения. Для этого отлично подходит метод магнезиального обескремнивания или известкования.
После такой обработки щелочность существенно снижается, также снижается количество солей жесткости — обессоливание воды, вследствие чего она становится мягче, практически полностью удаляются мельчайшие частицы, находящиеся во взвешенном состоянии, снижается количество органических соединений и т. д. Чтобы удалить кремнекислые соединения, помимо извести, можно добавить обожженный доломит или магнезит. Данные способы обработки называются методами осаждения, поскольку загрязняющие вещества выпадают в осадок и затем удаляются.
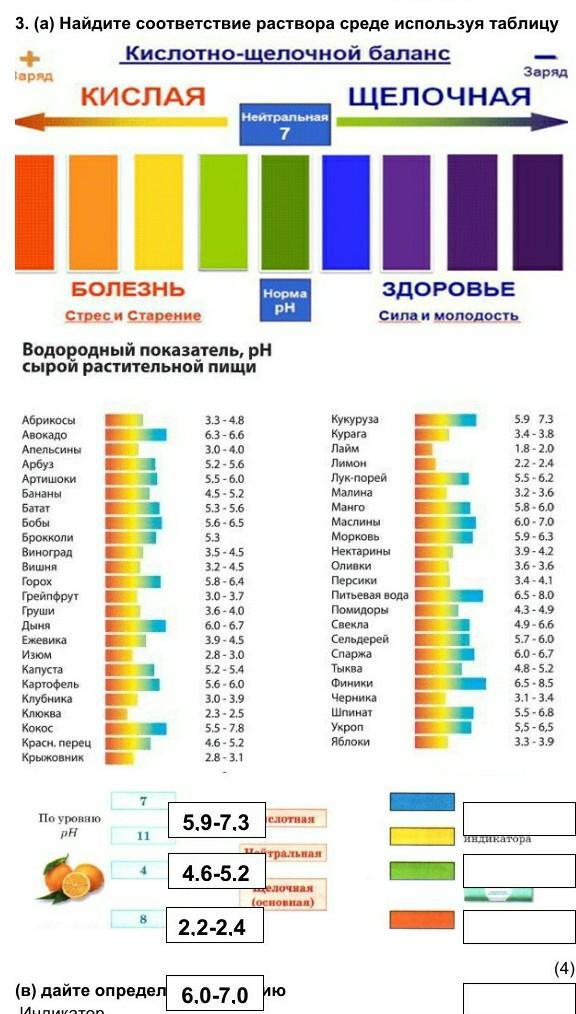
Что такое ph питьевой воды
Показатель ph – один из важнейших в определении качества воды, пригодной для питья. Он может превратить жидкость, которая течет у нас из крана, в отраву или сделать из нее целебную минералку. Что скрывается за этими латинскими буквами, как определить уровень ph, можно ли его контролировать?
Как появилось понятие ph и что оно означает
Ученым, который основательно изучил этот показатель, был датчанин Серенсен. В начале 20-го века он придумал специальный термин – potentiahydrogeni– чтобы обозначать уровень активности ионов водорода. По этому показателю определяется кислотно-щелочной баланс среды. От него зависит:
- скорость химических реакций;
- агрессивное или пассивное коррозийное воздействие;
- уровень токсичности.
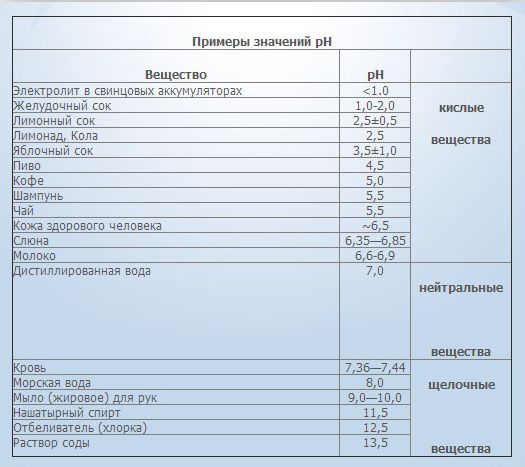
Внутренние жидкости человеческого организма имеют собственный кислотно-щелочной баланс. Его уровень влияет на наше состояние здоровья и самочувствие.
Стандарты рH
В нашей стране действуют три стандарта, по которым определяется качество питьевой воды:
- Нормативы, принятые и действующие в Российской Федерации;
- Нормативы, поддерживаемые Всемирной организацией здравоохранения;
- Нормативы, применяемые в странах ЕС.
Все эти нормы определяют единый оптимальный ph воды, пригодной для питья, – от 7 до 7,5 ммоль/л. Допускаются колебания от 6 до 9 ммоль. Это нейтральная и слабощелочная среда. Остальные показатели даны в таблице.
|
Показатель ph |
Среда |
|---|---|
|
меньше 3 |
Зона повышенной кислотности |
|
3-5 |
Зона средней кислотности |
|
5-6,5 |
Зона слабой кислотности |
|
6,5-7,5 |
Нейтральная зона |
|
7,5-8,5 |
Зона слабой щелочности |
|
8,5-9,5 |
Зона средней щелочности |
|
больше 9,5 |
Зона сильной щелочности |
Влияние уровня ph воды на здоровье
Средний оптимальный показатель ph воды, пригодной для питья, –
7,5 ммоль. Он соответствует нормальной кислотности нашей крови.
Потребление такой воды способствует:
Он соответствует нормальной кислотности нашей крови.
Потребление такой воды способствует:
- оптимизации обменных процессов;
- повышению уровня насыщения крови кислородом;
- нормальному функционированию микрофлоры кишечника;
- укреплению иммунитета;
- увеличению продолжительности жизни.
Очень важно контролировать ph воды, которую вы ежедневно потребляете, не допускать значительных отклонений от нормы.
Как самостоятельно определить уровень рh
Смещение кислотно-щелочного баланса не только снижает полезные свойства воды, но и плохо влияет на ее вкус и запах. В домашних условиях определить, насколько показатель отвечает норме, можно с применением таких средств:
- Лакмусовая бумага. Выдает мгновенный результат. Ее можно попросить у лаборантов в поликлинике или купить онлайн. Дешевый и простой метод.
- Pн-метр. Специальный прибор, который дает более точный результат, чем лакмусовая бумага, определяет
уровень кислотности с точностью до сотых.
 Приборы могут иметь автоматическую калибровку или нуждаться
в настройке. Бывают портативными и стационарными. Из минусов – высокая цена.
Приборы могут иметь автоматическую калибровку или нуждаться
в настройке. Бывают портативными и стационарными. Из минусов – высокая цена. - Самодельный тест. При желании можно самостоятельно соорудить подобие лакмусовой бумажки. Для этого нужно нарезать полголовки красной капусты, залить литром воды и полчаса кипятить. Фиолетовый отвар остудить. Нарезать полосками ксероксную бумагу, окунуть в отвар на 10 мин. Дать высохнуть. Результаты теста оценивать по традиционной шкале, применяемой для лакмусовой бумаги.
Также определение уровня Рн воды можно доверить специалистам. Точные данные лабораторного анализа воды пригодятся, чтобы подобрать фильтрующее оборудование, которое сделает воду в Вашем доме идеальной.
так ли полезна щелочная вода
Принято считать, что pH -один из самых важных показателей качества питьевой воды, который показывает ее кислотно-щелочное равновесие и определяет, как будут протекать химические и биологические процессы в организме.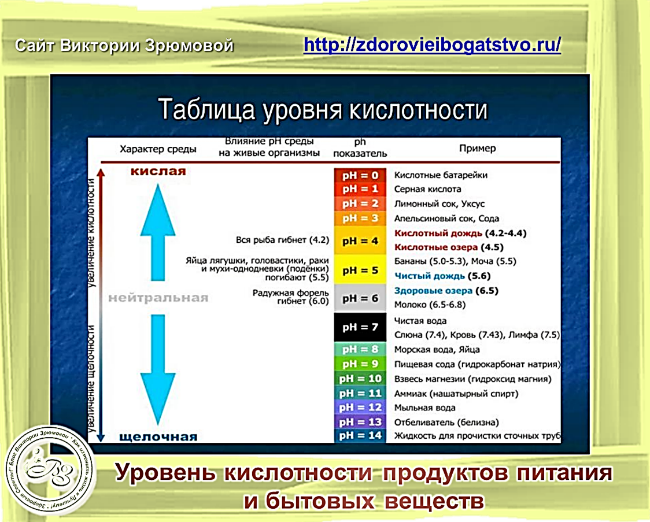 Причем большинство продавцов продвигают воду с рН не меньше 8.5, а 10-11 ед. называют просто панацеей.
Причем большинство продавцов продвигают воду с рН не меньше 8.5, а 10-11 ед. называют просто панацеей.
Что о щелочной воде говорят эксперты?
Итак, каковы же рекомендации по оптимальной рН для питьевой воды? ВОЗ опубликовала почти 600-страничный документ под названием «Рекомендации по качеству питьевой воды». Кажется, что в таком объемном документе должно хотя бы пару строк быть уделено рекомендациям об оптимальном для организма человека рН. Но нет! Утверждается, что рН, как правило, не оказывает «непосредственного влияния на потребителей», но тут же пишется, что рН является одним из «наиболее важных эксплуатационных параметров качества воды». Таким образом, конкретных научных рекомендаций о том, какой рН дожен быть у питьевой воды, нет. Но, например, правительство страны — рекордсмена по долгожителям — Японии, — законодательно устанавливает безопасный уровень рН питьевой воды — 7.5-8.6.
Щёлочность воды: флора и фауна
- В университете штата Мичиган изучали среду выращивания в парниках (в том числе, рН этой среды) и пришли к выводу, что чрезвычайно важно правильно подобрать рН среды еще до посадки.
Слишком высокий уровень рН (свыше 6,5) увеличивает шансы дефицита питательных микроэлементов. Слишком низкий уровень рН (менее 5,3) приводит к токсичности кальция и/или магния и/или марганца.
- Консультативная служба университета штата Огайо сообщает, что щелочная вода влияет на способность растения получать питательные вещества из почвы, и со временем может изменять рН почвы.
- По итогам экологического исследования, проведенного в Нидерландах, показало, что щелочная вода стала причиной гибели местного растения Stratiotes aloides L
- Рыба, подверженная постоянному воздействию щелочной мягкой воды, демонстрирует признаки стресса (иногда со смертельным исходом), в то время как рыба в щелочной жёсткой воде не испытывает такого неблагоприятного воздействия, сообщается по итогам исследования, проведенного в университете Британской Колумбии.
- Если у вас есть сад, то вы можете увидеть полезную иллюстрацию экологических последствий рН прямо там.
 Если уровень рН низкий, гортензии будут цвести розовым цветом, а если высокий – синим.
Если уровень рН низкий, гортензии будут цвести розовым цветом, а если высокий – синим.
Щёлочность воды: люди
- В крайне щелочных условиях нормальные клетки погибают. Опубликованное в «Вестнике биологической химии» исследование показало, что алкалоз (повышение клеточной рН) вызывает щелочно-индуцированную гибель клеток в результате изменения митохондриальной функции.
Кровь человека низко щелочная и имеет рН примерно 7,4. Невероятно важно сохранять рН крови в узком диапазоне 7.3-7.45. Даже небольшое колебание всего лишь 0,05 рН будет иметь серьёзные последствия для здоровья.
Здесь также вскользь затронем тему лечения и профилактики рака. Вся чаще можно найти информацию из научных исследований, которые выступают против щелочности, по крайней мере, в сфере профилактики или лечения рака. Так, Роберт Жиль который изучал образование опухоли и кислотность, пришел к мнению, что опухоли по своей природе являются кислыми – даже в щелочной клеточной структуре. Другими словами, они вырабатывают собственную кислотность. Ученые, которые разрабатывают прототипы потенциальных новых противоопухолевых препаратов, избирательно убивающих опухолевые клетки путем нарушения регуляции внутриклеточной pH, обнаружили, что щелочные препараты не оказывают желаемого эффекта – в отличие от сильно кислых. То есть здесь работает принцип клин клином вышибать — бороться кислотой с раковыми клетками, любящими кислоту.
Другими словами, они вырабатывают собственную кислотность. Ученые, которые разрабатывают прототипы потенциальных новых противоопухолевых препаратов, избирательно убивающих опухолевые клетки путем нарушения регуляции внутриклеточной pH, обнаружили, что щелочные препараты не оказывают желаемого эффекта – в отличие от сильно кислых. То есть здесь работает принцип клин клином вышибать — бороться кислотой с раковыми клетками, любящими кислоту.
Еще более интересно исследование, проведенное в 2005 г. Национальным институтом рака, в котором пересмотрен прием витамина С (аскорбиновой кислоты) для лечения рака. Установлено, что при внутривенном введении в фармакологических дозах аскорбиновая кислота успешно убивает раковые клетки, не причиняя вреда нормальным клеткам. Это еще один пример того, как раковые клетки уязвимы к кислотности, а не к щелочности.
Сторонники альтернативной медицины из Бадвиг Центра, в котором базируется клиника альтернативных методов лечения рака, считают, что наши органы должны строго поддерживать рН на уровне 7,4 единицы в целях достижения и поддержания оптимального здоровья и борьбы с раком.
Мы отнюдь не призываем упрощать связь между щелочностью и раком, поспешно делая преждевременные выводы. Просто поймите, что щелочная вода — не чудо-лекарство от рака.
Кислотно-щелочной баланс организма
Буферная система человека — это первый помощник при нормализации кислотно-щелочного баланса в организме человека. Стабильность pH нужна для нормальной работы биологических молекул и структур, клеток, органов и тканей. При нормальных условиях буферные процессы поддерживают равновесие между появлением и удалением ионов водорода и углекислого газа, что способствует обеспечению в крови постоянного уровня pH.
Один из главных параметров гомеостаза человеческого организма, нормы которого лежат в очень малых пределах, — это рН крови. Буферные системы крови моментально реагируют на изменения этого показателя, возвращая его к норме. Это взаимодействие дает возможность поддерживать динамическое равновесие организма наравне с другими системами регуляции. Вода является примером нейтральной реакции с рН равным 7,0. Нормы рН здоровой человеческой крови дает слабощелочную реакцию в пределах от 7,35 до 7,45. Такие узкие пределы говорят о том, насколько жизненно важен этот кровяной датчик.
Стоит отметить, что именно водородный показатель крови — один из наиболее стабильных в организме человека. Смещение рН в меньшую сторону (кислотную) приводит к ацидозу, в большую (щелочную) – к алкалозу. Это очень опасные для жизни состояния, поскольку, согласно данным исследований, критический для поддержания жизнедеятельности сдвиг рН составляет всего 0,4.
Вся суть в том, что ферменты организма чувствительны к рН и проявляют активность только в определенной среде. Поэтому кровь поддерживает оптимальные уровни водородного баланса во всех тканях, обеспечивая правильный уровень метаболизма. Разлад кислотно-щелочного равновесия крови выводит из равновесия все системы организма. По современным данным, в нашем организме содержится более 3000 различных ферментов (только в печени – 50). Максимальная активность каждого отдельного фермента проявляется при строго определенных значениях рН. Большинство ферментов в организме «работают» при рН=7,3-7,4, участвуя в различных видах обмена веществ (углеводном, жировом, белковом и т.д.).
Читайте статью Показатели питьевой воды TRU-WATER
Сбалансированность — залог здоровья!
Итак, слишком кислая или слишком щелочная вода одинаково вредны для здоровья человека. Это продемонстрировало шведское исследование колодезной воды, которое установило, что крайние значения рН приводят к возникновению проблем. Организм просто не предназначен постоянно пить высокощелочную воду. Именно поэтому вопрос того, какую воду вы будете пить ежедневно — является без преувеличения фундаментальным. Разумно пить воду, которая подходит организму в том числе с точки зрения рН. А это исключает ежедневное употребление высокощелочной воды с уровнем рН 8.6 и выше!
Например, если пить сильнощелочную воду все время, то может подняться щелочность желудка, что снизит в нём кислотность и ухудшит способность переваривать пищу. А пониженная кислотность желудка является одной из наиболее распространенных причин язвы. По словам доктора медицины Боба Арно (Bob Arnot, Doctor of Medicine) в статье журнала Men’s Health Journal «…Ваше тело сделает все для приведения организма к оптимальному балансу pH, независимо от того, что вы глотаете. Например, как только щелочная вода попадает в ваш желудок, ваше тело просто наливает большее количество кислоты, чтобы нейтрализовать ее».
Поддержание нормальной кислотности желудка также необходимо для защиты от бактериальных и вирусных инфекций. Кислая среда разрушает патогенные организмы, которые могут проникать в наш организма орально. Изменение кислотной среды желудка чрезмерным употреблением щелочной воды делает вас открытыми для кишечных инфекций.
Любители пить сильнощелочную воду со временем будет получать меньше минералов и питательных веществ – по сути, ряд этих последствий для здоровья уже можно увидеть у особо сильных фанатов питья сильнощелочной воды. Щелочность также потенциально является проблемой из-за своих антибактериальных свойств, ведь это потенциально может нарушить баланс полезных бактерий в организме.
Не попадайтесь на уловки маркетологов
Большинство людей хотят улучшить своё здоровье максимально быстро и без жертв. Всем нам нравится идея быстрого исправления ситуации. Ведь это так здорово поправить свое здоровье без изменения рациона питания, упражнений, а просто выпив щелочную воду? Разумные маркетологи сегодня открыто ведут охоту на таких потребителей, продавая бесполезные продукты в сфере системы фильтрации и ионизации воды, которые могут вызвать серьезные долгосрочные побочные эффекты.
Значения pH в нашем организме изящно сбалансированы в разных органах и тканях и поддерживаются, прежде всего, через сложную систему буферизации и дыхания. Однако есть некоторые простые вещи, которые вы можете начать делать уже сегодня для поддержания естественно здорового рН. Употребление большего количества фруктов и овощей, тренировка глубокого дыхания и питьё большого количества чистой воды с правильным рН (не более 8.6) позволит вашему организму легче удалить токсины и кислотные метаболические отходы.
Другие факторы, такие как отсутствие физических упражнений, эмоциональный стресс, лечение, кофе, алкоголь и курение, могут неблагоприятно влиять на внутренний уровень pH вашего тела в течение длительного периода времени.
Наслаждайтесь жизнью без рН-паранойи!
Посетите наш магазин инновационных корейских фильтров для витализации воды.
Снижение щелочности воды | Гидрокарбонаты в воде, как убрать
Щелочность бывает нескольких типов: карбонатная, бикарбонатная, гидратная. Уровень щелочности характеризуется количеством кислоты, необходимой для ее снижения. Если брать воду из естественных источников, подземных или поверхностных, щелочность в ней зависит от присутствия гидрокарбонатов кальция и магния.
Повышенная щелочность воды, особенно той, что используется в отопительных системах, плохо сказывается на оборудовании, качестве изготовленной из нее продукции. Под высокой щелочностью понимают повышенную концентрацию в воде ионов, вступающих в связь с сильной кислотой. Особенно огорчает большое содержание карбонатов. Щелочность воды – это сумма гидроксильных ионов, а также слабокислотных анионов, что присутствуют в воде. Они могут быть угольными, органическими, бикарбонатными и карбонатными.
Методы снижения щелочности:
- Обратный осмос, во время которого значительно снижается минерализация воды, уменьшается содержание щелочных анионов. Самый эффективный метод. Его можно считать универсальным, но установки обратного осмоса должны использоваться только отличного качества. При применении подобных установок, не обладающих достаточной технологичностью, а также имеющих несовершенную конструкцию, могут возрасти расходы на эксплуатацию оборудования, его обслуживание. Мембранные элементы будут быстро выходить из строя.
- Катионирование воды с применением слабокислотного катионита, имеющего водородную форму. Помимо уменьшения кислотности совершается неполная деминерализация, отклонение рН в сторону кислотности. Также может нормализоваться минеральный состав, точнее, содержание отдельных его соединений.
- Восстановление раствором соляной кислоты. Введение в воду ненасыщенного раствора соляной, серной или другой кислоты (этот процесс именуется подкислением воды). Процесс реализуется посредством применения аппарата пропорционального дозирования и нужного раствора кислоты.
Назад в раздел
pH воды, воздействие на организм
Potentia hydrogeni (pH) – водородный показатель. Он указывает на наличие в среде ионов водорода, количественно выражая кислотно-щелочной баланс питьевой воды. Показатель pH ниже 6,5-7 свидетельствует о повышенной кислотности среды. Если выше – это указывает на повышенную щелочность воды (концентрацию гидроксильных ионов).
Нормативные значения pH воды в Украине и ЕСВ Украине, кроме требований к очистке воды, также регламентируются и показатель pH воды. Он нормируется двумя стандартами:
- ГОСТ2874-82 – 6,0-9,0.
- ГСанПиН – 6,5-8,5.
Согласно европейскому стандарту качества, показатель кислотно-щелочного баланса питьевой воды в ЕС – 6,5-9,5.
Влияние кислотно-щелочного баланса воды на организм человекаОбщеизвестный факт, что для нормального функционирования организма человеку нужно употреблять в течение 1 дня от 1,5 до 2,5 литров чистой питьевой воды. Если фильтры для воды способны очистить среду от механических или бактериологических загрязнений, то для нормализации pH воды применяются природные кальциты и другие вещества.
Показатель кислотно-щелочного баланса спинномозговой, клеточной, межклеточной жидкости, лимфы, слюны и крови человека – 7,4-7,5. Если pH воды ниже, то она оказывает негативное воздействие на организм человека:
- нарушается обмен веществ;
- повышается риск отравлений;
- возникают проблемы с желудочно-кишечным трактом;
- сгущается лимфа, кровь, эритроциты, что препятствует обогащению клеток организма кислородом, выведению токсинов и приводит к образованию тромбов;
- кислая среда создает оптимальные условия для размножения и развития раковых клеток, гельминтов и вредных микроорганизмов, она разрушает клетки организма, что приводит к преждевременному старению;
- кислая вода не проникает в клетки, она скапливается и вызывает отеки;
- при низком уровне pH организму не хватает кремния и калия, магния и кальция, поэтому он «вытягивает» эти минералы из костных тканей, что приводит к остеопорозу;
- вода с низким показателем кислотно-щелочного баланса становится причиной стрессов, ухудшения сна, приводит к усталости и негативно влияет на состояние кожи.
Считается, что вода с повышенной щелочностью полезна для здоровья человека. Но это не так. Ученые доказали, что она негативно влияет на работу желудка и ухудшает ферментацию пепсина, который нейтрализует негативное воздействие бактерий на организм. Поэтому употребление воды с высоким показателем pH также вредно для здоровья людей.
Как можно нормализовать кислотно-щелочной баланс воды?Для определения уровня кислотно-щелочного баланса проводится бесплатный анализ воды.
Оптимальное оборудование для нормализации кислотно-щелочного баланса питьевой воды:
- Станции дозирования NaOH. Установки позволяют с помощью химических реагентов (амината БП, гидроксида натрия, гипохлорита натрия, коагулянтов, перманганата калия и др.) повышать уровень pH среды в линиях с постоянным или переменным расходом воды.
- Станции дозирования HCl – понижают кислотно-щелочной баланс питьевой воды путем дозирования различных реагентов: NaOCl (гипохлорита натрия), HCl (соляной кислоты), h3SO4 (серной кислоты), h3O2 (перекиси водорода), NaOH (едкого натрия) и KMnO4 (перманганата калия).
Для регулирования показателя pH в домашних условиях применяются фильтры для воды: для понижения кислотно-щелочного баланса – с мембранами обратного осмоса, для повышения – с картриджами-минерализаторами.
Проверка pH так же включается и в расширенный анализ воды позволяет подобрать наиболее эффективные методы и необходимые для повышения или понижения кислотно-щелочного баланса воды установки, реагенты, их количество и объем.
Объяснение щелочности питьевой воды
| |
| 1 | 2 |
Щелочность означает способность воды нейтрализовать кислоты. Щелочность воды может быть связана с наличием одного или нескольких ионов.К ним относятся гидроксиды, карбонаты и бикарбонаты. Как обсуждалось в предыдущих статьях, гидроксид-ионы всегда присутствуют в воде, даже если их концентрация очень мала. Однако значительные концентрации гидроксидов необычны в природных источниках воды, но могут присутствовать после определенных видов очистки. Небольшие количества карбонатов обнаруживаются в природных источниках воды в определенных частях страны, редко превышая 3 или 4 галлона на галлон. Они также могут быть обнаружены в воде после использования соды для смягчения воды.Бикарбонаты — наиболее распространенные источники щелочности. Почти все природные источники содержат измеримое количество этого иона, от 0 до примерно 50 галлонов на 100 г / г.
Щелочность воды можно определить как ее способность нейтрализовать кислоту. Щелочные вещества в воде включают гидроксиды или основания. Их можно определить по их едкому вкусу и по тому факту, что красная лакмусовая бумага становится синей.
Фосфаты и силикаты редко встречаются в природных источниках в значительных концентрациях в домашних условиях.Соединения, содержащие эти ионы, можно использовать в различных процессах очистки воды. Умеренные концентрации щелочности желательны в большинстве источников воды, чтобы уравновесить коррозионное воздействие кислотности. Однако чрезмерное количество вызывает ряд проблем. Эти ионы, конечно, свободны в воде, но имеют свои аналоги в виде катионов, таких как кальций, магний и натрий или калий.
Вы, вероятно, не заметите щелочного состояния из-за ионов бикарбоната, за исключением случаев, когда они присутствуют в больших количествах.Напротив, вы должны легко определить щелочность даже по довольно небольшому количеству карбонатных и гидроксид-ионов.
Сильная щелочная вода имеет неприятный «газированный» вкус. Регламент EPA для вторичной питьевой воды ограничивает щелочность только с точки зрения общего количества растворенных твердых веществ (500 ppm) и в некоторой степени путем ограничения значения pH.
| 1 | 2 |
Читать дальше: Что такое щелочность?
| |
Щелочность и жесткость
ЧТО ТАКОЕ ЩЕЛОЧНОСТЬ?
Щелочность — это способность воды противостоять кислым изменениям pH, в основном щелочности. способность воды нейтрализовать кислоту.Эта возможность называется буферизацией. емкость. Водоем с высоким уровнем щелочности (который отличается от щелочной водоем) имеет более высокий уровень карбоната кальция, CaCO3, который может уменьшаться кислотность воды. Следовательно, щелочность измеряет, сколько кислоты можно добавить в водоем до сильного изменения pH. происходит.
ЩЕЛОЧНОСТЬ ПРОТИВ ЖЕСТКОСТИ ВОДЫ
Щелочность и жесткость воды довольно похожи — по сути, они источники в природе.Вода движется сквозь камни (и при этом собирает минералы) по пути к рекам и озерам. Когда известняк и доломит растворяются в воде, один половина молекулы — это кальций или магний («твердость»), а другая половина — это карбонат («щелочность»). Это означает, что уровень жесткости воды и щелочность в месте будет очень похожей. Однако это очень отдельные измерения, и имеют совсем другое значение.
ЗАЧЕМ ЗАНИМАТЬСЯ ЩЕЛОЧНОСТЬЮ?
Для рыб и других водных организмов требуется диапазон pH от 6,0 до 9,0, а поскольку щелочность буферы против быстрых изменений pH, он защищает живые организмы, которым требуется специфическая Диапазон pH.Более высокий уровень щелочности в поверхностных водах будет сдерживать кислотные дожди и другие кислотные отходы, предотвращающие изменения pH, вредные для водных организмов. Щелочность также важна при очистке сточных вод и питьевой воды. вода, потому что она влияет на процессы очистки, такие как анаэробное пищеварение. Воды также может быть непригодным для использования при орошении, если уровень щелочности в воде выше естественного уровня щелочности почвы.
ПРИРОДНЫЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ЩЕЛОЧНОСТЬ
- Геология — типы пород, окружающих ручей, влияют на щелочность. Фосфаты, известняк, а бораты придают воде более высокую щелочность и буферную способность.
- Сезонная погода — весеннее таяние снега и дождь могут увеличить сток, что в целом также увеличивает кислотность, в свою очередь уменьшение щелочности.
ЧЕЛОВЕЧЕСКИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ЩЕЛОЧНОСТЬ
- Кислотные отходы горнодобывающей промышленности — Кислоты из шахт могут смываться в реки и ручьи и повышать кислотность, которая требует большей щелочности.
- Урбанизация — Частицы цемента и других городских строительных материалов могут смываться потоками. и влияют на щелочность.
КАК ИЗМЕРИТЬ ЩЕЛОЧНОСТЬ?
Utah Water Watch — Узнайте, как волонтеры в штате следят за качеством воды.
Stream Side Science — Изучите различные планы уроков, касающихся качества воды, и посмотрите, как они сочетаются с основной учебной программой для классов k-12.
Юта DEQ — Узнайте, как департамент качества воды штата контролирует поверхностные воды.
Проверьте свою питьевую воду
Щелочность и вода
• Школа наук о воде ГЛАВНАЯ • Темы о свойствах воды • Темы о качестве воды •
Способность нейтрализовать щелочность и кислотность
Измерение щелочности в мобильной лаборатории при работе на Мадди-Крик, восточная часть Юты, октябрь 2015 г.
Кредит: Стив Гернер, USGS
Щелочность — это не химическое вещество в воде, а, скорее, это свойство воды, которое зависит от присутствия в воде определенных химических веществ, таких как бикарбонаты, карбонаты и гидроксиды. Тогда определение щелочности будет «буферной способностью водоема; мерой способности водоема нейтрализовать кислоты и основания и, таким образом, поддерживать довольно стабильный уровень pH ». Проще говоря, вода с высокой щелочностью будет испытывать меньшее изменение собственной кислотности, например, когда кислая вода, такая как кислотный дождь или разлив кислоты, попадает в водоем.
Вы можете использовать эту аналогию — вы и ваш друг находитесь в отдельных небольших гребных лодках в озере . Обе лодки имеют протечку, что вас не беспокоит, поскольку вы оба были достаточно мудры, чтобы принести на борт ведро для спасения на случай непредвиденных обстоятельств. Вот только ваш друг схватил ведро размером с галлон, а все, что у вас есть, — это ведро поменьше, размером с пинту. Вы оба начинаете выкачивать воду из лодки, но через некоторое время ноги вашего друга становятся едва влажными, а внутри вашей лодки вода до колен.Ваш друг может выгрузить поступающую воду так же быстро, как она поступает, но вы не успеваете. У вашего друга лучшая «буферная способность», чем у вас, и он может в большей степени нейтрализовать поступающую воду. По этой аналогии его лодка будет иметь более высокую щелочность, чем ваша.
Почему важна щелочность
Хотя вы не часто слышите о щелочности вашего любимого озера в новостях, щелочность может иметь важное значение для здоровья и благополучия озера.Экосистема и организмы, обитающие в озере, эволюционировали в водоемах, которые не менялись быстро. До прихода людей водоемы не подвергались разливам химикатов и кислотным дождям. Вероятно, pH и водные характеристики озера не сильно изменились за короткий промежуток времени, что прекрасно подходило для рыб в озере.
В наше время водные объекты могут подвергаться внезапному поступлению химикатов, например, содержащихся в кислотных дождях и сточных водах , которые могут вызывать быстрые изменения кислотно-щелочного баланса озера, снижая pH воды в озере. , например.Внезапное изменение pH вредно для рыб и организмов, живущих в воде. Водные организмы выигрывают от стабильных значений pH, а вода с высокой щелочностью лучше способна поддерживать довольно постоянный pH.
Что влияет на щелочность?
В поверхностных водоемах, таких как озеро, щелочность воды в основном возникает из-за камней и земли, окружающих озеро. Осадки выпадают в водоразделе, окружающем озеро, и большая часть воды, поступающей в озеро, поступает из стока над ландшафтом.Если ландшафт находится в области, содержащей камни, такие как известняк, то сток улавливает химические вещества, такие как карбонат кальция , (CaCO 3 ), что повышает pH и щелочность воды. Например, в областях, где геология содержит большое количество гранита, озера будут иметь более низкую щелочность. Но пруд в пригороде, даже в области с большим количеством гранита, может иметь высокую щелочность из-за стока с домашних газонов, где был применен известняк (используется для повышения pH почвы для лучшего выращивания газонов).
Измерение щелочности
Измерение пробы воды в лаборатории для определения щелочности.
Кредит: Джозеф Айотте, USGS
Один из распространенных методов, используемых Геологической службой США (USGS) для измерения щелочности, состоит в том, чтобы взять образец воды и добавить в него кислоту, одновременно проверяя pH воды по мере добавления кислоты. Снимают начальное значение pH воды, затем постепенно добавляют небольшие количества кислоты, воду перемешивают и измеряют pH.Это делается много раз. Вначале добавленная кислота будет нейтрализована соединениями в воде, такими как бикарбонаты. По мере добавления кислоты бикарбонаты «расходуются», так как они также нейтрализуются кислотой. В конце концов, все соединения, нейтрализующие кислоту, израсходованы. После этого любая кислота, добавленная в воду, будет понижать pH линейным образом, и ученый сможет увидеть эту точку отражения, просмотрев линейную диаграмму количества кислоты, добавленной в воду, и результирующего pH.Точка, в которой линия изменения pH становится линейной, используется для определения щелочности воды.
На этом снимке ученый Геологической службы США выполняет титрование щелочности, чтобы определить щелочность образца воды. Обратите внимание на pH-метр на заднем плане (на данный момент он показывает 5,477). Большая серая трубка, идущая в стакан, — это зонд pH. Черное устройство с правой стороны проталкивает фиксированное количество кислоты через белую трубку, которая попадает в правую сторону стакана с водой.Черный ящик на дне имеет вращающийся магнит, который затем вращает небольшой магнит, расположенный на дне стакана, который поддерживает перемешивание пробы воды.
Карта щелочности поверхностных вод в США
Вот карта, составленная Агентством по охране окружающей среды США (EPA), которая показывает значения щелочности для поверхностных вод США. Согласно EPA, эта карта представляет собой общую иллюстрацию национальных закономерностей щелочности поверхностных вод на территории Соединенных Штатов.Щелочность является наиболее доступным показателем кислотонейтрализующей способности поверхностных вод и дает разумную оценку относительной потенциальной чувствительности озер и водотоков к кислотным осаждениям. Хотя фактическая чувствительность водного объекта зависит от многих характеристик и процессов водосбора, области с низкой щелочностью на карте указывают, где наиболее вероятно обнаружение чувствительных поверхностных вод.
Карта щелочности поверхностных вод в U.S. Карта основана на данных о щелочности примерно 39 000 участков озер и ручьев и на ассоциациях значений данных с такими факторами, как землепользование, физиография, геология и почвы. Данные были получены из различных источников, включая федеральные агентства и агентства штата, университетских исследователей. и частные корпорации. Во многих областях, представленных определенным диапазоном щелочности, в данных о качестве воды наблюдался еще больший диапазон. Затенением на карте обозначен диапазон щелочности, в который попадают среднегодовые значения большей части поверхностных вод данного района.
Авторы и права: Джеймс М. Омерник, Гленн Э. Гриффит, Джеффри Т. Айриш и Коллин Б. Джонсон
Щелочность воды и pH: что они означают для качества воды
Понимание разницы между щелочностью и pH и того, как щелочная вода может повлиять на растения, важно для определения того, что делать для устранения возможных проблем с питанием.
Когда речь идет о качестве воды, щелочность намного важнее, чем pH.pH показывает, является ли вода кислой, нейтральной или щелочной, но не буферная способность воды. Буферная способность — это способность воды (или соединения) противостоять изменению pH. Щелочность показывает буферную способность воды в основном диапазоне pH.
У вас может быть вода с высоким (или низким) pH с очень небольшой буферной емкостью, что означает, что вы можете легко и быстро изменить pH воды; это также означает, что вода вряд ли изменит pH почвы или почвенных смесей.У вас также может быть вода с pH выше 7 и высокой щелочностью, а это значит, что будет сложно изменить pH воды. Это также означает, что вода, если ее щелочность достаточно высока или применяется много воды, может повысить pH почвы или почвенных смесей.
По мере увеличения щелочности воды увеличивается сопротивление изменению pH воды или, что более важно, повышается способность воды изменять pH чего-либо другого, например почвы или почвенных смесей. Вероятность изменения pH почвенной смеси гораздо выше, поскольку горшки поливают гораздо чаще, чем растения в земле, а объем почвенной смеси в горшке ограничен.Ни pH, ни щелочность в диапазонах, которые обычно наблюдаются в неочищенной воде, не вызывают прямого повреждения растений; ущерб является косвенным, вызывая изменение pH почвы или почвенных смесей, из-за чего некоторые питательные вещества становятся недоступными. Если вода очень щелочная, она может вызвать повреждение растений, медленно образуя отложения на листьях — мы действительно наблюдаем это с небольшим количеством воды в Мичигане, и если большое количество щелочной воды часто применяется к растениям. Большинство муниципальных процессов очистки воды снижают щелочность.
Сообщения о нарушении питательных веществ у ландшафтных растений в течение сезона могут быть связаны с водой с высокой щелочностью, но обычно являются результатом других проблем. Естественный pH большинства почв Мичигана находится в диапазоне от 5,5 до 7,7, что подходит для полноценного питания большинства растений. Однако есть некоторые растения (большинство хвойных пород, некоторые клены, другие), которые будут демонстрировать симптомы дефицита питательных веществ при pH почвы выше 6, а иногда и ниже. Эти симптомы могут проявляться не в начале года, а развиваться по мере того, как на растениях появляется больше роста и вегетации.
В любом случае, независимо от того, является ли вода щелочной или pH почвы относительно высок, корректировка pH почвы является самым простым и долгосрочным решением для домовладельцев и производителей полевых культур. У коммерческих производителей контейнерных декоративных растений есть и другие варианты, от изменения методов выращивания до введения кислоты в воду.
Я получил вопросы о воде обратного осмоса с высоким pH. Вода обратного осмоса создается путем пропускания воды через ультратонкие мембраны, в результате чего удаляются почти все ионы.Вода обратного осмоса обычно бывает нейтральной или слабокислой, но может быть щелочной (не щелочной) в зависимости от исходной воды и способа ее обработки. Кроме того, из-за низкого содержания ионов очень трудно точно измерить pH воды обратного осмоса — незначительные остатки на датчиках или сборных стаканах могут вызвать большую ошибку.
Некоторые муниципалитеты используют гидроксид натрия (NaOH, часто используемый для очистки питьевой воды) или аналогичное химическое вещество (которое генерирует ионы OH —) как часть очистки воды, которая может привести к повышению pH после процесса обратного осмоса.Мембраны обратного осмоса не пропускают ионы натрия, но не гидроксид-ионы; ионы гидроксида увеличивают pH, но не щелочность. Опять же, легко изменить pH воды с высоким pH и низким уровнем щелочности. Высокая щелочность исходной (питающей) воды для системы обратного осмоса может вызвать образование накипи на мембране, поскольку карбонат кальция (основная причина щелочности воды) осаждается на мембранах.
Таким образом, основная проблема, возникающая из-за воды с высоким pH, — это щелочная вода.Щелочная вода может повысить pH почвы или почвенных смесей. Дефицит питательных веществ возникнет, если pH почвы или почвенных смесей будет выше идеального диапазона для растворимости питательных веществ. Лаборатория питательных веществ для почв и растений Университета штата Мичиган будет проверять воду на щелочность (за плату), и есть частные лаборатории, которые также будут делать это. У Департамента качества окружающей среды Мичигана есть список сертифицированных лабораторий, которые будут проверять щелочность и пригодность воды для питья, хотя щелочность не влияет на пригодность для питья.
Для коммерческих производителей и специалистов по внесению пестицидов щелочная вода также может влиять на смешивание некоторых удобрений и пестицидов, вызывая их выпадение в осадок из раствора. Существуют относительно недорогие наборы для определения щелочности воды. В дополнение к Лаборатории питательных веществ для почвы и растений МГУ, есть также несколько коммерческих лабораторий, которые будут анализировать воду по параметрам качества сельскохозяйственных культур.
Вы нашли эту статью полезной?
Расскажите, пожалуйста, почему
Представлять на рассмотрение5.10 Общая щелочность | Мониторинг и оценка
Что такое общая щелочность и почему это важно?
Щелочность — это мера способности воды нейтрализовать кислоты (см. Описание pH). Щелочные соединения в воде, такие как бикарбонаты (пищевая сода — один из видов), карбонаты и гидроксиды, удаляют ионы H + и снижают кислотность воды (что означает повышение pH). Обычно они делают это путем объединения с ионами H + для создания новых соединений. Без этой способности нейтрализации кислоты любая кислота, добавляемая в поток, вызовет немедленное изменение pH.Измерение щелочности важно для определения способности потока нейтрализовать кислотное загрязнение от дождя или сточных вод. Это один из лучших показателей чувствительности потока к поступлению кислоты.
На щелочность водотоков влияют горные породы и почвы, соли, некоторые виды деятельности растений и некоторые сбросы промышленных сточных вод.
Общая щелочность измеряется путем измерения количества кислоты (например, серной кислоты), необходимой для доведения pH образца до 4,2. При этом pH все щелочные соединения в образце «израсходованы».»Результат выражается в миллиграммах на литр карбоната кальция (мг / л CaCO 3 ).
Анализ и анализ оборудования
Для определения общей щелочности рекомендуется двойное титрование по конечной точке с использованием pH-метра (или pH-метра) и цифрового титратора или бюретки. Это можно сделать в полевых условиях или в лаборатории. Если вы будете анализировать щелочность в полевых условиях, рекомендуется использовать цифровой титратор вместо бюретки, поскольку бюретка хрупкая и ее сложнее установить и использовать в полевых условиях.Описанный ниже метод определения щелочности был разработан в рамках проекта мониторинга кислотных дождей Исследовательского центра водных ресурсов Массачусетского университета.
Бюретки, титраторы и цифровые титраторы для измерения щелочности
Анализ общей щелочности включает титрование. В этом тесте титрование представляет собой добавление небольших точных количеств серной кислоты (реагента) к образцу до тех пор, пока образец не достигнет определенного значения pH (известного как конечная точка). Количество использованной кислоты соответствует общей щелочности образца.Щелочность можно измерить с помощью бюретки, титратора или цифрового титратора (описано ниже).
- Бюретка представляет собой длинную градуированную стеклянную трубку с коническим наконечником, как у пипетки, и клапаном, который открывается, позволяя реагенту капать из трубки. Количество используемого реагента рассчитывается путем вычитания исходного объема бюретки из объема, оставшегося после достижения конечной точки. Щелочность рассчитывается исходя из использованного количества.
- Титраторы принудительно вытесняют реагент с помощью ручного или механического поршня.Количество используемого реагента рассчитывается путем вычитания исходного объема в титраторе из объема, оставшегося после достижения конечной точки. Затем щелочность рассчитывается на основе использованного количества или считывается непосредственно с титратора.
- Цифровые титраторы имеют счетчики, отображающие числа. Поршень вдавливается в картридж, содержащий реагент, поворотом ручки на титраторе. Когда ручка поворачивается, счетчик изменяется пропорционально количеству использованного реагента.Затем рассчитывается щелочность на основе использованного количества. Цифровые титраторы стоят примерно 90 долларов.
Цифровые титраторы и бюретки позволяют добиться большей точности и единообразия в количестве используемого титранта.
Как собирать и анализировать образцы
Полевые процедуры сбора и анализа проб на pH и общую щелочность состоят из следующих задач:
ЗАДАЧА 1 Подготовить контейнеры для проб
Контейнеры для проб (и вся стеклянная посуда, используемая в этой процедуре) необходимо очистить и ополоснуть перед первым запуском и после каждого цикла отбора проб в соответствии с процедурой, описанной в методе A в главе 5 — Условия качества воды.Не забудьте надеть латексные перчатки.
ЗАДАНИЕ 2 Подготовиться перед выездом на место отбора проб
См. Раздел 2.3 — Меры безопасности для получения подробной информации о подтверждении даты и времени отбора проб, соображениях безопасности, проверке расходных материалов, а также проверке погоды и направления. Помимо стандартного оборудования для отбора проб и одежды, при отборе проб на pH и щелочность включается следующее оборудование:
- Цифровой титратор
- Градуированный цилиндр 100 мл
- Стакан 250 мл
- pH-метр с комбинацией температуры и электрода сравнения или pH «карманный приятель»
- Картридж для титрования серной кислоты, 0.16 N
- Паспорт pH и общей щелочности для записи результатов
- Стандартные волюметрические ампулы щелочности, 0,500 Н, для проверки точности
- Промыть бутыль деионизированной водой для ополаскивания электрода pH-метра
- Магнитная мешалка, если титрование в лаборатории
Обязательно откалибруйте pH-метр перед анализом пробы. Измеритель pH следует откалибровать перед анализом пробы и после каждых 25 проб в соответствии с инструкциями в руководстве к прибору.Используйте два стандартных буферных раствора pH: 4,01 и 7,0. Ниже приведены примечания относительно буферов:
- Буферные растворы должны быть комнатной температуры при калибровке глюкометра.
- Не использовать буфер после истечения срока его действия.
- Всегда закрывайте буферы во время хранения, чтобы предотвратить загрязнение.
- Поскольку значения pH буферного раствора меняются в зависимости от температуры, измеритель должен иметь встроенный датчик температуры, который автоматически стандартизирует pH при калибровке измерителя.
- Не используйте буферные растворы повторно!
Обязательно сообщите кому-нибудь, куда вы собираетесь и когда собираетесь вернуться.
ЗАДАЧА 3 Собрать образец
См. Задание 2 в главе 5 — Условия качества воды для получения подробной информации о том, как отбирать пробы воды с помощью бутылок с завинчивающейся крышкой или мешков Whirl-pak®.
ЗАДАЧА 4 Измерение общей щелочности (полевые или лабораторные)
Следующие шаги предназначены для использования цифрового титратора в полевых условиях или в лаборатории.Если вы используете бюретку, обратитесь к Стандартным методам (APHA, 1992).
Щелочность обычно измеряется серной кислотой с помощью цифрового титратора. Серная кислота добавляется к пробе воды в отмеренных количествах до тех пор, пока три основные формы щелочности (бикарбонат, карбонат и гидроксид) не превратятся в угольную кислоту. При pH 10 гидроксид (если он присутствует) реагирует с образованием воды. При pH 8,3 карбонат превращается в бикарбонат. При pH 4,5 очевидно, что весь карбонат и бикарбонат превращаются в угольную кислоту.Ниже этого pH вода не может нейтрализовать серную кислоту, и существует линейная зависимость между количеством серной кислоты, добавленной к образцу, и изменением pH образца. Таким образом, к образцу добавляют дополнительную серную кислоту, чтобы снизить pH 4,5 ровно на 0,3 единицы pH (что соответствует точному удвоению pH) до pH 4,2. Однако точный pH, при котором могло произойти преобразование этих оснований, или общая щелочность, все еще неизвестны. В этой процедуре используется уравнение, полученное из наклона линии, описанной выше, для экстраполяции обратно на количество серной кислоты, которое было добавлено для фактического преобразования всех оснований в угольную кислоту.Затем множитель (0,1) преобразует это в общую щелочность в мг / л CaCO 3 . Следующие шаги описывают процедуры, необходимые для определения щелочности вашего образца.
- Вставьте чистую подающую трубку в картридж для титрования 0,16 N серной кислоты и прикрепите картридж к корпусу титратора.
- Держите титратор кончиком картриджа вверх над раковиной. Поверните ручку подачи, чтобы выпустить воздух и несколько капель титранта. Сбросьте счетчик на 0 и протрите кончик.
- Измерьте pH образца (см. PH, раздел 5.4). Если оно меньше 4,5, перейдите к шагу 9 ниже.
- Вставьте трубку для доставки в стакан с пробой. Поверните ручку подачи, перемешивая стакан с помощью магнита, пока pH-метр не покажет 4,5. Запишите количество цифр, используемых для достижения этого pH. Не сбрасывайте счетчик.
- Продолжайте титрование до pH 4,2 и запишите количество цифр.
- Примените следующее уравнение: Щелочность (как мг / л CaCO 3 ) = (2a — b) x 0.1
Пример:Где: а = цифры титранта для достижения pH 4,5 б = цифры титранта для достижения pH 4,2 (включая цифры, необходимые для достижения pH 4,5) 0,1 = -разрядный множитель для титровального картриджа 0,16 и образца объемом 100 мл
Начальный pH пробы равен 6.5.
Для достижения pH 4,5 требуется 108 оборотов.
Для достижения pH 4,2 требуется еще 5 ходов, всего 113 ходов.Щелочность =
=((2 x 108) — 113) x 0,1
10,3 мг / л - Запишите результаты как щелочность в мг / л в лабораторный лист.
- Промойте стакан дистиллированной водой перед следующей пробой.
- Если pH пробы воды перед титрованием меньше 4.5 действуйте следующим образом:
- Вставьте трубку подачи в стакан с пробой.
- Поверните ручку подачи, вращая стакан, пока pH-метр не покажет ровно на 0,3 единицы pH меньше начального pH пробы.
- Запишите количество цифр, используемых для достижения этого pH.
- Примените уравнение, как в шаге 6, но a = 0 и b = количество цифр, необходимое для уменьшения начального pH точно на 0,3 единицы pH.
Начальный pH пробы равен 4.3.
Введите «0» в столбец 4.5 на листе лаборатории.
Титровать до pH на 0,3 единицы меньше исходного pH в этом cas 4.0.
Чтобы добраться до 4.0, нужно 10 цифр.
Введите это значение в столбец 4,2 на листе лаборатории и обратите внимание, что конечная точка pH составляет 4,0. Щелочность = (0-10) x 0,1 = -1,0.- Запишите результаты как щелочность в мг / л в лабораторный лист.
- Выполните проверку точности первого полевого образца, в середине цикла и после анализа последнего образца, как описано ниже.Проверяйте pH-метр по буферам pH 7,0 и 4,01 после каждых 10 проб.
ЗАДАЧА 5 Проверить точность
Эту проверку точности следует выполнять на первом титрованном образце в полевых условиях, снова примерно на полпути через полевые образцы и на последнем полевом образце.
- Отломите горлышко от эталонной ампулы с объемной щелочностью 0,500 Н. Или, если вы используете стандартный раствор из бутылки, налейте несколько миллилитров стандарта в чистый стакан.
- Пипетка 0.1 мл стандарта на титрованный образец (см. Выше). Возобновите титрование до конечной точки pH 4,2. Запишите необходимое количество цифр.
- Повторите, используя еще две добавки по 0,1 мл стандарта. После каждого добавления титровать до pH 4,2.
- Для каждого добавления 0,1 мл стандарта требуется 250 дополнительных цифр 0,16 н. Титранта.
ЗАДАНИЕ 6 Верните полевые листы данных и образцы в лабораторию или в пункт выдачи
Пробы на щелочность должны быть проанализированы в течение 24 часов после их сбора.Если образцы не могут быть проанализированы в полевых условиях, храните образцы на льду и как можно скорее отнесите их в лабораторию или в пункт сдачи.
Список литературы
APHA. 1992. Стандартные методы исследования воды и сточных вод. 18 -е изд. Американская ассоциация общественного здравоохранения, Вашингтон, округ Колумбия.
Годфри, П.Дж. 1988. Кислотный дождь в Массачусетсе. Центр исследований водных ресурсов Массачусетского университета, Амхерст, Массачусетс.
Сеть речного дозора. 1992. Полевые и лабораторные процедуры общей щелочности и pH (на основе проекта мониторинга кислотных дождей Массачусетского университета). 1 июля.
Каким должен быть показатель pH питьевой воды?
Помните время на уроке естествознания, когда вы проводили тот эксперимент с лакмусовой бумагой, и она стала красной, когда вы положили ее на лимон, и синей в мыльной воде? Вероятно, это был ваш первый эксперимент в чудесной науке о pH.
Индикатор кислотности и щелочности известен как значение pH.Значение pH 7 означает, что вещество нейтрально. Более низкое значение указывает на кислотность, а более высокое значение — на щелочность. Чтобы лучше понять диапазон pH, взгляните на эти примеры: яблочный сок 3, апельсиновый сок 3,5, кофе 5,5, молоко 6,2, пищевая сода 8,5, мыльная вода 10, отбеливатель 12.
Все последние новости следите за The Daily Канал Звезды Google News.
Итак, что означает pH для воды?
По сути, значение pH является хорошим индикатором того, жесткая или мягкая вода.PH чистой воды равен 7. Как правило, вода с pH ниже 7 считается кислой, а с pH выше 7 — щелочной. Нормальный диапазон pH для систем поверхностных вод составляет от 6,5 до 8,5, а диапазон pH для систем грунтовых вод составляет от 6 до 8,5. Щелочность — это мера способности воды противостоять изменению pH, которое может сделать воду более кислой. Измерение щелочности и pH необходимо для определения коррозионной активности воды.
Эффекты
Употребление чрезмерно кислой или щелочной воды опасно, предупреждает Агентство по охране окружающей среды (EPA).Питьевая вода должна иметь значение pH 6,5-8,5, чтобы соответствовать стандартам EPA, и они также отмечают, что даже в пределах допустимого диапазона pH вода со слегка высоким или низким pH может быть непривлекательной по нескольким причинам.
Вода с высоким pH кажется скользкой, немного похожей на пищевую соду и может оставлять отложения на приборах, согласно веб-сайту EPA. С другой стороны, вода с низким pH может иметь горький или металлический привкус и может способствовать коррозии арматуры.
Мнение эксперта
Университет Уилкса указывает на еще одну проблему, связанную с питьевой водой и pH: вода с высоким pH часто бывает жесткой.Они отмечают, что жесткая вода «не представляет опасности для здоровья, но может вызвать эстетические проблемы». Среди проблем, связанных с жесткой водой, они называют образование накипи на приспособлениях, горький привкус, трудности с вспениванием мыла и снижение эффективности водонагревателя. Они предполагают, что воду можно смягчить с помощью ионообменных устройств для умягчения воды.
Согласно исследованию Университета Уилкса, связь pH с атмосферными газами и температурой является основной причиной, по которой пробы воды следует проверять на регулярной основе.В исследовании говорится, что значение pH воды не является мерой силы кислотного или основного раствора и само по себе не может предоставить полную картину характеристик или ограничений, связанных с водоснабжением.
В то время как идеальный уровень pH питьевой воды должен составлять 6-8,5, человеческий организм постоянно поддерживает равновесие pH, и на него не влияет потребление воды. Например, наш желудок имеет естественный низкий уровень pH, равный 2, что является полезной кислотностью, которая помогает нам переваривать пищу.
Щелочность воды
Что такое щелочность?
Щелочность отличается от pH. В то время как pH указывает, является ли раствор кислотой или основанием, щелочность говорит вам, сколько кислоты раствор может поглотить без изменения pH. По сути, это буферная способность раствора (также известного как вода). Следовательно, растворы с низкой щелочностью имеют более низкую буферную способность и довольно быстро изменяют pH при добавлении чего-то кислого. И наоборот, образцы с высокой щелочностью имеют более высокую буферную способность и меньше подвержены влиянию добавления чего-то кислого; вам нужно добавить намного больше кислоты, чтобы получить такое же изменение pH, как и в образце с низкой щелочностью.
Что вызывает щелочность?
В природных источниках воды щелочность варьируется в зависимости от географического положения. Геология местности напрямую влияет на степень щелочности. В первую очередь виноваты минералы из окружающих пород и почвы. Например, области с высокой частотой встречаемости известняка будут иметь гораздо более высокую щелочность, чем области с высокой частотой встречаемости гранита. При измерении щелочности результаты отображаются в миллионных долях карбоната кальция (CaCO 3 ).Ионы гидроксида (OH — ), ионы бикарбоната (HCO 3 — ) и ионы карбоната (CO 3 2-) способствуют щелочности воды.
Зачем измерять щелочность?
Щелочность важна в различных отраслях промышленности. Все, от аквариумов и аквакультуры до покрытия и очистки воды, требует проверки на щелочность. Незнание щелочности воды в нескольких областях может иметь катастрофические последствия для конечного продукта.Правильный мониторинг щелочности может сэкономить время, материалы и деньги пользователей и операторов.
Аквариумы
Хотя буферная способность аквариума важна как для резервуаров с пресной водой, так и для резервуаров с соленой водой, многие дополнительные организмы, встречающиеся в морской среде, гораздо более восприимчивы к проблемам, вызванным неправильной щелочностью. Неправильная щелочность может вызвать такие проблемы, как колебания pH, ожог щелочью, обесцвечивание кораллов и потеря тканей. Рекомендуется еженедельное тестирование.Для получения дополнительной информации, пожалуйста, ознакомьтесь с нашим блогом «Как проверить щелочность (dKH или ppm) в вашем аквариуме»!
Сельское хозяйство Щелочность очень важна для роста растений. Однако мы говорим не о щелочности растений, а об их системах орошения и / или питательных растворов. Если щелочность слишком высока, питательные вещества, необходимые для роста растений, не будут свободны в растворе. Когда питательные вещества не находятся в свободном состоянии в растворе, они не могут усваиваться растениями и, следовательно, , неэффективны.Не удивляйтесь, если вы заметите появление пятен или обесцвечивание растений или задержку роста, если показания щелочности окажутся неверными.
Обработка поверхности
Гальванические ванны Поддержание надлежащего pH является ключевым условием для нанесения металлических покрытий на детали и предотвращения таких ошибок, как неровное покрытие, точечная коррозия и ожоги. Соответствующий pH также жизненно важен для ванн для очистки и травления; если pH не соответствует норме, детали не будут очищены или отполированы должным образом.Способ поддерживать pH — иметь буферную емкость, щелочность в ваннах. Чем больше загрязняющих веществ попадает в детали, которые нужно покрыть, они могут вызвать большие колебания pH, если ванна не забуферирована.
Муниципалитеты
Щелочность — это параметр, за которым внимательно следят в процессах очистки питьевой воды и сточных вод. Оптимальная щелочность может упростить обработку и сократить затраты времени и материалов. Неправильная щелочность может вызвать такие проблемы, как замедление реакций обработки, необходимость в дополнительных материалах, остановка обработки, дефекты конечного продукта и экологические последствия.Читайте дальше, чтобы узнать больше о щелочности и муниципальных системах водоснабжения!
Когда и где следует контролировать щелочность?
Питьевая вода
При просмотре отчета о водоснабжении вашего города вы не увидите щелочность согласно основным или вторичным стандартам питьевой воды. Он не подпадает под эти необходимые тесты на загрязняющие вещества и / или параметры. Однако щелочность может влиять на то, как нужно обрабатывать воду на протяжении всего процесса очистки воды.Обычно он измеряется в исходной воде и в распределительной воде, хотя его также можно измерить на стадии коагуляции и флокуляции.
Коагуляция и флокуляция
Когда щелочность воды, проходящей через процесс очистки питьевой воды, достаточно высока, вода будет защищена от летучих изменений pH. Это важно, потому что различные коагулянты (вещества, используемые для удаления загрязняющих веществ из питьевой воды) могут вызывать снижение pH в воде.Если pH упадет слишком низко, необходимо будет произвести корректировку перед последующими этапами. Это приведет к тому, что на очистку воды будет потрачено больше времени, ресурсов и денег. В идеале вам понадобится не менее 110 мг / л CaCO 3 для буферизации воды на стадии коагуляции. Зная степень щелочности очищенной воды, операторы могут заранее регулировать дозировку коагулянта, pH и щелочность воды.
Сточные воды
Так же, как и в питьевой воде, щелочность является показателем того, насколько вода чувствительна к изменениям pH.Он также может указывать на pH и жесткость воды.
Коагуляция и флуктуация
Вам необходим определенный уровень щелочности, чтобы гарантировать, что обработка осадком не вызовет падения pH. Если щелочность слишком низкая, коагулянт изменит pH, и помутнение не будет удалено. По мере добавления коагулянта операторы также иногда добавляют известь или кальцинированную соду, чтобы отрегулировать pH и поддерживать стабильную щелочность.
Бак аэрации
Щелочность на этом этапе процесса обработки контролируется и регулируется для нитрификации.Процессы нитрификации потребляют существующую щелочность, в то время как денитрификация вызывает щелочность. Операторы будут регулярно контролировать щелочность, а не pH, чтобы предварительно обработать воду бикарбонатом натрия или кальцинированной содой, чтобы биологическая очистка воды и отходов была эффективной.
Нитрификация — это превращение аммиака из отходов в нитраты. Для нитрификации требуется pH 6,5-8,5. Если щелочность ниже 50 мг / л, операторы будут испытывать большие колебания pH, что замедлит процесс нитрификации.В процессе нитрификации требуется ~ 7,1 мг щелочности на 1 мг аммиака. Поэтому очень важно измерить как аммиак, так и щелочность, чтобы убедиться, что щелочность достаточна для завершения обработки.
Удаление питательных веществ: фосфор
Фосфор — еще один загрязнитель, который необходимо удалить до того, как сточные воды станут сточными водами и попадут в природный ландшафт. Известь можно использовать для удаления фосфора. Однако для того, чтобы известь эффективно удаляла фосфор, известь должна сначала прореагировать со щелочностью воды.Бикарбонатная щелочность реагирует с известью и образует карбонат кальция. Уровень pH повысится из-за добавления извести, и тогда кальций будет присутствовать в избытке. Избыток кальция вступает в реакцию с фосфатом в сточных водах и образует осадок. Затем осадок можно удалить. Чтобы эта реакция была эффективной, количество извести, добавляемой в сточные воды, должно быть в 1,4–1,6 раза больше общего количества присутствующей щелочности.
Сточные воды
Важно, чтобы сточные воды имитировали химический состав природных вод, в которые они попадают.Согласование сточных вод с природной водой помогает снизить риск кислотного шока и больших колебаний pH. Стоки должны иметь щелочность не менее 50 мг / л.
Щелочность и связь VA в цистерне осадка
Летучая кислотность относится к летучим жирным кислотам, содержащимся в сточных водах. Летучая кислотность указывает на наличие биологической активности в результате анаэробного переваривания отходов. Для полного переваривания отходов необходимо контролировать щелочность вместе с летучей кислотностью.Это сбраживание (разложение) отходов происходит в варочном котле для отходов. Для разложения твердых отходов отношение летучей кислотности к щелочности должно быть ниже 0,25. Если это соотношение выключено, то пищеварение будет подавлено и будет медленным или не дойдет до завершения. Типичная летучая кислотность в варочном котле составляет 50–300 мг / л уксусной кислоты, а щелочность обычно составляет 2500–3500 мг / л, как CaCO 3 .
Как измерить щелочность
Щелочность всегда измеряется методом титрования.Химические наборы, такие как HI3811 для определения общей щелочности, просты в использовании, но очень субъективны из-за необходимости сравнивать изменение цвета невооруженным глазом. Пресноводный колориметр щелочности HI775 Checker® HC — это следующий шаг на пути к выборочной проверке и использованию в домашних условиях. Его проще использовать, чем химические тест-наборы, и он представляет собой карманный колориметр для прямого измерения.
Для многопараметрического варианта, все еще портативного, но с большей точностью, HI97104 pH, щелочность, свободный хлор, общий хлор и фотометр циануровой кислоты.Точность лабораторного класса в сочетании с простотой калибровки и обучающим режимом делают этот глюкометр отличным вариантом для любого пользователя. Перед тестированием не требуется времени на прогрев источника света, что экономит ваше время во время тестирования.
Более автоматический вариант — мини-титратор HI84531U-01 для измерения титруемой щелочности воды и сточных вод.
Это доступный способ автоматизировать титрование щелочности. Прецизионный дозирующий насос позволяет точно определять конечную точку с помощью pH-электрода в стеклянном корпусе. Титратор поставляется со всеми реагентами, необходимыми для проведения каждого теста. Предварительно стандартизованные реагенты позволяют проводить измерения в низком диапазоне (30 — 400 мг / л CaCO 3 ) и высоком диапазоне (300 — 4000 мг / л CaCO 3 ).Этот мини-титратор также можно использовать в качестве измерителя pH или мВ.
Самым универсальным и настраиваемым вариантом является автоматический титратор HI932, который можно использовать для различных анализов, включая свободную и общую щелочность.
