|
Селективные ингибиторы ЦОГ-2
Входит в группу: 05.01.01.07 — Коксибы
Описания препаратов с недействующими рег. уд. или не поставляемые на рынок РФ
Описания препаратов с недействующими рег. уд. или не поставляемые на рынок РФ
Описания препаратов с недействующими рег. уд. или не поставляемые на рынок РФ
|
||||
Ингибиторы ЦОГ-2 увеличивают риск развития ишемического инсульта
В национальном популяционном исследовании когорты ученые рассмотрели датскую национальную базу данных оплачиваемых рецептов и выявили 100043 датских пациентов, впервые госпитализированных с острым инсультом в период с июля 2004 года по 2012 год, в том числе 51224 пациента с ишемическим инсультом, 32512 – с неопределенным инсульта, 11779 — с внутримозговым кровоизлиянием и 4528 — с субарахноидальным кровоизлиянием. Исследователи также проспективно определили рецепты на нестероидные противовоспалительные препараты (НПВП), выданные пациентам до госпитализации по поводу инсульта. Селективные НПВП, определенные для анализа, включили дексибупрофен, ибупрофен, индометацин, кетопрофен, напроксен и толфенамовую кислоту. Селективные ингибиторы ЦОГ-2 также были включены в анализ и подразделены на ингибиторы ЦОГ-2 прошлых поколений (диклофенак, этодолак, мелоксикам и набуметон) или коксибы (целекоксиб, эторикоксиб и рофекоксиб).
Пациенты были разделены в соответствии с применением НПВП: на тех, кто принимал препараты на момент инсульта (лекарство было отпущено по рецепту в течение 60 дней до госпитализации; N = 10835), на пациентов, которые ранее принимали препараты (лекарство было отпущено по рецепту в течение 60-180 дней до госпитализации; N = 8402), и пациентов, не использовавших препараты (N = 80806). Данные о 30-дневной общей смертности были получены из датской системы учета актов гражданского состояния. Пациенты наблюдались до госпитализации, смерти или эмиграции.
Смертность в течение 30 дней среди пациентов, не принимавших НПВП, с субарахноидальным кровоизлиянием составила 35,1%, у пациентов с внутримозговым кровоизлиянием — 24,5%, у пациентов с неуточненным инсультом — 14,3%, у пациентов с ишемическим инсультом — 8,7%. Многофакторный анализ пациентов с ишемическим инсультом не показал существенной связи между текущим использованием НПВП и риском смертности по сравнению с пациентами, не принимавшими НПВП.
Пациенты, принимавшие ингибиторы ЦОГ-2 на момент инсульта, имели скорректированный ОР смертности 1,19 (95% ДИ 1,02-1,38) по сравнению с пациентами, не принимавшими препараты, что было обусловлено новыми пользователями (ОР = 1,42; 95% ДИ 1,14-1,77). В частности, эта связь была выявлена среди пациентов, впервые начавших применение традиционных ингибиторов ЦОГ-2 (ОР = 1,42, 95% ДИ 1,14-1,78), в том числе этодолака (ОР = 1,53; 95% ДИ 1,02-2,28) и диклофенака (ОР = 1,28; 95% ДИ 0,98-1,68). Подобранный по показателю предрасположенности анализ показал аналогичные результаты.
Никакой связи не было выявлено между риском развития ишемического инсульта и бывшим использованием ингибиторов ЦОГ-2, или между 30-дневной смертностью и применением неселективных НПВП среди пациентов с внутримозговым или субарахноидальным кровоизлиянием. Тем не менее, исследователи отметили снижение риска смертности, связанной с субарахноидальным кровоизлиянием, у пациентов, принимавших неселективные НПВП (ОР = 0,61; 95% ДИ 0,41-0,91), и тех, кто принимал препараты этой группы ранее (ОР = 0,69; 95% ДИ 0,49-0,97).
«Наше исследование добавляет доказательств к ранее полученным данным в отношении сосудистого риска и прогностического значения, связанных с использованием ингибиторов ЦОГ-2, что нужно учитывать при назначении новых ингибиторов ЦОГ-2 людям старшего возраста или пациентам с повышенным риском тромбоэмболических осложнений», — пишут исследователи.
Источник: www.healio.com
Роль селективных ингибиторов ЦОГ-2 в периоперационном обезболивании
Авторы: Ю. Ю. Кобеляцкий, кафедра анестезиологии и интенсивной терапии Днепропетровской государственной медицинской академии
Послеоперационное обезболивание неотложная составляющая периоперационной медицины, рост оперативных вмешательств во всем мире делает эту проблему весьма актуальной. В сложных процессах ноцицепции и воспаления, неизбежно возникающих вслед за операционной травмой, большое место уделяется препаратам, которые могли бы оказать влияние на выраженность воспаления и тем самым способствовать оптимизации состояния больных и более легкому течению послеоперационного периода. Традиционно считается, что нестероидные противовоспалительные препараты (НСПВП) в виде монотерапии показаны для лечения послеоперационной боли слабой и средней интенсивности. Однако в настоящее время, когда появляется все больше НСПВП различных групп, возникает проблема выбора наиболее оптимального из них с позиций эффективности и безопасности. Важно отметить, что опиатные аналгетики устраняют преимущественно спонтанную послеоперационную боль, а НСПВП сравнительно эффективны как в отношении спонтанной, так и индуцированной боли, которая задерживает активизацию больных и лимитирует скорость их послеоперационного восстановления.
НСПВП подавляют продукцию первичных простаноидов посредством блокирования доступа арахидоновой кислоты к активным центрам циклооксигеназ. Поэтому простаноиды, продуцируемые циклооксигеназой 1 типа (ЦОГ-1), играют физиологическую роль (защита слизистой желудка, агрегация тромбоцитов, сосудистый гомеостаз, поддержание почечного натриево-водного баланса), в то время как другие, продуцируемые ЦОГ-2, в основном влияют на воспалительный ответ и определенные процессы, связанные с клеточной пролиферацией.
Хотя приблизительно 60% изоформ ЦОГ-1 и ЦОГ-2 являются гомологичными, с молекулярным весом 70 kD, но имеют сходные механизмы метаболизма арахидоновой кислоты и определенные различия [1]:
- различные генетические последствия для каждой изоформы. Гены регулируются двумя независимыми системами, хотя ферментные реакции, катализируемые ими, идентичны;
- место связывания ЦОГ-2 структурно на 25% больше, чем для ЦОГ-1, с вторичным местом связывания дополнительно к каталитическому центру. Это позволило создавать препараты, блокирующие активность ЦОГ-2 в концентрациях с минимальным эффектом на ЦОГ-1. Одно и то же вещество может действовать как ингибитор ЦОГ-2 в низкой концентрации и как конкурентный ингибитор ЦОГ-1 в высокой; молекулярная основа для такого взаимодействия не вполне понятна;
- ЦОГ-1 представлена в большинстве тканей, в условиях воспаления активность этой изоформы остается неизменной или с небольшим увеличением в 2-4 раза. В меньших количествах ЦОГ-2 найдена в таких тканях, как мозг, кишечник, почки, яички, щитовидная и поджелудочная железы. При воспалении экспрессия ЦОГ-2 увеличивается в 20 и более раз;
- кроме арахидоновой кислоты, ЦОГ-2 способна участвовать в метаболизме других субстанций, таких как линолевая и линоленовая кислоты.
Была выдвинута гипотеза, что селективные ингибиторы ЦОГ-2 теоретически должны быть способны поддерживать терапевтические свойства НСПВП с меньшим количеством побочных эффектов вследствие поддержания продукции простагландинов на нормальных физиологических уровнях.
Гипотеза селективности изоферментов ЦОГ способствовала созданию предположительной классификации блокаторов ЦОГ.
- ЦОГ-1 селективные ингибиторы (низкие дозы аспирина).
- ЦОГ неселективные блокаторы (большинство традиционных НСПВП, которые вводили в течение длительного времени, например при ревматоидном артрите, становились причиной язв 12-перстной кишки в 20% случаев и желудочных кровотечений в 1-4% случаев в год).
- Преимущественные ЦОГ-2 ингибиторы (мелоксикам и нимесулид, которые имеют меньшее количество побочных эффектов в сравнении со стандартными НСПВП, но сохраняется риск развития их при использовании в высоких дозах).
- Селективные ЦОГ-2 ингибиторы (целекоксиб, рофекоксиб, валдекоксиб, парекоксиб, эторикоксиб).
В таблице 1 приведены данные по селективности в отношении ЦОГ основных, наиболее часто использующихся НСПВП.
Предварительные клинические исследования показали, что селективные ЦОГ-2 ингибиторы равны по эффективности традиционным НСПВП и имеют меньшее количество побочных эффектов, таким образом подтверждается предложенная классификация. В Великобритании вышеупомянутые исследования привели к коммерциализации рофекоксиба для купирования боли и лечения остеоартритов, в то время как целекоксиб был внедрен в медицинскую практику в США и других странах для лечения ревматоидного артрита и остеоартритов [2].
Роль ингибиторов ЦОГ-2 в периоперационном обезболивании в последнее время интенсивно изучается, о чем свидетельствуют публикации в ведущих мировых изданиях [3-11]. Однако их место в послеоперационной аналгезии окончательно не определено в связи с тем, что существует много нерешенных проблем в их использовании. Если ретроспективно проанализировать достижения в послеоперационном обезболивании за последние 10-15 лет, то они выглядят впечатляюще. Большим шагом вперед в этом направлении стали системное и нейроаксиальное использование опиатов, контролируемая пациентом аналгезия, продленная регионарная анестезия и использование вспомогательных препаратов, к которым и относятся НСПВП, а также создание служб острой боли. Среди насущных вопросов сегодняшнего дня наиболее важными являются следующие: более эффективное обезболивание у всех пациентов в послеоперационный период; предотвращение и/или лечение других послеоперационных симптомов (связанных и несвязанных с обезболиванием), таких как тошнота, рвота, зуд, седация и когнитивная дисфункция; обеспечение восстановления после операции посредством и/или лечением послеоперационной физиологичеcкой дисфункции, такой как ателектазы или непроходимость кишечника. Повышение эффективности послеоперационного обезболивания предполагает достижение хотя бы одной из этих целей без влияния на другие.
Есть еще несколько аспектов, которые объясняют необходимость искать альтернативу традиционным НСПВП.
- Существуют области хирургии, где неселективные НСПВП противопоказаны (например, при тонзиллэктомии, в хирургии глаза и спинальной хирургии и др.).
- Часть больных в течение длительного времени принимают неселективные НСПВП по поводу других заболеваний.
- В структуре больных, которым проводятся различные хирургические вмешательства, преобладают лица пожилого и старческого возраста, которые в большей степени подвержены побочным эффектам НСПВП.
- Селективные НСПВП более показаны, исходя из логики развития ноцицептивных процессов в послеоперационном периоде.
Интересно отметить и те работы, в которых поднимаются вопросы экономической целесообразности использования ЦОГ-2 ингибиторов [12]. Фармако-экономический анализ эффективности послеоперационного обезболивания непростая задача, так как он зависит и от стоимости используемых медицинских ресурсов, и от снижения функциональных возможностей пациента, что в значительной степени влияет на качество жизни больных и может вызвать развитие депрессии и тревожных состояний. Поэтому улучшение клинических исходов связывают не только с наличием эффективных препаратов, но и с их рациональным использованием.
Во многих работах проводилось сравнение специфических и селективных блокаторов ЦОГ-2 с другими НСПВП. Так, показано преимущество рофекоксиба перед мефенаминовой кислотой при экстракции 3 моляра [13], перед напроксеном после абдоминальной гистерэктомии как в качестве аналгезии, так и в профиле побочных эффектов [14]. В других исследованиях показана равная эффективность парентерального парекоксиба и кеторолака в челюстно-лицевой хирурги [15]. Несмотря на то, что ЦОГ-2 играет ключевую роль в сенситизации к сенсорным стимулам во время острого послеоперационного воспаления, нельзя сбрасывать со счетов значение ЦОГ-1 спинного мозга в развитии послеоперационной боли [16].
Одной из стратегий использования НСПВП разных групп в послеоперационном обезболивании является их назначение в комплексе сбалансированной аналгезии, например комбинация регионарного обезболивания (интратекальное болюсное введение морфина) с нимесулидом после торакотомии [17]. Экспериментальной базой для совместного использования ингибиторов ЦОГ-2 и опиатов может служить работа J. S. Kroin с соавт. [18], которые показали, что водорастворимый селективный ингибитор ЦОГ-2 L-745337 модифицирует аллодинический ответ на модели острой послеоперационной боли.
В настоящее время нередко клинические впечатления от использования различных препаратов идут вразрез с принципами доказательной медицины. Так A. H. Jeske (2002) [19] показал важность научного подхода к выбору препарата для обезболивания острой зубной боли, считая, что целекоксиб и валдекоксиб вообще не показаны для послеоперационного обезболивания в челюстно-лицевой хирургии, а рофекоксиб не более эффективен, чем традиционные НСПВП. Выбор препарата для обезболивания должен базироваться на учете всех фармакологических характеристик данного препарата, особенно тех, которые связаны с максимальными дозировками, длительностью действия и эффективностью. Важность обоих типов ЦОГ подтверждены в работе S. M. Gordon с соавт. (2002) [20]. Более того, авторы утверждают, что существует этапность в продукции простаноидов на периферическом уровне, поэтому актуально рассмотрение возможности местного применения НСПВП непосредственно в месте операционной раны. Интересно отметить, что даже новейшие парентеральные ингибиторы ЦОГ-2 не всегда эффективны для послеоперационного обезболивания. Так, парекоксиб при абдоминальной послеоперационной боли снижал количество морфина при КПА, но не способен был улучшить обезболивание и уменьшить связанные с использованием опиатов побочные эффекты [21]. При лапароскопических операциях этот препарат показывал сходные аналгетические эффекты с 30 мг кеторолака и превосходил по эффективности морфин в дозе 4 мг внутривенно [22]. В травматологии и ортопедии комбинация опиатов и ЦОГ-2 ингибиторов является перспективной лечебной стратегией, так же как и в детской хирургии [23-26].
Большая серия работ посвящена использованию селективных ингибиторов ЦОГ-2 для купирования острой боли и возможности влиять этими препаратами на базовые механизмы ноцицепции. Среди препаратов этой группы обращает на себя внимание мелоксикам (Мовалис). Он в значительной степени связывается с белками плазмы (99,5%), имеет большой объем распределения (10-15 л), низкий клиренс (0,42-0,48 л/ч), длительное окончательное время полужизни (T1/2 20-22 ч), что позволяет вводить его раз в сутки. Максимальная концентрация в плазме (Сmax= 0,72 мг/л после приема 15 мг препарата) достигается через 5 часов после перорального и ректального приема (Сmax=1,72 мг/л) [27]. Данные по влиянию Мовалиса на ноцицептивные процессы достаточно многогранны. Так, показано, что наряду в морфином и клофелином Мовалис эффективен для обезболивания даже при отсутствии воспаления благодаря своим спинальным и супраспинальным эффектам, которые реализуются через освобождение ацетилхолина [28]. Мелоксикам в терапевтичеcких концентрациях не оказывает влияния на время кровотечения и агрегацию тромбоцитов [29]. Препарат показал меньшую токсичность в отношении гастроинтестинальных побочных эффектов в сравнении с традиционными НСПСП [30,31]. При сравнении мелоксикама, лорноксикама и пироксикама все препараты обладали противовоспалительным действием, но только первый из них полностью устранял гипералгезию [32]. Это подтверждает диссоциацию между противовоспалительным и антигипералгезическим действием НСПВП. Обращает на себя внимание возможность использования мелоксикама как системно, так и местно, например при герниопластике [33]. Предоперационное использование мелоксикама при абдоминальных операциях (лапаротомия, герниопластика, спленэктомия) обеспечивало до 20 часов послеоперационной аналгезии, сравнимой с таковой при использовании кетопрофена и превышающей эффекты буторфанола [34]. Особый интерес представляет сравнение Мовалиса со специфическими ингибиторами ЦОГ-2, такими как рофекоксиб. Несмотря на то, что последний препарат показал меньшую гастроинтестинальную токсичность, он имел свои побочные эффекты в виде тошноты, головокружения, головной боли [35]. Особенностью действия мелоксикама на уровне спинного мозга является его модуляция возбуждающих эффектов ноцицептивных входов в нейроны дорзальных рогов спинного мозга, в особенности продленных после разрядов [36]. Появление в последнее время внутримышечной формы Мовалиса привело к появлению новой лечебной стратегии, которая позволяет быстро достигать необходимой концентрации препарата в крови и представляет дополнительные перспективы для лечения острой боли различного генеза [37]. Препарат хорошо переносится больными и устойчив по уровню креатинфосфокиназы. После овариогистерэктомии у кошек мелоксикам демонстрирует одинаковую эффективность с карпрофеном, кетопрофеном и толфенамовой кислотой [38]. В работах других авторов есть данные о том, что ЦОГ-2 селективные ингибиторы имеют такие же побочные явления, как и традиционные НСПВП (боль в животе, диспепсия и диарея), и только количество язв желудка и 12-перстной кишки было меньшим [39]. Кроме того, ЦОГ-2 имеют другие побочные эффекты за пределами ЖКТ, что связано с угнетением этого фермента [40]. Было показано, что мелоксикам в дозозависимой манере уменьшал эффекты введенного интраперитонеального тимулина, который вызывал развитие термической и механической гипералгезии, а также снижал интенсивность повышения цитокинов и фактора роста нервов [41]. Местное использование мелоксикама вызывало уменьшение 2-й фазы формалинового теста у крыс и показало, что периферичеcкое антиноцицептивное действие препарата осуществлялось на уровне пути NO цГМФ [42]. В клинике при выполнении абдоминальной гистерэктомии использование мелоксикама позволило снизить интенсивность боли в покое и при кашле в первые 24 часа после операции [43]. Важными являются исследования, которые показывают роль простагландинов в развитии гипералгезии вследствие травмы нервов и эффект Мовалиса при местном применении в область травмированного нерва [44]. Эти исследования важны как дополнение к проблеме хронизации острой боли при неадекватном ее устранении. Мелоксикам проявлял дозозависимые антиноцицептивные свойства как при нейрогенной, так и при воспалительной боли [45]. Местные и системные эффекты мелоксикама дополняются его центральными эффектами, которые невозможно объяснить с циклооксигеназных позиций [46]. При использовании полного адъюванта Фрейда и для вызывания воспалительной реакции каррагенином показано, что эффекты системного введения Мовалиса имеют преимущественно периферическую природу [47].
Особого внимания заслуживают вопросы безопасности назначения НСПВП различных классов. Хорошо известно, что использование специфических ингибиторов ЦОГ-2 связано с большим риском осложнений со стороны сердечно-сосудистой системы, а именно артериальной гипертензии, церебральных катастроф, инфаркта миокарда, конгестивной сердечной недостаточности [48], отеков нижних конечностей. Появилась и совершенно новая проблема по мере накопления данных по использованию, особенно длительному, специфических ингибиторов ЦОГ-2 и которая имеет особенно важное значение для периоперационной медицины, это проблема повышенного риска развития тромбоэмболических осложнений (сердечно-сосудистых, цереброваскулярных и периферических венозных тромбозов). Эти осложнения нередко трудно прогнозируемы и дают высокий процент летальности у больных в различных областях хирургии.
По данным английских авторов, использование селективных ингибиторов ЦОГ-2 имеет преимущество перед специфическими ингибиторами [49]. Эти авторы выделяют те нозологические формы тромбоэмболических осложнений, которые наиболее часто встречаются (табл. 2).
Таким образом, использование селективних ингибиторов ЦОГ-2, в частности мелоксикама, будет иметь место у больных, которые принимают в течение длительного времени НСПВП по поводу других заболеваний. Это целесообразно и с позиций нарушения функций печени [50] и поджелудочной железы [51]. Среди традиционных неселективных НСПВП на примере 7400 больных печеночная дисфункция имела место в 0,8% случаев при использовании целекоксиба; 0,9% случаев плацебо и 3,7% диклофенака [52]. Побочные же эффекты целекоксиба связывают и с присутствием в его химической структуре сульфонамида, который, возможно, запускает аллергические реакции и не должен использоваться у пациентов, которые не переносят препараты серы.
Среди вопросов использования ингибиторов ЦОГ-2, которые требуют своего дальнейшего решения на современном этапе, можно назвать следующие [53].
- Имеют ли селективные ингибиторы ЦОГ-2 эффект опережающего обезболивания?
- Вызывают ли ингибиторы ЦОГ-2 клинически значительно меньшую кровопотерю в сравнении с традиционными?
- Нарушают ли препараты этой группы регенерацию костной ткани у людей?
- Являются ли ингибиторы ЦОГ-2 причиной гастроинтестинальной токсичности у больных высокого риска (язва желудка в анамнезе)?
- Повышает ли использование ингибиторов ЦОГ-2 риск токсических реакций со стороны сердечно-сосудистой системы (гипертензия, нарушения мозгового кровообращения, инфаркт миокарда)?
- Оправдано ли использование ингибиторов ЦОГ-2 в фармако-экономическом аспекте?
Использование НСПВП во многих областях медицины, в том числе в периоперационном периоде, делает актуальной задачу выбора наиболее оптимального из них в каждом конкретном случае с учетом пола, возраста, сопутствующей патологии больных, объема предстоящего оперативного вмешательства, области хирургии, риска возможных побочных эффектов и фармако-экономических критериев. Традиционные НСПВП эффективны во многих клинических ситуациях, но имеют, кроме традиционных (в отношении ЖКТ, функции почек и тромбоцитов), и дополнительные негативные эффекты, в том числе замедляют заживление ран, потенциально возможна большая интраоперационная кровопотеря и т.д. Специфические ингибиторы ЦОГ-2 имеют свои негативные эффекты (артериальная гипертензия, сердечная недостаточность, повышение риска тромбоэмболических осложнений). Кроме того, они являются менее сильными аналгетиками в сравнении с неселективными НСПВП. Открытие роли ЦОГ-1 в спинальных процессах ноцицепции обращает внимание на группу селективных НСПВП (мелоксикам), которые сочетают в себе преимущества обеих групп препаратов, что обусловливает необходимость их более широкого использования при подготовке, проведении оперативных вмешательств и в послеоперационном периоде.
Литература
- Schonbek U., Suckova GK., Graber P. et al. Augmented expression of COX-2 in human atherosclerotic lesions. Am J Pathol. 19990;155:1281-1291.
- Blain H, Jouzeau JY, Netter P, Jeandel C [Non-steroidal anti-inflammatory agents with selective inhibitory activity on cyclooxygenase-2. Interest and future prospects][Article in French] Rev Med Interne. 2000 Nov;21(11):978-88.
- Kharasch ED. Perioperative COX-2 inhibitors: knowledge and challenges. Anesth Analg. 2004 Jan;98(1):1-3.
- Schwarz SK. COX-2 inhibition for postoperative analgesia. Anesth Analg. 2003 Apr;96(4):1235; author reply 1235.
- Ruoff G, Lema M.Strategies in pain management: new and potential indications for COX-2 specific inhibitors. J Pain Symptom Manage. 2003 Feb;25(2 Suppl):S21-31.
- Rowbotham DJ.COX-2-selective inhibitors: clinical relevance in surgical and acute pain. Eur J Anaesthesiol Suppl. 2002;25:11-20.
- Rollins G. COX-2 inhibitors reduce knee replacement surgery problems. Rep Med Guidel Outcomes Res. 2003 Dec 12;14(24):1, 5-6.
- Nekoofar MH, Sadeghipanah M, Dehpour AR. Evaluation of meloxicam (A cox-2 inhibitor) for management of postoperative endodontic pain: a double-blind placebo-controlled study. J Endod. 2003 Oct;29(10):634-7.
- Sinatra R. Role of COX-2 inhibitors in the evolution of acute pain management. J Pain Symptom Manage. 2002 Jul;24(1 Suppl):S18-27.
- Katz WA. Cyclooxygenase-2-selective inhibitors in the management of acute and perioperative pain. Cleve Clin J Med. 2002;69 Suppl 1:SI65-75.
- Kummer CL., Coelho TCRB. Cyclooxygenase-2 inhibitors nonsteroid anti-inflammatory drugs: current issues. Revista Brasileira de Anestesiologia. 2002;52(4):505-512.
- Stephens J, Laskin B, Pashos C, Pena B, Wong J. The burden of acute postoperative pain and the potential role of the COX-2-specific inhibitors. Rheumatology (Oxford). 2003 Nov;42 Suppl 3:iii40-52.
- Pain management after third molar extraction. Observations of the use of mefenamic acid and rofecoxib in the treatment of postoperative pain in the dental office] Schweiz Monatsschr Zahnmed.2003;113(8):887-96. [Article in French, German]Pajarola G, Riva C, Good M, Gratz KW.
- Celik JB, Tuncer S, Reisli R, Sarkilar G, Celik C, Akyurek C. A comparative study of the effect of rofecoxib (a COX 2 inhibitor) and naproxen sodium on analgesic requirements after abdominal hysterectomy. Arch Gynecol Obstet. 2003 Oct;268(4):297-300. Epub 2002 Sep 26.
- Mehlisch DR, Desjardins PJ, Daniels S, Hubbard RC. Single doses of parecoxib sodium intravenously are as effective as ketorolac in reducing pain after oral surgery. J Oral Maxillofac Surg. 2003 Sep;61(9):1030-7.
- Zhu X, Conklin D, Eisenach JC. Cyclooxygenase-1 in the spinal cord plays an important role in postoperative pain. Pain. 2003 Jul;104(1-2):15-23.
- McCrory C, Diviney D, Moriarty J, Luke D, Fitzgerald D.Comparison between repeat bolus intrathecal morphine and an epidurally delivered bupivacaine and fentanyl combination in the management of post-thoracotomy pain with or without cyclooxygenase inhibition. J Cardiothorac Vasc Anesth. 2002 Oct;16(5):607-11.
- Kroin JS, Buvanendran A, McCarthy RJ, Hemmati H, Tuman KJ. Cyclooxygenase-2 inhibition potentiates morphine antinociception at the spinal level in a postoperative pain model. Reg Anesth Pain Med. 2002 Sep-Oct;27(5):451-5.
- Jeske AH.Selecting new drugs for pain control: evidence-based decisions or clinical impressions? J Am Dent Assoc. 2002 Aug;133(8):1052-6; quiz 1093-4.
- Gordon SM, Brahim JS, Rowan J, Kent A, Dionne RA.Peripheral prostanoid levels and nonsteroidal anti-inflammatory drug analgesia: replicate clinical trials in a tissue injury model. Clin Pharmacol Ther. 2002 Aug;72(2):175-83.
- Tang J, Li S, White PF, Chen X, Wender RH, Quon R, Sloninsky A, Naruse R, Kariger R, Webb T, Norel E.Effect of parecoxib, a novel intravenous cyclooxygenase type-2 inhibitor, on the postoperative opioid requirement and quality of pain control. Anesthesiology. 2002 Jun;96(6):1305-9.
- Barton SF, Langeland FF, Snabes MC, LeComte D, Kuss ME, Dhadda SS, Hubbard RC. Efficacy and safety of intravenous parecoxib sodium in relieving acute postoperative pain following gynecologic laparotomy surgery. Anesthesiology. 2002 Aug;97(2):306-14.
- Sinatra RS, Torres J, Bustos AM.Pain management after major orthopaedic surgery: current strategies and new concepts. J Am Acad Orthop Surg. 2002 Mar-Apr;10(2):117-29.
- Berti M, Danelli G, Albertin A, Deni F, Moizo E, Muzzolon F. [Systemic analgesia after peripheral block] Minerva Anestesiol. 2001 Sep; 67 (9 Suppl 1):195-9.[Article in Italian].
- Camu F, Beecher T, Recker DP, Verburg KM. Valdecoxib, a COX-2-specific inhibitor, is an efficacious, opioid-sparing analgesic in patients undergoing hip arthroplasty. Am J Ther. 2002 Jan-Feb;9(1):43-51.Camu F, Beecher T, Recker DP, Verburg KM.
- Farrar MW, Lerman J. Novel concepts for analgesia in pediatric surgical patients. Cyclo-oxygenase-2 inhibitors, alpha 2-agonists, and opioids. Anesthesiol Clin North America. 2002 Mar;20(1):59-82, vi.
- Turck D., Roth W., Busch U. A review of pharmacokinetics of meloxicam. Br J Rheumatol. 1996,35 (Suppl.1):12-16.
- Pinardi G, Sierralta F, Miranda HF. Atropine reverses the antinociception of nonsteroidal anti-inflammatory drugs in the tail-flick test of mice. Pharmacol Biochem Behav. 2003 Feb;74(3):603-8.
- Ogino K, Saito K, Osugi T, Satoh H.Ogino K., [Meloxicam (Mobic): a review of its pharmacological and clinical profile][Article in Japanese] Nippon Yakurigaku Zasshi. 2002 Dec;120(6):391-7.
- Hawkey C., Kahan A., Steinbruck et al. Gastrointestinal tolerability of the COX-2 inhibitor, meloxicam in ostheoartritis patients: the meloxicam large scale international study safety assessment (MELISSA). Br J Rheumatol. 1998, 37: 937-45.
- Dequecker J., Hawkey C., Kahan A. et al. Improvement in gastrointestinal tolerability of the selective cyclooxygenase (COX-2) inhibitor, meloxicam compared with piroxicam: results of the safety and efficacy large scale evaluation of COX-ingibiting (SELECT) trial in ostheoartritis. Br J Rheumatol. 1998, 37: 946-51.
- Bianchi M, Panerai AE. Effects of lornoxicam, piroxicam, and meloxicam in a model of thermal hindpaw hyperalgesia induced by formalin injection in rat tail. Pharmacol Res. 2002 Feb;45(2):101-5.
- Romsing J, Mysager S, Vilmann P, Sonne J, Larsen NE, Stergaard D. Postoperative analgesia is not different after local vs systemic administration of meloxicam in patients undergoing inguinal hernia repair. Can J Anaesth. 2001 Nov;48(10):978-84.
- Mathews KA, Pettifer G, Foster R, McDonell W. Safety and efficacy of preoperative administration of meloxicam, compared with that of ketoprofen and butorphanol in dogs undergoing abdominal surgery. Am J Vet Res. 2001 Jun;62(6):882-8.
- Matheson AJ, Figgitt DP. Rofecoxib: a review of its use in the management of osteoarthritis, acute pain and rheumatoid arthritis. Drugs. 2001;61(6):833-65.
- Pitcher GM, Henry JL. Meloxicam selectively depresses the afterdischarge of rat spinal dorsal horn neurones in response to noxious stimulation. Neurosci Lett. 2001 Jun 1;305(1):45-8.
- Euller-Ziegler L, Velicitat P, Bluhmki E, Turck D, Scheuerer S, Combe B. Meloxicam: a review of its pharmacokinetics, efficacy and tolerability following intramuscular administration. Inflamm Res. 2001 Mar;50 Suppl 1:S5-9.
- Slingsby LS, Waterman-Pearson AE. Postoperative analgesia in the cat after ovariohysterectomy by use of carprofen, ketoprofen, meloxicam or tolfenamic acid. J Small Anim Pract. 2000 Oct;41(10):447-50.
- Noble SL, King DS, Olutade JI. Cyclooxygenase-2 enzyme inhibitors: place in therapy. Am Fam Physician. 2000 Jun 15;61(12):3669-76.
- Jackson LM, Hawkey CJ. COX-2 selective nonsteroidal anti-Inflammatory drugs: do they really offer any advantages? Drugs. 2000 Jun;59(6):1207-16.
- Safieh-Garabedian B, Dardenne M, Kanaan SA, Atweh SF, Jabbur SJ, Saade NE. The role of cytokines and prostaglandin-E(2) in thymulin induced hyperalgesia. Neuropharmacology. 2000 Jul10;39(9):1653-61.
- Aguirre-Banuelos P, Granados-Soto V. Evidence for the participation of the nitric oxide-cyclic GMP pathway in the antinociceptive action of meloxicam in the formalin test. Eur J Pharmacol. 2000 Apr 21;395(1):9-13.
- Thompson JP, Sharpe P, Kiani S, Owen-Smith O. Effect of meloxicam on postoperative pain after abdominal hysterectomy. Br J Anaesth. 2000 Feb;84(2):151-4.
- Syriatowicz JP, Hu D, Walker JS, Tracey DJ. Hyperalgesia due to nerve injury: role of prostaglandins. Neuroscience. 1999;94(2):587-94
- Santos AR, Vedana EM, De Freitas GA. Antinociceptive effect of meloxicam, in neurogenic and inflammatory nociceptive models in mice. Inflamm Res. 1998 Jul;47(7):302-7.
- Lopez-Garcia JA, Laird JM Central antinociceptive effects of meloxicam on rat spinal cord in vitro. Neuroreport. 1998 Mar 9;9(4):647-51.
- Laird JM, Herrero JF, Garcia de la Rubia P, Cervero F. Analgesic activity of the novel COX-2 preferring NSAID, meloxicam in mono-arthritic rats: central and peripheral components. Inflamm Res. 1997 Jun;46(6):203-10.
- McQuay H., Moore R.A. Side effects of COX-2inhibitors and other NSAIDs / Proceeding of 10th World Congress on Pain. Progress in pain research and management. Vol. 24. Eds. J.O.Dostrovsky, D.B.Carr., M.Koltzenburg. IASP Press, Seattle. 2003; 499-510.
- Layton D., Hughes K., Harris S., Shakir S A.W. Comparison of the incidence tyromboembolic events reported for the patients prescribed celecocib and meloxicam in general practice in England using Prescription-Event Monitoring) PEM data. Rheumatology.2003;42:1-11.
- O. Beirne JP., Cairns SR. Cholestatic hepatitis in association with celecoxib Br Med J. 2001;323:23.
- Carillo-Jimenez R., Nurnberger M. Celecoxib-induced acute pencreatitis and hepatitis. Arch Intern.Med. 2000; 170:553-554.
- Maddrey WC., Maurath CJ., Verburg KM et al. The hepatic safety and tolerability of the novel cyclooxygenase inhibitor celecoxib. Am J Ther, 2000;7:153-158.
- Gilron J, Milne B., Hong M. Cyclooxygenase-2 inhibitors in postoperative pain management Anesthesiology. 2003 Nov;99(5):1198-2008.
СТАТТІ ЗА ТЕМОЮ
27.10.2021 Пульмонологія та оториноларингологія Бронхипрет у лікуванні гострого бронхіту: перші докази зменшення потреби в антибіотикахГострий бронхіт визначають як гостре захворювання, що виникає в пацієнта без хронічної бронхолегеневої патології, проявляється кашлем, який може бути продуктивним або ні, а також іншими симптомами та клінічними ознаками, які вказують на інфекцію нижніх дихальних шляхів і не мають альтернативного пояснення (тобто не спричинені, наприклад, астмою або синуситом) [1, 2]….
27.10.2021 Терапія та сімейна медицина Мікробіота та модуляція імунної відповіді на вакцинаціюПотреба у високоефективних вакцинах, що забезпечують стійкий і довготривалий імунітет, ніколи не була такою очевидною, як під час пандемії COVID‑19. Однак з недостатньо зрозумілих причин імунна відповідь на вакцинацію може дуже відрізнятися як між окремими людьми, так і серед певних груп населення. На жаль, імуногенність вакцин є часто зниженою саме в тих популяційних групах, які мають найбільший ризик несприятливого перебігу інфекційного захворювання. В цьому огляді наведено погляд австралійських науковців на проблему субоптимальної відповіді на вакцини з акцентуванням їхньої уваги на важливій ролі кишкової мікробіоти у формуванні імунної відповіді. Саме корекція складу кишкової мікробіоти, зокрема за допомогою пробіотиків, на думку дослідників, може бути ефективним способом посилення імунної відповіді серед категорій населення з підвищеним ризиком дисбіотичних порушень (особи похилого віку, пацієнти з ожирінням, нераціональним харчуванням тощо)….
404 Not Found
Дата вступления в силу: «12» ноября 2015 г.
Настоящие Условия онлайн-использования регламентируют Ваш доступ к веб-сайтам, контролируемым компанией «Верофарм», включая ее подразделения и филиалы (совместно именуемые «Верофарм»), которые ссылаются на настоящие Условия онлайн- использования (совместно именуемые «веб-сайтами компании «Верофарм»). Настоящие Условия онлайн-использования не применимы к веб-сайтам компании «Верофарм», которые не ссылаются на настоящие Условия онлайн-использования и к веб-сайтам третьих лиц, с которыми могут быть связаны веб-сайты компании «Верофарм». Использование Вами веб-сайтов компании «Верофарм» подпадает под действие настоящих Условий онлайн-использования и Политики в отношении обработки персональных данных на веб-сайтах компании «Верофарм».
В пределах, допустимых применимым законодательством, компания «Верофарм» сохраняет за собой право вносить поправки в данные Условия онлайн-использования с учетом технологического прогресса, юридических и правовых изменений, надлежащей бизнес-практики. Если компания «Верофарм» внесет изменения в настоящие Условия онлайн-использования, обновленная версия Условий онлайн-использования будет отражать соответствующие изменения, и мы уведомим Вас об их наличии, обновив дату вступления в силу Условий онлайн-использования, указанную выше.
Осуществляя доступ и используя веб-сайты компании «Верофарм», Вы соглашаетесь с тем, что прочитали, поняли и согласились соблюдать настоящие Условия онлайн-использования в их текущей версии, с которыми Вы имели возможность ознакомиться при доступе к веб-сайтам компании «Верофарм». Если Вы не согласны с данными Условиями онлайн-использования или не удовлетворены деятельностью веб-сайтов компании «Верофарм», Вашим единственным и исключительным способом правовой защиты, в пределах допустимых применимым законодательством, является прекращение использования данного веб-сайта компании «Верофарм».
Отказ от ответственности
Вы признаете и соглашаетесь с тем, что:
а. Несмотря на то что на веб-сайтах компании «Верофарм» мы всегда стремимся представить новейшие разработки, связанные с нашими продуктами и услугами, а также иную информацию о компании «Верофарм», информация представлена в формате «КАК ЕСТЬ» и может содержать технические неточности, типографские ошибки или являться неактуальной. Компания «Верофарм» сохраняет за собой право добавлять, удалять или изменять информацию, содержащуюся на веб-сайтах компании «Верофарм» в любое время без предварительного уведомления.
б. Компания «Верофарм» не предоставляет никаких заверений или гарантий какого-либо рода или характера относительно информации или данных, размещенных на веб-сайтах компании «Верофарм».
В пределах, допустимых действующим законодательством, настоящим компания «Верофарм» снимает с себя ответственность за любые утверждения или гарантии, высказанные или подразумеваемые, предписанные законом, контрактом или иным образом, ни в коем случае компания «Верофарм» не несет ответственности за любой ущерб любого рода или характера, в том числе, без ограничений, прямой, косвенный, особый (включая упущенную выгоду), явившийся следствием или случайным, ущерб, возникший в связи или на основе существования или использования веб-сайтов компании «Верофарм», и/или информации или сведений, размещенных на веб-сайтах компании «Верофарм» независимо от того, предполагала ли компания «Верофарм» возможность такого ущерба.
в. Компания «Верофарм» не несет ответственности и не предоставляет никаких гарантий относительно точности, эффективности, своевременности и приемлемости любой информации или сведений, полученных от третьих лиц, включая гиперссылки на или с сайтов третьих лиц. За исключением случаев, оговоренных на веб-сайтах компании «Верофарм», компания «Верофарм» не проводит редактирование, рецензирование или иной контроль информационного наполнения, представляемого третьими лицами на досках объявлений, в чатах и на других аналогичных форумах, размещаемых на веб-сайтах компании «Верофарм». В этой связи, такая информация должна рассматриваться как подозрительная и не является подтвержденной компанией «Верофарм».
г. Веб-сайты компании «Верофарм» могут содержать прогностические утверждения, которые отражают ожидания компании «Верофарм» в отношении предстоящих событий и развития бизнеса. Прогностические утверждения предполагают риски и неопределенность. Реальное развитие событий или результаты могут значительно отличаться от предполагаемых и зависят от множества факторов, включая (но не ограничиваясь этим) успешным завершением продолжающихся программ разработки, результатами текущих или будущих клинических исследований, продолжающимся коммерческим внедрением продукции, регуляторным одобрением фармацевтических препаратов, достоверностью и приведением в действие патентов, стабильностью коммерческих взаимоотношений и общими экономическими условия. Компания «Верофарм» намерена регулярно обновлять свои веб-сайты, однако не принимает на себя никаких обязательств по обновлению любого информационного наполнения веб-сайтов.
Ваше использование
Вы понимаете, принимаете к сведению и соглашаетесь, что:
а. Используя веб-сайты компании «Верофарм», Вы согласны не изменять и не разрушать нашу электронную информацию, размещенную на веб-сайтах компании «Верофарм» или на любых наших серверах. Кроме того, Вы также соглашаетесь не пытаться обойти меры безопасности веб-сайтов компании «Верофарм» и соблюдать требования всех действующих местных, государственных, федеральных и международных законов, правил и постановлений.
б. Вы предоставляете компании «Верофарм» право использовать любые материалы, которые Вы загружаете или иным образом передаете на веб-сайты компании «Верофарм», в соответствии с настоящими Условиями онлайн-использования и Политикой в отношении обработки персональных данных на веб-сайтах компании «Верофарм», любым способом, который компания «Верофарм» сочтет предпочтительным, включая, но не ограничиваясь копированием, показом, воспроизводством или публикацией в каком бы то ни было формате, с изменением материалов, включением в иные материалы или проведением основанных на этих материалах работ.
в. За исключением случаев, специально оговоренных и заранее согласованных компанией «Верофарм», отношения по конфиденциальности между компанией «Верофарм» и пользователем веб-сайтов компании «Верофарм» не будут возникать в том случае, если пользователь веб-сайтов компании «Верофарм» направит какое-либо устное, письменное или электронное сообщение компании «Верофарм» (обратная связь, вопросы, комментарии, предложения, идеи и т.д.).
Если какой-либо веб-сайт компании «Верофарм» требует или просит предоставить такую информацию, и эта информация содержит сведения, позволяющие идентифицировать личность (например, фамилию, адрес, номер телефона, электронный адрес), компания «Верофарм» намерена получить, использовать и сохранить эту информацию с согласия соответствующего пользователя в соответствии с положениями, указанными в Политике в отношении обработки персональных данных на веб-сайтах компании «Верофарм».
В ином случае такие сообщения и любая информация, предоставленная в их контексте, будет рассматриваться как не конфиденциальная, и компания «Верофарм» будет располагать правом воспроизводить, публиковать или иным образом использовать эту информацию для каких бы то ни было целей, включая, без ограничений, исследование, разработку, производство, использование или продажу продукции, предполагающие внедрение данной информации. Лицо, направившее какую-либо информацию в компанию «Верофарм», несет полную ответственность за ее содержание, включая ее достоверность, точность и тот факт, что она не несет в себе нарушения чьих-либо прав, в том числе, права собственности.
Маркировка продукции
Локальные веб-сайты компании «Верофарм» содержат общую информацию о компании «Верофарм» и ее продуктах, которые официально зарегистрированы на соответствующей территории и находятся в свободном обращении, рекламные материалы, строго соответствующие локальному законодательству, а также иную научную информацию, которую мы посчитали полезной для размещения на соответствующем веб-сайте для Вашего ознакомления с такой информации в личных некоммерческих целях или для повышения Вашего профессионального уровня, если Вы являетесь медицинским, фармацевтическим работником или иным работником системы здравоохранения.
Тем не менее, обращаем Ваше внимание на то, что на локальных веб-сайтах соответствующей страны могут иметься ссылки на зарубежные веб-сайты компании «Верофарм». В таком случае названия, описания и маркировки продуктов могут иметь более тесную связь или быть созданы в соответствии с законодательством иной страны, которая не является страной вашего постоянного места жительства. Некоторые продукты могут быть доступны не во всех странах или быть доступны под другими торговыми наименованиями, в другой дозировке или с иными показаниями к применению. Многие из перечисленных продуктов могут отпускаться только по назначению местного специалиста в области здравоохранения.
За исключением случаев, заранее согласованных компанией «Верофарм», директор, сотрудники, агенты или представители компании «Верофарм», ее дочерних компаний и филиалов, не принимают участия в проведении медицинских консультаций, диагностике, лечении или осуществлении иных медицинских услуг, которые могли бы создать какую бы то ни было взаимосвязь, как, например, «врач-пациент», посредством веб-сайтов компании «Верофарм». В любом случае никакая информация о наших продуктах, размещенная на наших веб-сайтах, не должна рассматриваться и пониматься как непосредственная консультация специалиста или замена такой консультации у соответствующего специалиста (врача).
Обращаем Ваше внимание на то, что у продуктов «Верофарм» имеются противопоказания к применению, поэтому перед их употреблением необходимо внимательно ознакомится с инструкцией по их применению и обратиться за консультацией врача.
Ни в коем случае информация, размещенная на веб-сайтах компании «Верофарм», не должна использоваться для самостоятельной диагностики Вашего здоровья и возможных заболеваний.
В соответствии с требованиями законодательства РФ, информация, расположенная в некоторых разделах веб-сайтов компании «Верофарм», может предназначаться исключительно для медицинских и фармацевтических работников, а также иных работников системы здравоохранения. В этом случае доступ к таким разделам может быть ограничен в соответствии с правилами, указанными в Правилах пользования разделом по рецептурным лекарственным средствам и медицинским изделиям, для использования которых требуется специальная подготовка.
Для входа в такие разделы компания «Верофарм» оставляет за собой право попросить Вас ответить на некоторые вопросы, связанные с медициной или фармацевтикой, и/или предоставить информацию путем осуществления дополнительной регистрации на веб-сайтах для целей подтверждения действительного статуса медицинского, фармацевтического работника или иного работника системы здравоохранения на момент посещения соответствующего веб-сайта.
Интеллектуальная собственность
Информация, документы и соответствующая графика, опубликованные на веб-сайтах компании «Верофарм» (далее — «Информация») являются исключительной собственностью компании «Верофарм», за исключением информации, предоставленной третьим лицом, связанным с компанией «Верофарм» контрактными взаимоотношениями. Разрешение на использование Информации предоставляется при условии, что (1) на всех копиях будет приведено ссылка на оригинальный источник и вышеупомянутое заявление об авторском праве; (2) Информация будет использоваться для информационных некоммерческих целей и только в рамках личного использования; (3) Информация не будет никаким образом изменяться; (4) графические изображения, представленные на данном веб-сайте компании «Верофарм», не будут использоваться отдельно от сопровождающего их текста.
Компания «Верофарм» не несет ответственности за информационное наполнение, предоставленное третьим лицом, и Вы не вправе использовать и распространять такие материалы без разрешения их правообладателей. За исключением описанных выше разрешенных случаев, никому не предоставляются никакие лицензии или права, явные и подразумеваемые, ни по каким патентам, торговым маркам или иным правам собственности компании «Верофарм».
Использование товарных знаков, торговых названий, фирменного стиля или продуктов компании «Верофарм» на веб-сайтах компании «ВЕРОФАРМ» не допускается без предварительного письменного разрешения компании «ВЕРОФАРМ».
КОНФИДЕНЦИАЛЬНОСТЬ И БЕЗОПАСНОСТЬ
Компания «Верофарм» обязуется сохранять конфиденциальность Вашей информации, переданной через настоящий веб-сайт. Мы осознаем важность конфиденциальности для наших потребителей и посетителей веб-сайтов компании «Верофарм». Использование нами персональных данных определяется нашей Политикой в отношении обработки персональных данных на веб-сайтах компании «Верофарм», свое согласие с которой Вы подтвердили, начав использовать веб-сайты компании «Верофарм».
Настоящим Вы признаете и согласны с тем, что при отправке Ваших персональных данных на веб-сайты компании «Верофарм», несмотря на то, что компания «Верофарм» располагает действенными мерами защиты для предотвращения неавторизованного доступа или вмешательства, абсолютная конфиденциальность Ваших персональных данных, предоставленных на веб-сайты компании «Верофарм», не может полностью зависеть от принятых компанией «Верофарм» мер.
В том маловероятном случае, если, несмотря на наши усилия, произойдет вмешательство или неавторизованный доступ, компания «Верофарм» не будет нести ответственности за подобное вмешательство или неавторизованный доступ в пределах, допустимых применимиым законодательством, а также за любой прямой, косвенный, особый, случайный или явившийся следствием ущерб (также упущенную выгоду), от которого пострадает потребитель или пользователь, даже в том случае, если ранее компания «Верофарм» была предупреждена о возможности такого ущерба, компания «Верофарм» не гарантирует прямо или косвенно, что информация, предоставленная пользователем, не подвергнется вмешательству или неавторизованному доступу, и не предоставляет никаких потенциальных гарантий относительно коммерческого качества и пригодности при применении для определенных целей.
Каждый пользователь несет самостоятельную ответственность за сохранение конфиденциальности своего пароля.
Ограничения ответственности
Компания «Верофарм» не принимает на себя никаких обязательств в отношении материалов, информации или мнений, представленных, направленных или иным путем попавших на веб-сайты компании «Верофарм». Вы можете полагаться на достоверность этих материалов, информации и мнений исключительно на свой риск. Компания «Верофарм» не несет ответственности за вред и/или ущерб, причиненный в результате использования веб-сайтов компании «Верофарм» или представленных на них материалов.
Веб-сайты компании «Верофарм», содержимое сайта, продукты и услуги, предоставляемые на сайтах или через веб-сайты компании «Верофарм» представлены в форме «как есть» и «по мере поступления», со всеми вытекающими последствиями. Ни в каком случае компания «Верофарм» или ее поставщики, или, соответственно, их руководители, сотрудники или агенты (именуемые ниже «лица, связанные с «Верофарм», не будут нести ответственность за какой-либо ущерб любого рода, возникший на основе или в связи с вашим использованием или неспособностью использовать веб-сайты компании «Верофарм».
А также материалов сайтов, услуги, предоставляемые на сайтах или через них, или на каких-либо связанных с ними сайтах, включая любой особый, косвенный, штрафной, случайный, присужденный в порядке наказания или явившийся следствием ущерб, в том числе (но не ограничиваясь этим) вред, потерю выгоды или ущерб, связанный с задержкой, временным прекращением услуг, вирусами, удалением файлов или электронных сообщений, ошибками, пропусками или другими неточностями на веб-сайтах компании «Верофарм» или в материалах сайтов, независимо от того, связано ли это с какими-либо упущениями со стороны компании «Верофарм» и была ли предупреждена компания «Верофарм» о возможности такого ущерба.
Помните, что к веб-сайтам компании «Верофарм» могут быть применены дополнительные официальные уведомления, заявления об отказе от ответственности и прочие правила и условия.
Общие положения
Настоящим Вы соглашаетесь, что настоящие Условия онлайн-использования и Политика в отношении обработки персональных данных на веб-сайтах компании «Верофарм» являются единым неделимым соглашением. Настоящим Вы соглашаетесь с тем, что, ознакомившись с настоящими Условиями онлайн-использования и Политикой в отношении обработки персональных данных на веб-сайтах компании «Верофарм». Вы подтверждаете свое согласие с ними, и уведомлены, что указанные Условия онлайн-использования, а также иные условия функционирования Веб-сайтов компании «Верофарм» регулируются в том числе законами штата Иллинойс и иными федеральными законами США.
Законы штата Иллинойс будут контролировать выполнение настоящих Условий онлайн-использования в той степени, в какой законы штата Иллинойс не противоречат императивным нормам законодательства Российской Федерации, в частности, законодательства о защите прав потребителя. В том случае, если компетентные судебные органы решат, что какое-либо положение настоящих Условий онлайн-использования недействительно или не имеет юридической силы, Вы соглашаетесь с тем, что остальные положения настоящих Условий онлайн-использования сохранят свою полную силу и действие.
В связи с вышеизложенным любыми Вашим действиями, направленными на использование Вами веб-сайтов компании «Верофарм» посредством Вашего доступа или иного использования веб-сайтов и содержащейся на них информации, Вы подтверждаете, что ознакомлены с настоящими Условиями онлайн-использования и полностью согласны с такими Условиями онлайн-использования. Таким образом, Вы автоматически принимаете на себя обязательства по их безусловному соблюдению и обеспечению их выполнения с Вашей стороны без каких-либо ограничений или оговорок в процессе Вашего посещения и использования веб-сайтов компании «Верофарм», а также любой информации, содержащейся на них.
|
Препарат (МНН) |
Механизм действия |
Формы выпуска |
Схемы назначения |
Противопоказания |
|
Барицитиниб |
Селективные ингибиторы янус киназ (JAK1 и JAK2). |
Таблетки |
4 мг 1 р/сут в течение 7 — 14 дней |
— Сепсис, подтвержденный патогенами, отличными от COVID-19 — Лимфопения < 0,5 * 109/л, — Нейтропения < 1 * 109/л, — Гемоглобин < 8 г/дл, — Клиренс креатинина < 30 мл/мин, — Тяжелая печеночная недостаточность/если есть подозрение на лекарственное повреждение печени, — Активный гепатит B и/или C, — Активный туберкулез, — ТВГ/ТЭЛА в анамнезе С осторожностью: возраст старше 75 лет, прием ЦОГ-2 ингибиторов |
|
Тофацитиниб |
Таблетки |
10 мг 2 р/сут в течение 7 — 14 дней |
||
|
Нетакимаб |
Рекомбинантные гуманизированные моноклональные антитела, ингибирующие интерлейкин-17А (ИЛ-17А) |
Раствор для подкожного введения |
120 мг в виде двух подкожных инъекций по 1 мл (60 мг) препарата каждая. |
— Гиперчувствительность к нетакимабу, а также к любому из вспомогательных веществ препарата. — Клинически значимые инфекционные заболевания в острой фазе, включая туберкулез. — Детский и подростковый возраст до 18 лет. Беременность, грудное вскармливание. |
|
Олокизумаб |
Гуманизированные моноклональные антитела изотипа иммуноглобулина G4/каппа, разработанные в качестве антагониста ИЛ-6 |
Раствор для подкожного введения |
64 мг (один флакон 160 мг/мл 0,4 мл) подкожно или внутривенно. При недостаточном эффекте повторить введение внутривенно через 24 часа. Суммарно вводить не более 256 мг. |
— Сепсис, подтвержденный патогенами, отличными от COVID-19; — Гиперчувствительность к любому компоненту препарата; — Вирусный гепатит B; — Сопутствующие заболевания, связанные с неблагоприятным прогнозом; — Иммуносупрессивная терапия при трансплантации органов; — Нейтропения составляет < 0,5 * 109/л; — Повышение активности АСТ или АЛТ более чем в 5 раз; — Тромбоцитопения < 50 * 109/л. |
|
128 мг (два флакона по 160 мг/мл 0,4 мл) разводят в 100 мл 0,9% раствора NaCl, вводят внутривенно капельно в течение 60 минут. При недостаточном эффекте повторить введение через 12 ч. Суммарно вводить не более 256 мг. |
||||
|
256 мг (четыре флакона по 160 мг/мл 0,4 мл) разводят в 100 мл 0,9% раствора NaCl, вводят однократно внутривенно капельно в течение 60 минут. |
||||
|
При беременности и лактации нежелательны. |
||||
|
Левилимаб |
Моноклональные антитела, ингибируют рецепторы ИЛ-6. |
Раствор для подкожного введения |
324 мг (два преднаполненных шприца по 162 мг/0,9 мл) подкожно или внутривенно однократно. При недостаточном эффекте повторить введение через 24 часа. |
|
|
648 мг (четыре преднаполненных шприца по 162 мг/0,9 мл) разводят в 100 мл 0,9% раствора NaCl, вводят внутривенно капельно в течение 60 минут в сочетании с ГКС. |
||||
|
Тоцилизумаб |
Концентрат для приготовления раствора для инфузий |
4 — 8 мг/кг/введение в сочетании с ГКС. 400 мг разводят в 100 мл 0,9% раствора NaCl, вводят внутривенно капельно в течение 60 минут. Вводить не более 800 мг. При недостаточном эффекте повторить введение через 12 ч . |
||
|
Сарилумаб |
Раствор в шприц-ручке |
200 мг или 400 мг в сочетании с ГКС. Предварительно заполненную шприц-ручку в дозировке 200 мг (1 или 2 шприца в зависимости от дозы)) разводят в 100 мл 0,9% раствора NaCl, вводят в/в капельно в течение 60 минут. При недостаточном эффекте повторить введение через 12 ч. |
||
|
Канакинумаб |
Моноклональные антитела, ингибируют рецепторы . |
Лиофилизат |
Канакинумаб 4 — 8 мг/кг в/в в сочетании с ГКС. Назначается при невозможности использования или неэффективности тоцилизумаба или сарилумаба. 150 мг лиофилизата растворяют в 1 мл воды для инъекций. Приготовленный концентрат вводят во флакон с 250 мл 5% раствора глюкозы. Не встряхивают. Доза канакинумаба (объем концентрата для приготовления раствора (150 мг/мл) 300 мг — 2 мл 150 мг — 1 мл |
|
|
Анакинра |
Ингибиторы интерлейкина, является ключевым провоспалительным цитокином |
Раствор для подкожного введения |
200 — 400 мг/сут, в течение 10 дней |
|
|
Метилпреднизолон |
Относятся к глюкокортикостероидам, обладают иммуновоспалительным, иммунодеспрессивным, противошоковым фармакологическим действием. Влияют на все фазы воспаления. |
Раствор |
При среднетяжелом течении: — без анатагонистов рецептора ИЛ-6 или блокаторов ИЛ-6 — в дозе 125 мг/введение внутривенно каждые 12 ч. ИЛИ — 250 мг/введение внутривенно один раз в сутки. При среднетяжелом течении с дыхательной недостаточностью, в сочетании с блокаторами рецептора ИЛ-6 или ИЛ-6 — в дозе 60 мг/введение/внутривенно каждые 8 ч. При тяжелом течении: — без анатагонистов рецептора ИЛ-6 или блокаторов ИЛ-6, или ИЛ-1 — в дозе 125 мг/введение внутривенно каждые 6 — 8 ч. ИЛИ — 250 мг/введение внутривенно однократно. При тяжелом течении: — в сочетании с анатагонистами рецептора ИЛ-6 или блокаторами ИЛ-6, или — в дозе 60 мг/введение/внутривенно каждые 6 — 8 ч. Максимальная доза. Метилпреднизолона применяется в течение 3 — 4 суток. Доза метилпреднизолона снижается на 20 — 25% на введение каждые 1 — 2 суток, далее на 50% каждые 1 — 2 суток до полной отмены. Снижение дозы начинается при условии стабильного (в течение 3 — 4 суток) купирования лихорадки, снижения уровня CРБ и уровня ферритина сыворотки крови не менее чем на 15%. |
Применять с осторожностью при: — Сахарном диабете, — Гипертонической болезни, — Язвенной болезни желудка и 12-перстной кишки, — Ожирении, — Признаках активной бактериальной инфекции, — Тромботических нарушениях. |
|
Таблетки |
6 — 12 мг — однократно утром, после приема пищи, за 12 ч до начала снижения дозы метилпреднизолона для в/в введения, в течение 7 дней, с 8 дня постепенное снижение дозы на 2 мг в сутки. |
|||
|
Дексаметазон |
Раствор |
При среднетяжелом течении: — без анатагонистов рецептора ИЛ-6 или блокаторов ИЛ-6 — в дозе 16 — 20 мг/сутки внутривенно в зависимости от тяжести состояния пациента за 2 введения. При среднетяжелом течении с дыхательной недостаточностью: — в сочетании с анатагонистами рецептора ИЛ-6 или блокаторами ИЛ-6 — в дозе 16 — 24 мг/сутки внутривенно в зависимости от тяжести состояния пациента за 2 введения. При тяжелом течении: — в сочетании с анатагонистами рецептора ИЛ-6 или блокаторами ИЛ-6 или — в дозе 16 — 24 мг/сутки внутривенно в зависимости от тяжести состояния пациента за 2 введения. — без блокаторов рецептора ИЛ-6 или блокаторов ИЛ-6, или — в дозе 24 мг/сутки/внутривенно за 2 введения. Максимальная доза дексаметазона применяется в течение 3 — 4 суток. Доза Дексаметазона снижается на 20 — 25% на введение каждые 1 — 2 суток, далее на 50% каждые 1 — 2 суток до полной отмены. Снижение дозы начинается при условии стабильного (в течение 3 — 4 суток) купирования лихорадки, снижения уровня CРБ и уровня ферритина сыворотки крови не менее чем на 15%. |
||
|
Гидрокортизон |
Раствор |
Внутривенное (болюсное) введение в дозе 50 — 100 мг, с последующим медленным, внутривенным введением в течение часа в дозе 200 мг в сутки только при развитии надпочечниковой недостаточности |
||
|
Будесонид |
Относится к глюкокортикостероидам, обладает противовоспалительным действием. Влияет на все фазы воспаления. |
Порошок для ингаляций дозированный |
По 800 мкг 2 раза в сутки до выздоровления, но не более 14 суток |
— Детский возраст до 6 лет; — Повышенная чувствительность к будесониду. |
|
С осторожностью: (требуется более тщательное наблюдение за больными) следует назначать препарат пациентам с активной формой туберкулеза легких, грибковыми, бактериальными инфекциями органов дыхания, циррозом печени. При назначении следует принимать во внимание возможное проявление системного действия ГКС. |
cox inhibitor — Translation into Russian — examples English
These examples may contain rude words based on your search.
These examples may contain colloquial words based on your search.
Suggest an example
Other results
Indometacin, therefore, like other non-selective COX inhibitors can cause peptic ulcers.
Таким образом, индометацин, как и другие неселективные ингибиторы СОХ, может вызывать пептические язвы.Selective COX-2 inhibitors show less activity on COX-1 compared to traditional non-steroidal anti-inflammatory drugs (NSAID).
Селективные ингибиторы ЦОГ-2 показывают меньшую активность на СОХ-1 по сравнению с традиционными нестероидными противовоспалительными препаратами (НПВС).The COX-2 inhibitor rofecoxib (Vioxx) was removed from the market in 2004 due to its risk.
В 2004 году из рынка был удален ингибитор COX-2 рофекоксиб (Vioxx) из-за его риска.Like all other NSAIDs the COX-2 inhibitors too have their share of adverse effects.
Rofecoxib is a selective COX-2 inhibitor, or «coxib».
Isoxazoles also form the basis for a number of drugs, including the COX-2 inhibitor valdecoxib (Bextra) and a neurotransmitter agonist AMPA.
Изоксазолы также образуют основу для ряда лекарственных средств, в том числе для ЦОГ-2 ингибиторов вальдекоксиба (Bextra) и агонистов нейромедиаторов АМРА.In 2005, a study published in the Annals of Internal Medicine found that cardiovascular effects of COX-2 inhibitors differ, depending on the drug.
В 2005 году исследование, опубликованное в Annals of Internal Medicine, показало, что сердечно-сосудистые эффекты ингибиторов ЦОГ-2 различаются в зависимости от препарата.In a 2006 meta-analysis of randomized control studies, the cerebrovascular events associated with COX-2 inhibitors were examined, but no significant risks were found when compared to nonselective NSAIDs or placebos.
В метаанализе рандомизированных контрольных исследований 2006 года были проанализированы цереброваскулярные события, связанные с ингибиторами ЦОГ-2, но не было обнаружено существенных рисков по сравнению с неселективными НПВП или плацебо.Other COX-2-selective inhibitors, such as rofecoxib, have significantly higher myocardial infarction rates than celecoxib.
Like any other selective COX-2 inhibitor («coxib»), etoricoxib selectively inhibits isoform 2 of the enzyme cyclooxygenase (COX-2).
Как и любой другой селективный ингибитор СОХ-2 («коксиб»), эторикоксиб избирательно ингибирует изоформу 2 фермента циклооксигеназы (СОХ-2).No COX-2 selective inhibitor has been approved in the US since that time, regardless of the safety profile of parecoxib in Europe.
С тех пор в США не было утверждено селективного ингибитора ЦОГ-2, независимо от профиля безопасности парекоксиба в Европе.Parecoxib, along with other COX-2 selective inhibitors, celecoxib, valdecoxib, and mavacoxib, were discovered by a team at the Searle division of Monsanto led by John Talley.
Парекоксиб, наряду с другими селективными ингибиторами ЦОГ-2, целекоксибом, валдекоксибом и мавакоксибом, был обнаружен командой в подразделении Сирле Монсанто во главе с Джоном Тэлли.Флурбипрофен при лечении остеоартроза — WebCardio.org
Т.С. Силантьева Г. П. Иванова Т.М. Костюченко М.Ф. Полудненко Е.П. Цуцарина
Национальная медицинская академия последипломного образования им. П.Л. Шупика, 6-я клиническая больница г. Киева
Клінічні дослідження
В статье представлены данные об эпидемиологии, основных клинических проявлениях остеоартроза. Дана характеристика флурбипрофена, его анальгезирующий, противовоспалительный эффект, влияние на хрящ, данные о частоте побочных эффектов. Приведены результаты собственных наблюдений о влиянии флурбипрофена на симптомы остеоартроза у пациентов с гонартрозом.
Ключевые слова:
остеоартроз, лечение, нестероидные противовоспалительные препараты, флурбипрофен.
Остеоартроз (ОА) относится к ревматическим заболеваниям костно-мышечной системы и сегодня его рассматривают как гетерогенную группу заболеваний различной этиологии, при которых в патологический процесс вовлекаются все компоненты сустава, в первую очередь, суставной хрящ, субхондральная кость, синовиальная оболочка, капсула, связки, околосуставные мышцы (Altman R. etal.,1986; Коваленко В.М., БорткевичО.П., 2010).
ОА — одно из самых распространенных и наиболее частых заболеваний суставов, являющееся причиной обращения к семейному врачу или терапевту. Среди заболеваний суставов эта патология занимает 1-е место (70-80%). В последние годы во всех странах мира отмечается постоянный рост числа больных ОА, чему способствует увеличение длительности и повышение темпа жизни. Заболеваемость ОА среди населения всех стран составляет 8,2 на 100 тыс. жителей, распространенность — 20% населения земного шара. В Украине в 2011 г. распространенность артроза составила 33,1%, от всех заболеваний костно-мышечной системы, в том числе среди трудоспособного населения — 18,5%, что превысило соответствующий показатель 2007 г. на 7,8%. В целом распространенность ОА составляет от 11 до 12%. Заболеваемость артрозом в 2011 г. в Украине составила 227 661 человек (605,6 на 100 тыс. населения), а распространенность —1 290 509 (3432,7 на 100 тыс. населения) (Коваленко В.М., КорнацькийВ.М., 2012). Социальное значение ОА определяется не только фактом значительного распространения этой патрологии, но и тем, что он существенно снижает качество жизни человека, часто приводит к временной нетрудоспособности, а впоследствии — к инвалидизации.
Заболеваемость ОА повышается с возрастом. Поэтому ОА является «привилегией» лиц старшего возраста (40-60 лет). В этом возрасте обычно имеет место ассоциация ряда заболеваний, ухудшающих качество жизни человека и ограничивающих возможности терапии. ОА одинаково часто диагностируют у мужчин и у женщин, однако существует разница в преимущественной локализации процесса — у женщин чаще поражаются коленные суставы, кисти, у мужчин—тазобедренные суставы.
ОА возникает в результате взаимодействия ряда механических и биологических факторов. Развитию заболевания способствуют чрезмерная нагрузка на суставы, избыточная масса тела и ожирение, пожилой возраст, женский пол, дефицит эстрогенов в постменопаузальный период, травмы суставов, врожденные и приобретенные воспалительные, микрокристаллические заболевания суставов и др. Многими исследователями подчеркивается важная роль генетической предрасположенности, выражающаяся в дефекте гена коллагена типа ІІ, главного структурного компонента матрикса хряща. При ОА наблюдается сложный комплекс дегенеративных процессов в хряще, воспалительных реакций с вовлечением системы цитокинов и активацией протеолитических ферментов в синовиальной оболочке, патологические процессы в субхондральной кости (van den Berg W.B.,2000; Бур’янов О.А., 2009; Коваленко В.М., Борткевич О.П., 2010; Казимирко В.К. и соавт., 2011). Использующийся в англоязычной литературе термин «остеоартрит» отражает значение воспалительного компонента при данном заболевании.
Разрушение матриксных компонентов соединительной ткани при ОА является серьезным обстоятельством, которое вызывает прогрессирующее разрушение сустава. Сегодня, очевидно, что главными медиаторами деструкции и воспаления, ведущих к деградации суставного хряща, являются интерлейкин (ИЛ)-1 β, фактор некроза опухоли (ФНО)-альфа, простагландин Е2 (Яременко О.В., 2003; Коваленко В.М., Борткевич О.П., 2010). В хондроцитах под влиянием медиаторов активируется синтез и секреция металлопротеиназ и NO — синтетазы, что ведет к повреждению протеингликан-коллагенового матрикса хряща, высвобождению фосфолипидов из мембран и, следовательно, арахидоновой кислоты, простагландинов, лейкотриенов. Это служит пусковым механизмом в развитии воспалительной реакции и ведет к полной потере хрящевого протеогликана как путем стимулирования деградации протеогликанов, так и путем подавления его синтеза и, через активацию коллагеназы, деградацию коллагена. Апоптоз клеток хряща, играющий основную роль в развитии ОА, обусловлен перекисным окислением липидов и выходом цитохрома С из митохондрий, что, в свою очередь, связано с появлением свободных радикалов в митохондриях (Blanco F.J. et al., 2004). Показано, что оксид азота может быть посредником для некоторых катаболических реакций, вызванных ИЛ-1 β в хондроцитах, таких как подавление синтеза протеогликанов, индукция апоптоза, активация экспрессии гена коллагеназы и ингибирование клеточной пролиферации.
Одним из основных клинических проявлений, а часто и дебютных, при ОА является боль. Механизм возникновения боли сложен и обусловлен взаимодействием нескольких факторов. Появление боли может быть связано с повреждением суставного хряща, околосуставных тканей, реактивным синовитом, раздражением периоста остеофитами. Преходящий болевой синдром «механического» характера, при котором боль исчезает во время отдыха, свидетельствует об уменьшении амортизационной способности хряща к нагрузкам и характерен для начальных этапов ОА. Присоединение воспалительного компонента — главная причина хронической суставной боли. Возникновение боли в покое, усиление боли в положении стоя и при нагрузке, припухлость сустава за счет небольшого выпота, утренняя скованность, крепитация свидетельствуют о воспалении. Боль по утрам и утренняя стартовая боль наблюдаются при длительном воспалении и связаны с трением поврежденных суставных поверхностей. Локальный болевой синдром, беспокоящий пациента при определенных движениях, чаще всего связан с развитием бурситов, тендобурситов. Боль мышечного типа, возникающая при рефлекторном спазме нагрузочных мышц, сопровождает синовит. Тупая, постоянная ночная боль обьясняется венозным стазом, гиперемией в субхондральной кости. При ОА основным механизмом развития боли является ноцицептивный. В тоже время возможна и боль невропатического характера, о чем свидетельствуют такие проявления, как жгучая боль, жжение, онемение, покалывание — симптомы нейропатической боли. Лекарственные препараты для купирования боли назначают с учетом предполагаемых механизмов формирования ее в каждом конкретном случае.
Хроническая боль, являясь по сути защитно-приспособительным механизмом, снижает качество жизни пациента, а также вызывает психоэмоциональные нарушения, способствующие снижению трудоспособности, социальной активности, приводит к регионарным и системным нарушениям микроциркуляции, является причиной вторичных иммунных депрессий, нарушает деятельность висцеральных систем, вызывая комплекс дезадаптивных реакций. Особенно она опасна для больных пожилого возраста и лиц с коморбидными заболеваниями сердечнососудистой системы.
Терапевтическая тактика при ОА направлена на уменьшение выраженности боли, улучшение функционального состояния сустава, замедление дальнейшего разрушения хряща.
Выраженный болевой синдром вынуждает больных, страдающих ОА, более или менее регулярно применять препараты, купирующие боль. При остром преходящем умеренном болевом синдроме без признаков воспаления пациентам назначают ненаркотический анальгетик парацетамол. Основой лечения при хроническом болевом синдроме у пациентов с ОА, обусловленном, в первую очередь, воспалением, в настоящее время считают нестероидные противовоспалительные препараты (НПВП), помогающие решать такие задачи в терапии ОА, как устранение болевого синдрома и явлений воспаления, что является патогенетическим при хронической боли. Следовательно, НПВП позволяют повысить качество жизни больных. Эти рекомендации базируются на данных многочисленных исследований и согласно им сегодня НПВП являются препаратами первой линии в Европейских рекомендациях по лечению боли, подобная практика имеет место и в США (Коваленко В.М., 2009; Коваленко В.М., БорткевичО.П., 2010).
История создания НПВП уходит в доисторические времена, когда пациенты в качестве обезболивающих средств использовали листья мирта, листья и кору ивы, мелиссу. Первый НПВП был синтезирован лишь во второй половине ХІХ века (ацетилсалициловая кислота) и почти через 100 лет, во второй половине ХХ века, появляются большинство применяемых в настоящее время НПВП — неселективных, а с 1999 г. — селективных ингибиторов циклооксигеназы (ЦОГ)-2. Механизм действия НПВП посредством угнетения синтеза простагландинов из арахидоновой кислоты при помощи обратимого ингибирования активности ЦОГ как в периферических тканях, так и в структурах центральной нервной системы, открытый Джоном Вейном, сегодня дополнен многими новыми данными. Это и данные о наличии двух, а на сегодня, видимо, трех изоформ ЦОГ, ключевой роли в образовании провоспалительных протеогликанов ЦОГ-2, ингибирование которой лежит в основе терапевтического действия НПВП.
По избирательности действия в отношении ингибирования обеих изоформ ЦОГ выделяют селективные и неселективные НПВП. Неселективные в одинаковой степени подавляют оба изофермента, селективные — преимущественно угнетают ЦОГ-2. Некоторые авторы отмечают, что селективные ингибиторы ЦОГ-2 менее эффективны при боли, связанной с воспалительными поражениями суставов и позвоночника, нежели неселективные НПВП. Следует также учитывать, что селективность всех НПВП относительна in vivo и зависит от характеристик вводимых фармакологических веществ и их доз. Именно поэтому многие побочные реакции, зачастую сопровождающие применение неселективных представителей класса НПВП, в определенной степени свойственны и многим селективным препаратам. Имеются сообщения о том, что, возможно, НПВП способны оказывать не только симптоматическое, но и патогенетическое лечебное действие путем модулирования системы цитокинов и повышения уровня ингибиторов протеолитических ферментов. Известно, что некоторые НПВП, например индометацин, могут подавлять синтез протеогликанов суставного хряща. Выявлены особенности влияния ЦОГ-2-ингибиторов на сердечнососудистую систему (Шуба Н.М., 2006; Викторов А.П., 2009).
Многолетний опыт применения НПВП при ОА, а также большое количество клинических исследований, проведенных за эти годы, выявивших положительные и отрицательные стороны этих препаратов, позволили выработать основные требования, предъявляемые к ним. Наиболее важными из них являются выраженность противовоспалительного и анальгезирующего эффекта в сочетании с максимальной безопасностью. При этом важным критерием выбора лекарственного средства является уникальный баланс польза/риск для каждого из классов препаратов (Насонова В.А., 2002). Неудовлетворенность результатами применения НПВП обусловливает потребность поиска новых препаратов или возвращения вновь к тем, которые когда-то были изучены.
Среди НПВП, применяемых при лечении пациентов с ОА, одно из основных мест принадлежит производным пропионовой кислоты (ибупрофен, флурбипрофен, напроксен, кетопрофен) (Насонова В.А., 1995; Насонов Е.Л., 1996). Препараты этой группы, в первую очередь ибупрофен, считаются классическими средствами лечения при ОА, поскольку они отличаются достаточным противовоспалительным действием, хорошим обезболивающим эффектом, большим диапазоном лечебных доз и удовлетворительной переносимостью. Кроме того, у производных пропионовой кислоты имеется ряд других положительных свойств. В.А. Насонова (1996) высказывала мнение о производных арилпропионовой кислоты как о препаратах первого ряда при ОА.
Флурбипрофен, (RS)-2-(2-фторбифенил-4-ил) пропионовая кислота, был создан в Великобритании (в исследовательском отделе компании Boots pharmaceuticals) в 1965 г. и является достаточно хорошо изученным представителем группы производных пропионовой кислоты. Клиническое применение препарата разрешено с 1977 г. Опыт применения флурбипрофена при ОА в мире насчитывает более 30 лет. За этот период были изучены его анальгезирующий, противовоспалительный эффект, переносимость и безопасность при кратковременном и длительном применении. В России впервые апробирован в Институте ревматологии (Сигидин Я.А. и соавт. 1995; Каратеев Д.Е., 1998). В Украине препарат зарегистрирован в 2009 г., поступил на реализацию в марте 2012 г.
Еще в конце 1980-х годов в 9 клиниках Великобритании, Нидерландов и Бельгии проведено двойное слепое плацебо-контролируемое исследование флурбипрофена у больных с артрозом коленных суставов. При 3-недельном лечении улучшение наблюдалось у 51% пациентов (симптомы полностью исчезли у 11 %). Эти данные подтверждены и в последующих исследованиях. Так, в двойных слепых и перекрестных исследованиях показано, что флурбипрофен существенно превосходит плацебо и ацетилсалициловую кислоту, сопоставим по анальгезирующему эффекту с индометацином, диклофенаком, напроксеном (Stubbs D., Freman B., 1989). Суммарная оценка эффективности препарата на основании 55 клинических испытаний, проведенных с 1973 по 1990 г. с участием 3209 пациентов (Renes J. et al., 1995), показывает, что флубипрофен по сравнению с другими НПВП продемонстрировал более высокую эффективность в 22% исследований и меньшую — только в 2% исследований. Флурбипрофен обладает мощными противовоспалительным, анальгезирующим, жаропонижающим свойствами (Wu H. etal., 2009). Исследования показали, что анальгезия наступает быстро, уже через 30 мин, эффект сохраняется около 12 ч. Противовоспалительный эффект препарата выявляется уже через 24-48 ч, максимально он выражен на 2-3-й неделе лечения, в то время как у ибупрофена, это долакаон наступает на 7-е сутки, у напроксена— на 14-е сутки. Флурбипрофен — один из наиболее мощных ингибиторов синтеза простагландинов среди основных НПВП. В этом отношении он не уступает диклофенаку, пироксикаму, напроксену, кетопрофену (Каневская М.З. и соавт., 1995). В кратковременных клинических испытаниях (при длительности лечения больных ОА от 1 до 12 нед) в 30% случаев он был эффективнее и в 70% случаев был равен по эффективности другим НПВП (диклофенак, фенилбутазон). Поданным С.А. Саундерс и соавторов (1995), ни в одном случае препарат сравнения не превосходил флурбипрофен.
Кроме противовоспалительного действия, флурбипрофен обладает выраженным анальгезирующим эффектом, который был многократно продемонстрирован на таких стандартных моделях, как зубная боль, дисменорея, послеоперационная боль. В клинических исследованиях обезболивающий эффект флурбипрофена в дозе 100 мг наступал через 30 мин и был сопоставим с таковым при внутримышечном введении 10 мг морфинасульфата(DeLiaJ.E.,etal., 1986). Первый опыт применения препарата в России подтвердил выраженное анальгезирующее действие препарата в дозе 300-400 мг/сут. В отдельных случаях флурбипрофен устранял боль «подобно действию наркоза» (Сигидин Я.А., 1995). На большом клиническом материале показано, что флурбипрофен в дозе 150-300 мг/сут по эффективности сопоставим с ацетилсалициловой кислотой 3600-4000 мг/ сут, индометацином 75-150 мг/сут, диклофенаком 150 мг/сут. По наблюдению Я.А. Сигидина и соавторов (1988), наиболее выраженный клинический эффект флурбипрофена отмечали именно при ОА.
Флурбипрофен, наряду с ибупрофеном, диклофенаком, напроксеном, относится к группе НПВП с умеренной селективностью в отношении к ЦОГ-1. Он ингибирует ЦОГ-2, ответственную за синтез простагландинов, регулирующих развитие воспаления и восприятие боли, а также умеренно блокирует ЦОГ-1, постоянно активный фермент, ответственный за множество физиологических функций. Механизм действия флурбипрофена обусловлен повышением синтеза эндоканнабиноидов в центральной нервной системе, ингибированием ЦОГ-2 и снижением синтеза простагландинов E2 в спинном мозгу, а также в месте повреждения (Seidel K. et al., 2003; Bishay P. etal.,2010).
Флурбипрофен уменьшает проявления не только ноцицептивной, но и нейропатической боли. Если ингибирование ЦОГ-2 и простагландина Е2 является основным механизмом для ингибирующего действия флурбипрофена, анальгезирующий эффект препарата в значительной степени связан с его воздействием на афферентные нервы и снижением выраженности центростремительных болевых импульсов. Таким образом, флурбипрофен уменьшает проявления как ноцицептивной, так и нейропатической боли, этот эффект является дозозависимым и сопоставим с эффектом габапентина. При этом флурбипрофен лишен побочных эффектов (привыкание, нарушение памяти и др.), характерных для каннабиноидов и антиконвульсантов (Ates M. et al., 2003; Seidel K. et al., 2003; Bishay P. etal., 2010).
Известно, что некоторые НПВП способствуют разрушению суставного хряща путем ингибирования биосинтеза протеогликанов, имеющих решающее значение для поддержания вязкоупругих функций этой ткани. Как правило, эрозия хряща при ОА первоначально вызвана снижением содержания протеогликанов, а затем разрушением коллагеновых волокон. Недавно высказано предположение, что некоторые НПВП могут защитить от разрушения хрящ и кости при ОА. Некоторые производные арилпропионовой кислоты, в том числе флурбипрофен, не вызывают ухудшения состояния хряща по экспериментальным и клиническим данным (GishenР.etal., 1995; QuinteroM.etal., 1996). Производные 2-арилпропионовых кислот или «профены» по химическому составу являются слабыми кислотами и благодаря хиральному атому углерода набоковой цепи пропионовой кислоты существуют в виде энантиомерных пар, с (R, S)-изомерами, которые, в первую очередь, отвечают за ингибирование образования простагландина и воспалительных процессов. Большинство из этих кислот по-прежнему используются в качестве рацемата, хотя известно, что (R, S)-форма является более эффективной при ингибировании ЦОГ, это аргумент в пользу флурбипрофена [(R, S)-2-(2-фтор-4-бифенилил) пропионовая кислота).
Показано, что флурбипрофен, в качестве (R)-и (S)-энантиомеров и rac, подавляет на 41,1; 65,5 и 52,12% соответственно выделение протеогликанов, индуцированное ИЛ-1 β. Причина того, почему (R)- и в основном (S)-флурбипрофен эффективно подавляет выделение протеогликанов, не изучена. Вероятно, он может препятствовать образованию ключевых ферментов металлопротеиназы, вызывающих патологическое разрушение хряща. Также показано, что (R)- и (S)-флурбипрофен в равной степени подавляет образование оксида азота, индуцированное ИЛ-1, и что (S)-флурбипрофен, по сравнению с (R)-флурбипрофеном, в большей степени снижает распад протеогликанов человеческого суставного хряща (Gishen Р. et al., 1995; QuinteroM.etal., 1996).
Вполне вероятно, что терапевтический эффект флурбипрофена при РА и/или ОА обусловлен, по крайней мере частично, хондропротекторными действиями, которые в основном свидетельствуют в пользу (S)-флурбипрофена, вместе с известным ингибирующим действием образования простагландина Е2 (Panico M. et al., 2003).
Флурбипрофен относится к группе короткоживущих НПВП. Он быстро и хорошо всасывается при приеме внутрь. Связь с белками плазмы крови составляет >90%. Метаболизируется в печени. Максимальная концентрация препарата при однократном приеме внутрь натощак достигается через 0,5-2 ч (в среднем — 1,5 ч), период полувыведения составляет 3,8-6 ч (Kaiser D.G., 1986). Это является благоприятным фактором, поскольку высокая скорость выведения флурбипрофена предотвращает накопление препарата при возрастном замедлении элиминации НПВП, в то время как при применении ряда других препаратов, таких как индометацин, напроксен и кетопрофен, может наблюдаться кумуляция и повышение риска токсических реакций у пациентов пожилого возраста. Препарат принимают peros по 50-100 мг2-3 раза в сутки (максимум — 300 мг/сут). Применение препарата 2 раза в сутки обеспечивает сохранение терапевтической концентрации флурбипрофена в синовиальной жидкости (Smith R. etal., 1987).
Побочные реакции при применении НПВП по частоте, согласно данным ВОЗ, занимают второе место после антибактериальных препаратов. Поданным Государственного фармакологического центра МОЗ Украины, появление побочных реакций при применении НПВП улиц с заболеваниями суставов требовало отмены препаратов при применении диклофенака натрия — у65,2% пациентов, нимесулида — у 51,2%, мелоксикама — у 74,3%, индометацина — у 79,1% лиц (Викторов А.П., 2009).
Одной из важнейших проблем, возникающих при лечении НПВП, является НПВП-гастропатии, частота которых, по данным Института ревматологии РАМН (Российская Федерация, Москва), достигает 39% (Насонов Е.Н., 1996) Хотя флурбипрофен, являясь неселективным ингибитором ЦОГ, и, как и другие НПВП, может вызывать развитие гастропатии, на практике, однако, она отмечается достаточно редко. Серьезные неблагоприятные реакции со стороны верхних отделов желудочно-кишечного тракта (ЖКТ) при лечении флурбипрофеном развивались в 2 раза реже, чем при лечении ацетилсалициловой кислотой, а частота отмены из-за неблагоприятных реакций была приблизительно в 2 раза ниже, чем при лечении индометацином и была сопоставимой с таковой ибупрофена и напроксена (Richy F., 2007). Флурбипрофен — один из самых безопасных НПВП относительно риска развития желудочно-кишечных кровотечений (табл. 1) (Garcia R.L.A. et al., 1994). Вероятно, это можно объяснить отсутствием выраженного местного повреждающего действия флурбипрофена на слизистую оболочку ЖКТ с разобщением окислительного фосфорилирования и нарушением энергетического обмена в клетках, которые являются начальным звеном НПВП-гастропатии.
Таблица 1
Риск развития желудочно-кишечных кровотечений при применении НПВП
Лекарственное средство Риск кровотечения, баллов
наркотические анальгетики 1
Флурбипрофен 2,9
напроксен 3,1
диклофенак 3,9
кетопрофен 5,4
Индометацин 6,3
Пироксикам 18
Лекарственные поражения печени при применении НПВП являются проявлением иммунных, аллергических, метаболических и смешанных реакций и наблюдаются с частотой 1 на 10 тыс. (Althal G.P. et al., 1998) как при применении селективных, так и неселективных препаратов.
В целом флурбипрофен, в отличие от ряда других распространенных НПВП (ацетилсалициловая кислота, индометацин, фенилбутазон, пироксикам), реже вызывает серьезные побочные реакции как со стороны ЖКТ, так и нервной системы, почек, печени, костного мозга, а также аллергические реакции, и относится к наиболее безопасным препаратам среди НПВП (табл. 2). Частота отмены флурбипрофена из-за непереносимости (5,4%) была ниже, чем препаратов сравнения (7,1%).
Таблица 2
Неблагоприятные реакции лекарств в течение первых 5 лет продажи в Великобритании
Препарат Серьезные неблагоприятные реакции (на 1 млн назначений) всего
Индометацин н/д
Ибупрофен 13,2
Флубипрофен 35,8
кетопрофен 38,6
диклофенак 39,4
напроксен 41,1
КЛ I Н I Ч Н I ДОСЛ1ДЖЕННЯ
Препарат Серьезные неблагоприятные реакции (на 1 млн назначений) всего
сулиндак 54,3
Пироксикам 68,1
Неселективные препараты не стимулируют окислительную модификацию липопротеидов низкой плотности, что присуще сульфоновым ингибиторам ЦОГ-2 и не повышают риск атерогенеза. ЦОГ-2-селективные препараты повышают риск возникновения сердечнососудистых тромботических осложнений. Улиц, применявших ибупрофен, отмечали на 38% более низкий риск развития болезни Паркинсона(GaoX. еtal., 2010).
Важно изучить побочные эффекти препарата и при длительном применении. Рандомизированное клиническое исследование, проведенное в Институте ревматологии РАМН, показало, что длительная терапия флурбипрофеном дозе 200 мг/сут в форме таблеток (по 100 мг 2 раза в сутки) у больных ОА (в основном гонартрозом) была эффективной, через 12 мес выраженность боли уменьшилась в 66% случаев, усилилась только в 7% и не изменилась — в 27%. По оценке врачей, состояние больных улучшилось в 44% случаев, ухудшилось — в 12% и не изменилось — в 44%. 70,5% больных завершили 12-месячный курс лечения. Флурбипрофен был отменен из-за побочных эффектов у 10 (16,4%) пациентов, из-за недостаточной эффективности — у 3 (4,9%). Частота гастропатии, подтвержденной эндоскопически, при 12-месячном наблюдении составила 6,6% (4 случая). В 70% случаев побочные эффекты (как со стороны ЖКТ, так и другие) развивались в течение первых 4 мес лечения. При наличии хорошего обезболивающего и противовоспалительного эффекта терапию флурбипрофеном можно продолжать в течение многих месяцев, не опасаясь ослабления лечебного действия. При этом эффективность и безопасность препарата у конкретного пациента врач может оценить за более короткий срок (1-3 мес). При хорошей переносимости в первые 3-4 мес более продолжительное (6-12 мес) применение флурбипрофена не сопровождалось существенным повышением риска осложнений со стороны ЖКТ (Каратеев Д.Е. и соавт., 1997).
Нами проведено исследование, цель которого — оценить эффективность, переносимость и безопасность препарата флурбипрофен при лечении пациентов с ОА коленных суставов II и III степени по Kellgren — Lawrence с болевым синдромом и симптомами воспаления. Наблюдались 26 больных первичным ОА. Из них 18женщин и 8 мужчин, возраст пациентов колебался от 46 до 78 лет, средний возраст пациентов составил 59 лет при средней длительности болезни 10 лет. Диагноз устанавливали в соответствии со стандартами диагностики и лечения ревматических заболеваний Американской коллегии ревматологов. Ни у одного из обследованных не установлен язвенный анамнез или хронический гастрит.
Другие сопутствующие заболевания: ишемическая болезнь сердца диагностирована у 12, артериальная гипертензия — у 10 пациентов. Не было ни одного пациента, перенесшего инфаркт миокарда.
Флурбипрофен (Мажезик-Сановель) назначали в дозе 200 мг/сут в форме таблеток (по 100 мг 2 раза всутки). Продолжительность лечения составляла от 7 дней до 3 нед. При усилении выраженности боли допускалось нерегулярное применение парацетамола в умеренных дозах в качестве дополнительного анальгетика. В соответствии с существующими рекомендациями больным назначали ингибиторы протонной помпы. В ходе лечения оценивали динамику следующих параметров: выраженность болевого синдрома с помощью анкеты ВАШ, определение альгофункционального состояния коленных суставов с помощью индекса Лекена, шкал Womac, выраженность синовита, активность воспаления по количеству С-реактивного белка, оценивали функцию печени по содержанию АлАТ и АсАТ.
До проведения терапии у всех пациентов был зафиксирован выраженный болевой синдром в суставах при движениях, утренняя скованность. Боль в покое отмечали 76,5% обследованных. Выраженное нарушение функции пораженных суставов отмечали 23 больных. У всех участников исследования отмечали явления синовита.
Динамика основных клинических показателей подтвердила анальгезирующее и противовоспалительное действие флурбипрофена. У 6 больных ОА II стадии заболевания и у 2 с ОА ІІІ стадии — болевой синдром был купирован на 2-е сутки после начала терапии. Все остальные пациенты отмечали уменьшение выраженности боли, явлений синовита, улучшение функции суставов чаще к 4-5-му дню терапии. У большинства участников ОА в течение первых 2 нед. лечения наступило улучшение. Эффективность была определена как очень хорошая у 10 больных, хорошая — у 14, удовлетворительная — у 2.
Установлено, что флурбипрофен хорошо переносится больными. По оценке участников исследования, переносимость была хорошая у 96,4%, у 3,6% — удовлетворительная. Ни в одном случае не возникло осложнений со стороны ЖКТ. Не отмечено аллергических реакций либо обострения других сопутствующих заболеваний. Ни одному больному не было необходимости корригировать антигипертензивную терапию.
Таким образом, флурбипрофен является эффективным и достаточно безопасным препаратом для лечения пациентов с ОА. Он обладает рядом положительных качеств, которые делают его весьма ценным препаратом именно при этой патологии: быстрый выраженный обезболивающий и противовоспалительный эффект, отсутствие отрицательного действия на хрящ, относительно низкая частота гастропатий и других нежелательных реакций, особенности фармакокинетики, делающие применение препарата у людей пожилого возраста более безопасным. Все это позволяет считать флурбипрофен одним из средств выбора лечения у пациентов с ОА. Он существенно уменьшает выраженность болевого синдрома и воспаления и, как следствие этого, повышает двигательную активность больного. Следовательно, он улучшает качество жизни больных ОА.
Список использованной литературы
Бабак О.Я., Біловол О.М., Чекман І.С. (ред.) (2008) клінічна фармакология: Підручник. Медицина, київ,768 с.
Бур’янов О.А. (2009) остеоартроз: питання патогенезу, диагностики та лікування. Здоров’я України, 23(228): 30-32.
Викторов А.П. (2009) Подводные камни терапии нестероидными противовоспалительными препаратами. Взгляд клинического фармаколога. Здоров’я України, 3: 67-68.
Казимирко В.К., Коваленко В.М., Флегонтова В.В. (2011) Инволюционный остеоартроз и остеопороз. Издатель Заславский А.Ю., Донецк, 724 с.
Каневская М.З., Чичасова Н.В., Френкель В.Е. и соавт. (1995) Флугалин при ревматоидном артрите по данным клинико-инструментального исследования. клин. ревматол., 2: 65-67.
Каратеев Д.Е. (1998) Применение флурбипрофена при остеоартрозе. клин. фармакол. и тер., 7(2): 87-92.
Каратеев Д.Е., Насонова В.А., Донован С.и др. (1997) длительное применение флюрбипрофена при ревматоидном артрите: 12-месячное контролируемое исследование. клин. ревматол., 1: 37-40.
Коваленко В.М. (2009) Ревматичні захворювання: сучасні тенденції фармакотерапії. Укр. ревматол. журн., 3(37): 5-11.
Коваленко В.М, Борткевич О.П. (2010) остеоартроз: Практ. руководство. МоРИон, киев, 592 с.
Коваленко В.М., Корнацький В.М. (2012) динамика стану здоров’я народу України та регіональні особливості (Аналітично-статистичний посібник). Киев, 211 с.
Насонов Е.Л. (1996) Противовоспалительная терапия ревматических болезней. М-сити, Москва, 345 с.
Насонова В.А. (2002) Рациональное применение нестероидных противовоспалительных препаратов в ревматологии. РМж, 6:302-306.
Насонова В.А. (1995) Производные пропионовой (акрилпро-пионовой) кислоты в ревматологии. клин. ревматология, 2: 60-64.
Саундерс С., Хиггинс К., Донован С. (1995) Флугалин (Флурбипрофен, Boots Pharmaceuticals): сравнительные критерии эффективности при классических ревматических болезнях клин. ревматол., 2: 50-56.
Сигидин Я.А. и др. (1988) лекарственная терапия воспалительного процесса: экспериментальная и клиническая фармакология противовоспалительных препаратов. Медицина, Москва, 240 с.
Сигидин Я.А., Муравьев Ю.В. (1988) лекарственная терапия воспалительного процесса: экспериментальная и клиническая фармакология противовоспалительных препаратов. Медицина, Москва, 240 с.
Шуба Н.М. (2006) Эффекты нПВП, не обусловленные ингибици-ей циклооксигеназы-2. Мистецтволікування, 9(35): 79-81.
Яременко О.Б. (2003) сучасна медикаментозна терапія остеоартрозу. Кур. ревматол. журн., 3(13): 24-32.
Ait ha l G.P., Rawlins M.D., Day Ch.P.(1999) Accuracy of hepatic adverse drug reaction reporting in one English health region. DMJ, 319:1541.
Altman R., Asch E., Bloch D. et al. (1986) Developement of criteria for the classification and reporting of osteoarthritis: classification of osteoarthritis of the knee. Arthritis Rheum., 29:1039-1049.
Ates M., Hamza M., Seidel K. etal. (2003) Intrathecally applied flurbiprofen produces an endocannabinoiddependent antinociception in the rat formalin test. Eur. J. Neurosci., 17(3): 597-604.
Bishay P., Schmidt H., Marian С et al. (2010) R-flurbiprofen reduces neuropathic pain in rodents by restoring endogenous cannabinoids. PLoS One.,13(5): e10628.
Blanco F.J., Lopez M.J., Maneiro E. (2004). Mitohondrial dysfunction in osteoarthritis. Rheumatologi, 4: 715-728.
De Lia J.E. et al. (1986) Am. J. Med., 80 (Suppl. 3A): 60-64.
GaoX. (2010) Аmerican Academy of Neurology 62nd Annual Meeting: Abstract 1347. Presented April 10-17.
Garcia RLA et al. (1994) Lancet, 343: 769-772.
GishenР. etal. (1995) Rheumatology in Europe, 24 (Suppl. 3): 331.
Kaiser D.G., Brooks C.D., LomenP.L(1986)Pharmacokinetics of flurbiprofen. Am. J. Med., 80 (3A): 10-15.
Panico M., Cardile V., Vittorio F. et al. (2003) Èditions scientifiques et medicales Elsevier SAS: www.sciencedirect.com
Quintero M. et al. (1996) Rheumatology in Europe, 25 (Suppl. 1):111.
Renes J., Donovan S., Higgins C., Saunders С (1995) Rheumatology in Europe, 24 (Suppl. 3): 222.
Richy F., Rabenda V., Mawet A., Reginster J.Y. (2007) Flurbiprofen in the symptomatic management of rheumatoid arthritis: a valuable alternative. Inter. J. Clin. Pract., 61(8): 1396-1406.
Seidel K., Hamza M., Ates M. etal. (2003) Flurbiprofen inhibits capsaicin induced calcitonin gene related peptide release from rat spinal cord via an endocannabinoid dependent mechanism. Neurosci Lett., 338(2): 99-102.
Smith R. etal. (1987) Flurbiprofen. In: Nonsteroidal antiinflammatory drugs. Mechanisms and clinical use. Eds Lewis A., Furst D. Marcel Deker: 393-418.
Stubbs D., Freman B. (1989) Curr. Ther. Res., 46(3): 11-28.
van den Berg W.B. (2000) Pathophisiology of osteoarthritis. J. Bone Spine, 67: 555-556.
Wu H., Chen Z., Sun G. et al. (2009) Intravenous flurbiprofen axetil can increase analgesic effect in refractory cancer pain. J. Exp. Clin. Cancer. Res., 28: 33.
ФЛУРБІПРОФЕН ПРИ ЛІКУВАНН1 ОСТЕОАРТРО3У
Т.С. Силантьєва, Г. П. Іванова,
Т.М. Костюченко, М.Ф. Полудненко,
О. П. Цуцаріна
резюме. У статті містяться дані про епідеміологію, основні клінічні прояви остеоартрозу. Наведено характеристику флурбіпрофену, його анальгезивний, протизапальний ефект, влив на хрящ, дані про частоту побічних ефектів. Наведено результати власних спостережень про вплив флурбіпрофену на симптоми остеоартрозу в пацієнтів із гонартрозом.
Ключові слова: остеоартроз, лікування, нестероїдні протизапальні препарати, флурбіпрофен.
Flurbipro Fen in the treatment oF osteoarthritis
Т.S. Silantieva, H.P. Ivanova,
T.M. Kostuchenko, M.F. Poludnenko,
Е.P. Cucazina
summary. This article provides information on the epidemiology, major clinical manifestations of osteoarthritis. The characteristic of flurbiprofen its analgesic and anti-inflammatory effects, effects on cartilage and information about the frequency of side effectsis given. In this article we provide the results of our own observations on the impact of flurbiprofen on symptoms of osteoarthritis in patients with gonarthrosis.
Key words: osteoarthritis, treatment, nonsteroidal anti-inflammatory drugs flurbiprofen.
адрес для переписки:
Силантьева Татьяна Сергеевна 04112, Киев, ул. Дорогожицкая, 9 Национальная медицинская академия последипломного образования им. П.Л.Шупика, информация для профессиональной деятельности медицинских и фармацевтических работников.
Мажезик-сановель
р.с. UA/10349/01/01 от 21.12.2009 г. состав: 1 таблетка, покрытая оболочкой, содержит флурбипрофена 100 мг. Фармакотерапевтическая группа. Нестероидные противовоспалительные препараты. Код атс. M01AE09. Фармакологические свойства.
Флурбипрофен — мощный нестероидный противовоспалительный препарат с аналь-гезирующими свойствами. Механизм его действия связан с выраженным ингибированием синтеза простагландинов за счет ингибирования фермента циклооксигеназы (ЦОГ 1-го и 2-го типа), что приводит к уменьшению выраженности воспаления, гиперемии, отека и боли. показания. Головная боль, зубная боль, невралгия, дисменорея, неотложная и долгосрочная симптоматическая терапия при ревматоидном артрите, остеоартрите, анкилозирующем спондилите, острый подагрический артрит, артралгия, артроз, люмбаго, острый радикулит, уменьшение выраженности боли и воспаления после хирургических вмешательств, в посттравматический период при травмах мягких тканей, в отоларингологии, стоматологии. побочные эффекты.
При применении в рекомендованных дозах могут развиться временные побочные эффекты легкой степени тяжести.
Со стороны желудочно-кишечного тракта: диспепсия, тошнота, рвота, диарея, гастропатия, абдоминальная боль, нарушение функции печени, при длительном применении — изъязвление слизистой оболочки, кровотечение; со стороны сердечно-сосудистой системы: повышение артериального давления, тахикардия, сердечная недостаточность; со стороны органов кроветворения: редко — анемия, агранулоцитоз, лейкопения; со стороны нервной системы: головная боль, головокружение, сонливость, астения, депрессия, амнезия, тремор, возбуждение; со стороны мочевыделительной системы: тубулоинтерстициальный нефрит, отечный синдром, нарушение функции почек; аллергические реакции: сыпь на коже, зуд, крапивница, бронхоспазм, фотосенсибилизация, отек Квинке, анафилактический шок; прочие: снижение слуха, усиление потоотделения.
Полная информация о лекарственном средстве содержится в инструкции по медицинскому применению.
Влияние селективных ингибиторов на циклические нуклеотидфосфодиэстеразы аорты кролика
В этом исследовании были фармакологически охарактеризованы три формы циклической нуклеотидфосфодиэстеразы (PDE), выделенные из аорты кролика, и последствия избирательного ингибирования кальмодулин-стимулированной PDE (CaM-PDE) и cGMP-специфической PDE (cG-PDE) оценивались с использованием ингибиторов PDE. . CG-PDE (F1) селективно ингибировался M&B 22948 (IC50 = 0.5 мкМ) и дипиридамола (IC50 = 7 мкМ). ЦАМФ-ФДЭ (цА-ФДЭ, F3) более эффективно ингибировался ингибитором цА-ФДЭ милриноном, чем другими ингибиторами ФДЭ. Препарат сА-ФДЭ, по-видимому, содержал как ФДЭ, ингибирующий цГ, так и нечувствительный к цГ ФДЭ на основании аддитивного ингибирования активности милриноном и SQ 65442, соответствующими ингибиторами этих ферментов. Винпоцетин, 8-метоксиметилизобутилметилксантин (8-MeOMeMIX) и M&B 22948 эффективно ингибировали CaM-PDE (F2). Винпоцетин был более селективным ингибитором CaM-PDE, чем M&B 22948 или 8-MeOMeMIX.CaM-PDE, выделенные из аорты кролика и головного мозга крупного рогатого скота, проявляли аналогичную чувствительность к этим ингибиторам. Семьдесят два процента цГМФ-гидролизирующей активности этого препарата CaM-PDE аорты кролика иммуноадсорбировались моноклональным антителом (ACC-1) против CaM, связанного с CaM-PDE мозга. Винпоцетин, 8-MeOMeMIX и M&B 22948 в концентрациях (30 и 100 мкМ), которые ингибируют CaM-PDE более чем на 60%, увеличивают уровни цГМФ, но не уровни цАМФ в предварительно инкубированных срезах аорты кролика с l-норэпинефрином (NE).В концентрациях, избирательно ингибирующих cG-PDE, дипиридамол и M&B 22948 повышали уровни cGMP в необработанных срезах, но не смогли значительно повысить уровни cGMP в срезах, обработанных NE. Напротив, винпоцетин не смог значительно увеличить цГМФ в необработанных срезах, хотя он увеличил уровни цГМФ в предварительно инкубированных срезах NE или KCl. Эти данные показывают, что в активированной (предварительно сокращенной) аорте СаМ-ФДЭ является основным ферментом, тогда как в необработанной аорте цГ-ФДЭ является преобладающим ферментом для гидролиза цГМФ.Это исследование также показывает полезность селективных ингибиторов для идентификации различных форм PDE и аналогичной лекарственной чувствительности и иммуноадсорбции CaM-PDE аорты и мозга моноклональными антителами.
Изоферментное селективное ингибирование стимулированных цГМФ циклических нуклеотид-фосфодиэстераз эритро-9- (2-гидрокси-3-нонил) аденином
https://doi.org/10.1016/0898-6568(95)00042-NGet права и содержаниеРеферат
Эритро-9- (2-гидрокси-3-нонил) аденин (EHNA), мощный ингибитор аденозиндезаминазы (ADA), был протестирован в качестве ингибитора растворимых изоферментов циклической нуклеотидной фосфодиэстеразы (PDE) свиньи и человека. миокард.Четыре растворимые активности PDE были выделены из экстрактов сосочковых мышц человека с помощью анионообменной хроматографии (DEAE-сефароза CL-6B). Эти виды деятельности были обозначены PDE I – IV согласно номенклатуре Биво. ФДЭ I стимулировали кальмодулином Ca 2+ , а ФДЭ II — цГМФ (1 мкМ). ФДЭ III ингибировалась цГМФ (1 мкМ), а также SK&F 94120, а ФДЭ IV как ролипрамом, так и Ro 20-1724. Кинетика ферментов и константы ингибирования были аналогичны изоферментам ФДЭ из сердца свиньи.Однако в миокарде свиньи отсутствует стимулируемая Ca 2+ -кальмодулин активность растворимого PDE I. Настоящие данные показывают, что EHNA оказывала зависимое от концентрации ингибирование cGMP-стимулированного PDE II (cGs-PDE) (ic 50 : 0,8 мкМ (человек), 2 мкМ (свинья)), но не ингибировала другие изоферменты PDE. (ic 50 > 100 мкМ). Эти данные указывают на то, что EHNA является мощным и, что касается цитозольных PDE, селективным ингибитором PDE, стимулированных cGMP. Соединение может быть использовано для рациональной разработки других селективных изоферментов ингибиторов PDE II и для исследования конкретных биологических функций cGs-PDE.EHNA может использоваться в системах, в которых ингибирование ADA не имеет значения. Напротив, двойное ингибирование как ADA, так и cGs-PDE с помощью EHNA может вызывать накопление двух ингибирующих метаболитов, аденозина и cGMP, которые могут действовать синергетически, опосредуя различные фармакологические реакции, включая противовирусные, противоопухолевые и антиаритмические эффекты.
Ключевые слова
Циклические нуклеотидные фосфодиэстеразы
ФДЭ, стимулированная цГМФ
Селективные ингибиторы изоцима
EHNA
Аритмии
Сокращения
EHNA-9-9-нон-2-денин-аденин-аденин-аденин-аденин-аденин--AHNA (аденозинаминогидролаза) [EC 3.5.4.4] PDEциклическая нуклеотидфосфодиэстераза [EC 3.1.4.17]
cGsPDE-cGMP-стимулированная PDE
ic 50 Концентрация ингибитора, обеспечивающая 50% ингибирование
Рекомендуемые статьи Цитирующие статьи (0)
Просмотреть полный текстАвторские права © 1995 Издано Elsevier Inc.
Рекомендуемые статьи
Цитирующие статьи
Селективное ингибирование разделенных форм циклической нуклеотидной фосфодиэстеразы тромбоцитов человека ингибиторами агрегации тромбоцитов
Abstract
Человеческие тромбоциты содержат три различных циклических нуклеотид-фосфодиэстеразы, которые катализируют гидролиз как циклических 3 ‘, 5′-АМФ, так и циклических 3′, 5’-GMP.Это относительно специфическая циклическая GMP-фосфодиэстераза (F I), циклическая нуклеотид-фосфодиэстераза (F II) и относительно специфическая циклическая AMP-фосфодиэстераза (F III). Это исследование было проведено для оценки возможности избирательного ингибирования этих трех форм фосфодиэстеразы различными ингибиторами агрегации тромбоцитов: папаверином, теофиллином, кофеином, EG 626, аденозином, 2-хлоаденозином и дипиридамолом. Селективное ингибирование было обнаружено, когда ингибирующие способности соединений сравнивали с помощью графиков Диксона.Все испытанные агенты, за исключением дипиридамола, показали относительно селективное ингибирование F III, и порядок действия этих препаратов в качестве ингибитора фермента F III был папаверином, EG 626, дипиридамолом, теофиллином, 2-хлоаденозином, кофеином и аденозином. EG 626 был в 30 раз более активным как ингибитор F III, чем F I. С другой стороны, дипиридамол был в 20 раз более эффективным как ингибитор F I, чем F III. Значения K и этих агентов для F I и F III были идентичны, независимо от того, использовался ли в качестве субстрата циклический AMP или циклический GMP.Однако эти соединения показали примерно в 2 раза большее сродство к F II при использовании циклического GMP, чем с циклическим AMP в качестве субстрата. Значения K и этих соединений для ингибирования гидролиза циклического АМФ с помощью F II снизились вдвое в присутствии 2 мкМ циклического GMP и, как было обнаружено, соответствуют значениям K и , полученным с использованием циклического GMP, как субстрат. Гидролиз циклического АМФ под действием F II стимулировался 0,1-10 мкМ циклическим GMP. Снижение значений K и в присутствии низкой концентрации циклического GMP может быть связано с влиянием циклического GMP на активный центр F II.
- Copyright © 1977 Академик Пресс, Inc.
Селективное ингибирование циклической нуклеотидфосфодиэстеразы типа 7 (PDE7): новый и эффективный подход к лечению болезни Паркинсона
Многообещающие результаты первоначального гранта :
Мы исследуем регуляторный фермент (циклическую нуклеотидфосфодиэстеразу 7-го типа, PDE7) в качестве новой терапевтической мишени для лечения болезни Паркинсона. Наши результаты на сегодняшний день показали, что ингибиторы PDE7 высокоэффективны в одной доклинической модели MPTP, но неэффективны в другой модели.В первой модели мы обнаружили, что ингибиторы PDE7 действуют путем усиления пути передачи сигналов D1, пути, который имеет терапевтическое значение для пациентов-людей. Однако, чтобы определить, является ли PDE7 допустимой клинической мишенью, нам необходимо понять причину наших отрицательных результатов во второй доклинической модели.
Цели дополнительного исследования :
Настоящее исследование исследует возможные причины наших отрицательных результатов во второй модели MPTP.Одна из гипотез состоит в том, что считывание, используемое во второй модели, не отвечает через дофаминергический путь D1, как те, которые используются в первой модели (что интересно, пациенты-люди действительно реагируют на агонисты D1). Таким образом, мы будем непосредственно тестировать эффекты агонистов D1 на оценки движений в этих моделях и сравнивать их с эффектами агонистов D2, а также L-допа.
Вторая гипотеза состоит в том, что длительное лечение MPTP этих доклинических моделей приводит к подавлению PDE7. Поэтому мы сравним уровни PDE7A и PDE7B в доклинических моделях необработанных и обработанных MPTP.
Менее вероятная гипотеза состоит в том, что наши соединения не смогли проникнуть через гематоэнцефалический барьер, несмотря на их эффективное проникновение в мозг грызунов. Поэтому мы будем непосредственно оценивать, достигают ли наши препараты достаточных уровней в мозге доклинических моделей, обработанных МРТР, для ингибирования PDE7.
Важность этого исследования для разработки новой терапии БП :
Мы считаем, что это исследование имеет двойную важность. Как отмечалось выше, понимание расходящихся результатов в двух наших моделях важно для того, чтобы определить, является ли PDE7 действительной мишенью при болезни Паркинсона.Поскольку ингибиторы PDE7 не являются дофаминергическими агонистами, а действуют вместо этого, усиливая эффекты эндогенного дофамина, они представляют возможность повышения безопасности и переносимости по сравнению с L-допа, что приводит к улучшению качества жизни пациентов.
Второй аспект относится к фармакологическим свойствам доклинических моделей моделей, которые обычно используются для тестирования кандидатов в лекарства. Обычное продвижение от доклинических моделей к пациенту предполагает, что все они одинаково реагируют на агенты, влияющие на передачу сигналов дофамина.Однако исследования, которые напрямую сравнивают две разные доклинические модели, часто отсутствуют. Настоящее исследование представляет собой такое прямое сравнение и, как мы надеемся, окажется полезным для других исследователей в этой области.
Влияние неселективных и селективных изоферментов циклических нуклеотидных ингибиторов фосфодиэстеразы на антиген-индуцированную экспрессию генов цитокинов в мононуклеарных клетках периферической крови.
Ферменты циклической нуклеотидфосфодиэстеразы (PDE) могут участвовать в регуляции воспалительной реакции посредством своего воздействия на вторичных мессенджеров.В настоящем исследовании мы исследовали роль неселективных и селективных изоферментов ингибиторов PDE в изменении антиген-управляемой экспрессии генов цитокинов мононуклеарных клеток периферической крови (PBMC) у лиц с атопией. В качестве модельных антигенов использовали амброзию и столбнячный анатоксин. Неселективный ингибитор PDE, 3-изобутил-1-метилксантин (IBMX), и селективный ингибитор PDE4, ролипрам, заметно подавляли экспрессию генов интерлейкина-5 (IL-5) и интерферона гамма (IFN гамма) в обеих системах, управляемых антигеном.Эти агенты не влияли на экспрессию генов IL-4 в системе, управляемой амброзией. Сообщение для IL-4 не может быть обнаружено в системе, управляемой столбнячным анатоксином, несмотря на использование количественного, конкурентного анализа полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР), чувствительного к менее чем 10 фг матрицы-мишени. Ингибитор PDE3, сигуазодан, был неэффективен в подавлении экспрессии генов исследуемых провоспалительных цитокинов; при использовании в комбинации с ингибитором PDE4 ингибитор PDE3 не давал увеличения эффективности по сравнению с эффектом, наблюдаемым с одним ингибитором PDE4.На экспрессию генов изоформ A и B PDE4 в PBMC не влияла стимуляция антигеном или обработка ингибитором PDE4; однако различия в экспрессии этих двух изоформ были очевидны при изучении различных линий иммунных клеток. Эти данные подтверждают гипотезу о том, что первичной противовоспалительной мишенью для ингибирования PDE в PBMC является PDE4. Кроме того, экспрессия различных изоформ этого фермента может различаться в зависимости от типа иммунных клеток. Наконец, экспрессия изоформы PDE4 в PBMC не зависит от лечения селективным ингибитором изоферментов.
KF31327, новый мощный и селективный ингибитор циклической нуклеотидфосфодиэстеразы 5
Abstract
Действие KF31327 (3-этил-8- [2- (4-гидроксиметилпиперидино) бензиламино] -2,3-дигидро- 1H-имидазо [4,5-g] хиназолин-2-тион дигидрохлорид) на активность фосфодиэстеразы 5 (циклической GMP-специфической фосфодиэстеразы) и агрегацию тромбоцитов были исследованы и сравнены с таковыми силденафила, хорошо известного ингибитора фосфодиэстеразы 5. KF31327 ингибировал фосфодиэстеразу 5 из трахеи собаки (K (i) = 0.16 нМ) более эффективен, чем силденафил (K (i) = 7,2 нМ). Кинетический анализ показал, что KF31327 был неконкурентным ингибитором. В присутствии нитроглицерина (генератор оксида азота) оба соединения ингибировали индуцированную коллагеном агрегацию тромбоцитов кролика на уровне менее 0,1 мкМ, увеличивая внутриклеточный уровень циклического GMP, не влияя на циклический AMP. Напротив, в отсутствие нитроглицерина более высокая концентрация (10 мкМ) KF31327 требовалась для ингибирования агрегации тромбоцитов и повышения уровней обоих циклических нуклеотидов.Однако 10 мкМ силденафила не влияли на агрегацию, несмотря на повышение циклического GMP, сравнимое с таковым в присутствии нитроглицерина. Эти результаты показывают, что в присутствии нитроглицерина ингибирование агрегации тромбоцитов с помощью KF31327 связано с повышением циклического GMP, что … Продолжить чтение
Ссылки
1 марта 1991 г. · Журнал сердечно-сосудистой фармакологии · R Bowen, RJ Haslam
1 января 1991 г. · Тенденции в фармакологических науках · CD NicholsonM Shahid
1 июля 1991 г. · Грудная клетка · TJ Torphy, BJ Undem
1 мая 1990 г. · Гипертония · RE WeishaarR Panek
1 апреля, 1990 · Тенденции в фармакологических науках · JA Beavo, DH Reifsnyder
1 января 1990 г. · Офтальмологические исследования · GM AclandG D Aguirre
6 ноября 1990 г. · Биохимия · HL TrongH Charbonneau
15 июня 1988 г. · Биохимическая фармакология · AW SimpsonT J Rink
15 сентября 1995 г. · Европейский журнал фармакологии · M MiyaharaT Nakano
1 августа 1996 г. · Британский журнал урологии · M BoolellM J Allen
1 апреля 1997 г. · Архив фармакологии Наунин-Шмидеберг · PJC привет J Sybertz
1 декабря 1996 г. · Сотовая сигнализация · M ItoT Nakano
1 августа 1997 г. · Шок · MK SlyM D Prager
16 апреля 1998 г. · Журнал биологической химии · IV TurkoJ D Corbin
23 мая , 1998 · Журнал урологии · SA BallardA M Naylor
21 июля 1998 г. · Европейский журнал фармакологии · CH LiaoC M Teng
17 марта 1999 г. · Американский журнал кардиологии · RM WallisP Ellis
29 сентября 2000 г. · Биохимическая фармакология · J KoteraK Omori
1 августа 1963 г. · Журнал физиологии · GV BORN, MJ CROSS
1 января 1995 г. · Тромбоциты · SB Sheth, RW Colman
Цитаты
27 июля 2005 г. · Архив фармакологических исследований · Кунг-Ву Намвунчон, 9 марта
, 5 сентября 2002 г. · Nature Reviews.Открытие лекарств · Дэвид П Ротелла
2 сентября 2008 г. · Химический и фармацевтический бюллетень · Нахоко Учияма Юкихиро Года
3 февраля 2009 г. · Химический и фармацевтический бюллетень · Такаши Хасэгава Нобуо Кавахара
17 ноября 2011 г. · Дизайн, разработка и терапия лекарств Amjad AlwaalSerge Carrier
22 мая 2008 г. · Заключение эксперта по исследуемым препаратам · Серап Гурвейн Дж. Г. Хеллстром
20 октября 2005 г. · Журнал фармакологии и экспериментальной терапии · Ронг-Джих ЛинИнг-Джун Чен
4 ноября 2020 г. · Европейский Heart Journal · Thomas MünzelSanjay Rajagopalan
3 сентября 2019 г. · Shokuhin eiseigaku zasshi.Журнал Японского общества гигиены пищевых продуктов · Михо СакамотоКоити Сайто
8 октября 2019 г. · Журнал физической химии. a · Xueli MuTao Liu
Фосфодиэстераза и циклическое аденозинмонофосфат-зависимое ингибирование хемотаксиса Т-лимфоцитов
Реферат
Имеется множество доказательств рекрутирования Т-лимфоцитов в дыхательные пути при аллергических воспалительных реакциях. Это исследование проверило гипотезу о том, что хемотаксис Т-клеток, индуцированный фактором активации тромбоцитов (PAF) и человеческим рекомбинантным интерлейкином-8 (hrIL-8), может быть ослаблен путем ингибирования активности фосфодиэстеразы и повышения внутриклеточного 3 ‘, 5’-циклического аденозина. уровни монофосфата (цАМФ).В этом исследовании использовали теофиллин, неселективный ингибитор фосфодиэстеразы (PDE), и ролипрам, селективный ингибитор PDE4, для изучения влияния ингибирования PDE на хемотаксис Т-клеток. Агонист бета2-адренорецепторов, сальбутамол, активатор аденилатциклазы, форсколин, и аналог цАМФ, дибутирил-цАМФ (db-цАМФ), были использованы для демонстрации роли повышенных уровней цАМФ. Т-клетки были получены от 10 атопических астматиков, и фенотип мигрирующих клеток исследовали с помощью проточной цитометрии. Теофиллин вызывал ингибирование как PAF-, так и hrIL-8-индуцированного хемотаксиса (среднее +/- SEM максимальное ингибирование при 1 мМ: 73 +/- 4% и 48 +/- 8% для hrIL-8 и PAF, соответственно), что было не специфичен для подмножеств CD4 +, CD8 +, CD45RO + или CD45RA + Т-клеток.Хемотаксис Т-клеток был более чувствителен к лечению ролипрамом, эффект которого уже был значительным, начиная с 0,1 мкМ, на хемотаксис, индуцированный hrIL-8. И низкая концентрация сальбутамола (0,1 мМ), и форсколина (10 мкМ) усиливали ингибирующий эффект низкой концентрации теофиллина (25 мкМ) на ответы на PAF, но не на hrIL-8. Наконец, хемотаксис Т-клеток также ингибировался db-цАМФ. Сделан вывод, что ослабление хемотаксиса Т-клеток по отношению к двум хемоаттрактантам, имеющим отношение к патогенезу астмы, может быть достигнуто за счет ингибирования фосфодиэстеразы и увеличения внутриклеточного 3 ‘, 5’-циклического монофосфата с использованием препаратов, активных в отношении циклической нуклеотидной фосфодиэстеразы.Это действие может объяснить противовоспалительное действие теофиллина и родственных ему лекарств при астме.
.
 , покр. пленочной оболочкой, 30 мг: 14, 28 или 56 шт.
, покр. пленочной оболочкой, 30 мг: 14, 28 или 56 шт. , покр. пленочной оболочкой, 60 мг: 7, 10, 14, 20, 28, 40 или 56 шт.
рег. №: ЛП-005756
от 28.08.19
, покр. пленочной оболочкой, 60 мг: 7, 10, 14, 20, 28, 40 или 56 шт.
рег. №: ЛП-005756
от 28.08.19
 , покр. пленочной оболочкой, 60 мг: 5, 10, 15, 20, 30 или 60 шт.
рег. №: ЛП-004896
от 25.06.18
Дата перерегистрации: 25.02.19
, покр. пленочной оболочкой, 60 мг: 5, 10, 15, 20, 30 или 60 шт.
рег. №: ЛП-004896
от 25.06.18
Дата перерегистрации: 25.02.19
 , покр. пленочной оболочкой, 30 мг: 7, 10, 14, 20, 21, 28, 30, 40, 42, 56, 90 или 100 шт.
рег. №: ЛП-006935
от 13.04.21
, покр. пленочной оболочкой, 30 мг: 7, 10, 14, 20, 21, 28, 30, 40, 42, 56, 90 или 100 шт.
рег. №: ЛП-006935
от 13.04.21
 , покр. пленочной оболочкой, 120 мг: 7, 10, 14, 20, 28, 30, 50, 56, 60, 84, 90, 98 или 100 шт.
рег. №: ЛП-004581
от 12.12.17
Дата перерегистрации: 18.09.19
, покр. пленочной оболочкой, 120 мг: 7, 10, 14, 20, 28, 30, 50, 56, 60, 84, 90, 98 или 100 шт.
рег. №: ЛП-004581
от 12.12.17
Дата перерегистрации: 18.09.19
 , покр. пленочной оболочкой, 60 мг: 7, 10, 14, 20, 28, 30, 50, 56, 60, 84, 90, 98 или 100 шт.
, покр. пленочной оболочкой, 60 мг: 7, 10, 14, 20, 28, 30, 50, 56, 60, 84, 90, 98 или 100 шт.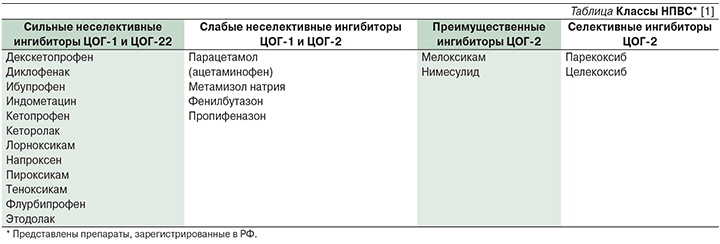 , покр. пленочной оболочкой, 30 мг: 7, 10, 14, 20, 21, 28, 30, 35, 40, 42, 50, 56, 60, 63, 70, 80, 84, 90, 112 или 126 шт.
, покр. пленочной оболочкой, 30 мг: 7, 10, 14, 20, 21, 28, 30, 35, 40, 42, 50, 56, 60, 63, 70, 80, 84, 90, 112 или 126 шт. , покр. пленочной оболочкой, 30 мг: 7 или 14 шт.
, покр. пленочной оболочкой, 30 мг: 7 или 14 шт.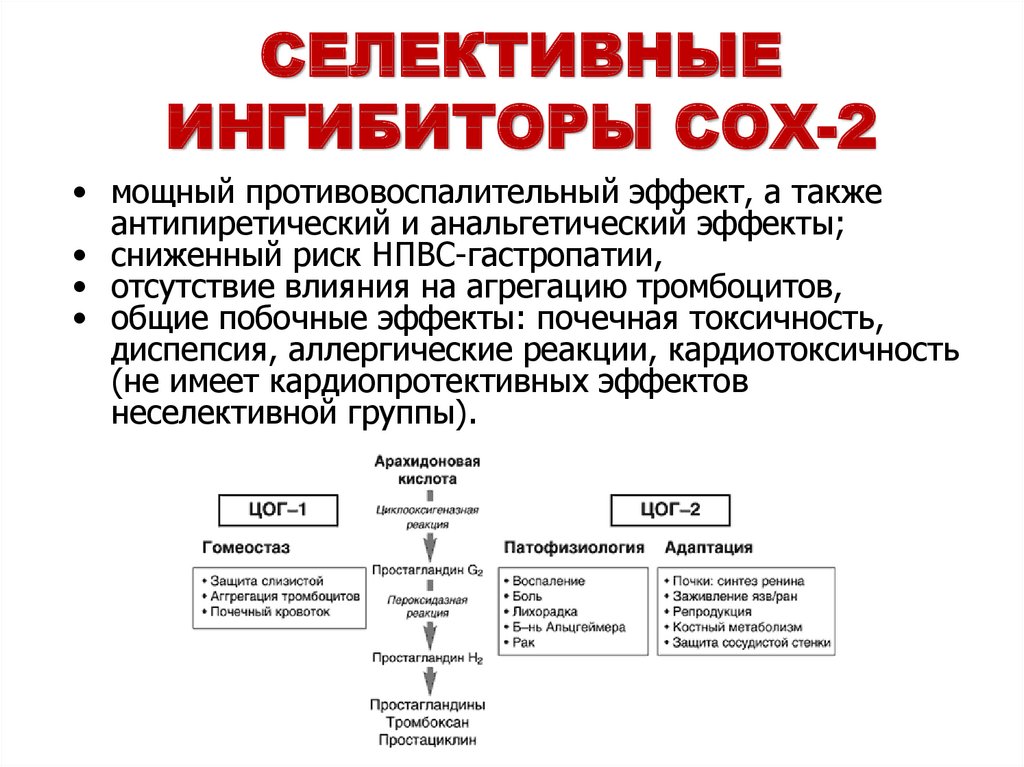 , покр. пленочной оболочкой, 30 мг: 2, 4, 7, 8, 14, 16, 20, 28, 30, 50, 56, 60, 84, 90, 98 или 100 шт.
, покр. пленочной оболочкой, 30 мг: 2, 4, 7, 8, 14, 16, 20, 28, 30, 50, 56, 60, 84, 90, 98 или 100 шт. , покр. пленочной оболочкой, 90 мг: 2, 4, 7, 8, 14, 16, 20, 28, 30, 50, 56, 60, 84, 90, 98 или 100 шт.
, покр. пленочной оболочкой, 90 мг: 2, 4, 7, 8, 14, 16, 20, 28, 30, 50, 56, 60, 84, 90, 98 или 100 шт. №: ЛП-005687
№: ЛП-005687
 , покр. пленочной оболочкой, 30 мг: 2, 4, 7, 8, 14, 16, 28, 42 или 140 шт.
, покр. пленочной оболочкой, 30 мг: 2, 4, 7, 8, 14, 16, 28, 42 или 140 шт. , покр. пленочной оболочкой, 30 мг: 7, 14, 28 или 56 шт.
, покр. пленочной оболочкой, 30 мг: 7, 14, 28 или 56 шт.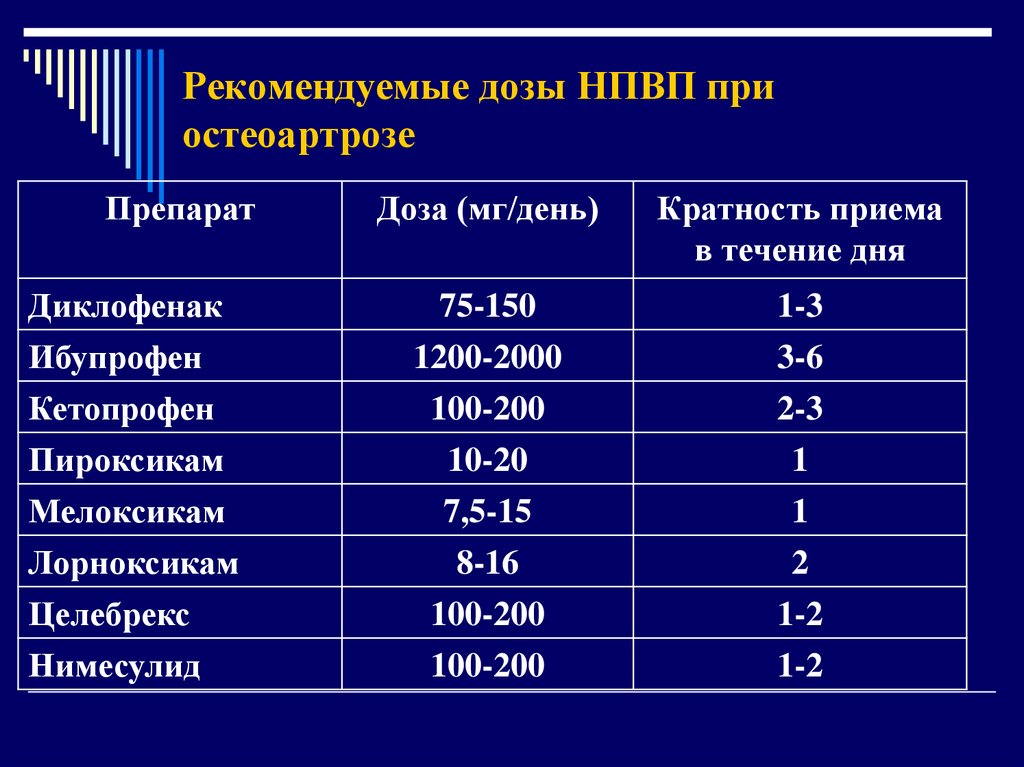 , покр. пленочной оболочкой, 60 мг: 7, 14 или 28 шт.
, покр. пленочной оболочкой, 60 мг: 7, 14 или 28 шт. , покр. пленочной оболочкой, 60 мг: 2, 4, 8, 10, 14, 16, 20, 24, 28, 40, 42, 56, 60 или 84 шт.
, покр. пленочной оболочкой, 60 мг: 2, 4, 8, 10, 14, 16, 20, 24, 28, 40, 42, 56, 60 или 84 шт. , покр. пленочной оболочкой, 60 мг: 7, 10, 14, 15, 28, 30, 56 или 60 шт.
, покр. пленочной оболочкой, 60 мг: 7, 10, 14, 15, 28, 30, 56 или 60 шт. , покр. пленочной оболочкой, 30 мг: 7, 14, 28 или 30 шт.
, покр. пленочной оболочкой, 30 мг: 7, 14, 28 или 30 шт. , покр. пленочной оболочкой, 30 мг: 7, 28, 56 или 98 шт
, покр. пленочной оболочкой, 30 мг: 7, 28, 56 или 98 шт