Саркома Юинга, лимфостаз. 18-летний отдаленный результат
В этой рубрике мы постоянно обновляем и публикуем непосредственные и отдаленные результаты лечения. Читайте, смотрите, анализируйте и делайте выводы!
2007 – №1
Больная С.О.С., 19 лет, житель Казахстана, в 1988 г. подвернула ногу. В местной травматологической больнице, сделав рентгенологический снимок, врач заверил: «ничего страшного – растяжение связок». Наложена тугая повязка. Отек и боль уменьшились, но не прошли полностью.
Больная беременна 4 месяца, наблюдалась у гинеколога, травматолога. Через 4 месяца после травмы появилась плотная опухоль на малоберцовой кости. Травматологом расценено как следствие длительной нагрузки на ногу.
В марте 1989 г. опухолевидное уплотнение, лимфостаз, боли начали увеличиваться. В мае, после очередного осмотра травматолога, больная прочла запись: «Оперативное лечение после родоразрешения». 16 июля 1989 г. родилась дочь, после чего больную снова направили на рентген.

Взяв билет на Украину в г. Суммы, больная посетила родственников – медработников, которые после консультации специалистов направили ее на консультацию в г. Киев. Но больная, вспомнив рекомендации цыганки, поехала в Донецкий ОЗО, где узнала точный адрес Н.П.Шматкова.
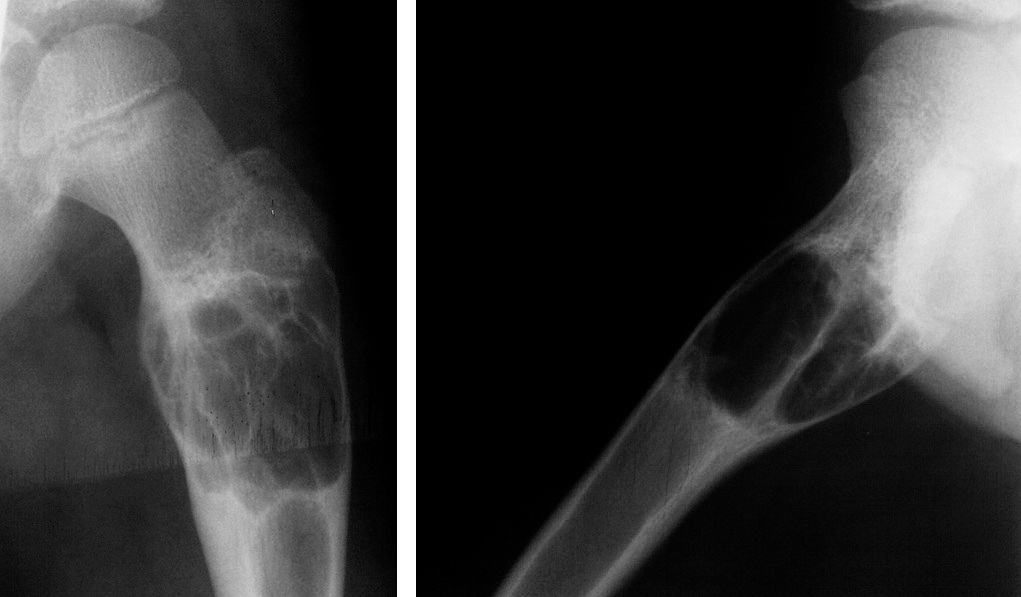
Объективно: при поступлении – правая голень отечная, больше в н/3, по наружной поверхности правой голени плотная, бугристая опухоль в центре с распадом и кровотечением (см. фото). На рентгенограмме опухолевидный конгломерат поражает малоберцовую кость (см. фото). Взята биопсия – гистологически: «Саркома Юинга».
3 октября 1989 г. оперирована в Центре лимфохирургии (согласно областной программы оказания лечебной помощи онкологическим больным с запущенными и прогрессирующими формами болезни (см. приказ от 10.05.1978 г.):
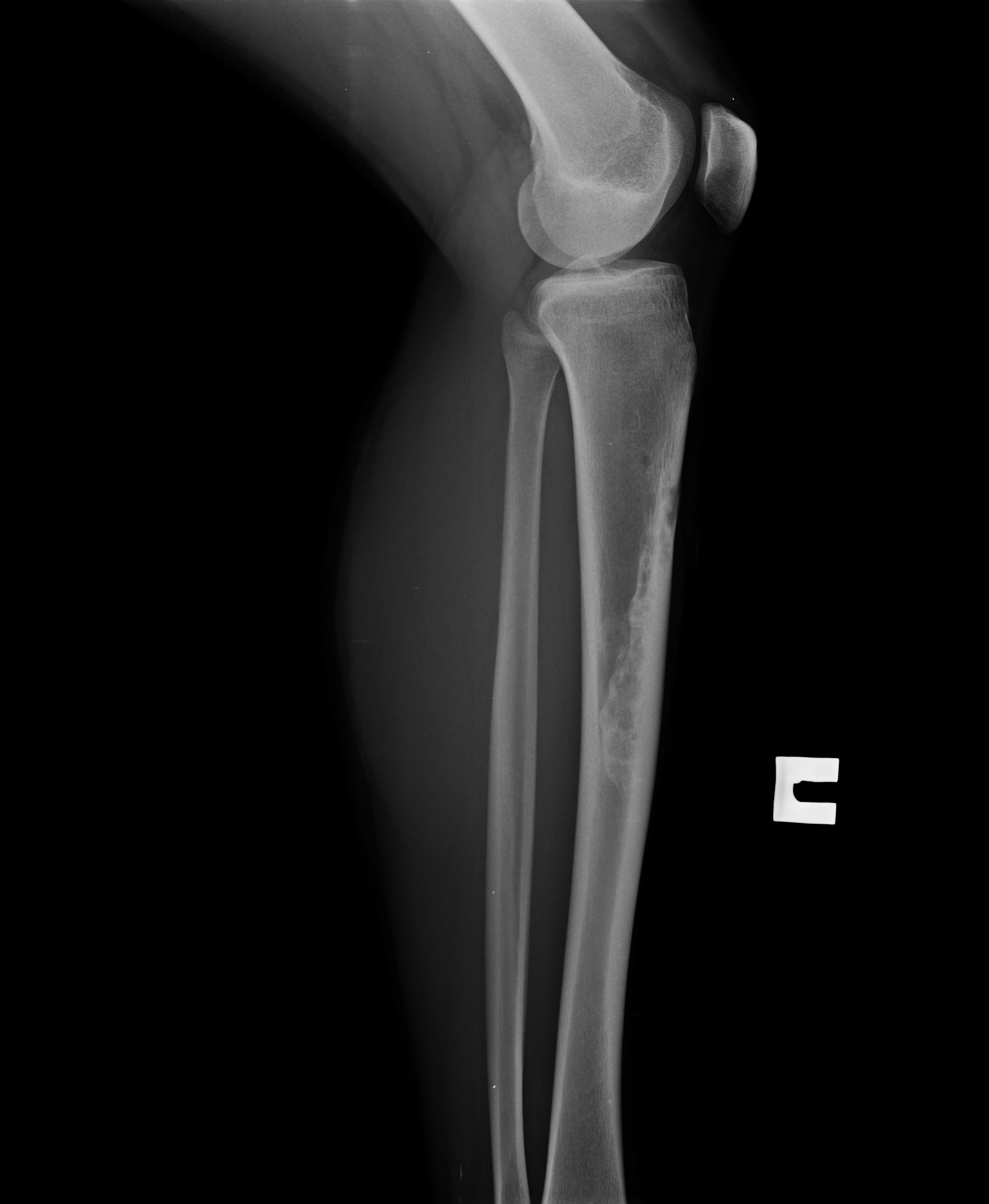 фото).
фото).2. Плазменная обработка раны и опухоли на большеберцовой кости.
3. Катетеризация 2-х лимфатических сосудов на правом бедре.
4. ЛВА на правом бедре.
Проведен послеоперационный курс ЭЛТ, на 10 сутки сняты швы. Рана зажила (см. фото). Больная приняла 1 курс профилактической телегамматерапии. Через 1,5 года, в 1991 г., мы получили письмо от больной с благодарностью: «У меня все хорошо. Вы вернули меня к жизни, подарив ее ещё раз, сохранив маму дочурке Олесе. Спасибо».
Дело вовсе не в группе инвалидности, и не в политике, а в величайшем счастье быть здоровой и радоваться своей жизнью и жизнью дочери, внучки!
Центр лимфохирургии и дальше будет поддерживать связь с бывшими больными, лечить нуждающихся независимо от политических границ и человеческой зависти!
До лечения в ЛЦШ (1989 г.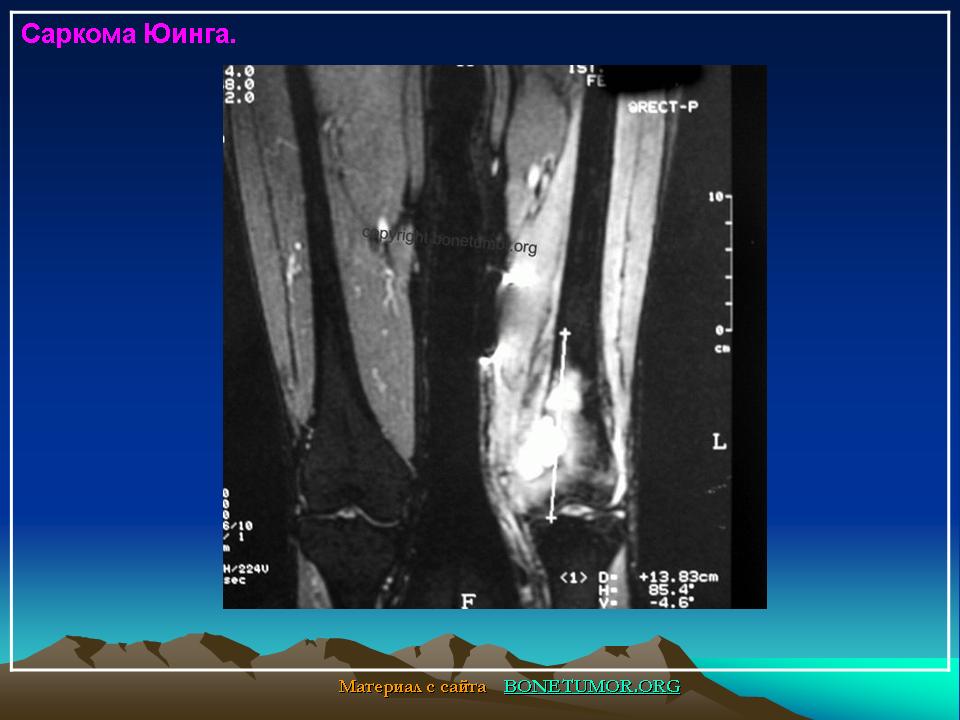 )
)
После лечения в ЛЦШ (1989 г.)
Через 18 лет после лечения в ЛЦШ (2007 г.)
Смотрите так же: Инфовест №13 – Лимфедема с лимфовенозной недостаточностью правой нижней конечности при рецидивном раке мочевого пузыря
Россиянин лишился половины лица из-за 8-сантиметровой опухоли: Общество: Россия: Lenta.ru
Врачи онкологического отделения №2 «Медицинского города» удалили мужчине злокачественную опухоль 8-10 сантиметров вместе с верхней челюстью. Об этом сообщила пресс-служба департамента здравоохранения Тюменской области в своей группе во «ВКонтакте».
У пациента обнаружили саркому верхней челюсти еще в прошлом году. Процесс удаления образования усложнили размеры опухоли. Как сообщает пресс-служба, при таком объеме опухоли операция невозможна. Поэтому онкологи провели сначала курс химиотерапии. Это способствовало уменьшению размера опухоли и позволило хирургическое вмешательство.
По словам заведующей онкологическим отделением №2 «Медицинского города» Юлии Шубиной, хирурги удалили опухоль вместе с левой частью верхней челюсти. Это возможно, так как верхняя челюсть неподвижная и сращена с лицевыми костями.
Это возможно, так как верхняя челюсть неподвижная и сращена с лицевыми костями.
У пациента удалили фактически половину лица — «всю стенку щеки, нижнюю стенку глазной орбиты, часть скуловой кости, носовые кости, десна, твердое и мягкое небо во рту». Как отметила Шубина, удаленный участок лица очень большой, поэтому необходима сложная пластика. Если пораженные участки закрыть лишь кожей, на лице будет огромных размеров впадина и произойдет смещение глаза.
«Нам же было важно удалить раковую опухоль, сохранив при этом жизненно важные функции – дыхание, жевание, глотание, речь», — рассказала Шубина.
Такую сложную операцию по протезированию верхней челюсти с саркомой в Тюменской области проводили впервые. В комплексе хирургических вмешательств участвовали пять врачей. Они провели реконструкцию челюстно-лицевого скелета с заменой пораженной области на ткани кости голени, взятые у пациента. При операции использовали индивидуальную титановую модель, повторяющую черты здорового лица пациента.
Ранее врачи Санкт-Петербурга и Тюмени восстановили пациенту лицо, которое было повреждено в области глаз из-за агрессивной опухоли. Злокачественное образование разрушило лицевые кости и проросло к черепу.
Истории без цензуры и запретов — в «Ленте дна» в Telegram
Childhood Synovial Sarcoma | Интернет-издание «Новости медицины и фармации»
В онкопедиатрии синовиальная саркома встречается сравнительно редко [1, 2, 4, 6]. Данная опухоль занимает третье место после рабдомиосаркомы и ангиосаркомы среди всех сарком мягких тканей у детей [1, 7, 9]. Синовиальная саркома является мезенхимальной веретеноклеточной опухолью с возможным присутствием тканевого компонента с эпителиальной дифференцировкой, включая формирование железистых структур, а также с наличием специфической хромосомной транслокации t (x 18) (p 11 q II) [2–5, 8]. Локализация синовиальной саркомы в мягких тканях конечностей достигает 60–80 %, в меньшей степени эти опухоли встречаются в области головы и шеи, туловища, в забрюшинном пространстве [2, 4, 5]. Описаны случаи наблюдения синовиальной саркомы в средостении, коже, а также в висцеральных органах: печени, кишечнике, почках, сердце, пищеводе, желудке. Возможна и внутрикостная локализация [4, 5].
Локализация синовиальной саркомы в мягких тканях конечностей достигает 60–80 %, в меньшей степени эти опухоли встречаются в области головы и шеи, туловища, в забрюшинном пространстве [2, 4, 5]. Описаны случаи наблюдения синовиальной саркомы в средостении, коже, а также в висцеральных органах: печени, кишечнике, почках, сердце, пищеводе, желудке. Возможна и внутрикостная локализация [4, 5].
Вопреки своему названию синовиальная саркома не исходит из синовиальной ткани, хотя длительное время считалось, что синовиальная саркома возникает именно из синовиальной оболочки суставов, сухожилий и фасций [1, 2, 4, 8]. На сегодняшний день синовиальная саркома в международной классификации опухолей мягких тканей и костей Всемирной организации здравоохранения (2002) фигурирует в группе опухолей с неясной тканевой дифференцировкой [1, 2].
Для больных синовиальной саркомой характерен высокий риск развития рецидивов и возникновения метастазов в легких, костях, плевре, периферических лимфоузлах, который может достигать 60 %. Пятилетняя выживаемость колеблется от 15 до 71 % в зависимости от уровня злокачественности опухоли. По мнению ряда авторов, бифазный гистологический субтип синовиальной саркомы более благоприятен, чем монофазный [3, 6].
Пятилетняя выживаемость колеблется от 15 до 71 % в зависимости от уровня злокачественности опухоли. По мнению ряда авторов, бифазный гистологический субтип синовиальной саркомы более благоприятен, чем монофазный [3, 6].
До операции диагноз синовиальной саркомы выставить чрезвычайно трудно, что обусловлено не только редкостью этой патологии, но и отсутствием каких-либо специфических клинических, лабораторных и выявляемых дополнительными методами (ультразвуковое исследование (УЗИ), компьютерная томография (КТ), радионуклидное исследование) признаков. Обычно предполагают наличие десмоидной фибромы, фибролипомы, реже — фибросаркомы. При поражении костей — остеогенной саркомы или хронического остеомиелита.
В клинике детской хирургии им. проф. Н.Л. Куща за 30-летний период (2005–2014 гг.) по поводу синовиальной саркомы лечилось 16 детей в возрасте от 1 г. 3 мес. до 16 лет. Пациентов женского пола было 10 (62,5 %), мужского — 6 (37,5 %). В возрасте до 4 лет поступило 3 детей, от 5 до 8 лет — 3, от 9 до 12 лет — 5, от 13 до 16 лет — 5. Наши данные не подтверждают данные литературы о некотором преобладании пациентов мужского пола [1, 4, 7].
Наши данные не подтверждают данные литературы о некотором преобладании пациентов мужского пола [1, 4, 7].
В предоперационном периоде, помимо общеклинических и биохимических исследований, также было произведено УЗИ, КТ, магнитно-резонансная томография, пункционная или открытая биопсия опухоли. После верификации диагноза проводились курсы химиотерапии, иногда в сочетании с лучевой терапией.
Клинические проявления синовиальной саркомы определялись локализацией и размерами новообразования. Симптомы появлялись по мере роста опухоли, поэтому на ранних стадиях синовиальная саркома чаще характеризовалась бессимптомным течением. Обычно чувство дискомфорта в зоне очага появлялось одновременно с появлением пальпируемого образования. С течением времени появлялся нарастающий болевой синдром, который имел место у 10 наблюдаемых нами больных. Давность заболевания варьировала от нескольких недель до 3–4 месяцев.
Общие (паранеобластические) симптомы интоксикации отмечены у половины больных (8 детей): повышенная утомляемость, снижение аппетита, слабость, потеря массы тела, периодические подъемы температуры. У 4 детей в анамнезе имела место травма (падение, удар кулаком и др.), 3 детей до госпитализации получали лечение по поводу предполагаемого неврита, артрита, миозита.
У 4 детей в анамнезе имела место травма (падение, удар кулаком и др.), 3 детей до госпитализации получали лечение по поводу предполагаемого неврита, артрита, миозита.
Поражение мягких тканей предплечья было выявлено у 3 детей, бедра — у 2, голени — у 2, поясничной области — у 1, височной области — у 1, надлобковой области — у 1. Наряду с мягкотканным компонентом у 4 (25 %) детей было выявлено поражение костей. В том числе бедренная кость была поражена у 2 детей, большеберцовая кость — у 1, малоберцовая — у 1 ребенка. Случаев висцеральных поражений синовиальной саркомы у наших пациентов не наблюдали.
Приводим наши отдельные наблюдения.
Ребенок С., 16 лет, история болезни № 874, поступил в клинику детской хирургии 23.01.2008 с жалобами на боли и увеличение правого бедра в объеме. Болеет с ноября 2007 г., когда появились вышеперечисленные жалобы. С течением времени болевой синдром усилился ночью, увеличился объем бедра. В январе 2008 года больная консультирована у травматолога, с диагнозом «опухоль правого бедра» направлена в клинику.
При поступлении общее состояние тяжелое. Тяжесть обусловлена основным заболеванием, болевым синдромом. Явления опухолевой интоксикации не выражены. Кожные покровы и видимые слизистые бледные, чистые. Со стороны внутренних органов без патологии.
Местно — средняя треть правого бедра увеличена в объеме, отечна, уплотнена, с наличием венозного рисунка. Движения умеренно болезненные, ротационная подвижность не в полном объеме. При пальпации отмечается незначительная болезненность мягких тканей, больше по передней поверхности.
Рентгенография костей правого бедра: практически вся средняя треть правого бедра представлена опухолью, которая в виде муфты охватывает бедренную кость.
25.01.2008 — открытая биопсия опухоли правого бедра, кожно-мышечного лоскута, надкостницы, кости. Разрез кожи по передненаружной поверхности правого бедра длиной до 4,5 см с биопсией участка кожно-фасциального лоскута. Гемостаз. Верхние слои мышцы отечные. Участок мышцы взят на исследование.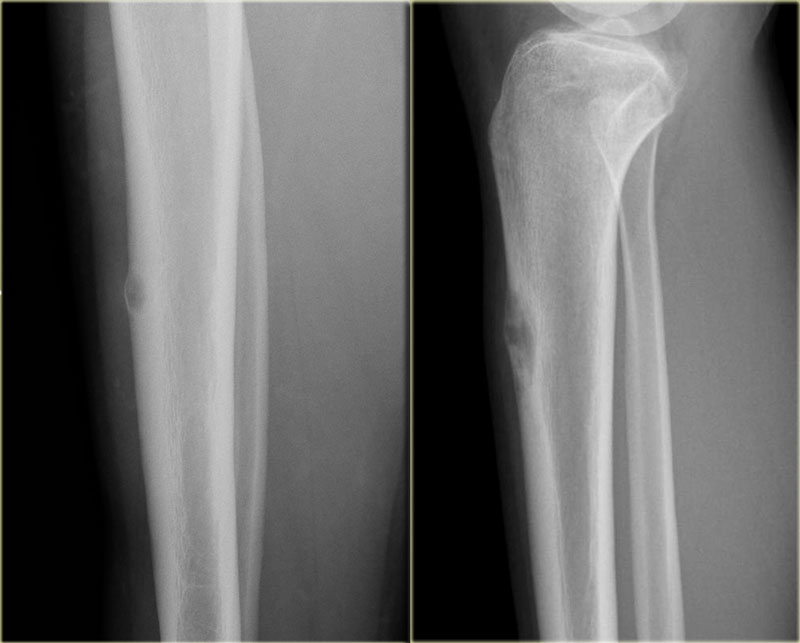 Мышцы разведены до кости. В глубине определяется опухолевая ткань сероватого цвета, местами с распадом. Опухоль связана с надкостницей. Произведена биопсия опухолевой ткани и надкостницы, частично с участками кортикального слоя. При осмотре выявлено, что мышечный массив ближе к бедренной кости полностью поражен опухолевым процессом. Рана ушита послойно до резинового пластинчатого дренажа. Туалет. Асептическая повязка.
Мышцы разведены до кости. В глубине определяется опухолевая ткань сероватого цвета, местами с распадом. Опухоль связана с надкостницей. Произведена биопсия опухолевой ткани и надкостницы, частично с участками кортикального слоя. При осмотре выявлено, что мышечный массив ближе к бедренной кости полностью поражен опухолевым процессом. Рана ушита послойно до резинового пластинчатого дренажа. Туалет. Асептическая повязка.
Гистологическое заключение № 664-683 от 29.01.08: синовиальная саркома кости и мягких тканей. Послеоперационный период протекал без осложнений, швы сняты на 11-е сутки после операции, рана зажила первичным натяжением.
Проведен курс паллиативной химиотерапии (ПХТ) (карбоплатин, винкристин, циклофосфан, доксорубицин). Консультирована в Национальном институте рака (НИР) г. Киева, диагноз подтвержден. Проводились курсы полихимиотерапии согласно протоколу, отмечено улучшение. Однако в 2009 г. развился патологический перелом бедренной кости в зоне основного очага.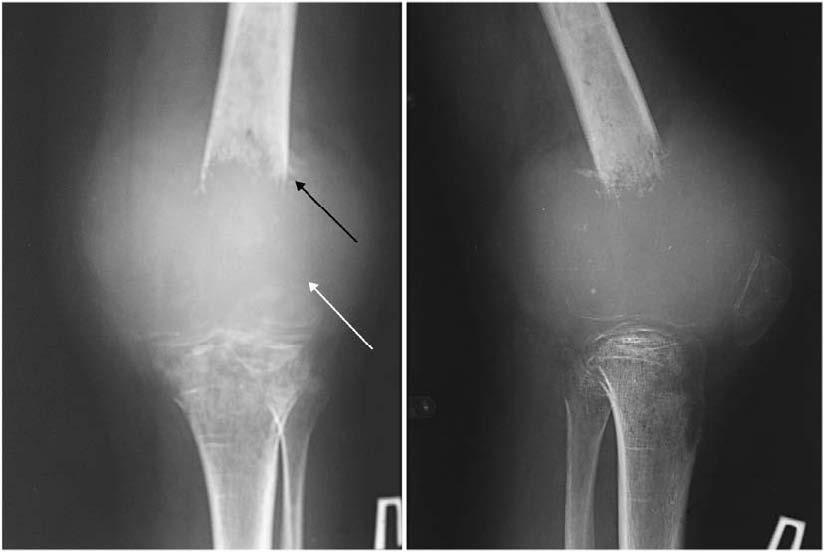 Проводилась иммобилизация. После срастания перелома консультирована и обследована в НИР г. Киева. Диагностирован солитарный метастаз легкого. После курса полихимиотерапии была произведена торакотомия, лобэктомия с опухолью. Послеоперационный период протекал гладко. Рана зажила первичным натяжением, швы сняты. Еще в течение 4 месяцев получала курсы полихимиотерапии. Осмотрена через 1, 2, 6 месяцев. Жалоб нет. Здорова.
Проводилась иммобилизация. После срастания перелома консультирована и обследована в НИР г. Киева. Диагностирован солитарный метастаз легкого. После курса полихимиотерапии была произведена торакотомия, лобэктомия с опухолью. Послеоперационный период протекал гладко. Рана зажила первичным натяжением, швы сняты. Еще в течение 4 месяцев получала курсы полихимиотерапии. Осмотрена через 1, 2, 6 месяцев. Жалоб нет. Здорова.
В 2013 году вышла замуж, родила здорового ребенка.
Ребенок А., 1 год 3 месяца, история болезни № 4269, поступил в клинику детской хирургии 06.04.2010 с жалобами родителей на наличие опухолевидного образования в области правого предплечья, которое заметили за 2 недели до поступления. Заподозрена десмоидная фиброма.
При поступлении общее состояние средней тяжести. Ребенок в сознании, на осмотр реагирует адекватно. Кожные покровы бледно-розовые, чистые, сухие. Видимые слизистые обычной окраски. Со стороны костно-мышечной системы — без особенностей. В легких дыхание везикулярное, слева — несколько ослаблено, хрипов нет. Тоны сердца приглушены. Живот правильной формы, симметричный, участвует в акте дыхания. При пальпации мягкий во всех отделах. Печень +1 см. Почки, селезенка не пальпируются. Стул и мочеиспускания не нарушены.
Тоны сердца приглушены. Живот правильной формы, симметричный, участвует в акте дыхания. При пальпации мягкий во всех отделах. Печень +1 см. Почки, селезенка не пальпируются. Стул и мочеиспускания не нарушены.
Местно — в области верхней трети правого предплечья, по ладонной поверхности, определяется опухолевидное образование 3,0 × 4,0 см, плотной консистенции, безболезненное, кожа над ним не изменена.
Дополнительные методы исследования. Сонографически в области верхней трети правого предплечья по его внутренней поверхности визуализируется гетерогенное образование неправильной округлой формы, с четкими границами 3,2 × 4,0 см. Структура образования неоднородная. Кожа над образованием не изменена. Подкожная клетчатка гипоэхогенная, однородная. При проведении допплерографии дополнительных патологических потоков не обнаружено. Окружающие ткани не изменены. Эхографические признаки фибромиомы.
На рентгенографии правого предплечья костно-деструктивных изменений не выявлено.
Выставлен диагноз «десмоидная фиброма (фибросаркома?) верхней трети правого предплечья».
08.04.2010 произведена операция — удаление опухолевидного образования правого предплечья (хирург — к.мед.н. Литовка В.К.). Разрез кожи в верхней трети правого предплечья по передней поверхности до 5,0 см, над пальпируемым опухолевидным образованием. Гемостаз. Рассечена поверхностная фасция. Тупым и острым путем выделено опухолевидное образование 4,0 × 3,0 × 2,5 см в тонкостенной капсуле, белесовато-серого цвета. Образование уходит в межкостное пространство, интимно спаяно с сухожилием сгибателя пальцев и мышечным массивом. Тупым и острым путем опухоль удалена в пределах видимых здоровых тканей. Гемостаз. В ложе опухоли установлен пластинчатый резиновый дренаж. Рана послойно ушита до дренажа. Туалет. Асептическая повязка.
Гистологическое заключение № 2386-2393: двухфазная синовиальная саркома с выраженным инфильтративным ростом, возможно на фоне предшествующей десмопластической фибромы.
Послеоперационный период протекал без осложнений. Швы сняты на 8-е сутки. Консультирован в НИР г. Киева: рекомендовано дообследование, проведение ПХТ по месту жительства.
Ребенку проведен курс послеоперационной полихимиотерапии по протоколу EpSSaNRST2005. Лечение переносил удовлетворительно. В связи с локальным метастазом в октябре 2010 года ребенок повторно прооперирован в НИР г. Киева. В последующем проводились курсы полихимиотерапии ежемесячно, согласно протоколу.
В июле 2011 года метрономная терапия завершена. При УЗИ места болезни объемных образований не выявлено. Осмотрен в ноябре 2014 г., данных за рецидив, метастазы нет. Здоров.
Среди наблюдаемых нами больных с синовиальной саркомой умерло 4 (25 %) на фоне диссеминации и генерализации опухолевого процесса.
Одному ребенку вынужденно была произведена ампутация правого предплечья, так как на фоне прогрессирования основного заболевания развился лизис лучевой кости с угрозой развития флегмоны предплечья. После ампутации прошло 10 лет. Данных за метастазы нет. Здоров. Носит протез.
После ампутации прошло 10 лет. Данных за метастазы нет. Здоров. Носит протез.
Трое детей получают курсы полихимиотерапии. Судьбу одного ребенка установить не удалось в связи с переменой места жительства.
Выводы
1. Синовиальная саркома у детей встречается сравнительно редко.
2. У 25 % больных с синовиальной саркомой определяется поражение костей.
3. Лечение синовиальной саркомы комплексное, включает радикальную операцию (при невозможности — биопсию) с последующей химиолучевой терапией.
Саркома Капоши — Заболевания — Медкомпас
Саркома Капоши является множественным злокачественным онкологическим процессом, который поражает кожу. В популяции распространенность этого заболевания незначительна. Однако его встречаемость существенно возрастает у ВИЧ-инфицированных пациентов, достигая 40-60%.
Симптомы болезни
Клинический вариант саркомы Капоши определяет симптомы, которыми проявляется это заболевание. Принято выделять следующие типы:
- Дермальный – встречается чаще всего и характеризуется поражением кожи
- Поражение слизистых оболочек
- Поражение лимфатической системы
- Поражение внутренних органов (либо легкие, либо органы пищеварительной системы).

Классическими проявлениями саркомы Капоши являются:
- Чаще всего поражения затрагивают стопы и кисти, а также голень (боковые поверхности)
- Кожные высыпания имеют четкие границы
- Субъективно кожные поражения обычно никак себя не проявляют, только изредка могут ощущаться зуд и жжение.
Высыпания проходят несколько стадий:
- Пятнистая – появляются пятна красного или синюшного цвета, диаметр которых от 1 до 5 мм
- Папулезная – высыпания возвышаются над уровнем кожи, при этом они могут сливаться в бляшки различного размера
- Опухолевая – папулы сливаются и увеличиваются, образуя узлы, которые склонны к изъязвлению.
Причины болезни
Заболевание является идиопатическим. Оно связано с вирусом герпеса, относящимся к 8-му типу. Выделяют предрасполагающие факторы, которые повышают вероятность инфицирования этим вирусом:
- Инфицированность вирусом герпеса
- Снижение иммунитета на фоне ВИЧ инфекции
- Люди, находящиеся на иммуносупрессивной терапии после пересадки органов
- Жители экваториальной Африки.

Герпетическая инфекция 8-го типа может передаваться через:
- Кровь
- Слюну
- Половым путем.
Диагностика
Диагностический поиск при подозрении на саркому Капоши включает в себя проведение следующих исследований:
- Капилляроскопия, которая позволяет определить характер распространения сосудов в патологических очагах
- Ультразвуковое исследование лимфатических узлов
- Рентгенологическое исследование органов грудной клетки
- Эндоскопическое исследование желудочно-кишечного тракта
- Определение состояния иммунитета (клеточного и гуморального).
Окончательный диагноз саркомы Капоши выставляется на основании результатов гистологического исследования.
Осложнения
Развитие осложнений саркомы Капоши зависит от стадии болезни и места поражения. К осложнениям относятся следующие:
- Контрактуры, проявляющиеся ограниченными движениями в конечностях
- Деформация рук или ног
- Раковая интоксикация
- Кровотечения различной локализации
- Снижение зрения или его полная потеря при поражении глаз и т.
 д.
д.
Лечение болезни
Лечением саркомы Капоши занимается либо инфекционист, либо дерматолог. Оно может быть:
- Местным
- Системным.
Местная терапия заключается в следующем:
- Облучение поражений
- Химиотерапевтические средства, которые вводятся непосредственно в высыпания
- Инъекционное введение в опухолевые очаги интерферона, повышающего местный иммунитет.
Системное лечение подразумевает проведение иммунотерапии рекомбинанатными интерферонами. Это помогает организму быстрее и эффективнее справиться с герпетической инфекцией.
Саркома Юинга и саркома Капоши
Саркомой называется группа злокачественных опухолей, возникающих из соединительной ткани. Видов заболевания существует значительное количество, но все они отличаются высокой агрессивностью и быстрым распространением по организму. Избавиться или остановить рост ракового поражения возможно только при использовании современных методов лечения. Клиники Израиля обеспечивают большой процент излечения, в том числе от сарком Юинга и Капоши. Пациенты не становятся инвалидами, если вовремя проведен индивидуальный курс лечения.
Клиники Израиля обеспечивают большой процент излечения, в том числе от сарком Юинга и Капоши. Пациенты не становятся инвалидами, если вовремя проведен индивидуальный курс лечения.
Кратко о болезни
Возникая из соединительных клеточных структур, раковые клетки распространяются на окружающие ткани. Несмотря на небольшой процент (5%) ко всем онкологическим заболеваниям, саркома может привести к быстрому летальному исходу. Болезнь чаще диагностируется у пациентов мужского пола, в детском, юношеском возрасте. Этимология саркомы до конца не изучена, но считается важным фактором присутствие отрицательной наследственности и онкологических заболеваний у родственников.
В начальных стадиях поражение выглядит как припухлость, постепенно увеличивается в размерах и причиняет все большие неудобства больному. Нередко первичные стадии принимаются пациентами за последствия удара, другой травмы или вывиха сустава. Только обратившись к травматологу, можно установить недуг на ранних стадиях, когда пациент еще может передвигаться, но уже испытывает сильные боли.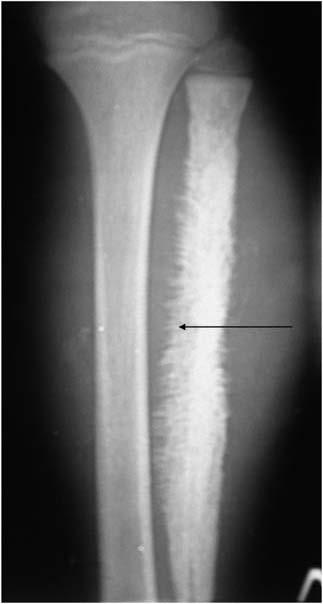 Затем раковые клетки отрываются от основного очага и распространяются по всему организму, провоцируя вторичный рак.
Затем раковые клетки отрываются от основного очага и распространяются по всему организму, провоцируя вторичный рак.
Симптомы и признаки саркомы Юинга и саркомы Капоши
У каждого человека могут случиться различные повреждения и доброкачественные образования. Об онкологии мягких тканей следует задуматься в следующих случаях:
- увеличивающееся образование, размер более 5 см;
- глубокое расположение, нечеткие границы;
- при пальпации вызывает боль, со временем сильную;
- характерна общая интоксикация организма больного, постоянная температура, снижение веса.
Кроме видимых признаков, у каждой разновидности могут быть свои особенности. Например, первыми симптомами саркомы Капоши являются яркие пятна на коже в различных местах, которые постепенно переходят в разряд округлых дисков. Симптомом саркомы Юинга, которая чаще поражает трубчатые кости, становится сильная боль, нарастающая в ночное время, в покое. Боли не проходят круглосуточно, движение становится невозможным, поэтому больной вынужден обратиться за медицинской помощью, где и ставят онкологический диагноз.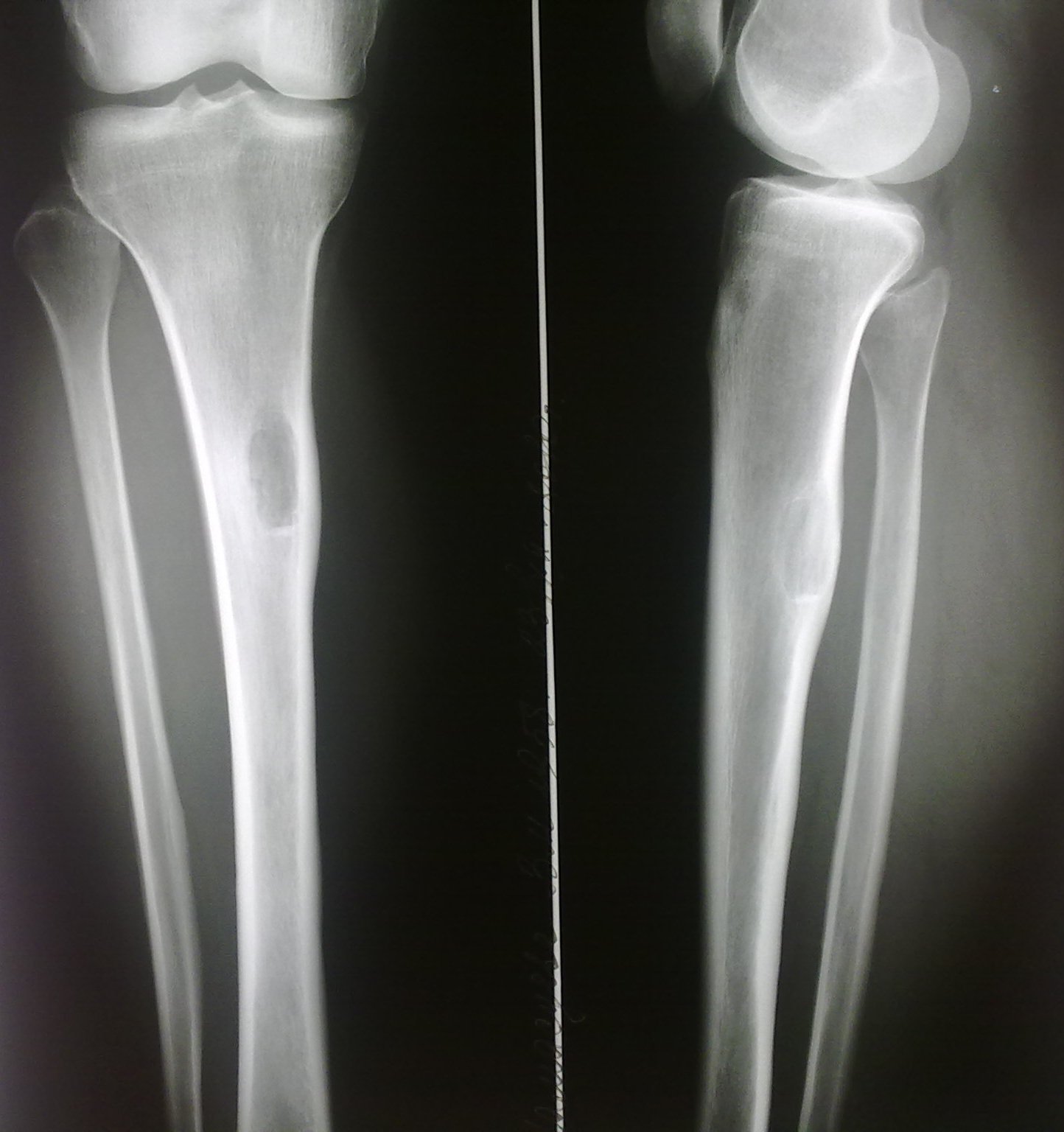
Особенности лечения саркомы Капоши
Возбудителем болезни является вирус герпеса 8-го типа, поражающий людей с проблемным иммунитетом. Саркома Капоши часто сопутствует ВИЧ, является реакцией организма на иммунные отклонения.
На начальной стадии саркомы Капоши возможен реактивный процесс. Болезнь может перестать распространяться при повышении иммунной защиты организма. Такие тенденции характерны для хронического течения болезни, когда поражение может замереть при улучшении состояния организма, в результате принятия лекарственных препаратов. Хроническое течение болезни позволяет прожить при терапии 10-15 лет, прогноз наиболее благоприятный при локализованном высыпании на коже.
При острой форме, которая чаще присутствует при ВИЧ поражении, болезнь распространяется бурно и генерализуется на поверхности, затем внутри организма.
От первичного высыпания до летального исхода проходит не более одного года. Если патологические изменения не так явны, то без лечения больной может прожить три года. При острой и подострой форме болезни пациент испытывает резкие боли в области изъязвлений, развивается интоксикация и происходит поражение слизистой всех органов.
При острой и подострой форме болезни пациент испытывает резкие боли в области изъязвлений, развивается интоксикация и происходит поражение слизистой всех органов.
Рекомендации при саркоме Капоши направлены на терапевтическое, лучевое и химическое воздействие на организм. Важное значение имеет иммунотерапия новейшими препаратами. Независимо от выявленной стадии саркомы Капоши, прогноз неблагоприятный. Системное лечение саркомы Капоши носит паллиативный характер, любая инфекция вновь обостряет течение болезни.
Лечение саркомы Юинга
Этот вид онкологии чаще поражает кости, но может диагностироваться и в мягких тканях. Как правило, сначала проводится химиотерапия, затем опухоль удаляется хирургическим путем, после чего назначается лучевое воздействие. Если речь идет об удалении костной ткани, то после восстановления производится протезирование. Раковое поражение распространяется быстро, происходит метастазирование в органы и костные ткани. Чтобы предотвратить рецидивы, больной проходит несколько курсов интенсивной терапии.
Иногда на 3 и 4 стадии ампутации избежать не удается, при этом проводится комплексное лучевое и химиотерапевтическое лечение. В настоящее время больным после удаления опухоли устанавливают импланты вместо удаленной части кости, что позволяет сохранить конечность. При поражениях такого плана хорошо зарекомендовала себя пересадка костного мозга в Израиле. При ранней диагностике выживаемость составляет 5 лет у 70% пациентов. При наличии метастаз прогноз снижается до 30%, худшие ожидания наступают при невозможности удалить опухоль хирургическим путем.
Мы поможем организовать лечение саркомы Юинга в Израиле и лечение саркомы Капоши в Израиле, просто обратитесь к нашим консультантам и они дадут исчерпывающую информацию по дальнейшим действиям.
Саркома молочной железы — причины, симптомы, диагностика и лечение
Саркома молочной железы — злокачественное неэпителиальное новообразование молочной железы, характеризующееся быстрым ростом и дессеминацией, неблагоприятным течением. Саркома проявляется наличием в молочной железе плотной бугристой опухоли, истончением и гиперемией кожи над образованием, расширением сети подкожных вен. Выявление саркомы молочной железы производится на основе комплекса эхографических, рентгенологических, томографических, цитологических данных. При саркоме молочной железы показано радикальное хирургическое лечение (расширенная мастэктомия) с лучевой и химиотерапией.
Саркома проявляется наличием в молочной железе плотной бугристой опухоли, истончением и гиперемией кожи над образованием, расширением сети подкожных вен. Выявление саркомы молочной железы производится на основе комплекса эхографических, рентгенологических, томографических, цитологических данных. При саркоме молочной железы показано радикальное хирургическое лечение (расширенная мастэктомия) с лучевой и химиотерапией.
Общие сведения
В маммологии и онкологии саркома молочной железы относится к редким типам злокачественных новообразований, составляя среди них от 0,6 до 2%. Саркома молочной железы может развиваться у женщин и у мужчин; гистологически данный тип новообразования идентичен аналогичным опухолям мягких тканей, встречающимся в в других анатомических областях. Чаще всего саркома развивается на фоне листовидной опухоли молочной железы. Саркома груди склонна к быстрому росту и метастазированию, имеет чрезвычайно злокачественное течение и неблагоприятный прогноз.
Саркома молочной железы
Классификация типов саркомы молочной железы
В структуре саркомы отсутствует эпителиальная и железистая ткань. Чаще всего саркомы происходят из стромального компонента — поперечно-полосатых или гладких мышц, жировой, нервной, костной ткани и др. В молочной железе возможно развитие различных гистологических типов сарком. Размеры саркомы молочной железы варьируют в диапазоне от 1,5 до 15 см.
В соответствии с морфологическим вариантом различают фибросаркому, липосаркому, хондросаркому, ангиосаркому, лейомиосаркому, рабдомиосаркому, остеосаркому, злокачественную фиброзную гистиоцитому и др. При гистологическом исследовании чаще выявляются фибросаркомы (около 30%), происходящие из волокон соединительной ткани, которые, достигают больших размеров и не сопровождаются изъязвлением.
Липосаркомы — злокачественные мезенхимальные опухоли из жировой ткани, также характеризуются стремительным прогрессированием, но при этом часто изъязвляются и синхронно поражают обе молочные железы.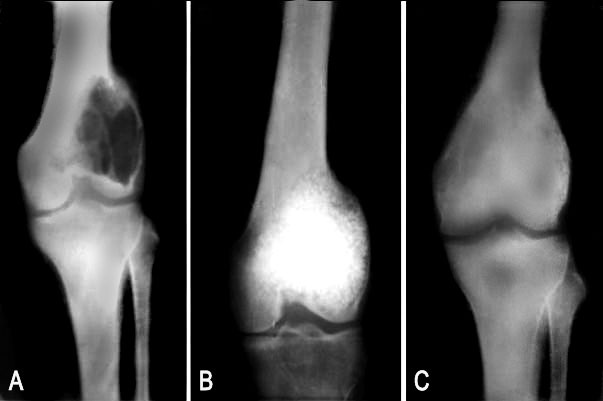 Рабдомиосаркомы, представленные элементами поперечно-полосатых мышц, отличаются крайней злокачественностью, бурным ростом с инфильтрацией тканей. Данный тип саркомы молочной железы поражает преимущественно молодых женщин, не достигших 25 лет.
Рабдомиосаркомы, представленные элементами поперечно-полосатых мышц, отличаются крайней злокачественностью, бурным ростом с инфильтрацией тканей. Данный тип саркомы молочной железы поражает преимущественно молодых женщин, не достигших 25 лет.
Ангиосаркомы, образованные клетками эндотелия сосудов, являются быстрорастущими опухолями, характеризующимися упорным рецидивирующим течением; выявляются преимущественно в возрасте 35-45 лет. Хондросаркомы и остеосаркомы внескелетной локализации составляют 0,25% случаев всех сарком молочных желез, отличаются выраженной степенью злокачественности; встречаются у женщин старше 55 лет. По происхождению различают первичную саркому молочной железы и вторичную, развивающуюся из первоначально доброкачественных образований (например, листовидных опухолей).
Причины развития саркомы молочной железы
Истинные причины возникновения саркомы молочной железы не определены. В числе факторов, располагающих к развитию саркомы, могут выступать химические канцерогены, радиация, травмирование молочной железы, отягощенный семейный онкоанамнез.
Довольно часто появлению саркомы предшествует недостаточно радикальное проведение секторальной резекции молочной железы по поводу какого-либо доброкачественного новообразования — фиброаденомы, листовидной или веретеноклеточной опухоли. Саркома молочной железы может сочетаться с фиброаденомой или раком противоположной железы, раком шейки матки и влагалища, раком прямой кишки.
Симптомы саркомы молочной железы
Развитие саркомы начинается с появления в молочной железе плотного узлового образования, имеющего четкие контуры и бугристую поверхность. По мере роста опухолевого узла кожа над ним истончается, приобретает синюшно-багровый оттенок, на фоне которого выделяется расширенный подкожный венозный рисунок.
Рост опухоли приводит к увеличению объема пораженной молочной железы, асимметрии груди, болезненности, изъязвлению кожного покрова над опухолью. В запущенных стадиях распадающаяся опухоль может кровоточить. При бурном росте саркомы иногда развивается выраженная воспалительная реакция, имитирующая абсцесс молочной железы.
Темпы местного распространения саркомы молочной железы могут быть медленными, прогрессирующими, скачкообразными и бурными. Отмечено, что высокозлокачественные саркомы развиваются бурно или скачкообразно, за несколько месяцев; опухоли с относительно благоприятным прогнозом — медленно, иногда в течение долгих лет. Для сарком молочной железы характерен гематогенный путь метастазирования в легкие и скелет; вовлечение регионарных лимфоузлов отмечается редко.
Диагностика саркомы молочной железы
Четкие критерии диагностики саркомы молочной железы в маммологии не разработаны ввиду редкой встречаемости патологии и большого спектра гистологической вариабельности. Диагностикой и лечением саркомы молочной железы занимается маммолог-онколог. Пальпаторно в молочной железе определяется крупнобугристая, эластичная, подвижная опухоль, имеющая неоднородную консистенцию; при осмотре обращает внимание отечность и гиперемия кожи, участки изъязвления.
Данные обзорной маммографии и УЗИ молочных желез при саркоме неспецифичны.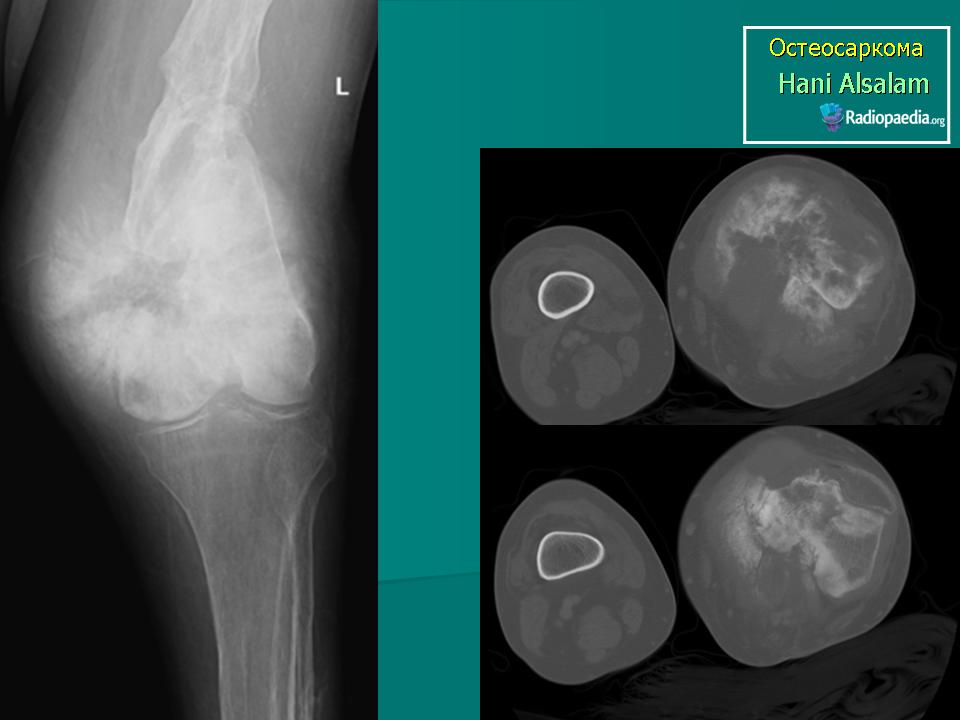 В процессе исследования выявляются тени в виде конгломерата узлов с бугристыми контурами, оттесняющими в сторону окружающие ткани. Хорошо определяется истончение кожи над опухолью и расширенные подкожные вены молочной железы. Дополнительно может проводиться МРТ или сцинтиграфия молочных желез с технецием-99.
В процессе исследования выявляются тени в виде конгломерата узлов с бугристыми контурами, оттесняющими в сторону окружающие ткани. Хорошо определяется истончение кожи над опухолью и расширенные подкожные вены молочной железы. Дополнительно может проводиться МРТ или сцинтиграфия молочных желез с технецием-99.
Окончательно диагноз саркомы молочной железы может быть подтвержден только с помощью морфологического и цитологического исследования образцов опухоли, полученных при тонкоигольной или трепан-биопсии. Микроскопически саркома представлена элементами стромы, клеточной атипией с выраженным полиморфизом и увеличенными ядрами, отсутствием эпителиального компонента.
Лечение саркомы молочной железы
Адекватным объемом вмешательства при выявлении саркомы молочной железы является мастэктомия. Реже, при высокодифференцированных саркомах, выполняется радикальная резекция. Лимфаденэктомия показана при выявлении метастазов в регионарных лимфоузлах либо в случае близкого расположения саркомы к лимфатическим структурам, особенно при распаде опухоли.
Комплексный подход к лечению саркомы молочной железы позволяет улучшить отдаленные результаты. Поэтому в постоперационном периоде проводится химиотерапия антрациклиновыми антибиотиками. Необходимость лучевой терапии рассматривается только при сомнительном радикализме оперативного вмешательства.
Прогноз при саркоме молочной железы
Прогностическими факторами, влияющими на продолжительность безрецидивного периода и выживаемость, служат гистотип саркомы молочной железы, степень дифференцировки, размеры опухоли. Лучшие показатели выживаемости отмечаются при высокодифференцированных саркомах и отсутствии метастазирования в регионарные лимфоузлы.
Саркома молочной железы склонна к местному рецидивированию в области постоперационных рубцов, культе молочной железы, а также отдаленному метастазированию в легочную и костную ткань. Вопрос целесообразности проведения реконструктивной маммопластики дискутабелен.
Синовиальная саркома мягких тканей: признаки, терапия, прогноз
Синовиальная саркома мягких тканей — это злокачественное поражение, которое формируется из клеток синовиальной оболочки, сухожилия и сухожильных влагалищ. Подобное новообразование не ограничено капсулой, в результате чего может врастать в мягкие ткани и в твердые костные структуры.
Подобное новообразование не ограничено капсулой, в результате чего может врастать в мягкие ткани и в твердые костные структуры.
Практически в половине случаев диагностируется синовиальная саркома мягких тканей правого голеностопного сустава. Иногда опухоль развивается в суставах рук, предплечий, в шее и области головы, и с трудом поддается терапии.
Что в составе?
В составе подобного новообразования находятся кистозные полости, некрозы и кровоизлияния. Патологическое образование имеет мягкую структуру, однако не исключается ее способность к отвердению и кальцификации. На разрезе при визуальном осмотре саркома напоминает рыбное филе: она имеет пещеристое строение и белый цвет. Внутри образования наблюдается слизистое отделяемое, которое похоже на синовиальную жидкость. От иных злокачественных новообразований синовиальная саркома мягких тканей отличается тем, что не имеет капсулы.
Данная патология характеризуется довольно агрессивным течением и быстрым развитием.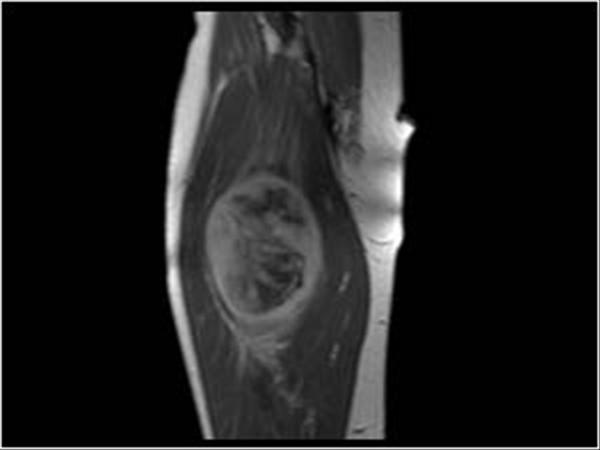 В большинстве числе случаев она не поддается лечению и рецидивирует в ближайшие несколько лет. Даже при успешной терапии метастазы синовиомы могут возникнуть спустя 5-7 лет в лимфоузлах, легочной ткани или костях.
В большинстве числе случаев она не поддается лечению и рецидивирует в ближайшие несколько лет. Даже при успешной терапии метастазы синовиомы могут возникнуть спустя 5-7 лет в лимфоузлах, легочной ткани или костях.
По статистике, с синовиальной саркомой сталкиваются и мужчины, и женщины, в равной степени. Чаще всего такая опухоль диагностируется в возрасте от 15 до 25 лет, однако считается такое заболевание редким – диагностируется оно у трех человек из миллиона.
Причины
Основные причины, провоцирующие развитие синовиальной саркомы мягких тканей, достоверно неизвестны. Тем не менее в отдельную группу выделены некоторые факторы, которые могут послужить толчком к возникновению злокачественного процесса. В их число входят:
- Наследственная предрасположенность.
- Ионизирующее излучение. Воздействие на организм радиации может спровоцировать озлокачествление клеток в различных тканях, например, в костной.
- Травмы. Серьезные нарушения целостности суставов иногда становятся причиной онкологического перерождения клеток.

- Химические вещества. Влияние канцерогенов весьма опасно и может вызвать злокачественный процесс.
- Иммуносупрессивная терапия. Осуществление данного вида лечения в определенных случаях приводит к онкологическим заболеваниям.
- Нездоровый образ жизни, вредные привычки.
Возраст больных
Злокачественная синовиома считается болезнью молодых. Онкопроцесс, по мнению медиков, в большинстве случаев провоцируется неблагоприятной наследственностью и состоянием окружающей среды. В группу риска по саркоме входят молодые люди и подростки, проживающие в неблагополучных экологических зонах.
Симптоматика заболевания
На ранних стадиях злокачественного процесса, пока образование не имеет больших размеров, клинические признаки не наблюдаются. С прогрессированием синовиальной саркомы мягких тканей возникают неприятные ощущения в области сустава, ограничение его двигательной функции. Чем мягче структура опухоли, тем менее выражен болевой синдром.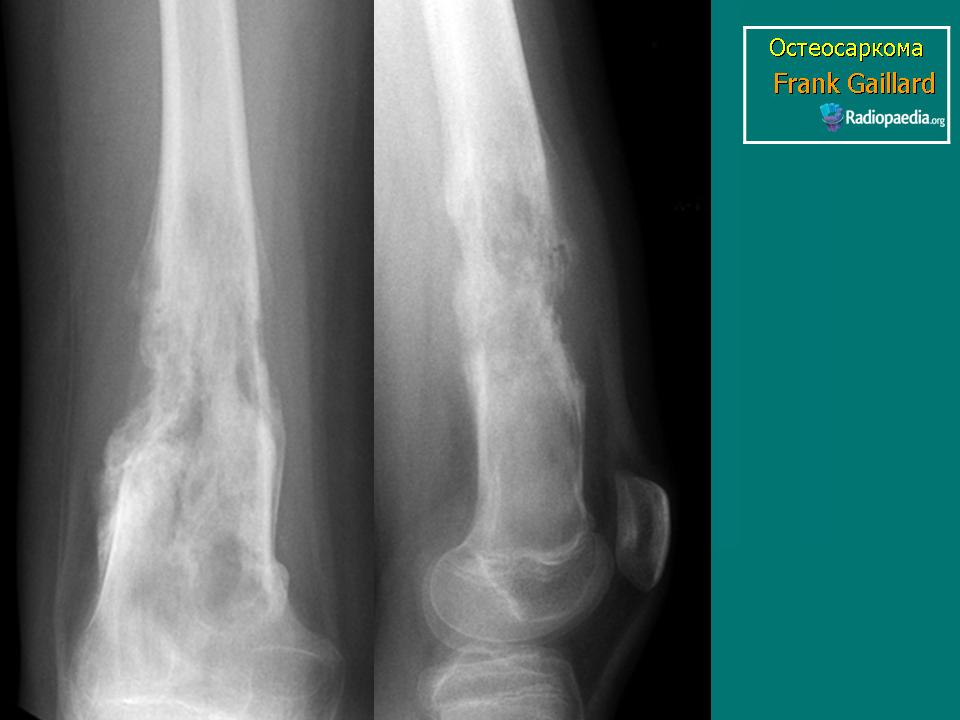
Если на данном этапе специалист проведет пальпацию патологического очага, он может отметить опухоль размерами от 2 до 15 см. Онкологический процесс не имеет границ, наблюдается слабая подвижность опухоли, плотная или мягкая ее консистенция. Кожный покров над ней характерно выпячивается, меняется его цвет и температура.
Фото синовиальной саркомы мягких тканей представлено.
По мере разрастания синовиома деструктивно воздействует на пораженные ткани, они начинают разрушаться, болевой синдром усиливается. Сустав или конечность перестает нормально функционировать, возникает потеря чувствительности или онемение в связи с давлением новообразования на нервные окончания. Если оно поразило область шеи или головы, могут возникать такие симптомы, как ощущение постороннего тела при глотании, нарушения дыхания, изменение голоса.
Общие симптомы интоксикации
Кроме того, у пациента отмечаются общие симптомы онкологической интоксикации, к которым относятся:
- хроническая слабость;
- субфебрилитет;
- непереносимость физической нагрузки;
- похудение.
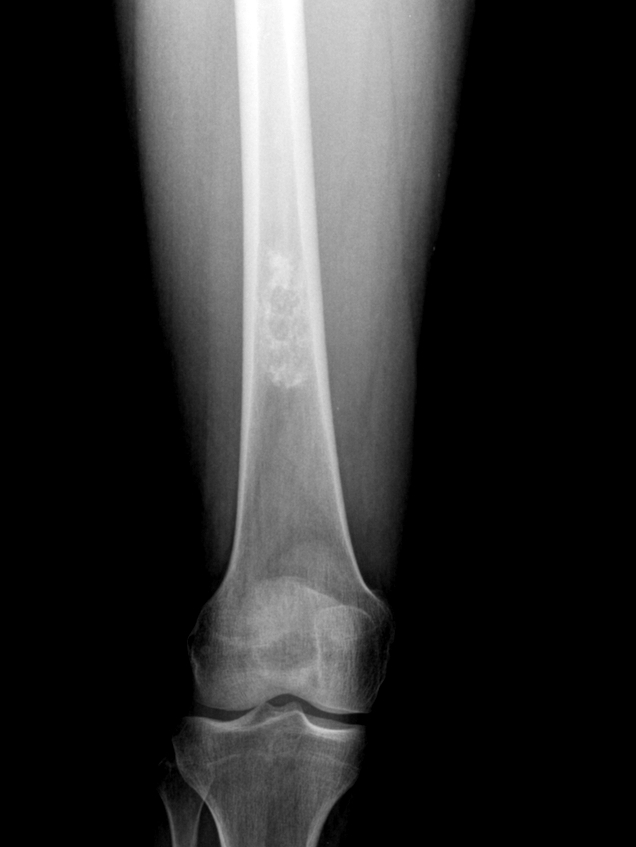
При развитии метастазов и распространении онкологических клеток в региональные лимфоузлы отмечается их увеличение в объемах.
Синовиальная саркома коленного сустава, голени и бедра
Злокачественная опухоль, которая поразила коленный сустав, является неэпителиальным онкологическим новообразованием вторичного типа. Основной причиной патологического процесса становятся метастазы из соседних лимфоузлов или тазобедренного сустава. При поражении участков костной ткани врач диагностирует остеосаркому, а при вовлечении в онкологический процесс хрящевых фрагментов — хондросаркому.
При локализации опухоли в полости коленного сустава главным признаком патологии становится боль, которая охватывает, как правило, всю нижнюю конечность. На этом фоне нарушаются двигательные функции ноги. Если опухоль распространяется наружу, то есть локализуется ближе к коже, можно наблюдать местную отечность и диагностировать процесс на начальной стадии.
В случае поражения саркомой связочного аппарата нога лишается всех функциональных возможностей, поскольку сустав полностью разрушается.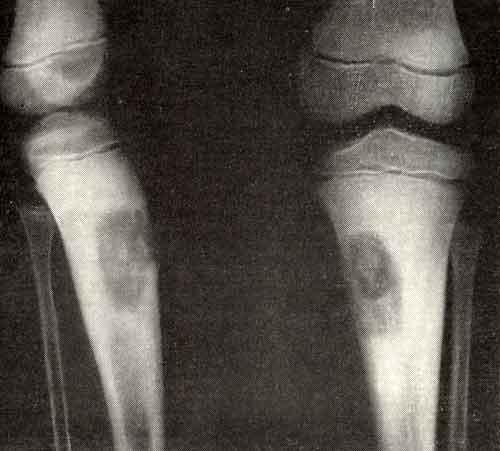 При опухолях больших размеров меняется кровоток в тканях, в голени возникает острая нехватка кислорода и питательных веществ.
При опухолях больших размеров меняется кровоток в тканях, в голени возникает острая нехватка кислорода и питательных веществ.
Синовиальная саркома мягких тканей бедра может формироваться практически из всех его структур. Большинство таких новообразований на начальной стадии имеют похожую картину с доброкачественными опухолевыми процессами. Основную массу патологий данной локализации составляют рак костей и опухоли мягких тканей.
Саркома мягких тканей бедра является довольно редкой патологией и поражает чаще всего мужчин 30-60 лет.
Разновидности синовиальной саркомы
По тканевому строению данная опухоль подразделяется на:
- целлюлярную, которая формируется из клеток железистого эпителия и состоит из папилломатозных и кистозных структур;
- волокнистую, которая растет из волокон, по природе напоминающих фибросаркому.
По морфологическому строению можно выделить следующие типы саркомы:
- альвеолярная;
- гигантоклеточная;
- фиброзная;
- гистоидная;
- смешанная;
- аденоматозная.
По классификации ВОЗ
По классификации ВОЗ опухоль делится на два вида:
- Монофазная синовиальная саркома мягких тканей, когда злокачественный процесс состоит из крупных светлых и веретенообразных клеток. Дифференциация новообразования слабо выражена, что существенно затрудняет диагностику заболевания.
- Бифазная синовиальная саркома мягких тканей, когда образование состоит из синовиальных клеток и имеет множественные полости. Легко определяется при проведении диагностических процедур.
Наилучший прогноз для больного отмечается при развитии синовиомы бифазного типа.
Очень редко выявляется такой вид, как светлоклеточная фасциогенная синовиома. По основным признакам она имеет много общего с онкомеланомой, и диагностировать ее крайне сложно. Опухоль поражает сухожилия и фасции и отличается медленным течением патологического процесса.
Стадии патологии
На начальной стадии новообразование не превышает 5 см и имеет низкую степень злокачественности. Прогноз на выживаемость при этом весьма благоприятный и составляет 90%.
Прогноз на выживаемость при этом весьма благоприятный и составляет 90%.
На второй стадии опухоль имеет размеры больше 5 см, однако уже может поражать сосуды, нервные окончания, регионарные лимфоузлы и костную ткань.
На третьей стадии данного онкологического процесса наблюдаются метастазы в лимфоузлах.
На четвертой стадии площадь онкологического процесса не поддается измерению. При этом происходит поражение важных костных структур, сосудов и нервов. Наблюдается множественное метастазирование. Прогноз выживаемость таких пациентов равен нулю. Как проходит лечение синовиальной саркомы мягких тканей бедра или голени?
Лечение и прогноз
Терапия синовиомы в 70% основана на ее резекции. Опухоли в крупных суставах: тазобедренном, плечевом или коленном врастают в лимфоузлы и магистральные сосуды, в связи с чем наблюдаются частые рецидивы и метастазы, поэтому специалисты прибегают к ампутации той или иной конечности.
В целом лечение и прогноз синовиальной саркомы мягких тканей зависит от стадии ее развития. На первой и второй стадиях патология успешно лечится и прогноз выживаемости пациентов наиболее благоприятный. На третьей стадии при успешно ампутированной конечности и отсутствии метастазов прогнозируется выживаемость на 60%, на четвертой же стадии, когда злокачественный процесс распространяется по всему организму, прогноз крайне неблагоприятен.
На первой и второй стадиях патология успешно лечится и прогноз выживаемости пациентов наиболее благоприятный. На третьей стадии при успешно ампутированной конечности и отсутствии метастазов прогнозируется выживаемость на 60%, на четвертой же стадии, когда злокачественный процесс распространяется по всему организму, прогноз крайне неблагоприятен.
Хирургическое лечение проводится следующими способами:
- Локальное удаление, которое осуществимо исключительно на первой стадии болезни, когда обследование подтвердило доброкачественность опухоли. Дальнейшая тактика терапии зависит от гистологического исследования изъятых тканей и определения их злокачественности. Рецидив патологии составляет до 95%.
- Широкое иссечение, которое проводится с захватом соседних тканей площадью приблизительно 5 см. Рецидивы синовиальной саркомы в данном случае возникают в 50%.
- Радикальная резекция, при которой опухоль удаляется с сохранением органа, но приближая хирургическое вмешательство к ампутации.
 В подобном случае, как правило, применяется протезирование, в частности, замена сустава или сосудов, пластика нервных окончаний, резекция кости. После операции все дефекты скрываются при помощи аутодермопластики. Также используются кожные лоскуты и пересадка мышечной ткани. Рецидивы процесса случаются примерно 20% случаев.
В подобном случае, как правило, применяется протезирование, в частности, замена сустава или сосудов, пластика нервных окончаний, резекция кости. После операции все дефекты скрываются при помощи аутодермопластики. Также используются кожные лоскуты и пересадка мышечной ткани. Рецидивы процесса случаются примерно 20% случаев. - Ампутация, которая проводится при поражении магистрального сосуда, основного нервного ствола, а также при массивном разрастании опухоли в тканях конечности. Риск рецидивов в подобном случае самый низкий — 15%.
Применяя хирургическое лечение одновременно с химиотерапией и облучением, имеются шансы сохранить орган в 80% клинических ситуаций. Удаление лимфоузлов вместе с очагом патологического процесса проводится при условии, что исследование подтвердило факт злокачественности их тканей.
Лучевая терапия
Лучевая терапия при синовиоме проводится следующими методами:
- Предоперационная или неоадъювантная, которая необходима для инкапсулирования новообразования, уменьшения ее размеров, повышения эффективности операции.
- Интраоперационная, которая сокращает риск рецидива заболевания на 40%.
- Послеоперационная или адьювантная, которая применяется при невозможности осуществления хирургического лечения в силу запущенности патологического процесса и распада опухоли.
Саркома Капоши | Саркома мягких тканей | Cancer Research UK
Саркома Капоши (СК) — редкий тип саркомы мягких тканей. Саркома мягких тканей — это разновидность рака.
Что такое саркома Капоши?
Саркома Капоши (СК) развивается из клеток, называемых эндотелиальными клетками, которые выстилают кровеносные и лимфатические сосуды. Чаще всего он обнаруживается на коже, но также может поражать внутренние части тела, такие как лимфатические узлы, легкие, кишечник, печень и селезенку.KS разрастания также называют повреждениями или опухолями.
KS развивается иначе, чем другие виды рака. Большинство видов рака начинаются в одном месте тела, а затем могут распространяться на другие части тела (метастазировать). СК может начинаться одновременно в нескольких областях тела.
СК может начинаться одновременно в нескольких областях тела.
Причины саркомы Капоши
Основной причиной СК является вирус, называемый вирусом герпеса человека 8 (HHV8), также известный как вирус герпеса, связанный с саркомой Капоши (KSHV). Вирус заражает клетки, и считается, что из-за этого они становятся злокачественными.
HHV8 — это обычно вирус, передающийся половым путем. Он также может передаваться через кровь между наркопотребителями, пользующимися общими иглами.
Не все инфицированные HHV8 заболевают KS. Считается, что есть и другие факторы. Ученые согласны с тем, что наличие ослабленной иммунной системы или определенных типов инфекции наряду с HHV8 также играет определенную роль в развитии СК.
Признаки и симптомы саркомы Капоши
Признаки и симптомы различаются в зависимости от того, есть ли у вас СК на коже или СК внутри тела.Поражения на коже встречаются чаще, чем внутренние поражения внутри тела.
Саркома кожи Капоши
Поражения на коже обычно начинаются очень маленькими и плоскими. Они не вызывают боли и зуда и кажутся безвредными. Они выглядят как синяк, но не теряют цвет при надавливании, как синяк.
По мере роста они могут начать выступать над окружающей кожей и врастать друг в друга. Поражения могут быть разных цветов, например, коричневого, синего, красного или темно-фиолетового.
Иногда поражения образуют комки (узелки), которые могут изъязвляться и кровоточить. Шишки связаны с болезненной опухолью (отеком).
KS в коже может расти очень медленно и не проявлять никаких изменений в течение нескольких месяцев. Но некоторые растут быстрее, и новые области появляются еженедельно.
Внутренняя саркома Капоши
Внутренние поражения СК могут расти в лимфатических узлах и органах тела, таких как легкие, печень, селезенка и пищеварительная система. Симптомы зависят от того, какие органы поражены.
Самый распространенный тип СК связан со СПИДом. При СК, связанном со СПИДом, обычно поражаются лимфатические узлы.Клетки KS могут блокировать поток лимфы (тканевой жидкости) через лимфатическую систему. Это скопление жидкости может вызвать отек рук или ног. Это называется лимфатическим отеком.
Лимфедема может быть очень болезненной и неприятной. К сожалению, от этого состояния нет лекарства. Но лечение может помочь контролировать и облегчить его. Чем раньше это будет обнаружено и обработано, тем легче будет контролировать это. Так что сообщите своему врачу, если у вас есть отек, который, по вашему мнению, может быть лимфатическим отеком.
Типы сарком Капоши
Существует четыре типа саркомы Капоши:
- классический KS
- эндемичный или африканский KS
- , связанный с трансплантатом KS
- Связанные со СПИДом KS
Классический KS
Этот тип СК очень редок и обнаруживается только на коже, в основном на голенях и ступнях.Это наиболее часто встречается у пожилых мужчин средиземноморского или средне- и восточноевропейского происхождения. Это может быть медленнорастущий рак, который обычно не вызывает никаких проблем, кроме появления повреждений.
Возможно, вам не понадобится лечение, пока поражения СК не станут большими и находятся на очень заметных участках тела.
Эндемичный или африканский KS
Этот тип KS встречается в тех частях Африки, где распространена инфекция HHV8.Растет быстрее, чем классический KS.
Поражает как взрослых, так и детей.
Связанный с трансплантатом KS
Этот тип СК встречается очень редко и чаще всего встречается у людей с пониженным иммунитетом. Сюда входят люди, перенесшие трансплантацию стволовых клеток или органов. Этим людям необходимо принимать лекарства, чтобы их организм не отторгал новый орган или стволовые клетки.Эти препараты подавляют иммунную систему. Их называют иммунодепрессантами или иммунодепрессантами.
Связанный со СПИДом KS
KS — наиболее распространенный тип опухоли у людей, инфицированных ВИЧ. Он имеет тенденцию расти быстрее, чем другие виды. У людей со СПИДом ослабленная иммунная система. Это увеличивает риск развития СК.
Тесты
Саркома Капоши (СК) обычно диагностируется с помощью биопсии. Это означает, что у вас взят образец ткани (биопсия). Затем врач-специалист (патолог) рассматривает клетки под микроскопом.
Способ проведения биопсии зависит от того, где в вашем теле находится поражение.
Поражения кожи
Обычно вам делают биопсию под местной анестезией, если поражение находится на коже. Местный анестетик вызывает обезболивание.
Поражения легких
Возможно, вам сделают бронхоскопию, чтобы взять биопсию из поражения легкого.
Поражения пищеварительной системы
Вам могут назначить эндоскопию или колоноскопию для биопсии поражений пищеварительной системы.
Другие тесты могут включать:
- анализ крови
- МРТ
- компьютерная томография
- ПЭТ сканирование
- Тест на кровь в стуле
Лечение саркомы Капоши
Ваше лечение зависит от:
- тип KS
- размер и расположение поражений
- степень тяжести
- ваше общее состояние здоровья
Варианты лечения всех типов KS могут включать одно или несколько из следующих, в зависимости от того, являются ли поражения локализованы или распространены:
- замораживание участка жидким азотом (криотерапия)
- лазерное лечение
- Удаление высыпаний с помощью небольшой операции
- Лучевая терапия очагов поражения
- кремы, нанесенные на очаги поражения (местная терапия)
- химиотерапия в кровоток
- иммунотерапия под названием интерферон альфа
Дополнительные методы лечения СК, связанных с трансплантацией, включают:
- отмена иммунодепрессанта или изменение дозы
- иммунодепрессант сиролимус, который предотвращает отторжение почки после трансплантации почки
Дополнительное лечение СК, связанного со СПИДом, включает антиретровирусную терапию.
Лечение продвинутого KS
Обычно вам назначают химиотерапию, если у вас широко распространенное поражение саркоидоза. Лечение на этой стадии является паллиативным, то есть используется для лечения симптомов, а не для лечения. Обычно у вас есть 2 или более из этих препаратов:
- доксорубицин липосомальный
- даунорубицин липосомальный
- паклитаксел
- винорелбин
- этопозид
- гемцитабин
Вы также можете пройти лечение в рамках клинического исследования.Поговорите со своим врачом, если хотите узнать больше об исследованиях саркомы Капоши.
Как справиться
Справиться с диагнозом редкого рака может быть особенно сложно. Если вы узнаете больше о своей саркоме и ее лечении, вам будет проще. Это может помочь вам принимать решения и справляться с происходящим.
Sarcoma UK предоставляет поддержку и информацию для людей, страдающих саркомой мягких тканей и костей.
The Rare Cancer Alliance предлагает поддержку и информацию людям с редкими формами рака.
Также может помочь разговор с другими людьми, у которых есть то же самое.
Наш дискуссионный форум Cancer Chat — это место для всех, кто страдает раком. Вы можете поделиться своим опытом, историями и информацией с другими людьми, которые знают, через что вы проходите.
Отличие синовиальной саркомы от доброкачественной и злокачественной имитации: индикаторы МРТ
Синовиальные саркомы (СС) — это злокачественные опухоли мягких тканей, на долю которых приходится 5-10% сарком мягких тканей. 1-3 Синовиальные саркомы встречаются редко, их частота составляет 2,75 на 100 000 человек. 4 Однако они являются вторыми по распространенности опухолями мягких тканей после рабдомиозаркомы у детей, подростков и молодых людей. 1
Поскольку синовиальные саркомы очень редки, многие клиницисты и радиологи не знакомы с их внешним видом и визуализацией. Для биопсии этих опухолей важно, чтобы рентгенологи или онкологи-ортопеды не сочли их доброкачественными.Неправильное предположение, что СС является доброкачественным поражением, приведет к задержке диагностики и, возможно, прогноза. И наоборот, ошибочное принятие доброкачественного поражения за СС может привести к увеличению беспокойства пациента и увеличению затрат из-за ненужных процедур и визуализационных тестов.
Целью данной статьи является описание основных характеристик ССД при магнитно-резонансной томографии (МРТ), а также описание тех доброкачественных и злокачественных опухолей, которые часто путают с СС (Таблица 1).
В одном исследовании 84% пациентов с синовиальной саркомой были в возрасте от 10 до 50 лет. 5 Мужчины и женщины страдают одинаково. 6 Девяносто процентов СС возникает в нижних конечностях, часто вблизи суставов и в стенке туловища, но болезнь может быть обнаружена в любом месте тела 9 с редкими сообщениями о внутрисуставном СС. 10 Синовиальные саркомы высокой степени злокачественности (II / III). 11 Есть три общих гистологических типа. 12 Монофазный тип является наиболее распространенным и состоит только из веретенообразных клеток. 12 Двухфазный тип состоит из веретеновидных и эпителиальных клеток. 12 Наконец, недифференцированный тип состоит из клеток, напоминающих маленькие круглые голубые клеточные опухоли. 12
Факторы, которые приводят к худшему прогнозу, включают большой размер опухоли, метастазы при постановке диагноза, заболевание туловища и положительные границы после хирургической резекции. 13 Пятилетняя и 10-летняя выживаемость СС оценивается примерно в 70% и 60% соответственно. 13 Низкая выживаемость СС, вероятно, связана с местным рецидивом и метастазами в легких. 13
Синовиальные саркомы обычно сначала обнаруживаются как безболезненные растущие образования. 14 Подтверждение наличия новообразования с помощью рентгенографии и МРТ обычно выполняется до биопсии. 14 Окончательный диагноз СС основывается на биопсии. Биопсийную ткань часто тестируют на транслокацию t (X; 18) (p11; q11) с использованием флуоресцентной гибридизации in situ (FISH), для которой около 90% SS являются положительными. 15
МРТ: Доброкачественные имитаторы синовиальной саркомы
Нейрофибромы
Нейрофибромы являются доброкачественными опухолями оболочек нервов 21 и могут быть связаны с нейрофиброзом 1 типа (NF1).Нейрофибромы обычно возникают на любом участке тела поверхностно. 22,23 Функции МР-визуализации, которые помогают идентифицировать нейрофибромы, включают (1) возникновение вдоль основного нерва, (2) визуализацию входа и выхода нерва из опухоли, (3) целевой знак (круглое гипоинтенсивное поражение с гиперинтенсивным ободком) на Т2-взвешенное изображение (рис. 2), (4) фасцикулярный признак (несколько небольших гипоинтенсивных очагов, разбросанных в гиперинтенсивной области на Т2-взвешенных или взвешенных по протонной плотности МР-изображениях) и (5) знак расщепленного жира — ободок жира, окружающего поражение (лучше всего оценивается на T1-взвешенных изображениях). 24,25 В то время как большинство нейрофибром демонстрируют сильное усиление на постконтрастной визуализации T1, характер усиления может быть различным. 26
Гемангиомы
Гемангиомы — это аномальное разрастание кровеносных сосудов, которое, возможно, лучше назвать венозными мальформациями. 27 Это одна из самых распространенных опухолей мягких тканей у детей. 28 Гемангиомы поражают женщин в три раза чаще, чем мужчин. 29 Большинство гемангиом возникает на поверхности, в области головы и шеи. 28 На МРТ гемангиомы демонстрируют интенсивность сигнала от низкой до средней на T1-взвешенных изображениях; однако они кажутся гиперинтенсивными на Т2-взвешенных изображениях. 30,31 Они демонстрируют переменное усиление на T1-взвешенных изображениях с контрастом, в зависимости от динамики потока и времени введения болюса контрастного вещества. 32 Синовиальные гемангиомы присутствуют с вышеуказанными особенностями, а также могут иметь линейные структуры низкой интенсивности, вероятно, из-за фиброзных перегородок или сосудистых каналов (Рисунок 3), а также из-за уровней жидкости-жидкости. 33 Поскольку СС может возникать внутрисуставно и поскольку СС может иметь жидкостно-жидкостные уровни, их можно спутать с синовиальными гемангиомами.
Липомы веретенообразных клеток
Липомы из веретенообразных клеток — это липомы, состоящие из липоцитов и веретеновидных клеток. 34 Чаще всего они возникают у мужчин в возрасте от 45 до 65 лет и, как правило, поражают заднюю часть шеи и плеча. 35-39 Обычно они поверхностные и часто появляются в подкожно-жировой клетчатке. 40 Интенсивность сигнала не жировых областей этих поражений выше, чем у жира на T2-взвешенных последовательностях, и аналогична интенсивности сигнала скелетных мышц на T1-взвешенных последовательностях. 40 Нежирная ткань демонстрирует усиление, такое же, как и в соседних сосудах после введения внутривенного контраста. 40
Пигментный виллонодулярный синовит (ПВНС) / гигантоклеточные опухоли теносиновиального происхождения
ПВНС — доброкачественное и редкое моноартикулярное заболевание суставов, характеризующееся пролиферацией синовиальных клеток, излияниями и эрозиями костей. 41 ПВНС обычно возникает между 3 и 5 десятилетиями жизни. 42 PVNS чаще поражает коленный сустав у пожилых людей, тогда как у более молодых пациентов PVNS имеет тенденцию поражать бедро. 43 Соотношение женщин и мужчин оценивается в 1,35: 10. 44 ПВНС может быть диффузным или локализованным. 45, 46 PVNS показывает промежуточный сигнал на T1-взвешенных изображениях (Рисунок 4A), низкий сигнал на T2-взвешенных изображениях с областями высокого сигнала (Рисунок 4B) из-за воспаления синовиальной оболочки или суставной жидкости и переменное усиление на T1 с контрастным усилением взвешенные изображения. 45, 46 PVNS имеет низкий сигнал на последовательностях градиент-эхо (GE) и иногда артефакты цветения. 45, 46 Артефакты цветения, отмеченные на последовательностях градиент-эхо, вызваны гемосидерином от хронического кровотечения в этих поражениях. 45,46
Поражения Мореля-Лавалле
Повреждения Мореля-Лавалле возникают посттравматически и представляют собой глубокие подкожные закрытые отслаивающие повреждения, при которых кожа и подкожные ткани отделены от подлежащей фасции. 47 При этой травме образуется полость, которая может заполняться кровью и некротическим жиром. 48, 49 Поражения обычно возникают над большим вертелом, но также могут быть замечены в поясничной области, над лопаткой и над коленом. 50, 51 При МРТ жидкость внутри полости может демонстрировать переменную интенсивность сигнала и может иметь уровни жидкость-жидкость. 50 Если поражение находится в характерном месте с историей травмы и имеет классический вид, то дифференциального диагноза не существует. В противном случае поражение можно принять за саркому. 50, 52 Если предоставленная клиническая история сомнительна, то можно использовать краткосрочные контрольные изображения, чтобы гарантировать разрешение / изменение размера поражения.
Синовиальный хондроматоз
Синовиальный хондроматоз — доброкачественное заболевание, при котором образуются хрящевые узелки в синовиальной оболочке суставов, влагалищах сухожилий и выстилке прилегающих внесуставных сумок. 53 Эти узелки могут отделяться и существовать как тела в суставной щели. 53 Синовиальный хондроматоз возникает в крупных суставах, таких как тазобедренный, локтевой, коленный (рис. 5) и плечевой сустав. 54 Расстройство может появиться в любом возрасте, но наиболее часто встречается в 4 и 5 десятилетиях жизни. 54 Мужчины болеют сильнее, чем женщины, в соотношении 2-4: 1. 55,56 Появление синовиального хондроматоза на МРТ зависит от наличия синовиальной пролиферации, образования рыхлых тел и степени минерализации. 57 Синовиальный хондроматоз называется синовиальным остеохондроматозом, если внутрисуставные тела минерализованы. 55
Кисты ганглиозов
Ганглиозные кисты — это доброкачественные кистозные образования, которые обычно выглядят как однокамерные или многокамерные жидкостные сигнальные образования, прилегающие к суставу или влагалищу сухожилия. 58 Вероятность поражения женщин примерно в три раза выше, чем у мужчин. 59 Ганглиозные кисты чаще всего встречаются на тыльной поверхности запястья.Ганглиозные кисты могут поражать людей любого возраста, но чаще встречаются у людей в возрасте от 25 до 45 лет. 60 Очень маленькие кисты могут имитировать небольшой выпот, но нехватка жидкости в суставе и локальный характер жидкости должны предоставить ключи для диагностики. 61 Кисты обычно имеют низкую интенсивность сигнала на T1-взвешенных изображениях, но могут казаться гиперинтенсивными, если они имеют высокое содержание белка или кровоизлияние. 62 Ганглиозные кисты обычно имеют высокий сигнал на Т2-взвешенных последовательностях 62 и показывают периферическое усиление после введения внутривенного контраста. 61 Разорванные кисты ганглия часто нерегулярно очерчиваются с перикапсулярным отеком на Т2-взвешенных последовательностях. 61
Ангиолейомиома
Ангиолейомиомы — это доброкачественные опухоли гладких мышц с выраженными сосудистыми компонентами. 63 Ангиолейомиомы чаще встречаются у женщин. 64 Пик заболеваемости приходится на 3–6-е десятилетия жизни. 64 Ангиолейомиомы могут возникать в любом месте тела, чаще всего на нижних конечностях, и в 60% случаев они являются болезненными. 64 На Т2-взвешенной МРТ поражения демонстрируют смешанные области гиперинтенсивного и изоинтенсивного сигнала. 65-67 Т2-гиперинтенсивные области соответствуют клеткам пучка гладких мышц и демонстрируют сильное усиление при контрастировании. 65-67 Изоинтенсивные области соответствуют фиброзной ткани или внутрисосудистым тромбам. 65-67
Внутрисосудистая папиллярная эндотелиальная гиперплазия (IPEH) / опухоль Массона
Внутрисосудистая папиллярная гиперплазия эндотелия — доброкачественное сосудистое заболевание, характеризующееся разрастанием эндотелия в кровеносных сосудах. 68 Чаще всего встречается у молодых людей, причем женщины страдают чаще, чем мужчины. 69 Возникает в основном на коже и подкожных мягких тканях пальцев, туловища, головы и шеи и редко в области рта, проявляясь в виде небольшой поверхностной массы от красного до синего цвета. 70 Т1-взвешенные последовательности могут отображать однородный сигнал (рис. 6А). 71 На T2-взвешенных изображениях поражения демонстрируют гетерогенный гиперинтенсивный сигнал с фокусами сигнала низкой интенсивности (Рисунок 6B). 71 и имеют переменное усиление после введения внутривенного контраста (Рисунок 6C).
МРТ: Злокачественные образования, принимаемые за синовиальную саркому
Лимфома
Лимфомы низкой степени злокачественности, такие как фолликулярная лимфома, могут быть ошибочно приняты за СС. Фолликулярная лимфома составляет около 45% всех неходжкинских лимфом. 72 Это лимфомы низкой степени злокачественности, но они могут трансформироваться в более агрессивные лимфомы. 72 Лимфомы обычно бывают изоинтенсивными или гипоинтенсивными (рис. 7A), T2-гиперинтенсивными (рис. 7B) и демонстрируют усиление после введения внутривенного контраста (рис. 7C).
Недифференцированная плеоморфная саркома (UPS) (ранее известная как злокачественные фиброзные гистиоцитомы)
Этиология и происхождение ИБП не выяснены. 73 Эта опухоль возникает в основном в зрелом и позднем возрасте и возникает в проксимальной области нижних конечностей. 74 Недифференцированная плеоморфная саркома обычно имеет интенсивность сигнала от низкой до средней для последовательностей, взвешенных по T1, и от средней до высокой для последовательностей, взвешенных по T2. 75 Myxoid UPS имеет тенденцию быть гиперинтенсивным на T2-взвешенных последовательностях из-за высокого содержания воды в его поражениях. 75
Внескелетная миксоидная хондросаркома
Внесскелетная миксоидная хондросаркома (ЭМС) — редкий подтип хондросаркомы. 76 Средний возраст постановки диагноза составляет приблизительно 50 лет, при этом 50% пациентов находятся в возрасте от 41 до 60 лет. 77 Мужчины болеют чаще, чем женщины; соотношение 2: 1. 78 Имеется склонность к поражению нижних (62%) и верхних конечностей (17%). 77,78 EMC имеет характерную хромосомную транслокацию, обычно t (9; 22) (q22; q12.2), слияние EWSR1 с NR4A3, и перегруппировка EWSR1 может быть обнаружена флуоресцентной гибридизацией in situ. 79 В результате хромосомной транслокации образуется продукт гибридного гена, ответственный за изменения в росте и дифференцировке клеток. 79 Это злокачественное новообразование лучше всего оценивается с помощью МРТ, которая позволяет визуализировать миксоидную строму и многоузловые четко определенные границы новообразования. 80 EMC имеет тенденцию быть изоинтенсивным или гипоинтенсивным на T1-взвешенных изображениях и гиперинтенсивным T2 на T2-взвешенных изображениях. 79
Липосаркома
Липосаркомы происходят из примитивных мезенхимальных клеток, а не из зрелых жировых клеток. 81 Следовательно, наличие адипоцитов не обязательно для развития этой распространенной опухоли мягких тканей. 81 Липосаркома — это в первую очередь опухоль взрослого человека с пиком заболеваемости между 4 и 6 десятилетиями жизни. 81 Мужчины болеют несколько чаще, чем женщины. 81 Липосаркомы чаще всего возникают в области бедра и забрюшинного пространства. 81 Миксоидная гистология является наиболее частым признаком липосаркомы, составляя 45-55% всех поражений. 81 Миксоидные липосаркомные поражения имеют низкую / среднюю интенсивность сигнала Т1 (рис. 8А) из-за миксоидной стромы и высокого содержания воды в миксоматозных элементах, а также очень высокой интенсивности сигнала Т2 (рис. 8В). 82 Присутствие и относительная доля круглых клеток может снизить содержание воды в опухоли, что приведет к получению сигнала Т2 от низкого до среднего. 83, 84 Большинство поражений демонстрируют интенсивное усиление после введения внутривенного контраста.Часто видны инкапсулированные края и толстые внутренние перегородки. 82
Эпителиоидные саркомы
Эпителиоидные саркомы — это злокачественные опухоли с неизвестным гистогенезом. 85 Это наиболее распространенная саркома мягких тканей кисти и запястья. 85 Это происходит в основном на пальцах, кистях и предплечьях, но может также возникать и в других местах, в том числе в мускулатуре. 86 Часто присутствует региональная лимфаденопатия, поскольку эта опухоль имеет склонность распространяться на лимфатические узлы. 86 Эта опухоль часто встречается у подростков и молодых людей в возрасте от 10 до 35 лет. 85 Мужчины поражаются вдвое чаще, чем женщины. 85 Эта опухоль имеет различные характеристики сигнала МРТ и должна подозреваться у пациентов с локальным увеличением лимфатических узлов или без них, а также у пациентов с изъязвлением кожных узлов. 86
Меланома
Меланомы — это опухоли, возникающие из меланоцитов. 87 Плохой прогноз связан с более молодым возрастом диагноза, семейным и личным анамнезом меланомы. 87
Меланомы имеют тенденцию быть изоинтенсивными или гиперинтенсивными на Т2-взвешенных изображениях (рис. 9) и часто гиперинтенсивными на Т1-взвешенных изображениях. 88 Присутствие меланина и продуктов крови в меланомах приводит к гиперинтенсивности этих опухолей на T1-взвешенных последовательностях.
Заключение
Точный диагноз синовиальной саркомы может повлиять на прогноз и общую выживаемость, увеличивая шансы на соответствующее и агрессивное лечение. Хотя синовиальные саркомы наиболее распространены у детей и молодых людей, чаще встречаются в конечностях и могут возникать в любом возрасте и в любом месте тела.Мы рекомендуем проверять все визуализационные исследования рентгенологом, имеющим опыт оценки опухолей опорно-двигательного аппарата. Поражение следует рассматривать как потенциальную синовиальную саркому, если оно имеет какие-либо подозрительные признаки. Авторы рекомендуют биопсию всех подозрительных поражений и использование FISH для подтверждения диагноза синовиальной саркомы.
Список литературы
- Goldblum JR, Flope AL, Weiss SW. Злокачественные опухоли мягких тканей неопределенного типа. В: Опухоли мягких тканей Enzinger & Weiss .Филадельфия: Эльзевьер; 2013: 1052–1070.
- Milchgrub S, Ghandur-Mnaymneh L, Dorfman HD, et al. Синовиальная саркома с обширным образованием остеоида и кости. Am J Surg Pathol . 1993; 17 (4): 357-363.
- Миеттинен М., Виртанен И. Синовиальная саркома — неправильное название. Ам Дж. Патол . 1984; 117 (1): 18-25.
- Deshmukh R, Mankin HJ, Singer S. Синовиальная саркома: важность размера и местоположения для выживания. Clin Orthop Relat Res . 2004; (419): 155-161.
- Cadman NL, Soule EH, Kelly PJ. Синовиальная саркома; Анализ 34 опухолей. Рак . 1965; 18: 613-627.
- Kransdorf MJ. Злокачественные опухоли мягких тканей в большой популяции, направляемой к специалистам: распределение диагнозов по возрасту, полу и местоположению. AJR Am J Roentgenol . 1995; 164 (1): 129-134.
- Смит М.Э., Фишер С., Уилкинсон Л.С. и др. Синовиальная саркома лишена синовиальной дифференцировки. Гистопатология . 1995; 26 (3): 279-281.
- Haldar M, Hancock JD, Coffin CM, et al.Условная модель синовиальной саркомы на мышах: понимание миогенного происхождения. Раковые клетки . 2007; 11 (4): 375-388.
- Skytting B. Синовиальная саркома. Скандинавский групповой проект саркомы. Acta Orthop Scand Suppl . 2000; 291: 1-28.
- Sistla R, Tameem A, Vidyasagar JVS. Внутрисуставная синовиальная саркома. Индийский Дж. Патол Микробиол . 2010; 53 (1): 115-116.
- Enzinger, FM, Weiss SW. Синовиальная саркома. В: Enzinger, FM, Weiss SW, ред. Опухоли мягких тканей. 3-е изд. Сент-Луис: Мосби; 1995: 757-786.
- Бакри А., Шинагаре А.Б., Краевски К.М. и др. Синовиальная саркома: особенности визуализации общих и необычных первичных локализаций, паттерны метастазов и ответ на лечение. AJR Am J Roentgenol . 2012; 199 (2): W208-215.
- Криг А.Х., Хефти Ф., Спет Б.М. и др. Синовиальные саркомы обычно метастазируют через> 5 лет: многоцентровый ретроспективный анализ с минимальным периодом наблюдения 10 лет для выживших. Энн Онкол . 2011; 22 (2): 458-467.
- Enzinger, FM, Weiss SW. В: Enzinger, FM, Weiss SW, ред. Опухоли мягких тканей . 3-е изд. Сент-Луис: Мосби, 1995: 39
- Mansuy L, Bernier V, Ranchère-Vince D, et al. Синовиальная саркома у детей и подростков. Бычий рак . 2016; 103 (2): 210-218.
- Wilkerson BW, Crim JR, Hung M и др. Характеристика кальцификации синовиальной саркомы. AJR Am J Roentgenol . 2012; 199 (6): W730-734.
- Jones BC, Sundaram M, Kransdorf MJ.Синовиальная саркома: результаты МРТ у 34 пациентов. AJR Am J Roentgenol . 1993; 161 (4): 827-830.
- Hasegawa T, Yokoyama R, Matsuno Y, et al. Прогностическое значение гистологической степени и ядерной экспрессии бета-катенина при синовиальной саркоме. Хум Патол . 2001; 32 (3): 257-263.
- Frazier AA, Franks TJ, Pugatch RD, et al. Из архива AFIP: Плевропульмональная синовиальная саркома. Рентгенография . 2006; 26 (3): 923-940.
- Bixby SD, Hettmer S, Taylor GA и др.Синовиальная саркома у детей: особенности визуализации и распространенные доброкачественные имитации. AJR Am J Roentgenol . 2010; 195 (4): 1026-1032.
- Chee DWY, Peh WCG, Shek TWH. Иллюстрированный очерк: визуализация опухолей оболочек периферических нервов. Can Assoc Radiol J . 2011; 62 (3): 176-182.
- Pilavaki M, Chourmouzi D, Kiziridou A, et al. Визуализация опухолей оболочек периферических нервов с патологической корреляцией: иллюстрированный обзор. Eur J Radiol . 2004; 52 (3): 229-239.
- Enzinger, FM, Weiss SW.Доброкачественные опухоли периферических нервов. В: Enzinger, FM, Weiss SW, ред. Опухоли мягких тканей. 3-е изд. Сент-Луис: Мосби; 1995: 844.
- Каккар С., Шетти С.М., Котешвара П. и др. Признаки периферических нейрогенных опухолей на магнитно-резонансной томографии. Индийская компания J Radiol Imaging . 2015; 25 (4): 453-458.
- Анил Г, Тан Т. КТ и МРТ опухоли оболочек шейного блуждающего нерва. AJR Am J Roentgenol . 2011; 197 (1): 195-201.
- Wasa J, Nishida Y, Tsukushi S и др.Особенности МРТ в дифференциации злокачественных опухолей оболочек периферических нервов и нейрофибром. AJR Am J Roentgenol . 2010; 194 (6): 1568-1574.
- Enzinger, FM, Weiss SW. Доброкачественные опухоли и опухолевидные поражения сосудов. В: Enzinger, FM, Weiss SW, ред. Опухоли мягких тканей. 3-е изд. Сент-Луис: Мосби; 1995: 579
- Enzinger, FM, Weiss SW. Опухоли мягких тканей . 3-е изд. Сент-Луис: Мосби; 1995: 581
- Марчук Д.А. Патогенез гемангиомы. Дж. Клин Инвест . 2001; 107 (6): 665-666.
- Cross JJ, Antoun NM, Laing RJ и др. Визуализация компрессионных гемангиом позвонков. Eur Radiol . 2000; 10 (6): 997-1002.
- Росс Дж. С., Масарик Т. Дж., Модич М. Т. и др. Гемангиомы позвонков: МРТ. Радиология . 1987; 165 (1): 165-169.
- Наварро ОМ. Магнитно-резонансная томография сосудистых аномалий мягких тканей у детей. Педиатр Радиол . 2016; 46 (6): 891-901.
- Шелдон П.Дж., Форрестер Д.М., Лирч Т.Дж.Визуализация внутрисуставных образований. Рентгенография . 2005; 25 (1): 105-119.
- Enzinger, FM, Weiss SW. Доброкачественные липоматозные опухоли. В: Enzinger, FM, Weiss SW, ред. Опухоли мягких тканей. 3-е изд. Сент-Луис: Мосби; 1995: 394
- Болен Дж. В., Торнинг Д. Веретено-клеточная липома. Клиническое, световое и электронно-микроскопическое исследование. Am J Surg Pathol . 1981; 5 (5): 435-441.
- Enzinger FM. Доброкачественные липоматозные опухоли, имитирующие саркому: в Enzinger FM. Лечение первичных опухолей костей и мягких тканей .Чикаго: Издательство «Ежегодник по медицине»; 1977: 11.
- Горелкин Л., Конрад-Инглэнд Р. Липома веретеновидных клеток: доброкачественный вариант липомы с потенциальной опасностью неправильной интерпретации диагностики. South Med J . 1978; 71 (9): 1163-1164.
- МакДэниел РК, Ньюленд-младший, Чилийский генеральный директор. Липома внутриротовых веретеновидных клеток: клинический случай с коррелированной световой и электронной микроскопией. Oral Surg Oral Med Oral Pathol . 1984; 57 (1): 52-57.
- Мейстер П. Липома веретено-клеточная (отчет о 2 случаях и дифференциальный диагноз). Бейтр Патол . 1977; 161 (4): 376-384.
- Bancroft LW, Kransdorf MJ, Peterson JJ, et al. Характеристики изображения веретено-клеточной липомы. AJR Am J Roentgenol . 2003; 181 (5): 1251-1254.
- Frassica FJ, Bhimani MA, McCarthy EF, et al. Пигментный виллонодулярный синовит бедра и колена. Врач Фам . 1999; 60 (5): 1404-1410; обсуждение 1415.
- Murphey MD, Rhee JH, Lewis RB, et al. Пигментный виллонодулярный синовит: лучевая и патологическая корреляция. Рентгенография . 2008; 28 (5): 1493-1518.
- Lynskey SJ, Pianta MJ. МРТ и особенности таллия при пигментном виллонодулярном синовите и гигантоклеточных опухолях влагалищ сухожилий: ретроспективное одноцентровое исследование изображений и обзор литературы. Br J Радиол . 2015; 88 (1056): 20150528.
- Xie G, Jiang N, Liang C, et al. Пигментный виллонодулярный синовит: ретроспективное многоцентровое исследование 237 случаев. PLOS ONE . 2015; 10 (3): e0121451.
- Murphey MD, Rhee JH, Lewis RB, et al.Пигментный виллонодулярный синовит: лучевая и патологическая корреляция. Рентгенография . 2008; 28 (5): 1493-1518.
- Narváez JA, Narváez J, Ortega R, et al. Гипоинтенсивные синовиальные поражения на Т2-взвешенных изображениях: дифференциальный диагноз с патологической корреляцией. AJR Am J Roentgenol . 2003; 181 (3): 761-769.
- Наир А.В., Назар П., Сехар Р. и др. Поражение Мореля-Лавалле: закрытая отслаивающаяся травма, требующая пристального внимания. Индийский журнал радиологии и визуализации .2014; 24 (3): 288-290.
- Kottmeier SA, Wilson SC, Born CT, et al. Хирургическое лечение поражений мягких тканей, связанных с повреждением тазового кольца. Clin Orthop Relat Res . 1996; (329): 46-53.
- Кудск КА, Шелдон Г.Ф., Уолтон Р.Л. Деглобулирующие травмы конечностей и туловища. J Травма . 1981; 21 (10): 835-839.
- Gilbert BC, Bui-Mansfield LT, Dejong S. МРТ поражения Мореля-Лавелле. AJR Am J Roentgenol . 2004; 182 (5): 1347-1348.
- Теджвани С.Г., Коэн С.Б., Брэдли Дж.Лечение поражения колена Мореля-Лавалле: 27 случаев в национальной футбольной лиге. Am J Sports Med . 2007; 35 (7): 1162-1167.
- Mellado JM, Pérez del Palomar L, Díaz L, et al. Давно существующие поражения Мореля-Лавалле вертельной области и проксимального отдела бедра: результаты МРТ у пяти пациентов. AJR Am J Рентгенол . 2004; 182 (5): 1289-1294.
- Enzinger, FM, Weiss SW. Опухоли хрящевых мягких тканей. В: Enzinger, FM, Weiss SW, ред. Опухоли мягких тканей. 3-е изд. Сент-Луис: Мосби; 1995: 997
- Кирици О., Цитас К., Гроллиос Г. Случай идиопатического синовиального хондроматоза бурсальной сумки, напоминающего ревматоидный артрит. Гиппократия . 2009; 13 (1): .
- 61-63.
- Murphey MD, Vidal JA, Fanburg-Smith JC, DA Gajewski. Визуализация синовиального хондроматоза с радиолого-патологической корреляцией. Рентгенография . 2007. 27 (5): 1465–1488.
- Narváez JA, Narváez J, Ortega R, et al.Гипоинтенсивные синовиальные поражения на Т2-взвешенных изображениях: дифференциальный диагноз с патологической корреляцией. AJR Am J Roentgenol . 2003; 181 (3): 761-769.
- Murphey MD, Vidal JA, Fanburg-Smith JC, et al. Визуализация синовиального хондроматоза с лучевой и патологической корреляцией. Рентгенография . 2007; 27 (5): 1465-1488.
- Enzinger, FM, Weiss SW. Доброкачественные опухоли мягких тканей неопределенного типа. В: Enzinger, FM, Weiss SW, ред. Опухоли мягких тканей. 3-е изд.Сент-Луис: Мосби; 1995: 1053
- Thornburg LE. Ганглии кисти и запястья. J Am Acad Orthop Surg . 1999; 7 (4): 231-238.
- Enzinger, FM, Weiss SW. Доброкачественные опухоли мягких тканей неопределенного типа. В: Enzinger, FM, Weiss SW, ред. Опухоли мягких тканей. 3-е изд. Сент-Луис: Мосби; 1995: 1053
- Vanhoenacker FM, Eyselbergs M, Van Hul E, et al. Псевдоопухолевые поражения мягких тканей кисти и запястья: фотообзор. Insights Imaging .2011; 2 (3): 319-333.
- Freire V, Guérini H, Campagna R, et al. Визуализация кист кисти и запястья: клинический подход. AJR Am J Roentgenol . 2012; 199 (5): W618-628.
- Sun L, Zhu Y, Wang H. Ангиолейомиома, редкая внутричерепная опухоль: отчет о 3 случаях и обзор литературы. Мир J Surg Oncol . 2014; 12: 216.
- Рамеш П., Аннапуредди С.Р., Хан Ф. и др. Ангиолейомиома: клинический, патологический и рентгенологический обзор. Инт Дж. Клиническая Практика .2004; 58 (6): 587-591.
- Ратиган Р.М., Ким З.Э. Лейомиома, возникающая рядом с лункой верхнечелюстного зуба: внутрикостная лейомиома, проявляющаяся одотогенным поражением. South Med J 1976; 69 (4): 493-494.
- Голдблатт Л.И., Эдесесс РБ. Центральная лейомиома нижней челюсти. Oral Surg Oral Med Oral Pathol . 1977; 43 (4): 591–597.
- McMillan MD, Ferguson JW, Kardos TB. Сосудистая лейомиома нижней челюсти. Oral Surg Oral Med Pathol . 1985; 62 (4): 427–33.
- Таралло М., Спаньоли А.М., Фино П. и др. Опухоль Массона: опухоль мягких тканей, имитирующая кисту сухожилия: клинический случай. Г Чир . 2012; 33 (1-2): 34-37.
- Clearkin KP, Enzinger FM. Внутрисосудистая папиллярная гиперплазия эндотелия. Arch Pathol Lab Med . 1976: 100 (8): 441-444.
- Махапатра QS, Сахай К., Малик А. и др. Внутрисосудистая папиллярная эндотелиальная гиперплазия: необычное гистопатологическое образование. Индийский дерматол онлайн J . 2015; 6 (4): 277-279.
- Liné A, Sanchez J, Jayyosi L, et al. Папиллярная эндотелиальная гиперплазия (опухоль Массона) у детей. Энн Чир Пласт Эстет . Июнь 2016 г. doi: 10.1016 / j.anplas.2016.05.010.
- Mendenhall N, Lynch JW, Jr. Лимфомы низкой степени злокачественности. Семин Радиат Онкол . 1995; 5: 254-266.
- Matushansky I, Charytonowicz E, Mills J, et al. Классификация MFH: дифференциация недифференцированной плеоморфной саркомы в 21 веке. Expert Rev Anticancer Ther .2009; 9 (8): 1135-1144.
- Enjoyji M, Hashimoto H, Tsuneyoshi M и др. Злокачественная фиброзная гистиоцитома. Клинико-патологическое исследование 130 случаев. Acta Pathol Jpn . 1980; 30 (5): 727-741.
- Murphey MD, Gross TM, Rosenthal HG. Из архивов AFIP. Злокачественная фиброзная гистиоцитома опорно-двигательного аппарата: лучевая и патологическая корреляция. Рентгенограф ICS . 1994; 14 (4): 807-826; викторина 827-828.
- Stacchiotti S, Dagrada GP, Morosi C и др.Экстраскелетная миксоидная хондросаркома: ответ опухоли на сунитиниб. Clin Sarcoma Res . 2012; 2 (1): 22.
- Drilon AD, Popat S, Bhuchar G и др. Внескелетная миксоидная хондросаркома: ретроспективный обзор двух справочных центров, подчеркивающий отдаленные результаты хирургического вмешательства и химиотерапии. Рак . 2008 15; 113 (12): 3364-3371.
- Enzinger, FM, Weiss SW. Опухоли хрящевых мягких тканей. В: Enzinger, FM, Weiss SW, ред. Опухоли мягких тканей. 3-е изд.Сент-Луис: Мосби; 1995: 998.
- Шао Р., Лао И. В., Ван Л. и др. Клинико-патологические и радиологические особенности внескелетной миксоидной хондросаркомы: ретроспективное исследование 40 случаев в Китае с обзором литературы. Энн Диагноз Патол . 2016; 23: 14-20. DOI: 10.1016 / j.anndiagpath.2016.04.004. Epub 2016 13 апреля
- Антонеску CR, Аргани П., Эрландсон Р.А. и др. Скелетная и экстраскелетная миксоидная хондросаркома: сравнительное клинико-патологическое, ультраструктурное и молекулярное исследование. Рак . 1998; 83 (8): 1504-1521.
- Enzinger, FM, Weiss SW. Липосаркома. В: Enzinger, FM, Weiss SW, ред. Опухоли мягких тканей. 3-е изд. Сент-Луис: Мосби; 1995: 431-443
- Wortman JR, Tirumani SH, Jagannathan JP, et al. Первичная липосаркома конечностей: особенности МРТ, гистопатология и клинические результаты. J Comput Assist Tomogr . 2016. DOI: 10.1097 / RCT.0000000000000431.
- Murphey MD, Arcara LK, Fanburg-Smith J. Из архивов AFIP: визуализация скелетно-мышечной липосаркомы с радиологически-патологической корреляцией. Рентгенография . 2005; 25 (5): 1371-1395.
- Райзер М., Зингер А.Д., Эдгар М. и др. Гистологические варианты липосаркомы: прогностические данные МРТ с прогностическим значением, лечение, наблюдение и дифференциальный диагноз. Скелетная радиология . 2016; 45 (9): 1193-1204.
- Enzinger, FM, Weiss SW. Злокачественные опухоли мягких тканей неопределенного типа. В: Enzinger, FM, Weiss SW, ред. Опухоли мягких тканей. 3-е изд. Сент-Луис: Мосби; 1995: 1074-1075
- Hanna SL, Kaste S, Jenkins JJ и др.Эпителиоидная саркома: клинические, МРТ и патологические данные. Скелетная радиология . 2002; 31 (7): 400-412.
- Вт CG, Мадронио С., Мортон Р.Л. и др. Клинические особенности, связанные с людьми с повышенным риском меланомы: популяционное исследование. Дерматол JAMA . 2016 9. doi: 10.1001 / jamadermatol.2016.3327.
- Гавиани П., Маллинс М.Э., Брага Т.А. и др. Улучшенное обнаружение метастатической меланомы с помощью Т2 * -взвешенной визуализации. AJNR Am J Нейрорадиол .2006; 27 (3): 605-608.
новых исследований показывают, что динозавры также страдают от злокачественного рака: NPR
Ученые в Канаде впервые диагностировали злокачественный рак у динозавра, Centrosaurus apertus , , от 76 до 77 миллионов лет назад. Сергей Красовский / Stocktrek Images / Getty Images скрыть подпись
переключить подпись Сергей Красовский / Stocktrek Images / Getty ImagesКанадские ученые впервые диагностировали злокачественный рак у динозавра, Centrosaurus apertus , от 76 до 77 миллионов лет назад.
Сергей Красовский / Stocktrek Images / Getty ImagesУченые из Королевского музея Онтарио в Канаде и Университета Макмастера говорят, что они впервые выявили злокачественный рак кости у динозавра.
Новое исследование было опубликовано ранее на этой неделе в журнале The Lancet Oncology.
Диагноз? Остеосаркома — агрессивный рак кости — малоберцовой кости или кости голени Centrosaurus apertus , однорогого динозавра, питающегося растениями, который жил 76–77 миллионов лет назад.
Это открытие открывает новое понимание других болезней, которые могли развиться у динозавров, среди других аспектов жизни динозавров.
«Это исследование показывает, что, поскольку мы обнаружили рак кости на довольно поздней стадии, это то, что динозавры были поражены не только раком костей, но, вероятно, и другими видами рака, которые мы наблюдаем у позвоночных сегодня», — говорит Дэвид Эванс, палеонтолог. в Королевском музее Онтарио и одним из ведущих исследователей исследования.
Хотя диагноз новый, кость была обнаружена в 1989 году.Именно тогда команда из Королевского музея Тиррелла в Драмхеллер, Канада, обнаружила малоберцовую кость в массивном костном ложе в Альберте, Канада.
Малоберцовая кость была сильно деформирована, но ученые сначала оценили ее как заживающую сломанную кость, а причудливую форму — мозолистый перелом.
Кость находилась в коллекции музея до 2017 года, когда команда под руководством Эванса и Марка Кроутера, профессора патологии в Университете Макмастера, начала поиск среди сотен травмированных или частично исцеленных костей во время миссии.
«По сути, мы охотились на рак динозавров», — говорит Эванс.
Эванс, Кроутер и Снежана Попович, остеопатолог из McMasters, прочесали сотни костей, прежде чем обнаружили необычно деформированную малоберцовую кость, чтобы исследовать ее на наличие признаков рака.
Они привлекли специалистов в различных областях, включая патологию, радиологию, ортопедическую хирургию и палеопатологию, чтобы исследовать и диагностировать подозреваемую опухоль.
« Подход, который мы использовали в этом случае, был очень похож на то, как мы подходим к пациенту с новой опухолью, и мы не знаем, что это за опухоль», — говорит Сепер Эхтиари, хирург-ортопед. резидент Университета Макмастера, работавший в команде.
Они смогли визуализировать прогрессирование рака через кость, выполнив компьютерную томографию малоберцовой кости с высоким разрешением и изучив тонкие срезы кости на клеточном уровне под микроскопом.
Команда подтвердила диагноз остеосаркомы, сравнив кость с малоберцовой костью здорового центрозавра и человека с остеосаркомой.
Два изображения голени (малоберцовой кости) Centrosaurus apertus со злокачественным раком кости (остеосаркома).Обширная инвазия рака по всей кости (желтый) предполагает, что он сохранялся в течение значительного периода жизни динозавра и, возможно, распространился на другие части тела до смерти. Королевский музей Онтарио / Университет Макмастера скрыть подпись
переключить подпись Королевский музей Онтарио / Университет МакмастераХотя это первый выявленный случай остеосаркомы у динозавров, Эхтиари говорит, что имеет смысл предположить, что рак, связанный с быстрым ростом костей, поразил динозавров.
«Один из способов, которым они достигли таких огромных размеров, — это то, что они очень быстро росли с момента своего рождения», — говорит Эхтиари. «Так что обнаружение этого у динозавра неудивительно». На самом деле, по его словам, рак костей «вероятно, встречается чаще, чем мы думаем, или более распространен, чем мы обнаружили до сих пор».
Патолог Кроутер добавляет, что их открытие предполагает, что динозавры, вероятно, страдали другими заболеваниями, поражающими кости, такими как туберкулез и остеомиелит.
Несмотря на то, что это указывает на потенциальную причину смерти динозавров, открытие рака также дало представление о том, как они жили и выживали.
Возьмите больного центрозавра. Хотя он был бы серьезно затруднен из-за поздней стадии рака, обнаруженного в его малоберцовой кости, он не умер от болезни и не был схвачен хищником, таким как Tyrannosaurus rex . Его кости были найдены в массивном костяном ложе, который, по мнению ученых, является частичными останками большого стада, затопленного наводнением.
«Рак смог развиться до той стадии, на которой он развился, благодаря сохранности численности стада, в котором он жил», — говорит палеонтолог Эванс.
Хотя открытие открывает множество новых дверей в палеонтологии и патологии, одним из самых значительных результатов исследования может стать изменение нашего восприятия динозавров.
«Мы часто думаем о динозаврах как о мифических могущественных существах, и я думаю, что это открытие действительно подчеркивает, что они могут страдать от болезней, которые мы наблюдаем сегодня вокруг нас, даже от ужасных смертельных раковых заболеваний», — говорит Эванс.«Я думаю, что странным образом это еще больше возвращает их к жизни».
Рак кости — Болезни и состояния
Лечение рака костей зависит от типа рака костей, степени его распространения и общего состояния здоровья. Основными видами лечения являются хирургия, химиотерапия и лучевая терапия.
Ваш план лечения
Вашим лечением должен управлять специализированный центр, имеющий опыт лечения рака костей, где за вами будет ухаживать группа различных медицинских специалистов, известная как многопрофильная команда (MDT).
В состав MDT войдут, в частности, хирург-ортопед (хирург, специализирующийся на хирургии костей и суставов), клинический онколог (специалист по безоперационному лечению рака) и медсестра-специалист по онкологическим заболеваниям.
Ваш MDT порекомендует вам то, что, по его мнению, является лучшим лечением, но окончательное решение будет за вами.
Ваш рекомендуемый план лечения может включать комбинацию:
- Операция по удалению части пораженной раком кости — часто можно восстановить или заменить удаленную кость, хотя иногда требуется ампутация.
- Химиотерапия — лечение мощными противораковыми препаратами
- лучевая терапия — где радиация используется для уничтожения раковых клеток
В некоторых случаях также может быть рекомендовано лекарство под названием мифамуртид.
Хирургия
Операция по удалению злокачественной области кости является важной частью лечения рака кости, хотя ее часто сочетают с другими видами лечения, упомянутыми ниже.
В настоящее время обычно можно полностью избежать удаления пораженной части тела (это называется операцией по сохранению конечностей), хотя до 1 из 10 человек может нуждаться в окончательном удалении конечности (ампутации).
Конечносохраняющая хирургия
Операция с сохранением конечностей обычно возможна, если рак не распространился за пределы кости и кость может быть восстановлена.
Наиболее распространенный тип операции по сохранению конечностей включает удаление части пораженной кости и части окружающей ткани (на случай, если какие-либо раковые клетки распространились в ткань).
Затем удаленный участок кости можно заменить металлическим имплантатом, называемым протезом, или куском кости из другого места вашего тела (костный трансплантат).
Если опухоль находится рядом с суставом, например коленом, возможно, удастся удалить сустав и заменить его искусственным.Узнайте больше о замене коленного сустава и замене тазобедренного сустава.
Ампутация
Ампутация может потребоваться, если операция по сохранению конечностей невозможна или не дала результатов. Например, может понадобиться, если:
- рак распространился за пределы кости в крупные кровеносные сосуды или нервы
- у вас развилась инфекция после операции по сохранению конечностей, и вам пришлось удалить протез или костный трансплантат
- рак развился в части тела, где операция по сохранению конечностей технически невозможна, например, в голеностопном суставе.
Ваша медицинская бригада поймет, какой шок и страх вы или ваш ребенок можете испытывать, если потребуется ампутация, и сможет предоставить вам консультации и другую поддержку.В некоторых случаях ваша медицинская бригада может познакомить вас с кем-то, кто уже перенес ампутацию.
После ампутации большинство людей заменяют удаленную конечность протезом. Эти конечности сейчас очень развиты и удобны в использовании. Например, люди с протезом ноги часто могут ходить, бегать и заниматься спортом, и у них отличное качество жизни.
Восстановление после операции
После операции по сохранению конечностей или ампутации вам понадобится помощь, чтобы вернуться к нормальной жизни.Это называется реабилитацией.
Реабилитация обычно включает сеансы физиотерапии, когда вы выполняете упражнения, чтобы помочь восстановить надлежащую функцию в обработанной части тела, и трудотерапию, где вас обучают навыкам, которые помогут вам справляться с повседневными делами.
После ампутации вас могут направить в местный центр лечения конечностей для получения совета, поддержки и реабилитационного лечения. Узнайте больше о жизни с ампутацией.
Химиотерапия
Существует четыре способа химиотерапии для лечения рака костей.Может использоваться:
- перед операцией, чтобы уменьшить опухоль и облегчить операцию
- в сочетании с лучевой терапией перед операцией (химиолучевой) — этот подход особенно хорошо работает при лечении саркомы Юинга
- после операции, чтобы предотвратить возвращение рака
- для контроля симптомов в случаях, когда излечение невозможно (известная как паллиативная химиотерапия)
Химиотерапия при раке костей включает прием комбинации различных лекарств, которые обычно вводятся через капельницу в вену или по трубопроводу, введенному в более крупный кровеносный сосуд.
Лечение обычно проводится циклами. Цикл включает в себя прием химиотерапевтических препаратов в течение нескольких дней, а затем перерыв на несколько недель, чтобы ваше тело могло оправиться от последствий лечения. Количество необходимых циклов будет зависеть от типа и степени рака кости.
Побочные эффекты
Химиотерапия может повредить как здоровые, так и раковые клетки, что означает, что она часто вызывает ряд побочных эффектов.
Общие побочные эффекты химиотерапии включают:
Большинство побочных эффектов, связанных с химиотерапией, исчезнут после завершения лечения.Однако есть риск навсегда остаться бесплодным. Ваша медицинская бригада предоставит более подробную информацию о конкретном риске для вашей фертильности.
Подробнее о побочных эффектах химиотерапии
Радиотерапия
Как и химиотерапия, лучевая терапия может использоваться до и после операции для лечения рака костей или для контроля симптомов и замедления распространения рака, когда излечение невозможно.
Радиотерапия рака кости включает в себя пучки радиации, направленные на пораженный раком участок кости с помощью внешнего аппарата.
Обычно это дается на ежедневных занятиях пять дней в неделю, каждое занятие длится несколько минут. Весь курс лечения обычно длится несколько недель.
Побочные эффекты
Излучение, которому вы подвергаетесь во время лучевой терапии, будет в основном сосредоточено на раковых клетках, но здоровые клетки поблизости также могут быть повреждены. Это может привести к таким побочным эффектам, как:
- покраснение и раздражение кожи (может ощущаться как солнечный ожог)
- Боль в суставах в обрабатываемой части тела
- плохое самочувствие
- Выпадение волос в обрабатываемой части тела
- усталость
Эти побочные эффекты проходят после завершения лучевой терапии, хотя чувство усталости может сохраняться в течение нескольких недель.
Подробнее о побочных эффектах лучевой терапии
Мифамуртид
Для людей с типом рака костей, называемым остеосаркомой, наряду с лечением, описанным выше, можно использовать лекарство под названием мифамуртид.
Мифамуртид — стимулятор иммунных макрофагов. Это означает, что он работает, побуждая иммунную систему производить специализированные клетки, которые убивают раковые клетки.
Обычно рекомендуется для молодых людей с остеосаркомой высокой степени и назначается после операции в сочетании с химиотерапией, чтобы предотвратить повторение рака.
Мифамуртид медленно вводится в одну из ваших вен в течение часа (это называется инфузией). Рекомендуемый курс лечения обычно составляет два раза в неделю в течение 12 недель, а затем один раз в неделю в течение следующих 24 недель.
Побочные эффекты
Мифамуртид может вызывать широкий спектр побочных эффектов. Сюда могут входить:
- тошнота и рвота
- понос или запор
- головная боль
- головокружение
- потеря аппетита
- усталость и слабость
Неясно, безопасно ли принимать мифамуртид во время беременности, поэтому в качестве меры предосторожности важно использовать эффективный метод контрацепции, если вы сексуально активная женщина.Вам нужно будет как можно скорее сообщить об этом своему врачу-терапевту, если вы считаете, что беременны, и вам следует избегать грудного вскармливания во время приема мифамуртида.
Последующая деятельность
По окончании лечения вам необходимо будет регулярно посещать контрольные приемы, чтобы убедиться, что рак не вернулся.
Вам будет предложено часто посещать приемы в течение первых двух лет после завершения лечения — возможно, каждые три месяца. С годами они станут реже.
Обратитесь к своему специалисту или терапевту, если у вас снова появятся симптомы рака костей и вы считаете, что рак, возможно, вернулся.
Адамантинома | Фонд исследования рака костей
Пациенты с различными типами первичного рака кости оцениваются одинаково. По этой причине диагностические тесты более подробно описаны в разделе «О первичном раке костей».
Цель этого раздела — предоставить информацию о конкретных деталях диагностики адамантиномы и обсудить другие состояния, которые могут быть диагностически похожими на адамантиному.
К врачу
Симптомы адамантиномы общие. Нет одного четкого признака, который врачи могли бы легко найти, чтобы поставить диагноз адамантиномы.
Люди сообщают о различных переживаниях, когда обращаются за медицинской помощью по поводу своих симптомов. Большинство людей с тревожными симптомами обращаются к своему терапевту.
Некоторые пациенты обращаются в отделение неотложной помощи местной больницы или другие медицинские центры.
Некоторых людей быстро направляют для дальнейших анализов или получения второго мнения, но часто пациенты должны возвращаться к своему терапевту три или четыре раза, прежде чем их направят на дополнительные анализы.Первичный рак костей очень редок, и многие врачи никогда не сталкиваются с подобными случаями.
Если терапевт или больничный врач обеспокоен симптомами пациента, им следует соблюдать национальные правила. Согласно рекомендациям Национального института клинического мастерства (NICE) по подозрению на рак кости и саркому:
- Детям, подросткам и молодым людям с необъяснимым отеком костей или болями в костях следует срочно сделать рентгеновский снимок в течение 48 часов. Если рентгеновский снимок указывает на возможный рак кости, ваш терапевт должен направить вас к специалисту в течение 48 часов.
- Взрослые должны быть осмотрены специалистом в течение 2 недель, если результаты рентгена указывают на рак кости.
Если рентген в норме, но симптомы сохраняются, за пациентом следует наблюдать и / или повторить рентген или МРТ в течение 2 недель (взрослый) или в течение 48 часов (ребенок) или запросили направление к специалисту.
Инициатива по повышению осведомленности о раке костей
Фонд исследования рака костей пытается найти способы сократить время между появлением симптомов и постановкой диагноза.Наш отчет об обследовании пациентов за 2020 год является наиболее полным анализом симптомов и способов диагностики первичного рака и опухолей костей в Великобритании на сегодняшний день. Это наша доказательная база, на которой мы будем сосредоточивать наши дальнейшие усилия по повышению осведомленности.
В отчете основное внимание уделяется двум основным областям — времени и способам постановки диагноза, а также диапазону симптомов во всех анатомических местах и формах первичного рака костей и опухолей костей.
Наш анализ показал, что пациенты ждут, в среднем, более 7 месяцев и совершают 8 посещений нескольких медицинских работников , прежде чем получить точный диагноз.
Обращение в центр по лечению рака костей для проведения дополнительных анализов
Как только в кости обнаруживается аномалия, указывающая на возможность рака, пациента направляют в хирургический центр по лечению рака костей.
Хирургические центры при раке костей — это специализированные больницы. У них есть группа медицинских специалистов, которые являются экспертами в диагностике и лечении рака костей.
В Англии в настоящее время существует пять центров рака костей, которые специализируются на диагностике и лечении первичного рака костей.Эти центры находятся в Бирмингеме, Ньюкасле, Освестри, Оксфорде и Стэнморе.
В Ирландии нет специализированных центров по лечению рака костей. Пациенты сначала осматриваются в своей местной больнице, а затем направляются в специализированные больницы в Дублине или Корке для дальнейших анализов и, при необходимости, для лечения.
Пациенты из Уэльса обычно едут в Освестри или Бирмингем для прохождения этих специализированных тестов.
В Шотландии есть пять центров саркомы, поэтому пациенты едут в один из этих центров для диагностики, если есть подозрение на первичный рак кости.Эти центры находятся в Эдинбурге, Глазго, Инвернессе, Абердине и Данди.
В Северной Ирландии пациентов обычно принимают в Белфасте.
Чтобы просмотреть полный список мест, куда могут обратиться пациенты для подтверждения диагноза первичного рака кости, щелкните здесь
The MDT
Специалисты в различных областях медицины в центрах рака костей, Региональных онкологических центрах в Великобритания и больницы Ирландии работают вместе как «многопрофильная команда» (MDT).Члены MDT работают вместе, чтобы диагностировать состояние пациента.
В состав MDT входят:
- Хирурги-специалисты по лечению саркомы.
- Специалист по онкологии саркомы (онкологи — это врачи, которые ухаживают за больными раком).
- Специалист по патологии саркомы (патологи — это врачи, которые используют лабораторные методы для диагностики заболеваний).
- Радиологи (врачи, которые диагностируют заболевания и состояния на основе рентгеновских снимков или снимков).
- Специалисты по уходу за раком саркомы (иногда называемые «ЦНС»), которые играют важную роль в лечении и уходе за пациентами с первичным раком костей.
Какие тесты проводятся?
Когда человека направляют в хирургический центр по лечению рака костей, будут проведены дополнительные обследования, чтобы узнать больше и подтвердить, есть ли у пациента рак кости, и если да, то какого типа.
Эти тесты могут включать:
Рентген
Могут быть сделаны рентгеновские снимки костей, включая суставы сверху и снизу, и их изучение. Эти рентгеновские лучи могут показать опухоль вокруг кости или участки аномального роста кости. Иногда делается рентген грудной клетки, чтобы показать, распространился ли рак на легкие.Cancer Research UK предоставляет дополнительную информацию о рентгеновских лучах.
Анализы крови
К ним относятся:
-
- Химический состав крови (мочевина и электролиты) проверяется для определения уровней нормальных солей и мочевины и креатинина, которые являются продуктами жизнедеятельности. Этот тест может дать ключ к пониманию того, насколько хорошо работают почки.
- Полный анализ крови (FBC) подсчитывает количество различных типов клеток крови в крови пациента на данный момент.
- Красные кровяные тельца — переносят кислород в кровь.
- Белые кровяные тельца — важные для иммунной системы (и в целом для каждого типа).
- Тромбоциты — необходимы для образования тромбов и струпьев.
- Уровни гемоглобина, который содержится в красных кровяных тельцах.
- Функциональные пробы печени (LFT), чтобы увидеть, как работает печень.
- Скорость оседания эритроцитов (СОЭ) — это тест для выявления признаков воспаления.
- Уровни C-реактивного белка (CRP) проверяются по мере увеличения уровня CRP при воспалении.
- Уровни щелочной фосфатазы (ЩФ) измеряются у пациентов с подозрением на остеосаркому.
Cancer Research UK предоставляет дополнительную информацию об анализах крови.
МРТ
МРТ означает «магнитно-резонансная томография». Этот тип сканирования похож на компьютерную томографию, но вместо рентгеновских лучей используются магнетизм и радиоволны для создания очень подробного трехмерного изображения.
МРТ всей кости используется для получения дополнительной информации об опухоли в кости.Также используется инъекция специального красителя, известного как контрастное вещество. Это делает определенные ткани более четкими и детализированными на сканированном изображении. Результаты сканирования будут изучены радиологом, и будет составлен отчет. Некоторым пациентам также может быть проведено МРТ всего тела для поиска областей аномалий в других костях, таких как распространение опухоли (метастазы).
Cancer Research UK предоставляет дополнительную информацию о МРТ.
КТ
КТ означает «компьютерная томография».Их также можно назвать компьютерной томографией, что означает «компьютеризированная аксиальная томография».
Сканер делает рентгеновские снимки под разными углами, а компьютер создает трехмерное изображение тела с мельчайшими подробностями. На фотографиях показаны сечения внутренней части кузова.
КТ легких выявляет любые вторичные опухоли, по которым рак мог распространиться (метастазы). Он используется, если результаты МРТ не подтвердили диагноз остеосаркомы.
Cancer Research UK предоставляет дополнительную информацию о компьютерной томографии.
КТ и МРТ не могут точно диагностировать адамантиному. Однако они предоставляют важную информацию о точном местонахождении опухоли, стадии опухоли и наличии опухоли, распространившейся где-либо еще в организме. Кроме того, эти сканирования полезны для планирования лечения отдельных пациентов и принятия решения о наилучшем способе хирургического удаления опухоли (2).
ПЭТ сканирование
ПЭТ означает позитронно-эмиссионную томографию.«Не во всех больницах есть ПЭТ-сканеры, но они используются для обнаружения распространения или метастазов при остеосаркоме.
ПЭТ-сканирование позволяет исследовать все тело, а не определенную область. Они также могут определить, насколько эффективно лечение.
Перед сканированием будет сделана небольшая инъекция радиоактивной глюкозы (радиоактивного индикатора) под названием фтор18.
Трассирующий агент распространяется по телу примерно за час. Во время сканирования, которое может длиться около часа, пациент лежит на кровати, и сканер проходит над ним.Сканер определяет, где сосредоточено излучение, и создает изображения. Горячие точки на ПЭТ-сканировании позволяют обнаружить метастазы.
Результаты сканирования проверит рентгенолог.
Cancer Research UK предоставляет дополнительную информацию о ПЭТ-сканировании.
Биопсия
Биопсия кости необходима для подтверждения диагноза адамантиномы. Биопсия кости — это специализированная процедура, которую может выполнить специалист в области ортопедической хирургии или радиологии саркомы в хирургическом центре рака кости.Биопсия включает в себя взятие небольшого образца шишки или опухоли, чтобы патолог мог исследовать клетки в образце и определить, является ли шишка злокачественной или нет.
Биопсия может быть «иглой» или «открытой биопсией».
- Игольная биопсия: в опухоль вводится игла, чтобы извлечь небольшое количество опухолевой ткани (это можно сделать под местной анестезией). Часто, чтобы точно знать, где взять образец, этот тест проводится вместе с рентгеновским снимком или компьютерной томографией, чтобы помочь врачу.
- Открытая биопсия (или хирургическая биопсия): используется реже, чем игольная биопсия. Эта форма биопсии проводится во время небольшой операции по удалению небольшого фрагмента опухоли под общим наркозом. Этот тест, как правило, используется, если пункционная биопсия не позволяет поставить диагноз и врач желает провести дальнейшее исследование.
Cancer Research UK предоставляет дополнительную информацию о биопсии костей. .
Биопсия кости необходима для подтверждения диагноза адамантиномы.Эта специальная процедура берет небольшой образец опухоли, чтобы его мог исследовать патолог. Это включает в себя просмотр образца под микроскопом и выполнение специальных тестов на определенные белки и молекулы костного матрикса, специфичные для этого типа опухоли.
Для получения результатов биопсии может потребоваться до двух недель, и они позволяют врачам подтвердить наличие адамантиномы.
Альтернативный диагноз?
При диагностике адамантиномы возраст пациента и история болезни играют большую роль в дифференциации этой редкой опухоли от других заболеваний.Эти состояния здоровья могут проявляться аналогично адамантиноме с точки зрения симптомов и признаков, но важно поставить правильный диагноз, чтобы обеспечить подходящее лечение. Местоположение предполагаемой адамантиномы помогает подтвердить диагноз (2).
Подтверждение диагноза первичного рака кости после биопсии иногда может занять много времени, потому что эти опухоли редки и иногда их трудно идентифицировать. Заболевания с похожими симптомами или признаками известны как «дифференциальные диагнозы».
Другие состояния, которые могут проявляться так же, как адамантинома, включают:
Костно-фиброзная дисплазия — доброкачественное (незлокачественное) детское заболевание, которое регрессирует в возрасте около 20 лет. Между костно-фиброзной дисплазией и адамантиномой есть сходство, например расположение опухоли и их внешний вид на рентгеновском снимке. Возраст пациента, когда появляются симптомы, является основным фактором дифференциации адамантиномы от костно-фиброзной дисплазии (4,7).
Фиброзная дисплазия — это необычное заболевание костей, которое чаще всего встречается у подростков и молодых людей. Это происходит, когда на месте нормальной кости образуется рубцовидная ткань (фиброзная ткань). Пациенты испытывают боль в длинных костях тела, таких как руки или ноги, аналогично адамантиноме (4).
Остеомиелит — это воспаление (покраснение, отек, боль и / или ощущение жара) кости или костного мозга, вызванное бактериальной или грибковой инфекцией.Инфекция может попасть в кость через кровоток или через прямую травму, которая оставляет глубокий порез или открытую рану. Это состояние часто поражает длинные кости тела, такие как большеберцовая кость (большеберцовая кость), и вызывает боль в костях (5).
Неосифицирующие фибромы являются наиболее распространенной доброкачественной (незлокачественной) детской опухолью кости, однако у большинства пациентов нет никаких симптомов. Эти опухоли возникают в большеберцовой кости (большеберцовой кости) и регрессируют после того, как костная структура пациента полностью сформировалась.Расположение этой доброкачественной опухоли очень похоже на адамантиному, и поэтому возраст пациента, когда появляются симптомы, является основным фактором в дифференциации адамантиномы от неосифицирующей фибромы (8).
Если диагноз адамантиномы подтвердится, вам потребуется лечение в центре лечения опухолей костей.
Для получения дополнительной информации о местонахождении Центров рака костей нажмите здесь.
5 приложений, которые помогают обнаружить изменения кожи, которые могут привести к раку кожи
Меланома — один из самых серьезных видов рака кожи.Одна из причин, по которой меланома классифицируется как серьезный рак кожи, заключается в том, что она может распространяться на другие части тела.
Ваша кожа состоит из трех слоев:
- Эпидермис — самый внешний слой кожи
- Дерма — средний слой, содержащий кровеносные сосуды и соединительную ткань
- Гиподерма — нижний слой жира
Внешний слой кожи (эпидермис) содержит специализированные клетки, называемые меланоцитами, которые производят пигмент нашей кожи (естественный цвет).Меланома возникает, когда эти меланоциты начинают бесконтрольно размножаться и образуют раковую опухоль.
Факты о меланоме
У пациентов может развиться меланома из существующей доброкачественной родинки — вы начнете замечать изменения во внешнем виде родинки. Но вы также можете увидеть новую родинку, которая отличается от других ваших родинок.
Знаете ли вы, что меланома может возникнуть где угодно на вашем теле? Меланома развивается не только на руках и ногах, но также может развиваться на коже головы, под ногтями, в области гениталий и даже на подошвах ног.
Меланома редко может развиваться на слизистых оболочках тела, включая глаза, задний проход и влагалище.
В следующем году в Соединенных Штатах Америки меланомой разовьется чуть более 100 000 человек.
Факторы риска меланомы
Если у вас есть один из этих факторов риска меланомы, разумно начать самообследование кожи. Как и в случае с другими видами рака, раннее обнаружение спасает жизни. Вот некоторые из факторов риска меланомы.
- Воздействие солнца. Жизнь на больших высотах или в местах, где солнце ярко светит круглый год, подвергает вас более высокому риску рака кожи. Повышенному риску подвержены и люди, которые регулярно работают на открытом воздухе.
- Солнечные ожоги. Всего пять солнечных ожогов в жизни удваивают риск меланомы.
- Загар в помещении. Солярии повышают риск развития меланомы и других видов рака кожи.
- Родинки. Если у вас много родинок, называемых диспластическими невусами, вы подвержены повышенному риску развития меланомы.
- Светлая кожа. Люди со светлой кожей, голубыми или зелеными глазами, светлыми или рыжими волосами, веснушками или кожей, которая легко обжигается, имеют более высокий риск развития меланомы.
- Семейная история. Если у вас есть родственник первой степени родства (мать, отец, брат, сестра или ребенок), страдающий меланомой, ваш риск развития меланомы на 2–3 выше среднего. Этот риск может быть связан с тем, где вы живете — выше или ближе к экватору. А если у вас есть близкие родственники, которые живут в разных местах, где развивается меланома, ваш риск увеличивается.
- Предыдущий анамнез рака кожи. Если у вас был базально-клеточный или плоскоклеточный рак кожи, вы подвержены повышенному риску развития меланомы.
- Гонка. Заболеваемость меланомой у белых в двадцать раз выше, чем у чернокожих.
Возраст иногда считается фактором риска. Однако правда в том, что меланома бывает в любой возрастной группе, даже у подростков. Половина людей с диагнозом меланома старше 50 лет — это означает, что у взрослых до 50 лет такая же вероятность развития меланомы.Меланома чаще встречается у молодых людей, чем при многих других видах рака. До 50 лет меланома чаще встречается у женщин; после 50 чаще встречается у мужчин.
Вы можете узнать больше о факторах риска и профилактике меланомы, посетив наш раздел, посвященный меланоме.
Советы для самостоятельного обследования кожи
Специалисты рекомендуют ежемесячный осмотр кожи. Ежемесячный самообследование позволяет вам узнать, как выглядят ваши родинки, чтобы вы могли обнаружить изменения.Ежемесячный осмотр также позволит вам увидеть новые родинки.
Рекомендации ABCDE — это простой и удобный способ проводить ежемесячный осмотр кожи.
- A — Асимметрия. Если вы посмотрите на родинку меланомы, половинки не совпадают. Левый край может иметь другую форму, чем правый, или одна сторона родинки может быть темнее другой.
- B — Граница. Меланомы имеют кайму неправильной формы; граница может быть размытой, неровной, зубчатой или зубчатой.
- C- Цвет. Родинки разного цвета могут быть меланомой. Вы можете увидеть несколько оттенков коричневого или коричневого, смешанные с пятнами черного. На более крупных меланомах могут появляться пятна синего, розового, красного или белого цвета.
- D — Диаметр или темнота. Родинки размером более четверти дюйма (диаметр ластика карандаша) могут быть меланомой. Будьте бдительны, если одна родинка значительно темнее других ваших родинок.
- E — Развитие. «Развитие» означает изменение или прогрессирование — в размере, форме или цвете, или оно становится зудящим или начинает кровоточить.
Также обратите внимание на Гадкий утенок — родинку, которая значительно отличается от ближайших кротов. Меланома может отличаться от других родинок, потому что она темнее, светлее, больше или меньше. Единственная родинка на большом участке кожи, на которой нет других родинок, тоже считается «гадким утенком».
Около четверти меланом возникает из существующих родинок. Поразительные 75% появляются в виде новообразований на коже.
Цветные люди более склонны к развитию меланом в местах, не подверженных воздействию солнца.У них более вероятно возникновение меланомы на ладони, подошве стопы или под ногтем на руке или на ноге.
Раннее выявление является ключевым моментом — пятилетняя выживаемость составляет 99% при раннем обнаружении меланомы.
Пять приложений, которые помогут вам отслеживать изменения кожи
Есть несколько способов отслеживать родинки и другие изменения кожи. Старый школьный способ заключался в том, чтобы иметь бумажную «карту тела», которую вы использовали, чтобы отмечать родинки, наросты или другие подозрительные пятна.Многие люди предпочитают продолжать использовать бумажный метод, и это нормально. Однако есть и другие варианты, если вы предпочитаете вести записи в цифровом виде, включая приложения для смартфонов.
Несколько приложений для смартфонов могут помочь вам отслеживать изменения кожи и изменения конкретных родинок. Эти приложения полезны, но они не заменяют посещения дерматолога, когда вы обнаруживаете родинки, которые выглядят подозрительно. Всегда помните, что лучше сделать ошибку, попросив дерматолога взглянуть на любые кожные новообразования, которые выглядят иначе или появляются и быстро растут.
Эти приложения доступны как для телефонов Apple, так и для Android.
- Мийскин . Miiskin — платное приложение премиум-класса. Он использует фотографию в высоком разрешении, чтобы делать снимки больших частей вашего тела. Приложение позволяет пользователю сравнивать отдельные родинки с течением времени, чтобы обнаружить изменения.
- МольМаппер . MoleMapper — результат усилий биолога-онколога, помогающего своей жене. Орегонский университет здоровья и науки сотрудничал с Apple и Sage Bionetworks при разработке этого приложения.Это доступно бесплатно. OHSU помогает врачам контролировать подозрительные поражения без ежемесячных личных посещений.
- Молескоп . Пользователи должны приобрести устройство, которое подключается к их смартфону. Фотографии, сделанные с помощью приставки, отправляются дерматологу для онлайн-оценки.
- SkinVision . Это платное приложение разработало совет дерматологов. Приложение использует алгоритм глубокого обучения, чтобы проанализировать вашу фотографию родинки и в течение минуты оценить, является ли она высокой.
- UMSkinCheck . Это приложение Медицинской школы Мичиганского университета является бесплатным. UMSkinCheck позволяет пользователям проводить полное обследование на предмет рака кожи и отслеживать изменения с течением времени. Это приложение дает полезные советы о том, как провести осмотр кожи. Приложение хранит ваши базовые фотографии для сравнения. Он также предлагает напоминания о необходимости регулярно проверять состояние кожи.
Раннее обнаружение подозрительных родинок спасает жизни и помогает предотвратить обезображивание из-за того, что пациент слишком долго ждал обращения к дерматологу.Обязательно включайте в свой распорядок ежемесячный самообследование кожи.
Источники
- https://www.cancer.net/cancer-types/melanoma/introduction
- https://stayskinhealthy.org/
- https://www.skincancer.org/
- https://www.uofmhealth.org/patient%20and%20visitor%20guide/my-skin-check-app
- https://www.skinvision.com/
- https://www.molescope.com/
- https://molemapper.org/
МРТ опухолей мягких тканей стопы и голеностопного сустава | Взгляд на визуализацию
Подошвенный фиброматоз
Подошвенная фасция — это структура соединительной ткани, которая помогает поддерживать продольный свод стопы.Он простирается от медиального бугорка пяточной кости, покрывает короткий сгибатель пальцев и разделяется на ветви, которые входят в плюснево-фаланговые суставы. Различают центральную и боковую связки, из средней части центральной полосы выходит более тонкая медиальная полоса.
Подошвенный фиброматоз (болезнь Леддерхозы) — распространенное доброкачественное пролиферативное заболевание подошвенной фасции, состоящей из фибробластов и коллагеновых волокон. Это происходит преимущественно в 4–6-м десятилетии, причем мужчины поражаются чаще, чем женщины.Двустороннее заболевание присутствует в 20–50% случаев, а множественные узелки — в 33% [14,15,16,17,18,19,20,21,22]. Это чаще встречается у людей с диабетом, эпилепсией и избытком алкоголя [19]. Существует связь с другими фиброзными заболеваниями, такими как ладонный фиброматоз (болезнь Дюпюитрена), который сосуществует в 40% случаев, и фиброматоз полового члена (болезнь Пейронни) [14, 15, 18]. Чаще поражаются дистальные две трети, хотя встречаются и проксимальные узелки [16, 17]. Он проявляется как дискретно пальпируемое образование, которое обычно не вызывает болезненных ощущений, если только оно не очень большое.
Одного ультразвука может быть достаточно для диагностики подошвенного фиброматоза. Он выглядит как веретенообразная гипоэхогенная или неоднородная масса, возникающая из подошвенной фасции [16, 19]. Точно так же на МРТ это видно как веретенообразное образование, исходящее из подошвенной фасции, чаще медиальное, чем латеральное [16, 17]. Обычно он неоднороден по интенсивности сигнала, гипоинтенсивен для скелетных мышц на T1-взвешенных (T1W) изображениях и изо-гиперинтенсивен для скелетных мышц на T2-взвешенных (T2W) изображениях (рис. 1) [14,15,16,17, 18,19,20,21].Ранние поражения являются более клеточными и имеют тенденцию быть более гиперинтенсивными на изображениях T2W, тогда как более зрелые поражения имеют тенденцию быть более фиброзными с низким сигналом на T2W [15]. Глубокий край часто не очень хорошо отграничен от подлежащей мышцы, но поверхностный край обычно четко определяется. Он демонстрирует переменное усиление при постконтрастной визуализации, которое обычно не требуется для диагностики [14, 17].
Рис.1Подошвенная фиброма. a Сагиттальный T2 жир с подавлением (T2FS) и ( b ) коронарное T1-взвешенное изображение стопы, демонстрирующее неоднородную массу с центром на подошвенной фасции, отличную от подлежащей мускулатуры.Показаны характерные линейные полосы с низким сигналом (стрелки).
Глубокий фиброматоз
Глубокий фиброматоз — это редкое, локально агрессивное поражение, состоящее из фибробластов, встроенных в коллагеновый матрикс, с пиковым возрастом начала между 25 и 40 годами. Несколько чаще встречается у женщин [14, 15]. На одной конечности могут возникать множественные поражения. Обычно это безболезненное образование, но может иметь местный массовый эффект, приводящий к соударению или нервной компрессии. И подошвенный, и глубокий фиброматоз характеризуются инфильтративным характером роста и имеют тенденцию к местным рецидивам после хирургической резекции, причем последняя является более агрессивной.Фиброматоз не дает метастазов [15].
На МРТ он имеет изменчивый вид, отражающий изменчивый состав поражения (рис. 2). Масса имеет тенденцию расти вдоль фасциальных плоскостей и может вызывать смещение или закрытие соседних сухожилий, связок и мышц. Эта тенденция к росту вдоль фасции или апоневроза известна как «признак фасциального хвоста» и описывается до 80% случаев, хотя и не специфична для этого состояния [23]. На соседнюю кость может быть эрозия под давлением.Поражение, как правило, равно интенсивному мышце на T1W и изо-гиперинтенсивному на T2W с усилением на постконтрастной визуализации. Полосообразные очаги слабого сигнала на всех последовательностях были описаны как характерная находка. Эти полосы коллагена с низким сигналом показывают незначительное усиление или его отсутствие при постконтрастной визуализации, что также наблюдается при старых, зрелых или обработанных лучевой терапией поражениях [14, 15, 18, 24].
Рис. 2Глубокий фиброматоз. Осевые изображения T1W ( a ) и T2FS ( b ), показывающие образование на тыльной стороне стопы.На T1W масса одинакова с мышечной массой. На T2FS масса гиперинтенсивна с линейными полосами коллагена с низким сигналом (стрелки)
Oka et al. предположили, что диффузионно-взвешенная визуализация может помочь дифференцировать десмоидные опухоли от злокачественных опухолей мягких тканей, при этом фиброматоз показывает более высокий коэффициент видимой диффузии (ADC), чем злокачественные опухоли [25]. Для подтверждения этой техники требуются более масштабные исследования.
Гемангиома
Поражения, обычно называемые гемангиомами, относятся к спектру сосудистых аномалий.Стремясь стандартизировать номенклатуру этой гетерогенной группы поражений, Международное общество по изучению сосудистых аномалий (ISSVA) опубликовало пересмотренную систему классификации, которая делит сосудистые поражения на неопластические опухоли и неопухолевые пороки развития. Сосудистые мальформации подразделяются на капиллярные, лимфатические, венозные, артериовенозные и комбинированные. Существуют отдельные категории поражений, связанных с крупными названными сосудами, поражений, связанных с другими аномалиями, и временно неклассифицированных сосудистых аномалий [26].
Поражения вокруг стопы и лодыжки обычно относятся к категории сосудистых мальформаций. Они могут быть поверхностными или глубокими и могут быть связаны с жиром, фиброзной тканью и / или гладкими мышцами, часто адаптируя свою форму к соседним структурам. На их долю приходится 7% доброкачественных поражений мягких тканей стопы и голеностопного сустава [17]. Чаще всего они появляются в возрасте до 30 лет и часто протекают бессимптомно, но могут проявляться болью после упражнений, вторичной по отношению к феномену местного сосудистого обкрадывания [13].Голубоватое изменение цвета кожи — классический результат осмотра. Рентгенограммы полезны для демонстрации флеболитов и могут показать ассоциированную периостальную реакцию или утолщение коры [1].
На МРТ сосудистые мальформации могут быть хорошо или плохо очерченными поражениями с небольшим влиянием массы для своего размера (рис. 3). У них может быть высокий сигнал на T1W, отражающий содержание жира или внутреннее кровотечение. Большинство из них представляют собой медленные поражения, которые выглядят гиперинтенсивно на Т2 и могут демонстрировать жидкостно-жидкостные уровни.Поражения с высокой степенью кровотока (артериовенозные мальформации) демонстрируют серпигинозные пустоты. Флеболиты могут быть видны как очаги слабого сигнала на всех последовательностях, и их следует соотносить с простой пленочной рентгенографией. Поражения с высоким потоком обычно демонстрируют сильное усиление, но иногда могут проявлять отсроченное усиление. Картина усиления отражает состав поражения и характеристики потока вовлеченного подтипа сосуда. Атрофия в соседней мышце может быть вызвана обкрадыванием сосудов, а также может иметь место перилезионное кровотечение [14, 15, 17, 27].
Рис. 3Сосудистая мальформация. a Axial T1W и ( b ) изображения плотности протонов с подавлением жира (PDFS) голеностопного сустава, демонстрирующие сосудистую мальформацию с низким потоком над латеральной стороной пяточной кости с отсроченным многоузловым усилением (стрелки) на постконтрастном изображении T1FS ( c )
Ангиомиома
Также известная как сосудистая лейомиома или ангиолейомиома, это редкая подкожная лейомиома, чаще всего возникающая у женщин в 4-6-м десятилетии.Он имеет склонность к нижним конечностям, чаще всего в области стопы и лодыжки [14, 15, 28]. Обычно это небольшие (<2 см) медленно растущие, болезненные, круглые или яйцевидные опухоли, возникающие из мелких сосудов в глубоких слоях дермы или подкожно-жировой клетчатки, и состоят из мелких сосудистых каналов в гладких мышцах [14, 15, 28].
На МРТ обычно наблюдается фиброзная капсула со слабым сигналом. В редких случаях они могут вызывать эрозию прилегающих костей под давлением. Они имеют тенденцию быть слегка гиперинтенсивными на Т1-взвешенных изображениях и неоднородными на Т2-взвешенных изображениях с заметным усилением в сосудистом компоненте (рис.4) [14, 15, 28].
Рис.4Ангиомиома. Осевое T1W ( a ), сагиттальное T2FS ( b ) и постконтрастное T1FS ( c ) изображения голеностопного сустава, демонстрирующие четко выраженное поражение, прилегающее к ахиллову сухожилию, которое выглядит одинаково интенсивным на T1W, гиперинтенсивным на T2W и сильно улучшается при постконтрастной визуализации. Обратите внимание на капсулу, видимую на T2FS (стрелки)
Липома
Это доброкачественные инкапсулированные опухоли, состоящие из зрелых адипоцитов. Липомы — это наиболее частая опухоль мягких тканей в организме, но нечасто в области стопы и голеностопного сустава [14, 16, 18, 19].На МРТ липомы следуют сигналу подкожно-жировой клетчатки (рис. 5), являясь гиперинтенсивной на Т1- и Т2-взвешенных изображениях и демонстрируя равномерную потерю сигнала на последовательностях подавления жира [14,15,16,17,18, 27]. Многие липомы содержат внутренние перегородки. Наличие утолщенных перегородок (> 2 мм), узелков увеличивающихся мягких тканей, быстро растущих болезненных очагов или поражений с содержанием жира менее 75% должно вызывать опасения по поводу злокачественности, хотя липосаркома стопы и голеностопного сустава встречается редко [14, 17].Изменение сигнала может происходить в липомах в местах, несущих нагрузку, вторичных по отношению к воспалению, кровотечению и инфаркту [14, 15]. Когда липомы возникают в мышцах, мышечные волокна, пересекающие очаг поражения, могут имитировать утолщенные перегородки, и следует проявлять осторожность, чтобы не путать это с признаками злокачественности [14].
Рис.5Липома. Осевые изображения голеностопного сустава T1W ( a ) и PDFS ( b ), демонстрирующие инкапсулированное поражение (стрелки). Поражение изоинтенсивно жиру на Т1 с равномерной потерей сигнала на PDFS, что соответствует липоме
Хондрома мягких тканей
Доброкачественная внекостная внесиновиальная хрящевидная опухоль, состоящая из зрелого гиалинового хряща, которая развивается в мягких тканях, не прикрепленных к кости [14 , 15, 19].Существует небольшой перевес у мужчин, и большинство поражений возникает на руках и ногах [14, 15, 19].
МРТ демонстрирует хорошо разграниченную дольчатую массу мягких тканей, изоинтенсивную по отношению к хрящу, от низкого до среднего сигнала на T1W и гиперинтенсивную на T2W (рис. 6). Могут быть центральные сигнальные пустоты, соответствующие минерализации, что может быть лучше видно при простой пленочной рентгенографии [17, 19]. Большие поражения бывает трудно отличить от внекостной хондросаркомы, которая является нечастой злокачественной опухолью, и первичное поражение стопы встречается редко [13, 15].
Рис.6Хондрома мягких тканей. Осевые изображения T1W ( a ) и T2FS ( b ) голеностопного сустава с большой четко выраженной заднемедиальной массой (стрелки), которая проявляется гипоинтенсивным T1 и гиперинтенсивным T2 с внутренними слабосигнальными хондроидными очагами (наконечники стрелок). Хондроидный матрикс легко увидеть на соответствующей рентгенограмме ( c )
Пигментный виллонодулярный синовит и гигантоклеточная опухоль влагалища сухожилия
Пигментный виллонодулярный синовит (ПВНС) — доброкачественное пролиферативное внутрисуставное заболевание синовиальной оболочки.Гигантоклеточная опухоль (ГКТ) влагалища сухожилия — несколько более частое внесуставное проявление заболевания, которое может поражать сумки, сухожилия и связки [14,15,16]. Они могут возникать в любом возрасте, но предпочтительнее 3-4-го десятилетия [14,15,16]. И гигантоклеточная опухоль, и ПВНС состоят из многоядерных гигантских клеток с внутрисуставным и внесуставным отложением гемосидерина, макрофагов, фибробластов и клеток ксантомы [1, 13]. Гиперваскулярный характер этих поражений часто приводит к кровотечениям.ПВНС обычно является моноартикулярным и чаще всего поражает голеностопные и предплюсневые суставы, проявляясь болезненным отеком суставов [16, 18]. GCT чаще встречается в переднем отделе стопы и обычно представляет собой безболезненное медленнорастущее образование [16, 17, 19].
PVNS обычно не содержит минерализации, но может быть виден в виде плотных выделений на простых рентгенограммах [16, 19]. T1W обычно показывает смешанные мягкие ткани со средним или низким уровнем сигнала в пораженном суставе, в зависимости от относительной доли содержания жира, коллагена и гемосидерина (рис.7). На градиентно-эхо-визуализации наблюдается характерное «поседение» продуктов гемосидерина; однако это не является специфическим для PVNS, и дифференциация этого внешнего вида должна включать гемофилию, амилоид и ревматоидный артрит [16, 19]. Масса мягких тканей демонстрирует неоднородное усиление, и могут быть четко выраженные эрозии и кисты с тонкими склеротическими краями с обеих сторон пораженного сустава [14]. GCT похож на PVNS, но связан с сухожилием и чаще гомогенно гипоинтенсивен с более однородным усилением (рис.8) [1]. Основным отличием для GCT является фиброма оболочки сухожилия, которая может иметь похожий внешний вид, но менее распространена и не демонстрирует «цветения» на последовательностях градиент-эхо [16, 17].
Рис.7PVNS. Корональные T1 ( a ) и аксиальные T2FS ( b ) изображения голеностопного сустава демонстрируют обширную аномальную мягкую ткань с промежуточным сигналом на T1W и гипоинтенсивным на T2FS
Рис. 8Гигантоклеточная опухоль влагалища сухожилия. Изображение Sagittal T2FS показывает гетерогенное гиперинтенсивное поражение под плюсневой костью, связанное с сухожилием сгибателя. b Градиентное эхо-изображение показывает очаги расцвета (наконечник стрелки)
Синовиальный остеохондроматоз
Синовиальный остеохондроматоз — это заболевание синовиальной оболочки, приводящее к метапластическим узелкам разрастания хрящей в суставах, сумке или влагалищах сухожилий, которые переходят в [1] минеральные оболочки [1] . У мужчин он встречается вдвое чаще, чем у женщин, и чаще всего проявляется в 3-5-м десятилетии [14, 16, 19]. Он часто бывает моноартикулярным, но может быть двусторонним [16]. Злокачественное превращение во вторичную синовиальную хондросаркому встречается редко.
На поздней стадии обычные рентгенограммы или КТ могут продемонстрировать многочисленные внутрисуставные минерализованные тела с вторичным остеоартритом. На ранних стадиях заболевания неминерализованные внутрисуставные тела представляют собой более сложный диагноз. В начальной фазе пролиферации типично дольчатое внутрисуставное поражение с сигналом от среднего до слегка гиперинтенсивного на T1W и высоким сигналом на T2W (рис. 9) [14, 16, 19]. Позже минерализованные узелки можно рассматривать как сигнальные пустоты на всех последовательностях или как окостеневшие тела с низким сигналом коры головного мозга и центральным сигналом от жирового костного мозга [14, 16, 19].Корреляция с рентгенологическими данными может быть полезна для дальнейшего определения и классификации любых очагов минерализации. Постконтрастная визуализация показывает усиление гиперпластической синовиальной оболочки, более выраженное на более ранней стадии [14, 16].
Рис. 9Синовиальный хондроматоз. a сагиттальное изображение T2FS голеностопного сустава, демонстрирующее дольчатое гиперинтенсивное поражение T2 с ободком низкого сигнала (стрелки) и b яркое синовиальное усиление при постконтрастной визуализации T1FS (стрелки). c Минерализация лучше видна на соответствующей рентгенограмме (стрелки).
Опухоли оболочки периферических нервов
Нейрофиброма и шваннома относительно редко встречаются вокруг стопы и голеностопного сустава, составляя соответственно 5,4% и 3,9% всех доброкачественных поражений мягких тканей в этой области [12]. Чаще всего они возникают на 3–4-м десятилетии и часто представляют собой медленно растущие безболезненные образования, хотя могут присутствовать неврологические симптомы [18, 20]. Большинство из них представляют собой изолированные поражения, но при нейрофиброматозе I типа могут наблюдаться множественные или плексиформные поражения [16, 20].
Эти поражения обычно имеют яйцевидную форму, одинаковую интенсивность со скелетными мышцами на T1W и гиперинтенсивную на T2W с неоднородным усилением (рис. 10) [16, 20, 27, 29]. Считается, что некоторые классические особенности МРТ указывают на опухоли нервных оболочек [18, 20, 29]. Знак «расщепленный жир» описывает тонкий ободок жира, охватывающий поражение, что лучше всего видно на T1W. Можно увидеть, как исходный нерв входит в очаг поражения и выходит из него, что называется знаком «мяч на веревочке». «Целевой знак» описывает периферический высокий сигнал с центральным низким сигналом на поперечном сечении поражения T2W и чаще встречается при нейрофибромах.Однако это неспецифично и также может наблюдаться как при шванноме, так и при злокачественных опухолях оболочки нервов [20]. Шванномы обычно расположены эксцентрично и отделяются от нерва во время операции, тогда как нейрофибромы имеют тенденцию проникать в нерв, что требует жертвы нерва при резекции [18, 20].
Рис.