ABC-медицина
Атеросклероз – это хроническое заболевание артерий, которое возникает из-за нарушения жирового и белкового обмена и сопровождается отложением холестерина и липопротеидов на внутренних стенках сосудов. Эти отложения формируются в виде бляшек. Из-за последующего разрастания в них соединительной ткани (склероза) и кальциноза стенок сосудов происходит деформация и сужение просвета вплоть до закупорки сосуда. Основная опасность атеросклероза – это существенное повышение риска развития ишемической болезни сердца. Из-за того что заболевание становится главной причиной этой и других серьезных проблем со здоровьем, профилактике и лечению атеросклероза нужно уделить должное внимание.
Лечение атеросклероза является комплексным и включает целый ряд мероприятий, связных с коррекцией образа жизни, изменением питания, отказом от вредных привычек, а также проведением медикаментозного лечения, способствующего восстановлению нормального обмена веществ в организме.
Причины и факторы риска атеросклероза
:max_bytes(150000):strip_icc()/GettyImages-480792117-56b9e2923df78c0b1367f154.jpg) В современном мире формирование атеросклероза начинается естественным образом примерно с 10–15 лет. С возрастом этот процесс может замедляться, а может ускоряться. Существует также целый ряд факторов риска развития атеросклероза, которые ускоряют образование бляшек.
В современном мире формирование атеросклероза начинается естественным образом примерно с 10–15 лет. С возрастом этот процесс может замедляться, а может ускоряться. Существует также целый ряд факторов риска развития атеросклероза, которые ускоряют образование бляшек.
Пол. Мужчины в большей степени подвержены развитию атеросклероза, чем женщины. Первые симптомы данной проблемы могут быть заметны уже с 45 лет или ранее, у женщин – только с 55 лет. Предположительно это связано с более активным участием эстрогенов и липопротеидов низкой и очень низкой плотности в обмене холестерина.
Возраст. С возрастом проявления атеросклероза становится заметнее, это естественный фактор риска.
Наследственность. В увеличении интенсивности развития атеросклероза значительную роль играют такие наследственные факторы, как уровень гормонального фона, активность иммунной системы, наследственная дислипопротеидемия (нарушение липидного профиля плазмы).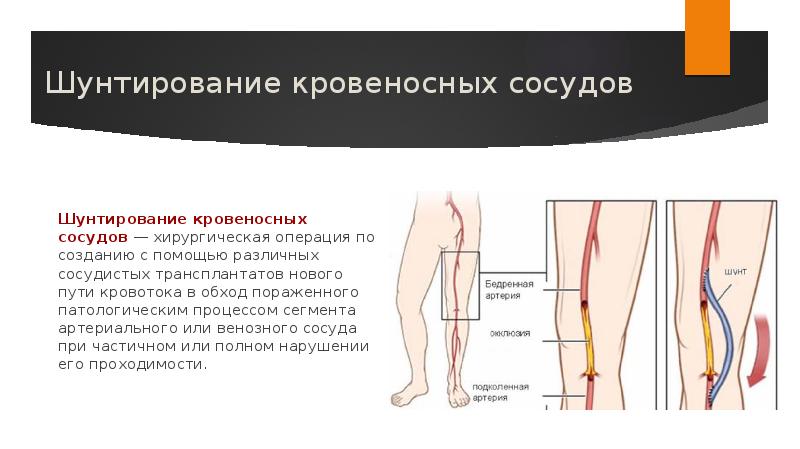
Вредные привычки. Доказано, что курение способствует формированию холестериновых бляшек на стенках сосудов. Как и алкоголь, оно приводит к регулярному и систематическому повышению артериального давления, которое усугубляет течение атеросклероза и негативно сказывается на работе сердца.
Лишний вес. У людей с избыточной массой тела в крови повышена концентрация холестерина. В итоге на ослабленных участках сосудов образуются атеросклеротические бляшки.
Сахарный диабет. Атеросклероз при диабете имеет ряд особенностей: он протекает более агрессивно, имеется склонность к осложненным поражениям с образованием аневризм, развивается при диабете в более раннем в возрасте.
Питание.
 Во многом из-за особенностей питания риск развития сердечно-сосудистых заболеваний у представителей восточных народов (китайцев, японцев) ниже, чем у европейцев, а продолжительность жизни больше.
Во многом из-за особенностей питания риск развития сердечно-сосудистых заболеваний у представителей восточных народов (китайцев, японцев) ниже, чем у европейцев, а продолжительность жизни больше.
Симптомы атеросклероза
Симптомами атеросклероза (нарушенного кровоснабжения тканей) являются:
- холодные конечности и изменение их цвета на синюшно-белый;
- неприятные ощущения в области сердца, учащенное сердцебиение;
- ухудшение памяти и плохая концентрация внимания;
- изменение настроения на преобладающее нервное и раздражительное;
- ощущение общей усталости и разбитости.
Симптомами атеросклероза мозга являются ишемия мозга и ухудшение мозговых функций, что проявляется ослаблением памяти, снижением интеллектуальных способностей, изменением психики. Атеросклероз почечных артерий вызывает ишемию почек и артериальную гипертензию. Симптомами атеросклероза артерий ног являются похолодание ног, болевые ощущения в икрах во время ходьбы.
При появлении первых признаков атеросклероза следует сразу обратиться к врачу, так как на ранней стадии развития процесс можно остановить, изменив свой образ жизни.
Последствия атеросклероза
Поскольку в основе атеросклероза лежит расстройство липидного (жирового) обмена в организме, приводящее к поражению стенок кровеносных сосудов, заболевание может способствовать частичному или полному нарушению функций любого органа. Последствия атеросклероза могут предс тавлять серьезную опасность для здоровья и жизни человека. К числу основных возможных осложнений относятся следующие.
Коронарная болезнь сердца. Атеросклероз может привести к развитию нарушений сердечного ритма, стенокардии, инфаркту миокарда и внезапной остановке сердца, поскольку сужение коронарных сосудов приводит к тому, что сердечная мышца недополучает кислород, и сердце, компенсируя его дефицит, усиливает свою работу.
Нарушение работы мозга. Без лечения атеросклероз головного мозга может привести к ухудшению кровоснабжения мозга и, как следствие, инсульту, параличам, систематическим головным болям, головокружениям, расстройству зрения и слуха, нарушению глотания и речи и др. Ухудшение кровообращения в тканях глаз приводит к постепенному снижению остроты зрения, которое не получается компенсировать. Поэтому важно вовремя уделить внимание лечению атеросклероза мозга.
Тромбоз брыжеечных артерий. Атеросклероз может спровоцировать острую закупорку артерий, обеспечивающих кровоснабжение кишок, о чем свидетельствуют сильные боли в животе.
Сморщенная почка. Нехватка кислорода в тканях может привести к постепенному разрушению почечной ткани, на месте которой образуется соединительная рубцовая ткань. Почка уменьшается в размерах и частично теряет свои функции.
Диагностика атеросклероза
Для диагностики атеросклероза выполняется полное обследование, в которое входят сбор жалоб врачом, определение наличия факторов риска, непосредственный осмотр пациента с измерением артериального давления и выявлением наличия или отсутствия:
- нарушений сердечного ритма;
- нарушений липидного обмена;
- шумов в области сердца.
Для диагностики атеросклероза и определения наличия проводимости импульсов и нарушений сердечного ритма зачастую выполняется электрокардиограмма (ЭКГ). Обследование может включать ультразвуковое исследование (УЗИ) сердца и органов брюшной полости, измерение уровня холестерина в крови, допплерографию сосудов конечностей.
Профилактика и лечение атеросклероза
К лечению атеросклероза сосудов мозга и другим разновидностям заболевания следует подходить комплексно и проводить его по нескольким направлениям.
Немедикаментозная терапия. Ее можно рассматривать и в качестве профилактики заболевания. Суть процесса сводится к устранению факторов риска и коррекции образа жизни пациента. Человек должен правильно питаться, поддерживать оптимальную массу тела, повысить физическую активность, отказаться от вредных привычек, минимизировать стрессовые факторы.
Медикаментозная терапия. Ее применяют, если снизить уровень холестерина в крови не удается за счет изменения образа жизни и диеты. В лечении используются такие группы препаратов, как статины (тормозят синтез холестерина), фибраты (ускоряют ферменты для расщепления липидов в крови), секвестры желчных кислот (препятствуют всасыванию холестерина из продуктов), никотиновая кислота и ее производные (ускоряют превращения жиров) и др.
В лечении используются такие группы препаратов, как статины (тормозят синтез холестерина), фибраты (ускоряют ферменты для расщепления липидов в крови), секвестры желчных кислот (препятствуют всасыванию холестерина из продуктов), никотиновая кислота и ее производные (ускоряют превращения жиров) и др.
Терапия сопутствующих заболеваний. Лечение атеросклероза сосудов нерационально без лечения заболеваний, провоцирующих его развитие: сахарного диабета, артериальной гипертонии, ожирения и др.
Хирургическое лечение. Оно применяется при наличии поражений стенок артерий, которые нарушают кровоснабжение определенной части тела и не могут быть устранены иными путями. Зачастую методы хирургического лечения атеросклероза сосудов предусматривает удаление пораженных тканей или тромба, протезирование сосуда.
Атеросклероз является серьезной проблемой, которую необходимо вовремя устранить для предотвращения более серьезных последствий. Если Вы хотите пройти обследование для выявления причин и лечения атеросклероза, Вы можете обратиться за помощью к специалистам «ABC-Медицина».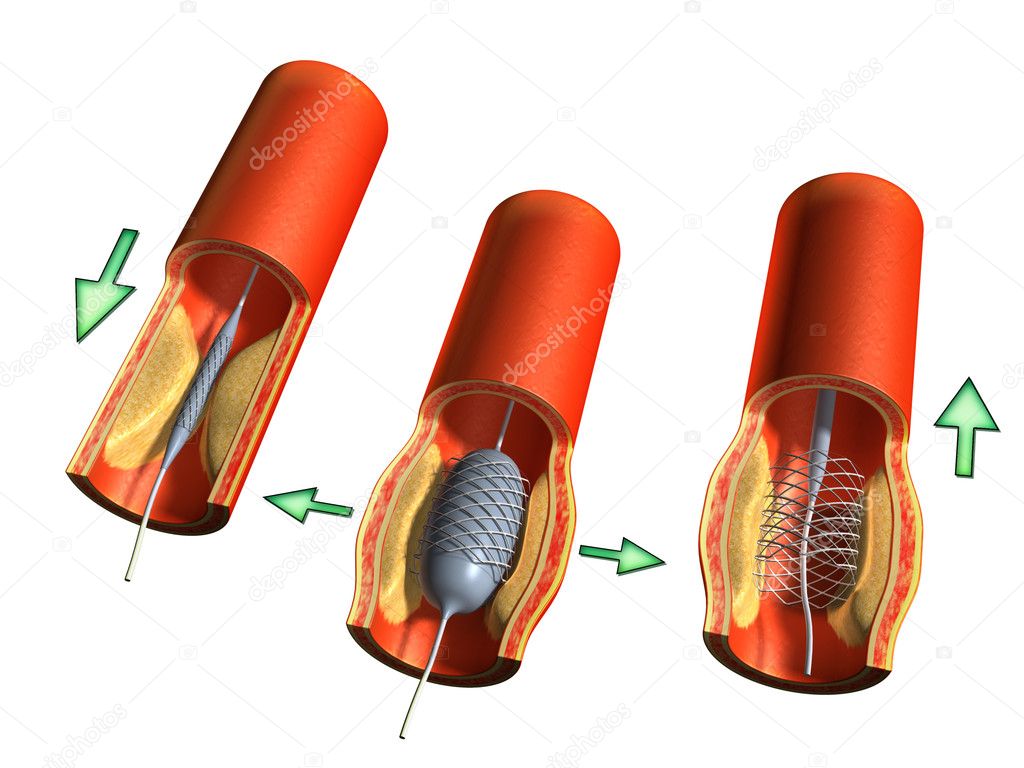
Атеросклероз сонных артерий, инсульт, транзиторные ишемические атаки (ТИА)
Что такое атеросклероз сонных артерий?
Атеросклероз сонных артерий — это заболевание, при котором имеется сужение или полное перекрытие крупных кровеносных сосудов на шее, называемых сонными артериями. Сонные артерии отходят от аорты, затем проходят на шее, и далее, в полость черепа, неся кровь к головному мозгу.
Атеросклероз сонных артерий чаще развивается у пожилых людей. Только 1 процент взрослых в возрасте 50-59 лет имеет значительное сужение сонных артерий, но в возрасте старше 70 лет уже 10% пациентов имеют это заболевание.
В норме артерии имеют гладкую и ровную поверхность изнутри. Но при атеросклерозе в стенке артерии откладывается рыхлая субстанция, состоящая из холестерина, кальция и фиброзной ткани, образуя атеросклеротическую бляшку, которая и суживает просвет сосуда. Атеросклеротическая бляшка может расти, значительно изменяя нормальный ток крови по артерии. Кроме того, ее поверхность может разрушаться, в результате чего мельчайшие кусочки содержимого бляшки отрываются и закрывают сосуды головного мозга. Это ведет к развитию инсульта.
Атеросклеротическая бляшка может расти, значительно изменяя нормальный ток крови по артерии. Кроме того, ее поверхность может разрушаться, в результате чего мельчайшие кусочки содержимого бляшки отрываются и закрывают сосуды головного мозга. Это ведет к развитию инсульта.
Риск развития атеросклероза можно значительно снизить, если отказаться от курения. Кроме того необходимо:
- Вести активный образ жизни (регулярные физические упражнения)
- Соблюдать диету с низким потреблением холестерина
- Контролировать свой вес
Если у вас сахарный диабет, повышенный уровень артериального давления, холестерина в крови, необходимо принять ряд дополнительных мер для снижения риска развития атеросклероза.
Каковы симптомы заболевания?
Атеросклероз сонных артерий может никак не проявляться на ранних стадиях. К сожалению, очень часто первым проявлением этого заболевания является инсульт. Однако у ряда пациентов, развитию инсульта предшествуют, так называемые транзиторные ишемические атаки (ТИА). При этом появляются временные симптомы нарушения мозгового кровоснабжения (продолжительностью от нескольких минут до 1 часа):
Однако у ряда пациентов, развитию инсульта предшествуют, так называемые транзиторные ишемические атаки (ТИА). При этом появляются временные симптомы нарушения мозгового кровоснабжения (продолжительностью от нескольких минут до 1 часа):
- Ощущение слабости, онемения или покалывания на одной половине тела, например, в правой руке и ноге
- Невозможность контролировать движения в руке или ноге
- Потеря зрения на один глаз
- Невозможность внятно говорить
Эти симптомы обычно полностью проходят в течение 24 часов. Однако, вы не должны игнорировать их.
Появление вышеописанных симптомов означает, что имеется очень высокий риск развития инсульта. Необходимо немедленно обратиться к врачу. Если подобные симптомы не проходят в течение нескольких часов, то это говорит о развитии инсульта. Необходимо немедленно обратиться к врачу.
Какие исследования необходимо выполнить?
Во время беседы врачу следует рассказать о ваших жалобах, а так же о том, курите вы или нет и бывают ли у вас подъемы артериального давления.
Так же врач поинтересуется, когда и как часто появляются жалобы. При осмотре, врач при помощи фонендоскопа прослушает область над сонными артериями, так как при прохождении крови через суженный сосуд появляется шум.
Для подтверждения наличия атеросклероза сонных артерий выполняется специальное исследование — дуплексное сканирование. В большинстве случаев этого исследования бывает достаточно, чтобы определить насколько поражены артерии и выбрать метод лечения. Однако в ряде случаев необходимо выполнить компьютерную томографию (КТ), магнитнорезонансную томографию (МРТ), или ангиографическое исследование.
Лечение
Выбор метода лечения производится на основе данных о степени поражения сонных артерий, наличия или отсутствия симптомов, так же учитывается общее состояние пациента. На ранних стадиях, специалист может порекомендовать медикаментозное лечение и изменение образа жизни.
При наличии сопутствующих заболеваний, при которых ускоряется развитие атеросклероза, будут даны дополнительные рекомендации. Например, при диабете, необходимо контролировать нормальный уровень сахара крови. Если имеется повышенное артериальное давление, врач назначит лекарственные препараты для его нормализации. Если вы курите, необходимо бросить. Если повышен уровень холестерина крови, необходимо соблюдать специальную диету, иногда назначают специальные препараты (статины) для снижения уровня холестерина.
Например, при диабете, необходимо контролировать нормальный уровень сахара крови. Если имеется повышенное артериальное давление, врач назначит лекарственные препараты для его нормализации. Если вы курите, необходимо бросить. Если повышен уровень холестерина крови, необходимо соблюдать специальную диету, иногда назначают специальные препараты (статины) для снижения уровня холестерина.
Хирургическое лечение
Если имеется значительное поражение сонных артерий, может потребоваться хирургическое лечение. Признаками серьезного заболевания являются транзиторные ишемические атаки, недавно перенесенный инсульт. Однако у значительного числа больных жалобы могут отсутствовать даже при очень тяжелом поражении сонных артерий.
Хирургическая операция заключается в удалении атеросклеротической бляшки. Эта процедура называется каротидная эндартерэктомия.
Как показывает наш опыт, эта операция, в руках опытных специалистов, достаточно безопасна и, как правило, не сопровождается осложнениями.
Эндоваскулярные методики
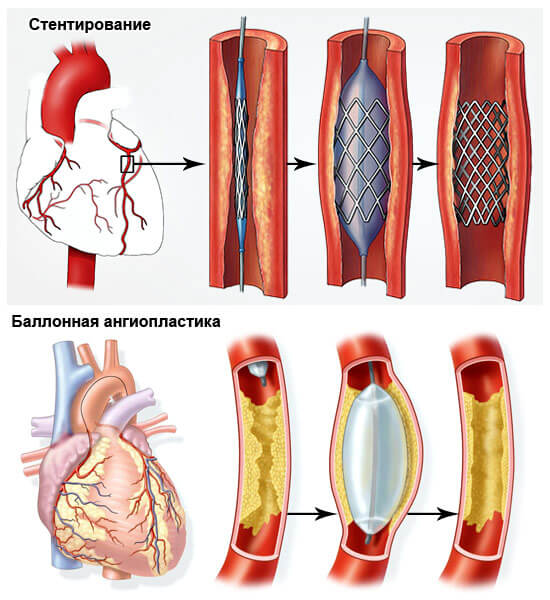
Наряду с традиционными операциями при атеросклерозе сонных артерий, могут быть применены более новые методы лечения. К ним относится баллонная ангиопластика и стентирование.
Метод заключается в том, что через небольшой прокол артерии на бедре или плече, в просвет сонной артерии вводится длинная узкая трубка называемая катетером. Катетер проводят к месту сужения сосуда, где устанавливают специальное металлическое устройство — стент. Стент расширяет просвет артерии и служит каркасом, который поддерживает нормальную проходимость сосуда.
В настоящее время данную методику применяют в основном у пациентов с выраженными сопутствующими заболеваниями (например, сердечная недостаточность), для которых обычная хирургическая операция связана с высоким риском осложнений.
Что нужно предпринять чтобы оставаться здоровым?
Изменение стиля жизни может остановить прогрессирование атеросклероза сонных артерий. Первый шаг — необходимо бросить курить. Борьба с ожирением, регулярные физические упражнения и диета с низким содержанием холестерина могут значительно снизить риск развития атеросклероза.
Стеноз артерий — цены на лечение, симптомы и диагностика кисты головного мозга в «СМ-Клиника»
Лечением данного заболевания занимается КардиологНужна дополнительная информация?
Спасибо за оставленную заявку.
Наш оператор свяжется с вами с 8:00 до 22:00
Заявки, поступившие после 22:00, будут обработаны на следующий день.
Нужна дополнительная информация?
Не нашли ответ на свой вопрос?
Оставьте заявку и наши специалистыпроконсультируют Вас.
Спасибо за оставленную заявку.
Наш оператор свяжется с вами с 8:00 до 22:00
Заявки, поступившие после 22:00, будут обработаны на следующий день.
Спасибо за обращение.
Ваша заявка принята.
Наш специалист свяжется с Вами в ближайшее время
Описание заболевания
Стенозом артерий называется патологическое состояние кровеносных сосудов, характеризующееся сужением их просвета. В большинстве случаев причина развития заболевания заключается в атеросклеротическом поражении артерий, когда на их стенках откладываются холестериновые бляшки. С течением времени патология прогрессирует от стадии небольшого сужения до полной закупорки (непроходимости) сосуда.Стеноз артерий является крайне опасным состоянием, которое при отсутствии лечения способно стать угрозой для жизни человека. В зависимости от того, какая именно артерия закупорена, могут страдать те или иные жизненно важные органы – головной мозг, сердце, почки, легкие и т.д. Стеноз – главная причина ишемического инсульта, инфаркта миокарда и других серьезных болезней. В связи с этим необходимо обращаться за медицинской консультацией к специалисту уже при первых симптомах сосудистой патологии.
Симптомы
На ранних стадиях стеноз артерий никак себя не проявляет. В этом заключается главная опасность заболевания: человек может длительное время жить, не догадываясь о нависшей над ним угрозе.Дальнейшая клиническая картина болезни напрямую зависит от места локализации поврежденной стенозом артерии. Так, при поражении сосудов головного мозга у человека наблюдаются проявления недостаточного кровообращения и питания мозга; при закупорке артерий сердца больной чувствует симптомы сердечной недостаточности и т.д.
Симптомы сужения просвета сонной артерии
Сонная артерия отвечает за поступление питательных веществ к головному мозгу. При нарушении ее проходимости возникают следующие проявления:- головокружение
- потемнение в глазах
- шум в ушах
- слабость
Часто стеноз артерий предшествует ишемическому инсульту. Распознать патологию можно по следующим симптомам:
- тошнота и рвота
- сложности с координацией
- головная боль
- проблемы с речью
- онемение одной из конечностей и половины лица
Симптомы стеноза артерий ног
Сужение просвета сосудов нижних конечностей, в отличие от стеноза сонной артерии, нетрудно распознать на любой стадии. К основным проявлениям заболевания относятся:
К основным проявлениям заболевания относятся:- бледность кожи ног
- боли в ногах
- хромота
- слабость в мышцах ног
- возникновение язв на конечностях
Симптомы стеноза артерий сердца
О закупорке сосудов сердца говорят следующие симптомы:- одышка
- учащение пульса
- боль в области груди
- отеки конечностей
Симптомы стеноза почечных артерий
Стеноз почечных артерий провоцирует развитие ишемической нефропатии – почечной недостаточности. Патологическое состояние характеризуется несколькими признаками:- артериальная гипертензия
- скудное мочевыделение
- отечность конечностей и лица
- слабость, низкая работоспособность
- расстройства ЖКТ (на поздних стадиях)
Стеноз легочной артерии
При стенозе устья легочной артерии происходит сужение выводного тракта правого желудочка, из-за чего нарушается приток крови к стволу легкого. Болезнь проявляется следующими симптомами:
Болезнь проявляется следующими симптомами:- головокружение
- слабость
- одышка
- учащенное сердцебиение
- склонность к обморокам
- изменение цвета кожи (бледность или синюшность)
Причины
Стеноз артерий не имеет какой-то одной причины. Чаще всего возникновение заболевания связано сразу с группой внешних и внутренних факторов.В первую очередь необходимо отметить атеросклероз – скопление на артериальных стенках холестериновых бляшек. Формирование атеросклеротических бляшек провоцирует сужение просвета сосудов изнутри, вызывая сосудистую патологию.
Другие причины развития заболевания:
- врожденные аномалии строения сосудов – извилистость, гипоплазия
- диссекция (расслоение) стенок артерии
- сдавливание сосудов доброкачественными или злокачественными новообразованиями
- повышенное тромбообразование
- сахарный диабет
- нарушение обмена веществ
- сильный удар, сотрясение
- воспалительные сосудистые заболевания – васкулит, артериит, болезнь Хортона, болезнь Такаясу и др.
Отметим, что существуют определенные факторы, значительно повышающие риски развития стеноза артерий. Так, заболеванию чаще подвержены люди, страдающие ожирением, ведущие малоподвижный образ жизни, злоупотребляющие алкоголем, табакокурением и употребляющие большое количество жирной пищи.
Диагностика
На первичном осмотре врач опрашивает пациента, выслушивает жалобы и проводит осмотр. Во время осмотра специалист измеряет артериальное давление и пульс, прослушивает сердечный ритм, проводит визуальный осмотр кожных покровов пациента. В процессе беседы доктор выясняет наличие хронических заболеваний в анамнезе, узнает о приеме сгущающих кровь лекарственных препаратов, наличии выявленных аномалий строения сосудов. Затем пациент направляется на дополнительные исследования для уточнения диагноза.В медицинском центре «СМ-Клиника» диагностика стеноза артерий производится следующими методами:
Лечение
В зависимости от стадии заболевания может применяться консервативное или хирургическое лечение.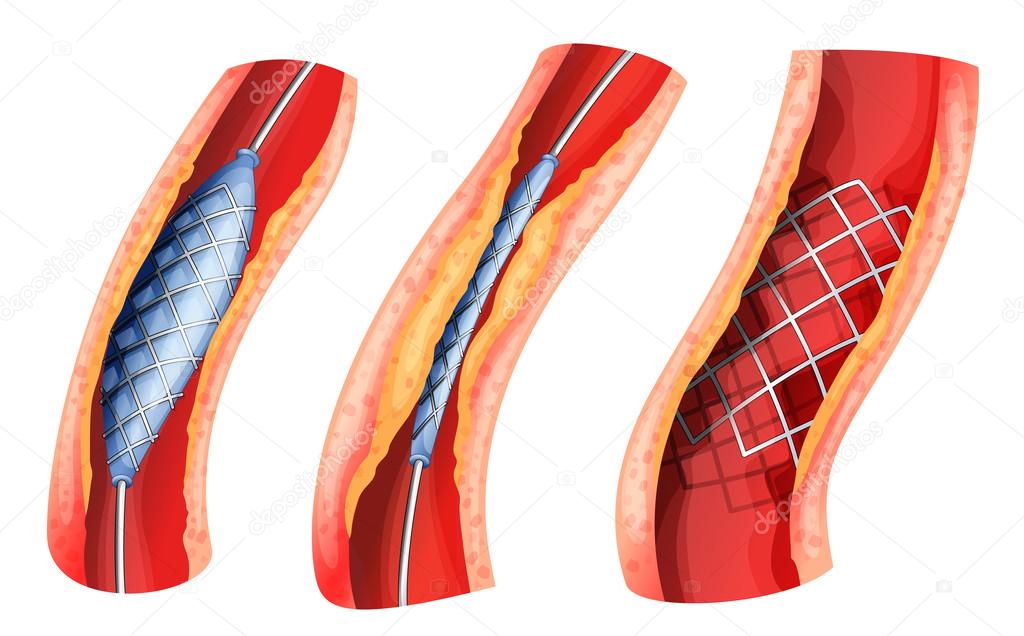
Терапевтическое лечение
На ранних стадиях заболевания применяются консервативные методы лечения. Терапия различается в зависимости от локализации сужения просвета сосудов и основной причины развития патологии. Так, если стеноз сосудов спровоцирован образованием тромба в артерии, пациенту назначается прием антитромботических препаратов. При атеросклеротическом поражении сосудов выписываются препараты, снижающие уровень холестерина в крови.Также пациенту необходим прием средств, устраняющих симптомы заболевания – препараты, снижающие артериальное давление, противовоспалительные и обезболивающие средства.
Хирургическое лечение
В том случае, если сужение просвета сосуда достигло свыше 50%, а также при наличии внешних симптомов (например, перенесенных ишемических инсультов) консервативные методы лечения не помогут достичь нужного эффекта. В этом случае врачи прибегают к проведению оперативного вмешательства.Специалисты Центра хирургии «СМ-Клиника» в совершенстве владеют сразу несколькими методами хирургического вмешательства:
- Баллонная ангиопластика – внутрисосудистая операция, позволяющая восстановить нормальную проходимость артерий. Во время операции внутрь сосуда вводится небольшой баллон, при расправлении которого удаляются скопившиеся бляшки, а просвет сосуда расширяется. Операция незаменима при атеросклеротической природе стеноза.
- Стентирование сосуда – современная малоинвазивная методика лечения стеноза артерии, во время которой в просвет сосуда внедряется стент – специальный каркас, укрепляющий стенки артерии и предотвращающий ее повторное сужение. В результате операции восстанавливается функционирование сосудов и налаживается кровоснабжение органов человека.
- Шунтирование сосудов – часто используемая операция, позволяющая перенаправить ток крови в обход суженного сосуда, при помощи формирования нового русла. В результате операции по поврежденным сосудам перестает течь кровь, она идет в обход. Это восстанавливает кровообращение.
Центр хирургии «СМ-Клиника» — это современная медицинская помощь мирового уровня. Наши специалисты помогают справиться даже с самыми сложными клиническими ситуациями.
Наши преимущества:
Более 50 ведущих кардиологов
Все специалисты
в одной клинике
Передовое медицинское оборудование
Гарантия качества обслуживания
Хотите, мы Вам перезвоним?
Спасибо за оставленную заявку.
Наш оператор свяжется с вами с 8:00 до 22:00
Заявки, поступившие после 22:00, будут обработаны на следующий день.
Поражение сосудов шеи
Поражение сосудов шеи (прецеребральных отделов артерий головного мозга).
Брахиоцефальные артерии (БЦА) – это магистральные сосуды организма. К БЦА относятся:
- брахиоцефальный ствол,
- общая сонная артерия (делится на внутреннюю и наружную артерии)
- подключичные артерии,
- позвоночные артерии.
Анатомия позвоночных артерий часто индивидуальна. Внутренние сонные и позвоночные артерии (они же прецеребральные отделы артерий головного мозга) после проникновения внутрь черепа образуют Виллизиев круг. Это анатомическое образование призвано обеспечивать равномерное распределение крови по всем отделам головного мозга.
Проблема в том, что анатомия Вилизиевого круга также вариабельна и более чем у 20% людей европейской популяции круг разомкнут. При такой особенности анатомии достаточно прекращения кровообращения даже в одной из артерий для развития инсульта (гибель ткани мозга).
Однако, подавляющее число ишемических инсультов эмбологенного характера. Это означает, что причиной недуга является засорение артерий мозга материальными объектами.
Эмболию могут вызывать тромбы из полостей сердца (при его патологии), но чаще всего – это фрагменты распадающихся атеросклеротических бляшек из сонных артерий и зоны деления общей сонной артерии на внутреннюю и наружную (зона бифуркации). Именно зона бифуркации — типичное место для возникновения и развития атеросклеротической бляшки.
Бляшки, в свою очередь подразделяются на различные типы и классифицируются по степени сужения сосуда. Наиболее опасными являются эмбологенный бляшки – то есть те, которые в любой момент могут разрушиться и все их содержимое мгновенно закупорит множество артерий головного мозга и вызовет инсульт.
Предвестниками инсульта могут быть:
- головная боль;
- головокружение;
- онемение половины тела;
- нарушения зрения;
- затруднения при формулировании мыслей.
- нарушение артикуляции
- нарушения в тонких функциях кистей рук (например, при письме)
- затруднения при ходьбе и т.д.
Очень часто инсульт возникает без каких либо предвестников. Именно поэтому ультразвуковая диагностика артерий шеи (триплексное, дуплексное сканирование) совершенно необходимая процедура для мужчин и женщин после 40-50 лет.
Ангиохирурги СПБ больницы РАН используют различные методы лечения атеросклероза БЦС, в случае сонных артерий – это прежде всего каротидная эндартерэктомия — радикальное оперативное лечение, позволяющее извлечь бляшку и восстановить целостность стенки сосуда.
Операция проводится по методике обеспечивающей максимально возможную степень защиты головного мозга и микрохирургическое восстановление артерии.
На сегодняшний день каротидная эндартерэктомия дает наиболее стойкие положительные результаты на отдаленных периодах наблюдения – от 5 до 20~25 лет. Именно поэтому в странах с развитой медициной каротидная эндартерэктомия является основным методом лечения данной патологии.
Для других зон поражения в СПб больнице РАН проводятся трансплантации артерий и шунтирующие операции.
Получить консультацию специалистов и узнать подробности можно через контакт-центр 323 45 35
Атеросклероз артерий нижних конечностей, лечение и диагностика причин, симптомов в Москве
Медведев Василий Алексеевич
3 Мая 2021
Хочу выразить сердечную благодарность сосудистому хирургу Паршину Павлу Юрьевичу и всему коллективу центра сосудистой хирургии за профессионализм, внимание и чуткость к пациентам. У меня варикозная болезнь ног. После операции стал чувствовать себя здоровым человеком несмотря…
ПодробнееВдовенко Ольга Александровна
13 Марта 2020
Огромная благодарность Сергей Владимировичу за его талант ! Это — счастье, что такие компетентные, умелые и талантливые, неравнодушные люди работают именно там, где они больше всего нужны.
Большое спасибо от всей моей семьи и желаю Вам дальнейших профессиональных успехов и достойного…
Ланцов Василий Владимирович
11 Марта 2019
Выражаю огромную благодарность Дерябину Сергею Владимировичу за чуткий и профессиональный подход к работе! Спасибо вам огромное! Вы и ваша работа дали мне практически вторую жизнь, полностью поставив меня на ноги и позволив свободно двигаться и забыть про страшные, мучительные бо…
ПодробнееГолубева Наталия Владимировна
6 Сентября 2018
Огромная благодарность медицинскому персоналу отделения вашей благородной, сложной, которым руководит Конев Алексей Васильевич, за профессионализм, внимание и чуткость к больным. Низкий поклон кардиохирургу Колмакову Эрнесту Александровичу — у него золотые руки и душа настоящего …
Подробнееmila
22 Мая 2018
Хочу оставить свой отзыв о сосудистых врачах: Дерябин Сергей Владимирович и Титович Алексей Станиславович. Очень внимательные, добрые, приветливые и лучшие в своей сфере деятельности. Оба красавчики, особенно Дерябин! Советую! Да- да, Сергей Владимирович, ты просто шикарный специ…
ПодробнееЛюдмила
14 Марта 2018
Хочу оставить свой отзыв о сосудистых врачах: Дерябин Сергей Владимирович и Титович Алексей Станиславович. Очень внимательные, добрые, приветливые и лучшие в своей сфере деятельности. Оба красавчики, особенно Дерябин! Советую! Да- да, Сергей Владимирович, ты просто шикарный специ…
ПодробнееБесстрашников Михаил Александрович
24 Января 2018
Я, Бесстрашников Михаил Александрович, хочу выразить огромную благодарность врачам отделения сосудистой хирургии Федерального научно-клинического центра, а именно благодарю: д.м.н. Чупина Андрея Валерьевича – руководителя центра сосудистой хирургии, профессора, к.м.н. Орехова Павла…
ПодробнееЕлена Александровна
3 Ноября 2017
Хочу выразить огромную благодарность коллективу, который меня «поставил на ноги». Анестезиолог (к сожалению, не знаю его имени) правильно проинформировал меня о предстоящих мероприятиях по подготовке к операции и профессионально выполнил свою работу. Хирурги — высший пи…
ПодробнееБаранов Геннадий Рудольфович
5 Сентября 2017
Я ,как ветеран и участник ликвидации аварии на ЧАЭС в подразделения особого риска, хочу сказать, что успел побывать во многих лечебных учреждениях, вот и сейчас имею честь находиться в Клинике 83, как мы её называем,в отделении сосудистой хирургии.Что можно сказать? Честь Вам и хвала…
ПодробнееГлотова Л.В.
23 Декабря 2016
Очень благодарна врачу отделения сосудистой хирургии Зайцеву М.В. за теплое отношение к пациентам и искреннее желание помочь. Профессионализм на высоте, индивидуальный подход, терпение, отзывчивость. Огромное спасибо замечательному врачу Максиму Владимировичу Зайцеву за его труд!…
ПодробнееВОЗЬМИ СОННЫЕ АРТЕРИИ ПОД БДИТЕЛЬНЫЙ КОНТРОЛЬ
Возьми сонные артерии под бдительный контроль
Ежегодно в России инсульт уносит жизни порядка 200 тысяч человек. Врачи бьют тревогу, ведь три случая инсульта их четырех можно предотвратить. Особое внимание в плане профилактики ишемического инсульта, который встречается чаще всего, уделяется ранней диагностике такого грозного заболевания как стеноз сонных артерий. Это сужение или полная закупорка просвета крупных сосудов, которые проходят вдоль шеи и питают мозг. Чаще всего причиной является образование в артериях тромба или атеросклеротической бляшки. Если болезнь вовремя скорректировать, человеку можно спасти жизнь, поскольку риск развития инсульта при стенозе чрезвычайно высок.
От ангиографии к ультразвуку
Сейчас ранняя диагностика стеноза сонных артерий не представляет большой проблемы, как было когда-то. Революционный скачок совершен 30 лет назад благодаря появлению ультразвуковых методов исследования, в частности дуплексного сканирования сонных артерий.
Исследование с помощью ультразвука — не инвазивное (не требует хирургического вмешательства в организм), спокойно проводится в любой поликлинике и доступно каждому. Метод позволяет со 100% долей вероятности поставить диагноз «стеноз сонных артерий» и дает точную картину имеющегося поражения сосудов. В частности, врач может с уверенностью определить степень болезни — имеет место полная закупорка сосуда, выраженный стеноз, когда сосуд сужен на 80-99%, или умеренный стеноз (40-60%). В отличие от ангиографии ультразвуковое обследование определяет форму и строение атеросклеротической бляшки. С помощью ультразвука возможно даже построение трехмерного изображения бляшки в разных плоскостях. Совершенно очевидно, что все это дает врачам возможность определять дальнейшую тактику ведения больного индивидуально.
Мозг дает сигналы
Нередко возникает потребность в проведении дополнительных обследований. Это могут быть ангиография, электроэнцефалограмма головного мозга (ЭЭГ) и реоэнцефалография мозга (РЭГ).
Во время проведения ангиографии тонкий катетер вводится в артерию на ноге или запястье и продвигается к шее. Контрастное вещество, которым наполняют катетер, делает видимыми артерии. Но назначается этот метод по строгим показаниям, зачастую для уточнения мельчайших деталей состояния кровеносного русла перед операциями. А роль первой обязательной процедуры обследования для выявления стеноза сонных артерий играет ультразвуковая допплерография.
Во ходе ЭЭГ на голову пациента надевается специальная «шапка» с электродами, которые регистрируют электрическую активность мозга. Благодаря этому выявляются, в том числе, признаки патологии сосудов. Фактически с помощью ЭЭГ можно определить, насколько стеноз сонных артерий дестабилизирует работу мозга в целом.
Что касается РЭГ, то это исследование направлено на изучение движения крови в мозге. К голове пациента тоже подсоединяются резиновые ленты с металлическими датчиками, а пациент во время исследования по просьбе врача принимает различные позы, что позволяет всесторонне оценить состояние эластичности стенок сосудов, скорость их наполнения кровью, вязкость самой крови и получить другие важные данные. Все они имеют большое значения для выстраивания плана лечения в случаях, если стеноз сонных артерий подтверждается.
Стоит отметить, что ЭЭГ и РЭГ назначаются далеко не только в случае подозрений на атеросклероз или стеноз. Нередко случается, что при проведении этих процедур по другим основаниям выявляются признаки атеросклеротических наростов в сосудах мозга, что позволяет начать лечение болезни еще до ее ярких проявлений.
Неврологи на посту
К сожалению, на определенном этапе стеноз сонных артерий протекает бессимптомно либо с минимальными неврологическими симптомами. Поэтому даже без видимых оснований обследовать сонные артерии стоит регулярно, а тем более – при появлении проблем. Совершенно нельзя медлить в случае так называемой «транзиторной ишемической атаки» — преходящего нарушения кровообращения головного мозга. При таких кризах бывает временно нарушение речи, слабость в конечностях, дезориентация в пространстве. Если такое случилось, к врачам надо обращаться срочно, ведь, скорее всего, стеноз сонных артерий уже есть и инсульт не за горами.
Ответственными за диагностику стенозов и других заболеваний – предвестников инсульта – являются невропатологи. Они и обследования назначают, и лекарственную терапию проводят, и предоперационной подготовкой занимаются. Перед операцией (если принято решение о ее необходимости), например, назначается «сканирование брахиоцефальных артерий». Это ультразвуковое обследование позволяет проверить уже не только сонные артерии, но и другие крупные сосуды, питающие мозг и верхние конечности. Также проводится компьютерная и магнитно-резонансная томография мозга.
Современные диагностические достижения медицины впечатляют. Надо только позаботиться о себе, вовремя обратиться к врачу и начать контролировать состояние сосудов головного мозга, особенно сонных артерий. Тогда есть шанс, что инсульт обойдет вас стороной.
ЧТО МОГУТ СЕГОДНЯ СОСУДИСТЫЕ ХИРУРГИ
В помощь практическому врачу
А.В. Покровский
Первое, чего добились сосудистые хирурги, – это ставить достаточно точно диагноз поражения магистральных артерий в условиях первичного осмотра больного. В этом основную роль сыграло внедрение аускультации сосудов. Аускультация – это «золотой ключик», который позволяет в считанные минуты поставить абсолютно правильный диагноз стеноза сонной или стеноза подвздошной артерии, а также аорты или других артерий. Основной недостаток – это то, что общие хирурги и врачи других специальностей практически не используют аускультацию магистральных сосудов в своей ежедневной практике.
Двадцать, тридцать лет тому назад топическая диагностика сосудов основывалась целиком на ангиографии. В последние десять лет ангиография пока остается «золотым стандартом» диагностики, однако основное место сейчас занимают ультразвуковые методы исследования, в частности, ведущим методом стало дуплексное сканирование. Есть только одно «слабое» место в этой методике – его зависимость от исполнителя. Здесь, как и во многих других случаях, в медицине нужна строгая специализация, так как только это дает возможность вырастить высококлассного специалиста. При этом сейчас внутри даже одной специальности необходима работа в узком разделе, и только накопление большого опыта в нем позволяет стать таким высококлассным специалистом и ставить точный диагноз. Поэтому сейчас необходимы специальные ультразвуковые кабинеты с врачами, работающими именно и только с сосудистыми больными. Тогда во многих случаях возможна точная топическая диагностика неинвазивными методами. Огромное преимущество этой диагностика – это ее точность и возможность выполнения в амбулаторных условиях. Кроме того, ультразвуковая диагностика дает информацию о поражении аорты, магистральных артерий, состоянии венозной системы и в тех случаях, когда нет никаких клинических признаков того или иного заболевания.
Конечно, наряду с ультразвуковыми методами диагностики сейчас существуют и другие неинвазивные методики выявления поражения сосудов. Например, магнитно-резонансная ангиография, электронно-лучевая томография и ряд других. Но все они основаны на использовании дорогих аппаратов и не могут быть применены в массовом масштабе. Однако, несмотря на большие возможности инструментальной диагностики заболеваний сосудов, основным является правильная первичная диагностика заболеваний самим врачом. Поэтому фактически сосудистые хирурги закладывают основы и создают в нашей стране новую специальность, которой у нас еще нет, – это ангиология. Именно врач-ангиолог должен заниматься диагностикой различных сосудистых заболеваний, определять тактику лечения и вовремя направлять больных на оперативное лечение к сосудистому хирургу.
Одной их самых многочисленных групп больных, которые в настоящее время направляются к сосудистому хирургу, являются больные с заболеваниями артерий нижних конечностей. Даже в США количество ампутаций в последние 20 лет колеблется от 19 до 30 на 100 000 человек в год (Kalra M., 2001).
В последние десятилетия в России, также как и в других странах, резко уменьшилось количество молодых больных с облитерирующим тромбангиитом артерий нижних конечностей. В Европе число больных облитерирующим тромбангиитом составляет 0,5-2% от числа всех больных с заболеваниями артерий нижних конечностей. Обычно это злостные курильщики, и обращаются они к врачу только после появления трофических язв или гангрены пальцев на стопе. Учитывая, что при этом заболевании страдают сосуды голени и стопы, прекрасные возможности для топической диагностики поражения имеет дуплексное сканирование, которое позволяет увидеть резко утолщенную стенку артерии, выявить сегменты стенозирования или окклюзии артерий, вплоть до пальцевых артерий. В последние десять лет (с 1988 года) в сосудистом отделении института хирургии им. А.В. Вишневского была разработана принципиально новая методика лечения больных облитерирующим тромбангиитом. В первую очередь, лечение направлено на подавление воспаления, которое имеется у этих больных. С этой целью используется комбинированное лечение цитостатиками и гормонами. До этого такое лечение не применялось никем. Схема лечения очень проста. Внутривенно вводится в первый день 1000 мг циклофосфана и 1000 мг депо-преднизолона. На второй и третий дни вводят только по 1000 мг гормона и на этом курс терапии прекращают и проверяют эффект по «С»-реактивному белку, СОЭ и имуннологическим показателям (IgG, IgM и ЦИК). Через 7-10 дней, если не достигнут эффект, курс лечения может быть повторен. У тяжелых больных возможно проведение 2-3 курсов лечения. Обычная гормонотерапия не используется.
Вторым препаратом, который с успехом используется при лечении больных облитерирующим тромбангиитом, является простагландин Е1. При наличии воспаления целесообразно сначала провести лечение цитостатиками и гормонами, а потом простагландинами.
Однако даже такая мощная терапия не всегда купирует ишемию нижней конечности у больного облитерирующим тромбангиитом. Учитывая, что у этих больных, как правило, окклюзированы все артерии голени и стопы, выполнение типичных шунтирующих сосудистых операций у них невозможно. Поэтому в отделении была предложена и внедрена новая оригинальная операция – артериализация венозной системы больной конечности. Сущность операции заключается в том, что венозный трансплантат, который вшивается в подколенную артерию, затем анастомозируется с поверхностной или глубокой венозной системой стопы. Ключик к успеху этой операции заключается в тщательном и эффективном разрушении венозных клапанов на стопе. Накопленный клинический опыт показал, что если такой трансплантат работает хотя бы 3 месяца, этого достаточно, чтобы ликвидировать ишемию конечности.
Конечно, следует отметить, что для успеха лечения больного облитерирующим тромбангиитом необходимо полное прекращение им курения. Среди 282 больных облитерирующим тромбангиитом, которые были пролечены в сосудистом отделении института хирургии им. А.В. Вишневского, у 80% были трофические язвы или гангрена пальцев на стопе. У половины больных проксимальный уровень поражения был на уровне голени, а у второй половины – на уровне бедра. Окклюзию всех артерий стопы имели 86% больных, что показывает тяжесть поражения дистального русла у этих больных. В этой группе пациентов пульс-терапия была проведена у 63 больных, а лечение вазапростаном – у 82 больных. При поражении артерий голени и стопы консервативная терапия была эффективна у 58%, а если были окклюзированы подколенная и бедренная артерия – только у 30% больных. Стандартные сосудистые реконструкции были выполнены только 43 больным, а артериализация венозного кровотока применена у 35 больных. Такое комбинированное лечение позволило добиться 89% положительных результатов у больных облитерирующим тромбангиитом и спасти их от ампутации. При наблюдении больных в сроки до 11 лет оказалось, что у 71% больных явления критической ишемии были полностью купированы и не возникали вновь, 24% больных требовали повторных курсов лечения и 5% потребовалась ампутация. Была четко выявлена зависимость результатов лечения от прекращения курения: у больных, прекративших курить, конечность была сохранена в 90%, а у тех, кто продолжал курить, только у 74%.
Но в повседневной практике сосудистого хирурга подавляющее большинство больных обращается с облитерирующим атеросклерозом сосудов нижних конечностей. Нами в 1978 году была предложена и широко используется в стране классификация четырех степеней ишемии конечности. Она основана на клинике заболевания и выделяет первую степень ишемии, когда больной может пройти без боли в икроножных мышцах около километра. При второй «А» степени ишемии перемежающаяся хромота появляется при ходьбе на расстоянии 500-200 метров. При второй «Б» степени ишемии боли появляются при прохождении расстояния меньше 200 метров. При этом важно, когда впервые появляются боли, а не сколько может пройти больной. При третьей степени ишемии боли имеются в покое или при ходьбе всего на 20-50 метров. При четвертой степени ишемии у больного имеются трофические язвы или гангрена пальцев.
Эксперты Европейских стран пришли к заключению, что целесообразно объединить больных с III и IV степенями ишемии в одну группу, которую они определили как больные с критической ишемией. Выделение этих больных необходимо из-за высокой вероятности ампутации у них, и поэтому для избежания этого они нуждаются в стационарном лечении в сосудистых отделениях. Количество больных с заболеваниями артерий нижних конечностей, у которых уже наступила критическая ишемия, достигает от 500 до 1000 человек на 1 млн. населения в год. На фоне сахарного диабета критическая ишемия встречается примерно в пять раз чаще. Следует подчеркнуть, что 90% ампутаций нижних конечностей во всем мире выполняется по поводу критической ишемии.
Первичная диагностика облитерирующего атеросклероза сосудов нижних конечностей основана на возрасте больного (обычно старше 40 лет), клинике заболевания (наличие перемежающейся хромоты), объективных данных осмотра (наличие систолического шума над подвздошными и бедренными артериями, отсутствие пульсации артерий стоп). В первичной инструментальной диагностике поражения самым ценным является определение артериального давления на уровне лодыжки и вычисление лодыжечно-плечевого индекса давления – ЛПИ (величина равная делению систолического артериального давления на уровне лодыжки на цифру систолического артериального давления на плече). У здорового человека ЛПИ всегда больше 1,0. Снижение ЛПИ ниже 0,9 свидетельствует о наличии поражения сосудов нижних конечностей. Исключение составляют больные с тяжелым сахарным диабетом, у которых из-за кальциноза артерий могут определяться высокие цифры ЛПИ.
Определение степени ишемии у конкретного больного имеет принципиальное значение, так как это определяет тактику лечения. При наличии I или II «А» степени ишемии больному проводится консервативная терапия. При наличии II «Б» степени ишемии лечение начинают с консервативной терапии, и в зависимости от ее эффективности может быть принято два решения: или продолжить консервативную терапию, или выполнить больному реконструктивную сосудистую операцию, особенно если больной настаивает на улучшении качества жизни и уменьшения перемежающейся хромоты.
Другой принципиальный подход должен быть к больным с критической ишемией (при наличии III и IV степеней ишемии). Эти больные требуют стационарного лечения. И, конечно, у них в первую очередь необходимо детальное уточнение характера поражения артериальной системы обеих нижних конечностей. Здесь «золотым» стандартом пока остается аорто-артериография с обязательным контрастированием брюшной аорты и артерий конечностей вплоть до артерий стопы. Дуплексное сканирование может тоже дать точную картину поражения, но для этого требуется квалифицированный специалист и достаточное время для исследования. Последние модификации ультразвуковых аппаратов позволяют получить панорамное изображение артерий на всем протяжении конечности.
Опыт многих сотен тысяч операций и наш многолетний опыт показал, что при наличии у больного III или IV степеней ишемии конечности наилучшие результаты дает реконструктивная сосудистая операция. Здесь мы должны сказать, что показания и противопоказания к операции должен устанавливать только сосудистый хирург, а не врачи других специальностей.
У каждого конкретного больного уточняется точная локализация поражения и выбирается оптимальный вариант операции. Много ошибок бывает при определении противопоказаний к операции несосудистыми хирургами. Поэтому следует подчеркнуть, что ни возраст больного, ни наличие ишемической болезни сердца, ни инфаркты, ни артериальная гипертензия, ни другие заболевания не являются противопоказанием для проведения сосудистой операции. Противопоказаниями могут служить сердечная недостаточность IIБ-III степени, наличие крайней степени хронической почечной недостаточности, требующей проведения гемодиализа (когда такого нет), и тяжелая декомпенсированная легочная недостаточность. Практически эти противопоказания у больных встречаются крайне редко.
Техника большинства реконструктивных сосудистых операций хорошо отработана. При бифуркационном аорто-бедренном протезировании или шунтировании нами на протяжении десятков лет используются отечественные протезы «Север», хотя могут быть применены и протезы фирм «Экофлон», «Горе» или «Зульцер». Пожалуй, следует подчеркнуть только некоторые принципиальные детали операции. Лучше использовать минимальную мобилизацию брюшной аорты, но обязательно проксимальный анастомоз протеза с аортой должен быть на уровне или выше устья нижней брыжеечной артерии, но нельзя его накладывать ниже устья этой артерии. Дистальные анастомозы выполняются с общей бедренной с переходом на поверхностную бедренную артерию длиной 20-30 мм или с глубокой бедренной артерией. Проксимальный анастомоз должен быть укрыт или клетчаткой или сальником, чтобы к нему не прилежала двенадцатиперстная кишка. Раны на бедрах обязательно дренируются на 24 часа с подключением активного отсоса. Операции лучше выполнять с использованием эпидуральной анестезии.
Проведенное нами изучение отдаленных результатов показало высокую эффективность и стабильность этих операций. В сосудистом отделении института хирургии им. А.В. Вишневского выполнено свыше 1300 операций у больных с синдромом Лериша. Мы изучили отдаленные результаты у 250 больных со сроками наблюдения от 5 до 10 лет. У больных в возрасте 45-60 лет выживаемость в течение 5 лет составила 87%, а в течение 10 лет – 63%. При этом кумулятивная проходимость аорто-бедренных трансплантатов составила 97% через 5 лет и 91% – через 10 лет, если у больных был проходим бедренно-подколенный сегмент, а при его окклюзии проходимость сохранялась в 87% через пять лет и 70% – через 10 лет. Сохранение проходимости протеза было лучше у больных старше 60 лет, чем у больных моложе 45 лет.
Следует подчеркнуть, что в те годы больные не получали лечения статинами или другими препаратами. Однако четко подтверждено отрицательное влияние продолжения курения, так, 5-летняя проходимость аорто-бедренных трансплантатов у некурящих больных достигла 94%, в то время как в группе злостных курильщиков она равнялась всего 80%. К исходу 10 лет разница в кумулятивной проходимости трансплантатов среди курящих и некурящих больных достигла 40% и у некурящих она была 89%, а у курящих – всего 49%.
Отметим важность динамического наблюдения за больными, особенно за состоянием дистальных анастомозов, что можно сделать при дуплексном сканировании и измерении ЛПИ. Наблюдения показали, что при стенозе анастомоза больше 60% через год у большинства больных развивается тромбоз бранши. В то же время превентивные операции при стенозе анастомоза больше 60% не сопровождаются летальностью и сохраняют проходимость трансплантата в сроки до 6 лет у 78% больных.
Реваскуляризация артерий нижних конечностей ниже пупартовой связки с течением времени хотя и осталась на тех же принципах, но выбор операции и трансплантата видоизменились. В первую очередь это связано с необходимостью сохранения лучшего вида трансплантата – собственной большой подкожной вены больного – для использования при аорто-коронарном шунтировании. Изучение многолетних отдаленных результатов выявило малые различия в проходимости различных шунтов с дистальным анастомозом с подколенной артерией выше щели коленного сустава. Поэтому в этой позиции все чаще используются синтетические протезы из политетрафторэтилена (фирм «Экофлон», «Горе»). В нашем отделении выполнено более 600 операций при поражении артерий нижних конечностей. За последние 10 лет оперировано 239 больных с критической ишемией нижних конечностей, при этом у 80% больных имелись язвенно-некротические поражения стопы и голени, ЛПИ у большинства был 0,35 и у половины больных Тсро2 на стопе было ниже 10 мм рт.ст. После бедренно-подколенного шунтирования выше щели коленного сустава через 5 лет у 75% конечность была сохранена при 65% проходимости шунта. При изучении факторов риска, определяющих успех самой операции, было выявлено большое значение состояния путей оттока. При хорошей проходимости артерий голени и стопы через 5 лет проходимы 87% трансплантатов. Не меньшее значение имеет и исходное состояние микроциркуляции, в частности, по показателям ТсрО2. Если до операции консервативным лечением не удастся поднять ТсрО2 выше 10 мм рт.ст., то прогноз реконструктивной операции плохой.
Отдаленные результаты, безусловно, лучше после реконструктивных сосудистых операций, чем после консервативной терапии.
При необходимости шунтирования артерий с дистальным анастомозом ниже щели коленного сустава предпочтительнее использовать большую подкожную вену больного. При дистальных шунтированиях артерий голени применяются два варианта шунтирования: реверсированной веной и веной «in situ». Для улучшения отдаленных результатов некоторые авторы использовали различные модификации дистального анастомоза с помощью дополнительной заплаты из вены или наложения артерио-венозного свища. Однако статистически достоверных убедительных данных в пользу той или иной методики не получено. Считается, что дистальное шунтирование по методике «in situ» позволяет сохранить проходимость шунта в более длительные сроки. По данным Darling R.C. III и соавт. (2002), который привел результаты различных видов шунтирования ниже паховой связки у 3944 больных, через 5 лет проходимыми были 81% шунтов in situ, и конечность была сохранена у 94%.
Несколько уточнились показания к этим операциям. Более сдержанно стали ставить показания к реваскуляризации при наличии у молодого больного ишемии IIА-IIБ степени. Основным контингентом для этой операции являются больные с III-IV степенями ишемии, когда речь идет о спасении конечности. В этой группе особенно следует выделить больных с так называемой диабетической стопой. Если у такого больного имеются условия для выполнения операции реваскуляризации, то ее следует обязательно использовать для спасения конечности. В противном случае больному грозит ампутация, при которой летальность сохраняется на уровне 20-40%.
К сожалению, в России очень редко выполняются операции по дистальному шунтированию с выполнением анастомозов на уровне лодыжки или прямо с артериями стопы. В какой-то степени это связано с недостатками ангиографического исследования, когда не выявляются артерии стопы, и практически не используют для исследования этих артерий дуплексное сканирование.
Убедительные данные были приведены из клиники Мэйо США в 2001 году (Kalra M. с соавт.). За 12 лет они прооперировали 256 больных с критической ишемией (90% из них имели язвы или гангрену). Средний возраст больных был 70 лет, 75% из них были диабетиками, 20% имели почечную недостаточность с креатинином более 2 мг/дл (7,4% из них были на диализе). Этим больным выполнялось шунтирование аутовеной, при этом в 46% шунтирование было от бедренной артерии до артерий стопы (длинные шунты), у остальных шунтирование от подколенной артерии к артериям стопы. В 65% использовалась реверсированная аутовена, «in situ» только в 12,5%, а у остальных использовался составной трансплантат, в том числе в 27% вены с руки. Чаще всего анастомоз выполнялся с тыльной артерией стопы под микроскопом, и проводилась контрольная ангиография. Летальность составила 1,6%, 6% имели инфаркт, ампутацию выполнили у 3,2%. В течение 5 лет вторичная проходимость шунтов составила 71%, а выживаемость – 60%. В то время как после ампутаций через пять лет выживаемость составила 26%. Результаты были хуже при комбинированных шунтах, а также у больных с критической почечной недостаточностью. Следует отметить, что почти у трети больных понадобились дополнительные операции по закрытию трофических язв. Эта работа убедительно показывает целесообразность подобных операций даже у тяжелых больных.
Конечно, при поражении брюшной аорты, подвздошных и бедренных артерий применяют и другие виды шунтирующих операций, такие как бедренно-бедренное шунтирование «cross-over», различные виды экстраанатомического шунтирования, используют также и методику эндартерэктомии.
В последние 10-15 лет в сосудистой хирургии появился новый раздел по реконструкции пораженных сосудов – это дилатация, стентирование и эндопротезирование. Как обычно, вслед за бурным восхищением, которым сопровождались первые успехи этих новых видов операции, появилась сейчас уже возможность оценить их отдаленные результаты с точки зрения длительности сохранения полученных результатов. И здесь выявилась значительная разница в эффективности в зависимости от локализации и протяженности поражения артерий. Безусловно, дилатация дает хорошие результаты при стенозе общей подвздошной артерии, возможно, дилатация и при окклюзии артерии, когда сначала проводником выполняется реканализация артерии, а затем ее дилатация. Как показал наш опыт дилатаций у 105 больных, особенно надежные результаты получены у больных при стенозе общей подвздошной артерии. Несколько хуже результаты дилатации наружной подвздошной артерии, особенно при ее протяженных стенозах. Применение стентов пока только набирает темпы и не выявило их явных преимуществ. Дилатация стенозов и окклюзий бедренных артерий дает ближайший результат только при коротком поражении артерии на протяжении 3-5 см. Не оставляются попытки дилатации артерий голени с использованием новых проводников и катетеров малого диаметра. Однако длительной проходимости дилатированных артерий пока получить не удается.
Вместе с тем разработка новых малоинвазивных методик продолжается. Нами впервые выполнено эндопротезирование поверхностной бедренной артерии после ультразвуковой эндартерэктомии из нее. В качестве эндопротеза использовался специально изготовленный на фирме «Экофлон» тонкий, толщиной в 100 микрон, протез из политетрафторэтилена. Подобная операция была выполнена у 32 больных, при этом ультразвуковая эндартерэктомия из бедренной артерии выполнялась по полузакрытому методу. Использовались тонкостенные протезы диаметром 6-8 мм. Контроль за состоянием просвета эндопротеза после его имплантации проводили с помощью ангиоскопии и интраоперационной ангиографии. Возможные интраоперационные осложнения могут быть из-за перекрута эндопротеза или из-за его перерастяжения. Первичная проходимость сосудистого эндопротеза составила 84,3%. Потенциально эта методика позволяет создать гладкую атромбогенную поверхность после эндартерэктомии и, кроме того, сохраняет собственную вену больного.
Мы видим, какие огромные возможности имеет сосудистый хирург, чтобы помочь больному с поражением сосудов нижних конечностей избежать ампутации и улучшить качество своей жизни. В лечении этих больных большое значение имеет своевременное направление их к сосудистому хирургу. Фактически появление болей в покое или при прохождении 10-15 метров должно служить сигналом для лечения больного в специализированном отделении.
Другим заболеванием, при котором сосудистый хирург может спасти больного от смерти, является аневризма брюшной аорты. Выявление аневризмы брюшной аорты сейчас очень простое дело. Необходимо только во время любого ультразвукового исследования органов брюшной полости измерить именно наружный диаметр брюшного отдела аорты (во многих случаях специалисты определяют размер просвета аорты – это неправильно). Если максимальный наружный поперечный диаметр брюшной аорты в любом ее участке больше 30 мм, то такому больному должен выставляться диагноз аневризмы брюшной аорты и ему необходимо с интервалом в 6 месяцев проводить повторное УЗИ или КТ-исследование.
Как показали наблюдения Santilli S.M. с соавт. (2002) за 1445 больными с аневризмами брюшной аорты диаметром 30-39 мм, в среднем за каждый год аневризма увеличивается на 1,1 мм. Однако если аневризма имеет исходный диаметр 35 мм, она растет на 2 мм в год и у 63% больных достигает в диаметре 40 и более миллиметров в течение 4 лет. Увеличение максимального диаметра брюшной аорты до 40 мм должно служить основанием для направления больного к сосудистому хирургу для оперативного лечения. Принципиально важно, что в то время у больного нет никаких жалоб, а ему необходимо операция независимо от его возраста и сопутствующих заболеваний. Почему так? Потому, что даже сейчас в самых лучших клиниках мира смертность при разрыве аневризмы брюшной аорты равна 90%! Многочисленные мировые данные показывают резкое увеличение возможности разрыва аневризмы брюшной аорты, когда ее диаметр равен или превышает 40 мм.
Техника операции хорошо разработана. Может использоваться лапаротомный или забрюшинный доступы. Аневризма аорты не выделяется, освобождают только проксимальную часть аорты и подвздошные артерии. Прямой или бифуркационный протез анастомозируется внутрь аневризматического мешка с «нормальной» аортой и артериями и затем закрывается стенками аневризмы. Мы считаем целесообразным дренировать на 24 часа полость аневризмы. Как обычно, на следующий день больной встает.
В сосудистом отделении института хирургии им. А.В. Вишневского мы прооперировали 335 больных с аневризмами брюшной аорты. Следует отметить, что количество подобных больных значительно увеличилось за последние 3 года. Почему мы так настойчиво рекомендуем операцию у этих больных? Во-первых, послеоперационная летальность обычно низкая, в пределах 3-5%. Во-вторых, мы изучили отдаленные результаты операций при аневризме брюшной аорты специально у больных старше 70 лет (средний возраст был 73,2+2,9 года, старшему больному было 85 лет). Среднее количество сопутствующих заболеваний у них было 8,1, срок наблюдения от 4 до 12 лет. Выживаемость больных этого возраста после операции через 5 лет составила 72%. При определении средней продолжительности жизни выяснилось, что 65% больных доживают до 85 лет и 50% больных доживают до 80 лет при возрасте на момент операции 70 лет и более. При этом следует учесть, что, в отличие от больных США и других стран, наши больные не имели предшествующего аорто-коронарного шунтирования. Наши данные и данные других клиник доказывают целесообразность и эффективность хирургического лечения больных с аневризмами брюшной аорты.
Конечно, в результате операций большую роль играет квалификация хирурга. Tu J.V. c соавт. в 2001 году опубликовали сборные данные по провинции Онтарио, Канада, по результатам 5878 операций при аневризмах брюшной аорты. Оказалось, что самую низкую послеоперационную летальность в 3,5% имеют сосудистые хирурги, а у общих хирургов она равна 6,2%. Кроме того, имеет значение ежегодное количество подобных операций: если в год выполняется меньше 5 операций, то летальность 7,1%, а если хирург производит свыше 13 операций, то летальность равна 3,5%. У общего хирурга риск послеоперационного летального исхода на 62% выше, чем у сосудистого хирурга.
Интересные данные были приведены в 2001 году Cronenwett J.L. по резекции аневризм брюшной аорты в США в 1996 году. Оказывается, плановые операции только в 39% были выполнены сосудистыми хирургами, 33% произвели сердечные хирурги, а 28% – общие хирурги. Сосудистые хирурги в среднем выполняют 7,4 операции в год, а общие хирурги – 2,9 операции. Средняя летальность была 5,5%. Если хирург выполнял хотя бы 11 операций в год, то летальность была 4,0%, а если его опыт был всего 3 операции, то летальность возрастала до 7,9%. Хирург с малым объемом операций имеет на 83% большую летальность, чем хирург с большим опытом. Эти данные основаны на опыте 25 000 операций по данным Medicare. Автор отмечает, что это не все данные по США.
Через несколько лет после того, как проф. Володось Н.Л. произвел первое в мире эндопротезирование аорты, а Parodi J. стал пропагандировать этот тип операции, эндопротезирование аневризм брюшной аорты стало быстро распространяться по миру. В настоящее время более 10 фирм предлагают различные модификации эндопротезов аорты. Методику до сих пор считают показанной у больных с высоким риском открытого оперативного вмешательства. Сама техника этой операции постоянно меняется и усовершенствуется. Если при первых операциях преимущество отдавали прямому протезированию, то в настоящее время предпочтение отдают применению бифуркационных протезов. Основные осложнения, которые встречаются при этой методике, связаны с негерметичностью прилегания эндопротеза. С течение времени выявилось, что эндопротез может смещаться, ломаться, и у некоторых больных после эндопротезирования может произойти разрыв аневризмы. В среднем, по данным многих авторов, 25% больных нуждаются в повторных эндоваскулярных вмешательствах.
По данным регистра США, опубликованном в 2002 году, при наблюдении 1646 больных после эндопротезирования аневризм брюшной аорты в течение только первого года у 1,6% больных наблюдался разрыв аневризмы, а у 4,9% больных потребовалась открытая операция протезирования. Почти сходные данные приводят в 2002 году Dattilo J.B. с соавт. из Гарвардского университета. За 7 лет они провели 362 эндопротезирования с летальностью 1,6%, однако у 10,7% больных потребовалось повторное вмешательство для обеспечения успеха операции.
Сам эндопротез достаточно дорогой (около 10 000$), кроме того, больному обязательно необходимо каждые 6 месяцев повторные УЗ- и КТ-исследования.
Тем не менее, конструкции эндопротезов постоянно совершенствуются, и это позволяет улучшать результаты. Так, Zarins Ch.K. с соавт. (2001) сообщил сборные данные по 1192 больным с имплантацией модифицированного бифуркационного AneuRx эндопротеза. Разрыв аневризмы наблюдался в 0,4%, необходимость в повторном вмешательстве была у 12% в течение 3 лет, а открытое протезирование было произведено у 7% больных в течение 3 лет.
С другой стороны, и стандартная открытая резекция аневризмы брюшной аорты с протезированием имеет отличные и стабильные результаты. Так, Hertzer N.R. с соавт. в 2002 году привел данные Кливлендской клиники США за 10 лет. Было оперировано 1135 больных с летальностью 1,2%, и в отдаленном периоде только у 0,4% больных имелись поздние осложнения, связанные с протезированием.
Таким образом, в квалифицированном учреждении с успехом могут применяться и та, и другая методика, хотя эндопротезирование пока остается экспериментальным методом.
Есть еще одно заболевание, при котором огромную роль должен играть сосудистый хирург, – это ишемический инсульт. Инсульт является вторым по частоте «убийцей» людей во всем мире. В современной России среди причин смертности на втором месте после инфаркта миокарда стоит инсульт головного мозга. Ежегодно 450 000 человек переносят инсульт, фактически это население большого города. Показатели смертности населения от заболеваний сосудов головного мозга в России в 4 раза выше, чем в Канаде и США. Среди европейских стран в России показатель смертности от цереброваскулярных заболеваний самый высокий. По данным Всероссийского центра профилактической медицины, в нашей стране от цереброваскулярных заболеваний умирает 25% мужчин и 39% женщин.
Частота инсульта колеблется от 460 до 560 на 100 000 населения. В Санкт-Петербурге, например, частота инсульта в 1997 году составила 528 на 100 000 населения (по данным Скоромца А.А.). При этом летальность при ишемическом инсульте в том же году в Санкт-Петербурге равнялась 39%. А всего с заболеваниями сосудов головного мозга там же регистрируется более 200 000 пациентов. В Москве количество больных с инсультом в течение уже длительного времени, почти 20 лет, не снижается меньше 36 000 пациентов ежегодно.
В США ежегодное количество инсультов достигает 730 000. Летальность от инсульта в США составляет 31 на 100 000 мужчин и 27 на 100 000 женщин.
Следует подчеркнуть катастрофические последствия ишемического инсульта – до 84-87% больных умирают или остаются инвалидами и только 10-13% пациентов больных полностью выздоравливают. Сюда следует добавить, что даже среди выживших больных у 50% наступают повторный инсульт в последующие 5 лет жизни.
За последние годы были во многом уточнены частота и причины возникновения ишемического инсульта. Во-первых, подтверждено, что в настоящее время среди причин инсульта основным является его ишемический генез, который встречается у 80% больных. Во-вторых, причиной ишемического инсульта может быть не только ишемия, связанная с резким уменьшением объемного кровотока вследствие стеноза или окклюзии сосуда, но и нарушения кровотока, вызванные эмболией сосудов головного мозга по типу артерио-артериолярной эмболии. При этом эмболия, как правило, связана с атеросклеротическими изменениями сосудов. Большинство авторов полагают, что атеросклероз является причиной стенозов и окклюзией экстракраниальных отделов артерий головного мозга в 84-90% случаев ишемических поражений головного мозга. Принципиально важным является тот факт, что источником артерио-артериолярной эмболии в 70% являются именно экстракраниальные сосуды головного мозга и чаще всего область бифуркации сонной артерии.
Несмотря на то, что первая операция при стенозе сонной артерии была выполнена M.De Bakey в 1953 году, почти 40 лет понадобилось, чтобы доказать ее эффективность. В 1991 году были опубликованы данные многоцентрового исследования по сравнительной оценке консервативного и оперативного лечения симптомных больных со стенозом сонной артерии более 70%. И хотя исследование планировалось сроком на 5 лет, оно было досрочно прекращено через 2 года. Основанием для этого послужили убедительные данные, полученные уже в первые 2 года. Оказалось, что при медикаментозном лечении подобных больных через 2 года у 24% наблюдается инсульт (смертельный или нет), в то время как у больных после каротидной эндартерэктомии инсульт имеется только у 7% (включая интраоперационные осложнения).
Огромное значение в диагностике поражений сонных артерий сыграло повсеместное распространение ультразвуковых методов исследования, в частности, дуплексного сканирования. Если раньше «золотым» стандартом считалась ангиография, то в настоящее время это место занимает дуплексное сканирование. Однако следует отметить, что высокая точность дуплексного сканирования возможна только в руках опытного специалиста, который работает именно в этой области. С внедрением дуплексного сканирования появилась возможность диагностики поражений сонных артерий в условиях поликлиники.
С 1984 года по май 2002 года в сосудистом отделении института хирургии им. А.В. Вишневского были произведены 1492 реконструктивных операции на брахиоцефальных сосудах, включая 1057 операций при поражении сонных артерий. Возраст больных колебался от 37 лет до 81 года (средний возраст – 61,3+2,4 года). Если в первые годы работы основным методом, подтверждающим диагноз стеноза сонной артерии, была ангиография, то в последние 10 лет таким методом стало ультразвуковое исследование с помощью дуплексного сканирования (зав. лабораторией – проф. Кунцевич Г.И.). В этот последний 10-летний период времени мы практически не использовали ангиографию. Показанием к операции являлся стеноз сонной артерии больше 70%. В работе Lovelack T. с соавт. (2001) было показано, что даже при исходном стенозе сонной артерии меньше 60%, но при пиковой скорости кровотока во внутренней сонной артерии больше 175 см/сек, в течение 2 лет у 30% больных стеноз артерии увеличивается до 60-99%. Внедрение ультразвуковых методов исследования не только в практику нашего отделения, но и других учреждений, появление дуплексного сканирования изменило характер оперированных больных. Еще в 1978 г. нами была предложена клиническая классификация сосудисто-мозговой недостаточности. Первая степень включает асимптомных больных, вторая – пациентов с транзиторными ишемическими атаками. В группу больных с третьей степенью включены пациенты с хронической сосудистой энцефалопатией. Четвертая степень объединяет пациентов, перенесших инсульты. Если в середине нашей работы больных с первой (асимптомной) степенью сосудисто-мозговой недостаточности по классификации Покровского А.В. (1978) было всего 2%, то в настоящее время выявление подобных больных стало чаще, и их число возросло до 35%. К сожалению, уменьшилось число больных, направляемых на оперативное лечение, которые перенесли транзиторные нарушения мозгового кровообращения. К нам практически не направляются больные, у которых наблюдалась преходящая слепота на один ипсилатеральный глаз, то есть с amaurosis fugax – одним из основных симптомов атеросклеротического стеноза сонной артерии. Врачи, и особенно окулисты, плохо знают об этой симптоматике стеноза сонной артерии. К сожалению, не только не снизилось, но даже возросло с 37,7% до 44% число больных, которые направляются на оперативное лечение уже после перенесенного ишемического инсульта, то есть с 4 степенью сосудисто-мозговой недостаточности.
Несмотря на кажущуюся простоту операций на сонной артерии, они требуют специальных условий для их выполнения. Незыблемой остается необходимость интраоперационного контроля за толерантностью к пережатию сонной артерии. С этой целью в отделении использовались или выполнение операции под местной анестезией, или определение ретроградного артериального давления, или измерение скорости кровотока по средней мозговой артерии с помощью транскраниальной допплерографии (ТКДГ). Среди больных, оперированных с 2000 года, применение внутреннего шунта потребовалось у 20% больных.
С течением времени отрабатывалась техника операции. Классическая каротидная эндартерэктомия всегда выполнялась в открытом поле зрения. Во время эндартерэктомии удаляется не только интима, но и медиа.
В первые годы работы для закрытия артериотомии мы во многих случаях использовали простой шов. Однако изучение отдаленных результатов в сроки до 196 мес. показало плохие отдаленные результаты подобных операций (у 9% наступила окклюзия сонной артерии, а у 20% развился гемодинамически значимый стеноз больше 60%).
С 1990-х годов мы перестали использовать прямое закрытие артериотомии с помощью шва, а считаем обязательным применение заплаты. Первоначально нами использовались различные материалы: аутовена, ксеноперикард, твердая мозговая оболочка и синтетические заплаты из политетрафторэтилена (ПТФЭ). При наблюдении больных в отдаленном периоде со средним сроком 61,9+3,9 мес. были получены различные результаты. Худшие результаты наблюдались при использовании твердой мозговой оболочки (почти 43% развития гемодинамически значимых рестенозов и окклюзий). Наилучшие результаты были получены при использовании заплаты из аутовены. Однако при этом возможно образование аневризматических расширений, особенно если вена для пластики забирается с уровня лодыжки. Хорошие результаты были получены при применении синтетических заплат.
Второй методикой, которая используется при стенозе сонной артерии, является эверсионная эндартерэктомия. В последние годы эта методика использовалась у 35% больных. Основным условием для ее успешного применения является наличие короткой бляшки 10-15мм во внутренней сонной артерии и дополнительно желательно, чтобы артерия имела изгиб или кинкинг. Для выполнения эверсионной эндартерэктомии внутренняя сонная артерия отсекается прямо у бифуркации. Во время выполнения эверсионной эндартерэктомии важно четко увидеть ее окончание и проконтролировать фиксацию интимы в ее дистальном отделе. Для этого можно дополнительно рассечь стенку по ее внутренней поверхности. Затем обязательно выполняется эндартерэктомия из общей и наружной сонных артерий. Для удаления остатков медии иногда целесообразно «протереть» поверхность маленьким тупфером. Мы считаем необходимым наложение широкого анастомоза, для чего обычно дополнительно обязательно рассекаем как стенку внутренней, так и общей сонных артерий. Конечно, эту методику целесообразно использовать, когда больной не требует использования внутреннего шунта. Однако и при использовании внутреннего шунта возможно применение эверсионной эндартерэктомии.
20 лет отработки этой операции позволили добиться результатов, которые соответствуют мировым стандартам. Начиная с 1998 года послеоперационная летальность колеблется в пределах 0,9-1,2%. Основной причиной летальности остаются послеоперационные инфаркты. Среди осложнений следует отметить нелетальные инсульты, число которых варьирует от 1,1 до 1,4%. При этом еще раз следует отметить, что среди оперированных нами больных 44% уже перенесли инсульт до операции.
Особое внимание в нашей работе мы уделили изучению отдаленных результатов операции. Так, в группе 148 больных были изучены отдаленные результаты в сроки до 196 мес. При этом у половины больных срок превышал 5 лет, а у 13% больных прошло после операции 10 лет. Главное, что было доказано, – это высокая эффективность каротидной эндартерэктомии: у 94,3% больных в отдаленные сроки не отмечено появления или возобновления ипсилатеральной неврологической симптоматики. Это при том, что больные в то время не принимали никаких противоатеросклеротических препаратов. Конечно, на результаты операции в первую очередь влияет качество выполнения операции.
Наиболее благоприятное течение в отдаленном периоде отмечается у больных, оперированных с исходной асимптомной степенью сосудисто-мозговой недостаточности.
Каротидная эндартерэктомия становится самой частой операцией в мире после АКШ. По данным Takao Onki и Frank J. Veith, в США в год производится 150 000 каротидных эндартерэктомий и около 2 млн. людей имеют поражение сонных артерий. Например, в 10 штатах США частота каротидной эндартерэктомими варьирует от 25,7 до 38,4 на 10 000 застрахованных (Kresowik T. et al, 2001).
Возраст как таковой не является противопоказанием к операции. Так, по сборным данным 10 штатов США, 19% больных, которые были оперированы по поводу стеноза сонной артерии, были старше 80 лет вплоть до 95 лет (Kresowik T. et al, 2001).
Некоторые авторы подчеркивают, что под местной анестезией более точно определяются показания к использованию внутреннего шунта и в связи с этим он реже употребляется, мозг меньше повреждается, чем при наркозе.
Что касается техники самой операции, то в 2000 году Archie J., Edrington K. привели данные рандомизированных исследований по сравнению результатов операций с прямым швом и с заплатой. Оказалось, что интраоперационный инсульт при прямом шве наблюдается в 2,2-5,7%, при заплате – в 0,2-2,0%, развитие рестеноза в 50% и более через 1 год отмечается при шве в 5,1-9,7%, при заплате – в 0,9-3,1%. Приведенные данные убедительно свидетельствуют в пользу использования заплаты.
При анализе свыше 10 000 каротидных эндартерэктомий было показано, что стандартное интраоперационное применение гепарина уменьшает возможность осложнений (инсульта и смерти) на 51%, а использование заплаты снижает риск осложнений на 27%.
Что касается летальности и осложнений, то, например, в 10 различных штатах США общая летальность при каротидной эндартерэктомии колеблется в пределах 1,0-2,2%, а частота инсультов плюс смерть – от 4,1 до 6,4%. Больные, которые перед операцией перенесли инсульт, имели 7,7% осложнений (новый инсульт/смерть). У асимптомных больных летальность составляет 0,5-1,4%, а общие осложнения (инсульт/смерть) не превышают 2,3-4,2% (Kresowik T. et al, 2001).
Мировой опыт многих сотен тысяч операций каротидной эндартерэктомии и наши данные показали, что эта операция может спасти больного от ишемического инсульта. Даже при поражении интракраниальных артерий (что встречается не чаще, чем у 10-15% больных) эта операция улучшает и интракраниальный кровоток, исключает возможность развития инсульта из-за эмболии с атеросклеротической бляшки в бифуркации сонной артерии. В 2000 году был опубликован мета-анализ 23 публикаций (Archie J., Edrington R.), который убедительно показывает, что эффективность каротидной эндартерэктомии у симптомных больных со стенозом 70% и больше очень высока, так как снижает риск смерти или инсульта на 48%. Особенно важно подчеркнуть результаты рандомизированного многоцентрового исследования у асимптомных больных со стенозом внутренней сонной артерии 60-90% (ACAS). Наблюдения в течение 5 лет показали, что каротидная эндартерэктомия уменьшает на 53% возможность ипсилатерального инсульта или смерти по сравнению с медикаментозным лечением. Конечно, такая высокая результативность операции возможна только при условии низкого риска самой операции, то есть риска развития инсульта или смерти больного. Отсюда необходимость выполнения этой операции только хирургами, которые хорошо владеют техникой сосудистых операций. В 2000 году Pearce W.H. сделал доклад, в котором привел анализ 45 000 каротидных эндартерэктомий, сделанных во Флориде, США. Результаты этой операции на 15% лучше по показателям летальности и осложнений у сертифицированных сосудистых хирургов в сравнении с результатами общих хирургов США. Опыт хирургов играет огромную роль в результатах операций. Следует подчеркнуть еще очень важную экономическую сторону этой операции– она не требует больших материальных затрат.
Учитывая открывающиеся широкие возможности ультразвукового амбулаторного обследования больных, направление их на оперативное лечение с асимптомной степенью сосудисто-мозговой недостаточности становится вполне реальным. В качестве примера можно привести опыт Кливлендской клиники США, где за 10 лет выполнено 3061 каротидная эндартерэктомия, при этом 64,6% больных были оперированы с асимптомной степенью сосудисто-мозговой недостаточности (Ouriel K., Hertzer N. et al, 2001).
Если сравнить летальность при ишемическом инсульте в пределах 40% и послеоперационную летальность после каротидной эндартерэктомии в пределах 1-3%, то становится абсолютно ясно, что профилактическая операция может спасти жизнь многим тысячам больных.
В последние годы появились работы по применению дилатации и стентирования при стенозе сонной артерии. Первоначально применение этой методики считалось возможным при рестенозе после эндартерэктомии, при радиационном стенозе и у больных с повышенным риском операции. Однако в первых работах частота интраоперационного инсульта и летальность были значительно выше, чем при стандартной эндартерэктомии, и доходили до 8-10% и даже 16%. С 1995 года стало использоваться стентирование. При этом было подтверждено, что основная опасность методики заключается в эмболизации сосудов головного мозга из атеросклеротической бляшки в момент ее дилатации. Поэтому были предложены и в настоящее время проходят испытания три методики по защите мозга во время дилатации. Первая методика – введение во внутреннюю сонную артерию дистальнее стеноза окклюзирующего баллона, который перекрывает кровоток в мозг во время дилатации. При этом больной должен быть толерантен к прекращению мозгового кровотока. Вторая методика – введение в дистальный отрезок внутренней сонной артерии специального зонтика с отверстиями, которые не прерывают кровоток, а зонтик улавливает крупные эмболы, которые, кроме того, еще отсасываются катетером. При обеих методиках существует опасность эмболии в момент первичного проведения защитных устройств. Третья методика заключается в окклюзии общей и наружной сонных артерий баллоном и отведение ретроградного кровотока в бедренную вену.
Кроме опасности эмболии и инсульта во время дилатации сонной артерии, ранние результаты дилатации оказались неудовлетворительными. Процент рестеноза в некоторых небольших исследованиях доходил до 44% через 3 года. Интересные данные приводят d’Audiffret A. и Becquemin J.P. (2001) в период усовершенствования методики. Среди 77 больных неврологические осложнения были у 9,3% больных, 4,6% были срочно оперированы стандартным методом, а общий успех составил всего 82%. Однако после начала использования защиты мозга, низкопрофильных катетеров и самораскрывающихся стентов авторы не имели осложнений. При наблюдении больных в течение 21 месяца частота рестеноза больше 50% составила 5%.
Golledge с соавт. (2000) провел мета-анализ первых сравнительных 33 публикаций по стентированию и каротидным эндартерэктомиям и показал, что 30-дневная летальность и инсульт составляют при дилатации сонной артерии 7,1%, а при стандартной эндартерэктомии – всего 3,3%.
Criado F. с соавт. (2002) привел результаты 135 стентирований сонной артерии без защиты мозга. 60% больных были асимптомными. Технические неудачи были у 2,2% больных. Четверо больных (3%) имели инсульт, летальности не было. Срок наблюдения за больными был небольшим – в среднем 16 месяцев – и авторы выявили 4 гемодинамических рестеноза в самих стентах.
Macdonald S. с соавт.(2002) привели сборные данные 50 стентирований с защитой мозга, в которых частота инсульта и смерти составила 6%.
В ноябре 1999 года собрание экспертов приняло консенсус по стентированию стеноза сонной артерии (Veith F. et al., 2001). В нем подчеркивается, что стентирование сонной артерии может применяться только в высококвалифицированных учреждениях и только у больных с высоким риском стандартной каротидной эндартерэктомии. Методика не может быть рекомендована для широкого применения. Для высоквалифицированных учреждений специалисты, участники консенсуса рекомендовали следующие показания к стентированию стеноза сонной артерии:
- больные высокого риска с симптомным стенозом сонной артерии;
- больные с рестенозом;
- больные после радиационной терапии на шее;
- при высокой бифуркации сонной артерии;
- у больных, неоперабельных открытым путем.
В дополнение стентирование возможно показано у больных с окклюзией контрлатеральной сонной артерии. Стентирование должно проводиться с защитой мозга. Консенсус пришел к выводу, что для широкого распространения методики необходимо ожидать результатов рандомизированных исследований.
В противоположность ангиопластики сонных артерий дилатация других брахиоцефальных артерий (брахиоцефального ствола, подключичных артерий) начала применяться в институте хирургии им. А.В. Вишневского с 1984 года. Мы имеем опыт свыше 70 дилатаций. Проведенное изучение отдаленных результатов у 59 больных (27 дилатаций брахиоцефального ствола, 31 дилатация подключичных артерий и 1 дилатация общей сонной артерии) показали следующие результаты. При стенозе брахиоцефального ствола после дилатации в сроки до 9,5 лет только у одного больного возникло ОНМК. Кумулятивные показатели проходимости достигали 94%. Учитывая, что дилатация сопровождается меньшей частотой осложнений и летальности, мы считаем ее операцией выбора при стенозе брахиоцефального ствола. С внедрением стентирования расширились показания к ангиопластике при стенозе I сегмента подключичной артерии. Мы видим, что эндоваскулярные вмешательства все чаще стали использоваться при атеросклеротическом поражении брахиоцефальных артерий.
Конечно, сосудистый хирург в первую очередь является хирургом, но в то же время он главный лечащий доктор больного с заболеваниями сосудов. Так как сейчас большинство больных имеют мультифокальное атеросклеротическое поражение сосудов, то лечение больного должно обязательно включать и медикаментозную терапию. Лечение направлено на коррекцию артериальной гипертензии (лучше бета-блокаторами и ингибиторами АПФ, антагонистами кальция). Одновременно такое лечение проводится и при ишемической болезни сердца. При этом сейчас доказана целесообразность постоянного приема 50-100 мг аспирина ежедневно. Последние исследования показывают необходимость сочетания приема аспирина и другого антиагреганта – тиклида или плавикса. После исследования «4S» никем не оспаривается целесообразность постоянного приема одного из статинов с тем, чтобы удерживать уровень общего холестерина ниже, чем 5,2 ммоль/л. У больных диабетом необходима постоянная коррекция уровня сахара в крови, и он не должен быть выше 5,5 ммоль/л. В силе остается старое положение, что больным с поражением сосудов необходимо полное прекращение курения независимо от его длительности. Только такое комбинированное лечение позволяет продлить жизнь больных и улучшить ее качество.
В данной работе мы коснулись только некоторых направлений деятельности сосудистого хирурга. Недаром сосудистая хирургия во многих странах мира выделена в отдельную специальность. В нашей стране с 1986 года существует общество сосудистых хирургов, которое пытается объединить и других специалистов и вырастить в стране ангиологов. За прошедшие годы сложилась большая специализированная сеть сосудистых отделений по всей стране, особенно в крупных городах.
Главное, о больших возможностях сосудистой хирургии в помощи и спасении жизней многих тысяч больных должны знать врачи всех специальностей, особенно хирурги, и, конечно, население страны должно быть хорошо информированным о современных успехах в лечение сосудистых заболеваний.
Список литературы
- Котловар А.Н., Верещагин Н.В., Людковская И.Г., Моргунов В.А. Патологическая анатомия нарушений мозгового кровообращения. М., 1975, стр. 256.
- Покровский А.В. Эверсионная каротидная эндартерэктомия. // Ангиология и сосудистая хирургия – 2001 – 7,2 – стр. 105-106.
- Покровский А.В., Буяновский В.Л. Местная анестезия в хирургии сонных артерий. // Хирургия – 1986 – 5 – стр. 47-54.
- Покровский А.В., Волынский Ю.Д., Кунцевич Г.И. Ультразвуковая ангиография в диагностике поражений брахиоцефальных ветвей аорты. // Кардиология – 1985 – 10 – стр. 82-86.
- Покровский А.В., Кованева Р.А. Показания к хирургическому лечению сосудисто-мозговой недостаточности. // Невропатология и психиатрия – 1977 – 12 – стр. 1789-1797.
- Покровский А.В., Кованева Р.А., Грозовский Ю.Л. Реконструктивная хирургия экстракраниальных артерий головного мозга. // Вестник АМН СССР – 1983 – 1 – стр. 52-61.
- Покровский А.В., Кунцевич Г.И., Лаврентьева М.А. Транскраниальное ультразвуковое исследование артерий мозга. // Кардиология – 1988 – 9 – стр. 114-120.
- Покровский А.В., Работников В.С. Профилактические операции на брахиоцефальных сосудах при мозговой сосудистой недостаточности. // Международный конгресс хирургов, Братислава, ЧССР, 1973, с. 69.
- Смертность от сердечно-сосудистых заболеваний в России и некоторые влияющие на нее факторы. // Кардилогия – 1994 – 34,4 – стр. 80 – 83.
- Фокин А.А., Глазырин С.А., Алехин Д.И. Отдаленные результаты различных реконструктивных операций на сонных артериях – срок наблюдения более 10 лет. // Ангиология и сосудистая хирургия – 2001 – 7,3 – стр.139.
- Archie J.P. Reoperation for carotid artery stenosis. Role of primary and secondary reconstructions. // J.Vasc.Surg. – 2001. – Vol.33,3 – p.495-503.
- Archie J.P..Jr., Edrington R.D. Carotid Surgery in book: Vascular Surgery Highlights 1999-2000. Health press, Oxford, 2000, p.61-68.
- Cronenwett J.L. Shopping for vascular surgery. // J.Vasc.Surg. – 2001. – Vol.33,3 – p.654-657.
- Darling R.C.IIId., Roddy S.P., Chang B.B. et al. Long-term results of revised infrainguinal arterial reconstructions. // J.Vasc.Surg. – 2002. – Vol.35,4 – p.773-778.
- Dattilo J.D., Brewester D.C., Fanental Ch. Clinical benefits of endovascular abdominal aortic aneurism repair. // J.Vasc.Surg. – 2002. – Vol.35,6 – p.1137-1144.
- Endarterectomy for asymptomatic carotid artery stenosis. Executive Committee for ACAS.// JAMA – 1995.- Vol.273 – p. 1421-8.
- Hertzer N.R., Mascha E.R., Kafara M.T. et al. Open infrarenal abdominal aortic repair: the Cleveland Clinic experience from 1989 to 1998. // J.Vasc.Surg. – 2002. – Vol.35,6 – p.1145-1154.
- Kalra M., Gloviczki P., Bower T.C. et al. Limb salvage after successful pedal bypass grafting is associated with improved long-term survival. // J.Vasc.Surg. – 2001. – Vol.33,1 – p.6-16.
- Kresowik T.F., Bratzler D., Karp H.R. et al. Multistate utilization, processes and outcomes of carotid endarterectomy. // J.Vasc.Surg. – 2001. – Vol.33,2 – p.227-235.
- Lifeline Registry of Endovascular Aneurism Repair Steering Committee. // J.Vasc.Surg. – 2001. – Vol.35,3 – p.616-620.
- Lovelace T.D., Moneta G.L., Abon A.M. et al. Optimizing duplex follow-up in patients with an asymptomatic internal carotid artery stenosis. // J.Vasc.Surg. – 2001. – Vol.33,1 – p.56-61.
- Quriel K., Hertzer N.R., Beren E.G. et al. Preprocedural risk stratification: Identifying an appropriate population for carotid stenting. // J.Vasc.Surg. – 2001. – Vol.33,4 – p.728-732.
- Santilli S.M., Littooy F.N., Cambria R.A. et al. Expansion rates and outcomes for 3.0 cm to the 3.9 cm infrarenal abdominal aortic aneurysm. // J.Vasc.Surg. – 2002. – Vol.35,4 – p.666-671.
- Tu J.V., Austin P.C., Johnston K.W. The influence of surgical specialty training on the outcomes of elective abdominal aortic aneurysm surgery. // J.Vasc.Surg. – 2001. – Vol.33,3 – p.447-452.
- Zarins Ch.K., White R.A., Moll F.L. et al. The AneuRx stent graft: Four-year results and worldwide experience 2000. // J.Vasc.Surg. – 2001. – Vol.33,2 – p.135-145.
* Перепечатывается из сборника «50 лекций по хирургии» под редакцией В.С. Савельева, выпущенного издательством Media Medica, 2003, стр.37-46.
границ | Сосудистая проницаемость и доставка лекарств при раке
Проницаемость сосудов при раке
Организация сосудистых барьеров
Эндотелиальные клетки, перициты, гладкомышечные клетки и базальная мембрана вместе образуют стенку кровеносных сосудов, которая обеспечивает селективный обмен между плазмой и орошаемыми тканями. Прохождение макромолекул, жидкостей и клеток через этот эндотелиальный барьер может происходить либо через (трансцеллюлярный), либо между клетками (параклеточный) (1).Способность проходить из интерстициального пространства в компартмент крови и наоборот зависит от заряда, размера и характеристик связывания.
Небольшие молекулы (размером менее 3 нм) обычно транспортируются трансцеллюлярным путем, для чего требуется система транспортных везикул, называемых везикулярными вакуолярными органеллами (VVO) (Рисунок 1). Было продемонстрировано, что некоторые факторы проницаемости, такие как фактор роста эндотелия сосудов (VEGF) и гистамин, активируют VVO и регулируют гомеостаз сосудов (2).Эти VVO включают, среди прочего, сгруппированные кавеолы и зависят от функции белка кавеолина-1, что, в частности, гарантирует транспорт альбумина. Интересно, что кавеолин-1 играет двойную регулирующую роль в проницаемости микрососудов, стабилизируя структуры кавеол и обеспечивая кавеолярный трансцитоз, одновременно действуя как негативный регулятор через эндотелиальную синтазу оксида азота (eNOS) (3, 4).
Рисунок 1. Трансклеточные и парацеллюлярные пути в эндотелиальных клетках .Прохождение клеток и макромолекул через эндотелиальный барьер может происходить по трансцеллюлярным (везикулярные вакуолярные органеллы) или парацеллюлярным (плотные и адгезивные соединения) путями. Щелевые переходы обеспечивают транспорт воды и ионов. Более того, эндотелиальные клетки закреплены и связаны с внеклеточным матриксом (ЕСМ) посредством адгезионных комплексов на основе интегрина, а именно фокальных адгезий.
Клетки и макромолекулы размером более 3 нм используют параклеточный путь, который опосредуется скоординированным открытием и закрытием эндотелиальных межклеточных соединений.Адгезивные (AJ) и плотные (TJ) контакты поддерживают рестриктивность барьера, в то время как щелевые контакты соединяют соседние эндотелиальные клетки. Щелевые соединения отвечают за транспорт воды и ионов, но не вносят значительного или прямого вклада в создание сосудистых барьеров (рис. 1). Среди белков AJ наиболее важным является кадгерин эндотелия сосудов (VE-кадгерин), который экспрессируется исключительно в сосудах (1, 5). У мышей делеция гена VE-кадгерина приводит к ранней эмбриональной летальности из-за массивных сосудистых дефектов, в то время как потеря его функции вызывает фенотип гиперпроницаемости у взрослых (6, 7).VE-кадгерин включает пять повторов иммуноглобулин-подобных доменов во внеклеточной области, один однопроходный трансмембранный домен и короткий цитоплазматический хвост. В то время как внеклеточный домен обеспечивает зависимость Ca ++ и допускает гомофильное взаимодействие в транс (т.е. между кадгеринами на соседних клетках), трансмембранный домен участвует в латеральной кластеризации внутри одной и той же клетки ( цис ) (8). Цитоплазматическая часть VE-кадгерина связывается с белками из семейства генов броненосных повторов, а именно с p120-катенином и либо β-катенином, либо плакоглобином (γ-катенин).Этот комплекс служит для усиления сил сцепления и обеспечивает возможность динамических контактов (рис. 2). p120-катенин взаимодействует с юкстамембранной частью цитоплазматического домена VE-кадгерина и участвует в его удерживании на поверхности клетки, в то время как β / γ-катенины, с другой стороны, действуют как конститутивные партнеры VE-кадгерина, связанные с его карбокси-концевая часть (9, 10). Важно отметить, что VE-кадгерин также связан с актиновым цитоскелетом через актин-связывающий белок α-катенин (5). Другие адгезивные белки, которые накапливаются в AJ или рядом с ним, включают N-кадгерин, молекулу адгезии тромбоцитов к эндотелиальным клеткам (PECAM-1) и соединительные молекулы адгезии (JAM).
Рисунок 2. Адгезивный комплекс VE-кадгерин . VE-кадгерин опосредует адгезию между эндотелиальными клетками кальций-зависимым образом. VE-кадгерин состоит из внеклеточного домена, который обеспечивает гомофильное взаимодействие в транс . Трансмембранный домен участвует в латеральной кластеризации cis . Внутриклеточный домен VE-кадгерина связывает p120-катенин (p120) и β-катенин (β-cat), который участвует в удерживании VE-кадгерина на мембране.Актиновый цитоскелет прикреплен к VE-кадгерину через α-катенин (α-cat) или плакоглобин (plako). Кроме того, VE-кадгерин может связывать VEGF-R2 (рецептор 2 фактора роста эндотелия сосудов) и VE-PTP (фосфотирозинфосфатазу эндотелия сосудов).
Плотные соединения участвуют в когезии эндотелиальных клеток и блокируют диффузию молекул вдоль апикального и базолатерального полюсов (11). Они полагаются на белки трансмембранной адгезии (окклюдин и клаудины), белки семейства JAM и внутриклеточные соединители, включая ZO-1, -2, -3 (Zonula Occludens).Во-первых, окклюдин и клаудины содержат четыре трансмембранных домена с N- и C-концевыми внутриклеточными частями. Во-вторых, JAM-A принадлежит к суперсемейству иммуноглобулинов с одним внутриклеточным коротким доменом, одним единственным трансмембранным доменом и двумя внеклеточными иммуноглобулиноподобными доменами. В-третьих, белки ZO содержат три PDZ (белок постсинаптической плотности PSD95, супрессор больших опухолей диска Drosophila Dlg1 и белок zonula occludens-1 zo-1), один Sh4 (SRC гомология 3) и один гуанилилкиназоподобный домен (11). .В отличие от VE-кадгерина, делеция гена клаудина-5 не нарушает развитие эмбриона мыши, а скорее приводит к послеродовой смерти, вызванной дефектным гематоэнцефалическим барьером (12). Таким образом, VE-кадгерин играет важную роль в целостности сосудистого барьера, тогда как клаудины могут играть более ограничительную роль (13). Тем не менее, AJ и TJ функционально и структурно связаны и могут влиять друг на друга (14, 15).
Внутри кровеносных сосудов эндотелиальные клетки интерактивно закреплены на внеклеточном матриксе (ЕСМ) посредством адгезионных комплексов на основе интегрина, а именно фокальных адгезий (Рисунок 1).Действительно, интегрины соединяют ЕСМ с аппаратом сократительной способности актомиозина (16) и позволяют эндотелиальным клеткам адаптироваться к внеклеточным сигналам и сигналам (например, сдвиговому напряжению и секретируемым молекулам). С молекулярной точки зрения активация Rho-GTPase, формирование стрессовых волокон и сокращение актомиозина тонко регулируются посредством адгезии интегрина и в совокупности вносят вклад в модуляцию целостности эндотелиального соединения (17, 18). Совсем недавно было продемонстрировано, что интегрин-ассоциированная тирозинкиназа фокальной адгезии (FAK) способствует нарушению функции сосудистого барьера (19).Действительно, было показано, что активация FAK, индуцированная VEGF, приводит к взаимодействию VE-кадгерин / FAK в ассоциации с фосфорилированием β-катенина по тирозину Y142, что приводит к диссоциации VE-кадгерина / β-катенина, открытию соединений и разрушению эндотелиального барьера.
Следовательно, свойства сосудистого барьера зависят как от структурных (базальная мембрана, гладкомышечные клетки, эндотелиальные клетки), так и от функциональных (VVO, AJ, TJ) характеристик. Чтобы подтвердить эту роль, адгезия эндотелиальных клеток должна строго регулироваться.Действительно, аберрантное и неконтролируемое увеличение проницаемости сосудов может участвовать в прогрессировании многих патологических состояний, таких как хронические воспалительные заболевания, диабет и ангиогенез опухоли.
Утечка сосудов в микросреде опухоли
По сравнению с нормальными тканями, сосудистая сеть опухоли является незрелой и демонстрирует структурные аномалии, такие как дилатация, мешковидное образование и гиперразветвленный и скрученный рисунок. Более того, в солидных опухолях функциональные лимфатические сосуды практически отсутствуют (20, 21).Многие молекулярные и клеточные факторы способствуют этой морфологической и функциональной недостаточности, в которой проницаемость сосудов является центральной. Быстрорастущие опухоли секретируют множество различных факторов (VEGF, хемокины и др.), Которые управляют неконтролируемым ангиогенезом. В таких микросредах обходится большинство критериев, определяющих свойства эндотелиального барьера.
Во-первых, сосуды опухоли характеризуются обширным ангиогенезом, то есть образованием новых сосудов из уже существующих сосудистых сетей.В этом случае эндотелиальные клетки опухоли имеют скорость пролиферации в 50–200 раз быстрее, чем нормальные покоящиеся эндотелиальные клетки (22). Они также должны мигрировать и перестраиваться в сосудистые канальцы, предназначенные для подпитки опухолевой массы. Эта высокая эндотелиальная пластичность постоянно реконструируемой сосудистой стенки сопровождается повышенной проницаемостью. Гиперпроницаемость опухолевых сосудов коррелирует со слабой экспрессией VE-кадгерина, открытием параклеточных соединений и образованием трансклеточных отверстий (23).В процессе роста опухоли прямым следствием гиперпроницаемости сосудов является экстравазация белков плазматической мембраны и образование провизорного матрикса, позволяющего эндотелиальным клеткам разрастаться и формировать новые сосуды (24).
Морфологически перициты, окружающие сосуды опухоли, имеют аномальную форму и слабо связаны с эндотелиальными клетками (25). Кроме того, в кровеносных сосудах опухоли отсутствуют гладкие мышцы (рис. 3). Точно так же базальная мембрана может быть либо необычно толстой, либо полностью отсутствовать (26).В этих условиях сопротивление кровотоку увеличивается, и, следовательно, эффективность кровоснабжения опухоли снижается. Как следствие, несмотря на высокую плотность микрососудов, опухоли плохо васкуляризированы с гиперпроницаемой сосудистой сетью. Это могло привести к штрафу к накоплению продуктов метаболизма (молочной и угольной кислот) и снижению внеклеточного pH (27). Дефекты сосудов опухоли также подавляют поступление кислорода, часто вызывая гипоксию в микросреде опухоли. Гипоксия, в свою очередь, поддерживает ангиогенез опухоли за счет факторов транскрипции, индуцируемых гипоксией (HIF), и дополнительно повышает экспрессию проангиогенных молекул, таких как VEGF, TNF (фактор некроза опухоли) и PDGF (фактор роста тромбоцитов). .Интересно, что из-за его участия в химио- и радиорезистентности, а также в метастазировании, гипоксия была предложена как неблагоприятный прогностический фактор (28).
Рисунок 3. Эндотелиальный барьер в нормальных и опухолевых сосудах . Структура эндотелиального барьера различается в нормальных (A) и опухолевых (B) кровеносных сосудах. В отличие от нормальных сосудов, паттерн сосудистой сети опухоли чрезвычайно дезорганизован и анархичен, имеет морфологические и структурные различия, т.е.е., слабая ассоциация между эндотелиальными клетками, аномальная форма перицитов, отсутствие гладкой мускулатуры, а также модификация базальной мембраны.
Внутри микросреды опухоли ECM претерпевает значительные композиционные модификации, в первую очередь за счет увеличения уровней экспрессии коллагена-1, матриксных металлопротеаз (MMP) -1 и -2 и ламинина-5 (29). Например, отложение коллагена-1 увеличивает жесткость ВКМ, что связано с плохим прогнозом и более высоким потенциалом метастазирования (30).Кроме того, жесткость ECM увеличивает экспрессию интегрина и способствует передаче сигналов фокальной адгезии и, следовательно, влияет на злокачественность опухолевых клеток (31).
Таким образом, аномальные кровеносные сосуды и отсутствие лимфатических сосудов в опухолях, а также повышенная жесткость ECM и относительно высокое давление интерстициальной жидкости (IFP) в совокупности способствуют функциональному результату, называемому повышенной проницаемостью и удерживанием (EPR). Это явление способствует экстравазации и удержанию макромолекул.В то время как нормальные сосуды образуют селективный барьер, ограничивающий прохождение клеток и макромолекул, сосудистая сеть опухоли чрезвычайно негерметична и не ограничивает. Следовательно, хотя эти особенности могут быть полезны для ангиогенеза и роста опухоли, доставка противоопухолевого лекарственного средства довольно ограничена.
Влияние на доставку лекарств
Для повышения биодоступности и селективности в отношении опухолевых клеток терапевтические молекулы должны противодействовать биологическим и физическим барьерам, среди которых эндотелиальный транспорт и кровоток.Насосы для оттока лекарств — одно из основных препятствий, которые необходимо преодолеть противораковыми препаратами. Эти транспортеры высоко экспрессируются в большой панели раковых клеток, а также в гематоэнцефалическом барьере, где они обеспечивают детоксикацию лекарств (32, 33).
Однако сосуды опухоли не могут обеспечить правильную перфузию крови опухоли, поскольку они структурно аберрантны и сверхпроницаемы (24). Разница давлений между сосудами и окружающими тканями также представляет собой важный физический барьер.При сосудистой утечке транскапиллярный поток интерстициальной жидкости уменьшается, а IFP увеличивается, что приводит к плохому проникновению лекарства через сосуды опухоли (21). В дополнение к утечке кровеносных сосудов, как отсутствие функциональной лимфатической системы, так и повышенное сопротивление трению ЕСМ также приводят к увеличению IFP опухоли (34). В конечном итоге это вызывает нарушение направления кровотока, снова ограничивая доставку лекарственного средства.
Важно отметить, что доставка лекарственного средства опухоли может быть адаптирована путем изменения размера и заряда доставленной молекулы.Интересно, что молекулы крупнее 40 кДа не могут пассивно элиминироваться через почечный клиренс и не могут пересекать нормальные кровеносные сосуды через эндотелиальные соединения; однако они могли легко проникать в опухоли через протекающие сосуды. ЭПР сосудов опухоли позволяет проходить молекулам в диапазоне от 40 до 70 кДа, таким образом, в сочетании с другими свойствами, такими как способность преодолевать относительно большие расстояния, длительный период полужизни в плазме и медленный клиренс, было предложено, чтобы эти более крупные молекулы были наиболее подходящий для конкретной доставки опухоли (35, 36).Кроме того, из-за отрицательных зарядов на поверхности просвета сосуда использование катионных терапевтических молекул также может способствовать накоплению в сосудах, что, в свою очередь, может повышать концентрацию лекарственного средства против опухоли (37).
Таким образом, хотя доставка лекарств в опухоли сильно нарушена из-за структурных и функциональных дефектов сосудов, некоторые из этих ограничений, такие как негерметичность сосудов, могут быть использованы в лечебных целях.
Молекулярные механизмы, участвующие в проницаемости сосудов
Как указано выше, целостность эндотелиального барьера обеспечивает гомеостаз сосудов и тканей.При раке нарушение регуляции этой точно настроенной функции приводит к образованию хаотической сети кровеносных сосудов, связанной с повышенной проницаемостью. Теперь мы подробно рассмотрим молекулярные механизмы, вовлеченные в управляемую опухолью проницаемость сосудов, сосредоточив внимание на основных факторах, продуцируемых опухолевыми клетками, таких как VEGF и хемокины. Эти знания могут открыть новые возможности для разработки лекарств.
Фактор роста эндотелия сосудов
Фактор роста эндотелия сосудов относится к семейству факторов роста тромбоцитов и первоначально назывался фактором проницаемости сосудов (38).Это гомодимерный гликопротеин, несколько форм которого были описаны у млекопитающих, это: VEGF-A, B, C, D и фактор роста плаценты PlGF. Среди них VEGF-A наиболее изучен и лучше описан в литературе. Различные типы клеток, такие как эндотелиальные клетки, гладкомышечные клетки, фибробласты и иммунные клетки (макрофаги, лимфоциты, нейтрофилы и эозинофилы), могут продуцировать и высвобождать VEGF в окружающей среде. В свою очередь, VEGF может действовать как аутокринным, так и паракринным образом.При раке опухолевые клетки представляют собой важный источник VEGF. VEGF стимулирует рост эндотелиальных клеток и способствует васкулогенезу и ангиогенезу. Он также увеличивает проницаемость сосудов, свою первую описанную функцию, во многих тканях и играет решающую роль в развитии сосудистой сети опухоли (22). Внутриклеточная передача сигналов VEGF опосредуется тремя рецепторами тирозинкиназы, а именно VEGF-R1, -R2 и -R3, а также корецепторами, такими как нейропилины. Связывание лиганда с его родственными рецепторами вызывает их димеризацию, аутофосфорилирование и последующую передачу сигнала (39).VEGF-A взаимодействует как с VEGF-R1, так и с -R2, но только VEGF-R2 принимает непосредственное участие в нормальной и патологической проницаемости сосудов (40). Однако сообщается, что VEGF-R1 действует как регулятор передачи сигналов VEGF-R2 и, таким образом, может косвенно регулировать проницаемость сосудов.
VEGF-A способствует проницаемости сосудов за счет нарушения AJ и TJ, что приводит к временному открытию контактов эндотелиальная клетка-клетка (5, 14) (Рисунок 4). Действительно, VEGF-A способствует фосфорилированию тирозином VE-кадгерина и его партнеров по связыванию β-катенина, плакоглобина и p120 по Src-зависимому механизму (41).В соответствии с этим фосфорилирование VE-кадгерина ингибируется у мышей с дефицитом Src (41). VE-кадгерин также может связываться с VEGF-R2 и ингибировать его фосфорилирование и последующую интернализацию (42). Эта ассоциация усиливает фосфорилирование компонентов AJ с помощью Src, таким образом нарушая целостность эндотелиального барьера и способствуя экстравазации и распространению опухолевых клеток в патологических моделях (43). Ассоциация VE-кадгерин / VEGF-R2 также вносит вклад в индуцированное VE-кадгерином контактное ингибирование роста клеток и требует β-, но не p120-катенин, связывающего домена VE-кадгерина (42, 44).Кроме того, VEGF-A опосредует фосфорилирование и интернализацию VE-кадгерина посредством последовательной активации Src, фактора обмена гуаниновых нуклеотидов Vav2, Rho-GTPase Rac и его последующего эффектора, серин-треонинкиназы PAK (Рисунок 4). Этот сигнальный путь завершается PAK-зависимым фосфорилированием VE-кадгерина, которое направляет его интернализацию (45). Более того, передача сигналов VEGF снижает ассоциацию VE-кадгерин / p120-катенин, способствуя клатрин-зависимому эндоцитозу VE-кадгерина (46).В самом деле, связывание p120 с VE-cadherin предотвращает его интернализацию, тогда как его молчание с помощью siRNA ведет к деградации VE-cadherin и потере межклеточных контактов (10, 47). Экспрессия мутантов VE-кадгерина, которые конкурируют с эндогенной молекулой за связывание с p120, запускает деградацию VE-кадгерина, предполагая, что p120 может действовать как сигнал удерживания на плазматической мембране. Совсем недавно был идентифицирован мотив в VE-cadherin, который отвечает за связывание VE-cadherin / p120 и сортировку эндоцитоза (48).В этом контексте VE-кадгерин-опосредованные межклеточные контакты стабилизируются малой GTPase Rap1 и ее эффектором, циклическим аденозинмонофосфатом (cAMP) -активированным фактором обмена гуанидина Epac (49, 50). Малые GTPases также регулируют фосфорилирование легкой цепи миозина (MLC), сократимость актомиозина и проницаемость эндотелия (51). Действительно, VEGF индуцирует фосфорилирование MLC, что приводит к образованию стрессовых волокон, которые оказывают центростремительное напряжение на межклеточные соединения (52).
Рисунок 4.Молекулярные пути, участвующие в проницаемости VEGF-эндотелия . Стимуляция VEGF-A вызывает димеризацию VEGF-R2 и последовательную активацию Vav2, Rac и PAK через Src. Это приводит к фосфорилированию серина VE-кадгерина с помощью PAK и его последующей интернализации в ямки, покрытые клатрином. VEGF может также запускать фосфорилирование тирозина VE-кадгерина и его партнеров по связыванию β-катенина (β-cat) и p120 Src-зависимым образом. Кроме того, VEGF-A снижает ассоциацию VE-кадгерин / p120-катенин и способствует эндоцитозу VE-кадгерина.VEGF-A также индуцирует фосфорилирование легких цепей миозина (MLC), в результате чего образуются стрессовые волокна, которые оказывают напряжение на межклеточные соединения, тем самым ослабляя межклеточные контакты. Наконец, стимуляция VEGF-A вызывает диссоциацию VE-PTP / VE-кадгерина и вызывает потерю адгезии и увеличение проницаемости.
Следует отметить, что проницаемость эндотелия также может регулироваться путем изменения экспрессии компонентов AJ и TJ (15, 53). Например, передача сигналов VEGF через VEGF-R2 индуцирует экспрессию SRF (сывороточный фактор ответа), который важен для экспрессии VE-кадгерина (54).Действительно, нокдаун SRF у мышей снижает экспрессию VE-кадгерина и ангиогенез. Кроме того, экспрессия клаудина-5 регулируется VE-кадгерином, подтверждая, что последний играет важную роль в контроле функции эндотелиального барьера (15). Недавно было описано, что VEGF участвует в подавлении регуляции клаудина-5 в эндотелии брюшины, вызывая асцит у пациентов с раком яичников (55).
Интерлейкин-8
Цитокины являются ключевыми факторами иммунного ответа и играют важную роль в прогрессировании рака.Среди них хемокин IL-8 (CXCL8, хемокиновый лиганд CXC 8) сверхэкспрессируется и секретируется раковыми клетками. Следует отметить, что их родственные рецепторы, связанные с G-белком (GPCR), CXCR1 и CXCR2, экспрессируются на эндотелиальных клетках, опухолевых клетках и нейтрофилах / опухолевых макрофагах, что свидетельствует о плейотропной активности IL-8. Известно, что активация эндотелиальных рецепторов IL-8 способствует ангиогенным ответам за счет повышенной пролиферации, выживаемости и миграции (56). Кроме того, предполагается, что внутриопухолевая концентрация IL-8 в основном вызывает рекрутирование нейтрофилов в микросреду опухоли и способствует метастазированию (57).Помимо своей хемотаксической роли, IL-8 возник как важный фактор ангиогенеза и повышения проницаемости сосудов (58). Действительно, IL-8 может провоцировать фосфорилирование и трансактивацию VEGF-R2, что, в свою очередь, приводит к активации как Src, так и RhoA, что приводит к образованию эндотелиальной щели и повышенной проницаемости (59). IL-8 может также увеличивать проницаемость в эндотелиальных клетках мыши и человека посредством независимого от VEGF-R2 механизма (60). IL-8 инициирует путь передачи сигнала через CXCR2 / Rac / PI3Kγ, который запускает фосфорилирование и последующую интернализацию VE-кадгерина, тем самым способствуя повышенной проницаемости.Более того, блокада CXCR2 и PI3Kγ фармакологическими ингибиторами или посредством РНК-интерференции (РНКи) ограничивает индуцированную IL-8 неоваскуляризацию и утечку сосудов (60). Было обнаружено, что в глиобластоме раковые клетки секретируют высокие концентрации IL-8, который, как было дополнительно продемонстрировано, функционирует как ключевой фактор, участвующий в индуцированной опухолью проницаемости in vitro , и передает сигнал эндотелиальным клеткам микрососудов мозга через CXCR2, способствуя VE. ремоделирование межклеточного соединения кадгерина и повышенная проницаемость (61).Точно так же при раке простаты секреция IL-8 связана с повышенной экспрессией и активацией Akt, что влияет на выживаемость эндотелиальных клеток, ангиогенез и миграцию клеток (62).
Трансформирующий фактор роста-β1
TGF-β1 представляет собой многофункциональный полипептид, входящий в суперсемейство трансформирующего фактора роста бета. Он регулирует выработку цитокинов и компонентов внеклеточного матрикса и участвует в различных биологических процессах, таких как пролиферация и дифференцировка во многих типах клеток (63– 65).В микросреде опухоли макрофаги, мезенхимальные и раковые клетки секретируют TGF-β1 в условиях гипоксии и воспаления. Было высказано предположение, что TGF-β1 действует как мощный индуктор ангиогенеза, поскольку его повышенная экспрессия коррелирует с высокой плотностью микрососудов и плохим прогнозом при различных типах рака (66). TGF-β1 также увеличивает проницаемость сосудов, изменяя межклеточные контакты. Считается, что это связано с участием митоген-активируемой протеинкиназы p38 (MAPK) и сигнальных каскадов RhoA, которые, в свою очередь, модулируют адгезию ECM и приводят к потере целостности и функции эндотелиального барьера (67).В первичных опухолях молочной железы активность TGF-β1 связана с повышенным риском метастазирования в легкие. В самом деле, родственный ангиопоэтину белок 4 (ANGPTL4), ген-мишень TGF-β1, разрушает эндотелиальные межклеточные соединения и способствует экстравазации клеток рака груди (68). Более того, TGF-β1 индуцирует экспрессию VEGF в фибробластах (69), тогда как он ингибирует ангиопоэтин-1, фактор, препятствующий проницаемости, тем самым усугубляя сосудистую утечку, связанную с опухолью (70). Кроме того, TGF-β1 усиливает секрецию и активацию ММП (71).
Фактор, производный от стромальных клеток 1
Фактор 1, происходящий из стромальных клеток, также известный как CXCL12, является членом подсемейства α-хемокинов и лигандом GPCR CXCR4. Во взрослом возрасте SDF-1 участвует в ангиогенезе путем привлечения эндотелиальных клеток-предшественников из костного мозга (72). SDF-1 высоко экспрессируется при ряде видов рака и связан с экстравазацией опухоли и увеличением метастазов (73, 74). Экспрессия CXCR4 также подтверждает метастатические свойства клеток рака молочной железы (75).Действительно, было обнаружено, что уровни CXCR4 выше в злокачественных опухолях молочной железы по сравнению с уровнями нормальных здоровых собратьев. In vivo , нейтрализующий ось передачи сигналов CXCR4 / SDF-1, значительно нарушает экстравазацию и размножение клеток рака молочной железы (75, 76). SDF-1 может также опосредовать проницаемость эндотелия через CXCR4, например, стимуляция SDF-1 клеток рака молочной железы in vitro увеличивала их прохождение через эндотелиальный барьер. Этот эффект зависит как от PI3K / Akt, так и от передачи сигналов кальция в эндотелиальных клетках (77).С другой стороны, ингибирование этого пути с помощью антител против CXCR4 уменьшало сосудистую утечку (77). Более того, SDF-1 участвует в рекрутировании макрофагов в опухоли груди у мышей в ответ на химиотерапию (78). Считается, что это действие стимулирует рост кровеносных сосудов опухоли, противодействуя действию препарата. Наконец, следует отметить, что VEGF стимулирует секрецию SDF-1, а — наоборот, (79, 80). Однако роль VEGF в проницаемости, индуцированной SDF-1, еще предстоит выяснить.
Интерлейкин-10
IL-10, также известный как фактор ингибирования синтеза цитокинов человека, является противовоспалительным цитокином. Роль IL-10 при раке, хотя и хорошо принята, изучена нечетко (81). Действительно, предполагается, что IL-10 проявляет как про-, так и противоопухолевую активность, и были получены противоречивые результаты относительно его участия в ангиогенезе опухоли. С одной стороны, IL-10 может препятствовать ангиогенезу и росту опухоли у мышей, несущих VEGF-продуцирующий рак яичников (82), а также подавлять рост опухоли и метастазирование клеток меланомы человека (83).С другой стороны, другие исследования показали, что IL-10 может способствовать ангиогенезу в модели клеток меланомы, подавляя функции макрофагов и индуцируя пролиферацию опухолевых и сосудистых клеток (84).
Матричные металлопротеиназы
Металлопротеиназы — это большое семейство протеаз, в которое входят MMP и ADAM (дезинтегрин и металлопротеиназа). ММП принадлежат к семейству цинксодержащих эндопептидаз, которые разрушают различные компоненты ЕСМ. Их аберрантная сверхэкспрессия коррелирует с прогрессированием рака, клеточной инвазией и метастазированием (85).Связанные с опухолью макрофаги секретируют VEGF и MMP-9, которые напрямую участвуют в инвазии и метастазировании клеток как рака молочной железы, так и колоректального рака (86). Кроме того, ММП способствуют прогрессированию опухоли за счет перестройки внеклеточного матрикса. Действительно, они урезают молекулы клеточной адгезии и разрушают белки матрикса, способствуя пролиферации клеток и ангиогенезу. MMP-7 может выделять VE-кадгерин, в то время как MMP-2 и MMP-9 участвуют в протеолизе окклюдина, тем самым повышая проницаемость эндотелия (87, 88). ММП также могут усиливать утечку из сосудов более непрямым образом, через расщепление и активацию хемокинов, таких как ИЛ-8, который процессируется ММП-9 (89, 90).Более того, экспериментов in vitro продемонстрировали роль ADAM10 и ADAM17 в образовании эндотелиальной щели в ответ на цитокины. Это, вероятно, опосредуется расщеплением адгезионных молекул внутри межклеточных соединений, включая VE-cadherin и JAM-A (91).
Семафорины
Семафорины соответствуют семейству секретируемых и связанных с мембранами белков, которые могут действовать как молекулы притяжения, так и отталкивания (92, 93). Помимо своей роли в развитии нервной системы, некоторые из этих молекул могут модулировать пластичность эндотелия (94).Действительно, семафорин 4D играет положительную роль в миграции эндотелия и ангиогенезе опухолей (95, 96). Напротив, семафорины класса 3, особенно семафорин 3A (S3A) и семафорин 3E, как сообщается, действуют как селективные ингибиторы VEGF-индуцированного ангиогенеза (97–97). 100). Однако S3A и VEGF также могут взаимодействовать, вызывая проницаемость сосудов (101). В самом деле, S3A индуцирует фосфорилирование Akt посредством передачи сигналов PI3K, тем самым увеличивая проницаемость сосудов (101). В глиобластоме субпопуляция раковых стволовых клеток экспрессирует и секретирует S3A ex vivo (102).В этом контексте S3A обеспечивает дестабилизацию межклеточного соединения эндотелия и повышает проницаемость эндотелия (102). На молекулярном уровне S3A разрушает комплекс VE-кадгерин / PP2A, обеспечивая фосфорилирование серина VE-кадгерином и последующую интернализацию (45, 102). В соответствии с этим было продемонстрировано, что ингибирование S3A путем блокирования антител или подавления РНК аннулирует эти эффекты.
Оксид азота и пероксинитрит
Оксид азота (NO) — это высокоактивный свободный радикал, который опосредует множество клеточных реакций (103).NO производится из l-аргинина и кислорода NO-синтазами (NOS). Существует три основных изоформы NOS: индуцибельная NO-синтаза (NOS2 / iNOS), eNOS (NOS3 / eNOS) и нейрональная NO-синтаза (NOS1 / nNOS). NOS3 конститутивно экспрессируется в эндотелиальных клетках, сердечных миоцитах и пирамидных клетках гиппокампа и участвует в подавлении агрегации тромбоцитов, поддержании сосудистого тонуса, ингибировании пролиферации гладкомышечных клеток и стимулировании ангиогенеза (104). При раке NOS3 генерирует NO в кровеносных сосудах, что может способствовать пролиферации эндотелия, миграции и прогрессированию опухоли (105, 106).Следует отметить, что NOS3 может индуцироваться VEGF MAPK / PLC-γ-зависимым образом (107). NOS3 может также участвовать в модулировании утечки из сосудов. Действительно, сообщалось, что транслокация eNOS в цитозоль, но не в Гольджи, связана с повышенной проницаемостью in vitro и in vivo (108, 109). Стимуляция эндотелиальных клеток фактором активации тромбоцитов (PAF) индуцирует S-нитрозилирование β-катенина и p120 и значительно снижает их связь с VE-кадгерином (110).Кроме того, обработка VEGF вызвала S-нитрозилирование β-катенина по остатку Cys619 в сайте взаимодействия VE-кадгерина (111). Ингибирование S-нитрозилирования β-катенина предотвращает NO-зависимую диссоциацию β-катенина от VE-кадгерина и разборку комплексов AJ, тем самым ингибируя VEGF-опосредованную проницаемость эндотелия (111). Более того, окисленные продукты NO, такие как пероксинитрит (ONOO-), активируют ММП, которые способствуют перестройке матрикса и проницаемости эндотелия, как обсуждалось выше.Однако NO может вызывать цитотоксическое действие на раковые клетки. Таким образом, при нацеленной на опухоль терапии следует учитывать баланс между проницаемостью, опосредованной NO, и ангиогенезом или апоптозом (112).
В заключение, сигнальные пути, обеспечиваемые проницаемостью эндотелия, сходятся при нарушении и дестабилизации межклеточных контактов, способствуя реструктуризации AJ и TJ и последующему открытию соединений эндотелиальная клетка-клетка. Теперь мы представим факторы, препятствующие проницаемости, и нормализующие агенты, которые могут представить новые перспективы в терапии рака.
Перспективы лечения рака
В настоящее время хорошо известно, что проницаемость сосудов ограничивает доставку лекарств, таким образом ограничивая эффективность традиционных методов лечения. Новые подходы теперь нацелены на уменьшение как чрезмерного ангиогенеза, так и повышенной проницаемости. В этом параграфе будут обсуждаться перспективы лечения рака, такие как использование факторов, препятствующих проницаемости, и агентов, нормализующих кровеносные сосуды.
Факторы антипроницаемости
Наиболее важными факторами антипроницаемости являются ангиопоэтин-1 и родственный ему рецептор Tie2, сфингозин-1-фосфат (S1P) и фактор роста фибробластов (FGF) (Рисунок 5).
Рисунок 5. Сигнальные пути факторов антипроницаемости . Наиболее важными факторами антипроницаемости являются ангиопоэтин-1 (Ang1), сфингозин-1-фосфат (S1P) и фактор роста фибробластов (FGF). Активация Ang1 его родственного рецептора, Tie2, вызывает сигнальный путь и способствует секвестрации Src; тем самым препятствуя передаче сигналов VEGF-A и интернализации VE-кадгерина. Передача сигналов S1P поддерживает целостность сосудов, модулируя интернализацию VE-кадгерина, перестройку цитоскелета, усиление барьера и целостность через его родственный рецептор S1P1R.FGF поддерживает целостность комплекса VE-кадгерин / p120-катенин, таким образом стабилизируя VE-кадгерин на мембране.
Ангиопоэтин-1 является мощным проангиогенным фактором, который стабилизирует кровеносные сосуды и противодействует VEGF-индуцированной проницаемости сосудов (63, 113). Как упоминалось выше, VEGF повышает проницаемость эндотелия за счет дестабилизации адгезии VE-кадгерина по Src-зависимому механизму (41, 45). Ангиопоэтин-1 активирует путь передачи сигналов через Tie2, который способствует секвестрации Src через диафан у млекопитающих (mDia) (114), тем самым препятствуя передаче сигналов VEGF и интернализации VE-кадгерина.В интактном эндотелиальном монослое ангиопоэтин-1 способствует взаимодействию Tie2 с тирозинфосфатазой VE-PTP эндотелиального эндотелия сосудов (115, 116). VE-PTP связывается с VE-кадгерином и стабилизирует его на плазматической мембране, блокируя его фосфорилирование тирозина в ответ на активацию VEGF-R2 (117). Ангиопоэтин-1 также поддерживает целостность барьера за счет увеличения ассоциации между VE-кадгерином и плакоглобином (118), тем самым усиливая межклеточные контакты и ограничивая проницаемость эндотелия.Соответственно, передача сигналов VEGF in vivo запускает диссоциацию VE-PTP от VE-кадгерина, облегчая экстравазацию лейкоцитов и утечку сосудов (119). Кроме того, ангиопоэтин-1 уравновешивает действия, связанные с проницаемостью VEGF, контролируя высвобождение NO из эндотелиальных клеток. В самом деле, он увеличивает фосфорилирование eNOS на Thr497 и, следовательно, снижает высвобождение NO и трансэндотелиальную проницаемость (120).
В дополнение к ангиопоэтину-1, S1P, биологически активный фосфорилированный липидный фактор роста, высвобождаемый из активированных тромбоцитов, появился в качестве защитного агента эндотелиального барьера.Как в легочной артерии, так и в эндотелиальных клетках микрососудов легких S1P был способен обратить вспять дисфункцию барьера, вызванную тромбином (121). На молекулярном уровне передача сигналов S1P поддерживает целостность сосудов за счет перестройки цитоскелета и повышения барьера за счет активации Rac (121). Более того, липопротеины высокой плотности, действующие в качестве основных плазменных переносчиков S1P, способствуют целостности эндотелиального барьера посредством пути передачи сигналов Akt (122). S1P, полученный из плазмы, также играет важную роль в поддержании целостности сосудов.Действительно, мутантные мыши, сконструированные с избирательным отсутствием S1P в плазме, демонстрируют повышенную утечку из сосудов и ухудшение выживаемости после введения факторов, индуцирующих проницаемость (123). Повышенная утечка была связана с межэндотелиальными клеточными промежутками в венулах и купировалась экстренным лечением агонистом рецептора S1P 1 (S1PR1) (123). Более того, недавние работы представляют S1PR1 как ключевой компонент стабильности сосудов (124, 125). Эти два исследования элегантно показали, что S1PR1 ингибирует VEGF-индуцированную дестабилизацию и интернализацию VE-cadherin и тем самым усиливает межклеточную адгезию (124, 125).
Другие факторы, такие как FGF, могут действовать как стабилизаторы VE-кадгерина. В самом деле, ингибирование передачи сигналов FGF приводит к диссоциации комплекса VE-cadherin / p120-catenin и последующей интернализации VE-cadherin, разборке AJ и TJ и потере целостности сосудистого барьера (126).
Таким образом, поскольку они противодействуют VEGF-индуцированной проницаемости и способствуют поддержанию функции сосудистого барьера, факторы антипроницаемости появляются в качестве потенциальных терапевтических кандидатов.Другой многообещающий подход — использование препаратов против VEGF / VEGF-R для нормализации сосудистой стенки и ее микросреды.
Агенты нормализации
С 1950 по 2000-е годы единственным существующим неинвазивным лечением солидных опухолей была химиотерапия, которая в основном основана на снижении пролиферации опухолевых клеток. Поскольку его недостаточная селективность вызывает большое количество побочных эффектов, новые стратегии, такие как молекулярная и персонализированная терапия, пытаются сосредоточиться на молекулах, сверхэкспрессируемых при раке.К сожалению, результаты клинических испытаний, нацеленных на такие молекулы в противораковой терапии, были весьма разочаровывающими, учитывая общее низкое увеличение выживаемости, за исключением иматиниба, ингибитора тирозинкиназы (TKI), используемого при лечении хронического миелогенного лейкоза (127). Кроме того, антиангиогенные молекулы были предложены для улучшения противораковой терапии не только потому, что они уменьшают васкуляризацию опухоли, но также благодаря их «нормализующему» действию, которое улучшает доставку лекарств.
Бевацизумаб (продаваемый как Авастин) был одним из первых клинически доступных антиангиогенных препаратов. Это гуманизированное мышиное антитело, нацеленное на VEGF, было одобрено FDA около десяти лет назад для комбинированного использования со стандартной химиотерапией при колоректальном и немелкоклеточном раке легких. Кроме того, один бевацизумаб может значительно замедлить прогрессирование заболевания у пациентов с метастатическим почечно-клеточным раком (128). Недавно опубликованные данные свидетельствуют о многообещающей клинической эффективности монотерапии бевацизумабом при метастатической меланоме (129).Помимо анти-VEGF, многоцелевые TKI широкого спектра действия продлевают выживаемость без рака за счет совместного уменьшения диаметра, плотности и проницаемости опухолевых сосудов, даже когда их вводят в отсутствие традиционных методов лечения. Например, монотерапия сунитинибом и сорафенибом особенно эффективна при раке желудочно-кишечного тракта и почек (130). Тем не менее, и бевацизумаб, и TKI могут вызывать серьезные побочные эффекты, такие как перфорация желудочно-кишечного тракта.
Notch лиганд дельта-подобный 4 (Dll4) недавно стал важным регулятором ангиогенеза опухолей (131).Активация пути Notch в соседних эндотелиальных клетках вызывает ингибирование образования концевых клеток, что является ранним событием в прорастании ангиогенеза. Механически это, как полагают, происходит за счет подавления проангиогенного пути VEGF-R2 / 3 и усиления антиангиогенного пути VEGF-R1 (132). Интересно, что VEGF также может действовать выше Dll4, усиливая его эффекты (133). Однако точная роль Dll4 в росте опухоли и его потенциал в противораковой терапии остаются неясными.Действительно, активация Dll4 / Notch снижает общий ангиогенез опухоли, в то время как сосудистая функция опухоли улучшается и рост опухоли увеличивается (134). Это поддерживает идею о том, что дальнейшая стратегия противораковой терапии может быть основана на блокаде передачи сигналов Dll4 / Notch. С другой стороны, активация Notch, управляемая Dll4, может снижать как индуцированный опухолью ангиогенез, так и чувствительность эндотелиальных клеток к VEGF (135), и поэтому скорее выступают за использование Dll4 в качестве эффективного терапевтического подхода при раке.
Комбинированная терапия и стратегии будущего
Недавно, основываясь на общих признаках сосудистой сети опухоли, то есть на плохом кровотоке, утечке и сниженном потреблении лекарств, появилась новая тенденция в противораковом лечении, которая включает комбинирование средств для нормализации сосудов с традиционными методами лечения для улучшения ответа на лечение.
Чтобы восстановить эффективную васкуляризацию опухоли, были разработаны вспомогательные молекулы, а именно те, которые обладают антиангиогенными или антипроницаемыми свойствами, и протестированы в клинических испытаниях параллельно с цитотоксическими препаратами.В этом случае использование либо сосудосуживающего ангиотензина II (136), либо сосудорасширяющего агониста рецептора В2 брадикинина (137) улучшает эффективность лечения опухоли за счет увеличения транскапиллярного давления. Аналогичным образом, для облегчения пересечения стромального барьера было показано, что разрушающий ECM фермент коллагеназа (138) вызывает благоприятные изменения в градиенте транскапиллярного давления и, таким образом, увеличивает проникновение противораковых лекарств.
В качестве альтернативы, бевацизумаб, препарат против VEGF, влияет как на плотность микрососудов, так и на IFP опухоли, а также улучшает поглощение препарата у пациентов с колоректальной карциномой (139).Более того, пазопаниб, ингибитор рецепторов VEGF и PDGF, индуцирует лучшую липосомную доставку лекарственного средства в опухоль (140). Аналогичным образом, лучевая терапия в сочетании с антителом к интегрину (интетумумаб) снижает плотность сосудов опухоли, увеличивая апоптоз опухолевых клеток и препятствуя метастазированию (141). Интересно, что помимо его роли в проницаемости, сообщалось, что высокие уровни VEGF способствуют пролиферации T-reg, ингибируют созревание антигенпрезентирующих клеток и, как следствие, уменьшают иммунные ответы (142, 143).Следовательно, антиангиогенные препараты, особенно те, которые нацелены на действие VEGF, могут улучшить иммунотерапию рака за счет стимуляции иммунных ответов микроокружения опухоли (142). Хотя значительные доказательства продемонстрировали преимущества терапии против VEGF при лечении рака, ее общее использование все еще остается спорным. Во-первых, значительное увеличение общей выживаемости наблюдается только при сочетании бевацизумаба со стандартной химиотерапией. Кроме того, многие пациенты проявляют устойчивость к лечению анти-VEGF, в то время как время и дозы, которые необходимо вводить, стоимость и эффекты рецидива вызывают некоторые серьезные опасения.Наконец, возобновление роста сосудов остается весьма проблематичным. В самом деле, вторая волна ангиогенеза, организованная проангиогенными лигандами семейства FGF, может объяснить краткосрочную эффективность антиангиогенной терапии на основе VEGF (144). В отличие от бевацизумаба, комбинация ИТК с традиционной химиотерапией не улучшает исход противоракового лечения. В этом сценарии использование эрлотиниба, мощного ингибитора тирозинкиназы рецептора эпидермального фактора роста, со стандартной химиотерапией не привело к усилению опухолевого ответа или выживаемости при карциноме легкого (145).Высокоэффективную монотерапию TKI можно сочетать с химиотерапией только тогда, когда опухолевые клетки становятся устойчивыми к TKI.
Кроме того, доза, режим и снижение токсичности могут изменить ответ опухоли. В отличие от стандартной химиотерапии, то есть высоких доз с длительными перерывами без лекарств, метрономная химиотерапия относится к хроническому и равномерному введению низких доз цитотоксических лекарств без пауз. Например, уменьшенные, но постоянные дозы циклофосфамида подавляли рост опухоли более эффективно, чем каноническое планирование химиотерапии, даже при опухолях, устойчивых к лекарствам (146).Интересно, что метрономная химиотерапия оказывает противоопухолевое и антиметастатическое действие, снижая концентрацию VEGF в сыворотке и увеличивая апоптоз раковых клеток (147). По этим причинам метрономная химиотерапия может рассматриваться как антиангиогенная химиотерапия.
Важно отметить, что эффективность антиангиогенной терапии в сочетании с традиционными цитотоксическими методами лечения (химио- и / или радиотерапия) зависит от оптимального расписания лечения. Действительно, для каждой противораковой терапии необходимо определить «окно нормализации», чтобы определить период и дозы, необходимые для нормализации сосудов опухоли (148).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарны сотрудникам лаборатории Джули Гавард, особенно доктору Дж. Дуайеру, за комментарии к рукописи. Это исследование финансировалось Национальной лигой по борьбе с раком в Париже , Fondation ARC , Fondation pour la Recherche Medicale и Международным грантом на реинтеграцию Марии Кюри в рамках Седьмой рамочной программы.Джагода К. Хебда получает докторскую стипендию Парижского университета Декарта, а Сэнди Аззи — постдокторскую стипендию от Fondation ARC.
Список литературы
2. Фэн Д., Надь Дж., Хипп Дж., Дворак Х. Ф., Дворак А. М.. Везикуло-вакуолярные органеллы и регуляция проницаемости венул для макромолекул с помощью фактора проницаемости сосудов, гистамина и серотонина. J Exp Med (1996) 183 : 1981–6. DOI: 10.1084 / jem.183.5.1981
CrossRef Полный текст
3.Шуберт В., Франк П.Г., Вудман С.Е., Хиого Н., Коэн Д.Е., Чоу К.В. и др. Повышенная проницаемость микрососудов у мышей с нокаутом кавеолин-1 (- / -). Лечение специфическим ингибитором синтазы оксида азота, L-NAME, восстанавливает нормальную проницаемость микрососудов у Cav-1 нулевых мышей. J Biol Chem (2002) 277 : 40091–8. DOI: 10.1074 / jbc.M205948200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
4. Миншалл Р.Д., Сесса В.К., Стэн Р.В., Андерсон Р.Г., Малик А.Б.Кавеолиновая регуляция функции эндотелия. Am J Physiol Lung Cell Mol Physiol (2003) 285 : L1179–83.
Pubmed Аннотация | Pubmed Полный текст
5. Дежана Э. Эндотелиальные межклеточные соединения: счастливы вместе. Nat Rev Mol Cell Biol (2004) 5 : 261–70. DOI: 10.1038 / nrm1357
CrossRef Полный текст
6. Кармелиет П., Лампунани М.Г., Мунс Л., Бревиарио Ф., Компернолл В., Боно Ф. и др.Целенаправленная недостаточность или цитозольное усечение гена VE-кадгерина у мышей ухудшает VEGF-опосредованную выживаемость эндотелия и ангиогенез. Cell (1999) 98 : 147–57. DOI: 10.1016 / S0092-674 (00) 81010-7
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
7. Кросби К.В., Флеминг П.А., Аргрейвс В.С., Корада М., Занетта Л., Дежана Е. и др. VE-кадгерин не требуется для образования возникающих кровеносных сосудов, но предотвращает их разрушение. Кровь (2005) 105 : 2771–6. DOI: 10.1182 / кровь-2004-06-2244
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
8. Koch AW, Bozic D, Pertz O, Engel J. Гомофильная адгезия кадгеринами. Curr Opin Struct Biol (1999) 9 : 275–81. DOI: 10.1016 / S0959-440X (99) 80038-4
CrossRef Полный текст
9. Хубер А.Х., Стюарт Д.Б., Лоуренс Д.В., Нельсон В.Дж., Вайс В.И.Цитоплазматический домен кадгерина неструктурирован в отсутствие бета-катенина. Возможный механизм регуляции оборота кадгерина. J Biol Chem (2001) 276 : 12301–9. DOI: 10.1074 / jbc.M010377200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
10. Сяо К., Эллисон Д.Ф., Бакли К.М., Коттке, М.Д., Винсент П.А., Фаундез В. и др. Клеточные уровни катенина p120 служат точкой отсчета для уровней экспрессии кадгерина в эндотелиальных клетках микрососудов. J Cell Biol (2003) 163 : 535–45. DOI: 10.1083 / jcb.200306001
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
12. Нитта Т., Хата М., Гото С., Со Й., Сасаки Х., Хашимото Н. и др. Селективное по размеру ослабление гематоэнцефалического барьера у мышей с дефицитом клаудина-5. J Cell Biol (2003) 161 : 653–60. DOI: 10.1083 / jcb.200302070
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
13.Клюгер М.С., Кларк П.Р., Теллидес Дж., Герке В., Побер Дж. С.. Клаудин-5 контролирует межклеточные барьеры кожных микрососудов человека, но не эндотелиальных клеток пупочной вены человека. Артериосклер тромб Vasc Biol (2013) 33 : 489–500. DOI: 10.1161 / ATVBAHA.112.300893
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
14. Gavard J, Gutkind JS. VE-кадгерин и клаудин-5: для танго нужны двое. Nat Cell Biol (2008) 10 : 883–5.DOI: 10.1038 / ncb0808-883
CrossRef Полный текст
15. Таддеи А., Джампьетро С., Конти А., Орсениго Ф., Бревиарио Ф., Пираццоли В. и др. Соединения эндотелиальных сращений контролируют плотные соединения посредством VE-кадгерин-опосредованной активации клаудина-5. Nat Cell Biol (2008) 10 : 923–34. DOI: 10.1038 / ncb1752
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
16.Гейгер Б, Шпатц Дж.П., Бершадский А.Д. Восприятие окружающей среды через очаговые спайки. Nat Rev Mol Cell Biol (2009) 10 : 21–33. DOI: 10.1038 / nrm2593
CrossRef Полный текст
18. Huveneers S, Oldenburg J, Spanjaard E, Van Der Krogt G, Grigoriev I, Akhmanova A, et al. Винкулин связывается с эндотелиальными соединениями VE-кадгерин для контроля силозависимого ремоделирования. J Cell Biol (2012) 196 : 641–52.DOI: 10.1083 / jcb.201108120
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
19. Chen XL, Nam JO, Jean C., Lawson C., Walsh CT, Goka E, et al. VEGF-индуцированная проницаемость сосудов опосредуется FAK. Dev Cell (2012) 22 : 146–57. DOI: 10.1016 / j.devcel.2011.11.002
CrossRef Полный текст
20. Leu AJ, Berk DA, Lymboussaki A, Alitalo K, Jain RK.Отсутствие функциональных лимфатических сосудов в саркоме мыши: молекулярная и функциональная оценка. Cancer Res (2000) 60 : 4324–7.
Pubmed Аннотация | Pubmed Полный текст
21. Ву М., Frieboes HB, Макдугалл С.Р., капеллан М.А., Кристини В., Ловенгруб Дж. Влияние внутреннего давления на рост опухоли: связь с кровеносной и лимфатической сосудистой системами. J Theor Biol (2013) 320 : 131–51.DOI: 10.1016 / j.jtbi.2012.11.031
CrossRef Полный текст
23. Hashizume H, Baluk P, Morikawa S, Mclean JW, Thurston G, Roberge S и др. Открытия между дефектными эндотелиальными клетками объясняют неплотность сосудов опухоли. Am J Pathol (2000) 156 : 1363–80. DOI: 10.1016 / S0002-9440 (10) 65006-7
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
25.Морикава С., Балук П., Кайдо Т., Хаскелл А., Джайн Р.К., Макдональд Д.М. Нарушения перицитов кровеносных сосудов и эндотелиальных отростков в опухолях. Am J Pathol (2002) 160 : 985–1000. DOI: 10.1016 / S0002-9440 (10) 64920-6
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
26. Балук П., Морикава С., Хаскелл А., Манкузо М., Макдональд Д.М. Аномалии базальной мембраны кровеносных сосудов и эндотелиальных отростков опухолей. Am J Pathol (2003) 163 : 1801–15. DOI: 10.1016 / S0002-9440 (10) 63540-7
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
28. Кейт Б., Джонсон Р.С., Саймон М.С. HIF1alpha и HIF2alpha: соперничество братьев и сестер в гипоксическом росте и прогрессировании опухоли. Nat Rev Cancer (2012) 12 : 9–22.
29. Сефер Р. Э., Сефер Э. А., Кошикава Н., Мельцер П. С., Гарднер Л. М., Бильбан М. и др.Кооперативные взаимодействия гамма2 цепи ламинина 5, матричной металлопротеиназы-2 и мембранной матрицы / металлопротеиназы 1-го типа необходимы для имитации эмбрионального васкулогенеза при агрессивной меланоме. Cancer Res (2001) 61 : 6322–7.
Pubmed Аннотация | Pubmed Полный текст
30. Баркан Д., Грин Дж. Э., Чемберс А.Ф. Внеклеточный матрикс: привратник при переходе от состояния покоя к метастатическому росту. Eur J Cancer (2010) 46 : 1181–8.DOI: 10.1016 / j.ejca.2010.02.027
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
31. Levental KR, Yu H, Kass L, Lakins JN, Egeblad M, Erler JT, et al. Сшивание матрикса вызывает прогрессирование опухоли за счет усиления передачи сигналов интегрина. Cell (2009) 139 : 891–906. DOI: 10.1016 / j.cell.2009.10.027
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
32.Кордон-Кардо С., О’Брайен Дж. П., Казальс Д., Риттман-Грауэр Л., Бидлер Дж. Л., Меламед М. Р. и др. Ген множественной лекарственной устойчивости (Р-гликопротеин) экспрессируется эндотелиальными клетками на участках гематоэнцефалического барьера. Proc Natl Acad Sci U S A (1989) 86 : 695–8. DOI: 10.1073 / pnas.86.2.695
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
33. Готтесман М.М. Механизмы лекарственной устойчивости рака. Annu Rev Med (2002) 53 : 615–27.DOI: 10.1146 / annurev.med.53.082901.103929
CrossRef Полный текст
34. Нетти П.А., Берк Д.А., Шварц М.А., Гродзинский А.Дж., Джайн Р.К. Роль сборки внеклеточного матрикса в интерстициальном транспорте в солидных опухолях. Cancer Res (2000) 60 : 2497–503.
Pubmed Аннотация | Pubmed Полный текст
35. Сеймур Л.В., Миямото Ю., Маеда Х., Бреретон М., Штрохальм Дж., Ульбрих К. и др.Влияние молекулярной массы на пассивное накопление в опухоли растворимого макромолекулярного лекарственного носителя. Eur J Cancer (1995) 31A : 766–70. DOI: 10.1016 / 0959-8049 (94) 00514-6
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
36. Фанг Дж., Накамура Х., Маэда Х. Эффект ЭПР: уникальные особенности кровеносных сосудов опухоли для доставки лекарств, задействованные факторы, а также ограничения и усиление эффекта. Adv Drug Deliv Rev (2011) 63 : 136–51.DOI: 10.1016 / j.addr.2010.04.009
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
37. Кэмпбелл Р. Б., Фукумура Д., Браун Э. Б., Маццола Л. М., Изуми Ю., Джайн Р. К. и др. Катионный заряд определяет распределение липосом между сосудистым и внесосудистым отделами опухоли. Cancer Res (2002) 62 : 6831–6.
Pubmed Аннотация | Pubmed Полный текст
38.Сенгер Д.Р., Галли С.Дж., Дворак А.М., Перруцци К.А., Харви В.С., Дворак Х.Ф. Опухолевые клетки выделяют фактор проницаемости сосудов, который способствует накоплению асцитной жидкости. Наука (1983) 219 : 983–5. DOI: 10.1126 / science.6823562
CrossRef Полный текст
39. Waltenberger J, Claesson-Welsh L, Siegbahn A, Shibuya M, Heldin CH. Различные свойства передачи сигнала KDR и Flt1, двух рецепторов фактора роста эндотелия сосудов. J Biol Chem (1994) 269 : 26988–95.
Pubmed Аннотация | Pubmed Полный текст
41. Элисейри Б.П., Пол Р., Шварцберг П.Л., Худ Д.Д., Ленг Дж., Череш Д.А. Селективная потребность в киназах Src во время VEGF-индуцированного ангиогенеза и проницаемости сосудов. Mol Cell (1999) 4 : 915–24. DOI: 10.1016 / S1097-2765 (00) 80221-X
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
42.Lampugnani MG, Orsenigo F, Gagliani MC, Tacchetti C, Dejana E. Кадгерин эндотелия сосудов контролирует интернализацию VEGFR-2 и передачу сигналов из внутриклеточных компартментов. J Cell Biol (2006) 174 : 593–604. DOI: 10.1083 / jcb.200602080
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
43. Weis S, Cui J, Barnes L, Cheresh D. Нарушение эндотелиального барьера за счет VEGF-опосредованной активности Src потенцирует экстравазацию опухолевых клеток и метастазирование. J Cell Biol (2004) 167 : 223–9. DOI: 10.1083 / jcb.200408130
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
44. Грация Лампунани М., Занетти А., Корада М., Такахаши Т., Балкони Дж., Бревиарио Ф. и др. Для контактного ингибирования VEGF-индуцированной пролиферации необходим кадгерин эндотелия сосудов, бета-катенин и фосфатаза DEP-1 / CD148. J Cell Biol (2003) 161 : 793–804. DOI: 10.1083 / jcb.200209019
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
45. Gavard J, Gutkind JS. VEGF контролирует проницаемость эндотелиальных клеток, способствуя зависимому от бета-аррестина эндоцитозу VE-кадгерина. Nat Cell Biol (2006) 8 : 1223–34. DOI: 10.1038 / ncb1486
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
46.Сяо К., Гарнер Дж., Бакли К.М., Винсент П.А., Чиассон С.М., Дежана Э. и др. p120-катенин регулирует клатрин-зависимый эндоцитоз VE-кадгерина. Mol Biol Cell (2005) 16 : 5141–51. DOI: 10.1091 / mbc.E05-05-0440
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
48. Нанес Б.А., Чиассон-Маккензи С., Лоури А.М., Исияма Н., Фаундез В., Икура М. и др. Связывание p120-катенина маскирует эндоцитарный сигнал, консервативный в классических кадгеринах. J Cell Biol (2012) 199 : 365–80. DOI: 10.1083 / jcb.201205029
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
49. Каллере Х, Шоу С.К., Андерссон Л., Хирахаши Дж., Лусцинскас Ф.В., Маядас Т.Н. Регулирование функции сосудистого эндотелиального барьера с помощью Epac, цАМФ-активированного фактора обмена для Rap GTPase. Кровь (2005) 105 : 1950–5. DOI: 10.1182 / кровь-2004-05-1987
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
50.Фукухара С., Сакураи А., Сано Х., Ямагиши А., Сомекава С., Такакура Н. и др. Циклический АМФ усиливает опосредованный кадгерином эндотелия сосудов межклеточный контакт для усиления функции эндотелиального барьера через сигнальный путь Epac-Rap1. Mol Cell Biol (2005) 25 : 136–46. DOI: 10.1128 / MCB.25.1.136-146.2005
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
51. Стоктон Р.А., Шефер Э., Шварц М.А.p21-активированная киназа регулирует проницаемость эндотелия посредством модуляции сократимости. J Biol Chem (2004) 279 : 46621-30. DOI: 10.1074 / jbc.M408877200
CrossRef Полный текст
53. Hebda JK, Leclair HM, Azzi S, Roussel C, Scott MG, Bidere N, et al. Область С-конца бета-аррестина1 модулирует экспрессию VE-кадгерина и проницаемость эндотелиальных клеток. Сигнал Cell Commun (2013) 11 : 37.DOI: 10.1186 / 1478-811X-11-37
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
54. Franco CA, Mericskay M, Parlakian A, Gary-Bobo G, Gao-Li J, Paulin D, et al. Фактор сывороточного ответа необходим для прорастания ангиогенеза и целостности сосудов. Dev Cell (2008) 15 : 448–61. DOI: 10.1016 / j.devcel.2008.07.019
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
55.Герр Д., Саллманн А., Бекеш И., Конрад Р., Хольжеу И., Крайенберг Р. и др. VEGF вызывает асцит у пациентов с раком яичников за счет увеличения проницаемости брюшины за счет подавления уровня Claudin 5. Gynecol Oncol (2012) 127 : 210–6. DOI: 10.1016 / j.ygyno.2012.05.002
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
56. Ли А., Дубей С., Варни М.Л., Дэйв Б.Дж., Сингх Р.К. IL-8 непосредственно увеличивает выживаемость эндотелиальных клеток, пролиферацию, продукцию матриксных металлопротеиназ и регулирует ангиогенез. J Immunol (2003) 170 : 3369–76.
Pubmed Аннотация | Pubmed Полный текст
57. De Larco J.E., Wuertz BR, Furcht LT. Потенциальная роль нейтрофилов в стимулировании метастатического фенотипа опухолей, выделяющих интерлейкин-8. Clin Cancer Res (2004) 10 : 4895–900. DOI: 10.1158 / 1078-0432.CCR-03-0760
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
58.Schraufstatter IU, Chung J, Burger M. IL-8 активирует эндотелиальные клетки CXCR1 и CXCR2 через пути передачи сигналов Rho и Rac. Am J Physiol Lung Cell Mol Physiol (2001) 280 : L1094–103.
Pubmed Аннотация | Pubmed Полный текст
59. Petreaca ML, Yao M, Liu Y, Defea K, Martins-Green M. Трансактивация рецептора-2 фактора роста эндотелия сосудов интерлейкином-8 (IL-8 / CXCL8) необходима для индуцированного IL-8 / CXCL8 эндотелия. проницаемость. Mol Biol Cell (2007) 18 : 5014–23. DOI: 10.1091 / mbc.E07-01-0004
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
60. Gavard J, Hou X, Qu Y, Masedunskas A, Martin D, Weigert R, et al. Роль гамма-сигнальной оси CXCR2 / фосфатидилинозитол-3-киназы в острой и хронической проницаемости сосудов. Mol Cell Biol (2009) 29 : 2469–80. DOI: 10.1128 / MCB.01304-08
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
61.Дуайер Дж., Хебда Дж. К., Ле Гельте А., Галан-Мойя Е. М., Смит С. С., Аззи С. и др. Интерлейкин-8, секретируемый клетками глиобластомы, индуцирует проницаемость эндотелиальных клеток головного мозга через CXCR2. PLoS One (2012) 7 : e45562. DOI: 10.1371 / journal.pone.0045562
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
62. Макманус К.Ф., Петтигрю Дж., Ситон А., Уилсон С., Максвелл П.Дж., Берлингери С. и др. Передача сигналов интерлейкина-8 способствует регуляции трансляции циклина D в андрогеннезависимых клетках рака простаты. Mol Cancer Res (2007) 5 : 737–48. DOI: 10.1158 / 1541-7786.MCR-07-0032
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
63. Dumont N, Arteaga CL. Киназно-неактивный рецептор TGFbeta типа II нарушает передачу сигналов BMP в клетках рака молочной железы человека. Biochem Biophys Res Commun (2003) 301 : 108–12. DOI: 10.1016 / S0006-291X (02) 02977-7
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
64.Siegel PM, Massague J. Цитостатические и апоптотические действия TGF-бета при гомеостазе и раке. Nat Rev Cancer (2003) 3 : 807–21. DOI: 10.1038 / nrc1208
CrossRef Полный текст
66. Hasegawa Y, Takanashi S, Kanehira Y, Tsushima T., Imai T., Okumura K. Уровень трансформирующего фактора роста-бета1 коррелирует с ангиогенезом, прогрессированием опухоли и прогнозом у пациентов с немелкоклеточной карциномой легкого. Рак (2001) 91 : 964–71.DOI: 10.1002 / 1097-0142 (20010301) 91: 5 <964 :: AID-CNCR1086> 3.3.CO; 2-F
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
67. Goldberg PL, Macnaughton DE, Clements RT, Minnear FL, Vincent PA. Активация p38 MAPK с помощью TGF-beta1 увеличивает фосфорилирование MLC и проницаемость эндотелиального монослоя. Am J Physiol Lung Cell Mol Physiol (2002) 282 : L146–54.
Pubmed Аннотация | Pubmed Полный текст
68.Падуя Д., Чжан XH, Ван К., Надаль С., Джеральд В.Л., Гомис Р.Р. и др. TGFbeta подготавливает опухоли молочной железы к посеву метастазов в легкие через ангиопоэтин-подобный 4. Cell (2008) 133 : 66–77. DOI: 10.1016 / j.cell.2008.01.046
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
69. Пертоваара Л., Кайпайнен А., Мустонен Т., Орпана А., Феррара Н., Саксела О. и др. Фактор роста эндотелия сосудов индуцируется в ответ на трансформацию фактора роста бета в фибробластических и эпителиальных клетках. J Biol Chem (1994) 269 : 6271–4.
Pubmed Аннотация | Pubmed Полный текст
70. Энхольм Б., Паавонен К., Ристимаки А., Кумар В., Гунджи Ю., Клефстром Дж. И др. Сравнение регуляции мРНК VEGF, VEGF-B, VEGF-C и Ang-1 сывороткой, факторами роста, онкопротеинами и гипоксией. Онкоген (1997) 14 : 2475–83. DOI: 10.1038 / sj.onc.1201090
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
71.Hagedorn HG, Bachmeier BE, Nerlich AG. Синтез и деградация базальных мембран и внеклеточного матрикса и их регуляция с помощью TGF-бета в инвазивных карциномах (Обзор). Int J Oncol (2001) 18 : 669–81.
Pubmed Аннотация | Pubmed Полный текст
72. Salcedo R, Oppenheim JJ. Роль хемокинов в ангиогенезе: взаимодействие CXCL12 / SDF-1 и CXCR4, ключевой регулятор ответов эндотелиальных клеток. Микроциркуляция (2003) 10 : 359–70.DOI: 10.1080 / mic.10.3-4.359.370
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
73. Деван М.З., Ахмед С., Ивасаки Ю., Охба К., Той М., Ямамото Н. Взаимодействие фактора-1, полученного из стромальных клеток, и рецептора CXCR4 при росте опухоли и метастазировании рака молочной железы. Biomed Pharmacother (2006) 60 : 273–6. DOI: 10.1016 / j.biopha.2006.06.004
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
74.Gassmann P, Haier J, Schluter K, Domikowsky B, Wendel C, Wiesner U, et al. CXCR4 регулирует раннюю экстравазацию метастатических опухолевых клеток in vivo. Неоплазия (2009) 11 : 651–61.
Pubmed Аннотация | Pubmed Полный текст
76. Яги Х., Тан В., Дилленбург-Пилла П., Армандо С., Аморнфимолтам П., Симан М. и др. Подход синтетической биологии обнаруживает ось передачи сигналов CXCR4-G13-Rho, управляющую трансэндотелиальной миграцией метастатических клеток рака молочной железы. Научный сигнал (2011) 4 : ra60. DOI: 10.1126 / scisignal.2002221
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
77. Ли BC, Ли TH, Avraham S, Avraham HK. Участие хемокинового рецептора CXCR4 и его лигандного фактора 1альфа, производного от стромальных клеток, в миграции клеток рака груди через эндотелиальные клетки микрососудов головного мозга человека. Mol Cancer Res (2004) 2 : 327–38.
Pubmed Аннотация | Pubmed Полный текст
78.Велфорд А.Ф., Бизиато Д., Коффелт С.Б., Нуцера С., Фишер М., Пуччи Ф. и др. Макрофаги, экспрессирующие TIE2, ограничивают терапевтическую эффективность агента, разрушающего сосуды, комбретастатина А4 фосфата у мышей. Дж. Клин Инвест (2011) 121 : 1969–73. DOI: 10.1172 / JCI44562
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
79. Kijowski J, Baj-Krzyworzeka M, Majka M, Reca R, Marquez LA, Christofidou-Solomidou M, et al.Ось SDF-1-CXCR4 стимулирует секрецию VEGF и активирует интегрины, но не влияет на пролиферацию и выживаемость лимфогематопоэтических клеток. Стволовые клетки (2001) 19 : 453–66. DOI: 10.1634 / стволовые клетки.19-5-453
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
80. Salvucci O, Yao L, Villalba S, Sajewicz A, Pittaluga S, Tosato G. Регуляция морфогенеза ветвления эндотелиальных клеток с помощью эндогенного хемокинового фактора-1, производного от стромы. Кровь (2002) 99 : 2703–11. DOI: 10.1182 / blood.V99.8.2703
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
81. Хамидулла, Чангкиджа Б., Конвар Р. Роль интерлейкина-10 при раке груди. Лечение рака груди (2012) 133 : 11–21. DOI: 10.1007 / s10549-011-1855-x
CrossRef Полный текст
82. Коно Т., Мизуками Х., Сузуки М., Сага Й, Такей Й, Шимпо М. и др.Опосредованное интерлейкином-10 ингибирование ангиогенеза и роста опухоли у мышей с раком яичников, продуцирующим VEGF. Cancer Res (2003) 63 : 5091–4.
83. Huang S, Xie K, Bucana CD, Ullrich SE, Bar-Eli M. Интерлейкин 10 подавляет рост опухоли и метастазирование клеток меланомы человека: потенциальное ингибирование ангиогенеза. Clin Cancer Res (1996) 2 : 1969–79.
Pubmed Аннотация | Pubmed Полный текст
84.Гарсия-Эрнандес М.Л., Эрнандес-Пандо Р., Гариглио П., Берумен Дж. Интерлейкин-10 способствует росту В16-меланомы путем ингибирования функций макрофагов и индукции пролиферации опухолевых и сосудистых клеток. Иммунология (2002) 105 : 231–43. DOI: 10.1046 / j.1365-2567.2002.01363.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
85. Rundhaug JE. Матричные металлопротеиназы, ангиогенез и рак: комментарий к статье А.C. Lockhart et al., Снижение ангиогенеза раны у пациентов, получавших BMS-275291, ингибитор матриксной металлопротеиназы широкого спектра действия. Clin. Cancer Res., 9: 00-00, 2003. Clin Cancer Res. (2003) 9 : 551–4.
86. Pollard JW. Макрофаги, образованные опухолью, способствуют прогрессированию опухоли и метастазированию. Nat Rev Cancer (2004) 4 : 71–8. DOI: 10.1038 / nrc1256
CrossRef Полный текст
87.Итикава Ю., Исикава Т., Момияма Н., Камияма М., Сакурада Х., Мацуяма Р. и др. Матрилизин (ММР-7) разрушает VE-кадгерин и ускоряет накопление бета-катенина в ядре эндотелиальных клеток пупочной вены человека. Oncol Rep (2006) 15 : 311–5.
88. Reijerkerk A, Kooij G, Van Der Pol SM, Khazen S, Dijkstra CD, De Vries HE. Диапедез моноцитов связан с исчезновением ММП-опосредованного окклюдина в эндотелиальных клетках головного мозга. FASEB J (2006) 20 : 2550–2. DOI: 10.1096 / fj.06-6099fje
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
89. Van den Steen PE, Proost P, Wuyts A, Van Damme J, Opdenakker G. Нейтрофильная желатиназа B в десять раз усиливает интерлейкин-8 за счет аминотерминального процессинга, в то время как он разрушает CTAP-III, PF-4 и GRO-alpha и оставляет RANTES и ГЦН-2 в целости и сохранности. Кровь (2000) 96 : 2673–81.
Pubmed Аннотация | Pubmed Полный текст
90. Van Den Steen PE, Wuyts A, Husson SJ, Proost P, Van Damme J, Opdenakker G. Желатиназа B / MMP-9 и нейтрофильная коллагеназа / MMP-8 обрабатывают хемокины GCP-2 / CXCL6, ENA-78 / человека. CXCL5 и GCP-2 / LIX мыши и модулируют их физиологическую активность. Eur J Biochem (2003) 270 : 3739–49. DOI: 10.1046 / j.1432-1033.2003.03760.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
91.Коенен Р.Р., Прюссмайер Дж., Зёнлейн О., Фрамос Л., Цернеке А., Шварц Н. и др. Регулируемое высвобождение и функциональная модуляция соединительной молекулы адгезии А дезинтегрин-металлопротеиназами. Кровь (2009) 113 : 4799–809. DOI: 10.1182 / кровь-2008-04-152330
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
92. Колодкин А.Л., Маттес Д.Д., О’Коннор Т.П., Патель Н.Х., Адмон А., Бентли Д. и др. Фасциклин IV: последовательность, экспрессия и функция во время управления конусом роста у эмбриона кузнечика. Нейрон (1992) 9 : 831–45. DOI: 10.1016 / 0896-6273 (92)
-8Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
93. Колодкин А.Л., Маттес Д.Д., Гудман К.С. Гены семафоринов кодируют семейство трансмембранных и секретируемых молекул, направляющих конус роста. Cell (1993) 75 : 1389–99. DOI: 10.1016 / 0092-8674 (93)
-ZPubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
94.Treps L, Le Guelte A, Gavard J. Новые роли семафоринов в регуляции эпителиальных и эндотелиальных соединений. Тканевые барьеры (2013) 1 : e23272. DOI: 10.4161 / tisb.23272
CrossRef Полный текст
95. Базиль JR, Холмбек K, Bugge TH, Gutkind JS. MT1-MMP контролирует индуцированный опухолью ангиогенез посредством высвобождения семафорина 4D. J Biol Chem (2007) 282 : 6899–905. DOI: 10.1074 / JBC.M609570200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
96. Сьерра Дж. Р., Корсо С., Кайоне Л., Сеперо В., Конротто П., Сигнетти А. и др. Ангиогенез и прогрессирование опухоли усиливаются за счет Sema4D, продуцируемого ассоциированными с опухолью макрофагами. J Exp Med (2008) 205 : 1673–85. DOI: 10.1084 / jem.20072602
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
97.Кесслер О., Шрага-Хелед Н., Ланге Т., Гутманн-Равив Н., Сабо Е., Барух Л. и др. Семафорин-3F является ингибитором ангиогенеза опухоли. Cancer Res (2004) 64 : 1008–15. DOI: 10.1158 / 0008-5472.CAN-03-3090
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
98. Варшавский А., Кесслер О., Абрамович С., Кигель Б., Заффряр С., Акири Г. и др. Семафорин-3B представляет собой ингибитор ангиогенеза, который инактивируется фурин-подобными про-протеинконвертазами. Cancer Res (2008) 68 : 6922–31. DOI: 10.1158 / 0008-5472.CAN-07-5408
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
99. Сакураи А., Гавард Дж., Аннас-Линьярес Й., Базиль Дж. Р., Аморнфимолтам П., Палмби Т. Р. и др. Семафорин 3E инициирует передачу антиангиогенных сигналов через плексин D1, регулируя Arf6 и R-Ras. Mol Cell Biol (2010) 30 : 3086–98. DOI: 10.1128 / MCB.01652-09
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
100.Wu F, Zhou Q, Yang J, Duan GJ, Ou JJ, Zhang R и др. Хеморепульсант семафорин-3F, ведущий эндогенный аксон, подавляет рост и метастазирование колоректальной карциномы. Clin Cancer Res (2011) 17 : 2702–11. DOI: 10.1158 / 1078-0432.CCR-10-0839
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
101. Асеведо Л. М., Барильяс С., Вайс С. М., Готерт Дж. Р., Череш Д. А.. Семафорин 3А подавляет ангиогенез, опосредованный VEGF, но действует как фактор проницаемости сосудов. Кровь (2008) 111 : 2674–80. DOI: 10.1182 / кровь-2007-08-110205
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
102. Ле Гельте А., Галан-Мойя Е.М., Дуайер Дж., Трепс Л., Кеттлер Г., Хебда Дж. К. и др. Семафорин 3A повышает проницаемость эндотелиальных клеток за счет инактивации PP2A. J Cell Sci (2012) 125 : 4137–46. DOI: 10.1242 / jcs.108282
CrossRef Полный текст
104.Кроуэлл Дж. А., Стил В. Е., Сигман СС, Фэй-младший. Является ли индуцибельная синтаза оксида азота мишенью для химиопрофилактики? Mol Cancer Ther (2003) 2 : 815–23.
Pubmed Аннотация | Pubmed Полный текст
105. Дженкинс, округ Колумбия, Чарльз И.Г., Томсен Л.Л., Мосс Д.В., Холмс Л.С., Бейлис С.А. и др. Роль оксида азота в росте опухолей. Proc Natl Acad Sci U S A (1995) 92 : 4392–6. DOI: 10.1073 / pnas.92.10.4392
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
106.Амбс С., Мерриам В.Г., Беннетт В.П., Фелли-Боско Э., Огунфусика М.О., Озер С.М. и др. Частая экспрессия синтазы оксида азота-2 в аденомах толстой кишки человека: значение для опухолевого ангиогенеза и прогрессирования рака толстой кишки. Cancer Res (1998) 58 : 334–41.
Pubmed Аннотация | Pubmed Полный текст
108. Фигероа XF, Гонсалес Д.Р., Мартинес А.Д., Дюран В.Н., Борич М.П. ACh-индуцированная транслокация эндотелиальной NO-синтазы, высвобождение NO и расширение сосудов в микроциркуляции хомяков in vivo. J Physiol (2002) 544 : 883–96. DOI: 10.1113 / jphysiol.2002.021972
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
109. Санчес Ф.А., Савалия Н.Б., Дюран Р.Г., Лал Б.К., Борич М.П., Дюран В.Н. Функциональное значение дифференциальной транслокации eNOS. Am J Physiol Heart Circ Physiol (2006) 291 : h2058–64. DOI: 10.1152 / ajpheart.00370.2006
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
110.Марин Н., Заморано П., Карраско Р., Мухика П., Гонсалес Ф. Г., Кесада С. и др. S-нитрозирование бета-катенина и катенина p120: новый регуляторный механизм гиперпроницаемости эндотелия. Circ Res (2012) 111 : 553–63. DOI: 10.1161 / CIRCRESAHA.112.274548
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
111. Thibeault S, Rautureau Y, Oubaha M, Faubert D, Wilkes BC, Delisle C, et al. S-нитрозилирование бета-катенина NO, происходящим из eNOS, способствует индуцированной VEGF проницаемости эндотелиальных клеток. Mol Cell (2010) 39 : 468–76. DOI: 10.1016 / j.molcel.2010.07.013
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
113. Терстон Дж., Сури С., Смит К., Макклейн Дж., Сато Т. Н., Янкопулос Г. Д. и др. Устойчивые к утечке кровеносные сосуды у мышей, трансгенно сверхэкспрессирующих ангиопоэтин-1. Наука (1999) 286 : 2511–4. DOI: 10.1126 / science.286.5449.2511
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
114.Гавард Дж., Пател В., Гуткинд Дж. С. Ангиопоэтин-1 предотвращает VEGF-индуцированную проницаемость эндотелия за счет секвестрации Src через mDia. Dev Cell (2008) 14 : 25–36. DOI: 10.1016 / j.devcel.2007.10.019
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
115. Фукухара С., Сако К., Минами Т., Нода К., Ким Х.З., Кодама Т. и др. Дифференциальная функция Tie2 в контактах клетка-клетка и контактах клетка-субстрат регулируется ангиопоэтином-1. Nat Cell Biol (2008) 10 : 513–26. DOI: 10.1038 / ncb1714
CrossRef Полный текст
116. Сахаринен П., Эклунд Л., Миеттинен Дж., Вирккала Р., Анисимов А., Виндерлих М. и др. Ангиопоэтины собирают отдельные сигнальные комплексы Tie2 в контактах эндотелиальная клетка-клетка и клетка-матрикс. Nat Cell Biol (2008) 10 : 527–37. DOI: 10.1038 / ncb1715
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
117.Nawroth R, Poell G, Ranft A, Kloep S, Samulowitz U, Fachinger G и др. Эктодомены VE-PTP и VE-кадгерина взаимодействуют для облегчения регуляции фосфорилирования и межклеточных контактов. EMBO J (2002) 21 : 4885–95. DOI: 10.1093 / emboj / cdf497
CrossRef Полный текст
118. Nottebaum AF, Cagna G, Winderlich M, Gamp AC, Linnepe R, Polaschegg C, et al. VE-PTP поддерживает эндотелиальный барьер с помощью плакоглобина и отделяется от VE-кадгерина лейкоцитами и VEGF. J Exp Med (2008) 205 : 2929–45. DOI: 10.1084 / jem.20080406
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
119. Броерманн А., Виндерлих М., Блок Н, Фрай М., Россент Дж., Зарбок А. и др. Диссоциация VE-PTP от VE-кадгерина необходима для экстравазации лейкоцитов и для VEGF-индуцированной проницаемости сосудов in vivo. J Exp Med (2011) 208 : 2393–401. DOI: 10.1084 / jem.20110525
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
120.Oubaha M, Gratton JP. Фосфорилирование эндотелиальной синтазы оксида азота атипичной PKC zeta способствует ангиопоэтин-1-зависимому ингибированию VEGF-индуцированной проницаемости эндотелия in vitro. Кровь (2009) 114 : 3343–51. DOI: 10.1182 / кровь-2008-12-196584
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
121. Гарсия Дж. Г., Лю Ф., Верин А. Д., Бирюкова А., Декерт М. А., Гертоффер В. Т. и др. Сфингозин-1-фосфат способствует целостности барьера эндотелиальных клеток за счет Edg-зависимой перестройки цитоскелета. Дж. Клин Инвест (2001) 108 : 689–701. DOI: 10.1172 / JCI200112450
CrossRef Полный текст
122. Argraves KM, Gazzolo PJ, Groh EM, Wilkerson BA, Matsuura BS, Twal WO и др. Сфингозин-1-фосфат, связанный с липопротеинами высокой плотности, способствует эндотелиальной барьерной функции. J Biol Chem (2008) 283 : 25074–81. DOI: 10.1074 / jbc.M801214200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
123.Camerer E, Regard JB, Cornelissen I, Srinivasan Y, Duong DN, Palmer D, et al. Сфингозин-1-фосфат в компартменте плазмы регулирует базальную и вызванную воспалением утечку из сосудов у мышей. J Clin Invest (2009) 119 : 1871–9.
Pubmed Аннотация | Pubmed Полный текст
124. Гаенгель К., Ниадет С., Хагикура К., Лавина Б., Мюль Л., Хофманн Дж. Дж. И др. Сфингозин-1-фосфатный рецептор S1PR1 ограничивает прорастающий ангиогенез, регулируя взаимодействие между VE-кадгерином и VEGFR2. Dev Cell (2012) 23 : 587–99. DOI: 10.1016 / j.devcel.2012.08.005
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
125. Юнг Б., Обината Х., Гальвани С., Мендельсон К., Динг Б.С., Скура А. и др. Регулируемая потоком передача сигналов эндотелиального рецептора S1P-1 поддерживает развитие сосудов. Dev Cell (2012) 23 : 600–10. DOI: 10.1016 / j.devcel.2012.07.015
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
126.Murakami M, Nguyen LT, Zhuang ZW, Moodie KL, Carmeliet P, Stan RV и др. Система FGF играет ключевую роль в регулировании целостности сосудов. J Clin Invest (2008) 118 : 3355–66. DOI: 10.1172 / JCI35298
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
127. Киран М.В., Каллури Р., Чо Й.Дж. Путь VEGF при раке и болезнях: ответы, устойчивость и путь вперед. Cold Spring Harb Perspect Med (2012) 2 : a006593.DOI: 10.1101 / cshperspect.a006593
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
128. Ян Дж. К., Хаворт Л., Шерри Р. М., Хву П., Шварцентрубер Д. Д., Топалян С. Л. и др. Рандомизированное исследование бевацизумаба, антител против фактора роста эндотелия сосудов, при метастатическом раке почек. N Engl J Med (2003) 349 : 427–34. DOI: 10.1056 / NEJMoa021491
CrossRef Полный текст
129.Шустер С., Эйкесдал Х.П., Пунтерволл Х., Гейслер Дж., Гейслер С., Генрих Д. и др. Клиническая эффективность и безопасность монотерапии бевацизумабом у пациентов с метастатической меланомой: прогностическое значение индуцированной ранней гипертензии. PLoS ONE (2012) 7 : e38364. DOI: 10.1371 / journal.pone.0038364
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
131. Hellstrom M, Phng LK, Hofmann JJ, Wallgard E, Coultas L, Lindblom P, et al.Передача сигналов Dll4 через Notch2 регулирует образование концевых клеток во время ангиогенеза. Nature (2007) 445 : 776–80. DOI: 10.1038 / nature05571
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
132. Phng LK, Potente M, Leslie JD, Babbage J, Nyqvist D, Lobov I, et al. Nrarp координирует передачу сигналов эндотелия Notch и Wnt для контроля плотности сосудов в ангиогенезе. Dev Cell (2009) 16 : 70–82.DOI: 10.1016 / j.devcel.2008.12.009
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
133. Патель Н.С., Ли Дж. Л., Дженерали Д., Поулсом Р., Крэнстон Д. В., Харрис А. Л.. Повышающая регуляция дельта-подобного 4 лиганда в сосудистой сети опухоли человека и роль базовой экспрессии в функции эндотелиальных клеток. Cancer Res (2005) 65 : 8690–7. DOI: 10.1158 / 0008-5472.CAN-05-1208
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
134.Ли Дж. Л., Сейнсон Р. К., Ши В., Лик Р., Харрингтон Л. С., Преуссер М. и др. Дельта-подобный лиганд 4 Notch регулирует ангиогенез опухоли, улучшает сосудистую функцию опухоли и способствует росту опухоли in vivo. Cancer Res (2007) 67 : 11244–53. DOI: 10.1158 / 0008-5472.CAN-07-0969
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
135. Сегарра М., Уильямс К.К., Сьерра Мде Л., Бернардо М., Маккормик П.Дж., Марич Д. и др.Активация Dll4 передачи сигналов Notch снижает васкулярность опухоли и подавляет рост опухоли. Кровь (2008) 112 : 1904–11. DOI: 10.1182 / кровь-2007-11-126045
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
136. Нагамицу А., Грейш К., Маэда Х. Повышение артериального давления как стратегия увеличения направленной на опухоль доставки макромолекулярного препарата SMANCS: случаи распространенных солидных опухолей. Jpn J Clin Oncol (2009) 39 : 756–66.DOI: 10.1093 / jjco / hyp074
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
137. Зарин Х., Каневский А.С., Фунг С.Х., Бутман Дж. А., Кокс Р.В., Глен Д. и др. Метаболически стабильные агонисты рецептора брадикинина B2 усиливают трансваскулярную доставку лекарственного средства в злокачественные опухоли головного мозга за счет увеличения периода полувыведения лекарственного средства. J Transl Med (2009) 7 : 33. DOI: 10.1186 / 1479-5876-7-33
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
138.Eikenes L, Bruland OS, Brekken C, Davies Cde L. Коллагеназа увеличивает градиент транскапиллярного давления и улучшает захват и распределение моноклональных антител в ксенотрансплантатах остеосаркомы человека. Cancer Res (2004) 64 : 4768–73. DOI: 10.1158 / 0008-5472.CAN-03-1472
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
139. Willett CG, Boucher Y, Di Tomaso E, Duda DG, Munn LL, Tong RT и др.Прямые доказательства того, что бевацизумаб, специфичное к VEGF, обладает противоваскулярным действием при раке прямой кишки человека. Нат Мед (2004) 10 : 145–7. DOI: 10,1038 / нм988
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
140. Портной Т.Д., Ханна Г., Ярмоленко П.С., Дреер М.Р., Бетоф А.С., Никсон А.Б. и др. Влияние пазопаниба на микроокружение опухоли и доставку липосом. Mol Cancer Ther (2010) 9 : 1798–808.DOI: 10.1158 / 1535-7163.MCT-09-0856
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
141. Нин С., Тиан Дж., Маршалл Д. Д., Нокс С. Дж. Моноклональные антитела к интегрину против альфа-в-интегрина, интетумумаб, повышают эффективность лучевой терапии и уменьшают метастазирование ксенотрансплантатов рака человека у голых крыс. Cancer Res (2010) 70 : 7591–9. DOI: 10.1158 / 0008-5472.CAN-10-1639
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
142.Хуанг И, Гоэль С., Дуда Д.Г., Фукумура Д., Джайн Р.К. Нормализация сосудов как новая стратегия усиления иммунотерапии рака. Cancer Res (2013) 73 : 2943–8. DOI: 10.1158 / 0008-5472.CAN-12-4354
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
143. Terme M, Pernot S, Marcheteau E, Sandoval F, Benhamouda N, Colussi O, et al. Блокада пути VEGFA-VEGFR ингибирует индуцированную опухолью пролиферацию регуляторных Т-клеток при колоректальном раке. Cancer Res (2013) 73 : 539–49. DOI: 10.1158 / 0008-5472.CAN-12-2325
CrossRef Полный текст
144. Казановас О., Хиклин Д. Д., Бергерс Г., Ханахан Д. Устойчивость к лекарствам путем уклонения от антиангиогенного нацеливания передачи сигналов VEGF на поздних стадиях опухолей островков поджелудочной железы. Cancer Cell (2005) 8 : 299–309. DOI: 10.1016 / j.ccr.2005.09.005
CrossRef Полный текст
145.Gatzemeier U, Pluzanska A, Szczesna A, Kaukel E, Roubec J, De Rosa F и др. Фаза III исследования эрлотиниба в сочетании с цисплатином и гемцитабином при запущенном немелкоклеточном раке легкого: испытание Tarceva Lung Cancer Investigation Trial. J Clin Oncol (2007) 25 : 1545–52. DOI: 10.1200 / JCO.2005.05.1474
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
146. Браудер Т., Баттерфилд К.Э., Кралинг Б.М., Ши Б., Маршалл Б., О’Рейли М.С. и др.Планирование антиангиогенной химиотерапии повышает эффективность против экспериментального лекарственно-устойчивого рака. Cancer Res (2000) 60 : 1878–86.
147. Mainetti LE, Rico MJ, Fernandez-Zenobi MV, Perroud HA, Roggero EA, Rozados VR, et al. Терапевтическая эффективность метрономной химиотерапии циклофосфамидом и доксорубицином на аденокарциномах молочной железы мышей. Энн Онкол (2013). DOI: 10.1093 / annonc / mdt164. [Epub перед печатью].
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
(PDF) Сосудистая проницаемость — Основы
26.Куени Л.Н., Детмар М. Лимфатическая система в здоровье и
болезни. Lymphat Res Biol. 2008; 6: 109–22.
27. Адкинс Дж. Н., Варнум С. М., Окберри К. Дж., Мур Р. Дж., Энджелл Н. Х.,
Смит Р. Д. и др. В отношении протеома сыворотки крови человека: анализ
методом многомерного разделения в сочетании с масс-спектрометрией
. Протеомика клеток Mol. 2002; 1: 947–55.
28. Дворжак Х.Ф., Харви В.С., Эстрелла П., Браун Л.Ф., МакДонах Дж.,
Дворак А.М. Гели, содержащие фибрин, вызывают ангиогенез.
Значение для образования стромы опухоли и заживления ран.
Lab Invest. 1987. 57: 673–86.
29. Вествебер Д., Вессель Ф., Ноттебаум А.Ф. Сходства и
различий в регуляции экстравазации лейкоцитов
и проницаемости сосудов. Semin Immunopathol. 2014; 36:
177–92.
30. Вествебер Д. Актуальность эндотелиальных соединений в лейкоцитах
Экстравазация и проницаемость сосудов. Ann N Y Acad Sci.
2012; 1257: 184–92.
31. Филлипсон М., Кубес П. Нейтрофилы в сосудистой системе плазмы крови
. Nat Med. 2011; 17: 1381–90.
32. Nourshargh S, Hordijk PL, Sixt M. Нарушение нескольких барьеров
: подвижность лейкоцитов через стенки вен и интерстиций
. Nat Rev Mol Cell Biol. 2010; 11: 366–78.
33. Schulte D, Kuppers V, Dartsch N, Broermann A, Li H,
Zarbock A, et al. Стабилизация комплекса VE-кадгерин-катенин
блокирует экстравазацию лейкоцитов и проницаемость сосудов.
EMBO J. 2011; 30: 4157–70.
34. Баскурт ОК, Ялчин О., Мейзельман Х.Дж. Гемореология и
сосудистых механизмов контроля. Clin Hemorheol Microcirc.
2004; 30: 169–78.
35. Майнингер Г.А., Дэвис М.Дж. Клеточные механизмы
участвуют в миогенном ответе сосудов. Am J Physiol. 1992; 263:
H647–59.
36. Сенгер Д.Р., Галли С.Дж., Дворжак А.М., Перруцци, Калифорния, Харви В.С.,
Дворак Х.Ф. Опухолевые клетки секретируют фактор проницаемости сосудов
, который способствует накоплению асцитной жидкости.Наука. 1983;
219: 983–5.
37. Феррара Н. VEGF как терапевтическая мишень при раке. Онкология.
2005; 69: 11–16.
38. Кох С., Тьюгес С., Ли Х, Гуаланди Л., Клаессон-Уэлш Л.
Передача сигнала сосудистым эндотелиальным фактором роста
рецепторов. Биохим Дж. 2011; 437: 169–83.
39. Мацумото Т., Бохман С., Дикселиус Дж., Берге Т., Димберг А.,
Магнуссон П. и др. Передача сигналов Y951 рецептора VEGF-2 и роль
адапторной молекулы TSAd в ангиогенезе опухоли.
EMBO J. 2005; 24: 2342–53.
40. Сан З., Ли Х, Массена С., Кутчера С., Падхан Н.,
Гуаланди Л. и др. VEGFR2 индуцирует передачу сигналов c-Src и проницаемость сосудов
in vivo через адаптерный белок TSAd.
J Exp Med. 2012; 209: 1363–77.
41. Weis S, Cui J, Barnes L, Cheresh D. Нарушение эндотелиального барьера
за счет VEGF-опосредованной активности Src потенцирует экстравазацию и метастазирование клеток опухоли
. J Cell Biol. 2004; 167: 223–9.
42. Элисейри Б.П., Пол Р., Шварцберг П.Л., Худ Д.Д., Ленг Дж.,
Череш Д.А. Селективная потребность в киназах Src во время
VEGF-индуцированного ангиогенеза и проницаемости сосудов. Mol
Cell. 1999; 4: 915–24.
43. Сакураи Ю., Огимото К., Катаока Ю., Йошида Н., Сибуя М.
Существенная роль остатка тирозина
1173 Flk-1 (рецептор 2 VEGF) в васкулогенезе у мышей. Proc Natl Acad Sci USA.
2005; 102: 1076–81.
44.Funa NS, Kriz V, Zang G, Calounova G, Akerblom B,
Mares J, et al. Дисфункциональная микрососудистая сеть как следствие инактивации гена shb
вызывает нарушение роста опухоли
. Cancer Res. 2009; 69: 2141–8.
45. Lamalice L, Houle F, Huot J. Фосфорилирование
Tyr1214 в VEGFR-2 запускает рекрутирование Nck
и активацию Fyn, что приводит к активации SAPK2 / p38 и миграции эндотелиальных клеток
в ответ на VEGF.J Biol Chem.
2006; 281: 34009–20.
46. Claesson-Welsh L, Welsh M. VEGFA и опухолевый ангиоген-
esis. J Intern Med. 2013; 273: 114–27.
47. Маршалл I. Характеристика и распределение гистаминовых
h2- и h3-рецепторов в прекапиллярных сосудах. J Cardiovasc
Pharmacol. 1984; 6: S587–97.
48. Шарма Дж. Н., Аль-Дхалмави Г.С. Антаго-
рецепторов брадикинина: терапевтическое значение. ID наркотиков. 2003. 6: 581–6.
49.Phung TL, Ziv K, Dabydeen D, Eyiah-Mensah G, Riveros M,
Perruzzi C и др. Патологический ангиогенез индуцируется
устойчивой передачей сигналов Akt и ингибируется рапамицином. Рак
Cell. 2006; 10: 159–70.
50. Fulton D, Gratton JP, McCabe TJ, Fontana J, Fujio Y,
Walsh K, et al. Регулирование продукции оксида азота
, производного эндотелия, протеинкиназой Akt. Природа. 1999;
399: 597–601.
51. Фукумура Д., Гохонги Т., Кадамби А., Изуми Ю., Анг Дж.,
Юн СО и др.Преобладающая роль эндотелиальной оксида азота
-синтазы в генезе ангио-
, индуцированном сосудистым эндотелиальным фактором роста, и проницаемости сосудов. Proc Natl Acad Sci USA.
2001; 98: 2604–9.
52. Dimmeler S, Fleming I, Fisslthaler B, Hermann C, Busse R,
Zeiher AM. Активация синтазы оксида азота в эндотелиальных клетках
путем Akt-зависимого фосфорилирования. Природа. 1999; 399:
601–5.
53. Forstermann U, Sessa WC.Синтазы оксида азота: положение
и функции. Eur Heart J. 2012; 33: 829–37.
54. Thibeault S, Rautureau Y, Oubaha M, Faubert D,
Wilkes BC, Delisle C, et al. S-нитрозилирование бета-катенина
посредством NO, происходящего из eNOS, способствует индуцированной VEGF проницаемости эндотелиальных клеток
. Mol Cell. 2010; 39: 468–76.
55. Макдональд Д.М., Балук П. Визуализация ангиогенеза в пораженных
дыхательных путях и опухолях: новообразованные кровеносные сосуды не похожи на
и могут быть совершенно ненормальными: Parker B.Лекция Фрэнсиса. Грудь.
2005; 128: 602S – 8S.
56. Джайн РК. Нормализация сосудистой сети опухоли: новая концепция
в антиангиогенной терапии. Наука. 2005. 307: 58–62.
57. Сингх М., Феррара Н. Моделирование и прогнозирование клинической эффективности
лекарств, нацеленных на опухолевую среду. Nat Biotechnol. 2012;
30: 648–57.
58. Аззи С., Хебда Дж. К., Гавард Дж. Проницаемость сосудов и доставка лекарств
при раке. Фасад Онкол. 2013; 3: 211.
59. Weis SM. Сосудистая проницаемость при сердечно-сосудистых заболеваниях и
раке. Curr Opin Hematol. 2008; 15: 243–9.
60. Carbone F, Nencioni A, Mach F, Vuilleumier N,
Montecucco F. Патофизиологическая роль нейтрофилов в остром
инфаркте миокарда. Thromb Haemost. 2013; 110: 501–14.
61. Meuwese MC, Stroes ES, Hazen SL, van Miert JN,
Kuivenhoven JA, Schaub RG, et al. Сывороточные уровни миелопероксидазы
связаны с будущим риском заболевания коронарной артерии
у практически здоровых людей: проспективное популяционное исследование EPIC-Norfolk
.J Am Coll Cardiol. 2007; 50:
159–65.
62. Каракас М., Кениг В., Цирер А., Гердер С., Роттбауэр В.,
Баумерт Дж. И др.
Ишемическая болезнь сердца связана с миелопероксидазой, независимо от традиционных факторов риска.
факторов: результаты исследования MONICA / KORA в Аугсбурге.
J Intern Med. 2012; 271: 43–50.
63. Baldus S, Heeschen C, Meinertz T, Zeiher AM, Eiserich JP,
Munzel T, et al. Уровни миелопероксидазы в сыворотке позволяют прогнозировать риск в
142 л.Claesson-Welsh
1.4: Распространение — Медицина LibreTexts
Второй этап фармакокинетики — это процесс, известный как распространение лекарственного средства . Распространение — это процесс, при котором лекарство распространяется по телу через кровоток. Как только лекарство попадает в системный кровоток путем абсорбции или прямого введения, оно должно быть распределено по интерстициальной и внутриклеточной жидкости, чтобы добраться до клеток-мишеней. Распределение лекарства по телу зависит от общих факторов, таких как кровоток, связывание с белками плазмы, растворимость липидов, гематоэнцефалический барьер и плацентарный барьер.Другие факторы включают проницаемость капилляров, разницу между кровью / тканью и объем распределения.
Распространение лекарства также может вызвать нежелательные или побочные эффекты. Лекарства предназначены в первую очередь для того, чтобы вызывать один эффект, то есть они сильнее связываются с одним конкретным рецепторным участком и предсказуемо вызывают или блокируют действие. Однако побочные эффекты могут возникать, когда лекарство связывается с другими участками помимо ткани-мишени, вызывая вторичные побочные эффекты. Эти побочные эффекты могут варьироваться от переносимых до неприемлемых, что приводит к прекращению приема лекарства.Например, человек может принимать болеутоляющее ибупрофен (Адвил) для лечения болезненной мышцы ноги, и впоследствии боль может быть уменьшена, но также может возникнуть раздражение желудка в качестве побочного эффекта, который может заставить человека прекратить прием ибупрофена.
Кровоток
Кровоток доставляет лекарства по назначению в организме. На кровоток и доставку лекарств могут влиять многие факторы, такие как снижение кровотока (из-за обезвоживания), закупорка сосудов (из-за атеросклероза), сужение сосудов (из-за неконтролируемой гипертонии) или ослабление перекачки крови в сердечной мышце (из-за сердца). отказ).Например, при введении антибиотика пациенту с диабетом с инфицированным пальцем ноги может быть затруднено прохождение антибиотика по кровеносным сосудам до клеток инфицированного пальца ноги.
Когда лекарство попадает в кровоток, часть его может существовать в виде свободного лекарственного средства, растворенного в воде плазмы. Часть препарата обратимо поглощается эритроцитами, а часть обратимо связывается с белками плазмы. Для многих лекарств связанные формы могут составлять 95-98% от общего количества.Это важно, потому что это свободный препарат, который проникает через клеточные мембраны и дает желаемый эффект. Это также важно, потому что связанное с белком лекарство может действовать как резервуар, который медленно высвобождает лекарство и, таким образом, продлевает его действие. При распределении лекарств важно учитывать как количество свободного лекарства, которое легко доступно тканям, так и потенциальные резервы лекарства, которые могут высвобождаться с течением времени.
Связывание с белками
Распространенным фактором, влияющим на распределение лекарств, является белок плазмы в крови.Альбумин — один из важнейших белков крови. Уровень альбумина может быть снижен несколькими факторами, такими как недоедание и заболевание печени. Определенный процент почти каждого лекарства связывается с белками плазмы, когда он первоначально попадает в кровоток и начинает циркулировать. Часть лекарства, которая становится «связанной с белком», неактивна, пока она связана, но часть лекарства, которая ускользает от первоначального связывания с белком, немедленно становится «свободной» для связывания с тканью-мишенью и оказания или блокирования действия.
Пациент, принимающий несколько препаратов с высоким содержанием белков, часто испытывает более серьезные побочные эффекты. Некоторые лекарства способны конкурентно захватывать (или связываться с) белками плазмы легче, чем другие лекарства, таким образом, в первую очередь захватывая доступные белковые молекулы. Это предотвращает прочное связывание вторичных лекарств с белком и намеченным целевым сайтом. Вместо этого эти лекарства свободно плавают в кровотоке, не оказывая никакого действия, и увеличивают риск побочных эффектов и токсичности.
Рисунок 1.4 Связывание с белками похоже на свободные места в автобусеДумайте о связывании с белками как об автобусной остановке (см. Рис. 1.4). Многие пассажиры (или молекулы лекарств) хотят прокатиться на автобусе. Все хотят добраться до места назначения и хотят найти себе место. Некоторые пассажиры сильнее и первыми сядут на сиденья (например, молекулы лекарств с большей способностью связывать белок связываются с белком). Иногда в автобусе может не хватать мест, и часть пассажиров остается на остановке.Оставшиеся пассажиры (молекулы лекарств) «свободны» передвигаться и дойти до места назначения. Они могут нанести удар самостоятельно и «схватиться» (соединиться с целевым рецептором) во время ходьбы. Подобным образом «свободные» частицы лекарства, не связанные с белками, циркулируют в кровотоке и предсказуемым образом соединяются с рецепторными участками, имеющими сродство к этому конкретному лекарству. Эти активные молекулы лекарства, которые не связались с белком (например, те пассажиры, которые не смогли занять место в автобусе), произведут первый эффект на организм.Со временем молекулы лекарства, которые связаны с белком (например, пассажиры с сиденьями в автобусе), выйдут из автобуса, начнут ходить и «схватятся» за рецепторный сайт, который имеет сродство к ним.
Барьер кровь-мозг
Лекарства, предназначенные для центральной нервной системы (головной и спинной мозг), сталкиваются с еще большим препятствием, чем связывание с белками; они также должны пройти через почти непреодолимую преграду, называемую гематоэнцефалическим барьером .Эта блокада построена из плотно сплетенной сетки капилляров, защищающих мозг от потенциально опасных веществ, таких как яды или вирусы. Только определенные лекарства, содержащие липиды (жиры) или имеющие «носитель», могут пройти через гематоэнцефалический барьер.
Ученые-исследователи разработали способы проникновения некоторых лекарств через гематоэнцефалический барьер. Примером этого является лекарство под торговой маркой Sinemet®, которое представляет собой комбинацию двух препаратов: карбидопы и левадопы. Карбидопа предназначена для переноса препарата левадопа через гематоэнцефалический барьер, где он попадает в мозг и превращается в дофамин, оказывая свое влияние на симптомы болезни Паркинсона.
Некоторые лекарства непреднамеренно преодолевают гематоэнцефалический барьер и влияют на функцию центральной нервной системы человека. Например, дифенгидрамин (Бенадрил®) — это антигистаминный препарат, используемый для уменьшения симптомов аллергии. Однако он также может преодолевать гематоэнцефалический барьер, угнетать центральную нервную систему и вызывать побочный эффект в виде сонливости. Если человеку трудно заснуть, этот побочный эффект сонливости может быть полезен, но для другого человека это может быть проблематично, поскольку он пытается безопасно выполнять повседневные дела.
Плацентарный барьер
Всегда важно учитывать эффекты лекарств во время беременности или для пациенток, которые могут забеременеть. Плацента проницаема для некоторых лекарств, в то время как другие специально не изучались у беременных. Некоторые препараты могут нанести вред будущему плоду в течение любого триместра. Поэтому необходимо всегда консультироваться с врачом относительно безопасности лекарств для использования во время беременности. Этот императив предполагается в оставшихся главах, посвященных классам лекарств, и медсестры всегда должны проверять самые последние, основанные на фактических данных справочные материалы о лекарствах, прежде чем назначать лекарства во время беременности.
Соображения о продолжительности жизни
Новорожденные и педиатры: Содержание жира у молодых пациентов снижается из-за увеличения общего содержания воды в организме. Кроме того, у растущего педиатрического пациента печень все еще формируется, и способность связывания белков снижается, а развивающийся гематоэнцефалический барьер позволяет большему количеству лекарств проникать в мозг.
Пожилые люди: У стареющего взрослого пациента наблюдается уменьшение общего количества воды в организме и мышечной массы.Жир в организме может увеличиваться, что приводит к более длительному действию многих лекарств. Сывороточный альбумин часто также снижается, что приводит к более активному свободному лекарству в организме. Это одна из причин, по которой многим пожилым пациентам требуется более низкий уровень лекарств.
В таблице 1.2 описаны другие факторы, влияющие на распространение наркотиков.
Таблица 1.2. Другие факторы, влияющие на распространение лекарств
1) Тканевые различия в скорости поглощения лекарств.
- Кровоток: наиболее быстро распределение происходит в тканях с большим количеством кровеносных сосудов, обеспечивающих высокий кровоток (легкие, почки, печень, мозг), и наименее быстро — в тканях с меньшим количеством кровеносных сосудов, что приводит к низкому кровотоку (жир ).
- Проницаемость капилляров: проницаемость капилляров зависит от ткани. Скорость распространения в ЦНС относительно медленнее или отсутствует из-за плотного соединения между эндотелиальными клетками капилляров и гематоэнцефалическим барьером.Капилляры печени и почек более пористые, что обеспечивает большую проницаемость.
2) Различия в соотношении ткань / кровь при равновесии
- Растворение липидорастворимых препаратов в жировой ткани
- Связывание лекарств с внутриклеточными сайтами
- Связывание с белками плазмы
3) Видимый объем распределения
- Компартменты жидкости: плазма, внеклеточная вода, общая вода тела.
- Период полувыведения лекарства из плазмы
- Период полувыведения — это время, необходимое для выведения половины лекарства из организма.Период полувыведения напрямую зависит от продолжительности терапевтического эффекта лекарства. На период полувыведения могут влиять многие факторы, например, заболевание печени или дисфункция почек.
- Информацию о периоде полувыведения лекарства можно найти в научно обоснованных справочниках по лекарствам. Например, в разделе «Клиническая фармакология» справочника Daily Med для фуросемида период полувыведения составляет примерно 2 часа.
Значение герметичности кровеносных сосудов при раке
Реферат
Несмотря на значительные достижения в области ангиогенеза опухолей, относительно мало внимания уделяется проницаемости кровеносных сосудов в опухолях.Негерметичность сосудов опухоли хорошо задокументирована на экспериментальных моделях опухолей и при раке человека, но механизм плохо изучен, как и влияние на скорость роста рака, предрасположенность к метастазированию и доставку макромолекулярных терапевтических средств к опухолевым клеткам. Шестнадцать экспертов в области биологии рака и биологии сосудов собрались на конференции Уильяма Гая Форбека «В фокусе будущего», чтобы обсудить эту тему. Встреча была первой в своем роде, посвященной значению герметичности кровеносных сосудов при опухолях.Участники обсудили клеточную основу герметичности сосудов опухоли, эндотелиальную барьерную функцию кровеносных сосудов, мониторинг герметичности сосудов опухоли, медиаторы эндотелиальной проницаемости, последствия герметичности сосудов опухоли, геномный анализ сосудистых мишеней, нацеливание лекарств на сосуды опухоли и терапевтические манипуляции с ними. сосуды опухоли. Группа пришла к выводу, что необходимо более полное понимание базовой биологии сосудов опухоли, чтобы полностью оценить последствия утечки сосудов при раке.Новые инструменты исследования, такие как прижизненные измерения кровотока в опухоли и герметичности сосудов, фаговый дисплей in vivo , магнитно-резонансная томография и использование селективных ингибиторов ангиогенеза будут способствовать этому пониманию.
Введение
Существует общее мнение, что кровеносные сосуды в опухолях ненормальны. Одним из проявлений этой аномалии является дефектный и негерметичный эндотелий. Герметичность кровеносных сосудов не только влияет на внутреннюю среду опухолей и, возможно, на скорость ангиогенеза, но также регулирует доступ терапевтических антител, векторов генной терапии и липосомальных систем доставки лекарств к опухолевым клеткам.Целью конференции Уильяма Гая Форбека «Фокус на будущее» было предоставить возможность ученым, изучающим барьерную функцию кровеносных сосудов, объединить усилия с учеными, работающими над ангиогенезом опухолей и другими областями биологии рака, чтобы определить современное состояние и значение герметичности кровеносных сосудов при раке и наметить направления будущих исследований в этой области.
В начале конференции доктор Дональд М. Макдональд (Калифорнийский университет, Сан-Франциско, Калифорния) предложил участникам рассмотреть пять вопросов: ( a ) Почему кровеносные сосуды в опухолях протекают и каковы последствия негерметичности? ( b ) Как можно оценить герметичность кровеносных сосудов при экспериментальных опухолях и раке человека? ( c ) Какие существуют стратегии для нацеливания терапевтических средств на сосуды опухоли с целью нормализации или разрушения сосудов? ( d ) Было бы терапевтически выгодно уменьшить утечку, и если да, то как этого можно было бы достичь? ( e ) Может ли «нормализация» структуры и функции сосудов опухоли быть полезной при лечении рака, и если да, то как этого можно достичь?
Клеточная основа герметичности опухолевого сосуда
Большинство сосудов опухоли имеют неправильный диаметр и паттерн ветвления и не вписываются в обычную классификацию артериол, капилляров или венул.Даже у крупнокалиберных сосудов тонкие дырявые стенки. Доктор Питер Балук (Калифорнийский университет, Сан-Франциско, Калифорния), изучающий морфологические аномалии сосудов опухоли, изобразил структурную неоднородность, неоднородность и неплотность сосудов опухоли как причудливые признаки склонности к нарушению всех правил нормальной жизни. строительство кровеносных сосудов. Хотя в некоторых сообщениях предполагается, что в сосудах опухоли отсутствуют эндотелиальные клетки, перициты (настенные клетки) или базальная мембрана, недавние исследования показывают, что все эти компоненты присутствуют, но ненормальны. (1 , 2) .Эндотелиальные клетки, хотя и присутствуют на большинстве, если не на всех сосудах опухоли, не образуют нормальный монослой и, следовательно, не имеют нормальной барьерной функции. (1 , 3) . Клетки неорганизованы и имеют неправильную форму. Эндотелиальные клетки некоторых сосудов опухоли перекрывают друг друга, имеют просветные выступы и дают начало аблюминальным отросткам. Клетки также имеют неплотные соединения и очаговые межклеточные отверстия, которые, вероятно, ответственны за большую часть протекающих сосудов. Размер отверстий (<2 мкм в диаметре) между эндотелиальными клетками, исследованных с помощью сканирующей электронной микроскопии, соответствует функциональным измерениям порового размера сосудов опухоли.Перициты с альфа-гладкомышечным актином и / или иммунореактивностью десмина присутствуют в большинстве сосудов опухоли, но они имеют ненормально слабую связь с эндотелиальными клетками, и у многих есть цитоплазматические процессы, которые проникают глубоко в ткань опухоли. (2) . Базальная мембрана сосудов, визуализируемая коллагеном IV типа, ламинином, фибронектином или иммунореактивностью нидогена, покрывает большую часть поверхности сосудов опухоли. Тем не менее базальная мембрана имеет ненормально слабую ассоциацию с эндотелиальными клетками и перицитами и состоит из нескольких слоев.Избыточные слои базальной мембраны представляют собой историческую запись непрерывного ремоделирования сосудов.
Доктор Рагху Каллури (Гарвардская медицинская школа, больница Бет Исраэль, Гарвардская медицинская школа, Бостон, Массачусетс) подробно остановился на аномальной структуре и составе базальной мембраны сосудов опухоли. Базальная мембрана сосудов, которая образована эндотелиальными клетками, перицитами и гладкомышечными клетками кровеносных сосудов и окружает их, отличается от других компонентов внеклеточного матрикса. (4 , 5) .Базальная мембрана сосудов состоит на 50% из коллагена IV типа и на 30% из ламинина, а также из значительных количеств нидогена (энтактина), фибронектина и других белков и протеогликанов гепарансульфата. Аналитические методы выявили различия между базальной мембраной сосудов и другими базальными мембранами. Кроме того, состав базальной мембраны сосудов не одинаков во всех кровеносных сосудах. В настоящее время признано, что базальная мембрана сосудов претерпевает важные изменения при заболевании и может отличаться от сосудов опухоли.Например, делеция гена цепи ламинина α4 приводит к кровотечению у мышей с нокаутом, а также к кровотечению и нарушению роста сосудов в анализах ангиогенеза. Некоторые ламинины, содержащие α4-цепь (, например, , ламинин-8), связаны с опухолевыми сосудами.
Базальная мембрана также является потенциальным источником про- и антиангиогенных молекул. Некоторые структурные белки базальной мембраны могут быть расщеплены ферментами с образованием более мелких молекул с мощным действием. Одним из примеров является эндостатин, который представляет собой COOH-концевой фрагмент коллагена XVIII.Другой, тумстатин, представляет собой неколлагеновый-1 домен цепи α3 коллагена IV типа. Третий пример, arresten, представляет собой неколлагеновый-1 домен цепи α1 коллагена IV типа. (4 , 5) . Эти молекулы демонстрируют большой потенциал в замедлении роста рака на доклинических моделях и уже проходят или скоро будут проходить клинические испытания. Доктор Каллури пришел к выводу, что ( a ) аномалии сосудов опухоли включают изменения в составе, сборке и архитектуре базальной мембраны сосудов и ( b ) изменения базальной мембраны сосудов, вероятно, будут важны для избирательной проницаемости. сосудов опухоли и, наряду с аномалиями в эндотелии, может влиять на экстравазацию плазмы и ограничивать приток иммунных клеток в опухоли.
Какова причина этих аномалий в сосудах опухоли? Здесь больше вопросов, чем ответов. Считается, что растворимые и связанные с матриксом факторы, продуцируемые опухолевыми клетками и гипоксической средой, имеют важное значение. Стромальные клетки, вероятно, также вовлечены, возможно, участвуя в дисбалансе факторов роста в опухолях. VEGF, 3 который может вызвать образование очень причудливых сосудов в экспериментальных моделях, является вероятным фактором сосудистых аномалий.Ang1, который может быть произведен перицитами, Ang2, который может быть сверхэкспрессирован эндотелиальными клетками в опухолях, и PDGF, который необходим для нормального развития перицитов, являются другими участниками, но об их роли в герметичности сосудов опухоли известно меньше.
Эндотелиальная барьерная функция кровеносных сосудов
На утечку веществ из кровеносных сосудов влияет множество факторов. Доктор Фитц-Рой Карри (Калифорнийский университет, Дэвис, Калифорния) описал физиологические механизмы, регулирующие перемещение веществ из нормальных кровеносных сосудов.Основными факторами являются площадь поверхности просвета и проницаемость стенки сосуда, концентрация и движущие силы (гидростатические и осмотические градиенты) через эндотелий и кровоток. (6 , 7) . Важной целью будет понимание относительного вклада каждого из этих факторов в экстравазацию макромолекул, таких как белки плазмы, терапевтические антитела или вирусные векторы из сосудов опухоли, но в настоящее время нет четкого понимания. Одна из причин заключается в том, что переменные, управляющие утечкой, которые можно легко измерить в экспериментальных моделях, таких как брыжеечные кровеносные сосуды лягушки или крысы, трудно оценить в опухолях.Доктор Карри описал, как в нормальных условиях проницаемость одного микрососудистого слоя для водорастворимых веществ может варьироваться по крайней мере в 10 000 раз, причем электролиты находятся на одном конце спектра, а макромолекулы — на другом. (6 , 7) . Проницаемость различных сосудов варьируется от самых низких значений в головном мозге, скелетных и сердечных мышцах до брыжейки, кишечника, слюнных желез и почечных клубочков. Вода и небольшие водорастворимые растворенные вещества имеют самые большие вариации.Различия между сосудистыми ложами основаны на нескольких факторах, включая количество плотных соединительных тяжей и пор в эндотелии, а также проницаемость гликокаликса, выстилающего просветную поверхность эндотелия.
Мелкие растворенные вещества выходят из сосудов в основном за счет диффузии, но крупные растворенные вещества могут перемещаться за счет диффузии и конвекции, когда экстравазация сочетается с потоком воды, особенно если сосуды очень негерметичны. Доктор Карри подчеркнул важность различения проницаемости или неплотности стенки сосуда от потока и накопления экстравазированной жидкости и растворенных веществ вне сосудов, которые зависят от множества факторов, включая проницаемость, площадь поверхности и силы, которые перемещают воду и растворенные вещества через сосуд. стены.
Основываясь на принципах, извлеченных из нормальных кровеносных сосудов, где поток через стенки сосудов является продуктом проводимости и движущей силы, д-р Карри оценивает, что одиночное отверстие> 0,5 мкм в диаметре в эндотелии сосуда опухоли сделает проницаемость этого сосуда. сосуд достаточно большой, чтобы экстравазация растворенного вещества была ограничена кровотоком. Таким образом, кровоток ограничит утечку макромолекул, а усиленный кровоток должен улучшить доставку макромолекулярных терапевтических средств к периваскулярным раковым клеткам.Доставка в раковые клетки, расположенные на некотором расстоянии от кровеносных сосудов, будет ограничиваться межуточным транспортом, а также кровотоком.
Зависимость доставки макромолекулярных препаратов от кровотока поднимает вопрос «нормализации» сосудов опухоли в ответ на определенные виды лечения. По словам доктора Ракеша Джайна (Массачусетская больница общего профиля, Гарвардская медицинская школа, Бостон, Массачусетс), ингибиторы VEGF, ингибиторы ангиогенеза и даже герцептин могут нормализовать сосуды опухоли. (8 , 9) .Это могло бы быть результатом уменьшения извилистости сосуда; уменьшение вариабельности размеров, формы и разветвленности сосудов; исправление аномалий сосудистой стенки; и, возможно, даже уменьшилась неплотность. Доктор Джайн высказал предположение, которое на первый взгляд кажется нелогичным, что нормализация сосудов опухоли может улучшить доставку лекарства к опухолевым клеткам. Теоретически процесс нормализации увеличивал бы кровоток за счет уменьшения сопротивления из-за извилистости сосудов и неправильного диаметра. Повышенный кровоток может улучшить доставку лекарственного средства, даже если протечка сосудов в некоторой степени уменьшилась во время нормализации.Однако усиленный кровоток также может стимулировать рост опухоли. Чтобы проверить эти возможности, д-р Джейн подчеркнул необходимость дополнительных исследований в нескольких областях, включая: ( a ) молекулярные, клеточные и физиологические механизмы нормализации сосудов в опухолях во время терапии; ( b ) методы визуализации, включая использование суррогатных маркеров, для определения условий нормализации сосудов опухоли и для улучшения комбинированной терапии; и ( c ) динамические исследования взаимодействия эндотелиальных клеток / перицитов / базальной мембраны / стромальных клеток для лучшего понимания последствий манипулирования функцией сосудов опухоли.Д-р Карри добавил, что, если это технически возможно, эффект увеличения кровотока должен быть протестирован на единичных сосудах опухоли до и после нормализации в условиях, когда измеряются кровоток и проницаемость.
Сосуды опухоли на порядок более негерметичны, чем нормальные сосуды. Размер отсечки пор (указывающий на самые большие частицы, которые могут пересекать стенки сосуда) измеряется в сотнях нанометров, а не в десятках нанометров. (8 , 10) . Однако экстравазация белков из сосудов опухоли происходит медленнее, чем можно было бы предсказать по размеру пор, если бы в остальном сосуды были нормальными.Аномально малый гидростатический градиент изнутри сосудов наружу, возникающий из-за высокого интерстициального гидростатического давления внутри опухолей, снижает движущую силу конвективного движения. В отсутствие конвекции движение макромолекул из сосудов опухоли происходит в основном за счет диффузии — медленного процесса для больших молекул. Высокое интерстициальное давление в опухолях является следствием утечки из кровеносных сосудов в сочетании с нарушенным клиренсом жидкости через лимфатические сосуды и, возможно, жесткими или сократительными стромальными клетками, которые снижают эластичность тканей.Необходимы дополнительные эксперименты, чтобы определить судьбу веществ, которые выделяются из сосудов опухоли, и почему функциональные лимфатические сосуды не могут развиваться в опухолях даже в присутствии лимфангиогенного фактора роста VEGF-C. Это признано очень плодородной областью для экспериментов из-за недавней доступности реагентов, которые могут локализовать и стимулировать или блокировать образование лимфатических сосудов.
Мало что известно о судьбе растворенных веществ, которые выводятся из протекающих сосудов опухоли.Из-за отсутствия функциональных лимфатических сосудов экстравазированные растворенные вещества могут медленно покидать опухоль путем диффузии, возвращаться в кровь, удерживаться путем связывания с опухолевыми или стромальными клетками или метаболизироваться. Связь между плохой проницаемостью макромолекул в опухоли и отсутствием лимфатических сосудов повышает вероятность того, что доставка лекарств может быть улучшена за счет нормализации лимфодренажа из опухолей. Однако рост функциональных лимфатических сосудов в опухоли может предрасполагать опухоль к метастазированию.
Мониторинг герметичности сосудов опухоли
Разрабатываются методы контроля проницаемости сосудов в опухолях.Это было достигнуто в экспериментальных моделях, где сосуды опухоли видны in vivo через прозрачное окно. Неинвазивные подходы к использованию при раке человека более сложны. Введенные в кровоток макромолекулярные индикаторы могут быть обнаружены в опухолях с помощью МРТ, а математические модели используются для количественной оценки экстравазации.
Доктор Роберт Браш (Калифорнийский университет, Сан-Франциско, Калифорния) разработал методы МРТ для измерения утечки сосудов опухоли у грызунов и людей, а также для тестирования лекарств, которые могут изменить утечку.Он был пионером в использовании комплексов альбумин-гадолиний и частиц оксида железа, покрытых декстраном, в качестве макромолекулярных индикаторов для визуализации сосудов опухоли и оценки их утечки с помощью МРТ. (11 , 12) . Одной из причин визуализации протечки сосудов опухоли является оценка серьезности или степени опухоли, которая коррелирует с объемом утечки. Визуализация также предоставляет средства для идентификации опухолей, чувствительных к лекарствам, и мониторинга реакции опухолей на лечение. Доктор Браш показал, что облучение увеличивает утечку макромолекулярных контрастных агентов для МРТ из сосудов опухоли и что антитела против VEGF уменьшают утечку.Доктор Браш приходит к выводу, что неплотность сосудов опухоли — это постоянное и полезное физиологическое свойство, которое можно измерить у животных и людей и которым можно манипулировать для получения клинических преимуществ, и оно отражает биологический статус опухолей. Он рекомендовал дополнительные исследования с целью определения морфологических детерминант и способов управления утечкой.
Хотя все еще остаются вопросы относительно интерпретации и количественной оценки сигнала при МРТ-исследованиях проницаемости сосудов, этот подход важен, поскольку он предлагает потенциальные средства неинвазивной оценки протекаемости сосудов опухоли у людей и может быть полезен при оценке эффективности ингибиторов ангиогенеза. .
Медиаторы эндотелиальной утечки
Д-р Нил Грейнджер (Университет штата Луизиана, Шривпорт, Луизиана) рассмотрел, как медиаторы воспаления увеличивают проницаемость кровеносных сосудов и как при некоторых условиях утечка может быть связана с миграцией лейкоцитов через стенки сосудов. (13) . Многие медиаторы, включая гистамин, брадикинин, серотонин, вещество P и некоторые цитокины, увеличивают проницаемость эндотелия, но некоторые (например, оксид азота) могут увеличивать или уменьшать проницаемость сосудов при различных обстоятельствах.Лейкоциты являются ключом к протечке кровеносных сосудов при некоторых воспалительных реакциях и в условиях ишемии с последующей реперфузией, но не участвуют во многих других типах утечки. Функциональный размер пор в эндотелиальных клетках кишечника может увеличиваться просто за счет воздействия определенных пищевых компонентов. Что касается механизмов негерметичности сосудов опухоли, д-р Грейнджер рекомендовал дополнительную работу над ( a ) структурной основой неплотности сосудов опухоли, ( b ) ролью делящихся и растущих или мигрирующих эндотелиальных клеток в опухоли. герметичность сосудов и ( c ) относительный вклад измененной проницаемости сосудов и нарушения лимфатического дренажа в накопление экстравазированных макромолекул в опухолях.
Последствия герметичности сосудов опухоли
Какая связь между утечкой кровеносных сосудов и ростом опухоли? Доктор Гарольд Дворак (больница Бет Исраэль, Гарвардская медицинская школа) представил модельную систему с использованием фокальной трансфекции кожи аденовирусным вектором для изучения эффектов факторов роста сосудов у мышей. (14 , 15) . Высокая экспрессия VEGF в этой модели стимулирует пролиферацию крупных «материнских сосудов» и извилистых «гломерулоидных тел», которые имеют структурные и функциональные особенности, общие с некоторыми опухолевыми сосудами.Эта модельная система дает возможность создать «виртуальную опухоль», состоящую из кровеносных сосудов без опухолевых клеток, которую проще изучить, чем настоящие опухоли. Доктор Дворак также рассмотрел роль экстравазации фибриногена из протекающих сосудов опухоли и последующего отложения фибрина в создании среды внутри опухолей, которая способствует ангиогенезу и росту опухоли. Соответствующие вопросы включают: ( a ) Важен ли фибрин для ангиогенеза в опухолях? Растут ли опухоли медленнее у мышей с нокаутом фибриногена? ( b ) Каковы аномалии эндотелиального гликокаликса в сосудах опухоли? ( c ) Почему из сосудов опухоли выходит больше эритроцитов, чем тромбоцитов или лейкоцитов? ( d ) Почему VEGF-C вызывает образование новых лимфатических сосудов в нормальных тканях, но не в опухолях?
Геномный анализ сосудистых мишеней
Значительный прогресс был достигнут в профилировании экспрессии генов в эндотелиальных и опухолевых клетках.Доктор Ричард Мюррей (Eos Biotechnology, Inc., Южный Сан-Франциско, Калифорния) описал высокопроизводительные исследования экспрессии генов как инструменты для обнаружения новых мишеней для противоопухолевых препаратов. Eos Biotechnology, Inc. собрала базу данных значений экспрессии для 40 000 генов человека в сотнях опухолей и нормальных тканях. Данные этих образцов, проанализированные с использованием мощных инструментов биоинформатики, позволили ученым Eos Biotechnology, Inc. выявить уникальные генетические различия между покоящимися и растущими эндотелиальными клетками, а также между опухолями и нормальными тканями, с особым акцентом на выявлении потенциальных мишеней для лекарств на поверхности клеток .Антитела, вырабатываемые к этим молекулам, в некоторых случаях в сочетании с токсичными лекарствами, могут нацеливаться на опухоли. Что касается будущего, доктор Мюррей сосредоточился на скорейшем переводе открытий фундаментальной науки в кандидаты на лекарства, что является ключом к быстрому доставке новых лекарств в клинику. Доказательства принципиальных исследований наиболее полезны, когда они предоставляют данные, относящиеся к последующим клиническим исследованиям. В связи с этим эксперименты по герметичности сосудов опухоли должны учитывать практические аспекты доставки лекарств преимущественно в сосуды опухоли.
Нацеливание лекарственных препаратов на сосуды опухоли
Существует общее мнение о полезности обнаружения молекул на опухолевых сосудах и раковых клетках, которые можно использовать в качестве мишеней для диагностики и лечения. Идентификация молекул, которые предпочтительно экспрессируются или однозначно доступны на сосудах опухоли, перемещает область нацеливания лекарств от теории к реальности, но лучшие цели и лучшие методы их поиска все еще не определены. Молекулы, идентифицированные с помощью исследований экспрессии генов, in vivo, фагового дисплея и других подходов, предлагают большие перспективы для концентрации системно вводимых терапевтических средств в опухолях при одновременном снижении побочных эффектов.
Доктор Филип Торп (Юго-западный медицинский центр Техасского университета, Даллас, Техас) описал несколько потенциальных мишеней на сосудах опухоли. Среди них были α v β 3 и α 5 β 1 интегрин, комплекс VEGF-VEGFR-2, эндоглин (CD105), простатоспецифический мембранный антиген, ED-B-домен фибронектина, эндосиалин, матрикс. металлопротеиназа-9 и фосфатидилсерин (16 , 17) . По словам доктора Торпа, фосфатидилсерин, который обычно экспрессируется на цитоплазматической поверхности клеточных мембран, переходит на внешнюю поверхность сосудов опухоли и попадает в кровоток.Переворот может быть вызван активацией эндотелиальных клеток или повреждением, вызванным гипоксией, воспалительными цитокинами или реактивными формами кислорода, генерируемыми в опухоли. Антитела к фосфатидилсерину нетоксичны и обладают противоопухолевым действием у мышей. Другая стратегия нацелена на факторы свертывания крови в сосудах опухоли с целью вызвать внутрисосудистый тромбоз внутри опухоли. (16 , 17) . Эти подходы могут разрушать сосуды опухоли и вызывать регресс солидных опухолей в экспериментальных моделях. Исследования показывают, что нацеленные на сосуды агенты могут быстро закрывать сосудистую сеть опухолей, эффективны при низких дозах и уменьшают маленькие и большие солидные опухоли у мышей.Их свойства отличаются от свойств ингибиторов ангиогенеза, которые блокируют рост опухоли путем подавления образования кровеносных сосудов, и дополняют их.
Drs. Рената Паскуалини и Вадих Арап (оба из Онкологического центра им. М. Д. Андерсона Университета Техаса, Хьюстон, Техас) используют фаговый дисплей in vivo для идентификации белков, которые преимущественно экспрессируются на сосудах опухоли и могут служить мишенями для доставки лекарств. (18, 19, 20, 21) . Эксперименты на мышах показывают, что целевые химиотерапевтические препараты эффективны при гораздо более низких дозах, чем нецелевые препараты.Используя библиотеки бактериофагов, которые экспрессируют случайные пептиды, лаборатория Drs. Паскуалини и Арап определили специфические молекулярные мишени (почтовые индексы) в сосудах опухолей, а также в нормальном мозге, легких, поджелудочной железе, жировой ткани и простате. (18 , 19) . Большинство мишеней находятся на эндотелиальных клетках, но некоторые в опухолях могут находиться на перицитах, которые доступны через дефекты эндотелия. (20) . Эффективные мишени используют молекулярную гетерогенность сосудистой сети и сайт-специфические нарушения функции эндотелиального барьера.Из-за природы технологии мишени, идентифицированные фаговым дисплеем in vivo , также будут доступны для макромолекулярных терапевтических средств, таких как антитела, липосомы или вирусные векторы. Хотя большинство исследований с использованием фагового дисплея in vivo было выполнено на мышах, в настоящее время проводятся новаторские исследования, в которых фаговый дисплей in vivo проводится на онкологических больных. (21) . Текущие исследования определяют молекулярные мишени на кровеносных сосудах опухолей и здоровых тканях человека.Рецептор интерлейкина 11 является одной из таких мишеней, идентифицированных в простате. (21) . Чтобы использовать весь потенциал фагового дисплея in vivo для исследований нацеливания на лекарства, необходима дополнительная работа для развития более полного понимания клеточной локализации и доступности сосудистых почтовых индексов в опухолях и здоровых тканях.
Терапевтические манипуляции с опухолевыми сосудами
Трансгенные мыши, у которых развиваются спонтанные многоочаговые многоступенчатые опухоли, используются для сравнения эффективности лекарств в предотвращении роста опухоли и ее регрессии.Д-р Дуглас Ханахан (Калифорнийский университет, Сан-Франциско, Калифорния) описал недавние успехи, достигнутые в анализе этапов ангиогенеза опухоли и влияния лекарств на этот процесс. (22 , 23) . Его группа обнаружила, что ингибирование передачи сигналов VEGF в эндотелиальных клетках предотвращает рост опухолей островковых клеток поджелудочной железы у трансгенных мышей с RIP-Tag, но, по-видимому, менее эффективно вызывает регрессию опухоли. Можно ожидать, что ингибирование передачи сигналов VEGF-R2 в опухолевых сосудах затронет в основном эндотелиальные клетки.Присутствие перицитов на сосудах опухоли, а также поддерживающая функция перицитов на эндотелиальных клетках и зависимость перицитов от PDGF повышает вероятность того, что комбинация ингибиторов VEGF и PDGF будет более эффективной в разрушении сосудов опухоли и вызове регрессии опухоли. Однако интерпретация таких экспериментов зависит от селективности и доступа ингибиторов к своим мишеням. Кроме того, еще предстоит определить, будут ли такие ингибиторы разрушать одни сосуды опухоли, нормализовать другие и оставлять одни без изменений.В отношении проницаемости кровеносных сосудов д-р Ханахан рекомендовал продолжать усилия по управлению проницаемостью сосудов в опухолях с целью понимания значимости повышенной проницаемости для малых молекул, белков, включая антитела, и лейкоцитов. В то время как некоторые терапевтические стратегии могут принести пользу за счет нормализации сосудистой сети опухоли и уменьшения протекания, другие могут быть более эффективными при увеличении проницаемости, например, при иммунотерапии, где может быть полезным усиление притока лейкоцитов в опухоли.
Герметичность сосудов опухоли может быть результатом дисбаланса факторов роста, приводящего к дефектам эндотелиальных клеток, перицитов и базальной мембраны. Доктор Гэвин Терстон (Regeneron Pharmaceuticals, Inc., Тарритаун, штат Нью-Йорк) предположил, что коррекция этого дисбаланса может обратить вспять аномалии, но предупредил, что системно вводимые факторы роста или их ингибиторы могут не имитировать обычно очаговое действие их эндогенных аналогов. Некоторые факторы роста (например, VEGF) могут продуцироваться в количествах, которые запускают ангиогенез и аномальный фенотип сосудов опухоли, тогда как другие факторы, такие как ингибиторы Ang1 и VEGF, приводят сосуды опухоли к более нормальному фенотипу.С другой стороны, ингибиторы Ang2 и VEGF могут вызывать регрессию и исчезновение сосудов опухоли. Чтобы оценить эти возможности, необходимо разбираться в игроках. VEGF — мощный митоген эндотелиальных клеток. Новообразованные кровеносные сосуды, как правило, зависят от VEGF. VEGF-Trap, который является ингибитором VEGF, состоящим из растворимых VEGFR-1 и VEGFR-2, связанных с хвостом Fc иммуноглобулина, блокирует ранний рост опухолей, но имеет тенденцию к нормализации кровеносных сосудов в уже сформировавшихся опухолях. Ang1, который не является митогеном эндотелиальных клеток, избирательно действует на эндотелиальные клетки через рецепторы Tie2 и, по-видимому, выполняет противовоспалительную и противовоспалительную роль. (24 , 25) .Ang2 также действует на рецепторы Tie2 и имитирует эффекты Ang1 в одних условиях, но блокирует Ang1 и способствует регрессии сосудов в других. Ang2 может быть маркером эндотелиальных клеток в опухолях и может способствовать лимфангиогенезу. В отсутствие Ang2 ремоделирование сосудов не происходит нормально во время развития. Важные вопросы, которые необходимо решить для оценки этих проблем, включают: ( a ) Является ли сверхэкспрессия VEGF ключевым дисбалансом в отношении аномалий сосудов опухоли? Как ингибирование VEGF изменяет клеточную морфологию, проницаемость и экспрессию рецепторов сосудов опухоли? Сосуды нормализуются или регрессируют? ( b ) Какова роль Ang2 в опухолях? Влияет ли соотношение Ang1 и Ang2 на морфологию кровеносных сосудов? ( c ) Будет ли клинически более полезным при лечении рака нормализовать сосуды опухоли или сделать их еще более аномальными до такой степени, что они регрессируют?
Доктор.Дэвид Череш (Исследовательский институт Скриппса, Ла-Хойя, Калифорния) описал свои недавние эксперименты по внутриклеточным сигнальным путям, участвующим в VEGF-индуцированной утечке плазмы. Его эксперименты выявили, что тирозинкиназа Src играет ключевую роль во внутриклеточной передаче сигналов, что приводит к утечке, производимой VEGF, но не другими медиаторами. (26) . Src находится ниже рецепторов VEGF и через β-катенин связан с эндотелиальным кадгерином сосудов в межклеточных соединениях. VEGF не вызывает утечки у мышей, у которых отсутствует Src — или его родственник Да .Вызванная VEGF утечка также может блокироваться ингибитором Src PP1. Доктор Череш сообщил, что опухоли, выросшие у мышей Src -null, больше и имеют меньше фибрина на поверхности, и предположил, что фибрин, образованный из экстравазированного фибриногена, может участвовать в сдерживании опухолей. Ингибирование Src также снижает утечку плазмы в мозг и увеличивает выживаемость в модели инсульта у мышей, демонстрируя, как исследования в области ангиогенеза и проницаемости сосудов могут неожиданно принести пользу в других клинических ситуациях. (27) .В этой модели набухание мозга, связанное с инсультом, приводит к ишемии, гипоксии тканей, увеличению выработки VEGF и большей утечке плазмы, которая усугубляет отек мозга. Ингибиторы Src облегчают эту проблему. Доктор Череш пришел к выводу, что более глубокие знания о контроле проницаемости сосудов, вероятно, окажут глубокое влияние на рак, а также на другие патологические процессы, включая воспаление и ишемию. Для этого необходимо уделять больше внимания молекулярным механизмам и клеточной основе изменений проницаемости сосудов и кровотока при опухолях и других заболеваниях.Хотя роль Src в индуцированной VEGF утечке в опухоли только начинает изучаться, мышей с нокаутом Src могут быть полезны для оценки функционального значения герметичности сосудов опухоли.
Заключение
Герметичность — это одно из множественных аномалий сосудов опухоли, которое не только влияет на ангиогенез, рост опухоли и метастазирование, но также влияет на доставку лекарств и представляет собой новые мишени для терапевтического вмешательства при раке. Утечка плазмы в опухолях — это проявление структурных дефектов стенок сосудов, возникающих в результате аномальной среды внутри опухолей.Дисбаланс VEGF, PDGF, Ang1, Ang2 и других факторов роста, вероятно, играет важную роль. Негерметичность сосуда способствует возникновению аномальной окружающей среды и способствует прорастанию и росту сосудов. Несмотря на сильно нарушенную барьерную функцию, опухолевые сосуды не протекают в такой степени, как ожидалось, потому что высокое межуточное давление в опухолях ограничивает экстравазацию жидкости и макромолекул. Отсутствие функциональных лимфатических сосудов способствует высокому интерстициальному давлению. Терапевтические вмешательства, затрагивающие сосуды опухоли, могут разрушить одни сосуды и оставить другие с более нормальным фенотипом.Нормализация сосудов опухоли может увеличить кровоток и улучшить доставку макромолекулярных терапевтических средств. Однако последствия увеличения потока и уменьшения протекания для роста опухоли и применения клеточной терапии до сих пор неясны. Множество новых подходов используются для идентификации молекул на сосудах опухоли, которые могут служить мишенями для предпочтительной доставки лекарств. Эта стратегия должна иметь преимущество в снижении доз и побочных эффектов противоопухолевых препаратов. Это также может повысить эффективность антиангиогенной терапии.С оптимизмом в отношении таких новых терапевтических подходов настало время получить дополнительную информацию о природе и функциональных аномалиях сосудов опухоли и о том, как их протекаемость способствует росту и метастазированию опухолей.
Сноски
-
Расходы на публикацию этой статьи были частично покрыты за счет оплаты страницы. Таким образом, данная статья должна быть помечена как реклама в соответствии с 18 U.S.C. Раздел 1734 исключительно для указания этого факта.
-
№1 Эта конференция, организованная Дональдом М. Макдональдом, проходила 4–7 октября 2001 г. в Сильверадо, Вэлли Напа, Калифорния. Конференция проходила при поддержке Фонда Уильяма Гая Форбека (Хилтон-Хед-Айленд, Южная Каролина), Eos Biotechnology, Inc. (Южный Сан-Франциско, Калифорния) и Regeneron Pharmaceuticals, Inc. (Тарритаун, штат Нью-Йорк). Среди участников были Вадих Арап, Питер Балук, Роберт Браш, Дэвид Череш, Фитц-Рой Карри, Гарольд Дворак, Нил Грейнджер, Дуглас Ханахан, Ракеш Джайн, Рагу Каллури, Стивен Мецгер (Фонд AngelWorks, Даллас, Техас), Ричард Мюррей, Рената. Паскуалини, Филип Торп и Гэвин Терстон.
-
↵2. Кому следует обращаться с запросами на оттиски, в Институте сердечно-сосудистых исследований, кабинет S1363, Калифорнийский университет, 513 Parnassus Avenue, Сан-Франциско, CA 94143-0130. Телефон: (415) 476-2118; Факс: (415) 476-4845; Эл. Почта: dmcd {at} itsa.ucsf.edu
-
↵3 Используемые сокращения: VEGF, фактор роста эндотелия сосудов; Ang, ангиопоэтин; PDGF, фактор роста тромбоцитов; VEGFR, рецептор VEGF; МРТ, магнитно-резонансная томография.
- Получено 22 апреля 2002 г.
- Принято 11 июля 2002 г.
- © 2002 Американская ассоциация исследований рака.
Каталожные номера
- ↵
Макдональд Д. М., Фосс А. Дж. Эндотелиальные клетки сосудов опухоли: аномальные, но не отсутствующие. Раковые метастазы Rev., 19 : 109-120, 2000.
- ↵
Морикава С., Балук П., Кайдо Т., Хаскелл А., Джейн Р. К., Макдональд Д. М. Аномалии перицитов на кровеносных сосудах и эндотелиальных отростках в опухолях. Являюсь. J. Pathol., 160 : 985-1000, г. 2002.
- ↵
Хашизуме Х., Балук П., Морикава С., Маклин Дж. У., Терстон Г., Роберж С., Джейн Р. К., Макдональд Д. М. Открытие между дефектными эндотелиальными клетками объясняет негерметичность сосудов опухоли. Являюсь. J. Pathol., 156 : 1363-1380, г. 2000.
- ↵
Колорадо П.К., Торре А., Кампхаус Г., Маэшима Ю., Хопфер Х., Такахаши К., Фолк Р., Замборский Э.Д., Герман С., Саркар П.К., Эриксен МБ, Дханабал М., Саймонс М., Пост М. ., Kufe DW, Weichselbaum RR, Sukhatme VP, Kalluri R. Антиангиогенные сигналы от коллагена базальной мембраны сосудов. Cancer Res., 60 : 2520-2526, г. 2000.
- ↵
Кампхаус Г. Д., Колорадо П. К., Панка Д. Дж., Хопфер Х., Рамчандран Р., Торре А., Маешима Ю., Майер Дж. У., Сухатме В. П., Каллури Р. Канстатин, новый матричный ингибитор ангиогенеза и роста опухоли. J. Biol. Chem., 275 : 1209-1215, г. 2000.
- ↵
Мишель К. К., Карри Ф. Э. Проницаемость микрососудов. Physiol. Rev., 79 : 703-761, 1999.
- ↵
Бейтс Д. О., Хилд Р. И., Карри Ф. Э., Уильямс Б. Фактор роста эндотелия сосудов увеличивает проницаемость сосудов Рана и податливость посредством различных сигнальных путей.J. Physiol., 533 : 263-272, 2001.
- ↵
Джейн Р. К. Нормализация сосудистой сети опухоли с помощью антиангиогенной терапии: новая парадигма комбинированной терапии. Nat. Мед., 7 : 987-989, г. 2001.
- ↵
Идзуми Ю., Сюй Л., ди Томазо Э., Фукумура Д., Джайн Р. К. Биология опухоли: Герцептин действует как антиангиогенный коктейль. Природа (Лонд.), 416 : 279-280, 2002 г.
- ↵
Кармелиет П., Джейн Р. К. Ангиогенез при раке и других заболеваниях. Природа (Лонд.), 407 : 249–257, 2000.
- ↵
Pham C. D., Roberts T. P. L., van Bruggen N., Melnyk O., Mann J., Ferrara N., Cohen R. L., Brasch R. C. Магнитно-резонансная томография выявляет подавление проницаемости сосудов опухоли после введения антитела к фактору роста эндотелия сосудов.Раковые исследования., 16 : 225-230, 1998.
- ↵
Турецчек К., Хубер С., Флойд Э., Хельбич Т. Х., Робертс Т. П. Л., Шеймс Д. М., Тарло К. С., Вендланд М. Ф., Браш Р. С. МР-визуализация микрососудов в экспериментальных опухолях молочной железы с использованием контрастного вещества в виде частиц с гистопатологической корреляцией. Радиология, 218 : 562-569, г. 2001.
- ↵
Грейнджер Д.Н., Гришем М. Б., Квиетис П. Р. Механизмы микрососудистого поражения Джонсон Л. Р. ред. . Физиология желудочно-кишечного тракта, 1693-1722, Raven Press New York, NY 1994.
- ↵
Петтерссон А., Надь Дж. А., Браун Л. Ф., Сандберг К., Морган Э., Джанглс С., Картер Р., Кригер Дж. Э., Мансо Е. Дж., Харви В. С., Экельхофер И. А., Фенг Д., Дворжак А. М., Маллиган Р. К., Дворак HF Неоднородность ангиогенного ответа, индуцированного в различных нормальных тканях взрослого человека фактором проницаемости сосудов / фактором роста эндотелия сосудов.Лаборатория. Исследование., 80 : 99-115, 2000.
- ↵
Sundberg C., Nagy J. A., Brown L. F., Feng D., Eckelhoefer I. A., Manseau E. J., Dvorak A. M., Dvorak H. F. Гломерулоидная микрососудистая пролиферация следует за доставкой гена фактора проницаемости сосудов аденовируса / фактора роста эндотелия сосудов-164. Являюсь. J. Pathol., 158 : 1145-1160, г. 2001.
- ↵
Хуанг Х., Молема Г., Кинг С., Уоткинс Л., Эджингтон Т. С., Торп П. Э. Инфаркт опухоли у мышей путем направленного антителами нацеливания тканевого фактора на сосудистую сеть опухоли. Наука (Вашингтон, округ Колумбия), 275 : 547-550, г. 1997.
- ↵
Торп П. Э., Ран С. Инфаркт опухоли путем нацеливания тканевого фактора на сосудистую сеть опухоли. Рак J. Sci. Являюсь., 6 (Дополнение 3) : S237-S244, 2000.
- ↵
Трепель М., Арап В., Паскуалини Р. Модуляция гуморального иммунного ответа путем нацеливания антигенов на лимфатические узлы. Cancer Res., 61 : 8110-8112, г. 2001.
- ↵
Lahdenranta J., Pasqualini R., Schlingemann R., Hagedorn M., Stallcup W. M., Bucana C.D., Sidman R., Arap W. Антиангиогенное состояние у мышей и людей с дегенерацией фоторецепторных клеток сетчатки. Proc. Natl. Акад. Sci. США, 98 : 10368-10373, г. 2001.
- ↵
Курнис Ф., Arrigoni G., Sacchi A., Fischetti L., Arap W., Pasqualini R., Corti A. Дифференциальная экспрессия изоформ CD13 в опухолевых сосудах, эпителии и миелоидных клетках: механизм свойств лекарств, содержащих NGR мотив. Cancer Res., 62 : 867-874, г. 2002.
- ↵
Арап В., Колонин М. Г., Трепель М., Лахденранта Дж., Кардо-Вила М., Джордано Р. Дж., Минц П. Дж., Ардельт П. У., Яо В. Дж., Видаль В. И., Чен Л., Фламм А., Valtanen H., Weavind LM, Hicks ME, Pollock RE, Botz GH, Bucana CD, Koivunen E., Cahill D., Troncoso P., Baggerly KA, Pentz RD, Do KA, Logothetis CJ, Pasqualini R. сосудистая сеть человека с помощью фагового дисплея. Nat. Мед., 8 : 121-127, 2002.
- ↵
Бергерс Г., Джавахериан К., Ло К. М., Фолкман Дж., Ханахан Д. Влияние ингибиторов ангиогенеза на многоступенчатый канцерогенез у мышей.Наука (Вашингтон, округ Колумбия), 284 : 808-812, г. 1999.
- ↵
Bergers G., Brekken R., McMahon G., Vu TH, Itoh T., Tamaki K., Tanzawa K., Thorpe P., Itohara S., Werb Z., Hanahan D. Матричная металлопротеиназа-9 запускает ангиогенный переключатель во время канцерогенеза. Nat. Клетка. Биол., 2 : 737-744, 2000.
- ↵
Терстон Г., Сури К., Смит К., Макклейн Дж., Сато Т.Н., Янкопулос Г. Д., Макдональд Д. М. Устойчивые к утечкам кровеносные сосуды у мышей, трансгенно сверхэкспрессирующих ангиопоэтин-1. Наука (Вашингтон, округ Колумбия), 286 : 2511-2514, г. 1999.
- ↵
Thurston G., Rudge J. S., Ioffe E., Zhou H., Ross L., Croll S. D., Glazer N., Holash J., McDonald D. M., Yancopoulos G.D. Ангиопоэтин-1 защищает сосудистую сеть взрослого человека от утечки плазмы. Nat. Мед., 6 : 460-463, г. 2000.
- ↵
Элисейри Б.П., Пол Р., Шварцберг П. Л., Худ Дж. Д., Ленг Дж., Череш Д. А. Селективная потребность в Src-киназах во время VEGF-индуцированного ангиогенеза и проницаемости сосудов. Мол. Клетка, 4 : 915-924, 1999.
- ↵
Пол Р., Чжан З. Г., Элисейри Б. П., Цзян К., Бочча А. Д., Чжан Р. Л., Чопп М., Череш Д. А. Дефицит или блокада активности Src у мышей обеспечивает церебральную защиту после инсульта. Nat. Мед., 7 : 222-227, 2001 г.
Кровеносные сосуды — AMBOSS
Последнее обновление: 15 июля 2020 г.
Резюме
Кровеносные сосуды являются неотъемлемой частью кровеносной системы. Пять типов кровеносных сосудов (в порядке кровообращения): артерии, артериолы, капилляры, венулы и вены. Основная функция крупных кровеносных сосудов (то есть артерий и вен) — транспортировка крови к сердцу и от него, тогда как более мелкие кровеносные сосуды (например, капилляры) обеспечивают обмен веществами между клетками и кровью.Артерии несут богатую кислородом кровь от сердца к периферии. Достигнув органа или конечности, они разветвляются и разделяются на артериолы и, в конечном итоге, на множество мелких капилляров, формируя капиллярное русло, которое обеспечивает доставку кислорода и питательных веществ к окружающим тканям. Дистальнее капиллярного ложа посткапиллярные венулы соединяются вместе, образуя вены, которые доставляют бедную кислородом кровь обратно к сердцу. И артерии, и вены состоят из одних и тех же трех слоев ткани: внутренней оболочки, средней оболочки и адвентициальной оболочки.Артерии содержат значительно больше гладких мышц, чем вены (особенно в средней оболочке), тогда как вены содержат клапаны в внутренней оболочке. Капилляры полностью состоят из эндотелиального слоя с базальной мембраной или без нее. Существует три различных типа капилляров (непрерывные, окончатые и синусоидальные), все из которых различаются по проницаемости и функциям. Кровеносные сосуды вместе называются сосудистой системой и вместе с сердцем составляют систему кровообращения или сердечно-сосудистую систему.
Отдельная статья по физиологии сосудов посвящена гемодинамике, регуляции артериального давления и капиллярному обмену.
Крупные кровеносные сосуды
Состоят из артерий и вен, которые имеют три основных микроскопических слоя стенки.
Слои крупных кровеносных сосудов
Артерии
- Функция: транспортировка артериальной (оксигенированной) крови от сердца к периферии
- Курс: артерия → артериола → капилляр
- Типы артерий: компоненты стенки кровеносных сосудов различаются в зависимости от расположения и функции
Жил
- Функция: транспортировка венозной (дезоксигенированной) крови от периферии к сердцу
- Ход: капилляр → венула → вена
- Характерная особенность: вены известны как емкостные сосуды, потому что они способны хранить значительно больший объем крови, чем артерии, из-за их большого просвета и высокой податливости.
- Структура: см. «Слои кровеносных сосудов» выше
Ссылки: [1] [2] [3]
Мелкие кровеносные сосуды
Микроциркуляция
Артериолы
Метартериолы
Капилляры
- Функция: обмен газов и питательных веществ с тканями (плотность распределения капилляров варьируется в зависимости от региона / органа)
- Характерные черты
- Структура (от внутреннего к внешнему слою)
Эндотелий составляет часть гематоэнцефалического барьера.Плотные плотные контакты между эндотелиальными клетками препятствуют параклеточному транспорту через капилляры головного мозга.
Венулы
- Функция: сбор крови из капилляров для передачи в вены
-
Строение: зависит от типа венулы
-
Посткапиллярные венулы
- Расположены непосредственно после капиллярного русла
- Структура напоминает капилляры (обеспечивает высокую проницаемость и обмен веществ)
-
Собирающие венулы:
- Перед собирающими венами
- Структура напоминает более крупные кровеносные сосуды (т.е.е., с тремя слоями)
- Венулы высокого эндотелия обладают специальными поверхностными молекулами для распознавания лейкоцитов, которые являются местами экстравазации лейкоцитов в лимфатические органы или из них
-
Посткапиллярные венулы
Ссылки: [1] [3]
Клиническое значение
Источники
- Модули обучения NIH SEER — Классификация и структура кровеносных сосудов. https: // обучение.seer.cancer.gov/anatomy/cardiovascular/blood/classification.html . Обновлено: 1 января 2019 г. Доступ: 22 апреля 2019 г.
- Стандринг С. Анатомия Грея: анатомические основы клинической практики . Elsevier Health Sciences ; 2016 г.
- Лесли П. Гартнер, Джеймс Л. Хиатт. Цветной учебник гистологии . Grune & Stratton Inc. ; 2006 г.
|
Лекарство |
Пример |
Как они влияют на сосудистую систему |
Изменения в мозгу |
|
Ингибиторы АПФ |
Периндоприл, Каптоприл |
Ингибиторы АПФ снижают артериальное давление, подавляя действие фермента, который стимулирует сужение кровеносных сосудов. |
Ингибиторы АПФ более старшего поколения могут преодолевать гематоэнцефалический барьер и могут предотвратить снижение когнитивных функций у людей с болезнью Альцгеймера. Некоторые данные свидетельствуют о том, что препараты могут замедлять накопление вредных белков в головном мозге. Однако новые типы ингибиторов АПФ не преодолевают барьер, и было обнаружено, что они имеют противоположный эффект: они могут увеличивать риск развития деменции. |
|
Антигистаминные препараты |
Бенадрил, Кларитин, Аллегра |
Во время аллергической реакции гистамины связываются с рецепторами кровеносных сосудов, заставляя их расширяться и становиться более проницаемыми, поэтому лейкоциты могут атаковать патоген.Антигистаминные препараты блокируют этот механизм, в результате чего кровеносные сосуды сужаются. |
В головном мозге гистамины играют важную роль в регулировании цикла сна и бодрствования. Они также были связаны с обучением, памятью и вниманием. Старые антигистаминные препараты могут подавлять активность мозга, что приводит к сонливости и проблемам с обучением. Новые антигистаминные препараты, такие как Зиртек, действуют более избирательно и имеют меньше побочных эффектов. |
|
Бета-адреноблокаторы |
Пропранолол, Карведилол, Атенолол |
Бета-блокаторы предотвращают связывание гормона стресса адреналина с рецепторами нервной системы.Как правило, адреналин вызывает реакцию «бей или беги», которая заставляет кровеносные сосуды сжиматься, чтобы перекачивать больше крови к сердцу. |
Врачи часто прописывают бета-адреноблокаторы не по назначению людям с тревожными расстройствами, а актеры и музыканты иногда принимают их, чтобы успокоить страх сцены. Кроме того, недавнее исследование предполагает, что бета-адреноблокаторы могут снизить риск деменции, высвобождая слишком плотные кровеносные сосуды в головном мозге. Бета-адреноблокаторы также могут вызывать такие побочные эффекты, как усталость, бессонница и, возможно, депрессия. |
|
Блокаторы кальциевых каналов |
Нифедипин |
Блокаторы кальциевых каналов предотвращают попадание ионов кальция в клеточные мембраны сердца и артерий — процесс, который обычно сигнализирует кровеносным сосудам о сокращении. Уменьшая силу сокращения, эти препараты позволяют сердцу перекачивать кровь с меньшими усилиями. |
Некоторые ученые предполагают, что избыток кальциевых каналов в головном мозге может способствовать развитию болезни Паркинсона, поскольку слишком много кальция может быть токсичным для дофаминовых нейронов.Эпидемиологические исследования показывают, что прием блокаторов кальциевых каналов, проникающих через гематоэнцефалический барьер (не все это делают), снижает вероятность развития болезни Паркинсона. |
|
Противоотечные средства |
Эфедрин, Sudafed |
Противоотечные средства устраняют насморк, заставляя сужаться опухшие кровеносные сосуды слизистой оболочки носа и носовых пазух. При приеме таблеток этот эффект распространяется на все тело. |
Псевдоэфедрин, активный ингредиент большинства противоотечных средств, также вызывает сужение кровеносных сосудов в головном мозге, что может вызвать бессонницу, беспокойство и беспокойство, а также головную боль, если кровеносные сосуды сужаются слишком быстро. |
|
Нестероидные противовоспалительные средства (НПВП) |
Ибупрофен (Мотрин, Адвил) Напроксен (Алев) |
НПВП уменьшают боль и воспаление, предотвращая выработку простагландинов и тромбоксана, химических соединений, вызывающих сужение кровеносных сосудов. |
Простагландины и тромбоксан синтезируются из жирового вещества в мозговой и мышечной ткани, которое участвует в восстановлении клеток. Некоторые исследования показывают, что НПВП защищают от атрофии мозга и потери памяти на ранних стадиях болезни Альцгеймера, блокируя расщепление этого жирного вещества. |
|
Силденафил |
Виагра, Сиалис, Левитра |
При стимуляции полового члена вырабатывается циклический гуанозинмонофосфат (цГНП), химическое вещество, расширяющее кровеносные сосуды.Виагра подавляет фермент, разрушающий цГНП, позволяя большему притоку крови к органу. |
Блокирование фермента, разрушающего цГНП, также увеличивает количество окситоцина в головном мозге. Окситоцин, который иногда называют «гормоном любви», способствует эмоциональной связи. Кроме того, исследования на животных показывают, что Виагра может увеличивать кровоток и способствовать росту нервов в головном мозге, потенциально облегчая депрессию. |
Если молекула не может проходить между эндотелиальными клетками капилляров, то ее необходимо транспортировать через клеточная мембрана.Механизмы, доступные для транспортировки через стенку капилляра, различаются для различные вещества в зависимости от их молекулярных размеров и степени растворимости в липидах. Например, определенные белки избирательно транспортируются через эндотелиальные клетки медленным, требующим энергии процесс, известный как «трансцитоз». В этом процессе эндотелиальные клетки первоначально поглощают белки в плазме внутри капилляров за счет эндоцитоза. Затем молекулы переправляются через клетки путем везикулярного транспорта и высвобождаются путем экзоцитоза в интерстициальную жидкость с другой стороны боковая сторона.Эндотелиальные клетки обычно содержат большое количество эндоцитотических и экзоцитотических везикул и иногда они сливаются, образуя непрерывные везикулярные каналы через клетку. Капилляры в сердце обычно предотвращают чрезмерное движение жидкостей и молекул. через их стены, но были отмечены клинические ситуации, когда они могут стать «протекающими». Для Например, «синдром утечки капилляров», который может быть вызван после искусственного кровообращения, может продолжаться. от часов до дней.Более конкретно, в таких случаях воспалительная реакция в сосудистой эндотелий может нарушить «привратную» функцию капилляров; их повышенная проницаемость будет привести к отеку миокарда. Из капилляров кровь по всему телу попадает в венозную систему. Он сначала входит венулы, которые затем сливаются, образуя более крупные сосуды — вены (см. рис. 2). Затем вены из различные системные ткани и органы (за вычетом газообменной части легких) объединяются, чтобы произвести две основные вены — нижняя полая вена (нижняя часть тела) и верхняя полая вена (над сердцем).От По этим двум магистральным сосудам кровь возвращается к правому сердечному насосу, особенно в правое предсердие. Как и капилляры, стенки мельчайших венул очень пористые и являются местами, где много фагоцитарные лейкоциты мигрируют из крови в воспаленные или инфицированные ткани. Венулы и вены также обильно иннервируются симпатическими нервами и гладкими мышцами, внутри сужаются, когда эти нервы активируются.Таким образом, повышенная активность симпатического нерва связана с уменьшение венозного объема, что приводит к увеличению сердечного наполнения и, следовательно, к увеличению сердечный выброс (согласно закону сердца Старлинга).
|
