Лечение спондилеза грудного отдела позвоночника — врачи, лечащие заболевание
Спондилез грудного отдела позвоночника – дегенеративно-дистрофический процесс в грудном отделе позвоночника, сопровождающийся деформацией позвоночных дисков, появлением выростов (остеофитов), на поздних стадиях – срастанием позвонков. Возникает в результате нарушений осанки, травм, чрезмерных нагрузок. Развивается на фоне нарушения обменных процессов, врожденных патологий или возрастных изменений, снижения уровня коллагена и кальция.
Симптомы: на ранних стадиях бессимптомно, в дальнейшем появляются боли на фоне ограниченного движения. Давление остеофитов на межреберные мышцы сопровождается кардиопатиями, затруднением дыхания, мышечными спазмами, онемением. Терапия: симптоматическая и противовоспалительная, физиотерапия, ЛФК, массаж, при необходимости – хирургическое лечение.
Вертебрологи Москвы — последние отзывы
Игорь Николаевич чудесный доктор и большой молодец, вот именно про таких врачей говорят, что у них золотые руки и большое доброе сердце! На все вопросы мне ответил, приём вёл очень корректно. На мой взгляд доктор Фильченков, сделал всё максимально точно и правильно, общаться с ним одно удовольствие. С момента приёма прошла неделя, я иду на поправку.
На мой взгляд доктор Фильченков, сделал всё максимально точно и правильно, общаться с ним одно удовольствие. С момента приёма прошла неделя, я иду на поправку.
Елена, 02 ноября 2021
Наталья, 02 ноября 2021
 Была у него в прошлый четверг, обратилась с болью в спине. Доктор проявил себя превосходным диагностом, его диагноз подтвердился на мрт. Мне был предложен комплексный подход и даны все рекомендации. Спустя 5 дней от начала лечения самочувствие стало приходить в норму, болевой синдром ушел полностью движения восстановлены.
Была у него в прошлый четверг, обратилась с болью в спине. Доктор проявил себя превосходным диагностом, его диагноз подтвердился на мрт. Мне был предложен комплексный подход и даны все рекомендации. Спустя 5 дней от начала лечения самочувствие стало приходить в норму, болевой синдром ушел полностью движения восстановлены. Ирина, 01 ноября 2021
Спасибо доктору Каяшевой за помощь, внимательно меня выслушала, грамотная консультация, уже начала выполнять рекомендации, думаю результат не за горами
Дарья, 31 октября 2021
Как хорошо, что врач меня обрадовал тем, что не потребуется такого глубокого и длительного лечения, как я себе представляла.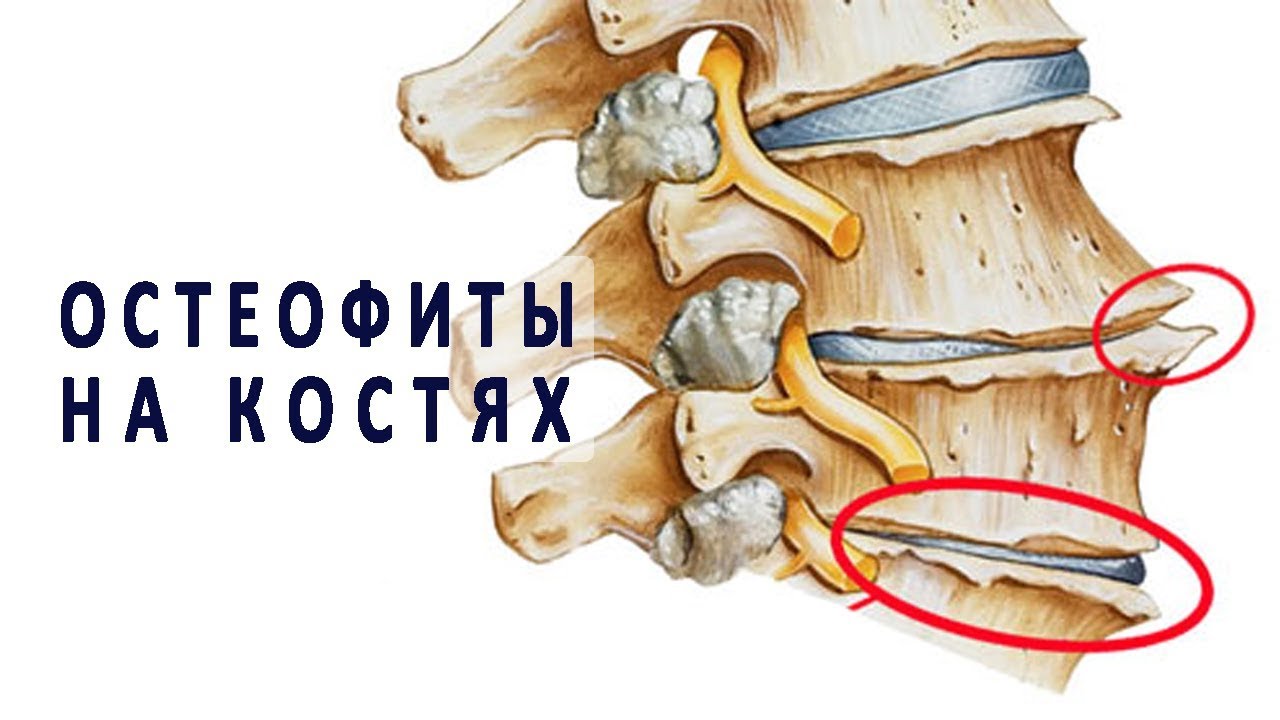 Сразу сказал, что и без таблеток можно сформировать лечение. Очень коммуникабельный врач, который всегда готов к любым вопросам. Отвечает охотно и терпеливо. Спасибо!
Сразу сказал, что и без таблеток можно сформировать лечение. Очень коммуникабельный врач, который всегда готов к любым вопросам. Отвечает охотно и терпеливо. Спасибо!
Вера, 31 октября 2021
Все пока что нравится. Нет причин не доверять врачу. С первых минут врач внушил доверие. Очень подробно меня опросил, провел осмотр. Поставил предположительный диагноз, однако, сказал что необходимо дождаться результатов диагностики и созданных ранее мной анализов. Результаты показали, что врач изначально был прав. Сейчас уже данный специалист является моим личным врачом.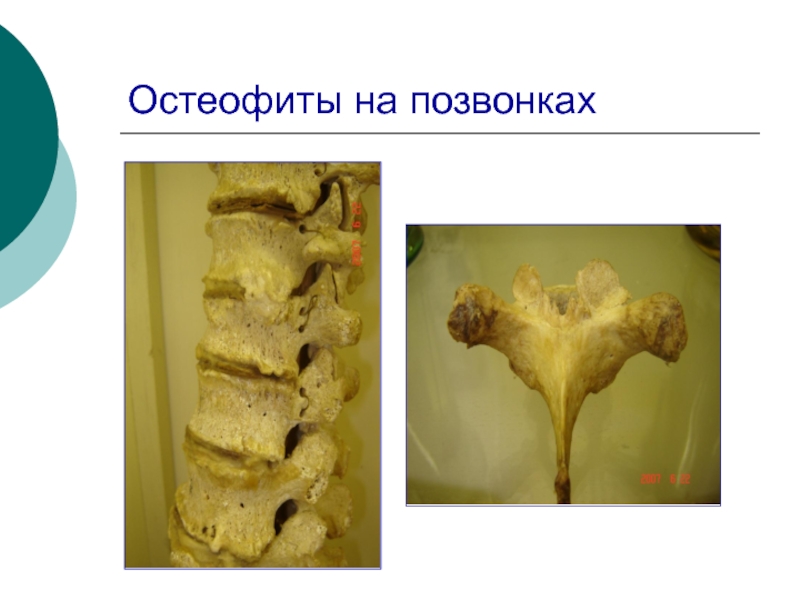
Ксения, 25 октября 2021
Дмитрий, 10 октября 2021
 Андрей Сергеевич провёл осмотр, назначил процедуры и прописал лечение. Я остался доволен, специалист мне помог.
Андрей Сергеевич провёл осмотр, назначил процедуры и прописал лечение. Я остался доволен, специалист мне помог.
Владимир, 12 сентября 2021
На приёме доктор поставил мне диагноз и назначил курс лечения. Врач обладает всеми как человеческими, так и профессиональными качествами, которыми должен обладать хороший специалист. Спустя какое-то время я обращусь к нему повторно. Качеством приёма я остался доволен.
Владислав, 26 августа 2021
Доктор хорошо ответила на мои вопросы и назначила необходимые обследования. Врач профессиональный. Она помогла! Такого специалиста редко можно найти.
Врач профессиональный. Она помогла! Такого специалиста редко можно найти.
Гурун, 18 июня 2021
Остеохондроз позвоночника. Причины и симптомы, лечение
Остеохондроз позвоночника – полифакторное дегенеративно-дистрофическое заболевание позвоночного — двигательного сегмента, поражающее первично межпозвонковый диск, а вторично другие отделы позвонкового — двигательного сегмента, опорно-двигательного аппарата, нервной системы, сосудов. Если представить позвоночный столб в виде стопки кирпичиков, то каждый кирпичик будет соответствовать функциональной единице позвоночного столба – позвонковому — двигательному сегменту. Позвонковый — двигательный сегмент это два соседних позвонка, соединенных межпозвонковым диском и окружающих их мышцами и связками./GettyImages-184327749-565a2dfd3df78c6ddf52268c.jpg)
Кто болеет остеохондрозом?
В наше время остеохондрозом страдают от 40 до 90% населения земного шара. Чаще всего болезнь поражает людей старше 30 лет. Однако первые симптомы остеохондроза могут проявляться в подростковом возрасте.
Этапы развития остеохондроза позвоночника.
Начинается дегидратация (потеря жидкости) пульпозного ядра. Это приводит к снижению высоты стояния диска. Появляются трещины в фиброзном кольце, но патологический процесс не выходит за пределы межпозвонкового диска.
2. Второй этап развития остеохондроза.
В результате снижения высоты стояния диска, точки прикрепления мышц и связок, принадлежащие двум соседним позвонкам, сближаются. Поэтому мышцы и связки провисают. Это может приводить к избыточной подвижности двух позвонков относительно друг друга, т. е. формируется нестабильность позвонкового — двигательного сегмента. На этом этапе характерно соскальзывание или смещение позвонков относительно друг друга с формированием спондилолистеза.
е. формируется нестабильность позвонкового — двигательного сегмента. На этом этапе характерно соскальзывание или смещение позвонков относительно друг друга с формированием спондилолистеза.
3. Третий этап развития остеохондроза.
На данном этапе, прежде всего, страдают сами межпозвонковые диско и формируются выпячивания дисков (протрузии и грыжи), страдает и суставный аппарат позвонкового двигательного сегмента. В этот период происходят наиболее выраженные морфологические изменения, двигательного сегмента. В межпозвонковых суставах возникают подвывихи, формируются артрозы.
4. Четвертый этап развития остеохондроза.
На этом этапе в пораженных сегментах позвоночника происходят приспособительные изменения. Организм пытается преодолеть избыточную подвижность позвонков, иммобилизовать позвоночник для сохранения его опорной и защитной функций. В связи с этим появляются краевые костные разрастания на смежных поверхностях тел позвонков, иначе говоря, остеофиты. Выросший «не там» остеофит вызывает микротравматизацию нервного корешка. На четвертом этапе обычно начинаются процессы фиброзного анкилоза в межпозвонковых дисках и суставах. В конечном итоге позвонковый — двигательный сегмент оказывается как бы замурованным в панцирь, клинические проявления затихают.
Выросший «не там» остеофит вызывает микротравматизацию нервного корешка. На четвертом этапе обычно начинаются процессы фиброзного анкилоза в межпозвонковых дисках и суставах. В конечном итоге позвонковый — двигательный сегмент оказывается как бы замурованным в панцирь, клинические проявления затихают.
Причины остеохондроза позвоночника.
В каждой из множества существующих теорий развития остеохондроза выделяются различные причины, способствующие возникновению заболевания, к примеру, механическая травма, наследственная предрасположенность или нарушение обмена веществ. Особенная трудность в определении причины остеохондроза связана с тем, что это заболевание может встречаться как у пожилых, так и у молодых людей, как у хорошо физически сложенных, так и у менее тренированных. Распространенным является ложное убеждение, что причиной остеохондроза является «отложение солей» в позвоночнике: якобы на рентгеновских снимках «соли» можно увидеть в виде «наростов» или «крючков» на позвонках.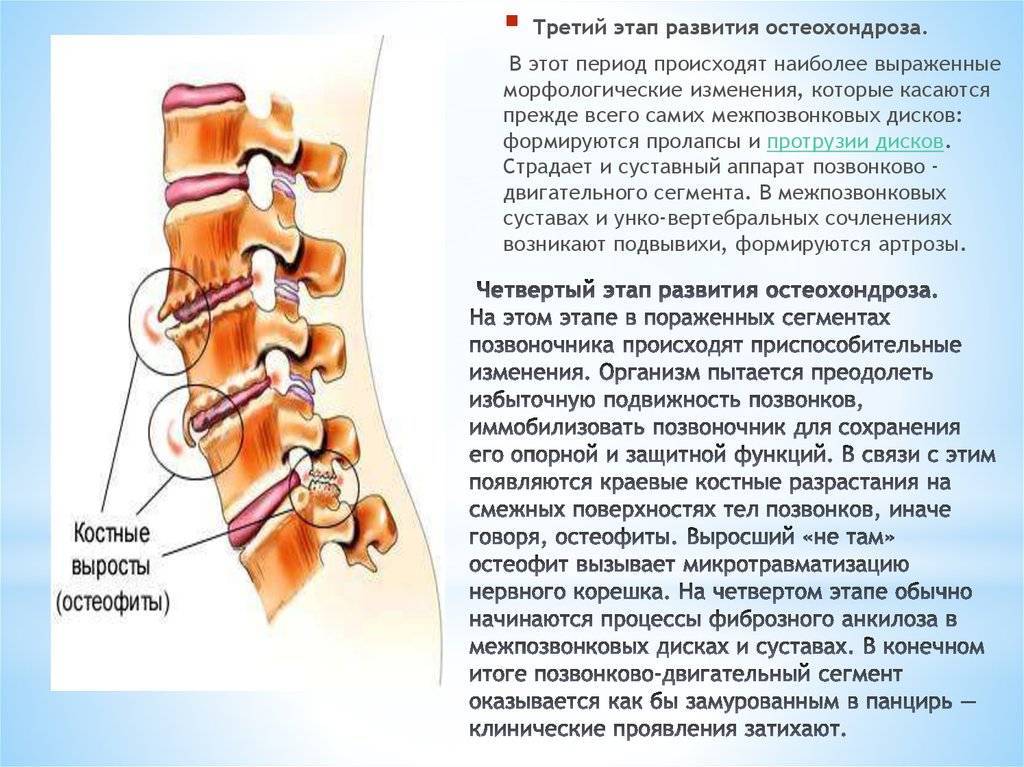 Если при движении возникает похрустывание и скрип в суставах, как будто между ними насыпали песок, для многих пациентов единственным объяснением такого состояния является пресловутое «отложение солей».
Если при движении возникает похрустывание и скрип в суставах, как будто между ними насыпали песок, для многих пациентов единственным объяснением такого состояния является пресловутое «отложение солей».
Термин «остеохондроз» произошел от греческих корней osteon – «кость» и chondr –«хрящ». Окончание «-оз» обозначает, что заболевание кости и хряща не связано с воспалительными процессами, носит дегенеративно-дистрофический характер, то есть в основе заболевания лежит нарушение питания тканей и, как следствие, перерождение ее структуры. Как все живые ткани, костная ткань позвонков и хрящевая ткань межпозвонковых дисков постоянно перестраиваются и самообновляются. Под действием регулярно оказываемых физических нагрузок они приобретают прочность и упругость, а при отсутствии нагрузок прочность тканей снижается. Связано это с особенностями питания и кровоснабжения костной и хрящевой тканей. Диски взрослых людей не имеют собственных сосудов, они из соседних тканей получают питательные вещества и кислород. Поэтому для полноценного питания дисков необходима активизация кровообращения в окружающих диски тканях. А это может быть достигнуто только за счет интенсивной мышечной работы. По составу межпозвонковый диск можно поделить на две части: это придающее диску упругость студенистое ядро, расположенное в центре и окружающее его прочное волокнистое кольцо. Из-за ухудшения питания межпозвонковых дисков сложная структура биополимерных соединений, составляющая студенистое ядро, разрушается. Уменьшается содержание влаги в студенистом ядре, и оно становится более хрупким. При воздействии даже незначительных перегрузок студенистое ядро может распасться на фрагменты. Это приводит к снижению его упругости в еще большей степени. Также происходит уменьшение прочности волокнистых колец дисков. Для восстановления функции позвоночника необходимо рубцевание поврежденного межпозвонкового диска, мобилизация компенсаторных возможностей позвоночника, а также костно-мышечного аппарата в целом, а не рассасывание «отложения солей» или устранение «шипов» на позвонках.
Поэтому для полноценного питания дисков необходима активизация кровообращения в окружающих диски тканях. А это может быть достигнуто только за счет интенсивной мышечной работы. По составу межпозвонковый диск можно поделить на две части: это придающее диску упругость студенистое ядро, расположенное в центре и окружающее его прочное волокнистое кольцо. Из-за ухудшения питания межпозвонковых дисков сложная структура биополимерных соединений, составляющая студенистое ядро, разрушается. Уменьшается содержание влаги в студенистом ядре, и оно становится более хрупким. При воздействии даже незначительных перегрузок студенистое ядро может распасться на фрагменты. Это приводит к снижению его упругости в еще большей степени. Также происходит уменьшение прочности волокнистых колец дисков. Для восстановления функции позвоночника необходимо рубцевание поврежденного межпозвонкового диска, мобилизация компенсаторных возможностей позвоночника, а также костно-мышечного аппарата в целом, а не рассасывание «отложения солей» или устранение «шипов» на позвонках. При проведении рентгенологического обследования после окончания лечения можно увидеть, что позвонки не изменили свою форму. А пресловутые «шипы» являются не причиной остеохондроза, а следствием приспособительных процессов. Краевые разрастания увеличивают площадь опорной поверхности тела позвонка. Благодаря увеличению площади уменьшается удельное давление, что позволяет компенсировать снижение прочности и упругости межпозвонкового диска. Происходящие в позвоночнике дегенеративно-дистрофические изменения сопровождает обызвествление (кальцификация) поврежденных дисков, отдельных участков суставных связок, хрящей, капсул. Этот процесс назвать отложением солей можно только условно. Таким образом, это не причина остеохондроза, а лишь следствие и конечная стадия вышеописанного процесса. Обратное развитие структурных изменений в позвоночнике практически невозможно. Но сведение их к минимуму является вполне реальной задачей. Если не прилагать никаких усилий, чтобы поддерживать позвоночник в том же состояния, которое достигнуто в результате лечения, боли могут возобновиться.
При проведении рентгенологического обследования после окончания лечения можно увидеть, что позвонки не изменили свою форму. А пресловутые «шипы» являются не причиной остеохондроза, а следствием приспособительных процессов. Краевые разрастания увеличивают площадь опорной поверхности тела позвонка. Благодаря увеличению площади уменьшается удельное давление, что позволяет компенсировать снижение прочности и упругости межпозвонкового диска. Происходящие в позвоночнике дегенеративно-дистрофические изменения сопровождает обызвествление (кальцификация) поврежденных дисков, отдельных участков суставных связок, хрящей, капсул. Этот процесс назвать отложением солей можно только условно. Таким образом, это не причина остеохондроза, а лишь следствие и конечная стадия вышеописанного процесса. Обратное развитие структурных изменений в позвоночнике практически невозможно. Но сведение их к минимуму является вполне реальной задачей. Если не прилагать никаких усилий, чтобы поддерживать позвоночник в том же состояния, которое достигнуто в результате лечения, боли могут возобновиться.
Клинические проявления остеохондроза позвоночника.
Клинические проявления остеохондроза весьма разнообразны, они зависят от этапа развития остеохондроза. Основные клинические симптомы остеохондроза возникают, когда патологический процесс распространяется на задний отдел фиброзного кольца и заднюю продольную связку. В зависимости от стадии дегенерации межпозвоночных дисков происходит раздражение, сдавление или нарушение проводимости корешков спинного мозга, сдавление сосудов или спинного мозга. Развиваются различные неврологические синдромы — рефлекторные и компрессионные. Главной причиной болевого синдрома при остеохондрозе является раздражение нервного корешка. При этом происходит нарушение кровообращения, возникает отек и в дальнейшем может развиться фиброз окружающих его структур, что сопровождается повышением чувствительности корешков к различным воздействиям (движения в пораженном сегменте позвоночника и др.). Сосудистые расстройства при остеохондрозе чаще связаны с нарушением сосудодвигательной иннервации. Также возможно и механическое сдавление сосудов остеофитами, например в шейном отделе позвоночника.
Также возможно и механическое сдавление сосудов остеофитами, например в шейном отделе позвоночника.
Одной из характерных черт остеохондроза позвоночника является обширность его симптоматики. Это могут быть боли в позвоночнике и конечностях, боли в мышцах, мышечное напряжение, ограничение подвижности позвоночника и суставов, признаки страдания внутренних органов. Боли могут иррадиировать в руку или ногу, может появиться слабость в конечностях, головные боли, головокружение, расстройства мочеиспускания. Таким образом, важен внимательный анализ своего состояния и изменений, происходящих в организме. Необходимо своевременно обратиться к врачу, пройти необходимое обследование, установить диагноз и начинать лечение под наблюдением лечащего врача. К первым симптомам остеохондроза позвоночника относятся, в первую очередь, боли и дискомфорт в спине. При этом, боли могут быть периодическими то, появляясь, то исчезая. Но уже первое ощущение дискомфорта или болей в позвоночнике должно Вас насторожить. При появлении болей постарайтесь вспомнить ситуацию, при которой они появились. Такой причиной может быть поднятие тяжелого предмета, резкое движение, падение и т.д. Подводя итоги, можно сказать, что к основным симптомам остеохондроза относятся боль и дискомфорт в спине, мышечное напряжение, ограничение подвижности позвоночника.
При появлении болей постарайтесь вспомнить ситуацию, при которой они появились. Такой причиной может быть поднятие тяжелого предмета, резкое движение, падение и т.д. Подводя итоги, можно сказать, что к основным симптомам остеохондроза относятся боль и дискомфорт в спине, мышечное напряжение, ограничение подвижности позвоночника.
Диагностика остеохондроза позвоночника.
Для правильной диагностики остеохондроза позвоночника необходимо уточнить жалобы, историю развития страдания, провести детальное объективное обследование, в том числе ортопедическое и неврологическое, назначить рентгенологическое и МРТ — исследование. Наиболее доступным методом является рентгенологическое исследование. Чаще всего выполняется прицельная рентгенография – основываясь на симптомах заболевания и жалобах больного и объективного обследования, определяется место поражения позвоночника. На рентгенограмме можно увидеть уменьшение высоты межпозвоночных дисков, склерозировоние замыкательных пластин, появление костных выростов тел позвонков, частичное растворение костной ткани тела позвонка, изменение изгибов позвоночника, ограниченную или повышенную подвижность позвоночника.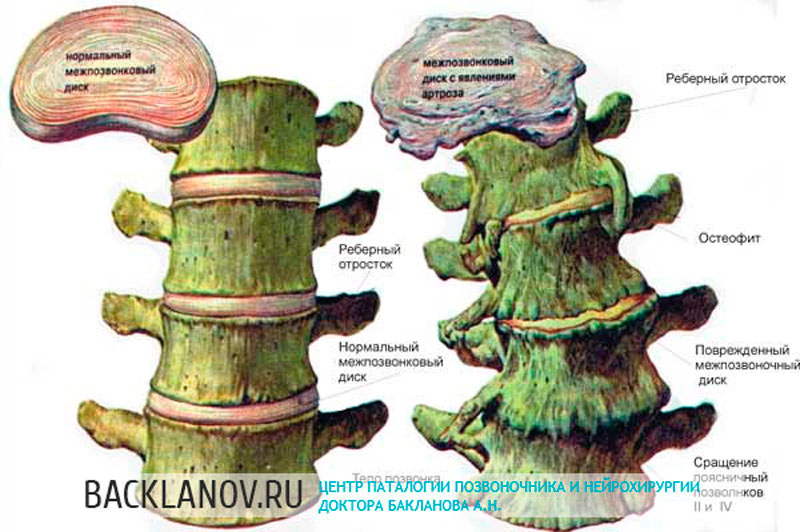 Компьютерная томография и магнитно — резонансная томография являются самыми современными, но и самыми дорогостоящими методами диагностики остеохондроза. Применяют эти методы диагностики обычно при необходимости проведения дифференциального диагноза между остеохондрозом и другими заболеваниями позвоночника, которые имеют сходную симптоматику, исключения опухолей, подтверждение наличия грыжи диска.
Компьютерная томография и магнитно — резонансная томография являются самыми современными, но и самыми дорогостоящими методами диагностики остеохондроза. Применяют эти методы диагностики обычно при необходимости проведения дифференциального диагноза между остеохондрозом и другими заболеваниями позвоночника, которые имеют сходную симптоматику, исключения опухолей, подтверждение наличия грыжи диска.
Лечение остеохондроза позвоночника.
Основными задачами при лечении остеохондроза позвоночника являются быстрейшее купирование болевого синдрома, снятие воспаления, мышечного спазма, восстановление функции позвоночного — двигательного сегмента, дальнейшая реабилитация с целью формирования полноценного мышечного корсета и предотвращения обострения. Медикаментозное лечение включает назначение нестероидных противовоспалительных препаратов, обезболивающих препаратов, препаратов снимающих мышечный спазм, при наличии диско-радикулярного конфликта применяют противосудорожные препараты, назначают физиотерапевтическое лечение. После уменьшения болей мануальная терапия, массаж. С первых дней назначается лечебная физкультура, в дальнейшем плавание, постоянная лечебная физкультура, кинезиотерапия. Дальнейший прогноз во многом зависит от пациента, насколько упорно он занимается лечебной физкультурой и насколько правильно себя ведет.
После уменьшения болей мануальная терапия, массаж. С первых дней назначается лечебная физкультура, в дальнейшем плавание, постоянная лечебная физкультура, кинезиотерапия. Дальнейший прогноз во многом зависит от пациента, насколько упорно он занимается лечебной физкультурой и насколько правильно себя ведет.
Остеофиты позвоночника: причины и лечение
Нарастание костной ткани на участках опорно-двигательного аппарата называется спондилезом. Костные образования, остеофиты, могут быть различны по форме и размерам, располагаются в разных отделах позвоночного столба и приводят к большому количеству симптомов.
Остеофиты могут образовываться на надкостнице, связках, хрящах и других структурах. Причины образований различны, и от них зависит место локализации наростов.
Причины спондилеза:
1. Травмы. Повреждения надкостницы, кости или суставов часто приводят к тому, что в районе места сращения возникают наросты, снижающие эластичность и подвижность тканей.
2. Дегенеративно-дистрофические процессы. При артрозе, остеохондрозе или межпозвоночной грыже зачастую происходит окостенение мягких тканей и хрящей, приводящее к снижению подвижности.
3. Воспалительные процессы. Обычно воспаление в суставе или надкостнице приводит к перерождению тканей в твердые и окостеневшие.
4. Онкологические заболевания. Остеофиты костей могут быть обусловлены метастазированием и разрастанием трубчатой ткани.
5. Неврогенные нарушения. Остеофиты могут образовываться в местах нарушения нервной проводимости.
Часто на первых этапах остеофиты не обнаруживают себя, т. к. больной не чувствует никаких симптомов. Коварство спондилеза заключается как раз в том, что порой наросты обнаруживают только тогда, когда подвижность структуры полностью нарушена. Особенно часто такие незаметные изменения происходят в грудном отделе, ведь его амплитуда движений и так невелика, ее уменьшение трудно заметить.
По мере разрастания остеофиты начинают давить на нервные корешки и сосуды, в месте нарастания ощущается болезненность и отечность. Далее к боли прибавляются невротические или вегетативные симптомы, поскольку нарушается нормальное кровообращение и проводимость нервных волокон.
Абонемент позволит вам сэкономить до 20% стоимости услуг, заказанных по отдельности.
Постановка диагноза обычно не вызывает сложностей, поскольку остеофиты – это костные структуры и их видно на рентгенографии и МРТ. Лечение спондилеза длительное и комплексное, как и лечение других заболеваний опорно-двигательного аппарата. Полностью излечить болезнь нельзя, ведь выросшие остеофиты уже не могут рассосаться. С помощью медикаментозного лечения можно избавиться от болей и спазмов, однако лекарства не могут остановить развитие новых наростов. Для нормализации трофики тканей и профилактики появления новых образований используются методы массажа, физиотерапии, рефлексотерапии, ЛФК.
 В запущенных случаях уже имеющиеся остеофиты приходится удалять хирургическим путем, а затем уже заниматься профилактикой возникновения новых.
В запущенных случаях уже имеющиеся остеофиты приходится удалять хирургическим путем, а затем уже заниматься профилактикой возникновения новых. Стеноз позвоночного канала, остеофиты позвонков и оссификация связок
Стеноз позвоночного канала, остеофиты позвонков и оссификация связок
Стеноз позвоночного канала как самостоятельное заболевание чаще всего рассматривается на поясничном уровне позвоночника. Но встречается стеноз позвоночного канала и на шейном и грудном уровне позвоночника. Стеноз позвоночного канала связан с врожденными или приобретенными анатомическими изменениями в самих позвонках (костные остеофиты), а также в хрящевых и связочных образованиях, формирующих позвоночный канал.
Сужение поперечного сечения позвоночного канала может быть или следствием увеличения в размерах костных образований: дужек, суставных отростков, разрастания задних поверхностей тел позвонков, или в результате расплющивания позвонков и смещения их в просвет позвоночного канала.
Стеноз (сужение) просвета позвоночного канала со сдавлением спинного мозга с гипертрофией задней продольной и жёлтой связки.
Также к сужению позвоночного канала приводят гипертрофия желтой и задней продольной связок, увеличение толщины суставных капсул межпозвонковых суставов, смещения межпозвонковых дисков и фиброзного кольца, участвующих в формировании позвоночного канала.
Стеноз позвоночного канала может быть равномерным со всех сторон, но чаще встречается сужение позвоночного канала спереди назад. Также стеноз позвоночного канала может наблюдаться на уровне всех или нескольких поясничных позвонков, но встречается и на уровне одного позвонка.
Сужение позвоночного канала в переднезаднем направлении может быть обусловлено его вторичным стенозом, гипертрофией задней продольной и жёлтой связки, спондилолистезом. Для установления стеноза позвоночного канала необходимо измерение канала в сагиттальной плоскости. Абсолютным стенозом принято считать уменьшение диаметра канала до 10 мм и менее. Величина в 10–15 мм соответствует частичному стенозу. Толщина задней продольной связки в норме не должна превышать 2 мм, желтой связки — 3 мм.
Стеноз позвоночного канала со сдавлением спинного мозга при спондилёзе на уровне шейного отдела позвоночника с гипертрофией задней продольной и жёлтой связки.
Сдавление L3 спинального нерва в межпозвонковом отверстии при экстрафораминальном стенозе (сужении просвета).
Стеноз позвоночного канала поясничного отдела позвоночника (люмбальный стеноз) — это преходящая хроническая компрессия нервных корешков конского хвоста. Стеноз поясничного отдела позвоночника (люмбальный стеноз) возникает при врожденной узости позвоночного канала на поясничном уровне, которое усиливается в результате протрузии диска и спондилёзе позвоночника.
Физические нагрузки при стенозе провоцирует у больного боли в области ягодиц, бёдер и икр, иррадиирущие по ходу седалищного нерва. Боли при стенозе позвоночного канала уменьшаются у больных в покое. Эти боли напоминают перемежающуюся хромоту сосудистого генеза и требуют консультации сосудистого хирурга для исключения заболеваний артерий нижних конечностей. На усилении болей по сравнению с состоянием покоя определяется снижение глубоких сухожильных рефлексов и чувствительности на ногах, тогда как при исследовании сосудов на УЗИ изменений не обнаруживают. Стеноз позвоночного канала поясничного отдела позвоночника (люмбальный стеноз) и шейный спондилёз часто сочетаются друг с другом у одних и тех же пациентов, что может провоцировать периодические спазмы и подёргивания мышц (фасцикуляции) на ногах при шейном спондилёзе.
Стеноз позвоночного канала поясничного отдела позвоночника (люмбальный стеноз) и шейный спондилёз часто сочетаются друг с другом у одних и тех же пациентов, что может провоцировать периодические спазмы и подёргивания мышц (фасцикуляции) на ногах при шейном спондилёзе.
Лечение остеофита в Люберцы. Клиника «Ист Клиник»
Как перестать ходить по врачам и аптекам и получить реальную помощь?
- Экспертный уровень специалистов — у нас консультируют врачи с опытом более 25 лет.
- Командное мнение — врачи нескольких специальностей сотрудничают между собой для достижения лучшего результата.
- Консультация длится столько, сколько надо — чтобы детально разобраться в ситуации.
Запишитесь на первичный приём и узнаете:
- Какова причина вашего заболевания, точный диагноз и стадия процесса.
- Что вам подходит для лечения, а какие процедуры противопоказаны.
- Что делать дома — упражнения, питание и многое другое.

- А также сразу пройдите первый лечебную процедуру.
В зависимости от стадии заболевания мы выбираем один или несколько методов лечения:
Остеопатия
Мягкая техника работы с позвоночником, суставами, мышцами, связками, внутренними органами. Устраняет болевой синдром, запускает процесс самовосстановления.
Лечебный массаж, остеопатия, мануальная терапия
Помогает костям и суставам занять правильное физиологичное положение, снимает боли и спазмы, расслабляет мышцы.
Иглоукалывание
Работа по биологически активным точкам. Действует на пораженную область и организм в целом. Устраняет причину болезни и убирает симптомы.
Кроме того по показаниям применяются: тейпирование, фармакопунктура, стельки ФормТотикс, ЛФК с инструктором и другие методы. Выбор процедур зависит от текущего состояния, в комплексе они действуют быстрее и дают более стойкий результат.
Выбор процедур зависит от текущего состояния, в комплексе они действуют быстрее и дают более стойкий результат.
консультация остеопата в Москве
Что такое остеофиты на позвоночнике. Симптомы и лечение.
Часто причинами болей в спине являются остеофиты на позвоночнике. Остеофит — это повреждение в позвоночном отделе, которое разрастается в костной ткани в виде шипа или отростка.
При нарушении целостности хрящевой ткани, суставы беспрепятственно трутся друг об друга, тем самым вызывая остеофит. Эти патологии могут наблюдаться также в области шеи, рук, ног. Причины развития костных разрастаний различаются в зависимости от того, в какой части тела они обнаружены.
Поясничного отдела, пальцев рук, тазобедренного сустава, разрастания, удаления, причины возникновения, пальце ног, пяточного бугра, пяточная шпора, грудного отдела, мелкие, массивные, краевые. Позвоночника, что это, причины.
Симптомы
При движении человек испытывает боль в поясничном, шейном или грудном отделах. Это происходит из-за того, что костные разрастания в виде шипа сдавливают нервные окончания при движении.
Это происходит из-за того, что костные разрастания в виде шипа сдавливают нервные окончания при движении.
В тех же областях появляется скованность движений. Также появление остеофита характеризуется мышечным напряжением в пораженных участках тела.
На поздних стадиях заболевания появляется деформация сустава.
Симптомы спондилеза схожи с симптомами межпозвоночной грыжи. В случае появления болей в позвоночнике необходимо обратиться к врачам, чтобы узнать точный диагноз и начать лечение.
Область шеи, шейного, грудного отдела. Что это такое. Краевые остеофиты.
Шейные позвонки очень подвижны, поэтому в процессе движения они могут резко смещаться и сдавливать тем самым нервные окончания. Такие процессы часто приводят к нарушению кровообращения и появлению остеофитов.
Область груди
Остеофиты могут появиться и в грудном отделе, но в отличие от шейного, эта область позвонков менее активна. Поэтому данное заболевание может долго не беспокоить человека, а потом внезапно парализовать его.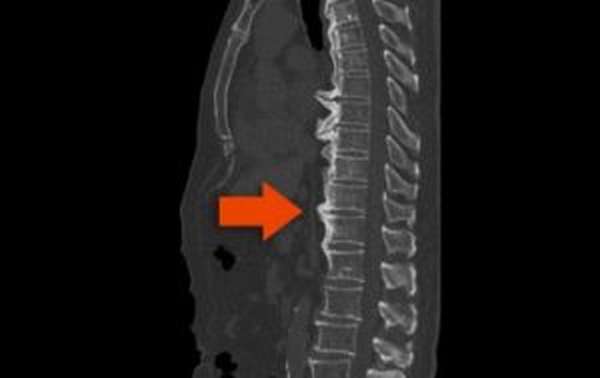
Область поясницы
Самой подвижной частью позвоночника является поясничный отдел. Позвонки поясничного отдела страдают так же сильно, как и шейный. По статистике остеофит возникает чаще в шейном отделе, чем в поясничном.
Стопы, позвоночника, пяточных костей, как лечить, как избавиться. Шейного отдела, голеностопного сустава, лечение, на пятке. Пяточный остеофит. Костный остеофит. Суставных поверхностей. Как убрать. Шиповидные. Остеофит. Грудного отдела позвоночника, надколенники. Как лечить остеофиты мелкие и крупные, клювовидные, позвонков, коленного, локтевого сустава, краевые, передние.
Классификация остеофитов
1) Посттравматический остеофит. Развивается в результате повреждения и травм кости.
2) Дегенеративно-дистрофический остеофит. Появляется вследствие дегенеративных процессов в суставах. Этот тип остеофита уменьшает подвижность позвонков. На рентгене такой остеофит выглядит как скопление шипов вокруг суставов.
3) Периостальный остеофит. Образуется из-за воспаления надкостниц. Этот процесс вызывает окостенение суставов.
4) Массивный остеофит. Самый опасный вид, появляющийся из-за опухолей костной ткани. Причиной появления остеофита этого вида является остеоклеротические метастазы.
Остеофиты коленного сустава, что это такое. Краевые, пяточных костей. Шейного отдела, лечение, поясничного отдела. Что это такое, как лечить. Остеофиты позвоночника, коленного сустава, шейного отдела.
Лечение
Консервативный курс
На первых стадиях заболевания всегда назначается консервативный курс. В этом случае болезнь можно вылечить без вмешательства хирургов. В ходе курса, пациенту назначается медикаментозное лечение, физиотерапия, специальная гимнастика. Также активно применяются нетрадиционные способы лечения.
На ранних стадиях заболевания пациентам рекомендуется использовать такие средства, как: «Ибупрофен», «Диклофенак», «Напроксен», «Аспирин», «Найз».
Для того, чтобы пациент перестал ощущать болевой синдром, врач назначает ему мази и гели, которые снимут боль. Если воспаленное место нужно «разогреть», то помогут «Випросал», «Капсикам», «Финалгон».
Если воспаленное место нужно «разогреть», то помогут «Випросал», «Капсикам», «Финалгон».
Лечебная физкультура
Лечение остиофита проходит эффективно при применении лечебной физкультуры. Однако у этого вида лечения есть некоторые условия, которые нужно знать:
1) Нельзя заниматься лечебной физкультурой в периоды острого воспаления, т.к нагрузка может только усилить болевые ощущения.
2) В начале курса пациент должен выполнять легкие упражнения, постепенно увеличивая нагрузку.
3) Все упражнения выполняются плавно. Быстрые резкие движения наносят вред организму.
Нетрадиционная медицина
Мануальная терапия
Терапия улучшает кровообращение, облегчает боль. Мануальный терапевт использует в процессе массажа «мягкую» технику, которая повышает скорость регенеративных процессов. Мануальная терапия снимает напряжение и существенно улучшает самочувствие пациента.
Ударно-волновая терапия
Метод лечения основан на использовании низких акустических частот. Исследования показали, что этот метод эффективен. Большинство людей, испытавших на себе УВТ-терапию заявляют об улучшении самочувствия.
Интересное
инструктор лфк
кинезиолог
врач реабилитолог
Врач первичного приёма: Клюев Кирилл ЕвгеньевичАнализы на коронавирус
определение. Остеофиты тазобедренного и коленного сустава, остеофиты позвоночника
Здоровье – главная жизненная ценность для любого человека, остающаяся на все времена. И, к сожалению, его нельзя купить, полностью вернуть или восстановить до былого уровня, если вовремя не обращать внимания на сигналы, посылаемые организмом в ответ на начинающиеся отклонения при пренебрежительном к нему отношении. Для оказания помощи человечеству в этой нелегкой борьбе была придумана медицинская наука, позволяющая выявлять и излечивать многие людские страдания. Ведь, зачастую, на фоне кажущегося хорошего самочувствия может возникнуть то или иное серьезное заболевание. Схожая ситуация бывает и при так называемом латентном, или, проще сказать, скрытом течении болезни, когда диагноз врача звучит как гром среди ясного неба и вводит в ступор от неожиданности.
Невидимая опасность
Именно к таким нарушениям медики часто относят различные патологические образования у человека. Они способны приносить сильнейшие болевые ощущения и инвалидизировать пациента, особенно остеофиты позвонков и крупных суставов, относящиеся к подобным находкам. Опасность упомянутых изменений заключается в их позднем обнаружении на финальных стадиях заболевания, а адекватное лечебное воздействие возможно лишь с минимальным положительным эффектом. Сразу же может возникнуть резонный вопрос: «Остеофиты – что это?» Такое своеобразное название получила обособленная группа заболеваний, имеющих в основе своего патогенеза развитие костной патологии по типу разрастаний, определяемых в основном только с помощью дополнительных методов обследования.
Остеофиты – что это такое?
Дословно в переводе с греческого данный медицинский термин обозначает костный росток (osteon – кость, phyton – отпрыск, растение). Сами остеофиты могут выглядеть как шипы, зубцы, выступы или бугорки, более крупные называются экзостозами. В основе своего строения подобные образования имеют губчатую или компактную костную структуру. Другими словами, можно сказать про остеофиты, что это такое плотное новообразование по типу локально ограниченных наростов из-за нарушения в сторону избыточного синтеза кости в месте воспаления наружной ее оболочки.
В основе своего строения подобные образования имеют губчатую или компактную костную структуру. Другими словами, можно сказать про остеофиты, что это такое плотное новообразование по типу локально ограниченных наростов из-за нарушения в сторону избыточного синтеза кости в месте воспаления наружной ее оболочки.
Пусковыми процессами считаются травматические воздействия или инфекционные агенты, в том числе и в окружающих скелет мягких тканях. Как причину также рассматривают и нарушение метаболизма кальция в организме. Выделяют несколько основных разновидностей остеофитов в соответствии с их этиологической причиной. Посттравматические, дегенеративно-дистрофические, нейрогенные процессы лежат в основе старта всего патогенетического механизма болезни.
Предпосылки закладываются с детства…
Следует отметить, что весь комплекс изменений в позвоночнике начинается с самого раннего детства, еще с того момента, когда малыш начинает садиться и постепенно переходить от горизонтального положения к вертикальному прямохождению на двух ногах. В итоге уже взрослому приходится расплачиваться за подобные эволюционные изменения ухудшением состояния здоровья своей опорно-двигательной системы, и, в первую очередь, позвоночного столба за счет постоянных перегрузок и повседневного травматизма при несоблюдении необходимых физиологических нормативов. Сами по себе краевые остеофиты зачастую расцениваются, особенно в последнее время, как составляющие процесса инволюции структур позвоночника, приводящего к дистрофии фиброзного кольца и последовательных нарушений анатомо-топографического соотношения костных структур и связочного аппарата.
В итоге уже взрослому приходится расплачиваться за подобные эволюционные изменения ухудшением состояния здоровья своей опорно-двигательной системы, и, в первую очередь, позвоночного столба за счет постоянных перегрузок и повседневного травматизма при несоблюдении необходимых физиологических нормативов. Сами по себе краевые остеофиты зачастую расцениваются, особенно в последнее время, как составляющие процесса инволюции структур позвоночника, приводящего к дистрофии фиброзного кольца и последовательных нарушений анатомо-топографического соотношения костных структур и связочного аппарата.
Спондилез — защита от разрушений временем и болезнью
Подобные механизмы наблюдаются при развитии онкологии костей или при метастазах рака молочной или поджелудочной желез. Доброкачественные опухоли также способствуют нарушению нормального развития хрящевой ткани, стимулируя рост патологических костных новообразований. Можно сказать про остеофиты позвоночника, что это такое своеобразное проявление реакции защиты организма на разрушение межпозвонкового диска. Медицинской наукой все это объединяется в один емкий термин спондилез.
Медицинской наукой все это объединяется в один емкий термин спондилез.
При нарушении механико-динамических показателей любого локомоторного акта, производимого человеческим телом, возможно вовлечение в процесс крупных и мелких суставов конечностей. При изменении физиологических норм двигательного процесса может формироваться сколиоз, встречающийся чуть ли не у каждого второго современного обывателя. Однако можно встретить не только поражение позвонков. В последнее время нередки такие диагнозы, как остеофиты тазобедренного сустава, шеи, колена, пяточной кости.
Предрасполагающие факторы
Межпозвонковое пространство, заполненное хрящом, в норме способно обеспечить оптимальное соотношение многочисленных суставных поверхностей и амортизацию их между собой при ходьбе. Однако при дисковой патологии, развивающейся при чрезмерных или нефизиологических нагрузках, неправильной осанке, длительном нахождении в сидячей позе и подобных состояниях, приводящих, например, к остеохондрозу, наблюдается возникновение изменений в этих и без того несовершенных суставах. Предрасполагают к этому лишний вес, плоская стопа, различные нарушения обмена веществ, травмы и наследственность.
Предрасполагают к этому лишний вес, плоская стопа, различные нарушения обмена веществ, травмы и наследственность.
Как результат, характерно появление полных и неполных вывихов, различных воспалительных процессов, отчего, как защитная реакция, развивается уплотнение и разрастание костной ткани в краевых участках суставных поверхностей тел позвонков, в том числе и для увеличения площади их опоры на окружающие ткани. Описанные изменения особенно ярко проявляются в старшем возрасте, после 50 лет, когда процессы изнашивания организма провоцируют развитие патологии не только в строении скелета, но и со стороны многих органов и систем.
Симптоматика поражения шеи
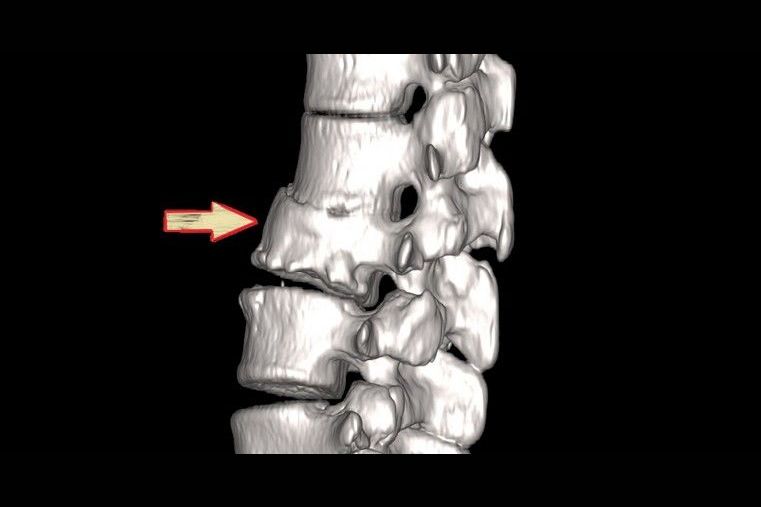
В патологический процесс может вовлекаться любой отдел позвоночного столба. В зависимости от уровня поражения ему будет соответствовать характерная клиническая картина. Остеофиты шейного отдела позвоночника обычно образуются по заднебоковым поверхностям позвонков и проявляются частыми мигренозными приступами, локальными болевыми ощущениями в шее, иррадиирущими в плечо, руку или лопатку, чувством скованности при движениях головы в вертикальном положении. Из-за сопутствующих воздействий на кровообращение рядом расположенных органов и нервных сплетений может появляться болевой синдром в области сердца, а также признаки недостаточности кровообращения головного мозга по типу шума в ушах, нарушений зрения, усугубляющихся при наклонах головы назад. Шейный остеофит, как и аналогичные образования в других отделах позвоночника и суставах, можно определить с помощью рентгенологического исследования, компьютерной или магнитно-резонансной томографии.
Из-за сопутствующих воздействий на кровообращение рядом расположенных органов и нервных сплетений может появляться болевой синдром в области сердца, а также признаки недостаточности кровообращения головного мозга по типу шума в ушах, нарушений зрения, усугубляющихся при наклонах головы назад. Шейный остеофит, как и аналогичные образования в других отделах позвоночника и суставах, можно определить с помощью рентгенологического исследования, компьютерной или магнитно-резонансной томографии.
Особенности проявлений костных наростов в нижних участках спины
Учитывая малоподвижность в суставах позвонков грудного отдела, клиника костных новообразований данной локализации менее яркая и зачастую проходит незаметно для пациента. В основном здесь формируются передние остеофиты.
Болевые ощущения в пояснице, особенно при нагрузках, чувство онемения и покалываний в конечностях, а также нарушение нормального функционирования мочевого пузыря и кишечника более свойственны для поясничного спондилеза.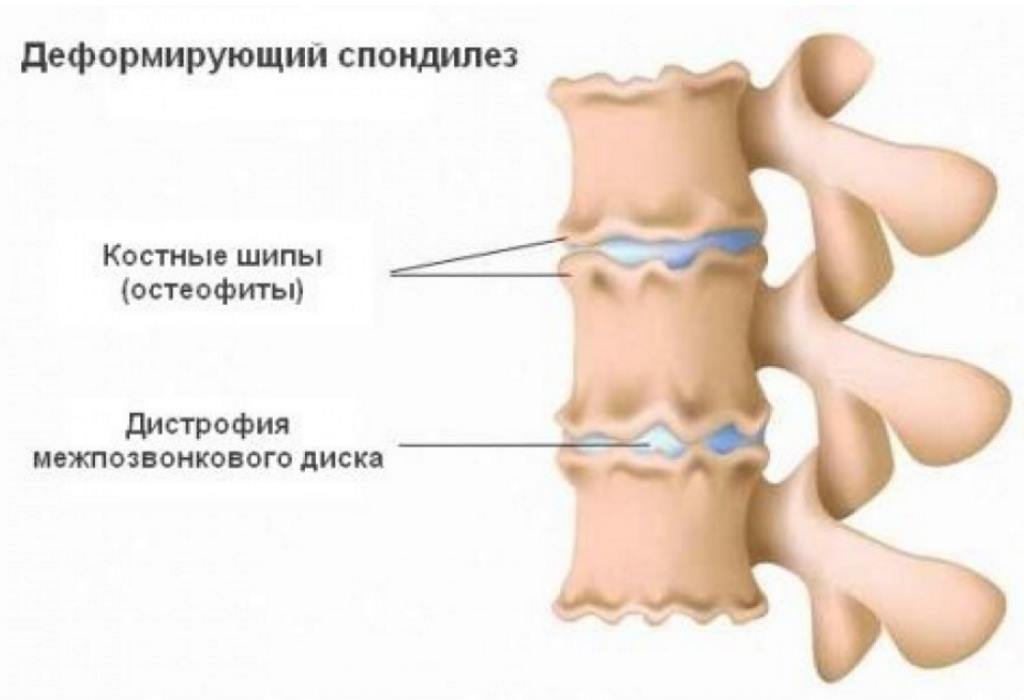 Учитывая максимальное давление в данном отделе спины позвонков друг на друга, из-за возникающей патологии хрящевого диска здесь образуются переднебоковые остеофиты. Их своеобразие заключается в горизонтальном направлении, необычности форм и частой ориентации соседних наростов в сторону друг друга (так называемые «целующиеся» композиции).
Учитывая максимальное давление в данном отделе спины позвонков друг на друга, из-за возникающей патологии хрящевого диска здесь образуются переднебоковые остеофиты. Их своеобразие заключается в горизонтальном направлении, необычности форм и частой ориентации соседних наростов в сторону друг друга (так называемые «целующиеся» композиции).
Самые чувствительные образования локализуются по дорзальным поверхностям позвонков и именуются задними остеофитами. Болевой синдром обусловлен сдавлением проходящих рядом нервных стволов через отверстия между костными структурами.
К какому врачу обратиться
Как только возникли неприятные или болезненные ощущения в спине или конечностях, следует незамедлительно обращаться за медицинской помощью, а не заниматься самолечением. Самый простой выход – прийти на прием к участковому терапевту, который посоветует или сразу назначит осмотр невролога или ревматолога. При наличии в поликлинике вертебролога, с болями в позвоночнике можно самостоятельно направиться в его кабинет.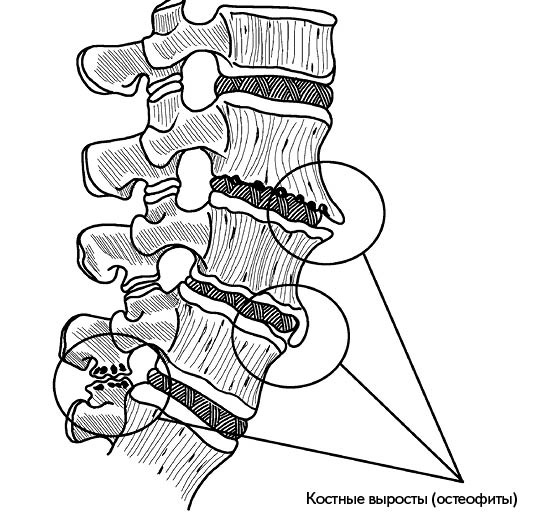 При патологии в руке или ноге не помешает проконсультироваться с врачом-ортопедом. Не исключено, что возникнет необходимость осмотра хирурга или нейрохирурга. На финальном этапе лечения помогут специалисты по массажу, лечебной физкультуре и физиотерапевты.
При патологии в руке или ноге не помешает проконсультироваться с врачом-ортопедом. Не исключено, что возникнет необходимость осмотра хирурга или нейрохирурга. На финальном этапе лечения помогут специалисты по массажу, лечебной физкультуре и физиотерапевты.
Как подтвердить наличие остеофитов
Поставить диагноз грамотному специалисту, особенно при анализе жалоб и истории заболевания, можно уже на этапе проведения пальпации как самих остеофитов, определяемых в виде плотных, безболезненных и неподвижных наростов, так и при проведении полного неврологического осмотра.
При невозможности детального ощупывания патологических образований, ввиду физиологических особенностей пациента или небольшого размера костного ростка, доктор назначает дополнительные методы диагностики. К ним относятся, как уже упоминалось выше, рентгенологическое исследование, компьютерная или магнитно-резонансная томография.
Благодаря детальному изучению костной патологии в пораженной области с помощью таких современных высокотехнологичных методов обследования, возможно не только поставить правильный и своевременный клинический диагноз, но и выявить осложнения по типу компрессии участка спинного мозга и нервных корешков, а также помочь назначить необходимое адекватное лечение в каждом конкретном случае.
Частые локализации патологии вне позвоночника
Остеофиты тазобедренного сустава являются признаком такой патологии, как деформирующий остеоартроз с развитием ограничения амплитуды полноценного движения в вертлужной впадине данного костного соединения. Помимо этого, причинами развития патологических нарушений могут стать перелом шейки бедра в анамнезе, сахарный диабет, бруцеллез, сифилис, остеомиелит и другие воспалительные процессы из-за сопутствующего сбоя обмена веществ в окружающих тканях.
Остеофит пяточной кости, или в простонародье шпора, способен вызывать сильнейшие болевые ощущения и выявляется при рентгенологическом исследовании в виде дополнительного вкрапления или шипообразного отростка.
Надрыв надкостницы — более характерный процесс в развитии остеофитов крупных суставов, например, коленных или локтевых, при их сложных травмах или вывихах. При заживлении поврежденного места наружная костная оболочка уплотняется с образованием гипертрофических структур. Поэтому во врачебной практике в настоящее время уже не редко можно услышать диагноз артроз, включающий в себя такую составляющую, как остеофиты коленного сустава.
Поэтому во врачебной практике в настоящее время уже не редко можно услышать диагноз артроз, включающий в себя такую составляющую, как остеофиты коленного сустава.
Лечение без операции
Современная медицина, в зависимости от показаний и стадии процесса, имеет в арсенале лечения несколько подходов к данной патологии. Консервативная терапия предлагает бороться с подобными суставными проблемами в их начальной стадии развития или легких формах с помощью медикаментозных препаратов. К основной группе относят нестероидные противовоспалительные средства, например, препараты «Найз», «Нимулид», «Ибупрофен», «Диклофенак» и подобные лекарственные вещества. Основной их эффект развивается за счет противовоспалительного действия с последующим уменьшением отека и боли.
Кроме того, назначаются вспомогательные средства, содержащие витаминные комплексы группы В, никотиновую кислоту, фосфор, кальций, магний, хондропротекторы, сосудорасширяющие препараты. Местное применение мазей с разогревающим эффектом способно на короткое время облегчить боль за счет отвлекающего воздействия.
Свои особенности имеют остеофиты коленного сустава, лечение которых несколько отличается из-за возможности и частой необходимости внутрисуставного введения препаратов.
Другие эффективные методы лечения
Массаж, рефлексотерапия, лечебная гимнастика также обладают целебными свойствами, улучшая микроциркуляцию и эластичность мышечных волокон, окружающих измененный костный каркас. В истории медицины имеются клинические наблюдения, свидетельствующие об обратном развитии и рассасывании патологических структур позвонков, в том числе и на фоне появления остеопороза.
Однако непроходящие мучительные боли, неэффективность лекарственной терапии или тяжелая степень поражения опорной системы сориентируют врача в пользу назначения хирургического вмешательства с целью удаления остеофитов и снятия патологической компрессии нервов. Противопоказаниями к операции служат общие заболевания, такие как сахарный диабет и тяжелая сердечно-сосудистая патология.
Предупредить легче, чем лечить
Всегда следует помнить, что проведенная операция избавит от определенного симптома лишь на время, но от болезни в целом чудодейственного препарата пока еще не придумано. Все это не исключает возможности повторения или появления в будущем новых остеофитов с характерными патологическими изменениями и клинической картиной.
Все это не исключает возможности повторения или появления в будущем новых остеофитов с характерными патологическими изменениями и клинической картиной.
Поэтому, в целях профилактики возникновения таких нарушений, следует вести активный и здоровый образ жизни. А это значит, правильно питаться, спать в соответствии с физиологическими требованиями на ровной твердой поверхности с небольшой подушкой-валиком под головой, постоянно следить, находясь в положении сидя, за своей позой и осанкой, при необходимости длительного пребывания в одном положении делать регулярные перерывы на выполнение гимнастических упражнений для здоровья спины.
Только подробно узнав о существовании такого заболевания, как остеофиты, что это такое, рассмотрев их характерные клинические проявления, а также современные возможности диагностики и лечебных мероприятий, удастся вовремя предупредить возникновение подобного недуга или дать отпор уже развившимся патологическим изменениям.
Что представляют собой дегенеративные изменения межпозвонкового диска?
Ближе к 20-25 годам, когда организм человека достигает биологической зрелости, в межпозвонковых дисках начинают происходить естественные возрастные изменения. Диски начинают постепенно грубеть, терять влагу и эластичность. Уплотнения дисков с течением времени вызывают уменьшение их высоты. Как следствие этого у позвоночника в целом снижается осевая упругость, а уменьшение просвета между позвонками вызывает сдавление боковых нервных корешков. Потеря высоты межпозвоночного диска может также запускать формирование костных разрастаний (остефитов и костных шпор), которые могут оказывать давление на спинной мозг и нервные корешки, вызывая их компрессию.
Эти изменения могли бы протекать незамеченными, если бы не образование грыжевых выпячиваний дисков — одного из самых опасных и сложных заболеваний позвоночника. Частые травмы позвоночника вследствие чрезмерных нагрузок при поднятии тяжестей, резких поворотах корпуса и головы, резких сгибаний-разгибаний ведут к разрывам дисков и образованиям грыжевых выпячиваний, которые оказывают давление на спинной мозг и его корешки, обуславливают болевые и другие симптомы, как, например, слабость мышц шеи, спины, конечностей или покалывание в них. Длительное игнорирование симптомов сдавления корешков и спинного мозга может привести к инвалидности.
Основные признаки дегенеративно-дистрофического поражения позвоночника:
- Болевой корешковый синдром (радикулопатия), вызванный грыжевым выпячиванием межпозвонкового диска, на фоне выраженного снижения активности и трудоспособности пациента.
- Радикулопатии, вызванные прорастанием остеофитов в просвет позвоночного канала.
- Нарушение функции спинного мозга и спинальных корешков в виде параличей и выпадения функций органов из-за грыжевого выпячивания диска (миелопатия).
- Заметное, достоверное снижение высоты промежутка между телами позвонков, выявляемое на рентгенограмме.
Как правило, в таких случаях консервативная терапия против этих проявлений малоэффективна, и пациенты с болевым синдромом в поясничном отделе позвоночника, не получая облегчения от консервативной терапии, вынуждены обращаться со своими хроническими и рецидивирующими формами заболевания к хирургам. Показанием к срочному хирургическому лечению в этих случаях принято считать, кроме сильных болей, грубые неврологические нарушения: выключение чувствительности конечностей, резкое падение мышечной силы рук и ног, потери некоторыми органами своих функций (например, недержание мочи).
Симптомы стеноза позвоночного канала
Симптомы стеноза позвоночного канала проявляют себя разными путями в зависимости от места и выраженности стеноза. В 95% случаев они представлены сильными болями, в 71% случаев — нарушениями чувствительности, в 33% случаев возможно развитие параличей конечностей.
Одной из характеристик стеноза позвоночного канала поясничной области в 90% случаев является укорочение возможной продолжительной прогулки пешим шагом из-за резкого проявления указанных выше симптомов. Часто такого плана грубый дискомфорт, возникающий во время ходьбы, распространяется на ягодичную область и бедра и вынуждает пациента прекратить движение. При этом пациент далее не способен сделать и нескольких шагов.
Указанная гамма симптомов заметно уменьшается при наклоне туловища вперед, при сидении на стуле или в положении лежа, поскольку в этом случае позвоночный канал высвобождается. При наклоне вперед давление на задний край межпозвоночного диска снижается, размер протрузионного выпячивания уменьшается, и вследствие этого уменьшается давление на нервные структуры. Так, например, езда на велосипеде в случае стеноза позвоночного канала не имеет особых проблем. Однако, если Вы разогнете свою спину, отклонитесь назад, Вы создадите давление на задний край межпозвоночного диска, увеличится протрузионное (грыжевое) выпячивание диска, возникнет дополнительное сужение позвоночного канала, и болевые ощущения, соответственно, усилятся.
Лечение
Для освобождения раздраженных нервных пучков и сдавленного спинного мозга широко используется декомпрессионная хирургия. Степень вмешательства при этом зависит от особенностей, которые присущи различным пациентам. Однако для предотвращения повторного сужения позвоночного канала требуется именно декомпрессия в поврежденном участке позвонка и эффективная стабилизация состояния для сохранения подвижности.
Хирургические подходы для разных случаев следующие:
- Декомпрессия. При процедуре декомпрессии дужка позвонка, костные шпоры, утолщенные связки и суставы, выпяченные или просевшие межпозвоночные диски, которые оказывают давление на нервные структуры, могут быть удалены хирургом на одном или нескольких позвоночных сегментах.
- Декомпрессия с жесткой стабилизацией/фиксацией. Хирургическая процедура декомпрессии может вызывать впоследствии нестабильность позвонков в месте вмешательства. Для ее предотвращения может быть использована техника объединения позвонков погружной винтовой конструкцией. Эта техника получила название операции транспедикулярной фиксации/стабилизации (ТПФ). Операция установки систем ТПФ требует много операционного времени, сложного оборудования в операционной и большой нагрузки на персонал и пациента. Объединение позвонков металлической конструкцией прочно и жестко ограничивает их подвижность.
- Декомпрессия с межостистой стабилизацией при помощи импланта Coflex® (Кофлекс). Установка импланта Coflex® (Кофлекс) обеспечивает стабильность позвоночника в месте декомпрессии без жесткого объединения позвонков. Более того, имплант Coflex® (Кофлекс), помимо обеспечения стабильности позвоночника, позволяет сохранять движение в прооперированном участке, а также нормальную высоту просвета между позвонками.
Существенные остеофиты тела позвонков защищают от тяжелых переломов позвонков при компрессии
PLoS One. 2017; 12 (10): e0186779.
, Концептуализация, курирование данных, формальный анализ, исследование, методология, администрирование проекта, ресурсы, проверка, визуализация, написание — первоначальный черновик, написание — просмотр и редактирование, 1, 2, 3, * , Концептуализация, получение финансирования, методология, администрирование проекта, надзор, проверка, написание — обзор и редактирование, 3, 4, 5 , исследование, ресурсы, написание — обзор и редактирование, 6, 7 , Концептуализация, Написание — просмотр и редактирование, 2, 5, 8 , Формальный анализ, Визуализация, Написание — просмотр и редактирование, 1 , Концептуализация, Визуализация, Написание — обзор и редактирование, 1, 2, 3 , Курирование данных, Исследование, Написание — просмотр и редактирование, 4, 9 и, Концептуализация, Методология, Управление проектами, Ресурсы, Надзор, Написание — re просмотр и редактирование 9, 10Eric Wagnac
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
Карл-Эрик Обен
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
4 Кафедра машиностроения, Политехническая школа Монреаля, Монреаль, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
Катя Чаумутр
6 Отделение медицинской визуализации, Северная больница, Университет Экс Марсель, Марсель, Франция
7 Laboratoire d’Anthropologie Biologique, Университет Экс Марсель, Марсель, Франция
Жан-Марк Мак-Тионг
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
8 Отделение хирургии медицинского факультета Монреальского университета, Монреаль, Квебек, Канада
Анн-Лор Менар
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
Иван Пети
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
Анаис Гаро
4 Департамент машиностроения, Политехническая школа Монреаля, Монреаль, Канада
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
Pierre-Jean Arnoux
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
10 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Марсель, Франция
Хосе Мануэль Гарсия Аснар, редактор
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
4 Кафедра машиностроения, Политехническая школа Монреаля, Монреаль, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
6 Отделение медицинской визуализации, Северная больница, Университет Экс Марсель, Марсель, Франция
7 Лаборатория биологической антропологии, Университет Экс Марсель, Марсель, Франция
8 Отделение хирургии медицинского факультета Монреальского университета, Монреаль, Квебек, Канада
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
10 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Марсель, Франция
Университет Сарагосы, ИСПАНИЯ
Конкурирующие интересы: Авторы заявили, что не существует конкурирующих интересов.
Поступила 17.05.2017; Принято 6 октября 2017 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. другими статьями в PMC.- Дополнительные материалы
-
S1 Рис. Индивидуальные данные для каждого субъекта, упорядоченные по группе с существенными остеофитами и с небольшими остеофитами.(TIF)
GUID: 02E46D00-34BE-4701-ADF6-01A8E5BF4A2B
S1 Таблица: Индивидуальные данные для каждого испытуемого: трабекулярная плотность позвонков (VTD), площадь поперечного сечения (CSA), высота образца (H), жесткость ( K ) и параметры отказа ( F FAIL , D FAIL и E FAIL ) без нормализации. (DOCX)
GUID: EC8270B3-7D62-4E9E-94A5-FDB3AC5E64C5
- Заявление о доступности данных
-
Все соответствующие данные находятся в документе.
Abstract
Недавние открытия предполагают, что остеофиты позвоночника повышают сопротивляемость позвоночника сжатию. Однако роль остеофитов позвоночника в биомеханической реакции позвоночника при быстром динамическом сжатии, вплоть до отказа, неясна. Семнадцать образцов позвоночника человека, состоящего из трех позвонков (от T5-T7 до T11-L1) и окружающих их мягких тканей, были взяты у девяти трупов в возрасте от 77 до 92 лет. Образцы получали с помощью количественной компьютерной томографии (ККТ) для медицинского наблюдения, классификации дегенерации межпозвонкового диска (степень Томсона) и измерения плотности трабекул позвонков (VTD), высоты и площади поперечного сечения.Образцы были разделены на две группы (с (n = 9) или без (n = 8) существенными остеофитами тела позвонков) и подверглись осевому сжатию со скоростью динамического смещения 1 м / с, вплоть до отказа. Нормализованные кривые «сила-смещение», видео и изображения QCT позволили охарактеризовать параметры разрушения (сила, смещение и энергия при разрыве) и характер разрушения. Результаты были проанализированы с использованием критериев хи-квадрат для выборочных распределений и линейной регрессии для корреляции между VTD и параметрами отказов.Образцы со значительными остеофитами тела позвонков демонстрируют более высокую жесткость (в среднем в 2,7 раза) и силу при разрушении (в среднем в 1,8 раза), чем другие сегменты. Наличие остеофитов существенно влияет на расположение, характер и тип перелома. VTD был хорошим предиктором динамической силы и энергии при разрушении для образцов без существенных остеофитов. Это исследование также показало, что остеофиты тела позвонка обеспечивают защитный механизм нижележащего позвонка от тяжелых компрессионных переломов.
Введение
Остеофит тела позвонка — распространенная форма остеоартрита, определяемая как аномальный костный рост или костная шпора, образующаяся вдоль межпозвонковых суставов [1]. На поздних стадиях развития остеофитов соседние позвонки срастаются друг с другом, образуя костный мост через межпозвоночный диск, называемый мостиковым остеофитом. Остеофиты позвонков обычно связаны со старением, дегенерацией межпозвоночного диска, травматическими повреждениями, склерозом замыкательной пластинки, сужением дискового пространства [1, 2], ремоделированием фасеточных суставов [3], болями в спине [4] и диффузным идиопатическим гиперостозом скелета (DISH) или болезнью Форестье. [5].Соответственно, значительный остеофит можно найти в 20–25% шипов в возрасте 20–45 лет и в 73–90% шипов старше 60 лет [2–4, 6]. Осложнения, связанные с образованием остеофитов, многочисленны (дисфагия, компрессия грудной аорты, обструкция полой вены, компрессия нервных корешков) и влияют на большинство структур, расположенных в непосредственной близости от позвоночника. Как следствие, они обычно рассматриваются как дегенеративное состояние и могут быть удалены хирургическим путем традиционными или малоинвазивными методами во время операций на позвоночнике, когда они приводят к инвалидности или неврологическим симптомам [1, 7].Недавно было высказано предположение, что остеофиты позвоночника в первую очередь стабилизируют позвоночник при изгибе и повышают его сопротивление при сжатии [8, 9]. Действительно, если остеофиты обеспечивают стабильность, добавляя кость и увеличивая площадь поперечного сечения позвонков, они также могут обеспечивать защитный механизм от переломов позвонков, несмотря на генерализованную остеопению, наблюдаемую в большинстве стареющих позвоночников.
Однако механическая роль остеофитов тела позвонков в отношении риска и тяжести переломов позвоночника остается неясной.Большинство переломов позвонков варьируются от болезненных компрессионных переломов до более серьезных травм, таких как разрывные и дистракционные переломы. Многие из них расположены на средне-грудном, грудопоясничном или среднем поясничном уровнях и являются результатом механизма осевой компрессии с комбинированным сгибанием или без него [10]. Чтобы лучше понять биомеханику переломов позвонков, было проведено множество экспериментальных исследований трупных тканей человека при осевом сжатии. Несущая способность отдельных позвонков и функциональных спинномозговых единиц (FSU) сформировала основу для количественной оценки устойчивости межпозвоночной структуры к сопротивлению нагрузке и сохранению невредимости [11–18].Другие дополнительные исследования были нацелены на прогнозирование риска переломов позвоночника путем выявления потенциальных корреляций между нагрузкой отказа / переломами позвонков отдельных позвонков или ПСС и клиническими измерениями, такими как минеральная плотность кости (МПК) и морфология [19–24], степень поражения дегенерация [25] и костная архитектура [26–28].
Хотя вышеупомянутые эксперименты предоставили существенное понимание биомеханики переломов позвонков, ни один из них не объяснил механический вклад остеофитов позвоночника.Недавно было высказано предположение, что остеофиты позвоночника увеличивают сопротивление позвоночника сжатию и что в их присутствии клинические измерения МПК занижают прочность позвоночника на сжатие [9, 29]. Однако их тесты на трупах проводились при квазистатических физиологических нагрузках (без отказов). Следовательно, они не воспроизводили динамические реальные условия травм (например, падения или дорожно-транспортные происшествия), которые приводят к компрессионным переломам позвонков.
Настоящее исследование направлено на анализ роли значительных остеофитов позвоночника на биомеханическую реакцию позвоночника при динамическом сжатии, вплоть до отказа.Их влияние на прогноз прочности позвонков на сжатие посредством клинических измерений также было исследовано. Наша гипотеза состоит в том, что существенные остеофиты позвонков имеют значительное влияние на параметры, тип, характер, расположение и прогноз риска переломов позвонков, когда позвоночник подвергается динамической компрессии.
Материалы и методы
Трупные образцы
Протокол исследования был одобрен институциональным наблюдательным советом IFSTTAR / Университета Экс-Марсель.Ни один из доноров трансплантата не был из уязвимой группы населения, и все доноры или ближайшие родственники предоставили письменное информированное согласие, которое было дано свободно. Семнадцать образцов человеческих сегментов позвоночника, состоящих из трех позвонков и окружающих их мягких тканей, были взяты из девяти забальзамированных трупов. Средний возраст, рост стоя и вес испытуемых составляли 86 ± 5 лет, 164 ± 6 см и 60 ± 13 кг (). Семь экземпляров были расположены в T11-L1, семь — в T8-T10 и три — в T5-T7. Все костные ребра и несвязочные мягкие ткани были удалены из образцов, и изображения количественной компьютерной томографии (ККТ) были получены с использованием клинического сканера (SIEMENS Somatom Sensation Cardiac 64: 120 кВ, 300–350 мАс, смежные срезы 0.6 мм) для медицинского наблюдения, классификации и измерения остеофитов, которые наблюдались на всех позвоночных уровнях. Каждый образец классифицировали в соответствии с направлением каждой пары остеофитов в межпозвоночном пространстве [30] и в соответствии со схемой классификации дегенерации диска Томсона [31]. Размер остеофитов измеряли с использованием метода, описанного Аль-Равахи и др. [9]. Экземпляры были разделены на две группы (). В первой группе (n = 9), названной «образцы со значительными остеофитами», были остеофиты типа C, характеризующиеся почти полным костным мостом, сформированным через пространство межпозвонкового диска.Их остеофиты варьировали от 10 до 15 мм. Во второй группе (n = 8), названной «образцы с небольшими остеофитами», были остеофиты типа E, характеризующиеся остеофитами, которые простирались почти горизонтально до границы тела позвонка, не закрывая пространство межпозвонкового диска. Их остеофиты варьировались от 2 мм (минимальный размер, чтобы считать шпору остеофитом [32]) до 5 мм.
Таблица 1
Подробная информация о 17 образцах спинного мозга, извлеченных из 9 трупов.
| ID субъекта | Пол | Возраст (лет) | Вес (кг) | Рост стоя (см) | Образец | Группа | IVD | 88 | 64 | 155 | T11-L1 | 1 | 5 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 02 | F | 83 | 49 | 165 | 83 9028 3 | -T4- ||||||||||||||||
| 03 | F | 85 | 48 | 154 | T11-L1 | 1 | 5 | ||||||||||||||
| 04 | F | 92 | 54 1 | 5 | |||||||||||||||||
| T11-L1 | 2 | 4 | |||||||||||||||||||
| 05 | F | 9028 3 9339 | 165 | T8-T10 | 2 | 3 | |||||||||||||||
| T11-L1 | 2 | 88 | 71 | 165 | T8-T10 | 2 | 4 | ||||||||||||||
| T11-L1 | |||||||||||||||||||||
| M | 77 | 75 | 173 | T5-T7 | 2 | 3 | |||||||||||||||
| T11-L1 | 2 | 3 | |||||||||||||||||||
| 08 | M | 90 | 91 | 170 | T5-T7 | 1 | 5 | ||||||||||||||
| T8-T10 | 1 | 5 | 9028 -L1 | 1 | 5 | ||||||||||||||||
| 09 | M | 82 | 53 | 165 | T5-T7 | 1 | 5 | 9028 T8-T10 | 1 | 5 |
Затем были проведены измерения плотности трабекул позвонков (VTD), высоты (H) и площади поперечного сечения (CSA) каждого образца.VTD измеряли на каждом позвонке, создавая сканирующий участок толщиной 9 мм, параллельный замыкательным пластинкам позвонка, в средней плоскости тела позвонка [33]. Положение тела посередине позвонка подтверждалось входом базивертебральной вены в среднюю плоскость сканируемого разреза. Средняя единица Хаунсфилда (HU) была рассчитана для интересующей овальной области размером 25 мм 2 , которая включала только губчатую кость (без кортикального ободка или частей базивертебральной вены). Для целей стандартизации (калибровки) средние значения HU каждого позвонка были преобразованы в значения VTD (г / мм 3 ) с использованием линейной регрессии, полученной из фантома электронной плотности КЛКТ (модель 062A, CIRS Inc., Вирджиния, США), помещенные рядом с образцами позвоночника во время ККТ. В конце концов, VTD образца была рассчитана путем усреднения VTD трех составляющих его позвонков. Высота образца измерялась между центром верхней и нижней замыкательных пластинок хвостового и дистального позвонков соответственно. ППС каждого позвонка измеряли по середине тела позвонка. Общая ППС образца была получена путем усреднения ППС трех позвонков. После визуализации образцы замораживали при -20 ° C до тестирования.
Испытательное оборудование и процедуры
Динамическое осевое сжатие было выполнено с использованием сервогидравлической системы испытаний материалов (MTS Axial 370.02 15 кН, Эден-Прери, Миннесота), которая включала одноосный датчик нагрузки и индуктивный датчик смещения для измерения силы привода и отклонение (). Две высокоскоростные камеры (1000 кадров в секунду) были размещены в стороне от образца для визуализации и хронологического отслеживания повреждений позвоночника. За два дня (48 ч) до испытания образцы оттаивали в холодильнике (4 ° C) и накрывали полотенцами, пропитанными физиологическим раствором.Чтобы зафиксировать образец на MTS и равномерно нагружать его, половина дистального и проксимального позвонков была помещена в параллельные чашки, заполненные полиуретановой смолой за двадцать четыре часа до испытания. Во время этого процесса сохранялась сагиттальная естественная кривизна образцов.
Экспериментальная установка, состоящая из сервогидравлической системы испытания материалов (1), двух высокоскоростных камер (2), одноэлементного датчика нагрузки (3) и трупного сегмента позвоночника (4). Трупный сегмент позвоночника (4) был зафиксирован на MTS путем заливки дистального и проксимального позвонков в полиуретановую смолу (5).
Перед испытанием образцы размораживали при комнатной температуре (23 ° C) в течение 3 часов. Каждый образец помещали на MTS и прикладывали предварительную нагрузку 0,25 кН в течение 1 минуты [20]. Затем образцы подвергались динамическому сжатию со скоростью 1 м / с до разрушения. Испытание было остановлено, когда образец был сжат примерно до 60% высоты среднего позвонка (от 12 до 15 мм). Все испытания проводились при комнатной температуре. После сжатия для медицинской диагностики были сделаны изображения QCT образцов.
Анализ данных и статистика
Кривые сила-смещение были записаны и нормализованы (F норма = f (D норма )) в соответствии со средним размером всех образцов, как описано уравнениями (1) и (2) :
Fnorm = FCSAspecimenMeanCSA = F.MeanCSACSAspecimen
(1)
Dnorm = DHeightspecimenMeanHeight = D.MeanHeightHeightspecimen
(2)
(4) уровни.Разрушение было определено как первая точка, в которой дальнейшее увеличение смещения вызвало уменьшение нагрузки. Из каждой кривой были извлечены нормализованная жесткость ( K ), сила ( F FAIL ), смещение ( D FAIL ) и энергия при отказе ( E FAIL ). . Жесткость определялась как наклон наиболее линейного участка кривой до разрушения. Энергия разрушения определялась как площадь под кривой «сила-смещение» до разрушения.Среднее и стандартное отклонения биомеханических параметров ( K , F FAIL , D FAIL и E FAIL ) были вычислены для каждой группы и статистически сравнивались. Воспроизведение тестов и чистые оценки дисперсии ошибок для биомеханических параметров не могли быть выполнены, поскольку тесты были деструктивными.
Обычные модели линейной регрессии были приспособлены для оценки степени линейной корреляции между VTD и каждым измеряемым параметром для каждой группы, без учета какого-либо взаимодействия между параметрами.Чтобы проверить, была ли взаимосвязь между VTD и нормализованными биомеханическими параметрами для группы с небольшими остеофитами аналогична группе с существенными остеофитами, модель, подобранная для первой группы, использовалась для прогнозирования биомеханических параметров другой группы. Затем биомеханические параметры (среднее и стандартное отклонение), рассчитанные на основе этих соотношений, сравнивали с биомеханическими параметрами, полученными экспериментально для другой группы.
Видео были проанализированы для определения места разрушения и характера трещин.ККТ-изображения сломанных образцов были использованы для определения типа перелома на основе классификации AO (инициалы немецких терминов «Arbeitsgemeinschaft für Osteosynthesefragen») для грудных и поясничных травм [34]. Тесты хи-квадрат были выполнены для изучения влияния остеофитов на расположение, тип и характер перелома. Все статистические анализы были выполнены с использованием программы STATISTICA v.7.0 (StatSoft, Талса, Оклахома, США). Различия считали достоверными при p <0.05.
Результаты
Морфология и плотность трабекул позвонков
Образцы со значительными остеофитами показали более высокий (в 1,6 раза) VTD, чем образцы с небольшими остеофитами (p = 0,003) (см. Рис. S1 и таблицу S1). Они также показали большую площадь поперечного сечения (p = 0,307), но меньшую высоту (p = 0,071). Однако, в отличие от VTD, различия в общей морфологии образцов не были значительными.
Таблица 2
Плотность трабекул позвонков (VTD), площадь поперечного сечения (CSA) и высота образца (H) по группам образцов (среднее значение ± стандартное отклонение).
| Образцы с существенными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | Отношение (существенное / малое) | |
|---|---|---|---|
| VTD4 (г / мм) ) | 103 ± 24 | 64 ± 25 | 1,60 * |
| CSA (мм 2 ) | 1062 ± 171 | 1009 ± 251 | 1,05 |
| 77.0 ± 5,0 | 81,3 ± 6,6 | 0,95 |
Кривые «сила-перемещение»
Все образцы имели нормированные кривые «сила-перемещение» одинаковой формы (). Кривые со встроенными маркерами (квадраты, треугольники, кресты и т. Д.) Представляют образцы со значительными остеофитами. Типичная кривая изображена на. До разрушения кривая имеет нелинейную форму, характеризующуюся первым изогнутым сегментом увеличивающейся жесткости (сегмент A-B), за которым сразу следует линейный сегмент (B-C).Этот линейный сегмент предшествует сильно нелинейному сегменту (C-D), характеризующемуся уменьшающейся жесткостью. Сегмент BC называется упругой частью кривой, в то время как сегмент CD называется неупругой частью, где повреждение на микроуровне (потеря целостности материала из-за образования трещин и пустот, ухудшающих жесткость), пластичность (процесс течения, создающий безвозвратные повреждения). деформации) и вязкоупругости (диссипативный процесс). После разрушения (точка D) кривая показывает уменьшение прочности (D-E) до точки E, после чего образец либо сохраняет (девять образцов), либо восстанавливает (восемь образцов) некоторую прочность (сегмент E-F).
Нормированные кривые «сила-смещение» для образцов T5-T7 (a), T8-T10 (b) и T11-L1 (c). Кривые с символами представляют образцы со значительными остеофитами. Эти образцы показали большую жесткость, нагрузки и смещения до разрушения.
Типичная кривая силы-смещения (F-D) (образец T11-L1, объект 3).Шесть сегментов (от A-B до E-F), изображенные на этой кривой, наблюдались на всех образцах.
Нормализованная жесткость и параметры разрушения
Средняя нормализованная жесткость ( K ) образцов со значительными остеофитами составляла 1.В 9 раз превышает жесткость образцов с мелкими остеофитами (). Среднее значение F FAIL , D FAIL и E FAIL образцов со значительными остеофитами было в 2,7, 1,8 и 5,3 раза больше соответствующих значений образцов с небольшими остеофитами, соответственно. . Все различия между группами были статистически значимыми, со значениями p 0,0004 ( K ), 0,0006 ( F FAIL ), 0.006 ( D FAIL ) и 0,002 ( E FAIL ).
Таблица 3
Нормализованные параметры жесткости и разрушения по группам (среднее значение ± стандартное отклонение).
| Образцы со значительными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | Отношение (существенное / малое) | ||
|---|---|---|---|---|
| 3207 ± 735 | 1716 ± 586 | 1.9 † | ||
| F ОТКАЗ (N) | 6873 ± 2534 | 2510 ± 1152 | 2,7 † | |
| D ОТКАЗ (мм) 3,5803 | 1,9 ± 0,91,8 † | |||
| E FAIL (J) | 14,8 ± 8,1 | 2,8 ± 2,4 | 5,3 † | |
Корреляция между 9 нормализованными параметрами биомеханики VT образцы со значительными остеофитами, не было обнаружено статистически значимой корреляции между VTD и биомеханическими параметрами ().Для образцов с небольшими остеофитами VTD был хорошим предиктором нормализованного
F FAIL (r 2 = 0,80, p <0,03) и E FAIL (r 2 = 0,55, р <0,035). Напротив, VTD не коррелировал с K (r 2 = 0,42, p <0,12) и D FAIL (r 2 = 0,33, p <0,14). Линейная регрессия между VTD и нормализованными биомеханическими параметрами.VTD коррелировал только с нормализованными F FAIL и E FAIL образцов без остеофитов.
Следуя этим результатам, значения для F FAIL и E FAIL были предсказаны с использованием линейных соотношений и VTD образцов со значительными остеофитами, так что образцы с аналогичным VTD могли быть в сравнении. Опять же, значительные различия были обнаружены между группами ( F FAIL = 4117 ± 1002 N; E FAIL = 5.5 ± 1,7), таким образом гарантируя, что одна VTD не может объяснить различия, наблюдаемые между группами.
Типы, типы и места переломов
При неудаче видеоанализ показал, что один из позвонков разрушился, и костный мозг был выброшен струями в месте перелома, а также из отверстий и сосудистых каналов в коре головного мозга. Тело первого позвонка, разрушившееся, и характер перелома значительно различались между двумя группами образцов. Действительно, первое тело позвонка, которое разрушилось, было средним или дистальным для семи из восьми образцов с небольшими остеофитами (), в то время как оно было проксимальным для восьми из девяти образцов со значительными остеофитами ().
Разрушение первого позвонка с характерным переломом.a) Образец без остеофитов (образец сегмента T11-L1 субъекта 3). Средний позвонок (Т12) разрушается первым. Горизонтальный узор разделяет позвонок на верхнюю и нижнюю части. На ККТ-изображении наблюдается взрывная трещина. б) Образец со значительными остеофитами (сегмент Т8-Т10 субъекта 2). Проксимальный позвонок (Т11) разрушается первым. Вертикальный узор разделяет позвонок на переднюю и заднюю части.На ККТ-изображении наблюдается перелом остеофита. Пунктирными линиями обозначен выброс костного мозга на месте перелома.
На корковых поверхностях были идентифицированы три модели перелома. В первом варианте кортикальная кость раскалывается по окружности и по горизонтали в центре, оставляя линию, разделяющую тело позвонка на верхнюю и нижнюю части (). Во втором случае кортикальная кость раскалывается вертикально, оставляя линию, которая в основном разделяет тело позвонка на переднюю и заднюю части ().Третий образец представлял собой комбинацию двух других образцов и привел к полному разрушению образца. Первая картина наблюдалась на семи из восьми образцов с небольшими остеофитами, а вторая картина наблюдалась на семи из девяти образцов со значительными остеофитами. Третий образец наблюдали на одном экземпляре из каждой группы.
КТ-изображения показали, что наличие значительных остеофитов влияет на типы переломов (). У пяти образцов с небольшими остеофитами был полный взрывной перелом с ретропульсивным фрагментом кости и нарушением канала (тип А.3.3 классификации AO), а у трех из этих образцов был ударный перелом с коллапсом тела позвонка (тип A.1.3). Только у одного образца с остеофитами позвонков был полный взрывной перелом (с переломом остеофита). Остальные восемь образцов имели ударный перелом с коллапсом тела позвонка (тип A.1.3), иногда с небольшим смещением задней кортикальной стенки. Среди этих образцов у шести были переломы по крайней мере одного из их остеофитов.
Таблица 4
Распределение типов трещин по группам образцов.
| Типы переломов | Образцы со значительными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | ||
|---|---|---|---|---|
| Разрывные переломы | 0 | 5 | ||
| — С переломом остеофита | 1 | 0 | ||
| Импульсный перелом или коллапс тела позвонка | 9028 — 9028 — 9028 — | — С переломом остеофита | 6 | 0 |
Обсуждение
Предыдущие исследования [9, 35] показали, что остеофиты позвонков вызывают значительные изменения устойчивости и гибкости ПСС в квазистатических или физиологических условиях нагрузки. .Настоящее исследование отличается тем, что были протестированы более длинные сегменты позвоночника (трехпозвоночные) при динамическом сжатии и оценена роль остеофитов тела позвонков в механизмах перелома сегментов позвоночника. Значительные остеофиты позвонков увеличивают жесткость и несущую способность сегментов позвоночника. Они также влияют на характер, расположение и прогнозирование риска переломов позвонков.
Ограничения настоящего исследования необходимо обсудить до интерпретации результатов.Во-первых, из-за ограниченной доступности и стоимости человеческих трупов у девяти испытуемых было извлечено только семнадцать образцов. Такой небольшой размер выборки является важным ограничением исследования. Поэтому, чтобы максимизировать размер выборки, данные разных полов и уровней позвоночника были объединены вместе с использованием процесса нормализации. Однако антропометрические различия между мужчинами и женщинами () могли уменьшить или замаскировать потенциальные корреляции с VTD, хотя обе группы содержали образцы мужчин и женщин.Было бы интересно изучить влияние пола и найти гендерные корреляции с большим количеством выборок. С этой точки зрения индивидуальные данные биомеханических параметров были доступны для дальнейшего использования (рис. S1 и таблица S1). Также размеры тела позвонков зависят от пола; поэтому учет поперечных сечений позвонков имеет первостепенное значение для выражения силы, необходимой для сравнения образцов. Процесс нормализации, подобный построению инженерных кривых напряжения-деформации, был выбран таким образом, чтобы биомеханические параметры были выражены в единицах, согласующихся с теми, которые обычно используются клиницистами или сообщаются в других исследованиях [9, 16, 36, 37].Нормализованная сила была предпочтительнее сжимающего напряжения для выражения нагрузки, поскольку позвонки являются неоднородными и сложными материалами. Нормализация была основана на средней CSA тела среднего позвонка и общей высоте образцов, поскольку эти морфологические параметры не изменились из-за присутствия остеофитов. Во-вторых, условия хранения образцов могли повлиять на результаты, но замораживание и хранение существенно не меняют их физические свойства [38–40]. Наконец, применяемые нагрузки и граничные условия были упрощены по сравнению с реальными ситуациями травм (падения, автомобильные аварии и т. Д.).) из-за очень ограниченных знаний о сложных нагрузках, возникающих в таких ситуациях, и из-за присущих им трудностей экспериментального воспроизведения этих нагрузок. Однако полученные в результате переломы были аналогичны тем, которые наблюдались клинически, и энергия, приложенная к образцам, хорошо согласовывалась с энергией, примененной в других экспериментах in vitro , направленных на воспроизведение компрессионных переломов [41–44].
Обе группы образцов показали последовательные механические реакции вплоть до разрушения, с нормализованными кривыми силы-смещения, показывающими аналогичные формы (сегменты от A-B до C-D), как кривые сила-смещение, описанные в других исследованиях [16, 37].Более того, основные силы разрушения 6873 ± 2534 Н и 2510 ± 1152 Н, соответственно, наблюдаемые на образцах со значительными и небольшими остеофитами, находились в том же диапазоне, что и в аналогичных экспериментах, проведенных на здоровых поясничных сегментах позвоночника двух и шести позвонков [37]. . После отказа обе группы образцов смогли сохранить или увеличить свою прочность (сегменты E-F). Эта характеристика может быть объяснена механизмом раздавливания губчатого вещества кости. Lindahl [45] наблюдал аналогичные кривые после сжатия небольших кубических блоков пояснично-губчатой кости.Картер и Хейс [46] предположили, что по мере увеличения нагрузки коллапс увеличивающегося количества межтрабекулярных пространств ограничивает движение костного мозга, тем самым обеспечивая гидравлическую амортизацию спинного сегмента. Они также сообщили, что образцы с повышенной прочностью после разрушения были связаны с более высокой общей минеральной плотностью кости. В текущем исследовании образцы с остеофитами позвонков были связаны с более высоким VTD и были способны выдерживать большие нагрузки после неудачи ().На данный момент невозможно подтвердить, может ли этот более высокий VTD, который был измерен в пределах кортикального края, быть отнесен к образованию остеофитов или биологическим различиям между образцами. В дальнейшем исследовании анализ образцов с использованием структур трещин большего размера также может улучшить корреляцию с VTD.
Биомеханические параметры образцов с небольшими остеофитами хорошо согласуются с данными других экспериментальных исследований, проведенных в аналогичных условиях [36, 37, 47].Более высокие значения K и F FAIL , измеренные для образцов со значительными остеофитами, хорошо согласуются с результатами Al-Rawahi et al. [9], которые показали на постсоветском пространстве, что остеофиты умножают эти параметры в 1,17 и 1,18 раза соответственно. Наши более высокие коэффициенты размножения (1,9 и 2,7 соответственно) могут быть связаны с различными условиями нагрузки (динамическое и квазистатическое сжатие), а также природой и размером протестированных остеофитов (длина остеофитов в Al-Rawahi et al.[9] в среднем составляли 7 мм, и ни у одного из них не было обнаружено полного и жесткого переднего моста кости). Это последнее наблюдение кажется актуальным, поскольку возрастающая тяжесть образования остеофитов связана с сопутствующим сужением межпозвоночного дискового пространства [2], что, в свою очередь, вызывает жесткость спинного сегмента при сжатии [35]. Регрессионный анализ показал, что существенные различия между группами для F FAIL и E FAIL нельзя было объяснить только значительным различием в VTD, тем самым подтверждая роль позвоночных остеофитов в отказе. спинномозговых препаратов.
Для образцов с небольшими остеофитами сильная линейная связь между VTD образца и F FAIL и E FAIL хорошо согласуется с результатами, полученными в квазистатических условиях [20 , 24] и убедителен, поскольку сила разрушения — свойство, обычно зависящее от плотности. Напротив, ни один из параметров разрушения образцов со значительными остеофитами не коррелировал с VTD, что позволяет предположить, что значительные остеофиты вызывают значительные костные изменения, которые добавляют неопределенный вклад в прочность позвоночника.Аналогичные выводы были сделаны Al-Rawahi et al. [9] с измерениями МПК с помощью двухфотонной рентгеновской абсорбциометрии. Это открытие предполагает, что клиническая оценка риска переломов для образцов со значительными остеофитами должна основываться не только на VTD и общей морфологии образца до тех пор, пока не будут предоставлены дальнейшие исследования.
Поддерживая большую часть сжимающей нагрузки до разрушения, существенные остеофиты позвонков, по-видимому, обеспечивают защиту от напряжения нижележащего тела позвонка и предотвращают возникновение полного поперечного и горизонтального разрушения тела позвонка (часто связанного с взрывным переломом).Высокая частота взрывных переломов у образцов с небольшими остеофитами, несмотря на умеренно или сильно дегенерированный диск (степень 3 или 4), может быть объяснена более высокими сдвигающими силами, передаваемыми фасетками на заднюю стенку позвонка. Более того, защитный механизм, обеспечиваемый остеофитами позвонков, можно объяснить их способностью изменять сопротивление деформации соседних дисков (за счет увеличения их CSA) или их более высокой плотностью костей. Эти данные подтверждают гипотезу о том, что остеофиты являются адаптивными, а не дегенеративными [9], и что их присутствие позволяет снизить чрезмерную деформацию костей до нормального уровня.
В настоящем исследовании были проведены трупные тесты для оценки роли остеофитов тела позвонков на биомеханический ответ сегментов позвоночника при динамическом сжатии. Полученные результаты подтверждают нашу гипотезу о том, что существенные остеофиты позвонков играют ключевую роль в параметрах, типе, характере, локализации и прогнозировании риска переломов позвонков. В будущих работах будет полезно использовать вычислительные модели [48–50] для обхода ограничений, присущих тестам in vitro (размер выборки, биологические вариации, упрощенные нагрузки и т. Д.).). В этом отношении данные, представленные в настоящем исследовании, могут быть полезны для разработки и проверки этих инструментов.
Дополнительная информация
S1 Рис.
Индивидуальные данные для каждого субъекта, упорядоченные по группе с существенными остеофитами и с небольшими остеофитами.(TIF)
S1 Таблица
Индивидуальные данные для каждого субъекта: плотность трабекул позвонков (VTD), площадь поперечного сечения (CSA), высота образца (H), жесткость ( K ) и параметры разрушения () F FAIL , D FAIL и E FAIL ) без нормализации.(DOCX)
Благодарности
Авторы выражают особую благодарность Ю. Годио, К. Конте, М. Пи, К. Ренье и медицинскому персоналу «Service d’imagerie médicale de l’Hôpital Nord». для экспериментальной установки и in vitro для подготовки образцов и визуализации.
Заявление о финансировании
Эта работа была поддержана CEA: Канадским научно-исследовательским отделом ортопедической инженерии Совета по естественным наукам и инженерным исследованиям Канады.
Доступность данных
Все соответствующие данные находятся в документе.
Список литературы
3. Вайнберг Д., Се К.К., Лю Р.В., Гебхарт Дж.Дж., Гордон З.Л. Повышенная заболеваемость тазом связана с большей ориентацией коронковой фасетки в нижнем поясничном отделе позвоночника: трупное исследование 599 поясничных отделов позвоночника. Позвоночник. 2016; 41 (19): E1138–45. DOI: 10.1097 / BRS.0000000000001577 [PubMed] [Google Scholar] 4. О’Нил Т., МакКлоски Э.В., Канис Дж. А., Бхалла А. К., Рив Дж., Рид Д. М. и др. Распространение, детерминанты и клинические корреляты остеофитоза позвонков: популяционное обследование.J Rheumatol. 1999. 26 (4): 842–8. [PubMed] [Google Scholar] 6. Натан Х. Остеофиты позвоночника: анатомическое исследование их развития в зависимости от возраста, расы и пола с учетом их этиологии и значения. J Bone Joint Surg Am. 1962. 44 (2): 243–68. [Google Scholar] 7. Водица М., Косак Р., Венгуст Р. Отдаленные результаты хирургического лечения симптоматических передних шейных остеофитов: серия случаев с обзором литературы. Clin Spine Surg. 2016; 29 (9): E482–7. DOI: 10.1097 / BSD.0b013e31829046af [PubMed] [Google Scholar] 8. Гальбусера Ф., ван Райсберген М., Ито К., Хюйге Дж. М., Брайда-Бруно М., Вилке Х. Дж. Старение и дегенеративные изменения межпозвоночного диска и их влияние на гибкость позвоночника. Eur J Spine. 2014; 32: S324–32. [PubMed] [Google Scholar] 9. Аль-Равахи М., Луо Дж., Поллинтин П., Долан П., Адамс М.А. Механическая функция остеофитов тела позвонков, выявленная в экспериментах на трупных шипах. Позвоночник. 2011; 36 (10): 770–7. DOI: 10.1097 / BRS.0b013e3181df1a70 [PubMed] [Google Scholar] 11.Карри В., Пинтар Ф.А., Доан Н.Б., Нгуен Х.С., Эккардт Дж., Байсден Дж. Л. и др. Переломы замыкательной пластинки поясничного отдела позвоночника: биомеханическая оценка и клинические аспекты посредством экспериментальной индукции травмы. J Orthop Res. 2016; 34 (6): 1084–91. DOI: 10.1002 / jor.23112 [PubMed] [Google Scholar] 12. Вирджин В. Экспериментальные исследования физических свойств межпозвоночного диска. J Bone Joint Surg Br. 1951; 33-В: 607–11. [PubMed] [Google Scholar] 13. Бартелинк Д. Роль абдоминального давления в снятии давления на поясничные межпозвоночные диски.J Bone Joint Surg Br. 1957; 39-В: 718–25. [PubMed] [Google Scholar] 14. Хаттон В., Адамс Массачусетс. Можно ли сломать поясничный отдел при поднятии тяжестей? Позвоночник. 1982. 7 (6): 586–90. [PubMed] [Google Scholar] 15. Хаттон В., Адамс Массачусетс. Выпадение межпозвоночного диска. Травма, вызванная гиперфлексией, 1981 г. Премия Volvo в области фундаментальных наук. Позвоночник. 1982; 7 (3): 184–91. [PubMed] [Google Scholar] 16. Йоганандан Н., Рэй Дж., Пинтар Ф.А., Миклебуст Дж. Б., Сансес А. Мл. Критерии жесткости и энергии деформации для оценки порога повреждения межпозвонкового сустава.J Biomech. 1989. 22 (2): 135–42. [PubMed] [Google Scholar] 17. Очиа Р., Тенсер А.Ф., Чинг Р.П. Влияние скорости нагрузки на замыкательную пластину и прочность тела позвонков в поясничных позвонках человека. J Biomech. 2003. 36 (12): 1875–81. [PubMed] [Google Scholar] 18. Казарян Л, Грейвс Г.А. Характеристики прочности на сжатие позвоночника человека. Позвоночник. 1977; 2 (1): 1–14. [Google Scholar] 19. МакБрум Р., Хейс В. К., Эдвардс В. Т., Голдберг Р. П., Уайт А. А. 3-е место. Прогнозирование компрессионного перелома тела позвонка с помощью количественной компьютерной томографии.J Bone Joint Surg Am. 1985. 67 (8): 1206–14. [PubMed] [Google Scholar] 20. Singer K, Edmonston S, Day R, Breidahl P, Price R. Прогнозирование прочности на сжатие тела грудного и поясничного позвонков: корреляция с минеральной плотностью кости и областью позвоночника. Кость. 1995. 17 (2): 167–74. [PubMed] [Google Scholar] 21. Mosekilde L, Bentzen SM, Ortoft G, Jorgensen J. Прогностическая ценность количественной компьютерной томографии для прочности на сжатие тела позвонка и плотности золы. Кость. 1989. 10 (6): 465–70. [PubMed] [Google Scholar] 22.Cann C, Genant HK, Kolb FO, Etinger B. Количественная компьютерная томография для прогнозирования риска перелома позвонков. Кость. 1985; 6 (1): 1–7. [PubMed] [Google Scholar] 23. Дэн Х., Сюй Ф.Х., Дэвис К.М., Хини Р., Рекер Р. Различия в минеральной плотности костной ткани, минеральном содержании костной ткани и размере костной поверхности у женщин с переломами и без переломов, а также их взаимосвязь в позвоночнике и бедре. J Bone Miner Metab. 2002. 20 (6): 358–66. DOI: 10.1007 / s007740200052 [PubMed] [Google Scholar] 24. Эрикссон С., Исберг Б.О., Линдгрен Ю.Прогнозирование прочности позвоночника с помощью двухфотонной абсорбциометрии и количественной компьютерной томографии. Calcif Tissue Int. 1989. 44 (4): 243–50. [PubMed] [Google Scholar] 25. Ширадо О, Канеда К., Тадано С., Исикава Х., McAfee PC, Warder KE. Влияние дегенерации диска на механизм разрывных переломов грудопоясничного отдела. Позвоночник. 1992. 17 (3): 286–92. [PubMed] [Google Scholar] 26. Дай Л., Ван XY, Ван К.Г., Цзян Л.С., Сюй Х.З. Минеральная плотность костной ткани грудопоясничного отдела позвоночника по отношению к взрывным переломам: количественное исследование компьютерной томографии.Eur Spine J. 2006; 15 (12): 1817–22. DOI: 10.1007 / s00586-006-0148-2 [PubMed] [Google Scholar] 27. Zhao F, Pollintine P, Hole BD, Adams MA, Dolan P. Переломы позвонков обычно поражают замыкательную пластинку черепа, потому что она тоньше и поддерживается менее плотной губчатой костью. Кость. 2009. 44 (2): 372–9. DOI: 10.1016 / j.bone.2008.10.048 [PubMed] [Google Scholar] 29. Коккорис П., Хатзидакис И., Хацелис Э., Макрас П., Толумис Г. Плотность костей в бедре и поясничном отделе позвоночника у здорового мужского населения. Эндокринные аннотации.2016; 41: doi: 10.1530 / endoabs.41.EP114 [Google Scholar] 31. Томпсон Дж., Пирс Р.Х., Шехтер М.Т., Адамс М.Э., Цанг И.К., Епископ ПБ. Предварительная оценка схемы оценки общей морфологии межпозвоночного диска человека. Позвоночник (Phila Pa 1976). 1990; 15 (5): 411–5. [PubMed] [Google Scholar] 32. Макнаб И. Тяговая шпора. Индикатор сегментарной нестабильности. J Bone Joint Surg Am. 1971; 53 (4): 663–70. [PubMed] [Google Scholar] 34. Магерл Ф., Эби М., Гертцбейн С.Д., Хармс Дж., Назарян С. Исчерпывающая классификация травм грудного и поясничного отделов.Eur Spine J. 1994; 3 (4): 184–201. [PubMed] [Google Scholar] 35. Гальбусера Ф., Шмидт Х., Нейдлингер-Вильке С., Готтшалк А., Вильке Х. Дж. Механический ответ поясничного отдела позвоночника на различные комбинации дегенеративных изменений диска исследовали с использованием рандомизированных пороупругих моделей конечных элементов. Eur Spine J. 2011; 20 (4): 563–71. DOI: 10.1007 / s00586-010-1586-4 [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Кемпер А., Макнелли С., Дума С.М. Влияние скорости деформации на свойства жесткости на сжатие поясничных межпозвонковых дисков человека.Biomed Sci Instrum. 2007. 43: 176–81. [PubMed] [Google Scholar] 37. Дума С., Кемпер А.Р., Макнили Д.М., Бролинсон П.Г., Мацуока Ф. Биомеханический ответ поясничного отдела позвоночника при динамическом сжатии. Biomed Sci Instrum. 2006; 42: 476–81. [PubMed] [Google Scholar] 38. Диллон Н., Басс ЕС, Лотц Дж. Влияние замороженного хранения на ползучесть межпозвоночных дисков человека. Позвоночник. 2001. 26 (8): 883–8. [PubMed] [Google Scholar] 40. Сметерс Дж., Джоанес Д. Н.. Динамические сжимающие свойства поясничных межпозвонковых суставов человека: сравнение свежих и размороженных образцов.J Biomech. 1988. 21 (5): 425–33. [PubMed] [Google Scholar] 41. Кифуне М., Панджаби М.М., Аранд М., Лю В. Характер переломов и нестабильность грудопоясничных травм. Eur Spine J. 1995; 4 (2): 98–103. [PubMed] [Google Scholar] 42. Кифунэ М., Панджаби М.М., Лю В., Аранд М., Васавада А., Оксланд Т. Функциональная морфология позвоночного канала после замыкательных, клиновых и взрывных переломов. J Расстройство позвоночника. 1997. 10 (6): 457–66. [PubMed] [Google Scholar] 43. Пенджаби М., Оксланд Т.Р., Кифуне М., Аранд М., Вен Л., Чен А. Обоснованность теории трех столбцов грудопоясничных переломов.Позвоночник. 1995. 20 (10): 1122–7. [PubMed] [Google Scholar] 44. Панджаби М, Оксланд Т.Р., Лин Р.М., МакГоуэн Т.В. Грудопоясничный разрывной перелом. Биомеханическое исследование его разнонаправленной гибкости. Позвоночник (Phila Pa 1976). 1994. 19 (5): 578–85. [PubMed] [Google Scholar] 45. Линдаль О. Механические свойства высушенной обезжиренной губчатой кости. Акта Ортоп Сканд 1976; 47 (1): 11–9. [PubMed] [Google Scholar] 46. Картер Д., Хейс WC. Сжимающее поведение кости как двухфазной пористой структуры. J Bone Joint Surg Am 1977. 59 (7): 954–62.[PubMed] [Google Scholar] 47. Эдмондстон С., Певица КП, Дэй РЭ, Брейдал П.Д., Прайс РИ. Взаимосвязь in vitro между плотностью тела позвонка, размером и прочностью на сжатие в грудопоясничном отделе позвоночника пожилого возраста. Clin Biomech (Бристоль, Эйвон). 1994. 9 (3): 180–86. [PubMed] [Google Scholar] 48. Chagnon A, Aubin CE, Villemure I. Биомеханическое влияние свойств диска на передачу нагрузки здоровых и дегенерированных дисков с использованием пороупругой модели конечных элементов. J Biomech Eng. 2010; 132 (11): 111006 DOI: 10.1115 / 1.4002550 [PubMed] [Google Scholar] 49. Эль-Рич М., Арну П.Дж., Ваньак Э, Брюне С., Обен С.Е. Конечноэлементное исследование влияния скорости нагрузки на изменения распределения нагрузки на позвоночник в условиях удара. J Biomech. 2009. 42 (9): 1252–62. DOI: 10.1016 / j.jbiomech.2009.03.036 [PubMed] [Google Scholar] 50. Wagnac E, Arnoux PJ, Garo A, Aubin CE. Конечно-элементный анализ влияния скорости нагружения на модель всего поясничного отдела позвоночника в условиях динамического нагружения. Med Biol Eng Comput. 2012; 50 (9): 903–15.DOI: 10.1007 / s11517-012-0908-6 [PubMed] [Google Scholar]Существенные остеофиты тела позвонков защищают от тяжелых переломов позвонков при компрессии
PLoS One. 2017; 12 (10): e0186779.
, Концептуализация, курирование данных, формальный анализ, исследование, методология, администрирование проекта, ресурсы, проверка, визуализация, написание — первоначальный черновик, написание — просмотр и редактирование, 1, 2, 3, * , Концептуализация, получение финансирования, методология, администрирование проекта, надзор, проверка, написание — обзор и редактирование, 3, 4, 5 , исследование, ресурсы, написание — обзор и редактирование, 6, 7 , Концептуализация, Написание — просмотр и редактирование, 2, 5, 8 , Формальный анализ, Визуализация, Написание — просмотр и редактирование, 1 , Концептуализация, Визуализация, Написание — обзор и редактирование, 1, 2, 3 , Курирование данных, Исследование, Написание — просмотр и редактирование, 4, 9 и, Концептуализация, Методология, Управление проектами, Ресурсы, Надзор, Написание — re просмотр и редактирование 9, 10Eric Wagnac
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
Карл-Эрик Обен
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
4 Кафедра машиностроения, Политехническая школа Монреаля, Монреаль, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
Катя Чаумутр
6 Отделение медицинской визуализации, Северная больница, Университет Экс Марсель, Марсель, Франция
7 Laboratoire d’Anthropologie Biologique, Университет Экс Марсель, Марсель, Франция
Жан-Марк Мак-Тионг
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
8 Отделение хирургии медицинского факультета Монреальского университета, Монреаль, Квебек, Канада
Анн-Лор Менар
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
Иван Пети
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
Анаис Гаро
4 Департамент машиностроения, Политехническая школа Монреаля, Монреаль, Канада
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
Pierre-Jean Arnoux
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
10 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Марсель, Франция
Хосе Мануэль Гарсия Аснар, редактор
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
4 Кафедра машиностроения, Политехническая школа Монреаля, Монреаль, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
6 Отделение медицинской визуализации, Северная больница, Университет Экс Марсель, Марсель, Франция
7 Лаборатория биологической антропологии, Университет Экс Марсель, Марсель, Франция
8 Отделение хирургии медицинского факультета Монреальского университета, Монреаль, Квебек, Канада
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
10 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Марсель, Франция
Университет Сарагосы, ИСПАНИЯ
Конкурирующие интересы: Авторы заявили, что не существует конкурирующих интересов.
Поступила 17.05.2017; Принято 6 октября 2017 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. другими статьями в PMC.- Дополнительные материалы
-
S1 Рис. Индивидуальные данные для каждого субъекта, упорядоченные по группе с существенными остеофитами и с небольшими остеофитами.(TIF)
GUID: 02E46D00-34BE-4701-ADF6-01A8E5BF4A2B
S1 Таблица: Индивидуальные данные для каждого испытуемого: трабекулярная плотность позвонков (VTD), площадь поперечного сечения (CSA), высота образца (H), жесткость ( K ) и параметры отказа ( F FAIL , D FAIL и E FAIL ) без нормализации. (DOCX)
GUID: EC8270B3-7D62-4E9E-94A5-FDB3AC5E64C5
- Заявление о доступности данных
-
Все соответствующие данные находятся в документе.
Abstract
Недавние открытия предполагают, что остеофиты позвоночника повышают сопротивляемость позвоночника сжатию. Однако роль остеофитов позвоночника в биомеханической реакции позвоночника при быстром динамическом сжатии, вплоть до отказа, неясна. Семнадцать образцов позвоночника человека, состоящего из трех позвонков (от T5-T7 до T11-L1) и окружающих их мягких тканей, были взяты у девяти трупов в возрасте от 77 до 92 лет. Образцы получали с помощью количественной компьютерной томографии (ККТ) для медицинского наблюдения, классификации дегенерации межпозвонкового диска (степень Томсона) и измерения плотности трабекул позвонков (VTD), высоты и площади поперечного сечения.Образцы были разделены на две группы (с (n = 9) или без (n = 8) существенными остеофитами тела позвонков) и подверглись осевому сжатию со скоростью динамического смещения 1 м / с, вплоть до отказа. Нормализованные кривые «сила-смещение», видео и изображения QCT позволили охарактеризовать параметры разрушения (сила, смещение и энергия при разрыве) и характер разрушения. Результаты были проанализированы с использованием критериев хи-квадрат для выборочных распределений и линейной регрессии для корреляции между VTD и параметрами отказов.Образцы со значительными остеофитами тела позвонков демонстрируют более высокую жесткость (в среднем в 2,7 раза) и силу при разрушении (в среднем в 1,8 раза), чем другие сегменты. Наличие остеофитов существенно влияет на расположение, характер и тип перелома. VTD был хорошим предиктором динамической силы и энергии при разрушении для образцов без существенных остеофитов. Это исследование также показало, что остеофиты тела позвонка обеспечивают защитный механизм нижележащего позвонка от тяжелых компрессионных переломов.
Введение
Остеофит тела позвонка — распространенная форма остеоартрита, определяемая как аномальный костный рост или костная шпора, образующаяся вдоль межпозвонковых суставов [1]. На поздних стадиях развития остеофитов соседние позвонки срастаются друг с другом, образуя костный мост через межпозвоночный диск, называемый мостиковым остеофитом. Остеофиты позвонков обычно связаны со старением, дегенерацией межпозвоночного диска, травматическими повреждениями, склерозом замыкательной пластинки, сужением дискового пространства [1, 2], ремоделированием фасеточных суставов [3], болями в спине [4] и диффузным идиопатическим гиперостозом скелета (DISH) или болезнью Форестье. [5].Соответственно, значительный остеофит можно найти в 20–25% шипов в возрасте 20–45 лет и в 73–90% шипов старше 60 лет [2–4, 6]. Осложнения, связанные с образованием остеофитов, многочисленны (дисфагия, компрессия грудной аорты, обструкция полой вены, компрессия нервных корешков) и влияют на большинство структур, расположенных в непосредственной близости от позвоночника. Как следствие, они обычно рассматриваются как дегенеративное состояние и могут быть удалены хирургическим путем традиционными или малоинвазивными методами во время операций на позвоночнике, когда они приводят к инвалидности или неврологическим симптомам [1, 7].Недавно было высказано предположение, что остеофиты позвоночника в первую очередь стабилизируют позвоночник при изгибе и повышают его сопротивление при сжатии [8, 9]. Действительно, если остеофиты обеспечивают стабильность, добавляя кость и увеличивая площадь поперечного сечения позвонков, они также могут обеспечивать защитный механизм от переломов позвонков, несмотря на генерализованную остеопению, наблюдаемую в большинстве стареющих позвоночников.
Однако механическая роль остеофитов тела позвонков в отношении риска и тяжести переломов позвоночника остается неясной.Большинство переломов позвонков варьируются от болезненных компрессионных переломов до более серьезных травм, таких как разрывные и дистракционные переломы. Многие из них расположены на средне-грудном, грудопоясничном или среднем поясничном уровнях и являются результатом механизма осевой компрессии с комбинированным сгибанием или без него [10]. Чтобы лучше понять биомеханику переломов позвонков, было проведено множество экспериментальных исследований трупных тканей человека при осевом сжатии. Несущая способность отдельных позвонков и функциональных спинномозговых единиц (FSU) сформировала основу для количественной оценки устойчивости межпозвоночной структуры к сопротивлению нагрузке и сохранению невредимости [11–18].Другие дополнительные исследования были нацелены на прогнозирование риска переломов позвоночника путем выявления потенциальных корреляций между нагрузкой отказа / переломами позвонков отдельных позвонков или ПСС и клиническими измерениями, такими как минеральная плотность кости (МПК) и морфология [19–24], степень поражения дегенерация [25] и костная архитектура [26–28].
Хотя вышеупомянутые эксперименты предоставили существенное понимание биомеханики переломов позвонков, ни один из них не объяснил механический вклад остеофитов позвоночника.Недавно было высказано предположение, что остеофиты позвоночника увеличивают сопротивление позвоночника сжатию и что в их присутствии клинические измерения МПК занижают прочность позвоночника на сжатие [9, 29]. Однако их тесты на трупах проводились при квазистатических физиологических нагрузках (без отказов). Следовательно, они не воспроизводили динамические реальные условия травм (например, падения или дорожно-транспортные происшествия), которые приводят к компрессионным переломам позвонков.
Настоящее исследование направлено на анализ роли значительных остеофитов позвоночника на биомеханическую реакцию позвоночника при динамическом сжатии, вплоть до отказа.Их влияние на прогноз прочности позвонков на сжатие посредством клинических измерений также было исследовано. Наша гипотеза состоит в том, что существенные остеофиты позвонков имеют значительное влияние на параметры, тип, характер, расположение и прогноз риска переломов позвонков, когда позвоночник подвергается динамической компрессии.
Материалы и методы
Трупные образцы
Протокол исследования был одобрен институциональным наблюдательным советом IFSTTAR / Университета Экс-Марсель.Ни один из доноров трансплантата не был из уязвимой группы населения, и все доноры или ближайшие родственники предоставили письменное информированное согласие, которое было дано свободно. Семнадцать образцов человеческих сегментов позвоночника, состоящих из трех позвонков и окружающих их мягких тканей, были взяты из девяти забальзамированных трупов. Средний возраст, рост стоя и вес испытуемых составляли 86 ± 5 лет, 164 ± 6 см и 60 ± 13 кг (). Семь экземпляров были расположены в T11-L1, семь — в T8-T10 и три — в T5-T7. Все костные ребра и несвязочные мягкие ткани были удалены из образцов, и изображения количественной компьютерной томографии (ККТ) были получены с использованием клинического сканера (SIEMENS Somatom Sensation Cardiac 64: 120 кВ, 300–350 мАс, смежные срезы 0.6 мм) для медицинского наблюдения, классификации и измерения остеофитов, которые наблюдались на всех позвоночных уровнях. Каждый образец классифицировали в соответствии с направлением каждой пары остеофитов в межпозвоночном пространстве [30] и в соответствии со схемой классификации дегенерации диска Томсона [31]. Размер остеофитов измеряли с использованием метода, описанного Аль-Равахи и др. [9]. Экземпляры были разделены на две группы (). В первой группе (n = 9), названной «образцы со значительными остеофитами», были остеофиты типа C, характеризующиеся почти полным костным мостом, сформированным через пространство межпозвонкового диска.Их остеофиты варьировали от 10 до 15 мм. Во второй группе (n = 8), названной «образцы с небольшими остеофитами», были остеофиты типа E, характеризующиеся остеофитами, которые простирались почти горизонтально до границы тела позвонка, не закрывая пространство межпозвонкового диска. Их остеофиты варьировались от 2 мм (минимальный размер, чтобы считать шпору остеофитом [32]) до 5 мм.
Таблица 1
Подробная информация о 17 образцах спинного мозга, извлеченных из 9 трупов.
| ID субъекта | Пол | Возраст (лет) | Вес (кг) | Рост стоя (см) | Образец | Группа | IVD | 88 | 64 | 155 | T11-L1 | 1 | 5 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 02 | F | 83 | 49 | 165 | 83 9028 3 | -T4- ||||||||||||||||
| 03 | F | 85 | 48 | 154 | T11-L1 | 1 | 5 | ||||||||||||||
| 04 | F | 92 | 54 1 | 5 | |||||||||||||||||
| T11-L1 | 2 | 4 | |||||||||||||||||||
| 05 | F | 9028 3 9339 | 165 | T8-T10 | 2 | 3 | |||||||||||||||
| T11-L1 | 2 | 88 | 71 | 165 | T8-T10 | 2 | 4 | ||||||||||||||
| T11-L1 | |||||||||||||||||||||
| M | 77 | 75 | 173 | T5-T7 | 2 | 3 | |||||||||||||||
| T11-L1 | 2 | 3 | |||||||||||||||||||
| 08 | M | 90 | 91 | 170 | T5-T7 | 1 | 5 | ||||||||||||||
| T8-T10 | 1 | 5 | 9028 -L1 | 1 | 5 | ||||||||||||||||
| 09 | M | 82 | 53 | 165 | T5-T7 | 1 | 5 | 9028 T8-T10 | 1 | 5 |
Затем были проведены измерения плотности трабекул позвонков (VTD), высоты (H) и площади поперечного сечения (CSA) каждого образца.VTD измеряли на каждом позвонке, создавая сканирующий участок толщиной 9 мм, параллельный замыкательным пластинкам позвонка, в средней плоскости тела позвонка [33]. Положение тела посередине позвонка подтверждалось входом базивертебральной вены в среднюю плоскость сканируемого разреза. Средняя единица Хаунсфилда (HU) была рассчитана для интересующей овальной области размером 25 мм 2 , которая включала только губчатую кость (без кортикального ободка или частей базивертебральной вены). Для целей стандартизации (калибровки) средние значения HU каждого позвонка были преобразованы в значения VTD (г / мм 3 ) с использованием линейной регрессии, полученной из фантома электронной плотности КЛКТ (модель 062A, CIRS Inc., Вирджиния, США), помещенные рядом с образцами позвоночника во время ККТ. В конце концов, VTD образца была рассчитана путем усреднения VTD трех составляющих его позвонков. Высота образца измерялась между центром верхней и нижней замыкательных пластинок хвостового и дистального позвонков соответственно. ППС каждого позвонка измеряли по середине тела позвонка. Общая ППС образца была получена путем усреднения ППС трех позвонков. После визуализации образцы замораживали при -20 ° C до тестирования.
Испытательное оборудование и процедуры
Динамическое осевое сжатие было выполнено с использованием сервогидравлической системы испытаний материалов (MTS Axial 370.02 15 кН, Эден-Прери, Миннесота), которая включала одноосный датчик нагрузки и индуктивный датчик смещения для измерения силы привода и отклонение (). Две высокоскоростные камеры (1000 кадров в секунду) были размещены в стороне от образца для визуализации и хронологического отслеживания повреждений позвоночника. За два дня (48 ч) до испытания образцы оттаивали в холодильнике (4 ° C) и накрывали полотенцами, пропитанными физиологическим раствором.Чтобы зафиксировать образец на MTS и равномерно нагружать его, половина дистального и проксимального позвонков была помещена в параллельные чашки, заполненные полиуретановой смолой за двадцать четыре часа до испытания. Во время этого процесса сохранялась сагиттальная естественная кривизна образцов.
Экспериментальная установка, состоящая из сервогидравлической системы испытания материалов (1), двух высокоскоростных камер (2), одноэлементного датчика нагрузки (3) и трупного сегмента позвоночника (4). Трупный сегмент позвоночника (4) был зафиксирован на MTS путем заливки дистального и проксимального позвонков в полиуретановую смолу (5).
Перед испытанием образцы размораживали при комнатной температуре (23 ° C) в течение 3 часов. Каждый образец помещали на MTS и прикладывали предварительную нагрузку 0,25 кН в течение 1 минуты [20]. Затем образцы подвергались динамическому сжатию со скоростью 1 м / с до разрушения. Испытание было остановлено, когда образец был сжат примерно до 60% высоты среднего позвонка (от 12 до 15 мм). Все испытания проводились при комнатной температуре. После сжатия для медицинской диагностики были сделаны изображения QCT образцов.
Анализ данных и статистика
Кривые сила-смещение были записаны и нормализованы (F норма = f (D норма )) в соответствии со средним размером всех образцов, как описано уравнениями (1) и (2) :
Fnorm = FCSAspecimenMeanCSA = F.MeanCSACSAspecimen
(1)
Dnorm = DHeightspecimenMeanHeight = D.MeanHeightHeightspecimen
(2)
(4) уровни.Разрушение было определено как первая точка, в которой дальнейшее увеличение смещения вызвало уменьшение нагрузки. Из каждой кривой были извлечены нормализованная жесткость ( K ), сила ( F FAIL ), смещение ( D FAIL ) и энергия при отказе ( E FAIL ). . Жесткость определялась как наклон наиболее линейного участка кривой до разрушения. Энергия разрушения определялась как площадь под кривой «сила-смещение» до разрушения.Среднее и стандартное отклонения биомеханических параметров ( K , F FAIL , D FAIL и E FAIL ) были вычислены для каждой группы и статистически сравнивались. Воспроизведение тестов и чистые оценки дисперсии ошибок для биомеханических параметров не могли быть выполнены, поскольку тесты были деструктивными.
Обычные модели линейной регрессии были приспособлены для оценки степени линейной корреляции между VTD и каждым измеряемым параметром для каждой группы, без учета какого-либо взаимодействия между параметрами.Чтобы проверить, была ли взаимосвязь между VTD и нормализованными биомеханическими параметрами для группы с небольшими остеофитами аналогична группе с существенными остеофитами, модель, подобранная для первой группы, использовалась для прогнозирования биомеханических параметров другой группы. Затем биомеханические параметры (среднее и стандартное отклонение), рассчитанные на основе этих соотношений, сравнивали с биомеханическими параметрами, полученными экспериментально для другой группы.
Видео были проанализированы для определения места разрушения и характера трещин.ККТ-изображения сломанных образцов были использованы для определения типа перелома на основе классификации AO (инициалы немецких терминов «Arbeitsgemeinschaft für Osteosynthesefragen») для грудных и поясничных травм [34]. Тесты хи-квадрат были выполнены для изучения влияния остеофитов на расположение, тип и характер перелома. Все статистические анализы были выполнены с использованием программы STATISTICA v.7.0 (StatSoft, Талса, Оклахома, США). Различия считали достоверными при p <0.05.
Результаты
Морфология и плотность трабекул позвонков
Образцы со значительными остеофитами показали более высокий (в 1,6 раза) VTD, чем образцы с небольшими остеофитами (p = 0,003) (см. Рис. S1 и таблицу S1). Они также показали большую площадь поперечного сечения (p = 0,307), но меньшую высоту (p = 0,071). Однако, в отличие от VTD, различия в общей морфологии образцов не были значительными.
Таблица 2
Плотность трабекул позвонков (VTD), площадь поперечного сечения (CSA) и высота образца (H) по группам образцов (среднее значение ± стандартное отклонение).
| Образцы с существенными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | Отношение (существенное / малое) | |
|---|---|---|---|
| VTD4 (г / мм) ) | 103 ± 24 | 64 ± 25 | 1,60 * |
| CSA (мм 2 ) | 1062 ± 171 | 1009 ± 251 | 1,05 |
| 77.0 ± 5,0 | 81,3 ± 6,6 | 0,95 |
Кривые «сила-перемещение»
Все образцы имели нормированные кривые «сила-перемещение» одинаковой формы (). Кривые со встроенными маркерами (квадраты, треугольники, кресты и т. Д.) Представляют образцы со значительными остеофитами. Типичная кривая изображена на. До разрушения кривая имеет нелинейную форму, характеризующуюся первым изогнутым сегментом увеличивающейся жесткости (сегмент A-B), за которым сразу следует линейный сегмент (B-C).Этот линейный сегмент предшествует сильно нелинейному сегменту (C-D), характеризующемуся уменьшающейся жесткостью. Сегмент BC называется упругой частью кривой, в то время как сегмент CD называется неупругой частью, где повреждение на микроуровне (потеря целостности материала из-за образования трещин и пустот, ухудшающих жесткость), пластичность (процесс течения, создающий безвозвратные повреждения). деформации) и вязкоупругости (диссипативный процесс). После разрушения (точка D) кривая показывает уменьшение прочности (D-E) до точки E, после чего образец либо сохраняет (девять образцов), либо восстанавливает (восемь образцов) некоторую прочность (сегмент E-F).
Нормированные кривые «сила-смещение» для образцов T5-T7 (a), T8-T10 (b) и T11-L1 (c). Кривые с символами представляют образцы со значительными остеофитами. Эти образцы показали большую жесткость, нагрузки и смещения до разрушения.
Типичная кривая силы-смещения (F-D) (образец T11-L1, объект 3).Шесть сегментов (от A-B до E-F), изображенные на этой кривой, наблюдались на всех образцах.
Нормализованная жесткость и параметры разрушения
Средняя нормализованная жесткость ( K ) образцов со значительными остеофитами составляла 1.В 9 раз превышает жесткость образцов с мелкими остеофитами (). Среднее значение F FAIL , D FAIL и E FAIL образцов со значительными остеофитами было в 2,7, 1,8 и 5,3 раза больше соответствующих значений образцов с небольшими остеофитами, соответственно. . Все различия между группами были статистически значимыми, со значениями p 0,0004 ( K ), 0,0006 ( F FAIL ), 0.006 ( D FAIL ) и 0,002 ( E FAIL ).
Таблица 3
Нормализованные параметры жесткости и разрушения по группам (среднее значение ± стандартное отклонение).
| Образцы со значительными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | Отношение (существенное / малое) | ||
|---|---|---|---|---|
| 3207 ± 735 | 1716 ± 586 | 1.9 † | ||
| F ОТКАЗ (N) | 6873 ± 2534 | 2510 ± 1152 | 2,7 † | |
| D ОТКАЗ (мм) 3,5803 | 1,9 ± 0,91,8 † | |||
| E FAIL (J) | 14,8 ± 8,1 | 2,8 ± 2,4 | 5,3 † | |
Корреляция между 9 нормализованными параметрами биомеханики VT образцы со значительными остеофитами, не было обнаружено статистически значимой корреляции между VTD и биомеханическими параметрами ().Для образцов с небольшими остеофитами VTD был хорошим предиктором нормализованного
F FAIL (r 2 = 0,80, p <0,03) и E FAIL (r 2 = 0,55, р <0,035). Напротив, VTD не коррелировал с K (r 2 = 0,42, p <0,12) и D FAIL (r 2 = 0,33, p <0,14). Линейная регрессия между VTD и нормализованными биомеханическими параметрами.VTD коррелировал только с нормализованными F FAIL и E FAIL образцов без остеофитов.
Следуя этим результатам, значения для F FAIL и E FAIL были предсказаны с использованием линейных соотношений и VTD образцов со значительными остеофитами, так что образцы с аналогичным VTD могли быть в сравнении. Опять же, значительные различия были обнаружены между группами ( F FAIL = 4117 ± 1002 N; E FAIL = 5.5 ± 1,7), таким образом гарантируя, что одна VTD не может объяснить различия, наблюдаемые между группами.
Типы, типы и места переломов
При неудаче видеоанализ показал, что один из позвонков разрушился, и костный мозг был выброшен струями в месте перелома, а также из отверстий и сосудистых каналов в коре головного мозга. Тело первого позвонка, разрушившееся, и характер перелома значительно различались между двумя группами образцов. Действительно, первое тело позвонка, которое разрушилось, было средним или дистальным для семи из восьми образцов с небольшими остеофитами (), в то время как оно было проксимальным для восьми из девяти образцов со значительными остеофитами ().
Разрушение первого позвонка с характерным переломом.a) Образец без остеофитов (образец сегмента T11-L1 субъекта 3). Средний позвонок (Т12) разрушается первым. Горизонтальный узор разделяет позвонок на верхнюю и нижнюю части. На ККТ-изображении наблюдается взрывная трещина. б) Образец со значительными остеофитами (сегмент Т8-Т10 субъекта 2). Проксимальный позвонок (Т11) разрушается первым. Вертикальный узор разделяет позвонок на переднюю и заднюю части.На ККТ-изображении наблюдается перелом остеофита. Пунктирными линиями обозначен выброс костного мозга на месте перелома.
На корковых поверхностях были идентифицированы три модели перелома. В первом варианте кортикальная кость раскалывается по окружности и по горизонтали в центре, оставляя линию, разделяющую тело позвонка на верхнюю и нижнюю части (). Во втором случае кортикальная кость раскалывается вертикально, оставляя линию, которая в основном разделяет тело позвонка на переднюю и заднюю части ().Третий образец представлял собой комбинацию двух других образцов и привел к полному разрушению образца. Первая картина наблюдалась на семи из восьми образцов с небольшими остеофитами, а вторая картина наблюдалась на семи из девяти образцов со значительными остеофитами. Третий образец наблюдали на одном экземпляре из каждой группы.
КТ-изображения показали, что наличие значительных остеофитов влияет на типы переломов (). У пяти образцов с небольшими остеофитами был полный взрывной перелом с ретропульсивным фрагментом кости и нарушением канала (тип А.3.3 классификации AO), а у трех из этих образцов был ударный перелом с коллапсом тела позвонка (тип A.1.3). Только у одного образца с остеофитами позвонков был полный взрывной перелом (с переломом остеофита). Остальные восемь образцов имели ударный перелом с коллапсом тела позвонка (тип A.1.3), иногда с небольшим смещением задней кортикальной стенки. Среди этих образцов у шести были переломы по крайней мере одного из их остеофитов.
Таблица 4
Распределение типов трещин по группам образцов.
| Типы переломов | Образцы со значительными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | ||
|---|---|---|---|---|
| Разрывные переломы | 0 | 5 | ||
| — С переломом остеофита | 1 | 0 | ||
| Импульсный перелом или коллапс тела позвонка | 9028 — 9028 — 9028 — | — С переломом остеофита | 6 | 0 |
Обсуждение
Предыдущие исследования [9, 35] показали, что остеофиты позвонков вызывают значительные изменения устойчивости и гибкости ПСС в квазистатических или физиологических условиях нагрузки. .Настоящее исследование отличается тем, что были протестированы более длинные сегменты позвоночника (трехпозвоночные) при динамическом сжатии и оценена роль остеофитов тела позвонков в механизмах перелома сегментов позвоночника. Значительные остеофиты позвонков увеличивают жесткость и несущую способность сегментов позвоночника. Они также влияют на характер, расположение и прогнозирование риска переломов позвонков.
Ограничения настоящего исследования необходимо обсудить до интерпретации результатов.Во-первых, из-за ограниченной доступности и стоимости человеческих трупов у девяти испытуемых было извлечено только семнадцать образцов. Такой небольшой размер выборки является важным ограничением исследования. Поэтому, чтобы максимизировать размер выборки, данные разных полов и уровней позвоночника были объединены вместе с использованием процесса нормализации. Однако антропометрические различия между мужчинами и женщинами () могли уменьшить или замаскировать потенциальные корреляции с VTD, хотя обе группы содержали образцы мужчин и женщин.Было бы интересно изучить влияние пола и найти гендерные корреляции с большим количеством выборок. С этой точки зрения индивидуальные данные биомеханических параметров были доступны для дальнейшего использования (рис. S1 и таблица S1). Также размеры тела позвонков зависят от пола; поэтому учет поперечных сечений позвонков имеет первостепенное значение для выражения силы, необходимой для сравнения образцов. Процесс нормализации, подобный построению инженерных кривых напряжения-деформации, был выбран таким образом, чтобы биомеханические параметры были выражены в единицах, согласующихся с теми, которые обычно используются клиницистами или сообщаются в других исследованиях [9, 16, 36, 37].Нормализованная сила была предпочтительнее сжимающего напряжения для выражения нагрузки, поскольку позвонки являются неоднородными и сложными материалами. Нормализация была основана на средней CSA тела среднего позвонка и общей высоте образцов, поскольку эти морфологические параметры не изменились из-за присутствия остеофитов. Во-вторых, условия хранения образцов могли повлиять на результаты, но замораживание и хранение существенно не меняют их физические свойства [38–40]. Наконец, применяемые нагрузки и граничные условия были упрощены по сравнению с реальными ситуациями травм (падения, автомобильные аварии и т. Д.).) из-за очень ограниченных знаний о сложных нагрузках, возникающих в таких ситуациях, и из-за присущих им трудностей экспериментального воспроизведения этих нагрузок. Однако полученные в результате переломы были аналогичны тем, которые наблюдались клинически, и энергия, приложенная к образцам, хорошо согласовывалась с энергией, примененной в других экспериментах in vitro , направленных на воспроизведение компрессионных переломов [41–44].
Обе группы образцов показали последовательные механические реакции вплоть до разрушения, с нормализованными кривыми силы-смещения, показывающими аналогичные формы (сегменты от A-B до C-D), как кривые сила-смещение, описанные в других исследованиях [16, 37].Более того, основные силы разрушения 6873 ± 2534 Н и 2510 ± 1152 Н, соответственно, наблюдаемые на образцах со значительными и небольшими остеофитами, находились в том же диапазоне, что и в аналогичных экспериментах, проведенных на здоровых поясничных сегментах позвоночника двух и шести позвонков [37]. . После отказа обе группы образцов смогли сохранить или увеличить свою прочность (сегменты E-F). Эта характеристика может быть объяснена механизмом раздавливания губчатого вещества кости. Lindahl [45] наблюдал аналогичные кривые после сжатия небольших кубических блоков пояснично-губчатой кости.Картер и Хейс [46] предположили, что по мере увеличения нагрузки коллапс увеличивающегося количества межтрабекулярных пространств ограничивает движение костного мозга, тем самым обеспечивая гидравлическую амортизацию спинного сегмента. Они также сообщили, что образцы с повышенной прочностью после разрушения были связаны с более высокой общей минеральной плотностью кости. В текущем исследовании образцы с остеофитами позвонков были связаны с более высоким VTD и были способны выдерживать большие нагрузки после неудачи ().На данный момент невозможно подтвердить, может ли этот более высокий VTD, который был измерен в пределах кортикального края, быть отнесен к образованию остеофитов или биологическим различиям между образцами. В дальнейшем исследовании анализ образцов с использованием структур трещин большего размера также может улучшить корреляцию с VTD.
Биомеханические параметры образцов с небольшими остеофитами хорошо согласуются с данными других экспериментальных исследований, проведенных в аналогичных условиях [36, 37, 47].Более высокие значения K и F FAIL , измеренные для образцов со значительными остеофитами, хорошо согласуются с результатами Al-Rawahi et al. [9], которые показали на постсоветском пространстве, что остеофиты умножают эти параметры в 1,17 и 1,18 раза соответственно. Наши более высокие коэффициенты размножения (1,9 и 2,7 соответственно) могут быть связаны с различными условиями нагрузки (динамическое и квазистатическое сжатие), а также природой и размером протестированных остеофитов (длина остеофитов в Al-Rawahi et al.[9] в среднем составляли 7 мм, и ни у одного из них не было обнаружено полного и жесткого переднего моста кости). Это последнее наблюдение кажется актуальным, поскольку возрастающая тяжесть образования остеофитов связана с сопутствующим сужением межпозвоночного дискового пространства [2], что, в свою очередь, вызывает жесткость спинного сегмента при сжатии [35]. Регрессионный анализ показал, что существенные различия между группами для F FAIL и E FAIL нельзя было объяснить только значительным различием в VTD, тем самым подтверждая роль позвоночных остеофитов в отказе. спинномозговых препаратов.
Для образцов с небольшими остеофитами сильная линейная связь между VTD образца и F FAIL и E FAIL хорошо согласуется с результатами, полученными в квазистатических условиях [20 , 24] и убедителен, поскольку сила разрушения — свойство, обычно зависящее от плотности. Напротив, ни один из параметров разрушения образцов со значительными остеофитами не коррелировал с VTD, что позволяет предположить, что значительные остеофиты вызывают значительные костные изменения, которые добавляют неопределенный вклад в прочность позвоночника.Аналогичные выводы были сделаны Al-Rawahi et al. [9] с измерениями МПК с помощью двухфотонной рентгеновской абсорбциометрии. Это открытие предполагает, что клиническая оценка риска переломов для образцов со значительными остеофитами должна основываться не только на VTD и общей морфологии образца до тех пор, пока не будут предоставлены дальнейшие исследования.
Поддерживая большую часть сжимающей нагрузки до разрушения, существенные остеофиты позвонков, по-видимому, обеспечивают защиту от напряжения нижележащего тела позвонка и предотвращают возникновение полного поперечного и горизонтального разрушения тела позвонка (часто связанного с взрывным переломом).Высокая частота взрывных переломов у образцов с небольшими остеофитами, несмотря на умеренно или сильно дегенерированный диск (степень 3 или 4), может быть объяснена более высокими сдвигающими силами, передаваемыми фасетками на заднюю стенку позвонка. Более того, защитный механизм, обеспечиваемый остеофитами позвонков, можно объяснить их способностью изменять сопротивление деформации соседних дисков (за счет увеличения их CSA) или их более высокой плотностью костей. Эти данные подтверждают гипотезу о том, что остеофиты являются адаптивными, а не дегенеративными [9], и что их присутствие позволяет снизить чрезмерную деформацию костей до нормального уровня.
В настоящем исследовании были проведены трупные тесты для оценки роли остеофитов тела позвонков на биомеханический ответ сегментов позвоночника при динамическом сжатии. Полученные результаты подтверждают нашу гипотезу о том, что существенные остеофиты позвонков играют ключевую роль в параметрах, типе, характере, локализации и прогнозировании риска переломов позвонков. В будущих работах будет полезно использовать вычислительные модели [48–50] для обхода ограничений, присущих тестам in vitro (размер выборки, биологические вариации, упрощенные нагрузки и т. Д.).). В этом отношении данные, представленные в настоящем исследовании, могут быть полезны для разработки и проверки этих инструментов.
Дополнительная информация
S1 Рис.
Индивидуальные данные для каждого субъекта, упорядоченные по группе с существенными остеофитами и с небольшими остеофитами.(TIF)
S1 Таблица
Индивидуальные данные для каждого субъекта: плотность трабекул позвонков (VTD), площадь поперечного сечения (CSA), высота образца (H), жесткость ( K ) и параметры разрушения () F FAIL , D FAIL и E FAIL ) без нормализации.(DOCX)
Благодарности
Авторы выражают особую благодарность Ю. Годио, К. Конте, М. Пи, К. Ренье и медицинскому персоналу «Service d’imagerie médicale de l’Hôpital Nord». для экспериментальной установки и in vitro для подготовки образцов и визуализации.
Заявление о финансировании
Эта работа была поддержана CEA: Канадским научно-исследовательским отделом ортопедической инженерии Совета по естественным наукам и инженерным исследованиям Канады.
Доступность данных
Все соответствующие данные находятся в документе.
Список литературы
3. Вайнберг Д., Се К.К., Лю Р.В., Гебхарт Дж.Дж., Гордон З.Л. Повышенная заболеваемость тазом связана с большей ориентацией коронковой фасетки в нижнем поясничном отделе позвоночника: трупное исследование 599 поясничных отделов позвоночника. Позвоночник. 2016; 41 (19): E1138–45. DOI: 10.1097 / BRS.0000000000001577 [PubMed] [Google Scholar] 4. О’Нил Т., МакКлоски Э.В., Канис Дж. А., Бхалла А. К., Рив Дж., Рид Д. М. и др. Распространение, детерминанты и клинические корреляты остеофитоза позвонков: популяционное обследование.J Rheumatol. 1999. 26 (4): 842–8. [PubMed] [Google Scholar] 6. Натан Х. Остеофиты позвоночника: анатомическое исследование их развития в зависимости от возраста, расы и пола с учетом их этиологии и значения. J Bone Joint Surg Am. 1962. 44 (2): 243–68. [Google Scholar] 7. Водица М., Косак Р., Венгуст Р. Отдаленные результаты хирургического лечения симптоматических передних шейных остеофитов: серия случаев с обзором литературы. Clin Spine Surg. 2016; 29 (9): E482–7. DOI: 10.1097 / BSD.0b013e31829046af [PubMed] [Google Scholar] 8. Гальбусера Ф., ван Райсберген М., Ито К., Хюйге Дж. М., Брайда-Бруно М., Вилке Х. Дж. Старение и дегенеративные изменения межпозвоночного диска и их влияние на гибкость позвоночника. Eur J Spine. 2014; 32: S324–32. [PubMed] [Google Scholar] 9. Аль-Равахи М., Луо Дж., Поллинтин П., Долан П., Адамс М.А. Механическая функция остеофитов тела позвонков, выявленная в экспериментах на трупных шипах. Позвоночник. 2011; 36 (10): 770–7. DOI: 10.1097 / BRS.0b013e3181df1a70 [PubMed] [Google Scholar] 11.Карри В., Пинтар Ф.А., Доан Н.Б., Нгуен Х.С., Эккардт Дж., Байсден Дж. Л. и др. Переломы замыкательной пластинки поясничного отдела позвоночника: биомеханическая оценка и клинические аспекты посредством экспериментальной индукции травмы. J Orthop Res. 2016; 34 (6): 1084–91. DOI: 10.1002 / jor.23112 [PubMed] [Google Scholar] 12. Вирджин В. Экспериментальные исследования физических свойств межпозвоночного диска. J Bone Joint Surg Br. 1951; 33-В: 607–11. [PubMed] [Google Scholar] 13. Бартелинк Д. Роль абдоминального давления в снятии давления на поясничные межпозвоночные диски.J Bone Joint Surg Br. 1957; 39-В: 718–25. [PubMed] [Google Scholar] 14. Хаттон В., Адамс Массачусетс. Можно ли сломать поясничный отдел при поднятии тяжестей? Позвоночник. 1982. 7 (6): 586–90. [PubMed] [Google Scholar] 15. Хаттон В., Адамс Массачусетс. Выпадение межпозвоночного диска. Травма, вызванная гиперфлексией, 1981 г. Премия Volvo в области фундаментальных наук. Позвоночник. 1982; 7 (3): 184–91. [PubMed] [Google Scholar] 16. Йоганандан Н., Рэй Дж., Пинтар Ф.А., Миклебуст Дж. Б., Сансес А. Мл. Критерии жесткости и энергии деформации для оценки порога повреждения межпозвонкового сустава.J Biomech. 1989. 22 (2): 135–42. [PubMed] [Google Scholar] 17. Очиа Р., Тенсер А.Ф., Чинг Р.П. Влияние скорости нагрузки на замыкательную пластину и прочность тела позвонков в поясничных позвонках человека. J Biomech. 2003. 36 (12): 1875–81. [PubMed] [Google Scholar] 18. Казарян Л, Грейвс Г.А. Характеристики прочности на сжатие позвоночника человека. Позвоночник. 1977; 2 (1): 1–14. [Google Scholar] 19. МакБрум Р., Хейс В. К., Эдвардс В. Т., Голдберг Р. П., Уайт А. А. 3-е место. Прогнозирование компрессионного перелома тела позвонка с помощью количественной компьютерной томографии.J Bone Joint Surg Am. 1985. 67 (8): 1206–14. [PubMed] [Google Scholar] 20. Singer K, Edmonston S, Day R, Breidahl P, Price R. Прогнозирование прочности на сжатие тела грудного и поясничного позвонков: корреляция с минеральной плотностью кости и областью позвоночника. Кость. 1995. 17 (2): 167–74. [PubMed] [Google Scholar] 21. Mosekilde L, Bentzen SM, Ortoft G, Jorgensen J. Прогностическая ценность количественной компьютерной томографии для прочности на сжатие тела позвонка и плотности золы. Кость. 1989. 10 (6): 465–70. [PubMed] [Google Scholar] 22.Cann C, Genant HK, Kolb FO, Etinger B. Количественная компьютерная томография для прогнозирования риска перелома позвонков. Кость. 1985; 6 (1): 1–7. [PubMed] [Google Scholar] 23. Дэн Х., Сюй Ф.Х., Дэвис К.М., Хини Р., Рекер Р. Различия в минеральной плотности костной ткани, минеральном содержании костной ткани и размере костной поверхности у женщин с переломами и без переломов, а также их взаимосвязь в позвоночнике и бедре. J Bone Miner Metab. 2002. 20 (6): 358–66. DOI: 10.1007 / s007740200052 [PubMed] [Google Scholar] 24. Эрикссон С., Исберг Б.О., Линдгрен Ю.Прогнозирование прочности позвоночника с помощью двухфотонной абсорбциометрии и количественной компьютерной томографии. Calcif Tissue Int. 1989. 44 (4): 243–50. [PubMed] [Google Scholar] 25. Ширадо О, Канеда К., Тадано С., Исикава Х., McAfee PC, Warder KE. Влияние дегенерации диска на механизм разрывных переломов грудопоясничного отдела. Позвоночник. 1992. 17 (3): 286–92. [PubMed] [Google Scholar] 26. Дай Л., Ван XY, Ван К.Г., Цзян Л.С., Сюй Х.З. Минеральная плотность костной ткани грудопоясничного отдела позвоночника по отношению к взрывным переломам: количественное исследование компьютерной томографии.Eur Spine J. 2006; 15 (12): 1817–22. DOI: 10.1007 / s00586-006-0148-2 [PubMed] [Google Scholar] 27. Zhao F, Pollintine P, Hole BD, Adams MA, Dolan P. Переломы позвонков обычно поражают замыкательную пластинку черепа, потому что она тоньше и поддерживается менее плотной губчатой костью. Кость. 2009. 44 (2): 372–9. DOI: 10.1016 / j.bone.2008.10.048 [PubMed] [Google Scholar] 29. Коккорис П., Хатзидакис И., Хацелис Э., Макрас П., Толумис Г. Плотность костей в бедре и поясничном отделе позвоночника у здорового мужского населения. Эндокринные аннотации.2016; 41: doi: 10.1530 / endoabs.41.EP114 [Google Scholar] 31. Томпсон Дж., Пирс Р.Х., Шехтер М.Т., Адамс М.Э., Цанг И.К., Епископ ПБ. Предварительная оценка схемы оценки общей морфологии межпозвоночного диска человека. Позвоночник (Phila Pa 1976). 1990; 15 (5): 411–5. [PubMed] [Google Scholar] 32. Макнаб И. Тяговая шпора. Индикатор сегментарной нестабильности. J Bone Joint Surg Am. 1971; 53 (4): 663–70. [PubMed] [Google Scholar] 34. Магерл Ф., Эби М., Гертцбейн С.Д., Хармс Дж., Назарян С. Исчерпывающая классификация травм грудного и поясничного отделов.Eur Spine J. 1994; 3 (4): 184–201. [PubMed] [Google Scholar] 35. Гальбусера Ф., Шмидт Х., Нейдлингер-Вильке С., Готтшалк А., Вильке Х. Дж. Механический ответ поясничного отдела позвоночника на различные комбинации дегенеративных изменений диска исследовали с использованием рандомизированных пороупругих моделей конечных элементов. Eur Spine J. 2011; 20 (4): 563–71. DOI: 10.1007 / s00586-010-1586-4 [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Кемпер А., Макнелли С., Дума С.М. Влияние скорости деформации на свойства жесткости на сжатие поясничных межпозвонковых дисков человека.Biomed Sci Instrum. 2007. 43: 176–81. [PubMed] [Google Scholar] 37. Дума С., Кемпер А.Р., Макнили Д.М., Бролинсон П.Г., Мацуока Ф. Биомеханический ответ поясничного отдела позвоночника при динамическом сжатии. Biomed Sci Instrum. 2006; 42: 476–81. [PubMed] [Google Scholar] 38. Диллон Н., Басс ЕС, Лотц Дж. Влияние замороженного хранения на ползучесть межпозвоночных дисков человека. Позвоночник. 2001. 26 (8): 883–8. [PubMed] [Google Scholar] 40. Сметерс Дж., Джоанес Д. Н.. Динамические сжимающие свойства поясничных межпозвонковых суставов человека: сравнение свежих и размороженных образцов.J Biomech. 1988. 21 (5): 425–33. [PubMed] [Google Scholar] 41. Кифуне М., Панджаби М.М., Аранд М., Лю В. Характер переломов и нестабильность грудопоясничных травм. Eur Spine J. 1995; 4 (2): 98–103. [PubMed] [Google Scholar] 42. Кифунэ М., Панджаби М.М., Лю В., Аранд М., Васавада А., Оксланд Т. Функциональная морфология позвоночного канала после замыкательных, клиновых и взрывных переломов. J Расстройство позвоночника. 1997. 10 (6): 457–66. [PubMed] [Google Scholar] 43. Пенджаби М., Оксланд Т.Р., Кифуне М., Аранд М., Вен Л., Чен А. Обоснованность теории трех столбцов грудопоясничных переломов.Позвоночник. 1995. 20 (10): 1122–7. [PubMed] [Google Scholar] 44. Панджаби М, Оксланд Т.Р., Лин Р.М., МакГоуэн Т.В. Грудопоясничный разрывной перелом. Биомеханическое исследование его разнонаправленной гибкости. Позвоночник (Phila Pa 1976). 1994. 19 (5): 578–85. [PubMed] [Google Scholar] 45. Линдаль О. Механические свойства высушенной обезжиренной губчатой кости. Акта Ортоп Сканд 1976; 47 (1): 11–9. [PubMed] [Google Scholar] 46. Картер Д., Хейс WC. Сжимающее поведение кости как двухфазной пористой структуры. J Bone Joint Surg Am 1977. 59 (7): 954–62.[PubMed] [Google Scholar] 47. Эдмондстон С., Певица КП, Дэй РЭ, Брейдал П.Д., Прайс РИ. Взаимосвязь in vitro между плотностью тела позвонка, размером и прочностью на сжатие в грудопоясничном отделе позвоночника пожилого возраста. Clin Biomech (Бристоль, Эйвон). 1994. 9 (3): 180–86. [PubMed] [Google Scholar] 48. Chagnon A, Aubin CE, Villemure I. Биомеханическое влияние свойств диска на передачу нагрузки здоровых и дегенерированных дисков с использованием пороупругой модели конечных элементов. J Biomech Eng. 2010; 132 (11): 111006 DOI: 10.1115 / 1.4002550 [PubMed] [Google Scholar] 49. Эль-Рич М., Арну П.Дж., Ваньак Э, Брюне С., Обен С.Е. Конечноэлементное исследование влияния скорости нагрузки на изменения распределения нагрузки на позвоночник в условиях удара. J Biomech. 2009. 42 (9): 1252–62. DOI: 10.1016 / j.jbiomech.2009.03.036 [PubMed] [Google Scholar] 50. Wagnac E, Arnoux PJ, Garo A, Aubin CE. Конечно-элементный анализ влияния скорости нагружения на модель всего поясничного отдела позвоночника в условиях динамического нагружения. Med Biol Eng Comput. 2012; 50 (9): 903–15.DOI: 10.1007 / s11517-012-0908-6 [PubMed] [Google Scholar]Существенные остеофиты тела позвонков защищают от тяжелых переломов позвонков при компрессии
PLoS One. 2017; 12 (10): e0186779.
, Концептуализация, курирование данных, формальный анализ, исследование, методология, администрирование проекта, ресурсы, проверка, визуализация, написание — первоначальный черновик, написание — просмотр и редактирование, 1, 2, 3, * , Концептуализация, получение финансирования, методология, администрирование проекта, надзор, проверка, написание — обзор и редактирование, 3, 4, 5 , исследование, ресурсы, написание — обзор и редактирование, 6, 7 , Концептуализация, Написание — просмотр и редактирование, 2, 5, 8 , Формальный анализ, Визуализация, Написание — просмотр и редактирование, 1 , Концептуализация, Визуализация, Написание — обзор и редактирование, 1, 2, 3 , Курирование данных, Исследование, Написание — просмотр и редактирование, 4, 9 и, Концептуализация, Методология, Управление проектами, Ресурсы, Надзор, Написание — re просмотр и редактирование 9, 10Eric Wagnac
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
Карл-Эрик Обен
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
4 Кафедра машиностроения, Политехническая школа Монреаля, Монреаль, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
Катя Чаумутр
6 Отделение медицинской визуализации, Северная больница, Университет Экс Марсель, Марсель, Франция
7 Laboratoire d’Anthropologie Biologique, Университет Экс Марсель, Марсель, Франция
Жан-Марк Мак-Тионг
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
8 Отделение хирургии медицинского факультета Монреальского университета, Монреаль, Квебек, Канада
Анн-Лор Менар
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
Иван Пети
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
Анаис Гаро
4 Департамент машиностроения, Политехническая школа Монреаля, Монреаль, Канада
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
Pierre-Jean Arnoux
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
10 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Марсель, Франция
Хосе Мануэль Гарсия Аснар, редактор
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
4 Кафедра машиностроения, Политехническая школа Монреаля, Монреаль, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
6 Отделение медицинской визуализации, Северная больница, Университет Экс Марсель, Марсель, Франция
7 Лаборатория биологической антропологии, Университет Экс Марсель, Марсель, Франция
8 Отделение хирургии медицинского факультета Монреальского университета, Монреаль, Квебек, Канада
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
10 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Марсель, Франция
Университет Сарагосы, ИСПАНИЯ
Конкурирующие интересы: Авторы заявили, что не существует конкурирующих интересов.
Поступила 17.05.2017; Принято 6 октября 2017 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. другими статьями в PMC.- Дополнительные материалы
-
S1 Рис. Индивидуальные данные для каждого субъекта, упорядоченные по группе с существенными остеофитами и с небольшими остеофитами.(TIF)
GUID: 02E46D00-34BE-4701-ADF6-01A8E5BF4A2B
S1 Таблица: Индивидуальные данные для каждого испытуемого: трабекулярная плотность позвонков (VTD), площадь поперечного сечения (CSA), высота образца (H), жесткость ( K ) и параметры отказа ( F FAIL , D FAIL и E FAIL ) без нормализации. (DOCX)
GUID: EC8270B3-7D62-4E9E-94A5-FDB3AC5E64C5
- Заявление о доступности данных
-
Все соответствующие данные находятся в документе.
Abstract
Недавние открытия предполагают, что остеофиты позвоночника повышают сопротивляемость позвоночника сжатию. Однако роль остеофитов позвоночника в биомеханической реакции позвоночника при быстром динамическом сжатии, вплоть до отказа, неясна. Семнадцать образцов позвоночника человека, состоящего из трех позвонков (от T5-T7 до T11-L1) и окружающих их мягких тканей, были взяты у девяти трупов в возрасте от 77 до 92 лет. Образцы получали с помощью количественной компьютерной томографии (ККТ) для медицинского наблюдения, классификации дегенерации межпозвонкового диска (степень Томсона) и измерения плотности трабекул позвонков (VTD), высоты и площади поперечного сечения.Образцы были разделены на две группы (с (n = 9) или без (n = 8) существенными остеофитами тела позвонков) и подверглись осевому сжатию со скоростью динамического смещения 1 м / с, вплоть до отказа. Нормализованные кривые «сила-смещение», видео и изображения QCT позволили охарактеризовать параметры разрушения (сила, смещение и энергия при разрыве) и характер разрушения. Результаты были проанализированы с использованием критериев хи-квадрат для выборочных распределений и линейной регрессии для корреляции между VTD и параметрами отказов.Образцы со значительными остеофитами тела позвонков демонстрируют более высокую жесткость (в среднем в 2,7 раза) и силу при разрушении (в среднем в 1,8 раза), чем другие сегменты. Наличие остеофитов существенно влияет на расположение, характер и тип перелома. VTD был хорошим предиктором динамической силы и энергии при разрушении для образцов без существенных остеофитов. Это исследование также показало, что остеофиты тела позвонка обеспечивают защитный механизм нижележащего позвонка от тяжелых компрессионных переломов.
Введение
Остеофит тела позвонка — распространенная форма остеоартрита, определяемая как аномальный костный рост или костная шпора, образующаяся вдоль межпозвонковых суставов [1]. На поздних стадиях развития остеофитов соседние позвонки срастаются друг с другом, образуя костный мост через межпозвоночный диск, называемый мостиковым остеофитом. Остеофиты позвонков обычно связаны со старением, дегенерацией межпозвоночного диска, травматическими повреждениями, склерозом замыкательной пластинки, сужением дискового пространства [1, 2], ремоделированием фасеточных суставов [3], болями в спине [4] и диффузным идиопатическим гиперостозом скелета (DISH) или болезнью Форестье. [5].Соответственно, значительный остеофит можно найти в 20–25% шипов в возрасте 20–45 лет и в 73–90% шипов старше 60 лет [2–4, 6]. Осложнения, связанные с образованием остеофитов, многочисленны (дисфагия, компрессия грудной аорты, обструкция полой вены, компрессия нервных корешков) и влияют на большинство структур, расположенных в непосредственной близости от позвоночника. Как следствие, они обычно рассматриваются как дегенеративное состояние и могут быть удалены хирургическим путем традиционными или малоинвазивными методами во время операций на позвоночнике, когда они приводят к инвалидности или неврологическим симптомам [1, 7].Недавно было высказано предположение, что остеофиты позвоночника в первую очередь стабилизируют позвоночник при изгибе и повышают его сопротивление при сжатии [8, 9]. Действительно, если остеофиты обеспечивают стабильность, добавляя кость и увеличивая площадь поперечного сечения позвонков, они также могут обеспечивать защитный механизм от переломов позвонков, несмотря на генерализованную остеопению, наблюдаемую в большинстве стареющих позвоночников.
Однако механическая роль остеофитов тела позвонков в отношении риска и тяжести переломов позвоночника остается неясной.Большинство переломов позвонков варьируются от болезненных компрессионных переломов до более серьезных травм, таких как разрывные и дистракционные переломы. Многие из них расположены на средне-грудном, грудопоясничном или среднем поясничном уровнях и являются результатом механизма осевой компрессии с комбинированным сгибанием или без него [10]. Чтобы лучше понять биомеханику переломов позвонков, было проведено множество экспериментальных исследований трупных тканей человека при осевом сжатии. Несущая способность отдельных позвонков и функциональных спинномозговых единиц (FSU) сформировала основу для количественной оценки устойчивости межпозвоночной структуры к сопротивлению нагрузке и сохранению невредимости [11–18].Другие дополнительные исследования были нацелены на прогнозирование риска переломов позвоночника путем выявления потенциальных корреляций между нагрузкой отказа / переломами позвонков отдельных позвонков или ПСС и клиническими измерениями, такими как минеральная плотность кости (МПК) и морфология [19–24], степень поражения дегенерация [25] и костная архитектура [26–28].
Хотя вышеупомянутые эксперименты предоставили существенное понимание биомеханики переломов позвонков, ни один из них не объяснил механический вклад остеофитов позвоночника.Недавно было высказано предположение, что остеофиты позвоночника увеличивают сопротивление позвоночника сжатию и что в их присутствии клинические измерения МПК занижают прочность позвоночника на сжатие [9, 29]. Однако их тесты на трупах проводились при квазистатических физиологических нагрузках (без отказов). Следовательно, они не воспроизводили динамические реальные условия травм (например, падения или дорожно-транспортные происшествия), которые приводят к компрессионным переломам позвонков.
Настоящее исследование направлено на анализ роли значительных остеофитов позвоночника на биомеханическую реакцию позвоночника при динамическом сжатии, вплоть до отказа.Их влияние на прогноз прочности позвонков на сжатие посредством клинических измерений также было исследовано. Наша гипотеза состоит в том, что существенные остеофиты позвонков имеют значительное влияние на параметры, тип, характер, расположение и прогноз риска переломов позвонков, когда позвоночник подвергается динамической компрессии.
Материалы и методы
Трупные образцы
Протокол исследования был одобрен институциональным наблюдательным советом IFSTTAR / Университета Экс-Марсель.Ни один из доноров трансплантата не был из уязвимой группы населения, и все доноры или ближайшие родственники предоставили письменное информированное согласие, которое было дано свободно. Семнадцать образцов человеческих сегментов позвоночника, состоящих из трех позвонков и окружающих их мягких тканей, были взяты из девяти забальзамированных трупов. Средний возраст, рост стоя и вес испытуемых составляли 86 ± 5 лет, 164 ± 6 см и 60 ± 13 кг (). Семь экземпляров были расположены в T11-L1, семь — в T8-T10 и три — в T5-T7. Все костные ребра и несвязочные мягкие ткани были удалены из образцов, и изображения количественной компьютерной томографии (ККТ) были получены с использованием клинического сканера (SIEMENS Somatom Sensation Cardiac 64: 120 кВ, 300–350 мАс, смежные срезы 0.6 мм) для медицинского наблюдения, классификации и измерения остеофитов, которые наблюдались на всех позвоночных уровнях. Каждый образец классифицировали в соответствии с направлением каждой пары остеофитов в межпозвоночном пространстве [30] и в соответствии со схемой классификации дегенерации диска Томсона [31]. Размер остеофитов измеряли с использованием метода, описанного Аль-Равахи и др. [9]. Экземпляры были разделены на две группы (). В первой группе (n = 9), названной «образцы со значительными остеофитами», были остеофиты типа C, характеризующиеся почти полным костным мостом, сформированным через пространство межпозвонкового диска.Их остеофиты варьировали от 10 до 15 мм. Во второй группе (n = 8), названной «образцы с небольшими остеофитами», были остеофиты типа E, характеризующиеся остеофитами, которые простирались почти горизонтально до границы тела позвонка, не закрывая пространство межпозвонкового диска. Их остеофиты варьировались от 2 мм (минимальный размер, чтобы считать шпору остеофитом [32]) до 5 мм.
Таблица 1
Подробная информация о 17 образцах спинного мозга, извлеченных из 9 трупов.
| ID субъекта | Пол | Возраст (лет) | Вес (кг) | Рост стоя (см) | Образец | Группа | IVD | 88 | 64 | 155 | T11-L1 | 1 | 5 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 02 | F | 83 | 49 | 165 | 83 9028 3 | -T4- ||||||||||||||||
| 03 | F | 85 | 48 | 154 | T11-L1 | 1 | 5 | ||||||||||||||
| 04 | F | 92 | 54 1 | 5 | |||||||||||||||||
| T11-L1 | 2 | 4 | |||||||||||||||||||
| 05 | F | 9028 3 9339 | 165 | T8-T10 | 2 | 3 | |||||||||||||||
| T11-L1 | 2 | 88 | 71 | 165 | T8-T10 | 2 | 4 | ||||||||||||||
| T11-L1 | |||||||||||||||||||||
| M | 77 | 75 | 173 | T5-T7 | 2 | 3 | |||||||||||||||
| T11-L1 | 2 | 3 | |||||||||||||||||||
| 08 | M | 90 | 91 | 170 | T5-T7 | 1 | 5 | ||||||||||||||
| T8-T10 | 1 | 5 | 9028 -L1 | 1 | 5 | ||||||||||||||||
| 09 | M | 82 | 53 | 165 | T5-T7 | 1 | 5 | 9028 T8-T10 | 1 | 5 |
Затем были проведены измерения плотности трабекул позвонков (VTD), высоты (H) и площади поперечного сечения (CSA) каждого образца.VTD измеряли на каждом позвонке, создавая сканирующий участок толщиной 9 мм, параллельный замыкательным пластинкам позвонка, в средней плоскости тела позвонка [33]. Положение тела посередине позвонка подтверждалось входом базивертебральной вены в среднюю плоскость сканируемого разреза. Средняя единица Хаунсфилда (HU) была рассчитана для интересующей овальной области размером 25 мм 2 , которая включала только губчатую кость (без кортикального ободка или частей базивертебральной вены). Для целей стандартизации (калибровки) средние значения HU каждого позвонка были преобразованы в значения VTD (г / мм 3 ) с использованием линейной регрессии, полученной из фантома электронной плотности КЛКТ (модель 062A, CIRS Inc., Вирджиния, США), помещенные рядом с образцами позвоночника во время ККТ. В конце концов, VTD образца была рассчитана путем усреднения VTD трех составляющих его позвонков. Высота образца измерялась между центром верхней и нижней замыкательных пластинок хвостового и дистального позвонков соответственно. ППС каждого позвонка измеряли по середине тела позвонка. Общая ППС образца была получена путем усреднения ППС трех позвонков. После визуализации образцы замораживали при -20 ° C до тестирования.
Испытательное оборудование и процедуры
Динамическое осевое сжатие было выполнено с использованием сервогидравлической системы испытаний материалов (MTS Axial 370.02 15 кН, Эден-Прери, Миннесота), которая включала одноосный датчик нагрузки и индуктивный датчик смещения для измерения силы привода и отклонение (). Две высокоскоростные камеры (1000 кадров в секунду) были размещены в стороне от образца для визуализации и хронологического отслеживания повреждений позвоночника. За два дня (48 ч) до испытания образцы оттаивали в холодильнике (4 ° C) и накрывали полотенцами, пропитанными физиологическим раствором.Чтобы зафиксировать образец на MTS и равномерно нагружать его, половина дистального и проксимального позвонков была помещена в параллельные чашки, заполненные полиуретановой смолой за двадцать четыре часа до испытания. Во время этого процесса сохранялась сагиттальная естественная кривизна образцов.
Экспериментальная установка, состоящая из сервогидравлической системы испытания материалов (1), двух высокоскоростных камер (2), одноэлементного датчика нагрузки (3) и трупного сегмента позвоночника (4). Трупный сегмент позвоночника (4) был зафиксирован на MTS путем заливки дистального и проксимального позвонков в полиуретановую смолу (5).
Перед испытанием образцы размораживали при комнатной температуре (23 ° C) в течение 3 часов. Каждый образец помещали на MTS и прикладывали предварительную нагрузку 0,25 кН в течение 1 минуты [20]. Затем образцы подвергались динамическому сжатию со скоростью 1 м / с до разрушения. Испытание было остановлено, когда образец был сжат примерно до 60% высоты среднего позвонка (от 12 до 15 мм). Все испытания проводились при комнатной температуре. После сжатия для медицинской диагностики были сделаны изображения QCT образцов.
Анализ данных и статистика
Кривые сила-смещение были записаны и нормализованы (F норма = f (D норма )) в соответствии со средним размером всех образцов, как описано уравнениями (1) и (2) :
Fnorm = FCSAspecimenMeanCSA = F.MeanCSACSAspecimen
(1)
Dnorm = DHeightspecimenMeanHeight = D.MeanHeightHeightspecimen
(2)
(4) уровни.Разрушение было определено как первая точка, в которой дальнейшее увеличение смещения вызвало уменьшение нагрузки. Из каждой кривой были извлечены нормализованная жесткость ( K ), сила ( F FAIL ), смещение ( D FAIL ) и энергия при отказе ( E FAIL ). . Жесткость определялась как наклон наиболее линейного участка кривой до разрушения. Энергия разрушения определялась как площадь под кривой «сила-смещение» до разрушения.Среднее и стандартное отклонения биомеханических параметров ( K , F FAIL , D FAIL и E FAIL ) были вычислены для каждой группы и статистически сравнивались. Воспроизведение тестов и чистые оценки дисперсии ошибок для биомеханических параметров не могли быть выполнены, поскольку тесты были деструктивными.
Обычные модели линейной регрессии были приспособлены для оценки степени линейной корреляции между VTD и каждым измеряемым параметром для каждой группы, без учета какого-либо взаимодействия между параметрами.Чтобы проверить, была ли взаимосвязь между VTD и нормализованными биомеханическими параметрами для группы с небольшими остеофитами аналогична группе с существенными остеофитами, модель, подобранная для первой группы, использовалась для прогнозирования биомеханических параметров другой группы. Затем биомеханические параметры (среднее и стандартное отклонение), рассчитанные на основе этих соотношений, сравнивали с биомеханическими параметрами, полученными экспериментально для другой группы.
Видео были проанализированы для определения места разрушения и характера трещин.ККТ-изображения сломанных образцов были использованы для определения типа перелома на основе классификации AO (инициалы немецких терминов «Arbeitsgemeinschaft für Osteosynthesefragen») для грудных и поясничных травм [34]. Тесты хи-квадрат были выполнены для изучения влияния остеофитов на расположение, тип и характер перелома. Все статистические анализы были выполнены с использованием программы STATISTICA v.7.0 (StatSoft, Талса, Оклахома, США). Различия считали достоверными при p <0.05.
Результаты
Морфология и плотность трабекул позвонков
Образцы со значительными остеофитами показали более высокий (в 1,6 раза) VTD, чем образцы с небольшими остеофитами (p = 0,003) (см. Рис. S1 и таблицу S1). Они также показали большую площадь поперечного сечения (p = 0,307), но меньшую высоту (p = 0,071). Однако, в отличие от VTD, различия в общей морфологии образцов не были значительными.
Таблица 2
Плотность трабекул позвонков (VTD), площадь поперечного сечения (CSA) и высота образца (H) по группам образцов (среднее значение ± стандартное отклонение).
| Образцы с существенными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | Отношение (существенное / малое) | |
|---|---|---|---|
| VTD4 (г / мм) ) | 103 ± 24 | 64 ± 25 | 1,60 * |
| CSA (мм 2 ) | 1062 ± 171 | 1009 ± 251 | 1,05 |
| 77.0 ± 5,0 | 81,3 ± 6,6 | 0,95 |
Кривые «сила-перемещение»
Все образцы имели нормированные кривые «сила-перемещение» одинаковой формы (). Кривые со встроенными маркерами (квадраты, треугольники, кресты и т. Д.) Представляют образцы со значительными остеофитами. Типичная кривая изображена на. До разрушения кривая имеет нелинейную форму, характеризующуюся первым изогнутым сегментом увеличивающейся жесткости (сегмент A-B), за которым сразу следует линейный сегмент (B-C).Этот линейный сегмент предшествует сильно нелинейному сегменту (C-D), характеризующемуся уменьшающейся жесткостью. Сегмент BC называется упругой частью кривой, в то время как сегмент CD называется неупругой частью, где повреждение на микроуровне (потеря целостности материала из-за образования трещин и пустот, ухудшающих жесткость), пластичность (процесс течения, создающий безвозвратные повреждения). деформации) и вязкоупругости (диссипативный процесс). После разрушения (точка D) кривая показывает уменьшение прочности (D-E) до точки E, после чего образец либо сохраняет (девять образцов), либо восстанавливает (восемь образцов) некоторую прочность (сегмент E-F).
Нормированные кривые «сила-смещение» для образцов T5-T7 (a), T8-T10 (b) и T11-L1 (c). Кривые с символами представляют образцы со значительными остеофитами. Эти образцы показали большую жесткость, нагрузки и смещения до разрушения.
Типичная кривая силы-смещения (F-D) (образец T11-L1, объект 3).Шесть сегментов (от A-B до E-F), изображенные на этой кривой, наблюдались на всех образцах.
Нормализованная жесткость и параметры разрушения
Средняя нормализованная жесткость ( K ) образцов со значительными остеофитами составляла 1.В 9 раз превышает жесткость образцов с мелкими остеофитами (). Среднее значение F FAIL , D FAIL и E FAIL образцов со значительными остеофитами было в 2,7, 1,8 и 5,3 раза больше соответствующих значений образцов с небольшими остеофитами, соответственно. . Все различия между группами были статистически значимыми, со значениями p 0,0004 ( K ), 0,0006 ( F FAIL ), 0.006 ( D FAIL ) и 0,002 ( E FAIL ).
Таблица 3
Нормализованные параметры жесткости и разрушения по группам (среднее значение ± стандартное отклонение).
| Образцы со значительными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | Отношение (существенное / малое) | ||
|---|---|---|---|---|
| 3207 ± 735 | 1716 ± 586 | 1.9 † | ||
| F ОТКАЗ (N) | 6873 ± 2534 | 2510 ± 1152 | 2,7 † | |
| D ОТКАЗ (мм) 3,5803 | 1,9 ± 0,91,8 † | |||
| E FAIL (J) | 14,8 ± 8,1 | 2,8 ± 2,4 | 5,3 † | |
Корреляция между 9 нормализованными параметрами биомеханики VT образцы со значительными остеофитами, не было обнаружено статистически значимой корреляции между VTD и биомеханическими параметрами ().Для образцов с небольшими остеофитами VTD был хорошим предиктором нормализованного
F FAIL (r 2 = 0,80, p <0,03) и E FAIL (r 2 = 0,55, р <0,035). Напротив, VTD не коррелировал с K (r 2 = 0,42, p <0,12) и D FAIL (r 2 = 0,33, p <0,14). Линейная регрессия между VTD и нормализованными биомеханическими параметрами.VTD коррелировал только с нормализованными F FAIL и E FAIL образцов без остеофитов.
Следуя этим результатам, значения для F FAIL и E FAIL были предсказаны с использованием линейных соотношений и VTD образцов со значительными остеофитами, так что образцы с аналогичным VTD могли быть в сравнении. Опять же, значительные различия были обнаружены между группами ( F FAIL = 4117 ± 1002 N; E FAIL = 5.5 ± 1,7), таким образом гарантируя, что одна VTD не может объяснить различия, наблюдаемые между группами.
Типы, типы и места переломов
При неудаче видеоанализ показал, что один из позвонков разрушился, и костный мозг был выброшен струями в месте перелома, а также из отверстий и сосудистых каналов в коре головного мозга. Тело первого позвонка, разрушившееся, и характер перелома значительно различались между двумя группами образцов. Действительно, первое тело позвонка, которое разрушилось, было средним или дистальным для семи из восьми образцов с небольшими остеофитами (), в то время как оно было проксимальным для восьми из девяти образцов со значительными остеофитами ().
Разрушение первого позвонка с характерным переломом.a) Образец без остеофитов (образец сегмента T11-L1 субъекта 3). Средний позвонок (Т12) разрушается первым. Горизонтальный узор разделяет позвонок на верхнюю и нижнюю части. На ККТ-изображении наблюдается взрывная трещина. б) Образец со значительными остеофитами (сегмент Т8-Т10 субъекта 2). Проксимальный позвонок (Т11) разрушается первым. Вертикальный узор разделяет позвонок на переднюю и заднюю части.На ККТ-изображении наблюдается перелом остеофита. Пунктирными линиями обозначен выброс костного мозга на месте перелома.
На корковых поверхностях были идентифицированы три модели перелома. В первом варианте кортикальная кость раскалывается по окружности и по горизонтали в центре, оставляя линию, разделяющую тело позвонка на верхнюю и нижнюю части (). Во втором случае кортикальная кость раскалывается вертикально, оставляя линию, которая в основном разделяет тело позвонка на переднюю и заднюю части ().Третий образец представлял собой комбинацию двух других образцов и привел к полному разрушению образца. Первая картина наблюдалась на семи из восьми образцов с небольшими остеофитами, а вторая картина наблюдалась на семи из девяти образцов со значительными остеофитами. Третий образец наблюдали на одном экземпляре из каждой группы.
КТ-изображения показали, что наличие значительных остеофитов влияет на типы переломов (). У пяти образцов с небольшими остеофитами был полный взрывной перелом с ретропульсивным фрагментом кости и нарушением канала (тип А.3.3 классификации AO), а у трех из этих образцов был ударный перелом с коллапсом тела позвонка (тип A.1.3). Только у одного образца с остеофитами позвонков был полный взрывной перелом (с переломом остеофита). Остальные восемь образцов имели ударный перелом с коллапсом тела позвонка (тип A.1.3), иногда с небольшим смещением задней кортикальной стенки. Среди этих образцов у шести были переломы по крайней мере одного из их остеофитов.
Таблица 4
Распределение типов трещин по группам образцов.
| Типы переломов | Образцы со значительными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | ||
|---|---|---|---|---|
| Разрывные переломы | 0 | 5 | ||
| — С переломом остеофита | 1 | 0 | ||
| Импульсный перелом или коллапс тела позвонка | 9028 — 9028 — 9028 — | — С переломом остеофита | 6 | 0 |
Обсуждение
Предыдущие исследования [9, 35] показали, что остеофиты позвонков вызывают значительные изменения устойчивости и гибкости ПСС в квазистатических или физиологических условиях нагрузки. .Настоящее исследование отличается тем, что были протестированы более длинные сегменты позвоночника (трехпозвоночные) при динамическом сжатии и оценена роль остеофитов тела позвонков в механизмах перелома сегментов позвоночника. Значительные остеофиты позвонков увеличивают жесткость и несущую способность сегментов позвоночника. Они также влияют на характер, расположение и прогнозирование риска переломов позвонков.
Ограничения настоящего исследования необходимо обсудить до интерпретации результатов.Во-первых, из-за ограниченной доступности и стоимости человеческих трупов у девяти испытуемых было извлечено только семнадцать образцов. Такой небольшой размер выборки является важным ограничением исследования. Поэтому, чтобы максимизировать размер выборки, данные разных полов и уровней позвоночника были объединены вместе с использованием процесса нормализации. Однако антропометрические различия между мужчинами и женщинами () могли уменьшить или замаскировать потенциальные корреляции с VTD, хотя обе группы содержали образцы мужчин и женщин.Было бы интересно изучить влияние пола и найти гендерные корреляции с большим количеством выборок. С этой точки зрения индивидуальные данные биомеханических параметров были доступны для дальнейшего использования (рис. S1 и таблица S1). Также размеры тела позвонков зависят от пола; поэтому учет поперечных сечений позвонков имеет первостепенное значение для выражения силы, необходимой для сравнения образцов. Процесс нормализации, подобный построению инженерных кривых напряжения-деформации, был выбран таким образом, чтобы биомеханические параметры были выражены в единицах, согласующихся с теми, которые обычно используются клиницистами или сообщаются в других исследованиях [9, 16, 36, 37].Нормализованная сила была предпочтительнее сжимающего напряжения для выражения нагрузки, поскольку позвонки являются неоднородными и сложными материалами. Нормализация была основана на средней CSA тела среднего позвонка и общей высоте образцов, поскольку эти морфологические параметры не изменились из-за присутствия остеофитов. Во-вторых, условия хранения образцов могли повлиять на результаты, но замораживание и хранение существенно не меняют их физические свойства [38–40]. Наконец, применяемые нагрузки и граничные условия были упрощены по сравнению с реальными ситуациями травм (падения, автомобильные аварии и т. Д.).) из-за очень ограниченных знаний о сложных нагрузках, возникающих в таких ситуациях, и из-за присущих им трудностей экспериментального воспроизведения этих нагрузок. Однако полученные в результате переломы были аналогичны тем, которые наблюдались клинически, и энергия, приложенная к образцам, хорошо согласовывалась с энергией, примененной в других экспериментах in vitro , направленных на воспроизведение компрессионных переломов [41–44].
Обе группы образцов показали последовательные механические реакции вплоть до разрушения, с нормализованными кривыми силы-смещения, показывающими аналогичные формы (сегменты от A-B до C-D), как кривые сила-смещение, описанные в других исследованиях [16, 37].Более того, основные силы разрушения 6873 ± 2534 Н и 2510 ± 1152 Н, соответственно, наблюдаемые на образцах со значительными и небольшими остеофитами, находились в том же диапазоне, что и в аналогичных экспериментах, проведенных на здоровых поясничных сегментах позвоночника двух и шести позвонков [37]. . После отказа обе группы образцов смогли сохранить или увеличить свою прочность (сегменты E-F). Эта характеристика может быть объяснена механизмом раздавливания губчатого вещества кости. Lindahl [45] наблюдал аналогичные кривые после сжатия небольших кубических блоков пояснично-губчатой кости.Картер и Хейс [46] предположили, что по мере увеличения нагрузки коллапс увеличивающегося количества межтрабекулярных пространств ограничивает движение костного мозга, тем самым обеспечивая гидравлическую амортизацию спинного сегмента. Они также сообщили, что образцы с повышенной прочностью после разрушения были связаны с более высокой общей минеральной плотностью кости. В текущем исследовании образцы с остеофитами позвонков были связаны с более высоким VTD и были способны выдерживать большие нагрузки после неудачи ().На данный момент невозможно подтвердить, может ли этот более высокий VTD, который был измерен в пределах кортикального края, быть отнесен к образованию остеофитов или биологическим различиям между образцами. В дальнейшем исследовании анализ образцов с использованием структур трещин большего размера также может улучшить корреляцию с VTD.
Биомеханические параметры образцов с небольшими остеофитами хорошо согласуются с данными других экспериментальных исследований, проведенных в аналогичных условиях [36, 37, 47].Более высокие значения K и F FAIL , измеренные для образцов со значительными остеофитами, хорошо согласуются с результатами Al-Rawahi et al. [9], которые показали на постсоветском пространстве, что остеофиты умножают эти параметры в 1,17 и 1,18 раза соответственно. Наши более высокие коэффициенты размножения (1,9 и 2,7 соответственно) могут быть связаны с различными условиями нагрузки (динамическое и квазистатическое сжатие), а также природой и размером протестированных остеофитов (длина остеофитов в Al-Rawahi et al.[9] в среднем составляли 7 мм, и ни у одного из них не было обнаружено полного и жесткого переднего моста кости). Это последнее наблюдение кажется актуальным, поскольку возрастающая тяжесть образования остеофитов связана с сопутствующим сужением межпозвоночного дискового пространства [2], что, в свою очередь, вызывает жесткость спинного сегмента при сжатии [35]. Регрессионный анализ показал, что существенные различия между группами для F FAIL и E FAIL нельзя было объяснить только значительным различием в VTD, тем самым подтверждая роль позвоночных остеофитов в отказе. спинномозговых препаратов.
Для образцов с небольшими остеофитами сильная линейная связь между VTD образца и F FAIL и E FAIL хорошо согласуется с результатами, полученными в квазистатических условиях [20 , 24] и убедителен, поскольку сила разрушения — свойство, обычно зависящее от плотности. Напротив, ни один из параметров разрушения образцов со значительными остеофитами не коррелировал с VTD, что позволяет предположить, что значительные остеофиты вызывают значительные костные изменения, которые добавляют неопределенный вклад в прочность позвоночника.Аналогичные выводы были сделаны Al-Rawahi et al. [9] с измерениями МПК с помощью двухфотонной рентгеновской абсорбциометрии. Это открытие предполагает, что клиническая оценка риска переломов для образцов со значительными остеофитами должна основываться не только на VTD и общей морфологии образца до тех пор, пока не будут предоставлены дальнейшие исследования.
Поддерживая большую часть сжимающей нагрузки до разрушения, существенные остеофиты позвонков, по-видимому, обеспечивают защиту от напряжения нижележащего тела позвонка и предотвращают возникновение полного поперечного и горизонтального разрушения тела позвонка (часто связанного с взрывным переломом).Высокая частота взрывных переломов у образцов с небольшими остеофитами, несмотря на умеренно или сильно дегенерированный диск (степень 3 или 4), может быть объяснена более высокими сдвигающими силами, передаваемыми фасетками на заднюю стенку позвонка. Более того, защитный механизм, обеспечиваемый остеофитами позвонков, можно объяснить их способностью изменять сопротивление деформации соседних дисков (за счет увеличения их CSA) или их более высокой плотностью костей. Эти данные подтверждают гипотезу о том, что остеофиты являются адаптивными, а не дегенеративными [9], и что их присутствие позволяет снизить чрезмерную деформацию костей до нормального уровня.
В настоящем исследовании были проведены трупные тесты для оценки роли остеофитов тела позвонков на биомеханический ответ сегментов позвоночника при динамическом сжатии. Полученные результаты подтверждают нашу гипотезу о том, что существенные остеофиты позвонков играют ключевую роль в параметрах, типе, характере, локализации и прогнозировании риска переломов позвонков. В будущих работах будет полезно использовать вычислительные модели [48–50] для обхода ограничений, присущих тестам in vitro (размер выборки, биологические вариации, упрощенные нагрузки и т. Д.).). В этом отношении данные, представленные в настоящем исследовании, могут быть полезны для разработки и проверки этих инструментов.
Дополнительная информация
S1 Рис.
Индивидуальные данные для каждого субъекта, упорядоченные по группе с существенными остеофитами и с небольшими остеофитами.(TIF)
S1 Таблица
Индивидуальные данные для каждого субъекта: плотность трабекул позвонков (VTD), площадь поперечного сечения (CSA), высота образца (H), жесткость ( K ) и параметры разрушения () F FAIL , D FAIL и E FAIL ) без нормализации.(DOCX)
Благодарности
Авторы выражают особую благодарность Ю. Годио, К. Конте, М. Пи, К. Ренье и медицинскому персоналу «Service d’imagerie médicale de l’Hôpital Nord». для экспериментальной установки и in vitro для подготовки образцов и визуализации.
Заявление о финансировании
Эта работа была поддержана CEA: Канадским научно-исследовательским отделом ортопедической инженерии Совета по естественным наукам и инженерным исследованиям Канады.
Доступность данных
Все соответствующие данные находятся в документе.
Список литературы
3. Вайнберг Д., Се К.К., Лю Р.В., Гебхарт Дж.Дж., Гордон З.Л. Повышенная заболеваемость тазом связана с большей ориентацией коронковой фасетки в нижнем поясничном отделе позвоночника: трупное исследование 599 поясничных отделов позвоночника. Позвоночник. 2016; 41 (19): E1138–45. DOI: 10.1097 / BRS.0000000000001577 [PubMed] [Google Scholar] 4. О’Нил Т., МакКлоски Э.В., Канис Дж. А., Бхалла А. К., Рив Дж., Рид Д. М. и др. Распространение, детерминанты и клинические корреляты остеофитоза позвонков: популяционное обследование.J Rheumatol. 1999. 26 (4): 842–8. [PubMed] [Google Scholar] 6. Натан Х. Остеофиты позвоночника: анатомическое исследование их развития в зависимости от возраста, расы и пола с учетом их этиологии и значения. J Bone Joint Surg Am. 1962. 44 (2): 243–68. [Google Scholar] 7. Водица М., Косак Р., Венгуст Р. Отдаленные результаты хирургического лечения симптоматических передних шейных остеофитов: серия случаев с обзором литературы. Clin Spine Surg. 2016; 29 (9): E482–7. DOI: 10.1097 / BSD.0b013e31829046af [PubMed] [Google Scholar] 8. Гальбусера Ф., ван Райсберген М., Ито К., Хюйге Дж. М., Брайда-Бруно М., Вилке Х. Дж. Старение и дегенеративные изменения межпозвоночного диска и их влияние на гибкость позвоночника. Eur J Spine. 2014; 32: S324–32. [PubMed] [Google Scholar] 9. Аль-Равахи М., Луо Дж., Поллинтин П., Долан П., Адамс М.А. Механическая функция остеофитов тела позвонков, выявленная в экспериментах на трупных шипах. Позвоночник. 2011; 36 (10): 770–7. DOI: 10.1097 / BRS.0b013e3181df1a70 [PubMed] [Google Scholar] 11.Карри В., Пинтар Ф.А., Доан Н.Б., Нгуен Х.С., Эккардт Дж., Байсден Дж. Л. и др. Переломы замыкательной пластинки поясничного отдела позвоночника: биомеханическая оценка и клинические аспекты посредством экспериментальной индукции травмы. J Orthop Res. 2016; 34 (6): 1084–91. DOI: 10.1002 / jor.23112 [PubMed] [Google Scholar] 12. Вирджин В. Экспериментальные исследования физических свойств межпозвоночного диска. J Bone Joint Surg Br. 1951; 33-В: 607–11. [PubMed] [Google Scholar] 13. Бартелинк Д. Роль абдоминального давления в снятии давления на поясничные межпозвоночные диски.J Bone Joint Surg Br. 1957; 39-В: 718–25. [PubMed] [Google Scholar] 14. Хаттон В., Адамс Массачусетс. Можно ли сломать поясничный отдел при поднятии тяжестей? Позвоночник. 1982. 7 (6): 586–90. [PubMed] [Google Scholar] 15. Хаттон В., Адамс Массачусетс. Выпадение межпозвоночного диска. Травма, вызванная гиперфлексией, 1981 г. Премия Volvo в области фундаментальных наук. Позвоночник. 1982; 7 (3): 184–91. [PubMed] [Google Scholar] 16. Йоганандан Н., Рэй Дж., Пинтар Ф.А., Миклебуст Дж. Б., Сансес А. Мл. Критерии жесткости и энергии деформации для оценки порога повреждения межпозвонкового сустава.J Biomech. 1989. 22 (2): 135–42. [PubMed] [Google Scholar] 17. Очиа Р., Тенсер А.Ф., Чинг Р.П. Влияние скорости нагрузки на замыкательную пластину и прочность тела позвонков в поясничных позвонках человека. J Biomech. 2003. 36 (12): 1875–81. [PubMed] [Google Scholar] 18. Казарян Л, Грейвс Г.А. Характеристики прочности на сжатие позвоночника человека. Позвоночник. 1977; 2 (1): 1–14. [Google Scholar] 19. МакБрум Р., Хейс В. К., Эдвардс В. Т., Голдберг Р. П., Уайт А. А. 3-е место. Прогнозирование компрессионного перелома тела позвонка с помощью количественной компьютерной томографии.J Bone Joint Surg Am. 1985. 67 (8): 1206–14. [PubMed] [Google Scholar] 20. Singer K, Edmonston S, Day R, Breidahl P, Price R. Прогнозирование прочности на сжатие тела грудного и поясничного позвонков: корреляция с минеральной плотностью кости и областью позвоночника. Кость. 1995. 17 (2): 167–74. [PubMed] [Google Scholar] 21. Mosekilde L, Bentzen SM, Ortoft G, Jorgensen J. Прогностическая ценность количественной компьютерной томографии для прочности на сжатие тела позвонка и плотности золы. Кость. 1989. 10 (6): 465–70. [PubMed] [Google Scholar] 22.Cann C, Genant HK, Kolb FO, Etinger B. Количественная компьютерная томография для прогнозирования риска перелома позвонков. Кость. 1985; 6 (1): 1–7. [PubMed] [Google Scholar] 23. Дэн Х., Сюй Ф.Х., Дэвис К.М., Хини Р., Рекер Р. Различия в минеральной плотности костной ткани, минеральном содержании костной ткани и размере костной поверхности у женщин с переломами и без переломов, а также их взаимосвязь в позвоночнике и бедре. J Bone Miner Metab. 2002. 20 (6): 358–66. DOI: 10.1007 / s007740200052 [PubMed] [Google Scholar] 24. Эрикссон С., Исберг Б.О., Линдгрен Ю.Прогнозирование прочности позвоночника с помощью двухфотонной абсорбциометрии и количественной компьютерной томографии. Calcif Tissue Int. 1989. 44 (4): 243–50. [PubMed] [Google Scholar] 25. Ширадо О, Канеда К., Тадано С., Исикава Х., McAfee PC, Warder KE. Влияние дегенерации диска на механизм разрывных переломов грудопоясничного отдела. Позвоночник. 1992. 17 (3): 286–92. [PubMed] [Google Scholar] 26. Дай Л., Ван XY, Ван К.Г., Цзян Л.С., Сюй Х.З. Минеральная плотность костной ткани грудопоясничного отдела позвоночника по отношению к взрывным переломам: количественное исследование компьютерной томографии.Eur Spine J. 2006; 15 (12): 1817–22. DOI: 10.1007 / s00586-006-0148-2 [PubMed] [Google Scholar] 27. Zhao F, Pollintine P, Hole BD, Adams MA, Dolan P. Переломы позвонков обычно поражают замыкательную пластинку черепа, потому что она тоньше и поддерживается менее плотной губчатой костью. Кость. 2009. 44 (2): 372–9. DOI: 10.1016 / j.bone.2008.10.048 [PubMed] [Google Scholar] 29. Коккорис П., Хатзидакис И., Хацелис Э., Макрас П., Толумис Г. Плотность костей в бедре и поясничном отделе позвоночника у здорового мужского населения. Эндокринные аннотации.2016; 41: doi: 10.1530 / endoabs.41.EP114 [Google Scholar] 31. Томпсон Дж., Пирс Р.Х., Шехтер М.Т., Адамс М.Э., Цанг И.К., Епископ ПБ. Предварительная оценка схемы оценки общей морфологии межпозвоночного диска человека. Позвоночник (Phila Pa 1976). 1990; 15 (5): 411–5. [PubMed] [Google Scholar] 32. Макнаб И. Тяговая шпора. Индикатор сегментарной нестабильности. J Bone Joint Surg Am. 1971; 53 (4): 663–70. [PubMed] [Google Scholar] 34. Магерл Ф., Эби М., Гертцбейн С.Д., Хармс Дж., Назарян С. Исчерпывающая классификация травм грудного и поясничного отделов.Eur Spine J. 1994; 3 (4): 184–201. [PubMed] [Google Scholar] 35. Гальбусера Ф., Шмидт Х., Нейдлингер-Вильке С., Готтшалк А., Вильке Х. Дж. Механический ответ поясничного отдела позвоночника на различные комбинации дегенеративных изменений диска исследовали с использованием рандомизированных пороупругих моделей конечных элементов. Eur Spine J. 2011; 20 (4): 563–71. DOI: 10.1007 / s00586-010-1586-4 [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Кемпер А., Макнелли С., Дума С.М. Влияние скорости деформации на свойства жесткости на сжатие поясничных межпозвонковых дисков человека.Biomed Sci Instrum. 2007. 43: 176–81. [PubMed] [Google Scholar] 37. Дума С., Кемпер А.Р., Макнили Д.М., Бролинсон П.Г., Мацуока Ф. Биомеханический ответ поясничного отдела позвоночника при динамическом сжатии. Biomed Sci Instrum. 2006; 42: 476–81. [PubMed] [Google Scholar] 38. Диллон Н., Басс ЕС, Лотц Дж. Влияние замороженного хранения на ползучесть межпозвоночных дисков человека. Позвоночник. 2001. 26 (8): 883–8. [PubMed] [Google Scholar] 40. Сметерс Дж., Джоанес Д. Н.. Динамические сжимающие свойства поясничных межпозвонковых суставов человека: сравнение свежих и размороженных образцов.J Biomech. 1988. 21 (5): 425–33. [PubMed] [Google Scholar] 41. Кифуне М., Панджаби М.М., Аранд М., Лю В. Характер переломов и нестабильность грудопоясничных травм. Eur Spine J. 1995; 4 (2): 98–103. [PubMed] [Google Scholar] 42. Кифунэ М., Панджаби М.М., Лю В., Аранд М., Васавада А., Оксланд Т. Функциональная морфология позвоночного канала после замыкательных, клиновых и взрывных переломов. J Расстройство позвоночника. 1997. 10 (6): 457–66. [PubMed] [Google Scholar] 43. Пенджаби М., Оксланд Т.Р., Кифуне М., Аранд М., Вен Л., Чен А. Обоснованность теории трех столбцов грудопоясничных переломов.Позвоночник. 1995. 20 (10): 1122–7. [PubMed] [Google Scholar] 44. Панджаби М, Оксланд Т.Р., Лин Р.М., МакГоуэн Т.В. Грудопоясничный разрывной перелом. Биомеханическое исследование его разнонаправленной гибкости. Позвоночник (Phila Pa 1976). 1994. 19 (5): 578–85. [PubMed] [Google Scholar] 45. Линдаль О. Механические свойства высушенной обезжиренной губчатой кости. Акта Ортоп Сканд 1976; 47 (1): 11–9. [PubMed] [Google Scholar] 46. Картер Д., Хейс WC. Сжимающее поведение кости как двухфазной пористой структуры. J Bone Joint Surg Am 1977. 59 (7): 954–62.[PubMed] [Google Scholar] 47. Эдмондстон С., Певица КП, Дэй РЭ, Брейдал П.Д., Прайс РИ. Взаимосвязь in vitro между плотностью тела позвонка, размером и прочностью на сжатие в грудопоясничном отделе позвоночника пожилого возраста. Clin Biomech (Бристоль, Эйвон). 1994. 9 (3): 180–86. [PubMed] [Google Scholar] 48. Chagnon A, Aubin CE, Villemure I. Биомеханическое влияние свойств диска на передачу нагрузки здоровых и дегенерированных дисков с использованием пороупругой модели конечных элементов. J Biomech Eng. 2010; 132 (11): 111006 DOI: 10.1115 / 1.4002550 [PubMed] [Google Scholar] 49. Эль-Рич М., Арну П.Дж., Ваньак Э, Брюне С., Обен С.Е. Конечноэлементное исследование влияния скорости нагрузки на изменения распределения нагрузки на позвоночник в условиях удара. J Biomech. 2009. 42 (9): 1252–62. DOI: 10.1016 / j.jbiomech.2009.03.036 [PubMed] [Google Scholar] 50. Wagnac E, Arnoux PJ, Garo A, Aubin CE. Конечно-элементный анализ влияния скорости нагружения на модель всего поясничного отдела позвоночника в условиях динамического нагружения. Med Biol Eng Comput. 2012; 50 (9): 903–15.DOI: 10.1007 / s11517-012-0908-6 [PubMed] [Google Scholar]Существенные остеофиты тела позвонков защищают от тяжелых переломов позвонков при компрессии
PLoS One. 2017; 12 (10): e0186779.
, Концептуализация, курирование данных, формальный анализ, исследование, методология, администрирование проекта, ресурсы, проверка, визуализация, написание — первоначальный черновик, написание — просмотр и редактирование, 1, 2, 3, * , Концептуализация, получение финансирования, методология, администрирование проекта, надзор, проверка, написание — обзор и редактирование, 3, 4, 5 , исследование, ресурсы, написание — обзор и редактирование, 6, 7 , Концептуализация, Написание — просмотр и редактирование, 2, 5, 8 , Формальный анализ, Визуализация, Написание — просмотр и редактирование, 1 , Концептуализация, Визуализация, Написание — обзор и редактирование, 1, 2, 3 , Курирование данных, Исследование, Написание — просмотр и редактирование, 4, 9 и, Концептуализация, Методология, Управление проектами, Ресурсы, Надзор, Написание — re просмотр и редактирование 9, 10Eric Wagnac
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
Карл-Эрик Обен
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
4 Кафедра машиностроения, Политехническая школа Монреаля, Монреаль, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
Катя Чаумутр
6 Отделение медицинской визуализации, Северная больница, Университет Экс Марсель, Марсель, Франция
7 Laboratoire d’Anthropologie Biologique, Университет Экс Марсель, Марсель, Франция
Жан-Марк Мак-Тионг
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
8 Отделение хирургии медицинского факультета Монреальского университета, Монреаль, Квебек, Канада
Анн-Лор Менар
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
Иван Пети
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
Анаис Гаро
4 Департамент машиностроения, Политехническая школа Монреаля, Монреаль, Канада
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
Pierre-Jean Arnoux
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
10 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Марсель, Франция
Хосе Мануэль Гарсия Аснар, редактор
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
4 Кафедра машиностроения, Политехническая школа Монреаля, Монреаль, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
6 Отделение медицинской визуализации, Северная больница, Университет Экс Марсель, Марсель, Франция
7 Лаборатория биологической антропологии, Университет Экс Марсель, Марсель, Франция
8 Отделение хирургии медицинского факультета Монреальского университета, Монреаль, Квебек, Канада
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
10 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Марсель, Франция
Университет Сарагосы, ИСПАНИЯ
Конкурирующие интересы: Авторы заявили, что не существует конкурирующих интересов.
Поступила 17.05.2017; Принято 6 октября 2017 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. другими статьями в PMC.- Дополнительные материалы
-
S1 Рис. Индивидуальные данные для каждого субъекта, упорядоченные по группе с существенными остеофитами и с небольшими остеофитами.(TIF)
GUID: 02E46D00-34BE-4701-ADF6-01A8E5BF4A2B
S1 Таблица: Индивидуальные данные для каждого испытуемого: трабекулярная плотность позвонков (VTD), площадь поперечного сечения (CSA), высота образца (H), жесткость ( K ) и параметры отказа ( F FAIL , D FAIL и E FAIL ) без нормализации. (DOCX)
GUID: EC8270B3-7D62-4E9E-94A5-FDB3AC5E64C5
- Заявление о доступности данных
-
Все соответствующие данные находятся в документе.
Abstract
Недавние открытия предполагают, что остеофиты позвоночника повышают сопротивляемость позвоночника сжатию. Однако роль остеофитов позвоночника в биомеханической реакции позвоночника при быстром динамическом сжатии, вплоть до отказа, неясна. Семнадцать образцов позвоночника человека, состоящего из трех позвонков (от T5-T7 до T11-L1) и окружающих их мягких тканей, были взяты у девяти трупов в возрасте от 77 до 92 лет. Образцы получали с помощью количественной компьютерной томографии (ККТ) для медицинского наблюдения, классификации дегенерации межпозвонкового диска (степень Томсона) и измерения плотности трабекул позвонков (VTD), высоты и площади поперечного сечения.Образцы были разделены на две группы (с (n = 9) или без (n = 8) существенными остеофитами тела позвонков) и подверглись осевому сжатию со скоростью динамического смещения 1 м / с, вплоть до отказа. Нормализованные кривые «сила-смещение», видео и изображения QCT позволили охарактеризовать параметры разрушения (сила, смещение и энергия при разрыве) и характер разрушения. Результаты были проанализированы с использованием критериев хи-квадрат для выборочных распределений и линейной регрессии для корреляции между VTD и параметрами отказов.Образцы со значительными остеофитами тела позвонков демонстрируют более высокую жесткость (в среднем в 2,7 раза) и силу при разрушении (в среднем в 1,8 раза), чем другие сегменты. Наличие остеофитов существенно влияет на расположение, характер и тип перелома. VTD был хорошим предиктором динамической силы и энергии при разрушении для образцов без существенных остеофитов. Это исследование также показало, что остеофиты тела позвонка обеспечивают защитный механизм нижележащего позвонка от тяжелых компрессионных переломов.
Введение
Остеофит тела позвонка — распространенная форма остеоартрита, определяемая как аномальный костный рост или костная шпора, образующаяся вдоль межпозвонковых суставов [1]. На поздних стадиях развития остеофитов соседние позвонки срастаются друг с другом, образуя костный мост через межпозвоночный диск, называемый мостиковым остеофитом. Остеофиты позвонков обычно связаны со старением, дегенерацией межпозвоночного диска, травматическими повреждениями, склерозом замыкательной пластинки, сужением дискового пространства [1, 2], ремоделированием фасеточных суставов [3], болями в спине [4] и диффузным идиопатическим гиперостозом скелета (DISH) или болезнью Форестье. [5].Соответственно, значительный остеофит можно найти в 20–25% шипов в возрасте 20–45 лет и в 73–90% шипов старше 60 лет [2–4, 6]. Осложнения, связанные с образованием остеофитов, многочисленны (дисфагия, компрессия грудной аорты, обструкция полой вены, компрессия нервных корешков) и влияют на большинство структур, расположенных в непосредственной близости от позвоночника. Как следствие, они обычно рассматриваются как дегенеративное состояние и могут быть удалены хирургическим путем традиционными или малоинвазивными методами во время операций на позвоночнике, когда они приводят к инвалидности или неврологическим симптомам [1, 7].Недавно было высказано предположение, что остеофиты позвоночника в первую очередь стабилизируют позвоночник при изгибе и повышают его сопротивление при сжатии [8, 9]. Действительно, если остеофиты обеспечивают стабильность, добавляя кость и увеличивая площадь поперечного сечения позвонков, они также могут обеспечивать защитный механизм от переломов позвонков, несмотря на генерализованную остеопению, наблюдаемую в большинстве стареющих позвоночников.
Однако механическая роль остеофитов тела позвонков в отношении риска и тяжести переломов позвоночника остается неясной.Большинство переломов позвонков варьируются от болезненных компрессионных переломов до более серьезных травм, таких как разрывные и дистракционные переломы. Многие из них расположены на средне-грудном, грудопоясничном или среднем поясничном уровнях и являются результатом механизма осевой компрессии с комбинированным сгибанием или без него [10]. Чтобы лучше понять биомеханику переломов позвонков, было проведено множество экспериментальных исследований трупных тканей человека при осевом сжатии. Несущая способность отдельных позвонков и функциональных спинномозговых единиц (FSU) сформировала основу для количественной оценки устойчивости межпозвоночной структуры к сопротивлению нагрузке и сохранению невредимости [11–18].Другие дополнительные исследования были нацелены на прогнозирование риска переломов позвоночника путем выявления потенциальных корреляций между нагрузкой отказа / переломами позвонков отдельных позвонков или ПСС и клиническими измерениями, такими как минеральная плотность кости (МПК) и морфология [19–24], степень поражения дегенерация [25] и костная архитектура [26–28].
Хотя вышеупомянутые эксперименты предоставили существенное понимание биомеханики переломов позвонков, ни один из них не объяснил механический вклад остеофитов позвоночника.Недавно было высказано предположение, что остеофиты позвоночника увеличивают сопротивление позвоночника сжатию и что в их присутствии клинические измерения МПК занижают прочность позвоночника на сжатие [9, 29]. Однако их тесты на трупах проводились при квазистатических физиологических нагрузках (без отказов). Следовательно, они не воспроизводили динамические реальные условия травм (например, падения или дорожно-транспортные происшествия), которые приводят к компрессионным переломам позвонков.
Настоящее исследование направлено на анализ роли значительных остеофитов позвоночника на биомеханическую реакцию позвоночника при динамическом сжатии, вплоть до отказа.Их влияние на прогноз прочности позвонков на сжатие посредством клинических измерений также было исследовано. Наша гипотеза состоит в том, что существенные остеофиты позвонков имеют значительное влияние на параметры, тип, характер, расположение и прогноз риска переломов позвонков, когда позвоночник подвергается динамической компрессии.
Материалы и методы
Трупные образцы
Протокол исследования был одобрен институциональным наблюдательным советом IFSTTAR / Университета Экс-Марсель.Ни один из доноров трансплантата не был из уязвимой группы населения, и все доноры или ближайшие родственники предоставили письменное информированное согласие, которое было дано свободно. Семнадцать образцов человеческих сегментов позвоночника, состоящих из трех позвонков и окружающих их мягких тканей, были взяты из девяти забальзамированных трупов. Средний возраст, рост стоя и вес испытуемых составляли 86 ± 5 лет, 164 ± 6 см и 60 ± 13 кг (). Семь экземпляров были расположены в T11-L1, семь — в T8-T10 и три — в T5-T7. Все костные ребра и несвязочные мягкие ткани были удалены из образцов, и изображения количественной компьютерной томографии (ККТ) были получены с использованием клинического сканера (SIEMENS Somatom Sensation Cardiac 64: 120 кВ, 300–350 мАс, смежные срезы 0.6 мм) для медицинского наблюдения, классификации и измерения остеофитов, которые наблюдались на всех позвоночных уровнях. Каждый образец классифицировали в соответствии с направлением каждой пары остеофитов в межпозвоночном пространстве [30] и в соответствии со схемой классификации дегенерации диска Томсона [31]. Размер остеофитов измеряли с использованием метода, описанного Аль-Равахи и др. [9]. Экземпляры были разделены на две группы (). В первой группе (n = 9), названной «образцы со значительными остеофитами», были остеофиты типа C, характеризующиеся почти полным костным мостом, сформированным через пространство межпозвонкового диска.Их остеофиты варьировали от 10 до 15 мм. Во второй группе (n = 8), названной «образцы с небольшими остеофитами», были остеофиты типа E, характеризующиеся остеофитами, которые простирались почти горизонтально до границы тела позвонка, не закрывая пространство межпозвонкового диска. Их остеофиты варьировались от 2 мм (минимальный размер, чтобы считать шпору остеофитом [32]) до 5 мм.
Таблица 1
Подробная информация о 17 образцах спинного мозга, извлеченных из 9 трупов.
| ID субъекта | Пол | Возраст (лет) | Вес (кг) | Рост стоя (см) | Образец | Группа | IVD | 88 | 64 | 155 | T11-L1 | 1 | 5 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 02 | F | 83 | 49 | 165 | 83 9028 3 | -T4- ||||||||||||||||
| 03 | F | 85 | 48 | 154 | T11-L1 | 1 | 5 | ||||||||||||||
| 04 | F | 92 | 54 1 | 5 | |||||||||||||||||
| T11-L1 | 2 | 4 | |||||||||||||||||||
| 05 | F | 9028 3 9339 | 165 | T8-T10 | 2 | 3 | |||||||||||||||
| T11-L1 | 2 | 88 | 71 | 165 | T8-T10 | 2 | 4 | ||||||||||||||
| T11-L1 | |||||||||||||||||||||
| M | 77 | 75 | 173 | T5-T7 | 2 | 3 | |||||||||||||||
| T11-L1 | 2 | 3 | |||||||||||||||||||
| 08 | M | 90 | 91 | 170 | T5-T7 | 1 | 5 | ||||||||||||||
| T8-T10 | 1 | 5 | 9028 -L1 | 1 | 5 | ||||||||||||||||
| 09 | M | 82 | 53 | 165 | T5-T7 | 1 | 5 | 9028 T8-T10 | 1 | 5 |
Затем были проведены измерения плотности трабекул позвонков (VTD), высоты (H) и площади поперечного сечения (CSA) каждого образца.VTD измеряли на каждом позвонке, создавая сканирующий участок толщиной 9 мм, параллельный замыкательным пластинкам позвонка, в средней плоскости тела позвонка [33]. Положение тела посередине позвонка подтверждалось входом базивертебральной вены в среднюю плоскость сканируемого разреза. Средняя единица Хаунсфилда (HU) была рассчитана для интересующей овальной области размером 25 мм 2 , которая включала только губчатую кость (без кортикального ободка или частей базивертебральной вены). Для целей стандартизации (калибровки) средние значения HU каждого позвонка были преобразованы в значения VTD (г / мм 3 ) с использованием линейной регрессии, полученной из фантома электронной плотности КЛКТ (модель 062A, CIRS Inc., Вирджиния, США), помещенные рядом с образцами позвоночника во время ККТ. В конце концов, VTD образца была рассчитана путем усреднения VTD трех составляющих его позвонков. Высота образца измерялась между центром верхней и нижней замыкательных пластинок хвостового и дистального позвонков соответственно. ППС каждого позвонка измеряли по середине тела позвонка. Общая ППС образца была получена путем усреднения ППС трех позвонков. После визуализации образцы замораживали при -20 ° C до тестирования.
Испытательное оборудование и процедуры
Динамическое осевое сжатие было выполнено с использованием сервогидравлической системы испытаний материалов (MTS Axial 370.02 15 кН, Эден-Прери, Миннесота), которая включала одноосный датчик нагрузки и индуктивный датчик смещения для измерения силы привода и отклонение (). Две высокоскоростные камеры (1000 кадров в секунду) были размещены в стороне от образца для визуализации и хронологического отслеживания повреждений позвоночника. За два дня (48 ч) до испытания образцы оттаивали в холодильнике (4 ° C) и накрывали полотенцами, пропитанными физиологическим раствором.Чтобы зафиксировать образец на MTS и равномерно нагружать его, половина дистального и проксимального позвонков была помещена в параллельные чашки, заполненные полиуретановой смолой за двадцать четыре часа до испытания. Во время этого процесса сохранялась сагиттальная естественная кривизна образцов.
Экспериментальная установка, состоящая из сервогидравлической системы испытания материалов (1), двух высокоскоростных камер (2), одноэлементного датчика нагрузки (3) и трупного сегмента позвоночника (4). Трупный сегмент позвоночника (4) был зафиксирован на MTS путем заливки дистального и проксимального позвонков в полиуретановую смолу (5).
Перед испытанием образцы размораживали при комнатной температуре (23 ° C) в течение 3 часов. Каждый образец помещали на MTS и прикладывали предварительную нагрузку 0,25 кН в течение 1 минуты [20]. Затем образцы подвергались динамическому сжатию со скоростью 1 м / с до разрушения. Испытание было остановлено, когда образец был сжат примерно до 60% высоты среднего позвонка (от 12 до 15 мм). Все испытания проводились при комнатной температуре. После сжатия для медицинской диагностики были сделаны изображения QCT образцов.
Анализ данных и статистика
Кривые сила-смещение были записаны и нормализованы (F норма = f (D норма )) в соответствии со средним размером всех образцов, как описано уравнениями (1) и (2) :
Fnorm = FCSAspecimenMeanCSA = F.MeanCSACSAspecimen
(1)
Dnorm = DHeightspecimenMeanHeight = D.MeanHeightHeightspecimen
(2)
(4) уровни.Разрушение было определено как первая точка, в которой дальнейшее увеличение смещения вызвало уменьшение нагрузки. Из каждой кривой были извлечены нормализованная жесткость ( K ), сила ( F FAIL ), смещение ( D FAIL ) и энергия при отказе ( E FAIL ). . Жесткость определялась как наклон наиболее линейного участка кривой до разрушения. Энергия разрушения определялась как площадь под кривой «сила-смещение» до разрушения.Среднее и стандартное отклонения биомеханических параметров ( K , F FAIL , D FAIL и E FAIL ) были вычислены для каждой группы и статистически сравнивались. Воспроизведение тестов и чистые оценки дисперсии ошибок для биомеханических параметров не могли быть выполнены, поскольку тесты были деструктивными.
Обычные модели линейной регрессии были приспособлены для оценки степени линейной корреляции между VTD и каждым измеряемым параметром для каждой группы, без учета какого-либо взаимодействия между параметрами.Чтобы проверить, была ли взаимосвязь между VTD и нормализованными биомеханическими параметрами для группы с небольшими остеофитами аналогична группе с существенными остеофитами, модель, подобранная для первой группы, использовалась для прогнозирования биомеханических параметров другой группы. Затем биомеханические параметры (среднее и стандартное отклонение), рассчитанные на основе этих соотношений, сравнивали с биомеханическими параметрами, полученными экспериментально для другой группы.
Видео были проанализированы для определения места разрушения и характера трещин.ККТ-изображения сломанных образцов были использованы для определения типа перелома на основе классификации AO (инициалы немецких терминов «Arbeitsgemeinschaft für Osteosynthesefragen») для грудных и поясничных травм [34]. Тесты хи-квадрат были выполнены для изучения влияния остеофитов на расположение, тип и характер перелома. Все статистические анализы были выполнены с использованием программы STATISTICA v.7.0 (StatSoft, Талса, Оклахома, США). Различия считали достоверными при p <0.05.
Результаты
Морфология и плотность трабекул позвонков
Образцы со значительными остеофитами показали более высокий (в 1,6 раза) VTD, чем образцы с небольшими остеофитами (p = 0,003) (см. Рис. S1 и таблицу S1). Они также показали большую площадь поперечного сечения (p = 0,307), но меньшую высоту (p = 0,071). Однако, в отличие от VTD, различия в общей морфологии образцов не были значительными.
Таблица 2
Плотность трабекул позвонков (VTD), площадь поперечного сечения (CSA) и высота образца (H) по группам образцов (среднее значение ± стандартное отклонение).
| Образцы с существенными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | Отношение (существенное / малое) | |
|---|---|---|---|
| VTD4 (г / мм) ) | 103 ± 24 | 64 ± 25 | 1,60 * |
| CSA (мм 2 ) | 1062 ± 171 | 1009 ± 251 | 1,05 |
| 77.0 ± 5,0 | 81,3 ± 6,6 | 0,95 |
Кривые «сила-перемещение»
Все образцы имели нормированные кривые «сила-перемещение» одинаковой формы (). Кривые со встроенными маркерами (квадраты, треугольники, кресты и т. Д.) Представляют образцы со значительными остеофитами. Типичная кривая изображена на. До разрушения кривая имеет нелинейную форму, характеризующуюся первым изогнутым сегментом увеличивающейся жесткости (сегмент A-B), за которым сразу следует линейный сегмент (B-C).Этот линейный сегмент предшествует сильно нелинейному сегменту (C-D), характеризующемуся уменьшающейся жесткостью. Сегмент BC называется упругой частью кривой, в то время как сегмент CD называется неупругой частью, где повреждение на микроуровне (потеря целостности материала из-за образования трещин и пустот, ухудшающих жесткость), пластичность (процесс течения, создающий безвозвратные повреждения). деформации) и вязкоупругости (диссипативный процесс). После разрушения (точка D) кривая показывает уменьшение прочности (D-E) до точки E, после чего образец либо сохраняет (девять образцов), либо восстанавливает (восемь образцов) некоторую прочность (сегмент E-F).
Нормированные кривые «сила-смещение» для образцов T5-T7 (a), T8-T10 (b) и T11-L1 (c). Кривые с символами представляют образцы со значительными остеофитами. Эти образцы показали большую жесткость, нагрузки и смещения до разрушения.
Типичная кривая силы-смещения (F-D) (образец T11-L1, объект 3).Шесть сегментов (от A-B до E-F), изображенные на этой кривой, наблюдались на всех образцах.
Нормализованная жесткость и параметры разрушения
Средняя нормализованная жесткость ( K ) образцов со значительными остеофитами составляла 1.В 9 раз превышает жесткость образцов с мелкими остеофитами (). Среднее значение F FAIL , D FAIL и E FAIL образцов со значительными остеофитами было в 2,7, 1,8 и 5,3 раза больше соответствующих значений образцов с небольшими остеофитами, соответственно. . Все различия между группами были статистически значимыми, со значениями p 0,0004 ( K ), 0,0006 ( F FAIL ), 0.006 ( D FAIL ) и 0,002 ( E FAIL ).
Таблица 3
Нормализованные параметры жесткости и разрушения по группам (среднее значение ± стандартное отклонение).
| Образцы со значительными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | Отношение (существенное / малое) | ||
|---|---|---|---|---|
| 3207 ± 735 | 1716 ± 586 | 1.9 † | ||
| F ОТКАЗ (N) | 6873 ± 2534 | 2510 ± 1152 | 2,7 † | |
| D ОТКАЗ (мм) 3,5803 | 1,9 ± 0,91,8 † | |||
| E FAIL (J) | 14,8 ± 8,1 | 2,8 ± 2,4 | 5,3 † | |
Корреляция между 9 нормализованными параметрами биомеханики VT образцы со значительными остеофитами, не было обнаружено статистически значимой корреляции между VTD и биомеханическими параметрами ().Для образцов с небольшими остеофитами VTD был хорошим предиктором нормализованного
F FAIL (r 2 = 0,80, p <0,03) и E FAIL (r 2 = 0,55, р <0,035). Напротив, VTD не коррелировал с K (r 2 = 0,42, p <0,12) и D FAIL (r 2 = 0,33, p <0,14). Линейная регрессия между VTD и нормализованными биомеханическими параметрами.VTD коррелировал только с нормализованными F FAIL и E FAIL образцов без остеофитов.
Следуя этим результатам, значения для F FAIL и E FAIL были предсказаны с использованием линейных соотношений и VTD образцов со значительными остеофитами, так что образцы с аналогичным VTD могли быть в сравнении. Опять же, значительные различия были обнаружены между группами ( F FAIL = 4117 ± 1002 N; E FAIL = 5.5 ± 1,7), таким образом гарантируя, что одна VTD не может объяснить различия, наблюдаемые между группами.
Типы, типы и места переломов
При неудаче видеоанализ показал, что один из позвонков разрушился, и костный мозг был выброшен струями в месте перелома, а также из отверстий и сосудистых каналов в коре головного мозга. Тело первого позвонка, разрушившееся, и характер перелома значительно различались между двумя группами образцов. Действительно, первое тело позвонка, которое разрушилось, было средним или дистальным для семи из восьми образцов с небольшими остеофитами (), в то время как оно было проксимальным для восьми из девяти образцов со значительными остеофитами ().
Разрушение первого позвонка с характерным переломом.a) Образец без остеофитов (образец сегмента T11-L1 субъекта 3). Средний позвонок (Т12) разрушается первым. Горизонтальный узор разделяет позвонок на верхнюю и нижнюю части. На ККТ-изображении наблюдается взрывная трещина. б) Образец со значительными остеофитами (сегмент Т8-Т10 субъекта 2). Проксимальный позвонок (Т11) разрушается первым. Вертикальный узор разделяет позвонок на переднюю и заднюю части.На ККТ-изображении наблюдается перелом остеофита. Пунктирными линиями обозначен выброс костного мозга на месте перелома.
На корковых поверхностях были идентифицированы три модели перелома. В первом варианте кортикальная кость раскалывается по окружности и по горизонтали в центре, оставляя линию, разделяющую тело позвонка на верхнюю и нижнюю части (). Во втором случае кортикальная кость раскалывается вертикально, оставляя линию, которая в основном разделяет тело позвонка на переднюю и заднюю части ().Третий образец представлял собой комбинацию двух других образцов и привел к полному разрушению образца. Первая картина наблюдалась на семи из восьми образцов с небольшими остеофитами, а вторая картина наблюдалась на семи из девяти образцов со значительными остеофитами. Третий образец наблюдали на одном экземпляре из каждой группы.
КТ-изображения показали, что наличие значительных остеофитов влияет на типы переломов (). У пяти образцов с небольшими остеофитами был полный взрывной перелом с ретропульсивным фрагментом кости и нарушением канала (тип А.3.3 классификации AO), а у трех из этих образцов был ударный перелом с коллапсом тела позвонка (тип A.1.3). Только у одного образца с остеофитами позвонков был полный взрывной перелом (с переломом остеофита). Остальные восемь образцов имели ударный перелом с коллапсом тела позвонка (тип A.1.3), иногда с небольшим смещением задней кортикальной стенки. Среди этих образцов у шести были переломы по крайней мере одного из их остеофитов.
Таблица 4
Распределение типов трещин по группам образцов.
| Типы переломов | Образцы со значительными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | ||
|---|---|---|---|---|
| Разрывные переломы | 0 | 5 | ||
| — С переломом остеофита | 1 | 0 | ||
| Импульсный перелом или коллапс тела позвонка | 9028 — 9028 — 9028 — | — С переломом остеофита | 6 | 0 |
Обсуждение
Предыдущие исследования [9, 35] показали, что остеофиты позвонков вызывают значительные изменения устойчивости и гибкости ПСС в квазистатических или физиологических условиях нагрузки. .Настоящее исследование отличается тем, что были протестированы более длинные сегменты позвоночника (трехпозвоночные) при динамическом сжатии и оценена роль остеофитов тела позвонков в механизмах перелома сегментов позвоночника. Значительные остеофиты позвонков увеличивают жесткость и несущую способность сегментов позвоночника. Они также влияют на характер, расположение и прогнозирование риска переломов позвонков.
Ограничения настоящего исследования необходимо обсудить до интерпретации результатов.Во-первых, из-за ограниченной доступности и стоимости человеческих трупов у девяти испытуемых было извлечено только семнадцать образцов. Такой небольшой размер выборки является важным ограничением исследования. Поэтому, чтобы максимизировать размер выборки, данные разных полов и уровней позвоночника были объединены вместе с использованием процесса нормализации. Однако антропометрические различия между мужчинами и женщинами () могли уменьшить или замаскировать потенциальные корреляции с VTD, хотя обе группы содержали образцы мужчин и женщин.Было бы интересно изучить влияние пола и найти гендерные корреляции с большим количеством выборок. С этой точки зрения индивидуальные данные биомеханических параметров были доступны для дальнейшего использования (рис. S1 и таблица S1). Также размеры тела позвонков зависят от пола; поэтому учет поперечных сечений позвонков имеет первостепенное значение для выражения силы, необходимой для сравнения образцов. Процесс нормализации, подобный построению инженерных кривых напряжения-деформации, был выбран таким образом, чтобы биомеханические параметры были выражены в единицах, согласующихся с теми, которые обычно используются клиницистами или сообщаются в других исследованиях [9, 16, 36, 37].Нормализованная сила была предпочтительнее сжимающего напряжения для выражения нагрузки, поскольку позвонки являются неоднородными и сложными материалами. Нормализация была основана на средней CSA тела среднего позвонка и общей высоте образцов, поскольку эти морфологические параметры не изменились из-за присутствия остеофитов. Во-вторых, условия хранения образцов могли повлиять на результаты, но замораживание и хранение существенно не меняют их физические свойства [38–40]. Наконец, применяемые нагрузки и граничные условия были упрощены по сравнению с реальными ситуациями травм (падения, автомобильные аварии и т. Д.).) из-за очень ограниченных знаний о сложных нагрузках, возникающих в таких ситуациях, и из-за присущих им трудностей экспериментального воспроизведения этих нагрузок. Однако полученные в результате переломы были аналогичны тем, которые наблюдались клинически, и энергия, приложенная к образцам, хорошо согласовывалась с энергией, примененной в других экспериментах in vitro , направленных на воспроизведение компрессионных переломов [41–44].
Обе группы образцов показали последовательные механические реакции вплоть до разрушения, с нормализованными кривыми силы-смещения, показывающими аналогичные формы (сегменты от A-B до C-D), как кривые сила-смещение, описанные в других исследованиях [16, 37].Более того, основные силы разрушения 6873 ± 2534 Н и 2510 ± 1152 Н, соответственно, наблюдаемые на образцах со значительными и небольшими остеофитами, находились в том же диапазоне, что и в аналогичных экспериментах, проведенных на здоровых поясничных сегментах позвоночника двух и шести позвонков [37]. . После отказа обе группы образцов смогли сохранить или увеличить свою прочность (сегменты E-F). Эта характеристика может быть объяснена механизмом раздавливания губчатого вещества кости. Lindahl [45] наблюдал аналогичные кривые после сжатия небольших кубических блоков пояснично-губчатой кости.Картер и Хейс [46] предположили, что по мере увеличения нагрузки коллапс увеличивающегося количества межтрабекулярных пространств ограничивает движение костного мозга, тем самым обеспечивая гидравлическую амортизацию спинного сегмента. Они также сообщили, что образцы с повышенной прочностью после разрушения были связаны с более высокой общей минеральной плотностью кости. В текущем исследовании образцы с остеофитами позвонков были связаны с более высоким VTD и были способны выдерживать большие нагрузки после неудачи ().На данный момент невозможно подтвердить, может ли этот более высокий VTD, который был измерен в пределах кортикального края, быть отнесен к образованию остеофитов или биологическим различиям между образцами. В дальнейшем исследовании анализ образцов с использованием структур трещин большего размера также может улучшить корреляцию с VTD.
Биомеханические параметры образцов с небольшими остеофитами хорошо согласуются с данными других экспериментальных исследований, проведенных в аналогичных условиях [36, 37, 47].Более высокие значения K и F FAIL , измеренные для образцов со значительными остеофитами, хорошо согласуются с результатами Al-Rawahi et al. [9], которые показали на постсоветском пространстве, что остеофиты умножают эти параметры в 1,17 и 1,18 раза соответственно. Наши более высокие коэффициенты размножения (1,9 и 2,7 соответственно) могут быть связаны с различными условиями нагрузки (динамическое и квазистатическое сжатие), а также природой и размером протестированных остеофитов (длина остеофитов в Al-Rawahi et al.[9] в среднем составляли 7 мм, и ни у одного из них не было обнаружено полного и жесткого переднего моста кости). Это последнее наблюдение кажется актуальным, поскольку возрастающая тяжесть образования остеофитов связана с сопутствующим сужением межпозвоночного дискового пространства [2], что, в свою очередь, вызывает жесткость спинного сегмента при сжатии [35]. Регрессионный анализ показал, что существенные различия между группами для F FAIL и E FAIL нельзя было объяснить только значительным различием в VTD, тем самым подтверждая роль позвоночных остеофитов в отказе. спинномозговых препаратов.
Для образцов с небольшими остеофитами сильная линейная связь между VTD образца и F FAIL и E FAIL хорошо согласуется с результатами, полученными в квазистатических условиях [20 , 24] и убедителен, поскольку сила разрушения — свойство, обычно зависящее от плотности. Напротив, ни один из параметров разрушения образцов со значительными остеофитами не коррелировал с VTD, что позволяет предположить, что значительные остеофиты вызывают значительные костные изменения, которые добавляют неопределенный вклад в прочность позвоночника.Аналогичные выводы были сделаны Al-Rawahi et al. [9] с измерениями МПК с помощью двухфотонной рентгеновской абсорбциометрии. Это открытие предполагает, что клиническая оценка риска переломов для образцов со значительными остеофитами должна основываться не только на VTD и общей морфологии образца до тех пор, пока не будут предоставлены дальнейшие исследования.
Поддерживая большую часть сжимающей нагрузки до разрушения, существенные остеофиты позвонков, по-видимому, обеспечивают защиту от напряжения нижележащего тела позвонка и предотвращают возникновение полного поперечного и горизонтального разрушения тела позвонка (часто связанного с взрывным переломом).Высокая частота взрывных переломов у образцов с небольшими остеофитами, несмотря на умеренно или сильно дегенерированный диск (степень 3 или 4), может быть объяснена более высокими сдвигающими силами, передаваемыми фасетками на заднюю стенку позвонка. Более того, защитный механизм, обеспечиваемый остеофитами позвонков, можно объяснить их способностью изменять сопротивление деформации соседних дисков (за счет увеличения их CSA) или их более высокой плотностью костей. Эти данные подтверждают гипотезу о том, что остеофиты являются адаптивными, а не дегенеративными [9], и что их присутствие позволяет снизить чрезмерную деформацию костей до нормального уровня.
В настоящем исследовании были проведены трупные тесты для оценки роли остеофитов тела позвонков на биомеханический ответ сегментов позвоночника при динамическом сжатии. Полученные результаты подтверждают нашу гипотезу о том, что существенные остеофиты позвонков играют ключевую роль в параметрах, типе, характере, локализации и прогнозировании риска переломов позвонков. В будущих работах будет полезно использовать вычислительные модели [48–50] для обхода ограничений, присущих тестам in vitro (размер выборки, биологические вариации, упрощенные нагрузки и т. Д.).). В этом отношении данные, представленные в настоящем исследовании, могут быть полезны для разработки и проверки этих инструментов.
Дополнительная информация
S1 Рис.
Индивидуальные данные для каждого субъекта, упорядоченные по группе с существенными остеофитами и с небольшими остеофитами.(TIF)
S1 Таблица
Индивидуальные данные для каждого субъекта: плотность трабекул позвонков (VTD), площадь поперечного сечения (CSA), высота образца (H), жесткость ( K ) и параметры разрушения () F FAIL , D FAIL и E FAIL ) без нормализации.(DOCX)
Благодарности
Авторы выражают особую благодарность Ю. Годио, К. Конте, М. Пи, К. Ренье и медицинскому персоналу «Service d’imagerie médicale de l’Hôpital Nord». для экспериментальной установки и in vitro для подготовки образцов и визуализации.
Заявление о финансировании
Эта работа была поддержана CEA: Канадским научно-исследовательским отделом ортопедической инженерии Совета по естественным наукам и инженерным исследованиям Канады.
Доступность данных
Все соответствующие данные находятся в документе.
Список литературы
3. Вайнберг Д., Се К.К., Лю Р.В., Гебхарт Дж.Дж., Гордон З.Л. Повышенная заболеваемость тазом связана с большей ориентацией коронковой фасетки в нижнем поясничном отделе позвоночника: трупное исследование 599 поясничных отделов позвоночника. Позвоночник. 2016; 41 (19): E1138–45. DOI: 10.1097 / BRS.0000000000001577 [PubMed] [Google Scholar] 4. О’Нил Т., МакКлоски Э.В., Канис Дж. А., Бхалла А. К., Рив Дж., Рид Д. М. и др. Распространение, детерминанты и клинические корреляты остеофитоза позвонков: популяционное обследование.J Rheumatol. 1999. 26 (4): 842–8. [PubMed] [Google Scholar] 6. Натан Х. Остеофиты позвоночника: анатомическое исследование их развития в зависимости от возраста, расы и пола с учетом их этиологии и значения. J Bone Joint Surg Am. 1962. 44 (2): 243–68. [Google Scholar] 7. Водица М., Косак Р., Венгуст Р. Отдаленные результаты хирургического лечения симптоматических передних шейных остеофитов: серия случаев с обзором литературы. Clin Spine Surg. 2016; 29 (9): E482–7. DOI: 10.1097 / BSD.0b013e31829046af [PubMed] [Google Scholar] 8. Гальбусера Ф., ван Райсберген М., Ито К., Хюйге Дж. М., Брайда-Бруно М., Вилке Х. Дж. Старение и дегенеративные изменения межпозвоночного диска и их влияние на гибкость позвоночника. Eur J Spine. 2014; 32: S324–32. [PubMed] [Google Scholar] 9. Аль-Равахи М., Луо Дж., Поллинтин П., Долан П., Адамс М.А. Механическая функция остеофитов тела позвонков, выявленная в экспериментах на трупных шипах. Позвоночник. 2011; 36 (10): 770–7. DOI: 10.1097 / BRS.0b013e3181df1a70 [PubMed] [Google Scholar] 11.Карри В., Пинтар Ф.А., Доан Н.Б., Нгуен Х.С., Эккардт Дж., Байсден Дж. Л. и др. Переломы замыкательной пластинки поясничного отдела позвоночника: биомеханическая оценка и клинические аспекты посредством экспериментальной индукции травмы. J Orthop Res. 2016; 34 (6): 1084–91. DOI: 10.1002 / jor.23112 [PubMed] [Google Scholar] 12. Вирджин В. Экспериментальные исследования физических свойств межпозвоночного диска. J Bone Joint Surg Br. 1951; 33-В: 607–11. [PubMed] [Google Scholar] 13. Бартелинк Д. Роль абдоминального давления в снятии давления на поясничные межпозвоночные диски.J Bone Joint Surg Br. 1957; 39-В: 718–25. [PubMed] [Google Scholar] 14. Хаттон В., Адамс Массачусетс. Можно ли сломать поясничный отдел при поднятии тяжестей? Позвоночник. 1982. 7 (6): 586–90. [PubMed] [Google Scholar] 15. Хаттон В., Адамс Массачусетс. Выпадение межпозвоночного диска. Травма, вызванная гиперфлексией, 1981 г. Премия Volvo в области фундаментальных наук. Позвоночник. 1982; 7 (3): 184–91. [PubMed] [Google Scholar] 16. Йоганандан Н., Рэй Дж., Пинтар Ф.А., Миклебуст Дж. Б., Сансес А. Мл. Критерии жесткости и энергии деформации для оценки порога повреждения межпозвонкового сустава.J Biomech. 1989. 22 (2): 135–42. [PubMed] [Google Scholar] 17. Очиа Р., Тенсер А.Ф., Чинг Р.П. Влияние скорости нагрузки на замыкательную пластину и прочность тела позвонков в поясничных позвонках человека. J Biomech. 2003. 36 (12): 1875–81. [PubMed] [Google Scholar] 18. Казарян Л, Грейвс Г.А. Характеристики прочности на сжатие позвоночника человека. Позвоночник. 1977; 2 (1): 1–14. [Google Scholar] 19. МакБрум Р., Хейс В. К., Эдвардс В. Т., Голдберг Р. П., Уайт А. А. 3-е место. Прогнозирование компрессионного перелома тела позвонка с помощью количественной компьютерной томографии.J Bone Joint Surg Am. 1985. 67 (8): 1206–14. [PubMed] [Google Scholar] 20. Singer K, Edmonston S, Day R, Breidahl P, Price R. Прогнозирование прочности на сжатие тела грудного и поясничного позвонков: корреляция с минеральной плотностью кости и областью позвоночника. Кость. 1995. 17 (2): 167–74. [PubMed] [Google Scholar] 21. Mosekilde L, Bentzen SM, Ortoft G, Jorgensen J. Прогностическая ценность количественной компьютерной томографии для прочности на сжатие тела позвонка и плотности золы. Кость. 1989. 10 (6): 465–70. [PubMed] [Google Scholar] 22.Cann C, Genant HK, Kolb FO, Etinger B. Количественная компьютерная томография для прогнозирования риска перелома позвонков. Кость. 1985; 6 (1): 1–7. [PubMed] [Google Scholar] 23. Дэн Х., Сюй Ф.Х., Дэвис К.М., Хини Р., Рекер Р. Различия в минеральной плотности костной ткани, минеральном содержании костной ткани и размере костной поверхности у женщин с переломами и без переломов, а также их взаимосвязь в позвоночнике и бедре. J Bone Miner Metab. 2002. 20 (6): 358–66. DOI: 10.1007 / s007740200052 [PubMed] [Google Scholar] 24. Эрикссон С., Исберг Б.О., Линдгрен Ю.Прогнозирование прочности позвоночника с помощью двухфотонной абсорбциометрии и количественной компьютерной томографии. Calcif Tissue Int. 1989. 44 (4): 243–50. [PubMed] [Google Scholar] 25. Ширадо О, Канеда К., Тадано С., Исикава Х., McAfee PC, Warder KE. Влияние дегенерации диска на механизм разрывных переломов грудопоясничного отдела. Позвоночник. 1992. 17 (3): 286–92. [PubMed] [Google Scholar] 26. Дай Л., Ван XY, Ван К.Г., Цзян Л.С., Сюй Х.З. Минеральная плотность костной ткани грудопоясничного отдела позвоночника по отношению к взрывным переломам: количественное исследование компьютерной томографии.Eur Spine J. 2006; 15 (12): 1817–22. DOI: 10.1007 / s00586-006-0148-2 [PubMed] [Google Scholar] 27. Zhao F, Pollintine P, Hole BD, Adams MA, Dolan P. Переломы позвонков обычно поражают замыкательную пластинку черепа, потому что она тоньше и поддерживается менее плотной губчатой костью. Кость. 2009. 44 (2): 372–9. DOI: 10.1016 / j.bone.2008.10.048 [PubMed] [Google Scholar] 29. Коккорис П., Хатзидакис И., Хацелис Э., Макрас П., Толумис Г. Плотность костей в бедре и поясничном отделе позвоночника у здорового мужского населения. Эндокринные аннотации.2016; 41: doi: 10.1530 / endoabs.41.EP114 [Google Scholar] 31. Томпсон Дж., Пирс Р.Х., Шехтер М.Т., Адамс М.Э., Цанг И.К., Епископ ПБ. Предварительная оценка схемы оценки общей морфологии межпозвоночного диска человека. Позвоночник (Phila Pa 1976). 1990; 15 (5): 411–5. [PubMed] [Google Scholar] 32. Макнаб И. Тяговая шпора. Индикатор сегментарной нестабильности. J Bone Joint Surg Am. 1971; 53 (4): 663–70. [PubMed] [Google Scholar] 34. Магерл Ф., Эби М., Гертцбейн С.Д., Хармс Дж., Назарян С. Исчерпывающая классификация травм грудного и поясничного отделов.Eur Spine J. 1994; 3 (4): 184–201. [PubMed] [Google Scholar] 35. Гальбусера Ф., Шмидт Х., Нейдлингер-Вильке С., Готтшалк А., Вильке Х. Дж. Механический ответ поясничного отдела позвоночника на различные комбинации дегенеративных изменений диска исследовали с использованием рандомизированных пороупругих моделей конечных элементов. Eur Spine J. 2011; 20 (4): 563–71. DOI: 10.1007 / s00586-010-1586-4 [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Кемпер А., Макнелли С., Дума С.М. Влияние скорости деформации на свойства жесткости на сжатие поясничных межпозвонковых дисков человека.Biomed Sci Instrum. 2007. 43: 176–81. [PubMed] [Google Scholar] 37. Дума С., Кемпер А.Р., Макнили Д.М., Бролинсон П.Г., Мацуока Ф. Биомеханический ответ поясничного отдела позвоночника при динамическом сжатии. Biomed Sci Instrum. 2006; 42: 476–81. [PubMed] [Google Scholar] 38. Диллон Н., Басс ЕС, Лотц Дж. Влияние замороженного хранения на ползучесть межпозвоночных дисков человека. Позвоночник. 2001. 26 (8): 883–8. [PubMed] [Google Scholar] 40. Сметерс Дж., Джоанес Д. Н.. Динамические сжимающие свойства поясничных межпозвонковых суставов человека: сравнение свежих и размороженных образцов.J Biomech. 1988. 21 (5): 425–33. [PubMed] [Google Scholar] 41. Кифуне М., Панджаби М.М., Аранд М., Лю В. Характер переломов и нестабильность грудопоясничных травм. Eur Spine J. 1995; 4 (2): 98–103. [PubMed] [Google Scholar] 42. Кифунэ М., Панджаби М.М., Лю В., Аранд М., Васавада А., Оксланд Т. Функциональная морфология позвоночного канала после замыкательных, клиновых и взрывных переломов. J Расстройство позвоночника. 1997. 10 (6): 457–66. [PubMed] [Google Scholar] 43. Пенджаби М., Оксланд Т.Р., Кифуне М., Аранд М., Вен Л., Чен А. Обоснованность теории трех столбцов грудопоясничных переломов.Позвоночник. 1995. 20 (10): 1122–7. [PubMed] [Google Scholar] 44. Панджаби М, Оксланд Т.Р., Лин Р.М., МакГоуэн Т.В. Грудопоясничный разрывной перелом. Биомеханическое исследование его разнонаправленной гибкости. Позвоночник (Phila Pa 1976). 1994. 19 (5): 578–85. [PubMed] [Google Scholar] 45. Линдаль О. Механические свойства высушенной обезжиренной губчатой кости. Акта Ортоп Сканд 1976; 47 (1): 11–9. [PubMed] [Google Scholar] 46. Картер Д., Хейс WC. Сжимающее поведение кости как двухфазной пористой структуры. J Bone Joint Surg Am 1977. 59 (7): 954–62.[PubMed] [Google Scholar] 47. Эдмондстон С., Певица КП, Дэй РЭ, Брейдал П.Д., Прайс РИ. Взаимосвязь in vitro между плотностью тела позвонка, размером и прочностью на сжатие в грудопоясничном отделе позвоночника пожилого возраста. Clin Biomech (Бристоль, Эйвон). 1994. 9 (3): 180–86. [PubMed] [Google Scholar] 48. Chagnon A, Aubin CE, Villemure I. Биомеханическое влияние свойств диска на передачу нагрузки здоровых и дегенерированных дисков с использованием пороупругой модели конечных элементов. J Biomech Eng. 2010; 132 (11): 111006 DOI: 10.1115 / 1.4002550 [PubMed] [Google Scholar] 49. Эль-Рич М., Арну П.Дж., Ваньак Э, Брюне С., Обен С.Е. Конечноэлементное исследование влияния скорости нагрузки на изменения распределения нагрузки на позвоночник в условиях удара. J Biomech. 2009. 42 (9): 1252–62. DOI: 10.1016 / j.jbiomech.2009.03.036 [PubMed] [Google Scholar] 50. Wagnac E, Arnoux PJ, Garo A, Aubin CE. Конечно-элементный анализ влияния скорости нагружения на модель всего поясничного отдела позвоночника в условиях динамического нагружения. Med Biol Eng Comput. 2012; 50 (9): 903–15.DOI: 10.1007 / s11517-012-0908-6 [PubMed] [Google Scholar]Существенные остеофиты тела позвонков защищают от тяжелых переломов позвонков при компрессии
PLoS One. 2017; 12 (10): e0186779.
, Концептуализация, курирование данных, формальный анализ, исследование, методология, администрирование проекта, ресурсы, проверка, визуализация, написание — первоначальный черновик, написание — просмотр и редактирование, 1, 2, 3, * , Концептуализация, получение финансирования, методология, администрирование проекта, надзор, проверка, написание — обзор и редактирование, 3, 4, 5 , исследование, ресурсы, написание — обзор и редактирование, 6, 7 , Концептуализация, Написание — просмотр и редактирование, 2, 5, 8 , Формальный анализ, Визуализация, Написание — просмотр и редактирование, 1 , Концептуализация, Визуализация, Написание — обзор и редактирование, 1, 2, 3 , Курирование данных, Исследование, Написание — просмотр и редактирование, 4, 9 и, Концептуализация, Методология, Управление проектами, Ресурсы, Надзор, Написание — re просмотр и редактирование 9, 10Eric Wagnac
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
Карл-Эрик Обен
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
4 Кафедра машиностроения, Политехническая школа Монреаля, Монреаль, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
Катя Чаумутр
6 Отделение медицинской визуализации, Северная больница, Университет Экс Марсель, Марсель, Франция
7 Laboratoire d’Anthropologie Biologique, Университет Экс Марсель, Марсель, Франция
Жан-Марк Мак-Тионг
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
8 Отделение хирургии медицинского факультета Монреальского университета, Монреаль, Квебек, Канада
Анн-Лор Менар
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
Иван Пети
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
Анаис Гаро
4 Департамент машиностроения, Политехническая школа Монреаля, Монреаль, Канада
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
Pierre-Jean Arnoux
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
10 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Марсель, Франция
Хосе Мануэль Гарсия Аснар, редактор
1 Департамент машиностроения, Высшая школа технологий, Монреаль, Квебек, Канада
2 Исследовательский центр, больница Сакре-Кер, Монреаль, Квебек, Канада
3 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Монреаль, Канада
4 Кафедра машиностроения, Политехническая школа Монреаля, Монреаль, Канада
5 Исследовательский центр, Университетский госпитальный центр Сент-Жюстин, Монреаль, Квебек, Канада
6 Отделение медицинской визуализации, Северная больница, Университет Экс Марсель, Марсель, Франция
7 Лаборатория биологической антропологии, Университет Экс Марсель, Марсель, Франция
8 Отделение хирургии медицинского факультета Монреальского университета, Монреаль, Квебек, Канада
9 Laboratoire de Biomécanique Appliquée, IFSTTAR Aix Marseille Université, Марсель, Франция
10 iLAB-Spine, Ассоциированная международная лаборатория биомеханики позвоночника и изображений, Марсель, Франция
Университет Сарагосы, ИСПАНИЯ
Конкурирующие интересы: Авторы заявили, что не существует конкурирующих интересов.
Поступила 17.05.2017; Принято 6 октября 2017 г.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. другими статьями в PMC.- Дополнительные материалы
-
S1 Рис. Индивидуальные данные для каждого субъекта, упорядоченные по группе с существенными остеофитами и с небольшими остеофитами.(TIF)
GUID: 02E46D00-34BE-4701-ADF6-01A8E5BF4A2B
S1 Таблица: Индивидуальные данные для каждого испытуемого: трабекулярная плотность позвонков (VTD), площадь поперечного сечения (CSA), высота образца (H), жесткость ( K ) и параметры отказа ( F FAIL , D FAIL и E FAIL ) без нормализации. (DOCX)
GUID: EC8270B3-7D62-4E9E-94A5-FDB3AC5E64C5
- Заявление о доступности данных
-
Все соответствующие данные находятся в документе.
Abstract
Недавние открытия предполагают, что остеофиты позвоночника повышают сопротивляемость позвоночника сжатию. Однако роль остеофитов позвоночника в биомеханической реакции позвоночника при быстром динамическом сжатии, вплоть до отказа, неясна. Семнадцать образцов позвоночника человека, состоящего из трех позвонков (от T5-T7 до T11-L1) и окружающих их мягких тканей, были взяты у девяти трупов в возрасте от 77 до 92 лет. Образцы получали с помощью количественной компьютерной томографии (ККТ) для медицинского наблюдения, классификации дегенерации межпозвонкового диска (степень Томсона) и измерения плотности трабекул позвонков (VTD), высоты и площади поперечного сечения.Образцы были разделены на две группы (с (n = 9) или без (n = 8) существенными остеофитами тела позвонков) и подверглись осевому сжатию со скоростью динамического смещения 1 м / с, вплоть до отказа. Нормализованные кривые «сила-смещение», видео и изображения QCT позволили охарактеризовать параметры разрушения (сила, смещение и энергия при разрыве) и характер разрушения. Результаты были проанализированы с использованием критериев хи-квадрат для выборочных распределений и линейной регрессии для корреляции между VTD и параметрами отказов.Образцы со значительными остеофитами тела позвонков демонстрируют более высокую жесткость (в среднем в 2,7 раза) и силу при разрушении (в среднем в 1,8 раза), чем другие сегменты. Наличие остеофитов существенно влияет на расположение, характер и тип перелома. VTD был хорошим предиктором динамической силы и энергии при разрушении для образцов без существенных остеофитов. Это исследование также показало, что остеофиты тела позвонка обеспечивают защитный механизм нижележащего позвонка от тяжелых компрессионных переломов.
Введение
Остеофит тела позвонка — распространенная форма остеоартрита, определяемая как аномальный костный рост или костная шпора, образующаяся вдоль межпозвонковых суставов [1]. На поздних стадиях развития остеофитов соседние позвонки срастаются друг с другом, образуя костный мост через межпозвоночный диск, называемый мостиковым остеофитом. Остеофиты позвонков обычно связаны со старением, дегенерацией межпозвоночного диска, травматическими повреждениями, склерозом замыкательной пластинки, сужением дискового пространства [1, 2], ремоделированием фасеточных суставов [3], болями в спине [4] и диффузным идиопатическим гиперостозом скелета (DISH) или болезнью Форестье. [5].Соответственно, значительный остеофит можно найти в 20–25% шипов в возрасте 20–45 лет и в 73–90% шипов старше 60 лет [2–4, 6]. Осложнения, связанные с образованием остеофитов, многочисленны (дисфагия, компрессия грудной аорты, обструкция полой вены, компрессия нервных корешков) и влияют на большинство структур, расположенных в непосредственной близости от позвоночника. Как следствие, они обычно рассматриваются как дегенеративное состояние и могут быть удалены хирургическим путем традиционными или малоинвазивными методами во время операций на позвоночнике, когда они приводят к инвалидности или неврологическим симптомам [1, 7].Недавно было высказано предположение, что остеофиты позвоночника в первую очередь стабилизируют позвоночник при изгибе и повышают его сопротивление при сжатии [8, 9]. Действительно, если остеофиты обеспечивают стабильность, добавляя кость и увеличивая площадь поперечного сечения позвонков, они также могут обеспечивать защитный механизм от переломов позвонков, несмотря на генерализованную остеопению, наблюдаемую в большинстве стареющих позвоночников.
Однако механическая роль остеофитов тела позвонков в отношении риска и тяжести переломов позвоночника остается неясной.Большинство переломов позвонков варьируются от болезненных компрессионных переломов до более серьезных травм, таких как разрывные и дистракционные переломы. Многие из них расположены на средне-грудном, грудопоясничном или среднем поясничном уровнях и являются результатом механизма осевой компрессии с комбинированным сгибанием или без него [10]. Чтобы лучше понять биомеханику переломов позвонков, было проведено множество экспериментальных исследований трупных тканей человека при осевом сжатии. Несущая способность отдельных позвонков и функциональных спинномозговых единиц (FSU) сформировала основу для количественной оценки устойчивости межпозвоночной структуры к сопротивлению нагрузке и сохранению невредимости [11–18].Другие дополнительные исследования были нацелены на прогнозирование риска переломов позвоночника путем выявления потенциальных корреляций между нагрузкой отказа / переломами позвонков отдельных позвонков или ПСС и клиническими измерениями, такими как минеральная плотность кости (МПК) и морфология [19–24], степень поражения дегенерация [25] и костная архитектура [26–28].
Хотя вышеупомянутые эксперименты предоставили существенное понимание биомеханики переломов позвонков, ни один из них не объяснил механический вклад остеофитов позвоночника.Недавно было высказано предположение, что остеофиты позвоночника увеличивают сопротивление позвоночника сжатию и что в их присутствии клинические измерения МПК занижают прочность позвоночника на сжатие [9, 29]. Однако их тесты на трупах проводились при квазистатических физиологических нагрузках (без отказов). Следовательно, они не воспроизводили динамические реальные условия травм (например, падения или дорожно-транспортные происшествия), которые приводят к компрессионным переломам позвонков.
Настоящее исследование направлено на анализ роли значительных остеофитов позвоночника на биомеханическую реакцию позвоночника при динамическом сжатии, вплоть до отказа.Их влияние на прогноз прочности позвонков на сжатие посредством клинических измерений также было исследовано. Наша гипотеза состоит в том, что существенные остеофиты позвонков имеют значительное влияние на параметры, тип, характер, расположение и прогноз риска переломов позвонков, когда позвоночник подвергается динамической компрессии.
Материалы и методы
Трупные образцы
Протокол исследования был одобрен институциональным наблюдательным советом IFSTTAR / Университета Экс-Марсель.Ни один из доноров трансплантата не был из уязвимой группы населения, и все доноры или ближайшие родственники предоставили письменное информированное согласие, которое было дано свободно. Семнадцать образцов человеческих сегментов позвоночника, состоящих из трех позвонков и окружающих их мягких тканей, были взяты из девяти забальзамированных трупов. Средний возраст, рост стоя и вес испытуемых составляли 86 ± 5 лет, 164 ± 6 см и 60 ± 13 кг (). Семь экземпляров были расположены в T11-L1, семь — в T8-T10 и три — в T5-T7. Все костные ребра и несвязочные мягкие ткани были удалены из образцов, и изображения количественной компьютерной томографии (ККТ) были получены с использованием клинического сканера (SIEMENS Somatom Sensation Cardiac 64: 120 кВ, 300–350 мАс, смежные срезы 0.6 мм) для медицинского наблюдения, классификации и измерения остеофитов, которые наблюдались на всех позвоночных уровнях. Каждый образец классифицировали в соответствии с направлением каждой пары остеофитов в межпозвоночном пространстве [30] и в соответствии со схемой классификации дегенерации диска Томсона [31]. Размер остеофитов измеряли с использованием метода, описанного Аль-Равахи и др. [9]. Экземпляры были разделены на две группы (). В первой группе (n = 9), названной «образцы со значительными остеофитами», были остеофиты типа C, характеризующиеся почти полным костным мостом, сформированным через пространство межпозвонкового диска.Их остеофиты варьировали от 10 до 15 мм. Во второй группе (n = 8), названной «образцы с небольшими остеофитами», были остеофиты типа E, характеризующиеся остеофитами, которые простирались почти горизонтально до границы тела позвонка, не закрывая пространство межпозвонкового диска. Их остеофиты варьировались от 2 мм (минимальный размер, чтобы считать шпору остеофитом [32]) до 5 мм.
Таблица 1
Подробная информация о 17 образцах спинного мозга, извлеченных из 9 трупов.
| ID субъекта | Пол | Возраст (лет) | Вес (кг) | Рост стоя (см) | Образец | Группа | IVD | 88 | 64 | 155 | T11-L1 | 1 | 5 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 02 | F | 83 | 49 | 165 | 83 9028 3 | -T4- ||||||||||||||||
| 03 | F | 85 | 48 | 154 | T11-L1 | 1 | 5 | ||||||||||||||
| 04 | F | 92 | 54 1 | 5 | |||||||||||||||||
| T11-L1 | 2 | 4 | |||||||||||||||||||
| 05 | F | 9028 3 9339 | 165 | T8-T10 | 2 | 3 | |||||||||||||||
| T11-L1 | 2 | 88 | 71 | 165 | T8-T10 | 2 | 4 | ||||||||||||||
| T11-L1 | |||||||||||||||||||||
| M | 77 | 75 | 173 | T5-T7 | 2 | 3 | |||||||||||||||
| T11-L1 | 2 | 3 | |||||||||||||||||||
| 08 | M | 90 | 91 | 170 | T5-T7 | 1 | 5 | ||||||||||||||
| T8-T10 | 1 | 5 | 9028 -L1 | 1 | 5 | ||||||||||||||||
| 09 | M | 82 | 53 | 165 | T5-T7 | 1 | 5 | 9028 T8-T10 | 1 | 5 |
Затем были проведены измерения плотности трабекул позвонков (VTD), высоты (H) и площади поперечного сечения (CSA) каждого образца.VTD измеряли на каждом позвонке, создавая сканирующий участок толщиной 9 мм, параллельный замыкательным пластинкам позвонка, в средней плоскости тела позвонка [33]. Положение тела посередине позвонка подтверждалось входом базивертебральной вены в среднюю плоскость сканируемого разреза. Средняя единица Хаунсфилда (HU) была рассчитана для интересующей овальной области размером 25 мм 2 , которая включала только губчатую кость (без кортикального ободка или частей базивертебральной вены). Для целей стандартизации (калибровки) средние значения HU каждого позвонка были преобразованы в значения VTD (г / мм 3 ) с использованием линейной регрессии, полученной из фантома электронной плотности КЛКТ (модель 062A, CIRS Inc., Вирджиния, США), помещенные рядом с образцами позвоночника во время ККТ. В конце концов, VTD образца была рассчитана путем усреднения VTD трех составляющих его позвонков. Высота образца измерялась между центром верхней и нижней замыкательных пластинок хвостового и дистального позвонков соответственно. ППС каждого позвонка измеряли по середине тела позвонка. Общая ППС образца была получена путем усреднения ППС трех позвонков. После визуализации образцы замораживали при -20 ° C до тестирования.
Испытательное оборудование и процедуры
Динамическое осевое сжатие было выполнено с использованием сервогидравлической системы испытаний материалов (MTS Axial 370.02 15 кН, Эден-Прери, Миннесота), которая включала одноосный датчик нагрузки и индуктивный датчик смещения для измерения силы привода и отклонение (). Две высокоскоростные камеры (1000 кадров в секунду) были размещены в стороне от образца для визуализации и хронологического отслеживания повреждений позвоночника. За два дня (48 ч) до испытания образцы оттаивали в холодильнике (4 ° C) и накрывали полотенцами, пропитанными физиологическим раствором.Чтобы зафиксировать образец на MTS и равномерно нагружать его, половина дистального и проксимального позвонков была помещена в параллельные чашки, заполненные полиуретановой смолой за двадцать четыре часа до испытания. Во время этого процесса сохранялась сагиттальная естественная кривизна образцов.
Экспериментальная установка, состоящая из сервогидравлической системы испытания материалов (1), двух высокоскоростных камер (2), одноэлементного датчика нагрузки (3) и трупного сегмента позвоночника (4). Трупный сегмент позвоночника (4) был зафиксирован на MTS путем заливки дистального и проксимального позвонков в полиуретановую смолу (5).
Перед испытанием образцы размораживали при комнатной температуре (23 ° C) в течение 3 часов. Каждый образец помещали на MTS и прикладывали предварительную нагрузку 0,25 кН в течение 1 минуты [20]. Затем образцы подвергались динамическому сжатию со скоростью 1 м / с до разрушения. Испытание было остановлено, когда образец был сжат примерно до 60% высоты среднего позвонка (от 12 до 15 мм). Все испытания проводились при комнатной температуре. После сжатия для медицинской диагностики были сделаны изображения QCT образцов.
Анализ данных и статистика
Кривые сила-смещение были записаны и нормализованы (F норма = f (D норма )) в соответствии со средним размером всех образцов, как описано уравнениями (1) и (2) :
Fnorm = FCSAspecimenMeanCSA = F.MeanCSACSAspecimen
(1)
Dnorm = DHeightspecimenMeanHeight = D.MeanHeightHeightspecimen
(2)
(4) уровни.Разрушение было определено как первая точка, в которой дальнейшее увеличение смещения вызвало уменьшение нагрузки. Из каждой кривой были извлечены нормализованная жесткость ( K ), сила ( F FAIL ), смещение ( D FAIL ) и энергия при отказе ( E FAIL ). . Жесткость определялась как наклон наиболее линейного участка кривой до разрушения. Энергия разрушения определялась как площадь под кривой «сила-смещение» до разрушения.Среднее и стандартное отклонения биомеханических параметров ( K , F FAIL , D FAIL и E FAIL ) были вычислены для каждой группы и статистически сравнивались. Воспроизведение тестов и чистые оценки дисперсии ошибок для биомеханических параметров не могли быть выполнены, поскольку тесты были деструктивными.
Обычные модели линейной регрессии были приспособлены для оценки степени линейной корреляции между VTD и каждым измеряемым параметром для каждой группы, без учета какого-либо взаимодействия между параметрами.Чтобы проверить, была ли взаимосвязь между VTD и нормализованными биомеханическими параметрами для группы с небольшими остеофитами аналогична группе с существенными остеофитами, модель, подобранная для первой группы, использовалась для прогнозирования биомеханических параметров другой группы. Затем биомеханические параметры (среднее и стандартное отклонение), рассчитанные на основе этих соотношений, сравнивали с биомеханическими параметрами, полученными экспериментально для другой группы.
Видео были проанализированы для определения места разрушения и характера трещин.ККТ-изображения сломанных образцов были использованы для определения типа перелома на основе классификации AO (инициалы немецких терминов «Arbeitsgemeinschaft für Osteosynthesefragen») для грудных и поясничных травм [34]. Тесты хи-квадрат были выполнены для изучения влияния остеофитов на расположение, тип и характер перелома. Все статистические анализы были выполнены с использованием программы STATISTICA v.7.0 (StatSoft, Талса, Оклахома, США). Различия считали достоверными при p <0.05.
Результаты
Морфология и плотность трабекул позвонков
Образцы со значительными остеофитами показали более высокий (в 1,6 раза) VTD, чем образцы с небольшими остеофитами (p = 0,003) (см. Рис. S1 и таблицу S1). Они также показали большую площадь поперечного сечения (p = 0,307), но меньшую высоту (p = 0,071). Однако, в отличие от VTD, различия в общей морфологии образцов не были значительными.
Таблица 2
Плотность трабекул позвонков (VTD), площадь поперечного сечения (CSA) и высота образца (H) по группам образцов (среднее значение ± стандартное отклонение).
| Образцы с существенными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | Отношение (существенное / малое) | |
|---|---|---|---|
| VTD4 (г / мм) ) | 103 ± 24 | 64 ± 25 | 1,60 * |
| CSA (мм 2 ) | 1062 ± 171 | 1009 ± 251 | 1,05 |
| 77.0 ± 5,0 | 81,3 ± 6,6 | 0,95 |
Кривые «сила-перемещение»
Все образцы имели нормированные кривые «сила-перемещение» одинаковой формы (). Кривые со встроенными маркерами (квадраты, треугольники, кресты и т. Д.) Представляют образцы со значительными остеофитами. Типичная кривая изображена на. До разрушения кривая имеет нелинейную форму, характеризующуюся первым изогнутым сегментом увеличивающейся жесткости (сегмент A-B), за которым сразу следует линейный сегмент (B-C).Этот линейный сегмент предшествует сильно нелинейному сегменту (C-D), характеризующемуся уменьшающейся жесткостью. Сегмент BC называется упругой частью кривой, в то время как сегмент CD называется неупругой частью, где повреждение на микроуровне (потеря целостности материала из-за образования трещин и пустот, ухудшающих жесткость), пластичность (процесс течения, создающий безвозвратные повреждения). деформации) и вязкоупругости (диссипативный процесс). После разрушения (точка D) кривая показывает уменьшение прочности (D-E) до точки E, после чего образец либо сохраняет (девять образцов), либо восстанавливает (восемь образцов) некоторую прочность (сегмент E-F).
Нормированные кривые «сила-смещение» для образцов T5-T7 (a), T8-T10 (b) и T11-L1 (c). Кривые с символами представляют образцы со значительными остеофитами. Эти образцы показали большую жесткость, нагрузки и смещения до разрушения.
Типичная кривая силы-смещения (F-D) (образец T11-L1, объект 3).Шесть сегментов (от A-B до E-F), изображенные на этой кривой, наблюдались на всех образцах.
Нормализованная жесткость и параметры разрушения
Средняя нормализованная жесткость ( K ) образцов со значительными остеофитами составляла 1.В 9 раз превышает жесткость образцов с мелкими остеофитами (). Среднее значение F FAIL , D FAIL и E FAIL образцов со значительными остеофитами было в 2,7, 1,8 и 5,3 раза больше соответствующих значений образцов с небольшими остеофитами, соответственно. . Все различия между группами были статистически значимыми, со значениями p 0,0004 ( K ), 0,0006 ( F FAIL ), 0.006 ( D FAIL ) и 0,002 ( E FAIL ).
Таблица 3
Нормализованные параметры жесткости и разрушения по группам (среднее значение ± стандартное отклонение).
| Образцы со значительными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | Отношение (существенное / малое) | ||
|---|---|---|---|---|
| 3207 ± 735 | 1716 ± 586 | 1.9 † | ||
| F ОТКАЗ (N) | 6873 ± 2534 | 2510 ± 1152 | 2,7 † | |
| D ОТКАЗ (мм) 3,5803 | 1,9 ± 0,91,8 † | |||
| E FAIL (J) | 14,8 ± 8,1 | 2,8 ± 2,4 | 5,3 † | |
Корреляция между 9 нормализованными параметрами биомеханики VT образцы со значительными остеофитами, не было обнаружено статистически значимой корреляции между VTD и биомеханическими параметрами ().Для образцов с небольшими остеофитами VTD был хорошим предиктором нормализованного
F FAIL (r 2 = 0,80, p <0,03) и E FAIL (r 2 = 0,55, р <0,035). Напротив, VTD не коррелировал с K (r 2 = 0,42, p <0,12) и D FAIL (r 2 = 0,33, p <0,14). Линейная регрессия между VTD и нормализованными биомеханическими параметрами.VTD коррелировал только с нормализованными F FAIL и E FAIL образцов без остеофитов.
Следуя этим результатам, значения для F FAIL и E FAIL были предсказаны с использованием линейных соотношений и VTD образцов со значительными остеофитами, так что образцы с аналогичным VTD могли быть в сравнении. Опять же, значительные различия были обнаружены между группами ( F FAIL = 4117 ± 1002 N; E FAIL = 5.5 ± 1,7), таким образом гарантируя, что одна VTD не может объяснить различия, наблюдаемые между группами.
Типы, типы и места переломов
При неудаче видеоанализ показал, что один из позвонков разрушился, и костный мозг был выброшен струями в месте перелома, а также из отверстий и сосудистых каналов в коре головного мозга. Тело первого позвонка, разрушившееся, и характер перелома значительно различались между двумя группами образцов. Действительно, первое тело позвонка, которое разрушилось, было средним или дистальным для семи из восьми образцов с небольшими остеофитами (), в то время как оно было проксимальным для восьми из девяти образцов со значительными остеофитами ().
Разрушение первого позвонка с характерным переломом.a) Образец без остеофитов (образец сегмента T11-L1 субъекта 3). Средний позвонок (Т12) разрушается первым. Горизонтальный узор разделяет позвонок на верхнюю и нижнюю части. На ККТ-изображении наблюдается взрывная трещина. б) Образец со значительными остеофитами (сегмент Т8-Т10 субъекта 2). Проксимальный позвонок (Т11) разрушается первым. Вертикальный узор разделяет позвонок на переднюю и заднюю части.На ККТ-изображении наблюдается перелом остеофита. Пунктирными линиями обозначен выброс костного мозга на месте перелома.
На корковых поверхностях были идентифицированы три модели перелома. В первом варианте кортикальная кость раскалывается по окружности и по горизонтали в центре, оставляя линию, разделяющую тело позвонка на верхнюю и нижнюю части (). Во втором случае кортикальная кость раскалывается вертикально, оставляя линию, которая в основном разделяет тело позвонка на переднюю и заднюю части ().Третий образец представлял собой комбинацию двух других образцов и привел к полному разрушению образца. Первая картина наблюдалась на семи из восьми образцов с небольшими остеофитами, а вторая картина наблюдалась на семи из девяти образцов со значительными остеофитами. Третий образец наблюдали на одном экземпляре из каждой группы.
КТ-изображения показали, что наличие значительных остеофитов влияет на типы переломов (). У пяти образцов с небольшими остеофитами был полный взрывной перелом с ретропульсивным фрагментом кости и нарушением канала (тип А.3.3 классификации AO), а у трех из этих образцов был ударный перелом с коллапсом тела позвонка (тип A.1.3). Только у одного образца с остеофитами позвонков был полный взрывной перелом (с переломом остеофита). Остальные восемь образцов имели ударный перелом с коллапсом тела позвонка (тип A.1.3), иногда с небольшим смещением задней кортикальной стенки. Среди этих образцов у шести были переломы по крайней мере одного из их остеофитов.
Таблица 4
Распределение типов трещин по группам образцов.
| Типы переломов | Образцы со значительными остеофитами (n = 9) | Образцы с небольшими остеофитами (n = 8) | ||
|---|---|---|---|---|
| Разрывные переломы | 0 | 5 | ||
| — С переломом остеофита | 1 | 0 | ||
| Импульсный перелом или коллапс тела позвонка | 9028 — 9028 — 9028 — | — С переломом остеофита | 6 | 0 |
Обсуждение
Предыдущие исследования [9, 35] показали, что остеофиты позвонков вызывают значительные изменения устойчивости и гибкости ПСС в квазистатических или физиологических условиях нагрузки. .Настоящее исследование отличается тем, что были протестированы более длинные сегменты позвоночника (трехпозвоночные) при динамическом сжатии и оценена роль остеофитов тела позвонков в механизмах перелома сегментов позвоночника. Значительные остеофиты позвонков увеличивают жесткость и несущую способность сегментов позвоночника. Они также влияют на характер, расположение и прогнозирование риска переломов позвонков.
Ограничения настоящего исследования необходимо обсудить до интерпретации результатов.Во-первых, из-за ограниченной доступности и стоимости человеческих трупов у девяти испытуемых было извлечено только семнадцать образцов. Такой небольшой размер выборки является важным ограничением исследования. Поэтому, чтобы максимизировать размер выборки, данные разных полов и уровней позвоночника были объединены вместе с использованием процесса нормализации. Однако антропометрические различия между мужчинами и женщинами () могли уменьшить или замаскировать потенциальные корреляции с VTD, хотя обе группы содержали образцы мужчин и женщин.Было бы интересно изучить влияние пола и найти гендерные корреляции с большим количеством выборок. С этой точки зрения индивидуальные данные биомеханических параметров были доступны для дальнейшего использования (рис. S1 и таблица S1). Также размеры тела позвонков зависят от пола; поэтому учет поперечных сечений позвонков имеет первостепенное значение для выражения силы, необходимой для сравнения образцов. Процесс нормализации, подобный построению инженерных кривых напряжения-деформации, был выбран таким образом, чтобы биомеханические параметры были выражены в единицах, согласующихся с теми, которые обычно используются клиницистами или сообщаются в других исследованиях [9, 16, 36, 37].Нормализованная сила была предпочтительнее сжимающего напряжения для выражения нагрузки, поскольку позвонки являются неоднородными и сложными материалами. Нормализация была основана на средней CSA тела среднего позвонка и общей высоте образцов, поскольку эти морфологические параметры не изменились из-за присутствия остеофитов. Во-вторых, условия хранения образцов могли повлиять на результаты, но замораживание и хранение существенно не меняют их физические свойства [38–40]. Наконец, применяемые нагрузки и граничные условия были упрощены по сравнению с реальными ситуациями травм (падения, автомобильные аварии и т. Д.).) из-за очень ограниченных знаний о сложных нагрузках, возникающих в таких ситуациях, и из-за присущих им трудностей экспериментального воспроизведения этих нагрузок. Однако полученные в результате переломы были аналогичны тем, которые наблюдались клинически, и энергия, приложенная к образцам, хорошо согласовывалась с энергией, примененной в других экспериментах in vitro , направленных на воспроизведение компрессионных переломов [41–44].
Обе группы образцов показали последовательные механические реакции вплоть до разрушения, с нормализованными кривыми силы-смещения, показывающими аналогичные формы (сегменты от A-B до C-D), как кривые сила-смещение, описанные в других исследованиях [16, 37].Более того, основные силы разрушения 6873 ± 2534 Н и 2510 ± 1152 Н, соответственно, наблюдаемые на образцах со значительными и небольшими остеофитами, находились в том же диапазоне, что и в аналогичных экспериментах, проведенных на здоровых поясничных сегментах позвоночника двух и шести позвонков [37]. . После отказа обе группы образцов смогли сохранить или увеличить свою прочность (сегменты E-F). Эта характеристика может быть объяснена механизмом раздавливания губчатого вещества кости. Lindahl [45] наблюдал аналогичные кривые после сжатия небольших кубических блоков пояснично-губчатой кости.Картер и Хейс [46] предположили, что по мере увеличения нагрузки коллапс увеличивающегося количества межтрабекулярных пространств ограничивает движение костного мозга, тем самым обеспечивая гидравлическую амортизацию спинного сегмента. Они также сообщили, что образцы с повышенной прочностью после разрушения были связаны с более высокой общей минеральной плотностью кости. В текущем исследовании образцы с остеофитами позвонков были связаны с более высоким VTD и были способны выдерживать большие нагрузки после неудачи ().На данный момент невозможно подтвердить, может ли этот более высокий VTD, который был измерен в пределах кортикального края, быть отнесен к образованию остеофитов или биологическим различиям между образцами. В дальнейшем исследовании анализ образцов с использованием структур трещин большего размера также может улучшить корреляцию с VTD.
Биомеханические параметры образцов с небольшими остеофитами хорошо согласуются с данными других экспериментальных исследований, проведенных в аналогичных условиях [36, 37, 47].Более высокие значения K и F FAIL , измеренные для образцов со значительными остеофитами, хорошо согласуются с результатами Al-Rawahi et al. [9], которые показали на постсоветском пространстве, что остеофиты умножают эти параметры в 1,17 и 1,18 раза соответственно. Наши более высокие коэффициенты размножения (1,9 и 2,7 соответственно) могут быть связаны с различными условиями нагрузки (динамическое и квазистатическое сжатие), а также природой и размером протестированных остеофитов (длина остеофитов в Al-Rawahi et al.[9] в среднем составляли 7 мм, и ни у одного из них не было обнаружено полного и жесткого переднего моста кости). Это последнее наблюдение кажется актуальным, поскольку возрастающая тяжесть образования остеофитов связана с сопутствующим сужением межпозвоночного дискового пространства [2], что, в свою очередь, вызывает жесткость спинного сегмента при сжатии [35]. Регрессионный анализ показал, что существенные различия между группами для F FAIL и E FAIL нельзя было объяснить только значительным различием в VTD, тем самым подтверждая роль позвоночных остеофитов в отказе. спинномозговых препаратов.
Для образцов с небольшими остеофитами сильная линейная связь между VTD образца и F FAIL и E FAIL хорошо согласуется с результатами, полученными в квазистатических условиях [20 , 24] и убедителен, поскольку сила разрушения — свойство, обычно зависящее от плотности. Напротив, ни один из параметров разрушения образцов со значительными остеофитами не коррелировал с VTD, что позволяет предположить, что значительные остеофиты вызывают значительные костные изменения, которые добавляют неопределенный вклад в прочность позвоночника.Аналогичные выводы были сделаны Al-Rawahi et al. [9] с измерениями МПК с помощью двухфотонной рентгеновской абсорбциометрии. Это открытие предполагает, что клиническая оценка риска переломов для образцов со значительными остеофитами должна основываться не только на VTD и общей морфологии образца до тех пор, пока не будут предоставлены дальнейшие исследования.
Поддерживая большую часть сжимающей нагрузки до разрушения, существенные остеофиты позвонков, по-видимому, обеспечивают защиту от напряжения нижележащего тела позвонка и предотвращают возникновение полного поперечного и горизонтального разрушения тела позвонка (часто связанного с взрывным переломом).Высокая частота взрывных переломов у образцов с небольшими остеофитами, несмотря на умеренно или сильно дегенерированный диск (степень 3 или 4), может быть объяснена более высокими сдвигающими силами, передаваемыми фасетками на заднюю стенку позвонка. Более того, защитный механизм, обеспечиваемый остеофитами позвонков, можно объяснить их способностью изменять сопротивление деформации соседних дисков (за счет увеличения их CSA) или их более высокой плотностью костей. Эти данные подтверждают гипотезу о том, что остеофиты являются адаптивными, а не дегенеративными [9], и что их присутствие позволяет снизить чрезмерную деформацию костей до нормального уровня.
В настоящем исследовании были проведены трупные тесты для оценки роли остеофитов тела позвонков на биомеханический ответ сегментов позвоночника при динамическом сжатии. Полученные результаты подтверждают нашу гипотезу о том, что существенные остеофиты позвонков играют ключевую роль в параметрах, типе, характере, локализации и прогнозировании риска переломов позвонков. В будущих работах будет полезно использовать вычислительные модели [48–50] для обхода ограничений, присущих тестам in vitro (размер выборки, биологические вариации, упрощенные нагрузки и т. Д.).). В этом отношении данные, представленные в настоящем исследовании, могут быть полезны для разработки и проверки этих инструментов.
Дополнительная информация
S1 Рис.
Индивидуальные данные для каждого субъекта, упорядоченные по группе с существенными остеофитами и с небольшими остеофитами.(TIF)
S1 Таблица
Индивидуальные данные для каждого субъекта: плотность трабекул позвонков (VTD), площадь поперечного сечения (CSA), высота образца (H), жесткость ( K ) и параметры разрушения () F FAIL , D FAIL и E FAIL ) без нормализации.(DOCX)
Благодарности
Авторы выражают особую благодарность Ю. Годио, К. Конте, М. Пи, К. Ренье и медицинскому персоналу «Service d’imagerie médicale de l’Hôpital Nord». для экспериментальной установки и in vitro для подготовки образцов и визуализации.
Заявление о финансировании
Эта работа была поддержана CEA: Канадским научно-исследовательским отделом ортопедической инженерии Совета по естественным наукам и инженерным исследованиям Канады.
Доступность данных
Все соответствующие данные находятся в документе.
Список литературы
3. Вайнберг Д., Се К.К., Лю Р.В., Гебхарт Дж.Дж., Гордон З.Л. Повышенная заболеваемость тазом связана с большей ориентацией коронковой фасетки в нижнем поясничном отделе позвоночника: трупное исследование 599 поясничных отделов позвоночника. Позвоночник. 2016; 41 (19): E1138–45. DOI: 10.1097 / BRS.0000000000001577 [PubMed] [Google Scholar] 4. О’Нил Т., МакКлоски Э.В., Канис Дж. А., Бхалла А. К., Рив Дж., Рид Д. М. и др. Распространение, детерминанты и клинические корреляты остеофитоза позвонков: популяционное обследование.J Rheumatol. 1999. 26 (4): 842–8. [PubMed] [Google Scholar] 6. Натан Х. Остеофиты позвоночника: анатомическое исследование их развития в зависимости от возраста, расы и пола с учетом их этиологии и значения. J Bone Joint Surg Am. 1962. 44 (2): 243–68. [Google Scholar] 7. Водица М., Косак Р., Венгуст Р. Отдаленные результаты хирургического лечения симптоматических передних шейных остеофитов: серия случаев с обзором литературы. Clin Spine Surg. 2016; 29 (9): E482–7. DOI: 10.1097 / BSD.0b013e31829046af [PubMed] [Google Scholar] 8. Гальбусера Ф., ван Райсберген М., Ито К., Хюйге Дж. М., Брайда-Бруно М., Вилке Х. Дж. Старение и дегенеративные изменения межпозвоночного диска и их влияние на гибкость позвоночника. Eur J Spine. 2014; 32: S324–32. [PubMed] [Google Scholar] 9. Аль-Равахи М., Луо Дж., Поллинтин П., Долан П., Адамс М.А. Механическая функция остеофитов тела позвонков, выявленная в экспериментах на трупных шипах. Позвоночник. 2011; 36 (10): 770–7. DOI: 10.1097 / BRS.0b013e3181df1a70 [PubMed] [Google Scholar] 11.Карри В., Пинтар Ф.А., Доан Н.Б., Нгуен Х.С., Эккардт Дж., Байсден Дж. Л. и др. Переломы замыкательной пластинки поясничного отдела позвоночника: биомеханическая оценка и клинические аспекты посредством экспериментальной индукции травмы. J Orthop Res. 2016; 34 (6): 1084–91. DOI: 10.1002 / jor.23112 [PubMed] [Google Scholar] 12. Вирджин В. Экспериментальные исследования физических свойств межпозвоночного диска. J Bone Joint Surg Br. 1951; 33-В: 607–11. [PubMed] [Google Scholar] 13. Бартелинк Д. Роль абдоминального давления в снятии давления на поясничные межпозвоночные диски.J Bone Joint Surg Br. 1957; 39-В: 718–25. [PubMed] [Google Scholar] 14. Хаттон В., Адамс Массачусетс. Можно ли сломать поясничный отдел при поднятии тяжестей? Позвоночник. 1982. 7 (6): 586–90. [PubMed] [Google Scholar] 15. Хаттон В., Адамс Массачусетс. Выпадение межпозвоночного диска. Травма, вызванная гиперфлексией, 1981 г. Премия Volvo в области фундаментальных наук. Позвоночник. 1982; 7 (3): 184–91. [PubMed] [Google Scholar] 16. Йоганандан Н., Рэй Дж., Пинтар Ф.А., Миклебуст Дж. Б., Сансес А. Мл. Критерии жесткости и энергии деформации для оценки порога повреждения межпозвонкового сустава.J Biomech. 1989. 22 (2): 135–42. [PubMed] [Google Scholar] 17. Очиа Р., Тенсер А.Ф., Чинг Р.П. Влияние скорости нагрузки на замыкательную пластину и прочность тела позвонков в поясничных позвонках человека. J Biomech. 2003. 36 (12): 1875–81. [PubMed] [Google Scholar] 18. Казарян Л, Грейвс Г.А. Характеристики прочности на сжатие позвоночника человека. Позвоночник. 1977; 2 (1): 1–14. [Google Scholar] 19. МакБрум Р., Хейс В. К., Эдвардс В. Т., Голдберг Р. П., Уайт А. А. 3-е место. Прогнозирование компрессионного перелома тела позвонка с помощью количественной компьютерной томографии.J Bone Joint Surg Am. 1985. 67 (8): 1206–14. [PubMed] [Google Scholar] 20. Singer K, Edmonston S, Day R, Breidahl P, Price R. Прогнозирование прочности на сжатие тела грудного и поясничного позвонков: корреляция с минеральной плотностью кости и областью позвоночника. Кость. 1995. 17 (2): 167–74. [PubMed] [Google Scholar] 21. Mosekilde L, Bentzen SM, Ortoft G, Jorgensen J. Прогностическая ценность количественной компьютерной томографии для прочности на сжатие тела позвонка и плотности золы. Кость. 1989. 10 (6): 465–70. [PubMed] [Google Scholar] 22.Cann C, Genant HK, Kolb FO, Etinger B. Количественная компьютерная томография для прогнозирования риска перелома позвонков. Кость. 1985; 6 (1): 1–7. [PubMed] [Google Scholar] 23. Дэн Х., Сюй Ф.Х., Дэвис К.М., Хини Р., Рекер Р. Различия в минеральной плотности костной ткани, минеральном содержании костной ткани и размере костной поверхности у женщин с переломами и без переломов, а также их взаимосвязь в позвоночнике и бедре. J Bone Miner Metab. 2002. 20 (6): 358–66. DOI: 10.1007 / s007740200052 [PubMed] [Google Scholar] 24. Эрикссон С., Исберг Б.О., Линдгрен Ю.Прогнозирование прочности позвоночника с помощью двухфотонной абсорбциометрии и количественной компьютерной томографии. Calcif Tissue Int. 1989. 44 (4): 243–50. [PubMed] [Google Scholar] 25. Ширадо О, Канеда К., Тадано С., Исикава Х., McAfee PC, Warder KE. Влияние дегенерации диска на механизм разрывных переломов грудопоясничного отдела. Позвоночник. 1992. 17 (3): 286–92. [PubMed] [Google Scholar] 26. Дай Л., Ван XY, Ван К.Г., Цзян Л.С., Сюй Х.З. Минеральная плотность костной ткани грудопоясничного отдела позвоночника по отношению к взрывным переломам: количественное исследование компьютерной томографии.Eur Spine J. 2006; 15 (12): 1817–22. DOI: 10.1007 / s00586-006-0148-2 [PubMed] [Google Scholar] 27. Zhao F, Pollintine P, Hole BD, Adams MA, Dolan P. Переломы позвонков обычно поражают замыкательную пластинку черепа, потому что она тоньше и поддерживается менее плотной губчатой костью. Кость. 2009. 44 (2): 372–9. DOI: 10.1016 / j.bone.2008.10.048 [PubMed] [Google Scholar] 29. Коккорис П., Хатзидакис И., Хацелис Э., Макрас П., Толумис Г. Плотность костей в бедре и поясничном отделе позвоночника у здорового мужского населения. Эндокринные аннотации.2016; 41: doi: 10.1530 / endoabs.41.EP114 [Google Scholar] 31. Томпсон Дж., Пирс Р.Х., Шехтер М.Т., Адамс М.Э., Цанг И.К., Епископ ПБ. Предварительная оценка схемы оценки общей морфологии межпозвоночного диска человека. Позвоночник (Phila Pa 1976). 1990; 15 (5): 411–5. [PubMed] [Google Scholar] 32. Макнаб И. Тяговая шпора. Индикатор сегментарной нестабильности. J Bone Joint Surg Am. 1971; 53 (4): 663–70. [PubMed] [Google Scholar] 34. Магерл Ф., Эби М., Гертцбейн С.Д., Хармс Дж., Назарян С. Исчерпывающая классификация травм грудного и поясничного отделов.Eur Spine J. 1994; 3 (4): 184–201. [PubMed] [Google Scholar] 35. Гальбусера Ф., Шмидт Х., Нейдлингер-Вильке С., Готтшалк А., Вильке Х. Дж. Механический ответ поясничного отдела позвоночника на различные комбинации дегенеративных изменений диска исследовали с использованием рандомизированных пороупругих моделей конечных элементов. Eur Spine J. 2011; 20 (4): 563–71. DOI: 10.1007 / s00586-010-1586-4 [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Кемпер А., Макнелли С., Дума С.М. Влияние скорости деформации на свойства жесткости на сжатие поясничных межпозвонковых дисков человека.Biomed Sci Instrum. 2007. 43: 176–81. [PubMed] [Google Scholar] 37. Дума С., Кемпер А.Р., Макнили Д.М., Бролинсон П.Г., Мацуока Ф. Биомеханический ответ поясничного отдела позвоночника при динамическом сжатии. Biomed Sci Instrum. 2006; 42: 476–81. [PubMed] [Google Scholar] 38. Диллон Н., Басс ЕС, Лотц Дж. Влияние замороженного хранения на ползучесть межпозвоночных дисков человека. Позвоночник. 2001. 26 (8): 883–8. [PubMed] [Google Scholar] 40. Сметерс Дж., Джоанес Д. Н.. Динамические сжимающие свойства поясничных межпозвонковых суставов человека: сравнение свежих и размороженных образцов.J Biomech. 1988. 21 (5): 425–33. [PubMed] [Google Scholar] 41. Кифуне М., Панджаби М.М., Аранд М., Лю В. Характер переломов и нестабильность грудопоясничных травм. Eur Spine J. 1995; 4 (2): 98–103. [PubMed] [Google Scholar] 42. Кифунэ М., Панджаби М.М., Лю В., Аранд М., Васавада А., Оксланд Т. Функциональная морфология позвоночного канала после замыкательных, клиновых и взрывных переломов. J Расстройство позвоночника. 1997. 10 (6): 457–66. [PubMed] [Google Scholar] 43. Пенджаби М., Оксланд Т.Р., Кифуне М., Аранд М., Вен Л., Чен А. Обоснованность теории трех столбцов грудопоясничных переломов.Позвоночник. 1995. 20 (10): 1122–7. [PubMed] [Google Scholar] 44. Панджаби М, Оксланд Т.Р., Лин Р.М., МакГоуэн Т.В. Грудопоясничный разрывной перелом. Биомеханическое исследование его разнонаправленной гибкости. Позвоночник (Phila Pa 1976). 1994. 19 (5): 578–85. [PubMed] [Google Scholar] 45. Линдаль О. Механические свойства высушенной обезжиренной губчатой кости. Акта Ортоп Сканд 1976; 47 (1): 11–9. [PubMed] [Google Scholar] 46. Картер Д., Хейс WC. Сжимающее поведение кости как двухфазной пористой структуры. J Bone Joint Surg Am 1977. 59 (7): 954–62.[PubMed] [Google Scholar] 47. Эдмондстон С., Певица КП, Дэй РЭ, Брейдал П.Д., Прайс РИ. Взаимосвязь in vitro между плотностью тела позвонка, размером и прочностью на сжатие в грудопоясничном отделе позвоночника пожилого возраста. Clin Biomech (Бристоль, Эйвон). 1994. 9 (3): 180–86. [PubMed] [Google Scholar] 48. Chagnon A, Aubin CE, Villemure I. Биомеханическое влияние свойств диска на передачу нагрузки здоровых и дегенерированных дисков с использованием пороупругой модели конечных элементов. J Biomech Eng. 2010; 132 (11): 111006 DOI: 10.1115 / 1.4002550 [PubMed] [Google Scholar] 49. Эль-Рич М., Арну П.Дж., Ваньак Э, Брюне С., Обен С.Е. Конечноэлементное исследование влияния скорости нагрузки на изменения распределения нагрузки на позвоночник в условиях удара. J Biomech. 2009. 42 (9): 1252–62. DOI: 10.1016 / j.jbiomech.2009.03.036 [PubMed] [Google Scholar] 50. Wagnac E, Arnoux PJ, Garo A, Aubin CE. Конечно-элементный анализ влияния скорости нагружения на модель всего поясничного отдела позвоночника в условиях динамического нагружения. Med Biol Eng Comput. 2012; 50 (9): 903–15.DOI: 10.1007 / s11517-012-0908-6 [PubMed] [Google Scholar]Направление образования остеофитов передних поясничных позвонков | BMC Musculoskeletal Disorders
Этиология остеофитов передних поясничных позвонков рассматривается следующим образом. Повышенная гибкость между телами позвонков из-за дегенерации диска приводит к возникновению неоднородной механической нагрузки на окостенение кости под хрящом тела позвонка; следовательно, на краю тела позвонка возникают склеротические или гиперпластические изменения, приводящие к образованию остеофитов [4, 9, 10].Однако уровень деградации межпозвонкового диска не всегда согласуется со степенью образования остеофитов [8, 11], и, подобно синдесмофитам, описанным Schumacher et al. [12], остеофиты могут быть вызваны окостенением передней продольной связки и фиброзного кольца межпозвонкового диска.
Исследование остеофитов передних поясничных позвонков, проведенное O’Neill et al. [9] продемонстрировали, что рентгенологическое исследование поясничного отдела позвоночника у лиц, прошедших скрининг на остеопороз, показало увеличение частоты остеофитов передних поясничных позвонков с возрастом.Кроме того, Watanabe et al. [13] сообщили, что существует положительная корреляция между размером остеофитов и возрастом пациентов, у которых при вскрытии измеряли размер остеофитов поясничных позвонков. Эти исследования показали, что причиной остеофитов являются изменения старения. С другой стороны, остеофиты передних поясничных позвонков чаще всего встречаются в L3 – L4 [7, 9], и чаще у мужчин [7, 9] и пациентов с ожирением [14, 15] или людей с тяжелой физической активностью. [9], чем у женщин или других пациентов.Другие исследования показали, что образование шпор ежегодно усиливается примерно у 4% людей [16], и что у людей с остеофитами вероятность развития остеопороза ниже [17].
Мы проанализировали литературу относительно направления образования шпор и нашли исследование Pate et al. [8], которые использовали 200 трупов для определения частоты появления остеофитов когтей и тракции в 2000 местах в межпозвонковых пространствах Th22-L1, L1 – L2, L2 – L3, L3 – L4 и L4 – L5.Они отметили, что 182 (91%) из 200 трупов имели остеофиты по крайней мере в одном межпозвоночном пространстве. Эти шпоры были распределены примерно в 48% из 2000 мест, при этом остеофиты копытца составляли около 39%, а остеофиты тяги — около 9%. Первые доминировали в Th22-L2, тогда как вторые были более очевидны в L3-L5. Наши результаты показывают аналогичную тенденцию. Хотя есть предыдущий отчет о направлении образования шпор, мы сочли, что наше исследование стоило усилий, потому что оно внимательно изучило значительное количество случаев с точки зрения направления образования шпор.Мы полагаем, что обсуждение направления образования шпоры в нашем исследовании поможет исследователям в этой области изучить причины и значение образования шпоры, а также изучить патологию и прогресс дегенерации поясничного отдела позвоночника.
Результаты этого исследования показали, что пары остеофитов часто образуются в направлении соседнего диска в верхних поясничных позвонках (L1 – L2 и L2 – L3) и в направлении от соседнего диска в средних или нижних поясничных позвонках ( L3 – L4, L4 – L5 и L5-S1).Shao et al. [18] сообщили, что высота вентрального диска и угол лордоза были больше в L3 – L4, L4 – L5 и L5-S1, чем в L1 – L2 и L2 – L3. Также сообщалось, что степень дегенерации диска была выше в L3 – L4, L4 – L5 и L5-S1, чем в L1 – L2 и L2 – L3, при этом межпозвонковая нестабильность чаще наблюдалась в нижних поясничных позвонках. Мы считаем, что анатомические и биомеханические различия, а также различия в дегенеративном процессе верхних и нижних поясничных позвонков являются одними из важных факторов, определяющих направление образования шпор в межпозвонковых пространствах.
В качестве ограничения данного исследования следует упомянуть, что пациенты были амбулаторными пациентами отделения позвоночника нашего отделения. Таким образом, мы планируем провести подобное исследование, ориентированное на население в целом. В будущем исследовании мы изучим деформацию множества межпозвонковых дисковых пространств с учетом биомеханических различий между верхними поясничными позвонками и средними или нижними поясничными позвонками в поясничных позвонках трупов человека. Мы также планируем изучить направление образования шпор в поперечном сечении и в продольном исследовании.
Остеофитов шейных позвонков (C3 – C7) — Демографические перспективы — Ezra — 2019 — Анатомические записи
Остеофиты позвоночника (спондилез) являются возрастным проявлением дегенеративных изменений позвоночника (Nathan, 1962 и Heggeness). Doherty, 1998; O’neill et al., 1999). Остеофиты возникают в результате разрастания ткани фиброзного кольца, которая претерпевает метаплазию в гиалиновый хрящ, а затем окостеневает, подобно эндохондральному окостенению пластинок роста.Хотя их этиология все еще обсуждается, эксперименты, проведенные с использованием моделей на животных, показали, что вызванная скальпелем дегенерация диска приводит к росту остеофитов в соседних позвонках (Lipson and Muir, 1980). Точно так же суставная дегенерация коленного сустава, вызванная химическим повреждением, приводит к быстрому образованию остеофитов (Williams and Thonar, 1989). Примечательно, что в нескольких сообщениях о случаях было высказано предположение, что после травмы позвоночника могут развиваться остеофиты (Kissel and Youmans, 1992; McGarrah and Teller, 1997).
Остеофиты чаще всего присутствуют на переднебоковых краях тел позвонков, в основном на нижних шейных, нижних грудных и среднем поясничных позвонках (Nathan, 1962; O’neill et al., 1999). Обычно они делятся на шпоры «тяги» и «когтя» (Macnab, 1971), хотя эти два типа могут сосуществовать на одном и том же позвонке (Heggeness and Doherty, 1998) и могут просто представлять раннюю и позднюю стадии одного процесса (Nathan , 1962). У женщин среднего возраста остеофиты поясничных позвонков обычно растут на 4% в год (Hassett et al., 2003).
В шейном отделе позвоночника остеофиты могут вызывать неподвижность и жесткость шеи, остеоартрит и головные боли (Klaassen et al., 2011). Более того, остеофиты могут быть вовлечены в синдром защемления нерва (Nathan, 1962) или приводить к сдавлению позвоночной артерии из-за крючковидных отростков позвоночника. Крупные остеофиты могут механически вызывать закупорку пищевода, вызывая дисфагию (Strasser et al., 2000; Ozgocmen et al., 2002) и, возможно, приводя к апноэ во сне (Hughes et al., 1994), тогда как небольшие остеофиты могут вызывать обструкцию, сдавливая сегмент пищевода, прикрепленный к перстневидному хрящу, чаще всего в области C5 / C6 (Strasser et al., 2000).
Формирование остеофитов позвонков связано с высокой сжимающей нагрузкой (O’neill et al., 1999; Echarri and Forriol, 2002) и, как предполагается, способствует стабильности позвоночника при изгибе (Al-Rawahi et al., 2011). Увеличение массы тела и тяжелая физическая активность, в основном у мужчин, могут вызвать дегенерацию межпозвонкового диска с последующим образованием остеофитов (Nathan, 1962; Macnab, 1971; Heggeness and Doherty, 1998; O’neill et al., 1999; Hardcastle et al., 2014). Тем не менее их механическое значение остается предметом споров.
Чтобы пролить дополнительный свет на это явление, в данном исследовании основное внимание уделяется остеофитам суставных поверхностей тел позвонков по сегментам движения в шейном отделе позвоночника.
МАТЕРИАЛЫ И МЕТОДЫ
Исследуемая популяция была взята из коллекции человеческих скелетов, хранящейся в Музее естественной истории в Кливленде, штат Огайо (Остеологическая коллекция Хаманна-Тодда).Информация о месте рождения, этнической принадлежности, заболеваемости, возрасте и поле была собрана из истории болезни людей (Cobb, 1932).
Выборка исследования (таблица 1) включала 273 человека (133 женщины и 140 мужчин), из которых 143 были афроамериканцами (69 женщин и 74 мужчины) и 130 были американцами европейского происхождения (64 женщины и 66 мужчин). Восемьдесят восемь человек были в возрасте от 20 до 39 лет, 92 человека — от 40 до 59 лет и 93 — старше 60 лет. Наблюдения проводились на шейных позвонках C3 – C7.Всего было изучено и измерено 1365 шейных позвонков.
Таблица 1. Общая выборка исследования (N = 273) по полу, этнической и возрастной группе| Пол | Этническая группа | Возрастная группа | |||
|---|---|---|---|---|---|
| 20–39 | 40–59 | 60+ | Итого | ||
| Самцы | Афроамериканцы | 24 | 24 | 26 | 74 |
| Американцы европейского происхождения | 21 | 23 | 22 | 66 | |
| Самки | Афроамериканцы | 23 | 25 | 21 | 69 |
| Американцы европейского происхождения | 20 | 20 | 24 | 64 | |
| Итого | 88 | 92 | 93 | 273 | |
Система оценки остеофитоза суставных поверхностей шейного отдела позвоночника была разработана для оценки наличия и степени тяжести явления в каждом теле позвонка.Были определены четыре категории остеофитов, а именно:
Степень 1: Тело позвонка без шпор или незначительных шпор. Эпифизарное кольцо и костная поверхность не повреждены (рис. 1А).
Система оценки остеофитоза шейки матки. ( A ) Степень 1: тело позвонка без шпор или незначительных шпор. ( B ) 2 степень: тело позвонка с небольшой степенью остеофитии. ( C ) Степень 3: тело позвонка с умеренной степенью остеофитии.( D ) Степень 4: тело позвонка с тяжелым остеофитозом.
2 степень: Тело позвонка с небольшой степенью остеофитии. По краю тела позвонка имеются костные шпоры. Эпифизарное кольцо нарушено лишь незначительно, в то время как костная поверхность не повреждена (рис. 1B).
Степень 3: Тело позвонка с остеофитией средней степени. Костные шпоры у края тела позвонка> 2 мм, нарушена целостность эпифизарного кольца, тело позвонка эродировано, губчатая кость обнажена (рис.1С).
Степень 4: Тело позвонка с тяжелым остеофитозом. Костные шпоры> 4 мм, большая часть эпифизарного кольца повреждена, на дисковой поверхности тела позвонка имеются отверстия и поры (рис. 1D).
Надежность внутри и между наблюдателями была оценена с помощью теста Каппа путем сравнения оценок, определенных тремя наблюдателями на выборке из 15 случаев с недельным интервалом между тестами, и оказалась высокой (Каппа = 0.95, P <0,001).
Для изучения характера дегенеративных процессов в шейном отделе позвоночника по двигательным сегментам был рассчитан индекс остеофитической распространенности двигательных сегментов (MSOP). Это было вычислено как среднее значение между распространенностью остеофитов на нижней дисковой поверхности (IDS) данного верхнего позвонка и распространенностью на верхней дисковой поверхности (SDS) соседнего нижнего позвонка.
Чтобы проверить связь между распространенностью остеофитов и полом, возрастом или этнической принадлежностью, был проведен тест хи-квадрат с использованием SPSS v.20. Уровень значимости (альфа) был установлен на уровне 0,05.
РЕЗУЛЬТАТЫ
Из 1365 позвонков, охваченных в нашем исследовании, мы идентифицировали 513 позвонков, пораженных остеофитами на краях SDS, и 584 пораженных позвонка в IDS, что дает распространенность 37,58% и 42,78%, соответственно (Таблица 2). Самая высокая частота остеофитов была обнаружена по IDS C5 (51,28%), а самая низкая — по SDS C3 (25,64%) (рис. 2A).
Таблица 2.Распространенность остеофитов (%) по степени тяжести на верхней и нижней дисковых поверхностях тел позвонков (N = 1365 позвонков)| Степень тяжести остеофитов | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 класс | 2 класс | 3 класс | 4 класс | Общая распространенность остеофитов | ||||||
| SDS | IDS | SDS | IDS | SDS | IDS | SDS | IDS | SDS | IDS | |
| C3 | 74.36 | 56,04 | 18,32 | 24,18 | 4,03 | 12,82 | 3,30 | 6,96 | 25.64 | 43,96 |
| C4 | 63,00 | 54,58 | 17,22 | 24,18 | 9,52 | 10.62 | 10,26 | 10,62 | 37,00 | 45,42 |
| C5 | 57,14 | 48,72 | 19.05 | 12,82 | 10,99 | 14,29 | 12,82 | 24,18 | 42,86 | 51,28 |
| C6 | 54.95 | 56,41 | 12,45 | 15,38 | 13,55 | 12,82 | 19,05 | 15,38 | 45.05 | 43,59 |
| C7 | 62,64 | 70,33 | 17,58 | 20,51 | 9,16 | 6.23 | 10,62 | 2,93 | 37,36 | 29,67 |
| Все | 62,42 | 57,22 | 16.92 | 19,41 | 9,45 | 11,36 | 11,21 | 12,01 | 37,58 | 42,78 |
- Сокращения: SDS = верхняя поверхность диска; IDS = нижняя поверхность диска.
Распространенность остеофитов в шейном отделе позвоночника. ( A ) Сочетание всех степеней остеофита. ( B ) Только тяжелые остеофиты (степень 4).
При исследовании с помощью индекса MSOP наибольшая распространенность остеофитов была обнаружена в двигательном сегменте C5 / C6 (48,2%), затем следуют C4 / C5 (44,1%) и C6 / C7 и C3 / C4 (40,5%) (таблица 3). Примечательно, что самый высокий уровень остеофитов степени 4 (тяжелой) был обнаружен между IDS C5 и SDS C6 (рис.2Б). IDS C7 показывает самый низкий уровень остеофитов 4 степени. Во всех двигательных сегментах в IDS верхнего позвонка выявляется больше остеофитов, чем в SDS нижнего (таблица 2). В двигательном сегменте C3 / C4 разница в частоте остеофитов между верхним и нижним позвонком наибольшая (7%).
Таблица 3. Распространенность остеофитов (%) по степени тяжести, по сегментам движения в шейном отделе позвоночника (N = 1365 позвонков)| 1 класс | 2 класс | 3 класс | 4 класс | Общая распространенность остеофитов | |
|---|---|---|---|---|---|
| C3 / C4 | 59.52 | 20,70 | 11,71 | 8,61 | 40,48 |
| C4 / C5 | 55,86 | 21,62 | 10.81 | 11,72 | 44,14 |
| C5 / C6 | 51,84 | 12,64 | 13,92 | 21,62 | 48.17 |
| C6 / C7 | 59,53 | 16,48 | 10,99 | 13,00 | 40,48 |
- Индекс распространенности остеофитов двигательного сегмента (MSOP) рассчитывался как среднее значение между преобладанием остеофитов на нижней дисковой поверхности данного верхнего позвонка и преобладанием на верхней дискальной поверхности соседнего нижнего позвонка.
Данные о распространенности остеофитов в двух изученных этнических группах представлены в Таблице 4. В целом, распространенность остеофитов выше среди американцев европейского происхождения, чем среди афроамериканцев. Только в двух позвонках (C5 и C7) американцы европейского происхождения демонстрируют значительно более высокие показатели остеофитов (на –,14%), чем афроамериканцы. Если рассматривать только остеофиты 3-й и 4-й степени, их распространенность в шейном отделе позвоночника одинакова для обеих этнических групп.
Таблица 4. Распространенность остеофитов (%) у 143 афроамериканцев и 130 американцев европейского происхождения на верхней дискальной поверхности шейных позвонков| Степень остеофита | Общая распространенность остеофитов | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 класс | 2 класс | 3 класс | 4 класс | ||||||||
| AA | EA | AA | EA | AA | EA | AA | EA | AA | EA | P значение | |
| C3 | 73.43 | 75,38 | 17,48 | 19,23 | 5,59 | 2,31 | 3,50 | 3,08 | 26.57 | 24,62 | 0,782 |
| C4 | 63,64 | 62,31 | 13,29 | 21,54 | 9.09 | 10,00 | 13,99 | 6,15 | 36,36 | 37,69 | 0,900 |
| C5 | 63.64 | 50,00 | 12,59 | 26,15 | 7,69 | 14,62 | 16,08 | 9,23 | 36.36 | 50,00 | 0,028 * |
| C6 | 58,04 | 51,54 | 11,19 | 13,85 | 11.89 | 15,38 | 18,88 | 19,23 | 41,96 | 48,46 | 0,330 |
| C7 | 69.23 | 55,38 | 13,85 | 22,31 | 8,39 | 10,00 | 9,09 | 12,31 | 30.77 | 44,62 | 0,024 * |
| Все | 65,60 | 58,92 | 13,57 | 20.62 | 8,53 | 10,46 | 12,31 | 10,00 | 34,40 | 41,08 | 0,012 * |
- Сокращения: AA = афроамериканцы; EA = американцы европейского происхождения.Связь между наличием остеофитов и этнической принадлежностью была проверена с помощью двустороннего критерия хи-квадрат
- * Статистически значимая разница.
Общая распространенность остеофитов шейки матки выше среди мужчин, чем среди женщин (Таблица 5). Это связано со значительной разницей между двумя полами в верхних шейных позвонках C3 и C4. В нижних шейных позвонках (C5 – C7) количество остеофитов одинаково у мужчин и женщин.
Таблица 5. Распространенность остеофитов (%) на верхней дискальной поверхности шейных позвонков у 140 мужчин и 133 женщин| Степень остеофита | Общая распространенность остеофитов | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 класс | 2 класс | 3 класс | 4 класс | ||||||||
| Женский | Мужской | Женский | Мужской | Женский | Мужской | Женский | Мужской | Женский | Мужской | P значение | |
| C3 | 82.71 | 66,43 | 13,53 | 22,86 | 1,50 | 6,43 | 2,26 | 4,29 | 17.29 | 33,57 | 0,002 * |
| C4 | 72,93 | 53,57 | 13,53 | 20,71 | 6.02 | 12,86 | 7,52 | 12,86 | 27,07 | 46,43 | 0,001 * |
| C5 | 59.40 | 55,00 | 18,80 | 19,29 | 10,53 | 11,43 | 11,28 | 14,29 | 40.60 | 45,00 | 0,541 |
| C6 | 55,64 | 54,29 | 11,28 | 13,57 | 14.29 | 12,86 | 18,80 | 19,29 | 44,36 | 45,71 | 0,903 |
| C7 | 63.91 | 61,43 | 15,04 | 20,00 | 11,28 | 7,14 | 9,77 | 11,43 | 36.09 | 38,57 | 0,708 |
| Все | 66,92 | 58,14 | 14,44 | 19,29 | 8.72 | 10,14 | 9,92 | 12,43 | 33,08 | 41,86 | 0,001 * |
- Связь между общей распространенностью остеофитов и полом была проверена с помощью двустороннего критерия хи-квадрат.
- * Статистически значимая разница.
Во всех исследованных шейных позвонках (C3 – C7) распространенность остеофитов увеличивалась от молодой возрастной группы (20–39 лет) к пожилой возрастной группе (60+ лет) (Таблица 6). В молодой возрастной группе, например, только 3,41% исследованных лиц имели остеофиты по шкале SDS C3 по сравнению с у 50,53% лиц старше 60 лет.Как и ожидалось, распространенность тяжелых остеофитов (степень 4) также увеличивается с возрастом. В группе C6, например, только у 1,14% людей в возрастной когорте 20–39 были обнаружены тяжелые остеофиты по сравнению с 37,63% в возрастной когорте 60+.
Таблица 6. Распространенность остеофитов (%) на верхних дисковых поверхностях 1365 тел позвонков по возрастным группам| Степень остеофита | Общая распространенность остеофитов | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 класс | 2 класс | 3 класс | 4 класс | |||||||||||||
| 20–39 | 40–59 | 60+ | 20–39 | 40–59 | 60+ | 20–39 | 40–59 | 60+ | 20–39 | 40–59 | 60+ | 20–39 | 40–59 | 60+ | P значение | |
| C3 | 96.59 | 78,26 | 49,46 | 3,41 | 19,57 | 31,18 | 0 | 1,09 | 10.75 | 0 | 1,09 | 8,60 | 3,41 | 21,75 | 50,53 | <0,001 |
| C4 | 95.45 | 59,78 | 35,48 | 3,41 | 23,91 | 23,66 | 0 | 9,78 | 18.28 | 1,14 | 6,52 | 22,58 | 4,55 | 40,21 | 64,52 | <0,001 |
| C5 | 94.32 | 54,35 | 24,73 | 3,41 | 21,74 | 31,18 | 0 | 14,13 | 18.28 | 2,27 | 9,78 | 25,81 | 5,68 | 45,65 | 75,27 | <0,001 |
| C6 | 94.32 | 53,26 | 19,35 | 3,41 | 14,13 | 19,35 | 1,14 | 15,22 | 23.66 | 1,14 | 17,39 | 37,63 | 5,69 | 46,74 | 80,64 | <0,001 |
| C7 | 97.73 | 59,78 | 32,26 | 1,14 | 20,65 | 30,11 | 1,14 | 13,04 | 12.90 | 0 | 6,52 | 24,73 | 2,28 | 40,21 | 67,74 | <0,001 |
| Все | 95.68 | 61,09 | 32,26 | 2,96 | 20,00 | 27,10 | 0,46 | 10,65 | 16.77 | 0,91 | 8,26 | 23,87 | 4,32 | 38,91 | 67,74 | <0,001 |
- Различия между группами проверяли с помощью двустороннего критерия хи-квадрат.
ОБСУЖДЕНИЕ
В этом исследовании мы показываем, что самая высокая распространенность остеофитов в целом и тяжелых остеофитов (степень 4) наблюдается в двигательном сегменте C5 / C6 (рис. 2). Это совпадает с тем фактом, что пик лордоза шейки матки расположен в точке C5, подвергая межпозвоночный диск C5 / C6 максимуму движений сгибания / разгибания (Harrison et al., 2011). Это создает значительную нагрузку на кости и межпозвоночный диск, в основном на фиброзное кольцо.Предыдущие исследования, например, проведенные на останках скелета из Германии (Weber et al., 2003) и Кореи (Kim et al., 2012), также продемонстрировали, что остеофиты преобладают в основном в сегментах C5 / C6 и C6 / C7. Примечательно, что аналогичное наблюдение было обнаружено в отношении остеофитов в пояснично-лордозной области, а именно, что самая высокая распространенность остеофитов была обнаружена на один сегмент движения ниже, чем лордотический пик (Nathan, 1962). Приведенные выше данные свидетельствуют о том, что нагрузка не является ведущей причиной развития остеофитов в шейном отделе позвоночника, потому что, если бы это было так, наибольшая распространенность была бы обнаружена в сегменте C6 / C7.В нашем исследовании частота остеофитов в сегменте C6 / C7 меньше, чем в сегменте C5 / C6, и идентична верхним шейным сегментам C3 / C4. Тот факт, что сегменты C3 / C4 и C6 / C7 демонстрируют наименьшее количество образования остеофитов, может быть объяснен относительно небольшим количеством движений, происходящих в этих сегментах (Panjabi et al., 1991).
Интересно, что мы обнаружили, что в пределах данного сегмента движения верхний позвонок (IDS) демонстрирует более высокую распространенность остеофитов, чем нижний позвонок (SDS).Мы предполагаем, что это связано с анатомической формой позвоночника. Тела позвонков имеют трапециевидную форму: IDS верхнего позвонка в данном сегменте движения всегда шире, чем SDS нижнего позвонка при виде спереди. Это явление придает позвоночнику несколько «пагодальную» форму (Masharawi et al., 2008). Такое морфологическое расположение позволяет межпозвоночному диску лучше противостоять скручивающим движениям (Ezra, 2006) и в то же время обеспечивает стабильность позвоночника. Примечательно, что образование остеофитов связано с повышенным сопротивлением изгибу позвоночника (Al-Rawahi et al., 2011). Хотя образование остеофитов является патологическим процессом, их присутствие на суставных поверхностях тел позвонков может способствовать поддержанию стабильности позвоночника. Мы отмечаем, что предполагаемая адаптивная роль остеофитов была предложена для других частей скелета, такая как наблюдаемое улучшение стабильности тазобедренного сустава после развития крупных остеофитов (Perry et al., 1972).
Ранее сообщалось, что люди разных национальностей различаются по морфологии шейных позвонков (Roche, 1957; Taitz, 1999).Мы стремились проверить, будут ли две группы населения, афроамериканцы и американцы европейского происхождения, различаться по расположению и тяжести остеофитов шейки матки. В соответствии с предыдущими исследованиями (Roche, 1957; Nathan, 1962; Taitz, 1999) мы обнаружили, что для некоторых позвоночных уровней частота остеофитов различалась между двумя группами, хотя это не относилось к распространенности тяжелых остеофитов.
Ранее сообщалось о более высоком уровне остеофитов в шейных позвонках у мужчин по сравнению с женщинами (Nathan, 1962).Основываясь на нашем исследовании, значительные различия между мужчинами и женщинами в распространенности остеофитов очевидны только для верхних шейных уровней (C3 и C4), хотя на данном этапе неясно, почему эта разница возникает только в этих позвонках.
Наконец, связь между остеофитами шейки матки и возрастом была описана в других исследованиях (Nathan, 1962; O’neill et al., 1999), что может быть использовано для оценки возраста на момент смерти в судебно-медицинском контексте ( Ватанабэ и Терадзава, 2006 г.).Эту ассоциацию обычно связывают с дегенерацией межпозвоночных дисков с возрастом (Kumaresan et al., 2001). Кроме того, чрезмерное механическое напряжение, особенно в молодом возрасте, может предрасполагать к образованию остеофитов в более позднем возрасте (O’neill et al., 1999; Schmitt et al., 2004).
В заключение, здесь мы показываем, что распространенность остеофитов позвоночника зависит от сегмента движения в шейном отделе позвоночника, причем сегмент C5 / C6 наиболее подвержен развитию этой патологии.Таким образом, мы предполагаем, что это явление в основном связано с анатомической структурой позвоночника, а не с чрезмерной нагрузкой. Кроме того, мы предоставляем крупномасштабный набор данных по остеофитизу шейки матки с разбивкой по полу, возрасту и этническому происхождению, который может быть использован в качестве основы для будущих исследований по изучению этой и других патологий шейного отдела позвоночника.
БЛАГОДАРНОСТИ
Авторы также благодарят Лаймана Джеллема, Анну Бечар и Варду Векслер за их помощь.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
Спонсор гранта: Фонд Дэна Дэвида
Спонсор гранта: Израильский научный фонд; Номер гранта: 1397/08
Спонсор гранта: Кафедра истории и философии медицины Тассия и д-ра Джозефа Мейчана
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
- Аль-Равахи М., Луо Дж., Поллинтин П., Долан П., Адамс Массачусетс.2011. Механическая функция остеофитов тела позвонков, выявленная в экспериментах на трупных шипах. Spine (Phila PA 1976) 36: 770– 777.
- Кобб WM. 1932. Человеческий архив. Диссертация, Западный резервный университет.
- Эчарри Дж. Дж., Форриол Ф. 2002. Влияние осевой нагрузки на шейный отдел позвоночника: исследование конголезских лесоносцев. Инт Ортоп 26: 141–144.
- Эзра Д. 2006. Морфометрические изменения шейного отдела позвоночника с возрастом: исследование скелетной популяции. Диссертация, Тель-Авивский университет.
- Hardcastle SA, Dieppe P, Gregson CL, Arden NK, Spector TD, Hart DJ, Edwards MH, Dennison EM, Cooper C, Williams M, et al. 2014. Остеофиты, энтезофиты и высокая костная масса: триада костеобразования, потенциально имеющая отношение к остеоартриту. Arthritis Rheumatol 66: 2429–2439.
- Харрисон Д.Е., Харрисон Д.Д., Яник Т.Дж. 2011. Сравнение осевых и изгибных напряжений при лордозе и трех изогнутых конфигурациях шейного отдела позвоночника. Clin Biomech (Бристоль, Эйвон) 16: 276–284.
- Hassett G, Hart DJ, Manek NJ, Doyle DV, Spector TD. 2003 г.Факторы риска прогрессирования дегенерации диска поясничного отдела позвоночника: исследование Чингфорда. Arthritis Rheum 48: 3112– 3117.
- Heggeness MH, Doherty BJ. 1998. Морфологическое исследование остеофитов поясничных позвонков. South Med J 91: 187– 189.
- Хьюз Т.А., Уайлс С.М., Лори Б.В., Смит А.П. 1994. Отчет о клиническом случае: дисфагия и апноэ во сне, связанные с шейными остеофитами из-за диффузного идиопатического гиперостоза скелета (DISH). J Neurol Neurosurg Psychiatry 57: 384.
- Ким Д.К., Ким М.Дж., Ким Ю.С., О CS, Шин Д.Х. 2012. Позвоночный остеофит досовременных корейских скелетов из гробниц Чосон. Anat Cell Biol 45: 274–281.
- Kissel P, Youmans JR. 1992. Посттравматический передний шейный остеофит и дисфагия: хирургический отчет и обзор литературы. J Расстройство позвоночника 5: 104– 107.
- Клаассен З., Таббс Р.С., Апайдин Н., Хаге Р., Джордан Р., Лукас М. 2011. Остеофиты позвоночника. Anat Sci Int 86: 1–9.
- Кумаресан С, Йоганандан Н, Пинтар Ф.А., Майман DJ, Гоэль ВК. 2001. Вклад дегенерации диска в образование остеофитов в шейном отделе позвоночника: биомеханическое исследование. J Orthop Res 19: 977–984.
- Lipson SJ, Muir H. 1980. Образование остеофитов позвоночника при экспериментальной дегенерации диска. Морфологические и протеогликановые изменения со временем. Arthritis Rheum 23: 319–324.
- Macnab I. 1971. Тяговая шпора. Индикатор сегментарной нестабильности. Bone Joint Surg Am 53: 663– 670.
- Masharawi Y, Salame K, Mirovsky Y, Peleg S, Dar G, Steinberg N, Hershkovitz I. 2008. Вариации формы тела позвонка в грудном и поясничном отделах позвоночника: характеристика его асимметрии и заклинивания. Clin Anat 21: 46–54.
- McGarrah PD, Teller D. 1997. Посттравматический шейный остеофитоз, вызывающий прогрессирующую дисфагию. South Med J 90: 858– 860.
- Натан Х. 1962. Остеофиты позвоночника. Анатомическое исследование их развития в зависимости от возраста, расы и пола с учетом их этиологии и значения. J Bone Joint Surg Am 44: 243– 268.
- О’Нил Т.В., Макклоски Е.В., Канис Дж. А., Бхалла А. К., Рив Дж., Рид Д. М., Тодд С., Вульф А. Д., Силман А. Дж..1999. Распространение, детерминанты и клинические корреляты остеофитии позвоночника: обследование населения. J Rheumatol 26: 842–848.
- Озгокмен С., Кирис А., Коджакоч Е., Ардикоглу О. 2002. Дисфагия, вызванная остеофитами: отчет о трех случаях. Костный сустав позвоночника 69: 226–229.
- Панджаби М.М., Дюрансау Дж., Гоэль В., Оксланд Т., Таката К.1991. Шейные позвонки человека. Количественная трехмерная анатомия среднего и нижнего отделов. Spine (Phila PA 1976) 16: 861–869.
- Перри Г.Х., Смит М.Дж., Уайтсайд К.Г. 1972. Самопроизвольное восстановление суставной щели при дегенеративном заболевании тазобедренного сустава. Ann Rheum Dis 31: 440–448.
- Рош МБ.1957. Заболеваемость остеофитозом и остеоартрозом 419 скелетонированных позвоночных столбов. Am J Phys Anthropol 15: 433–434.
- Шмитт Х., Дублянин Э., Шнайдер С., Шильтенвольф М. 2004. Рентгенографические изменения поясничного отдела позвоночника у бывших элитных спортсменов. Spine (Phila PA 1976) 29: 2554–2559.
- Штрассер Г., Шима В., Шобер Э., Покизер П., Кайдер А., Денк Д.М.2000. Шейные остеофиты, поражающие глотку: важность размера и сопутствующих заболеваний для развития аспирации. Am J Roentgenol 174: 449–453.
- Taitz C. 1999. Остеофитоз шейного отдела позвоночника у чернокожих и белых южноафриканцев. Clin Anat 12: 103–109.
- Ватанабэ С., Теразава К.2006. Оценка возраста по степени остеофитообразования позвоночника на японском языке. Leg Med 8: 156–160.
- Уильямс Дж.А., Тонар Э.Дж.-МА. 1989. Раннее образование остеофитов после химически индуцированного повреждения суставного хряща. Am J Sports Med 17: 7–15.
- Вебер Дж., Чарнецкий А., Весна А.2003. Палеопатологические особенности шейного отдела позвоночника в раннем средневековье: естественная история дегенеративных заболеваний. Нейрохирургия 53: 1418–1424.
