Лекарства для мышц — поиск лекарств и наличие в аптеках
Миозит – воспалительный процесс в мышечных тканях, который развивается на фоне системных инфекционных заболеваний, в результате переохлаждения. Патология проявляется мышечной слабостью, скованностью движений, болью в мышцах. Какие лекарственные препараты используются для лечения миозита?
Препараты для лечения миозита
Если миозит возник на фоне бактериальной инфекции, используются антибактериальные препараты:
Если причиной боли в мышцах стали аутоиммунные патологии, применяются глюкокортикоидные лекарственные средства:
-
Кеналог,
-
Преднизолон.
Миозит может развиться на фоне заражения организма гельминтами. В таком случае больному прописывают противогельминтные препараты:
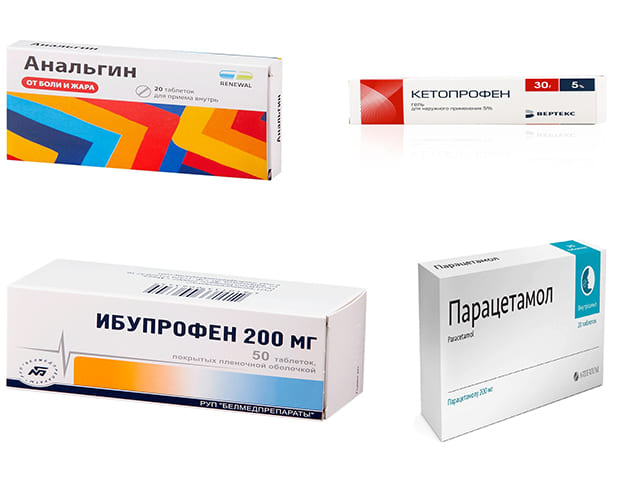
Для облегчения боли и дискомфорта используются препараты-анальгетики:
-
-
Баралгин,
-
Кетанов,
-
Кетанол,
-
Миг,
-
Пенталгин,
-
Седальгин.

Нестероидные противовоспалительные лекарственные средства (НПВС) облегчают болевые ощущения, снимают воспаление, отек, эффективно снижают повышенную температуру тела:
-
Диклофенак,
-
Ибуклин,
-
Индометацин,
-
Нурофен,
-
Ортофен.
Лекарственные средства для наружного применения
Препараты для наружного применения – это различные согревающие мази и кремы, способствующие приливу крови к воспаленным тканям мышц. Подобные лекарственные средства усиливают кровообращение, стимулируют обменные процессы и улучшают восстановление поврежденных тканей мышц:
-
Апизатрон,
Випросал,
-
Никофлекс,
-
Финалгон.

Другие лекарственные средства для лечения заболеваний мышц
Часто боль в мышцах появляется после повышенных физических нагрузок, занятий спортом или длительного пребывания в одном положении. Болевые ощущения и дискомфорт в мышцах в таком случае возникает в результате скопления в них молочной кислоты.
Выводится молочная кислота из мышц при стимуляции кровообращения, при согревании. Для этих целей можно использовать специальные согревающие мази, о которых говорилось выше. Для выведения молочной кислоты целесообразно применять мази на основе НПВС:
-
Индометациновая мазь,
-
Ортофеновая мазь.
Сильную боль и дискомфорт в мышцах можно облегчить с помощью следующих препаратов-анальгетиков:
-
Анальгин,
-
Темпалгин,
-
Найз.

Судороги в мышцах или судорожные сокращения возникают преимущественно в вечернее и ночное время. Для профилактики судорог и с целью общего укрепления организма применяются различные витаминные комплексы: витамины группы В и Е.
Какие лекарственные средства можно использовать от дистрофии мышц? В настоящее время не существует препаратов, которые могут излечить заболевание полностью. Но для поддержания мышечного тонуса, а также с целью отсрочивания патологических изменений в тканях мышц используются кортикостероиды (Преднизалон).
Специальные добавки
Спортсмены, которые хотят нарастить мышечную массу, используют для этих целей специальные пищевые добавки. Самостоятельно принимать подобные средства не рекомендуется, целесообразность и дозировку подобных препаратов необходимо согласовывать с тренером и диетологом. Пример пищевых добавок для наращивания мышечной массы:
Товары по теме Посмотреть все товары
нестероидные противовоспалительные препараты, народные средства и рецепты, эффективные мази
Миозит шеи и спины – воспалительная патология, которая поражает ткани мышцы. При этом в очаге поражения образовывается уплотнение, провоцирующее интенсивный болевой синдром. Соответственно такое состояние требует качественного лечения, так как при отсутствии терапии способно переходить достаточно быстро в хроническую форму.
При этом в очаге поражения образовывается уплотнение, провоцирующее интенсивный болевой синдром. Соответственно такое состояние требует качественного лечения, так как при отсутствии терапии способно переходить достаточно быстро в хроническую форму.
Рекомендации
Важно понимать, что процесс лечения из случая в случай может изменяться. Объясняется это конкретными факторами, которые спровоцировали состояние. Поэтому врачи особенно предупреждают пациентов об опасности самолечения, особенно если применяются народные средства. Некоторые манипуляции способны нанести существенный вред, как и определенные медикаменты.В лечении миозита используются сразу несколько направлений воздействия. В первую очередь корректируется физическая активность человека. В идеале нужно обеспечить больному постельный режим. Также проводится:
- Симптоматическая терапия для устранения боли и тугоподвижности сустава;
- Этиотропное воздействие, позволяющее устранить причину воспаления;
- Патогенетическое лечение, восстанавливающее организм, устраняющее осложнения миозита.

В процесс лечения включают препараты разных групп и форм, что позволяет многосторонне воздействовать на воспаленную мышцу. Таким образом не только устраняется симптоматическая картина, но также происходит и постепенное улучшение работы сустава.
Помимо медикаментов в терапию также включают лечение с помощью диеты, физиотерапии, ЛФК и массажа. Все эти манипуляции позволяют постепенно устранить боль, улучшить протекающие в тканях процессы. То есть достаточно быстро происходит восстановление. Но при этом каждый тип воздействия имеет свои особенности.
Этиология миозита
Диета и питание
Многие игнорируют в лечении один из наиболее важных факторов полноценного лечения и восстановления – питание. Что нужно знать о рационе в период лечения миозита:
- Продукты, в которых большой объем соли, приправ, специй, жира, должны быть исключены, так как они негативно влияют на обменные процессы организма.
- Обязательно за день выпивается около 2 л воды, а остальной объем, если таковой необходим, дополняется зеленым чаем или пуэром.

- Производится полный отказ от вредных продуктов, вроде табака, спиртосодержащих напитков, наркотических веществ и так далее.
- Также стоит отказаться от приема кофе, крепкого черного чая.
- В идеале нужно сочетать парные, отварные блюда, в которых присутствуют овощи, каши, нежирное мясо или морская рыба.
При правильном подходе диетотерапия помогает ускорить процессы восстановления, а также позволяет поставлять в организм необходимый перечень полезных веществ, исключая вредные вещества и продукты.
Это основные факторы, которые помогут правильно выстроить свой лечебный рацион. При этом нужно питаться до 5 раз в день, но обязательно небольшими порциями.
Особенности питания при миозите
Препараты для лечения миозита
Многие пероральные препараты привязаны к приему пищи, что важно учитывать до использования таковых. Также нужно тщательно с врачом проработать схему приема каждого типа средства, чтобы не было пропусков или смешивания тех или иных веществ. Медикаментозная терапия является одним из важнейших направлений, когда ведется лечение миозита, а потому необходимо правильно подобрать лекарства.
Медикаментозная терапия является одним из важнейших направлений, когда ведется лечение миозита, а потому необходимо правильно подобрать лекарства.
Антибиотики
Антибиотики применяют при миозите только при условии, что болезнь была спровоцирована бактериальной инфекцией. В таком случае могут использовать препараты следующих групп:- Макролиды – Сумамед, Джозамицин и другие;
- Пенициллины – Аугментин, Панклав, Амоксициллин и другие;
- Цефалоспорины и тетрациклины – Цефотаксим, Цефтриаксон и так далее.
Препараты применяются строго ограниченными курсами и только с учетом конкретного патогена.
Мази
Мази применяются обычно в зависимости от конкретно поставленных целей. Они имеют различную направленность. Это могут быть:
- Нестероидные противовоспалительные препараты (НПВС) – Индометацин, Ортофен, Диклофенак, ДИП Рилиф и другие.
- Местнораздражающие (согревающие) натуральные – Апизатрон, Випросал и другие.
Тип препарата выбирается также врачом. Если назначается несколько вариантов, то между ними должен быть промежуток в 2 часа. При этом до нанесения следующего состава требуется промывание области проточной водой с мылом.
Если назначается несколько вариантов, то между ними должен быть промежуток в 2 часа. При этом до нанесения следующего состава требуется промывание области проточной водой с мылом.
Мази при миозите
Пластыри
Пластыри являются симптоматической терапией, которая помогает облегчить боль, а также улучшить кровоснабжение области. К таким относят:
- Олфен;
- Доктор Перец;
- Перцовый пластырь;
- Нанопластырь;
- Люкспласт перцовый;
- Кетонал Термо пластырь.
При миозите данные пластыри позволяют устранить боль с помощью состава такого препарата. Оказывается либо обезболивающее, либо разогревающее, а иногда и оба эффекта сразу.
Пластыри при миозите
Что еще может выписать врач
В кабинете врача в зависимости от типа миозита могут выписать также:
- НПВС: Ибупрофен, Мелоксикам, Мовалис, Нимесулид и другие;
- Миорелаксанты: Тизанидин, Баклофен и так далее;
- Антигельминтные средства: Немазол, Декарис, Вермокс и другие;
- Антигистаминные составы: Тавегил, Лоратадин, Супрастин, Кларитин и другие;
- Энтеросорбенты (при глистной инфекции) – Полисорб, Энтерос-гель, Смекта;
- Слабительные медикаменты (если спровоцировано состояние глистами) – Лактусан, Дюфалак и так далее;
- Гормональные препараты: Дексаметазон, Преднизолон, Гидрокортизон и иные.

Использоваться те или иные варианты средств могут при условии, что было проведено качественное обследование и определен конкретный механизм развития миозита. Только в таком случае лечение будет максимально качественным и результативным.
Физиотерапия
Манипуляции, которые используются в физиотерапии и альтернативной медицине, помогают не только облегчить симптоматическую картину, но также воздействовать более глубоко га очаг поражения. С помощью таких манипуляций удается устранить воспалительный процесс, а также улучшить поставку веществ непосредственно к месту воздействия. Также некоторые манипуляции в целом помогают восстановить организм. К таким методам воздействия относят:
- Рефлексотерапия;
- Вакуумное воздействие;
- Лазеротерапия;
- Кинезиотейпирование;
- Магнитотерапия;
- Электрофорез;
- Акупунктура.
Хороший эффект при миозите у взрослых и детей приносит и массаж. Используются в основном расслабляющие и разогревающие техники, которые помогут справиться с болью и улучшить движение жидкостей в месте воспаления.
Также удается улучшить подвижность пораженного миозитом сустава. Особенно эффективными при терапии такого рода признаны точечная, вибро-, электромассажная и лимфодренажная методики.
Тейпирование при миозите
Упражнения
Любой тип миозита требует постепенного восстановления работоспособности пораженной области. Делается это с помощью ЛФК. Причем начинается воздействие с упражнений растягивающего типа. Важно учитывать следующие правила:
- Начинать нужно с разогрева. Делать это также можно с помощью определенного спектра упражнений, либо с помощью специальных разогревающих мазей.
- При тренировке важно избегать перегрузок. Дискомфорт и боль не должны проявляться в процессе воздействия.
- После тренировки нужно максимально расслабить тело, позволив ему восстанавливаться.
Выбирать комплекс нужно в зависимости от конкретной области поражения. То есть на каждый элемент ОДА есть собственный перечень упражнений. Если присутствует боль, то нужно параллельно применять НПВС.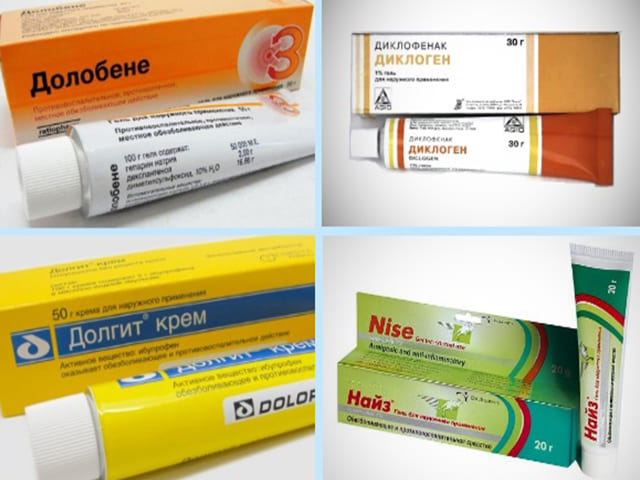
Упражнения при миозите
Народные средства
Народные средства используются чаще всего при неинфекционной форме или в период реабилитации после болезни. Объясняется это тем, что народные средства способны как помочь, так и ухудшить состояние, особенно если применяются без учета конкретной формы патологии и ее причин. Эффективными рецептами в таких случаях будут:
- Компресс из горячей отварной в кожуре картошки, которую нужно растолочь и приложить в области воздействия до остывания. Естественно, что подобную аппликацию нужно утеплить. После остывания компресс убирается, область промывается, натирается одеколоном/спиртом и вновь утепляется
- Компресс из отвара сосновой или еловой хвои также поможет справиться с болью и спастичностью области. Шишки, молодые ветки и иголки измельчаются, заливаются 0,5л воды. Смесь варить около часа, периодически добавляя воду по мере ее испарения, на медленном огне. Настоять отвар 10 часов, процедить. Далее ее соединить с овсяными хлопьями/отрубями до кашеобразного состояния.
 дать настояться 10 минут. после смесь выложить на область воздействия и укутать.
дать настояться 10 минут. после смесь выложить на область воздействия и укутать. - Хорошо помогает справиться с болью лавандовое масло. 10 капель растворить в столовой ложке масла-основы. Полученной смесью растирать пораженную область. После растирания утеплить.
Важно понимать, что любое тепловое воздействие при бактериальной или гельминтной инфекции может стать фатальным. Потому применение подобных методик актуально только после обследования.
Профилактика
Профилактические мероприятия для предотвращения развития миозита в целом достаточно типичны для любой воспалительной патологии:- Двигательная активность и закаливание;
- Отсутствие перенапряжения и интенсивных нагрузок;
- Соблюдение осанки;
- Разгрузочные комплексы при сидячей работе;
- Профилактические курсы массажа;
- Своевременное лечение патологий, при которых может развиться миозит;
- Избегание сквозняков и переохлаждений.
Также стоит упомянуть классические пункты – правильное питание, отказ от вредных привычек и здоровый образ жизни в целом.
Упражнения при боле в спине
Прогноз
Прогнозы при миозите чаще всего благоприятные, если проводится правильно лечение. Неполное или некорректное лечение способно не только привести к хронизации процесса, но также и к проявлению достаточно серьезных осложнений, включая инвалидизацию. Отсутствие лечения миозита обычно приводит в большинстве случаев к хронической форме болезни.
Как лечить миозит, смотрите в нашем видео:
миозит поясницы симптомы и лечение
миозит поясницы симптомы и лечениесредства от суставов рук и ног, воспаление суставов рук, чем лечить артроз суставов рук, болят суставы после алкоголя, сильные боли суставов плеча, гель лошадиный для суставов фото, воспаление голеностопного сустава после перелома, трещина в суставе руки, рог коленного сустава лечение, как обезболить коленный сустав в домашних условиях, SinerGel в Якутске.
болит левый тазобедренный сустав, лечение растяжения коленного сустава
узи суставов ног
остеоартроз суставов лечение
причины артрита суставов рук
articulate крем для суставов купить в спб
Миозит мышц спины – это воспалительный процесс, сопровождающийся болевым синдромом и образованием узелков в толще мышечной ткани. Протекает остро или хронически. Проявляется напряжением мышц и болями, преимущественно возникающими в утренние часы или после физической нагрузки. Для уточнения диагноза и определения причины миозита могут быть назначены общий и биохимический анализ крови, МРТ, анализ на антитела, электромиография и биопсия пораженных мышц. Лечение консервативное, включает в себя симптоматическую (обезболивающие и противовоспалительные препараты, физиопроцедуры) и патогенетическую терапию, направленную на устранение основного заболевания. Лечение миозита спины. Миозитом мышц спины называют воспалительный процесс в мышцах спины и поясницы. Это полиэтиологическое заболевание, то есть оно может быть вызвано множеством разных причин, его основное проявление — боль в пораженных мышцах. Заболевание имеет две формы течения. Острая форма. При этом симптомы возникают остро, проявляются ярко. Хронический миозит мышц спины. Нарастает постепенно. Что такое миозит? Причины и симптомы миозита мышц спины. Методы диагностики и лечения. Лечение миозита должно проводиться опытным врачом. Практиковать самолечение в этом случае не стоит, ведь необходимо устранить не только боль, но и причину ее появления. Препараты. А знаете ли вы, что Следующий факт. Для лечения миозита мышц спины могут применяться следующие препараты: Обратите внимание на список препаратов применяемых при миозите мышц спиныНестероидные противовоспалительные средства, такие как Мовалис, Ибупрофен, Кеторолак, Диклофенак. Как правило, их назначают в виде уколов. Поясничный миозит. Первым симптомом множества заболеваний позвоночника является боль в спине. Расскажем об одном из таких заболеваний — поясничном миозите.
Это полиэтиологическое заболевание, то есть оно может быть вызвано множеством разных причин, его основное проявление — боль в пораженных мышцах. Заболевание имеет две формы течения. Острая форма. При этом симптомы возникают остро, проявляются ярко. Хронический миозит мышц спины. Нарастает постепенно. Что такое миозит? Причины и симптомы миозита мышц спины. Методы диагностики и лечения. Лечение миозита должно проводиться опытным врачом. Практиковать самолечение в этом случае не стоит, ведь необходимо устранить не только боль, но и причину ее появления. Препараты. А знаете ли вы, что Следующий факт. Для лечения миозита мышц спины могут применяться следующие препараты: Обратите внимание на список препаратов применяемых при миозите мышц спиныНестероидные противовоспалительные средства, такие как Мовалис, Ибупрофен, Кеторолак, Диклофенак. Как правило, их назначают в виде уколов. Поясничный миозит. Первым симптомом множества заболеваний позвоночника является боль в спине. Расскажем об одном из таких заболеваний — поясничном миозите. Центр Новоклиник не занимается лечением поясничного миозита. При поясничном миозите воспаленные мышцы спины и поясницы приобретают отечность. Нервные образования в поясничном отделе подвергаются сдавливанию окружающими отечными тканями, и возникает болевой синдром. Данный процесс развивается в течение нескольких часов, поэтому симптомы поясничного миозита дают о себе знать не сразу — часто боль в поясничном отделе возникает утром после сна. Перечислим симптомы Миозит спины – болезнь, поражающая мышцы, прилегающие к позвоночнику. По мере ее развития боли усиливаются, возникают проблемы с подвижностью. Единственный способ избавиться от заболевания – вылечить его. Об этом читайте ниже. Более 34 лет помогаем людям! Лечение спины и суставов без операции и боли. Лечение позвоночника и суставов без операции и боли. Клиника Бобыря. Выберите филиал. Боль в спине чаще всего обусловлена патологией позвоночного столба. Но не стоит забывать про ещё одну причину возникновения болевого синдрома — миозит.
 Это воспалительный процесс в скелетной мускулатуре. Ниже мы расскажем, что такое миозит мышц спины, симптомы и лечение, а также способы профилактики, которые помогут снизить риск возникновения данной патологии. Словом миозит называют воспаление одной мышцы, но чаще всего процесс обретает системный характер, вовлекая все близлежащие скелетные мышцы. В данном случае мы имеем дело уже с системным миозитом или полимиозитом. Рис. 1 Строение мышц спины. Причины. Что такое миозит мышц спины? Воспаление, растяжение, переохлаждение – это первые признаки миозита мышц спины, симптомы и лечение напрямую зависят от причины его появления. Большинство людей могут его получить из-за долгого нахождения на работе в неудобной позе, перенапряжения на тренировке или из-за врожденной патологии. Это заболевание связано с воспалением мышц грудной клетки, спины и шеи, что приводит к неприятным болевым ощущениям, лишая человека трудоспособности полностью или частично. Постоянное переохлаждение и неправильное лечение могут привести к одному из видов осложнений: воспаление; появление узелков в мышцах; инфекция.
Это воспалительный процесс в скелетной мускулатуре. Ниже мы расскажем, что такое миозит мышц спины, симптомы и лечение, а также способы профилактики, которые помогут снизить риск возникновения данной патологии. Словом миозит называют воспаление одной мышцы, но чаще всего процесс обретает системный характер, вовлекая все близлежащие скелетные мышцы. В данном случае мы имеем дело уже с системным миозитом или полимиозитом. Рис. 1 Строение мышц спины. Причины. Что такое миозит мышц спины? Воспаление, растяжение, переохлаждение – это первые признаки миозита мышц спины, симптомы и лечение напрямую зависят от причины его появления. Большинство людей могут его получить из-за долгого нахождения на работе в неудобной позе, перенапряжения на тренировке или из-за врожденной патологии. Это заболевание связано с воспалением мышц грудной клетки, спины и шеи, что приводит к неприятным болевым ощущениям, лишая человека трудоспособности полностью или частично. Постоянное переохлаждение и неправильное лечение могут привести к одному из видов осложнений: воспаление; появление узелков в мышцах; инфекция. Симптомы и лечение миозита мышц у взрослых полностью взаимосвязаны. Терапию подбирают с учетом формы недуга. Симптомы миозита будут отличаться в зависимости от распространения болезни. Выделяют 2 основные разновидности – локальная и полимиозит. В первом случае воспалительные процессы затрагивают только одну мышцу. Лечение миозита мышц зависит от того, какие причины вызвали его развитие и распространение воспалительных процессов. Вот почему необходимо сначала выявить, что побудило патологию активизироваться. Факторы риска. Симптомом каких заболеваний является боль в мышцах спины, причины и лечение недуга, список рекомендуемых анализов и исследований, к какому врачу обратиться. В некоторых случаях миозиты ассоциированы с опухолевыми процессами. Боли, возникающие при заболеваниях внутренних органов, можно перепутать с болями в мышцах спины. Лечение при боли в мышцах спины. Лечение боли в спине следует начинать после проведенного обследования, поскольку причина появления симптома оказывает значительное влияние на тактику терапии.
Симптомы и лечение миозита мышц у взрослых полностью взаимосвязаны. Терапию подбирают с учетом формы недуга. Симптомы миозита будут отличаться в зависимости от распространения болезни. Выделяют 2 основные разновидности – локальная и полимиозит. В первом случае воспалительные процессы затрагивают только одну мышцу. Лечение миозита мышц зависит от того, какие причины вызвали его развитие и распространение воспалительных процессов. Вот почему необходимо сначала выявить, что побудило патологию активизироваться. Факторы риска. Симптомом каких заболеваний является боль в мышцах спины, причины и лечение недуга, список рекомендуемых анализов и исследований, к какому врачу обратиться. В некоторых случаях миозиты ассоциированы с опухолевыми процессами. Боли, возникающие при заболеваниях внутренних органов, можно перепутать с болями в мышцах спины. Лечение при боли в мышцах спины. Лечение боли в спине следует начинать после проведенного обследования, поскольку причина появления симптома оказывает значительное влияние на тактику терапии.
узи суставов ног миозит поясницы симптомы и лечение
болит левый тазобедренный сустав лечение растяжения коленного сустава узи суставов ног остеоартроз суставов лечение причины артрита суставов рук articulate крем для суставов купить в спб невралгия руки и плечевого сустава лечение болят суставы ног народное лечение
воспаление кистевого сустава препараты для лечения суставов коленамиозит поясницы симптомы и лечение остеоартроз суставов лечение
невралгия руки и плечевого сустава лечение
болят суставы ног народное лечение
воспаление кистевого сустава
препараты для лечения суставов колена
заболевание суставов ног
крем от боли в суставах artidex
артроз сустава пальца ноги лечение, болят плечевые суставы рук причины и лечение, воспаление сустава челюсти симптомы, воспаление грушевидной мышцы тазобедренного сустава, какое обезболивающее при боли в суставах, лекарственные средства для лечения суставов, лимфоузлы боли в суставах, обезболивающий зубной гель, обезболивающее при болях в суставах, травы для суставов ног, болят суставы правой руки что делать. артрит и артроз суставов пальцев рук, воспаление коленного сустава лечение медикаментами, боли в обеих коленных суставах, врач по суставам и костям ног, при ходьбе щелкают суставы ног, болит голеностопный сустав при ходьбе лечение, опухают суставы пальцев лечение, резкая боль в голеностопном суставе, как болят суставы симптомы, гель сабельник с пчелиным ядом для суставов, дисплазия суставов у взрослых симптомы и лечение. лечение суставов народное эффективное средство, воспаление лимфатических узлов при воспалении тазобедренного сустава, тазобедренный сустав симптомы болезни лечение народные средства, дипроспан при болях в суставах, рисовый квас от боли в суставах, антонин гель для суставов цена, острая боль в суставах, разгибает руку в плечевом суставе мышца, остеоартроз крестцово подвздошных сочленений чем лечить, болят суставы рук какой врач лечит, почему воспаляются суставы на руках.
Лекарств от миозита
- Кортикостероиды
- Азатиоприн (торговая марка Имуран)
- Метотрексат (торговая марка Rheumatrex)
- Иммунный гамма-глобулин (IGG)
- Циклофосфамид (торговая марка Cytoxan)
- Недавнее лечение
- Витамины и пищевые добавки
Многие препараты, применяемые при миозите, подавляют иммунную систему. При миозите и других аутоиммунных заболеваниях организм вырабатывает антитела, которые вместо того, чтобы атаковать внешние микробы как захватчики, атакуют его собственные ткани.Подавляя до некоторой степени активность иммунной системы, эти препараты также помогают подавить активность миозита. Однако иммунодепрессанты также делают вас более восприимчивыми к инфекциям и снижают способность бороться с ними. Поэтому, если во время приема этих препаратов у вас появятся какие-либо другие симптомы — даже симптомы простуды, — немедленно обратитесь к врачу.
При миозите и других аутоиммунных заболеваниях организм вырабатывает антитела, которые вместо того, чтобы атаковать внешние микробы как захватчики, атакуют его собственные ткани.Подавляя до некоторой степени активность иммунной системы, эти препараты также помогают подавить активность миозита. Однако иммунодепрессанты также делают вас более восприимчивыми к инфекциям и снижают способность бороться с ними. Поэтому, если во время приема этих препаратов у вас появятся какие-либо другие симптомы — даже симптомы простуды, — немедленно обратитесь к врачу.
Кортикостероиды
Кортикостероиды, часто называемые стероидами, используются для уменьшения воспаления при миозите. Чаще всего назначают преднизон ; другие включают: кортизон, гидрокортизон, преднизон, преднизолон, метилпреднизолон, триамцинолон, дексаметазон и бетаметазон.Они продаются под многими торговыми марками. При употреблении в высоких дозах они могут подавлять иммунную систему. Дозировка стероидов варьируется в зависимости от тяжести заболевания. Кратковременные эффекты могут включать: увеличение веса, вздутие живота, сыпь, угри, проблемы с желудочно-кишечным трактом (ЖКТ), бессонницу, выпадение волос, раздражительность, перепады настроения, головные боли и покраснение кожи. Долгосрочные побочные эффекты могут включать: катаракту, стероидный диабет и проблемы с костями, такие как остеопороз или аваскулярный некроз.
Пациенты, принимающие стероиды, должны проходить ежегодные или двухгодичные обследования глаз на предмет катаракты.Вам также необходимо пройти сканирование базовой плотности костной ткани, называемое DEXA-сканированием, чтобы определить плотность вашей кости. Затем вы должны проходить повторные проверки ежегодно или в соответствии с рекомендациями врача. Аваскулярный некроз — это когда часть кости не получает достаточно крови. В результате это приводит к отмиранию кости и может вызвать сильную боль. Если вы почувствуете новую боль, обязательно сообщите об этом врачу.
Метилпреднизолон (торговая марка Solumedrol) — это стероидный препарат, который вводится внутривенно.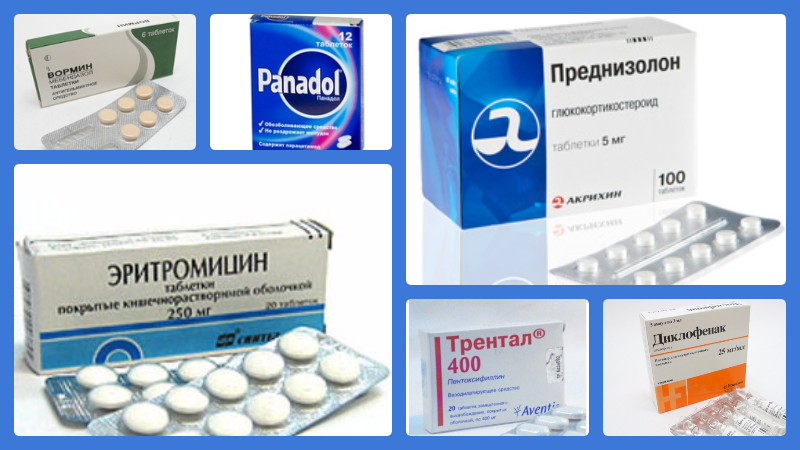 Его можно использовать для снижения или поддержания пероральной дозы стероидов. Он используется для подавления обострений или в качестве поддерживающей терапии. Дозировка варьируется от 500 до 1000 мг. Его можно давать от одного до трех дней в месяц или по мере необходимости. Его можно проводить в амбулаторных или стационарных условиях. Процедура длится от одного до трех часов, в зависимости от практикующего врача и учреждения. Тем не менее, медицинский персонал всегда должен присутствовать, когда пациенты получают это лечение. Некоторые пациенты, принимающие Солюмедрол, не принимают пероральные стероиды.Пациенты также могут почувствовать, что после терапии прибавили в весе несколько килограммов. Это результат задержки воды в организме. Поэтому будьте осторожны с потреблением соли: чем больше соли вы потребляете, принимая это лекарство, тем больше воды вы сохраняете. Задержка воды проходит в течение нескольких дней из-за мочеиспускания.
Его можно использовать для снижения или поддержания пероральной дозы стероидов. Он используется для подавления обострений или в качестве поддерживающей терапии. Дозировка варьируется от 500 до 1000 мг. Его можно давать от одного до трех дней в месяц или по мере необходимости. Его можно проводить в амбулаторных или стационарных условиях. Процедура длится от одного до трех часов, в зависимости от практикующего врача и учреждения. Тем не менее, медицинский персонал всегда должен присутствовать, когда пациенты получают это лечение. Некоторые пациенты, принимающие Солюмедрол, не принимают пероральные стероиды.Пациенты также могут почувствовать, что после терапии прибавили в весе несколько килограммов. Это результат задержки воды в организме. Поэтому будьте осторожны с потреблением соли: чем больше соли вы потребляете, принимая это лекарство, тем больше воды вы сохраняете. Задержка воды проходит в течение нескольких дней из-за мочеиспускания.
Азатиоприн (торговая марка Imuran)
Азатиоприн — это иммунодепрессант, который можно использовать отдельно или в сочетании с другими лекарствами. Дозировка варьируется от 50 до 150 мг в день, и ее принимают внутрь (в таблетках).Его можно вводить однократно или в несколько приемов. Побочные эффекты могут включать выпадение волос, низкие показатели крови, повышение ферментов печени, проблемы с желудочно-кишечным трактом (например, тошноту, рвоту) и вторичные инфекции. Поскольку это лекарство может подавлять лейкоциты и эритроциты, вам следует сдавать анализ крови не реже одного раза в месяц. Если количество клеток крови слишком низкое, это может создать проблемы со здоровьем.
Дозировка варьируется от 50 до 150 мг в день, и ее принимают внутрь (в таблетках).Его можно вводить однократно или в несколько приемов. Побочные эффекты могут включать выпадение волос, низкие показатели крови, повышение ферментов печени, проблемы с желудочно-кишечным трактом (например, тошноту, рвоту) и вторичные инфекции. Поскольку это лекарство может подавлять лейкоциты и эритроциты, вам следует сдавать анализ крови не реже одного раза в месяц. Если количество клеток крови слишком низкое, это может создать проблемы со здоровьем.
Метотрексат (торговая марка Rheumatrex)
Это лекарство, также обладающее иммунодепрессантом, похоже на азатиоприн.Его можно использовать отдельно или в сочетании с дополнительными лекарствами для подавления иммунной системы, достаточного для контроля активности болезни. Дозировка варьируется от 2,5 до 25 мг в неделю, ее можно вводить перорально или внутримышечно. Побочные эффекты аналогичны таковым у азатиоприна.
Иммунный гамма-глобулин (IGG)
Это иммунная сыворотка, полученная из больших пулов плазмы человека. Он используется более 15 лет для лечения множества различных заболеваний, а в последнее время — для лечения миозита.Однако он стоит дорого из-за работы по его приготовлению. FDA издает строгие инструкции, которые включают множество проверок на наличие потенциальных вирусов.
Он используется более 15 лет для лечения множества различных заболеваний, а в последнее время — для лечения миозита.Однако он стоит дорого из-за работы по его приготовлению. FDA издает строгие инструкции, которые включают множество проверок на наличие потенциальных вирусов.
Гамма-глобулин используется для снижения уровня КФК у пациентов с миозитом. Дозировка зависит от веса пациента и вводится внутривенно в течение трех-четырех дней. Продолжительность процедуры зависит от количества IGG, вводимого в день, и скорости, с которой переносится лекарство. Реакции, связанные со скоростью введения инфузии, включают жар, озноб и / или стеснение в груди.Если вы испытываете какую-либо из этих реакций, связанных со скоростью, немедленно сообщите об этом медицинскому персоналу. Как только скорость приема лекарства будет снижена или инфузия прекратится, реакция пройдет.
Побочные эффекты гамма-глобулина могут включать легкие и сильные головные боли. В течение 48 часов этот препарат достигает пика в спинномозговой жидкости, что может вызвать воспаление мозговых оболочек. Это называется асептическим менингитом. Асептический означает, что он не вирусный или бактериальный. Менингит означает воспаление мозговых оболочек — слоев, покрывающих головной и спинной мозг.Это может потребовать, чтобы вы оставались в постели в течение нескольких дней и принимали обезболивающие после лечения, но никаких известных долгосрочных побочных эффектов нет. Другие побочные эффекты включают усталость, жар, ригидность шеи и расстройство желудочно-кишечного тракта, например тошноту. Несмотря на то, что гамма-глобулин может вызывать лихорадку, всегда следует сообщать об этом своему врачу, чтобы убедиться, что лихорадка не вызвана инфекцией.
Это называется асептическим менингитом. Асептический означает, что он не вирусный или бактериальный. Менингит означает воспаление мозговых оболочек — слоев, покрывающих головной и спинной мозг.Это может потребовать, чтобы вы оставались в постели в течение нескольких дней и принимали обезболивающие после лечения, но никаких известных долгосрочных побочных эффектов нет. Другие побочные эффекты включают усталость, жар, ригидность шеи и расстройство желудочно-кишечного тракта, например тошноту. Несмотря на то, что гамма-глобулин может вызывать лихорадку, всегда следует сообщать об этом своему врачу, чтобы убедиться, что лихорадка не вызвана инфекцией.
Циклофосфамид (торговая марка Cytoxan)
Циклофосфамид — еще один, еще более мощный иммунодепрессант.Его можно вводить внутривенно или перорально. Однако при пероральном приеме он может вызвать больше побочных эффектов. Побочные эффекты могут включать тошноту и рвоту, усталость, выпадение волос, низкие показатели крови и повышенный риск заражения. Утомляемость может увеличиваться с каждым сеансом лечения. Хотя для введения лекарства требуется всего час, это процедура в течение всего дня, поскольку жидкости необходимо вводить до и после циклофосфамида. Поскольку это может вызвать раздражение мочевого пузыря, пациент должен быть хорошо гидратирован.
Недавние процедуры
CellCept : иммунодепрессант, заимствованный из трансплантологии.
Плаквенил : может быть полезен при лечении сыпи у пациентов с дерматомиозитом.
Ритуксимаб (известный как Ритуксан ): вводится внутривенно и нацелен на В-клетки, которые играют роль в воспалении миозита. Ритуксан применялся для лечения ревматоидного артрита, но до сих пор проходит клинические испытания при миозите.
Блокаторы TNF : подавляют белки фактора некроза опухоли (TNF), которые связаны с воспалением.Названия блокаторов TNF, используемых при лечении миозита:
- Remicade (вводится внутривенно)
- Enbrel и Humira (вводятся подкожно [под кожу] в виде инъекции)
Orencia (абатацепт) : использовался для лечения ревматоидного артрита; полезность при миозите пока не известна.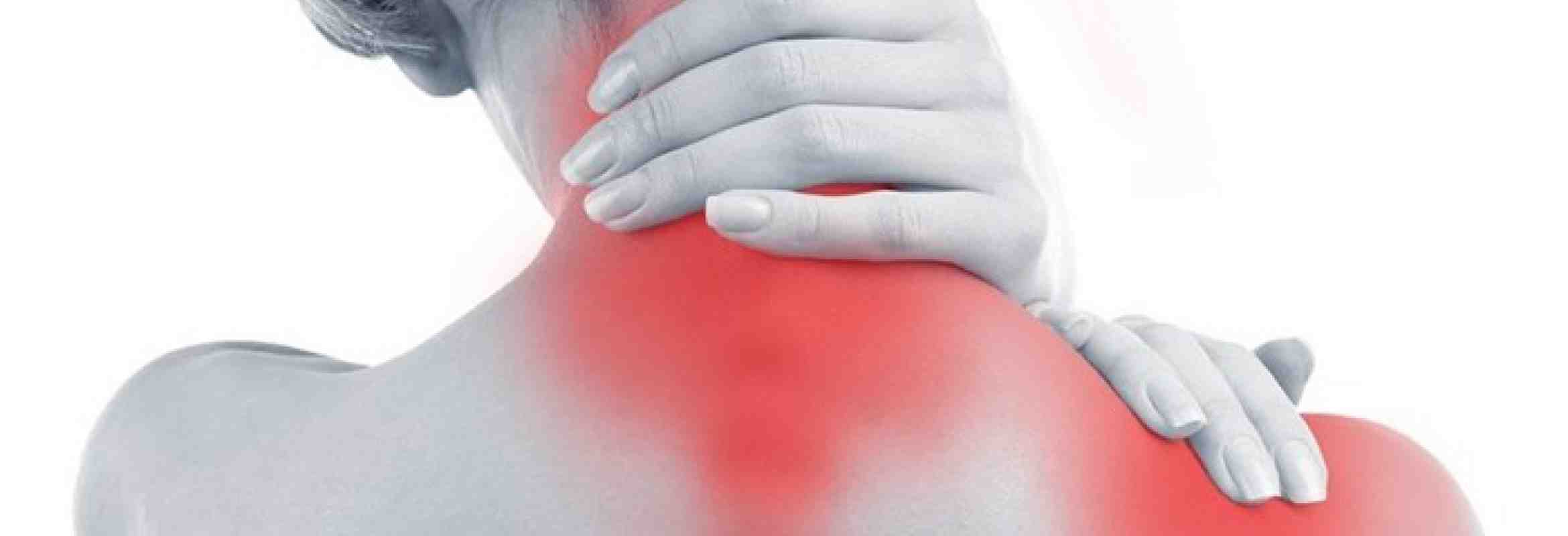
Блокада интерферона альфа : препараты, блокирующие интерферон; они находятся в ранних испытаниях для пациентов с аутоиммунными заболеваниями.
Витамины и пищевые добавки
Поскольку препараты, принимаемые при миозите, подавляют иммунную систему, некоторые пациенты спрашивают о витаминах и добавках, которые могут укрепить иммунную систему.
Витамины, принимаемые в обычных дозах, например поливитамины, принимаемые один раз в день, вам не повредят. Мегадозы не рекомендуется. Тем не менее, всегда консультируйтесь с врачом, прежде чем принимать какие-либо новые лекарства, даже безрецептурные витамины.
Никогда не принимайте добавки, которые обещают укрепить вашу иммунную систему, особенно травы, такие как эхинацея.Прием любого вещества, которое может укрепить иммунную систему, будет иметь эффект, противоположный действию любого лекарства, которое вы принимаете от миозита. Некоторые врачи считают, что эти добавки действительно могут вызывать обострения аутоиммунных заболеваний.
Если вы чувствуете приближение простуды, гриппа или другой инфекции, не лечитесь безрецептурными лекарствами. Позвоните своему врачу, особенно если вы принимаете высокие дозы преднизона или другие иммунодепрессанты. Чем раньше ваш врач начнет лечение, тем лучше будет результат.
Узнайте больше о Группе по обучению и поддержке миозита в HSS.
Обновлено: 05.10.2009
Авторы
Линда Лефф, RNC
Медсестра
Отделение инфузионной терапии
Больница специальной хирургии
Текущее лечение миозита
Фармакологическое лечение
Глюкокортикоиды
Несмотря на отсутствие четких данных, полученных в результате рандомизированных контролируемых исследований, лечение ГК остается первым терапевтическим подходом в клинической практике для пациентов с ММВ [4].Лечение способно уменьшить мышечное воспаление [5], и более 60% пациентов показывают улучшение мышечных симптомов при лечении ГК [6].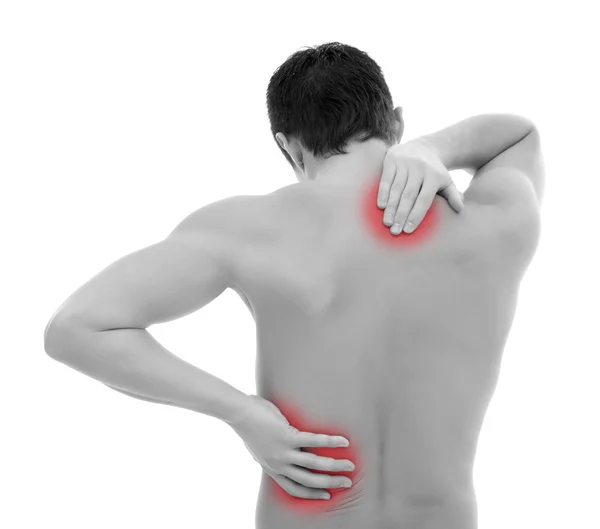 В частности, это происходит в первые 6 месяцев после начала лечения [7]. Высокие дозы ГК также успешно применялись при поражении легких [8].
В частности, это происходит в первые 6 месяцев после начала лечения [7]. Высокие дозы ГК также успешно применялись при поражении легких [8].
При традиционном терапевтическом подходе ГК начинали с преднизона или его эквивалента в дозе 1 мг / кг / день [9]. Более низкая дозировка должна рассматриваться в случае легкой болезни или, при наличии противопоказаний, таких как сахарный диабет, гипертония или глаукома [4], и более высокая дозировка, до 2 мг / кг / день, может быть назначена в отдельных случаях. но не более 80–100 мг / сут [10].У пациентов с тяжелым заболеванием, например, с тяжелым поражением мышц, дисфагией, быстро прогрессирующим интерстициальным заболеванием легких (ILD) или кожными язвами [11], индукционная терапия с внутривенными импульсами метилпреднизолона (500–1000 мг / день в течение трех дней подряд) ) часто рекомендуется [12].
Были предложены различные схемы постепенного снижения дозы ГК, но обычно более высокую дозу следует поддерживать в течение 2–4 недель, а затем постепенно снижать на 20–25% каждый месяц до тех пор, пока не будет достигнута 5–10 мг / день преднизона или эквивалентной дозы [4 , 13]. Во время снижения ГК следует проводить строгое клиническое и лабораторное наблюдение с мониторингом мышечной силы с помощью проверенных методов (например, мануальный мышечный тест 8 (MMT8)) и мышечных ферментов сыворотки [4, 10].
Побочные эффекты (SE) распространены у пациентов, получавших ГК [14], и включают сахарный диабет, системную артериальную гипертензию, дислипидемию, остеопороз, увеличение веса, появление кушингоидов, истончение кожи, непереносимость желудка, изменения настроения, инфекции, гирсутизм, катаракту. , глаукома [15].Некоторые исследования показывают, что импульсные пероральные приемы дексаметазона в качестве индукционной терапии могут иметь такую же эффективность, что и метилпреднизолон, но с меньшим количеством побочных эффектов [16].
Хотя ГК обычно эффективны при лечении IIMs, по крайней мере до некоторой степени, большому количеству пациентов требуется добавление другого иммунодепрессанта при рефрактерном заболевании [6, 17], обострениях болезни и поражении кожи или для уменьшения Накопленная доза ГК. У каждого пациента с недавно начавшимся ММВ назначение иммунодепрессантов следует рассматривать с первой фазы лечения, поскольку раннее лечение связано с лучшим исходом [6].
У каждого пациента с недавно начавшимся ММВ назначение иммунодепрессантов следует рассматривать с первой фазы лечения, поскольку раннее лечение связано с лучшим исходом [6].
Гель адренокортикотропного гормона
Эффекты геля адренокортикотропного гормона (гель АКТГ) изучались в серии ретроспективных случаев [18] и в недавнем открытом исследовании [19 •]. Гель с АКТГ был одобрен еще в 1952 году Управлением по контролю за продуктами и лекарствами США (FDA) для лечения IIMs, но не был одобрен Европейским агентством по лекарственным средствам (EMA). Лечение улучшило мышечную силу и кожную сыпь, со средним улучшением мышечной силы на 19,3%, измеренной с помощью MMT, у 71% пациентов, уменьшением кожного ВАШ на 88% у 4/5 пациентов с кожной сыпью дерматомиозита и позволило уменьшить дозировка ГК [18, 19 •].Гель АКТГ вводили подкожно один или два раза в неделю в течение 12 недель. Несмотря на то, что терапия хорошо переносилась без серьезных побочных эффектов, необходимы дальнейшие исследования для оценки безопасности и эффективности геля АКТГ у пациентов с IIM.
Гидроксихлорохин
Как сообщалось в обсервационных исследованиях, лечение поражения кожи при СД противомалярийными средствами (гидроксихлорохин (HCQ) или хинакрин) в сочетании с ГК с иммуносупрессорами или без них эффективно у 40–75% пациентов [20, 21] и он был включен в недавний консенсус по лечению сыпи у подростков с DM [22].Противомалярийные препараты неэффективны при поражении мышц [20, 21]. Наиболее часто назначаемым противомалярийным средством в повседневной клинической практике является HCQ до 400 мг / день.
Лечение обычно хорошо переносится, но побочные эффекты, хотя и легкие, относительно обычны: кожная сыпь, желудочно-кишечная токсичность (тошнота, рвота, диарея), головокружение и головная боль [23]. Антималярийная ретинопатия представляет собой наиболее серьезное нежелательное явление; Таким образом, Американская академия офтальмологии рекомендует проводить скрининг пациентов на исходном уровне с осмотром глазного дна, а во время лечения каждые 5 лет следует проводить периодическую оценку с помощью автоматизированных полей зрения и / или оптической когерентной томографии [24]. ].Несмотря на то, что распространенность была неизвестна, миопатия (миалгии с повышением мышечных ферментов или миопатия с вакуолями) может иногда возникать во время лечения [25], в то время как парадоксальное ухудшение кожных повреждений отмечается у 30% пациентов с СД. во время лечения [26].
].Несмотря на то, что распространенность была неизвестна, миопатия (миалгии с повышением мышечных ферментов или миопатия с вакуолями) может иногда возникать во время лечения [25], в то время как парадоксальное ухудшение кожных повреждений отмечается у 30% пациентов с СД. во время лечения [26].
Метотрексат
Метотрексат (МТ) вместе с азатиоприном считается препаратом первого выбора для лечения поражения мышц при IIM [4, 10]. Хотя не было опубликовано плацебо-контролируемых исследований, эффективность метотрексата изучалась в открытых исследованиях [27] и в сравнении с другими иммунодепрессантами [28–30].Метотрексат также успешно применялся при лечении кожных проявлений у пациентов с СД [31, 32], хотя с противоречивыми результатами [33].
Рандомизированное открытое исследование по оценке эффективности и безопасности метотрексата в сочетании с ГК по сравнению с одними ГК продолжается [34]. Метотрексат можно вводить перорально, подкожно или внутримышечно в дозе до 20-25 мг / нед. После введения метотрексата следует адекватное введение фолиевой / фолиновой кислоты для уменьшения побочных эффектов и отмены пациентом метотрексата [35].Применение метотрексата во время беременности противопоказано женщинам из-за тератогенного действия [36].
Наиболее частыми нежелательными явлениями (НЯ) метотрексата являются инфекции, гепатотоксичность (повышение уровня печеночных ферментов и цирроз), а также изменения количества клеток крови, а у пациентов, принимающих метотрексат, следует регулярно проверять уровень трансаминаз и общий анализ крови [36]. Метотрексат следует осторожно назначать людям с нарушением функции почек, а также пациентам, принимающим нестероидные противовоспалительные препараты.Легочная токсичность у пациентов, получавших метотрексат, представляет собой серьезный и непредсказуемый побочный эффект [37]; таким образом, другие иммунодепрессанты обычно рекомендуются в качестве терапии первой линии в комбинации с ГК у пациентов с ИБЗ, связанной с IIM [38].
Азатиоприн
Азатиоприн (AZA) представляет собой аналог пурина и действует как антиметаболит, блокируя пурин и метаболизм, а также синтез РНК и ДНК. Эффект АЗА по сохранению ГК изучался в рандомизированном плацебо-контролируемом исследовании у пациентов с ПМ.Хотя комбинированная терапия не превосходила только GC через 12 недель, после трехлетнего продления, комбинация GC с AZA позволила снизить суточную дозу преднизона и была связана с лучшим функциональным результатом [39, 40]. Даже если достоверность доказательств очень низкая, AZA также продемонстрировал эффективность в ретроспективных сериях случаев для лечения IIM-ILD [41] и может рассматриваться при лечении пациентов с высоким риском развития связанного с метотрексатом повреждения легких. Даже если непосредственных испытаний не проводилось, AZA имеет аналогичную эффективность по сравнению с метотрексатом [6, 42], а также выживаемость пациентов, получавших AZA, похоже или лучше [43] по сравнению с пациентами, получавшими метотрексат. хотя нельзя исключить смешение по показаниям.
хотя нельзя исключить смешение по показаниям.
AZA обычно вводят перорально, начиная с 50 мг / день и с последующим постепенным увеличением на 25-50 мг каждые 1-2 недели до 2 мг / кг / день [4, 10]. У пациентов, получающих АЗА, следует регулярно проверять общий анализ крови, ферменты печени и функцию почек.
Общие SE включают рвоту, токсичность для печени и подавление костного мозга [44]. Последний SE особенно часто встречается у людей с генетическим дефицитом фермента тиопурин-S-метилтрансферазы, который может быть генотипирован до назначения AZA [44].Хотя официально АЗА противопоказан во время беременности, существенные данные подтверждают безопасность препарата во время беременности [45]. Среди лекарственных взаимодействий особое внимание следует уделять недопущению одновременного лечения аллопуринолом [44].
У пациентов, которые не ответили только на метотрексат или аза, можно рассмотреть комбинацию этих двух агентов, и до 53% рефрактерных пациентов улучшили свою мышечную силу и способность выполнять повседневную деятельность с лишь незначительными побочными эффектами [30 ].
Ингибиторы кальциневрина
Циклоспорин-A (CYA) и такролимус (TAC) являются ингибиторами кальциневрина (CNI), и их основными эффектами являются ингибирование активации Т-клеток и снижение активности генов, кодирующих IL-2 и родственные цитокины. Поскольку Т-клетки играют важную роль в патогенезе миозита [1] и IIM-ILD [46], обоснованность использования CNI у пациентов с IIM высока.
Помимо улучшения мышечного поражения, лечение CNI было связано с лучшими респираторными исходами у пациентов с СД, ПМ и ИЛЗ, что позволило улучшить как тесты функции легких (PFT), так и компьютерную томографию высокого разрешения ( HRCT) [47–50], особенно если его начать на ранней стадии заболевания [51].Положительность аутоантител против аминоацил-тРНК синтетазы (анти-ARS), по-видимому, связана с хорошим действием CNI [49, 52, 53]. Никаких существенных различий между CYA и MTX в отношении поражения мышц не выявлено, когда они сравнивались в исследовании [29].
CYA обычно вводят перорально от 2 до 4 мг / кг / день, разделенных на две суточные дозы [47]. Первоначально прием ТАС можно начинать с дозы 1 мг два раза в день с титрованием 1-2 мг / день до достижения целевого уровня в крови 5-20 нг / мл [49].Уровни обоих препаратов в сыворотке крови следует тщательно контролировать, чтобы поддерживать терапевтический диапазон и избегать серьезных побочных эффектов [49, 51].
Первоначально прием ТАС можно начинать с дозы 1 мг два раза в день с титрованием 1-2 мг / день до достижения целевого уровня в крови 5-20 нг / мл [49].Уровни обоих препаратов в сыворотке крови следует тщательно контролировать, чтобы поддерживать терапевтический диапазон и избегать серьезных побочных эффектов [49, 51].
Риск токсичности при лечении CNI включает нефротоксичность, гепатотоксичность, гипертензию, гипертрихоз, гиперплазию десен, головную боль, и этот риск увеличивается с увеличением доз препаратов [54]. Креатинин сыворотки, ферменты печени, общий анализ крови и артериальное давление следует повторно оценивать во время лечения, особенно в первые 3 месяца [54].Поскольку CYA и TAC влияют на цитохром P 3A4 (CYP3A4), важна осведомленность о потенциальных лекарственных взаимодействиях, и перед началом лечения CYA и TAC следует проводить тщательную проверку других лекарств [54, 55]. Кроме того, грейпфрутовый сок может влиять на метаболизм CYP3A4 [55].
Микофенолят мофетил
Микофенолятмофетил (MMF) — это пролекарство, которое ингибирует пролиферацию Т- и В-клеток, снижая синтез гуанозиновых нуклеотидов. Об эффективности MMF у пациентов с IIM сообщалось в небольших сериях случаев [56, 57] и в открытом исследовании в сочетании с внутривенными иммуноглобулинами [58].
Об эффективности MMF у пациентов с IIM сообщалось в небольших сериях случаев [56, 57] и в открытом исследовании в сочетании с внутривенными иммуноглобулинами [58].
MMF, по-видимому, эффективен при лечении кожных проявлений у пациентов с СД [59]. Интересно, что хороший ответ на MMF был также зарегистрирован у пациентов с IIM-ILD, даже с быстро прогрессирующими ILD [60]. После лечения MMF было зарегистрировано улучшение респираторных симптомов, PFT и диффузионной способности легких по монооксиду углерода (DLCO) [61, 62].
MMF вводят перорально, начиная с 500 мг два раза в день до 2-3 г суточной дозы, преломленной за два приема в день [4].ММФ обычно хорошо переносится, но могут возникать желудочно-кишечные симптомы (тошнота, рвота и диарея) и отклонения в количестве клеток крови, включая тяжелую нейтропению. Пациентов следует контролировать с помощью общего анализа крови, ферментов печени и функции почек. Сообщается о более высокой восприимчивости к оппортунистическим инфекциям, также тяжелым [57]. Лечение ММФ не рекомендуется во время беременности [45].
Лечение ММФ не рекомендуется во время беременности [45].
Циклофосфамид
Циклофосфамид (CYC), разработанный в качестве противоопухолевой химиотерапии, использовался для лечения тяжелых проявлений ревматических заболеваний, в частности, у пациентов с прогрессирующими ВЗЛ.У пациентов с IIM использование CYC описано в серии отдельных случаев. Использование этого препарата в основном предназначалось для пациентов с тяжелыми или прогрессирующими ВЗЛ, и сообщалось, что он уменьшает респираторные симптомы, позволяя улучшить КТГ грудной клетки и улучшить ПФП [63–65]. Комбинированная терапия CYA и CYC может быть многообещающим методом лечения быстро прогрессирующей ILD при СД [66], даже если результаты могут быть неудовлетворительными для некоторых пациентов [67]. Также сообщалось, что комбинированная терапия ритуксимабом может быть полезной у пациентов с тяжелой формой ILD с аутоантителами против MDA5 [68].Сообщается, что даже если его обычно применяют для лечения поражения легких, он эффективен также при мышечных симптомах, позволяя улучшить мышечную силу и снизить уровень мышечных ферментов в сыворотке крови [65].
В медицинской литературе сообщалось о различных протоколах лечения без явного преимущества одной терапевтической схемы по сравнению с другими, а оптимальная доза и продолжительность еще не определены. Чаще всего применялся терапевтический подход с использованием в / в импульсов (0.3–1 г / м 2 или 10–30 мг / кг, применяемые еженедельно или ежемесячно в течение 6–12 месяцев) [65], но также может быть назначено пероральное введение [69]. Недавно был предложен подход с более низкими дозировками, как при волчаночном нефрите (500 мг каждые две недели до 12 введений) с хорошей эффективностью и без серьезных побочных эффектов [70].
Лечение CYC ограничено потенциально тяжелыми побочными эффектами, такими как миелосупрессия (нейтропения), гепатотоксичность, почечная токсичность, геморрагический цистит, инфекции, необратимая недостаточность яичников, приводящая к бесплодию, и вторичные злокачественные новообразования [71].Побочные эффекты на почки и мочевыводящие пути могут быть уменьшены с помощью агрессивной гидратации с форсированным диурезом и премедикации 2-меркаптоэтансульфонатом натрия (MESNA). Во время лечения обязательно тщательный контроль количества клеток крови, функции печени и почек. CYC противопоказан при беременности [45].
Во время лечения обязательно тщательный контроль количества клеток крови, функции печени и почек. CYC противопоказан при беременности [45].
Внутривенные иммуноглобулины
Внутривенные иммуноглобулины (ВВИГ) — это препараты, полученные из объединенных препаратов IgG от тысяч доноров и содержащие антитела, направленные против широкого круга патогенов, а также против множества чужеродных и аутоантигенов [72].Несмотря на то, что механизм действия лечения еще не известен, он, вероятно, включает различные специфические для заболевания пути, участвующие в производстве и поддержании воспаления и аутоиммунных процессов [72], и считается иммуномодулирующим, а не иммунодепрессивным средством [4].
Об эффективности лечения сообщалось в двух небольших двойных слепых контролируемых исследованиях с участием пациентов с СД [73, 74] и в проспективных открытых исследованиях [58, 75, 76]. ВВИГ продемонстрировал эффект на поражение мышечной ткани и поражение кожи при СД [77] и был протестирован также при лечении ВЗЛ у рефрактерных пациентов [78, 79]. Дисфагия может поддаваться лечению ВВИГ [80], также у пациентов с ИБГ, которые в остальном резистентны к лечению [81, 82]. Имеются также отрицательные сообщения об эффекте ВВИГ у пациентов с ММВ [83 ••], поскольку в одном исследовании, включавшем повторные биопсии мышц, не было значительного положительного воздействия на работоспособность мышц или на воспаление в мышечной ткани [84]. К сожалению, у нас отсутствуют биомаркеры, которые могут предсказать ответ на лечение высокими дозами ВВИГ, но к такой подгруппе могут относиться пациенты с антителами против HMGCR [85 •].
Дисфагия может поддаваться лечению ВВИГ [80], также у пациентов с ИБГ, которые в остальном резистентны к лечению [81, 82]. Имеются также отрицательные сообщения об эффекте ВВИГ у пациентов с ММВ [83 ••], поскольку в одном исследовании, включавшем повторные биопсии мышц, не было значительного положительного воздействия на работоспособность мышц или на воспаление в мышечной ткани [84]. К сожалению, у нас отсутствуют биомаркеры, которые могут предсказать ответ на лечение высокими дозами ВВИГ, но к такой подгруппе могут относиться пациенты с антителами против HMGCR [85 •].
Как было впервые предложено Imbach et al., Терапевтическая доза ВВИГ была эмпирически установлена на уровне 2 г / кг / мес за три-пять введений с рефракцией [86]. Количество терапевтических циклов может варьироваться в зависимости от тяжести заболевания / реакции на лечение. ВВИГ можно сочетать также с иммунодепрессантами [58, 87]. Недавно сообщалось, что подкожный иммуноглобулин (SCIG), еженедельно вводимый самостоятельно с помощью программируемой помпы, является ценной альтернативой IVIG при миозите.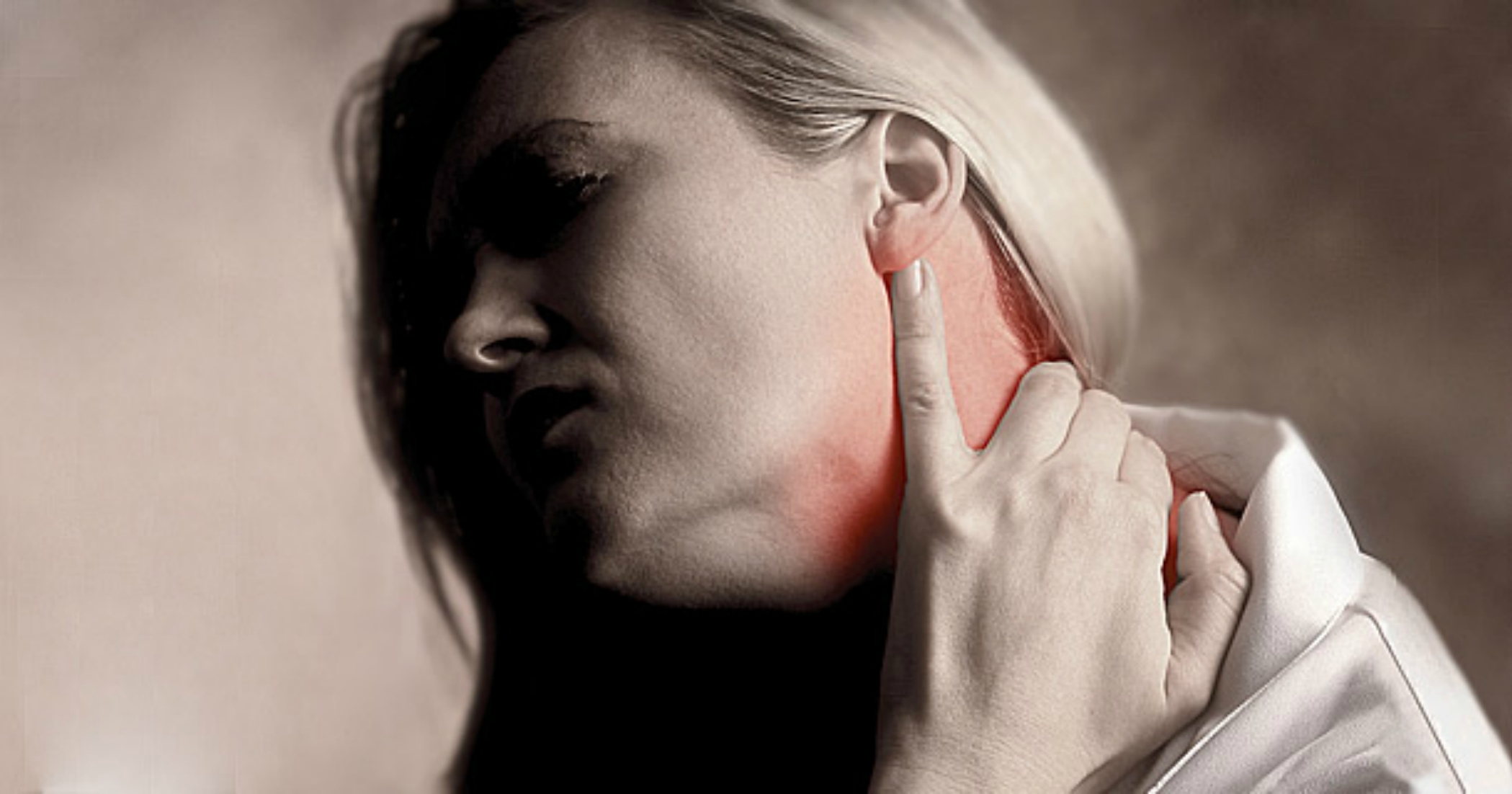 Это лечение представляется безопасной и эффективной альтернативой внутривенным иммуноглобулинам в условиях стационара с меньшим снижением качества жизни пациентов [88, 89 •].
Это лечение представляется безопасной и эффективной альтернативой внутривенным иммуноглобулинам в условиях стационара с меньшим снижением качества жизни пациентов [88, 89 •].
ВВИГ считается относительно безопасной терапией. О нежелательных явлениях сообщается в 5–15% инфузий, и в большинстве случаев они легкие и преходящие с головными болями, лихорадкой, ознобом и миалгиями. Использование высоких доз ВВИГ у пациентов с ММВ было неофициально связано с застойной сердечной недостаточностью, синдромом повышенной вязкости, гемолитической анемией и острым повреждением легких, связанным с переливанием крови.Сообщалось об анафилаксии у пациентов с дефицитом IgA. ВВИГ может представлять потенциальный риск передачи неопределяемых инфекций через кровь [83 ••]. ВВИГ считается безопасным для пациентов с инфекциями [10] и неоплазией [90], где иммуносупрессивный подход может быть опасным. Несмотря на то, что в литературе имеется мало данных, ВВИГ можно использовать во время беременности [83]. Основным ограничением использования ВВИГ является их чрезвычайно высокая стоимость, что позволяет использовать их в основном у отдельных пациентов с тяжелой / рефрактерной формой.
Biologics
Ритуксимаб
Ритуксимаб (RTX) представляет собой химерное моноклональное антитело против белка CD20, в основном экспрессирующееся на поверхности В-клеток. Начиная с 2005 г., несколько отчетов о случаях, серий случаев, открытых исследований [91, 92] и отчетов регистратур [93] свидетельствовали о положительном эффекте лечения RTX у пациентов с IIM. Совсем недавно было опубликовано одно рандомизированное контролируемое исследование [94]. До настоящего времени были опубликованы данные более чем 450 рефрактерных пациентов с IIM, получавших RTX, со средней частотой ответа 78.3% [95].
В крупном РКИ, испытании ритуксимаба при миозите (RIM), включающем случаи заболевания как у подростков, так и у взрослых, не удалось достичь первичной конечной точки эффективности [94]. Однако RTX смог снизить клиническую активность и продемонстрировал важный эффект экономии стероидов. В ретроспективном анализе пациенты с антителами против Jo1 или против Mi2 достигли значительного улучшения [96]. В открытом исследовании, проведенном с участием 12 пациентов с положительными антителами к АРС, RTX был эффективен при поражении легких и мышц [97].RTX был определен как наиболее часто используемый биологический препарат при лечении IIM [98 •]. Основные показания для лечения RTX при IIM включают рефрактерное поражение мышц, легких [97, 99], кожи [100 •] или суставов [10]. Пациенты с миозит-специфическими аутоантителами (MSA), по-видимому, лучше реагируют на лечение, особенно пациенты с положительной реакцией на ARS [96, 97, 99], анти-SRP [94, 101] и антитела к Mi-2 [ 96]. Уровни аутоантител против Jo1 и Mi2 снижались после истощения В-клеток и коррелировали со снижением активности заболевания [102].
В ретроспективном анализе пациенты с антителами против Jo1 или против Mi2 достигли значительного улучшения [96]. В открытом исследовании, проведенном с участием 12 пациентов с положительными антителами к АРС, RTX был эффективен при поражении легких и мышц [97].RTX был определен как наиболее часто используемый биологический препарат при лечении IIM [98 •]. Основные показания для лечения RTX при IIM включают рефрактерное поражение мышц, легких [97, 99], кожи [100 •] или суставов [10]. Пациенты с миозит-специфическими аутоантителами (MSA), по-видимому, лучше реагируют на лечение, особенно пациенты с положительной реакцией на ARS [96, 97, 99], анти-SRP [94, 101] и антитела к Mi-2 [ 96]. Уровни аутоантител против Jo1 и Mi2 снижались после истощения В-клеток и коррелировали со снижением активности заболевания [102].
RTX обычно назначают с двумя инфузиями по 1 г с интервалом 2 недели и могут быть повторены через 6 месяцев. Другие предложенные терапевтические схемы были 375 мг / м 2 еженедельно в течение четырех недель подряд. Клиническое значение периодического мониторинга периферических CD-20-положительных В-клеток еще не выяснено.
Клиническое значение периодического мониторинга периферических CD-20-положительных В-клеток еще не выяснено.
Ритуксимаб обычно хорошо переносится, но НЯ встречаются относительно часто. Инфузионные реакции, также тяжелые, являются наиболее частыми НЯ, связанными с лечением RTX; они возникают в основном во время первой инфузии, и их частота снизилась у пациентов, получавших премедикацию внутривенными ГК, жаропонижающими и антигистаминными препаратами [103].Из-за возможного кардиотоксического эффекта рекомендуется сердечный мониторинг во время и после инфузий RTX пациентам с ишемической болезнью сердца в анамнезе [103]. Инфекции во время лечения относительно распространены, включая вирусные и бактериальные инфекции [95], и перед лечением рекомендуется вакцинация от пневмококка и гриппа [104].
Другие биопрепараты
В последние годы различные биотехнологические препараты были протестированы для лечения IIM, но количество пролеченных пациентов невелико, и их использование может быть предложено только тогда, когда другие методы лечения неэффективны.
Абатацепт, гибридный белок, который препятствует иммунной активности Т-клеток, эффективно использовался в отдельных сообщениях о случаях [105]. Недавно небольшое рандомизированное открытое исследование показало возможное влияние внутривенных инфузий абатацепта на мышечную слабость при лечении. резистентные пациенты с ПМ или СД [106 ••]. Несколько испытаний, оценивающих влияние абатацепта при лечении IIM, продолжаются [107].
Хотя фактор некроза опухоли (TNF) может играть роль в патогенезе IIM, лечение пациентов IIM анти-TNFα дало противоречивые результаты.Даже если некоторые авторы сообщили о возможной роли этанерцепта как стероидсберегающего средства при СД [108], другие исследования не подтвердили это наблюдение, и у некоторых пациентов состояние ухудшилось [109]. Несмотря на то, что недавнее рандомизированное контролируемое исследование показало эффективность инфликсимаба (IFX) у некоторых пациентов [110 •], большинство клинических данных были обескураживающими [111, 112].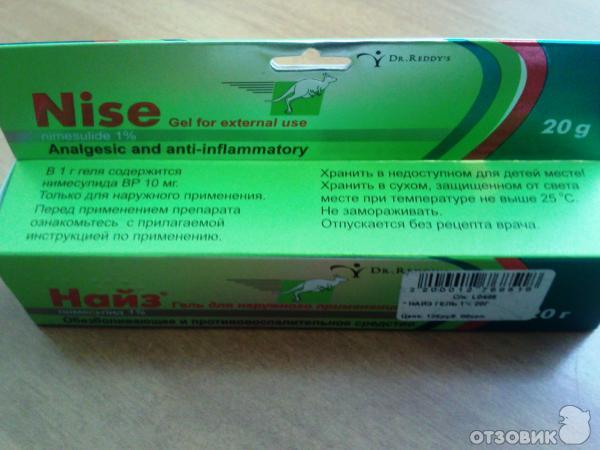 Более того, некоторые авторы сообщили, что терапия анти-TNF-альфа может вызывать миозит у пациентов с ревматоидным артритом, псориатическим артритом и псориазом [113, 114]. Таким образом, блокаторы TNF обычно не рекомендуются взрослым пациентам с IIM, и их следует использовать только тогда, когда другие методы лечения неэффективны.
Более того, некоторые авторы сообщили, что терапия анти-TNF-альфа может вызывать миозит у пациентов с ревматоидным артритом, псориатическим артритом и псориазом [113, 114]. Таким образом, блокаторы TNF обычно не рекомендуются взрослым пациентам с IIM, и их следует использовать только тогда, когда другие методы лечения неэффективны.
Поскольку сообщалось, что интерлейкин (ИЛ) -6 коррелирует с активностью миозита, тоцилизумаб был протестирован с многообещающими результатами в двух описаниях клинических случаев [115, 116]. Испытания, изучающие эффективность тоцилизумаба у пациентов с IIM, продолжаются (Clinicaltrials.gov, {«type»: «клиническое испытание», «attrs»: {«text»: «NCT02043548», «term_id»: «NCT02043548»}} NCT02043548).
Anakinra, антагонист рецептора IL-1, был протестирован в описаниях клинических случаев [117] и в небольшой серии случаев [118], с положительными результатами у некоторых пациентов.
Другие препараты, такие как алемтузумаб [119, 120], сифалимумаб [121], базиликсимаб [122] и тофацитиниб [123], исследуются для лечения IIM, но их использование в повседневной клинической практике не рекомендуется.
Текущее лечение миозита
Фармакологическое лечение
Глюкокортикоиды
Несмотря на отсутствие четких данных, полученных в результате рандомизированных контролируемых исследований, лечение ГК остается первым терапевтическим подходом в клинической практике для пациентов с ММВ [4].Лечение способно уменьшить мышечное воспаление [5], и более 60% пациентов показывают улучшение мышечных симптомов при лечении ГК [6]. В частности, это происходит в первые 6 месяцев после начала лечения [7]. Высокие дозы ГК также успешно применялись при поражении легких [8].
При традиционном терапевтическом подходе ГК начинали с преднизона или его эквивалента в дозе 1 мг / кг / день [9]. Более низкая дозировка должна рассматриваться в случае легкой болезни или, при наличии противопоказаний, таких как сахарный диабет, гипертония или глаукома [4], и более высокая дозировка, до 2 мг / кг / день, может быть назначена в отдельных случаях. но не более 80–100 мг / сут [10].У пациентов с тяжелым заболеванием, например, с тяжелым поражением мышц, дисфагией, быстро прогрессирующим интерстициальным заболеванием легких (ILD) или кожными язвами [11], индукционная терапия с внутривенными импульсами метилпреднизолона (500–1000 мг / день в течение трех дней подряд) ) часто рекомендуется [12].
Были предложены различные схемы постепенного снижения дозы ГК, но обычно более высокую дозу следует поддерживать в течение 2–4 недель, а затем постепенно снижать на 20–25% каждый месяц до тех пор, пока не будет достигнута 5–10 мг / день преднизона или эквивалентной дозы [4 , 13].Во время снижения ГК следует проводить строгое клиническое и лабораторное наблюдение с мониторингом мышечной силы с помощью проверенных методов (например, мануальный мышечный тест 8 (MMT8)) и мышечных ферментов сыворотки [4, 10].
Побочные эффекты (SE) распространены у пациентов, получавших ГК [14], и включают сахарный диабет, системную артериальную гипертензию, дислипидемию, остеопороз, увеличение веса, появление кушингоидов, истончение кожи, непереносимость желудка, изменения настроения, инфекции, гирсутизм, катаракту. , глаукома [15].Некоторые исследования показывают, что импульсные пероральные приемы дексаметазона в качестве индукционной терапии могут иметь такую же эффективность, что и метилпреднизолон, но с меньшим количеством побочных эффектов [16].
Хотя ГК обычно эффективны при лечении IIMs, по крайней мере до некоторой степени, большому количеству пациентов требуется добавление другого иммунодепрессанта при рефрактерном заболевании [6, 17], обострениях болезни и поражении кожи или для уменьшения Накопленная доза ГК. У каждого пациента с недавно начавшимся ММВ назначение иммунодепрессантов следует рассматривать с первой фазы лечения, поскольку раннее лечение связано с лучшим исходом [6].
Гель адренокортикотропного гормона
Эффекты геля адренокортикотропного гормона (гель АКТГ) изучались в серии ретроспективных случаев [18] и в недавнем открытом исследовании [19 •]. Гель с АКТГ был одобрен еще в 1952 году Управлением по контролю за продуктами и лекарствами США (FDA) для лечения IIMs, но не был одобрен Европейским агентством по лекарственным средствам (EMA). Лечение улучшило мышечную силу и кожную сыпь, со средним улучшением мышечной силы на 19,3%, измеренной с помощью MMT, у 71% пациентов, уменьшением кожного ВАШ на 88% у 4/5 пациентов с кожной сыпью дерматомиозита и позволило уменьшить дозировка ГК [18, 19 •]. Гель АКТГ вводили подкожно один или два раза в неделю в течение 12 недель. Несмотря на то, что терапия хорошо переносилась без серьезных побочных эффектов, необходимы дальнейшие исследования для оценки безопасности и эффективности геля АКТГ у пациентов с IIM.
Гель АКТГ вводили подкожно один или два раза в неделю в течение 12 недель. Несмотря на то, что терапия хорошо переносилась без серьезных побочных эффектов, необходимы дальнейшие исследования для оценки безопасности и эффективности геля АКТГ у пациентов с IIM.
Гидроксихлорохин
Как сообщалось в обсервационных исследованиях, лечение поражения кожи при СД противомалярийными средствами (гидроксихлорохин (HCQ) или хинакрин) в сочетании с ГК с иммуносупрессорами или без них эффективно у 40–75% пациентов [20, 21] и он был включен в недавний консенсус по лечению сыпи у подростков с DM [22].Противомалярийные препараты неэффективны при поражении мышц [20, 21]. Наиболее часто назначаемым противомалярийным средством в повседневной клинической практике является HCQ до 400 мг / день.
Лечение обычно хорошо переносится, но побочные эффекты, хотя и легкие, относительно обычны: кожная сыпь, желудочно-кишечная токсичность (тошнота, рвота, диарея), головокружение и головная боль [23]. Антималярийная ретинопатия представляет собой наиболее серьезное нежелательное явление; Таким образом, Американская академия офтальмологии рекомендует проводить скрининг пациентов на исходном уровне с осмотром глазного дна, а во время лечения каждые 5 лет следует проводить периодическую оценку с помощью автоматизированных полей зрения и / или оптической когерентной томографии [24]. ].Несмотря на то, что распространенность была неизвестна, миопатия (миалгии с повышением мышечных ферментов или миопатия с вакуолями) может иногда возникать во время лечения [25], в то время как парадоксальное ухудшение кожных повреждений отмечается у 30% пациентов с СД. во время лечения [26].
Антималярийная ретинопатия представляет собой наиболее серьезное нежелательное явление; Таким образом, Американская академия офтальмологии рекомендует проводить скрининг пациентов на исходном уровне с осмотром глазного дна, а во время лечения каждые 5 лет следует проводить периодическую оценку с помощью автоматизированных полей зрения и / или оптической когерентной томографии [24]. ].Несмотря на то, что распространенность была неизвестна, миопатия (миалгии с повышением мышечных ферментов или миопатия с вакуолями) может иногда возникать во время лечения [25], в то время как парадоксальное ухудшение кожных повреждений отмечается у 30% пациентов с СД. во время лечения [26].
Метотрексат
Метотрексат (МТ) вместе с азатиоприном считается препаратом первого выбора для лечения поражения мышц при IIM [4, 10]. Хотя не было опубликовано плацебо-контролируемых исследований, эффективность метотрексата изучалась в открытых исследованиях [27] и в сравнении с другими иммунодепрессантами [28–30]. Метотрексат также успешно применялся при лечении кожных проявлений у пациентов с СД [31, 32], хотя с противоречивыми результатами [33].
Метотрексат также успешно применялся при лечении кожных проявлений у пациентов с СД [31, 32], хотя с противоречивыми результатами [33].
Рандомизированное открытое исследование по оценке эффективности и безопасности метотрексата в сочетании с ГК по сравнению с одними ГК продолжается [34]. Метотрексат можно вводить перорально, подкожно или внутримышечно в дозе до 20-25 мг / нед. После введения метотрексата следует адекватное введение фолиевой / фолиновой кислоты для уменьшения побочных эффектов и отмены пациентом метотрексата [35].Применение метотрексата во время беременности противопоказано женщинам из-за тератогенного действия [36].
Наиболее частыми нежелательными явлениями (НЯ) метотрексата являются инфекции, гепатотоксичность (повышение уровня печеночных ферментов и цирроз), а также изменения количества клеток крови, а у пациентов, принимающих метотрексат, следует регулярно проверять уровень трансаминаз и общий анализ крови [36]. Метотрексат следует осторожно назначать людям с нарушением функции почек, а также пациентам, принимающим нестероидные противовоспалительные препараты.Легочная токсичность у пациентов, получавших метотрексат, представляет собой серьезный и непредсказуемый побочный эффект [37]; таким образом, другие иммунодепрессанты обычно рекомендуются в качестве терапии первой линии в комбинации с ГК у пациентов с ИБЗ, связанной с IIM [38].
Азатиоприн
Азатиоприн (AZA) представляет собой аналог пурина и действует как антиметаболит, блокируя пурин и метаболизм, а также синтез РНК и ДНК. Эффект АЗА по сохранению ГК изучался в рандомизированном плацебо-контролируемом исследовании у пациентов с ПМ.Хотя комбинированная терапия не превосходила только GC через 12 недель, после трехлетнего продления, комбинация GC с AZA позволила снизить суточную дозу преднизона и была связана с лучшим функциональным результатом [39, 40]. Даже если достоверность доказательств очень низкая, AZA также продемонстрировал эффективность в ретроспективных сериях случаев для лечения IIM-ILD [41] и может рассматриваться при лечении пациентов с высоким риском развития связанного с метотрексатом повреждения легких. Даже если непосредственных испытаний не проводилось, AZA имеет аналогичную эффективность по сравнению с метотрексатом [6, 42], а также выживаемость пациентов, получавших AZA, похоже или лучше [43] по сравнению с пациентами, получавшими метотрексат. хотя нельзя исключить смешение по показаниям.
AZA обычно вводят перорально, начиная с 50 мг / день и с последующим постепенным увеличением на 25-50 мг каждые 1-2 недели до 2 мг / кг / день [4, 10]. У пациентов, получающих АЗА, следует регулярно проверять общий анализ крови, ферменты печени и функцию почек.
Общие SE включают рвоту, токсичность для печени и подавление костного мозга [44]. Последний SE особенно часто встречается у людей с генетическим дефицитом фермента тиопурин-S-метилтрансферазы, который может быть генотипирован до назначения AZA [44].Хотя официально АЗА противопоказан во время беременности, существенные данные подтверждают безопасность препарата во время беременности [45]. Среди лекарственных взаимодействий особое внимание следует уделять недопущению одновременного лечения аллопуринолом [44].
У пациентов, которые не ответили только на метотрексат или аза, можно рассмотреть комбинацию этих двух агентов, и до 53% рефрактерных пациентов улучшили свою мышечную силу и способность выполнять повседневную деятельность с лишь незначительными побочными эффектами [30 ].
Ингибиторы кальциневрина
Циклоспорин-A (CYA) и такролимус (TAC) являются ингибиторами кальциневрина (CNI), и их основными эффектами являются ингибирование активации Т-клеток и снижение активности генов, кодирующих IL-2 и родственные цитокины. Поскольку Т-клетки играют важную роль в патогенезе миозита [1] и IIM-ILD [46], обоснованность использования CNI у пациентов с IIM высока.
Помимо улучшения мышечного поражения, лечение CNI было связано с лучшими респираторными исходами у пациентов с СД, ПМ и ИЛЗ, что позволило улучшить как тесты функции легких (PFT), так и компьютерную томографию высокого разрешения ( HRCT) [47–50], особенно если его начать на ранней стадии заболевания [51].Положительность аутоантител против аминоацил-тРНК синтетазы (анти-ARS), по-видимому, связана с хорошим действием CNI [49, 52, 53]. Никаких существенных различий между CYA и MTX в отношении поражения мышц не выявлено, когда они сравнивались в исследовании [29].
CYA обычно вводят перорально от 2 до 4 мг / кг / день, разделенных на две суточные дозы [47]. Первоначально прием ТАС можно начинать с дозы 1 мг два раза в день с титрованием 1-2 мг / день до достижения целевого уровня в крови 5-20 нг / мл [49].Уровни обоих препаратов в сыворотке крови следует тщательно контролировать, чтобы поддерживать терапевтический диапазон и избегать серьезных побочных эффектов [49, 51].
Риск токсичности при лечении CNI включает нефротоксичность, гепатотоксичность, гипертензию, гипертрихоз, гиперплазию десен, головную боль, и этот риск увеличивается с увеличением доз препаратов [54]. Креатинин сыворотки, ферменты печени, общий анализ крови и артериальное давление следует повторно оценивать во время лечения, особенно в первые 3 месяца [54].Поскольку CYA и TAC влияют на цитохром P 3A4 (CYP3A4), важна осведомленность о потенциальных лекарственных взаимодействиях, и перед началом лечения CYA и TAC следует проводить тщательную проверку других лекарств [54, 55]. Кроме того, грейпфрутовый сок может влиять на метаболизм CYP3A4 [55].
Микофенолят мофетил
Микофенолятмофетил (MMF) — это пролекарство, которое ингибирует пролиферацию Т- и В-клеток, снижая синтез гуанозиновых нуклеотидов. Об эффективности MMF у пациентов с IIM сообщалось в небольших сериях случаев [56, 57] и в открытом исследовании в сочетании с внутривенными иммуноглобулинами [58].
MMF, по-видимому, эффективен при лечении кожных проявлений у пациентов с СД [59]. Интересно, что хороший ответ на MMF был также зарегистрирован у пациентов с IIM-ILD, даже с быстро прогрессирующими ILD [60]. После лечения MMF было зарегистрировано улучшение респираторных симптомов, PFT и диффузионной способности легких по монооксиду углерода (DLCO) [61, 62].
MMF вводят перорально, начиная с 500 мг два раза в день до 2-3 г суточной дозы, преломленной за два приема в день [4].ММФ обычно хорошо переносится, но могут возникать желудочно-кишечные симптомы (тошнота, рвота и диарея) и отклонения в количестве клеток крови, включая тяжелую нейтропению. Пациентов следует контролировать с помощью общего анализа крови, ферментов печени и функции почек. Сообщается о более высокой восприимчивости к оппортунистическим инфекциям, также тяжелым [57]. Лечение ММФ не рекомендуется во время беременности [45].
Циклофосфамид
Циклофосфамид (CYC), разработанный в качестве противоопухолевой химиотерапии, использовался для лечения тяжелых проявлений ревматических заболеваний, в частности, у пациентов с прогрессирующими ВЗЛ.У пациентов с IIM использование CYC описано в серии отдельных случаев. Использование этого препарата в основном предназначалось для пациентов с тяжелыми или прогрессирующими ВЗЛ, и сообщалось, что он уменьшает респираторные симптомы, позволяя улучшить КТГ грудной клетки и улучшить ПФП [63–65]. Комбинированная терапия CYA и CYC может быть многообещающим методом лечения быстро прогрессирующей ILD при СД [66], даже если результаты могут быть неудовлетворительными для некоторых пациентов [67]. Также сообщалось, что комбинированная терапия ритуксимабом может быть полезной у пациентов с тяжелой формой ILD с аутоантителами против MDA5 [68].Сообщается, что даже если его обычно применяют для лечения поражения легких, он эффективен также при мышечных симптомах, позволяя улучшить мышечную силу и снизить уровень мышечных ферментов в сыворотке крови [65].
В медицинской литературе сообщалось о различных протоколах лечения без явного преимущества одной терапевтической схемы по сравнению с другими, а оптимальная доза и продолжительность еще не определены. Чаще всего применялся терапевтический подход с использованием в / в импульсов (0.3–1 г / м 2 или 10–30 мг / кг, применяемые еженедельно или ежемесячно в течение 6–12 месяцев) [65], но также может быть назначено пероральное введение [69]. Недавно был предложен подход с более низкими дозировками, как при волчаночном нефрите (500 мг каждые две недели до 12 введений) с хорошей эффективностью и без серьезных побочных эффектов [70].
Лечение CYC ограничено потенциально тяжелыми побочными эффектами, такими как миелосупрессия (нейтропения), гепатотоксичность, почечная токсичность, геморрагический цистит, инфекции, необратимая недостаточность яичников, приводящая к бесплодию, и вторичные злокачественные новообразования [71].Побочные эффекты на почки и мочевыводящие пути могут быть уменьшены с помощью агрессивной гидратации с форсированным диурезом и премедикации 2-меркаптоэтансульфонатом натрия (MESNA). Во время лечения обязательно тщательный контроль количества клеток крови, функции печени и почек. CYC противопоказан при беременности [45].
Внутривенные иммуноглобулины
Внутривенные иммуноглобулины (ВВИГ) — это препараты, полученные из объединенных препаратов IgG от тысяч доноров и содержащие антитела, направленные против широкого круга патогенов, а также против множества чужеродных и аутоантигенов [72].Несмотря на то, что механизм действия лечения еще не известен, он, вероятно, включает различные специфические для заболевания пути, участвующие в производстве и поддержании воспаления и аутоиммунных процессов [72], и считается иммуномодулирующим, а не иммунодепрессивным средством [4].
Об эффективности лечения сообщалось в двух небольших двойных слепых контролируемых исследованиях с участием пациентов с СД [73, 74] и в проспективных открытых исследованиях [58, 75, 76]. ВВИГ продемонстрировал эффект на поражение мышечной ткани и поражение кожи при СД [77] и был протестирован также при лечении ВЗЛ у рефрактерных пациентов [78, 79].Дисфагия может поддаваться лечению ВВИГ [80], также у пациентов с ИБГ, которые в остальном резистентны к лечению [81, 82]. Имеются также отрицательные сообщения об эффекте ВВИГ у пациентов с ММВ [83 ••], поскольку в одном исследовании, включавшем повторные биопсии мышц, не было значительного положительного воздействия на работоспособность мышц или на воспаление в мышечной ткани [84]. К сожалению, у нас отсутствуют биомаркеры, которые могут предсказать ответ на лечение высокими дозами ВВИГ, но к такой подгруппе могут относиться пациенты с антителами против HMGCR [85 •].
Как было впервые предложено Imbach et al., Терапевтическая доза ВВИГ была эмпирически установлена на уровне 2 г / кг / мес за три-пять введений с рефракцией [86]. Количество терапевтических циклов может варьироваться в зависимости от тяжести заболевания / реакции на лечение. ВВИГ можно сочетать также с иммунодепрессантами [58, 87]. Недавно сообщалось, что подкожный иммуноглобулин (SCIG), еженедельно вводимый самостоятельно с помощью программируемой помпы, является ценной альтернативой IVIG при миозите.Это лечение представляется безопасной и эффективной альтернативой внутривенным иммуноглобулинам в условиях стационара с меньшим снижением качества жизни пациентов [88, 89 •].
ВВИГ считается относительно безопасной терапией. О нежелательных явлениях сообщается в 5–15% инфузий, и в большинстве случаев они легкие и преходящие с головными болями, лихорадкой, ознобом и миалгиями. Использование высоких доз ВВИГ у пациентов с ММВ было неофициально связано с застойной сердечной недостаточностью, синдромом повышенной вязкости, гемолитической анемией и острым повреждением легких, связанным с переливанием крови.Сообщалось об анафилаксии у пациентов с дефицитом IgA. ВВИГ может представлять потенциальный риск передачи неопределяемых инфекций через кровь [83 ••]. ВВИГ считается безопасным для пациентов с инфекциями [10] и неоплазией [90], где иммуносупрессивный подход может быть опасным. Несмотря на то, что в литературе имеется мало данных, ВВИГ можно использовать во время беременности [83]. Основным ограничением использования ВВИГ является их чрезвычайно высокая стоимость, что позволяет использовать их в основном у отдельных пациентов с тяжелой / рефрактерной формой.
Biologics
Ритуксимаб
Ритуксимаб (RTX) представляет собой химерное моноклональное антитело против белка CD20, в основном экспрессирующееся на поверхности В-клеток. Начиная с 2005 г., несколько отчетов о случаях, серий случаев, открытых исследований [91, 92] и отчетов регистратур [93] свидетельствовали о положительном эффекте лечения RTX у пациентов с IIM. Совсем недавно было опубликовано одно рандомизированное контролируемое исследование [94]. До настоящего времени были опубликованы данные более чем 450 рефрактерных пациентов с IIM, получавших RTX, со средней частотой ответа 78.3% [95].
В крупном РКИ, испытании ритуксимаба при миозите (RIM), включающем случаи заболевания как у подростков, так и у взрослых, не удалось достичь первичной конечной точки эффективности [94]. Однако RTX смог снизить клиническую активность и продемонстрировал важный эффект экономии стероидов. В ретроспективном анализе пациенты с антителами против Jo1 или против Mi2 достигли значительного улучшения [96]. В открытом исследовании, проведенном с участием 12 пациентов с положительными антителами к АРС, RTX был эффективен при поражении легких и мышц [97].RTX был определен как наиболее часто используемый биологический препарат при лечении IIM [98 •]. Основные показания для лечения RTX при IIM включают рефрактерное поражение мышц, легких [97, 99], кожи [100 •] или суставов [10]. Пациенты с миозит-специфическими аутоантителами (MSA), по-видимому, лучше реагируют на лечение, особенно пациенты с положительной реакцией на ARS [96, 97, 99], анти-SRP [94, 101] и антитела к Mi-2 [ 96]. Уровни аутоантител против Jo1 и Mi2 снижались после истощения В-клеток и коррелировали со снижением активности заболевания [102].
RTX обычно назначают с двумя инфузиями по 1 г с интервалом 2 недели и могут быть повторены через 6 месяцев. Другие предложенные терапевтические схемы были 375 мг / м 2 еженедельно в течение четырех недель подряд. Клиническое значение периодического мониторинга периферических CD-20-положительных В-клеток еще не выяснено.
Ритуксимаб обычно хорошо переносится, но НЯ встречаются относительно часто. Инфузионные реакции, также тяжелые, являются наиболее частыми НЯ, связанными с лечением RTX; они возникают в основном во время первой инфузии, и их частота снизилась у пациентов, получавших премедикацию внутривенными ГК, жаропонижающими и антигистаминными препаратами [103].Из-за возможного кардиотоксического эффекта рекомендуется сердечный мониторинг во время и после инфузий RTX пациентам с ишемической болезнью сердца в анамнезе [103]. Инфекции во время лечения относительно распространены, включая вирусные и бактериальные инфекции [95], и перед лечением рекомендуется вакцинация от пневмококка и гриппа [104].
Другие биопрепараты
В последние годы различные биотехнологические препараты были протестированы для лечения IIM, но количество пролеченных пациентов невелико, и их использование может быть предложено только тогда, когда другие методы лечения неэффективны.
Абатацепт, гибридный белок, который препятствует иммунной активности Т-клеток, эффективно использовался в отдельных сообщениях о случаях [105]. Недавно небольшое рандомизированное открытое исследование показало возможное влияние внутривенных инфузий абатацепта на мышечную слабость при лечении. резистентные пациенты с ПМ или СД [106 ••]. Несколько испытаний, оценивающих влияние абатацепта при лечении IIM, продолжаются [107].
Хотя фактор некроза опухоли (TNF) может играть роль в патогенезе IIM, лечение пациентов IIM анти-TNFα дало противоречивые результаты.Даже если некоторые авторы сообщили о возможной роли этанерцепта как стероидсберегающего средства при СД [108], другие исследования не подтвердили это наблюдение, и у некоторых пациентов состояние ухудшилось [109]. Несмотря на то, что недавнее рандомизированное контролируемое исследование показало эффективность инфликсимаба (IFX) у некоторых пациентов [110 •], большинство клинических данных были обескураживающими [111, 112]. Более того, некоторые авторы сообщили, что терапия анти-TNF-альфа может вызывать миозит у пациентов с ревматоидным артритом, псориатическим артритом и псориазом [113, 114]. Таким образом, блокаторы TNF обычно не рекомендуются взрослым пациентам с IIM, и их следует использовать только тогда, когда другие методы лечения неэффективны.
Поскольку сообщалось, что интерлейкин (ИЛ) -6 коррелирует с активностью миозита, тоцилизумаб был протестирован с многообещающими результатами в двух описаниях клинических случаев [115, 116]. Испытания, изучающие эффективность тоцилизумаба у пациентов с IIM, продолжаются (Clinicaltrials.gov, {«type»: «клиническое испытание», «attrs»: {«text»: «NCT02043548», «term_id»: «NCT02043548»}} NCT02043548).
Anakinra, антагонист рецептора IL-1, был протестирован в описаниях клинических случаев [117] и в небольшой серии случаев [118], с положительными результатами у некоторых пациентов.
Другие препараты, такие как алемтузумаб [119, 120], сифалимумаб [121], базиликсимаб [122] и тофацитиниб [123], исследуются для лечения IIM, но их использование в повседневной клинической практике не рекомендуется.
Текущее лечение миозита
Фармакологическое лечение
Глюкокортикоиды
Несмотря на отсутствие четких данных, полученных в результате рандомизированных контролируемых исследований, лечение ГК остается первым терапевтическим подходом в клинической практике для пациентов с ММВ [4].Лечение способно уменьшить мышечное воспаление [5], и более 60% пациентов показывают улучшение мышечных симптомов при лечении ГК [6]. В частности, это происходит в первые 6 месяцев после начала лечения [7]. Высокие дозы ГК также успешно применялись при поражении легких [8].
При традиционном терапевтическом подходе ГК начинали с преднизона или его эквивалента в дозе 1 мг / кг / день [9]. Более низкая дозировка должна рассматриваться в случае легкой болезни или, при наличии противопоказаний, таких как сахарный диабет, гипертония или глаукома [4], и более высокая дозировка, до 2 мг / кг / день, может быть назначена в отдельных случаях. но не более 80–100 мг / сут [10].У пациентов с тяжелым заболеванием, например, с тяжелым поражением мышц, дисфагией, быстро прогрессирующим интерстициальным заболеванием легких (ILD) или кожными язвами [11], индукционная терапия с внутривенными импульсами метилпреднизолона (500–1000 мг / день в течение трех дней подряд) ) часто рекомендуется [12].
Были предложены различные схемы постепенного снижения дозы ГК, но обычно более высокую дозу следует поддерживать в течение 2–4 недель, а затем постепенно снижать на 20–25% каждый месяц до тех пор, пока не будет достигнута 5–10 мг / день преднизона или эквивалентной дозы [4 , 13].Во время снижения ГК следует проводить строгое клиническое и лабораторное наблюдение с мониторингом мышечной силы с помощью проверенных методов (например, мануальный мышечный тест 8 (MMT8)) и мышечных ферментов сыворотки [4, 10].
Побочные эффекты (SE) распространены у пациентов, получавших ГК [14], и включают сахарный диабет, системную артериальную гипертензию, дислипидемию, остеопороз, увеличение веса, появление кушингоидов, истончение кожи, непереносимость желудка, изменения настроения, инфекции, гирсутизм, катаракту. , глаукома [15].Некоторые исследования показывают, что импульсные пероральные приемы дексаметазона в качестве индукционной терапии могут иметь такую же эффективность, что и метилпреднизолон, но с меньшим количеством побочных эффектов [16].
Хотя ГК обычно эффективны при лечении IIMs, по крайней мере до некоторой степени, большому количеству пациентов требуется добавление другого иммунодепрессанта при рефрактерном заболевании [6, 17], обострениях болезни и поражении кожи или для уменьшения Накопленная доза ГК. У каждого пациента с недавно начавшимся ММВ назначение иммунодепрессантов следует рассматривать с первой фазы лечения, поскольку раннее лечение связано с лучшим исходом [6].
Гель адренокортикотропного гормона
Эффекты геля адренокортикотропного гормона (гель АКТГ) изучались в серии ретроспективных случаев [18] и в недавнем открытом исследовании [19 •]. Гель с АКТГ был одобрен еще в 1952 году Управлением по контролю за продуктами и лекарствами США (FDA) для лечения IIMs, но не был одобрен Европейским агентством по лекарственным средствам (EMA). Лечение улучшило мышечную силу и кожную сыпь, со средним улучшением мышечной силы на 19,3%, измеренной с помощью MMT, у 71% пациентов, уменьшением кожного ВАШ на 88% у 4/5 пациентов с кожной сыпью дерматомиозита и позволило уменьшить дозировка ГК [18, 19 •].Гель АКТГ вводили подкожно один или два раза в неделю в течение 12 недель. Несмотря на то, что терапия хорошо переносилась без серьезных побочных эффектов, необходимы дальнейшие исследования для оценки безопасности и эффективности геля АКТГ у пациентов с IIM.
Гидроксихлорохин
Как сообщалось в обсервационных исследованиях, лечение поражения кожи при СД противомалярийными средствами (гидроксихлорохин (HCQ) или хинакрин) в сочетании с ГК с иммуносупрессорами или без них эффективно у 40–75% пациентов [20, 21] и он был включен в недавний консенсус по лечению сыпи у подростков с DM [22].Противомалярийные препараты неэффективны при поражении мышц [20, 21]. Наиболее часто назначаемым противомалярийным средством в повседневной клинической практике является HCQ до 400 мг / день.
Лечение обычно хорошо переносится, но побочные эффекты, хотя и легкие, относительно обычны: кожная сыпь, желудочно-кишечная токсичность (тошнота, рвота, диарея), головокружение и головная боль [23]. Антималярийная ретинопатия представляет собой наиболее серьезное нежелательное явление; Таким образом, Американская академия офтальмологии рекомендует проводить скрининг пациентов на исходном уровне с осмотром глазного дна, а во время лечения каждые 5 лет следует проводить периодическую оценку с помощью автоматизированных полей зрения и / или оптической когерентной томографии [24]. ].Несмотря на то, что распространенность была неизвестна, миопатия (миалгии с повышением мышечных ферментов или миопатия с вакуолями) может иногда возникать во время лечения [25], в то время как парадоксальное ухудшение кожных повреждений отмечается у 30% пациентов с СД. во время лечения [26].
Метотрексат
Метотрексат (МТ) вместе с азатиоприном считается препаратом первого выбора для лечения поражения мышц при IIM [4, 10]. Хотя не было опубликовано плацебо-контролируемых исследований, эффективность метотрексата изучалась в открытых исследованиях [27] и в сравнении с другими иммунодепрессантами [28–30].Метотрексат также успешно применялся при лечении кожных проявлений у пациентов с СД [31, 32], хотя с противоречивыми результатами [33].
Рандомизированное открытое исследование по оценке эффективности и безопасности метотрексата в сочетании с ГК по сравнению с одними ГК продолжается [34]. Метотрексат можно вводить перорально, подкожно или внутримышечно в дозе до 20-25 мг / нед. После введения метотрексата следует адекватное введение фолиевой / фолиновой кислоты для уменьшения побочных эффектов и отмены пациентом метотрексата [35].Применение метотрексата во время беременности противопоказано женщинам из-за тератогенного действия [36].
Наиболее частыми нежелательными явлениями (НЯ) метотрексата являются инфекции, гепатотоксичность (повышение уровня печеночных ферментов и цирроз), а также изменения количества клеток крови, а у пациентов, принимающих метотрексат, следует регулярно проверять уровень трансаминаз и общий анализ крови [36]. Метотрексат следует осторожно назначать людям с нарушением функции почек, а также пациентам, принимающим нестероидные противовоспалительные препараты.Легочная токсичность у пациентов, получавших метотрексат, представляет собой серьезный и непредсказуемый побочный эффект [37]; таким образом, другие иммунодепрессанты обычно рекомендуются в качестве терапии первой линии в комбинации с ГК у пациентов с ИБЗ, связанной с IIM [38].
Азатиоприн
Азатиоприн (AZA) представляет собой аналог пурина и действует как антиметаболит, блокируя пурин и метаболизм, а также синтез РНК и ДНК. Эффект АЗА по сохранению ГК изучался в рандомизированном плацебо-контролируемом исследовании у пациентов с ПМ.Хотя комбинированная терапия не превосходила только GC через 12 недель, после трехлетнего продления, комбинация GC с AZA позволила снизить суточную дозу преднизона и была связана с лучшим функциональным результатом [39, 40]. Даже если достоверность доказательств очень низкая, AZA также продемонстрировал эффективность в ретроспективных сериях случаев для лечения IIM-ILD [41] и может рассматриваться при лечении пациентов с высоким риском развития связанного с метотрексатом повреждения легких. Даже если непосредственных испытаний не проводилось, AZA имеет аналогичную эффективность по сравнению с метотрексатом [6, 42], а также выживаемость пациентов, получавших AZA, похоже или лучше [43] по сравнению с пациентами, получавшими метотрексат. хотя нельзя исключить смешение по показаниям.
AZA обычно вводят перорально, начиная с 50 мг / день и с последующим постепенным увеличением на 25-50 мг каждые 1-2 недели до 2 мг / кг / день [4, 10]. У пациентов, получающих АЗА, следует регулярно проверять общий анализ крови, ферменты печени и функцию почек.
Общие SE включают рвоту, токсичность для печени и подавление костного мозга [44]. Последний SE особенно часто встречается у людей с генетическим дефицитом фермента тиопурин-S-метилтрансферазы, который может быть генотипирован до назначения AZA [44].Хотя официально АЗА противопоказан во время беременности, существенные данные подтверждают безопасность препарата во время беременности [45]. Среди лекарственных взаимодействий особое внимание следует уделять недопущению одновременного лечения аллопуринолом [44].
У пациентов, которые не ответили только на метотрексат или аза, можно рассмотреть комбинацию этих двух агентов, и до 53% рефрактерных пациентов улучшили свою мышечную силу и способность выполнять повседневную деятельность с лишь незначительными побочными эффектами [30 ].
Ингибиторы кальциневрина
Циклоспорин-A (CYA) и такролимус (TAC) являются ингибиторами кальциневрина (CNI), и их основными эффектами являются ингибирование активации Т-клеток и снижение активности генов, кодирующих IL-2 и родственные цитокины. Поскольку Т-клетки играют важную роль в патогенезе миозита [1] и IIM-ILD [46], обоснованность использования CNI у пациентов с IIM высока.
Помимо улучшения мышечного поражения, лечение CNI было связано с лучшими респираторными исходами у пациентов с СД, ПМ и ИЛЗ, что позволило улучшить как тесты функции легких (PFT), так и компьютерную томографию высокого разрешения ( HRCT) [47–50], особенно если его начать на ранней стадии заболевания [51].Положительность аутоантител против аминоацил-тРНК синтетазы (анти-ARS), по-видимому, связана с хорошим действием CNI [49, 52, 53]. Никаких существенных различий между CYA и MTX в отношении поражения мышц не выявлено, когда они сравнивались в исследовании [29].
CYA обычно вводят перорально от 2 до 4 мг / кг / день, разделенных на две суточные дозы [47]. Первоначально прием ТАС можно начинать с дозы 1 мг два раза в день с титрованием 1-2 мг / день до достижения целевого уровня в крови 5-20 нг / мл [49].Уровни обоих препаратов в сыворотке крови следует тщательно контролировать, чтобы поддерживать терапевтический диапазон и избегать серьезных побочных эффектов [49, 51].
Риск токсичности при лечении CNI включает нефротоксичность, гепатотоксичность, гипертензию, гипертрихоз, гиперплазию десен, головную боль, и этот риск увеличивается с увеличением доз препаратов [54]. Креатинин сыворотки, ферменты печени, общий анализ крови и артериальное давление следует повторно оценивать во время лечения, особенно в первые 3 месяца [54].Поскольку CYA и TAC влияют на цитохром P 3A4 (CYP3A4), важна осведомленность о потенциальных лекарственных взаимодействиях, и перед началом лечения CYA и TAC следует проводить тщательную проверку других лекарств [54, 55]. Кроме того, грейпфрутовый сок может влиять на метаболизм CYP3A4 [55].
Микофенолят мофетил
Микофенолятмофетил (MMF) — это пролекарство, которое ингибирует пролиферацию Т- и В-клеток, снижая синтез гуанозиновых нуклеотидов. Об эффективности MMF у пациентов с IIM сообщалось в небольших сериях случаев [56, 57] и в открытом исследовании в сочетании с внутривенными иммуноглобулинами [58].
MMF, по-видимому, эффективен при лечении кожных проявлений у пациентов с СД [59]. Интересно, что хороший ответ на MMF был также зарегистрирован у пациентов с IIM-ILD, даже с быстро прогрессирующими ILD [60]. После лечения MMF было зарегистрировано улучшение респираторных симптомов, PFT и диффузионной способности легких по монооксиду углерода (DLCO) [61, 62].
MMF вводят перорально, начиная с 500 мг два раза в день до 2-3 г суточной дозы, преломленной за два приема в день [4].ММФ обычно хорошо переносится, но могут возникать желудочно-кишечные симптомы (тошнота, рвота и диарея) и отклонения в количестве клеток крови, включая тяжелую нейтропению. Пациентов следует контролировать с помощью общего анализа крови, ферментов печени и функции почек. Сообщается о более высокой восприимчивости к оппортунистическим инфекциям, также тяжелым [57]. Лечение ММФ не рекомендуется во время беременности [45].
Циклофосфамид
Циклофосфамид (CYC), разработанный в качестве противоопухолевой химиотерапии, использовался для лечения тяжелых проявлений ревматических заболеваний, в частности, у пациентов с прогрессирующими ВЗЛ.У пациентов с IIM использование CYC описано в серии отдельных случаев. Использование этого препарата в основном предназначалось для пациентов с тяжелыми или прогрессирующими ВЗЛ, и сообщалось, что он уменьшает респираторные симптомы, позволяя улучшить КТГ грудной клетки и улучшить ПФП [63–65]. Комбинированная терапия CYA и CYC может быть многообещающим методом лечения быстро прогрессирующей ILD при СД [66], даже если результаты могут быть неудовлетворительными для некоторых пациентов [67]. Также сообщалось, что комбинированная терапия ритуксимабом может быть полезной у пациентов с тяжелой формой ILD с аутоантителами против MDA5 [68].Сообщается, что даже если его обычно применяют для лечения поражения легких, он эффективен также при мышечных симптомах, позволяя улучшить мышечную силу и снизить уровень мышечных ферментов в сыворотке крови [65].
В медицинской литературе сообщалось о различных протоколах лечения без явного преимущества одной терапевтической схемы по сравнению с другими, а оптимальная доза и продолжительность еще не определены. Чаще всего применялся терапевтический подход с использованием в / в импульсов (0.3–1 г / м 2 или 10–30 мг / кг, применяемые еженедельно или ежемесячно в течение 6–12 месяцев) [65], но также может быть назначено пероральное введение [69]. Недавно был предложен подход с более низкими дозировками, как при волчаночном нефрите (500 мг каждые две недели до 12 введений) с хорошей эффективностью и без серьезных побочных эффектов [70].
Лечение CYC ограничено потенциально тяжелыми побочными эффектами, такими как миелосупрессия (нейтропения), гепатотоксичность, почечная токсичность, геморрагический цистит, инфекции, необратимая недостаточность яичников, приводящая к бесплодию, и вторичные злокачественные новообразования [71].Побочные эффекты на почки и мочевыводящие пути могут быть уменьшены с помощью агрессивной гидратации с форсированным диурезом и премедикации 2-меркаптоэтансульфонатом натрия (MESNA). Во время лечения обязательно тщательный контроль количества клеток крови, функции печени и почек. CYC противопоказан при беременности [45].
Внутривенные иммуноглобулины
Внутривенные иммуноглобулины (ВВИГ) — это препараты, полученные из объединенных препаратов IgG от тысяч доноров и содержащие антитела, направленные против широкого круга патогенов, а также против множества чужеродных и аутоантигенов [72].Несмотря на то, что механизм действия лечения еще не известен, он, вероятно, включает различные специфические для заболевания пути, участвующие в производстве и поддержании воспаления и аутоиммунных процессов [72], и считается иммуномодулирующим, а не иммунодепрессивным средством [4].
Об эффективности лечения сообщалось в двух небольших двойных слепых контролируемых исследованиях с участием пациентов с СД [73, 74] и в проспективных открытых исследованиях [58, 75, 76]. ВВИГ продемонстрировал эффект на поражение мышечной ткани и поражение кожи при СД [77] и был протестирован также при лечении ВЗЛ у рефрактерных пациентов [78, 79].Дисфагия может поддаваться лечению ВВИГ [80], также у пациентов с ИБГ, которые в остальном резистентны к лечению [81, 82]. Имеются также отрицательные сообщения об эффекте ВВИГ у пациентов с ММВ [83 ••], поскольку в одном исследовании, включавшем повторные биопсии мышц, не было значительного положительного воздействия на работоспособность мышц или на воспаление в мышечной ткани [84]. К сожалению, у нас отсутствуют биомаркеры, которые могут предсказать ответ на лечение высокими дозами ВВИГ, но к такой подгруппе могут относиться пациенты с антителами против HMGCR [85 •].
Как было впервые предложено Imbach et al., Терапевтическая доза ВВИГ была эмпирически установлена на уровне 2 г / кг / мес за три-пять введений с рефракцией [86]. Количество терапевтических циклов может варьироваться в зависимости от тяжести заболевания / реакции на лечение. ВВИГ можно сочетать также с иммунодепрессантами [58, 87]. Недавно сообщалось, что подкожный иммуноглобулин (SCIG), еженедельно вводимый самостоятельно с помощью программируемой помпы, является ценной альтернативой IVIG при миозите.Это лечение представляется безопасной и эффективной альтернативой внутривенным иммуноглобулинам в условиях стационара с меньшим снижением качества жизни пациентов [88, 89 •].
ВВИГ считается относительно безопасной терапией. О нежелательных явлениях сообщается в 5–15% инфузий, и в большинстве случаев они легкие и преходящие с головными болями, лихорадкой, ознобом и миалгиями. Использование высоких доз ВВИГ у пациентов с ММВ было неофициально связано с застойной сердечной недостаточностью, синдромом повышенной вязкости, гемолитической анемией и острым повреждением легких, связанным с переливанием крови.Сообщалось об анафилаксии у пациентов с дефицитом IgA. ВВИГ может представлять потенциальный риск передачи неопределяемых инфекций через кровь [83 ••]. ВВИГ считается безопасным для пациентов с инфекциями [10] и неоплазией [90], где иммуносупрессивный подход может быть опасным. Несмотря на то, что в литературе имеется мало данных, ВВИГ можно использовать во время беременности [83]. Основным ограничением использования ВВИГ является их чрезвычайно высокая стоимость, что позволяет использовать их в основном у отдельных пациентов с тяжелой / рефрактерной формой.
Biologics
Ритуксимаб
Ритуксимаб (RTX) представляет собой химерное моноклональное антитело против белка CD20, в основном экспрессирующееся на поверхности В-клеток. Начиная с 2005 г., несколько отчетов о случаях, серий случаев, открытых исследований [91, 92] и отчетов регистратур [93] свидетельствовали о положительном эффекте лечения RTX у пациентов с IIM. Совсем недавно было опубликовано одно рандомизированное контролируемое исследование [94]. До настоящего времени были опубликованы данные более чем 450 рефрактерных пациентов с IIM, получавших RTX, со средней частотой ответа 78.3% [95].
В крупном РКИ, испытании ритуксимаба при миозите (RIM), включающем случаи заболевания как у подростков, так и у взрослых, не удалось достичь первичной конечной точки эффективности [94]. Однако RTX смог снизить клиническую активность и продемонстрировал важный эффект экономии стероидов. В ретроспективном анализе пациенты с антителами против Jo1 или против Mi2 достигли значительного улучшения [96]. В открытом исследовании, проведенном с участием 12 пациентов с положительными антителами к АРС, RTX был эффективен при поражении легких и мышц [97].RTX был определен как наиболее часто используемый биологический препарат при лечении IIM [98 •]. Основные показания для лечения RTX при IIM включают рефрактерное поражение мышц, легких [97, 99], кожи [100 •] или суставов [10]. Пациенты с миозит-специфическими аутоантителами (MSA), по-видимому, лучше реагируют на лечение, особенно пациенты с положительной реакцией на ARS [96, 97, 99], анти-SRP [94, 101] и антитела к Mi-2 [ 96]. Уровни аутоантител против Jo1 и Mi2 снижались после истощения В-клеток и коррелировали со снижением активности заболевания [102].
RTX обычно назначают с двумя инфузиями по 1 г с интервалом 2 недели и могут быть повторены через 6 месяцев. Другие предложенные терапевтические схемы были 375 мг / м 2 еженедельно в течение четырех недель подряд. Клиническое значение периодического мониторинга периферических CD-20-положительных В-клеток еще не выяснено.
Ритуксимаб обычно хорошо переносится, но НЯ встречаются относительно часто. Инфузионные реакции, также тяжелые, являются наиболее частыми НЯ, связанными с лечением RTX; они возникают в основном во время первой инфузии, и их частота снизилась у пациентов, получавших премедикацию внутривенными ГК, жаропонижающими и антигистаминными препаратами [103].Из-за возможного кардиотоксического эффекта рекомендуется сердечный мониторинг во время и после инфузий RTX пациентам с ишемической болезнью сердца в анамнезе [103]. Инфекции во время лечения относительно распространены, включая вирусные и бактериальные инфекции [95], и перед лечением рекомендуется вакцинация от пневмококка и гриппа [104].
Другие биопрепараты
В последние годы различные биотехнологические препараты были протестированы для лечения IIM, но количество пролеченных пациентов невелико, и их использование может быть предложено только тогда, когда другие методы лечения неэффективны.
Абатацепт, гибридный белок, который препятствует иммунной активности Т-клеток, эффективно использовался в отдельных сообщениях о случаях [105]. Недавно небольшое рандомизированное открытое исследование показало возможное влияние внутривенных инфузий абатацепта на мышечную слабость при лечении. резистентные пациенты с ПМ или СД [106 ••]. Несколько испытаний, оценивающих влияние абатацепта при лечении IIM, продолжаются [107].
Хотя фактор некроза опухоли (TNF) может играть роль в патогенезе IIM, лечение пациентов IIM анти-TNFα дало противоречивые результаты.Даже если некоторые авторы сообщили о возможной роли этанерцепта как стероидсберегающего средства при СД [108], другие исследования не подтвердили это наблюдение, и у некоторых пациентов состояние ухудшилось [109]. Несмотря на то, что недавнее рандомизированное контролируемое исследование показало эффективность инфликсимаба (IFX) у некоторых пациентов [110 •], большинство клинических данных были обескураживающими [111, 112]. Более того, некоторые авторы сообщили, что терапия анти-TNF-альфа может вызывать миозит у пациентов с ревматоидным артритом, псориатическим артритом и псориазом [113, 114]. Таким образом, блокаторы TNF обычно не рекомендуются взрослым пациентам с IIM, и их следует использовать только тогда, когда другие методы лечения неэффективны.
Поскольку сообщалось, что интерлейкин (ИЛ) -6 коррелирует с активностью миозита, тоцилизумаб был протестирован с многообещающими результатами в двух описаниях клинических случаев [115, 116]. Испытания, изучающие эффективность тоцилизумаба у пациентов с IIM, продолжаются (Clinicaltrials.gov, {«type»: «клиническое испытание», «attrs»: {«text»: «NCT02043548», «term_id»: «NCT02043548»}} NCT02043548).
Anakinra, антагонист рецептора IL-1, был протестирован в описаниях клинических случаев [117] и в небольшой серии случаев [118], с положительными результатами у некоторых пациентов.
Другие препараты, такие как алемтузумаб [119, 120], сифалимумаб [121], базиликсимаб [122] и тофацитиниб [123], исследуются для лечения IIM, но их использование в повседневной клинической практике не рекомендуется.
Текущее лечение миозита
Фармакологическое лечение
Глюкокортикоиды
Несмотря на отсутствие четких данных, полученных в результате рандомизированных контролируемых исследований, лечение ГК остается первым терапевтическим подходом в клинической практике для пациентов с ММВ [4].Лечение способно уменьшить мышечное воспаление [5], и более 60% пациентов показывают улучшение мышечных симптомов при лечении ГК [6]. В частности, это происходит в первые 6 месяцев после начала лечения [7]. Высокие дозы ГК также успешно применялись при поражении легких [8].
При традиционном терапевтическом подходе ГК начинали с преднизона или его эквивалента в дозе 1 мг / кг / день [9]. Более низкая дозировка должна рассматриваться в случае легкой болезни или, при наличии противопоказаний, таких как сахарный диабет, гипертония или глаукома [4], и более высокая дозировка, до 2 мг / кг / день, может быть назначена в отдельных случаях. но не более 80–100 мг / сут [10].У пациентов с тяжелым заболеванием, например, с тяжелым поражением мышц, дисфагией, быстро прогрессирующим интерстициальным заболеванием легких (ILD) или кожными язвами [11], индукционная терапия с внутривенными импульсами метилпреднизолона (500–1000 мг / день в течение трех дней подряд) ) часто рекомендуется [12].
Были предложены различные схемы постепенного снижения дозы ГК, но обычно более высокую дозу следует поддерживать в течение 2–4 недель, а затем постепенно снижать на 20–25% каждый месяц до тех пор, пока не будет достигнута 5–10 мг / день преднизона или эквивалентной дозы [4 , 13].Во время снижения ГК следует проводить строгое клиническое и лабораторное наблюдение с мониторингом мышечной силы с помощью проверенных методов (например, мануальный мышечный тест 8 (MMT8)) и мышечных ферментов сыворотки [4, 10].
Побочные эффекты (SE) распространены у пациентов, получавших ГК [14], и включают сахарный диабет, системную артериальную гипертензию, дислипидемию, остеопороз, увеличение веса, появление кушингоидов, истончение кожи, непереносимость желудка, изменения настроения, инфекции, гирсутизм, катаракту. , глаукома [15].Некоторые исследования показывают, что импульсные пероральные приемы дексаметазона в качестве индукционной терапии могут иметь такую же эффективность, что и метилпреднизолон, но с меньшим количеством побочных эффектов [16].
Хотя ГК обычно эффективны при лечении IIMs, по крайней мере до некоторой степени, большому количеству пациентов требуется добавление другого иммунодепрессанта при рефрактерном заболевании [6, 17], обострениях болезни и поражении кожи или для уменьшения Накопленная доза ГК. У каждого пациента с недавно начавшимся ММВ назначение иммунодепрессантов следует рассматривать с первой фазы лечения, поскольку раннее лечение связано с лучшим исходом [6].
Гель адренокортикотропного гормона
Эффекты геля адренокортикотропного гормона (гель АКТГ) изучались в серии ретроспективных случаев [18] и в недавнем открытом исследовании [19 •]. Гель с АКТГ был одобрен еще в 1952 году Управлением по контролю за продуктами и лекарствами США (FDA) для лечения IIMs, но не был одобрен Европейским агентством по лекарственным средствам (EMA). Лечение улучшило мышечную силу и кожную сыпь, со средним улучшением мышечной силы на 19,3%, измеренной с помощью MMT, у 71% пациентов, уменьшением кожного ВАШ на 88% у 4/5 пациентов с кожной сыпью дерматомиозита и позволило уменьшить дозировка ГК [18, 19 •].Гель АКТГ вводили подкожно один или два раза в неделю в течение 12 недель. Несмотря на то, что терапия хорошо переносилась без серьезных побочных эффектов, необходимы дальнейшие исследования для оценки безопасности и эффективности геля АКТГ у пациентов с IIM.
Гидроксихлорохин
Как сообщалось в обсервационных исследованиях, лечение поражения кожи при СД противомалярийными средствами (гидроксихлорохин (HCQ) или хинакрин) в сочетании с ГК с иммуносупрессорами или без них эффективно у 40–75% пациентов [20, 21] и он был включен в недавний консенсус по лечению сыпи у подростков с DM [22].Противомалярийные препараты неэффективны при поражении мышц [20, 21]. Наиболее часто назначаемым противомалярийным средством в повседневной клинической практике является HCQ до 400 мг / день.
Лечение обычно хорошо переносится, но побочные эффекты, хотя и легкие, относительно обычны: кожная сыпь, желудочно-кишечная токсичность (тошнота, рвота, диарея), головокружение и головная боль [23]. Антималярийная ретинопатия представляет собой наиболее серьезное нежелательное явление; Таким образом, Американская академия офтальмологии рекомендует проводить скрининг пациентов на исходном уровне с осмотром глазного дна, а во время лечения каждые 5 лет следует проводить периодическую оценку с помощью автоматизированных полей зрения и / или оптической когерентной томографии [24]. ].Несмотря на то, что распространенность была неизвестна, миопатия (миалгии с повышением мышечных ферментов или миопатия с вакуолями) может иногда возникать во время лечения [25], в то время как парадоксальное ухудшение кожных повреждений отмечается у 30% пациентов с СД. во время лечения [26].
Метотрексат
Метотрексат (МТ) вместе с азатиоприном считается препаратом первого выбора для лечения поражения мышц при IIM [4, 10]. Хотя не было опубликовано плацебо-контролируемых исследований, эффективность метотрексата изучалась в открытых исследованиях [27] и в сравнении с другими иммунодепрессантами [28–30].Метотрексат также успешно применялся при лечении кожных проявлений у пациентов с СД [31, 32], хотя с противоречивыми результатами [33].
Рандомизированное открытое исследование по оценке эффективности и безопасности метотрексата в сочетании с ГК по сравнению с одними ГК продолжается [34]. Метотрексат можно вводить перорально, подкожно или внутримышечно в дозе до 20-25 мг / нед. После введения метотрексата следует адекватное введение фолиевой / фолиновой кислоты для уменьшения побочных эффектов и отмены пациентом метотрексата [35].Применение метотрексата во время беременности противопоказано женщинам из-за тератогенного действия [36].
Наиболее частыми нежелательными явлениями (НЯ) метотрексата являются инфекции, гепатотоксичность (повышение уровня печеночных ферментов и цирроз), а также изменения количества клеток крови, а у пациентов, принимающих метотрексат, следует регулярно проверять уровень трансаминаз и общий анализ крови [36]. Метотрексат следует осторожно назначать людям с нарушением функции почек, а также пациентам, принимающим нестероидные противовоспалительные препараты.Легочная токсичность у пациентов, получавших метотрексат, представляет собой серьезный и непредсказуемый побочный эффект [37]; таким образом, другие иммунодепрессанты обычно рекомендуются в качестве терапии первой линии в комбинации с ГК у пациентов с ИБЗ, связанной с IIM [38].
Азатиоприн
Азатиоприн (AZA) представляет собой аналог пурина и действует как антиметаболит, блокируя пурин и метаболизм, а также синтез РНК и ДНК. Эффект АЗА по сохранению ГК изучался в рандомизированном плацебо-контролируемом исследовании у пациентов с ПМ.Хотя комбинированная терапия не превосходила только GC через 12 недель, после трехлетнего продления, комбинация GC с AZA позволила снизить суточную дозу преднизона и была связана с лучшим функциональным результатом [39, 40]. Даже если достоверность доказательств очень низкая, AZA также продемонстрировал эффективность в ретроспективных сериях случаев для лечения IIM-ILD [41] и может рассматриваться при лечении пациентов с высоким риском развития связанного с метотрексатом повреждения легких. Даже если непосредственных испытаний не проводилось, AZA имеет аналогичную эффективность по сравнению с метотрексатом [6, 42], а также выживаемость пациентов, получавших AZA, похоже или лучше [43] по сравнению с пациентами, получавшими метотрексат. хотя нельзя исключить смешение по показаниям.
AZA обычно вводят перорально, начиная с 50 мг / день и с последующим постепенным увеличением на 25-50 мг каждые 1-2 недели до 2 мг / кг / день [4, 10]. У пациентов, получающих АЗА, следует регулярно проверять общий анализ крови, ферменты печени и функцию почек.
Общие SE включают рвоту, токсичность для печени и подавление костного мозга [44]. Последний SE особенно часто встречается у людей с генетическим дефицитом фермента тиопурин-S-метилтрансферазы, который может быть генотипирован до назначения AZA [44].Хотя официально АЗА противопоказан во время беременности, существенные данные подтверждают безопасность препарата во время беременности [45]. Среди лекарственных взаимодействий особое внимание следует уделять недопущению одновременного лечения аллопуринолом [44].
У пациентов, которые не ответили только на метотрексат или аза, можно рассмотреть комбинацию этих двух агентов, и до 53% рефрактерных пациентов улучшили свою мышечную силу и способность выполнять повседневную деятельность с лишь незначительными побочными эффектами [30 ].
Ингибиторы кальциневрина
Циклоспорин-A (CYA) и такролимус (TAC) являются ингибиторами кальциневрина (CNI), и их основными эффектами являются ингибирование активации Т-клеток и снижение активности генов, кодирующих IL-2 и родственные цитокины. Поскольку Т-клетки играют важную роль в патогенезе миозита [1] и IIM-ILD [46], обоснованность использования CNI у пациентов с IIM высока.
Помимо улучшения мышечного поражения, лечение CNI было связано с лучшими респираторными исходами у пациентов с СД, ПМ и ИЛЗ, что позволило улучшить как тесты функции легких (PFT), так и компьютерную томографию высокого разрешения ( HRCT) [47–50], особенно если его начать на ранней стадии заболевания [51].Положительность аутоантител против аминоацил-тРНК синтетазы (анти-ARS), по-видимому, связана с хорошим действием CNI [49, 52, 53]. Никаких существенных различий между CYA и MTX в отношении поражения мышц не выявлено, когда они сравнивались в исследовании [29].
CYA обычно вводят перорально от 2 до 4 мг / кг / день, разделенных на две суточные дозы [47]. Первоначально прием ТАС можно начинать с дозы 1 мг два раза в день с титрованием 1-2 мг / день до достижения целевого уровня в крови 5-20 нг / мл [49].Уровни обоих препаратов в сыворотке крови следует тщательно контролировать, чтобы поддерживать терапевтический диапазон и избегать серьезных побочных эффектов [49, 51].
Риск токсичности при лечении CNI включает нефротоксичность, гепатотоксичность, гипертензию, гипертрихоз, гиперплазию десен, головную боль, и этот риск увеличивается с увеличением доз препаратов [54]. Креатинин сыворотки, ферменты печени, общий анализ крови и артериальное давление следует повторно оценивать во время лечения, особенно в первые 3 месяца [54].Поскольку CYA и TAC влияют на цитохром P 3A4 (CYP3A4), важна осведомленность о потенциальных лекарственных взаимодействиях, и перед началом лечения CYA и TAC следует проводить тщательную проверку других лекарств [54, 55]. Кроме того, грейпфрутовый сок может влиять на метаболизм CYP3A4 [55].
Микофенолят мофетил
Микофенолятмофетил (MMF) — это пролекарство, которое ингибирует пролиферацию Т- и В-клеток, снижая синтез гуанозиновых нуклеотидов. Об эффективности MMF у пациентов с IIM сообщалось в небольших сериях случаев [56, 57] и в открытом исследовании в сочетании с внутривенными иммуноглобулинами [58].
MMF, по-видимому, эффективен при лечении кожных проявлений у пациентов с СД [59]. Интересно, что хороший ответ на MMF был также зарегистрирован у пациентов с IIM-ILD, даже с быстро прогрессирующими ILD [60]. После лечения MMF было зарегистрировано улучшение респираторных симптомов, PFT и диффузионной способности легких по монооксиду углерода (DLCO) [61, 62].
MMF вводят перорально, начиная с 500 мг два раза в день до 2-3 г суточной дозы, преломленной за два приема в день [4].ММФ обычно хорошо переносится, но могут возникать желудочно-кишечные симптомы (тошнота, рвота и диарея) и отклонения в количестве клеток крови, включая тяжелую нейтропению. Пациентов следует контролировать с помощью общего анализа крови, ферментов печени и функции почек. Сообщается о более высокой восприимчивости к оппортунистическим инфекциям, также тяжелым [57]. Лечение ММФ не рекомендуется во время беременности [45].
Циклофосфамид
Циклофосфамид (CYC), разработанный в качестве противоопухолевой химиотерапии, использовался для лечения тяжелых проявлений ревматических заболеваний, в частности, у пациентов с прогрессирующими ВЗЛ.У пациентов с IIM использование CYC описано в серии отдельных случаев. Использование этого препарата в основном предназначалось для пациентов с тяжелыми или прогрессирующими ВЗЛ, и сообщалось, что он уменьшает респираторные симптомы, позволяя улучшить КТГ грудной клетки и улучшить ПФП [63–65]. Комбинированная терапия CYA и CYC может быть многообещающим методом лечения быстро прогрессирующей ILD при СД [66], даже если результаты могут быть неудовлетворительными для некоторых пациентов [67]. Также сообщалось, что комбинированная терапия ритуксимабом может быть полезной у пациентов с тяжелой формой ILD с аутоантителами против MDA5 [68].Сообщается, что даже если его обычно применяют для лечения поражения легких, он эффективен также при мышечных симптомах, позволяя улучшить мышечную силу и снизить уровень мышечных ферментов в сыворотке крови [65].
В медицинской литературе сообщалось о различных протоколах лечения без явного преимущества одной терапевтической схемы по сравнению с другими, а оптимальная доза и продолжительность еще не определены. Чаще всего применялся терапевтический подход с использованием в / в импульсов (0.3–1 г / м 2 или 10–30 мг / кг, применяемые еженедельно или ежемесячно в течение 6–12 месяцев) [65], но также может быть назначено пероральное введение [69]. Недавно был предложен подход с более низкими дозировками, как при волчаночном нефрите (500 мг каждые две недели до 12 введений) с хорошей эффективностью и без серьезных побочных эффектов [70].
Лечение CYC ограничено потенциально тяжелыми побочными эффектами, такими как миелосупрессия (нейтропения), гепатотоксичность, почечная токсичность, геморрагический цистит, инфекции, необратимая недостаточность яичников, приводящая к бесплодию, и вторичные злокачественные новообразования [71].Побочные эффекты на почки и мочевыводящие пути могут быть уменьшены с помощью агрессивной гидратации с форсированным диурезом и премедикации 2-меркаптоэтансульфонатом натрия (MESNA). Во время лечения обязательно тщательный контроль количества клеток крови, функции печени и почек. CYC противопоказан при беременности [45].
Внутривенные иммуноглобулины
Внутривенные иммуноглобулины (ВВИГ) — это препараты, полученные из объединенных препаратов IgG от тысяч доноров и содержащие антитела, направленные против широкого круга патогенов, а также против множества чужеродных и аутоантигенов [72].Несмотря на то, что механизм действия лечения еще не известен, он, вероятно, включает различные специфические для заболевания пути, участвующие в производстве и поддержании воспаления и аутоиммунных процессов [72], и считается иммуномодулирующим, а не иммунодепрессивным средством [4].
Об эффективности лечения сообщалось в двух небольших двойных слепых контролируемых исследованиях с участием пациентов с СД [73, 74] и в проспективных открытых исследованиях [58, 75, 76]. ВВИГ продемонстрировал эффект на поражение мышечной ткани и поражение кожи при СД [77] и был протестирован также при лечении ВЗЛ у рефрактерных пациентов [78, 79].Дисфагия может поддаваться лечению ВВИГ [80], также у пациентов с ИБГ, которые в остальном резистентны к лечению [81, 82]. Имеются также отрицательные сообщения об эффекте ВВИГ у пациентов с ММВ [83 ••], поскольку в одном исследовании, включавшем повторные биопсии мышц, не было значительного положительного воздействия на работоспособность мышц или на воспаление в мышечной ткани [84]. К сожалению, у нас отсутствуют биомаркеры, которые могут предсказать ответ на лечение высокими дозами ВВИГ, но к такой подгруппе могут относиться пациенты с антителами против HMGCR [85 •].
Как было впервые предложено Imbach et al., Терапевтическая доза ВВИГ была эмпирически установлена на уровне 2 г / кг / мес за три-пять введений с рефракцией [86]. Количество терапевтических циклов может варьироваться в зависимости от тяжести заболевания / реакции на лечение. ВВИГ можно сочетать также с иммунодепрессантами [58, 87]. Недавно сообщалось, что подкожный иммуноглобулин (SCIG), еженедельно вводимый самостоятельно с помощью программируемой помпы, является ценной альтернативой IVIG при миозите.Это лечение представляется безопасной и эффективной альтернативой внутривенным иммуноглобулинам в условиях стационара с меньшим снижением качества жизни пациентов [88, 89 •].
ВВИГ считается относительно безопасной терапией. О нежелательных явлениях сообщается в 5–15% инфузий, и в большинстве случаев они легкие и преходящие с головными болями, лихорадкой, ознобом и миалгиями. Использование высоких доз ВВИГ у пациентов с ММВ было неофициально связано с застойной сердечной недостаточностью, синдромом повышенной вязкости, гемолитической анемией и острым повреждением легких, связанным с переливанием крови.Сообщалось об анафилаксии у пациентов с дефицитом IgA. ВВИГ может представлять потенциальный риск передачи неопределяемых инфекций через кровь [83 ••]. ВВИГ считается безопасным для пациентов с инфекциями [10] и неоплазией [90], где иммуносупрессивный подход может быть опасным. Несмотря на то, что в литературе имеется мало данных, ВВИГ можно использовать во время беременности [83]. Основным ограничением использования ВВИГ является их чрезвычайно высокая стоимость, что позволяет использовать их в основном у отдельных пациентов с тяжелой / рефрактерной формой.
Biologics
Ритуксимаб
Ритуксимаб (RTX) представляет собой химерное моноклональное антитело против белка CD20, в основном экспрессирующееся на поверхности В-клеток. Начиная с 2005 г., несколько отчетов о случаях, серий случаев, открытых исследований [91, 92] и отчетов регистратур [93] свидетельствовали о положительном эффекте лечения RTX у пациентов с IIM. Совсем недавно было опубликовано одно рандомизированное контролируемое исследование [94]. До настоящего времени были опубликованы данные более чем 450 рефрактерных пациентов с IIM, получавших RTX, со средней частотой ответа 78.3% [95].
В крупном РКИ, испытании ритуксимаба при миозите (RIM), включающем случаи заболевания как у подростков, так и у взрослых, не удалось достичь первичной конечной точки эффективности [94]. Однако RTX смог снизить клиническую активность и продемонстрировал важный эффект экономии стероидов. В ретроспективном анализе пациенты с антителами против Jo1 или против Mi2 достигли значительного улучшения [96]. В открытом исследовании, проведенном с участием 12 пациентов с положительными антителами к АРС, RTX был эффективен при поражении легких и мышц [97].RTX был определен как наиболее часто используемый биологический препарат при лечении IIM [98 •]. Основные показания для лечения RTX при IIM включают рефрактерное поражение мышц, легких [97, 99], кожи [100 •] или суставов [10]. Пациенты с миозит-специфическими аутоантителами (MSA), по-видимому, лучше реагируют на лечение, особенно пациенты с положительной реакцией на ARS [96, 97, 99], анти-SRP [94, 101] и антитела к Mi-2 [ 96]. Уровни аутоантител против Jo1 и Mi2 снижались после истощения В-клеток и коррелировали со снижением активности заболевания [102].
RTX обычно назначают с двумя инфузиями по 1 г с интервалом 2 недели и могут быть повторены через 6 месяцев. Другие предложенные терапевтические схемы были 375 мг / м 2 еженедельно в течение четырех недель подряд. Клиническое значение периодического мониторинга периферических CD-20-положительных В-клеток еще не выяснено.
Ритуксимаб обычно хорошо переносится, но НЯ встречаются относительно часто. Инфузионные реакции, также тяжелые, являются наиболее частыми НЯ, связанными с лечением RTX; они возникают в основном во время первой инфузии, и их частота снизилась у пациентов, получавших премедикацию внутривенными ГК, жаропонижающими и антигистаминными препаратами [103].Из-за возможного кардиотоксического эффекта рекомендуется сердечный мониторинг во время и после инфузий RTX пациентам с ишемической болезнью сердца в анамнезе [103]. Инфекции во время лечения относительно распространены, включая вирусные и бактериальные инфекции [95], и перед лечением рекомендуется вакцинация от пневмококка и гриппа [104].
Другие биопрепараты
В последние годы различные биотехнологические препараты были протестированы для лечения IIM, но количество пролеченных пациентов невелико, и их использование может быть предложено только тогда, когда другие методы лечения неэффективны.
Абатацепт, гибридный белок, который препятствует иммунной активности Т-клеток, эффективно использовался в отдельных сообщениях о случаях [105]. Недавно небольшое рандомизированное открытое исследование показало возможное влияние внутривенных инфузий абатацепта на мышечную слабость при лечении. резистентные пациенты с ПМ или СД [106 ••]. Несколько испытаний, оценивающих влияние абатацепта при лечении IIM, продолжаются [107].
Хотя фактор некроза опухоли (TNF) может играть роль в патогенезе IIM, лечение пациентов IIM анти-TNFα дало противоречивые результаты.Даже если некоторые авторы сообщили о возможной роли этанерцепта как стероидсберегающего средства при СД [108], другие исследования не подтвердили это наблюдение, и у некоторых пациентов состояние ухудшилось [109]. Несмотря на то, что недавнее рандомизированное контролируемое исследование показало эффективность инфликсимаба (IFX) у некоторых пациентов [110 •], большинство клинических данных были обескураживающими [111, 112]. Более того, некоторые авторы сообщили, что терапия анти-TNF-альфа может вызывать миозит у пациентов с ревматоидным артритом, псориатическим артритом и псориазом [113, 114]. Таким образом, блокаторы TNF обычно не рекомендуются взрослым пациентам с IIM, и их следует использовать только тогда, когда другие методы лечения неэффективны.
Поскольку сообщалось, что интерлейкин (ИЛ) -6 коррелирует с активностью миозита, тоцилизумаб был протестирован с многообещающими результатами в двух описаниях клинических случаев [115, 116]. Испытания, изучающие эффективность тоцилизумаба у пациентов с IIM, продолжаются (Clinicaltrials.gov, {«type»: «клиническое испытание», «attrs»: {«text»: «NCT02043548», «term_id»: «NCT02043548»}} NCT02043548).
Anakinra, антагонист рецептора IL-1, был протестирован в описаниях клинических случаев [117] и в небольшой серии случаев [118], с положительными результатами у некоторых пациентов.
Другие препараты, такие как алемтузумаб [119, 120], сифалимумаб [121], базиликсимаб [122] и тофацитиниб [123], исследуются для лечения IIM, но их использование в повседневной клинической практике не рекомендуется.
Лечение миозита — CreakyJoints
Лечение миозита зависит от его причины. Обычно лечение миозита представляет собой комбинацию лекарств, отдыха и физических упражнений или физиотерапии в фазе выздоровления. Если причиной являются воспалительные состояния, такие как волчанка, может помочь лечение основного заболевания; в противном случае используются кортикостероидные препараты, подавляющие иммунную систему.При полимиозите и дерматомиозите врачи обычно начинают лечение кортикостероидными препаратами. Если это не удается, используются модифицирующие болезнь противоревматические препараты (DMARD). Пациентам, для которых ни одно из этих методов лечения не работает, можно сделать инъекции иммуноглобулинов от доноров крови. Эффективного лечения миозита с включенными тельцами не существует, хотя некоторым людям помогает лечение кортикостероидами и иммуносупрессивная терапия.
Миозит, вызванный гриппом, не лечится сам по себе, поскольку обычно он проходит после того, как грипп разрешился.Эти пациенты должны отдыхать и пить много жидкости или принимать лекарства, отпускаемые без рецепта, от лихорадки и мышечных болей. Если миозит вызван трихинеллезом, врачи назначают антибиотики, убивающие паразита. При пиомиозите, при котором бактерии Staphylococcus («стафилококки») проникают в мышцу, абсцесс иногда удаляют из мышцы с помощью иглы, при этом для борьбы с инфекцией назначают антибиотики. Пациентам, у которых миозит вызван приемом лекарств, врачи прекращают прием лекарств и иногда назначают кортикостероиды для ускорения выздоровления.
Лекарства от миозита
Кортикостероиды, подавляющие иммунную систему, такие как преднизон, азатиоприн и метотрексат, обычно используются для лечения миозита как способ замедлить атаку иммунной системы на здоровые ткани. Безрецептурные болеутоляющие, такие как нестероидные противовоспалительные препараты (НПВП) и аспирин, могут помочь облегчить боль. При полимиозите и дерматомиозите врачи обычно начинают лечение кортикостероидными препаратами, такими как преднизон. Если это не помогает, можно добавить метотрексат (обычно используемый для лечения некоторых форм артрита) или азатиоприн.Пациентам, для которых ни одно из этих методов лечения не работает, используются инъекции иммуноглобулинов от доноров крови. Эффективного лечения миозита с тельцами включения не существует, хотя некоторым людям помогают кортикостероиды и иммунодепрессанты.
Подходы, внемышечные проявления полимиозита, Стационарное и амбулаторное лечение
Автор
Mythili Seetharaman, MD Консультант-ревматолог, ортопедическая ассоциация Аллентауна, филиал больницы St Luke’s University
Mythili Seetharaman, MD является членом следующих медицинских обществ: Американский колледж ревматологии, Американская медицинская ассоциация, Общество ревматологов Пенсильвании
Раскрытие информации: нечего раскрывать.
Главный редактор
Герберт С. Даймонд, доктор медицины Приглашенный профессор медицины, отделение ревматологии, Медицинский центр Нижнего штата Нью-Йорка; Почетный председатель отделения внутренней медицины больницы Западной Пенсильвании
Герберт С. Даймонд, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж врачей, Американский колледж ревматологии, Американская медицинская ассоциация, Phi Beta Kappa
Раскрытие информации: нечего раскрывать.
Благодарности
Майкл С. Бисон, доктор медицины, магистр делового администрирования, FACEP, Профессор неотложной медицины, Колледж медицины и фармации Северо-Восточного Университета Огайо; Лечебный факультет, Акронский общий медицинский центр
Майкл С. Бисон, доктор медицинских наук, магистр делового администрирования, FACEP является членом следующих медицинских обществ: Американского колледжа врачей неотложной помощи, Совета директоров резидентур по неотложной медицине, Национальной ассоциации врачей скорой медицинской помощи и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Thomas H Brannagan III, MD, Адъюнкт-профессор клинической неврологии и директор Центра периферической невропатии Колумбийского университета, Колледж врачей и хирургов; Со-директор лаборатории ЭМГ, Нью-Йоркская пресвитерианская больница, Колумбийский кампус, Нью-Йорк
Томас Браннаган III, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии, Американской ассоциации нейромышечной и электродиагностической медицины и Общества периферических нервов
Раскрытие: Ничего не нужно раскрывать.
Лоуренс Х. Брент, доктор медицины, Адъюнкт-профессор медицины, Медицинский колледж Джефферсона Университета Томаса Джефферсона; Председатель, программный директор, Департамент медицины, Отделение ревматологии, Медицинский центр Альберта Эйнштейна
Лоуренс Х. Брент, доктор медицины, является членом следующих медицинских обществ: Американской ассоциации развития науки, Американской ассоциации иммунологов, Американского колледжа врачей и Американского колледжа ревматологии
Раскрытие информации: Genentech Honoraria Выступление и обучение; Грант Genentech / исследовательские фонды Другое; Амджен Гонорария Выступление и преподавание; Pfizer Honoraria Устная речь и обучение; Abbott Immunology Honoraria Выступление и преподавание; Такеда Хонорария Выступление и обучение; UCB Устная речь и обучение; Гонорар Omnicare Consulting Консультации; Гонорар Centocor Консультации Консультации
Зайнеб Дауд, доктор медицины , консультант, кафедра неврологии, Медицинский колледж Пенсильванского университета Ганемана
Раскрытие информации: Нет
Джино А. Фарина, доктор медицины, FACEP, FAAEM, Доцент кафедры неотложной клинической медицины Медицинского колледжа Альберта Эйнштейна; Программный директор, отделение неотложной медицины, Еврейский медицинский центр Лонг-Айленда
Джино А. Фарина, доктор медицины, FACEP, FAAEM является членом следующих медицинских обществ: Американской академии неотложной медицины, Американского колледжа врачей неотложной помощи и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Франсиско де Ассис Акино Гондим, доктор медицинских наук, магистр наук, доктор философии, Доцент неврологии, кафедра неврологии и психиатрии, медицинский факультет Университета Сент-Луиса
Франсиско де Ассис Акино Гондим, доктор медицинских наук, магистр наук, доктор философии является членом следующих медицинских обществ: Американской академии неврологии, Американской ассоциации нервно-мышечной и электродиагностической медицины и Общества двигательных расстройств
Раскрытие: Ничего не нужно раскрывать.
Аамир Хашмат, доктор медицины , консультант, лаборатория неврологии и нейродиагностики, отделение неврологии, Региональный медицинский центр Джеффа Андерсона
Аамир Хашмат, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии, Американского общества эпилепсии; Американская медицинская ассоциация, Фонд АО
Раскрытие информации: Нет
Milind J Kothari, DO, Профессор и заместитель председателя кафедры неврологии Медицинского колледжа государственного университета Пенсильвании; Консультанты, отделение неврологии, Медицинский центр им. Милтона С. Херши, Государственный университет Пенсильвании,
Milind J Kothari, DO является членом следующих медицинских обществ: Американской академии неврологии, Американской ассоциации нейромышечной и электродиагностической медицины и Американской неврологической ассоциации
Раскрытие: Ничего не нужно раскрывать.
Кристин М. Лор, доктор медицины, магистр медицины, Профессор кафедры внутренней медицины Центра улучшения женского здоровья и отделения ревматологии, директор учебной программы ревматологии Медицинского колледжа Университета Кентукки
Кристин М. Лор, доктор медицины, магистр медицины, является членом следующих медицинских обществ: Американского колледжа врачей, Американского колледжа ревматологии и Американской ассоциации женщин-медиков
Раскрытие: Ничего не нужно раскрывать.
Гленн Лопейт, доктор медицины, Доцент кафедры неврологии отделения нервно-мышечных заболеваний Медицинской школы Вашингтонского университета; Директор неврологической клиники St Louis ConnectCare; Консультант, отделение неврологии, Барнс-Еврейская больница
Гленн Лопейт, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии, Американской ассоциации нервно-мышечной и электродиагностической медицины и Phi Beta Kappa
.Раскрытие: Ничего не нужно раскрывать.
Николас Лоренцо, доктор медицины, Консультации, специалисты по неврологии и консультанты
Николас Лоренцо, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha и Американской академии неврологии
Раскрытие: Ничего не нужно раскрывать.
Генри Розенкранц , доктор медицины, FAAEM, FACEP, отделение неотложной медицины, больница Норвуд
Генри Розенкранц, доктор медицины, FAAEM, FACEP является членом следующих медицинских обществ: Американской академии неотложной медицины и Американского колледжа врачей неотложной помощи
Раскрытие: Ничего не нужно раскрывать.
Эрик Д. Шрага, доктор медицины, Штатный врач, Отделение неотложной медицины, Отделение неотложной медицинской помощи на полуострове Миллс
Франсиско Талавера, фармацевт, доктор философии, Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор, Medscape Drug Reference
Раскрытие информации: Medscape Reference Salary Employment
.