Монотерапия (лечение одним лекарством) ламотриджином в сравнении с монотерапией карбамазепином при эпилепсии
Это обновленная версия Кокрейновского обзора, ранее опубликованного в 11 выпуске 2016 года Кокрейновской базы данных систематических обзоров
Актуальность
Эпилепсия является распространенным неврологическим расстройством, при котором аномальные электрические разряды в головном мозге вызывают повторяющиеся припадки. В этом обзоре мы изучали два типа эпилептических припадков: генерализованные припадки, при которых электрические разряды начинаются в одной части мозга и далее распространяются по мозгу, и парциальные припадки, при которых приступ начинается в одной части мозга (целое полушарие или часть доли мозга), на которую и оказывает воздействие. Парциальные припадки могут становиться генерализованными (вторично-генерализованными) и распространяться из одной части мозга по всему головному мозгу. Примерно у 70% пациентов с эпилепсией возможен контроль генерализованных или парциальных припадков с помощью одного противоэпилептического средства.
Этот обзор применим к людям с парциальными припадками (с вторичной генерализацией или без) и людям с генерализованными тонико-клоническими припадками — особым видом генерализованных припадков. Этот обзор не применим к людям с другими видами генерализованных припадков, таких как абсансы или миоклонические припадки, так как при них рекомендовано другое лечение.
Цель
Карбамазепин и ламотриджин являются средствами первой линии у пациентов с недавно диагностированной эпилепсией. Целью этого обзора было сравнение эффективности этих средств в контроле приступов, поиск связи между средствами и побочными эффектами, которые могли бы приводить к отказу от приема лекарств пациентами, а также прояснение информации, позволяющей сделать выбор между этими средствами.
Методы
Последний поиск клинических испытаний был проведен в феврале 2018 года. Мы оценили доказательства из 14 рандомизированных контролируемых испытаний, посвященных сравнению ламотриджина и карбамазепина. Мы смогли объединить данные от 2572 человек в 9 из 14 испытаний; данные от остальных 1215 человек из пяти испытаний не были доступны для использования в этом обзоре.
Мы смогли объединить данные от 2572 человек в 9 из 14 испытаний; данные от остальных 1215 человек из пяти испытаний не были доступны для использования в этом обзоре.
Результаты
Результаты обзора позволяют предположить, что на ранних сроках лечения пациенты более склонны к отказу от карбамазепина, нежели от ламотриджина. Наиболее распространенной причиной, связанной с медициной, причиной отмены были побочные эффекты: 52% отказов были у участников, принимавших карбамазепин, и 36% отказов у участников, принимавших ламотриджин. Второй наиболее распространенной причиной отказов, связанных с лекарством, было повторение судорог : 58 из 719 отказов (8%) при использовании карбамазепина и 105 из 697 отказов (15%) при использовании ламотриджина.
Результаты позволяют предположить, что повторение судорог после начала лечения ламотриджином может произойти раньше, чем при лечении карбамазепином. Они также позволяют предположить, что такой исход, как отсутствие судорог в течение 6 месяцев, может произойти раньше на карбамазепине, чем ламотриджине.
Наиболее часто во время проведения испытаний участники сообщали о следующих побочных эффектах: головокружение, усталость, расстройства со стороны желудочно-кишечного тракта, головные боли и проблемы с кожей. Об этих побочных эффектах в равной степени сообщали пациенты, принимавшие как ламотриджин, так и карбамазепин.
Качество доказательств
Мы оценили качество доказательств по рецидивам и ремиссиям припадков у пациентов с парциальными припадками как высокое. Качество доказательств по отказам от лечения мы оценили как умеренное. Дизайн испытаний (особенно, знали ли пациенты и лечащие врачи о том, какое лекарство используется) мог повлиять на частоту отказа от лечения. Вплоть до 50% пациентов во включенных испытаниях могли быть ошибочно приняты за страдающих генерализованными припадками./Injured-Leg-1500-56a108ad3df78cafdaa83e81.jpg) Мы оценили качество доказательств по рецидивам и ремиссиям припадков у пациентов с генерализованными припадками как умеренное, в то время как качество доказательств по отказам от лечения было оценено нами как низкое.
Мы оценили качество доказательств по рецидивам и ремиссиям припадков у пациентов с генерализованными припадками как умеренное, в то время как качество доказательств по отказам от лечения было оценено нами как низкое.
Выводы
Ламотриджин и карбамазепин являются эффективными средствами лечения у пациентов с парциальными припадками; следует тщательно делать выбор между ними. Необходимо больше информации для людей с генерализованными припадками. Желательно, чтобы все дальнейшие исследования, посвященные сравнению этих или любых других противоэпилептических средств, были спланированы с использованием высококачественных методов. Помимо этого, особое внимание следует уделять определению видов припадков у участников испытаний, чтобы обеспечить высокое качество результатов.
Рекомендации — Областной наркологический диспансер
Четверг, 30 Июль 2015
В последнее время общественность обеспокоена тем, что многие лекарственные препараты продаются в аптеках без рецепта и применяются гражданами без назначения врача. Абсолютно безопасных лекарств не существует. Даже витамины, если их принимать бесконтрольно и не учитывая рекомендацию врача, могут принести вред. Особую озабоченность вызывает прием без назначения врача лекарственных средств содержащих «прегабалин» и «габапентин».
Абсолютно безопасных лекарств не существует. Даже витамины, если их принимать бесконтрольно и не учитывая рекомендацию врача, могут принести вред. Особую озабоченность вызывает прием без назначения врача лекарственных средств содержащих «прегабалин» и «габапентин».
Лекарственные вещества «прегабалин»
В ряде случаев пациенты нарушают предписанный режим и дозировку приема препарата или принимают его без назначения врача. В этом случае развиваются вредные последствия для организма:
При приеме без назначения врача лекарственных средств, содержащих прегабалин, отмечаются головные боли, дрожание в руках, ногах, шаткая походка, потливость, нечеткость речи, ухудшение памяти, нарушение концентрации внимания, депрессия, снижение полового влечения, заторможенность или психомоторное возбуждение. Отмечается высокий риск совершения самоубийства.
Прием габапентина и его аналогов без назначения врача вызывает нарушения практически во всех системах и органах
Со стороны центральной нервной системы отмечается головокружение, нарушение сна, усталость, повышенная возбудимость, тревожность, раздражительность, в редких случаях возможно депрессивное состояние и нарушение мышления, звон в ушах, ухудшение зрения, снижение памяти.
Сердечно-сосудистая система реагирует резким повышением артериального давления, учащенным сердцебиением, расширением сосудов, снижением числа лейкоцитов.
Нарушается функция желудочно-кишечного тракта: боль в животе, тошнота, рвота, ощущение сухости во рту, метеоризм, панкреатит, нарушение аппетита.
Со стороны мочеполовой системы развивается снижение потенции, недержание мочи.
Возникают боли в суставах, мышцах, в спине, повышенная хрупкость костей.
Часто отмечаются аллергические реакции: зуд, кожная сыпь, лихорадка.
Нередко отмечаются отеки, угревая сыпь, изменение цвета зубов.
Часто развивается привыкание к данным лекарственным средствам.
ПОМНИТЕ:
прием лекарственных средств без назначения врача опасен и чреват непоправимыми последствиями. Чтобы не произошло беды, надо строго следовать только рекомендациям Вашего доктора.
Миоклоническая эпилепсия — причины, симптомы, диагностика и лечение
Миоклоническая эпилепсия — заболевание, основу которого оставляют миоклонические эпилептические пароксизмы. Эпизоды миоклонических судорог у больных сочетаются с генерализованными клонико-тоническими эпиприступами, абсансами. Сопутствующая неврологическая симптоматика зависит от формы эпилепсии. Диагностика включает сбор анамнеза, оценку неврологического и психического статуса, электроэнцефалографию, генеалогический анализ, биохимические исследования, нейровизуализацию. Лечение проводится антиконвульсантами, при резистентности — комбинацией противоэпилептических препаратов.
Общие сведения
Миоклонические судороги (миоклонии) представляют собой непроизвольные сокращения отдельной мышцы/мышечной группы. Соответственно, эпилепсия с преобладанием в клинической картине миоклоний получила название миоклоническая. Понятие «миоклоническая эпилепсия» (МЭ) включает ряд заболеваний, разнородных по этиопатогенезу, возрасту дебюта, особенностям симптоматики. В подавляющем большинстве случаев они характеризуется сочетанием миоклоний и генерализованных тонико-клонических судорожных приступов, имеют генетическую обусловленность. Встречаемость МЭ различна, некоторые нозологические формы являются настолько редкими, что в литературе по неврологии описано не более 100 клинических случаев.
Миоклоническая эпилепсия
Причины миоклонической эпилепсии
Обычно ведущим является генетический фактор. Чёткое аутосомно-доминантное наследование прослеживается при синдроме Драве, аутосомно-рецессивное — в отдельных случаях ранней миоклонической энцефалопатии. Некоторые заболевания имеют полигенное наследование. Локализация генетических дефектов установлена не для всех наследственных форм, исследования в этом направлении продолжаются. К генетически детерминированным патологиям относится и симптоматическая МЭ, возникающая вследствие дисметаболических процессов, обусловленных наличием дефектных генов. Образованию спонтанных мутаций в геноме способствуют:
Некоторые заболевания имеют полигенное наследование. Локализация генетических дефектов установлена не для всех наследственных форм, исследования в этом направлении продолжаются. К генетически детерминированным патологиям относится и симптоматическая МЭ, возникающая вследствие дисметаболических процессов, обусловленных наличием дефектных генов. Образованию спонтанных мутаций в геноме способствуют:
- Внутриутробные инфекции. Инфекционный процесс неблагоприятно отражается на развитии плода. Особенно опасны вирусные инфекции, поскольку вирусы способны провоцировать аномальную перестройку отдельных генов.
- Хронические заболевания беременной. Сахарный диабет, сердечная недостаточность, хронические заболевания лёгких, эндокринная патология матери приводят к гипоксии, метаболическим расстройствам на ранних стадиях развития зародыша. В результате происходят сбои формирования ЦНС, отдельных механизмов обмена веществ.
- Повышенный радиоактивный фон.
 Радиация оказывает мутагенное влияние на живые организмы. Развивающийся плод наиболее подвержен подобному воздействию. Следствием является возникновение структурных, дисметаболических, функциональных аномалий, влекущих за собой повышенную эпилептическую активность.
Радиация оказывает мутагенное влияние на живые организмы. Развивающийся плод наиболее подвержен подобному воздействию. Следствием является возникновение структурных, дисметаболических, функциональных аномалий, влекущих за собой повышенную эпилептическую активность. - Прием тератогенных медикаментов. Самолечение, незнание о своей беременности в раннем периоде, медицинская необходимость фармакотерапии приводят к приёму опасных для плода медикаментов. Химические вещества оказывают повреждающее воздействие на отдельные гены, вносят изменения в существующие метаболические механизмы.
- Токсические воздействия на плод. Алкоголизм, наркомания, курение женщины в период беременности сопровождаются проникновением токсических веществ в организм плода. Подобно тератогенным фармпрепаратам они способны повредить отдельный локус генома, в результате возникает миоклоническая эпилепсия.
Патогенез
Идиопатические варианты МЭ развиваются вследствие генетически обусловленной повышенной возбудимости церебральных нейронов, приводящей к эпилептогенной активности мозга. Симптоматическая миоклоническая эпилепсия формируется в результате обменных нарушений, накопления в нервных клетках патологических соединений (полисахаридных включений, прионных белков).
Симптоматическая миоклоническая эпилепсия формируется в результате обменных нарушений, накопления в нервных клетках патологических соединений (полисахаридных включений, прионных белков).
При болезни Лафоры, миоклонической энцефалопатии младенцев повышенная эпиактивность обусловлена дисметаболизмом нейронов в условиях разрастания глиальных элементов (при гибели нейронов, нарушении апоптоза астроцитов). Нейрональная гипервозбудимость вызывает возникновение патологической нервной импульсации, идущей к мышечным волокнам. Результатом являются отдельные мышечные сокращения (миоклонии), тонические, клонические судороги. Различная локализация миоклоний отражает локальное возбуждение разных зон мозговой коры. При диффузном распространении гипервозбуждения возникает клонико-тонический пароксизм с тотальным вовлечением мышечных групп.
Классификация
В основе группировки отдельных видов МЭ лежит этиологический принцип. Согласно Международной классификации эпилепсии 1989 года выделяют 3 основные группы:
- Идиопатические — наследственно обусловленные формы.
 Характерна манифестация симптоматики в детском/подростковом возрасте. Идиопатическими являются доброкачественная миоклоническая эпилепсия младенчества (ДМЭМ), юношеская миоклоническая эпилепсия (ЮМЭ), болезнь Унферрихта-Лундборга, синдром Драве.
Характерна манифестация симптоматики в детском/подростковом возрасте. Идиопатическими являются доброкачественная миоклоническая эпилепсия младенчества (ДМЭМ), юношеская миоклоническая эпилепсия (ЮМЭ), болезнь Унферрихта-Лундборга, синдром Драве. - Криптогенные — не имеющие установленной этиологии. Отличаются выраженной резистентностью к фармакотерапии, наличием сопутствующей очаговой симптоматики, интеллектуального дефицита. К криптогенным относятся эпилепсия с миоклонически-астатическими приступами, эпилепсия с миоклоническими абсансами.
- Симптоматические — возникающие на фоне происходящих в организме патологических процессов. В большинстве случаев обусловлены метаболическими нарушениями. Симптоматическими считаются ранняя миоклоническая энцефалопатия, болезнь Лафоры, миоклонические пароксизмы при подостром склерозирующем панэнцефалите, болезни Крейтцфельдта-Якоба.
Впоследствии были выявлены генетические аспекты возникновения криптогенных форм МЭ. Учитывая результаты исследований, Международное общество неврологов предложило относить ранее считавшиеся криптогенными виды МЭ к идиопатическим.
Учитывая результаты исследований, Международное общество неврологов предложило относить ранее считавшиеся криптогенными виды МЭ к идиопатическим.
Симптомы миоклонической эпилепсии
Базовым симптомом выступают пароксизмы миоклоний, затрагивающие различные мышечные группы конечностей, реже — лица, еще реже — туловища. Миоклонии выглядят как мышечные подёргивания, при вовлечении мышц одной группы сокращения приводят к непроизвольным двигательным актам, напоминающим гиперкинезы. Миоклонический эпилептический пароксизм происходит при сохранённом сознании, может протекать с перемещением сокращений по различным мышцам. Миоклоническая эпилепсия характеризуется комбинацией миоклоний с клонико-тоническими приступами и/или абсансами. В зависимости от нозологической формы наблюдаются задержка психического развития, атаксия, пирамидная недостаточность, расстройства мышечного тонуса, зрительные нарушения.
ДМЭМ дебютирует в возрастном периоде от 6 месяцев до 3 лет. Приступы захватывают верхние конечности, лицо, шею, могут имитировать наклон головы, моргание, кивки головой. Заболевание редко сопровождается интеллектуальным снижением. Миоклоническая эпилепсия юношеского возраста (манифестация в возрасте 12-18 лет) отличается присоединением тонико-клонических эпизодов, отсутствием неврологического дефицита. Синдром Драве клинически проявляется на первом году жизни, сопровождается олигофренией, нарушениями поведения, пирамидным дефицитом. Семейная миоклония Унферрихта-Лундборга начинается в 5-16 лет, сочетается с тремором, атаксией, дизартрией, психическими расстройствами.
Приступы захватывают верхние конечности, лицо, шею, могут имитировать наклон головы, моргание, кивки головой. Заболевание редко сопровождается интеллектуальным снижением. Миоклоническая эпилепсия юношеского возраста (манифестация в возрасте 12-18 лет) отличается присоединением тонико-клонических эпизодов, отсутствием неврологического дефицита. Синдром Драве клинически проявляется на первом году жизни, сопровождается олигофренией, нарушениями поведения, пирамидным дефицитом. Семейная миоклония Унферрихта-Лундборга начинается в 5-16 лет, сочетается с тремором, атаксией, дизартрией, психическими расстройствами.
Миоклонически-астатические пароксизмы отличаются возникающей на фоне миоклоний потерей устойчивости. Пациенты описывают приступ как «удар под коленки», «подкашивание ног», вынуждающее становиться на колени, падать. Миоклонические абсансы представляют собой эпизоды кратковременного отключения сознания с миоклоническими сокращениями плечевого пояса, мышц конечностей, периорбитальной области.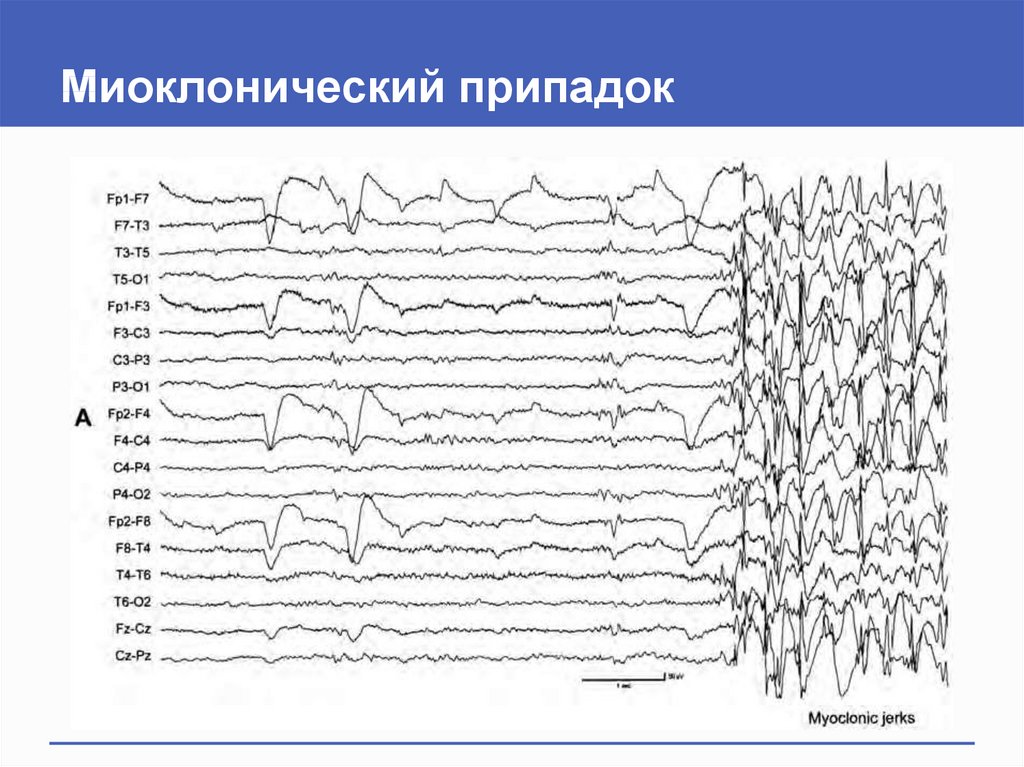 Заболевание возникает у детей 2-12 лет.
Заболевание возникает у детей 2-12 лет.
Миоклоническая эпилепсия симптоматического характера отличается прогрессированием симптоматики, выраженным когнитивным дефицитом, прочими неврологическими нарушениями, наличием проявлений основного заболевания, клинико-лабораторных признаков метаболических расстройств.
Осложнения
Клонико-тонические, астатические приступы осложняются травмированием пациента вследствие падения. Генерализованные судороги с утратой сознания опасны западением языка, перекрытием дыхательных путей и асфиксией. Аспирация слюны, рвотных масс приводит к последующему развитию пневмонии. Длительный миоклонический пароксизм, непрерывно следующие кластерные сокращения перерастают в миоклонический эпистатус. В эпилептическом статусе возможны серьёзные дыхательные расстройства, остановка сердца, развитие отёка головного мозга.
Диагностика
Миоклоническая симптоматика входит в клинику многих болезней, эпилептических синдромов. Диагноз «миоклоническая эпилепсия» устанавливается только при превалировании миоклонических приступов над другими клиническими проявлениями. Диагностика направлена на верификацию нозологической формы эпилепсии, при выявлении вторичного характера миоклоний — на поиск основной патологии. Основными диагностическими этапами являются:
Диагноз «миоклоническая эпилепсия» устанавливается только при превалировании миоклонических приступов над другими клиническими проявлениями. Диагностика направлена на верификацию нозологической формы эпилепсии, при выявлении вторичного характера миоклоний — на поиск основной патологии. Основными диагностическими этапами являются:
- Сбор анамнестических данных. Большое значение имеет возраст дебюта, характер начала, порядок развития симптоматики.
- Неврологический осмотр. Проводится неврологом, направлен на выявление миоклонических сокращений, очагового дефицита, определение уровня психического развития, степени когнитивных расстройств, оценку психического статуса.
- Электроэнцефалография. У большинства пациентов регистрируются диффузные интериктальные симметричные эпилептогенные разряды, иктальные высокоамплитудные спайки. В ряде случаев для выявления эпиактивности требуется суточный ЭЭГ-видеомониторинг, проведение провокационных проб (ЭЭГ при вспышках света, гипервентиляции, резких звуковых сигналах).
 Результаты исследований оцениваются нейрофизиологом, эпилептологом.
Результаты исследований оцениваются нейрофизиологом, эпилептологом. - Нейровизуализация. До закрытия родничков осуществляется путём нейросонографии, у детей старше года — при помощи МРТ головного мозга. Взрослым может проводиться МСКТ. Морфологические изменения церебральных тканей характерны для симптоматических МЭ.
- Лабораторные исследования. Производятся при подозрении на наличие обменных расстройств. Включают биохимический анализ крови и мочи, специфические анализы.
- Консультация генетика. Сбор семейного анамнеза, составление генеалогического древа позволяют определить наследственный характер эпилепсии, установить тип наследования.
Дифференциальная диагностика осуществляется с неэпилептическим миоклонусом, отличительной особенностью которого выступает фокальный характер миоклоний, отсутствие реакции на провокацию, нормальная ЭЭГ-картина. Дифференцировка МЭ необходима также с судорожным синдромом инфекционной этиологии, фебрильными судорогами, синдромом Леннокса-Гасто, мозжечковой миоклонической диссинергией Ханта.
Лечение миоклонической эпилепсии
Терапия базируется на антиконвульсантах. Подбор фармпрепарата и дозировки осуществляется индивидуально. Препаратами выбора выступают производные вальпроевой кислоты, обладающие противоэпилептическим эффектом в равной степени в отношении миоклонических, клонико-тонических, абсансных пароксизмов. В фармакорезистентных случаях показано комбинированное лечение вальпроатами, бензодиазепинами, этосуксимидом, барбитуратами, антиконвульсантами нового поколения (топираматом, леветирацетамом). Важным моментом является исключение провоцирующих приступы факторов: резких звуков, вспышек света, эмоциональных всплесков, физических перегрузок, перегреваний.
Прогноз и профилактика
Наиболее прогностически неблагоприятна ранняя миоклоническая энцефалопатия, смертность составляет половину случаев заболевания, остальные дети являются глубокими инвалидами. Миоклоническая эпилепсия при болезни Лафоры, Крейтцфельдта-Якоба плохо поддаётся противоэпилептической терапии, сопровождается прогрессирующим интеллектуальным распадом.2006/59/3.png) ДМЭМ и ЮМЭ отличаются доброкачественным течением, редко приводят к когнитивному дефициту. Более 50% случаев ДМЭ заканчиваются спонтанным выздоровлением.
ДМЭМ и ЮМЭ отличаются доброкачественным течением, редко приводят к когнитивному дефициту. Более 50% случаев ДМЭ заканчиваются спонтанным выздоровлением.
МЭ не имеет специфических мер профилактики. К мероприятиям, способным предупредить рождение больного ребёнка, относятся планирование беременности, ранняя постановка на учёт, исключение неблагоприятных воздействий на плод. Ведение беременности должно включать разъяснительные беседы с женщиной по поводу необходимости охранительного режима, тератогенной опасности лекарственных средств, пагубного воздействия на будущего ребёнка вредных привычек.
Юношеская миоклоническая эпилепсия (для родителей)
Что такое ювенильная миоклоническая эпилепсия?
У детей с ювенильной миоклонической эпилепсией миоклонические припадки обычно начинаются в подростковом возрасте. У них также могут быть абсансы и генерализованные тонико-клонические приступы.
Судороги могут происходить реже в зрелом возрасте, но лекарства, скорее всего, понадобятся на всю жизнь.
Каковы признаки и симптомы миоклонического припадка у несовершеннолетних?
При ювенильной миоклонической (my-uh-KLON-ik) эпилепсии могут возникать различные типы припадков.Типы и их симптомы:
Миоклонические припадки
При миоклоническом припадке ребенок:
- имеет короткие мышечные подергивания или подергивания в предплечьях, плечах или шее
- имеет движения с обеих сторон корпуса одновременно
- обычно бодрствует и может ясно мыслить во время и сразу после припадка
Отсутствие изъятий
Приступ отсутствия начинается внезапно в середине активности и внезапно заканчивается.Во время изъятия у ребенка:
- «пропадает» или имеет заклинания пристального взгляда, которые длятся 5–20 секунд
- могут трепетать глазами или смотреть вверх
- не знает, что происходит во время захвата
- возвращается к нормальной активности и не будет вспоминать приступ после того, как будет более
Тонико-клонические судороги
При этом типе припадка у ребенка:
- судороги или ригидные мышцы и ритмичные подергивания тела
- закатывает глаза
- кричит
- может писать или какать
- не может ответить во время занятия
- смущен и сонлив после захвата
Приступы при ювенильной миоклонической эпилепсии обычно происходят в течение 30 минут после пробуждения утром или после дневного сна. Они более вероятны, когда кто-то устал или находится в стрессе.
Они более вероятны, когда кто-то устал или находится в стрессе.
Что вызывает юношескую миоклоническую эпилепсию?
Ювенильная миоклоническая эпилепсия в основном вызвана генетическими изменениями (мутациями). Обычно это происходит в семьях.
Как диагностируется ювенильная миоклоническая эпилепсия?
Если у ребенка эпилептический припадок, врачи будут искать причину. Детям, у которых был припадок, может потребоваться посещение детского невролога (врача, который занимается лечением заболеваний головного мозга, позвоночника и нервной системы).Тесты могут включать:
- ЭЭГ для измерения волновой активности мозга.
- ВЭЭГ, или видеоэлектроэнцефалография (ЭЭГ с видеозаписью)
- Компьютерная томография или МРТ для получения очень подробных изображений головного мозга и исключения других причин припадков
Как лечится юношеская миоклоническая эпилепсия?
Приступы обычно хорошо купируются лекарствами. Если это не так, врачи могут попробовать другие методы лечения.
Если это не так, врачи могут попробовать другие методы лечения.
Чем могут помочь родители?
Чтобы помочь вашему ребенку лучше жить с эпилепсией, обязательно следуйте рекомендациям невролога:
- принимать любые лекарства
- Избегание триггеров (таких как чрезмерный стресс, недостаток сна, мигание света, употребление алкоголя, некоторые виды лекарств)
- Меры предосторожности при плавании или купании
- , может ли ваш подросток водить машину
- , следует ли вашему ребенку носить медицинский браслет для удостоверения личности
Чтобы обезопасить своего ребенка во время припадка, убедитесь, что другие взрослые и лица, осуществляющие уход (члены семьи, няни, учителя, тренеры и т. Д.)) Знать, что делать.
Юношеская миоклоническая эпилепсия — это пожизненное заболевание. Когда придет время, помогите своему ребенку успешно перейти на лечение взрослых.
Что еще мне нужно знать?
Если у вашего ребенка эпилепсия, убедите его, что он не одинок. Ваш врач и медицинский персонал могут ответить на вопросы и предложить поддержку. Они также могут порекомендовать местную группу поддержки. Интернет-организации тоже могут помочь, например:
Ваш врач и медицинский персонал могут ответить на вопросы и предложить поддержку. Они также могут порекомендовать местную группу поддержки. Интернет-организации тоже могут помочь, например:
Миоклоническая эпилепсия в младенчестве или раннем детстве: история вопроса, патофизиология, этиология
Автор
Майкл Круер, доктор медицины Директор, программы нейрогенетики и детских двигательных расстройств, Неврологический институт Барроу, Детская больница Феникса; Доцент кафедры детского здоровья и неврологии, Междисциплинарная программа магистратуры по генетике, Медицинский колледж Университета Аризоны в Фениксе
Майкл Круер, доктор медицины, является членом следующих медицинских обществ: Американской академии церебрального паралича и медицины развития, США. Академия неврологии, Американская академия педиатрии, Американская неврологическая ассоциация, Американская ассоциация ученых-терапевтов, Американское общество клеточной биологии, Американское общество генетики человека, Общество детской неврологии, Международная ассоциация детской неврологии, Общество митохондриальной медицины, Общество двигательных расстройств
Раскрытие: Нечего раскрывать.
Соавтор (ы)
Raj D Sheth, MD Руководитель отделения детской неврологии детской клиники Nemours; Профессор неврологии Медицинской школы Аликс клиники Мэйо; Профессор педиатрии Медицинского колледжа Университета Флориды
Радж Д. Шет, доктор медицины, является членом следующих медицинских обществ: Американской академии неврологии, Американской академии педиатрии, Американского общества эпилепсии, Американской неврологической ассоциации, Общества детской неврологии
Раскрытие информации : Нечего раскрывать.
Главный редактор
Стивен Л. Нельсон, младший, доктор медицины, доктор философии, FAACPDM, FAAN, FAAP, FANA Профессор педиатрии, неврологии, нейрохирургии и психиатрии, медицинский директор Тулейнского центра аутизма и родственных расстройств Медицинской школы Тулейнского университета; Детский невролог и эпилептолог, Детский госпиталь Окснера; Профессор неврологии, Медицинский факультет Университета штата Луизиана
Стивен Л. Нельсон, младший, доктор медицинских наук, FAACPDM, FAAN, FAAP, FANA является членом следующих медицинских обществ: Американской академии церебрального паралича и медицины развития, Американской академии Неврология, Американская академия педиатрии, Американское общество эпилепсии, Американская медицинская ассоциация, Американская неврологическая ассоциация, Ассоциация военных хирургов США, Общество детской неврологии, Южное общество педиатрической неврологии
Нельсон, младший, доктор медицинских наук, FAACPDM, FAAN, FAAP, FANA является членом следующих медицинских обществ: Американской академии церебрального паралича и медицины развития, Американской академии Неврология, Американская академия педиатрии, Американское общество эпилепсии, Американская медицинская ассоциация, Американская неврологическая ассоциация, Ассоциация военных хирургов США, Общество детской неврологии, Южное общество педиатрической неврологии
Раскрытие информации: служить (d) в качестве докладчика или члена бюро спикеров для: BioMarin; LivaNova; Supernus; Sunovion
Полученный доход в размере 250 долларов США или более от: BioMarin; Американский совет педиатрии; LivaNova.
Благодарности
Джеймс Дж. Ривьелло-младший, доктор медицины Заведующий кафедрой педиатрии, профессор педиатрии, отдел неврологии и нейробиологии развития, профессор неврологии отделения нейрофизиологии Питера Келлавея Медицинского колледжа Бейлора; Заведующий нейрофизиологией, директор программы эпилепсии и нейрофизиологии Детской больницы Техаса
Раскрытие информации: актуальный редактор раздела роялти
Франсиско Талавера, фармацевт, доктор философии, Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Reference Salary Employment
Что такое миоклонические приступы?
Фишер Р.С., ван Эмде Боас В., Блюм В. и др.Эпилептические припадки и эпилепсия: определения, предложенные Международной лигой против эпилепсии (ILAE) и Международным бюро эпилепсии (IBE). Эпилепсия . 2005 апр. 46 (4): 470-2. [Медлайн].
Rho JM, Sankar R, Cavazos JE. Эпилепсия: научные основы клинической практики .Нью-Йорк, Нью-Йорк: Марсель Деккер; 2004.
Kramer MA, Cash SS. Эпилепсия как нарушение организации корковой сети. Невролог . 2012 18 августа (4): 360-72. [Медлайн].
Houser CR, Esclapez M. Уязвимость и пластичность системы ГАМК в пилокарпиновой модели спонтанных рецидивирующих приступов. Epilepsy Res . 1996 26 декабря (1): 207-18. [Медлайн].
Sloviter RS. Повреждение нейронов, вызванное эпилептическим статусом, и реорганизация сети. Эпилепсия . 1999. 40 (приложение 1): S34-9; обсуждение S40-1. [Медлайн].
Scharfman HE, Schwartzkroin PA. Защита зубчатых прикорневых клеток от длительной стимуляции хелатированием внутриклеточного кальция. Наука . 1989, 13 октября. 246 (4927): 257-60. [Медлайн].
Cavazos JE, Das I, Sutula TP. Потеря нейронов, индуцированная киндлингом в лимбических путях: доказательства индукции склероза гиппокампа повторными кратковременными припадками. Дж. Neurosci . 1994 Май. 14 (5 пт 2): 3106-21. [Медлайн].
Sutula T, Cascino G, Cavazos J, et al. Синаптическая реорганизация мшистых волокон в височной доле эпилепсии человека. Энн Нейрол . 1989 Сентябрь 26 (3): 321-30. [Медлайн].
Мастранджело М., Леуцци В. Гены эпилептических энцефалопатий с ранним началом: от генотипа к фенотипу. Педиатр Нейрол . 2012 Январь 46 (1): 24-31. [Медлайн].
2012 Январь 46 (1): 24-31. [Медлайн].
Маккормик DA.Клеточные механизмы, лежащие в основе холинергической и норадренергической модуляции режима возбуждения нейронов в дорсальном латеральном коленчатом ядре кошек и морских свинок. Дж. Neurosci . 1992, 12 января (1): 278-89. [Медлайн].
Хосфорд Д.А., Кларк С., Цао З. и др. Роль активации рецептора ГАМКВ при абсансных приступах летаргических (lh / lh) мышей. Наука . 1992, 17 июля. 257 (5068): 398-401. [Медлайн].
Hagberg B, Hanefeld F, Percy A, Skjeldal O.Обновленная информация о клинически применимых диагностических критериях синдрома Ретта. Комментарии к Консенсусной группе по клиническим критериям синдрома Ретта на заседании Европейского общества педиатрических неврологов, Баден-Баден, Германия, 11 сентября 2001 г. Eur J Paediatr Neurol . 2002. 6 (5): 293-7. [Медлайн].
2002. 6 (5): 293-7. [Медлайн].
Steffenburg U, Hagberg G, Hagberg B. Эпилепсия в репрезентативной серии синдрома Ретта. Acta Paediatr . 2001, январь 90 (1): 34-9. [Медлайн].
Whalen S, Héron D, Gaillon T., Moldovan O, Rossi M, Devillard F, et al.Новая комплексная стратегия диагностики синдрома Питта-Хопкинса: клиническая оценка и дальнейшее определение мутационного спектра TCF4. Хум Мутат . 2012 января 33 (1): 64-72. [Медлайн].
Роуч Е.С., Спарагана СП. Диагностика туберозного комплекса склероза. J Детский нейрол . 2004 сентября 19 (9): 643-9. [Медлайн].
Kao A, Mariani J, McDonald-McGinn DM, Maisenbacher MK, Brooks-Kayal AR, Zackai EH, et al. Повышенная распространенность неспровоцированных судорог у пациентов с 22q11. 2 удаления. Ам Дж. Мед Генет А . 2004 15 августа. 129A (1): 29-34. [Медлайн].
2 удаления. Ам Дж. Мед Генет А . 2004 15 августа. 129A (1): 29-34. [Медлайн].
Battaglia A, Filippi T, South ST, Carey JC. Спектр эпилепсии и паттерны электроэнцефалограммы при синдроме Вольфа-Хиршхорна: опыт с 87 пациентами. Дев Мед Детский Нейрол . 2009 Май. 51 (5): 373-80. [Медлайн].
Battaglia A, Hoyme HE, Dallapiccola B, Zackai E., Hudgins L, McDonald-McGinn D, et al. Дальнейшее определение синдрома делеции 1p36 у 60 пациентов: узнаваемый фенотип и частая причина задержки развития и умственной отсталости. Педиатрия . 2008 Февраль 121 (2): 404-10. [Медлайн].
Hauser WA, Annegers JF, Rocca WA. Описательная эпидемиология эпилепсии: вклад популяционных исследований из Рочестера, Миннесота. Mayo Clin Proc . 1996 июнь 71 (6): 576-86. [Медлайн].
Людерс Х., Ачарья Дж., Баумгартнер С. и др. Семиологическая классификация приступов. Эпилепсия . 1998 Сентябрь 39 (9): 1006-13. [Медлайн].
Loddenkemper T, Kellinghaus C, Wyllie E, Najm IM, Gupta A, Rosenow F. Предложение по пятимерной классификации эпилепсии, ориентированной на пациента. Эпилептическое расстройство . 2005 Декабрь 7 (4): 308-16. [Медлайн].
Энгель мл.Отчет основной группы классификации ILAE. Эпилепсия . 2006 Сентябрь 47 (9): 1558-68. [Медлайн].
Вольф П. Основные принципы классификации синдромов ILAE. Epilepsy Res . 2006 г., август 70, приложение 1: S20-6. [Медлайн].
Epilepsy Res . 2006 г., август 70, приложение 1: S20-6. [Медлайн].
Берг А.Т., Беркович С.Ф., Броди М.Дж. и др. Пересмотренная терминология и концепции для организации припадков и эпилепсий: отчет Комиссии ILAE по классификации и терминологии, 2005-2009 гг. Эпилепсия . 2010 апр. 51 (4): 676-85. [Медлайн].
Энгель-младший. Предлагаемая схема диагностики для людей с эпилептическими припадками и эпилепсией: отчет Рабочей группы ILAE по классификации и терминологии. Эпилепсия . 2001 июн. 42 (6): 796-803. [Медлайн].
Вольф П. Капуста и короли: некоторые соображения по классификации, диагностическим схемам, семиологии и концепциям. Эпилепсия . 2003 Янв.44 (1): 1-4; обсуждение 4-13. [Медлайн].
Беги Э. Концепция синдрома эпилепсии: насколько она полезна в клинической практике ?. Эпилепсия . 2009 Май. 50 дополнение 5: 4-10. [Медлайн].
Эпилепсия . 2009 Май. 50 дополнение 5: 4-10. [Медлайн].
[Рекомендации] Чен Д.К., Со Ю.Т., Фишер Р.С. Использование пролактина в сыворотке для диагностики эпилептических припадков: отчет Подкомитета по оценке терапии и технологий Американской академии неврологии. Неврология . 2005 13 сентября. 65 (5): 668-75.[Медлайн].
Первая судебная группа по изъятию (FIR.S.T Group). Рандомизированное клиническое испытание эффективности противоэпилептических препаратов в снижении риска рецидива после первого неспровоцированного тонико-клонического приступа. Неврология . 1993, 43 марта (3, п.1): 478-83. [Медлайн].
Glauser TA, Cnaan A, Shinnar S, et al, для исследовательской группы детской абсансной эпилепсии. Этосуксимид, вальпроевая кислота и ламотриджин при абсансной эпилепсии у детей. N Engl J Med .2010 г., 4 марта. 362 (9): 790-9. [Медлайн].
Ng YT, Конри Дж. А., Драммонд Р., Штолле Дж., Вайнберг Массачусетс. Результаты рандомизированного исследования III фазы клобазама при синдроме Леннокса-Гасто. Неврология . 11 октября 2011 г. 77 (15): 1473-1481. [Медлайн].
Bastings E. Письмо об одобрении заявки на новое лекарственное средство (NDA): капсулы с пролонгированным высвобождением Qudexy XR (топирамат). NDA нет. 205122. Доступно по адресу https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2014/205122Orig1s000ltr.pdf. Доступ: 14 марта 2014 г.
Qudexy XR: Текст маркировки одобрения FDA от 11 марта 2014 г. Доступно на https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/205122s000lbl.pdf. Доступ: 14 марта 2014 г.
Джеффри С. FDA одобрило еще один топирамат с расширенным высвобождением для лечения эпилепсии. Медицинские новости Medscape . 13 марта 2014 г. [Полный текст].
Upsher-Smith Laboratories, Inc. Апшер-Смит получает одобрение FDA на капсулы с пролонгированным высвобождением Qudexy XR (топирамат) [пресс-релиз].12 марта 2014 г. Доступно по адресу https://www.upsher-smith.com/wp-content/uploads/108885.01-QXR-PR-FDA-Approval-FINAL.pdf. Доступ: 14 марта 2014 г.
Marson AG, Al-Kharusi AM, Alwaidh M и др. Для исследовательской группы SANAD. Исследование SANAD эффективности вальпроата, ламотриджина или топирамата при генерализованной и неклассифицируемой эпилепсии: неслепое рандомизированное контролируемое исследование. Ланцет . 2007 24 марта. 369 (9566): 1016-26. [Медлайн].
Брукс М.Леветирацетам, принимаемый во время беременности, признан безопасным для развития нервной системы ребенка. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/818902. Доступ: 16 января 214.
Шеллкросс Р., Бромли Р.Л., Чейн С.П., Гарсия-Финьяна М., Ирвин Б., Морроу Дж. И др. Воздействие леветирацетама по сравнению с вальпроатом внутриутробно: развитие и речь в 3-летнем возрасте. Неврология . 2014 8 января [Medline].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.FDA одобряет Fycompa для лечения судорог. 22 октября 2012 г. Доступно по адресу https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm325038.htm. Дата обращения: 19 сентября 2013 г.
Mattson RH, Cramer JA, Collins JF и др. Сравнение карбамазепина, фенобарбитала, фенитоина и примидона при парциальных и вторично генерализованных тонико-клонических припадках. N Engl J Med . 18 июля 1985 г. 313 (3): 145-51. [Медлайн].
Mattson RH, Cramer JA, Collins JF.Сравнение вальпроата и карбамазепина для лечения сложных парциальных припадков и вторично генерализованных тонико-клонических припадков у взрослых. Отделение по делам ветеранов Эпилепсии Кооперативная исследовательская группа № 264. N Engl J Med . 1992, 10 сентября. 327 (11): 765-71. [Медлайн].
Роуэн А.Дж., Рамзи Р.Э., Коллинз Дж.Ф. и др. Для группы VA Cooperative Study 428. Новое начало гериатрической эпилепсии: рандомизированное исследование габапентина, ламотриджина и карбамазепина. Неврология . 2005, 14 июня. 64 (11): 1868-73. [Медлайн].
Marson AG, Al-Kharusi AM, Alwaidh M и др., Для исследовательской группы SANAD. Исследование SANAD эффективности карбамазепина, габапентина, ламотриджина, окскарбазепина или топирамата для лечения парциальной эпилепсии: неслепое рандомизированное контролируемое исследование. Ланцет . 2007 24 марта. 369 (9566): 1000-15. [Медлайн].
French JA, Kanner AM, Bautista J, et al, для Подкомитета по оценке терапевтических средств и технологий AAN; Подкомитет по стандартам качества AAN; и AES.Эффективность и переносимость новых противоэпилептических препаратов I: лечение впервые возникшей эпилепсии: отчет Подкомитета по оценке терапевтических средств и технологий и Подкомитета по стандартам качества Американской академии неврологии и Американского общества эпилепсии. Неврология . 2004, 27 апреля. 62 (8): 1252-60. [Медлайн].
French JA, Kanner AM, Bautista J, et al. Для Подкомитета по оценке терапевтических средств и технологий AAN; Подкомитет по стандартам качества AAN; и AES.Эффективность и переносимость новых противоэпилептических препаратов. II: лечение рефрактерной эпилепсии. Отчет Подкомитета по оценке терапии и технологий и Подкомитета по стандартам качества Американской академии неврологии и Американского общества эпилепсии. Неврология . 2004, 27 апреля. 62 (8): 1261-73. [Медлайн].
Герман А.О. Противосудорожный препарат, связанный с аномалиями сетчатки, обесцвечиванием кожи. Первые часы врача . 29 апреля 2013 г.[Полный текст].
Джеффри С. Изменения в этикетке FDA подчеркивают риски, связанные с эзогабином. Медицинские новости Medscape . 31 октября 2013 г. [Полный текст].
FDA. Сообщение FDA по безопасности лекарств: FDA одобряет изменения на этикетке противосудорожного препарата Potiga (эзогабин), описывающие риск аномалий сетчатки, потенциальной потери зрения и обесцвечивания кожи. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США . 31 октября 2013 г. Доступно по адресу https://www.fda.gov/Drugs/DrugSafety/ucm372774.htm.
Kwan P, Arzimanoglou A, Berg AT, Brodie MJ, Allen Hauser W., Mathern G, et al. Определение лекарственно-устойчивой эпилепсии: согласованное предложение специальной рабочей группы Комиссии ILAE по терапевтическим стратегиям. Эпилепсия . 2010 июн. 51 (6): 1069-77. [Медлайн].
Ramos-Lizana J, Rodriguez-Lucenilla MI, Aguilera-López P, Aguirre-Rodríguez J, Cassinello-García E. Исследование лекарственно-устойчивой детской эпилепсии, проверяющее новые критерии ILAE. Захват . 2012 май. 21 (4): 266-72. [Медлайн].
Иорио Р., Ассенца Дж., Делла Марка Дж. И др. Нервные аутоантитела и иммунотерапевтическая эпилепсия: проспективное исследование [аннотация 1956]. Представлено на: XXI Всемирном конгрессе неврологов (WNC), 2013; 22 сентября 2013 г .; Вена, Австрия. [Полный текст].
Келлер ДМ. Иммунотерапия помогает больным эпилепсией с помощью нейрональных антител. Медицинские новости Medscape . 27 сентября 2013 г.[Полный текст].
[Рекомендации] Harden CL, Pennell PB, Koppel BS и др. Для AAN и AES. Вопросы ведения женщин с эпилепсией — акцент на беременности (обзор, основанный на фактических данных): III. Витамин К, фолиевая кислота, уровни в крови и кормление грудью: отчет Подкомитета по стандартам качества и Подкомитета по оценке терапии и технологий Американской академии неврологии и Американского общества эпилепсии. Эпилепсия . 2009 Май. 50 (5): 1247-55. [Медлайн].
[Рекомендации] Бирбек Г.Л., Френч Дж.А., Перукка Э., Симпсон Д.М., Фраймов Х., Джордж Дж. М. и др. Выбор противоэпилептических препаратов для людей с ВИЧ / СПИДом: научно обоснованные рекомендации ILAE и AAN. Эпилепсия . 2012 января, 53 (1): 207-14. [Медлайн].
[Рекомендации] Harden CL, Hopp J, Ting TY и др. Для AAN и AES. Вопросы ведения женщин с эпилепсией — В центре внимания беременность (обзор, основанный на фактических данных): I. Акушерские осложнения и изменение частоты приступов: отчет Подкомитета по стандартам качества и Подкомитета по оценке терапии и технологий Американской академии неврологии и Американской эпилепсии. Общество. Эпилепсия . 2009 Май. 50 (5): 1229-36. [Медлайн].
[Рекомендации] Harden CL, Meador KJ, Pennell PB и др. Для AAN и AES. Вопросы ведения женщин с эпилепсией — Акцент на беременности (научно обоснованный обзор): II. Тератогенез и перинатальные исходы: Отчет Подкомитета по стандартам качества и Подкомитета по терапии и технологиям Американской академии неврологии и Американского общества эпилепсии. Эпилепсия . 2009 Май. 50 (5): 1237-46.[Медлайн].
Леви Р.Г., Купер П.Н., Гири П. Кетогенная диета и другие диетические методы лечения эпилепсии. Кокрановская база данных Syst Rev . 2012 14 марта 3: CD001903. [Медлайн].
Kossoff EH, Turner Z, Bluml RM, Pyzik PL, Vining EP. Рандомизированное перекрестное сравнение дневных пределов углеводов с использованием модифицированной диеты Аткинса. Эпилептическое поведение . 2007 май. 10 (3): 432-6. [Медлайн].
Weber S, Mølgaard C, Karentaudorf, Uldall P.Модифицированная диета Аткинса для детей и подростков с трудноизлечимой эпилепсией. Захват . 2009 Май. 18 (4): 237-40. [Медлайн].
Смит М., Политцер Н., Макгарви Д., МакЭндрюс М. П., Дель Кампо М. Эффективность и переносимость модифицированной диеты Аткинса у взрослых с фармакорезистентной эпилепсией: проспективное обсервационное исследование. Эпилепсия . 2011 Апрель 52 (4): 775-80. [Медлайн].
Anderson P. FDA одобрило лекарство от эпилепсии с пролонгированным высвобождением один раз в день. Медицинские новости Medscape . 21 августа 2013 г. [Полный текст].
Supernus Pharmaceuticals, Inc. Supernus объявляет об окончательном одобрении FDA и предстоящем выпуске препарата Trokendi XR ™ [пресс-релиз]. 19 августа 2013 г. Доступно по адресу https://ir.supernus.com/releasedetail.cfm?ReleaseID=785927. Доступ: 27 августа 2013 г.
Englot DJ, Chang EF, Auguste KI. Стимуляция блуждающего нерва при эпилепсии: метаанализ эффективности и предикторов ответа. Дж. Нейросург . 2011 декабрь 115 (6): 1248-55. [Медлайн].
Андерсон П. Группа FDA одобрила нейростимулятор эпилепсии. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/779901. Доступ: 4 марта 2013 г.
Lowes R. FDA одобрило имплантируемый нейростимулятор для лечения эпилепсии. Медицинские новости Medscape . 14 ноября 2013 г. [Полный текст].
FDA. FDA одобряет медицинское устройство для лечения эпилепсии.14 ноября 2013 г. [Полный текст].
Wiebe S, Blume WT, Girvin JP, Eliasziw M, за эффективность и действенность хирургического вмешательства при исследовании височной эпилепсии. Рандомизированное контролируемое исследование хирургии височной эпилепсии. N Engl J Med . 2001, 2 августа. 345 (5): 311-8. [Медлайн].
Hyslop A, Miller I, Bhatia S, Jayakar P. Функциональная резекция поражений: минимально резективная стратегия, эффективная у детей с МРТ-отрицательной, трудноизлечимой эпилепсией [аннотация 1.280]. Представлено на: 66-м ежегодном собрании Американского общества эпилепсии; 1 декабря 2012 г .; Сан-Диего, Калифорния
Melville NA. Минимальная резекция эффективна для некоторых пациентов с эпилепсией. Медицинские новости Medscape. 3 января 2013 г. [Полный текст].
Энгель Дж. Младший, Макдермотт М.П., Вибе С., Лангфитт Дж. Т., Стерн Дж. М., Дьюар С. и др. Раннее хирургическое лечение лекарственно-устойчивой височной эпилепсии: рандомизированное исследование. ДЖАМА . 2012 7 марта. 307 (9): 922-30.[Медлайн].
Чен З., Броди М.Дж., Лью Д., Кван П. Результаты лечения пациентов с впервые диагностированной эпилепсией, леченных известными и новыми противоэпилептическими препаратами: 30-летнее продольное когортное исследование. JAMA Neurol . 2017 26 декабря. [Medline].
Хирургия эпилепсии в детстве может защитить память. Медицинские новости сегодня . 14 ноября 2014 г. [Полный текст].
Skirrow C, Cross JH, Harrison S, Cormack F, Harkness W., Coleman R и др.Хирургия височной доли в детстве и нейроанатомические предикторы результатов долгосрочной декларативной памяти. Мозг . 2014 12 ноября [Medline].
Андерсон П. Перспективы лазерной абляции у больных эпилепсией. Медицинские новости Medscape . 9 декабря 2013 г. [Полный текст].
Новак Б. Мидазолам более эффективен при судорогах, чем диазепам, при введении внутримышечно. Медскап . 24 января 2014 г. [Полный текст].
Брукс М.FDA одобрило первые умные часы для обнаружения припадков и лечения эпилепсии. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/892329. 6 февраля 2018 г .; Доступ: 15 февраля 2018 г.
Девинский О., Пател А.Д., Кросс Дж. Х., Вильянуэва В., Виррелл Е.С., Привитера М. и др. Влияние каннабидиола на припадки при синдроме Леннокса-Гасто. N Engl J Med . 2018 17 мая. 378 (20): 1888-1897. [Медлайн].
Thiele EA, Marsh ED, French JA, Mazurkiewicz-Beldzinska M, Benbadis SR, Joshi C, et al.Каннабидиол у пациентов с судорогами, связанными с синдромом Леннокса-Гасто (GWPCARE4): рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3. Ланцет . 2018 17 марта. 391 (10125): 1085-1096. [Медлайн].
Диакомит (стирипентол) [вставка в упаковку]. Франция: Биокодекс. Август 2018 г. Доступно по ссылке [Полный текст].
Лечение миоклонических припадков у пациентов с ювенильной миоклонической эпилепсией
Neuropsychiatr Dis Treat. 2007 Dec; 3 (6): 729–734.
Отделение детской неврологии, Университетская больница Лилля, Лилль, Франция; Лаборатория фармакологии, Медицинская школа Лилля, Лилль, Франция
Для переписки: Стефан Оувен, Отделение детской неврологии, Больница Роджера Саленгро, 59037 Лилль Седекс, Франция, тел. +33 3 20 44 40 57, факс +33 3 20 44 53 93, электронная почта Авторские права © 2007 Dove Medical Press Limited. Все права защищеныЭта статья цитировалась в других статьях PMC.Abstract
Медикаментозное лечение ювенильной миоклонической эпилепсии (ЮМЭ) в основном основано на клиническом опыте, проспективных и ретроспективных исследованиях с небольшим количеством данных рандомизированных клинических испытаний.Прямых сравнений между старыми и новыми противоэпилептическими препаратами (AED), а также препаратов, лицензированных специально для JME, не проводится. Вальпроат, несомненно, является препаратом первого выбора для мужчин с JME. Женщинам следует отдавать предпочтение ламотриджину из-за тератогенности и побочных эффектов вальпроата. Кроме того, леветирацетам и топирамат эффективны и могут использоваться в комбинации или в качестве лечения второй линии. Некоторые AED могут усугубить JME. Помимо AED, при JME важное значение имеют немедикаментозные методы лечения.JME обычно требует пожизненного лечения, потому что приступы почти всегда возвращаются после прекращения терапии.
Ключевые слова: миоклонический припадок, миоклоническая эпилепсия, противоэпилептические препараты
Введение
Ювенильная миоклоническая эпилепсия (ЮМЭ) является распространенным эпилептическим синдромом, который классифицируется среди идиопатических генерализованных эпилепсий (ИГЭ, 1989 г. Это набор паттернов приступов, которые клинически отличаются от паттернов при других формах ИГЭ, при этом основной характеристикой являются миоклонические припадки, начинающиеся в подростковом возрасте.Хотя патогенез неизвестен, последние достижения, особенно в области генетики, предполагают несколько возможных механизмов. JME генетически и клинически неоднороден; некоторые клинические различия могут указывать на различия в патогенезе у разных групп пациентов. Нозология и классификация синдромов ИГЭ в настоящее время пересматриваются ( Andermann and Berkovic 2001 ; Engel 2001 ). JME отличается особой фармакологической чувствительностью. Вальпроат обладает особой силой действия.Другие противоэпилептические препараты (AED) также эффективны, например, ламотриджин, клоназепам, топирамат и леветирацетам, в то время как другие могут иметь отягчающее действие.
Электроклинические особенности ювенильной миоклонической эпилепсии
JME — это распространенный ИГЭ, который характеризуется миоклоническими припадками. Это наиболее распространенный ИГЭ у взрослых, особенно у женщин. Характерны единичные миоклонические подергивания рук, особенно вскоре после пробуждения. Часто возникают генерализованные тонико-клонические припадки, у трети людей наблюдаются абсансы.Генерализованным тонико-клоническим припадкам часто предшествуют несколько минут генерализованного миоклонуса с нарастающей частотой и интенсивностью. Они возникают преимущественно после пробуждения. Возникновение приступов более вероятно при недосыпании, усталости и отмене алкоголя. Начало обычно в подростковом возрасте, но судороги могут начаться или диагностироваться только в возрасте 20 лет. У 80% пациентов с JME приступы начинаются в возрасте от 12 до 18 лет. Средний возраст начала генерализованных тонических клонических приступов составляет 15 лет.5 лет. Наиболее важным элементом диагностики JME является история болезни.
Типичная аномалия на электроэнцефалографии (ЭЭГ) — это двусторонние множественные спайковые или полиспайк-волновые комплексы, которые предшествуют миоклоническому толчку. Разряд ЭЭГ включает 5–20 спайков с частотой от 12 до 16 Гц. Амплитуда шипов часто бывает максимальной в передних отделах. Иктальную запись лучше всего получить с помощью полиграфической видео-ЭЭГ, выполняемой при спровоцированном раннем утреннем пробуждении во время записи полноценного ночного сна или, по крайней мере, после ночного лишения сна.
JME — один из эпилептических синдромов, явно связанных с фоточувствительностью, встречающихся примерно у 30% ( Janz 1985 ; Loiseau and Duche 1990 ). Миоклонический приступ может быть вызван периодической световой стимуляцией у светочувствительных пациентов, но клиническая светочувствительность встречается реже, чем во время записи ЭЭГ.
В некоторых случаях у пациентов с ЮМЭ могут наблюдаться очаговые клинические или ЭЭГ-особенности или и то, и другое. Эти особенности включают не только односторонние миоклонические подергивания, но также вариант и асимметричную тоническую позу конечностей ( Aliberti et al 1994, ; Lancman et al 1994, ; Usui et al 2005 ).
Ошибочный диагноз и поздний диагноз остаются обычным явлением, как сообщается в литературе ( Grunewald et al 1992, ; Atakli et al 1998 ). Пациенты часто обращаются за медицинской помощью только после генерализованных судорог, и история гораздо более ранних миоклонических судорог в этом случае часто получается только ретроспективно ( Grunewald et al 1992, ).
Лечение
Цель лечения — избавить человека от припадков без побочного действия лекарства.JME требует пожизненного лечения, поскольку приступы почти всегда возвращаются после прекращения терапии ( Delgado-Escueta and Enrile-Bascal 1984 ; Baruzzi et al 1998 ). JME трудно лечить примерно у 15% пациентов. Предикторы фармакорезистентности включают: (1) сосуществование всех трех типов приступов (миоклонические судороги, абсансы и GTCS), (2) наличие связанных психиатрических проблем и (3) очаговые клинические симптомы и / или очаговые выделения ЭЭГ ( Dasheiff and Ritaccio 1993 ; Fernando-Dongas et al 2000 ; Gelisse et al 2001 ).
Немедикаментозное лечение
При JME недостаток сна и прием алкоголя могут вызывать судороги. Ритм сна и бодрствования необходимо регулировать. Следует устранить обстоятельства, мешающие нормальному сну и прогрессирующему пробуждению по утрам. Если пациент ложится спать поздно ночью, на следующее утро он должен спать дольше. Алкогольные напитки разрешены только в небольших количествах в общественных местах. Пациентам следует рекомендовать не пить при недостатке сна. Если у пациента есть светочувствительность, ему следует избегать соответствующих визуальных раздражителей.Некоторые маневры снижают риск светочувствительных приступов, включая полную окклюзию монокуляра, увеличенное расстояние от видеотерминала и обеспечение фонового освещения ( Harding and Jeavons 1992, ). Мы предлагаем эти подходы пациентам, которые проявляют светочувствительность на ЭЭГ, но не знают, насколько успешны эти изменения окружающей среды при ЮМЭ.
Вальпроат
Механизм действия
Вальпроевая кислота представляет собой жирную кислоту с разветвленной цепью, которая заметно отличается по структуре от всех других AEDS при клиническом применении.Механизм его действия остается до конца не выясненным. Есть свидетельства того, что вальпроевая кислота увеличивает концентрацию ГАМК, механизм, с помощью которого это происходит, остается неизвестным. Был предложен ряд механизмов, включая ингибирование действия GABA-T, активацию синтеза GABA за счет увеличения активности GAD и повышенное высвобождение GABA в синапс.
Эффективность
Основываясь на клиническом опыте, вальпроат был впервые предложен для лечения миоклонических припадков. 22 года назад сообщалось о чувствительности VPA ( Delgado-Escueta и Enrile-Bascal 1984 ).Хотя JME является важным синдромом, почти не проводилось рандомизированных клинических испытаний с использованием каких-либо лекарств для его лечения. Тем не менее, было проведено много открытых тематических исследований с использованием VPA в управлении JME. Открытые серии, опубликованные с использованием VPA, показывают, что у пациентов, получающих VPA в качестве дополнительного лекарства или в качестве монотерапии, от 41% до 88% случаев исчезновения приступов ( Atakli et al 1998, ; Kleveland and Engelsen 1998 ). Тематические исследования также показали, что низкая суточная доза (500 мг) VPA может эффективно контролировать JME и предотвращать приступы у пациентов в течение 2 лет ( Panagariya et al 2001 ; Karlovassitou-Koriari et al. al 2002 ).Все более новые исследования, в которых изучалась эффективность ламотриджина, топирамата и вальпроата при JME, показали, что вальпроат имеет лучшую эффективность из трех ( Prasad et al 2003 ; Nicolson et al 2004 ; Mohanraj and Brodie 2005 ).
Вальпроат на сегодняшний день является одним из самых эффективных AED при JME. Его следует рассматривать как препарат первой линии, по крайней мере, для мужчин. Принимая во внимание тератогенность (которая может уменьшаться при одновременном приеме фолиевой кислоты) и некоторые побочные эффекты (увеличение веса), VPA часто считается неприемлемым для молодых женщин детородного возраста.
Бензодиазепин
Механизм действия
Бензодиазепины работают, в первую очередь, путем усиления эргического ингибирования гамма-аминомасляной кислоты (ГАМК) путем связывания с бензодиазепиновым рецептором на рецепторах ГАМК ( Rudolph et al 1999 ).
Эффективность
Клоназепам также может быть эффективным при лечении JME. Obeid and Panayiotopoulos (1989) лечили 17 пациентов с JME клоназепамом. У всех пациентов были миоклонические судороги до лечения, а у 14 из 17 были судороги GTC до лечения.После лечения клоназепамом миоклонические приступы контролировались у 15 (88%) из 17 пациентов, а у оставшихся двух пациентов частота приступов снизилась на 75%. Однако клоназепам не дал эффективных результатов в снижении судорожных припадков. Шесть (43%) из 14 пациентов с приступами GTC контролировались. Кроме того, два пациента получили травмы во время приступов GTC, потому что клоназепам устранил их миоклонические припадки, что послужило предупреждением, и они сразу перешли в припадок GTC.Авторы пришли к выводу, что клоназепам, хотя и эффективен при лечении миоклонических припадков, вероятно, не должен использоваться для контроля припадков GTC.
Ламотриджин
Механизм действия
Ламотриджин является производным фенилтриазина. Ламотриджин действует путем ингибирования активируемых напряжением натриевых каналов и, возможно, кальциевых каналов, так что он предотвращает высвобождение глутамата ( Lees and Leach 1993 ).
Эффективность
Ламотриджин эффективен в борьбе с генерализованными тоническими клоническими приступами и абсансами, хотя есть некоторые сообщения об обострениях миоклонических приступов ( Biraben et al 2000, ; Carrazana and Wheeler 2001 ).
Многие исследования, проведенные за последние годы, продемонстрировали клиническую полезность для лечения JME. Открытое исследование по оценке ламотриджина как альтернативы вальпроату (63 пациента перешли с вальпроата на ламотриджин) продемонстрировало улучшение у 67% пациентов. Об ухудшении клинических симптомов также не сообщалось ( Morris et al 2004 ). Buchanan провел исследование 12 пациентов с JME, получавших монотерапию LTG ( Buchanan 1996, ). У пяти (41%) из этих 12 пациентов приступы исчезли во время приема монотерапии LTG, и авторы пришли к выводу, что LTG может быть эффективным при лечении JME.В ретроспективном исследовании сравнивали монотерапию вальпроатом (n = 36) и монотерапию ламотриджином (n = 14), а также сравнивали вальпроат (n = 22), ламотриджин (n = 21) и политерапию топираматом (n = 15). Результаты показали, что ламотриджин был эффективным вариантом в качестве монотерапии и политерапии ( Prasad et al., 2003, ). Кроме того, эффективность ламотриджина при JME оценивалась в битерапии. Политерапия особенно интересна при лекарственной устойчивости. Комбинация ламотриджина с вальпроатом, по-видимому, синергетична при многих типах эпилепсии.Но такая же комбинация приводит к повышенному риску развития серьезной кожной сыпи ( Gerike et al 1999, ; Pisani et al 1999, ).
Леветирацетам
Механизм действия
Леветирацетам — производное пирролидона, S-энантиомер этилового аналога пирацетама. Хотя точный механизм действия леветирацетама неизвестен, он, по-видимому, действует через специфический сайт связывания в головном мозге (но не влияет напрямую на ГАМК или глутамат), не изменяет свойства натриевых каналов, вызывает ограниченное снижение высокого напряжения. -активированные кальциевые токи и, возможно, модулируют переходные процессы внутриклеточного кальция ( Herdon et al 1997 ; Zona et al 2001 ).Молекулярные исследования с участием трансгенных мышей показывают, что леветирацетам связывается с белком синаптических везикул (SVA2), который участвует в экзоцитозе нейромедиатора везикул, и что аффинность связывания с SVA2 прямо пропорциональна защите от припадков ( Lynch et al 2004 ).
Эффективность
Леветирацетам, вероятно, является лучшим новым противоэпилептическим средством в лечении JME и может заменить вальпроат для лечения расстройства из-за высокой и устойчивой эффективности, быстрого действия и отличного профиля безопасности.Более 60% пациентов с трудноизлечимым JME избавились от приступов с помощью монотерапии леветирацетамом или политерапии ( Czapinski and Czapinska 2004 ; Resor and Resor 2005 ). Resor и его коллеги оценили монотерапию леветирацетамом у 24 пациентов с JME и GTCS ( Resor and Resor 2005, ). Шестнадцать пациентов (66,7%) освободились от GTCS; у трех из них был один судорожный припадок либо после прекращения приема леветирацетама на 24 часа, либо после снижения дозы до 500 мг / день, но впоследствии судорожные припадки у них не возникали.Миоклонические приступы эффективно контролировались у 22 из 24 пациентов. Более того, Шарп и его коллеги выполнили ретроспективный обзор медицинских карт 30 пациентов с JME в возрасте от 5 до 21 года, получавших леветирацетам в диапазоне доз от 12 до 50 мг / кг / мл ( Sharpe et al 2005 ). Срок наблюдения составил 27 месяцев. У 24 пациентов (80%) приступы исчезли после монотерапии леветирацетамом, а у 2 дополнительных пациентов наблюдалось улучшение контроля над приступами. Andermann и коллеги оценили леветирацетам у 122 пациентов (113 с JME и 9 с ювенильной абсансной эпилепсией).Исследование представляло собой многоцентровое плацебо-контролируемое испытание с двойным связыванием, проведенное с участием пациентов без контроля, принимавших один противоэпилептический агент. Частота ответивших на лечение леветирацетама составила 58,3% по сравнению с 23,3% при приеме плацебо ( Andermann et al 2005, ). Specchio et al. Провели многоцентровое проспективное открытое исследование пациентов с JME ( Specchio et al 2006, ). У 10 пациентов был диагностирован новый диагноз, а у 38 были резистентность и / или непереносимость предыдущих ПЭП. 5 пациентов выбыли. 18 пациентов (37,5%) не имели миоклонии и 35 (73%) не имели генерализованного тонического припадка.
Топирамат
Механизм действия
Топирамат представляет собой сульфамат-замещенный моносахарид, который проявляет некоторое ингибирование карбоангидразы. Его активность AED не зависит от этого эффекта. Топирамат имеет несколько способов действия, включая модуляцию потенциал-зависимых натриевых каналов, усиление ГАМКергического ингибирования на новом участке рецептора ГАМК и возможное действие на рецепторы, не являющиеся N-метил-D-аспартатом (NMDA) ( Hanaya et al 1998 ; White et al 2000 ; Zona et al 1997 ).
Эффективность
Несколько исследований показали полезность топирамата у пациентов с JME. Существует одно рандомизированное контролируемое исследование эффективности топирамата у пациентов с генерализованным тоническим клоническим приступом, включая пациентов с JME ( Biton et al 2005 ). Сообщалось о снижении более чем на 50% генерализованных тонических клонических приступов у 8/11 пациентов, получавших топирамат, по сравнению с 2/11 у пациентов, получавших плацебо. Сообщалось также о снижении миоклонических приступов и абсансов, но не достигло статистической значимости.Эффективность и переносимость топирамата оценивались у 22 пациентов с JME ( Sousa Pda et al 2005 ). 16 пациентов завершили первый год наблюдения, 4 пациента вышли из исследования из-за плохого контроля приступов и 2 из-за низкого соблюдения режима лечения. Миоклонические приступы контролировались у 11 пациентов и сохранялись у 5 пациентов. Генерализованные тонические клонические приступы полностью контролировались у 10 пациентов, у 4 пациентов наблюдалось снижение припадков более чем на 50%, а у 2 — менее чем на 50%. В ходе рандомизированного открытого лечения 28 пациентов с недавно диагностированным JME получали топирамат или вальпроат ( Levisohn et al 2003 ).12 из 19 пациентов, получавших топирамте, завершили исследование, а 7 из 9 пациентов, получавших вальпроат, завершили исследование. Генерализованные тонические клонические, миоклонические и абсансные приступы полностью контролировались у 10/12, 9/14 и 2/2 пациентов, получавших топирамат, соответственно, и у 3/4, 7/9 и 1/2 пациентов, получавших вальпроат. В ретроспективной когорте монотерапия топираматом и политерапия рассматривались как альтернатива VPA ( Prasad et al 2003 ).
Зонисамид
Механизм действия
Зонисамид, блокируя чувствительные к напряжению натриевые каналы, предотвращает повторное возбуждение нейронов.Он также снижает потенциал-зависимые кальциевые каналы Т-типа, способствует допаминергической и серотонинеригической нейротрансмиссии, слабо ингибирует карбоангидразу и может защищать нейроны от повреждения свободными радикалами, тем самым стабилизируя нейронные мембраны ( Suzuki et al 1992 ; Kito et al. 1996 ).
Эффективность
Имеется мало исследований, посвященных влиянию зонисамида. Ретроспективное исследование с анализом 15 пациентов (монотерапия у 13 пациентов и добавление вальпроата у 2 пациентов) показало хороший контроль над приступами.69%, 62% и 38% избавились от генерализованных тонико-клонических, миоклонических и абсансных приступов соответственно. Побочные эффекты были зарегистрированы у 20% пациентов ( Kothare et al 2004 ). В нейрофизиологическом исследовании пациента зонисамид позволяет почти полностью исчезнуть генерализованные спайковые и волновые разряды ( Szaflarski 2004 ). Эти данные предполагают возможную полезность этого AED в JME.
AED, усугубляющее JME
В настоящее время хорошо известно, что AED могут усугубить эпилепсию.Было показано, что фенитоин и карбамазепин усугубляют миоклонические судороги и приступы абсанса при ЮМЭ, поэтому их следует избегать ( Genton et al, 2000, ; , , Gelisse et al, 2004, ; , , Thomas et al, 2006, ). Genton et al (2000) провели исследование CBZ и PHT для определения риска обострения приступов у 40 пациентов с JME. В группе CBZ у 19 (68%) из 28 пациентов наблюдалось обострение приступа, обычно влияющее на миоклонический приступ, и только у шести (21%) из 28 пациентов улучшилось состояние.В группе PHT у шести (38%) из 16 пациентов наблюдалось обострение приступа, и только у двух (12%) из 16 пациентов улучшилось состояние. Обострение в основном выражалось в усилении миоклонических подергиваний. Авторы пришли к выводу, что среди обычно назначаемых ПЭП CBZ, по-видимому, имеет самый сильный отягчающий потенциал у пациентов с JME, тогда как отягчающий эффект PHT менее выражен.
Были отдельные серии сообщений, указывающих на то, что ламотриджин может усугублять или усугублять миоклонические припадки.Biraben et al. Сообщили о четырех пациентах с JME, получавших терапию LTG, у которых наблюдалось обострение миоклонического приступа ( Biraben et al 2000, ). Carrazana et al. Также обнаружили, что у двух пациентов с JME (2/24) развилось резкое обострение миоклонуса, а у двух других (2/24) наблюдалось легкое преходящее увеличение утреннего миоклонуса при приеме ламотриджина ( Carrazana and Wheeler 2001, ).
Выбор противоэпилептических препаратов
При обращении к пациенту с эпилепсией врачи должны прописать лекарство, которое будет эффективно контролировать припадки, но не подвергать пациента опасности нежелательных явлений или обострения припадков.Хотя JME является важным синдромом, не проводилось рандомизированных клинических испытаний с использованием каких-либо лекарств для его лечения. Медикаментозное лечение JME в основном основано на клиническом опыте, проспективных и ретроспективных исследованиях. Нет прямых сравнений между старыми и новыми AED, а также нет лекарств, лицензированных специально для JME.
Консенсусные исследования экспертов по эпилепсии у взрослых в 2001 и 2005 годах ( Karceski et al 2001 , 2005 ) оценили вальпроат как лечение выбора при идиопатической генерализованной эпилепсии, когда пол пациента не был указан.Однако в ходе исследования эпилепсии у взрослых в 2005 г., когда было указано, что пациентом была женщина, эксперты назвали ламотриджин методом выбора. В экспертном заключении 2005 года о лечении детской эпилепсии вальпроат и ламотриджин были рекомендованы для 15-летнего мужчины с JME, в то время как ламотриджин был единственным выбором для 15-летней женщины с JME ( Wheless et al 2005 ).
Вальпроат, несомненно, является препаратом первого выбора для мужчин с JME. У женщин, когда уместны соображения тератогенности, увеличения веса и синдрома поликистозных яичников, другие варианты включают леветирацетам, ламотриджин, топирамат и, возможно, зонисамид.У пациентов с симптомами, не поддающимися лечению одним лекарственным средством, эффективная комбинация вальпроата с небольшими дозами ламотриджина часто оказывается эффективной. Когда вальпроат нежелателен, может быть эффективным сочетание леветирацетама с ламотриджином.
Ссылки
- Алиберти В., Грюневальд Р.А., Панайотопулос С.П. и др. Очаговые электроэнцефалографические аномалии при ювенильной миоклонической эпилепсии. Эпилепсия. 1994; 35: 297–301. [PubMed] [Google Scholar]
- Андерманн Э., Андерманн Ф., Мейвиш П. и др.Контроль приступов с помощью леветирацетама при ювенильных миоклонических эпилепсиях. Эпилепсия. 2005; 46 (Дополнение 8): 205. [Google Scholar]
- Andermann F, Berkovic SF. Идиопатическая генерализованная эпилепсия с генерализованными и другими припадками в подростковом возрасте. Эпилепсия. 2001; 42: 317–20. [PubMed] [Google Scholar]
- Атакли Д., Созуер Д., Атай Т. и др. Ошибочная диагностика и лечение юношеской миоклонической эпилепсии. Захват. 1998. 7: 63–6. [PubMed] [Google Scholar]
- Baruzzi A, Procaccianti G, Tinuper P и др.Отмена противоэпилептических препаратов в детстве при детской эпилепсии: предварительные результаты проспективного исследования. В: Faienza C, Prati G, редакторы. Диагностические и терапевтические проблемы в детской эпилептологии. Амстердам: Эльзевир; 1998. С. 117–23. [Google Scholar]
- Biraben A, Allain H, Scarabin J, et al. Обострение юношеской миоклонической эпилепсии на фоне приема ламотриджина. Неврология. 2000; 55: 1758. [PubMed] [Google Scholar]
- Biton V, Bourgeois B Исследователи YTC / YTCE. Топирамат у пациентов с ювенильной миоклонической эпилепсией.Arch Neurol. 2005; 62: 1705–8. [PubMed] [Google Scholar]
- Бьюкенен Н. Использование ламотриджина при ювенильной миоклонической эпилепсии. Захват. 1996; 5: 149–51. [PubMed] [Google Scholar]
- Карразана Э., Уиллер С. Обострение юношеской миоклонической эпилепсии с помощью ламотриджина. Неврология. 2001; 56: 1424–5. [PubMed] [Google Scholar]
- Чапинский П.П., Чапинская Е.М. Эффективность леветирацетама при лекарственно-устойчивой ювенильной миоклонической эпилепсии. Эпилепсия. 2004; 45 (Дополнение 3): 141. [Google Scholar]
- Дашейфф Р.М., Ритаччо А.Л.Характеристика трудноизлечимой юношеской миоклонической эпилепсии: новые взгляды на первично генерализованные судороги. Захват. 1993; 2: 11–19. [PubMed] [Google Scholar]
- Дельгадо-Эскуэта А., Энриле-Баскаль Ф. Ювенильная миоклоническая эпилепсия Янца. Неврология. 1984; 34: 285–94. [PubMed] [Google Scholar]
- Энгель Дж. Предлагаемая схема диагностики для людей с эпилептическими припадками и эпилепсией: отчет Целевой группы ILAE по классификации и терминологии. Эпилепсия. 2001; 42: 1–8. [PubMed] [Google Scholar]
- Фернандо-Донгас М.К., Радтке Р.А., ВанЛандингем К.Э. и др.Характеристики ювенильной миоклонической эпилепсии, устойчивой к вальпроевой кислоте. Захват. 2000; 9: 385–8. [PubMed] [Google Scholar]
- Гелисс П., Гентон П., Куате С. и др. Ухудшение судорог под действием окскарбазепина при ювенильной идиопатической генерализованной эпилепсии. Эпилепсия. 2004. 45: 1282–6. [PubMed] [Google Scholar]
- Гелисс П., Гентон П., Томас П. и др. Клинические факторы лекарственной устойчивости при ювенильной миоклонической эпилепсии. J Neurol Neurosurg Psychiatry. 2001; 70: 240–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гентон П., Гелисс П., Томас П. и др.Усугубляют ли карбамазепин и фенитоин ювенильную миоклоническую эпилепсию? Неврология. 2000; 55: 1106–9. [PubMed] [Google Scholar]
- Gerike C, Picard F, Saint-Martin A, et al. Эффективность ламотриджина при синдромах идиопатической генерализованной эпилепсии: открытое исследование под контролем видео-ЭЭГ. Эпилептическое расстройство. 1999; 1: 159–65. [PubMed] [Google Scholar]
- Грюневальд Р.А., Хрони Э., Панайотопулос С.П. Поздняя диагностика ювенильной миоклонической эпилепсии. J Neurol Neurosurg Psychiatry. 1992; 55: 497–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hanaya R, Sasa M, Ujihara H, et al.Подавление топираматом взрывных разрядов эпилептиформ в нейронах СА3 гиппокампа крыс со спонтанной эпилепсией in vitro. Brain Res. 1998. 789: 274–82. [PubMed] [Google Scholar]
- Harding W, Jeavons J. In: Светочувствительная эпилепсия. Harding W, Jeavons J, редакторы. Лондон: MacKeith Press; 1992. С. 125–50. [Google Scholar]
- Herdon HJ, Jerman JC, Stean TO, et al. Характеристика связывания [3H] -SB-204269, радиоактивно меченной формы нового противосудорожного средства SB-204269, с новым сайтом связывания в мембранах головного мозга крысы.Br J Pharmacol. 1997; 121: 1687–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- ILAE. Предложение о пересмотренной классификации эпилепсий и эпилептических синдромов. Комиссия по классификации и терминологии Международной лиги против эпилепсии. Эпилепсия. 1989; 30: 389–99. [PubMed] [Google Scholar]
- Янц Д. Эпилепсия с импульсивной petit mal (ювенильная миоклоническая эпилепсия) Acta Neurol Scand. 1985. 72: 449–59. [PubMed] [Google Scholar]
- Карчески С., Моррелл М., Карпентер Д.Серия рекомендаций экспертов по консенсусу: Лечение эпилепсии. Эпилепсия. 2001; 2: A1–50. [Google Scholar]
- Karceski S, Morrell M, Carpenter D. Лечение эпилепсии у взрослых: мнение экспертов. Эпилепсия. 2005; 7: S1–64. [PubMed] [Google Scholar]
- Карловасситу-Кориари А., Алексиу Д., Ангелопулос П. и др. Низкие дозы вальпроата натрия в лечении ювенильной миоклонической эпилепсии. J Neurol. 2002; 249: 396–9. [PubMed] [Google Scholar]
- Кито М., Маэхара М., Ванатабе К.Механизмы блокады каналов Т-типа зонисамидом. Захват. 1996; 5: 115–9. [PubMed] [Google Scholar]
- Клевеланд Г., Энгельсен Б. Юношеская миоклоническая эпилепсия: клинические характеристики, лечение и прогноз у норвежской популяции пациентов. Захват. 1998; 7: 31–8. [PubMed] [Google Scholar]
- Kothare S, Valencia I, Khurana D, et al. Эффективность и переносимость зонисамида при ювенильной миоклонической эпилепсии. Эпилептическое расстройство. 2004; 6: 267–70. [PubMed] [Google Scholar]
- Lancman ME, Asconape JJ, Penry JK.Клиническая асимметрия и асимметрия ЭЭГ при ювенильной миоклонической эпилепсии. Эпилепсия. 1994; 35: 302–6. [PubMed] [Google Scholar]
- Lees G, Leach MJ. Исследования механизма действия нового противосудорожного ламотриджина (Ламиктал) с использованием первичных неврологических культур коры головного мозга крыс. Brain Res. 1993; 612: 190–9. [PubMed] [Google Scholar]
- Levisohn P, Holland K, Hulihan J, et al. Топирамат по сравнению с вальпроатом у пациентов с ювенильной миоклонической эпилепсией. Эпилепсия. 2003. 44: 267–8. [Google Scholar]
- Луазо П., Герцог Б.Юношеская эпилепсия миоклоническая. Rev Neurol. 1990; 146: 719–25. [PubMed] [Google Scholar]
- Линч Б.А., Ламбенг Н., Нока К. и др. Белок синаптических везикул SV2A является местом связывания противоэпилептического препарата леветирацетама. Proc Natl Acad Sci USA. 2004. 101: 9861–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Моханрадж Р., Броди М. Фармакологические результаты при впервые диагностированной эпилепсии. Эпилепсия. 2005; 6: 382–7. [PubMed] [Google Scholar]
- Моррис Дж., Хаммер А., Кустра Р. и др.ламотриджин для пациентов с ювенильной миоклонической эпилепсией после предшествующего лечения вальпроатом: результаты открытого исследования. Эпилепсия. 2004; 5: 509–21. [PubMed] [Google Scholar]
- Николсон А., Аппелтон Р., Чедвик Д. и др. Взаимосвязь между лечением вальпроатом, ламотриджином и топираматом и прогнозом идиопатической генерализованной эпилепсии. J Neurol Neurosurg Psychiatry. 2004; 75: 75–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Обейд Т., Панайотопулос С.П.Клоназепам при ювенильной миоклонической эпилепсии. Эпилепсия. 1989; 30: 603–6. [PubMed] [Google Scholar]
- Панагария А., Сурика Р., Ардана В. Юношеская миоклоническая эпилепсия — опыт из северо-западной Индии. Acta Neurol Scand. 2001; 104: 12–16. [PubMed] [Google Scholar]
- Пизани Ф., Отери Дж., Руссо М. и др. Эффективность вальпроата-ламотриджина при рефрактерных сложных парциальных припадках: данные о фармакодинамическом взаимодействии. Эпилепсия. 1999; 40: 1141–6. [PubMed] [Google Scholar]
- Prasad A, Kuzniecky R, Knowlton R, et al.Развитие противоэпилептической лекарственной терапии при ювенильной миоклонической эпилепсии. Arch Neurol. 2003. 60: 1100–5. [PubMed] [Google Scholar]
- Resor SR, Resor LD. Монотерапия леветирацетамом в лечении судорожных припадков при ювенильной миоклонической эпилепсии. Представлено на 54-м ежегодном собрании Американской академии неврологии; 13–20 апреля 2002 г .; Денвер, Колорадо, 2005 г. [Google Scholar]
- Рудольф У., Крестани Ф., Бенке Д. и др. Действие бензодиазепина опосредовано специфическими подтипами рецепторов гамма-аминомасляной кислоты (А).Природа. 1999; 401: 796–800. [PubMed] [Google Scholar]
- Шарп Д.В., Патель А., Фенихель Г.М. и др. Использование леветирацетама при ювенильной миоклонической эпилепсии [аннотация] Эпилепсия. 2005; 46 (Дополнение 8): 192. [Google Scholar]
- Sousa Pda S, Araujo Fihlo G, Garzon E et al. Топирамат для лечения юношеской миоклонической эпилепсии. Arq Neuropsquiatr. 2005; 63: 733–7. [PubMed] [Google Scholar]
- Specchio L, Gambardella A, Giallonardo A, et al. Открытое долгосрочное прагматическое исследование леветирацетама в лечении ювенильной миклонической эпилепсии.Epilepsy Res. 2006; 71: 32–9. [PubMed] [Google Scholar]
- Suzuki S, Kawakami K, Nishimura S и др. Зонисамид блокирует канал Т-типа в культивируемых нейронах коры головного мозга крыс. Epilepsy Res. 1992; 12: 21–7. [PubMed] [Google Scholar]
- Szaflarski J. Влияние зонисамида на электроэнцефалограмму пациента с ювенильной миоклонической эпилепсией. Эпилепсия. 2004. 5: 1024–6. [PubMed] [Google Scholar]
- Томас П., Валтон Л., Гентон П. Эпилептический эпилептический статус и миоклонический статус, вызванный противоэпилептическими препаратами при идиопатической генерализованной эпилепсии.Головной мозг. 2006; 129: 1281–92. [PubMed] [Google Scholar]
- Усуи Н., Котагал П., Мацумото Р. и др. Очаговые семиологические и электроэнцефалографические особенности у пациентов с ювенильной миоклонической эпилепсией. Эпилепсия. 2005; 46: 1668–76. [PubMed] [Google Scholar]
- Уилесс Дж. У., Кларк Д. Ф., Карпентер Д. Лечение детской эпилепсии: мнение экспертов. Юношеская миоклоническая эпилепсия. J Child Neurol. 2005; 20: S42–3. [Google Scholar]
- White H, Brown S, Woodhead J, et al. Топирамат модулирует вызванные ГАМК токи в нейронах коры головного мозга мышей по небензодиазепиновому механизму.Эпилепсия. 2000; 41: 17–20. [PubMed] [Google Scholar]
- Zona C, Ciotti MT, Avoli M. Топирамат ослабляет потенциал-зависимые натриевые токи в гранулярных клетках мозжечка крыс. Neurosci Lett. 1997. 231: 123–6. [PubMed] [Google Scholar]
- Zona C, Niespodziany I, Marchetti C, et al. Леветирацетам не модулирует нейронные потенциал-зависимые токи Na + и Ca2 + Т-типа. Захват. 2001; 10: 279–86. [PubMed] [Google Scholar]
Миоклонический припадок — обзор
Признаки и симптомы
Миоклонические припадки проявляются в виде толчков, которые бросают пациента на пол.Обычно они поражают аксиальные или дистальные мышцы и обычно возникают при пробуждении. Они могут возникать сами по себе или в сочетании с генерализованными припадками.
В форме EME , которая начинается в младенчестве, наблюдаются массивные двусторонние миоклонии с частыми беспорядочными миоклониями, которые переходят из одной части тела в другую. У пациентов также развиваются фокальные моторные судороги и детские спазмы. Более половины детей с этим заболеванием умирают в возрасте до 1 года. ЭЭГ показывает сложные всплески синхронных всплесков и нерегулярных резких и медленных волн.
При форме BMEI судороги возникают в первые два года жизни у нормальных детей, у которых в семейном анамнезе имеется сильная семейная история приступов. Приступы бывают краткими, частыми и симметричными миоклониями, а на ЭЭГ выявляются двусторонние спайк-волновые или полиспайк-волновые разряды.
При форме SMEI приступы состоят из двусторонней миоклонии с аксиальной доминантой, которая приводит к бросанию предметов и падению на землю. Приступы обычно возникают при пробуждении.Они появляются в первые четыре года жизни и могут начаться как фебрильные судороги. Часто судороги имеют семейный анамнез. Хотя эти припадки трудно контролировать, они могут исчезнуть по мере взросления ребенка. У пациентов часто наблюдается задержка психомоторного развития и атаксия. Паттерн ЭЭГ обычно показывает бистинхронные спайк-волны или множественные спайк-волны. При этой форме расстройства часто встречается светочувствительность.
Припадки LGS состоят из двусторонних и симметричных рывков, приводящих к сгибанию туловища и отведению рук и резкому падению на землю.Синдром обычно начинается к 8 годам. ЭЭГ показывает двусторонние симметричные спайки или резкие волны, за которыми следуют медленные волны.
У EMAS, симметричные подергивания плеч, рук и головы. Пациенты также могут испытывать резкие подергивания, вызывающие их падение и подергивание лица. В редких случаях припадок может быть вызван светом. ЭЭГ обычно показывает короткие пароксизмы нерегулярных спайк-волн и полиспайк-волн.
У JME, есть очень короткие, двусторонние, симметричные и синхронные толчки плеч и рук.Приступы могут происходить группами или по отдельности, и их частота может варьироваться. Lancman et al (1994). Обычно они возникают при пробуждении. Пациенты могут впадать в состояние тумана, но не терять сознание. Сокращения синергетических групп мышц происходят без вовлечения отдельных групп мышц. Даже если пациент упадет из-за сильных рывков, он не спит и может стоять. У пациента может развиться эпилептический статус, который обычно проявляется в виде хореи. Во время статуса у пациентов может наблюдаться сердцебиение и потливость.Судороги могут быть вызваны повышенной мозговой активностью. Недосыпание, употребление алкоголя, световая стимуляция и менструации могут спровоцировать приступы. ЭЭГ показывает двусторонние симметричные лобно-центральные полиспайк-волны. При каждом рывке происходит всплеск спайков, за которым следуют медленные волны Aliberti et al (1994).
PE в общем указывает на пароксизмальные электрические разряды в головном мозге в ответ на световую стимуляцию и линейные паттерны Fujiwara et al (1983). Этот ответ наблюдается при миоклонических припадках, абсансах с миоклоническими компонентами и генерализованных тонико-клонических припадках.Это чаще встречается у женщин и часто бывает семейным. На ЭЭГ наблюдаются спайк-волновые комплексы и всплески полиспайк-волн.
Эффективность перампанела при миоклонических припадках при синдроме Дауна с изодицентрической хромосомой 21 — FullText — Case Reports in Neurology 2020, Vol. 12, № 3
Абстрактные
Эпилептические припадки часто встречаются у пожилых людей с синдромом Дауна. Мы встретили пациента с синдромом Дауна, у которого кариотипирование показало редкую изодицентрическую хромосому 21 и который страдал от миоклонических припадков.У 52-летней женщины с синдромом Дауна внезапно появилась сонливость и частые миоклонические подергивания в верхней части тела. Записи видео-ЭЭГ продемонстрировали генерализованные полиспайк-волновые разряды, соответствующие миоклоническим толчкам, которые усугублялись фотостимуляцией. Миоклонус полностью разрешился после приема перампанела. Перампанель был эффективен при миоклонических припадках у нашего пациента. Мы предлагаем использовать перампанел в качестве терапии первой линии при эпилепсии и миоклонусе у пожилых пациентов с синдромом Дауна.
© 2020 Автор (ы). Опубликовано S. Karger AG, Базель
Введение
Увеличение продолжительности жизни пациентов с синдромом Дауна (СД) привело к тому, что неврологи чаще сталкиваются с эпилепсией и снижением когнитивных функций (CD) [1-3]. Эпилепсия чаще всего начинается в течение года после начала БК [2, 3]. Эпилепсия обычно сопровождается миоклоническими подергиваниями и формирует генерализованные тонико-толстокишечные судороги [2, 3]. По прошествии месяцев и лет прогрессирования миоклонические приступы сменяются неэпилептическим миоклонусом и развивается светочувствительность [2, 3].Мы столкнулись со случаем СД с редким кариотипированием, то есть с изодицентрической хромосомой 21, при котором миоклонические приступы впервые появились через 12 лет после начала БК. Пациент хорошо отреагировал на монотерапию низкими дозами перампанела.
История болезни
52-летняя женщина без судорог или миоклонуса в анамнезе была направлена в наше неврологическое отделение с постоянными подергиваниями в верхней части тела, которые начались накануне. В 9 месяцев ей был поставлен диагноз СД. Она могла бегать, танцевать и петь, и ее повседневная деятельность была в основном независимой.Начиная с 40 лет, ее когнитивные функции постепенно ухудшались, что приводило к постепенной утрате автономии. В возрасте 50 лет она попала в нашу больницу. В то время, хотя она не могла стоять и ходить, она весело говорила и каждый день участвовала в играх. Находясь в нашем отделении, при общем медицинском осмотре ее рост и вес были 146 см и 47 кг соответственно. Артериальное давление 118/60 мм рт. Ст., Частота сердечных сокращений 117 уд / мин, температура 36,9 ° C, насыщение кислородом 97% при комнатной температуре.Общий осмотр выявил морфологические особенности СД, включая небольшой подбородок, раскосые глаза, плоскую переносицу, единственную складку на ладони и выступающий язык. При неврологическом обследовании она была сонной и проявляла мутизм. Она не выполняла никаких приказов и добровольно двигала глазами, ртом, головой и конечностями. При этом миоклонические подергивания появлялись непрерывно раз в 3-5 с в верхней части тела. Ее нижние конечности атрофировались в легкой форме. Ни фасцикуляции, ни миокимии нигде не обнаружено.Мышечный тонус был слегка повышенным, с двусторонним паратонием верхних конечностей. Она не могла ходить и стоять даже с посторонней помощью, и ей требовался ремень на туловище, чтобы выдерживать сидячую позицию в инвалидной коляске. Рефлексы глубоких сухожилий, включая бицепсы, трицепсы, сухожилия надколенника и ахилловы сухожилия, показали гиперрефлексию как в верхних, так и в нижних конечностях. Симптомы Бабинского были отрицательными на обеих ногах. Лабораторные исследования выявили натрий 143 ммоль / л; калий, 3,3 ммоль / л; хлорид, 106 ммоль / л; глюкоза, 120 мг / дл; креатинин, 0.48 мг / дл; кальций, 8,0 мг / дл; сывороточный альбумин 3,1 г / дл; и аммиак 18 мкг / дл. Функция щитовидной железы и уровни тиамина и витамина B 12 были в пределах нормы. Записи видео-ЭЭГ показали генерализованное непрерывное замедление, генерализованные прерывистые ритмические резкие волны и общие полиспайк-волновые комплексы, соответствующие миоклоническим подергиваниям на мониторе (рис. 1а). Прерывистая фотостимуляция в диапазоне 9–24 Гц вызывала полиспайк-волновые комплексы и миоклонические толчки (рис. 1b). МРТ головного мозга показала тяжелую корковую атрофию и увеличение желудочков (рис.2а). На диффузно-взвешенном изображении не было обнаружено высокоинтенсивного поражения (рис. 2b). Однофотонная эмиссионная компьютерная томография (ОФЭКТ) выявила значительную гипоперфузию вокруг сильвиевой щели, теменной области и поясной извилины (рис. 2c). Хромосомный анализ обнаружил женский кариотип, обозначенный 46, XX, idic (21) (q22.3) с нормальной 21 хромосомой и изодицентрической хромосомой 21, который имел 2 копии длинного плеча хромосомы 21 с перевернутым слиянием в q22. 3 полосы (рис. 2г). Она была начата на перампанеле в дозе 2 мг / сут.Через неделю концентрация перампанела в крови составила 176 нг / мл. Миоклонус полностью разрешился, и она вернулась к своему исходному мышлению. На контрольной ЭЭГ миоклонические разряды исчезли и не были вызваны даже фотостимуляцией.
Рис. 1.
a Видео-ЭЭГ, сделанная в день обращения, показывает генерализованные комплексы полиспайк-волна (стрелки), соответствующие миоклоническим подергиваниям на мониторе. b Прерывистая фотостимуляция с частотой 12 Гц вызывает полиспайк-волновые комплексы и миоклонические подергивания.
Рис. 2.
a МРТ головного мозга показывает тяжелую корковую атрофию и увеличение желудочков. b На диффузно-взвешенном изображении очага поражения не обнаружено. c Однофотонная эмиссионная компьютерная томография выявляет значительную гипоперфузию вокруг сильвиевой щели, теменной области и поясной извилины. d Хромосомный анализ обнаруживает женский кариотип, обозначенный цифрами 46, XX, idic (21) (q22.3), с нормальной 21 хромосомой и изодицентрической хромосомой 21.идическая, изодицентрическая хромосома.
Обсуждение / Заключение
Мы обнаружили 2 важных клинических проблемы. У пожилого пациента с СД была изодицентрическая хромосома 21 с миоклоническими припадками, впервые появившимися через 12 лет после начала БК. Монотерапия низкими дозами перампанела была чрезвычайно эффективной при приступах.
Около половины пациентов с СД в возрасте старше 50 лет страдают эпилепсией, которой в большинстве случаев предшествует БК [2, 3]. Эпилепсию, ассоциированную с СД, по течению можно разделить на 3 стадии [3].Стадия I. В начале БК проявляются диффузные нарушения ЭЭГ во время сна и церебральная атрофия. Стадия II: В течение года после начала БК обычно возникают генерализованные тонико-клонические припадки с эпилептическими миоклоническими подергиваниями лица и рук при пробуждении. Стадия III: в течение нескольких месяцев и лет прогрессирования миоклонические приступы сменяются неэпилептическим миоклонусом, развиваются тяжелая деменция и светочувствительность на ЭЭГ. У нашего пациента нечасто возникали миоклонические приступы внезапно через 12 лет после начала БК.
Более 90% пациентов с DS идентифицируются как свободная трисомия 21 [4, 5]. Изодицентрическая хромосома 21 [46, XX, idic (21) (q22.3)], показанная у нашего пациента, представляет собой редкую хромосомную перестройку, которая может привести к DS [4]. Перестройка имеет 2 копии длинного плеча хромосомы 21 с перевернутым слиянием на полосе q22.3, что приводит к частичной моносомии из-за терминальной делеции 21q22.3 [4]. Случаи с изодицентрической хромосомой 21, о которых сообщалось ранее, не имели каких-либо отличий по фенотипу от обычной трисомии 21 [4, 6].Таким образом, неясно, способствовала ли эта изодицентрическая хромосома 21 необычному клиническому течению у нашего пациента с большим интервалом между началом БК и эпилепсией.
Низкая доза перампанела оказалась чрезвычайно эффективной при миоклонических припадках у нашего пациента. Перампанел, противоэпилептический препарат третьего поколения, представляет собой неконкурентный антагонист рецепторов альфа-амино-3-гидрокси-5-метил-4-изоксазолепропионовой кислоты (AMPA), который очень эффективен в качестве адъювантной терапии у пациентов с генерализованной и фокальной эпилепсией. [7].Кроме того, перампанел был недавно одобрен в качестве монотерапии фокальной эпилепсии в Японии в январе 2020 г. [8]. Недавно сообщалось об эффективности низких доз перампанела при рефрактерном миоклонусе у пациентов с эпилепсией [9, 10]. Перампанел имеет хороший профиль безопасности и хорошо переносится, поэтому терапевтический мониторинг лекарственных средств считается полезным, поскольку доза линейно коррелирует с эффектом и побочными эффектами [11]. Однако надежный терапевтический диапазон плазменной концентрации перампанела не установлен, поскольку индивидуальные референсные диапазоны широко варьируются [11].Согласно ранее опубликованным данным [12], у 92 взрослых пациентов в стабильном состоянии средняя общая концентрация перампанела в плазме составила 323,5 нг / мл. Соответствующая средняя доза составляла 7,5 мг (диапазон 2–12 мг). С другой стороны, в нашей больнице концентрация в плазме пациентов, принимавших перампанел, обычно составляла около 1000 нг / мл [неопубликовано. данные]. Таким образом, нашему пациенту удалось добиться разрешения приступов с помощью более низкой дозы и более низкой концентрации перампанела в плазме.
В заключение следует отметить, что монотерапия низкими дозами перампанела была эффективной при миоклонических припадках у нашего пациента с изодицентрической хромосомой 21.Если у пожилых пациентов с DS наблюдаются эпилепсия и миоклонус даже на запущенной стадии, мы предлагаем перампанел в качестве варианта терапии первой линии. Необходимо собрать дополнительные данные о клинической картине СД с редким кариотипированием и назначением перампанела от СД.
Заявление об этике
Родитель пациента предоставил как устное, так и письменное информированное согласие на публикацию этого отчета (включая публикацию изображений).
Заявление о конфликте интересов
Авторы не заявляют о конфликте интересов.
Источники финансирования
Авторы не получали внешнего финансирования.
Вклад авторов
Коджи Обара был основным неврологом пациента и составил рукопись. Шигео Мамия был основным неврологом и врачом пациента. Цуёси Имота проводил электрофизиологическое обследование пациента. Итару Тойосима отредактировал рукопись и отредактировал статью.
Список литературы
- Байен Э., Поссин К.Л., Чен Й., Клерет де Лангавант Л., Яффе К.Распространенность старения, деменции и мультиморбидности у пожилых людей с синдромом Дауна. JAMA Neurol. 2018 ноя; 75 (11): 1399–406.
- Де Симон Р., Пуч XS, Желисс П., Креспель А., Гентон П. Старческая миоклоническая эпилепсия: описание общего состояния, связанного с болезнью Альцгеймера при синдроме Дауна.Захват. 2010 Сен; 19 (7): 383–9.
- d’Orsi G, Specchio LM; Апулийская исследовательская группа по старческой миоклонической эпилепсии. Прогрессирующая миоклоническая эпилепсия у пациентов с синдромом Дауна с деменцией. J Neurol. 2014 август; 261 (8): 1584–97.
- Путра М., Сурти Ю., Ху Дж., Стил Д., Клеменс М., Саллер Д. Н. и др.Фенотип не только синдрома Дауна: изодицентрическая хромосома 21, полученная по отцовской линии, с частичной моносомией 21q22.3. Am J Med Genet A. 2017 декабрь; 173 (12): 3153–7.
- Флорес-Рамирес Ф., Паласиос-Герреро С., Гарсия-Дельгадо С., Моралес-Хименес А.Б., Ариас-Вильегас С.М., Сервантес А. и др. Цитогенетический профиль в 1921 случае синдрома трисомии 21.Arch Med Res. 2015 август; 46 (6): 484–9.
- Эгашира М., Кондо Т., Кавара Х., Мотомура Х., Тагава М., Харада Н. и др. Зеркальное дублирование хромосомы 21 с полным фенотипом синдрома Дауна. Pediatr Int. 2008 август; 50 (4): 597–9.
- Почка Х, Тринка Э.Перампанель: имеет ли он потенциал широкого спектра действия? Эпилепсия. 2019 март; 60 Приложение 1: 22–36.
- Eisai [Интернет]. Одобрение противоэпилептического препарата FYCOMPA® в Японии для монотерапии и по педиатрическим показаниям при частичном приступе, а также новой лекарственной формы. [цитируется 23 января 2020 г.].Доступно по ссылке: https://www.eisai.co.jp/news/2020/pdf/news202004pdf.pdf
- Ои К., Нешиге С., Хитоми Т., Кобаяши К., Тодзима М., Мацухаши М. и др. Перампанел в низких дозах улучшает рефрактерный кортикальный миоклонус за счет диспергированных и подавленных пароксизмальных деполяризационных сдвигов в сенсомоторной коре.Clin Neurophysiol. 2019 Октябрь; 130 (10): 1804–12.
- Иидзима М., Огуни Х., Кобаяси М., Китагава К. Перампанель улучшил трудноизлечимый миоклонус у двух пациентов с миоклонической эпилепсией. eNeurologicalSci. 2019 Ноябрь; 17: 100215.
- Reimers A, Berg JA, Burns ML, Brodtkorb E, Johannessen SI, Johannessen Landmark C.Пересмотр референтных диапазонов для противоэпилептических препаратов: практический подход к созданию национальных руководств. Drug Des Devel Ther. 2018 Февраль; 12: 271–80.
- Steinhoff BJ, Hübers E, Kurth C, Jürges Kehl-Kork U. Концентрация в плазме и клинические эффекты перампанеля — опыт Kork.Захват. 2019 апр; 67: 18–22.
Автор Контакты
Кодзи Обара
Отделение неврологии
Национальная больничная организация, Национальная больница Акита
84-40 Иваки, Учимитчикава-аза, Идоносава, Юрихондзё, Акита 018-1393 (Япония)
obarako @ hotmail.co.jp
Подробности статьи / публикации
Поступила: 9 апреля 2020 г.
Дата принятия: 3 мая 2020 г.
Опубликована онлайн: 10 сентября 2020 г.
Дата выпуска: сентябрь — декабрь
Количество страниц для печати: 6
Количество рисунков: 2
Количество столов: 0
eISSN: 1662-680X (онлайн)
Для дополнительной информации: https: // www.karger.com/CRN
Лицензия открытого доступа / Дозировка лекарства / Заявление об ограничении ответственности
Эта статья находится под международной лицензией Creative Commons Attribution-NonCommercial 4.0 (CC BY-NC). Для использования и распространения в коммерческих целях требуется письменное разрешение. Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат. Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Генерализованная миоклоническая эпилепсия с фоточувствительностью у молодых собак, вызванная дефектной ГТФазой 1 семейства DIRAS
Значимость
Комплексные клинические, неврологические и генетические исследования характеризовали синдром генерализованной миоклонической эпилепсии с фоточувствительностью у молодых собак родезийского риджбека.Средний возраст начала судорог — 6 мес. Генетический анализ выявил дефектный ген и белок GTPase 1 ( DIRAS1 ) семейства DIRAS. DIRAS1 широко экспрессируется в головном мозге, предполагается, что он регулирует высвобождение ацетилхолина и играет роль в развитии нервной системы. Это исследование раскрывает ген-кандидат миоклонической эпилепсии человека и модель трансляции для дальнейшего выяснения роли DIRAS1 в нейротрансмиссии и нервном развитии, а также его модуляции в качестве терапевтического варианта при распространенной эпилепсии.
Abstract
Описаны клинические и электроэнцефалографические особенности генерализованной миоклонической эпилепсии у собак с фоточувствительностью и началом у молодых собак родезийского риджбека (от 6 недель до 18 месяцев). Полностью пенетрантная рецессивная делеция 4 п.н. была идентифицирована в гене GTPase 1 семейства DIRAS ( DIRAS1 ) с измененным паттерном экспрессии белка DIRAS1 в пораженном мозге. Этот нейрональный ген DIRAS1 с предполагаемой ролью в холинергической передаче не только является кандидатом на миоклоническую эпилепсию человека, но и дает представление об этиологии заболевания, создавая спонтанную модель для будущих интервенционных исследований и функциональной характеристики.
Собаки представляют собой физиологически релевантные модели болезней человека. Агрессивное разведение привело к уникальной генетической архитектуре, которая облегчает открытие генов (1). Многие породы происходят от ограниченного числа животных-основателей, и использование популярных производителей является обычной практикой. Как следствие, каждая порода представляет собой изолированную популяцию с высоким уровнем фенотипической однородности, сниженным генетическим разнообразием и большим количеством заболеваний, характерных для породы (2). Сотни естественных собачьих заболеваний аналогичны человеческим заболеваниям, таким как диабет, рак, эпилепсия, глазные болезни, аутоиммунные заболевания и моногенные заболевания.
Эпилепсия — наиболее частое хроническое неврологическое заболевание у собак (3). У многих пород собак подозревается сильный генетический фон с высокой распространенностью (4), и несколько генов были обнаружены как при симптоматической, так и при идиопатической эпилепсии. Большинство этих генов представляют собой ортологи соответствующих генов эпилепсии человека, таких как собачьи модели прогрессирующей миоклонической эпилепсии, включая NHLRC1 при болезни Лафора (5, 6) и CLN1 , CLN2 , ATP13A2 , CLN , CLN6 , CLN8 и MFSD8 при различных типах цероидного липофусциноза нейронов (1, 7).Только два гена связаны с идиопатической эпилепсией у собак: ADAM23 и LGI2 (8, 9).
В этом исследовании мы описываем уникальную модель генетической генерализованной эпилепсии у собак родезийского риджбека (RR), для которой характерен молодой возраст начала. RR — африканская порода собак, происходящая из Родезии, ныне Зимбабве. Характерной особенностью породы является спинной гребень, вызванный латеральной, а не каудальной ориентацией волос в этой области (10). RR отражает смесь нескольких европейских пород собак и местной гребенчатой собаки готтентот-кой и изначально разводился для охоты на львов (10, 11).Наличие нескольких пораженных собак с определенным фенотипом во многих пометах предполагало унаследованное заболевание, что потребовало от нас проведения всестороннего исследования для описания клинических особенностей и поиска генетической причины.
Результаты
Генерализованная миоклоническая эпилепсия с фоточувствительностью у молодых собак RR.
В общей сложности мы изучили 95 собак RR, из которых 24 (15 самцов, 9 самок) обладали уникальным эпилептическим фенотипом с частыми миоклоническими подергиваниями / подергиваниями с началом у молодых собак (в среднем 6 мес; медиана 3.5 мес; диапазон от 6 недель до 18 месяцев) как выдающуюся особенность. Одиннадцать собак были в возрасте от 5 до 18 месяцев (молодые, подростковые) в возрасте начала заболевания, у 12 собак начало заболевания было в возрасте от 2 до 4 месяцев (что соответствует возрасту от 2 до 10 лет у людей в детстве), а у одной собаки. это было на 6 неделе (младенческий). Сообщалось о светочувствительности у восьми собак. Заболевание прогрессировало до генерализованных тонико-клонических приступов (GTCS) у 38% собак в течение 6 месяцев (в среднем 1,5–29 месяцев) после начала миоклонических приступов. Владельцы трех собак (возраст> 8 лет) сообщили, что собаки сохраняли нормальные познавательные способности на протяжении всей жизни.
Миоклонические судороги описывались владельцами как сильные пугающие или даже напоминающие поражение электрическим током. Предыдущих изменений в поведении не наблюдалось. Миоклонические подергивания в основном возникали, когда животные находились в лежачем положении и были расслабленными, сонливыми или на первых этапах сна и с закрытыми или открытыми глазами. Иногда подергивания возникали также, когда собаки сидели, стояли или гуляли (фильм S1). Во время миоклонических приступов вегетативных признаков не наблюдалось.Судя по видеообзору, миоклонические подергивания в основном ограничиваются туловищем, мускулатурой проксимальных отделов конечностей (особенно грудных конечностей), шейной мускулатурой, вызывающей кивающие движения головой (фильм S2), и лицом (жевательные мышцы, приводящие к жевательным движениям, веками и т. ухо дергается). Миоклонические подергивания часто ограничиваются одной стороной тела или начинаются с нее; однако последовательного побочного пристрастия обнаружить не удалось. Интенсивность варьировалась между событиями и отдельными собаками. Некоторые сокращения мышц были довольно тонкими, с небольшим диапазоном движений, тогда как другие были очень сильными и временами заставляли собак подпрыгивать в воздухе или биться об пол, стену или мебель.Хотя единичное событие длилось менее 1 секунды, подергивания часто происходили сериями как повторяющиеся сокращения миоклонических мышц. GTCS также часто предшествовала серия миоклонических подергиваний. Некоторые собаки казались сбитыми с толку или напуганными после этих эпизодов и, казалось, были очень взволнованы после событий, вставали и беспокойно бродили вокруг. Следовательно, сон у этих собак оказался нарушенным. Между событиями собаки были нормальными. Владельцы сообщали о ежедневных (87%) или почти ежедневных (13%; каждый второй-третий день) возникновении миоклонических подергиваний с частотой до 150 подергиваний в день.У некоторых собак регистрировалось до 50 рывков в час. У двух собак во время течки отмечалось усиление миоклонических подергиваний (случаи 2 и 11). У трех братьев и сестер (случаи 8, 9 и 10) и еще одной собаки (случай 6) начало миоклонии наблюдалось через 2 дня после вакцинации. Начало GTCS, по-видимому, было временно связано с вакцинацией еще у двух собак (случаи 6 и 7).
Диагностические исследования (таблица S1) не выявили каких-либо устойчивых структурных аномалий. Несколько собак имели потенциальные аномалии мозга при оценке нейровизуализации, которые могут быть случайными обнаружениями, такими как асимметрия желудочков (12) (Таблица S2).Двадцать один RR с миоклонической эпилепсией лечился различными противоэпилептическими препаратами (AED: фенобарбитал, бромид калия, примидон, леветирацетам, клоназепам, имепитоин; монотерапия или комбинация) в адекватных дозах и концентрациях в сыворотке (фенобарбитал: в среднем 28,6 мг / л). ; бромид калия: в среднем 1353 мг / л) в пределах терапевтического диапазона (13). Леветирацетам, который также является эффективным лекарством от ювенильной миоклонической эпилепсии (ЮМЭ) у людей (14), и бромид калия оказались наиболее эффективными на основе реакции владельцев собак.
Таблица S1.Клинические протоколы
Таблица S2.Клинические данные и данные ЭЭГ
На момент подачи заявки три собаки были усыплены в возрасте 9 месяцев, 2 лет и 5 лет из-за плохого контроля над приступами; три собаки умерли от причин, не связанных с эпилепсией, и одна умерла по неизвестным причинам (Таблица S2). Одна собака была доступна для патологоанатомического исследования (случай 2), которое исключило экстракраниальные патологии. В этом единственном мозге гистология показала только постиктальные изменения, включая умеренную кластеризованную нейрональную гиперэозинофилию в латеральном коленчатом ядре и слоях пирамидных клеток неокортекса.Гистоархитектурные изменения, дисморфические нейроны и реактивный глиоз не были очевидны. Остальные собаки были живы без каких-либо признаков снижения умственных или когнитивных функций.
Амбулаторная беспроводная видео-ЭЭГ для определения электроклинического синдрома.
Одновременные записи видео и ЭЭГ документально подтвердили эпилептическое происхождение событий в 82% обследованных случаев (Таблица S2). ЭЭГ регистрировали в течение длительного времени (> 1 ч, 13 отведений для записи) в 17 пораженных RR, показывающих миоклонические подергивания, и 11 контрольных группах, соответствующих породе (10 здоровых RR, 1 RR с идиопатической эпилепсией с GTCS).Фоновая активность была указана у всех собак (15). Миоклонические подергивания переменной интенсивности наблюдались во всех случаях, кроме двух, во время записи ЭЭГ. Характерный иктальный паттерн представлял собой обобщенные спайк-волновые комплексы (SWC) 4–5 Гц (рис. 1 A и B ) или полиспайк-волновые комплексы (PSWC) во время начальной фазы с преимущественно лобно-центральным максимум, который часто переключался между разными отведениями в обоих полушариях, а иногда и генерализовался с задержкой во времени.Другой иктальный паттерн состоял из двухфазных спайков и пароксизмальных всплесков, состоящих из спайков с частотой 7-8 Гц, которые иногда снова сопровождались SWC и случайным возникновением фокальной активности (рис. S1). У некоторых собак миоклоническая активность соответствовала началу иктальных разрядов, тогда как у других миоклоническим подергиваниям предшествовало нарастание пароксизмов ЭЭГ. Не вся двигательная активность сопровождалась пароксизмом ЭЭГ, но миоклонические подергивания выглядели одинаково, а мышечный артефакт в некоторых случаях мог скрывать коррелят ЭЭГ.В пораженных RR также наблюдались эпилептиформные разряды, включающие иктальные спайки или интерктальные SWC с частотой 4–5 Гц (рис. S1). Кроме того, некоторые собаки периодически демонстрировали ритмичное замедление на 4-5 Гц, которое временами трансформировалось в SWC, сопровождаемое миоклоническими подергиваниями. При записи ЭЭГ миоклонические подергивания возникали преимущественно во время спокойного отдыха, сонливости или медленноволнового сна. У некоторых собак единичные эпизоды регистрировались в состоянии бодрствования и еще реже — в положении стоя. Точно так же пароксизмы ЭЭГ возникали с большей частотой, когда собаки были менее бдительны.Эффект от недосыпания не оценивался. Для ЭЭГ вместо лишения сна мы поощряли собак спать. Незаметные записи ЭЭГ были получены от контрольных собак.
Рис. 1.Иктальная ЭЭГ. LFF: 1 с; HFF: 70 Гц. ( A и B ) Незначительные подергивания головы и век сопровождались комплексами спайк-волна 4 Гц с центральным максимумом ( A : ссылочный монтаж Cz; B : биполярный монтаж). ЭЭГ также представлена как вспомогательный онлайн-материал (рис.S1 и фильм S4).
Рис. S1.Видео-ЭЭГ с межприступными и иктальными спайками. LFF: 1 с; HFF: 70 Гц. ( A и B ) Эти пиково-волновые комплексы с частотой 4 Гц не сопровождались какими-либо видимыми движениями ( A : ссылочный монтаж Cz; B : биполярный монтаж). ( C и D ) Иктальные шипы ( C : ссылочный монтаж Cz; D : биполярный монтаж).
Фоточувствительность — признак генерализованной миоклонической эпилепсии у собак RR.
Визуально индуцированные судороги были зарегистрированы в 8 из 23 (35%; доверительный интервал 95%: 18,7–55,2%) ОР с генерализованной миоклонической эпилепсией (Таблица S2). Они были описаны как миоклонические припадки, вызванные зрительными стимулами, такими как вспышки света, внезапное попадание света при открытии ставен утром или солнечный свет, прерываемый деревьями во время прогулки по лесу. Была предоставлена видеокассета, на которой за каждым световым стимулом (производимым фотовспышками) следовали миоклонические рывки (фильм S3).После записи видео-ЭЭГ с фотической стимуляцией в шести пораженных RR, четыре собаки (66%) демонстрировали фотоконвульсивные реакции, синхронизированные по времени с началом светового стимула (таблица S2 и фильм S4). Видео-ЭЭГ с фотостимуляцией не выявила каких-либо отклонений у клинически здоровых контролей RR, включая трех гетерозиготных носителей делеции гена. Помимо света, шум также был триггером у трех братьев и сестер (случаи 8–10).
Генетический анализ выявил делеционную мутацию длиной 4 п.н. в
DIRAS1 .Родословная, установленная вокруг пораженных собак, свидетельствует об аутосомно-рецессивном наследовании (рис. S2). Чтобы определить генетическую причину генерализованной миоклонической эпилепсии в RR, мы объединили исследование полногеномной ассоциации (GWAS) и анализ секвенирования следующего поколения с использованием всего экзома (WES) и полногенома (WGS) ресеквенирования. Предполагая рецессивный тип наследования, WES-анализ двух несвязанных случаев против 169 экзомов от неэпилептических собак (Таблица S3) привел к группе из 10 вариантов, из которых 6 находились в предсказанных кодирующих областях (Таблица S4).Был обнаружен только один несинонимичный вариант, делеция 4 п.н. в экзоне 2 гена DIRAS1 (c.564_567delAGAC; структура гена в соответствии с данными CanFam3 Improved Annotation Data v1 Института Броуда) (рис.2 D ), в результате в смещении фреймворка и стоп-лосс (рис. S3). GWAS и анализ гаплотипов в 10 случаях RR и 18 контроле RR поддержали исследование WES, определив наиболее ассоциированную область ( P = 0,977 × 10 −5 ) (Таблица S5) в области 1,6 МБ (55 597 243– 57,195,857) на хромосоме 20 (рис.2 A ), включая ген DIRAS1 (рис.2 C ). В одном из случаев критическая область была далее разделена на области размером 300 т.п.н. и 890 т.п.н. (фиг. 2 B ) путем рекомбинации 400 т.п.н. WGS одной собаки с эпилепсией также идентифицировал делецию c.564_567delAGAC в DIRAS1 , но она отсутствовала в 99 контрольных полных геномах (Таблица S3). Анализ структурных вариаций в данных WGS был проведен в пределах исходной 1,6-мегабайтной ассоциированной области собаки с эпилептическим RR.Только одна дупликация размером 35 т.п.н. (56 210 949–56 246 523) была обнаружена в регионе; однако он находился за пределами гаплоблока размером 890 т.п.н., связанного с заболеванием, который начинается с 56,3 МБ (рис. 2 B ). Кроме того, дупликация присутствовала у нескольких неэпилептических контрольных собак в наших данных WGS для 99 собак (Таблица S3), исключая ее как кандидата на эпилепсию в RR.
Рис. 2.GWAS. ( A ) Манхэттенский график показывает наилучшие значения P на хромосоме 20. ( B ) Гаплотип размером 890 т.п.н. является общим для всех случаев.( C ) Связанная область содержит 33 гена, включая DIRAS1 . ( D ) Хроматограммы пораженной собаки, носителя и собаки дикого типа указывают на вариант c.564_567delAGAC.
Рис. S2.Родословная. Пример родословной RR с генерализованной миоклонической эпилепсией, предполагающий рецессивный тип наследования.
Таблица S3.Породы с данными NGS
Таблица S4.Кандидаты в мутации
Рис. S3.Сравнение последовательностей. ( A ) Выравнивание последовательностей нормального и мутированного белка DIRAS1 было построено для оценки эффекта c.564_567delAGAC смещение рамки. Вариант изменяет последние 10 аминокислот обычно длиной 198 аминокислот белка и производит стоп-лосс, приводящий к белку на 104 аминокислоты длиннее, чем у белка дикого типа. Домен Ras остается нетронутым. ( B ) Обзор схем.
Генотипирование делеции DIRAS1 в 14 клинически подтвержденных случаях RR и 26 контрольных случаях выявило гомозиготный мутантный генотип во всех случаях, гетерозиготный генотип у облигатных носителей и гомозиготный генотип дикого типа в контроле (рис.2 D ), что указывает на полную сегрегацию делеционного аллеля с заболеванием. Генотипирование дополнительных 498 RR из 13 стран показало несущую частоту ~ 15% (Таблица S6). Чтобы исследовать породную и эпилептическую специфичность делеции, мы генотипировали еще 965 собак с эпилепсией в 12 породах, но не нашли носителей, что указывает на то, что мутация специфична для генерализованной миоклонической эпилепсии в RR. В совокупности эти результаты убедительно свидетельствуют о том, что делеция в кодирующей области DIRAS1 вызывает генерализованную миоклоническую эпилепсию в породе.
Таблица S6.Собаки с генотипом: эпидемиологическое расследование
Измененный паттерн внутриклеточной экспрессии мутанта DIRAS1.
Характер экспрессии транскрипта DIRAS1 плохо охарактеризован и предположительно ограничивается мозгом и сердцем (16). Мы амплифицировали транскрипт в 28 тканях собак, включая 12 областей головного мозга, спинной мозг и 15 периферических тканей, и обнаружили обильную экспрессию во всех областях мозга, в то время как паттерн был более ограниченным и изменчивым в дополнительных нервных тканях (рис.S4). Возможный паттерн онтогенетической экспрессии DIRAS1 также был исследован в лобной коре в шести различных временных точках: 2, 5 и 23 месяца, а также 4, 5 и 9 лет. Результаты указывают на повышенную экспрессию до взрослого возраста (фиг. 3 A ).
Рис. 3. ВыражениеDIRAS1 . ( A ) Увеличение экспрессии транскрипта DIRAS1 с возрастом наблюдалось при сравнении шести разных возрастных точек во фронтальной коре (возраст 2 мес., 5 мес., 23 мес., 4 года и 10 мес., 5 мес. y и 3 мес, и 9 лет, n = 1 в каждом).( B ) Стабильность транскрипта DIRAS1 изучалась в лобной коре головного мозга соответствующего возраста (24 и 23 месяца) пациента (RR, n = 1) и контроля (немецкий дог, ). n = 1) собак методом количественной ПЦР. Результат предполагает умеренное снижение стабильности мутантного транскрипта. Планки погрешностей относятся к отклонениям в трех экспериментальных повторах (SD <0,13 в каждом). YWHAZ и GADPH использовали в качестве контроля загрузки в количественной ПЦР.
Рис. S4.Паттерн экспрессии DIRAS1 . Профили экспрессии транскрипта DIRAS1 в 28 тканях указывают на обильный паттерн в различных областях мозга, но более ограниченный паттерн обнаруживается в неневральных тканях. Стабильность транскрипта DIRAS1 заметно не изменяется в лобных долях случайной (RR) и контрольной (бельгийской овчарки) собаки с помощью полуколичественной ПЦР с использованием GADPH в качестве контроля загрузки. А — артерия; L, лобус.
Делеция 4 п.н. находится в конце кодирующей области DIRAS1 , что приводит к сдвигу рамки считывания на С-конце предсказанного белка (рис. S3). Последние 10 аминокислот DIRAS1 изменяются, вызывая стоп-лосс, за которым следуют 104 дополнительные аминокислоты. Единственный функциональный домен, RAS, остается интактным, но белок имеет дополнительные области низкой сложности по направлению к его С-концу (Fig. S3), вероятно, делая мутантный белок функционально измененным. Влияние делеционной мутации на стабильность транскрипта DIRAS1 исследовали с помощью количественной ПЦР в лобной коре между двухлетними собаками соответствующего возраста и контрольными собаками.Результат показал лишь небольшое уменьшение в случае (рис. 3 B ), что также согласуется с незначительным изменением полуколичественной ПЦР (рис. S4).
Иммуномечение выявило обильную экспрессию антигена DIRAS1 во всем головном мозге (стволе мозга, мозжечке и переднем мозге), включая холинергические базальные ядра переднего мозга, изображенные на рис. 4. Паттерны внутриклеточной экспрессии дикого типа и мутантного DIRAS1 несколько различались между отдельными пораженная собака и контрольные собаки.Характерный ядерный и мембранный паттерн, наблюдаемый у контрольных собак (RR и не RR) (рис. 4 A и C ), изменился на расширенное диффузное окрашивание сомат нервных клеток в пораженном RR (рис. 4 B ). и D ). Эти результаты предполагают, что существует постоянная экспрессия мутированного белка DIRAS1 с измененной внутриклеточной локализацией.
Рис. 4.Иммуногистохимическая экспрессия DIRAS1 . RR дикого типа демонстрируют преимущественно ядерное окрашивание (черная стрелка), что видно в теменной коре ( A ; синяя рамка) и холинергических ядрах переднего мозга ( C ; черная рамка).При мутации DIRAS1 ( B и D ) экспрессия белка является обильной, и наблюдается более диффузное окрашивание перикария нервных клеток (белая стрелка) во всех областях мозга, включая ствол мозга. На рисунке показана экспрессия в теменной коре головного мозга ( B ; синяя рамка) и ядрах переднего мозга ( D ; черная рамка). Холинергические целевые области были подтверждены окрашиванием на везикулярный переносчик ацетилхолина (AChT), как показано на вставке .(Шкала: A — D , 35 мкм; входной АЧТ, 150 мкм.)
Обсуждение
Это исследование характеризует генерализованную миоклоническую эпилепсию, специфичную для данной породы, с ранним началом. Результаты генетических и функциональных исследований показывают, что эпилепсия вызвана делецией 4 п.н. в кодирующей области гена DIRAS1 , что приводит к сдвигу рамки считывания и стоп-лоссу. Мы обнаружили обильную экспрессию DIRAS1 по всему мозгу собаки с различиями в паттернах субклеточной экспрессии между белками дикого типа и мутантными белками.Хотя функции млекопитающих неизвестны, предыдущие исследования показывают, что DIRAS1 необходим для передачи ацетилхолина в нервно-мышечных соединениях у Caenorhabditis elegans (17) и развития нейронов у рыбок данио (18). Следовательно, этот собачий дефект DIRAS1 обеспечивает не только ген-кандидат для генерализованной миоклонической эпилепсии, но также дает представление об этиологии заболевания, создавая спонтанную модель для доклинических исследований и функциональной характеристики.
Общие идиопатические генерализованные эпилепсии человека, признанные Международной лигой против эпилепсии, включают абсансную эпилепсию в детском возрасте, эпилепсию с миоклоническими абсансами, эпилепсию с миоклоническими атоническими припадками, эпилепсию только с GTCS, ювенильную абсансную эпилепсию, миоклоническую эпилепсию МЭ (19) и JE в младенчестве.Генерализованная миоклоническая эпилепсия у собак RR обнаруживает важные параллели с JME, которая является одной из наиболее распространенных форм эпилепсии у людей (14, 20–23). Как и у людей, подергивания являются двусторонними, аритмичными, иногда асимметричными и преобладают в верхних конечностях и туловище (20, 21), в результате чего в некоторых RR присутствуют дополнительные кивательные движения головой. Записи ЭЭГ выявили закономерность, наблюдаемую у пациентов с ЮМЭ: SW или PSW разряды с лобно-центральной акцентуацией и нормальной фоновой активностью со случайным возникновением фокальной активности, асимметриями ЭЭГ, меняющими стороны, и диффузным или периодическим замедлением (22, 24, 25). ).Важной характеристикой, присущей JME человека и генерализованной миоклонической эпилепсии в RR, является проявление светочувствительности, особенно потому, что JME имеет одну из самых сильных ассоциаций с светочувствительностью среди всех эпилепсий (26, 27). Фенотипическая гетерогенность была очевидной, потому что не все собаки были светочувствительными, что может отражать влияние возраста, пола или индивидуального генетического фона собак. У людей светочувствительность является возрастным феноменом и чаще встречается у детей с пиковым возрастом начала заболевания около 12 лет (27).Имеются также убедительные доказательства генетического компонента фотопароксизмального ответа (PPR) у людей, и были идентифицированы многие локусы (27–30). Таким образом, пораженные RR представляют собой еще одну спонтанную модель на крупных животных для исследования нейронных механизмов фоточувствительности (31, 32).
Однако существует также ряд отличительных характеристик и фенотипической гетерогенности: низкая распространенность GTCS (JME 80–95%; ОР 38%), отсутствие абсансов (хотя этот тип приступов может быть трудно распознать у собак. ), а также различный возраст начала: у некоторых собак было относительно раннее начало (6-10 недель) в период социализации (6-12 недель), а у других — в юношеский период (начиная с 12 недель) и в подростковом возрасте до 18 лет. мес., когда поведенческое созревание у собак имеет тенденцию к достижению взрослых значений (33–35).Существуют различия между породами собак и различия в порядке развития социальных и моторных навыков между собаками и людьми (34). Таким образом, ранний возраст начала может все еще соответствовать синдромам генетической генерализованной эпилепсии человека, таким как JME, при котором у 25% могут быть абсансы, а не миоклонические приступы в детстве. Люди с JME также имеют интерктальные эпилептические разряды от 2 до 3 Гц и от 4 до 6 Гц, и у большинства из них наблюдаются полиспайки (22). ЭЭГ в некоторых случаях не показывала четких иктальных разрядов в связи с миоклонусом.Хотя считалось, что ЭЭГ скрыта мышечным артефактом миоклонуса, миоклоническое поведение необходимо отслеживать с помощью телеметрии для дальнейших исследований. Также есть вероятность, что генератор миоклонических приступов не поверхностный, а подкорковый. ЭЭГ не сможет обнаружить глубокую функцию нейронов, если генератор находится на уровне ствола мозга. Хотя светочувствительность наблюдалась у 35% собак, распространенность светочувствительности, основанная на исследованиях ЭЭГ, оказалась выше (66%), чем у людей, а у людей фотопароксизмальные и фотосудорожные реакции максимальны лобно-центрально, а не затылочно.Результаты МРТ широко распространены, что не характерно для ЮМЭ человека. Мы признаем, что наличие результатов МРТ указывает на симптоматическую этиологию; однако последовательных результатов не было. Асимметрия желудочков также часто присутствует у собак без эпилептических припадков и, следовательно, может не иметь клинического значения (12). Точно так же у нормальных собак постоянно наблюдается небольшое усиление менингеальной оболочки (36). Однако мы не можем исключить, что некоторые структурные аномалии взаимодействовали с фенотипом: например, снижение порога припадков на обоих полушариях.Фенотип ЭЭГ соответствует генерализованной миоклонической эпилепсии и, конечно, не фокальной эпилепсии. Наконец, человеческий JME характеризуется сильной хронозависимостью с миоклоническими подергиваниями и GTCS утром после пробуждения или во время периодов расслабления вечером (37). Хотя генерализованная миоклоническая эпилепсия в RRs также показывает сильную связь с циклом сна-бодрствования, миоклонические подергивания и разряды ЭЭГ появлялись преимущественно в расслабленном состоянии, в состоянии покоя или во время первых стадий сна, отражая подтипы JME (38).Наблюдаемые различия могут отражать видоспецифические различия в биоритмичности и регуляции сна или могут указывать на параллели с другими генетическими эпилепсиями, связанными со сном, такими как миоклоническая эпилепсия в младенчестве, которая иногда прогрессирует до JME (39), или аутосомно-доминантной ночной лобной эпилепсии. (НФЛЭ) (40).
DIRAS1 — новый ген эпилепсии с устойчивым паттерном экспрессии в тканях ЦНС. Он является частью семейства малых GTPases Ras, которые связаны со многими клеточными сигнальными путями в росте и дифференцировке клеток, синаптической пластичности, обучении и памяти (41–43).DIRAS1 и DIRAS2 образуют биохимически и функционально отличную ветвь Ras GTPases, которые характеризуются высокой скоростью обмена гуанидин-нуклеотид (16). Биологическая функция DIRAS1 у млекопитающих плохо изучена. Предполагается, что DIRAS1 действует как опухолевый супрессор в глиобластоме и других линиях опухолевых клеток за счет ингибирования Ras-опосредованной трансформации, изменения транскрипционной активности NF-κB, снижения передачи сигналов ERK1 / 2 и MAPK и антагонизма проонкогенных малых Ras GTPases. (44).Исследования C. elegans продемонстрировали, что DIRAS1 и обменный белок, непосредственно активируемый ортологами цАМФ (EPAC), колокализуются на пресинаптических мембранах и необходимы для поддержания нормального пресинаптического высвобождения ацетилхолина в нервно-мышечных соединениях (17). DIRAS1 также предположительно играет роль в миграции клеток, росте нейритов и архитектуре дендритов в развивающейся нервной системе модели рыбок данио (18).
Понимание роли и механизмов DIRAS1 в холинергической нейротрансмиссии и эпилепсии остается важной задачей.Никотинэргическая холинэргическая активность влияет на возбудимость мозга и когнитивные функции, регулирует возбуждающее / тормозное переключение ГАМК во время развития нейронов (45), стимулирует высвобождение глутамата из таламокортикальных окончаний, контролирует высвобождение ГАМК на пирамидные нейроны и поддерживает небыстрый сон при движении глаз за счет низких уровней ацетилхолина, при этом холинергическая стимуляция связана с микровозбуждением на этой стадии сна (46). Мутации в субъединицах никотинергического ацетилхолинового рецептора (nAChR) CHRNA4 , CHRNA2 и CHRNB2 связаны с аутосомно-доминантной NFLE и спорадической NFLE (47).C HRNA7 , кодирующий субъединицу α7 nAChR, также является потенциальным геном-кандидатом для JME у человека (48). Аномальная функция DIRAS1 может изменять холинергическую нейротрансмиссию или формирование нейронных цепей и сборку сетей в развивающемся мозге, что приводит к миоклонической эпилепсии и светочувствительности. Эта собачья модель представляет собой главный ресурс для решения этих вопросов и механизмов в будущих экспериментах, включая индуцированные мутациями культуры нейронов.
Таким образом, тщательные клинические и генетические исследования идентифицировали ген-кандидат одной из наиболее распространенных форм эпилепсии человека с предполагаемой функцией холинергической нейротрансмиссии.При проверке гена в когортах людей с миоклонической и эпилепсией на предмет вариантов риска будущие функциональные исследования должны выявить DIRAS1-опосредованные механизмы нейротрансмиссии и предоставить лекарственные мишени для обычных эпилепсий.
Материалы и методы
Группы исследования.
Выявлено 24 случая RR (Таблица S2). Критериями включения были клиническое наблюдение за миоклоническими подергиваниями на видеозаписи или наблюдение в одном из центров исследования и заполнение онлайн-анкеты или интервью.В общей сложности 538 образцов крови и тканей с ЭДТА были собраны в частных RR в Германии, Финляндии и 11 других странах (Таблица S6). Была включена когорта из 965 собак с эпилепсией 12 других пород из Финляндии (Таблица S6). Сбор образцов был одобрен с этической точки зрения Комитетом по этике животных Государственного провинциального управления Южной Финляндии, Хямеэнлинна, Финляндия (ESAVI / 6054 / 04.10.03 / 2012), «Кантональным комитетом по экспериментам на животных» (кантон Берн; разрешение 23/10) и Немецкий закон о защите животных.Более подробная информация представлена в документе SI «Материалы и методы» .
Нейродиагностическое исследование.
Все пациенты РР прошли клиническое, неврологическое и лабораторное обследование. Структурная эпилепсия была исключена с помощью МРТ в 12 случаях RR и патологоанатомического исследования 1 собаки. Дополнительные исследования, включающие анализ спинномозговой жидкости (CSF), нейрометаболический скрининг, визуализацию с помощью компьютерной томографии, биопсию кожи и измерения концентрации сыворотки AED, были выполнены для ряда изученных собак.Более подробная информация представлена в документе SI «Материалы и методы» .
ЭЭГ.
Амбулаторная беспроводная видео-ЭЭГ в состоянии бодрствования была проведена в 17 случаях RR и 11 контрольных собаках RR. Запись велась в тихой обстановке, собакам предлагали лечь. ЭЭГ регистрировали с использованием 15 (7 на одну собаку) подкожных игольчатых электродов. В шести случаях и четырех контрольных была проведена дополнительная видео-ЭЭГ с фотостимуляцией в конце исследования ЭЭГ. Более подробная информация представлена в документе SI «Материалы и методы» .
Патологоанатомическое исследование.
Патологоанатомическое исследование было проведено на одном пораженном рубце. Животное подверглось стандартному вскрытию, при котором мозг был полностью удален и обрезан в соответствии со стандартизованными алгоритмами (49). Соответствующие области головного мозга (передний мозг, мозжечок, ствол мозга) были взяты и гистологически оценены с использованием нейрогистологических стандартных красок на парафиновых срезах.
GWAS.
Было проведено генотипирование 10 затронутых RR из исходной когорты исследования и 18 незатронутых RR.Данные генотипа были отфильтрованы, а частота и генотипирование удалены. Тест на ассоциацию случай-контроль был проведен PLINK (50) и программой Mendel Software’s Ped-GWAS (51). Более подробная информация представлена в документе SI «Материалы и методы» .
Изменение последовательности.
Были созданы библиотеки экзомов собак для двух случаев немецкого RR. Данные секвенирования были проанализированы и отфильтрованы в рамках рецессивной модели против 169 дополнительных экзомов (Таблица S3). Патогенность вариантов кодирования была предсказана в CanFam 3.1 аннотация. Один случай RR был секвенирован по всему геному и отфильтрован против 99 дополнительных полных геномов (Таблица S3), а наличие мутации-кандидата проверяли визуально. Более подробная информация представлена в документе SI «Материалы и методы» .
Секвенирование по Сэнгеру и генотипирование TaqMan.
Выявленный вариант-кандидат был подтвержден стандартной ПЦР с последующим секвенированием по Сэнгеру в 33 немецких образцах RR, включая 12 случаев из исходной когорты исследования. Для скрининга более крупных мутаций в дополнительных образцах (таблица S6) был проведен анализ TaqMan.Более подробная информация представлена в документе SI «Материалы и методы» .
Экспрессия гена.
Свежие посмертные образцы были собраны (полный список, рис. 3 и рис. S4) от одного случая и шести контрольных собак. РНК экстрагировали и обратно транскрибировали в кДНК. Собачий транскрипт DIRAS1 амплифицировали и секвенировали. Были проведены полуколичественные и количественные ПЦР. Более подробная информация представлена в документе SI «Материалы и методы» .
Иммуногистохимия.
Исследования тканей были проведены в головном мозге (передний мозг, мозжечок, ствол мозга) одного случая RR и трех контрольных RR (архив мозга невропатологии LMU в Мюнхене). Первичные антитела (pAB) были направлены против DIRAS1 и везикулярного переносчика ацетилхолина. Слайды демаскировали антигеном, инкубировали с pAB и окрашивали с использованием полимерной технологии и тетрагидрохлорида диаминобензидина. Более подробная информация представлена в документе SI «Материалы и методы» .
SI Материалы и методы
Группы исследования.
Выявлено 24 случая RR. Четыре исследовательских центра (Ветеринарная больница Трир, Трир, Германия; Ветеринарная клиника Батен-Нётен, Кельн, Германия; Отделение медицины и хирургии мелких животных, Университет ветеринарной медицины, Ганновер, Германия; Клиника медицины мелких животных, LMU Мюнхен, Германия) участвовал в наборе исходной когорты. Дополнительные случаи были отобраны путем обращения к участникам исследования на домашней странице LMU в Мюнхене и направления дипломатов Европейского колледжа ветеринарной неврологии.Критериями включения были клиническое наблюдение миоклонических подергиваний на видеозаписи или наблюдение в одном из центров исследования и заполнение обширного онлайн-опроса (semse.vetmed.uni-muenchen.de/umfragen/index.php?sid=%2018469&lang=de) или личное интервью. Исключались собаки с другими типами мышечных сокращений (например, тремор, фасцикуляции) или GTCS или фокальные припадки как единственное проявление эпилепсии. Собакам без видеодокументации миоклонических рефлексов с недостаточно заполненными анкетами было отказано в участии в исследовании.
Всего было собрано 538 образцов крови и тканей с ЭДТА в частных RR в Германии, Финляндии и 11 других странах (Таблица S6). Немецкая когорта исследования RR включала образцы крови 19 пораженных RR с генерализованным фенотипом миоклонической эпилепсии, 11 здоровых родственников (мать и отец двух пометов, четырех однопометников, одна дополнительная мать и ее сестра, одна двоюродная сестра) и 18 контрольных (13 здоровых RR). , 4 RR с идиопатическим GTCS, 2 RR с другими типами мышечных сокращений).Анализ генотипирования включал также когорту из 965 собак с эпилепсией 12 других пород из Финляндии (Таблица S6). Образцы хранили при -20 ° C до экстракции геномной ДНК с использованием полуавтоматического экстракционного робота Chemagen (PerkinElmer Chemagen Technologie) или набора Nucleon Bacc2 (GE Healthcare). Концентрацию ДНК определяли с помощью спектрофотометра NanoDrop ND-1000 UV / Vis или флуорометра Qubit 3.0 (Thermo Fisher Scientific). Сбор образцов был одобрен этически Комитетом по этике животных Государственного провинциального управления Южной Финляндии, Хямеэнлинна, Финляндия (ESAVI / 6054/04.10.03.2012), «Кантональный комитет по экспериментам на животных» (кантон Берн; разрешение 23/10) и «Институциональный наблюдательный совет» Клиники медицины мелких животных (LMU, Мюнхен, Германия, 28.05.13).
Нейродиагностическое исследование.
Все собаки прошли клиническое и неврологическое обследование у ветеринарного невролога. Лабораторные исследования включали полный подсчет клеток крови и биохимический профиль сыворотки (аланинаминотрансфераза, щелочная фосфатаза, общий билирубин, мочевина, креатинин, общий белок, альбумин, глюкоза, натрий, калий, хлорид, кальций, фосфат), венозный аммиак натощак (14 случаев) , желчные кислоты натощак и после приема пищи (7 случаев), активность креатинкиназы (8 случаев), ионизированный кальций (4 случая), профиль коагуляции (PT, PTT, TT; 1 случай) и панель щитовидной железы (общий T4, свободный T4, тироидный стимулирующий гормон; 7 случаев).Измерения концентрации AED в сыворотке (IDEXX Laboratories) были выполнены у шести собак, получавших фенобарбитал, и у четырех собак, получавших бромид калия. Нейрометаболический скрининг включал в себя органические кислоты, олигосахариды, мукополисахариды и аминокислоты в моче и сыворотке крови в 10 случаях и 1 связанный контрольный RR в специализированных лабораториях (Детская больница Франкфурта, Германия; Biocontrol, Labor Ingelheim, Ингельхайм, Германия; Ветеринарное отделение лаборатории сравнительной биохимической генетики. , Калифорнийский университет, Сан-Диего, Калифорния; Лаборатория скрининга метаболической генетики, Школа ветеринарной медицины, Университет Филадельфии, Пенсильвания).Биопсию кожи одной пораженной собаки погружали в 2,5% глутаровый альдегид и проверяли на ультраструктурные признаки метаболических нарушений с помощью электронной микроскопии (ZM 906, Zeiss). Продвинутая визуализация с помощью МРТ (LMU Munich: 1.5T Magnetom Symphony Syngo MR Siemens; Лейпцигский университет: Philips MR Ingenia 3T с Omega HP Gradient; Philips Medical Systems; различные другие МРТ-аппараты с высоким и низким полем) или КТ были выполнены в 12 и 7 собак соответственно. ЦСЖ для анализа получали после стерильной подготовки путем атланто-затылочной пункции у собак под общей анестезией в 17 случаях.
ЭЭГ.
Амбулаторная беспроводная видео-ЭЭГ в состоянии бодрствования была проведена в 17 случаях RR и 11 контрольных собаках RR (10 здоровых RR и 1 RR с идиопатической эпилепсией с GTCS) с использованием регистратора ЭЭГ Trackit MK3 / полиграфии с видео (Lifelines Neurodiagnostic Systems) и Persyst 12. программного обеспечения (Persyst Development Corporation и Micromed Morpheus Home LTM амбулаторный регистратор ЭЭГ (Micromed Neurodiagnostic). Поскольку рассматриваемые эпизоды возникали в основном, когда собаки были расслаблены, записи проводились в тихой обстановке, где собаки имели возможность лечь в удобную позиция.ЭЭГ регистрировали с использованием 15 подкожных игольчатых электродов из нержавеющей стали (F3, Fz, F4, F7, F8, C3, Cz, C4, O1, Pz, O2, T1, T2, Ref, Neut; Natus Europe, номер продукта 019-475800. ). Размещение электродов было таким, как описано Pellegrino и Sica (52) для мезэнцефальных собак, но изменено в соответствии с нашими требованиями: мы поместили подкожные иглы в передний угол глазной щели у основания уха для височных локусов (T3, T4), а эталон — более каудально. между медиальными уголками глазной щели, как было предложено James et al.(53). Мы не использовали лобные полярные отведения, но добавили два дополнительных электрода на расстоянии 1–1,5 см дорсолатерально от бокового угла угла глазной щели (F7, F8). После позиционирования все электроды фиксировали медицинской лентой (Leukoplast). Впоследствии записывающее устройство, а также оставшиеся провода были прикреплены к шлейке на спине собаки с помощью липких бинтов (Co-Flex). У одной собаки использовалось семь подкожных электродов, включая два лобных (F3, F4), один центральный (V) и два затылочных (O1, O2), а также контрольный электрод на тыльной стороне носа (Ref) и земля в шее (нейт.).В трех случаях и в одном контрольном для установки электродов потребовалась седация (0,015 мг / кг дексмедетомидина, реверсирование — 0,15 мг / кг атипамезола). В одном случае и в одном контроле запись видео-ЭЭГ проводилась после пробуждения от общей анестезии. Импеданс в большинстве случаев поддерживался ниже 10 кОм (в редких случаях до 20 кОм). В шести случаях и четырех контролях в конце исследования ЭЭГ была проведена дополнительная видео-ЭЭГ с фотостимуляцией (амбулаторный регистратор ЭЭГ Micromed Morpheus Home LTM, Micromed Neurodiagnostic).Использовалась лампа с круглым отражателем и расстоянием обзора 30 см. Стимуляцию проводили в течение 10 с с последующим отдыхом по 5 с на каждую частоту вспышек. Следующие частоты вспышек (в Гц) использовались в этом порядке: 1–6–11–18–7–12–16–4–25–10–17–9–14–3.
GWAS.
Генотипирование 10 пораженных и 18 незатронутых RR из немецкой исследовательской группы (рис. S2) было выполнено с использованием массива собачьих HD Illumina (173 k). Данные генотипа были отфильтрованы с частотой вызовов SNP> 95%, частотой вызовов массива> 95%, частотой минорных аллелей> 5% и с использованием равновесия Харди-Вайнберга P ≤ 0.00005. После обрезки частоты и генотипирования (с размером окна 50, шагом в пять SNP и порогом r 2 0,5) ни одна собака не была удалена, а 110 492 SNP оставались для анализа. Тест ассоциации случай-контроль (GWAS) был проведен PLINK (50) и Ped-GWAS с использованием программного обеспечения Mendel (51). Два случая и четыре контроля были исключены из анализа PLINK из-за родства. После анализа контроля качества Ped-GWAS в анализ были включены 107 852 SNP.
Изменение последовательности.
Библиотеки экзомов собак для двух случаев RR в Германии были созданы из стандартных индексированных библиотек Illumina с использованием специальной библиотеки захвата на основе решений Roche / Nimblegen (120705_CF3_Uppsala_Broad_EZ_HX1) в соответствии с протоколом, описанным ранее Elvers et al. (54). Данные секвенирования были проанализированы с использованием наших собственных сценариев, как описано ранее (55). Средний охват секвенированием варьировал от 25 до 35 × на образец и выявлял в среднем ∼108 909 вариантов на образец.Две пораженные собаки имели 30 506 гомозиготных вариантов; однако фильтрация в рамках рецессивной модели по 169 дополнительным экзомам от других доступных пород, не затронутых болезнью (Таблица S3), привела к получению в общей сложности 10 гомозиготных вариантов для конкретных случаев (Таблица S4), из которых 6 вариантов находились в предсказанных кодирующих областях (1 отступ, 5 синоним). SnpEff (56) использовался для прогнозирования патогенности вариантов кодирования в аннотации CanFam 3.1. В одном случае RR был секвенирован весь геном в лаборатории Science for Life в Стокгольме, Швеция, как описано ранее (57).Полный геном RR (~ 25 ×) был отфильтрован против 99 дополнительных полных геномов из других доступных пород, не затронутых заболеванием (Таблица S3). Были исследованы варианты в критической области 890 т.п.н. на хромосоме 20, выявив ранее идентифицированную мутацию в этом случае, хотя ни одна из других собак не несла ее. Наличие мутации-кандидата проверяли визуально в файле BAM с помощью Integrative Genomics Viewer. Анализ структурных вариаций в ассоциированной области был выполнен с использованием DELLY v0.6.7 для выявления возможных делеций или дупликаций для конкретного случая в данных WGS эпилептического RR против 99 неэпилептических контрольных геномов, включая два RR (Таблица S3). Обнаруженные сайты были объединены и регенотипированы по всем образцам с использованием DELLY v0.7.5. Варианты количества копий с генотипом должны были иметь поддержку как раздельного чтения (SR), так и парного конца (PE) (SR> 1 и PE> 5 или SR> 5 и PE> 1) для сохранения набора вызовов с высокой степенью достоверности.
Секвенирование по Сэнгеру и генотипирование TaqMan.
Выявленный вариант-кандидат (chr20: g.56’474’668_56’474’671delAGAC) была сначала подтверждена стандартной ПЦР с последующим секвенированием по Сэнгеру в 33 немецких образцах, включая 12 случаев из исходной когорты исследования. Прямой (ACAATGTCAAGGAGCTCTTCC) и обратный (GCTCACATGAGGACGCATT) праймеры были разработаны для амплификации области мутации с использованием AmpliTaq Gold 360 Mastermix (Applied Biosystems, Life Technologies) или ДНК-полимеразы Biotools. Затем реакции секвенирования проводили на капиллярном секвенаторе ABI 3730 (Applied Biosystems, Life Technologies) после обработки экзонуклеазой I и щелочной фосфатазой креветок.Данные последовательности Сэнгера анализировали с помощью Sequencher 5.1 (GeneCodes). Для более масштабного скрининга мутаций в дополнительных образцах (таблица S6) был разработан анализ TaqMan (Applied Biosystems) (зонды: GGAACATGAGCCTCAACATCGAT и GGACGCATTTGCCCTTGAC), и реакции проводились с помощью прибора Bio-Rad CFX96 Touch Real-Time PCR Detection System в соответствии с инструкции производителя.
Выравнивание последовательности.
Сборка CanFam 3.1 использовалась для всех анализов. Вся нумерация в пределах гена собачьего DIRAS1 соответствует образцам XM_005633100.2 и XP_005633157.1. Для аннотации гена и идентифицированного варианта риска мы использовали Broad Institute CanFam3 Improved Annotation Data v1. Выравнивания последовательностей нормальных и мутированных белков DIRAS1 были сконструированы с использованием инструмента Clustal Omega (www.ebi.ac.uk/Tools/msa/clustalo/). Выровненные белковые последовательности были взяты из базы данных Entrez Protein (https://www.ncbi.nlm.nih.gov/protein). Доменные структуры исследовались компанией SMART (smart.embl-heidelberg.de/).
Экспрессия гена.
Свежие образцы вскрытия были собраны у семи собак. Двадцать восемь различных тканей были собраны у одной финской бельгийской овчарки, не страдающей эпилепсией (полный список, рис. S4), убитой в возрасте 4 лет и 10 месяцев. Фронтальная кора головного мозга была собрана у пяти других контрольных собак без эпилепсии (одна двухмесячная жесткошерстная фокстерьер, одна пятимесячная лабрадор-ретривер, два немецких дога в возрасте 23 мес., 5 лет и 3 мес., Одна 9-летняя собака. -старый Салюки) и один футляр РР. 24-месячная самка RR была убита из-за тяжелых припадков, не поддающихся лечению фенобарбиталом, и контрольных собак из-за расстройств, не связанных с эпилепсией, или поведения с согласия владельцев.Образцы собирали сразу после умерщвления и мгновенно замораживали в жидком азоте перед хранением при -80 ° C. Тотальную РНК экстрагировали из тканей собаки с помощью набора RNeasy Mini Kit (Qiagen), а концентрации образцов измеряли с помощью флуориметра Qubit 3.0 (Thermo Fisher Scientific). Затем использовали набор High Capacity RNA-to-cDNA (Applied Biosystems, Life Technologies) для обратной транскрипции равных количеств общей РНК в кДНК. Как в полуколичественной, так и в количественной ПЦР, собачий транскрипт DIRAS1 был амплифицирован и секвенирован с использованием пары праймеров (TGAAGATGGACGTCATACTGCTT и GAACACCACCACTCGGTAGTC), которая была разработана для перекрытия границ экзон-интрон для контроля загрязнения геномной ДНК.Полуколичественная ПЦР выполнялась в трех разных циклах (27, 32 и 37 циклов) перед визуализацией ампликонов на 2,5% (мас. / Об.) Агарозном геле (100 об., 2 ч). GAPDH использовали в качестве контроля загрузки. Количественную ПЦР проводили для трех экземпляров каждого образца с использованием оборудования системы обнаружения ПЦР в реальном времени CFX96 Touch от компании Bio-Rad в соответствии с инструкциями производителя. YWHAZ и GAPDH использовали в качестве контроля загрузки. Относительный нормализованный паттерн экспрессии рассчитывали с помощью программного обеспечения Bio-Rad CFX Manager.SE между тремя повторами был ниже 0,13 в каждом исследуемом образце.
Иммуногистохимия.
Исследования тканей были проведены на головном мозге одного пораженного RR (случай 2), подаренного владельцем для патологоанатомического исследования. Животное подверглось стандартному вскрытию, на котором мозг был полностью удален и обрезан в соответствии со стандартизованными алгоритмами (49). Соответствующие области головного мозга (передний мозг, мозжечок, ствол мозга) были взяты и гистологически оценены с использованием нейрогистологических стандартных красок на парафиновых срезах.Идентичные срезы были получены и исследованы от трех здоровых (две собаки без припадков и одна с припадками, вторичными по отношению к острому геморрагическому инсульту) RR, допущенных по диагностическим причинам, не связанным с целью данного исследования. pAB были направлены на белок DIRAS1 (кроличий поликлональный, PA5-26409, Fisher Scientific) и везикулярный переносчик ацетилхолина (VAChT, кроличий поликлональный, Ab68984, Abcam). Поликлональные антитела против DIRAS1 были разработаны против синтетического пептида между 109 и 136 аминокислотами из центральной области человеческого DIRAS1.Этот эпитоп имеет 100% аминокислотную идентичность с соответствующим эпитопом собаки. Следовательно, шкала гомологии последовательностей делает весьма вероятным специфическую перекрестную реакцию антитела. Перед окрашиванием предметные стекла подвергали демаскированию антигена в цитратном буфере с помощью микроволнового излучения. Срезы инкубировали с pAB (DIRAS1 1: 500; ВАЧТ 1: 100) в течение 18 ч при 4 ° C. Для последующего окрашивания использовали полимерную технологию (IMPRESS Linaris) и набор для окрашивания диаминобензидинтетрагидрохлоридом.
Благодарности
Мы благодарим Мартина Дж.Шмидту, Тане А. Стейнберг, Верене Бутц, Андреасу Брюшвайну, Мартину Врзосеку и Ане Васелау за поддержку этого исследования; Тома Пипера, Стефана Арнольда и Силке Линка за обучение ЭЭГ; Адриану Сьюэллу за обсуждение результатов метаболического скрининга; Сини Карьялайнен и Риккардо Сольда за отличную техническую помощь; Консорциум базы данных биомедицинских вариантов собак (Гас Агирре, Кэтрин Андре, Даника Баннаш, Дорин Беккер, Корд Дрёгемюллер, Ева Ферроу, Урс Гигер, Кристоф Хитте, Марджо Хитёнен, Видхья Джаганнатан, Тоссо Либ, Джимбери Либ, Ойбери Либ, Ойбери Либ, Ойбери Либ, Ойбери Либ Schoenebeck, Claire Wade) за предоставление доступа к полногеномным вариантам контрольных собак; и всем владельцам собак за предоставленные образцы, и особенно тем, кто участвовал в клинических исследованиях.Исследование было поддержано Академией Финляндии (1268091), Фондом Сигрид Юселиус, Фондом Джейн и Аатос Эркко, ERCStG (260997), Epilepsiatutkimussäätiö, Biocentrum Helsinki, Обществом Мюнхенского университета, Фондом здоровья собак (грант CHF 02248), Фонд Альберта Хейма (проект 105) и Канадский фонд инноваций и Министерство исследований и инноваций Онтарио (30953).
Сноски
-
Вклад авторов: А.Ф. и Х.Л. разработали исследование; Ф.W., R.S., F.J., M.K.H., G.K., L.L.E.K., M.K., A.B.-N., K.M., A.F. и H.L. проводили исследования; F.J., G.K., M.A., M.K., A.B.-N., A.T., K.R., S.F.M.B., V.H., I.C.B., C.T., T.F., E.D., T.L., K.M. и H.L. предоставили новые реагенты / аналитические инструменты; M.K., A.B.-N., A.T., K.R., S.F.M.B., V.H., I.C.B., C.T., T.F. и E.D. внесенные дела; A.T., E.D., T.L. и K.M. дополнительные элементы управления; F.W., R.S., F.J., M.K.H., M.A.C., G.K., MA, A.T., K.M., A.F. и H.L. проанализировали данные; и F.W., R.S., F.J., A.F. и H.Л. написал статью.
