это скопление в тканях лимфатической жидкости из-за нарушения ее транспортировки
Что вызывает лимфедему?
Лимфатическая система вместе с сердечно-сосудистой системой составляет циркулятоную систему организма и выполняет ряд важных функций. Она играет решающую роль в иммунной системе, поэтому у здорового человека вряд ли есть основания задумываться о лимфатической системе. Мы вспоминаем о ней только тогда, когда происходят сбои в ее работе, например, в случае развития лимфедемы.
Что это такое? Лимфедема возникает, когда лимфатическая жидкость не может отводиться от тканей и накапливается в них. Руки и ноги увеличиваются в объеме и формируются хронические отеки.
Тем не менее, при правильном лечении и позитивном настрое пациент может вести обычную повседневную жизнь. Одно можно сказать наверняка: способы остановить развитие лимфедемы -ЕСТЬ.
Служба «утилизации опасных отходов» организма
Лимфатическую систему можно сравнить со службой «утилизации опасных отходов», поскольку она выводит их из организма.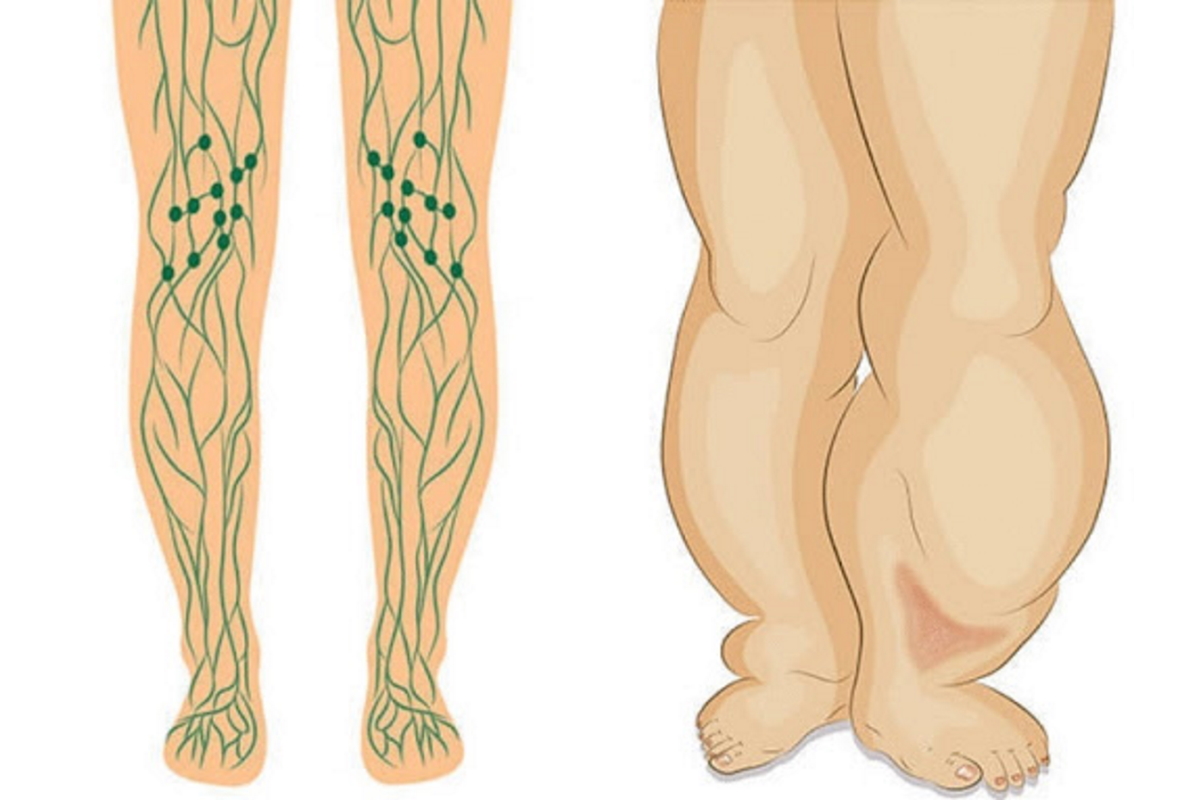
Каждый день лимфатическая система транспортирует до четырех литров очищенной лимфы обратно в кровоток. Лимфедема может развиться, если отток жидкости от тканей нарушается. При помощи современных вариантов лечения пациент с лимфедемой может вести обычную жизнь.
Формы лимфедемы
Существует две формы лимфедемы: первичная и вторичная лимфедема:
Первичная лимфедема:
Первичная лимфедема — это врожденное заболевание. Как правило она развивается из-за нарушения развития лимфатических узлов и сосудов.
Вторичная лимфедема:
Вторичная лимфедема — это отек, который не является врожденным и развивается в течение жизни пациента. Причинами могут быть, например, операции, инфекции, травмы и т.д.
Причинами могут быть, например, операции, инфекции, травмы и т.д.
Признаки и симптомы
Это признак лимфедемы. Кроме того, углубление естественные кожных складок над суставами, отеки на тыльной стороне кистей рук и ног, а также туго натянутая кожа указывают на наличие лимфедемы.
Стадии лимфедемы
- Стадия 0: Лимфатические сосуды повреждены, но видимых отеков еще нет.
- Стадия 1: Отек развивается в течение дня, но частично или полностью исчезает, когда конечность находится в приподнятом положении. При надавливании на ткани пальцем образуется ямка, которая сохраняется в течение некоторого времени.
:max_bytes(150000):strip_icc()/female-lymph-node-structure--illustration-769724269-c6ab24b480734e9d8e61e9a1e48af745.jpg)
- Стадия 2: Подъем конечности больше не помогает. Отек сохраняется даже при длительном отдыхе. Кожа начинает уплотняться. Трудно или даже невозможно сделать ямку на коже при надавливании.
- Стадия 3: Характеризуется выраженным отеком и изменениями кожи (например, в виде отверстий, из которых подтекает лимфатическая жидкость). Другое название этой стадии развития лимфедемы — слоновость или элефантиаз.
Рекомендуется проконсультироваться с врачом на как можно более ранней стадии (в идеале — уже на первой стадии). Врач порекомендует подходящее лечение и проконтролирует, что отек не увеличивается, а начинает уменьшаться или, по крайней мере, стабилизировался. Таким образом возможно предотвратить дальнейшее развитие отека до Стадии 3.
Лимфедема после операции при лечении рака молочной железы
Рак молочной железы — это одна из наиболее часто встречающихся форм рака у женщин. Ежегодно диагностируется более 70 000 новых случаев.
В среднем от 20 до 30% пациенток страдают от лимфедемы, связанной с операцией по поводу рака молочной железы с удалением подмышечных лимфатических узлов и адъювантной лучевой терапии.
Факторы риска
Онкологическим пациенткам часто приходится проводить лучевую терапию лимфатических узлов или удалять их полностью. Разумеется, это влияет на всю лимфатическую систему, поэтому могут начать развиваться отеки. Другие факторы, такие как возраст или женский пол, также могут способствовать развитию лимфедемы.
Зачастую лимфедема также может развиться в связи с предшествующим венозным расстройством в сочетании с недостаточными физическими нагрузками. Причин развития лимфедемы существует много, но хорошей новостью на данный момент является наличие эффективных вариантов лечения, которые могут вернуть пациентам качество жизни.
Профилактика
У вас лимфедема? Уделяйте внимание мелочам в повседневной жизни, которые помогут контролировать отек. Например, носите удобную одежду, которая не давит и не стесняет движения. Для ухода за кожей используйте только средства с нейтральным pH. У вас избыточный вес? Постарайтесь его снизить. Например, узнайте у врача о группах лечебной гимнастики и упражнений для устранения застойных явлений в конечностях. Избегайте травмирования кожи. Избегайте стрессов и переохлаждений, так как это приводит к сужению сосудов. Также не рекомендуются занятия, которые могут привести к устойчивому расширению сосудов, такие как солнечные ванны, посещение сауны или горячие ванны. Важно: хотя мануальный лимфодренаж положительно влияет на лимфатическую систему, грубого массажа, который может привести к перенапряжению пораженной части тела, следует избегать. И последний, но не менее важный совет: при физической нагрузке (например, во время занятий спортом) обязательно используйте компрессионный трикотаж.
Например, носите удобную одежду, которая не давит и не стесняет движения. Для ухода за кожей используйте только средства с нейтральным pH. У вас избыточный вес? Постарайтесь его снизить. Например, узнайте у врача о группах лечебной гимнастики и упражнений для устранения застойных явлений в конечностях. Избегайте травмирования кожи. Избегайте стрессов и переохлаждений, так как это приводит к сужению сосудов. Также не рекомендуются занятия, которые могут привести к устойчивому расширению сосудов, такие как солнечные ванны, посещение сауны или горячие ванны. Важно: хотя мануальный лимфодренаж положительно влияет на лимфатическую систему, грубого массажа, который может привести к перенапряжению пораженной части тела, следует избегать. И последний, но не менее важный совет: при физической нагрузке (например, во время занятий спортом) обязательно используйте компрессионный трикотаж.
Жизнь с лимфедемой — информирование, лечение, качество жизни
Если объяснять по-простому, то лимфатическая система — это система детоксикации, а также система «доставки» питательных веществ клеткам и «дом» иммунной системы.
Лимфатическая система состоит из множества лимфатических капилляров, начинающихся в тканях и перерастающих в лимфососуды, которые образуют лимфоузлы. Образование лимфы происходит путем фильтрации тканевой жидкости через стенку лимфатического капилляра, и каждый раз это качественно новое образование, состав которого зависит от многих факторов. Ток лимфы может осуществляться только при поступлении новой ее порции в капилляр (не подошла очередная порция лимфы — нет и оттока). При этом просвет капилляра никогда не сужается (даже если давление жидкости вокруг него больше, чем внутри него).
Лимфа участвует в транспорте белков и жиров из тонкого кишечника в клетки. Если в организме имеются застойные процессы, начинается в некотором роде голодовка, кожа становится сухой и неприглядной. Лимфа «вытягивает» всякую гадость из клеток (например, только из мозга удаляется около 1,5 кг токсинов ежегодно!), и если функция нарушена — начинается интоксикация организма.
Плохой лимфоток также приводит к нарушению работы центральной нервной системы, ухудшению психологических и когнитивных функций — отсюда жалобы на отсутствие сил и «тупнячок» при лимфостазе.
Причины застоя лимфы
Основные причины, мешающие полноценной работе лимфатической системы:
Ношение тесной одежды
О том, чем грозит ношение тесного белья и джинсов в обтяжку, мы уже писали в другой статье. Тем, кто носит бюстгальтеры и трусы, от которых остаются следы на коже, обтягивающие джинсы и брюки, для улучшения оттока лимфы необходимо сменить гардероб хотя бы на месяц — выбирайте вещи, которые не сковывают движения и не оставляют следов от резинок (например, бесшовные трусы).
У девочек до 16−18 лет не должно быть никаких тугих элементов гардероба. Берегите девочек, у них сейчас поголовно из-за моды таз формируется неправильно, что впоследствии может привести к различным проблемам, вплоть до невозможности родить самостоятельно! И это не говоря уже о том, что в подростковом возрасте хороший лимфодренаж необходим!
Использование дезодорантов
Почему не стоит пользоваться дезодорантами и антиперспирантами и как тогда устранить неприятный запах пота, рассказано в этой статье.
Нарушения в работе ЖКТ
Для нормализации процесса оттока лимфы необходим рабочий ЖКТ, в частности, адекватно функционирующие печень и кишечник. И вот почему. Кишечный лимфососуд — это соединительный канал между двумя потоками — кровью и кишечником. Когда в кишечник поступает пища, лимфокапилляр втягивает питательные вещества (воду, жиры, простые сахара). А вот пока пищи в кишечнике нет, через лимфокапилляр в просвет кишечной трубки могут сбрасываться «отходы» из тканей и лимфатических узлов кишечника. Через кишечные ворсинки может быть сброшена грязная лимфа из воспалительного очага. Это одна из возможных спонтанных чисток организма. И все бы хорошо, но эта грязная лимфа может быть снова втянута в кишечнике другим лимфатическим капилляром, расположенным ниже «по течению». Так нарушения в ЖКТ и перегружают лимфатическую систему.
Гиподинамия
Главная мышца для привода лимфы в движение — диафрагма. В оттоке лимфы от диафрагмы имеет значение ее сократительная функция. Отток лимфы происходит через передние медиастинальные лимфатические узлы, расположенные непосредственно на диафрагме, задние медиастинальные и поддиафрагмальные лимфатические узлы. Поэтому на ежедневной основе в обязательном порядке вы должны смеяться (при смехе хорошо напрягается диафрагма), ходить, прыгать, практиковать диафрагмальное дыхание, заниматься сексом в позе наездницы, танцевать.
Ходите не как старые бабки, еле переставляя конечности и озираясь по сторонам, а как задорные молодушки! С ровной спиной, широким интенсивным шагом, хорошо отталкиваясь от пяток и размахивая руками 20−30 минут. Если у вас сидячая работа — не забывайте вставать и ходить каждые 30 минут или делать хотя бы 15−20 прыжков / приседаний.
Упражнения для разгона лимфы
Из всего вышесказанного следует, что для улучшения движения лимфы необходимо отказаться от давящего белья, не пользоваться дезодорантами, работать над нормализацией работы ЖКТ, больше двигаться. Также можно делать лимфатическую гимнастику.
Выполнять упражнения, направленные на активизацию лимфатической системы (большая часть взята из методички по ЛФК и системы Ниши), лучше после пробуждения или, если вы гипотоник, во второй половине дня (несколько снижают давление).
Перед выполнением первого упражнения следует выпить стакан воды с настойкой мяты перечной (10−15 капель на стакан). У всех невротиков ЖКТ спазмирован, и выполнение упражнений может приносить дискомфорт, мята перечная — отличный спазмолитик.
Вводить упражнения плавно, выполнять именно в рекомендованной последовательности на протяжении 3−4 недель, после — ситуативно.
1. Упражнение «Вакуум». В положении лежа на правом боку, правая рука под головой, ноги слегка согнуты в коленях, надувать живот как шарик (по сути — диафрагмальное дыхание в положении лежа на боку). Интенсивность дыхания любая, главное — делать упражнение на протяжении 10−15 минут.
2. Упражнение «Таракан». В положении лежа на спине поднять руки и ноги вверх, трясти ими минуту, минута перерыв и повторить, 2−3 подхода.
3. Упражнение «Гусеничка». Лучше выполнять на полу: в положении лежа на спине делать наклоны к стопам из стороны в сторону. 1 подход на протяжении 1 минуты.
4. Массаж тела сухой щеткой. Во время массажа стоять нужно на коврике-аппликаторе! Попробуйте выстоять на иголках хотя бы минуту, но оптимально, конечно, продержаться на коврике весь массаж. В крайнем случае коврик можно заменить массажными тапочками или горячей ванной для стоп.
Движения щеткой осуществляйте по массажным линиям5. Лимфатические прыжки. Для отличников — прыжки на полной стопе, для халтурщиков — лайт-вариант — ритмичные опускания с носка на пятку. 100 прыжков средней интенсивности. Прыжки можно выполнять на домашнем мини батуте. Противопоказания к выполнению упражнения: камни в желчном пузыре/почках, беременность.
После зарядки первые 10−14 дней обязательно принимайте сорбент (Зостерин, Энтеросгель или Полисорб), запивая его водой (300−500 мл).
Если на лимфатической зарядке у вас появляются симптомы интоксикации — слабость, головная боль и пр. — принимайте сорбент 3−4 раза в день (за час до еды либо через два часа после), а зарядку на первых порах делайте через день. И с утра не забывайте еще выпивать стакан подсоленной воды!
Также для улучшения оттока лимфы помимо лимфатической гимнастики подключить:
Других трав и препаратов для разгона лимфы рекомендовать не могу, нужно подбирать индивидуально. Многие используют солодку, но это мощнейший фитоэстроген, поэтому — с осторожностью. Лучший лимфодренаж — это упражнения и диета.
В течение дня необходимо обильное питье. Рацион должен быть преимущественно сырой, овощной, с полным ограничением простых углеводов и сахаров, а также белка в вечернее время на 3−4 недели.
Сейчас по утрам практикую лимфодренажную гимнастику — такой легкости в теле на протяжении всего дня я не испытывала никогда!
@stacy_zhuk
Сделала три раза лимфатическую гимнастику и один раз компресс с касторкой. И — о чудо! — «шарик» в районе живота сдулся! Ощущения — огонь! А ведь я и до этого делала похожие упражнения, но без нюансов — такого эффекта не было. Только вот зря сорбент не пила — обсыпало лицо, хотя прыщи — это вообще не про меня. Теперь буду пить!
@onemillionmilles
Упражнения — огонь! После коврика и щетки начало подташнивать. Но после приема Полисорба пошел прилив бодрости.
@ya_victorova
Попробовала сегодня лимфатическую зарядку и была удивлена, сколько появилось энергии. Серьезно! Поднялось настроение и захотелось свернуть горы. Так что гипотоникам, тем более с утра, надо делать — хоть расшевелиться можно. Причем на аппликаторе мне стоять — нормально, а вот упражнение «Таракан» дается сложнее .
@mashunyats
Лимфостаз: патофизиология, диагностика и лечение
Вальдемар Л. Ольшевски, доктор медицины, доктор философии является профессором хирургии и директором отделения хирургических исследований и трансплантологии Медицинского исследовательского центра Польской академии наук в Варшаве, Польша. Доктор Ольшевский окончил медицинский факультет Медицинской академии в Варшаве, получил степень доктора медицины в 1954 году и доктора философии. в 1962 году. Он получил хирургическое образование в хирургическом отделении Варшавской городской больницы, а затем в хирургическом отделении Медицинской академии в Варшаве.Он работал доцентом в Медицинской академии и Медицинском исследовательском центре с 1962 по 1968 год и доцентом с 1968 по 1978 год. В 1978 году он стал профессором хирургии. С 1962 по 1975 год он был заместителем директора отделения хирургических исследований Медицинского исследовательского центра, а в 1975 году занял должность директора. С 1974 года он работал в Лаборатории гематологии и лимфологии Норвежской радиевой больницы в Осло, Норвегия. Доктор Ольшевски был научным сотрудником в Королевской медицинской школе последипломного образования в Лондоне с 1962 по 1963 год и в больнице Питера Бента Бригама. , Гарвардская медицинская школа, Бостон, в 1968 и 1969 годах.Д-р Ольшевски является членом Европейского общества хирургических исследований, Международного лимфологического общества, Международного общества микрохирургии и Международного общества трансплантологии. Он был президентом Европейского общества хирургических исследований с 1977 по 1978 год и членом Исполнительного комитета до 1982 года. Он был избран президентом Международного общества лимфологии на период 1989–1993 годов. Он является заместителем редактора Лимфологии, Zeitschrift für Experimentelle Chirurgie, Transplant International, Angiology International и Immunologia Polska.Он также является почетным членом Бразильского сосудистого общества и Корейской медицинской ассоциации. Недавно он основал Польско-японское хирургическое общество и начал сотрудничество в лечении лимфедемы с Национальной лимфедемой сетью Америки и Танджавурским университетом, Индия. Доктор Ольшевский является автором более 250 статей по лимфатической и лимфоидной тканям, трансплантационной иммунологии. , сосудистые проблемы, и был автором или редактором 6 книг, в том числе «Справочник по микрохирургии», «Периферическая лимфа: формирование и иммунная функция» и «Миграция иммунных клеток in vivo».Его основные клинические интересы связаны с сосудистой и лимфатической хирургией, а также исследовательскими интересами в области физиологии лимфоидных органов и иммунорегуляции. Томас Х. Адэр, доктор философии. Профессор кафедры физиологии и биофизики, Медицинский центр Университета Миссисипи, Джексон, Миссисипи, Кнут Окланд, доктор медицины, профессор кафедры физиологии, Бергенский университет, Берген, Норвегия, Джеймс А. Барроумен, доктор медицины, доктор философии Профессор кафедры медицины Мемориального университета Ньюфаундленда, Сент-Джонс, Ньюфаундленд, Канада, Рюдигер Г.Х. Баумейстер, доктор медицины, профессор кафедры хирургии, Мюнхенский университет, Мюнхен, Германия, Джозеф Бенинсон, доктор медицины, директор, клиника язвы ноги и периферических сосудистых заболеваний, отделение дерматологии, больница Генри Форда, Детройт, Мичиган, Том Берган, доктор медицины и заведующий кафедрой микробиологии Университета Осло, Осло, Норвегия, Йозеф Бруна, доктор медицины, профессор кафедры радиологии, Карлов университет Праги, Прага, Чехословакия, Коррадино Кампизи, доктор медицины, доцент кафедры общей и неотложной помощи, хирургии и микрохирургии Отделение, Школа медицины и хирургии Генуэзского университета, Генуя, Италия, Ян Карр, M.Н., К.э.н. Профессор кафедры патологии Университета Манитобы, Виннипег, Манитоба, Канада, А. Кастенхольц, доктор медицины, профессор кафедры биологии человека, Кассельский университет, Кассель, Германия, Ти-Шенг Чанг, доктор медицины, профессор кафедры пластической хирургии, девятая Народная больница, Шанхай, Китайская Народная Республика, Роберт В. Клюзан, доктор медицины, руководитель отделения лимфологии, Hôpital Cognacq-Jay, Париж, Франция, Марио Деньи, доктор медицины, профессор отделения хирургии, Pontìficia Universidade, Católica de Campinas, Кампинас , Сан-Паулу, Бразилия, Аллан Э.Dumont, доктор медицинских наук, почетный профессор, отделение хирургии, Школа медицины Нью-Йоркского университета, Нью-Йорк, Нью-Йорк, Arfinn Engeset, MD Det Norske Radiumhospitalet, Осло, Норвегия, Ethel Földi, главный медицинский суперинтендант, Földi Clinic, Hinterzarten, Германия, Михаэль Фёльди, доктор медицины, директор клиники Földi-Klinik и Földi-Schulen, Фрайбург, Мюнхен, Берлин, Германия, Умберто Фокс, доктор медицины, профессор кафедры хирургии Миланского университета, Милан, Италия, Цзи-Лян Ган, доктор медицины, отделение пластической хирургии , Девятая народная больница, Шанхай, Китайская Народная Республика, Питер Хирнле, М.D. Отделение гинекологии и акушерства, Тюбингенский университет, Тюбинген, Германия, Альф Кольбенстведт, доктор медицины, профессор, отделение диагностической радиологии, Рикшоспиталет, Осло, Норвегия, Сэнфорд Э. Лидс, доктор медицинских наук, заместитель начальника отделения экспериментальной хирургии, Mount Zion Medical Центр Калифорнийского университета в Сан-Франциско, Калифорния, Ханс Хенрик Лиен, доктор медицины, отделение диагностической радиологии, Норвежская радиальная больница, Осло, Норвегия, Майкл Т. Лотце, доктор медицины, профессор хирургии, молекулярной генетики и биохимии, заместитель директора по хирургической онкологии, Питтсбургский онкологический институт, Университет Питтсбурга, Питтсбург, Пенсильвания, Ноэль Г.Макхейл, доктор философии Доцент кафедры физиологии и биофизики, Медицинский центр Университета Миссисипи, Джексон, Миссисипи, Уолтер Монторси, доктор медицинских наук, доцент кафедры физиологии и биофизики, доцент кафедры физиологии и биомедицинских наук Королевского университета Белфаста, Белфаст, Ирландия. Заведующий кафедрой хирургии Миланского университета, Милан, Италия, Л. Моска, доктор медицины, профессор и председатель отделения патологии Миланского университета, Милан, Италия, Мория Окума, доктор медицины, профессор кафедры дерматологии, Медицинский факультет Университета Кинки , Осака, Япония, Вальдемар Л.Ольшевский, доктор медицинских наук, Заведующий отделением хирургических исследований и трансплантологии Медицинского исследовательского центра Польской академии наук, Варшава, Польша, и Норвежской радиевой больницы, Лаборатория гематологии и лимфологии, Осло, Норвегия, Хьюго Партш, доктор медицинских наук, профессор и руководитель отделения дерматологии , Больница Вильгельминен, Вена, Австрия, Ален М. Пекинг. Доктор медицины, руководитель отделения ядерной медицины, Центр Рене Хугенина, Сен-Клу, Франция, Карл Фредрик Петлунд, доктор медицины, отделение физической медицины, Рикшоспиталет, Осло, Норвегия, Норман М.Петтигрю, доктор медицины, кафедра патологии, Университет Манитобы, Виннипег, Манитоба, Канада, Нил Б. Пиллер, доктор философии. Адъюнкт-профессор Школы медсестер и Департамента первичной медико-санитарной помощи Университета Флиндерса Южной Австралии, Бедфорд-Парк, Австралия, Рольф К. Рид, профессор кафедры физиологии Бергенского университета, Берген, Норвегия, Джулиано Романьоли, кафедра медицины хирургии, Миланский университет, Милан, Италия, Вильгельм Шнайдер, доктор медицины, отделение дерматологии, Тюбингенский университет, Тюбинген, Германия, E.Трабукки, доктор медицинских наук, доцент кафедры хирургии Миланского университета, Милан, Италия, Герман Н. Улей, заместитель директора медицинского отделения Медицинского центра Mount Zion Калифорнийского университета, Сан-Франциско, Калифорния, Теренс П. Уэйд , Доцент кафедры хирургии Медицинского центра Университета Сент-Луиса, Сент-Луис, штат Миссури, Чарльз Л. Витте, доктор медицины, профессор кафедры хирургии Медицинского колледжа Университета Аризоны, Тусон, Аризона, Марлис Х. Витте, М.Доктор медицинских наук, профессор кафедры хирургии Медицинского колледжа Университета Аризоны, Тусон, Аризона
Нарушения лимфотока — PubMed
Нарушения капиллярного обмена жидкости, макромолекул и клеток через неповрежденные и аномальные микрососуды, а также нарушение лимфатического транспорта являются неотъемлемыми, взаимодействующими компонентами нарушений отека тканей. Лимфедема или недостаточность лимфообращения с низким выходом часто протекает вяло в течение многих лет, прежде чем лимфатическая недостаточность (недостаточность) и отек тканей проявятся и сохранятся.Наложенная скрытая или явная инфекция (лимфангит), вероятно, является основным фактором прогрессирующей деформации конечностей (слоновости). Длительно существующая лимфедема характеризуется улавливанием в коже и подкожной клетчатке жидкости, экстравазированных белков плазмы и других макромолекул: нарушение транспорта иммунных клеток; аномальная обработка аутологичных и чужеродных антигенов; повышенная восприимчивость к наложенной инфекции; местная иммунодисрегуляция; нарушение лимфатического (лимфангионального) движения из-за дисбаланса медиаторов, регулирующих вазомоцию; разрастание мягких тканей; рубцевание и гипертрофия; и обильный ангиогенез, иногда заканчивающийся сосудистыми опухолями (рис.8). В отличие от кровообращения, где кровоток зависит в первую очередь от движущей силы миокарда, движение лимфы зависит в основном от внутреннего сокращения ствола, филогенетического остатка лимфатических сердец земноводных. В то время как венозная «плазма» течет быстро (2-3 л / мин) при низком сосудистом сопротивлении, лимфа течет медленно (1-2 мл / мин) при высоком сосудистом сопротивлении. Иногда нарушение транспорта кишечной лимфы может быть связано с рефлюксом, накоплением и утечкой кишечного хилуса в опухшей ноге.Хотя термин «лимфедема» обычно используется для обозначения отека конечностей, патогенез широкого спектра висцеральных заболеваний также может быть прослежен до дефектной тканевой жидкости и циркуляции макромолекул и нарушения клеточного транспорта лимфоцитов и макрофагов. Таким образом, застой лимфы с нарушением оттока тканевой жидкости лежит в основе или осложняет вялотекущее субклиническое течение с длительным латентным периодом и спорадическими эпизодами лимфангита, которые завершаются интенсивным рубцеванием. Примеры — фиброз легких (например, фиброз легких).g., пневмокониоз), регионарный энтерит, забрюшинный фиброз и, возможно, хронический панкреатит и цирроз печени. Трансдифференцировка и, в конечном итоге, трансформация эндотелиальных и других сосудистых дополнительных клеток во время лимфостаза также может иметь решающее значение для широкого спектра диспластических и неопластических сосудистых нарушений, включая ангиосаркому Стюарта-Тревеса, СПИД-ассоциированную саркому Капоши и лимфангитный метастатический карциноматоз. Лимфсцинтиграфия теперь заменила обычную лимфографию в качестве предпочтительной процедуры для подтверждения диагноза периферической лимфедемы, тогда как МРТ с использованием парамагнитных и суперпарамагнитных контрастных агентов может принести огромные дивиденды в углублении понимания множества загадочных отечных состояний, включая лимфедему.Вероятно, появятся не только лучшие объяснения и понимание расстройств отека, но, что не менее важно, эти новые, безопасные, неинвазивные методы визуализации могут и должны использоваться для отслеживания эволюции и документирования эффективности обычно рекомендуемых операций и неоперативных средств лечения дефектных лимфотранспорт и функция.
Флеболимфедема — распространенная проблема с недостаточной диагностикой и лечением в клинике по уходу за ранами
J Am Col Certif Wound Spec.2010; 2 (1): 14–23.
Уэйд Фэрроу
a Центр лечения ран и гипербаризации Уильяма П. Файфа, Медицинский центр Колледж-Стейшн, Колледж-Стейшн, Техас 77845, США
a Центр заживления ран и гипербаризации Уильяма П. Файфа, Медицинский центр Колледж-Стейшн , College Station, TX 77845, USA
Эта статья цитируется в других статьях в PMC.Abstract
Эта статья посвящена патофизиологии флеболимфедемы, а также правильной диагностике и лечению.Надеемся, что эта статья улучшит уход за пациентами в клиниках по уходу за ранами и побудит врачей по уходу за ранами рассмотреть возможность добавления ухода за пациентами с лимфедемой в свою клиническую практику.
Ключевые слова: Хроническая венозная недостаточность, отек, лимфедема, флеболимфедема
Коррекция и лечение хронического отека неизбежны в клинике по уходу за ранами, невозможно провести хороший уход за раной и не встретить пациентов с различными формами лимфедемы .Тем не менее, у большинства врачей очень мало формальной подготовки или знаний в области лечения и диагностики лимфедемы.
Самой распространенной формой лимфедемы во всем мире может быть филяриальная инфекция, но наиболее распространенной в западном мире является флеболимфедема. Флеболимфедема — опухоль смешанной этиологии, вызванная хронической венозной недостаточностью (ХВН) и лимфатической недостаточностью. Флеболимфедема чаще всего возникает из-за неспособности лимфатической системы адекватно дренировать интерстициальную жидкость, которая накапливается при тяжелой хронической венозной гипертензии.Кроме того, существует множество факторов, которые могут увеличить нагрузку на лимфатическую систему и привести к развитию флеболимфедемы. Лимфатическая недостаточность из-за повреждения лимфатической системы также может привести к флеболимфедеме. Часто играют роль несколько факторов, в том числе системное заболевание (например, застойная сердечная недостаточность, цирроз или нефропатия), которые усугубляют проблему и приводят к неспособности лимфатической системы отводить межклеточные жидкости и макромолекулы. Таким образом, флеболимфедема возникает из-за недостаточности венозной или лимфатической системы (или обеих) в сочетании с возможными системными факторами, что приводит к накоплению интерстициальной жидкости, богатой белком, в межклеточном пространстве.
Эта статья посвящена патофизиологии флеболимфедемы, а также правильной диагностике и лечению. Надеемся, что эта статья улучшит уход за пациентами в клиниках по уходу за ранами и побудит врачей по уходу за ранами рассмотреть возможность добавления ухода за пациентами с лимфедемой в свою клиническую практику.
Заболеваемость
Лимфедема — это пожизненное заболевание, от которого нет лекарства. По оценкам, лимфедемой во всем мире страдают около 300 миллионов человек. Филяриатоз — парацитарная инфекция, наиболее частая причина лимфедемы во всем мире, от которой страдают 100 миллионов человек.1 Флеболимфедема, наиболее распространенная форма лимфедемы в западном мире, представляет собой вторичную лимфедему, которая развивается у пациентов с ХВН. Факторами, способствующими отеку нижних конечностей, являются увеличенная выживаемость пациентов с сердечной недостаточностью, многочисленные лекарства, связанные с отеками, и повышенная частота ожирения. С возрастом бэби-бумеров и недостаточным обучением лиц, осуществляющих уход за лимфедемой, заболеваемость почти наверняка увеличится в ближайшие десятилетия. Лимфедема считается «сиротским» заболеванием, поскольку не относится к какой-либо медицинской специальности.Следовательно, немногие врачи хорошо разбираются в его патофизиологии или лечении.2
Патофизиология CVI
CVI вызывается дисфункцией односторонней клапанной системы в перфораторах и глубоком венозном сплетении нижних конечностей. Клапанная дисфункция приводит к обратному току венозной крови в поверхностную венозную систему. Эта потеря клапанной функции может быть результатом возрастного снижения компетентности клапанов, скрытого или перенесенного ранее тромбоза глубоких вен (ТГВ), хирургического вмешательства или другой этиологии.Заболеваемость составляет приблизительно от 6% до 7% пациентов в возрасте 50 лет, с увеличением до> 20% в возрасте 70 лет. ХВН имеет небольшой преобладание у женщин3. До 76% могут быть диагностированы только на основании клинических проявлений, но при дуплексном ультразвуковом исследовании. также может использоваться и проводится некоторыми врачами в плановом порядке.4
Патофизиология лимфедемы
Проблема лимфедемы начинается с капилляров. Обзор физиологии капилляров напоминает нам, что на прекапиллярном конце артериолы гидростатическое давление вытесняет жидкость (называемую ультрафильтратом ) из капилляра.По направлению к венульной стороне капилляра онкотическое давление внутри капилляра является основной силой, втягивающей жидкость обратно в капилляр. Около 10% ультрафильтрата не реабсорбируется обратно в капилляр. Ультрафильтрат также содержит небольшое количество белков и клеточного мусора. Задача лимфатической системы — улавливать и отводить эту жидкость, фильтровать и концентрировать ее в лимфатических узлах, а затем возвращать в сосудистую систему. Фактический поток лимфатической жидкости в организме человека сильно различается.Лимфоток зависит от потребности и сердечно-сосудистой гемодинамики. Нередко лимфатический поток колеблется более чем в 20 раз выше исходного, когда лимфатическая система находится на максимальном уровне.5 Обычно лимфатическая система имеет большой резервный потенциал. Лимфатические сосуды нормальных здоровых тканей работают только на 5–10% своей емкости.6 Фактическое количество лимфатической жидкости, возвращаемой через грудной проток, составляет от 2 до 4 литров в день. Однако общий поток в лимфатическую систему до концентрации в лимфатических узлах дает объем, который у нормального взрослого человека составляет не менее 8 л.7 Удаление белков из интерстиция является важной функцией. Без функциональной лимфатической системы мы бы умерли примерно через 24 часа5.
Дренаж в лимфатическую систему начинается в лимфатических преколлекторах, которые содержат однослойные эндотелиальные клетки с фиксирующими нитями и клапанами. Растяжение этих фиксирующих нитей открывает щели между клетками для расширения, позволяя проникать интерстициальной жидкости и макромолекулам. Из лимфатических предколлекторов и коллекторов лимфа проходит через лимфатические капилляры.После этого он попадает в лимфатические узлы, которые концентрируют и фильтруют лимфу. В конце концов лимфа возвращается в сердечно-сосудистую систему через грудной проток.
Давление межклеточной жидкости и степень активности лимфатического насоса являются основными факторами, управляющими потоком через лимфатическую систему. Лимфатический насос управляется несколькими факторами. Эти факторы включают сокращение мышц части тела, движение частей тела, артериальную пульсацию, сжатие объектами вне тела и микронасос лимфангиона.Микронасос расположен по всему лимфатическому капилляру и собирательной системе. Лимфангиональные микронасосы — это грубые насосы лимфатической системы, которые обладают собственной сократительной активностью и двустворчатыми клапанами, которые предотвращают лимфатический обратный ток.5 Лимфангионы содержат актомиозиновые нити и имеют свою собственную ритмическую сократимость и потенциалы действия. Эта система похожа на желудочно-кишечный тракт. Скорость лимфатической перистальтики сильно колеблется от 1 до 30 пульсаций в минуту. Лимфангионы имеют ряд односторонних клапанов, позволяющих течь жидкости только в одном направлении.Степень лимфатического кровотока варьируется в широких пределах. Во время физических упражнений или в периоды сильного дренажа кровоток может увеличиваться в 10–30 раз. Однако в периоды покоя лимфатический поток может быть очень вялым. Эффективность действия лимфангионного насоса на лимфатический поток обсуждается, но вполне вероятно, что лимфангион и лимфатическое сокращение играют некоторую роль в определении скорости лимфотока.
Таким образом, лимфатическая система — это динамическая система, которая обрабатывает капиллярный ультрафильтрат с большим разбросом в зависимости от потребности.Лимфатическая система имеет ограничения по объему жидкости, с которой она может справиться. Лимфатическая система содержит хрупкие сосуды, которые можно легко повредить в результате инфекции, травмы, воспаления тканей или радиации. Повреждение лимфатических сосудов приводит к развитию лимфедемы с опухшей конечностью или частью тела.
Использование диуретиков у пациентов с лимфедемой просто увеличит концентрацию белков и макромолекул в интерстициальном пространстве и ускорит воспалительный процесс, который приводит к необратимым изменениям кожи и мягких тканей и увеличению риска целлюлита.Поэтому использование диуретиков исключительно для уменьшения отека у пациентов с лимфедемой противопоказано.
Развитие флеболимфедемы (вторичная лимфедема при венозной недостаточности)
Чтобы понять, как у пациентов с венозной гипертензией развивается вторичная лимфедема, нам необходимо рассмотреть венозную патофизиологию. В положении лежа артериальное давление может составлять приблизительно 100 мм рт. Ст., А венозное давление — приблизительно 8 мм рт. Ст. 8 При стоянии повышается давление в венах ног из-за повышения гидростатического давления.Степень повышения давления прямо пропорциональна росту человека и вертикальному расстоянию от сердца до ступней. Таким образом, у среднего человека артериальное и венозное давление увеличивается примерно на 100 мм рт. Ст., Когда человек стоит. Стояние приводит к пассивной гиперемии в кровеносных капиллярах из-за повышенного гидростатического давления и снижения онкотического давления. Таким образом, не происходит реабсорбции ультрафильтрованной жидкости. Во время ходьбы венозное давление в стопе может снизиться до ~ 25 мм рт. Ст. Из-за воздействия икроножной мышцы на глубокую венозную систему, увеличивая венозный возврат.Это давление считается нормальной амбулаторной венозной гипертензией и намного превышает 8 мм рт. Это приводит к накоплению интерстициальной жидкости и подфасциальному отеку, а также к увеличению давления в компартменте. Работа лимфатической системы — отвод этой межклеточной жидкости. Однако лимфатическая система может быть перегружена и вызвать дальнейшее накопление межклеточной жидкости.Накопление лимфатической жидкости в интерстиции приводит к провоспалительному состоянию, которое может вызвать фиброз тканей. ТГВ часто формируется в кармане клапана и растет оттуда. Острое воспаление приводит к длительному разрушению створок клапана. Пациенты со значительным ТГВ будут иметь субфасциальный отек, который клинически имеет очень твердое и почти напряженное ощущение при осмотре. Подфасциальный отек можно отличить от липодерматосклеротических изменений, поскольку он поражает более глубокие ткани, тогда как липодерматосклероз (ЛДС) поражает кожный слой дермы.
При постфлеботическом синдроме организованный ТГВ заменяется соединительной тканью с различными уровнями реканализации, что приводит к долговременной венозной гипертензии.8 В тяжелых случаях ходьба может привести к артериальному притоку, который превышает отток вен. Это создает даже более высокое давление во время движения, чем во время стояния. Этот признак венозной хромоты приводит к боли при ходьбе. Боль при венозной хромоте отличается от боли, наблюдаемой у пациентов с заболеванием периферических артерий, тем, что она продолжается до тех пор, пока подъем конечности не снимет боль за счет снижения повышенного венозного давления.По мере того, как ТГВ становится хроническим, развивается вторичное варикозное расширение вен, снижающее венозную гипертензию, когда пациент находится в лежачем положении. Однако у пациента сохраняется амбулаторная венозная гипертензия, вызванная клапанной недостаточностью из-за дилатации клапанного кольца в оставшихся функциональных венозных клапанах.
Венозная гипертензия и пассивная гиперемия запускают каскад событий, который в конечном итоге может привести к фиброзу тканей. Межэндотелиальные соединения, расширенные уже за счет диапедеза лейкоцитов, растягиваются дальше.8 Расширенные соединения вызывают диапедез эритроцитов, что приводит к классическому гемосидерозу, наблюдаемому при ХВН. Эта большая проницаемость кровеносных капилляров приводит к дальнейшей экстравазации белков. Белки и связанные с ними онкотические нагрузки теперь находятся во интерстициальном пространстве. Таким образом, простое сжатие только дополнительно сконцентрирует белки за счет удаления части воды, но оставшиеся белки будут удерживаться на молекулах воды. Это объясняет, почему лечение лимфедемы только компрессией не очень эффективно для уменьшения объема конечностей.Чтобы быть успешным, лечение должно способствовать возвращению богатой белком жидкости в оставшиеся функциональные лимфатические сосуды. Для правильного удаления белков требуется ручной лимфодренаж, который эффективно удаляет белки, проталкивая их в лимфатическую систему, где они и удаляются. Мы обсудим это позже в статье.
Белки и провоспалительные цитокины могут приводить к фиброзу тканей, сложному процессу, который называется липодерматосклерозом .Интересно, что во многих статьях по дерматологии, в которых обсуждается процесс LDS, полностью не упоминается лимфатическая система и акцент делается на коже и дерматопатологии, тогда как в некоторых текстах о лимфедеме описывается, что все LDS возникают из-за недостаточности лимфатических сосудов для обработки гиперемии и повышенной нагрузки ультрафильтрата.
Присутствие белков в интерстициальном пространстве создает провоспалительное состояние. Накопление этих белков приводит к воспалительным процессам, поскольку организм пытается их устранить.
Повреждения кожи могут привести к проникновению бактерий, которые быстро распространяются через богатое белком межклеточное пространство. Некоторые эксперты считают, что эти белки могут служить субстратом для микроорганизмов, распространяя и усиливая инфекции. Другие эксперты считают, что воспалительный процесс и связанное с ним изменение иммунной системы способствует более высокому уровню и серьезности целлюлита у пациентов с лимфедемой. Эти инфекции могут привести к усилению рубцов и травм хрупких лимфатических коллекторов и могут вызвать дальнейшее повреждение лимфатической системы.Повреждение лимфатической системы еще больше снижает способность организма выводить лимфедемную жидкость. Таким образом, повторные инфекции могут вызвать повреждение оставшихся лимфатических сосудов ступенчатого типа и привести к клинической нисходящей спирали ухудшения лимфедемы с каждой дополнительной инфекцией.
Если лимфатическая система не может справиться с нагрузкой интерстициальной жидкостью, то жидкость и белки начинают накапливаться. Эти белки обладают собственным онкотическим давлением и удерживают молекулы воды, вызывая опухание конечностей.Это иногда называют динамической недостаточностью , потому что нагрузка жидкостью превысила максимальную транспортную способность лимфатических сосудов и приводит к клиническому развитию флеболимфедемы.9 Механическая недостаточность развивается, когда лимфатическая система повреждена и имеет пониженную транспортную способность. Механическая недостаточность может возникнуть в результате травмы, хирургического вмешательства, облучения, повреждения лимфатических сосудов в результате предыдущих инфекций и т. Д. Часто флеболимфедема возникает из-за сочетания как динамической недостаточности, так и механической недостаточности.Системные факторы, способствующие отеку, могут усилить динамическую недостаточность, способствуя развитию флеболимфедемы.
Если лимфатическая система повреждена (механическая недостаточность) или нагрузка ультрафильтрата становится больше, чем способность лимфатической системы дренировать ее (динамическая недостаточность), белки и макромолекулы начинают накапливаться в интерстиции. Эти белки имеют собственное онкотическое давление, которое вызывает клиническую лимфедему. Кроме того, присутствие этих белков вызывает воспалительный каскад, ведущий к необратимым изменениям, наблюдаемым на поздних стадиях лимфедемы. Скорость воспаления сильно различается у разных людей и до конца не изучена. Таким образом, хотя все пациенты прогрессируют в направлении необратимых изменений, некоторые пациенты прогрессируют намного быстрее, чем другие.
Застойный дерматит
Застойный дерматит — распространенное воспалительное заболевание кожи, которое возникает на нижних конечностях у пациентов с ХВН. Обычно это первое кожное осложнение ХВН, но оно может быть предвестником венозных язв и липодерматосклероза. Застойный дерматит — прямое следствие венозной гипертензии.Повышенное гидростатическое давление передается на кожную микроциркуляцию, что приводит к увеличению проницаемости капилляров и утечке фибриногена. Считается, что утечка фибриногена и снижение активности фибриногена вызывают образование фибриновых манжет. Это приводит к гипоксии тканей и повреждению клеток.6,10 Клинически у пациента обычно появляется незаметное начало зуда, за которым следует изменение цвета кожи на красновато-коричневый цвет и гиперпигментация. Эти глубокие отложения гемосидерина в дерме происходят из деградированных экстравазированных эритроцитов и называются гемосидерозом.По мере прогрессирования застойного дерматита могут возникать шелушащиеся экзематозные пятна. Чаще всего поражается медиальная лодыжка. Когда он распространяется по окружности, он упоминается как чулочная эритродермия . Другие изменения кожи включают атрофические пятна. Пациенты с застойным дерматитом имеют более высокий риск развития аллергического контактного дерматита от местного лечения. Наиболее частые контактные аллергены включают антибиотики для местного применения, такие как неомицин и бацитрацин.
Лечение застойного дерматита включает компрессию, а также мягкие местные смягчающие средства для максимального увеличения влажности эпидермиса.Недорогое окклюзионное увлажняющее средство — белый вазелин. Утвержденные FDA препараты для лечения застойного дерматита включают местные нестероидные ингибиторы кальциневрина, такролизм и пимекролизм. Использование сильнодействующих стероидов не рекомендуется из-за повышенной абсорбции, риска стероид-индуцированной атрофии кожи и возможной тахифилаксии.10
Липодерматосклероз (LDS)
LDS — это кожное изменение в нижних конечностях, которое является разновидностью панникулита. (воспаление подкожно-жировой клетчатки).У пораженных пациентов часто наблюдается уплотнение кожи из-за кожного фиброза и повышенной пигментации.11 Нога может приобретать классический вид «перевернутой бутылки шампанского» или «кегли для боулинга» (см.). LDS может быть острым или хроническим заболеванием. Острый LDS (ALDS) может имитировать целлюлит, проявляясь в виде болезненного воспаления ноги с покраснением, болезненностью и повышенным теплом. 12,13 LDS возникает, когда есть изменения в глубоких слоях дермы и подкожного слоя, приводящие к сужающемуся панникулиту. Патология заболевания довольно разнообразна.14 Фиброз можно увидеть в дермальных слоях. Патология показывает толстостенные капилляры, окруженные фибрином, сидерофагами (макрофагами, проглотившими железо) и фиброзом. Дольчатый и перегородочный панникулит может возникать в подкожно-жировых слоях, опосредованно лимфоцитами. Позже это прогрессирует до ишемического некроза жира с кистозными пространствами.
Классическая замена бутылки шампанского при флеболимфедеме (хроническая венозная недостаточность с развитием вторичной лимфедемы и липодерматосклероза).
ALDS представляет собой чрезвычайно болезненные и воспаленные бляшки красного или фиолетового цвета с плохо разграниченными границами, часто с уплотненной или отечной кожей. В основном это связано с ХВН, но до 30% может возникать без основного ХВН.12
Хронический СПД вызывает боль и локализованное утолщение и может вызвать атрофи-бланш (видимые в виде небольших белых рубцов). Точный механизм тканевого фиброза до сих пор полностью не изучен, но есть четкие доказательства активации лейкоцитов и активации провоспалительных цитокинов.При хроническом LDS может быть незначительное повреждение эндотелия нейтрофилами и моноцитами. Этот хронический воспалительный процесс приводит к усилению высвобождения цитокинов и пролиферации клеток. Макрофаги высвобождают трансформирующий фактор роста бета (TGF-Beta), который, в свою очередь, стимулирует фибробласты к синтезу большего количества коллагена и белков соединительной ткани.15
Биопсия пациентов с LDS показывает патологию с характерными признаками венозного застоя — поверхностная дерма, расширенные сосуды, панникулюс с утолщение и фиброз перегородок, а также липофагические изменения с некрозом адипоцитов в жировых долях.Липомембранозное изменение является типичным, с перистыми эозинофильными псевдомембранами, сильно окрашивающими периодическую кислоту — положительным по Шиффу.15 Биопсия для диагностики LDS активно не рекомендуется из-за медленного заживления участков биопсии и должна быть клиническим диагнозом, устанавливаемым при физикальном обследовании в отсутствие инфекции.
Клиническое обследование и диагностика
Наиболее частой находкой у пациентов с флеболимфедемой является отек нижней конечности. Чтобы помочь дифференцировать флеболимфедему от других типов отеков, существует несколько важных клинических данных.
Признак Капоши-Штеммера
Классический диагноз лимфедемы опухшей конечности ставится по признаку Капоши-Штеммера (см.), Названному в честь Капоши, который впервые описал его в 1887 году, а затем Штеммера, описавшего его в 1976 году, после чего он получил более широкое клиническое применение2,16. Знак Капоши-Штеммера оценивает способность ущемлять кожную складку, что обычно делается у основания второго пальца ноги. Отрицательный признак Капоши-Штеммера возникает, когда кожа легко слипается. Положительный симптом Капоши-Штеммера возникает, когда кожа на тыльной стороне основания второго пальца не может быть защемлена в виде складки между пальцами.Признак Капоши-Штеммера, хотя и описан для пальцев ног, может быть применен на любом участке тела, чтобы помочь в диагностике лимфедемы. Если кожа не сжимается легко, это указывает на то, что лимфатические белки и жидкость препятствуют перераспределению межклеточных жидкостей и, таким образом, препятствуют легкому натяжению. Положительный признак Капоши-Штеммера считается диагностическим признаком лимфедемы. Однако, если признак Капоши-Штеммера отрицательный, возможно, у пациента лимфедема. Причины отрицательного знака Капоши-Штеммера при лимфедеме могут быть связаны с суточными колебаниями или регионально функциональными лимфатическими узлами.
Признак Капоши-Стеммера: неспособность сжимать кожу между пальцами является диагностическим признаком лимфедемы.
«Колбасные пальцы ног»
Тыльная поверхность стопы обычно поражается лимфедемой, и у пациента могут развиться большие опухшие пальцы ног, напоминающие сосиску. На тыльной стороне стопы может образоваться большой выступ в виде полочки из-за скопления лимфы в интерстициальных тканях. показывает расширенный внешний вид колбасного пальца с папилломами. показывает ранние изменения пальцев стопы из-за скопления лимфы и отека тыльной стороны стопы, что характерно для пациентов с лимфедемой.
Флеболимфедема у пациента с венозной язвой и ассоциированным липодерматосклерозом околопавневой зоны. Обратите внимание на незначительные изменения пальцев ног и отек тыльной стороны стопы, которые характерны для лимфедемы.
Липодерматосклеротические изменения
Если знак Капоши-Штеммера отрицательный, возможно, что у пациента лимфедема. Хронические кожные воспалительные изменения LDS, которые наблюдаются при лимфедеме, включают фиброз кожи (см. Нижнюю часть голени) и мелкий папилломатоз, который может ощущаться как наждачная бумага (также называемый гиперкератозом — см. Изменения кожи стопы) или может на поздних стадиях стать больше и сильнее. бородавчатый вид, как у пациента со слоновой болезнью ().Узловой эпидермальный фиброз (также называемый узловым фиброзом) также является проявлением LDS у пациентов с лимфедемой (A и B).
Тяжелая форма хронической лимфедемы с папилломатозом, липодерматосклерозом и фиброзом кожных покровов.
A, Пациент с флеболимфедемой с обширными изменениями узлового фиброза на поздней стадии липодерматосклероза. B. Крупный план пациента на фиг. 5A: флеболимфедема с обширными изменениями узлового фиброза или прогрессирующим липодерматосклерозом.
Lymphedema Rubra
показан пациент с красной лимфедемой. Lymphedema rubra — это бледное покраснение пораженной кожи, которое может имитировать и ошибочно приниматься за целлюлит. Часто пациенты обращаются к пациентам с историей повторного лечения целлюлита и длительного лечения антибиотиками, хотя на самом деле инфекции никогда не было. У этих пациентов в анамнезе обычно не было лихорадки и покраснения не исчезло после лечения антибиотиками. Lymphedema rubra представляет собой воспалительную гиперемию из-за провоспалительных изменений из-за жидкости с высоким содержанием белка в интерстиции.Этот признак свидетельствует о раннем липодерматосклеротическом воспалительном процессе. Эти пациенты могут иметь тепло в этой области из-за усиленного кровотока из-за провоспалительного состояния, что может вызвать замешательство у неопытного исследователя.
A, Демонстрация Lymphedema Rubra у пациента с флеболимфедемой. B, Демонстрация Lymphedema Rubra у пациента с флеболимфедемой: фотография, сделанная непосредственно после отпускания пальца.
Для проницательного врача важно уметь отличить красную лимфедему от истинного целлюлита.Правильная история важна. У пациентов с красной лимфедемой не будет лихорадки, отсутствия прогрессирования эритемы и хронических симптомов, и они могут сообщить в анамнезе о прошлом лечении «множественных инфекций», которые были ошибочно диагностированы как целлюлит.
Согласно Foldi, все липодерматосклеротические процессы у пациентов с ХВН указывают на нарушение работы или недостаточность лимфатических узлов.8
Хотя диагноз лимфедемы обычно ставится на основании анамнеза и обследования, в сложных случаях диагноз может быть подтвержден лимфосцинтиграфией.Этот процесс покажет замедленный лимфодренаж у пациентов с лимфедемой. Однако этот тест часто не подходит для пациентов с флеболимфедемой, поскольку у большинства этих пациентов флеболимфедема возникает из-за динамической недостаточности, и их лимфатические сосуды работают с максимальной нагрузкой, но все еще перегружены. Пациенты с динамической недостаточностью флеболимфедемы имеют тяжелую венозную гипертензию и могут иметь скорость прохождения лимфы выше нормы.8 Заболевание не всегда определяется скоростью транспорта лимфы, но часто связано с неадекватной способностью оставшихся лимфатических коллекторов справляться с большим объемом ультрафильтрата при ХВН.Венозная гипертензия может подавлять лимфатическую систему, что приводит к чрезмерному накоплению жидкости в интерстиции. Следовательно, лимфосцинтиграфия может давать ложноотрицательные результаты у пациентов с флеболимфедемой и, следовательно, не является надежным тестом для диагностики пациентов с флеболимфедемой, связанной с динамической недостаточностью.
LDS и ALDS часто со временем улучшаются и размягчаются с уменьшением набухания за счет сжатия. Это сжатие может быть достигнуто с помощью многослойной или короткоэластичной повязки.Если есть клинические признаки лимфедемы, рекомендуется ручной лимфодренаж и короткоэластичные перевязки.
Было документально подтверждено успешное медикаментозное лечение ALDS с использованием станозолола 2 мг два раза в день в течение 8-недельного курса.17,18 Станозолол имеет низкий коэффициент андрогенного эффекта и в некоторых случаях может значительно уменьшить боль за 3-4 недели. Он успешно применяется у пациентов, которые не могут переносить компрессию из-за боли от их ALDS. Сообщается, что побочных эффектов мало, хотя рекомендуется еженедельный мониторинг артериального давления и липидного профиля каждые 3-4 недели.Станозолол больше не доступен на рынке США.
Смешанные отеки
Отек смешанной этиологии может иметь множество факторов, и нередко пациенты имеют несколько факторов, лежащих в основе отека нижних конечностей. Таким образом, существует множество факторов, помимо ХВН, которые могут вызвать хронический отек нижних конечностей, а в некоторых случаях серьезность этих других причин может привести к вторичному развитию лимфедемы. Выше описаны основные системные факторы, способствующие отеку нижних конечностей, и они обсуждаются в следующих абзацах.
Таблица 1
Причины и факторы отека нижних конечностей
Нефротический синдром
7.Травма |
Некоторые элементы в таблице заслуживают комментария. Частота возникновения периферических отеков при применении нестероидных противовоспалительных средств оценивается в 5%.Частота возникновения периферических отеков при применении блокаторов кальциевых каналов зависит от дозы. Фактическую частоту трудно определить, потому что она различается для разных типов блокаторов кальциевых каналов и зависит от дозы, но сообщалось о частоте от 5% до 70 %.19 Lyrica является частой причиной периферических отеков нижних конечностей, и доза были зарегистрированы уровни зависимости от 17% до 27 %.20 Уровень натрийуретического пептида в головном мозге (BNP) позволяет исключить застойную сердечную недостаточность (ЗСН) из-за его высокой чувствительности, составляющей 90%.21
Ожирение — частая причина венозной гипертензии и фактор риска сердечно-сосудистых заболеваний, липодерматосклероза и флеболимфедемы. Между увеличением обхвата живота и повышенным давлением в брюшной полости существует почти линейная зависимость. Абдоминальное ожирение увеличивает внутрибрюшное давление, которое передается через полую вену и общие подвздошные кости непосредственно в бедренную вену, где, таким образом, оно может воздействовать на поверхностную и глубокую венозные системы. Большой паннус на ножке также может нарушать отток поверхностной лимфы.Таким образом, любое абдоминальное ожирение может ухудшить ХВН и увеличить риск развития флеболимфедемы.22
Легочная гипертензия — это часто недиагностируемая этиология отека нижних конечностей. В одном исследовании с участием 45 пациентов с отеком нижних конечностей, оцененных их лечащим врачом, у 71% был выявлен ХВН. После полного обследования окончательный диагноз: легочная гипертензия (> 40 мм рт. Ст.) У 20% и пограничная легочная гипертензия (31-40 мм рт. Ст.) У 22%. Поэтому при оценке легочной гипертензии следует учитывать эхо у пациентов старше 45 лет с отеком ног неясной этиологии.23
Дисфункция икроножных мышц — причина венозной гипертензии, которую часто не замечают. Атрофия мышц или артропатия голеностопного сустава снижает насос икроножных мышц. Это может значительно снизить скорость заживления венозных язв.
Лечение флеболимфедемы
Лечение пациента со значительной флеболимфедемой такое же, как лечение любого пациента с диагнозом лимфедема. В очень легких случаях флеболимфедемы, которая имеет в основном венозный компонент, часто можно использовать многослойные компрессионные бинты или короткие компрессионные повязки, и формальное лечение лимфедемы может не потребоваться.В этих легких случаях повязки способствуют значительному увеличению лимфатического потока. Когда пациент передвигается с перевязками, высокое давление под повязкой может способствовать току лимфы через дерму. Часто рекомендуется перевязать пальцы ног, чтобы предотвратить ретроградное накопление лимфатической жидкости к пальцам стопы и дистальному отделу переднего отдела стопы. Это можно сделать с помощью специальных бинтов для пальцев ног с очень низкой степенью сжатия. Для пациентов с любой значительной степенью флеболимфедемы стандарт лечения — полная противоотечная терапия (CDT). 8
Полная противоотечная терапия (CDT)
Большинству пациентов с флеболимфедемой требуется курс CDT. CDT состоит из острой фазы для уменьшения лимфедемы, за которой следует пожизненная поддерживающая фаза для предотвращения рецидивов24. Фаза I CDT состоит из процедур от 2 до 5 раз в неделю в течение примерно 4 недель. Процедуры включают ручной лимфодренаж (MLD), уход за кожей, упражнения и компрессионную перевязку короткими эластичными компрессионными повязками. Часто измерения конечностей производятся еженедельно, и лечение прекращается после того, как состояние пациента снизилось до исходного уровня или больше не прогрессирует.После уменьшения лимфедемы в фазе I у пациента начинается II фаза CDT. CDT фазы II состоит из ежедневного сжатия в течение всей жизни, сжатия в ночное время, если необходимо, ухода за кожей и физических упражнений. Пациентов часто обучают самостоятельной MLD, которую они могут продолжить дома. Некоторые эксперты не рекомендуют обучать пациентов самомассажу.
Рекомендуется, чтобы лечение фазы I CDT проводилось сертифицированным терапевтом по лимфедеме или терапевтом, прошедшим повышение квалификации по MLD.25 Такое обучение включает 135 часов обучения, как установлено Лимфологической ассоциацией Северной Америки.Национальная сеть лимфедемы имеет документ с изложением позиции по лечению лимфедемы, а также обучение терапевтов лимфедемы24,25. Терапевту рекомендуется пройти повышение квалификации по программе, которая приведет к сертификации.
Ручной лимфодренаж (MLD)
MLD — это поверхностный метод, который стимулирует лимфатические сосуды и помогает открывать и выталкивать жидкость в лимфатическую систему. MLD может выполняться таким образом, чтобы направлять лимфатический поток из перегруженных областей в функциональные лимфатические сосуды проксимально.26 MLD воздействует на фиксирующие нити лимфатических коллекторов с помощью мягкого двухтактного механизма, который открывает щели. Движение MLD заставляет жидкость поступать в лимфатическую систему и стимулирует лимфатическую перистальтику в остальных функциональных лимфатических сосудах.27
Short-Stretch Bandaging
Перевязка Lymphedema выполняется с помощью многоразовых короткоэластичных повязок, которые имеют ограниченную растяжимость (30% -70%). максимальная растяжимость) по сравнению с другими повязками. Бинты наматываются в несколько слоев, обычно в форме восьмерки.Набивка состоит из слоев поролона, вискозно-хлопчатобумажной или полиэфирной набивки. Давление в короткоэластичных повязках должно быть низким, когда конечность неактивна, что часто называют давлением покоя . При усилении мышечного сокращения во время активации конечностей мышца расширяется за счет полужестких повязок. Эта мышечная активация увеличивает давление в конечности, создавая более высокое давление, которое часто называют рабочим давлением . Хотя это увеличение больше всего наблюдается в икроножной мышце, тот же феномен наблюдается и в других перевязанных мышечных участках, таких как предплечье. Короткоэластичные бинты работают, создавая циклическое переключение между рабочим давлением и давлением в покое, что создает внутренний мышечный насос и способствует перемещению скопившейся лимфатической жидкости из пораженной конечности за счет стимуляции транспорта лимфы. 28
Пена высокой плотности или пена с трещинами часто используется в сочетании с компрессионной перевязкой для прокладки костных и сухожильных выступов, а также для уменьшения фиброза тканей LDS. Большинство терапевтов, занимающихся лимфедемой, считают, что использование пены и компрессии с течением времени помогает уменьшить фиброз тканей.Это подтверждается серией тематических исследований, но отсутствуют крупные случайные испытания. Кожные дольки следует набивать, приподнимать и сжимать, чтобы облегчить декомпрессию, и со временем они могут значительно уменьшиться при адекватном сжатии. Многие терапевты используют каналированную пену, которая имитирует лимфатический поток. Каналчатая пена создает области с высоким давлением, где пена давит на кожу, и каналы в областях с низким давлением, где пена меньше прижимается к коже. Считается, что каналированная пена работает, выталкивая лимфу из областей высокого давления и позволяя ей стекать в проксимальном направлении через области низкого давления.Хотя эти виды лечения широко используются в Соединенных Штатах и многие терапевты считают их полезными, строго контролируемых клинических исследований нет.
Длинные бинты, такие как бинты типа Ace, имеют высокую степень растяжения, примерно на 300% (растяжимость 300%). Длинные эластичные повязки обычно теряют примерно 50% своей компрессии за 6 часов и не воссоздают важную цикличность между нагрузками на рабочем месте и в покое. В этих длинноэластичных бинтах отсутствует «блокировка» или концевое растяжение бинта, как это видно на короткоэластичных бинтах.Короткие эластичные бинты создают гибкую неэластичную оболочку при наложении на конечность и максимально усиливают насос икроножных мышц. Не рекомендуется использовать длинные эластичные повязки для лечения любых острых или хронических отеков по следующим причинам: (1) они быстро теряют компрессию со временем и становятся субтерапевтическими; они предлагают очень небольшое увеличение функции икроножных мышц. Таким образом, бинты с высокой степенью растяжения (удлиненные) не должны играть роли в лечении отеков и не рекомендуются к использованию из-за их неэффективности в уменьшении и поддержании отеков.
Упражнения
Упражнения являются очень важным компонентом CDT и работают за счет улучшения локального перекачивания мышц для повышения эффективности транспорта лимфы.24 Повышенное отрицательное давление в грудной клетке при выполнении упражнений также может улучшить лимфатический поток в грудную клетку, поскольку лимфатическая жидкость следует за давлением. градиент к областям с более низким давлением. Упражнения особенно полезны в сочетании с короткими эластичными бинтами и одеждой. Упражнения можно выполнять как передвижение, или они могут быть почти столь же эффективными с упражнениями на носки вверх-вниз, которые значительно усиливают насос икроножных мышц.При лечении пациентов с лимфедемой плеча упражнения по-прежнему являются эффективным и важным компонентом уменьшения отека за счет активации мускулатуры предплечья.
Уход за кожей
Уход за кожей — важный компонент CDT. Цели ухода за кожей — уменьшить колонизацию кожи бактериями и грибками.29 Поскольку пациенты с лимфедемой имеют большие кожные складки и могут иметь лимфостатические язвы с высокой скоростью дренирования, крайне важно использовать хорошие кожные барьеры вокруг раны. Продукты на основе цинка часто рекомендуют для предотвращения мацерации и разрушения околоплодной раны.Кроме того, необходим тщательный уход за кожей между кожными складками, чтобы предотвратить ее повреждение. Сообщалось, что продукты, содержащие оливамин, обладают противовоспалительным действием. Диметиконовые барьеры полезны для уменьшения и предотвращения дерматитных реакций. При смене повязки зуд и дерматит можно лечить кремом с триамцинолоном. Продукты, содержащие бальзам Перу, полезны для барьеров вокруг раны, а также при неглубоких изъязвлениях с низким дренажем.
Компрессионное белье
После фазы I CDT уменьшения лимфедемы пациенту потребуется вспомогательное компрессионное белье для предотвращения повторного накопления отека.Типичным пациентам с флеболимфедемой требуется компрессия не менее 30-40 мм рт. Для большинства пациентов со значительной лимфедемой компрессионные чулки плоской вязки предпочтительнее, чем компрессионные чулки круговой вязки. Чулки плоской вязки обычно изготавливаются на заказ по размеру и растягиваются меньше, чем чулки круглой вязки, обеспечивая более плотную компрессию и предотвращая отек конечностей. Таким образом, пациентам с сильным отеком рекомендуется носить одежду плоской вязки вместо одежды круговой вязки. Для пациентов, которые не могут использовать компрессионные чулки из-за трудностей надевания и снятия, или для пациентов с атипичной геометрией конечностей, рекомендуются продукты типа липучки.29 В одежде из поролонового материала, такой как Jovi-Pak, используется пена, направленная по лимфатическим каналам, она может быть полезным дополнением для уменьшения фиброза тканей и часто используется для компрессии в ночное время. Другая ночная одежда, используемая в качестве альтернативы перевязкам, включает ReidSleeve.
Пневматические насосы
Пневматические насосы не являются компонентами CDT, но могут быть полезными дополнениями.24 В целом, усовершенствованные насосы с большим количеством камер и способностью преклирровать участки туловища, по мнению многих экспертов, более эффективны, чем насосы с меньшим количеством камер. камеры.Предварительная очистка лимфатических сосудов относится к процессу декомпрессии лимфатических сосудов проксимальнее пораженного участка. Путем декомпрессии проксимальных лимфатических сосудов перед использованием помпы на пораженном участке можно удалить больше жидкости из пораженных участков без переполнения проксимальных лимфатических сосудов. Насосы следует использовать в сочетании с рекомендациями квалифицированных терапевтов по лечению лимфедемы, и их не следует рассматривать как панацею или альтернативу MLD. CDT — стандарт лечения лимфедемы.Пневматические насосы не являются составной частью CDT, но могут использоваться дополнительно. Использование пневматических насосов не отменяет необходимости в CDT и не заменяет необходимости в длительном ежедневном обслуживании компрессии.
Краткое описание
Флеболимфедема может быть вызвана недостаточностью венозной или лимфатической системы или обеих. Большинство случаев флеболимфедемы происходит из-за перегрузки венозной системы, которая подавляет способность лимфатической системы удалять интерстициальную жидкость. Системные и способствующие факторы могут играть значительную роль в возникновении или обострении флеболимфедемы, и их следует по возможности устранять.Использование сертифицированного терапевта по лимфедеме в клинике или в сочетании с лечением раны равносильно предоставлению качественной помощи. Стандартным лечением для всех пациентов с клинически значимой лимфедемой должна быть CDT, проводимая квалифицированным терапевтом, включая MLD, уход за кожей, упражнения и сжатие с коротким растяжением. Целью CDT должен быть постоянный контроль всего отека, потому что всякий раз, когда происходит накопление провоспалительной лимфатической жидкости в интерстиции, для пациента повышается риск инфекции и долгосрочных процессов LDS.
Дополнительные ресурсы, чтобы узнать больше о лимфедеме
-
1.
Национальная сеть лимфедемы: https://www.lymphnet.org
-
2.
Учебник лимфологии Фёльди , глава 11: Хронический Венозная недостаточность (CVI) и венозно-лимфостатическая недостаточность)
-
3.
Согласованный документ Международного общества лимфологов 2009
-
4.
Практика ухода за ранами , 2-е изд., глава 15: Лимфедема, эпидемия, скрытая на виду
-
5.
Лимфологическая ассоциация Северной Америки: https://www.clt-lana.org
Сноски
Конфликт интересов: Автор не сообщает о конфликте интересов. Автор является членом правления Национальной сети лимфедемы, а также основателем и генеральным директором Farrow Medical Innovations.
Ссылки
1. Сзуба А., Шин В.С., Штраус Х.В., Роксон С. Третье обращение: радионуклидная лимфосцинтография в оценке лимфедемы.J Nucl Med. 2003. 44 (1): 43–57. [PubMed] [Google Scholar] 2. Бреннер Э., Путц Д., Мориггл Б. Стеммер (Капоши-Штеммер-) знак — 30 лет спустя. Phlebologie. 2007. 36 (6): 320–324. [Google Scholar] 3. Вейсманн К., Кракауэр Р., Ваншер Б. Распространенность кожных заболеваний в пожилом возрасте. Acta Derm Venereol. 1980. 60 (4): 352–353. [PubMed] [Google Scholar] 4. Валенсия I.C., Фалабелла А., Кирснер Р.С., Иглштейн W.H. Хроническая венозная недостаточность и венозные язвы голени. J Am Acad Dermatol. 2001. 44 (3): 401–421. [PubMed] [Google Scholar] 5.Гайтон А.С. 8-е изд. У. Б. Сондерс; Филадельфия, Пенсильвания: 1991. Учебник медицинской физиологии. [Google Scholar] 6. Фёльди М., Фёльди Э., Кубик С. Учебник по лимфологии для врачей и терапевтов по лимфедеме. Урбан и Фишер; Мюнхен, Германия: 2003. Дефицит и недостаточность лимфатической системы. п. 209–215. [Google Scholar] 7. Киркман Р., Содон М. Капиллярная динамика и лимфатическая система интерстициальной жидкости. Anaesth Intensive Care Med. 2004. 6 (1): 179–183. [Google Scholar] 8. Фёльди Э., Фёльди М. Учебник лимфологии Фёлди.2-е изд. Эльзевир; Мюнхен, Германия: 2006. Хроническая венозная недостаточность и венозно-лимфостатическая недостаточность. п. 434–447. [Google Scholar] 9. Pillar N. Флеболимфедема / хроническая венозная лимфатическая недостаточность: введение в стратегии обнаружения, дифференциации и лечения. Флебология. 2009; 24: 51–55. [PubMed] [Google Scholar] 11. Фаланга В., Муса Х. Х., Немет А. Дж., Альштадт С. П., Иглштейн В. Х. Кожный перикапиллярный фибрин при заболеваниях вен и язве вен. Arch Dermatol. 1987. 123 (5): 620–623.[PubMed] [Google Scholar] 12. Брюс А.Дж., Беннетт Д.Д., Лозе К.М., Рук Т.В., Дэвис М.Д.П. Липодерматосклероз: обзор случаев, проведенных в клинике Майо. J Am Acad Dermatol. 2002. 46 (2): 187–192. [PubMed] [Google Scholar] 13. Фелпс Р.Г., Сёдзи Т. Последние сведения о панникулите. Гора Синай J Med. 2001. 68 (4-5): 262–267. [PubMed] [Google Scholar] 14. Кирснер Р.С., Пардес Дж. Б., Иглштейн В. Клинический спектр липодерматосклероза. J Am Acad Dermatol. 1993. 28 (4): 623–627. [PubMed] [Google Scholar] 15.Смит П.С. Причины повреждения кожи и язв на ногах при хронических заболеваниях вен. Int J Раны нижних конечностей. 2006. 5: 160–168. [PubMed] [Google Scholar] 16. Stemmer R. Ein klinisches Zeichen zur gruhund дифференциальная диагностика Lyphodems. Васа. 1976; 5: 261–262. [PubMed] [Google Scholar] 17. Vesic S., Vukovic J., Medenica L.J., Pavlovic M.D. Острый липодерматосклероз: открытое клиническое испытание станозолола у пациентов, не способных выдержать компрессионную терапию. Derm Online J. 2008; 14 (2): 1. [PubMed] [Google Scholar] 18.Хельфман Т., Фаланга В. Станозолол как новое терапевтическое средство в дерматологии. J Am Acad Dermatol. 1995. 33 (2 Pt 1): 254–258. [PubMed] [Google Scholar] 20. Фрэмптон Дж.Э., Скотт Л.Дж. Прегабалин в лечении болезненной диабетической периферической нейропатии. Наркотики. 2004. 64: 2813–2820. [PubMed] [Google Scholar] 21. Майзел А.С., Кришнасвами П., Новак Р.М. Быстрое определение натрийуретического пептида B-типа в экстренной диагностике сердечной недостаточности. N Engl J Med. 2002. 347 (3): 161–167. [PubMed] [Google Scholar] 22.Гольдман М.П. Липодерматосклероз: обзор случаев, проведенных в клинике Майо. J Am Acad Dermatol. 2002; 46: 187–192. [PubMed] [Google Scholar] 23. Бланкфилд Р.П., Финкельхор Р.С., Александр Дж.Дж. Этиология и диагностика двустороннего отека ног в первичной медико-санитарной помощи. Am J Med. 1998. 105: 192–197. [PubMed] [Google Scholar] 26. Диагностика и лечение периферической лимфедемы: согласованный документ Международного общества лимфологов 2009 г. Лимфология. 2009; 42: 51–60. [PubMed] [Google Scholar] 27. Виттлингер Г., Виттлингер Х. 7-е изд. Георг Тиме Верлаг; Штутгарт, Германия: 2004. Учебник по ручному лимфодренажу доктора Воддера. [Google Scholar] 28. Фёльди Э. Хаос лимфпедемы: ланцет. Ann Plast Surg. 1989; 22: 505–515. [PubMed] [Google Scholar] 29. Файф С.Э. Лимфедема, эпидемия, скрытая у всех на виду. В: Джойнер Дж. Т., Ласки К., редакторы. Практика ухода за ранами. 2-е изд. Лучший; Flagstaff, AZ: 2007. С. 379–399. [Google Scholar]CD4 + клеток регулируют фиброз и лимфангиогенез в ответ на застой лимфатической жидкости
Абстрактные
Введение
Лимфедема — это хроническое заболевание, которое обычно возникает после удаления лимфатических узлов для лечения рака и характеризуется отеком, фиброзом, воспалением и отложением жира.Хотя предыдущие гистологические исследования изучали воспалительные изменения, возникающие при лимфедеме, точный клеточный состав воспалительного инфильтрата остается неизвестным. Также неясно, играет ли эта воспалительная реакция причинную роль в патологии лимфедемы. Таким образом, цель этого исследования состояла в том, чтобы охарактеризовать воспалительную реакцию на лимфатический застой и определить, необходимы ли эти ответы для патологических изменений, возникающих при лимфедеме.
Методы
Мы использовали модели лимфедемы хвоста мыши и подмышечной лимфодиссекции (ANLD) для изучения воспалительных изменений тканей.Суспензии отдельных клеток были созданы и проанализированы с использованием многоцветной проточной цитометрии для идентификации отдельных типов клеток. Мы использовали методы истощения антител для анализа причинной роли клеток CD4 +, CD8 + и CD25 + в регуляции воспаления, фиброза, отложения жира и лимфангиогенеза.
Результаты
Лимфедема в хвосте мыши привела к смешанному воспалительному клеточному ответу со значительным увеличением Т-хелперов, Т-регуляторных, нейтрофилов, макрофагов и популяций дендритных клеток.Интересно, что мы обнаружили, что ALND приводит к значительному увеличению Т-хелперных клеток, предполагая, что эти адаптивные иммунные ответы предшествуют изменениям в инфильтрации макрофагов и дендритных клеток. В подтверждение этого мы обнаружили, что истощение CD4 +, но не CD8 или CD25 + клеток, значительно снижает лимфедему хвоста, воспаление, фиброз и отложение жира. Кроме того, истощение CD4 + клеток значительно увеличивало лимфангиогенез как в нашей модели хвоста, так и в модели воспалительного лимфангиогенеза.
Выводы
Лимфедема и лимфатический застой приводят к воспалению CD4 + клеток и инфильтрации зрелых Т-хелперных клеток. Потеря CD4 +, но не CD8 + или CD25 + клеток, воспаление заметно снижает патологические изменения, связанные с лимфедемой. Кроме того, клетки CD4 + регулируют лимфангиогенез во время заживления ран и воспалительный лимфангиогенез.
Образец цитирования: Zampell JC, Yan A, Elhadad S, Avraham T., Weitman E, Mehrara BJ (2012) Клетки CD4 + регулируют фиброз и лимфангиогенез в ответ на застой лимфатической жидкости.PLoS ONE 7 (11): e49940. https://doi.org/10.1371/journal.pone.0049940
Редактор: Нильс Олсен Сараива Камара, Университет Сан-Паулу, Бразилия
Поступила: 27.07.2012; Одобрена: 15 октября 2012 г .; Опубликован: 20 ноября 2012 г.
Авторские права: © 2012 Zampell et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Это исследование было поддержано исследовательской стипендией Фонда образования в области пластической хирургии: «Механизмы, регулирующие фиброз при хронической лимфедеме» (награда: 50 000 долларов США; PI: Джейми Зампелл; 100% усилий; наставник: Бабак Дж. Мехрара, доктор медицины) . Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Лимфедема — это хроническое заболевание, которое характеризуется прогрессирующим отеком тканей и отложением жира, вторичным по отношению к врожденным дефектам, инфекциям или повреждению лимфатической системы.В своих наиболее запущенных формах лимфедема приводит к массивным изменениям конечностей, обычно называемым слоновостью. Хотя наиболее частой причиной лимфедемы во всем мире являются паразитарные инфекции, вызываемые нематодами, такими как Wuchereria bancrofti , эти инфекции редко встречаются в развитых странах, где лимфедема чаще всего возникает после хирургического вмешательства при раке. [1] В этих случаях у пациентов развивается лимфедема после прямого повреждения лимфатической системы в результате расслоения лимфатических узлов или вторичного удаления кожи и лучевой терапии.По оценкам, у 1 из 3 женщин, которым проводилась диссекция подмышечных лимфатических узлов по поводу рака груди, развивается лимфедема. [2] Лимфедема также часто встречается при других солидных злокачественных новообразованиях, встречающихся почти у 1 из 8 пациентов, леченных по поводу различных опухолей. [3].
Отсутствие четкого понимания патологии лимфедемы послужило серьезным препятствием для разработки эффективных, целенаправленных методов лечения или профилактических мер для этого инвалидизирующего осложнения. Вместо этого современные методы лечения носят паллиативный характер и направлены на предотвращение прогрессирования заболевания и уменьшение симптомов, а не на лечение основной патологии.Тот факт, что лимфедема в большинстве случаев развивается через 8–12 месяцев после операции (а не сразу после вскрытия лимфатических узлов) [4], предполагает, что повреждение лимфатических узлов является просто исходным событием, необходимым для активации клеточных и молекулярных изменений, которые со временем приводят к хронический отек тканей, воспаление, фиброз и отложение жира. Однако остается неизвестным, играют ли ключевые гистологические признаки лимфедемы, такие как воспаление и фиброз, причинную роль в этой патологии, или эти изменения просто отражают ухудшение патологии.Аналогичным образом, хотя предыдущие отчеты продемонстрировали, что пациенты с вторичной лимфедемой имеют высокие концентрации лимфоцитов в периферической лимфе, повышенную плотность клеток Лангерганса и экспрессию антигена класса II в коже, а также повышенную границу гранулоцитов в лимфедематозных тканях, [5], [6] , [7], [8] точный клеточный ответ на застой лимфатической жидкости и хроническую лимфедему остается неизвестным. Это важно, поскольку недавние исследования показали критическую роль воспалительных клеток в регуляции фиброза, лимфангиогенеза и отложения жировой ткани при других заболеваниях.[9], [10], [11], [12] Таким образом, понимание того, как застой лимфатической жидкости резко регулирует эти реакции, и, что более важно, как эти ответы координируются хронически, является важным первым шагом в разработке целевых методов лечения, которые могут блокировать начало или прогрессирование патологических последствий лимфатической травмы.
Имея в виду эти цели, целью данного исследования было определить, как лимфатический застой регулирует воспалительные изменения тканей. Кроме того, мы стремились определить, играют ли эти хронические воспалительные реакции патологическую роль в лимфатической дисфункции, фиброзе и отложении жира при лимфедеме.Мы показываем, что специфические субпопуляции Т-клеток являются критическим компонентом подострого и хронического воспалительного клеточного ответа на застой лимфатической жидкости. Кроме того, используя исследования истощения антител, мы показываем, что воспалительные реакции Т-хелперных клеток необходимы для фиброза, лимфатической дисфункции, отложения подкожного жира и хронического воспаления, возникающего в ответ на устойчивый застой лимфатической жидкости. Наши результаты важны, потому что мы впервые показываем, что лимфедема вызывает характерные воспалительные реакции.Кроме того, мы показываем, что эти реакции играют роль в патологии лимфедемы, а не просто отражают ухудшение патологии.
Методы
Модели животных
Использовались взрослые самки (возраст 10–12 недель) мышей C57B6 дикого типа или трансгенных мышей C57B6 с дефицитом CD4 + клеток (CD4KO; Jackson Labs, Bar Harbor, ME), и все исследования проводились в соответствии со стандартами IACUC и утвержденными протоколами на животных в Memorial Онкологический центр Слоуна-Кеттеринга. В каждой группе / эксперименте использовалось 8–10 животных.
Чтобы изучить влияние устойчивого тяжелого лимфатического застоя на воспалительные реакции, мы использовали хорошо описанную модель лимфедемы хвоста мыши, в которой поверхностная и глубокая лимфатическая система хвоста нарушены путем иссечения 3-миллиметрового участка кожи. и микрохирургическое лигирование глубоких лимфатических каналов, которые проходят вдоль боковых хвостовых вен. [13], [14], [15], [16] Наша группа и другие ранее показали, что эта модель приводит к стойкой лимфедеме дистального отдела хвоста, серьезному нарушению лимфатической функции и гистологическим особенностям клинической лимфедемы (e .г. хроническое воспаление, отложение жира, фиброз) в течение не менее 10 недель после операции. [13], [14], [15], [16] Контрольным животным был проведен круговой разрез кожи хвоста, но не было повреждения поверхностной или глубокой лимфатической системы. Лимфатическая функция, проточная цитометрия и гистологический анализ были выполнены через 6 недель после операции, как описано ниже.
Мы также использовали мышиную модель рассечения подмышечных лимфатических узлов для изучения последствий лимфаденэктомии и нарушения работы глубокой лимфатической системы.Ранее мы показали, что аналогично клиническому сценарию, рассечение подмышечных лимфатических узлов (ALND) у мышей приводит к незначительному, но значительному увеличению объема конечностей, что позволяет нам изучать острые тканевые изменения, возникающие в ответ на лимфатический застой. [17] У экспериментальных мышей была проведена диссекция ALND с использованием подмышечного разреза 1 см, и все идентифицируемые подмышечные лимфатические узлы были удалены. Контрольным животным выполняли разрез кожи подмышечных впадин без удаления лимфатических узлов.
Проточная цитометрия
Часть ткани размером 1 см была взята на 1 см дистальнее места диссекции подмышечных лимфатических узлов или 1.5 см дистальнее места иссечения кожи хвоста. Проточная цитометрия и анализ были выполнены с использованием модификации наших ранее описанных методов. [18] Вкратце, кожу и подкожные ткани отделяли от подлежащих тканей и переваривали при 37 ° C в течение 30 минут в фосфатно-солевом буфере (PBS), растворе коллагеназы D (0,2 мг / мл), ДНКазы I (0,1 мг / мл. ), Dispase (0,1 мг / мл) и 2% фетальной телячьей сыворотки (все от Sigma Aldrich, Сент-Луис, Миссури). Затем перевариваемые ткани фильтровали и ресуспендировали в виде суспензии отдельных клеток в растворе PBS / 2% FCS / азида натрия для анализа проточной цитометрии.Одновременно выделяли спленоциты путем разрыва селезенки, лизирования эритроцитов и фильтрации для получения суспензий отдельных клеток. Клетки блокировали при 4 ° Fc-блоком (CD16 / CD32, eBiosciences (Сан-Диего, Калифорния), чтобы блокировать эндогенные рецепторы Fc. Для оптимизации настроек цитометра проводили одиночное окрашивание спленоцитов. -конъюгированные антитела к следующим маркерам клеточной поверхности: CD45, CD4, CD8, TCRB, CD25, F4 / 80, CD11b, CD11c, Ly6c, Ly6g, B220 (все антитела от Biolegend, Сан-Диего, Калифорния) и NK Т-лимфоцитов. специфический тетрамер (тетрамеры PBS57 – CD1d были получены от Национального института здоровья США, США).Альтернативно, клеточные суспензии блокировали Fc с последующей фиксацией, пермеабилизацией в течение ночи при 4 ° C и окрашивали на внутриклеточный маркер FoxP3 (eBiosciences) и маркеры клеточной поверхности CD4 и CD25 (Biolegend).
Суспензии клетоканализировали с использованием проточного цитометра LSR II (BD Biosciences, Сан-Хосе, Калифорния) с программным обеспечением BD FACSDiva, а последующий анализ данных выполняли с использованием программного обеспечения FlowJo (Tree Star, Ashland, OR). Популяции клеток анализировали и определяли с использованием маркеров клеточной поверхности, перечисленных в таблице 1, с использованием 5-7 животных / группу / эксперимент, причем каждый эксперимент проводили в трех повторностях.
Эксперименты по истощению
Эксперименты по истощению были выполнены с использованием хвостовой модели лимфедемы, как описано выше. После иссечения кожи хвоста и лимфатических сосудов животным давали возможность восстановиться в течение 2 недель, а затем рандомизировали в экспериментальные или контрольные группы (n = 8–10 / группу). Экспериментальные животные были истощены по клеткам CD4, CD8 или CD25 с использованием внутрибрюшинного введения моноклональных нейтрализующих антител (все от Bio-X-Cell, Ливан, Нью-Гэмпшир) в концентрации 10 мкг / г каждые 5 дней в течение всего 4 недель. (я.е. Через 6 недель после операции), как описано ранее. Контрольных животных лечили неспецифическими контрольными антителами изотипа, вводимыми в той же дозе и в те же сроки. Адекватность истощения подтверждали анализом проточной цитометрии суспензий единичных клеток селезенки, сравнивая экспериментальных и контрольных животных во время умерщвления (через 6 недель после операции).
Объем хвоста, лимфосцинтиграфия, микролимфангиография
Лимфедему хвоста контролировали еженедельно с использованием множественных измерений окружности хвоста цифровым штангенциркулем дистальнее зоны лимфатического повреждения и расчета объемов хвоста с использованием формулы усеченного конуса, как описано ранее.[15] Лимфосцинтиграфия была выполнена, как описано ранее, для количественной оценки лимфатического потока путем инъекции 50 мл фильтрованного коллоида серы технеция (Tc 99 m ) в дистальный отдел хвоста и анализа поглощения с поправкой на распад в крестцовых лимфатических узлах с помощью камеры X-SPECT ( Gamma Medica, Northridge, CA) и анализ интересующей области с использованием программного обеспечения ASIPro (CTI Molecular Imaging, Knoxville, TN). [15] Чтобы проанализировать архитектуру лимфатической системы и рассчитать поток интерстициальной жидкости, мы выполнили микролимфангиографию, используя наши ранее опубликованные методы.[14] Вкратце, декстран, конъюгированный с флуоресцеинизотиоцианатом (FITC) (2000 кДа, 10 мг / мл, Invitrogen, Carlsbad, CA), вводили при постоянном анатомическом давлении в дистальный отдел хвоста, а затем визуализировали через 15 минут с фиксированными интервалами 10 мм по длине. хвост с помощью стереоскопа Lumar (Carl Zeiss Inc, Пибоди, Массачусетс) и программного обеспечения для визуализации Metamorph (Molecular Devices, Саннивейл, Калифорния). Экспозиция, усиление, увеличение и температура тела поддерживались постоянными, и животное анестезировали, чтобы предотвратить артефакты движения.Поглощение FITC-декстрана выражали как отношение средней интенсивности пикселей в областях, проксимальных по отношению к областям, удаленным от места хирургического вмешательства, через 15 минут после инъекции.
Лимфангиогенез лимфатических узлов
Лимфангиогенез лимфатических узлов использовали, как описано ранее, для определения того, как клетки CD4 регулируют воспалительный лимфангиогенез независимо от заживления ран. Вкратце, смесь полного адъюванта Фрейнда (Sigma) и овальбумина (1-1) эмульгировали и вводили в задние лапы взрослых самок мышей C57B6 дикого типа, а через 7 дней собирали подколенные лимфатические узлы.Экспериментальные животные (n = 8) были истощены по CD4 + клеткам с использованием моноклональных нейтрализующих антител за 3 дня до инъекции CFA / OVA, как указано выше, в то время как контрольных животных (n = 8) лечили эквивалентной дозой неспецифических контрольных антител изотипа. Чтобы подтвердить наши выводы об истощении CD4, мы провели идентичные эксперименты на мышах C57B6 дикого типа (n = 8) и сравнили их с трансгенными мышами C57B6, дефицитными по клеткам CD4 (CD4KO; n = 8; Jackson labs).
Иммуногистохимия и гистологический анализ
Ткани хвоста фиксировали в 4% параформальдегиде и декальцинировали в Immunocal перед заливкой в парафин.Лимфатические узлы помещали в среду OCT (Sigma-Aldrich, Сент-Луис, Миссури) и замораживали при -80 ° C; Для анализа были приготовлены срезы размером 5 мкм из всех тканей.
Иммуногистохимическое окрашивание с использованием методов окрашивания на основе пероксидазы хрена проводили в соответствии с установленными нами методами [14]. Вкратце, залитые в парафин ткани регидратировали и демаскировку антигена проводили с использованием кипящего цитрата натрия (Sigma). Активность эндогенной пероксидазы подавлялась, а неспецифическое связывание блокировалось с помощью 2% BSA / 20% сыворотки животных.Ткани инкубировали с первичным антителом в течение ночи и окрашивание антител визуализировали, используя вторичные антитела, конъюгированные с пероксидазой хрена, и проявление с диаминобензаминовым комплексом (DAB; Vector, Burlingame, CA). Первичные антитела, используемые для иммуногистохимического окрашивания, включали коллаген I, коллаген III, подпланин, CD4, F4 / 80, CD45 (все от Abcam, Кембридж, Массачусетс) и фактор роста эндотелия сосудов-C (VEGF-C; Novus Biological, Littleton, CO. ). Все вторичные антитела были получены от Vector Laboratories.Срезы анализировали с помощью светлопольной микроскопии, а интересующие области сканировали с помощью сканера слайдов Mirax (Zeiss, Мюнхен, Германия). Подсчет клеток проводился на высокоэффективных срезах минимум 4–6 животных в группе и 4–5 hpf / животное двумя слепыми рецензентами.
Иммунофлуоресцентное окрашивание проводили, как описано выше, за исключением этапов тушения пероксидазы. Для окрашивания использовали первичное антитело к LYVE-1 (R&D Systems, Миннеаполис, Миннесота) и вторичное антитело, конъюгированное с TRITC.Для замороженных срезов лимфатических узлов слайды на короткое время фиксировали в ацетоне с последующим блокированием и окрашиванием, как описано выше. Плотность лимфатических сосудов определяли с использованием программного обеспечения Metamorph Scanner и Metamorph Offline (Molecular Devices, Sunnyvale CA), как описано ранее. [19].
Анализ толщины подкожной клетчатки проводился на гистологических срезах, расположенных на расстоянии 1,5 см дистальнее от места операции, слепыми рецензентами (n = 6–8 на группу). Расстояние от базального слоя эпидермиса до глубокой фасции анализировали в 4 стандартизованных областях на срез.Площадь лимфатических сосудов измеряли, как описано ранее. [14] Вкратце, самый широкий радиус отдельных лимфатических сосудов, идентифицированный окрашиванием подпланином или LYVE-1 в гистологических поперечных срезах, был использован для расчета площади лимфатических сосудов. Фиброз тканей оценивали с использованием ранее опубликованных нами методов количественной оценки Сириуса красного (индекс рубца), а также с помощью иммуногистохимического окрашивания на коллаген типа I и типа III. [14] Отложение коллагена определялось количественно как отношение положительно окрашенной дермы и подкожных тканей в пределах фиксированного порога к общей площади ткани с использованием программного обеспечения Metamorph Offline.
Анализ белков
Ткани хвоста или лимфатические узлы лизировали (Thermofischer Scientific, Уолтем, Массачусетс) и 20–30 мг объединенного белка (n = 3–5 животных) использовали для вестерн-блот-анализа с использованием ранее опубликованных нами методов. [14] Мы проанализировали экспрессию гамма-интерферона (IFN-y), интерлейкина-4 (IL-4; оба от Abcam), FoxP3, Tbet, GATA3 (все от Santa Cruz Biotechnology, Санта-Крус, Калифорния), типа Коллаген I, коллаген III типа, альфа-актин гладких мышц (a-SMA), E-кадгерин, фосфорилированный SMAD-3 (pSMAD3; все от Abcam), TGFB-1 (Santa Cruz), VEGF-A (Abcam) и VEGF-C (Novus Biologic).Равную нагрузку обеспечивали с помощью актина (Abcam), а плотность полос определяли с помощью анализа ImageJ (https://rsbweb.nih.gov/ij/). Нормализованную экспрессию определяли как отношение к контролю. Для ELISA анализировали 20-30 мг белка из объединенных образцов (n = 3-5 животных / группу) для количественного определения VEGF-A и VEGF-C в соответствии с инструкциями производителя (eBioscience, Сан-Диего, Калифорния). Все эксперименты проводили в трех повторностях.
Статистический анализ
T-критерий Стьюдента использовался для сравнения различий между 2 группами; парные Т-тесты были выполнены для всех согласованных ALND и фиктивных контрольных образцов.Многогрупповые сравнения были выполнены с использованием двухфакторного дисперсионного анализа (ANOVA) с апостериорным критерием Тьюки-Крамера. Данные представлены в виде среднего значения ± стандартное отклонение, если не указано иное, с р <0,05, считающимся значимым.
Результаты
Хроническая лимфедема вызывает смешанный воспалительный клеточный ответ
Мы использовали хорошо описанную модель лимфедемы «мышиный хвост», чтобы определить, как хронический лимфатический застой регулирует воспаление тканей. Как и ожидалось, через 6 недель после операции у мышей, подвергшихся удалению кожи хвоста и лимфатической ткани, наблюдалось заметное увеличение объема хвоста, контрактура и фиброз хвоста, а также гиперкератоз (рис.Напротив, у контрольных животных, которым был проведен разрез кожи хвоста, в это время не было отека или аномальных изменений. Анализ перевариваемых тканей, собранных на 1,5 см дистальнее зоны лимфатического повреждения, также подтвердил наши предыдущие наблюдения [14] и продемонстрировал заметно увеличенное количество клеток CD45 + , соответствующих тканевому воспалению, по сравнению с контролем (2,3 раза; Рисунок 1C ). . Анализ этих образцов ткани с помощью многоцветной проточной цитометрии показал, что процент зрелых Т-хелперов (CD45 + / CD4 + / TCRB + ) также резко увеличился в лимфедематозных тканях (2.2 раза; Рисунок 1D ). Напротив, мы не отметили значительных различий в процентном содержании зрелых цитотоксических Т-клеток, NKT-клеток или В-клеток. Интересно, что согласуется с нашими предыдущими отчетами [17], мы также отметили значительно увеличенный процент нейтрофилов (в 1,4 раза), макрофагов (в 1,6 раза) и дендритных клеток (в 1,9 раза) в лимфедематозных тканях ( Рисунок 1E ).
Рис. 1. Хроническая лимфедема вызывает смешанный воспалительный клеточный ответ.
А. Фотография хвостов мыши через 6 недель после иссечения кожи / лимфатических сосудов (лимфедема; слева) или разреза кожи (контроль; справа). B. Репрезентативная гистология поперечного сечения хвостов мыши при сравнении лимфедемы (слева) и контрольных (справа) мышей через 6 недель после операции. Поперечные сечения были получены на расстоянии 2 см дистальнее хвостовой раны (стрелка на рисунке A). Обратите внимание на отложение подкожного жира (скобки), расширение лимфатических сосудов и воспаление в участке лимфедемы. C. Анализ проточной цитометрии CD45 + клеток в суспензиях отдельных клеток, приготовленных из ткани хвоста на расстоянии 2 см от раны лимфедемы или контрольных мышей (n = 5-7 / группа) через 6 недель после операции.Показан процент клеток CD45 + как функция от общей популяции клеток. Справа показана типичная гистограмма. D., E. Анализ проточной цитометрии Т-хелперов, Т-цитотоксических, естественных киллеров Т-клеток (NKT), В-клеток (Рисунок D) и нейтрофилов, моноцитов, макрофагов и дендритных клеток (Рисунок E) в отдельной клетке суспензии лимфедематозных или контрольных мышей (n = 5-7 / группа) через 6 недель после операции. Справа показаны характерные точечные графики. Овальные ворота указывают на популяции двойных положительных клеток.
https://doi.org/10.1371/journal.pone.0049940.g001
Рассечение подмышечных лимфатических узлов приводит к воспалению Т-клеток
Чтобы определить тип воспалительных реакций, которые инициируются лимфатическим повреждением до начала хронической лимфедемы, мы проанализировали воспаление ткани в верхней конечности мышей, перенесших диссекцию подмышечных лимфатических узлов (ALND) или разрез кожи подмышек без лимфатических узлов. травма через 3 или 6 недель после операции.Этот подход был основан на наших предыдущих исследованиях, показывающих, что: 1). ALND в этой модели (аналогично клиническому сценарию) приводит к легкому, но значительному отеку верхней конечности через 3 недели после операции и проходит через 6 недель; 2.) Воспалительные реакции тканей на ALND гистологически очевидны, начиная с 3 недель после операции. [17], [20].
Через 3 недели мы отметили умеренное (в 1,3 раза), но незначительное увеличение процента лейкоцитов CD45 + у животных, получавших ALND, по сравнению с контролем ( Рисунок 2A, ).Эта разница стала более выраженной (в 1,8 раза) и значительной к 6 неделям после операции. Интересно, что когда мы анализировали подтипы воспалительных клеток через 3 недели после операции, мы отметили значительное увеличение процента подтипов Т-клеток (1,8-кратное увеличение Т-хелперных клеток, 2-кратное увеличение цитотоксических Т-клеток и 1,7-кратное увеличение NKT). в виде нейтрофилов (в 2,1 раза). Однако В-клетки, моноциты, макрофаги и дендритные клетки были мало изменены (, рис. 2В, ). Повышенный процент Т-хелперных клеток (1.3 раза) и NKT (1,4 раза) сохранялись в течение 6 недель, однако различия между цитотоксическими Т-клетками и нейтрофилами стали незначительными ( Рисунок 2C, , ), . Точно так же мы не обнаружили существенных различий в процентном содержании нейтрофилов, моноцитов, макрофагов или дендритных клеток в этот момент времени.
Рис. 2. Диссекция подмышечных лимфатических узлов приводит к воспалительной реакции Т-клеток. A.
Анализ проточной цитометрии CD45 + клеток в суспензиях одиночных клеток, приготовленных из мягких тканей верхних конечностей 1.На 5 см дистальнее подмышечной раны у животных, получавших лечение подмышечных лимфатических узлов (ALND) или подмышечный разрез без лимфаденэктомии (имитация; n = 5-7 / группа) через 3 или 6 недель после операции. Справа показана типичная гистограмма. В . Анализ проточной цитометрии Т-хелперов, Т-цитотоксических, естественных киллерных Т-клеток (NKT), В-клеток (верхняя панель) и нейтрофилов, моноцитов, макрофагов и дендритных клеток в суспензиях единичных клеток мягких тканей верхних конечностей, собранных 3 недели после АЛНД или имитационного разреза (n = 5–7 / группа).Репрезентативные точечные графики показаны ниже. С . Анализ проточной цитометрии Т-хелперов, Т-цитотоксических, естественных киллерных Т-клеток (NKT), В-клеток (верхняя панель) и нейтрофилов, моноцитов, макрофагов и дендритных клеток в суспензиях единичных клеток мягких тканей верхних конечностей, собранных 6 недель после АЛНД или имитационного разреза (n = 5–7 / группа). Репрезентативные точечные графики показаны ниже.
https://doi.org/10.1371/journal.pone.0049940.g002
Истощение клеток CD4 уменьшает лимфедему
Основываясь на выводах о том, что воспаление Т-клеток инициируется лимфатическим повреждением (ALND) и сохраняется при хронической лимфедеме, мы проверили гипотезу о том, что эти воспалительные реакции вносят вклад в патологию лимфедемы, выполнив исследования истощения антител.Эта гипотеза подтверждается недавними открытиями, демонстрирующими, что Т-клетки могут регулировать лимфангиогенез [11], [21], [22] и, как известно, играют роль в фиброзных расстройствах и, следовательно, могут способствовать патологическому фиброзу, связанному с хронической лимфедемой.
Как и ожидалось, истощение CD4 или CD8 клеток с помощью нейтрализующих антител было высокоэффективным, приводя к почти полному отсутствию этих клеток в селезенке ( Рисунок 3A, ). Мы решили начать истощение Т-лимфоцитов через 2 недели после удаления кожи хвоста и лимфатической системы, основываясь на наших предыдущих исследованиях, демонстрирующих, что воспалительные реакции в этой модели впервые проявляются в этот момент времени.[15] Интересно, что мы обнаружили, что истощение клеток CD4 привело к заметному уменьшению лимфедемы хвоста и уменьшению фиброзной кривизны хвоста дистальнее места лимфатического разрушения по сравнению с контрольной группой или животными, получавшими нейтрализующие CD8 антитела ( Рисунок 3B, ). Эти изменения отражались в значительном уменьшении объема хвоста (в 1,9 раза) и толщины подкожной клетчатки на гистологических срезах (в 1,5 раза) у мышей с истощенным CD4 ( Рисунок 3C, D ). Гистологические срезы продемонстрировали заметное уменьшение воспаления, подкожного отека и отложения жира у животных с истощением CD4 ( Рисунок 3C, ).Напротив, истощение CD8 имело незначительный эффект. Изменения объема хвоста, отложения подкожной жировой ткани и воспаления у мышей с истощенным CD4 коррелировали со снижением диаметра лимфатических сосудов с положительным подпланином (, рис. 3E, ), предполагая, что у этих животных уменьшился лимфатический застой, потому что их капилляры и собирающие лимфатические сосуды разрушены. [ 16 ] Напротив, контрольные животные и животные с истощенным CD8 имели большие расширенные экстатические лимфатические сосуды, соответствующие стойкой лимфатической дисфункции.Взятые вместе, эти результаты предполагают, что лимфатический застой вызывает воспаление Т-клеток и что клетки CD4 + могут вносить вклад в патологические изменения, которые возникают.
Рисунок 3. Истощение клеток CD4 снижает лимфедему. A.
Анализ проточной цитометрии суспензий единичных клеток селезенки от мышей, обработанных изотипическими контрольными антителами или лишенных клеток CD4 + (верхняя панель) или клеток CD8 + (нижняя панель), с использованием нейтрализующих антител (n = 5–7 / группа). Справа показаны характерные точечные графики. B. Репрезентативная фотография контрольных мышей, мышей с истощенными CD8 + или CD4 + -клетками через 6 недель после поверхностного и глубокого лимфатического иссечения хвоста. Обратите внимание на почти полное исчезновение отека у животных, получавших CD4 +, и потерю фиксированной контрактуры хвоста (J-образная форма, наблюдаемая у контрольных животных или животных, получавших CD8 +). C. Репрезентативная гистология поперечного сечения и количественная оценка толщины подкожной ткани (скобки) у контрольных животных с истощенными CD8 + и CD4 +. D. Объемы хвоста у контрольных животных с истощенными CD8 + или CD4 + в ходе эксперимента.Истощение клеток CD4 + или CD8 + началось через 2 недели после операции (стрелка). E. Анализ диаметра лимфатических сосудов (подпланин + сосуды) у контрольных животных с обедненными CD8 + или CD4 + (слева) и репрезентативные микрофотографии (справа). В скобках указан диаметр лимфатического сосуда.
https://doi.org/10.1371/journal.pone.0049940.g003
CD4
+ Истощение клеток снижает вызванное лимфедемой хроническое воспалениеПоскольку истощение CD4 после лимфатического повреждения привело к уменьшению лимфедемы, мы предположили, что клетки CD4 могут быть ответственны за регулирование воспалительных изменений в тканях, подверженных застою лимфатической жидкости.Чтобы проверить эту гипотезу, мы проанализировали популяции воспалительных клеток в тканях, расположенных дистальнее зоны лимфатического повреждения, с помощью иммуногистохимии у животных, получавших нейтрализующие CD4 или CD8 антитела. Этот анализ показал, что у животных, получавших нейтрализующие CD4 антитела, значительно уменьшилось количество инфильтрирующих лейкоцитов CD45 + (в 2,5 раза), клеток CD4 + (в 16,7 раза) и макрофагов F4 / 80 + (в 2 раза). ; Рисунки 4 A – C ).
Рисунок 4. Истощение клеток CD4 + снижает хроническое воспаление, вызванное лимфедемой. A, B, C.
Репрезентативные микрофотографии иммуногистохимического окрашивания CD45 (рисунок A), F4 / 80 (рисунок B) и CD4 (рисунок C) в тканях хвоста контрольных животных, животных с истощенными клетками CD8 + или CD4 + через 6 недель после хвоста поверхностное и глубокое лимфатическое иссечение. Количественное определение количества ячеек на поле высокой мощности (hpf) показано ниже для каждого типа ячеек. D. Представитель (трех повторных экспериментов) вестерн-блоттинга из тканей хвоста для маркеров Th2 (IFN-y, Tbet), T-reg (FoxP3) и Th3 (Gata-3) в контроле, у животных с истощенными CD8 + и CD4 + 6 через несколько недель после поверхностного и глубокого лимфатического иссечения хвоста.Количественное определение плотности полосы относительно контроля (произвольно установленное на 1 и представленное пунктирной линией) показано справа.
https://doi.org/10.1371/journal.pone.0049940.g004
Вестерн-блот-анализ цельного тканевого белка продемонстрировал заметное снижение экспрессии маркеров Th2 и Th3 у CD4, но не у истощенных по CD8 животных, по сравнению с контрольной группой (рис. 4D ). Например, экспрессия маркеров Th2 IFN-y и T-bet снизилась на 9 и 2.7 складок соответственно. Точно так же экспрессия Th3-маркера Gata-3 снизилась в 4,8 раза. Экспрессия FoxP3, маркера дифференцировки Т-регуляторных клеток, также была немного снижена (в 1,3 раза) у животных с истощением CD4. В совокупности эти результаты предполагают, что истощение CD4, но не CD8 после лимфатического повреждения снижает воспалительные реакции на лимфатический застой, что приводит к снижению общего воспаления, уменьшению количества Т-клеток и макрофагов и снижению экспрессии цитокинов Th2 и Th3.
CD4
+ Истощение клеток подавляет фиброз и улучшает лимфатическую функциюВоспалительные реакции Т-лимфоцитов играют решающую роль в регуляции фиброза при различных фибропролиферативных заболеваниях как клинически, так и экспериментально. [22] Наша группа ранее показала, что фиброз является важным регулятором лимфатической функции и лимфатической регенерации [14], [15], [23], [24], а фиброз является клиническим гистопатологическим признаком лимфедемы.[25] Таким образом, в этих экспериментах мы стремились определить, способствует ли воспаление клеток CD4 или CD8 фиброзу и лимфатической дисфункции в модели лимфедемы хвоста мыши.
Интересно, что мы обнаружили, что истощение клеток CD4 + привело к заметному снижению фиброза кожи, что отражено отложением и организацией коллагена (индекс рубца; Рисунок 5A, B ). У животных с обедненным CD4 индекс кожных рубцов снизился в 6,8 раза по сравнению с контрольной группой. Напротив, животные с истощенным CD8 продемонстрировали незначительное снижение индекса рубца по сравнению с контролем.Эти данные были подтверждены иммуногистохимическим анализом коллагена I типа, показавшим 2,8-кратное уменьшение отложения коллагена I типа в дерме животных с истощенными CD4 ( фиг. 5B, ). Кроме того, соотношение коллагена типа I: III было значительно снижено (в 2,3 раза) у животных с истощением CD4, что согласуется с уменьшением отложения внеклеточного матрикса и фиброзом (, , фиг. 5C, ).
Рисунок 5. Истощение CD4 + клеток снижает фиброз и улучшает лимфатическую функцию.A.
Анализ индекса рубцов (ниже) и репрезентативные микрофотографии микроскопических изображений в поляризованном свете (вверху) у контрольных животных с обедненными CD8 + и CD4 + (n = 5-7 на группу) через 6 недель после операции. B. Репрезентативные микрофотографии иммуногистохимии коллагена типа I (вверху) и расчет окрашивания коллагена типа I в дерме (положительные пиксели / мм 2 ; внизу) в контроле, животных с истощенными CD8 + и CD4 + через 6 недель после операции. C. Расчет соотношения окрашивания коллагена типа I: типа III в срезах ткани хвоста контрольных мышей, мышей с истощенным CD8 + и CD4 + через 6 недель после операции. D. Репрезентативный (из трех экспериментов) вестерн-блоттинг-анализ a-sma, E-кадгерина, коллагена III типа, pSMAD и TGF-B1 в белковых лизатах, полученных из тканей хвоста контрольных животных, животных с истощенными CD8 + и CD4 + клетками 6 недели после операции. Количественное определение плотности полосы относительно контроля (произвольно установленное на 1 и представленное пунктирной линией) показано справа. E. Репрезентативная микролимфангиография (вверху) и количественная оценка цветения тканей проксимальнее раны хвоста (соотношение проксимального и дистального цветения) у контрольных мышей, мышей с истощением CD8 + и CD4 + через 6 недель после операции.Обратите внимание на пересечение хвостовой раны флуоресцентным маркером только у мышей с истощенным CD4 +. F. Лимфосцинтиграфия и захват крестцовых лимфатических узлов у контрольных мышей с истощенными CD8 + и CD4 + через 6 недель после операции. Типичная тепловая карта показана справа (белая стрелка = место инъекции; красный кружок = крестцовые лимфатические узлы).
https://doi.org/10.1371/journal.pone.0049940.g005
Вестерн-блот анализ лизатов цельных тканей контрольных животных с истощенными CD4 или CD8 аналогичным образом выявил снижение маркеров внеклеточного матрикса, согласующееся со снижением фиброза ( Рисунок 5D ).Например, экспрессия a-sma, E-кадгерина и коллагена типа III была снижена в 2–3 раза у животных с истощенным CD4 по сравнению с контролем (, фиг. 5D, ). Аналогичным образом, экспрессия фосфорилированного SMAD-3 (14-кратная) и TGF-B1 (1,4-кратная) также заметно снижалась у животных с истощенным CD4. Это важно, поскольку мы ранее показали, что активация передачи сигналов TGF-B1 играет важную роль в фиброзе тканей при лимфедеме как клинически, так и в нашей модели хвоста мыши. [14], [15], [24].
Чтобы определить, соответствует ли снижение фиброза у животных с дефицитом CD4 улучшенной лимфатической функции, мы проанализировали транспорт лимфатической жидкости в целом с помощью микролимфангиографии и путем анализа поглощения радиоактивных индикаторов Tc 99 путем дренирования лимфатических узлов хвоста. Анализ микролимфангиографии продемонстрировал течение интерстициальной жидкости через рубец на хвосте только у животных с истощением CD4 (, фиг. 5E, ). Кроме того, количественная оценка флуоресцентного индикатора в проксимальной части хвоста продемонстрировала заметно увеличенный транспорт интерстициальной жидкости в CD4 (8.8 раз), но не с истощенными по CD8 животными по сравнению с контролем. Эти результаты были подтверждены лимфосцинтиграфией крестцовых лимфатических узлов после инъекции в дистальный хвост Tc 99 , демонстрирующей как увеличенный наклон (т.е. более быстрый лимфатический транспорт), так и увеличение общего поглощения CD4 с поправкой на распад (23 раза) в дренирующих лимфатических узлах. истощенные животные ( Рисунок 5F ).
CD25
+ Истощение клеток не улучшает лимфедему и не увеличивает лимфатическую функциюПоскольку иммунная дисрегуляция и иммуносупрессия являются основными патологическими признаками лимфедемы [6], [26] и поскольку Т-регуляторные (T-reg) клетки являются важным компонентом популяции клеток CD4 +, мы затем попытались определить, улучшается ли лимфедема хвоста. отмеченные у животных с истощением CD4, были связаны с изменениями воспаления T-reg-клеток.В подтверждение этой гипотезы мы обнаружили, что процент клеток T-reg (CD4 + / CD25 + / Foxp3 +) в мягких тканях верхних конечностей у животных, получавших диссекцию подмышечных лимфатических узлов (ALND), был значительно увеличен по сравнению с фиктивным контролем как в ранние (3 недели; 5,5 раза) и поздние (6 недель; 6 раз) моменты времени (, рис. 6A, ). Точно так же мы обнаружили, что процент клеток T-reg был значительно увеличен (в 7,7 раза) у мышей с лимфедемой хвоста по сравнению с контролем ( Рисунок 6B, ).
Рис. 6. Воспаление Т-регуляторных клеток сильно усиливается за счет застоя лимфатической жидкости и лимфедемы. A.
Анализ проточной цитометрии Т-регуляторных (T-reg) клеток в суспензиях одиночных клеток, приготовленных из мягких тканей верхней конечности на 1,5 см дистальнее подмышечной раны у животных, получавших лечение подмышечной лимфодиссекции (ALND) или подмышечный разрез без лимфаденэктомии (фиктивная; n = 5–7 / группа) через 3 или 6 недель после операции. B. Анализ проточной цитометрии Т-регуляторных (T-reg) клеток в суспензиях отдельных клеток, приготовленных из ткани хвоста на расстоянии 2 см от раны лимфедемы или контрольных мышей (n = 5-7 / группа) через 6 недель после операции. C. Проточная цитометрия суспензий единичных клеток селезенки для определения CD4 + / CD25- клеток после обработки контрольными или нейтрализующими CD25 антителами. Обратите внимание на отсутствие значительного уменьшения общего количества клеток CD4 +. Типичный точечный график показан справа. D. Проточная цитометрия суспензий единичных клеток селезенки для клеток CD4 + / CD25 + / Foxp3 + (T-regs) после обработки контрольными или нейтрализующими CD25 антителами. Обратите внимание на отсутствие значительного уменьшения общего количества клеток CD4 +. Типичный точечный график показан справа.
https://doi.org/10.1371/journal.pone.0049940.g006
Чтобы более конкретно изучить роль клеток T-reg, мы лечили мышей нейтрализующими антителами CD25 +, поскольку ранее было показано, что это лечение значительно снижает Популяции клеток T-reg и использовались для изучения ответов T-reg. [27], [28] В подтверждение этого мы обнаружили, что обработка нейтрализующими CD25 антителами значительно снижает процент T-reg-клеток по сравнению с контролем в гомогенатах селезенки (16.8 раз; Рисунок 6D ). Что еще более важно, это лечение не изменило процентное содержание клеток CD4 + / CD25- у этих животных (, фиг. 6C, ).
Однако, несмотря на значительное истощение T-reg клеток, мы не отметили значительных различий в общей морфологии хвоста или объема хвоста у животных, получавших нейтрализующие антитела к CD25, по сравнению с контрольной группой ( Рисунок 7A – C ) . Точно так же не было значительных различий в отеке ткани / подкожном отложении жира, воспалительных реакциях или экспрессии маркеров Th2 / Th3 после истощения CD25 ( фигура 7D, ).Наиболее важно то, что мы обнаружили, что истощение клеток CD25 не влияло на фиброз, отложение коллагена типа I / типа III или соотношение коллагена I / III ( Рисунок 7F – H ), а также не было различий в экспрессии фиброзных маркеров, таких как как a-sma, E-кадгерин, TGF-B1, p-SMAD3 (, фиг. 7I, ). Истощение CD25 также не улучшало лимфатический транспорт через рану или поглощение лимфатическим узлом Tc 99 ( фиг. 7E ). Взятые вместе, эти результаты показывают, что, хотя популяции T-reg-клеток увеличиваются в ответ на лимфатический застой и при хронической лимфедеме, потеря этих популяций клеток существенно не меняет патологические проявления (воспаление, фиброз, лимфатическая дисфункция) этого расстройства.
Рисунок 7. Истощение клеток CD25 + не улучшает лимфедему, не уменьшает фиброз и не увеличивает лимфатическую функцию. A.
Репрезентативная фотография контрольных мышей или мышей, лишенных CD25 +, через 6 недель после поверхностного и глубокого лимфатического иссечения хвоста. B. Репрезентативная гистология поперечного сечения и количественная оценка толщины подкожной ткани (скобки) у контрольных животных и животных с истощенными CD25 + клетками. C. Объемы хвоста у контрольных животных и животных с истощенными CD25 + клетками в ходе эксперимента.Истощение CD25 + клеток началось через 2 недели после операции (стрелка). D. Репрезентативные (трехкратные эксперименты) вестерн-блоттинг из тканей хвоста для маркеров Th2 (IFN-y, Tbet) и Th3 (Gata-3, IL4) у контрольных и животных с истощенными CD25 + клетками через 6 недель после поверхностного и глубокого лимфатического хвоста. иссечение. Количественное определение плотности полос относительно контроля (кратное изменение) показано справа. E. Лимфосцинтиграфия и захват крестцовых лимфатических узлов у контрольных мышей и мышей с истощением CD25 + клеток через 6 недель после операции.Типичная тепловая карта показана справа (белая стрелка = место инъекции; красный кружок = крестцовые лимфатические узлы). F. Анализ индекса рубцов (ниже) и репрезентативные микрофотографии микроскопических изображений в поляризованном свете (вверху) у контрольных животных и животных с истощенными CD25 + клетками (n = 5-7 на группу) через 6 недель после операции. G. Репрезентативные микрофотографии иммуногистохимии коллагена типа I (вверху) и расчет окрашивания коллагена типа I в дерме (положительные пиксели / мм 2 ; внизу) у контрольных животных и животных с истощенными CD25 + клетками через 6 недель после операции. H. Расчет соотношения окрашивания коллагена типа I: типа III в срезах ткани хвоста от контрольных мышей и мышей, лишенных CD25 + клеток, через 6 недель после операции. I. Представитель (трех повторных экспериментов) вестерн-блоттинг-анализ a-sma, E-кадгерина, коллагена III типа, pSMAD и TGF-B1 в белковых лизатах, полученных из тканей хвоста контрольных животных и животных, лишенных CD25 + клеток, через 6 недель после операции . Количественное определение плотности полос относительно контроля (кратное изменение) показано справа.
https://doi.org/10.1371/journal.pone.0049940.g007
Потеря CD4
+ , но не CD8 + или CD25 + Клеток увеличивает лимфангиогенезЧтобы изучить механизмы, регулирующие улучшенную лимфатическую функцию у животных с истощенными CD4, мы определили влияние истощения CD4 на лимфангиогенез и экспрессию лимфангиогенных цитокинов. При анализе тканей хвоста, расположенных дистальнее зоны лимфатического разрушения через 6 недель после операции, мы отметили значительное увеличение (2.3-кратное увеличение сосудов LYVE-1 +; 2,2-кратное увеличение в сосудах подпланин +) в количестве лимфатических капилляров (LYVE-1 + или подпланин +) у животных с истощенным CD4 по сравнению с контролем ( фиг. 8A, B ). Напротив, истощение CD8 или CD25 мало повлияло на этот результат. Интересно, что мы не отметили значительных изменений количества собираемых лимфатических сосудов ни в одной группе (не показано). Вестерн-блоттинг лизатов ткани хвоста этих животных продемонстрировал небольшое изменение экспрессии VEGF-A в любой экспериментальной группе (, фиг. 8D, ).Однако экспрессия VEGF-C заметно увеличивалась у животных с истощенным CD4 (в 4 раза) и снижалась у мышей с истощенным CD8 (в 3,3 раза). Несмотря на эти изменения в экспрессии белков VEGF-A и VEGF-C у животных с истощенными CD4 или CD8, мы не обнаружили значительных различий в количестве VEGF-A или VEGF-C положительных клеток, локализованных с помощью иммуногистохимии, что позволяет предположить, что изменения в общей экспрессии белка могут отражают регуляцию этих белков на клеточном уровне ( Рисунок 8C ) .
Рисунок 8. Потеря клеток CD4 + , но не клеток CD8 + или CD25 + увеличивает лимфангиогенез. A.
LYVE-1 + количество сосудов (слева) и репрезентативные цифры (справа) хвостовых секций от контрольных мышей, мышей с истощенными клетками CD8 +, CD4 + или CD25 + через 6 недель после операции. B. Подопланин + количество сосудов (слева) и репрезентативные цифры (справа) срезов хвоста от контрольных мышей, мышей с истощенными клетками CD8 +, CD4 + или CD25 + через 6 недель после операции. C. Подсчет клеток VEGF-C + / поле высокой мощности (HPF) (слева) и репрезентативные цифры иммуногистохимии VEGF-C в тканях хвоста от контрольных животных, животных с истощенными клетками CD8 +, CD4 + или CD25 + (справа) через 6 недель после операции. D. Репрезентативный (из трех экспериментов) вестерн-блоттинг-анализ VEGF-A и экспрессии VEGF-C в белковых лизатах, полученных из тканей хвоста от контрольных животных, лишенных клеток CD8 +, CD4 + или CD25 +, через 6 недель после операции. Количественное определение плотности полосы относительно контроля (произвольно установленное на 1 и представленное пунктирной линией) показано справа.
https://doi.org/10.1371/journal.pone.0049940.g008
Мы использовали модель воспалительных лимфатических узлов, чтобы дополнительно изучить влияние истощения клеток CD4 на острый воспалительный лимфангиогенез, поскольку эта модель позволяет избежать изменений, которые могут быть вторичными. к ранозаживляющим эффектам.В подтверждение наших наблюдений на модели хвоста мы обнаружили, что истощение CD4 + клеток заметно увеличивало плотность сосудов LYVE-1 + через 5-7 дней после инъекции CFA / OVA в задние конечности по сравнению с контролем ( Рисунок 9A ) . Мы получили аналогичные результаты, когда повторили эти эксперименты на трансгенных мышах с дефицитом CD4 + клеток (CD4KO). Кроме того, мы обнаружили умеренное, хотя и значительное увеличение экспрессии белков VEGF-A (в 1,3 раза) и VEGF-C (в 1,6 раза) в лимфатических узлах животных с истощенным CD4 по сравнению с контролем ( Рисунок 9B, C ). .
Рисунок 9. Клетки CD4 + регулируют воспалительный лимфангиогенез.
A. Плотность сосудов LYVE-1 + в подколенных лимфатических узлах через 7 дней после индуцированного CFA / OVA лимфангиогенеза лимфатических узлов у контрольных, истощенных CD4 + клеток или нокаутированных по CD4 (CD4KO) мышей. Типичная гистология поперечного сечения лимфатического узла (синяя окраска DAPI, красная окраска LYVE-1) показана справа. B., C. Экспрессия белков VEGF-A (A) и VEGF-C (B) с помощью ELISA в подколенных лимфатических узлах, собранных через 7 дней после индуцированного CFA / OVA лимфангиогенеза в лимфатических узлах у контрольных мышей или мышей с истощенным CD4.
https://doi.org/10.1371/journal.pone.0049940.g009
Обсуждение
В текущем исследовании, согласующемся с предыдущими отчетами, мы обнаружили, что хроническая лимфедема приводит к воспалению тканей. Используя многоцветную проточную цитометрию для характеристики клеточных популяций в переваривании тканей, мы обнаружили, что лимфедема в модели мышиного хвоста приводит к значительным изменениям в популяции воспалительных клеток, которые присутствуют. Более конкретно, в отличие от ранее опубликованных исследований, использование нескольких поверхностных антигенов клетки позволило нам идентифицировать конкретные популяции клеток и продемонстрировало, что процент зрелых Т-хелперных клеток, Т-регуляторных клеток, нейтрофилов, макрофагов и дендритных клеток был значительно повышен. в лимфедематозных тканях по сравнению с хирургическим контролем.Наши результаты подтверждаются данными, полученными Галковской и Ольшевском с использованием окрашивания по Гимзе клеточных мазков лимфатической жидкости, собранных у собак с хронической лимфедемой, или фиктивных контрольных образцов, демонстрирующих значительно увеличенное количество лимфоцитов и скрытых клеток (дендритных клеток) у животных с хронической лимфедемой. [7] В более позднем исследовании пациентов с лимфедемой эти же авторы использовали гистологические окрашивания и иммуногистохимию с одним антигеном для характеристики популяций воспалительных клеток у пациентов с давней лимфедемой по сравнению с нормальной кожей и обнаружили, что у пациентов с лимфедемой качественно больше лимфоцитов, чем в контрольной группе.[5] Результаты нашего исследования также подтверждаются исследованиями на микроматрицах на модели мышиного хвоста, демонстрирующими резкое увеличение семейств генов, регулирующих острое воспаление и иммунные ответы. [16] Взятые вместе, наши результаты и эти предыдущие исследования подтверждают гипотезу о том, что лимфедема приводит к смешанной воспалительной реакции, включающей заметный лимфоцитарный компонент.
Чтобы определить, как острый лимфатический застой низкой степени, возникающий в результате резекции лимфатических узлов, регулирует воспалительные реакции, мы проанализировали суспензии единичных клеток из области плеча мышей, подвергшихся подмышечной лимфаденэктомии (ALND), по сравнению с подмышечным разрезом без удаления лимфатических узлов 3 или 6 недель после операции.Интересно, что мы обнаружили, что ALND, как и лимфедема хвоста, приводит к стойкому и значительному увеличению воспаления тканей даже в течение 6 недель после операции. Что еще более важно, мы обнаружили, что, как и в случае лимфедемы хвоста, воспалительные реакции на ALND включают заметное увеличение процента различных Т-лимфоцитов (Т-хелперов, Т-цитотоксических, Treg, NKT). Однако, в отличие от воспалительных изменений в модели хвоста, мы обнаружили, что ALND оказывает лишь умеренное и в значительной степени незначительное влияние на макрофаги, моноциты и дендритные клетки, предполагая, что воспалительные реакции Т-клеток предшествуют и, возможно, вносят свой вклад в патологию лимфедемы.
Затем мы исследовали гипотезу о том, что воспалительные реакции вносят вклад в патологию лимфедемы и регулируют, прямо или косвенно, отек тканей, отложение жира, фиброз и лимфатическую дисфункцию. Мы обнаружили, что истощение CD4 +, но не CD8 + или CD25 + клеток привело к заметному улучшению лимфедемы и уменьшению отека хвоста, отложения жировой ткани и фиброза. Кроме того, только истощение CD4 + клеток значительно снизило воспаление тканей (инфильтрацию CD45 + клеток) и экспрессию Th2 и Th3 маркеров, включая IFN-y, T-Bet и GATA-3.Гипотеза о том, что воспаление клеток CD4 + способствует патологии лимфедемы, подтверждается нашими предыдущими исследованиями, демонстрирующими, что блокада активации TGF-B1 в модели хвоста мыши значительно улучшает лимфедему и связана со значительным снижением воспаления тканей, инфильтрацией клеток CD4 + и экспрессией Маркеры Th2 / Th3. [14] Точно так же наша гипотеза подтверждается нашими предыдущими исследованиями, демонстрирующими, что у мышей с дефицитом всех Т-клеток (голые мыши) значительно уменьшились лимфедема хвоста, фиброз и лимфатическая дисфункция по сравнению с однопометниками дикого типа.[21] Гипотеза о том, что воспаление способствует патологии лимфедемы, также подтверждается предыдущими исследованиями Роксона и его коллег, демонстрирующими, что подавление генерализованных воспалительных реакций с помощью кетопрофена, нестероидного противовоспалительного препарата, заметно улучшает лимфатическую функцию и уменьшает лимфедему в модель хвоста мыши. [29] Наконец, гипотеза о том, что клетки CD4 + прямо или косвенно способствуют возникновению и прогрессированию лимфедемы, подтверждается тем фактом, что эти реакции были вовлечены в патологию ожирения, включая метаболическую дисфункцию и отложение жира.[10], [30] Эти последние эффекты важны, поскольку определяющим признаком конечной стадии лимфедемы является отложение жира.
Чтобы определить, как воспаление CD4 + клеток способствует патологии лимфедемы, мы проанализировали фиброз тканей и регуляторы отложения внеклеточного матрикса. Интересно и согласуется с нашими предыдущими наблюдениями [14], мы обнаружили, что истощение CD4 + клеток заметно ингибирует фиброз тканей в областях хвоста, подверженных хроническому лимфатическому стазу, по сравнению с контрольными животными или мышами, лишенными CD8 + или CD25 + клеток.У мышей с истощением CD4 + значительно снизился индекс рубца (показатель отложения и организации коллагена I типа), уменьшилось окрашивание коллагена I типа с помощью иммуногистохимии и уменьшилось соотношение отложения коллагена I / IIII типа. Эти результаты важны, поскольку ранее мы показали, что фиброз является важным регулятором лимфатической функции. Например, ранее мы показали, что ингибирование радиационно-индуцированного фиброза заметно улучшает лимфатическую функцию. [24] Аналогичным образом, мы ранее показали, что образцы клинической лимфедемы имеют повышенную экспрессию профибротического регулятора TGF-B1 и что ингибирование TGF-B-сигналов локально или системно снижает фиброз тканей и заметно улучшает лимфатическую функцию на модели хвоста мыши.[14] Наши текущие исследования также предполагают, что регуляция фиброза воспалительными реакциями Т-клеток взаимодействует с передачей сигналов TGF-B, поскольку мы обнаружили, что истощение CD4 + клеток заметно снижает экспрессию TGF-B1 и его нижестоящего медиатора pSMAD-3. согласуется с нашим предыдущим исследованием, демонстрирующим, что ингибирование TGF-B1 заметно снижает Т-клеточное воспаление и что истощение CD3 + -клеток (всех подмножеств Т-клеток) снижает экспрессию TGF-1. [14] Взятые вместе, эти данные свидетельствуют о том, что клетки CD4 + регулируют лимфатическую функцию при хронической лимфедеме, по крайней мере, частично, регулируя фиброз тканей.
Недавние исследования нашей лаборатории и других также показали, что Т-клетки являются независимыми и важными регуляторами лимфангиогенеза. Например, мы ранее показали, что у голых мышей (без всех Т-клеток) значительно улучшилась лимфатическая функция и заметно снизилась экспрессия антилимфангиогенных цитокинов, таких как TGF-B1, IFN-y и эндостатин. [21] Аналогичным образом, Koh и его коллеги показали в недавних элегантных исследованиях, что Т-клетки регулируют лимфангиогенез в лимфатических узлах, по крайней мере частично, путем экспрессии IFN-γ.[11] Наконец, мы ранее показали, что воспаление CD4 + клеток необходимо для стабилизации индуцируемого гипоксией фактора-1 альфа (HIF-1a) и регуляции экспрессии VEGF-A / C при хронической лимфедеме и воспалительном лимфангиогенезе. [19] Результаты нашего текущего исследования согласуются с этими результатами, поскольку мы обнаружили, что истощение CD4 +, но не CD8 + или CD25 + клеток заметно увеличивает лимфангиогенез в лимфедематозных областях хвоста. Точно так же мы обнаружили, что истощение CD4 + -клеток или воспаление у трансгенных мышей, лишенных CD4 + -клеток, заметно увеличивало плотность лимфатических сосудов в дренирующих лимфатических узлах и было связано с повышенной экспрессией VEGF-A и VEGF-C.Наши результаты дополняют и дополняют работу Коха и его коллег, поскольку, в отличие от предыдущего исследования, мы показываем, что клетки CD4 + (а не Т-клетки в целом) являются важными регуляторами лимфангиогенеза во время заживления ран, и что эти эффекты, вероятно, включают регуляцию как про-, так и антилимфангиогенные пути. Будущие исследования потребуются, чтобы точно определить, как баланс между про- и антилимфангиогенными путями регулирует восстановление и регенерацию лимфы во время заживления ран и при физиологическом воспалении.
Интересным открытием нашего исследования было массивное увеличение количества T-reg клеток в ответ на лимфатический застой как после ALND, так и в ответ на лимфедему хвоста. Мы не наблюдали значительных изменений в патологических проявлениях лимфедемы после истощения CD25 + клеток (т. Е. Фиброза, лимфатической функции, отложения жировой ткани, объема хвоста), что позволяет предположить, что Т-регуляторные клетки могут играть дополнительные или отдельные роли в лимфатическом застое. Действительно, повышенное количество T-reg клеток может просто представлять гомеостатический ответ на хроническое воспаление, вызванное лимфатическим застоем.Этот ответ может быть ответственным за иммунные нарушения у пациентов с лимфедемой, такие как повышенный риск инфекций (лимфангит и целлюлит) и неспособность вызвать иммунный ответ или приобрести иммунитет к вакцинам при введении в лимфедематозную конечность. Точно так же наши результаты служат обоснованием для предыдущих отчетов, демонстрирующих улучшение выживаемости кожного трансплантата аллотрансплантата после лигирования афферентных лимфатических сосудов и отсроченное отторжение опухолей аллотрансплантата на животных моделях. [7], [31] Совершенно очевидно, что необходимы дополнительные исследования, которые будут выполнены в будущих отчетах для определения роли T-reg клеток в патологии лимфедемы.
В заключение, в текущем исследовании мы охарактеризовали клеточный иммунный ответ на застой лимфатической жидкости в результате расслоения лимфатических узлов и хронической лимфедемы с использованием моделей на мышах. Кроме того, мы показали, что истощение клеток CD4 +, но не клеток CD8 + или CD25 +, заметно снижает патологические проявления лимфедемы, включая отек, фиброз, отложение жира и лимфатическую дисфункцию. Хотя CD8 + Т-клетки, по-видимому, не регулируют центрально патофизиологию лимфедемы, они могут играть роль в других аспектах застоя и дисфункции лимфатической жидкости.Кроме того, мы показали, что клетки CD4 + играют важную роль в регуляции лимфангиогенеза при лимфедеме и воспалительном лимфангиогенезе. Наконец, мы показали, что лимфатический застой приводит к увеличению количества Т-регуляторных клеток, однако точная роль, которую эти клетки играют в регуляции патологии лимфедемы, остается неизвестной.
Вклад авторов
Задумал и спроектировал эксперименты: JCZ AY SE TA EW BJM. Проведены эксперименты: JCZ AY SE TA EW BJM.Проанализированы данные: JCZ AY SE TA EW BJM. Написал статью: JCZ EW BJM.
Ссылки
- 1. Роксон С.Г., Ривера К.К. (2008) Оценка популяционного бремени лимфедемы. Ann N Y Acad Sci 1131: 147–154.
- 2. Петрек JA, Heelan MC (1998) Заболеваемость лимфедемой, связанной с карциномой груди. Рак 83: 2776–2781.
- 3. Cormier JN, Askew RL, Mungovan KS, Xing Y, Ross MI, et al. (2010) Лимфедема помимо рака груди: систематический обзор и метаанализ вторичной лимфедемы, связанной с раком.Рак 116: 5138–5149.
- 4. Hayes SC, Janda M, Cornish B, Battistutta D, Newman B (2008) Лимфедема после рака груди: заболеваемость, факторы риска и влияние на функцию верхней части тела. Дж. Клин Онкол 26: 3536–3542.
- 5. Ольшевский В.Л., Джамал С., Лукомска Б., Манокаран Г., Гжелак И. (1992) Иммунные белки в жидкости-лимфе периферических тканей у пациентов с филяриальной лимфедемой нижних конечностей. Лимфология 25: 166–171.
- 6. Ольшевский В.Л., Энгесет А., Романюк А., Гжелак И., Циолковска А. (1990) Иммунные клетки в периферической лимфе и коже пациентов с обструктивной лимфедемой.Лимфология 23: 23–33.
- 7. Галковска Х., Ольшевский В.Л. (1986) Клеточный состав лимфы при экспериментальной лимфедеме. Лимфология 19: 139–145.
- 8. Olszewski WL, Loe K, Engeset A (1978) Иммунные белки и другие биохимические составляющие периферической лимфы у пациентов со злокачественными новообразованиями и пострадиационной лимфедемой. Лимфология 11: 174–180.
- 9. Винн Т.А. (2008) Клеточные и молекулярные механизмы фиброза. Дж. Патол 214: 199–210.
- 10. Winer S, Winer DA (2012) Адаптивная иммунная система как фундаментальный регулятор воспаления жировой ткани и инсулинорезистентности. Immunol Cell Biol.
- 11. Катару Р.П., Ким Х., Джанг С., Чой Д.К., Ко Б.И. и др. (2011) Т-лимфоциты негативно регулируют формирование лимфатических сосудов в лимфатических узлах. Иммунитет 34: 96–107.
- 12. Ким К.Э., Кох Й.Дж., Чон Б.Х., Чан С., Хан Дж. И др. (2009) Роль макрофагов CD11b + во внутрибрюшинном индуцированном липополисахаридом аберрантном лимфангиогенезе и лимфатической функции в диафрагме.Am J Pathol 175: 1733–1745.
- 13. Rutkowski JM, Moya M, Johannes J, Goldman J, Swartz MA (2006) Вторичная лимфедема в хвосте мыши: лимфатическая гиперплазия, активация VEGF-C и защитная роль MMP-9. Microvasc Res 72: 161–171.
- 14. Авраам Т., Далувой С., Зампелл Дж., Ян А., Хавив Ю.С. и др. (2010) Блокада трансформирующего фактора роста — {бета} 1 ускоряет регенерацию лимфы во время заживления ран. Am J Pathol 177: 3202–3214.
- 15.Клавин Н.В., Авраам Т., Фернандес Дж., Далувой С.В., Соарес М.А. и др. (2008) TGF-beta1 является негативным регулятором лимфатической регенерации во время заживления ран. Am J Physiol Heart Circ Physiol 295: h3113–2127.
- 16. Табибиазар Р., Чунг Л., Хан Дж., Суонсон Дж., Бейлхак А. и др. (2006) Воспалительные проявления экспериментальной лимфатической недостаточности. PLoS Med 3: e254.
- 17. Зампелл Дж. К., Ян А., Авраам Т., Андраде В., Маллиарис С. и др. (2011) Временные и пространственные паттерны экспрессии эндогенного сигнала опасности после заживления ран и в ответ на лимфедему.Am J Physiol Cell Physiol 300: C1107–1121.
- 18. Мехрара Б.Дж., Авраам Т., Соарес М., Фернандес Дж.Г., Ян А. и др. (2010) p21cip / WAF является ключевым регулятором долгосрочного радиационного повреждения в тканях, происходящих из мезенхимы. FASEB J 24: 4877–4888.
- 19. Zampell JC, Yan A, Avraham T., Daluvoy S, Weitman ES, et al. (2011) HIF-1альфа координирует лимфангиогенез во время заживления ран и в ответ на воспаление. FASEB J.
- 20. Зампелл Дж., Ашен С., Вайтман Э., Эльхадад С., Де Брот, Андраде М. и др.(2012) Регулирование адипогенеза застоем лимфатической жидкости: Часть I Адипогенез, фиброз и воспаление. Пласт Реконстр Сург 129; 825–34.
- 21. Зампелл Дж. К., Авраам Т., Йодер Н., Форт Н., Ян А. и др. (2012) Лимфатическая функция регулируется скоординированной экспрессией лимфангиогенных и антилимфангиогенных цитокинов. Am J Physiol Cell Physiol 302: C392-404.
- 22. Винн Т. (2008) Клеточные и молекулярные механизмы фиброза. Дж. Патол 214: 199–210.
- 23. Авраам Т., Клавин Н.В., Далувой С.В., Фернандес Дж., Соарес М.А. и др. (2009) Фиброз — ключевой ингибитор лимфатической регенерации. Пласт Реконстр Сург 124: 438–450.
- 24. Авраам Т., Ян А., Зампелл Дж. К., Далувой С. В., Хаймовиц-Фридман А. и др. (2010) Лучевая терапия вызывает потерю дермальных лимфатических сосудов и нарушает лимфатическую функцию из-за TGF-бета1-опосредованного фиброза тканей. Am J Physiol Cell Physiol 299: C589–605.
- 25. Ольшевский В.Л., Джамал С., Манокаран Г., Лукомска Б., Кубицка Ю. (1993) Кожные изменения при филяриальном и нефиляриальном лимфатическом отеке нижних конечностей.Троп Мед Паразитол 44: 40–44.
- 26. Ольшевский В.Л. (2003) Патофизиологические аспекты лимфедемы конечностей человека: I. Белковый состав лимфы. Lymphat Res Biol 1: 235–243.
- 27. Лю Ф, Лю Дж, Вэн Д., Чен Й, Сун Л. и др. (2010) Истощение CD4 + CD25 + Foxp3 + регуляторных Т-клеток может ослабить развитие фиброза легких, индуцированного диоксидом кремния, у мышей. PLoS One 5: e15404.
- 28. Morgan ME, Sutmuller RP, Witteveen HJ, van Duivenvoorde LM, Zanelli E, et al.(2003) Истощение CD25 + клеток ускоряет начало тяжелого заболевания коллаген-индуцированного артрита. Arthritis Rheum 48: 1452–1460.
- 29. Накамура К., Радхакришнан К., Вонг Ю.М., Роксон С.Г. (2009) Противовоспалительная фармакотерапия кетопрофеном улучшает экспериментальную лимфатическую сосудистую недостаточность у мышей. PLoS One 4: e8380.
- 30. Winer S, Chan Y, Paltser G, Truong D, Tsui H, et al. (2009) Нормализация инсулинорезистентности, связанной с ожирением, с помощью иммунотерапии.Нат Мед 15: 921–929.
- 31. Старк Р. Б., Дефорест М., Полякофф С., Шу Ф. (1965) Лимфатический узел и гомопластика. Am J Surg 110: 394–397.
Лимфедема | DermNet NZ
Автор: Ванесса Нган, штатный писатель, 2006 г.
Что такое лимфедема?
Лимфедема (по-американски «лимфедема») — это опухоль части или частей тела, которая возникает, когда лимфатическая система не работает должным образом.Лимфедема может быть локализована на небольшом участке или распространяться на большую область, например на одну или обе верхние или нижние конечности.
Чтобы понять, как возникает лимфатический отек, нам нужно немного знать, что такое лимфатическая система и как она работает.
Что такое лимфатическая система?
Лимфатическая система является частью иммунной системы и частью сосудистой системы.
Лимфатическая система состоит из множества крошечных сосудов, которые проходят по всему телу и постепенно соединяются, образуя более крупные сосуды.В коже небольшие лимфатические сосуды находятся в дерме, но не в подкожной клетчатке. По этим сосудам проходит прозрачная жидкость, называемая лимфой. Лимфа содержит избыточный белок, воду, бактерии и продукты жизнедеятельности, которые не требуются организму, и движется по лимфатической системе, пока не достигнет лимфатических узлов (желез).
Лимфатические узлы, расположенные в области шеи, подмышек, паха и глубоко внутри груди и живота, фильтруют и очищают лимфу для удаления любых посторонних предметов (например,г. бактерии) и запустить необходимые иммунные реакции. Пройдя через лимфатические узлы, лимфа, наконец, стекает в крупные вены, расположенные в нижней части шеи. Движение соседних мышц помогает лимфе двигаться по лимфатической системе. Кроме того, стенки лимфатических сосудов сокращаются, а клапаны внутри сосудов поддерживают работу.
Кто болеет лимфатическим отеком?
Лимфедема:
- Чаще встречается у женщин, чем у мужчин
- Встречается во всех гонках
- Может возникать у младенцев и детей и может сохраняться на протяжении всей жизни
- Может начаться и во взрослой жизни
- Обычно ассоциируется с ожирением
Почему возникает лимфедема?
Отек (припухлость) возникает, когда избыток жидкости и белка из поврежденных кровеносных сосудов (например,г. после ожога или растяжения связок голеностопного сустава) проникает в лимфатическую систему со скоростью, слишком быстрой для отвода лимфы. Это вызывает временный отек, который постепенно проходит сам по себе, поскольку поврежденная ткань заживает, кровеносные сосуды больше не протекают чрезмерно, и лимфатическая система может идти в ногу с нормальным током лимфы.
Лимфедема — это отек, который возникает из-за поврежденной или заблокированной лимфатической системы. Белок, вода и продукты жизнедеятельности попадают в ткани обычным образом, но поврежденная лимфатическая система препятствует дренажу, что приводит к отеку пораженного участка (лимфостаз).Кроме того, конечность может воспалиться.
Локализованный лимфатический отек
Примеры локализованного или ограниченного лимфатического отека включают:
- Шрам лимфатического отека
- Солидный отек лица / век у пациентов с фиматозной розацеа
- Висячая припухлость и новообразования у пациентов с патологическим ожирением
- Аногенитальные фиброэпителиальные полипы (большие твердые кожные бирки)
- Набухание половых органов без ямок при болезни Крона
- Отек вокруг суставов, пораженных артритом
Диффузный лимфатический отек
Существует два основных типа диффузного лимфатического отека в зависимости от первопричин.
Первичный лимфатический отек
- Первичный лимфатический отек также известен как болезнь Милроя.
- Поврежденная лимфатическая система обычно присутствует при рождении (обычно в результате недоразвития)
- Поражает обоих полов, хотя 70–80% случаев составляют женщины
- Возраст начала различается — опухоль присутствует при рождении в 10% случаев, в 80% случаев опухоль развивается до 35 лет и в 10% после 35 лет
- Наиболее частыми местами отека являются ноги, руки, гениталии и лицо
Вторичный лимфатический отек
- Нарушение функционирования лимфатической системы вызвано каким-либо другим состоянием или фактором
- Хроническая болезнь вен — из-за несостоятельности поверхностных и / или глубоких вен в нижних конечностях, приводящей к венозной гипертензии (повышенному давлению) и вторичному повреждению лимфатической системы
- Хирургия — удаление лимфатических узлов при лечении некоторых видов рака, например.г. грудь, простата
- Лучевая терапия — используется для лечения рака, но может вызывать образование рубцовой ткани, которая прерывает лимфатический поток
- Случайная травма, травма или инфекция (например, целлюлит), непосредственно повреждающая лимфатические сосуды
- Ограниченная подвижность — движение заставляет мышцы сокращаться, что способствует оттоку лимфы
Каковы клинические признаки лимфатического отека?
Первоначально симптомы и признаки лимфатического отека могут быть очень незначительными и почти незаметными.Если не лечить, отек может увеличиться и в конечном итоге стать постоянным. Некоторые или все из следующих симптомов могут наблюдаться при диффузном лимфатическом отеке.
- Ощущение стеснения и тяжести в конечности
- Изменение ощущения, например, иглы и иголки, стреляющая боль или ощущение жара
- Дискомфорт в суставах из-за отека, например, локтя, колена
- Болезненность в паху пораженной ноги
- Изменение температуры конечности или пораженной кожи
- Дальность передвижения уменьшена
Если надавить большим пальцем, сначала на опухшей области образуется ямка.Однако по мере того, как он становится больше и тяжелее, ямки больше не будут. Если лимфедему не лечить и отек усиливается, могут произойти изменения кожи. Кожа может стать очень толстой с складками и выпуклостями, и ее нельзя будет поднять или ущипнуть. На лодыжках, ступнях и пальцах ног появляются сухие бородавчатые пятна (бородавчатая слоновость или лимфатический папилломатоз).
Лимфедема ног часто бывает хуже, чем лимфатический отек рук, так как лимфодренаж от ног затруднен. Ходьба затруднена, поскольку пациент несет лишний вес.
Осложнения лимфедемы
Какие осложнения лимфатического отека?
При тяжелой диффузной лимфатической болезни часто возникают осложнения.
- Поскольку иммунные клетки не могут циркулировать через пораженную ткань, лимфедема приводит к локализованному иммунодефициту, что делает ее склонной к бактериальным инфекциям (импетиго и целлюлит). Это особенно актуально, если лимфа попадает на поверхность кожи или на коже имеются трещины.
- Лимфедема приводит к нарушению барьерной функции кожи, что приводит к дерматиту.
- Развитие контактного аллергического дерматита задерживается из-за иммунодефицита, но в случае его развития может быть тяжелым и трудно поддающимся эффективному лечению.
- Тяжелый лимфатический отек связан с хроническим воспалением и фиброзом (рубцеванием).
- Лимфедема может быть осложнена раком кожи, включая ангиосаркому (синдром Стюарта Тревеса), базальноклеточную карциному, плоскоклеточную карциному и сальную карциному. Опухоли часто бывают множественными.
- Вирусные бородавки чаще встречаются на лимфатической коже, чем на непораженной коже.
- Бородавчатые папилломы и полипы, возникающие при бородавчатой слоновости, могут быть вызваны активацией вируса папилломы человека (betaHPV).
Как диагностируется лимфедема?
Диагноз лимфатического отека ставится на основании истории болезни пациента и наблюдения. Если не удается найти причину опухоли, следует изучить возможность рака. В некоторых сложных случаях может быть проведен рентгенологический тест, называемый лимфосцинтиграфией. Это измеряет лимфатическую функцию и дает четкое изображение лимфатической системы.
Лимфедему следует отличать от липедемы, при которой отек бедер и голеней возникает из-за скопления жира под кожей.
Как лечить лимфатический отек?
Лимфедема — это хроническое заболевание, лечения от которого не существует. Основная цель лечения — уменьшить отек и свести его к минимуму. Очень важно лечить лимфатический отек на ранних стадиях, чтобы предотвратить дальнейший отек и такие осложнения, как инфекция. Если причина обнаружена, необходимо устранить причину, например.г. рак.
Пациентам с отеком конечностей от легкой до умеренной степени тяжести рекомендуется курс лечения, называемый комплексной физической (лимфатической / лимфатической) терапией (C.P.T./C.L.T.). Этот режим состоит из 4 основных частей.
- Уход за кожей — включает поддержание чистоты кожи для уменьшения инфекции, использование смягчающих средств для восстановления и поддержания эластичности кожи и кератолитиков для удаления твердой омертвевшей кожи.
- Простой лимфодренаж — это техника нежного массажа, при которой простые движения рук пытаются убрать опухоль с пораженного участка.Пациента, родственника или опекуна обучают этой технике.
- Компрессионная повязка, рукав или чулок для предотвращения повторного отека конечности.
- Упражнения и движения — специально разработанная программа, дополняющая массаж и помогающая за счет максимального оттока лимфы без перенапряжения
Людям с более сильным отеком обычно рекомендуется дополнительное лечение. К ним относятся:
- Ручной лимфодренаж — специализированная форма массажа, выполняемая обученным терапевтом для перемещения кожи в определенных направлениях в зависимости от анатомии и физиологии лимфатической системы.
- Multi-Layer Lymphoedema Bandaging — многослойная система компрессионных повязок
- Медикаментозная терапия — исследования эффективности медикаментозной терапии при лимфатическом отеке продолжаются. Были использованы бензопирены, включая флавоноиды. Использование кумарина было прекращено из-за токсичности для печени.
- Операция — выполняется редко, но может помочь при отеке век или половых органов. Только хирурги, имеющие опыт работы с лимфатическим отеком и лимфатической системой, должны проводить операцию.
Границы | Неразрешенная патофизиология лимфедемы
Введение
Лимфатическая система состоит из сети сосудов, соединяющих лимфоидные органы, такие как лимфатические узлы, миндалины, тимус и селезенка. Основная функция лимфатической системы, идущей параллельно венозному кровообращению, — отводить избыток межклеточной жидкости, вытекающей из кровеносных капилляров в тканевые пространства. Другие функции включают всасывание жира в кишечнике, иммунный надзор и разрешение воспаления.Лимфатическая жидкость транспортирует различные антигены и антигенпрезентирующие клетки в лимфатические узлы для иммунного ответа. Лимфа, содержащая липиды, иммунные клетки, макромолекулы и жидкость, сначала собирается путем слепого окончания начальных или капиллярных лимфатических сосудов, которые, в свою очередь, опорожняются в более крупные лимфатические сосуды, то есть в собирающие сосуды или коллекторы. В отличие от начальных лимфатических сосудов, собирающие лимфатические сосуды демонстрируют периферическое покрытие гладкомышечных клеток и просветные клапаны, которые продвигают и поддерживают однонаправленный поток (Tammela and Alitalo, 2010).
Лимфедема — хроническое и прогрессирующее заболевание, возникающее из-за нарушения лимфодренажа, вызывающего накопление интерстициальной жидкости, что приводит к набуханию тканей (Rockson, 2001). Лимфатическая дисфункция может быть вызвана генетическими аномалиями, влияющими на развитие и / или функцию лимфатической системы, и обычно проявляется в младенчестве, детстве или подростковом возрасте, состояние, известное как первичная лимфедема. Реже первичная лимфедема может появиться после 35 лет и известна как поздняя лимфедема (Rockson, 2001; Greene and Maclellan, 2013).Заболеваемость первичной лимфедемой низка и поражает 1 человека из 100 000 во всем мире (Smeltzer et al., 1985). Лимфедема может возникать вторично по отношению к повреждению или обструкции лимфатических сосудов из-за инфекционных заболеваний, таких как филяриатоз или травма, включая лучевую терапию и хирургическое удаление лимфатического узла при лечении рака (Rockson, 2001; Witte, 2001; Greene and Maclellan, 2013). Сегодня вторичная лимфедема более распространена из-за увеличения заболеваемости раком, поражая 1 человека из 1000, при этом у 24–49% больных раком развивается вторичная лимфедема после лечения рака (Karaca-Mandic et al., 2015; Курт и др., 2016). Однако этот уровень заболеваемости и распространенности, вероятно, недооценивается, поскольку лимфедема остается недооцененной и недостаточно документированной. Лимфедема, связанная с раком груди, является наиболее распространенной формой лимфедемы в развитых странах, за которой следуют саркома, гинекологический рак и злокачественная меланома (Rockson, 2018). Набухание тканей конечностей из-за скопления интерстициальной жидкости вызывает дискомфорт, ограничивает диапазон движений и снижает качество жизни пациентов с лимфедемой.Повышенная восприимчивость к инфекциям, рецидивирующие инфекции, психологическая заболеваемость, функциональная инвалидность, изменения кожи и злокачественная трансформация являются известными осложнениями, связанными с лимфедемой человека (Greene and Maclellan, 2013).
Патофизиология лимфедемы
Исследования последних десятилетий привели к пониманию того, что факторы, вызывающие лимфедему, не связаны исключительно с накоплением лимфы и жидкости в интерстициальной ткани. Предполагается, что его патофизиология включает в себя цепь сложных и прогрессирующих событий, влияющих на различные тканевые компартменты.Эти события описаны ниже, хотя их точный хронологический порядок остается неустановленным.
Расширение и ремоделирование жировой ткани при лимфедеме
Существуют веские доказательства того, что набухание тканей при лимфедеме происходит из-за отложения жира, а не только из-за накопления жидкости. Наличие избыточной жировой ткани в пораженной конечности было хорошо задокументировано у пациентов с хронической лимфедемой без ямок после рака груди (Brorson and Svensson, 1997). Наши клинические наблюдения показывают, что гипертрофированные жировые дольки сжимают и разрушают свои питающие лимфатические капилляры, что приводит к порочному кругу нарушения транспорта жидкости и липидов, что в конечном итоге приводит к дальнейшему накоплению жира на периферии.Недавнее исследование с использованием магнитно-резонансной томографии (МРТ) показало, что отложение жира не ограничивается эпифасциальным компартментом (между кожными и мышечными клетками) лимфедематозного компартмента, но также присутствует в подфасции (между мышечными клетками или внутри мышечных клеток), которые не изменилось после липосакции (Hoffner et al., 2018b). Однако с клинической точки зрения подкожный отсек является основной зоной накопления жира, и этот жир можно удалить с помощью липосакции.Накопление жировой ткани также описано на моделях мышей с лимфатическим стазом (таблица 1). Например, у мышей, у которых лимфатические сосуды кожи были удалены хирургическим путем, отложение подкожного жира и толщина жира увеличивались (Aschen et al., 2012). Точно так же у мышей Chy , мышиной модели лимфедемы, из-за гетерозиготных инактивирующих мутаций в рецепторе 3 фактора роста эндотелия сосудов развивалось аномальное отложение подкожного жира, особенно в отечной подкожной жировой ткани, близкой к дисфункциональным гипопластическим лимфатическим сосудам (Karkkainen et al., 2001). Кроме того, наблюдался высокий уровень жира в коже хвоста (Rutkowski et al., 2010). У гетерозиготных мышей Prox1 нарушение лимфатической функции приводит к утечке лимфы и накоплению жировой ткани, что приводит к ожирению у взрослых (Harvey et al., 2005). Важно отметить, что in vivo восстановления уровня Prox1, особенно в лимфатической эндотелиальной клетке, было достаточным, чтобы обратить лимфатические дефекты у мышей Prox1 ± и улучшить их фенотип ожирения (Escobedo et al., 2016). Вместе эти данные, полученные на мышах и людях, подтверждают связь между лимфатической дисфункцией и накоплением жировой ткани. Подробный гистологический анализ жировой ткани здоровых и пациентов с лимфедемой нижних конечностей выявил существенные различия между двумя группами (Tashiro et al., 2017). Макроскопическое и ультразвуковое исследование продемонстрировало, что жировая ткань лимфедемы имеет более крупные дольки, которые окружены более толстым коллагеновым матриксом и лимфатической жидкостью по сравнению со здоровой жировой тканью.Здоровые адипоциты не разорваны и имеют одинаковый размер, тогда как адипоциты при лимфедеме гипертрофированы и сильно различаются по размеру (Tashiro et al., 2017).
Таблица 1. Животные модели лимфедемы.
Жировая ткань функционирует как резервуар энергии, либо накапливая избыточные питательные вещества, либо поставляя питательные вещества другим тканям (Birsoy et al., 2013). Он также играет важную эндокринную функцию, посредством которой адипоциты секретируют гормоны и цитокины, известные как адипокины, для регулирования энергетического гомеостаза (Rondinone, 2006).При ожирении патологическое ремоделирование жировой ткани происходит, когда избыток питательных веществ вызывает увеличение размеров адипоцитов (гипертрофия) или увеличение количества (гиперплазия) после того, как они достигли своей максимальной способности накапливать липиды. Это ремоделирование жировой ткани приводит к нарушению регуляции выработки адипокинов, метаболическому стрессу и локальному воспалению низкой степени за счет повышенной секреции провоспалительных цитокинов (TNF-α, IL-6, MCP-1, IL-8), которые способствуют иммунной клеточная инфильтрация и их провоспалительная поляризация (de Ferranti and Mozaffarian, 2008; Drolet et al., 2008). Гипертрофия жировой ткани при лимфедеме сопровождается ремоделированием жировой ткани, аналогичным тому, что происходит при ожирении. Повышенные уровни адипонектина и лептина в сыворотке крови были обнаружены у пациентов с лимфедемой, что, вероятно, отражает увеличение жировой ткани (Zaleska and Olszewski, 2017). Повышенная экспрессия адипонектина, которая коррелирует с накоплением жира, вызванным застоем лимфы, также наблюдалась в хирургической модели лимфедемы на хвосте мыши (Aschen et al., 2012) (Таблица 1). Более того, экспрессия IL-6, которая коррелирует с депо жировой ткани у пациентов с ожирением (Mohamed-Ali et al., 1997; Fried et al., 1998), как было показано, повышается в лимфедематозных тканях человека и мыши, а также в сыворотке пациентов с лимфедемой (Olszewski et al., 1992; Cuzzone et al., 2014). Повышенная экспрессия IL-6 в лимфедематозных тканях мышей связана с отложением жира, и предполагается, что его роль заключается в регулировании гомеостаза жировой ткани, поскольку блокирование его активности ограничивает рост жировой ткани (Cuzzone et al., 2014).
Фиброз при лимфедеме
Фиброз, то есть чрезмерное отложение внеклеточного матрикса в различных органах, потенциально приводит к их дисфункции.Это состояние возникает при лимфедеме конечностей и является важным патологическим изменением лимфедемы. Гистологические и иммуногистохимические исследования кожных тканей клинической и экспериментальной лимфедемы выявили повышенное количество коллагеновых волокон в отечной коже (Schirger et al., 1962; Ryan, 1995; Rutkowski et al., 2010; Zampell et al., 2012c; Gardenier et al., др., 2016; таблица 1). Фиброз при лимфедеме не ограничивается дермой, но также обнаруживается в подкожной клетчатке, включая жировую ткань.Гипертрофические адипоциты имеют толстый волокнистый матрикс между долками (Tashiro et al., 2017) при лимфедеме человека. Накопление коллагена в подкожно-жировой клетчатке наблюдалось на мышиных моделях лимфедемы (Zampell et al., 2012c; Gardenier et al., 2016). Это приводит к затвердеванию лимфедематозной ткани, в результате чего возникает отек без язв.
Было показано, что собирающие лимфатические сосуды играют роль в возникновении лимфедемы, а исследования пациентов с лимфедемой и животных моделей продемонстрировали морфологические и структурные изменения в собирающих лимфатических сосудах, включая отложение коллагена (Mihara et al., 2012; Gardenier et al., 2016). При лимфедеме застой лимфатической жидкости приводит к увеличению давления в лимфатических сосудах. Когда этот процесс продолжается, гладкомышечные клетки в лимфатических сосудах становятся тоньше и уплощаются (Koshima et al., 1996; Ogata et al., 2015), а лимфатические сосуды кожных капилляров становятся гипертрофированными (Tashiro et al., 2017), вызывая кожные обратный ток лимфатической жидкости. Михара и др. (2012) элегантно исследовали четыре типа изменений собирающих лимфатических сосудов на протяжении прогрессирования заболевания у пациентов с лимфедемой, которое началось до начала лимфедемы.Нормальный тип собирающих лимфатических сосудов имеет волокна коллагена и гладкомышечные клетки, присутствующие в медиальном слое. Тип эктазии характеризуется расширением стенки лимфатического сосуда длинными и удлиненными коллагеновыми волокнами. Тип сокращения показывает отложение толстых волокон коллагена, смешанных с гладкомышечными клетками в медиальном слое. Толстые коллагеновые волокна нарушают сокращение сосудов, что приводит к потере функции собирающих лимфатических сосудов. В сосудах типа склероза наблюдается увеличение количества гладкомышечных клеток и коллагеновых волокон, а также потеря их способности транспортировать лимфатическую жидкость, что приводит к чрезмерной утечке лимфы (Mihara et al., 2012). Эти изменения в собирающих сосудах согласуются с предыдущими данными, показывающими снижение сократимости лимфатических сосудов при лимфедеме человека (Olszewski, 2002; Modi et al., 2007). Кроме того, фиброз кожи и подкожной клетчатки может усугубить дисфункцию лимфатических сосудов за счет прямого ингибирования пролиферации лимфатических эндотелиальных клеток и предотвращения прорастания и разветвления новых лимфатических сосудов. Это подтверждается данными на моделях мышей и крыс, демонстрирующих, что фиброз отрицательно регулирует лимфатический поток и лимфангиогенез, что, в свою очередь, усиливает отек, транспорт жидкости и лимфодренаж (Lynch et al., 2015). Однако, когда фиброз подавлялся, восстановление и транспорт лимфатических сосудов улучшались, замедляя прогрессирование лимфедемы (Avraham et al., 2009, 2010; Savetsky et al., 2014).
В отличие от наших знаний о пагубном влиянии повышенного отложения коллагена на лимфедему, имеется мало информации о структуре коллагеновых волокон и пространственной организации лимфедемы. Два недавних исследования тканей лимфедемы человека и мыши с использованием многофотонной микроскопии выявили изменения в пространственной организации коллагеновой сети, ведущие к необратимым структурным повреждениям (Wu et al., 2011; Кистенев и др., 2019). Однако возможные последствия этих изменений для лимфатической функции и лимфедемы еще предстоит выяснить.
Изменения кожи
На более поздних стадиях прогрессирования лимфедемы кожные изменения, такие как гиперкератоз, могут возникать вместе с фиброзом дермы, подкожной клетчатки и мышечной фасции (Daroczy, 1995; Domaszewska-Szostek et al., 2016). По мере прогрессирования заболевания затвердевшая кожа приобретает кожистую консистенцию и более склонна к рецидивирующим инфекциям, образованию бородавок, целлюлиту, бородавкам, изъязвлениям, трещинам и, в редких случаях, кожной ангиосаркоме (Sinclair et al., 1998; Града и Филлипс, 2017).
Потенциальные механизмы трансформации тканей при лимфедеме
Механизм образования жировой ткани и фиброза при лимфедеме остается неясным, и несколько исследований, особенно на мышиной модели лимфедемы, выявили потенциальные факторы этих процессов.
Роль лимфатического застоя и отложений липидов
При лимфедеме пораженная ткань наполняется лимфой в результате лимфатической обструкции или недостаточности. Исследования Г.Группа Оливера на мышах Prox1, , ± предоставила первое доказательство того, что лимфатическая утечка может способствовать гипертрофии жировой ткани и адипогенезу (Harvey et al., 2005). Они показали, что жир накапливается возле протекающих брыжеечных лимфатических сосудов у мышей Prox1 ± , а выделенная жидкость индуцирует in vitro дифференцировку адипоцитов (Harvey et al., 2005). Одним из признаков адипогенеза является повышенная экспрессия маркеров дифференцировки жира, продемонстрированная на хвостовой модели лимфедемы (Aschen et al., 2012). Застойная лимфа содержит различные факторы, включая белки и липиды. В последующем исследовании группа Дж. Оливера продемонстрировала, что липидная фракция в просачивающейся жидкости является адипогенным фактором, хотя не было замечено никаких существенных различий в липидном составе лимфы мышей WT и Prox1 ± . Лимфа из обеих групп способствовала дифференцировке преадипоцитов в зрелые адипоциты (Escobedo et al., 2016). Этот результат согласуется с предыдущей работой, показывающей, что мезентериальная лимфа, или, более конкретно, хиломикрон, выделенный из лимфы, поддерживает дифференцировку предшественников адипоцитов (Cambon et al., 1998). Кроме того, свободные жирные кислоты, которых много в лимфе, способствовали адипогенезу in vitro (Escobedo et al., 2016). Холестерин — еще один липидный компонент, который может откладываться в ткани из-за застоя лимфы. Липопротеины, включая липопротеины низкой плотности (ЛПНП) и высокой плотности (ЛПВП), играют решающую роль в транспорте липидов в лимфе, а также в крови (Randolph and Miller, 2014). Транспорт холестерина, конъюгированного с HDL, из периферических тканей обратно в системный кровоток известен как обратный транспорт холестерина (RCT) и в значительной степени зависит от эффективного лимфатического транспорта.В экспериментальных моделях хирургическое нарушение лимфатических каналов нарушает возврат холестерина в системный кровоток из трансплантированной артерии (Martel et al., 2013) и кожи (Lim et al., 2013). Примечательно, что жировая ткань является основным местом хранения холестерина, а изменения баланса холестерина в адипоцитах могут модулировать метаболические и провоспалительные функции жировой ткани (Chung and Parks, 2016). Это повышает вероятность того, что РКИ может быть нарушена при лимфедеме в результате нарушения лимфодренажа.Возникающее в результате накопление холестерина в пораженной конечности, в свою очередь, может способствовать ремоделированию жировой ткани. Это явление необходимо продемонстрировать экспериментально. С клинической точки зрения указанные выше липидные факторы в лимфедематозной ткани и, соответственно, их уровни в крови еще не были четко изучены.
Традиционно считается, что высокое содержание белка в интерстициальной ткани вызывает отложение жира и фиброз. Исследование на модели трансгенной лимфедемы K14-VEGFR3-Ig на мышах показало, что застоя лимфы per se может быть недостаточно, чтобы вызвать эти тканевые изменения (Markhus et al., 2013). Очевидно, что другие факторы и события, развивающиеся вокруг стаза лимфы, вызывают эти патологические изменения в лимфедематозных тканях, что объясняет, почему у большинства пациентов лимфедема развивается через месяцы или годы после первоначального повреждения (Petrek et al., 2001).
Роль воспаления
Из экспериментальных и клинических исследований ясно, что воспаление играет важную роль в патофизиологии лимфедемы (Ly et al., 2017). Первая демонстрация того, что лимфедема у крыс приводит к хронической воспалительной реакции (Gaffney and Casley-Smith, 1981), вместе с более поздней идентификацией воспалительных генов, связанных с несколькими симптомами лимфедемы человека (Fu et al., 2016), подтолкнула к дальнейшим исследованиям в этой области. Одним из наиболее характерных проявлений воспалительной реакции, связанной с лимфедемой, является инфильтрация воспалительных клеток в отечных тканях. Исследования группы BJ Mehrara и M. Detmar показали при клинической и экспериментальной лимфедеме, что большинство клеток, которые хронически накапливаются в лимфедематозных тканях, являются T-клетками CD4 + и что они вносят свой вклад в патологические изменения, включая фиброз (Avraham et al. ., 2010, 2013; Zampell et al., 2012c; Советский и др., 2014; Gousopoulos et al., 2016b). Дальнейшая фенотипическая характеристика инфильтрирующих CD4 + Т-клеток показала, что существует смесь Th2, Th3 и регуляторных Т-клеток (Avraham et al., 2013; Gousopoulos et al., 2016a). Примечательно, что блокада дифференцировки Th3, но не дифференцировка Th2, была эффективной для предотвращения развития лимфедемы и, в установленных случаях, лечения ее (Avraham et al., 2013; Ly et al., 2019). Аналогичные результаты были получены, когда профиброзные цитокины и факторы роста i.е., IL-4, IL-13 и TGF-β, продуцируемые Th3-клетками, были заблокированы (Avraham et al., 2013; Savetsky et al., 2015). В отличие от патогенной роли клеток Th3 в лимфедеме, регуляторные Т-клетки (Treg), по-видимому, ограничивают патологические изменения лимфедемы. Действительно, истощение Treg-клеток усугубляет отек и фиброз и связано с повышенной инфильтрацией иммунных клеток со смешанным профилем цитокинов Th2 / Th3 (Gousopoulos et al., 2016a). Напротив, экспансия Т-регуляторных клеток значительно снижает развитие лимфедемы за счет ослабления воспаления тканей при лимфедеме (Gousopoulos et al., 2016а). Однако эти клетки могут также участвовать в местном подавлении иммунитета, наблюдаемом при лимфедеме, что согласуется с рецидивом инфекций мягких тканей, наблюдаемым при этом заболевании (Sharkey et al., 2017; Garcia Nores et al., 2018). В совокупности эти результаты предполагают, что нацеливание на Т-клетки является потенциальной новой терапевтической стратегией при лимфедеме.
Макрофаги могут выполнять множество функций, включая регуляцию лимфатических сосудов (Kataru et al., 2009), воспаление, иммунитет и восстановление тканей (Ginhoux and Jung, 2014), которые являются функциями, имеющими отношение к прогрессированию лимфедемы.При лимфедеме обнаружено скопление макрофагов. Однако было показано, что макрофаги выполняют противоположные функции. Макрофаги обычно подразделяются на альтернативно активированные макрофаги (M2) или классический (M1) фенотип, с восстанавливающими и провоспалительными функциями, соответственно. Однако эта классификация является упрощенной и может не отражать весь спектр фенотипов макрофагов и их соответствующие функции in vivo (Ginhoux and Jung, 2014). Истощение макрофагов в модели хирургии хвоста мыши значительно способствует фиброзу (Zampell et al., 2012b; Ghanta et al., 2015). Макрофаги, которые проявляют фенотип M2, могут опосредовать эту антифиброзную функцию посредством регуляции накопления CD4 + Т-клеток и дифференцировки Th3 (Ghanta et al., 2015; Savetsky et al., 2015; Shin et al., 2015). В здоровой жировой ткани доминируют макрофаги М2. В жировой ткани людей с ожирением количество макрофагов M2 уменьшилось, в то время как макрофаги M1, по-видимому, встречаются чаще. В соответствии с этими наблюдениями при ожирении, анализ проточной цитометрии клеток, полученных из жировой ткани от здоровых субъектов и субъектов с лимфедемой, показал, что существует дисбаланс между макрофагами M1 и M2, где количество макрофагов M2 уменьшилось в жировых тканях лимфедемы по сравнению со здоровым контролем (Tashiro и другие., 2017). Примечательно, что макрофаги M1 в жировой ткани с ожирением, как было показано, локализуются преимущественно в мертвых адипоцитах с образованием короноподобных структур и удаляют остаточные липиды и дебрис из некротических адипоцитов (Cinti et al., 2005). В отчете Таширо и др. показывает, что накопление макрофагов M1 в жировой ткани пациента с лимфедемой редко было связано с короноподобными структурами (Tashiro et al., 2017). В модели хвоста мыши застой лимфы связан с инфильтрацией макрофагов F4 / 80 + , которые накапливаются вокруг увеличенного подкожного жира (Zampell et al., 2012c). Является ли эта инфильтрация прелюдией к формированию короноподобной структуры, может быть подтверждено только наличием некроза адипоцитов и фенотипом макрофагов M1. Следовательно, необходимы дальнейшие исследования для изучения образования короноподобных структур при ремоделировании адипоцитов, ассоциированного с лимфедемой, и его значения. Макрофаги также могут контролировать ремоделирование жировой ткани за счет выработки IL-6, который является ключевым фактором хронического воспаления и метаболизма жировой ткани (Scheller et al., 2011). Кроме того, макрофаги могут играть роль в лимфедеме, контролируя лимфангиогенез за счет продукции фактора роста сосудистого эндотелия-C, поскольку истощение макрофагов при установленной лимфедеме снижает лимфатическую транспортную активность и экспрессию VEGF-C (Zampell et al., 2012b; Ghanta et al., 2015). Наконец, макрофаги могут улучшать застой лимфы за счет усиления лимфатической насосной активности путем модуляции экспрессии индуцибельной синтазы оксида азота (Liao et al., 2011; Scallan et al., 2016). В целом, эти данные свидетельствуют о сложной роли макрофагов в патофизиологии лимфедемы. Это разнообразие функций может зависеть от стадии заболевания, его анатомического расположения (верхняя или нижняя конечность) и типа популяции макрофагов.
Клинические исследования и исследования на животных показывают, что воспалительные гены активируются при лимфедеме (Foldi et al., 2000; Lin et al., 2012; Leung et al., 2014). Важно отметить, что экспрессия провоспалительных генов, таких как TNF-α и IFN-γ, снижалась после полного противоотечного лечения.Транскрипционное профилирование лимфедематозных тканей на модели хвоста мыши выявило активацию генов, участвующих в остром воспалении, иммунном ответе, фиброзе и заживлении ран (Tabibiazar et al., 2006). Авторы предполагают, что лейкотриены, продуцируемые 5-липоксигеназой (5-LO), могут играть потенциальную роль в патогенезе заболевания. У пациентов с лимфедемой человека наблюдается повышенный уровень лейкотриена B4 (LTB4) в плазме (Tian et al., 2017). У мышей, получавших антагонист LTB4, отек обращался вместе с улучшением лимфатической функции и патологическими изменениями кожи (Tian et al., 2017). Кетопрофен — это НПВП с двойным противовоспалительным механизмом действия, включая ингибирование пути 5-LO (Rajic et al., 2010). Интересно, что системное лечение кетопрофеном мышей с установленной лимфедемой обращает заболевание и гистопатологические изменения (Nakamura et al., 2009). Ингибирование пути 5-LO объясняет терапевтический эффект кетопрофена. В совокупности эти доклинические результаты привели к клиническому пилотному исследованию по оценке потенциального терапевтического эффекта кетопрофена для облегчения лимфедемы человека.Это предварительное исследование продемонстрировало положительный эффект таргетной противовоспалительной терапии кетопрофеном у пациентов с лимфедемой, о чем свидетельствует уменьшение толщины кожи и улучшение гистологических изменений (Rockson et al., 2018). Еще неизвестно, сможет ли это лечение обратить вспять фиброз, отложение жировой ткани и будет ли оно длительным.
Диагностика и оценка лимфедемы и связанных изменений тканей
Лимфедема диагностируется клинически и классифицируется на четыре стадии в соответствии с Международным сообществом лимфологов (ISL).Стадия 0 является латентной, и, несмотря на нарушение лимфотранспорта, отек не проявляется. Стадия I характеризуется ранним накоплением жидкости, и приподнятие пораженной конечности может уменьшить отек. Язвы (вмятины остаются, когда палец надавливают на пораженный участок) также могут возникать на стадии I. Язвы более очевидны на стадии II, поскольку отек увеличивается и не спадает только от подъема конечности. По мере перехода к поздней стадии II ямки могут возникать, а могут и не возникать из-за начала фиброза. Лимфедема III стадии, также известная как лимфостатическая слоновая болезнь, представляет собой развитую лимфедему с отсутствием ямок.
Методы диагностики лимфедемы в первую очередь были сосредоточены на обнаружении отека, транспорта лимфатических сосудов и лимфотока, пока недавние достижения в наших знаниях о патофизиологии заболеваний не привели к разработке методов оценки трансформации тканей, включая фиброз и отложение жира (O’Donnell и др., 2017). Эти новые подходы могут быть более эффективными методами мониторинга прогрессирования заболевания и реакции на лечение, которое, насколько нам известно, все еще отсутствует в клинике.Анализ структуры и транспорта лимфатических сосудов проводится с помощью прямой или непрямой лимфографии. Прямая лимфография — это введение контрастных веществ в лимфатические сосуды (Kinmonth, 1952). Из-за риска повреждения лимфатических сосудов этот метод со временем был заменен непрямой лимфографией, основанной на введении радиоактивно меченных контрастных веществ, вводимых в мягкие ткани, которые проникают в лимфатические сосуды, что позволяет проводить их анализ (Cambria et al., 1993). Однако стандартизация отсутствует из-за различных используемых изотопов.Совсем недавно инфракрасная флуоресцентная визуализация лимфатических сосудов с использованием красителя индоцианинового зеленого позволила визуализировать тонкие лимфатические сосуды и использовалась для диагностики и определения степени лимфедемы (Unno et al., 2010). Новейшим методом визуализации является фотоакустическая лимфангиография, которая обеспечивает визуализацию лимфатических сосудов и вен с высоким разрешением (Kajita et al., 2020).
Методы, направленные на измерение и регистрацию увеличения объема конечности, включают вытеснение воды, оптоэлектронную перометрию, биоэлектрический импеданс и измерения окружности (Rincon et al., 2016). Однако эти методы не являются неэффективными для выявления ранней лимфедемы.
Неинвазивные методы, такие как ультразвуковое исследование, МРТ, компьютерная томография и двухэнергетическая рентгеновская абсорбциометрия, способны обнаруживать изменения в тканях кожи, такие как изменения плотности ткани, накопление жидкости, фиброз и жировые компоненты. Хотя эти методы использовались и могут предоставить информацию о лимфоэдематозной ткани, они дороги, сложны и представляют некоторые потенциальные опасности (Brorson et al., 1998; Уорд, 2011). В последнее время SkinFibroMeter показал многообещающие результаты для оценки жесткости кожи при лимфедеме человека с использованием специального трехмерного вычислительного конечного элемента для анализа биомеханической реакции кожной ткани на внешнюю силу (Sun et al., 2017). Как обсуждалось выше, многофотонная микроскопия позволяет анализировать структуру коллагена, а также может использоваться для диагностики лимфедемы, поскольку этот метод был использован для in vivo оценки старения кожи человека и фотостарения (Lin et al., 2005; Koehler et al., 2006).
Лечение лимфедемы многомодальным лечением
Лекарства от лимфедемы пока нет. Современные методы лечения являются мультимодальными и направлены на уменьшение отека и дискомфорта пораженной конечности у пациентов с лимфедемой. Одним из вариантов лечения лимфедемы на ранней стадии является противоотечная терапия, которая включает ручной лимфодренаж (MLD), компрессионную повязку, упражнения, уход за кожей и компрессионное белье. Хирургические методы лечения показаны для стадии I и далее, при этом методы широко классифицируются на лимфатические реконструктивные процедуры и процедуры эксцизии (Raju and Chang, 2015).Эксцизионные процедуры могут привести к резкому уменьшению обхвата конечностей, но могут быть осложнены нестабильными рубцами и плохим эстетическим видом. Реконструктивные лимфатические процедуры, такие как лимфо-венозный анастомоз и лимфатико-лимфатический анастомоз, являются полезными хирургическими методами лечения острых деконгестивных заболеваний и могут проводиться поэтапно под местной анестезией. Создание периферической связи между лимфатической и венозной системами для лечения лимфедемы было описано еще в 1960-х годах (Olszewski et al., 1968), но только в 2000-х годах (Koshima et al., 2000), с появлением усовершенствованных инструментов и техник, этот лимфовенозный обходный анастомоз получил распространение во всем мире. Преимущества этого метода заключаются в том, что он малоинвазивен и эффективен для немедленного дренирования лимфатической жидкости. Лимфовенозное шунтирование сочетается с компрессионной терапией. Однако фиброз на поздних стадиях лимфедемы может ограничивать эффективность этого хирургического вмешательства, нарушая функцию оставшихся лимфатических сосудов, которые больше не подходят (Suami and Chang, 2010).Поэтому важно время вмешательства, и предполагается, что хирургические вмешательства имеют лучшие результаты, если они выполняются на более ранних стадиях заболевания (Becker et al., 2006).
В последние годы перенос васкуляризированных лимфатических узлов стал быстро развивающимся методом лимфатической реконструкции, который, как было показано, приводит к регенерации лимфатических сосудов (Tan et al., 2016). Имплантированные лимфатические узлы создают новые каналы и пути, по которым оттекает жидкость. Лимфангиогенез опосредуется фактором роста эндотелия сосудов С (Viitanen et al., 2013). Когда новые каналы прорастают из перенесенного лимфатического узла, соединенного с периферической артерией и функционируя вены, он становится «ретрансляционной станцией» васкуляризированного лимфатико-венозного обхода. Обладая лучшим пониманием сосудистой анатомии лимфатических узлов, хирурги могут безопасно извлекать лимфатические узлы из области паха, головы, шеи и живота для передачи в качестве лоскутов лимфатических узлов (Gould et al., 2018). По клиническим наблюдениям, для формирования и функционирования новых лимфатических каналов требуется около 2 лет.Недостатком методики является заболеваемость донорским участком, приводящая к лимфедему.
Наблюдения, что набухание тканей при лимфедеме происходит из-за отложений жира, привели к развитию липосакции для лечения этого заболевания (Brorson et al., 2006, 2009; Damstra et al., 2009). Наши клинические наблюдения показывают, что гипертрофированные жировые дольки сжимают и разрушают свои питающие лимфатические капилляры, что приводит к порочному кругу нарушения транспорта жидкости и липидов, что в конечном итоге приводит к дальнейшему накоплению жира на периферии.Консервативные формы хирургии, такие как лимфатическое шунтирование, способствуют очищению лимфатической жидкости и содержащихся в ней липидов, но неэффективны для удаления большого объема жира. Сегодня, лучше понимая лимфатическую анатомию и пути лимфатических каналов, хирурги проводят селективную липосакцию, при которой жир удаляется с минимальным нарушением лимфатических каналов (Brorson, 2016). Показанием к липосакции является гипертрофия жира в пораженных конечностях, как показано на МРТ. Сторонники липосакции демонстрируют хорошее уменьшение объема и отсутствие рецидивов через 5 лет (Hoffner et al., 2018а). Риски липосакции включают потерю крови, гематому, неровности контура и некроз кожи (Chen et al., 2019). Этим пациентам необходимо носить компрессионную одежду на протяжении всей жизни.
Заключение и дальнейшие направления
В заключение, лимфедема характеризуется несколькими патофизиологическими явлениями, включая застой лимфы, ремоделирование и дисфункцию лимфатических сосудов, воспаление, отложение жировой ткани и фиброз. Однако точная последовательность этих событий и их взаимодействие во время развития и прогрессирования лимфедемы далеко не полностью описаны (Рисунок 1).Большая часть недавних знаний в патофизиологии лимфедемы получена на животных моделях лимфедемы, особенно на мышах. Большинство животных моделей лимфедемы являются острыми, при этом отек возникает сразу после лимфатического повреждения и разрешается в течение нескольких недель, за некоторыми исключениями, такими как мышь FLT4-DTR, у которой развивается более длительное состояние лимфедемы с патологическими особенностями человека (Gardenier et al., 2016; Таблица 1). Напротив, лимфедема у людей является хронической и сохраняется на протяжении всей жизни, развиваясь через несколько месяцев или лет после операции.Следовательно, модели на животных плохо стимулируют начало развития и прогрессирования лимфедемы человека. Из-за этого ограничения не все наблюдения на животных моделях острой лимфедемы можно экстраполировать на людей. Необходимы дополнительные исследования на людях с особым вниманием к типам изменений тканей на разных стадиях лимфедемы. Лучшее понимание патофизиологии лимфедемы и ее клеточных и молекулярных медиаторов проложит путь для новых терапевтических подходов к этому хроническому и изнурительному состоянию.
Рисунок 1. Взаимосвязь и хронология патологических изменений лимфедемы изучены недостаточно. На клинических моделях и моделях лимфедемы на животных очевидно, что воспаление, ремоделирование жировой ткани и фиброз кожи и лимфатических сосудов возникают по мере прогрессирования лимфедемы. В частности, остается неизученной хронология ремоделирования жировой ткани между стадиями лимфедемы. Более того, неизвестно, являются ли ремоделирование жировой ткани (1) и воспаление двумя отдельными или синхронизированными событиями и может ли ремоделирование жировой ткани при лимфедеме способствовать фиброзу (2), наблюдаемому при ожирении.
Авторские взносы
VA, HL, B-KT и SA внесли свой вклад в рукопись. SA и HL создали рисунок и таблицу.
Финансирование
Эта работа была поддержана грантами Министерства образования Сингапура и Национального исследовательского фонда Канцелярии премьер-министра Сингапура в рамках программы «Кампус передового опыта исследований и технологических предприятий» (CREATE) для VA.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Ссылки
Ашен, С., Зампелл, Дж. К., Эльхадад, С., Вейтман, Э., Де Брот, М., и Мехрара, Б. Дж. (2012). Регулирование адипогенеза за счет застоя лимфатической жидкости: часть II. Экспрессия генов дифференцировки жировой ткани. Пласт. Реконстр. Surg. 129, 838–847. DOI: 10.1097 / PRS.0b013e3182450b47
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Авраам, Т., Клавин, Н. В., Далувой, С. В., Фернандес, Дж., Соарес, М. А., Кордейро, А. П., и другие. (2009). Фиброз — ключевой ингибитор лимфатической регенерации. Пласт. Реконстр. Surg. 124, 438–450. DOI: 10.1097 / PRS.0b013e3181adcf4b
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Авраам Т., Далувой С., Зампелл Дж., Ян А., Хавив Ю. С., Роксон С. Г. и др. (2010). Блокада трансформирующего фактора роста-бета1 ускоряет регенерацию лимфы во время заживления ран. Am. J. Pathol. 177, 3202–3214. DOI: 10.2353 / ajpath.2010.100594
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Avraham, T., Zampell, J. C., Yan, A., Elhadad, S., Weitman, E. S., Rockson, S. G., et al. (2013). Дифференцировка Th3 необходима при фиброзе мягких тканей и лимфатической дисфункции в результате лимфедемы. FASEB J. 27, 1114–1126. DOI: 10.1096 / fj.12-222695
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беккер, К., Ассуад, Дж., Рике, М., и Хидден, Г. (2006).Лимфедема после мастэктомии: отдаленные результаты после микрохирургической трансплантации лимфатических узлов. Ann. Surg. 243, 313–315. DOI: 10.1097 / 01.sla.0000201258.10304.16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Блюм, К. С., Хадамицкий, К., Грац, К. Ф., и Пабст, Р. (2010). Влияние аутотрансплантированных фрагментов лимфатических узлов на лимфатическую систему на модели свиньи. Breast Cancer Res. Рассматривать. 120, 59–66. DOI: 10.1007 / s10549-009-0367-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брорсон, Х., Олин, К., Олссон, Г., и Карлссон, М. К. (2009). Хроническая лимфедема руки, связанная с раком груди, связана с избытком жировой и мышечной ткани. Лимфат. Res. Биол. 7, 3–10. DOI: 10.1089 / lrb.2008.1022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брорсон, Х., Олин, К., Олссон, Г., Лангстрем, Г., Виклунд, И., и Свенссон, Х. (2006). Качество жизни после липосакции и консервативного лечения лимфедемы руки. Лимфология 39, 8–25.
PubMed Аннотация | Google Scholar
Брорсон, Х., Свенссон, Х. (1997). Полное уменьшение лимфатического отека руки липосакцией после рака груди. Сканд. J. Plast. Реконстр. Surg. Hand Surg. 31, 137–143. DOI: 10.3109 / 028443197080
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брорсон, Х., Свенссон, Х., Норргрен, К., и Торссон, О. (1998). Липосакция уменьшает лимфедему руки без значительного изменения и без того нарушенного транспорта лимфы. Лимфология 31, 156–172.
PubMed Аннотация | Google Scholar
Камбон Б., Рейн Ю. и Нуг Дж. (1998). Индукция in vitro мРНК UCP1 в преадипоцитах кролика, рассматриваемая как модель развития коричневой жировой ткани у крупных млекопитающих: важность агонистов PPARgamma для клеток, выделенных в постнатальный период. Мол. Клетка. Эндокринол. 146, 49–58. DOI: 10.1016 / s0303-7207 (98) 00200-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камбрия, Р.А., Гловицки П., Нессенс Дж. М. и Ванер Х. У. (1993). Неинвазивная оценка лимфатической системы с лимфосцинтиграфией: проспективный полуколичественный анализ на 386 конечностях. J. Vasc. Surg. 18, 773–782. DOI: 10.1067 / mva.1993.50510
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, В. Ф., Цзэн, В. Ф., Хоукс, П. Дж., Мэн, Дж. И Боуэн, М. (2019). Липосакция лимфедемы с немедленным контуром конечностей. Пласт. Реконстр. Surg.Glob. Откройте 7: e2513. DOI: 10.1097 / GOX.0000000000002513
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cinti, S., Mitchell, G., Barbatelli, G., Murano, I., Ceresi, E., Faloia, E., et al. (2005). Гибель адипоцитов определяет локализацию и функцию макрофагов в жировой ткани мышей и людей с ожирением. J. Lipid Res. 46, 2347–2355. DOI: 10.1194 / jlr.m500294-jlr200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Куззоне, Д.A., Weitman, E. S., Albano, N. J., Ghanta, S., Savetsky, I. L., Gardenier, J. C., et al. (2014). IL-6 регулирует отложение жира и гомеостаз при лимфедеме. Am. J. Physiol. Heart Circ. Physiol. 306, h2426 – h2434. DOI: 10.1152 / ajpheart.01019.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Damstra, R.J., Voesten, H.G., Klinkert, P., and Brorson, H. (2009). Круговая аспирационная липэктомия при лимфедеме после операции по поводу рака груди. Br. J. Surg. 96, 859–864. DOI: 10.1002 / bjs.6658
PubMed Аннотация | CrossRef Полный текст | Google Scholar
де Ферранти, С., Мозаффариан, Д. (2008). Идеальный шторм: ожирение, дисфункция адипоцитов и метаболические последствия. Clin. Chem. 54, 945–955. DOI: 10.1373 / Clinchem.2007.100156
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Деллинджер, М. Т., Хантер, Р. Дж., Бернас, М. Дж., Витте, М. Х. и Эриксон, Р.П. (2007). Мыши Chy-3 являются Vegfchaploinsufficient и демонстрируют дефектный дермальный переход от поверхностного к глубокому лимфатическому каналу и кожную лимфатическую гипоплазию. Dev. Дин. 236, 2346–2355. DOI: 10.1002 / dvdy.21208
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Domaszewska-Szostek, A., Zaleska, M., and Olszewski, W. L. (2016). Гиперкератоз при лимфедеме нижних конечностей человека: влияние застойной тканевой жидкости / лимфы. J. Eur. Акад. Дерматол. Венереол. 30, 1002–1008.DOI: 10.1111 / jdv.13565
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дролет Р., Ричард К., Снайдерман А. Д., Майлу Дж., Фортье М., Хуот К. и др. (2008). Гипертрофия и гиперплазия жировой ткани брюшной полости у женщин. Внутр. J. Obes. (Лондон) 32, 283–291. DOI: 10.1038 / sj.ijo.0803708
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эскобедо, Н., Пру, С. Т., Караман, С., Диллард, М. Э., Джонсон, Н., Детмар, М., и другие. (2016). Восстановление лимфатической функции помогает избавиться от ожирения у мышей с дефицитом гаплонедостата Prox1. JCI Insight 1: e85096.
PubMed Аннотация | Google Scholar
Фернандес Пеньуэла, Р., Понс Плайя, Г., КасаниАразо, Л., и Масия Аяла, Дж. (2018). Экспериментальная модель лимфедемы на животных для оценки результатов лимфовенозного анастомоза. Лимфат. Res. Биол. 16, 234–239. DOI: 10.1089 / lrb.2016.0068
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Foldi, E., Зауэрвальд А. и Хенниг Б. (2000). Влияние комплексной противоотечной физиотерапии на экспрессию генов воспалительного ответа при периферической лимфедеме. Лимфология 33, 19–23.
PubMed Аннотация | Google Scholar
Фрид, С. К., Бункин, Д. А., и Гринберг, А. С. (1998). Сальниковая и подкожная жировая ткань субъектов с ожирением выделяет интерлейкин-6: разница депо и регуляция глюкокортикоидами. J. Clin. Эндокринол. Метаб. 83, 847–850.DOI: 10.1210 / jc.83.3.847
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фу К., Искьердо Р., Вандевендер Д., Варпеха Р. Л. и Фарид Дж. (1998). Трансплантация фрагментов лимфатических узлов на модели лимфедемы уха кролика: новый метод восстановления лимфатического пути. Пласт. Реконстр. Surg. 101, 134–141. DOI: 10.1097 / 00006534-199801000-00022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фу М. Р., Конли Ю.П., Аксельрод, Д., Гут, А. А., Ю, Г., Флетчер, Дж. И др. (2016). Прецизионная оценка гетерогенности фенотипа лимфедемы, генотипов и прогнозирование риска. Грудь 29, 231–240. DOI: 10.1016 / j.breast.2016.06.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаффни Р. М. и Кэсли-Смит Дж. Р. (1981). Избыток белков плазмы как причина хронического воспаления и лимфатического отека: биохимические оценки. J. Pathol. 133, 229–242. DOI: 10.1002 / путь.1711330306
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гарсия Норес, Г. Д., Ли, К. Л., Советский, И. Л., Катару, Р. П., Ганта, С., Хеспе, Г. Е. и др. (2018). Регуляторные Т-клетки опосредуют местную иммуносупрессию при лимфедеме. J. Invest. Дерматол. 138, 325–335. DOI: 10.1016 / j.jid.2017.09.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гарденье, Дж. К., Хеспе, Г. Э., Катару, Р. П., Советский, И. Л., Torrisi, J. S., Nores, G. D., et al. (2016). Опосредованная дифтерийным токсином абляция лимфатических эндотелиальных клеток приводит к прогрессирующей лимфедеме. JCI Insight 1: e84095. DOI: 10.1172 / jci.insight.84095
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ганта С., Куззоне Д. А., Торриси Дж. С., Альбано Н. Дж., Джозеф В. Дж., Советский И. Л. и др. (2015). Регулирование воспаления и фиброза макрофагами при лимфедеме. Am. J. Physiol. Heart Circ.Physiol. 308, h2065 – h2077. DOI: 10.1152 / ajpheart.00598.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гулд Д. Дж., Мехрара Б. Дж., Нелиган П., Ченг М. Х. и Патель К. М. (2018). Трансплантация лимфатических узлов для лечения лимфедемы. J. Surg. Онкол. 118, 736–742. DOI: 10.1002 / jso.25180
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gousopoulos, E., Proulx, S. T., Bachmann, S. B., Dieterich, L.C., Scholl, J., Karaman, S., et al. (2017). Важная роль VEGF-C в развитии лимфедемы. J. Invest. Дерматол. 137, 1995–2004. DOI: 10.1016 / j.jid.2017.04.033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gousopoulos, E., Proulx, S. T., Bachmann, S. B., Scholl, J., Dionyssiou, D., Demiri, E., et al. (2016a). Регуляторный перенос Т-лимфоцитов уменьшает лимфедему и улучшает функцию лимфатических сосудов. JCI Insight 1: 9081.DOI: 10.1172 / jci.insight.89081
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gousopoulos, E., Proulx, S.T., Scholl, J., Uecker, M., and Detmar, M. (2016b). Выраженная гиперплазия лимфатических сосудов с прогрессирующей дисфункцией и отчетливой инфильтрацией иммунных клеток при лимфедеме. Am. J. Pathol. 186, 2193–2203. DOI: 10.1016 / j.ajpath.2016.04.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харви, Н. Л., Сринивасан, Р.С., Диллард, М. Э., Джонсон, Н. С., Витте, М. Х., Бойд, К. и др. (2005). Дефекты лимфатических сосудов, вызванные гаплонедостаточностью Prox1, вызывают ожирение у взрослых. Nat. Genet. 37, 1072–1081. DOI: 10.1038 / ng1642
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хеспе, Г. Э., Ли, К. Л., Катару, Р. П., и Мехрара, Б. Дж. (2019). Исходная лимфатическая дисфункция усиливает негативные последствия лимфатического повреждения. Пласт. Реконстр. Surg. 143, 77e – 87e.DOI: 10.1097 / PRS.0000000000005091
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hoffner, M., Ohlin, K., Svensson, B., Manjer, J., Hansson, E., Troeng, T., et al. (2018a). Липосакция дает полное уменьшение лимфедемы руки после лечения рака груди — 5-летнее проспективное исследование с участием 105 пациентов без рецидива. Пласт. Реконстр. Surg. Glob. Откройте 6: e1912. DOI: 10.1097 / GOX.0000000000001912
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хоффнер, М., Петерсон, П., Манссон, С., Брорсон, Х. (2018b). Лимфедема приводит к отложению жира в мышцах и уменьшению объема мышц / воды после липосакции: исследование магнитно-резонансной томографии. Лимфат. Res. Биол. 16, 174–181. DOI: 10.1089 / lrb.2017.0042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йоргенсен, М. Г., Тойсеркани, Н. М., Томсен, Дж. Б., и Соренсен, Дж. А. (2018). Инфекция в области хирургического вмешательства после удаления лимфатического узла указывает на предрасположенность к лимфедему: ретроспективное когортное исследование пациентов со злокачественной меланомой. J. Plast. Реконстр. Эстет. Surg. 71, 590–596. DOI: 10.1016 / j.bjps.2017.11.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джун, Х., Ли, Дж. Й., Ким, Дж. Х., Но, М., Квон, Т. У., Чо, Ю. П. и др. (2017). Модифицированные мышиные модели хронической вторичной лимфедемы: модели хвоста и задних конечностей. Ann. Васк. Surg. 43, 288–295. DOI: 10.1016 / j.avsg.2017.01.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кадзита, Х., О, А., Урано, М., Такемару, М., Иманиши, Н., Отаки, М., и др. (2020). Фотоакустическая лимфангиография. J. Surg. Онкол. 121, 48–50. DOI: 10.1002 / jso.25575
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карача-Мандич, П., Хирш, А. Т., Роксон, С. Г., и Риднер, С. Х. (2015). Кожные, чистые клинические и экономические преимущества передовых пневматических компрессионных устройств у пациентов с лимфедемой. JAMA Dermatol. 151, 1187–1193.DOI: 10.1001 / jamadermatol.2015.1895
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Караман С., Холлмен М., Робчук М. Р., Алитало А., Нурми Х., Морф Б. и др. (2015). Блокада VEGF-C и VEGF-D модулирует воспаление жировой ткани и улучшает метаболические параметры при диете с высоким содержанием жиров. Мол. Метаб. 4, 93–105. DOI: 10.1016 / j.molmet.2014.11.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карккайнен, М.J., Saaristo, A., Jussila, L., Karila, K.A., Lawrence, E.C., Pajusola, K., et al. (2001). Модель генной терапии наследственной лимфедемы человека. Proc. Natl. Акад. Sci. США 98, 12677–12682.
PubMed Аннотация | Google Scholar
Карлсен, Т. В., Карккайнен, М. Дж., Алитало, К., и Уиг, Х. (2006). Последствия отсутствия начальных лимфатических сосудов на транскапиллярном балансе жидкости изучали на модели первичной лимфедемы на мышах. J. Physiol. 574, 583–596.DOI: 10.1113 / jphysiol.2006.108308
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карлсен, Т. В., МакКормак, Э., Мухич, М., Тенстад, О., и Уиг, Х. (2012). Минимально инвазивная количественная оценка лимфотока у мышей и крыс путем визуализации клиренса депо альбумина в ближнем инфракрасном диапазоне. Am. J. Physiol. Heart Circ. Physiol. 302, h491 – h501. DOI: 10.1152 / ajpheart.00842.2011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Катару, Р.П., Юнг, К., Янг, К., Янг, Х., Швенденер, Р. А., Байк, Дж. Э. и др. (2009). Критическая роль макрофагов CD11b + и VEGF в воспалительном лимфангиогенезе, клиренсе антигена и разрешении воспаления. Кровь 113, 5650–5659. DOI: 10.1182 / кровь-2008-09-176776
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кинмонт, Дж. Б. (1952). Лимфангиография у мужчин; метод очертания лимфатических стволов при операции. Clin. Sci. 11, 13–20.
Google Scholar
Кистенев Ю.В., Николаев В.В., Курочкина О.С., Борисов А.В., Вражнов Д.А., Сандыкова Е.А. (2019). Применение многофотонной визуализации и машинного обучения для анализа лимфедемной ткани. Биомед. Опт. Экспресс 10, 3353–3368. DOI: 10.1364 / BOE.10.003353
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Найт, К. Р., Коллопи, П. А., Макканн, Дж. Дж., Вандерколк, К. А., Коу, С. А., Бартон, Р. М. и др.(1987). Обмен белков и фиброз при экспериментальной обструктивной лимфедеме собак. J. Lab. Clin. Med. 110, 558–566.
PubMed Аннотация | Google Scholar
Келер, М. Дж., Кениг, К., Эльснер, П., Бакл, Р., и Каатц, М. (2006). Оценка in vivo старения кожи человека с помощью многофотонной лазерной сканирующей томографии. Опт. Lett. 31, 2879–2881.
PubMed Аннотация | Google Scholar
Косима И., Инагава К., Урушибара К. и Моригути Т.(2000). Супермикрохирургический лимфатико-венулярный анастомоз для лечения лимфедемы верхних конечностей. J. Reconstr. Microsurg. 16, 437–442. DOI: 10,1055 / с-2006-947150
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Косима И., Кавада С., Моригути Т. и Кадзивара Ю. (1996). Ультраструктурные наблюдения лимфатических сосудов при лимфедеме конечностей человека. Пласт. Реконстр. Surg. 97, 397–405; обсуждение 406–397.
PubMed Аннотация | Google Scholar
Курт, Х., Арнольд, К. А., Пейн, Дж. Э., Миллер, М. Дж., Скораки, Р. Дж., И Ивенофу, О. Х. (2016). Массивная локализованная лимфедема: клинико-патологическое исследование 46 пациентов с обогащением для множественности. Мод. Патол. 29, 75–82. DOI: 10.1038 / modpathol.2015.135
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lahteenvuo, M., Honkonen, K., Tervala, T., Tammela, T., Suominen, E., Lahteenvuo, J., et al. (2011). Терапия факторами роста и перенос аутологичных лимфатических узлов при лимфедеме. Тираж 123, 613–620. DOI: 10.1161 / CIRCULATIONAHA.110.965384
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леунг Г., Бэгготт К., Уэст К., Эльбойм К., Пол С. М., Купер Б. А. и др. (2014). Гены-кандидаты цитокинов предсказывают развитие вторичной лимфедемы после операции по поводу рака груди. Лимфат. Res. Биол. 12, 10–22. DOI: 10.1089 / lrb.2013.0024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ляо, С., Ченг, Г., Коннер, Д. А., Хуанг, Ю., Кучерлапати, Р. С., Манн, Л. Л. и др. (2011). Нарушение лимфатического сокращения, связанное с иммуносупрессией. Proc. Natl. Акад. Sci. США 108, 18784–18789. DOI: 10.1073 / pnas.1116152108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лим, Х. Ю., Тиам, К. Х., Йео, К. П., Бизоэндиаль, Р., Хии, С. С., МакГрат, К. С. и др. (2013). Лимфатические сосуды необходимы для удаления холестерина из периферических тканей посредством SR-BI-опосредованного транспорта HDL. Cell Metab. 17, 671–684. DOI: 10.1016 / j.cmet.2013.04.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лин, С., Ким, Дж., Ли, М. Дж., Рош, Л., Янг, Н. Л., Цао, П. С. и др. (2012). Перспективный анализ транскриптомных путей лимфатической сосудистой недостаточности человека: идентификация и проверка панели циркулирующих биомаркеров. PLoS One 7: e52021. DOI: 10.1371 / journal.pone.0052021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линь, С.J., Wu, R Jr, Tan, H.Y., Lo, W., Lin, W.C., Young, T.H., et al. (2005). Оценка фотостарения кожи с помощью многофотонной флуоресценции и микроскопии генерации второй гармоники. Опт. Lett. 30, 2275–2277.
PubMed Аннотация | Google Scholar
Ли, К. Л., Норес, Г. Д. Г., Катару, Р. П., и Мехрара, Б. Дж. (2019). Дифференцировка Т-хелпера 2 необходима для развития лимфедемы. Пер. Res. 206, 57–70. DOI: 10.1016 / j.trsl.2018.12.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линч, Л.Л., Мендес, У., Валлер, А. Б., Жилетт, А. А., Гиллори, Р. Дж. II, и Гольдман, Дж. (2015). Фиброз усугубляет хроническую лимфедему в тканях грызунов. Am. J. Physiol. Heart Circ. Physiol. 308, h2229 – h2236. DOI: 10.1152 / ajpheart.00527.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mäkinen, T., Jussila, L., Veikkola, T., Karpanen, T., Kettunen, M. I., Pulkkanen, K. J., et al. (2001). Ингибирование лимфангиогенеза, что приводит к лимфедему у трансгенных мышей, экспрессирующих растворимый рецептор VEGF-3. Nat. Med. 7, 199–205. DOI: 10.1038 / 84651
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Markhus, C. E., Karlsen, T. V., Wagner, M., Svendsen, O. S., Tenstad, O., Alitalo, K., et al. (2013). Повышенный уровень интерстициального белка из-за нарушения оттока лимфы не вызывает фиброза и воспаления при лимфедеме. Артериосклер. Тромб. Васк. Биол. 33, 266–274. DOI: 10.1161 / ATVBAHA.112.300384
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартель, К., Ли, В., Фулп, Б., Платт, А.М., Готье, Э.Л., Вестертерп, М. и др. (2013). Лимфатическая сосудистая сеть опосредует обратный транспорт холестерина макрофагами у мышей. J. Clin. Вкладывать деньги. 123, 1571–1579. DOI: 10.1172 / JCI63685
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Михара М., Хара Х., Хаяси Ю., Нарушима М., Ямамото Т., Тодокоро Т. и др. (2012). Патологические стадии лимфедемы, связанной с раком: гистологические изменения собирающих лимфатических сосудов после лимфаденэктомии. PLoS One 7: e41126. DOI: 10.1371 / journal.pone.0041126
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моди С., Стэнтон А. В., Мортимер П. С. и Левик Дж. Р. (2007). Клиническая оценка лимфотока человека с использованием констант скорости удаления интерстициальных макромолекул: критический обзор лимфосцинтиграфии. Лимфат. Res. Биол. 5, 183–202. DOI: 10.1089 / lrb.2007.5306
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мохамед-Али, В., Гудрик, С., Равеш, А., Кац, Д. Р., Майлз, Дж. М., Юдкин, Дж. С. и др. (1997). Подкожная жировая ткань высвобождает интерлейкин-6, но не фактор некроза опухоли альфа in vivo. J. Clin. Эндокринол. Метаб. 82, 4196–4200. DOI: 10.1210 / jc.82.12.4196
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Накамура К., Радхакришнан К., Вонг Ю. М. и Роксон С. Г. (2009). Противовоспалительная фармакотерапия кетопрофеном улучшает экспериментальную лимфатическую сосудистую недостаточность у мышей. PLoS One 4: e8380. DOI: 10.1371 / journal.pone.0008380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
О’Доннелл, Т. Ф. младший, Расмуссен, Дж. К., и Севик-Мурака, Э. М. (2017). Новые диагностические методы в оценке лимфедемы. J. Vasc. Surg. Венозный. Лимфат. Disord. 5, 261–273. DOI: 10.1016 / j.jvsv.2016.10.083
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Огата, Ф., Фудзиу, К., Косима, И., Нагаи, Р., и Манабе, I. (2015). Фенотипическая модуляция гладкомышечных клеток при лимфедеме. Br. J. Dermatol. 172, 1286–1293. DOI: 10.1111 / bjd.13482
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ольшевский В., Маховски З., Соколовски Дж. И Нилубович Дж. (1968). Экспериментальная лимфедема у собак. J. Cardiovasc. Surg. (Турин) 9, 178–183.
Google Scholar
Ольшевский, В. Л. (2002). Паттерны сократимости нормальной и патологически измененной лимфатической системы человека. Ann. Акад. Sci. 979, 52–63; обсуждение 76–59.
PubMed Аннотация | Google Scholar
Ольшевский, В. Л., Джамал, С., Лукомска, Б., Манокаран, Г., и Гржелак, И. (1992). Иммунные белки жидкости-лимфы периферических тканей у пациентов с филяриальной лимфедемой нижних конечностей. Лимфология 25, 166–171.
PubMed Аннотация | Google Scholar
Петрек, Дж. А., Сени, Р. Т., Петерс, М., и Розен, П. П. (2001). Лимфедема в когорте выживших после рака груди через 20 лет после постановки диагноза. Рак 92, 1368–1377. DOI: 10.1002 / 1097-0142 (20010915) 92: 6 <1368 :: help-cncr1459> 3.0.co; 2-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Rajic, Z., Hadjipavlou-Litina, D., Pontiki, E., Kralj, M., Suman, L., и Zorc, B. (2010). Новые кетопрофенамиды — синтез и биологическая оценка в качестве антиоксидантов, ингибиторов липоксигеназы и цитостатических агентов. Chem. Биол. Препарат, средство, медикамент. Des. 75, 641–652. DOI: 10.1111 / j.1747-0285.2010.00963.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Раджу, А., и Чанг, Д. В. (2015). Перенос васкуляризированных лимфатических узлов для лечения лимфедемы: всесторонний обзор литературы. Ann. Surg. 261, 1013–1023. DOI: 10.1097 / SLA.0000000000000763
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ринкон К., Шах П., Рамелла-Роман Дж. И Бхансали С. (2016). Обзор инженерных подходов к обнаружению лимфедемы. IEEE Rev. Biomed. Англ. 9, 79–90. DOI: 10.1109 / RBME.2016.2582178
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роксон, С.Г. (2018). Лимфедема после лечения рака груди. N. Engl. J. Med. 379, 1937–1944.
Google Scholar
Роксон С.Г., Тиан В., Цзян X., Кузнецова Т., Хаддад Ф., Зампелл Дж. И др. (2018). Пилотные исследования демонстрируют потенциальные преимущества противовоспалительной терапии лимфедемы человека. JCI Insight 3: e123775. DOI: 10.1172 / jci.insight.123775
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рутковски, Я.М., Мархус, К. Э., Дьенге, К. С., Алитало, К., Уиг, Х. и Шварц, М. А. (2010). Отложение кожного коллагена и липидов коррелирует с набуханием тканей и гидравлической проводимостью при первичной лимфедеме мышей. Am. J. Pathol. 176, 1122–1129. DOI: 10.2353 / ajpath.2010.0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райан Т. Дж. (1995). Ориентиры в понимании лимфатической функции и лечении отеков. Clin. Дерматол. 13, 417–418.DOI: 10.1016 / 0738-081x (95) 00090-3
CrossRef Полный текст | Google Scholar
Советский, И. Л., Ганта, С., Гарденье, Дж. К., Торриси, Дж. С., Гарсия Норес, Г. Д., Хеспе, Г. Е. и др. (2015). Цитокины Th3 подавляют лимфангиогенез. PLoS One 10: e0126908. DOI: 10.1371 / journal.pone.0126908
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Советский И. Л., Торриси Дж. С., Куззоне Д. А., Ганта С., Альбано Н. Дж., Гарденье, Дж. К., и другие. (2014). Ожирение усиливает воспаление и ухудшает лимфатическую функцию на мышиной модели лимфедемы. Am. J. Physiol. Heart Circ. Physiol. 307, h265 – h272. DOI: 10.1152 / ajpheart.00244.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скаллан, Дж. П., Завьеха, С. Д., Касторена-Гонсалес, Дж. А., и Дэвис, М. Дж. (2016). Лимфатическая помпа: механика, механизмы и неисправности. J. Physiol. 594, 5749–5768. DOI: 10.1113 / JP272088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шеллер, Дж., Халарис, А., Шмидт-Аррас, Д., и Роуз-Джон, С. (2011). Про- и противовоспалительные свойства цитокина интерлейкина-6. Biochim. Биофиз. Acta 1813, 878–888. DOI: 10.1016 / j.bbamcr.2011.01.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ширгер А., Харрисон Э. и Джейнс Дж. (1962). Идиопатическая лимфедема. Рассмотрение 131 дела. J. Am. Med. Доц. 182, 14–22.
Google Scholar
Шарки, А. Р., Кинг, С. В., Рамсден, А. Дж., И Фернисс, Д. (2017). Уменьшают ли хирургические вмешательства при лимфедеме конечностей частоту приступов целлюлита? Микрохирургия 37, 348–353. DOI: 10.1002 / micr.30115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шин К., Катару Р. П., Парк Х. Дж., Квон Б. И., Ким Т. В., Хонг Ю. К. и др. (2015). Клетки Th3 и их цитокины регулируют образование и функцию лимфатических сосудов. Nat. Commun. 6: 6196. DOI: 10.1038 / ncomms7196
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Синклер, С.А., Свиланд, Л., и Натараджан, С. (1998). Ангиосаркома, возникающая при хроническом лимфатическом отеке ноги. Br. J. Dermatol. 138, 692–694. DOI: 10.1046 / j.1365-2133.1998.02188.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смельцер Д. М., Стиклер Г. Б. и Ширгер А. (1985). Первичная лимфедема у детей и подростков: последующее исследование и обзор. Педиатрия 76, 206–218.
Google Scholar
Шринивасан, Р. С., Эскобедо, Н., Янг, Ю., Интериано, А., Диллард, М. Э., Финкельштейн, Д., и др. (2014). Петля обратной связи Prox1-Vegfr3 поддерживает идентичность и количество предшественников лимфатических эндотелиальных клеток. Genes Dev. 28, 2175–2187. DOI: 10.1101 / gad.216226.113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сунь, Д., Ю, З., Чен, Дж., Ван, Л., Хань, Л., и Лю, Н.(2017). Значение использования SkinFibroMeter для диагностики и оценки вторичной лимфедемы и связанного с ней фиброза кожи нижних конечностей. Лимфат. Res. Биол. 15, 70–76. DOI: 10.1089 / lrb.2016.0029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сзуба А., Скобе М., Карккайнен М. Дж., Шин В. С., Бейнет Д. П., Роксон Н. Б. и др. (2002). Лечебный лимфангиогенез с человеческим рекомбинантным VEGF-C. FASEB J. 16, 1985–1987. DOI: 10.1096 / fj.02-0401fje
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Табибиазар, Р., Чунг, Л., Хан, Дж., Суонсон, Дж., Бейлхак, А., Ан, А. и др. (2006). Воспалительные проявления экспериментальной лимфатической недостаточности. PLoS Med. 3: e254. DOI: 10.1371 / journal.pmed.0030254
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тан, П. В., Го, Т., Нономура, Х., и Тан, Б. К. (2016). Прикорневые сосуды подчелюстных и верхних яремных лимфатических узлов шеи: анатомическое исследование переноса васкуляризированных лимфатических узлов на лимфедему конечностей. Ann. Пласт. Surg. 76, 117–123. DOI: 10.1097 / SAP.0000000000000582
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Таширо К., Фенг Дж., Ву С. Х., Машико Т., Канаяма К., Нарушима М. и др. (2017). Патологические изменения жировой ткани при вторичном лимфатическом отеке. Br. J. Dermatol. 177, 158–167. DOI: 10.1111 / bjd.15238
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тиан В., Роксон С. Г., Цзян X., Ким, Дж., Бегай, А., Шаффл, Э. М. и др. (2017). Антагонизм лейкотриена B4 облегчает экспериментальную лимфедему. Sci. Пер. Med. 9: eaal3920. DOI: 10.1126 / scitranslmed.aal3920
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Triacca, V., Pisano, M., Lessert, C., Petit, B., Bouzourene, K., Nahimana, A., et al. (2019). Экспериментальное дренажное устройство для уменьшения лимфообращения на модели крысы. Eur. J. Vasc. Эндоваск. Surg. 57, 859–867. DOI: 10.1016 / j.ejvs.2018.04.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Унно, Н., Нишияма, М., Судзуки, М., Танака, Х., Ямамото, Н., Сагара, Д. и др. (2010). Новый метод измерения лимфатической помпы человека с помощью флуоресцентной лимфографии индоцианина зеленого. J. Vasc. Surg. 52, 946–952. DOI: 10.1016 / j.jvs.2010.04.067
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Виитанен, Т. П., Висури, М. Т., Хартиала, П., Маки, М. Т., Сеппанен, М. П., Суоминен, Э. А. и др. (2013). Функция лимфатических сосудов и секреция лимфатического фактора роста после переноса микрососудистых лимфатических узлов у пациентов с лимфедемой. Пласт. Реконстр. Surg. Glob. Откройте 1, 1–9. DOI: 10.1097 / GOX.0b013e318293a532
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван З., Ким К. Ю., Юн С. Х., Пак Дж. Х., Чой Дж., Бакхит Н. и др. (2020). Облучение ингибирует лимфодренаж на модели задних конечностей мыши с приобретенной лимфедемой. Лимфат. Res. Биол. 18, 16–21. DOI: 10.1089 / lrb.2018.0072
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уорд, Л. С. (2011). Оценка лимфедемы методом биоэлектрической импедансной спектроскопии. Jpn. J. Nurs. Sci. 8: 108; ответ автора 109.
Google Scholar
Витте, К. Л. (2001). Насосы и лимфедема. Лимфология 34, 150–151.
Google Scholar
Ву, Г., Сюй, Х., Чжоу, В., Юань, X., Янг, З., Янг, К., и др. (2014). Обезьяна-резус — это новая модель вторичной лимфедемы верхней конечности. Внутр. J. Clin. Exp. Патол. 7, 5665–5673.
Google Scholar
Ву, X., Чжуо, С., Чен, Дж., И Лю, Н. (2011). Визуализация коллагена in vivo в лимфедематозной коже в реальном времени с помощью многофотонной микроскопии. Сканирование 33, 463–467. DOI: 10.1002 / sca.20266
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янг, К. Ю., Нгуен, Д.Х., Ву, К. В., Фанг, Ю. Х., Чао, К. Т., Патель, К. М. и др. (2014). Разработка животной модели лимфедемы нижних конечностей с комбинированной лимфаденэктомией и низкой дозой облучения. Пласт. Реконстр. Surg. Glob. Откройте 2: e121. DOI: 10.1097 / GOX.0000000000000064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Юн, Ю.С., Мураяма, Т., Граверо, Э., Ткебучава, Т., Сильвер, М., Карри, К. и др. (2003). Генная терапия VEGF-C увеличивает постнатальный лимфангиогенез и уменьшает вторичную лимфедему. J. Clin. Вкладывать деньги. 111, 717–725. DOI: 10.1172 / jci15830
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Залеска, М. Т., и Ольшевский, В. Л. (2017). Иммунные белки сыворотки при лимфедеме конечностей, отражающие тканевые процессы, вызванные застоем лимфы и хроническим дерматолимфангиоаденитом (целлюлитом). Лимфат. Res. Биол. 15, 246–251. DOI: 10.1089 / lrb.2017.0003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зампелл, Дж.C., Aschen, S., Weitman, E. S., Yan, A., Elhadad, S., De Brot, M., et al. (2012a). Регулирование адипогенеза за счет застоя лимфатической жидкости: часть I. Адипогенез, фиброз и воспаление. Пласт. Реконстр. Surg. 129, 825–834. DOI: 10.1097 / PRS.0b013e3182450b2d
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зампелл, Дж. К., Эльхадад, С., Авраам, Т., Вейтман, Э., Ашен, С., Ян, А. и др. (2012b). Дефицит толл-подобных рецепторов усугубляет воспаление и лимфедему после лимфатической травмы. Am. J. Physiol. Cell Physiol. 302, C709 – C719. DOI: 10.1152 / ajpcell.00284.2011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зампелл, Дж. К., Ян, А., Эльхадад, С., Авраам, Т., Вейтман, Э., и Мехрара, Б. Дж. (2012c). Клетки CD4 (+) регулируют фиброз и лимфангиогенез в ответ на застой лимфатической жидкости. PLoS One 7: e49940. DOI: 10.1371 / journal.pone.0049940
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Диагностика и лечение лимфатических сосудистых заболеваний
Лимфатическая сосудистая сеть состоит из сети сосудов, которые необходимы как для гомеостаза жидкости, так и для опосредования региональных иммунных реакций.В здоровом состоянии лимфатическая сосудистая сеть обладает необходимой транспортной способностью для размещения наложенной на нее нагрузки жидкости. Наиболее легко узнаваемым признаком недостаточности лимфатических сосудов является наличие характерного набухания тканей, называемого лимфедемой , которое возникает как следствие недостаточного транспорта лимфы. Диагноз лимфатического сосудистого заболевания во многом зависит от физического обследования. Если диагноз остается под вопросом, наличие лимфатической сосудистой недостаточности можно установить с помощью визуализации, включая непрямую радионуклидную лимфосцинтиграфию.Помимо лимфосцинтиграфии, клинически значимые методы визуализации включают магнитно-резонансную томографию и компьютерную аксиальную томографию. Современный терапевтический подход к лимфатическому отеку основан на физиотерапевтических методах. Комплексная противоотечная физиотерапия — это эмпирический эффективный многокомпонентный метод, предназначенный для уменьшения объема конечностей и поддержания здоровья кожи и поддерживающих структур. Применение фармакологической терапии заметно отсутствовало в стратегиях лечения состояний лимфатической сосудистой недостаточности.В целом подходы, основанные на лекарствах, были в лучшем случае противоречивыми. Хирургические подходы к улучшению лимфатического потока через сосудистый реанастомоз в значительной степени оказались безуспешными, но контролируемая липосакция дает длительные преимущества у отдельных пациентов. В будущем могут быть разработаны специально разработанные молекулярные терапевтические средства для облегчения контролируемого возобновления роста поврежденных, дисфункциональных или облитерированных лимфатических сосудов, чтобы обойти или смягчить сосудистую недостаточность, которая приводит к отеку и разрушению тканей.
Ключевые слова
лимфатический
лимфедема
сосудистая недостаточность
отек
лимфангиогенез
лимфатическое сосудистое заболевание
Аббревиатуры и аббревиатуры
CDPTAM0002 комплекс 9000 CDPT
0002 Синдром децитологии ручной лимфодренаж
VEGFфактор роста эндотелия сосудов
VEGFRРецептор фактора роста сосудистого эндотелия
Рекомендуемые статьиЦитирующие статьи (0)
Copyright © 2008 American College of Cardiology Foundation.
