отзывы о лечении заболеванияФлебологический Центр «Антирефлюкс»
К сожалению, острый тромбоз глубоких вен нижних конечностей – заболевание достаточно распространенное. Виной тому и гиподинамический образ жизни, и «сидячая» работа – например, водителем, бухгалтером или программистом, и частые авиаперелеты, и многие другие факторы.
Именно поэтому все большее число людей интересуют отзывы о лечении острого тромбоза глубоких вен нижних конечностей. Известно, что лечение может быть либо хирургическим, либо консервативным. Разумеется, большинство пациентов предпочло бы консервативное лечение – без радикального вмешательства в организм – однако, не во всех случаях можно обойтись без операции на венах. И, дабы не пришлось прибегать к хирургии, помните, что ни в коем случае нельзя затягивать со своевременным лечением.
К счастью, прогресс не стоит на месте – и сегодня вместо традиционных хирургических методов специалистыФлебологического Центра НМХЦ им. Н.И. Пирогова могут предложить своим пациентам малоинвазивное (безоперационное) лечение. К примеру, стентирование подвздошных вен – высокоэффективную процедуру, которую хвалят и доктора, и пациенты.
Пирогова могут предложить своим пациентам малоинвазивное (безоперационное) лечение. К примеру, стентирование подвздошных вен – высокоэффективную процедуру, которую хвалят и доктора, и пациенты.
Итак, что же такое стентирование — лечение острого тромбоза глубоких вен нижних конечностей, отзывы о котором самые положительные:
- Стентирование – малоинвазивный, но весьма эффективный метод лечения, позволяющий, в отличие от традиционных операций, обойтись без повреждения биологических тканей (разрезов)
- Стентирование позволяет восстановить просвет вен, поврежденных тромботической болезнью
- Стентирование минимизирует проявления посттромботической болезни
Отзывы о лечении острого тромбоза глубоких вен нижних конечностей при помощи стентирования хорошие именно потому, что эта инновационная методика не только помогает решить уже существующую проблему (тромбоз), но и предотвратить развитие повторного тромбоза или посттромботической болезни, часто отравляющей пациенту жизнь и плохо поддающейся консервативному лечению.
Приходите на прием к специалистам Флебологического Центра НМХЦ им. Н.И. Пирогова: Вы узнаете все подробности проведения стентирования подвздошных вен и поймете, почему доктора так приветствуют данную методику.
ЛЕЧЕНИЕ ОСТРОГО ТРОМБОЗА ГЛУБОКИХ ВЕН НИЖНИХ КОНЕЧНОСТЕЙ В АМБУЛАТОРНЫХ УСЛОВИЯХ
1. Балуда В.П. Физиология системы гемостаза. /Балуда В.П., Балуда М.В., Деянов Н.И., и др. //. М. — Медицина. — 1995. — с. 243.
2. Баркаган З.С. Тромбофилия, характеризующаяся резистентностью к антикоагулянтам прямого действия. /Баркаган З.С., Буевич Е.И., Тимошенко Е.А.//. Терапевт, арх. 1995. — №7. — с. 50-52.
3. Баркаган З.С. Диагностика и контролируемая терапия нарушений гемостаза. /Баркаган З.С., Момот А.П.//. М. Ньюдиамед. — 2001. — с. 296.
4. Баркаган З.С. Основы диагностики нарушений гемостаза. /Баркаган З.С., Момот А.Ш/. М. Ньюдиамед. — 1999. — с. 224.
5. Баркаган З.С. Ошибки, просчеты и пути совершенствования клинического применения низкомолекулярных гепаринов. /Баркаган З.С., Цывкина Л.П., Момот А.П., и др.//. Клиническая фармакология и терапия. 2002. — 11(1). — с. 78-83.
/Баркаган З.С., Цывкина Л.П., Момот А.П., и др.//. Клиническая фармакология и терапия. 2002. — 11(1). — с. 78-83.
6. Бокарев И.Н. Достижения и эволюция гепаринотерапии. /Бокарев И.Н.//. Тромбы, кровоточивость и болезни сосудов. 2003. — 3. — с. 4-14.
7. Бокарев И.Н. Современные достижения и проблемы противотромботической терапии. /Бокарев И.Н.//. Терапевт, арх. 1993. -т.65. — №10. — с. 101-105.
8. Боровков С.А. Клинико-морфологические параллели при тромботических поражениях вен подвздошно-бедренного сегмента и их последствия. /Боровков С.А., Демис ДТ.П. Клиническая хирургия. 1975. — №1. — с. 812.
9. Ю.Ильин В.Н. Методы антикоагулянтной терапии при остром тромбозе магистральных вен. /Ильин В.Н.//. Автореферат дисс. канд. М. — 1974.
10. П.Кириенко А.И. Острый венозный тромбоз: базовые принципы терапии. /Кириенко А.И., Матюшенко A.A., Андрияшкин В.В.//. Consilium-medicum приложение. 2001. — 3(7). — с. 1-7.
11. Кириенко А.И. Клексан при лечении острого венозного тромбоза.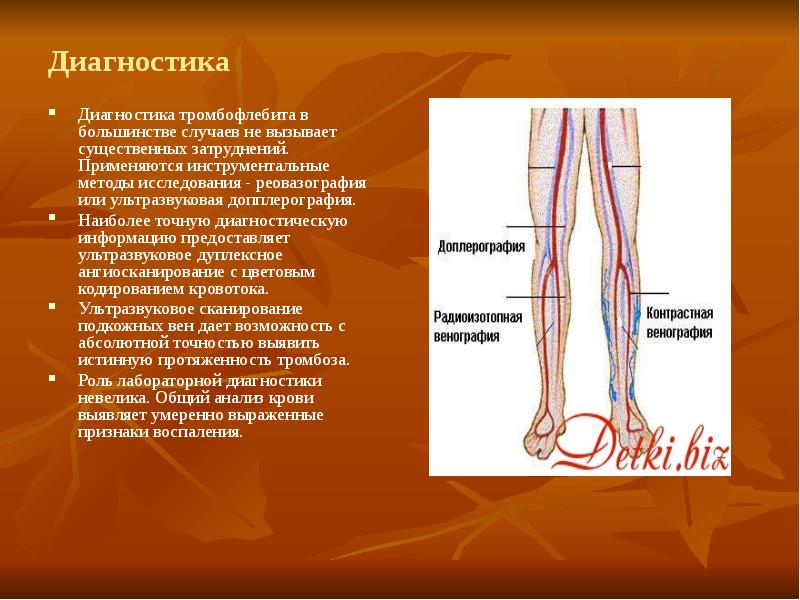 /Кириенко А.И., Золотухин И.А.//. Тер. архив. 1998. — №9. — с.91-92.
/Кириенко А.И., Золотухин И.А.//. Тер. архив. 1998. — №9. — с.91-92.
12. Кириченко JI.JI. Лечение непрямыми антикоагулянтами. /Кириченко Л.Л.//. Кардиология. 1988. — т.28. — №10. — с. 109-113.
13. Конюхов С.Г. Применение фибринолизина и антикоагулянтов при лечении тромбозов вен конечностей. /Конюхов С.Г., Никофорова Т.В.//. Вестник хирургии. 1971. — №2. — с. 72-75.
14. Конюхов С.Г. Длительная антикоагулянтная терапия при остром подвздошно-бедренном венозном тромбозе. /Конюхов С.Г., Малахов В.П.//. Клиническая медицина. 1984. — №7. — с. 44-46.
15. Кудряшов Б.А. В кн. Биологические проблемы регуляции жидкого состояния крови и ее свертывания. /Кудряшов Б.А.//. М. 1975.
16. Леонтьев С.Г. Консервативная терапия при острых тромбозах системы нижней полой вены. /Леонтьев С.Г., Капранов С.А., Ан Е.С. и др.//. Третья ежегодная сессия НЦССХ им. А.Н. Бакулева. 23-25 мая. — 1999. — с. 65.
17. Макацария А.Д. В кн. Тромбофилические состояния в акушерской практике. /Макацария А. Д., Бицадзе В.О.//. М. Руссо. — 2001. — с. 704.
Д., Бицадзе В.О.//. М. Руссо. — 2001. — с. 704.
18. Малиновский H.H. Антитромботическая и тромболитическая терапия в хирургии. /Малиновский H.H., Козлов В.А.//. М. Медицина. — 1976. — с. 424.
19. Моисеев B.C. Низкомолекулярные гепарины. /Моисеев B.C.//. Клин, фармакол. тер. 2000. — 9(1). — с. 2-8.
20. Панченко В.М. В кн. Клиническа коагуляция. /Панченко В.М.//. М. 1970.111
21. Панченко Е.П. Противотромботические препараты. /Панченко Е.П.//. Клин, фармакол. тер. 1997. — 3. — с. 38.
22. Панченко Е.П. В кн. Тромбозы в кардиологии. Механизмы развития и возможности терапии. /Панченко Е.П., Добровольский А.Б.//. М. Спорт и культура. — 1999. — с. 464.
23. Папаян Л.П. Д-димер в клинической практике. /Папаян Л.П., Князева Е.С.//. Пособие для врачей. М. — Инсайт полиграфик. — 2002. — с. 20.
24. Родионов С.В. Комплексная антитромботическая терапия при остром подвздошно-бедренном венозном тромбозе. /Родионов С.В.//. Автореферат дисс. канд. М. — 1979.
25. Савельев B.C. Флебология. /Савельев B.C., Гологорский В.А., Кириенко А.И. и др.//. Руководство для врачей. М. — Медицина. — 2001. — с. 664.
Савельев B.C. Флебология. /Савельев B.C., Гологорский В.А., Кириенко А.И. и др.//. Руководство для врачей. М. — Медицина. — 2001. — с. 664.
26. Савельев B.C. Болезни вен. В кн. Болезни сердца и сосудов (Под редакцией Чазова Е.И.). /Савельев B.C., Яблоков Е.Г.//. М. Медицина. -1992.-т.З.-с. 417-443.
27. Ферстрате М. Проблемы и перспективы клинического применения гепарина. /Ферстрате М.//. Кардиология. 1981. — т.21. — №8. — с. 28-31.
28. Ферстрате М. Тромбозы (перевод с французского). /Ферстрате М., Фермилен Ж.//. М. Медицина. — 1986. — с. 336.
29. Чазов Е.И. В кн. Антикоагулянты и фибринолитические средства. /Чазов Е.И., Лакин К.М.//. М. 1977.
30. Abildgaard U. Highly purified antithrombin 3 with heparin cofactor activity prepared by disc electrophoresis. /Abildgaard U.//. Scand J Clin Lab Invest. -1968.-21.-p. 89-91.
31. Abramovicz M. Lepirudin for heparin-induced thrombocytopenia. /Abramovicz M.H. Med Lett Drugs Ther. 1998. — 40. — p. 94-95.
32. Ageno W. Home-treatment of deep vein thrombosis in patient with cancer.// Haematologica 2005; 90:220-224
Ageno W. Home-treatment of deep vein thrombosis in patient with cancer.// Haematologica 2005; 90:220-224
33. Agnelli G. Effects of standard heparin and low molecular weight heparin (Kabi 2165) on fibrinolysis. /Agnelli G., Borm J., Cosmi B., et al.//. Thromb Haemost.- 1988. Oct 31. — 60. — p. 311-313.
34. Altman R. Efficacy of unfractionated heparin, low molecular weight heparin and both combined for releasing total and free tissue factor pathway inhibitor. /Altaian R., Scazziota A., Rouvier J.//. Haemostasis. 1998. — 28. — p. 229-235.
35. Ansell J. Managing oral anticoagulant therapy. /Ansell J., Hirsh J., Dalen J., et al.//. Chest. 2001. — 119. — p. 228-283.
36. Arnesen H., Hoiseth A., Ly B. Streptokinase or heparin in the treatment of deep vein thrombosis: follow-up results of a prospective trial. /Arnesen H., Hoiseth A., Ly B.//. Acta Med Scand. 1982. — 211. p. 65.
37. Aujesky D. Uptake of new treatment strategies for deep vein thrombosis: an international audit. International Journal for Quality in Health Care 2004; Volume 16, Number 3: pp. 193-200
38. Basu D. A prospective study of the value of monitoring heparin treatment with the activated partial thromboplastin time. /Basu D., Gallus A., Hirsh J., et al.//. N Engl J Med. 1972. — 287. — p. 325-327.
39. Bates S.M. A latex D-dimer reliably excludes venous thromboembolism. /Bates S.M., Grand’Maison A., Johnston M. et al.//. Arch Intern Med. 2001. — 161. -p. 447-453.
40. Belt A.G. Replacing inpatient care by outpatient care in the treatment of deep venous thrombosis: an economic evaluation: TASMAN Study Group, /van den Belt A.G., Bossuyt P.M., Prins M. H., et al.//. Thromb Haemost. 1998. — 79. -p. 259-263.
41. Bergqvist D. Incidence of venous thromboembolism in medical and surgical patients. /Bergqvist D, Lundblad B.//. London. Med-Orion Press. — 1994. — p. 3.
42. Bernardi E. The post-thrombotic syndrome. /Bernardi E., Prandoni P.//. Curr Opin Pulm Med. 2000. — Jul. — 6(4). — p. 335-342.
— 6(4). — p. 335-342.
43. Blajchman M.A. Effects of unfractionated heparin, dermatan sulfate and low molecular weight heparin on vessel wall permeability in rabbits. /Blajchman M.A., Young E., Ofosu F.A.//. Ann N Y Acad Sci. 1989. — 556. — p. 245-254.
44. Blattler W. Implementation of outpatient treatment of deep vein thrombosis in private practices in Germany. I I Eur J Vase Endovasc Surg 30, 319-324 (2005)
45. BoccaIon |H. Clinical outcome and cost of hospital vs home treatment of proximal deep vein thrombosis with low-molocular-heparins.// Arch Intern Med. 200:160:1769-1773
46. Boisclair M.D. Assessment of hypercoagulable states by measurement of activation fragments and peptides. /Boisclair M.D., Ireland H., Lane D.A.//. Blood Rev. 1990. — 4. — p. 25-40.
47. Borris L.C. Thromboprophylaxis with low-molecular weight heparin after major orthopaedic surgery is cost effective. /Borris L.C., Lassen M.R.//. Drags. 1996.-suppl.7.-p. 42-46.
48. Boshcov L. K. Heparin-induced thrombocytopenia and thrombosis: clinical and laboratory studies. /Boshcov L.K., Warkentin T.E., Hayward C.P., et al.//. Br J Heamatol. 1993. — 84. — p. 322-328.
K. Heparin-induced thrombocytopenia and thrombosis: clinical and laboratory studies. /Boshcov L.K., Warkentin T.E., Hayward C.P., et al.//. Br J Heamatol. 1993. — 84. — p. 322-328.
49. Boucher M. Shifting from inpatient to outpatient treatment of deep vein thrombosis in a tertiary care center: a cost-minimization analysis. /Boucher M., Rodger M., Johnson J.A., et al.//. Pharmacotherapy. 2003. — Mar. — 23(3). — p. 301-309.
50. Brandjes D.PM. Acenocoumarol and heparin compared with acenocoumarol alone in the initial treatment of proximal vein thrombosis. /Brandjes D.PM., Heijboer H., Buller H.R., et al.//. N Engl J Med. 1992. — 327. — p. 1485-1489.
51. Brill-Edwards P. Safety of withholding antepatrum heparin despite previous venous thromboembolism (VTE). /Brill-Edwards P., Ginsberg J.S.//. Thromb Haemost. 1999. — 2097. — p. 664.
52. Brill-Edwards P. Establishing a therapeutic range for heparin therapy. /Brill-Edwards P., Ginsberg J.S., Johnston M., et al.//. Ann Intern Med. 1245.
1245.
55. Cina G. Epidemiology, pathophisiology, and natural history of venous thromboembolism. Raus. /Cina G., Marrd R., Di Stasi C., et al.//. 1996. — Jul-Sep. — Vol. 21. — № 3. — p. 315 — 327.
56. Cines D.B. Immune endothelial-cell injury in the heparin-associated thrombocytopenia. /Cines D.B., Tomaski A., Tannenbaum S.//. N Engl J Med. 1987.-316.-p. 581-589.
57. Cohen M. A comparison of low molecular weight heparin with unfractionated heparin for unstable coronary artery disease. /Cohen M., Demers C., Gurfinlcel E.P., et al.//. New Engl J Med. 1997. — 337. — p. 447-452.
58. Collins R. Clinical effects of anticoagulant therapy in suspected acute myocardial infarction: systematic overview of randomised trials. /Collins R., MacMahon S., Flather M., et al.//. Br Med J. 1996. — 313. — p. 652-659.
59. Constans J. Clinical prediction of lower limb deep vein thrombosis in symptomatic hospitalized patients. /Constans J., Nelzy M.L., Salmi L.R., et al.//. Thromb Haemost. 2001. — 86. — p. 985-990.
2001. — 86. — p. 985-990.
60. Danhof M. Pharmacokinetic considerations on Orgaran (Org 10172) therapy. /Danhof M., de Boer A., Magnani H.N., et al.//. Haemostasis. 1992. — 22. — p. 73-84.
61. Das S.K. Low-molecular weight heparin versus warfarin for prevention of recurrent venous thromboembolism: a randomised trial. /Das S.K., Cohen A.T., Edmondson R.A., et al.//. World of Surg. 1996. — 20. — p. 521-527.
62. Davydov L. Outcomes of weight-based heparin dosing based on literature guidelines and institution individualization. /Davydov L., Dietz P.A., Lewis P., et al.//. Pharmacotherapy. 2000. — 20(10). — p. 1179-1183.
63. Dempfle C.E. Use of D-dimer assays in the diagnosis of venous thrombosis. /Dempfle C.E.//. Semin Thromb Hemost. 2000. — 26(6). — p. 631-641.
64. Douketis J.D. Risk of fatal pulmonary embolism in patient with treated venous thromboembolism. /Douketis J.D., Kearon C., Bates S., et al.//. JAMA. 1998. — 279. — p. 458-462.
65. Douketis J.D Treatment of deep vein thrombosis. What factors determine appropriate treatment? // Can Fam Physician 2005;51:217-223.
What factors determine appropriate treatment? // Can Fam Physician 2005;51:217-223.
66. Edes T.E. Heparin-induced hyperkalemia. /Edes T.E., Sunderrajan E.V.//. Arch Intern Med. 1985. — 145. — p. 1070-1072.
67. Eikelboom J. Baker R. Routine home treatment of deep vein thrombosis.// BMJ 2001;322;1192-1193
68. Elg M. Antithrombotic effects and bleeding time of thrombin inhibitors and warfarin in the rat. /Elg M., Gustafsson D., Carlsson S.// Thromb Res. 1999. -94.-p. 187-197.
69. Erikssoa E. Heparin and fibrinolysis-comparison of subcutaneous administration of unfractionated and low molecular weight heparin. /Erikssoa E., Wollter I.M., Christenson B., et al.// Thromb Haemost. 1988. — Apr 8. -59. — p. 284-288.
70. Eriksson B.I. A comparative study of free low-molecular weight heparin (LMWH) and unfractionated heparin (UH) in healthy volunteers. /Eriksson B.I., Soderberg K., Windlund L., et al.//. Thromb Haemost. 1995. — 73. — p. 398401.
71. Everett R.N. Warfarin-induced skin necrosis: a cutaneous sign of malignancy? /Everett R. N., Jones F.L.//. Postgrad Med. 1986. — 79. — p. 97-103.
N., Jones F.L.//. Postgrad Med. 1986. — 79. — p. 97-103.
72. Falanga A. The hypercoagulable state in cancer patient: evidence for impaired thrombin inhibitions. /Falanga A., Ofosu F.A., Oldani E., et al.//. Blood Coagul Fibrinolysis. 1994. — Suppl 1. — p. 19-23.
73. Fiessinger J.N. Once-daily subcutaneous dalteparin, a low molecular weight heparin, for the initial treatment of acute deep vein thrombosis. /Fiessinger J.N., Lopez-Fernandez M., Gatterer E., et al.//. Thromb Haemost. 1996. — 76. — p. 195-199.
74. Fischer M. Dangerous thrombocytopenia in thrombolytic therapy of venous thrombosis of the leg. /Fischer M., Tempel J., Schenker G.//. Vasa. 1997. -Aug. — 26(3). — p. 235-238.
75. Gallus A. Safety and efficacy of warfarin started early after submassive venous thrombosis or pulmonary embolism. /Gallus A., Jackaman J., Tillett J., et al.//. Lancet. 1986. — 2. — p. 1293-1296.
76. Gando S. Posttrauma coagulation and fibrinolysis. /Gando S., Tedo I., Kubota MM. Crit Care Med. 1992. — 20. — p. 594-600.
Crit Care Med. 1992. — 20. — p. 594-600.
77. Ginsberg J.S. A D-dimer in patients with clinically suspected pulmonary embolism. /Ginsberg J.S., Brill-Edwards P., Demers C., et al.//. Chest. 1993. -104.-p. 1679-1684.
78. Glazier R.L. Randomized prospective trial of continuous versus intermittent heparin therapy. /Glazier R.L., Crowell E.B.//. JAMA. 1976. — 236. — p. 13651367.
79. Goldhaber S.Z. Prevention of venous thromboembolism. /Goldhaber S.Z.//. New York. 1993.-p. 608.
80. Goldhaber S.Z. Randomized controlled trial of tissue plasminogen activator in proximal deep venous thrombosis. /Goldhaber S.Z., Meyerovitz M.F., Green D., et al.//. Am J Med. 1990. — 88. — p. 235-240.
81. Grau E. Home treatment of deep vein thrombosis with low-molecular-weight heparin: long term incidence of recurrent venous thromboembolism. // American Journal of Hematology 67:10-14 2001
82. Greinacher A. A rapid and sensitive test for diagnosing heparin-associated thrombocytopenia. /Greinacher A., Michel I., Kiefel V., et al.//. Thromb Haemost. 1991. — 66. — p. 734-736.
/Greinacher A., Michel I., Kiefel V., et al.//. Thromb Haemost. 1991. — 66. — p. 734-736.
83. Greinacher A. Recombinant hirudin (lepirudin) provides safe and effective anticoagulation in patients with heparin-induced thrombocytopenia: A prospective study. /Greinacher A., Volpel H., Janssens U., et al.//. Circulation. 1999.-99.-p. 73-80.
84. Haas S. Deep vein thrombosis: beyond the operating table. /Haas S.//. Orthopedics. 2000. — Jun. — 23. — Suppl 6. — p. 629-632.
85. Harrison L. Assesment of outpatient treatment of deep vein thrombosis with low-molecular-weight heparin.// Arh Intern Med. 1998. — 158. — p. 2001-2003.
86. Heaton D. Outpatient treatment of community acquired venous thromboembolism the Christchurch experience. // NZMJ 2002, Vol 115 No 1158
87. Hirsh J. Heparin. /Hirsh J.//. N Engl J Med. 1991. — 324. — p. 1565-1574.
88. Hirsh J. Oral anticoagulants: mechanism of action, clinical effectiveness, and optimal therapeutic range. /Hirsh J., Dalen J. E., Anderson D.R., et al.//. Chest. -2001.- 119. -p. 8-21.
E., Anderson D.R., et al.//. Chest. -2001.- 119. -p. 8-21.
89. Hirsh J. Guide to anticoagulant therapy. Part 2: Oral anticoagulants. /Hirsh J., Fuster V.//. Circulation. 1994. — 89. — p. 1469-1480.
90. Hirsh J. Low molecular weight heparin. /Hirsh J., Levine M.N.//. Blood. -1992.-79. p. 1-17.
91. Hirsh J. Heparin: mechanics of action, pharmacokinetics, dosing considerations, monitoring, efficacy, and safety. /Hirsh J., Raschke R., Warkentin T.E., et al.//. Chest. 1995. — Suppl 8. — p. 258-275.
92. Hirsh J. Heparin and low-molecular-weight heparin: mechanism of action, pharmacokinetics, dosing considerations, monitoring, efficacy, and safety. /Hirsh J., Warkentin T.E., Raschke R., et al.//. Chest. 1998. — 114. — Suppl 5. -p. 489-510.
93. Hull R.D. Adjusted subcutaneous heparin versus warfarin sodium in the long-treatment of venous thrombosis. /Hull R.D., Delmore T.J., Carter C., et al.//. N Engl J Med. 1982. — 306. — p. 189-194
94. Hull R.D. Warfarin sodium versus low-dose heparin in the long-treatment of venous thrombosis. /Hull R.D., Delmore T.J., Genton E., et al.//. N Engl J Med. 1979.-301.-p. 855-858.
/Hull R.D., Delmore T.J., Genton E., et al.//. N Engl J Med. 1979.-301.-p. 855-858.
95. Hull R.D. Different intensities of oral anticoagulant therapy in the treatment of proximal vein thrombosis. /Hull R.D., Hirsh J., Jay R., et al.//. N Engl J Med. 1982. — 307. — p. 1676-1681.
96. Hull R.D. Low-molecular-weight heparin in the treatment of venous thromboembolism. /Hull R.D., Pineo G.F.//. Seminars in thrombosis and hemostasis. 2000. — 26. — Suppl. 1. — p. 61-67.
97. Hull R.D. The importance of initial heparin treatment on long-term clinical outcomes of antithrombotic therapy. The emerging theme of delayed recurrence. /Hull R.D., Rascob G.E., Brant R.F., £t al.//. Arh Intern Med. -1997. 157.-p. 2317-2321.
98. Hull R.D. Continuous intravenous heparin compared with intermittent subcutaneous heparin in the initial treatment of proximal-vein thrombosis. /Hull R.D., Rascob G.E., Hirsh J et al.//. N Engl J Med. 1986. — 315. — p. 11091114.
99. Hull R.D. Subcutaneous low-molecular weight heparin compared with continuous intravenous heparin in the treatment of proximal-vein thrombosis.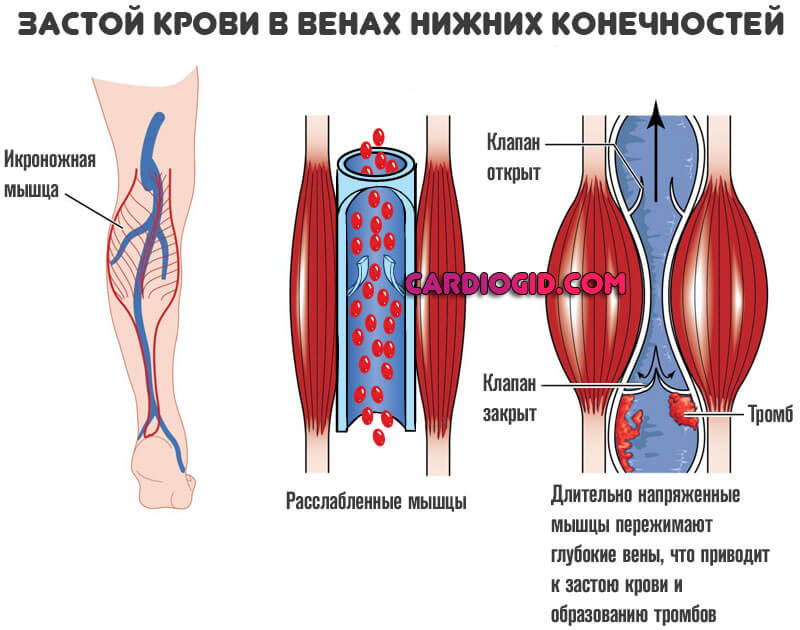 /Hull R.D., Rascob G.E., Pineo G.F., et al.//. N Engl J Med. 1992. — 326. — p. 975-982.
/Hull R.D., Rascob G.E., Pineo G.F., et al.//. N Engl J Med. 1992. — 326. — p. 975-982.
100. Hull R.D. Heparin for 5 days as compared with 10 days in the initial treatment of proximal venous thrombosis. /Hull R.D., Rascob G.E., Rosenbloom D. et al.//. N Engl J Med. 1990. — 322. — p. 1260-1264.
101. Hull R.D. Optimal therapeutic level of heparin therapy in patient with venous thrombosis. /Hull R.D., Rascob G.E., Rosenbloom D. et al.//. Arh Intern Med. 1992. — 152. — p. 1589-1595.
102. Hyers T.M. Antithrombotic therapy for venous thromboembolic disease. /Hyers T.M., Agnelly G., Hull R.D., et al.//. Chest. 1998. — 114. — p. 561-578.
103. Janssen M.C.H. Reliability of five rapid D-dimer assays compared to ELISA in the exclusion of deep venous thrombosis. /Janssen M.C.H., Heebels A.E., de Metz M., et al.//. Thromb Haemost. 1997. — 77. — p. 262-266.
104. Kahn S.R. Clinical prediction of deep vein thrombosis in patients with leg symptoms. /Kahn S.R., Joseph, Abenhaim L. , et al.//. Thromb Haemost. -1999.-81.-p. 353-357.
, et al.//. Thromb Haemost. -1999.-81.-p. 353-357.
105. Kahn S.R. Long-term outcomes after deep vein thrombosis: postphlebitic syndrome and quality of life. /Kahn S.R., Solymoss S., Lamping D.L., et al.//. J Gen Intern Med. 2000. — Jun. — 15(6). — p. 425-429.
106. Kakkar V. V. Prevention and management of venous thrombosis. /Kakkar V. V.//. British Medical Bulletin. 1994. — Vol. 50. — No 4. — p. 871-903.
107. Kakkar V.V. Low-molecular-weight heparin in the acute and long-term treatment of deep vein thrombosis. /Kakkar V.V., Gebska M., Kadziola Z., et al.//. Thromb Haemost. 2003. — Apr. — 89(4). — p. 674-680.
108. Kakkar V.V. Hemodynamic and clinical assessment after therapy for acute deep vein thrombosis. A prospective study. /Kakkar V.V., Lawrence D.//. Am J Surg. 1985. — Oct 8. — 150(4A). — p. 54-63.
109. Kambayashi J. Activation of coagulation and fibrinolysis during surgery, analyzed by molecular markers. /Kambayashi J., Sakon M., Yokota M., et al.//. Thromb Res. 1990. — 60. — p. 157-167.
1990. — 60. — p. 157-167.
110. Kazmier F.J. Thromboembolism, coumarin necrosis, and protein C. /Kazmier F.J.//. Mayo Clin Proc. 1985. — 60. — p. 673-674.
111. Kelly J. Plasma D-dimers in the diagnosis of venous thromboembolism. /Kelly J., Rudd A., Lewis R.R., et al.//. Arch Intern Med. 2002. — Apr 8. -162(7).-p. 747-756.
112. Kelton J.G. Heparin-induced thrombocytopenia. /Kelton J.G.//. Haemostasis. 1986. — 16. — p. 173-186.
113. Khamashta M.A. The management of thrombosis in the antiphospholipid-antibody syndrome. /Khamashta M.A., Cuadrado M.J., Mujic R., et al.//. N Engl J Med. 1995. — 332. — p. 993-997.
114. Kirchner J. T. Outpatient Management of Lower Extremity DVT. // American Family Physician 1, 1999
115. Kovacs M.J Outpatient Treatment of Pulmonary Embolism with Dalteparin. // Thromb Haemost 2000; 83: 209-11
116. Kroegel C. Principle mechanisms underlying venous thromboembolism: epidemiology, risk factors, pathophysiology and pathogenesis. /Kroegel C., Reissig A.//. Respiration. 2003. — 70(1). — p. 7-30.
/Kroegel C., Reissig A.//. Respiration. 2003. — 70(1). — p. 7-30.
117. Labas P. The home treatment of deep vein thrombosis with low molecular weight heparin, forced mobilisation and compression. /Labas P., Ohradka B., Vladimir J., et al.//. Int Angiol. 2000. — Dec. — 19(4). — p. 303-307.
118. Labas P, Ohradka B, Cambal M. Could deep vein thrombosis be safely treated at home? // Bratisl Lek Listy 2001; 102 (10): 458-461
119. Lackie C.L. Weight-based heparin dosing: clinical response and resource utilization. /Lackie C.L., Luzier A.B., Donovan J.A.//. Clin Ther. 1998. — 20. -p. 699-710.
120. Lane B., Harrison M. Outpatient treatment for patients with uncomplicated above knee deep vein thrombosis.// Emerg. Med. J. 2000;17;403-404
121. Lensing A.W. Deep-vein thrombosis. /Lensing A.W., Prandoni P., Buller M.H.//. Lancet. 1999. — 353. — p. 479-485.
122. Lindahl U. Extension and structural variability of the antithrombin-binding sequence in heparin. /Lindahl U. , Thunberg L., Backstrom G., et al.//. J Biol Chem. 1984. — 259. — p. 12368-12376.
, Thunberg L., Backstrom G., et al.//. J Biol Chem. 1984. — 259. — p. 12368-12376.
123. Lindblad B. Incidence of venous thromboembolism verified by necropsy over 30 years. /Lindblad B., Sterby N.H., Berqvist D.//. BMJ. 1991. — 302. — p. 709-711.
124. Loeliger E.A. Progress in the control of oral anticoagulant therapy. /Loeliger E.A.//. Thromb Haemost. 1972. — 28. — p. 109-119.
125. Magnani H.N. Heparin-induced thrombocytopenia (HIT): an overview of 230 patients treated with orgaran. /Magnani H.N.//. Thromb Haemost. 1993. -70. — p. 554-561.
126. Magnani H.N. Heparin-induced thrombocytopenia (HIT): an overview of 230 patients treated with Orgaran (Org 10172). /Magnani H.N.//. Thromb Haemost. 1993. — 70. — p. 554-561.
127. Markward E. Past, present and future of hirudin. /Markward E.//. Haemostasis. -1991.-21.-p. 11-26.
128. Matsuo T. Treatment of heparin-induced thrombocytopenia by use of argatroban, a synthetic thrombin inhibitor. /Matsuo T., Kario K., Chikahira Y. , et al.//. Br J Haematol. 1992. — 82. — p. 627-629.
, et al.//. Br J Haematol. 1992. — 82. — p. 627-629.
129. McGehee W.G. Coumarin necrosis associated with hereditary protein C deficiency. /McGehee W.G., Klotz T.A., Epstein D.J., et al.//. Ann Intern Med. 1984.- 100.-p. 59-60.
130. McKenna R. Is warfarin sodium contraindicated in the lactating mother? /McKenna R., Cale E.R., Vasan U.U. J Pediatr. 1983. — 103. — p. 325-327.
131. Meissner M.H. Markers of plasma coagulation and fibrinolysis after deep venous thrombosis. /Meissner M.H., Zierler B.K., Bergelin R.O., et al.//. J Vase Surg. 2000. — 32. — p. 870-880.
132. Merli G. Subcutaneous enoxaparin once or twice daily compared with intravenous unfractionated heparin for treatment of venous thromboembolic disease. /Merli G., Spiro T.E., Olsson C.G., et al.//. Ann Intern Med. 2001. -134.-p. 191-202.
133. Merlini P.A. Current status of activation markers in ischemic heart disease: markers of coagulation activation. /Merlini P.A., Ardissino D.//. Thromb Haemost. 1997. — 78. — p. 276-279.
— 78. — p. 276-279.
134. Miller K. E. Outpatient vs. inpatient management of acute DVT. // American Family Physician 15, 2002
135. Morris T.A. Antibodies against the fibrin B-chain amino terminus detect active canine venous thrombi. /Morris T.A., Marsh J.J., Konopka R.G., et al.//. Circulation. 1997. — 96. — p. 3173-3179.
136. Nordstrom M. A prospective study of the incidence of deep vein thrombosis within a defined urban population. /Nordstrom M., Lindblad B., Bergqvist D., et al.//. J Intern Med. 1992. — 232. — p.’ 155-160.
137. Padilla A. Inhibition of thrombin generation by heparin and low molecular weight (LMW) heparins in the absence and presence of platelet factor 4 (PF4). /Padilla A., Gray E., Peppers D.S., et al.//. Br J Hematol. 1992. — Oct. — 82. -p. 406-413.
138. Palareti G. Risk of venous thromboembolism recurrence: high negative predictive value of D-dimer performed after oral anticoagulation is stopped. /Palareti G., Legnani C., Cosmi B., et al. //. Thromb Haemost. 2002. — Jan. -87(1).-p. 7-12.
//. Thromb Haemost. 2002. — Jan. -87(1).-p. 7-12.
139. Partsch H. Frequency of PE in patients who have iliofemoral DVT and are treated with once- or twice-daily low-molecular-weight heparin. /Partsch H., Kechavarz B., Mostbeck A., et al.//. J Vase Surg. 1996. — vol. 24. — p. 774782.
140. Perone N. Comparison of four strategies for diagnosing deep vein thrombosis: a cost-effectiveness analysis. /Perone N., Bounameaux H., Perrier A.//. Am J Med. 2001. — Jan. — 110(1). — p. 33-40.
141. Pearson S. An outpatient program to treat deep venous thrombosis with low-molecular-weight heparin. //
142. Pinede L. Optimal duration of anticoagulant therapy after an episode of venous thromboembolism. /Pinede L., Cucherat M., Duhaut P., et al.//. Blood Coagul Fibrinolysis. 2000. — Dec. — 11(8). — p. 701-707.
143. Pini M. Subcutaneous vs. intravenous heparin in the treatment of deep venous thrombosis a randomized clinical trial. /Pini M., Pattachini C., Quintavalla R., et al.//.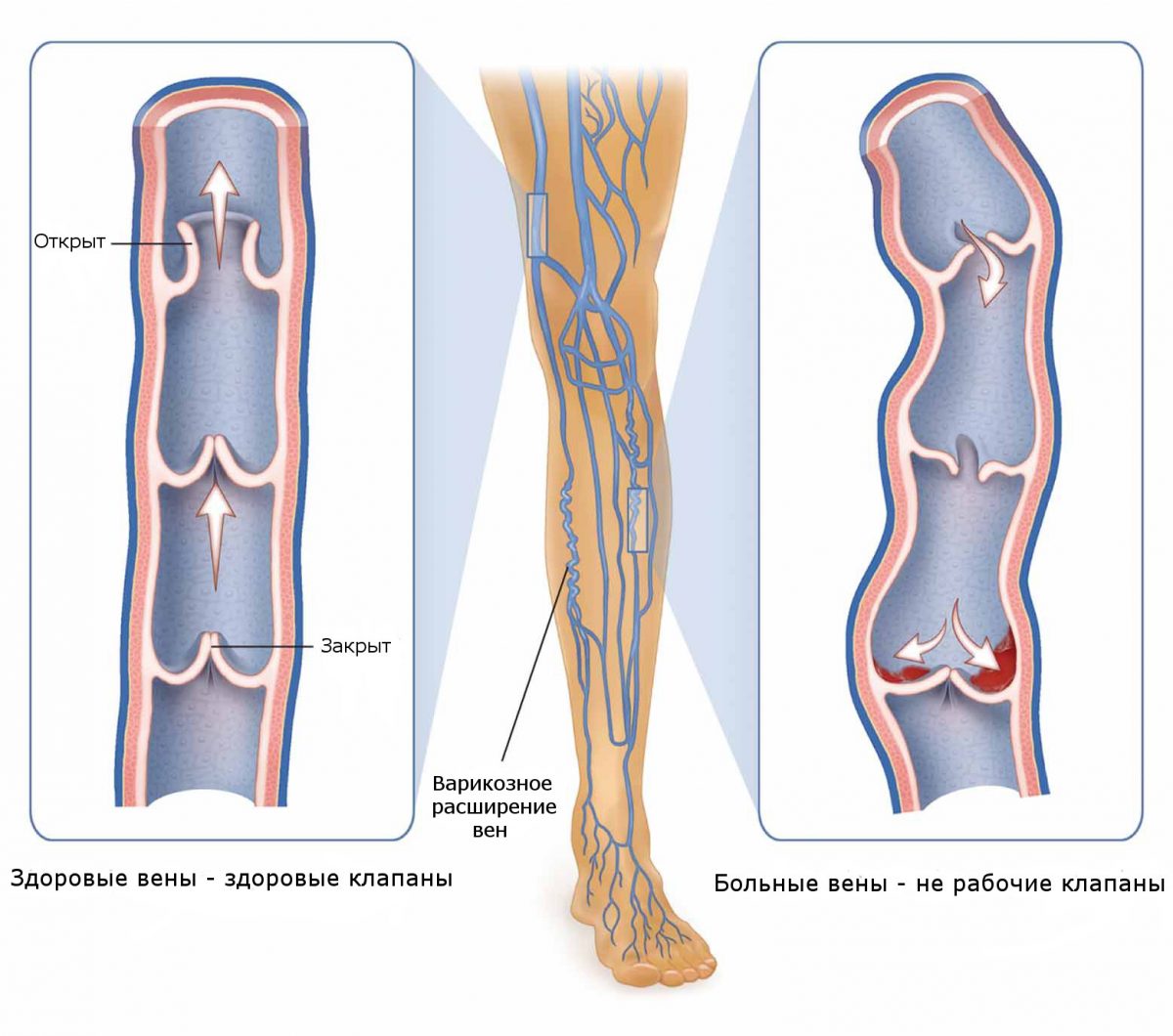 Thromb Haemost. — 1990. — 64. — p. 222-226.
Thromb Haemost. — 1990. — 64. — p. 222-226.
144. Piovella F. Long-term management of deep vein thrombosis. /Piovella F., Barone M.//. Blood Coagul Fibrinolysis. 1999. — Aug 10. — Suppl 2. — p. 11722.
145. Planes A. Prevention of deep vein thrombosis after hip replacement. Comparison between two low-molecular-weight heparins, tinzaparin and enoxaparin. /Planes A., Samama M.M., Lensing A., et al.//. Thromb Haemost. -1999.-81.-p. 22-25.
146. Poller L. Heparin and partial thromboplastin time; an international survey. /Poller L., Tomson J.M., Yee K.F.//. Br J Haematol. 1980. — 44. — p.161-165.
147. Prandoni P. Long-term clinical course of proximal deep venous thrombosis and detection of recurrent thrombosis. /Prandoni P.//. Semin Thromb Hemost. -2001.-27(1).-p. 9-13.
148. Prandoni P. Comparison of subcutaneous LMWH with intravenous standard heparin in proximal deep-vein thrombosis. /Prandoni P., Lensing A.W., Buller H.R., et al.//. Lancet. 1992. — 339. — p. 441-445.
149. Prandoni P. The long-term clinical course of acute deep venous thrombosis. /Prandoni P., Lensing A.W., Cogo A., et al.//. Ann Int Med. 1996. — 125. — p. 1 -7.
150. Prandoni P. Residual venous thrombosis as a predictive factor of recurrent venous thromboembolism. /Prandoni P., Lensing A.W., Prins M.H., et al.//. Ann Intern Med. 2002. — Dec 17. — 137(12). — p. 955-960.
151. Proctor MC, Greenfield LJ, Froehlich JB, Montgomery P, Wakefield TW. Limitations and value of ambulating treatment of DVT. American Venous Forum, February 1999, Dana Point, CA
152. Ramaswami G. The natural history of deep vein thrombosis. /Ramaswami G, Nicolaides A.N.//. London. Med-Orion Press. — 1994. — p. 3.
153. Ramzi D.W, DVT and Pulmonary embolism.// American family physician:69-12
154. Raschke R.A. The weight-based heparin dosing nomogram compared with a «standard care» nomogram: a randomised controlled trial. /Raschke R.A., Reilly B.M., Guidry J.R., et AJÍ. Ann Intern Med. 1993. — 119. — p. 874-881.
1993. — 119. — p. 874-881.
155. Research Committee of the British Thoracic Society. Optimum duration of anticoagulation for deep-vein thrombosis and pulmonary embolism. Lancet. -1992.-340.-p. 873-876.
156. Rodger M. Cost effectiveness of low-molecular-heparins and unfractionated heparin in treatment of deep vein thrombosis.// CMAJ 1998.158.931-8
157. Rodger M. A. The outpatient treatment of deep vein thrombosis delivers cost savings to patients and their families, compared to inpatient therapy. // Thrombosis Research 112 (2003) 13-18
158. Roger D. Yusen. Criteria for outpatient management of proximal deep vein thrombosis Chest 1999;115;972-979
159. Rose P. The outcome of ambulatory DVT management using a multidisciplinary approach. // Clin. Lab. Haem.2001, 23, 301-306
160. Rosenberg R.D. Correlation between structure and function of heparin. /Rosenberg R.D., Lam L.//. Proc Natl Acad Sci USA. 1979. — 76. — p. 12181222.
161. Rosendaal F.R. Venous thrombosis: a multicausal disease. /Rosendaal F.R.//. Lancet. 1999. -353. -p. 1167-1173.
/Rosendaal F.R.//. Lancet. 1999. -353. -p. 1167-1173.
162. Saeger W. Venous thromboses and pulmonary embolism in post-mortem series: probable causes by correlations of clinical data and basic diseases. /Saeger W., Genzkow M.//. Pat Res Pract. 1994. — 190. — p. 394-399.
163. Sallah S. Warfarin and heparin-induced skin necrosis and the purple toe syndrome: infrequent complications of anticoagulant treatment. /Sallah S., Thomas D.P., Roberts H.R.//. Thromb Haemost. 1997. — 78. — p. 785-790.
164. Salzman E.W. Management of heparin therapy; controlled prospective trial. /Salzman E.W., Deykin D., Shapiro R.M., et al.//. N Engl Med. 1975. — 292. -p. 1046-1050.
165. Salzman E.W. Effect of heparin and heparin fractions on platelet aggregation. /Salzman E.W., Rosenberg R.D., Smith M.H., et al.//. J Clin Invest. 1980. — 65. — p. 64-73.
166. Samama M.M. Comparative pharmacokinetics of LMWHs. /Samama M.M., Gerotziafas G.T.//. Seminars in thrombosis and hemostasis. 2000. — 26. -Suppl. 1. — p. 31-38.
— 26. -Suppl. 1. — p. 31-38.
167. Schafer A.I. Warfarin for venous thromboembolism walking the dosing tightrope. /Schafer A.I.//. N Engl J Med. — 2003. — p. 348: 15.
168. Schulman S. The duration of oral anticoagulant therapy after a second episode of venous thromboembolism: the Duration of Anticoagulation Trial Study Group. /Schulman S., Granqvist S., Holmstrom M., et al.//. N Engl Med. 1997.-336.-p. 393-398.
169. Schulman S. A comparison of six weeks with six months of oral anticoagulant therapy after a first episode of venous thromboembolism. /Schulman S., Rhedin A.S., Lindmarker P., et al.//. N Engl J Med. 1995. -332.-p. 1661-1665.
170. Schwartz K.A. Complications of heparin administration in normal individuals. /Schwartz K.A., Royer G., Kaufman D.B., et al.//. Am J Hematol. -1985.- 19.-p. 355-363.
171. Schwarz T. Eligibility for home treatment of deep vein thrombosis: prospective study. /Schwarz T., Schmidt B., Hohlein U., et al.//. BMJ. 2001. -May 19. — 322(7296). — p. 1212-1213.
— 322(7296). — p. 1212-1213.
172. Schweizer J. Short- and long-term results after thrombolytic treatment of deep venous thrombosis. /Schweizer J., Kirch W., Koch R., et al.//. J Am Coll Cardiol. 2000. — Oct. — 36(4). — p. 1336-1343.
173. Segal Jodi B. Management of venous thromboembolism: a systematic review practice guidelines.// Ann Intern Med. 2007;146:211-222.
174. Silverstein M.D. Trends in the incidence of deep vein thrombosis and pulmonary embolism: A 25-year population-based study. /Silverstein M.D., Heit J.A., Mohr D.N., et al.//. Arch Intern Med. 1998. — 158. — p. 585.
175. Simonneau G. A comparison LMWH with unfractionated heparin for acute pulmonary embolism. /Simonneau G., Sors H., Charbonnier B. et al.//. N Engl J Med. 1997. — 337. — p. 663-669.
176. Siragusa S. Home therapy for deep vein thrombosis and pulmonary embolism in cancer patients. // Annals of Oncology 16 (Supplement 4): ivl36-ivl39, 2005
177. Stein P.D. Prevalence of acute pulmonary embolism among patients in a general hospital and at autopsy. /Stein P.D., Henry J.W.//. Chest. 1995. — 108. -p. 978-981.
/Stein P.D., Henry J.W.//. Chest. 1995. — 108. -p. 978-981.
178. Stockelberg D. Treatment of deep vein thrombosis with low molecular weight heparin at patient’s home. /Stockelberg D., Hansson E., Jonson T.//. J Thromb Thrombolysis. 1998. — Sep. — 6(2). — p. 169-171.
179. Tapson V. F. Deep vein thrombosis: outpatient treatment with low-molecular-weight heparin.// Management Care Special Supplement 1999
180. Tillman D. Effectiveness and economic impact associated with a program of outpatient management of acute deep vein thrombosis.// Arch Intern Med. -2000. 1160.-p. 2926-2932
181. The Columbus Investigators. Low-molecular-weight heparin in the in the treatment of patient with venous thromboembolism. N Engl J Med. 1997. -337. — p. 657-662.
182. Tollefsen D.M. Heparin cofactor II. Purification and properties of a heparin-dependent inhibitor of thrombin in human plasma. /Tollefsen D.M., Majerus D.W., Blank M.K.//. J Biol Chem. 1982. — 257. — p. 2162-2169.
183. Triplett D.A. The effect of heparin on the activated partial thromboplastin time. /Triplett D.A., Harris C.S., Koepke J.A.//. Am J Clin Pathol. 1978. — 70. -p. 556-559.
Triplett D.A. The effect of heparin on the activated partial thromboplastin time. /Triplett D.A., Harris C.S., Koepke J.A.//. Am J Clin Pathol. 1978. — 70. -p. 556-559.
184. Troy S. Absolute and comparative subcutaneous bioavailability of ardeparin sodium, a low-molecular weight heparin. /Troy S., Fruncillo R., Ozawa T., et al.//. Thromb Haemost. 1997. — 78. — p. 871-875.
185. Valk H.W. Comparing subcutaneous danaparoid with intravenous unfractionated heparin for the treatment of venous thromboembolism. A randomized controlled trial, /de Valk H.W., Banga J.D., Wester J.WJ., et al.//. Ann Intern Med. 1995. — 123. — p. 1-9.
186. Vigano S. Decrease in protein C antigen and formation of an abnormal protein soon after starting oral anticoagulant therapy. /Vigano S., Mannuci P.M., Solanis S., et al.//. Br J Haematol. 1984. — 57. — p. 213-220.
187. Vinson D.R. Outpatients of deep vein thrombosis: 2 model of integrated care. // Am J Manag Care. 2006;12:405-410
188. Walling A.D. Deciding on hospitalization for patients with DVT. // American Family Physician 1, 2005
Walling A.D. Deciding on hospitalization for patients with DVT. // American Family Physician 1, 2005
189. Wakefield T.W. Treatment options for venous thrombosis. /Wakefield T.W.//. J Vase Surg. 2000. — 31. — p. 613-620.
190. Warkentin T.E. Newer strategies for the treatment of heparin-induced thrombocytopenia. /Warkentin T.E., Barkin R.L.//. Pharmacotherapy. 1999. -19(2).-p. 181-195.
191. Warkentin T.E. Heparin-induced thrombocytopenia: Towards consensus. /Warkentin T.E., Chong B.H., Greinacher A.//. Tromb Haemost. 1998. — 79. -p. 1-7.
192. Warkentin T.E. Laboratory testing for heparin-induced thrombocytopenia. Heparin-induced thrombocytopenia. /Warkentin T.E., Greinacher A.//. New York: Marcel Dekker Inc. 2000. — p. 211-244.
193. Warkentin T.E. Heparin-induced thrombocytopenia in patients treated with low-molecular weight heparin or unfractionated heparin. /Warkentin T.E., Levine M.N., Hirsh J., et al.//. N Engl J Med. 1995. — 332. — p. 1330-1335.
194. Warkentin T.E. Multicentric warfarin-induced skin necrosis complicating heparin-induced thrombocytopenia. /Warkentin T.E., Sikov W.M., Lillicrap D.P.//. Am J Haematol. 1999. — 62. — p. 44-48.
Warkentin T.E. Multicentric warfarin-induced skin necrosis complicating heparin-induced thrombocytopenia. /Warkentin T.E., Sikov W.M., Lillicrap D.P.//. Am J Haematol. 1999. — 62. — p. 44-48.
195. Weismann R. Arterial embolism occurring during systemic heparin therapy. /Weismann R., Tobin R.//. Arch Surg. 1958. — 76. — №l. p. 219-225.
196. Weitz J.I. Low molecular weight heparins. /Weitz J.I.//. N Engl J Med. -1997.-337.-p. 688-698.
197. Weitz J.I. Clotbound thrombin is protected from inhibition by heparin-antithrombin III but is susceptible to inactivation by antithrombin Ill-independent inhibitors. /Weitz J.I., Hudoba M., Massel D., et al.//. J Clin Invest. 1990. — 86. — p. 385-391.
198. Wells P.S. Outpatient treatment of patients with deep-vein thrombosis or pulmonary embolism. /Wells P.S.//. Curr Opin Pulm Med. 2001. — Sep. — 7(5). — p. 360-364.
199. Wells P.S. Application of the diagnostic clinical model for the management of hospitalized patient with suspected deep-vein thrombosis. /Wells P.S., Anderson D.R., Bormanis J, et al.//. Thromb Haemost. 1999. — 81. — p. 493497.
/Wells P.S., Anderson D.R., Bormanis J, et al.//. Thromb Haemost. 1999. — 81. — p. 493497.
200. Wells P.S. Assessment of deep vein thrombosis or pulmonary embolism by the combined use of clinical model and noninvasive diagnostic tests. /Wells P.S., Anderson D.R., Ginsberg J.//. Semin Thromb Hemost. 2000. — 26(6). — p. 643-656.
201. Wells P.S. Warfarin and its drug/food interactions; a critical appraisal of the literature. /Wells P.S., Holbrook A.M., Crowther R., et al.//. Ann Intern Med. -1994. 121.-p. 676-683.
202. Wells P.S A randomized trial comparing 2 low-weight-molecular heparins for the outpatient treatment of deep vein thrombosis and pulmonary embolism.// Arch Intern Med. 2005;165:733-738
203. Wheeler A.P. Physician practices in the treatment of pulmonary embolism and deep venous thrombosis. /Wheeler A.P., Jaquiss R.D., Newman J.H.//. Arh Intern Med. 1988. — 148. — p. 1321-1325.
204. White P.W. Thrombotic complications of heparin therapy. /White P. W., Sadd Jr., Nensel R.E.//. Ann Surg. 1979. — 190. — p. 595-608.
W., Sadd Jr., Nensel R.E.//. Ann Surg. 1979. — 190. — p. 595-608.
205. White R.H. Effect of weight, sex, age, clinical diagnosis, and thromboplastin reagent on steady-state intravenous heparin requirements. /White R.H., Zhou H., Woo L., et al.//. Arch Intern Med. 1997. — 157. — p. 2468-2472.
206. Wilson J.R. Heparin therapy: a randomized prospective study. /Wilson J.R., Lampman J.//. Am Heart J. 1979. — 97. — p. 155-158.
207. Winter M. Procedures for the outpatient management of patients with deep venous thrombosis Clin. Lab. Haem.2005, 27, 61-66
208. Young E. Heparin building to plasma proteins: an important mechanism for heparin resistance. /Young E., Pruis M., Levine M.N., et al.//. Thromb Haemost. 1992. — 67. — p. 639-643
209. Zidane M. Out of hospital treatment with subcutaneous lowmolecular weight heparin in patients with acute deep-vein thrombosis: a prospective study in daily practice.// Haematologica 2006; 91:1052-105
СОВРЕМЕННЫЙ ПОДХОД В ЛЕЧЕНИИ ОСТРОГО ТРОМБОЗА ГЛУБОКИХ ВЕН ПРЕПАРАТОМ РИВАРОКСАБАН
РАЦИОНАЛЬНАЯ ФАРМАКОТЕРАПИЯ
Архивъ внутренней медицины
• №
3(23)
•
2015
78
стоянном подборе дозы препарата в случаях высоких
колебаний МНО в анализах пациента, что особенно
удобно для жителей, отдаленных от центральных
районных больниц.
Таким образом, полученные результаты подтвержда-
ют эффективность, безопасность, удобство примене-
ния препарата ривароксабан, начиная с первого дня
терапии венозного тромбоза, высокую привержен-
ность к терапии препаратом, являющимся совре-
менной альтернативой стандартной антикоагулянт-
ной терапии.
Список литературы
1. Бокери я Л.А., Михай личенко М.В., Ковале нко В.И. Методы про-
филактики тромбоза глубоких вен после операций по поводу
варикозной болезни вен нижних конечностей. Ангиология и
сосудистая хирургия том. 20 № 2 2014; 53–54.
2. Кузьми н А.В., Богдано ва Л.А. Организация профилактики
венозных тромбоэмболических осложнений с использованием
клинической информационной системы ДОКА+ в региональной
клинической больнице. Флебология том 6 № 3 2014; 6–9.
3. Кривощеков Е.П., Дмитриева И.А., Губанова Т.А. Флеб ологиче-
ская помощь больным с осложненными формами хронической
венозной недостаточности на амбулаторном этапе. Флебология
Флебология
№ 2 том 8 2014; 117–118.
4. Кривощеко в Е.П., Романов В.Е., Д митриева И. А. Консервативное
лечение осложненных форм хронической венозной недостаточ-
ности на фоне сахарного диабета. Флебология № 2 том 8 2014;
118.
5. Кривощ еков Е.П., Дмит риева И.А., Ал ексеев А.В., Мел ьник Н.В.
Хирургическое лечение больных с осложненными формами
варикозной болезни нижних конечностей в условиях ангио-
логического дневного стационара. Вестник всероссийского
общества специалистов по медико-социальной экспертизе,
реабилитации и реабилитационной индуст рии № 3 2013; 94–99.
6. Савелье в В.С., Кири енко А.И., Золот ухин И.А., Ан дрияшкин В.В.
Профилактика послеоперационных венозных тромбоэмболи-
ческих осложнений в российских с тационарах. Флебология
№ 3 2010; 3–8.
7. Саве льев B.C., Чазо в Е.И., Гусев Е.И., Ки риенко А.И. Российские
клинические рекомендации по диагностике, лечению и профи-
лактике венозных тромбоэмболических осложнений. Флеболо-
Флеболо-
гия 2010; 5 –6.
8. Шилова А.Н., Карпенко А.А., Кармодонова Н.А.,Старосоцкая М.В.,
Клеванец Ю.Е. Особенности терапии ТЭЛА при гематогенной
тромбофилии. Ангиология и сосудистая хирургия том. 19
№ 3 2013; 71–73.
9. Angelli G. Current issues in anticoagulation. Patophysiol. Haemost.
Tromb. 2005; 2–9.
10. EINSTEIN Investigators. Oral rivaroxaban for symptomatic venous
thromboembolism. Engl Med 2010; 2499–2510.
11. Dmitriev a I, Krivoshchekov E. Flebological help patients with
complicated forms of chronic venous insufficitncy. 24 Conference of
the European Wound Management Association EWMA 2014 Madrid
Spain Espana 2014; 360.
12. Guyat t G.H., Akl E. A., Crowther M ., Gutterman D.D., S chuunemann
H.J. American College of Chest Physicians Antithrombotic Therapy and
Prevention of Thrombosis Panel. Executive summary: Antithrombotic
Therapy and Prevention of Thrombosis, 9th ed: American College of
Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest
Chest
2012; 7–47.
13. Naess L A., Christia nsen S.C., Romun dstad P., Cannegieter
S.C.,Ro sendaal F.R., Hammer strom J. Incidence and mortality of
venous thrombosis: a population-based study. Thromb Haemost
2007; 692–699.
Авторы заявляют, что данная работа, её тема, предмет
и содержание не затрагивают конкурирующих интересов.
ТРОМБОЗ ГЛУБОКИХ ВЕН НИЖНИХ КОНЕЧНОСТЕЙ
Синонимы: Глубокий венозный тромбофлебит. Острый тромбоз глубоких вен. Флебит глубоких вен.
Тромбофлебит глубоких вен. Острая венозная недостаточность нижних конечностей.
Тромбоз глубоких вен нижних конечностей — формирование одного или нескольких тромбов в пределах глубоких вен нижних конеч-
ностей или таза, сопровождаемое воспалением сосудистой стенки. Может осложняться нарушением венозного оттока и трофическими
расстройствами нижних конечностей, флегмоной бедра или голени, а также ТЭЛА. Флеботромбоз — первичный тромбоз вен нижних
конечностей, характеризующийся непрочной фиксацией тромба к стенке вены.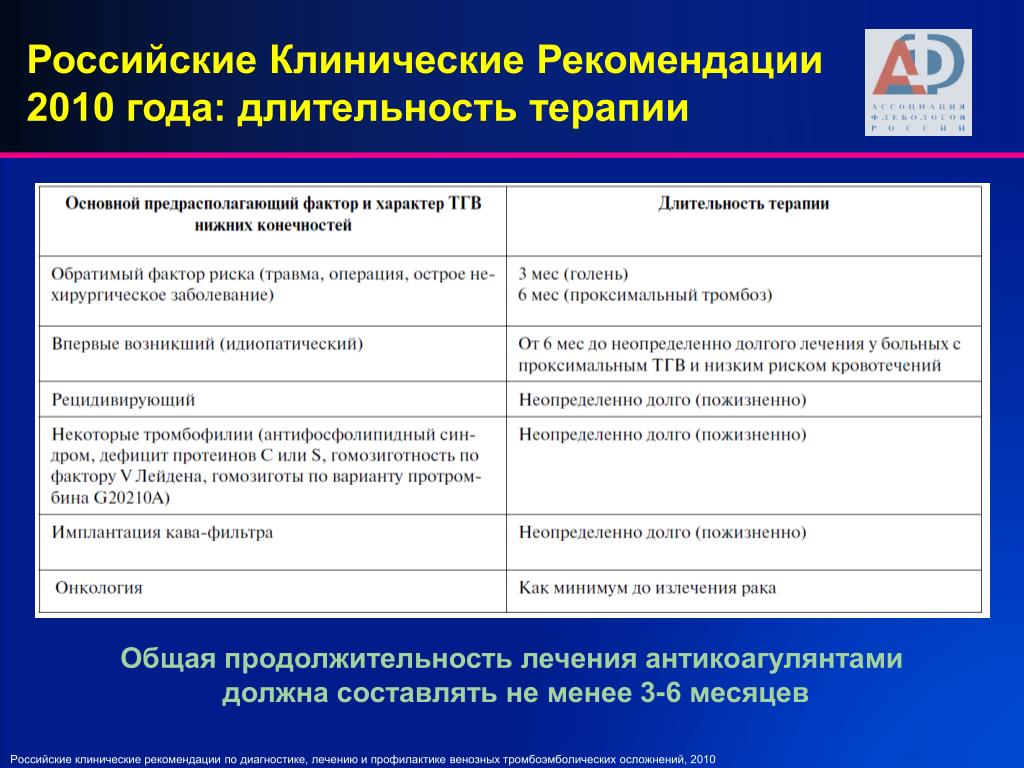 Тромбофлебит — вторичный тромбоз, обусловленный
Тромбофлебит — вторичный тромбоз, обусловленный
воспалением внутренней оболочки вены (эндофлебит). Тромб прочно фиксирован к стенке сосуда, поэтому ТЭЛА при тромбофлебите
происходит реже, чем при флеботромбозе.
Частота. В развитых странах -1:1 000 населения, чаще у лиц старше 40 лет.
КЛИНИЧЕСКАЯ КАРТИНА
• Глубокий венозный тромбоз (подтверждённый флебографией)
имеет классические клинические проявления лишь в 50% случаев
• Первым проявлением заболевания у многих заболевших может
быть ТЭЛА
• Жалобы: чувство тяжести в ногах, распирающие боли, стойкий
отёк голени или всей конечности
• Острый тромбофлебит: увеличение температуры тела до 39°С
и выше
• Местные изменения
• Симптом Пратта: кожа становится глянцевой, чётко выступает ри-
сунок подкожных вен
• Симптом Пайра: распространение боли по внутренней плоскости
стопы, голени или бедра
• Симптом Хоманса: боль в голени при тыльном сгибании стопы
• Симптом Ловенберга: боль при сдавлении голени манжетой аппа-
рата для измерения АД при величине 80—100 мм рт. ст., в то время
ст., в то время
как сдавление здоровой голени до 150—180 мм рт.ст. не вызывает
неприятных ощущений
• На ощупь больная конечность холоднее здоровой
• При тромбозе вен таза наблюдают лёгкие перитонеальные симп-
томы и иногда динамическую кишечную непроходимость.
МКБ-10. 180 Флебит и тромбофлебит
Тромбоз глубоких вен нижних конечностей
Острым тромбозом глубоких вен нижних конечностей называют образование сгустков крови (тромбов) в просвете вен при жизни человека. Тромбозы вен — достаточно распространенное заболевание, возникают у 27−38% пациентов. Главная опасность этого заболевания — тромбоэмболия легочных артерий и вследствие чего возможен летальный исход. За последние годы отмечается увеличение числа тромбозов.
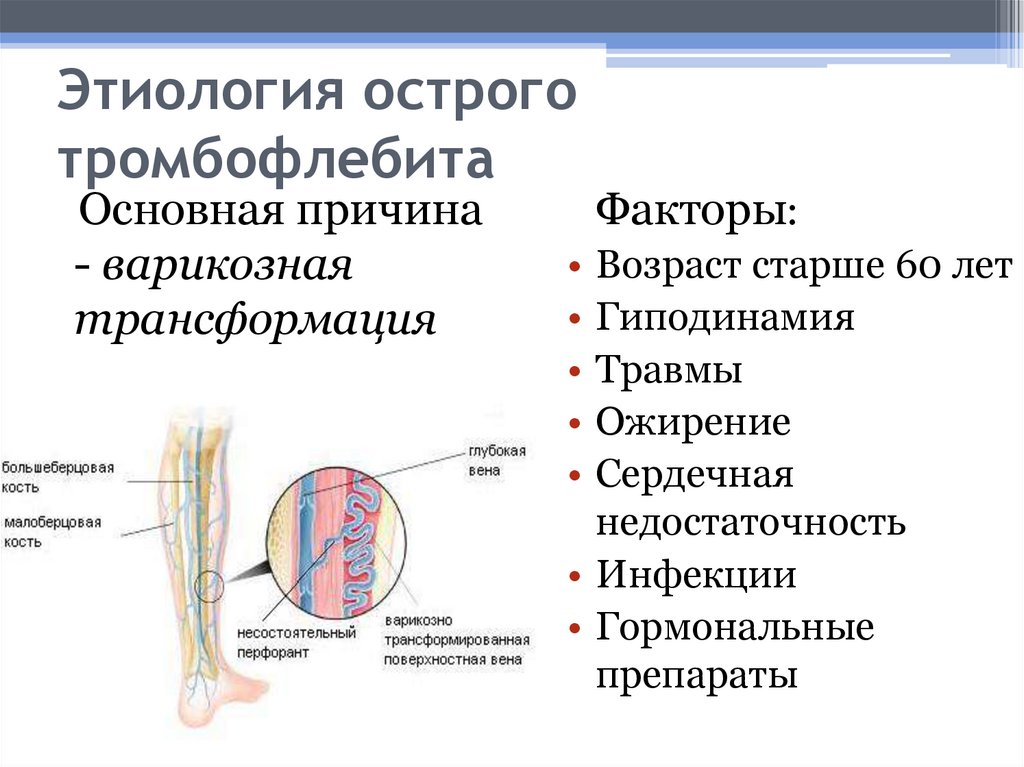
Причины появления тромбоза
1. Возраст: с возрастом риск тромботических осложнений увеличивается. По данным Prof. Eberhard Rabe (2018 г.), частота венозных тромбозов у мужчин составляет 0,5% в возрасте до 50 лет; 0,9% — 54 года; 1,3% — 60 лет; 2% — 67 лет; 4,5% — 75 лет и 5,8% — 80 лет.
2. Операция: на прямую видна закономерность в продолжительности перенесенных хирургических операций и возникновением тромбоза (с каждым часом операции удваивается опасность тромботических осложнений).
3. Переломы костей нижних конечностей: часто вызывает тромбоз глубоких вен длительная иммобилизация конечностей. При переломах костей голени тромбоз глубоких магистральных вен и их притоков наблюдается у 58−72% пострадавших.
4. Варикозное расширение вен нижних конечностей: при варикозном расширении вен нижних конечностей имеются все условия для развития тромбоза: несостоятельность клапанов, замедление кровотока, деформация сосудистой стенки.
5. Ожирение: установлено достоверно, что у больных страдающих ожирением чаще развиваются тромбоэмболические осложнения, при ожирении 3−4 ст. после 40−45 лет их риск увеличивается в пять раз.
6. Наличие онкологических новообразований: при онкологических заболеваниях склонность к внутрисосудистому тромбообразованию известна давно. Без особой на то причины (отсутствие варикозной болезни) тромбоз глубоких вен является поводом для проведения онкопоиска.
Без особой на то причины (отсутствие варикозной болезни) тромбоз глубоких вен является поводом для проведения онкопоиска.
7. Беременность и роды: длительные статические нагрузки, физиологическое расширение вен нижних конечностей и таза (когда матка с плодом придавливает внутренние подвздошные сосуды) с изменением их гемодинамики, особенно на фоне уже имеющейся патологии вен, представляют большую угрозу для развития тромбоза.
8. Терапия эстрогенами (прием противозачаточных гормональных контрацептивов и др.).
9. Травмы сосудов (спортивные, бытовые, производственные и др.)
10. Временное нарушение кровотока в сосудах нижних конечностей (при авиаперелетах, в авто-путешествиях, когда человек длительно находится в вынужденном сидячем положении).
11. Ранее перенесенные тромбозы вен.
Так же острому тромбозу глубоких вен предшествуют: переохлаждения, злоупотребление алкоголем, никотином, жирной, жаренной пищей.
Клинические проявления тромбоза
Наблюдаемая клиническая картина при тромбозе глубоких вен определяется остро возникшим нарушением венозного оттока крови от нижних конечностей при сохраненном артериальном.
Основные симптомы:
1. Отек мышц стопы и голени.
2. Острая распирающая боль в области икроножных мышц.
3. Синюшность кожи.
При тромбозе подколенной вены наблюдается увеличение в объеме всей голени на 3−4 см и более, при тромбозе бедренной вены отмечается отек не только на стопе и голени, но и на бедре. Так же отмечается болезненность по ходу сосудистого пучка.
Наиболее опасны «флотирующие» тромбы, когда одна часть тромба фиксирована к венозной стенке, а другая свободно свисает в просвет вены. Для отрыва такого тромба достаточно усиление скорости кровотока в венах, небольшие колебательные движения, неловкое движение, вставание с постели, вызывают отрыв тромба и эмболию легочной артерии.
Разнообразность клинических проявлений тромбоза всегда требует проведения дифференциальной диагностики с другими патологиями, протекающими со сходной симптоматикой (миозиты, ушибы, гематомы, растяжения связок и мышц, артриты, артрозы и др. ). В связи с этим возникает необходимость привлечения дополнительных, инструментальных методов диагностики.
). В связи с этим возникает необходимость привлечения дополнительных, инструментальных методов диагностики.
Методы и виды диагностики тромбоза глубоких вен нижних конечностей
Основное место в диагностике тромботического процесса в венозной системе наряду с клинической картиной занимают ультразвуковые методы диагностики.
1. Ультразвуковая допплерография — самый распространенный метод, который позволяет достаточно четко выявить тромбоз и его локализацию. Однако этот метод не позволяет достоверно установить протяженность тромботического процесса, характер кровотока и состояние венозной стенки, особенно глубоких вен.
2. Дуплексное ангиосканирование — наиболее точный и высокоинформативный метод в диагностике венозного тромбоза. Ангиосканирование позволяет верно оценить состояние венозной стенки и просвета, установить характер тромбоза (пристеночный или полный), определить дистальную и проксимальную границу тромба, оценить проходимость перфорантных вен и судить о выраженности воспалительной инфильтрации окружающих тканей (перифлебит). Ультразвуковое дуплексное сканирование, проводимое при диагностике, позволяет выбрать наиболее верную тактику лечения в каждом конкретном случае.
Ультразвуковое дуплексное сканирование, проводимое при диагностике, позволяет выбрать наиболее верную тактику лечения в каждом конкретном случае.
Что может сделать пациент:
При подозрении на тромбоз глубоких вен следует немедленно обратиться к врачу-флебологу.
Что может сделать врач:
Если врач предполагает наличие тромбоза глубоких вен, он обследует вас и задаст некоторые вопросы. Далее проводится специальное ультразвуковое ангиосканирование, чтобы оценить состояние и проходимость вен нижних конечностей, анализ крови, с целью найти вещество, которое продуцируется организмом, когда он пытается разрушить тромбы. Иногда эти анализы не дают достаточной информации, и вам может понадобиться процедура, носящая название ангиография, когда врач вводит краситель в вены, чтобы проследить их ход.
Основная цель лечения при тромбозе глубоких вен предотвращение лёгочной эмболии. Вам назначат противосвёртывающие препараты (антикоагулянты).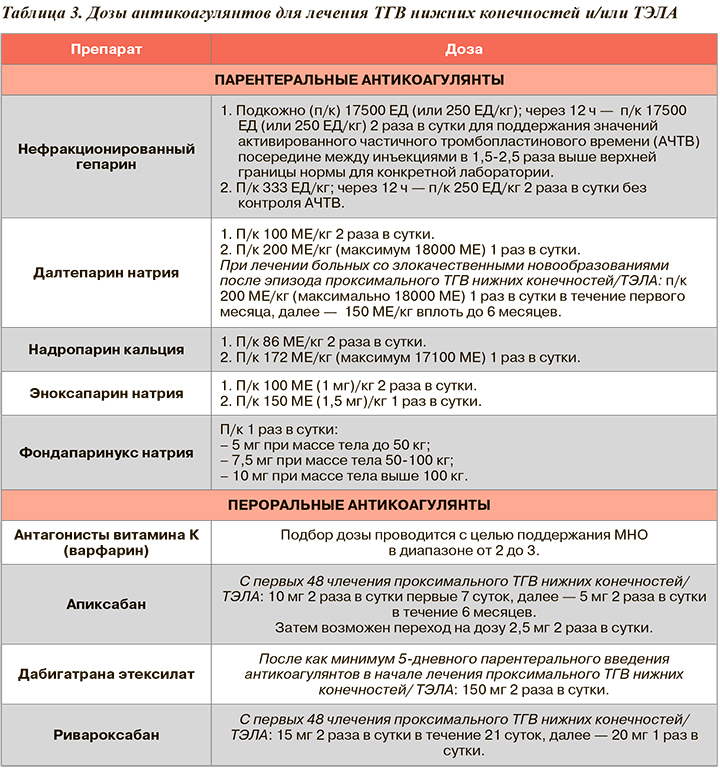 Возможно, вам придётся сделать несколько анализов крови, чтобы убедиться, что эти препараты действуют. Так же назначаются неспецифические противовоспалительные препараты для купирования воспаления.
Возможно, вам придётся сделать несколько анализов крови, чтобы убедиться, что эти препараты действуют. Так же назначаются неспецифические противовоспалительные препараты для купирования воспаления.
В отдельных тяжёлых случаях проводится тромболизис — когда через вену вводится специальное вещество, растворяющее тромб. Современная медицина располагает препаратами, которые действительно в состоянии растворить тромб, однако они также могут вызвать кровотечения, и применимы не во всех случаях.
Другая стратегия введение кава-фильтра во внутреннюю полую вену (вена, которая собирает кровь от нижних частей тела). Этот фильтр призван задерживать все перемещающиеся тромбы (эмболы) на пути к лёгким. Обычно кава-фильтр устанавливается только в том случае, если больной по каким-то причинам не может принимать противосвертывающие препараты или если такая терапия неэффективна.
Врач обязательно порекомендует вам носить специальные компрессионные чулки или гольфы (как правило II класс компрессии), что может уменьшить риск возникновения осложнений.
Длительность лечения зависит от каждого конкретного случая, включая факторы риска по развитию повторного тромбоза глубоких вен. Рецидив венозных тромбозов в течение 12 месяцев по данным различных авторов составляет от 5% до 30% (8,9).
Обычно минимальное время лечения 3 месяца, но в некоторых случаях врачи рекомендуют пожизненную терапию. Ваш доктор может рассказать вам о рисках и пользе длительного лечения антикоагулянтами, так что вместе вы сможете принять оптимальное решение в вашем конкретном случае.
Профилактика тромбоза глубоких вен после лечения:
Профилактика рецидивов тромбоза глубоких вен начинается на стадии реабилитации после лечения болезни. Основной мерой является исключение факторов риска, минимизация негативного влияния неправильного образа жизни на состояние сосудов.
Для этого рекомендуется:
- Ранняя двигательная активность пациентов после оперативного лечения;
- Исключение длительного пребывания в статичной позе — сидя или стоя;
- Предупреждение резкого ограничения подвижности в будущем;
- Лечебная физкультура по назначению врача.

Правильное питание — обязательное условие для предотвращения тромбоза глубоких вен. В рацион включают большое количество растительной клетчатки, то есть сырых овощей и фруктов. Именно они способствуют укреплению стенок сосудов.
Берегите свое здоровье!
Записаться на прием к флебологу
Врач хирург-флеболог — Нисин Андрей Александрович
Записаться можно по телефону (391) 218−35−13 или через личный кабинет
Диагностика и лечение тромбоза глубоких вен нижних конечностей: Практические рекомендации Кореи
①. Визуализационная диагностика острого ТГВ нижних конечностей
Обычно мы не рекомендуем использовать инвазивные диагностические стратегии, когда доступна сравнительно точная неинвазивная альтернатива для диагностики ТГВ нижних конечностей. Это связано с тем, что инвазивные тесты обычно связаны с большим дискомфортом пациента, побочными эффектами (например, реакциями на контраст) и радиационным воздействием, чем неинвазивные тесты. Однако мы рекомендуем инвазивное тестирование вместо неинвазивного, если преимущества более точного диагноза перевешивают эти недостатки. На это решение влияют индивидуальные предпочтения пациента в отношении дискомфорта при тестировании и терпимости к диагностической неопределенности.
Однако мы рекомендуем инвазивное тестирование вместо неинвазивного, если преимущества более точного диагноза перевешивают эти недостатки. На это решение влияют индивидуальные предпочтения пациента в отношении дискомфорта при тестировании и терпимости к диагностической неопределенности.
(1) Ультразвук: УЗИ широко используется и предпочитается в качестве метода визуализации первой линии для диагностики проксимального ТГВ [2–4,74–76]. Он неинвазивен, может быть легко выполнен у постели пациента и достаточно надежен для серийной оценки.Невозможность полного коллапса венозного сегмента под легким давлением ультразвукового зонда считается диагностическим признаком ТГВ. УЗИ-обследование на ТГВ часто сочетается с допплеровской визуализацией в реальном времени, такой как дуплексная, непрерывно-волновая и цветовая допплеровская визуализация. Дуплексная ультразвуковая визуализация может помочь определить сгусток как обструктивный или частично обструктивный.
УЗИ имеет высокую чувствительность и специфичность для диагностики симптоматического ТГВ проксимального отдела нижних конечностей по сравнению с традиционной венографией [4]. Однако диагностическая эффективность УЗИ одинакова в бедренной и подколенной вене, но менее стабильна в подвздошно-кавальной области и ниже колена [74,75]. Недавний метаанализ показал, что УЗИ обладает очень высокой чувствительностью (диапазон 93,2–95,0%; совокупная чувствительность 94,2%) и высокой специфичностью (диапазон 93,1–94,4%; совокупная специфичность 93,8%) для диагностики проксимального ТГВ, но гораздо более низкая чувствительность (диапазон 59,8–67,0%; совокупная чувствительность 63,5%) для диагностики дистального ТГВ [77].
Однако диагностическая эффективность УЗИ одинакова в бедренной и подколенной вене, но менее стабильна в подвздошно-кавальной области и ниже колена [74,75]. Недавний метаанализ показал, что УЗИ обладает очень высокой чувствительностью (диапазон 93,2–95,0%; совокупная чувствительность 94,2%) и высокой специфичностью (диапазон 93,1–94,4%; совокупная специфичность 93,8%) для диагностики проксимального ТГВ, но гораздо более низкая чувствительность (диапазон 59,8–67,0%; совокупная чувствительность 63,5%) для диагностики дистального ТГВ [77].
Существует два метода УЗИ исследования ТГВ нижних конечностей.Проксимальное компрессионное УЗИ позволяет оценить сжимаемость бедренной и подколенной вен. При УЗИ всей ноги оцениваются глубокие вены проксимального отдела голени и голени. Дистальный ТГВ может присутствовать у пациентов с нормальным проксимальным компрессионным УЗИ; однако это редко связано с серьезными клиническими последствиями, такими как ПЭ или ПИН [2]. Таким образом, УЗИ всей ноги как отдельный тест для исключения ТГВ имеет риск чрезмерного лечения. Тем не менее, поскольку дистальный ТГВ может распространяться проксимально и приводить к ТЭЛА, могут потребоваться дополнительные исследования, такие как УЗИ всей ноги или второе (серийное или повторное УЗИ) проксимальное УЗИ, чтобы исключить дистальный ТГВ или обнаружить раннее распространение в проксимальные вены [60 , 78,79].
Тем не менее, поскольку дистальный ТГВ может распространяться проксимально и приводить к ТЭЛА, могут потребоваться дополнительные исследования, такие как УЗИ всей ноги или второе (серийное или повторное УЗИ) проксимальное УЗИ, чтобы исключить дистальный ТГВ или обнаружить раннее распространение в проксимальные вены [60 , 78,79].
Предварительная оценка клинической вероятности и результат D-димера имеют значительное влияние на полезность УЗИ [2,75,80]. У пациентов с низкой предтестовой вероятностью ТГВ первой нижней конечности, если D-димер отрицательный, дальнейшее тестирование с помощью УЗИ или венографии не рекомендуется. Если D-димер положительный, рекомендуется УЗИ вместо проведения тестов или венографии. Первоначальное тестирование с помощью УЗИ предпочтительнее, чем D-димер, если у пациента имеется сопутствующее заболевание, связанное с повышенным уровнем D-димера [2,74].УЗИ всей ноги может быть предпочтительнее проксимального УЗИ у пациентов, которые не могут вернуться для серийного обследования, и у пациентов с тяжелыми симптомами, соответствующими ТГВ теленка [2]. Пациентам с высокой предтестовой вероятностью ТГВ первой нижней конечности рекомендуется УЗИ вместо автономного теста на D-димер. У пациентов с обширным необъяснимым отеком ног в группе высокой вероятности, если на УЗИ нет ТГВ и тест на D-димер не проводился или положительный, необходимо визуализировать подвздошные вены, чтобы исключить изолированный ТГВ подвздошной кости [2,4].
Пациентам с высокой предтестовой вероятностью ТГВ первой нижней конечности рекомендуется УЗИ вместо автономного теста на D-димер. У пациентов с обширным необъяснимым отеком ног в группе высокой вероятности, если на УЗИ нет ТГВ и тест на D-димер не проводился или положительный, необходимо визуализировать подвздошные вены, чтобы исключить изолированный ТГВ подвздошной кости [2,4].
Рецидивирующая боль в ногах часто встречается у пациентов после эпизода ТГВ и может быть вызвана рецидивирующим заболеванием, острым обострением посттравматического стрессового синдрома или нетромботическими проблемами. Точный диагноз рецидива важен, потому что неправильный диагноз имеет значительные последствия. УЗИ предпочтительно у пациентов с подозрением на рецидив ТГВ нижних конечностей. Однако стойкие аномалии глубоких вен после первого эпизода тромбоза затрудняют оценку с помощью компрессионного УЗИ. Проспективные последующие исследования сообщили об остаточных аномалиях УЗИ (несжимаемость) примерно у 80% пациентов через 3 месяца и у 50% пациентов через 1 год после постановки диагноза проксимального ТГВ нижних конечностей. Таким образом, наличие несжимаемого венозного сегмента при компрессионном УЗИ не является диагностическим признаком рецидива тромбоза [81]. Хотя обнаружение новой несжимаемости общей бедренной или подколенной вены по сравнению с предыдущим УЗИ считается диагностическим признаком рецидива, это обнаружение встречается только у 10-20% пациентов с рецидивирующим ТГВ [2,81,82] . Наличие новой несжимаемости ранее нормальной подколенной или общей бедренной вены и / или увеличения на 2 мм остаточного диаметра одной из этих двух вен при измерении в поперечной плоскости во время максимального сжатия имеет чувствительность 91 % и специфичность 97% для диагностики рецидива ТГВ [81–83].Увеличение диаметра вен во время компрессии на 4 мм по сравнению с предыдущим результатом УЗИ вен имеет чувствительность 71% и специфичность 100% для диагностики рецидива ТГВ [84,85].
Таким образом, наличие несжимаемого венозного сегмента при компрессионном УЗИ не является диагностическим признаком рецидива тромбоза [81]. Хотя обнаружение новой несжимаемости общей бедренной или подколенной вены по сравнению с предыдущим УЗИ считается диагностическим признаком рецидива, это обнаружение встречается только у 10-20% пациентов с рецидивирующим ТГВ [2,81,82] . Наличие новой несжимаемости ранее нормальной подколенной или общей бедренной вены и / или увеличения на 2 мм остаточного диаметра одной из этих двух вен при измерении в поперечной плоскости во время максимального сжатия имеет чувствительность 91 % и специфичность 97% для диагностики рецидива ТГВ [81–83].Увеличение диаметра вен во время компрессии на 4 мм по сравнению с предыдущим результатом УЗИ вен имеет чувствительность 71% и специфичность 100% для диагностики рецидива ТГВ [84,85].
Рекомендация
(2) Венография: традиционная контрастная венография — золотой стандарт диагностики ТГВ нижних конечностей. В этом методе накладываются проксимальные компрессионные жгуты, и после инъекции контрастного вещества в дорсальную вену стопы получают серию перекрывающихся рентгенограмм, чтобы очертить всю глубокую венозную систему нижней конечности.ТГВ диагностируется по наличию постоянного дефекта внутрипросветного наполнения, который присутствует более чем в одном ракурсе; отсутствие наполнения венозного сегмента, несмотря на повторную инъекцию, является подозрительным, но не диагностическим признаком ТГВ [86]. Однако венография не всегда доступна, неудобна для пациентов и противопоказана пациентам с почечной недостаточностью и тяжелыми аллергическими реакциями на контрастное вещество. Кроме того, при венографии часто встречается неадекватная визуализация; визуализация венозного сегмента неадекватна в 20% случаев.Невозможно канюлировать тыльную вену стопы в 5% случаев. Кроме того, это может быть трудно интерпретировать, и обозначение «ТГВ присутствует» или «ТГВ отсутствует» зависит от значительной степени вариации внутри и между наблюдателями [2].
В этом методе накладываются проксимальные компрессионные жгуты, и после инъекции контрастного вещества в дорсальную вену стопы получают серию перекрывающихся рентгенограмм, чтобы очертить всю глубокую венозную систему нижней конечности.ТГВ диагностируется по наличию постоянного дефекта внутрипросветного наполнения, который присутствует более чем в одном ракурсе; отсутствие наполнения венозного сегмента, несмотря на повторную инъекцию, является подозрительным, но не диагностическим признаком ТГВ [86]. Однако венография не всегда доступна, неудобна для пациентов и противопоказана пациентам с почечной недостаточностью и тяжелыми аллергическими реакциями на контрастное вещество. Кроме того, при венографии часто встречается неадекватная визуализация; визуализация венозного сегмента неадекватна в 20% случаев.Невозможно канюлировать тыльную вену стопы в 5% случаев. Кроме того, это может быть трудно интерпретировать, и обозначение «ТГВ присутствует» или «ТГВ отсутствует» зависит от значительной степени вариации внутри и между наблюдателями [2]. Таким образом, венография сейчас редко используется в клинической практике, и многие больницы не могут выполнить эту процедуру. Тем не менее, венография по-прежнему является эталонным стандартным тестом на ТГВ и может использоваться, когда другие тесты не могут однозначно исключить диагноз ТГВ или для планирования эндоваскулярного лечения.
Таким образом, венография сейчас редко используется в клинической практике, и многие больницы не могут выполнить эту процедуру. Тем не менее, венография по-прежнему является эталонным стандартным тестом на ТГВ и может использоваться, когда другие тесты не могут однозначно исключить диагноз ТГВ или для планирования эндоваскулярного лечения.
(3) КТ-венография: хотя УЗИ широко используется для диагностики ТГВ, КТ-венография недавно была задокументирована как быстрая и доступная альтернатива УЗИ при ТГВ нижних конечностей с чувствительностью и специфичностью 89% –100% и 94 % –100% соответственно [87–92]. КТ-венография обычно включает инъекцию контрастного вещества в вену руки с последующей мультидетекторной КТ-визуализацией, синхронизируемой с помутнением глубоких вен ног, что позволяет оценить эти вены на предмет тромба.Внутривенное введение контрастного вещества объемом от 100 до 150 мл используется со скоростью инъекции 3–4 мл / с. Однако особенности протокола могут отличаться в зависимости от учреждения. КТ-венография также может быть включена в комплексное обследование, которое включает КТ-ангиографию легких для оценки как ТЭЛА, так и проксимального ТГВ [93]. У пациентов с подозрением на ТЭЛА недавний метаанализ показал, что КТ-венография для диагностики проксимального ТГВ имеет высокую чувствительность (диапазон 71–100%; совокупная чувствительность 95.9%) и высокой специфичностью (диапазон 93–100%; объединенная специфичность 95,2%), сравнимой с таковой в США [94]. КТ-венография является неинвазивным методом и имеет неотъемлемое преимущество изображения поперечного сечения для выявления внесосудистых источников внешней компрессии, предположительно основной причины ТГВ. Тем не менее, он имеет тот же недостаток, что и обычная контрастная венография, требующая воздействия ионизирующего излучения и использования йодсодержащих контрастных веществ.
КТ-венография также может быть включена в комплексное обследование, которое включает КТ-ангиографию легких для оценки как ТЭЛА, так и проксимального ТГВ [93]. У пациентов с подозрением на ТЭЛА недавний метаанализ показал, что КТ-венография для диагностики проксимального ТГВ имеет высокую чувствительность (диапазон 71–100%; совокупная чувствительность 95.9%) и высокой специфичностью (диапазон 93–100%; объединенная специфичность 95,2%), сравнимой с таковой в США [94]. КТ-венография является неинвазивным методом и имеет неотъемлемое преимущество изображения поперечного сечения для выявления внесосудистых источников внешней компрессии, предположительно основной причины ТГВ. Тем не менее, он имеет тот же недостаток, что и обычная контрастная венография, требующая воздействия ионизирующего излучения и использования йодсодержащих контрастных веществ.
(4) Магнитно-резонансная венография: Магнитно-резонансная (МР) венография — это неинвазивный метод визуализации, который разделяет многие клинические преимущества УЗИ, такие как предотвращение воздействия ионизирующего излучения или йодсодержащих контрастных веществ [95–98]. МР-венография имеет преимущество в виде поперечного сечения для определения внесосудистой анатомии и выявления потенциальных источников внешней венозной компрессии, которая может быть основной причиной ТГВ нижних конечностей или предлагать альтернативные условия, имитирующие ТГВ. Следовательно, МР-венография может быть методом выбора для пациентов, у которых ультразвуковое исследование невозможно. МР-венография может применяться с использованием различных импульсных последовательностей или техник [95–98]. Некоторые методы, такие как времяпролетная или фазоконтрастная венография, позволяют визуализировать кровоток без необходимости использования контрастного вещества.Однако визуализацию сосудистых структур часто можно улучшить за счет использования контрастных веществ [98]. Несмотря на широкое разнообразие методов, недавний метаанализ показал, что МР-венография обладает высокой чувствительностью (диапазон 87,5–94,5%; совокупная чувствительность 92%) и специфичностью (диапазон 92,6–96,5%; совокупная специфичность 95 %) [98].
МР-венография имеет преимущество в виде поперечного сечения для определения внесосудистой анатомии и выявления потенциальных источников внешней венозной компрессии, которая может быть основной причиной ТГВ нижних конечностей или предлагать альтернативные условия, имитирующие ТГВ. Следовательно, МР-венография может быть методом выбора для пациентов, у которых ультразвуковое исследование невозможно. МР-венография может применяться с использованием различных импульсных последовательностей или техник [95–98]. Некоторые методы, такие как времяпролетная или фазоконтрастная венография, позволяют визуализировать кровоток без необходимости использования контрастного вещества.Однако визуализацию сосудистых структур часто можно улучшить за счет использования контрастных веществ [98]. Несмотря на широкое разнообразие методов, недавний метаанализ показал, что МР-венография обладает высокой чувствительностью (диапазон 87,5–94,5%; совокупная чувствительность 92%) и специфичностью (диапазон 92,6–96,5%; совокупная специфичность 95 %) [98].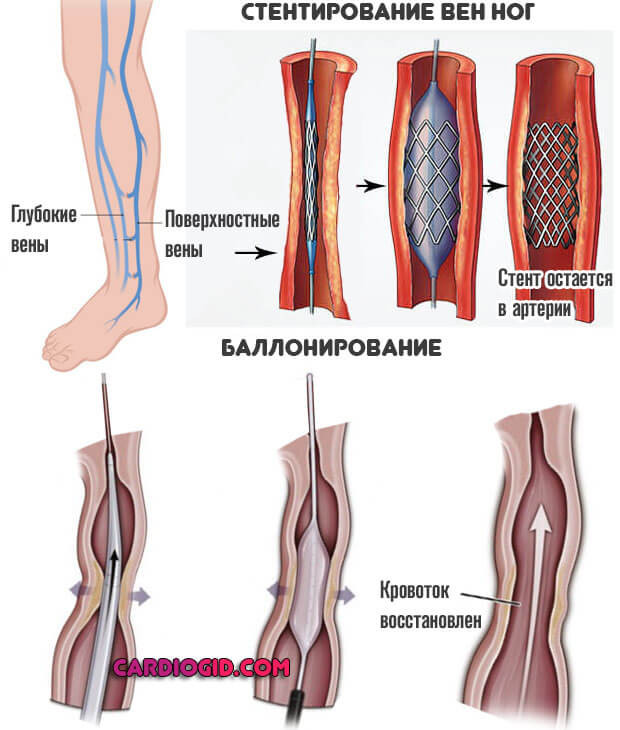 Однако следует отметить, что МРТ-венография имеет меньше оценок в исследованиях, имеет противопоказания и не рекомендуется у некоторых пациентов, например у пациентов с небезопасными устройствами для МРТ.
Однако следует отметить, что МРТ-венография имеет меньше оценок в исследованиях, имеет противопоказания и не рекомендуется у некоторых пациентов, например у пациентов с небезопасными устройствами для МРТ.
Рекомендация
②. Визуализационная диагностика хронического ТГВ нижних конечностей
Ультразвуковое исследование улучшило диагностическую точность и воспроизводимость и является предпочтительным диагностическим тестом первой линии для пациентов с подозрением на хронический ТГВ [99,100]. Дуплексное УЗИ позволяет оценить как венозную обструкцию, так и рефлюкс и включает в себя следующие компоненты: прямую визуализацию анатомических сегментов глубоких, поверхностных и перфораторных вен; сжимаемость бедренной и подколенной вен; фазовый венозный кровоток с увеличивающими маневрами и без них; и документирование венозного рефлюкса с измерением времени закрытия клапана [101].
Дуплексное УЗИ бедренной вены может косвенно свидетельствовать об обструкции оттока подвздошной вены с монофазными формами волны, потере дыхательных вариаций в траектории бедренной кости или плохом усилении сигнала при компрессии дистального отдела конечности [102].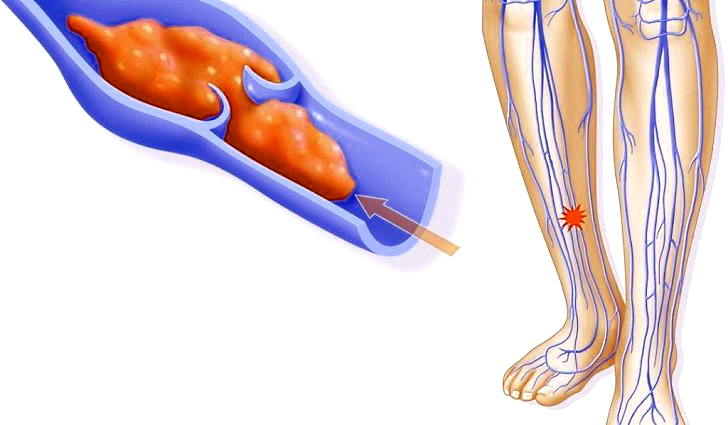 Диагностическая точность дуплексного УЗИ может быть улучшена путем проведения прямого дуплексного УЗИ подвздошно-кавальных вен; однако надежная и воспроизводимая визуализация ограничена габитусами тела, кишечными газами и вариабельностью оператора [103]. Для повышения точности диагностики, если требуется дополнительная информация о подвздошной вене, пациентам с подозрением на хроническую тромботическую венозную обструкцию следует пройти дополнительные визуализационные исследования с помощью традиционной венографии, КТ-венографии или МР-венографии [104–106].Восходящая венография может точно идентифицировать посттромботические изменения в глубокой венозной системе, паттерны коллатералей и состояние подвздошно-кавальных вен и, таким образом, полезна для определения необходимости эндоваскулярного или хирургического вмешательства и того, какая процедура осуществима [107]. Нисходящая венография может определить степень рефлюкса и может быть полезна для определения необходимости реконструктивной хирургии глубоких вен и того, какой тип операции возможен [63].
Диагностическая точность дуплексного УЗИ может быть улучшена путем проведения прямого дуплексного УЗИ подвздошно-кавальных вен; однако надежная и воспроизводимая визуализация ограничена габитусами тела, кишечными газами и вариабельностью оператора [103]. Для повышения точности диагностики, если требуется дополнительная информация о подвздошной вене, пациентам с подозрением на хроническую тромботическую венозную обструкцию следует пройти дополнительные визуализационные исследования с помощью традиционной венографии, КТ-венографии или МР-венографии [104–106].Восходящая венография может точно идентифицировать посттромботические изменения в глубокой венозной системе, паттерны коллатералей и состояние подвздошно-кавальных вен и, таким образом, полезна для определения необходимости эндоваскулярного или хирургического вмешательства и того, какая процедура осуществима [107]. Нисходящая венография может определить степень рефлюкса и может быть полезна для определения необходимости реконструктивной хирургии глубоких вен и того, какой тип операции возможен [63]. Визуализация с помощью внутрисосудистого УЗИ с изображениями поперечного сечения вены и прилегающих структур имеет высокую диагностическую точность для выявления тромбов подвздошно-впадинной кишки или компрессии подвздошно-каверной кишки из-за синдрома Мэй-Тернера или других смежных структур, что может повлиять на терапевтические возможности [108,109].
Визуализация с помощью внутрисосудистого УЗИ с изображениями поперечного сечения вены и прилегающих структур имеет высокую диагностическую точность для выявления тромбов подвздошно-впадинной кишки или компрессии подвздошно-каверной кишки из-за синдрома Мэй-Тернера или других смежных структур, что может повлиять на терапевтические возможности [108,109].
Рекомендации
-
УЗИ является одним из основных методов визуализации для диагностики хронического ТГВ нижних конечностей. (Класс I, уровень B)
-
КТ или МРТ-венография может выполняться пациентам с хроническим ТГВ нижних конечностей, если требуется дополнительная информация о состоянии подвздошной вены или для планирования перед хирургическим или эндоваскулярным вмешательством. (Класс IIa, уровень C)
Диагностика и лечение острого тромбоза глубоких вен
Из этого согласованного документа Европейского общества кардиологов о диагностике и лечении острого тромбоза глубоких вен (ТГВ) следует помнить следующие ключевые моменты:
- Клинические признаки и симптомы острого ТГВ очень вариабельны и неспецифичны.
 Рекомендуется использовать балл Уэллса для оценки вероятности предварительного тестирования.
Рекомендуется использовать балл Уэллса для оценки вероятности предварительного тестирования. - Пациентам с маловероятной предтестовой вероятностью ТГВ следует назначить тест на D-димер. Если результат отрицательный, то острый ТГВ исключен и лечение не требуется.
- Пациентам с ТГВ с вероятностью до теста или положительным D-димером следует выполнить полное УЗИ вен.
- Пациенты с изолированным дистальным ТГВ и высоким риском рецидива должны получать антикоагулянтную терапию в течение 3 месяцев.Если риск рецидива низкий, тогда их можно лечить коротким курсом (4-6 недель) антикоагулянтов (профилактическая доза или полная доза) или с помощью контрольного ультразвукового исследования.
- Пациенты с проксимальным ТГВ должны получать антикоагулянтную терапию не менее 3 месяцев. Расширенный курс антикоагуляции следует определять на основе комбинации результатов ультразвукового исследования вен, баланса риска / пользы, соблюдения пациентом режима терапии и предпочтений пациента.
- Больных без рака следует лечить прямыми пероральными антикоагулянтами (DOAC) или варфарином, тогда как больные раком пациенты должны получать низкомолекулярный гепарин (НМГ).
- При остром ТГВ начальная антикоагуляция должна быть одной из следующих схем: 1) апиксабан 10 мг два раза в день в течение 7 дней, затем 5 мг два раза в день; 2) дабигатран 150 мг два раза в день после 5-10-дневного вводного курса НМГ; 3) эдоксабан 60 мг в день (30 мг при клиренсе креатинина 30-50 мл / мин или применении сильного ингибитора протонной помпы) после 5-10-дневного вводного курса; 4) ривароксабан 15 мг 2 раза в сутки в течение 21 дня, затем 20 мг ежедневно; или 5) варфарин с целевым международным нормализованным соотношением (МНО) 2-3 и НМГ в течение 5-10 дней (до МНО>
- Для оценки риска рецидива ВТЭ можно использовать различные модели прогнозирования риска. К ним относятся венская модель, оценка DASH и HERDOO-2.
- Для расширенной вторичной профилактики рецидива ТГВ пациенты могут лечиться низкими дозами аспирина, апиксабаном 2,5 мг два раза в день или ривароксабаном 10 мг в день. В общем, антикоагулянтная терапия предпочтительнее аспириновой терапии.
- Для ТГВ верхних конечностей ультразвуковое исследование является методом выбора, и лечение аналогично ТГВ нижних конечностей.
- Во время беременности НМГ — рекомендуемые антикоагулянты для начального и длительного лечения. Антикоагулянтную терапию следует продолжать как минимум 6 недель после родов (как минимум 3 месяца лечения).
Клинические темы: Антикоагулянтное лечение, Группа сердечно-сосудистой помощи, Гериатрическая кардиология, сердечная недостаточность и кардиомиопатии, неинвазивная визуализация, профилактика, сосудистая медицина, атеросклеротическое заболевание (ИБС / ЗПА), острая сердечная недостаточность, эхокардиография / УЗИ
Ключевые слова: Антикоагулянты, Аспирин, Консенсус, Креатинин, Диагностическая визуализация, Гериатрия, Сердечная недостаточность, Гепарин, низкомолекулярный вес, Международное нормализованное соотношение, Новообразования, Заболевания периферических сосудов, Беременность, Первичная профилактика, Ингибиторы протонной помпы, Легочное кровообращение, Ультразвуковое исследование, Тромбоз глубоких вен верхних конечностей,
<Вернуться к списку
Американский журнал рентгенологии Vol.208, No. 4 (AJR)
Венозная тромбоэмболия (ВТЭ), по оценкам, встречается у 1-2 человек на 1000 населения в год, проявляясь как тромбоз глубоких вен (ТГВ), тромбоэмболия легочной артерии (ТЭЛА) или и то, и другое [1-3 ]. Это причина более 100 000 смертей ежегодно и наиболее предотвратимая причина смерти госпитализированных пациентов в США [4]. Несмотря на лечение антикоагулянтами, значительная часть выживших после острого ТГВ или ТЭЛА, вероятно, будет страдать от инвалидизирующих последствий, таких как посттромботический синдром (ПТС), рецидивирующая ВТЭ или хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ) [1, 5].Учитывая ограничения медикаментозной терапии, за последние два десятилетия были разработаны многообещающие методы эндоваскулярного лечения, призванные уменьшить острую и хроническую инвалидность от ВТЭ [6, 7]. Цель этого обзора — обсудить обоснование и доказательства эндоваскулярного подхода к лечению пациентов с острым ТГВ и ТЭЛА высокого риска.
| Обоснование интервенционного подхода к лечению венозной тромбоэмболии | Выбирать К началу страницы РЕЗЮМЕ Обоснование Inte… << Отбор пациентов и разработка ... Современное лечение St ... Постпроцедурная помощь Предикторы неблагоприятного исхода ... Направления на будущее Заключение Ссылки ЦИТИРУЮЩИЕ СТАТЬИ |
|---|
Наиболее тревожные острые осложнения проксимальных отделов нижних конечностей ТГВ — это ПЭ и голубая флегмазия (PCD). ТЭЛА может быть первичным проявлением до 30% случаев и является основной причиной немедленной, а также долгосрочной смертности у пациентов с ВТЭ [1, 8].Напротив, PCD — это редкое состояние, при котором DVT вызывает сильную боль и отек всей конечности, что приводит к нарушению кровообращения в артериях и острой ишемии конечностей из-за значительного повышения интерстициального и венозного давления. Хронические осложнения проксимального тромбоза нижних конечностей (рецидивирующая ВТЭ и посттравматический синдром) часто истощают. До 25% пациентов с ВТЭ имеют вероятность рецидива, а те, кто не получает антикоагулянтную терапию в течение длительного периода времени, имеют риск рецидива более 50% в течение 10 лет [1, 9].Было показано, что посттравматический синдром возникает у 50% пациентов в течение 2 лет после индексного диагноза симптоматического ТГВ нижних конечностей [9–11]. В нормальных физиологических условиях венозное давление является самым высоким, когда пациент находится в вертикальном положении и не двигается. При ходьбе сократительное действие мышц голени и бедра постепенно снижает давление. Это действие в сочетании с компетентными венозными клапанами помогает возвращать кровь к нижней полой вене. Острый тромбоз вены приводит к обструкции и локальному воспалению, которое, в свою очередь, вызывает недостаточность клапана и рефлюкс.В острой фазе после тромбоза местная обструкция оттока и воспаление приводят к клапанному рефлюксу. Со временем может произойти реканализация сосуда, но она часто бывает неполной и несостоятельность клапана сохраняется. Следовательно, в болезненном состоянии пациенты испытывают амбулаторную венозную гипертензию, которая при сохранении может привести к патологическому ремоделированию, отрицательно влияющему на целостность стенок сосудов [12]. Клинически это состояние может проявляться в виде отека, обесцвечивания кожи, изъязвлений и плохого заживления ран — характеристик, характерных для ПИН.Последствия развития СТВ часто бывают серьезными как с экономической точки зрения, так и с точки зрения качества жизни, связанной с оказанием медицинской помощи [13, 14]. Пациенты с тяжелым ПИН имеют показатели качества жизни, аналогичные показателям, используемым для рака или застойной сердечной недостаточности [13]. Было показано, что анатомическая протяженность ТГВ коррелирует с частотой и тяжестью ПТС. ТГВ с поражением подвздошной и общей бедренной вены более чем в два раза чаще вызывает посттравматический стресс или рецидивы, чем изолированный тромбоз бедренно-подколенной вены [15].Наличие подвздошно-бедренного ТГВ также является основным предиктором тяжелого ПТС. Эти наблюдения привели к так называемой гипотезе открытой вены о том, что устранение этой обструкции оттока может предотвратить развитие или снизить тяжесть посттравматического стрессового синдрома. Эта гипотеза была подтверждена несколькими исследованиями, в которых для лечения острого подвздошно-бедренного ТГВ использовалась хирургическая тромбэктомия или системный тромболизис [16–18]. Заметно повышенная частота кровотечений в результате системного тромболизиса и инвазивный характер хирургических подходов привели к быстрому внедрению катетерной эндоваскулярной терапии ТГВ проксимальной и нижней полой вены за последнее десятилетие [19] (рис.1А и 1Б). Эндоваскулярная терапия на основе катетера позволяет направлять тромболитики на определенную, но большую площадь поверхности внутри тромба и может дополняться механической тромбэктомией, ангиопластикой и стентированием. Эти стратегии, когда они используются по отдельности или в комбинации, привели к заметному снижению частоты ПИН.
