Взаимосвязь между эрозивно-деструктивными изменениями костной ткани и генерализованным остеопорозом у больных ревматоидным артритом
Ревматоидный артрит характеризуется прогрессированием эрозивно-деструктивного полиартрита, который является причиной функциональных нарушений, снижает качество жизни и приводит к инвалидизации больных. Присоединившийся остеопороз усугубляет эти нарушения и становится причиной таких осложнений, как переломы. В настоящем исследовании мы изучали взаимосвязь между эрозивно-деструктивными изменениями костной ткани и выраженностью генерализованного остеопороза у 66 женщин с достоверным ревматоидным артритом (по критериям Американской коллегии ревматологов) в возрасте от 18 до 65 лет, с давностью заболевания от полугода до 38 лет.
Независимо от возраста пациенток на момент обследования, по мере увеличения значения суммарного модифицированного индекса Sharp снижалась минеральная плотность кости (МПК) во всех отделах скелета и увеличивалось количество больных с остеопорозом хотя бы в одном из анализируемых участков скелета.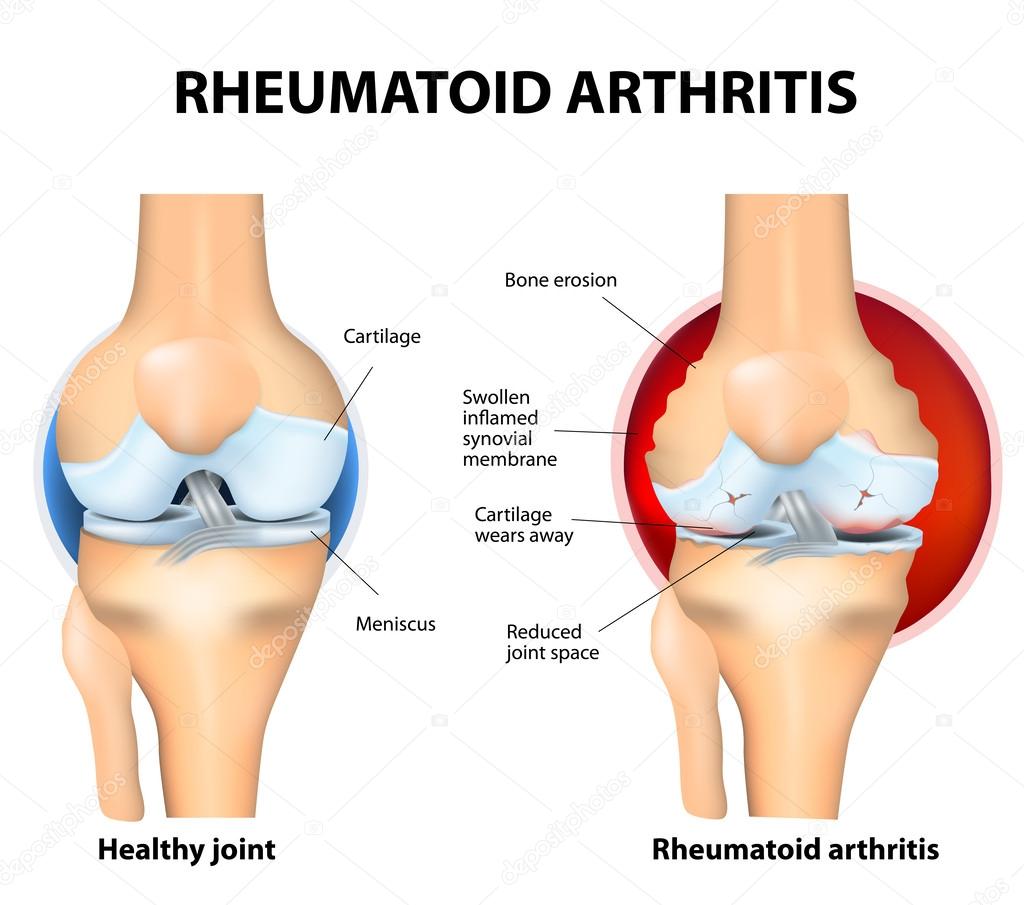
Таблица 1. Характеристика изменений МПК в различных отделах скелета у пациенток с ревматоидным артритом
Таблица 2. Значения модифицированного индекса Sharp у больных ревматоидным артритом в зависимости от возраста, длительности заболевания и МПК
Таблица 3. Взаимосвязь особенностей течения ревматоидного артрита и выраженности остеопороза в различных областях скелета с возрастом начала заболевания
Взаимосвязь особенностей течения ревматоидного артрита и выраженности остеопороза в различных областях скелета с возрастом начала заболевания
Ревматоидный артрит (РА) – аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом и системным воспалительным поражением внутренних органов.
Установлено, что РА является фактором, способствующим потере минеральной плотности кости (МПК), то есть заболеванием, увеличивающим риск развития остеопороза (ОП) [1]. Вторичный ОП при РА диагностируется как у женщин, так и у мужчин, причем во всех возрастных группах. Околосуставной (периартикулярный) ОП – одно из ранних рентгенологических проявлений артрита – развивается еще до образования костных эрозий [2]. По мере увеличения длительности РА развивается генерализованный (распространенный) ОП. Генерализованный ОП присоединяется на более поздних этапах болезни на фоне хронического воспаления, снижения физической активности пациентов.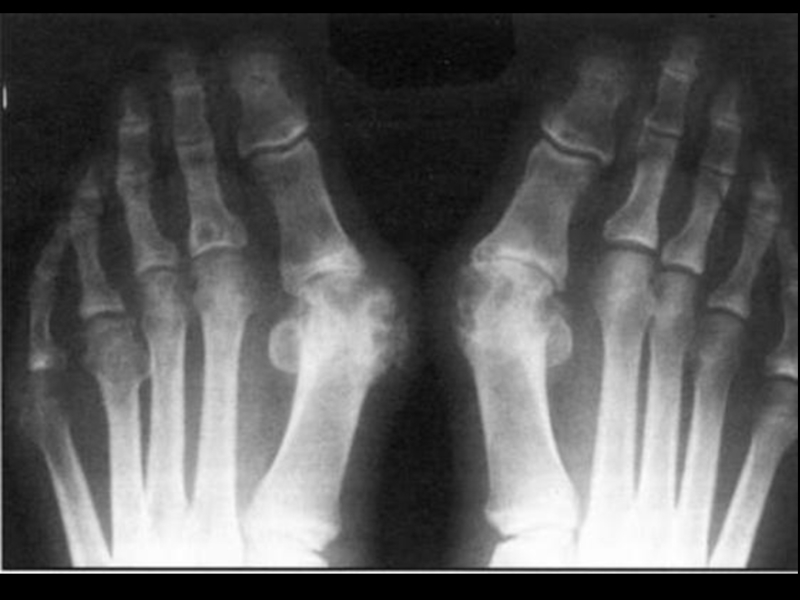
В последние годы широко обсуждается положение о том, что прогрессирование эрозивно-деструктивных изменений в кистях и стопах при РА (увеличение числа эрозий) тесно связано со снижением МПК, а увеличение количества и активности остеокластов при РА играет ключевую роль в возникновении эрозий и снижении костной массы [4, 5].
Изучение взаимосвязи между эрозивно-деструктивными изменениями костной ткани и генерализованным остеопорозом у больных ревматоидным артритом очень важно для оценки прогноза течения заболевания и принятия решения о проведении дополнительных диагностических и лечебно-профилактических мероприятий.
Целью исследования стало изучение взаимосвязи между эрозивно-деструктивными изменениями костной ткани и генерализованным остеопорозом у больных ревматоидным артритом.
Материалы и методы исследования
Данная работа является фрагментом многоцентровой программы «Остеопороз при ревматоидном артрите: диагностика, факторы риска, переломы, лечение». В исследовании, проведенном в ФГБУ НИИР РАМН в 2011–2013 гг., участвовали 66 женщин с достоверным РА, отвечавших критериям Американской коллегии ревматологов (American College of Rheumatology, ACR) 1987 г., в возрасте от 18 до 65 лет, с давностью заболевания от полугода до 38 лет. На всех больных были заполнены специально разработанные тематические карты, данные внесены в таблицу Exсel для дальнейшей статистической обработки. Сведения о больных включали результаты опроса и сбора анамнеза, осмотра, анализов крови (скорость оседания эритроцитов, тест на С-реактивный белок, ревматоидный фактор (РФ), гемоглобин, общепринятые биохимические показатели), оценку активности заболевания (DAS28) и качества жизни (оценивавшегося с помощью опросника HAQ (Health Assessment Questionnaire – Опросник для оценки состояния здоровья)).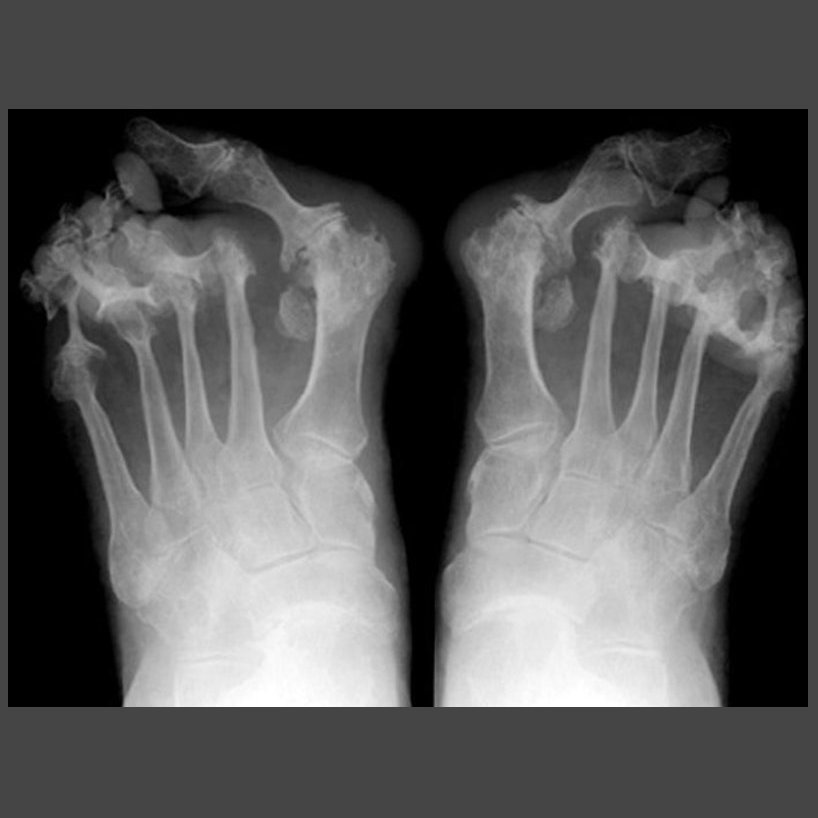
Женщинам в пери- и постменопаузе диагноз ОП устанавливали клинически на основании перенесенного при минимальной травме или спонтанного перелома (кроме переломов пальцев или костей черепа) либо по результатам денситометрии: при Т-критерии ≤ -2,5 стандартных отклонения (СО) от пика костной массы или ≤ -1,5 СО на фоне приема глюкокортикостероидов (ГКС).
Статистический анализ проводили с использованием программы Statistica 6.0. Применяли стандартные методы описательной статистики (вычисление средних значений, средних квадратичных отклонений), критерии Краскела – Уоллиса и Стьюдента. Статистическая значимость показателей была определена как р
Результаты
Средний возраст больных, включенных в исследование, составил 51,6 ± 9,6 года, средняя длительность РА – 13,2 ± 9,1 года. Позитивными по РФ были 54 (82%) пациентки, негативными – 11 (18%). Терапию ГКС получали 45 (68%) больных. Средний показатель количества эрозий по методу Sharp/van der Heijde составил 38,8 ± 51,5 балла, число суженных щелей – 87,2 ± 41,4 балла, суммарный индекс Sharp/van der Heijde – 125,4 ± 85,4 балла. Среднее значение МПК в L1–L4 составило 0,908 ± 0,147 г/см², в ШБ – 0,695 ± 0,118 г/см², в ДОП – 0,469 ± 0,090 г/см².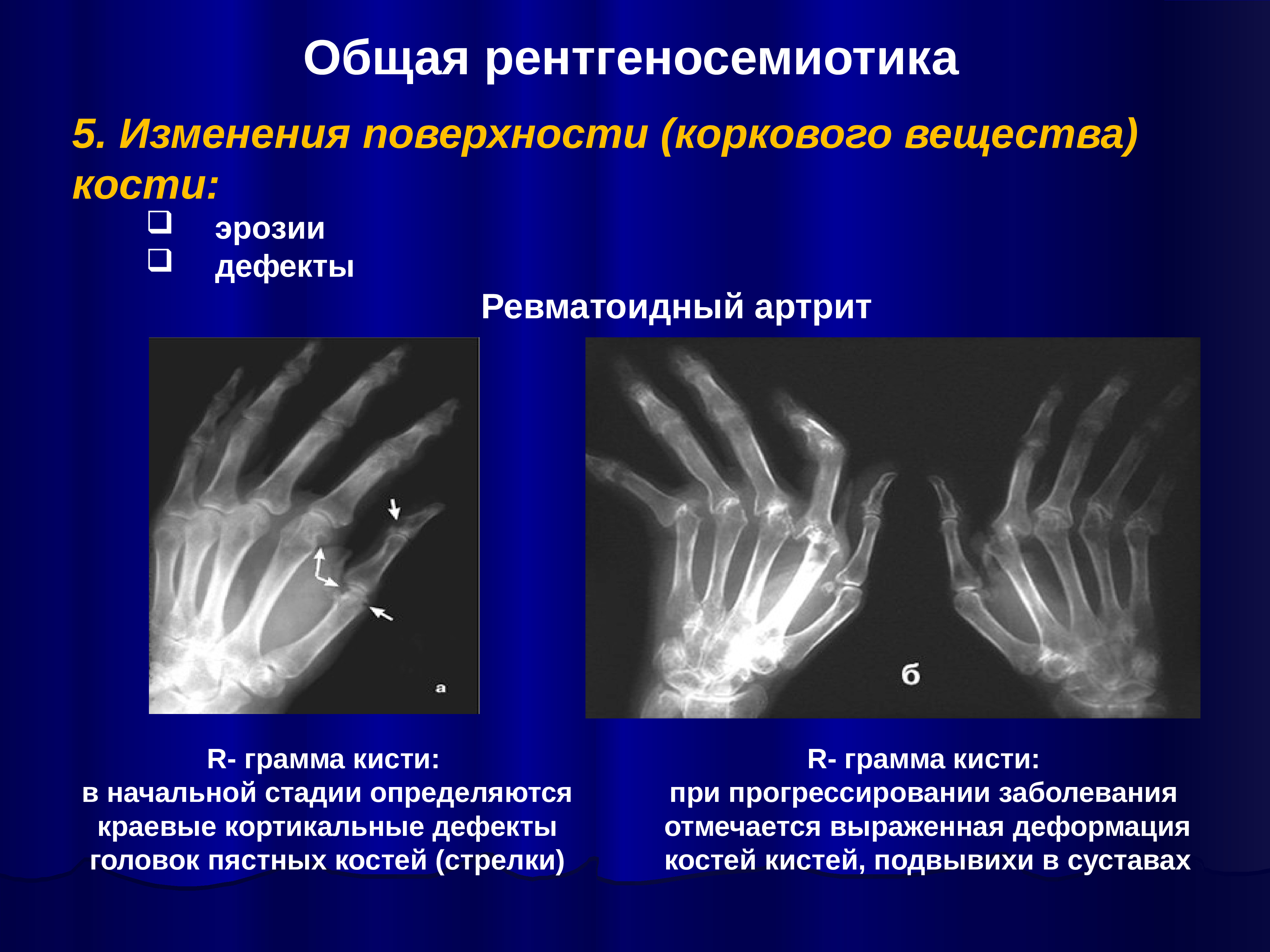
В зависимости от суммарного индекса Sharp больных распределили на 3 группы: 1-я группа – менее 50 баллов (12 (19%) пациенток), 2-я – от 51 до 150 баллов (30 (45%)), 3-я – более 150 баллов (24 (36%)) (табл. 2). Средний возраст пациенток составил 53,1 ± 6,2, 48,1 ± 11,3 и 55,3 ± 6,1 года соответственно. Возраст больных 1-й группы был сопоставим с возрастом больных 2-й и 3-й группы, а средний возраст пациенток 2-й группы был достоверно меньше, чем пациенток 3-й группы. По мере увеличения суммарного индекса Sharp увеличивалась средняя длительность болезни – 8,4 ± 4,1, 9,7 ± 6,7 и 19,9 ± 9,5 года в 1-й, 2-й и 3-й группе соответственно и в 3-й группе она была достоверно больше, чем в 1-й и 2-й.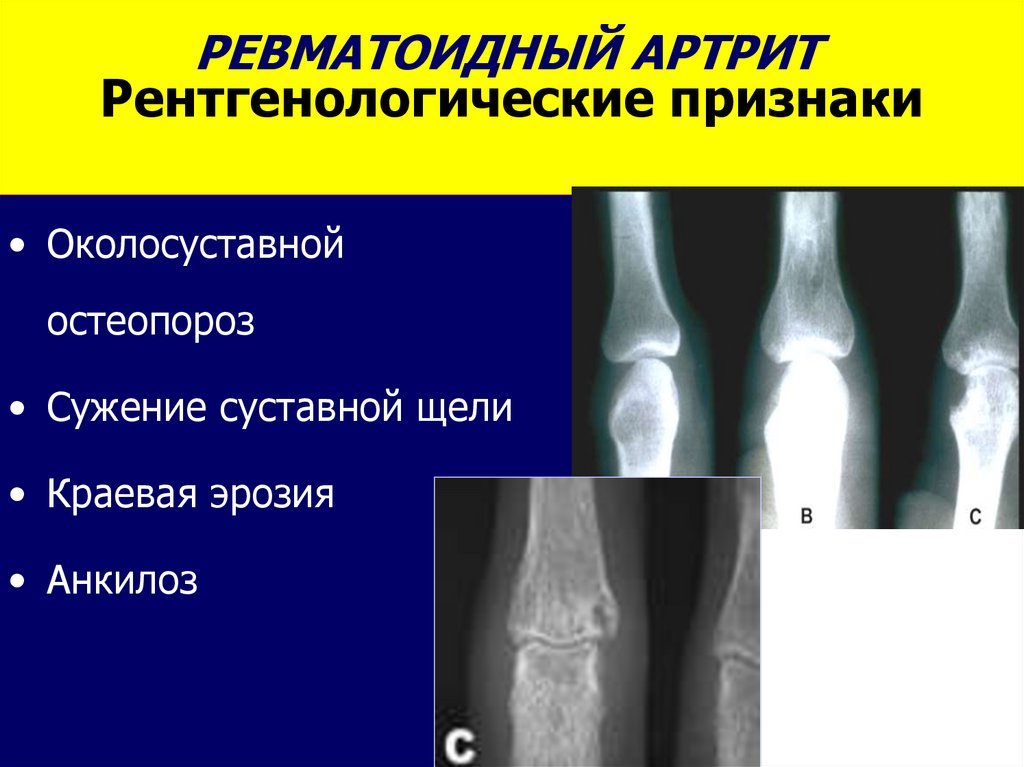
в L1–L4 – 0,980 ± 0,160, 0,898 ± 0,150 и 0,886 ± 0,100 г/см²;
ШБ – 0,773 ± 0,070, 0,715 ± 0,12 и 0,628 ± 0,08 г/см²;
ДОП – 0,506 ± 0,040, 0,477 ± 0,110 и 0,437 ± 0,100 г/см².
По мере увеличения показателя индекса Sharp возрастало количество больных с ОП и остеопенией. Остеопороз хотя бы в одном из анализируемых участков скелета был выявлен у 1 (8%) больной 1-й группы, у 11 (37%) пациенток 2-й группы и 16 (67%) больных 3-й группы, остеопения – у 7 (58%), 13 (43%) и 5 (21%) больных 1-й, 2-й и 3-й группы соответственно. У больных 3-й группы по сравнению с больными 1-й и 2-й группы частота ОП была достоверно выше (р
При изучении МПК и прогрессирования эрозивных изменений в суставах особый интерес вызывает возраст больных на момент начала РА. В связи с этим мы сформировали три группы в зависимости от возраста на момент начала заболевания. В 1-ю группу вошли пациентки, заболевшие в возрасте от 18 до 30 лет, – 20 (30%), во 2-ю – заболевшие в возрасте от 31 до 50 лет – 36 (55%) и в 3-ю группу – заболевшие в возрасте 51 года и старше – 10 (15%). Характеристика эрозивно-деструктивных изменений и МПК этих больных представлена в табл. 3. Как видим, пациентки 1-й группы были достоверно моложе больных 2-й и 3-й группы, а больные 2-й группы – моложе больных 3-й группы. Средний возраст больных 1-й группы составил 46,7 ± 12,1, 2-й группы – 51,9 ± 6,7 и 3-й группы – 60,3 ± 3,3 года. При этом длительность РА в 1-й группе была достоверно больше, чем во 2-й и 3-й группах, – 21,4 ± 10,7, 10,5 ± 4,6 и 6,75 ± 2,9 года соответственно. В свою очередь длительность болезни во 2-й группе была больше, чем в 3-й (р
В связи с этим мы сформировали три группы в зависимости от возраста на момент начала заболевания. В 1-ю группу вошли пациентки, заболевшие в возрасте от 18 до 30 лет, – 20 (30%), во 2-ю – заболевшие в возрасте от 31 до 50 лет – 36 (55%) и в 3-ю группу – заболевшие в возрасте 51 года и старше – 10 (15%). Характеристика эрозивно-деструктивных изменений и МПК этих больных представлена в табл. 3. Как видим, пациентки 1-й группы были достоверно моложе больных 2-й и 3-й группы, а больные 2-й группы – моложе больных 3-й группы. Средний возраст больных 1-й группы составил 46,7 ± 12,1, 2-й группы – 51,9 ± 6,7 и 3-й группы – 60,3 ± 3,3 года. При этом длительность РА в 1-й группе была достоверно больше, чем во 2-й и 3-й группах, – 21,4 ± 10,7, 10,5 ± 4,6 и 6,75 ± 2,9 года соответственно. В свою очередь длительность болезни во 2-й группе была больше, чем в 3-й (р
Заключение
В результате проведенного нами исследования установлена ассоциация между эрозивно-деструктивными изменениями в суставах кистей и стоп и МПК различных отделов скелета. Независимо от возраста больных РА по мере увеличения длительности заболевания возрастает не только показатель суммарного индекса Sharp, но и число больных с ОП. Снижение МПК отмечено преимущественно в ШБ. Пациентки с РА, заболевшие в возрасте до 30 лет (в период формирования костной массы), по сравнению с теми, кто заболел после 50 лет (после наступления менопаузы), также имеют более низкие значения МПК в ШБ, высокий показатель числа эрозий и суммарного индекса Sharp. При этом пациентки, заболевшие до 30 лет, на момент обследования были значительно моложе, но продолжительность РА у них была больше.
Независимо от возраста больных РА по мере увеличения длительности заболевания возрастает не только показатель суммарного индекса Sharp, но и число больных с ОП. Снижение МПК отмечено преимущественно в ШБ. Пациентки с РА, заболевшие в возрасте до 30 лет (в период формирования костной массы), по сравнению с теми, кто заболел после 50 лет (после наступления менопаузы), также имеют более низкие значения МПК в ШБ, высокий показатель числа эрозий и суммарного индекса Sharp. При этом пациентки, заболевшие до 30 лет, на момент обследования были значительно моложе, но продолжительность РА у них была больше.
Обсуждение
РА характеризуется прогрессированием эрозивно-деструктивного полиартрита, который становится причиной функциональных нарушений, снижения качества жизни и инвалидизации больных. Присоединившийся ОП усугубляет эти нарушения и становится причиной таких осложнений, как переломы.
Отметим, что для многих больных денситометрия по-прежнему остается малодоступным методом обследования из-за недостаточной оснащенности рентгеновскими денситометрами лечебных учреждений, в которых наблюдаются больные РА, и высокой стоимости исследования.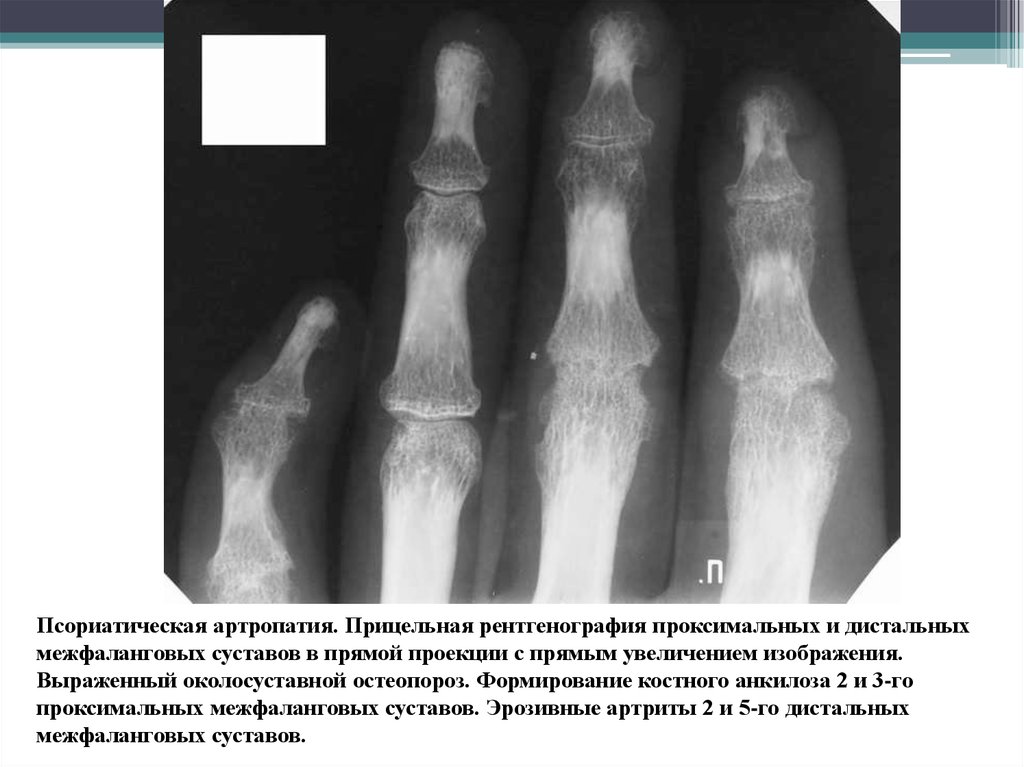
Увеличение длительности болезни сопровождается увеличением числа эрозий независимо от возраста, что отражает патогенез заболевания. Снижение МПК (и возникновение ОП) ассоциируется прежде всего с возрастом, наступлением менопаузы и другими традиционными факторами. В нашем исследовании снижение МПК во всех отделах скелета ассоциировалось не с возрастом больных, а с длительностью болезни и увеличением значения модифицированного индекса Sharp. Так, у сопоставимых по возрасту больных с длительностью заболевания свыше 20 лет МПК оказалась ниже, чем у больных с длительностью заболевания не более 7,5 года. У пациенток с меньшей давностью заболевания, несмотря на пожилой возраст, МПК оказалась выше, чем у больных более молодых, но с большей длительностью РА.
Связь генерализованной потери костной ткани с РА была доказана в эпидемиологических исследованиях с помощью различных методов. Так, исследование R.F. Laan и соавт. было первым, в котором использование двухэнергетической рентгеновской костной абсорбциометрии (DXA) для диагностики ОП продемонстрировало, что больные РА имели более низкие показатели МПК по сравнению с пациентами контрольной группы [6].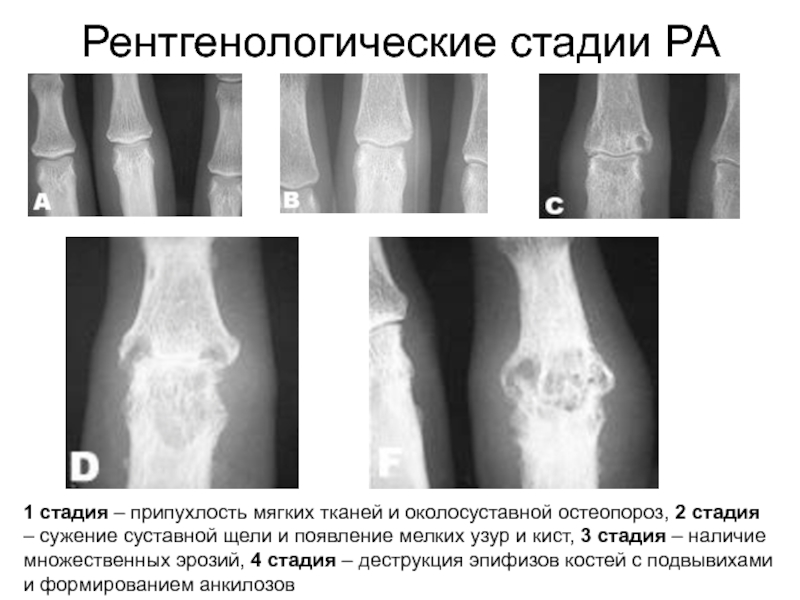 Впоследствии A.K. Gough и соавт. обнаружили нарастающую потерю МПК в поясничном отделе позвоночника и области большого вертела у пациентов с ранним РА в сравнении с больными контрольной группы [7]. Распространенность ОП у больных РА в поясничном отделе позвоночника (L1–L4) и проксимальном отделе бедра (ШБ), по данным ряда авторов, составляет от 10 до 67% и определяется качеством, количеством выборки, возрастом больных, включенных в исследование [2, 8–15]. По данным, полученным в ФГБУ НИИР РАМН при анализе протоколов денситометрии 1923 больных РА (88% женщин, 12% мужчин) в возрасте от 20 до 94 лет, выполненной на аппарате Hologic Discovery A за период с 2004 по 2009 г. в трех областях (L1–L4, ШБ и ДОП недоминантной руки), ОП хотя бы в одной области измерения выявлен у 29% больных, в том числе у 15% больных моложе 50 лет. Наиболее часто ОП диагностировали в области предплечья (34%). Частота ОП в L1–L4 и ШБ была примерно одинаковой (16%). У молодых мужчин частота ОП в L1–L4 (18%) и ШБ (21%) оказалась выше, чем у молодых женщин (7 и 4% соответственно) (р
Впоследствии A.K. Gough и соавт. обнаружили нарастающую потерю МПК в поясничном отделе позвоночника и области большого вертела у пациентов с ранним РА в сравнении с больными контрольной группы [7]. Распространенность ОП у больных РА в поясничном отделе позвоночника (L1–L4) и проксимальном отделе бедра (ШБ), по данным ряда авторов, составляет от 10 до 67% и определяется качеством, количеством выборки, возрастом больных, включенных в исследование [2, 8–15]. По данным, полученным в ФГБУ НИИР РАМН при анализе протоколов денситометрии 1923 больных РА (88% женщин, 12% мужчин) в возрасте от 20 до 94 лет, выполненной на аппарате Hologic Discovery A за период с 2004 по 2009 г. в трех областях (L1–L4, ШБ и ДОП недоминантной руки), ОП хотя бы в одной области измерения выявлен у 29% больных, в том числе у 15% больных моложе 50 лет. Наиболее часто ОП диагностировали в области предплечья (34%). Частота ОП в L1–L4 и ШБ была примерно одинаковой (16%). У молодых мужчин частота ОП в L1–L4 (18%) и ШБ (21%) оказалась выше, чем у молодых женщин (7 и 4% соответственно) (р
Как известно, на возникновение и течение вторичного ОП при РА влияют не только традиционные (общепринятые, популяционные) факторы риска ОП, такие как женский пол, возраст, ИМТ, низкая МПК, семейный анамнез ОП, низкая физическая активность, курение, злоупотребление алкоголем, дефицит витамина D, недостаточное потребление кальция, гипогонадизм, ранняя менопауза, длительная иммобилизация, но и собственные факторы, отражающие развитие и течение РА, внесуставные проявления болезни, вовлечение в патологический процесс внутренних органов.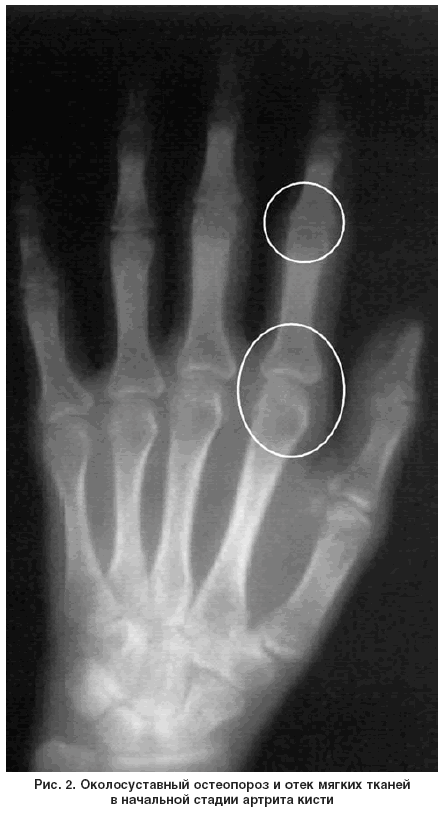
Противоречивые результаты получены исследователями, изучавшими взаимосвязь между длительностью РА и снижением МПК. Одни ее установили [9, 17–19], другие не подтвердили [3].
При РА описаны три формы изменения костной ткани: фокальная потеря костной массы непосредственно в субхондральной кости и суставных поверхностях (с образованием эрозий), периартикулярная остеопения в воспаленных суставах и генерализованный ОП с вовлечением осевого и периферического скелета.
Предполагалось, что патофизиологические механизмы генерализованной потери костной ткани и фокальных эрозий различны. Однако была выдвинута гипотеза о том, что патофизиологические механизмы этих процессов могут быть общими [20]. Эта гипотеза была подтверждена в исследовании L. Sinigaglia и соавт., подтвердившем связь между высокой распространенностью ОП и наличием эрозий у женщин с РА [21]. Достоверная положительная корреляция между МПК и эрозиями в суставах кистей и стоп зарегистрирована в ряде исследований [22–28].
Например, K. Forslind и соавт. были обследованы 204 пациента с РА (134 женщины и 70 мужчин, средний возраст 55 и 61 год соответственно). Получена корреляция между количеством эрозий в кистях и стопах и МПК. Значительные различия обнаружены только у женщин. Так, женщины с низкой МПК и ОП имели более высокие показатели эрозий [24].
В исследовании OSTRA представлены данные из трех стран в отношении МПК и деформации позвонков у женщин в возрасте 50–70 лет с многолетним РА. Исследователи продемонстрировали связь между количеством эрозий в суставах кистей и стоп и низкой МПК [25]. Корреляция эрозий и низкой МПК получена также в ходе исследования М. Rossini [26]. В исследовании участвовал 1191 пациент с РА (1014 женщин и 177 мужчин, средний возраст составлял 58,9 ± 11,1 года). Рентгенологически костные эрозии в кистях и стопах выявлены у 64,1% пациентов. У этих пациентов средние значения МПК были значительно ниже как в L1–L4 (-0,74 ± 1,19 vs -0,46 ± 1,31, р = 0,05), так и в ШБ (-0,72 ± 1,07 vs -0,15 ± 1,23, р
В недавнем исследовании D. Solomon и соавт. анализировали взаимосвязь между МПК и эрозиями в когорте постменопаузальных женщин, страдающих РА. Установлено, что изменение МПК ШБ коррелировало с числом эрозий (r = -0,33, р
Solomon и соавт. анализировали взаимосвязь между МПК и эрозиями в когорте постменопаузальных женщин, страдающих РА. Установлено, что изменение МПК ШБ коррелировало с числом эрозий (r = -0,33, р
Таким образом, нами проанализированы материалы рентгенологического и денситометрического обследования больных РА, представлены предварительные результаты сравнительного анализа, демонстрирующие связь между МПК и эрозивно-деструктивными изменениями в костной ткани по мере увеличения длительности болезни независимо от возраста больных. Более подробный последующий анализ большей выборки больных с учетом различных факторов позволит определить вклад каждого фактора и соответственно разработать алгоритм и персонифицированную тактику клинико-диагностических и лечебных мероприятий при РА.
Эрозия хряща: общая информация
Эрозия хряща, не считаясь самостоятельным заболеванием, относится к дегенеративным процессам, которые являются формой воспаления сустава, чаще всего коленного.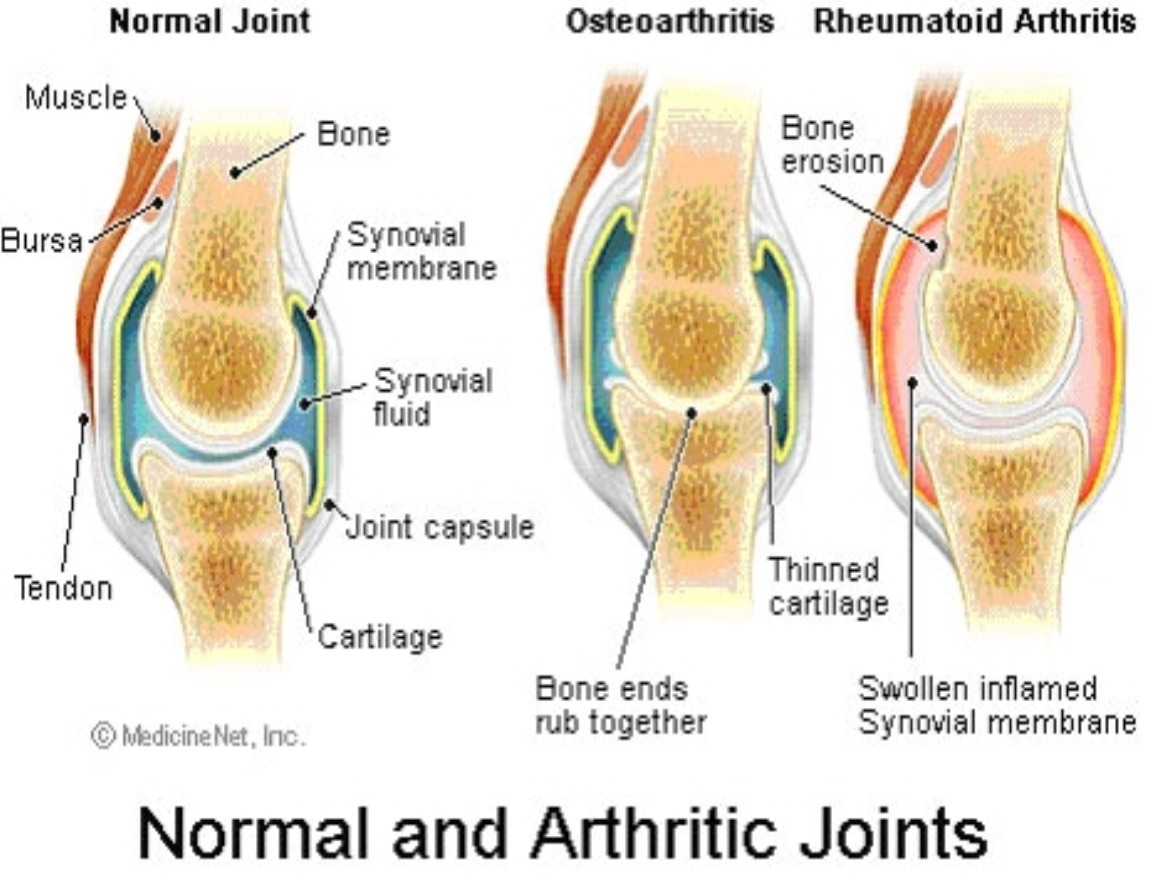 Повреждение суставного хряща характерно для пожилых людей. Хрящ представляет собой плотную, но эластичную ткань, состоящую преимущественно из воды, количество которой с возрастом уменьшается, заменяясь гелеобразным веществом. Расположение хрящевой ткани позволяет суставу двигаться легко и гладко. Прогрессирующее разрушение хряща, с поражением суставной сумки, ее оболочки, мышц, костей и связок, называют остеоартритом, на возникновение которого, кроме возраста влияют такие факторы:
Повреждение суставного хряща характерно для пожилых людей. Хрящ представляет собой плотную, но эластичную ткань, состоящую преимущественно из воды, количество которой с возрастом уменьшается, заменяясь гелеобразным веществом. Расположение хрящевой ткани позволяет суставу двигаться легко и гладко. Прогрессирующее разрушение хряща, с поражением суставной сумки, ее оболочки, мышц, костей и связок, называют остеоартритом, на возникновение которого, кроме возраста влияют такие факторы:
- Женский пол, что связано с гормональными перестройками.
- Врожденные аномалии суставов.
- Большой вес тела, что дает непосильную нагрузку на суставные хрящи, негативно влияет на обмен веществ.
- Механическое повреждение сустава.
- Регулярные физические нагрузки, связанные с родом деятельности.
- Малоподвижный образ жизни.
- Операции на суставах.
Эрозия сопровождается атрофией хрящевых тканей, которая продолжается до полного обнажения суставных костей, лишенных оболочки или амортизирующих прослоек. Хрящ не имеет сосудов и его трудно восстановить после повреждения эрозией, в результате чего человек будет ощущать постоянную боль и другие осложнения, что значительно снижает качество жизни.
Хрящ не имеет сосудов и его трудно восстановить после повреждения эрозией, в результате чего человек будет ощущать постоянную боль и другие осложнения, что значительно снижает качество жизни.
Симптомы эрозии суставного хряща
Характерным признаком развивающегося дегенеративного процесса в коленях, являются интенсивные болезненные ощущения, которые возникают и ночью, в состоянии покоя. Эрозия сопровождается затруднением движения, вследствие чего человек не может нормально ходить, приседать, подниматься по лестнице. Движения сопровождаются хрустом, отечностью, треском. Чтобы не запускать патологию, способную привести к необратимой инвалидности, следует не терпеть боль, не заниматься самолечением, а довериться настоящим профессионалам, которые работают в израильской клинике Tel Aviv Medical Clinic, оказывая квалифицированную медицинскую помощь всем пациентам.
Диагностика и лечение в Tel Aviv Medical Clinic
При планировании лечения учитывается сила и частота боли, состояние мышц и суставов, что показывают результаты рентгенографии и другие инструментальные методы исследования.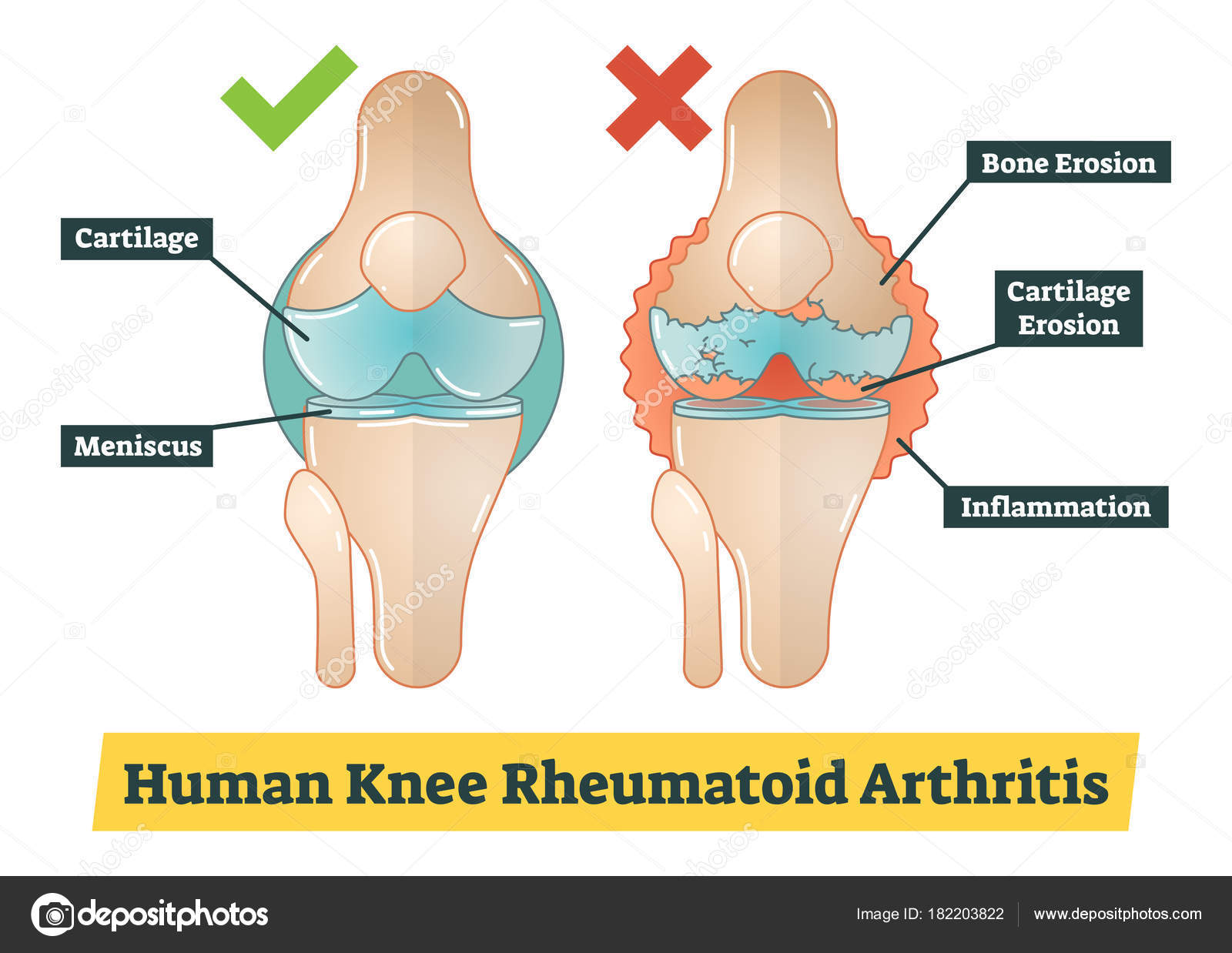 Лечение эрозии начинается с консервативной терапии, направленной на увеличение объема движений, снижение боли. Назначаются специальные физиотерапевтические процедуры, фармакологические препараты, по необходимости применяется хирургическое вмешательство.
Лечение эрозии начинается с консервативной терапии, направленной на увеличение объема движений, снижение боли. Назначаются специальные физиотерапевтические процедуры, фармакологические препараты, по необходимости применяется хирургическое вмешательство.
(PDF) Differential X-Ray Diagnosis of Changes in the Joints of the Hands and the Distal Foot in Rheumatic Diseases
35
№ 2 (18), 2015 www.mif-ua.com
Лекції, огляди / Lectures, Reviews
на наружных краях проксимального эпифиза 1-й пяст-
ной кости и трапециевидной кости запястья (в 1-м ЗП)
при нормальной или слегка суженной суставной щели.
Для более выраженных стадий ОА характерны круп-
ные остеофиты и деформация краев суставных поверх-
ностей, значительное сужение суставных щелей, суб-
хондральный остеосклероз, кисты со склеротическим
ободком. Обычно кистовидные просветления костной
ткани окружены зоной остеосклероза. Типичным на-
до считать и сочетание ОА 1-х ПЛФ с вальгусной де-
виацией суставов и деформацию трапециевидной ко-
сти в 1-м ЗП.
Подагрический артрит
Для подагрического артрита (ПА) характерно пре-
имущественное поражение суставов дистальных от-
делов стоп с преобладанием изменений в 1-х ПЛФ.
Значительно реже изменения выявляются в мелких
суставах кистей. Ранний рентгенологический сим-
птом при ПА — преходящее утолщение мягких тка-
ней в измененных суставах в течение острой подаг-
рической атаки. С переходом заболевания в хрони-
ческую стадию выявляются типичные для ПА узло-
вые образования (тофусы) в костях (в виде кистовид-
ных просветлений костной ткани) и в мягких тканях
(в виде участков повышения ее плотности) в области
фаланг пальцев кистей и стоп. В отдельных наблюде-
ниях можно обнаружить частичную кальцификацию
внутри тофусов, что сочетается у больных с подагри-
ческим нефритом, но данный симптом обнаружива-
ется редко [10].
Костные эрозии часто обнаруживаются при хрони-
ческом течении ПА. Внутрисуставные эрозии чаще ло-
Внутрисуставные эрозии чаще ло-
кализуются на краях эпифизов костей и в дальнейшем
распространяются на центральные отделы суставов.
Внесуставные эрозии определяются в области мета-
диафизов костей и часто взаимосвязаны с мягкоткан-
ными тофусами. Эрозии при ПА имеют округлую или
овальную форму, часто со склеротическим ободком.
Склеротический ободок в основании эрозии или во-
круг внутрикостного тофуса создает типичный для ПА
рентгенологический симптом «пробойника». Крае-
вая эрозия кости в виде «свешивающейся губы» — еще
один характерный для ПА рентгенологический сим-
птом. Выраженная пролиферативная реакция, отра-
жающая репаративные процессы в костях, может быть
обнаружена в плюснефаланговых и межфаланговых
суставах (рис. 15).
При ПА ширина рентгенологической суставной
щели обычно сохраняется в норме даже в поздних ста-
диях заболевания. Наличие внутрисуставной, кальци-
фицированной костной эрозии с сохраненной шири-
ной суставной щели в первую очередь предполагает
диагноз ПА.
Иногда может обнаруживаться внутрисуставной
костный анкилоз межфаланговых суставов стоп. Пре-
ходящий локальный остеопороз обнаруживается толь-
ко во время острой подагрической атаки. В хрониче-
ской стадии заболевания остеопороз не является ха-
рактерным проявлением ПА.
Основные рентгенологические симптомы ПА сход-
ны во всех местах поражений, однако поражение опре-
деленных, специфических для ПА, областей может
быть диагностически важным [10]. Первый ПЛФ —
наиболее характерное место поражения при ПА. Эро-
зии обычно обнаруживаются в верхней и медиаль-
ной части головки плюсневой кости и часто в сочета-
нии с вальгусной девиацией суставов. Достаточно ча-
сто определяются изменения в проксимальных и ди-
стальных межфаланговых суставах стоп. Типичными
являются асимметричные артриты с чередование вну-
трикостных и мягкотканных тофусов. Крупные мягко-
тканные и внутрикостные тофусы могут вызывать
остеолиз больших участков костей, в основном это ме-
тадиафизы костей, но в проксимальных и дистальных
фалангах пальцев кистей и стоп возможен тотальный
остеолиз костей [21] (рис. 16).
16).
В заключение можно сказать, что для более точ-
ной и детальной оценки патологических изменений
в костях, суставах и мягких тканях стопы, так же как
и для оценки состояния мелких суставов кистей, не-
обходимо использовать весь спектр новейших ди-
агностических технологий. К ним можно отнести
прицельную рентгенографию с прямым увеличени-
Рисунок 15. Подагрический артрит. Рентгенография
дистальных отделов стоп. Утолщены и уплотнены
мягкие ткани в 1-х плюснефаланговых суставах.
Множественные кисты со склеротическим ободком
(симптом «пробойника»). Выраженные пролиферативные
костные изменения и множественные деструкции
костей в 1-х ПЛФ. Кальцифицированы сосуды в мягких
тканях
Рисунок 16. Подагрический артрит. Рентгенография
дистальных отделов стоп. Крупный мягкотканный
тофус и остеолиз средней фаланги 5-го правого пальца.
Крупные внутрикостные тофусы 4-х средних фаланг.
Множественные кисты (симптом «пробойника»)
и мягкотканные тофусы в 1-х ПЛФ и в 1-м правом
межфаланговом суставе стопы
Врожденная эрозия шейки матки
В 21 веке эрозия шейки матки является наиболее распространённым заболеванием, которое встречается у 15% женщин. Многие, услышав данный диагноз, пугаются и начинают паниковать. Но переживать раньше времени не стоит. Давайте во всем разберемся. Что же такое эрозия шейки матки, и какая она бывает?
Термином «эрозия шейки матки» зачастую обозначают дефект, некое нарушение целостности влагалищного эпителия шейки матки. Выявляют ее при обычном гинекологическом исследовании. Измененный участок легко отличить от здоровой окружающей ткани по характерной розово-красной окраске и зернистости.
Врожденная эрозия шейки матки – это естественный процесс, который наблюдается у молодой женщины или девочки. Все дело в том, что шейка представляет собой некий цилиндр, изнутри он выстлан цилиндрическим эпителием, а снаружи – плоским. У девочек часто бывает так, что цилиндрический эпителий изначально расположен снаружи. Но с возрастом он смещается внутрь. Если же этого не произошло по ряду причин (гормональный фон, наследственность, возраст), тогда говорят о врожденной эрозии шейки матки.
У девочек часто бывает так, что цилиндрический эпителий изначально расположен снаружи. Но с возрастом он смещается внутрь. Если же этого не произошло по ряду причин (гормональный фон, наследственность, возраст), тогда говорят о врожденной эрозии шейки матки.
Также бывает истинная (приобретенная) эрозия шейки матки – это, как правило, нарушение у влагалищной части шейки матки целостности плоского эпителия слизистой оболочки. Возникает данная патология в результате воспалительного процесса шейки матки, который может быть вызван стрептококками, стафилококками, трихомонадами, хламидиями, гонококками, дрожжевыми грибками и др. Довольно часто эрозия шейки матки и ВПЧ (вирус папилломы человека) взаимосвязаны. Очень важно рано выявить наличие остроконечных вирусных кондилом и ВПЧ. Ведь инфекции, передаваемые половым путем, совместно с эрозией шейки матки являются хорошей предпосылкой для развития рака шейки матки. Эрозия может возникнуть в результате хирургического аборта, во время родов, при гормональном дисбалансе в организме, хотя жалобы при этом могут отсутствовать. Поэтому осматриваться у гинеколога необходимо в обязательном порядке 1 раз в полгода, чтобы эрозию шейки матки и ВПЧ вовремя выявить, устранить все причины и начать своевременно лечение.
Поэтому осматриваться у гинеколога необходимо в обязательном порядке 1 раз в полгода, чтобы эрозию шейки матки и ВПЧ вовремя выявить, устранить все причины и начать своевременно лечение.
У многих возникает вопрос: лечить или не лечить эрозию? Что делать, если ее обнаружили? Чаще всего эрозию лечить не нужно, так как она может пройти самостоятельно после гормональной встряски. Подобное случается во время полового созревания, беременности или родов. Если планируете завести ребенка, то эрозию лучше пока оставить в покое. Во время родов она не помешает, в период беременности может исчезнуть сама. «Врожденную эрозию» прижигать грубым методом не стоит, ведь при первых родах довольно важна эластичность шейки матки при ее раскрытии. А прижигание может нарушить этот процесс. Если же лечение необходимо, то прибегают к одному из таких методов, как диатермокоагуляция, криотерапия, лазеротерапия или радиоволновая хирургия.
Наши клиники в Санкт-Петербурге
Получить подробную информацию и записаться на прием Вы можете по телефону +7 (812) 640-55-25
В Саудовской Аравии нашли древнейшие в мире изваяния животных
Автор фото, AFP
Подпись к фото,Эрозия повредила поверхность, что усложнило изучение скульптур
Гигантские изображения верблюдов, высеченные из целых скал, были открыты еще в 2018 году, но тогда археологи отнесли время их создания к началу нашей эры.
По данным последнего исследования, они появились 7-8 тысяч лет назад, что делает их древнейшими скульптурами животных среди известных науке. Они намного старше Стоунхенджа (4,5-5 тыс. лет) и пирамид Гизы (4,5 тыс. лет).
В основе прежней оценки лежало сходство статуй верблюдов с подобными изображениями в знаменитом городе Петра в Иордании.
Датирование каменных изваяний — задача большой сложности. В отличие от наскальной живописи, они не содержат органических остатков, возраст которых достаточно просто определить.
Автор фото, Corbis News
Подпись к фото,Подобные небольшие изображения верблюдов наиболее типичны в регионе
Исследователи из Университета короля Сауда, немецкого Института имени Макса Планка и Национального центра научных исследований Франции использовали целый набор методов: анализ следов инструментов, моделирование процессов выветривания и эрозии, портативную рентгенофлуоресцентную спектрометрию для измерения плотности минерального налета и датирование по люминесценции отколовшихся фрагментов.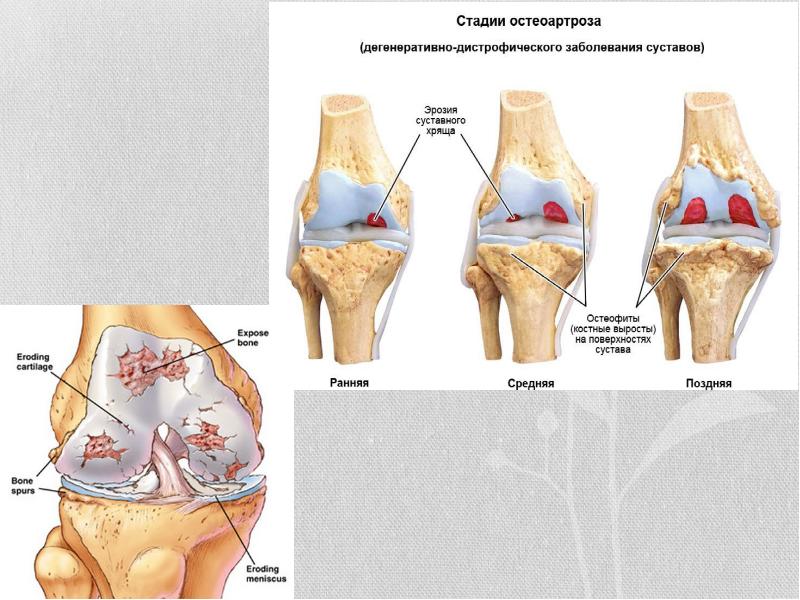
Кроме того, археологи провели раскопки вблизи памятника и обнаружили каменные орудия труда и кости животных, которые удалось датировать радиоуглеродным методом.
Результаты их работы опубликованы в американском академическом журнале Journal of Archaeological Science.
«Теперь мы можем связать Стоянку верблюдов с доисторическим периодом, когда скотоводческое население Северной Аравии создавало наскальные рисунки и строило большие каменные сооружения, называемые мустатилами. Таким образом, Стоянка верблюдов является частью более широкой схемы взаимодействия групп людей, которые собирались вместе в символических местах, чтобы создавать памятники», — пишут авторы исследования.
Автор фото, AFP
Подпись к фото,Эти древние горельефы были датированы эпохой Неолита, завершающим этапом Каменного века
Комплекс, известный как Стоянка верблюдов, включает в себя 21 натуралистическое изображение разных животных, в том числе три гигантские статуи верблюдов, вытесанных из горных отрогов.
Предназначение комплекса точно неизвестно. Ученые предполагают, что он долгое время служил местом встреч кочевых племен.
Залежи кремня, из которого изготавливались орудия, находятся примерно в 15 км от Стоянки верблюдов. Инструменты быстро тупились, и их приходилось менять.
Скульптуры находятся на высоте, так что древним мастерам проходилось сооружать леса. Поэтому эксперты уверены, что Стоянка верблюдов — дело рук больших коллективов.
По мнению входивших в исследовательскую группу специалистов резьбы по камню, создание каждого изваяния требовало примерно 15 дней.
Любопытно, что статуи были вытесаны еще до одомашнивания верблюдов, давшего мощный толчок развитию цивилизации на Аравийском полуострове.
В те времена территория нынешней Саудовской Аравии представляла собой не пустыню, а зеленую саванну с многочисленными озерами.
Патология шейки матки — (клиники Di Центр)
Всем женщинам хорошо известно, что посещать гинеколога необходимо хотя бы раз в год для профилактики, даже если ничего не болит. Вот только поступают так немногие, уж очень малоприятная это процедура — гинекологический осмотр.
Вот только поступают так немногие, уж очень малоприятная это процедура — гинекологический осмотр.
Оказывается, регулярный поход к гинекологу не блажь, а насущная необходимость. Некоторые женские болезни протекают незаметно: без боли, неприятных выделений и нарушений менструального цикла, выявить их может только специалист. К таким скрытым болезням относится и эрозия шейки матки. Собственно говоря, эрозия — не одно заболевание, а целая группа. На сегодняшний день любое повреждение поверхности шейки матки гинекологи называют эрозией.
Что такое эрозия шейки матки?
Самая распространенная ситуация — нормальные клетки, покрывающие шейку матки, изменяются на каком-то участке. Такое иногда происходит в результате перенесенных воспалительных заболеваний или при гормональных нарушениях. Это, так называемая, псевдоэрозия шейки матки.
Истинная же эрозия возникает, когда разрушается участок слизистой оболочки шейки матки, а на этом месте образуется ранка. Причин появления эрозии может быть несколько: механические травмы (в результате родов, абортов и изощренного секса), половые инфекции (герпес и т. п.) и гормональные нарушения.
На месте дефекта в шейке матки может развиться воспаление, вызванное болезнетворными микроорганизмами, которое, в свою очередь, может перейти на другие внутренние половые органы женщины.
И, кроме того, длительно существующие эрозии, если их не лечить, могут переродиться в опухоли.
Диагностика и лечение
Догадаться о том, что в шейке матки притаилась эрозия, очень непросто. В большинстве случаев она никак себя не проявляет. Лишь изредка и только в случае истинной эрозии, у женщины могут появиться кровянистые выделения из влагалища после полового акта, спринцеваний или осмотра гинеколога. Еще реже возникают несильные боли внизу живота.
Поставить правильный диагноз может только врач-гинеколог.
Увидеть эрозию можно при обычном гинекологическом осмотре, введя зеркало во влагалище. Доктор знает, что поврежденный участок шейки матки имеет красноватый цвет и при легком надавливании кровоточит, а участок с перерожденными клетками на вид бледноватый (или бархатистый).
Более точный метод исследования — кольпоскопия — изучение шейки матки под микроскопом.
Цитологическое исследование и биопсию при эрозии тоже делают в обязательном порядке. Для первого — соскабливают клетки с сомнительного участка шейки матки шпателем и рассматривают этот мазок под большим увеличением, для второго — отщипывают кусочек подозрительной ткани и тоже изучают под микроскопом. Биопсия — самый точный метод, позволяющий выявить не только эрозию, но и рак.
После того, как эрозия обнаружена, от нее необходимо срочно избавиться. Лечение рекомендуют проводить комплексно, с учетом причины возникновения эрозии. Сначала необходимо ликвидировать воспалительный процесс. Для этого используются спринцевания и мази с противовоспалительными компонентами. При выявлении инфекции назначают антибактериальную терапию. Затем измененные участки слизистой шейки матки удаляют. Для этого существуют несколько методов:
- лазерная коагуляция — самый эффективный и современный метод лечения заболеваний шейки матки, обеспечивает высокую точность, сохранение здоровых тканей, а заживление происходит быстро и без рубцов;
- диатермокоагуляция — эрозию выжигают электрическим током;
- криодеструкция — эрозию удаляют с помощью жидкого азота;
- химическая коагуляция — участок с эрозией обрабатывают специальными препаратами, которые разъедают измененные клетки;
- и, наконец, хирургическое удаление — при опасности рака вырезают шейку матки (или ее часть).
Флюороз – что это? Причины и лечение флюороза
Флюороз — это заболевание зубной эмали, связанное с длительным попаданием в организм чрезмерного количества фтора. Оно может носить эндемический и профессиональный характер — развиваться в связи с проживанием в регионе, где питьевая вода содержит много фтора или быть связанным с условиями труда и количеством фтора в воздухе.
Эндемический флюороз распространен в регионах, где в литре питьевой воды количество фтора превышает 1,5 мг. Профессиональная форма заболевания встречается существенно реже, обычно у сотрудников алюминиевой промышленности.
Причины и механизмы развития
Фтор — микроэлемент, который поступает в организм с водой и пищей участвует во многих физиологических процессах. В высокой концентрации он содержится в костной ткани и зубах человека. Поступающий фтор усваивается не полностью, основная доля приходится на фториды, растворенные в воде. Если нехватка микроэлемента увеличивает риск кариозного поражения зубов, то избыток становится причиной болезни.
Наиболее часто наблюдается флюороз у детей при прорезывании постоянных зубов. Это относится к детям, в том числе ранее проживавшим в регионах с высокой концентрацией фтора в воде. Достаточно проживать в таком регионе до 3−4 лет. Избыток фтора влияет и на зачатки постоянных зубов. Молочные зубы при этом болезнью не поражаются, поскольку их зачатки формируются внутриутробно, а избыток фтора задерживается плацентой и не передается малышу.
К развитию флюороза у взрослых концентрация элемента в 1,5 мг на литр воды не приведет. К болезни приводит употребление воды с содержанием 6 мг фтора в литре.
Классификация флюороза
По происхождению различают эндемический и профессиональный флюороз. Несмотря на похожую клиническую картину рекомендации при прохождении курса лечения для этих двух видов болезни будут различаться. При профессиональном заболевании возникает заболевание не только зубов, но и костей — остеопороз, остеосклероз. Заболевания сопровождаются нарушением подвижности суставов.
По мере развития недуга присоединяются вегетососудистые нарушения и патологии печени, возрастает риск онкологического заболевания — остеосаркомы. Стоит отметить, что пятна на зубах при таком флюорозе могут отсутствовать вовсе.
По клиническим проявлениям исследователи выделяют пять форм болезни:
Первые две формы считаются легкой степенью заболевания. Меловидно-крапчатую относят к флюорозу средней степени тяжести. Последние две представляют собой тяжелые формы.
У одного пациента может наблюдаться сразу несколько форм клинических проявлений — на разных зубах и группах зубов формируются различные симптомы. Врачи отмечают, что возникшая форма болезни сохраняется на всю жизнь и не меняется даже при изменениях концентрации микроэлемента в питьевой воде.
Симптомы и проявления
Эндемический флюороз зубов проявляется белыми пятнами или характерными полосами на эмали. По мере развития болезни они приобретают желтый и даже бурый оттенок. Чаще поражаются резцы верхней челюсти, но при высоких концентрациях фтора возникают поражения всех зубов. Наблюдается повышенная стираемость эмали, формируются сколы и эрозии. Симптомы зависят от формы заболевания.
Штриховая
Для этой формы болезни характерно появление белых полос на наружной поверхности резцов. Иногда они выражены, но чаще заметны только при высушивании поверхности эмали. В некоторых случаях возникает слияние полос в крупные пятна, но врач обнаружит отдельные полосы в структуре пятна.
Пятнистая
При этой форме возникают множественные белые пятна, сливающиеся друг с другом. Поверхность пятна блестящая и гладкая, без шероховатостей. Отсутствуют четкие границы пятна – оно плавно переходит в здоровые участки эмали.
Меловидно-крапчатая
При этой форме флюороза эмали появляется матовый оттенок всей поверхности твердых тканей зуба. На поверхности появляются четко очерченные пятна и точки. В ряде случаев эмаль приобретает желтый цвет. Кроме того, на зубах могут наблюдаться участки деструкции: крапинки-углубления диаметром до 1,5 мм и глубиной до 0,2 мм. Дно у таких углублений пигментированное.
Для этой формы характерна повышенная стираемость эмали, при которой возникает обнажение дентина — более глубоких тканей зуба, имеющих темно-коричневый цвет. Чувствительность зубов при обнажении дентина выраженная.
Эрозивная
Эта форма отличается наличием более крупных участков деструкции эмали — эрозий. В области такого углубления эмаль отсутствует вовсе, а на жевательных поверхностях зубов наблюдается повышенная стираемость.
Деструктивная
При деструктивной форме болезни возникает стирание и эрозии не только самой эмали, но и другой твердой ткани зуба — дентина. Зубы становятся хрупкими, возникают крупные сколы, нарушается форма коронок. Организм стремится предотвратить вскрытие полости зуба путем формирования заместительного дентина. Это тяжелая форма болезни, которая может развиваться в регионах, где питьевая вода содержит не менее 10 мг фтора на литр воды.
Диагностика флюороза
Обычно диагностика флюороза не представляет сложности для стоматолога. Пятнистая форма болезни может напоминать так называемое меловое пятно — начальную стадию кариеса или участок деминерализации эмали. Однако в случае с флюорозом такие пятна имеют множественный характер и поражают постоянные зубы после их прорезывания. А начальный кариес развивается единично или на небольшом количестве зубов. Стандартного осмотра врача, как правило, достаточно для постановки точного диагноза.
Одной из особенностей диагностики является рекомендация сдать питьевую воду на анализ, это позволит определить концентрацию в ней фтора. Если будут выявлены повышенные показатели, врач предпишет поменять источник питьевой воды или очищать ее перед употреблением. Если не следовать этой рекомендации, может развиться тяжелая форма болезни, сопровождающаяся разрушением зубов.
Особенности лечения
При флюорозе эмали врач посоветует использовать зубные пасты и ополаскиватели для полости рта без фтора. Эта рекомендация относится ко всем случаям и формам болезни.
Удаление пораженных участков эмали и пломбирование не используются, поскольку вероятность выпадения пломбы и дальнейшего разрушения зуба очень высока. Врач может назначить прием препаратов фосфора и кальция для дополнительного укрепления твердых тканей.
Легкие формы болезни подлежат косметическому исправлению. Могут быть использованы химическое, фотоотбеливание или лазерное отбеливание зубов. После этого обязательно выполняется реминерализирующая терапия: врач нанесет на эмаль препараты на основе соединений фосфора и кальция с помощью электрофореза, ультрафонофореза или аппликацией. Иногда целесообразно использовать каппы со специальным составом внутри — эта процедура может проводиться как дома, так и в условиях стоматологического кабинета. Курс реминерализирующей терапии при этом заболевании состоит из 10−20 процедур в зависимости от степени поражения тканей.
Меловидно-крапчатая, эрозивная и деструктивная формы не позволяют провести эффективное отбеливание. В этом случае помочь достичь косметического эффекта может реставрация зубов — установка люминиров или виниров. В тяжелых случаях лечение флюороза проводится путем восстановления зубов искусственными коронки из металлокерамики или керамики.
Ортопедическое лечение позволяет не только устранить косметический дефект, но и предупредить дальнейшее разрушение зуба, а также справиться с повышенной чувствительностью.
Прогноз и профилактика
Прогноз благоприятен в том случае, если пациент своевременно обратился к врачу и выполняет все предписания. Даже тяжелые формы болезни оставляют возможность для восстановления эстетичности улыбки с помощью современных методов. Но чем раньше вы обратитесь к специалисту, тем меньших усилий потребует лечение флюороза зубов.
Главным направлением профилактики является уменьшение количества фтора, попадающего в организм. При проживании в регионе с высокой концентрацией микроэлемента в питьевой воде важно найти другой источник — потреблять очищенную воду или приобретать привезенную из другого региона. Также следует ограничить употребление фторсодержащих продуктов: морской рыбы, шпината, сливочного масла, морской капусты и др.
Важно отказаться от использования зубных паст, гелей и ополаскивателей с фтором. Обратите внимание, что детские зубные пасты в своем большинстве не содержат фтора и агрессивных абразивных частиц.
Стоматологи клиники «СТОМА» знают, как лечить флюороз любых форм. Мы располагаем широкими возможностями для профессионального отбеливания и качественного восстановления зубов. Записаться на осмотр и консультацию врача вы можете по телефону или через специальную форму на сайте.
Эрозия кости — обзор
ПОДХОД К БОЛЬШИМ РЕТОРРЕКТАЛЬНЫМ ОПУХОЛЯМ
К более крупным опухолям, к опухолям с эрозией костей и к опухолям, вызывающим симптомы компрессии нервов, следует подходить как спереди, так и сзади. Широкое иссечение может быть очень опасным, если выполняется только из заднего доступа. Опухоли, затрагивающие нижний крестец, могут быть удалены с использованием комбинированного абдоминально-крестцового доступа, когда пациент находится в боковом положении, как описано Localio. В брюшную полость вводят косой разрез в левом нижнем квадранте.Прямая кишка мобилизуется из крестцовой впадины, и любая внутрибрюшная опухоль мобилизуется, в то время как вторая группа работает через задний срединный или паракокцигеальный разрез, чтобы широко иссечь опухоль на один сегмент выше любого подозреваемого костного поражения.
Для очень больших опухолей или опухолей с поражением верхнего крестца мы предпочитаем следующий подход. Сначала выполняется передняя диссекция, когда пациент лежит на спине (рис. 28-6). Для опухолей, не имеющих значимого заднего компонента, передний доступ можно комбинировать с биопсией.Во избежание внутрибрюшинного посева следует поместить пакеты вокруг поражения, а поверхность биопсии следует прижечь. Если замороженный срез демонстрирует доброкачественную опухоль, такую как аневризматическая киста кости, может быть выполнено внутриочаговое иссечение, что устраняет необходимость в задней диссекции. Во время передней диссекции можно полностью визуализировать опухоль. Прямая кишка мобилизуется из крестцовой впадины, а средняя крестцовая артерия и вена перевязываются. Контроль внутренней подвздошной артерии и вены может быть достигнут с помощью петель сосудов для уменьшения кровопотери.При опухолях, затрагивающих стенку прямой кишки, или пациентам, ранее перенесшим трансректальную биопсию, в это время выполняется резекция прямой кишки. Колостомия рекомендуется пациентам с обширной инфекцией, контаминацией или кровопотерей или когда обширное поражение прямой кишки делает анастомоз опасным или непрактичным. В зависимости от степени опухоли резекция может быть проведена либо в один этап, либо, в редких случаях, в два этапа. Если резекция должна быть выполнена в два этапа, пациента закрывают и планируют завершить операцию через 3–7 дней.Если, как обычно, передний доступ не требует слишком больших затрат времени и пациент находится в хорошем физическом состоянии, задний этап операции выполняется под той же анестезией.
Важно, чтобы задний доступ был достаточно обширным, чтобы обеспечить хорошую визуализацию крестца, кровеносных сосудов и основных неврологических структур. Сохранение нервных корешков S1 – S5 с одной стороны сохраняет воздержание, но с потерей полусенсора и некоторой слабостью в ногах. Если можно сохранить оба нервных корешка S3, воздержание и чувствительность будут почти нормальными.Даже принесение в жертву одного корня S3 обычно хорошо переносится. Резекция обоих нервных корешков S2 часто требует от пациента практики периодической катетеризации и тренировки кишечника, а пациенты мужского пола страдают импотенцией. Некоторые авторы действительно успешно удалили нервные корешки S1, но отмечается недержание мочи и некоторая слабость ноги. Сохранение верхней половины S1 позвонка обычно считается необходимым для стабильности позвоночника и таза, хотя современные ортопедические методы могут вскоре позволить замену позвонка.
Затем пациента поворачивают на живот для заднего доступа. Если биопсия была выполнена ранее, рубец будет полностью эллиптическим, а кожа, окружающая рубец, будет включена в резецированный образец (рис. 28-7). Разрез начинают примерно на уровне L4 и расширяют дистально до места соединения копчика и крестца. Боковые расширения разреза производятся вдоль волокон большой ягодичной мышцы по направлению к большим вертлугам. Затем рассечение проводится через ягодичную фасцию, и волокна большой ягодичной мышцы расщепляются, идентифицируя грушевидную мышцу (рис.28-8). Сухожилие грушевидной мышцы рассекается, и мышца втягивается кнутри. Если есть подозрение на инвазию в мышцу, необходимо также взять часть большой ягодичной мышцы. Образец должен быть взят со всех сторон не менее 2 см, чтобы получить широкий диапазон рассечения. Седалищный нерв и нервное питание большой ягодичной мышцы можно визуализировать после мобилизации грушевидной мышцы, что позволяет сделать поперечный разрез большой ягодичной мышцы без ущерба для ее нервного питания. Крестцово-остистая и крестцово-бугровая связки разделяются под прямым зрением как можно дальше латеральнее (рис.28-9). Уровень крестцовой резекции будет предварительно определен методами сканирования и наблюдениями, полученными во время переднего доступа. Затем нейрохирург или ортопед может войти в спинномозговой канал на один сегмент выше предполагаемой верхней протяженности опухоли и осмотреть канал на предмет распространения опухоли и определить нервные корешки, которые необходимо сохранить (рис. 28-10). Остеотом устанавливают дистальнее нервного корешка и выполняют V-образную остеотомию. Во время этого маневра передние структуры защищены большим рюкзаком.Передняя продольная связка обычно разделяется и мобилизуется во время передней диссекции, а кровеносные сосуды, которые ранее контролировались предоперационной эмболизацией или перевязаны и обрезаны во время передней фазы операции, не должны вызывать проблем. Оставшиеся фасциальные и мышечные структуры затем разделяются через задний доступ, и образец удаляется (рис. 28-11). Отрезанные нервные корешки обрезаются хирургическим путем, чтобы предотвратить утечку спинномозговой жидкости. Затем через задний разрез удаляется передний тампон и достигается гемостаз.Если послеоперационная лучевая терапия планируется у женщин детородного возраста и младше, то яичники мобилизуются на переднем этапе операции и выводятся из прогнозируемого радиационного поля. Вводятся множественные отсасывающие дренажи и повторно аппроксимируются ягодичные мышцы. Затем кожа закрывается обычным образом над дренажами, которые остаются на месте до тех пор, пока суточный выход не станет менее 60 мл в день. Дренаж не следует удалять слишком рано, чтобы предотвратить образование серомы, которая может инфицироваться.
На следующий день после операции пациенту разрешают сидеть у постели больного, а затем его постепенно передвигают в течение следующих 3–7 дней. Мочевой пузырь дренируется катетером Фолея, который при больших резекциях удаляется на пятый-седьмой день. Назначается диета с низким содержанием остатков.
Эрозия костей при ревматоидном артрите: механизмы, диагностика и лечение
Nat Rev Rheumatol. Авторская рукопись; доступно в PMC 2014 15 июля.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC4096779
NIHMSID: NIHMS601272
Георг Шетт
Кафедра внутренней медицины 3, Университет Эрлангена-Нюрнберга,
, Кранкенхауз, 12 Эрланген, Германия
Эллен Граваллезе
Медицинский факультет, Мемориальный медицинский центр Массачусетского университета и Медицинская школа Массачусетского университета, 55 Lake Avenue North, Вустер, Массачусетс, США 01655, США
Георг Шетт, Департамент внутренней медицины 3, Университет Эрланген-Нюрнберг, Кранкенхаусштрассе 12,
Эрланген, Германия;
Оба автора внесли одинаковый вклад во все аспекты этой статьи.
Окончательная отредактированная версия этой статьи издателя доступна на сайте Nat Rev Rheumatol. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Эрозия костей является центральным признаком ревматоидного артрита и связана с тяжестью заболевания и плохим функциональным исходом. Эрозия околосуставной кортикальной кости, типичная особенность, наблюдаемая на простых рентгенограммах у пациентов с ревматоидным артритом, возникает в результате чрезмерной местной резорбции кости и недостаточного костеобразования.Основными триггерами эрозии суставной кости являются синовит, включая выработку провоспалительных цитокинов и активатора рецептора лиганда ядерного фактора κB (RANKL), а также антител, направленных против цитруллинированных белков. Действительно, как цитокины, так и аутоантитела стимулируют дифференцировку резорбирующих костную ткань остеокластов, тем самым стимулируя местную резорбцию кости. Хотя современная противоревматическая терапия подавляет как эрозию, так и воспаление костей, восстановление существующих костных повреждений, хотя и возможно с физиологической точки зрения, происходит редко.Отсутствие восстановления происходит, по крайней мере частично, из-за активного подавления образования кости провоспалительными цитокинами. В этом обзоре суммируется значительный прогресс, достигнутый в понимании патофизиологии эрозий костей, и обсуждаются улучшения в диагностике, мониторинге и лечении таких поражений.
Введение
Скелет состоит из губчатой кости, тонкой костной сети, в которой находится костный мозг, и кортикальной кости, плотной костной оболочки, которая обеспечивает структурную поддержку в областях, несущих нагрузку.Оба типа костей нацелены на эрозию при ревматоидном артрите (РА). Более того, РА является независимым фактором риска генерализованной остеопении и остеопороза с поражением трабекулярной и кортикальной костей в осевом и аппендикулярном скелете. Эрозия суставной кости представляет собой локальную потерю костной массы (остеолиз), первоначально затрагивающую кортикальную кость, и разрушение естественного барьера между внескелетной тканью и межтрабекулярными пространствами полости костного мозга. Остеолиз является результатом дисбаланса, при котором резорбция костной ткани остеокластами предпочтительнее, чем костеобразование остеобластами.Понимание механизмов, определяющих образование эрозий костей, требует понимания биологии костного гомеостаза и молекулярной регуляции дифференцировки и функции остеокластов и остеобластов. 1–3
Хотя некоторые патологические процессы могут привести к эрозии костей, включая злокачественные новообразования, метаболические процессы, такие как гиперпаратиреоз, и хронические воспалительные заболевания, такие как гистиоцитоз и саркоидоз, наиболее частой причиной является РА. Первоначально описанные более 100 лет назад, 4,5 эрозий суставных костей в настоящее время стали центральным элементом диагностики, лечения и мониторинга РА.Более того, эти поражения являются ожидаемым следствием серопозитивного РА, если заболевание не лечить своевременно и эффективно. Эрозии отражают клинические последствия тесного взаимодействия между активацией иммунной системы и моделированием и ремоделированием скелета. Действительно, исследование взаимодействия иммунной системы и костей привело к появлению новой области, называемой остеоиммунологией. 6–9
Определение эрозии кости
Эрозия кости — это радиологический термин, который отражает тот факт, что для обнаружения используется визуализация. 10 Эрозии видны на простых рентгенограммах как разрывы кортикальной поверхности кости и часто сопровождаются потерей прилегающей губчатой кости. Напротив, костные кисты представляют собой области остеолиза внутри компартмента губчатой кости без каких-либо признаков деструкции кортикальной кости. Хотя эрозии также могут наблюдаться при формах артрита, отличных от РА, таких как подагра, псориатический артрит, спондилоартрит и даже остеоартрит, они включены в диагностические критерии РА. 11 Вследствие серьезности и типичной картины распределения по множеству периферических участков скелета, а также отсутствия сопутствующего образования новой кости, появление эрозий костей является уникальным при РА и существенно отличается от других типов артрита.
Эрозии костей представляют собой ключевой критерий исхода при РА и позволяют прогнозировать более тяжелое течение болезни с более высокой степенью инвалидности и повышенной смертностью. 12–14 Клинические испытания всех основных противоревматических средств, одобренных для модификации РА, были подтверждены на предмет их способности замедлять или даже останавливать структурное повреждение, которое представляет собой смесь эрозии кости и деградации хряща.Кроме того, рентгенография широко используется для оценки структурных повреждений в клинической практике и для мониторинга эффективности терапии в замедлении структурных повреждений. Таким образом, в настоящее время обнаружение и количественная оценка эрозии костей является основным инструментом для диагностики заболеваний, а также для мониторинга и измерения эффективности лекарственной терапии у пациентов с РА. В этом обзоре основное внимание уделяется эрозии костей при РА и не обсуждается повреждение хряща. Тем не менее, повреждение хряща является не менее важным признаком структурного повреждения при РА, которое происходит по принципиально различным механизмам по отношению к эрозиям костей. 15
Анатомические факторы и микроструктура
Эрозии костей не возникают в случайных местах, но проявляют склонность к определенным анатомическим участкам. Подробный анализ распределения эрозий костей был проведен с помощью КТ высокого разрешения, УЗИ высокого разрешения и МРТ. Выявлено, что лучевые аспекты суставов пальцев являются «горячими точками» для эрозий костей, тогда как локтевые аспекты поражаются реже, а ладонная и ладонная поверхности суставов практически избавлены от таких повреждений. 16–18 Этот отчетливый паттерн локализации костной эрозии при RA интригует и может быть связан с определенными анатомическими особенностями, как описано ниже. Более того, эрозии костей обычно возникают в месте прямого контакта синовиальной оболочки с костью (так называемые голые области), что позволяет предположить, что анатомические факторы делают эти области околосуставной кости подверженными эрозии. 19,20 Эта концепция также подтверждается исследованиями на здоровых людях с использованием КТ высокого разрешения, которые показали, что эрозии костей диаметром менее 2 мм могут быть обнаружены у здоровых людей с характером распределения, который точно отражает характер эрозивные поражения, наблюдаемые у пациентов с РА. 15,21 Анатомические факторы, которые предрасполагают участки скелета к эрозии, включают: присутствие минерализованного хряща, ткани, особенно склонной к разрушению резорбирующими костную ткань клетками; места прикрепления связок к поверхности кости, которые передают механические силы к кости и могут вызвать микроповреждения; 22 и воспаленные влагалища сухожилий (так называемый теносиновит), которые проходят через поверхность кости и способствуют распространению воспаления от сухожилия на синовиальную оболочку сустава. 23
Мелкие костные каналы, которые проникают в кортикальный слой кости, несут микрососуды и соединяют внешнюю синовиальную мембрану и внутреннее пространство костного мозга; эти каналы также подвержены эрозивным изменениям на ранних этапах развития РА. Микрососуды, расположенные внутри этих каналов, способствуют перемещению клеток-предшественников остеокластов в кость, которые при контакте с костью и получении соответствующих молекулярных сигналов дифференцируются в остеокласты. Расширение кортикальных костных каналов в результате опосредованной остеокластами резорбции кости является типичным ранним изменением в моделях артрита на животных. 24,25 Более того, кортикальные фенестрации были описаны на компьютерных томограммах высокого разрешения суставов пациентов с РА, что, вероятно, отражает такое расширение кортикальных костных каналов. 15 Эти изменения соответствуют известному снижению массы кортикальной кости при РА, которое было зарегистрировано в нескольких исследованиях у пациентов с РА и, по-видимому, тесно связано с активностью заболевания и развитием эрозий костей. 26–30
Развитие эрозий костей
Продольные рентгенографические исследования показали, что эрозии костей возникают на ранних стадиях патогенеза РА, поражая примерно половину нелеченных пациентов через 6 месяцев после начала заболевания. 31 Радиографические исследования пациентов с РА продолжительностью менее 3 месяцев показывают, что у некоторых пациентов эрозии костей можно обнаружить уже через несколько недель после начала заболевания. 32 Более того, несколько исследований с участием пациентов с РА показали, что существует взаимосвязь между эрозиями костей и развитием остеопении и остеопороза. 33–35
Обнаружение эрозий костей улучшилось благодаря значительным технологическим достижениям в визуализации опорно-двигательного аппарата.КТ, УЗИ высокого разрешения и МРТ могут надежно обнаружить даже небольшие эрозии костей у пациентов с РА. 36,37 Визуализация также подчеркнула и обосновала роль воспаления в запуске эрозий костей, показав, что не только синовит, но и воспаление прилегающего межтрабекулярного пространства (остит) коррелирует с развитием рентгенологических эрозий костей. 38,39 Остается неясным, приводит ли эрозия костей к оститу или остит является результатом эрозии костей. 40 Эрозии костей обычно рассматриваются как необратимые повреждения, хотя детальная продольная оценка этих повреждений с точки зрения восстановления все еще недостаточна. Самопроизвольное восстановление, однако, встречается редко, что контрастирует со значительной реакцией образования надкостницы, отмеченной в сочетании с эрозиями костей у пациентов с псориатическим артритом или остеоартритом. 41
Остеокласты опосредуют эрозию костей
Остеокласты, гигантские многоядерные клетки, происходящие из линии моноцитов, являются единственными клетками, способными резорбировать кости в организме. 2,3 Остеокласты предназначены для рассасывания кости за счет плотного прилегания к поверхности кости за счет взаимодействия как с интегринами, так и с белками внеклеточного матрикса, а также путем сборки соединений, которые герметизируют поверхность кости и остеокласт и тем самым отделяют кость от окружающей среды. внеклеточное пространство. Протоны накачиваются вдоль взъерошенной границы остеокластов, а затем создают кислую среду, позволяющую солюбилизировать кальций из кости. Матричные ферменты, синтезируемые остеокластом, включая катепсин К, матриксную металлопротеиназу 9 и тартрат-резистентную кислую фосфатазу типа 5 (TRAP), разрушают костный матрикс. 2
Остеокласты населяют поверхность раздела между воспалительной синовиальной тканью и околосуставной поверхностью кости. Первое косвенное описание клеток, резорбирующих костную ткань при РА, относится к 19 — веку, 5 и было пересмотрено Bromley и Woolley 42 и Leisen et al. 43 в 1980-е годы. Остеокласты при РА были окончательно идентифицированы и подробно охарактеризованы с использованием современных иммуногистохимических и молекулярных методов Gravallese et al. 44 в 1998. Многоядерные клетки на границе паннус-кость демонстрируют все фенотипические особенности истинных остеокластов, включая образование взъерошенной границы и экспрессию специфических маркеров, включая TRAP, катепсин К и рецептор кальцитонина. Клетки-предшественники остеокластов накапливаются внутри так называемого синовиального паннуса — плотной воспалительной синовиальной ткани, расположенной как на границе с костью, так и внутри самих костных эрозий. Подобные изменения также обнаружены во всех соответствующих моделях воспалительного артрита на животных, и исследования с участием этих моделей на животных продемонстрировали решающую роль остеокластов в патогенезе эрозии суставной кости при артрите, вызванном адъювантом, 45 коллаген, 46,47 сыворотка передача 48 и TNF. 49,50 Было показано, что при индукции артрита у мышей без остеокластов эти мыши полностью защищены от эрозий костей. 48,49 Остеокласты, таким образом, стали важным типом клеток в процессе эрозии.
Пути дифференцировки остеокластов
Развитие остеокластов происходит локально в синовиальной ткани в результате экспрессии двух основных остеокластогенных медиаторов, макрофагального колониестимулирующего фактора 1 (M-CSF) 51,52 и активатора ядерных рецепторов. лиганд фактора κB (RANKL; также известный как член суперсемейства TNF-лиганд 11). 53–58 Этот процесс включает миграцию клеток моноцитарного происхождения из костного мозга во вторичные лимфатические органы и, наконец, в суставы. Стадия дифференцировки, на которой моноциты попадают в сустав, неясна. В самом деле, моноциты могут быть уже преданы определенному клону моноцитов, например, макрофагам M1 или M2, дендритным клеткам или клеткам-предшественникам остеокластов, когда они входят в сустав. Некоторые данные предполагают, что TNF, ключевой провоспалительный цитокин, экспрессируемый в синовиальной ткани RA, стимулирует миграцию клеток-предшественников остеокластов из костного мозга на периферию. 59,60 Кроме того, TNF стимулирует экспрессию поверхностных рецепторов, таких как иммуноглобулиноподобный рецептор, связанный с остеокластами, до того, как клетки-предшественники попадают в сустав, и эти рецепторы облегчают дифференцировку. 61 Попав в микросреду сустава, эти клетки подвергаются воздействию M-CSF и RANKL и дифференцируются в остеокласты. После контакта с поверхностью кости достигается окончательная дифференцировка в остеокласты, резорбирующие кость.
Было показано, что блокада дифференцировки остеокластов путем ингибирования RANKL или M-CSF плюс RANKL останавливает эрозию костей практически во всех моделях воспалительного артрита на животных. 45–50,62 Одно клиническое испытание с участием пациентов с РА также показало, что блокада RANKL с использованием нейтрализующих антител (деносумаб) замедляет прогрессирование эрозии костей, но не замедляет воспаление. 63 Таким образом, прямое нацеливание на остеокласты при РА защищает кость от последствий воспаления даже при отсутствии подавления самого воспаления. Это наблюдение также в значительной степени исключает возможность того, что резорбция кости оказывает положительную обратную связь на синовиальное воспаление.
Триггеры эрозии костей
Доклинический аутоиммунитет
Аутоиммунитет является одним из самых сильных прогностических индикаторов структурных повреждений при РА. Неопровержимые доказательства связи между аутоиммунитетом и эрозией суставов были выявлены наличием в сыворотке крови пациентов с РА антител к цитруллинированному белку (ACPA) и антител к карбамилированному белку, которые могут возникать задолго до начала синовита и независимо предсказывать эрозия костей у этих пациентов. 64–67 Это наблюдение согласуется с несколькими когортами пациентов с РА и не зависит от показателей активности заболевания, таких как оценка активности заболевания 28 суставов или воспаление, измеряемых уровнями С-реактивного белка. 64–67 Исследование, проведенное в 2012 году, показало, что ACPA распознает цитруллинированный виментин, экспрессируемый на поверхности клеток-предшественников остеокластов. 68 Связывание ACPA с поверхностью клетки увеличивает клеточную дифференцировку до резорбирующих костную ткань остеокластов посредством аутокринной стимуляции выработки TNF.Остеокласты экспрессируют высокие уровни фермента пептидиларгининдезиминазы 2 типа (PADI2), который индуцируется потоком кальция и отвечает за цитруллинирование белка (). В клетках линии остеокластов активация PADI2 приводит к преимущественному цитруллинированию виментина, вызывая изменение его субклеточной локализации и делая его доступным для связывания ACPA. Индукция остеокластогенеза за счет связывания ACPA также подтверждается высокими уровнями маркеров резорбции кости в сыворотке пациентов с РА, 9 , отражающих опосредованную остеокластами резорбцию кости.Было бы интересно определить, является ли этот эффект специфичным для цитруллинированного виментина или антитела, специфичные к другим цитруллинированным белкам, имеют аналогичные эффекты. Эти данные проливают новый свет на взаимосвязь между воспалением и повреждением костей при РА и подтверждают концепцию, согласно которой структурные изменения костей происходят в начале заболевания или даже до начала заболевания у пациентов с РА (2).
Аутоантитела против цитруллинированных белков и остеокластогенеза. Плазматические клетки продуцируют ACPA со специфичностью к цитруллинированному виментину, который связывается с клетками-предшественниками остеокластов и стимулирует высвобождение TNF, что, в свою очередь, усиливает дифференцировку этих клеток в зрелые остеокласты.Во время процесса дифференцировки остеокластов выработка фермента PADI2 индуцируется кальцием. Активность PADI2 приводит к цитруллинированию виментина, который в большом количестве экспрессируется на поверхности клеток линии остеокластов. Сокращения: ACPA, антитела к цитруллинированному белку; PADI2, пептидил-аргининдеиминаза, тип 2.
Развитие эрозии костей в ходе РА. Во время доклинической фазы РА ACPA продуцируются плазматическими клетками на ранней стадии. ACPA может стимулировать дифференцировку остеокластов и приводить к начальной потере костной массы.Эти ранние изменения могут начаться в костном мозге, прилегающем к суставу. Синовит в начале клинического заболевания приводит к выработке цитокинов, которые стимулируют остеокластогенез, индуцируя экспрессию RANKL, и взаимодействуют с RANKL, усиливая эрозию кости. Установленный РА характеризуется наличием крупных эрозий костей, заполненных воспаленной тканью паннуса синовиального происхождения. Сокращения: ACPA, антитела к цитруллинированному белку; РА, ревматоидный артрит; RANKL, активатор рецептора лиганда ядерного фактора κB.
Врожденный иммунитет
Накопление доказательств указывает на роль врожденной иммунной системы в эрозии костей при РА. Остеокласты рассматриваются как ключевые клетки врожденного иммунитета в кости, поскольку они экспрессируют рецепторы врожденного иммунитета, аналогичные макрофагам и дендритным клеткам, которые регулируют их способность реагировать на воспаление в суставе и, таким образом, определяют их судьбу и функции. Эти рецепторы включают в себя рецепторы, несущие мотив активации тирозина иммунорецептора (ITAM), которые играют важную костимулирующую роль с RANKL и M-CSF в остеокластогенезе. 69 Роль Toll-подобных рецепторов (TLR) в патогенезе воспаления и эрозии костей при RA также была предложена, поскольку стимуляция TLR синовиоцитов индуцирует экспрессию RANKL, тем самым способствуя остеокластогенезу. Лиганды TLR могут также активировать пути, которые подавляют остеокластогенез, путем ингибирования экспрессии активатора рецептора NFκB (RANK; также известного как член суперсемейства рецепторов TNF 11A), тем самым ограничивая патологическую потерю костной массы, связанную с воспалением. 70 Таким образом, роль врожденной иммунной системы в эрозии костей при РА остается плодородной областью для дальнейших исследований.
Переход от аутоиммунитета к воспалению
Изменения иммунного баланса могут замедлить или даже предотвратить переход от ACPA-положительных здоровых людей к пациентам с воспалительным артритом. Регуляторные механизмы, включающие баланс субпопуляций Т-клеток, могут иметь решающее значение в блокировании клинических проявлений РА. Хотя Т-клетки и, в частности, Т-хелперы типа 17 (T H 17) всегда считались типами клеток, которые запускают остеокластогенез, Т-клетки 62,71 также могут способствовать поддержанию гомеостаза костей.Например, экспрессия цитотоксического Т-лимфоцит-ассоциированного антигена 4 (CTLA4) на Т-клетках, в частности регуляторных Т (T REG ) клетках, является мощным сигналом для блокирования дифференцировки остеокластов. 72–75 CTLA4 нарушает костимуляцию Т-клеток и тем самым действует как иммуномодулирующий сигнал. Связывание CTLA4 с рецепторами CD80 и CD86 на клеточной поверхности на предшественниках остеокластов останавливает дальнейшую дифференцировку этих клеток в остеокласты даже в присутствии стимулирующих факторов M-CSF и RANKL. 75 Эта концепция была переведена на терапевтическое применение у пациентов с введением CTLA4-Ig (абатацепт), который блокирует костимуляцию Т-клеток и, таким образом, блокирует воспаление и эрозию костей у пациентов с РА. Более того, тот факт, что иммунорегуляторная молекула защищает кость, расширяет спектр описанных в настоящее время иммунно-костных взаимодействий и демонстрирует двойную роль типов клеток и факторов как в иммунной системе, так и в скелете. Таким образом, активация иммунной системы способствует резорбции костей, тогда как иммунная модуляция оказывает защитное действие на скелет.
Синовит
Когда синовиальное воспаление развивается в результате аутоиммунитета при РА, дополнительные триггеры усиливают процесс эрозии кости. Отсюда следует, что жесткий контроль синовиального воспаления защитит от прогрессирования эрозии кости; это предсказание подтвердилось у пациентов с РА, получающих строго контролируемое противовоспалительное лечение БПВП и глюкокортикоидами. 76,77 Синовит — богатый источник провоспалительных цитокинов, которые управляют процессом дифференцировки остеокластов. 15 TNF, IL-1 и IL-6 усиливают остеокластогенез за счет разрешающего действия на экспрессию RANKL в мезенхимальных клетках, а также за счет прямого воздействия на клетки-предшественники остеокластов и, таким образом, создают подходящую микросреду для остеокластогенеза. Более того, экспрессия рецепторов дифференцировки остеокластов, таких как RANK, стимулируется цитокинами синовиального происхождения (2). 78–83 Следует отметить, что чем больше выраженность синовита, тем обширнее эрозивный процесс.Соответственно, и УЗИ, и МРТ показали, что степень синовита и остита связана с вероятностью последующего повреждения костей. 38,39 Кроме того, кажется, что уровни реагентов острой фазы, таких как C-реактивный белок, также положительно коррелируют с вероятностью развития эрозий костей при RA. 84 Поскольку синовит развивается незадолго до клинического начала заболевания у пациентов с РА, неудивительно, что риск эрозий костей увеличивается после клинического начала заболевания. 85,86
Таблица 1
Клинические эффекты цитокинов во время РА
| Цитокин | Провоспалительный эффект | Скелетный эффект | ||||
|---|---|---|---|---|---|---|
| TNF | Ключевой ингибитор костеобразования в RA | Про-остеокластогенные рецепторы через стимуляцию TNF-рецепторов через прямую стимуляцию TNF-рецепторов и стимуляцию остеокластогенных рецепторов TNF за счет прямой стимуляции остеокластогенных рецепторов TNF. также подавляет образование костей | ||||
| IL-6 | Главный провоспалительный цитокин в RA | Проостеокластогенный эффект за счет индукции RANKL и прямой стимуляции предшественников остеокластов посредством индукции передачи сигнала gp130 | M | потенциальные провоспалительные эффекты | Существенный фактор для дифференцировки остеокластов | |
| RANKL | Не влияет на воспаление | Существенный фактор для дифференцировки остеокластов | ||||
| IL-1 | Умеренные провоспалительные эффекты | |||||
| IL-17 | Возможные провоспалительные эффекты при RA | Проостеокластогенный эффект за счет индукции RANKL и блокирования антиостеокластогенных факторов, таких как IL-4, IFN-γ и IL-12 | 1 | IL-15 | Цитокин, участвующий в врожденных и адаптивных ve иммунные ответы с потенциальными провоспалительными эффектами в RA | Проостеокластогенный, индуцируя RANKL |
| IL-33 | Провоспалительные и противовоспалительные эффекты; нет определенной роли в воспалении при RA | Мощный ингибитор остеокластогенеза и резорбции кости | ||||
| Dkk-1 | Ингибитор Wnt, не влияющий на воспаление при RA | Ключевой ингибитор образования кости при RA |
Провоспалительные цитокины при эрозии костей
Ингибирование цитокинов, в том числе с помощью блокаторов TNF (инфликсимаб, этанерцепт, адалимумаб, цертолизумабпегол и голимумаб) и блокады рецептора IL-6 (IL-6R) (тоцилизумаб), является одним из наиболее эффективных подходов к замедляют или останавливают эрозивный процесс кости при РА () и могут предотвратить прогрессирование системной потери костной массы. 88 Этот эффект имеет двоякое объяснение. Во-первых, цитокиновая блокада обычно более эффективна, чем традиционные противоревматические препараты, в уменьшении синовита, включая субклинический синовит. Однако в настоящее время нет данных, свидетельствующих о том, что бремя синовита различается у пациентов с РА в стадии ремиссии, лечившихся либо обычными препаратами, либо блокаторами цитокинов. Во-вторых, блокада TNF и IL-6R оказывает прямое влияние на ограничение процесса остеокластогенеза. Эта концепция подтверждается наблюдениями из клинических испытаний 92 , а также патофизиологическими исследованиями, показывающими, что комплексы TNF и IL-6 – IL-6R непосредственно индуцируют дифференцировку клеток-предшественников остеокластов в остеокласты, резорбирующие костную ткань. 78,82
Место действия противоревматических препаратов на дифференцировку остеокластов и эрозию костей. Ингибиторы (зеленые прямоугольники) TNF, IL-1 и IL-6R блокируют экспрессию RANKL мезенхимальными клетками и Т-клетками; они также напрямую влияют на остеокластогенез. Абатацепт подавляет дифференцировку остеокластов, напрямую взаимодействуя с CD80 и CD86 на поверхности клеток-предшественников остеокластов. На активацию Т-клеток нацелены низкомолекулярные ингибиторы тирозинкиназы, такие как тофацитиниб, ингибитор JAK.В-клетки дифференцируются в плазматические клетки, которые являются источником RANKL. В-клетки истощаются антителом против CD20 (ритуксимаб) и ингибируются низкомолекулярными ингибиторами тирозинкиназы, такими как фостаматиниб, ингибитор SYK. Сокращения: IL-6R, рецептор IL-6; JAK, киназа Януса; RANKL, активатор рецептора лиганда ядерного фактора κB; SYK, тирозинкиназа селезенки.
Прямое влияние на остеокластогенез может не ограничиваться цитокин-блокирующими агентами, но может также применяться к ингибиторам межклеточных протеинкиназ. 93 Новыми соединениями, которые проходят клинические испытания на их модифицирующее заболевание действие, являются тофацитиниб, ингибитор янус-ассоциированной киназы (JAK), 94,95 и фостаматиниб, ингибитор тирозин-протеинкиназы, нацеленный на тирозинкиназу селезенки (SYK). . 96 Эти тирозинкиназы экспрессируются иммунными клетками, включая остеокласты, и функционируют, чтобы интегрировать передачу сигналов цитокинов и клеточные ответы во время воспаления. 96 Как следствие, их ингибирование может одновременно приводить к противовоспалительному, а также противоэрозивному действию у пациентов с РА.Прямое ингибирование остеокластов и эрозии костей особенно вероятно, когда киназы, такие как SYK 97 и тирозинкиназа Брутона (BTK), нацелены на низкомолекулярные препараты, поскольку эти киназы преимущественно экспрессируются антигенпрезентирующими клетками, такими как В-клетки и моноциты. 98 Как обсуждалось ранее, IL-1 может участвовать в запуске эрозий костей у пациентов с RA. 99 Было показано, что этот цитокин является основным триггером потери хряща и костной ткани на животных моделях воспалительного артрита. 79,80 Однако при РА роль блокады IL-1 в улучшении клинических признаков заболевания ограничена. Тем не менее, блокада IL-1 обеспечивает защиту от эрозии костей при РА. 99 Даже с учетом его умеренного противовоспалительного эффекта при РА, роль блокады ИЛ-1 в защите пациентов от эрозии костей при заболеваниях, которые запускаются ИЛ-1, таких как подагра, может быть значительной.
Цитокины-кандидаты, сочетающие провоспалительные и проостеокластогенные свойства, включают IL-17 и IL-15.IL-17 — провоспалительный цитокин, который индуцирует выработку простагландинов, оксида азота, цитокинов и хемокинов. IL-17 индуцирует продукцию IL-1 и TNF в макрофагах и фибробластах и является синергическим с IL-1 в повышении регуляции медиаторов воспаления, высвобождаемых синовиальными фибробластами. 100–102 Таким образом, подчеркивается роль IL-17 в патогенезе РА. 103 IL-17 продуцируется несколькими клеточными линиями, включая клетки T , H 17 и тучные клетки, и является мощным индуктором экспрессии RANKL на поверхности остеобластов и синовиальных фибробластов. 104,105 В то же время IL-17 блокирует функцию компенсаторных антиостеокластогенных факторов, таких как клетки T , REG и IL-4, и тем самым ингибирует локальную эрозию костей, а также системную потерю костной ткани на мышиной модели TNF. -опосредованный артрит. 106 IL-15 — еще один провоспалительный цитокин, который регулирует врожденные и адаптивные иммунные ответы, а также опосредует остеокластогенез и эрозию костей. 107 Однонуклеотидные полиморфизмы в гене, кодирующем IL-15, как было показано, коррелировали с разрушением суставов при РА в многокомпонентном исследовании, подтверждая прямую роль этого цитокина в эрозии суставной кости. 108
Не все провоспалительные цитокины вызывают потерю костной массы. Например, алармин IL-33 и цитокины, полученные из дендритных клеток, IL-23 и IL-12, а также интерфероны типа I и типа II являются мощными супрессорами остеокластогенеза. 6,109,110 Хотя эти факторы также экспрессируются в синовиальной ткани, их действие не может перевесить резорбтивные эффекты вышеупомянутых провоспалительных сигналов в синовиальной оболочке RA, которые приводят к чистой потере костной массы.
Новые достижения, способствующие восстановлению эрозии.
После того, как эрозии образовались, они восстанавливаются редко. 111,112 Действительно, спонтанное восстановление эрозий практически отсутствует, и даже при использовании мощных противовоспалительных терапевтических стратегий, таких как блокада TNF или IL-6R, отмечаются лишь ограниченные признаки восстановления эрозий костей. 113,114 Если присутствует, восстановление проявляется в виде нового костного сочленения (то есть склероза) в основании эрозии и, по-видимому, затрагивает околосуставной костный мозг. 113 Действительно, гистопатология синовиальной ткани пациентов с РА выявила обилие остеокластов в костных эрозиях, но недостаток или даже отсутствие зрелых остеобластов, 115 , что позволяет предположить, что определенные молекулы в синовиальной оболочке эффективно блокируют дифференцировку костеобразования. остеобласты. Гистоморфометрические исследования на мышиной модели RA продемонстрировали, что образование кости в местах эрозии заметно ограничено, причем скорость образования кости аналогична таковой у здоровых людей. 115,116 Таким образом, синовит при РА, по-видимому, способствует потере очаговой суставной кости, блокируя локальное образование кости, что приводит к фундаментальному дисбалансу гомеостаза кости (). Напротив, данные модели на животных показали, что после разрешения синовита остеобласты действительно заселяют поверхность эродированной кости и образуют новую кость для восстановления эрозий. 117 Смысл этого открытия заключается в том, что у пациентов, у которых восстановление не наблюдается, воспаление может не контролироваться полностью. Действительно, когда чувствительные рентгенографические методы используются для исследования суставов пациентов, находящихся в клинической ремиссии, часто наблюдается остаточное воспаление. 91 Важность восстановления эрозии для функционального статуса будет важна, так же как и понимание возможных пагубных последствий остаточного воспаления для сердечно-сосудистой системы и костей в осевом и аппендикулярном скелете.
Нарушение гомеостаза костей при синовите. Воспаление в синовиальной ткани индуцирует остеокластогенез за счет повышенной экспрессии RANKL и продукции провоспалительных цитокинов, которые управляют остеокластогенезом и взаимодействуют с RANKL.Кроме того, экспрессия Dkk-1 синовиальными фибробластами приводит к ингибированию дифференцировки остеобластов и, следовательно, к образованию кости. Сам Dkk-1 индуцирует экспрессию остеоцитами другой антианаболической молекулы, склеростина. Сокращения: Дкк-1; Белок 1, родственный Диккопфу; RANKL, активатор рецептора лиганда ядерного фактора κB.
Ограниченное восстановление костных эрозий при RA, по-видимому, связано с индукцией сигналов, которые блокируют образование новой кости. Было показано, что введение паратироидного гормона способствует восстановлению эрозий костей на модели артрита у мышей в сочетании с ингибиторами TNF. 118 Другие молекулы-кандидаты, которые могут ограничивать образование и восстановление костей, включают антагонисты пути передачи сигналов Wnt, одного из самых сильных анаболических путей костей. Производство Dickkopf-родственного белка 1 (Dkk-1), например, индуцируется TNF в синовиальных фибробластах и экспрессируется в синовиальной оболочке пациентов с RA. 116 Dkk-1 сильно мешает передаче сигналов Wnt и блокирует образование новой кости в модели RA у мышей. 116 Более того, экспрессия других антагонистов Wnt, таких как секретируемый родственный Frizzled белок-1 и склеростин, может быть индуцирована во время воспаления, а также может ингибировать восстановление эрозии кости путем подавления образования кости. 117,119,120 Однако, вызывает ли блокада Dkk-1 или других антагонистов Wnt, таких как склеростин, восстановление или даже заживление эрозии кости, в настоящее время неясно, и, несмотря на некоторые данные, полученные на моделях артрита на животных, необходимо провести соответствующие клинические исследования. чтобы ответить на этот вопрос.
Выводы
Таким образом, эрозия суставной кости является отличительным признаком РА и важна для диагностики, лечения и мониторинга заболевания. Знания о механизмах, вызывающих эрозию костей, значительно расширились благодаря усовершенствованию технологий визуализации, а также новым открытиям в патофизиологии.Данные, полученные за последние несколько лет, дополнительно пересмотрели концепции патогенеза, переместив нас от восприятия эрозий как необратимых поражений на конечной стадии к динамическому взгляду на эрозию как на активный процесс. Что наиболее важно, эрозия костей начинается на ранних стадиях РА и неразрывно связана с механизмами врожденного иммунитета, аутоиммунитетом и синовитом. Дальнейшее понимание молекулярных путей потери костной массы и образования костной ткани во время воспаления должно способствовать разработке новых терапевтических стратегий восстановления эрозий костей.
Ключевые моменты
- ▪ Эрозии суставных костей являются центральным клиническим признаком ревматоидного артрита
- ▪ Методы визуализации позволяют раннее обнаруживать эрозии костей и дают представление о патогенезе заболевания
- ▪ Эрозия костей является результатом усиленной дифференциации остеокластов и ингибирование опосредованного остеобластами восстановления костей
- ▪ Аутоантитела и цитокины, включая провоспалительные цитокины и активатор рецепторов лиганда ядерного фактора κB, являются основными провоцирующими факторами эрозии костей при ревматоидном артрите
- ▪ Антиревматическая терапия блокирует прогрессирование эрозии костей воспаление и восстановление костного баланса
Критерии обзора
Поиск оригинальных статей, опубликованных между 1970 и 2012 годами, проводился с использованием базы данных PubMed с поисковыми терминами «ревматоидный артрит», «кость» и «эрозия», как отдельно, так и в сочетании.Рассматривались только полнотекстовые статьи, опубликованные на английском языке. Справочные списки идентифицированных статей также использовались для определения дальнейших релевантных статей.
Благодарности
Работа Г. Шетта поддерживается Deutsche Forschungsgemeinschaft (SPP1468-IMMUNOBONE), Bundesministerium für Bildung und Forschung (BMBF; проект ANCYLOSS) и проектом MASTERSWITCH, финансируемым Европейским союзом. Работа Э. Граваллезе поддерживается Национальным институтом здравоохранения (R01 AR055952) и Фондом исследований и образования Американского колледжа ревматологии (Кампания «В пределах нашей досягаемости: поиск лекарства от ревматоидного артрита»).
Сноски
Конкурирующие интересы
G. Schett заявляет об отсутствии конкурирующих интересов. E. Gravallese заявляет о сотрудничестве со следующими компаниями: Abbott Laboratories, Lilly. Подробную информацию об отношениях смотрите в статье в Интернете.
Информация для авторов
Георг Шетт, Отделение внутренней медицины 3, Университет Эрлангена-Нюрнберга, Кранкенхаусштрассе 12,
Эрланген, Германия.
Эллен Граваллезе, медицинский факультет, Мемориальный медицинский центр Массачусетского университета и медицинская школа Массачусетского университета, 55 Lake Avenue North, Worcester, MA 01655, США.
Ссылки
1. Карсенти Г., Кроненберг Х.М., Сеттембре С. Генетический контроль образования кости. Анну. Rev. Cell. Dev. Биол. 2009. 25: 629–648. [PubMed] [Google Scholar] 2. Тейтельбаум С.Л., Росс Ф.П. Генетическая регуляция развития и функции остеокластов. Nat. Преподобный Жене. 2003. 4: 638–649. [PubMed] [Google Scholar] 3. Бойл В.Дж., Саймонет В.С., Лейси Д.Л. Дифференциация и активация остеокластов. Природа. 2003. 423: 337–342. [PubMed] [Google Scholar] 4. Бейкер WM. Формирование аномальных синовиальных кист в суставах.Отчеты больницы Святого Бартоломея. 1855; 21: 177–190. [Google Scholar] 5. Вайхзельбаум А. Die feineren Veränderungen des Gelenkknorpels bei Fungöser Synovitis und Karies der Gelenkenden [немецкий] Archiv. Патол. Анат. Physiol. Клин. Med. 1878; 73: 461–475. [Google Scholar] 6. Такаянаги Х. Остеоиммунология: общие механизмы и перекрестные помехи между иммунной и костной системами. Nat. Rev. Immunol. 2007. 7: 292–304. [PubMed] [Google Scholar] 7. Аррон Дж. Р., Чой Ю. Остеоиммунология: кость против иммунной системы. Природа.2000; 408: 535–536. [PubMed] [Google Scholar] 8. Schett G, Дэвид JP. Множество лиц аутоиммунной потери костной массы. Nat. Rev. Endocrinol. 2010. 6: 698–706. [PubMed] [Google Scholar] 9. Schett G, Saag KG, Bijlsma JW. От биологии костей до клинических результатов: современное состояние и перспективы на будущее. Анна. Реум. Дис. 2010; 69: 1415–1419. [PubMed] [Google Scholar] 10. Sharp JT, Lidsky MD, Collins LC, Moreland J. Методы оценки прогрессирования радиологических изменений при ревматоидном артрите. Взаимосвязь рентгенологических, клинических и лабораторных отклонений.Ревматоидный артрит. 1971; 14: 706–720. [PubMed] [Google Scholar] 11. Aletaha D, et al. Критерии классификации ревматоидного артрита 2010 года: совместная инициатива Американского колледжа ревматологии / Европейской лиги против ревматизма. Анна. Реум. Дис. 2010; 69: 1580–1588. [PubMed] [Google Scholar] 12. Ødegård S, et al. Связь раннего рентгенологического повреждения с нарушением физических функций при ревматоидном артрите: десятилетнее продольное обсервационное исследование с участием 238 пациентов. Ревматоидный артрит. 2006; 54: 68–75.[PubMed] [Google Scholar] 13. Скотт Д.Л. и др. Связь между повреждением суставов и инвалидностью при ревматоидном артрите. Ревматология (Оксфорд) 2000; 39: 122–132. [PubMed] [Google Scholar] 14. Welsing PM, van Gestel AM, Swinkels HL, Kiemeney LA, van Riel PL. Взаимосвязь между активностью заболевания, разрушением суставов и функциональной способностью в течение ревматоидного артрита. Ревматоидный артрит. 2001; 44: 2009–2017. [PubMed] [Google Scholar] 15. McInnes I, Schett G. Цитокины в патогенезе ревматоидного артрита.Nat. Иммунол. 2007. 7: 429–442. [PubMed] [Google Scholar] 16. Stach CM, et al. Структура околосуставной кости у пациентов с ревматоидным артритом и здоровых людей, оцененная с помощью компьютерной томографии высокого разрешения. Ревматоидный артрит. 2010. 62: 330–339. [PubMed] [Google Scholar] 17. Døhn UM, et al. Объемы эрозии костей при ревматоидном артрите на КТ и МРТ: надежность и корреляция с оценками эрозии на КТ, МРТ и рентгенографии. Анна. Реум. Дис. 2007; 66: 1388–1392. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18.Wakefield RJ и др. Значение сонографии в обнаружении эрозий костей у пациентов с ревматоидным артритом: сравнение с традиционной рентгенографией. Ревматоидный артрит. 2000. 43: 2762–2770. [PubMed] [Google Scholar] 19. McGonagle D, Tan AL, Møller Døhn U, Ostergaard M, Benjamin M. Микроанатомические исследования для определения прогностических факторов топографии образования околосуставных эрозий при воспалительном артрите. Ревматоидный артрит. 2009; 60: 1042–1051. [PubMed] [Google Scholar] 20. Мартель В., Хейс Дж. Т., Дафф ИФ.Картина эрозии костей кисти и запястья при ревматоидном артрите. Радиология. 1965; 84: 204–214. [PubMed] [Google Scholar] 21. Ejbjerg B, et al. Магнитно-резонансная томография суставов запястья и пальцев у здоровых людей иногда показывает изменения, напоминающие эрозии и синовит, наблюдаемые при ревматоидном артрите. Ревматоидный артрит. 2004. 50: 1097–1106. [PubMed] [Google Scholar] 22. Тан А.Л. и др. Роль анатомических факторов пястно-фалангового сустава в распространении синовита и эрозии костей при раннем ревматоидном артрите.Ревматоидный артрит. 2003. 48: 1214–1222. [PubMed] [Google Scholar] 23. Hayer S, et al. Теносиновит и образование остеокластов как начальные доклинические изменения на мышиной модели воспалительного артрита. Ревматоидный артрит. 2007; 56: 79–88. [PubMed] [Google Scholar] 24. Маринова-Мутафчиева Л., Уильямс Р.О., Фуна К., Майни Р.Н., Звайфлер Н.Дж. Воспалению предшествует зависящая от фактора некроза опухоли инфильтрация мезенхимальных клеток при экспериментальном артрите. Ревматоидный артрит. 2002; 46: 507–513. [PubMed] [Google Scholar] 25.Schett G, et al. Анализ кинетики остеокластогенеза у крыс с артритом. Ревматоидный артрит. 2005. 52: 3192–3201. [PubMed] [Google Scholar] 26. Tournis S и др. Влияние ревматоидного артрита на объемную минеральную плотность кости и геометрию кости, оцененное с помощью количественной периферической компьютерной томографии у женщин в постменопаузе, получавших бисфосфонаты. J. Rheumatol. 2012; 39: 1215–1220. [PubMed] [Google Scholar] 27. Aeberli D, et al. Снижение минеральной плотности трабекулярной кости и толщины кортикального слоя, сопровождающееся увеличением окружности наружной кости в пястной кости пациентов с ревматоидным артритом: поперечное исследование.Arthritis Res. Ther. 2010; 12: R119. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Sharp JT, et al. Деносумаб предотвращает потерю кортикальной кости ствола пястной кости у пациентов с эрозивным ревматоидным артритом. Arthritis Care Res. (Хобокен) 2010; 62: 537–544. [PubMed] [Google Scholar] 29. Хофф М. и др. Потеря кортикальной костной ткани кисти через 1 год при раннем ревматоидном артрите позволяет прогнозировать рентгенологическое повреждение суставов кисти через 5 и 10 лет наблюдения. Анна. Реум. Дис. 2009. 68: 324–329. [PubMed] [Google Scholar] 30. Haugeberg G, et al.Масса кортикальной кости кисти и ее связь с рентгенологическим повреждением суставов и переломами у пациенток в возрасте 50–70 лет с ревматоидным артритом: совместное поперечное исследование Осло-Труро-Амстердам (OSTRA). Анна. Реум. Дис. 2004. 63: 1331–1334. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Van der Heijde DM. Эрозии суставов и пациенты с ранним ревматоидным артритом. Br. J. Rheumatol. 1995; 34: 74–78. [PubMed] [Google Scholar] 32. Махольд К.П. и др. Ревматоидный артрит с очень недавним началом: клинические и серологические характеристики пациента, связанные с рентгенологическим прогрессированием в течение первых лет болезни.Ревматология (Оксфорд) 2007: 46: 342–349. [PubMed] [Google Scholar] 33. Güler-Yüksel M, et al. Изменения минеральной плотности костей рук и общая минеральная плотность у пациентов с недавно начавшимся ревматоидным артритом. Анна. Реум. Дис. 2009. 68: 330–336. [PubMed] [Google Scholar] 34. Соломон Д.Х. и др. Связь между очаговыми эрозиями и генерализованным остеопорозом у женщин в постменопаузе с ревматоидным артритом. Ревматоидный артрит. 2009. 60: 1624–1631. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Пай С.Р. и др. Активность заболевания и тяжесть раннего воспалительного артрита позволяют прогнозировать потерю кортикальной кости кисти.Ревматология (Оксфорд) 2010; 49: 1943–1948. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Møller Døhn U, et al. Отсутствие общего прогрессирования и периодического восстановления эрозий, несмотря на стойкое воспаление у пациентов с ревматоидным артритом, леченных адалимумабом: результаты продольного сравнительного исследования МРТ, УЗИ, КТ и рентгенографии. Анна. Реум. Дис. 2011; 70: 252–258. [PubMed] [Google Scholar] 37. Finzel S, et al. Подробное сравнительное исследование ультразвука высокого разрешения и микрокомпьютерной томографии для выявления артритных эрозий костей.Ревматоидный артрит. 2011; 63: 1231–1236. [PubMed] [Google Scholar] 38. Хаавардсхольм Э.А., Бойесен П., Остергаард М., Шильдволд А., Квиен Т.К. Результаты магнитно-резонансной томографии у 84 пациентов с ранним ревматоидным артритом: отек костного мозга позволяет прогнозировать эрозивную прогрессию. Анна. Реум. Дис. 2008. 67: 794–800. [PubMed] [Google Scholar] 39. McQueen FM и др. Отек кости, оцененный на магнитно-резонансной томографии доминирующего запястья при представлении, предсказывает рентгенологическое повреждение суставов рук и ног через шесть лет у пациентов с ревматоидным артритом.Ревматоидный артрит. 2003. 48: 1814–1827. [PubMed] [Google Scholar] 41. Finzel S, Englbrecht M, Engelke K, Stach C, Schett G. Сравнительное исследование околосуставных поражений костей при ревматоидном артрите и псориатическом артрите. Анна. Реум. Дис. 2011; 70: 122–127. [PubMed] [Google Scholar] 42. Бромли М, Вулли ДЕ. Хондрокласты и остеокласты на субхондральных участках эрозии ревматоидного сустава. Ревматоидный артрит. 1984; 27: 968–975. [PubMed] [Google Scholar] 43. Leisen JCDH, Риддл JM, Питчфорд WC. Эрозивный фронт: топографическое исследование соединения паннуса и субхондральной пластинки в мацерированной ревматоидной пястной головке.J. Rheumatol. 1988; 15: 17–22. [PubMed] [Google Scholar] 44. Gravallese EM, et al. Идентификация типов клеток, ответственных за резорбцию костей при ревматоидном артрите и ювенильном ревматоидном артрите. Являюсь. J. Pathol. 1998; 152: 943–951. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Kong YY и др. Активированные Т-клетки регулируют потерю костной массы и разрушение суставов при адъювантном артрите через лиганд остеопротегерина. Природа. 1999; 402: 304–309. [PubMed] [Google Scholar] 46. Romas E, et al. Остеопротегерин уменьшает количество остеокластов и предотвращает эрозию костей при артрите, вызванном коллагеном.Являюсь. J. Pathol. 2002; 161: 1419–1427. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Lubberts E, et al. Увеличение экспрессии активатора рецептора ядерного фактора κB в местах эрозии костей коррелирует с прогрессированием воспаления при развивающемся коллаген-индуцированном артрите. Ревматоидный артрит. 2002; 46: 3055–3064. [PubMed] [Google Scholar] 48. Pettit AR, et al. Мыши с нокаутом TRANCE / RANKL защищены от эрозии костей в модели артрита с переносом сыворотки. Являюсь. J. Pathol. 2001; 159: 1689–1699. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50.Редлих К. и др. Опосредованное фактором некроза опухоли разрушение суставов ингибируется за счет нацеливания на остеокласты остеопротегерина. Ревматоидный артрит. 2002; 46: 785–792. [PubMed] [Google Scholar] 51. Йошида Х. и др. Остеопетроз с мутацией мышей находится в кодирующей области гена фактора, стимулирующего колонии макрофагов. Природа. 1990; 345: 442–444. [PubMed] [Google Scholar] 52. Firestein GS, et al. Цитокины при хроническом воспалительном артрите. I. Неспособность обнаружить Т-клеточные лимфокины (интерлейкин 2 и интерлейкин 3) и присутствие фактора, стимулирующего колонии макрофагов (CSF-1) и нового фактора роста тучных клеток при ревматоидном синовите.J. Exp. Med. 1988; 168: 1573–1586. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Wong BR, et al. TRANCE представляет собой новый лиганд семейства рецепторов фактора некроза опухолей, который активирует N-концевую киназу c-Jun в Т-клетках. J. Biol. Chem. 1997; 272: 25190–25194. [PubMed] [Google Scholar] 54. Yasuda H, et al. Фактор дифференцировки остеокластов является лигандом для фактора ингибирования остеопротегерина / остеокластогенеза и идентичен TRANCE / RANKL. Proc. Natl Acad. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 1998. 95: 3597–3602. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55.Лейси Д.Л. и др. Лиганд остеопротегерина — это цитокин, регулирующий дифференцировку и активацию остеокластов. Клетка. 1998. 93: 165–176. [PubMed] [Google Scholar] 56. Kong Y-Y и др. OPGL является ключевым регулятором остеокластогенеза, развития лимфоцитов и органогенеза лимфатических узлов. Природа. 1999; 397: 315–323. [PubMed] [Google Scholar] 57. Gravallese EM, et al. Синовиальная ткань при ревматоидном артрите является источником фактора дифференцировки остеокластов. Ревматоидный артрит. 2000. 43: 250–258. [PubMed] [Google Scholar] 58.Shigeyama Y, et al. Экспрессия фактора дифференцировки остеокластов при ревматоидном артрите. Ревматоидный артрит. 2000; 43: 2523–2530. [PubMed] [Google Scholar] 59. Ли П. и др. Передача сигналов RANK не требуется для TNFα-опосредованного увеличения предшественников остеокластов CD11hi, но необходима для образования зрелых остеокластов при TNFα-опосредованном воспалительном артрите. J. Bone Miner. Res. 2004; 19: 207–213. [PubMed] [Google Scholar] 60. Ритчлин К.Т., Хаас-Смит С.А., Ли П., Хикс Д.Г., Шварц Э.М. Механизмы TNF- и RANKL-опосредованного остеокластогенеза и резорбции кости при псориатическом артрите.J. Clin. Инвестировать. 2003; 111: 821–831. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Германн С. и др. ОСКАР — ключевая молекула костимуляции остеокластов индуцируется у пациентов с ревматоидным артритом. Ревматоидный артрит. 2008. 58: 3041–3050. [PubMed] [Google Scholar] 62. Оно Х и др. Активный при пероральном приеме и селективный ингибитор тирозинкиназы c-Fms Ki20227 ингибирует прогрессирование заболевания на мышиной модели индуцированного коллагеном артрита. Евро. J. Immunol. 2008. 38: 283–291. [PubMed] [Google Scholar] 63. Коэн С.Б. и др.Влияние лечения деносумабом на структурные повреждения, минеральную плотность костной ткани и метаболизм костной ткани при ревматоидном артрите: двенадцатимесячное, многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое клиническое исследование фазы II. Ревматоидный артрит. 2008. 58: 1299–1309. [PubMed] [Google Scholar] 64. Visser H, le Cessie S, Vos K, Breedveld FC, Hazes JM. Как диагностировать ревматоидный артрит на ранней стадии: модель прогнозирования стойкого (эрозивного) артрита. Ревматоидный артрит. 2002. 46: 357–365. [PubMed] [Google Scholar] 65. Кастбом А., Страндберг Г., Линдроос А., Скох Т.Тест на антитела к ЦЦП позволяет прогнозировать течение заболевания в течение 3 лет при раннем ревматоидном артрите (шведский проект TIRA) Ann. Реум. Дис. 2004. 63: 1085–1089. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Мейер О. и др. Анализы антицитруллинированных белков / пептидных антител при раннем ревматоидном артрите для прогнозирования пятилетних радиографических повреждений. Анна. Реум. Дис. 2003. 62: 120–126. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Ши Дж. И др. Аутоантитела, распознающие карбамилированные белки, присутствуют в сыворотке крови пациентов с ревматоидным артритом и предсказывают повреждение суставов.Proc. Natl Acad. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2011; 108: 17372–17377. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Харре У и др. Индукция остеокластогенеза и потери костной массы человеческими аутоантителами против цитруллинированного виментина. J. Clin. Инвестировать. 2012; 122: 1791–1802. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Ву Y, Хамфри МБ, Накамура М.С. Остеокласты — врожденные иммунные клетки кости. Аутоиммунитет. 2008. 41: 183–194. [PubMed] [Google Scholar] 70. Джи Д. и др. Ингибирование экспрессии RANK и остеокластогенеза TLR и IFN-γ в предшественниках остеокластов человека.J. Immunol. 2009; 183: 7223–7233. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Сато К. и др. Th27 функционирует как субпопуляция остеокластогенных хелперных Т-клеток, которая связывает активацию Т-клеток и разрушение костей. J. Exp. Med. 2006; 203: 2673–2682. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Заисс М.М. и др. Регуляторные Т-клетки защищают от местного и системного разрушения костей при артрите. J. Immunol. 2010. 184: 7238–7246. [PubMed] [Google Scholar] 73. Заисс М.М. и др. Повышенная плотность костной ткани и устойчивость к потере костной массы, вызванной овариэктомией, у FoxP3-трансгенных мышей на основе нарушения дифференцировки остеокластов.Ревматоидный артрит. 2010; 62: 2328–2338. [PubMed] [Google Scholar] 74. Axmann R, et al. CTLA-4 напрямую подавляет образование остеокластов. Анна. Реум. Дис. 2008. 67: 1603–1609. [PubMed] [Google Scholar] 75. Заисс М.М. и др. Клетки TREG подавляют образование остеокластов: новое звено между иммунной системой и костью. Ревматоидный артрит. 2007. 56: 4104–4112. [PubMed] [Google Scholar] 76. Баккер М.Ф. и др. Утрехтская группа исследования ревматоидного артрита. Включение низких доз преднизона в основанную на метотрексате стратегию жесткого контроля раннего ревматоидного артрита: рандомизированное исследование.Анна. Междунар. Med. 2012; 156: 329–339. [PubMed] [Google Scholar] 77. Grigor C, et al. Эффект от стратегии лечения ревматоидного артрита (исследование TICORA): простое слепое рандомизированное контролируемое исследование. Ланцет. 2004; 364: 263–269. [PubMed] [Google Scholar] 78. Лам Дж. И др. TNF-α индуцирует остеокластогенез путем прямой стимуляции макрофагов, подверженных допустимым уровням лиганда RANK. J. Clin. Инвестировать. 2000; 106: 1481–1488. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Бойс Б.Ф. и др.Влияние интерлейкина-1 на метаболизм костей у нормальных мышей. Эндокринология. 1989; 125: 1142–1150. [PubMed] [Google Scholar] 81. Ishimi YMC, et al. ИЛ-6 продуцируется остеобластами и вызывает резорбцию кости. J. Immunol. 1990; 145: 3297–3303. [PubMed] [Google Scholar] 82. Axmann R, et al. Ингибирование рецептора интерлейкина-6 напрямую блокирует образование остеокластов in vitro и in vivo . Ревматоидный артрит. 2009. 60: 2747–2756. [PubMed] [Google Scholar] 83. Poli V и др. Мыши с дефицитом интерлейкина-6 защищены от потери костной массы, вызванной истощением эстрогена.EMBO J. 1994; 13: 1189–1196. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Янсен Л.М., ван дер Хорст-Брюинсма И.Е., ван Шаарденбург Д., Беземер П.Д., Дейкманс Б.А. Предикторы рентгенологического поражения суставов у пациентов с ранним ревматоидным артритом. Анна. Реум. Дис. 2001; 60: 924–927. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Kraan MC и др. Бессимптомный синовит предшествует клинически манифестному артриту. Ревматоидный артрит. 1998; 41: 1481–1488. [PubMed] [Google Scholar] 86. Ван де Санде М.Г. и др. Различные стадии ревматоидного артрита: особенности синовиальной оболочки в доклинической фазе.Анна. Реум. Дис. 2011; 70: 772–777. [PubMed] [Google Scholar] 87. Рич Э., Морленд Л. В., Аларкон Г. С.. Недостаточность рентгенологического прогрессирования ревматоидного артрита, получавшего метотрексат в качестве первого противоревматического препарата, изменяющего заболевание. J. Rheumatol. 1999; 26: 259–261. [PubMed] [Google Scholar] 88. Schett G, Stach C, Zwerina J, Voll R, Manger B. Как противоревматические препараты защищают суставы от повреждений при ревматоидном артрите. Ревматоидный артрит. 2008. 58: 2936–2948. [PubMed] [Google Scholar] 89. Коэн Дж. И др. Радиологические повреждения у пациентов с ревматоидным артритом в стойкой ремиссии.Анна. Реум. Дис. 2007. 66: 358–363. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Molenaar ET, et al. Прогрессирование радиологического повреждения у пациентов с ревматоидным артритом в стадии клинической ремиссии. Ревматоидный артрит. 2004; 50: 36–42. [PubMed] [Google Scholar] 91. Браун А.К. и др. Объяснение очевидной диссоциации между клинической ремиссией и продолжающимся структурным ухудшением ревматоидного артрита. Ревматоидный артрит. 2008. 58: 2958–2967. [PubMed] [Google Scholar] 92. Vis M, et al. Оценка минеральной плотности костной ткани, метаболизма костей, уровня остеопротегерина и активатора рецепторов лиганда NFκB в сыворотке крови во время лечения инфликсимабом у пациентов с ревматоидным артритом.Анна. Реум. Дис. 2006; 65: 1495–1499. [Бесплатная статья PMC] [PubMed] [Google Scholar] 94. ван Волленховен РФ и др. Тофацитиниб или адалимумаб в сравнении с плацебо при ревматоидном артрите. N. Engl. J. Med. 2012; 367: 508–519. [PubMed] [Google Scholar] 95. Fleischmann R, et al. Плацебо-контролируемое исследование монотерапии тофацитинибом при ревматоидном артрите. N. Engl. J. Med. 2012; 367: 495–507. [PubMed] [Google Scholar] 96. Weinblatt ME, et al. Оральный ингибитор тирозинкиназы селезенки (Syk) при ревматоидном артрите.N. Engl. J. Med. 2010; 363: 1303–1312. [PubMed] [Google Scholar] 97. Mócsai A, et al. Иммуномодулирующие адаптерные белки DAP12 и γ-цепь рецептора Fc (FcRγ) регулируют развитие функциональных остеокластов посредством тирозинкиназы Syk. Proc. Natl Acad. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2004. 101: 6158–6163. [Бесплатная статья PMC] [PubMed] [Google Scholar] 98. Макиннес И.Б., Шетт Г. Патогенез ревматоидного артрита. N. Engl. J. Med. 2011; 365: 2205–2219. [PubMed] [Google Scholar] 99. Jiang Y, et al. Многоцентровое, двойное слепое, рандомизированное, плацебо-контролируемое исследование рекомбинантного антагониста рецептора интерлейкина-1 человека у пациентов с ревматоидным артритом: радиологическое прогрессирование и корреляция оценок Генанта и Ларсена.Ревматоидный артрит. 2000; 43: 1001–1009. [PubMed] [Google Scholar] 100. Fossiez F, et al. Т-клеточный интерлейкин-17 побуждает стромальные клетки продуцировать провоспалительные и гемопоэтические цитокины. J. Exp. Med. 1996; 183: 2593–2603. [Бесплатная статья PMC] [PubMed] [Google Scholar] 101. Йованович Д.В. и др. IL-17 стимулирует выработку и экспрессию провоспалительных цитокинов, IL-β и TNF-α, макрофагами человека. J. Immunol. 1998. 160: 3513–3521. [PubMed] [Google Scholar] 102. Chabaud M, et al. Человеческий интерлейкин-17: провоспалительный цитокин Т-лимфоцитов, продуцируемый ревматоидной синовиальной оболочкой.Ревматоидный артрит. 1999; 42: 963–970. [PubMed] [Google Scholar] 103. Miossec P, Korn T, Kuchroo VK. Интерлейкин-17 и хелперные Т-клетки 17 типа. N. Engl. J. Med. 2009; 361: 888–889. [PubMed] [Google Scholar] 104. Kotake S, et al. IL-17 в синовиальной жидкости пациентов с ревматоидным артритом является мощным стимулятором остеокластогенеза. J. Clin. Инвестировать. 1999; 103: 1345–1352. [Бесплатная статья PMC] [PubMed] [Google Scholar] 105. Сато К. и др. Th27 функционирует как субпопуляция остеокластогенных хелперных Т-клеток, которая связывает активацию Т-клеток и разрушение костей.J. Exp. Med. 2006; 203: 2673–2682. [Бесплатная статья PMC] [PubMed] [Google Scholar] 106. Зверина К. и др. Терапия против IL-17A подавляет потерю костной массы при TNF-α-опосредованном артрите мышей путем модуляции баланса Т-клеток. Евро. J. Immunol. 2012; 42: 413–423. [PubMed] [Google Scholar] 107. Огата Ю. и др. Новая роль IL-15 в развитии остеокластов: неспособность заменить его активность на IL-2. J. Immunol. 1999. 162: 2754–2760. [PubMed] [Google Scholar] 108. Knevel R, et al. Генетические варианты в IL15 и связаны с прогрессированием разрушения суставов при ревматоидном артрите: многокомпонентное исследование.Анна. Реум. Дис. 2012; 71 (Приложение 1): A56 – A57. [PubMed] [Google Scholar] 109. Заисс М.М. и др. IL-33 сдвигает баланс от остеокластов к альтернативно активируемой дифференцировке макрофагов и защищает от опосредованной TNFα потери костной массы. J. Immunol. 2011; 186: 6097–6105. [PubMed] [Google Scholar] 110. Куинн Дж. М. и др. IL-23 подавляет остеокластогенез опосредованно через лимфоциты и необходим для поддержания костной массы у мышей. J. Immunol. 2008. 181: 5720–5729. [PubMed] [Google Scholar] 111. Лукас К., ван дер Хейде Д., Фатенежад С., Ландеве Р.Ремонт эрозий происходит почти исключительно на поврежденных суставах без отека. Анна. Реум. Дис. 2010; 69: 851–855. [PubMed] [Google Scholar] 112. Møller Døhn U, et al. У пациентов с ревматоидным артритом, получавших адалимумаб, развитие эрозии минимально, но заживление эрозии происходит редко. Контрольное исследование продолжительностью 1 год, инициированное исследователем, с использованием компьютерной томографии высокого разрешения в качестве основного критерия оценки результатов. Анна. Реум. Дис. 2009. 68: 1585–1590. [PubMed] [Google Scholar] 114. Finzel S, et al. Восстановление эрозий костей при ревматоидном артрите, леченном ингибиторами фактора некроза опухолей, основано на наложении костей в основании эрозии.Анна. Реум. Дис. 2011; 70: 1587–1593. [PubMed] [Google Scholar] 115. Уолш NC и др. Функция остеобластов нарушается в местах очаговой эрозии костей при воспалительном артрите. J. Bone Miner. Res. 2009; 24: 1572–1585. [PubMed] [Google Scholar] 116. Диарра Д., Столина М., Пользер К. и др. Dickkopf-1 — главный регулятор ремоделирования суставов. Nat. Med. 2007. 13: 156–163. [PubMed] [Google Scholar] 117. Matzelle MM, et al. Разрешение воспаления вызывает функцию остеобластов и регулирует путь передачи сигналов Wnt.Ревматоидный артрит. 2012; 64: 1540–1550. [Бесплатная статья PMC] [PubMed] [Google Scholar] 118. Редлих К. и др. Восстановление местных эрозий костей и устранение системной потери костной массы при терапии противоопухолевым фактором некроза в сочетании с остеопротегерином или паратироидным гормоном при артрите, опосредованном фактором некроза опухоли. Являюсь. J. Pathol. 2004. 164: 543–555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 119. Пул К.Е. и др. Склеростин — это продукт замедленной секреции остеоцитов, который препятствует образованию кости.FASEB J. 2005; 19: 1842–1844. [PubMed] [Google Scholar] 120. Семенов М., Тамай К., He X. SOST является лигандом для LRP5 / LRP6 и ингибитором передачи сигналов Wnt. J. Biol. Chem. 2005; 280: 26770–26775. [PubMed] [Google Scholar]Эрозия костей при ревматоидном артрите: механизмы, диагностика и лечение
Nat Rev Rheumatol. Авторская рукопись; доступно в PMC 2014 15 июля.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC4096779
NIHMSID: NIHMS601272
Георг Шетт
Кафедра внутренней медицины 3, Университет Эрлангена-Нюрнберга,
, Кранкенхауз, 12 Эрланген, Германия
Эллен Граваллезе
Медицинский факультет, Мемориальный медицинский центр Массачусетского университета и Медицинская школа Массачусетского университета, 55 Lake Avenue North, Вустер, Массачусетс, США 01655, США
Георг Шетт, Департамент внутренней медицины 3, Университет Эрланген-Нюрнберг, Кранкенхаусштрассе 12,
Эрланген, Германия;
Оба автора внесли одинаковый вклад во все аспекты этой статьи.
Окончательная отредактированная версия этой статьи издателя доступна на сайте Nat Rev Rheumatol. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Эрозия костей является центральным признаком ревматоидного артрита и связана с тяжестью заболевания и плохим функциональным исходом. Эрозия околосуставной кортикальной кости, типичная особенность, наблюдаемая на простых рентгенограммах у пациентов с ревматоидным артритом, возникает в результате чрезмерной местной резорбции кости и недостаточного костеобразования.Основными триггерами эрозии суставной кости являются синовит, включая выработку провоспалительных цитокинов и активатора рецептора лиганда ядерного фактора κB (RANKL), а также антител, направленных против цитруллинированных белков. Действительно, как цитокины, так и аутоантитела стимулируют дифференцировку резорбирующих костную ткань остеокластов, тем самым стимулируя местную резорбцию кости. Хотя современная противоревматическая терапия подавляет как эрозию, так и воспаление костей, восстановление существующих костных повреждений, хотя и возможно с физиологической точки зрения, происходит редко.Отсутствие восстановления происходит, по крайней мере частично, из-за активного подавления образования кости провоспалительными цитокинами. В этом обзоре суммируется значительный прогресс, достигнутый в понимании патофизиологии эрозий костей, и обсуждаются улучшения в диагностике, мониторинге и лечении таких поражений.
Введение
Скелет состоит из губчатой кости, тонкой костной сети, в которой находится костный мозг, и кортикальной кости, плотной костной оболочки, которая обеспечивает структурную поддержку в областях, несущих нагрузку.Оба типа костей нацелены на эрозию при ревматоидном артрите (РА). Более того, РА является независимым фактором риска генерализованной остеопении и остеопороза с поражением трабекулярной и кортикальной костей в осевом и аппендикулярном скелете. Эрозия суставной кости представляет собой локальную потерю костной массы (остеолиз), первоначально затрагивающую кортикальную кость, и разрушение естественного барьера между внескелетной тканью и межтрабекулярными пространствами полости костного мозга. Остеолиз является результатом дисбаланса, при котором резорбция костной ткани остеокластами предпочтительнее, чем костеобразование остеобластами.Понимание механизмов, определяющих образование эрозий костей, требует понимания биологии костного гомеостаза и молекулярной регуляции дифференцировки и функции остеокластов и остеобластов. 1–3
Хотя некоторые патологические процессы могут привести к эрозии костей, включая злокачественные новообразования, метаболические процессы, такие как гиперпаратиреоз, и хронические воспалительные заболевания, такие как гистиоцитоз и саркоидоз, наиболее частой причиной является РА. Первоначально описанные более 100 лет назад, 4,5 эрозий суставных костей в настоящее время стали центральным элементом диагностики, лечения и мониторинга РА.Более того, эти поражения являются ожидаемым следствием серопозитивного РА, если заболевание не лечить своевременно и эффективно. Эрозии отражают клинические последствия тесного взаимодействия между активацией иммунной системы и моделированием и ремоделированием скелета. Действительно, исследование взаимодействия иммунной системы и костей привело к появлению новой области, называемой остеоиммунологией. 6–9
Определение эрозии кости
Эрозия кости — это радиологический термин, который отражает тот факт, что для обнаружения используется визуализация. 10 Эрозии видны на простых рентгенограммах как разрывы кортикальной поверхности кости и часто сопровождаются потерей прилегающей губчатой кости. Напротив, костные кисты представляют собой области остеолиза внутри компартмента губчатой кости без каких-либо признаков деструкции кортикальной кости. Хотя эрозии также могут наблюдаться при формах артрита, отличных от РА, таких как подагра, псориатический артрит, спондилоартрит и даже остеоартрит, они включены в диагностические критерии РА. 11 Вследствие серьезности и типичной картины распределения по множеству периферических участков скелета, а также отсутствия сопутствующего образования новой кости, появление эрозий костей является уникальным при РА и существенно отличается от других типов артрита.
Эрозии костей представляют собой ключевой критерий исхода при РА и позволяют прогнозировать более тяжелое течение болезни с более высокой степенью инвалидности и повышенной смертностью. 12–14 Клинические испытания всех основных противоревматических средств, одобренных для модификации РА, были подтверждены на предмет их способности замедлять или даже останавливать структурное повреждение, которое представляет собой смесь эрозии кости и деградации хряща.Кроме того, рентгенография широко используется для оценки структурных повреждений в клинической практике и для мониторинга эффективности терапии в замедлении структурных повреждений. Таким образом, в настоящее время обнаружение и количественная оценка эрозии костей является основным инструментом для диагностики заболеваний, а также для мониторинга и измерения эффективности лекарственной терапии у пациентов с РА. В этом обзоре основное внимание уделяется эрозии костей при РА и не обсуждается повреждение хряща. Тем не менее, повреждение хряща является не менее важным признаком структурного повреждения при РА, которое происходит по принципиально различным механизмам по отношению к эрозиям костей. 15
Анатомические факторы и микроструктура
Эрозии костей не возникают в случайных местах, но проявляют склонность к определенным анатомическим участкам. Подробный анализ распределения эрозий костей был проведен с помощью КТ высокого разрешения, УЗИ высокого разрешения и МРТ. Выявлено, что лучевые аспекты суставов пальцев являются «горячими точками» для эрозий костей, тогда как локтевые аспекты поражаются реже, а ладонная и ладонная поверхности суставов практически избавлены от таких повреждений. 16–18 Этот отчетливый паттерн локализации костной эрозии при RA интригует и может быть связан с определенными анатомическими особенностями, как описано ниже. Более того, эрозии костей обычно возникают в месте прямого контакта синовиальной оболочки с костью (так называемые голые области), что позволяет предположить, что анатомические факторы делают эти области околосуставной кости подверженными эрозии. 19,20 Эта концепция также подтверждается исследованиями на здоровых людях с использованием КТ высокого разрешения, которые показали, что эрозии костей диаметром менее 2 мм могут быть обнаружены у здоровых людей с характером распределения, который точно отражает характер эрозивные поражения, наблюдаемые у пациентов с РА. 15,21 Анатомические факторы, которые предрасполагают участки скелета к эрозии, включают: присутствие минерализованного хряща, ткани, особенно склонной к разрушению резорбирующими костную ткань клетками; места прикрепления связок к поверхности кости, которые передают механические силы к кости и могут вызвать микроповреждения; 22 и воспаленные влагалища сухожилий (так называемый теносиновит), которые проходят через поверхность кости и способствуют распространению воспаления от сухожилия на синовиальную оболочку сустава. 23
Мелкие костные каналы, которые проникают в кортикальный слой кости, несут микрососуды и соединяют внешнюю синовиальную мембрану и внутреннее пространство костного мозга; эти каналы также подвержены эрозивным изменениям на ранних этапах развития РА. Микрососуды, расположенные внутри этих каналов, способствуют перемещению клеток-предшественников остеокластов в кость, которые при контакте с костью и получении соответствующих молекулярных сигналов дифференцируются в остеокласты. Расширение кортикальных костных каналов в результате опосредованной остеокластами резорбции кости является типичным ранним изменением в моделях артрита на животных. 24,25 Более того, кортикальные фенестрации были описаны на компьютерных томограммах высокого разрешения суставов пациентов с РА, что, вероятно, отражает такое расширение кортикальных костных каналов. 15 Эти изменения соответствуют известному снижению массы кортикальной кости при РА, которое было зарегистрировано в нескольких исследованиях у пациентов с РА и, по-видимому, тесно связано с активностью заболевания и развитием эрозий костей. 26–30
Развитие эрозий костей
Продольные рентгенографические исследования показали, что эрозии костей возникают на ранних стадиях патогенеза РА, поражая примерно половину нелеченных пациентов через 6 месяцев после начала заболевания. 31 Радиографические исследования пациентов с РА продолжительностью менее 3 месяцев показывают, что у некоторых пациентов эрозии костей можно обнаружить уже через несколько недель после начала заболевания. 32 Более того, несколько исследований с участием пациентов с РА показали, что существует взаимосвязь между эрозиями костей и развитием остеопении и остеопороза. 33–35
Обнаружение эрозий костей улучшилось благодаря значительным технологическим достижениям в визуализации опорно-двигательного аппарата.КТ, УЗИ высокого разрешения и МРТ могут надежно обнаружить даже небольшие эрозии костей у пациентов с РА. 36,37 Визуализация также подчеркнула и обосновала роль воспаления в запуске эрозий костей, показав, что не только синовит, но и воспаление прилегающего межтрабекулярного пространства (остит) коррелирует с развитием рентгенологических эрозий костей. 38,39 Остается неясным, приводит ли эрозия костей к оститу или остит является результатом эрозии костей. 40 Эрозии костей обычно рассматриваются как необратимые повреждения, хотя детальная продольная оценка этих повреждений с точки зрения восстановления все еще недостаточна. Самопроизвольное восстановление, однако, встречается редко, что контрастирует со значительной реакцией образования надкостницы, отмеченной в сочетании с эрозиями костей у пациентов с псориатическим артритом или остеоартритом. 41
Остеокласты опосредуют эрозию костей
Остеокласты, гигантские многоядерные клетки, происходящие из линии моноцитов, являются единственными клетками, способными резорбировать кости в организме. 2,3 Остеокласты предназначены для рассасывания кости за счет плотного прилегания к поверхности кости за счет взаимодействия как с интегринами, так и с белками внеклеточного матрикса, а также путем сборки соединений, которые герметизируют поверхность кости и остеокласт и тем самым отделяют кость от окружающей среды. внеклеточное пространство. Протоны накачиваются вдоль взъерошенной границы остеокластов, а затем создают кислую среду, позволяющую солюбилизировать кальций из кости. Матричные ферменты, синтезируемые остеокластом, включая катепсин К, матриксную металлопротеиназу 9 и тартрат-резистентную кислую фосфатазу типа 5 (TRAP), разрушают костный матрикс. 2
Остеокласты населяют поверхность раздела между воспалительной синовиальной тканью и околосуставной поверхностью кости. Первое косвенное описание клеток, резорбирующих костную ткань при РА, относится к 19 — веку, 5 и было пересмотрено Bromley и Woolley 42 и Leisen et al. 43 в 1980-е годы. Остеокласты при РА были окончательно идентифицированы и подробно охарактеризованы с использованием современных иммуногистохимических и молекулярных методов Gravallese et al. 44 в 1998. Многоядерные клетки на границе паннус-кость демонстрируют все фенотипические особенности истинных остеокластов, включая образование взъерошенной границы и экспрессию специфических маркеров, включая TRAP, катепсин К и рецептор кальцитонина. Клетки-предшественники остеокластов накапливаются внутри так называемого синовиального паннуса — плотной воспалительной синовиальной ткани, расположенной как на границе с костью, так и внутри самих костных эрозий. Подобные изменения также обнаружены во всех соответствующих моделях воспалительного артрита на животных, и исследования с участием этих моделей на животных продемонстрировали решающую роль остеокластов в патогенезе эрозии суставной кости при артрите, вызванном адъювантом, 45 коллаген, 46,47 сыворотка передача 48 и TNF. 49,50 Было показано, что при индукции артрита у мышей без остеокластов эти мыши полностью защищены от эрозий костей. 48,49 Остеокласты, таким образом, стали важным типом клеток в процессе эрозии.
Пути дифференцировки остеокластов
Развитие остеокластов происходит локально в синовиальной ткани в результате экспрессии двух основных остеокластогенных медиаторов, макрофагального колониестимулирующего фактора 1 (M-CSF) 51,52 и активатора ядерных рецепторов. лиганд фактора κB (RANKL; также известный как член суперсемейства TNF-лиганд 11). 53–58 Этот процесс включает миграцию клеток моноцитарного происхождения из костного мозга во вторичные лимфатические органы и, наконец, в суставы. Стадия дифференцировки, на которой моноциты попадают в сустав, неясна. В самом деле, моноциты могут быть уже преданы определенному клону моноцитов, например, макрофагам M1 или M2, дендритным клеткам или клеткам-предшественникам остеокластов, когда они входят в сустав. Некоторые данные предполагают, что TNF, ключевой провоспалительный цитокин, экспрессируемый в синовиальной ткани RA, стимулирует миграцию клеток-предшественников остеокластов из костного мозга на периферию. 59,60 Кроме того, TNF стимулирует экспрессию поверхностных рецепторов, таких как иммуноглобулиноподобный рецептор, связанный с остеокластами, до того, как клетки-предшественники попадают в сустав, и эти рецепторы облегчают дифференцировку. 61 Попав в микросреду сустава, эти клетки подвергаются воздействию M-CSF и RANKL и дифференцируются в остеокласты. После контакта с поверхностью кости достигается окончательная дифференцировка в остеокласты, резорбирующие кость.
Было показано, что блокада дифференцировки остеокластов путем ингибирования RANKL или M-CSF плюс RANKL останавливает эрозию костей практически во всех моделях воспалительного артрита на животных. 45–50,62 Одно клиническое испытание с участием пациентов с РА также показало, что блокада RANKL с использованием нейтрализующих антител (деносумаб) замедляет прогрессирование эрозии костей, но не замедляет воспаление. 63 Таким образом, прямое нацеливание на остеокласты при РА защищает кость от последствий воспаления даже при отсутствии подавления самого воспаления. Это наблюдение также в значительной степени исключает возможность того, что резорбция кости оказывает положительную обратную связь на синовиальное воспаление.
Триггеры эрозии костей
Доклинический аутоиммунитет
Аутоиммунитет является одним из самых сильных прогностических индикаторов структурных повреждений при РА. Неопровержимые доказательства связи между аутоиммунитетом и эрозией суставов были выявлены наличием в сыворотке крови пациентов с РА антител к цитруллинированному белку (ACPA) и антител к карбамилированному белку, которые могут возникать задолго до начала синовита и независимо предсказывать эрозия костей у этих пациентов. 64–67 Это наблюдение согласуется с несколькими когортами пациентов с РА и не зависит от показателей активности заболевания, таких как оценка активности заболевания 28 суставов или воспаление, измеряемых уровнями С-реактивного белка. 64–67 Исследование, проведенное в 2012 году, показало, что ACPA распознает цитруллинированный виментин, экспрессируемый на поверхности клеток-предшественников остеокластов. 68 Связывание ACPA с поверхностью клетки увеличивает клеточную дифференцировку до резорбирующих костную ткань остеокластов посредством аутокринной стимуляции выработки TNF.Остеокласты экспрессируют высокие уровни фермента пептидиларгининдезиминазы 2 типа (PADI2), который индуцируется потоком кальция и отвечает за цитруллинирование белка (). В клетках линии остеокластов активация PADI2 приводит к преимущественному цитруллинированию виментина, вызывая изменение его субклеточной локализации и делая его доступным для связывания ACPA. Индукция остеокластогенеза за счет связывания ACPA также подтверждается высокими уровнями маркеров резорбции кости в сыворотке пациентов с РА, 9 , отражающих опосредованную остеокластами резорбцию кости.Было бы интересно определить, является ли этот эффект специфичным для цитруллинированного виментина или антитела, специфичные к другим цитруллинированным белкам, имеют аналогичные эффекты. Эти данные проливают новый свет на взаимосвязь между воспалением и повреждением костей при РА и подтверждают концепцию, согласно которой структурные изменения костей происходят в начале заболевания или даже до начала заболевания у пациентов с РА (2).
Аутоантитела против цитруллинированных белков и остеокластогенеза. Плазматические клетки продуцируют ACPA со специфичностью к цитруллинированному виментину, который связывается с клетками-предшественниками остеокластов и стимулирует высвобождение TNF, что, в свою очередь, усиливает дифференцировку этих клеток в зрелые остеокласты.Во время процесса дифференцировки остеокластов выработка фермента PADI2 индуцируется кальцием. Активность PADI2 приводит к цитруллинированию виментина, который в большом количестве экспрессируется на поверхности клеток линии остеокластов. Сокращения: ACPA, антитела к цитруллинированному белку; PADI2, пептидил-аргининдеиминаза, тип 2.
Развитие эрозии костей в ходе РА. Во время доклинической фазы РА ACPA продуцируются плазматическими клетками на ранней стадии. ACPA может стимулировать дифференцировку остеокластов и приводить к начальной потере костной массы.Эти ранние изменения могут начаться в костном мозге, прилегающем к суставу. Синовит в начале клинического заболевания приводит к выработке цитокинов, которые стимулируют остеокластогенез, индуцируя экспрессию RANKL, и взаимодействуют с RANKL, усиливая эрозию кости. Установленный РА характеризуется наличием крупных эрозий костей, заполненных воспаленной тканью паннуса синовиального происхождения. Сокращения: ACPA, антитела к цитруллинированному белку; РА, ревматоидный артрит; RANKL, активатор рецептора лиганда ядерного фактора κB.
Врожденный иммунитет
Накопление доказательств указывает на роль врожденной иммунной системы в эрозии костей при РА. Остеокласты рассматриваются как ключевые клетки врожденного иммунитета в кости, поскольку они экспрессируют рецепторы врожденного иммунитета, аналогичные макрофагам и дендритным клеткам, которые регулируют их способность реагировать на воспаление в суставе и, таким образом, определяют их судьбу и функции. Эти рецепторы включают в себя рецепторы, несущие мотив активации тирозина иммунорецептора (ITAM), которые играют важную костимулирующую роль с RANKL и M-CSF в остеокластогенезе. 69 Роль Toll-подобных рецепторов (TLR) в патогенезе воспаления и эрозии костей при RA также была предложена, поскольку стимуляция TLR синовиоцитов индуцирует экспрессию RANKL, тем самым способствуя остеокластогенезу. Лиганды TLR могут также активировать пути, которые подавляют остеокластогенез, путем ингибирования экспрессии активатора рецептора NFκB (RANK; также известного как член суперсемейства рецепторов TNF 11A), тем самым ограничивая патологическую потерю костной массы, связанную с воспалением. 70 Таким образом, роль врожденной иммунной системы в эрозии костей при РА остается плодородной областью для дальнейших исследований.
Переход от аутоиммунитета к воспалению
Изменения иммунного баланса могут замедлить или даже предотвратить переход от ACPA-положительных здоровых людей к пациентам с воспалительным артритом. Регуляторные механизмы, включающие баланс субпопуляций Т-клеток, могут иметь решающее значение в блокировании клинических проявлений РА. Хотя Т-клетки и, в частности, Т-хелперы типа 17 (T H 17) всегда считались типами клеток, которые запускают остеокластогенез, Т-клетки 62,71 также могут способствовать поддержанию гомеостаза костей.Например, экспрессия цитотоксического Т-лимфоцит-ассоциированного антигена 4 (CTLA4) на Т-клетках, в частности регуляторных Т (T REG ) клетках, является мощным сигналом для блокирования дифференцировки остеокластов. 72–75 CTLA4 нарушает костимуляцию Т-клеток и тем самым действует как иммуномодулирующий сигнал. Связывание CTLA4 с рецепторами CD80 и CD86 на клеточной поверхности на предшественниках остеокластов останавливает дальнейшую дифференцировку этих клеток в остеокласты даже в присутствии стимулирующих факторов M-CSF и RANKL. 75 Эта концепция была переведена на терапевтическое применение у пациентов с введением CTLA4-Ig (абатацепт), который блокирует костимуляцию Т-клеток и, таким образом, блокирует воспаление и эрозию костей у пациентов с РА. Более того, тот факт, что иммунорегуляторная молекула защищает кость, расширяет спектр описанных в настоящее время иммунно-костных взаимодействий и демонстрирует двойную роль типов клеток и факторов как в иммунной системе, так и в скелете. Таким образом, активация иммунной системы способствует резорбции костей, тогда как иммунная модуляция оказывает защитное действие на скелет.
Синовит
Когда синовиальное воспаление развивается в результате аутоиммунитета при РА, дополнительные триггеры усиливают процесс эрозии кости. Отсюда следует, что жесткий контроль синовиального воспаления защитит от прогрессирования эрозии кости; это предсказание подтвердилось у пациентов с РА, получающих строго контролируемое противовоспалительное лечение БПВП и глюкокортикоидами. 76,77 Синовит — богатый источник провоспалительных цитокинов, которые управляют процессом дифференцировки остеокластов. 15 TNF, IL-1 и IL-6 усиливают остеокластогенез за счет разрешающего действия на экспрессию RANKL в мезенхимальных клетках, а также за счет прямого воздействия на клетки-предшественники остеокластов и, таким образом, создают подходящую микросреду для остеокластогенеза. Более того, экспрессия рецепторов дифференцировки остеокластов, таких как RANK, стимулируется цитокинами синовиального происхождения (2). 78–83 Следует отметить, что чем больше выраженность синовита, тем обширнее эрозивный процесс.Соответственно, и УЗИ, и МРТ показали, что степень синовита и остита связана с вероятностью последующего повреждения костей. 38,39 Кроме того, кажется, что уровни реагентов острой фазы, таких как C-реактивный белок, также положительно коррелируют с вероятностью развития эрозий костей при RA. 84 Поскольку синовит развивается незадолго до клинического начала заболевания у пациентов с РА, неудивительно, что риск эрозий костей увеличивается после клинического начала заболевания. 85,86
Таблица 1
Клинические эффекты цитокинов во время РА
| Цитокин | Провоспалительный эффект | Скелетный эффект | ||||
|---|---|---|---|---|---|---|
| TNF | Ключевой ингибитор костеобразования в RA | Про-остеокластогенные рецепторы через стимуляцию TNF-рецепторов через прямую стимуляцию TNF-рецепторов и стимуляцию остеокластогенных рецепторов TNF за счет прямой стимуляции остеокластогенных рецепторов TNF. также подавляет образование костей | ||||
| IL-6 | Главный провоспалительный цитокин в RA | Проостеокластогенный эффект за счет индукции RANKL и прямой стимуляции предшественников остеокластов посредством индукции передачи сигнала gp130 | M | потенциальные провоспалительные эффекты | Существенный фактор для дифференцировки остеокластов | |
| RANKL | Не влияет на воспаление | Существенный фактор для дифференцировки остеокластов | ||||
| IL-1 | Умеренные провоспалительные эффекты | |||||
| IL-17 | Возможные провоспалительные эффекты при RA | Проостеокластогенный эффект за счет индукции RANKL и блокирования антиостеокластогенных факторов, таких как IL-4, IFN-γ и IL-12 | 1 | IL-15 | Цитокин, участвующий в врожденных и адаптивных ve иммунные ответы с потенциальными провоспалительными эффектами в RA | Проостеокластогенный, индуцируя RANKL |
| IL-33 | Провоспалительные и противовоспалительные эффекты; нет определенной роли в воспалении при RA | Мощный ингибитор остеокластогенеза и резорбции кости | ||||
| Dkk-1 | Ингибитор Wnt, не влияющий на воспаление при RA | Ключевой ингибитор образования кости при RA |
Провоспалительные цитокины при эрозии костей
Ингибирование цитокинов, в том числе с помощью блокаторов TNF (инфликсимаб, этанерцепт, адалимумаб, цертолизумабпегол и голимумаб) и блокады рецептора IL-6 (IL-6R) (тоцилизумаб), является одним из наиболее эффективных подходов к замедляют или останавливают эрозивный процесс кости при РА () и могут предотвратить прогрессирование системной потери костной массы. 88 Этот эффект имеет двоякое объяснение. Во-первых, цитокиновая блокада обычно более эффективна, чем традиционные противоревматические препараты, в уменьшении синовита, включая субклинический синовит. Однако в настоящее время нет данных, свидетельствующих о том, что бремя синовита различается у пациентов с РА в стадии ремиссии, лечившихся либо обычными препаратами, либо блокаторами цитокинов. Во-вторых, блокада TNF и IL-6R оказывает прямое влияние на ограничение процесса остеокластогенеза. Эта концепция подтверждается наблюдениями из клинических испытаний 92 , а также патофизиологическими исследованиями, показывающими, что комплексы TNF и IL-6 – IL-6R непосредственно индуцируют дифференцировку клеток-предшественников остеокластов в остеокласты, резорбирующие костную ткань. 78,82
Место действия противоревматических препаратов на дифференцировку остеокластов и эрозию костей. Ингибиторы (зеленые прямоугольники) TNF, IL-1 и IL-6R блокируют экспрессию RANKL мезенхимальными клетками и Т-клетками; они также напрямую влияют на остеокластогенез. Абатацепт подавляет дифференцировку остеокластов, напрямую взаимодействуя с CD80 и CD86 на поверхности клеток-предшественников остеокластов. На активацию Т-клеток нацелены низкомолекулярные ингибиторы тирозинкиназы, такие как тофацитиниб, ингибитор JAK.В-клетки дифференцируются в плазматические клетки, которые являются источником RANKL. В-клетки истощаются антителом против CD20 (ритуксимаб) и ингибируются низкомолекулярными ингибиторами тирозинкиназы, такими как фостаматиниб, ингибитор SYK. Сокращения: IL-6R, рецептор IL-6; JAK, киназа Януса; RANKL, активатор рецептора лиганда ядерного фактора κB; SYK, тирозинкиназа селезенки.
Прямое влияние на остеокластогенез может не ограничиваться цитокин-блокирующими агентами, но может также применяться к ингибиторам межклеточных протеинкиназ. 93 Новыми соединениями, которые проходят клинические испытания на их модифицирующее заболевание действие, являются тофацитиниб, ингибитор янус-ассоциированной киназы (JAK), 94,95 и фостаматиниб, ингибитор тирозин-протеинкиназы, нацеленный на тирозинкиназу селезенки (SYK). . 96 Эти тирозинкиназы экспрессируются иммунными клетками, включая остеокласты, и функционируют, чтобы интегрировать передачу сигналов цитокинов и клеточные ответы во время воспаления. 96 Как следствие, их ингибирование может одновременно приводить к противовоспалительному, а также противоэрозивному действию у пациентов с РА.Прямое ингибирование остеокластов и эрозии костей особенно вероятно, когда киназы, такие как SYK 97 и тирозинкиназа Брутона (BTK), нацелены на низкомолекулярные препараты, поскольку эти киназы преимущественно экспрессируются антигенпрезентирующими клетками, такими как В-клетки и моноциты. 98 Как обсуждалось ранее, IL-1 может участвовать в запуске эрозий костей у пациентов с RA. 99 Было показано, что этот цитокин является основным триггером потери хряща и костной ткани на животных моделях воспалительного артрита. 79,80 Однако при РА роль блокады IL-1 в улучшении клинических признаков заболевания ограничена. Тем не менее, блокада IL-1 обеспечивает защиту от эрозии костей при РА. 99 Даже с учетом его умеренного противовоспалительного эффекта при РА, роль блокады ИЛ-1 в защите пациентов от эрозии костей при заболеваниях, которые запускаются ИЛ-1, таких как подагра, может быть значительной.
Цитокины-кандидаты, сочетающие провоспалительные и проостеокластогенные свойства, включают IL-17 и IL-15.IL-17 — провоспалительный цитокин, который индуцирует выработку простагландинов, оксида азота, цитокинов и хемокинов. IL-17 индуцирует продукцию IL-1 и TNF в макрофагах и фибробластах и является синергическим с IL-1 в повышении регуляции медиаторов воспаления, высвобождаемых синовиальными фибробластами. 100–102 Таким образом, подчеркивается роль IL-17 в патогенезе РА. 103 IL-17 продуцируется несколькими клеточными линиями, включая клетки T , H 17 и тучные клетки, и является мощным индуктором экспрессии RANKL на поверхности остеобластов и синовиальных фибробластов. 104,105 В то же время IL-17 блокирует функцию компенсаторных антиостеокластогенных факторов, таких как клетки T , REG и IL-4, и тем самым ингибирует локальную эрозию костей, а также системную потерю костной ткани на мышиной модели TNF. -опосредованный артрит. 106 IL-15 — еще один провоспалительный цитокин, который регулирует врожденные и адаптивные иммунные ответы, а также опосредует остеокластогенез и эрозию костей. 107 Однонуклеотидные полиморфизмы в гене, кодирующем IL-15, как было показано, коррелировали с разрушением суставов при РА в многокомпонентном исследовании, подтверждая прямую роль этого цитокина в эрозии суставной кости. 108
Не все провоспалительные цитокины вызывают потерю костной массы. Например, алармин IL-33 и цитокины, полученные из дендритных клеток, IL-23 и IL-12, а также интерфероны типа I и типа II являются мощными супрессорами остеокластогенеза. 6,109,110 Хотя эти факторы также экспрессируются в синовиальной ткани, их действие не может перевесить резорбтивные эффекты вышеупомянутых провоспалительных сигналов в синовиальной оболочке RA, которые приводят к чистой потере костной массы.
Новые достижения, способствующие восстановлению эрозии.
После того, как эрозии образовались, они восстанавливаются редко. 111,112 Действительно, спонтанное восстановление эрозий практически отсутствует, и даже при использовании мощных противовоспалительных терапевтических стратегий, таких как блокада TNF или IL-6R, отмечаются лишь ограниченные признаки восстановления эрозий костей. 113,114 Если присутствует, восстановление проявляется в виде нового костного сочленения (то есть склероза) в основании эрозии и, по-видимому, затрагивает околосуставной костный мозг. 113 Действительно, гистопатология синовиальной ткани пациентов с РА выявила обилие остеокластов в костных эрозиях, но недостаток или даже отсутствие зрелых остеобластов, 115 , что позволяет предположить, что определенные молекулы в синовиальной оболочке эффективно блокируют дифференцировку костеобразования. остеобласты. Гистоморфометрические исследования на мышиной модели RA продемонстрировали, что образование кости в местах эрозии заметно ограничено, причем скорость образования кости аналогична таковой у здоровых людей. 115,116 Таким образом, синовит при РА, по-видимому, способствует потере очаговой суставной кости, блокируя локальное образование кости, что приводит к фундаментальному дисбалансу гомеостаза кости (). Напротив, данные модели на животных показали, что после разрешения синовита остеобласты действительно заселяют поверхность эродированной кости и образуют новую кость для восстановления эрозий. 117 Смысл этого открытия заключается в том, что у пациентов, у которых восстановление не наблюдается, воспаление может не контролироваться полностью. Действительно, когда чувствительные рентгенографические методы используются для исследования суставов пациентов, находящихся в клинической ремиссии, часто наблюдается остаточное воспаление. 91 Важность восстановления эрозии для функционального статуса будет важна, так же как и понимание возможных пагубных последствий остаточного воспаления для сердечно-сосудистой системы и костей в осевом и аппендикулярном скелете.
Нарушение гомеостаза костей при синовите. Воспаление в синовиальной ткани индуцирует остеокластогенез за счет повышенной экспрессии RANKL и продукции провоспалительных цитокинов, которые управляют остеокластогенезом и взаимодействуют с RANKL.Кроме того, экспрессия Dkk-1 синовиальными фибробластами приводит к ингибированию дифференцировки остеобластов и, следовательно, к образованию кости. Сам Dkk-1 индуцирует экспрессию остеоцитами другой антианаболической молекулы, склеростина. Сокращения: Дкк-1; Белок 1, родственный Диккопфу; RANKL, активатор рецептора лиганда ядерного фактора κB.
Ограниченное восстановление костных эрозий при RA, по-видимому, связано с индукцией сигналов, которые блокируют образование новой кости. Было показано, что введение паратироидного гормона способствует восстановлению эрозий костей на модели артрита у мышей в сочетании с ингибиторами TNF. 118 Другие молекулы-кандидаты, которые могут ограничивать образование и восстановление костей, включают антагонисты пути передачи сигналов Wnt, одного из самых сильных анаболических путей костей. Производство Dickkopf-родственного белка 1 (Dkk-1), например, индуцируется TNF в синовиальных фибробластах и экспрессируется в синовиальной оболочке пациентов с RA. 116 Dkk-1 сильно мешает передаче сигналов Wnt и блокирует образование новой кости в модели RA у мышей. 116 Более того, экспрессия других антагонистов Wnt, таких как секретируемый родственный Frizzled белок-1 и склеростин, может быть индуцирована во время воспаления, а также может ингибировать восстановление эрозии кости путем подавления образования кости. 117,119,120 Однако, вызывает ли блокада Dkk-1 или других антагонистов Wnt, таких как склеростин, восстановление или даже заживление эрозии кости, в настоящее время неясно, и, несмотря на некоторые данные, полученные на моделях артрита на животных, необходимо провести соответствующие клинические исследования. чтобы ответить на этот вопрос.
Выводы
Таким образом, эрозия суставной кости является отличительным признаком РА и важна для диагностики, лечения и мониторинга заболевания. Знания о механизмах, вызывающих эрозию костей, значительно расширились благодаря усовершенствованию технологий визуализации, а также новым открытиям в патофизиологии.Данные, полученные за последние несколько лет, дополнительно пересмотрели концепции патогенеза, переместив нас от восприятия эрозий как необратимых поражений на конечной стадии к динамическому взгляду на эрозию как на активный процесс. Что наиболее важно, эрозия костей начинается на ранних стадиях РА и неразрывно связана с механизмами врожденного иммунитета, аутоиммунитетом и синовитом. Дальнейшее понимание молекулярных путей потери костной массы и образования костной ткани во время воспаления должно способствовать разработке новых терапевтических стратегий восстановления эрозий костей.
Ключевые моменты
- ▪ Эрозии суставных костей являются центральным клиническим признаком ревматоидного артрита
- ▪ Методы визуализации позволяют раннее обнаруживать эрозии костей и дают представление о патогенезе заболевания
- ▪ Эрозия костей является результатом усиленной дифференциации остеокластов и ингибирование опосредованного остеобластами восстановления костей
- ▪ Аутоантитела и цитокины, включая провоспалительные цитокины и активатор рецепторов лиганда ядерного фактора κB, являются основными провоцирующими факторами эрозии костей при ревматоидном артрите
- ▪ Антиревматическая терапия блокирует прогрессирование эрозии костей воспаление и восстановление костного баланса
Критерии обзора
Поиск оригинальных статей, опубликованных между 1970 и 2012 годами, проводился с использованием базы данных PubMed с поисковыми терминами «ревматоидный артрит», «кость» и «эрозия», как отдельно, так и в сочетании.Рассматривались только полнотекстовые статьи, опубликованные на английском языке. Справочные списки идентифицированных статей также использовались для определения дальнейших релевантных статей.
Благодарности
Работа Г. Шетта поддерживается Deutsche Forschungsgemeinschaft (SPP1468-IMMUNOBONE), Bundesministerium für Bildung und Forschung (BMBF; проект ANCYLOSS) и проектом MASTERSWITCH, финансируемым Европейским союзом. Работа Э. Граваллезе поддерживается Национальным институтом здравоохранения (R01 AR055952) и Фондом исследований и образования Американского колледжа ревматологии (Кампания «В пределах нашей досягаемости: поиск лекарства от ревматоидного артрита»).
Сноски
Конкурирующие интересы
G. Schett заявляет об отсутствии конкурирующих интересов. E. Gravallese заявляет о сотрудничестве со следующими компаниями: Abbott Laboratories, Lilly. Подробную информацию об отношениях смотрите в статье в Интернете.
Информация для авторов
Георг Шетт, Отделение внутренней медицины 3, Университет Эрлангена-Нюрнберга, Кранкенхаусштрассе 12,
Эрланген, Германия.
Эллен Граваллезе, медицинский факультет, Мемориальный медицинский центр Массачусетского университета и медицинская школа Массачусетского университета, 55 Lake Avenue North, Worcester, MA 01655, США.
Ссылки
1. Карсенти Г., Кроненберг Х.М., Сеттембре С. Генетический контроль образования кости. Анну. Rev. Cell. Dev. Биол. 2009. 25: 629–648. [PubMed] [Google Scholar] 2. Тейтельбаум С.Л., Росс Ф.П. Генетическая регуляция развития и функции остеокластов. Nat. Преподобный Жене. 2003. 4: 638–649. [PubMed] [Google Scholar] 3. Бойл В.Дж., Саймонет В.С., Лейси Д.Л. Дифференциация и активация остеокластов. Природа. 2003. 423: 337–342. [PubMed] [Google Scholar] 4. Бейкер WM. Формирование аномальных синовиальных кист в суставах.Отчеты больницы Святого Бартоломея. 1855; 21: 177–190. [Google Scholar] 5. Вайхзельбаум А. Die feineren Veränderungen des Gelenkknorpels bei Fungöser Synovitis und Karies der Gelenkenden [немецкий] Archiv. Патол. Анат. Physiol. Клин. Med. 1878; 73: 461–475. [Google Scholar] 6. Такаянаги Х. Остеоиммунология: общие механизмы и перекрестные помехи между иммунной и костной системами. Nat. Rev. Immunol. 2007. 7: 292–304. [PubMed] [Google Scholar] 7. Аррон Дж. Р., Чой Ю. Остеоиммунология: кость против иммунной системы. Природа.2000; 408: 535–536. [PubMed] [Google Scholar] 8. Schett G, Дэвид JP. Множество лиц аутоиммунной потери костной массы. Nat. Rev. Endocrinol. 2010. 6: 698–706. [PubMed] [Google Scholar] 9. Schett G, Saag KG, Bijlsma JW. От биологии костей до клинических результатов: современное состояние и перспективы на будущее. Анна. Реум. Дис. 2010; 69: 1415–1419. [PubMed] [Google Scholar] 10. Sharp JT, Lidsky MD, Collins LC, Moreland J. Методы оценки прогрессирования радиологических изменений при ревматоидном артрите. Взаимосвязь рентгенологических, клинических и лабораторных отклонений.Ревматоидный артрит. 1971; 14: 706–720. [PubMed] [Google Scholar] 11. Aletaha D, et al. Критерии классификации ревматоидного артрита 2010 года: совместная инициатива Американского колледжа ревматологии / Европейской лиги против ревматизма. Анна. Реум. Дис. 2010; 69: 1580–1588. [PubMed] [Google Scholar] 12. Ødegård S, et al. Связь раннего рентгенологического повреждения с нарушением физических функций при ревматоидном артрите: десятилетнее продольное обсервационное исследование с участием 238 пациентов. Ревматоидный артрит. 2006; 54: 68–75.[PubMed] [Google Scholar] 13. Скотт Д.Л. и др. Связь между повреждением суставов и инвалидностью при ревматоидном артрите. Ревматология (Оксфорд) 2000; 39: 122–132. [PubMed] [Google Scholar] 14. Welsing PM, van Gestel AM, Swinkels HL, Kiemeney LA, van Riel PL. Взаимосвязь между активностью заболевания, разрушением суставов и функциональной способностью в течение ревматоидного артрита. Ревматоидный артрит. 2001; 44: 2009–2017. [PubMed] [Google Scholar] 15. McInnes I, Schett G. Цитокины в патогенезе ревматоидного артрита.Nat. Иммунол. 2007. 7: 429–442. [PubMed] [Google Scholar] 16. Stach CM, et al. Структура околосуставной кости у пациентов с ревматоидным артритом и здоровых людей, оцененная с помощью компьютерной томографии высокого разрешения. Ревматоидный артрит. 2010. 62: 330–339. [PubMed] [Google Scholar] 17. Døhn UM, et al. Объемы эрозии костей при ревматоидном артрите на КТ и МРТ: надежность и корреляция с оценками эрозии на КТ, МРТ и рентгенографии. Анна. Реум. Дис. 2007; 66: 1388–1392. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18.Wakefield RJ и др. Значение сонографии в обнаружении эрозий костей у пациентов с ревматоидным артритом: сравнение с традиционной рентгенографией. Ревматоидный артрит. 2000. 43: 2762–2770. [PubMed] [Google Scholar] 19. McGonagle D, Tan AL, Møller Døhn U, Ostergaard M, Benjamin M. Микроанатомические исследования для определения прогностических факторов топографии образования околосуставных эрозий при воспалительном артрите. Ревматоидный артрит. 2009; 60: 1042–1051. [PubMed] [Google Scholar] 20. Мартель В., Хейс Дж. Т., Дафф ИФ.Картина эрозии костей кисти и запястья при ревматоидном артрите. Радиология. 1965; 84: 204–214. [PubMed] [Google Scholar] 21. Ejbjerg B, et al. Магнитно-резонансная томография суставов запястья и пальцев у здоровых людей иногда показывает изменения, напоминающие эрозии и синовит, наблюдаемые при ревматоидном артрите. Ревматоидный артрит. 2004. 50: 1097–1106. [PubMed] [Google Scholar] 22. Тан А.Л. и др. Роль анатомических факторов пястно-фалангового сустава в распространении синовита и эрозии костей при раннем ревматоидном артрите.Ревматоидный артрит. 2003. 48: 1214–1222. [PubMed] [Google Scholar] 23. Hayer S, et al. Теносиновит и образование остеокластов как начальные доклинические изменения на мышиной модели воспалительного артрита. Ревматоидный артрит. 2007; 56: 79–88. [PubMed] [Google Scholar] 24. Маринова-Мутафчиева Л., Уильямс Р.О., Фуна К., Майни Р.Н., Звайфлер Н.Дж. Воспалению предшествует зависящая от фактора некроза опухоли инфильтрация мезенхимальных клеток при экспериментальном артрите. Ревматоидный артрит. 2002; 46: 507–513. [PubMed] [Google Scholar] 25.Schett G, et al. Анализ кинетики остеокластогенеза у крыс с артритом. Ревматоидный артрит. 2005. 52: 3192–3201. [PubMed] [Google Scholar] 26. Tournis S и др. Влияние ревматоидного артрита на объемную минеральную плотность кости и геометрию кости, оцененное с помощью количественной периферической компьютерной томографии у женщин в постменопаузе, получавших бисфосфонаты. J. Rheumatol. 2012; 39: 1215–1220. [PubMed] [Google Scholar] 27. Aeberli D, et al. Снижение минеральной плотности трабекулярной кости и толщины кортикального слоя, сопровождающееся увеличением окружности наружной кости в пястной кости пациентов с ревматоидным артритом: поперечное исследование.Arthritis Res. Ther. 2010; 12: R119. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Sharp JT, et al. Деносумаб предотвращает потерю кортикальной кости ствола пястной кости у пациентов с эрозивным ревматоидным артритом. Arthritis Care Res. (Хобокен) 2010; 62: 537–544. [PubMed] [Google Scholar] 29. Хофф М. и др. Потеря кортикальной костной ткани кисти через 1 год при раннем ревматоидном артрите позволяет прогнозировать рентгенологическое повреждение суставов кисти через 5 и 10 лет наблюдения. Анна. Реум. Дис. 2009. 68: 324–329. [PubMed] [Google Scholar] 30. Haugeberg G, et al.Масса кортикальной кости кисти и ее связь с рентгенологическим повреждением суставов и переломами у пациенток в возрасте 50–70 лет с ревматоидным артритом: совместное поперечное исследование Осло-Труро-Амстердам (OSTRA). Анна. Реум. Дис. 2004. 63: 1331–1334. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Van der Heijde DM. Эрозии суставов и пациенты с ранним ревматоидным артритом. Br. J. Rheumatol. 1995; 34: 74–78. [PubMed] [Google Scholar] 32. Махольд К.П. и др. Ревматоидный артрит с очень недавним началом: клинические и серологические характеристики пациента, связанные с рентгенологическим прогрессированием в течение первых лет болезни.Ревматология (Оксфорд) 2007: 46: 342–349. [PubMed] [Google Scholar] 33. Güler-Yüksel M, et al. Изменения минеральной плотности костей рук и общая минеральная плотность у пациентов с недавно начавшимся ревматоидным артритом. Анна. Реум. Дис. 2009. 68: 330–336. [PubMed] [Google Scholar] 34. Соломон Д.Х. и др. Связь между очаговыми эрозиями и генерализованным остеопорозом у женщин в постменопаузе с ревматоидным артритом. Ревматоидный артрит. 2009. 60: 1624–1631. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Пай С.Р. и др. Активность заболевания и тяжесть раннего воспалительного артрита позволяют прогнозировать потерю кортикальной кости кисти.Ревматология (Оксфорд) 2010; 49: 1943–1948. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Møller Døhn U, et al. Отсутствие общего прогрессирования и периодического восстановления эрозий, несмотря на стойкое воспаление у пациентов с ревматоидным артритом, леченных адалимумабом: результаты продольного сравнительного исследования МРТ, УЗИ, КТ и рентгенографии. Анна. Реум. Дис. 2011; 70: 252–258. [PubMed] [Google Scholar] 37. Finzel S, et al. Подробное сравнительное исследование ультразвука высокого разрешения и микрокомпьютерной томографии для выявления артритных эрозий костей.Ревматоидный артрит. 2011; 63: 1231–1236. [PubMed] [Google Scholar] 38. Хаавардсхольм Э.А., Бойесен П., Остергаард М., Шильдволд А., Квиен Т.К. Результаты магнитно-резонансной томографии у 84 пациентов с ранним ревматоидным артритом: отек костного мозга позволяет прогнозировать эрозивную прогрессию. Анна. Реум. Дис. 2008. 67: 794–800. [PubMed] [Google Scholar] 39. McQueen FM и др. Отек кости, оцененный на магнитно-резонансной томографии доминирующего запястья при представлении, предсказывает рентгенологическое повреждение суставов рук и ног через шесть лет у пациентов с ревматоидным артритом.Ревматоидный артрит. 2003. 48: 1814–1827. [PubMed] [Google Scholar] 41. Finzel S, Englbrecht M, Engelke K, Stach C, Schett G. Сравнительное исследование околосуставных поражений костей при ревматоидном артрите и псориатическом артрите. Анна. Реум. Дис. 2011; 70: 122–127. [PubMed] [Google Scholar] 42. Бромли М, Вулли ДЕ. Хондрокласты и остеокласты на субхондральных участках эрозии ревматоидного сустава. Ревматоидный артрит. 1984; 27: 968–975. [PubMed] [Google Scholar] 43. Leisen JCDH, Риддл JM, Питчфорд WC. Эрозивный фронт: топографическое исследование соединения паннуса и субхондральной пластинки в мацерированной ревматоидной пястной головке.J. Rheumatol. 1988; 15: 17–22. [PubMed] [Google Scholar] 44. Gravallese EM, et al. Идентификация типов клеток, ответственных за резорбцию костей при ревматоидном артрите и ювенильном ревматоидном артрите. Являюсь. J. Pathol. 1998; 152: 943–951. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Kong YY и др. Активированные Т-клетки регулируют потерю костной массы и разрушение суставов при адъювантном артрите через лиганд остеопротегерина. Природа. 1999; 402: 304–309. [PubMed] [Google Scholar] 46. Romas E, et al. Остеопротегерин уменьшает количество остеокластов и предотвращает эрозию костей при артрите, вызванном коллагеном.Являюсь. J. Pathol. 2002; 161: 1419–1427. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Lubberts E, et al. Увеличение экспрессии активатора рецептора ядерного фактора κB в местах эрозии костей коррелирует с прогрессированием воспаления при развивающемся коллаген-индуцированном артрите. Ревматоидный артрит. 2002; 46: 3055–3064. [PubMed] [Google Scholar] 48. Pettit AR, et al. Мыши с нокаутом TRANCE / RANKL защищены от эрозии костей в модели артрита с переносом сыворотки. Являюсь. J. Pathol. 2001; 159: 1689–1699. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50.Редлих К. и др. Опосредованное фактором некроза опухоли разрушение суставов ингибируется за счет нацеливания на остеокласты остеопротегерина. Ревматоидный артрит. 2002; 46: 785–792. [PubMed] [Google Scholar] 51. Йошида Х. и др. Остеопетроз с мутацией мышей находится в кодирующей области гена фактора, стимулирующего колонии макрофагов. Природа. 1990; 345: 442–444. [PubMed] [Google Scholar] 52. Firestein GS, et al. Цитокины при хроническом воспалительном артрите. I. Неспособность обнаружить Т-клеточные лимфокины (интерлейкин 2 и интерлейкин 3) и присутствие фактора, стимулирующего колонии макрофагов (CSF-1) и нового фактора роста тучных клеток при ревматоидном синовите.J. Exp. Med. 1988; 168: 1573–1586. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Wong BR, et al. TRANCE представляет собой новый лиганд семейства рецепторов фактора некроза опухолей, который активирует N-концевую киназу c-Jun в Т-клетках. J. Biol. Chem. 1997; 272: 25190–25194. [PubMed] [Google Scholar] 54. Yasuda H, et al. Фактор дифференцировки остеокластов является лигандом для фактора ингибирования остеопротегерина / остеокластогенеза и идентичен TRANCE / RANKL. Proc. Natl Acad. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 1998. 95: 3597–3602. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55.Лейси Д.Л. и др. Лиганд остеопротегерина — это цитокин, регулирующий дифференцировку и активацию остеокластов. Клетка. 1998. 93: 165–176. [PubMed] [Google Scholar] 56. Kong Y-Y и др. OPGL является ключевым регулятором остеокластогенеза, развития лимфоцитов и органогенеза лимфатических узлов. Природа. 1999; 397: 315–323. [PubMed] [Google Scholar] 57. Gravallese EM, et al. Синовиальная ткань при ревматоидном артрите является источником фактора дифференцировки остеокластов. Ревматоидный артрит. 2000. 43: 250–258. [PubMed] [Google Scholar] 58.Shigeyama Y, et al. Экспрессия фактора дифференцировки остеокластов при ревматоидном артрите. Ревматоидный артрит. 2000; 43: 2523–2530. [PubMed] [Google Scholar] 59. Ли П. и др. Передача сигналов RANK не требуется для TNFα-опосредованного увеличения предшественников остеокластов CD11hi, но необходима для образования зрелых остеокластов при TNFα-опосредованном воспалительном артрите. J. Bone Miner. Res. 2004; 19: 207–213. [PubMed] [Google Scholar] 60. Ритчлин К.Т., Хаас-Смит С.А., Ли П., Хикс Д.Г., Шварц Э.М. Механизмы TNF- и RANKL-опосредованного остеокластогенеза и резорбции кости при псориатическом артрите.J. Clin. Инвестировать. 2003; 111: 821–831. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Германн С. и др. ОСКАР — ключевая молекула костимуляции остеокластов индуцируется у пациентов с ревматоидным артритом. Ревматоидный артрит. 2008. 58: 3041–3050. [PubMed] [Google Scholar] 62. Оно Х и др. Активный при пероральном приеме и селективный ингибитор тирозинкиназы c-Fms Ki20227 ингибирует прогрессирование заболевания на мышиной модели индуцированного коллагеном артрита. Евро. J. Immunol. 2008. 38: 283–291. [PubMed] [Google Scholar] 63. Коэн С.Б. и др.Влияние лечения деносумабом на структурные повреждения, минеральную плотность костной ткани и метаболизм костной ткани при ревматоидном артрите: двенадцатимесячное, многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое клиническое исследование фазы II. Ревматоидный артрит. 2008. 58: 1299–1309. [PubMed] [Google Scholar] 64. Visser H, le Cessie S, Vos K, Breedveld FC, Hazes JM. Как диагностировать ревматоидный артрит на ранней стадии: модель прогнозирования стойкого (эрозивного) артрита. Ревматоидный артрит. 2002. 46: 357–365. [PubMed] [Google Scholar] 65. Кастбом А., Страндберг Г., Линдроос А., Скох Т.Тест на антитела к ЦЦП позволяет прогнозировать течение заболевания в течение 3 лет при раннем ревматоидном артрите (шведский проект TIRA) Ann. Реум. Дис. 2004. 63: 1085–1089. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Мейер О. и др. Анализы антицитруллинированных белков / пептидных антител при раннем ревматоидном артрите для прогнозирования пятилетних радиографических повреждений. Анна. Реум. Дис. 2003. 62: 120–126. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Ши Дж. И др. Аутоантитела, распознающие карбамилированные белки, присутствуют в сыворотке крови пациентов с ревматоидным артритом и предсказывают повреждение суставов.Proc. Natl Acad. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2011; 108: 17372–17377. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Харре У и др. Индукция остеокластогенеза и потери костной массы человеческими аутоантителами против цитруллинированного виментина. J. Clin. Инвестировать. 2012; 122: 1791–1802. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Ву Y, Хамфри МБ, Накамура М.С. Остеокласты — врожденные иммунные клетки кости. Аутоиммунитет. 2008. 41: 183–194. [PubMed] [Google Scholar] 70. Джи Д. и др. Ингибирование экспрессии RANK и остеокластогенеза TLR и IFN-γ в предшественниках остеокластов человека.J. Immunol. 2009; 183: 7223–7233. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Сато К. и др. Th27 функционирует как субпопуляция остеокластогенных хелперных Т-клеток, которая связывает активацию Т-клеток и разрушение костей. J. Exp. Med. 2006; 203: 2673–2682. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Заисс М.М. и др. Регуляторные Т-клетки защищают от местного и системного разрушения костей при артрите. J. Immunol. 2010. 184: 7238–7246. [PubMed] [Google Scholar] 73. Заисс М.М. и др. Повышенная плотность костной ткани и устойчивость к потере костной массы, вызванной овариэктомией, у FoxP3-трансгенных мышей на основе нарушения дифференцировки остеокластов.Ревматоидный артрит. 2010; 62: 2328–2338. [PubMed] [Google Scholar] 74. Axmann R, et al. CTLA-4 напрямую подавляет образование остеокластов. Анна. Реум. Дис. 2008. 67: 1603–1609. [PubMed] [Google Scholar] 75. Заисс М.М. и др. Клетки TREG подавляют образование остеокластов: новое звено между иммунной системой и костью. Ревматоидный артрит. 2007. 56: 4104–4112. [PubMed] [Google Scholar] 76. Баккер М.Ф. и др. Утрехтская группа исследования ревматоидного артрита. Включение низких доз преднизона в основанную на метотрексате стратегию жесткого контроля раннего ревматоидного артрита: рандомизированное исследование.Анна. Междунар. Med. 2012; 156: 329–339. [PubMed] [Google Scholar] 77. Grigor C, et al. Эффект от стратегии лечения ревматоидного артрита (исследование TICORA): простое слепое рандомизированное контролируемое исследование. Ланцет. 2004; 364: 263–269. [PubMed] [Google Scholar] 78. Лам Дж. И др. TNF-α индуцирует остеокластогенез путем прямой стимуляции макрофагов, подверженных допустимым уровням лиганда RANK. J. Clin. Инвестировать. 2000; 106: 1481–1488. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Бойс Б.Ф. и др.Влияние интерлейкина-1 на метаболизм костей у нормальных мышей. Эндокринология. 1989; 125: 1142–1150. [PubMed] [Google Scholar] 81. Ishimi YMC, et al. ИЛ-6 продуцируется остеобластами и вызывает резорбцию кости. J. Immunol. 1990; 145: 3297–3303. [PubMed] [Google Scholar] 82. Axmann R, et al. Ингибирование рецептора интерлейкина-6 напрямую блокирует образование остеокластов in vitro и in vivo . Ревматоидный артрит. 2009. 60: 2747–2756. [PubMed] [Google Scholar] 83. Poli V и др. Мыши с дефицитом интерлейкина-6 защищены от потери костной массы, вызванной истощением эстрогена.EMBO J. 1994; 13: 1189–1196. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Янсен Л.М., ван дер Хорст-Брюинсма И.Е., ван Шаарденбург Д., Беземер П.Д., Дейкманс Б.А. Предикторы рентгенологического поражения суставов у пациентов с ранним ревматоидным артритом. Анна. Реум. Дис. 2001; 60: 924–927. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Kraan MC и др. Бессимптомный синовит предшествует клинически манифестному артриту. Ревматоидный артрит. 1998; 41: 1481–1488. [PubMed] [Google Scholar] 86. Ван де Санде М.Г. и др. Различные стадии ревматоидного артрита: особенности синовиальной оболочки в доклинической фазе.Анна. Реум. Дис. 2011; 70: 772–777. [PubMed] [Google Scholar] 87. Рич Э., Морленд Л. В., Аларкон Г. С.. Недостаточность рентгенологического прогрессирования ревматоидного артрита, получавшего метотрексат в качестве первого противоревматического препарата, изменяющего заболевание. J. Rheumatol. 1999; 26: 259–261. [PubMed] [Google Scholar] 88. Schett G, Stach C, Zwerina J, Voll R, Manger B. Как противоревматические препараты защищают суставы от повреждений при ревматоидном артрите. Ревматоидный артрит. 2008. 58: 2936–2948. [PubMed] [Google Scholar] 89. Коэн Дж. И др. Радиологические повреждения у пациентов с ревматоидным артритом в стойкой ремиссии.Анна. Реум. Дис. 2007. 66: 358–363. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Molenaar ET, et al. Прогрессирование радиологического повреждения у пациентов с ревматоидным артритом в стадии клинической ремиссии. Ревматоидный артрит. 2004; 50: 36–42. [PubMed] [Google Scholar] 91. Браун А.К. и др. Объяснение очевидной диссоциации между клинической ремиссией и продолжающимся структурным ухудшением ревматоидного артрита. Ревматоидный артрит. 2008. 58: 2958–2967. [PubMed] [Google Scholar] 92. Vis M, et al. Оценка минеральной плотности костной ткани, метаболизма костей, уровня остеопротегерина и активатора рецепторов лиганда NFκB в сыворотке крови во время лечения инфликсимабом у пациентов с ревматоидным артритом.Анна. Реум. Дис. 2006; 65: 1495–1499. [Бесплатная статья PMC] [PubMed] [Google Scholar] 94. ван Волленховен РФ и др. Тофацитиниб или адалимумаб в сравнении с плацебо при ревматоидном артрите. N. Engl. J. Med. 2012; 367: 508–519. [PubMed] [Google Scholar] 95. Fleischmann R, et al. Плацебо-контролируемое исследование монотерапии тофацитинибом при ревматоидном артрите. N. Engl. J. Med. 2012; 367: 495–507. [PubMed] [Google Scholar] 96. Weinblatt ME, et al. Оральный ингибитор тирозинкиназы селезенки (Syk) при ревматоидном артрите.N. Engl. J. Med. 2010; 363: 1303–1312. [PubMed] [Google Scholar] 97. Mócsai A, et al. Иммуномодулирующие адаптерные белки DAP12 и γ-цепь рецептора Fc (FcRγ) регулируют развитие функциональных остеокластов посредством тирозинкиназы Syk. Proc. Natl Acad. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2004. 101: 6158–6163. [Бесплатная статья PMC] [PubMed] [Google Scholar] 98. Макиннес И.Б., Шетт Г. Патогенез ревматоидного артрита. N. Engl. J. Med. 2011; 365: 2205–2219. [PubMed] [Google Scholar] 99. Jiang Y, et al. Многоцентровое, двойное слепое, рандомизированное, плацебо-контролируемое исследование рекомбинантного антагониста рецептора интерлейкина-1 человека у пациентов с ревматоидным артритом: радиологическое прогрессирование и корреляция оценок Генанта и Ларсена.Ревматоидный артрит. 2000; 43: 1001–1009. [PubMed] [Google Scholar] 100. Fossiez F, et al. Т-клеточный интерлейкин-17 побуждает стромальные клетки продуцировать провоспалительные и гемопоэтические цитокины. J. Exp. Med. 1996; 183: 2593–2603. [Бесплатная статья PMC] [PubMed] [Google Scholar] 101. Йованович Д.В. и др. IL-17 стимулирует выработку и экспрессию провоспалительных цитокинов, IL-β и TNF-α, макрофагами человека. J. Immunol. 1998. 160: 3513–3521. [PubMed] [Google Scholar] 102. Chabaud M, et al. Человеческий интерлейкин-17: провоспалительный цитокин Т-лимфоцитов, продуцируемый ревматоидной синовиальной оболочкой.Ревматоидный артрит. 1999; 42: 963–970. [PubMed] [Google Scholar] 103. Miossec P, Korn T, Kuchroo VK. Интерлейкин-17 и хелперные Т-клетки 17 типа. N. Engl. J. Med. 2009; 361: 888–889. [PubMed] [Google Scholar] 104. Kotake S, et al. IL-17 в синовиальной жидкости пациентов с ревматоидным артритом является мощным стимулятором остеокластогенеза. J. Clin. Инвестировать. 1999; 103: 1345–1352. [Бесплатная статья PMC] [PubMed] [Google Scholar] 105. Сато К. и др. Th27 функционирует как субпопуляция остеокластогенных хелперных Т-клеток, которая связывает активацию Т-клеток и разрушение костей.J. Exp. Med. 2006; 203: 2673–2682. [Бесплатная статья PMC] [PubMed] [Google Scholar] 106. Зверина К. и др. Терапия против IL-17A подавляет потерю костной массы при TNF-α-опосредованном артрите мышей путем модуляции баланса Т-клеток. Евро. J. Immunol. 2012; 42: 413–423. [PubMed] [Google Scholar] 107. Огата Ю. и др. Новая роль IL-15 в развитии остеокластов: неспособность заменить его активность на IL-2. J. Immunol. 1999. 162: 2754–2760. [PubMed] [Google Scholar] 108. Knevel R, et al. Генетические варианты в IL15 и связаны с прогрессированием разрушения суставов при ревматоидном артрите: многокомпонентное исследование.Анна. Реум. Дис. 2012; 71 (Приложение 1): A56 – A57. [PubMed] [Google Scholar] 109. Заисс М.М. и др. IL-33 сдвигает баланс от остеокластов к альтернативно активируемой дифференцировке макрофагов и защищает от опосредованной TNFα потери костной массы. J. Immunol. 2011; 186: 6097–6105. [PubMed] [Google Scholar] 110. Куинн Дж. М. и др. IL-23 подавляет остеокластогенез опосредованно через лимфоциты и необходим для поддержания костной массы у мышей. J. Immunol. 2008. 181: 5720–5729. [PubMed] [Google Scholar] 111. Лукас К., ван дер Хейде Д., Фатенежад С., Ландеве Р.Ремонт эрозий происходит почти исключительно на поврежденных суставах без отека. Анна. Реум. Дис. 2010; 69: 851–855. [PubMed] [Google Scholar] 112. Møller Døhn U, et al. У пациентов с ревматоидным артритом, получавших адалимумаб, развитие эрозии минимально, но заживление эрозии происходит редко. Контрольное исследование продолжительностью 1 год, инициированное исследователем, с использованием компьютерной томографии высокого разрешения в качестве основного критерия оценки результатов. Анна. Реум. Дис. 2009. 68: 1585–1590. [PubMed] [Google Scholar] 114. Finzel S, et al. Восстановление эрозий костей при ревматоидном артрите, леченном ингибиторами фактора некроза опухолей, основано на наложении костей в основании эрозии.Анна. Реум. Дис. 2011; 70: 1587–1593. [PubMed] [Google Scholar] 115. Уолш NC и др. Функция остеобластов нарушается в местах очаговой эрозии костей при воспалительном артрите. J. Bone Miner. Res. 2009; 24: 1572–1585. [PubMed] [Google Scholar] 116. Диарра Д., Столина М., Пользер К. и др. Dickkopf-1 — главный регулятор ремоделирования суставов. Nat. Med. 2007. 13: 156–163. [PubMed] [Google Scholar] 117. Matzelle MM, et al. Разрешение воспаления вызывает функцию остеобластов и регулирует путь передачи сигналов Wnt.Ревматоидный артрит. 2012; 64: 1540–1550. [Бесплатная статья PMC] [PubMed] [Google Scholar] 118. Редлих К. и др. Восстановление местных эрозий костей и устранение системной потери костной массы при терапии противоопухолевым фактором некроза в сочетании с остеопротегерином или паратироидным гормоном при артрите, опосредованном фактором некроза опухоли. Являюсь. J. Pathol. 2004. 164: 543–555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 119. Пул К.Е. и др. Склеростин — это продукт замедленной секреции остеоцитов, который препятствует образованию кости.FASEB J. 2005; 19: 1842–1844. [PubMed] [Google Scholar] 120. Семенов М., Тамай К., He X. SOST является лигандом для LRP5 / LRP6 и ингибитором передачи сигналов Wnt. J. Biol. Chem. 2005; 280: 26770–26775. [PubMed] [Google Scholar]Эрозия костей при ревматоидном артрите: механизмы, диагностика и лечение
Nat Rev Rheumatol. Авторская рукопись; доступно в PMC 2014 15 июля.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC4096779
NIHMSID: NIHMS601272
Георг Шетт
Кафедра внутренней медицины 3, Университет Эрлангена-Нюрнберга,
, Кранкенхауз, 12 Эрланген, Германия
Эллен Граваллезе
Медицинский факультет, Мемориальный медицинский центр Массачусетского университета и Медицинская школа Массачусетского университета, 55 Lake Avenue North, Вустер, Массачусетс, США 01655, США
Георг Шетт, Департамент внутренней медицины 3, Университет Эрланген-Нюрнберг, Кранкенхаусштрассе 12,
Эрланген, Германия;
Оба автора внесли одинаковый вклад во все аспекты этой статьи.
Окончательная отредактированная версия этой статьи издателя доступна на сайте Nat Rev Rheumatol. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Эрозия костей является центральным признаком ревматоидного артрита и связана с тяжестью заболевания и плохим функциональным исходом. Эрозия околосуставной кортикальной кости, типичная особенность, наблюдаемая на простых рентгенограммах у пациентов с ревматоидным артритом, возникает в результате чрезмерной местной резорбции кости и недостаточного костеобразования.Основными триггерами эрозии суставной кости являются синовит, включая выработку провоспалительных цитокинов и активатора рецептора лиганда ядерного фактора κB (RANKL), а также антител, направленных против цитруллинированных белков. Действительно, как цитокины, так и аутоантитела стимулируют дифференцировку резорбирующих костную ткань остеокластов, тем самым стимулируя местную резорбцию кости. Хотя современная противоревматическая терапия подавляет как эрозию, так и воспаление костей, восстановление существующих костных повреждений, хотя и возможно с физиологической точки зрения, происходит редко.Отсутствие восстановления происходит, по крайней мере частично, из-за активного подавления образования кости провоспалительными цитокинами. В этом обзоре суммируется значительный прогресс, достигнутый в понимании патофизиологии эрозий костей, и обсуждаются улучшения в диагностике, мониторинге и лечении таких поражений.
Введение
Скелет состоит из губчатой кости, тонкой костной сети, в которой находится костный мозг, и кортикальной кости, плотной костной оболочки, которая обеспечивает структурную поддержку в областях, несущих нагрузку.Оба типа костей нацелены на эрозию при ревматоидном артрите (РА). Более того, РА является независимым фактором риска генерализованной остеопении и остеопороза с поражением трабекулярной и кортикальной костей в осевом и аппендикулярном скелете. Эрозия суставной кости представляет собой локальную потерю костной массы (остеолиз), первоначально затрагивающую кортикальную кость, и разрушение естественного барьера между внескелетной тканью и межтрабекулярными пространствами полости костного мозга. Остеолиз является результатом дисбаланса, при котором резорбция костной ткани остеокластами предпочтительнее, чем костеобразование остеобластами.Понимание механизмов, определяющих образование эрозий костей, требует понимания биологии костного гомеостаза и молекулярной регуляции дифференцировки и функции остеокластов и остеобластов. 1–3
Хотя некоторые патологические процессы могут привести к эрозии костей, включая злокачественные новообразования, метаболические процессы, такие как гиперпаратиреоз, и хронические воспалительные заболевания, такие как гистиоцитоз и саркоидоз, наиболее частой причиной является РА. Первоначально описанные более 100 лет назад, 4,5 эрозий суставных костей в настоящее время стали центральным элементом диагностики, лечения и мониторинга РА.Более того, эти поражения являются ожидаемым следствием серопозитивного РА, если заболевание не лечить своевременно и эффективно. Эрозии отражают клинические последствия тесного взаимодействия между активацией иммунной системы и моделированием и ремоделированием скелета. Действительно, исследование взаимодействия иммунной системы и костей привело к появлению новой области, называемой остеоиммунологией. 6–9
Определение эрозии кости
Эрозия кости — это радиологический термин, который отражает тот факт, что для обнаружения используется визуализация. 10 Эрозии видны на простых рентгенограммах как разрывы кортикальной поверхности кости и часто сопровождаются потерей прилегающей губчатой кости. Напротив, костные кисты представляют собой области остеолиза внутри компартмента губчатой кости без каких-либо признаков деструкции кортикальной кости. Хотя эрозии также могут наблюдаться при формах артрита, отличных от РА, таких как подагра, псориатический артрит, спондилоартрит и даже остеоартрит, они включены в диагностические критерии РА. 11 Вследствие серьезности и типичной картины распределения по множеству периферических участков скелета, а также отсутствия сопутствующего образования новой кости, появление эрозий костей является уникальным при РА и существенно отличается от других типов артрита.
Эрозии костей представляют собой ключевой критерий исхода при РА и позволяют прогнозировать более тяжелое течение болезни с более высокой степенью инвалидности и повышенной смертностью. 12–14 Клинические испытания всех основных противоревматических средств, одобренных для модификации РА, были подтверждены на предмет их способности замедлять или даже останавливать структурное повреждение, которое представляет собой смесь эрозии кости и деградации хряща.Кроме того, рентгенография широко используется для оценки структурных повреждений в клинической практике и для мониторинга эффективности терапии в замедлении структурных повреждений. Таким образом, в настоящее время обнаружение и количественная оценка эрозии костей является основным инструментом для диагностики заболеваний, а также для мониторинга и измерения эффективности лекарственной терапии у пациентов с РА. В этом обзоре основное внимание уделяется эрозии костей при РА и не обсуждается повреждение хряща. Тем не менее, повреждение хряща является не менее важным признаком структурного повреждения при РА, которое происходит по принципиально различным механизмам по отношению к эрозиям костей. 15
Анатомические факторы и микроструктура
Эрозии костей не возникают в случайных местах, но проявляют склонность к определенным анатомическим участкам. Подробный анализ распределения эрозий костей был проведен с помощью КТ высокого разрешения, УЗИ высокого разрешения и МРТ. Выявлено, что лучевые аспекты суставов пальцев являются «горячими точками» для эрозий костей, тогда как локтевые аспекты поражаются реже, а ладонная и ладонная поверхности суставов практически избавлены от таких повреждений. 16–18 Этот отчетливый паттерн локализации костной эрозии при RA интригует и может быть связан с определенными анатомическими особенностями, как описано ниже. Более того, эрозии костей обычно возникают в месте прямого контакта синовиальной оболочки с костью (так называемые голые области), что позволяет предположить, что анатомические факторы делают эти области околосуставной кости подверженными эрозии. 19,20 Эта концепция также подтверждается исследованиями на здоровых людях с использованием КТ высокого разрешения, которые показали, что эрозии костей диаметром менее 2 мм могут быть обнаружены у здоровых людей с характером распределения, который точно отражает характер эрозивные поражения, наблюдаемые у пациентов с РА. 15,21 Анатомические факторы, которые предрасполагают участки скелета к эрозии, включают: присутствие минерализованного хряща, ткани, особенно склонной к разрушению резорбирующими костную ткань клетками; места прикрепления связок к поверхности кости, которые передают механические силы к кости и могут вызвать микроповреждения; 22 и воспаленные влагалища сухожилий (так называемый теносиновит), которые проходят через поверхность кости и способствуют распространению воспаления от сухожилия на синовиальную оболочку сустава. 23
Мелкие костные каналы, которые проникают в кортикальный слой кости, несут микрососуды и соединяют внешнюю синовиальную мембрану и внутреннее пространство костного мозга; эти каналы также подвержены эрозивным изменениям на ранних этапах развития РА. Микрососуды, расположенные внутри этих каналов, способствуют перемещению клеток-предшественников остеокластов в кость, которые при контакте с костью и получении соответствующих молекулярных сигналов дифференцируются в остеокласты. Расширение кортикальных костных каналов в результате опосредованной остеокластами резорбции кости является типичным ранним изменением в моделях артрита на животных. 24,25 Более того, кортикальные фенестрации были описаны на компьютерных томограммах высокого разрешения суставов пациентов с РА, что, вероятно, отражает такое расширение кортикальных костных каналов. 15 Эти изменения соответствуют известному снижению массы кортикальной кости при РА, которое было зарегистрировано в нескольких исследованиях у пациентов с РА и, по-видимому, тесно связано с активностью заболевания и развитием эрозий костей. 26–30
Развитие эрозий костей
Продольные рентгенографические исследования показали, что эрозии костей возникают на ранних стадиях патогенеза РА, поражая примерно половину нелеченных пациентов через 6 месяцев после начала заболевания. 31 Радиографические исследования пациентов с РА продолжительностью менее 3 месяцев показывают, что у некоторых пациентов эрозии костей можно обнаружить уже через несколько недель после начала заболевания. 32 Более того, несколько исследований с участием пациентов с РА показали, что существует взаимосвязь между эрозиями костей и развитием остеопении и остеопороза. 33–35
Обнаружение эрозий костей улучшилось благодаря значительным технологическим достижениям в визуализации опорно-двигательного аппарата.КТ, УЗИ высокого разрешения и МРТ могут надежно обнаружить даже небольшие эрозии костей у пациентов с РА. 36,37 Визуализация также подчеркнула и обосновала роль воспаления в запуске эрозий костей, показав, что не только синовит, но и воспаление прилегающего межтрабекулярного пространства (остит) коррелирует с развитием рентгенологических эрозий костей. 38,39 Остается неясным, приводит ли эрозия костей к оститу или остит является результатом эрозии костей. 40 Эрозии костей обычно рассматриваются как необратимые повреждения, хотя детальная продольная оценка этих повреждений с точки зрения восстановления все еще недостаточна. Самопроизвольное восстановление, однако, встречается редко, что контрастирует со значительной реакцией образования надкостницы, отмеченной в сочетании с эрозиями костей у пациентов с псориатическим артритом или остеоартритом. 41
Остеокласты опосредуют эрозию костей
Остеокласты, гигантские многоядерные клетки, происходящие из линии моноцитов, являются единственными клетками, способными резорбировать кости в организме. 2,3 Остеокласты предназначены для рассасывания кости за счет плотного прилегания к поверхности кости за счет взаимодействия как с интегринами, так и с белками внеклеточного матрикса, а также путем сборки соединений, которые герметизируют поверхность кости и остеокласт и тем самым отделяют кость от окружающей среды. внеклеточное пространство. Протоны накачиваются вдоль взъерошенной границы остеокластов, а затем создают кислую среду, позволяющую солюбилизировать кальций из кости. Матричные ферменты, синтезируемые остеокластом, включая катепсин К, матриксную металлопротеиназу 9 и тартрат-резистентную кислую фосфатазу типа 5 (TRAP), разрушают костный матрикс. 2
Остеокласты населяют поверхность раздела между воспалительной синовиальной тканью и околосуставной поверхностью кости. Первое косвенное описание клеток, резорбирующих костную ткань при РА, относится к 19 — веку, 5 и было пересмотрено Bromley и Woolley 42 и Leisen et al. 43 в 1980-е годы. Остеокласты при РА были окончательно идентифицированы и подробно охарактеризованы с использованием современных иммуногистохимических и молекулярных методов Gravallese et al. 44 в 1998. Многоядерные клетки на границе паннус-кость демонстрируют все фенотипические особенности истинных остеокластов, включая образование взъерошенной границы и экспрессию специфических маркеров, включая TRAP, катепсин К и рецептор кальцитонина. Клетки-предшественники остеокластов накапливаются внутри так называемого синовиального паннуса — плотной воспалительной синовиальной ткани, расположенной как на границе с костью, так и внутри самих костных эрозий. Подобные изменения также обнаружены во всех соответствующих моделях воспалительного артрита на животных, и исследования с участием этих моделей на животных продемонстрировали решающую роль остеокластов в патогенезе эрозии суставной кости при артрите, вызванном адъювантом, 45 коллаген, 46,47 сыворотка передача 48 и TNF. 49,50 Было показано, что при индукции артрита у мышей без остеокластов эти мыши полностью защищены от эрозий костей. 48,49 Остеокласты, таким образом, стали важным типом клеток в процессе эрозии.
Пути дифференцировки остеокластов
Развитие остеокластов происходит локально в синовиальной ткани в результате экспрессии двух основных остеокластогенных медиаторов, макрофагального колониестимулирующего фактора 1 (M-CSF) 51,52 и активатора ядерных рецепторов. лиганд фактора κB (RANKL; также известный как член суперсемейства TNF-лиганд 11). 53–58 Этот процесс включает миграцию клеток моноцитарного происхождения из костного мозга во вторичные лимфатические органы и, наконец, в суставы. Стадия дифференцировки, на которой моноциты попадают в сустав, неясна. В самом деле, моноциты могут быть уже преданы определенному клону моноцитов, например, макрофагам M1 или M2, дендритным клеткам или клеткам-предшественникам остеокластов, когда они входят в сустав. Некоторые данные предполагают, что TNF, ключевой провоспалительный цитокин, экспрессируемый в синовиальной ткани RA, стимулирует миграцию клеток-предшественников остеокластов из костного мозга на периферию. 59,60 Кроме того, TNF стимулирует экспрессию поверхностных рецепторов, таких как иммуноглобулиноподобный рецептор, связанный с остеокластами, до того, как клетки-предшественники попадают в сустав, и эти рецепторы облегчают дифференцировку. 61 Попав в микросреду сустава, эти клетки подвергаются воздействию M-CSF и RANKL и дифференцируются в остеокласты. После контакта с поверхностью кости достигается окончательная дифференцировка в остеокласты, резорбирующие кость.
Было показано, что блокада дифференцировки остеокластов путем ингибирования RANKL или M-CSF плюс RANKL останавливает эрозию костей практически во всех моделях воспалительного артрита на животных. 45–50,62 Одно клиническое испытание с участием пациентов с РА также показало, что блокада RANKL с использованием нейтрализующих антител (деносумаб) замедляет прогрессирование эрозии костей, но не замедляет воспаление. 63 Таким образом, прямое нацеливание на остеокласты при РА защищает кость от последствий воспаления даже при отсутствии подавления самого воспаления. Это наблюдение также в значительной степени исключает возможность того, что резорбция кости оказывает положительную обратную связь на синовиальное воспаление.
Триггеры эрозии костей
Доклинический аутоиммунитет
Аутоиммунитет является одним из самых сильных прогностических индикаторов структурных повреждений при РА. Неопровержимые доказательства связи между аутоиммунитетом и эрозией суставов были выявлены наличием в сыворотке крови пациентов с РА антител к цитруллинированному белку (ACPA) и антител к карбамилированному белку, которые могут возникать задолго до начала синовита и независимо предсказывать эрозия костей у этих пациентов. 64–67 Это наблюдение согласуется с несколькими когортами пациентов с РА и не зависит от показателей активности заболевания, таких как оценка активности заболевания 28 суставов или воспаление, измеряемых уровнями С-реактивного белка. 64–67 Исследование, проведенное в 2012 году, показало, что ACPA распознает цитруллинированный виментин, экспрессируемый на поверхности клеток-предшественников остеокластов. 68 Связывание ACPA с поверхностью клетки увеличивает клеточную дифференцировку до резорбирующих костную ткань остеокластов посредством аутокринной стимуляции выработки TNF.Остеокласты экспрессируют высокие уровни фермента пептидиларгининдезиминазы 2 типа (PADI2), который индуцируется потоком кальция и отвечает за цитруллинирование белка (). В клетках линии остеокластов активация PADI2 приводит к преимущественному цитруллинированию виментина, вызывая изменение его субклеточной локализации и делая его доступным для связывания ACPA. Индукция остеокластогенеза за счет связывания ACPA также подтверждается высокими уровнями маркеров резорбции кости в сыворотке пациентов с РА, 9 , отражающих опосредованную остеокластами резорбцию кости.Было бы интересно определить, является ли этот эффект специфичным для цитруллинированного виментина или антитела, специфичные к другим цитруллинированным белкам, имеют аналогичные эффекты. Эти данные проливают новый свет на взаимосвязь между воспалением и повреждением костей при РА и подтверждают концепцию, согласно которой структурные изменения костей происходят в начале заболевания или даже до начала заболевания у пациентов с РА (2).
Аутоантитела против цитруллинированных белков и остеокластогенеза. Плазматические клетки продуцируют ACPA со специфичностью к цитруллинированному виментину, который связывается с клетками-предшественниками остеокластов и стимулирует высвобождение TNF, что, в свою очередь, усиливает дифференцировку этих клеток в зрелые остеокласты.Во время процесса дифференцировки остеокластов выработка фермента PADI2 индуцируется кальцием. Активность PADI2 приводит к цитруллинированию виментина, который в большом количестве экспрессируется на поверхности клеток линии остеокластов. Сокращения: ACPA, антитела к цитруллинированному белку; PADI2, пептидил-аргининдеиминаза, тип 2.
Развитие эрозии костей в ходе РА. Во время доклинической фазы РА ACPA продуцируются плазматическими клетками на ранней стадии. ACPA может стимулировать дифференцировку остеокластов и приводить к начальной потере костной массы.Эти ранние изменения могут начаться в костном мозге, прилегающем к суставу. Синовит в начале клинического заболевания приводит к выработке цитокинов, которые стимулируют остеокластогенез, индуцируя экспрессию RANKL, и взаимодействуют с RANKL, усиливая эрозию кости. Установленный РА характеризуется наличием крупных эрозий костей, заполненных воспаленной тканью паннуса синовиального происхождения. Сокращения: ACPA, антитела к цитруллинированному белку; РА, ревматоидный артрит; RANKL, активатор рецептора лиганда ядерного фактора κB.
Врожденный иммунитет
Накопление доказательств указывает на роль врожденной иммунной системы в эрозии костей при РА. Остеокласты рассматриваются как ключевые клетки врожденного иммунитета в кости, поскольку они экспрессируют рецепторы врожденного иммунитета, аналогичные макрофагам и дендритным клеткам, которые регулируют их способность реагировать на воспаление в суставе и, таким образом, определяют их судьбу и функции. Эти рецепторы включают в себя рецепторы, несущие мотив активации тирозина иммунорецептора (ITAM), которые играют важную костимулирующую роль с RANKL и M-CSF в остеокластогенезе. 69 Роль Toll-подобных рецепторов (TLR) в патогенезе воспаления и эрозии костей при RA также была предложена, поскольку стимуляция TLR синовиоцитов индуцирует экспрессию RANKL, тем самым способствуя остеокластогенезу. Лиганды TLR могут также активировать пути, которые подавляют остеокластогенез, путем ингибирования экспрессии активатора рецептора NFκB (RANK; также известного как член суперсемейства рецепторов TNF 11A), тем самым ограничивая патологическую потерю костной массы, связанную с воспалением. 70 Таким образом, роль врожденной иммунной системы в эрозии костей при РА остается плодородной областью для дальнейших исследований.
Переход от аутоиммунитета к воспалению
Изменения иммунного баланса могут замедлить или даже предотвратить переход от ACPA-положительных здоровых людей к пациентам с воспалительным артритом. Регуляторные механизмы, включающие баланс субпопуляций Т-клеток, могут иметь решающее значение в блокировании клинических проявлений РА. Хотя Т-клетки и, в частности, Т-хелперы типа 17 (T H 17) всегда считались типами клеток, которые запускают остеокластогенез, Т-клетки 62,71 также могут способствовать поддержанию гомеостаза костей.Например, экспрессия цитотоксического Т-лимфоцит-ассоциированного антигена 4 (CTLA4) на Т-клетках, в частности регуляторных Т (T REG ) клетках, является мощным сигналом для блокирования дифференцировки остеокластов. 72–75 CTLA4 нарушает костимуляцию Т-клеток и тем самым действует как иммуномодулирующий сигнал. Связывание CTLA4 с рецепторами CD80 и CD86 на клеточной поверхности на предшественниках остеокластов останавливает дальнейшую дифференцировку этих клеток в остеокласты даже в присутствии стимулирующих факторов M-CSF и RANKL. 75 Эта концепция была переведена на терапевтическое применение у пациентов с введением CTLA4-Ig (абатацепт), который блокирует костимуляцию Т-клеток и, таким образом, блокирует воспаление и эрозию костей у пациентов с РА. Более того, тот факт, что иммунорегуляторная молекула защищает кость, расширяет спектр описанных в настоящее время иммунно-костных взаимодействий и демонстрирует двойную роль типов клеток и факторов как в иммунной системе, так и в скелете. Таким образом, активация иммунной системы способствует резорбции костей, тогда как иммунная модуляция оказывает защитное действие на скелет.
Синовит
Когда синовиальное воспаление развивается в результате аутоиммунитета при РА, дополнительные триггеры усиливают процесс эрозии кости. Отсюда следует, что жесткий контроль синовиального воспаления защитит от прогрессирования эрозии кости; это предсказание подтвердилось у пациентов с РА, получающих строго контролируемое противовоспалительное лечение БПВП и глюкокортикоидами. 76,77 Синовит — богатый источник провоспалительных цитокинов, которые управляют процессом дифференцировки остеокластов. 15 TNF, IL-1 и IL-6 усиливают остеокластогенез за счет разрешающего действия на экспрессию RANKL в мезенхимальных клетках, а также за счет прямого воздействия на клетки-предшественники остеокластов и, таким образом, создают подходящую микросреду для остеокластогенеза. Более того, экспрессия рецепторов дифференцировки остеокластов, таких как RANK, стимулируется цитокинами синовиального происхождения (2). 78–83 Следует отметить, что чем больше выраженность синовита, тем обширнее эрозивный процесс.Соответственно, и УЗИ, и МРТ показали, что степень синовита и остита связана с вероятностью последующего повреждения костей. 38,39 Кроме того, кажется, что уровни реагентов острой фазы, таких как C-реактивный белок, также положительно коррелируют с вероятностью развития эрозий костей при RA. 84 Поскольку синовит развивается незадолго до клинического начала заболевания у пациентов с РА, неудивительно, что риск эрозий костей увеличивается после клинического начала заболевания. 85,86
Таблица 1
Клинические эффекты цитокинов во время РА
| Цитокин | Провоспалительный эффект | Скелетный эффект | ||||
|---|---|---|---|---|---|---|
| TNF | Ключевой ингибитор костеобразования в RA | Про-остеокластогенные рецепторы через стимуляцию TNF-рецепторов через прямую стимуляцию TNF-рецепторов и стимуляцию остеокластогенных рецепторов TNF за счет прямой стимуляции остеокластогенных рецепторов TNF. также подавляет образование костей | ||||
| IL-6 | Главный провоспалительный цитокин в RA | Проостеокластогенный эффект за счет индукции RANKL и прямой стимуляции предшественников остеокластов посредством индукции передачи сигнала gp130 | M | потенциальные провоспалительные эффекты | Существенный фактор для дифференцировки остеокластов | |
| RANKL | Не влияет на воспаление | Существенный фактор для дифференцировки остеокластов | ||||
| IL-1 | Умеренные провоспалительные эффекты | |||||
| IL-17 | Возможные провоспалительные эффекты при RA | Проостеокластогенный эффект за счет индукции RANKL и блокирования антиостеокластогенных факторов, таких как IL-4, IFN-γ и IL-12 | 1 | IL-15 | Цитокин, участвующий в врожденных и адаптивных ve иммунные ответы с потенциальными провоспалительными эффектами в RA | Проостеокластогенный, индуцируя RANKL |
| IL-33 | Провоспалительные и противовоспалительные эффекты; нет определенной роли в воспалении при RA | Мощный ингибитор остеокластогенеза и резорбции кости | ||||
| Dkk-1 | Ингибитор Wnt, не влияющий на воспаление при RA | Ключевой ингибитор образования кости при RA |
Провоспалительные цитокины при эрозии костей
Ингибирование цитокинов, в том числе с помощью блокаторов TNF (инфликсимаб, этанерцепт, адалимумаб, цертолизумабпегол и голимумаб) и блокады рецептора IL-6 (IL-6R) (тоцилизумаб), является одним из наиболее эффективных подходов к замедляют или останавливают эрозивный процесс кости при РА () и могут предотвратить прогрессирование системной потери костной массы. 88 Этот эффект имеет двоякое объяснение. Во-первых, цитокиновая блокада обычно более эффективна, чем традиционные противоревматические препараты, в уменьшении синовита, включая субклинический синовит. Однако в настоящее время нет данных, свидетельствующих о том, что бремя синовита различается у пациентов с РА в стадии ремиссии, лечившихся либо обычными препаратами, либо блокаторами цитокинов. Во-вторых, блокада TNF и IL-6R оказывает прямое влияние на ограничение процесса остеокластогенеза. Эта концепция подтверждается наблюдениями из клинических испытаний 92 , а также патофизиологическими исследованиями, показывающими, что комплексы TNF и IL-6 – IL-6R непосредственно индуцируют дифференцировку клеток-предшественников остеокластов в остеокласты, резорбирующие костную ткань. 78,82
Место действия противоревматических препаратов на дифференцировку остеокластов и эрозию костей. Ингибиторы (зеленые прямоугольники) TNF, IL-1 и IL-6R блокируют экспрессию RANKL мезенхимальными клетками и Т-клетками; они также напрямую влияют на остеокластогенез. Абатацепт подавляет дифференцировку остеокластов, напрямую взаимодействуя с CD80 и CD86 на поверхности клеток-предшественников остеокластов. На активацию Т-клеток нацелены низкомолекулярные ингибиторы тирозинкиназы, такие как тофацитиниб, ингибитор JAK.В-клетки дифференцируются в плазматические клетки, которые являются источником RANKL. В-клетки истощаются антителом против CD20 (ритуксимаб) и ингибируются низкомолекулярными ингибиторами тирозинкиназы, такими как фостаматиниб, ингибитор SYK. Сокращения: IL-6R, рецептор IL-6; JAK, киназа Януса; RANKL, активатор рецептора лиганда ядерного фактора κB; SYK, тирозинкиназа селезенки.
Прямое влияние на остеокластогенез может не ограничиваться цитокин-блокирующими агентами, но может также применяться к ингибиторам межклеточных протеинкиназ. 93 Новыми соединениями, которые проходят клинические испытания на их модифицирующее заболевание действие, являются тофацитиниб, ингибитор янус-ассоциированной киназы (JAK), 94,95 и фостаматиниб, ингибитор тирозин-протеинкиназы, нацеленный на тирозинкиназу селезенки (SYK). . 96 Эти тирозинкиназы экспрессируются иммунными клетками, включая остеокласты, и функционируют, чтобы интегрировать передачу сигналов цитокинов и клеточные ответы во время воспаления. 96 Как следствие, их ингибирование может одновременно приводить к противовоспалительному, а также противоэрозивному действию у пациентов с РА.Прямое ингибирование остеокластов и эрозии костей особенно вероятно, когда киназы, такие как SYK 97 и тирозинкиназа Брутона (BTK), нацелены на низкомолекулярные препараты, поскольку эти киназы преимущественно экспрессируются антигенпрезентирующими клетками, такими как В-клетки и моноциты. 98 Как обсуждалось ранее, IL-1 может участвовать в запуске эрозий костей у пациентов с RA. 99 Было показано, что этот цитокин является основным триггером потери хряща и костной ткани на животных моделях воспалительного артрита. 79,80 Однако при РА роль блокады IL-1 в улучшении клинических признаков заболевания ограничена. Тем не менее, блокада IL-1 обеспечивает защиту от эрозии костей при РА. 99 Даже с учетом его умеренного противовоспалительного эффекта при РА, роль блокады ИЛ-1 в защите пациентов от эрозии костей при заболеваниях, которые запускаются ИЛ-1, таких как подагра, может быть значительной.
Цитокины-кандидаты, сочетающие провоспалительные и проостеокластогенные свойства, включают IL-17 и IL-15.IL-17 — провоспалительный цитокин, который индуцирует выработку простагландинов, оксида азота, цитокинов и хемокинов. IL-17 индуцирует продукцию IL-1 и TNF в макрофагах и фибробластах и является синергическим с IL-1 в повышении регуляции медиаторов воспаления, высвобождаемых синовиальными фибробластами. 100–102 Таким образом, подчеркивается роль IL-17 в патогенезе РА. 103 IL-17 продуцируется несколькими клеточными линиями, включая клетки T , H 17 и тучные клетки, и является мощным индуктором экспрессии RANKL на поверхности остеобластов и синовиальных фибробластов. 104,105 В то же время IL-17 блокирует функцию компенсаторных антиостеокластогенных факторов, таких как клетки T , REG и IL-4, и тем самым ингибирует локальную эрозию костей, а также системную потерю костной ткани на мышиной модели TNF. -опосредованный артрит. 106 IL-15 — еще один провоспалительный цитокин, который регулирует врожденные и адаптивные иммунные ответы, а также опосредует остеокластогенез и эрозию костей. 107 Однонуклеотидные полиморфизмы в гене, кодирующем IL-15, как было показано, коррелировали с разрушением суставов при РА в многокомпонентном исследовании, подтверждая прямую роль этого цитокина в эрозии суставной кости. 108
Не все провоспалительные цитокины вызывают потерю костной массы. Например, алармин IL-33 и цитокины, полученные из дендритных клеток, IL-23 и IL-12, а также интерфероны типа I и типа II являются мощными супрессорами остеокластогенеза. 6,109,110 Хотя эти факторы также экспрессируются в синовиальной ткани, их действие не может перевесить резорбтивные эффекты вышеупомянутых провоспалительных сигналов в синовиальной оболочке RA, которые приводят к чистой потере костной массы.
Новые достижения, способствующие восстановлению эрозии.
После того, как эрозии образовались, они восстанавливаются редко. 111,112 Действительно, спонтанное восстановление эрозий практически отсутствует, и даже при использовании мощных противовоспалительных терапевтических стратегий, таких как блокада TNF или IL-6R, отмечаются лишь ограниченные признаки восстановления эрозий костей. 113,114 Если присутствует, восстановление проявляется в виде нового костного сочленения (то есть склероза) в основании эрозии и, по-видимому, затрагивает околосуставной костный мозг. 113 Действительно, гистопатология синовиальной ткани пациентов с РА выявила обилие остеокластов в костных эрозиях, но недостаток или даже отсутствие зрелых остеобластов, 115 , что позволяет предположить, что определенные молекулы в синовиальной оболочке эффективно блокируют дифференцировку костеобразования. остеобласты. Гистоморфометрические исследования на мышиной модели RA продемонстрировали, что образование кости в местах эрозии заметно ограничено, причем скорость образования кости аналогична таковой у здоровых людей. 115,116 Таким образом, синовит при РА, по-видимому, способствует потере очаговой суставной кости, блокируя локальное образование кости, что приводит к фундаментальному дисбалансу гомеостаза кости (). Напротив, данные модели на животных показали, что после разрешения синовита остеобласты действительно заселяют поверхность эродированной кости и образуют новую кость для восстановления эрозий. 117 Смысл этого открытия заключается в том, что у пациентов, у которых восстановление не наблюдается, воспаление может не контролироваться полностью. Действительно, когда чувствительные рентгенографические методы используются для исследования суставов пациентов, находящихся в клинической ремиссии, часто наблюдается остаточное воспаление. 91 Важность восстановления эрозии для функционального статуса будет важна, так же как и понимание возможных пагубных последствий остаточного воспаления для сердечно-сосудистой системы и костей в осевом и аппендикулярном скелете.
Нарушение гомеостаза костей при синовите. Воспаление в синовиальной ткани индуцирует остеокластогенез за счет повышенной экспрессии RANKL и продукции провоспалительных цитокинов, которые управляют остеокластогенезом и взаимодействуют с RANKL.Кроме того, экспрессия Dkk-1 синовиальными фибробластами приводит к ингибированию дифференцировки остеобластов и, следовательно, к образованию кости. Сам Dkk-1 индуцирует экспрессию остеоцитами другой антианаболической молекулы, склеростина. Сокращения: Дкк-1; Белок 1, родственный Диккопфу; RANKL, активатор рецептора лиганда ядерного фактора κB.
Ограниченное восстановление костных эрозий при RA, по-видимому, связано с индукцией сигналов, которые блокируют образование новой кости. Было показано, что введение паратироидного гормона способствует восстановлению эрозий костей на модели артрита у мышей в сочетании с ингибиторами TNF. 118 Другие молекулы-кандидаты, которые могут ограничивать образование и восстановление костей, включают антагонисты пути передачи сигналов Wnt, одного из самых сильных анаболических путей костей. Производство Dickkopf-родственного белка 1 (Dkk-1), например, индуцируется TNF в синовиальных фибробластах и экспрессируется в синовиальной оболочке пациентов с RA. 116 Dkk-1 сильно мешает передаче сигналов Wnt и блокирует образование новой кости в модели RA у мышей. 116 Более того, экспрессия других антагонистов Wnt, таких как секретируемый родственный Frizzled белок-1 и склеростин, может быть индуцирована во время воспаления, а также может ингибировать восстановление эрозии кости путем подавления образования кости. 117,119,120 Однако, вызывает ли блокада Dkk-1 или других антагонистов Wnt, таких как склеростин, восстановление или даже заживление эрозии кости, в настоящее время неясно, и, несмотря на некоторые данные, полученные на моделях артрита на животных, необходимо провести соответствующие клинические исследования. чтобы ответить на этот вопрос.
Выводы
Таким образом, эрозия суставной кости является отличительным признаком РА и важна для диагностики, лечения и мониторинга заболевания. Знания о механизмах, вызывающих эрозию костей, значительно расширились благодаря усовершенствованию технологий визуализации, а также новым открытиям в патофизиологии.Данные, полученные за последние несколько лет, дополнительно пересмотрели концепции патогенеза, переместив нас от восприятия эрозий как необратимых поражений на конечной стадии к динамическому взгляду на эрозию как на активный процесс. Что наиболее важно, эрозия костей начинается на ранних стадиях РА и неразрывно связана с механизмами врожденного иммунитета, аутоиммунитетом и синовитом. Дальнейшее понимание молекулярных путей потери костной массы и образования костной ткани во время воспаления должно способствовать разработке новых терапевтических стратегий восстановления эрозий костей.
Ключевые моменты
- ▪ Эрозии суставных костей являются центральным клиническим признаком ревматоидного артрита
- ▪ Методы визуализации позволяют раннее обнаруживать эрозии костей и дают представление о патогенезе заболевания
- ▪ Эрозия костей является результатом усиленной дифференциации остеокластов и ингибирование опосредованного остеобластами восстановления костей
- ▪ Аутоантитела и цитокины, включая провоспалительные цитокины и активатор рецепторов лиганда ядерного фактора κB, являются основными провоцирующими факторами эрозии костей при ревматоидном артрите
- ▪ Антиревматическая терапия блокирует прогрессирование эрозии костей воспаление и восстановление костного баланса
Критерии обзора
Поиск оригинальных статей, опубликованных между 1970 и 2012 годами, проводился с использованием базы данных PubMed с поисковыми терминами «ревматоидный артрит», «кость» и «эрозия», как отдельно, так и в сочетании.Рассматривались только полнотекстовые статьи, опубликованные на английском языке. Справочные списки идентифицированных статей также использовались для определения дальнейших релевантных статей.
Благодарности
Работа Г. Шетта поддерживается Deutsche Forschungsgemeinschaft (SPP1468-IMMUNOBONE), Bundesministerium für Bildung und Forschung (BMBF; проект ANCYLOSS) и проектом MASTERSWITCH, финансируемым Европейским союзом. Работа Э. Граваллезе поддерживается Национальным институтом здравоохранения (R01 AR055952) и Фондом исследований и образования Американского колледжа ревматологии (Кампания «В пределах нашей досягаемости: поиск лекарства от ревматоидного артрита»).
Сноски
Конкурирующие интересы
G. Schett заявляет об отсутствии конкурирующих интересов. E. Gravallese заявляет о сотрудничестве со следующими компаниями: Abbott Laboratories, Lilly. Подробную информацию об отношениях смотрите в статье в Интернете.
Информация для авторов
Георг Шетт, Отделение внутренней медицины 3, Университет Эрлангена-Нюрнберга, Кранкенхаусштрассе 12,
Эрланген, Германия.
Эллен Граваллезе, медицинский факультет, Мемориальный медицинский центр Массачусетского университета и медицинская школа Массачусетского университета, 55 Lake Avenue North, Worcester, MA 01655, США.
Ссылки
1. Карсенти Г., Кроненберг Х.М., Сеттембре С. Генетический контроль образования кости. Анну. Rev. Cell. Dev. Биол. 2009. 25: 629–648. [PubMed] [Google Scholar] 2. Тейтельбаум С.Л., Росс Ф.П. Генетическая регуляция развития и функции остеокластов. Nat. Преподобный Жене. 2003. 4: 638–649. [PubMed] [Google Scholar] 3. Бойл В.Дж., Саймонет В.С., Лейси Д.Л. Дифференциация и активация остеокластов. Природа. 2003. 423: 337–342. [PubMed] [Google Scholar] 4. Бейкер WM. Формирование аномальных синовиальных кист в суставах.Отчеты больницы Святого Бартоломея. 1855; 21: 177–190. [Google Scholar] 5. Вайхзельбаум А. Die feineren Veränderungen des Gelenkknorpels bei Fungöser Synovitis und Karies der Gelenkenden [немецкий] Archiv. Патол. Анат. Physiol. Клин. Med. 1878; 73: 461–475. [Google Scholar] 6. Такаянаги Х. Остеоиммунология: общие механизмы и перекрестные помехи между иммунной и костной системами. Nat. Rev. Immunol. 2007. 7: 292–304. [PubMed] [Google Scholar] 7. Аррон Дж. Р., Чой Ю. Остеоиммунология: кость против иммунной системы. Природа.2000; 408: 535–536. [PubMed] [Google Scholar] 8. Schett G, Дэвид JP. Множество лиц аутоиммунной потери костной массы. Nat. Rev. Endocrinol. 2010. 6: 698–706. [PubMed] [Google Scholar] 9. Schett G, Saag KG, Bijlsma JW. От биологии костей до клинических результатов: современное состояние и перспективы на будущее. Анна. Реум. Дис. 2010; 69: 1415–1419. [PubMed] [Google Scholar] 10. Sharp JT, Lidsky MD, Collins LC, Moreland J. Методы оценки прогрессирования радиологических изменений при ревматоидном артрите. Взаимосвязь рентгенологических, клинических и лабораторных отклонений.Ревматоидный артрит. 1971; 14: 706–720. [PubMed] [Google Scholar] 11. Aletaha D, et al. Критерии классификации ревматоидного артрита 2010 года: совместная инициатива Американского колледжа ревматологии / Европейской лиги против ревматизма. Анна. Реум. Дис. 2010; 69: 1580–1588. [PubMed] [Google Scholar] 12. Ødegård S, et al. Связь раннего рентгенологического повреждения с нарушением физических функций при ревматоидном артрите: десятилетнее продольное обсервационное исследование с участием 238 пациентов. Ревматоидный артрит. 2006; 54: 68–75.[PubMed] [Google Scholar] 13. Скотт Д.Л. и др. Связь между повреждением суставов и инвалидностью при ревматоидном артрите. Ревматология (Оксфорд) 2000; 39: 122–132. [PubMed] [Google Scholar] 14. Welsing PM, van Gestel AM, Swinkels HL, Kiemeney LA, van Riel PL. Взаимосвязь между активностью заболевания, разрушением суставов и функциональной способностью в течение ревматоидного артрита. Ревматоидный артрит. 2001; 44: 2009–2017. [PubMed] [Google Scholar] 15. McInnes I, Schett G. Цитокины в патогенезе ревматоидного артрита.Nat. Иммунол. 2007. 7: 429–442. [PubMed] [Google Scholar] 16. Stach CM, et al. Структура околосуставной кости у пациентов с ревматоидным артритом и здоровых людей, оцененная с помощью компьютерной томографии высокого разрешения. Ревматоидный артрит. 2010. 62: 330–339. [PubMed] [Google Scholar] 17. Døhn UM, et al. Объемы эрозии костей при ревматоидном артрите на КТ и МРТ: надежность и корреляция с оценками эрозии на КТ, МРТ и рентгенографии. Анна. Реум. Дис. 2007; 66: 1388–1392. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18.Wakefield RJ и др. Значение сонографии в обнаружении эрозий костей у пациентов с ревматоидным артритом: сравнение с традиционной рентгенографией. Ревматоидный артрит. 2000. 43: 2762–2770. [PubMed] [Google Scholar] 19. McGonagle D, Tan AL, Møller Døhn U, Ostergaard M, Benjamin M. Микроанатомические исследования для определения прогностических факторов топографии образования околосуставных эрозий при воспалительном артрите. Ревматоидный артрит. 2009; 60: 1042–1051. [PubMed] [Google Scholar] 20. Мартель В., Хейс Дж. Т., Дафф ИФ.Картина эрозии костей кисти и запястья при ревматоидном артрите. Радиология. 1965; 84: 204–214. [PubMed] [Google Scholar] 21. Ejbjerg B, et al. Магнитно-резонансная томография суставов запястья и пальцев у здоровых людей иногда показывает изменения, напоминающие эрозии и синовит, наблюдаемые при ревматоидном артрите. Ревматоидный артрит. 2004. 50: 1097–1106. [PubMed] [Google Scholar] 22. Тан А.Л. и др. Роль анатомических факторов пястно-фалангового сустава в распространении синовита и эрозии костей при раннем ревматоидном артрите.Ревматоидный артрит. 2003. 48: 1214–1222. [PubMed] [Google Scholar] 23. Hayer S, et al. Теносиновит и образование остеокластов как начальные доклинические изменения на мышиной модели воспалительного артрита. Ревматоидный артрит. 2007; 56: 79–88. [PubMed] [Google Scholar] 24. Маринова-Мутафчиева Л., Уильямс Р.О., Фуна К., Майни Р.Н., Звайфлер Н.Дж. Воспалению предшествует зависящая от фактора некроза опухоли инфильтрация мезенхимальных клеток при экспериментальном артрите. Ревматоидный артрит. 2002; 46: 507–513. [PubMed] [Google Scholar] 25.Schett G, et al. Анализ кинетики остеокластогенеза у крыс с артритом. Ревматоидный артрит. 2005. 52: 3192–3201. [PubMed] [Google Scholar] 26. Tournis S и др. Влияние ревматоидного артрита на объемную минеральную плотность кости и геометрию кости, оцененное с помощью количественной периферической компьютерной томографии у женщин в постменопаузе, получавших бисфосфонаты. J. Rheumatol. 2012; 39: 1215–1220. [PubMed] [Google Scholar] 27. Aeberli D, et al. Снижение минеральной плотности трабекулярной кости и толщины кортикального слоя, сопровождающееся увеличением окружности наружной кости в пястной кости пациентов с ревматоидным артритом: поперечное исследование.Arthritis Res. Ther. 2010; 12: R119. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Sharp JT, et al. Деносумаб предотвращает потерю кортикальной кости ствола пястной кости у пациентов с эрозивным ревматоидным артритом. Arthritis Care Res. (Хобокен) 2010; 62: 537–544. [PubMed] [Google Scholar] 29. Хофф М. и др. Потеря кортикальной костной ткани кисти через 1 год при раннем ревматоидном артрите позволяет прогнозировать рентгенологическое повреждение суставов кисти через 5 и 10 лет наблюдения. Анна. Реум. Дис. 2009. 68: 324–329. [PubMed] [Google Scholar] 30. Haugeberg G, et al.Масса кортикальной кости кисти и ее связь с рентгенологическим повреждением суставов и переломами у пациенток в возрасте 50–70 лет с ревматоидным артритом: совместное поперечное исследование Осло-Труро-Амстердам (OSTRA). Анна. Реум. Дис. 2004. 63: 1331–1334. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Van der Heijde DM. Эрозии суставов и пациенты с ранним ревматоидным артритом. Br. J. Rheumatol. 1995; 34: 74–78. [PubMed] [Google Scholar] 32. Махольд К.П. и др. Ревматоидный артрит с очень недавним началом: клинические и серологические характеристики пациента, связанные с рентгенологическим прогрессированием в течение первых лет болезни.Ревматология (Оксфорд) 2007: 46: 342–349. [PubMed] [Google Scholar] 33. Güler-Yüksel M, et al. Изменения минеральной плотности костей рук и общая минеральная плотность у пациентов с недавно начавшимся ревматоидным артритом. Анна. Реум. Дис. 2009. 68: 330–336. [PubMed] [Google Scholar] 34. Соломон Д.Х. и др. Связь между очаговыми эрозиями и генерализованным остеопорозом у женщин в постменопаузе с ревматоидным артритом. Ревматоидный артрит. 2009. 60: 1624–1631. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Пай С.Р. и др. Активность заболевания и тяжесть раннего воспалительного артрита позволяют прогнозировать потерю кортикальной кости кисти.Ревматология (Оксфорд) 2010; 49: 1943–1948. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Møller Døhn U, et al. Отсутствие общего прогрессирования и периодического восстановления эрозий, несмотря на стойкое воспаление у пациентов с ревматоидным артритом, леченных адалимумабом: результаты продольного сравнительного исследования МРТ, УЗИ, КТ и рентгенографии. Анна. Реум. Дис. 2011; 70: 252–258. [PubMed] [Google Scholar] 37. Finzel S, et al. Подробное сравнительное исследование ультразвука высокого разрешения и микрокомпьютерной томографии для выявления артритных эрозий костей.Ревматоидный артрит. 2011; 63: 1231–1236. [PubMed] [Google Scholar] 38. Хаавардсхольм Э.А., Бойесен П., Остергаард М., Шильдволд А., Квиен Т.К. Результаты магнитно-резонансной томографии у 84 пациентов с ранним ревматоидным артритом: отек костного мозга позволяет прогнозировать эрозивную прогрессию. Анна. Реум. Дис. 2008. 67: 794–800. [PubMed] [Google Scholar] 39. McQueen FM и др. Отек кости, оцененный на магнитно-резонансной томографии доминирующего запястья при представлении, предсказывает рентгенологическое повреждение суставов рук и ног через шесть лет у пациентов с ревматоидным артритом.Ревматоидный артрит. 2003. 48: 1814–1827. [PubMed] [Google Scholar] 41. Finzel S, Englbrecht M, Engelke K, Stach C, Schett G. Сравнительное исследование околосуставных поражений костей при ревматоидном артрите и псориатическом артрите. Анна. Реум. Дис. 2011; 70: 122–127. [PubMed] [Google Scholar] 42. Бромли М, Вулли ДЕ. Хондрокласты и остеокласты на субхондральных участках эрозии ревматоидного сустава. Ревматоидный артрит. 1984; 27: 968–975. [PubMed] [Google Scholar] 43. Leisen JCDH, Риддл JM, Питчфорд WC. Эрозивный фронт: топографическое исследование соединения паннуса и субхондральной пластинки в мацерированной ревматоидной пястной головке.J. Rheumatol. 1988; 15: 17–22. [PubMed] [Google Scholar] 44. Gravallese EM, et al. Идентификация типов клеток, ответственных за резорбцию костей при ревматоидном артрите и ювенильном ревматоидном артрите. Являюсь. J. Pathol. 1998; 152: 943–951. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Kong YY и др. Активированные Т-клетки регулируют потерю костной массы и разрушение суставов при адъювантном артрите через лиганд остеопротегерина. Природа. 1999; 402: 304–309. [PubMed] [Google Scholar] 46. Romas E, et al. Остеопротегерин уменьшает количество остеокластов и предотвращает эрозию костей при артрите, вызванном коллагеном.Являюсь. J. Pathol. 2002; 161: 1419–1427. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Lubberts E, et al. Увеличение экспрессии активатора рецептора ядерного фактора κB в местах эрозии костей коррелирует с прогрессированием воспаления при развивающемся коллаген-индуцированном артрите. Ревматоидный артрит. 2002; 46: 3055–3064. [PubMed] [Google Scholar] 48. Pettit AR, et al. Мыши с нокаутом TRANCE / RANKL защищены от эрозии костей в модели артрита с переносом сыворотки. Являюсь. J. Pathol. 2001; 159: 1689–1699. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50.Редлих К. и др. Опосредованное фактором некроза опухоли разрушение суставов ингибируется за счет нацеливания на остеокласты остеопротегерина. Ревматоидный артрит. 2002; 46: 785–792. [PubMed] [Google Scholar] 51. Йошида Х. и др. Остеопетроз с мутацией мышей находится в кодирующей области гена фактора, стимулирующего колонии макрофагов. Природа. 1990; 345: 442–444. [PubMed] [Google Scholar] 52. Firestein GS, et al. Цитокины при хроническом воспалительном артрите. I. Неспособность обнаружить Т-клеточные лимфокины (интерлейкин 2 и интерлейкин 3) и присутствие фактора, стимулирующего колонии макрофагов (CSF-1) и нового фактора роста тучных клеток при ревматоидном синовите.J. Exp. Med. 1988; 168: 1573–1586. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Wong BR, et al. TRANCE представляет собой новый лиганд семейства рецепторов фактора некроза опухолей, который активирует N-концевую киназу c-Jun в Т-клетках. J. Biol. Chem. 1997; 272: 25190–25194. [PubMed] [Google Scholar] 54. Yasuda H, et al. Фактор дифференцировки остеокластов является лигандом для фактора ингибирования остеопротегерина / остеокластогенеза и идентичен TRANCE / RANKL. Proc. Natl Acad. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 1998. 95: 3597–3602. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55.Лейси Д.Л. и др. Лиганд остеопротегерина — это цитокин, регулирующий дифференцировку и активацию остеокластов. Клетка. 1998. 93: 165–176. [PubMed] [Google Scholar] 56. Kong Y-Y и др. OPGL является ключевым регулятором остеокластогенеза, развития лимфоцитов и органогенеза лимфатических узлов. Природа. 1999; 397: 315–323. [PubMed] [Google Scholar] 57. Gravallese EM, et al. Синовиальная ткань при ревматоидном артрите является источником фактора дифференцировки остеокластов. Ревматоидный артрит. 2000. 43: 250–258. [PubMed] [Google Scholar] 58.Shigeyama Y, et al. Экспрессия фактора дифференцировки остеокластов при ревматоидном артрите. Ревматоидный артрит. 2000; 43: 2523–2530. [PubMed] [Google Scholar] 59. Ли П. и др. Передача сигналов RANK не требуется для TNFα-опосредованного увеличения предшественников остеокластов CD11hi, но необходима для образования зрелых остеокластов при TNFα-опосредованном воспалительном артрите. J. Bone Miner. Res. 2004; 19: 207–213. [PubMed] [Google Scholar] 60. Ритчлин К.Т., Хаас-Смит С.А., Ли П., Хикс Д.Г., Шварц Э.М. Механизмы TNF- и RANKL-опосредованного остеокластогенеза и резорбции кости при псориатическом артрите.J. Clin. Инвестировать. 2003; 111: 821–831. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Германн С. и др. ОСКАР — ключевая молекула костимуляции остеокластов индуцируется у пациентов с ревматоидным артритом. Ревматоидный артрит. 2008. 58: 3041–3050. [PubMed] [Google Scholar] 62. Оно Х и др. Активный при пероральном приеме и селективный ингибитор тирозинкиназы c-Fms Ki20227 ингибирует прогрессирование заболевания на мышиной модели индуцированного коллагеном артрита. Евро. J. Immunol. 2008. 38: 283–291. [PubMed] [Google Scholar] 63. Коэн С.Б. и др.Влияние лечения деносумабом на структурные повреждения, минеральную плотность костной ткани и метаболизм костной ткани при ревматоидном артрите: двенадцатимесячное, многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое клиническое исследование фазы II. Ревматоидный артрит. 2008. 58: 1299–1309. [PubMed] [Google Scholar] 64. Visser H, le Cessie S, Vos K, Breedveld FC, Hazes JM. Как диагностировать ревматоидный артрит на ранней стадии: модель прогнозирования стойкого (эрозивного) артрита. Ревматоидный артрит. 2002. 46: 357–365. [PubMed] [Google Scholar] 65. Кастбом А., Страндберг Г., Линдроос А., Скох Т.Тест на антитела к ЦЦП позволяет прогнозировать течение заболевания в течение 3 лет при раннем ревматоидном артрите (шведский проект TIRA) Ann. Реум. Дис. 2004. 63: 1085–1089. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Мейер О. и др. Анализы антицитруллинированных белков / пептидных антител при раннем ревматоидном артрите для прогнозирования пятилетних радиографических повреждений. Анна. Реум. Дис. 2003. 62: 120–126. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Ши Дж. И др. Аутоантитела, распознающие карбамилированные белки, присутствуют в сыворотке крови пациентов с ревматоидным артритом и предсказывают повреждение суставов.Proc. Natl Acad. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2011; 108: 17372–17377. [Бесплатная статья PMC] [PubMed] [Google Scholar] 68. Харре У и др. Индукция остеокластогенеза и потери костной массы человеческими аутоантителами против цитруллинированного виментина. J. Clin. Инвестировать. 2012; 122: 1791–1802. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Ву Y, Хамфри МБ, Накамура М.С. Остеокласты — врожденные иммунные клетки кости. Аутоиммунитет. 2008. 41: 183–194. [PubMed] [Google Scholar] 70. Джи Д. и др. Ингибирование экспрессии RANK и остеокластогенеза TLR и IFN-γ в предшественниках остеокластов человека.J. Immunol. 2009; 183: 7223–7233. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Сато К. и др. Th27 функционирует как субпопуляция остеокластогенных хелперных Т-клеток, которая связывает активацию Т-клеток и разрушение костей. J. Exp. Med. 2006; 203: 2673–2682. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Заисс М.М. и др. Регуляторные Т-клетки защищают от местного и системного разрушения костей при артрите. J. Immunol. 2010. 184: 7238–7246. [PubMed] [Google Scholar] 73. Заисс М.М. и др. Повышенная плотность костной ткани и устойчивость к потере костной массы, вызванной овариэктомией, у FoxP3-трансгенных мышей на основе нарушения дифференцировки остеокластов.Ревматоидный артрит. 2010; 62: 2328–2338. [PubMed] [Google Scholar] 74. Axmann R, et al. CTLA-4 напрямую подавляет образование остеокластов. Анна. Реум. Дис. 2008. 67: 1603–1609. [PubMed] [Google Scholar] 75. Заисс М.М. и др. Клетки TREG подавляют образование остеокластов: новое звено между иммунной системой и костью. Ревматоидный артрит. 2007. 56: 4104–4112. [PubMed] [Google Scholar] 76. Баккер М.Ф. и др. Утрехтская группа исследования ревматоидного артрита. Включение низких доз преднизона в основанную на метотрексате стратегию жесткого контроля раннего ревматоидного артрита: рандомизированное исследование.Анна. Междунар. Med. 2012; 156: 329–339. [PubMed] [Google Scholar] 77. Grigor C, et al. Эффект от стратегии лечения ревматоидного артрита (исследование TICORA): простое слепое рандомизированное контролируемое исследование. Ланцет. 2004; 364: 263–269. [PubMed] [Google Scholar] 78. Лам Дж. И др. TNF-α индуцирует остеокластогенез путем прямой стимуляции макрофагов, подверженных допустимым уровням лиганда RANK. J. Clin. Инвестировать. 2000; 106: 1481–1488. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Бойс Б.Ф. и др.Влияние интерлейкина-1 на метаболизм костей у нормальных мышей. Эндокринология. 1989; 125: 1142–1150. [PubMed] [Google Scholar] 81. Ishimi YMC, et al. ИЛ-6 продуцируется остеобластами и вызывает резорбцию кости. J. Immunol. 1990; 145: 3297–3303. [PubMed] [Google Scholar] 82. Axmann R, et al. Ингибирование рецептора интерлейкина-6 напрямую блокирует образование остеокластов in vitro и in vivo . Ревматоидный артрит. 2009. 60: 2747–2756. [PubMed] [Google Scholar] 83. Poli V и др. Мыши с дефицитом интерлейкина-6 защищены от потери костной массы, вызванной истощением эстрогена.EMBO J. 1994; 13: 1189–1196. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Янсен Л.М., ван дер Хорст-Брюинсма И.Е., ван Шаарденбург Д., Беземер П.Д., Дейкманс Б.А. Предикторы рентгенологического поражения суставов у пациентов с ранним ревматоидным артритом. Анна. Реум. Дис. 2001; 60: 924–927. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Kraan MC и др. Бессимптомный синовит предшествует клинически манифестному артриту. Ревматоидный артрит. 1998; 41: 1481–1488. [PubMed] [Google Scholar] 86. Ван де Санде М.Г. и др. Различные стадии ревматоидного артрита: особенности синовиальной оболочки в доклинической фазе.Анна. Реум. Дис. 2011; 70: 772–777. [PubMed] [Google Scholar] 87. Рич Э., Морленд Л. В., Аларкон Г. С.. Недостаточность рентгенологического прогрессирования ревматоидного артрита, получавшего метотрексат в качестве первого противоревматического препарата, изменяющего заболевание. J. Rheumatol. 1999; 26: 259–261. [PubMed] [Google Scholar] 88. Schett G, Stach C, Zwerina J, Voll R, Manger B. Как противоревматические препараты защищают суставы от повреждений при ревматоидном артрите. Ревматоидный артрит. 2008. 58: 2936–2948. [PubMed] [Google Scholar] 89. Коэн Дж. И др. Радиологические повреждения у пациентов с ревматоидным артритом в стойкой ремиссии.Анна. Реум. Дис. 2007. 66: 358–363. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Molenaar ET, et al. Прогрессирование радиологического повреждения у пациентов с ревматоидным артритом в стадии клинической ремиссии. Ревматоидный артрит. 2004; 50: 36–42. [PubMed] [Google Scholar] 91. Браун А.К. и др. Объяснение очевидной диссоциации между клинической ремиссией и продолжающимся структурным ухудшением ревматоидного артрита. Ревматоидный артрит. 2008. 58: 2958–2967. [PubMed] [Google Scholar] 92. Vis M, et al. Оценка минеральной плотности костной ткани, метаболизма костей, уровня остеопротегерина и активатора рецепторов лиганда NFκB в сыворотке крови во время лечения инфликсимабом у пациентов с ревматоидным артритом.Анна. Реум. Дис. 2006; 65: 1495–1499. [Бесплатная статья PMC] [PubMed] [Google Scholar] 94. ван Волленховен РФ и др. Тофацитиниб или адалимумаб в сравнении с плацебо при ревматоидном артрите. N. Engl. J. Med. 2012; 367: 508–519. [PubMed] [Google Scholar] 95. Fleischmann R, et al. Плацебо-контролируемое исследование монотерапии тофацитинибом при ревматоидном артрите. N. Engl. J. Med. 2012; 367: 495–507. [PubMed] [Google Scholar] 96. Weinblatt ME, et al. Оральный ингибитор тирозинкиназы селезенки (Syk) при ревматоидном артрите.N. Engl. J. Med. 2010; 363: 1303–1312. [PubMed] [Google Scholar] 97. Mócsai A, et al. Иммуномодулирующие адаптерные белки DAP12 и γ-цепь рецептора Fc (FcRγ) регулируют развитие функциональных остеокластов посредством тирозинкиназы Syk. Proc. Natl Acad. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2004. 101: 6158–6163. [Бесплатная статья PMC] [PubMed] [Google Scholar] 98. Макиннес И.Б., Шетт Г. Патогенез ревматоидного артрита. N. Engl. J. Med. 2011; 365: 2205–2219. [PubMed] [Google Scholar] 99. Jiang Y, et al. Многоцентровое, двойное слепое, рандомизированное, плацебо-контролируемое исследование рекомбинантного антагониста рецептора интерлейкина-1 человека у пациентов с ревматоидным артритом: радиологическое прогрессирование и корреляция оценок Генанта и Ларсена.Ревматоидный артрит. 2000; 43: 1001–1009. [PubMed] [Google Scholar] 100. Fossiez F, et al. Т-клеточный интерлейкин-17 побуждает стромальные клетки продуцировать провоспалительные и гемопоэтические цитокины. J. Exp. Med. 1996; 183: 2593–2603. [Бесплатная статья PMC] [PubMed] [Google Scholar] 101. Йованович Д.В. и др. IL-17 стимулирует выработку и экспрессию провоспалительных цитокинов, IL-β и TNF-α, макрофагами человека. J. Immunol. 1998. 160: 3513–3521. [PubMed] [Google Scholar] 102. Chabaud M, et al. Человеческий интерлейкин-17: провоспалительный цитокин Т-лимфоцитов, продуцируемый ревматоидной синовиальной оболочкой.Ревматоидный артрит. 1999; 42: 963–970. [PubMed] [Google Scholar] 103. Miossec P, Korn T, Kuchroo VK. Интерлейкин-17 и хелперные Т-клетки 17 типа. N. Engl. J. Med. 2009; 361: 888–889. [PubMed] [Google Scholar] 104. Kotake S, et al. IL-17 в синовиальной жидкости пациентов с ревматоидным артритом является мощным стимулятором остеокластогенеза. J. Clin. Инвестировать. 1999; 103: 1345–1352. [Бесплатная статья PMC] [PubMed] [Google Scholar] 105. Сато К. и др. Th27 функционирует как субпопуляция остеокластогенных хелперных Т-клеток, которая связывает активацию Т-клеток и разрушение костей.J. Exp. Med. 2006; 203: 2673–2682. [Бесплатная статья PMC] [PubMed] [Google Scholar] 106. Зверина К. и др. Терапия против IL-17A подавляет потерю костной массы при TNF-α-опосредованном артрите мышей путем модуляции баланса Т-клеток. Евро. J. Immunol. 2012; 42: 413–423. [PubMed] [Google Scholar] 107. Огата Ю. и др. Новая роль IL-15 в развитии остеокластов: неспособность заменить его активность на IL-2. J. Immunol. 1999. 162: 2754–2760. [PubMed] [Google Scholar] 108. Knevel R, et al. Генетические варианты в IL15 и связаны с прогрессированием разрушения суставов при ревматоидном артрите: многокомпонентное исследование.Анна. Реум. Дис. 2012; 71 (Приложение 1): A56 – A57. [PubMed] [Google Scholar] 109. Заисс М.М. и др. IL-33 сдвигает баланс от остеокластов к альтернативно активируемой дифференцировке макрофагов и защищает от опосредованной TNFα потери костной массы. J. Immunol. 2011; 186: 6097–6105. [PubMed] [Google Scholar] 110. Куинн Дж. М. и др. IL-23 подавляет остеокластогенез опосредованно через лимфоциты и необходим для поддержания костной массы у мышей. J. Immunol. 2008. 181: 5720–5729. [PubMed] [Google Scholar] 111. Лукас К., ван дер Хейде Д., Фатенежад С., Ландеве Р.Ремонт эрозий происходит почти исключительно на поврежденных суставах без отека. Анна. Реум. Дис. 2010; 69: 851–855. [PubMed] [Google Scholar] 112. Møller Døhn U, et al. У пациентов с ревматоидным артритом, получавших адалимумаб, развитие эрозии минимально, но заживление эрозии происходит редко. Контрольное исследование продолжительностью 1 год, инициированное исследователем, с использованием компьютерной томографии высокого разрешения в качестве основного критерия оценки результатов. Анна. Реум. Дис. 2009. 68: 1585–1590. [PubMed] [Google Scholar] 114. Finzel S, et al. Восстановление эрозий костей при ревматоидном артрите, леченном ингибиторами фактора некроза опухолей, основано на наложении костей в основании эрозии.Анна. Реум. Дис. 2011; 70: 1587–1593. [PubMed] [Google Scholar] 115. Уолш NC и др. Функция остеобластов нарушается в местах очаговой эрозии костей при воспалительном артрите. J. Bone Miner. Res. 2009; 24: 1572–1585. [PubMed] [Google Scholar] 116. Диарра Д., Столина М., Пользер К. и др. Dickkopf-1 — главный регулятор ремоделирования суставов. Nat. Med. 2007. 13: 156–163. [PubMed] [Google Scholar] 117. Matzelle MM, et al. Разрешение воспаления вызывает функцию остеобластов и регулирует путь передачи сигналов Wnt.Ревматоидный артрит. 2012; 64: 1540–1550. [Бесплатная статья PMC] [PubMed] [Google Scholar] 118. Редлих К. и др. Восстановление местных эрозий костей и устранение системной потери костной массы при терапии противоопухолевым фактором некроза в сочетании с остеопротегерином или паратироидным гормоном при артрите, опосредованном фактором некроза опухоли. Являюсь. J. Pathol. 2004. 164: 543–555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 119. Пул К.Е. и др. Склеростин — это продукт замедленной секреции остеоцитов, который препятствует образованию кости.FASEB J. 2005; 19: 1842–1844. [PubMed] [Google Scholar] 120. Семенов М., Тамай К., He X. SOST является лигандом для LRP5 / LRP6 и ингибитором передачи сигналов Wnt. J. Biol. Chem. 2005; 280: 26770–26775. [PubMed] [Google Scholar]последних достижений в патогенезе и терапевтических последствиях
Abstract
Эрозии костей развиваются на ранних стадиях ревматоидного артрита (РА) и постепенно ухудшаются, вызывая повреждение суставов и приводя к нарушению функциональных возможностей пациентов. За последние годы значительное количество исследований расширило наше понимание патогенетических механизмов, опосредующих развитие эрозий костей при РА.Повышенная продукция RANKL и других цитокинов, нарушение регуляции механизмов врожденного иммунитета, аутоантитела, специфичные к RA, и изменения экспрессии микроРНК стимулируют дифференцировку и функцию остеокластов, которые ответственны за развитие эрозий костей. Кроме того, повышенные уровни цитокинов, избыточная продукция антагонистов канонического сигнального пути Wnt и недостаточная продукция костных морфогенетических белков приводят к нарушению дифференцировки и функции остеобластов, что подрывает способность костных эрозий восстанавливаться.Модифицирующие заболевание противоревматические препараты, синтетические или биологические, которые в настоящее время используются для лечения РА, могут остановить прогрессирование эрозий костей и даже привести к частичному восстановлению, хотя полное восстановление недостижимо. Нацеливание на патогенетические механизмы, участвующие в эрозивном процессе, может усилить терапевтический эффект DMARD и помочь в предотвращении или восстановлении эрозий костей. Тем не менее, необходимы дополнительные исследования, чтобы подтвердить эффективность таких терапевтических стратегий.
Ключевые слова: Кость, эрозии костей, ревматоидный артрит, патогенез
Введение
Ревматоидный артрит (РА) является наиболее распространенным хроническим воспалительным артритом и характеризуется стойким воспалением синовиальной оболочки (синовит), которое может вызывать прогрессирующее повреждение костей и хрящей суставов.РА представляет собой симметричный периферический полиартрит, который, если его не лечить, постепенно приводит к необратимому повреждению суставов и инвалидности. Потеря костной массы является отличительной чертой этого заболевания и проявляется в трех формах: (а) очаговые эрозии костей, расположенные на краях суставов и субхондральной кости, (б) околосуставные потери костной ткани, прилегающие к воспаленным суставам, и (в) системная потеря костной массы (остеопороз). [1].
Эрозии костей появляются на ранних стадиях РА, иногда в течение нескольких недель после постановки диагноза. Более чем у 10% пациентов эрозии костей развиваются в течение 8 недель после начала заболевания, в то время как до 60% имеют эрозии через 1 год [2].Эрозии костей со временем прогрессируют и способствуют повреждению суставов у пациентов с РА, что приводит к нарушению функциональной способности [3,4]. Таким образом, наличие эрозий костей предсказывает более тяжелое клиническое течение, что делает их важным критерием исхода при РА. Клинические испытания противоревматических препаратов оценивают их способность замедлять или останавливать рентгенологические повреждения, которые включают эрозии костей и разрушение хрящей. В клинической практике рентгенография используется для оценки поражения суставов и контроля эффективности лечения.В последние годы был достигнут значительный прогресс в понимании патогенетических механизмов, которые опосредуют образование эрозий костей при РА. Этот прогресс создает возможности для новых терапевтических целей в лечении этого заболевания, которые можно использовать для предотвращения новых эрозий костей или даже восстановления существующих.
Целью данной статьи является обзор литературы о патогенетических механизмах, приводящих к развитию эрозий костей при РА, а также о влиянии на лечение этого заболевания.
Остеокласты — это клетки, ответственные за эрозии костей при РА.
Хроническое воспаление синовиальной оболочки (синовиальной оболочки) при РА приводит к гиперплазии и образованию паннуса, утолщенной, гипертрофированной синовиальной мембраны, которая проникает в прилегающие хрящи и кость и вызывает деградацию хрящей и костные эрозии. Таким образом, костные эрозии при РА обычно локализуются на границе между паннусом и костью на краях суставов и субхондральной кости. Остеокласты — это клетки, ответственные за развитие эрозий костей.Используя устойчивую к тартрату кислотную фосфатазу (TRAP) и рецептор кальцитонина в качестве маркеров остеокластов, Gravallese et al. (1998) идентифицировали эти клетки на границе паннуса и кости, где они образуют ямки для резорбции, что в конечном итоге приводит к эрозиям костей [5].
Визуализирующие исследования показали, что отек костного мозга при магнитно-резонансной томографии (МРТ) часто предшествует развитию эрозий костей при РА [6-8]. Гистологический анализ показал, что эрозии костей на МРТ при РА соответствуют локализованному разрушению кортикальной кости, прилегающей к замещению жира костного мозга воспалительными клетками.Кроме того, отек костного мозга при МРТ возникает из-за инфильтрации костного мозга воспалительными клетками, что делает термин «остит» более подходящим, чем «отек костного мозга» [9]. В другом исследовании гистологическое исследование образцов костей с отеком костей при МРТ при РА выявило инфильтрацию костного мозга остеокластами, макрофагами, плазматическими клетками, а также CD8 + Т-клетками и В-клетками [10]. Следовательно, инфильтрация кости, прилегающей к воспаленной синовиальной оболочке, воспалительными клетками и остеокластами приводит к усилению резорбции кости и, в конечном итоге, к развитию эрозий костей.
Существует ряд патогенетических механизмов, ведущих к активации остеокластов и развитию эрозий костей при РА, и они будут рассмотрены в следующих разделах этой статьи.
Активатор рецептора ядерного фактора лиганда каппа-B (RANKL) стимулирует остеокласты в RA
Активатор рецептора ядерного фактора лиганда каппа-B (RANKL) представляет собой цитокин, принадлежащий суперсемейству фактора некроза опухоли (TNF), который связывается с рецептором активатор ядерного фактора каппа-B (RANK) на остеокластах и предшественниках остеокластов и является ключевым фактором дифференцировки и активации остеокластов.Остеопротегерин (OPG) представляет собой растворимый рецептор-ловушку RANKL, который связывается с RANKL и ингибирует активацию RANK. Воспаленная синовиальная оболочка и паннус при РА продуцируют значительно более высокие уровни RANKL и более низкие уровни OPG по сравнению со здоровой синовиальной оболочкой [11-13]. Клетками, ответственными за повышенную экспрессию RANKL в воспаленной синовиальной мембране, являются фибробластоподобные синовиоциты (FLS) и Т-лимфоциты. Повышенное соотношение RANKL / OPG приводит к усилению дифференцировки и активации остеокластов на границе синовиальной оболочки и кости и развитию эрозий костей при РА [13,14].
Роль цитокинов в активации остеокластов при RA
Центральная роль повышенного продуцирования цитокинов в остеокластогенезе и образовании эрозии костей при RA хорошо известна. Однако в последние годы наши знания о цитокин-индуцированном остеокластогенезе при РА и о задействованных сигнальных путях постоянно расширяются.
Фактор некроза опухоли (TNF) — это цитокин, играющий основную роль в патогенезе РА, и он высоко экспрессируется моноцитами периферической крови и синовиальными макрофагами у пациентов с РА [15].TNF стимулирует дифференцировку остеокластов (остеокластогенез) как косвенно, путем усиления сигнального пути RANK, так и непосредственно, воздействуя на предшественников остеокластов. Во-первых, TNF усиливает экспрессию RANK в предшественниках остеокластов [16], а также продукцию RANKL фибробластоподобными синовиоцитами (FLS) [17]. Более того, TNF стимулирует экспрессию ядерного фактора активированных Т-клеток (NFATc1) и белка-1 созревания, индуцированного В-лимфоцитами (Blimp1) в предшественниках остеокластов. NFATc1 и Blimp1 являются факторами транскрипции, которые индуцируются RANKL и усиливают остокластогенез [18,19].С другой стороны, TNF действует непосредственно на предшественников остеокластов и способствует их дифференцировке [20,21]. Кроме того, TNF стимулирует экспрессию макрофагального колониестимулирующего фактора (M-CSF) стромальными клетками костного мозга [22], а также экспрессию c-fms (рецептора для M-CSF) предшественниками остеокластов [23]. M-CSF играет важную роль в дифференцировке остеокластов.
Интерлейкин-1 (IL-1) — еще один цитокин, участвующий в патогенезе РА, он продуцируется моноцитами периферической крови и синовиальными макрофагами в синовиальной оболочке РА [15].IL-1 стимулирует многоядерность и активацию остеокластов. Кроме того, IL-1 действует синергетически с TNF, способствуя дифференцировке остеокластов. TNF усиливает экспрессию IL-1, а последний индуцирует экспрессию RANKL стромальными клетками костного мозга [24].
IL-6 также играет роль в патогенезе РА и повышенной активности остеокластов. Он экспрессируется FLS и синовиальными макрофагами синовиальной оболочки RA [25,26] и опосредует индукцию RANKL с помощью TNF и IL-17, поскольку он напрямую стимулирует экспрессию RANKL с помощью FLS [17].
IL-17 продуцируется Т-хелперами типа 17 (клетки Th27) и играет важную роль в патогенезе РА и усилении остеокластогенеза. IL-17 косвенно стимулирует остеокластогенез путем усиления передачи сигналов RANK, поскольку он индуцирует экспрессию RANKL на остеобластических клетках [27], а также экспрессию RANK на предшественниках остеокластов [28]. IL-17 также усиливает дифференцировку и функцию остеокластов, индуцируя экспрессию простагландина-E 2 (PGE 2 ) на остеобластах [29].Кроме того, IL-17 действует непосредственно на предшественников остеокластов, способствуя остеокластогенезу [30]. Кроме того, IL-17 увеличивает продукцию цитокинов TNF и IL-1 макрофагами [31] и IL-6 фибробластами [32].
IL-15, IL-33 и IL-34 также способствуют остеокластогенезу при RA. ИЛ-15 продуцируется в воспаленной синовиальной оболочке при РА, он индуцирует продукцию цитокинов Т-клетками [33] и усиливает RANKL-зависимый и Т-клеточно-зависимый остеокластогенез [34,35]. IL-33 экспрессируется синовиальными фибробластами при РА [36] и стимулирует остеокластогенез [37].Экспрессия IL-33 индуцируется TNF и IL-1 [36]. IL-34 продуцируется FLS при RA и способствует хемотаксической миграции мононуклеарных клеток периферической крови и RANKL-зависимой дифференцировке остеокластов. Экспрессия IL-34 с помощью FLS индуцируется TNF [38].
С другой стороны, другие цитокины оказывают ингибирующее действие на остеокластогенез. ИЛ-4, ИЛ-10, ИЛ-23, IFN-α, -β, -γ (интерферон-α, -β, -γ) и GM-CSF (фактор, стимулирующий колонию гранулоцитов и макрофагов) продуцируются воспаленной синовиальной оболочкой. при РА [39–44] и подавляют остеокластогенез [45–51].Однако эти цитокины не способны противодействовать остеокластогенному эффекту RANKL, TNF, IL-1, -6, -15, -17, -33 и -34, что приводит к усилению дифференцировки и активации остеокластов при РА и развитию эрозий костей.
Врожденные иммунные механизмы и активация остеокластов при РА
В последние годы выяснилась роль механизмов врожденного иммунитета в усилении остеокластогенеза и образовании эрозии костей при РА. Эти механизмы включают сигнальный путь ITAM и Toll-подобные рецепторы.
— иммунорецепторный мотив активации на основе тирозина (ITAM) сигнальный путь
— Иммунорецепторный мотив активации на основе тирозина (ITAM) представляет собой обычную последовательность из четырех аминокислот, дважды повторяющуюся в цитоплазматических доменах трансмембранных белков, которые служат сигнальными адаптерами у врожденных и адаптивные иммунные клетки и в остеокластах. Мотив содержит два остатка тирозина, которые фосфорилируются, когда связанные рецепторы связываются со своими лигандами. Фосфорилированные остатки тирозина образуют сайты стыковки для тирозинкиназ и других белков, которые активируют внутриклеточные сигнальные каскады [52].Основными сигнальными адаптерами, несущими ITAM, экспрессируемыми предшественниками остеокластов, являются DAP12 (ДНКX-активирующий белок 12) и FcRγ (общая субъединица γ рецептора Fc). Рецепторами, связанными с DAP12, являются TREM2 (запускающий рецептор, экспрессируемый на миелоидных клетках-2), MDL-1 (миелоидный DAP12-ассоциированный лектин 1) и Siglec-15 (связывающий сиаловую кислоту иммуноглобулиноподобный лектин 15), тогда как рецепторы, связанные с FcRγ, являются OSCAR (рецептор, активирующий остеокласты), PIR-A (парный иммуноглобулиноподобный рецептор A) и FcR (рецепторы Fc).Сигнальный путь ITAM в предшественниках остеокластов действует синергетически с сигнальным путем RANK, чтобы индуцировать дифференцировку и активацию остеокластов. Активация сигнальных адаптеров ITAM приводит к увеличению цитозольной концентрации кальция, что необходимо для активации NFATc1 — фактора транскрипции пути RANK [53].
Сигнальный путь ITAM активируется в RA. Герман и др. продемонстрировали, что OSCAR экспрессируется остеокластами в местах эрозий костей в суставах пациентов с РА.OSCAR также экспрессировался мононуклеарными клетками, прилегающими к синовиальным микрососудам, и моноцитами периферической крови (PBMC). Экспрессия OSCAR с помощью PBMC у пациентов с РА была значительно выше по сравнению со здоровым контролем и коррелировала с активностью заболевания. Моноциты с более высокой экспрессией OSCAR с большей вероятностью дифференцировались в остеокласты. Экспрессия OSCAR моноцитами индуцировалась TNF. Таким образом, активация сигнального пути ITAM при РА приводит к усилению остеокластогенеза [54].В другом исследовании Crotti et al. обнаружили, что процент клеток, экспрессирующих OSCAR, FcRγ, DAP12 и TREM2, был значительно выше в активной синовиальной оболочке RA по сравнению со здоровой синовиальной оболочкой. Эти клетки были в основном макрофагоподобными клетками [55].
Толл-подобные рецепторы (TLR)
Толл-подобные рецепторы играют важную роль в врожденном иммунитете, поскольку они экспрессируются клетками врожденного иммунитета и активируются молекулярными паттернами, связанными с патогенами. TLR также экспрессируются остеобластами и остеокластами и участвуют в остеокластогенезе.Активация TLR в остеобластах индуцирует экспрессию RANKL и TNF, что приводит к усилению остеокластогенеза. Активация TLR в предшественниках остеокластов на ранних стадиях дифференцировки ингибирует остеокластогенез, тогда как в клетках, начавших дифференцировку остеокластов, активация TLR усиливает остеокластогенез. TLR также способствуют выживанию зрелых остеокластов [56].
Экспрессия Toll-подобного рецептора-5 (TLR5) в синовиальной ткани RA и макрофагах жидкости, а также в моноцитах периферической крови RA значительно выше по сравнению с контрольными моноцитами.Кроме того, экспрессия TLR5 коррелирует с активностью заболевания RA. Активация TLR5 в моноцитах RA приводит к увеличению экспрессии TNF, в то время как экспрессия TLR5 усиливается TNF (регуляция положительной обратной связи). Более того, экспрессия TLR5 в макрофагах RA индуцируется IL-8 и IL-17 [57]. Другое исследование продемонстрировало, что лигирование и активация TLR5 в моноцитах пациентов с РА приводит к стимуляции экспрессии RANK и усилению дифференцировки в зрелые остеокласты. Кроме того, стимуляция TLR5 на мышиной модели RA увеличивала продукцию TNF, воспаление суставов, инфильтрацию остеокластов и эрозии костей воспаленных суставов.С другой стороны, лечение антителом против TLR5 уменьшало воспаление суставов и эрозии костей на мышиной модели RA [58]. Таким образом, похоже, что повышенная экспрессия TLR5 при RA участвует в остеокластогенезе и формировании эрозий костей.
TLR4 — еще один Toll-подобный рецептор, роль которого в патогенезе и остеокластогенезе RA изучается. Пациенты с РА имеют повышенные уровни эндогенных лигандов TLR4, таких как белки S100A8, S100A9, тенасцин-C и HMGB-1 (хромосомный белок 1 группы высокой подвижности), в периферической крови и в синовиальной жидкости [59–63].Кроме того, стимуляция TLR4 в синовиальных фибробластах RA индуцирует ими экспрессию RANKL [64]. Модели RA на животных демонстрируют повышенную экспрессию TLR4 в синовиальной мембране воспаленных суставов, в то время как делеция гена TLR4 приводит к уменьшению воспаления суставов, уменьшению инфильтрации остеокластов и уменьшению эрозий костей суставов [65-67]. Кроме того, мышиные модели RA демонстрируют повышенную экспрессию эндогенных лигандов TLR4, которые усиливают остеокластогенез через TNF и IL-6. Лечение антителом против TLR4 уменьшало воспаление суставов и инфильтрацию суставов остеокластами на модели мыши с РА [68].
Следовательно, помимо TLR5, TLR4, по-видимому, также участвует в образовании эрозии кости при RA. Однако необходимы дополнительные исследования для выяснения роли Toll-подобных рецепторов в остеокластогенезе при РА и патогенетических механизмов, которые приводят к их активации.
Опосредованный аутоантителами остеокластогенез при РА. Антитела к цитруллинированному белку (ACPA)
Антитела к цитруллинированному белку (ACPA) выявляются у пациентов с РА и полезны при диагностике РА, поскольку они характеризуются высокой специфичностью.Кроме того, положительный ACPA у пациентов с РА является прогностическим фактором развития тяжелого заболевания и эрозий костей в суставах [69]. Кроме того, у здоровых людей, положительных по ACPA, без клинических признаков РА наблюдается околосуставная потеря костной массы. Учитывая, что положительный результат по ACPA предшествует клиническому началу заболевания на несколько лет и что эрозии костей могут быть обнаружены у пациентов с РА в течение первых нескольких недель после постановки диагноза, можно предположить, что активация остеокластов и резорбция кости начинаются до клинического начала РА и не вызываются. только синовитом и цитокинами, но также и аутоантителами, такими как ACPA [70].
Harre et al. исследовали влияние ACPA на остеокластогенез. Они продемонстрировали, что остеокласты и клетки-предшественники остеокластов экспрессируют ферменты, вызывающие цитруллинирование белков (Peptidylarginine Deiminases, PAD), и что цитруллинирование виментина в предшественниках остеокластов увеличивается во время их дифференцировки. ACPA со специфичностью к цитруллинированному виментину обнаруживается в сыворотке крови пациентов с РА и связывается с поверхностью предшественников остеокластов. Harre et al. показали, что связывание цитруллинированного виментин-специфичного ACPA с предшественниками остеокластов стимулирует остеокластогенез и активность остеокластов в отношении резорбции костей.Они также выяснили механизм этого эффекта; ACPA индуцирует экспрессию TNF предшественниками остеокластов, которые действуют аутокринным образом, усиливая остеокластогенез. Кроме того, ACPA индуцирует экспрессию RANK и рецептора M-CSF предшественниками остеокластов [71]. Индукция продукции TNF моноцитами и макрофагами, вызванная ACPA, была продемонстрирована и в другом исследовании [72].
В недавнем исследовании Krishnamurthy et al. продемонстрировали, что ACPA, специфичный для цитруллинированного виментина и енолазы, способствует остеокластогенезу, тогда как ACPA, специфичный для других цитруллинированных эпитопов, этого не делает.Они также показали, что ACPA индуцирует экспрессию IL-8 клетками-предшественниками остеокластов, которые действуют аутокринным образом, чтобы облегчить остеокластогенез. Ингибирование IL-8 антителом против IL-8 нейтрализовало этот эффект ACPA, что означает, что IL-8, вероятно, опосредует остеокластогенный эффект ACPA [73].
Далее, в другом отчете было показано, что у ACPA-отрицательных пациентов наблюдались более высокие z-значения бедренной кости, а также более низкая распространенность остеопороза [74]. С другой стороны, сообщалось, что у ACPA-положительных пациентов наблюдались более низкие ИМТ и продолжительность заболевания.Наконец, поясничный z-показатель был выше у ACPA-отрицательных пациентов с маргинальной значимостью, а также наблюдалась обратная корреляция между титром ACPA и шейкой бедренной кости, общим значением бедренной кости и поясничным Z-показателем [74].
Таким образом, все больше данных указывает на роль ACPA в остеокластогенезе, образовании эрозии костей и потере костной массы при РА. Необходимы дальнейшие исследования, чтобы показать, могут ли эти результаты найти применение в клинической практике.
Иммунные комплексы аутоантител
Кроме ACPA, кажется, что иммунные комплексы аутоантител (комплексы, полученные из связывания аутоантител с их антигеном) также способствуют остеокластогенезу при РА.Клетки-предшественники остеокластов и зрелые остеокласты экспрессируют фрагменты кристаллизующихся (Fc) γ-рецепторов (FcγR) на поверхности клетки, которые распознают и связываются с антителами IgG (иммуноглобулин G). Seeling et al. показали, что стимуляция FcγRIV на поверхности предшественников остеокластов способствует дифференцировке и активности остеокластов. Более того, в модели RA на мышах делеция гена FcγRIV, в частности, из предшественников остеокластов приводила к уменьшению как инфильтрации остеокластов, так и эрозий костей в воспаленных суставах [75].Кроме того, Harre et al. продемонстрировали, что сиалирование IgG влияет на способность иммунных комплексов IgG способствовать остеокластогенезу. Десиалилированные иммунные комплексы стимулировали дифференцировку остеокластов и резорбцию кости, тогда как сиалированные иммунные комплексы не имели этого эффекта. Кроме того, используя случайный IgG, Harre et al. показали, что остеокластогенный эффект десиалилированных иммунных комплексов является общей чертой всех антител IgG, независимо от их антигенной специфичности, из-за стимуляции рецепторов FcγR.Более того, пациенты с РА, демонстрирующие низкий уровень сиалирования IgG, имеют значительно меньший объем кости по сравнению с пациентами с высоким уровнем сиалирования IgG. Кроме того, патогенные антитела, такие как ACPA, менее сиалилированы по сравнению с общим IgG и in vitro и сиалированием ACPA по Harre et al. привело к потере их остеокластогенного действия. Эти результаты привели к тому, что Harre et al. изучить влияние предшественника сиаловой кислоты N-ацетилманнозамина (ManNAc) на мышиной модели RA. Обработка ManNAc значительно уменьшила инфильтрацию остеокластов и предотвратила эрозии костей в суставах на мышиной модели RA [76].Таким образом, кажется, что иммунные комплексы способствуют остеокластогенезу и развитию эрозий костей при РА, особенно десиалилированных иммунных комплексов IgG.
микроРНК регулируют остеокластогенез в RA
микроРНК (миРНК) представляют собой небольшие одноцепочечные некодирующие РНК, состоящие из 20-25 нуклеотидов, которые регулируют экспрессию генов на посттранскрипционном уровне. miRNA связываются с 3’-нетранслируемой областью (3’-UTR) своей целевой матричной РНК (мРНК) посредством частичной комплементарности, и они ингибируют ее трансляцию или вызывают ее деградацию.Следовательно, miRNA ингибируют экспрессию своего гена-мишени на посттранскрипционном уровне. miRNA кодируются либо отдельными генами miRNA, либо последовательностями, расположенными в интронах других генов. Множественные miRNA могут регулировать экспрессию одного целевого гена, и каждая miRNA может регулировать экспрессию нескольких целевых генов [77]. Экспрессия 90% генов, кодирующих белок, регулируется miRNA. В результате miRNA участвуют в нескольких биологических процессах, таких как пролиферация клеток, дифференцировка клеток, апоптоз и фиксация клонов иммунных клеток.Кроме того, измененная экспрессия miRNA участвует в развитии различных заболеваний. В последние годы участие miRNA в патогенезе РА привлекло большое внимание и широко изучается [78]. В ряде исследований изучалась, в частности, роль miRNA в регуляции остеокластогенеза при RA.
Экспрессия miRNA-155 (miR-155) повышается в макрофагах и фибробластах синовиальной мембраны и в макрофагах синовиальной жидкости пациентов с RA [79,80].Мишенью miR-155 является Src Homology 2-содержащая инозитолфосфатаза-1 (SHIP-1), которая ингибирует экспрессию нескольких провоспалительных цитокинов. Следовательно, повышающая регуляция miR-155 в синовиальных моноцитах и макрофагах RA приводит к подавлению регуляции SHIP-1 и увеличению экспрессии TNF, IL-1, IL-6 и IL-8 [79]. Действительно, делеция гена miR-155 на мышиной модели RA (мыши с коллаген-индуцированным артритом) предотвращала воспаление суставов и развитие эрозий костей [79,81]. В другой модели РА на мышах (модель артрита, индуцированного переносом сыворотки K / BxN) Bluml et al., делеция miR-155 значительно снижает инфильтрацию остеокластов и эрозию костей суставов, не влияя на воспаление суставов. Кроме того, Bluml et al. продемонстрировали, что делеция miR-155 ингибирует дифференцировку остеокластов в культурах клеток-предшественников остеокластов in vitro , особенно на поздних стадиях остеокластогенеза. Таким образом, Buml et al. пришли к выводу, что miR-155 играет важную роль в поздней стадии остеокластогенеза [81].
miR-223 активируется в Т-клетках и в синовиальной мембране пациентов с РА [82,83].Мишенью miR-223 является ядерный фактор I-A (NFI-A), который ингибирует экспрессию рецептора M-CSF (M-CSFR). Таким образом, miR-223 подавляет NFI-A в клетках-предшественниках остеокластов, что приводит к повышенной экспрессии M-CSFR и стимуляции остеокластогенеза. Кроме того, M-CSF индуцирует экспрессию miR-223 в предшественниках остеокластов через фактор транскрипции PU.1 (регуляция положительной обратной связи) [84]. miR-223 также активируется в суставах мышей модели RA, в то время как ингибирование miR-223 уменьшало воспаление суставов, ослабляло остеокластогенез и уменьшало эрозии костей в модели RA мышей [83].
Другая miRNA, активируемая при RA, — это miR-146, которая сверхэкспрессируется в макрофагах синовиальной мембраны и Т-клетках пациентов с RA, а также в моноцитах периферической крови и Т-клетках [85,86]. Однако, в отличие от miR-155 и miR-223, miR-146 ингибирует остеокластогенез, поскольку его мишенью является TNF Receptor-Associated Factor 6 (TRAF6), который участвует в передаче сигналов RANKL и в остеокластогенезе [87]. Экспрессия miR-146 индуцируется NF-κΒ, в то время как его мишени TRAF6 и IRAK1 (киназа 1, ассоциированная с рецептором IL-1) участвуют в врожденном иммунитете, продукции цитокинов и остеокластогенезе.Таким образом, кажется, что роль miR-146 в RA включает контроль передачи сигналов цитокинов и остеокластогенеза посредством петли регуляции отрицательной обратной связи [87,88]. Накаса и др. исследовали потенциал использования miR-146 для предотвращения эрозий костей при РА. Они вводили miR-146 на мышиной модели RA, что привело к снижению инфильтрации остеокластов и предотвращению разрушения костей без уменьшения воспаления суставов [87].
miR-124 — еще одна miRNA, которая недавно была изучена на предмет возможности ее использования в лечении RA.Одной из мишеней miR-124 является NFATc1, который участвует в передаче сигналов RANKL и остеокластогенезе. Введение miR-124 на крысиной модели RA приводило к уменьшению артрита, подавлению экспрессии NFATc1 и RANKL, ингибированию остеокластогенеза, уменьшению количества остеокластов и ослаблению разрушения костей [89].
Следовательно, изменения в экспрессии miRNA вносят вклад в усиление остеокластогенеза и развитие эрозий костей в суставах RA. Кроме того, некоторые miRNA, которые ингибируют дифференцировку остеокластов, могут быть использованы для уменьшения разрушения кости при RA.Однако необходимы дополнительные доклинические исследования в этой области, чтобы решить проблемы доставки и безопасности, прежде чем miRNAs будут протестированы на людях с RA.
Дифференцировка и функция остеобластов нарушены при РА
Развитие эрозий костей при РА связано не только с усилением дифференцировки и активации остеокластов, но также с нарушением дифференцировки и функции остеобластов. Подавление дифференцировки и функции остеобластов при РА приводит к нарушению костеобразования и ограниченной способности к восстановлению костных эрозий.Walsh et al. продемонстрировали, что образование костной ткани было снижено на поверхностях костей, прилегающих к воспаленной синовиальной оболочке в местах эрозии костей в модели RA на мышах, по сравнению с поверхностями костей дистальнее воспаленной синовиальной оболочки. Кроме того, в местах эрозии костей было мало зрелых остеобластов, тогда как клеток-предшественников остеобластов было много. Таким образом, воспаление нарушает дифференцировку остеобластов и формирование кости, что приводит к неспособности заживления эрозий костей при РА [90].Кроме того, разрешение воспаления в той же модели RA у мышей привело к увеличению количества зрелых остеобластов, заселяющих места эрозии кости, что привело к увеличению образования кости и восстановлению эрозии [91].
Патогенетические механизмы, приводящие к нарушению дифференцировки и функции остеобластов и снижению способности эрозий к восстановлению, будут рассмотрены в следующих разделах.
Цитокины ингибируют дифференцировку и функцию остеобластов в RA
TNF , ключевой фактор патогенеза RA, является мощным ингибитором дифференцировки остеобластов [92,93].Ιt способствует деградации фактора транскрипции Runx2, который играет центральную роль в дифференцировке остеобластов [94]. Кроме того, TNF подавляет продукцию некоторых компонентов костного матрикса остеобластами, таких как коллаген I типа и остеокальцин, а также выработку щелочной фосфатазы, которая участвует в минерализации костного матрикса. В-третьих, TNF вызывает апоптоз остеобластов [95]. Кроме того, TNF-трансгенные мыши, мышиная модель RA, которые сверхэкспрессируют TNF, характеризуются нарушением дифференцировки и активности остеобластов, что приводит к снижению костеобразования и отсутствию репарации при эрозиях костей [96].
IL-1 , другой цитокин, участвующий в патогенезе РА, ингибирует пролиферацию остеобластов и экспрессию компонентов костного матрикса, что приводит к снижению образования кости [97]. Более того, IL-1 ингибирует хемотаксическую миграцию остеобластов и ухудшает их рекрутирование в места эрозий костей при RA [98].
IL-6 также принимает участие в патогенезе РА, и недавно было продемонстрировано, что он опосредует ингибирование дифференцировки остеобластов с помощью TNF. Кроме того, IL-6 ингибирует костный морфогенетический белок (BMP) -2 / 7-опосредованную дифференцировку остеобластов [99].
Канонический путь передачи сигналов Wnt ингибируется в RA
Канонический путь передачи сигналов Wnt играет ключевую роль в дифференцировке и активности остеобластов. Он активируется растворимыми лигандами Wnt, которые связываются с рецепторами белка Frizzled и корецепторами белка, связанного с рецептором липопротеинов (LRP) -5/6. Активация канонического пути Wnt приводит к ингибированию гликоген-синтазокиназы (GSK) -3β и транслокации фактора транскрипции β-катенина в ядро, где он индуцирует экспрессию генов, контролирующих дифференцировку остеобластов.Канонический путь Wnt ингибируется растворимыми антагонистами, включая секретируемые Frizzled-Related Proteins (SFRP), белки Dickkopf (Dkk) и склеростин (SOST). SFRP связываются с лигандами Wnt и предотвращают их взаимодействие с комплексом Frizzled-LRP5 / 6, тогда как белки Dkk и склеростин связываются с корецепторами LRP5 / 6 и ингибируют активацию пути Wnt [100].
В нескольких исследованиях изучалась роль антагонистов Wnt в ингибировании остеобластов и развитии эрозий костей при RA. Diarra et al.(2007) продемонстрировали, что фибробласты синовиальной ткани RA экспрессируют повышенные уровни Dickkopf-1 (Dkk-1), а TNF индуцирует экспрессию Dkk-1. Кроме того, уровни Dkk-1 в сыворотке крови у пациентов с РА повышены по сравнению со здоровым населением и коррелируют с активностью заболевания. Кроме того, ингибирование Dkk-1 антителом против Dkk-1 на мышиной модели RA усиливало дифференцировку и функцию остеобластов, увеличивало образование костей и предотвращало развитие эрозий костей, но не влияло на воспаление суставов.Следовательно, повышенная экспрессия антагониста передачи сигналов Wnt Dkk-1 при RA вносит вклад в развитие эрозий костей за счет ингибирования дифференцировки и функции остеобластов [101]. Другие исследования подтвердили повышенную экспрессию Dkk-1 синовиальными фибробластами при РА [102] и повышенные уровни Dkk-1 в сыворотке крови у пациентов с РА [103-105]. Уровни Dkk-1 в периферической крови коррелируют с активностью заболевания и связаны с повышенным риском развития эрозий костей. Лечение ингибиторами TNF и антагонистом рецептора IL-1 снижает уровни Dkk-1 у пациентов с РА [103-105].Кроме того, три однонуклеотидных полиморфизма (SNP) гена Dkk-1 были связаны с деструкцией кости в когорте пациентов с РА, в то время как один SNP Dkk-1 был связан с уровнями Dkk-1 в сыворотке [106]. Более того, Dkk-1 усиливает TNF-опосредованную экспрессию склеростина остеобластами [107], тогда как, в отличие от TNF, IL-6 подавляет экспрессию Dkk-1 синовиальными фибробластами [108].
Помимо Dkk-1, экспрессия других антагонистов передачи сигналов Wnt также повышается в суставах, пораженных артритом. В модели РА на мышах, в которой дифференцировка остеобластов была нарушена в местах эрозии кости, синовиальная мембрана экспрессировала повышенные уровни Dkk-1, Dkk-3, SFRP-1, SFRP-2 и SFRP-4 по сравнению с мышами, не страдающими артритом [ 90].В той же мышиной модели РА разрешение воспаления привело к подавлению экспрессии SFRP-1 и SFRP-2 синовиальной мембраной и усилению регуляции лиганда Wnt Wnt10b, что привело к увеличению дифференцировки остеобластов, образованию кости и восстановлению эрозий. [91].
Склеростин — еще один антагонист передачи сигналов Wnt, и полиморфизмы (SNP) его гена были связаны с деструкцией костей суставов у пациентов с РА [106]. В модели RA на мышах (TNF-трансгенные мыши) ингибирование склеростина моноклональным антителом остановило прогрессирование эрозий костей, а также околосуставную и системную потерю костной массы.Более того, комбинированное лечение антителами к склеростину и TNF привело к увеличению числа околосуставных остеобластов и регрессу эрозий костей [109]. С другой стороны, небольшое исследование с 40 пациентами с РА не обнаружило значительных различий в уровнях склеростина в сыворотке между пациентами с РА и здоровыми людьми из контрольной группы. Также не было обнаружено значительной корреляции между уровнем склеростина в сыворотке и прогрессированием деструкции кости в суставах [110]. Кроме того, ингибирование склеростина у мышей с коллаген-индуцированным артритом (мышиная модель РА) не могло предотвратить развитие эрозий костей или их восстановление, хотя оно предотвращало или обращало вспять системную потерю костной ткани [111].Кроме того, недавнее исследование Wehmeyer et al. обнаружили, что ингибирование склеростина у трансгенных мышей TNF ускоряет воспалительный артрит и присоединяется к разрушению. В другой мышиной модели RA (модель артрита, индуцированного переносом сыворотки K / BxN), которая не зависит от передачи сигналов TNF, ингибирование склеростина уменьшало тяжесть заболевания. Wehmeyer et al. пришли к выводу, что склеростин может играть защитную роль при TNF-опосредованном воспалении [112]. Следовательно, необходимы дополнительные исследования роли склеростина в патогенезе РА и развитии эрозий костей.
Кроме того, изменения в экспрессии микроРНК (миРНК) воспаленной синовиальной тканью влияют на формирование кости при РА и потенциально участвуют в развитии эрозий костей. Недавнее исследование модели RA на мышах выявило 22 miRNA, экспрессия которых в синовиальной ткани различалась у мышей с артритом и без него, и некоторые из них нацелены на пути передачи сигналов Wnt и BMP. miR-221-3p, который сверхэкспрессируется в воспаленной синовиальной ткани, нацелен на Dkk-2, который способствует дифференцировке остеобластов и минерализации костного матрикса.Более того, TNF индуцировал экспрессию miR-221-3p фибробластоподобными синовиоцитами (FLS), полученными от пациентов с RA, а также секрецию miR-221-3p посредством FLS, упакованных во внеклеточные везикулы, называемые экзосомами. Следовательно, похоже, что воспаление в синовиальной оболочке RA усиливает экспрессию miR-221-3p с помощью FLS. FLS секретирует экзосомы, содержащие miR-221-3p, которые захватываются остеобластами в местах эрозии. В результате экспрессия Dkk-2 в остеобластах подавляется, что приводит к ингибированию дифференцировки остеобластов и дефектному образованию кости при эрозиях RA [113].
Таким образом, растущее число доклинических и клинических исследований указывает на патогенетическую роль канонического пути передачи сигналов Wnt при RA. Похоже, что подавление этого пути приводит к нарушению дифференцировки и активности остеобластов и, как следствие, к снижению способности костных эрозий к восстановлению. Доклинические исследования показывают, что эти результаты могут иметь значение для лечения РА, хотя в этом направлении требуются дополнительные исследования.
Передача сигналов костного морфогенетического белка (BMP) в RA
Передача сигналов костного морфогенетического белка (BMP) и, в частности, BMP-2, -4, -5, -6 и -7, играют важную роль в дифференцировке остеобластов и индуцируют образование костей [114 ].Экспрессия BMP-4 и BMP-5 значительно снижена в синовиальной ткани пациентов с РА по сравнению со здоровыми людьми из контрольной группы [115] и может частично отвечать за снижение костеобразования в местах эрозии костей. Кроме того, было обнаружено, что экспрессия BMP-4, BMP-6 и BMP-7 подавляется в суставах мышиной модели RA, тогда как экспрессия рецепторов BMP типа IA и II повышается [116]. С другой стороны, сывороточные уровни BMP-7 были выше у пациентов с РА по сравнению со здоровым контролем [117].
BMP-3 является антагонистом передачи сигналов BMP, и его участие в эрозивном процессе при RA недавно было изучено на двух моделях RA на мышах. Matzelle et al. (2016) обнаружили, что BMP-3 высоко экспрессируется остеобластами в местах эрозии костей, а также TNF индуцирует экспрессию BMP-3. Таким образом, они предположили, что повышенная регуляция BMP-3 ингибирует дифференцировку и функцию остеобластов при RA и способствует развитию эрозий костей [118].
Следовательно, нарушение регуляции передачи сигналов BMP, по-видимому, участвует в ингибировании активности остеобластов и дефектном формировании кости в местах эрозий костей при RA, хотя необходимы дальнейшие исследования в этом направлении.
Терапевтическое значение
Эрозии костей со временем прогрессируют, вызывают повреждение суставов и ухудшают функциональные возможности пациентов [3,4]. Таким образом, подавление эрозионного процесса и восстановление эрозий костей является важной терапевтической целью при РА. Обычные синтетические противоревматические препараты, модифицирующие заболевание (csDMARD), такие как метотрексат, сульфасалазин и хлорохин, продемонстрировали ограниченные результаты, поскольку они обеспечивают ограниченное восстановление эрозий костей у небольшой части (7-10%) пациентов с РА [119, 120].Таким образом, внимание было обращено на биологические агенты (биологические DMARD), введение которых в терапию РА позволило достичь клинической ремиссии или низкой активности заболевания. В течение последних лет было исследовано, может ли борьба с воспалением с помощью биологических агентов при РА привести к восстановлению эрозий костей.
Finzel et al. изучили влияние ингибиторов TNF (TNFi) на эрозии костей; они использовали микрокомпьютерную томографию высокого разрешения (мкКТ) для оценки ширины и глубины костных эрозий у пациентов с РА, получавших TNFi по сравнению с метотрексатом.Эрозии костей у пациентов, получавших TNFi, показали частичное восстановление и уменьшение глубины после 1 года лечения, в отличие от эрозий костей у пациентов, получавших метотрексат, которые ухудшились. Ремонт был отмечен только при эрозиях с признаками костного сочленения (склероз). Более того, более глубокие эрозии более склонны к восстановлению, что означает, что восстановление начинается с эндостальной выстилки и костного мозга [121]. Другие исследования также показали, что TNFi останавливает прогрессирование эрозий костей и может обеспечить их частичное восстановление [122–124].
Finzel et al. (2013) также исследовали влияние блокады рецептора IL-6 (IL-6R) моноклональным антителом на эрозии костей у пациентов с РА. Блокада IL-6R индуцировала частичное восстановление эрозий, проявляющих склероз; восстановление было более выраженным при более крупных эрозиях [125]. Другие исследования также показали, что блокада IL-6R останавливает прогрессирование эрозий костей при РА [126, 127]. Кроме того, было показано, что абатацепт, биологический агент, который ингибирует костимуляцию Т-клеток, замедляет прогрессирование эрозий костей у пациентов с РА [128].Помимо биологических агентов, в арсенал методов лечения РА недавно были добавлены целевые синтетические DMARD, такие как ингибиторы JAK. Киназы Януса (JAK) участвуют в путях передачи сигналов множественных цитокиновых рецепторов, которые участвуют в патогенезе РА [129, 130]. Тофацитиниб подавляет JAK1 и JAK3 и, как было показано, останавливает прогрессирование эрозий костей у пациентов с РА [129, 131]. В то же время барицитиниб блокирует киназы JAK1 и JAK2. Барицитиниб обратимо ингибирует JAK1 и JAK2, в то время как он менее селективен в отношении киназы JAK3.В общем, ингибиторы JAK действуют через путь передачи сигнала с участием белков STAT, который окончательно регулирует последующую экспрессию генов в иммунологических клетках [132]. Недавно было показано, что барицитиниб снижает прогрессирование эрозий костей и структурных повреждений суставов у пациентов с РА [133].
Таким образом, биологические и синтетические DMARD контролируют воспаление при РА, достигают клинической ремиссии или низкой активности заболевания, останавливают эрозивный процесс и приводят к частичному восстановлению эрозий костей.Однако эти препараты не могут вызвать полное заживление и регресс эрозий. Причиной этого, по-видимому, является остаточное воспаление суставов, несмотря на клиническую ремиссию. В вышеупомянутой модели РА на мышах воспаление подавляло дифференцировку и функцию остеобластов в местах эрозии костей [90], тогда как разрешение воспаления увеличивало количество зрелых остеобластов, заселяющих эти участки, и приводило к образованию новой кости и восстановлению эрозии [91]. . Другой причиной возможной неэффективности БПВП с точки зрения профилактики или регресса эрозий может быть наличие сопутствующего остеопороза [134].Кроме того, эрозии костей, которые прогрессировали у пациентов с РА, несмотря на лечение TNFi, характеризовались наличием воспаления (остита) на МРТ [122]. Таким образом, для полного восстановления эрозии рассматривалось применение остеоанаболиков наряду с лечением DMARD. Однако, хотя совместное введение паратгормона (ПТГ) и TNFi на мышиной модели РА привело к полной регрессии эрозий костей [96], совместное введение аналога ПТГ терипаратида и TNFi у пациентов с РА не привело к восстановлению эрозии [135, 136].Помимо терипаратида, деносумаб — еще один антиостеопоротический препарат, действие которого на эрозии костей при РА было изучено. Деносумаб представляет собой моноклональное антитело, нацеленное на RANKL, с антикатаболическим и антиостеокластогенным действием. Несколько исследований показали, что деносумаб останавливает эрозивный процесс при РА [137–139]. Более того, недавнее исследование показало, что деносумаб приводит к частичному восстановлению эрозий костей у пациентов с РА, поскольку он уменьшает их ширину, глубину и объем. Кроме того, деносумаб увеличивал минеральную плотность костной ткани на краю эрозии [140].
В последнее время ингибирование патогенетических механизмов, участвующих в эрозивном процессе, изучается в доклинических исследованиях как новая терапевтическая стратегия лечения РА. Блокада TLR4 моноклональным антителом на мышиной модели RA снижает инфильтрацию суставов остеокластами [68], тогда как блокада TLR5 ингибирует дифференцировку остеокластов и снижает эрозии костей в той же модели RA на мышах [58]. Более того, усиление сиалирования иммунных комплексов IgG с предшественником сиаловой кислоты N-acetylmannosamine (ManNAc) на мышиной модели RA привело к значительному снижению инфильтрации остеокластов в суставах и предотвратило образование эрозий костей [76].Кроме того, ингибирование miR-223 на мышиной модели RA ослабляло остеокластогенез и уменьшало эрозии костей [83], тогда как введение miR-146 уменьшало инфильтрацию остеокластов и предотвращало разрушение кости [87]. Сходным образом введение miR-124 подавляло экспрессию NFATc1 и RANKL, ингибировало остеокластогенез, уменьшало количество остеокластов и ослабляло разрушение костей [89]. Однако это доклинические исследования на животных моделях РА. Необходимы клинические исследования, чтобы определить, эффективны ли эти стратегии при лечении РА и профилактике эрозий костей.
Генная терапия в РА
Кроме того, появились новые инновационные терапевтические подходы к лечению РА, включая генную терапию и клеточную терапию. Несколько генов-мишеней были изучены для генной терапии РА. В двойном слепом плацебо-контролируемом исследовании фазы 1 аденоассоциированный вирусный вектор, содержащий ген антагониста TNF, вводили внутрисуставно пациентам с RA. Было обнаружено, что он безопасен и хорошо переносится, но не показал превосходства над плацебо после 12 недель наблюдения [141].В другом клиническом исследовании два пациента с РА получали генную терапию ex vivo с геном антагониста рецептора IL-1 (IL-1Ra). Аутологичные синовиальные фибробласты трансдуцировали ретровирусом, несущим IL-1Ra, а затем инъецировали в артритные суставы пациентов. Через 4 недели боль и отек в суставах, пораженных артритом, уменьшились, в то время как в синовиальной оболочке была измерена повышенная экспрессия IL-1Ra и сниженная экспрессия IL-1 и матриксной металлопротеиназы-3 [142]. В более недавнем исследовании на животной модели РА ген IL-1Ra трансфицировали в мезенхимальные стволовые клетки (МСК), которые затем инкапсулировали в микрокапсулы альгинат-поли-L-лизин (АРА).Было показано, что микрокапсулы APA, содержащие МСК, модифицированные геном IL-1Ra, ослабляют артрит на крысиной модели RA [143]. IL-10 представляет собой противовоспалительный цитокин, который также изучался в генной терапии RA. Наночастицы, содержащие плазмидную ДНК, кодирующую IL-10, вводили в крысиную модель RA, что приводило к значительному снижению системной и совместной экспрессии провоспалительных цитокинов (TNF, IL-1 и IL-6), а также к ослаблению воспаление и поражение суставов [144].
Помимо цитокинов, кальциевые каналы также изучались в качестве генов-мишеней при РА.CD4 T-клетки пациентов с РА экспрессируют повышенные уровни кальциевых каналов, активируемых высвобождением кальция (CRAC), что приводит к усилению притока Ca 2+ и экспрессии провоспалительных цитокинов [145]. Системное подавление гена CRACM3 на мышиной модели RA с использованием лентивирусных векторов, содержащих короткую шпилечную РНК, нацеленную на этот конкретный ген, привело к значительному снижению экспрессии цитокинов (включая TNF, IL-2, IL-6, Il-17), заметному ослаблению. степени тяжести артрита, а также значительное снижение воспалительной инфильтрации, образования паннуса, деструкции хряща и эрозий костей [146].Таким образом, генная терапия при РА показала свою эффективность в нескольких доклинических и некоторых клинических исследованиях, и это многообещающий подход к лечению РА. Однако необходимы дополнительные исследования, чтобы получить больше информации о фармакокинетике и вопросах безопасности, прежде чем генная терапия РА войдет в клиническую практику [147].
Клеточная терапия в РА
Еще одна новая область в терапии РА — клеточная терапия; мезенхимальные стволовые клетки и дендритные клетки изучались в последние годы на предмет их потенциала в лечении РА.Таким образом, было показано, что системное введение мезенхимальных стволовых клеток (МСК) пациентам с РА и на животных моделях РА оказывает противовоспалительное и иммуномодулирующее действие. Действительно, было показано, что трансплантация МСК снижает количество Т-клеток CD4, экспрессирующих GM-CSF [148], а также количество Т-фолликулярных хелперных клеток [149] и клеток CD4 Th2 и Th27 [150], которые играют центральную роль. роль в патогенезе РА. Кроме того, введение МСК приводит к увеличению количества регуляторных Т-клеток в дренирующих лимфатических узлах [148].Таким образом, системное введение МСК на животных моделях РА снижает тяжесть артрита, поскольку уменьшает синовит, образование паннуса и разрушение хрящей и костей [148, 150]. Кроме того, МСК ослабляют локальную деструкцию костей, околосуставную и системную потерю костной массы в моделях RA на животных, ингибируя RANKL-индуцированный остеокластогенез [151]. В двух клинических испытаниях изучали введение МСК пациентам с РА, которые не ответили на стандартную терапию. В первый вошли 172 пациента с РА, которые получали МСК пуповины человека (UC-MSCS) плюс DMARD или только DMARD.Никаких серьезных побочных эффектов не наблюдалось, и UC-MSC снижали уровни TNF и IL-6 в сыворотке, увеличивали популяцию регуляторных Т-клеток в периферической крови и вызывали значительную ремиссию РА [152]. Недавно проведенное многоцентровое, рандомизированное, одинарное слепое (двойное слепое для оценки эффективности) плацебо-контролируемое клиническое исследование фазы Ib / IIa показало безопасность аллогенных МСК, полученных из жировой ткани, у 53 пациентов с активным рефрактерным РА. Кроме того, он продемонстрировал тенденцию к клинической эффективности МСК [153].
Толерогенные дендритные клетки также были изучены как новый терапевтический подход к РА. Дендритные клетки (ДК) играют ключевую роль в иммунной системе, поскольку они представляют антигены Т-клеткам. Толерогенные DC представляют антигены без адекватной костимуляции, что приводит к анергии Т-клеток, делеции клонов, индукции регуляторных Т-клеток и, в конечном итоге, к толерантности к антигенам. Ren et al. инкубировали незрелые DC с такролимусом, чтобы получить толерогенные DC, а затем вводили их мышиной модели RA.Толерогенные ДК ослабляли развитие артрита и изменяли популяцию Т-лимфоцитов CD4, способствуя Th2 и подавляя дифференцировку Th27 [154]. В другом полклиническом исследовании Zhang et al. вводили экспрессирующие IL-10 и TGF-бета ДК мышиной модели RA и продемонстрировали, что эти клетки уменьшали артрит, уменьшали эрозию хрящей и костей, ингибировали дифференцировку Th27 и индуцировали образование регуляторных Т-клеток [155]. Кроме того, Park et al. обнаружили, что толерогенные полузрелые DC улучшают артрит на мышиной модели RA, увеличивая популяцию регуляторных Т-клеток и подавляя иммунитет Th2 / Th27 [156].Кроме того, в ходе клинического испытания фазы 1 были получены толерогенные ДК путем обработки ДК ингибитором NF-κΒ и воздействия на них четырех цитруллинированных пептидных антигенов. Затем DC вводили внутрикожно 18 пациентам с РА, которые были HLA-DRB1 и ACPA-положительными. Иммунотерапия хорошо переносилась, увеличивалась популяция регуляторных Т-клеток и снижалась активность заболевания [157]. Недавно в другом клиническом исследовании фазы 1 оценивалась безопасность внутрисуставных аутологичных толерогенных ДК у пациентов с РА и воспалительным артритом.Толерогенные ДК инкубировали с аутологичной синовиальной жидкостью в качестве источника аутоантигенов, а затем вводили пациентам артроскопически. Было продемонстрировано, что внутрисуставная толерогенная терапия ДК безопасна, хотя клинических или иммуномодулирующих эффектов в периферической крови обнаружено не было [158].
Таким образом, мезенхимальные стволовые клетки и толерогенные дендритные клетки продемонстрировали многообещающие результаты в доклинических и предварительных клинических исследованиях. Они обладают иммуномодулирующим действием, и их применение на ранних стадиях РА может привести к ремиссии.Однако необходимы более масштабные клинические исследования, чтобы получить больше доказательств их эффективности и безопасности.
Заключение
Эрозии костей развиваются на ранних стадиях РА и указывают на худший прогноз. Они постепенно ухудшаются и вызывают повреждение суставов, что приводит к нарушению функциональных возможностей и инвалидности. В последнее время значительное количество исследований расширило наше понимание патогенетических механизмов, участвующих в развитии эрозий костей при РА.Остеокласты являются ответственными клетками, и было выявлено множество факторов, стимулирующих их дифференцировку и функцию. RANKL и другие цитокины, как известно, усиливают остеокластогенез уже давно, но недавно была выявлена роль и других путей. Таким образом, нарушение регуляции механизмов врожденного иммунитета при РА — включая активацию сигнального пути ITAM и повышенную экспрессию Toll-подобных рецепторов в клетках-предшественниках остеокластов — приводит к усилению остеокластогенеза.Кроме того, антитела к цитруллинированному белку связываются с эпитопами цитруллинированного белка на клеточной мембране предшественников остеокластов и стимулируют их дифференцировку, в то время как иммунные комплексы аутоантител связываются с рецепторами на тех же клетках и также усиливают их дифференцировку. Кроме того, нарушение регуляции экспрессии микроРНК остеокластами и клетками синовиальной мембраны способствует усилению остеокластогенеза при РА. Помимо чрезмерного остеокластогенеза, нарушение дифференцировки и функции остеобластов также играет роль в формировании костной эрозии при РА.Воспаленная синовиальная мембрана продуцирует повышенные уровни цитокинов и антагонистов канонического сигнального пути Wnt, которые ингибируют дифференцировку и функцию остеобластов. Кроме того, более низкая продукция костных морфогенетических белков нарушает остеобластогенез.
Более глубокое понимание механизмов, способствующих развитию эрозий костей при РА, создало новые терапевтические цели. Существующие в настоящее время модифицирующие болезнь противоревматические препараты (БПВП) — синтетические или биологические — контролируют воспаление и активность заболевания, облегчают симптомы, останавливают развитие эрозий костей и могут даже частично восстанавливать некоторые из них.Однако DMARD никогда полностью не восстанавливают существующие костные эрозии. Нацеливание на патогенетические механизмы, участвующие в эрозивном процессе, может усилить терапевтический эффект БПВП и обеспечить профилактику и полное восстановление эрозий костей при РА. Существует небольшое количество доклинических исследований на животных моделях РА, указывающих на эффективность блокирования TLR4 и TLR5 в предотвращении эрозивного процесса, а также на эффективность усиления сиалирования иммунных комплексов, ингибирования miRNAs, которые способствуют остеокластогенезу, или введения miRNA, которые уменьшают остеокластогенез. .Кроме того, появились новые терапевтические подходы, включая генную терапию и клеточную терапию. Тем не менее, необходимы дополнительные доклинические и клинические исследования, чтобы подтвердить, являются ли эти терапевтические стратегии эффективными, безопасными и предотвращают прогрессирование заболевания и эрозии костей. Кроме того, учитывая, что низкая минеральная плотность костной ткани в кортикальном слое кости была связана с эрозиями костей у пациентов с РА, интересным подходом было бы лечение агентами, которые не только устраняют воспаление, но и улучшают состояние кортикального слоя кости [159].
Предотвращение эрозии костей путем эффективного лечения ревматоидного артрита
Эрозию костей, частый побочный эффект ревматоидного артрита, можно предотвратить, используя комбинацию тщательного наблюдения за пациентом и индивидуализированных терапевтических режимов, которые включают агенты, блокирующие цитокины, блокирующие остеокласты, или нацелены на аномальные клеточные реакции.
Эрозию костей, частый побочный эффект ревматоидного артрита, можно предотвратить, используя комбинацию тщательного наблюдения за пациентом и индивидуализированных терапевтических режимов, которые включают агенты, блокирующие цитокины, блокирующие остеокласты или нацеленные на аномальные клеточные реакции.
Эллен Граваллезе, доктор медицины, из Медицинской школы Массачусетского университета, обсуждала способы лечения ревматоидного артрита и предотвращения эрозии костей на конференции Американского общества исследования костей и минералов в 2014 году в Хьюстоне, штат Техас.
При ревматоидном артрите с поражением кисти суставные эрозии являются предиктором инвалидности. Эти аномалии в конечном итоге можно рассматривать как анатомические деформации, но они также могут быть идентифицированы на рентгенографии, когда прогрессирование носит субклинический характер. Параметры, связанные с повышенным риском рентгенологического прогрессирования, включают повышенные маркеры воспаления, эрозию костей при предъявлении, генетический риск, наличие или отсутствие аутоантител и курение.
Отек кости представляет собой воспаление костного мозга, и степень отека коррелирует с воспалением и эрозией. Итак, по мере того как воспаление проходит при лечении, уменьшается и отек. И наоборот, когда воспаление в костном мозге усиливается, это приводит к эрозии.
Д-р Граваллезе описал, как эффективный мониторинг пациентов с использованием биохимических, радиологических и клинических маркеров позволяет проводить индивидуальное лечение. В исследовании TICORA пациенты с ревматоидным артритом были рандомизированы для интенсивного лечения по сравнению с обычным лечением.Исследование показало, что пациенты, которые были оценены с использованием объективных инструментов (таких как клинические и рентгенологические данные) для оценки воспаления суставов, имели улучшенные результаты.
Доктор Гравалле также обсудил использование биомаркеров в лечении ревматоидного артрита. В одном исследовании, которое показало диссоциацию между клинической ремиссией и визуализацией, она сказала: «Я бы сказала, что не так важно, чтобы остеобласты залечивали участки эрозии, но заживление эрозий могло быть важным биомаркером».
В настоящее время существует три широких терапевтических класса, которые используются для лечения ревматоидного артрита: агенты могут блокировать цитокины, остеокласты или клетки. Терапевтические средства, которые блокируют цитокины, включают те, которые нацелены на IL-1, фактор некроза опухоли (TNF) и IL-6 (например, тоцилизумаб). Терапевтические агенты, которые имеют клеточные мишени, включают ритуксимаб (В-клетки), абатацепт (костимуляция Т-клеток) и тофацитиниб.
Хотя эти препараты имеют осложнения, включая инфекции и гиперлипидемию, таргетная терапия против определенных цитокинов является новым способом лечения пациентов с ревматоидным артритом.В клинические испытания в настоящее время включаются пациенты, которые ранее не принимали традиционное лечение.
Эрозии костей при ревматоидном артрите | Ревматология
Взгляд через край
Эта редакционная статья относится к сегментации и количественной оценке эрозий костей в наборах данных периферической количественной компьютерной томографии с высоким разрешением пястно-фаланговых суставов пациентов с ревматоидным артритом, проведенной Домиником Тёпфером и др., Rheumatology 2013; doiumatology 2013; doiumatology 2013; doiumatology 2013; doiumatology 2013; : 10.1093 / ревматология / ket259.
У пациентов с РА наличие, количество и размер эрозий костей и количество суставов с эрозиями на обычных рентгенограммах (CR) являются отличительными признаками для диагностики, определения стадии и прогнозирования прогрессирования повреждения и используются для мониторинга лечения в рандомизированном контролируемом режиме. учеба и в повседневной практике [1–3]. В этом выпуске Töpfer et al. [4] представляет метод точной трехмерной (3D) сегментации с использованием периферической количественной компьютерной томографии высокого разрешения (HRpQCT) для количественной оценки объема, площади поверхности и формы эрозий в суставах MCP у пациентов с РА.
Изучение эрозий костей в суставах является сложной задачей. Во-первых, наличие эрозий неспецифично для РА; они также обнаруживаются у здоровых людей и могут возникать при других заболеваниях суставов, таких как ПсА, ОА и кристаллических артропатиях, таких как подагра [3]. Во-вторых, CR является золотым стандартом для оценки эрозий костей в клинических испытаниях и повседневной практике, но по сравнению с УЗИ, МРТ и HRpQCT, это один из наименее чувствительных методов их обнаружения [5]. Кроме того, CR не обеспечивает 3D-оценку эрозий.В-третьих, РА — это мультикомпартментное заболевание, затрагивающее не только кортикальный край кости, но также костный мозг, синовиальную оболочку, хрящи и сухожилия [6]. Таким образом, более точная оценка наличия, количества и размера костных эрозий при РА является многообещающим шагом в понимании изменений в костном компартменте, особенно когда она может выполняться автоматически с высокой воспроизводимостью [4].
Какое клиническое значение имеет эрозия костей? Эрозия суставной кости — это радиологический термин, который относится к разрыву кортикальной кости с разрушением естественного барьера между внескелетной тканью и компартментами костного мозга, предпочтительно на оголенных участках суставов, на минерализованном хряще или рядом с ним. в местах прикрепления околосуставных связок и в местах вышележащих теносиновита [3].Небольшие костные каналы, которые пронизывают кортикальную кость и несут микрососуды, соединяющие внешнюю синовиальную мембрану и внутреннее пространство костного мозга, могут имитировать эрозии кости. Однако при РА эрозии костей сопровождаются потерей прилегающей губчатой и кортикальной кости и наличием отека костного мозга на МРТ в отличие от каналов кортикальных сосудов. Кроме того, отек костного мозга как проявление остита является сильным предиктором возникновения и прогрессирования эрозий костей в будущем.Наличие остита, богатой воспалительной костной ткани, содержащей плазму, Т- и В-клетки, которую можно рассматривать как вторичную лимфоидную ткань, указывает на то, что компонент костного мозга существенно участвует в возникновении воспаления и эрозий костей [3].
При РА воспалительные клетки и цитокины вызывают дисбаланс в локальном обмене костной ткани, что приводит к усилению резорбции остеокластической кости, вызывая потерю кортикальной и трабекулярной кости (эрозию и исчезновение прилегающей губчатой кости), подавляет образование остеобластной кости в остеите, так что он редко восстанавливается. и усиление образования окружающей кости (склероз) [3].Сочетание этих характеристик хорошо видно на изображениях, представленных Töpfer et al. [4], а также у одного из наших пациентов с РА в проекте MosaHand (рис. 1).
Рис. 1
Пример эрозии кости в суставе MCP у пациента с РА по данным HRpQCT.
Обратите внимание на сочетание кортикального разрыва (эрозии), интрамедуллярного исчезновения прилегающей губчатой кости и перилезионного склероза (изображение исследования MosaHand, Медицинский центр Маастрихтского университета).
Рис. 1
Пример эрозии кости в суставе MCP у пациента с РА по данным HRpQCT.
Обратите внимание на сочетание кортикального разрыва (эрозии), интрамедуллярного исчезновения прилегающей губчатой кости и перилезионного склероза (изображение исследования MosaHand, Медицинский центр Маастрихтского университета).
С этими новыми взглядами на РА и возможностью визуализации с высоким разрешением с помощью HRpQCT, клиническое значение эрозий костей смещается от клинического инструмента к более сложным неинвазивным методам описания и исследования патологии суставов [7].У здоровых людей эрозии костей связывают с восстановлением микроповреждений, вызванных механическим напряжением в связках вокруг суставов [8]. Напротив, при раннем РА эрозии костей позволяют компоненту костного мозга вносить вклад в деструкцию и воспаление костей [6], в то время как на более поздних этапах заболевания деструкция костей является одним из компонентов, которые способствуют разрушению суставов, помимо разрушения хрящей, сухожилий и других тканей. связки [1]. В этом контексте предполагается несколько сценариев [3].Во-первых, если предположить, что движущей силой является синовит, воспалительные цитокины и ACPA привлекают циркулирующие предшественники остеокластов, такие как дендритные клетки, которые могут дифференцироваться в остеокласты из кровотока по направлению к суставу или местным воспалительным клеткам. Комбинация ACPA и активных остеокластов приводит к образованию эрозий в результате синовита по направлению к кости по сценарию «снаружи внутрь». Во-вторых, когда причиной считается остит, ACPA, продуцируемая В-клетками в костном мозге, активирует остеокласты, что приводит к потере околосуставной кости и перфорации в чрезвычайно тонкой коре головного мозга внутри и вокруг оголенной области суставов (сценарий «наизнанку»).В-третьих, у пациентов с эрозиями из-за механического стресса до возникновения РА или после того, как эрозии развились во время болезни, оба сценария возможны и могут усиливать друг друга.
Недавно было высказано предположение, что сохранение структурной целостности сустава при ПР, а не подавление прогрессирования поражений сустава при ПР должно быть основой для изучения новых методов лечения РА [9]. Учитывая высокий уровень эффективности HRpQCT для выявления и количественной оценки эрозий костей более подробно и, вероятно, на более ранней стадии, как показано Töpfer et al. [4], HRpQCT может быть хорошей альтернативой CR для этой цели.
Однако необходимы дальнейшие исследования с использованием HRpQCT у пациентов с ранним RA и у субъектов с ACPA без клинического RA. В самом деле, остеокласты при RA имеют различное происхождение и функции [10]. Ввиду сложных изменений суставов при РА важно изучить наличие, расположение, размер и количество эрозий, обнаруженных с помощью HRpQCT, в зависимости от клинических параметров, а также в контексте других аспектов поражения суставов, которые могут теперь можно оценивать с помощью других доступных методов, таких как структура кортикальной и губчатой кости (с помощью цифровой рентгеновской абсорбциометрии, рентгенографии высокого разрешения, двухэнергетической абсорбциометрии), остита (с помощью МРТ), вовлечения синовиальной ткани (толщина синовиальной оболочки, васкуляризация и выпот с помощью УЗИ и МРТ), деструкции хряща (с помощью CR, MRI и HRpQCT), энтезита (с помощью MRI и US) и тендинита (с помощью MRI и US).
Эти методы позволяют детально оценить мелкие суставы рук и, вместе с полуавтоматическим анализом с высокой воспроизводимостью с использованием HRpQCT с 3D-изображением высокого разрешения, они открывают окно возможностей для лучшего понимания степени и времени повреждение суставов в различных отделах не только при РА, но также при микроповреждениях у здоровых субъектов и при других заболеваниях, поражающих суставы рук, таких как ПсА и ОА кисти. Если заглянуть за грань эрозии, действительно можно увидеть ее содержание.
Заявление о раскрытии информации : Авторы заявили об отсутствии конфликта интересов.
Список литературы
1« и др.Какое клиническое значение имеют эрозии и сужение суставной щели при РА?
,Nat Rev Rheumatol
,2012
, vol.8
(стр.117
—20
) 2« и др.EULAR определение эрозивного заболевания в свете критериев классификации ревматоидного артрита ACR / EULAR 2010
,Ann Rheum Dis
,2013
, vol.72
(стр.479
—81
) 3,.Эрозия кости при ревматоидном артрите: механизмы, диагностика и лечение
,Nat Rev Rheumatol
,2012
, vol.8
(стр.656
—6
) 4« и др.Сегментация и количественная оценка эрозий костей в наборах данных периферической количественной компьютерной томографии высокого разрешения пястно-фаланговых суставов пациентов с ревматоидным артритом
,Ревматология
,2014
, vol.53
(стр.65
—71
) 5« и др.Сравнение эффективности сонографии, магнитно-резонансной томографии и традиционной рентгенографии для выявления эрозий костей у пациентов с ревматоидным артритом: систематический обзор и метаанализ
,Ревматология
,2011
, vol.50
(стр.1137
—47
) 6« и др.Воспалительные поражения костного мозга у пациентов с ревматоидным артритом: морфологическая перспектива
,Arthritis Res Ther
,2012
7.Отек костного мозга и остит при ревматоидном артрите: перспективы визуализации
,Arthritis Res Ther
,2012
, vol.14
стр.224
8« и др.Микроанатомические исследования для определения прогностических факторов топографии образования околосуставных эрозий при воспалительном артрите
,Arthritis Rheum
,2009
, vol.60
(стр.1042
—51
) 9,,.От подавления рентгенологического прогрессирования к поддержанию структурной целостности: методологическая основа для рентгенологического прогрессирования в клинических испытаниях ревматоидного артрита и псориатического артрита
,Ann Rheum Dis
,2013
, vol.72
(стр.1113
—7
) 10« и др.Остеокласты в РА: различное происхождение и функции
,Костный сустав
,2013
© Автор, 2013. Опубликовано Oxford University Press от имени Британского общества ревматологов. Все права защищены.
