Статьи, тезисы клиники «Нейрохирургия детского возраста» ФГУ РНХИ им. проф. А.Л. Поленова
ФОКАЛЬНАЯ КОРКОВАЯ ДИСПЛАЗИИ У ДЕТЕЙ С МЕДИКАМЕНТОЗНО-РЕЗИСТЕНТНОЙ ЭПИЛЕПСИЕЙ
Изучение результатов хирургического лечения медикаментозно-резистентной эпилепсии (МРЭ) у детей и подростков с гистологически подтвержденной фокальной корковой дисплазией (ФКД).
Проанализированы результаты хирургического лечения 68 пациентов с МРЭ и ФКД в зависимости от локализации процесса, характера приступов и операции. Возраст больных варьировал от 1 до 18 лет (9+4,6). Лиц мужского пола было 51,5%. Всем проводилось неврологическое, нейроофтальмологическое, нейропсихологическое обследование, ЭЭГ, КТ, МРТ, МРТ с сосудистой программой, ПЭТ, ОФЭКТ, нейросонография, церебральная ангиография и ультразвуковая допплерография. Полнота резекции эпилептогенных зон интраоперационно оценивалась по результатам ЭКоГ.
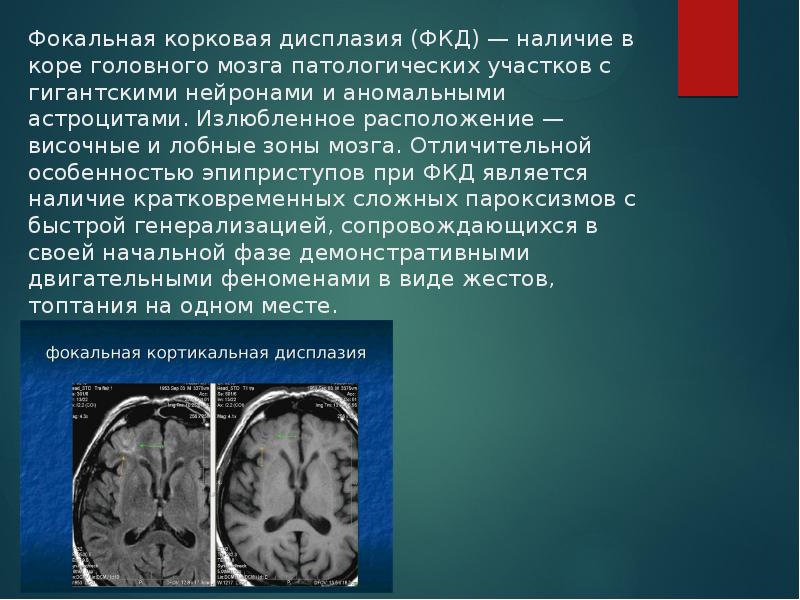
По данным МРТ у 66 (97%) пациентов выявлены изменения характерные для корковой дисплазии.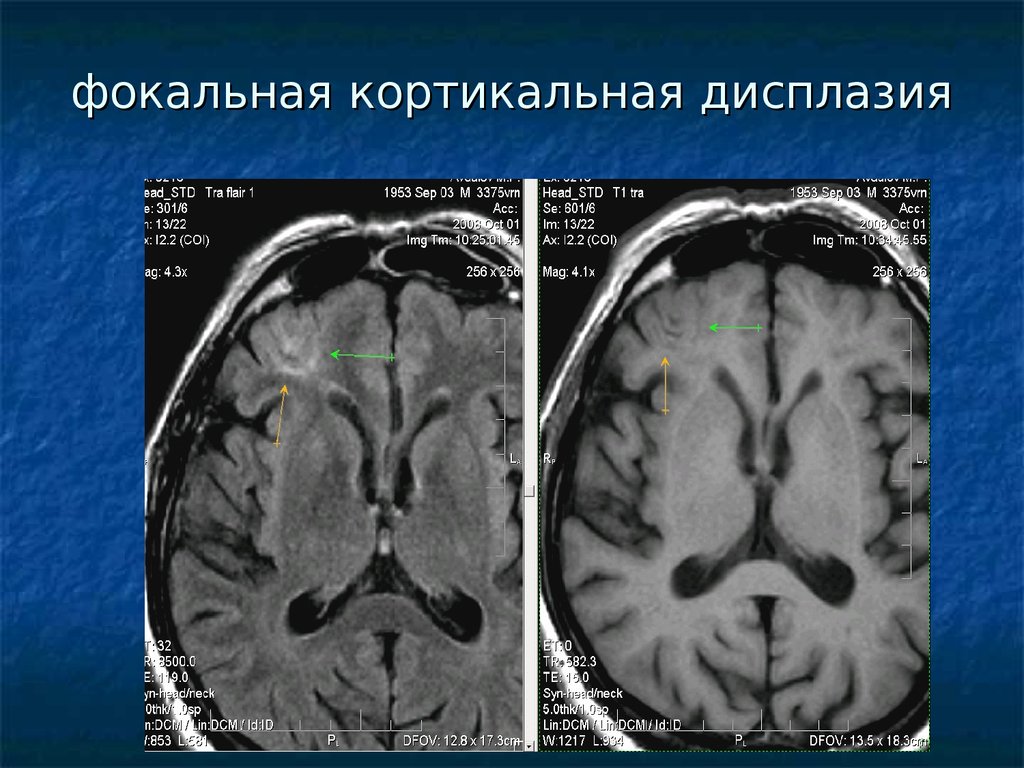
Анализ исходов хирургического лечения МРЭ у детей и подростков с ФКД выявлено, что у значительной части наблюдений отмечается прекращение эпилептических припадков. Результаты отмечены при полной резекции эпилептического очага, а множественные субпиальные транссекции и неполное удаление эпилептогенного очага уменьшает процент хороших результатов. Следовательно, удаление ФКД при лечении МРЭ при прочих равных условиях должно быть полнее.
Всего 33 статей
1. «Малоинвазивные вмешательства в лечении коллоидных кист»;
«Малоинвазивные вмешательства в лечении коллоидных кист»;
2. «Нейроэндоскопия в детской практике»;
3. Эндоскопические вмешательства как альтернатива шунтирующим операциям в детской хирургии. В.А. Хачатрян, К.А. Самочерных, А.В. Ким;
4. Хирургическое лечение корковой дисплазии у детейс медикаментозно-резистентной эпилепсией.В.А. Хачатрян, К.Э.Лебедев, Л.П. Лассан
5. Остеопластическая ламинотомия при лечении заболеваний спинного мозга у детей Коммунаров В.В., Самочерных К.А.;
6. Проблема хирургического лечения парастволовых новообразований мозга у детей. Хачатрян В.А., Ким А.В.;
7. Вентрикулосинустрансверзостомия при лечении гидроцефалии. Хачатрян В.А., Ким А.В., Коммунаров В.В., Самочерных К.А.;
8. Проблема хирургии эпилепсии;
9. Инфратенториальный супрацеребеллярный доступ;
10. К проблеме хирургического лечения гидроцефалии. Хачатрян В.А., Себелев К.И., Самочерных К.А., Ким А.
11. Вопросы диагностики гидроцефалии у детей с сопутствующей соматической патологией на догоспитальном этапе. Сахно Л.В.;
12. Течение пароксизмального синдрома у больных с кистой червя мозжечка и большой цистерны мозга. Хачатрян В.А., Самочерных К.А., Ким А.В., Лебедев К.Э. ;
13. Хирургическое лечение пациентов детского возраста при повторном росте астроцитом больших полушарий головного мозга. А.В. Ким;
14. ТОТАЛЬНАЯ ХИРУРГИЯ В ДЕТСКОЙ НЕЙРОХИРУРГИИ. А.В. Хачатрян;
15. Малоинвазивная нейрохирургия в лечении кист больших полушарий мозга с гидроцефалией
16. Нейроэндоскопия в лечении аномалии Денди-Уолкера у детей;
17. К ВОПРОСУ О ХИРУРГИЧЕСКОМ ЛЕЧЕНИИ ОПУХОЛЕЙ МОЗГА У ДЕТЕЙ;
18. ХИРУРГИЧЕСКИЕ ПРОБЛЕМЫ ЭПИЛЕПСИИ;
19. РАСПРОСТРАНЕННОСТЬ УШИБА ГОЛОВНОГО МОЗГА ЛЕГКОЙ СТЕПЕНИ ТЯЖЕСТИ СРЕДИ ДЕТЕЙ;
20. Результаты лечения детей с диастематомиелией в нейрохирургической клинике;
21.
 Результаты хирургического лечения детей с миелодислазией ;
Результаты хирургического лечения детей с миелодислазией ;22. ЭФФЕКТИВНОСТЬ ЭЛЕКТРОФИЗИОЛОГИЧЕСКОГО МОНИТОРИНГА ПРИ УДАЛЕНИИ ОПУХОЛЕЙ у детей;
23. ОСОБЕННОСТИ ПРОЯВЛЕНИЙ И ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ОПУХОЛЕЙ У ДЕТЕЙ ПЕРВЫХ 2 ЛЕТ;
24. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ВИСОЧНОЙ ЭПИЛЕПСИИ У ДЕТЕЙ
25. ФОКАЛЬНАЯ КОРКОВАЯ ДИСПЛАЗИИ У ДЕТЕЙ С МЕДИКАМЕНТОЗНО-РЕЗИСТЕНТНОЙ ЭПИЛЕПСИЕЙ;
26. НЕКЛАССИЧЕСКИЕ ЛИКВОРОШУНТИРУЮЩИЕ ОПЕРАЦИИ В ЛЕЧЕНИИ ГИДРОЦЕФАЛИИ;
27. ДОРСОЛАТЕРАЛЬНЫЙ ДОСТУП К ВНУТРИСТВОЛОВЫМ ОПУХОЛЯМ МОЗГА У ДЕТЕЙ. ;
28. ГИДРОЦЕФАЛИЯ;
29. ОПТИМАЛЬНАЯ ХИРУРГИЯ СТВОЛОВЫХ И ПАРАСТВОЛОВЫХ НОВООБРАЗОВАНИЙ МОЗГА ;
30. Особенности хирургической тактики при арахноидальных кистах больших размеров ;
31. Биомеханика мозга при краниокоррегирующих вмешательствах;
32. Современный подход к малоинвазивной нейрохирургии;
33. Организация нейрохирургической помощи «детская нейрохирургия» в Украине
Фокальная корковая дисплазия, тип IIIa, у больного с задержкой психического развития и эпилептическим синдромом
Радиологические научные достижения последних лет революционизировали наши представления о происхождении фокальной корковой дисплазии (ФКД), ее видах и терапии эпилептических синдромов.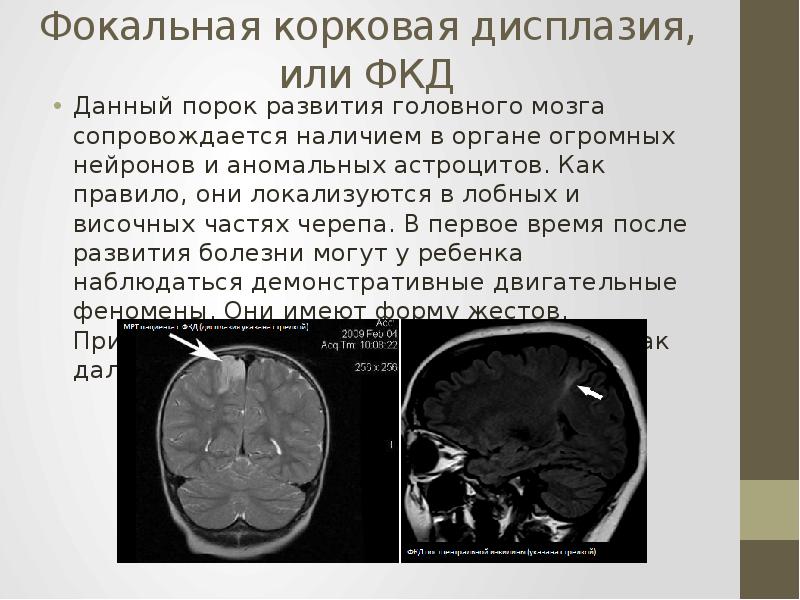 Согласно многочисленным исследованиям, наиболее частым проявлением ФКД является эпилептический синдром, возникающий как у детей, так и у взрослых. С нашей точки зрения, эпилептическому синдрому у детей при ФКД очень часто сопутствует синдром задержки психического развития или когнитивных расстройств. Более того, отмечено, что задержка психического развития доминирует при определенных типах ФКД. Она проявляется после рождения и в течение какогото периода времени является единственным синдромом, а затем могут появиться эпиприступы. Однако на такой клинический аспект, как задержка психического развития или когнитивные расстройства, клиницисты не очень обращают внимание.
Согласно многочисленным исследованиям, наиболее частым проявлением ФКД является эпилептический синдром, возникающий как у детей, так и у взрослых. С нашей точки зрения, эпилептическому синдрому у детей при ФКД очень часто сопутствует синдром задержки психического развития или когнитивных расстройств. Более того, отмечено, что задержка психического развития доминирует при определенных типах ФКД. Она проявляется после рождения и в течение какогото периода времени является единственным синдромом, а затем могут появиться эпиприступы. Однако на такой клинический аспект, как задержка психического развития или когнитивные расстройства, клиницисты не очень обращают внимание.
Фокальная корковая дисплазия впервые была подробно описана Taylor et al. (1971). Было сообщено о 10 пациентах с медикаментозной резистентностью эпилепсии, которым была произведена хирургическая резекция (Taylor et al., 1971). Микроскопические исследования показали своеобразные анатомические изменения (дезорганизацию) коры головного мозга, включая большие «причудливые» нейроны.
ФКД отмечаются в различных отделах коры головного мозга. Они имеют разный размер и местоположение и различную архитектонику. Например, ФКД типа II чаще встречается в лобных областях. Если область ФКД небольшая, у пациентов нет симптомов тяжелого неврологического дефицита, а основным клиническим проявлением является эпилептический синдром. Припадки могут начаться в любом возрасте (как правило, в раннем детстве) и обладают выраженной резистентностью к антиконвульсантам. Вид эпилепсии зависит от места расположения ФКД и ее типов. В частности, при I и II типе дисплазии, как правило, спонтанная электрическая активность более высокая и захватывает другие участки мозга. Это в последующем проявляется нарушением поведения, особенно у тех, у кого эпиприступы появились в раннем возрасте, особенно неблагоприятным, если ФКД локализуется в височной области.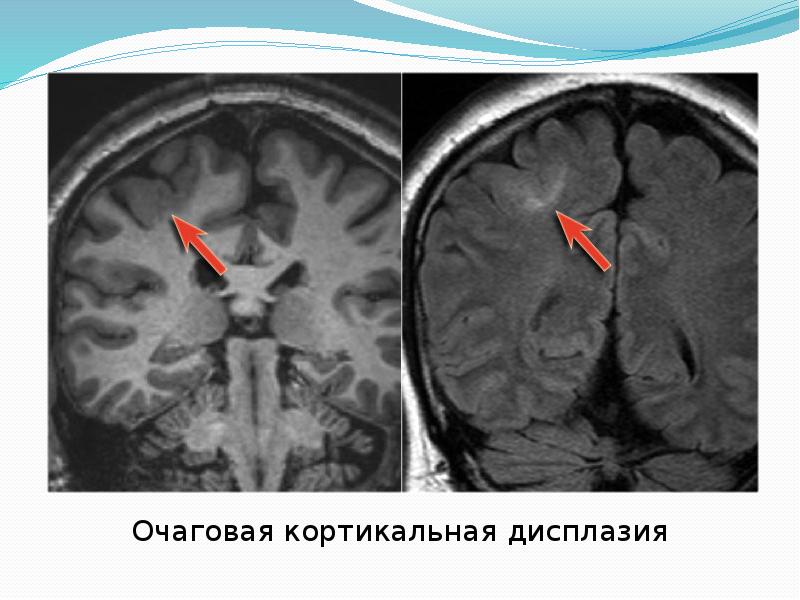
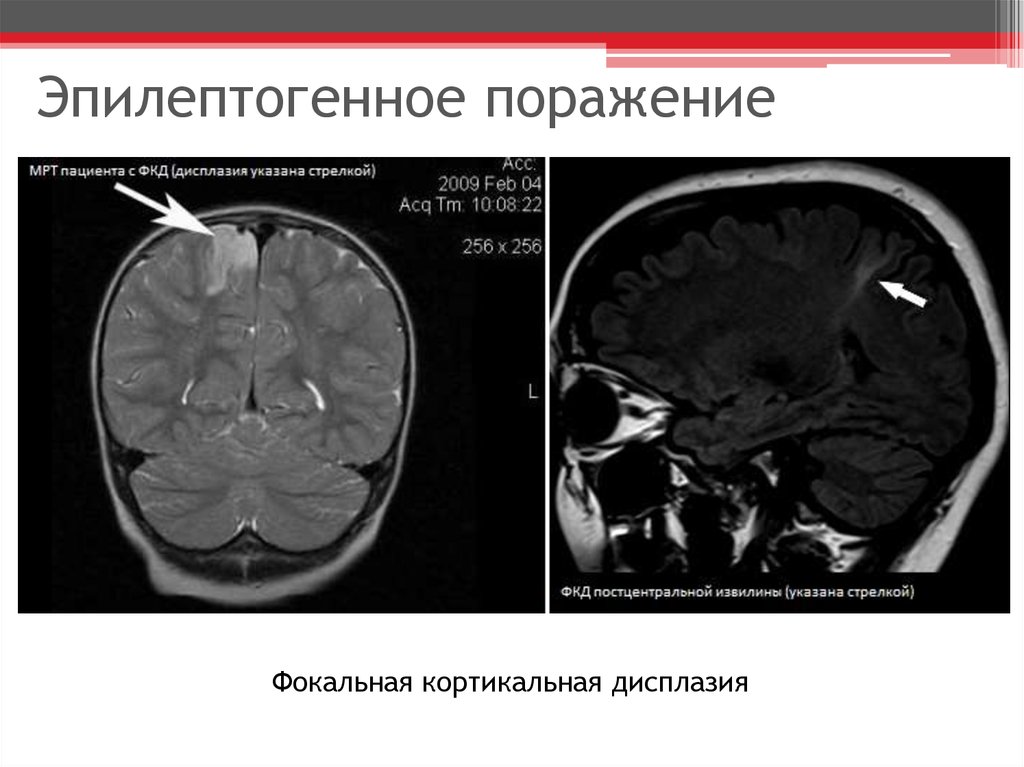
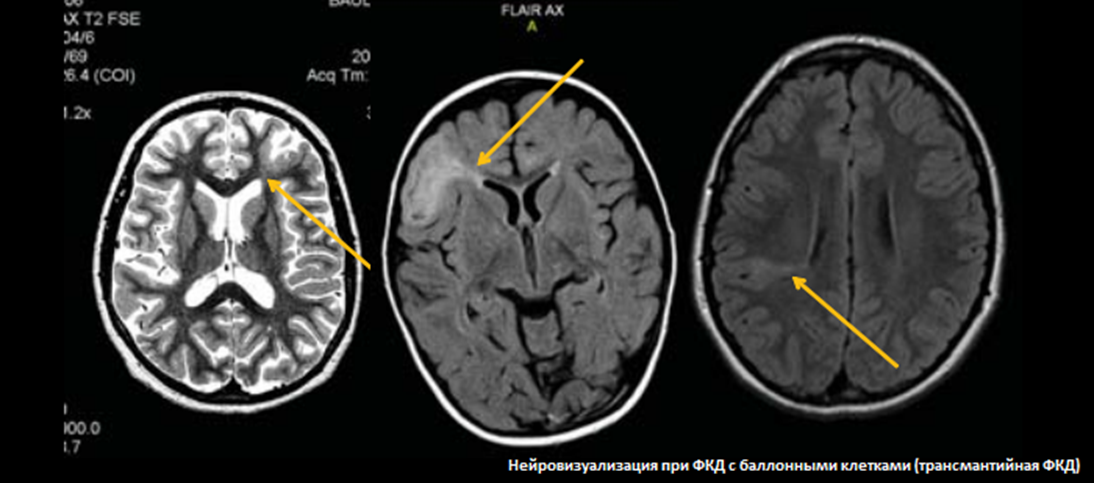
При гистологическом исследовании очагов ФКД обнаруживают: «баллонообразные» клетки (или клетки, напоминающие воздушный шар), нейроны больших размеров, гетеротопионы, участки полимикрогирии, нейроны в молекулярном слое, гетеротопические нейроны белого вещества, кортикальную дезорганизацию. Но проведение этого исследования в практической деятельности врача весьма затруднено. Поэтому во многих случаях эпилептогенные очаги диагностируются только с помощью магнитнорезонансной томографии (МРТ) (Barkovich et al., 2005).
Существуют достаточно четкие и чувствительные визуализационные маркеры, по которым можно надежно различать подтипы ФКД. Нейровизуализационные характеристики (маркеры) ФКД являются очень важным компонентом клинической оценки (Barkovich et al., 2005; Colombo et al., 2009; Lerner et al., 2009). Такими маркерами могут быть увеличение толщины коры, размытые границы серобелого вещества, фокальное усиление сигнала на T2взвешенных изображениях, радиальноориентированные или конусные трансмантийные полосы T2гиперинтенсивности, участки «разряженной» коры, локальные участки атрофии мозга и др.
В течение последних 15 лет было предложено много разных классификаций ФКД.
Международная группа исследователей ILAE представила проект классификации ФКД, в которой ранжирована электроклиническая характеристика различных видов ФКД. В классификацию включен достаточно широкий спектр гистопатологических изменений при данной патологии.
В проекте классификации группа иследователей ILAE предлагает трехуровневую систему ФКД. К ФКД, тип I, относятся изолированные очаги, в которых присутствуют радиальные (ФКД типа Ia) или тангенциально расположенные (ФКД типа Ib) дисламинации в неокортексе, микроскопически выявленные в одном или нескольких слоях коры. ФКД, тип II, является изолированным дисламинационным расстройством участка коры головного мозга без «баллонообразных» клеток (тип IIa) или с «балонообразными» клетками (balloon cells) (тип IIb).
Основным новшеством предложенной классификации является введение ФКД типа III. При этой ФКД у больного всегда имеется гиппокампальный склероз (ГС) в различных сочетаниях: ФКД, тип IIIa, — ГС в сочетании с нарушением ламинации коры головного мозга в височной области; ФКД, тип IIIb, — ГС в сочетании с эпилепсияассоциированными глиальными и глионейрональными опухолями; ФКД, тип IIIc, — ГС в сочетании с сосудистой мальформацией; диагноз ФКД, тип IIId, может быть поставлен при наличии ГС в сочетании с эпилептогенным поражением, приобретенным в ранний период жизни (травматические повреждения, ишемические повреждения или энцефалит).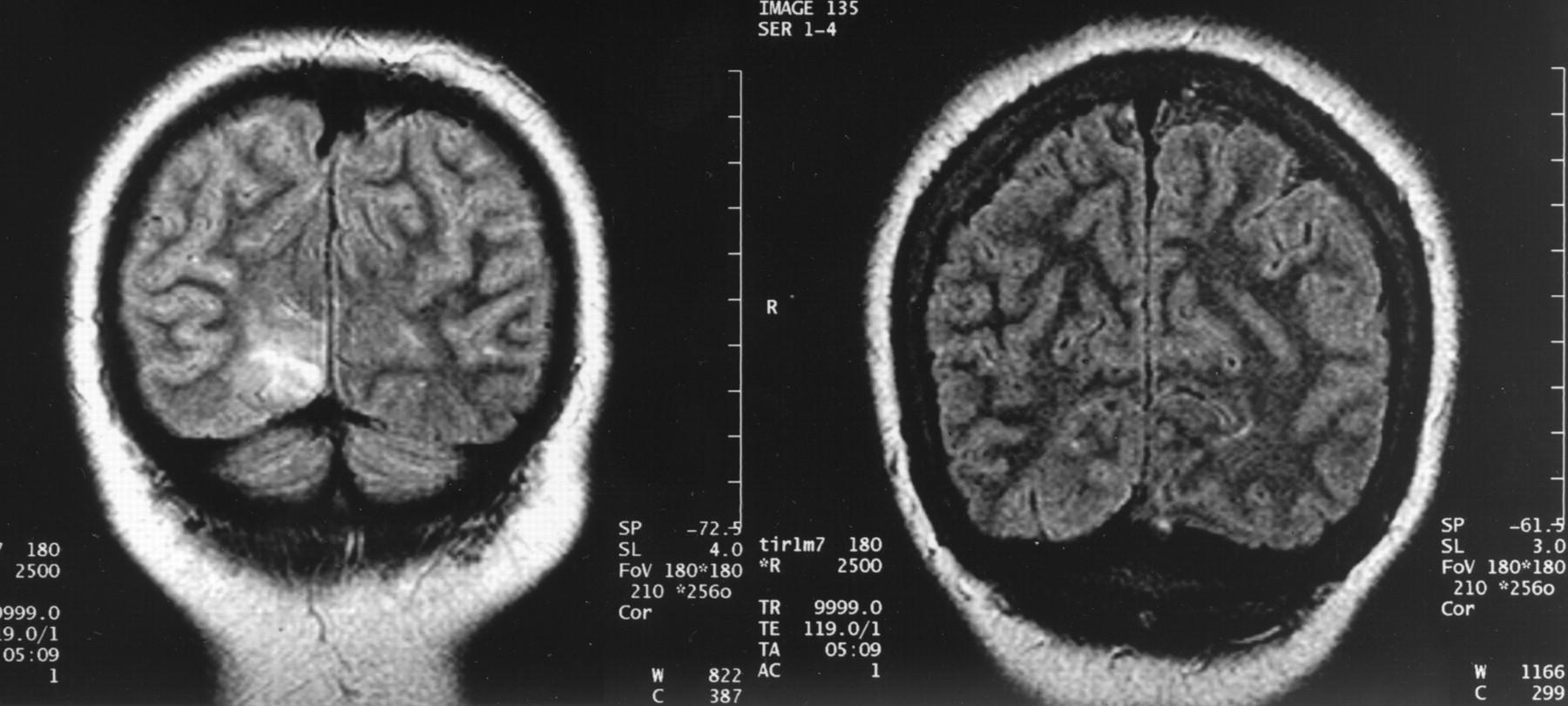
Эта трехуровневая система классификации станет важной основой для оценки радиологических изображений, электроклинических данных, контроля приступов после хирургического лечения, а также для изучения молекулярного патомеханизма при ФКД.
С нашей точки зрения, наиболее узнаваемым при проведении МРТ является ФКД, тип IIIa, так как явления гиппокампального склероза визуализируются на рутинных T2взвешенных изображениях. Гистологически при ФКД, тип IIIa, в коре височной области обнаруживают изменения архитектоники коры в виде дисламинации (отсутствие 2го и 4го слоя клеток) или цитоархитектоники (строения самой клетки) в виде гипертрофии 5го внешнего слоя клеток, неизменно сопровождающиеся гиппокампальным склерозом. Этиология и патогенез ФКД типа IIIa до конца не определены. Авторы классификации считают, что гиппокампальный склероз и корковые дисплазии являются отдельным вариантом ФКД.
Приводим пример необычного случая — двустороннего расположения ФКД, тип IIIa. Ребенок К. , 7 месяцев, находился в неврологическом отделении областной детской клинической больницы г. Донецка. При поступлении жалобы родителей на частые приступы в виде пропульсий в течение дня (по 5–7 серий в сутки), задержку развития.
, 7 месяцев, находился в неврологическом отделении областной детской клинической больницы г. Донецка. При поступлении жалобы родителей на частые приступы в виде пропульсий в течение дня (по 5–7 серий в сутки), задержку развития.
Anamnesis morbi. С первых месяцев жизни отстает в психическом развитии. В возрасте 4 месяцев появились редкие приступы миоклоний в виде пропульсий, которые родители не расценивали как судороги.
Anamnesis vitae. Родился от 1й беременности, протекавшей с токсикозом и угрозой срыва в первой половине. Роды досрочные в 37 недель путем экстренного кесарева сечения. Масса тела при рождении — 2500 г. После рождения ребенку проводились реанимационные мероприятия.
В неврологическом статусе: взгляд не фиксирует, не следит, на имя не реагирует, к игрушке не тянется, мать не знает, не сидит. Выпрямляющие рефлексы с туловища на голову и с головы на туловище сформированы. Отмечается асимметрия носогубных складок, мышечный тонус соответствует возрасту.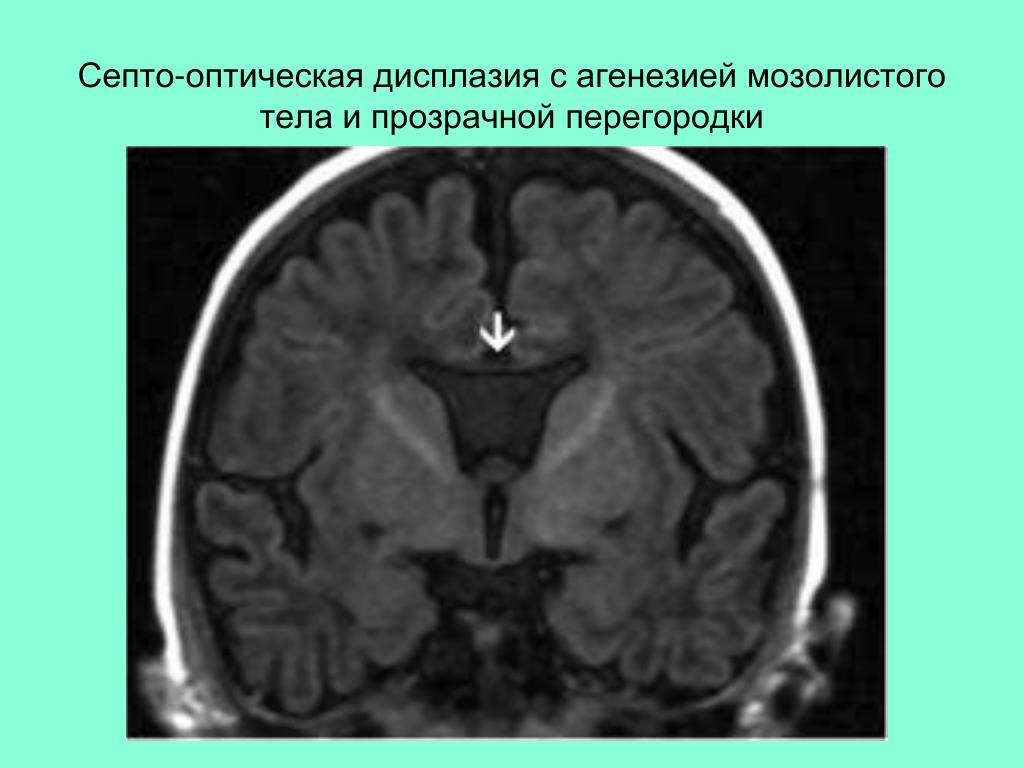 Сухожильнопериостальные рефлексы живые, равны. На коже левого бедра ахроматический невус (заключение дерматолога). В области копчика — дермоидные синусы.
Сухожильнопериостальные рефлексы живые, равны. На коже левого бедра ахроматический невус (заключение дерматолога). В области копчика — дермоидные синусы.
Данные дополнительного обследования:
1. Анализы крови, мочи (общие), билирубин, кальций, фосфор — без патологических изменений.
2. ЭКГ: вертикальная электрическая позиция сердца. Синусовая тахикардия.
3. ЭхоКГ: дополнительная хорда в левом желудочке.
4. Заключение осмотра окулиста: диски зрительных нервов бледные.
5. ЭЭГ: на фоне выраженных неспецифических диффузных изменений биоэлектрической активности мозга независимо друг от друга регистрируются частые пики над задними отделами обоих полушарий с максимумом в затылочных и задневисочных отведениях с вариабельным распространением кпереди. Разряды чаще и больше по амплитуде справа.
6. УЗИ органов брюшной полости: признаки умеренно выраженной гепатомегалии.
7. УЗИ органов забрюшинного пространства и тимуса: без патологических изменений.
8. МРТ головного мозга: признаки двусторонней гипоплазии гиппокампа, гипоплазия височных долей больше слева, нечеткость границы между серым и белым веществом мозга в области височных долей с обеих сторон (ФКД, тип IIIa) (рис. 1).
9. Кариотип, тонкослойная хроматография крови и мочи — без патологии.
10. ПЦР крови: ДНК вирусов Эпштейна — Барр, герпеса 1, 2 и 6го типов, цитомегаловируса не обнаружены.
Лечение начато с назначения сиропа депакин по 75 мг 2 раза в день. Затем ввиду сохранения частоты пропульсий присоединен в/в дексаметазон 4 мг. После трехразового введения приступы стали реже. Затем добавили вигабатрин по 250 мг два раза в день (70 мг/кг/сут) постоянно.
В отделении состояние ребенка стабилизировалось, приступы купированы. Ребенок выписан под наблюдение неврологом по месту жительства.
Таким образом, согласно предложенной классификации, мы наблюдали случай необычного двустороннего варианта ФКД, тип IIIa, что проявилось тяжелыми клиническими синдромами: грубой задержкой психомоторного развития с рождения и присоединением резистентных эпилептических приступов по типу пропульсий. Назначение кортикостероидов и вигабатрина было адекватным. Данный случай является примером начального назначения препаратов из международных протоколов во избежание формирования резистентности к противоэпилептическим препаратам в дальнейшем.
Назначение кортикостероидов и вигабатрина было адекватным. Данный случай является примером начального назначения препаратов из международных протоколов во избежание формирования резистентности к противоэпилептическим препаратам в дальнейшем.
Нейрохирургическая операция помогает вылечить эпилепсию!
Эпилепсия – это наиболее распространенное заболевание нервной системы. Нейрохирургическая операция помогает полностью избавиться от эпилептических приступов у 65% пациентов с эпилепсией, которая плохо поддается медикаментозной коррекции. Раннее проведение операции имеет преимущества!
В Германии эпилепсией страдает около 600.000 человек. Из них около 90.000 пациентов имеют сложную форму эпилепсии, вызываемую фокальной кортикальной дисплазией.
При фокальной кортикальной дисплазии эпилептические приступы или плохо поддаются лечению или совсем не снимаются медикаментами или другими неинвазивными (без внедрения в организм) методами.
Какие методы лечения эпилепсии существуют?
- подбор медикаментозной терапии (эффективно у 70 % пациентов),
- нейрохирургическая операция (максимально эффективный метод; лучший метод для пациентов с тяжелыми формами эпилепсии, у которых медикаментозная терапия не эффективна),
- нейростимуляция (приносит облегчение, но не избавляет от приступов; применяется, если эпилептогенный очаг расположен в неоперабельной зоне головного мозга).

Нейрохирургическое вмешательство дает шанс больным эпилепсией!
Самое крупное научное исследование, проведенное командой ученых (под руководством доктора медицинских наук профессора Андреаса Шульце-Бонхаге) в Эпилептическом центре при Нейроцентре Университетской клиники Фрайбурга показывает, что даже через 12 лет после проведения операции по удалению области коры головного мозга, ответственной за возникновение эпиприступов, эпилептические приступы отсутствуют у 2/3 пациентов с фокальной кортикальной дисплазией (тяжелой формой эпилепсии).
Из них 67 % пациентов частично или полностью отказались от медикаментозной терапии, а около 30 % пациентов решили продолжить медикаментозную терапию, опасаясь повторения приступов (хотя с медицинской точки зрения показаний для назначения дополнительного медикаментозного лечения не было).
Сверхточная диагностика – залог успеха операции при эпилепсии!
В Эпилептическом центре Фрайбурга, благодаря развитию нейрорадиологии, можно точно локализовать очаг, который вызывает эпилептические приступы!
Еще недавно пациенты с тяжелой формой эпилепсии считались неоперабельными, но применение магнитно-резонансной томографии в комплексе с точным определением активности клеток головного мозга дает возможность точно локализовать эпилептический очаг!
С какого возраста проводятся операции при эпилепсии?
В Эпилептическом центре Фрайбурга операции проводятся начиная с 3-месячного возраста, после установления диагноза эпилепсии, плохо поддающейся или не поддающейся медикаментозной коррекции (когда медикаменты не могут избавить ребенка от эпилептических приступов).
Чем раньше проводится нейрохирургическая операция при эпилепсии, тем больше шансов на выздоровление!
Но даже у взрослых пациентов оперативное вмешательство при эпилепсии намного эффективнее, чем постоянная медикаментозная терапия для предотвращения приступов.
Сотрудники Центра Международных Медицинских Услуг «MedClassic» помогут Вам организовать диагностику и лечение эпилепсии в Германии с использованием новейших эффективных методик!
Дата публикации:
Рейтинг статьи: Отлично (3 голосов)
МРТ при эпилепсии — Деметра МРТ
Как диагностируют эпилепсию?
Анамнез
Диагностика эпилепсии начинается с тщательного опроса больного и его близких. Важна каждая деталь: чувствует ли пациент приближение приступа, случается ли потеря сознания, падает ли пациент, начинаются ли судороги сразу во всех конечностях или в одной из них, в какую сторону он поворачивает голову во время приступа, что чувствует после него и т.д.
Эпилепсия — это коварная болезнь, которая иногда длительное время остается не распознанной. Опытный врач — эпилептолог обычно очень долго разговаривает с пациентом и его семьей, чтобы получить самое подробное описание болезни. Это позволяет определить тип приступа (генерализованный или фокальный, фокальный простой или фокальный сложный) и предположить, в какой части мозга зарождается и куда распространяется патологическая электрическая активность.
Очень важно знать, как часто случаются приступы, в каком возрасте началось заболевание, болели ли эпилепсией ближайшие родственники.
Неврологическое обследование
Наличие у пациента таких неврологических симптомов, как головная боль, слабость одной стороны тела (гемипарез), неустойчивая походка и других признаков, свидетельствует об органическом заболевании головного мозга, таком как, опухоль головного мозга или рассеянный склероз.
МРТ при эпилепсии
МРТ необходима, чтобы исключить наличие заболеваний нервной системы, которые могут привести к судорожным приступам: опухоли головного мозга, аномалии сосудов мозга (артерио-венозные мальформации и кавернозные ангиомы), врожденные аномалии строения мозга (гиппокампальный склероз, кортикальная дисплазия, гетеротопия серого вещества) и другие заболевания.
МРТ является важнейшей частью диагностики эпилепсии и должно быть проведено при появлении первых приступов.
Электроэнцефалография (ЭЭГ)
Электрическая активность мозга может быть зарегистрирована с помощью электродов, расположенных на коже головы. Полученные сигналы усиливаются в миллионы раз и регистрируются компьютером. Во время обследования больной лежит с закрытыми глазами в затемненной комнате. При эпилепсии на ЭЭГ будут регистрироваться изменения, называемые эпилептической активностью.
Необходимо заметить, что наличие эпилептической активности на ЭЭГ еще не говорит о том, что пациент болен эпилепсией, так как у 10 % абсолютно здорового населения могут быть выявлены различные нарушения электроэнцефалограммы.
В то же время многие больные эпилепсией между приступами могут иметь нормальную картину ЭЭГ. Одна из возможностей диагностировать эпилептическую активность у таких больных – спровоцировать патологические электрические импульсы в коре головного мозга. Это можно сделать различными способами. Например, проводить запись ЭЭГ во время сна пациента. Сон провоцирует усиление эпилептической активности. Пациента просят отправиться ко сну поздно ночью перед исследованием или не спать совсем. Перед исследованием пациент засыпает самопроизвольно или ему дают слабое снотворное. Другие способы провокации эпилептической активности на ЭЭГ- гипервентиляция и фотостимуляция. Гипервентиляция – это частое дыхание в течение нескольких минут, которое провоцирует эпилептиформные нарушения ЭЭГ у детей с абсансами. При фотостимуляции пациент смотрит на вспышки света определенной частоты. Фотостимуляция также вызывает появление эпилептиформной активности на электроэнцефалограмме.
Видео-ЭЭГ мониторинг
Видео-ЭЭГ сочетает в себе видео-мониторинг больного с одновременной записью ЭЭГ. Данный вид исследования позволяет зафиксировать эпилептическую активность во время приступа, сопоставить клиническую картину приступа и изменения на энцефалограмме, определить местоположение эпилептогенного очага. Больного госпитализируют в специальную палату на 5-10 дней. 24 часа в сутки он находится под наблюдением видеокамеры. На голове пациента закрепляются электроды, запись ЭЭГ проводится непрерывно в автоматическом режиме. Во время мониторинга пациент может свободно передвигаться, смотреть телевизор, принимать посетителей. В момент возникновения приступа камера фиксирует изменения поведения больного, наличие судорог и т.д.
Врач-эпилептолог в дальнейшем сопоставляет записанную на видео клиническую картину приступа и данные ЭЭГ. На основании этого он выносит заключение о виде эпилепсии и локализации эпилептогенного очага.
Видео-ЭЭГ сочетает в себе видео-мониторинг больного с одновременной записью ЭЭГ. Данный вид исследования позволяет зафиксировать эпилептическую активность во время приступа, сопоставить клиническую картину приступа и изменения на энцефалограмме, определить местоположение эпилептогенного очага. Больного госпитализируют в специальную палату на 5-10 дней. 24 часа в сутки он находится под наблюдением видеокамеры. На голове пациента закрепляются электроды, запись ЭЭГ проводится непрерывно в автоматическом режиме. Во время мониторинга пациент может свободно передвигаться, смотреть телевизор, принимать посетителей. В момент возникновения приступа камера фиксирует изменения поведения больного, наличие судорог и т.д.
Врач-эпилептолог в дальнейшем сопоставляет записанную на видео клиническую картину приступа и данные ЭЭГ. На основании этого он выносит заключение о виде эпилепсии и локализации эпилептогенного очага.
МРТ позволяет исключить наличие заболеваний нервной системы, которые могут привести к судорожным приступам:
- Опухоли мозга, как доброкачественные, так и злокачественные, могут вызывать повторные эпилептические приступы.
- Аномалии сосудов головного мозга: сосудистые мальформации (кавернозные ангиомы, артерио-венозные мальформации).
- Рассеянный склероз.
- Абсцесс мозга (гнойное воспаление ткани мозга) также вызывает эпилептические приступы.
- Врожденные аномалии строения мозга: мезиальный височный склероз, кортикальная дисплазия, гетеротопия серого вещества.
Согласно рекомендациям Международной противоэпилептической лиги при первичной постановке диагноза эпилепсии обязательным является проведение магнитно-резонансной томографии (МРТ) головного мозга (за исключением идиопатических форм эпилепсии с четко очерченной клиникой и ЭЭГ-картиной). Это связано с тем, что более чем в 60% случаев первичной эпилепсии заболевание развивается на фоне морфологических изменений в ткани головного мозга, которые можно выявить при проведении магнитно-резонансной томографии (МРТ). Изменения структуры головного мозга, вызывающие эпилепсию, очень разнообразны. У детей раннего возраста чаще всего выявляются пороки развития головного мозга, последствия перенесенных внутриутробных инфекций и кровоизлияний. У взрослых причиной развития эпилептических припадков могут быть опухоли головного мозга, травмы, инсульты, инфекционные и воспалительные заболевания и их последствия, сосудистые мальформации, паразитозы, острые и хронические интоксикации.
Перечисленные патологические процессы относятся к макроструктурным поражениям головного мозга, однако причиной фармакорезистентной эпилепсии могут быть и минимальные морфологические изменения головного мозга, такие, например, как фокальные кортикальные дисгенезии и дисплазии, гетеротопии, гамартомы. Кортикальной дисгенезией называют нарушение нейрональной миграции на этапах внутриутробного развития, когда микроскопические участки коры головного мозга (серое вещество) находят в нетипичном месте, например среди слоев нейроглии (в белом веществе головного мозга), где они приобретают эпилептогенные свойства.
Для обнаружения кортикальной дисгенезии показано проведение магнитно-резонансной томографии с трехмерным сбором данных с высоким разрешением с минимальной толщиной среза (не более 1,7 мм, при возможности – 1 мм и менее) и отсутствием межсрезового промежутка, наилучшие результаты достигаются на томографах с напряженностью магнитного поля 1,5 Тесла с применением современных многоканальных катушек и методик параллельного сбора данных.
Для адекватной диагностики таких тонких патологических изменений как фокальная кортикальная дисплазия, корковая дисгенезия, гетеротопия, гамартома и склероз гиппокампа кроме современного высокотехнологичного оборудования нужен квалифицированный врач лучевой диагностики, который проводит исследование не по стандартной методике, а более подробно, делая дополнительные срезы в тех участках мозга, где эпилептолог подозревает наличие патологического процесса, а также помимо стандартных режимов Т1 и Т2 взвешенных изображений при необходимости использует дополнительные методики суть которых заключается в трехмерном сборе данных с возможностью последующей реконструкции в любой плоскости, а также криволинейных реконструкций.
Таким образом, для успешной МРТ диагностики при эпилепсии необходимо:
- рамотное, составленное врачом эпилептологом, направление на МР-исследование. В большинстве случаев на основании данных клинической картины и результатов ЭЭГ невролог-эпилептолог может высказать предположение о характере и локализации патологического процесса и должен отразить это в направлении.
- Современный МР-томограф с достаточной мощностью магнитной индукции – не менее 1,5 Тесла и возможностью проводить исследование с минимальной толщиной среза 1-2 мл.
- Квалифицированный врач МРТ, хорошо знающий специфику фукнционирования нервной системы и применяющий, при необходимости, дополнительные методы сбора данных, выходящие за рамки обычного протокола.
Мировые тенденции развития эпилептологии говорят о неизменном уменьшении количества криптогенных (с неустановленной причинной) эпилепсий и увеличение количества симптоматических, то есть развивающихся вторично на фоне структурно-морфологических изменений головного мозга.
Медицинский вестник Северного Кавказа :: Научно-практический журнал
[Обзор]
Чухловина Мария Лазаревна;
Представлен анализ факторов риска сосудистой патологии головного мозга при наследственной дисплазии соединительной ткани. Показано значение морфологических изменений сосудов головного мозга, поражений сердца, нарушений центральной и церебральной гемодинамики, коагулопатии при синдромах Марфана, Элерса – Данло, фибромышечной дисплазии. Ведение лиц с наследственными нарушениями соединительной ткани требует мультидисциплинарного подхода с учётом выявленных факторов риска церебро-васкулярной патологии.
Скачать
Список литературы:
1. Арсентьев, В. Г. Наследственные заболевания соединительной ткани как конституциональная причина полиорганных нарушений у детей / В. Г. Арсентьев, В. С. Баранов, Н. П. Шабалов . – СПб. : СпецЛит., 2014. – С. 1–188.
2. Вершинина, М. В. Эффективность медицинской реабилитации при бронхолёгочном синдроме у пациентов с дисплазией соединительной ткани / М. В. Вершинина, Г. И. Нечаева, А. А. Хоменя, О. В. Дрокина // Медицинский вестник Северного Кавказа. – 2015. – Т. 10, № 1. – С. 50–55.
3. Гнусаев, С. Ф. Синдром соединительнотканной дисплазии сердца у детей / С. Ф. Гнусаев // Лечащий врач. – 2010. – № 8. – С. 40–44.
4. Гусев, Е. И. Проблема инсульта в Российской Федерации: время активных совместных действий / Е. И. Гусев, В. И. Скворцова, Л. В. Стаховская // Журнал неврологии и психиатрии им. С. С. Корсакова. – 2007. – Т. 107, № 8. – С. 4–10.
5. Земцовский, Э. В. Диспластические синдромы и фенотипы как предикторы фибрилляции предсердий у пациентов со стабильным течением ишемической болезни сердца / Э. В. Земцовский, М. Ю. Лобанов, К. У. Давтян // Вестник аритмологии. – 2009. – Т. 56, № 1. – С. 14–19.
6. Земцовский, Э. В. Малые аномалии сердца и диспластические фенотипы / Э. В. Земцовский, Э. Г. Малев. – СПб. : «Изд-во ИВЭСЭП», 2012. –С. 1–160.
7. Кадурина, Т. И. Дисплазия соединительной ткани : руководство для врачей / Т. И. Кадурина, В. Н. Горбунова. – СПб. : «ЭЛБИ», 2009. – С. 1–704.
8. Клочихина, О. А. Анализ эпидемиологических показателей инсульта по данным территориально-популяционных регистров 2009–2012 / О. А. Клочихина, Л. В. Стаховская // Журнал неврологии и психиатрии им. С. С. Корсакова. – 2014. – Т. 114, № 6. – С. 63–69.
9. Костик, И. А. Особенности патологии нервной системы у детей с недифференцированной дисплазией соединительной ткани / И. А. Костик, М. Л. Чухловина, В. И. Ларионова, Т. И. Кадурина // Казанский медицинский журнал. – 2007. – Т. 88, № 5 (прил.). – С. 113–114.
10. Морозов, Ю. А. Особенности нарушений системы гемостаза у больной с синдромом дифференцированной дисплазии соединительной ткани / Ю. А. Морозов, И. И. Дементьева, Е. А. Кукаева // Клиническая лабораторная диагностика. – 2012. – № 11. – С. 25–26.
11. Ягода, А. В. Малые аномалии сердца / А. В. Ягода, Н. Н. Гладких. – Ставрополь : «Изд-во СтГМА», 2005. – С. 1–248.
12. Ягода, А. В. Молекулы адгезии: вклад в формирование диспластического фенотипа / А. В. Ягода, Л. Н. Гладких, Н. Н. Гладких// Медицинский вестник Северного Кавказа. – 2015. – Т. 10, № 1. – С. 55–60.
13. Arnold, M. Triple and quadruple spontaneous cervical artery dissection / M. Arnold, G. M. Marchis, C. Stapf, R. W. Baumgartner // J. Neurol. Neurosurg. Psychiat. – 2009. – Vol. 80, № 2. – P. 171–174.
14. Bradley, T. J. The expanding clinical spectrum of extracardiovascular and cardiovascular manifestations of heritable thoracic aortic aneurysm and dissection / T. J. Bradley, S. C. Bowdin, C. F. Morel, R. E. Pyeritz // Can. J. Cardiol. – 2016. – Vol. 32, № 1. – P. 86–99.
15. Cook, J. R. Cardiovascular manifestations in Marfan syndrome and related diseases; multiple genes causing similar phenotypes / J. R Cook, L. Carta, J. Galatioto, F. Ramirez // Clin. Genet. 2015. – Vol. 87, № 1. – P. 11–20.
16. Davis, F. M. Pediatric nonaortic arterial aneurysms / F. M. Davis, J. L. Eliason, S. K. Ganesh [et al.] // J. Vasc. Surg. – 2016. – Vol. 63, № 2. – P. 466–476.
17. Debette, S. Neurologic manifestations of inherited disorders of connective tissue / S. Debette, D. P. Germain // Handb. Clin. Neurol. 2014. – Vol.119, № 1. – P. 565–576.
18. Groth, K. A. Prevalence, incidence, and age at diagnosis in Marfan syndrome / K. A. Groth, H. Hovу, K. Kyhl [et al.] // Orphanet J. Rare Dis. – 2015. – Vol. 10, № 1. – P. 153. doi 10.1186/s13023-015-0369-8.
19. Jackson, S. C. Suspected collagen disorders in the bleeding disorder clinic: a case-control study / S. C. Jackson, L. Odiaman, R. T. Card [et al.] // Haemophilia. – 2013. – Vol. 19, № 2. – P. 246–250.
20. Jahnlova, D. Fibromuscular dysplasia of renal and carotid arteries / D. Jahnlova, J. Veselka // Int. J. Angiol. – 2015. – Vol. 24, № 3. – P. 241–243. doi: 10.1055/s-0034-1396931.
21. Jaradat, S. A. Two novel mutations of FBN1 in Jordanian patients with Marfan syndrome / S. A. Jaradat, L. A. Abujamous, A. A. Al-Hawamdeh [et al.] // Int. J. Clin. Exp. Med. – 2015. – Vol. 8, № 10. – P. 18786–8792.
22. Kiando, S. R. Exome sequencing in seven families and gene-based association studies indicate genetic heterogeneity and suggest possible candidates for fibromuscular dysplasia / S. R. Kiando, C. Barlassina, D. Cusi [et al.] // Hypertension. – 2015. – Vol. 33, № 9. – P. 1802–1810.
23. Martinic-Popovic, I. The association of inflammatory markers with cerebral vasoreactivity and carotid atherosclerosis in transient ischaemic attack / I. Martinic- Popovic, A. M. Simundic, L. Dukic [et al] // Сlin. Biochem. 2014. – Vol. 47, № 16–17. – P. 182–186.
24. Mogler, C. Fibromuscular dysplasia of the coronary arteries: a rare cause of death in infants and young children / C. Mogler, W. Springer, M. Gorenflo // Cardiol. Young. 2016. – Vol. 26, № 1. – P. 202–205.
25. Poant, L. Atrial septal aneurysm and stroke / L. Poant, L. Dumitraescu, D. Fodor, A. Albu // Rom. J. Intern. Med. – 2008. – Vol. 46, № 4. – P. 57–360.
26. Poloskey, S. L. Low yield of genetic testing for known vascular connective tissue disorders in patients with fibromuscular dysplasia / S. L. Poloskey, E. sh. Kim, R. Sanghani [et al.] // Vasc. Med. – 2012. – Vol. 17, № 6. – P. 371–378.
27. Reyes-Hernández, O. D. Skeletal manifestations of Marfan syndrome associated to heterozygous R2726W FBN1 variant: sibling case report and literature review / O. D. Reyes-Hernández, C. Palacios-Reyes, S. Chávez- Ocaña [et al.] // BMC Musculoskelet Disord. – 2016. – Vol. 17, № 1. – P. 79. doi: 10.1186/s12891-016-0935-9.
28. Spengos, K. Etiology and outcome of cardioembolic stroke in young adults in Greece / K. Spengos, K. N. Vemmos // J. Hellenic Cardiol. – 2010. – Vol. 51, № 2. – P. 127–132.
29. Westerland, O. Vascular manifestations of syndromic aortopathies: role of current and emerging imaging techniques / O. Westerland, A. Frigiola, L. Robert [et al.] // Clin. Radiol. – 2015. – Vol. 70, № 12. – P. 1344–1354. doi: 10.1016/j.crad.2015.08.008.
30. Zeyer, K. A. Fibrillin-containing microfibrils are key signal relay stations for cell function / K. A. Zeyer, D. P. Reinhardt // Cell. Commun. Signal. – 2015. – Vol. 9, № 4. – P. 309–325. doi: 10.1007/s12079-015- 0307-5.
Ключевые слова: синдром Марфана, синдром Элерса – Данло, фибромышечная дисплазия, инсульт
Нейронная сеть помогает ученым выявлять патологии головного мозга, вызывающие эпилепсию
Исследователи Сколтеха и их коллеги из Национального медико-хирургического центра им. Н.И. Пирогова и Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии имени академика В.И. Кулакова использовали сверточную нейронную сеть для автоматизации обнаружения на МРТ-изображениях фокальных кортикальных дисплазий (ФКД) – частой причины эпилепсии. С помощью полученных результатов можно будет быстрее и точнее диагностировать это заболевание. Свою работу ученые представили на Международной конференции по когнитивной науке (Intercognsci 2020).
Фокальная кортикальная дисплазия – врожденный порок развития коры головного мозга, связанный с тем, что в отдельной области коры нейроны не образуют упорядоченную структуру. ФКД – одно из наиболее распространенных поражений головного мозга, являющееся причиной развития эпилепсии. Для диагностики ФКД медики, как правило, используют МРТ-изображения головного мозга.
Группа исследователей под руководством профессора Сколтеха Александра Бернштейна, доцента Евгения Бурнаева, а также старшего научного сотрудника Максима Шараева, решила усовершенствовать существующий метод автоматизации обнаружения ФКД, основанный на глубоком обучении. С помощью размеченных МРТ-снимков головного мозга здоровых людей и пациентов с диагнозом «фокальная кортикальная дисплазия», ученые обучили и использовали сверточную нейронную сеть для обнаружения ФКД. Ведущие рентгенологи медицинских центров-партнеров Сколтеха Олег Бронов, Владимир Быченко, Егор Сыркашев и Алексей Маринец осуществляли разметку данных и научно-медицинское консультирование по проекту. Вычисления проводились с использованием установленного в Сколтехе суперкомпьютера «Жорес».
«Выявление первопричины эпилепсии – крайне сложная задача, требующая специальных навыков. К сожалению, у нас существует острая нехватка специалистов-рентгенологов с большим опытом практической работы и специальными навыками, необходимыми для диагностики таких аномалий, а неточность в локализации очагов эпилепсии может привести к ошибкам при проведении хирургических операций», – рассказывает Максим Шараев.
«Известно всего несколько примеров, когда глубокие сверточные нейронные сети использовали для решения данной задачи; при этом наиболее серьезными проблемами, с которыми пришлось столкнуться ученым, оказались нехватка и низкое качество аннотированных данных. «Для решения этих проблем мы разработали нашу собственную систему маркировки изображений, с помощью которой врач-рентгенолог может самостоятельно аннотировать МРТ-изображения. Еще одна проблема – трехмерный характер МРТ-изображений, поэтому мы предложили несколько решений для работы с трехмерными данными и их двухмерными проекциями», – поясняет Евгений Бурнаев.
Как отмечают авторы, при наиболее эффективной конфигурации модели очаги ФКД были успешно обнаружены у 11 из 15 пациентов. «Уже можно говорить о том, что наши методы выдержали первое испытание (proof of concept), хотя нам еще предстоит немало сделать для повышения качества, надежности и других характеристик модели. Только после решения этих задач можно будет говорить о возможности реализации нашей нейронной сети в клинических условиях», – комментирует Максим Шараев.
В настоящее время ученые совместно с их коллегами из медицинских организаций работают над получением дополнительных наборов данных для обучения и проверки модели, а также исследуют различные варианты архитектуры машинного обучения и глубокого обучения. «Например, сейчас некоторые из наших аспирантов заняты разработкой новых технологий глубоких нейросетей для обработки данных, представленных в виде полигональных сетей, и обработки облаков точек для извлечения информации об аномалиях из трехмерных данных МРТ», – отмечает Евгений Бурнаев.
Ученые также ведут работу в рамках стартапа по созданию веб-платформы для анализа МРТ-изображений, которая уже находится на этапе тестирования на предмет использования в качестве вспомогательного средства диагностики аномалий на основе получаемых МРТ-изображений головного мозга. «Параллельно мы разрабатываем более сложные подходы, аналогичные представленному в статье, которые могли бы помочь в создании гораздо более точной автоматической системы анализа МРТ-изображений и обнаружения патологий развития головного мозга», – добавляет Бурнаев.
Контакты:
Skoltech Communications
+7 (495) 280 14 81
Септооптическая дисплазия (синдром де Морсье) — ДНК-диагностика септооптической дисплазии
Септо-оптическая дисплазия (синдром де Морсье) – клинически гетерогенное заболевание, определяющееся как гипоплазия зрительного нерва в свободном сочетании с гипоплазией гипофиза и аномалиями срединных структур головного мозга, такими как отсутствие мозолистого тела и прозрачной перегородки. Диагноз этой редкой врожденной аномалии ставится в случае, если присутствует два признака из классической триады. Септо-оптическая дисплазия может манифестировать с косоглазия, нистагма, понижения остроты зрения или ухудшением зрения, совместно с эндокринной дисфункцией или в сочетании с умственной отсталостью, или церебральным параличом (ДЦП), задержкой развития и задержкой роста. Заболевание встречается с одинаковой частотой у мальчиков и у девочек.
Возраст матери может являться фактором риска рождения детей с гипоплазией зрительного нерва и септо-оптической дисплазией. Было обнаружено, что септо-оптическая дисплазия встречается с повышенной частотой у детей, рожденных от молодых матерей (средней и поздней юности), с зарегистрированной заболеваемостью 1 на 10 000 живорожденных.
Септо-оптическая дисплазия имеет либо мультифакторную этиологию, которая включает в себя повреждения во время беременности (вирусной этиологии, диабетическая нефропатия), или сосудистые нарушения (дизрупции), или же генетическую природу – мутации в гене HESX1.
Ген HESX1 расположен в хромосомном локусе 3p14, принадлежит к группе эмбриональных гомеобоксных генов, участвующих в раннем эмбриогенезе, в частности в осевой дифференцировке эмбриона, и играющих определяющую роль в развитии переднего мозга, срединных структур мозга и гипофиза.
В настоящее время описано четыре мутации в гене HESX1, ведущие к септо-оптической дисплазии, которая наследуется по аутосомно-рецессивному типу.
В Центре Молекулярной Генетики проводится поиск мутаций в гене HESX1 методом прямого автоматического секвенирования.
Септо-оптическая дисплазияКортикальная дисплазия
Центр эпилепсии при Детском здравоохранении — это центр эпилепсии уровня 4, обеспечивающий высочайший уровень лечения детей, страдающих эпилепсией. Это означает, что у нас есть опыт выявления генетического состояния, вызывающего корковую дисплазию, и лечения этого состояния.
Что такое корковая дисплазия?
Кортикальная дисплазия возникает до рождения ребенка, когда развивающиеся клетки мозга или нейроны не могут достичь тех частей мозга, для которых они генетически предназначены.В результате в этих областях мозга отсутствуют соответствующие нейронные связи для правильного функционирования. Это состояние — одна из наиболее частых причин эпилепсии и судорог.
Кортикальная дисплазия — один из наиболее распространенных типов эпилепсии у детей, который часто сопровождается припадками, которые трудно контролировать с помощью лекарств. Мы были первой такой программой в стране, которая была сертифицирована Совместной комиссией, ведущим национальным органом, устанавливающим стандарты аккредитации и сертификации в сфере здравоохранения.Наша междисциплинарная медицинская команда имеет опыт не только всесторонней диагностики детей с этим заболеванием, но и остается единственным центром в этом районе, где проводят самые передовые процедуры и методы лечения эпилепсии.
Поскольку это заболевание влияет на вашего ребенка и вашу семью, вы будете рады узнать, что мы обеспечиваем уход за всей семьей, включая образование и поддержку.
Кроме того, Центр эпилепсии работает с лечащими врачами и региональными отделениями неотложной помощи по номеру:
- Обеспечить образовательные программы по технике безопасности при изъятии
- Ускоренная запись на прием для быстрой оценки вашего ребенка
Каковы признаки и симптомы корковой дисплазии?
Самый частый симптом корковой дисплазии — судороги.Всего изъято:
Тонико-клонический припадок : Этот тип припадка может включать тряску (называемую судорогами) в сочетании с ригидностью тела, сжатием челюсти и прикусыванием языка. Некоторые люди до сих пор знают этот тип припадка как большой припадок.
Прихват без присутствия : Этот тип приступа может включать в себя взгляд в космос. Или ваш ребенок может резко перестать говорить, а затем снова начать говорить или начать повторяющиеся движения, такие как жевание губ или движение рукой.Эти типы раньше были известны как мелкие припадки.
Иногда перед припадком у вашего ребенка может возникать аура, в результате чего ребенок чувствует запах чего-то, чего нет, онемение или покалывание.
Как диагностируется корковая дисплазия?
Чтобы диагностировать эпилепсию, ваш врач проведет подробный физический осмотр вашего ребенка, спросит вас об истории болезни вашего ребенка и его семейной истории, а также узнает от вас как можно больше о том, как начался приступ и что вы наблюдали.При подозрении на корковую дисплазию может быть назначено обследование, включая ЭЭГ и образец ткани.
Каковы причины корковой дисплазии?
Кортикальная дисплазия — это дефект головного мозга, который присутствует при рождении. Это состояние — одна из наиболее частых причин эпилепсии и судорог.
Как лечится корковая дисплазия?
Лечение корковой дисплазии направлено на борьбу с приступами. Если у вашего ребенка диагностирована эпилепсия, важно как можно быстрее начать правильное лечение.Отсутствие лечения эпилепсии может увеличить риск серьезной травмы вашего ребенка в результате судорог. Судороги также могут поставить вашего ребенка в невыгодное положение в социальном и академическом плане.
После завершения анализов ваш врач может выписать:
Лекарства
Противоэпилептические препараты помогают контролировать припадки. Хотя эти лекарства вызывают побочные эффекты (например, сонливость, усталость, сыпь), они помогают людям, страдающим эпилепсией, вести нормальный образ жизни. У большинства детей с корковой дисплазией приступы трудно контролировать с помощью лекарств
.Хирургия
Если судороги случаются так часто, что ухудшают качество жизни ребенка, может потребоваться операция.Хирургия может включать удаление участка мозга, в котором возникают судороги, или имплантация небольшого устройства, регулирующего электронную активность мозга. Центр эпилепсии в рамках программы по хирургии эпилепсии Детского здравоохранения имеет высокий уровень успеха, при этом результаты наших пациентов часто превосходят результаты других центров.
Диета
Вашему ребенку может быть назначена кетогенная диета, которая включает в себя режим питания с высоким содержанием жиров и низким содержанием углеводов.
Фокальная корковая дисплазия — врожденная аномалия
Особое внимание: хирургия эпилепсии по поводу фокальной корковой дисплазии
В этом разделе : Комплекс туберозного склероза | Фокальная корковая дисплазия | Гемимегаленцефалия | Энцефалит Расмуссена | Синдром Стерджа-Вебера
Хирургия эпилепсии по поводу фокальной корковой дисплазии в UCLA
Фокальная корковая дисплазия — это врожденная аномалия, при которой имеется аномальная организация слоев мозга и нейроны странного вида. Есть как генетические, так и приобретенные факторы, которые участвуют в развитии корковой дисплазии. В целом различают три патологических подтипа корковой дисплазии. Эти поражения часто вызывают эпилепсию, не поддающуюся лечению. На самом деле они являются наиболее частой причиной, по которой у детей требуется операция по поводу эпилепсии.
Хирургическое лечение эпилепсии у детей с фокальной корковой дисплазией
Иногда фокальную корковую дисплазию бывает очень трудно обнаружить или она может оставаться невидимой на МРТ.В других случаях пораженная область головного мозга может быть больше, чем аномалия, выявленная при МРТ, что может быть возможной причиной плохих результатов, если операция основана только на данных МРТ. По этой причине несколько других методов визуализации очень полезны, чтобы помочь очертить аномалию. Доктор Норико Саламон из отделения нейрорадиологии использует передовые методы визуализации путем объединения МРТ высокого разрешения с исследованием FDG-PET, изобретением Калифорнийского университета в Лос-Анджелесе, для обнаружения этих тонких поражений.FDG-PET может продемонстрировать область пониженного метаболизма, затронутую дисплазией. Магнитоэнцефалография — это неинвазивный метод, позволяющий локализовать аномальную электрическую активность, чтобы найти и оценить размер очага припадка. Визуализация с помощью тензора диффузии анализирует молекулы свободной воды в головном мозге, чтобы помочь идентифицировать и отслеживать аномальные волокна мозга, которые могут быть связаны с корковой дисплазией. Иногда могут потребоваться инвазивные методы, такие как внутричерепное исследование ЭЭГ, чтобы точно сопоставить начало припадка с учетом фокальной корковой дисплазии.Этот метод дает возможность хирургического лечения пациентам, которые в противном случае не были бы кандидатами на лечебную процедуру.
Варианты резекционного хирургического вмешательства, которые в целом направлены на купирование приступов, включают в себя резекцию поражений, лобэктомию и, в некоторых случаях, гемисферэктомию. Как правило, чем младше ребенок или младенец, тем крупнее требуется операция. Это связано с тем, что фокальная корковая дисплазия II типа чаще всего встречается у очень маленьких детей, а аномалия более обширна.Напротив, операции у детей старшего возраста и молодых людей, как правило, проводятся по поводу фокальной корковой дисплазии I типа и характеризуются менее обширными аномалиями, чаще всего обнаруживаемыми в височной доле.
После операции у 60–80% детей судороги не развиваются, в зависимости от центра, в котором она проводится. Некоторые из наиболее благоприятных факторов, предсказывающих успешность операции, включают полную резекцию фокальной корковой дисплазии. Иногда полная резекция аномалии может считаться неприемлемой, если она включает резекцию неврологически важной структуры (такой как двигательная, сенсорная или связанная с речью ткань мозга).В этих ситуациях были разработаны новые хирургические методы, которые могут быть вариантом.
Хирургия сопряжена с рисками, связанными с инфекциями, переливанием крови (обычно у младенцев) и особыми рисками, связанными с тканями мозга, которые необходимо удалить. Постоянные нарушения, такие как новый неврологический дефицит или гидроцефалия, встречаются редко. Свобода от приступов обычно определяется как минимум через 1 год, а иногда и через 2 года после операции. Если операция прошла успешно, вероятность полного прекращения приема лекарств составляет 50%.Другие преимущества могут включать улучшение поведения, концентрации, внимания, познания и развития.
<Вернуться к болезням и состояниям
Фокальная корковая дисплазия | Фонд эпилепсии
Что такое фокальная корковая дисплазия?
- Фокальная корковая дисплазия (FCD) — это термин, используемый для описания фокальной области аномальной организации и развития клеток головного мозга («нейрона»).
- Клетки мозга или «нейроны» обычно образуют организованные слои клеток, чтобы сформировать «кору» головного мозга, которая является самой внешней частью мозга.
- При FCD происходит дезорганизация этих клеток в определенной области мозга, что приводит к гораздо более высокому риску судорог и возможному нарушению функции мозга, которое обычно возникает в этой области.
Существует несколько типов FCD в зависимости от конкретного микроскопического вида и других связанных с ним изменений мозга.
- FCD Тип I: клетки мозга имеют аномальную организацию в горизонтальных или вертикальных линиях коры. Этот тип FCD часто подозревают на основании клинического анамнеза припадков (фокальные припадки, устойчивые к лекарственным средствам), результатов ЭЭГ, подтверждающих начало очагового припадка, но часто не ясно видно на МРТ.Другие исследования, такие как ПЭТ, SISCOM или ОФЭКТ и МЭГ, могут помочь указать на аномальную область, которая вызывает приступы, но FCD типа I часто подтверждается только после того, как эта область области мозга, вызывающая приступы, была резецирована и затем исследована. под микроскопом.
- FCD Тип II: , когда, помимо аномальной организации, сами клетки мозга выглядят ненормально, с «дисморфными нейронами» или «баллонными клетками». FCD типа II обычно проявляется в раннем детстве и обычно выявляется на МРТ.
- FCD тип III: , когда в дополнение к любому из вышеперечисленных результатов имеется еще одна связанная аномалия, такая как атрофия гиппокампа, опухоли, инсульт или травматическое повреждение головного мозга.
Какие типы припадков можно наблюдать при FCD?
- FCD связан с широким спектром приступов в зависимости от конкретной области мозга, в которой расположены аномальные клетки, и возраста пациента.
- Наиболее распространенными типами приступов являются приступы с фокальным началом, которые могут прогрессировать до генерализованной тонико-клонической активности.Начальные симптомы фокального припадка часто указывают на то, какая область мозга поражена FCD.
- Маленькие дети также могут иметь инфантильные спазмы или, реже, судороги, связанные с синдромом Леннокса-Гасто.
Как диагностируется FCD?
Диагноз FCD часто можно сильно заподозрить на основании подробного анамнеза и физического обследования. FCD часто вызывает судороги, которые начинаются в первые 5 лет жизни, и у большинства из них приступы возникают к 16 годам.Реже приступы могут начаться в зрелом возрасте. Подтип FCD в некоторой степени коррелирует с возрастом начала заболевания, при этом FCD типа II чаще всего проявляется в очень раннем детстве, а некоторые случаи FCD типа III проявляются в более позднем возрасте. Помимо судорог, FCD может привести к появлению клинических симптомов, возникающих в результате локального нарушения функции мозга в области, пораженной дисплазией, таких как задержка речи, слабость или проблемы со зрением.
Электроэнцефалограмма (ЭЭГ) может показывать замедление фоновой активности в области FCD, однако это открытие не специфично для FCD и может наблюдаться при других причинах эпилепсии.Более подозрительным на FCD является аномальная быстрая очаговая активность. Также часто наблюдаются эпилептиформные выделения.
Во многих случаях FCD, и особенно при типе II, МРТ является ненормальным, показывая аномально яркую фокальную область на последовательностях T2 и FLAIR, которая часто имеет характерный «хвост», простирающийся до краев желудочков. Однако в некоторых случаях МРТ может быть нормальным, особенно при FCD типа I. В этих случаях диагноз может быть поставлен только после удаления области мозга, вызывающей припадки, и детального обследования под микроскопом.
Если МРТ в норме, другие тесты, такие как ПЭТ, SISCOM или MEG, могут помочь точно определить место в головном мозге, где возникают судороги. Хотя эти тесты могут помочь выявить область возникновения припадков, они не могут отличить FCD от других очаговых причин эпилепсии.
При рассмотрении вопроса об операции можно провести функциональную МРТ головного мозга (фМРТ), чтобы оценить, какие области мозга контролируют определенные функции. Часто при FCD можно увидеть нетипичную локализацию определенных функций.
Что вызывает FCD?
Мы знаем, что FCD возникает из-за аномального формирования клеточных слоев и клеток мозга во время формирования мозга, когда ребенок еще находится в утробе матери. В некоторых случаях, вероятно, играют роль генетические факторы, и определенные гены, такие как DEPDC5, могут приводить к FCD у нескольких членов семьи. Эти изменения обычно происходят на поздних стадиях созревания мозга, что объясняет, почему эти изменения часто ограничиваются небольшой областью мозга. В других случаях считается, что внутриутробная инфекция может играть роль в FCD.Однако в большинстве случаев FCD причина неизвестна.
Как лечится FCD?
Оптимальное лечение FCD зависит от тяжести эпилепсии и реакции на противосудорожные препараты. Противосудорожные препараты считаются терапией первой линии. Тем не менее, у многих людей с FCD будут лекарственно-устойчивые судороги, и только около 1 из 5 человек может добиться хорошего контроля приступов только с помощью лекарств.
Если два или более противосудорожных препарата не приводят к хорошему контролю припадков, следует рассмотреть возможность хирургического вмешательства при эпилепсии, так как шанс контроля припадков с помощью дополнительных лекарств очень низок.Если FCD расположен в фокальной области мозга, которую можно безопасно удалить без нарушения функции мозга, резекционная операция является хорошим вариантом. Успех операции зависит от типа FCD (лучшие результаты при типе II) и от способности полностью удалить аномальную область. В целом хирургический успех может достигать 50-60%. Если резекция FCD была неполной, что может произойти, если FCD вовлекает красноречивую кору (области мозга, отвечающие за важные функции, такие как язык или движение), исход без припадков маловероятен.
Если большая часть FCD включает область мозга, которая выполняет критическую функцию, то хирургическое удаление может оказаться невозможным — в этой ситуации нейромодуляция с помощью имплантированного устройства, такого как RNS, DBS или VNS, может снизить судорожную нагрузку, но вряд ли приведет. в захвате свободы.
Реагирующая нейростимуляция (RNS) — это небольшое устройство, которое имплантируется в голову с помощью проводов и полосок, имплантированных в область FCD. Он непрерывно записывает активность мозга и, когда видит приступ, может произвести небольшой электрический разряд, чтобы остановить приступ.
Устройство для глубокой стимуляции мозга (DBS) имеет генератор, имплантированный в грудную клетку под ключицей, и провода, которые имплантируются глубоко в мозг в структуре, называемой таламус, которая соединяет различные области мозга и которая часто используется при судорожной активности для распространяются на разные участки мозга. Это устройство DBS подает электрические разряды, чтобы модулировать эту активность и уменьшить судороги.
Стимуляция блуждающего нерва (VNS) — это устройство-стимулятор, которое помещается под кожу чуть ниже ключицы в груди, и провода соединяют его с блуждающим нервом на левой стороне шеи.Электрические импульсы передаются в мозг через блуждающий нерв, чтобы модулировать судорожную активность. Новые устройства также могут обнаруживать изменения частоты сердечных сокращений, которые могут указывать на начало припадка, и могут вызывать стимул в ответ на это.
Нехирургические варианты лечения FCD включают диетические методы лечения, такие как кетогенная диета, модифицированная диета Аткинса и диета с низким гликемическим индексом, которые во многих случаях могут уменьшить судороги, но обычно не приводят к избавлению от приступов.
Каковы перспективы FCD?
Большинство случаев FCD связаны с устойчивыми к лекарствам судорогами.В таких случаях пациента следует обследовать на предмет хирургического вмешательства по поводу резекционной эпилепсии, поскольку это может значительно снизить бремя приступов или, возможно, привести к их освобождению.
Очаговая корковая дисплазия: нейропатологические подтипы, ЭЭГ, нейровизуализация и исход хирургического вмешательства
Со времени первоначального описания Тейлора термин фокальная корковая дисплазия использовался для обозначения широкого спектра изменений корковой мантии.Совсем недавно эти состояния были описаны с нейровизуализационной, нейропатологической и генетической точек зрения, в результате чего было создано несколько классификаций. Широко признано, что эти классификации неудовлетворительны. Мы предлагаем упрощенную классификацию фокальных корковых дисплазий, основанную на легко распознаваемых невропатологических характеристиках. Мы ретроспективно повторно исследовали гистологические срезы коры 52 из 224 (23%) пациентов, прооперированных по поводу лекарственно-устойчивой парциальной эпилепсии, у которых присутствовала корковая дисплазия, но не ассоциировалась с другими патологиями головного мозга, кроме склероза гиппокампа.Были выделены три подгруппы: (i) архитектурная дисплазия (31 пациент), характеризующаяся аномальным кортикальным слоем и эктопическими нейронами в белом веществе; (ii) цитоархитектурная дисплазия (шесть пациентов), характеризующаяся наличием гигантских нейрофиламентов, обогащенных нейронами, в дополнение к измененному кортикальному слою; и (iii) кортикальная дисплазия по типу Тейлора (15 пациентов) с гигантскими дисморфическими нейронами и баллонными клетками (все, кроме двух пациентов), связанными с кортикальным ламинарным разрывом. У пациентов с архитектурной дисплазией частота приступов была ниже, чем у пациентов с цитоархитектурной дисплазией и дисплазией типа Тейлора, а эпилептогенная зона находилась в основном в височной доле.У пациентов с дисплазией по типу Тейлора эпилептогенная зона была в основном вневисочной, а интерктальная стерео-ЭЭГ была отчетливой. МРТ не выявила у 34% пациентов, но отчетливые изменения сигнала характеризовали большинство пациентов с дисплазией типа Тейлора, в то время как очаговая гипоплазия с аномалиями МРТ была обнаружена при архитектурной дисплазии. Пациенты с дисплазией типа Тейлора имели лучший результат: у 75% пациентов с дисплазией не было припадков (класс Ia по Энгелю) после как минимум года наблюдения, по сравнению с 50% пациентов с цитоархитектурной дисплазией и 43% пациентов с архитектурной дисплазией без припадков.Эта классификация по трем категориям основана на легко распознаваемых гистопатологических характеристиках и избегает сложной терминологии, в то время как отличительный набор других характеристик определяет клинически однородные группы.
Кортикальная дисплазия — обзор
Фокальная корковая дисплазия
FCD включает аномальную пролиферацию нейронов в перивентрикулярных зародышевых зонах; аномальная управляемая клетками миграция нейронов в корковые слои; или аномальная дифференцировка нейронов и синаптическая организация в корковых пластинках (Siedlecka et al., 2016). FCD обычно (77–90% пациентов) связан с эпилепсией, хотя FCD также встречается с низкой частотой (1,7%) у здоровых субъектов (Mencke and Veith, 1992; Raymond et al., 1995; Bingaman, 2004).
Различные причины FCD включают пренатальные инфекции (например, TORCH-микроорганизмы: токсоплазмоз, сифилис, ветряная оспа, парвовирус B19, краснуха, цитомегаловирус, герпесвирус). Обнаружение FCD онкопротеина E6 вируса папилломы 16 человека в образцах, удаленных хирургическим путем, является интригующим, хотя и спорным, поскольку оно не было подтверждено в некоторых исследованиях (Coras et al., 2015; Крино, 2015; Шапиро и др., 2015).
FCD был связан с мутациями в механистической мишени рапамицина (mTOR), важном элементе пути передачи сигнала, важного для развития мозга (Jansen et al., 2015; Citraro et al., 2016; Weckhuysen et al., 2016) . Например, мозаичные активирующие мутации в PIK3CA и AKT3 были идентифицированы в образцах коры головного мозга после хирургической резекции не только пациентов с FCD, но и пациентов с мегалэнцефалией и гемимегалэнцефалией (Jansen et al., 2015). Имеются также доказательства того, что ген туберозного склероза ( TSC1 ) может способствовать FCD: (1) TSC1 генетический полиморфизм ассоциирован с FCD; (2) потеря TSC1 гетерозиготности была продемонстрирована в FCD; и (3) TSC1 взаимодействует с туберином, негативным регулятором пути mTOR, который, как обсуждалось выше, участвует в FCD (Siedlecka et al., 2016). Эти данные указывают на участие сигнального пути PI3K / AKT / mTOR в различных нарушениях развития мозга, связанных с эпилепсией, включая мегалэнцефалию, гемимегалэнцефалию, FCD и туберозный склероз.Недавнее исследование эверолимуса, аналога рапамицина и ингибитора mTOR, у пациентов с туберозным склерозом показало, что у 12 из 20 пациентов наблюдалось снижение приступов как минимум на 50% (Krueger et al., 2016).
Соматические мутации головного мозга в MTOR вызывают очаговую корковую дисплазию типа II, ведущую к трудноизлечимой эпилепсии
Баст, Т., Рамантани, Г., Зейтц, А. & Рейтинг, Д. Фокусная корковая дисплазия: распространенность, клинические проявления и эпилепсия у детей и взрослых. Acta Neurol.Сканд. 113 , 72–81 (2006).
CAS Статья Google ученый
Тейлор, округ Колумбия, Фалконер, М.А., Брутон, С.Дж. и Корселлис, Дж. А. Очаговая дисплазия коры головного мозга при эпилепсии. J. Neurol. Нейрохирургия. Психиатрия 34 , 369–387 (1971).
CAS Статья Google ученый
Крино, П. Б. Очаговые пороки развития головного мозга: судороги, сигнализация, секвенирование. Эпилепсия 50 (приложение 9), 3–8 (2009).
CAS Статья Google ученый
Poduri, A., Evrony, G.D., Cai, X. & Walsh, C.A. Соматические мутации, геномные вариации и неврологические заболевания. Наука 341 , 1237758 (2013).
Артикул Google ученый
Krsek, P. et al. Различные особенности гистопатологических подтипов детской фокальной корковой дисплазии. Ann. Neurol. 63 , 758–769 (2008).
Артикул Google ученый
Fauser, S. et al. Фокальные корковые дисплазии: хирургический результат у 67 пациентов в зависимости от гистологических подтипов и двойной патологии. Мозг 127 , 2406–2418 (2004).
Артикул Google ученый
Blümcke, I. et al. Клинико-патологический спектр фокальных корковых дисплазий: согласованная классификация, предложенная специальной рабочей группой Комиссии по диагностическим методам ILAE. Эпилепсия 52 , 158–174 (2011).
Артикул Google ученый
Fauser, S. et al. Клинические характеристики фокальной корковой дисплазии: ретроспективная оценка на серии из 120 пациентов. Мозг 129 , 1907–1916 (2006).
Артикул Google ученый
Chen, J. et al. Обнаружение вируса папилломы человека при очаговой корковой дисплазии человека IIB типа. Ann. Neurol. 72 , 881–892 (2012).
CAS Статья Google ученый
Сисодия, С.М., Фаузер, С., Кросс, Дж. Х. И Том, М. Фокальная корковая дисплазия II типа: биологические особенности и клинические перспективы. Lancet Neurol. 8 , 830–843 (2009).
Артикул Google ученый
Colombo, N. et al.Фокальная корковая дисплазия типа IIa и IIb: аспекты МРТ в 118 случаях, подтвержденные гистопатологией. Нейрорадиология 54 , 1065–1077 (2012).
Артикул Google ученый
Cibulskis, K. et al. Чувствительное обнаружение соматических точечных мутаций в нечистых и гетерогенных образцах рака. Nat. Biotechnol. 31 , 213–219 (2013).
CAS Статья Google ученый
Ким, С.и другие. Вирмид: точное обнаружение соматических мутаций с выводом примеси образца. Genome Biol. 14 , R90 (2013).
Артикул Google ученый
Робаски, К., Льюис, Н.Э. И Церковь, Г. Роль репликатов в устранении ошибок при секвенировании следующего поколения. Nat. Преподобный Жене. 15 , 56–62 (2014).
CAS Статья Google ученый
Ширли М.D. et al. Синдром Стерджа-Вебера и винные пятна, вызванные соматической мутацией в GNAQ. N. Engl. J. Med. 368 , 1971–1979 (2013).
CAS Статья Google ученый
Williams, C. et al. Высокая частота изменений последовательности связана с формалиновой фиксацией архивных образцов. Am. J. Pathol. 155 , 1467–1471 (1999).
CAS Статья Google ученый
Грабинер, Б.C. et al. Разнообразный набор мутаций MTOR, связанных с раком, гиперактивирует и может предсказать чувствительность к рапамицину. Рак Discov. 4 , 554–563 (2014).
CAS Статья Google ученый
Янг, Х. и др. Структура, механизм и регуляция киназы mTOR. Природа 497 , 217–223 (2013).
CAS Статья Google ученый
Урано, Дж.и другие. Точечные мутации в TOR обеспечивают Rheb-независимый рост у делящихся дрожжей и независимую от питательных веществ передачу сигналов TOR млекопитающих в клетках млекопитающих. Proc. Natl. Акад. Sci. США 104 , 3514–3519 (2007).
CAS Статья Google ученый
Крино, П. Б. mTOR: патогенный сигнальный путь пороков развития головного мозга. Trends Mol. Med. 17 , 734–742 (2011).
CAS Статья Google ученый
Наварро-Кирога, И., Читтаджаллу, Р., Галло, В., Хайдар, Т.Ф. Долгосрочная селективная экспрессия генов в развивающихся и взрослых пирамидных нейронах гиппокампа с использованием фокальной электропорации in utero . J. Neurosci. 27 , 5007–5011 (2007).
CAS Статья Google ученый
Rivière, J.B. et al. De novo мутации зародышевой линии и постзиготные мутации в AKT3, PIK3R2 и PIK3CA вызывают спектр связанных синдромов мегалэнцефалии. Nat. Genet. 44 , 934–940 (2012).
Артикул Google ученый
Poduri, A. et al. Соматическая активация AKT3 вызывает пороки развития полушарного мозга. Нейрон 74 , 41–48 (2012).
CAS Статья Google ученый
Ли, Дж. Х. и другие. De novo соматические мутации в компонентах пути PI3K – AKT3-mTOR вызывают гемимегалэнцефалию. Nat. Genet. 44 , 941–945 (2012).
CAS Статья Google ученый
Reumers, J. et al. Оптимизированная фильтрация снижает частоту ошибок при обнаружении геномных вариантов путем короткого секвенирования. Nat. Biotechnol. 30 , 61–68 (2012).
CAS Статья Google ученый
Крюгер, Д.А. и другие. Эверолимус при субэпендимных гигантоклеточных астроцитомах при туберозном склерозе. N. Engl. J. Med. 363 , 1801–1811 (2010).
CAS Статья Google ученый
Крюгер, Д.А. и другие. Лечение эверолимусом рефрактерной эпилепсии в комплексе туберозного склероза. Ann. Neurol. 74 , 679–687 (2013).
CAS Статья Google ученый
Ароника, Э., Беккер, А.Дж. И Спреафико, Р.Пороки развития коры головного мозга. Brain Pathol. 22 , 380–401 (2012).
Артикул Google ученый
Крино, П. Б., Натансон, К. Л. И Хенске, Э. Комплекс туберозного склероза. N. Engl. J. Med. 355 , 1345–1356 (2006).
CAS Статья Google ученый
Фелисиано, Д.М., Су, Т., Лопес, Дж., Platel, J.C. & Bordey, A. Нокаут одноклеточного Tsc1 во время кортикогенеза генерирует клубнеподобные поражения и снижает порог припадка у мышей. J. Clin. Инвестировать. 121 , 1596–1607 (2011).
CAS Статья Google ученый
Baybis, M. et al. Активация каскада mTOR отличает клубни от очаговой корковой дисплазии. Ann. Neurol. 56 , 478–487 (2004).
CAS Статья Google ученый
Мията, Х., Chiang, A.C. & Vinters, H.V. Пути передачи сигналов инсулина при корковой дисплазии и TSC-клубнях: анализ тканевого микрочипа. Ann. Neurol. 56 , 510–519 (2004).
CAS Статья Google ученый
Лю, Дж. И др. Доказательства активации пути mTOR в спектре патологий, связанных с эпилепсией. Acta Neuropathol Commun 2 , 71 (2014).
Артикул Google ученый
Ясин, С.A. et al. Нарушения аутофагии, зависимые от mTOR, характеризуют пороки развития коры головного мозга человека: данные о фокальной корковой дисплазии и туберозном склерозе. Acta Neuropathol. 126 , 207–218 (2013).
CAS Статья Google ученый
Беккер, А.Дж. и другие. Фокальная корковая дисплазия типа баллонных клеток Тейлора: мутационный анализ гена TSC1 указывает на патогенную связь с туберозным склерозом. Ann. Neurol. 52 , 29–37 (2002).
CAS Статья Google ученый
Scheffer, I.E. и другие. Мутации в регуляторе рапамицина DEPDC5 у млекопитающих вызывают фокальную эпилепсию с пороками развития мозга. Ann. Neurol. 75 , 782–787 (2014).
CAS Статья Google ученый
Ким, Ю.Х. и другие.Нейровизуализация в выявлении очаговой корковой дисплазии и прогностических факторов в хирургии детской и подростковой эпилепсии. Эпилепсия 52 , 722–727 (2011).
Артикул Google ученый
Zeng, L.H., Xu, L., Gutmann, D.H. & Wong, M. Рапамицин предотвращает эпилепсию на мышиной модели комплекса туберозного склероза. Ann. Neurol. 63 , 444–453 (2008).
CAS Статья Google ученый
Генетические исследования обнаруживают потенциальные альтернативы хирургии головного мозга у детей с корковой дисплазией — CURE Epilepsy
Возможная альтернатива уже проходит клинические испытания
Недавнее исследование грантополучателя CURE Dr.Чон Хо Ли из Корейского передового института науки и технологий пролил свет на генетические мутации, которые приводят к фокальной корковой дисплазии, тяжелой форме детской эпилепсии, которая неадекватно поддается лечению. Генетические мутации были обнаружены в мозговой ткани людей, страдающих определенным подтипом фокальной корковой дисплазии (фокальная корковая дисплазия типа II), который характеризуется аномалиями головного мозга, приводящими к припадкам и эпилепсии.
Обычные методы генетического тестирования для выявления генетических мутаций у людей с эпилепсией часто используют кровь или слюну пациентов.Однако эти последние результаты доктора Ли и его команды предполагают, что определенные мутации генов, связанные с эпилепсией, могут быть обнаружены только при анализе ткани мозга.
Мутации только в головном мозге в генах, вызывающих фокальную корковую дисплазию
Сравнивая образцы крови и слюны с образцами ткани мозга от группы из 40 человек, ранее перенесших операцию на головном мозге по поводу фокальной корковой дисплазии II типа, д-р Ли и его команда обнаружили, что у значительного числа этих людей (12.5%) имели мутации только в головном мозге в генах TSC1 и TSC2. Вместе с предыдущей новаторской работой его команды по выявлению мутаций только в мозге в гене MTOR у людей с фокальной корковой дисплазией II типа, они показали, что мутации только в головном мозге в генах сигнального пути mTOR мозга (включая гены TSC1, TSC2) и MTOR) обнаруживаются почти у 30% людей с очаговой корковой дисплазией. Тот факт, что эти мутации были обнаружены только в головном мозге, означает, что эти мутации нельзя будет обнаружить с помощью обычных методов генетического тестирования, что предполагает более широкое изучение мутаций, связанных только с мозгом.
В дополнение к выявлению мутаций, связанных только с мозгом, ведущих к фокальной корковой дисплазии, доктор Ли и его команда также обратились к текущему дефициту адекватных животных моделей, чтобы лучше изучить заболевание. Команда смогла успешно воссоздать мутации только мозга в генах TSC1 и TSC2 у развивающихся мышей, предоставив столь необходимую животную модель для дальнейшего изучения способов, которыми мутации генов могут приводить к фокальной корковой дисплазии II типа.
Клинические испытания лечения фокальной корковой дисплазии
Кроме того, команда предоставила доказательства того, что ингибиторы mTOR, такие как рапамицин или эверолимус, являются многообещающими противоэпилептическими препаратами для лечения фокальной корковой дисплазии.Фактически, эверолимус в настоящее время проходит II фазу клинических испытаний для лечения фокальной корковой дисплазии.
Как отмечает д-р Ли, поскольку фокальная корковая дисплазия является лекарственно-устойчивой эпилепсией, многим детям с этим расстройством в качестве лечения требуется инвазивная операция на головном мозге. Однако даже в тех случаях, когда проводится хирургическое вмешательство, до 40% этих детей все еще могут иметь судороги. Выявив гены, связанные с фокальной корковой дисплазией, а также создав новый способ изучения генетических механизмов, лежащих в основе этого расстройства, д-р.Ли и его команда достигли прогресса в создании новых нехирургических мишеней, на которые нацелено лечение этой разрушительной формы лекарственно-устойчивой детской эпилепсии.
[1] Lim et al. Соматические мутации в TSC1 и TSC2 вызывают очаговую корковую дисплазию. Am J Human Genet 2017; 100 (3): 454-472.
[2] Guerrini et al. Методы диагностики и варианты лечения очаговой корковой дисплазии.
