Минздрав зарегистрировал второй препарат от спинальной мышечной атрофии :: Общество :: РБК
Фото: Юрий Смитюк / ТАСС
Минздрав выдал регистрационное удостоверение фармкомпании Roche на препарат для лечения спинальной мышечной атрофии с международным непатентованным наименованием рисдиплам, следует из государственного реестра лекарственных средств.
Спинальная мышечная атрофия (СМА) — генетическое прогрессирующее заболевание, при котором поражаются двигательные нейроны спинного мозга, что приводит к атрофии мышц. По словам главы фонда «Семьи СМА» Ольги Германенко, на сегодняшний день в России, по данным пациентского реестра, насчитывается 1048 человек с заболеванием, в том числе 823 ребенка. Всего в России число пациентов со СМА может доходить до 4 тыс., так как далеко не везде в регионах есть возможность всех учесть, говорит она.
В программу раннего доступа к препарату рисдиплам были включены 230 россиян, сообщили РБК в фармкомпании Roche.
Первый препарат для терапии спинальной мышечной атрофии с действующим веществом нусинерсен был зарегистрирован в России в августе 2019 года.
Профилактика и лечение осложнений со стороны сердца при мышечной дистрофии Дюшенна и Беккера и дилятационной кардиомиопатии, сцепленной с X-хромосомой
Вопрос обзора
Каковы эффекты вариантов лечения, используемых для профилактики или лечения осложнений со стороны сердца при мышечной дистрофии Дюшенна (МДД), мышечной дистрофии Беккера (БМД) и дилятационной кардиомиопатии, сцепленной с X-хромосомой (XLDCM)?
Актуальность
Белок дистрофин необходим для нормальной работы мышц. МДД, БМД и XLDCM являются наследственными заболеваниями мышц, вызванными изменениями в гене, который контролирует выработку дистрофина. У людей с такими заболеваниями развивается атрофия мышц и слабость. В сердце недостаток дистрофина вызывает повреждение сердечной мышцы и рубцевание, что со временем приводит к сердечной недостаточности. В конце концов камеры сердца расширяются, что называется дилятационной кардиомиопатией. Это серьезное осложнение может стать причиной смерти. Существует ряд возможных методов лечения проблем с сердцем при этих мышечных состояниях. Одним из вариантов является снижение нагрузки на сердце с помощью лекарств, которые снижают кровяное давление (ингибиторы ангиотензин-преобразующего фермента, ингибиторы АПФ) или замедляют сердечный ритм (бета-блокаторы или ивабрадин). Другой подход заключается в снижении мышечного повреждения антиоксидантами (например, идебеноном) или лекарствами, направленного противовоспалительного действия (например, кортикостероидами). Недавно были разработаны лекарства, повышающие уровень дистрофина, к ним относятся аталурен и этеплирсен.
У людей с такими заболеваниями развивается атрофия мышц и слабость. В сердце недостаток дистрофина вызывает повреждение сердечной мышцы и рубцевание, что со временем приводит к сердечной недостаточности. В конце концов камеры сердца расширяются, что называется дилятационной кардиомиопатией. Это серьезное осложнение может стать причиной смерти. Существует ряд возможных методов лечения проблем с сердцем при этих мышечных состояниях. Одним из вариантов является снижение нагрузки на сердце с помощью лекарств, которые снижают кровяное давление (ингибиторы ангиотензин-преобразующего фермента, ингибиторы АПФ) или замедляют сердечный ритм (бета-блокаторы или ивабрадин). Другой подход заключается в снижении мышечного повреждения антиоксидантами (например, идебеноном) или лекарствами, направленного противовоспалительного действия (например, кортикостероидами). Недавно были разработаны лекарства, повышающие уровень дистрофина, к ним относятся аталурен и этеплирсен.
Характеристика исследований
Авторы Кокрейновского обзора собрали все релевантные исследования, чтобы ответить на вопрос обзора.
— Трехлетнее исследование периндоприла в сравнении с плацебо (неактивная таблетка) для профилактики осложнений со стороны сердца у 57 мальчиков с МДД. За рандомизированным исследованием последовало двухлетнее открытое лечение, а затем последующее исследование продолжительностью 10 лет, когда все дети получали периндоприл.
— Годовое исследование лизиноприла в сравнении с лозартаном у 23 пациентов с МДД и недавно диагностированными осложнениями со стороны сердца.
— Годовое исследование идебенона в сравнении с плацебо у 21 мальчика с МДД, которое финансировалось производителем.
— Годовое исследование эплеренона в сравнении с плацебо у 42 пациентов с МДД, у которых уже были осложнения со стороны сердца, которое было частично финансировано производителем.
— Трехмесячное исследование гормона роста в сравнении с плацебо у 10 пациентов с МДД или БМД.
Основные результаты и определённость доказательств
На основании имеющихся данных из РКИ раннее лечение ингибиторами АПФ или блокаторами рецепторов ангиотензина (БРА) может помочь людям с МДД. У мальчиков с ранним поражением сердца действие ингибитора АПФ и БРА может быть эквивалентным; однако эти доказательства высокой степени неопределенности. Результаты нерандомизированных исследований, некоторые из которых были долгосрочными, привели к использованию этих лекарств в повседневной клинической практике. Очень низкая степень определённости доказательств свидетельствует о том, что добавление эплеренона может принести дополнительную пользу при МДД при обнаружении ранней кардиомиопатии.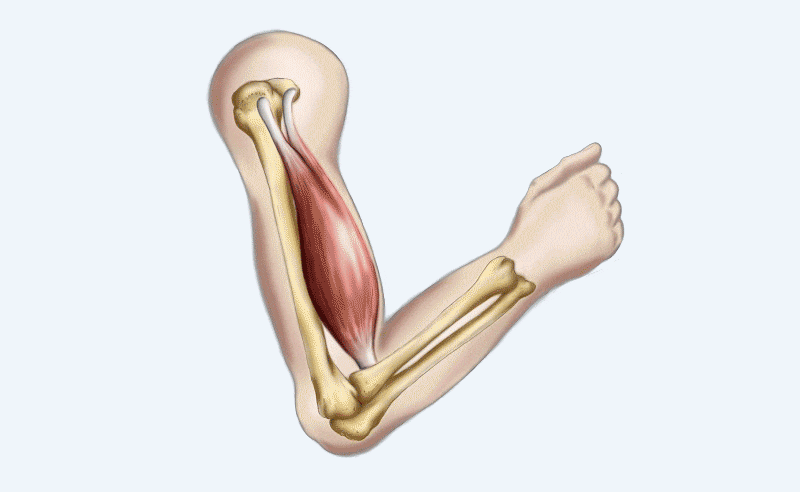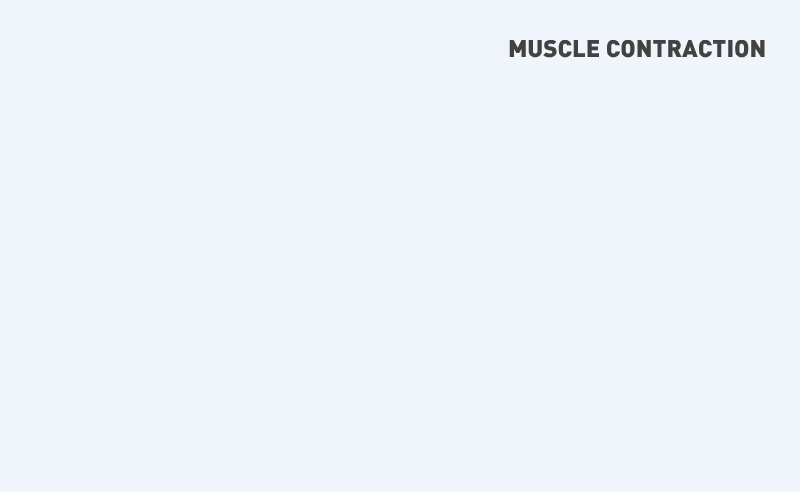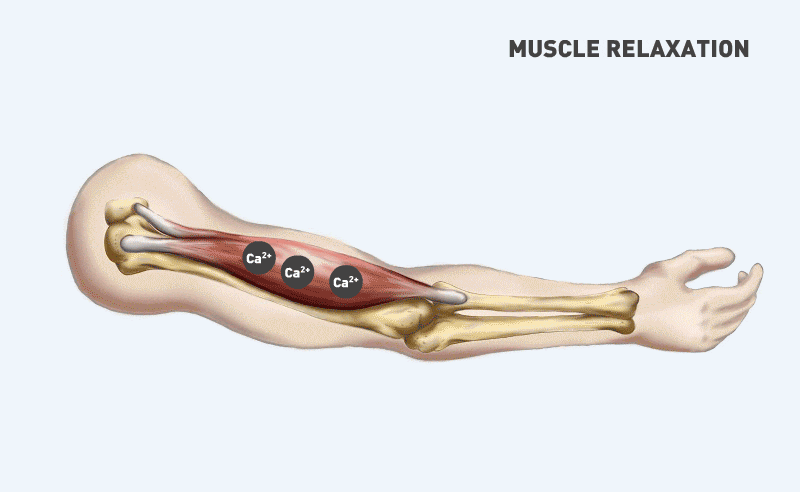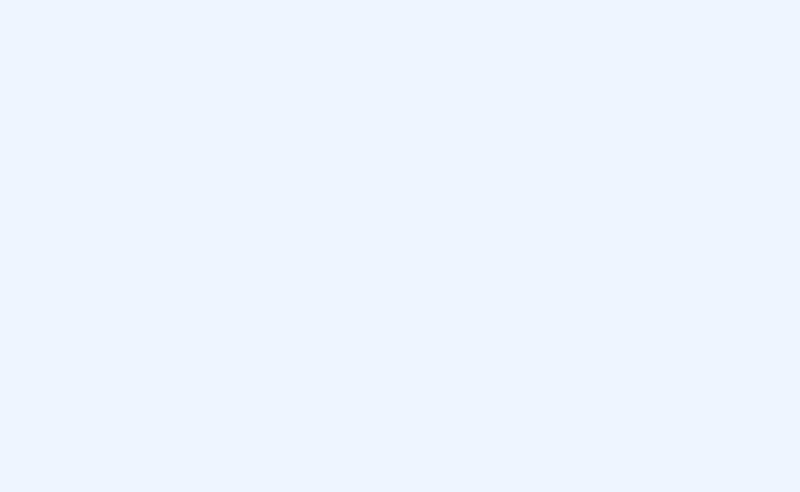
В целом, число пациентов в каждом из этих исследований было небольшим, и некоторые исследования имели ограничения, которые могли повлиять на результаты, поэтому у нас очень высокая степень неопределенности в отношении этих результатов.
Доказательства актуальны на октябрь 2017 года.
Спинальная мышечная атрофия у детей и взрослых: причины, диагностика и «укол жизни»
Спинальная мышечная атрофия (СМА) — очень редкое заболевание, которое за год в среднем диагностируют у 35 украинцев. Однако услышать аббревиатуру СМА можно довольно часто: в интернете, на телевидении и даже в метро сегодня нередки сообщения о сборах средств на дорогостоящее лечение этой болезни. За так называемый «укол жизни», который может остановить тяжелое развитие диагноза, надо выложить восьмизначную сумму. Что надо знать о спинальной мышечной атрофии и почему в Украине пациенты не могут получить помощь от государства? Заборона поговорила об этом с Виталием Матюшенко, главой харьковского благотворительного фонда «Дети со спинальной мышечной атрофией».
Что надо знать о спинальной мышечной атрофии и почему в Украине пациенты не могут получить помощь от государства? Заборона поговорила об этом с Виталием Матюшенко, главой харьковского благотворительного фонда «Дети со спинальной мышечной атрофией».
Что такое СМА?
Спинальная мышечная атрофия — это наследственное генетическое заболевание, поражающее моторные нейроны в спинном мозге. Это руководящие центры организма, которые подают сигналы от мозга к мышцам и наоборот. За работоспособность моторных нейронов отвечает белок SMN (survival motor neuron) — его производит ген SMN1. Однако из-за мутации в гене выработка белка останавливается, а его отсутствие провоцирует постепенное отмирание моторных нейронов и далее — атрофию мышц.
Заболевание передается от родителей к ребенку при условии, что у обоих есть сломанный ген. В таком случае вероятность его наследования равна 25%. Проявить себя СМА может в любом возрасте — как у ребенка, так и у взрослого, но какой именно механизм является катализатором этого процесса, науке пока неизвестно.
В зависимости от проявлений различают четыре типа спинальной мышечной атрофии. Для четвертого типа, который обычно обнаруживают у взрослых, характерны совсем поверхностные проявления заболевания — в частности, физическая усталость. Для самого тяжелого — первого — поражение мышц дыхания, глотания и скелетной мускулатуры. Такие пациенты почти никогда не доживают до четырех лет и обычно умирают в первый год жизни.
Распространенность спинальной мышечной атрофии не исследована подробно из-за ее редкости. Это орфанная болезнь — то есть такая, которая встречается не чаще 1 случая на 2000 населения. Согласно общемировой статистике, один из 10 тысяч новорожденных будет иметь спинальную мышечную атрофию. В Украине, по данным Фонда больных СМА, в 2020 году зарегистрировали 45 случаев этого заболевания. Ежегодное среднее количество новых случаев за последние 3 года в Украине составляет 35 пациентов.
Как распознать заболевание?
Спинальная мышечная атрофия начинается с мышечной слабости и общей потери сил.
«Врачи в большинстве случаев говорят: «Переждите, это возрастное. Ребенок просто не хочет двигаться, активно работать. Потому что ему комфортно так лежать. Потому что он наелся. Потому что он просто такой ленивый. Не будем ничего сейчас делать. Потом немного активизируется», — объясняет Виталий Матюшенко.
Виталий Матюшенко
Эта «лень» особенно проявляется в раннем возрасте при тяжелом типе СМА. Именно тогда нужно немедленно принимать меры по поддержке и обезопасить ребенка от респираторных заболеваний, которые в случае ослабления дыхательных функций могут привести к смерти.
У ребенка самого Виталия Матюшенко признаком заболевания стала так называемая утиная походка: «Это выставленный вперед животик, отставленная попка и движение немного вразвалочку, когда туловище качается и ребенок переваливается с ноги на ногу». Но такое проявление СМА можно заметить уже у тех пациентов, которые достигли функции ходьбы.
Но такое проявление СМА можно заметить уже у тех пациентов, которые достигли функции ходьбы.
У взрослых заболевание не появляется внезапно: оно сопровождает человека в течение всей жизни. Однако характерные для спинальной мышечной атрофии признаки не распознают на первичном осмотре пациента, поэтому диагноз ставится с большой задержкой.
Можно ли вылечить СМА?
Генетические заболевания не лечатся: изменить генетическую природу клетки уже невозможно. Ее можно только откорректировать — или имитировать здоровый ген, или заместить те функции, которые ген не выполняет.
На сегодня есть три лекарственных средства: «Золгенсма», «Эврисди» и «Спинраза». Первый препарат направлен на внесение в организм похожего здорового гена, который некоторое время будет замещать работу недееспособного гена. А два других — на компенсацию недееспособности поломанного гена. Все три в результате способствуют продуцированию в организме белка SMN, который защищает моторные нейроны.
- Упаковка «Спинразы» – одного из препаратов для облегчения жизни пациентов со СМА. Фото: Sebastian Gollnow/picture alliance via Getty Images
«Золгенсма» — это внутривенная инъекция. Сделать ее можно только до конкретного момента — пока ребенку не исполнится 2 года, а его вес не превысит 21 килограмм. «Мы рассчитываем, что ее действенность, то есть то, сколько она будет работать, достигает пяти лет. Производитель гарантирует 10 лет. Но в любом случае после инъекции мы переступаем порог летальности в два года», — говорит Виталий Матюшенко.
«Спинраза» — тоже инъекция, которую делают в эпидуральный (нижний) отдел спинного мозга. В течение первого года жизни есть нагрузочная доза, после чего надо пожизненно делать укол три раза в год. А «Эврисди» — это сироп для употребления в домашних условиях. Его надо принимать пожизненно, каждый день в одно и то же время.
А «Эврисди» — это сироп для употребления в домашних условиях. Его надо принимать пожизненно, каждый день в одно и то же время.
Таким образом удается создать здоровый фон белка на ранней стадии, когда в организме еще не начались необратимые изменения. На более поздних стадиях можно гарантировать определенную стабилизацию. И уже в зависимости от состояния, к которому пришел организм, можно говорить об эффективности реабилитации и восстановлении утраченных функций. Конечно, есть определенные функции, которые невозможно восстановить, так как в организме отсутствуют ткани, отвечающие за их выполнение — например, мышечные ткани при первом типе СМА.
- Йенс, пятилетний мальчик с диагнозом СМА ходит в своём новом экзоскелете, Барселона, 2017 год.
 Фото: Lola Bou/Anadolu Agency/Getty Images
Фото: Lola Bou/Anadolu Agency/Getty Images
Насколько эти лекарства доступны?
Средняя цена «Эврисди» для Украины составляет около 260 тысяч гривен. То есть годовая стоимость сиропа для одного пациента в случае максимальной дозы составит около 9 млн гривен. Инъекция «Спинразы» в первый год будет стоить около 12 млн гривен, а в последующие годы — 5,5-6 млн. Стоимость «Золгенсмы» — 2,3 миллиона долларов. Купить препарат можно только в США.
Все орфанные препараты дорогостоящие — не потому, что производитель хочет на них нажиться (хотя часто и поэтому тоже), а из-за высокой стоимости производства маленьких партий, поскольку эти препараты выпускают редко из-за недостаточного спроса.
Виталий Матюшенко отмечает, что такие лекарства не рассматриваются как те, что можно приобрести за свой счет: «Это априори прерогатива государства — обеспечивать таким лечением пациентов, которые в нем нуждаются. Это политика государства, политика системы здравоохранения, политика защиты своих граждан».
В Украине пока лечение от СМА никак не доступно, поскольку не существует ни одной государственной программы, которая финансировала бы приобретение лекарственных средств и специального оборудования. Но 2 июня 2021-го Верховная Рада Украины приняла в первом чтении законопроект 4662, определяющий процедуру закупки дорогостоящих инновационных лекарств в порядке заключения договора управляемого доступа (ДУД).
В пояснительной записке к законопроекту говорится, что ДУД — это специальные договоры между владельцем регистрационного удостоверения на лекарственное средство и распорядителем бюджетных средств. Такой договор заключается по результатам переговоров и позволяет обеспечить пациентам доступ к инновационным медицинским технологиям.
Виталий Матюшенко называет этот законопроект «лазейкой в украинском законодательстве», поскольку он позволит прописывать финансирование лечения отдельной строкой в бюджете без необходимости быть включенным в соответствующую государственную программу (которой сейчас нет). Но пока неизвестно, что будет после окончания срока ДУД. «Закрывает ли власть проблему временно или у нее какие-то другие намерения, которые могут быть как полезными для пациентского сообщества, так и наоборот обернуться худшей ситуацией для нас», — говорит Матюшенко.
Но пока неизвестно, что будет после окончания срока ДУД. «Закрывает ли власть проблему временно или у нее какие-то другие намерения, которые могут быть как полезными для пациентского сообщества, так и наоборот обернуться худшей ситуацией для нас», — говорит Матюшенко.
То есть единственный выход — это получать помощь за границей?
Сейчас — да. Ближайший и самый простой путь — ехать в Польшу. Чтобы получить помощь, нужно иметь трудовую визу и официальное трудоустройство с оформлением государственной страховки. А дальше — обратиться к врачу и подтвердить диагноз СМА. Для этого необходимо иметь результаты соответствующего ДНК-теста, который можно сделать и в Украине (Польша обычно дополнительно его не проверяет).
«Самое быстрое наше достижение — месяц от пересечения границы до получения лечения пациентом, — говорит Матюшенко. — Но если у родителей до этого были какие-то трудовые отношения в Польше, получить помощь можно будет еще быстрее».
атрофия мышц — это.
 .. Что такое атрофия мышц?
.. Что такое атрофия мышц? АТРОФИЯ МЫШЦ — Ацидум муриатикум, 6, 12 и бвр общая слабость, головокружения, тяжесть в затылке. Из за слабости ног все время съезжает с постели вниз. Походка нетвердая, с подкашиванием в коленях. Боли в ахилловых сухожилиях. Слабость конечностей, они… … Справочник по гомеопатии
АТРОФИЯ МЫШЦ ПРИ ЗАБОЛЕВАНИЯХ НЕРВНОЙ СИСТЕМЫ — АТРОФИЯ МЫШЦ ПРИ ЗАБОЛЕВАНИЯХ НЕРВНОЙ СИСТЕМЫ. I. А. м. п р и параличах церебрального происхождения можно наблюдать при детских церебральных параличах, т. е. при детских гемиплегиях, диплегиях и т. п.; при этом обыкновенно встречается атрофия не… … Большая медицинская энциклопедия
атрофия — и, только ед., ж. 1) Прижизненное уменьшение, ослабление или отмирание органа, ткани в организме животных и человека, сопровождающееся нарушением или прекращением их функции. Атрофия мышц конечности. 2) перен. Притупление, утрата какого л.… … Популярный словарь русского языка
Атрофия Спинного Мозга Мышечная (Spinal Muscular Atrophy (Sma)) — наследственное заболевание, при котором происходит гибель двигательных нейронов спинного мозга и наблюдается прогрессирующая атрофия мышц верхних и нижних конечностей. Недавно был выявлен ген, отвечающий за развитие этого заболевания: у больных… … Медицинские термины
АТРОФИЯ СПИННОГО МОЗГА МЫШЕЧНАЯ — (spinal muscular atrophy (SMA)) наследственное заболевание, при котором происходит гибель двигательных нейронов спинного мозга и наблюдается прогрессирующая атрофия мышц верхних и нижних конечностей. Недавно был выявлен ген, отвечающий за… … Толковый словарь по медицине
атрофия мышечная — (atrophia musculorum) атрофия мышц, характеризующаяся постепенным истончением и перерождением мышечных волокон, уменьшением их сократительной способности; наблюдается при различных интоксикациях, является ведущим признаком некоторых… … Большой медицинский словарь
АТРОФИЯ — (от греч. а отриц. част, и trophe питание), термин, употребляющийся для обозначения уменьшения объема клеток, ткани или органа вследствие нарушения питания их. Следовательно, А. есть прижизненный, приобретенный процесс уменьшения объема той или… … Большая медицинская энциклопедия
АТРОФИЯ ДЕТСКАЯ — АТРОФИЯ ДЕТСКАЯ, термин, впервые появившийся в детской медицине в XVI в. , применяется для обозначения тяжелого, нередко смертельного, хронич. расстройства питания у детей, сопровождающегося явлениями резкого исхудания и истощения организма. В… … Большая медицинская энциклопедия
, применяется для обозначения тяжелого, нередко смертельного, хронич. расстройства питания у детей, сопровождающегося явлениями резкого исхудания и истощения организма. В… … Большая медицинская энциклопедия
Атрофия — – дегенерация психической функции (стыда и т. д.) в результате стресса, конфликта, фрустрации, наркотиков и др. Так, при пожаре, люди не стыдятся выбегать на улицу полуголые, при далеко зашедшей ссоре не совестятся показать свои низменные… … Энциклопедический словарь по психологии и педагогике
Атрофия — I Атрофия (atrophia; греч. отрицательная приставка а + trophē питание) уменьшение объема органов, тканей и клеток, сопровождающееся снижением их функций. Выделяют физиологическую и патологическую А. Физиологическая А. развивается по мере старения … Медицинская энциклопедия
Атрофия Зудека — Син.: Атрофия костная острая. Синдром Лериша–Зудека. Острые вазомоторные и артропатические изменения в связи с травмой или воспалительным поражением тканей дистальных отделов конечностей. В начальной стадии процесса характерны гиперемия кожи,… … Энциклопедический словарь по психологии и педагогике
В начальной стадии процесса характерны гиперемия кожи,… … Энциклопедический словарь по психологии и педагогике
Атрофия мышц — причины, симптомы, диагностика и лечение в Челябинске
Мышечная атрофия. Что это?
Атрофия мышц – серьезное заболевание, при котором мышцы (как правило, мышцы конечностей) постепенно уменьшаются в объемах, истончаются, вследствие чего утрачивают свои функции, частично либо полностью. Пострадать могут мышцы только на одной стороне тела, другая же – будет оставаться здоровой.
Причины и симптомы атрофии мышц
Уменьшение мышц в объёмах в области поражения, мышечная слабость, спазмы в мышцах, боль при прикосновении, общее угнетённое состояние – это основные симптомы мышечной атрофии. При вторичной форме часто деформируются стопы и голени, из-за чего сильно меняется походка .
Причины возникновения атрофии мышц могут быть самыми разными:
Гиподинамия (длительное обездвиженное состояние)Различные инфекционные болезни (например, полиомиелит и др.
)
Нарушение обмена веществ, повлекшие дистрофические изменения в тканях мышц
Поражение нервной системы
Наследственный фактор (проявляется в раннем детстве и, как правило, в очень тяжёлой форме)
Старение организма
Травмы, длительное голодание, отравления
Таким образом, атрофия мышц может возникать и как самостоятельный недуг, и быть спутником других тяжелых болезней. В зависимости от источника болезни, выделяют типы мышечной атрофии: первичную (простую) и вторичную (неврогенную). Причиной первичной атрофии чаще служат внешние факторы. Вторичная атрофия мышц развивается на фоне поражения нервной системы.
Атрофия мышц вследствие гиподинамии
Очень часто мышечная атрофия появляется у людей, длительное время пребывающих без физической активности. Это состояние может возникнуть вынужденно после перелома конечности, после операции, после перенесённого инсульта или на фоне различных соматических заболеваний. Обездвиженное положение ведёт к тому, что клетки плохо снабжаются кровью, возникает гипоксия мозга и других важных органов (в частности, сердца), происходит нарушение в работе гормональной и нервной систем. Таким образом, мышцы прекращают передавать сигналы в мозг и постепенно теряют свою функциональность.
Вслед за атрофией мышц организм продолжит разрушаться дальше: могут возникнуть необратимые изменения в сердечно-сосудистой системе. Очень важно не допускать состояния гиподинамии у детей, ведь у них только формируются все жизненно важные системы и опорно-двигательный аппарат. Отставание в моторном развитии и координации чревато серьезными неврологическими нарушениями.
Лечение атрофии мышц
Сегодня, благодаря современным методам исследования, диагностировать мышечную атрофию не сложно. Собственно, и лечение атрофии мышц будет достаточно эффективным, если его начать вовремя и заниматься этим серьёзно.
Большую роль, помимо лекарственных комплексов и соблюдения определённой диеты, в лечении этого заболевания играют физиотерапевтические процедуры. Лечение проводится курсом. Но оно позволит запустить процессы самовосстановления в организме и остановить атрофию мышц.
В Клинике Белозеровой помогут восстановить объем двигательной активности.
|
Атрофия мышц
Атрофия мышц является следствием ряда заболеваний суставов, периферических нервов и спинного мозга (параличи), травм мышц, интоксикаций, злокачественных опухолей, авитаминоза Е и В, голодания и др.
3) функциональная, или атрофия от бездеятельности, вследствие ограничения функции движения при многих заболеваниях (артриты,особенно остеоартриты, анкилозы суставов, остеомиелит, хроническое воспаление сухожилий и их влагалищ). Разновидностью функциональной атрофии является травматическая атрофия, возникающая вследствие непосредственного повреждения мышц (ушибы, разрывы, сдавливания). Некоторые авторы атрофию при гнойных артритах относят к функциональной, что не вполне правильно, так как в ее возникновении большое значение имеют болевая реакция и патологические рефлексы с пораженной ткани.
Похожий материал по теме:
|
Что такое атрофия рук?
Атрофия рук — это состояние, при котором мышцы руки разрушаются и отмирают. Также называемая атрофия мышц, атрофия рук приводит к тому, что мышцы начинают терять свою массу и силу. Это, в свою очередь, может привести к общему снижению способности руки двигаться.
Когда рука неподвижна в течение длительного периода времени, мышцы начинают терять силу и размер. Эти симптомы свидетельствуют о атрофии рук. Условие распространено, когда перелом руки или запястья требует отливки. Проблемы с суставами, такие как артрит, при которых нормальные движения становятся болезненными, также могут вызвать атрофию рук.
В дополнение к общей слабости с видимым сокращением мышц, атрофия рук может привести к искаженному виду руки и пальцев. Состояние, называемое «коготь руки», является продуктом давней атрофии. Характеризуемая сжатием руки с преувеличенным разгибанием суставов и сгибанием пальцев, коготь кисти может серьезно ограничить общее использование руки. Это измененное положение руки обычно наблюдается при состояниях, которые вызывают прогрессирующую мышечную атрофию.
Истощение мышц также может произойти, если есть проблемы с нервами. Нервы передают сигналы, которые заставляют мышцы сокращаться или напрягаться. Нервное расстройство может быть результатом травмы или болезненного процесса. Например, диабет может привести к повреждению нервов. Это состояние, которое приводит к повреждению нервов в результате чрезмерно высокого уровня сахара в крови, называется диабетической невропатией.
Состояние здоровья, такое как Gullain-Barre и боковой амиотрофический склероз или ALS, может вызвать ухудшение мышц по всему телу, включая руку. Считается, что вызванный вирусом синдром Гуллена-Барре поражает нервы, вызывая болевые симптомы, а в крайних случаях — паралич. Эта потеря движения увеличивает риск снижения мышечного тонуса или атрофии, особенно в руке.
БАС, обычно называемая болезнью Лу Герига, представляет собой прогрессирующее состояние, вызывающее широко распространенное разрушение мышц, которое в конечном итоге распространяется на атрофию рук. Эта болезнь убивает нервы, которые контролируют сокращение или движение мышц по всему телу. Когда разрушается достаточное количество нервных клеток, весь организм теряет способность функционировать.
Лечение атрофии кисти включает устранение ее первопричины и возникающей в результате слабости или деформации. Выполнение общей программы движений и упражнений может увеличить общее движение рук и силу. Шины, обычно используемые в состоянии покоя, могут помочь ограничить степень искажения руки, медленно вытягивая руку назад в более нормальное положение.
ДРУГИЕ ЯЗЫКИ
Мышечная атрофия | Мультимедийная энциклопедия | Информация о здоровье
Атрофия мышц; Расточительство; Атрофия мышцМышечная атрофия — это истощение или потеря мышечной ткани.
Причины
Существует два типа мышечной атрофии: неиспользованная и нейрогенная.
Атрофия неиспользования вызвана: недостаточно задействовать мышцы .Этот тип атрофии часто можно исправить с помощью физических упражнений и улучшения питания. Больше всего страдают те, кто:
- Сидячая работа, проблемы со здоровьем, ограничивающие движение, или пониженный уровень активности.
- Прикованы к постели
- Не может двигать конечностями из-за инсульта или другого заболевания головного мозга
Нейрогенная атрофия — самый тяжелый тип мышечной атрофии.Это может быть травма или заболевание нерва, который соединяется с мышцей. Этот тип мышечной атрофии обычно возникает более внезапно, чем атрофия неиспользования.
Примеры заболеваний нервов, контролирующих мышцы:
Хотя люди могут адаптироваться к атрофии мышц, даже незначительная атрофия мышц вызывает некоторую потерю движений или силы.
Другие причины атрофии мышц могут включать:
Уход на дому
Программа упражнений может помочь при мышечной атрофии.Упражнения могут включать упражнения в бассейне для уменьшения нагрузки на мышцы и другие виды реабилитации. Ваш лечащий врач может рассказать вам об этом больше.
Люди, которые не могут активно двигать одним или несколькими суставами, могут выполнять упражнения с подтяжками или шины .
Когда обращаться к медицинскому работнику
Позвоните своему врачу, чтобы записаться на прием, если у вас необъяснимая или длительная потеря мышечной массы.Это часто можно увидеть, сравнивая одну руку, руку или ногу с другой.
Чего ожидать при посещении офиса
Провайдер выполнит физический осмотр и спросите о вашей истории болезни и симптомах, в том числе:
- Когда началась атрофия мышц?
- Становится хуже?
- Какие еще симптомы у вас есть?
Врач осмотрит ваши руки и ноги и измерит размер мышц.Это может помочь определить, какие нервы поражены.
Проверки, которые могут быть выполнены, включают:
Лечение может включать физиотерапию, ультразвуковую терапию и, в некоторых случаях, операцию по исправлению контрактура .
Список литературы
Гибсон Дж., Хантли Дж.Опорно-двигательный аппарат. В: Douglas G, Nicol F, Robertson C, eds. Клиническое обследование Маклеода . 13-е изд. Филадельфия, Пенсильвания: Эльзевьер; 2013: глава 14.
Селцен Д. Мышечные заболевания. В: Goldman L, Schafer AI, ред. Медицина Сесила Гольдмана .25-е изд. Филадельфия, Пенсильвания: Эльзевьер Сондерс; 2016: глава 421.
Атрофия мышечной мускулатуры | STIWELL
Симптомы и прогрессирование мышечной атрофии
Мышечная атрофия вызывает потерю мышечной массы . Атрофия мышц может затронуть одну или несколько мышц и привести к снижению силы, то есть к мышечной слабости. Типичные симптомы мышечной слабости — нарушение движений или действий (ходьба, подъем по лестнице, работа по дому и т. Д.).
В отличие от атрофий и нервно-мышечных заболеваний, связанных с иммобилизацией, повреждение центрального или периферического нерва может также вызывать другие симптомы, например, сенсорные расстройства. В случае периферического повреждения (нижнего МН) непроизвольные мышечные подергивания (фасцикуляции) может возникнуть помимо атрофии.
Если атрофия мышцы вызвана изолированной травмой (удар, порез и т. Д.), Истощается только та часть мышцы, которая снабжается пораженным нервом. В таких случаях дальнейшего ухудшения не происходит, возможно даже улучшение (реиннервация) после определенная стадия атрофии.В противном случае в случае раннего начала (например, в детстве) прогрессирование обычно бывает более тяжелым, чем если заболевание возникает в более позднем возрасте. Боковой амиотрофический склероз и миастения (миастения), которые обычно появляются в более зрелом возрасте и быстро прогрессируют, являются исключением из этого правила.
Если это сохраняется в течение более длительного периода, уменьшение толщины мышцы становится очевидным, т. Е. Пораженная мышца или конечность тоньше, чем непораженная. Во многих случаях лекарство невозможно, но функцию можно улучшить с помощью помощь лечебных мероприятий, таких как физиотерапия или электролечение.
Терапия и реабилитация при атрофии мышц
Сначала необходимо выяснить причину. После подробного изучения истории болезни и неврологического обследования становится ясно, требуются ли другие процедуры для постановки диагноза . Возможные дополнительные обследования:
- электромиография (ЭМГ)
- Тест скорости нервной проводимости (NCV)
- лабораторная диагностика (определение креатинкиназы)
- методы визуализации (рентген, МРТ и т. Д.))
- биопсия мышцы или нерва
Атрофия мышц — обзор
Болезнь Хираямы
Болезнь Хираямы (БХ) — относительно доброкачественное заболевание, связанное с мышечной слабостью и атрофией дистальных мышц верхних конечностей. Для описания HD использовалось несколько названий, включая мономельную амиотрофию, дистальную атрофию дистального отдела верхней конечности и косую амиотрофию. Впервые HD был описан Хираямой в 1959 году. 79 Патогенез HD был связан с передним смещением твердой мозговой оболочки, вызывающим нарушение микроциркуляции в нижнем шейном отделе спинного мозга и потерю двигательных нейронов. 34 , 54 Расстройство в первую очередь поражает мужчин в подростковом возрасте или в начале 20-летнего возраста, а начало слабости коварно и медленно прогрессирует. Естественная история болезни связана с прогрессированием в течение 5 лет и менее. 66 , 69 Вовлечение может быть односторонним или двусторонним, но обычно более выражено в одной конечности (рис. 40.6A и B). Интересно, что было отмечено преобладание правостороннего участия. 69 Феномен усиления слабости при воздействии холода, называемый холодовым парезом, часто описывался у пациентов с HD. 69 Признаки UMN, аномалии черепных нервов или недержание кишечника или мочевого пузыря не видны, а сенсорные нарушения обычно отсутствуют или минимальны.
Электродиагностическая оценка демонстрирует активную и хроническую денервацию в мышцах, иннервируемых миотомами C7 – T1 с особенностями потенциалов фибрилляции и увеличенными MUAP со сниженным рекрутингом. Фасцикуляции не видны при клинических или электродиагностических исследованиях. МРТ со сгибанием шеи используется для оценки смещения заднего дурального мешка вперед. 30 , 69 , 91
Из-за незаметного начала, медленного прогрессирования и относительно необычной природы расстройства обычно наблюдается значительная задержка в распознавании HD. Хотя HD является в целом доброкачественным и самоограничивающимся заболеванием, ранняя диагностика имеет решающее значение, чтобы избежать задержки в лечении и избежать ненужной потери функции верхних конечностей. Лечение может включать использование шейного воротника для ограничения сгибания шеи, а пациентам с продолжающимся прогрессированием, несмотря на консервативное лечение, может быть показана операция на шейном отделе позвоночника для декомпрессии и стабилизации. 160 Раннее лечение может продемонстрировать значительную эффективность, что подтверждает мнение о том, что причина связана со структурной дисфункцией, а не с истинным дегенеративным процессом. 66
Потеря кусочков без распада: потеря сократительного белка во время мышечной атрофии
Скелетная мышца — это пластичная ткань, которая может увеличиваться в размере (гипертрофия) в ответ на упражнение или уменьшаться (атрофия) при бездействии (1). Атрофия мышц возникает системно при физиологических состояниях, таких как голодание или старение, и при различных патологических состояниях, включая кахексию рака, сердечную недостаточность, почечную недостаточность и хроническую обструктивную болезнь легких.Очаговая атрофия определенных мышц или групп мышц может быть вызвана иммобилизацией гипсовой повязкой или травматическим повреждением периферических нервов. Удивительным аспектом потери мышечной ткани в этих условиях является тот факт, что мышечные волокна сохраняют в основном свою нормальную структуру и функцию во время атрофии, по крайней мере, на ранних стадиях. Рассмотрим голодание, когда мышцы подвергаются быстрой деградации белка и высвобождают аминокислоты, которые превращаются в глюкозу печенью, что позволяет выжить организму.Однако, несмотря на потерю мышечной массы, сократительная сила, нормализованная на мышечную массу, сохраняется (2), и голодное животное может преследовать свою добычу или перемещаться в отдаленные места для поиска пищи, подчеркивая запрограммированный характер этой эволюционно сохраненной адаптивной реакции. Исследование атрофических волокон, выделенных из денервированных мышц, также показало, что сила, нормализованная на площадь поперечного сечения, не снижается через 7 и 14 дней после перерезки седалищного нерва (3). Как может мышечная машина терять части, не теряя функции, чего не могут сделать машины, созданные руками человека?
Отличительной особенностью сократительного аппарата является модульная конструкция, повышающая его сопротивляемость после повреждений и позволяющая сохранить сократительную функцию при атрофии.В мышечных волокнах, которые представляют собой гигантские удлиненные клетки, содержащие сотни ядер, сократительный материал организован в миофибриллы, расположенные параллельно и состоящие из модульных единиц, расположенных последовательно, саркомеров (рис. 1). Одно мышечное волокно человека, которое в длинных мышцах может достигать 10–20 см в длину и 0,1 мм в ширину, может содержать миллионы саркомеров, каждый ∼2 мкм в длину и 1 мкм в ширину. Саркомеры состоят из двух наборов нитей, толстой (миозин) и тонкой (актин), которые могут скользить одна по другой благодаря АТФазной активности молекулярного мотора, молекулы миозина, таким образом вызывая укорочение и / или генерацию силы.Толстые и тонкие филаменты содержатся внутри саркомерного цитоскелета, состоящего из жестких Z-дисков и эластичных филаментов тайтина, которые проходят между двумя Z-дисками. Внесаркомерный цитоскелет, состоящий из промежуточных филаментов десмина и других белков, обеспечивает поперечный каркас, окружающий миофибриллы на уровне Z-дисков и связывающий соседние миофибриллы, таким образом удерживая саркомеры и создавая типичный полосатый вид волокон скелетных мышц.
Рис.1.На верхней панели показан продольный разрез волокна скелетных мышц крысы, визуализированный с помощью электронной микроскопии. Цитоплазма заполнена миофибриллами, которые состоят из саркомеров, расположенных последовательно и окаймленных Z-дисками (Z). На нижней панели представлена схема двух соседних саркомеров с толстыми (миозин) и тонкими (актиновыми) филаментами. Z-диски соединены поперечно ориентированными десминовыми нитями (D). Проиллюстрированы два важных этапа разрушения саркомеров во время мышечной атрофии: во-первых, TRIM32-индуцированное убиквитинирование (u) десминовых филаментов, тонких филаментов и белков Z-диска, за которым следует PAX4-зависимая регуляция p97, который отвечает за экстракцию убиквитинированных белков (uP) из саркомеров до их деградации в протеасоме.
Механизм, приводящий к потере сократительных белков во время мышечной атрофии, плохо изучен, но недавние исследования, такие как PNAS, проведенные Volodin et al. (4) проливают свет на этот процесс. Система убиквитин-протеасома, основной путь деградации белков, присутствующий во всех клетках, участвует в деградации сократительных белков мышц (5). В этой системе белки сначала конъюгируются с убиквитином посредством трехэтапного процесса, при этом фермент E1 сначала связывает убиквитин, который затем переносится на фермент E2 и, наконец, конъюгируется с субстратом с помощью лигазы E3.Убиквитинированные белки распознаются протеасомными рецепторами и расщепляются протеасомными протеазами. Идентифицировано большое количество лигаз E3 с отчетливой субстратной специфичностью. В частности, две мышечно-специфичные убиквитинлигазы, мышечный RING-finger 1 (MuRF1) и Atrogin1 / MAFbx, быстро индуцируются при различных типах мышечной атрофии (6, 7), и их потеря снижает мышечное истощение (6). Экспрессия как MuRF1, так и Atrogin1 регулируется фактором транскрипции FoxO3, который вызывает драматическую атрофию мышц при сверхэкспрессии в мышечных волокнах взрослых (8).Общий набор многих генов, называемых атрогенами, индуцируется факторами транскрипции FoxO в различных условиях истощения мышц (9).
Последующие исследования показали, что толстые и тонкие волокна разлагаются по разным механизмам. MuRF1 убиквитинирует белки толстых филаментов, сначала легкие цепи миозина и миозин-связывающий белок C, а затем тяжелые цепи миозина, что приводит к их протеасомной деградации (10, 11). Напротив, отдельная убиквитинлигаза, белок 32, содержащий трехкомпонентный мотив (Trim32), отвечает за деградацию белков тонких филаментов, актина, тропомиозина и тропонина, а также белка Z-диска, α-актинина, потеря которого составляет очевидно, предшествует Trim32-зависимая деградация десминных филаментов (12).Однако эти анализы деградации тонких волокон проводились во время чрезвычайно быстрой мышечной атрофии, вызванной голоданием; поэтому точная последовательность событий, ведущих к атрофии мышц, не могла быть четко определена. В PNAS Володин и др. (4) повторно исследовать тонкие волокна и изменения десмина во время более медленной атрофии, вызванной денервацией. Они сообщают, что ранним изменением в течение первой недели после перерезки нерва является фосфорилирование и убиквитинирование десмина, за которым в течение второй недели следует диссоциация десминных филаментов и их убиквитинирование, за которым следует убиквитинирование и деградация сократительных белков.Полученные данные указывают на то, что деполимеризация сети десмина, процесс, ускоренный электропорацией денервированных мышц доминантно-отрицательным ингибитором сборки десмина, является условием разрушения миофибрилл, предположительно потому, что он делает белки тонких филаментов более восприимчивыми к убиквитинированию. С другой стороны, общее количество десмина не снижалось через 14 дней после денервации, в отличие от исчезновения десмина после голодания в течение 2 дней (12).
Первым важным результатом настоящего исследования (4) является идентификация двух фаз транскрипционной программы, вызванной атрофией денервации: ранняя фаза, характеризующаяся повышающей регуляцией различных атрогенов, которая происходит через несколько дней после перерезки нерва под воздействием атрофии. контроль факторов транскрипции FoxO и вторая фаза через 10–14 дней, характеризующаяся повышающей регуляцией других ферментов, включая p97 / VCP, которая не регулируется FoxO.Действительно, уровень p97 не изменяется из-за избыточной экспрессии конститутивно активного FoxO3 в мышечных трубках, хотя доминантно-отрицательный мутант p97 блокирует увеличение деградации долгоживущих белков с помощью конститутивно активного FoxO3 (13). Известно, что ААА-АТФаза p97 / VCP взаимодействует с убиквитинированными белками, связанными с мембранами эндоплазматического ретикулума, хроматином или митохондриями, с помощью убиквитин-связывающих кофакторов и способна извлекать эти целевые белки из этих структур, чтобы обеспечить деградацию протеасомами ( 14).По аналогии было высказано предположение, что p97, который в мышцах образует комплексы с кофакторами Ufd1 и p47, ассоциирует и извлекает убиквитинированные белки из миофибрилл перед доставкой в протеасому (13). Эта интерпретация подтверждается открытием, что накопление p97, Ufd1 и p47 в атрофированных мышечных волокнах совпадает с быстрым распадом миофибриллярных белков через 10-14 дней после денервации (4).
Для определения фактора (ов) транскрипции, ответственного за экспрессию P97 и других транскриптов, активируемую в течение второй недели после перерезки нерва, Volodin et al.(4) проанализировали промоторы этих генов и обнаружили, что все они содержат мотивы связывания для фактора транскрипции PAX4. Это открытие является совершенно неожиданным, во-первых, потому, что факторы транскрипции PAX известны своей ролью в работе Volodin et al. дают общую, хотя, конечно, еще не полную картину пути, участвующего в контролируемом демонтаже цитоскелетных и миофибриллярных структур во время мышечной атрофии.
органогенез во время развития и обычно подавляется у взрослых, во-вторых, потому что Pax4 контролирует дифференцировку продуцирующих инсулин бета-клеток в поджелудочной железе (15), тогда как два других члена семейства PAX, Pax 3 и Pax7, регулируют мышечных предшественников. ячейки (16).Володин и др. (4) показывают, что Pax4 экспрессируется в скелетных мышцах и что экспрессия p97 заметно снижается, когда уровни PAX4 снижены путем электропорации мышц натощак со специфическими shРНК. В этих условиях убиквитинированные белки сохраняются в миофибриллярной фракции, эффект подобен тому, который вызывается доминантно-негативным p97, подтверждая критическую роль оси PAX4-p97 в экстракции и деградации миофибриллярных компонентов. Интересно, что PAX4 также индуцирует экспрессию MuRF1 через 10 дней после перерезки нерва, тем самым способствуя деградации толстых филаментов.
В заключение Володин и др. (4) предоставляют общую, хотя, конечно, еще не полную картину пути, участвующего в контролируемом демонтаже цитоскелетных и миофибриллярных структур во время атрофии мышц (Рис. 1). Первый этап менее хорошо охарактеризован, поскольку киназа, ответственная за фосфорилирование десмина во время атрофии in vivo, еще не идентифицирована. За этим следует убиквитинирование и разборка десмина с помощью убиквитинлигазы TRIM32, которая, в свою очередь, способствует последующему убиквитинированию белков тонких филаментов и Z-дисков с помощью TRIM32.На более поздней стадии PAX4-зависимая регуляция p97 делает возможным связывание и экстракцию миофибриллярных белков с помощью p97, предположительно с последующим их переносом в протеасому. Эта схема была проверена как после голодания, так и после перерезки нервов, хотя прогрессирование изменений намного быстрее после голодания по сравнению с денервацией. Будет интересно определить, как многочисленные другие факторы, которые, как известно, участвуют в распаде миофибрилл, вписываются в эту схему, и имеет ли подобная последовательность изменений в других моделях мышечного истощения, таких как раковая кахексия или сердечная недостаточность.
Другой открытый вопрос заключается в том, затрагиваются ли миофибриллы и цитоскелет однородно по всему мышечному волокну во время атрофии или процесс деградации происходит преимущественно в определенных областях. Ранние ультраструктурные исследования показали, что в течение первых 2 недель после денервации периферические миофибриллы часто оказывались разрушенными, тогда как внутренние миофибриллы демонстрировали «хорошую сохранность и выравнивание полос» (17). Будет важно повторно исследовать эту проблему путем иммуноокрашивания соответствующими антителами для картирования областей разрушения цитоскелета и миофибрилл.Например, можно спросить, происходит ли рекрутирование протеасом в определенных регионах, например, на периферии волокон или на периферии миофибрилл. Можно также попытаться визуализировать убиквитинирование миофибрилл и разрушение живых мышечных волокон, подход, ранее использовавшийся для визуализации дислокации белков из эндоплазматического ретикулума (18). Визуализация живых клеток позволила бы определить, является ли деградация сократительного белка однородным и медленно прогрессирующим процессом или скорее характеризуется спорадическими катастрофическими событиями, вызванными очаговой дестабилизацией миофибрилл.
Сноски
-
Вклад авторов: С.С. написал статью.
-
Автор заявляет об отсутствии конфликта интересов.
-
См. Сопутствующую статью на стр. E1375.
Механизмы атрофии и гипертрофии мышц: последствия для здоровья и болезней
Баскин К. К., Виндерс Б. Р. и Олсон Э. Н. Мышцы как «посредник» системного метаболизма. Cell Metab. 21 , 237–248 (2015).
CAS PubMed PubMed Central Статья Google ученый
Sandri, M. et al. PGC-1alpha защищает скелетные мышцы от атрофии, подавляя действие FoxO3 и транскрипцию специфичных для атрофии генов. Proc. Natl Acad. Sci. США 103 , 16260–16265 (2006).
ADS CAS PubMed Статья PubMed Central Google ученый
Brocca, L. et al. FoxO-зависимые атрогены различаются в зависимости от катаболических состояний и играют ключевую роль в атрофии мышц, вызванной подвешиванием задних конечностей. J. Physiol. 595 , 1143–1158 (2017).
CAS PubMed Статья PubMed Central Google ученый
Grumati, P. et al. Физические упражнения стимулируют аутофагию в нормальных скелетных мышцах, но вредны для мышц с дефицитом коллагена VI. Аутофагия 7 , 1415–1423 (2011).
CAS PubMed PubMed Central Статья Google ученый
Лю, Г. Ю. и Сабатини, Д. М. mTOR на стыке питания, роста, старения и болезней. Nat. Rev. Mol. Cell Biol. 21 , 183–203 (2020).
CAS PubMed Статья PubMed Central Google ученый
Musaro, A. et al. Локальная экспрессия трансгена Igf-1 поддерживает гипертрофию и регенерацию стареющих скелетных мышц. Nat. Genet. 27 , 195–200 (2001).
CAS PubMed Статья PubMed Central Google ученый
Ascenzi, F. et al. Влияние изоформ IGF-1 на рост мышц и саркопению. Ячейка старения 18 , e12954 (2019).
PubMed PubMed Central Статья CAS Google ученый
Murgia, M. et al. Ras участвует в зависимой от нервной активности регуляции мышечных генов. Nat. Cell Biol. 2 , 142–147 (2000).
CAS PubMed Статья PubMed Central Google ученый
Pallafacchina, G., Calabria, E., Serrano, A. L., Kalhovde, J. M. & Schiaffino, S. Зависимый от протеинкиназы B и чувствительный к рапамицину путь контролирует рост скелетных мышц, но не определение типа волокна. Proc. Natl Acad. Sci. США 99 , 9213–9218 (2002).
ADS CAS PubMed Статья PubMed Central Google ученый
Blaauw, B. et al. Индуцируемая активация Akt увеличивает массу и силу скелетных мышц без активации сателлитных клеток. Faseb J. 23 , 3896–3905 (2009).
CAS PubMed Статья Google ученый
Bentzinger, C. F. et al. Специфическая абляция скелетных мышц хищника, но не риктора, вызывает метаболические изменения и приводит к мышечной дистрофии. Cell Metab. 8 , 411–424 (2008).
CAS PubMed Статья Google ученый
Risson, V. et al. Мышечная инактивация mTOR вызывает метаболические и дистрофиновые дефекты, приводящие к тяжелой миопатии. J. Cell Biol. 187 , 859–874 (2009).
CAS PubMed PubMed Central Статья Google ученый
You, J. S. et al. Роль хищника в индуцированной механической нагрузкой регуляции передачи сигналов mTOR, синтеза белка и гипертрофии скелетных мышц. FASEB J. 33 , 4021–4034 (2019).
CAS PubMed Статья Google ученый
Zhang, Q.и другие. Недостаток мышечной активности киназы mTOR вызывает раннее начало миопатии и нарушает гомеостаз всего тела. J. Cachexia Sarcopenia Muscle 10 , 35–53 (2019).
PubMed Статья Google ученый
Castets, P. et al. Устойчивая активация mTORC1 в скелетных мышцах подавляет конститутивную аутофагию и аутофагию, вызванную голоданием, и вызывает тяжелую миопатию с поздним началом. Cell Metab. 17 , 731–744 (2013).
CAS PubMed Статья Google ученый
Макферрон, А. К., Лоулер, А. М. и Ли, С. Дж. Регулирование массы скелетных мышц у мышей новым членом суперсемейства TGF-бета. Nature 387 , 83–90 (1997).
ADS CAS PubMed Статья Google ученый
Sartori, R. et al. Факторы транскрипции Smad2 и 3 контролируют мышечную массу в зрелом возрасте. Am. J. Physiol. Cell Physiol. 296 , C1248 – C1257 (2009).
CAS PubMed Статья Google ученый
Winbanks, C.E. et al. Фоллистатин-опосредованная гипертрофия скелетных мышц регулируется Smad3 и mTOR независимо от миостатина. J. Cell Biol. 197 , 997–1008 (2012).
CAS PubMed PubMed Central Статья Google ученый
Sartori, R. et al. Передача сигналов BMP контролирует мышечную массу. Nat. Genet. 45 , 1309–1318 (2013).
CAS PubMed Статья Google ученый
Traore, M. et al. Эмбриональная изоформа CaVbeta1 способствует поддержанию мышечной массы посредством передачи сигналов GDF5 у взрослых мышей. Sci. Пер. Med. 11 , eaaw1131 (2019).
CAS PubMed Статья Google ученый
Winbanks, C.E. et al. Доставка гена Smad7 предотвращает мышечное истощение, связанное с раковой кахексией у мышей. Sci. Пер. Med. 8 , 348ra398 (2016).
Артикул CAS Google ученый
Davey, J. R. et al. Комплексный анализ экспрессии мышечной гипертрофии определяет Asb2 как негативный регулятор мышечной массы. JCI Insight 1 , e85477 (2016).
PubMed PubMed Central Статья Google ученый
Winbanks, C.E. et al. Ось костного морфогенетического белка является положительным регулятором массы скелетных мышц. J. Cell Biol. 203 , 345–357 (2013).
CAS PubMed PubMed Central Статья Google ученый
Клайн, У. О., Панаро, Ф. Дж., Янг, Х. и Бодин, С. С. Рапамицин подавляет рост и эффекты кленбутерола в отношении сохранения мышц. J. Appl. Physiol. 102 , 740–747 (2007).
CAS PubMed Статья Google ученый
Goncalves, D. A. et al. Передача сигналов инсулина / IGF1 опосредует эффекты бета2-адренергического агониста на протеостаз и рост мышц. J. Cachexia Sarcopenia Muscle 10 , 455–475 (2019).
PubMed PubMed Central Статья Google ученый
Benoit, B. et al.Фактор роста фибробластов 19 регулирует массу скелетных мышц и уменьшает мышечное истощение у мышей. Nat. Med. 23 , 990–996 (2017).
CAS PubMed Статья Google ученый
Ост, Л. Дж., Кустерманн, М., Армани, А., Блаау, Б. и Романелло, В. Фактор роста фибробластов 21 контролирует митофагию и мышечную массу. J. Cachexia Sarcopenia Muscle 10 , 630–642 (2019).
PubMed PubMed Central Статья Google ученый
Коэн, С., Ли, Д., Чжай, Б., Гайги, С. П. и Голдберг, А. Л. Trim32 снижает передачу сигналов PI3K-Akt-FoxO при мышечной атрофии, способствуя диссоциации плакоглобина-PI3K. J. Cell Biol. 204 , 747–758 (2014).
CAS PubMed PubMed Central Статья Google ученый
Summermatter, S. et al. Блокада металлотионеинов 1 и 2 увеличивает массу и силу скелетных мышц. Mol. Cell Biol. 37 , e00305-16 (2017).
Wang, G. et al. Метастатический рак способствует развитию кахексии за счет активации ZIP14 в скелетных мышцах. Nat. Med. 24 , 770–781 (2018).
CAS PubMed PubMed Central Статья Google ученый
Mammucari, C. et al. Митохондриальный унипортер кальция контролирует трофику скелетных мышц in vivo. Cell Rep. 10 , 1269–1279 (2015).
CAS PubMed PubMed Central Статья Google ученый
Ruas, J. L. et al. Изоформа PGC-1альфа, индуцированная тренировкой с отягощениями, регулирует гипертрофию скелетных мышц. Ячейка 151 , 1319–1331 (2012).
CAS PubMed PubMed Central Статья Google ученый
White, J. P. et al. Рецептор 56, связанный с G-белком, регулирует гипертрофию мышц, вызванную механической перегрузкой. Proc. Natl Acad. Sci. США 111 , 15756–15761 (2014).
ADS CAS PubMed Статья Google ученый
Das, S. et al. Цитратлиаза АТФ улучшает функцию митохондрий в скелетных мышцах. Cell Metab. 21 , 868–876 (2015).
CAS PubMed Статья Google ученый
Cai, X. et al. Альфа-кетоглутарат способствует гипертрофии скелетных мышц и синтезу белка через сигнальные пути Akt / mTOR. Sci. Отчет 6 , 26802 (2016).
ADS CAS PubMed PubMed Central Статья Google ученый
Lahiri, S. et al. Микробиота кишечника влияет на массу и функцию скелетных мышц у мышей. Sci. Пер. Med. 11 , eaan5662 (2019).
Hunt, L.C. et al. Ключевая роль убиквитинлигазы UBR4 в гипертрофии миофибрилл у дрозофилы и мышей. Cell Rep. 28 , 1268–1281 e1266 (2019).
CAS PubMed PubMed Central Статья Google ученый
Conte, M. et al. Мышечно-специфическое подавление перилипина2 влияет на метаболизм липидов и вызывает гипертрофию миофибрилл. J. Cachexia Sarcopenia Muscle 10 , 95–110 (2019).
PubMed Статья Google ученый
Bodine, S.C. et al. Идентификация убиквитинлигаз, необходимых для атрофии скелетных мышц. Наука 294 , 1704–1708 (2001).
ADS CAS PubMed Статья Google ученый
Панкив С. и др. p62 / SQSTM1 связывается непосредственно с Atg8 / LC3, облегчая деградацию убиквитинированных белковых агрегатов за счет аутофагии. J. Biol. Chem. 282 , 24131–24145 (2007).
CAS PubMed Статья Google ученый
Сандри, М. Распад белка при мышечном истощении: роль аутофагии-лизосомы и убиквитин-протеасомы. Внутр. J. Biochem Cell Biol. 45 , 2121–2129 (2013).
CAS PubMed PubMed Central Статья Google ученый
Коэн, С., Натан, Дж. А. и Голдберг, А. Л. Мышечное истощение при болезни: молекулярные механизмы и перспективные методы лечения. Nat. Rev. Drug Discov. 14 , 58–74 (2015).
CAS PubMed Статья Google ученый
Cadena, S. M. et al. Скелетные мышцы мышей, нулевых по MuRF1, не защищены в условиях низкой гравитации, что указывает на то, что атрофия происходит с помощью уникальных механизмов в космосе. Sci. Отчетность 9 , 9397 (2019).
ADS PubMed PubMed Central Статья CAS Google ученый
Baehr, L.M., Furlow, J. D. & Bodine, S. C. Сохранение мышц в мышцах RING finger 1 null мышей: ответ на синтетические глюкокортикоиды. J. Physiol. 589 , 4759–4776 (2011).
CAS PubMed PubMed Central Статья Google ученый
Хви, Д. Т., Баер, Л. М., Филп, А., Баар, К. и Бодин, С. С. Поддержание мышечной массы и индуцированный нагрузкой рост в мышцах нулевых мышей RING Finger 1 с возрастом. Ячейка старения 13 , 92–101 (2014).
CAS PubMed Статья PubMed Central Google ученый
Sandri, M. et al. Сигнальные пути, регулирующие мышечную массу в стареющих скелетных мышцах. Роль пути IGF1-Akt-mTOR-FoxO. Биогеронтология 14 , 303–323 (2013).
CAS PubMed Статья PubMed Central Google ученый
Коэн, С., Чжай, Б., Гайги, С. П. и Голдберг, А. Л. Убиквитилирование с помощью Trim32 вызывает сопряженную потерю десмина, Z-полос и тонких нитей при атрофии мышц. J. Cell Biol. 198 , 575–589 (2012).
CAS PubMed PubMed Central Статья Google ученый
Di Rienzo, M. et al. Для индукции аутофагии в атрофических мышечных клетках требуется активация ULK1 с помощью TRIM32 через незакрепленные цепи полиубиквитина, связанные с K63. Sci. Adv. 5 , eaau8857 (2019).
ADS CAS PubMed PubMed Central Статья Google ученый
Paul, P. K. et al. Целенаправленное удаление TRAF6 подавляет истощение скелетных мышц у мышей. J. Cell Biol. 191 , 1395–1411 (2010).
CAS PubMed PubMed Central Статья Google ученый
Paul, P. K. et al. Убиквитинлигаза E3 TRAF6 вмешивается в вызванную голоданием атрофию скелетных мышц посредством множества механизмов. Mol. Cell Biol. 32 , 1248–1259 (2012).
CAS PubMed PubMed Central Статья Google ученый
Carnio, S.и другие. Нарушение аутофагии в мышцах вызывает дегенерацию нервно-мышечных соединений и преждевременное старение. Cell Rep. 8 , 1509–1521 (2014).
CAS PubMed PubMed Central Статья Google ученый
Bujak, A. L. et al. AMPK-активация мышечной аутофагии предотвращает гипогликемию и миопатию, вызванные голоданием, во время старения. Cell Metab. 21 , 883–890 (2015).
CAS PubMed PubMed Central Статья Google ученый
Raben, N. et al. Подавление аутофагии в скелетных мышцах раскрывает накопление убиквитинированных белков и их потенциальную роль в повреждении мышц при болезни Помпе. Гум. Мол. Genet. 17 , 3897–3908 (2008).
CAS PubMed PubMed Central Статья Google ученый
Немазаный И.И. и др. Дефекты Vps15 в скелетных мышцах приводят к аутофагической вакуолярной миопатии и лизосомной болезни. EMBO Mol. Med. 5 , 870–890 (2013).
CAS PubMed PubMed Central Статья Google ученый
Fuqua, J. D. et al. ULK2 необходим для деградации убиквитинированных белковых агрегатов и гомеостаза в скелетных мышцах. FASEB J 33 , 11735–12745 (2019).
Ryu, D. et al. Уролитин А вызывает митофагию и увеличивает продолжительность жизни у C.elegans и увеличивает мышечную функцию у грызунов. Nat. Med. 22 , 879–888 (2016).
CAS PubMed Статья Google ученый
Milan, G. et al. Регуляция аутофагии и убиквитин-протеасомной системы транскрипционной сетью FoxO во время мышечной атрофии. Nat. Commun. 6 , 6670 (2015).
ADS CAS PubMed PubMed Central Статья Google ученый
Ли Д., Такаяма С. и Голдберг А. Л. ZFAND5 / ZNF216 является активатором протеасомы 26S, который стимулирует общую деградацию белка. Proc. Natl Acad. Sci. США 115 , E9550 – E9559 (2018).
CAS PubMed Статья Google ученый
VerPlank, J. J. S., Lokireddy, S., Zhao, J. & Goldberg, A. L. 26S протеасомы быстро активируются различными гормонами и физиологическими состояниями, которые повышают цАМФ и вызывают фосфорилирование Rpn6. Proc. Natl Acad. Sci. США 116 , 4228–4237 (2019).
Piccirillo, R. & Goldberg, A. L. АТФаза p97 / VCP имеет решающее значение при атрофии мышц и ускоренной деградации мышечных белков. EMBO J. 31 , 3334–3350 (2012).
CAS PubMed PubMed Central Статья Google ученый
Wang, C. et al. Метилтрансферазоподобный 21c метилирует и стабилизирует белок теплового шока Hspa8 в миофибриллах I типа у мышей. J. Biol. Chem. 294 , 13718–13728 (2019).
CAS PubMed PubMed Central Статья Google ученый
Wiederstein, J. L. et al. Метилтрансфераза METTL21C, специфичная для скелетных мышц, триметилирует p97 и регулирует распад белка, связанный с аутофагией. Cell Rep. 23 , 1342–1356 (2018).
CAS PubMed Статья Google ученый
O’Neill, B.T. et al. Факторы транскрипции FoxO являются критическими регуляторами мышечной атрофии, связанной с диабетом. Диабет 68 , 556–570 (2019).
PubMed Статья CAS Google ученый
Segales, J. et al. Сестрин предотвращает атрофию вышедших из употребления и стареющих мышц, интегрируя анаболические и катаболические сигналы. Nat. Commun. 11 , 189 (2020).
ADS CAS PubMed PubMed Central Статья Google ученый
Beharry, A. W. et al. HDAC1 активирует FoxO и является достаточным и необходимым для атрофии скелетных мышц. J. Cell Sci. 127 , 1441–1453 (2014).
CAS PubMed PubMed Central Статья Google ученый
Бертаджа Э., Колетто Л. и Сандри М. Посттрансляционные модификации контролируют активность FoxO3 во время денервации. Am. J. Physiol. Cell Physiol. 302 , C587 – C596 (2012).
CAS PubMed Статья Google ученый
Браулт, Дж. Дж., Джесперсен, Дж. Г. и Голдберг, А. Л. Гамма-коактиватор рецептора, активируемого пролифератором пероксисом, гиперэкспрессия 1альфа или 1бета ингибирует деградацию мышечного белка, индукцию убиквитинлигаз и атрофию неиспользования. J. Biol. Chem. 285 , 19460–19471 (2010).
CAS PubMed PubMed Central Статья Google ученый
Raffaello, A. et al. Фактор транскрипции JunB поддерживает массу скелетных мышц и способствует гипертрофии. J. Cell Biol. 191 , 101–113 (2010).
CAS PubMed PubMed Central Статья Google ученый
Yin, J. et al. Dkk3-зависимая регуляция транскрипции контролирует возрастную атрофию скелетных мышц. Nat. Commun. 9 , 1752 (2018).
ADS PubMed PubMed Central Статья CAS Google ученый
Shimizu, N. et al. Перекрестные помехи между рецептором глюкокортикоидов и датчиком питания mTOR в скелетных мышцах. Cell Metab. 13 , 170–182 (2011).
CAS PubMed Статья Google ученый
Cai, D. et al. Активация IKKbeta / NF-kappaB вызывает у мышей тяжелое мышечное истощение. Cell 119 , 285–298 (2004).
CAS PubMed Статья Google ученый
Mittal, A. et al. Система TWEAK-Fn14 является критическим регулятором вызванной денервацией атрофии скелетных мышц у мышей. J. Cell Biol. 188 , 833–849 (2010).
CAS PubMed PubMed Central Статья Google ученый
Bonetto, A. et al. Ингибирование пути JAK / STAT3 блокирует истощение скелетных мышц ниже IL-6 и при экспериментальной кахексии рака. Am. J. Physiol. Эндокринол.Метаб. 303 , E410 – E421 (2012).
CAS PubMed PubMed Central Статья Google ученый
Ebert, S. M. et al. Вызванная стрессом экспрессия Gadd45a в скелетных мышцах перепрограммирует миоядра и вызывает атрофию мышц. J. Biol. Chem. 287 , 27290–27301 (2012).
CAS PubMed PubMed Central Статья Google ученый
Gallot, Y. S. et al. PERK регулирует массу скелетных мышц и сократительную функцию у взрослых мышей. FASEB J. 33 , 1946–1962 (2019).
CAS PubMed Статья Google ученый
Bohnert, K. R. et al. Ось передачи сигналов toll-подобного рецептора / MyD88 / XBP1 опосредует истощение скелетных мышц во время раковой кахексии. Mol. Ячейка Биол . 39 , e00184-19 (2019).
Tezze, C. et al. Связанная с возрастом потеря OPA1 в мышцах влияет на мышечную массу, метаболический гомеостаз, системное воспаление и старение эпителия. Cell Metab. 25 , 1374–1389 e1376 (2017).
CAS PubMed PubMed Central Статья Google ученый
Favaro, G. et al. DRP1-опосредованная форма митохондрий контролирует гомеостаз кальция и мышечную массу. Nat. Commun. 10 , 2576 (2019).
ADS PubMed PubMed Central Статья CAS Google ученый
Choi, S. et al. Специфическая для скелетных мышц делеция Prmt1 вызывает атрофию мышц за счет нарушения регуляции оси PRMT6-FOXO3. Аутофагия 15 , 1069–1081 (2019).
CAS PubMed PubMed Central Статья Google ученый
Сегатто, М.и другие. Эпигенетическое нацеливание на белок бромодомена BRD4 противодействует раковой кахексии и продлевает выживаемость. Nat. Commun. 8 , 1707 (2017).
ADS PubMed PubMed Central Статья CAS Google ученый
Bowman, C.J., Ayer, D. E. и Dynlacht, B. D. Белки Foxk подавляют запуск программ атрофии и аутофагии, вызванных голоданием. Nat. Cell Biol. 16 , 1202–1214 (2014).
CAS PubMed PubMed Central Статья Google ученый
Sun, L. et al. Длинная некодирующая РНК Atrolnc-1 способствует истощению мышц у мышей с хроническим заболеванием почек. J. Cachexia Sarcopenia Muscle 9 , 962–974 (2018).
PubMed PubMed Central Статья Google ученый
Kravic, B. et al. В скелетных мышцах млекопитающих фосфорилирование TOMM22 протеинкиназой CSNK2 / CK2 контролирует митофагию. Аутофагия 14 , 311–335 (2018).
CAS PubMed PubMed Central Статья Google ученый
Pin, F. et al. PDK4 вызывает метаболические изменения и атрофию мышц при раковой кахексии. FASEB J. 33 , 7778–7790 (2019).
CAS PubMed PubMed Central Статья Google ученый
He, W. A. et al. Опосредованная NF-kappaB нарушение регуляции Pax7 в мышечном микроокружении способствует раковой кахексии. J. Clin. Расследование. 123 , 4821–4835 (2013).
CAS PubMed Статья Google ученый
Parajuli, P. et al. Активация Twist1 в мышечных клетках-предшественниках вызывает потерю мышечной массы, подобную раковой кахексии. Dev. Ячейка 45 , 712–725 e716 (2018).
CAS PubMed PubMed Central Статья Google ученый
Madaro, L. et al. Активированная денервацией передача сигналов STAT3-IL-6 в фибро-адипогенных предшественниках способствует атрофии и фиброзу миофибрилл. Nat. Cell Biol. 20 , 917–927 (2018).
CAS PubMed PubMed Central Статья Google ученый
Zhang, G. et al. Опухоль вызывает истощение мышц у мышей за счет высвобождения внеклеточных Hsp70 и Hsp90. Nat. Commun. 8 , 589 (2017).
ADS PubMed PubMed Central Статья CAS Google ученый
Ekelund, U. et al. Уменьшает ли физическая активность или даже устраняет вредную связь времени сидения со смертностью? Гармонизированный мета-анализ данных более чем 1 миллиона мужчин и женщин. Ланцет 388 , 1302–1310 (2016).
Артикул Google ученый
Чакраварти, Э. Ф., Хуберт, Х. Б., Лингала, В. Б. и Фрис, Дж. Ф. Снижение инвалидности и смертности среди стареющих бегунов: 21-летнее продольное исследование. Arch. Междунар. Med. 168 , 1638–1646 (2008).
PubMed PubMed Central Статья Google ученый
Hall, D. T. et al. Агонист AMPK 5-аминоимидазол-4-карбоксамид рибонуклеотид (AICAR), но не метформин, предотвращает связанное с воспалением кахектическое истощение мышц. EMBO Mol. Med. 10 , e8307 (2018).
PubMed PubMed Central Статья CAS Google ученый
Mills, K. F. et al. Длительное введение никотинамидмононуклеотида снижает физиологический спад у мышей, связанный с возрастом. Cell Metab. 24 , 795–806 (2016).
CAS PubMed PubMed Central Статья Google ученый
Wagner, K. R. et al. Испытание фазы I / II MYO-029 у взрослых с мышечной дистрофией. Ann. Neurol. 63 , 561–571 (2008).
CAS PubMed Статья Google ученый
Golan, T. et al. LY2495655, антитело к антимиостатину, при раке поджелудочной железы: рандомизированное исследование фазы 2. J. Cachexia Sarcopenia Muscle 9 , 871–879 (2018).
PubMed PubMed Central Статья Google ученый
Porporato, P.E. et al. Ацилированный и неацилированный грелин ухудшают атрофию скелетных мышц у мышей. J. Clin. Расследование. 123 , 611–622 (2013).
CAS PubMed Google ученый
Garcia, J. M. et al. Анаморелин для пациентов с раковой кахексией: комплексный анализ двух рандомизированных плацебо-контролируемых двойных слепых исследований фазы 2. Ланцет Онкол. 16 , 108–116 (2015).
CAS PubMed Статья Google ученый
Baraldo, M. et al. Скелетная мышца mTORC1 регулирует стабильность нервно-мышечного соединения. J. Cachexia Sarcopenia Muscle 11 , 208–225 (2019).
Pietrocola, F. et al. Спермидин вызывает аутофагию, ингибируя ацетилтрансферазу EP300. Cell Death Differ. 22 , 509–516 (2015).
CAS PubMed Статья Google ученый
Koeberl, D. D. et al. Коррекция биохимических нарушений и улучшение мышечной функции в клинических испытаниях фазы I / II кленбутерола при болезни Помпе. Mol. Ther. 26 , 2304–2314 (2018).
CAS PubMed PubMed Central Статья Google ученый
Adams, V. et al. Опосредованное низкими молекулами химическое подавление MuRF1 / MuRF2 и ослабление дисфункции диафрагмы при хронической сердечной недостаточности. J. Cachexia Sarcopenia Muscle 10 , 1102–1115 (2019).
PubMed PubMed Central Статья Google ученый
Атрофия мышц и способы ее предотвращения
Внутри каждого из нас идет постоянный цикл разрушения и строительства. Старые клетки выходят из строя и заменяются новыми. Мы видим, что это происходит автоматически с нашей кожей, поскольку пятна, порезы и царапины исчезают в течение нескольких дней или недель.Поврежденные клетки заменяются новыми. Если бы мы увеличили масштаб в каждой ячейке, мы бы увидели тот же процесс в меньшем масштабе. Биомолекулы, такие как белки, разрушаются, и новые белки заменяют старые.
Однако этот же процесс не происходит автоматически в наших мышцах. Физические упражнения, питание и ряд других факторов сильно влияют на цикл обмена мышечных клеток и белков. Как орган, мышца либо увеличивается в массе (гипертрофия), либо теряет массу (атрофия) [1].
Почему возникает атрофия мышц?
Мышечная атрофия может возникать по разным причинам, но всегда имеет один и тот же результат — меньшие, более слабые мышцы.Фактически, каждая мышечная клетка будет сокращаться индивидуально, что в совокупности делает мышцу более слабой. Вот некоторые из причин, по которым может возникнуть атрофия мышц [2]:
- Недостаток физических упражнений.
- Различные заболевания: рак, синдром приобретенного иммунодефицита, хроническая обструктивная болезнь легких, артрит, боковой амиотрофический склероз и многие другие.
- Недоедание
- Хирургия
- Старение
Как видите, мышечная атрофия часто является результатом нагрузки на человеческий организм.Это потому, что организм рассматривает скелетные мышцы как расходный материал во время трудностей. Например, в периоды голодания или недоедания мышечный белок расщепляется, чтобы обеспечить энергией и питательными веществами более важные органы. Часто хирургическое вмешательство может предъявлять аналогичные требования к нашим мышцам. Тело отдает приоритет исцелению, которое требует питания. Чтобы получить энергию и питательные вещества для создания новой ткани, мышечный белок будет метаболизироваться [3].
Атрофия мышц, связанная со старением, может отличаться от других форм атрофии.Это состояние, часто называемое саркопенией, включает потерю массы и качества мышечной ткани. Этот тип потери мышечной массы связан не только с уменьшением размера клеток, но и их количества. При саркопении соединительная ткань и жир часто замещают мышечные клетки и дополнительно подавляют способность мышц сокращаться [4].
Атрофия мышц и наше общее состояние здоровья
Потеря мышечной массы — это проблема не только для тех из нас, кто хочет бегать быстрее и поднимать большие веса.Предотвращение атрофии мышц после операции — одна из основных задач профессиональной и физиотерапии. Атрофия мышц может замедлить восстановление после операции и привести к более длительному пребыванию в больнице, снижению качества жизни и увеличению шансов повторной госпитализации [5].
Мышцы имеют решающее значение для поддержания здорового обмена веществ. Поскольку мышцам требуется очень много энергии, наличие здоровой мышечной массы предотвращает попадание лишних калорий в жировые отложения. Следовательно, атрофия мышц также связана с повышенным риском ожирения и диабета 2 типа [6].
Способы предотвращения мышечной атрофии
Предотвращение мышечной атрофии требует как физических упражнений, так и правильного питания. Упражнения при игнорировании питания контрпродуктивны. Когда мы тренируемся, наш организм сжигает калории и потребляет больше питательных веществ.
Если мы не дополним нашу диету, чтобы отразить этот возросший спрос, это поставит наши тела в состояние голода. Опять же, когда наши тела находятся на питательных веществах, они метаболизируют мышечный белок для поддержания жизнедеятельности, что приводит к атрофии мышц.Когда мы тренируемся, нам нужно больше калорий и больше питательных веществ, таких как белок, витамины и минералы.
В случае саркопении, связанной со старением, другое питательное вещество, по-видимому, имеет решающее значение для борьбы с потерей мышечной массы — HMB. Было показано, что это производное аминокислоты лейцина борется с потерей мышечной массы из-за старения в исследовании за исследованием [7] [4]. Именно по этой причине MEND Regenerate содержит HMB — для стимулирования роста мышц и предотвращения их разрушения.
Атрофия мышц и ее различные причины
Атрофия скелетных мышц относится к потере мышечной массы.Истощенные мышцы выглядят сморщенными и меньшими по размеру по сравнению с непораженной стороной. Также будет соответствующая потеря мышечного тонуса и силы. Мышцы расходуются в результате неиспользования, отека, повреждения нервов или болезненного процесса. Если не устранить причину, это может привести к серьезному снижению качества жизни. Там, где нет необратимых повреждений, упражнения или физическая активность — лучший способ предотвратить истощение мышц.
Причины мышечной атрофии
Неиспользование
Распространенной причиной мышечной атрофии является неиспользование.Это происходит, когда мышцы недостаточно напряжены из-за недостатка физической активности или из-за боли. Это обычно наблюдается у людей, ведущих малоподвижный образ жизни, и пожилых людей с пониженным уровнем активности. Было замечено, что мышцы начинают истощаться в течение 4 часов после начала постельного режима.
Отек
Отек суставов или выпот также могут привести к атрофии мышц и потере их силы. Это особенно заметно при травме колена. Например, разрыв ПКС, при котором отек препятствует активации мышцы бедра.Постепенно заставляя мышцы терять свою функцию. Следовательно, лечение отека является одним из наиболее важных аспектов острой спортивной травмы.
Повреждение нерва
Нейрогенная атрофия мышц возникает при повреждении нерва, нарушающем его нормальную функцию. Например, нерв, затронутый протрузией диска со смещением дискора, не сможет активировать свои соединительные мышцы. Мышцы, которые не активируются в течение длительного периода времени, тратят впустую. Это может стать серьезной проблемой, так как пациент может в конечном итоге потерять контроль над своими конечностями или испытать боль и дискомфорт из-за сморщенных, ослабленных мышц.
Болезнь
Кахексия, или «синдром истощения тела», и мышечная дистрофия являются примерами заболеваний, которые вызывают прогрессирующее истощение мышц. Кахексия часто наблюдается у пациентов со СПИДом, раком и другими серьезными хроническими заболеваниями. У этой группы пациентов могут возникнуть трудности с восстановлением мышечной ткани. Популярный сингапурский телевизионный актер Чу Чор Менг — местный пример, у которого была диагностирована мышечная дистрофия.
Упражнения — самый важный элемент в восстановлении мышечной ткани.Чтобы накачать мышцы, упражнения также можно дополнить специальной диетой. Если упражнения нецелесообразны, особенно для пациентов, прикованных к постели, электрическая стимуляция нерва атрофированной области может помочь уменьшить тяжесть атрофии мышц за счет искусственной активации мышц пациента.
Атрофия мышц может быть серьезной и изнурительной, приводя к снижению качества вашей жизни. Если атрофия мышц появляется внезапно и без видимой причины, рекомендуется обратиться к врачу.Правильное обследование и лечение позволят определить причину и предотвратить прогрессирующую атрофию и восстановить истощенные мышцы.
Испытываете боль в колене? Щелкните здесь, чтобы узнать больше о физиотерапии для снятия боли в коленях и о том, как Core Concepts может помочь
.