Активное вещество АЛЛОПУРИНОЛ (ALLOPURINOLUM) | Компендиум
USPDDN, RTECS: 1,5-дигидро-4H-пиразоло(3,4-d)пиримидин-4-он.
USPDDN, HSDB: 1H-пиразоло(3,4-d)пиримидин-4-ол.
HSDB, RTECS: 4′-гидроксипиразолол(3,4-d)пиримидин.
Mm = 136,11 Да. Белый или белый с кремовым оттенком мелкокристаллический порошок, практически нерастворимый в воде и спирте. Точка плавления — 355 °С; log P (октанол-вода) = –0,55; растворимость в воде — 569 мг/л при температуре 25 °С.
Форма выпуска: таблетки.
Лекарственные препараты содержащие активное вещество АЛЛОПУРИНОЛ
АЛЛОПУРИНОЛПАО НПЦ «Борщаговский ХФЗ»
таблетки 100 мг блистер, № 50
средства, применяемые при подагре
средства, применяемые при подагре
АЛЛОПУРИНОЛ-КВКиевский витаминный завод
таблетки 100 мг блистер в пачке, № 50
таблетки 300 мг блистер в пачке, № 30
средства, применяемые при подагре
противоподагрическое средство.
После приема внутрь почти полностью (около 90%) абсорбируется в пищеварительном тракте. Cmax аллопуринола в плазме крови достигается в среднем через 1,5 ч, аллоксантина — через 4,5 ч после однократного приема. T½ аллопуринола составляет 1–2 ч, аллоксантина — около 15 ч, поэтому ингибирование ксантиноксидазы в организме поддерживается в течение 1 сут после однократного приема аллопуринола. Около 20% принятой дозы выводится с калом, остальная часть аллопуринола и его метаболиты — с мочой.
Около 20% принятой дозы выводится с калом, остальная часть аллопуринола и его метаболиты — с мочой.
подагра; мочекаменная болезнь с образованием конкрементов, содержащих ураты; первичная и вторичная гиперурикемия при различных гемобластозах (остром лейкозе, хроническом миелолейкозе, лимфосаркоме и др.), при цитостатической и лучевой терапии опухолей, псориазе, а также при массивной терапии ГКС.
дозу подбирают индивидуально с учетом содержания мочевой кислоты в крови. Принимают внутрь после еды. Для взрослых минимальная терапевтическая доза — 100 мг/сут, максимальная — 800 мг/сут. Обычно при умеренной (70–100 мг/л) гиперурикемии назначают по 200–400 мг/сут в течение 2–3 нед, затем при снижении уровня мочевой кислоты в крови до 60–70 мг/л переходят на поддерживающую дозу — 200–300 мг/сут (в 2–3 приема). При тяжелом течении подагры, значительных отложениях уратов в тканях и постоянной гиперурикемии >80–100 мг/л аллопуринол назначают по 600–800 мг/сут дробно (не более 200 мг на прием) в течение 2–4 нед, затем при нормализации уровня мочевой кислоты переходят на поддерживающие дозы (100–300 мг/сут), которые принимают длительно (в течение нескольких месяцев).
Для профилактики гиперурикемии при лучевой терапии и химиотерапии опухолей аллопуринол назначают в среднем по 400 мг/сут; аллопуринол принимают за 2–3 дня до начала или одновременно с антибластомной терапией и продолжают прием в течение нескольких дней после окончания специфического лечения.
Детям в возрасте до 6 лет аллопуринол назначают в дозе 5 мг/кг массы тела в сутки; от 6 до 10 лет — 10 мг/кг/сут. Кратность приема — 3–4 раза в сутки.
Пациентам с умеренно выраженными нарушениями функции почек аллопуринол назначают в суточной дозе, не превышающей 200 мг.
период беременности и кормления грудью; выраженные нарушения функции печени и почек, азотемия; первичный (идиопатический) гемохроматоз, в том числе отягощенный анамнез по этому заболеванию; повышенная чувствительность к аллопуринолу.
возможны тошнота, рвота, боль в области живота, диарея, гепатит, преходящие нарушения функции печени с повышением уровня ЩФ, трансаминаз в крови; тромбоцитопения, эозинофилия, лейкопения, лейкоцитоз, апластическая анемия, гемолитическая анемия, ретикулоцитоз, лимфаденопатия, лимфоцитоз; неврит, нарушение сна, депрессия, амнезия; катаракта, конъюнктивит, амблиопия; экзантема, лихорадка; интерстициальный нефрит, гематурия, протеинурия; снижение либидо, гинекомастия, васкулит, перикардит, брадикардия, вазодилатация, тромбофлебит; миалгия; бронхоспазм.
В начале курса лечения может возникнуть острый приступ подагры из-за мобилизации мочевой кислоты из подагрических узелков и других тканевых депо.
детям аллопуринол назначают только при злокачественных новообразованиях и врожденных нарушениях пуринового обмена.
При лечении аллопуринолом необходимо поддерживать диурез на уровне не менее 2 л/сут, при этом реакция мочи должна быть нейтральной или слабощелочной, так как это предотвращает преципитацию уратов и образование конкрементов. С этой целью аллопуринол назначают в сочетании со средствами, ощелачивающими мочу.
С этой целью аллопуринол назначают в сочетании со средствами, ощелачивающими мочу.
Для профилактики возникновения в начале лечения приступов подагрического артрита можно применять НПВП или колхицин. Во время лечения аллопуринолом необходимо контролировать функцию печени.
У пациентов, принимающих азатиоприн или меркаптопурин, в случае дополнительного назначения аллопуринола могут развиться нежелательные явления, обусловленные кумуляцией в организме противоопухолевого препарата. Возможно возникновение тошноты, рвоты, признаков дисфункции печени, а также развитие симптомов угнетения костномозгового кроветворения (озноб, лихорадка, боль в горле и во рту, общая слабость, повышенная утомляемость и др.). В этих случаях дозы азатиоприна и меркаптопурина снижают до ¼–½ от обычной, периодически проверяют состав периферической крови и оценивают функцию печени.
при одновременном применении аллопуринола и азатиоприна или меркаптопурина наблюдается кумуляция последних в организме, так как в связи с ингибированием аллопуринолом активности ксантиноксидазы, необходимой для биотрансформации препаратов, замедляются их метаболизм и элиминация.
Под влиянием аллопуринола возможно также усиление эффектов, в том числе нежелательных, метотрексата, циклофосфана, антикоагулянтов непрямого действия, фенитоина, теофиллина, так как их инактивация в печени замедляется.
При сочетанном применении аллопуринола и препаратов ампициллина возрастает риск появления кожной сыпи.
Комбинация аллопуринола с препаратами железа считается нерациональной в связи с возможным накоплением железа в печени под влиянием аллопуринола. Одновременное применение аллопуринола и хлорпропамида может привести к усилению действия последнего, особенно при нарушении выделительной функции почек, за счет снижения его секреции в почечных канальцах, поэтому до и после сочетанного применения этих средств необходимо контролировать концентрацию глюкозы в крови и моче и, при необходимости, изменять дозу хлорпропамида.
Под влиянием тиазидных диуретиков, фуросемида, этакриновой кислоты, а также тиофосфамида антигиперурикемическое действие аллопуринола снижается, так как эти препараты повышают уровень мочевой кислоты в плазме крови.
проявляется тошнотой, рвотой, диареей, головокружением, олигурией. Лечение — форсированный диурез, гемо- и перитонеальный диализ.
Активное вещество АЛЛОПУРИНОЛ (ALLOPURINOLUM) | Компендиум
USPDDN, RTECS: 1,5-дигидро-4H-пиразоло(3,4-d)пиримидин-4-он.
USPDDN, HSDB: 1H-пиразоло(3,4-d)пиримидин-4-ол.
HSDB, RTECS: 4′-гидроксипиразолол(3,4-d)пиримидин.
Mm = 136,11 Да. Белый или белый с кремовым оттенком мелкокристаллический порошок, практически нерастворимый в воде и спирте. Точка плавления — 355 °С; log P (октанол-вода) = –0,55; растворимость в воде — 569 мг/л при температуре 25 °С.
Форма выпуска: таблетки.
Лекарственные препараты содержащие активное вещество АЛЛОПУРИНОЛ
АЛЛОПУРИНОЛПАО НПЦ «Борщаговский ХФЗ»
таблетки 100 мг блистер, № 50
средства, применяемые при подагре
средства, применяемые при подагре
АЛЛОПУРИНОЛ-КВКиевский витаминный завод
таблетки 100 мг блистер в пачке, № 50
таблетки 300 мг блистер в пачке, № 30
средства, применяемые при подагре
противоподагрическое средство. Угнетает процесс образования мочевой кислоты в организме и соответствующих конкрементов в мочевыводящих путях. Аллопуринол является структурным аналогом гипоксантина, в организме он превращается в аллоксантин, который также препятствует образованию мочевой кислоты, но по активности уступает аллопуринолу. Механизм действия обоих соединений заключается в их ингибирующем влиянии на ксантиноксидазу и подавлении образования из гипоксантина ксантина и из ксантина мочевой кислоты. В связи с этим снижается содержание уратов в плазме крови и предотвращается отложение их в тканях и почках. На фоне действия аллопуринола уменьшается выведение с мочой мочевой кислоты и увеличивается выведение гипоксантина и ксантина.
Угнетает процесс образования мочевой кислоты в организме и соответствующих конкрементов в мочевыводящих путях. Аллопуринол является структурным аналогом гипоксантина, в организме он превращается в аллоксантин, который также препятствует образованию мочевой кислоты, но по активности уступает аллопуринолу. Механизм действия обоих соединений заключается в их ингибирующем влиянии на ксантиноксидазу и подавлении образования из гипоксантина ксантина и из ксантина мочевой кислоты. В связи с этим снижается содержание уратов в плазме крови и предотвращается отложение их в тканях и почках. На фоне действия аллопуринола уменьшается выведение с мочой мочевой кислоты и увеличивается выведение гипоксантина и ксантина.
После приема внутрь почти полностью (около 90%) абсорбируется в пищеварительном тракте. Cmax аллопуринола в плазме крови достигается в среднем через 1,5 ч, аллоксантина — через 4,5 ч после однократного приема. T½ аллопуринола составляет 1–2 ч, аллоксантина — около 15 ч, поэтому ингибирование ксантиноксидазы в организме поддерживается в течение 1 сут после однократного приема аллопуринола.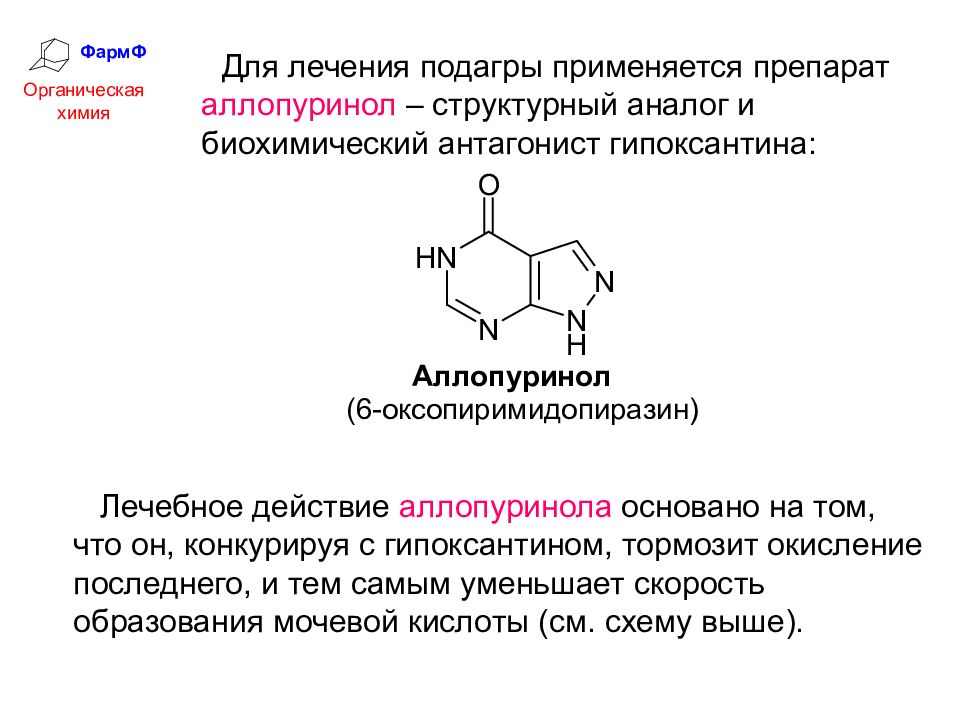 Около 20% принятой дозы выводится с калом, остальная часть аллопуринола и его метаболиты — с мочой.
Около 20% принятой дозы выводится с калом, остальная часть аллопуринола и его метаболиты — с мочой.
подагра; мочекаменная болезнь с образованием конкрементов, содержащих ураты; первичная и вторичная гиперурикемия при различных гемобластозах (остром лейкозе, хроническом миелолейкозе, лимфосаркоме и др.), при цитостатической и лучевой терапии опухолей, псориазе, а также при массивной терапии ГКС.
дозу подбирают индивидуально с учетом содержания мочевой кислоты в крови. Принимают внутрь после еды. Для взрослых минимальная терапевтическая доза — 100 мг/сут, максимальная — 800 мг/сут. Обычно при умеренной (70–100 мг/л) гиперурикемии назначают по 200–400 мг/сут в течение 2–3 нед, затем при снижении уровня мочевой кислоты в крови до 60–70 мг/л переходят на поддерживающую дозу — 200–300 мг/сут (в 2–3 приема). При тяжелом течении подагры, значительных отложениях уратов в тканях и постоянной гиперурикемии >80–100 мг/л аллопуринол назначают по 600–800 мг/сут дробно (не более 200 мг на прием) в течение 2–4 нед, затем при нормализации уровня мочевой кислоты переходят на поддерживающие дозы (100–300 мг/сут), которые принимают длительно (в течение нескольких месяцев). В случае прекращения приема аллопуринола урикемия и урикозурия на 3–4-й день развиваются вновь, поэтому лечение должно быть длительным и непрерывным: интервалы между приемами аллопуринола >2–3 дней нежелательны.
В случае прекращения приема аллопуринола урикемия и урикозурия на 3–4-й день развиваются вновь, поэтому лечение должно быть длительным и непрерывным: интервалы между приемами аллопуринола >2–3 дней нежелательны.
Для профилактики гиперурикемии при лучевой терапии и химиотерапии опухолей аллопуринол назначают в среднем по 400 мг/сут; аллопуринол принимают за 2–3 дня до начала или одновременно с антибластомной терапией и продолжают прием в течение нескольких дней после окончания специфического лечения.
Детям в возрасте до 6 лет аллопуринол назначают в дозе 5 мг/кг массы тела в сутки; от 6 до 10 лет — 10 мг/кг/сут. Кратность приема — 3–4 раза в сутки.
Пациентам с умеренно выраженными нарушениями функции почек аллопуринол назначают в суточной дозе, не превышающей 200 мг.
период беременности и кормления грудью; выраженные нарушения функции печени и почек, азотемия; первичный (идиопатический) гемохроматоз, в том числе отягощенный анамнез по этому заболеванию; повышенная чувствительность к аллопуринолу.
возможны тошнота, рвота, боль в области живота, диарея, гепатит, преходящие нарушения функции печени с повышением уровня ЩФ, трансаминаз в крови; тромбоцитопения, эозинофилия, лейкопения, лейкоцитоз, апластическая анемия, гемолитическая анемия, ретикулоцитоз, лимфаденопатия, лимфоцитоз; неврит, нарушение сна, депрессия, амнезия; катаракта, конъюнктивит, амблиопия; экзантема, лихорадка; интерстициальный нефрит, гематурия, протеинурия; снижение либидо, гинекомастия, васкулит, перикардит, брадикардия, вазодилатация, тромбофлебит; миалгия; бронхоспазм.
В начале курса лечения может возникнуть острый приступ подагры из-за мобилизации мочевой кислоты из подагрических узелков и других тканевых депо.
детям аллопуринол назначают только при злокачественных новообразованиях и врожденных нарушениях пуринового обмена.
При лечении аллопуринолом необходимо поддерживать диурез на уровне не менее 2 л/сут, при этом реакция мочи должна быть нейтральной или слабощелочной, так как это предотвращает преципитацию уратов и образование конкрементов. С этой целью аллопуринол назначают в сочетании со средствами, ощелачивающими мочу.
С этой целью аллопуринол назначают в сочетании со средствами, ощелачивающими мочу.
Для профилактики возникновения в начале лечения приступов подагрического артрита можно применять НПВП или колхицин. Во время лечения аллопуринолом необходимо контролировать функцию печени.
У пациентов, принимающих азатиоприн или меркаптопурин, в случае дополнительного назначения аллопуринола могут развиться нежелательные явления, обусловленные кумуляцией в организме противоопухолевого препарата. Возможно возникновение тошноты, рвоты, признаков дисфункции печени, а также развитие симптомов угнетения костномозгового кроветворения (озноб, лихорадка, боль в горле и во рту, общая слабость, повышенная утомляемость и др.). В этих случаях дозы азатиоприна и меркаптопурина снижают до ¼–½ от обычной, периодически проверяют состав периферической крови и оценивают функцию печени.
при одновременном применении аллопуринола и азатиоприна или меркаптопурина наблюдается кумуляция последних в организме, так как в связи с ингибированием аллопуринолом активности ксантиноксидазы, необходимой для биотрансформации препаратов, замедляются их метаболизм и элиминация.
Под влиянием аллопуринола возможно также усиление эффектов, в том числе нежелательных, метотрексата, циклофосфана, антикоагулянтов непрямого действия, фенитоина, теофиллина, так как их инактивация в печени замедляется.
При сочетанном применении аллопуринола и препаратов ампициллина возрастает риск появления кожной сыпи.
Комбинация аллопуринола с препаратами железа считается нерациональной в связи с возможным накоплением железа в печени под влиянием аллопуринола. Одновременное применение аллопуринола и хлорпропамида может привести к усилению действия последнего, особенно при нарушении выделительной функции почек, за счет снижения его секреции в почечных канальцах, поэтому до и после сочетанного применения этих средств необходимо контролировать концентрацию глюкозы в крови и моче и, при необходимости, изменять дозу хлорпропамида.
Под влиянием тиазидных диуретиков, фуросемида, этакриновой кислоты, а также тиофосфамида антигиперурикемическое действие аллопуринола снижается, так как эти препараты повышают уровень мочевой кислоты в плазме крови.
проявляется тошнотой, рвотой, диареей, головокружением, олигурией. Лечение — форсированный диурез, гемо- и перитонеальный диализ.
Активное вещество АЛЛОПУРИНОЛ (ALLOPURINOLUM) | Компендиум
USPDDN, RTECS: 1,5-дигидро-4H-пиразоло(3,4-d)пиримидин-4-он.
USPDDN, HSDB: 1H-пиразоло(3,4-d)пиримидин-4-ол.
HSDB, RTECS: 4′-гидроксипиразолол(3,4-d)пиримидин.
Mm = 136,11 Да. Белый или белый с кремовым оттенком мелкокристаллический порошок, практически нерастворимый в воде и спирте. Точка плавления — 355 °С; log P (октанол-вода) = –0,55; растворимость в воде — 569 мг/л при температуре 25 °С.
Форма выпуска: таблетки.
Лекарственные препараты содержащие активное вещество АЛЛОПУРИНОЛ
АЛЛОПУРИНОЛПАО НПЦ «Борщаговский ХФЗ»
таблетки 100 мг блистер, № 50
средства, применяемые при подагре
средства, применяемые при подагре
АЛЛОПУРИНОЛ-КВКиевский витаминный завод
таблетки 100 мг блистер в пачке, № 50
таблетки 300 мг блистер в пачке, № 30
средства, применяемые при подагре
противоподагрическое средство. Угнетает процесс образования мочевой кислоты в организме и соответствующих конкрементов в мочевыводящих путях. Аллопуринол является структурным аналогом гипоксантина, в организме он превращается в аллоксантин, который также препятствует образованию мочевой кислоты, но по активности уступает аллопуринолу. Механизм действия обоих соединений заключается в их ингибирующем влиянии на ксантиноксидазу и подавлении образования из гипоксантина ксантина и из ксантина мочевой кислоты. В связи с этим снижается содержание уратов в плазме крови и предотвращается отложение их в тканях и почках. На фоне действия аллопуринола уменьшается выведение с мочой мочевой кислоты и увеличивается выведение гипоксантина и ксантина.
Угнетает процесс образования мочевой кислоты в организме и соответствующих конкрементов в мочевыводящих путях. Аллопуринол является структурным аналогом гипоксантина, в организме он превращается в аллоксантин, который также препятствует образованию мочевой кислоты, но по активности уступает аллопуринолу. Механизм действия обоих соединений заключается в их ингибирующем влиянии на ксантиноксидазу и подавлении образования из гипоксантина ксантина и из ксантина мочевой кислоты. В связи с этим снижается содержание уратов в плазме крови и предотвращается отложение их в тканях и почках. На фоне действия аллопуринола уменьшается выведение с мочой мочевой кислоты и увеличивается выведение гипоксантина и ксантина.
После приема внутрь почти полностью (около 90%) абсорбируется в пищеварительном тракте. Cmax аллопуринола в плазме крови достигается в среднем через 1,5 ч, аллоксантина — через 4,5 ч после однократного приема. T½ аллопуринола составляет 1–2 ч, аллоксантина — около 15 ч, поэтому ингибирование ксантиноксидазы в организме поддерживается в течение 1 сут после однократного приема аллопуринола. Около 20% принятой дозы выводится с калом, остальная часть аллопуринола и его метаболиты — с мочой.
Около 20% принятой дозы выводится с калом, остальная часть аллопуринола и его метаболиты — с мочой.
подагра; мочекаменная болезнь с образованием конкрементов, содержащих ураты; первичная и вторичная гиперурикемия при различных гемобластозах (остром лейкозе, хроническом миелолейкозе, лимфосаркоме и др.), при цитостатической и лучевой терапии опухолей, псориазе, а также при массивной терапии ГКС.
дозу подбирают индивидуально с учетом содержания мочевой кислоты в крови. Принимают внутрь после еды. Для взрослых минимальная терапевтическая доза — 100 мг/сут, максимальная — 800 мг/сут. Обычно при умеренной (70–100 мг/л) гиперурикемии назначают по 200–400 мг/сут в течение 2–3 нед, затем при снижении уровня мочевой кислоты в крови до 60–70 мг/л переходят на поддерживающую дозу — 200–300 мг/сут (в 2–3 приема). При тяжелом течении подагры, значительных отложениях уратов в тканях и постоянной гиперурикемии >80–100 мг/л аллопуринол назначают по 600–800 мг/сут дробно (не более 200 мг на прием) в течение 2–4 нед, затем при нормализации уровня мочевой кислоты переходят на поддерживающие дозы (100–300 мг/сут), которые принимают длительно (в течение нескольких месяцев). В случае прекращения приема аллопуринола урикемия и урикозурия на 3–4-й день развиваются вновь, поэтому лечение должно быть длительным и непрерывным: интервалы между приемами аллопуринола >2–3 дней нежелательны.
В случае прекращения приема аллопуринола урикемия и урикозурия на 3–4-й день развиваются вновь, поэтому лечение должно быть длительным и непрерывным: интервалы между приемами аллопуринола >2–3 дней нежелательны.
Для профилактики гиперурикемии при лучевой терапии и химиотерапии опухолей аллопуринол назначают в среднем по 400 мг/сут; аллопуринол принимают за 2–3 дня до начала или одновременно с антибластомной терапией и продолжают прием в течение нескольких дней после окончания специфического лечения.
Детям в возрасте до 6 лет аллопуринол назначают в дозе 5 мг/кг массы тела в сутки; от 6 до 10 лет — 10 мг/кг/сут. Кратность приема — 3–4 раза в сутки.
Пациентам с умеренно выраженными нарушениями функции почек аллопуринол назначают в суточной дозе, не превышающей 200 мг.
период беременности и кормления грудью; выраженные нарушения функции печени и почек, азотемия; первичный (идиопатический) гемохроматоз, в том числе отягощенный анамнез по этому заболеванию; повышенная чувствительность к аллопуринолу.
возможны тошнота, рвота, боль в области живота, диарея, гепатит, преходящие нарушения функции печени с повышением уровня ЩФ, трансаминаз в крови; тромбоцитопения, эозинофилия, лейкопения, лейкоцитоз, апластическая анемия, гемолитическая анемия, ретикулоцитоз, лимфаденопатия, лимфоцитоз; неврит, нарушение сна, депрессия, амнезия; катаракта, конъюнктивит, амблиопия; экзантема, лихорадка; интерстициальный нефрит, гематурия, протеинурия; снижение либидо, гинекомастия, васкулит, перикардит, брадикардия, вазодилатация, тромбофлебит; миалгия; бронхоспазм.
В начале курса лечения может возникнуть острый приступ подагры из-за мобилизации мочевой кислоты из подагрических узелков и других тканевых депо.
детям аллопуринол назначают только при злокачественных новообразованиях и врожденных нарушениях пуринового обмена.
При лечении аллопуринолом необходимо поддерживать диурез на уровне не менее 2 л/сут, при этом реакция мочи должна быть нейтральной или слабощелочной, так как это предотвращает преципитацию уратов и образование конкрементов. С этой целью аллопуринол назначают в сочетании со средствами, ощелачивающими мочу.
С этой целью аллопуринол назначают в сочетании со средствами, ощелачивающими мочу.
Для профилактики возникновения в начале лечения приступов подагрического артрита можно применять НПВП или колхицин. Во время лечения аллопуринолом необходимо контролировать функцию печени.
У пациентов, принимающих азатиоприн или меркаптопурин, в случае дополнительного назначения аллопуринола могут развиться нежелательные явления, обусловленные кумуляцией в организме противоопухолевого препарата. Возможно возникновение тошноты, рвоты, признаков дисфункции печени, а также развитие симптомов угнетения костномозгового кроветворения (озноб, лихорадка, боль в горле и во рту, общая слабость, повышенная утомляемость и др.). В этих случаях дозы азатиоприна и меркаптопурина снижают до ¼–½ от обычной, периодически проверяют состав периферической крови и оценивают функцию печени.
при одновременном применении аллопуринола и азатиоприна или меркаптопурина наблюдается кумуляция последних в организме, так как в связи с ингибированием аллопуринолом активности ксантиноксидазы, необходимой для биотрансформации препаратов, замедляются их метаболизм и элиминация.
Под влиянием аллопуринола возможно также усиление эффектов, в том числе нежелательных, метотрексата, циклофосфана, антикоагулянтов непрямого действия, фенитоина, теофиллина, так как их инактивация в печени замедляется.
При сочетанном применении аллопуринола и препаратов ампициллина возрастает риск появления кожной сыпи.
Комбинация аллопуринола с препаратами железа считается нерациональной в связи с возможным накоплением железа в печени под влиянием аллопуринола. Одновременное применение аллопуринола и хлорпропамида может привести к усилению действия последнего, особенно при нарушении выделительной функции почек, за счет снижения его секреции в почечных канальцах, поэтому до и после сочетанного применения этих средств необходимо контролировать концентрацию глюкозы в крови и моче и, при необходимости, изменять дозу хлорпропамида.
Под влиянием тиазидных диуретиков, фуросемида, этакриновой кислоты, а также тиофосфамида антигиперурикемическое действие аллопуринола снижается, так как эти препараты повышают уровень мочевой кислоты в плазме крови.
проявляется тошнотой, рвотой, диареей, головокружением, олигурией. Лечение — форсированный диурез, гемо- и перитонеальный диализ.
Эффективность и профиль безопасности нового антигиперурикемического препарата при подагре
Дайджест
ВведениеПодагра — системное тофусное заболевание, характеризующееся отложением кристаллов моноурата натрия в различных органах и тканях, а также развивающимся в связи с этим воспалением, у лиц с гиперурикемией, обусловленной внешнесредовыми и/или генетическими факторами [1].
Подагра является одной из актуальных проблем ревматологии, значимость которой неуклонно увеличивается. Так, в последние десятилетия отмечается повышение распространенности подагры [2]. Согласно результатам эпидемиологических исследований, подагрой страдают не менее 1–3% взрослого населения. При этом пик заболеваемости отмечают в возрасте 40–50 лет у мужчин, ≥60 лет — у женщин [3]. Соотношение мужчин и женщин составляет 4:1, а среди пациентов в возрасте старше 65 лет — 3:1 [2].
Подагра может развиваться под действием различных факторов. Данная патология может быть следствием мутаций генов, кодирующих ферменты, задействованные в синтезе мочевой кислоты. Подагра может развиваться в результате активации процесса расщепления нуклеотидов в клеточных ядрах и приводить к формированию гиперурикемии. Указанные процессы имеют место при различных заболеваниях крови, лимфопролиферативной патологии, псориазе, саркоидозе и других заболеваниях, нарушающих почечную экскрецию. Кроме того, гиперурикемию может вызывать загрязнение окружающей среды и токсические вещества, которые нарушают экскрецию уратов почками [4].
Также риск развития подагры повышают такие факторы, как высокопуриновая диета, избыток жирной пищи в рационе питания, употребление которой способствует нарушению экскреции уратов почками, злоупотребление алкоголем (также нарушает экскрецию уратов). Аналогично могут влиять и интенсивные физические нагрузки. Кроме того, риск развития подагры повышается в результате применения некоторых препаратов, вызывающих гиперурикемию, например противотуберкулезных средств [4].
Выбор фармакотерапевтического подхода при подагре часто является сложной задачей, в особенности в контексте назначения лечения, направленного на снижение выраженности гиперурикемии. При этом важно обеспечить длительное непрерывное, часто пожизненное, применение соответствующих препаратов [2].
Цели антигиперурикемической терапии:
- Достижение уровня мочевой кислоты <360 мкмоль/л (снижение уровня мочевой кислоты в плазме крови до 420 мкмоль/л всего лишь замедляет прогрессирование заболевания).
- Уменьшение очагов накопления уратов в организме.
- Уменьшение объема (размеров) тофусов.
- Значительное снижение частоты приступов подагры [5].
Уратснижающие препараты влияют на продукцию мочевой кислоты посредством воздействия на фермент ксантиноксиредуктаза, который участвует в процессе расщепления пуринов: оксидации гипоксантина до ксантина, а ксантина — до мочевой кислоты [6].
Аллопуринол — первый разработанный ингибитор ксантиндегидрогеназы, который в течение длительного времени применяли для коррекции гиперурикемии при подагре. Однако аллопуринол имеет ряд недостатков, в частности при его применении могут отмечаться серьезные побочные реакции, такие как эозинофилия, васкулит, гепатит, прогрессирующая почечная недостаточность.
Однако аллопуринол имеет ряд недостатков, в частности при его применении могут отмечаться серьезные побочные реакции, такие как эозинофилия, васкулит, гепатит, прогрессирующая почечная недостаточность.
Кроме того, за время применения накоплены данные о том, что у ряда пациентов с подагрой аллопуринол неэффективен даже в максимальной дозе. Также необходимо учитывать, что аллопуринол структурно похож на гипоксантин, и поэтому может быть вовлечен в различные пуриновые и пиримидиновые реакции, что лишает его селективности и адресного воздействия на патологический процесс, вызывающий болезнь [7–10]. Все эти аспекты сделали актуальным вопрос разработки новых антигиперурикемических препаратов.
Одним из новых перспективных препаратов, применяющихся с целью снижения уровня уратов у пациентов с подагрой, является фебуксостат — селективный ингибитор ксантиноксидазы. Его применяют как для купирования, так и для профилактики приступов подагры.
В ходе многочисленных клинических исследований доказана высокая эффективность данного препарата по сравнению с аллопуринолом. Наряду с этим показатели профиля безопасности фебуксостата также превосходят аллопуринол [4].
Фебуксостат — 2-(3-циано-4-изобутоксифенил)-4-метилтиазол-5-карбоксильная кислота — непуриновый ингибитор ксантиноксидазы, являющийся производным арилтиазола. Его терапевтическое действие связано со снижением концентрации мочевой кислоты в сыворотке крови путем селективного подавления ксантиноксидазы. Молекулярная структура фебуксостата разительно отличается от аллопуринола. Поэтому фебуксостат в терапевтических концентрациях не влияет на другие ферменты, участвующие в метаболизме пуринов или пиримидинов, как гуаниндезаминаза, оротидинмонофосфатдекарбоксилаза, пуриннуклеозидфосфорилаза.
Фебуксостат — мощный и селективный непуриновий ингибитор ксантиноксидазы, его Кі (константа ингибирования) in vitro составляет <1 нМ. Показано, что фебуксостат в значительной степени подавляет активность как окисленной, так и восстановленной формы ксантиноксидазы. Кроме того, фебуксостат ингибирует данный фермент благодаря образованию высокоаффинных крепких связей, а аллопуринол связывается гораздо слабее и только с одной формой фермента. Также важно отметить, что фебуксостат, в отличие от аллопуринола, практически не влияет на активность других ферментов пуринового и пиримидинового метаболизма, таким образом являясь селективным ингибитором ксантиноксидазы [11, 3]. Следует также отметить, что, в отличие о аллопуринола, при применении фебуксостата у пациентов с нарушенной функцией почек нет необходимости подбирать дозу лекарственного средства [12].
Кроме того, фебуксостат ингибирует данный фермент благодаря образованию высокоаффинных крепких связей, а аллопуринол связывается гораздо слабее и только с одной формой фермента. Также важно отметить, что фебуксостат, в отличие от аллопуринола, практически не влияет на активность других ферментов пуринового и пиримидинового метаболизма, таким образом являясь селективным ингибитором ксантиноксидазы [11, 3]. Следует также отметить, что, в отличие о аллопуринола, при применении фебуксостата у пациентов с нарушенной функцией почек нет необходимости подбирать дозу лекарственного средства [12].
Эффективность фебуксостата изучена в ходе большого количества клинических исследований, в том числе и наивысшего уровня доказательности. В этих исследованиях эффективность фебуксостата изучали как в сравнении с плацебо, так и с аллопуринолом.
Так, в плацебо-контролируемом исследовании I фазы, в котором принимали участие 154 здоровых добровольца [13], изучали эффективность фебуксостата в зависимости от дозы. Доза фебуксостата титровалась в пределах 10–120 мг/сут в течение 2 нед, при этом снижение концентрации мочевой кислоты составило от 25 до 70% в зависимости от дозы препарата. Таким образом, показан дозозависимый эффект от применения фебуксостата.
Доза фебуксостата титровалась в пределах 10–120 мг/сут в течение 2 нед, при этом снижение концентрации мочевой кислоты составило от 25 до 70% в зависимости от дозы препарата. Таким образом, показан дозозависимый эффект от применения фебуксостата.
В другом — многоцентровом плацебо-контролируемом клиническом исследовании, в течение 28 дней изучали эффективность и профиль безопасности фебуксостата в дозе 40; 80 и 120 мг/сут у пациентов с подагрой и гиперурикемией [14]. Установлено, что количество больных с достигнутым уровнем мочевой кислоты <360 мкмоль/л и степень снижения уровня мочевой кислоты достоверно выше в группах пациентов, принимавших фебуксостат в любой дозе, по сравнению с получавшими плацебо, за весь период исследования. Так, в группе пациентов, применявших фебуксостат в дозе 120 мг/сут, 94% достигли целевого уровня мочевой кислоты, в группе фебуксостата в дозе 80 мг/сут — 76%, в группе фебуксостата в дозе 40 мг/сут — 54%, в группе плацебо — 0%.
Это исследование (FOCUS) было продолжено, и его результаты опубликованы после 4 лет наблюдения [15]. Доля пациентов, у которых сохранялся целевой уровень мочевой кислоты, была значительной и составила 78% по итогам 1-го года, 76% — 2-го года, 84 и 90% — 3-го и 4-го года применения фебуксостата соответственно. Кроме того, снижение уровня мочевой кислоты ассоциировано с уменьшением вероятности развития обострений и тофусов. Наиболее частыми нежелательными реакциями были диарея, желудочно-кишечные проблемы, повышение содержания печеночных ферментов, головная боль, гиперлипидемия.
Доля пациентов, у которых сохранялся целевой уровень мочевой кислоты, была значительной и составила 78% по итогам 1-го года, 76% — 2-го года, 84 и 90% — 3-го и 4-го года применения фебуксостата соответственно. Кроме того, снижение уровня мочевой кислоты ассоциировано с уменьшением вероятности развития обострений и тофусов. Наиболее частыми нежелательными реакциями были диарея, желудочно-кишечные проблемы, повышение содержания печеночных ферментов, головная боль, гиперлипидемия.
Значительное внимание в ходе исследований фебуксостата уделено изучению его эффективности и профиля безопасности по сравнению с аллопуринолом. Так, проведено рандомизированное двойное слепое 52-недельное многоцентровое исследование III фазы (Febuxostat versus Allopurinol Controlled Trial — FACT) [16]. В исследовании участвовали 760 пациентов с подагрой. Уровень мочевой кислоты до начала лечения составлял 583–589 мкмоль/л. Согласно результатам исследования, целевой уровень мочевой кислоты (<360 мкмоль/л) достигнут у 53% пациентов, получавших фебуксостат 80 мг/сут, у 62% — фебуксостат 120 мг/сут и у 21% — аллопуринол 300 мг/сут. При этом частота нежелательных явлений была сопоставимой во всех группах. Наиболее часто отмечали повышение уровня печеночных ферментов, диарею, головную боль. Таким образом, в данном исследовании продемонстрирована более высокая эффективность фебуксостата в снижении уровня мочевой кислоты по сравнению с аллопуринолом, при сопоставимых характеристиках профиля безопасности.
При этом частота нежелательных явлений была сопоставимой во всех группах. Наиболее часто отмечали повышение уровня печеночных ферментов, диарею, головную боль. Таким образом, в данном исследовании продемонстрирована более высокая эффективность фебуксостата в снижении уровня мочевой кислоты по сравнению с аллопуринолом, при сопоставимых характеристиках профиля безопасности.
В другом крупном плацебо-контролируемом исследовании III фазы — APEX (Allopurinoland Placebo-Controlled, Efficacy Study of Febuxostat Trial) [17] также сравнивали эффективность фебуксостата и аллопуринола. Кроме того, в ходе исследования изучали эффективность лечения у пациентов с поражением почек. В данном исследовании приняли участие более 1 тыс. пациентов с подагрой, уровень мочевой кислоты у которых >480 мкмоль/л. Пациенты были рандомизированы в группы, в течение 28 дней получавшие плацебо, фебуксостат (80; 120 и 240 мг/сут) или аллопуринол.
Количество пациентов, у которых удалось достичь целевого уровня мочевой кислоты в группах, получавших 80; 120 и 240 мг/сут фебуксостата, 300/100 мг/сут аллопуринола и плацебо, составило 48; 65; 69; 22 и 0% соответственно. Частота и спектр нежелательных явлений между группами не различались. Наиболее частыми были нарушения печеночных ферментов, головная боль, расстройства со стороны желудочно-кишечного тракта. У пациентов с нарушением функции почек применение фебуксостата в дозе 240 мг/сут не приводило к повышению частоты побочных эффектов. Таким образом, фебуксостат продемонстрировал более высокую эффективность в отношении снижения и последующего поддержания уровня мочевой кислоты по сравнению аллопуринолом и плацебо, а также хорошую переносимость в любой дозе.
Частота и спектр нежелательных явлений между группами не различались. Наиболее частыми были нарушения печеночных ферментов, головная боль, расстройства со стороны желудочно-кишечного тракта. У пациентов с нарушением функции почек применение фебуксостата в дозе 240 мг/сут не приводило к повышению частоты побочных эффектов. Таким образом, фебуксостат продемонстрировал более высокую эффективность в отношении снижения и последующего поддержания уровня мочевой кислоты по сравнению аллопуринолом и плацебо, а также хорошую переносимость в любой дозе.
Заслуживают внимания результаты открытого исследования EXCEL [18], в ходе которого изучали, способствует ли поддержание целевого уровня мочевой кислоты снижению частоты атак артрита и уменьшению тофусов. В данном исследовании участвовали >1 тыс. пациентов, 75% из которых завершили исследование. Длительность предварительного применения фебуксостата составила 492 дня для дозы 80 мг/сут, 428 дней для 120 мг/сут и 271 день — для аллопуринола 300/100 мг (в зависимости от почечной функции). Частота подагрических атак среди пациентов, применявших фебуксостат 80 и 120 мг/сут или аллопуринол 300/100 мг/сут, составила в среднем за 1 год приема соответственно 1,4; 1,72 и 1,49 атак. За 2-й год приема она снизилась до 0,19; 0,0; 0,11 соответственно. Среди нежелательных явлений в группах больных, применявших фебуксостат, наиболее частыми были нарушение функции печени, головная боль, диарея, артериальная гипертензия, артралгия. Среди нежелательных явлений в группах пациентов с аллопуринолом наиболее частыми были нарушение функции печени и сыпь.
Частота подагрических атак среди пациентов, применявших фебуксостат 80 и 120 мг/сут или аллопуринол 300/100 мг/сут, составила в среднем за 1 год приема соответственно 1,4; 1,72 и 1,49 атак. За 2-й год приема она снизилась до 0,19; 0,0; 0,11 соответственно. Среди нежелательных явлений в группах больных, применявших фебуксостат, наиболее частыми были нарушение функции печени, головная боль, диарея, артериальная гипертензия, артралгия. Среди нежелательных явлений в группах пациентов с аллопуринолом наиболее частыми были нарушение функции печени и сыпь.
Аналогичные результаты получены в ходе 28-недельного мультицентрового рандомизированного двойного слепого исследования III фазы (CONFIRMS), в ходе которого сравнивали эффективность и безопасность фебуксостата и аллопуринола у пациентов с подагрой. В исследовании приняли участие более 2,2 тыс. пациентов, которые были рандомизированы на группы с применением фебуксостата в дозе 40 мг/сут, фебуксостата в дозе 80 мг/сут или аллопуринола в дозе 200 или 300 мг/сут (в зависимости от почечной функции) [19]. У 1483 больных диагностировано нарушение функции почек. У 45% пациентов, применявших аллопуринол по 300 мг/сут, уровень мочевой кислоты достиг целевого показателя (<6,0 мг/дл), аналогичный результат получен и у пациентов, принимавших 40 мг/сут фебуксостата. У лиц, получающих фебуксостат в дозе 80 мг/сут, результат статистически достоверно превышал таковой в двух вышеуказанных группах и составил 67% пациентов.
У 1483 больных диагностировано нарушение функции почек. У 45% пациентов, применявших аллопуринол по 300 мг/сут, уровень мочевой кислоты достиг целевого показателя (<6,0 мг/дл), аналогичный результат получен и у пациентов, принимавших 40 мг/сут фебуксостата. У лиц, получающих фебуксостат в дозе 80 мг/сут, результат статистически достоверно превышал таковой в двух вышеуказанных группах и составил 67% пациентов.
Аналогичный результат получен и среди пациентов с различной степенью почечной недостаточности: 72% пациентов, получающих фебуксостат в дозе 80 мг/сут, достигли целевого уровня мочевой кислоты, тогда как в группах участников, применявших фебуксостат 40 мг/сут или аллопуринол 200/300 мг/сут, таких пациентов было 50 и 42% соответственно. Не получено статистически достоверных различий между группами по частоте развития неблагоприятных реакций, в том числе сердечно-сосудистых катастроф.
Кроме того, также изучено взаимодействие фебуксостата с препаратами, которые применяют для профилактики и лечения подагрических атак, включая колхицин, напроксен и индометацин, и получены данные об отсутствии обоюдного влияния на фармакокинетику [3].
Таким образом, базируясь на результатах клинических исследований І–ІІІ фазы в 2008 г., фебуксостат под торговым названием Adenuric компании «Menarini — Von Heyden GmbH» одобрен Европейским агентством по лекарственным средствам (European Medicines Agency — EMA), а теперь данный препарат доступен и в Украине под торговым названием Аденурик. Препарат показан для лечения пациентов с хронической гиперурикемией при заболеваниях, сопровождающихся отложением кристаллов уратов, в том числе при наличии тофусов и/или подагрического артрита в настоящее время или в анамнезе.
Отметим, что практический интерес представляют постмаркетинговые исследования эффективности и профиля безопасности фебуксостата. Так, в ходе мультицентрового открытого проспективного обсервационного клинического исследования, проведенного в условиях рутинной медицинской практики в Германии, изучали эффективность фебуксостата [20]. В исследовании участвовали >5,5 тыс. пациентов, среди которых 72,6% — мужчины, средний возраст составил 63,7 года. Лечение фебуксостатом в течение 4 нед позволяло статистически достоверно снизить уровень мочевой кислоты с 8,9±1,9 мг/дл (534,0±114,6 ммоль/л) до 6,2±2,5 мг/дл (372,0±150,0 ммоль/л). При этом 67% пациентов достигли целевого показателя уровня мочевой кислоты (6,1±1,0 мг/дл или 366,0±59,4 ммоль/л). Только 43,1% пациентов получали профилактическое лечение в отношении обострения заболевания. Всего отмечено 178 нежелательных реакций (в основном обострений подагры) у 152 (2,6%) пациентов. Таким образом, показано, что фебуксостат эффективно снижает уровень мочевой кислоты в рутинной медицинской практике. При этом фебуксостат в дозе 80 или 120 мг/сут характеризовался благоприятным профилем безопасности и хорошо переносился.
Лечение фебуксостатом в течение 4 нед позволяло статистически достоверно снизить уровень мочевой кислоты с 8,9±1,9 мг/дл (534,0±114,6 ммоль/л) до 6,2±2,5 мг/дл (372,0±150,0 ммоль/л). При этом 67% пациентов достигли целевого показателя уровня мочевой кислоты (6,1±1,0 мг/дл или 366,0±59,4 ммоль/л). Только 43,1% пациентов получали профилактическое лечение в отношении обострения заболевания. Всего отмечено 178 нежелательных реакций (в основном обострений подагры) у 152 (2,6%) пациентов. Таким образом, показано, что фебуксостат эффективно снижает уровень мочевой кислоты в рутинной медицинской практике. При этом фебуксостат в дозе 80 или 120 мг/сут характеризовался благоприятным профилем безопасности и хорошо переносился.
В другом клиническом исследовании изучали эффективность фебуксостата в старшей возрастной группе пациентов (≥65 лет) [21]. Так, показано, что фебуксостат эффективен в снижении уровня мочевой кислоты в данной группе пациентов. При этом снижение этого показателя более существенно среди женщин. Эффективность фебуксостата не зависит от исходного уровня мочевой кислоты, что также подтверждено в исследовании [22].
Эффективность фебуксостата не зависит от исходного уровня мочевой кислоты, что также подтверждено в исследовании [22].
Таким образом, высокая эффективность, приемлемый профиль безопасности и хорошая переносимость фебуксостата подтверждены в ходе клинических исследований и в рутинной медицинской практике. Фебуксостат (Аденурик) является эффективным средством для снижения уровня мочевой кислоты, который в дозе 80 мг/сут продемонстрировал более высокую эффективность по сравнению с аллопуринолом в дозе 300 мг/сут.
Список использованной литературы1. Насонова В.А., Барскова В.Г. (2004) Ранние диагностика и лечение подагры — научно обоснованное требование улучшения трудового и жизненного прогноза больных. Науч.-практ. ревматол., 1: 5–7.
2. Максудова А.Н., Халфина Т.Н., Митрофанова Е.И. (2011) Современные аспекты терапии подагры: опыт применения десенсибилизирующей терапии у пациента с хронической тофусной подагрой. Практ. мед., 48: 163–165.
3. Барскова В.Г., Ильиных Е.В., Насонов Е.Л. (2011) Фебуксостат — новый препарат в терапии подагры. Науч.-практ. ревматол., 2: 58–65.
Барскова В.Г., Ильиных Е.В., Насонов Е.Л. (2011) Фебуксостат — новый препарат в терапии подагры. Науч.-практ. ревматол., 2: 58–65.
4. Шуба Н.М. (2013) Гиперурикемия — мультиморбидная патология в ревматологии. Укр. ревматол. журн., 2(52): 14–22.Шуба Н.М., Воронова Т.Д. (2015) Подагра — мультиморбидная патология. Укр. ревматол. журн., 1 (59): 72–83.
5. Okamoto K., Eger B.T., Nishino T. et al. (2003) An extremely potent inhibitor of xanthinoxidoreductase. J. Bio. Chem., 278(3): 1848–1855.
6. Fox I.H., Wyngaarden J.B., Kelley W.N. (1970) Depletion of erythrocyte phosphoribosylpyrophosphate in man: a newly observed effect of allopurinol. N. Engl. J. Med., 283: 1177– 1182.
7. Beardmore T.D., Kelley W.N. (1971) Mechanism of allopurinol-mediated inhibition of pyrimidine biosyntesis. J. Lab. Clin. Med., 78: 696–704.
8. Nishida Y., Kamatami N., Tanimoto K., Akaoka I. (1979) Inhibition of purine nucleoside phosphorylase activity and of T-cell function with allopurinol-riboside. Agents Actions, 9: 549–552.
Agents Actions, 9: 549–552.
9. Fox R.M., Royse-Smith D., O’Sallivan W.J. (1970) Orotidinuria induced by allopurinol. Science,168: 861–862.
10. Zhao L., Takano Y., Horiuchi H. (2003) Effect of febuxostat, a novel non-purine, selective inhibitor of xantine oxidase (NP-SIXO), on enzymes in purine and pyrimidine methabolism pathway. Arthr. Rheum., 48(9): 531.
11. Frampton J.E. (2015). Febuxostat: a review of its use in the treatment of hyperuricaemia in patients with gout. Drugs, 75(4): 427–438.
12. Becker M.A., Kisicki J., Khosravan R. еt al. (2004) Febuxostat (TMX-67), a novel nonpurine selective inhibitor of xantine oxidase, is safe and decreases serum urate in healthy volunteers. Nucleosides Nucleotides Nucleic Acids, 23: 1111–1116.
13. Becker M.A., Schumacher H.R., Wortmann R.L. et al. (2005) Febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase: A twenty-eight-day, multicenter, phase II, randomized, double-blind, placebo-controlled, dose-response clinical trial examining safety and efficacy in patients with gout. Arthr. Rheum., 52(3): 916–23.
Arthr. Rheum., 52(3): 916–23.
14. Schumacher H.R., Becker M.A., Wortmann R.L. et al. (2006) The FOCUS Trial 48-Month Interim Analysis: Long-term Clinical Outcomes Of Treatment with Febuxostat in Subjects with Gout in an Ongoing Phase 2, Open-Label Extension Study. Ann. Rheum. Dis., 65: 93.
15. Becker M.A., Schumacher H.R., Wortmann R.L. et al. (2005) Febuxostat compared with allopurinol in patients with hyperuricemia and gout. New. Engl. J. Med., 8: 2450–2461.
16. Schumacher H.R. et al. (2008) Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: A 28‐week, phase III, randomized, double‐blind, parallel‐group trial. Arthritis Care Res., 59(11): 1540–1548.
17. Wortmann R.L., Becker M.A., Schumacher H.R. et al. (2006) Effect of febuxostat or allopurinol on the clinical manifestations of gout: reduction in gout flares and tophus size over time in the EXCEL trial. Arthritis Rheum., 54(9): 642.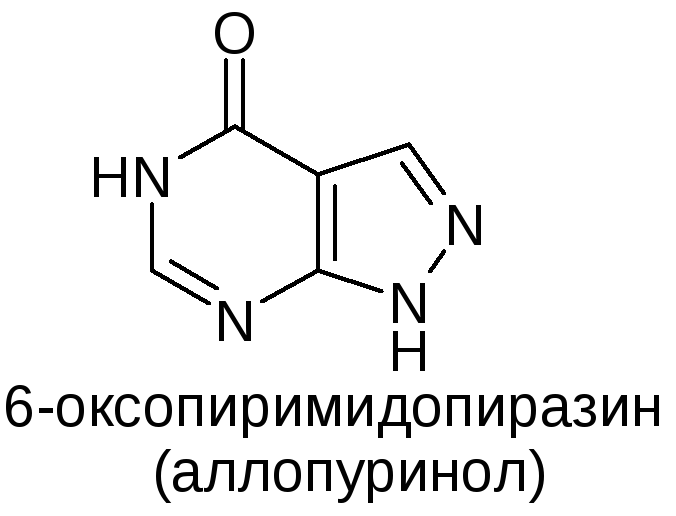
18. Becker M.A., Schumacher H.R., Espinoza L. et al. (2008) A phase III randomized, controlled, multicenter, double-blind trial comparing efficacy and safety of daily febuxostat and allopurinol in subjects with gout; Presented at: the Meeting of the American College of Rheumatology. October 24–29, 2008. San Francisco, California, abstr L11: 57.
19. Tausche A.K., Reuss-Borst M., Koch U. (2014). Urate Lowering Therapy with Febuxostat in Daily Practice — A Multicentre, Open-Label, Prospective Observational Study. Int. J. Rheumatol., 123105. Epub. 2014 Sep. 3.
20. Mizuno T., Hayashi T., Hikosaka S. et al.(2014). Efficacy and safety of febuxostat in elderly female patients. Clin. Interv. Aging, 9: 1489.
21. Yamamoto T., Hidaka Y., Inaba M. et al. (2015) Effects of febuxostat on serum urate level in Japanese hyperuricemia patients. Mod. Rheumatol., 12: 1–5.
Информация для профессиональной деятельности медицинских и фармацевтических работников
АДЕНУРИК 80 мг/АДЕНУРИК 120 мг
Состав. фебуксостата 80 или 120 мг. Лекарственная форма. Таблетки, покрытые пленочной оболочкой. Фармакологическая группа. Лекарственные средства для лечения подагры. Лекарственные средства, подавляющие образование мочевой кислоты. Код АТС. М04А А03. Показания. Лечение хронической гиперурикемии при заболеваниях, сопровождающихся отложением кристаллов уратов, в том числе при наличии тофусов и/или подагрического артрита в настоящее время или в анамнезе. Противопоказания. Гиперчувствительность к активному веществу или к любому другому вспомогательному веществу препарата. Побочные реакции. Наиболее частыми побочными реакциями в клинических исследованиях и в процессе постмаркетингового надзора были обострения (приступы) подагры, нарушения функции печени, диарея, тошнота, головная боль, высыпания и отеки. Во время постмаркетингового надзора были сообщения о серьезных реакциях гиперчувствительности на фебуксостат, некоторые из них сопровождались системными реакциями.
фебуксостата 80 или 120 мг. Лекарственная форма. Таблетки, покрытые пленочной оболочкой. Фармакологическая группа. Лекарственные средства для лечения подагры. Лекарственные средства, подавляющие образование мочевой кислоты. Код АТС. М04А А03. Показания. Лечение хронической гиперурикемии при заболеваниях, сопровождающихся отложением кристаллов уратов, в том числе при наличии тофусов и/или подагрического артрита в настоящее время или в анамнезе. Противопоказания. Гиперчувствительность к активному веществу или к любому другому вспомогательному веществу препарата. Побочные реакции. Наиболее частыми побочными реакциями в клинических исследованиях и в процессе постмаркетингового надзора были обострения (приступы) подагры, нарушения функции печени, диарея, тошнота, головная боль, высыпания и отеки. Во время постмаркетингового надзора были сообщения о серьезных реакциях гиперчувствительности на фебуксостат, некоторые из них сопровождались системными реакциями. Редко: панцитопения, тромбоцитопения; редко: анафилактические реакции, гиперчувствительность к препарату; часто: обострения (приступы) подагры; нечасто: сахарный диабет, гиперлипидемия, снижение аппетита, увеличение массы тела; редко: уменьшение массы тела, повышение аппетита, потеря аппетита; нечасто: снижение либидо, бессонница; редко: нервозность; часто: головная боль; нечасто: головокружение, парестезии, сонливость, изменение вкуса, снижение чувствительности кожи; редко: шум в ушах; нечасто: фибрилляция предсердий, сердцебиение, отклонения от нормы на ЭКГ, артериальная гипертензия, приливы; нечасто: одышка, бронхит, инфекции верхних дыхательных путей, кашель; часто: диарея, тошнота; нечасто: боль в животе, вздутие живота, гастроэзофагеальная рефлюксная болезнь, рвота, сухость во рту, диспепсия, запор, частый стул, метеоризм, дискомфорт в желудке или кишечнике; редко: панкреатит, язвы в области рта; часто: нарушение функции печени; нечасто: желчнокаменная болезнь; редко: гепатит, желтуха; часто: высыпания; нечасто: дерматит, крапивница, зуд, изменение окраски кожи, повреждения кожи, петехии, пятнистая сыпь, папулезные высыпания; редко: синдром Стивенса — Джонсона, генерализованная сыпь (серьезные), эритема, высыпания эксфолиативные, фолликулярные, везикулезные, пустулезные, зудящие, эритематозные, кореподобная сыпь, алопеция, повышенная потливость; нечасто: артрит, боль в суставах, в мышцах, скелетно-мышечная боль, слабость в мышцах, судороги мышц, скованность мышц, бурсит; редко: скованность суставов, костно-мышечная скованность; нечасто: почечная недостаточность, мочекаменная болезнь, гематурия, поллакиурия, протеинурия; редко: тубулоинтерстициальный нефрит, частые позывы к мочеиспусканию; редко: нарушения эрекции; часто: отеки; нечасто: повышенная утомляемость, боль в груди, ощущение дискомфорта в груди; редко: жажда.
Редко: панцитопения, тромбоцитопения; редко: анафилактические реакции, гиперчувствительность к препарату; часто: обострения (приступы) подагры; нечасто: сахарный диабет, гиперлипидемия, снижение аппетита, увеличение массы тела; редко: уменьшение массы тела, повышение аппетита, потеря аппетита; нечасто: снижение либидо, бессонница; редко: нервозность; часто: головная боль; нечасто: головокружение, парестезии, сонливость, изменение вкуса, снижение чувствительности кожи; редко: шум в ушах; нечасто: фибрилляция предсердий, сердцебиение, отклонения от нормы на ЭКГ, артериальная гипертензия, приливы; нечасто: одышка, бронхит, инфекции верхних дыхательных путей, кашель; часто: диарея, тошнота; нечасто: боль в животе, вздутие живота, гастроэзофагеальная рефлюксная болезнь, рвота, сухость во рту, диспепсия, запор, частый стул, метеоризм, дискомфорт в желудке или кишечнике; редко: панкреатит, язвы в области рта; часто: нарушение функции печени; нечасто: желчнокаменная болезнь; редко: гепатит, желтуха; часто: высыпания; нечасто: дерматит, крапивница, зуд, изменение окраски кожи, повреждения кожи, петехии, пятнистая сыпь, папулезные высыпания; редко: синдром Стивенса — Джонсона, генерализованная сыпь (серьезные), эритема, высыпания эксфолиативные, фолликулярные, везикулезные, пустулезные, зудящие, эритематозные, кореподобная сыпь, алопеция, повышенная потливость; нечасто: артрит, боль в суставах, в мышцах, скелетно-мышечная боль, слабость в мышцах, судороги мышц, скованность мышц, бурсит; редко: скованность суставов, костно-мышечная скованность; нечасто: почечная недостаточность, мочекаменная болезнь, гематурия, поллакиурия, протеинурия; редко: тубулоинтерстициальный нефрит, частые позывы к мочеиспусканию; редко: нарушения эрекции; часто: отеки; нечасто: повышенная утомляемость, боль в груди, ощущение дискомфорта в груди; редко: жажда. Нечасто: снижение гематокрита; уменьшение количества тромбоцитов, лейкоцитов и лимфоцитов в крови; снижение уровня гемоглобина крови; повышение уровня креатинина, амилазы, мочевой кислоты, триглицеридов, холестерина, лактатдегидрогеназы, калия в крови; редко: повышение уровня глюкозы в крови, удлинение активированного частичного тромбопластинового времени, уменьшение количества эритроцитов в крови, повышение уровня щелочной фосфатазы в крови. В рамках постмаркетингового надзора были сообщения о редких случаях серьезных реакций гиперчувствительности на фебуксостат, в том числе синдром Стивенса — Джонсона и анафилактические реакции/шок. Синдром Стивенса — Джонсона характеризуется прогрессирующими кожными высыпаниям с буллезным поражением кожи или слизистой оболочки и раздражением слизистой оболочки глаз. Реакции гиперчувствительности на фебуксостат могут проявляться такими симптомами: кожной реакцией в виде инфильтрированной макулопапулезной сыпи, генерализованного или эксфолиативного высыпания, тромбоцитопении и поражением отдельных органов или нескольких органов (печень и почки, в том числе тубулоинтерстициальний нефрит).
Нечасто: снижение гематокрита; уменьшение количества тромбоцитов, лейкоцитов и лимфоцитов в крови; снижение уровня гемоглобина крови; повышение уровня креатинина, амилазы, мочевой кислоты, триглицеридов, холестерина, лактатдегидрогеназы, калия в крови; редко: повышение уровня глюкозы в крови, удлинение активированного частичного тромбопластинового времени, уменьшение количества эритроцитов в крови, повышение уровня щелочной фосфатазы в крови. В рамках постмаркетингового надзора были сообщения о редких случаях серьезных реакций гиперчувствительности на фебуксостат, в том числе синдром Стивенса — Джонсона и анафилактические реакции/шок. Синдром Стивенса — Джонсона характеризуется прогрессирующими кожными высыпаниям с буллезным поражением кожи или слизистой оболочки и раздражением слизистой оболочки глаз. Реакции гиперчувствительности на фебуксостат могут проявляться такими симптомами: кожной реакцией в виде инфильтрированной макулопапулезной сыпи, генерализованного или эксфолиативного высыпания, тромбоцитопении и поражением отдельных органов или нескольких органов (печень и почки, в том числе тубулоинтерстициальний нефрит). Обострение (приступы) подагры обычно отмечали вскоре после начала лечения и в течение первых месяцев терапии. Частота приступов подагры снижалась со временем. Как и в случае с другими препаратами, для лечения пациентов с подагрой при применении фебуксостата рекомендуется проводить профилактику острых приступов подагры.
Обострение (приступы) подагры обычно отмечали вскоре после начала лечения и в течение первых месяцев терапии. Частота приступов подагры снижалась со временем. Как и в случае с другими препаратами, для лечения пациентов с подагрой при применении фебуксостата рекомендуется проводить профилактику острых приступов подагры.
Р.с. № UA/13527/01/01, UA/13527/01/02 от 18.03.2014 по 18.03.2019 г.
С полной информацией о препарате можно ознакомиться в инструкции по медицинскому применению.
Arpimed
Влияние на способность управлять транспортными средствами и механизмами
Если Вы ощутите сонливость, головокружение или нарушение координации, не управляйте транспортными средствами и другими механизмами.
Как принимать Аллопуринол
Аллопуринол следует принимать в точности так, как назначено врачом. Если у вас есть какие-то сомнения, то вам следует проконсультироваться с Вашим лечащим врачом или фармацевтом.
Аллопуринол следует принимать после еды, запивая 1 стаканом воды.
Рекомендуемая суточная доза составляет 100-900 мг. Начинают лечение аллопуринолом обычно с низкой дозы, постепенно увеличивая до оптимальной поддерживающей дозы, отвечающей потребностям больного.
Если Вы пожилой пациент или у Вас печеночная или почечная недостаточность, Ваш лечащий врач может назначить низкую дозу или увеличить интервал между приёмом аллопуринола. Если Вы на диализе с частотой 2-3 раза в неделю, Ваш лечащий врач может назначить лекарство в дозе 300-400 мг, которую следует принять сразу же после процедуры диализа.
Детям до 15 лет:
Суточная поддерживающая доза обычно составляет 100-400 мг.
Если Вы приняли Аллопуринола больше, чем рекомендовано
Если Вы приняли аллопуринола больше, чем рекомендовано, обратитесь к врачу или в ближайшую больницу. Возьмите с собой упаковку лекарства. Симптомы передозировки — тошнота, рвота, диарея и головокружение.
Если Вы забыли принять Аллопуринол
Если Вы забыли принять очередную дозу препарата, примите ее как только вспомните. Если подошло время очередного приема аллопуринола, пропустите непринятую дозу.
Не принимайте двойную дозу, чтобы компенсировать пропущенную.
Если вы прекращаете прием Аллопуринола
Вы должны посоветоваться со своим врачом, прежде чем прекратить использование аллопуринола.
Если у Вас есть дополнительные вопросы относительно приема препарата, обратитесь к лечащему врачу или фармацевту.
вступление
Аллопуринол представляет собой структурный аналог
естественного пуринового основания гипоксантина.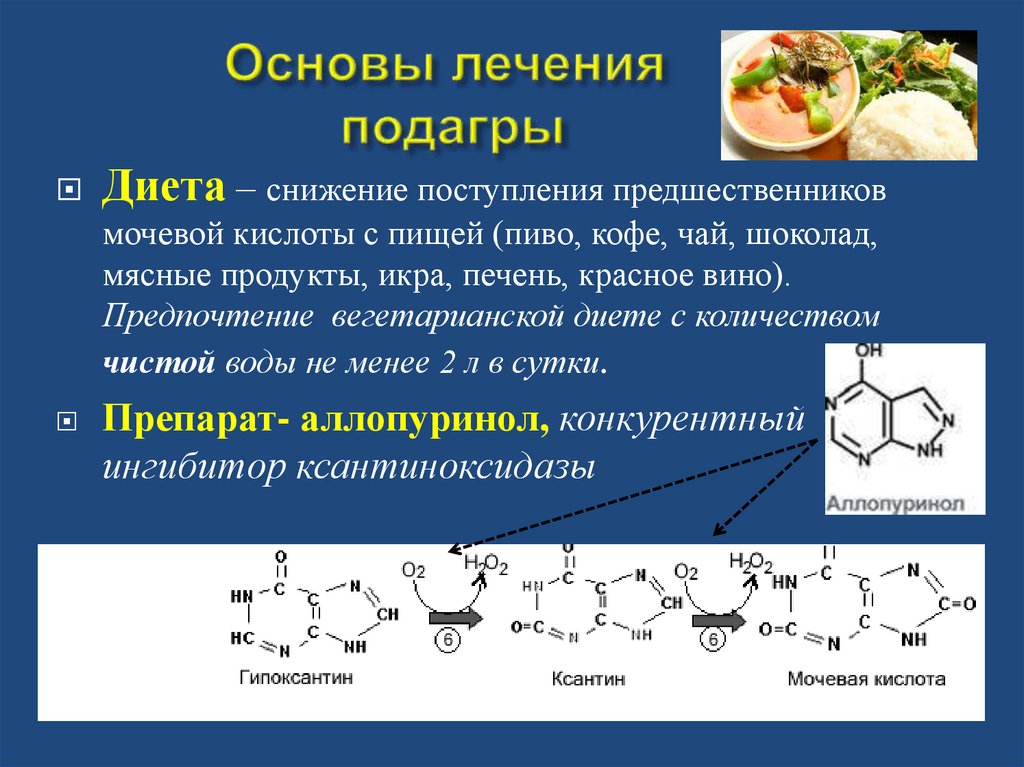 Он считается одним из самых
эффективных лекарственных препаратов, который применяется для снижения уровня
уратов и одобрен Управлением по контролю качества пищевых продуктов и
лекарственных средств США (FDA) для лечения подагры, кальций-оксалатных камней
и гиперурикемии, вызванной противоопухолевой терапией. Его также рекомендуют для
применения в составе терапии, снижающей уровень уратов, у пациентов с
хронической персистирующей формой подагрического артрита, узелковой подагрой,
мочекаменной болезнью.
Он считается одним из самых
эффективных лекарственных препаратов, который применяется для снижения уровня
уратов и одобрен Управлением по контролю качества пищевых продуктов и
лекарственных средств США (FDA) для лечения подагры, кальций-оксалатных камней
и гиперурикемии, вызванной противоопухолевой терапией. Его также рекомендуют для
применения в составе терапии, снижающей уровень уратов, у пациентов с
хронической персистирующей формой подагрического артрита, узелковой подагрой,
мочекаменной болезнью.
Фармакологическая группа: ингибиторы ксантиноксидазы
ПОКАЗАНИЯ ПРЕПАРАТА Аллопуринол
- Подагра
- Гиперурикемия, вызванная противоопухолевой терапией, или синдром лизиса опухоли
- Кальций-оксалатные камни
фармакологическое действие
Аллопуринол действует путем ингибирования ксантиноксидазы,
фермента, ответственного за превращение гипоксантина в ксантин и ксантина
в мочевую кислоту. Это приводит к сокращению выработки мочевой кислоты, в
результате чего снижаются уровни уратов и происходит ослабление выраженности
симптомов, вызванных подагрой, такие как болезненные тофусы, боль в суставах,
воспаление, покраснение, ограниченный диапазон движения и отек.
Это приводит к сокращению выработки мочевой кислоты, в
результате чего снижаются уровни уратов и происходит ослабление выраженности
симптомов, вызванных подагрой, такие как болезненные тофусы, боль в суставах,
воспаление, покраснение, ограниченный диапазон движения и отек.
ДОЗИРОВКА ПРЕПАРАТА Аллопуринол
Стандартная доза для взрослых при подагре составляет:
200–300 мг/сут — подагра легкой степени тяжести;
400–600 мг/сут — подагра от умеренной до тяжелой степени, узелковая подагра;
700–800 мг/сут — тяжелые формы подагры.
Максимальная рекомендованная доза для пациентов с нормальной функцией почек составляет 800 мг/сут.
Стандартная доза для взрослых в целях профилактики мочекислой нефропатии во время лечения опухолевых заболеваний:
600–800 мг/сут в течение 2–3 дней.
Стандартная доза для взрослых при лечении рецидивов кальций-оксалатных камней:
200–300 мг/сут однократно или в несколько приемов.
Фармакокинетика
Всасывание: примерно 90 % лекарственного препарата всасывается в желудочно-кишечном тракте. Пиковые уровни в плазме обычно достигаются через 1,5 часа после получения дозы аллопуринола. Максимальный уровень в плазме, наблюдаемый после приема одной дозы 300 мг аллопуринола внутрь, составляет 3 мкг/мл.
Объем распределения (Vd): аллопуринол
— субстрат фермента ксантиноксидазы, который присутствует в цитоплазме
эндотелиальных клеток капилляров и обладает наибольшей активностью в слизистой
оболочке печени и кишечника. Данные о проведении исследований по оценке
концентрации аллопуринола в тканях у человека отсутствуют, однако в исследованиях
на животных установлено, что самые высокие уровни препарата выявляются в крови, печени, кишечнике и сердце, а самые низкие — в
тканях мозга и легких.
Данные о проведении исследований по оценке
концентрации аллопуринола в тканях у человека отсутствуют, однако в исследованиях
на животных установлено, что самые высокие уровни препарата выявляются в крови, печени, кишечнике и сердце, а самые низкие — в
тканях мозга и легких.
Связывание с белками: аллопуринол почти не связывается с белками плазмы крови.
Метаболизм: аллопуринол быстро метаболизируется до соответствующих аналогов ксантина, оксипуринола (аллоксантина), ингибитора фермента ксантиноксидазы. Он преобразуется в соответствующие рибонуклеотиды путем реутилизации пурина. Эффект этих рибонуклеотидов, связанный с гипоурикемическим действием аллопуринола у человека, в настоящее время до конца не изучен.
Выведение: около 80 % принятого внутрь аллопуринола выводится с мочой и 20 % — с калом.
Период полувыведения: период
полувыведения аллопуринола из плазмы составляет 1–2 часа, что обусловлено
быстрым почечным клиренсом.
Клиренс: аллопуринол и его метаболиты в основном выводятся почками, следовательно, во избежание накапливания препарата у пациентов с нарушенной функцией почек доза должна быть уменьшена. Суточная доза 200 мг аллопуринола применима в том случае, если клиренс креатинина составляет 10–20 мл/мин, в то же время суточная доза не должна превышать 100 мг, если клиренс креатинина составляет менее 10 мл/мин.
ПРОТИВОПОКАЗАНИЯ ПРЕПАРАТА Аллопуринол
- Противопоказан пациентам с гиперчувствительностью к аллопуринолу, а также пациентам с тяжелой реакцией на применение этого препарата в анамнезе
- Противопоказан пациентам с нарушенной функцией почек, так как применение препарата может спровоцировать ухудшение устойчивого нарушения функции почек
- Противопоказан в период грудного вскармливания и детям (кроме тех, у кого гиперурикемия вызвана злокачественной опухолью)
лекарственные взаимодействия
- В сочетании со средствами, способствующими выведению мочевой кислоты, такими как пробенецид или салицилат в высоких дозах, может снижаться степень ингибирования ксантиноксидазы аллопуринолом или оксипуринолом, а также увеличивается почечный клиренс оксипуринола
- Аллопуринол увеличивает период полувыведения антикоагулянта дикумарола, следовательно, следует рассмотреть возможность применения аллопуринола в сочетании с антикоагулянтной терапией
- При одновременном применении хлорпропамида и аллопуринола, у пациентов с нарушенной функцией почек увеличивается известный риск развития длительной гипогликемической активности хлорпропамида
- Аллопуринол может увеличивать период полувыведения из плазмы и концентрацию видарабина и циклоспорина, что, соответственно, приводит к усилению токсического действия
- В экспериментальных условиях присутствие относительно высоких доз аллопуринола (300 мг два раза в сутки)ингибирует метаболизм теофиллина
- При одновременном применении ампициллина/амоксициллина и аллопуринола возможно увеличение частоты развития кожной сыпи
ПОБОЧНЫЕ ЭФФЕКТЫ ПРЕПАРАТА Аллопуринол
Аллопуринол широко назначается пациентам с
подагрой в качестве препарата терапии первой линии, снижающей уровень уратов в
крови.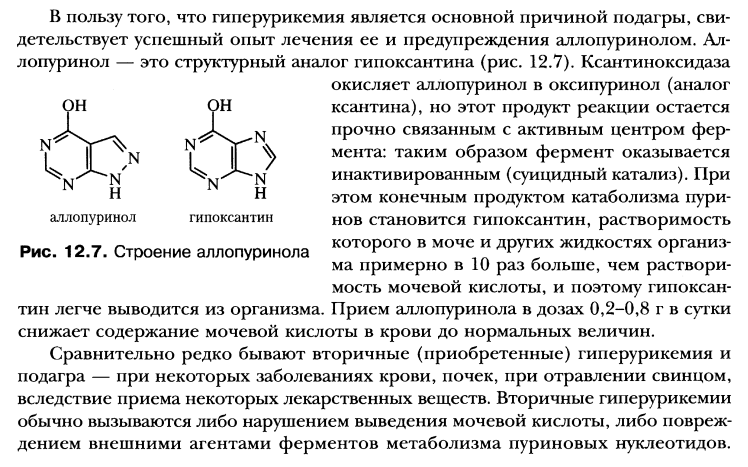 Уровень мочевой кислоты в сыворотке крови часто не достигается из-за
предполагаемой непереносимости доз выше 300 мг. Количество исследований по
оценке эффективности и безопасности применения аллопуринола в дозах выше 300 мг/сут
ограничено. Данные, полученные в ходе проведения масштабного открытого
исследования длительностью 6 месяцев (LASSO), указывают на эффективность
препарата в отношении снижения уровня мочевой кислоты в сыворотке крови,
частоты развития приступов подагры и безопасности подобранной дозы, что
подтверждается результатами клинических и лабораторных анализов, проводимых во
время ежемесячных визитов. В исследование было включено 1735 пациентов, распределенных
по трем категориям: категория 1 (< 300 мг), категория 2 (300 мг) и
категория 3 (> 300 мг). Согласно результатам исследования, аллопуринол
хорошо переносится и частота развития нежелательных явлений, возникших в ходе
лечения (НЯВХЛ), и НЯВХЛ, связанных с прекращением лечения, невысока.
Уровень мочевой кислоты в сыворотке крови часто не достигается из-за
предполагаемой непереносимости доз выше 300 мг. Количество исследований по
оценке эффективности и безопасности применения аллопуринола в дозах выше 300 мг/сут
ограничено. Данные, полученные в ходе проведения масштабного открытого
исследования длительностью 6 месяцев (LASSO), указывают на эффективность
препарата в отношении снижения уровня мочевой кислоты в сыворотке крови,
частоты развития приступов подагры и безопасности подобранной дозы, что
подтверждается результатами клинических и лабораторных анализов, проводимых во
время ежемесячных визитов. В исследование было включено 1735 пациентов, распределенных
по трем категориям: категория 1 (< 300 мг), категория 2 (300 мг) и
категория 3 (> 300 мг). Согласно результатам исследования, аллопуринол
хорошо переносится и частота развития нежелательных явлений, возникших в ходе
лечения (НЯВХЛ), и НЯВХЛ, связанных с прекращением лечения, невысока.
Другие распространенные НЯВХЛ, связанные с
отменой аллопуринола или прекращением участия в исследовании, включали сыпь, диарею,
увеличение уровня аланинаминотрансферазы и гамма-глутамилтрансферазы. Общая
частота развития тяжелых осложнений заболеваний сердца (смерть от осложнений
сердечно-сосудистых заболеваний (ССЗ), несмертельный инфаркт миокарда и
несмертельный инсульт) составила 0,58 % и соответствовала 1,42/100
человеко-лет (95 % ДИ: 0,68–2,61). Частота достижения конечных точек,
связанных с осложнениями ССЗ без развития тяжелых осложнений заболеваний
сердца, составила 0,75 %. В заключение необходимо отметить, что между
группами получения разных доз (< 300, 300 и > 300 мг в сутки) наблюдались
незначительные различия частоты развития НЯВХЛ, возможно связанные с приемом
аллопуринола. Дозы аллопуринола хорошо переносились без возникновения новых
сигналов по безопасности в течение 6 месяцев.
Общая
частота развития тяжелых осложнений заболеваний сердца (смерть от осложнений
сердечно-сосудистых заболеваний (ССЗ), несмертельный инфаркт миокарда и
несмертельный инсульт) составила 0,58 % и соответствовала 1,42/100
человеко-лет (95 % ДИ: 0,68–2,61). Частота достижения конечных точек,
связанных с осложнениями ССЗ без развития тяжелых осложнений заболеваний
сердца, составила 0,75 %. В заключение необходимо отметить, что между
группами получения разных доз (< 300, 300 и > 300 мг в сутки) наблюдались
незначительные различия частоты развития НЯВХЛ, возможно связанные с приемом
аллопуринола. Дозы аллопуринола хорошо переносились без возникновения новых
сигналов по безопасности в течение 6 месяцев.
меры предосторожности
- На начальном этапе терапии регистрировалась повышенная частота острых приступов подагры, поэтому в начале терапии аллопуринолом рекомендуется применять колхицин в поддерживающих дозах
- Важно обеспечить достаточное потребление жидкости, необходимое для выработки как минимум 2 л мочи в сутки, для снижения риска появления ксантиновых камней
- На начальном
этапе приема аллопуринола необходимо обеспечить тщательный мониторинг пациентов
с нарушенной функцией почек.
 Если нарушения функций почек продолжают
усугубляться, необходимо снизить дозу препарата или отменить его
Если нарушения функций почек продолжают
усугубляться, необходимо снизить дозу препарата или отменить его - Эффект аллопуринола у кормящих женщин и детей недостаточно изучен, поэтому препарат следует назначать с осторожностью
- Не следует назначать аллопуринол пациентам с бессимптомной гиперурикемией
клинические доказательства
Подагра. Li Wei и соавт. провели когортное исследование по изучению влияния аллопуринола на уровень уратов и развитие осложнений ССЗ, вызванных подагрой. В период 2000–2002 гг. в исследование было включено 7135 пациентов в возрасте ≥ 60 лет по показателю уровня уратов. Последующее наблюдение продолжалось до 2007 г. 6042 пациента отказались от проведения терапии по снижению уровня уратов, а уровень уратов у 45,9 % пациентов составлял ≤ 6 мг/дл−1. Из 1035 пациентов, получавших аллопуринол, 44,7 % удалось достичь целевого уровня уратов. По сравнению с пациентами, не получавшими терапию по снижению уровня уратов, и пациентами, не получавшими терапию по снижению уровня уратов и имеющими уровень уратов > 6 мг/дл−1, статистически значимого увеличения риска развития осложнений ССЗ среди пациентов, принимавших аллопуринол, зарегистрировано не было. Частота развития осложнений ССЗ в когорте пациентов, принимавших аллопуринол, составила 74,0 на 1000 человеко-лет в группе приема препарата в дозе 100 мг, 69,7 в группе приема препарата в дозе 200 мг и 47,6 в группе приема препарата в дозе ≥ 300 мг. У пациентов, принимавших высокие дозы препарата, отмечалось статистически значимое снижение риска развития осложнений ССЗ и смертности по сравнению с пациентами, принимавшими низкие дозы аллопуринола. Менее 50 % пациентов, принимавших аллопуринол, достигли целевых концентраций уратов. В заключение необходимо отметить, что более высокие дозы аллопуринола были связаны с более высоким контролем уровня уратов и пониженным риском развития осложнений ССЗ и смертности.
Из 1035 пациентов, получавших аллопуринол, 44,7 % удалось достичь целевого уровня уратов. По сравнению с пациентами, не получавшими терапию по снижению уровня уратов, и пациентами, не получавшими терапию по снижению уровня уратов и имеющими уровень уратов > 6 мг/дл−1, статистически значимого увеличения риска развития осложнений ССЗ среди пациентов, принимавших аллопуринол, зарегистрировано не было. Частота развития осложнений ССЗ в когорте пациентов, принимавших аллопуринол, составила 74,0 на 1000 человеко-лет в группе приема препарата в дозе 100 мг, 69,7 в группе приема препарата в дозе 200 мг и 47,6 в группе приема препарата в дозе ≥ 300 мг. У пациентов, принимавших высокие дозы препарата, отмечалось статистически значимое снижение риска развития осложнений ССЗ и смертности по сравнению с пациентами, принимавшими низкие дозы аллопуринола. Менее 50 % пациентов, принимавших аллопуринол, достигли целевых концентраций уратов. В заключение необходимо отметить, что более высокие дозы аллопуринола были связаны с более высоким контролем уровня уратов и пониженным риском развития осложнений ССЗ и смертности.
Кальций-оксалатные камни. В двойном слепом исследовании, проведенном Ettinger B. и соавт., изучали эффективность применения аллопуринола для профилактики рецидивов кальций-оксалатных камней в почках. В исследование было включено 60 пациентов с гиперурикозурией и нормокальциурией, имевших мочекаменную болезнь в анамнезе, которые были рандомизированы в группы приема аллопуринола (100 мг три раза в сутки) или плацебо. Результаты исследования указывают на статистически значимое снижение выраженности проявлений мочекаменной болезни в группе приема аллопуринола (81,2 %) по сравнению с плацебо (63,4 %). Средняя частота случаев известковых камней составила 0,26/человеко-лет в группе получения плацебо и 0,12 в группе получения аллопуринола. Сравнение результатов актуарного анализа в группах лечения указывает на то, что время до наступления рецидива мочекаменной болезни было статистически значимо длиннее в группе приема аллопуринола. По результатам исследования был сделан вывод об эффективности применения аллопуринола для профилактики кальций-оксалатных камней у пациентов с гиперурикозурией.
Рекомендации
- Allopurinol. FDA label. Reference ID: 4357411.
- NCBI. PubChem Database. Allopurinol, CID=135401907.
- Allopurinol. Drug Bank. DB00437 (APRD00435, DB03027).
- Aust Prescr. 2016 Aug; 39(4): 119–122.
- StatPearls. Allopurinol.2019 (Jan).
- Seminars in Arthritis and Rheumatism.2015; 45(2):174–183.
- Br J Clin Pharmacol. 2011 Apr; 71(4): 600–607.
- N Engl J Med. 1986 Nov 27;315(22):1386–9.
результаты рандомизированного исследования CARES (Cardiovascular Safety of Febuxostat and Allopurino
ИМ — инфаркт миокарда
ККр — клиренс креатинина
МК — мочевая кислота
НПВП — нестероидные противовоспалительные
препараты
ССЗ — сердечно-сосудистое заболевание
Предпосылки к проведению исследования
Подагра представляет собой хроническое заболевание, характеризующееся гиперурикемией, артропатией, образованием тофусов и уролитиазом, которое сопровождается увеличением риска развития сердечно-сосудистых заболеваний (ССЗ) и хронических болезней почек [1]. У больных с подагрой риск развития осложнений ССЗ, включая риск смерти, существенно выше, чем у лиц без подагры [2, 3]. Опубликование экспертами Администрации США по контролю за качеством пищевых продуктов и лекарственных препаратов рекомендательного документа, в котором подчеркивались требования к оценке безопасности гипогликемических препаратов по влиянию на риск развития осложнений ССЗ [4], стало основанием для проверки в сходных исследованиях такой безопасности и других терапевтических средств, включая препараты для лечения больных подагрой.
У больных с подагрой риск развития осложнений ССЗ, включая риск смерти, существенно выше, чем у лиц без подагры [2, 3]. Опубликование экспертами Администрации США по контролю за качеством пищевых продуктов и лекарственных препаратов рекомендательного документа, в котором подчеркивались требования к оценке безопасности гипогликемических препаратов по влиянию на риск развития осложнений ССЗ [4], стало основанием для проверки в сходных исследованиях такой безопасности и других терапевтических средств, включая препараты для лечения больных подагрой.
Фебуксостат — непуриновый ингибитор ксантиноксидазы, который используют для уменьшения выраженности гиперурикемии у больных с подагрой. Фебуксостат подавляет как окисленные, так и редуцированные формы ксантиноксидазы и уменьшает образование мочевой кислоты (МК) [5]. Применение фебуксостата обеспечивает высокоселективное и мощное подавление ксантиноксидазы и более выраженную гипоурикемическую активность по сравнению с применением аллопуринола в обычно применяемых дозах [6]. В период разработки прием фебуксостата сравнивали с приемом плацебо и аллопуринола в ходе выполнения клинических исследований, включавших более 5000 больных с подагрой [5—7]. Результаты таких исследований позволяли предположить небольшое увеличение частоты развития осложнений ССЗ при применении фебуксостата.
В период разработки прием фебуксостата сравнивали с приемом плацебо и аллопуринола в ходе выполнения клинических исследований, включавших более 5000 больных с подагрой [5—7]. Результаты таких исследований позволяли предположить небольшое увеличение частоты развития осложнений ССЗ при применении фебуксостата.
Цель исследования
В соответствии с требованиями Администрации США по контролю за качеством пищевых продуктов и лекарственных препаратов проверить гипотезу о том, что прием фебуксостата не менее безопасен, чем прием аллопуринола, по влиянию на риск развития тяжелых осложнений ССЗ у больных с подагрой и установленным диагнозом ССЗ.
Структура исследования
Многоцентровое рандомизированное двойное слепое исследование, выполненное в 320 исследовательских центрах Северной Америки, для проверки гипотезы о не менее высокой безопасности применения фебуксостата по сравнению с аллопуринолом; медиана продолжительности наблюдения 32 мес (максимальная продолжительность наблюдения 85 мес).
В исследование включали больных, у которых была диагностирована подагра в соответствии с критериями Американской ассоциации ревматологов [8] и в анамнезе было указание на ССЗ до рандомизации. Кроме того, для включения в исследование требовалось, чтобы концентрация МК была не менее 420 мкмоль/л или не менее 360 мкмоль/л при недостаточно эффективно леченной подагре после фазы вымывания в течение 1—3 нед, в которой больной не принимал ранее применяемые препараты для лечения подагры. ССЗ в анамнезе было критерием включения в исследование, если больной ранее переносил инфаркт миокарда (ИМ), госпитализировался по поводу нестабильной стенокардии, переносил инсульт, госпитализировался по поводу преходящего нарушения мозгового кровообращения, имел заболевание периферических сосудов, а также сахарный диабет с признаками микро- или макрососудистого заболевания. Подробно исходные характеристики больных представлены в таблице. Таблица. Исходные характеристики больных, включенных в исследование Примечание. Данные представлены как число больных в процентах, среднее ± стандартное отклонение или медиана значений (межквартильный диапазон), если не указано другое. ССЗ — сердечно-сосудистые заболевания; ХБП — хроническая болезнь почек.
Данные представлены как число больных в процентах, среднее ± стандартное отклонение или медиана значений (межквартильный диапазон), если не указано другое. ССЗ — сердечно-сосудистые заболевания; ХБП — хроническая болезнь почек.
Вмешательство
Больных распределяли в группу фебуксостата или группу аллопуринола. Оба препарата назначали 1 раз в день. Рандомизацию выполняли со стратификацией в зависимости от рассчитанного клиренса креатинина (ККр) при включении в исследование (60 мл/мин и более или в диапазоне от 30 мл/мин и более до менее 60 мл/мин).
Дозу аллопуринола подбирали в зависимости от функции почек. Больные, у которых рассчитанный ККр был не менее 60 мл/мин, начинали принимать аллопуринол по 300 мг 1 раз в сутки, а затем дозу увеличивали на 100 мг каждый месяц либо до достижения концентрации МК менее 360 мкмоль/л или достижения дозы аллопуринола 600 мг 1 раз в сутки. Больные, у которых рассчитанный ККр был в диапазоне от 30 мл/мин до менее 60 мл/мин, начинали принимать аллопуринол по 200 мг 1 раз в сутки и затем дозу увеличивали на 100 мг в месяц до достижения концентрации МК в крови менее 360 мкмоль/л или достижения дозы аллопуринола 400 мг 1 раз в сутки.
Доза фебуксостата не изменялась в зависимости от функции почек. Больные, распределенные в группу флебуксостата, начинали принимать препарат по 40 мг 1 раз в сутки и продолжали применять такую дозу, если концентрация МК оставалась менее 360 мкмоль/л после 2 нед терапии. Если уровень МК в крови был более 360 мкмоль/л во время посещения исследовательского центра через 2 нед после рандомизации, дозу фебуксостата увеличивали до 80 мг 1 раз в сутки и такая доза сохранялась до конца исследования.
Информация о концентрации МК предоставлялась исследователям только в течение 10-недельного периода подбора дозы для того, чтобы способствовать увеличению дозы исследуемых препаратов, которое основывалось на ответной реакции, оцениваемой по уровню МК в крови. В течение такого периода исследуемые препараты назначали в соответствии с двойным слепым двойным плацебо-контролируемым протоколом исследования с помощью интерактивной голосовой системы. Такой подход использовали для предотвращения нарушения слепого метода у больных, которым не подбирали дозу исследуемых препаратов. После завершения подбора дозы информацию об уровне МК в крови скрывали как от исследователей, так и представителей компании, финансирующей исследование, а интерактивная голосовая система использовалась только для регулирования выдачи препарата в ходе выполнения исследования.
После завершения подбора дозы информацию об уровне МК в крови скрывали как от исследователей, так и представителей компании, финансирующей исследование, а интерактивная голосовая система использовалась только для регулирования выдачи препарата в ходе выполнения исследования.
Во время первого посещения исследовательского центра все гипоурикемические препараты отменяли и в отсутствие указаний в анамнезе на неприемлемые побочные эффекты при приеме колхицина назначали колхицин по 0,6 мг/сут для профилактики обострения подагры. Все больные профилактически принимали колхицин в течение первых 6 мес после рандомизации. Если прием колхицина приводил к развитию неприемлемых побочных эффектов и рассчитанный ККр составлял не менее 50 мл/мин, больным назначали напроксен (по 250 мг 2 раза в сутки) в сочетании с ланзопразолом (по 15 мг 1 раз в сутки). Если больной не мог принимать ни колхицин, ни напроксен, для профилактики можно было применять другие нестероидные противовоспалительные препараты (НПВП) или преднизолон либо исследователь мог выбрать тактику лечения при обострении подагры.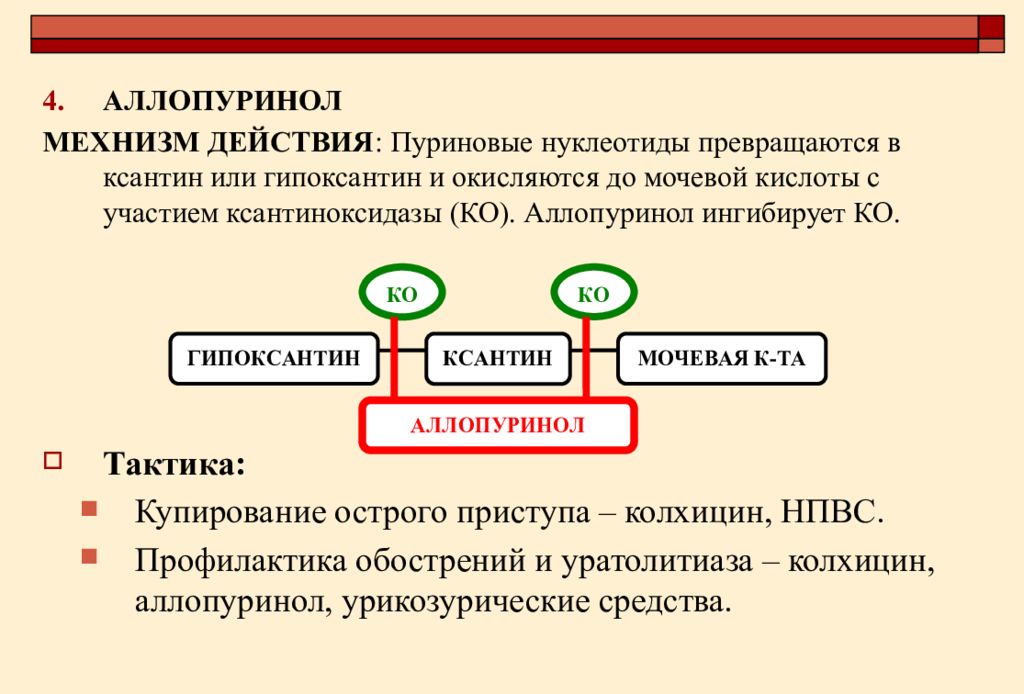
Больные должны были посещать исследовательский центр для первого обследования и в дальнейшем через 2, 4, 6, 8, 10 и 12 мес, а потом через 24 мес после рандомизации и затем каждые 6 мес до конца исследования. Больные со сниженной функцией почек или больные в возрасте 65 лет и старше при рандомизации также посещали исследовательский центр через 9 и 15 мес после рандомизации для оценки биохимических показателей в крови. Если больной был согласен наблюдаться, но не посещал исследовательский центр, с больным связывались по телефону, но такая тактика не считалась предпочтительной или рекомендуемой.
Критерии оценки/Клинические исходы
Основной комбинированный показатель: частота развития такого первого неблагоприятного исхода, как смерть от осложнений ССЗ, несмертельных ИМ, несмертельный инсульт или выполнение реваскуляризации миокарда по поводу нестабильной стенокардии.
Дополнительные показатели: комбинированный показатель смертности от осложнений ССЗ, частоты развития несмертельного ИМ, несмертельного инсульта, а также отдельные компоненты основного показателя.
Основные результаты
В период с апреля 2010 г. по май 2017 г. в исследование были включены 6198 больных. Не приняли ни одной таблетки исследуемого препарата 8 больных, так что в модифицированный анализ, выполненный исходя из допущения, что все больные приняли назначенное лечение, были включены данные о 6190 больных. Не отмечалось существенных различий между группами по исходным характеристикам.
В группе фебуксостата окончательная доза исследуемого препарата составляла 40 и 80 мг у 61 и 39% больных соответственно. В группе аллопуринола в соответствии с определенным протоколом исследования ККр дозу аллопуринола 200, 400, 300, 500 и 600 мг принимали 21,8, 44,6, 25,2, 4,3 и 4,1% больных соответственно.
В целом 56,6% больных стойко прекратили прием исследуемого препарата: в группе фебуксостата и группе аллопуринола 57,3 и 55,9% соответственно. Доля больных, которые не посещали исследовательский центр для очередного запланированного обследования, в целом достигала 45%: в группе фебуксостата и группе аллопуринола 45 и 44,9% соответственно.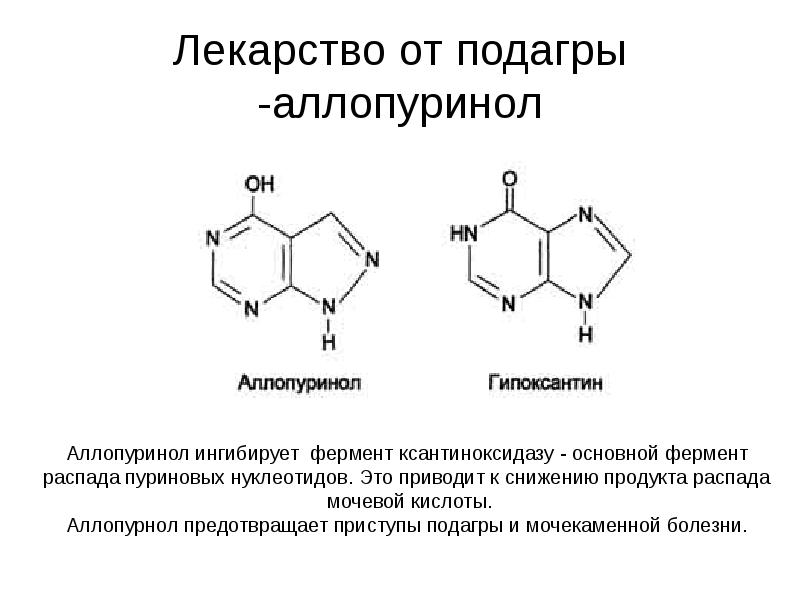 Медиана продолжительности приема фебуксостата и аллопуринола достигала 728 и 719 дней соответственно. Медиана продолжительности наблюдения в группе фебуксостата и группе аллопуринола составляла 968 и 942 дней соответственно.
Медиана продолжительности приема фебуксостата и аллопуринола достигала 728 и 719 дней соответственно. Медиана продолжительности наблюдения в группе фебуксостата и группе аллопуринола составляла 968 и 942 дней соответственно.
Доля больных, у которых через 2 нед после начала терапии концентрация МК в крови составляла менее 360 мкмоль/л, была выше в группе фебуксостата по сравнению с группой аллопуринола; после этого в ходе выполнения исследования у большего числа больных группы фебуксостата по сравнению с группой аллопуринола концентрация МК в крови была менее 360 мкмоль/л по данным большинства анализов, несмотря на то что различия между группами были небольшими. Кроме того, в группе фебуксостата по сравнению с группой аллопуринола в целом в ходе выполнения исследования была выше доля больных с уровнем МК в крови менее 300 мкмоль/л. Частота обострения подагры была сходной в группе фебуксостата и группе аллопуринола, составляя 0,68 и 0,63 случая на 1 человека в год соответственно.
В ходе выполнения исследования между группами не отмечалось статистически значимых различий по концентрации в крови электролитов, глюкозы и липидов, а также уровню артериального давления и частоте применения лекарственных средств для лечения ССЗ.
После развития 624 неблагоприятных клинических исходов, которые стали основанием для окончания исследования, и до закрытия базы данных развились дополнительные неблагоприятные клинические исходы. Результаты полного анализа свидетельствовали о сходной частоте развития неблагоприятных исходов, включенных в основной показатель: такие исходы в группе фебуксостата и группе аллопуринола развились у 10,8 и 10,4% больных соответственно в ходе наблюдения, медиана продолжительности которого достигала 32 мес (отношение риска 1,03 при верхней границе одностороннего 98,5% ДИ 1,23; p=0,002 для анализа, выполненного с целью проверки гипотезы о не менее высокой эффективности фебуксостата по сравнению с аллопуринолом). При анализе дополнительных показателей частоты развития несмертельных неблагоприятных исходов отношения риска были сходными с таковыми в исследовании в целом.
Однако риск смерти от любой причины и риск смерти от осложнений ССЗ были выше в группе фебуксостата по сравнению с группой аллопуринола. В группе фебуксостата и группе аллопуринола умерли от любой причины 7,8 и 6,4% больных соответственно (отношение риска 1,22 при 95% ДИ от 1,01 до 1,47; p=0,04), а от осложнений ССЗ — 4,3 и 3,2% больных соответственно (отношение риска 1,34 при 95% ДИ от 1,03 до 1,73; p=0,03). Среди причин смерти от осложнений ССЗ наиболее частой была внезапная смерть от осложнений заболевания сердца: такая причина смерти в группе фебуксостата и группе аллопуринола отмечалась у 2,7 и 1,8% больных соответственно. Частота госпитализаций по поводу сердечной недостаточности и госпитализаций по поводу аритмий, не связанных с ишемией, а также частота развития тромбоэмболических осложнений и госпитализаций по поводу преходящего нарушения мозгового кровообращения были сходными в двух группах.
Результаты анализа основного показателя в подгруппах свидетельствовали об отсутствии гетерогенности в подгруппах больных с определенными исходными характеристиками. Для смертности от ССЗ отмечено взаимодействие с применением НПВП и отсутствием приема низкой дозы аспирина (нестандартизованное p<0,05 для обоих сравнений).
Для смертности от ССЗ отмечено взаимодействие с применением НПВП и отсутствием приема низкой дозы аспирина (нестандартизованное p<0,05 для обоих сравнений).
По данным запланированного анализа частоты развития неблагоприятных исходов, включенных в основной показатель, которые развились в период приема исследуемого препарата или в течение 30 дней после прекращения терапии, такие исходы в группе фебуксостата и группе аллопуринола развились у 7,8 и 7,7% больных соответственно (отношение риска 1,00 при верхней границе одностороннего 98,5% ДИ 1,22). В ходе выполнения такого анализа было установлено, что смертность от осложнений ССЗ была статистически значимо выше в группе фебуксостата по сравнению с группой аллопуринола (отношение риска 1,49; при 95% ДИ от 1,01 до 2,22; p=0,047).
Результаты вторичного анализа частоты развития неблагоприятных исходов, включенных в основной комбинированный показатель, развившихся в период применения исследуемых препаратов, свидетельствовали о сходной частоте развития таких исходов в группе фебуксостата и группе аллопуринола (такие исходы развились у 6,2 и 6,4% больных соответственно; отношение риска 0,94 при верхней границе одностороннего 98,5% ДИ 1,17). Риск смерти от любой причины и риск смерти от осложнений ССЗ был выше в группе фебуксостата по сравнению с группой аллопуринола.
У больных с подагрой и сопутствующими тяжелыми ССЗ прием фебуксостата по сравнению с аллопуринолом был не менее безопасен по влиянию на риск развития осложнений ССЗ. Общая смертность и смертность от осложнений ССЗ были выше при применении фебуксостата по сравнению с аллопуринолом.
Вопросы и комментарии
1. Каковы основные результаты исследования CARES ?
В ходе выполнения исследования CARES были получены данные о том, что в целом частота развития тяжелых осложнений ССЗ была сходной при применении фебуксостата и аллопуринола у больных с подагрой и сопутствующими ССЗ. Однако смертность от осложнений ССЗ и общая смертность были выше в группе фебуксостата по сравнению с группой аллопуринола.
2. Насколько ранее была изучена безопасность применения ингибиторов ксантиноксидазы?
Несмотря на то что ингибиторы ксантиноксидазы широко используют в клинической практике у больных с подагрой [9], имелись лишь ограниченные данные о безопасности их применения по влиянию на риск развития осложнений ССЗ, которые были получены в ходе выполнения крупных РКИ. В ходе выполнения программы, в которую были включены более 5000 больных, частота развития осложнений ССЗ была выше у больных, принимавших фебуксостат (0,74 на 100 человеко-лет при 95% ДИ от 0,36 до 1,37), по сравнению с больными, которые принимали аллопуринол (0,60 на 100 человеко-лет при 95% ДИ от 0,16 до 1,53) [6, 7, 10]. Напротив, результаты обсервационных исследований позволяли предположить наличие преимуществ приема фебуксостата или аллопуринола по влиянию на риск развития осложнений ССЗ у больных с подагрой и сопутствующими ССЗ [11, 12].
3. Чем отличались характеристики больных, включенных в данное исследование, от характеристик участников ранее выполненных исследований?
Больные, включенные в исследование CARES, имели существенно более высокий риск развития осложнений ССЗ по сравнению с участниками других исследований по оценке безопасности применения различных препаратов для лечения подагры по влиянию на риск развития осложнений ССЗ [13, 14], причем риск развития осложнений ССЗ в ходе выполнения исследования CARES превышал 10%. Показатели безопасности в данном исследовании были заранее определены, а исходы, включенные в такие показатели, подтверждались членами комитета по подтверждению осложнений ССЗ в отсутствие информации о результатах распределения больных в группу определенной тактики; следовательно, полученные в исследовании CARES данные о безопасности могут быть более надежными по сравнению с данными, основанными на стандартных сообщениях о развитии нежелательных явлений.
4. Почему в ходе выполнения исследования CARES увеличивалась смертность больных при применении фебуксостата по сравнению с аллопуринолом?
Действительно, неожиданно для авторов данного исследования смертность при использовании фебуксостата оказалась выше, чем при применении аллопуринола, что было обусловлено увеличением смертности от осложнений ССЗ. Результаты были сходными по данным модифицированного анализа, выполненного исходя из допущения, что все больные приняли назначенное лечение, и запланированного анализа, в который были включены данные о неблагоприятных исходах, развившихся в период приема исследуемых препаратов и в течение 30 дней после прекращения терапии. Механизм такого увеличения риска смерти при использовании фебуксостата по сравнению с плацебо остается неясным. Результаты доклинических исследований фебуксостата свидетельствовали об отсутствии его токсического влияния на функцию сердца или метаболизм и увеличения риска развития аритмий [15—19]. Кроме того, частота развития подтвержденных несмертельных осложнений, включая ИМ, выполнения реваскуляризации миокарда, частота развития аритмий или госпитализаций по поводу сердечной недостаточности были сходными в группе фебуксостата и группе аллопуринола.
5. Насколько однородными были данные о смертности от осложнений ССЗ?
В ходе выполнения соответствующего анализа гетерогенность по влиянию на риск смерти от осложнений ССЗ была установлена только в 2 подгруппах: у больных с сопутствующим применением аспирина или НПВП. Прием таких препаратов может быть связан с более частыми обострениями подагры, что в свою очередь может приводить к увеличению частоты развития осложнений ССЗ [20]. Следует, однако, отметить, что не было выявлено существенных различий между группами как по выраженности снижения концентрации МК в крови, так и частоте обострений подагры. Более того, частоту развития обострений подагры и их выраженность трудно установить точно в ходе выполнения клинических исследований. Наконец, полученные данные могли быть случайными ввиду большого числа выполненных тестов и небольшого числа неблагоприятных исходов в каждой группе.
6. Какие ограничения данного исследования представляются наиболее важными?
Важными ограничениями данного исследования, по мнению его авторов, было большое число участников, которые досрочно прекратили прием исследуемых препаратов, и участников, которые не наблюдались до конца исследования. Досрочное прекращение приема исследуемых препаратов могло приводить к систематическим ошибкам анализа в сторону нулевой гипотезы, что могло затруднять выявление статистически значимых различий между группами по основному показателю, а также дополнительным показателям, включавшим частоту развития несмертельных неблагоприятных клинических исходов. Влияние высокой частоты потери контакта с больными прогнозировать труднее, так как потеря контакта может быть случайной. Следует, однако, отметить, что примерно одинаковое число больных досрочно прекратили участие в исследовании в обеих группах, а исходные характеристики таких участников были сходными с таковыми больных, которые наблюдались до конца исследования.
7. Как можно еще раз кратко сформулировать основные результаты исследования CARES ?
У больных с подагрой и ССЗ применение фебуксостата и аллопуринола в целом приводит к сходной частоте развития осложнений ССЗ. Однако в группе фебуксостата по сравнению с группой аллопуринола отмечалось увеличение общей смертности, которое было обусловлено увеличением смертности от осложнений ССЗ.
Аллопуринол (пероральное введение) Использование по назначению
Использование по назначению
Информация о лекарствах предоставлена: IBM Micromedex
Принимайте это лекарство точно так, как предписано вашим доктором. Не принимайте больше, не принимайте чаще и не принимайте дольше, чем прописал врач. Это может увеличить вероятность побочных эффектов.
Вы можете принимать это лекарство после еды, чтобы избежать расстройства желудка.
Принимайте это лекарство, запивая большим количеством жидкости, чтобы предотвратить образование камней в почках.Посоветуйтесь с врачом, сколько жидкости вам следует пить каждый день. Вам также следует увеличить потребление клетчатки.
Возможно, вам придется уменьшить потребление животного белка, натрия, рафинированного сахара или продуктов, богатых оксалатом и кальцием, особенно если у вас есть камни в почках, которые продолжают возвращаться.
Дозирование
Доза этого лекарства будет разной для разных пациентов. Следуйте указаниям врача или указаниям на этикетке. Следующая информация включает только средние дозы этого лекарства.Если ваша доза отличается, не меняйте ее, если это вам не скажет врач.
Количество лекарства, которое вы принимаете, зависит от его силы. Кроме того, количество доз, которые вы принимаете каждый день, время между приемами и продолжительность приема лекарства зависят от медицинской проблемы, для которой вы принимаете лекарство.
-
Для пероральной лекарственной формы (таблеток):
-
При подагре:
- Взрослые? Сначала от 100 до 300 миллиграммов (мг) в день один раз в день или в несколько приемов.Ваш врач может изменить вашу дозу по мере необходимости. Однако доза обычно составляет не более 800 мг в сутки.
- Дети? Использование и доза должны определяться вашим доктором.
-
При повышенном уровне мочевой кислоты, вызванном лекарствами от рака:
- Взрослые и дети в возрасте 11 лет и старше? 600-800 миллиграммов (мг) в день, в разделенных дозах в течение 2-3 дней.
- Дети от 6 до 10 лет? 300 мг в день, один раз в день в течение 2-3 дней.
- Дети младше 6 лет? 150 мг в день, один раз в день в течение 2-3 дней.
-
При камнях в почках:
- Взрослые? От 200 до 300 миллиграммов (мг) в день, один раз в день или в несколько приемов. Ваш врач может изменить вашу дозу по мере необходимости. Однако доза обычно составляет не более 800 мг в сутки.
- Дети? Использование и доза должны определяться вашим доктором.
-
При подагре:
Пропущенная доза
Если вы пропустите прием этого лекарства, примите его как можно скорее.Однако, если уже почти пришло время для следующей дозы, пропустите пропущенную дозу и вернитесь к своему обычному графику дозирования. Не принимайте двойные дозы.
Хранилище
Храните лекарство в закрытом контейнере при комнатной температуре, вдали от источников тепла, влаги и прямого света. Беречь от замерзания.
Хранить в недоступном для детей месте.
Не храните устаревшие лекарства или лекарства, которые больше не нужны.
Спросите своего лечащего врача, как следует утилизировать любое лекарство, которое вы не используете.
Последнее обновление частей этого документа: 1 февраля 2021 г.
Авторские права © IBM Watson Health, 2021 г. Все права защищены. Информация предназначена только для использования Конечным пользователем и не может быть продана, распространена или иным образом использована в коммерческих целях.
.
Какова рекомендуемая дозировка аллопуринола при лечении хронической подагры?
Тан SCW. Подагра: болезнь королей. Нефрол .2018. 192: 77-81. [Медлайн].
Фенандо А., Видрих Дж. Гут. Rheumatol Rehabil . 2020 17 (4) января: 205-17. [Медлайн]. [Полный текст].
Замора Е.А., Наик Р. Болезнь отложения пирофосфата кальция. Дж Клин Инвест . 2020 январь 116 (8): 2073-5. [Медлайн]. [Полный текст].
Дускин-Битан Х., Коэн Э., Голдберг Э., Шохат Т., Леви А., Гарти М. и др. Степень бессимптомной гиперурикемии и риск подагры.Ретроспективный анализ большой когорты. Клин Ревматол . 2014 Апрель 33 (4): 549-53. [Медлайн].
Эдвардс NL. Подагра безуспешного лечения: движущаяся цель. Революционный артрит . 2008 Сентябрь 58 (9): 2587-90. [Медлайн].
Bluestone R, Waisman J, Klinenberg JR. Подагрическая почка. Семенной ревматоидный артрит . 1977 г., 7 (2): 97-113. [Медлайн].
Towiwat P, Chhana A, Dalbeth N. Анатомическая патология подагры: систематический обзор литературы. BMC Диссонанс опорно-двигательного аппарата . 2019 1 апреля. 20 (1): 140. [Медлайн]. [Полный текст].
Бен Салем К., Слим Р., Фаталлах Н., Хмуда Х. Лекарственная гиперурикемия и подагра. Ревматология (Оксфорд) . 2016 7 августа [Medline].
Reginato AM, Mount DB, Yang I, Choi HK. Генетика гиперурикемии и подагры. Нат Ревматол . 2012 Октябрь 8 (10): 610-21. [Медлайн]. [Полный текст].
Кришнан Э., Лессов-Шлаггар С.Н., Краснов Р.Е., Лебедь Г.Е.Природа против воспитания при подагре: двойное исследование. Ам Дж. Мед. . 2012 май. 125 (5): 499-504. [Медлайн].
Лю-Брайан Р., Скотт П., Сидласке А. и др. Врожденный иммунитет, обеспечиваемый Toll-подобными рецепторами 2 и 4 и экспрессией миелоидного фактора дифференцировки 88, имеет решающее значение для воспаления, индуцированного кристаллами моногидрата моногидрата урата натрия. Революционный артрит . 2005 сентябрь 52 (9): 2936-46. [Медлайн].
Nagase M, Baker DG, Schumacher HR Jr.Покрытие иммуноглобулином G на кристаллах и керамике усиливает выработку супероксида полиморфно-ядерными клетками: корреляция с адсорбированным иммуноглобулином G. Дж. Ревматол. . 1989 июл.16 (7): 971-6. [Медлайн].
Ортис-Браво Э., Зик М.С., Шумахер Х.Р. мл. Изменения белков, покрывающих кристаллы мононатриевой соли урата во время активного и стихающего воспаления. Иммунозолотные исследования синовиальной жидкости у пациентов с подагрой и жидкости, полученной с использованием модели подкожного воздушного мешка у крыс. Революционный артрит . 1993 сентября, 36 (9): 1274-85. [Медлайн].
Wu M, Tian Y, Wang Q, Guo C. Подагра: заболевание, связанное со сложными иммуновоспалительными реакциями: повествовательный обзор. Клин Ревматол . 2020 Октябрь 39 (10): 2849-2859. [Медлайн].
Мартинон Ф. Механизмы ауто-воспалительного процесса, опосредованного кристаллами мочевой кислоты. Иммунол Ред. . 2010 Январь 233 (1): 218-32. [Медлайн].
Чатфилд С.М., Греб К., Уайтхед Л.В., Роджерс К.Л., Небл Т., Мерфи Дж.М. и др.Кристаллы мононатриевого урата образуют устойчивые к нуклеазам внеклеточные ловушки нейтрофилов посредством определенного молекулярного пути. Дж Иммунол . 1 марта 2018 г. 200 (5): 1802-1816. [Медлайн].
Теркельтауб РА. Что останавливает подагрический приступ ?. Дж. Ревматол. . 1992 19 января (1): 8-10. [Медлайн].
Ягник Д.Р., Эванс Б.Дж., Флори О. и др. Высвобождение макрофагами трансформирующего фактора роста бета1 во время разрешения воспаления, вызванного кристаллами моногидрата урата натрия. Революционный артрит . 2004 июл.50 (7): 2273-80. [Медлайн].
Lioté F, Ea HK. Последние разработки в патогенезе и лечении индуцированного кристаллами воспаления. Curr Rheumatol Rep . 2007 июн.9 (3): 243-50. [Медлайн].
Dalbeth N, Merriman TR, Stamp LK. Подагра. Ланцет . 2016 22 октября. 388 (10055): 2039-2052. [Медлайн].
Мерола Дж. Ф., Ву С., Хан Дж., Чой Г. К., Куреши А. А.. Псориаз, псориатический артрит и риск подагры у мужчин и женщин в США. Энн Рум Дис . 2014 20 марта. [Medline].
Choi HK, Atkinson K, Karlson EW, et al. Потребление алкоголя и риск возникновения подагры у мужчин: проспективное исследование. Ланцет . 2004 г. 17 апреля. 363 (9417): 1277-81. [Медлайн].
Choi HK, Curhan G. Подагра: эпидемиология и выбор образа жизни. Curr Opin Rheumatol . 2005 г., май. 17 (3): 341-5. [Медлайн].
Сингх Дж. А., Редди С. Г., Кундукулам Дж. Факторы риска подагры и профилактика: систематический обзор литературы. Curr Opin Rheumatol . 2011 марта 23 (2): 192-202. [Медлайн].
McAdams-Demarco MA, Maynard JW, Coresh J, Baer AN. Анемия и начало подагры в популяционной когорте взрослых: исследование риска атеросклероза в сообществах. Артикул: Артрит Ресурс . 2012 20 августа. 14 (4): R193. [Медлайн]. [Полный текст].
Choi HK, Willett W, Curhan G. Напитки, богатые фруктозой, и риск подагры у женщин. ЯМА . 2010 24 ноя.304 (20): 2270-8. [Медлайн].
Choi HK, Curhan G. Безалкогольные напитки, потребление фруктозы и риск подагры у мужчин: проспективное когортное исследование. BMJ . 2008, 9 февраля. 336 (7639): 309-12. [Медлайн]. [Полный текст].
Ян Кью, Гуо Си, Купплс, Лос-Анджелес, Леви Д., Уилсон П.У., Фокс К.С. Полногеномный поиск генов, влияющих на уровень мочевой кислоты в сыворотке: исследование сердца Фрамингема. Метаболизм . 2005 г., 54 (11): 1435-41. [Медлайн].
Дехган А., Кёттген А., Ян К., Хван С.Дж., Као В.Л., Риваденейра Ф. и др.Ассоциация трех генетических локусов с концентрацией мочевой кислоты и риском подагры: исследование ассоциации на уровне всего генома. Ланцет . 2008 декабрь 6. 372 (9654): 1953-61. [Медлайн]. [Полный текст].
Уоллес С., Ньюхаус С.Дж., Браунд П., Чжан Ф., Тобин М., Фалчи М. и др. Полногеномное ассоциативное исследование определяет гены биомаркеров сердечно-сосудистых заболеваний: сывороточные ураты и дислипидемию. Ам Джам Генет . 2008, январь 82 (1): 139-49. [Медлайн]. [Полный текст].
Кольц М., Джонсон Т., Санна С., Тоймер А., Витарт В., Перола М. и др.Мета-анализ 28 141 человека выявил общие варианты в пяти новых локусах, которые влияют на концентрацию мочевой кислоты. ПЛоС Генет . 5 (6) июня 2009 г .: e1000504. [Медлайн]. [Полный текст].
Merriman TR. Популяционная гетерогенность в генетическом контроле уратов сыворотки. Семин Нефрол . 2011 Сентябрь 31 (5): 420-5. [Медлайн].
Vitart V, Rudan I, Hayward C, Gray NK, Floyd J, Palmer CN, et al. SLC2A9 — это недавно идентифицированный переносчик уратов, влияющий на концентрацию уратов в сыворотке, экскрецию уратов и подагру. Нат Генет . 2008 апр. 40 (4): 437-42. [Медлайн].
Campion EW, Glynn RJ, DeLabry LO. Бессимптомная гиперурикемия. Риски и последствия в нормативном исследовании старения. Ам Дж. Мед. . 1987 Март 82 (3): 421-6. [Медлайн].
Холл AP, Barry PE, Dawber TR, McNamara PM. Эпидемиология подагры и гиперурикемии. Долгосрочное популяционное исследование. Ам Дж. Мед. . 1967, январь, 42 (1): 27-37. [Медлайн].
Rho YH, Zhu Y, Zhang Y, Reginato AM, Choi HK.Факторы риска псевдоподагры в общей популяции. Ревматология (Оксфорд) . 2012 ноябрь 51 (11): 2070-4. [Медлайн]. [Полный текст].
Lin HY, Rocher LL, McQuillan MA, Schmaltz S, Palella TD, Fox IH. Гиперурикемия и подагра, вызванные циклоспорином. N Engl J Med . 3 августа 1989 г. 321 (5): 287-92. [Медлайн].
Corominas H, Badlissi F, Shmerling RH. Кристаллический олигоартрит, вызванный пембролизумабом, ингибитором иммунных контрольных точек. Костный сустав позвоночника . 2018 Октябрь 85 (5): 647-648. [Медлайн].
Lai SW, Kuo YH, Liao KF. Риск обострения подагры после вакцинации. Энн Рум Дис . 17 августа 2019 г. [Medline].
Yokose C, McCormick N, Chen C, Neogi T, Chaisson C, Terkeltaub R и др. Риск обострения подагры после вакцинации: проспективное перекрестное исследование. Энн Рум Дис . 2019 ноябрь 78 (11): 1601-1604. [Медлайн].
Хуанг Ю.Дж., Куо К.Ф.Могут ли лекарственные препараты вызывать острые приступы ХПНБ? Костный сустав позвоночника . 2019 Март 86 (2): 131-134. [Медлайн].
Ватанабе Х., Ямада С., Анаяма С., Сато Е., Маэкава С., Сугияма Х и др. Приступ псевдоподагры, вызванный во время терапии этидронатом динатрием. Мод Ревматол . 2006. 16 (2): 117-9. [Медлайн].
Taggarshe D, Ng CH, Molokwu C, Singh S. Острая псевдоподагра после контрастной ангиографии. Клин Ревматол . 2006 фев.25 (1): 115-6. [Медлайн].
Ciancio G, Bortoluzzi A, Govoni M. Эпидемиология подагры и хондрокальциноза. Реуматизм . 2012 19 января. 63 (4): 207-20. [Медлайн].
Сингх Г., Лингала Б., Митал А. Подагра и гиперурикемия в США: распространенность и тенденции. Ревматология (Оксфорд) . 2019 декабрь 1. 58 (12): 2177-2180. [Медлайн]. [Полный текст].
Ким К.Ю., Ральф Шумахер Н, Хунше Э., Вертхаймер А.И., Kong SX.Обзор литературы по эпидемиологии и лечению острой подагры. Clin Ther . 2003 июн.25 (6): 1593-617. [Медлайн].
Теркельтауб РА. Подагра: последние достижения и новые методы лечения. Обновление клиники ревматических заболеваний . 2008; 3 (1): 1-9 .:
Гарг Р., Сэйлс Х.Р., Ю Ф., Мишо К., Сингх Дж., Сааг К.Г. и др. Обращение к службам здравоохранения при подагре в отделениях неотложной помощи США, 2006–2008 гг. Arthritis Care Res (Hoboken) .2013 Апрель 65 (4): 571-7. [Медлайн].
Сингх Дж. А., Гаффо А. Эпидемиология и сопутствующие заболевания подагры. Семенной ревматоидный артрит . 2020 июн. 50 (3S): S11-S16. [Медлайн]. [Полный текст].
Тан YM, Zhang L, Zhu SZ, Pan JJ, Zhou SH, He TJ, et al. Подагра в Китае, 1990–2017 гг .: Исследование глобального бремени болезней, 2017 г. Общественное здравоохранение . 2021, 19 января. 191: 33-38. [Медлайн].
Cea Soriano L, Rothenbacher D, Choi HK, García Rodríguez LA.Современная эпидемиология подагры среди населения Великобритании в целом. Артикул: Артрит Ресурс . 2011 3 марта. 13 (2): R39. [Медлайн]. [Полный текст].
Trifirò G, Morabito P, Cavagna L, Ferrajolo C, Pecchioli S, Simonetti M, et al. Эпидемиология подагры и гиперурикемии в Италии в 2005-2009 гг .: общенациональное популяционное исследование. Энн Рум Дис . 2013 май. 72 (5): 694-700. [Медлайн].
Рид Д., Лабарт Д., Сталлонес Р.Эпидемиологические исследования уровней мочевой кислоты в сыворотке крови среди микронезийцев. Революционный артрит . 1972 июль-авг. 15 (4): 381-90. [Медлайн].
Роза BS. Подагра у маори. Семенной ревматоидный артрит . 1975 г., 5 (2): 121-45. [Медлайн].
Чой Х.К., Де Вера М.А., Кришнан Э. Подагра и риск диабета 2 типа среди мужчин с высоким профилем сердечно-сосудистого риска. Ревматология (Оксфорд) . 2008 окт. 47 (10): 1567-70. [Медлайн].
Olaniyi-Leyimu BY. Учитывайте подагру у пациентов с факторами риска, независимо от возраста. Ам Фам Врач . 15 июля 2008 г. 78 (2): 176. [Медлайн].
Fravel MA, Ernst ME. Лечение подагры у пожилых людей. Ам Дж. Гериатр Фармакотер . 2011 Октябрь 9 (5): 271-85. [Медлайн].
Singh H, Torralba KD. Терапевтические проблемы в лечении подагры у пожилых людей. Гериатрия .Июль 2008 г., 63 (7): 13-8, 20. [Medline].
Simmonds HA, McBride MB, Hatfield PJ, Graham R, McCaskey J, Jackson M. Полинезийские женщины также подвержены риску гиперурикемии и подагры из-за генетического дефекта в работе с уратами в почках. Br J Ревматол . 1994 Октябрь 33 (10): 932-7. [Медлайн].
Хохберг М.С., Томас Дж., Томас Ди-джей, Мид Л., Левин Д.М., Клаг М.Дж. Расовые различия в заболеваемости подагрой. Роль гипертонии. Революционный артрит .1995 Май. 38 (5): 628-32. [Медлайн].
Моди GM, Найду ПД. Подагра у южноафриканских чернокожих. Энн Рум Дис . 1984 июн. 43 (3): 394-7. [Медлайн]. [Полный текст].
Шумахер Х.Р., Тейлор В., Джозеф-Ридж Н., Перес-Руис Ф., Чен Л.Х., Шлезингер Н. и др. Оценка исходов при подагре. Дж. Ревматол. . 2007 июн. 34 (6): 1381-5. [Медлайн].
Becker MA, MacDonald PA, Hunt BJ, Lademacher C, Joseph-Ridge N.Детерминанты клинических исходов подагры в течение первого года уратоснижающей терапии. Нуклеозиды Нуклеотиды Нуклеиновые кислоты . 27 июня 2008 г. (6): 585-91. [Медлайн].
Yü T, Talbott JH. Изменение тенденций смертности при подагре. Семенной ревматоидный артрит . 1980 10 августа (1): 1-9. [Медлайн].
Хуберт Дж., Вайзер Л., Хишке С., Улиг А., Рольвиен Т., Шмидт Т. и др. Кальцификация хряща голеностопного сустава у населения в целом связана с остеоартритом. BMC Диссонанс опорно-двигательного аппарата . 2018 24 мая. 19 (1): 169. [Медлайн]. [Полный текст].
Forman JP, Choi H, Curhan GC. Чувствительность к мочевой кислоте и инсулину и риск возникновения гипертонии. Arch Intern Med . 2009 26 января. 169 (2): 155-62. [Медлайн]. [Полный текст].
Ким С.Ю., Де Вера Массачусетс, Чой, Гонконг. Подагра и смертность. Clin Exp Rheumatol . 2008 сентябрь-октябрь. 26 (5 доп. 51): S115-9. [Медлайн].
Lottmann K, Chen X, Schädlich PK.Связь между подагрой и смертностью от всех причин, а также от сердечно-сосудистых заболеваний: систематический обзор. Curr Rheumatol Rep . 2012 г., 14 (2): 195-203. [Медлайн]. [Полный текст].
Фейг Д.И., Джонсон Р.Дж. Роль мочевой кислоты при гипертонической болезни у детей. Дж Рен Нутр . Янв / 2007. 17 (1): 79-83. [Медлайн].
Кришнан Э., Свендсен К., Нитон Дж. Д. и др. Долгосрочная сердечно-сосудистая смертность среди мужчин среднего возраста с подагрой. Arch Intern Med .2008 26 мая. 168 (10): 1104-10. [Медлайн].
Kuo CF, см. LC, Luo SF, Ko YS, Lin YS, Hwang JS, et al. Подагра: независимый фактор риска общей и сердечно-сосудистой смертности. Ревматология (Оксфорд) . 2010 января 49 (1): 141-6. [Медлайн].
Янечко Л. Подагра связана с повышенным риском сердечного приступа и инсульта. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/813367. Доступ: 4 ноября 2013 г.
Семиног О.О., Голдакр М.Дж.Подагра как фактор риска инфаркта миокарда и инсульта в Англии: данные исследований связи записей. Ревматология (Оксфорд) . 2013 17 сентября [Medline].
Barclay L. Подагра связана с повышенным риском сосудистых заболеваний. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/830663?nlid=64464_2224&src=wnl_edit_medp_rheu&spon=27. Доступ: 8 сентября 2014 г.
Clarson LE, Hider SL, Belcher J, Heneghan C, Roddy E, Mallen CD.Повышенный риск сосудистых заболеваний, связанных с подагрой: ретроспективное согласованное когортное исследование в UK Clinical Practice Research Datalink. Энн Рум Дис . 2014 27 августа. [Medline].
Chen JH, Lan JL, Cheng CF, Liang WM, Lin HY, Tsay GJ и др. Влияние уратоснижающей терапии на риск сердечно-сосудистых заболеваний и смертность от всех причин у пациентов с подагрой: когортное исследование с учетом конкретных случаев. Дж. Ревматол. . 2015 Сентябрь 42 (9): 1694-701. [Медлайн].
Соломон Д.Х., Лю С.К., Куо И.Х., Зак А., Ким СК. Влияние колхицина на риск сердечно-сосудистых событий и смертность среди пациентов с подагрой: когортное исследование с использованием электронных медицинских карт, связанных с заявлениями Medicare. Энн Рум Дис . 2016 Сентябрь 75 (9): 1674-9. [Медлайн]. [Полный текст].
Краснорядцева А., Дерксен С., Дальбет Н., Петри К.Дж. Не каждая картинка рассказывает историю: контент-анализ визуальных образов в образовательных ресурсах для пациентов о подагре. Дж. Ревматол. . 2020 г. 1. 47 (12): 1815-1821. [Медлайн].
Лин Ш, Се Эт, Ву Тай, Чанг Ч. Цервикальная миелопатия, вызванная псевдоподагрой в желтой связке и ретро-одонтоидным новообразованием: отчет о болезни. Спинной мозг . 2006 ноябрь 44 (11): 692-4. [Медлайн].
Puig JG, Michan AD, Jimenez ML, et al. Женская подагра. Клинический спектр и метаболизм мочевой кислоты. Arch Intern Med . 1991 апр. 151 (4): 726-32. [Медлайн].
Мейерс О.Л., Монтеагудо Ф.С. Подагра у женщин: анализ 92 больных. Clin Exp Rheumatol . 1985 апрель-июнь. 3 (2): 105-9. [Медлайн].
Macfarlane DG, Дьеп, Пенсильвания. Подагра, вызванная диуретиками, у пожилых женщин. Br J Ревматол . 1985 Май. 24 (2): 155-7. [Медлайн].
Kramer HM, Curhan G. Связь между подагрой и нефролитиазом: Национальное исследование здоровья и питания III, 1988–1994 гг. Ам Дж. Почки Дис . 2002 Июль 40 (1): 37-42. [Медлайн].
Марчини Г.С., Саркисян С., Тиан Д., Гебреселассие С., Монга М. Подагра, состав камней и риск образования мочевых камней: сравнительное исследование с подобранными случаями. Дж Урол . 2013 Апрель 189 (4): 1334-9. [Медлайн].
Танигучи Ю., Йошида М., Тамаки Т. Синдром заднего межкостного нерва из-за псевдоподагры. J Hand Surg Br . 1999 24 февраля (1): 125-7. [Медлайн].
Dalbeth N, Schauer C, Macdonald P, Perez-Ruiz F, Schumacher HR, Hamburger S, et al.Методы оценки тофуса в клинических испытаниях хронической подагры: систематический обзор литературы и графическое справочное руководство. Энн Рум Дис . 2011 апр. 70 (4): 597-604. [Медлайн].
Stocker SL, Graham GG, McLachlan AJ, Williams KM, Day RO. Фармакокинетическое и фармакодинамическое взаимодействие между аллопуринолом и пробенецидом у пациентов с подагрой. Дж. Ревматол. . 2011 Май. 38 (5): 904-10. [Медлайн].
Chehab MR, Goyal J, Schlesinger N.Трубоподобная пустулеподобная сыпь у пациента с подагрой. Дж. Ревматол. . 2012 Январь 39 (1): 194-5. [Медлайн].
Коассин М., Пиованетти О., Старк В.Дж., Грин В.Р. Отложение уратов в радужной оболочке и передней камере. Офтальмология . 2006 Март 113 (3): 462-5. [Медлайн].
Слански Х.Х., Кубара Т. Внутриядерные кристаллы уратов в эпителии роговицы. Арка офтальмол . 1968 Сентябрь 80 (3): 338-44. [Медлайн].
Bernad B, Narvaez J, Diaz-Torné C, Diez-Garcia M, Valverde J.Клинический снимок: отложение тофуса на роговице при подагре. Революционный артрит . 2006 г., 54 (3): 1025. [Медлайн].
MCWILLIAMS JR. Окулярные признаки при подагре; сообщение о случае конъюнктивальных тофусов. Ам Дж. Офтальмол . 1952 Декабрь 35 (12): 1778-83. [Медлайн].
Моррис В. Р., Флеминг Дж. К. Подагрический тофус на латеральном уголке глаза. Арка офтальмол . 2003 август 121 (8): 1195-7. [Медлайн].
Fishman RS, Сандерман FW.Ленточная кератопатия при подагре. Арка офтальмол . 1966 Март 75 (3): 367-9. [Медлайн].
Julkunen H, Heinonen OP, Pyörälä K. Гиперостоз позвоночника у взрослого населения. Его связь с гипергликемией и ожирением. Энн Рум Дис . 1971, 30 ноября (6): 605-12. [Медлайн]. [Полный текст].
КОСКОФ ЯД, МОРРИС ЛЕ, LUBIC LG. Параплегия как осложнение подагры. Дж. Ам Мед Ассо . 1953 г. 2 мая. 152 (1): 37-8. [Медлайн].
Nguyen C, Ea HK, Palazzo E, Lioté F. Тофацеозная подагра: необычная причина множественных переломов. Сканд Дж. Ревматол . 2010. 39 (1): 93-6. [Медлайн].
Анно М., Осима Ю., Танигучи Ю., Мацубаяси Ю., Като С., Сома К. и др. Распространенность и естественное течение поперечной связки кальцификации атласа у бессимптомных здоровых людей. Позвоночник (Фила Па, 1976) . 2018 15 декабря. 43 (24): E1469-E1473. [Медлайн].
Волд А, Петскэвэдж-Томас Дж., Уокер Э.А..Частота несращения переломов зубовидного отростка типа II и III у пациентов с ХПНПЛ по сравнению с контрольной популяцией. Скелетная радиология . 2018 Ноябрь 47 (11): 1499-1504. [Медлайн].
Janssens HJ, Fransen J, van de Lisdonk EH, van Riel PL, van Weel C, Janssen M. Диагностическое правило острого подагрического артрита в первичной медико-санитарной помощи без анализа суставной жидкости. Arch Intern Med . 12 июля 2010 г. 170 (13): 1120-6. [Медлайн].
Мейер М.М., Маркс Л.А., Аслам Ф.Клинические последствия обработки образцов синовиальной жидкости для связанных с кристаллами артритов: систематический обзор. Int J Rheum Dis . 2021 24 января (1): 10-20. [Медлайн].
Бартелеми CR, Накаяма Д.А., Каррера Г.Ф., Лайтфут Р.В. Младший, Вортманн Р.Л. Подагрический артрит: проспективная рентгенологическая оценка шестидесяти пациентов. Скелетная радиология . 1984. 11 (1): 1-8. [Медлайн].
Далбет Н., Кларк Б., Грегори К., Гэмбл Г., Шихан Т., Дойл А. и др.Механизмы эрозии костей при подагре: количественный анализ с использованием рентгенографии и компьютерной томографии. Энн Рум Дис . 2009 август 68 (8): 1290-5. [Медлайн].
Фодор Д., Альбу А., Герман С. Синовит, связанный с кристаллами — ультразвуковая характеристика и клиническая корреляция. Ortop Traumatol Rehabil . 2008 март-апрель. 10 (2): 99-110. [Медлайн].
де Авила Фернандес E, Кубота ES, Сандим Великобритания, Mitraud SA, Ferrari AJ, Fernandes AR.Ультразвуковые особенности тофусов при хронической кровяной подагре. Скелетная радиология . 2011 Март 40 (3): 309-15. [Медлайн].
Fernandes EA, Lopes MG, Mitraud SA, Ferrari AJ, Fernandes AR. Ультразвуковая характеристика подагрических тофусов в сумке локтевого отростка и оценка их воспроизводимости. евро J Радиол . 2011 г. 13 января [Medline].
Кристиансен С.Н., Остергаард М., Слот О, Фана В., Терслев Л. Ультразвук для диагностики подагры — значение поражений подагры, как определено группой ультразвуковых исследований в ревматологии. Ревматология (Оксфорд) . 2021 5 января. 60 (1): 239-249. [Медлайн].
Loffler C, Sattler H, Peters L, Loffler U, Uppenkamp M, Bergner R. Отличие подагрического артрита от болезни пирофосфата кальция и других артритов. Дж. Ревматол. . 2015 Март 42 (3): 513-20. [Медлайн].
Наредо Е., Усон Дж., Хименес-Палоп М., Мартинес А., Висенте Е., Брито Е. и др. Отложение кристаллов уратов в костно-мышечной системе, обнаруженное ультразвуком: какие суставы и какие результаты следует оценивать для диагностики подагры? Энн Рум Дис . 2014 августа 73 (8): 1522-8. [Медлайн].
Пинеда С., Амезкуа-Герра Л.М., Солано С., Родригес-Энрикес П., Эрнандес-Диас С., Варгас А. и др. Субклиническое поражение суставов и сухожилий, указывающее на подагрический артрит при бессимптомной гиперурикемии: контролируемое ультразвуком исследование. Артикул: Артрит Ресурс . 2011 17 января. 13 (1): R4. [Медлайн]. [Полный текст].
Ottaviani S, Juge PA, Aubrun A, Palazzo E, Dieudé P. Чувствительность и воспроизводимость ультразвукового исследования отложения кристаллов пирофосфата кальция в хряще коленного сустава: исследование поперечного сечения. Дж. Ревматол. . 2015 42 августа (8): 1511-3. [Медлайн].
Forien M, Combier A, Gardette A, Palazzo E, Dieudé P, Ottaviani S. Сравнение ультразвукового исследования и рентгенографии запястья для диагностики отложения пирофосфата кальция. Костный сустав позвоночника . 2018 Октябрь 85 (5): 615-618. [Медлайн].
De Miguel E, Puig JG, Castillo C, Peiteado D, Torres RJ, Martín-Mola E. Диагностика подагры у пациентов с бессимптомной гиперурикемией: пилотное ультразвуковое исследование. Энн Рум Дис . 2012 января 71 (1): 157-8. [Медлайн].
Ventura-Ríos L, Sánchez-Bringas G, Pineda C, Hernández-Díaz C, Reginato A, Alva M и др. Поражение сухожилий у пациентов с подагрой: ультразвуковое исследование распространенности. Клин Ревматол . 2016 авг. 35 (8): 2039-44. [Медлайн].
Далбет Н., Кларк Б., Грегори К., Гэмбл Г., Шихан Т., Дойл А. и др. Механизмы эрозии костей при подагре: количественный анализ с использованием рентгенографии и компьютерной томографии. Энн Рум Дис . 2009 август 68 (8): 1290-5. [Медлайн].
Аль-Арфадж А.М., Николау С., Эфтехари А., Мунк П., Шоджани К., Рид Г. и др. Применение двухэнергетической компьютерной томографии (DECT) при кровянистой подагре. Энн Рум Дис . 2008; 58: S878.
Ward IM, Scott JN, Mansfield LT, Battafarano DF. Двухэнергетическая компьютерная томография, демонстрирующая деструктивное отложение пирофосфата кальция в дистальном лучевом суставе, имитирующее подагру. Дж. Клин Ревматол . 2015 Сентябрь 21 (6): 314-7. [Медлайн].
Shimizu T, Hori H. Распространенность нефролитиаза у пациентов с первичной подагрой: поперечное исследование с использованием спиральной компьютерной томографии. Дж. Ревматол. . 2009 Сентябрь, 36 (9): 1958-62. [Медлайн].
Stamp LK, Anderson NG, Becce F, Rajeswari M, Polson M, Guyen O, et al. Клиническая применимость компьютерной томографии с многоэнергетическим спектральным подсчетом фотонов при кристаллическом артрите. Ревматический артрит . 2019 июл.71 (7): 1158-1162. [Медлайн].
Poh YJ, Dalbeth N, Doyle A, McQueen FM. Магнитно-резонансная томография. Отек костей не является серьезным признаком подагры, если только нет сопутствующего остеомиелита: данные за 10 лет, полученные из высокоразвитой популяции. Дж. Ревматол. . 2011 ноябрь 38 (11): 2475-81. [Медлайн].
Маккуин FM, Дойл А., Ривз К., Гао А., Цай А., Гэмбл Г.Д. Эрозии костей у пациентов с хронической подагрической артропатией связаны с тофусами, но не с отеком костей или синовитом: новые выводы из исследования 3 Т МРТ. Ревматология (Оксфорд) . 2014 Январь 53 (1): 95-103. [Медлайн].
Oostveen JC, van de Laar MA. Магнитно-резонансная томография при ревматических заболеваниях позвоночника и крестцово-подвздошных суставов. Семенной ревматоидный артрит . 2000 30 августа (1): 52-69. [Медлайн].
Абреу М., Джонсон К., Чунг С.Б., Де Лима Дж. Э. младший, Трюделл Д., Теркельтауб Р. и др. Кальцификация кристаллических отложений дигидрата пирофосфата кальция (CPPD) в колене: анатомические, рентгенографические, МРТ и гистологические исследования на трупах. Скелетная радиология . 2004 июл. 33 (7): 392-8. [Медлайн].
Далбет Н., Рид С., Стэмп Л.К., Арролл Б. Сделать правильный поступок проще простого: стратегии для улучшения результатов при подагре. Ланцет для ревматологии . 01 октября 2019. 1: 2: PE122-E131. [Полный текст].
[Рекомендации] Ханна Д., Фицджеральд Дж. Д., Кханна П. П., Бэ С., Сингх М. К., Неоги Т. и др. Рекомендации Американского колледжа ревматологии по лечению подагры, 2012 г. Часть 1: Систематические нефармакологические и фармакологические терапевтические подходы к гиперурикемии. Центр лечения артрита (Хобокен) . 2012 Октябрь 64 (10): 1431-46. [Медлайн]. [Полный текст].
[Рекомендации] Кханна Д., Кханна П.П., Фицджеральд Д.Д., Сингх М.К., Бэ С., Неоги Т. и др. Рекомендации Американского колледжа ревматологии по лечению подагры, 2012 г. Часть 2: Терапия и противовоспалительная профилактика острого подагрического артрита. Центр лечения артрита (Хобокен) . 2012 Октябрь 64 (10): 1447-61. [Медлайн]. [Полный текст].
[Рекомендации] Фитцджеральд Дж. Д., Далбет Н., Микулс Т. и др.Руководство Американского колледжа ревматологии по лечению подагры, 2020 г. Центр лечения артрита (Хобокен) . 2020 июн.72 (6): 744-760. [Медлайн]. [Полный текст].
Уилсон М.Э., Ван С.Х., Бейдер А., Осборн Т.Г., Бекман Т.Дж.. Острая полиартикулярная подагра, проявляющаяся делирием. Дж. Клин Ревматол . 2013 июн.19 (4): 221-2. [Медлайн].
Кильтц Ю., Смолен Дж., Бардин Т., Коэн Солал А., Далбет Н., Доэрти М. и др. Рекомендации по лечению до достижения цели (T2T) при подагре. Энн Рум Дис . 2016 22 сентября. [Medline].
Келли Дж. Подагра: выпущено руководство по целевому лечению. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/869613. 3 октября 2016 г .; Доступ: 6 октября 2016 г.
Далбет Н., Чой Х. К., Теркельтауб Р. Обзор: Подагра: дорожная карта подходов к улучшению глобальных результатов. Ревматический артрит . 2017 Январь 69 (1): 22-34. [Медлайн].
Гудман А.Снижение уратов помогает избавиться от осложнений при подагре. Medscape [сериал онлайн]. Доступно на https://www.medscape.com/viewarticle/814057. Доступ: 18 ноября 2013 г.
Рашид Н., Леви Г.Д., Ву Ю.Л., Чжэн С., Коблик Р., Читам ТК. Пациенты и клинические характеристики, связанные с приступами подагры, в интегрированной системе здравоохранения. Ревматол Инт . 2015, ноябрь 35 (11): 1799-807. [Медлайн]. [Полный текст].
Savient Pharmaceuticals, Inc. Информация о назначении Krystexxa.Доступно по адресу https://www.krystexxa.com/hcp/default.aspx.
Келли Дж. Риск подагры высок у людей с псориазом, псориатическим артритом. Медицинские новости Medscape . 28 марта 2014 г. [Полный текст].
Родди Е., Кларксон К., Благоевич-Бакнелл М., Мехта Р., Оппонг Р., Эйвери А. и др. Открытое рандомизированное прагматическое исследование (CONTACT), сравнивающее напроксен и низкие дозы колхицина для лечения обострений подагры в учреждениях первичной медико-санитарной помощи. Энн Рум Дис .2020 Февраль 79 (2): 276-284. [Медлайн]. [Полный текст].
Ребер П., Кревуазье Х, Нусбергер Б. Необычная локализация тошнотворной подагры. Отчет о четырех случаях и обзор литературы. Хирургическая установка для лечения травм ортопедической дуги . 1996. 115 (5): 297-9. [Медлайн].
Шапира Д., Шталь С, Ижак ОБ, Балбир-Гурман А, Нахир AM. Хронический тофагеозный подагрический артрит, имитирующий ревматоидный артрит. Семенной ревматоидный артрит . 1999 августа 29 (1): 56-63.[Медлайн].
Shogan CP, Folio CL. Осведомленность о подагре и ревматоидном артрите. Дж. Ам Остеопат Асс . 2008 июль 108 (7): 352; ответ автора 352-3. [Медлайн].
Zhang Y, Neogi T, Chen C, Chaisson C, Hunter DJ, Choi H. Использование низких доз аспирина и повторяющиеся приступы подагры. Энн Рум Дис . 2014 1 февраля. 73 (2): 385-90. [Медлайн].
Шумахер Х.Р., Бергер М.Ф., Ли-Ю Дж., Перес-Руис Ф., Бургос-Варгас Р., Ли К.Эффективность и переносимость целекоксиба при лечении острого подагрического артрита: рандомизированное контролируемое исследование. Дж. Ревматол. . 2012 Сентябрь 39 (9): 1859-66. [Медлайн].
Группа фармаконадзора Medsafe. Колхицин: меньшие дозы для большей безопасности. Доступно на https://www.medsafe.govt.nz/profs/puarticles/colchdose.htm. Доступ: 3 октября 2008 г.
Нуки Г. Колхицин: его механизм действия и эффективность при воспалении, вызванном кристаллами. Curr Rheumatol Rep . 2008 июл.10 (3): 218-27. [Медлайн].
Чжан В., Доэрти М., Бардин Т. и др. Рекомендации EULAR при подагре, основанные на фактических данных. Часть II: Менеджмент. Отчет рабочей группы Постоянного комитета EULAR по международным клиническим исследованиям, включая терапию (ESCISIT). Энн Рум Дис . 2006 Октябрь 65 (10): 1312-24. [Медлайн].
Terkeltaub RA, Furst DE, Bennett K, Kook KA, Crockett RS, Davis MW.Сравнение высоких и низких доз перорального колхицина при раннем обострении подагры: 24-часовой результат первого многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования колхицина в параллельных группах с сравнением доз. Революционный артрит . 2010 апр. 62 (4): 1060-8. [Медлайн].
Terkeltaub RA, Furst DE, Digiacinto JL, Kook KA, Davis MW. Новый научно обоснованный алгоритм снижения дозы колхицина для прогнозирования и предотвращения токсичности колхицина в присутствии ингибиторов цитохрома P450 3A4 / P-гликопротеина. Революционный артрит . 2011 августа 63 (8): 2226-37. [Медлайн].
FDA принимает меры, чтобы остановить маркетинг неразрешенных инъекционных препаратов, содержащих колхицин. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно по адресу https://wayback.archive-it.org/7993/20170113075756/https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm116853.htm. 6 февраля 2008 г .; Доступ: 15 марта 2018 г.
Desmarais J, Chu CQ. Полезность Анакинры при острых кристаллических заболеваниях: ретроспективное исследование, сравнивающее университетскую больницу с медицинским центром по делам ветеранов. Дж. Ревматол. . 2019 июл.46 (7): 748-750. [Медлайн].
Родди Э. Гиперурикемия, подагра и факторы образа жизни. Дж. Ревматол. . 2008 Сентябрь 35 (9): 1689-91. [Медлайн].
Фитцджеральд Дж. Д., Микулс Т. Р., Неоги Т., Сингх Дж. А., Роббинс М., Ханна П. П. и др. Разработка Американского колледжа ревматологии электронных клинических показателей качества при подагре. Центр лечения артрита (Хобокен) . 2018 май. 70 (5): 659-671. [Медлайн].
Перес-Руис Ф., Херреро-Бейтес А.М., Кармона Л. Двухэтапный подход к лечению гиперурикемии при подагре: гипотеза «грязного блюда». Революционный артрит . 2011 декабрь 63 (12): 4002-6. [Медлайн].
Келли Дж. Сомнения при подагре: эксперты оспаривают новые рекомендации ACP. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/871265. 2 ноября 2016 г .; Дата обращения: 23 ноября 2016 г.
[Рекомендации] Казим А., Харрис Р.П., Форсиа, Массачусетс, Комитет по клиническим рекомендациям Американского колледжа врачей.Управление острой и рецидивирующей подагрой: Руководство по клинической практике Американского колледжа врачей. Энн Интерн Мед. . 2016 г. 1 ноября. [Medline]. [Полный текст].
Фралик М, Чен СК, Паторно Е, Ким СК. Оценка риска подагры с помощью ингибиторов натрий-глюкозного котранспортера-2 у пациентов с диабетом 2 типа: популяционное когортное исследование. Энн Интерн Мед. 2020 14 января. [Medline].
Ю. Т. Эффективность профилактики колхицином при суставной подагре — переоценка через 20 лет. Семенной ревматоидный артрит . 1982, 12 ноября (2): 256-64. [Медлайн].
[Рекомендации] Wallace SL, Singer JZ, Duncan GJ, et al. Функция почек позволяет прогнозировать токсичность колхицина: рекомендации по профилактическому применению колхицина при подагре. Дж. Ревматол. . 1991 18 февраля (2): 264-9. [Медлайн].
Маркель А. Аллопуринол-индуцированный DRESS-синдром. Иср Мед Ассо Дж. . 2005 7 октября (10): 656-60. [Медлайн].
Singer JZ, Wallace SL.Синдром гиперчувствительности к аллопуринолу. Ненужная заболеваемость и смертность. Революционный артрит . 1986, 29 января (1): 82-7. [Медлайн].
Макадамс Демарко М.А., Мейнард Дж. В., Баер А. Н., Гелбер А. С., Янг Дж. Х., Алонсо А. и др. Использование диуретиков, повышенный уровень уратов в сыворотке и риск возникновения подагры в популяционном исследовании взрослых с артериальной гипертензией: когортное исследование «Риск атеросклероза в сообществах». Революционный артрит . 2012 января, 64 (1): 121-9. [Медлайн].[Полный текст].
Yokose C, Lu N, Xie H, Li L, Zheng Y, McCormick N, et al. Болезни сердца и риск тяжелых кожных побочных реакций, связанных с аллопуринолом: общее популяционное когортное исследование. CMAJ . 2019 30 сентября. 191 (39): E1070-E1077. [Медлайн]. [Полный текст].
Stamp LK, Taylor WJ, Jones PB, Dockerty JL, Drake J, Frampton C и др. Начальная доза является фактором риска синдрома гиперчувствительности к аллопуринолу: предлагаемая безопасная начальная доза аллопуринола. Революционный артрит . 2012 августа 64 (8): 2529-36. [Медлайн].
Васкес-Мелладо Дж., Моралес Э.М., Пачеко-Тена С. и др. Связь между нежелательными явлениями, связанными с аллопуринолом, и функцией почек у пациентов с подагрой. Энн Рум Дис . 2001 Октябрь 60 (10): 981-3. [Медлайн].
Ридель А.А., Нельсон М., Джозеф-Ридж Н., Уоллес К., Макдональд П., Беккер М. Соблюдение режима лечения аллопуринолом среди участников управляемой медицинской помощи с подагрой: ретроспективный анализ административных требований. Дж. Ревматол. . 2004 31 августа (8): 1575-81. [Медлайн].
Рис Ф., Дженкинс В., Доэрти М. Пациенты с подагрой придерживаются лечебного лечения, если проинформированы должным образом: экспериментальное исследование, подтверждающее концепцию. Энн Рум Дис . 7 июня 2012 г. [Medline].
Hair PI, McCormack PL, Keating GM. Фебуксостат. Наркотики . 2008. 68 (13): 1865-74. [Медлайн].
Schumacher HR Jr, Becker MA, Wortmann RL, Macdonald PA, Hunt B, Streit J, et al.Эффекты фебуксостата по сравнению с аллопуринолом и плацебо в снижении уровня уратов в сыворотке крови у пациентов с гиперурикемией и подагрой: 28-недельное рандомизированное двойное слепое исследование в параллельных группах, фаза III. Революционный артрит . 2008 15 ноября. 59 (11): 1540-8. [Медлайн].
Schumacher HR Jr, Becker MA, Lloyd E, MacDonald PA, Lademacher C. Febuxostat в лечении подагры: 5-летние результаты исследования эффективности и безопасности FOCUS. Ревматология (Оксфорд) . 2009 Февраль 48 (2): 188-94.[Медлайн].
Becker MA, Schumacher HR Jr, Wortmann RL, et al. Фебуксостат по сравнению с аллопуринолом у пациентов с гиперурикемией и подагрой. N Engl J Med . 2005 декабрь 8. 353 (23): 2450-61. [Медлайн].
Becker MA, Schumacher HR, Espinoza LR, Wells AF, MacDonald P, Lloyd E, et al. Уратснижающая эффективность и безопасность фебуксостата при лечении гиперурикемии подагры: исследование ПОДТВЕРЖДАЕТ. Артикул: Артрит Ресурс .2010. 12 (2): R63. [Медлайн]. [Полный текст].
Джексон Р.Л., Хант Б., Макдональд, Пенсильвания. Эффективность и безопасность фебуксостата для снижения уровня уратов у больных подагрой в возрасте 65+ лет. BMC Гериатр . 2012 21 марта, 12:11. [Медлайн]. [Полный текст].
Wells AF, MacDonald PA, Chefo S, Jackson RL. Афроамериканские пациенты с подагрой: эффективность и безопасность фебуксостата по сравнению с аллопуринолом. BMC Диссонанс опорно-двигательного аппарата . 2012 9 февраля, 13:15. [Медлайн].[Полный текст].
Chohan S, Becker MA, MacDonald PA, Chefo S, Jackson RL. Женщины с подагрой: эффективность и безопасность снижения уровня уратов фебуксостатом и аллопуринолом. Центр лечения артрита (Хобокен) . 2012 Февраль 64 (2): 256-61. [Медлайн].
Яманака Х, Тамаки С., Иде Й, Ким Х, Иноуэ К., Сугимото М. и др. Поэтапное увеличение дозы фебуксостата сравнимо с профилактикой колхицином для предотвращения обострений подагры на начальном этапе уратснижающей терапии: результаты проспективного многоцентрового рандомизированного исследования FORTUNE-1. Энн Рум Дис . 2018 Февраль 77 (2): 270-276. [Медлайн]. [Полный текст].
White WB, Saag KG, Becker MA, Borer JS, Gorelick PB, Whelton A, et al. Сердечно-сосудистая безопасность фебуксостата или аллопуринола у пациентов с подагрой. N Engl J Med . 2018 29 марта. 378 (13): 1200-1210. [Медлайн].
FDA добавляет предупреждение в штучной упаковке для повышенного риска смерти при приеме лекарства от подагры Uloric (фебуксостат). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно по адресу https: // www.fda.gov/Drugs/DrugSafety/ucm631182.htm. 21 февраля 2019 г .; Дата обращения: 24 февраля 2019 г.
Зурампик (лесинурад) [листок-вкладыш]. Уилмингтон, Делавэр: AstraZeneca Pharmaceuticals. Декабрь 2015 г. Доступно в [Полный текст].
Перес-Руис Ф., Санди Дж. С., Майнер Дж. Н., Кравец М., Сторгард С., RDEA594-203 Study Group. Лесинурад в комбинации с аллопуринолом: результаты рандомизированного двойного слепого исследования фазы 2 у пациентов с подагрой с неадекватным ответом на аллопуринол. Энн Рум Дис . 2016, 7 января, 7 (6): 433-42. [Медлайн]. [Полный текст].
Бибер Дж. Д., Теркельтауб, РА. Подагра: на пороге новых методов лечения древней болезни. Революционный артрит . 2004 августа 50 (8): 2400-14. [Медлайн].
Комитет по лекарственным средствам для человека (CHMP). Krystexxa (пеглотиказа). Европейское агентство по лекарственным средствам. Доступно по адресу https://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/002208/human_med_001591.jsp & mid = WC0b01ac058001d124. 25 января 2016 г .; Доступ: 30 января 2016 г.
Sundy JS, Baraf HS, Yood RA и др. Эффективность и переносимость пеглотиказы для лечения хронической подагры у пациентов, невосприимчивых к традиционному лечению: два рандомизированных контролируемых исследования. ЯМА . 2011 17 августа. 306 (7): 711-20. [Медлайн].
Huang HY, Appel LJ, Choi MJ, et al. Влияние добавок витамина С на концентрацию мочевой кислоты в сыворотке: результаты рандомизированного контролируемого исследования. Революционный артрит . 2005 июн.52 (6): 1843-7. [Медлайн].
Kobylecki CJ, Afzal S, Nordestgaard BG. Генетически высокий уровень витамина С и уратов в плазме: исследование методом менделевской рандомизации с участием 106 147 человек из общей популяции. Ревматология (Оксфорд) . 2018 г. 1. 57 (10): 1769-1776. [Медлайн].
Со А., Де Смедт Т., Реваз С. и др. Пилотное исследование ингибирования IL-1 анакинрой при острой подагре. Артикул: Артрит Ресурс .2007. 9 (2): R28. [Медлайн].
Lee YH, Lee CH, Lee J. Эффект фенофибрата в сочетании с уратоснижающими агентами у пациентов с подагрой. Корейский Дж. Стажер Мед. . 2006 г., 21 (2): 89-93. [Медлайн].
So A, De Meulemeester M, Pikhlak A, et al. Канакинумаб для лечения обострений при подагрическом артрите, который трудно поддается лечению: результаты многоцентрового исследования фазы II с определением диапазона доз. Революционный артрит . 2010 Октябрь.62 (10): 3064-76. [Медлайн].
Лоури Ф. Группа FDA отказывает канакинумабу при приступах подагры. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/745076. Доступ: 9 февраля 2011 г.
Yokose C, McCormick N, Choi HK. Роль диеты при гиперурикемии и подагре. Curr Opin Rheumatol . 2021, 4 января. Публикация в преддверии печати: [Medline].
Рай С.К., Фунг Т.Т., Лу Н, Келлер С.Ф., Курхан Г.К., Чой, Гонконг.Диетические подходы к борьбе с гипертонией (DASH), западная диета и риск подагры у мужчин: проспективное когортное исследование. BMJ . 2017 г. 9 мая. 357: j1794. [Медлайн]. [Полный текст].
[Рекомендации] Казим А., Маклин Р.М., Старки М., Форсиа М.А., Комитет по клиническим руководствам Американского колледжа врачей. Диагностика острой подагры: Руководство по клинической практике Американского колледжа врачей. Энн Интерн Мед. 2016 г. 1 ноября. [Medline]. [Полный текст].
Cipolletta E, Di Matteo A, Scanu A, Isidori M, Di Battista J, Punzi L, et al. Биопрепараты в лечении болезни отложения пирофосфата кальция: систематический обзор литературы. Clin Exp Rheumatol . 2020 сен-окт. 38 (5): 1001-1007. [Медлайн]. [Полный текст].
[Эффективность и переносимость увеличения дозы аллопуринола у пациентов с подагрой]
Вступление: Аллопуринол по-прежнему является препаратом выбора для длительного контроля гиперурикемии у пациентов с подагрой.Цель. Целью исследования было изучить эффективность и переносимость различных доз аллопуринола, используемых для достижения целевой концентрации мочевой кислоты (SUc) в сыворотке крови <6 мг / дл (360 микромоль / л).
Методы: Проспективное исследование было проведено у пациентов с первичной подагрой и нормальной функцией почек, без соответствующего заболевания печени и показаниями к лечению, снижающему SUc, включая 1-2 эпизода подагры в год, наличие тофуса и / или хронической уратной артропатии или рентгенологические данные об эрозиях. .Пациентам вводили аллопуринол по схеме постепенного увеличения дозы (начиная со 100 мг / день, затем увеличивая до 100 мг каждые четыре недели) до достижения терапевтической цели или развития побочных эффектов.
Результаты: В исследование был включен 41 пациент; На данный момент 27 пациентов закончили лечение. Целевой показатель лечения был достигнут у 19 из 27 пациентов, принимавших аллопуринол в дозе 300 мг / сут (70,4%).После увеличения дозы до 600 мг / сут общий успех лечения был достигнут у 25 из 27 пациентов (92,5%). Нежелательные лекарственные реакции (НЛР) были отмечены у 12/27 пациентов; наиболее частыми побочными эффектами были приступы подагры. Среднее снижение SUc от исходного уровня 533,9 +/- 83,4 мкмоль / л до 346,9 +/- 87,9 мкмоль / л было получено с аллопуринолом в дозе 300 мг / день (p = 0,000), а также в дозе до 600 мг. / день (274,9 +/- 92,7 мкмоль / л) (p = 0,000).
Выводы: Большинство обследованных пациентов с подагрой достигли целевого уровня SUc <360 ммоль / л при дозе аллопуринола 300 мг / день.Однако у 30% пациентов потребовалось дальнейшее повышение дозы до 600 мг / сут, но повышенная доза переносилась хорошо, и терапевтическая цель была достигнута даже у 92,5% пациентов. Такие дозы обычно хорошо переносятся в условиях хорошо сохранившейся функции почек.
Повышение дозы аллопуринола может лучше контролировать подагру
Следует ли пациенту с подагрой длительно принимать лекарства, снижающие уровень мочевой кислоты, для уменьшения обострений в будущем, в дополнение к лекарствам от симптомов обострения? И безопасно ли продолжать повышать дозу лекарства до тех пор, пока уровень мочевой кислоты не упадет ниже заданного уровня? Ревматологи и другие врачи в настоящее время пытаются решить эти вопросы, и новое исследование может помочь дать некоторые ответы.
Что такое подагра?
Подагра — самая распространенная форма воспалительного артрита в Соединенных Штатах, от которой страдают более 8 миллионов взрослых. Он развивается у некоторых людей с высоким уровнем мочевой кислоты в крови. В суставах и вокруг них образуются игольчатые кристаллы, часто начинающиеся у основания большого пальца ноги, что вызывает приступы сильной боли, жара и отека.
Чтобы предотвратить приступы и предотвратить переход болезни в хроническую форму, рекомендации по лечению включают использование лекарств, снижающих уровень уратов (производного мочевой кислоты) в крови, чтобы поддерживать его ниже 6 миллиграммов / децилитр (6 мг / дл).У людей с подагрой, у которых есть тофусы (твердые образования кристаллов мочевой кислоты, которые можно увидеть под кожей), врачи хотят, чтобы уровень мочевой кислоты был еще ниже. Если его можно поддерживать в целевом диапазоне, кристаллы мочевой кислоты растворяются, обострения подагры уменьшаются или устраняются, а тофусы уменьшаются.
Но многие люди не любят длительное лечение — особенно если после того, как острый приступ подагры утих, они чувствуют себя хорошо. И некоторые врачи не уверены, что агрессивное лечение по снижению уровня мочевой кислоты — правильный подход.
В прошлом году международная группа экспертов по подагре опубликовала рекомендации о том, что врачи должны использовать подход «лечение по назначению» для лечения подагры. Но примерно в то же время Американский колледж врачей (национальная организация врачей-терапевтов) опубликовал свои собственные рекомендации по лечению подагры, в которых не рекомендуется длительное использование препаратов, снижающих уровень мочевой кислоты, у пациентов с нечастыми обострениями до тех пор, пока не появятся дополнительные исследования.
Некоторые из этих исследований теперь могут быть доступны.Новое исследование, опубликованное недавно в журнале Annals of the Rheumatic Diseases , предполагает, что врачи могут безопасно увеличить дозы аллопуринола, лекарства от подагры, чтобы достичь этих целей. Безопасность этих более высоких доз особенно важна для многих людей с подагрой, которые также имеют хроническое заболевание почек или другие заболевания.
Аллопуринол
Аллопуринол является наиболее часто используемым препаратом, снижающим уровень мочевой кислоты, но многие врачи не решаются использовать его в дозах, необходимых для достижения целевого уровня уратов в сыворотке, из-за опасений побочных эффектов, — объясняет Лиза Стэмп, доктор философии, ведущий автор исследования и профессор медицины. Университет Отаго в Крайстчерче, Новая Зеландия.
Джонатан Кей, доктор медицинских наук, директор по клиническим исследованиям ревматологии Медицинской школы Массачусетского университета в Вустере, согласен. «Аллопуринол — эффективное лекарство для снижения уровня уратов в сыворотке крови, но его часто занижают, потому что врачи считают, что фиксированная дозировка является подходящим способом прописать это лекарство», — объясняет он. «Многие врачи не знают, что дозы аллопуринола могут быть увеличены до [дозы] 900 мг / день по мере необходимости для достижения целевого уровня урата сыворотки менее 6 мг / дл.”
Исследование
Чтобы определить безопасность и эффективность увеличения доз аллопуринола в реальных условиях, Стэмп и ее коллеги провели исследование с увеличением дозы. В исследовании приняли участие 183 человека с подагрой. Более чем у половины участников была снижена функция почек (обычная проблема среди людей с подагрой), а у 44 процентов была тяжелая подагра (что определялось наличием тофусов).
Все участники принимали аллопуринол не менее одного месяца, когда началось исследование.Девяносто участников были случайным образом распределены в группу повышения дозы (DE), а 93 — в контрольную группу. Участники контрольной группы оставались на исходной дозе аллопуринола в течение 12 месяцев исследования. В группе DE кровь брали каждый месяц, и уровень аллопуринола увеличивался до тех пор, пока уровень мочевой кислоты не достиг целевого значения менее 6 мг / дл или пока не возникли какие-либо побочные эффекты.
К последнему визиту за 12 месяцев 32 процента контрольной группы имели уровень мочевой кислоты в крови менее 6 мг / дл, а 69 процентов группы DE достигли целевого показателя.И 59 процентов группы DE достигли и поддерживали целевой уровень уратов в течение последних трех месяцев исследования.
Несмотря на то, что произошли некоторые побочные эффекты, по словам Стэмпа, «числа и типы были одинаковыми в двух группах, и считалось, что некоторые из них связаны с аллопуринолом».
«Это исследование показывает, что целевые уровни уратов в сыворотке достигаются у значительно большей части пациентов, получавших лечение с увеличением дозы, чем с фиксированной дозировкой», — говорит д-р Кей. «Это важное исследование, потому что оно подтверждает подход к лечению подагры.”
Влияние на симптомы
Когда начинается уратоснижающая терапия, пациенты имеют повышенный риск приступа подагры, поскольку уровень мочевой кислоты быстро падает, объясняет доктор Кей. Однако прием препарата колхицин в течение первых шести месяцев терапии аллопуринолом может помочь предотвратить приступы, говорит он.
Когда уровень уратов в сыворотке снижается до целевого, требуется время, чтобы кристаллы растворились и вспыхнули, чтобы уменьшить их количество. В однолетнем исследовании Stamp не было отмечено значительного уменьшения обострений подагры, уровня боли или размера тофусов в группе DE, несмотря на то, что большинство из них достигли целевого уровня мочевой кислоты.
«Вероятно, потребуется более длительный период наблюдений, чтобы увидеть разницу в интенсивности вспышек», — говорит Стэмп. «В настоящее время мы анализируем данные второго года исследования и ожидаем, что мы можем увидеть уменьшение количества вспышек. Мы надеемся, что эти данные будут опубликованы в ближайшие несколько месяцев ».
Что это значит для вас
Stamp побуждает пациентов брать на себя управление. «Если ваша подагра лечится хорошо, у вас не должно быть приступов подагры. Если у вас по-прежнему регулярные приступы или у вас тофусы, поговорите со своим врачом.Важно проверять уровень мочевой кислоты в крови и корректировать прием уратоснижающих лекарств, чтобы снизить уровень мочевой кислоты и улучшить симптомы ».
Доктор Кей соглашается. «Снижение общей нагрузки уратами в организме улучшит контроль подагрического артрита и, возможно, улучшит артериальную гипертензию и снизит сердечно-сосудистую заболеваемость», — говорит он.
Бет Экстелл для Фонда артрита
Связанные ресурсы
Побочные эффекты, использование, время работы
Побочные эффекты от приема аллопуринола могут включать:
- кожные высыпания
- головные боли
- чувство сонливости или головокружения
- плохое самочувствие
- меняет ваше чувство вкуса.
Если у вас появилась сыпь, вам следует прекратить прием аллопуринола и немедленно обратиться к врачу. Если во время приема аллопуринола у вас началось головокружение или сонливость, не садитесь за руль и не работайте с механизмами и как можно скорее обратитесь к врачу. Вам также следует поговорить со своим врачом, если у вас появятся какие-либо другие новые симптомы, которые вас беспокоят.
Большинство людей, принимающих аллопуринол, не испытывают побочных эффектов. Но если у вас есть побочные эффекты, возможно, можно будет возобновить прием аллопуринола с помощью специального курса «десенсибилизации».Это предполагает начало приема аллопуринола с очень низкой дозы и постепенное увеличение дозы.
Иногда прием аллопуринола может вызвать приступ подагры, поскольку кристаллы начинают растворяться. Вам, вероятно, дадут дополнительное лекарство в течение первых нескольких месяцев приема аллопуринола, чтобы снизить риск возникновения этих приступов.
Острые приступы подагры обычно лечат высокой дозой нестероидных противовоспалительных препаратов (НПВП), например:
- диклофенак натрия (die-clo-fe-nac sow-dee-um)
- диклофенак калия (die-clo-fe-nac po-tass-ee-um)
- эторикоксиб (ee-torry-cox-ib)
- индометацин (ин-доэ-мет-а-син)
- кетопрофен (key-toe-pro-fen)
- напроксен (na-procks-en)
- сулиндак (сух-лин-дак).
У всех этих лекарств есть торговые марки, поэтому тип, который вам дают, можно назвать иначе.
Если вы не можете принимать НПВП, вам могут назначить колхицин (уголь-чи-видим) или стероиды.
Если во время приема аллопуринола у вас случился острый приступ подагры, не прекращайте его прием.
Если вы не можете продолжать прием аллопуринола из-за побочных эффектов, вы можете вместо него принять фебуксостат, который действует аналогично аллопуринолу.
Если вы не можете принимать фебуксостат, ваш врач может порекомендовать бензбромарон (бенс-бро-марон) или сульфинпиразон (суль-фин-пира-зона).
Однако аллопуринол не следует применять для лечения острого приступа подагры. Это потому, что они могут продлить атаку.
Советы по снижению риска заражения
- Старайтесь избегать тесного контакта с людьми, которых вы знаете, что они инфицированы.
- Регулярно мойте руки и носите с собой небольшой флакон с антибактериальным гелем для рук.
- Держите рот в чистоте, регулярно чистя зубы.
- Бросьте курить, если вы курите.
- Убедитесь, что ваша еда хранится и готовится должным образом.
- Старайтесь поддерживать в доме чистоту и гигиену, особенно на кухне, в ванных комнатах и туалетах.
Аллопуринол — StatPearls — NCBI Bookshelf
Непрерывное обучение
Аллопуринол — это уратоснижающий препарат, одобренный FDA для лечения подагры, профилактики синдрома лизиса опухоли и профилактики рецидивирующего кальциевого нефролитиаза у пациентов с гиперурикозурией. В этом упражнении описаны показания, механизм, фармакология, противопоказания и побочные эффекты, связанные с лекарственной терапией аллопуринолом.
Цели:
-
Определить различные показания для терапии аллопуринолом.
-
Опишите возможные побочные эффекты аллопуринола.
-
Обобщите механизм действия аллопуринола.
-
Рассмотреть важность координации и сотрудничества между различными дисциплинами в межпрофессиональной медицинской бригаде для координации ухода и управления с целью улучшения результатов для пациентов, получающих терапию аллопуринолом.
Показания к применению
Аллопуринол, ингибитор ксантиноксидазы, является уратоснижающим препаратом.
Аллопуринол одобрен FDA для следующих показаний:
-
Подагра
-
Профилактика синдрома лизиса опухоли
-
Профилактика рецидивирующего кальциевого нефролитиаза у пациентов с гиперурикозурией
Другие показания, не одобренные FDA Гиперурикемия, связанная с синдромом Леша-Найхана, и профилактика рецидивирующего мочекислого нефролитиаза.[1]
Американский колледж ревматологии рекомендует начинать уратоснижающую терапию, такую как аллопуринол, пациентам с установленным диагнозом подагрического артрита в следующих ситуациях:
-
Частые приступы острого подагрического артрита, равные или превышающие два приступа в год
-
Хроническая болезнь почек 2 стадии или более тяжелая
-
Наличие тофусов или тофусов при клиническом осмотре или визуализации
-
История нефролитиаза
Важно отметить, что бессимптомная гиперурикемия не является указание на аллопуринол или любую уратснижающую терапию.[1]
Механизм действия
Аллопуринол метаболизируется в печени, где он превращается в свой фармакологически активный метаболит оксипуринол. Период полувыведения аллопуринола составляет 1-2 часа, а оксипуринола — около 15 часов. И аллопуринол, и оксипуринол выводятся почками. И аллопуринол, и оксипуринол ингибируют ксантиноксидазу, фермент в пути катаболизма пуринов, который превращает гипоксантин в ксантин в мочевую кислоту.
Администрация
Аллопуринол может применяться в двух формах: перорально или внутривенно (IV).В то время как пероральное введение является стандартным способом лечения подагры и нефролитиаза мочевой кислоты или оксалата кальция, внутривенное введение аллопуринола предназначено для профилактики синдрома лизиса опухоли и лечения гиперурикемии, вызванной терапией рака, у пациентов, которые не переносят пероральную терапию.
Для длительного лечения подагры рекомендуемая начальная доза аллопуринола составляет 100 мг в день, которую следует увеличивать на 100 мг каждые 2–5 недель до достижения целевого уровня мочевой кислоты в сыворотке крови. Американский колледж ревматологии рекомендует целевое значение мочевой кислоты ниже 6.0 мг / дл для всех пациентов с подагрой и менее 5,0 мг / дл у пациентов с точечной подагрой. Максимальная суточная доза аллопуринола — 800 мг. После того, как пациент достигнет целевого уровня мочевой кислоты в сыворотке, дозу аллопуринола, необходимую для достижения целевого уровня мочевой кислоты в сыворотке, следует продолжать бесконечно. [1]
У пациентов с почечной недостаточностью (стадия хронической болезни почек 4 и выше) аллопуринол следует начинать с суточной дозы 50 мг, затем дозу следует увеличивать на 50 мг каждые 2–5 недель до достижения целевой мочевой кислоты в сыворотке крови.2 / день в три приема каждые 8 часов, максимум 800 мг в день, а аллопуринол внутривенно составляет от 200 до 400 мг / м2 в день однократно или в 2-3 приема.
Дозировка аллопуринола составляет 300 мг перорально в день для профилактики рецидива мочевой кислоты или кальциевого нефролитиаза.
Побочные эффекты
Аллопуринол является относительно безопасным лекарством, хотя могут возникать побочные эффекты.
Из-за дестабилизации внутрисуставных микротрофов мочевой кислоты при начале любой уратснижающей терапии увеличивается частота обострений подагры, особенно в первые несколько месяцев.Чтобы предотвратить это, пациенты должны начать прием противовоспалительных средств, таких как колхицин, нестероидные противовоспалительные препараты (НПВП) или преднизон в низких дозах (только для пациентов, которые не могут принимать колхицин или НПВП) до или одновременно с началом приема аллопуринола. [3]
Макулопапулезная зудящая сыпь, побочные эффекты со стороны желудочно-кишечного тракта, включая тошноту и диарею, являются другими частыми побочными эффектами. Могут возникнуть лабораторные отклонения, включая трансаминит и повышенную щелочную фосфатазу в сыворотке крови, лейкопению и тромбоцитопению.Другие менее распространенные и редкие побочные эффекты включают некроз печени, гранулематозный гепатит, холестатическую желтуху, интерстициальный нефрит и васкулит.
Синдром гиперчувствительности к аллопуринолу (AHS) — это редкое тяжелое побочное действие аллопуринола с частотой около 1 на 1000, с высоким уровнем смертности от 20% до 25%. Механизм — это опосредованная Т-клетками иммунная реакция на оксипуринол. Самый высокий риск — в первые несколько месяцев терапии, особенно при более высоких начальных дозах аллопуринола.Сопутствующие диуретики, особенно использование тиазидов, почечная недостаточность 3 стадии или выше, являются основными факторами риска. Пациенты корейского, китайского и тайского происхождения с генотипом HLA-B * 5801 подвержены очень высокому риску АГЧ. Клинические признаки AHS включают синдром Стивенса-Джонсона, токсический эпидермальный некролиз, васкулит, гепатоцеллюлярное повреждение, острое повреждение почек, лихорадку, лейкоцитоз и эозинофилию. Менеджмент благосклонный. Снижение начальной дозы аллопуринола до менее 100 мг в день для всех пациентов и менее 50 мг в день для пациентов с хронической болезнью почек 3 или более тяжелой стадии может снизить риск АГЧ.
Существует несколько лекарственных взаимодействий с аллопуринолом. Наиболее важным лекарственным средством является взаимодействие с азатиоприном и 6-меркаптопурином, оба из которых метаболизируются ферментом ксантиноксидазой. Использование любого ингибитора ксантиноксидазы, такого как аллопуринол, у пациента, принимающего азатиоприн или 6-меркаптопурин, может вызвать тяжелый агранулоцитоз и панцитопению.
Противопоказания
Наличие генотипа HLA-B * 5801 у пациентов корейского происхождения с хронической болезнью почек 3 или более тяжелой стадии или у пациентов китайского или тайского происхождения хань, независимо от функции почек, является особенно высоким риском АГЧ ( степень опасности несколько сотен).Американский колледж ревматологии рекомендует провести скрининг этой популяции на генотип HLA-B * 5801 с помощью теста полимеразной цепной реакции (ПЦР) перед началом приема аллопуринола, а в случае положительного результата — использовать альтернативную терапию, снижающую уровень уратов. Однако универсальный скрининг аллопуринола HLA-B * 5801 не рекомендуется, учитывая значительно более низкую распространенность HLA-B * 5801 и соотношение рисков в других популяциях.
Мониторинг
Общий анализ крови, функциональные пробы печени, функция почек и уровни мочевой кислоты в сыворотке следует измерять каждые 2–5 недель при титровании дозы до достижения целевого уровня мочевой кислоты в сыворотке и каждые шесть месяцев после этого.Пациентам необходимо проконсультироваться о признаках и симптомах АГЧ с рекомендацией немедленно прекратить прием аллопуринола, если у них появится кожная сыпь, связанная с АГЧ, особенно на ранних этапах терапии.
Улучшение результатов команды здравоохранения
Аллопуринол является относительно безопасным лекарством и используется уже более полувека. Тем не менее, недавние исследования подагры показали значительное недоиспользование этого агента и использование субоптимальных доз, недостаточных для достижения целевого уровня мочевой кислоты в сыворотке крови у значительной части пациентов с подагрой.Вопреки распространенному мнению, недавние исследования показали, что аллопуринол безопасен при тяжелом хроническом заболевании почек и может препятствовать прогрессированию заболевания почек у пациентов с подагрой и хроническим заболеванием почек. [4] [5] Использование аллопуринола у пациентов с подагрой также связано с более низкой смертностью от всех причин и другими неблагоприятными сердечно-сосудистыми событиями, включая повторную госпитализацию из-за застойной сердечной недостаточности. [5] [6] [7] [8] Американский колледж ревматологии рекомендует аллопуринол в качестве одного из препаратов первой линии в качестве уратоснижающей терапии для лечения подагры.
Тем не менее, аллопуринол может вызывать редкие, хотя и серьезные побочные эффекты, и его использование требует контроля со стороны межпрофессиональной группы. Клиницисты, начинающие терапию аллопуринолом, должны гарантировать отсутствие лекарственных взаимодействий и что терапия ингибиторами ксантиноксидазы является оптимальным выбором. Бригада медсестер должна помочь в проверке соблюдения пациентом режима лечения, а также в отслеживании нежелательных явлений и терапевтической эффективности. Наилучший шанс для аллопуринола иметь терапевтический успех с минимальными побочными эффектами — это межпрофессиональный командный подход.[Уровень 5]
Вопросы для продолжения образования / повторения
Ссылки
- 1.
- Ханна Д., Фицджеральд Дж. Д., Ханна П. П., Бэ С., Сингх М. К., Неоги Т., Пиллинджер М. Х., Мерилл Дж., Ли С. , Kaldas M, Gogia M, Perez-Ruiz F, Taylor W., Lioté F, Choi H, Singh JA, Dalbeth N, Kaplan S., Niyyar V, Jones D, Yarows SA, Roessler B, Kerr G, King C, Levy G , Furst DE, Edwards NL, Mandell B, Schumacher HR, Robbins M, Wenger N, Terkeltaub R., Американский колледж ревматологии.Рекомендации Американского колледжа ревматологии по лечению подагры, 2012 г. Часть 1: систематические нефармакологические и фармакологические терапевтические подходы к гиперурикемии. Arthritis Care Res (Хобокен). 2012 Октябрь; 64 (10): 1431-46. [Бесплатная статья PMC: PMC3683400] [PubMed: 23024028]
- 2.
- Stamp LK, O’Donnell JL, Zhang M, James J, Frampton C, Barclay ML, Chapman PT. Использование аллопуринола сверх дозы, основанной на клиренсе креатинина, эффективно и безопасно у пациентов с хронической подагрой, в том числе с почечной недостаточностью.Rheum артрита. 2011 Февраль; 63 (2): 412-21. [PubMed: 21279998]
- 3.
- Кханна Д., Кханна П.П., Фицджеральд Д.Д., Сингх М.К., Бэ С., Неоги Т., Пиллинджер М.Х., Мерилл Дж., Ли С., Пракаш С., Калдас М., Гогиа М., Перес-Руис Ф, Тейлор В., Лиоте Ф, Чой Х., Сингх Дж. А., Далбет Н., Каплан С., Нийяр В., Джонс Д., Яроус С. А., Рёсслер Б., Керр Дж., Кинг С., Леви Дж., Ферст Д. Е., Эдвардс Н. Л., Манделл Б., Шумахер Х.Р., Роббинс М., Венгер Н., Теркельтауб Р., Американский колледж ревматологии. Рекомендации Американского колледжа ревматологии по лечению подагры, 2012 г.Часть 2: терапия и противовоспалительная профилактика острого подагрического артрита. Arthritis Care Res (Хобокен). 2012 Октябрь; 64 (10): 1447-61. [Бесплатная статья PMC: PMC3662546] [PubMed: 23024029]
- 4.
- Siu YP, Leung KT, Tong MK, Kwan TH. Использование аллопуринола для замедления прогрессирования почечной недостаточности за счет его способности снижать уровень мочевой кислоты в сыворотке крови. Am J Kidney Dis. 2006 Янв; 47 (1): 51-9. [PubMed: 16377385]
- 5.
- Goicoechea M, Garcia de Vinuesa S, Verdalles U, Verde E, Macias N, Santos A, Pérez de Jose A, Cedeño S, Linares T, Luño J.Аллопуринол и прогрессирование ХБП и сердечно-сосудистых событий: долгосрочное наблюдение в ходе рандомизированного клинического исследования. Am J Kidney Dis. 2015 Апрель; 65 (4): 543-9. [PubMed: 25595565]
- 6.
- Luk AJ, Levin GP, Moore EE, Zhou XH, Kestenbaum BR, Choi HK. Аллопуринол и смертность у пациентов с гиперурикемией. Ревматология (Оксфорд). 2009 июль; 48 (7): 804-6. [Бесплатная статья PMC: PMC4481712] [PubMed: 19447769]
- 7.
- Thanassoulis G, Brophy JM, Richard H, Pilote L. Подагра, употребление аллопуринола и исходы сердечной недостаточности.Arch Intern Med. 2010 августа 09; 170 (15): 1358-64. [PubMed: 20696962]
- 8.
- Struthers AD, Donnan PT, Lindsay P, McNaughton D, Broomhall J, MacDonald TM. Влияние аллопуринола на смертность и госпитализации при хронической сердечной недостаточности: ретроспективное когортное исследование. Сердце. 2002 Март; 87 (3): 229-34. [Бесплатная статья PMC: PMC1767024] [PubMed: 11847159]
Дозировка и введение аллопуринола | Уровень здоровья
О серьезных передозировках или остром отравлении аллопуринолом не сообщалось.
У мышей летальная доза 50% (LD 50 ) составляет 160 мг / кг, вводимая внутрибрюшинно (IP) с отсрочкой смерти до 5 дней, и 700 мг / кг перорально (PO) (примерно в 140 раз больше обычной дозы для человека. ) со смертью с задержкой до 3 дней. У крыс острая LD 50 составляет 750 мг / кг IP и 6000 мг / кг PO (примерно в 1200 раз больше дозы для человека).
При передозировке не существует специфического антидота для аллопуринола. Клинического опыта ведения пациента, принимавшего аллопуринол в больших количествах, не было.
И аллопуринол, и оксипуринол поддаются диализу; Однако польза гемодиализа или перитонеального диализа при лечении передозировки аллопуринола неизвестна.
Дозировка аллопуринола для полного контроля подагры и снижения уровня мочевой кислоты в сыворотке до нормального или почти нормального уровня зависит от тяжести заболевания. В среднем составляет от 200 до 300 мг / день для пациентов с подагрой легкой степени и от 400 до 600 мг / день для пациентов с приливной подагрой средней степени тяжести.Соответствующую дозу можно вводить разделенными дозами или в виде однократной эквивалентной дозы с таблеткой 300 мг. Требования к дозировке, превышающей 300 мг, следует вводить в несколько приемов. Минимальная эффективная доза составляет от 100 до 200 мг в день, а максимальная рекомендуемая доза составляет 800 мг в день. Чтобы снизить вероятность обострения приступов подагры, пациенту рекомендуется начинать с низкой дозы аллопуринола (100 мг в день) и увеличивать ее с недельными интервалами на 100 мг до уровня мочевой кислоты в сыворотке крови 6 мг / дл. или меньше, но без превышения максимальной рекомендованной дозировки.
Нормальный уровень уратов в сыворотке обычно достигается через 1–3 недели. Верхний предел нормы составляет около 7 мг / дл для мужчин и женщин в постменопаузе и 6 мг / дл для женщин в пременопаузе. Не следует слишком полагаться на одно определение мочевой кислоты, поскольку по техническим причинам оценка мочевой кислоты может быть затруднена. Путем выбора подходящей дозировки и, у некоторых пациентов, одновременного применения урикозурических средств, можно снизить уровень мочевой кислоты в сыворотке до нормального или, при желании, до 2–3 мг / дл и удерживать ее на этом уровне неопределенно долго.
При корректировке дозировки аллопуринола у пациентов, получающих колхицин и / или противовоспалительные агенты, целесообразно продолжать последнюю терапию до тех пор, пока уровень мочевой кислоты в сыворотке не нормализуется, и в течение нескольких лет не наблюдается острых приступов подагры. месяцы.
При переводе пациента с урикозурического средства на аллопуринол дозу урикозурического средства следует постепенно снижать в течение нескольких недель, а дозу аллопуринола постепенно увеличивать до дозы, необходимой для поддержания нормального уровня мочевой кислоты в сыворотке крови.
Следует также отметить, что аллопуринол обычно лучше переносится, если принимать его после еды. Желательно потребление жидкости, достаточное для обеспечения суточного диуреза не менее 2 литров, и поддержание нейтральной или, предпочтительно, слабощелочной мочи.
Поскольку аллопуринол и его метаболиты в первую очередь выводятся только почками, накопление препарата может происходить при почечной недостаточности, и, следовательно, доза аллопуринола должна быть уменьшена. При клиренсе креатинина от 10 до 20 мл / мин подходит суточная доза аллопуринола 200 мг.Когда клиренс креатина менее 10 мл / мин, суточная доза не должна превышать 100 мг. При крайнем нарушении функции почек (клиренс креатинина менее 3 мл / мин) интервал между дозами также может потребовать увеличения.
Правильный размер и частота дозировки для поддержания уровня мочевой кислоты в сыворотке крови в пределах нормы лучше всего определить, используя уровень мочевой кислоты в сыворотке в качестве показателя.
Для профилактики нефропатии мочевой кислоты во время интенсивной терапии опухолевых заболеваний рекомендуется лечение 600-800 мг в день в течение 2 или 3 дней вместе с большим потреблением жидкости.Во всем остальном соображения, аналогичные приведенным выше рекомендациям по лечению пациентов с подагрой, регулируют регулирование дозировки для поддерживающих целей при вторичной гиперурикемии.
Доза аллопуринола, рекомендованная для лечения рецидивирующих камней оксалата кальция у пациентов с гиперурикозурией, составляет от 200 до 300 мг / день в разделенных дозах или в виде единого эквивалента. Эта доза может быть увеличена или уменьшена в зависимости от результирующего контроля гиперурикозурии на основании последующих 24-часовых определений уратов в моче.Клинический опыт показывает, что пациентам с рецидивирующими камнями из оксалата кальция также могут быть полезны изменения в диете, такие как уменьшение количества животного белка, натрия, рафинированного сахара, продуктов, богатых оксалатами, и чрезмерного потребления кальция, а также увеличение количества пероральной жидкости и пищевых волокон. .
Детям в возрасте от 6 до 10 лет с вторичной гиперурикемией, связанной со злокачественными новообразованиями, можно давать 300 мг аллопуринола в день, а детям младше 6 лет — 150 мг в день. Ответ оценивается примерно через 48 часов терапии, и при необходимости корректируют дозу.
Таблетки аллопуринола, USP, доступны, содержащие 100 мг или 300 мг аллопуринола, USP.
Таблетки по 100 мг представляют собой белые круглые прессованные таблетки с насечками, отмеченные буквами M слева от отметки и 31 справа от отметки на одной стороне таблетки и пустыми символами на другой стороне.
