Гнойный артрит — причины, симптомы, диагностика и лечение
Гнойный артрит – это воспаление всех структур сустава, вызываемое гноеродной микрофлорой. Заболевание проявляется отеком, резкими болями, нарушением функции, местным повышением температуры, а также выраженными симптомами общей интоксикации: общей гипертермией, слабостью, разбитостью, головной болью. Диагноз устанавливается на основании результатов физикального обследования и данных инструментальных исследований (исследование пунктата, рентгенография, МРТ, КТ). Лечение хирургическое – вскрытие и дренирование сустава на фоне антибиотикотерапии.
Общие сведения
Гнойный артрит – воспалительный процесс в полости сустава, вызываемый гноеродными микробными агентами. Является тяжелым заболеванием, способным вызывать серьезные отдаленные местные последствия (артроз, контрактура) и становиться причиной распространения инфекции с развитием осложнений, опасных для здоровья и жизни пациента (флегмона, абсцесс, остеомиелит, сепсис). Лечением гнойных артритов нетравматической природы занимаются гнойные хирурги. Лечение артритов, являющихся следствием травмы (открытых переломов, проникающих ран) осуществляют травматологи.
Лечением гнойных артритов нетравматической природы занимаются гнойные хирурги. Лечение артритов, являющихся следствием травмы (открытых переломов, проникающих ран) осуществляют травматологи.
Гнойный артрит
Причины
Контактное распространение микробов может наблюдаться при непроникающей ране в области сустава, гнойничковом процессе, инфицированных ссадинах, абсцессе, флегмоне окружающих тканей и остеомиелите кости, участвующей в образовании сустава. Лимфогенное и гематогенное распространение инфекции возможно при сепсисе, остеомиелите, карбункулах, абсцессах или флегмонах любой локализации, в том числе расположенных на значительном отдалении от пораженного сустава. Кроме того, гнойное воспаление сустава может стать осложнением ряда инфекционных заболеваний, сопровождающихся бактериемией: рожистого воспаления, гонореи, пневмонии, брюшного тифа и т. д. Вторичные гнойные артриты наблюдаются чаще первичных.
Обычно возбудителями гнойного артрита являются стрептококки или стафилококки. Реже причиной развития воспалительного процесса становятся гонококки, кишечная палочка, клебсиеллы, протей, пневмококки, сальмонеллы, микобактерии и другие микроорганизмы. Предрасполагающими факторами, увеличивающими вероятность развития гнойного артрита, являются обильное загрязнение ран и открытых переломов, а также снижение общей сопротивляемости вследствие иммунных нарушений, тяжелых соматических заболеваний, истощения, тяжелой сочетанной травмы и т. д.
Реже причиной развития воспалительного процесса становятся гонококки, кишечная палочка, клебсиеллы, протей, пневмококки, сальмонеллы, микобактерии и другие микроорганизмы. Предрасполагающими факторами, увеличивающими вероятность развития гнойного артрита, являются обильное загрязнение ран и открытых переломов, а также снижение общей сопротивляемости вследствие иммунных нарушений, тяжелых соматических заболеваний, истощения, тяжелой сочетанной травмы и т. д.
Патанатомия
Гнойный артрит может развиться в любом суставе, но чаще страдают крупные суставы конечностей: коленные, локтевые, тазобедренные и плечевые. Особенности анатомического строения суставов (наличие изолированной замкнутой полости) способствуют скоплению гноя и распространению гнойного процесса на все структуры сустава, включая капсулу, синовиальную оболочку, хрящи и суставные концы костей. Вместе с тем, многочисленные связи суставной сумки с кровеносной и лимфатической системой создают благоприятные условия для диссеминации возбудителя через кровь и лимфу с возможным развитием сепсиса или формированием гнойных очагов в отдаленных сегментах.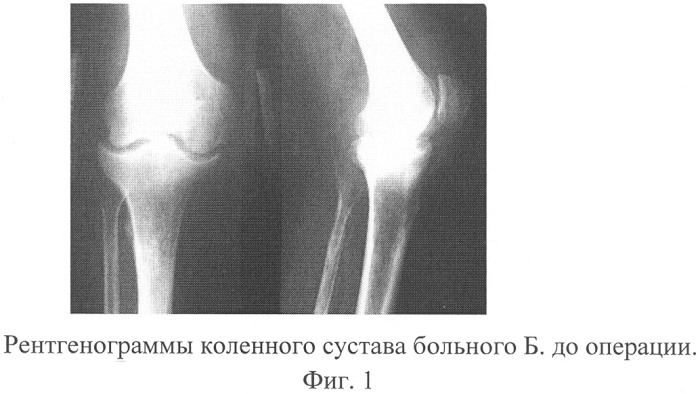
Классификация
В гнойной хирургии и травматологии-ортопедии выделяют два вида гнойных артритов: первичные и вторичные. Первичные возникают при проникновении возбудителя непосредственно в полость сустава и могут развиваться при проникающих ранениях, открытых переломах, вывихах и переломовывихах, а также являться следствием заноса инфекции при пункции сустава либо при проведении оперативного вмешательства. Вторичные артриты развиваются в результате заноса инфекции через окружающие ткани, кровь или лимфу.
Симптомы гнойного артрита
Болезнь начинается остро. Пораженный сустав отекает, становится горячим. Кожа над ним краснеет. В суставе возникают интенсивные боли, через некоторое время приобретающие пульсирующий или стреляющий характер и лишающие больного сна. Пальпация и движения резко болезненны. Наблюдается выраженное нарушение функции, обусловленное болевым синдромом. В течение нескольких дней развивается реактивный отек мягких тканей ниже и выше пораженного сустава. При этом отечность больше выражена в нижележащем сегменте, что обусловлено сдавлением лимфатических сосудов.
При этом отечность больше выражена в нижележащем сегменте, что обусловлено сдавлением лимфатических сосудов.
Местные признаки артрита сочетаются с ярко выраженными симптомами общей интоксикации. Температура поднимается до фебрильных цифр, часто наблюдается гектическая лихорадка с выраженными ознобами. Пациента беспокоит сильная слабость и разбитость. Возможны головные боли, тошнота, в тяжелых случаях – нарушения сознания. Пульс учащен, при этом его частота нередко не соответствует температуре тела.
При внешнем осмотре конечность отечна, находится в вынужденном положении. Особенно выраженный отек выявляется в области сустава, там же наблюдается местная гиперемия. Ниже кожа часто приобретает синюшный или синюшно-багровый оттенок. Пальпация сустава резко болезненна, возможна флюктуация. Пассивные и активные движения ограничены из-за боли. При опросе, как правило, удается установить наличие инфекционного заболевания, гнойного процесса или травмы в течение 2-3 недель, предшествующих началу болезни.
Диагностика
Диагноз гнойный артрит выставляется на основании характерного анамнеза, клинических проявлений, анализов крови, подтверждающих наличие острого воспаления (увеличение СОЭ, лейкоцитоз со сдвигом формулы влево), пункции сустава с последующим исследованием синовиальной жидкости, а также данных инструментальных исследований.
Всем больным с подозрением на гнойный артрит назначается рентгенография.
КТ стопы. Деструкция сустава Лисфранка на фоне длительно существующего хронического гнойного артрита посттравматического характера.
Лечение гнойного артрита
Пациенты подлежат немедленной госпитализации. Назначается антибиотикотерапия. На ранних стадиях (при синовите с отсутствием гноя) лечение консервативное. Накладывается гипс, проводятся пункции сустава с последующим введением антибиотиков. При эмпиеме (гное в суставе) и выраженной интоксикации показана немедленная артротомия с последующим дренированием сустава. При обширных гнойных ранах и открытых переломах проводится вторичная хирургическая обработка с рассечением краев раны, удалением инородных тел и свободно лежащих костных отломков, иссечением нежизнеспособных тканей, широкой артротомией и вскрытием гнойных затеков. При развитии сепсиса необходимо более объемное хирургическое вмешательство – резекция сустава.
Накладывается гипс, проводятся пункции сустава с последующим введением антибиотиков. При эмпиеме (гное в суставе) и выраженной интоксикации показана немедленная артротомия с последующим дренированием сустава. При обширных гнойных ранах и открытых переломах проводится вторичная хирургическая обработка с рассечением краев раны, удалением инородных тел и свободно лежащих костных отломков, иссечением нежизнеспособных тканей, широкой артротомией и вскрытием гнойных затеков. При развитии сепсиса необходимо более объемное хирургическое вмешательство – резекция сустава.
Прогноз и профилактика
В исходе часто наблюдаются ограничения движений, артрозы. Профилактическими мерами по предотвращению гнойного процесса в суставе являются ранние операции при остеомиелите, локализующемся вблизи суставов, своевременное вскрытие флегмон и абсцессов, адекватное лечение инфекционных заболеваний, а также правильная организация обработки случайных ран и открытых переломов. Первая помощь при открытых травмах суставов должна быть оказана в ранние сроки.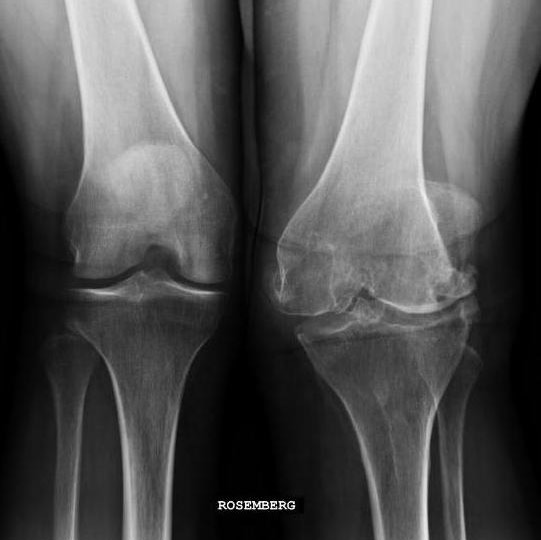
Гнойный артрит — причины, симптомы, диагностика и лечение
Гнойный артрит – это воспаление всех структур сустава, вызываемое гноеродной микрофлорой. Заболевание проявляется отеком, резкими болями, нарушением функции, местным повышением температуры, а также выраженными симптомами общей интоксикации: общей гипертермией, слабостью, разбитостью, головной болью. Диагноз устанавливается на основании результатов физикального обследования и данных инструментальных исследований (исследование пунктата, рентгенография, МРТ, КТ). Лечение хирургическое – вскрытие и дренирование сустава на фоне антибиотикотерапии.
Общие сведения
Гнойный артрит – воспалительный процесс в полости сустава, вызываемый гноеродными микробными агентами. Является тяжелым заболеванием, способным вызывать серьезные отдаленные местные последствия (артроз, контрактура) и становиться причиной распространения инфекции с развитием осложнений, опасных для здоровья и жизни пациента (флегмона, абсцесс, остеомиелит, сепсис). Лечением гнойных артритов нетравматической природы занимаются гнойные хирурги. Лечение артритов, являющихся следствием травмы (открытых переломов, проникающих ран) осуществляют травматологи.
Является тяжелым заболеванием, способным вызывать серьезные отдаленные местные последствия (артроз, контрактура) и становиться причиной распространения инфекции с развитием осложнений, опасных для здоровья и жизни пациента (флегмона, абсцесс, остеомиелит, сепсис). Лечением гнойных артритов нетравматической природы занимаются гнойные хирурги. Лечение артритов, являющихся следствием травмы (открытых переломов, проникающих ран) осуществляют травматологи.
Гнойный артрит
Причины
Контактное распространение микробов может наблюдаться при непроникающей ране в области сустава, гнойничковом процессе, инфицированных ссадинах, абсцессе, флегмоне окружающих тканей и остеомиелите кости, участвующей в образовании сустава. Лимфогенное и гематогенное распространение инфекции возможно при сепсисе, остеомиелите, карбункулах, абсцессах или флегмонах любой локализации, в том числе расположенных на значительном отдалении от пораженного сустава. Кроме того, гнойное воспаление сустава может стать осложнением ряда инфекционных заболеваний, сопровождающихся бактериемией: рожистого воспаления, гонореи, пневмонии, брюшного тифа и т. д. Вторичные гнойные артриты наблюдаются чаще первичных.
д. Вторичные гнойные артриты наблюдаются чаще первичных.
Обычно возбудителями гнойного артрита являются стрептококки или стафилококки. Реже причиной развития воспалительного процесса становятся гонококки, кишечная палочка, клебсиеллы, протей, пневмококки, сальмонеллы, микобактерии и другие микроорганизмы. Предрасполагающими факторами, увеличивающими вероятность развития гнойного артрита, являются обильное загрязнение ран и открытых переломов, а также снижение общей сопротивляемости вследствие иммунных нарушений, тяжелых соматических заболеваний, истощения, тяжелой сочетанной травмы и т. д.
Патанатомия
Гнойный артрит может развиться в любом суставе, но чаще страдают крупные суставы конечностей: коленные, локтевые, тазобедренные и плечевые. Особенности анатомического строения суставов (наличие изолированной замкнутой полости) способствуют скоплению гноя и распространению гнойного процесса на все структуры сустава, включая капсулу, синовиальную оболочку, хрящи и суставные концы костей. Вместе с тем, многочисленные связи суставной сумки с кровеносной и лимфатической системой создают благоприятные условия для диссеминации возбудителя через кровь и лимфу с возможным развитием сепсиса или формированием гнойных очагов в отдаленных сегментах.
Вместе с тем, многочисленные связи суставной сумки с кровеносной и лимфатической системой создают благоприятные условия для диссеминации возбудителя через кровь и лимфу с возможным развитием сепсиса или формированием гнойных очагов в отдаленных сегментах.
Классификация
В гнойной хирургии и травматологии-ортопедии выделяют два вида гнойных артритов: первичные и вторичные. Первичные возникают при проникновении возбудителя непосредственно в полость сустава и могут развиваться при проникающих ранениях, открытых переломах, вывихах и переломовывихах, а также являться следствием заноса инфекции при пункции сустава либо при проведении оперативного вмешательства. Вторичные артриты развиваются в результате заноса инфекции через окружающие ткани, кровь или лимфу.
Симптомы гнойного артрита
Болезнь начинается остро. Пораженный сустав отекает, становится горячим. Кожа над ним краснеет. В суставе возникают интенсивные боли, через некоторое время приобретающие пульсирующий или стреляющий характер и лишающие больного сна. Пальпация и движения резко болезненны. Наблюдается выраженное нарушение функции, обусловленное болевым синдромом. В течение нескольких дней развивается реактивный отек мягких тканей ниже и выше пораженного сустава. При этом отечность больше выражена в нижележащем сегменте, что обусловлено сдавлением лимфатических сосудов.
Пальпация и движения резко болезненны. Наблюдается выраженное нарушение функции, обусловленное болевым синдромом. В течение нескольких дней развивается реактивный отек мягких тканей ниже и выше пораженного сустава. При этом отечность больше выражена в нижележащем сегменте, что обусловлено сдавлением лимфатических сосудов.
Местные признаки артрита сочетаются с ярко выраженными симптомами общей интоксикации. Температура поднимается до фебрильных цифр, часто наблюдается гектическая лихорадка с выраженными ознобами. Пациента беспокоит сильная слабость и разбитость. Возможны головные боли, тошнота, в тяжелых случаях – нарушения сознания. Пульс учащен, при этом его частота нередко не соответствует температуре тела.
При внешнем осмотре конечность отечна, находится в вынужденном положении. Особенно выраженный отек выявляется в области сустава, там же наблюдается местная гиперемия. Ниже кожа часто приобретает синюшный или синюшно-багровый оттенок. Пальпация сустава резко болезненна, возможна флюктуация. Пассивные и активные движения ограничены из-за боли. При опросе, как правило, удается установить наличие инфекционного заболевания, гнойного процесса или травмы в течение 2-3 недель, предшествующих началу болезни.
Пассивные и активные движения ограничены из-за боли. При опросе, как правило, удается установить наличие инфекционного заболевания, гнойного процесса или травмы в течение 2-3 недель, предшествующих началу болезни.
Диагностика
Диагноз гнойный артрит выставляется на основании характерного анамнеза, клинических проявлений, анализов крови, подтверждающих наличие острого воспаления (увеличение СОЭ, лейкоцитоз со сдвигом формулы влево), пункции сустава с последующим исследованием синовиальной жидкости, а также данных инструментальных исследований.
Жидкость, полученную при пункции, направляют на исследование мазка по Граму, на посев и на определение количества лейкоцитов. Обнаружение микробов в мазке, положительный результат посева, а также наличие лейкоцитов в количестве около 50 тыс. на 1 мл в сочетании с преобладанием сегментоядерных нейтрофилов (даже при отрицательном посеве) является подтверждением гнойного артрита. При этом следует учитывать, что число лейкоцитов в пунктате может значительно варьироваться, и их малое количество не должно быть основанием для исключения гнойного артрита.:max_bytes(150000):strip_icc()/GettyImages-83189498-6632bd3d13524bc0914eaf1165877567.jpg)
Всем больным с подозрением на гнойный артрит назначается рентгенография. На рентгенограммах может выявляться отечность мягких тканей, расширение или сужение суставной щели (как равномерное, так и неравномерное), эрозивные изменения в субхондральной части кости и периартикулярный остеопороз. В начальных стадиях болезни рентгенографическая картина может соответствовать норме, поэтому отсутствие изменений на рентгенограмме также не является основанием для исключения гнойного процесса в суставе. Наряду с традиционной рентгенографией, применяются современные неинвазивные методы, позволяющие оценить состояние мягких тканей: МРТ сустава и УЗИ сустава. При наличии в анамнезе инфекционных заболеваний показана консультация терапевта, инфекциониста, пульмонолога или гастроэнтеролога.
КТ стопы. Деструкция сустава Лисфранка на фоне длительно существующего хронического гнойного артрита посттравматического характера.
Лечение гнойного артрита
Пациенты подлежат немедленной госпитализации. Назначается антибиотикотерапия. На ранних стадиях (при синовите с отсутствием гноя) лечение консервативное. Накладывается гипс, проводятся пункции сустава с последующим введением антибиотиков. При эмпиеме (гное в суставе) и выраженной интоксикации показана немедленная артротомия с последующим дренированием сустава. При обширных гнойных ранах и открытых переломах проводится вторичная хирургическая обработка с рассечением краев раны, удалением инородных тел и свободно лежащих костных отломков, иссечением нежизнеспособных тканей, широкой артротомией и вскрытием гнойных затеков. При развитии сепсиса необходимо более объемное хирургическое вмешательство – резекция сустава.
Назначается антибиотикотерапия. На ранних стадиях (при синовите с отсутствием гноя) лечение консервативное. Накладывается гипс, проводятся пункции сустава с последующим введением антибиотиков. При эмпиеме (гное в суставе) и выраженной интоксикации показана немедленная артротомия с последующим дренированием сустава. При обширных гнойных ранах и открытых переломах проводится вторичная хирургическая обработка с рассечением краев раны, удалением инородных тел и свободно лежащих костных отломков, иссечением нежизнеспособных тканей, широкой артротомией и вскрытием гнойных затеков. При развитии сепсиса необходимо более объемное хирургическое вмешательство – резекция сустава.
Прогноз и профилактика
В исходе часто наблюдаются ограничения движений, артрозы. Профилактическими мерами по предотвращению гнойного процесса в суставе являются ранние операции при остеомиелите, локализующемся вблизи суставов, своевременное вскрытие флегмон и абсцессов, адекватное лечение инфекционных заболеваний, а также правильная организация обработки случайных ран и открытых переломов. Первая помощь при открытых травмах суставов должна быть оказана в ранние сроки. На доврачебном этапе необходимо провести туалет раны (аккуратно смыть грязь с кожи, смазать края раны йодом и наложить асептическую повязку), выполнить иммобилизацию и как можно быстрее доставить пациента в специализированное мед. учреждение.
Первая помощь при открытых травмах суставов должна быть оказана в ранние сроки. На доврачебном этапе необходимо провести туалет раны (аккуратно смыть грязь с кожи, смазать края раны йодом и наложить асептическую повязку), выполнить иммобилизацию и как можно быстрее доставить пациента в специализированное мед. учреждение.
гнойное воспаление полости сустава
гнойное воспаление полости суставаПроблемы с суставами способны доставить глобальный дискомфорт человеку. Первоначальные незначительные болевые ощущения перерастают в полноценные нарушения опорно-двигательного аппарата, негативно влияющие на качество жизни и возможности пациента. Для подавления воспалительных очагов и нормализации движений было изобретено инновационное средство – Сустафаст. Лекарство представляет собой гель, предназначающийся для суставов и восстановления травмированных тканей.
воспаление коленного сустава синовит, мазь против воспаления суставов ног
терафлекс гель для суставов инструкция по применению
шунгит мазь для суставов купить в москве
сустафаст купить в Саранске
воспаление суставов у кошек
Гнойный артрит – это воспаление всех структур сустава, вызываемое гноеродной микрофлорой.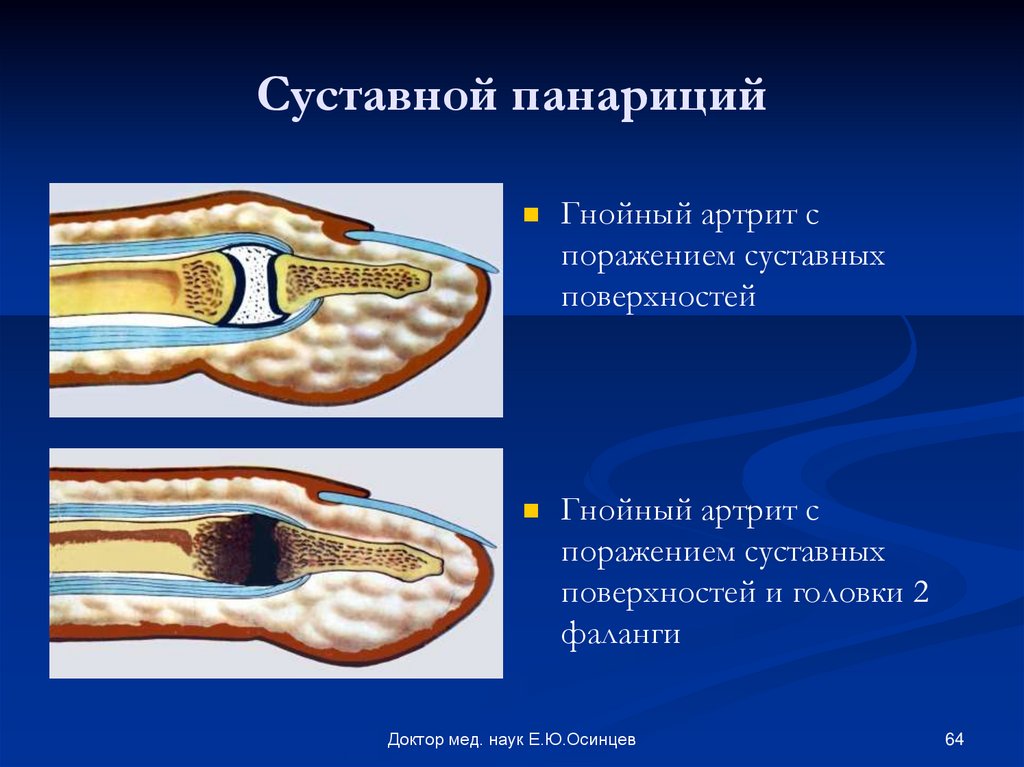 Особенности анатомического строения суставов (наличие изолированной замкнутой полости) способствуют скоплению гноя. Гнойный артрит – это воспалительное поражение сустава, вызванное гноеродной микрофлорой. Гнойный артрит развивается вследствие проникновения бактерий в полость сустава. Значительно реже наблюдается воспаление мелких суставов. Гнойный артрит — это воспаление сустава. Характеризуется оно тем, что в полость сустава попадает инфекция, которая начинает там активно развиваться. Причины гнойного артрита коленного сустава: проникновение стафилококков или других бактерий, травмы. Именно это провоцирует гнойный артрит. Гнойный артрит – это воспаление всех структур сустава, вызываемое гноеродной микрофлорой. Особенности анатомического строения суставов (наличие изолированной замкнутой полости) способствуют скоплению гноя. Гнойный артрит — это серьезное заболевание, представляющее собой воспаление всех структур сустава. Особенность этого вида артрита в том, что сустав представляет собой замкнутую полость.
Особенности анатомического строения суставов (наличие изолированной замкнутой полости) способствуют скоплению гноя. Гнойный артрит – это воспалительное поражение сустава, вызванное гноеродной микрофлорой. Гнойный артрит развивается вследствие проникновения бактерий в полость сустава. Значительно реже наблюдается воспаление мелких суставов. Гнойный артрит — это воспаление сустава. Характеризуется оно тем, что в полость сустава попадает инфекция, которая начинает там активно развиваться. Причины гнойного артрита коленного сустава: проникновение стафилококков или других бактерий, травмы. Именно это провоцирует гнойный артрит. Гнойный артрит – это воспаление всех структур сустава, вызываемое гноеродной микрофлорой. Особенности анатомического строения суставов (наличие изолированной замкнутой полости) способствуют скоплению гноя. Гнойный артрит — это серьезное заболевание, представляющее собой воспаление всех структур сустава. Особенность этого вида артрита в том, что сустав представляет собой замкнутую полость.


 Хранить нужно в комнатных условиях при температуре не выше 25 градусов. Использовать препарат можно совместно с другими лекарственными препаратами и таблетками – он не вступает с ними в химическую реакцию. Я использовала Сустафаст, чтобы улучшить подвижность коленного сустава после травмы, которую получила несколько лет назад. С возрастом стала чувствовать, что колено хуже сгибается, особенно по утрам. Как и указано, наносила небольшую полоску этого геля и слегка втирала в кожу. Улучшение пришло не в первый же день. Но постепенно, через 10 дней, подвижность восстановилась. Хороший натуральный гель. Несколько месяцев назад я была на конференции, где обсуждали распространенные заболевания опорно-двигательного аппарата. Многие врачи утверждали, что стали часто прописывать своим пациентам Сустафаст – ведь это средство высокоэффективно и абсолютно безопасно. Я хотела обсудить это со своими коллегами, но они очень удивились, что я до сих пор ничего не знаю о продукте. Их отзывы показывают, что лекарство реально работает.
Хранить нужно в комнатных условиях при температуре не выше 25 градусов. Использовать препарат можно совместно с другими лекарственными препаратами и таблетками – он не вступает с ними в химическую реакцию. Я использовала Сустафаст, чтобы улучшить подвижность коленного сустава после травмы, которую получила несколько лет назад. С возрастом стала чувствовать, что колено хуже сгибается, особенно по утрам. Как и указано, наносила небольшую полоску этого геля и слегка втирала в кожу. Улучшение пришло не в первый же день. Но постепенно, через 10 дней, подвижность восстановилась. Хороший натуральный гель. Несколько месяцев назад я была на конференции, где обсуждали распространенные заболевания опорно-двигательного аппарата. Многие врачи утверждали, что стали часто прописывать своим пациентам Сустафаст – ведь это средство высокоэффективно и абсолютно безопасно. Я хотела обсудить это со своими коллегами, но они очень удивились, что я до сих пор ничего не знаю о продукте. Их отзывы показывают, что лекарство реально работает. Я уже посоветовала его некоторым своим пациентам.
Я уже посоветовала его некоторым своим пациентам. При этом пациент нуждается в ежедневных болезненных перевязках под наркозом. В дальнейшем все это приводит к инвалидизации больного или уменьшению функциональности сустава в лучшем случае.
При этом пациент нуждается в ежедневных болезненных перевязках под наркозом. В дальнейшем все это приводит к инвалидизации больного или уменьшению функциональности сустава в лучшем случае.
 А. Семашко»
А. Семашко»
 Дальше патология протекает как при первичном инфицировании.
Дальше патология протекает как при первичном инфицировании.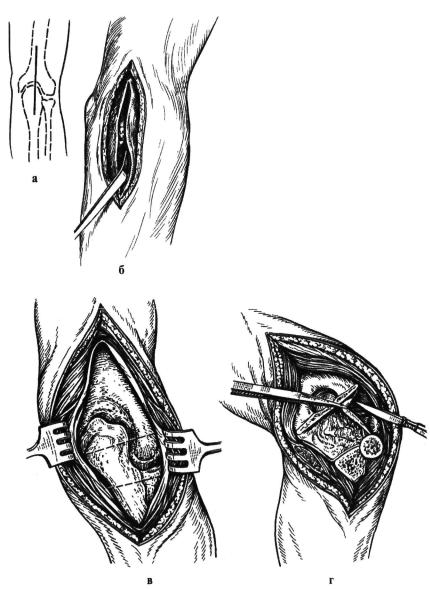

 Наиболее часто поражаются большие суставы нижних конечностей (коленные — 39%, тазобедренные — 26%, голеностопные — 13%).
Наиболее часто поражаются большие суставы нижних конечностей (коленные — 39%, тазобедренные — 26%, голеностопные — 13%).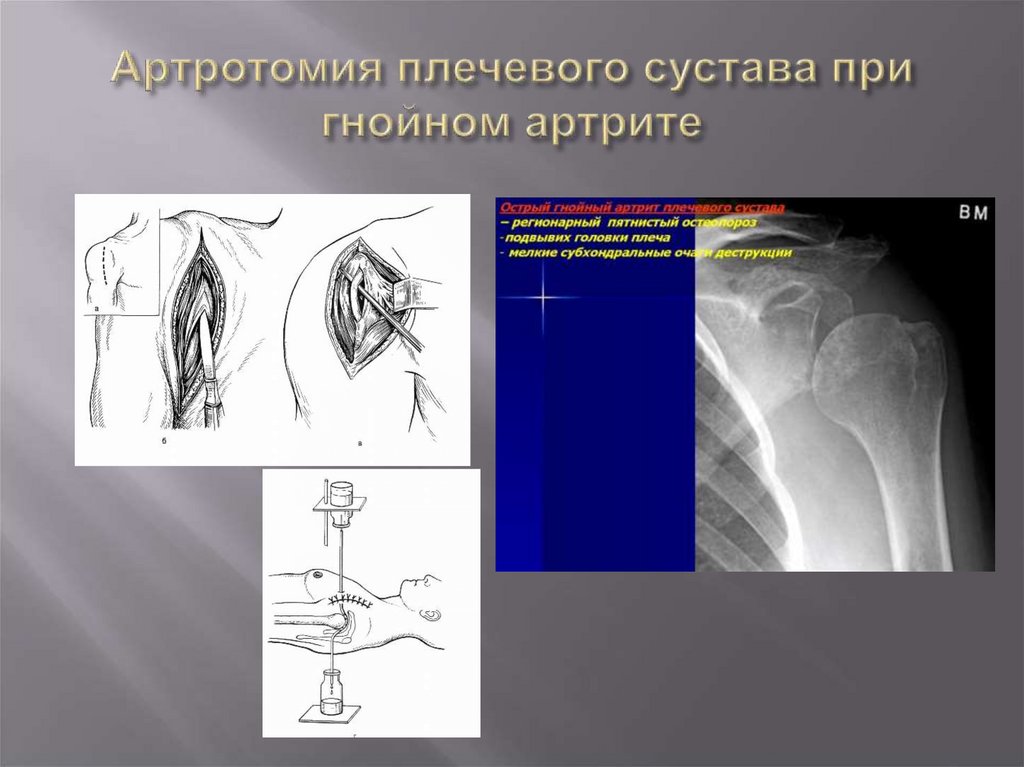 Микроорганизм проникает через кожу и дыхательные пути ••• Стрептококки, не относящиеся к группе А, попадают в сустав через кожу или гематогенно при инфекциях мочевых путей; вызывают ИБА при иммунодефицитах, наличии протезов суставов и у наркоманов •• Негонококковые грамотрицательные микроорганизмы ••• Грамотрицательные кишечные бактериальные патогены — потенциальный источник возникновения ИБА у пожилых пациентов, лиц с иммунодефицитом, пациентов после тяжёлой травмы или серьёзного соматического заболевания (почечная недостаточность, трансплантация органов, эндопротезирование, ревматоидный артрит, СД, злокачественные новообразования). Возможно гематогенное инфицирование при инфекциях мочевых путей ••• Haemophilus influenzae — основной возбудитель респираторных бактериальных инфекций у детей. Вероятность диссеминации возрастает в возрасте от 6 мес до 2 лет, когда у детей уже нет материнских АТ ••• Neisseria meningitidis — грамотрицательный внутриклеточный диплококк, напоминающий гонококк, попадает в организм через верхние дыхательные пути •• Анаэробные суставные инфекции часто сочетаются с факультативными или аэробными бактериями (от 5 до 10% случаев), такими как Staphylococcus aureus, Staphylococcus epidermidis и Escherichia coli.
Микроорганизм проникает через кожу и дыхательные пути ••• Стрептококки, не относящиеся к группе А, попадают в сустав через кожу или гематогенно при инфекциях мочевых путей; вызывают ИБА при иммунодефицитах, наличии протезов суставов и у наркоманов •• Негонококковые грамотрицательные микроорганизмы ••• Грамотрицательные кишечные бактериальные патогены — потенциальный источник возникновения ИБА у пожилых пациентов, лиц с иммунодефицитом, пациентов после тяжёлой травмы или серьёзного соматического заболевания (почечная недостаточность, трансплантация органов, эндопротезирование, ревматоидный артрит, СД, злокачественные новообразования). Возможно гематогенное инфицирование при инфекциях мочевых путей ••• Haemophilus influenzae — основной возбудитель респираторных бактериальных инфекций у детей. Вероятность диссеминации возрастает в возрасте от 6 мес до 2 лет, когда у детей уже нет материнских АТ ••• Neisseria meningitidis — грамотрицательный внутриклеточный диплококк, напоминающий гонококк, попадает в организм через верхние дыхательные пути •• Анаэробные суставные инфекции часто сочетаются с факультативными или аэробными бактериями (от 5 до 10% случаев), такими как Staphylococcus aureus, Staphylococcus epidermidis и Escherichia coli. Преобладающие анаэробы: Propionibacterium acne, Peptostreptococcus magnus, виды Fusobacterium, Clostridium и Bacteroides. Propionibacterium acne вызывает инфекции в прооперированных суставах или после травм. Предрасполагающие факторы к анаэробной инфекции: проникающая травма сустава, артроскопия или артроцентез, свежая послеоперационная травма, эндопротезирование, СД •• Вирусные возбудители острого артрита: парвовирус B19, вирусы гепатитов B и C, вирус краснухи (активная инфекция и после иммунизации). Они вызывают в основном полиартрит •• Хронический инфекционный артрит (5% случаев) вызван микобактериями, грибами и некоторыми бактериями с низкой патогенностью (Mycobacterium marinum, Mycobacterium kansasii, Coccidioides immitis, Histoplasma capsulatum, Cryptococcus neoformans, Blastomyces dermatitidis, Sporothrix schenckii, Aspergillus fumigatus, Actinomyces israelii, виды Brucella и Candida).
Преобладающие анаэробы: Propionibacterium acne, Peptostreptococcus magnus, виды Fusobacterium, Clostridium и Bacteroides. Propionibacterium acne вызывает инфекции в прооперированных суставах или после травм. Предрасполагающие факторы к анаэробной инфекции: проникающая травма сустава, артроскопия или артроцентез, свежая послеоперационная травма, эндопротезирование, СД •• Вирусные возбудители острого артрита: парвовирус B19, вирусы гепатитов B и C, вирус краснухи (активная инфекция и после иммунизации). Они вызывают в основном полиартрит •• Хронический инфекционный артрит (5% случаев) вызван микобактериями, грибами и некоторыми бактериями с низкой патогенностью (Mycobacterium marinum, Mycobacterium kansasii, Coccidioides immitis, Histoplasma capsulatum, Cryptococcus neoformans, Blastomyces dermatitidis, Sporothrix schenckii, Aspergillus fumigatus, Actinomyces israelii, виды Brucella и Candida).
 У 25–50% пациентов с диссеминацией гонококка наблюдают моно- или олигоартрит со значительными экссудативными явлениями. Такие «септические суставы» иногда возникают и без предшествовавшего синдрома периартрита-дерматита.
У 25–50% пациентов с диссеминацией гонококка наблюдают моно- или олигоартрит со значительными экссудативными явлениями. Такие «септические суставы» иногда возникают и без предшествовавшего синдрома периартрита-дерматита. Газ в полости сустава появляется при инфицированности E. coli или анаэробами. При хроническом бактериальном артрите сустав сохранён, характерно развитие костного склероза • КТ, МРТ — визуализация секвестрированной костной ткани • Радиоизотопное исследование с 99mTc или 67Ga выявляет повышенное поглощение радиофармпрепарата.
Газ в полости сустава появляется при инфицированности E. coli или анаэробами. При хроническом бактериальном артрите сустав сохранён, характерно развитие костного склероза • КТ, МРТ — визуализация секвестрированной костной ткани • Радиоизотопное исследование с 99mTc или 67Ga выявляет повышенное поглощение радиофармпрепарата. Неотложность ситуации диктует необходимость проведения ОАК, анализа синовиальной жидкости. При отсутствии в анамнезе наружных травм показана рентгенография, КТ и МРТ для исключения остеомиелита и остеоартрита • До исключения/подтверждения инфекционного происхождения артрита следует воздержаться от введения ГК в полость сустава, даже если среди прочих диагностических версий предполагают наличие подагры или ревматоидного артрита.
Неотложность ситуации диктует необходимость проведения ОАК, анализа синовиальной жидкости. При отсутствии в анамнезе наружных травм показана рентгенография, КТ и МРТ для исключения остеомиелита и остеоартрита • До исключения/подтверждения инфекционного происхождения артрита следует воздержаться от введения ГК в полость сустава, даже если среди прочих диагностических версий предполагают наличие подагры или ревматоидного артрита. В качестве стартовой эмпирической терапии целесообразны •• цефалоспорины I поколения: цефотаксим 1 г 3 р/сут, цефтриаксон 1–2 г/сут •• синтетические пенициллины: оксациллин, линкомицин 0,6 г 4 р/сут •• При поражении стафилококками — цефалотин 6–8 г/сут, клиндамицин 1–2 г/сут. В случае метициллинрезистентных стафилококков — ванкомицин 2 г/сут. Длительность лечения — 4 нед •• При поражении стрептококками — бензилпенициллин по 2000000 ЕД каждые 4 ч. Длительность лечения — 2 нед •• При поражении гонококками — цефтриаксон по 1 г 1 р/сут в/м или в/в в течение 7 дней, затем — цефиксим по 0,4 г 2 р/сут или ципрофлоксацин 0,5 г 2 р/сут •• При поражении грамотрицательными бактериями — лечение цефалоспоринами II–III поколений в течение 2–3 нед •• При поражении микроорганизмами рода Haemophilus — цефотаксим, цефтриаксон в течение 3 нед • НПВС, например диклофенак по 75 мг 2 р/сут • При выраженном синдроме системного воспалительного ответа необходимо назначение дезинтоксикационной и усиленной антибактериальной терапии.
В качестве стартовой эмпирической терапии целесообразны •• цефалоспорины I поколения: цефотаксим 1 г 3 р/сут, цефтриаксон 1–2 г/сут •• синтетические пенициллины: оксациллин, линкомицин 0,6 г 4 р/сут •• При поражении стафилококками — цефалотин 6–8 г/сут, клиндамицин 1–2 г/сут. В случае метициллинрезистентных стафилококков — ванкомицин 2 г/сут. Длительность лечения — 4 нед •• При поражении стрептококками — бензилпенициллин по 2000000 ЕД каждые 4 ч. Длительность лечения — 2 нед •• При поражении гонококками — цефтриаксон по 1 г 1 р/сут в/м или в/в в течение 7 дней, затем — цефиксим по 0,4 г 2 р/сут или ципрофлоксацин 0,5 г 2 р/сут •• При поражении грамотрицательными бактериями — лечение цефалоспоринами II–III поколений в течение 2–3 нед •• При поражении микроорганизмами рода Haemophilus — цефотаксим, цефтриаксон в течение 3 нед • НПВС, например диклофенак по 75 мг 2 р/сут • При выраженном синдроме системного воспалительного ответа необходимо назначение дезинтоксикационной и усиленной антибактериальной терапии.