1) определение и отличие от посмертного свертывания 2) стадии тромбозообразования и их характеристика 3) причины и патогенез тромбоза 4) классификация тромбов по морфологии 5) исходы
1) Тромбоз — прижизненное свертывание крови в просвете сосуда или в полостях сердца. В отличие от тромба посмертные сгустки гладкие, блестящие, эластичные, свободно лежат в просвете вен (не образуются при смерти от асфиксии).
2) Стадии тромбообразования:
1. Агглютинация тромбоцитов: выпадение тромбоцитов из тока крови и прилипание к месту повреждения эндотелия → высвобождение агглютинирующего гиаломера тромбоцитами (периферическая зона) → дегрануляция тромбоцитов → высвобождение тромбопластического фактора и образование активного тромбопластина
2. Коагуляция фибриногена и образования фибрина (матрица для фибрина — оголенная центральная зона тромбоцитов — грануломер, содержащий ретрактозим пластинок): протромбин + активный тромбопластин + ионы Са2+ → тромбин + фибриноген → фибрин-мономер + фибринстимулирующий фактор → фибрин-полимер → ретракция («сжатие») сгустка при участии ретрактозима
3.
4. Преципитация белков плазмы: осаждение белков плазмы на уже имеющемся свертке.
3) Причины и патогенез тромбоза:
а) местные факторы:
Внимание!
Если вам нужна помощь в написании работы, то рекомендуем обратиться к профессионалам. Более 70 000 авторов готовы помочь вам прямо сейчас. Бесплатные корректировки и доработки. Узнайте стоимость своей работы.
2. замедление и нарушение (завихрение) тока крови (чаще тромбы в венах ног, при декомпенсации СН — застойные тромбы; образование тромбов в местах бифуркаций)
б) общие факторы:
1. нарушение регуляции свертывающей и противосвертывающей систем крови (активация после операции свертывающей системы в ответ на травму)
нарушение регуляции свертывающей и противосвертывающей систем крови (активация после операции свертывающей системы в ответ на травму)
2. изменение состава крови (увеличение содержания фибриногена, тромбоцитов, изменения вязкости и реологии крови при гемобластозах, аутоиммунных болезнях)
4) Тромб обычно прикреплен к стенке сосуда, поверхность гофрирована, плотной консистенции, сухой, состоит из ветвящихся балок склеившихся тромбоцитов и находящихся между ними пучков фибрина с эритроцитами и лейкоцитами.
Классификация тромбов по морфологии:
а) белый тромб — тромбоциты+фибрин+лейкоциты — образуется медленно при быстром токе крови (артерии)
б) красный тромб — тробоциты+фибрин+эритроциты — образуется быстро при медленном токе крови (вены)
в) смешанный (слоистый) тромб — имеет слоистое пестрое строение, состоит из головки (строение белого тромба, прикреплена к эндотелию), тела (собственно смешанный тромб) и хвоста (строение красного тромба) — чаще в венах, в полостях аневризмы аорты и сердца
г) гиалиновый тромб — тромбоциты+эритроциты+преципитирующие белки плазмы — в сосудах МЦР
Тромбы: 1) пристеночные — большая часть просвета свободна — часто на эндокарде, в ушках, в крупных артериях при атеросклерозе и 2) закупоривающие (обтурирующие) — чаще в венах и мелких артериях
В зависимости от роста: 1) прогрессирующий тромб — растет по току крови 2) шаровидный тромб — «отшлифованный» в полости сердца тромб 3) дилатационный — тромб в аневризмах
5) Исходы тромбоза:
а) благоприятные: 1.
б) неблагоприятные: 1. отрыв тромба и его части → тромбоэмбол 2. септическое расплавление тромба и тромбобактериальная эмболия сосудов при сепсисе.
Поможем написать любую работу на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Тромбоз глубоких вен нижних конечностей причины возникновения, симптомы и лечение тромбоза :: АЦМД
Глубокая венозная система нижних конечностей играет основную роль в оттоке венозной крови от нижних конечностей, в норме обеспечивая отток 80-90% крови. При возникновении тромбоза глубоких вен нижних конечностей затрудняется отток большей части крови от нижних конечностей. Тромбоз глубоких вен – состояние, возникающее в следствии образования тромба в просвете вен нижних конечностей. Данное состояние является угрожающим жизни, в связи с возможностью отрыва тромба и миграции его с током крови к легочной артерии, что в таком случае приводит к возникновению тромбэмболии легочной артерии. Тромбоз глубоких вен является одной из основных причин тромбэмболии легочной артерии. В свою очередь, приблизительно треть всех случаев внезапной смерти вызывается тромбоэмболией легочной артерии.
При возникновении тромбоза глубоких вен нижних конечностей затрудняется отток большей части крови от нижних конечностей. Тромбоз глубоких вен – состояние, возникающее в следствии образования тромба в просвете вен нижних конечностей. Данное состояние является угрожающим жизни, в связи с возможностью отрыва тромба и миграции его с током крови к легочной артерии, что в таком случае приводит к возникновению тромбэмболии легочной артерии. Тромбоз глубоких вен является одной из основных причин тромбэмболии легочной артерии. В свою очередь, приблизительно треть всех случаев внезапной смерти вызывается тромбоэмболией легочной артерии.
Причины возникновения тромбоза глубоких вен
К возникновению тромбоза глубоких вен приводят различные причины, среди которых травмы конечностей, недавно перенесенные оперативные вмешательства, онкологические заболевания, химиотерапевтическое лечение, длительная иммобилизация и гиподинамия, гематологические заболевания, варикотромбофлебит поверхностных вен, прием гормональных контрацептивов, беременность и послеродовый период, ожирение, пожилой возраст и др.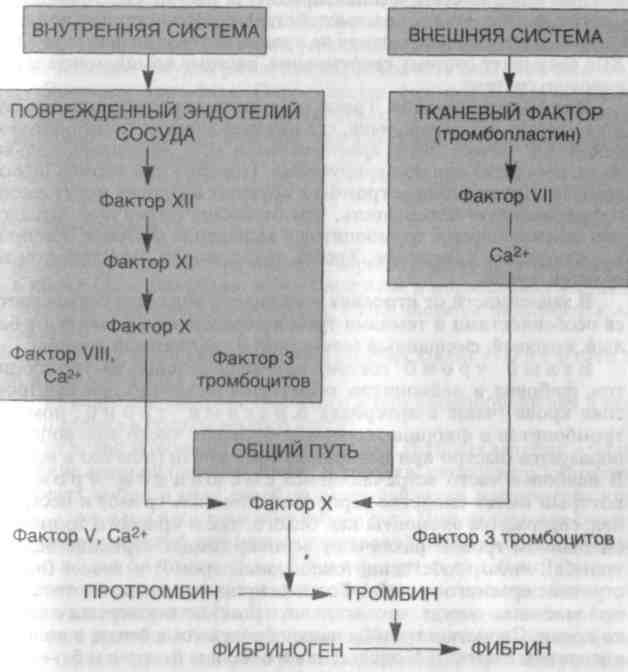
Симптомы тромбоза
Клиническая картина прямо пропорциональна степени распространения тромботического процесса. В начальной стадии тромбообразования возникают боли в нижней конечности, отек, повышение температуры. В случаях тотального тромбоза глубокой системы с переходом на подвздошные вены может развиться синяя флегмазия, характеризующая нарушением общего состояния, высокой температурой, изменением цвета кожных покровов до фиолетового оттенка, увеличением окружности конечности в несколько раз и выраженым болевым синдромом. Различают несколько стадий тромботического процесса: стадия формирования тромба, стадия организации и стадия реканализации. Наиболее опасен тромбоз в начальной стадии, когда тромботические массы еще не фиксированы к стенке вены. В этот период наиболее высокая вероятность тромбэмболии. В последующем тромб организуется и фиксируется к стенке вены. В определенных случаях возникает флотирующий тромб – свободно «болтающаяся», не фиксированная верхушка тромба, представляющая угрозу отрыва. По истечении времени происходит реканализация тромба – рассасывание тромба с восстановлением просвета вены в той или иной степени. Но, к сожалению, безвозвратно гибнут клапаны, регулирующие однонаправленный ток крови, что приводит к развитию посттромбофлебитического синдрома.
По истечении времени происходит реканализация тромба – рассасывание тромба с восстановлением просвета вены в той или иной степени. Но, к сожалению, безвозвратно гибнут клапаны, регулирующие однонаправленный ток крови, что приводит к развитию посттромбофлебитического синдрома.
Методы лечения тромбоза глубоких вен
Методы лечения зависят от стадии заболевания, состояния тромботических масс и распространенности тромботического процесса. Лечение преимущественно консервативное, в отдельных случаях показано хирургическое лечение. Чем раньше начато лечение, тем благоприятнее прогноз – многократно уменьшается риск тромбэмболии, прекращается дальнейшее распространение тромба, происходит в большей степени реканализация (восстановление) просвета сосуда, в связи с чем минимизируются проявления посттромбофлебитического синдрома на всю последующую жизнь.
При наличии жалоб клинически и с помощью инструментальных методов исследования удается поставить правильный диагноз и назначить курс необходимого лечения, а в отдельных случаях и спасти жизнь пациенту.
В АЦМД-Медокс Вас проконсультирует сосудистый хирург, при необходимости Вам буде проведена ультразвуковая диагностика сосудов (дуплексное сканирование сосудов) и др.инструментальные исследования.
Помните! Раннее обращение к сосудистому хирургу способствует более эффективному лечению и лучшему отдаленному прогнозу.
Врачи инновации наука — детям
Руководители проекта:
М.А. Пантелеев – заведующий лабораторией клеточного гемостаза и тромбоза НМИЦ ДГОИ им. Дмитрия Рогачева, д.ф.-м.н., профессорПочему этот проект важен?
Существующие методы диагностики нарушений тромбоцитарного гемостаза обладают низкой чувствительностью и специфичностью. Единственный способ понять, насколько тромбоциты человека могут формировать тромбы – вырастить такой тромб в лабораторных условиях.
Ведущим направлением исследований в этой области является попытка разработать интегральные тесты тромбоцитарного гемостаза, основанные на выращивании тромбов в микрофлюидных системах и видеомикроскопических наблюдениях за ними с помощью флуоресцентной микроскопии.
Это исследование является уникальным научным проектом, так как в мире подобные подходы начинают разрабатываться всего несколькими компаниями и научными командами, включая международный Biorheology Committee of ISTH, в работе которого участвует проектная группа специалистов нашего центра.
В центре им. Дмитрия Рогачева фундаментальные исследования роста тромбов в проточных камерах проводятся на протяжении 3 лет. Сейчас начата работа по внедрению этого лабораторного метода в клиническую практику.
Продолжительность проекта: 2017 — 2021 гг.
Чего мы достигли?
Проект находится на стадии апробации клинической методики.
В январе 2019 года в журнале Arteriosclerosis, Thrombosis, and Vascular Biology вышла важная статья, в которой мы фактически пересмотрели концепцию об артериальном тромбозе. Это актуально как для детей, так и для взрослых. Нам удалось обнаружить, что часть умирающих тромбоцитов в ходе активации, несмотря на то, что они умирают, выходят из тромба, а на их поверхности идут реакции свертывания крови. В статье описан один из ее вариантов.
Нам удалось обнаружить, что часть умирающих тромбоцитов в ходе активации, несмотря на то, что они умирают, выходят из тромба, а на их поверхности идут реакции свертывания крови. В статье описан один из ее вариантов.
Clot Contraction Drives the Translocation of Procoagulant Platelets to Thrombus Surface. Nechipurenko DY, Receveur N, Yakimenko AO, Shepelyuk TO, Yakusheva AA, Kerimov RR, Obydennyy SI, Eckly A, Léon C, Gachet C, Grishchuk EL, Ataullakhanov FI, Mangin PH, Panteleev MA. Arterioscler Thromb Vasc Biol. 2019 Jan;39(1):37-47. doi: 10.1161/ATVBAHA.118.311390.
Влияние COVID-19 на течение тромбообразования
Повышенный риск венозной тромбоэмболии представляет собой серьезную проблему для тяжелобольных пациентов с COVID-19 [4,10]. По данным исследователей диссеминированное внутрисосудистое свертывание (ДВС-синдром) наблюдалось у 71,4% пациентов, умерших от тяжелой формы COVID-19. У пациентов с ДВС-синдромом наблюдался повышенный уровень D-димера и фибриногена, низкий уровень антитромбина и застойные явления в легких с микроваскулярным тромбозом и окклюзией.
Клиническими характеристиками гиперкоагуляции у пациентов с коронавирусной инфекцией были: повышенный уровень С-реактивного белка, нормальное или повышенное количество тромбоцитов, нормальные показатели протромбинового времени и активированного частичного тромбопластинового времени, повышенный уровень фибриногена и резко повышенный уровень D-димера. Фактор VIII и фактор фон Виллебранда были увеличены. Антитромбин был незначительно снижен [6].
В Италии антитромбоцитарная терапия, включающая ацетилсалициловую кислоту, Клопидогрель, Тирофибан и Фондапаринукс, показала свою эффективность в уменьшении гипоксемии и успешном прекращении ИВЛ у пациентов с тяжелой дыхательной недостаточностью, двусторонними легочными инфильтратами и D-димером, превышающим верхний предел в 3 раза.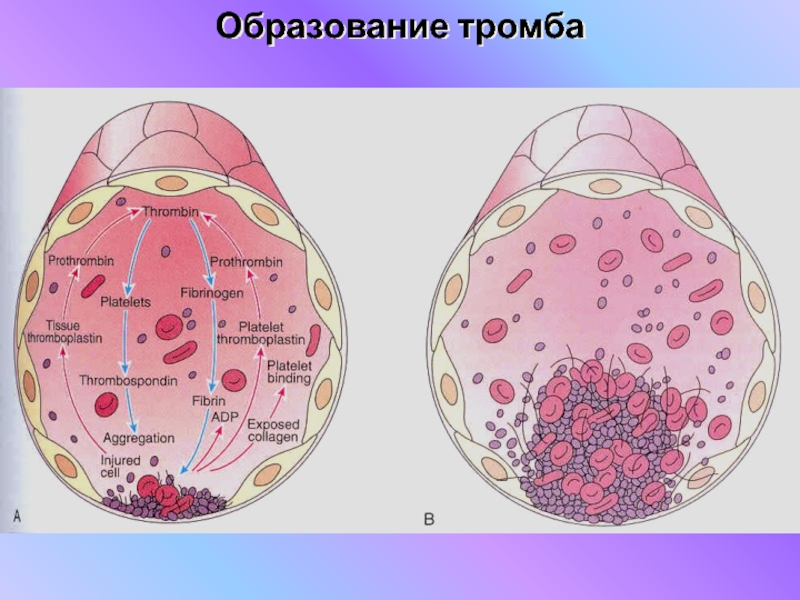
Согласно последнему отчету ВОЗ, пациенты с COVID-19 в легкой форме выздоравливают в течение двух недель [11]. В то же время рядом исследователей сообщалось о случаях легкой формы COVID-19, осложнившихся венозной тромбоэмболией в фазе реконвалесценции коронавирусной инфекции, когда симптомы, связанные с острым периодом, уже исчезли. [3]
В этих случаях отмечался повышенный уровень провоспалительных цитокинов, таких как интерлейкин 1B (IL 1B), интерферон-гамма (IFN-γ), индуцибельный белок 10 (IP10), моноцитарный хемоаттрактантный белок 1 (MCP1) и фактор некроза опухоли альфа (TNF-α) [2]. Воспалительный ответ вызывает повреждение эндотелия сосудов, нарушая его «тромбозащитное» состояние. И воспаление, и повреждение эндотелия активируют каскад коагуляции, что приводит к аномалиям свертывания, наблюдаемым у пациентов, инфицированных SARS-CoV-2.
Кроме того, повреждение эндотелия, вызванное прямой инвазией SARS-CoV-2 в эндотелиальные клетки, расположенные в паренхиме легких, может быть еще одним фактором, способствующим развитию местных тромботических событий.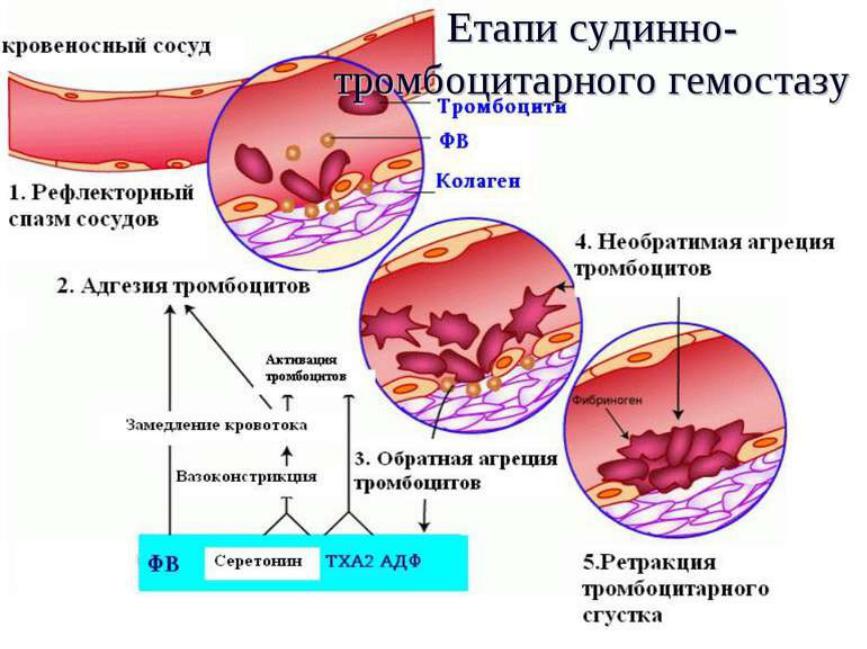 [1]
[1]
Серологические тесты у пациентов, инфицированных SARS-CoV-1, были положительными на антикардиолипин IgM и анти-β2-гликопротеин I IgM. [7] Эти антифосфолипидные антитела были также обнаружены у тяжелобольных пациентов с COVID-19, у которых развились множественные церебральные инфаркты, но волчаночный антикоагулянт не был обнаружен ни у одного из пациентов. [12] Но применение Ривароксабана на практике приводило к ложноположительным результатам для волчаночного антикоагулянта. [5]
Таким образом тромбоэмболические заболевания следует учитывать у тяжелобольных пациентов с COVID-19, у которых наблюдается ухудшение гипоксии и гемодинамическая нестабильность. Острая тромбоэмболия легочной артерии является потенциальным осложнением легких случаев COVID-19 и может возникать на поздних стадиях болезни, когда симптомы, связанные с острым заболеванием, уже исчезли. Это вызывает дискуссию о предотвращении тромбоэмболических событий в избранной группе пациентов с легкой формой COVID-19.
Список литературы:
- Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. 2020; 181:271-80
- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020; 395:497-506
- Jasinowodolinski D, Filisbino MM, Baldi BG. COVID-19 pneumonia: a risk factor for pulmonary thromboembolism? J Bras Pneumol. 2020;46: e20200168-19
- Klok FA, Kruip MJHA, van der Meer NJM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res. 2020; 191:145–147
- Merriman E, Kaplan Z, Butler J, Malan E, Gan E, Tran H. Rivaroxaban and false positive lupus anticoagulant testing. Thromb Haemost. 2011; 105:385-6
- Panigada M, Bottino N, Tagliabue P, et al.
 Hypercoagulability of COVID-19 patients in intensive care unit. A report of thromboelastography findings and other parameters of hemostasis. J Thromb Haemost. 2020;18(7):1738–1742]
Hypercoagulability of COVID-19 patients in intensive care unit. A report of thromboelastography findings and other parameters of hemostasis. J Thromb Haemost. 2020;18(7):1738–1742] - Sun W, Wang BL, Liu BL, Zhao FC, Shi ZC, Guo WS, et al. Osteonecrosis in patients after severe acute respiratory syndrome (SARS): possible role of anticardiolipin antibodies. J Clin Rheumatol. 2010; 16:61-3
- Viecca M, Radovanovic D, Forleo GB, Santus P. Enhanced platelet inhibition treatment improves hypoxemia in patients with severe Covid-19 and hypercoagulability. A case control, proof of concept study. Pharmacol Res. 2020;158: 104950
- Wang J, Hajizadeh N, Moore EE, et al. Tissue plasminogen activator (tPA) treatment for COVID-19 associated acute respiratory distress syndrome (ARDS): a case series. J Thromb Haemost. 2020;18(7):1752–1755.
- Wang T, Chen R, Liu C, et al. Attention should be paid to venous thromboembolism prophylaxis in the management of COVID-19.
 Lancet Haematol. 2020;7(5):e362–e363.
Lancet Haematol. 2020;7(5):e362–e363. - World Health Organization. WHO Director-General’s opening remarks at the media briefing on COVID-19: 24 February 2020. [cited 2020 Aug 12]. Available from: https://www.who.int/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19—24-february-2020
- Zhang Y, Xiao M, Zhang S, Xia P, Cao W, Jiang W, et al. Coagulopathy and antiphospholipid antibodies in patients with Covid-19. N Engl J Med. 2020;382: e38
Сбербанк Капитал :: Инновации
ООО «Сбербанк Капитал» совместно с ОАО «РОСНАНО» — являются инвесторами проекта «Разработка нового метода диагностики нарушений системы свертывания крови— Тромбодинамика», цель которого — разработка, производство и внедрение в клиническую практику нового диагностического теста и оборудования необходимого для проведения исследования.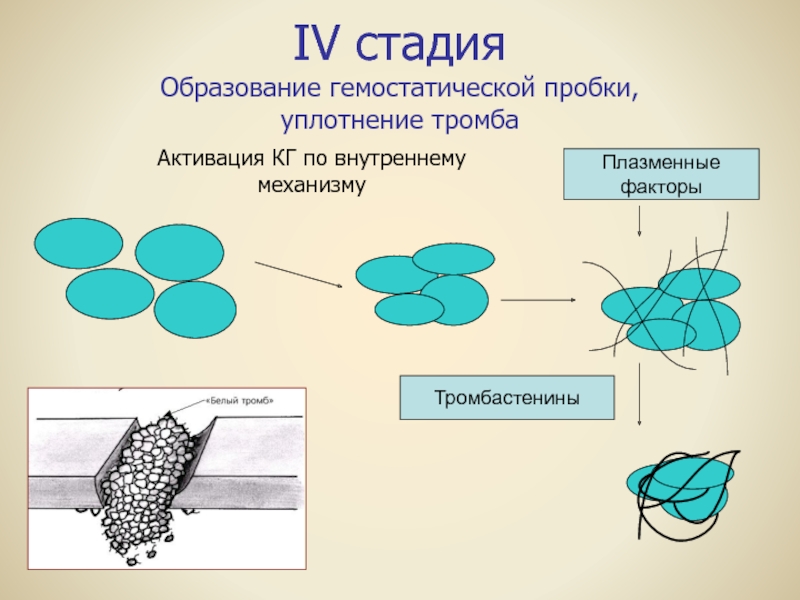
Актуальность проекта
На сегодняшний день тромбозы, ведущие к таким заболеваниям как тромбоэмболия легочной артерии, инфаркт и инсульт, являются непосредственной причиной 57% смертейсреди населения России. Количество людей в России, страдающих от различных болезней крови – порядка 700 тысяч человек.В то же время диагностика таких заболеваний до сих пор несовершенна и актуальна во всем мире.
Разработка компании «ГемаКор», созданная на базе научных исследований российских ученых, не имеет аналогов на рынке и позволяет с высокой точностью диагностировать нарушения системы свертывания крови на ранних стадиях и выявлять риски кровоточивости и тромбообразования (тромбозов).
Уникальность технологии
Тромбодинамика – глобальный тест для ранней диагностики нарушений системы свертывания крови – выявления рисков кровоточивости и тромбообразования.
В основе метода «Тромбодинамика» лежит наблюдение за пространственным ростом фибринового сгустка крови в условиях, максимально приближенных к физиологическим. Для реализации таких условий на искусственном аналоге мембраны клетки было создано нанопокрытие правильно ориентированного белка, содержащего фактор свертывания (тканевый фактор), который активирует весь сложный механизм свертывания крови.
Для реализации таких условий на искусственном аналоге мембраны клетки было создано нанопокрытие правильно ориентированного белка, содержащего фактор свертывания (тканевый фактор), который активирует весь сложный механизм свертывания крови.
При проведении исследования в прозрачнуюкювету с образцом плазмы крови вводится вставка с нанопокрытием, моделирующим поврежденный сосуд, и сгусток образуется в условиях, максимально близких к физиологическим. Тест «Тромбодинамика» универсален – он может применяться не только для оценки состояния пациента и контроля его лечения, но и для подбора индивидуальной дозы препарата, например при антикоагулянтной терапии. Чувствительность теста позволяет использовать его для профилактического скрининга здоровых людей с целью раннего выявления рисков повышенного тромбообразования.
Перспективы
В конце 2012 года компания «ГемаКор» объявила о запуске серийного производства и начале продаж прибора и расходных материалов для диагностики нарушений системы свертывания крови методом «Тромбодинамика» в России.
Высокая социальная значимость проекта и уникальность технологии обеспечивают компании хорошие перспективы выхода на международный рынок.
СПРАВКА
ООО «ГемаКор» – биотехнологическая компания, разработчик новых приборов и методов для диагностики гемостаза. Образована в апреле 2010 года. с целью реализации проекта «Разработка нового метода диагностики нарушений системы свертывания крови — Тромбодинамика». В 2012 году запущено серийное производство приборов и реактивов.
Система диагностическая лабораторная «Регистратор тромбодинамики Т-2»:
Регистрационное удостоверение № ФСР 2012/13248
Сертификат соответствия № РОСС RU.ИМ40.Н00020
Проект реализуется проектной компанией ООО «ГемаКор». Финансовые инвесторы: ОАО «РОСНАНО»и ООО«Сбербанк Капитал».
Подробнее – www.hemacore.com
Наночастицы помогут измерить риск тромбообразования uMEDp
Уровень тромбина в крови можно определить с помощью наночастиц, покрытых белком, который тромбин расщепляет. По расщеплённым фрагментам этого белка в моче можно понять, сколько в крови тромбина и следует ли бояться того, что он спровоцирует появление ненужного тромба.Тромб может возникнуть в любом сосуде и в любое время (разумеется, если у человека есть физиологическая предрасположенность к тромбообразованию), и в такой непредсказуемости главная его опасность. В противном случае появление тромба можно было бы предотвратить и спасти человека — скажем, от инсульта.
Образование тромба в результате свёртывания крови — сложный биохимический процесс, на последнем этапе которого фермент тромбин превращает белок фибриноген в фибрин, образующий нерастворимый плотный сгусток в кровеносном сосуде. В норме этот механизм защищает нас от кровопотери, но иногда тромб может появиться там, где не надо, перекрывая собой большие и мелкие сосуды. Учёные давно пытаются найти способ предсказания возникновения тромбов, засечь этот процесс на ранних стадиях, но до сих пор это плохо удавалось: обычно можно увидеть только побочные продукты разрушения фибриновых волокон. То есть терапия возможна лишь постфактум — после появления финального нерастворимого белка.
Однако исследователям из Массачусетского технологического института (США) удалось создать способ ранней диагностики тромба: в кровь вводятся наночастицы из оксида железа, покрытые белком, который может взаимодействовать с тромбином. Тромбин расщепляет этот белок на специфические элементы, которые потом можно легко обнаружить в моче.
Опыты на животных показали, что количество расщеплённого сигнального белка в моче прямо пропорционально вероятности тромбообразования в сосудах лёгких у мышей. Сами же эти фрагменты можно распознавать с помощью специфических антител, что упрощает применение этого метода в клинической практике.
На самом деле метод разрабатывался для ранней диагностики одного из видов рака, но потом его авторам пришло в голову испробовать его для измерения уровня тромбина. Место будущего тромба таким способом определить вряд ли удастся, зато можно узнать, грозят ли в принципе человеку тромбы, и принять меры, чтобы они не появлялись — где бы то ни было.
Простота теста позволяет надеяться, что он и впрямь скоро войдёт в повседневную медицинскую практику; во всяком случае авторы работы уже рассчитывают на определённую прибыль от созданного ими диагностического метода.
Результаты исследования опубликованы в журнале ACS Nano.
Подготовлено по материалам MIT News.
Дополнительные факторы тромбообразования ушка левого предсердия при неклапанной фибрилляции предсердий | Хорькова
1. Lloyd-Jones D, Adams RJ, Brown TM, et al. Heart disease and stroke statistics — 2010 update: a report from the American Heart Association. Circulation. 2010;121: e46-e215. DOI: 10.1161/CIRCULATIONA-HA.109.192667.
2. Posada-Martinez E, Trejo-Paredes C, Ortiz-Leon XA, et al. Differentiating spontaneous echo contrast, sludge, and thrombus in the left atrial appendage: сan ultrasound enhancing agents help? Echocardiography. 2019;36(7): 1413-1417. DOI: 10.1111/echo.14405.
3. Zhan Y, Joza J, Al Rawahi M, et al. Assessment and management of the Left Atrial Appendage Thrombus in Patients with Nonvalvular Atrial Fibrillation. Canadian Journal of Cardiology. 2018;34(3): 252-261. DOI: 10.1016/j.cjca.2017.12.008.
4. Кривошеев ЮС, Башта ДИ, Красильникова СЮ и др. Тромбоз ушка левого предсердия при фибрилляции предсердий — современное состояние проблемы. Вестник аритмологии. 2019;4 (98): 13-20. DOI: 10.35336/VA-2019-4-13-20.
5. Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016; 37: 2893-2962. DOI: 10.1093/eurheartj/ehw210.
6. Zhang E, Liu T, Li Z, et al. High CHA2DS2-VASc score predicts left atrial thrombus or spontaneous echo contrast detected by transesophageal echocardiography. International Journal of Cardiology. 2015;184(1): 540-542. DOI: 10.1016/j.ijcard.2015.02.109.
7. Huang J, Wu SL, Xue YM, et al. Association of CHADS2 and CHA2DS2-VASc scores with left atrial thrombus with nonvalvular atrial fibrillation: a single center based retrospective study in a cohort of 2695 Chinese subjects. Biomed Res Int. 2017;Article ID 6839589:1-6. DOI: 10.1155/2017/6839589.
8. Заиграев ИА, Явелов ИС. Тромбоз левого предсердия и/или его ушка при неклапанной фибрилляции предсердий: частота выявления и клинические факторы риска. Атеротромбоз. 2019;(2): 68-79. DOI: 10.21518/2307-1109-2019-2-68-79 .
9. Lang RM, Badano LP, Mor-Avi V, et al. Recommendation for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Journal of the American Society of Echocardiography. 2015;28: 1-39.e14. DOI: 10.1016/j.echo.2014.10.003.
10. Yalcin M, Aparci M, Uz O, et al. Neutrophil-lymphocyte ratio may predict left atrial thrombus in patients with nonvalvular atrial fibrillation. Clin Appl Thromb Hemost. 2015;21: 166-171. DOI:10.1177/1076029613503398.
11. Fukuda Y, Okamoto M, Tomomori S, et al. In Paroxysmal Atrial Fibrillation Patients, the Neutrophil-to-lym-phocyte Ratio Is Related to Thrombogenesis and More Closely Associated with Left Atrial Appendage Contraction than with the Left Atrial Body Function. Internal Medicine. 2018;57(5): 633-640. DOI: 10.2169/internalmedi-cine.9243-17.
12. Yu-Yang Chen, Qi Liu, Li Liu, et al. Effect of metabolic syndrome on risk stratification for left atrial or left atrial appendage thrombus formation in patients with nonvalvular atrial fibrillation. Chin Med J (Engl). 2016;129(20): 2395-2402. DOI: 10.4103/0366-6999.191744.
13. Дружилов МА, Кузнецова ТЮ. Фибрилляция предсердий, ассоциированная с ожирением: роль эпикардиальной жировой ткани в этиопатогенезе аритмии. Российский кардиологический журнал. 2017;(7): 178-184. DOI: 10.15829/1560-4071-2017-7-178-184.
14. Iacobellis G. Epicardial fat: a new cardiovascular therapeutic target. Curr Opin Pharmacol. 2016;27: 13-18. DOI: 10.1016/j.coph.2016.01.004.
15. Ganesan AN, Chew DP, Hartshorne T, et al. The impact of atrial fibrillation type on the risk of thromboembolism, mortality, and bleeding: a systematic review and meta-analysis. Eur Heart J. 2016;37: 1591-1602. DOI: 10.1093/eurheartj/ehw007.
16. Sikorska A, Baran J, Pilichowska-Paszkiet E, et al. Risk of left atrial appendage thrombus in patients scheduled for ablation for atrial fibrillation: beyond the CHA2DS2-VASc score. Pol Arch Med Wewn. 2015;125(12): 921-928. DOI: 10.20452/pamw.3213.
17. Бокерия ЛА, Шенгелия ЛД. Изменения в сердце при фибрилляции предсердий часть I. Кардиопатия фибрилляции предсердий: новые дилеммы и старые проблемы. Анналы аритмологии. 2016;13(3): 138-147. DOI: 10.15275/annaritmol.2016.3.2.
18. Апарина ОП, Стукалова ОВ, Пархоменко ДВ и др. Характеристика структуры миокарда левого предсердия у больных мерцательной аритмией и здоровых лиц по данным магнитно-резонансной томографии с отсроченным контрастированием. Вестник аритмологии. 2014;77: 5-12.
19. Гизатулина ТП, Мартьянова ЛУ, Павлов АВ и др. Предикторы выраженного фиброза левого предсердия у пациентов с неклапанной фибрилляцией предсердий. Кардиология. 2020;60(2): 47-53 DOI: 10.18087/cardio.2020.2.n850.
20. Goette A, Kalman JM, Aguinaga L, et al. EHRA/HRS/ APHRS/SOLAECE expert consensus on Atrial cardiomyopathies: Definition, characterization, and clinical implication. JArrhythm. 2016; 32(4): 247-78. DOI: 10.1016/j.joa.2016.05.002.
21. Батурова МА, Платонов ПГ, Медведев ММ. Межпредсердная блокада. Вестник аритмологии. 2019;4(98): 3946. DOI: 10.35336/VA-2019-4-39-46.
22. Копылов ФЮ, Иванов ГГ, Дворников ВЕ и др. Гипертрофия левого желудочка: патогенез, диагностика и прогноз. Вестник РУДН. 2002;3: 106-130.
23. Seko Y, Kato T, Haruna T, et al. Association between atrial fibrillation, atrial enlargement, and left ventricular geometric remodeling. Scientific reports. 2018;8(1): 63-66. DOI: 10.1038/s41598-018-24875-1.
24. Boyd AC, McKay T, Nasibi S, et al. Left ventricular mass predicts left atrial appendage thrombus in persistent atrial fibrillation. Eur Heart J Cardiovasc Imaging. 2013;14(3): 269-75. DOI: 10.1093/ehjci/jes153.
Ранние стадии тромбоза
J Clin Pathol. 1963 ноя; 16 (6): 523–528.
Школа патологии сэра Уильяма Данна, Оксфорд
Эта статья цитируется в других статьях в PMC.Полный текст
Полный текст доступен в виде отсканированной копии оригинальной печатной версии. Получите копию для печати (файл PDF) полной статьи (1,9M) или щелкните изображение страницы ниже, чтобы просмотреть страницу за страницей. Ссылки на PubMed также доступны для Избранные ссылки .
Изображения в этой статье
Щелкните изображение, чтобы увидеть его в увеличенном виде.
Избранные ссылки
Эти ссылки находятся в PubMed. Это может быть не полный список ссылок из этой статьи.
- CHANDLER AB. Тромботическая коагуляция крови in vitro; способ получения тромба. Lab Invest. Март-апрель 1958 г .; 7 (2): 110–114. [PubMed] [Google Scholar]
- Коннор В.Е. УСКОРЕНИЕ ОБРАЗОВАНИЯ ТРОМБА ОТ НЕКОТОРЫХ ЖИРНЫХ КИСЛОТ.J Clin Invest. 1962 июнь; 41 (6): 1199–1205. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- ДЕ РОБЕРТИС Э., ВАЗ ФЕРРЕЙРА А. Исследование с помощью электронного микроскопа выделения катеколсодержащих капель в мозговом веществе надпочечников. Exp Cell Res. 1957 июн; 12 (3): 568–574. [PubMed] [Google Scholar]
- FLOREY HW, GREER SJ, KISER J, POOLE JC, TELANDER R, WERTHESSEN NT. Развитие псевдоинтимы, выстилающей тканевые трансплантаты аорты. Br J Exp Pathol. 1962 декабрь; 43: 655–660. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- HAND RA, CHANDLER AB.Атеросклеротический метаморфоз аутологичных тромбоэмболов легких у кролика. Am J Pathol. 1962 апр; 40: 469–486. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- HONOR AJ, RUSSELL RW. Экспериментальная тромбоцитарная эмболия. Br J Exp Pathol. 1962, август; 43: 350–362. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- LEVENE M, LEVENE CI. Тромбоэмболия тромбоцитов легких. J Clin Pathol. 1957 августа; 10 (3): 200–203. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- MUSTARD JF, MURPHY EA, ROWSELL HC, DOWNIE HG.Факторы, влияющие на тромбообразование in vivo. Am J Med. 1962, ноябрь; 33: 621–647. [PubMed] [Google Scholar]
- ПАРМЕГИАНИ А. [Электронно-оптические наблюдения тромбоцитов крови человека во время вязкого метаморфоза]. Thromb Diath Haemorrh. 1961, 15 декабря; 6: 517–532. [PubMed] [Google Scholar]
- PEASE DC. Электронно-микроскопическое исследование красного костного мозга. Кровь. 1956 июн; 11 (6): 501–526. [PubMed] [Google Scholar]
- POOLE JC. Исследование искусственных тромбов, полученных по модификации метода Чандлера.Q J Exp Physiol Cogn Med Sci. 1959 Октябрь; 44: 377–384. [PubMed] [Google Scholar]
- POOLE JC, FRENCH JE. Тромбоз. J Atheroscler Res. 1961 июль-август; 1: 251–282. [PubMed] [Google Scholar]
- WIENER J, SPIRO D. Исследования экспериментального тромбоза с помощью электронного микроскопа. Опыт Мол Патол. 1962 декабрь; 1: 554–572. [PubMed] [Google Scholar]
Статьи из журнала клинической патологии предоставлены здесь с разрешения BMJ Publishing Group
Почечно-клеточный рак с распространением опухолевого тромба в полую вену: хирургическая стратегия и прогноз
Резюме
Цель: Результаты пациентов, перенесших радикальную резекцию почечно-клеточного рака, распространяющегося на полую вену, были ретроспективно проанализированы, а также изучены факторы риска долгосрочной выживаемости. Методы: С 1983 по 1999 год 33 пациентам с почечно-клеточной карциномой с опухолью нижней полой вены было выполнено 34 хирургических вмешательства. Было 27 мужчин и шесть женщин, средний возраст 60,1 года. Двадцать два случая (64,7%) были классифицированы как стадия III (T1-2 N1 M0 или T3 N0-1 M0) и 12 случаев (35,3%) как стадия IV (T4 или N2-3 или M1). Сосуществующие метастазы в легкие были обнаружены в семи случаях (20,6%). Тромбы опухоли проникли в нижнюю полую вену ниже ворот печени в 19 случаях, ниже устья печеночных вен в 12 и выше диафрагмы в 3.Искусственное кровообращение применено в 13 случаях (38,2%). Реконструкция нижней полой вены производилась прямым швом (n = 19), ангиопластикой политетрафторэтиленовой заплатой (n = 13) или протезированием трансплантата (n = 2). Результаты: Два пациента умерли в раннем послеоперационном периоде из-за ретропеченочной полой травмы и интраоперационной тромбоэмболии легочной артерии. Поздняя смерть наступила у 16 пациентов; Причинами смерти явились рецидив опухоли у 15 и острая тромбоэмболия легочной артерии в результате тромбоза трансплантата у 1.Общая 1-, 5- и 10-летняя выживаемость составила 70%, 44% и 26,4% соответственно. Показатели одно- и пятилетней выживаемости составили 81,3% и 52,9% для стадии III и 50% и 31,2% для стадии IV; была обнаружена статистически значимая корреляция между хирургической стадией и выживаемостью ( P = 0,049). Пациенты без метастазов в лимфатические узлы имели значительное преимущество в выживаемости по сравнению с пациентами с метастазами в лимфатические узлы ( P = 0,022). Не было существенной разницы в выживаемости на основании наличия или отсутствия синхронных метастазов в легкие ( P =.291). Степень локального распространения опухоли или уровень опухолевого тромба не влияли на выживаемость. Выводы: Хирургический прогноз у пациентов с почечно-клеточной карциномой, распространяющейся на полую вену, определялся стадией опухоли, особенно статусом лимфатических узлов, а не уровнем тромба опухоли или наличием сопутствующих метастазов в легкие. Для удаления опухолевого тромба, распространяющегося на диафрагму, рекомендуется использование искусственного кровообращения.(J Vasc Surg 2001; 33: 789-96.)
Рекомендуемые статьи Цитирующие статьи (0)
Авторские права © 2001 Society for Vascular Surgery и American Association for Vascular Surgery. Опубликовано Elsevier Inc. Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Тромб опухоли: частота, визуализация, прогноз и лечение — Quencer
Введение
Внутрисосудистый опухолевый тромб определяется как распространение опухоли в сосуд.Его наличие меняет стадию, прогноз и лечение. Это происходит при самых разных злокачественных новообразованиях, чаще всего при почечно-клеточной карциноме (ПКР), опухоли Вильмса, карциноме коры надпочечников (АКК) и гепатоцеллюлярной карциноме (ГЦК). Визуализация играет решающую роль как в обнаружении тромба опухоли, так и в дифференциации его от мягкого тромба. В статье обсуждаются частота возникновения, диагностика и подходы к лечению опухолевого тромба.
ПКР
ПКР является 9-м по распространенности типом рака, диагностируемым в США, и, по прогнозам, в 2017 году приведет к 14 400 случаям смерти.ПКР имеет известную склонность к сосудистой инвазии, которая встречается примерно в 10% случаев (1-3) (, рисунок 1, ). Наличие тромба опухоли меняет стадию, прогноз и хирургический подход (4-8).
Рис. 1 Женщина 54 лет с гематурией и образованием в правой почке (черный кружок). Тромб опухоли распространяется в правую почечную вену (сплошная белая стрелка) и НПВ (пунктирная черная стрелка). Обратите внимание на варикозное расширение вен таза (сплошная черная стрелка) и увеличенная левая гонадная вена (пунктирная белая стрелка), которые являются вторичными по отношению к обструкции НПВ.
Клинические симптомы, стадия и прогноз
Тромб опухоли может протекать бессимптомно или вызывать различные симптомы, включая варикоцеле, отек нижних конечностей, сердечную дисфункцию, тромбоэмболию легочной артерии или синдром Бадда-Киари (9–12). При отсутствии сопутствующей инвазии фасции Героты или ипсилатерального надпочечника ПКР с опухолевым тромбом классифицируется как T3 (2) (, таблица 1, ). Когда тромб опухоли присутствует только в сегментарной ветви почечной вены или в основной почечной вене, его стадия определяется как T3a.Когда тромб опухоли распространяется в НПВ, но ниже уровня диафрагмы, это стадия T3b. Когда тромб опухоли выходит за пределы диафрагмы или проникает в стенку НПВ, это стадия T3c. Альтернативной системой классификации уровня опухолевого тромба является классификация клиники Мэйо, которая полезна для хирургического планирования (, таблица 2, ) (13-16). Хотя вопрос о том, связаны ли тромбы более высокого уровня с увеличением смертности от рака, все же увеличивается, хирургическая заболеваемость и смертность.Сообщалось о периоперационных осложнениях 78% и смертности 13% при опухолях T3c (16-20).
Таблица 1 Стадия ПКР в соответствии с клинической стадией AJCC 2010Полная таблица Таблица 2 Mayo Clinic Система классификации уровней тромбов опухоли ПКР и потенциальный хирургический подход
Полная таблица
Изображения
И МРТ, и КТ обладают высокой точностью обнаружения тромба опухоли, оценки его распространения и отличия от мягкого тромба (21-24).Опухолевый тромб отличается от мягкого тромба по наличию увеличения, расширения сосудов и поглощения фтордезоксиглюкозы на позитронно-эмиссионной томографии ( 18 F-FDG-PET) (, таблица 3, ) (25). На ангиографии можно увидеть знак «полоса и нить» (26). Венография покажет дефекты наполнения пораженного сосуда.
Проникновение внутрь и сквозь стенку НПВ происходит нечасто (27,28). Окончательным признаком инвазии стенки НПВ является наличие опухоли с обеих сторон стенки полой полости.Инвазия в стенку сосуда предполагается, когда тромб опухоли вызывает полную окклюзию и расширение НПВ.
Лечение / хирургический доступ
Полная хирургическая резекция паренхиматозной опухоли и опухолевого тромба обеспечивает 5-летнюю выживаемость более 50% (29–32). При неполной резекции опухоли 5-летняя выживаемость снижается примерно до 10% (10,31). При наличии известного метастатического заболевания хирургическое удаление опухоли не только улучшает симптомы, но также может продлить выживаемость, особенно при последующем применении таргетной химиотерапии (33-35).Чем выше распространяется опухолевый тромб, тем сложнее хирургическое вмешательство и тем выше уровень заболеваемости и смертности.
Перед операцией пациент должен пройти анестезиологическое и / или кардиологическое обследование, чтобы оценить, является ли пациент подходящим хирургическим кандидатом, учитывая относительно высокие показатели периоперационной заболеваемости и смертности. В зависимости от распространения опухоли и / или необходимости реконструкции сосудов, для определения оптимального хирургического подхода может потребоваться многопрофильное обсуждение урологии, сосудистой хирургии и кардиоторакальной хирургии.
Если помимо опухолевого тромба присутствует мягкий тромб, следует рассмотреть возможность антикоагуляции (36). Однако следует избегать установки фильтра IVC. Наличие фильтра IVC может превратить сложную операцию в нечто практически невозможное. Наличие надпочечного фильтра затрудняет получение контроля над краниальным тромбом опухоли во время операции. Тромб опухоли также может попасть в фильтр, что затрудняет удаление как фильтра, так и тромба опухоли (36).
Традиционная неоадъювантная химиотерапия и лучевая терапия неэффективны против ПКР. Небольшие исследования целевых молекулярных методов лечения (например, сорафениба, эрлотиниба и темсиролимуса) показали их способность снижать уровень тромба опухоли, чтобы сделать последующую операцию более безопасной и легкой (37-39). Необходимы дополнительные исследования, чтобы увидеть, следует ли рекомендовать эти целевые неоадъювантные химиотерапевтические агенты в случаях опухолевого тромба (20).
Иногда выполняется предоперационная трансартериальная эмболизация.Хотя он действительно снижает операционную кровопотерю и сокращает время операции, не было показано, что он улучшает общую выживаемость (40-42). Поэтому его роль и использование обсуждаются.
Чтобы предотвратить эмболию опухолевого тромба в легкие во время операции, необходимо получить контроль над тромбом опухоли в центре (10,43). Подход к получению центрального контроля варьируется в зависимости от уровня внутрисосудистого распространения опухоли (, таблица 2, ). Для опухолевого тромба уровня 0 почечная вена лигируется по центру опухолевого тромба и выполняется нефрэктомия en bloc .Для опухолевого тромба I уровня пережатие или контроль НПВ не требуется; Тромб опухоли возвращается в почечную вену при удалении почки. Затем лигируют почечную вену и завершают нефрэктомию en bloc (20).
Операция по поводу опухолевого тромба II уровня более сложна. Тромб опухоли, простирающийся более чем на 2 см в НПВ, нельзя доить обратно в почечную вену. Чтобы получить контроль над нижней полой вены, расположенной ближе к тромбу опухоли, печень мобилизуют путем перевязки дополнительных печеночных вен, дренирующих хвостатую долю.Затем пережимают внутрипеченочную НПВ ниже уровня печеночных вен. Кроме того, необходим контроль притока. Необходимо пережать как инфраренальную НПВ, так и контралатеральную почечную вену. К счастью, сердечно-легочный или венозный обходной анастомоз не требуется при тромбах уровня II, поскольку печеночные вены обеспечивают примерно 1/3 потока НПВ. Следовательно, можно поддерживать адекватный венозный возврат. После получения адекватного проксимального и дистального контроля выполняется L-образная кавотомия, проходящая в пораженную почечную вену (16).Через этот разрез тромб опухоли удаляется из НПВ. Удаляют почку и оставшийся тромб опухоли en bloc .
Хирургическая резекция тромба опухоли III уровня, который простирается выше уровня слияния печеночной вены с IVC, но остается ниже диафрагмы, является сложной задачей. Во-первых, может потребоваться интраоперационная чреспищеводная эхокардиограмма, чтобы оценить точную краниальную протяженность опухоли. Как только будет показано, что она поддиафрагмальна, необходимо экстенсивно мобилизовать печень, чтобы получить контроль над НПВ над печеночными венами.Это делается путем отделения печени от ее диафрагмальных прикреплений и лигирования дополнительных печеночных вен. Эта мобилизация часто проводится совместно с гепатобилиарным хирургом или хирургом-трансплантологом (44). Сердечно-легочный обходной или венозный обходной анастомоз необходим, поскольку пережатие надпеченочной НПВ блокирует весь венозный возврат из НПВ, что составляет 2/3 всего венозного возврата.
Тромб опухоли IV уровня распространяется над диафрагмой в правое предсердие (10).Необходимо участие кардиоторакальной хирургии и искусственного кровообращения. TEE помогает предсказать прилипание опухоли к миокарду и трехстворчатому клапану, что помогает решить, необходим ли разрез сердца (45).
Когда опухоль проникла в стенку НПВ, необходимо выполнить резекцию НПВ для полного удаления опухоли. Когда опухоль вторглась в стенку НПВ, существует высокий риск местного рецидива опухоли. Перикард крупного рогатого скота, собственный перикард и расширенный политетрафторэтилен (ePTFE) были использованы для реконструкции НПВ.
HCC
ГЦК занимает 6-е место по распространенности рака и 3-е место среди причин смертей, связанных с раком (46,47). Макроваскулярная инвазия — хорошо известная характеристика ГЦК; Тромб опухоли воротной вены (ПВВТ) встречается в 35% случаев, а тромб опухоли печеночной вены — в 2% случаев (48,49). Макрососудистая инвазия, как правило, поражает более молодых пациентов, пациентов с агрессивной биологией опухолей и пациентов с плохой основной функцией печени (49).Прогноз ГЦК с опухолевым тромбом плохой и зависит от степени ПВЖТ (48,49). Следует отметить, что более 25% всех пациентов с циррозом имеют мягкий тромб воротной вены (50,51). Блочный тромб и опухолевый тромб можно отличить по характеристикам изображения (, таблица 3, ).
Стадия, клинические симптомы и прогноз
Общий прогноз при опухоли HCC плохой. Без PVTT средняя выживаемость составляет примерно 16 месяцев.Этот прогноз снижается до 6 месяцев, если присутствует PVTT (52). Было показано, что наличие PVTT оказывает более значительное влияние на прогноз, чем размер опухоли (53). Степень PVTT также очень важна для прогнозирования выживаемости (54-56). Установлено, что у пациентов с сегментарной ПВТТ в два раза больше времени выживания, чем у пациентов с инвазией главной воротной вены (9 против 4,6 месяца) (54). Ши и др. предложил систему классификации PVTT, основанную на степени поражения опухоли (, таблица 4, ) (56).Тромб опухоли может вызывать специфические симптомы. PVTT может вызвать портальную гипертензию из-за обструкции кровотока и / или артериопортального шунтирования. Тромб опухоли печеночной вены может привести к синдрому Бадда-Киари.
Таблица 4 Классификация гепатоцеллюлярной карциномы с тромбом опухоли воротной вены, предложенная Shi et al .Полный стол
пациентов с ГЦК с любой макроскопической сосудистой инвазией классифицируются как рак печени в клинике Барселоны (BCLC), стадия C (продвинутая стадия) (, таблица 5, ) (57-59).Пациенты с внепеченочным распространением и пациенты с пониженным статусом (группа 1 и 2 Восточной кооперативной онкологии) также классифицируются как стадия C. BCLC, поэтому стадия C BCLC включает гетерогенную группу пациентов с широким диапазоном выживаемости (54). Поэтому некоторые предлагают подклассифицировать стадию C (54,60).
Изображения
PVVT можно диагностировать и отличить от мягкого тромба с помощью множества различных методов визуализации, включая обычную ангиографию, цветное допплеровское ультразвуковое исследование, ультразвуковое исследование с контрастным усилением, компьютерную томографию с контрастным усилением, МРТ и FDG-ПЭТ-визуализацию (61-64) ( Таблица 3 , Рисунки 2-4 ).Сообщается, что УЗИ с контрастным усилением является 100% чувствительным и специфичным (65). Необходимо отличать мягкий тромб от опухолевого тромба, поскольку первый встречается у 25% пациентов с хроническим заболеванием печени (51). Ключевым признаком для диагностики тромба опухоли воротной вены является наличие усиления или цветового допплеровского потока внутри тромба (63,64). Вычитающая визуализация может быть полезна для обнаружения небольшого увеличения тромба. Диффузионная визуализация на МРТ может быть полезным дополнительным методом визуализации (62).Тромб опухоли имеет повышенную клеточную плотность и соотношение ядер к цитоплазме и будет демонстрировать ограниченную диффузию, выглядя яркими на диффузионно-взвешенном изображении (DWI) и темными на картировании кажущегося коэффициента диффузии (ADC) (66). Тем не менее, следует проявлять осторожность, чтобы не оценивать диффузионные последовательности изолированно, поскольку мягкий тромб может также демонстрировать низкие значения ADC. Это связано с высокой вязкостью тромба, а также с парамагнитными эффектами внутриклеточного дезоксигемоглобина и метгемоглобина, присутствующих в мягком тромбе (67).Другие характеристики визуализации, которые способствуют развитию тромба опухоли, включают расширение пораженного сосуда и повышенное поглощение при FDG-PET (63,64,68-70). На ангиографии тромбоз опухоли воротной вены можно распознать по характерной полосе и появлению нитей из-за параллельного помутнения мелких сосудов внутри опухоли и артериального венозного шунтирования (26).
Рисунок 2 У 72-летнего мужчины с криптогенным циррозом обнаружена ГЦК большой правой доли печени с обширной инвазией воротной вены.Тромб опухоли распространяется на ветви правой воротной вены (белые стрелки), а также в главную воротную вену (белая звездочка). Эта Т2-взвешенная МРТ показывает относительную гиперинтенсивность воротных вен. Нормальная проходимая воротная вена будет иметь гипоинтенсивность, вторичную по отношению к пустоте кровотока. Прошел курс лечения эмболизацией Y-90.
Рисунок 3 Другая последовательность для того же пациента, что и Рисунок 2 . Контрастная МРТ в артериальной фазе показывает раннее артериальное усиление тромбированной главной воротной вены, что отличает ее от мягкого тромба.Тромб опухоли главной воротной вены классифицируется как III тип по Ши.Рисунок 4 70-летний мужчина с алкогольным циррозом печени и ранее удаленным поражением сегмента V, у которого при последующем обследовании было обнаружено инфильтративное поражение в сегментах VI / VII (сплошная черная стрелка) с тромбом опухоли воротной вены ( пунктирная белая стрелка). Обратите внимание на проходимую портальную вену (изогнутая черная стрелка). Тромб гладкой опухоли присутствует на периферии правой доли (сплошные белые стрелки).
Лечение
Сорафениб — это мультикиназный ингибитор, нацеленный на VEGFR, PDGFR и киназы семейства Raf (71). По данным Американской ассоциации по изучению заболеваний печени (AASLD), Европейской ассоциации по изучению печени (EASL) и руководств по лечению BCLC, это рекомендованное лечение для пациентов со стадией C BCLC (72,73). У этого препарата много потенциальных побочных эффектов; одним характерным побочным эффектом является синдром ладоней и стоп, который состоит из покраснения, отека, онемения и шелушения ладоней рук и подошв ног (74).Выживаемость пациентов, получавших сорафениб, улучшается всего на 2–3 месяца (75,76). Ограничение пациентов с опухолевым тромбом лечением сорафенибом может быть слишком консервативным. В клинической практике используются другие, более агрессивные методы лечения (54).
В западных странах хирургическая резекция редко выполняется на фоне тромба опухоли ГЦК из-за плохой функции печени. На востоке цирроз в основном является следствием гепатита B. У этих пациентов основная функция печени лучше, чем у пациентов с циррозом, вызванным алкоголем или гепатитом C, наблюдаемым на западе.Поэтому хирургическая резекция проводится пациентам с тромбом ветви опухоли воротной вены (77). Отражая эту практику, Hong Kong Liver Staging не рассматривает сосудистую инвазию печени как противопоказание для хирургической резекции (78).
Из-за высокой частоты рецидивов после трансплантации наличие тромба опухоли считается абсолютным противопоказанием к трансплантации печени (79,80).
Термическая абляция тромба опухоли воротной вены рассматривается редко, учитывая продолговатую форму опухоли воротной вены, а также ее близость к критическим структурам, таким как печеночная артерия и желчные протоки.Однако в одном недавнем сообщении были показаны хорошие результаты после эндолюминальной аблации с последующим стентированием (81).
Учитывая риск некроза печени и ухудшения функции печени, наличие тромба опухоли воротной вены считается относительным противопоказанием к трансартериальной химиоэмболизации (TACE) (82,83). Руководства EASL, AASLD и BCLC не рекомендуют ТАСЕ у пациентов с макроскопической сосудистой инвазией (72,73). Однако у пациентов с неокклюзионным тромбом, сохраненной функцией печени и небольшой опухолевой нагрузкой суперселективная ТАСЕ может быть безопасно и эффективно проведена с улучшением выживаемости пациентов (83–85).Руководящие принципы Азиатско-Тихоокеанской ассоциации по изучению печени (APASL) рекомендуют ТАСЕ при тромбировании ответвления сосуда у пациентов A и B по шкале Чайлд-Пью (86). В то время как некроз печени не вызывает беспокойства у пациентов с тромбом опухоли печеночной вены, эмболизация частицами легочной сосудистой сети является потенциальным осложнением при артериовенозном шунтировании печени внутри тромба опухоли печеночной вены (87).
Селективная внутренняя радиоэмболизация (SIRT) с использованием иттрия-90 (Y-90) многими считается предпочтительным методом лечения пациентов с HCC и опухолью воротной вены (88,89).В рекомендациях EASL указано, что, хотя SIRT кажется безопасным и демонстрирует многообещающие результаты, необходимы дополнительные исследования, прежде чем его можно будет рекомендовать в качестве стандарта лечения (73). При лечении пациентов с тромбом опухоли печеночной вены следует учитывать склонность к гепатопульмональному шунтированию (90). Присутствие тромба опухоли печеночной вены связано с увеличением фракции легочного шунта в 3-4 раза, как было обнаружено с помощью микроагрегированного альбумина технеция-99m (Tc-99m MAA) (91). Поскольку предел радиационного воздействия на легкие установлен на уровне 30 Гр за один сеанс и 50 Гр за один сеанс, часто необходимо снижение кумулятивной дозы (92).
Появляются новые методы лечения тромба воротной вены. Наружная лучевая терапия в сочетании с внутриартериальной инфузией 5-ФУ и интерферона-альфа дала положительные результаты (93,94). Чрескожное стентирование воротной вены с последующим ТАСЕ и облучением внешним пучком также показало многообещающие результаты (95). Облучение стентов (саморасширяющийся стент, нагруженный семенами йода-125) в сочетании с ТАСЕ показало пользу в небольшой группе пациентов с частично закупоривающим тромбом опухоли воротной вены (96).
ACC
ACC — редкое и агрессивное злокачественное новообразование. ACC также имеет склонность вызывать тромбирование опухоли, которым страдает около 1/4 пациентов (, рис. 5, ). Подобно ПКР с опухолевым тромбом, пациенты могут иметь варикоцеле или отек нижних конечностей (97–99). Сообщалось о вторжении в стенку IVC с ACC (100). Хотя есть некоторые случаи длительного выживания при ОКС с сосудистой инвазией после полной резекции, это скорее исключение, чем правило (101-103).Системная химиотерапия является предпочтительным методом лечения.
Рис. 5 48-летней женщине с впервые появившейся гипертензией и учащенным сердцебиением, которой была сделана компьютерная томография брюшной полости, которая показала образование правого надпочечника (сплошная черная стрелка), вторгающееся в НПВ (пунктирная черная стрелка). Впоследствии она прошла эндокринологическое обследование, и у нее был обнаружен повышенный уровень катехоламинов, соответствующий феохромоцитоме.
Опухоль Вильма
Опухоль Вильма является наиболее распространенным образованием почек у детей и составляет 6% всех онкологических заболеваний у детей.Пик заболеваемости приходится на 3–4 года. Он имеет выраженную склонность к макрососудистой инвазии, которая встречается до 35% случаев. Распространение в НПВ происходит до 10% случаев (104). Внутрисердечное расширение встречается редко, но имеет место (105). Хотя обычно рекомендуется предоперационная химиотерапия, это решение следует принимать в индивидуальном порядке. Если тромб опухоли имеет высокий риск эмболизации, предпочтительнее хирургическое вмешательство перед химиотерапией (106,107).
Другие опухоли
Во многих других опухолях может развиться тромб опухоли, но это происходит реже.К ним относятся внутривенный лейомиоматоз, островковые опухоли поджелудочной железы, рак щитовидной железы.
Внутривенный лейомиоматоз — редкая доброкачественная гладкомышечная опухоль маточного происхождения, которая прорастает в вены тазовых вен. Это часто может вызвать отек нижних конечностей, но, как сообщается, приводит к смерти, если распространяется в сердце (108–110).
Островковые опухоли поджелудочной железы могут привести к развитию тромбов опухоли. Этот опухолевый тромб может поражать селезенку, портальную и / или верхнюю брыжеечные вены (111-115).Тромб опухоли селезеночной вены может вызвать левостороннюю портальную гипертензию с развитием изолированного варикозного расширения вен желудка (116). Как и в случае с другими опухолевыми тромбами, можно увидеть неоднородное артериальное усиление и расширение вовлеченных вен, прилегающих к первичной массе. ФДГ-авидность опухолевого тромба также можно увидеть на ПЭТ-сканировании (117).
Хотя заболеваемость неизвестна, имеются сообщения о макрососудистой инвазии рака щитовидной железы с распространением в яремную вену, ВПВ и правое предсердие (118–120).Как и в случае с другими опухолевыми тромбами, во время хирургического удаления необходим проксимальный и дистальный контроль тромба. Это проиллюстрировано в одном клиническом случае, в котором описывается эмболизация опухолевого тромба в легочную артерию во время операции при отсутствии адекватного центрального контроля (121). Тромб опухоли щитовидной железы может быть сначала обнаружен с помощью ультразвука, а затем может быть визуализирован с помощью КТ или МРТ с контрастным усилением (122). Хорошего долгосрочного результата можно добиться при полном иссечении.
Рак яичка редко может вызывать тромбирование опухоли.Хотя в отчетах о вскрытии указывается, что частота опухолевых тромбов достигает 11%, при визуализации он выявляется только в 1% случаев (123, 124). Помимо опухолевого тромба, исходящего из первичного очага и распространяющегося в гонадные вены, забрюшинная метастатическая лимфаденопатия может прорастать непосредственно в НПВ (125). Существуют различные подходы к лечению рака яичек на фоне опухолевого тромба; некоторые выступают за установку извлекаемого фильтра НПВ перед окончательной терапией, другие используют неоадъювантную химиотерапию, третьи выступают за только химиотерапию и, наконец, некоторые поддерживают раннюю первичную хирургическую резекцию (126–128).
Рак легких является вторым по распространенности раком и ответственен за наибольшее количество смертей, связанных с раком, как в США, так и во всем мире (129). В редких случаях может возникнуть тромб опухоли рака легких. Он может распространяться на легочные вены и даже в левое предсердие. Тромб опухоли в легочных венах может вызывать симптомы, отличные от тромба системной венозной опухоли. Сообщалось о случаях эмболизации, вызывающей инсульт, инфаркт кишечника и ишемическую ногу (130).Обструкция левого желудочка даже вызывает внезапную смерть (131 132). Учитывая эти потенциально разрушительные осложнения, обычно рекомендуется хирургическое вмешательство перед химиотерапией (133).
Колоректальный рак — 4-я ведущая причина рака в США (129). Тромб венозной опухоли — редкая находка при колоректальном раке, наблюдаемая только в 1-2% случаев (134). Когда это происходит, венозная инвазия в портальную венозную систему происходит от слепой кишки до сигмовидной кишки. Учитывая двойной венозный дренаж через портальную и внутреннюю подвздошную системы, опухолевый тромб при раке прямой кишки может поражать либо нижнюю брыжеечную вену (портальная венозная система), либо внутренние подвздошные вены (системная венозная система) (135).Предоперационная диагностика тромба опухоли воротной вены важна, поскольку позволяя хирургу перевязать пораженную вену над тромбом, можно избежать эмболии опухоли в печень. Может быть показан открытый, а не лапароскопический доступ, поскольку хирург может непосредственно пальпировать пораженную вену, чтобы определить, где лигировать и резектировать. Скорость метастазирования в печень выше при наличии тромба опухоли (134).
Выводы
Внутрисосудистое распространение опухоли может происходить при многих различных типах рака.К наиболее склонным относятся опухоль Вильма, ПКР, карцинома коры надпочечников и гепатоцеллюлярная карцинома. Тромб опухоли реже встречается при множестве других типов опухолей, включая доброкачественные и злокачественные гистологии. Визуализация играет центральную роль в его диагностике. Наличие опухолевого тромба значительно ухудшает прогноз и влияет на тактику лечения.
Благодарности
Нет.
Конфликт интересов : Авторы не заявляют о конфликте интересов.
Список литературы
- Зисман А., Видер Дж. А., Пантак А. Дж. И др. Почечно-клеточная карцинома с распространением опухолевого тромба: биология, роль нефрэктомии и ответ на иммунотерапию. Дж. Урол 2003; 169: 909-16. [Crossref] [PubMed]
- Лам Дж. С., Клатте Т., Бреда А. Стадия почечно-клеточного рака: современные концепции. Индиан Дж. Урол 2009; 25: 446-54. [Crossref] [PubMed]
- Турун С., Банхуа Л., Чжэн С. и др.Является ли размер опухоли надежным предиктором гистопатологических характеристик почечно-клеточного рака? Урол Энн 2012; 4: 24-8. [Crossref] [PubMed]
- Далл’Оглио М.Ф., Рибейро-Филхо Л.А., Антунес А.А. и др. Инвазия микрососудистой опухоли, размер опухоли и степень Фурмана: патологическая триада для прогностической оценки почечно-клеточного рака. J Urol 2007; 178: 425-8; обсуждение 428. [Crossref] [PubMed]
- Qi J, Gu Z, Chen F, et al. Лечение почечно-клеточного рака с опухолевым тромбом в почечной вене и нижней полой вене.Энн Васк Сург 2010; 24: 1089-93. [Crossref] [PubMed]
- Nesbitt JC, Soltero ER, Dinney CP и др. Хирургическое лечение почечно-клеточного рака с тромбом опухоли нижней полой вены. Энн Торак Сург 1997; 63: 1592-600. [Crossref] [PubMed]
- Parekh DJ, Cookson MS, Chapman W, et al. Почечно-клеточная карцинома с поражением почечной и нижней полой вены: клинико-патологические особенности, хирургические методы и исходы. Журнал Урол 2005; 173: 1897-902.[Crossref] [PubMed]
- Tsuji Y, Goto A, Hara I, et al. Почечно-клеточная карцинома с распространением опухолевого тромба в полую вену: хирургическая стратегия и прогноз. J Vasc Surg 2001; 33: 789-96. [Crossref] [PubMed]
- Sunela KL, Kataja MJ, Kellokumpu-Lehtinen PL. Изменения симптомов почечно-клеточного рака за четыре десятилетия. BJU Int 2010; 106: 649-53. [Crossref] [PubMed]
- Ногучи К., Хори Д., Номура Ю. и др.Почечно-клеточная карцинома с распространением опухоли-тромба в правый желудочек. Энн Васк Дис 2012; 5: 376-80. [Crossref] [PubMed]
- Эль-Абиад Y, Карро А. ИЗОБРАЖЕНИЯ В КЛИНИЧЕСКОЙ МЕДИЦИНЕ. Острое варикоцеле, обнаруживающее рак почек. N Engl J Med 2016; 374: 2075. [Crossref] [PubMed]
- Shirodkar SP, Soloway MS, Ciancio G. Синдром Бадда-Киари в урологии: влияние на нефрэктомию при поздней почечно-клеточной карциноме. Индийский журнал Дж. Урол 2011; 27: 351-6. [Crossref] [PubMed]
- Ноух М.А., Инуи М., Какехи Ю.Почечно-клеточная карцинома с тромбами НПВ; текущие концепции и перспективы на будущее. Clin Med Oncol 2008; 2: 247-56. [Crossref] [PubMed]
- Суини П., Вуд К. Г., Пистерс Л. Л. и др. Хирургическое лечение почечно-клеточного рака, связанного со сложными тромбами нижней полой вены. Урол Онкол 2003; 21: 327-33. [Crossref] [PubMed]
- Невес Р.Дж., Зинке Х. Хирургическое лечение рака почек с расширением полой вены. Br J Urol 1987; 59: 390-5. [Crossref] [PubMed]
- Blute ML, Лейбович BC, Lohse CM и др.Опыт клиники Мэйо в области хирургического лечения, осложнений и результатов лечения пациентов с почечно-клеточным раком и тромбом венозной опухоли. БЖУ Инт 2004; 94: 33-41. [Crossref] [PubMed]
- Martinez-Salamanca JI, Linares E, González J, et al. Уроки, извлеченные из Международного консорциума почечно-клеточной карциномы и венозного тромба (IRCC-VTC). Curr Urol Rep 2014; 15: 404. [Crossref] [PubMed]
- Wagner B, Patard JJ, Méjean A, et al. Прогностическое значение вовлечения почечной и нижней полой вены в почечно-клеточный рак.Eur Urol 2009; 55: 452-9. [Crossref] [PubMed]
- Дедейлиас П., Колецис Э., Русакис А.Г. и др. Глубокая гипотермия и остановка кровообращения при хирургическом лечении опухолей почек с кавоатриальным расширением. J Card Surg 2009; 24: 617-23. [Crossref] [PubMed]
- Псутка С.П., Лейбович БК. Лечение тромба опухоли нижней полой вены при местнораспространенной почечно-клеточной карциноме. Ther Adv Urol 2015; 7: 216-29. [Crossref] [PubMed]
- Zhang L, Yang G, Shen W и др.Спектр нижней полой вены: данные МДКТ. Визуализация брюшной полости 2007; 32: 495-503. [Crossref] [PubMed]
- Oto A, Herts BR, Remer EM, et al. Тромб опухоли нижней полой вены при почечно-клеточной карциноме: стадия с помощью МРТ и влияние на хирургическое лечение. AJR Am J Roentgenol 1998; 171: 1619-24. [Crossref] [PubMed]
- Лоурентчук Н., Гани Дж., Риордан Р. и др. Мультидетекторная компьютерная томография против магнитно-резонансной томографии для определения верхнего предела опухолевого тромба при почечно-клеточной карциноме: исследование и обзор.BJU Int 2005; 96: 291-5. [Crossref] [PubMed]
- Hockley NM, Foster RS, Bihrle R, et al. Использование магнитно-резонансной томографии для определения хирургической тактики почечно-клеточного рака с расширением полой вены. Урология 1990; 36: 55-60. [Crossref] [PubMed]
- Кауфман Л.Б., Йе Б.М., Брейман Р.С. и др. Дефекты наполнения нижней полой вены на КТ и МРТ. AJR Am J Roentgenol 2005; 185: 717-26. [Crossref] [PubMed]
- Raab BW.Знак резьбы и полосы. Радиология 2005; 236: 284-5. [Crossref] [PubMed]
- Псутка С.П., Бурджиан С.А., Томпсон Р.Х. и др. Клинико-рентгенологические предикторы необходимости резекции нижней полой вены при нефрэктомии у пациентов с почечно-клеточным раком и тромбом полой опухоли. БЖУ Инт 2015; 116: 388-96. [Crossref] [PubMed]
- Аслам Сохаиб С.А., Тех Дж., Наргунд В.Х. и др. Оценка опухолевой инвазии стенки полой вены в случаях почечно-клеточного рака с помощью магнитно-резонансной томографии.Дж. Урол 2002; 167: 1271-5. [Crossref] [PubMed]
- Киркали З., Ван Поппель Х. Критический анализ хирургии рака почки с инвазией в полую вену. Eur Urol 2007; 52: 658-62. [Crossref] [PubMed]
- Скиннер Д.Г., Притчетт Т.Р., Лесковски Г. и др. Поражение полой вены почечно-клеточной карциномой. Хирургическая резекция обеспечивает долгосрочное выживание. Ann Surg 1989; 210: 387-92; обсуждение 392-4. [Crossref] [PubMed]
- Иоаннис V, Панайотис С., Анастасиос А. и др.Опухоль, распространяющаяся через нижнюю полую вену в правое предсердие. Поздний рецидив почечно-клеточного рака. Int J Cardiovasc Imaging 2003; 19: 179-82. [Crossref] [PubMed]
- Haddad AQ, Wood CG, Abel EJ, et al. Онкологические исходы после хирургической резекции почечно-клеточного рака с тромбом нижней полой вены, простирающимся над печеночными венами: современная многоцентровая когорта. Журнал Урол 2014; 192: 1050-6. [Crossref] [PubMed]
- Flanigan RC, Mickisch G, Sylvester R, et al.Циторедуктивная нефрэктомия у больных метастатическим раком почки: комбинированный анализ. Дж. Урол 2004; 171: 1071-6. [Crossref] [PubMed]
- Mickisch GH, Garin A, van Poppel H, et al. Радикальная нефрэктомия плюс иммунотерапия на основе интерферона альфа по сравнению с одним только интерфероном альфа при метастатической почечно-клеточной карциноме: рандомизированное исследование. Ланцет 2001; 358: 966-70. [Crossref] [PubMed]
- Vergho DC, Loeser A, Kocot A, et al. Опухолевый тромб нижней полой вены у пациентов с почечно-клеточным раком — клинико-онкологические исходы 50 пациентов после операции.Примечания BMC Res 2012; 5: 5. [Crossref] [PubMed]
- Woodruff DY, Van Veldhuizen P, Muehlebach G, et al. Периоперационное ведение тромба опухоли нижней полой вены у пациентов с почечно-клеточным раком. Урол Онкол 2013; 31: 517-21. [Crossref] [PubMed]
- Bigot P, Fardoun T, Bernhard JC и др. Неоадъювантная таргетная молекулярная терапия у пациентов, перенесших нефрэктомию и тромбэктомию нижней полой вены: насколько это полезно? World J Urol 2014; 32: 109-14.[Crossref] [PubMed]
- Квон Т., Ли Дж. Л., Ким Дж. К. и др. Критерии ответа Чоя для тромба опухоли нижней полой вены при почечно-клеточном раке, получавшем таргетную терапию. J Cancer Res Clin Oncol 2014; 140: 1751-8. [Crossref] [PubMed]
- Borregales LD, Adibi M, Thomas AZ и др. Роль неоадъювантной терапии в лечении местнораспространенного почечно-клеточного рака. Ther Adv Urol 2016; 8: 130-41. [Crossref] [PubMed]
- Wotkowicz C, Wszolek MF, Libertino JA.Резекция опухолей почек с прорастанием полой вены. Урол Клин Норт Ам 2008; 35: 657-71. viii. [Crossref] [PubMed]
- Zielinski H, Szmigielski S, Petrovich Z. Сравнение предоперационной эмболизации с последующей радикальной нефрэктомией с одной только радикальной нефрэктомией для почечно-клеточного рака. Am J Clin Oncol 2000; 23: 6-12. [Crossref] [PubMed]
- May M, Brookman-Amissah S, Pflanz S, et al. Предоперационная эмболизация почечной артерии не обеспечивает выживаемости у пациентов, перенесших радикальную нефрэктомию по поводу почечно-клеточного рака.Br J Radiol 2009; 82: 724-31. [Crossref] [PubMed]
- Фукуи К., Нарита Дж., Такахаши С. и др. Отчет о случае массивной эмболии легочной опухоли, возникшей во время операции по поводу почечно-клеточного рака. Киобу Гека 1992; 45: 529-32. [PubMed]
- Zhang JP, Zhu Y, Liu YJ, et al. Временные фильтры и техника мобилизации печени улучшают безопасность и прогноз радикальной нефрэктомии и тромбэктомии нижней полой вены при почечно-клеточном раке с поддиафрагмальным тромбозом.Урол Инт 2013; 91: 279-84. [Crossref] [PubMed]
- Karnes RJ, Blute ML. Обзор хирургии: лечение почечно-клеточного рака с ассоциированным тромбом нижней полой вены. Нат Клин Практ Урол 2008; 5: 329-39. [PubMed]
- Waller LP, Deshpande V, Pyrsopoulos N. Гепатоцеллюлярная карцинома: всесторонний обзор. Всемирный журнал J Hepatol 2015; 7: 2648-63. [Crossref] [PubMed]
- Форнер А., Лловет Дж. М., Брюикс Дж. Гепатоцеллюлярная карцинома.Ланцет 2012; 379: 1245-55. [Crossref] [PubMed]
- Кокудо Т., Хасегава К., Ямамото С. и др. Хирургическое лечение гепатоцеллюлярной карциномы, связанной с тромбозом опухоли печеночной вены. Журнал Hepatol 2014; 61: 583-8. [Crossref] [PubMed]
- Ли YH, Hsu CY, Huang YH и др. Сосудистая инвазия при гепатоцеллюлярной карциноме: распространенность, детерминанты и прогностическое влияние. Дж. Клин Гастроэнтерол 2014; 48: 734-41. [Crossref] [PubMed]
- Amitrano L, Guardascione MA, Brancaccio V, et al.Факторы риска и клиническая картина тромбоза воротной вены у пациентов с циррозом печени. J Hepatol 2004; 40: 736-41. [Crossref] [PubMed]
- Огрен М., Бергквист Д., Бьорк М. и др. Тромбоз воротной вены: распространенность, характеристики пациентов и пожизненный риск: популяционное исследование, основанное на 23 796 последовательных вскрытиях. Всемирный журнал J Gastroenterol 2006; 12: 2115-9. [Crossref] [PubMed]
- Гретен Т.Ф., Папендорф Ф., Блек Дж. С. и др. Выживаемость пациентов с гепатоцеллюлярной карциномой: ретроспективный анализ 389 пациентов.Br J Cancer 2005; 92: 1862-8. [Crossref] [PubMed]
- Такаясу К., Ари С., Икаи И. и др. Проспективное когортное исследование трансартериальной химиоэмболизации неоперабельной гепатоцеллюлярной карциномы у 8510 пациентов. Гастроэнтерология 2006; 131: 461-9. [Crossref] [PubMed]
- Sinn DH, Cho JY, Gwak GY и др. Различная выживаемость пациентов с гепатоцеллюлярной карциномой стадии C в клинике Барселоны в зависимости от степени инвазии воротной вены и типа внепеченочного распространения.PLoS One 2015; 10: e0124434. [Crossref] [PubMed]
- Park KW, Park JW, Choi JI и др. Анализ выживаемости 904 пациентов с гепатоцеллюлярной карциномой в эндемичных по вирусу гепатита B районах. J Gastroenterol Hepatol 2008; 23: 467-73. [Crossref] [PubMed]
- Shi J, Lai EC, Li N, et al. Хирургическое лечение гепатоцеллюлярной карциномы с тромбом опухоли воротной вены. Энн Сург Онкол 2010; 17: 2073-80. [Crossref] [PubMed]
- Терзис I, Хаританти А., Эконому И.Фиброламеллярная гепатоцеллюлярная карцинома: отчет о болезни с отчетливыми рентгенологическими особенностями. J Gastrointest Cancer 2010; 41: 2-5. [Crossref] [PubMed]
- Chan SL, Chong CC, Chan AW и др. Ведение гепатоцеллюлярной карциномы с тромбозом опухоли воротной вены: обзор и обновление в 2016 г. World J Gastroenterol 2016; 22: 7289-300. [Crossref] [PubMed]
- Forner A, Reig ME, de Lope CR, et al. Текущая стратегия постановки и лечения: обновление BCLC и перспективы на будущее.Semin Liver Dis 2010; 30: 61-74. [Crossref] [PubMed]
- Bolondi L, Burroughs A, Dufour JF и др. Неоднородность пациентов с гепатоцеллюлярной карциномой средней степени (BCLC B): предложение о подклассе для облегчения принятия решений о лечении. Semin Liver Dis 2012; 32: 348-59. [PubMed]
- Ueno N, Kawamura H, Takahashi H и др. Характеристика тромба воротной вены с помощью ультразвукового исследования с контрастным усилением. J Ultrasound Med 2006; 25: 1147-52.[Crossref] [PubMed]
- Каталано О.А., Чой Г., Чжу А. и др. Дифференциация злокачественного тромба от мягкого тромба воротной вены у пациентов с гепатоцеллюлярной карциномой: применение диффузионно-взвешенной МРТ. Радиология 2010; 254: 154-62. [Crossref] [PubMed]
- Тублин М.Э., Додд Г.Д. 3-й, Барон Р.Л. Доброкачественный и злокачественный тромбоз воротной вены: дифференциация по КТ-характеристикам. AJR Am J Roentgenol 1997; 168: 719-23. [Crossref] [PubMed]
- Шах З.К., МакКернан М.Г., Хан П.Ф. и др.Усиление и расширение тромбоза воротной вены: значение в диагностике гепатоцеллюлярной карциномы у пациентов с множественными поражениями печени. AJR Am J Roentgenol 2007; 188: 1320-3. [Crossref] [PubMed]
- Росси С., Гиттони Г., Раветта В. и др. Ультрасонография с контрастным усилением и спиральная компьютерная томография в обнаружении и характеристике тромбоза воротной вены, осложняющего гепатоцеллюлярную карциному. Eur Radiol 2008; 18: 1749-56. [Crossref] [PubMed]
- Taouli B, Koh DM.МРТ печени с диффузионно-взвешенной визуализацией. Радиология 2010; 254: 47-66. [Crossref] [PubMed]
- Ан Дж. Х., Ю. Дж. С., Чо Э. С. и др. Диффузионно-взвешенная МРТ злокачественного и доброкачественного тромбоза воротной вены. Корейский журнал J Radiol 2016; 17: 533-40. [Crossref] [PubMed]
- Nguyen XC, Nguyen DS, Ngo VT, et al. FDG-Avid Тромбоз опухоли портальной вены из гепатоцеллюлярной карциномы при контрастной ПЭТ / КТ FDG. Азия Океан Журнал Nucl Med Biol 2015; 3: 10-7. [PubMed]
- Позняк М.А., Баус КМ.Гепатофугальный артериальный сигнал в главной воротной вене: индикатор внутрисосудистого распространения опухоли. Радиология 1991; 180: 663-6. [Crossref] [PubMed]
- Соррентино П., Д’Анджело С., Тарантино Л. и др. Сонография с контрастным усилением в сравнении с биопсией для дифференциальной диагностики тромбоза у пациентов с гепатоцеллюлярной карциномой. Мировой журнал J Gastroenterol 2009; 15: 2245-51. [Crossref] [PubMed]
- Вильгельм С.М., Картер С., Танг Л. и др. BAY 43-9006 проявляет широкий спектр пероральной противоопухолевой активности и нацелен на путь RAF / MEK / ERK и рецепторные тирозинкиназы, участвующие в прогрессировании опухоли и ангиогенезе.Cancer Res 2004; 64: 7099-109. [Crossref] [PubMed]
- Хаймбах Дж., Кулик Л. М., Финн Р. и др. Рекомендации по лечению гепатоцеллюлярной карциномы. Гепатология 2017. [Epub перед печатью]. [Crossref] [PubMed]
- Европейская ассоциация по изучению печени, Европейская организация по исследованию и лечению рака. Руководство EASL-EORTC по клинической практике: ведение гепатоцеллюлярной карциномы. Журнал Hepatol 2012; 56: 908-43. [Crossref] [PubMed]
- Берк В., Каплан М.А., Тоняли О. и др.Эффективность и побочные эффекты сорафениба для лечения запущенной гепатоцеллюлярной карциномы: ретроспективное исследование анатолийского общества медицинской онкологии. Азиатский Pac J Cancer Prev 2013; 14: 7367-9. [Crossref] [PubMed]
- Ченг А.Л., Кан Ю.К., Чен З. и др. Эффективность и безопасность сорафениба у пациентов в Азиатско-Тихоокеанском регионе с запущенной гепатоцеллюлярной карциномой: рандомизированное двойное слепое плацебо-контролируемое исследование фазы III. Ланцет Онкол 2009; 10: 25-34. [Crossref] [PubMed]
- Llovet JM, Ricci S, Mazzaferro V и др.Сорафениб при запущенной гепатоцеллюлярной карциноме. N Engl J Med 2008; 359: 378-90. [Crossref] [PubMed]
- Wu CC, Hsieh SR, Chen JT, et al. Оценка резекции печени и воротной вены при гепатоцеллюлярной карциноме с опухолевыми тромбами, доходящими до бифуркации воротной вены. Arch Surg 2000; 135: 1273-9. [Crossref] [PubMed]
- Лю П.Х., Ся Ц.Й., Ли Ю.Х. и др. Хирургическая резекция в сравнении с трансартериальной химиоэмболизацией при гепатоцеллюлярной карциноме стадии C. BCLC.J Surg Oncol 2015; 111: 404-9. [Crossref] [PubMed]
- Фигерас Дж., Ибанез Л., Рамос Э. и др. Критерии отбора для трансплантации печени при ранней стадии гепатоцеллюлярной карциномы с циррозом: результаты многоцентрового исследования. Трансплантация печени 2001; 7: 877-83. [Crossref] [PubMed]
- Mazzaferro V, Bhoori S, Sposito C и др. Миланские критерии трансплантации печени при гепатоцеллюлярной карциноме: доказательный анализ 15-летнего опыта.Трансплантация печени 2011; 17 Приложение 2: S44-57. [Crossref] [PubMed]
- Мизандари М, Азрумелашвили Т, Паксашвили Н и др. Регрессия опухоли у пациента с ГЦК с тромбозом опухоли воротной вены после интрапортальной радиочастотной термоабляции. Отчеты о случаях заболевания Hepatol 2016; 2016: 6843121. [PubMed]
- Woo HY, Heo J. Новые перспективы лечения гепатоцеллюлярной карциномы с тромбозом воротной вены. Clin Mol Hepatol 2015; 21: 115-21. [Crossref] [PubMed]
- Clark TW.Осложнения химиоэмболизации печени. Semin Intervent Radiol 2006; 23: 119-25. [Crossref] [PubMed]
- Prajapati HJ, Dhanasekaran R, El-Rayes BF, et al. Безопасность и эффективность трансартериальной химиоэмболизации гранул с лекарственным покрытием доксорубицина у пациентов с запущенной гепатоцеллюлярной карциномой. Журнал J Vasc Interv Radiol 2013; 24: 307-15. [Crossref] [PubMed]
- Xue TC, Xie XY, Zhang L, et al. Трансартериальная химиоэмболизация гепатоцеллюлярной карциномы с тромбом опухоли воротной вены: метаанализ.БМК Гастроэнтерол 2013; 13:60. [Crossref] [PubMed]
- Омата М., Лесмана Л.А., Татейши Р. и др. Азиатско-Тихоокеанская ассоциация по изучению консенсусных рекомендаций печени по гепатоцеллюлярной карциноме. Hepatol Int 2010; 4: 439-74. [Crossref] [PubMed]
- Mei Q, Li Y. Транскатетерная артериальная эмболизация печеночных артериовенозных шунтов у пациентов с гепатоцеллюлярной карциномой. Semin Intervent Radiol 2012; 29: 237-40. [Crossref] [PubMed]
- Салем Р., Левандовски Р. Дж., Малкахи М. Ф. и др.Радиоэмболизация гепатоцеллюлярной карциномы с использованием микросфер иттрия-90: подробный отчет о долгосрочных результатах. Гастроэнтерология 2010; 138: 52-64. [Crossref] [PubMed]
- Салем Р., Левандовски Р., Робертс С. и др. Использование стеклянных микросфер иттрия-90 (TheraSphere) для лечения неоперабельной гепатоцеллюлярной карциномы у пациентов с тромбозом воротной вены. J Vasc Interv Radiol 2004; 15: 335-45. [Crossref] [PubMed]
- Леунг В.Т., Лау В.Й., Хо С.К. и др.Измерение легочного шунтирования при гепатоцеллюлярной карциноме с внутрипеченочно-артериальным макроагрегированным альбумином технецием-99m. Журнал Nucl Med 1994; 35: 70-3. [PubMed]
- Олорунсола О.Г., Кохи М.П., Behr SC и др. Предикторы визуализации повышенной фракции легочного шунта у пациентов, рассматриваемых для радиоэмболизации иттрием-90. Журнал J Vasc Interv Radiol 2015; 26: 1472-8. [Crossref] [PubMed]
- Wright CL, Werner JD, Tran JM, et al. Лучевой пневмонит после радиоэмболизации иттрием-90: клинический случай и обзор литературы.J Vasc Interv Radiol 2012; 23: 669-74. [Crossref] [PubMed]
- Катамура Ю., Айката Х, Такаки С. и др. Внутриартериальная комбинированная терапия 5-фторурацил / интерферон при запущенной гепатоцеллюлярной карциноме с трехмерной конформной лучевой терапией при тромбозе опухоли воротной вены или без нее. Журнал Гастроэнтерол 2009; 44: 492-502. [Crossref] [PubMed]
- Юн С.М., Лим Ю.С., Вон Х.Дж. и др. Лучевая терапия плюс трансартериальная химиоэмболизация при гепатоцеллюлярной карциноме, проникающей в воротную вену: отдаленные результаты для пациентов.Int J Radiat Oncol Biol Phys 2012; 82: 2004-11. [Crossref] [PubMed]
- Zhang XB, Wang JH, Yan ZP и др. Гепатоцеллюлярная карцинома с тромбом опухоли основной воротной вены: лечение трехмерной конформной лучевой терапией после стентирования воротной вены и трансартериальной химиоэмболизации. Рак 2009; 115: 1245-52. [Crossref] [PubMed]
- Лу Дж., Го Дж. Х., Чжу HD и др. Безопасность и эффективность установки облучательного стента при злокачественном тромбе воротной вены в сочетании с трансартериальной химиоэмболизацией при гепатоцеллюлярной карциноме: опыт одного центра.Журнал J Vasc Interv Radiol 2017; 28: 786-94.e3. [Crossref] [PubMed]
- Cheungpasitporn W, Horne JM, Howarth CB. Адренокортикальная карцинома, проявляющаяся варикоцеле и тромбозом почечной вены: отчет о клиническом случае. Репортаж из журнала J Med 2011; 5: 337. [Crossref] [PubMed]
- Надер С., Хикки Р.С., Селлин Р.В. и др. Карцинома коры надпочечников. Исследование 77 случаев. Рак 1983; 52: 707-11. [Crossref] [PubMed]
- Chiche L, Dousset B, Kieffer E, et al.Адренокортикальная карцинома, распространяющаяся на нижнюю полую вену: презентация серии из 15 пациентов и обзор литературы. Хирургия 2006; 139: 15-27. [Crossref] [PubMed]
- Межир Дж. Дж., Сонг Дж., Фортепиано Дж. И др. Адренокортикальная карцинома, поражающая нижнюю полую вену: отчет о болезни и обзор литературы. Endocr Pract 2008; 14: 721-5. [Crossref] [PubMed]
- Wei CY, Chen KK, Chen MT, et al. Карцинома коры надпочечника с инвазией опухолевого тромба в нижнюю полую вену.Урология 1995; 45: 1052-4. [Crossref] [PubMed]
- Рейес М.А., Чианцио Г., Сингал Р. и др. Адренокортикальный рак с опухолевым тромбом в правой печеночной вене. Int J Urol 2006; 13: 1233-5. [Crossref] [PubMed]
- Haghdani S, Kafash Nayeri R, Zargar H, et al. Адренокортикальный рак с распространением тромба опухоли почечной вены. Урол Дж 2015; 12: 2037-9. [PubMed]
- Опухоль Эмира С. Вильмса с внутрисосудистым опухолевым тромбом.Перевод Педиатр 2014; 3: 29-33. [PubMed]
- Абдулла Ю., Карпеловски Дж., Дэвидсон А. и др. Ведение девяти случаев опухоли Вильмса с внутрисердечным расширением — опыт единого центра. J Pediatr Surg 2013; 48: 394-9. [Crossref] [PubMed]
- Shamberger RC, Ritchey ML, Haase GM и др. Внутрисосудистое распространение опухоли Вильмса. Энн Сург 2001; 234: 116-21. [Crossref] [PubMed]
- Vaideeswar P, Chaudhari JP. Опухоль Вильмса с расширением правых отделов сердца: сообщение о летальном исходе после химиотерапии.Индийский журнал J Pathol Microbiol 2012; 55: 381-3. [Crossref] [PubMed]
- Baert J, Vandamme B, Sciot R, et al. Доброкачественная ангиомиолипома с вовлечением почечной и полой вены как опухолевый тромб: отчет о клиническом случае. Дж. Урол 1995; 153: 1205-7. [Crossref] [PubMed]
- Моралес М.М., Анаклето А., Леал Дж. К. и др. Внутрисосудистая лейомиома с расширением сердца. Клиники (Сан-Паулу) 2012; 67: 83-7. [Crossref] [PubMed]
- Гундерсон С.С., Парсонс Б., Пенароза С. и др.Внутривенный лейомиоматоз, замаскированный под тромбоз больших глубоких вен. J Radiol Case Rep 2016; 10: 29-35. [Crossref] [PubMed]
- Бедирли А., Патироглу Т.Э., Сакрак О. и др. Резекция воротной вены по поводу тромба воротной вены, вызванного нефункционирующей карциномой островковых клеток: отчет о случае. Surg Today 2004; 34: 802-4. [Crossref] [PubMed]
- Родригес Р.А., Овертон Х., Моррис К.Т. Нейроэндокринная опухоль поджелудочной железы с тромбом опухоли селезеночной вены: клинический случай.Int J Surg Case Rep 2014; 5: 1271-4. [Crossref] [PubMed]
- Obuz F, Bora S, Sariolu S. Злокачественная островоклеточная опухоль поджелудочной железы, связанная с тромбом воротной вены. Eur Radiol 2001; 11: 1642-4. [Crossref] [PubMed]
- Smith TM, Semelka RC, Noone TC, et al. Островоклеточная опухоль поджелудочной железы, ассоциированная с опухолевым тромбом в воротной вене. Магнитно-резонансная визуализация 1999; 17: 1093-6. [Crossref] [PubMed]
- Гихан Д.М., Капкала Л.П., Сабериния М. и др.Внутрисосудистая опухоль: глюкагонома, о которой ранее не сообщалось. South Med J 1997; 90: 743-7. [Crossref] [PubMed]
- Далви А.Н., Реге С.А., Бапат М.Р. и др. Не функционирующая островково-клеточная опухоль с асцитом и портальной гипертензией. Индийский журнал J Gastroenterol 2002; 21: 227-8. [PubMed]
- Nguyen BD. Нейроэндокринная опухоль поджелудочной железы с тромбом опухоли воротной вены: ПЭТ-демонстрация. Clin Nucl Med 2005; 30: 628-9. [Crossref] [PubMed]
- Ямагами Ю., Тори М., Сакаки М. и др.Карцинома щитовидной железы с обширным опухолевым тромбом в предсердии. Gen Thorac Cardiovasc Surg 2008; 56: 555-8. [Crossref] [PubMed]
- Онода Н., Накамура М., Хосоно М. и др. Успешное хирургическое лечение запущенной фолликулярной карциномы щитовидной железы с опухолевым тромбом, инфильтрирующим верхнюю полую вену: отчет о случае. Surg Today 2012; 42: 185-90. [Crossref] [PubMed]
- Аль-Джарра К., Абу-Фоул А., Хейс Х. Внутрисосудистое распространение папиллярной карциномы щитовидной железы на внутреннюю яремную вену: отчет о клиническом случае.Int J Surg Case Rep 2014; 5: 551-3. [Crossref] [PubMed]
- Кавано Ф, Томита М, Танака Х и др. Карцинома щитовидной железы с обширным опухолевым тромбом в верхней полой вене: отчет о клиническом случае. Int J Surg Case Rep 2016; 29: 25-9. [Crossref] [PubMed]
- Кобаяси К., Хирокава М., Ябута Т. и др. Опухолевый тромб злокачественных новообразований щитовидной железы в венах: важность выявления с помощью ультразвукового исследования. Щитовидная железа 2011; 21: 527-31. [Crossref] [PubMed]
- Johnson DE, Appelt G, Samuels ML, et al.Метастазы рака яичка. Изучение 78 вскрытых случаев. Урология 1976; 8: 234-9. [Crossref] [PubMed]
- Муж Дж. Э., Беллами Е. А.. Необычные торакоабдоминальные участки метастазов при опухолях яичек. AJR Am J Roentgenol 1985; 145: 1165-71. [Crossref] [PubMed]
- Dusaud M, Bayoud Y, Desfemmes FR, et al. Необычное проявление рака яичка с опухолевым тромбом, распространяющимся на нижнюю полую вену. Case Rep Urol 2015; 2015: 160560. [PubMed]
- Масуи С., Ониши Т., Арима К. и др.Успешное лечение тромба нижней полой вены, осложняющего запущенную опухоль яичка из половых клеток, с помощью временного фильтра нижней полой вены. Int J Urol 2005; 12: 513-5. [Crossref] [PubMed]
- Savarese DM, Rohrer MJ, Pezzella AT и др. Успешное лечение внутрисердечного распространения опухолевого тромба у пациента с запущенным несеминоматозным раком семенных клеток яичек. Урология 1995; 46: 883-7. [Crossref] [PubMed]
- Geffen DB, Kaneti J, Hendler N и др.Карцинома яичка с тромбозом нижней полой вены, распространяющимся в правое предсердие, лечится химиотерапией и антикоагулянтами. Eur Urol 1992; 21: 82-4. [Crossref] [PubMed]
- Сигель Р.Л., Миллер К.Д., Джемаль А. Статистика рака, 2017. CA Cancer J Clin 2017; 67: 7-30. [Crossref] [PubMed]
- Sadat U, Noor N, см. TC, et al. Ишемия периферической артерии из-за первичной опухоли легкого, проникающей в левое предсердие. Рак легких 2007; 57: 237-9. [Crossref] [PubMed]
- Capdeville M, Hearn C, Rice TW, et al.Метастаз в левое предсердие крупноклеточной карциномы легкого у бессимптомного пациента: чреспищеводная эхокардиографическая оценка. J. Cardiothorac Vasc Anesth 1997; 11: 492-4. [Crossref] [PubMed]
- Брандт Р.Р., Рубин Дж., Ридер Г.С. Внутрисердечное распространение опухоли легкого, вызывающее обструкцию притока левого желудочка. J Am Soc Echocardiogr 1995; 8: 930-3. [Crossref] [PubMed]
- Учак А., Инан К., Онан Б. и др. Свободно плавающий опухолевый тромб в левом предсердии, связанный с немелкоклеточным раком легкого.J Card Surg 2009; 24: 686-9. [Crossref] [PubMed]
- Отани К., Исихара С., Хата К. и др. Колоректальный рак с тромбозом венозной опухоли. Asian J Surg 2016. pii: S1015-9584 (16) 30149-X.
- Gupta P, Kramer EL, Ponzo F. Поглощение FDG опухолевым тромбом в нижней полой вене от рака прямой кишки на позитронно-эмиссионной томографии. Clin Nucl Med 2005; 30: 342-3. [Crossref] [PubMed]
Цитируйте эту статью как: Quencer KB, Friedman T, Sheth R, Oklu R.Тромб опухоли: частота возникновения, визуализация, прогноз и лечение. Cardiovasc Diagn Ther 2017; 7 (Приложение 3): S165-S177. DOI: 10.21037 / cdt.2017.09.16
Классификация уровня тромба опухоли в соответствии со стадией Мейо …
Предпосылки: Соотношение нейтрофилов и лимфоцитов (NLR) — это установленный признак воспаления, используемый для оценки почечно-клеточного рака (ПКР). Задача: Определить полезность NLR и его взаимосвязь с известными факторами риска, связанными с плохой выживаемостью у пациентов с метастатическим ПКР и опухолевым тромбом, перенесших циторедуктивную нефрэктомию (CN).Дизайн, сеттинг и участники: Были проанализированы прогностические переменные для пациентов, перенесших ХН с тромбэктомией в период с 2000 по 2014 год в шести различных учреждениях. Пациенты были стратифицированы по NLR> 4,0 на основе анализа точки отсечения. Измерения результатов и статистический анализ: Кривые Каплана-Мейера сравнивали общую выживаемость всей когорты и установленные модели риска (Memorial Sloan Kettering Cancer Center [MSKCC], Международный консорциум баз данных по метастатическим почечно-клеточным карциномам [IMDC] и M.Онкологический центр Д. Андерсона [MDACC]), стратифицированный NLR. Многовариантная регрессия Кокса определила предикторы общей выживаемости. Кривые характеристик оператора приемника проверяли точность прогноза выживаемости ≥12 месяцев, а площадь под кривой (AUC) сравнивали между моделями. Результаты и ограничения: Всего выявлено 332 пациента. Пациенты с NLR ≤4,0 имели более длительную медианную выживаемость (24,7 против 15,2 мес, p = 0,004). NLR> 4,0 выделял пациентов со значительно более короткой выживаемостью для групп небедного риска, определенных критериями MSKCC, IMDC и MDACC.Системные симптомы, низкий гемоглобин, повышенная лактатдегидрогеназа, забрюшинная аденопатия, тромб IV уровня, повышенное абсолютное количество нейтрофилов и NLR> 4 были независимыми предикторами снижения выживаемости (p <0,05). Эти факторы имели более высокую точность прогноза выживаемости через 12 месяцев (AUC = 0,755), чем модели MKSCC, IMDC и MSKCC. Выводы: NLR> 4,0 независимо предсказывает плохую выживаемость и дополнительно различает кривые выживаемости установленных моделей риска. Мы идентифицировали семь предоперационных факторов риска, связанных с плохой выживаемостью для пациентов с метастатическим ПКР с опухолевым тромбом, перенесшим ХН.Краткое описание пациента: Отношение нейтрофилов к лимфоцитам и шесть дополнительных предоперационных переменных могут быть использованы для лучшего совета пациентов относительно выживаемости после операции по поводу метастатической почечно-клеточной карциномы с опухолевым тромбом.
Идентификация двухэтапного процесса агрегации тромбоцитов, опосредующего образование тромба в зависимости от сдвига | Кровь
Чрезмерное накопление тромбоцитов в местах разрыва атеросклеротической бляшки является одним из ключевых патогенных событий, ускоряющих образование артериальных тромбов, ведущих к острому инфаркту миокарда, внезапной смерти и ишемическому инсульту.Этот патологический процесс является причиной большей заболеваемости и смертности, чем любой другой болезненный процесс, и, как следствие, тромбоциты представляют собой главную мишень для терапевтического вмешательства. Несколько факторов влияют на мощные активирующие тромбоциты свойства разорванных бляшек, в том числе высокое содержание фибриллярных коллагенов в поражении, 1-3 , присутствие тканевого фактора, 4 , а также прямые эффекты активации тромбоцитов высокой напряжение сдвига, вызванное сужением артерии. 5-8 Реологические нарушения в местах стеноза артерий динамичны и сложны и в значительной степени зависят от степени сужения и измененной геометрии просвета сосудов. Тем не менее, высокий сдвиг является неизбежным следствием прогрессирующей окклюзии сосудов, устанавливая потенциально опасный цикл дальнейшей активации тромбоцитов и роста тромба.
Механизмы, лежащие в основе агрегации тромбоцитов и образования тромбов, были тщательно изучены и сильно зависят от преобладающих условий кровотока.В условиях относительно низкого сдвига (от 0 до 1000 с -1 ) агрегация тромбоцитов в первую очередь опосредуется растворимым фибриногеном, который физически сшивает тромбоциты за счет взаимодействия с интегрином α IIb β 3 . 9-11 При все более высоких скоростях сдвига стенки (от 1000 до 10 000 с -1 ) агрегация становится более зависимой от фактора фон Виллебранда (VWF), при этом фибриноген играет поддерживающую роль в стабилизации сформированных агрегатов. 11 Иммобилизованный VWF на поверхности тромбоцитов необходим для инициации агрегации тромбоцитов, зависящей от сдвига, благодаря своей способности быстро взаимодействовать с гликопротеином Ib (GPIb).Однако это адгезивное взаимодействие быстро обратимо, что приводит к перемещению тромбоцитов в направлении потока. Основываясь на современных моделях, тромбоциты активируются во время этого процесса, стимулируя интегрин α IIb β 3 вовлечение VWF и / или фибриногена, что приводит к стабильной агрегации тромбоцитов. Недавние исследования определили уникальный механизм, инициирующий агрегацию тромбоцитов, который в основном действует на патологических уровнях сдвига (более 10 000 с -1 ). 12 Этот механизм агрегации опосредуется исключительно участием GPIb в VWF и не требует активации тромбоцитов или лиганд-связывающей функции интегрина α IIb β 3 .Хотя патофизиологическое значение этого нового механизма агрегации еще предстоит установить, тем не менее, это предполагает, что при определенных экспериментальных условиях взаимодействие VWF-GPIb может потенциально поддерживать взаимодействия тромбоцитов с тромбогенными поверхностями независимо от других адгезивных взаимодействий.
Центральным в современных моделях адгезии тромбоцитов в потоке является концепция, согласно которой тромбоциты активируются во время взаимодействия с тромбогенными поверхностями, стимулируя активацию интегрина и образование дополнительных адгезионных связей, которые служат для снижения скорости транслокации клеток и способствуют остановке клеток.Такая модель хорошо зарекомендовала себя для адгезии лейкоцитов в потоке. 13 Однако в контексте тромбоцитов эта модель имеет потенциально важное значение для механизмов, регулирующих поверхностную транслокацию и образование агрегатов. Например, в отличие от лейкоцитов, которые имеют сферическую морфологию, хорошо подходящую для вращательного движения (качения), тромбоциты имеют плоскую дискоидную морфологию, которая не поддерживает гладкие перекатывающиеся взаимодействия. Одна возможность состоит в том, что сигналы, генерируемые во время поверхностной транслокации, вызывают морфологические изменения, достаточные для превращения дискоидных тромбоцитов в шипованные сферы, тем самым облегчая вращающийся фенотип.Такие морфологические изменения были ранее описаны во время адгезии тромбоцитов к VWF в потоке. 14-16 Альтернативная возможность заключается в том, что тромбоциты в основном перемещаются в виде плоских дисков посредством механизма поворота из стороны в сторону или через механизм скольжения, который максимизирует поверхностный контакт (образование связи) с клейкой поверхностью. Существуют экспериментальные данные, подтверждающие прежний механизм 15 ; однако взаимосвязь между морфологическим изменением тромбоцитов и стабильной адгезией не определена.Потенциальные механизмы, регулирующие адгезию тромбоцитов в потоке, дополнительно усложняются обнаружением, что тромбоциты образуют тонкие мембранные связи во время поверхностной транслокации на VWF. 12,17 Мембранные тросы отрываются от поверхности дискоидных тромбоцитов под действием сил гемодинамического сопротивления. Как таковые, их предпочтительно формуют в условиях высокого сдвига, где они обеспечивают механическое преимущество адгезивным связям VWF-GPIb. Однако физиологическое значение мембранных привязок еще не определено, и в настоящее время неясно, участвуют ли эти структуры в первую очередь во взаимодействиях тромбоцитов с сосудами или также имеют отношение к агрегации тромбоцитов.
В настоящем исследовании мы использовали методы визуализации с высоким разрешением для моделей тромбоза in vitro и in vivo, чтобы исследовать механизмы, регулирующие агрегацию тромбоцитов в условиях высокого напряжения сдвига. Эти исследования демонстрируют, что тромбоциты в основном перемещаются по поверхности тромбов in vivo в виде плоских скользящих дисков и участвуют в процессе агрегации тромбоцитов, образуя временные адгезивные контакты с другими дискоидными тромбоцитами.Исследования перфузии in vitro предполагают, что образование дискоидных агрегатов тромбоцитов включает образование мембранных связок между коадгерирующими тромбоцитами посредством адгезионных взаимодействий, опосредованных GPIb и интегрином α IIb β 3 . Мы определили 3 независимых переменных, влияющих на эффективность преобразования обратимых дискоидных агрегатов тромбоцитов в стабильную агрегацию: реактивность тромбогенной поверхности, уровень напряжения сдвига и плотность тромбоцитов на адгезивной поверхности.В сочетании эти факторы имеют большое влияние на скорость агрегации тромбоцитов. В целом, наши исследования определяют новый механизм зависящей от сдвига агрегации тромбоцитов, который имеет отношение к развитию тромба in vivo. Кроме того, наши исследования предоставляют модель, объясняющую, как дискоидная морфология тромбоцитов способствует поддержанию адгезивных взаимодействий с тромбогенными поверхностями в условиях высокого напряжения сдвига.
Анализы перфузии проводили в соответствии с модифицированным методом Cooke et al. 26 Микрокапиллярные пробирки (VitroCom, Mountain Lakes, NJ) покрывали либо очищенным VWF (50 мкг / мл), либо смесью VWF и фибриногена (10 мкг / мл VWF и 5, 10, 20 или 50 мкг / мл. фибриноген), а затем блокировали 5% сывороткой человека (с добавлением 50 мкг / мл фенилметилсульфонилфторида) перед экспериментом. Либо цельную кровь (антикоагулированную гирудином 400 Ед / мл), либо промытые тромбоциты (150 × 10 6 / мл), восстановленные уплотненными эритроцитами (гематокрит 0,45 [45%]), перфузировали через микрокапиллярные пробирки со скоростью сдвига 600. , 1800 или 5000 с −1 .Там, где указано, тромбоциты предварительно обрабатывали c7E3 Fab (20 мкг / мл), ARC69931MX (1 мкМ), A3P5P (1 мМ), MRS2179 (100 мкМ) или PGE 1 (0,5 мкг / мл) перед перфузией. Прилипшие тромбоциты визуализировали с помощью DIC-микроскопии (объектив × 100 PL APO, NA 1,40–0,7) на микроскопе Leica DMIRB. Адгезию контролировали в течение 250-секундного периода и записывали на видео для автономного анализа. В 15-, 30-, 45-, 60-, 90- и 120-секундные моменты времени подсчитывали количество прилипших пластинок в оптическом поле (размеры 70 мкм × 90 мкм).Агрегат был определен как кластер по меньшей мере из 5 тромбоцитов, поддерживающих физический контакт в течение по меньшей мере 3 секунд. Образование агрегатов количественно оценивали путем подсчета количества агрегатов, присутствующих в поле зрения, и регистрации количества тромбоцитов в отдельных агрегатах. Агрегат был классифицирован как «нестабильный», если он состоял из обратимо прикрепившихся тромбоцитов. «Стабильный» агрегат был классифицирован как агрегат, состоящий из необратимо прикрепившихся тромбоцитов.
В некоторых экспериментах промытые тромбоциты, восстановленные с помощью эритроцитов, перфузировали над смешанной матрицей VWF / фибриноген в течение 15 секунд, чтобы дать возможность небольшому количеству тромбоцитов прилипнуть (приблизительно от 6 до 7 тромбоцитов на поле 70 мкм × 90 мкм).Модифицированный буфер Тироде перфузировали еще в течение 2 минут, чтобы эти тромбоциты необратимо прикрепились и начали распространяться. Промытые тромбоциты, предварительно обработанные либо c7E3 Fab (20 мкг / мл), либо цитохалазином D (5 мкМ), восстанавливали эритроцитами, как описано, и затем перфузировали над прикрепившимися тромбоцитами. ДВС-микроскопия использовалась для визуализации последующих взаимодействий с предварительно прикрепленными тромбоцитами и видеозаписи, записанной, как описано в «Прижизненных исследованиях».
Было продемонстрировано, что тромбоциты перемещаются на матриксе VWF in vitro в виде плоских дисков или шипованных сфер. 14-16 Чтобы изучить, какая из этих морфологий наиболее важна для роста тромба in vivo, мы разработали метод визуализации ДИК с большим увеличением, который имеет достаточное оптическое разрешение для определения морфологии отдельных тромбоцитов в микроциркуляции крыс (см. Видео S1 –S6 [доступно на веб-сайте Blood ; см. Ссылку «Дополнительные материалы» в верхней части онлайн-статьи], видеоролики, исследующие образование тромбоцитов in vivo, для полного понимания динамики агрегации тромбоцитов).Повреждение сосудов брыжеечных артериол было вызвано фотоактивацией системно вводимого бенгальского розового, методика, которая вызывает повреждение сосудов, приводящее к развитию небольших неокклюзионных тромбов. 22 Тромбы обычно образуются в течение периода от 1 до 5 минут, и характерной особенностью роста тромба в этой модели является высокая доля тромбоцитов, перемещающихся по поверхности тромба. 22 Как показано на рисунке 1A, большинство тромбоцитов (более 95%), перемещающихся либо на поврежденную стенку сосуда, либо на поверхность образующихся тромбов, сохранили свою дискоидную морфологию (видео S1).В то время как небольшая подгруппа тромбоцитов перемещалась в движении из стороны в сторону, чаще всего перемещаясь в скользящем движении, поддерживая максимальный поверхностный контакт с поверхностью тромба (рис. 1B). Только несколько перемещающихся тромбоцитов (менее 1%) имели сферическую морфологию. Кроме того, тромбоциты, находящиеся в поверхностных слоях тромбов, сохранили свою дискоидную форму и оказались непрочно прикрепленными. Скользящие дискоидные тромбоциты были кардинальным признаком развития тромба независимо от степени повреждения сосудов.В то время как оптическое разрешение системы было недостаточным, чтобы обеспечить четкую визуализацию отдельных привязок мембраны, их присутствие предполагалось обнаружением того, что многие дискоидные тромбоциты демонстрируют свободное движение или даже вращение вокруг одной привязанной точки (Видео S3). Кроме того, отдельные тромбоциты удлиняются и отталкиваются от единственной точки контакта (рис. 1C), что является характерной чертой тромбоцитов, связанных с мембраной 17 (видео S3). Расстояние, на которое дискоидное тело прикрепленного тромбоцита отходило от единственной точки прикрепления, постепенно увеличивалось, достигая 3 мкм (в среднем 1.15 мкм; диапазон от 0,5 до 2,8 мкм). Как показано на рисунке 1C, несмотря на отсутствие видимого физического контакта между их внешними периферическими мембранами, эти тромбоциты были четко прикреплены, поскольку силы сопротивления тромбоцитам ниже по потоку всегда передавались на привязанные вверх по потоку тромбоциты (рисунок 1C, 0,02 секунды), что приводило к скоординированному движению и втягиванию. движение тромбоцитов на поверхности тромба. Таким образом, тромбоциты в поверхностных слоях образующихся тромбов изначально были слабо связаны друг с другом, так что под действием сил гемодинамического сопротивления эти клетки легко отделялись от поверхности тромба либо в виде отдельных клеток, либо в виде небольших скоплений рыхлых агрегатов тромбоцитов (рис. 1D). ; Видео S2).Эти данные указывают на то, что большинство тромбоцитов сохраняют свою дискоидную морфологию во время первоначального образования агрегатов in vivo. Более того, они предполагают потенциально важную роль мембранных связок в регуляции начального обратимого взаимодействия между тромбоцитами.
VWF — это относительно слабая тромбогенная поверхность, поддерживающая ограниченную агрегацию тромбоцитов и рост тромба. 30 In vivo тромбоциты обычно подвергаются воздействию ряда адгезивных белков в местах повреждения сосудов, при этом VWF и фибриноген играют основную роль в поддержании роста тромба. 31 Предыдущие исследования продемонстрировали, что комбинированная матрица VWF / фибриноген значительно более реактивна, чем матрицы, приготовленные с использованием только одного из белков. 30 Чтобы изучить влияние увеличения поверхностной реактивности на динамику агрегации тромбоцитов, исследования перфузии были выполнены на смешанной матрице, состоящей из фиксированной концентрации VWF и возрастающих концентраций адсорбированного на поверхности фибриногена. Как показано на фиг. 3A-B, перфузия промытых тромбоцитов в присутствии эритроцитов поверх очищенной матрицы VWF привела к развитию обратимых дискоидных агрегатов тромбоцитов с ограниченным превращением в стабильные агрегаты.Напротив, увеличение поверхностной концентрации фибриногена с помощью VWF увеличивало реактивность матрицы, что приводило к увеличению образования стабильных агрегатов (Рисунок 3A-B; Видео S5-S6). Как показано на Рисунке 3Bi, общее количество нестабильных дискоидных агрегатов не было существенно изменено присутствием фибриногена; однако при концентрации фибриногена выше 10 мкг / мл наблюдалось резкое увеличение скорости превращения нестабильных агрегатов в стабильные агрегаты. Повышение реакционной способности матрицы оказало 2 основных эффекта на процесс агрегации: оно значительно сократило время до образования как обратимых, так и необратимых агрегатов и заметно увеличило эффективность привлечения тромбоцитов в стабильные агрегаты, что привело к гораздо большему количеству тромбоцитов на агрегат. во все исследованные временные точки (рис. 3Bii).Примечательно, что при самых высоких используемых концентрациях фибриногена (50 мкг / мл) быстрый рост стабильных агрегатов означал, что количество тромбоцитов в отдельных агрегатах не может быть точно определено (рис. 3Bi). Кроме того, небольшие агрегаты часто сливаются вместе, что приводит к соответствующему сокращению общего количества агрегатов, но увеличению их размера (рис. 3Bii). Сканирующая электронная микроскопия показала, что большинство тромбоцитов первоначально сгруппировалось вокруг центральной активированной тромбоциты за счет образования тонких удлиненных выступов мембраны (Рисунки 2C и 3C).Мы подтвердили, что эти выступы были связями, а не филоподиями, потому что они не были предотвращены предварительной обработкой тромбоцитов ингибитором полимеризации актина, цитохалазином D (данные не показаны). Кроме того, изображение SEM подтвердило, что преобразование обратимых агрегатов в стабильные агрегаты было связано со сферизацией тромбоцитов и расширением множественных филоподиальных выступов (рис. 3D). Эти исследования определяют главную роль реакционной способности матрикса в регулировании начального образования дискоидных агрегатов тромбоцитов и в содействии их превращению в стабильные агрегаты.
Рисунок 3
Обратимой агрегации дискоидных тромбоцитов in vitro способствует повышение реакционной способности матрикса. Промытые тромбоциты (150 × 10 6 / мл), восстановленные с помощью эритроцитов, перфузировали через микрокапиллярные пробирки, покрытые VWF (10 мкг / мл) и различными концентрациями фибриногена (5, 10, 20 или 50 мкг / мл) при 1800 с −1 . (A) ДВС-изображения были получены в указанные моменты времени на матрице VWF (10 мкг / мл) или VWF / фибриноген (10 мкг / мл / 50 мкг / мл соответственно).На схематических диаграммах выделены неагрегированные тромбоциты (белые), обратимые агрегаты (серые) и стабильные агрегаты (черные). Масштабная линейка = 10 мкм. На VWF агрегаты оставались обратимыми, тогда как на VWF / фибриноген обратимые агрегаты (60 секунд) в конечном итоге становились стабильными (от 90 до 240 секунд). (B) Формирование агрегатов определяли количественно путем определения количества (i) и размера (ii) агрегатов в поле зрения. (i) График, показывающий количество нестабильных (○, пунктирная линия) и стабильных (•, сплошная линия) агрегатов.Каждая точка представляет собой среднее значение ± SEM по крайней мере из 4 независимых экспериментов. (ii) Каждая точка представляет количество тромбоцитов в совокупности, показывая данные, объединенные из 4 независимых экспериментов (столбик представляет собой медианное значение). * ND, количественный анализ не проводился, потому что несколько небольших агрегатов слились вместе в более крупные единичные агрегаты. Масштабная линейка = 10 мкм. (C) SEM-изображение, демонстрирующее типичный обратимый дискоидный агрегат тромбоцитов, образующийся на смешанной матрице VWF / фибриноген. Обратите внимание, что все тромбоциты группируются вокруг центральных активированных тромбоцитов за счет образования тонких мембранных связок.Тромбоциты были зафиксированы на 60 секундах. Масштабная линейка = 2 мкм. (D) SEM-изображения, демонстрирующие последовательные морфологические изменения тромбоцитов, связанные со сдвиговой агрегацией тромбоцитов. Тромбоциты перфузировали через микрокапиллярные пробирки, покрытые VWF / фибриногеном (10 мкг / мл / 50 мкг / мл соответственно) при 1800 с -1 . Эти репрезентативные изображения демонстрируют дискоидные тромбоциты, образующие мембранные связки во время поверхностной транслокации на смешанной матрице (30 секунд), типичный нестабильный агрегат, состоящий из нескольких дискоидных тромбоцитов, сгруппированных вокруг центральной частично распределенной тромбоциты (60 секунд), и тромбоцитов, которые претерпели классическое изменение формы ( сферическое и расширение множественных расширений филоподий) во время формирования стабильных агрегатов (90 секунд).Масштабная линейка = 2 мкм.
Рисунок 3
Обратимой агрегации дискоидных тромбоцитов in vitro способствует повышение реакционной способности матрикса. Промытые тромбоциты (150 × 10 6 / мл), восстановленные с помощью эритроцитов, перфузировали через микрокапиллярные пробирки, покрытые VWF (10 мкг / мл) и различными концентрациями фибриногена (5, 10, 20 или 50 мкг / мл) при 1800 с −1 . (A) ДВС-изображения были получены в указанные моменты времени на матрице VWF (10 мкг / мл) или VWF / фибриноген (10 мкг / мл / 50 мкг / мл соответственно).На схематических диаграммах выделены неагрегированные тромбоциты (белые), обратимые агрегаты (серые) и стабильные агрегаты (черные). Масштабная линейка = 10 мкм. На VWF агрегаты оставались обратимыми, тогда как на VWF / фибриноген обратимые агрегаты (60 секунд) в конечном итоге становились стабильными (от 90 до 240 секунд). (B) Формирование агрегатов определяли количественно путем определения количества (i) и размера (ii) агрегатов в поле зрения. (i) График, показывающий количество нестабильных (○, пунктирная линия) и стабильных (•, сплошная линия) агрегатов.Каждая точка представляет собой среднее значение ± SEM по крайней мере из 4 независимых экспериментов. (ii) Каждая точка представляет количество тромбоцитов в совокупности, показывая данные, объединенные из 4 независимых экспериментов (столбик представляет собой медианное значение). * ND, количественный анализ не проводился, потому что несколько небольших агрегатов слились вместе в более крупные единичные агрегаты. Масштабная линейка = 10 мкм. (C) SEM-изображение, демонстрирующее типичный обратимый дискоидный агрегат тромбоцитов, образующийся на смешанной матрице VWF / фибриноген. Обратите внимание, что все тромбоциты группируются вокруг центральных активированных тромбоцитов за счет образования тонких мембранных связок.Тромбоциты были зафиксированы на 60 секундах. Масштабная линейка = 2 мкм. (D) SEM-изображения, демонстрирующие последовательные морфологические изменения тромбоцитов, связанные со сдвиговой агрегацией тромбоцитов. Тромбоциты перфузировали через микрокапиллярные пробирки, покрытые VWF / фибриногеном (10 мкг / мл / 50 мкг / мл соответственно) при 1800 с -1 . Эти репрезентативные изображения демонстрируют дискоидные тромбоциты, образующие мембранные связки во время поверхностной транслокации на смешанной матрице (30 секунд), типичный нестабильный агрегат, состоящий из нескольких дискоидных тромбоцитов, сгруппированных вокруг центральной частично распределенной тромбоциты (60 секунд), и тромбоцитов, которые претерпели классическое изменение формы ( сферическое и расширение множественных расширений филоподий) во время формирования стабильных агрегатов (90 секунд).Масштабная линейка = 2 мкм.
Образование связки мембраны может происходить на иммобилизованной матрице VWF в присутствии антагонистов интегрина α IIb β 3 или на изолированных доменах VWF A1, 12,17 , демонстрируя, что одного взаимодействия VWF-GPIb достаточно, чтобы способствовать этому процесс. Чтобы выяснить, было ли взаимодействие VWF-GPIb достаточным для поддержки закрепления мембранной привязки и обратимой агрегации дискоидных тромбоцитов, исследования перфузии тромбоцитов были выполнены в присутствии интегрина α IIb β 3 антагониста, c7E3 Fab.Блокирование связывания лиганда с интегрином α IIb β 3 полностью устраняет образование привязки мембраны и развитие обратимых дискоидных агрегатов тромбоцитов. Однако это лечение также устранило стационарную адгезию, и в исследованиях SEM (рис. 3C) было отмечено, что дискоидные агрегаты часто группировались вокруг центрального стационарного активированного тромбоцита. Потенциал тромбоцитов, обработанных c7E3 Fab, к агрегации вокруг активированных тромбоцитов изучали в двухэтапном анализе перфузии, в котором исходной популяции необработанных промытых тромбоцитов позволяли прочно прикрепиться к субстрату VWF / фибриноген, после чего следовала перфузия второго популяция тромбоцитов, обработанных c7E3 Fab.В этих условиях перемещающиеся дискоидные тромбоциты лишь кратковременно (менее 3 секунд) взаимодействовали с иммобилизованными тромбоцитами, предотвращая образование привязки мембраны и развитие обратимых агрегатов тромбоцитов (рис. 4С). Точно так же перфузия тромбоцитов, обработанных c7E3, на предварительно сформированные распространившиеся монослои тромбоцитов устраняла образование привязки мембраны и образование агрегатов (данные не показаны). Эти исследования определяют главную роль интегрина α IIb β 3 в поддержании обратимой фазы взаимодействий тромбоцитов с тромбоцитами, необходимой для образования мембранных связок.
Предыдущие исследования показали потенциально важную роль мембранных связок в регуляции временной «стоп-фазы» транслокации тромбоцитов на матриксе VWF. 17 Чтобы исследовать влияние ингибирования связывания лиганда интегрина α IIb β 3 на продолжительность контактов адгезии тромбоцитов с тромбоцитами в потоке, обработанные c7E3 тромбоциты перфузировали по предварительно сформированным распределенным монослоям тромбоцитов.Ингибирование связывания лиганда с интегрином α IIb β 3 и последующее развитие мембранных привязок устраняли стоп-фазу поверхностной транслокации и резко сокращали продолжительность контактов адгезии тромбоцитов к тромбоцитам (данные не показаны). Аналогичные результаты были очевидны при использовании тромбоцитов с врожденным дефицитом интегрина α IIb β 3 (тромбастенические тромбоциты Гланцмана) (данные не показаны) и в экспериментах с обратным потоком, в которых нормальные тромбоциты и тромбоциты GT перфузировались по сравнению с нормальным монослоем и монослоем GT (соответственно и наоборот), интегрин α IIb β 3 на поверхности как иммобилизованных, так и текущих тромбоцитов способствовал продолжительности контактов адгезии тромбоцитов к тромбоцитам в потоке (рис. 4C).
Известно, что интегрин α IIb β 3 может взаимодействовать с фибриногеном независимо от активации. 32,33 Таким образом, чтобы определить, зависит ли от активации образование обратимых агрегатов между дискоидными тромбоцитами, исследования перфузии тромбоцитов были выполнены на смешанном матриксе VWF / фибриноген в присутствии мощного ингибитора активации тромбоцитов, PGE 1 . Как показано на фиг. 4D, PGE 1 не влиял на взаимодействие тромбоцитов с матрицей; однако обратимая фаза образования агрегатов тромбоцитов была полностью подавлена.В совокупности эти исследования определяют ключевую роль активации тромбоцитов и образования связи интегрина α IIb β 3 в поддержании обратимой фазы взаимодействий тромбоцитов, необходимых для образования мембранных связок.
Одним из наиболее поразительных эффектов увеличения поверхностной плотности тромбоцитов было усиление первичной адгезии тромбоцитов к матрице смешанного VWF / фибриногена, что привело к быстрому образованию сайтов зародышеобразования для последующей агрегации тромбоцитов (Видео S6).Как показано на Фигуре 5C, время, необходимое для образования стабильной первичной адгезии тромбоцитов, обратно коррелировало с поверхностной плотностью тромбоцитов, так что в отсутствие взаимодействия тромбоцитов с тромбоцитами первичная адгезия задерживалась в 4-6 раз. Этот эффект поверхностной плотности тромбоцитов также был очевиден на очищенной матрице VWF, без прочной адгезии, очевидной в отсутствие взаимодействий тромбоцитов с тромбоцитами (данные не показаны). Чтобы получить представление о биохимических механизмах, с помощью которых взаимодействия тромбоцитов способствуют первичной адгезии тромбоцитов, был исследован цитозольный поток кальция, поскольку существует тесная корреляция между уровнями кальция в цитозоле и прочной адгезией тромбоцитов. 27 В целом, кальциевые ответы тромбоцитов можно в широком смысле классифицировать на кальциевые ответы низкого, среднего и высокого диапазона, с образованием устойчивых адгезионных контактов, связанных с устойчивым потоком кальция высокого диапазона. 27 Как показано на Рисунке 6A, при низкой поверхностной плотности тромбоцитов (количество тромбоцитов 5 × 10 6 / мл) кальциевые ответы высокого диапазона обычно носили временный характер, а продолжительность кальциевого ответа коррелировала со временем стационарная адгезия.В отсутствие взаимодействий тромбоцитов и тромбоцитов не наблюдалось устойчивого притока кальция или стабильной адгезии (рис. 6А). Напротив, при высокой поверхностной плотности тромбоцитов (количество тромбоцитов 150 × 10 6 / мл) примерно 60% респондентов с высоким уровнем кальция демонстрировали устойчивый приток кальция (рис. 6А), что приводило к развитию стабильных адгезионных контактов (адгезия больше более 30 секунд). Эти данные свидетельствуют о том, что взаимодействие тромбоцитов с тромбоцитами способствует устойчивому цитозольному потоку кальция.
Рисунок 6
Повышенная плотность тромбоцитов помогает поддерживать приток кальция в агрегацию тромбоцитов. Промытые тромбоциты, нагруженные клеточным хелатором кальция NP-EGTA и индикаторными красителями кальция (см. «Анализ цитозольного потока кальция»), были восстановлены с помощью эритроцитов (до конечной концентрации 150 × 10 6 / мл или 5 × 10 × . 6 / мл) и перфузировали через микрокапиллярные пробирки, покрытые VWF (50 мкг / мл), при 1800 с -1 .Кратковременное повышение цитозольного кальция было индуцировано в перемещающихся тромбоцитах путем извлечения из каркаса с кратковременным воздействием ближнего УФ-света. (A) Доля тромбоцитов с высоким Δ [Ca 2+ ] c (демонстрирует временные или устойчивые колебания кальция при плотности тромбоцитов 5 × 10 6 / мл или 150 × 10 6 / мл [n = 3]). Примечательно, что все клетки, как наблюдали, претерпевали переходные стационарные события адгезии при плотности тромбоцитов 5 × 10 6 / мл. (B) Одноканальные изображения зеленой флуоресценции Oregon, показывающие транслокацию тромбоцитов до распаковки (0 секунд) и повышение уровня внутриклеточного кальция после воздействия УФ-излучения (1.8 секунд). На левых панелях показан типичный тромбоцит, не связанный с клетками при низкой плотности, где тромбоцит остается неподвижным в течение определенного периода, а затем продолжает транслокацию при снижении уровня кальция. Средние панели показывают типичный тромбоцит с высокой плотностью, где уровни кальция остаются повышенными после распаковки, а тромбоциты остаются неподвижными и становятся фокусом для рекрутирования других тромбоцитов в нестабильный агрегат (выделено на панелях с большим увеличением справа. боковая сторона).(C) После распаковки тромбоциты оставались неподвижными, в то время как уровень кальция оставался повышенным. Продолжительность стационарного периода была меньше у тромбоцитов с низкой плотностью по сравнению с тромбоцитами с высокой плотностью без клетки (n = 50; полоса представляет собой медианное значение; время отсечки составляло 48 секунд).
Рисунок 6
Повышенная плотность тромбоцитов помогает поддерживать приток кальция в агрегацию тромбоцитов. Промытые тромбоциты, нагруженные клеточным хелатором кальция NP-EGTA и индикаторными красителями кальция (см. «Анализ цитозольного потока кальция»), были восстановлены с помощью эритроцитов (до конечной концентрации 150 × 10 6 / мл или 5 × 10 × . 6 / мл) и перфузировали через микрокапиллярные пробирки, покрытые VWF (50 мкг / мл), при 1800 с -1 .Кратковременное повышение цитозольного кальция было индуцировано в перемещающихся тромбоцитах путем извлечения из каркаса с кратковременным воздействием ближнего УФ-света. (A) Доля тромбоцитов с высоким Δ [Ca 2+ ] c (демонстрирует временные или устойчивые колебания кальция при плотности тромбоцитов 5 × 10 6 / мл или 150 × 10 6 / мл [n = 3]). Примечательно, что все клетки, как наблюдали, претерпевали переходные стационарные события адгезии при плотности тромбоцитов 5 × 10 6 / мл. (B) Одноканальные изображения зеленой флуоресценции Oregon, показывающие транслокацию тромбоцитов до распаковки (0 секунд) и повышение уровня внутриклеточного кальция после воздействия УФ-излучения (1.8 секунд). На левых панелях показан типичный тромбоцит, не связанный с клетками при низкой плотности, где тромбоцит остается неподвижным в течение определенного периода, а затем продолжает транслокацию при снижении уровня кальция. Средние панели показывают типичный тромбоцит с высокой плотностью, где уровни кальция остаются повышенными после распаковки, а тромбоциты остаются неподвижными и становятся фокусом для рекрутирования других тромбоцитов в нестабильный агрегат (выделено на панелях с большим увеличением справа. боковая сторона).(C) После распаковки тромбоциты оставались неподвижными, в то время как уровень кальция оставался повышенным. Продолжительность стационарного периода была меньше у тромбоцитов с низкой плотностью по сравнению с тромбоцитами с высокой плотностью без клетки (n = 50; полоса представляет собой медианное значение; время отсечки составляло 48 секунд).
Для дальнейшего изучения этого явления мы провели исследования перфузии тромбоцитов, нагруженных хелатором кальция NP-EGTA в клетке.NP-EGTA представляет собой клеточный хелатор кальция, который демонстрирует заметное увеличение его K d для Ca 2+ при фотолизе в ближнем УФ-свете (от 300 до 400 нм). Этот реагент можно эффективно использовать для временного высвобождения относительно большой концентрации свободного Ca 2+ в цитозоле в течение миллисекунд УФ-активации. 34 Как показано на Фигуре 6B, при низкой плотности тромбоцитов (количество тромбоцитов 5 × 10 6 / мл) индукция временного кальциевого ответа в перемещающихся тромбоцитах приводила к немедленной остановке тромбоцитов на VWF; однако во всех тромбоцитах сигнал кальция не поддерживался, что приводило к возобновлению транслокации в 100% тромбоцитов.Напротив, при более высокой плотности тромбоцитов (количество тромбоцитов 150 × 10 6 / мл) индукция временного скачка кальция в популяции связанных с мембраной обратимых агрегатов тромбоцитов вызвала начало устойчивого повышения уровня кальция, которого было достаточно. для поддержки длительной адгезии тромбоцитов и стабильной агрегации (рис. 6С). Примечательно, что в отсутствие разрыхления, взаимодействия тромбоцитов с тромбоцитами на матрице VWF не были способны вызывать устойчивый приток кальция в формирующиеся агрегаты и не приводили к образованию стабильных агрегатов (рис. 3).Формирование стабильных агрегатов после распаковки зависело от АДФ, поскольку оно полностью ингибировалось апиразой (данные не показаны), что позволяет предположить, что паракринная стимуляция тромбоцитов во время начального образования агрегатов имеет решающее значение для поддержания цитозольных кальциевых ответов, необходимых для стабильной первичной адгезии тромбоцитов.
Долгое время считалось, что развитие тромба in vivo включает последовательное накопление отдельных тромбоцитов на поверхности тромбов, что приводит к изменению формы тромбоцитов, активации интегрина α IIb β 3 и прочной адгезии. 10,11,35-37 Однако эта концепция недавно была оспорена демонстрацией того, что в условиях очень высокого сдвига (более 10 000 с -1 ) развитие тромба может включать начальное образование и рекрутирование обратимых агрегаты тромбоцитов на поверхности с образованием тромбов посредством процесса, опосредованного исключительно связями VWF-GPIb, независимо от активации тромбоцитов. 12 Не определено, работает ли аналогичный механизм в более физиологически релевантных условиях сдвига (от 1000 до 10 000 с -1 ).Используя методы визуализации с высоким разрешением для моделей тромбоза in vivo и in vitro, мы смогли идентифицировать временную последовательность событий, лежащих в основе агрегации тромбоцитов при физиологической скорости сдвига. Мы продемонстрировали, что первая фаза агрегации тромбоцитов включает в себя индуцированное сдвигом образование мембранных связок между соединяющимися тромбоцитами. Эта начальная фаза агрегации в основном включает дискоидные тромбоциты, но отличается от механизма, описанного Ruggeri et al. 12 , тем, что требует активации тромбоцитов и адгезивной функции как GPIb, так и интегрина α IIb β 3 .Вторая фаза агрегации связана с изменением формы тромбоцитов и необратимой адгезией тромбоцитов и критически зависит от высвобождения АДФ. Мы продемонстрировали, что на динамику этого двухэтапного процесса агрегации критически влияют 3 переменных, в том числе высокое напряжение сдвига, поверхностная плотность тромбоцитов и реакционная способность матрицы, причем 2 первые переменные регулируют обратимое образование агрегатов, а вторые регулируют переход к стабильному состоянию. агрегация. В целом, эти исследования определяют механизмы, регулирующие агрегацию тромбоцитов при физиологически релевантном высоком сдвиговом потоке, и дают механистическое объяснение того, как изменения реакционной способности матрикса в сочетании с высоким сдвигом и поверхностной плотностью тромбоцитов синергетически усиливают рост тромбов тромбоцитов.
Рудольф Вирхов более 150 лет назад описал триаду факторов, способствующих патологическому тромбозу, включая изменения (1) стенки сосуда, (2) кровотока и (3) составляющих крови. 38 В контексте артериального тромбоза четко определено, что высокий сдвиг в сочетании с повышенной реактивностью субэндотелиального матрикса и повышенной реактивностью тромбоцитов вносят основной вклад в этот процесс. 39-41 В то время как последние 2 элемента играют четко определенную роль в тромбообразовании, механизмы, с помощью которых силы высокого сдвига способствуют активации и агрегации тромбоцитов, остаются менее четко определенными. Хорошо известно, что сдвиг усиливает адгезионную и сигнальную функцию GPIb 27,42 и что индуцированное сдвигом связывание VWF с GPIb важно для образования окклюзионных тромбов; однако сигналы, производные от GPIb, слабые и вызывают лишь ограниченную активацию тромбоцитов в отсутствие других костимул. 24,27,42 В соответствии с этим, воздействие на тромбоциты высокого сдвига (до 10 000 с -1 ) во время поверхностной транслокации на VWF не способствует быстрой активации тромбоцитов или эффективному росту тромба. 24 Аналогичным образом, воздействие на тромбоциты в суспензии сильного сдвига (до 10 000 с -1 ) в присутствии растворимого ФВ приводит к относительно медленному развитию макроскопических агрегатов тромбоцитов, 43 , предполагая, что сдвиг сам по себе является относительно слабый тромбогенный раздражитель.Мы продемонстрировали здесь, что одним из основных эффектов сдвига является инициирование образования обратимых агрегатов тромбоцитов, вызывая развитие мембранных привязок между соединяющимися тромбоцитами. На слабой тромбогенной поверхности, такой как VWF, эта физическая совместная локализация тромбоцитов неэффективна для индукции активации тромбоцитов или стабильной агрегации независимо от экзогенных стимулов. Как обсуждается в следующих абзацах, одним из основных эффектов сдвига может быть усиление физического взаимодействия между тромбоцитами, тем самым увеличивая вероятность длительной активации тромбоцитов растворимыми агонистами.
Наши исследования демонстрируют центральную роль реакционной способности матрикса в регулировании эффективности преобразования связанных с мембраной обратимых агрегатов в стабильные агрегаты. В течение многих лет было известно, что высокотромбогенные поверхности, такие как фибриллярные коллагены типа I или III, эффективны при индукции первичной адгезии тромбоцитов и последующей агрегации. 3,44 Примечательно, что только первичный адгезивный слой тромбоцитов находится в прямом физическом контакте с коллагеновыми волокнами, при этом все последующие слои тромбоцитов подвергаются воздействию адгезивных белков, экспрессируемых на поверхности агрегированных тромбоцитов.Представленные здесь исследования показывают, что поверхностные плотности VWF и фибриногена важны для влияния на эффективность стабильной агрегации тромбоцитов. Эти результаты могут иметь клиническое значение, поскольку концентрации фибриногена и VWF, используемые в этих экспериментах, находятся в пределах патофизиологических уровней, и, кроме того, повышенные уровни фибриногена или VWF в плазме повышают риск артериального тромбоза. 45-49 Таким образом, возникает соблазн предположить, что повышенная поверхностная адсорбция фибриногена и VWF на поверхности развивающихся тромбов, особенно в условиях высокого напряжения сдвига, является одним из ключевых механизмов, усиливающих превращение дискоидных агрегатов тромбоцитов в стабильные агрегаты.
Наши исследования определили важную роль поверхностной плотности тромбоцитов в регулировании начального образования обратимых агрегатов тромбоцитов, и это не является неожиданным открытием, учитывая, что одной из важных переменных, регулирующих эффективность гемостатического процесса, является плотность тромбоцитов на адгезивной поверхности. 50 Примечательно, что повышенное физическое взаимодействие между тромбоцитами усиливает образование агрегатов тромбоцитов, поддерживая уровни цитозольного кальция в прикрепленных тромбоцитах.Это зависит от АДФ и, вероятно, представляет собой феномен межклеточной коммуникации кальция, ранее описанный механизм распространения активирующих сигналов по всему развивающемуся тромбу. 20 Таким образом, зависящее от сдвига образование связок и совместная кластеризация тромбоцитов, вероятно, будут усиливать образование агрегатов тромбоцитов по крайней мере с помощью двух механизмов: за счет повышения эффективности активации между коадгерирующими тромбоцитами и путем поддержания активации в первичных зародышеобразующих тромбоцитах, тем самым обеспечивая обратную связь. механизм амплификации для распространения совокупного развития.
Одной из наиболее ярких особенностей развития тромбоцитов in vivo является высокая доля обратимых дискоидных агрегатов тромбоцитов на поверхности тромбов. Зависимая от сдвига кластеризация дискоидных тромбоцитов может служить для облегчения паракринной стимуляции тромбоцитов за счет ограничения «вымывающего» эффекта кровотока на генерируемые растворимые агонисты. Такой механизм может объяснить, почему большинство основных растворимых агонистов, регулирующих активацию тромбоцитов, таких как АДФ, ТХА2 и тромбин, либо высвобождаются из самих тромбоцитов, либо образуются в непосредственной близости от поверхности тромбоцитов.Это резко контрастирует с лейкоцитами, в которых многие растворимые хемокины и цитокины, регулирующие активацию лейкоцитов, вырабатываются стенкой сосуда. Таким образом, посредством образования обратимых агрегатов тромбоцитов, тромбоциты могли развить уникальный механизм облегчения локальной и устойчивой активации тромбоцитов растворимыми агонистами в среде с высоким сдвигом.
Наши исследования in vivo пролили новый свет на механизмы, регулирующие транслокацию тромбоцитов в местах повреждения сосудов.В отличие от лейкоцитов, которые имеют сферическую морфологию, хорошо подходящую для перекатывающегося взаимодействия со стенкой сосуда, дискоидная морфология нестимулированных тромбоцитов менее приспособлена к вращательному движению. Единственные данные о морфологии тромбоцитов во время поверхностной транслокации были получены из исследований перфузии in vitro на очищенной матрице VWF, в которой тромбоциты подвергаются вращательному движению либо в виде плоских дисков (переворачивание тромбоцитов), либо после преобразования в шипастые сферы, либо после принятия гладкой сферической морфологии. при очень высоких скоростях сдвига (10 000 с −1 ). 15 Вращательная транслокация плоских дисков относительно неэффективна, потому что эта морфология испытывает заметные колебания силы растяжения во время вращательного движения, что приводит к отслоению клеток от адгезионных поверхностей, 51 , тогда как адгезивные связи на сферических тромбоцитах испытывают более равномерную силу во время поверхностной транслокации, обеспечивает более плавное и устойчивое перекатывающее взаимодействие. 15 По сравнению с вращающимися дисками или катящимися сферами скользящие плоские диски испытывают минимальную силу сопротивления и имеют гораздо более низкие растягивающие напряжения на клеевых связях.Плоский диск также обеспечивает максимальную площадь контакта с клейкой поверхностью, увеличивая возможность поливалентного адгезионного взаимодействия. Кроме того, мембранные привязи увеличивают моментное плечо адгезионных связей, тем самым обеспечивая механическое преимущество для адгезионных контактов и уменьшая отрыв тромбоцитов от поверхности тромба. 17 Таким образом, развитие мембранных привязок с поверхности плоских дискоидных тромбоцитов представляет собой уникальный механизм минимизации сил сопротивления на прикрепленных тромбоцитах, тем самым обеспечивая устойчивое взаимодействие тромбоцитов с тромбогенными поверхностями независимо от существенной активации тромбоцитов.
Исследования, представленные здесь, в сочетании с предыдущими отчетами, 10,11,52 предполагают, что по крайней мере 3 различных механизма могут регулировать начало агрегации тромбоцитов, причем относительный вклад каждого механизма зависит от преобладающих условий сдвига. Как показано на рисунке 7, традиционная модель агрегации тромбоцитов, которая работает в условиях относительно низкого сдвига (менее 1000 с -1 ), включает стимуляцию тромбоцитов одним или несколькими растворимыми агонистами, которые вызывают изменение формы тромбоцитов и повышающую регуляцию аффинный статус интегрина α IIb β 3 .В условиях относительно низкого потока активированный интегрин α IIb β 3 может взаимодействовать с фибриногеном в жидкой фазе, димерной молекулой, которая физически связывает соседние активированные тромбоциты. Как подробно продемонстрировано в этом отчете, в условиях более высокого сдвига (от 1000 до 10 000 с -1 ) процессы, инициирующие агрегацию, весьма различны, включая дополнительные рецепторы, лиганды и привязки мембран. Этот механизм уникален тем, что в нем участвует интегрин α IIb β 3 адгезивные взаимодействия между дискоидными тромбоцитами посредством процесса активации, независимого от АДФ.Возникает соблазн предположить, что сигналы, производные от GPIb и интегрина α IIb β 3 , помогают облегчить локализованную активацию интегрина α IIb β 3 , которая необходима для устойчивой адгезии и образования мембранных связок. В соответствии с такой возможностью, мы продемонстрировали прогрессирующее низкоуровневое увеличение цитозольного потока кальция во время транслокации тромбоцитов и обратимого образования агрегатов. Этот сигнал кальция не зависит от АДФ и возникает до начала изменения формы и устойчивого колебательного потока кальция, необходимого для необратимой агрегации (I.Goncalves and S.P.J., неопубликованные наблюдения, январь 2006 г.). Недавно был описан третий механизм, инициирующий агрегацию тромбоцитов. Этот механизм работает в условиях чрезвычайно высокого сдвига (более 10 000 с -1 ), таких как те, которые действуют в сильно стенозированных артериях, и требует как иммобилизованных, так и растворимых форм VWF. В отличие от агрегации при физиологических скоростях сдвига, агрегация не требует интегрина α IIb β 3 или активации тромбоцитов и опосредуется исключительно адгезивными связями VWF-GPIb. 12 Эти агрегаты, скорее всего, возникли в результате развития мембранных тросов; однако, в отличие от наших результатов при физиологической скорости сдвига, эти связанные агрегаты развиваются между гладкими сферическими тромбоцитами, уникальной морфологической формой тромбоцитов, которая развивается в условиях патологического сдвига. 12,15 Взятые вместе, эти исследования подчеркивают уникальную взаимосвязь, действующую между адгезивными лигандами тромбоцитов, рецепторами и морфологическими формами, относящимися к зависящей от сдвига агрегации тромбоцитов.Кроме того, они повышают вероятность того, что процессы нацеливания, селективные к агрегации тромбоцитов при различных скоростях сдвига, могут привести к разработке новых специфичных к сдвигу ингибиторов агрегации тромбоцитов.
Рисунок 7
Модель агрегации тромбоцитов при различных скоростях сдвига. (A) Агрегация тромбоцитов при скоростях сдвига ниже примерно 1000 с -1 преимущественно зависит от активации рецепторов интегрина α IIb β 3 и присутствия его лиганда фибриногена.(B) При скоростях сдвига примерно до 10 000 с -1 агрегация тромбоцитов представляет собой двухэтапный процесс. Тромбоциты первоначально захватываются растущим агрегатом через рецепторы GPIb / V / IX и интегрина α IIb β 3 , связывающиеся с VWF и фибриногеном, присутствующими на поверхности агрегата. Образование мембранных ремней дает механическое преимущество адгезивным связям за счет снижения уровня силы, прилагаемой к ним. 17,53 (C) При экстремальных скоростях сдвига, значительно превышающих 10 000 с -1 , агрегация тромбоцитов больше не зависит от функции интегрина α IIb β 3 рецепторов и образования связки.Вместо этого иммобилизованный VWF в сочетании с растворимым мультимерным VWF способен инициировать большие нестабильные агрегаты неактивированных тромбоцитов. 12
Рисунок 7
Модель агрегации тромбоцитов при различных скоростях сдвига. (A) Агрегация тромбоцитов при скоростях сдвига ниже примерно 1000 с -1 преимущественно зависит от активации рецепторов интегрина α IIb β 3 и присутствия его лиганда фибриногена. (B) При скоростях сдвига примерно до 10 000 с -1 агрегация тромбоцитов представляет собой двухэтапный процесс.Тромбоциты первоначально захватываются растущим агрегатом через рецепторы GPIb / V / IX и интегрина α IIb β 3 , связывающиеся с VWF и фибриногеном, присутствующими на поверхности агрегата. Образование мембранных ремней дает механическое преимущество адгезивным связям за счет снижения уровня силы, прилагаемой к ним. 17,53 (C) При экстремальных скоростях сдвига, значительно превышающих 10 000 с -1 , агрегация тромбоцитов больше не зависит от функции интегрина α IIb β 3 рецепторов и образования связки.Вместо этого иммобилизованный VWF в сочетании с растворимым мультимерным VWF способен инициировать большие нестабильные агрегаты неактивированных тромбоцитов. 12
Онлайн-версия этой статьи содержит информационное дополнение.
An Inside Blood Анализ этой статьи помещен в начале этого выпуска.
Расходы на публикацию этой статьи были частично оплачены за счет оплаты страницы. Поэтому и исключительно для того, чтобы указать на этот факт, данная статья помечена как «реклама» в соответствии с разделом 18 USC 1734.
Раскрытие информации о конфликте интересов: авторы заявляют об отсутствии конкурирующих финансовых интересов.
Вклад: М.J.M. разработал и выполнил большую часть исследований и экспериментов и написал статью вместе с S.P.J .; E.W. собрал и проанализировал данные и помог в подготовке рукописи; W.S.N. и S.G. собрали данные для рисунков 1 и 7; S.M.D. собранные данные для рисунка 1; и С.П.Дж. разработал исследование, обеспечил общее руководство и написал статью вместе с M.J.M.
Эта работа была поддержана грантом Австралийского национального совета по здравоохранению и медицинским исследованиям.
1Бадимон Л. Атеросклероз и тромбоз: уроки на животных моделях.Thromb Haemost
2001
;86
:356
–365.2Шехонин Б.В., Домогацкий С.П., Идельсон Г.Л., Котелянский В.Е., Рукосуев В.С. Относительное распределение фибронектина и коллагенов типа I, III, IV, V в нормальной и атеросклеротической интиме артерий человекаАтеросклероз
1987
;67
:9
–16.3van Zanten GH, de Graaf S, Slootweg PJ, et al. Повышенное отложение тромбоцитов на атеросклеротических коронарных артериях.J Clin Invest
1994
;93
:615
–632,4 Вилкокс Дж. Н., Смит К. М., Шварц С. М., Гордон Д. Локализация тканевого фактора в нормальной стенке сосуда и в атеросклеротической бляшке.Proc Natl Acad Sci U S A
1989
;86
:2839
–2843,5 Kroll MH, Hellums JD, McIntire LV, Schafer AI, Moake JL. Тромбоциты и напряжение сдвига.Кровь
1996
;88
:1525
–1541.6 Икеда Ю., Мурата М., Гото С. Зависимая от фактора фон Виллебранда агрегация тромбоцитов, вызванная сдвигом: основные механизмы и клинические последствия.Ann N Y Acad Sci
1997
;811
:325
–336.7Ruggeri ZM. Фактор фон Виллебранда.J Clin Invest
1997
;100
:S41
–S46.8 Эндрюс Р.К., Лопес Дж. А., Берндт М.С. Молекулярные механизмы адгезии и активации тромбоцитов.Int J Biochem Cell Biol
1997
;29
:91
–105.9Ruggeri ZM. Механизмы, инициирующие тромбообразование тромбоцитов.Thromb Haemost
1997
;78
:611
–616.10 Savage B, Almus-Jacobs F, Ruggeri ZM. Специфический синергизм множественных взаимодействий субстрат-рецептор в образовании тромбоцитов в потоке.Cell
1998
;94
:657
–666.11 Savage B, Saldivar E, Ruggeri ZM.Инициирование адгезии тромбоцитов путем остановки фибриногена или транслокации фактора фон Виллебранда.Cell
1996
;84
:289
–297.12 Руджери З.М., Орье Дж. Н., Хаберманн Р., Федеричи А.Б., Райнингер А.Дж. Независимая от активации адгезия и агрегация тромбоцитов при повышенном напряжении сдвига.Кровь
2006
;108
:1903
–1910,13 Патель К.Д., Ноллерт М.Ю., МакЭвер Р.П. Р-селектин должен выходить на достаточную длину от плазматической мембраны, чтобы опосредовать перекатывание нейтрофилов.J Cell Biol
1995
;131
:1893
–1902,14 Yuan Y, Kulkarni S, Ulsemer P, et al. Взаимодействие фактора фон Виллебранда с гликопротеином Ib / V / IX вызывает полимеризацию актина и реорганизацию цитоскелета в перекатывающихся тромбоцитах и клетках, трансфицированных гликопротеином Ib / V / IX.J Biol Chem
1999
;274
:36241
–36251,15 Максвелл М.Дж., Допхайд С.М., Тернер С.Дж., Джексон С.П. Сдвиг вызывает уникальную серию морфологических изменений в перемещающихся тромбоцитах: влияние морфологии на динамику перемещения.Артериосклер Тромб Васк Биол
2006
;26
:663
–669,16 Кувахара М., Сугимото М., Цуджи С. и др. Изменение формы тромбоцитов и их адгезия при сильном сдвиговом потоке.Артериосклер Тромб Васк Биол
2002
;22
:329
–334,17 Дофеид С.М., Максвелл М.Дж., Джексон С.П. Формирование связки, зависящее от сдвига, во время транслокации тромбоцитов на фактор фон Виллебранда.Кровь
2002
;99
:159
–167.18Монтгомери Р.Р. и Циммерман Т.С. Антиген болезни фон Виллебранда II. Новый дефицит антигена плазмы и тромбоцитов при тяжелой болезни фон Виллебранда.J Clin Invest
1978
;61
:1498
–1507,19 Якобсен Э. и Киерульф П. Модифицированная процедура осаждения бета-аланином для получения фибриногена, свободного от антитромбина III и плазминогена.Thromb Res
1973
;3
:145
–159.20 Несбитт В.С., Джулиано С., Кулкарни С., Допхайде С.М., Харпер И.С., Джексон С.П.Межклеточная кальциевая связь регулирует агрегацию тромбоцитов и рост тромба.J Cell Biol
2003
;160
:1151
–1161.21 Денис К., Метиа Н., Френет П.С. и др. Мышиная модель тяжелой болезни фон Виллебранда: дефекты гемостаза и тромбоз.Proc Natl Acad Sci U S A
1998
;95
:9524
–9529.22 Kulkarni S, Dopheide SM, Yap CL, et al. Пересмотренная модель агрегации тромбоцитов.Дж. Клин Инвест
2000
;105
:783
–791.23Саниабади А.Р., Умемура К., Мацумото Н., Сакума С., Накашима М. Повреждение стенки сосуда и артериальный тромбоз, вызванные фотохимической реакцией.Thromb Haemost
1995
;73
:868
–872,24 Goncalves I, Nesbitt WS, Yuan Y, Jackson SP. Важность временных градиентов потока и механотрансдукции интегрина alphaIIbbeta3 для активации сдвига тромбоцитов.J Biol Chem
2005
;280
:15430
–15437,25 Яп CL, Hughan SC, Cranmer SL и др.Синергетические адгезивные взаимодействия и сигнальные механизмы, действующие между гликопротеином тромбоцитов Ib / IX и интегрином альфа IIbbeta 3. Исследования тромбоцитов человека и трансфицированных клеток яичников китайского хомячка.J Biol Chem
2000
;275
:41377
–41388.26 Кук Б.М., Моррис-Джонс С., Гринвуд Б.М., Нэш, Великобритания. Адгезия паразитированных эритроцитов к культивируемым эндотелиальным клеткам: потоковое исследование изолятов гамбийских детей с малярией falciparum.Паразитология
1993
;107
:pt 4
359
–368.27 Несбитт В.С., Кулкарни С., Джулиано С. и др. Определенные сигналы кальция, зависимые от гликопротеина Ib / V / IX и интегрина альфа IIbbeta 3, совместно регулируют адгезию тромбоцитов в потоке.J Biol Chem
2002
;277
:2965
–2972.28Goncalves I, Hughan SC, Schoenwaelder SM, Yap CL, Yuan Y, Jackson SP. Интегрин альфа IIb бета 3-зависимые кальциевые сигналы регулируют взаимодействия тромбоцитов с фибриногеном в условиях кровотока. Участие фосфолипазы C гамма 2.J Biol Chem
2003
;278
:34812
–34822.29Schoenwaelder SM, Jackson SP, Yuan Y, Teasdale MS, Salem HH, Mitchell CA. Тирозинкиназы регулируют прикрепление в цитоскелете интегрина альфа IIb бета 3 (гликопротеин тромбоцитов IIb / IIIa) и клеточную ретракцию полимеров фибрина.J Biol Chem
1994
;269
:32479
–32487.30Grunkemeier JM, Tsai WB, Horbett TA. Совместно адсорбированный фибриноген и фактор фон Виллебранда усиливают прокоагулянтную активность тромбоцитов и их распространение.J Biomater Sci Polym Ed
2001
;12
:1
–20.31Грунер С., Простредна М., Шульте В. и др. Множественные взаимодействия интегрин-лиганд синергируют в устойчивой к сдвигу адгезии тромбоцитов в местах повреждения артерий in vivo.Кровь
2003
;102
:4021
–4027,32 Шиба Э, Линдон Дж. Н., Кушнер Л. и др. Выявляемые антителами изменения адсорбции фибриногена, влияющие на активацию тромбоцитов на поверхности полимера.Am J Physiol
1991
;260
:C965
–C974.33Polanowska-Grabowska R, Simon CG Jr, Gear AR.Адгезия тромбоцитов к коллагену I типа, коллагену IV типа, фактору фон Виллебранда, фибронектину, ламинину и фибриногену: быстрая кинетика при сдвиге.Thromb Haemost
1999
;81
:118
–123,34 Эллис-Дэвис, GC. Разработка и применение клеточного кальция.Методы Enzymol
2003
;360
:226
–238.35Ruggeri ZM. Тромбоциты при атеротромбозе.Nat Med
2002
;8
:1227
–1234.36Sakariassen KS, Bolhuis PA, Sixma JJ. Адгезия тромбоцитов крови человека к субэндотелию артерии опосредуется фактором VIII-фон Виллебранда, связанным с субэндотелием.Nature
1979
;279
:636
–638.37Ruggeri ZM, Dent JA, Saldivar E. Вклад различных адгезивных взаимодействий в агрегацию тромбоцитов в текущей крови.Кровь
1999
;94
:172
–178.38Virchow R. Gesammelte Abhandlungen zur Wissenschaftlichen Medicin.1856
; Франкфурт, Германия Medinger Sohn & Co219
–732,39 Jackson SP и Schoenwaelder SM. Антиагрегантная терапия: в поисках «волшебной пули».Nat Rev Drug Discov
2003
;2
:775
–789,40Trip MD, Cats VM, van Capelle FJ, Vreeken J. Гиперреактивность тромбоцитов и прогноз у выживших после инфаркта миокарда.N Engl J Med
1990
;322
:1549
–1554.41Hirsh J. Гиперактивные тромбоциты и осложнения ишемической болезни сердца.N Engl J Med
1987
;316
:1543
–1544,42 Mazzucato M, Pradella P, Cozzi MR, De Marco L, Ruggeri ZM. Последовательные цитоплазматические кальциевые сигналы в двухэтапном процессе активации тромбоцитов, индуцированном механорецептором гликопротеина Ibalpha.Кровь
2002
;100
:2793
–2800.43Goto S, Salomon DR, Ikeda Y, Ruggeri ZM. Характеристика уникального механизма, опосредующего зависящее от сдвига связывание растворимого фактора фон Виллебранда с тромбоцитами.J Biol Chem
1995
;270
:23352
–23361.44Nieswandt B and Watson SP. Взаимодействие тромбоцитов с коллагеном: является ли GPVI центральным рецептором?Кровь
2003
;102
:449
–461,45 Рамли А., Лоу Г.Д., Свитнам П.М., Ярнелл Д.В., Форд Р.П. Фактор VIII, фактор фон Виллебранда и риск серьезной ишемической болезни сердца в исследовании Caerphilly Heart Study.Br J Haematol
1999
;105
:110
–116.46 Фолсом А.Р., Ву К.К., Шахар Э., Дэвис К.Э. Связь гемостатических переменных с распространенным сердечно-сосудистым заболеванием и бессимптомным атеросклерозом сонной артерии. Исследователи исследования риска атеросклероза в сообществах (ARIC).Arterioscler Thromb
1993
;13
:1829
–1836.47Maresca G, Di Blasio A, Marchioli R, Di Minno G. Измерение фибриногена в плазме для прогнозирования инсульта и инфаркта миокарда: обновленная информация.Артериосклер Тромб Васк Биол
1999
;19
:1368
–1377.48 Данеш Дж, Коллинз Р., Эпплби П., Пето Р. Связь фибриногена, С-реактивного белка, альбумина или количества лейкоцитов с ишемической болезнью сердца: метаанализ проспективных исследований.JAMA
1998
;279
:1477
–1482,49 Фейнблум Д. и Бауэр К.А. Оценка гемостатических факторов риска при прогнозировании артериальных тромботических событий.Артериосклер Тромб Васк Биол
2005
;25
:2043
–2053,50 Харрингтон В. Дж., Миннич В., Холлингсворт Дж. В., Мур CV.Демонстрация тромбоцитопенического фактора в крови пациентов с тромбоцитопенической пурпурой. 1951.J Lab Clin Med
1990
;115
:636
–645.51 Моди Н.А., Ломакин О., Доггетт Т.А., Дьяково Т.Г., Кинг MR. Механика переходной адгезии тромбоцитов к фактору Виллебранда под действием потока.Biophys J
2005
;88
:1432
–1443.52 Цуджи С., Сугимото М., Мията С., Кувахара М., Киношита С., Йошиока А. Анализ в реальном времени образования тромбов на стенах при различных нарушениях агрегации тромбоцитов: различные зависящие от сдвига роли рецепторов тромбоцитов и адгезивные белки под потоком.Кровь
1999
;94
:968
–975,53Shao JY, Ting-Beall HP, Hochmuth RM. Статическая и динамическая длина микроворсинок нейтрофилов.Proc Natl Acad Sci U S A
1998
;95
:6797
–6802.Лечение опухоли Вильмса с внутривенным тромбом у детей: опыт одного центра
Опухоль Вильмса с внутривенным тромбом клинически редко встречается у детей. Масса живота или увеличение окружности живота — наиболее частый симптом опухоли Вильмса.При первом обращении к врачу пациенты могут прикоснуться к 75–95% опухолей [4]. Тромб венозной опухоли обычно обнаруживается одновременно при постановке диагноза опухоли Вильмса. 6 из 165 детей с эмболом венозной опухоли имели соответствующие проявления, такие как гепатомегалия, асцит и варикозное расширение вен брюшной стенки, что составляет всего 3,6% [2]. По ретроспективным данным нашей больницы, только у 2 пациентов из 42 выявлено варикозное расширение вен грудной клетки и брюшной стенки, что составляет 5%.
Ультрасонография стала первым выбором для предварительной диагностики опухолей Вильмса и внутривенного опухолевого тромба из-за его безлучевой, быстрой и неинвазивности [5]. Ультрасонография имеет точность 60–100% диагностики тромба опухоли и может оценить степень спаек между тромбом и стенкой сосуда по венозному кровотоку. Однако Khanna et al. сообщает, что в группе первичной нефрэктомии чувствительность допплерографии для выявления кавоатриального тромба составляла 70.0%, ниже CT 84,6% [6]. В этом исследовании один случай тромба почечной вены был обнаружен с помощью расширенной компьютерной томографии, но тромб был обнаружен с помощью ультразвукового исследования. Исходя из нашего опыта, если полая вена расширена и увеличена или при КТ выявляется дефект наполнения низкой плотности, может существовать тромб опухоли. Улучшенная компьютерная томография и магнитно-резонансная томография более чувствительны, что позволяет точно диагностировать внутривенный и внутрипредсердный тромб опухоли и может показать расположение, размер тромба и взаимосвязь со стенкой сосуда.Они помогают судить о сроках операции, выборе методов операции и о возможности полного удаления опухолевого тромба. Хотя ангиография нижней полой вены имеет определенное диагностическое значение, при использовании этого исследования существует риск выпадения тромба опухоли и эмболии. Предоперационная рентгенография грудной клетки должна быть обычным обследованием, и при необходимости может использоваться КТ легких для определения наличия или отсутствия метастазов.
Внутривенный тромб, вызванный опухолью Вильмса, который превышает уровень печеночной вены, особенно когда тромб достигает предсердия или первичные опухоли слишком велики для полного удаления, рекомендуется предоперационная химиотерапия.Это может уменьшить размер опухоли и тромба, вероятность разрыва опухоли во время операции и частоту использования CPB, а также снизить уровень смертности и хирургических осложнений [7]. Исследование SIOP-9 (Международное общество детской онкологии в Европе) показало, что предоперационная химиотерапия в течение 4 и 8 недель была одинаково эффективна для улучшения прогноза у детей [8]. В нашей больнице мы рекомендуем предоперационную химиотерапию винкристином и актиномицином D в течение 4–8 недель. В исследовании Shamberger et al.показали, что во время операции у 61% пациентов, не получавших предоперационную химиотерапию, были выявлены спайки между тромбом и стенкой сосуда, а дети, получавшие предоперационную химиотерапию, составили 44% [2]. В нашем исследовании 86% пациентов прошли предоперационную химиотерапию. Большинство случаев были чувствительны к химиотерапии: тромб уменьшился на 72% и опухоль уменьшилась на 85% в случаях предоперационной химиотерапии. Особенно в 10 случаях с тромбом предсердия (стадия Даума IV) тромб в половине этих случаев сморщился за пределы предсердия (Таблица 1).Благодаря предоперационной химиотерапии использование CPB было сокращено. Только пяти случаям требуется CPB для удаления тромба предсердия. Предоперационная химиотерапия значительно снизила количество осложнений, связанных с ХПК, включая инфекцию, разрыв тромба и кровотечение. Интересно отметить, что у пациентов с IV стадией Даума к химиотерапии не чувствительны и опухоль, и опухолевый тромб. Только пять случаев опухоли и опухолевого тромба уменьшились одновременно. Нет соответствующих отчетов. Мы думаем, что причиной может быть явное сращение тромба опухоли предсердия со стенкой кровеносного сосуда.Даже если тромб опухоли чувствителен к химиотерапии, его усадка может быть ограничена, что требует дальнейшего изучения.
В этом исследовании тромб опухоли не был чувствителен к предоперационной химиотерапии у десяти пациентов, включая пять пациентов с Даумом IV. Патологический тип был: мезенхимальный тип ( n = 3), эпителиальный тип ( n = 1), смешанный тип ( n = 1) и некротическая опухолевая ткань ( n = 5). Патологически солидные опухолевые ткани зрелого типа, такие как опухоли мезенхимального типа, эпителиального типа или фетальной рабдомиомы типа Вильмса, не были чувствительны к предоперационной химиотерапии по сравнению с опухолями зародышевого типа.Однако у детей с этими патологическими типами обычно хороший прогноз после хирургического вмешательства и послеоперационной химиотерапии и / или лучевой терапии.
Однако исследователи NWTS полагают, что предоперационная химиотерапия опухоли Вильмса может влиять на гистопатологический тип, влиять на частоту выявления анаплазии, снижать клиническую стадию и может пропустить диагноз двусторонней опухоли Вильмса и, таким образом, повлиять на прогноз. Было обнаружено, что у некоторых детей с опухолью Вильмса без метастазов в лимфатические узлы, которые оценивались как стадия II после предоперационной химиотерапии, частота рецидивов опухоли была выше, чем у детей без предоперационной химиотерапии [9].
Удаление опухоли и тромба — основа хирургического лечения опухоли Вильмса с внутривенным тромбом у детей. Детям, у которых после предоперационной химиотерапии не наблюдается усыхания или прогрессирования опухолей, операция должна быть выполнена как можно скорее [10, 11]. Мы рекомендовали следующую хирургическую стратегию: для опухолевого тромба I – II стадии Даума почечная артерия была перевязана после обнажения почечной ножки, а полая вена была заблокирована сосудистыми зажимами на обоих концах опухолевого тромба при обнажении вдоль почечная вена.Почечная вена была отрезана, и сначала был удален тромб опухоли. Если тромб можно было удалить полностью, то почечную вену перевязывали. Для инфильтрации опухолевого тромба и врастания в стенку кровеносного сосуда можно сделать Т-образный разрез полой вены, чтобы отделить тромб опухоли с помощью рассекателя мозга, чтобы избежать повреждения полой вены, насколько это возможно, и общий разрез. полой вены можно зашить на месте. Для тромба на стадии III – IV, особенно стадии IV, следует использовать CPB, сотрудничая с кардиоторакальным хирургом.Тромб следует удалить осторожно, чтобы избежать тромбоэмболии легочной артерии из-за разрушения и отделения опухоли [12]. В нашей основной группе пять детей с тромбом внутрисердечной опухоли были прооперированы в условиях ХПБ с переохлаждением. У пяти пациентов не было госпитальной летальности и послеоперационных осложнений. Катамнез показал, что один ребенок умер в результате метастазов в печень через 3,2 года после операции. Chiappini et al. [13] сообщили, что у 13 пациентов, перенесших глубокую гипотермическую КПБ для удаления внутрисердечного опухолевого тромба, уровень госпитальной смертности был равен 0, с послеоперационными осложнениями, в основном включающими дыхательную недостаточность и кровотечение.После наблюдения в течение 33,9 месяцев 8 (62%) пациентов выжили. Нет никаких доказательств того, что частота рецидивов увеличивается у пациентов с остаточными опухолями в стенке сосудов во время операции. В нашей группе исследования в шести случаях было выполнено сегментарное удаление с небольшими остатками из-за сильных спаек с сосудистой стенкой. Среди этих шести случаев тромб опухоли в пяти случаях не был чувствителен к предоперационной химиотерапии. Послеоперационная химиотерапия была продолжена, рецидивов во время химиотерапии не наблюдалось. Однако последующее наблюдение показывает, что 1 пациент умер из-за рецидива опухоли in situ и множественных метастазов в постперитонеальные лимфатические узлы после операции 2.4 года; четыре из пяти других случаев выжили без опухоли до настоящего времени, а один случай потерял наблюдение из-за длительного периода времени.
Патологический тип группы был представлен следующим образом: 18 случаев смешанного типа, 5 случаев мезенхимального типа, 3 случая микробного типа, 1 случай анапластического типа, 1 случай эпителиального типа и 14 случаев некроза после химиотерапии. которые нельзя было классифицировать. Наибольшее количество патологических типов было смешанным, и большинство из них было распространено на стадии II Даума. Один случай анапластического типа относится к стадии III у Даума, который, как упоминалось в статье, умер в результате множественных метастазов в постперитонеальные лимфатические узлы.Поскольку большинство пациентов прошли предоперационную химиотерапию, патология 14 случаев с некрозом не могла быть классифицирована. Три случая микробного типа были распределены по Дауму на стадии I, II и IV, при этом стадии I и II выжили без опухоли до настоящего времени, а время последующего наблюдения составляет 6,2 и 3 года после операции, соответственно. Однако пациент с IV стадией был потерян для последующего наблюдения.
Была проведена соответствующая лучевая и химиотерапия в соответствии с классификацией патологии и клинической стадией после операции.Согласно последним стадиям NWTS, пациенты, которым проводится биопсия перед резекцией опухоли, пациенты, которым выполняется резекция обломков, включая отдельное удаление тромба в вене, края резекции под микроскопом или макроскопическое неполное иссечение, а также разрыв опухоли до или во время операции. включая разлив, ограниченный флангом, или диффузное перитонеальное заражение опухолью или там, где имеются перитонеальные имплантаты, классифицируются как находящиеся на стадии III и требуют послеоперационной лучевой терапии [14].NWTS-5 указал, что пациенты на стадии III с неанапластической гистопатологией, винкристин, актиномицин D и адриамицин, дополненные абдоминальной лучевой терапией, являются лучшими вариантами послеоперационного лечения. Даже если кумулятивная доза адриамицина достигает 150 мг на м 2 2 , частота долгосрочной кардиотоксичности остается низкой. Хотя долгосрочные осложнения лучевой терапии могут серьезно повлиять на качество жизни детей и даже привести к смерти, послеоперационная лучевая терапия по-прежнему играет важную роль в улучшении прогноза для детей с плохим прогнозом по патологической классификации и находящихся на стадии III– V [15].Ретроспективное исследование NWTS показало, что лучевая терапия в течение 10 дней после операции была важна для улучшения прогноза. Как контролировать дозировку лучевой терапии и уменьшить связанные с лучевой терапией осложнения и смертность при одновременном повышении выживаемости, по-прежнему требует постоянного обобщения опыта.
NWTS-4 сообщил, что 2-летняя выживаемость детей с опухолью Вильмса составила 91%. Не было существенной разницы в 3-летней выживаемости между пациентами с тромбом венозной или внутрипредсердной опухоли и пациентами без тромба опухоли с одним и тем же патологическим типом и стадией.Процент пациентов с хорошим и плохим прогнозом составил 90% и 41,7% соответственно, тогда как значения пациентов на II, III и IV стадии составили 100, 94,7 и 75,3% соответственно [2]. Поскольку в основном нет разницы в прогнозе, более важно минимизировать хирургические осложнения и долгосрочный вред, причиненный химиотерапией и лучевой терапией.
В заключение следует принять комплексное последовательное лечение детей с опухолью Вильмса, сопровождающейся внутривенным тромбом опухоли.Предоперационная химиотерапия должна проводиться пациентам с более высоким хирургическим риском крупных опухолей и тромбов, чтобы уменьшить сложность и осложнения операции. Хирургическое удаление опухоли и опухолевого тромба — залог хорошего прогноза. Послеоперационная лучевая терапия играет важную роль в улучшении прогноза для детей с клинической стадией выше II (стадии III – IV), и ее следует добавлять в течение 10 дней после операции. Стандартизированное комплексное лечение может позволить большинству детей выжить в течение длительного времени.
Сгустков крови
Что такое тромбы?
Свертывание крови — это нормальный процесс в организме. Его также называют коагуляцией . Когда вы получаете порез или травму, ваше тело отправляет клетки крови, называемые тромбоцитами , плюс другие специальные белки, к месту травмы и образует сгусток. Этот вид сгустка выглядит как комок засохшей крови, и некоторые люди называют его струпом. Если порез или травма не очень большие, сгусток закупорит область, где произошла травма.Это помогает остановить кровотечение и не потерять слишком много крови. Такие сгустки крови нормальны, остаются на месте во время выздоровления, а затем со временем отпадут или растворятся, когда в них больше не будет необходимости.
Типы тромбов
Иногда разные типы тромбов называют по месту их возникновения или по тем частям тела, на которые они влияют:
- Тромб (одиночный) или тромб (более одного)
- Тромбоэмболия: название тромба, который вырвался и застрял в другом кровеносном сосуде или в другой части тела, например в легких или ногах.
- Тромбоз глубоких вен (или ТГВ): сгусток крови в глубокой вене, обычно в ноге, а иногда в руке или других глубоких венах.
- Легочная эмболия (ТЭЛА): сгусток крови, который образовался где-то в другом месте, но вырывается и застревает в легких. Это серьезное, опасное для жизни состояние.
- Венозная тромбоэмболия (ВТЭ): слово, используемое для описания как ТГВ, так и ПЭ.
- Диссеминированное внутрисосудистое свертывание (ДВС): обычно редкое, но серьезное заболевание, которое является осложнением некоторых видов рака, вызывая одновременно сильное кровотечение и сильное свертывание крови.ДВС-синдром опасен для жизни и требует немедленного лечения.
У онкологических больных повышен риск развития венозной тромбоэмболии (ВТЭ). Сгустки крови могут быть опасными для жизни, к ним следует относиться серьезно и немедленно лечить.
Сгустки крови у онкологических больных
Рак сам по себе может увеличить риск образования тромбов. Известно, что рак является фактором риска тромбоза глубоких вен (ТГВ). Некоторые эксперты предполагают, что это связано с повреждением тканей, которое могут вызвать некоторые виды рака, которые могут вызвать процесс свертывания крови.
У любого ракового человека может образоваться тромб. Но некоторые виды рака (например, рак легких или рак поджелудочной железы), виды лечения и другие состояния и лекарства могут увеличить риск образования тромбов. Наличие метастатического рака (рака, распространившегося оттуда на другие части тела) увеличивает риск образования тромбов.
Другие заболевания имеют более высокий риск образования тромбов. Если у вас уже есть заболевание, повышающее ваш риск, рак еще больше увеличит этот риск.Некоторые заболевания, которые уже имеют риск образования тромбов, включают лейденскую тромбофилию фактора V, аномально высокие уровни определенных белков свертывания, аномально низкие уровни белков, предотвращающих образование сгустков, и определенные типы изменений генов. В редких случаях рак может быть диагностирован случайно во время тестирования, когда у человека есть сгусток крови.
Сгустки крови от лекарств или лечебных средств
Существуют некоторые лекарства, не являющиеся противораковыми, с повышенным риском образования тромбов или с побочными эффектами, которые могут вызвать образование тромбов.Некоторые витамины, минералы и добавки также могут увеличить риск образования тромбов. Очень важно поговорить со своим врачом обо всех лекарствах, витаминах, минералах и добавках, которые вы принимаете, чтобы обсудить ваш риск.
Лекарства, назначаемые для лечения рака, которые, как известно, связаны со сгустками крови или имеют побочные эффекты, способствующие образованию сгустков:
- Платина, например цисплатин
- Ингибиторы фактора роста эндотелия сосудов (VEGF), такие как бевацизумаб
- Ингибиторы рецепторов тирозинкиназы VEGF, такие как сорафениб или сунитиниб
- L-аспарагиназа
- Талидомид
- Леналидомид
- Тамоксифен
Другие факторы риска образования тромбов
Помимо рака и других заболеваний, риску образования тромбов могут подвергаться и другие факторы, например:
- Пожилой возраст (возраст старше 65 подвергает вас большему риску)
- Беременность
- Курение
- Сидеть или лежать в постели в течение длительного времени или находиться в постели более 3 дней подряд
- Прием противозачаточных таблеток или другой гормональной терапии
- Избыточный вес
- Операции, особенно ортопедические, абдоминальные или тазовые
- Наличие в семейном анамнезе тромбов
- Установлен центральный венозный катетер
- Переливание крови или прием препаратов, стимулирующих эритроциты, при некоторых типах анемии
- Инфекция.
Симптомы тромбов: на что обращать внимание
Иногда у сгустка крови нет симптомов, но важно обратиться за помощью , как только у вас появятся какие-либо из перечисленных здесь симптомов, потому что некоторые сгустки крови могут быть опасными и стать опасными для жизни:
- Внезапная боль в груди
- Внезапная боль в ноге или руке
- Отек ноги или руки
- Учащение пульса
- Одышка
- Чувство всепоглощающего страха или гибели
- Потливость или жар
- Кашель с кровью.
Обнаружение и лечение тромбов
Сгустки крови могут быть обнаружены после того, как пациент сообщает о симптомах, указывающих на наличие сгустка крови. В других случаях сгустки крови обнаруживаются случайно при проверке других вещей.
У пациентов без рака расчета вероятности образования сгустка крови и проведения специального анализа крови (называемого тестом на D-димер) часто бывает достаточно, чтобы исключить наличие сгустка крови.
У онкологических больных использование только этих тестов может быть не таким точным и полезным.Ваша медицинская бригада получит информацию, необходимую для принятия решения о том, понадобится ли вам один или несколько из них, а также дополнительные тесты, например:
Что можно сделать с тромбом?
Вы и ваш врач решите, как лучше всего лечить тромб. Некоторые виды лечения, которые вы могли бы пройти, включают одно или несколько из следующих.
- Лекарство, которое помогает остановить свертывание крови больше, чем обычно (эти лекарства также называют антикоагулянтами).Обычно они вводятся внутривенно (IV), но некоторым пациентам их можно принимать внутрь. Поскольку эти препараты помогают предотвратить образование тромбов, у них есть побочные эффекты, которые могут вызвать кровотечение. Вы и ваш врач взвесите преимущества лекарств и риски этих побочных эффектов.
- Лекарства, растворяющие сгустки (вводимые внутривенно)
- Фильтры, предотвращающие попадание тромба в легкие или сердце. Эти специальные фильтры вводятся в большую вену на груди во время хирургической процедуры.
Можно ли предотвратить образование тромба?
Если у вас повышенный риск образования тромба, у вас рак и вы начинаете лечение определенного типа рака, ваш врач может прописать вам лекарство для предотвращения образования тромба. Иногда ваш врач решит, что риск эпизодов кровотечения, связанный с препаратами, используемыми для лечения тромбов, стоит того, чтобы с самого начала никогда не получить тромб. В этом случае вам могут назначить лекарства, чтобы предотвратить образование тромба.
Если вам предстоит определенная операция, вы можете получать антикоагулянтные препараты до и в течение нескольких недель после операции, чтобы предотвратить образование тромбов. После операции вы также можете носить шланг, одежду или приспособление, которое помогает сжать ваши ноги или другую часть тела. Некоторые эксперты рекомендуют онкологическим больным принимать профилактические препараты от тромбов при любой госпитализации, а также до, во время и в течение нескольких дней после операции. Для большинства пациентов прием лекарств для предотвращения образования тромбов, если вы не в больнице, не является необходимым.Однако важно время от времени проверяться на риск образования тромба.
Поговорите со своим врачом о своем риске и о том, нужно ли вам принимать лекарства или использовать другие методы лечения для предотвращения образования тромбов. Также очень важно уведомить свою медицинскую бригаду, если вы считаете, что у вас есть какие-либо симптомы, связанные со сгустком крови.
Что может делать пациент
Если вас беспокоит риск образования тромбов, если вам сказали, что вы находитесь в группе риска, или вы лечитесь от тромба, вот несколько вопросов, которые следует задать своему врачу.
- Имеет ли тромб риск того, что в будущем у меня появится больше?
- Это опасный для жизни тромб?
- Что относительно моего рака или моего лечения требует, чтобы я принимал лекарства, когда у меня сейчас нет сгустка?
- Каких действий мне следует избегать, пока я принимаю это лекарство?
- Как долго я должен принимать это лекарство?
- Какие еще побочные эффекты можно ожидать от этого лекарства?
Лучше держаться подальше от противовоспалительных лекарств, таких как аспирин, напроксен или ибупрофен (Motrin ® , Advil ® , Naprosyn ® , Aleve ® , Midol ® ) и таких лекарств, как если ваша бригада по лечению рака не сообщит вам, что использовать их безопасно.Проконсультируйтесь с фармацевтом, если вы не уверены, обладает ли лекарство противовоспалительным действием или оно содержит одно из них. Не принимайте безрецептурные лекарства, такие как аспирин или ибупрофен, без предварительной консультации с врачом. Они, наряду с лекарствами от тромбов, могут разжижать кровь и вызывать легкое кровотечение.
Если вы получаете лекарство для предотвращения или лечения сгустка крови, важно позаботиться о том, чтобы не пораниться, поскольку способность крови к свертыванию замедляется.Это означает, что даже небольшие травмы могут вызвать сильное кровотечение, чем обычно. Вот некоторые вещи, которые вы можете сделать, чтобы предотвратить небольшие травмы:
- Использование для бритья электробритвы, а не опасной бритвы
- Используйте мягкую зубную щетку и аккуратно почистите зубы, чтобы не вызвать кровоточивость десен
- Не используйте зубную нить без разрешения врача
- Избегайте сильного сморкания, чтобы избежать кровотечения из носа
- Избегайте падений, которые могут вызвать ушибы; подобрать незакрепленные коврики, чтобы не споткнуться
- Придерживайтесь здоровой диеты, включающей клетчатку, чтобы избежать запоров.Если у вас запор, поговорите со своей бригадой по лечению рака об использовании смягчителя стула. Не используйте клизмы или свечи любого типа
- Держите голову на уровне сердца или выше (лягте или стойте прямо)
Немедленно обратитесь за помощью, если :
- Вы заметили какие-либо симптомы тромба
- У вас необычное кровотечение
- Любое кровотечение не прекращается
Чем раньше вы получите помощь, тем больше вероятность того, что лечение тромба или проблемы со свертыванием будет эффективным.
.