Эффективность и безопасность селективных ингибиторов ЦОГ-2
Наиболее широко применяемые в медицине препараты — нестероидные противовоспалительные (НПВП). Наряду с воспалительными заболеваниями, они используются при различных патологических состояниях, характеризующихся острыми и хроническими болями, а также в качестве компонента периоперационной и послеоперационной анальгезии.
Масштабы применения НПВП во всем мире колоссальны: достаточно сказать, что ежедневно их используют более 30 млн. человек. Являясь мощными «симптоматическими» средствами, НПВП, как правило, не оказывают влияния на патогенетические механизмы тех заболеваний, при которых они используются. Во многом по этой причине в последние годы основное внимание привлечено к созданию не столько более эффективных, сколько более безопасных НПВП.
НПВП проявляют 3 вида основных фармакологических эффектов: болеутоляющее, жаропонижающее и противовоспалительное действие, имеющие один и тот же механизм развития — нарушение синтеза медиаторов боли и воспаления – простагландинов (ПГ).
В настоящее время доказано наличие двух разновидностей ЦОГ – ЦОГ-1 и ЦОГ-2. ЦОГ-1 обладает функциональной активностью структурного фермента, экспрессируется в большинстве клеток, регулирует продукцию ПГ, участвующих в обеспечении нормальной функциональной активности клеток. ЦОГ-2 в норме отсутствует в большинстве тканей, однако ее экспрессия существенно увеличивается на фоне воспаления.
По современным представлениям, положительные терапевтические эффекты НПВП связаны с их способностью ингибировать ЦОГ-2, в то время как наиболее часто встречающиеся побочные эффекты (поражение ЖКТ, почек, нарушение агрегации тромбоцитов и др.) — с подавлением активности ЦОГ-1. В то же время сегодня вполне очевидно, что схематичное деление изоформ ЦОГ на «плохую» и «хорошую» не совсем верно.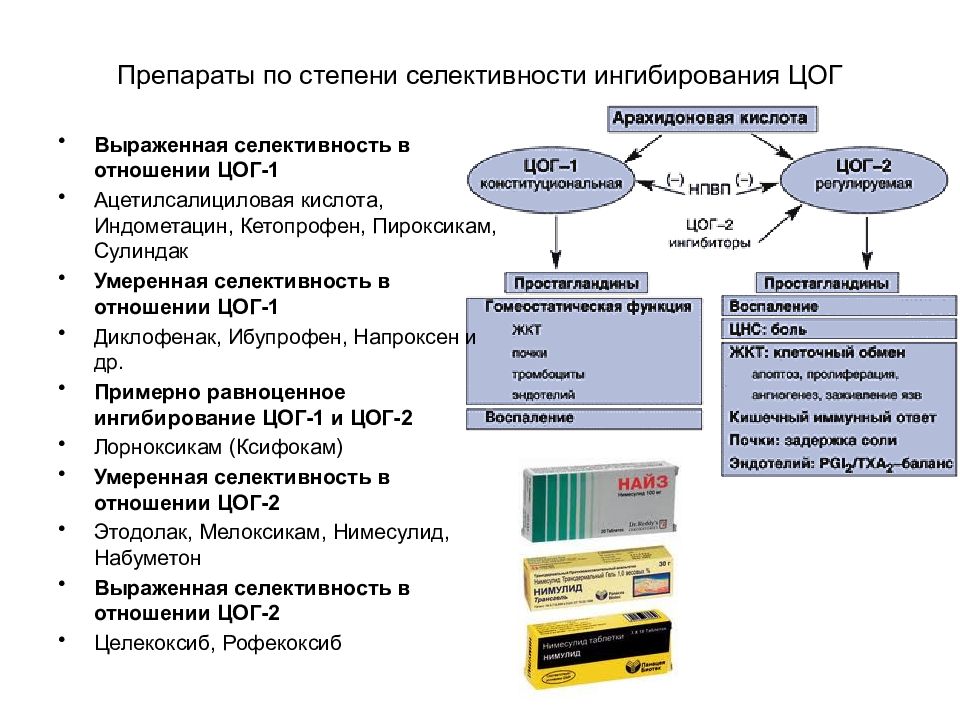 Установлено, что ЦОГ-2 также участвует во многих нормальных физиологических процессах организма.
Установлено, что ЦОГ-2 также участвует во многих нормальных физиологических процессах организма.
Чтобы нивелировать эти издержки НПВП-терапии, были синтезированы средства с селективным воздействием на ЦОГ-2. Данные клинических исследований подтвердили предположение о меньшей гастроинтестинальной токсичности избирательных ингибиторов ЦОГ-2: применение этих ЛС значительно понизило частоту гастропатий, хотя и не устранило полностью риск их развития.
Зарегистрированные в настоящее время в РФ селективные ингибиторы ЦОГ-2 представлены тремя группами препаратов:
- производные сульфонанилидов – нимесулид;
- представители коксибов – целекоксиб, валдекоксиб;
- производные оксикамов – мелоксикам.
Эти ЛС не превосходят традиционные неселективные НПВП по своей противовоспалительной активности, но обеспечивают большую безопасность применения у пациентов с заболеваниями ЖКТ.
При развитии НПВП-индуцированной гастропатии происходит местное повреждение слизистой оболочки и системное истощение цитопротективных ПГ. Для предупреждения развития или обострения уже имеющихся воспалительных заболеваний желудка или двенадцатиперстной кишки целесообразно сочетание НПВП с мизопростолом (синтетическим заменителем гастропротекторного ПГ).
Существенным достоинством селективных ингибиторов ЦОГ-2 является отсутствие у них антитромбоцитарного эффекта, которое объясняется тем, что тромбоциты содержат только ЦОГ-1.
Селективные НПВП проявляют нежелательное действие на сердечно-сосудистую систему, повышая риск развития инфаркта миокарда, сердечной недостаточности, инсульта и др. В основе этих осложнений лежит отсутствие у селективных ингибиторов ЦОГ-2 антиагрегантного эффекта, свойственного традиционным НПВП. При приеме ингибиторов ЦОГ-2 происходит селективное угнетение синтеза простациклина, предотвращающего тромбоз. Это приводит к уменьшению защитного эффекта данного простаноида и позволяет в полной мере реализоваться прокоагулянтному эффекту другого простаноида — тромбоксана, что увеличивает опасность возникновения тромбоза у пациентов из «группы риска».
Простаноиды, в регуляции которых принимают участие ЦОГ-1 и ЦОГ-2, участвуют также в поддержании водно-электролитного равновесия и регуляции АД. Нарушение их баланса в почках, возникающее при селективном угнетении ЦОГ-2, может приводить к задержке воды и солей в организме, гипертензии и обострению застойной сердечной недостаточности. В свою очередь негативное влияние ЛС на почки является причиной риска коронарных и цереброваскулярных осложнений.
Изофермент ЦОГ-2 играет важную роль в заживлении переломов. Селективные НПВП целекоксиб и рофекоксиб в значительно большей степени тормозят процесс заживления переломов, чем неселективные НПВП.
Некоторые НПВП оказывают негативное влияние на хрящ у больных остеоартрозом за счет стимуляции синтеза провоспалительных цитокинов или подавления синтеза протеогликана хондроцитами.
При использовании нимесулида следует учитывать наличие факторов риска поражения гепатоцитов (гепатотоксические реакции в анамнезе, хронические и острые заболевания гепатобилиарной системы, сопутствующий прием иных гепатотоксических препаратов). В процессе длительного лечения этим препаратом (как и другими НПВП) необходимо контролировать биохимические показатели крови, отражающие состояние функции печени.
В целом, в соответствии с установленными дополнительными противопоказаниями и предостережениями, баланс «польза – риск» при назначении специфических ингибиторов ЦОГ-2 «целевой» популяции пациентов остается, несомненно, позитивным.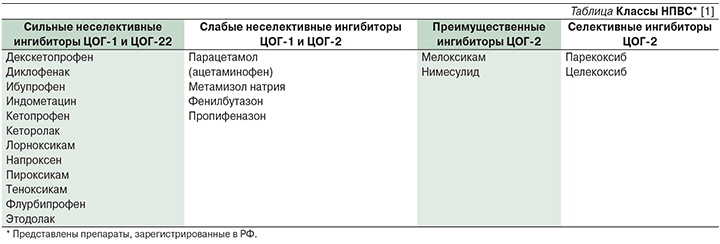 Это делает их востребованной группой лекарств для фармакотерапии воспалительных и дегенеративных заболеваний опорно-двигательного аппарата и других состояний, сопровождающихся болевым синдромом.
Это делает их востребованной группой лекарств для фармакотерапии воспалительных и дегенеративных заболеваний опорно-двигательного аппарата и других состояний, сопровождающихся болевым синдромом.
 Селективный ингибитор ЦОГ-2 Селективный ингибитор ЦОГ-2
Клинико-фармакологическая группа Препараты группы
Описания препаратов с недействующими рег. уд. или не поставляемые на рынок РФ |
||||
Лидер ХХI века в лечении болевого синдрома
Одним из ведущих клинических синдромов является боль, возникающая при различных патологиях. Болевой синдром может быть острым, но чаще всего имеет хронический характер. Распространенность этого синдрома, а также вызываемая им полная или частичная потеря трудоспособности определяют высокую актуальность и социальную значимость данной проблемы. Для успешного устранения болевого синдрома необходимо решение двух основных задач: эффект должен быть максимально быстрым, а лечение — максимально безопасным. Давно известна связь боли и воспаления. Незаменимыми для подавления воспаления, боли и лихорадки до сегодняшнего дня по-прежнему остаются нестероидные противовоспалительные препараты (НПВП). Они занимают особое место среди разнообразных групп препаратов, применяющихся для купирования болевого синдрома. Родоначальниками класса НПВП стали салицилаты растительного происхождения. Еще Гиппократ, ссылаясь на сведения из египетских папирусов, для лечения при лихорадке и боли применял отвар коры ивового дерева. Позже выяснилось, что активная субстанция этого отвара и есть салициловая кислота.
Болевой синдром может быть острым, но чаще всего имеет хронический характер. Распространенность этого синдрома, а также вызываемая им полная или частичная потеря трудоспособности определяют высокую актуальность и социальную значимость данной проблемы. Для успешного устранения болевого синдрома необходимо решение двух основных задач: эффект должен быть максимально быстрым, а лечение — максимально безопасным. Давно известна связь боли и воспаления. Незаменимыми для подавления воспаления, боли и лихорадки до сегодняшнего дня по-прежнему остаются нестероидные противовоспалительные препараты (НПВП). Они занимают особое место среди разнообразных групп препаратов, применяющихся для купирования болевого синдрома. Родоначальниками класса НПВП стали салицилаты растительного происхождения. Еще Гиппократ, ссылаясь на сведения из египетских папирусов, для лечения при лихорадке и боли применял отвар коры ивового дерева. Позже выяснилось, что активная субстанция этого отвара и есть салициловая кислота.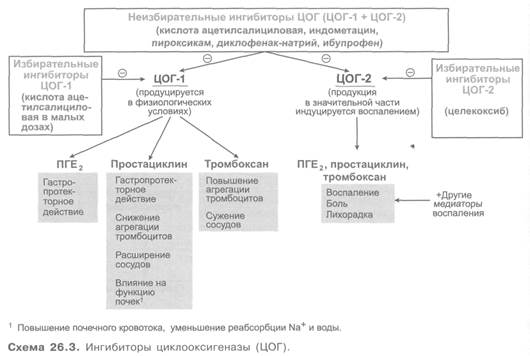 После выделения из коры ивы салициловой кислоты НПВП прочно заняли свое место в медикаментозной терапии различных заболеваний, проявляющихся болью или воспалением. Во второй половине XIX в. французский фармаколог Шарль Фредерик Жерар присоединил к салицину, получаемому из ивовой коры, ацетильную группу. Но лишь в конце XIX ст. Феликс Хоффман смог синтезировать ацетилсалициловую кислоту (АСК). И вот уже более 110 лет НПВП — неизменные лидеры в лечении болевых синдромов при различных патологиях.
После выделения из коры ивы салициловой кислоты НПВП прочно заняли свое место в медикаментозной терапии различных заболеваний, проявляющихся болью или воспалением. Во второй половине XIX в. французский фармаколог Шарль Фредерик Жерар присоединил к салицину, получаемому из ивовой коры, ацетильную группу. Но лишь в конце XIX ст. Феликс Хоффман смог синтезировать ацетилсалициловую кислоту (АСК). И вот уже более 110 лет НПВП — неизменные лидеры в лечении болевых синдромов при различных патологиях.
Несмотря на длительное применение данных препаратов в лечении боли и воспаления, лишь в конце прошлого века группа исследователей во главе с Jone Vane открыли фундаментальный механизм действия нестероидных противовоспалительных («аспириноподобных») препаратов. Он связан с обратимой ингибицией активности фермента циклооксигеназа (ЦОГ), регулирующего синтез простагландинов (ПГ) — важных медиаторов воспаления, боли и лихорадки.
Новым этапом в изучении механизма действия НПВП явилось открытие двух изоформ ЦОГ — ЦОГ-1 и -2. Это позволило классифицировать ненаркотические анальгетики не по их химическим свойствам, а по фармакологическим (ЦОГ-зависимым) механизмам действия (табл. 1).
Это позволило классифицировать ненаркотические анальгетики не по их химическим свойствам, а по фармакологическим (ЦОГ-зависимым) механизмам действия (табл. 1).
Таблица 1. Классификация ненаркотических анальгетиков по фармакологическим (ЦОГ-зависимым) механизмам действия
Изучение ЦОГ-1 и -2 выявило, что эти изоферменты играют различную (хотя и перекрещивающуюся) роль в регуляции многих физиологических, адаптационных и патофизиологических процессов, протекающих в организме человека (Насонов Е.Л., 2001; 2003а) (схема).
Изоформы отличаются по ряду параметров, в частности по локализации в тканях и функциональной способности. ЦОГ-1 (конститутивная) присутствует в различных количествах практически во всех тканях и регулирует образование физиологических ПГ. ЦОГ-2 в норме практически не выявляется, но ее уровень возрастает в десятки и сотни раз при воспалении. Вместе с тем в некоторых тканях она играет роль физиологического фермента (мозг, почки, костная ткань, репродуктивная система). С другой стороны, существует мнение, что и ЦОГ-1 может быть, в свою очередь, вовлечена в синтез провоспалительных ПГ (Martel-Pelletier J. et al., 2003). Также уже известно, что при подавлении активности обеих ЦОГ метаболизм арахидоновой кислоты через 5-липоксигеназный путь может даже увеличиться с естественным повышением продукции противовоспалительных ПГ и гастротоксических лейкотриенов (Brune K., 2004). При этом из двух изоформ ЦОГ в тромбоцитах образуется только ЦОГ-1. Соответственно только средства, ингибирующие ЦОГ-1, способны повлиять на синтез в них тромбоксана.
С другой стороны, существует мнение, что и ЦОГ-1 может быть, в свою очередь, вовлечена в синтез провоспалительных ПГ (Martel-Pelletier J. et al., 2003). Также уже известно, что при подавлении активности обеих ЦОГ метаболизм арахидоновой кислоты через 5-липоксигеназный путь может даже увеличиться с естественным повышением продукции противовоспалительных ПГ и гастротоксических лейкотриенов (Brune K., 2004). При этом из двух изоформ ЦОГ в тромбоцитах образуется только ЦОГ-1. Соответственно только средства, ингибирующие ЦОГ-1, способны повлиять на синтез в них тромбоксана.
Исследования на здоровых добровольцах показали, что ингибиторы ЦОГ-2 (в частности целекоксиб) уменьшают общее (системное) образование простациклина, который подавляет агрегацию тромбоцитов и является вазодилататором (оцененное по уровню экскреции его метаболитов с мочой). Соответственно, был сделан вывод, что в нормальных условиях (в здоровом сосуде) в клетках эндотелия индуцируется выработка ЦОГ-2 и что эта изоформа ЦОГ определяет уровень синтеза простациклина в организме. Наиболее вероятным стимулом для активации экспрессии ЦОГ-2 эндотелием признано воздействие ламинарного тока крови (McAdam B.F. et al., 1999).
Наиболее вероятным стимулом для активации экспрессии ЦОГ-2 эндотелием признано воздействие ламинарного тока крови (McAdam B.F. et al., 1999).
Несколько позже был частично расшифрован механизм действия «простого» анальгетика парацетамола, точкой приложения которого оказалась еще одна изоформа ЦОГ (ЦОГ-3), преимущественно локализующаяся в клетках коры головного мозга. Открытие изоформ ЦОГ имело не только важное теоретическое, но и большое практическое значение. Прежде всего, это позволило объяснить причины эффективности и токсичности НПВП.
Терапевтическая активность НПВП связана с предотвращением развития или снижением интенсивности воспаления благодаря участию в метаболизме арахидоновой кислоты. Анальгезирующее действие НПВП опосредовано несколькими механизмами, однако в основном связано с угнетающим влиянием на синтез ПГ (ПГЕ2, ПГF2, ПГI2), вызывающих гиперальгезию путем повышения чувствительности ноцицепторов к химическим и механическим стимулам. Противовоспалительное действие может быть связано с торможением перекисного окисления липидов, стабилизацией мембран лизосом и торможением агрегации нейтрофильных гранулоцитов (нарушается высвобождение из них медиаторов воспаления). Обсуждаются дополнительные механизмы противовоспалительной и анальгезирующей активности НПВП как связанные, так и не связанные с ингибицией ЦОГ. К ним относят подавление функции нейтрофильных гранулоцитов и взаимодействия лейкоцитов с эндотелием сосудов, ингибицию активации фактора транскрипции NF-кB (ядерный фактор «каппа-би» — nuclear factor kappa-light-chain enhancer of activated B cells), регулирующего синтез провоспалительных медиаторов и др.
Противовоспалительное действие может быть связано с торможением перекисного окисления липидов, стабилизацией мембран лизосом и торможением агрегации нейтрофильных гранулоцитов (нарушается высвобождение из них медиаторов воспаления). Обсуждаются дополнительные механизмы противовоспалительной и анальгезирующей активности НПВП как связанные, так и не связанные с ингибицией ЦОГ. К ним относят подавление функции нейтрофильных гранулоцитов и взаимодействия лейкоцитов с эндотелием сосудов, ингибицию активации фактора транскрипции NF-кB (ядерный фактор «каппа-би» — nuclear factor kappa-light-chain enhancer of activated B cells), регулирующего синтез провоспалительных медиаторов и др.
Все традиционные НПВП имеют ряд общих химических и фармакологических свойств. Будучи слабыми органическими кислотами, они хорошо абсорбируются в желудочно- кишечном тракте (ЖКТ), сильно связываются с альбумином и имеют примерно одинаковый объем распределения. Гипоальбуминемия ведет к повышению концентрации свободного препарата в сыворотке крови и может обусловливать увеличение токсичности.
В последние десятилетия активно разрабатывается новый класс НПВП — так называемые специфические (высокоселективные) ингибиторы ЦОГ-2, которые должны обладать более низкой токсичностью по сравнению со стандартными НПВП. Действительно, по ряду параметров, в первую очередь это касается побочных эффектов со стороны ЖКТ, ингибиторы ЦОГ-2 имеют ряд преимуществ перед стандартными НПВП. Однако в последние годы появились новые факты о физиологической (или адаптационной) роли ЦОГ-2-зависимого синтеза ПГ (Насонов Е.Л., 2003б). Но все же остается актуальным и вопрос кардиоваскулярных эффектов НПВП. Как уже известно, в норме продукты арахидоновой кислоты — ПГI2 и тромбоксан A2 — играют важную роль в регуляции сосудистого гомеостаза. Показано, что особенно значимые негативные «сосудистые» эффекты НПВП (высокоселективных ингибиторов ЦОГ-2) отмечаются у лиц с повышенным риском кардиоваскулярных осложнений, например у пациентов пожилого возраста с сопутствующими заболеваниями (артериальная гипертензия, ишемическая болезнь сердца, сахарный диабет), а также с воспалительными ревматическими болезнями, прежде всего системной красной волчанкой и ревматоидным артритом (Насонов Е. Л., 2003в). Полагают, что они могут снижать ЦОГ-2- зависимый синтез ПГI2 клетками сосудистого эндотелия, но не влияют на ЦОГ-1- зависимый синтез тромбоксана A2 тромбоцитами, что потенциально может приводить к нарушению баланса ПГI2/ тромбоксан A2, а следовательно — к активации, агрегации и адгезии тромбоцитов и повышению риска тромбообразования (Cheng Y. et al., 2002; Грацианский Н.А., 2004) (рисунок).
Л., 2003в). Полагают, что они могут снижать ЦОГ-2- зависимый синтез ПГI2 клетками сосудистого эндотелия, но не влияют на ЦОГ-1- зависимый синтез тромбоксана A2 тромбоцитами, что потенциально может приводить к нарушению баланса ПГI2/ тромбоксан A2, а следовательно — к активации, агрегации и адгезии тромбоцитов и повышению риска тромбообразования (Cheng Y. et al., 2002; Грацианский Н.А., 2004) (рисунок).
Рисунок. Сердечно-сосудистые эффекты ЦОГ-2
Ингибирование синтеза простациклина в сосудах и отсутствие действия на синтез тромбоксана в тромбоцитах
↓
Дисбаланс
↓
Протромботическое состояние
↓
Повышенный риск развития тромбоэмболических сердечно-сосудистых событий
Сравнительные клинические исследования неселективных и селективных НПВП (рофекоксиб, целекоксиб) показали значимость «сосудистых» эффектов (случаи инфаркта и инсульта) у лиц с повышенным риском кардиоваскулярных осложнений, что выдвинуло проблему дополнительного приема НПВП в процессе лечения профилактическими дозами АСК. Оказалось, что индометацин и ибупрофен могут конкурировать с АСК за связывание с активным центром ЦОГ-1 и отменять антиагрегантный эффект последней. Однако диклофенаку этот эффект не свойственен, то есть для больных, нуждающихся в лечении НПВП и имеющих фактор риска тромбоза, диклофенак может быть препаратом выбора. Учитывая тот факт, что не только ПГ, но и лейкотриены являются важными медиаторами, которые определяют гиперальгезию и воспаление, интересны данные, что диклофенак не только подавляет активность ЦОГ-1 и -2, но и моделирует липоксигеназный путь, подавляя высвобождение арахидоновой кислоты и, соответственно, лейкотриенов (Martel-Pelletier J. et al., 2003; Brune K., 2004).
Оказалось, что индометацин и ибупрофен могут конкурировать с АСК за связывание с активным центром ЦОГ-1 и отменять антиагрегантный эффект последней. Однако диклофенаку этот эффект не свойственен, то есть для больных, нуждающихся в лечении НПВП и имеющих фактор риска тромбоза, диклофенак может быть препаратом выбора. Учитывая тот факт, что не только ПГ, но и лейкотриены являются важными медиаторами, которые определяют гиперальгезию и воспаление, интересны данные, что диклофенак не только подавляет активность ЦОГ-1 и -2, но и моделирует липоксигеназный путь, подавляя высвобождение арахидоновой кислоты и, соответственно, лейкотриенов (Martel-Pelletier J. et al., 2003; Brune K., 2004).
Более того, оказалось, что ингибиторы ЦОГ-2 блокируют некоторые формы экспериментального воспаления только в очень высоких дозах, в которых они теряют свои ЦОГ-2-специфические свойства, а в стандартных дозах не влияют на некоторые важные компоненты воспалительного процесса (лейкоцитарная инфильтрация и др. ) (Wallace J.L., 1999; Simon L.S., 2000).
) (Wallace J.L., 1999; Simon L.S., 2000).
Именно эти свойства высокоселективных ингибиторов ЦОГ-2 заставляют медицинские сообщества ряда стран регламентировать прием данных препаратов (U.S. Food and Drug Administration (FDA), 2004). Согласно информации Британского медицинского журнала председатель Британского комитета по безопасности лекарств G. Duff в свое время разослал по электронной почте письма врачам Соединенного Королевства со следующей рекомендацией: «пациентов с ишемической болезнью сердца или цереброваскулярной болезнью, которые лечатся любым из ингибиторов ЦОГ-2, следует при первой возможности перевести на альтернативное (не ЦОГ-2- селективное) средство» (Gottlieb S., 2005).
Следовательно, несмотря на появление нового класса противовоспалительных средств — специфических ингибиторов ЦОГ-2 — вряд ли клиническая практика сможет обойтись без широкого применения традиционных НПВП. Учитывая, что НПВП — препараты, которые в большинстве случаев принимают пациенты преклонного возраста и длительно, врачу необходимо учитывать не только эффект, но и возможность развития жизни угрожающих осложнений.
Диклофенак
Среди различных НПВП большой интерес вызывает препарат диклофенак, надежно занимающий позиции золотого стандарта. Этот препарат является одним из наиболее изученных НПВП, считается лучшим представителем этого класса и применяется уже более 25 лет. Сочетание выраженного противовоспалительного и обезболивающего эффектов при хорошей переносимости делают его одним из наиболее часто назначаемых и длительно принимаемых препаратов.
Диклофенак является органической кислотой со сравнительно низким рН, благодаря чему он активно связывается с белками плазмы крови и накапливается в очаге воспаления. Основным механизмом действия диклофенака, как и других НПВП, является подавление активности ЦОГ, ответственной за превращение арахидоновой кислоты в ПГ, простациклин, тромбоксан.
Положительные качества диклофенака обусловлены оптимальными физико- химическими и структурными характеристиками, способностью проникать и накапливаться в очагах воспаления. В литературе также обсуждаются вопросы об иммуномодулирующих свойствах диклофенака, благодаря которым происходит более быстрое купирование всех воспалительных процессов (Annadurai S. et al., 1998; Annadurai S. et al., 2002; Насонов Е.Л., 2003а).
В литературе также обсуждаются вопросы об иммуномодулирующих свойствах диклофенака, благодаря которым происходит более быстрое купирование всех воспалительных процессов (Annadurai S. et al., 1998; Annadurai S. et al., 2002; Насонов Е.Л., 2003а).
Диклофенак является быстродействующим и быстровыводящимся НПВП, что соответствует одному из современных требований к применению как неселективных, так и селективных ингибиторов ЦОГ-2. Отсутствие аккумуляции и энтеропеченочной рециркуляции, длительное накопление в области воспаления также относят к преимуществам фармакокинетики этого препарата. Интерес к диклофенаку сохраняется в практической медицине, более того, возросло внимание к нему по соотношению польза/риск при сравнении с новыми селективными препаратами, появившимися в середине 90-х годов XX в.
На сегодня известно, что традиционные НПВП могут вызывать осложнения со стороны верхнего отдела ЖКТ, а селективные ингибиторы ЦОГ-2 снижают этот риск. Оставалось невыясненным, снижается ли риск осложнений при длительном применении ингибиторов ЦОГ-2 в сравнении с классическими НПВП со стороны нижнего отдела ЖКТ. В программе MEDAL проводилось сравнение частоты нежелательных эффектов НПВП у больных остеоартрозом и ревматоидным артритом, рандомизированных на длительный прием ингибитора ЦОГ-2 эторикоксиба и диклофенака. Заранее был запланирован анализ нежелательных явлений со стороны нижнего отдела ЖКТ. Его результаты доложены в журнале «Gastroenterology». В данном исследовании большинство осложнений со стороны ЖКТ составили кровотечения, перфорация и непроходимость кишечника. Использование селективного ингибитора ЦОГ-2 эторикоксиба не привело к более низкому риску этих осложнений в сравнении с традиционным НПВП диклофенаком. Риск нежелательных явлений со стороны нижнего отдела ЖКТ оставался устойчивым во времени, а главными факторами этого риска были возраст старше 65 лет, ранее перенесенные осложнения со стороны нижнего отдела ЖКТ и, возможно, сопутствующая антитромбоцитарная терапия (Laine L. et al., 2008).
Следовательно, учитывая данные ряда исследований, врачу необходимо помнить общие факторы риска возникновения нежелательных реакций со стороны ЖКТ у пациентов, длительно принимающих НПВП (табл. 2). А для профилактики возникновения побочных эффектов со стороны ЖКТ необходимо применять препараты, снижающие продукцию соляной кислоты париетальными клетками (Peura D.A., 2002) (табл. 3).
Физиологическая и патофизиологическая роль ЦОГ-1 и -2
Таблица 2. Факторы риска повреждения слизистой оболочки желудка и/или двенадцатиперстной кишки на фоне приема НПВП
| Установленные | Вероятные |
|
|
Таблица 3. Препараты для профилактики возникновения побочных эффектов со стороны ЖКТ
| Препарат | Категория доказательства |
Диспепсия
|
В |
Активная фаза
|
А |
Риск развития осложнений (профилактика)
|
А |
Индивидуальные различия в эффективности НПВП колеблются в широких пределах, поэтому на первое место выходят препараты с максимальной эффективностью и с минимальным количеством побочных эффектов. Именно с этой целью в конце прошлого века в клиническую практику была введена новая соль диклофенака. Новая форма была синтезирована для более быстрого купирования болевого синдрома. Доказав высокую эффективность и хорошую переносимость, с конца прошлого века с успехом применяется структурный аналог диклофенака — его калиевая соль. Известно, что препараты калиевой соли при приеме внутрь быстрее достигают максимальной концентрации в плазме крови. Введение в молекулу диклофенака калия позволило достичь более быстрого проявления фармакологического эффекта при пероральном применении. Отличительной особенностью этой соли является хорошая растворимость в воде, что позволяет изготавливать лекарственную форму с немедленным высвобождением действующего вещества. Уже через 10 мин после применения диклофенак калия присутствует в крови и ингибирует высвобождение медиаторов воспаления, купируя, таким образом, боль (концентрация в крови достигает максимума через 40–50 мин после приема препарата). Полный анальгезирующий эффект диклофенака калия проявляется уже через 20–30 мин, в то время как при использовании иных НПВП эффект обычно развивается через 1–3 ч. При одинаковой эффективности пероральная форма диклофенака калия действует так же быстро, как внутримышечная инъекция диклофенака натрия. Длительность обезболивания составляет около 6 ч. Благодаря лучшему всасыванию и высокой степени биодоступности калиевая соль диклофенака обусловливает меньший раздражающий эффект на слизистую оболочку желудка.
Раптен Рапид
На отечественном рынке хорошо зарекомендовал себя препарат Раптен Рапид — калиевая соль диклофенака. Быстрое всасывание препарата в ЖКТ делает его пригодным для лечения и острых, и хронических болевых синдромов при ревматических болезнях, травмах, при купировании послеоперационной и гинекологической боли.
Препарат оказывает стойкий анальгезирующий эффект значительно быстрее и продолжительнее, чем натриевая форма диклофенака и другие НПВП. Выраженность обезболивающего эффекта, а главное, быстрота наступления фармакологического действия определяет преимущество Раптена Рапида в купировании болевого синдрома. Все это сочетается с хорошей переносимостью препарата, обусловленной особенностями его фармакокинетики. В связи с этим Раптен Рапид может быть рекомендован для начальной терапии — быстрого купирования болевого синдрома в острый период с последующим переходом на другой анальгетик.
Благодаря таким свойствам, как быстрое всасывание (пиковая концентрация достигается через 40 мин), короткий период полувыведения (≈4 ч), отсутствие аккумуляции и энтеропеченочной рециркуляции, легкое проникновение и накопляемость в зоне воспаления, быстрое перераспределение в синовиальную жидкость, сбалансированная ингибиция ЦОГ-1 и -2, отсутствие риска осложнений, связанных с инъекционным введением препарата, Раптен Рапид обладает высокой эффективностью и низкой токсичностью.
На сегодняшний день ни один клиницист в своей повседневной практике не обходится без НПВП. Это хирурги, травматологи, гинекологи, оториноларингологи, стоматологи и, безусловно, все врачи терапевтического звена. Каждый клинический случай требует особого подхода к проведению лечения. Порой важно очень быстро купировать болевой синдром (если речь идет о травме, операциях как больших, так и незначительных), иногда важно получить более длительный клинический эффект (хроническая боль при патологии суставов), а иногда необходимо потенцирование основного эффекта за счет применения локальных средств. Очень часто все эти этапы объединяются у одного пациента: травма — острая ситуация — операция — послеоперационный период — реабилитация; обострение суставного синдрома — устранение острого воспаления и болевого синдрома — поддерживающая терапия. Учитывая наличие на фармацевтическом рынке чрезвычайно большого количества НПВП, очень важно у одного пациента применять препарат одного и того же производителя. Это гарантирует не только хороший клинический эффект и хорошую переносимость, а и приверженность пациента к лечению. Таким производителем, представившим на отечественный рынок высокоэффективные НПВП, является компания «Хемофарм» (Сербия). Диклофенак, представленный данной фармацевтической компанией, имеет формы рапид, ретард, гель и раствор для инъекций. Таким образом, у врача есть широкий спектр препаратов для применения в любой клинической ситуации или для рационального использования различных форм диклофенака при ступенчатой терапии болевого синдрома.
Так, когда необходим более быстрый противоболевой эффект (ушиб, растяжение, при острой боли в спине, послеоперационной боли) необходимо применять Раптен в форме раствора для инъекций (Раптен 75). Следует помнить, что продолжительность парентерального применения не должна быть длительной, не более 2 дней; при необходимости лечение продолжить Раптен Рапид, который также является препаратом для купирования острых болевых синдромов различной интенсивности.
При необходимости более длительного назначения препарата применяют Раптен Ретард, содержащий 100 мг диклофенака натрия. Это лекарственное средство принимается 1 раз в сутки, предпочтительное применение диклофенака в форме ретард — хронические болевые синдромы, в основном в ревматологической или травматологической практике. В ряде случаев препарат в форме геля дает возможность более быстрого и более эффективного уменьшения выраженности болевого синдрома, а также возможность применения таблетированных форм в более низких дозах.
В ряде случаев местное лечение может на определенный срок заменить средства общей терапии или сократить их применение, что особенно важно при наличии противопоказаний к лекарственным препаратам общего действия или их плохой переносимости. Препарат Раптен Гель является эффективным лекарственным средством для локальной терапии.
Препарат Раптен давно и успешно применяется на различных рынках мира. В нашей стране за достаточно короткий срок Раптен завоевал доверие врачей, подкрепленное результатами клинических исследований.
Выраженный противовоспалительный эффект Раптена и хороший профиль безопасности и переносимости при остеоартрозе коленных суставов показан в исследовании, проведенном в Харьковском государственном медицинском университете в 2007 г. (Біловол О.М. та співавт., 2007). Исследователи сравнивали время наступления анальгезирующего действия калиевой и натриевой солей диклофенака, а также изучали эффективность и переносимость терапии ретардной формой диклофенака натрия (Раптен Ретард) у больных остеоартрозом коленных суставов.
В 1-ю группу вошли 20 больных (12 женщин и 8 мужчин, средний возраст — 55,9±6,1 года, длительность заболевания — 6,3±2,5 года), которым был назначен диклофенак калия (Раптен Рапид). Во 2-ю группу вошли 18 больных (14 женщин и 4 мужчин, средний возраст — 56,3±4,2 года, длительность заболевания — 5,9±2,8 года), получавших инъекционную форму диклофенака натрия (Раптен 75).
После регистрации исходных данных проводили острую фармакодинамическую пробу (ОФП) с 50 мг per os диклофенака калия, с 75 мг диклофенака натрия в виде внутримышечной инъекции, после чего следовал курс лечения в суточной дозе соответственно 150 мг для диклофенака калия (по 50 мг per os 3 раза в сутки) и 150 мг для диклофенака натрия (по 75 мг внутримышечно 2 раза в сутки) в течение 4 дней. Далее пациентам обеих групп назначали ретардную форму диклофенака натрия 100 мг однократно в сутки (Раптен Ретард) длительностью 10–14 дней. Показанием к назначению диклофенака являлось обострение болевого суставного синдрома при его интенсивности не менее 5 баллов (по 10-балльной шкале).
Анализ эффективности терапии проводили с учетом количественной оценки боли (в покое, при движении), нарушения функциональной активности и выраженности воспаления (в баллах от 0 до 10). В ОФП с калиевой и натриевой солью диклофенака оценку указанных параметров проводили через 20; 30; 40; 50 и 60 мин после первого приема и через 4 сут непрерывной терапии. По завершении всего курса лечения эффект оценивался раздельно пациентом и врачом. Кроме того, всем больным проводили мониторинг артериального давления, стандартные клинические, биохимические и диагностические исследования. Безопасность применения диклофенака оценивалась на основании данных о побочных эффектах, зафиксированных в течение курса лечения.
Анализ клинических параметров показал, что анальгезирующий эффект проявлялся очень быстро, уже после первого приема диклофенака (через 36,1±1,3 мин после введения диклофенака натрия и через 37,5±1,2 мин после приема диклофенака калия), что приводило к улучшению функциональной активности пациентов в обеих группах. Следует отметить, что динамика оцениваемых симптомов в течение всех этапов лечения была положительной и статистически значимой.
Полученные данные свидетельствуют о том, что у пациентов с остеоартрозом коленных суставов время наступления анальгезирующего эффекта таблетированной формы калиевой соли диклофенака сопоставимо с таковым при внутримышечном введении натриевой соли диклофенака. Терапия ретардной формой диклофенака натрия в течение 10–14 дней приводит к снижению выраженности болевого синдрома у пациентов с остеоартрозом коленных суставов, повышению их функциональных возможностей при хорошем профиле безопасности и переносимости.
Заключение
Таким образом, несомненным преимуществом Раптена является не только его высокая клиническая эффективность и хорошая переносимость, но и многообразие лекарственных форм, включающих таблетки (быстрого и ретардного действия), раствор для парентерального введения, а также формы для локальной терапии (гель), что создает удобства при подборе индивидуальной дозы и способе применения препарата, а также дает возможность комбинации различных путей введения, что создает предпосылки для достижения положительного эффекта при уменьшении риска развития побочных реакций.
Адрес для переписки:
Селюк Марьяна Николаевна
03049, Киев, ул. Курская, 13А
Украинская военно-медицинская академия, кафедра терапии
Ремесулид — первый отечественный препарат нимесулида
Апр 02, 2004
На фармацевтическом рынке Украины появился новый препарат группы НПВП, ингибитор циклооксигеназы-2 (ЦОГ-2) — РЕМЕСУЛИД производства ОАО «Фармак». Предлагаем вниманию читателей авторитетное мнение относительно его использования в клинической практике доцента кафедры технологии лекарств и клинической фармации Киевской медицинской академии последипломного образования им. П.Л. Шупика, кандидата фармацевтических наук Тамары Торховой
Тамара Торхова, канд. фарм. наук, доц. каф. технологии лекарств и клин. фармации КМАПО им. П.Л. Шупика
— В структуре общей заболеваемости населения многих стран мира, в том числе и Украины, ведущие позиции занимают повреждения и заболевания опорно-двигательного аппарата. По нашим данным, боль в суставах возникает у 30% населения; 20% больных необходимы обязательное систематическое наблюдение и лечение; 10% становятся нетрудоспособными, а 5% — инвалидами. Основные причины поражения суставов — системные заболевания соединительной ткани, нарушение процессов обмена в костной и хрящевой тканях, травмы. В последнее время большое внимание уделяют изучению безопасных лекарственных средств, которые могут тормозить катаболические процессы в суставном хряще, угнетать воспаление в синовиальной оболочке, а также воздействовать на основной симптом — боль. НПВП приобретают все большее значение в лечении пациентов с заболеваниями опорно-двигательного аппарата за счет пополнения их перечня новыми, более безопасными представителями, к которым относятся селективные ингибиторы ЦОГ-2.
Основой для выделения этого нового класса НПВП послужило открытие двух изоформ ЦОГ- фермента, участвующего в синтезе простагландинов и тромбоксанов из арахидоновой кислоты. ЦОГ-1 контролирует выработку простагландинов, нормализующих физиологические функции различных клеток и оказывающих протекторное действие в отношении слизистой оболочки пищеварительного тракта. ЦОГ-2 активируется под влиянием провоспалительных реакций и участвует в синтезе простагландинов, инициирующих развитие воспаления. Противовоспалительное действие НПВП обусловлено ингибированием ЦОГ-2, а развитие побочных эффектов — ЦОГ-1. Неселективные НПВП блокируют обе изоформы ЦОГ и оказывают наряду с лечебным повреждающее действие на слизистую оболочку пищеварительного тракта. Селективные ингибиторы ЦОГ-2 практически не вызывают этих побочных эффектов и оказывают только противовоспалительное действие.
Представителем селективных ингибиторов ЦОГ-2 является РЕМЕСУЛИД, действующее вещество которого — нимесулид зарегистрировано в более, чем 50 странах мира. Препарат прошел апробацию на базе Института кардиологии им. М.Д. Стражеско АМН Украины в отделении некоронарогенных заболеваний миокарда и клинической ревматологии.
РЕМЕСУЛИД оказывает выраженное противовоспалительное, аналгезирующее и жаропонижающее действие. За счет этого препарат имеет широкие показания к применению: острый, инфекционный, псориатический и травматический артрит, остеоартроз, радикулит, ревматоидный артрит, миалгия, травматические и послеоперационные воспаления мягких тканей и опорно-двигательного аппарата, гинекологические и другие инфекционно-воспалительные заболевания, сопровождающиеся болевым синдромом и лихорадкой. Доказана также эффективность нимесулида в уменьшении выраженности боли во время месячных, при мелких травмах мягких тканей, у пациентов с радикулитом.
Аналгетическое и противовоспалительное действие нимесулида сравнимо с таковым индометацина и диклофенака. Большое значение имеет способность нимесулида влиять на апоптоз хондроцитов. Препарат угнетает синтез простагландинов в очаге воспаления и образование свободных кислородных радикалов, не влияя на гемостаз и фагоцитоз; тормозит синтез ферментов, разрушающих хрящевую ткань, и нормализует процессы синтеза хрящевой ткани, т. е. оказывает хондропротекторное действие.
Среди широко известных осложнений, обусловленных приемом НПВП, главное место занимают эрозивно-язвенные поражения слизистой оболочки желудка и двенадцатиперстной кишки, часто множественные, которые нередко манифестируются внезапным желудочно-кишечным кровотечением. Механизм негативного влияния НПВП на слизистую оболочку желудка обусловлен главным образом ингибированием ЦОГ-1 и последующим блокированием синтеза простагландинов, оказывающих цитопротекторное действие. Благодаря селективности действия нимесулид не обладает ульцерогенным эффектом, что дает ему значительные преимущества перед многими НПВП. Таким образом, пептическая язва желудка и двенадцатиперстной кишки, гастрит не являются противопоказаниями к назначению РЕМЕСУЛИДА.
Противопоказаниями являются данные заболевания только в стадии обострения, что существенно расширяет возможность применения препарата у больных этой категории.
Таким образом, РЕМЕСУЛИД практически не оказывает побочного действия на пищеварительный тракт, оказывает протекторное действие на обменные процессы в хрящевой ткани, устраняет факторы, формирующие воспаление, и эффективен как для немедленного устранения болевого синдрома при различных состояниях, так и для длительного применения при воспалении костно-мышечной ткани.
Взрослым РЕМЕСУЛИД назначают по 1 таблетке (100 мг) 2 раза в сутки после еды.
Следует отметить, что на украинском фармацевтическом рынке представлен широкий ассортимент НПВП, среди них есть и недорогие. Но для лекарственного средства важнейшим показателем является качество, а потребитель хочет приобрести качественный препарат по приемлемой цене. РЕМЕСУЛИД обладает оптимальным соотношением цена/качество. По моему мнению, препарат доступен для всех слоев населения. Препарат внесен в «Перечень лекарственных средств отечественного и импортного производства, которые могут закупать лечебные учреждения, финансируемые полностью или частично из государственного и местных бюджетов» (приказ № 169 МЗ Украины от 14.04.2003 г.).
Назад к Фармак в СМИЕщё больше публикаций
Селективный ингибитор ЦОГ-2 (мелоксикам) в терапии остеоартроза коленных суставов Текст научной статьи по специальности «Клиническая медицина»
Орипнальш дослщження
БОЛ к СУСТАВЫ.
ПШ60НОЧ1 II) к
ПОВОРОЗНЮК В.В., БЫСТРИЦКАЯ М.А.
ГУ «Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины», отдел клинической физиологии и патологии опорно-двигательного аппарата, г. Киев
СЕЛЕКТИВНЫЙ ИНГИБИТОР ЦОГ-2 (МЕЛОКСИКАМ) В ТЕРАПИИ ОСТЕОАРТРОЗА КОЛЕННЫХ СУСТАВОВ
Резюме. Во многих исследованиях доказана эффективность селективных ингибиторов ЦОГ-2 в лечении остеоартроза коленных суставов. Авторами статьи проведено исследование эффективности и безопасности препарата Ревмоксикам® по сравнению с диклофенаком натрия в комплексном лечении больных старших возрастных групп. Установлена высокая эффективность обоих препаратов. Однако в периоде дальнейшего наблюдения установлена более высокая эффективность Ревмоксикама®. Таким образом, отечественный препарат Ревмоксикам® может быть препаратом выбора при лечении пациентов старших возрастных групп.
Остеоартроз (ОА) — хроническое прогрессирующее заболевание суставов, характеризующееся постепенной деградацией хряща, изменениями субхондральной кости с формированием кист и остеофитов, приводящее к потере хряща и сопутствующему поражению других компонентов сустава (синовиальная оболочка, связочный аппарат) [3]. В современной литературе одновременно существует несколько терминов («остеоартроз», «артроз», «остеоартрит», «деформирующий артроз»), но на совместном пленуме ревматологов и ортопедов-травматологов в 2003 г. рекомендовано использовать термин «остеоартроз» [2]. Остеоартроз — наиболее распространенное заболевание синовиальных суставов, являющееся основной причиной болевых синдромов, самой частой причиной нетрудоспособности среди патологии опорно-двигательного аппарата, вызывающей существенное ухудшение качества жизни пациентов. Постарение населения и увеличение процента пожилых людей в популяции приводит к увеличению распространенности остео-артроза, значительным финансовым затратам на его лечение, что переводит проблему в категорию социальной и экономической.
В различных странах мира распространенность остеоартроза широко варьирует. В Украине она составляет 2,2 % (2200 на 100 тыс. населения), заболева-
емость — 497 чел. на 100 тыс. населения [1], что значительно меньше, чем в США, что, возможно, обусловлено недостаточным выявлением заболевания.
Несмотря на высокую распространенность заболевания, существует много противоречий в выборе оптимального метода лечения. В рекомендациях OARSI (2008) по лечению остеоартрита (остеоартроза) коленного и тазобедренного суставов было представлено 25 рекомендаций с указанием силы доказательности (СД) каждой рекомендации (от 0 до 100 %), охватывающих как консервативные (медикаментозные и немедикаментозные), так и хирургические методы лечения. Среди лекарственных препаратов наибольшей доказательностью обладают нестероидные противовоспалительные препараты (СД 93 %).
Противовоспалительное действие НПВП основано на ингибировании активности фермента циклооксигена-зы (ЦОГ). В организме человека существуют две изофор-мы этого фермента. ЦОГ-1 стимулирует продукцию факторов защиты слизистой оболочки желудочно-кишечного тракта, регулирует выделительную функцию почек, агрегационную способность тромбоцитов. Изофермент ЦОГ-2 стимулирует выработку простагландинов и лей-котриенов, которые являются факторами, стимулирующими воспалительные и аллергические реакции. Противовоспалительный эффект НПВП связан с непосредст-
венным угнетением ЦОГ-2. Таким образом, блокируется синтез простагландинов и уменьшаются проявления воспаления: боль, отек, гиперемия, повышение температуры, нарушение функции.
Современные НПВП эффективно выполняют главную задачу — оказывают противовоспалительный эффект. При одинаковой эффективности НПВП следующим критерием выбора препарата становится его безопасность для пациента. Именно этим отличаются молекулы, синтезированные за последние 20 лет. В отличие от традиционных НПВП, которые одинаково угнетают как ЦОГ-1, так и ЦОГ-2 и могут вызывать желудочно-кишечные кровотечения (ЖКК), нарушения функции почек, отеки, ухудшать течение артериальной гипертен-зии, сердечной недостаточности, нарушать активность свертывающей системы крови, современные селективные НПВП имеют меньшее количество таких осложнений. С другой стороны, крупномасштабные исследования, такие как VIGOR, CLASS, привели к запрету использования некоторых современных препаратов или ограничению их применения по возрасту, длительности терапии, сопутствующим заболеваниям в связи с увеличивающимся риском тромбоэмболических осложнений.
Для лечения хронического болевого синдрома, особенно у пациентов старших возрастных групп, препаратами выбора являются частично селективные ингибиторы ЦОГ-2, так как они обладают меньшим риском гастроинтестинальных (ГИ) осложнений по сравнению с неселективными НПВП и меньшим риском кардио-васкулярных осложнений по сравнению с селективными НПВП. Наиболее изученный на сегодняшний день представитель этой группы — мелоксикам, частично селективный ингибитор ЦОГ-2, применяющийся с 1995 года.
Во многих исследованиях доказана эффективность этого препарата в лечении ОА коленных суставов. Три систематических обзора оценивали эффективность частично селективных НПВП по сравнению с неселективными НПВП. По результатам одиннадцати рандомизированных двойных слепых исследований мелок-сикама в разных дозах (7,5, 15 или 22,5 мг) в сравнении с другими НПВП (диклофенак 100—150 мг/сут, пирок-сикам 20 мг/сут, напроксен 750 мг/сут) не было обнаружено достоверных различий в эффективности у пациентов с ОА коленных суставов [6].
При применении препарата у пациентов старших возрастных групп особое внимание уделяется безопасности. Риск развития гастроинтестинальных осложнений как основных для группы НПВП зависит от влияния препарата на ЦОГ-1, то есть его ЦОГ-2-селектив-ности (табл. 1).
НПВП с соотношением < 1 указывает на селективность ингибиторов циклооксигеназы-2, таким образом, высокая ЦОГ-2-селективность мелоксикама приводила к меньшему риску возникновения осложнений
Таблица 1. Индекс ЦОГ-2-селективности НПВП (адаптировано по M. Feldman, A.T. McMahon [7])
НПВП Индекс*
Флурбипрофен 10,27
Кетопрофен 8,16
Фенопрофен 5,14
Толметин 3,93
Аспирин 3,12
Оксапрозин 2,52
Напроксен 1,79
Индометацин 1,78
Ибупрофен 1,69
Кеторолак 1,64
Пироксикам 0,79
Набуметон 0,64
Этодолак 0,11
Целекоксиб 0,11
Мелоксикам 0,09
Примечание: * — индекс ЦОГ-2-селективности — отношение 50% ингибирующей концентрации ЦОГ-2 к 50% инги-бирующей концентрации ЦОГ-1 в крови.
со стороны желудочно-кишечного тракта, что доказано целой серией рандомизированных исследований. По данным исследования, проведенного в 2007 году в Великобритании и охватившего 11 561 пациента (мужчины и женщины) в возрасте 40—85 лет, было доказано, что прием мелоксикама сопровождается более низким относительным риском развития гастроинтестинальных осложнений (2,7; 1,4—4,3) по сравнению с диклофенаком (3,7; 2,4—4,2), кетопрофеном (5,4; 1,5—16,1), индометацином (7,2; 3,8—13,8), уступая лишь целекоксибу (2,7; 1,5—4,1) и ибупрофену (2,0; 1,4—2,9) [7]. Кроме того, прием мелоксикама ассоциирован с меньшим риском развития серьезных гастроин-тестинальных осложнений по сравнению с различными неселективными НПВП (6 исследований, ОР 0,53, 95% ДИ 0,29—0,97) [10] и не связан с повышенным риском ГИ-осложнений в том числе серьезных (перфорация, пенетрация, ЖКК, госпитализация по поводу ГИ-осложнений или связанная с ними смертность) по сравнению с неиспользованием препаратов.
К не менее опасным осложнениям НПВП на сегодняшний день относят кардиоваскулярные. Особый интерес к этой группе осложнений возник после исследований VIGOR, CLASS, в которых высокий относительный риск кардиоваскулярных осложнений был получен у препаратов с низким гастроинтестинальным риском. По результатам многочисленных исследований, риск кардиоваскулярных осложнений, ассоциированных с приемом мелоксикама, существенно не отличается от такового для других НПВП (мелоксикам (1,2; 1,0—1,6), целекоксиб (1,1; 0,91-1,2), напроксен (0,97; 0,87-1,1), ибупрофен (1,1; 0,97-1,2), пироксикам (1,1; 0,70-1,6),
диклофенак (1,4; 1,2—1,7)) [1]. Данных о нефро- или ге-патотоксичности мелоксикама не найдено.
Именно высокий профиль безопасности при эффективности, сравнимой с диклофенаком, обусловил выбор препарата мелоксикам для применения у пациентов старших возрастных групп.
В Украине производится отечественный мелоксикам под торговой маркой Ревмоксикам®. Препарат выпускается ОАО «Фармак» в виде трех лекарственных форм: в таблетках 7,5 мг и 15 мг, ампулах для внутримышечного введения по 15 мг и ректальных свечах по 15 мг.
В отделе клинической физиологии и патологии опорно-двигательного аппарата ГУ «Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины» было проведено исследование эффективности Ревмоксикама® у пациентов с остеоартрозом коленных суставов.
Целью исследования явилось изучение эффективности и безопасности препарата Ревмоксикам® (инъекционная и таблетированная формы) по сравнению с дикло-фенаком натрия в комплексном лечении больных старших возрастных групп с гонартрозом.
Материал и методы исследования
В исследование были включены 80 пациентов с остеоартрозом коленных суставов II—III ст. по Kellg-ren — Lawrence, разделенные на 2 группы. Все пациенты получали комплексную терапию остеоартроза, не отличавшуюся в двух группах пациентов, за исключением НПВП.
I группа — 40 больных, получавших Ревмоксикам®, из них:
!а — 20 больных получали препарат в форме раствора для инъекций, содержащего 15 мг мелоксикама в одной ампуле (1,5 мл 1% раствора) 1 раз в сутки в течение 10 дней;
I6 — 20 больных получали Ревмоксикам® инъекции 1 раз в сутки в течение 5 дней, затем 5 дней — таблетки Рев-моксикам® 15 мг 1 раз в сутки.
II группа — 40 больных, получавших диклофенак натрия, представленный европейским брендовым препаратом, из них:
На — 20 больных получали диклофенак натрия в дозе 75 мг внутримышечно 1 раз в течение 10 дней;
Нб — 20 больных получали диклофенак натрия инъекции 75 мг 1 раз в сутки в течение 5 дней, затем 5 дней — таблетки по 50 мг диклофенака натрия 2 раза в сутки.о1 5D. Статистическую оценку полученных данных проводили в программе Statistica 6.0.
Результаты и их обсуждение
Под влиянием Ревмоксикама® в составе комплексной терапии у пациентов достоверно снижалась выраженность болевого синдрома, связанного с остеоартрозом коленного сустава уже через 5 дней лечения и это снижение продолжалось даже через 10 дней после окончания приема препарата как в группе 1а (инъекционная терапия), так и в группе 1б (комбинированная инъекционная и таблетированная терапия). Статистически достоверных различий между группами не получено (рис. 1).
При помощи однофакторного дисперсионного анализа Anova сравнивали эффективность Ревмоксикама® и диклофенака натрия (рис. 2—5). При обследовании больных в период лечения препаратом достоверных отличий не найдено, но через 10 дней после прекращения терапии у пациентов, принимавших Ревмоксикам®, снижение болевого синдрома было достоверно большим и составило 51,30 ± 4,13 % (WOMAC, подшкала боли).
мм 60
50 40 30 ч 20 10 0
I I I
Группа la
■ I I
Группа 16
Долечения! 5дней ИЮдней I 20дней
Рисунок 1. Динамика суммарного показателя анкеты WOMAC под влиянием Ревмоксикама в составе комплексной терапии (группы 1а и 1б) Примечание: * — р < 0,05.
Таблица 2. Характеристика обследованных больных
*
Группы Возраст, лет Масса, кг Рост, см ИМТ
1а 61,8 ± 1,8 89,7 ± 3,3 166,9 ± 1,9 32,3 ± 1,2
1б 65,3 ± 2,0 79,6 ± 3,5 161,6 ± 2,1 33,0 ± 1,5
11а 66,7 ± 1,7 83,5 ± 3,4 161,7 ± 2,2 31,8 ± 0,9
II6 60,1 ± 1,7 87,1 ± 3,5 161,6 ± 1,6 30,3 ± 1,2
%
0 -10 -20 -30 -40 -50 -60
До лечения 5 дней
п 10 дней ‘ 20 дней
Ревмоксикам
-Дикпофенак
Рисунок 2. Сравнительная динамика выраженности болевого синдрома по шкале WOMAC (в % к базисному показателю) у пациентов, принимавших Ревмоксикам® или диклофенак натрия: F5 = 0,3; р > 0,05; F10 = 0,5; р > 0,05; F20 = 4,4; р < 0,05
% 0 -10 -20 -30 -40 -50 -60
Долечения 5дней Юдней 20дней
Ревмоксикам
-Дикпофенак
Рисунок4. Сравнительная динамика функциональных возможностей по данным шкалы WOMAC (в % к базисному показателю) у пациентов, принимавших Ревмоксикам® или диклофенак натрия: F5 = 0,01; р > 0,05; F10 = 0,02; р > 0,05; F20 = 2,1; р > 0,05
%
0 -5 -10 -15 -20 -25 -30 -35 -40 -45
Долечения 5дней Юдней 20дней
Ревмоксикам
-Диклофенак
Рисунок 3. Сравнительная динамика скованности по шкале WOMAC (в % к базисному показателю) у пациентов, принимавших Ревмоксикам® или диклофенак натрия: F5 = 0,5; р > 0,05; F10 = 0,2; р > 0,05; F20 = 1,6; р > 0,05
% 0 -10 -20 -30 -40 -50 -60
-1-1-1-
Долечения 5дней Юдней 20дней
Ревмоксикам
-Дикпофенак
Рисунок 5. Сравнительная динамика суммарного показателя анкеты WOMAC (в % к базисному показателю) пациентов, принимавших Ревмоксикам® или диклофенак натрия: F5 = 0,06; р > 0,05; F10 = 0,1; р > 0,05; F20 = 2,7; р > 0,05
баллы
6 —
4 2 -0 —
ВАШ боли
Ревмоксикам®
Дикпофенак
Долечения! 5дней ИЮдней I 20дней
%
0 -20 -40 -60
ВАШ боли
■
Ревмоксикам®
Диклофенак
5 дней
I Юдней
20 дней
Рисунок 6.о! 50)
Побочных реакций у пациентов зарегистрировано не было как в группе, принимавшей Ревмоксикам®, так и в группе, принимавшей диклофенак натрия.
В проведенном исследовании эффективность Ревмо-ксикама достоверно не отличалась от диклофенака натрия, признанного на сегодняшний день золотым стандартом терапии болевого синдрома при патологии опорно-двигательного аппарата. Полученные данные подтверждают результаты многочисленных международных исследований. Влияние Ревмоксикама® на боль и функциональные возможности пациентов с остеоартрозом коленных суставов во время приема препарата сравнимо с таковым в группе диклофенака натрия, но в периоде дальнейшего наблюдения эффективность Ревмоксикама® была выше, хотя отличия достигли достоверных значений только в оценке болевого синдрома и качества жизни пациентов. Влияние Рев-моксикама® на скованность движений в коленных суставах также было более эффективным как во время лечения, так и в период наблюдения, но отличия не были достоверными. Среди обследованных не было пациентов, выбывших из исследования по причине появления побочных эффектов или по другим причинам, что связано с коротким периодом активной терапии.
Выводы
Таким образом, отечественный селективный ингибитор ЦОГ-2 Ревмоксикам® эффективен в дозе 15 мг ежедневно в течение 10 дней для снижения выраженности болевого синдрома у больных с остеоартрозом коленных суставов. Ревмоксикам® не уступает по эффективности золотому стандарту в лечении ревматических заболеваний — диклофенаку натрия, достоверно снижает выраженность болевого синдрома, скованность и улучшает повседневную активность уже на 5-й день лечения и поддерживает их на указанном уровне через 10 дней после завершения терапии (независимо от приема инъекций или инъекций и таблеток). Препарат хорошо переносится больными старших возрастных групп. Ревмоксикам® может быть предложен для лечения болевого синдрома при остеоартрозе коленных суставов по схеме: 5 дней в виде внутримышечных инъекций, содержащих 15 мг ме-локсикама, с переходом на таблетированную форму (также 15 мг) в следующие 5 дней. Ревмоксикам® может быть препаратом выбора для лечения пациентов старших возрастных групп, так как является более безопасным и не менее эффективным по сравнению со стандартом лечения — диклофенаком натрия.
Список литературы
1. Коваленко В.Н., Борткевич О.П. Остеопороз. Практическое руководство. — К.: Морион, 2003. — 448 с.
2. Корж H.A., Филиппенко В.А., Дедух Н.В. Остеоартроз — подходы к лечению // Вюник ортопеда, травматологи та проте-зування. — 2004. — № 3. — С. 75-79.
3. Поворознюк В.В. Захворювання истково-м’язово! систе-ми у людей рiзного вжу (вибрат лекци, огляди, стати): У 2 т. — К., 2009.
4. Chen Y.F., Jobanputra P. et al. Cyclooxygenase-2 selective nonsteroidal anti-inflammatory drugs (etodolac, meloxicam, celecoxib, rofecoxib, etoricoxib, valdecoxib and lumiracoxib) for osteoarthritis and rheumatoid arthritis: a systematic review and economic evaluation // Health Technology Assessment. — 2008. — Vol. 12 (Suppl. 11). — Р. 1-278.
5. Chou R., McDonagh M.S., Nakamoto E. et al. Analgesics for Osteoarthritis: An Update of the 2006. Comparative Effectiveness Reviews // Rockville (MD): Agency for Healthcare Research and Quality (US). — 2011. — Vol. 38. — Р. 1-148.
6. Chu S.C., Yang S.F. et al. Naproxen, meloxicam and methylprednisolone inhibit urokinase plasminogen activator
and inhibitor and gelatinases expression during the early stage of osteoarthritis // Clinica Chimica Acta. — 2008. — Vol. 387 (Suppl. 1-2). — Р. 90-96.
7. Feldman M., McMahon A.T. Do cyclooxygenase-2 inhibitors provide benefits similar to those of traditional nonsteroidal antiinflammatory drugs, with less gastrointestinal toxicity? // Annals of Internal Medicine. — 2000. — Vol. 43. — Р. 132-134.
8. OARSI recommendations for the management of hip and knee osteoarthritis, Part II: OARSI evidence-based, expert consensus guidelines // Osteoarthritis and Cartilage. — 2008. — Vol. 16. — Р.137-162.
9. Povoroznyuk V.V., Bystrytska M.A., Orlyk T.V. Effectiveness of the meloxicam for treatment of pain syndrome under knee osteoarthritis, low back pain and neck pain in elderly people // Abstract Book (APLAR, Japan, September 23-27, 2008). — 2008. — P. 89.
10. Turajane T, Wongbunnak R. et al. Gastrointestinal and cardiovascular risk of non-selective NSAIDs and COX-2 inhibitors in elderly patients with knee osteoarthritis // Journal of The Medical Association of Thailand. — 2009 — Vol. 92 (Suppl. 6). — Р. 19-26.
Получено 21.12.11 ■
Поворознюк В.В., Бистрицька М.А. ДУ«1нститут геронтологи ‘¡мен! Д.Ф. Чеботарьова НАМН Украни», вiддiл клМчно/ ф’зюлоги й патологи опорно-рухового апарату, м. Ки/в
Селективний шпбггор ЦОГ-2 (мелоксикам) у терапп остеоартрозу колшних суглобiв
Резюме. У багатьох дослiдженнях доведена ефектив-нiсть селективних iнгiбiторiв ЦОГ-2 у лiкуваннi остеоартрозу колшних суглобiв. Авторами статтi проведене до-слiдження ефективностi й безпеки препарату Ревмоксикам® порiвняно з диклофенаком натрiю в комплексному лщувант хворих старших вiкових груп. Установлено ви-соку ефективнiсть обох препаралв. Однак у перiодi по-дальшого спостереження встановлена бiльш висока ефек-тивнiсть Ревмоксикаму®. Таким чином, вггчизняний препарат Ревмоксикам® може бути препаратом вибору при лiкуваннi пацieнтiв старших вшових груп.
Povoroznyuk V.V., Bystritskaya M.A. SI «Institute of Gerontology named after D.F. Chebotaryov of NAMS of Ukraine», Department of Clinical Physiology and Pathology of Locomotor Apparatus, Kyiv, Ukraine
COX-2 Selective Inhibitor (Meloxicam) for Knee Osteoarthritis Therapy
Summary. The efficacy of COX-2 selective inhibitors for knee osteoarthritis therapy was proved in a number of studies. The authors compared the efficacy and safety of Reumoxicam® and diclofenac sodium for a complex treatment of patients of older age groups. The both medications have the similar high effectiveness. However Reumoxicam® demonstrated higher effectiveness during follow-up period. Thus Ukrainion drug Reumoxicam® could be a preparation of choice for the treatment of patients of older age groups.
МЕЛОКСИКАМ (МОВАЛИС) — СЕЛЕКТИВНЫЙ ИНГИБИТОР ЦОГ-2 В КЛИНИЧЕСКОЙ ПРАКТИКЕ | Nassonova
1. <div><p>Коган К.М., Золотарева Г.Д., Шмидт Е.И. Опыт применения мовалиса у больных остеоартрозом в клиниках Москвы. Тер. Архив, 1999, 11, 52-54.</p><p>Насонов Е.Л., Цветкова Е.С., Балабанова P.M. с соавт. Новые аспекты противовоспалительной терапии ревматических болезней: теоретические предпосылки и клиническое применение мелоксикама. Клин. Медицина, 1996, 4, 4-8.</p><p>Насонова В.А. Новые данные о клинической эффективности и переносимости мелоксикама (мовалиса). Тер. Архив, 1999, 11, 4548.</p><p>Цветкова Е.С. Мовалис при остеоартрозе. Тер. Архив, 1999, 11, 48-50.</p><p>Шостак Н.А. Опыт применения мовалиса при синдроме болей в нижней части спины (LBP). Тер. Архив, 1999, 11, 50-52.</p><p>Boulton -Jones J.M., Geddes C.G., Heinzel G. et al. Meloxicam pharmacokinetics in renal impairment Br. J. Clin. Pharmacol, 1997, 43, 35-40.</p><p>Busch U., Heinzel G., Narjes H. et al. Pharmacokinetics of Meloxicam in patients with hepatic cirrhosis in comparison with healthy volunteers. Clin. Drug Invest, 1996, 11, 97107.</p><p>Chesne C., Guyomard C., Guillozo S. et al. Metabolism of Meloxicam by Human liver involves Cytochromes 2C9 and 3A4. Exp. Toxical. Phatol, 1996, 48,.406-410.</p><p>Degner F., Turk D., Pairet M. Meloxicam. Pharmacological, Pharmacokinetic and Clinical Profil. Drugs of Today, 1998, 34, Suppl A, 1-22.</p><p>Dequeker J., Hawkey C., Kahan A. et al. Improvement in gastrointestinal tolerability of the selective cycloxyganase (COX-2) inhibition Meloxicam, compared with piroxicam: result of the safety and efficacy Large-Scale evaluation of COX — inhibiting therapies (SELECT) trial in osteoarthritis. Brit. J. Rheumatol., 1998, 37, 9, 946-995.</p><p>Distel М., Mueller C., Bluhmki E., Fries J. Safely of meloxicam: a global analysis of clinical trial Br. J. Rheumatol., 1996, 35, Suppl 1, 68-71.</p><p>Hawkey C., Kahan A, Steinbruk K. et al. Gastrointestinal tolerability of Meloxicam compared to diclofenac in osteoarthritis patients. Brit. J. Rheumatol., 1998,37,9, 937-945.</p><p>Lapicque F., Gillet P., Vignon et, al. Diffuss- ion of Meloxicam into Synovial fluid after a single oral dose. Rheumatol. Eur., 1996, 25, Suppl. 1, 444-446.</p><p>Mohr W., Lehmann H., Engelhardt G., Chon- droneutrality of meloxicam in rats with spontaneous osteoarthritis of the ankle joints J. Rheumatol., 1997, 56, 21-30.</p><p>Rainsford, К D Skerry T.M., Chindemi P., Delaney K. Effects of the NSAIDs Meloxicam and Indomethacin on cartilage Proteoglycan Synthesis and Joint Responses to calcium Pyrophosphate Crystals in Dogs. Veterinary Reserch. Commun., 1999, 23, 101-113.</p><p>Shoenfeld Ph. Gastrointestinal Safety Profile of Meloxicam: A Meta- analysis and Systemic Review of Randomized Controlled Trials. Amer. J.Med., 1999, 107, 19, 48-54.</p><p>Zeidler H. Meloxicam in einer doppelblinden klinischen prufung bei spondyloitois anky- losant sowil in rahmen einer afifenen epidemi- ologischen beobachtungsstudie COX-2 Hem- mung: Von der Wissenschaft zur Klinik Satel- liten. Symposium Baden-Baden, 1998, 24-26.</p></div><br />
Нестероидные противовоспалительные препараты в симптоматической терапии ревматических заболеваний :: ТРУДНЫЙ ПАЦИЕНТ
Е.Ю.Погожева
ФГБУ НИИР РАМН, Москва
Рассмотрена общая клиническая характеристика нестероидных противовоспалительных препаратов (НПВП), их место в терапии ревматических заболеваний, обсуждена эффективность и переносимость нимесулида. Отмечен обширный отечественный опыт применения нимесулида при различных ревматических заболеваниях.
Ключевые слова: нестероидные противовоспалительные средства (НПВП), ревматические заболевания, нимесулид.
NSAIDs in symptomatic therapy of rheumatic diseases
E.Yu.Pogozheva
Rheumatic Science Research Institute, RAMS
The article reviews clinical features of NSAIDs, usage in rheumatology, discusses effectiveness and tolerability of nimesulide. Wide domestic experience of nimesulide prescribtion in rheumatic diseases has been emphasized.
Keywords: NSAIDs, rheumatic diseases, nimesulide.
Сведения об авторе:
Погожева Елена Юрьевна – к.м.н., н.с. ФГБУ НИИР РАМН, Москва.
Нестероидные противовоспалительные препараты (НПВП) являются средствами, активно используемыми как в амбулаторной, так и в стационарной практике, в мире их принимают миллионы пациентов. Большая популярность НПВП объясняется тем, что они обладают противовоспалительным, анальгезирующим и антипиретическим эффектами воздействуя на симптомы, отмечающиеся при очень широком круге заболеваний.
За последние годы перечень НПВП значительно расширился, и сегодня в этой группе насчитывается большое число препаратов, различающихся особенностями действия и применения. В класс НПВП входят около 20 оригинальных лекарственных средств, которые по химической структуре подразделяются на несколько групп: производные салициловой, индоловой, гетероарилуксусной, пропионовой и эноликовой кислот и др. Препараты всех этих групп имеют общие химические и фармакологические свойства. Условно их можно разделить на «короткоживущие» с периодом полувыведения до 6 ч (ацетилсалициловая кислота, диклофенак, ибупрофен, индометацин, кетопрофен, нимесулид, этодолак, целекоксиб и др.) и «длительноживущие» с периодом полувыведения более 6 ч (мелоксикам, напроксен, пироксикам, ацеклофенак, лорноксикам и др).
В практике ревматолога НПВП применяются в качестве симптоматических средств терапии воспалительных и дегенеративных заболеваний суставов, системных заболеваний соединительной ткани.
Эффективность и безопасность НПВП связаны с избирательным подавлением активности циклооксигеназы (ЦОГ) – ключевого фермента, регулирующего превращение арахидоновой кислоты в простагландины (ПГ), простациклин (ПГI2) и тромбоксан (ТхА2) [1].
Идентифицировано три основные изоформы ЦОГ, которые обозначаются как ЦОГ-1, ЦОГ-2 и ЦОГ-3. Первая (ЦОГ-1) постоянно присутствует в большинстве тканей (хотя и в различном количестве), относится к категории «структурных» ферментов, регулирующих физиологические эффекты ПГ. Через ЦОГ-1 опосредуется синтез тромбоксана А2 тромбоцитами, индуктора адгезии и агрегации тромбоцитов. Напротив, ЦОГ-2 в норме в большинстве тканей не обнаруживается, но ее уровень существенно увеличивается на фоне развития воспаления [1]. Подобно другим ферментам ЦОГ, ЦОГ-3 тоже участвует в синтезе простагландинов и играет роль в развитии боли и лихорадки. Однако в отличие от ЦОГ-1 и ЦОГ-2, ЦОГ-3 не принимает участия в развитии воспаления. Активность ЦОГ-3 ингибируется парацетамолом, который оказывает слабое влияние на ЦОГ-1 и ЦОГ-2. Однако стоит заметить, что ЦОГ-3 обнаружен в тканях экспериментальных животных, и существование данной изоформы ЦОГ в организме человека требует доказательства, как и требует дальнейшего изучения и доказательства связанный с ингибированием ЦОГ-3 механизм действия парацетамола [2–5].
Подавление ЦОГ-2 является одним из наиболее важных механизмов противовоспалительного действия НПВП, а ингибиция ЦОГ-1 связана с развитием побочных эффектов. Поэтому эффективность и токсичность «стандартных» неселективных НПВП связывают с их способностью в одинаковой степени подавлять активность обеих изоформ ЦОГ. Это послужило толчком к созданию новой группы НПВП, избирательно подавляющих ЦОГ-2 (селективные НПВП).
Наиболее распространенные побочные эффекты НПВП напрямую связаны с основным механизмом действия НПВП, а именно с подавлением ЦОГ-1-зависимого синтеза простагландинов, т.е являются класс-специфическими (таблица). К этим побочным эффектам относятся поражение ЖКТ, нарушение агрегации тромбоцитов, функции почек, негативное влияние на систему кровообращения. Другие побочные эффекты встречаются значительно реже и, вероятно, не связаны с ингибицией синтеза простагландинов.
Первым селективным НПВП был нимесулид, появившийся на фармацевтическом рынке Италии в 1985 г. В нашей стране нимесулид был зарегистрирован в 1995 г. и в настоящее время является наиболее популярным селективным НПВП. Так, В.Г.Барсковой [6] были проанализированы данные о продажах нестероидных противовоспалительных препаратов в Российской Федерации, полученные «Фармэкспертом». Ибупрофен, кеторолак, диклофенак и нимесулид являлись лидерами продаж в 2011 г. В Российской Федерации зарегистрировано 17 нимесулидов. На первом месте среди нимесулидов находится Найз®. Обращает на себя внимание, что количество проданных упаковок остальных нимесулидов в совокупности не превышает продажи препарата Найз® и отрыв между ним и следующим препаратом составляет практически 15 млн упаковок. При анализе продаж конкретных НПВП, Найз® становится лидером, превосходя ибупрофен и кеторолак.
Так как в России не зарегистрирован оригинальный нимесулид, весьма важным является вопрос биоэквивалентности нимесулидов. В исследовании Ф.М.Кудаевой было показано, что одинаково зарекомендовали себя гранулированный нимесулид и один из таблетированных (Найз®) [7]. К сожалению, два других таблетированных нимесулида проигрывали вышеуказанным.
Важной особенностью нимесулида является быстрота развития клинического эффекта. Через
30 мин после перорального приема в плазме определяется более 50% максимальной концентрации препарата. 99% препарата связывается с альбумином, в синовиальной жидкости накапливается треть его концентрации в плазме, а период полувыведения составляет менее 5 ч. Всего 1–3% абсорбированного препарата экскретируется в неизменном виде [8].
Основным фармакологическим действием нимесулида является его способность блокировать действие ЦОГ-2, подавлять активность ЦОГ-1 в очагах воспалении и при этом оказывать слабое влияние на ЦОГ-1 слизистой желудка.
Большой интерес представляют недавно полученные данные о способности нимесулида влиять на иммунные реакции, снижая активность провоспалительных цитокинов (интерлейкина 6 и фактора некроза опухоли a), а также металлопротеиназ фермента фосфодиэстеразы IV, стимулирующего активность нейтрофилов и макрофагов [9].
Еще одной важной особенностью нимесулида является его антигистаминный эффект (препарат способен снижать сокращение изолированной бронхиальной мускулатуры человека в ответ на воздействие гистамина, а в опытах на свиньях он уменьшал бронхоконстрикцию, вызванную ацетальдегидом) и не провоцировал развитие симптомов «аспириновой астмы» [10].
Эффективность нимесулида в терапии острой и хронической боли у пациентов с ревматическими заболеваниями была показана как в зарубежных, так и в российских исследованиях.
Среди зарубежных работ, основанных на относительно большом клиническом материале, следует отметить исследование E.Huskisson и соавт. [11]. При обследовании 279 больных с остеоартрозом, эффективность нимесулида в дозе 200 мг/сут была сравнима с таковой у диклофенака в дозе 150 мг/сут. При этом осложнения со стороны желудочно-кишечного тракта при назначении нимесулида встречались достоверно реже – 36 и 47% соответственно.
Большой интерес представляют данные, полученные при длительном (в течение 1 года) применении нимесулида [12]. При сравнении нимесулида с напроксеном (750 мг/сут) у 370 пациентов с остеоартрозом, эффективность обоих препаратов была сопоставимой, хотя нимесулид показал несколько лучший эффект в отношении динамики суммарного индекса WOMAC (22,5 и 19,9% соответственно). В сравнении с напроксеном, частота осложнений на фоне приема нимесулида была ниже – 54,5 и 47,5% соответственно. Обращает на себя внимание что в данных работах при использовании нимесулида не было отмечено серьезных кардиоваскулярных осложнений.
В 2011 г. А.Е.Каратеевым был опубликован обзор российских клинических исследований, посвященных данному вопросу [13]. Автором был проведен анализ 21 российского исследования, общее число больных, получавших нимесулид в дозе от 200 до
400 мг/сут, составило 1590 человек; 14 исследований (526 больных) включали группы активного контроля: в 9 исследованиях это был диклофенак в дозе от 100 до 200 мг/сут, в 3 исследованиях – другие НПВП (лорноксикам, кетопрофен, кеторолак, мелоксикам и целекоксиб), в 1 – парацетамол в дозе 3 г/сут, в 1 – трамадол в дозе 200–450 мг/сут, в 1 – гомеопатический препарат. Длительность лечения колебалась от 1 сут (в стоматологической практике) до 12 мес (при ОА), хотя подавляющее большинство исследований продолжалось не более 4 нед. Все работы носили открытый характер. Эффективность нимесулида, по данным различных авторов, существенно различалась: число больных, у которых отмечалось значимое улучшение, составляло от 40 до 90%. В целом оценка обезболивающего и противовоспалительного действия нимесулида была достаточно высока. Почти во всех исследованиях, где он являлся основным изучаемым препаратом, нимесулид оказался столь же или более эффективным, чем препарат сравнения (диклофенак). Нимесулид был достоверно эффективнее, чем парацетамол в дозе 3 г/сут (исследование ДИНАМО), и оказывал столь же выраженное анальгетическое, но при этом гораздо более сильное противовоспалительное действие, чем трамадол 200–450 мг/сут (работа Л.Л.Силина). В 3 работах (Л.Б.Лазебника, В.В.Ковальчук и Н.А.Шостак), где нимесулид выступал в роли препарата сравнения, он не уступил по своему лечебному действию другим НПВП и гомеопатическому средству (артрофоон).
В ФГБУ НИИР РАМН проводилось открытое рандомизированное исследование [14], в котором сравнивали скорость наступления противовоспалительного и анальгетического эффекта препарата Найз® (1-я группа, n=30), другого таблетированного нимесулида (2-я группа, n=30) и диклофенака натрия (3-я группа, n=30) при подагрическом артрите. Наиболее эффективным (скорость и выраженность анальгетического эффекта) оказался Найз®: у 5 больных уже через 20 мин после его приема, а у 10 – через 40 мин уменьшилась боль в суставах, через 1 ч 25 пациентов оценили эффект препарата как хороший, при этом у 5 из них боль уменьшилась значительно. Во 2-й группе лишь 1 пациент почувствовал небольшое облегчение боли через 20 мин, 5 – через 40 мин и 4 – через 1 ч после приема первой дозы препарата. В 3-й группе 4 больных указывали на какое-либо уменьшение боли через 1 ч после приема препарата. Таким образом, в результате 7 дней лечения приступ подагрического артрита был купирован в 1-й группе у 22 (73%) больных, во 2-й группе – у 13 (43%) и в 3-й группе – у 4 (13%). Наиболее быстрое снижение показателей, отражающих воспалительный процесс, – суставного индекса (СИ) и индекса припухлости (ИП) – также отмечалось в группе больных, принимавших Найз®.
В отношении безопасности нимесулида ситуация представляется не столь однозначной [13]. Как видно, общее число осложнений на фоне приема этого препарата меньше, чем в контрольных группах. Нимесулид намного реже вызывал появление эндоскопических язв, множественных эрозий и развитие или дестабилизацию АГ. В то же время частота диспепсических явлений фактически не различалась. Серьезных осложнений со стороны печени (желтуха, острая печеночная недостаточность) не возникало; существенное повышение уровня трансаминаз на фоне нимесулида отмечалось реже, чем в контроле. Хотя у 2 больных в работе Л.Б.Лазебника и др. повышение трансаминаз на фоне приема нимесулида сопровождалось болями в правом подреберье и гепатомегалией, авторы не сообщают о развитии тяжелой гепатопатии (жизнеугрожающее состояние), которая потребовала бы проведения активной терапии. В то же время на фоне приема нимесулида возникали осложнения, которые не были отмечены в контрольных группах: отеки (3 случая), кожные реакции (3 случая), кишечное кровотечение небольшой интенсивности (1 случай), снижение зрения (1 случай). Кроме того, в 12-месячном исследовании ДИНАМО при использовании нимесулида у 4 больных отмечалось появление признаков ИБС. Правда, эти пациентки исходно имели серьезный кардиоваскулярный риск. Кроме того, отсутствие сходных по длительности исследований безопасности других НПВП затрудняет оценку значимости данного осложнения.
Более позднее исследование, проведенное Р.М.Балабановой и др. [15] было основано на ретроспективном анализе 179 историй болезни пациентов с РА, проходивших лечение в ФГБУ НИИР РАМН и получавших в качестве симптоматической терапии Найз®, мовалис или диклофенак. Большинство больных (149) составили женщины в возрасте 55 лет. Длительность болезни достигала в среднем 5 лет. По данным анамнеза, 4 пациентки перенесли гепатит А, еще 4 – гепатит В и 3 – гепатит С. Ни у одной из них не был повышен уровень АСТ и АЛТ. Всего в группе повышенный уровень АЛТ выявлен в 11 случаях, АСТ – в 4, но это повышение превышало норму не более чем в 2 раза. Усиление эхогенности структуры печени отмечено у 71,6% обследованных. Треть больных (64) получала Найз® в дозе 200 мг/сут; 26 – мовалис по 15 мг/сут и 39 – диклофенак (в основном генерические формы). Из 64 пациентов, получавших Найз® в качестве симптоматического средства, повышение АСТ зафиксировано у 2, АЛТ – у 5. При этом авторы считают, что это повышение могло быть связано как с приемом препарата Найз®, так и с приемом базисных противовоспалительных препаратов. 3 пациента принимали метотрексат – МТ, 1- араву и 1 сульфасалазин. Монотерапию препаратом Найз® получали только 9 больных; Найз® в сочетании с метотрексатом (МТ) – 35, с аравой – 11, с плаквенилом, сульфасалазином – единичные пациенты. Среди больных, получавших мовалис в дозе 15 мг/сут, 16 принимали этот препарат комбинации с МТ или аравой. Повышение уровня АЛТ выявлено у 1 пациента, леченного комбинацией мовалиса с МТ; еще у 1 больной, получавшей монотерапию мовалисом, зафиксировано повышение уровня АСТ и АЛТ.
В группе больных, леченных мовалисом или диклофенаком, увеличение уровня АЛТ отмечено у 3 (у них НПВП комбинировали с аравой). У 1 пациентки, получавшей в качестве базисного препарата МТ, наблюдалось повышение АСТ и АЛТ. Таким образом, у больных РА, получавших НПВП, практически в равном процентном соотношении отмечено повышение уровня печеночных ферментов (при приеме препарата Найз® – у 7,8%, мовалиса – 7,7%), несколько чаще (10,2%) эти изменения регистрировали при приеме диклофенака. Следует подчеркнуть, что повышение уровня печеночных ферментов было незначительным и не потребовало изменения схемы лечения. Не выявлено зависимости между этими нарушениями и сонографическими изменениями (усилением эхогенности структуры печени), а также длительностью приема препаратов. По мнению авторов, проведенный анализ свидетельствует о том, что Найз® как генерик нимесулида не зарекомендовал себя как гепатотоксичный препарат, даже при сочетанном применении с МТ или аравой. Однако следует помнить, что при выборе препаратов из группы нимесулидов в качестве симптоматического анальгетического средства нужен тщательный мониторинг за функциональным состоянием печени, особенно при длительном лечении (более 15 дней). Если же в анамнезе у пациента имеются отягощающие факторы, особенно злоупотребление алкоголем, от приема нимесулидов следует воздержаться.
Таким образом, в отечественных и зарубежных исследованиях, нимесулид продемонстрировал свою эффективность в качестве симптоматической терапии многих ревматических заболеваний, и при этом был несколько безопаснее по сравнению с традиционными НПВП в отношении развития осложнений со стороны желудочно-кишечного тракта. По влиянию на печень и сердечно-сосудистую систему, значительных различий в риске развития осложнений между нимесулидом и неселективными НПВП продемонстрировано не было.
Литература
1. Насонов Е.Л. Нестероидные противовоспалительные препараты (Перспективы применения в медицине). М.: Анко, 2000; 5–20.
2. Chandrasekharan N.V., Hu Dai, Lamar Turepu Roos K., Nathan K. Evanson, Joshua Tomsik, Terry S. Elton, Daniel L. Simmons. COX-3, a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: Cloning, structure, and expression PNAS published September 19, 2002, 10.1073/pnas.162468699.
3. Chen C., Bazan N.G. Acetaminophen modifies hippocampal synaptic plasticity via a presynaptic 5-HT2 receptor. Neuroreport. 2003; 14: 5: 743–747.
4. Kolaczkowska E. Cyclooxygenases I. Role in Inflammation. Cell Biology. 2002; 29: 533–554.
5. Kolaczkowska E. Cyclooxygenases II. Nonsteroidal Anti-inflammatory Drugs as Their Inhibitor. Cell Biology, 2002; 29: 555–578.
6. Барскова В.Г. Что нам дает изучение статистики продаж нестероидных противовоспалительных препаратов в Российской Федерации? Совр. Ревматол. 2011; 3: 68–74.
7. Кудаева Ф.М., Елисеев М.С., Барскова В.Г. и др. Сравнение скорости наступления анальгетического и противовоспалительного эффектов различных форм нимесулида и диклофенака натрия при подагрическом артрите. Тер арх. 2007; 5: 35–40.
8. Bernareggi A. Clinical pharmacokinetics of nimesulide. Clin Pharmacokinet. 1998; 35 (4): 247–74.
9. Rainsford K. Current status of the therapertic uses and actions of the preferential cyclo-oxygenase-2 NSAID, nimesulide. Inflammopharmacology. 2006; 14: 120–37.
10. Rossoni G., Berti F., Buschi A. et al. New data concerning the antianaphylactic and antihistaminic activity of nimesulide. Drugs. 1993; 46 (Suppl. 1): 22–8.
11. Huskisson E., Macciocchi A., Rahlfs V. et al. Nimesulide versus diclofenac in the treatment of osteoarthritis of the hip or knee: an active controlled equivalence study. Curr Ther Res. 1999; 60: 253–265.
12. Kriegel W., Korff K., Ehrlich J. et al. Double-blind study comparing the long-term efficacy of the COX-2 inhibitor nimesulide and naproxen in patients with osteoarthritis. Int J Clin Pract. 2001; 55 (8): 510–514.
13. Каратеев А.Е. Российский опыт применения нимесулида: обзор клинических испытаний. Consilium Medicum. 2011; 13 (9).
14. Кудаева Ф.М., Барскова В.Г., Насонова В.А. Сравнение скорости наступления противовоспалительного и анальгетического эффектов таблетированных нимесулидов и диклофенака натрия при подагрическом артрите (рандомизированное исследование). Науч-практич ревматол. 2008; 1: 55–9.
15. Балабанова Р.М., Корешков Г.Г., Егорова О.Н., Запрягаева М.Е. Еще раз о безопасности нимесулида. Совр ревматол. 2011; 4: 58–61.
16. Насонов Е. Л. Ревматология: Клинические рекомендации. М.: ГЭОТАР, 2005; 264.
Влияние селективных ингибиторов на активность циклической нуклеотидной фосфодиэстеразы и секрецию инсулина в клональной линии клеток, секретирующих инсулин BRIN-BD11
Реферат
-
Циклические нуклеотидфосфодиэстеразы (PDE), присутствующие в линии клеток, секретирующих инсулин BD11, , были охарактеризованы с использованием кальция / кальмодулина, IGF-1, изофермент-селективных ингибиторов PDE и RT-PCR.
-
Кальмодулин активировал циклический AMP или циклический GMP PDE активность в осадке и был в 3 раза ( P = 0.002) более эффективно активирует гидролиз циклических нуклеотидов в осадке по сравнению с фракциями надосадочной жидкости.
-
Ингибитор PDE1 / PDE5 запринаст подавлял активность как циклического AMP, так и циклического GMP PDE как во фракциях осадка, так и в супернатанте гомогенатов клеток максимум примерно на 25% (IC 50 1–5 мкМ), в то время как ролипрам (PDE4 селективный) ингибировал только циклический гидролиз АМФ.
-
Селективные ингибиторы PDE3 Org 9935 (0,02–10 мкМ) и сигуазодан (0.1–10 мкМ) ингибировал активность циклического АМФ ФДЭ в осадке, но не в надосадочных фракциях клеточных гомогенатов, с максимальным ингибированием около 30%. IGF-1 (2–7,5 нг / мл –1 ) сильно увеличивал эту активность PDE.
-
ОТ-ПЦР с использованием специфических праймеров для PDE3B, но не для PDE3A, амплифицированная из общей РНК клеток BRIN – BD11, продукта из 351 пары оснований, который был> 97% гомологичен PDE3B жировой ткани крысы.
-
IBMX, Org 9935, сигуазодан и ролипрам (1–50 мкМ), но не запринаст, каждый увеличивал индуцированную глюкозой секрецию инсулина в присутствии 16.7 мМ, но не 1 мМ глюкозы.
-
Эти данные, полученные на клональной линии секретирующих инсулин клеток, согласуются с важной ролью PDE3B в регуляции пула циклического АМФ, относящегося к модуляции индуцированной глюкозой секреции инсулина.
Ключевые слова: фосфодиэстераза, секреция инсулина, селективные ингибиторы фосфодиэстеразы, клональные клетки, секретирующие инсулин
Введение
Циклический 3 ‘, 5’-аденозинмонофосфат (циклический АМФ) является важным физиологическим усилителем секреции глюкозы, индуцируемой инсулином. (Prentki & Matschinsky, 1987) и опосредует действие инкретиновых факторов, таких как глюкагоноподобный пептид-1 (GLP-1), на высвобождение инсулина.Разрушение циклического АМФ осуществляется за счет гидролиза, катализируемого несколькими различными семействами фосфодиэстераз (ФДЭ), которые различаются своей кинетикой, субстратной специфичностью и чувствительностью к ингибиторам (Beavo, 1995).
Пока что относительно мало известно о PDE, ответственных за циклический гидролиз AMP в β-клетках островков поджелудочной железы. Однако мы (Furman & Pyne, 1990; Shaffiee-Nick et al ., 1995) предположили, что PDE3 является функционально важным ферментом в отношении гидролиза пула циклического AMP, имеющего отношение к секреции инсулина в островках крысы и человека.PDE1, PDE4 и циклический 3 ‘, 5’-специфичный для гуанозинмонофосфата (cyclic GMP) PDE5 все экспрессируются в островке поджелудочной железы, о чем свидетельствует способность селективных ингибиторов ферментов снижать активность PDE (Shaffiee-Nick et al. ., 1995; Эль-Метвалли и др. ., 1997). Более того, др. (Capito et al. ., 1986; Valverde & Malaisse, 1994) показали присутствие стимулируемой кальций-кальмодулином активности PDE, что дополнительно указывает на присутствие PDE1. Однако индуцированная глюкозой секреция инсулина изолированными островками крысы или человека увеличивалась только селективными ингибиторами PDE3, но не ингибиторами PDE4 (ролипрам, ICI63197) или PDE1 / 5 (запринаст) (Furman & Pyne, 1990; Shaffiee-Nick ). и др. ., 1995). В настоящее время известно, что PDE3 существует в виде двух изоформ (Manganiello et al ., 1995), теперь называемых PDE3A и PDE3B. Недавно было показано, что PDE3B присутствует в островковых β-клетках и что его активация опосредует индуцированное IGF-1 ингибирование секреции инсулина (Zhao et al ., 1997).
Предыдущие биохимические и фармакологические исследования PDE в секретирующих инсулин клетках использовали интактные островки, которые включают гетерогенную популяцию эндокринных клеток, только 60–70% из которых являются β-клетками вместе с тканью сосудов и захваченными клетками крови.Таким образом, одна из гипотез неспособности некоторых селективных ингибиторов PDE увеличивать высвобождение инсулина заключается в том, что PDE1 и PDE4 экспрессируются в популяции островков, не относящихся к β-клеткам. Поэтому цель настоящего исследования состояла в том, чтобы охарактеризовать PDE в чистой популяции β-клеток. Ввиду трудности разделения чистых нативных β-клеток, в настоящем исследовании использовалась недавно охарактеризованная линия клональных инсулин-секретирующих клеток, чувствительных к глюкозе, BRIN-BD11 (McClenaghan et al ., 1996; McClenaghan & Flatt, 1999). впервые определить экспрессию и свойства изоформ PDE в линии β-клеток в качестве модели для нативных β-клеток.Была исследована чувствительность PDE к селективным по типу ингибиторам, а также способность этих препаратов модулировать индуцированную глюкозой секрецию инсулина. Некоторые из этих данных были представлены в абстрактной форме (Ahmad et al ., 1998; Flatt et al ., 1998).
Методы
Культура клеток
Клетки BRIN – BD11 культивировали в среде для культивирования тканей RPMI – 1640, содержащей 10% фетальной телячьей сыворотки, антибиотики (пенициллин 5000 МЕ мл -1 ; стрептомицин 5 мг мл -1 ) и 11.1 ммоль / л -1 глюкозы в вентилируемых колбах для культивирования тканей при 37 ° C в атмосфере 5% CO 2 и 95% воздуха с использованием инкубатора LEEC (Laboratory Technical Engineering, Ноттингем, Великобритания). Производство и характеристика этой клеточной линии описаны в другом месте (McClenaghan et al ., 1996). Клетки использовали в пассажах 18-32.
Анализ PDE
Клетки соскребали со дна колбы, суспендировали в культуральной среде и центрифугировали (600 × г, ) в течение 5 мин.Супернатант удаляли, а осадок, содержащий клетки, промывали 5 мл изотонического буфера, pH 7,4, содержащего 10 мМ трис-HCl, 0,25 мМ сахарозы, 0,1 мМ фенилметилсульфонилфторида (PMSF) и 2 мМ бензамидина. Суспензию снова центрифугировали и клетки гомогенизировали, пропуская через иглу калибра 0,24 мм три раза. После центрифугирования при 36400 × g в течение 20 минут при 4 ° C фракции осадка и супернатанта анализировали на PDE с использованием двухэтапного радиометрического анализа (Thomson & Appleman, 1971) и либо 3 H-cyclic AMP, либо 3 H-циклический GMP в качестве субстратов (0.5 мкМ).
Экстракция общей РНК
600 мкл лизирующего буфера Rneasy добавляли к культивированным клеткам BRIN – BD11, и лизат пропускали через измельчитель QIA. Тотальную РНК экстрагировали согласно протоколу Rneasy. Это включает инкубацию экстрагированной РНК с 4 единицами ДНКазы при 37 ° C в течение 15 минут для удаления загрязняющей геномной ДНК, перенесенной во время очистки РНК.
Реакция обратной транскриптазы (RT)
Синтез первой цепи проводили с использованием 5 мкг экстрагированной общей РНК и обратной транскриптазы Superscript II.Реакционную смесь праймировали с использованием 500 нг олиго (dT) 18. Эту смесь нагревали до 70 ° C в течение 10 мин и быстро охлаждали на льду. Общий объем анализа реакции обратной транскриптазы составлял 20 мкл и включал (конечные концентрации) (мМ) Трис / HCl 50, pH 8,3, KCl 75, MgCl 2 3, DTT 0,03 и смесь dNTP 0,5 (0,5 мМ dATP, dGTP , dCTP и dTTP) и 200 единиц обратной транскриптазы Superscript II. Смесь инкубировали при 42 ° C в течение 90 минут и прекращали нагреванием при 7 ° C в течение 15 минут.
ПЦР (полимеразная цепная реакция)
2 мкл кДНК BRIN – BD11 использовали в качестве матрицы для ПЦР.Смысловой праймер (последовательность GGAGATGAAGAAGCAACCCTGGGTC) использовали в сочетании с антисмысловым праймером (последовательность TTCAGTGAGGTGGTGCATTAGTTGGC) для амплификации PDE3B. Для PDE3A последовательности смыслового и антисмыслового праймеров были соответственно CTGGCCAACCTTCAGGAATC и CCCTCTTGGTTTCCCTTTCTC. 100 мкл реакционной смеси для ПЦР содержали (мМ) Tris HCl 10, pH 8,8, MgCl 2 1,5, KCL 50, 0,1% (v v -1 ) Triton X-100, 0,2 мМ dNTP и 2,5 единицы Dynazyme II. ДНК-полимераза, 1 мМ. Реакцию ПЦР проводили в термоциклере Perkin Elmer 480 по следующему протоколу: 95 ° C в течение 5 минут и 35 циклов при 95 ° C в течение 1 минуты 30 секунд, 55 ° C в течение 30 секунд и 68 ° C в течение 1 минуты. 40 сек.Затем следовало окончательное продление на 5 минут при 68 ° C. 15 мкл продукта подвергали электрофорезу в 2% (масс. Об. -1 ) агарозном геле.
Секреция инсулина
Высвобождение инсулина из клональных β-клеток определяли с использованием монослоев. Клетки собирали с помощью трипсина / ЭДТА (Gibco Life Technologies Ltd, Пейсли, Стратклайд, Великобритания), высевали в 24-луночные планшеты (Nunc, Роскилле, Дания) при плотности 2,5 × 10 5 клеток на лунку. и позволили прикрепить во время ночного культивирования.Острому исследованию высвобождения инсулина предшествовала 40-минутная преинкубация при 37 ° C в 1,0 мл бикарбонатного буфера Кребса (мМ) NaCl 115, KCl 4,7, CaCl 2 1,28, KH 2 PO 4 1,2, MgSO 4 1.2, NaHCO 3 10, 0,1% бычий сывороточный альбумин, pH 7,4) с добавлением 1,1 мМ глюкозы. Тестовые инкубации проводили при 37 ° C с использованием того же буфера, дополненного различными концентрациями глюкозы и тестируемыми агентами, как указано в. После 20 мин инкубации буфер удаляли из каждой лунки и аликвоты хранили при -20 ° C для последующего измерения инсулина радиоиммуноанализом (Flatt & Bailey, 1981).
Таблица 1
Влияние ингибиторов глюкозы и фосфодиэстеразы на секрецию инсулина (ng106 клеток − 1 20 мин − 1) из клеток BRIN – BD11
Лекарства и химические вещества
Org 9935 (Organon Laboratories, Ньюхаус, Ланаркшир, Великобритания), сигуазодан (SK&F 94836) (SmithKline Beecham, Harlow, Essex, UK), zaprinast (M&B 22948) (Rhone Poulenc Rorer, Dagenham, Essex, UK), ролипрам (ZK 62711) (SmithKline Beecham King of Prussia, USA) и 3 -изобутил-1-метилксантин, IBMX (Sigma Chemical Co., Poole, U.K.) готовили в виде исходных растворов в диметилсульфоксиде (ДМСО, Sigma Chemical Co.) и разбавляли в буфере. Соответствующее количество ДМСО использовали в качестве контроля. Среда для культивирования ткани RPMI 1640, фетальная телячья сыворотка, пенициллин и стрептомицин были приобретены у Gibco Life Technologies Ltd. 125 I для йодирования инсулина, 3 H-циклический AMP и 3 H-циклический GMP были получены от Amersham International. . Инсулин крыс был получен от Novo Industria, Копенгаген, Дания.Набор для выделения тотальной РНК Rneasy, измельчитель QIA и наборы спиновой ДНК Qiaquick были приобретены у Qiagen (Кроули, Суссекс, Великобритания). Обратная транскриптаза Superscript II и праймеры были приобретены у Life Technologies. ДНК-полимераза и ДНКаза Dynazyme II, наборы для GFX-ПЦР и гель-очистки, а также dNTP были приобретены у Flowgen (Шенстон, Великобритания), Promega (Саутгемптон, Великобритания) и Amersham Pharmacia Biotech (Великобритания) соответственно.
Статистический анализ
Все данные выражены как среднее ± s.e.mean. Приведенные значения n относятся к количеству различных используемых гомогенатов клеток, причем каждый гомогенат анализируют в трех экземплярах. Данные были проанализированы с использованием теста Стьюдента t для непарных наблюдений или ANOVA с последующим тестом Даннета, где это необходимо. Статистическая значимость была принята, если P <0,05.
Результаты
Влияние изобутилметилксантина (IBMX) на гидролиз циклического АМФ
IBMX вызывал зависимое от концентрации ингибирование активности циклической фосфодиэстеразы АМФ как в осадке, так и во фракциях супернатанта гомогенатов клеток BRIN – BD11 с максимальным ингибированием около 90% и IC 50 примерно 30 мкМ при 0.5 мкМ циклический АМФ ().
Влияние IBMX на активность циклической АМФ-фосфодиэстеразы во фракциях осадка и супернатанта гомогенатов клеток BRIN – BD11. Каждое значение является средним из семи наблюдений. Средние значения s.e. меньше символов и не отображаются.
Влияние кальций-кальмодулина на активность PDE
В присутствии добавленного 100 мкМ Ca 2+ кальмодулин вызывал зависимую от концентрации активацию циклического AMP или циклического GMP PDE как в осадке, так и в надосадочной фракции клеток BRIN – BD11. гомогенаты ().Кальмодулин был значительно ( P = 0,002 в каждом случае) более активным в активации гидролиза циклического AMP () или циклического GMP () в осадке (соответствующие значения EC 50 ( n = 5) 1,8 ± 0,2 мкМ и 1,5 ± 0,4 мкМ) по сравнению с фракциями супернатанта (соответствующие значения EC 50 ( n = 5) 4,8 ± 0,4 мкМ и 4,7 ± 0,6 мкМ).
Влияние кальмодулина на активность циклической AMP-фосфодиэстеразы (a) и активность циклической GMP-фосфодиэстеразы (b) в присутствии 100 мкМ Ca 2+ , добавленного в осадок и фракции супернатанта гомогенатов клеток BRIN – BD11.Каждое значение представляет собой среднее значение ± стандартное отклонение пяти отдельных экспериментов.
Влияние циклического GMP на активность циклического AMP PDE
Добавление циклического GMP сильно ингибировало активность циклического AMP PDE как в осадке, так и во фракциях супернатанта с приблизительной IC 50 0,7 мкМ и максимальным ингибированием примерно 30-40% при около 2 мкМ (). Концентрации циклического GMP выше 10 мкМ вызывали заметно повышенное ингибирование, которое не достигало максимума до 100 мкМ, эта концентрация обеспечивала примерно 75% ингибирования активности циклического AMP PDE (данные не показаны).
Влияние циклического GMP на активность фосфодиэстеразы циклического AMP во фракциях осадка и супернатанта гомогенатов клеток BRIN – BD11. Каждое значение представляет собой среднее значение ± стандартное отклонение пяти отдельных экспериментов.
Влияние IGF-1 на активность PDE
Инкубация клеток BRIN-BD11 в течение 10 минут с IGF-1 вызвала зависимую от концентрации активацию фермента в гомогенате клетки (процентное увеличение по сравнению с базовой активностью 309 ± 8,2 пмоль. мин -1 мг -1 ; IGF-1 2.5 нг мл -1 37,4 ± 3,3; 5 нг мл -1 94,4 ± 6; 10 нг мл −1 176 ± 6).
Влияние селективных по типу ингибиторов ФДЭ на активность ФДЭ
Запринаст ингибитор ФДЭ1 / ФДЭ5 подавлял как циклическую активность ФДЭ АМФ (), так и активность циклической ФДЭ ГМФ () в фракциях осадка и супернатанта гомогенатов клеток максимум примерно на 25% с IC 50 в диапазоне 1–5 мкМ.
Влияние запринаста на активность циклической АМФ-фосфодиэстеразы (а) и активность циклической ГМФ-фосфодиэстеразы (б) во фракциях осадка и супернатанта гомогенатов клеток BRIN – BD11.Каждое значение представляет собой среднее ± стандартное отклонение пяти наблюдений активности циклической АМФ ФДЭ и восьми наблюдений активности циклической ГМФ ФДЭ.
Селективные ингибиторы PDE3 Org 9935 (0,02–10 мкМ) и сигуазодан (0,1–10 мкМ) ингибировали активность циклического AMP PDE в осадке, но не в надосадочных фракциях клеточных гомогенатов. Максимальное ингибирование, производимое Org 9935, составляло примерно 35 ± 2%, а ингибирование, продуцируемое сигуазоданом, было примерно 28 ± 2% с соответствующими значениями IC 50 0,05 и 0,5 мкМ.
Влияние Org 9935 (a) и сигуазодана (b) на активность циклической АМФ-фосфодиэстеразы во фракциях осадка и супернатанта гомогенатов клеток BRIN – BD11. Каждое значение представляет собой среднее значение ± стандартное отклонение 15 отдельных экспериментов для Org 9935 и 10 для сигуазодана.
Селективный ингибитор PDE4 ролипрам сильно ингибировал активность циклического AMP PDE как во фракциях осадка, так и во фракциях супернатанта с максимальным ингибированием около 25% и значениями IC 50 около 0,04 и 0,1 мкМ во фракциях осадка и супернатанта, соответственно ().Ролипрам не смог изменить циклический гидролиз GMP при концентрациях до 100 мкМ.
Влияние ролипрама на активность циклической АМФ-фосфодиэстеразы во фракциях осадка и супернатанта гомогенатов клеток BRIN – BD11. Каждое значение представляет собой среднее значение ± стандартное отклонение пяти отдельных экспериментов.
ПЦР
ОТ-ПЦР клеток BRIN-BD11 со специфическими праймерами для PDE3B амплифицировала продукт из 351 пары оснований из общей РНК BRIN-BD11, который был гомологичен соответствующей области в PDE3B крысы и человека ().Сравнение кДНК и предсказанной аминокислотной последовательности этого продукта с соответствующей областью адипоцитов крысы PDE-3B показало сходство> 97%. Напротив, продукт не был получен при использовании специфических праймеров для PDE3A или при исключении обратной транскриптазы из реакции. Праймеры для PDE3A амплифицировали транскрипт PDE3A из легочной артерии крысы (данные не показаны).
Анализ полимеразной цепной реакции с обратной транскриптазой, показывающий (а) амплификацию продукта размером 351 п.н. при использовании праймеров для PDE3B (b) последовательность продукта и (c) соответствующую аминокислотную последовательность.
Секреция инсулина
Высвобождение инсулина из клеток BRIN – BD11 было увеличено на 16,7 мМ глюкозы. IBMX, Org 9935, сигуазодан и ролипрам (1–50 мкМ), но не запринаст, увеличивали индуцированную глюкозой секрецию инсулина () в присутствии 16,7 мМ глюкозы. Ни один из препаратов не влиял на высвобождение инсулина при 1,1 мМ глюкозы (данные не показаны).
Обсуждение
Эти данные показывают, что линия клеток, чувствительных к глюкозе, секретирующих инсулин, экспрессирует ряд циклических нуклеотидфосфодиэстеразных активностей.Сильная активация как циклического AMP, так и циклического GMP PDE кальмодулином предполагает присутствие PDE1 (Beavo, 1995). Это дополнительно подтверждается эффектом запринаста, который вызывает максимальное ингибирование циклического AMP PDE на 25%. Активация кальмодулином и ингибирование запринастом наблюдалась как во фракциях осадка, так и в надосадочной жидкости, хотя кальмодулин оказался значительно более сильным в активации активности фермента в осадке. Ранее мы обнаружили, что запринаст ингибирует активность ФДЭ как во фракциях осадка, так и в надосадочной жидкости гомогенатов островков крысы, хотя ингибирование в осадке не было постоянным (Shafiee-Nick et al ., 1995). Запринаст более эффективен в ингибировании PDE5 по сравнению с PDE1, но PDE5 не гидролизует циклический AMP, что дополнительно поддерживает участие PDE1. PDE1 обычно описывается в других тканях как активность растворимого фермента, хотя есть некоторые сообщения об активности частиц (Wang et al ., 1990). Несколько более ранних исследований на островках крыс и мышей (Sugden & Ashcroft, 1981; Lipsom & Oldham, 1983; Capito et al ., 1986) показали наличие стимулируемой кальций-кальмодулином активности PDE, но это было обнаружено только в растворимых фракция (Capito et al ., 1986). Существует мало доказательств функционального значения этого фермента в регуляции функции островковых β-клеток. Однако снижение стимулированного форсколином содержания циклического АМФ под действием Ca 2+ в клетках RINm5F (Ullrich & Wolheim, 1988) и его усиление под действием верапамила (Rajan et al ., 1989) совместимо с ролью Ca 2+ в регуляции уровней циклического АМФ в β-клетках через активацию PDE1. С другой стороны, неспособность запринаста увеличивать секрецию инсулина в настоящем исследовании или в более ранних исследованиях островков (Shafiee-Nick et al ., 1995) выступает против функциональной роли PDE1, которая имеет отношение к высвобождению инсулина. Интересно, что совсем недавно опубликованная статья, опубликованная как раз во время представления настоящей рукописи, предполагает, что PDE1C может играть важную роль в модулировании секреции инсулина в другой клеточной линии (инсулинома βTC3; Han et al. ., 1999). PDE1C явно экспрессировался как растворимый фермент, и секреция инсулина была усилена 8-метокси-изобутилметилксантином (8MM-IBMX), относительно селективным ингибитором PDE1C, а также запринастом.8MM-IBMX, хотя и в высоких концентрациях (500 мкМ), также увеличивал индуцированную глюкозой секрецию инсулина в островках, хотя запринаст не изучался.
Сильный ингибирующий эффект циклического GMP на активность PDE клеток BRIN-BD11, наряду с мощным ингибирующим действием селективных ингибиторов PDE3 Org 9935 и сигуазодана, предполагает, что PDE3 экспрессируется в клетках BRIN-BD11. Более того, исследования RT-PCR подтвердили, что это PDE3B, как было обнаружено Zhao et al . (1997) в нативных островковых β-клетках.С помощью ОТ-ПЦР нам удалось подтвердить, что транскрипты PDE-3B экспрессируются в клетках BRIN-BD11. Используемые праймеры были разработаны для амплификации области С-концевой части белка, которая содержит каталитический сайт. Продукт, как и продукт, соответствующий форме адипоцитов крысы, содержал повторяющуюся последовательность кодонов GAT, соответствующую аспартату. В форме адипоцитов крысы имеется 15 повторяющихся аспартатов, в то время как форма BRIN-BD11 имеет 18. Интересно, что PDE-3B из клеток BRIN-BD11 имеет вставку из девяти пар оснований, которая кодирует дополнительные три аспартата.Функциональная роль этого участка аспартатов неизвестна. Однако это может давать полианионную область, которая может препятствовать встраиванию цитоплазматического С-концевого хвоста белка в мембраны. Присутствие трех дополнительных аспаратов в форме BRIN-BD11 д. Придавать более кислую природу этой области, что может быть важно для определения немного иной топографии мембраны фермента. Селективные ингибиторы PDE3 максимально ингибировали активность PDE примерно на 30-40% во фракции осадка, что позволяет предположить, что примерно 30-40% активности PDE в виде частиц клеток BRIN-BD11 составляет PDE3.Это в целом подтверждает наше предыдущее исследование островков (Shafiee-Nick et al ., 1995), препаратов, демонстрирующих схожую эффективность в ингибировании PDE. Однако есть два отличия от островков. Во-первых, около 70% активности островковой PDE ингибируется Org 9935 или сигуазоданом. Во-вторых, хотя явно наблюдается активность PDE3 как во фракциях осадка, так и во фракциях супернатанта гомогенатов островков (Shafiee-Nick et al ., 1995), никакого ингибирования PDE фракции супернатанта не было получено ни одним из селективных ингибиторов PDE3 до 100 мкМ. , что свидетельствует об отсутствии растворимого PDE3.Это также было обнаружено в недавней статье Han et al в клетках инсулиномы βTC3 (1999). Интересно, что предыдущая работа в других тканях показывает, что экспрессия PDE3B преимущественно в виде частиц, тогда как экспрессия PDE3A, по-видимому, является цитозольной (Manganiello et al ., 1995; Liu & Maurice, 1998). Таким образом, растворимый PDE3, который мы продемонстрировали ранее в островках, мог быть PDE3A, локализованным в кровеносных сосудах, или клетками других типов, присутствующими в островках. Возможно, что растворимый PDE3, присутствующий в островках, представляет собой фермент в виде частиц, вытесненный из мембран.Ингибирование циклическим GMP активностей PDE как супернатанта, так и осадка в аналогичных количествах и с в целом схожей эффективностью можно частично объяснить конкурентным ингибированием PDE1.
Как и в островках, любой из ингибиторов PDE3 увеличивал секрецию инсулина в присутствии стимулирующих (16,7 мМ) концентраций глюкозы, но не в присутствии низких концентраций глюкозы. Это согласуется с нашей гипотезой (Shafiee-Nick et al ., 1995), что PDE3 регулирует пул циклического АМФ, ответственного за модуляцию высвобождения инсулина.Это было подтверждено другими исследователями, использующими селективные ингибиторы PDE3 (Parker et al. ., 1995; Han et al. ., 1999). Ингибирование высвобождения инсулина с помощью IGF-1 приписывалось его активации PDE3B в β-клетке (Zhao et al ., 1997). Настоящее исследование подтверждает, что активность PDE клеток BRIN-BD11 заметно усиливается IGF-1, показывая, что активность фермента в клеточной линии регулируется аналогично активности островков.
Сильный ингибирующий эффект ролипрама на гидролиз циклического AMP, но не циклического GMP, предполагает присутствие PDE4 в клетках BRIN-BD11, а максимальный процент ингибирования предполагает, что это составляет около 25% от общего количества PDE. активность во фракциях супернатанта и осадка.Это соответствует предыдущим находкам на островках с использованием ролипрама (Shaffiee-Nick et al ., 1995) или ICI16397 (Furman & Pyne, 1990). Однако, в отличие от данных на островках (Shafiee-Nick et al ., 1995; Parker et al ., 1995), ролипрам увеличивал индуцированную глюкозой секрецию инсулина. Возможно, PDE4 компартментализован или уровень экспрессии снижен в нативных β-клетках по сравнению с клональными β-клетками, хотя у нас нет доказательств этой возможности. Примечательно, что мы сообщили, что ингибирование ролипрамом активности циклической АМФ ФДЭ в островках не соответствовало различным экспериментам (Shafiee-Nick et al ., 1995). Данные Han et al . (1999) согласуются с нашими настоящими открытиями в клетках BRIN-D11 и нашими предыдущими открытиями в островках, поскольку они также показали, что ролипрам увеличивает секрецию инсулина только в их клеточной линии.
В целом, настоящее исследование предполагает, что активность циклического AMP PDE в клетках BRIN – BD11 может в значительной степени объясняться PDE1, PDE3 и PDE4, при этом PDE3 и PDE4 регулируют уровни циклического AMP, относящиеся к секреции инсулина. Около 10% общей активности циклического AMP PDE не ингибировалось максимальными концентрациями IBMX или одновременным применением Org 9935, ролипрама и запринаста в максимальных ингибирующих концентрациях (данные не показаны).Таким образом, эти клетки могут также экспрессировать высокоаффинные, нечувствительные к IBMX ферменты PDE7 и PDE8, хотя в настоящее время для них нет селективных ингибиторов. Очевидно, есть некоторые отличия от островков в пропорции различных экспрессируемых PDE и их функциональных ролях. Объяснения этих различий остаются спекулятивными, но могут относиться к трансформированной природе клетки BRIN-BD11. Кроме того, островок представляет собой сложную структуру, включающую по меньшей мере четыре типа эндокринных клеток, а также гладкие мышцы сосудов и эндотелиальные клетки.Таким образом, биохимический анализ ферментов островка не может отражать ситуацию, существующую в β-клетке. В этом смысле клетки BRIN-BD11 явно выгодны, так как они обеспечивают гомогенную популяцию клеток. Однако в монослое клеток BRIN должны отсутствовать взаимодействия между клетками, которые, вероятно, происходят в островке. Хотя такие взаимодействия плохо изучены, их важность иллюстрируется наблюдением, что изолированные β-клетки обнаруживают нарушение секреторной функции по сравнению с интактными островками (Pipeleers et al ., 1994). Более того, недавняя работа показала, что когда другая линия секретирующих инсулин клеток (Min6) выращивается на желатине, клетки образуют гладкие округлые «псевдоостровки», которые демонстрируют заметно более высокую секрецию инсулина по сравнению с теми же клетками, выращенными в виде монослоев (Haughe-Evans et al. ., 1999). Отсутствие островковой структуры в монослойных культурах может влиять на экспрессию и / или активность различных изоферментов PDE, и эта гипотеза в настоящее время исследуется.
В заключение, настоящие результаты, полученные на клональной линии секретирующих инсулин клеток, подтверждают гипотезу о важной роли PDE3 в регуляции пула циклического AMP, относящегося к модуляции индуцированной глюкозой секреции инсулина, хотя PDE4 также может вносить свой вклад.
Трициклические антидепрессанты и тетрациклические антидепрессанты
Трициклические антидепрессанты и тетрациклические антидепрессанты
Трициклические и тетрациклические антидепрессанты воздействуют на химические вещества мозга, облегчая симптомы депрессии. Изучите их возможные побочные эффекты и подойдет ли вам один из этих антидепрессантов.
Персонал клиники МэйоТрициклические и тетрациклические антидепрессанты, также называемые циклическими антидепрессантами, относятся к числу первых разработанных антидепрессантов.Они эффективны, но их обычно заменяют антидепрессантами, которые вызывают меньше побочных эффектов. Однако для некоторых людей циклические антидепрессанты могут быть хорошим вариантом. В некоторых случаях они снимают депрессию, когда другие методы лечения не помогают.
Циклические антидепрессанты обозначаются как трициклические или тетрациклические, в зависимости от количества колец в их химической структуре — три (три) или четыре (тетра).
Как действуют циклические антидепрессанты
Циклические антидепрессанты облегчают депрессию, воздействуя на химические посредники (нейротрансмиттеры), используемые для связи между клетками мозга.Как и большинство антидепрессантов, циклические антидепрессанты в конечном итоге воздействуют на изменения в химии мозга и коммуникации в цепях нервных клеток мозга, которые, как известно, регулируют настроение, помогая облегчить депрессию.
Циклические антидепрессанты блокируют реабсорбцию (обратный захват) нейротрансмиттеров серотонина (сер-о-ТОЕ-нин) и норэпинефрина (нор-эп-их-NEF-рин), повышая уровни этих двух нейротрансмиттеров в головном мозге. Циклические антидепрессанты также влияют на другие химические посредники, что может привести к ряду побочных эффектов.
Циклические антидепрессанты, одобренные для лечения депрессии
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило эти трициклические антидепрессанты для лечения депрессии:
- Амитриптилин
- Амоксапин
- Дезипрамин (Норпрамин)
- Доксепин
- Имипрамин (тофранил)
- Нортриптилин (памелор)
- Протриптилин
- Тримипрамин
FDA одобрило тетрациклиновый антидепрессант мапротилин для лечения депрессии.
Иногда циклические антидепрессанты используются для лечения состояний, отличных от депрессии, таких как обсессивно-компульсивное расстройство, тревожные расстройства или нервная (невропатическая) боль.
Возможные побочные эффекты и меры предосторожности
Из-за того, что циклические антидепрессанты действуют по-разному, побочные эффекты от лекарства к лекарству несколько различаются. Некоторые побочные эффекты могут исчезнуть со временем, в то время как другие могут побудить вас и вашего врача попробовать другое лекарство. Побочные эффекты также могут зависеть от дозы, при этом более высокие дозы часто вызывают больше побочных эффектов.
Некоторые общие возможные побочные эффекты включают:
- Сонливость
- Затуманенное зрение
- Запор
- Сухость во рту
- Падение артериального давления при переходе из положения сидя в положение стоя, что может вызвать головокружение
- Задержка мочи
Другие возможные побочные эффекты включают:
- Похудание
- Повышенный аппетит, приводящий к увеличению веса
- Чрезмерное потоотделение
- Тремор
- Сексуальные проблемы, такие как трудности с достижением эрекции, отсроченный оргазм или низкое половое влечение
Вообще говоря:
- Амитриптилин, доксепин, имипрамин и тримипрамин вызывают у вас сонливость чаще, чем другие трициклические антидепрессанты.Может помочь прием этих лекарств перед сном.
- Амитриптилин, доксепин, имипрамин и тримипрамин с большей вероятностью вызывают увеличение веса, чем другие трициклические антидепрессанты.
- Нортриптилин и дезипрамин , по-видимому, лучше переносят побочные эффекты, чем другие трициклические антидепрессанты.
Что касается антидепрессантов, вызывающих сонливость, будьте осторожны при выполнении действий, требующих бдительности, например вождения автомобиля, пока вы не узнаете, как лекарство повлияет на вас.
Какой антидепрессант лучше всего подходит для вас, зависит от ряда факторов, таких как ваши симптомы и любые другие состояния здоровья, которые у вас могут быть. Спросите своего врача и фармацевта о наиболее распространенных возможных побочных эффектах конкретного антидепрессанта и прочтите руководство по лекарствам для пациентов, которое прилагается к рецепту.
Проблемы безопасности
Некоторые трициклические антидепрессанты с большей вероятностью вызывают побочные эффекты, влияющие на безопасность, например:
- Дезориентация или спутанность сознания, особенно у пожилых людей при слишком высокой дозировке
- Повышенная или нерегулярная частота пульса
- Более частые припадки у людей с припадками
Другие вопросы, которые следует обсудить с врачом перед приемом циклического антидепрессанта:
- Антидепрессанты и беременность. Поговорите со своим врачом о рисках и преимуществах использования определенных антидепрессантов. Некоторые антидепрессанты могут нанести вред вашему ребенку, если вы принимаете их во время беременности или кормления грудью. Если вы принимаете антидепрессант и собираетесь забеременеть, поговорите со своим врачом или психиатром о возможных рисках. Не прекращайте прием лекарств, не посоветовавшись предварительно с врачом, так как это может быть опасно для вас.
- Лекарственные взаимодействия. Принимая антидепрессант, сообщите своему врачу о любых других лекарствах, отпускаемых по рецепту или без рецепта, травах или других добавках, которые вы принимаете. Некоторые антидепрессанты могут вызывать опасные реакции в сочетании с определенными лекарствами или травяными добавками.
- Серотониновый синдром. В редких случаях антидепрессант может вызвать накопление в организме высокого уровня серотонина. Серотониновый синдром чаще всего возникает при сочетании двух препаратов, повышающих уровень серотонина.К ним относятся другие антидепрессанты, некоторые лекарства от боли или головной боли, а также травяная добавка зверобоя.
- Признаки и симптомы серотонинового синдрома включают беспокойство, возбуждение, высокую температуру, потливость, спутанность сознания, тремор, беспокойство, отсутствие координации, серьезные изменения артериального давления и учащенное сердцебиение.
- Немедленно обратитесь за медицинской помощью, если у вас есть какие-либо из этих признаков или симптомов.
- Безопасность и анализы крови. Ваш врач может порекомендовать уровень в крови, чтобы определить наиболее эффективную дозу.Некоторые побочные эффекты и преимущества циклических антидепрессантов зависят от дозы. Передозировка циклических антидепрессантов может быть опасной.
- Хронические заболевания. Циклические антидепрессанты могут вызывать проблемы у людей с определенными заболеваниями. Например, если у вас глаукома, увеличенная простата, проблемы с сердцем, диабет, заболевание печени или судороги в анамнезе, поговорите со своим врачом о том, является ли циклический антидепрессант безопасным выбором для вас.
Суицидальный риск и антидепрессанты
Большинство антидепрессантов, как правило, безопасны, но FDA требует, чтобы все антидепрессанты имели предупреждения в виде черного ящика, самые строгие предупреждения для рецептов.В некоторых случаях у детей, подростков и молодых людей до 25 лет может наблюдаться усиление суицидальных мыслей или поведения при приеме антидепрессантов, особенно в первые несколько недель после начала приема или при изменении дозы.
За каждым, принимающим антидепрессанты, следует внимательно следить на предмет обострения депрессии или необычного поведения. Если у вас или вашего знакомого возникают суицидальные мысли при приеме антидепрессанта, немедленно обратитесь к врачу или обратитесь за неотложной помощью.
Имейте в виду, что антидепрессанты с большей вероятностью снижают риск суицида в долгосрочной перспективе за счет улучшения настроения.
Прекращение лечения циклическими антидепрессантами
Циклические антидепрессанты не вызывают привыкания. Однако резкое прекращение лечения антидепрессантами или пропуск нескольких доз может вызвать симптомы отмены. Симптомы могут различаться в зависимости от того, как действует препарат. Иногда это называют синдромом отмены. Проконсультируйтесь с врачом, чтобы постепенно и безопасно снизить дозу.
Симптомы абстиненции могут включать:
- Возбуждение, раздражительность или беспокойство
- Тошнота
- потеет
- Гриппоподобные симптомы, такие как озноб и мышечные боли
- Бессонница
- Летаргия
- Головная боль
В поисках подходящего антидепрессанта
Люди могут по-разному реагировать на один и тот же антидепрессант.Например, конкретный препарат может работать на вас лучше или хуже, чем на другого человека. Или у вас может быть больше или меньше побочных эффектов от приема определенного антидепрессанта, чем у кого-то другого.
Унаследованные черты могут играть роль в том, как на вас влияют антидепрессанты. В некоторых случаях, если это возможно, результаты специальных анализов крови могут помочь понять, как ваше тело может реагировать на конкретный антидепрессант. Однако на вашу реакцию на лекарства могут влиять и другие переменные, помимо генетики.
При выборе антидепрессанта ваш врач принимает во внимание ваши симптомы, любые проблемы со здоровьем, другие лекарства, которые вы принимаете, а также то, что помогало вам в прошлом.
Обычно может пройти несколько недель или больше, прежде чем антидепрессант станет полностью эффективным и начальные побочные эффекты исчезнут. Ваш врач может порекомендовать изменение дозы или другие антидепрессанты, но, проявив терпение, вы и ваш врач сможете найти лекарство, которое подойдет вам.
Октябрь08, 2019 Показать ссылки- Депрессия: могут помочь лекарства, одобренные FDA. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. https://www.fda.gov/consumers/consumer-updates/depression-fda-approved-medications-may-help. Проверено 13 августа 2019 г.
- Основы депрессии. Национальный институт психического здоровья. https://www.nimh.nih.gov/health/publications/depression/index.shtml. Проверено 13 августа 2019 г.
- Изменения в маркировке продукции. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. https: // www.fda.gov/media/77404/download. Проверено 13 августа 2019 г.
- Лекарства для психического здоровья. Национальный институт психического здоровья. https://www.nimh.nih.gov/health/topics/mental-health-medications/index.shtml#part_149856. Проверено 13 августа 2019 г.
- Габриэль М. и др. Синдром отмены антидепрессантов. Журнал Канадской медицинской ассоциации. 2017; DOI: 10.1503 / cmaj.160991.
- Что такое фармакогеномика? Домашний справочник по генетике. https://ghr.nlm.nih.gov/primer/genomicresearch/pharmacogenomics.Проверено 13 августа 2019 г.
- Hirsch M, et al. Трициклические и тетрациклические препараты: фармакология, способ применения и побочные эффекты. https://www.uptodate.com/contents/search. Проверено 19 августа 2019 г.
- Трициклические антидепрессанты. Факты и сравнения. Электронные ответы. https://www.wolterskluwercdi.com/facts-comparisons-online/. Проверено 19 августа 2019 г.
- Тетрациклические антидепрессанты. Факты и сравнения. Электронные ответы. https://www.wolterskluwercdi.com/facts-comparisons-online/.Проверено 19 августа 2019 г.
- Риттер Дж. И др. Антидепрессанты. В: Фармакология Рэнга и Дейла. 9 изд. Эльзевир; 2020.
- Амитриптилин (информация о назначении). Accord Healthcare Inc .; 2018. https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=1e6d2c80-fbc8-444e-bdd3-6a91fe1b95bd. Проверено 19 августа 2019 г.
- Амоксапин (информация о назначении). Actavis Pharma Inc .; 2015. https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=a16297df-3158-48db-85e5-5cd506885556.Проверено 19 августа 2019 г.
- Норпрамин (информация о назначении). ООО «Валидус Фармасьютикалз»; 2018. https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=70b562ea-9f21-4e4a-b3ed-0590b2892f6a. По состоянию на 12 сентября 2019 г.
- Доксепин (информация о назначении). Amneal Pharmaceuticals NY LLC; 2017. https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=20bfb8af-7933-4e5c-a2b5-010659d9125b. Проверено 19 августа 2019 г.
- Тофранил (информация о назначении). ООО «СпецГкс»; 2017 г.https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=1827a5aa-733a-49d9-89d9-48ea0367b230. По состоянию на 12 сентября 2019 г.
- Pamelor (информация о назначении). Mallinckrodt Inc .; 2019. https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=e17dc299-f52d-414d-ab6e-e809bd6f8acb. Проверено 19 августа 2019 г.
- Протриптилин (информация о назначении). West-Ward Pharmaceuticals Corp .; 2016. https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=700abc58-9362-4ef5-9d7a-dd3c4d364d0a.По состоянию на 26 августа 2019 г.
- Тримипрамин (информация о назначении). Брекенридж Фармасьютикал, Инк .; 2019. https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=4f31df66-7dc2-1f04-e054-00144ff88e88. Проверено 20 августа 2019 г.
- Мапротилин (информация о назначении). Mylan Pharmaceuticals Inc .; 2014. https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=c3ca69e6-1ea0-4c2c-abcb-7264b2e79a87. По состоянию на 12 сентября 2019 г.
- Krieger CA (экспертное заключение). Клиника Майо.11 сентября 2019 г.
Продукты и услуги
- Информационный бюллетень: Письмо о здоровье клиники Мэйо — цифровое издание
- Книга: Книга здоровья семьи клиники Мэйо, 5-е издание
.
Разработка лекарств и взаимодействия с ними | Таблица субстратов, ингибиторов и индукторов
- ферментов CYP
- In vitro
- Клинический индекс препаратов
- Примеры клинических субстратов, ингибиторов и индукторов
- Транспортеры
- In vitro
- Примеры клинических субстратов, ингибиторов и индукторов
Таблица 1-1: Примеры маркерных реакций in vitro на метаболизм, опосредованный P450 (26.09.2016)
| Фермент | Маркер реакции |
|---|---|
| CYP1A2 | О-деэтилирование фенацетина, О-деэтилирование 7-этоксирезоруфин |
| CYP2B6 | Гидроксилирование эфавиренца, гидроксилирование бупропиона |
| CYP2C8 | 6α-гидроксилирование паклитаксела, N-деэтилирование амодиахина |
| CYP2C9 | 7-гидроксилирование S-варфарина, 4′-гидроксилирование диклофенака |
| CYP2C19 | 4′-гидроксилирование S-мефенитоина |
| CYP2D6 | 1′-гидроксилирование буфуралола, O-деметилирование декстрометорфана |
| CYP3A4 / 5 * | 1′-гидроксилирование мидазолама, 6-гидроксилирование тестостерона |
* Рекомендуют использовать 2 структурно неродственных субстрата CYP3A4 / 5 для оценки ингибирования CYP3A4 / 5 in vitro.
Таблица 1-2: Примеры селективных ингибиторов in vitro метаболизма, опосредованного P450 (26.09.2016)
| Фермент | Ингибитор |
|---|---|
| CYP1A2 | α-Нафтофлавон, Фурафиллин * |
| CYP2B6 ** | Сертралин, фенциклидин *, тиотепа *, тиклопидин * |
| CYP2C8 | Монтелукаст, кверцетин, фенелзин * |
| CYP2C9 | Сульфафеназол, тиениловая кислота * |
| CYP2C19 ** | S — (+) — N-3-бензил-нирванол, нооткатон, тиклопидин * |
| CYP2D6 | хинидин, пароксетин * |
| CYP3A4 / 5 | Итраконазол, кетоконазол, азамулин *, тролеандомицин *, верапамил * |
Большинство химических ингибиторов неспецифичны для отдельного фермента CYP.Селективность и эффективность ингибиторов следует проверять в тех же экспериментальных условиях с использованием зондов-субстратов для каждого фермента CYP.
* Ингибиторы, зависящие от времени. ** Селективный ингибитор in vitro недоступен для метаболизма, опосредованного CYP2C19 и CYP2B6. Перечисленные здесь ингибиторы можно использовать вместе с другой информацией, такой как метаболические профили, полученные из систем экспрессии одного фермента.
Таблица 1-3. Примеры индукторов in vitro метаболизма, опосредованного P450 (26.09.2016)
| Фермент | Индуктор * |
|---|---|
| CYP1A2 | Омепразол, Лансопразол |
| CYP2B6 | Фенобарбитал |
| CYP2C8 | Рифампицин |
| CYP2C9 | Рифампицин |
| CYP2C19 | Рифампицин |
| CYP3A4 / 5 | Рифампицин |
Таблица 2-1: Примеры субстратов клинического индекса для P450-опосредованного метаболизма (для использования в индексных клинических исследованиях DDI) (26.09.2016)
| Основы с чувствительным индексом, если не указано иное | |
|---|---|
| CYP1A2 | кофеин, тизанидин |
| CYP2B6 (а) | – |
| CYP2C8 | репаглинид (б) |
| CYP2C9 | толбутамид (в) , S-варфарин (в) |
| CYP2C19 | лансопразол (c, d), омепразол |
| CYP2D6 | дезипрамин, декстрометорфан, небиволол |
| CYP3A | мидазолам, триазолам |
* Примечание. Индексные субстраты предсказуемо демонстрируют увеличение воздействия из-за ингибирования или индукции данного метаболического пути и обычно используются в проспективных клинических исследованиях DDI.См. Раздел IV.A.2. основного клинического руководства DDI. Субстраты с чувствительным индексом представляют собой индексные препараты, которые демонстрируют увеличение AUC в ≥5 раз с сильными индексными ингибиторами данного метаболического пути в клинических исследованиях DDI. Субстраты с умеренной чувствительностью — это лекарственные препараты, которые демонстрируют увеличение AUC от ≥2 до <5 раз с сильными ингибиторами индекса данного метаболического пути в клинических исследованиях DDI.
Эта таблица подготовлена для предоставления примеров клинически чувствительных или умеренно чувствительных индексных подложек и не является исчерпывающим списком.Индексные субстраты, перечисленные в этой таблице, были выбраны с учетом их чувствительности, специфичности, профилей безопасности и достаточного количества зарегистрированных клинических исследований DDI с различными ингибиторами in vivo (≥ 3 для CYP3A или ≥ 2 для CYP1A2, 2C8, 2C9, 2C19 и 2D6) . Данные DDI были собраны на основе поиска в базе данных по метаболизму и транспорту лекарственных средств Вашингтонского университета [Hachad et al. (2010), Hum Genomics, 5 (1): 61], а список литературы доступен здесь.
(a) В настоящее время у нас нет субстратов с чувствительным индексом для CYP2B6.
(b) Также субстрат OATP1B1.
(c) Умеренно чувствительные подложки.
(d) S-лансопразол является чувствительным субстратом у субъектов с ЭМ CYP2C19.
Сокращения:
AUC: площадь под кривой зависимости концентрации от времени; CYP: цитохром P450; DDI: лекарственное взаимодействие; EM: обширный метаболизатор; OATP1B1: полипептид 1B1, переносящий органический анион.
Таблица 2-2: Примеры клинических ингибиторов индекса P450-опосредованного метаболизма (для использования в индексных клинических исследованиях DDI) (26.09.2016)
| Сильные ингибиторы индекса | Ингибиторы умеренного индекса | |
|---|---|---|
| CYP1A2 | флувоксамин (а) | – |
| CYP2B6 (б) | – | – |
| CYP2C8 | клопидогрель (в) , гемфиброзил (г) | – |
| CYP2C9 | – | флуконазол (е) |
| CYP2C19 | флувоксамин (а) | – |
| CYP2D6 | флуоксетин (ф) , пароксетин | мирабегрон |
| CYP3A | кларитромицин (г) , итраконазол (г) | эритромицин, флуконазол (е) , верапамил (г) |
Примечание. Ингибиторы индекса предсказуемо подавляют метаболизм заданным путем и обычно используются в проспективных клинических исследованиях DDI.См. Раздел IV.A.2. основных руководящих документов. Сильные и умеренные ингибиторы — это препараты, которые увеличивают AUC субстратов чувствительного индекса данного метаболического пути в ≥5 раз и от ≥2 до <5 раз, соответственно.
Эта таблица подготовлена для предоставления примеров ингибиторов клинического индекса и не является исчерпывающим списком. Ингибиторы индекса, перечисленные в этой таблице, были выбраны на основе эффективности и селективности ингибирования, профилей безопасности и достаточного количества зарегистрированных клинических исследований DDI с различными субстратами in vivo [≥ 3 для CYP3A, ≥ 2 для CYP1A2, 2C9, 2C19 и 2D6, или ≥ 1 для CYP2C8 (сильные ингибиторы)].Данные DDI были собраны на основе поиска в базе данных по метаболизму и транспорту лекарственных средств Вашингтонского университета [Hachad et al. (2010), Hum Genomics, 5 (1): 61)], а список литературы доступен здесь.
(a) Сильный ингибитор CYP1A2 и CYP2C19 и умеренный ингибитор CYP2D6 и CYP3A.
(b) В настоящее время у нас нет ингибиторов индекса CYP2B6.
(c) Сильный ингибитор CYP2C8, слабый ингибитор CYP2B6 и ингибитор OATP1B1.Метаболит глюкуронида также является ингибитором CYP2C8 и OATP1B1.
(d) Сильный ингибитор CYP2C8 и ингибитор OATP1B1 и OAT3. Метаболит глюкуронида также является ингибитором CYP2C8 и OATP1B1.
(e) Сильный ингибитор CYP2C19 и умеренный ингибитор CYP2C9 и CYP3A.
(f) Сильные ингибиторы CYP2C19 и CYP2D6. (g) Ингибитор P-gp (определяемый как те, которые увеличивают AUC дигоксина до ≥1,25 раза).
Сокращения:
AUC: площадь под кривой зависимости концентрации от времени; CYP: цитохром P450; DDI: лекарственное взаимодействие; OATP1B1: полипептид 1B1, переносящий органический анион; OAT3: переносчик органических анионов 3; P-gp: P-гликопротеин.
Таблица 2-3: Примеры индукторов клинического индекса для P450-опосредованного метаболизма (для использования в индексных клинических исследованиях DDI) (26.09.2016)
| Индукторы сильные | Индукторы умеренные | |
|---|---|---|
| CYP1A2 | – | – |
| CYP2B6 | – | рифампицин (а) |
| CYP2C8 | – | рифампицин (а) |
| CYP2C9 | – | рифампицин (а) |
| CYP2C19 | рифампицин (а) | – |
| CYP3A | фенитоин (б) , рифампицин (а) | – |
Примечание. Индукторы индекса предсказуемо вызывают метаболизм заданным путем и обычно используются в проспективных клинических исследованиях DDI.См. Раздел IV.A.2. основных руководящих документов. Индукторы сильного и умеренного индекса — это препараты, снижающие AUC субстратов чувствительного индекса данного метаболического пути на ≥80% и ≥50% до <80% соответственно.
Эта таблица подготовлена для предоставления примеров индукторов клинического индекса и не является исчерпывающим списком. Индукторы индекса, перечисленные в этой таблице, были выбраны на основе эффективности индукции, профилей безопасности и количества опубликованных клинических исследований DDI с различными субстратами in vivo (≥ 2 субстратов).Данные DDI были собраны на основе поиска в базе данных по метаболизму и транспорту лекарственных средств Вашингтонского университета [Hachad et al. (2010), Hum Genomics, 5 (1): 61], а список литературы доступен здесь.
(a) Сильный индуктор CYP1A2, CYP2C19, CYP3A и умеренный индуктор CYP2B6, CYP2C8, CYP2C9.
(b) Сильный индуктор CYP3A и умеренный индуктор CYP1A2, CYP2C19.
Сокращения:
AUC: площадь под кривой зависимости концентрации от времени; CYP: цитохром P450; DDI: лекарственное взаимодействие.
Таблица 3-1: Примеры клинических субстратов для P450-опосредованного метаболизма (для клинических исследований DDI сопутствующего применения и / или маркировки лекарств) (12.03.2019)
| Чувствительные основы | Умеренно чувствительные подложки | |
|---|---|---|
| CYP1A2 | алосетрон, кофеин, дулоксетин, мелатонин, рамелтеон, тазимелтеон, тизанидин | клозапин, пирфенидон, рамосетрон, теофиллин |
| CYP2B6 | бупропион (а) | эфавиренц (а) |
| CYP2C8 | репаглинид (б) | монтелукаст, пиоглитазон, розиглитазон |
| CYP2C9 | целекоксиб (в) | глимепирид, фенитоин, толбутамид, варфарин |
| CYP2C19 | S-мефенитоин, омепразол | диазепам, лансопразол (d) , рабепразол, вориконазол |
| CYP2D6 | атомоксетин, дезипрамин, декстрометорфан, элиглюстат (e) , небиволол, нортриптилин, перфеназин, толтеродин, R-венлафаксин | энкаинид, имипрамин, метопролол, пропафенон, пропранолол, трамадол, тримипрамин, S-венлафаксин |
| CYP3A | альфентанил, аванафил, буспирон, кониваптан, дарифенацин, дарунавир (f) , эбастин, эверолимус, ибрутиниб, ломитапид, ловастатин (g) , мидазолам, налоксегол, симквинаставирон 23, 900 (сааквинаставир) ) , сиролимус, такролимус, типранавир (f) , триазолам, варденафил | алпразолам, апрепитант, аторвастатин (c) , колхицин, элиглустат (e) , пимозид, рилпивирин, ривароксабан, тадалафил |
| будесонид, дазатиниб, дронедарон, элетриптан, эплеренон, фелодипин, индинавир (f) , луразидон, маравирок, кветиапин, силденафил, тикагрелор, толваптан |
Примечание. Чувствительные субстраты — это препараты, которые демонстрируют увеличение AUC в ≥5 раз с сильными ингибиторами индекса данного метаболического пути в клинических исследованиях DDI.Умеренно чувствительные субстраты — это препараты, которые демонстрируют увеличение AUC от ≥2 до <5 раз с сильными ингибиторами индекса данного метаболического пути в клинических исследованиях DDI. Чувствительные субстраты CYP3A с ≥10-кратным увеличением AUC при совместном введении сильных ингибиторов индекса показаны над пунктирной линией. Другие пути выведения также могут способствовать удалению субстратов, перечисленных в таблице выше, и их следует учитывать при оценке потенциала взаимодействия с лекарственными средствами.
Эта таблица подготовлена для предоставления примеров клинических субстратов и не является исчерпывающим списком. Данные DDI были собраны на основе поиска в базе данных по метаболизму и транспорту лекарственных средств Вашингтонского университета [Hachad et al. (2010), Hum Genomics, 5 (1): 61].
(a) Включено в список на основании исследования индукции in vivo, и наблюдаемый эффект может быть частично связан с индукцией другого пути (путей).
(б) Субстрат OATP1B1.
(c) Включено в список на основании фармакогенетических исследований.
(d) S-лансопразол является чувствительным субстратом у субъектов с ЭМ CYP2C19.
(e) Чувствительный субстрат CYP2D6 и умеренно чувствительный субстрат CYP3A.
(f) Обычно назначают пациентам в комбинации с ритонавиром, сильным ингибитором CYP3A.
(г) Кислотная форма представляет собой субстрат OATP1B1
Сокращения:
AUC: площадь под кривой зависимости концентрации от времени; CYP: цитохром P450; DDI: лекарственное взаимодействие; EM: обширный метаболизатор; OATP1B1: полипептид 1B1, переносящий органический анион.
Таблица 3-2: Примеры клинических ингибиторов P450-опосредованного метаболизма (для клинических исследований DDI сопутствующего применения и / или маркировки лекарств) (06.03.2020)
| Сильные ингибиторы | Умеренные ингибиторы | Слабые ингибиторы | |
|---|---|---|---|
| CYP1A2 | ципрофлоксацин, эноксацин, флувоксамин (а) | метоксален, мексилетин, оральные контрацептивы | ацикловир, аллопуринол, циметидин, пегинтерферон альфа-2а, пиперин, зилеутон |
| CYP2B6 | – | – | клопидогрель (б) , тенофовир, тиклопидин (в) , вориконазол (г) |
| CYP2C8 | гемфиброзил (е) | клопидогрель (b) , деферасирокс, терифлуномид | триметоприм |
| CYP2C9 | – | амиодарон, флуконазол (f) , миконазол, пиперин | диосмин, дисульфирам, флувастатин, флувоксамин (а) , вориконазол |
| CYP2C19 | флуконазол (е) , флуоксетин (г) , флувоксамин (а) , тиклопидин | фелбамат | омепразол, вориконазол |
| CYP2D6 | бупропион, флуоксетин (г) , пароксетин, хинидин (ч) , тербинафин | абиратерон, цинакальцет, дулоксетин, лорказерин, мирабегрон | амиодарон, целекоксиб, циметидин, клобазам, кобицистат, эсциталопрам, флувоксамин (а) , лабеталол, ритонавир (h, i, j) , сертралин, вемурафениб |
| CYP3A4 | боцепревир, кобицистат (h) , данопревир и ритонавир (j) , элвитегравир и ритонавир (j) , грейпфрутовый сок (k) , индинавир и ритонавир (j) , итраконазол , кетоконазол, лопинавир и ритонавир (h, j) , паритапревир и ритонавир и (омбитасвир и / или дасабувир) (j) , позаконазол, ритонавир (h, j), саквинавир и ритонавир (h, j) , телапревир (h) , типранавир и ритонавир (h, j) , телитромицин, тролеандомицин, вориконазол | апрепитант, ципрофлоксацин, кониваптан (l) , кризотиниб, циклоспорин, дилтиазем (m) , дронедарон (h) , эритромицин, флуконазол (f) , флувоксамин (а), имопатин , флувоксамин (а) верапамил (ч) | хлорзоксазон, цилостазол, циметидин, клотримазол, фосапрепитант, истрадефиллин, ивакафтор (h) , ломитапид, ранитидин, ранолазин (h) , тикагрелор (h) |
| кларитромицин (h) , иделалисиб, нефазодон, нелфинавир (h) | – | – |
Примечание. Сильные, умеренные и слабые ингибиторы — это препараты, которые увеличивают AUC субстратов чувствительного индекса данного метаболического пути в ≥5 раз, от ≥2 до <5 раз и ≥1.От 25 до <2 раз соответственно. Сильные ингибиторы CYP3A, вызывающие ≥10-кратное увеличение AUC субстрата (ов) чувствительного индекса, показаны над пунктирной линией.
Эта таблица подготовлена для предоставления примеров клинических ингибиторов и не является исчерпывающим списком. Данные DDI были собраны на основе поиска в базе данных по метаболизму и транспорту лекарственных средств Вашингтонского университета [Hachad et al. (2010), Hum Genomics, 5 (1): 61].
(a) Сильный ингибитор CYP1A2 и CYP2C19.Умеренный ингибитор CYP3A и слабый ингибитор CYP2D6.
(b) Умеренный ингибитор CYP2C8 и слабый ингибитор CYP2B6.
(c) Сильный ингибитор CYP2C19 и слабый ингибитор CYP2B6.
(d) Сильный ингибитор CYP2C19 и CYP3A и слабый ингибитор CYP2B6.
(e) Сильный ингибитор CYP2C8 и ингибитор OATP1B1 и OAT3.
(f) Сильный ингибитор CYP2C19 и умеренный ингибитор CYP2C9 и CYP3A. (g) Сильные ингибиторы CYP2C19 и CYP2D6.
(h) Ингибитор P-gp (определяется как те, которые увеличивают AUC дигоксина до ≥1,25 раза).
(i) Сильные ингибиторы CYP3A и слабые ингибиторы CYP2D6.
(j) Ритонавир в клинической практике обычно назначается в комбинации с другими лекарствами против ВИЧ или вируса гепатита С. Следует проявлять осторожность при экстраполяции наблюдаемого эффекта одного ритонавира на влияние комбинированных схем на активность CYP3A.
(k) Действие грейпфрутового сока широко варьируется в зависимости от марки и зависит от концентрации, дозы и препарата.Исследования показали, что его можно классифицировать как «сильный ингибитор CYP3A», когда использовался определенный препарат (например, высокая доза, двойная сила), или как «умеренный ингибитор CYP3A», когда использовался другой препарат (например, низкая доза, однократная сила).
(l) Классификация основана на исследованиях, проведенных с внутривенным введением кониваптана.
(m) Дилтиазем увеличивал AUC некоторых чувствительных субстратов CYP3A (например, буспирона) более чем в 5 раз.
Сокращения:
AUC: площадь под кривой зависимости концентрации от времени; CYP: цитохром P450; DDI: лекарственное взаимодействие; ВИЧ: вирус иммунодефицита человека; ВГС: вирус гепатита С; OATP1B1: полипептид 1B1, переносящий органический анион; OAT3: переносчик органических анионов 3; P-gp: P-гликопротеин.
Таблица 3-3: Примеры клинических индукторов P450-опосредованного метаболизма (для клинических исследований DDI сопутствующего применения и / или маркировки лекарств) (12.03.2019)
| Индукторы сильные | Индукторы умеренные | Индукторы слабые | |
|---|---|---|---|
| CYP1A2 | фенитоин (а) рифампин (б), ритонавир (в, г) , курение, терифлуномид | – | |
| CYP2B6 | карбамазепин (е) | эфавиренц (е) , рифампицин (а) | невирапин, ритонавир (c, d) |
| CYP2C8 | – | рифампицин (а) | – |
| CYP2C9 | – | энзалутамид (г) , рифампицин (а) | апалутамид, апрепитант, карбамазепин (e) , ритонавир (c, d) |
| CYP2C19 | рифампицин (а) | апалутамид, эфавиренз (e, f) , энзалутамид (g) , фенитоин (b) | ритонавир (c, d) |
| CYP3A | апалутамид, карбамазепин (д) , энзалутамид (г) , митотан, фенитоин (б) , рифампицин (а) , св.Зверобой (ч) | бозентан, эфавиренз (f) , этравирин, фенобарбитал, примидон | армодафинил, модафинил (i) , руфинамид |
Примечание. Сильные, умеренные и слабые индукторы — это препараты, которые снижают AUC субстратов чувствительного индекса данного метаболического пути на ≥80%, ≥50% до <80% и ≥20% до <50%, соответственно.
Эта таблица подготовлена для предоставления примеров индукторов клинического индекса и не является исчерпывающим списком.Данные DDI были собраны на основе поиска в базе данных по метаболизму и транспорту лекарственных средств Вашингтонского университета [Hachad et al. (2010), Hum Genomics, 5 (1): 61].
(a) Сильный индуктор CYP3A и умеренный индуктор CYP1A2, CYP2C19.
(b) Сильный индуктор CYP2C19, CYP3A и умеренный индуктор CYP1A2, CYP2B6, CYP2C8, CYP2C9.
(c) Умеренный индуктор CYP1A2 с дозой ритонавира 800 мг / день (не с другими препаратами против ВИЧ).Влияние на CYP1A2 более низких доз ритонавира неизвестно.
(d) Слабый индуктор CYP2B6, CYP2C9 и CYP2C19. Классификация основана на исследованиях, проведенных с самим ритонавиром (не с другими препаратами против ВИЧ) в дозах 100-200 мг / день, хотя в литературе сообщалось о более значительных эффектах для высоких доз ритонавира.
(e) Сильный индуктор CYP2B6, CYP3A и слабый индуктор CYP2C9.
(f) Умеренный индуктор CYP2B6, CYP2C19 и CYP3A.
(г) Сильный индуктор CYP3A и умеренный индуктор CYP2C9 и CYP2C19.
(h) Эффект зверобоя сильно различается и зависит от препарата.
(i) На основе эффекта модафинила 200 мг / день. Более высокая доза (400 мг / день) модафинила оказывала большее индукционное действие на CYP3A.
Сокращения:
AUC: площадь под кривой зависимости концентрации от времени; CYP: цитохром P450; DDI: лекарственное взаимодействие.
Таблица 4-1: Примеры субстратов in vitro для транспортеров (26.09.2016)
| Транспортер | Джин | Субстрат |
|---|---|---|
| P-gp | ABCB1 | Дигоксин (а) |
| Фексофенадин (б, в, г) | ||
| Лоперамид | ||
| Хинидин | ||
| Талинолол (в) | ||
| Винбластин (в) | ||
| BCRP | ABCG2 | 2-амино-1-метил-6-фенилимидазо [4,5-b] пиридин (PhIP) (c, e) |
| Coumestrol | ||
| Daidzein | ||
| Дантролен | ||
| Эстрон-3-сульфат (б, е) | ||
| Геништейн | ||
| Prazosin (e) | ||
| Сульфасалазин | ||
| OATP1B1, OATP1B3 |
SLCO1B1, SLCO1B3 |
Октапептид холецистокинина (CCK-8) (g) |
| Эстрадиол-17β-глюкуронид (h) | ||
| Эстрон-3-сульфат (i) | ||
| Питавастатин (c, e, f, j) | ||
| Правастатин (c, f, k) | ||
| Телмисартан (л) | ||
| Розувастатин (c, f, j, k) | ||
| OAT1 | SLC22A6 | Адефовир |
| p -аминогиппурат | ||
| Цидофовир | ||
| Тенофовир | ||
| OAT3 | SLC22A8 | Бензилпенициллин (б) |
| Эстрон-3-сульфат (j, m) | ||
| Метотрексат (b, c, j, n) | ||
| Правастатин (б, в) | ||
| МАТЕ1, МАТЕ-2К | SLC47A1, SLC47A2 | Метформин (о) |
| 1-метил-4-фенилпиридиний (MPP +) (o) | ||
| Тетраэтиламмоний (TEA) (o) | ||
| ОКТ2 | SLC22A2 | Метформин (о) |
| 1-метил-4-фенилпиридиний (MPP +) (o) | ||
| Тетраэтиламмоний (TEA) (o) |
Примечание:
(a) Также является подложкой OATP1B3.
(b) Также субстрат ОАТФ.
(c) Также подложка MRP2.
(d) Также подложка из MRP3.
(e) Также подложка P-gp.
(f) Также подложка из NTCP.
(ж) Селективный субстрат OATP1B3 (по сравнению с OATP1B1).
(h) Согласно оценкам исследований ингибирования, значение Ki ниже. Это вещество имеет соответствующие характеристики лекарственного препарата-маркера.
(i) Селективный субстрат OATP1B1 (vs.OATP1B3). Сообщается, что расчетное значение Ki в исследованиях ингибирования имеет тенденцию быть ниже.
(j) Также субстрат BCRP.
(k) Также подложка из OAT3.
(l) Селективный субстрат OATP1B3 (по сравнению с OATP1B1). Следует рассмотреть возможность добавления альбумина в исследуемую систему для уменьшения эффектов неспецифической абсорбции.
(м) Также подложка OATP1B1.
(n) Также подложка OAT1.
(o) Подложка OCT и MATE.
Эта таблица подготовлена для предоставления примеров субстратов in vitro для различных транспортеров и не является исчерпывающим списком.
Таблица 4-2: Примеры ингибиторов in vitro для транспортеров (26.09.2016)
| Транспортер | Джин | Ингибитор |
|---|---|---|
| P-gp | ABCB1 | Циклоспорин (а) |
| Элакридар (GF120918) (б) | ||
| Кетоконазол (с) | ||
| Хинидин (г) | ||
| Резерпин (e) | ||
| Ритонавир (ж) | ||
| Такролимус (ж) | ||
| Валсподар (PSC833) e) | ||
| Верапамил (г) | ||
| Зосукидар (LY335979) | ||
| BCRP | ABCG2 | Элакридар (GF120918) (г) |
| Фумитреморгин С | ||
| Ko134 | ||
| Ko143 | ||
| Новобиоцин | ||
| Сульфасалазин | ||
| OATP1B1, OATP1B3 |
SLCO1B1, SLCO1B3 |
Циклоспорин (c, e, g, h) |
| Эстрадиол-17β-глюкуронид (б, д) | ||
| Эстрон-3-сульфат (б, в) | ||
| Рифампицин | ||
| Рифамицин SV | ||
| OAT1, OAT3 | SLC22A6, SLC22A8 | Бензилпенициллин |
| Пробенецид (ж) | ||
| MATE1, MATE-2K | SLC47A1, SLC47A2 | Циметидин (d, i) |
| Пириметамин | ||
| 2 октября | SLC22A2 | Циметидин (ч) |
Примечание:
(a) Ингибитор MRP2, BCRP, NTCP и OATP.
(b) Также ингибитор BCRP.
(c) Также ингибитор NTCP.
(г) Также ингибитор ОКТ.
(e) Также ингибитор MRP2.
(f) Также ингибитор ОАТФ.
(g) Также ингибитор P-gp.
(h) Предварительная инкубация с ингибиторами перед исследованиями ингибирования вызывает снижение значения Ki.
(i) Также ингибитор ОАТ3.
Эта таблица подготовлена для предоставления примеров ингибиторов in vitro для различных переносчиков и не является исчерпывающим списком.
Таблица 5-1: Примеры клинических субстратов для транспортеров (для использования в клинических исследованиях DDI и / или маркировке лекарств) (12.03.2019)
| Транспортер | Джин | Субстрат |
|---|---|---|
| P-gp | ABCB1 | дабигатрана этексилат, дигоксин, фексофенадин (e) |
| BCRP | ABCG2 | розувастатин, сульфасалазин |
| OATP1B1 OATP1B3 |
SLCO1B1, SLCO1B3 |
асунапревир, аторвастатин, бозентан, данопревир, доцетаксел (a) , фексофенадин (e) , глибурид, натеглинид, паклитаксел, питавастатин (b) , правастатин, репагатинид , розувастиновая кислота 909 |
| OAT1 OAT3 |
SLC22A6, SLC22A8 |
адефовир (c) , цефаклор, цефтизоксим, фамотидин (d) , фуросемид, ганцикловир (c) , метотрексат, осельтамивир карбоксилат (d) , пенициллин G 9023 (d) |
| MATE1, MATE-2K, OCT2 |
SLC47A1, SLC47A2, SLC22A2 | метформин |
Примечание:
Критерии выбора клинических субстратов следующие:
- P-gp: (1) кратное увеличение AUC ≥2 при совместном введении верапамила или хинидина и (2) транспорт in vitro системами экспрессии P-gp, но не подвергается экстенсивному метаболизму.
- BCRP: (1) кратное увеличение AUC ≥2 с фармакогенетическим изменением ABCG2 (421C> A) и (2) транспорт in vitro системами экспрессии BCRP.
- OATP1B1 / OATP1B3: (1) кратное увеличение AUC ≥2 при одновременном применении рифампицина (однократная доза) или циклоспорина A, или фармакогенетическое изменение SLCO1B1 (521T> C) и (2) транспорт in vitro с помощью систем экспрессии OATP1B1 или OATP1B3 .
- OAT1 / OAT3: (1) кратное увеличение AUC ≥1,5 при совместном применении с пробенецидом, (2) фракция, выводимая в неизмененном виде с мочой в неизмененном виде, ≥0.5 и (3) транспорт in vitro системами экспрессии OAT1 или OAT3.
- OCT2 / MATE: Хорошо зарекомендовавший себя субстрат катионной транспортной системы (метформин).
Эта таблица подготовлена для предоставления примеров клинических субстратов для различных транспортеров и не является исчерпывающим списком. Данные DDI были собраны на основе поиска в базе данных по метаболизму и транспорту лекарственных средств Вашингтонского университета [Hachad et al. (2010), Hum Genomics, 5 (1): 61].
(a) Данные in vitro предполагают более высокий вклад OATP1B3, чем OATP1B1.
(b) Данные in vitro и фармакогенетики предполагают более высокий вклад OATP1B1, чем OATP1B3.
(c) Данные in vitro предполагают более высокий вклад ОАТ1, чем ОАТ3.
(d) Данные in vitro предполагают более высокий вклад ОАТ3, чем ОАТ1.
(e) Фексофенадин является субстратом как для P-gp, так и для OATP1B.
Сокращения:
AUC: площадь под кривой зависимости концентрации в плазме от времени.
Таблица 5-2: Примеры клинических ингибиторов для транспортеров (для использования в клинических исследованиях DDI и маркировке лекарств) (26.09.2016)
| Транспортер | Джин | Ингибитор |
|---|---|---|
| P-gp (a) | ABCB1 | амиодарон, карведилол, кларитромицин, дронедарон, итраконазол, лапатиниб, лопинавир и ритонавир, пропафенон, хинидин, ранолазин, ритонавир, саквинавир и ритонавир, телапревир, типранавир и ритонавир 9057 |
| BCRP | ABCG2 | куркумин, циклоспорин А, элтромбопаг |
| OATP1B1, OATP1B3 | SLCO1B1, SLCO1B3 | атазанавир и ритонавир, кларитромицин, циклоспорин, эритромицин, гемфиброзил, лопинавир и ритонавир, рифампицин (разовая доза), симепревир |
| OAT1, OAT3 | SLC22A6, SLC22A8 | п-аминогиппуровая кислота (ПАУ) (б) , пробенецид, терифлуномид |
| MATE1, MATE2-K | SLC47A1, SLC47A2 | циметидин, долутегравир, изавуконазол, ранолазин, триметоприм, вандетаниб |
Примечание:
Критерии выбора ингибиторов in vivo следующие:
- P-gp: (1) кратное увеличение AUC дигоксина ≥2 при совместном применении и (2) ингибитор in vitro.
- BCRP: (1) кратное увеличение AUC сульфасалазина ≥1,5 при совместном применении и (2) ингибитор in vitro. Циклоспорин А и элтромбопаг также были включены, хотя доступная информация о DDI относилась к розувастатину, где ингибирование как BCRP, так и OATP могло способствовать наблюдаемому взаимодействию.
- OATP1B1 / OATP1B3: (1) кратное увеличение AUC ≥2 для по крайней мере одного из клинических субстратов, указанных в таблице 2-3, при совместном введении и (2) ингибитора in vitro.
- OAT1 / OAT3: (1) кратное увеличение AUC ≥1.5 по крайней мере для одного из клинических субстратов в Таблице 2-3 при совместном введении и (2) ингибитор in vitro. i = «»>
- OCT2 / MATE: (1) кратное увеличение AUC метформина ≥ 1,5 при совместном применении и (2) ингибитор in vitro.
Эта таблица подготовлена для предоставления примеров клинических ингибиторов для различных переносчиков и не является исчерпывающим списком. Данные DDI были собраны на основе поиска в базе данных по метаболизму и транспорту лекарственных средств Вашингтонского университета [Hachad et al.(2010), Hum Genomics, 5 (1): 61].
(a) Большинство ингибиторов P-gp также ингибируют CYP3A. (b) Данные in vivo свидетельствуют о специфическом ингибировании OAT1.
Сокращения:
AUC: площадь под кривой зависимости концентрации в плазме от времени.
Список литературы
Министерство здравоохранения, труда и социального обеспечения (MHLW), Япония (2014 г.). Руководство по взаимодействию с лекарствами для рекомендаций по разработке и маркировке лекарств (проект, на японском языке)
Европейское агентство по лекарственным средствам (2013 г.).Руководство по исследованию лекарственных взаимодействий.
Антиангиогенные циклические пептиды двойного нацеливания в качестве потенциальных лекарственных средств для лечения рака.
Кармелиет П. и Джейн Р. К. Ангиогенез при раке и других заболеваниях. Nature 407, 249–257 (2000).
CAS PubMed Google Scholar
Сингх М. и Феррара Н.Моделирование и прогнозирование клинической эффективности лекарств, нацеленных на опухолевую среду. Nat. Biotechnol. 30. С. 648–657 (2012).
CAS PubMed Google Scholar
Shojaei, F. Антиангиогенезная терапия рака: текущие проблемы и перспективы на будущее. Cancer Lett. 2012. Т. 320. С. 130–137.
CAS PubMed Google Scholar
Торнтон, А. Д., Равн, П., Уинслет, М.И Честер К. Ингибирование ангиогенеза с помощью бевацизумаба и хирургическое лечение колоректального рака. Br. J. Surg. 93, 1456–1463 (2006).
CAS PubMed Google Scholar
Chua, T.C. Онкологические операции на желудочно-кишечном тракте у пациентов с метастатическим раком, получавших лечение ингибиторами ангиогенеза: безопасно или нет? ANZ J. Surg. 79, 672–673 (2009).
PubMed Google Scholar
Отвос, Л.Jr. & Wade, J. D. Текущие проблемы в открытии пептидных лекарств. Фронт. Chem. 2, 62 (2014).
PubMed PubMed Central Google Scholar
Крейк, Д. Дж., Фэрли, Д. П., Лирас, С. и Прайс, Д. Будущее препаратов на основе пептидов. Chem. Биол. Drug Des. 2013. Т. 81. С. 136–147.
CAS PubMed Google Scholar
Рейнольдс, А. Р. и др. Стимуляция роста опухоли и ангиогенеза низкими концентрациями ингибиторов интегрина, миметика RGD.Nat. Med. 15. С. 392–400 (2009).
CAS PubMed Google Scholar
Craik, D. J., Daly, N. L., Bond, T. & Waine, C. Циклотиды растений: уникальное семейство циклических и связанных белков, которые определяют структурный мотив циклического цистинового узла. J. Mol. Биол. 294, 1327–1336 (1999).
CAS PubMed Google Scholar
Эрнандес, Дж. Ф. и др. Ингибиторы кабачкового трипсина из Momordica cochinchinensis обладают нетипичной макроциклической структурой.Биохимия 39, 5722–5730 (2000).
CAS PubMed Google Scholar
Luckett, S. et al. Структура высокого разрешения мощного ингибитора циклической протеиназы из семян подсолнечника. J. Mol. Биол. 290, 525–533 (1999).
CAS PubMed Google Scholar
Крейк, Д. Джозеф Рудингер мемориальная лекция: открытие и применение циклотидов. J. Pept.Sci. 19, 393–407 (2013).
CAS PubMed Google Scholar
Saether, O. et al. Выяснение первичной и трехмерной структуры утеротонического полипептида калата B1. Биохимия 34, 4147–4158 (1995).
CAS PubMed Google Scholar
Кларк, Р. Дж., Дейли, Н. Л. и Крейк, Д. Дж. Структурная пластичность каркаса циклического цистинового узла: последствия для биологической активности и дизайна лекарств.Biochem. J. 394, 85–93 (2006).
CAS PubMed PubMed Central Google Scholar
Пот, А. Г., Чан, Л. Ю. и Крейк, Д. Дж. Циклотиды как основы для трансплантации для приложений белковой инженерии и разработки лекарств. Биополимеры 100, 480–491 (2013).
CAS PubMed Google Scholar
Northfield, S.E. et al. Макроциклические пептиды с высоким содержанием дисульфидов в качестве шаблонов при разработке лекарств.Евро. J. Med. Chem. 77. С. 248–257 (2014).
CAS PubMed Google Scholar
Wong, C. T. et al. Перорально активные антагонисты пептидных рецепторов брадикинина B1, сконструированные из циклотидного каркаса для лечения воспалительной боли. Энгью. Chem. Int. Эд. Англ. 51, 5620–5624 (2012).
CAS PubMed Google Scholar
Chan, L. Y. et al. Конструирование проангиогенных пептидов с использованием стабильных, богатых дисульфидами циклических каркасов.Кровь 118, 6709–6717 (2011).
CAS PubMed Google Scholar
Ji, Y. et al. In vivo активация пути супрессора опухолей p53 с помощью сконструированного циклотида. Варенье. Chem. Soc. 135, 11623–11633 (2013).
CAS PubMed PubMed Central Google Scholar
Gunasekera, S. et al. Инженерные стабилизированные антагонисты фактора роста эндотелия сосудов А: синтез, структурная характеристика и биологическая активность привитых аналогов циклотидов.J. Med. Chem. 51, 7697–7704 (2008).
CAS PubMed Google Scholar
Велти, Дж., Логес, С., Диммелер, С. и Кармелиет, П. Недавние молекулярные открытия в ангиогенезе и антиангиогенной терапии рака. J. Clin. Вкладывать деньги. 123, 3190–3200 (2013).
CAS PubMed PubMed Central Google Scholar
Suich, D. J. et al. Ограниченные шаблоном циклические пептидные аналоги соматостатина: селективное связывание подтипа с рецепторами соматостатина и антиангиогенная активность.Биоорг. Med. Chem. 8, 2229–2241 (2000).
CAS PubMed Google Scholar
Райт, Р. М. и др. Связывающий эпитоп соматостатина, определенный с помощью фаговых пептидных библиотек. Биотехнология 13, 165–169 (1995).
CAS PubMed Google Scholar
Abe, R. et al. Местное применение антиангиогенных пептидов на основе фактора, происходящего из пигментного эпителия, может улучшить состояние при псориазе.J. Dermatol. Sci. 57, 183–191 (2010).
CAS PubMed Google Scholar
Доусон, Д. В. и др. Фактор, происходящий из пигментного эпителия: мощный ингибитор ангиогенеза. Science 285, 245–248 (1999).
CAS PubMed Google Scholar
Maik-Rachline, G. & Seger, R. Различные состояния фосфорилирования фактора, происходящего из пигментного эпителия, по-разному регулируют его функцию.Кровь 107, 2745–2752 (2006).
CAS PubMed Google Scholar
Bae, D. G., Gho, Y. S., Yoon, W. H. & Chae, C. B. Богатые аргинином пептиды антиваскулярного фактора роста эндотелия ингибируют рост опухоли и метастазирование путем блокирования ангиогенеза. J. Biol. Chem. 275, 13588–13596 (2000).
CAS PubMed Google Scholar
Yoo, S.A. et al. Богатый аргинином гексапептид антиваскулярного фактора роста эндотелия (анти-VEGF) ингибирует индуцированный коллагеном артрит и стимулированное VEGF производство TNF-альфа и IL-6 человеческими моноцитами.J. Immunol. 174, 5846–5855 (2005).
CAS PubMed Google Scholar
Подар К. и Андерсон К. С. Патофизиологическая роль VEGF в гематологических злокачественных новообразованиях: терапевтическое значение. Кровь 105, 1383–1395 (2005).
CAS Google Scholar
Вейс, С. М. и Череш, Д. А. Интегрины альфаV в ангиогенезе и раке. Харб Холодного источника. Перспектива.Med. 1, а006478 (2011).
PubMed PubMed Central Google Scholar
Adams, R. L., Adams, I. P., Lindow, S. W., Zhong, W. & Atkin, S. L. Рецепторы 2 и 5 соматостатина преимущественно экспрессируются в пролиферирующем эндотелии. Br. J. Cancer 92, 1493–1498 (2005).
CAS PubMed PubMed Central Google Scholar
Аткинс, М., Джонс, К.A. & Kirkpatrick, P. Малеат сунитиниба. Nat. Rev. Drug Discov. 5. С. 279–280 (2006).
CAS PubMed Google Scholar
Фосгерау, К. и Хоффманн, Т. Пептидная терапия: текущее состояние и будущие направления. Drug Discov. Сегодня 20, стр. 122–128 (2015).
CAS PubMed Google Scholar
Ovadia, O. et al. Улучшение лекарственных свойств пептидов: парадигма соматостатина.Мнение эксперта. Drug Discov. 5. С. 655–671 (2010).
CAS PubMed Google Scholar
Li, H. et al. Набор инструментов на основе триазина для разработки пептидных ПЭТ-зондов для визуализации: синтез, микрофлюидное радиоактивное мечение и оценка структура-активность. Биоконъюг. Chem. 25, 761–772 (2014).
CAS PubMed PubMed Central Google Scholar
Гиббонс, Д. Л.И Байерс, Л.А.А. ЕЙ удар 1-2: двойное нацеливание на EGFR наносит сопротивлению смертельный удар. Рак Discov. 4, 991–994 (2014).
CAS PubMed PubMed Central Google Scholar
Conibear, A.C. et al. Циклическая цистиновая лестница тета-дефенсинов как стабильный бифункциональный каркас: исследование, подтверждающее концепцию, с использованием интегрин-связывающего мотива RGD. ChemBioChem 15, 451–459 (2014).
CAS PubMed Google Scholar
Хуанг, Ю.H. et al. Дизайн ингибиторов киназы BCR-ABL на основе субстрата с использованием циклотидного каркаса. Sci. Отчет 5, 12974 (2015).
ADS CAS PubMed PubMed Central Google Scholar
Сан, Л. С. и Кой, Д. Х. Противораковая терапия, направленная на рецепторы соматостатина. Curr. Препарат Делив. 2011. Т. 8. С. 2–10.
CAS PubMed Google Scholar
Craword, S.Э., Фитчев П., Величеаса Д. и Вольперт О. В. Многогранность PEDF в открытии лекарств и болезни: алмаз в грубом или раздвоенном расстройстве личности? Мнение эксперта. Drug Discov. 8. С. 769–792 (2013).
CAS PubMed Google Scholar
Рай, У., Тримавитана, Т. Р., Валери, К. и Янг, С. А. Терапевтическое использование соматостатина и его аналогов: текущий взгляд и потенциальные применения. Pharmacol. Ther. 152, 98–110 (2015).
CAS PubMed Google Scholar
Бесерра, С. П. и Нотарио, В. Влияние PEDF на биологию рака: механизмы действия и терапевтический потенциал. Nat. Rev. Cancer 13, 258–271 (2013).
CAS PubMed PubMed Central Google Scholar
Чжан К., Чжан Л. и Вайнреб Р. Н. Открытие офтальмологических препаратов: новые мишени и механизмы лечения заболеваний сетчатки и глаукомы.Nat. Rev. Drug Discov. 11. С. 541–559 (2012).
CAS PubMed Google Scholar
Chan, L. Y. et al. Выделение и характеристика пептидов из семян Momordica cochinchinensis. J. Nat. Prod. 72, 1453–1458 (2009).
CAS PubMed Google Scholar
Чан, Л. Ю., Крейк, Д. Дж. И Дейли, Н. Л. Миметики циклического тромбоспондина-1: прививка последовательности тромбоспондина в кольцевые богатые дисульфидом каркасы для ингибирования миграции эндотелиальных клеток.Biosci. Отчет 35, e00270 (2015).
PubMed PubMed Central Google Scholar
Vranken, W. F. et al. Модель данных CCPN для ЯМР-спектроскопии: разработка программного обеспечения. Proteins 59, 687–696 (2005).
CAS PubMed PubMed Central Google Scholar
Вютрих, К. ЯМР белков и нуклеиновых кислот (Wiley-Interscience, 1986).
Wishart, D.S. et al. Определение химического сдвига 1H, 13C и 15N в биомолекулярном ЯМР. J. Biomol. ЯМР 6, 135–140 (1995).
CAS Google Scholar
Koradi, R., Billeter, M. & Wuthrich, K. MOLMOL: программа для отображения и анализа макромолекулярных структур. J. Mol. График. 14, 51–55, 29–32 (1996).
CAS PubMed Google Scholar
5 основных классов антидепрессантов
Как следует из названия, антидепрессант — это лекарство, которое в основном используется для лечения депрессии.Депрессия — это распространенное заболевание, которое влияет на химический состав и функции вашего мозга. Антидепрессанты могут помочь исправить дисфункцию, изменяя цепи и химические вещества, передающие сигналы по нервным путям в мозг.
Антидепрессанты сгруппированы в классы в зависимости от того, как они влияют на химический состав мозга. В то время как антидепрессанты одного класса будут иметь сходные побочные эффекты и механизмы действия, существуют различия в их молекулярных структурах, которые могут влиять на то, насколько хорошо лекарство всасывается, распространяется или переносится разными людьми.
Существует пять основных классов антидепрессантов и несколько других, которые используются реже. У каждого есть свои преимущества, риски и подходящее использование. Хотя некоторые из них могут считаться предпочтительными, выбор препарата может варьироваться в зависимости от ваших симптомов, истории лечения и сопутствующих психических расстройств.
Как работают антидепрессанты
Считается, что в регуляции настроения участвуют три основных молекулы, химически известные как моноамины.В первую очередь они работают как нейротрансмиттеры, которые буквально передают нервные сигналы соответствующим рецепторам в головном мозге. Антидепрессанты действуют, воздействуя на эти нейротрансмиттеры, в том числе:
- Дофамин , который играет центральную роль в принятии решений, мотивации, возбуждении и передаче сигналов удовольствия и вознаграждения
- Норэпинефрин , влияющий на бдительность и двигательную функцию, а также помогающий регулировать кровяное давление и частоту сердечных сокращений в ответ на стресс
- Серотонин , нейромедиатор, роль которого заключается в регулировании настроения, аппетита, сна, памяти, социального поведения и сексуального желания
У людей, страдающих депрессией, наличие этих нейромедиаторов в головном мозге обычно невелико.Антидепрессанты работают за счет увеличения доступности одного или нескольких из этих нейромедиаторов разными, отличительными способами.
Из пяти основных классов антидепрессантов наиболее часто назначаются селективные ингибиторы обратного захвата серотонина (СИОЗС) и ингибиторы обратного захвата серотонина и норэпинефрина (СИОЗСН), особенно при лечении первой линии. Если эти препараты неэффективны или неэффективны, могут использоваться другие антидепрессанты. случаи трудноизлечимой депрессии (также известной как резистентная к лечению депрессия).
Селективные ингибиторы обратного захвата серотонина (СИОЗС)
Существует ряд антидепрессантов, которые предотвращают реабсорбцию (обратный захват) нейротрансмиттеров в организме. В совокупности известные как ингибиторы обратного захвата, они предотвращают обратный захват одного или нескольких нейротрансмиттеров, так что большее их количество доступно и активно в головном мозге.
Селективные ингибиторы обратного захвата серотонина (СИОЗС) работают за счет специфического ингибирования обратного захвата серотонина. СИОЗС — это новый класс антидепрессантов, впервые разработанный в 1970-х годах.
Примеры включают:
- Celexa (циталопрам)
- Лексапро (эсциталопрам)
- Лувокс (флувоксамин)
- Паксил (пароксетин)
- Прозак (флуоксетин)
- Виибрид (вилазодон)
- Золофт (сертралин)
СИОЗС, как правило, имеют меньше побочных эффектов, чем старые антидепрессанты, но все же известны тошнота, бессонница, нервозность, тремор и сексуальная дисфункция.
Помимо лечения депрессии, СИОЗС также иногда используются для лечения обсессивно-компульсивного расстройства (ОКР), генерализованного тревожного расстройства (ГТР), расстройств пищевого поведения и преждевременной эякуляции.Они также оказались полезными при восстановлении после инсульта.
Ингибиторы обратного захвата серотонина и норэпинефрина (ИОЗСН)
Ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН) работают аналогично СИОЗС, за исключением того, что они ингибируют обратный захват норадреналина и серотонина. Первый ИОЗСН был одобрен FDA в декабре 1993 года.
Повышение уровня норадреналина одновременно с уровнем серотонина может быть особенно полезно людям с психомоторной отсталостью (замедление физических движений и мышления).
Примеры SNRI включают:
- Cymbalta (дулоксетин)
- Эффексор (венлафаксин)
- Фетцима (левомилнаципран)
- Пристик (десвенлафаксин)
- Савелла (милнаципран)
Общие побочные эффекты SNRI включают тошноту, сонливость, усталость, запор и сухость во рту.
Некоторые SNRI, такие как Cymbalta, также можно использовать для лечения хронической боли, состояния, тесно связанного с развитием депрессии.Они также оказались полезными при лечении генерализованной тревоги, посттравматического стрессового расстройства (PTSD), социального тревожного расстройства (SAD), панического расстройства и нервной боли, связанной с фибромиалгией.
Трициклические антидепрессанты (ТЦА)
Трициклические антидепрессанты (ТЦА) — это более старый класс препаратов, впервые обнаруженный в 1950-х годах. Они были названы в честь их химической структуры, которая состоит из трех взаимосвязанных колец атомов.
ТЦА действуют аналогично ингибиторам обратного захвата в том, что они блокируют абсорбцию серотонина и норадреналина нервными клетками, а также другого нейромедиатора, известного как ацетилхолин (который помогает регулировать движение скелетных мышц).
Примеры TCA включают:
- Анафранил (кломипрамин)
- Азендин (амоксапин)
- Элавил (амитриптилин)
- Норпрамин (дезипрамин)
- Памелор (нортриптилин)
- Синекван (доксепин)
- Сурмонтил (тримипрамин)
- Тофранил (имипрамин)
- Вивактил (протриптилин)
Людиомил (мапротилин) принадлежит к тому же классу препаратов, но более точно описывается как тетрациклический антидепрессант (TeCA) из-за его четвертого атомного кольца.Общие симптомы включают запор, сухость во рту, нечеткое зрение, сонливость, головокружение и увеличение веса. В некоторых случаях также могут наблюдаться нерегулярное сердцебиение, низкое кровяное давление и судороги.
Помимо применения при депрессии, трициклические антидепрессанты могут помочь в лечении хронической боли. Когда-то они также широко использовались у детей с гиперактивностью с дефицитом внимания (СДВГ), но с тех пор были заменены более эффективными лекарственными средствами с меньшим количеством побочных эффектов.
Ингибиторы моноаминоксидазы (ИМАО)
Одним из первых классов разработанных антидепрессантов были ингибиторы моноаминоксидазы (ИМАО).Этот класс антидепрессантов, впервые обнаруженный в 1950-х годах, подавляет действие фермента под названием моноаминоксидаза, роль которого заключается в расщеплении моноаминов. Блокируя этот эффект, становится доступно больше нейротрансмиттеров для регулирования настроения.
Примеры MAOI включают:
- Эмсам (селегилин)
- Марплан (изокарбоксазид)
- нардил (фенелзин)
- Парнат (транилципромин)
используются реже из-за потенциально серьезных реакций с продуктами с высоким содержанием тирамина.При неправильном приеме ИМАО могут вызвать повышение уровня тирамина, вызывая критическое повышение артериального давления.
Чтобы избежать этого, лечение MAOI обычно включает диетические ограничения. Другие побочные эффекты включают тошноту, головокружение, сонливость, беспокойство и бессонницу.
Несмотря на риски, ИМАО доказали свою эффективность при лечении агорафобии, социальной фобии, булимии, посттравматического стрессового расстройства, пограничного расстройства личности и биполярной депрессии. Даже в этом случае его использование обычно резервируется, когда другие варианты антидепрессантов не работают.
Атипичные антидепрессанты
Есть и другие относительно новые антидепрессанты, которые не попадают ни в одну из вышеперечисленных категорий. Их широко называют атипичными антидепрессантами, но они уникальным образом влияют на уровень серотонина, норадреналина и дофамина.
Примеры включают:
- Олептро (тразодон) и Бринтелликс (вортиоксетин) : антагонист серотонина и ингибиторы обратного захвата (ТОРИ), используемые при большой депрессии, которая как ингибирует обратный захват серотонина, так и блокирует адренергические рецепторы
- Ремерон (миртазапин) : норадренергический антагонист , используемый при большой депрессии, который блокирует рецепторы гормона стресса адреналина (адреналина) в головном мозге
- Symbax : объединяет флуоксетин СИОЗС с антипсихотическим препаратом флуоксетином для лечения биполярной депрессии или депрессии, устойчивой к лечению
- Веллбутрин (бупропион) : классифицируется как ингибитор обратного захвата дофамина, используется для лечения депрессии и сезонного аффективного расстройства, а также как средство для прекращения курения
Побочные эффекты могут различаться в зависимости от типа препарата, но могут включать головокружение, сухость во рту, бессонницу, тошноту, рвоту, запор, нечеткое зрение, увеличение веса и сексуальную дисфункцию.
Выбор подходящего антидепрессанта
Есть несколько факторов, которые влияют на выбор правильного антидепрессанта. Главный из них — переносимость. Поскольку многие антидепрессанты одинаково эффективны при лечении депрессии, больший акцент делается на назначении препаратов с наименьшими краткосрочными и долгосрочными побочными эффектами.
Это особенно верно в отношении тошноты и увеличения веса, которые могут повлиять на качество жизни человека и привести к преждевременному прекращению лечения.
Антидепрессанты никогда не следует использовать сами по себе для лечения большой депрессии, а лучше в сочетании с психотерапией, стратегиями самопомощи, социальной поддержкой и лечением сопутствующих состояний (таких как хроническая боль, тревога, биполярное расстройство и расстройства личности). .
Риски и соображения
Антидепрессанты иногда используются в сочетании с другими лекарствами для лечения различных состояний. В некоторых случаях комбинированное применение препаратов, которые обладают серотонинергическим действием, может привести к серотониновому синдрому.Это токсическое накопление серотонина, которое может вызвать каскад потенциально опасных физических и психических симптомов.
Чтобы этого избежать, всегда сообщайте своему врачу обо всех лекарствах, которые вы принимаете, включая рецептурные, отпускаемые без рецепта лекарства, пищевые добавки или лечебные травы.
Антидепрессанты следует использовать только по назначению, и может пройти до восьми недель, прежде чем вы почувствуете положительный эффект. Важно никогда не прекращать, не прерывать, не уменьшать или не увеличивать дозы, не посоветовавшись предварительно с врачом.
Резкое прекращение приема пищи может привести к разрушительным и часто изнурительным симптомам отмены, включая тошноту, рвоту, тремор, кошмары, головокружение, депрессию и ощущение поражения электрическим током. Этого можно избежать, постепенно снижая дозу, желательно под руководством врача.
Антидепрессанты следует применять с особой осторожностью у детей, подростков и молодых людей. В 2007 году FDA выпустило черный ящик с предупреждением о повышенном риске суицидальных мыслей и действий у людей младше 24 лет, принимающих антидепрессанты любого типа.
Антидепрессанты следует применять детям, подросткам и молодым людям только в случае крайней необходимости и только после сопоставления потенциальных преимуществ лечения с потенциальными рисками.
Дизайн на основе структуры кандидатных противовирусных препаратов, нацеленных на основную протеазу SARS-CoV-2
Перспективные ингибиторы противовирусных протеаз
Ученые спешат, не имея вакцины или доказанного эффективного препарата против вируса, вызывающего коронавирусную болезнь 2019 (COVID-19) найти клинические противовирусные препараты.Перспективной лекарственной мишенью является основная вирусная протеаза M pro , которая играет ключевую роль в репликации и транскрипции вируса. Dai et al. Компания разработала два ингибитора, 11a и 11b, на основе анализа структуры активного сайта M pro . Оба сильно ингибировали активность M pro и показали хорошую противовирусную активность в культуре клеток. Соединение 11a имело лучшие фармакокинетические свойства и низкую токсичность при тестировании на мышах и собаках, что позволяет предположить, что это соединение является многообещающим кандидатом в лекарство.
Наука , в этом выпуске стр. 1331
Реферат
SARS-CoV-2 (тяжелый острый респираторный синдром, коронавирус 2) является этиологическим агентом, ответственным за глобальную вспышку COVID-19 (коронавирусное заболевание 2019). Основная протеаза SARS-CoV-2, M pro , является ключевым ферментом, который играет ключевую роль в обеспечении репликации и транскрипции вируса. Мы разработали и синтезировали два соединения свинца ( 11a и 11b ), нацеленных на M pro .Оба показали отличную ингибирующую активность и сильную анти-SARS-CoV-2 инфекционную активность. Рентгеновские кристаллические структуры SARS-CoV-2 M pro в комплексе с 11a или 11b , определенные с разрешением 1,5 ангстрем, показали, что альдегидные группы 11a и 11b являются ковалентно связанный с цистеином 145 из M pro . Оба соединения показали хорошие фармакокинетические свойства in vivo, а 11a также проявили низкую токсичность, что позволяет предположить, что эти соединения являются многообещающими кандидатами в лекарства.
В конце декабря 2019 года в Ухане, Китай, был зарегистрирован кластер случаев пневмонии, вызванной новым коронавирусом ( 1 — 3 ). Геномное секвенирование показало, что этот патогенный коронавирус на 96% идентичен коронавирусу летучих мышей и имеет 79,6% идентичность последовательности с SARS-CoV ( 4 — 6 ). Этот новый коронавирус был назван Международным комитетом по таксономии вирусов тяжелым острым респираторным синдромом 2 (SARS-CoV-2), а пневмония была обозначена Всемирной организацией здравоохранения (ВОЗ) как коронавирусное заболевание 2019 года (COVID-19). 11 февраля 2020 г. ( 7 ).Эпидемия быстро распространилась на более чем 212 стран и была объявлена ВОЗ глобальной чрезвычайной ситуацией в области здравоохранения ( 8 ). В настоящее время нет клинически эффективных вакцин или специальных противовирусных препаратов для профилактики и лечения инфекций COVID-19. Использовалась комбинация α-интерферона и препаратов против ВИЧ, лопинавира / ритонавира (Калетра), но лечебный эффект остается очень ограниченным, и могут возникать токсические побочные эффекты ( 9 ). Ремдесивир, противовирусный препарат широкого спектра действия, разработанный Gilead Sciences Inc., также изучается для лечения COVID-19, но необходимы дополнительные данные, чтобы доказать его эффективность ( 10 — 12 ). Срочно необходимы специальные препараты против SARS-CoV-2, обладающие эффективностью и безопасностью.
Дерево максимального правдоподобия, основанное на геномной последовательности, показало, что вирус относится к подроду Sarbecovirus из рода Betacoronavirus ( 6 ). Коронавирусы представляют собой оболочечные одноцепочечные РНК-вирусы с положительным смыслом. Геномная РНК коронавирусов имеет длину ~ 30 000 нуклеотидов с 5′-кэп-структурой и 3′-поли (A) хвостом и содержит не менее шести открытых рамок считывания (ORF) ( 13 , 14 ).Первая ORF (ORF 1a / b), составляющая около двух третей длины генома, непосредственно транслирует два полипротеина, pp1a и pp1ab, названные так потому, что между ORF1a и ORF1b есть сдвиг рамки на 1. Эти полипротеины процессируются основной протеазой M pro [также известной как 3C-подобная протеаза (3CL pro )] и одной или двумя папаиноподобными протеазами в 16 неструктурных белков (NSP). Эти NSP участвуют в производстве субгеномных РНК, которые кодируют четыре основных структурных белка [белки оболочки (E), мембраны (M), шипы (S) и нуклеокапсид (N)] и другие вспомогательные белки ( 15 , 16 ). ).Следовательно, эти протеазы, особенно M pro , играют жизненно важную роль в жизненном цикле коронавирусов.
M pro представляет собой трехдоменную (домены с I по III) цистеиновую протеазу, участвующую в большинстве событий расщепления созревания в полипротеине-предшественнике ( 17 — 19 ). Active M pro — гомодимер, содержащий два протомера. Коронавирус M pro имеет неканоническую диаду Cys-His, расположенную в щели между доменами I и II ( 17 — 19 ).M pro является консервативным среди коронавирусов, и несколько общих черт являются общими для субстратов M pro в разных коронавирусах. Аминокислоты в субстратах от N-конца до C-конца пронумерованы следующим образом: -P4-P3-P2-P1 ↓ P1′-P2′-P3′-, с сайтом расщепления между P1 и P1 ‘. В частности, Gln почти всегда требуется в позиции P1 подложек. Поскольку M pro не имеет человеческого гомолога, он является идеальной противовирусной мишенью ( 20 — 22 ).
Дизайн и синтез 11a и 11b
Активные сайты M pro высоко консервативны среди всех коронавирусов M pro s и обычно состоят из четырех сайтов: S1 ‘, S1, S2 и S4 ( 22 ). Нам удалось разработать и синтезировать ингибиторы, нацеленные на SARS-CoV-2 M pro , путем анализа субстрат-связывающего кармана SARS-CoV M pro (PDB ID 2h3Z) (рис. 1). Тиол цистеинового остатка в сайте S1 ‘закрепляет ингибиторы ковалентной связью, что важно для ингибиторов для поддержания противовирусной активности.В нашей конструкции новых ингибиторов альдегид был выбран в качестве новой боеголовки в P1, чтобы образовать ковалентную связь с цистеином. Сообщенные ингибиторы SARS-CoV M pro часто имеют ( S ) -γ-лактамное кольцо, которое занимает сайт S1 M pro , и ожидалось, что это кольцо будет хорошим выбором для P1 ( 23 ). ). Кроме того, сайт S2 коронавируса M pro обычно достаточно велик, чтобы вместить более крупный фрагмент P2. Чтобы проверить важность различных кольцевых систем, мы ввели циклогексил или 3-фторфенил в P2, при этом ожидается, что фтор усилит активность.Индольная группа была введена в P3 для образования новых водородных связей с S4 и улучшения свойств, подобных лекарству.
Рис. 1. Стратегия дизайна ингибиторов основной протеазы SARS-CoV-2 (M pro ) и химические структуры 11a и 11b.Метод синтеза и химическая структура соединений ( 11a и 11b ) показаны на схеме S1. Исходный материал ( N, -Boc-1-диметиловый эфир глутаминовой кислоты 1 ) был получен от коммерческих поставщиков и использован без дополнительной очистки для синтеза ключевого промежуточного соединения 3 в соответствии с литературой ( 24 ).Промежуточные продукты 6a и 6b были синтезированы из 4 и кислот 5a и 5b . Удаление t -бутоксикарбонильной группы из 6a и 6b дало 7a и 7b . Соединение 7a и 7b с кислотой 8 давало сложные эфиры 9a и 9b . К пептидомиметическим альдегидам 11a и 11b подходили двухстадийным путем, в котором производные сложных эфиров 9 сначала восстанавливали NaBH 4 с образованием первичных спиртов 10a и 10b , которые впоследствии были окисляется до альдегидов 11a и 11b периодинаном Десс-Мартина (DMP).
11a и 11b являются мощными ингибиторами M
proРекомбинантный SARS-CoV-2 M pro был экспрессирован и очищен от Escherichia coli ( 18 , 25 ). Для ферментативного анализа был разработан и синтезирован флуоресцентно меченый субстрат — MCA-AVLQ ↓ SGFR-Lys (Dnp) -Lys-NH 2 , полученный из N-концевой последовательности авторасщепления вирусной протеазы.
И 11a , и 11b продемонстрировали высокую активность ингибирования SARS-CoV-2 M pro , которая достигала 100% для 11a и 96% для 11b при 1 мкМ соответственно.Мы использовали анализ расщепления на основе флуоресцентного резонансного переноса энергии (FRET), чтобы определить средние значения ингибирующей концентрации (IC 50 ). Результаты показали превосходную ингибирующую способность со значениями IC 50 0,053 ± 0,005 мкМ и 0,040 ± 0,002 мкМ для 11a и 11b , соответственно (рис. 2).
Рис. 2 Профили ингибирующей активности соединений 11a (A) и 11b (B) против SARS-CoV-2 M pro .Структуры SARS-CoV-2 M
pro в комплексе с 11a и 11bДля выяснения механизма ингибирования SARS-CoV-2 M pro с помощью 11a мы определили кристаллическую структуру этого комплекса при 1.Разрешение 5 Å (таблица S1). Кристалл M pro — 11a принадлежит пространственной группе C 2, а асимметричная единица содержит только одну молекулу (таблица S1). Две молекулы (обозначенные протомером A и протомером B) объединяются в гомодимер вокруг кристаллографической оси симметрии второго порядка (рис. S2). Структура каждого протомера содержит три домена с сайтом связывания субстрата, расположенным в щели между доменами I и II. В активном центре SARS-CoV-2 M pro , Cys 145 и His 41 (Cys-His) образуют каталитическую диаду (рис.S2).
Карта электронной плотности ясно показывает соединение 11a в субстрат-связывающем кармане SARS-CoV-2 M pro в расширенной конформации (фиг. 3A и фиг. S3, A и B). Детали взаимодействия показаны на рис. 3, B и C. Электронная плотность показывает, что C альдегидной группы 11a и Cys 145 каталитического центра SARS-CoV-2 M pro образуют стандартная ковалентная связь 1,8 Å C – S. Атом кислорода альдегидной группы также играет решающую роль в стабилизации конформаций ингибитора путем образования 2.Водородная связь 9 Å с остовом остатка Cys 145 в сайте S1 ‘. Кольцо ( S ) -γ-лактама из 11a в P1 хорошо вписывается в сайт S1. Кислород ( S ) -γ-лактамной группы образует водородную связь 2,7 Å с боковой цепью His 163 . Основная цепь Phe 140 и боковая цепь Glu 166 также участвуют в стабилизации ( S ) -γ-лактамного кольца, образуя водородные связи 3,2 Å и 3,0 Å с его группой NH, соответственно.Кроме того, амидные связи в цепи 11a образуют водородные связи с основными цепями His 164 (3,2 Å) и Glu 166 (2,8 Å) соответственно. Циклогексильный фрагмент 11a в P2 глубоко вставляется в сайт S2, стэкинг с имидазольным кольцом His 41 . Циклогексильная группа также окружена боковыми цепями Met 49 , Tyr 54 , Met 165 , Asp 187 и Arg 188 , вызывая обширные гидрофобные взаимодействия.Индольная группа 11a в P3 подвергается действию растворителя (сайт S4) и стабилизируется Glu 166 через водородную связь 2,6 Å. Боковые цепи остатков Pro 168 и Gln 189 взаимодействуют с индольной группой 11a посредством гидрофобных взаимодействий. Множественные молекулы воды (обозначенные от W1 до W6) играют важную роль в связывании 11a . W1 взаимодействует с амидными связями 11a через водородную связь 2,9 Å, тогда как W2-W6 способствуют стабилизации 11a в связывающем кармане, образуя ряд водородных связей с альдегидной группой 11a и остатками Asn 142 , Gly 143 , Thr 26 , Thr 25 , His 41 и Cys 44 .
Рис. 3. Режимы связывания ингибитора M pro для 11a и 11b.( A ) Мультяшное изображение кристаллической структуры SARS-CoV-2 M pro в комплексе с 11a . Соединение 11a показано в виде пурпурных палочек; молекулы воды показаны красными сферами. ( B ) Карман для переплета 11a крупным планом. Обозначены четыре подсайта: S1 ‘, S1, S2 и S4. Остатки, участвующие в связывании ингибитора, показаны в виде пшеничных палочек. 11a и молекулы воды показаны пурпурными палочками и красными сферами соответственно. Водородные связи обозначены пунктирными линиями. ( C ) Принципиальная схема взаимодействий SARS-CoV-2 M pro — 11a , показанная на (B). ( D ) Сравнение режимов привязки 11a и 11b в SARS-CoV-2 M pro . Основное различие между 11a и 11b отмечено пунктирным кружком; 11a и 11b показаны пурпурными и желтыми полосками соответственно.( E ) Карман для переплета 11b крупным планом. Водородные связи обозначены пунктирными линиями. ( F ) Принципиальная схема взаимодействий SARS-CoV-2 M pro — 11b , показанная на (E). Сокращения аминокислот: A, Ala; C, Cys; D, Asp; E, Glu; F, Phe; G, Gly; H, Его; Я, Иль; К, лиз; L, лей; M, Met; N, Asn; P, Pro; Q, Gln; R, Арг; S, Ser; Т, Тр; V, Val; W, Trp; Y, Tyr.
Кристаллическая структура SARS-CoV-2 M pro в комплексе с 11b очень похожа на структуру комплекса 11a и демонстрирует аналогичный режим связывания ингибитора (рис.3D и фиг. S3, C и D и S4A). Различие в способе связывания, скорее всего, связано с 3-фторфенильной группой 11b у P2. Относительно циклогексильной группы в 11a 3-фторфенильная группа претерпевает вращение вниз (рис. 3D). Боковые цепи остатков His 41 , Met 49 , Met 165 , Val 186 , Asp 187 и Arg 188 взаимодействуют с этой арильной группой посредством гидрофобных взаимодействий, а боковая цепь Gln 189 стабилизирует 3-фторфенильную группу с помощью дополнительных 3.Водородная связь 0 Å (рис. 3, E и F). Короче говоря, эти две кристаллические структуры обнаруживают сходный механизм ингибирования, в котором оба соединения занимают субстрат-связывающий карман и блокируют ферментативную активность SARS-CoV-2 M pro .
Соединения N1 , N3 и N9 являются ингибиторами широкого спектра действия, направленными на коронавирус M pro . По сравнению с режимами связывания N1 , N3 и N9 в комплексных структурах SARS-CoV M pro , о которых сообщалось ранее, режимы связывания 11a и 11b в SARS-CoV-2 M Сложные структуры pro похожи, и различия между этими общими структурами невелики (рис.4 и рис. S4, от B до F) ( 22 ). Различия в основном заключаются во взаимодействиях на субсайтах S1 ‘, S2 и S4, возможно потому, что размеры функциональных групп меняются в соответствующих сайтах P1’, P2 и P4 в ингибиторах (Fig. 4, A and C).
Рис. 4 Сравнение режимов связывания ингибитора в SARS-CoV M pro и SARS-CoV-2 M pro .( A ) Сравнение режимов привязки 11a в SARS-CoV-2 M pro с режимами привязки N1 , N3 и N9 в SARS-CoV M pro .SARS-CoV-2 M pro — 11a (пшеница; код PDB 6LZE), SARS-CoV M pro — N1 (небесно-голубой; код PDB 1WOF), SARS-CoV M pro — N3 (серый; код PDB 2AMQ) и SARS-CoV M pro — N9 (оливковый; код PDB 2AMD) показаны в виде мультфильмов. 11a , N1 , N3 и N9 показаны пурпурным, голубым, грязно-фиолетовым и соленым соответственно. ( B ) Сравнение обвязочных карманов 11a и N3 .Остатки в структурах M pro — 11a и M pro — N3 окрашены в пшеничный и серый цвета соответственно. 11a и N3 показаны в виде палочек пурпурного и грязно-фиолетового цветов соответственно. ( C ) Сравнение режимов привязки 11b в SARS-CoV-2 M pro с режимами привязки N1 , N3 и N9 в SARS-CoV M pro . SARS-CoV-2 M pro — 11b (код PDB 6M0K) показан в виде бледно-голубого рисунка. 11b , N1 , N3 и N9 показаны желтым, голубым, грязно-фиолетовым и соленым соответственно. ( D ) Сравнение обвязочных карманов 11b и N9 . Остатки в структурах M pro — 11b и M pro — N9 окрашены в бледно-голубой и оливковый цвета соответственно. 11b и N9 показаны как палочки, окрашенные в желтый и соленый цвета соответственно.
Противовирусная активность 11a и 11b
Для дальнейшего подтверждения результатов ингибирования ферментов мы оценили способность этих соединений ингибировать SARS-CoV-2 in vitro (рис.5 и рис. S5). Как показано на рис. 5, соединения 11a и 11b проявляли хорошую активность против инфекции SARS-CoV-2 в культуре клеток со значениями полумаксимальной эффективной концентрации (EC 50 ) 0,53 ± 0,01 мкМ и 0,72 мкМ. ± 0,09 мкМ соответственно по анализу налета. Ни одно соединение не вызывало цитотоксичности со значениями половинной цитотоксической концентрации (CC 50 )> 100 мкМ, что дает индексы селективности для 11a и 11b > 189 и> 139, соответственно.Мы также использовали иммунофлуоресценцию и количественную полимеразную цепную реакцию в реальном времени (qRT-PCR) для мониторинга противовирусной активности 11a и 11b . Результаты показали, что 11a и 11b проявляют хороший противовирусный эффект в отношении SARS-CoV-2 (рис. 5 и рис. S5).
Рис. 5 Ингибирование in vitro основных вирусных ингибиторов протеаз против SARS-CoV-2.( A и B ) Клетки Vero E6 обрабатывали серией концентраций указанных соединений 11a и 11b и инфицировали SARS-CoV-2 при множественности инфекции (MOI) 0.05. Через 24 часа после инфицирования выход вируса в супернатанте клеток определяли количественно с помощью анализа бляшек. Цитотоксичность этих соединений в клетках Vero E6 также определяли с помощью анализов CCK8. Левая и правая оси y каждого графика представляют средний процент ингибирования выхода вируса и средний процент жизнеспособности клеток лекарственных средств, соответственно. ( C и D ) Число копий вирусной РНК в клеточных супернатантах определяли количественно с помощью qRT-PCR. Данные представляют собой средние значения ± стандартное отклонение; n = 3 биологических повтора.
Фармакокинетические исследования и исследования токсичности
Для дальнейшего изучения лекарственной способности соединений 11a и 11b мы оценили оба соединения на предмет их фармакокинетических свойств. Как показано в таблице S2, соединение 11a , введенное мышам внутрибрюшинно (5 мг / кг) и внутривенно (5 мг / кг), показало период полувыведения ( T 1/2 ), составляющий 4,27 часа и 4,41 часа. соответственно, и мы наблюдали высокую максимальную концентрацию ( C max = 2394 нг / мл) и хорошую биодоступность 87.8% при внутрибрюшинном введении соединения 11a . Метаболическая стабильность 11a у мышей также была хорошей (клиренс = 17,4 мл мин. –1 кг –1 ). При внутрибрюшинном (20 мг / кг), подкожном (5 мг / кг) и внутривенном (5 мг / кг) введении соединение 11b также показало хорошие фармакокинетические свойства (его биодоступность превышала 80% при внутрибрюшинном и подкожном введении, и он отображал более длинный T 1/2 из 5.21 час при внутрибрюшинном введении). Учитывая опасность COVID-19, мы выбрали внутривенное капельное введение для дальнейшего изучения из-за его сравнительно высокой площади под кривой (AUC) и быстрого эффекта. По сравнению с 11a , введенным внутривенно мышам CD-1, 11b показал более короткий T 1/2 (1,65 часа) и более высокую скорость клиренса (клиренс = 20,6 мл мин. –1 кг –1 ). Соединение 11a было выбрано для дальнейшего исследования с внутривенным капельным введением у крыс Sprague-Dawley (SD) и гончих собак.Результаты показали (таблица S3), что 11a демонстрирует длинные значения T 1/2 (SD крыса, 7,6 часа; гончая собака, 5,5 часов), низкие скорости выведения (крыса, 4,01 мл мин. –1 кг). –1 ; собака, мин. 5,8 мл (–1 кг, –1 ) и высокие значения AUC (крыса, 41 500 часов · нг / мл; собака, 14 900 часов · нг / мл). Приведенные выше фармакокинетические результаты показывают, что соединение 11a требует дальнейшего изучения.
Исследование токсичности in vivo (таблица S4) 11a проводили на крысах SD и собаках породы бигль.Острая токсичность 11a была измерена на крысах SD. Крысы SD не умерли после внутривенного капельного введения 40 мг / кг. Когда дозу увеличили до 60 мг / кг, одна из четырех крыс SD умерла. Токсичность в диапазоне доз 11a изучали в течение 7 дней при уровнях дозировки 2, 6 и 18 мг / кг для крыс SD и от 10 до 40 мг / кг для гончих собак. Всем животным вводили дозу один раз в день (QD) путем внутривенного капельного введения, и за всеми животными наблюдали клинически не реже одного раза в день. Никакой очевидной токсичности не наблюдалось ни в одной из групп.Эти данные показывают, что 11a — хороший кандидат для дальнейшего клинического исследования.
Благодарности: Мы благодарим Дж. Халперта и LetPub (www.letpub.com) за лингвистическую помощь во время подготовки этой рукописи, а также персонал линий передачи BL17U1, BL18U1 и BL19U1 Шанхайского центра синхротронного излучения за помощь во время сбора данных . Финансирование: При поддержке Национального фонда естественных наук Китая гранты 21632008, 21672231, 21877118, 31970165,0 и 204310; Национальная программа ключевых исследований и разработок Китая предоставляет гранты 2017YFC0840300, 2020YFC0841400, 2020YFA0707500 и 2017YFB0202604; Грант Департамента науки и технологий Гуанси-Чжуанского автономного района 2020AB40007; и Frontier Biotechnologies Inc. Вклад авторов: H.Y. и Х.Л. задумали проект; Y.X., L.-K.Z., H.Y. и H.L. разработали эксперименты; W.D. и J.L. разработали и синтезировали соединения; X.-M.J. и H.S. протестировали тормозную активность; X.X., J.P., C.L., S.H. и J.W. провели химические эксперименты и собрали данные; B.Z., Y.Z., Z.J., F.L., F.B., H.W., X.C., X.L. и X.Y. собрал дифракционные данные и решил кристаллическую структуру; Ю.Л. и X.C. провели эксперименты по токсичности; Г.X., H.J., Z.R., L.-K.Z., Y.X., H.Y. и H.L. проанализировали и обсудили данные; и L.-K.Z., Y.X., H.Y. и H.L. написали рукопись. Конкурирующие интересы: Шанхайский институт Materia Medica подал заявку на РСТ и китайские патенты, которые охватывают 11a , 11b и родственные пептидомиметические альдегидные соединения. Наличие данных и материалов: Все данные имеются в основном тексте или в дополнительных материалах. Регистрационный номер PDB для координат SARS-CoV-2 M pro в комплексе с 11a — 6LZE, а для координат SARS-CoV-2 M pro в комплексе с 11b — 6M0K.Плазмида, кодирующая SARS-CoV-2 M pro , будет доступна в свободном доступе. Соединения 11a и 11b доступны от H.L. в соответствии с соглашением о передаче материала с Шанхайским институтом Materia Medica. В настоящее время предпринимаются международные усилия по объединению усилий для разработки лучших ингибиторов SARS-CoV-2 M pro , как описано на следующем веб-сайте: https://covid.postera.ai/covid. Эта работа находится под лицензией Creative Commons Attribution 4.0 International (CC BY 4.0) лицензия, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Чтобы просмотреть копию этой лицензии, посетите https://creativecommons.org/licenses/by/4.0/. Эта лицензия не применяется к рисункам / фотографиям / произведениям искусства или другому контенту, включенному в статью, приписываемому третьей стороне; получить разрешение от правообладателя перед использованием такого материала.
Ингибиторы фосфодиэстеразы — Knowledge @ AMBOSS
Последнее обновление: 10 апреля 2021 г.
Резюме
Ингибиторы фосфодиэстеразы (ингибиторы PDE) — это класс препаратов, которые ингибируют ферменты фосфодиэстеразы (ферменты PDE).Ферменты PDE обычно отщепляют фосфатные группы и снижают цАМФ или цГМФ в клетках-мишенях. Ингибиторы PDE классифицируются в зависимости от того, на какой фермент (ы) они действуют, как неспецифические ингибиторы PDE5, PDE4 и PDE3. Ингибиторы ФДЭ5 вызывают расширение сосудов легких и расслабление гладких мышц полового члена и используются при легочной гипертензии и эректильной дисфункции. Ингибиторы PDE4 способствуют расширению бронхов при тяжелой форме ХОБЛ. Ингибиторы PDE3 обладают положительным инотропным, сосудорасширяющим и антитромбоцитарным эффектами, которые используются при острой сердечной недостаточности и при заболеваниях периферических сосудов.Ингибиторы ФДЭ3 не рекомендуются для длительного применения у пациентов с сердечной недостаточностью из-за их сильного кардиостимулирующего действия. Нитраты или альфа-адреноблокаторы категорически противопоказаны пациентам, принимающим ингибиторы ФДЭ5, из-за риска опасной для жизни гипотензии.
Фармакодинамика
Ингибиторы фосфодиэстеразы (PDE) представляют собой гетерогенный класс препаратов, нацеленных на различные изоформы ферментов PDE. Обычно ФДЭ снижает цАМФ или цГМФ в клетках-мишенях, катализируя гидролиз этих вторичных мессенджеров.Ингибируя эту стадию, ингибиторы PDE фактически увеличивают концентрации цАМФ и / или цГМФ. Они классифицируются в соответствии с их целевыми изоформами как неспецифические ингибиторы PDE5, PDE4 и PDE3, каждый из которых имеет различное клиническое применение.
SildenaFIL, tadalaFIL, avanaFIL и vadenaFIL: терапия FIrst-Line для заполнения пещеристого тела
Ссылки: [1] [2] [3]
Побочные эффекты
Каталожные номера: [1] [4] [5] [7]
Мы перечисляем наиболее важные побочные эффекты.Выбор не исчерпывающий.
Противопоказания
Из-за их сосудорасширяющего и аритмогенного эффектов ингибиторы ФДЭ имеют ряд противопоказаний:
Пациентам, получающим ФДЭ5, нельзя принимать нитраты при нестабильной стенокардии, остром коронарном синдроме или инфаркте миокарда, поскольку это может привести к опасное для жизни снижение артериального давления!
Каталожные номера: [1] [4] [8] [9]
Перечислим наиболее важные противопоказания.Выбор не исчерпывающий.
Ссылки
- Кацунг Б., Тревор А. Фундаментальная и клиническая фармакология . McGraw-Hill Education ; 2014 г.
- Левин Т. Антитромботическая терапия при плановом чрескожном коронарном вмешательстве: Клинические исследования. В: Сообщение TW, под ред. Дата обновления . Уолтем, Массачусетс: UpToDate. https://www.uptodate.com/contents/antithrombotic-therapy-for-elective-percutaneous-coronary-intervention-clinical-studies .Последнее обновление: 25 октября 2016 г. Дата обращения: 22 февраля 2017 г.
- Барнс П.Дж. Теофиллин. Am J Respir Crit Care Med . 2013; 188 (8): с.901-906. DOI: 10.1164 / rccm.201302-0388pp. | Открыть в режиме чтения QxMD
- Утверждение цилостазола.
- Хуанг С.А., Лие Д.Д. Ингибиторы фосфодиэстеразы-5 (PDE5) в лечении эректильной дисфункции. П Т . 2013; 38 (7): стр.407-19.
- Cote RH. Характеристики фоторецепторной ФДЭ (ФДЭ6): сходства и различия с ФДЭ5. Int J Impot Res . 2004; 16 (S1): стр.S28-S33. DOI: 10.1038 / sj.ijir.32. | Открыть в режиме чтения QxMD
-
Браун WM.

 ректальные 7.5 мг: 1, 3, 5, 6, 9, 10 или 12 шт.
ректальные 7.5 мг: 1, 3, 5, 6, 9, 10 или 12 шт. с мерн. ложкой
с мерн. ложкой 15 мг: 10 или 20 шт.
15 мг: 10 или 20 шт. 2.5 мл 3, 5 или 10 шт.
2.5 мл 3, 5 или 10 шт. 05.10
Дата перерегистрации: 23.08.18
05.10
Дата перерегистрации: 23.08.18

 7.5 мг: 20 шт.
7.5 мг: 20 шт. , покр. пленочной оболочкой, 60 мг: 5, 10, 15, 20, 30 или 60 шт.
, покр. пленочной оболочкой, 60 мг: 5, 10, 15, 20, 30 или 60 шт. 5 мл амп. 3 или 5 шт.
5 мл амп. 3 или 5 шт. 7.5 мг: 6, 7, 10, 12, 14, 15, 18, 20, 21, 24, 28, 30, 35, 36, 40, 42, 45, 48, 49, 50, 54, 56, 60, 63, 70, 75, 80, 90, 100, 105, 120, 135, 140, 150, 160, 180, 200, 210, 240, 270 или 300 шт.
7.5 мг: 6, 7, 10, 12, 14, 15, 18, 20, 21, 24, 28, 30, 35, 36, 40, 42, 45, 48, 49, 50, 54, 56, 60, 63, 70, 75, 80, 90, 100, 105, 120, 135, 140, 150, 160, 180, 200, 210, 240, 270 или 300 шт. 7.5 мг: 10, 15, 20, 30, 40, 45, 60, 80, 90 или 120 шт.
7.5 мг: 10, 15, 20, 30, 40, 45, 60, 80, 90 или 120 шт. №: ЛП-006060
от 24.01.20
№: ЛП-006060
от 24.01.20
 100 мг: 10, 20 или 100 шт.
100 мг: 10, 20 или 100 шт. сусп. д/приема внутрь 100 мг: пак. 2 г 2, 4, 6, 10, 20 или 30 шт.
сусп. д/приема внутрь 100 мг: пак. 2 г 2, 4, 6, 10, 20 или 30 шт. 100 мг: 10, 15, 20, 30, 40, 45, 50, 60, 75, 80, 90, 100, 120, 150 или 200 шт.
100 мг: 10, 15, 20, 30, 40, 45, 50, 60, 75, 80, 90, 100, 120, 150 или 200 шт.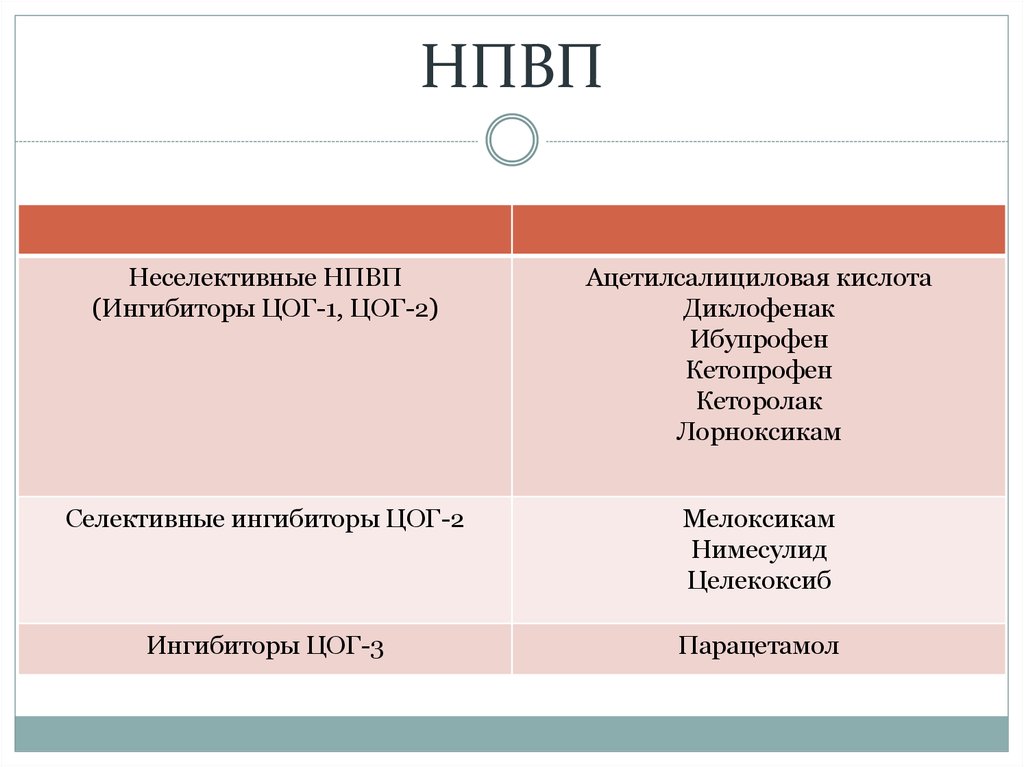 шипучие 100 мг: 10 шт.
шипучие 100 мг: 10 шт. сусп. д/приема внутрь 100 мг: 2 г пакеты 10, 20 или 30 шт.
сусп. д/приема внутрь 100 мг: 2 г пакеты 10, 20 или 30 шт. №: ЛП-N (000094)-(РГ- RU)
от 30.11.20
№: ЛП-N (000094)-(РГ- RU)
от 30.11.20
 100 мг: 10, 20 или 30 шт.
100 мг: 10, 20 или 30 шт. 100 мг: 10, 20 или 30 шт.
100 мг: 10, 20 или 30 шт. 100 мг: 10, 20, 30 или 100 шт.
100 мг: 10, 20, 30 или 100 шт. 100 мг: 10, 20, 30, 40, 50, 60 или 100 шт.
100 мг: 10, 20, 30, 40, 50, 60 или 100 шт. 100 мг: 10, 20, 30, 50 или 100 шт.
100 мг: 10, 20, 30, 50 или 100 шт.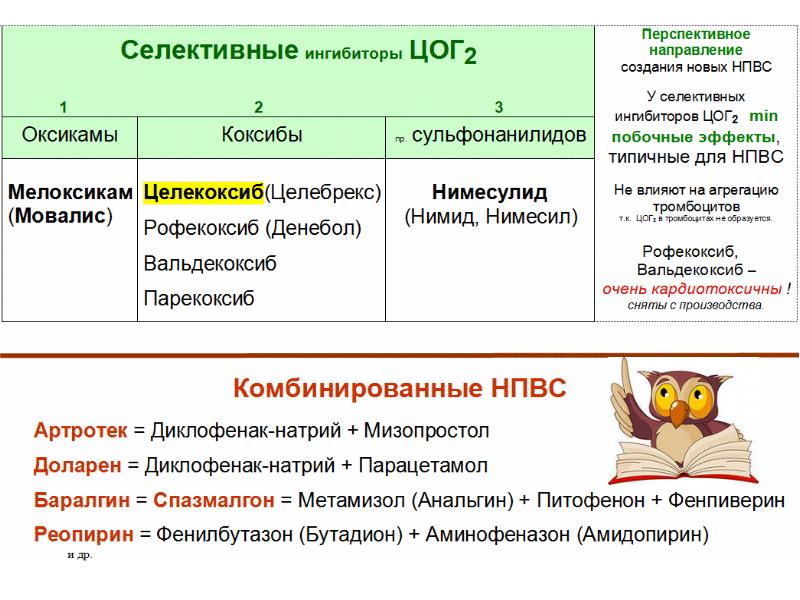 100 мг: 20 или 30 шт.
100 мг: 20 или 30 шт.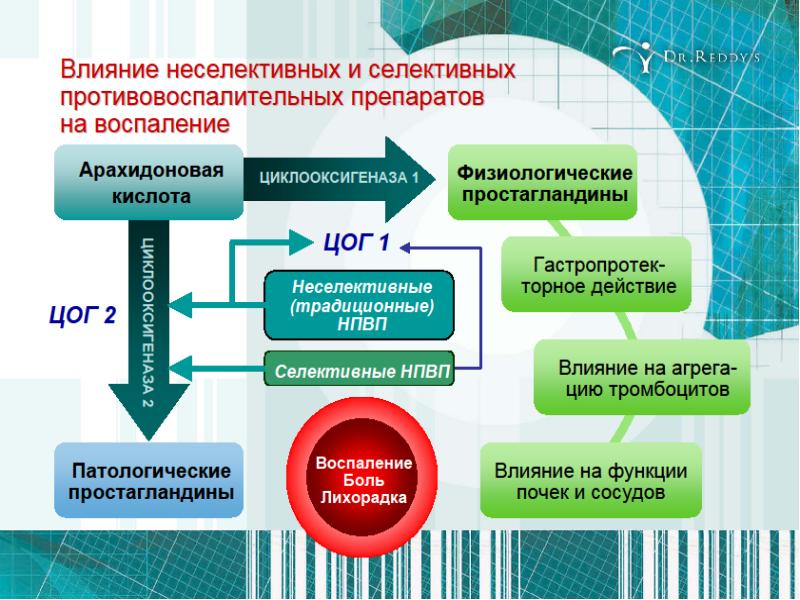 100 мг: 10, 14, 20, 28, 30 или 42 шт.
100 мг: 10, 14, 20, 28, 30 или 42 шт. 100 мг: 10, 20, 30 или 40 шт.
100 мг: 10, 20, 30 или 40 шт. сусп. д/приема внутрь 100 мг/1 пак.: пак. 2 г 5, 10, 20 или 30 шт.
сусп. д/приема внутрь 100 мг/1 пак.: пак. 2 г 5, 10, 20 или 30 шт. 100 мг: 10, 20, 30 или 60 шт.
100 мг: 10, 20, 30 или 60 шт. диспергируемые 50 мг: 20 шт.
диспергируемые 50 мг: 20 шт. 100 мг: 30 или 100 шт.
100 мг: 30 или 100 шт. диспергируемые 100 мг: 10 или 100 шт.
диспергируемые 100 мг: 10 или 100 шт. сусп. д/приема внутрь 100 мг: пак. 2 г 8, 12 или 24 шт.
сусп. д/приема внутрь 100 мг: пак. 2 г 8, 12 или 24 шт. 7.5 мг: 10, 20 или 30 шт.
7.5 мг: 10, 20 или 30 шт. , покр. пленочной оболочкой, 30 мг: 7, 10, 14, 28, 30, 56, 60, 84 или 100 шт.
, покр. пленочной оболочкой, 30 мг: 7, 10, 14, 28, 30, 56, 60, 84 или 100 шт. , покр. пленочной оболочкой, 90 мг: 7, 10, 14, 28, 30, 56, 60, 84 или 100 шт.
, покр. пленочной оболочкой, 90 мг: 7, 10, 14, 28, 30, 56, 60, 84 или 100 шт.

 , покр. пленочной оболочкой, 30 мг: 7, 28, 56 или 98 шт
, покр. пленочной оболочкой, 30 мг: 7, 28, 56 или 98 шт , покр. пленочной оболочкой, 60 мг: 2, 4, 7, 8, 10, 14, 20, 28, 30 шт.
, покр. пленочной оболочкой, 60 мг: 2, 4, 7, 8, 10, 14, 20, 28, 30 шт.