Цитологическое исследование соскобов шейки матки и цервикального канала с описанием по терминологической системе Бетесда (The Bethesda System – TBS)
Метод определения Цитологическое исследование осуществляется согласно «Номенклатуре клинических лабораторных исследований, применяемых в целях диагностики и слежения за состоянием пациентов в учреждениях Российской Федерации», утвержденной приказом Минздрава России от 21.02.2000 г. №64 и «Примерному перечню лабораторных исследований для клинико-диагностической лаборатории лечебно-профилактических учреждений» от 25.12.1997 г. №380.
Исследуемый материал Смотрите в описании
Доступен выезд на дом
Международный метод своевременного распознавания вероятной онкологической патологии матки.
Онкологические заболевания шейки матки являются серьезной проблемой здравоохранения, широко распространены, имеют надежно распознаваемую преклиническую фазу и длительный период развития. Для достоверной верификации диагноза и выбора методов эффективного лечения применяется надежный скрининг-тест – цитологическое исследование мазков, взятых из шейки матки и цервикального канала.
Цитологический метод исследования является весьма чувствительным в диагностике предрака (дисплазий) и начального преклинического рака шейки матки (карциномы in situ, микроинвазивного и скрытого инвазивного рака). Цитологический скрининг позволяет выявить пациенток в преклинической фазе заболевания, использовать щадящие методы лечения, сокращать его сроки, снижать частоту инвалидизации и смертности. Скрининговое цитологическое исследование шейки матки рекомендуется проводить ежегодно всем женщинам от 21 года (или через год от начала половой жизни), независимо от клинических показаний. При наличии клинических изменений частота цитологического исследования определяется врачом-гинекологом.
Для возникновения и развития многих патологических процессов существенное значение имеет особенность анатомического строения шейки матки и, в частности, состояние и взаимоотношение эпителиальных слоев влагалищной части шейки цервикального канала. Как правило, предраковые изменения, а затем и малигнизация, возникают в месте перехода многослойного плоского эпителия влагалищной порции шейки матки в цилиндрический эпителий цервикального канала (зоне трансформации), расположенного (в фертильном возрасте) в области наружного зева. Под влиянием гормональных факторов, травм, воспалительных процессов, диатермокоагуляции зона трансформации (зона стыка) может значительно варьировать. В период увядания овариально-менструальной функции в связи с процессами атрофии уровень стыка поднимается высоко в цервикальный канал.
В 95-97% случаев злокачественная трансформация происходит в клетках плоского эпителия, в остальных – в клетках цилиндрического эпителия цервикального канала.
Основоположником диагностической цитопатологии является Г. Папаниколау (G.N. Papanicolaou), который в 1928 г. описал раковые клетки в мазках из влагалища. Им была разработана широко используемая классификация изменения клеток влагалища и цервикального канала шейки матки. Но в этой классификации не учитываются цитологические изменения, обусловленные вирусом папилломы человека (ВПЧ). Поэтому в настоящее время Всемирная организация здравоохранения рекомендует систему, разработанную в клинике Бетесда (США).
Терминологическая система Бетесда (ТБС, 2001 г.)
разработана для унификации описаний результатов цитологического исследования эпителия шейки матки (с целью представления их в удобной клиницистам форме), с выделением в отдельные группы находок разной клинической значимости и оценкой адекватности исследуемого материала.
Система Бетесда включает 3 категории мазков: норма, мазки неопределенного значения (ASCUS) и внутриэпителиальные (предраковые) поражения низкой (LSIL) и высокой (HSIL) степеней.
Согласно ТБС, начальным компонентом интерпретации цервикальных мазков является оценка адекватности образца, так как его качество влияет на чувствительность цитологического метода. ТБС 2001 г. предполагает две категории образцов: «удовлетворительный» и «неудовлетворительный».
Терминология системы Бетесда (пересмотр 2004 г.).
NILM – интраэпителиальные изменения и злокачественные процессы отсутствуют. В эту группу включены цитологические заключения о нормальном состоянии эпителия, а также о наличии различных не неопластических состояний (заболеваний). Уточняют их характер и, по возможности, причину:
- атрофические изменения;
- наличие клеток железистого эпителия после гистерэктомии;
- реактивные изменения, ассоциированные с воспалением, включая типичную регенерацию, лучевую терапию, применение внутриматочных контрацептивов;
- кроме того, указывают наличие микроорганизмов:
- Trichomonas vaginalis;
- грибов, по морфологическому строению соответствующих Candida spp.
 ;
; - бактерий, по морфологическому строению соответствующих Actinomyces spp.;
- коккобациллярную микрофлору, характерную для бактериального вагиноза;
- клеточные изменения, соответствующие поражению Herpes simplex virus.
У женщин 40 лет и старше при отсутствии плоскоклеточных интраэпителиальных изменений указывается также наличие эндометриальных клеток.
ASCUS – клетки плоского эпителия с атипией неясного значения.
ASC-Н – клетки плоского эпителия с атипией неясного значения, не исключающие наличия высокой степени интраэпителиальных изменений.
LSIL – интраэпителиальные изменения плоского эпителия низкой степени, включают поражения, ассоциированные с HPV и CIN I.
НSIL – интраэпителиальные изменения плоского эпителия высокой степени, включают CIN II, CIN III, карциному in situ и случаи, подозрительные на наличие инвазии.
Плоскоклеточная карцинома.
AGC – клетки цервикального (железистого) эпителия с атипией неясного значения.
AGC, favor neoplastic – клетки цервикального (железистого) эпителия, возможно неоплазия.
Эндоцервикальная аденокарцинома in situ.
Эндоцервикальная аденокарцинома.
Эндометриальная аденокарцинома.
Вторичная аденокарцинома.
Неклассифицируемая карцинома.
Другие злокачественные опухоли.
мазок эпителия шейки матки (см. инструкцию по взятию биоматериала).
Инструкция по взятию материала:
Мазки берутся до бимануального исследования и кольпоскопии. Используемые инструменты должны быть стерильными и сухими, поскольку вода и дезинфицирующие растворы разрушают клеточные элементы.
При профилактическом осмотре женщин (цитологический скрининг) клеточный материал целесообразно получать с поверхности влагалищной части шейки матки (эктоцервикса) и стенок цервикального канала (эндоцервикса), при наличии патологических изменений шейки матки – прицельно.
В качестве инструмента для взятия материала из шейки матки при профилактическом осмотре используются модифицированные шпатели типа Эйра или щетки Cervix-Brash, Papette. С диагностической целью материал получают раздельно: шпателями из эктоцервикса, щетками типа Cytobrash из эндоцервикса.
Полученный биологический материал наносится тонким слоем на предметное стекло и подсушивается на воздухе. Стекло обязательно маркируется с указанием фамилии/кода и места взятия клеточного материала (шейка матки, цервикальный канал). Маркировка на предметном стекле и в направлении на цитологическое исследование должны соответствовать друг другу.
Обращаем внимание, что у девочек до 16 лет гинекологические анализы берутся только в присутствии родителей. В медицинских офисах не делают соскоб и мазок из цервикального канала беременным женщинам со сроком 22 недели и более, так как эта процедура может вызвать осложнения. В случае необходимости для взятия материала вы можете обратиться к своему лечащему врачу.
В направлении на цитологическое исследование биологического материала обязательно указывают клинические данные, диагноз, особенности и место получения материала, данные о менструальном цикле.
Мазок должен быть нанесен тонким слоем на стекло и полностью высушен.
Пролиферация железистого эпителия — Вопрос гинекологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте.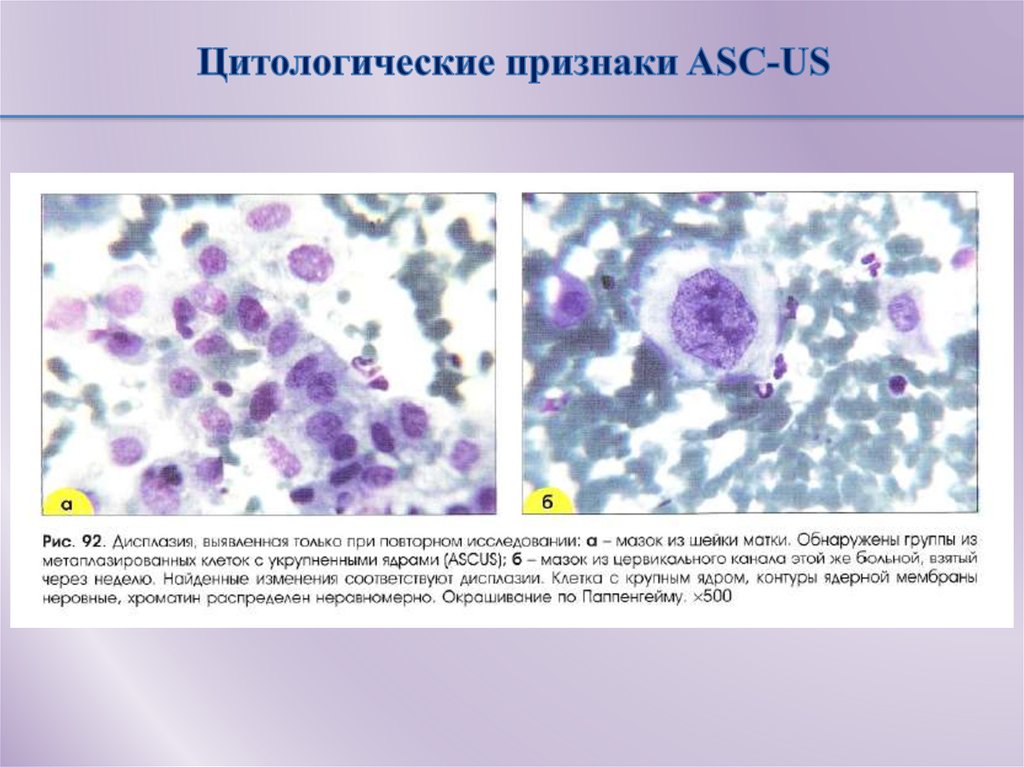 Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 71 направлению: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 71 направлению: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.55% вопросов.
Оставайтесь с нами и будьте здоровы!
Пролиферация железистого эпителия — серьезная угроза женскому здоровью!
Влагалище и шейку матки выстилает специальная ткань, называемая плоским эпителием, который обязательно должен присутствовать у здоровой женщины в мазке. Однако при избыточном его разрастании диагностируется пролиферация железистого эпителия, которая характеризуется появлением атипичных клеток. Данная патология может развиваться в результате доброкачественных заболеваний молочной железы, при которых стремительное разрастание тканей сопровождается болью и несвойственной секрецией. Кроме этого, пролиферация железистого эпителия может возникать из-за чрезмерного воздействия женских половых гормонов, а также различных воспалений, которые обусловлены нарушением микрофлоры или урогенитальными инфекциями. Следует отметить, что такое состояние в большинстве случаев не представляет собой существенной опасности для женского здоровья, однако это не означает, что его не следует лечить.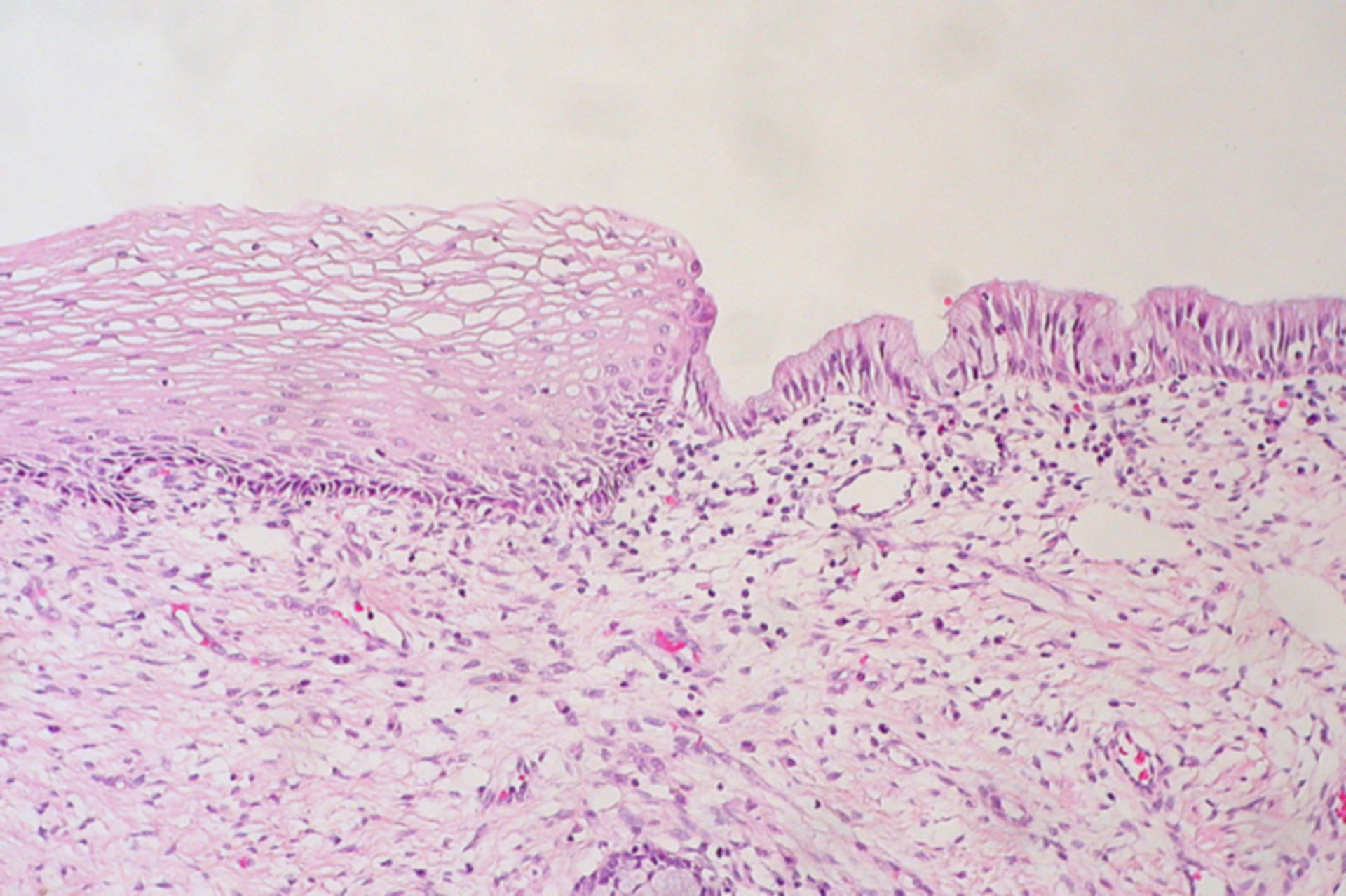
Гиперплазия железистого эпителия
Гиперплазией эндометрия называется маточное заболевание, при котором наблюдается
разрастание тканей, а также изменение структуры слизистой оболочки и желез. Данный процесс осуществляется прямым и непрямым делением клеток и ростом цитоплазматических ультраструктур. К причинам гиперплазии относятся расстройства нервной регуляции обменных процессов, нарушение работы органов внутренней секреции, воздействие на органы и ткани стимуляторов роста, а также наследственная предрасположенность. В большинстве случаев гиперплазия эндометрия, как и пролиферация железистого эпителия, протекает бессимптомно, однако у некоторых женщин она может спровоцировать дисфункциональные кровотечения и такие симптомы анемии, как слабость, головокружение и снижение аппетита.
Аденоматозный полип матки
Аденомой называется заболевание, которое сопровождается разрастанием маточной оболочки, слизистой цервикального канала и образованием специфических выростов — полипов. Иными словами, это пролиферация железистого эпителия, которая локализована в определенном месте. Аденоматозный маточный полип считается предраковым состоянием, которое возникает в результате нарушения выработки женского полового гормона. Однако предрасполагают к развитию данного заболевания и другие факторы, например хроническая форма аднексита и эндометрита, а также многочисленные аборты.
Иными словами, это пролиферация железистого эпителия, которая локализована в определенном месте. Аденоматозный маточный полип считается предраковым состоянием, которое возникает в результате нарушения выработки женского полового гормона. Однако предрасполагают к развитию данного заболевания и другие факторы, например хроническая форма аднексита и эндометрита, а также многочисленные аборты.
Симптомы и лечение
Основными симптомами маточных полипов являются кровотечения, ощущение дискомфорта при половом акте, частые боли и бесплодие. Лечение заболевания проводится хирургическим путем с помощью иссечения образования или выскабливания полости матки. Предраковые заболевания женской репродуктивной системы могут существовать на протяжении очень длительного времени, никак себя не проявляя. Однако бывают случаи, когда атипичные клетки настолько стремительно перерождаются в раковые, что устранить их уже достаточно сложно, а порой вообще невозможно. Поэтому при первых же тревожных сигналах необходимо посетить гинеколога и сдать нужные анализы.
(PDF) ДИАГНОСТИКА ДОБРОКАЧЕСТВЕННЫХ ЗАБОЛЕВАНИЙ ШЕЙКИ МАТКИ
108
ЛУЧЕВАЯ ДИАГНОСТИКА
www.imj.kh.ua
.
поверхности цилиндрического эпителия. Термин
«эрозия» истинному значению соответствует до
покрытия цилиндрическим эпителием всей по-
верхности дефекта плоского многослойного эпи-
телия, после завершенияя этого процесса более
правильным является термин «псевдоэрозия». По
результатам гистологического, цитологического,
гистохимического исследований различают врож-
денную, истинную и псевдоэрозию [2].
Известно, что в области наружного зева име-
ется отчетливая граница между многослойным
плоским эпителием эктоцервикса и цилиндриче-
ским эпителием эндоцервикса. Врожденная эро-
зия характеризуется смещением границы между
указанными видами эпителия за пределы наруж-
ного зева. При этом цилиндрический эпителий
покрывает небольшую зону, располагаясь вокруг
наружного зева. Врожденные эрозии возникают
Врожденные эрозии возникают
в детском и юношеском возрастах. Они имеют
округлую или неправильную форму, ярко-крас-
ный цвет, гладкую поверхность. Признаков пато-
логической секреции из цервикального канала
обычно не бывает, при кольпоскопии симптомы
воспалительной реакции (гиперемия, отечность
и др.) не выявляются. Врожденные эрозии обыч-
но подвергаются обратному развитию без лечения.
При сохранении их до периода половой зрелости
возможно инфицирование эрозий, развитие вос-
палительного процесса с последующими измене-
ниями. Изредка развиваются плоские кондиломы.
Врожденные эрозии не малигнизируются [9].
Истинная эрозия шейки матки характеризу-
ется повреждением и последующей десквамацией
многослойного плоского эпителия ее влагалищ-
ной части. В результате десквамации образуется
раневая поверхность — дефект эпителия с воспа-
лительной реакцией. Эрозия чаще располагается
Эрозия чаще располагается
вокруг наружного зева на задней (реже передней)
губе шейки матки. Кольпоскопия является основ-
ным методом диагностики, при этом эрозия имеет
ярко-красный цвет, неправильную, слегка окру-
гленную форму, часто кровоточит при контакте.
Визуально и при микроскопическом исследовании
в подэпителиальной ткани выявляются расшире-
ние сосудов, нарушения микроциркуляции, отеч-
ность, мелкоклеточные инфильтраты, наложения
фибрина на эрозийной поверхности. Нередко на
ней видны слизисто-гноевидные выделения, по-
ступающие из цервикального канала вследствие
хронического цервицита, который сопутству-
ет истинным эрозиям, являясь наиболее частой
причиной их возникновения. Истинная эрозия
существует в течение 1–2 нед и после переходит
на этап псевдоэрозии. Дефект многослойного
плоского эпителия покрывается цилиндрическим
эпителием за счет резервных клеток, находящих-
ся под цилиндрическим эпителием эндоцервикса.
Эти клетки обладают бипотентными свойствами,
превращаясь то в цилиндрический, то в много-
слойный плоский эпителий. Эту стадию называ-
ют первой стадией заживления истинной эрозии.
Псевдоэрозии характеризуются выраженным
развитием железистых ходов и кист и называются
железистыми. Иногда на поверхности псевдоэро-
зии возникают папиллярные разрастания стромы,
в которых часто находят воспалительные инфиль-
траты. Такие псевдоэрозии называют папиллярны-
ми, точнее железисто-папиллярными. Псевдоэро-
зия может существовать долго до устранения пато-
логических процессов, послуживших причиной ее
возникновения. В то же время псевдоэрозия сама
поддерживает воспалительный процесс в шейке
матки вследствие инфицирования эрозийных же-
лез. Микроорганизмы могут длительно существо-
вать в глубоких отделах эрозионных желез [10].
Большинство авторов считают, что регене-
рирующий многослойный плоский эпителий со
смежных здоровых участков подрастает под ци-
линдрический, который подвергается дистрофии
и десквамации.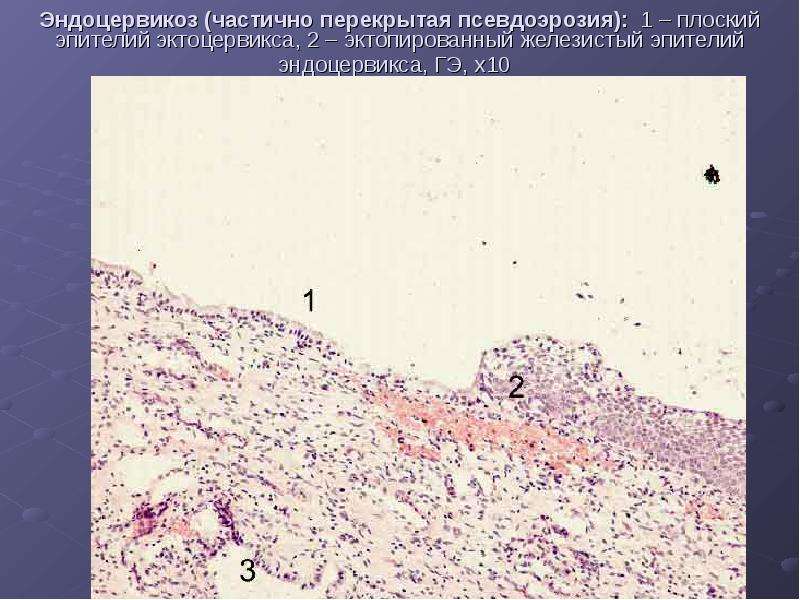 При этом часть эрозийных желез
При этом часть эрозийных желез
может остаться под многослойным плоским эпите-
лием и превратиться в ретенционные (наботовы)
кисты. Они бывают единичными или множествен-
ными, диаметром от 3–5 мм до 8–10 мм. Изредка
мелкие кисты, находящиеся вблизи наружного
зева, могут симулировать наличие полипа или
же рака шейки матки в стадии преинвазии [11,
12]. В процессе заживления псевдоэрозий много-
слойный плоский эпителий может проникнуть
под эрозийные железы, что приводит к полному
отторжению и последующей полной регенерации
нормального эпителиального покрова.
При кольпоскопии псевдоэрозии имеют непра-
вильную форму, красную окраску. На поверхности
псевдоэрозий часто наблюдаются слизисто-гное-
видные, слизистые или желтоватые выделения,
поступающие из цервикального канала (частич-
но из эрозированных желез). Полное заживле-
ние псевдоэрозии характеризуется отторжением
цилиндрического эпителия и эрозийных желез,
полной регенерацией плоского многослойного
эпителия.
Характерных клинических проявлений эрозий
и псевдоэрозий не отмечают, а такие симптомы,
как бели, боль, нарушения менструальной функ-
ции и др., связывают с наличием сопутствующих
заболеваний (цервицит, кольпит, сальпингоофорит
и др.). При кольпоскопии истинные и псевдоэро-
зии проявляются дефектом покровного эпителия
эндоцервикса, на котором видны точечные кро-
воизлияния. После обработки 5 %-ным раство-
ром йода эрозия (псевдоэрозия) выглядит свет-
ло-розовой, начинающиеся зоны превращения —
желтыми, атипические процессы — белыми. При
наличии прямых и косвенных признаков атипии
(дисплазии) производят прицельную биопсию по-
раженного участка с глубоким захватом слизистой
оболочки и подлежащей соединительной ткани,
желательно с последующим иссечением. После
биопсии края раны соединяют швом, чтобы пред-
упредить возможность деформации шейки. Био-
птат помещают в сосуд с 5–10 %-ным раствором
причины, симптомы, диагностика и методы лечения на сайте «Альфа-Центр Здоровья»
Доброкачественное разрастание внутренней слизистой оболочки матки, сопровождается нарушением менструального цикла, ановуляторными маточными кровотечениями, бесплодиемПризнаки гиперплазии эндометрия отмечаются у 5-25% женщин. Этим термином обозначают патологическое увеличение эндометрия – внутреннего слизистого слоя полости матки. В норме он растет каждый месячный цикл. Утолщаясь под влиянием половых гормонов эстрогена и прогестерона, слизистая готовится принять яйцеклетку. Если зачатие не наступает, то снижение уровней гормонов вызывает отторжение ткани. После менструации процесс начинается заново. При гормональном сбое, повышается уровень эстрогенов, что и запускает процесс патологического роста эпителия.
Причины и симптомы гиперплазии эндометрия
Выделяют формы гиперплазии:
- железистая – утолщается железистая ткань слизистой;
- железисто-кистозная – образуются доброкачественные кисты;
- очаговая – появляются железистые и фиброзные полипы;
- атипичная (аденоматозная) – появляются измененные клетки, опасна перерождением в онкологическую форму (аденокарциному).
Основные причины заболевания гормональные сбои. Вероятность столкнуться с признаками гиперплазии эндометрия в периоде полового созревания и в начале климакса, когда в женском организме происходит гормональная перестройка. Ряд смежных проблем усиливают риски появления патологии:
- воспаления в мочеполовой системе;
- аборты, гинекологические операции на матке;
- наследственность;
- лишний вес;
- эндокринные заболевания;
- заболевания маки и придатков – миома, поликистоз яичников;
- неблагоприятная экологическая обстановка;
- гормональная терапия.
Определить патологию только по жалобам пациента сложно. Многие гинекологические заболевания проявляются похожим образом. К основным симптомам гиперплазии эндометрия относятся:
- нерегулярные, частые (чаще, чем 21 день), длительные менструации, с мажущими выделениями между ними;
- боли схваткообразного типа в животе;
- кровянистые выделения в период менопаузы.
Заболевание может протекать бессимптомно, особенно при климаксе.
Как лечить гиперплазию эндометрия
Лечение начинается с постановки точного диагноза. Для этого потребуются:
- гинекологический осмотр;
- УЗИ для оценки размеров, толщины, структуры слизистой матки, кист, полипов;
- гистологическое исследование ткани;
- гистероскопия – осмотр матки специальным датчиком;
- лабораторные тесты на гормоны.
Как лечат гиперплазию эндометрия решает врач. При простых формах эффективно гормональное лечение с применением:
- гестагенов – гормонов яичников и надпочечников;
- внутриматочной спирали;
- оральных контрацептивов, которые нормализуют циклический рост и отторжение ткани;
- гормональную терапию при менопаузе.
Если форма очаговая, то лечить гиперплазию эндометрия придется хирургическим путем, для удаления полипов. При аденоматозной форме – матку удаляют из-за риска появления раковой опухоли.
Лечение гиперплазии эндометрия не эффективно с применением народных методов. Откладывание терапии на «потом» могут привести к необратимым последствиям: бесплодию, анемии, онкологии. При раннем выявлении и соблюдении рекомендаций, шансы на выздоровление высоки.
Железистые поражения шейки матки
Курман Р., Норрис Х., Уилкинсон Э. Опухоли шейки матки, влагалища и вульвы . Vol. 4 . Вашингтон, округ Колумбия: Институт патологии вооруженных сил; 1992.
Google ученый
Friedell G, McKay D. Аденокарцинома in situ эндоцервикса. Cancer 1953; 6 : 887–897.
CAS PubMed Статья Google ученый
Christopherson W, Nealon N, Gray L.Неинвазивные предшественники аденокарциномы и смешанной аденосквамозной карциномы шейки матки. Cancer 1979; 44 : 975–983.
CAS PubMed Статья Google ученый
Гызылбаш А. In-situ и микроинвазивная аденокарцинома шейки матки. Am J Clin Pathol 1975; 64 : 155–170.
CAS PubMed Статья Google ученый
Ляо С.Ю., Брюэр С., Завада Дж., Пасторек Дж., Пасторекова С., Манетта А., и др. .Идентификация антигена MN как диагностического биомаркера цервикального интраэпителиального плоскоклеточного и железистого новообразования и рака шейки матки. Am J Pathol 1994; 145 (3): 598–609.
CAS PubMed PubMed Central Google ученый
Яворски Р. Дисплазия эндоцервикальных желез, аденокарцинома in situ и ранняя инвазивная (микроинвазивная) аденокарцинома шейки матки. Semin Diagn Pathol 1990; 7 : 190–205.
CAS PubMed Google ученый
Каспер Г, Остор А, Куинн М. Клинико-патологическое исследование железистой дисплазии шейки матки. Gynecol Oncol 1997; 64 : 166–170.
CAS PubMed Статья Google ученый
Gompel C, Silverberg S. Патология в гинекологии и акушерстве .Филадельфия: Липпинкотт; 1994.
Google ученый
Браун Л.Дж., Уэллс М. Атипия шейных желез, связанная с плоскоклеточной интраэпителиальной неоплазией: предраковое поражение? J Clin Pathol 1986; 39 (1): 22–28.
CAS PubMed PubMed Central Статья Google ученый
Gloor E, Hurlimann J. Цервикальная интраэпителиальная железистая неоплазия (аденокарцинома in situ и железистая дисплазия): коррелятивное исследование 23 случаев с гистологической классификацией, гистохимическим анализом муцинов и иммуногистохимическим определением сродства к четырем лектинам. Cancer 1986; 58 (6): 1272–1280.
CAS PubMed Статья Google ученый
Клемент П., Янг Р. Глубокие наботианские кисты шейки матки. Int J Gynecol Pathol 1989; 8 : 340–348.
CAS PubMed Статья Google ученый
Fluhmann C. Очаговая гиперплазия (туннельные скопления) шейки матки. Obstet Gynecol 1961; 17 : 206–214.
CAS PubMed Google ученый
Клемент П., Янг Р. Опухоли и опухолевидные поражения тела и шейки матки. В: Рот Л., редактор. Современные проблемы хирургической патологии . Vol. 19 . Нью-Йорк: Черчилль Ливингстон; 1993. стр. 486.
Google ученый
Yeh IT, Li Volsi VA, Noumoff JS.Эндоцервикальная карцинома. Pathol Res Pract 1991; 187 (2–3): 129–144.
CAS PubMed Статья Google ученый
Нода К., Кимура К., Икеда М., Тешима К. Исследования гистогенеза аденокарциномы шейки матки. Int J Gynecol Pathol 1983; 1 : 336–346.
CAS PubMed Статья Google ученый
Fu Y, Рейган Дж. Патология шейки матки, влагалища и вульвы . Vol. 21 . Филадельфия: W.B. Сондерс; 1989.
Google ученый
Burghardt E. Микроинвазивная карцинома в гинекологической патологии. Clin Gynaecol Obstet 1984; 11 : 239–244.
CAS Google ученый
Бушема Дж., Вудрафф Дж. Значение неопластических аномалий в эндоцервикальном эпителии. Gynecol Oncol 1984; 17 : 356–362.
CAS PubMed Статья Google ученый
Остор А, Рим Р, Куинн М. Микроинвазивная аденокарцинома шейки матки: клинико-патологическое исследование 77 женщин. Obstet Gynecol 1997; 89 (1): 88–93.
CAS PubMed Статья Google ученый
Берек Дж., Хакер Н, Фу Й, Сокале Дж., Лойхтер Р., Лагассе Л.Аденокарцинома шейки матки: гистологические параметры, связанные с метастазами в лимфатические узлы и выживаемостью. Obstet Gynecol 1985; 65 : 46–52.
CAS PubMed Google ученый
Тешима С., Симосато Й, Киши К., Касамацу Т., Оми К., Уэй Ю. Аденокарцинома шейки матки на ранней стадии: гистопатологический анализ с учетом гистогенеза. Cancer 1985; 56 (1): 167–172.
CAS PubMed Статья Google ученый
Каспар Х.Г., Динь ТВ, Доэрти МГ, Ханниган Э.В., Кумар Д. Клинические последствия измерения объема опухоли при аденокарциноме шейки матки I стадии. Obstet Gynecol 1993; 81 (2): 296–300.
CAS PubMed Google ученый
Вестеринен Э, Форсс М, Ниеминен У. Увеличение аденокарциномы шейки матки: отчет о 520 случаях рака шейки матки, включая 112 опухолей с железистыми элементами. Gynecol Oncol 1989; 33 (1): 49–53.
CAS PubMed Статья Google ученый
Петерс Р.К., Чао А., Мак TM, Томас Д., Бернштейн Л., Хендерсон Б.Е. Повышенная частота аденокарциномы шейки матки у молодых женщин в округе Лос-Анджелес. J Natl Cancer Inst 1986; 76 (3): 423–428.
CAS PubMed Google ученый
Schwartz S, Weiss N.Повышенная заболеваемость аденокарциномой шейки матки у молодых женщин в США. Am J Epidemiol 1986; 124 : 1045–1047.
CAS PubMed Статья Google ученый
Бринтон Л.А., Хаггинс Г.Р., Леман ХФ, Маллин К., Савиц Д.А., Трапидо Е., и др. . Длительное использование оральных контрацептивов и риск инвазивного рака шейки матки. Int J Cancer 1986; 38 (3): 399–444.
Артикул Google ученый
Бринтон Л.А., Ташима К.Т., Леман ХФ, Левин Р.С., Маллин К., Савиц Д.А., и др. . Эпидемиология рака шейки матки по типу клеток. Cancer Res 1987; 47 (6): 1706–1711.
CAS PubMed Google ученый
Окагаки Т, Тасе Т, Твиггс Л.Б., Карсон ЛФ. Гистогенез аденокарциномы шейки матки со ссылкой на вирус папилломы-18 человека как канцероген. J Reprod Med 1989; 34 (9): 639–644.
CAS PubMed Google ученый
Фарнсворт А., Лаверти С., Столер М.Х. Экспрессия матричной РНК вируса папилломы человека в аденокарциноме in situ шейки матки. Int J Gynecol Pathol 1989; 8 (4): 321–330.
CAS PubMed Статья Google ученый
Тасэ Т., Окагаки Т., Кларк Б.А., Твиггс Л.Б., Острув Р.С., Фарас А.Дж.ДНК вируса папилломы человека при железистой дисплазии и микрогландулярной гиперплазии: предполагаемые предшественники аденокарциномы шейки матки. Obstet Gynecol 1989; 73 (6): 1005–1008.
CAS PubMed Google ученый
Дагган М.А., МакГрегор С.Е., Бенуа Дж. Л., Иноуэ М., Нация Дж. Г., Стюарт Г. К.. Статус вируса папилломы человека инвазивной аденокарциномы шейки матки: клинико-патологический анализ и анализ результатов. Хум Патол 1995; 26 (3): 319–325.
CAS PubMed Статья Google ученый
Milde-Langosch K, Schreiber C, Becker G, Loning T, Stegner HE. Выявление вируса папилломы человека при аденокарциноме шейки матки методом полимеразной цепной реакции. Хум Патол 1993; 24 (6): 590–594.
CAS PubMed Статья Google ученый
Yamakawa Y, Forslund O, Teshima H, Hasumi K, Kitagawa T., Hansson BG.ДНК вируса папилломы человека при аденокарциноме и аденосквамозной карциноме шейки матки выявляется методом полимеразной цепной реакции (ПЦР). Gynecol Oncol 1994; 53 : 190–195.
CAS PubMed Статья Google ученый
Чилверс С, Мант Д, Пайк М. Аденокарцинома шейки матки и оральные контрацептивы. Br J Med (Clin Res Ed ) 1987; 295 : 1446–1447.
CAS Статья Google ученый
Весси М., Лоулесс М., Макферсон К., Йейтс Д.Новообразование шейки матки и использование противозачаточных средств: возможное побочное действие таблетки. Lancet 1983; 2 : 930–934.
CAS PubMed Статья Google ученый
Dallenbach-Hellweg G. О происхождении и гистологической структуре аденокарциномы эндоцервикса у женщин до 50 лет. Pathol Res Pract 1984; 179 : 38–50.
CAS PubMed Статья Google ученый
Урсин Г., Петерс Р.К., Хендерсон Б.Е., д’Аблаинг Г. III, Монро К.Р., Пайк М.К.Использование оральных контрацептивов и аденокарцинома шейки матки. Lancet 1994; 344 (8934): 1390–1394.
CAS PubMed Статья Google ученый
Thomas DB, Ray RM. Оральные контрацептивы и инвазивные аденокарциномы и аденосквамозные карциномы шейки матки: совместное исследование неоплазии и стероидных контрацептивов Всемирной организацией здравоохранения. Am J Epidemiol 1996; 144 (3): 281–289.
CAS PubMed Статья Google ученый
Parazzini F, La Vecchia C. Эпидемиология аденокарциномы шейки матки. Gynecol Oncol 1990; 39 : 40–46.
CAS PubMed Статья Google ученый
Look KY, Brunetto VL, Clarke-Pearson DL, Averette HE, Major FJ, Alvarez RD, et al . Анализ клеточного типа у пациентов с хирургической стадией карциномы шейки матки IB: исследование группы гинекологической онкологии. Gynecol Oncol 1996; 63 : 304–311.
CAS PubMed Статья Google ученый
Dabbs DJ, Sturtz K, Zaino RJ. Иммуногистохимическая дискриминация эндометриоидных аденокарцином. Хум Патол 1996; 27 (2): 172–177.
CAS PubMed Статья Google ученый
Young RH, Scully RE.Виллогландулярная папиллярная аденокарцинома шейки матки: клинико-патологический анализ 13 случаев. Cancer 1989; 63 (9): 1773–1779.
CAS PubMed Статья Google ученый
Джонс М.В., Сильверберг С.Г., Курман Р.Дж. Хорошо дифференцированная виллогландулярная аденокарцинома шейки матки: клинико-патологическое исследование 24 случаев. Int J Gynecol Pathol 1993; 12 (1): 1–7.
CAS PubMed Статья Google ученый
Каку Т., Камура Т., Шигемацу Т., Сакаи К., Наканами Н., Уехира К., и др. . Аденокарцинома шейки матки с преимущественно виллогландулярным папиллярным типом роста. Gynecol Oncol 1997; 64 (1): 147–152.
CAS PubMed Статья Google ученый
Майкл Х., Саттон Дж., Халл М.Т., Рот Л.М.Ворсинчатая аденома шейки матки, ассоциированная с инвазивной аденокарциномой: гистологическое, ультраструктурное и иммуногистохимическое исследование. Int J Gynecol Pathol 1986; 5 (2): 163–169.
CAS PubMed Статья Google ученый
Каку Т., Эндзидзи М. Чрезвычайно хорошо дифференцированная аденокарцинома (злокачественная аденома) шейки матки. Int J Gynecol Pathol 1983; 2 : 28–41.
CAS PubMed Статья Google ученый
Камински П., Норрис Х. Карцинома минимального отклонения (злокачественная аденома) шейки матки. Int J Gynecol Pathol 1983; 2 : 141–152.
CAS PubMed Статья Google ученый
Гилкс С., Янг Р., Агирре П., Делеллис Р., Скалли Р. Злокачественная аденома (аденокарцинома минимального отклонения) шейки матки. Am J Surg Pathol 1989; 13 : 717–729.
CAS PubMed Статья Google ученый
Майкл Х., Грава Л., Краус Ф. Эндоцервикальная аденокарцинома с минимальным отклонением: клинические и гистологические особенности, иммуногистохимическое окрашивание на CEA и дифференциация от смешанных доброкачественных образований. Int J Gynecol Pathol 1984; 3 : 261–276.
CAS PubMed Статья Google ученый
Young RH, Scully RE.Эндометриоидная аденокарцинома шейки матки с минимальным отклонением: отчет о пяти случаях характерного новообразования, которое может быть ошибочно интерпретировано как доброкачественное. Am J Surg Pathol 1993; 17 (7): 660–665.
CAS PubMed Статья Google ученый
Гилкс CB, Клемент ПБ. Папиллярная серозная аденокарцинома шейки матки: отчет о трех случаях. Mod Pathol 1992; 5 (4): 426–431.
CAS PubMed Google ученый
Чжоу С., Гилкс С.Б., Хейс М., Клемент ПБ. Папиллярная серозная карцинома шейки матки: клинико-патологическое исследование 17 случаев. Am J Surg Pathol 1998; 22 : 113–120.
CAS PubMed Статья Google ученый
Ferry JA, Scully RE. Остатки мезонефрии, гиперплазия и новообразования в шейке матки: исследование 49 случаев. Am J Surg Pathol 1990; 14 (12): 1100–1111.
CAS PubMed Статья Google ученый
Валенте PT, Сусин М. Аденокарцинома шейки матки, возникающая при гиперплазии мезонефральной гиперплазии: отчет о случае с иммуноцитохимическими исследованиями. Gynecol Oncol 1987; 27 (1): 58–68.
CAS PubMed Статья Google ученый
Lang G, Dallenbach-Hellweg G.Иммуногистохимическими методами изучено гистогенетическое происхождение мезонефральной гиперплазии шейки матки и мезонефрической аденокарциномы шейки матки. Int J Gynecol Pathol 1990; 9 (2): 145–157.
CAS PubMed Статья Google ученый
Ferry JA, Scully RE. «Аденоидно-кистозная» карцинома и аденоидная базальная карцинома шейки матки: исследование 28 случаев. Am J Surg Pathol 1988; 12 (2): 134–144.
CAS PubMed Статья Google ученый
Грейсон В., Тейлор Л., Купер К. Аденоидно-кистозная и аденоидная базальная карцинома шейки матки. Am J Surg Pathol 1999; 23 : 448–458.
CAS PubMed Статья Google ученый
Cina SJ, Richardson MS, Austin RM, Kurman RJ. Иммуногистохимическое окрашивание на антиген Ki-67, карциноэмбриональный антиген и p53 в дифференциальной диагностике железистых поражений шейки матки. Mod Pathol 1997; 10 (3): 176–180.
CAS PubMed Google ученый
Флуманн С. Железистые структуры шейки матки. Surg Gynecol Obstet 1958; 106 : 715–723.
CAS PubMed Google ученый
Segal GH, Hart WR. Кистозные эндоцервикальные туннельные кластеры: клинико-патологическое исследование 29 случаев так называемой аденоматозной гиперплазии. Am J Surg Pathol 1990; 14 (10): 895–903.
CAS PubMed Статья Google ученый
Джонс М.А., Янг Р.Х., Скалли Р.Р. Диффузная ламинарная эндоцервикальная железистая гиперплазия: доброкачественное образование, которое часто путают со злокачественной аденомой (аденокарцинома с минимальным отклонением). Am J Surg Pathol 1991; 15 (12): 1123–1129.
CAS PubMed Статья Google ученый
Тейлор Х., Айри Н., Норрис Х.Атипичная эндоцервикальная гиперплазия у женщин, принимающих оральные контрацептивы. JAMA 1967; 202 : 185–190.
Артикул Google ученый
Кириакос М, Кемпсон Р, Коников Н. Клинико-патологическое исследование эндоцервикальных поражений, связанных с оральными контрацептивами. Cancer 1968; 22 : 99–109.
CAS PubMed Статья Google ученый
Грили С., Шредер С., Сильверберг С.Г.Микрогландулярная гиперплазия шейки матки: настоящее «таблеточное» поражение? Int J Gynecol Pathol 1995; 14 (1): 50–54.
CAS PubMed Статья Google ученый
Young RH, Scully RE. Атипичные формы микрогландулярной гиперплазии шейки матки, моделирующие карциному: отчет о пяти случаях и обзор литературы. Am J Surg Pathol 1989; 13 (1): 50–56.
CAS PubMed Статья Google ученый
Джонс М.А., Эндрюс Дж., Тарраза Х.М.Остаточная мезонефрическая гиперплазия шейки матки: клинико-патологический анализ 14 случаев. Gynecol Oncol 1993; 49 (1): 41–47.
CAS PubMed Статья Google ученый
Джонассон Дж. Г., Ван Х. Х., Антониоли Д. А., Дукатман Б. С.. Трубная метаплазия шейки матки: исследование распространенности у пациентов с гинекологическими патологическими данными. Int J Gynecol Pathol 1992; 11 (2): 89–95.
CAS PubMed Статья Google ученый
Сух К.С., Сильверберг С.Г. Трубная метаплазия шейки матки. Int J Gynecol Pathol 1990; 9 (2): 122–128.
CAS PubMed Статья Google ученый
McCluggage WG, Maxwell P, McBride HA, Hamilton PW, Bharucha H. Моноклональные антитела Ki-67 и MIB1 в отличии метаплазии тубоэндометрия от аденокарциномы шейки матки и аденокарциномы in situ в фиксированном формалином материале. Int J Gynecol Pathol 1995; 14 (3): 209–216.
CAS PubMed Статья Google ученый
Oliva E, Clement PB, Young RH. Трубная и трубчато-эндометриоидная метаплазия шейки матки: невыявленные особенности, которые могут вызвать проблемы при дифференциальной диагностике: сообщение о 25 случаях. Am J Clin Pathol 1995; 103 (5): 618–623.
CAS PubMed Статья Google ученый
Шлезингер С., Сильверберг С.Г.Эндоцервикальная аденокарцинома in situ трубного типа и ее связь с атипичной трубной метаплазией. Int J Gynecol Pathol 1999; 18 : 1–4.
CAS PubMed Статья Google ученый
Cove H. Реакция Ариаса-Стеллы, возникающая в эндоцервиксе при беременности. Am J Surg Pathol 1979; 3 : 567–568.
CAS PubMed Статья Google ученый
Гольдштейн Н.С., Мани А.Состояние и расстояние краев биопсии конуса как предиктор адекватности удаления при эндоцервикальной аденокарциноме in situ . Am J Clin Pathol 1998; 109 (6): 727–732.
CAS PubMed Статья Google ученый
Эктропион шейки матки — StatPearls — Книжная полка NCBI
Непрерывное образование
Эктропион шейки матки является доброкачественным гинекологическим заболеванием и считается нормальным вариантом, который часто встречается у женщин репродуктивного возраста.Это происходит из-за повышенного воздействия эстрогена на эпителий шейки матки. Диагноз ставится при плановом гинекологическом осмотре или Пап-скрининге. В этом упражнении рассматриваются этиология, патофизиология, оценка и лечение эктропиона шейки матки и подчеркивается роль межпрофессиональной группы в уходе за пациентами с этим заболеванием.
Целей:
-
Опишите этиологию выворота шейки матки.
-
Обрисуйте соответствующую оценку выворота шейки матки.
-
Определите доступные варианты лечения выворота шейки матки.
-
Обобщите важность улучшения координации помощи между членами межпрофессиональной команды для улучшения результатов для пациентов, пострадавших от эктропиона шейки матки.
Введение
Выворот шейки матки — доброкачественное заболевание, которое рассматривается как нормальный вариант, встречающийся у женщин репродуктивной возрастной группы.В этом состоянии железистые клетки (столбчатый эпителий), выстилающие эндоцервикс, присутствуют на эктоцервиксе, что приводит к контакту столбчатых клеток со средой влагалища. Это также известно как эктопия шейки матки или выворот шейки матки. [1] Это состояние также называют эрозией шейки матки, что вводит в заблуждение, поскольку на самом деле эрозия шейки матки отсутствует. [2]
Выворот шейки матки обычно обнаруживают при плановом гинекологическом осмотре женщин репродуктивного возраста.Это бессимптомный вариант, но он коррелирует с хроническим цервицитом. Это обычное физиологическое состояние среди подростков и беременных женщин.
Этиология
Возникновение эктропиона шейки матки связано с повышенным уровнем эстрогена. Шейка матки очень чувствительна к эстрогену, вызывая разрастание и дифференцировку эпителия шейки матки. Следовательно, эктропион шейки матки обычно встречается в условиях высокого воздействия эстрогена, а именно:
-
Подростки
-
Беременность
-
Женщины, принимающие гормональные контрацептивы
-
Наиболее часто наблюдаемые в годы менструации в овуляторной фазе
Это может быть врожденное заболевание, связанное с сохранением чешуйчато-столбчатого перехода в исходном неонатальном месте.Во время позднего развития плода и в первый месяц жизни воздействие материнских гормонов стимулирует гиперактивность эндоцервикального цилиндрического эпителия и вызывает эктропион шейки матки.
Нечасто встречается у женщин в постменопаузе. В фазе постменопаузы уровень эстрогена снижается, в результате чего шейка матки сокращается и инвертируется, в результате чего плоскоклеточный эпителий эктоцервикса втягивается в эндоцервикальный канал.
Эпидемиология
Выворот шейки матки — одно из наиболее часто встречающихся гинекологических состояний.Распространенность выворота шейки матки колеблется от 17 до 50 процентов. Распространенность увеличивается с ростом числа детей, но снижается с возрастом 35 лет и старше. Выворот шейки матки встречается у 80% сексуально активных подростков. Распространенность также зависит от типа используемых противозачаточных средств. Это чаще встречается у женщин, принимающих оральные противозачаточные таблетки, и в меньшей степени у женщин, использующих барьерные методы контрацепции. [3] [4]
Исследования показывают, что 54,9 процента женщин в Бенгази, Ливия, которые принимают оральные противозачаточные таблетки и внутриматочные медные устройства, имеют эктропион шейки матки.Таким образом, это было самое распространенное гинекологическое расстройство в этой популяции. У 43,2 процента женщин в Китае был выворот шейки матки [4]. Распространенность эктропиона шейки матки составляет около 29 процентов у недоношенных новорожденных женского пола и 68 процентов в течение первого месяца жизни из-за передачи материнского эстрогена через плаценту [5].
Патофизиология
Шейка матки — это нижняя часть матки, состоящая из двух частей:
-
Эндоцервикс. Это проксимальная часть шейки матки.
-
Эктоцервикс. Это дистальная часть шейки матки, которая выступает во влагалище.
Плоско-столбчатое соединение — это область шейки матки, где встречаются столбчатый и плоский эпителий. Положение чешуйчато-столбчатого перехода зависит от возраста и уровня гормонов. Положение чешуйчато-столбчатого сочленения у новорожденных меняется в зависимости от гормонального фона в утробе матери, в период полового созревания, во время беременности и после менопаузы. При рождении и менархе он располагается внутри цервикального канала.В репродуктивном возрасте столбчатый эпителий расширяется наружу на эктоцервикс по мере развития шейки матки. Это приводит к тому, что чешуйчато-столбчатое соединение также перемещается наружу, подвергая его воздействию кислого pH влагалища. При вывороте шейки матки происходит выворот плоского столбчатого соединения, а также столбчатого эпителия эндоцервикса на эктоцервикс. Со временем клетки базальнее столбчатых клеток разрастаются и дифференцируются в плоскоклеточные клетки, заменяя, таким образом, вышележащие столбчатые клетки.[6] Выворот шейки матки со временем уменьшается за счет двух процессов: плоской метаплазии и эпителизации. [7] [8]
По мере развития двух вышеуказанных процессов эктропион шейки матки с возрастом уменьшается. В результате этих процессов образуется новый чешуйчато-столбчатый стык. Зона трансформации — это динамическая область, расположенная на эктоцервиксе. Зона трансформации находится между исходным плоскоколончатым соединением и текущим плоскоколончатым соединением, где метапластический плоский эпителий заменил столбчатый эпителий, который является областью эктропиона.
Выворот шейки матки — частая находка при беременности. Процесс выворота начинается рано, но наиболее выражен во втором и третьем триместрах. Репродуктивные гормоны играют наиболее важную роль, но в третьем триместре венозная обструкция может быть одним из факторов развития шейного эктропиона. В послеродовом периоде вывернутый столбчатый эпителий возвращается обратно в эндоцервикс из-за уменьшения объема шейки матки [10].
У женщин в постменопаузе чешуйчато-столбчатое соединение невидимо, поскольку оно отступает в эндоцервикс.
Выворот шейки матки был связан с инфекцией из-за Chlamydia trachomatis . [11] Это можно объяснить тем фактом, что Chlamydia trachomatis отдает предпочтение железистому эпителию. Также области эктропиона представляют собой область низкого клеточного иммунитета. В этих областях уменьшается количество субпопуляций Т-лимфоцитов, а именно Т-хелперных клеток, CD8-клеток и CD1-лимфоцитов. [12] Поэтому он более восприимчив к таким инфекциям, как Chlamydia .Более того, гормональные контрацептивы, в основном депо ацетат медроксипрогестерона, коррелируют как с эктропионом шейки матки, так и с хламидийной инфекцией, что еще больше повышает восприимчивость женщин с эктропионом шейки матки к хламидийной инфекции [13].
Женщины с выворотом шейки матки также имеют более высокую восприимчивость к инфекции Neisseria gonorrheae . Риск заражения вирусом иммунодефицита человека (ВИЧ) также выше у женщин с выворотом шейки матки.[14] [15] Однако нет никакой связи между выворотом шейки матки и сифилисом, трихомониазом и инфекциями, вызванными цитомегаловирусом, дрожжами и грибами. [6] [16] [17]
Гистопатология
Микроскопическое исследование нормальной шейки матки показывает следующее:
-
Эндоцервикс обычно выстлан однослойными столбчатыми клетками, секретирующими слизь, как с ресничками, так и без ресничек. Шейка матки не содержит истинных железистых единиц; вместо этого эпителий сворачивается в продольные складки, которые инвагинируют, образуя крипты в центральном канале.Нересничные клетки секретируют муцин в гранулированной форме посредством экзоцитоза, а реснитчатые клетки продвигают секретируемый муцин. В эпителии есть недифференцированные резервные клетки. Однослойный эпителий представляет собой тонкий эпителий, который легко проникает в кровеносные сосуды стромы, придавая ему красный цвет.
-
Эктоцервикс обычно выстлан многослойным многослойным плоским неороговевшим эпителием. Эпителий состоит из четырех типов клеток, включая базальные клетки (самый глубокий слой клеток), парабазальные клетки, промежуточные клетки и поверхностные клетки.
-
Зона трансформации образована слоем эндоцервикальных резервных клеток, дифференцирующихся по направлению к клону плоских клеток. Его внешний вид похож на парабазальные клетки, но с относительно меньшим количеством цитоплазмы и плотными ядрами. Неспецифические воспалительные инфильтраты, состоящие из лимфоцитов, плазматических клеток и даже нейтрофилов, встречаются часто и не обязательно связаны с инфекцией.
При эктропионе шейки матки железистые эндоцервикальные клетки находятся на эктоцервиксе; таким образом, область вокруг зева шейки матки теперь становится красной.Кроме того, поскольку эндоцервикальные клетки более хрупкие и теперь подвергаются воздействию влагалищной среды, они более уязвимы для травм, например, во время полового акта. [18] [19]
Однако со временем недифференцированные резервные клетки эндоцервикса размножаются и дифференцируются. Первоначально это рассматривается как единый (не стратифицированный) слой маленьких круглых клеток с темными ядрами, расположенными очень близко к ядрам столбчатых клеток, которые далее пролиферируют с образованием гиперплазии резервных клеток . По мере прогрессирования метапластического процесса резервные клетки эндоцервикса пролиферируют и дифференцируются, образуя тонкий эпителий незрелых плоских клеток без расслоения. Этот новообразованный эпителий известен как незрелый плоский метапластический эпителий. Со временем незрелые метапластические плоские клетки дифференцируются в зрелый многослойный метапластический эпителий.
История и физика
Выворот шейки матки чаще всего протекает бессимптомно. В симптоматических случаях у женщин может наблюдаться любое из следующего:
-
Выделения из влагалища.Это наиболее часто проявляющийся симптом. Выделения из влагалища негнойные, могут быть белого или желтого цвета. Увеличена площадь поверхности слизистых столбчатых клеток; поэтому женщины с выворотом шейки матки испытывают обильные выделения из влагалища.
- Посткоитальное кровотечение. Это наблюдается у 5-25 процентов женщин с выворотом шейки матки. Тонкие кровеносные сосуды эпителия очень легко разрываются во время полового акта, что приводит к посткоитальному кровотечению. [20] Выворот шейки матки — одна из частых причин вагинального кровотечения в третьем триместре беременности.
-
Межменструальное кровотечение
-
Диспареуния
-
Боль в области таза
-
Рецидивирующий цервицит
-
Боль в спине
-
Появление покраснения в эпилепсии
Нарушения мочеиспускания на
кольцо вокруг внешнего зева. Посткоитальное кровотечение и красноватый оттенок шейки матки при осмотре зеркала можно спутать с ранними признаками рака шейки матки.Выворот шейки матки не является ранним признаком или симптомом рака шейки матки.
Симптомы эктропиона шейки матки и десквамативного воспалительного вагинита могут совпадать. Десквамативный воспалительный вагинит — это хронический вагинит с выделениями из влагалища, вульвовагинальным дискомфортом, диспареунией, эритематозными пятнами на шейке матки при осмотре в зеркалах. Причинно-следственной связи между выворотом шейки матки и десквамативным воспалительным вагинитом не обнаружено. [1]
Оценка
В большинстве случаев эктропион шейки матки, будучи бессимптомным, диагностируется во время обычного гинекологического осмотра или во время скрининга Папаниколау.[21] Выворот шейки матки оценивается и количественно определяется с помощью прямого осмотра с помощью зеркала без посторонней помощи, который показывает красноватую область вокруг зева шейки матки.
Продолжаются исследования, чтобы исключить другие возможности. К ним относятся следующие:
-
Тесты амплификации нуклеиновой кислоты на хламидиоз и гонорейный цервицит.
-
Тройной тампон. Для исключения цервицита берут эндоцервикальный мазок и мазки из влагалища. В основном это делается при гнойных выделениях из влагалища.
- Отличить эктропион шейки матки от интраэпителиальной неоплазии шейки матки и рака шейки матки сложно при макроскопической визуализации. Хотя эктропион шейки матки не связан с раком шейки матки, в случае боли в шее или кровянистых выделений наряду с красной воспаленной шейкой матки можно провести следующие тесты, чтобы исключить цервицит, интраэпителиальную неоплазию шейки матки (CIN) и рак шейки матки: [18 ] [22] [23]
-
Мазок Папаниколау
-
Кольпоскопия
-
Кольпоскопия с биопсией
Качественный тест на ХГЧ на бета-тест в моче проводится, так как репродуктивный гормональный фон во время беременности часто приводит к развитие выворота шейки матки.
Лечение / ведение
Выворот шейки матки не требует лечения, если только симптомы не влияют на повседневную жизнь пациента. Лечение первой линии — это прекращение приема гормональных контрацептивов, таких как оральные противозачаточные таблетки, депо ацетат медроксипрогестерона, и переход на негормональные методы контрацепции. Если симптомы не исчезнут, может быть предложено следующее лечение:
-
Электрокоагуляция также известна как холодовая коагуляция. Зонд для прижигания удерживают в течение 30 секунд против области эктропиона, в то время как эту область обрабатывают теплом, чтобы разрушить аномальные клетки.
- Криотерапия (замораживание): зонд для прижигания удерживают в течение двух минут против эктропиона, пока область замораживается. [24] Было замечено, что после лечения криотерапией наблюдается улучшение качества цервикальной слизи. [25] Таким образом, бесплодных женщин, у которых наряду с враждебной цервикальной слизью также имеется выворот шейки матки, можно лечить криотерапией. Это безопасно во время беременности. [24] [26] [27]
- СВЧ-коагуляция тканей. Хотя внешний вид шейки матки улучшается после микроволновой коагуляции ткани, не было обнаружено никаких других преимуществ по сравнению с терапией суппозиториями интерфероном-альфа или криотерапией.[28] Некоторые исследования показывают, что после микроволновой коагуляции тканей вагинальное кровотечение уменьшается по сравнению с вагинальным кровотечением после лазерной терапии.
-
Лазерная терапия. В этой процедуре лазерный луч на диоксиде углерода используется для разрушения аномального эпителия шейки матки, видимого при увеличении через кольпоскоп. Это амбулаторная процедура, которая не проводится под общей или местной анестезией. Преимущества лазерной терапии — лучшая точность, незначительная боль после процедуры и быстрое заживление.
-
Суппозиторий с альфа-интерфероном. Обладает иммуномодулирующим и антипролиферативным действием. Интерферон-альфа усиливает функцию Т-лимфоцитов.
- Суппозиторий вагинальный полидезоксирибонуклеотид. Это приводит к повторной эпителизации области эктропиона, таким образом уменьшая размер эктропиона. [26] Эффективность этого метода объясняется отличной переносимостью и соблюдением режима лечения среди пользователей, уменьшением воспаления, увеличением темных от йода участков, восстановлением нормального баланса Т- и В-лимфоцитов и снижением интенсивности симптомов.[29] [30]
-
Вагинальные суппозитории с борной кислотой можно использовать для повышения кислотности pH.
- Применение аутологичной плазмы, обогащенной тромбоцитами. Это многообещающая терапия. Время заживления тканей короткое, а кровотечение после процедуры намного меньше, чем при лазерной терапии. [31] [32]
- Сфокусированный ультразвук — еще один многообещающий метод лечения симптоматического эктропиона шейки матки, так как его можно использовать у самых разных женщин. [33] [34]
При каутеризации или микроволновой терапии коагуляцией тканей показатель излечения составляет 92 процента.Показатель излечения при лечении лазером составляет 79 процентов.
Успех лечения определяется следующим:
-
Улучшение внешнего вида шейки матки, ранее имевшей ярко-красный цвет
-
Уменьшение симптомов
-
Улучшение характеристик цервикальной слизи
-
Восстановление T и популяции B-лимфоцитов
Ультразвук не является надежным методом для контроля эффективности лечения эктропиона шейки матки.[35]
После соответствующего лечения следующие симптомы должны побудить пациента вернуться в клинику для дальнейшего обследования на инфекцию шейки матки или неоплазию.
Дифференциальный диагноз
Следующие ниже состояния имеют признаки или симптомы, похожие на эктропион шейки матки, и могут потребовать дальнейшего обследования. [18] [36]
-
Рак шейки матки. Посткоитальное кровотечение, межменструальное кровотечение, выделения из влагалища, жалобы на мочеиспускание, область красного цвета вокруг зева шейки матки при осмотре зеркала побуждают к дальнейшим исследованиям, чтобы исключить рак шейки матки.
-
Цервикальная интраэпителиальная неоплазия (ЦИН). При осмотре зеркала область красного цвета вокруг зева шейки матки может вызывать тревогу и побуждать к дальнейшему обследованию, чтобы исключить CIN.
-
Инфекционный цервицит. Присутствие увеличенных выделений из влагалища, которые могут быть гнойными, посткоитальными и межменструальными кровотечениями, побуждает к дальнейшему обследованию, чтобы исключить цервицит. Другие признаки и симптомы, такие как недавний незащищенный половой акт и инфекционный цервицит в анамнезе, подтверждают диагноз инфекционного цервицита.
- Хронический цервицит, то есть негонококковый нехламидийный цервицит. [37]
-
Вульвовагинит.
-
Воспалительные заболевания органов малого таза. Лихорадка, дисменорея, дисхезия, зуд или жжение вульвовагинальной области, гнойные выделения из влагалища, которые могут быть окрашены кровью, боль в области таза, болезненность при движении шейки матки, бесплодие, инфекционный цервицит в анамнезе способствует диагностике воспалительного заболевания органов малого таза.
- Десквамативный воспалительный вагинит.Это хронический воспалительный вагинит, наиболее часто встречающийся у женщин в перименопаузе. Его лечат вагинальным кремом с клиндамицином 2%, вагинальным кремом с гидрокортизоном 10% или вагинальными суппозиториями 25 мг кортизона ацетата. Было отмечено, что в рефрактерных случаях может быть полезна абляция. [1]
-
Беременность
Прогноз
Эктропион шейки матки обычно не приводит к медицинским осложнениям. Исследования показывают, что рутинное лечение эктропиона шейки матки бесполезно.Только женщины с симптомами должны рассматривать лечение. В противном случае проблема обычно разрешается сама собой, сверхурочно. [3] [38]
Тем не менее, эктропион шейки матки увеличивает уязвимость заражения инфекциями, передаваемыми половым путем, включая хламидиоз, цервицит, гонорею и ВИЧ. [21] Исследования показали, что польза от лечения выворота шейки матки проявляется только в некоторых группах, например, у женщин из группы высокого риска, которые с большей вероятностью могут заразиться этими инфекциями. В противном случае лечение женщин от выворота шейки матки среди населения в целом не обеспечивает достаточной защиты от этих инфекций, учитывая большое количество женщин, прошедших лечение.
Хотя эктропион шейки матки может предрасполагать к инфекции ВПЧ, он не является предшественником интраэпителиальной неоплазии шейки матки и рака шейки матки. Вместо этого было обнаружено, что не эктропион шейки матки, а процесс плоскоклеточной метаплазии приводит к повышенной уязвимости к инфекции ВПЧ 16, которая имеет злокачественный потенциал. Это связано с тем, что процесс репликации и дифференцировки клеток-хозяев во время плоскоклеточной метаплазии может быть благоприятной почвой для репликации вируса ВПЧ. [39]
Выворот шейки матки не приводит к бесплодию.Не оказывает вредного воздействия на беременность или плод.
Осложнения
Хотя эктропион шейки матки проходит со временем, он создает уязвимую почву для посева различных инфекций, передаваемых половым путем, из которых наиболее распространен хламидийный цервицит. Выворот шейки матки может быть изнурительным для женщин, у которых наблюдаются обильные выделения из влагалища или частые вагинальные кровотечения. Однако соответствующее лечение помогает облегчить эти симптомы.
Легкие осложнения могут быть отмечены после абляционных методов лечения.Эти осложнения включают легкое вагинальное кровотечение, раздражение влагалища, скудные выделения из влагалища или спазматическую боль в области таза. Однако они не мешают повседневной жизни и проходят через несколько недель после процедуры. Преимущества терапии, включая долгосрочное облегчение симптомов и безопасную, простую и недорогую амбулаторную процедуру, намного перевешивают незначительные риски.
Сдерживание и обучение пациентов
Пациенты с выворотом шейки матки могут не знать о нем до тех пор, пока он не будет диагностирован при обычном гинекологическом осмотре или мазке Папаниколау.Наличие таких симптомов, как вагинальное кровотечение, диспареуния, обильные выделения из влагалища, может настораживать пациенток. Пациентов обычно беспокоит возможность рака шейки матки, цервицита и бесплодия.
Важно проинформировать пациента о доброкачественности эктропиона шейки матки. Это не связано с патологическими состояниями, но требуется проведение других тестов, чтобы исключить возможность этих состояний. Пациент должен быть полностью проинформирован о доступных методах лечения и предлагаемом лечении, если симптомы беспокоят.Это поможет снизить страх перед ненужным финансовым бременем, последствиями для работы из-за частых посещений больницы и нарушения репродуктивного и сексуального здоровья.
Улучшение результатов команды здравоохранения
Выворот шейки матки представляет собой диагностическую дилемму. У этих пациентов могут быть неспецифические признаки и симптомы, такие как выделения из влагалища от белого до желтого цвета, посткоитальное или межменструальное кровотечение, боль в области таза и диспареуния. Такие признаки и симптомы приводят к множеству дифференциальных диагнозов, включая состояния, которые могут иметь шейное, вагинальное или вульварное происхождение.Межпрофессиональная команда, которая обеспечивает целостный и комплексный подход к формулированию плана управления, может помочь достичь наилучших возможных результатов.
Хотя гинеколог всегда оказывает помощь пациентам с выворотом шейки матки, важно проконсультироваться с межпрофессиональной группой специалистов, в которую входят радиолог, хирург и инфекционист. Вмешательства, проводимые для исключения более тяжелых состояний, пагубно сказываются на психической, социальной и сексуальной жизни женщин.Поэтому следует проконсультироваться с социальным работником, а медсестры по месту жительства, как важные члены межпрофессиональной группы, будут помогать в обучении и поддержке пациента и его семьи. Чем раньше будет исключена возможность инфекций, доброкачественных новообразований и злокачественных новообразований, тем лучше прогноз и исход. Сотрудничество, совместное принятие решений и общение — ключевые элементы для хорошего результата.
Рисунок
Эндоцервикальный полип. Полипы шейки матки часто встречаются в репродуктивном возрасте и могут быть обнаружены при эктропионе.На этом снимке слизистой оболочки шейки матки типичные эндоцервикальные железы с отечной стромой с явным застоем. Предоставлено Fabiola Farci, MD (подробнее …)
Ссылки
- 1.
- Mitchell L, King M, Brillhart H, Goldstein A. Цервикальный эктропион может быть причиной десквамативного воспалительного вагинита. Sex Med. 2017 Сентябрь; 5 (3): e212-e214. [Бесплатная статья PMC: PMC5562466] [PubMed: 28460993]
- 2.
- Chang AR. «Эрозия» шейки матки; анахронизм.Aust N Z J Obstet Gynaecol. 1991 ноябрь; 31 (4): 358-62. [PubMed: 1799353]
- 3.
- Голдакр М.Дж., Лаудон Н., Ватт Б., Грант Дж., Лаудон Д.Д., Макферсон К., Весси М.П. Эпидемиология и клиническое значение эрозии шейки матки у женщин, обращающихся в клинику планирования семьи. Br Med J. 1978, 25 марта; 1 (6115): 748-50. [Бесплатная статья PMC: PMC1603278] [PubMed: 630328]
- 4.
- Райт К.О., Мохаммед А.С., Салису-Олатунджи О., Куйину Ю.А. Эктропион шейки матки и внутриматочное контрацептивное средство (IUCD): пятилетнее ретроспективное исследование клиентов медицинского учреждения третичного уровня в Лагосе, Нигерия.BMC Res Notes. 2014 23 декабря; 7: 946. [Бесплатная статья PMC: PMC4307624] [PubMed: 25539789]
- 5.
- Madile BM. Эпителий шейки матки от возраста плода до подросткового возраста. Obstet Gynecol. 1976 Май; 47 (5): 536-9. [PubMed: 1264400]
- 6.
- Якобсон Д.Л., Перальта Л., Грэм Н.М., Зенилман Дж. Гистологическое развитие эктопии шейки матки: связь с репродуктивными гормонами. Sex Transm Dis. 2000 Май; 27 (5): 252-8. [PubMed: 10821596]
- 7.
- Райх О., Регауэр С., Макклагедж В.Г., Бержерон К., Редман К.Определение зоны трансформации шейки матки и плоскостолбчатого соединения: можем ли мы достичь общего кольпоскопического и гистологического определения? Int J Gynecol Pathol. 2017 ноя; 36 (6): 517-522. [PubMed: 28639968]
- 8.
- Autier P, Coibion M, Huet F, Grivegnee AR. Расположение зоны трансформации и интраэпителиальная неоплазия шейки матки. Br J Рак. 1996 август; 74 (3): 488-90. [Бесплатная статья PMC: PMC2074626] [PubMed: 8695371]
- 9.
- Maqueo M, Azuela JC, Calderon JJ, Goldzieher JW.Морфология шейки матки у женщин, получавших синтетические прогестины. Am J Obstet Gynecol. 1 декабря 1966 г .; 96 (7): 994-8. [PubMed: 4162849]
- 10.
- Ostergard DR. Влияние беременности на плоскоколонный переход шейки матки у пациентов с аномальной цитологией шейки матки. Am J Obstet Gynecol. 1979, 1 августа; 134 (7): 759-60. [PubMed: 463976]
- 11.
- Ли В., Тобин Дж. М., Фоли Э. Связь эктопии шейки матки с инфекцией хламидиоза у молодых женщин. J Fam Plann Reprod Health Care.2006 апр; 32 (2): 104-6. [PubMed: 16824301]
- 12.
- Де Лука Брунори I, Факкини В., Филиппески М., Баттини Л., Джусти Г., Романи Л., Сцида П., Урбано М. Клеточно-опосредованный иммунитет в ходе эктропиона шейки матки. Clin Exp Obstet Gynecol. 1994; 21 (2): 105-7. [PubMed: 78]
- 13.
- Моррисон С.С., Брайт П., Вонг Э.Л., Квок С., Якобсон И., Гайдос, Калифорния, Такер Х.Т., Блюменталь, PD. Использование гормональных контрацептивов, эктопия шейки матки и приобретение цервикальных инфекций. Sex Transm Dis.2004 сентябрь; 31 (9): 561-7. [PubMed: 15480119]
- 14.
- Венкатеш К.К., Ку-Увин С. Оценка взаимосвязи между эктопией шейки матки и восприимчивостью к ВИЧ: значение для профилактики ВИЧ у женщин. Am J Reprod Immunol. 2013 февраль; 69 Дополнение 1: 68-73. [PubMed: 23057756]
- 15.
- Monroy OL, Aguilar C, Lizano M, Cruz-Talonia F, Cruz RM, Rocha-Zavaleta L. Распространенность генотипов вируса папилломы человека и антивирусные ответы IgA слизистой оболочки у женщин с шейным отделом матки эктопия. J Clin Virol.2010 Янв; 47 (1): 43-8. [PubMed: 19
7]
- 16.
- Kleppa E, Holmen SD, Lillebø K, Kjetland EF, Gundersen SG, Taylor M, Moodley P, Onsrud M. Эктопия шейки матки: ассоциации с инфекциями, передаваемыми половым путем, и ВИЧ. Поперечное исследование старшеклассников в сельских районах Южной Африки. Половая трансмиссия. 2015 Март; 91 (2): 124-9. [Бесплатная статья PMC: PMC4345922] [PubMed: 25281761]
- 17.
- Junior JE, Giraldo PC, Gonçalves AK, do Amaral RL, Linhares IM. Эктопия шейки матки в репродуктивном возрасте: цитологические и микробиологические данные.Diagn Cytopathol. 2014 Май; 42 (5): 401-4. [PubMed: 24166971]
- 18.
- Casey PM, Long ME, Marnach ML. Аномальный вид шейки матки: что делать, когда волноваться? Mayo Clin Proc. 2011 февраль; 86 (2): 147-50; quiz 151. [Бесплатная статья PMC: PMC3031439] [PubMed: 21270291]
- 19.
- Joshi SN, Das S, Thakar M, Sahasrabuddhe V, Kumar BK, Callahan M, Mauck C. Кольпоскопически наблюдали сосудистые изменения в шейке матки отношение к гормональному фону и менструальному циклу. J Low Genit Tract Dis.Октябрь 2008; 12 (4): 293-9. [Бесплатная статья PMC: PMC4123683] [PubMed: 18820544]
- 20.
- Село-Оджеме Д.О., Дайуб Н., Патель А., Мета М. Клинико-патологическое исследование посткоитального кровотечения. Arch Gynecol Obstet. 2004 июл; 270 (1): 34-6. [PubMed: 15224216]
- 21.
- Critchlow CW, Wölner-Hanssen P, Eschenbach DA, Kiviat NB, Koutsky LA, Stevens CE, Holmes KK. Детерминанты эктопии шейки матки и цервицита: возраст, оральная контрацепция, специфическая цервикальная инфекция, курение и спринцевание.Am J Obstet Gynecol. 1995 Август; 173 (2): 534-43. [PubMed: 7645632]
- 22.
- Stillo A, Bianco V, Lorenzin MG, Franzosi N. [Кольпоскопическая оценка эпителия шейки матки во время пероральной контрацепции. Контролируемое клиническое исследование. Энн Остет Гинекол Мед Перинат. 1989 ноябрь-декабрь; 110 (6): 296-304. [PubMed: 2700878]
- 23.
- Slimani O, Ben Temim R, Makhlouf T, Mathlouthi N, Attia L. Цитоколпо-гистологическая корреляция: об аналитическом исследовании 120 кольпоскопий. Tunis Med.2016 Октябрь; 94 (10): 616-620. [PubMed: 28972254]
- 24.
- Гей С., Риль С., Рамана Р., Десмулин Г., Виолайн Б. [Криотерапия в лечении симптоматической эктопии шейки матки]. Gynecol Obstet Fertil. 2006 Март; 34 (3): 214-23. [PubMed: 16530444]
- 25.
- Чекмез Й., Шанлыкан Ф., Гечмен А, Вурал А, Тюркмен С.Б. Криотерапия — друг или враг при симптоматической эктопии шейки матки? Med Princ Pract. 2016; 25 (1): 8-11. [Бесплатная статья PMC: PMC5588317] [PubMed: 26436550]
- 26.
- Baram A, Paz GF, Peyser MR, Schachter A, Homonnai ZT. Лечение эктропиона шейки матки криохирургией: влияние на характеристики цервикальной слизи. Fertil Steril. 1985 Янв; 43 (1): 86-9. [PubMed: 3838091]
- 27.
- Ага Дж., Шарифзаде М., Хоссейнзаде А. Криотерапия как метод облегчения симптомов эктопии шейки матки: рандомизированное клиническое испытание. Oman Med J. 2019 июл; 34 (4): 322-326. [Бесплатная статья PMC: PMC6642705] [PubMed: 31360321]
- 28.
- Yang K, Li J, Liu Y, Ma B, Roberts H, Tan J, Tian J, Wu T, Zhang P.Микроволновая терапия при вывороте шейки матки. Кокрановская база данных Syst Rev.17 октября 2007 г .; (4): CD006227. [PubMed: 17943899]
- 29.
- Де Лука Брунори I, Урбано М., Романи Л., Тарани А., Фелипетто Р., Баттини Л., Амато А., Андреони П. [Клинико-морфологические изменения эктропиона после лечения полидезоксирибонуклеотидом (PDRN )]. Энн Остет Гинекол Мед Перинат. 1990 ноябрь-декабрь; 111 (6): 379-87. [PubMed: 2102065]
- 30.
- де Лука Брунори I, Баттини Л., Филиппески М., Романи Л., Тарани А., Урбано М.[Местная терапия плацентарным полидезоксирибонуклеотидом при эктопии и эктропионе шейки матки]. Энн Остет Гинекол Мед Перинат. 1989, январь-февраль; 110 (1): 35-41. [PubMed: 2757327]
- 31.
- Hua X, Zeng Y, Zhang R, Wang H, Diao J, Zhang P. Использование богатой тромбоцитами плазмы для лечения симптоматической эктопии шейки матки. Int J Gynaecol Obstet. 2012 Октябрь; 119 (1): 26-9. [PubMed: 22835570]
- 32.
- Dawood AS, Salem HA. Текущее клиническое применение богатой тромбоцитами плазмы при различных гинекологических заболеваниях: оценка теории и практики.Clin Exp Reprod Med. 2018 июн; 45 (2): 67-74. [Бесплатная статья PMC: PMC6030616] [PubMed: 29984206]
- 33.
- Chen J, Zhou D, Liu Y, Peng J, Li C, Chen W, Wang Z. Сравнение ультразвуковой терапии и лазерной терапии симптоматической шейки матки эктопия. Ультразвук Med Biol. 2008 ноя; 34 (11): 1770-4. [PubMed: 18471953]
- 34.
- Li C, Xiong X, Li Y, Li J, Peng B, Wang Z, Chen W. Терапевтические эффекты сфокусированного ультразвука у 4014 пациентов с симптоматической эктопией шейки матки.Ультразвук Med Biol. 2013 Апрель; 39 (4): 604-10. [PubMed: 23497842]
- 35.
- Cotarcea S, Stefanescu C, Adam G, Voicu C, Cara M, Comanescu A, Cernea N, Pană R. Важность ультразвукового мониторинга при лечении нормального и пораженного шейного эктропиона. Curr Health Sci J. 2016, апрель-июнь; 42 (2): 188-196. [Бесплатная статья PMC: PMC6256153] [PubMed: 30568831]
- 36.
- Митчелл Х. Выделения из влагалища — причины, диагностика и лечение. BMJ. 2004 29 мая; 328 (7451): 1306-8. [Бесплатная статья PMC: PMC420177] [PubMed: 15166070]
- 37.
- Mattson SK, Polk JP, Nyirjesy P. Хронический цервицит: особенности и ответ на терапию. J Low Genit Tract Dis. 2016 июл; 20 (3): e30-3. [PubMed: 27243142]
- 38.
- Machado Junior LC, Dalmaso AS, Carvalho HB. Доказательства преимуществ лечения эктопии шейки матки: обзор литературы. Сан-Паулу Med J. 2008 6 марта; 126 (2): 132-9. [PubMed: 18553039]
- 39.
- Hwang LY, Ma Y, Shiboski SC, Farhat S, Jonte J, Moscicki AB. Активная плоскоклеточная метаплазия эпителия шейки матки связана с последующим заражением вирусом папилломы человека 16 среди здоровых молодых женщин.J Infect Dis. 2012 15 августа; 206 (4): 504-11. [Бесплатная статья PMC: PMC34] [PubMed: 22696500]
Плоскоклеточная метаплазия — обзор
Плоскоклеточная метаплазия
Плоскоклеточная метаплазия проявляется в виде ряда изменений от доброкачественных реактивных процессов до плоскоклеточной дифференцировки при карциноме. Доброкачественные изменения включают изменения, связанные с хроническим эндометритом, внутриматочными спиралями и травмами (рис. 18.6A и B). 14,15 Обычно этот тип реактивной метаплазии проявляется в виде рассеянных поверхностных очагов.Трудно изученный вариант плоской метаплазии — ихтиоз матки (см. Рис. 18.6C). 16 Хотя такие поражения классифицируются как преувеличенные метаплазии эндометрия, они могут быть обширными, образуя кистообразные пространства в миометрии, а иногда они могут быть связаны с плоскоклеточной неоплазией. 17 Обширные плоские разрастания, даже если морфологически доброкачественные, заслуживают тщательного изучения, особенно у пациентов в постменопаузе.
Второй и наиболее частый образец плоской дифференцировки — моррулярная метаплазия, которая обычно принимает форму небольших, круглых, сплоченных и правильных гранулемоподобных агрегатов незрелых плоских клеток; они обычно располагаются внутри тракта железы (просвета), между железами или как отдельная находка, отделенная от железистого эпителия (рис.18.7). Центральное расположение морулы предполагает замену тракта железы плоскоклеточной метаплазией с вторичной пролиферацией столбчатого эпителия, похожей на шейную микрогландулярную метаплазию (см. Рис. 18.7B). Иногда морулы могут показывать центральный некроз (см. Рис. 18.7D). Изолированная морулярная метаплазия — с минимальной пролиферацией желез или без нее — не редкость у женщин репродуктивного возраста (см. Рис. 18.7A и E), и ее не следует путать с гистиоцитарными агрегатами. Однако морулярная метаплазия часто связана с некоторой степенью скученности желез, что затрудняет ее интерпретацию (см.рис.18.7B). 9,10
Классификация этих незначительных пролифераций желез, связанных с морулярной метаплазией, проблематична, поскольку может отсутствовать степень скученности желез или измененный внешний вид эпителия, необходимые для обоснования диагноза EIN. Когда эти железистые изменения более обширны, они могут вызывать беспокойство по поводу EIN или рака (рис. 18.8 и 18.9). Диагностический переход от плоских морул (или морулярной метаплазии) к EIN с плоскоклеточной дифференцировкой требует наличия скученности желез и измененных цитологических характеристик внутри железистого эпителия по сравнению с окружающими нормальными железами эндометрия (см.рис.18,8). Тем не менее, как обсуждается ниже, скученность желез без цитологических изменений может быть фактором риска для последующей карциномы эндометрия, независимо от степени ее расслоения и атипии.
Плоские морулы цитологически и архитектурно однородны в EIN, а также в поражениях, которые не могут быть классифицированы как EIN. Напротив, плоскоклеточная дифференцировка, связанная с аденокарциномой эндометрия, более вариабельна. В некоторых поражениях присутствуют дискретные морулы, и диагностика рака основывается строго на архитектуре железы (см.рис.18.9). В других случаях наблюдается аберрантная дифференцировка или ороговение (рис. 18.10). Как обсуждалось в главе 19, термины аденоакантома и аденосквамозная карцинома были отменены вместо термина аденокарцинома с плоскоклеточной дифференцировкой. 18 В некоторых случаях карциноматозный железистый компонент может быть очень тонким. Более плохо дифференцированные новообразования включают плоскоклеточный рак (обсуждается в главе 19), а также редкие, хорошо дифференцированные плоскоклеточные новообразования, включая кондиломы полости эндометрия и атипичные полиповидные аденомиомы. 19-22
Большинство морулярных метаплазий имеют доброкачественный исход. 9,10,23,24 В последующем исследовании морулярной метаплазии в Бригаме и женской больнице мы обнаружили, что биопсии эндометрия или выскабливания классифицируются как неосложненные (класс A или B, т. Е. Без ассоциированного EIN) морулярная метаплазия обычно регрессировали и сопровождались гистологически подтвержденной аденокарциномой эндометрия только в 5% случаев (таблица 18.2). 24 Напротив, морулярные метаплазии, описанные в связи с EIN (класс C), часто сохранялись и сопровождались аденокарциномой в 19% случаев. 23,24 По этой причине регулярное наблюдение с повторным забором образцов является разумным подходом к моррулярным метаплазиям с меньшими изменениями желез, хотя в некоторых случаях морулы могут появиться снова после интервала между нормальными биопсиями. Случаи с EIN должны обрабатываться так же, как и с любыми EIN. К сожалению, морулярная метаплазия часто встречается у женщин репродуктивного возраста, и шансы на успешную беременность после лечения считаются низкими, что может быть отражением измененного гормонального состояния или биологии эндометрия, которые, как предполагается, также связаны с образованием морул. как возможно причина бесплодия.В редких случаях новообразования яичников развиваются одновременно или после диагноза морулярной метаплазии эндометрия. 25
Ловушки в диагностике плоскоклеточной метаплазии эндометрия включают как гипердиагностику, так и недостаточную диагностику рака эндометрия. Листы плоской метаплазии эндометрия бывает трудно отличить от злокачественного новообразования (рис. 18.11). С другой стороны, очаги явно доброкачественного плоского эпителия в эндометрии могут быть безвредными или связаны с более запущенным заболеванием, включая плоскоклеточный рак (рис.18.12). 26
Похожая ошибка — неправильная интерпретация метастатической карциномы в шейку матки как нативную плоскоклеточную метаплазию. Наконец, атипичные полиповидные аденомиомы, сочетающие моррулярную метаплазию с атипичными железами в миоматозной строме, можно спутать с обычной моррулярной метаплазией при полипах или аденокарциноме. Оба из них более подробно обсуждаются в главе 19.
Учебное пособие по цитопатологии (мазок Папаниколау)
Что такое Пап-мазок
Отшелушенные клетки можно получить из различных участков тела с целью получения клинически полезной информации.Многие клетки и ткани тела подвергаются постоянному процессу созревания / смерти / регенерации, а отмирающие клетки отшелушиваются или отслаиваются. Разрастание и созревание эпителиальных клеток в конечном итоге приводит к отшелушиванию клеток. Доступны методы сбора отслоившихся клеток, в первую очередь, с эпителиальных поверхностей. Также можно механически усилить процесс отшелушивания для получения более жизнеспособных клеток с помощью различных шпателей или щеток. Образцы будут состоять из отдельных клеток или небольших фрагментов ткани по сравнению с большими срезами ткани, полученными при хирургической биопсии.
Диагностическое применение мазка Папаниколау
Женские половые пути покрыты эпителием. Верхняя часть влагалища имеет многослойный плоский эпителий, многослойный плоский эпителий эктоцервикса, простой столбчатый (железистый) эпителий эндометрия и простой столбчатый (железистый) эпителий эндометрия. Все эти эпителии подвержены циклическим гормональным воздействиям эстрогена и прогестерона во время менструального цикла, что вызывает пролиферацию (увеличение количества клеток) и дифференцировку или созревание (развитие функциональных и морфологических особенностей зрелых клеток исходного тканевого типа. ) этих эпителиев.
Дифференциация и созревание клеток отражаются характерными морфологическими особенностями, которые методы окрашивания позволяют нам идентифицировать. Шейка матки, являющаяся связующим звеном между внешним и внутренним телом, постоянно подвергается воздействию различных факторов стресса, включая механические, микробиологические, химические и гормональные воздействия.
Шейка матки может реагировать различными неспецифическими способами:
- Острые или хронические воспалительные реакции
- Адаптивные пролиферативные ответы (эктоцервикс-пролиферация и ороговение плоского эпителия; эндоцервикально-плоский метаплазия)
- Репаративные реакции
Также могут происходить клеточные изменения, которые позволяют точно определить, какой стрессор вызывает реакцию: e.g., вирус герпеса или вирус папилломы человека (ВПЧ). Частично из-за обычно высокой скорости пролиферации, которая происходит постоянно циклически в детородном возрасте, а также частично из-за пролиферативных эффектов стрессоров, действующих в области шейки матки, эпителий внутри и вокруг шейки матки особенно подвержен развитию случайных и случайных заболеваний. / или направленное стрессором (особенно ВПЧ) генетическое повреждение, которое может привести к неопластическому росту плоскоклеточных и / или железистых клеток шейки матки.
Во многих случаях клеточные аномалии, связанные с патологическими образованиями, присутствующими в шейке матки, могут быть обнаружены и охарактеризованы с помощью мазка Папаниколау на основе морфологических изменений клеток, созданных этими объектами, и наличия воспалительных клеток и / или фактическое присутствие микробиологических агентов.
Цервикальный / вагинальный мазок Папаниколау — это адекватно собранный клеточный образец, полученный из отслоившихся или механически смещенных клеток влагалища, шейки матки и, в некоторых случаях, эндометрия, которые были размазаны на предметном стекле, надлежащим образом сохранены и окрашены, а также оценены цитоморфологически. для одной или нескольких из следующих целей:
- Выявление скрытых патологических аномалий шейки матки у бессимптомных женщин
- Выявление рецидива известных патологических аномалий матки шейка матки
- Оценка подозреваемого гормонального нарушения
- Мониторинг гормональной терапии
Получение мазка Папаниколау
Конкретная используемая процедура сбора будет зависеть от типа требуемой информации или конкретных показаний для проведения мазка Папаниколау.Целью фактической процедуры сбора является получение адекватного, поддающегося оценке мазка клеточного материала из влагалища и / или шейки матки, который может быть отправлен в лабораторию вместе с соответствующей клинической информацией для окрашивания и оценки в соответствии с показаниями для тест. Для достижения этой цели мазок должен иметь следующие характеристики:
- Наличие достаточного количества клеток плоского эпителия
- Доказательства того, что была взята проба из зоны трансформации (т.е., наличие эндоцервикальных клеток на мазке)
- Распространение в относительно ровном монослое
- Эпителиальные клетки, не закрытые кровью, воспалительными клетками или чужеродными клетками материал, такой как смазка или тальк
- Соответствующим образом сохранено
Фактически процедура сбора начинается с соответствующего указания пациента относительно теста. Должен быть сдан мазок Папаниколау:
- Ежегодно после 18 лет или после начала половой жизни
- Во второй половине менструального цикла-i.е., по крайней мере, через две недели после начала одного менструального цикла и до начала следующего менструального цикла.
- Без полового акта в течение 24 часов до исследования
- Без спринцевания в течение 24 часов до исследования
Процедура сбора продолжается сбором точного сексуального анамнеза и истории здоровья. Информация, которая должна быть указана в форме заявки, отправляемой в лабораторию, включает:
- Имя пациента
- Возраст пациента
- Последняя менструация
- История беременности
- История использования гормонов
- История использования ВМС Факторы риска
- Предыдущие аномальные мазки Папаниколау
- Соответствующая клиническая информация-.например, аномальное кровотечение, выделения, тазовая боль и др.
Ограничения мазков Папаниколау
Несмотря на наилучшие процедуры сбора, обработки образцов и скрининга, уровень ложноотрицательных результатов (пропущенных поражений) по-прежнему будет составлять не менее 4%. До 2/3 ложноотрицательных результатов мазка Папаниколау являются результатом факторов, связанных с процедурой сбора. Однако естественная история дисплазий и карцином шейки матки такова, что от дисплазии до инвазивной карциномы проходит длительный интервал времени (годы).Если проводится ежегодный скрининг, то вероятность пропуска поражения очень мала.
Патология шейки матки
Шейка матки может поражать целый ряд патологических процессов:
-
Инфекции
-
Часто встречаются и могут быть связаны с острым и / или хроническим цервицитом. Симптоматология может включать выделения из влагалища. Микроскопические признаки, обнаруженные на мазках Папаниколау, могут помочь в диагностике некоторых инфекций (трихомонады, , Candida , герпес), в то время как микробиологический посев полезен для диагностики бактериальных инфекций, а серологические методы помогают в диагностике сифилиса, герпеса и хламидиоза.К возбудителям инфекции относятся:
- Хламидиоз
- Gardnerella vaginalis
- Trichomonas vaginalis
- Neisseria gonorrheae
- Группа B Стрептококк
- Candida albicans
- Простой герпес
- Treponema pallidum (сифилис)
- Вирус папилломы человека
-
Цервикальная интраэпителиальная неоплазия (CIN)
-
К ним относятся дисплазии через карциному in situ.Дисплазии являются предопухолевыми и потенциально обратимыми. Однако, если не лечить, есть естественная история развития карциномы. Наличие CIN, также называемого поражением плоского эпителия, тесно связано с историей инфицирования вирусом папилломы человека. Факторы риска для CIN включают:
- Половой акт в молодом возрасте
- Несколько половых партнеров
- Половой акт с мужчиной из группы высокого риска
- История инфекции ВПЧ
Классификация CIN следующая:
- LSIL: поражение плоского эпителия низкой степени, эквивалентно CIN 1: легкая дисплазия
- HSIL: плоскоклеточное эпителиальное поражение высокой степени, эквивалентно CIN 2: умеренная дисплазия
- HSIL: плоскоклеточное эпителиальное поражение высокой степени, эквивалентно CIN 3: тяжелая дисплазия до карциномы in situ
-
Инвазивная карцинома
-
Самым ранним поражением является микроинвазивная плоскоклеточная карцинома, определяемая как инвазия на расстоянии менее 3 мм от базальной мембраны и без лимфатической инвазии.Помимо этого, инвазивная плоскоклеточная карцинома может поражать в различной степени. Постановка зависит от степени и места вторжения. Аденокарциномы могут возникать в эндоцервикальных железах и составляют около 5% злокачественных новообразований шейки матки.
-
Прочие условия
-
Микрогландулярная эндоцервикальная гиперплазия может вызывать полиповидное образование в эндоцервикальном канале. Большинство этих поражений возникает при использовании оральных контрацептивов или во время беременности.
Полип эндоцервикального канала может присутствовать у 2–5% женщин и может вызывать лейкорею или аномальное кровотечение.
Плоская кондилома может возникнуть в результате инфекции вируса папилломы человека.
Изображения
Ниже представлены изображения поражений шейки матки размером от 40 до 250 КБ.
- Шейка матки нормальный внешний вид, макроскопический.
- Шейка матки нормального вида, микроскопическая.
- Шейка матки, хронический цервицит с инфекцией, микроскопический.
- Шейка матки, койлоцитозное изменение при инфекции вируса папилломы человека, микроскопия с малым увеличением.
- Шейка матки, койлоцитозное изменение при инфекции вируса папилломы человека, микроскопия среднего увеличения.
- Шейка матки, койлоцитозное изменение при инфекции вируса папилломы человека, микроскопия с большим увеличением.
- Шейка матки, дисплазия, микроскопия с малым увеличением.
- Шейка матки, HSIL (CINII), микроскопия с большим увеличением.
- Шейка матки, HSIL (CINIII), микроскопия с большим увеличением.
- Шейка матки, дисплазия, цитологические особенности Пап-мазка, микроскопические.
- Шейка матки, инвазивная плоскоклеточная карцинома, макроскопическая.
- Шейка матки, инвазивная плоскоклеточная карцинома, микроскопическая.
- Шейка матки, инвазивный плоскоклеточный рак, микроскопический.
- Шейка матки, инвазивный плоскоклеточный рак, цитологические особенности на мазке Папаниколау, микроскопический.
Эпителиальный рецептор эстрогена матки α необязателен для пролиферации, но необходим для полных биологических и биохимических реакций
Abstract
Для фертильности самок требуется, чтобы эстроген специфически стимулировал зависимый от рецептора эстрогена α (ERα) рост эпителия матки у взрослых мышей, в то время как у незрелых самок наблюдается пролиферация как в строме, так и в эпителии.Чтобы выяснить относительную роль ERα в опосредовании действия эстрогена в эпителии матки по сравнению со стромой, была получена линия мышей с нокаутом ERα маточного эпителия (UtEpiαERKO) путем скрещивания мышей Esr с мышами Wnt7a -Cre. Экспрессия Wnt7a , направленная на Cre-активность, вызвала селективную делецию ERα в эпителии матки, и самки UtEpiαERKO бесплодны. Здесь мы демонстрируем, что индуцированная 17β-эстрадиолом ( E 2 ) пролиферация эпителия матки не зависела от ERα эпителия матки, потому что синтез ДНК и повышающая регуляция митогенных медиаторов поддерживались в матке UtEpiαERKO после лечения E 2 E 2 E .Обработка IGF-1 приводила к лиганд-независимой активации ER как у дикого типа (WT), так и у UtEpiαERKO и имитировала стимулирующий эффект на синтез ДНК в эпителии матки. ERα эпителия матки был необходим для индукции лактоферрина, секреторного белка, регулируемого E 2 , селективно синтезируемого в эпителии матки. Однако потеря маточного эпителиального ERα не изменяет подавление регуляции зависимого от E 2 рецептора прогестерона (PR) в эпителии.Поразительно, что эпителий матки UtEpiαERKO имел убедительные доказательства апоптоза после 3 дней лечения E 2 . Таким образом, мы предполагаем, что индуцированная эстрогеном гиперплазия матки включает незаменимую роль ERα маточного эпителия в пролиферативном ответе, но ERα требуется после пролиферации для предотвращения апоптоза маточного эпителия, обеспечивая полный ответ эпителия матки, что иллюстрирует дифференциальную роль ERα в матке. ткань и ее вклад во время беременности.
Эстрогены действуют через белки рецепторов эстрогена (ER). ER альфа и бета (α и β) распределены по различным тканям тела. ERα преимущественно экспрессируется в матке, молочных железах, гипофизе, гипоталамусе и теках яичников, тогда как ERβ в основном экспрессируется в клетках гранулезы яичников, легких и предстательной железы (1). Матка является основной тканью-мишенью для эстрогена, и значительные уровни ERα экспрессируются во всех основных отделах матки (просветный и железистый эпителий, строма и миометрий), а уровень экспрессии ERα варьируется во время эстрального цикла и достигает пиков во время проэстральный в соответствии с повышением циркулирующего 17β-эстрадиола ( E 2 ), чтобы вызвать пролиферативный ответ (2).В ряде исследований показано, что пролиферация матки регулируется с помощью E 2 ERα-зависимым образом, что демонстрируется отсутствием стимуляции матки и ответов митотического роста в αERKO uteri (3). У неполовозрелых грызунов E 2 стимулирует пролиферацию просветного и железистого эпителия матки, а также стромы, тогда как у взрослых мышей E 2 стимулирует пролиферацию только просветного и железистого эпителия (4).В предыдущей серии исследований было высказано предположение, что эстроген, действующий на стромальные клетки, инициирует ответы, опосредующие пролиферацию эпителия. Такие доказательства были получены из исследований рекомбинации тканей новорожденных, в которых синтез ДНК маточного эпителия, активированный E 2 , был стромальным ERα-зависимым посредством индукции аутокринных или паракринных митогенных факторов в строме, которые стимулировали пролиферацию эпителия (5). Об оценке эпителиально-специфической роли ERα в пролиферации тканей недавно сообщалось в молочных железах.Использование MMTV-Cre, скрещенного с флоксированными мышами ERα, продемонстрировало, что для роста молочной железы и пролиферации протоковых эпителиальных клеток требуется ERα эпителия молочных желез (6), в отличие от предыдущих исследований рекомбинации мезенхимально-эпителиальной ткани, которые показали, что эпителиальный ERα молочных желез не является незаменимым для эпителия молочных желез. пролиферация клеток (7). Таким образом, мы оценили, будет ли подобное несоответствие иметь место в другой ткани, пролиферирующей эстроген, или ткань матки будет следовать той же схеме, что и молочная железа, в отношении незаменимой роли ERα в пролиферации эпителия матки.
Несколько исследований продемонстрировали, что ряд факторов роста, таких как IGF-1, EGF или трансформирующий фактор роста α (TGFα) (8-10), и их рецепторы индуцировались и активировались, соответственно, в матке под влиянием E 2 обращения (8–12). Экспериментально было показано, что IGF-1 является ключевым фактором роста, который стимулирует рост близлежащих эпителиальных клеток в результате их эстроген-зависимой экспрессии в матке (13). Отсутствие стимуляции IGF-1 у мышей αERKO продемонстрировало, что ERα необходим для опосредования действия маточного IGF-1 (14–16).Фактор транскрипции CCAAT энхансер связывающий белок бета (C / EBPβ) является еще одним регулируемым эстрогеном геном в женских репродуктивных тканях, который важен для функций матки (17) и регуляции пролиферации и дифференцировки эпителиальных клеток молочной железы (18).
Помимо митогенных эффектов, эстроген также играет роль в контроле апоптоза (запрограммированной гибели клеток) в некоторых типах клеток (19). В матке стероидные гормоны регулируют апоптоз. Уровни циркуляции E 2 обратно коррелируют с апоптозом в просвете матки и железистом эпителии во время эстрального цикла, с наивысшим уровнем апоптоза в эпителии в период метастоза, когда уровни E 2 снижаются (20).Было показано, что эстроген подавляет апоптоз в эпителии матки новорожденных мышей посредством ERα-зависимой индукции белков, ингибирующих апоптоз (AIP), включая Birc1a (бакуловирусные ингибиторы апоптоза, содержащие повторение 1), и ингибирование активации исполнителя апоптоза, цистеин-аспарагиновая протеаза-3 (каспаза-3) (21). Здесь мы оценили эффект E 2 на апоптоз эпителия матки у взрослых, когда ERα был избирательно удален в эпителии матки.Система экспрессии рекомбиназы Wnt7a -Cre и Esr1 — lox P была использована в нашем исследовании для изучения влияния E 2 на чувствительность эпителия матки после селективной потери ERα.
Результаты
Получение мышей с нокаутом ERα, специфичных для эпителия матки.
Модель мыши с нокаутом ERα, специфичным для эпителия матки (UtEpiαERKO), была создана путем скрещивания линии трансгенных мышей, экспрессирующих Wnt7a -Cre-рекомбиназу, с нашей новой линией мышей ERα, содержащих участков lox , фланкирующих экзон 3 мыши . Ген Esr1 (22).Специфическая для клеточного типа экспрессия Wnt7a -Cre привела к полной делеции ERα, особенно в просветных и железистых эпителиальных клетках матки. Экспрессию белка ERα оценивали с помощью иммуногистохимии (ИГХ), и она достоверно экспрессировалась во всей матке дикого типа (эпителий, строма и миометрий) (рис. 1, , слева, ). Белок ERα был обнаружен в тканях стромы и миометрия, но отсутствовал в просвете матки и железистом эпителии мышей UtEpiαERKO (рис. 1, , справа ), что свидетельствует об эффективности Cre-специфической делеции ERα.Тестовые вязки самок UtEpiαERKO показали, что они бесплодны (Таблица S1). Дополнительный анализ показывает, что у самок наблюдаются регулярные эстральные циклы, а гистология яичников показывает все стадии развития фолликулов и признаки овуляции на основании наличия желтого тела (рис. S1). Однако места имплантации наблюдались у 6 из 9 WT, но только у 0 из 6 у UtEpiαERKO после естественного спаривания или переноса эмбриона псевдобеременным самкам, что указывает на то, что мыши UtEpiαERKO имеют нарушенную восприимчивость эмбрионов матки.Соответственно, регулируемые эстрогеном транскрипты Lif (фактор ингибирования лейкемии) и Ihh (индийский еж), которые необходимы для прикрепления эмбриона (23, 24), остались неизменными у UtEpiαERKO, но были активированы в WT после E 2 обработки (рис. S2).
Рис. 1. Экспрессия белкаERα с помощью анализа ИГХ в матке WT ( слева, ) и UtEpiαERKO ( справа, ) с продольными срезами ( верхний ; 40-кратное увеличение) и поперечными срезами ( нижний ; 200-кратное увеличение) .
Пролиферативный эффект
E 2 на эпителий матки зависит от стромы ERα.E 2 значительно увеличивал влажную массу матки у мышей WT после овариэктомии (OVEX) через 24 часа после лечения ( p <0,001), но не у мышей UtEpiαERKO (фиг. 2 A ). Вес матки был значительно увеличен на E 2 в УтЭпиαЭРКО после 3-х дневного биоанализа; однако прирост был значительно ниже, чем у WT (рис.2 B , p <0,05), а пролиферативный ответ матки, индуцированный E 2 , был полностью ослаблен ICI 182780 (ICI) как у мышей WT, так и у мышей UtEpiαERKO, что указывает на то, что увеличение является ER-зависимым ответом. . Включение аналога дезокситимидина EdU (5-этинил-2′-дезоксиуридина) продемонстрировало, что E 2 индуцировал синтез ДНК в просветном эпителии (рис. 2 C ) через 24 часа как в WT, так и в UtEpiαERKO матке и снизилась в обоих генотипах через 3 дня.
Рис. 2.Пролиферативный ответ матки на E 2 и IGF-1 у мышей WT и UtEpiαERKO. Увеличение сырого веса матки после ( A ) 24 ч или ( B ) 3-дневного (три последовательных дня) лечения носителем, E 2 в присутствии или в отсутствие лечения ICI и ( C ) флуоресцентный сигнал включения Hoescht 33342 и EdU / окрашивания Alexafluor488 в срезах матки мышей, получавших носитель, E 2 (24 часа или 3 дня) или IGF-1 (24 часа).(Шкала: 20 мкм.) Результаты представляют собой среднее значение ± стандартная ошибка среднего ( n = 7). * и *** p <0,05 и 0,001, что значительно отличается от контроля носителя соответствующего генотипа, соответственно. + , p <0,05 значительно отличается от мышей WT, получавших E 2 .
C / EBPβ и IGF-1: постулируемые медиаторы
E 2 -индуцированная пролиферация в эпителии матки.На основании предыдущих исследований (5, 8, 9, 17) мы оценили, могут ли Cebpb и Igf1 быть медиаторами индуцированной E 2 пролиферации эпителия матки. E 2 значительно активировал Cebpb через 2 часа (рис.3 A ) и Igf1 через 6 часов (рис.3 B ) как в матке WT, так и в UtEpiαERKO, а экспрессия в оба генотипа снизились до базального уровня через 24 часа. Уровни экспрессии Cebpb и Igf1 после обработки E 2 у WT и UtEpiαERKO существенно не различались. Следовательно, маточный эпителиальный ERα не требуется для индукции эстрогеном маточных Cebpb и Igf1 .
Рис. 3.E 2 -регулируемые гены в матке WT и UtEpiαERKO. ( A ) мРНК Cebpb через 2 часа и 24 часа и ( B ) мРНК Igf1 через 6 часов и 24 часа после обработки носителем или E 2 ( n = 4). Результаты представляют собой среднее значение ± стандартная ошибка среднего. *, ** и *** p <0,05, 0,01 и 0,001, что значительно отличается от контроля носителя соответствующего генотипа, соответственно. нс ; незначительно отличается в E 2 , обработанных в течение 2 часов ( A ) и 6 часов ( B ) у WT и UtEpiαERKO, проанализированных с помощью непараметрического критерия Манна-Уитни.
Мы дополнительно исследовали влияние одного фактора роста на пролиферацию эпителия матки. Фактор роста, такой как IGF-1, был известен как митогенный фактор, который стимулировал пролиферацию маточного эпителия грызунов (9). Чтобы обойти действие E 2 , мы лечили животных IGF-1 (50 мкг / мышь) в отсутствие E 2 . IGF-1 индуцировал синтез эпителиальной ДНК в просвете матки в меньшей степени, чем при обработке E 2 , что проиллюстрировано включением EdU через 24 часа как у WT, так и у UtEpiαERKO (рис.2 С ). Следовательно, IGF-1, по-видимому, является возможным нижестоящим эффектором E 2 действия в строме, который стимулирует пролиферацию эпителия матки.
Оценка
E 2 -специфических ответов в эпителии и строме матки.Лактоферрин (Ltf) — это белок, регулируемый E 2 в эпителии матки млекопитающих (3, 25). Через 3 дня E 2 значительно индуцировал мРНК Ltf в матке WT (рис.4 A , p <0,001), а также повышенное содержание белка Ltf в просвете матки и железистом эпителии (рис. 4 B , стрелки), и это увеличение ингибировалось ICI (рис. В ). Потеря ERα в матке UtEpiαERKO привела к потере экспрессии лактоферрина, стимулированной E 2 (фиг. 4 A и B ). Кроме того, рецептор прогестерона (PR) необходим для установления и поддержания беременности (26), а также регулируется E 2 в матке (27).Таким образом, мы оценили экспрессию белка PR, которая показала, что PR снижается в эпителии и увеличивается в строме после обработки E 2 у мышей WT. Этот PR-ответ не был опосредован через маточный эпителиальный ERα, поскольку ответ был устойчивым в UtEpiαERKO (фиг. 4 C ). Более того, ингибирующий эффект ICI в обоих генотипах дополнительно указывает на то, что стромальный ERα, по-видимому, отвечает за подавление PR в эпителии матки (рис.4 С ). Также были оценены другие примеры транскриптов, чувствительных к эстрогену матки (рис. S3), и они указывают на потерю некоторых ответов, таких как Aqp8 (аквапорин 8) и Cdkn1a (ингибитор циклинзависимой киназы A или p21), а также сохранение других , такие как Dhcr24 (24-дегидрохолестеринредуктаза) и Ube2c (убиквитин-конъюгированный фермент E2C).
Рис. 4.Специфические для эпителия матки E 2 -регулируемые ответы. Экспрессия Ltf с использованием анализа ПЦР в реальном времени ( A ), анализа IHC лактоферрина ( B ) и экспрессии белка рецептора прогестерона ( C ) в WT ( слева, ) и UtEpiαERKO ( справа ) ) матки при лечении носителем, E 2 или E 2 + ICI в течение трех дней подряд ( n = 7). (Шкала: 40 мкм). Стрелки указывают на положительное окрашивание лактоферрина. Результаты представляют собой среднее значение ± стандартная ошибка среднего.*** p <0,001, достоверно отличается от носителя соответствующего генотипа.
Потеря ERα в эпителии матки усиливает апоптоз матки.
Потеря ERα в эпителии матки в сочетании с реакциями роста после 3 дней лечения E 2 изменила внешний вид эпителия UtEpiαERKO (рис. 5 A , стрелки) таким образом, чтобы предположить усиление апоптоза УтЭпиαЭРКО по сравнению с WT. В соответствии с этим, обработка E 2 значительно индуцировала экспрессию ингибитора апоптоза Birc1a у WT ( p <0.001), но не в UtEpiαERKO uteri (рис. 5 B ). Расщепленная каспаза-3 (активная форма каспазы-3) была немного увеличена на 3 дня обработки E 2 в WT (рис. 5 C , желтые стрелки), но интенсивно обнаруживалась в просветном и железистом эпителии UtEpiαERKO. в виде плотных круглых пятен как на базолатеральной, так и на просветной сторонах эпителиальных клеток (рис. 5 C , черные наконечники стрелок). Однако повышенные уровни маркера фрагментации ДНК, TUNEL (мечение ник-концов dUTP, опосредованное терминальной дезоксинуклеотидилтрансферазой), было обнаружено только в UtEpiαERKO uteri, что дополнительно указывает на усиление апоптоза после 3 дней лечения E 2 (рис.5 D , наконечники стрел). Следовательно, потеря маточного эпителия ERα коррелировала с усилением апоптоза матки после роста матки, индуцированного после лечения в течение 3 дней.
Рис. 5.Выражения медиатора апоптоза в WT и UtEpiαERKO uteri. После обработки носителем или E 2 в течение трех дней подряд окрашивание H&E ( A ) показало появление апоптоза эпителиальных клеток в обработанной E 2 матке UtEpiαERKO (черные стрелки).Экспрессия Birc1a с использованием анализа ПЦР в реальном времени ( B ) увеличивалась только у E 2 -обработанных WT. IHC расщепленного каспазы-3 ( C ) увеличился как в WT (желтые стрелки), так и в UtEpiαERKO (черные стрелки), а TUNEL IHC ( D ) увеличился только в E 2 -обработанных UtEpiαERKO uteri ) ( п = 7). (Шкала: 20 мкм). Результаты представляют собой среднее значение ± стандартная ошибка среднего. *** p <0,001, что значительно отличается от контроля носителя соответствующего генотипа, соответственно.
Обсуждение
Здесь мы проиллюстрировали физиологическое значение ERα для пролиферации эпителия матки и апоптоза под влиянием регуляции E 2 . Мы продемонстрировали, что ERα маточного эпителия является незаменимым для индуцированной E 2 пролиферации эпителия матки у взрослых мышей OVEX в отличие от того, что было описано для пролиферации эпителия молочных желез (6). В отсутствие маточного эпителиального ERα потенциальные митогенные медиаторы, такие как Cebpb и Igf1 , были увеличены при лечении E 2 , а фактор роста IGF-1 мог обойти эффект E 2 на разрастание эпителия матки.Мы подтвердили потерю ответа, специфичную для эпителия матки E 2 , показав, что делеция ERα в эпителии матки вызывает потерю продукции лактоферрина. Однако подавляющая регуляция маточного эпителия и стромальное перераспределение PR с помощью E 2 оставались неизменными у мышей UtEpiαERKO. Удивительно, но отсутствие функционального ERα в эпителии матки оказало выраженное влияние на апоптоз.
E 2 известен как мощный митогенный гормон яичников в тканях матки, который вызывает выраженный гиперпластический тканевый ответ, соответствующий развитию эндометрия во время эстрального цикла (28, 29).Поэтапные исследования мечения клеток показали эффект E 2 на привлечение эпителиальных клеток матки из состояния покоя ( G 0 ) в клеточный цикл и сокращение как G 1 , так и S-фазы клеточный цикл вызывает пролиферацию (4, 30). Введение E 2 индуцирует пролиферацию эпителия матки и стромы неполовозрелых мышей, но только стимулирует пролиферацию эпителия матки у взрослых мышей, и причина отсутствия чувствительности стромальных клеток связана с активностью прогестерона (4). ).Предыдущая работа с использованием моделей ксенографической ткани новорожденных и экстраполяция такой модели на взрослую ткань (5) показывают, что пролиферативный эффект E 2 на эпителий матки у взрослых мышей не зависит от экспрессии ERα в просветном эпителии, что позволяет предположить наличие стромального Экспрессия ERα имеет решающее значение для митотического ответа E 2 . Чтобы оценить и расширить эти наблюдения в естественной системе взрослых тканей in vivo, была создана наша модель мыши UtEpiαERKO со специфической делецией ERα в эпителии матки.Взрослые мыши UtEpiαERKO имели полную делецию белка ERα в просвете матки и железистом эпителии по всему рогу матки. Классический биоанализ матки использовали для иллюстрации эстрогенного эффекта E 2 на реакцию роста матки как через 24 часа, так и через 3 дня. Отсутствие ERα в эпителии матки скомпрометировало увеличение веса матки, индуцированное E 2 через 24 часа или 3 дня, что предполагает, что эпителиальный ERα вносит вклад в полную реакцию роста матки.Наши результаты предполагают, что начальная (24 часа) реакция пролиферации аналогична, но что просветные и железистые эпителиальные клетки впоследствии не развиваются должным образом в многослойные тканевые структуры, секретирующие лактоферрин, и дополнительно демонстрируют признаки апоптоза. Эти недостатки и изменения, скорее всего, объясняют затрудненное увеличение веса матки. Однако индукция синтеза ДНК через 24 часа и снижение через 3 дня обработки E 2 наблюдались как у WT, так и у UtEpiαERKO.Следовательно, эпителиальный ERα матки in vivo был незаменим для соответствующего митотического пролиферативного ответа от E 2 , что согласуется с более ранними экспериментами с ксенографией (5), в отличие от потребности в эпителиальном ERα для развития и пролиферации молочных желез (6).
Затем мы оценили возможные митогенные медиаторы (C / EBPβ и IGF-1) ниже E 2 . Предыдущие исследования показали, что фактор транскрипции C / EBPβ быстро увеличивается как в эпителиальных, так и в стромальных клетках на E 2 в матке (17).Существенная роль C / EBPβ в пролиферации эпителия матки была продемонстрирована снижением E 2 -зависимой пролиферации эпителия матки в результате нарушения репликации ДНК у мышей с нокаутом Cebpb (17, 31). Было продемонстрировано, что IGF-1 является паракринным митогенным эффектором, секретируемым из стромы матки для стимуляции пролиферации эпителия матки (5). E 2 увеличивает производство факторов роста, таких как IGF-1 и EGF, и эти факторы роста индуцируют синтез ДНК матки (8–10, 16). Igf1 Мыши с нокаутом проявляли нарушенный ответ матки на эстроген, что указывает на важную роль IGF-1 в росте матки (32). Сверхэкспрессия IGF-связывающего белка-1 (IGFBP-1) в матке мыши нарушала синтез ДНК, но влажная масса матки увеличивалась в ответ на E 2 (33). Следовательно, местное производство и доступность IGF-1, по-видимому, играет роль в пролиферации матки. Более того, данные также свидетельствуют о том, что пролиферативный эффект E 2 на продукцию IGF-1 в эпителии человека опосредован аутокринным образом в эпителиальных клетках матки человека (34).Дополнительные доказательства были получены при использовании ингибитора фактора роста в комбинации с введением E 2 , которое частично подавляло действие эстрогена на увеличение веса матки (13). Ранее мы показали, что лечение IGF-1 стимулировало пролиферацию эпителия матки ERα-зависимым образом (16). В этом исследовании полная делеция ERα, в частности, в эпителиальной клетке-мишени матки не повлияла на синтез ДНК через 24 часа лечения E 2 или IGF-1.Следовательно, в естественной тканевой среде ERα, находящийся в строме, а не в эпителии матки, был функциональным ERα, который отвечал на E 2 с образованием фактора (ов) роста, который высвобождался и действовал как паракринный медиатор (s). ), чтобы способствовать синтезу ДНК в эпителии. Как упоминалось выше, эти результаты in vivo согласуются с предыдущими исследованиями с использованием экспериментов по рекомбинации тканей новорожденных (5).
Чтобы подтвердить отсутствие активности ERα в эпителии матки, мы оценили регуляцию гена Ltf как ERα-зависимую эстроген-регулируемую реакцию в эпителии матки (35).Экспрессия лактоферрина коррелировала с циркулирующим уровнем E 2 (36). Наш результат показал, что повышающая регуляция мРНК Ltf и белка Ltf является ERα-зависимым действием, специфичным для эпителия матки, что согласуется с предыдущими данными исследования рекомбинантных тканей (37) и подтверждает отсутствие активности ERα у эпителий. Мы обнаружили, что E 2 перераспределяет экспрессию PR от эпителия к строме у UtEpiαERKO таким же образом, как и у WT.Эти результаты снова совпадают с предыдущими исследованиями с использованием моделей рекомбинации тканей новорожденных (38, 39). Следовательно, эстроген-зависимая чувствительность к перераспределению PR от эпителия матки к строме при лечении E 2 остается неизменной и, по-видимому, опосредуется стромальным ERα.
Во время женского репродуктивного цикла эстроген стимулирует пролиферативную фазу, облегчая имплантацию и беременность. У грызунов пролиферирующий эпителиальный слой устраняется путем индукции апоптоза in situ (40).Пролиферация и последующая элиминация эпителиальных клеток матки во время эстрального цикла регулируется относительной скоростью митоза и апоптоза под контролем гормонов яичников, особенно уровня циркулирующего E 2 (40). Прекращение лечения новорожденных мышей E 2 приводит к высокому индексу апоптоза в матке (41). AIP обладают защитным действием против активации важного медиатора апоптоза каспазы-3, которая является членом класса цистеин-аспартилпротеаз (42).Каспазы также присутствуют в нормальных здоровых клетках в виде инактивированных ферментов и активируются путем расщепления, чтобы инициировать апоптоз и индуцировать гибель клеток (43). В нашем исследовании увеличение активной каспазы-3 у WT может быть результатом нормального регулирования между ростом и апоптозом после индуцированной E 2 пролиферации эпителия матки. После лечения диэтилстильбэстролом матки новорожденных мышей с нокаутом ERα проявляли тяжелый апоптоз, тогда как мыши WT поддерживали апоптозную защиту (21), что указывает на то, что защита эстрогеном от апоптоза маточного эпителия опосредуется через ERα.В этом исследовании мы показали, что после роста, индуцированного обработкой E 2 , эпителий UtEpiαERKO обнаружил тяжелый апоптоз, о чем свидетельствует увеличение активной каспазы-3 и окрашивание TUNEL. Более того, в отсутствие ERα маточного эпителия, опосредованное E 2 увеличение апоптотического ингибитора, Birc1a , резко ослабляется. Как упоминалось ранее, C / EBPβ является критическим медиатором стимулированного E 2 пролиферативного ответа в эпителиальных клетках матки.Мыши с нокаутом C / EBPβ подвергаются апоптозу маточного эпителия в результате остановки G 1 -S-фазы (31), что свидетельствует о необходимости C / EBPβ в репликации ДНК и ответе на повреждение. В нашем исследовании уровень C / EBPβ после лечения E 2 в UtEpiαERKO сравним с таковым у WT. Однако мы не оценивали относительные уровни белка C / EBPβ в стромальных и эпителиальных клетках, и возможно, что существует дефицит этого важного фактора, присущего эпителиальным клеткам UtEpiαERKO после роста матки.Хотя апоптоз маточного эпителия в UtEpiαERKO после лечения E 2 может не быть следствием измененной регуляции C / EBPβ, он может быть альтернативным результатом дефекта других медиаторов ответа на повреждение ДНК. Таким образом, мы предполагаем, что во время репродуктивного цикла взрослого человека после стимулированного роста E 2 отсутствие ERα и действие E 2 в эпителиальных клетках нарушает ответы, инициированные неизвестным E 2 -зависимым вторичные медиаторы, приводящие к апоптозу эпителиальных клеток.Таким образом, эпителиальный апоптоз происходит из-за отсутствия эпителиального ERα. Интересно, что нормальная регуляция апоптоза важна для имплантации (44). Следовательно, изменение роста и апоптоза в результате потери маточного эпителия ERα приводит к фенотипу бесплодия у УтЭпиαЭРКО. Будут проведены более полные исследования фертильности для получения дополнительных сведений о роли маточного эпителиального ERα.
В целом, эта модель показывает, что пролиферация эпителия матки опосредуется ERα-зависимым митотическим пролиферативным сигналом, секретируемым из стромы, но что ERα необходим после митоза в эпителиальных клетках для минимизации апоптоза.Следовательно, ERα необходим в обоих тканевых компартментах для полной реакции роста матки. Удивительно, что эпителиальный ERα необходим для пролиферации молочных желез, но не обязателен при ответе матки. Потребуются дальнейшие исследования, чтобы определить, как эта дифференциальная клеточная роль ER может измениться при таких заболеваниях, как эндометриоз, гиперплазия эндометрия или рак.
Материалы и методы
Подробные методы приведены в SI «Материалы и методы» .К ним относятся создание линии трансгенных мышей Wnt7a -Cre, создание мышей с нокаутом ERα, специфичных для эпителия матки, химические вещества и соединения, биотест матки, выделение РНК и анализ ПЦР в реальном времени для экспрессии генов, гистологический анализ и анализ IHC матки, и статистический анализ.
Благодарности
Мы благодарим Джеймса Кларка, Пейдж Майерса, Дэвида Гулдинга из отделения сравнительной медицины Национального института гигиены окружающей среды (NIEHS) животных хирургической группы за выполнение операций на животных и анализа переноса эмбрионов, Дэвида Монроя за уход за животными, Джеффри Hurlburt и Dave Olsen (ядро иммуногистохимии NIEHS) для расщепленной каспазы-3 и окрашивания TUNEL, Casey Reed для генотипирования мышей и доктора.Эйприл Биндер и Дайан Клотц за критическое прочтение рукописи и полезные предложения. Это исследование было поддержано Национальным институтом наук об окружающей среде, отделом внутренних исследований (финансирование W.W., S.C.H. и K.S.K.), проектом Z01ES70065, а также NIH HD30284 и CA098258 (SPORE в раке матки) R.R.B. G.D.O. был поддержан программой обучения по молекулярной генетике рака Национального института рака CA09299.
Сноски
- 1 Кому следует направлять корреспонденцию.Электронная почта: korach {at} niehs.nih.gov.
-
Вклад авторов: W.W., S.C.H., G.D.O., R.R.B. и K.S.K. спланированное исследование; W.W., S.C.H. и G.D.O. проведенное исследование; W.W., S.C.H., G.D.O. и K.S.K. проанализированные данные; G.D.O. и Р.Р.Б. внесены новые реагенты / аналитические инструменты; и W.W., S.C.H., G.D.O. и K.S.K. написал газету.
-
Авторы заявляют об отсутствии конфликта интересов.
-
Эта статья представляет собой прямое представление PNAS.
-
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/lookup/suppl/doi:10.1073/pnas.1013226107/-/DCSupplemental.
Контуры патологии — эндоцервикальный полип
Доброкачественные / неопухолевые эпителиальные поражения
Эндоцервикальный полип
Главный редактор: Дебра Л. Зингер, MD
Тема завершена: 12 августа 2019
Незначительные изменения:
9197 3 сентября Авторские права : 2007-2021, PathologyOutlines.com, Inc.Поиск в PubMed: Эндоцервикальный полип [TIAB]
просмотров страниц в 2020 году: 33,821
просмотров страниц в 2021 году по настоящее время: 31,940
Цитируйте эту страницу: Buza N.Эндоцервикальный полип. Сайт PathologyOutlines.com. https://www.pathologyoutlines.com/topic/cervixendocervpolyp.html. По состоянию на 10 октября 2021 г.
Определение / общее
- Доброкачественная экзофитная пролиферация, состоящая из различной примеси эндоцервикального железистого и метапластического плоского эпителия с фиброваскулярным ядром
Основные признаки
- Эндоцервикальные полипы — это распространенные доброкачественные пролиферации, состоящие из фиброваскулярного ядра и эндоцервикального железистого или метапластического плоского эпителия
- Хроническое воспаление, поверхностная эрозия и реактивные изменения эпителия являются обычными явлениями
- В редких случаях могут быть обнаружены in situ или инвазивные плоскоклеточные или железистые поражения.
- Отсутствие листовой архитектуры и перигландулярной стромальной конденсации, которые являются ключевыми особенностями Мюллерова аденосаркома (Am J Surg Pathol 2009; 33: 278)
Кодировка МКБ
- МКБ-10: N84.1 — полип шейки матки
Эпидемиология
- Эндоцервикальные полипы очень распространены и могут появиться в любом возрасте, хотя чаще встречаются у пациентов старше 40 лет (Menopause 2009; 16: 524)
Патофизиология
- Скорее всего, неопухолевой природы
Этиология
- Этиологические факторы точно не известны, хотя существует гипотеза о роли хронического воспаления.
- Эндоцервикальные полипы с микрогландулярной гиперплазией / полиповидной микрогландулярной гиперплазией шейки матки могут быть связаны с беременностью или эффектом экзогенного прогестина (Int J Gynecol Pathol 1995; 14: 50)
Клинические особенности
- Большинство обнаруживается случайно во время обычного гинекологического осмотра.
- Могут также проявляться аномальные выделения из влагалища или кровотечения (посткоитальные или контактные) или аномальные выделения из влагалища (Obstet Gynecol 1963; 21: 659)
Клинические изображения
Изображения, размещенные на других серверах :
Кольпоскопия
Полип
Общее описание
- Обычно одиночный, чаще всего <1 см
Брутто фото
Предоставлено Натальей Буза, М.Д.
Маленький полип
Описание замороженного участка
- Микроскопические особенности эндоцервикального полипа на замороженных срезах аналогичны тем, которые наблюдаются на постоянных срезах
- Самым важным дифференциальным диагнозом по замороженному сечению является аденосаркома.
- В отличие от аденосаркомы, эндоцервикальные полипы лишены перигландулярной стромальной конденсации, внутрижелезистых папиллярных выступов и не выявлено значительной атипии стромальных или эпителиальных клеток (Am J Surg Pathol 2015; 39: 116)
Замороженные изображения разделов
Предоставлено Натальей Буза, М.Д.
Железы в однородной строме
Микроскопическое (гистологическое) описание
- Фиброваскулярное ядро с сосудистой сетью различного размера (часто включая толстостенные артерии)
- Вариабельная клеточность стромы, часто при смешанном хроническом воспалении
- Поверхностный эпителий эндоцервикального железистого типа может проявлять плоскоклеточную метаплазию, эрозии и реактивные / репаративные изменения
- Разрастание эндоцервикальных желез, которое может быть кистозным или может проявлять доброкачественную микрогландулярную гиперплазию
- Митотическая активность может быть заметной, особенно в случаях выраженного воспаления или гиперплазии микрогландулярных клеток (Int J Gynecol Pathol 2014; 33: 524)
- «Эпидермальную» метаплазию можно увидеть со структурами придатков кожи (Int J Gynecol Pathol 2016; 35: 478)
- Стромальные клетки могут быть многоядерными, могут иметь децидуальные изменения или могут содержать гетерологичные элементы (жир, хрящ, кость, глиальная ткань), которые могут представлять сохраненные ткани плода от предыдущей беременности (Int J Gynecol Pathol 2010; 29: 394)
- Эндоцервикальные полипы редко могут содержать in situ или инвазивные плоскоклеточные и железистые поражения, i.е. плоскоклеточное интраэпителиальное поражение высокой степени, аденокарцинома in situ, плоскоклеточная карцинома и аденокарцинома (J Womens Health (Larchmt) 2007; 16: 1317, Int J Gynecol Pathol 2009; 28: 567)
Микроскопические (гистологические) изображения
Предоставлено Натальей Буза, доктором медицины, и Андреем Бычковым, доктором медицины, доктором философии.
Артерии с толстыми стенками
Микрогландулярная гиперплазия
Плоская метаплазия
Хроническое воспаление
Митосес
Кистически расширенные железы
Положительные пятна
- Иммуногистохимические окрашивания обычно не нужны для постановки диагноза
- Окрашивание эпителиальных элементов различными эпителиальными маркерами (цитокератины, EMA) и окраска стромального компонента виментином и маркерами гладких мышц
Образец отчета о патологии
- Шейка матки, полипэктомия:
- Доброкачественный полип эндоцервикального канала с хроническим воспалением и реактивными изменениями
Дифференциальный диагноз
- Аденосаркома:
- Листовидная железистая структура, напоминающая филлодийную опухоль груди, с внутрижелезистыми папиллярными выступами и заметным перигландулярным сгустком стромы
- Также присутствуют атипия стромальных клеток и митотические фигуры стромы
- Полип эндометрия:
- Разрастание доброкачественных стромальных и железистых элементов эндометрия, выступающих в полость эндометрия
- Иногда более крупный полип, возникающий в нижнем сегменте матки, может выступать в эндоцервикальный канал или может быть виден через зев шейки матки, имитируя эндоцервикальный полип
- Полиповидная аденомиома:
- Кондилома:
- Экзофитное бородавчатое поражение эктоцервикса с плоскоклеточным эпителием, проявляющееся папилломатозом и койлоцитозом, обычно ассоциированным с папилломавирусной инфекцией низкого риска
Вопрос стиля проверки совета директоров № 1
Какое из следующих утверждений относительно этого эндоцервикального поражения верно?- Наличие какой-либо митотической активности указывает на злокачественность
- Наличие гетерологичных мезенхимальных элементов указывает на злокачественность
- Редко такие поражения могут содержать злокачественные новообразования in situ или инвазивные
- Такие поражения чаще всего встречаются у детей и подростков.
Стиль обзора совета директоров Вопрос № 2
Какие из следующих морфологических особенностей характерны для доброкачественных эндоцервикальных полипов?- Блочная пролиферация эндоцервикальных желез с плоскоклеточной метаплазией
- Выраженная ядерная атипия поверхностного эпителия с сильной диффузной иммунореактивностью p16
- Перигландулярная стромальная конденсация
- Выдающаяся листовая железистая структура с внутрижелезистыми выступами
Секс-стероидов и рак шейки матки
Реферат
В 19 веке исследования показали, что репродуктивные процессы участвуют в развитии рака шейки матки.Инфекция, вызванная вирусом папилломы человека (ВПЧ), является предпосылкой для развития рака, но необходимы сопутствующие факторы, в том числе действие половых стероидных гормонов. Роды были важным фактором риска, но сейчас, вероятно, играют второстепенную роль в промышленно развитом мире, где уровень паритета низок. Длительное использование оральных контрацептивов было тщательно изучено эпидемиологически и в большинстве исследований коррелирует с раком шейки матки. Исследования in vitro линий клеток шейки матки, трансфицированных ВПЧ, и исследования на животных показывают, что половые стероидные гормоны способны вызывать рак.В исследованиях тканей рака шейки матки in vivo были наблюдения, что эндогенный прогестерон в сыворотке коррелирует с негативным паттерном экспрессии клеточных и внеклеточных белков, онкомаркеров. Иммунный ответ может быть другим механизмом. Эстрадиол может быть связан с положительной картиной, а высокий уровень эстрадиола и низкий уровень прогестерона увеличивают продолжительность выживания при раке шейки матки. Исследования, в которых проводилось лечение соединениями, влияющими на половые стероидные гормоны, были редкими и разочаровывающими.
Рак шейки матки является вторым по распространенности типичным для женщин раком после рака груди. Около полумиллиона женщин в мире ежегодно страдают от этого заболевания, а глобальная смертность приближается к 60%, а в развивающихся странах даже выше (1).
Гиппократ, основоположник современной медицины, описал рак шейки матки в 400 г. до н. Э. Таким образом, он признал, что это неизлечимое заболевание, которое разрушает матку и неизменно приводит к смерти, и пришел к выводу, что ее не следует лечить (2).
Массовый гинекологический скрининг был введен в промышленно развитый мир в 1960-х годах, и благодаря обнаружению и лечению предшественников рака заболеваемость снизилась вдвое по сравнению с предыдущими уровнями (3-5). Этот успех не мог бы произойти без открытий Хинзельмана и Папаниколау в 1930-х и 1940-х годах. С изобретением Хинзельманном кольпоскопа стало возможным идентифицировать предшествующие поражения в эпителии порции и шейки матки, в дальнейшем называемом просто шейкой матки, и мишенями для биопсии и микроскопического исследования.Бинокулярный кольпоскоп обычно увеличивает шейку матки, очищенную слабым раствором уксусной кислоты, в 8-16 раз, и таким образом исследуют порцию и нижнюю часть цервикального канала снаружи влагалища во время обычного гинекологического осмотра (6). Папаниколау обнаружил, что после чистки шейки матки и изучения мазка под микроскопом можно определить нормальный эпителий, предшественников и инвазивный рак. Цитологию влагалища до сих пор часто называют мазком Папаниколау (7).
В 1970-х годах Цур Хаузен обнаружил, что рак шейки матки в значительной степени сопровождался папилломавирусной инфекцией (ВПЧ) (8). Потребовалось 20 лет, прежде чем научное сообщество убедилось, что ВПЧ является основным этиологическим фактором в развитии рака шейки матки, за что Цур Хаузен был удостоен Нобелевской премии в 2008 году. Примерно 15 из более чем 100 типов ВПЧ считаются относящимися к группе высокого риска. , в частности, на шейку матки (9).
Инфекция ВПЧ считается «необходимой, но недостаточной» для прогрессирования предшественника, цервикальной интраэпителиальной неоплазии (ЦИН), до инвазивного рака (10). In vitro , присутствие HPV само по себе приводит к развитию карциномы in situ из нормальных эпителиальных клеток, но не к инвазивному раку. Для этого последнего шага, по-видимому, необходимы кофакторы. Наиболее изученными кандидатами в сопутствующие факторы являются курение и женские половые стероидные гормоны (11, 12). Здесь обсуждаются доказательства биологической роли эндогенных и экзогенных половых стероидных гормонов при раке шейки матки. Если не указано иное, «неоплазия шейки матки» относится к инвазивному плоскоклеточному раку или CIN.Также необходимо подчеркнуть, что в дальнейшем маркеры биологических тканей, а также клеточные и внеклеточные белки будут называться опухолевыми маркерами, чтобы отличать их от белков, которые не были связаны с раком.
Репродукция
В 1840-х годах итальянский врач Ригони-Штерн опубликовал свои знаменитые статьи, в которых указывалось на связь между репродуктивными факторами и раком шейки матки. Таким образом, он заметил, что болезнь часто встречается у проституток и почти отсутствует у монахинь.Рак шейки матки стал заболеванием «бедных и социально незащищенных женщин», и низкий социально-экономический статус остается фактором риска во многих исследованиях. Позже, в 19 веке, немецкий врач фон Скацони предположил, что причинными факторами были «слишком много секса или самозагрязнения» (13). В 19 веке считалось, что мастурбация вызывает большое количество болезней. В 1950-х годах появились исследования, подтвердившие роль рискованного сексуального поведения как основного эпидемиологического фактора риска рака шейки матки.Возраст на момент первого полового акта был одним из первых исследованных факторов (14). Считалось, что эта связь вызвана уязвимой шейкой матки у молодых женщин. Впоследствии было обнаружено, что количество сексуальных партнеров на протяжении всей жизни является более сильным фактором риска (15). Предполагаемая биологическая роль низкого возраста при первом половом акте все еще остается спорной. Однако чем больше лет половой жизни, тем выше статистическая вероятность наличия нескольких партнеров и тем выше риск контакта с мужчиной-носителем генитальной инфекции ВПЧ.
Паритет был одним из первых исследованных репродуктивных факторов, и Ригони-Стерн также заметил, что это заболевание чаще встречается у замужних женщин и вдов, чем у незамужних женщин. Если половые стероидные гормоны являются истинными кофакторами, с одной стороны, существует биологическое обоснование множественности в качестве кофактора, поскольку уровни гормонов в сыворотке крови высоки во время беременности (16). С другой стороны, множественность может быть причиной рискованного сексуального поведения, особенно до появления современных противозачаточных средств, но они все еще недоступны во многих частях мира.Новообразования шейки матки, ЦИН и рак относительно часто выявляются во время беременности. Тем не менее, беременность — это ситуация, когда женщинам часто проводят гинекологические осмотры и делают мазки Папаниколау, что может привести к смещению выявления. Распространенным наблюдением является спонтанное заживление таких повреждений после родов, что может подтвердить гормональную теорию. В этом отношении «заживление» часто обнаруживалось через 3-6 месяцев после родов. Однако в долгосрочном исследовании рецидив CIN достигал 25%, а истинная скорость регресса была такой же, как у небеременных женщин с CIN (17).
В большинстве эпидемиологических исследований паритет был связан с раком шейки матки и CIN. В большинстве крупных и недавних исследований, ограничивающих анализ только ВПЧ-положительными женщинами, сообщается о повышенном риске неоплазии шейки матки с увеличением паритета (18), но результаты были противоречивыми, поскольку в ряде исследований не было обнаружено никакого эффекта паритета. . Ранние исследования не могли приспособиться к сексуальному поведению (19) и не будут здесь комментироваться. Даже после корректировки факторов сексуального риска остается несколько проблем с установлением причинно-следственных связей.Во многих частях промышленно развитого мира высокий паритет встречается редко (20, 21), в то время как множественный паритет обычен в развивающихся странах или странах с ограничениями на использование противозачаточных средств (16, 22). В странах с низким паритетом его корреляция с заболеваемостью новообразованиями шейки матки, как правило, отсутствует или низкая (21), или имеет низкую статистическую мощность (20). Корректировка рискованного сексуального поведения имеет решающее значение, когда исследуются корреляции между репродуктивными факторами или использованием гормональных контрацептивов и неоплазией шейки матки (см. Ниже).Все вышеперечисленные исследования с поправкой на сексуальное поведение (16, 20, 22) выявили повышенный риск неоплазии шейки матки с увеличением числа родов, но следует учитывать остаточные искажения.
В целом, эпидемиологические исследования предполагают корреляцию между паритетом и неоплазией шейки матки. Было высказано предположение, что повышенное воздействие на зону трансформации шейки матки, где начинается неоплазия шейки матки, после беременности может способствовать инфицированию ВПЧ (18). Это противоречит теории о том, что половые стероидные гормоны являются истинными кофакторами, i.е. участвует в клеточных молекулярных событиях, вызывающих развитие инвазивного рака шейки матки. Результаты одного исследования не обнаружили никакой корреляции между паритетом и инфекцией ВПЧ, что указывает на то, что паритет является независимым кофактором (23). Для выяснения роли половых стероидов в неоплазиях шейки матки необходимы экспериментальные данные.
Гормональные контрацептивы
Первое сообщение о возможном влиянии половых стероидных гормонов на рак половых органов у человека появилось в 1971 г. (24).Более высокая частота светлоклеточной аденокарциномы влагалища, редкого типа рака, была диагностирована у женщин и девочек в возрасте 7 лет, матери которых подвергались воздействию диэтилстильбэстрола во время беременности. Последующие исследования новообразований шейки матки противоречивы (25, 26). Диэтилстильбестрол — синтетический эстроген, который с 1940-х по 1960-е давали беременным женщинам, которые, как считается, подвергались риску самопроизвольного аборта.
Использование оральных контрацептивов (ОК) рано стало эпидемиологическим фактором риска неоплазии шейки матки, но только в начале 1980-х годов появились исследования с поправкой на другие факторы риска (27, 28).Исследования использования OC требуют даже более тщательной методологии, чем исследования, касающиеся паритета. Можно было ожидать, что пользователи ОК более сексуально активны, чем не употребляющие. Половое воздержание, брак и другие характеристики, связанные с сексуальным поведением с низким уровнем риска, уменьшат необходимость в использовании противозачаточных средств. Четность может быть ниже среди пользователей OC и может привести к отрицательному смещению. Привычки в отношении курения, систематическая ошибка выявления из-за частой оценки мазка Папаниколау и социально-экономический статус являются другими источниками систематической ошибки.Самое главное, следует учитывать эффект доза-ответ, , т.е. лет использования ОК. Раньше использовались ОК «с высокими дозами», что еще больше усложняло интерпретацию результатов.
Также необходимо учитывать опасное сексуальное поведение, кроме нескольких половых партнеров и возраста начала полового акта, например половой акт с неизвестными мужчинами и секс на первом свидании. Анальный половой акт связан с увеличением распространенности инфекций, передаваемых половым путем, таких как инфекция ВПЧ.Что наиболее важно, но редко, если вообще когда-либо было включено в расследование, так это рискованное сексуальное поведение партнера-мужчины. Хорошо известно, что в разных популяциях и частях света у женщин относительно мало половых партнеров на протяжении всей жизни, в отличие от мужчин. В одном исследовании количество партнеров мужей было более важным, чем количество жен. Эти переменные никогда не включались в исследования использования гормональных контрацептивов (29).
OC повышает уровень половых стероидных гормонов в сыворотке крови.В эпидемиологических исследованиях невозможно подтвердить теорию половых стероидных гормонов как причинных кофакторов с ВПЧ во время перехода от нормального эпителия к ЦИН и инвазивному раку. Идеальным исследованием было бы консервативное лечение ЦИН до регресса к норме или прогрессирования до рака, связанного с использованием ОК. Такое исследование, очевидно, было бы глубоко неэтичным. Альтернативой было бы изучение женщин с КИН, которые были потеряны для последующего наблюдения и у которых в конечном итоге развился рак шейки матки, но ретроспективные исследования неизменно предвзяты, и эти результаты также будут неубедительными.
Когда были опубликованы первые эпидемиологические исследования с поправкой на рискованное сексуальное поведение, которое также включало курение, стало ясно, что использование ОК, но только долгосрочное, , т.е. более 4-5 лет, независимо коррелировало с неоплазией шейки матки. независимо от сексуального поведения и курения (27, 28). Отношение шансов в целом было умеренным, 1,5–2,0, но значительным. Последующие исследования показали расходящиеся результаты, но в целом с тенденцией к значительной связи между неоплазией шейки матки и использованием ОК (30–32).
ИспользованиеOC, как и паритет, должно быть исследовано на предмет возможной корреляции с инфекцией ВПЧ. Использование OC может быть просто сторонним наблюдателем. Если использование ОК является фактором риска, независимым от инфекции ВПЧ, это может быть настоящим биологическим кофактором, а не только коррелированным с неоплазией шейки матки в эпидемиологических исследованиях. В нескольких исследованиях изучалась возможная корреляция употребления ОК с инфекцией ВПЧ и корректировались результаты с учетом рискованного сексуального поведения (33–36). Эти исследования обнаружили независимую корреляцию между использованием ОК и неоплазией шейки матки.Интересно, что использование ОК в высоких дозах, но не в низких дозах, было в значительной степени связано с инфекцией ВПЧ (34). Причина неясна, но может предполагать, что биологическое влияние экзогенных стероидных гормонов, например, при эктопиях шейки матки, может напрямую способствовать проникновению ВПЧ в эпителий шейки матки. Граница между железистым эпителием эндометрия и плоскоклеточным эпителием влагалища, зона трансформации, является источником неоплазии шейки матки и мишенью для ВПЧ.Эктопия увеличивает вагинальное воздействие на зону трансформации и может быть более легкой мишенью для ВПЧ. В исследования, проведенные в течение последних 20 лет, ОК в высоких дозах включались редко, если вообще включались.
Обзорыпришли к выводу, что существует эпидемиологическая корреляция между длительным использованием ОК и новообразованиями шейки матки, будь то ЦИН или инвазивный рак, независимо от статуса ВПЧ. Сообщалось о повышенной частоте использования ОК до 15 лет (30–32). Сообщалось о противоречивых результатах, но в любом исследовании необходимо принимать во внимание размер исследуемой популяции.Стратификация на группы по годам использования ОК может дать ограниченные возможности для достижения значительных различий. Например, анализ 60 случаев с использованием ОК в течение 5-10 лет и 40 случаев использования ОК в течение более 10 лет не продемонстрировал каких-либо существенных отличий от тех, кто не использовал ОК, несмотря на постоянное повышение риска рака шейки матки с 1,5 до 3,4 (отношение шансов ) при сравнении использования от 1 года до более чем 10 лет (37).
При заместительной гормональной терапии в постменопаузе (ЗГТ) природный эстрадиол или эстрогены назначают отдельно или в комбинации с прогестагеном.Длительное использование относительно редко, и исследования редки, но результаты показывают, что нет никакой корреляции с раком шейки матки (38, 39), а ЗГТ, по-видимому, не влияет на прогноз после лечения рака шейки матки (38, 40).
В важном метаанализе, охватывающем 24 всемирных исследования, были проанализированы 16573 женщины с раком шейки матки и 35509 женщин без рака шейки матки. Объединенный относительный риск при длительном применении ОК (среднее значение = 11 лет среди случаев) составил 1,9, что является наиболее актуальной оценкой риска в настоящее время.Что касается связи курения и рака легких, риск неоплазии шейки матки снизился до нормального через 10 лет после прекращения использования ОК (41). Имеющиеся данные не указывают на то, что стероидные гормональные контрацептивы влияют на прогноз ЦИН или инвазивного рака. Таким образом, ОК следует рассматривать как фактор риска неоплазии шейки матки, независимо от инфекции ВПЧ и эпидемиологических факторов риска.
Прогестогенные контрацептивы чаще всего вводятся перорально или в виде инъекций медроксипрогестерона ацетата, но прогестины также выделяются в лекарственные внутриматочные спирали и подкожные имплантаты.Сообщалось о противоречивых результатах в отношении возможных эффектов на эпителий шейки матки. В исследовании, проведенном в Южной Африке, отношение шансов у пользователей прогестагенных контрацептивов составляло 1,0 для развития инвазивного рака шейки матки (42), в то время как в ямайском исследовании карциномы in situ было показано отношение шансов 1,9, но это не было значимым (43). ). Совместное исследование неоплазии и стероидных контрацептивов ВОЗ выявило относительный риск 2,4 при использовании инъекционного депо-медроксипрогестерона ацетата не менее пяти лет, но не исключило, что результат был вызван неправильной поправкой на сексуальные факторы (44).
Иммунитет
Половые стероидные гормоны модулируют иммунные реакции. В целом прогестерон связан с подавлением иммунитета, тогда как эстрадиол, по-видимому, связан с усилением иммунной защиты (45). У женщин уровень иммуноглобулина выше, чем у мужчин, но у них может быть сниженный клеточный иммунитет, что позволяет иммунологически ускользать от инфицированных ВПЧ клеток (46, 47). Во время беременности активность естественных клеток-киллеров подавляется, что указывает на снижение иммунологического ответа (48).Рецепторы эстрогена были идентифицированы в ряде иммунокомпетентных клеток, а прогестерон увеличивает продукцию иммуносупрессивных факторов в ткани эндометрия и интерлейкина-1 в моноцитах (49). Это некоторые примеры иммунологических эффектов половых стероидных гормонов. Клиническая роль этих результатов неясна.
Экспериментальные и лабораторные исследования
Как обсуждалось выше, эпидемиологические исследования не могут предоставить убедительных результатов и причинно-следственных связей при изучении корреляции между заболеванием и факторами риска.Результаты усиливаются, когда несколько независимых исследований демонстрируют аналогичные наблюдения и когда вносятся поправки на известные смешивающие факторы. Тем не менее, возможны остаточные искажения, в частности, когда относительные риски или отношения шансов снижаются после корректировок.
Экспериментальные и лабораторные результаты повысят биологическую достоверность эпидемиологических результатов, а — наоборот . Такие исследования включают исследования на животных, культуры клеток человека с вмешательствами, серологические исследования и молекулярные исследования тканей человека.
Исследования на животных. Результаты исследований на животных сбивают с толку из-за разной чувствительности к соединениям у разных видов животных по сравнению с людьми. Одним из примеров является канцерогенный эффект эстрогенов у некоторых линий мышей, но не у других линий или видов (50). Были изучены трансгенные мыши, экспрессирующие разные типы ВПЧ. При лечении мышей последовательно сниженными дозами эстрогенов в одном исследовании было достигнуто пятикратное снижение многоэтапного рака влагалища и шейки матки (51), и, наконец, эстрогены влияли исключительно на зону трансформации.Он подтвердил, что эта область шейки матки является мишенью для индуцированного эстрогеном рака шейки матки у мышей (52). Это также иллюстрирует проблему выбора соответствующих концентраций исследуемого соединения, и это также верно в исследованиях клеточных культур. Также сообщалось, что у мышей, трансгенных по онкогенам ВПЧ E6 или E7, развился рак шейки матки после лечения эстрогеном в течение 6-9 месяцев (53).
Ранние исследования также показали эпителиальные аномалии шейки матки мышей при лечении прогестагенами (54).Онкогенная трансформация клеток почек детенышей крыс с интегрированной ДНК ВПЧ 16 была обнаружена при введении прогестерона или прогестинов из ОК (55). Однако у животных эстрогены изучены более широко, чем прогестины.
Клеточные линии рака шейки матки. В одном из ранних исследований элементы ответа на прогестерон и глюкокортикоиды были идентифицированы в длинной области нескольких типов генома ВПЧ, а введение прогестинов увеличивало экспрессию онкогенов E6 и E7, которые считаются критическими для трансформации клеток (56).В другом исследовании на ВПЧ-положительных клеточных линиях обработка прогестероном усиливала образование колоний, в то время как на ВПЧ-отрицательные клеточные линии не наблюдалось никакого эффекта (57). Кроме того, было обнаружено, что увеличение концентрации прогестерона вызывает ингибирование роста за счет остановки клеточного цикла, но также снижает апоптоз (запрограммированную гибель клеток), обеспечивая рост клеток (58). Эти исследования клеточных линий человека подтверждают мнение о том, что прогестерон является основным кофактором половых стероидов при раке шейки матки. Однако также сообщалось, что лечение эстрогеном стимулировало транскрипты ВПЧ 16 в другой клеточной линии, а прогестерон — нет (59).Подобные результаты были получены на других клеточных линиях рака шейки матки человека после лечения эстрогеном (2-метоксиэстрадиолом) (60). Авторы предположили, была ли дополнительная антиэстрогеновая терапия вариантом лечения рака шейки матки. Эти разные результаты исследований клеточных культур иллюстрируют трудности, с которыми приходится делать клинические выводы, в частности, когда используются разные клеточные линии, разные эстрогены и прогестины и разные дозы. Однако исследования клеточных культур необходимы для фундаментальных исследований и генерируют идеи для клинических исследований, а — наоборот, .
Наконец, экспрессия опухолевых маркеров все больше изучается в клеточных линиях. Таким образом, экспрессия р53 увеличивалась в линиях клеток рака шейки матки, инфицированных ВПЧ, после лечения высокими дозами эстрадиола, но не низкими или средними дозами, что является возможным благоприятным эффектом в подавлении опухоли (61). p53 является ключевым медиатором клеточного цикла, вызывающим остановку клеточного цикла, позволяя репарацию мутантной ДНК или индуцировать апоптоз. cox-2 — это белок, участвующий в нескольких механизмах канцерогенеза, вероятно, действующий как промотор опухоли.Инкубация с эстрадиолом увеличивала экспрессию Цокс, в то время как синтетический прогестин снижал экспрессию (62). Следует подчеркнуть, что канцерогенез настолько сложен и связан с таким большим количеством событий и экспрессией опухолевых маркеров, которые влияют на многие этапы, необходимые в развитии опухоли, и исследование только отдельных маркеров даст неубедительные результаты.
Уровни сыворотки половых стероидов
Идея изучения новообразований шейки матки путем сопоставления клинических переменных с уровнями гормонов в сыворотке привлекательна, поскольку отражает физиологические условия.Однако есть ряд предубеждений. Такие исследования должны быть проспективными, чтобы получить надежный и релевантный структурированный анамнез пациента. При оценке уровня эндогенных гормонов следует исключить женщин, принимающих гормональные препараты и контрацептивы, а также хирургические процедуры, которые могут повлиять на уровень гормонов и клиническую стадию опухоли. День менструального цикла тесно связан с уровнем эндогенных гормонов. Согласно нашему опыту, женщины в постменопаузе должны быть исключены, так как уровень циркулирующих гормонов у женщин в период менопаузы чрезвычайно низок.Однако, если учесть такие предубеждения, серологические исследования могут предоставить дополнительные клинические и экспериментальные знания о неоплазии шейки матки.
Было проведено два исследования, одно клиническое и одно лабораторное, в которых учитывались вышеуказанные предубеждения. В обоих исследованиях все женщины в пре- и постменопаузе анализировались вместе и по отдельности. Анализы, в которых участвовали все участники, не показали различий в отношении включенных переменных. В группе пременопаузы один исход был связан с фракцией S-фазы, i.е. процент делящихся клеток в раковой ткани, как маркер пролиферации и роста рака. Почти все опухоли с высокими уровнями прогестерона в сыворотке имели высокую фракцию S-фазы. Не было обнаружено корреляций с уровнями эстрадиола в сыворотке крови, и после поправки на восемь переменных выяснилось, что только прогестерон в сыворотке и курение значимо коррелируют с пролиферацией. Это подтверждает теорию о том, что прогестины являются стимуляторами роста рака и коррелируют с плохим прогнозом (63).
В нашем клиническом исследовании изучалась смертность от инвазивного рака шейки матки, и были внесены поправки для ряда переменных, таких как клиническая стадия рака, основная прогностическая переменная. Уровни стероидов в сыворотке не использовались в качестве инструмента прогноза у женщин в постменопаузе. Уровни эстрадиола и прогестерона в сыворотке не коррелировали с общим прогнозом и смертностью. Женщины в пременопаузе с высоким уровнем эстрадиола в сыворотке крови, которые в конечном итоге умерли от своего заболевания, показали увеличенную продолжительность выживания по сравнению с женщинами с низким уровнем эстрадиола в сыворотке крови, но это было незначительно.С другой стороны, у женщин с высоким уровнем прогестерона продолжительность выживания была ниже (незначительная), чем у женщин с низким уровнем. Было рассчитано соотношение эстрадиола и прогестерона, и сочетание высокого уровня эстрадиола и низкого уровня прогестерона значительно коррелировало с более длительной выживаемостью (64).
Таким образом, похоже, что помимо уровня половых стероидных гормонов в оценке смертности участвуют другие факторы, в частности клиническая стадия постановки диагноза. Однако исследование показало усиление роста опухоли в сочетании с низким уровнем эндогенного эстрадиола и высоким уровнем прогестерона, что повлияло на продолжительность до наступления смерти.
CIN подразделяется на CIN1 (легкая дисплазия), CIN2 (умеренная дисплазия) и CIN3 (карцинома in situ ). Мы не обнаружили корреляции между степенью CIN и уровнями эстрадиола и прогестерона (Hellberg D, неопубликованные результаты). Эти результаты подтверждают результаты исследования, в которое были включены эстрадиол, прогестерон, эстрон, глобулин, связывающий половые гормоны, и дегидроэпиадростерон. Исследование было ограниченным и включало 67 женщин в пременопаузе и 43 женщины в постменопаузе с ВПЧ-положительной ЦИН или инвазивным раком.Ни один из измеренных гормонов не коррелировал со степенью предраковых поражений или стадией инвазивного рака ни у женщин в пременопаузе, ни у женщин в постменопаузе (65). В другом исследовании наблюдалась более высокая частота ВПЧ в мазках Папаниколау в связи с более высокими уровнями прогестерона в сыворотке крови, что требует подтверждения (66). Также была выдвинута гипотеза, что повышенные уровни эстрадиола, ведущие к увеличению конверсии в эстрон и, в конечном итоге, в 16α-гидроксистерон могут быть фактором риска рака шейки матки из-за стимулирования пролиферации.Повышение уровня эстрона было обнаружено с увеличением степени CIN, но в трех исследуемых группах в среднем было всего 20 женщин, и ни гипотеза, ни результаты не были подтверждены (67).
Исследования тканей шейки матки
Мы провели четыре исследования инвазивного рака и CIN и изучили экспрессию 14 и 17 опухолевых маркеров, соответственно, и коррелировали экспрессию с уровнями эстрадиола и прогестерона в сыворотке. При инвазивном раке высокие уровни прогестерона в сыворотке значительно коррелировали с повышенной экспрессией c-MYC и снижением экспрессии p53, в то время как высокие уровни эстрадиола коррелировали с низкой экспрессией рецептора эпидермального фактора роста (EGFR) (45).p53 — один из наиболее важных опухолевых супрессоров, в то время как c-MYC — классический онкопротеин. EGFR, по-видимому, является одним из наиболее важных факторов пролиферации. Эти результаты подтверждают нашу гипотезу о том, что прогестерон влияет на развитие рака шейки матки и связан с плохим прогнозом.
Дальнейшее подтверждение было получено в исследовании новых опухолевых маркеров, богатых лейцином, иммуноглобулин-подобных повторов 1 (LRIG1). Экспрессия LRIG1 коррелировала с благоприятным прогнозом рака шейки матки на ранней стадии и оказалась супрессором опухоли.Экспрессия не была связана с эстрадиолом в сыворотке крови, но снижение экспрессии наблюдалось с увеличением уровня прогестерона (68). Обнаружение более низкой экспрессии р27, супрессора опухолей, по сравнению с женщинами в постменопаузе, дало дополнительные доказательства роли стероидных гормонов и показало, что более молодых и пожилых женщин следует анализировать отдельно, прежде чем исследовать их как одну группу (69).
При CIN была обнаружена значительно более высокая экспрессия cox-2, низкая экспрессия белка ретинобластомы (опухолевый супрессор) и низкая экспрессия p16 (опухолевый супрессор) с высокими уровнями прогестерона, причем первые не зависели от степени CIN (70).Не было обнаружено никакой корреляции между эстрадиолом сыворотки и экспрессией этих онкомаркеров. Экспрессия остальных онкомаркеров также не коррелировала с уровнями половых стероидов. Можно сделать вывод, что уровни прогестерона при ЦИН и инвазивном раке связаны с негативным паттерном опухолевых маркеров. Предыдущие исследования в этой области не проводились, и наши результаты нуждаются в подтверждении.
Стероидные рецепторы
Большое внимание было уделено присутствию рецепторов эстрогена (ER) и прогестерона (PR) при неоплазии шейки матки.Частично это вызвано ранней возможностью анализа экспрессии стероидных рецепторов, когда было доступно несколько других биологических маркеров. Таким образом, в 1980-х и начале 1990-х годов на эту тему было опубликовано множество статей, а после этого было немного статей. Результаты в целом были неутешительными с клинической точки зрения (71, 72).
Естественно, что стероидные рецепторы присутствуют на более высоком уровне у женщин до менопаузы, чем у женщин в постменопаузе (71), но подавление экспрессии ER считается ранним событием перехода нормального эпителия в CIN (73).
В некоторых исследованиях сообщалось, что экспрессия ER и PR коррелировала с выживаемостью, в то время как другие не обнаружили никакой разницы. Эти исследования, проведенные в 1980-х годах, обычно не учитывали клиническую стадию. В одном исследовании повышенная экспрессия ER и PR коррелировала с более высокой выживаемостью независимо от стадии (74), а также была обнаружена, когда анализировалась только ранняя стадия рака (75). Корреляции были ограничены женщинами в пременопаузе. Среди недостатков — невозможность оценить уровень гормонов в сыворотке крови.Другие исследования не обнаружили корреляции между стероидными рецепторами и прогнозом, но не смогли проанализировать отдельно женщин в пре- и постменопаузе (76, 77). Половые стероидные гормоны в сыворотке крови у женщин в пременопаузе с учетом дня менструального цикла могут лучше отражать клеточную гормональную среду и могут быть более чувствительным методом оценки агрессивности опухоли и прогноза.
Экспрессия рецептора андрогеновплохо изучена, но, по-видимому, снижается с увеличением стадии новообразования шейки матки (78).Следует провести дальнейшие исследования прогностической роли.
Инфекция ВПЧ
Большое количество исследований пытались выяснить молекулярные связи между инфекцией ВПЧ и половыми стероидными гормонами, если таковые имеются. ДНК ВПЧ должна быть интегрирована в геном хозяина для развития рака. ДНК HPV делится на область раннего гена (E) и область позднего контроля (LCR), где последняя участвует в активации генов E6 и E7. E6 и E7 являются основными онкогенами HPV. E7 разрушает белок ретинобластомы, в то время как E6 разрушает p53, поэтому мутантный p53 не доминирует при раке шейки матки, в отличие от многих других типов рака.Инактивация обоих этих опухолевых супрессоров имеет решающее значение и является одним из признаков канцерогенеза.
Исследования связи между половыми стероидами и наличием и активацией ВПЧ носили клинический и экспериментальный характер. Как упоминалось выше, использование ОК не влияет или оказывает незначительное влияние на распространенность или приобретение цервикальной ВПЧ-инфекции, когда учитываются факторы, влияющие на факторы (79, 80). Несколько исследований показали увеличение CIN3 по сравнению с CIN1-CIN2 у пользователей ОК с ВПЧ-положительными поражениями.Персистирование инфекции HPV в нормальном эпителии увеличивает риск развития CIN, но роль использования ОК, если таковая имеется, все еще неясна. Было высказано предположение, что ОК может играть роль в переходе от КИН к инвазивному раку, но такие исследования не будут проводиться по этическим причинам, как обсуждалось выше (23).
Экспериментальные исследования были проведены на культурах доброкачественных клеток, иммортализованных типами ВПЧ высокого риска, и на линиях раковых клеток с ДНК ВПЧ, интегрированной в геном хозяина.Таким образом, когда ВПЧ типа 16 был введен в культуру эпителиальных клеток шейки матки, прогестерон индуцировал экспрессию ВПЧ и заметное увеличение вирусной информационной РНК. Ответ ингибировался антипрогестином RU486. Авторы пришли к выводу, что экспрессия HPV в ответ на прогестерон опосредована элементами ответа на глюкокортикоиды HPV (81). Кроме того, первичные эктоцервикальные клетки человека с интегрированным ВПЧ типа 16 трансфицировали элементами ответа на глюкокортикоиды. Обработка прогестероном вызывала более высокие темпы роста и диспластические клетки в этих клетках по сравнению с первичной культурой (82).
У трансгенных мышей HPV 18 высокие уровни эстрогена или прогестерона активировали β-галактозидазу раннего промотора HPV. Овариэктомия вызвала подавление исключительно в шейке матки и влагалище, но введение только эстрогена или в комбинации с прогестероном восстановило экспрессию β-галактозидазы, которая ингибировалась RU486 (83). Другим механизмом может быть регуляция лейкоцитарного антигена человека I класса (HLA) с помощью прогестерон, который также блокируется RU 486. Иммуносупрессия, вызываемая HLA, может способствовать интеграции ДНК ВПЧ и вести к иммунологическому ускользанию от цитотоксических Т-клеток (84).Эти и другие исследования демонстрируют влияние стероидных гормонов на ВПЧ в культурах доброкачественных клеток и предполагают, что эти гормоны могут играть роль на ранних стадиях инфекций ВПЧ.
В линиях раковых клеток основное внимание уделялось установлению того, будет ли введение половых стероидных гормонов усиливать экспрессию онкогенов E6 и E7, а также гена E2, необходимого для репликации. В различных исследованиях использовалось несколько линий клеток рака шейки матки человека, в том числе HeLa, C-33A, SiHa, HCE16 / 3 и CaSki.Исследования показывают противоречивые результаты и отсутствие подтверждающих исследований с использованием тех же методов, клеточных линий, доз половых стероидных гормонов, инкубации и т. Д. ограничивает убедительные доказательства.
При исследовании клеток CaSki прогестерон увеличивал транскрипцию как Е6, так и Е7 ВПЧ (57), что также было обнаружено в линии клеток HCE16 / 3 (85). В последнем исследовании также оценивался рост клеток, но не было обнаружено никакого эффекта прогестерона или эстрадиола. Противоречивые результаты были обнаружены в исследовании, которое включало как клетки CaSki, так и клетки SiHa, где не было обнаружено повышенной экспрессии E6 или E7 после лечения эстрогенами или прогестероном.Прогестерон увеличивал пролиферацию в обеих клеточных линиях, а также имел апоптотический эффект, в то время как эстрогены только увеличивали пролиферацию в клетках SiHa (86). В исследовании с использованием клеток HeLa целью было введение физиологического уровня эстрадиола. Повышения экспрессии E6 после введения эстрадиола не наблюдалось (87). Эти расходящиеся результаты подчеркивают необходимость подтверждения результатов с помощью аналогичных методов и клеточных линий.
Еще больше усложняет ситуацию то, что скорость апоптоза изучалась в нескольких исследованиях.Как упоминалось выше, одно исследование показало, что прогестерон увеличивает апоптоз в клеточных линиях CaSKi и SiHa (86). В другом исследовании с использованием клеточной линии HeLa введение как эстрогена, так и прогестерона было связано с E2- и E7-индуцированным апоптозом (88).
Исследования механизмов, с помощью которых половые стероидные гормоны влияют на экспрессию ДНК ВПЧ как в доброкачественных, так и в раковых клетках, противоречивы и изучены не полностью, но, по крайней мере, прогестерон, по-видимому, связан с пролиферацией, как в наших исследованиях тканей in vivo (63).Опосредованы ли механизмы E6 и E7, остается неясным.
Аденокарцинома
В то время как эктоцервикс покрыт плоским эпителием, как и во влагалище, эндоцервикс имеет железистый эпителий, аналогичный эндометрию матки. Эндометрий по-другому реагирует на половые стероидные гормоны, чем плоскоклеточный эптелий. Эстрогены увеличивают пролиферацию, а прогестагены уменьшают железистый эпителий. Таким образом, можно было ожидать других эффектов половых стероидов при аденокарциноме, чем при плоскоклеточном раке.Сообщалось о различиях в экспрессии опухолевых маркеров между этими двумя гистологическими типами рака шейки матки. В плоскоклеточной карциноме была более высокая экспрессия p53, кластера дифференцировки 4 (CD4), EGFR, CD44 и стратифина, чем в аденокарциноме, в то время как один из основных онкопротеинов, c-MYC, был более сильно экспрессирован в аденокарциноме. Кроме того, три из 11 исследованных онкомаркеров коррелировали с прогнозом при плоскоклеточной карциноме, а ни один — при аденокарциноме (89). Это также интересно, поскольку оба подтипа рака шейки матки разделяют ВПЧ как этиологический фактор.
Большинство исследований аденокарциномы и половых стероидных гормонов были эпидемиологическими и изучали роль использования ОК в этом подтипе рака. Экспрессия рецепторов гормонов оценивалась в некоторых исследованиях. Сообщалось о более длительной безрецидивной, но не общей выживаемости с высокой экспрессией PR (90). В небольшом исследовании 30-40% опухолей выражали PR и ER. Не было значимой корреляции с безрецидивной или общей выживаемостью (91). Другие лабораторные исследования, посвященные гормональной роли при аденокарциноме шейки матки, редки.Большинство исследований длительного использования ОК выявили повышенный риск аденокарциномы той же степени, что и плоскоклеточный рак (92, 93). Сообщалось о высоком соотношении шансов (5,5) между использованием ОК более 12 лет и риском аденокарциномы (94).
Лечение рака половыми стероидными гормонами
На основании лабораторных исследований клеточных линий было предложено гормональное или антигормональное лечение рака шейки матки. В исследовании, в котором наблюдалось подавление HLA при добавлении прогестерона, авторы пришли к выводу, что исследование предоставило доказательства для лечения антипрогестероном RU486 на ранней стадии рака шейки матки (84).Известно, что эстрогены вызывают рак шейки матки у мышей. В модели на мышах антагонист рецептора эстрадиола ICI давали мышам с новообразованиями шейки матки. Утверждалось, что ICI эффективно устраняет как предшественников, так и инвазивный рак, и авторы пришли к выводу, что он может иметь потенциальную ценность при лечении людей (95). В клеточной линии CaSki эстрадиол увеличивает экспрессию онкогенов ВПЧ. Введение 13C, соединения с антиэстрогенной активностью, отменяет экспрессию онкогенов HPV, и авторы пришли к выводу, что 13C может предотвращать рак в клетках шейки матки (96).
По крайней мере, в двух исследованиях, in vivo, оценивалась терапия половыми стероидами у женщин с КИН. После лечения дегидроэпиандростероном женщин с CIN1 в течение шести месяцев 83% CIN регрессировали. Контрольной группы не было, и не исключено, что регресс также мог произойти без лечения. В это исследование были включены только 12 женщин, более крупных рандомизированных исследований не опубликовано (97). По неясным причинам вагинальное лечение прогестероном в течение шести месяцев CIN1 также использовалось в более крупном исследовании (40 случаев и 96 нерандомизированных контролей).Интересно, что лечение прогестероном было связано с более высокой устойчивостью CIN (98).
Заключение
Связь с раком шейки матки и репродуктивными заболеваниями наблюдается с 19 века. В эпидемиологических исследованиях в начале 1990-х годов сообщалось, что длительное использование ОК, независимо от других факторов риска, коррелирует с раком шейки матки. В исследованиях на животных и в исследованиях клеточной линии шейки матки как эстрогены, так и гестагены трансформировали нормальные клетки в раковые.Недавно было изучено влияние сывороточных уровней половых стероидов и гормональных контрацептивов на экспрессию онкомаркеров. Имеющиеся данные показывают, что высокие уровни прогестерона в сыворотке коррелируют с экспрессией неблагоприятного паттерна опухолевых маркеров, в то время как роль эстрогена неясна, но высокие уровни в сыворотке могут коррелировать с благоприятным прогнозом при раке шейки матки.
- Получено 22 марта 2012 г.
- Исправление получено 23 апреля 2012 г.
-
