Терифлуномид — препарат для лечения рассеянного склероза
Лечение должно проводиться под наблюдением врача, имеющего опыт лечения пациентов с рассеянным склерозом.
Во время лечения терифлуномидом следует регулярно контролировать следующие параметры:- артериальное давление;
- активность АЛТ;
- в случае появления новых симптомов и признаков (например, инфекции) во время лечения необходимо выполнить общий анализ крови с подсчетом лейкоцитарной формулы и определением количества тромбоцитов в периферической крови.
Процедура ускоренного выведения терифлуномида из организма
Терифлуномид медленно выводится из плазмы: концентрации в плазме достигают значений ниже 0,02 мг/л в среднем за 8 месяцев, хотя из-за индивидуальных отклонений в процессе выведения лекарственных веществ выведение может длиться до 2-х лет.
Выведение терифлуномида можно ускорить с помощью ускоренной процедуры выведения терифлуномида, описанной в разделе «Фармакокинетика», подраздел «Выведение», приводящей к снижению более чем на 98 % концентрации терифлуномида в плазме крови.
Пациенты старшей возрастной группы
Препарат Терифлуномид необходимо назначать с осторожностью пациентам в возрасте 65 лет и старше в связи с недостаточным количеством данных об эффективности и безопасности терифлуномида в данной возрастной группе.
Почечная недостаточность
У пациентов с почечной недостаточностью легкой, средней или тяжелой степени, не находящихся на гемодиализе, коррекции дозы не требуется.
Пациенты с почечной недостаточностью тяжелой степени, находящиеся на гемодиализе, не принимали участия в клинических исследованиях. Этой группе пациентов противопоказан прием терифлуномида.
Пациенты детского возраста
Безопасность и эффективность препарата Терифлуномид у детей и подростков в возрасте до 18 лет не установлена.
Печеночная недостаточность
У пациентов с печёночной недостаточностью легкой или средней степени коррекция дозы не требуется.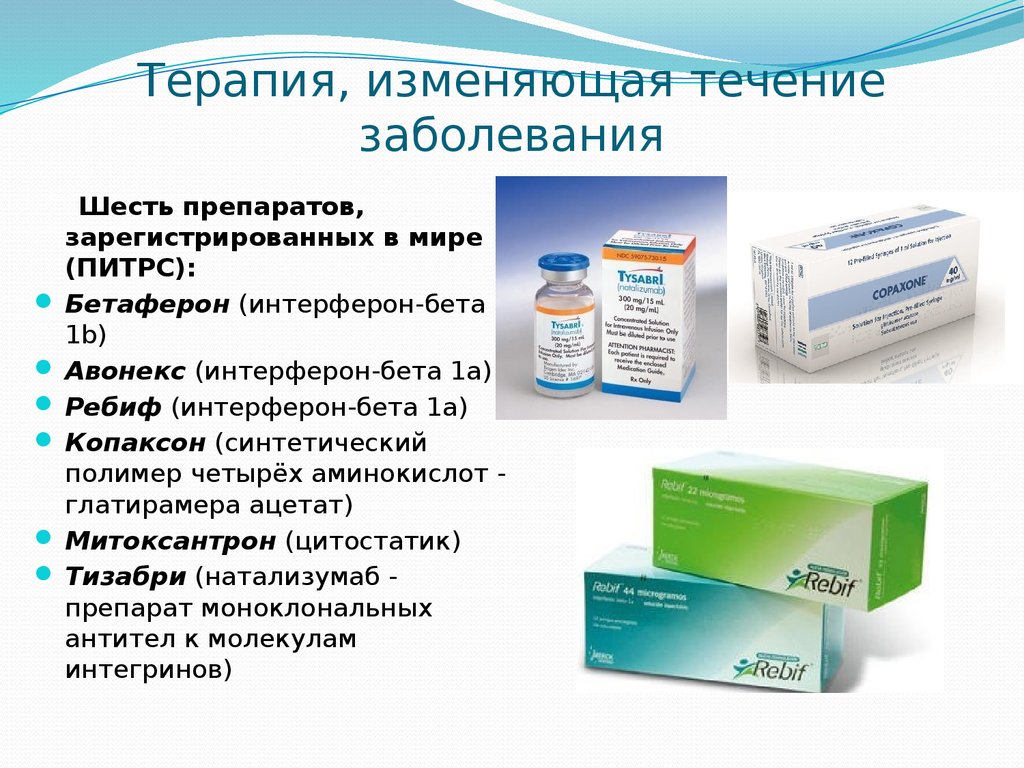
Терифлуномид противопоказан пациентам с тяжелой печёночной недостаточностью.
У пациентов, принимавших терифлуномид, наблюдалось повышение активности ферментов печени. Повышения активности АЛТ в основном отмечались в течение первых 6 месяцев лечения. В половине случаев показатели вернулись к норме без отмены препарата. В клинических исследованиях применение терифлуномида прекращалось, если повышение активности АЛТ дважды превышало ВГН в З раза. Активность трансаминаз в сыворотке крови возвращалась к норме в течение, приблизительно, 2 месяцев после отмены терифлуномида
Следует контролировать показатели активности трансаминаз и концентрации билирубина в сыворотке крови в течение 6 месяцев до начала лечения препаратом Терифлуномид. Активность АЛТ следует определять каждые 2 недели в течение шести месяцев после начала применения препарата Терифлуномид. Вопрос о мониторинге показателей функции печени также следует рассматривать, когда препарат Терифлуномид применяется одновременно с другими потенциально гепатотоксичными препаратами. Вопрос об отмене препарата Терифлуномид следует рассматривать при подтверждении повышения активности трансаминаз в сыворотке крови, более чем в три раза превышающем ВГН. Следует мониторировать активность трансаминаз и концентрацию билирубина в сыворотке крови на фоне терапии препаратом Терифлуномид, особенно у пациентов, у которых развиваются такие симптомы, указывающие на нарушение функции печени, как необъяснимая тошнота, рвота, боли в животе, повышенная утомляемость, анорексия, желтуха и/или потемнение мочи. Если подозревается, что повреждение печени вызвано применением препарата Терифлуномид, его прием следует прекратить и начать процедуру ускоренного выведения терифлуномида (см. раздел «Фармакокинетика», подраздел «Выведение») с еженедель-ным контролем показателей функции печени до их нормализации. Если вызванное применением терифлуномида повреждение печени маловероятно, по причине выявления какой-либо другой вероятной причины, может быть рассмотрен вопрос о возобновлении лечения терифлуномидом.
Вопрос об отмене препарата Терифлуномид следует рассматривать при подтверждении повышения активности трансаминаз в сыворотке крови, более чем в три раза превышающем ВГН. Следует мониторировать активность трансаминаз и концентрацию билирубина в сыворотке крови на фоне терапии препаратом Терифлуномид, особенно у пациентов, у которых развиваются такие симптомы, указывающие на нарушение функции печени, как необъяснимая тошнота, рвота, боли в животе, повышенная утомляемость, анорексия, желтуха и/или потемнение мочи. Если подозревается, что повреждение печени вызвано применением препарата Терифлуномид, его прием следует прекратить и начать процедуру ускоренного выведения терифлуномида (см. раздел «Фармакокинетика», подраздел «Выведение») с еженедель-ным контролем показателей функции печени до их нормализации. Если вызванное применением терифлуномида повреждение печени маловероятно, по причине выявления какой-либо другой вероятной причины, может быть рассмотрен вопрос о возобновлении лечения терифлуномидом.
Терифлуномид необходимо назначать с осторожностью пациентам, злоупотребляющим алкоголем.
Поскольку терифлуномид в высокой степени связывается с белками крови, в основном с альбуминами, концентрация несвязанного терифлуномида в плазме может повышаться у пациентов с гипопротеинемией, например, при нефротическом синдроме. Терифлуномид не следует назначать пациентам с выраженной гипопротеинемией.
Артериальное давление
На фоне применения терифлуномида может отмечаться повышение артериального давления. Необходимо проконтролировать артериальное давление перед началом лечения терифлуномидом, и периодически впоследствии. В случае повышения артериального давления необходимо проводить соответствующую антигипертензивную терапию до и на фоне лечения терифлуномидом.
Инфекции
У пациентов с тяжелыми активными инфекциями начало лечения терифлуномидом необходимо откладывать до полного выздоровления.
В плацебо-контролируемых исследованиях при приёме терифлуномида повышения частоты тяжелых инфекций не наблюдалось. Однако, с учетом иммуномодулирующего эффекта препарата Терифлуномид, в случае развития у пациента тяжелой инфекции необходимо рассмотреть необходимость прекращения лечения препаратом, и перед возобновлением терапии необходимо оценить возможные преимущества и риски. В связи с длительным периодом полувыведения препарата необходимо рассмотреть необходимость проведения процедуры ускоренного выведения терифлуномида с помощью колестирамина или активированного угля.
Однако, с учетом иммуномодулирующего эффекта препарата Терифлуномид, в случае развития у пациента тяжелой инфекции необходимо рассмотреть необходимость прекращения лечения препаратом, и перед возобновлением терапии необходимо оценить возможные преимущества и риски. В связи с длительным периодом полувыведения препарата необходимо рассмотреть необходимость проведения процедуры ускоренного выведения терифлуномида с помощью колестирамина или активированного угля.
Пациенты, принимающие препарат Терифлуномид, должны немедленно сообщать о симптомах инфекций врачу. Пациенты с активными острыми и хроническими инфекциями не должны начинать лечение препаратом Терифлуномид до полного излечения. Прием препарата Терифлуномид не рекомендуется при тяжелом иммунодефиците, нарушениях со стороны костного мозга или при тяжелых неконтролируемых инфекциях.
Безопасность препарата Терифлуномид у пациентов с латентной формой туберкулеза неизвестна. Скрининг на туберкулёз в клинических исследованиях систематически не проводился. Пациентам, имеющим положительный тест на туберкулёз при скрининге, перед началом приёма препарата Терифлуномид необходимо пройти соответствующее лечение.
Пациентам, имеющим положительный тест на туберкулёз при скрининге, перед началом приёма препарата Терифлуномид необходимо пройти соответствующее лечение.
Влияние на органы дыхания
В клинических исследованиях терифлуномида не наблюдалось случаев интерстициальных легочных нарушений. При постмаркетинговом применении терифлуномида наблюдались интерстициальные болезни легких, включая острый интерстициальный пневмонит.
Во время лечения лефлуномидом, активным метаболитом которого является терифлуномид, сообщалось о развитии интерстициальных болезней легких, обострении ранее существовавших интерстициальных болезней легких. Интерстициальные болезни легких могут развиваться остро в любое время в течение лечения и иметь различные клинические проявления.
Интерстициальные болезни легких могут приводить к летальному исходу.
Развитие новых или ухудшение существующих легочных симптомов, таких как кашель и одышка, сочетающихся с лихорадкой или без лихорадки, может быть причиной для прекращения терапии и для дальнейшего соответствующего обследования пациента. В случае необходимости отмены препарата следует рассмотреть вопрос о начале процедуры ускоренного выведения терифлуномида (см. раздел «Фармакокинетика» подраздел «Выведение»).
В случае необходимости отмены препарата следует рассмотреть вопрос о начале процедуры ускоренного выведения терифлуномида (см. раздел «Фармакокинетика» подраздел «Выведение»).
Гематологические эффекты
В плацебо-контролируемых исследованиях наблюдалось уменьшение среднего количества лейкоцитов в крови приблизительно на 15% от исходного уровня (главным образом, нейтрофильных лейкоцитов и лимфоцитов) и количества тромбоцитов приблизительно на 10%. Перед началом терапии препаратом Терифлуномид и во время лечения необходимо проводить клинический анализ крови с определением лейкоцитарной формулы и количества тромбоцитов в периферической крови. На фоне терапии препаратом Терифлуномид необходимо проводить дополнительный мониторинг при появлении клинических симптомов и признаков, указывающих на наличие инфекции.
У пациентов с существующей анемией, лейкопенией и/или тромбоцитопенией, а также у пациентов с нарушениями костномозгового кроветворения или имеющих высокий риск подавления костномозгового кроветворения, имеется повышенный риск развития гематологических нарушений при применении препарата Терифлуномид. В случае развития указанных нежелательных реакций для уменьшения концентрации терифлуномида в плазме крови необходимо рассмотреть вопрос о применении процедуры ускоренного выведения терифлуномида.
В случае развития указанных нежелательных реакций для уменьшения концентрации терифлуномида в плазме крови необходимо рассмотреть вопрос о применении процедуры ускоренного выведения терифлуномида.
В случаях выраженных гематологических реакций, включая панцитопению, применение препарата Терифлуномид и любого другого подавляющего костномозговое кроветворение препарата должно быть прекращено, и следует рассмотреть вопрос о проведении процедуры ускоренного выведения терифлуномида.
Кожные реакции
В ходе клинических исследований терифлуномида не было выявлено ни одного случая развития тяжелых кожных реакций. Такие случаи, включая развитие синдрома Стивенса-Джонсона и токсического эпидермального некролиза, редко наблюдались при постмаркетинговом применении препарата.
У пациентов, получавших лефлуномид, исходное соединение, главным метаболитом которого является терифлуномид, также сообщалось об очень редких случаях развития лекарственной реакции с эозинофилией и системными симптомами (DRESS).
В случае появления язвенного стоматита приём терифлуномида следует прекратить. Если возникает подозрение, что наблюдаемые со стороны кожи и/или слизистых оболочек реакции принимают характер тяжелых генерализованных кожных реакций (синдрома Стивенса-Джонсона или токсического эпидермального некролиза синдрома Лайелла), приём терифлуномида и любых других препаратов, потенциально вызывающих подобные реакции, необходимо прекратить и следует немедленно начать процедуру ускоренного выведения терифлуномида. В таких случаях пациенты не должны возобновлять лечение терифлуномидом (см раздел «Противопоказания»).
Периферическая нейропатия
У пациентов, принимавших терифлуномид наблюдались случаи периферической нейропатии. После прекращения приёма препарата состояние большинства пациентов улучшалось. Тем не менее, отмечалась значительная вариабельность исхода периферической нейропатии, т.е. у некоторых пациентов нейропатия разрешилась, а у части пациентов интенсивность симптомов не менялась. Если у пациента, принимавшего препарат Терифлуномид, диагностирована периферическая нейропатия, следует рассмотреть вопрос о прекращении приёма препарата Терифлуномид и проведение процедуры ускоренного выведения терифлуномида.
Если у пациента, принимавшего препарат Терифлуномид, диагностирована периферическая нейропатия, следует рассмотреть вопрос о прекращении приёма препарата Терифлуномид и проведение процедуры ускоренного выведения терифлуномида.
Вакцинация
Два клинических исследования показали, что вакцинации инактивированным неоантигеном (первая вакцинация) или повторным антигеном (ревакцинация) или сенсибилизирующим антигеном (стимуляция) были безопасными и эффективными во время лечения терифлуномидом. Применение живых ослабленных вакцин может быть связано с риском инфицирования и поэтому его следует избегать.
Иммуносупрессивная и иммуномодулирующая терапия
Поскольку лефлуномид является исходным соединением для терифлуномида, одновременный приём терифлуномида с лефлуномидом не рекомендован.
Одновременное применение терифлуномида с антинеопластическими или иммуносупрессивными препаратами, используемыми для лечения рассеянного склероза, не изучался. Исследования по безопасности, в которых терифлуномид принимался одновременно с интерфероном бета или с глатирамера ацетатом на протяжении до одного года, не выявили проблем с безопасностью. Безопасность этой комбинации при длительном приёме для лечения рассеянного склероза не изучалась.
Исследования по безопасности, в которых терифлуномид принимался одновременно с интерфероном бета или с глатирамера ацетатом на протяжении до одного года, не выявили проблем с безопасностью. Безопасность этой комбинации при длительном приёме для лечения рассеянного склероза не изучалась.
Применение у женщин детородного возраста/беременных женщин
Данные, полученные в ходе исследований, проведенных у животных, свидетельствуют об имеющемся риске для плода. Женщины детородного возраста должны использовать эффективные способы контрацепции для предотвращения наступления беременности во время приема препарата Терифлуномид. Если терапия препаратом Терифлуномид прекращается, женщины должны продолжать контрацепцию до подтвержденного снижения концентрации терифлуномида в плазме крови до 0,02 мкг/мл или ниже. Женщинам, которые планируют беременность или беременны, следует рекомендовать провести процедуру ускоренного выведения терифлуномида для быстрого уменьшения концентрации терифлуномида в плазме крови. Без процедуры ускоренного выведения терифлуномида, время достижения концентрации препарата в плазме крови меньшей или равной 0,02 мкг/мл в среднем составляет 8 месяцев; однако из-за индивидуальных различий в процессе выведения терифлуномида, этот период может длиться до 2-х лет. Процедура ускоренного выведения терифлуномида может применяться в любое время после прекращения терапии препаратом Терифлуномид (см. раздел «Фармакокинетика», подраздел «Выведение»).
Без процедуры ускоренного выведения терифлуномида, время достижения концентрации препарата в плазме крови меньшей или равной 0,02 мкг/мл в среднем составляет 8 месяцев; однако из-за индивидуальных различий в процессе выведения терифлуномида, этот период может длиться до 2-х лет. Процедура ускоренного выведения терифлуномида может применяться в любое время после прекращения терапии препаратом Терифлуномид (см. раздел «Фармакокинетика», подраздел «Выведение»).
Переход на или с препарата Терифлуномид
На основании клинических данных, относящихся к одновременному применению терифлуномида с интерфероном бета или с глатирамера ацетатом, можно сказать, что нет никакой необходимости в периоде ожидания при начале терапии терифлуномидом после интерферона бета или глатирамера ацетата, или при начале терапии интерфероном бета или глатирамера ацетатом после терапии терифлуномидом.
В связи с длительным периодом полувыведения натализумаба одновременная системная экспозиция, и, следовательно, одновременное воздействие на иммунную систему может произойти в случае начала терапии препаратом Терифлуномид в течение 2-3-х месяцев после прекращения приёма натализумаба. Поэтому следует соблюдать меры предосторожности при переходе с терапии натализумабом на Терифлуномид
С учетом периода полувыведения финголимода необходим 6-недельный интервал без терапии для элиминации из организма циркулирующих веществ. От 1 до 2-х месяцев необходимо для возвращения количества лимфоцитов к норме после прекращения применения финголимода. Начало лечения препаратом Терифлуномид в течение этого временного интервала может привести к одновременной системной экспозиции финголимода и терифлуномида. Это может иметь следствием аддитивное воздействие на иммунную систему. Поэтому следует соблюдать меры предосторожности при переходе с терапии финголимодом на терапию препаратом Терифлуномид
У пациентов с рассеянным склерозом медиана периода полувыведения из организма (t1/2z) была приблизительно 19 дней на фоне приема повторных доз терифлуномида в дозе 14 мг. Если принято решение о прекращении лечения препаратом Терифлуномид в течение 5 периодов полувыведения (приблизительно 3,5 месяца, хотя у некоторых пациентов может быть и дольше) начало другой терапии приведёт к одновременной системной экспозиции с препаратом Терифлуномид. Это может привести к аддитивному воздействию на иммунную систему, что требует обязательного соблюдения мер предосторожности.
Это может привести к аддитивному воздействию на иммунную систему, что требует обязательного соблюдения мер предосторожности.
Лактоза
Поскольку таблетки препарата Терифлуномид содержат лактозу, пациентам с непереносимостью галактозы, дефицитом лактазы или глюкозо-галактозной мальабсорбцией не следует принимать этот лекарственный препарат.
Препарат для борьбы с рассеянным склерозом внесен на рассмотрение в Перечень основных лекарственных средств ВОЗ
Рассеянный склероз – это хроническое аутоиммунное заболевание, при котором повреждается миелиновая оболочка нервных волокон головного и спинного мозга. Несмотря на то, что РС ошибочно ассоциируется с пожилым возрастом, заболевание чаще всего встречается именно у молодых людей 20-40 лет – в самый социально активный период жизни. Прогрессирующие неврологические нарушения – проблемы со зрением и координацией, потеря чувствительности, повышенная утомляемость – постепенно отнимают у них возможность вести полноценную жизнь, приводя, в том числе, к утрате трудоспособности.
Спустя всего несколько лет, человек уже не может самостоятельно передвигаться, а впоследствии вынужден постоянно использовать инвалидное кресло.
Перечень основных лекарственных средств (Essential Medicines List) пересматривается ВОЗ каждые два года и формируется на основе рекомендаций экспертов и независимых организаций, занимающихся теми или иными заболеваниями. В 2019 году раздел по РС появился в нем впервые. В связи с этим Международная федерация по борьбе с рассеянным склерозом (Multiple sclerosis International Federation) – независимая организация по борьбе с РС и его последствиями – рекомендовала ВОЗ три препарата в качестве жизненно необходимых в лечении этого заболевания. Окрелизумаб оказался в их числе.
По мнению ВОЗ, в лечении различных заболеваний необходимо предоставлять доступ к более чем одной методике, поэтому каждая организация обязана предложить три лекарственных средства. При формировании рекомендаций, MSIF составила приоритетную шкалу препаратов, основываясь на их профилях эффективности и безопасности, переносимости, путях введения, безопасности приема по время беременности, наличия биоаналогов и пр.
Включение препарата окрелизумаб в Перечень основных лекарственных средств будет означать то, что в мире официально признана важность постоянной доступности данного препарата для лечения рассеянного склероза. В России существуют собственный перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) и с 2019 года препарат окрелизумаб включен в данный перечень.
Для улучшения обеспечения пациентов в России внедрена федеральная программа по обеспечению больных высокозатратными нозологиями, в том числе, рассеянным склерозом.
Включение препарата окрелизумаб в перечень лекарственных препаратов, предназначенных для обеспечения лиц, больных рассеянным склерозом в рамках государственной программы, обеспечит широкий доступ российских пациентов с ППРС к единственной, а пациентов с РРС к наиболее эффективной опции терапии.
Моноклональные антитела в терапии рассеянного склероза: от клинических исследований к практическому применению
Н.Ю. Лащ, Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Рассеянный склероз (РС) – хроническое аутоиммунное воспалительное демиелинизирующее и нейродегенеративное заболевание с мультифакториальной этиологией развития. РС в большинстве случаев имеет волнообразное течение (периоды обострений сменяются ремиссиями), со временем болезнь приобретает прогрессирующий характер, что ухудшает качество жизни пациентов. Более 30 лет активно применяется в клинической практике патогенетическая иммуномодулирующая терапия РС для профилактики обострений и прогрессирования РС. У пациентов с РС, у которых болезнь протекает с частыми обострениями и признаками радиологической активности демиелинизирующего процесса по данным магнитно-резонансной томографии (МРТ) головного и спинного мозга, в настоящее время рекомендуется использовать препараты моноклональных антител. Для терапии первично-прогрессирующего РС зарегистрирован единственный препарат – окрелизумаб.
Более 30 лет активно применяется в клинической практике патогенетическая иммуномодулирующая терапия РС для профилактики обострений и прогрессирования РС. У пациентов с РС, у которых болезнь протекает с частыми обострениями и признаками радиологической активности демиелинизирующего процесса по данным магнитно-резонансной томографии (МРТ) головного и спинного мозга, в настоящее время рекомендуется использовать препараты моноклональных антител. Для терапии первично-прогрессирующего РС зарегистрирован единственный препарат – окрелизумаб.
Кроме того, окрелизумаб показан пациентам с ремиттирующим и вторично-прогрессирующим РС. В арсенале российских неврологов имеется 18 препаратов, большинство входят в перечень жизненно необходимых, часть из них включена в программу «12 высокозатратных нозологий» (12 ВЗН), некоторые будут включены с 2021 г. Пациенты получают лечение бесплатно. Окрелизумаб представляет собой гуманизированное моноклональное антитело, которое избирательно истощает популяцию CD20+ В-клеток.
Monoclonal antibodies in the treatment of multiple sclerosis: from clinical research to practical application
Nataliia Yu. Lashch, ORCID: 0000-0003-2826-0560, e-mail: [email protected], Pirogov Russian National Research Medical University
Multiple sclerosis (MS) is a chronic autoimmune inflammatory demyelinating and neurodegenerative disease with a multifactorial etiology of development. MS in most cases has a wave-like course (periods of exacerbations and remissions), over time, the disease becomes progressive, which worsens the quality of life of patients. The drugs disease-modifying therapies (DMT) has been actively used in clinical practice for more than 30 years to prevent exacerbations and progression of MS. In patients with MS, in which the disease occurs with frequent exacerbations and signs of radiological activity of the demyelinating process, according to magnetic resonance imaging (MRI) of the brain and spinal cord, it is recommended to use monoclonal antibody preparations. The only drug registered for the treatment of primary progressive MS is ocrelizumab. In addition, ocrelizumab is indicated for patients with remitting and secondary progressive MS.
Ocrelizumab is a humanized monoclonal antibody that selectively depletes a population of CD20+ B cells. The article presents data from clinical studies of OPERA I and OPERA II and describes a clinical case from the practice of a neurologist. Depletion of the B cell population is achieved by several mechanisms, including antibody-dependent cell-mediated phagocytosis, antibody-dependent T cell-mediated cytotoxicity, complement-dependent cytotoxicity, and apoptosis induction. The issues of efficacy and safety of ocrelizumab therapy in patients with MS are considered.
Depletion of the B cell population is achieved by several mechanisms, including antibody-dependent cell-mediated phagocytosis, antibody-dependent T cell-mediated cytotoxicity, complement-dependent cytotoxicity, and apoptosis induction. The issues of efficacy and safety of ocrelizumab therapy in patients with MS are considered.
Рассеянный склероз (РС) – самое распространенное демиелинизирующее заболевание центральной нервной системы (ЦНС), поражающее лиц молодого трудоспособного возраста и быстро приводящее их к инвалидизации. По распространенности среди неврологических заболеваний ЦНС РС занимает четвертое место после острых нарушений мозгового кровообращения, эпилепсии и паркинсонизма, а в молодом возрасте – второе место после эпилепсии [1, 2]. Повышенное внимание к РС связано с увеличением числа пациентов во всем мире. Рост заболеваемости отмечается за счет улучшения методов диагностики, внедрения МРТ в рутинную практику врача, настороженности различных специалистов в отношении развития демиелинизирующих заболеваний, внедрения ранних уточняющих диагностических критериев.
В настоящий момент этиология РС неизвестна. Причины, приводящие к запуску патологической аутоиммунной реакции, пока не найдены. Считается, что РС – это мультифакториальное заболевание, поэтому развитие процесса обусловлено несколькими факторами: генетической предрасположенностью в сочетании с условиями внешней среды, ухудшением экологической обстановки, особенностями питания, избыточной массой тела, курением, недостатком витамина D, наличием вирусных инфекций (вирусы кори, краснухи, ветряной оспы). Особую роль триггера дебюта РС отводят условно-патогенному вирусу Эпштейна – Барр и некоторым ретровирусам [1, 3]. Ежегодное увеличение числа пациентов с РС обусловливает необходимость постоянного изучения патогенетических механизмов и поиска новых, более эффективных препаратов для лечения.
Современные научные исследования в области нейроиммунологии, генетики и молекулярной биологии позволили достигнуть значительного прогресса в понимании механизмов развития демиелинизирующего и нейродегенеративного процессов при РС, разработать инновационные терапевтические подходы, тем самым увеличить продолжительность и повысить качество жизни пациентов, длительно сохранить их трудоспособность и социальную активность. Более 30 лет активно применяются в клинической практике препараты, изменяющие течение РС (ПИТРС). Эффективность и безопасность данных препаратов показаны в многочисленных международных научно-клинических исследованиях на основе принципов доказательной медицины. В арсенале российских неврологов имеется 18 препаратов, большинство входят в перечень жизненно необходимых, часть из них включена в программу «12 высокозатратных нозологий» (12 ВЗН), некоторые будут включены с 2021 г. Пациенты получают лечение бесплатно. Это инъекционные подкожные или внутримышечные препараты бетаинтерферонов 1б и 1а, глатирамера ацетата, внутривенные инфузии митоксантрона, натализумаба, окрелизумаба, алемтузумаба, пероральные препараты терифлуномид, финголимод, диметилфумарат. Современные ПИТРС позволяют существенно снизить, а иногда практически полностью контролировать активность демиелинизирующего процесса у пациентов, однако влиять на нейродегенерацию – более сложная задача, над решением которой работают ученые в разных странах.
Более 30 лет активно применяются в клинической практике препараты, изменяющие течение РС (ПИТРС). Эффективность и безопасность данных препаратов показаны в многочисленных международных научно-клинических исследованиях на основе принципов доказательной медицины. В арсенале российских неврологов имеется 18 препаратов, большинство входят в перечень жизненно необходимых, часть из них включена в программу «12 высокозатратных нозологий» (12 ВЗН), некоторые будут включены с 2021 г. Пациенты получают лечение бесплатно. Это инъекционные подкожные или внутримышечные препараты бетаинтерферонов 1б и 1а, глатирамера ацетата, внутривенные инфузии митоксантрона, натализумаба, окрелизумаба, алемтузумаба, пероральные препараты терифлуномид, финголимод, диметилфумарат. Современные ПИТРС позволяют существенно снизить, а иногда практически полностью контролировать активность демиелинизирующего процесса у пациентов, однако влиять на нейродегенерацию – более сложная задача, над решением которой работают ученые в разных странах. Основная задача врача при назначении ПИТРС – индивидуальный подбор терапии для каждого пациента, постоянный мониторинг эффективности и безопасности назначенного лечения, а при его неэффективности – своевременное изменение лечения. Идеальная цель терапии – достичь 100% критерия NEDA (No Evidence of Disease Activity – нет данных за активность заболевания (НДАЗ)) – нет обострений, нет прогрессирования инвалидности (по шкале EDSS (Expanded Disability Status Scale — расширенная шкала оценки степени инвалидизации), нет активности по данным МРТ (нет новых или увеличенных очагов на Т2-взвешенных изображениях или очагов, накапливающих контраст на Т1-взвешенных изображениях) [4–6]. В настоящее время нет единого препарата, достигающего этой цели. У многих пациентов часто наблюдается клиническая и субклиническая активность заболевания, а неврологическая инвалидизация продолжает увеличиваться.
Таким образом, всегда существует потребность в более эффективном лечении с приемлемыми профилями безопасности [7]. Тактика активного лечения (особенно на ранних стадиях заболевания), применение современных генноинженерных и иммуномодулирующих препаратов, симптоматической медикаментозной и немедикаментозной терапии, использование физиотерапевтических методик, робототехники и методов психологической коррекции меняют прогноз течения РС у большинства пациентов. Однако у части пациентов ни один из методов не останавливает активность и прогрессирование болезни. Это стимулирует исследователей к дальнейшему изучению механизмов демиелинизации и нейродегенерации при РС. Патогенез РС складывается из комплекса иммунопатологических и биохимических реакций, развивающихся в нервной системе [2, 8]. Считается, что иммунные процессы индуцируются антигенными структурами ЦНС, прежде всего основным белком миелина и гликопротеином миелина – макромолекулами олигодендроцита. Активация Т-лимфоцитов на периферии (вне ЦНС) является начальным механизмом иммунопатогенеза РС [9].
Тактика активного лечения (особенно на ранних стадиях заболевания), применение современных генноинженерных и иммуномодулирующих препаратов, симптоматической медикаментозной и немедикаментозной терапии, использование физиотерапевтических методик, робототехники и методов психологической коррекции меняют прогноз течения РС у большинства пациентов. Однако у части пациентов ни один из методов не останавливает активность и прогрессирование болезни. Это стимулирует исследователей к дальнейшему изучению механизмов демиелинизации и нейродегенерации при РС. Патогенез РС складывается из комплекса иммунопатологических и биохимических реакций, развивающихся в нервной системе [2, 8]. Считается, что иммунные процессы индуцируются антигенными структурами ЦНС, прежде всего основным белком миелина и гликопротеином миелина – макромолекулами олигодендроцита. Активация Т-лимфоцитов на периферии (вне ЦНС) является начальным механизмом иммунопатогенеза РС [9].
Следующим этапом патологического процесса является проникновение аутореактивных Т-лимфоцитов в ЦНС через гематоэнцефалический барьер посредством активации экспрессии молекул адгезии и присоединения к эндотелиальным клеткам сосудов. В ЦНС активированные Т-клетки, а также макрофаги и клетки микроглии выделяют различные провоспалительные цитокины, которые индуцируют адгезивные рецепторы на эндотелиальных и иммунных клетках, что также усиливает миграцию соответствующих иммунокомпетентных клеток к новому очагу воспаления. Помимо Т-клеточного звена иммунной системы одну из основных ролей при повреждении нервной ткани играют В-лимфоциты [10]. Предполагают, что механизм участия В-клеток при РС связан с презентацией антигена [11], производством аутоантител [12, 13] или синтеза цитокинов [11] и образованием эктопических лимфоидных фолликул в мозговых оболочках, что, возможно, способствует демиелинизации, нейродегенерации и поддержанию хронического воспаления в тканях головного и спинного мозга [14–17]. Наиболее перспективными в отношении влияния на В-клетки являются моноклональные антитела к мембранному белку CD20. CD20 представляет собой поверхностный антиген, который обнаруживается на пре-В-клетках, зрелых B-клетках и В-клетках памяти, однако не экспрессируется на более ранних предшественниках B-клеток или плазматических клетках.
В ЦНС активированные Т-клетки, а также макрофаги и клетки микроглии выделяют различные провоспалительные цитокины, которые индуцируют адгезивные рецепторы на эндотелиальных и иммунных клетках, что также усиливает миграцию соответствующих иммунокомпетентных клеток к новому очагу воспаления. Помимо Т-клеточного звена иммунной системы одну из основных ролей при повреждении нервной ткани играют В-лимфоциты [10]. Предполагают, что механизм участия В-клеток при РС связан с презентацией антигена [11], производством аутоантител [12, 13] или синтеза цитокинов [11] и образованием эктопических лимфоидных фолликул в мозговых оболочках, что, возможно, способствует демиелинизации, нейродегенерации и поддержанию хронического воспаления в тканях головного и спинного мозга [14–17]. Наиболее перспективными в отношении влияния на В-клетки являются моноклональные антитела к мембранному белку CD20. CD20 представляет собой поверхностный антиген, который обнаруживается на пре-В-клетках, зрелых B-клетках и В-клетках памяти, однако не экспрессируется на более ранних предшественниках B-клеток или плазматических клетках. Основная их роль в патогенезе РС заключается в продукции аутоантител, провоспалительных цитокинов, представлении антигенов Т-клеткам, миграции антигенов и в формировании эктопических лимфоидных фолликулов. Данный антиген к CD20 регулирует все стадии созревания В-лимфоцитов и транспорт ионов кальция через клеточную мембрану. Моноклональные антитела связываются на поверхности В-лимфоцитов с рецепторами CD20, что уменьшает пул данных клеток и ведет к стиханию иммунопатологического воспаления [6, 18]. Однако точный механизм, посредством которого достигается терапевтический клинический эффект анти-В-клеточной терапии при РС, полностью не установлен.
Основная их роль в патогенезе РС заключается в продукции аутоантител, провоспалительных цитокинов, представлении антигенов Т-клеткам, миграции антигенов и в формировании эктопических лимфоидных фолликулов. Данный антиген к CD20 регулирует все стадии созревания В-лимфоцитов и транспорт ионов кальция через клеточную мембрану. Моноклональные антитела связываются на поверхности В-лимфоцитов с рецепторами CD20, что уменьшает пул данных клеток и ведет к стиханию иммунопатологического воспаления [6, 18]. Однако точный механизм, посредством которого достигается терапевтический клинический эффект анти-В-клеточной терапии при РС, полностью не установлен.
Окрелизумаб
Тем не менее на основании данных клинических испытаний первым моноклональным антителом к CD20, показавшим свою эффективность в отношении замедления прогрессирования РС, стал окрелизумаб. В марте 2017 г. окрелизумаб был зарегистрирован FDA для лечения первично-прогрессирующего РС, а в октябре 2017 г. окрелизумаб был одобрен к применению в Российской Федерации для лечения взрослых пациентов с рецидивирующими формами РС или с первично-прогрессирующим РС1. Его регистрация проводилась на основании данных исследований OPERA I и OPERA II (рецидивирующие формы (РРС) и ORATORIO (первично-прогрессирующий тип течения (ППРС)).
Его регистрация проводилась на основании данных исследований OPERA I и OPERA II (рецидивирующие формы (РРС) и ORATORIO (первично-прогрессирующий тип течения (ППРС)).
1 Инструкция по медицинскому применению препарата Окревус, ЛП 004503, 2017
Окрелизумаб представляет собой гуманизированное моноклональное антитело к поверхностному антигену CD20, который располагается на определенном пуле В-лимфоцитов. Этот мембранный белок состоит из 297 аминокислотных остатков и экспрессируется на пре-B-клетках, зрелых В-клетках и B-клетках памяти. В то же время стволовые лимфоидные клетки и плазматические клетки не несут на себе белок CD20 [21, 22]. Механизм действия препарата предполагает, что после связывания с антигеном CD20 на поверхности В-клеток окрелизумаб селективно уменьшает их количество посредством антителозависимого клеточного фагоцитоза, антителозависимой клеточной цитотоксичности, комплемент-зависимой цитотоксичности и апоптоза [19, 20].

Так как истощение популяции касается определенного пула В-клеток, то сохраняются способность к восстановлению В-клеток и существующий гуморальный иммунитет. Кроме того, окрелизумаб не влияет на врожденный иммунитет и общее количество Т-клеток [21, 22]. Профиль эффективности и безопасности препарата окрелизумаб оценивали у пациентов с рецидивирующими формами РС (как ремиттирующее течение, так и вторичное прогрессирование с обострениями) в двух рандомизированных двойных слепых клинических исследованиях с одинаковым дизайном, с двойной имитацией и с использованием активного препарата сравнения (интерферон бета-1а) длительностью 96 нед. – OPERA I и OPERA II. Пациенты были рандомизированы в соотношении 1:1, в группе окрелизумаба (N = 827) они получали окрелизумаб в дозе 600 мг каждые 24 нед. и плацебо подкожно 3 раза в неделю, в группе сравнения (N = 829) – интерферон бета-1а в дозе 44 мкг подкожно 3 раза в неделю и плацебо в виде внутривенных инфузий каждые 24 нед. В качестве первичной конечной точки оценивали среднегодовую частоту обострений (СЧО) на 96-й нед. исследования.
исследования.
Также были установлены вторичные конечные точки: доля пациентов с прогрессированием заболевания, подтвержденным на 12-й нед. (прогрессирование заболевания определялось как увеличение в сравнении с исходным уровнем оценки по шкале EDSS по крайней мере на 1,0 балл (или на 0,5 балла, если исходная оценка по шкале EDSS составляла > 5,5 балла), которая сохранялась в течение не менее 12 нед.) и на 24-й нед.; общее среднее количество очагов в головном мозге, накапливающих контрастное вещество, на неделях 24, 48 и 96; общее количество новых или недавно увеличенных гиперинтенсивных очагов на T2-взвешенных МР-изображениях на неделях 24, 48 и 96; доля пациентов с улучшением состояния, подтвержденным в течение 12 нед., у пациентов с исходной оценкой по шкале EDSS не менее 2,0 балла; общее количество новых гипоинтенсивных очагов на T1-взвешенных МР-изображениях на неделях 24, 48 и 96. Оказалось, что в группе окрелизумаба СЧО была ниже, чем в группе сравнения (0,155 и 0,156 в сравнении с 0,290 и 0,292, р < 0,0001), т. е. относительное снижение частоты обострений составило 46 и 47% в течение двухлетнего периода исследований. Также снижался риск прогрессирования инвалидизации, подтвержденного как на 12-й (CDP-12), так и на 24-й нед. (CDP-24). По данным анализа объединенных данных, к 96-й нед. исследования в группе окрелизумаба доля пациентов, достигших CDP12, составила 9,1%, тогда как аналогичный показатель в группе интерферона бета-1а был равен 13,6%. В отношении достижения CDP-24 – 6,9% пациентов в группе окрелизумаба и 10,5% пациентов в группе интерферона бета1а. Различие между группами было статистически значимым, относительное снижение CDP-12 составило 40% (ОШ (95% ДИ): 0,60 (0,45; 0,81), р = 0,0006), равно как и относительное снижение CDP-24 (ОШ (95% ДИ): 0,60 (0,43; 0,84), р = 0,0025) [21]. Статистически значимые изменения отмечались и в отношении вторичных конечных точек, которые определяли по МР-показателям. Так, было выявлено практически полное подавление МР-активности: общее количество очагов на Т1-изображениях, которые накапливают контраст, оказалось на 94% и 95% ниже в группе препарата окрелизумаб, чем в группе интерферона бета-1а (p < 0,0001) к 96-й нед.
е. относительное снижение частоты обострений составило 46 и 47% в течение двухлетнего периода исследований. Также снижался риск прогрессирования инвалидизации, подтвержденного как на 12-й (CDP-12), так и на 24-й нед. (CDP-24). По данным анализа объединенных данных, к 96-й нед. исследования в группе окрелизумаба доля пациентов, достигших CDP12, составила 9,1%, тогда как аналогичный показатель в группе интерферона бета-1а был равен 13,6%. В отношении достижения CDP-24 – 6,9% пациентов в группе окрелизумаба и 10,5% пациентов в группе интерферона бета1а. Различие между группами было статистически значимым, относительное снижение CDP-12 составило 40% (ОШ (95% ДИ): 0,60 (0,45; 0,81), р = 0,0006), равно как и относительное снижение CDP-24 (ОШ (95% ДИ): 0,60 (0,43; 0,84), р = 0,0025) [21]. Статистически значимые изменения отмечались и в отношении вторичных конечных точек, которые определяли по МР-показателям. Так, было выявлено практически полное подавление МР-активности: общее количество очагов на Т1-изображениях, которые накапливают контраст, оказалось на 94% и 95% ниже в группе препарата окрелизумаб, чем в группе интерферона бета-1а (p < 0,0001) к 96-й нед. исследования. Более того, это снижение отмечалось и на начальных этапах, на 24-й нед. исследования, т. е. уже после первой дозы исследуемого препарата. Общее количество новых и/или увеличившихся очагов на Т2-взвешенных изображениях снизилось на 77% и 83% в группе окрелизумаба в сравнении с группой интерферона бета-1а (p < 0,0001) [21]. У пациентов оценивали также достижение статуса NEDA. Оказалось, что к 96-й нед. заболевания статус NEDA чаще отмечался у пациентов в группе окрелизумаба: в исследовании OPERA I – у 48% пациентов (в сравнении с 29% пациентов в группе интерферона бета-1а) и в исследовании OPERA II – у 48% пациентов (в сравнении с 25% пациентов в группе интерферона бета-1а).
исследования. Более того, это снижение отмечалось и на начальных этапах, на 24-й нед. исследования, т. е. уже после первой дозы исследуемого препарата. Общее количество новых и/или увеличившихся очагов на Т2-взвешенных изображениях снизилось на 77% и 83% в группе окрелизумаба в сравнении с группой интерферона бета-1а (p < 0,0001) [21]. У пациентов оценивали также достижение статуса NEDA. Оказалось, что к 96-й нед. заболевания статус NEDA чаще отмечался у пациентов в группе окрелизумаба: в исследовании OPERA I – у 48% пациентов (в сравнении с 29% пациентов в группе интерферона бета-1а) и в исследовании OPERA II – у 48% пациентов (в сравнении с 25% пациентов в группе интерферона бета-1а).
Таким образом, относительное увеличение числа пациентов в статусе NEDA в группе окрелизумаба составило 64% и 89% (p < 0,001) [23]. Самыми частыми нежелательными явлениями на фоне терапии препаратом окрелизумаб в клинических исследованиях OPERA I и OPERA II были инфузионные реакции (34,3% в группе окрелизумаба в сравнении с 9,9% в группе интерферона бета-1а, в которой внутривенно вводилось плацебо). Частота инфузионных реакций была максимальной во время 1-й инфузии 1-й дозы препарата окрелизумаб (27,5%) и снижалась со временем до < 10% во время введения 4-й дозы. Большинство инфузионных реакций в обеих группах лечения были легкой или умеренной степени тяжести. Наблюдались следующие симптомы, связанные с инфузионными реакциями: зуд, сыпь, крапивница, эритема, приливы, понижение артериального давления, повышение температуры тела, повышенная утомляемость, головная боль, головокружение, раздражение горла, боль в ротоглотке, одышка, отек глотки или гортани, тошнота, тахикардия. Случаев фатальных инфузионных реакций не было. Не наблюдалось увеличения частоты серьезных инфекций у пациентов, получавших окрелизумаб (1,3%), по сравнению с пациентами при лечении интерфероном бета-1а (2,9%) [21]. В группе окрелизумаба несколько чаще наблюдались инфекции верхних дыхательных путей, преимущественно легкой и умеренной степени тяжести (15,2% в сравнении с 10,2%). Такие нежелательные явления, как гриппоподобный синдром (4,6% в группе окрелизумаба и 21,4% в группе интерферона бета-1а) и реакция в месте подкожного введения препарата (менее 1% в группе окрелизумаба и 15,6% в группе интерферона бета-1а) чаще встречались на фоне применения интерферона бета-1а [21].
Частота инфузионных реакций была максимальной во время 1-й инфузии 1-й дозы препарата окрелизумаб (27,5%) и снижалась со временем до < 10% во время введения 4-й дозы. Большинство инфузионных реакций в обеих группах лечения были легкой или умеренной степени тяжести. Наблюдались следующие симптомы, связанные с инфузионными реакциями: зуд, сыпь, крапивница, эритема, приливы, понижение артериального давления, повышение температуры тела, повышенная утомляемость, головная боль, головокружение, раздражение горла, боль в ротоглотке, одышка, отек глотки или гортани, тошнота, тахикардия. Случаев фатальных инфузионных реакций не было. Не наблюдалось увеличения частоты серьезных инфекций у пациентов, получавших окрелизумаб (1,3%), по сравнению с пациентами при лечении интерфероном бета-1а (2,9%) [21]. В группе окрелизумаба несколько чаще наблюдались инфекции верхних дыхательных путей, преимущественно легкой и умеренной степени тяжести (15,2% в сравнении с 10,2%). Такие нежелательные явления, как гриппоподобный синдром (4,6% в группе окрелизумаба и 21,4% в группе интерферона бета-1а) и реакция в месте подкожного введения препарата (менее 1% в группе окрелизумаба и 15,6% в группе интерферона бета-1а) чаще встречались на фоне применения интерферона бета-1а [21]. Частота герпетической инфекции у пациентов с рецидивирующими формами РС была выше на фоне терапии препаратом окрелизумаб (5,9%) по сравнению с терапией интерфероном бета-1а (3,4%). В группах окрелизумаба и интерферона бета-1а частота следующих нежелательных реакций составляла: опоясывающий лишай (Herpes Zoster) – 2,1% и 1,0%, простой герпес – 0,7% и 0,1%, герпес ротовой полости – 3,0% и 2,2% соответственно. Герпетические инфекции были преимущественно легкой и умеренной степени тяжести, пациенты выздоравливали после стандартного лечения. Случаев диссеминированного герпеса не наблюдалось. Серьезные нежелательные явления были зарегистрированы у 6,9% пациентов, получавших окрелизумаб, и у 7,8% пациентов, получавших интерферон бета-1а, в исследовании OPERA I; у 7,0% пациентов, получавших окрелизумаб, и у 9,6% пациентов, получавших интерферон бета-1a, в исследовании OPERA II. Было зарегистрировано три случая смерти, в т. ч. одна смерть в группе окрелизумаба (самоубийство в исследовании OPERA II) и две смерти в группе интерферона бета-1а (одно самоубийство в исследовании OPERA I и одна смерть вследствие механической непроходимости кишечника в исследовании OPERA II).
Частота герпетической инфекции у пациентов с рецидивирующими формами РС была выше на фоне терапии препаратом окрелизумаб (5,9%) по сравнению с терапией интерфероном бета-1а (3,4%). В группах окрелизумаба и интерферона бета-1а частота следующих нежелательных реакций составляла: опоясывающий лишай (Herpes Zoster) – 2,1% и 1,0%, простой герпес – 0,7% и 0,1%, герпес ротовой полости – 3,0% и 2,2% соответственно. Герпетические инфекции были преимущественно легкой и умеренной степени тяжести, пациенты выздоравливали после стандартного лечения. Случаев диссеминированного герпеса не наблюдалось. Серьезные нежелательные явления были зарегистрированы у 6,9% пациентов, получавших окрелизумаб, и у 7,8% пациентов, получавших интерферон бета-1а, в исследовании OPERA I; у 7,0% пациентов, получавших окрелизумаб, и у 9,6% пациентов, получавших интерферон бета-1a, в исследовании OPERA II. Было зарегистрировано три случая смерти, в т. ч. одна смерть в группе окрелизумаба (самоубийство в исследовании OPERA II) и две смерти в группе интерферона бета-1а (одно самоубийство в исследовании OPERA I и одна смерть вследствие механической непроходимости кишечника в исследовании OPERA II).
Также в этих двух 96-недельных исследованиях четыре опухоли (у 0,5% пациентов) развились в группе окрелизумаба (два случая инвазивной карциномы молочной железы, один случай карциномы почек и один случай злокачественной меланомы) и два случая (0,2%) — в группе интерферона бета-1а (один случай мантийно-клеточной лимфомы и один случай плоскоклеточной карциномы в грудной клетке) [21, 22]. Для того чтобы оценить риск развития малигнизаций у пациентов, принимающих окрелизумаб, сравнивали заболеваемость пациентов во всех исследованиях окрелизумаба при РС (в расчете на количество пациенто-лет) с имеющимися данными Датского, Шведского и Канадского регистров пациентов с РС. Было выявлено, что частота развития малигнизаций у пациентов с РС, принимавших окрелизумаб, находится в пределах эпидемиологических показателей, в т. ч. частота случаев рака молочной железы [23]. Исследователи продолжают анализ частоты случаев малигнизации при применении окрелизумаба и в расширенной фазе исследований, и в клинической практике: к февралю 2017 г. уровень заболеваемости злокачественными новообразованиями, в т. ч. заболеваемость раком молочной железы, также оставался в пределах эпидемиологических значений [21]. Таким образом, пациентам рекомендовано следовать стандартным скрининговым процедурам для рака молочной железы [23].
уровень заболеваемости злокачественными новообразованиями, в т. ч. заболеваемость раком молочной железы, также оставался в пределах эпидемиологических значений [21]. Таким образом, пациентам рекомендовано следовать стандартным скрининговым процедурам для рака молочной железы [23].
Влияние на фертильность. Окрелизумаб не оказывал влияния на репродуктивную систему самцов и эстральный цикл самок яванских макак.
Беременность. Окрелизумаб, предположительно, проникает через плацентарный барьер, т. к. относится к иммуноглобулинам подтипа G1. Не следует применять окрелизумаб во время беременности. Изменение числа В-клеток у новорожденных, матери которых получали окрелизумаб, не изучалось в клинических исследованиях. Данные контролируемых исследований окрелизумаба с участием беременных женщин отсутствуют.
Контрацепция. Женщины с сохранной репродуктивной функцией должны использовать эффективные методы контрацепции в период лечения данным препаратом и в течение 6 мес. после последней инфузии препарата.
после последней инфузии препарата.
Дети. Исследований фармакокинетики окрелизумаба у детей и подростков в возрасте < 18 лет не проводилось.
Пациенты пожилого возраста. Исследований фармакокинетики окрелизумаба у пациентов в возрасте ≥ 65 лет не проводилось.
Иммуногенность. В ходе клинических исследований как при РРС, так и при ППРС проводили тестирование на наличие антитерапевтических антител (АТТ) в нескольких временных точках (перед первым введением и каждые 6 мес. в течение всего исследования). Из 1311 пациентов, получавших лечение окрелизумабом, положительный результат анализа на АТТ отмечался у 12 пациентов (~ 1%), из которых у 2 пациентов положительный результат анализа отмечался на нейтрализующие антитела. Оценить влияние возникших во время лечения АТТ на профиль безопасности и эффективности терапии не представляется возможным из-за низкой частоты встречаемости АТТ к препарату окрелизумаб.
Противопоказания к применению. Среди противопоказаний указаны гиперчувствительность к окрелизумабу или любому компоненту препарата, активный гепатит В, беременность, период грудного вскармливания, детский возраст до 18 лет (эффективность и безопасность применения препарата окрелизумаб у детей и подростков < 18 лет не изучались), а также жизнеугрожающие инфузионные реакции при применении окрелизумаба в анамнезе.
Схема назначения и план управления рисками во время терапии
Рекомендуемая доза препарата окрелизумаб составляет 600 мг каждые 6 мес. в виде в/в инфузии. Начальную дозу следует вводить в виде двух отдельных в/в введений: во время первой капельницы вводят 300 мг препарата, затем через 2 нед. вводят еще 300 мг препарата. Далее все последующие дозы препарата вводятся в виде однократной в/в инфузии в дозе 600 мг каждые 6 мес. Первую из последующих доз препарата следует проводить через 6 мес. после 1-й начальной дозы. Минимальный интервал между каждым введением лекарства должен составлять 5 мес. Введение препарата следует проводить в/в капельно через отдельный катетер с фильтром, под тщательным наблюдением опытного медицинского работника и при наличии доступа к средствам для оказания экстренной помощи в случае возникновения тяжелых реакций (например, серьезные инфузионные реакции). Необходимо наблюдать за пациентом в течение по меньшей мере 1 ч после завершения инфузии на предмет развития нежелательных явлений. Перед каждым введением окрелизумаба следует проводить премедикацию приблизительно за 30 мин – метилпреднизолоном (или эквивалентным лекарственным препаратом) в дозе 1000 мг в/в для снижения частоты и тяжести инфузионных реакций. С целью дальнейшего снижения частоты и тяжести побочных реакций рекомендуется при необходимости применять антигистаминные препараты (например, дифенгидрамин) или антипиретики (например, ацетаминофен/парацетамол) приблизительно за 30–60 мин перед каждым введением препарата.
Перед каждым введением окрелизумаба следует проводить премедикацию приблизительно за 30 мин – метилпреднизолоном (или эквивалентным лекарственным препаратом) в дозе 1000 мг в/в для снижения частоты и тяжести инфузионных реакций. С целью дальнейшего снижения частоты и тяжести побочных реакций рекомендуется при необходимости применять антигистаминные препараты (например, дифенгидрамин) или антипиретики (например, ацетаминофен/парацетамол) приблизительно за 30–60 мин перед каждым введением препарата.
При одновременном применении препарата окрелизумаб и глюкокортикостероидов (или других препаратов для иммуносупрессивной или иммуномодулирующей терапии) необходимо учитывать риск развития аддитивного эффекта в отношении иммунной системы, что увеличивает риск иммуносупрессии. Таким образом, при переводе пациента с терапии препаратами, обладающими пролонгированным действием на иммунную систему (даклизумаб, финголимод, натализумаб, терифлуномид или митоксантрон), на терапию препаратом окрелизумаб необходимо учитывать длительность и механизм действия данных препаратов из-за возможности развития нежелательных реакций.
Клинический случай
У пациента А. в 23-летнем возрасте (2014 г.) появилась слабость в левых конечностях, снижение зрения, дизартрия и шаткость при ходьбе. Обратился к неврологу, проведено обследование, впервые по данным МРТ головного мозга (ГМ) выявлены множественные очаговые изменения в белом веществе, проведена пульс-терапия (метилпреднизолон 1000 мг в/в капельно № 5) с положительным эффектом. Через полгода выполнено контрольное МРТ-исследование ГМ (май 2015 г.) – отмечено появление нового очага, без признаков активности заболевания. Пациенту назначена терапия 1 линии ПИТРС. С ноября 2015 г. начат прием интерферона бета-1b 250 мкг п/к через день, переносимость лечения удовлетворительная. В декабре 2015 г. обратился к офтальмологу по поводу снижения остроты зрения слева. Проведена пульстерапия солумедролом 1000 мг №3 с регрессом жалоб. В апреле 2016 г. отметил ухудшение ходьбы, по данным МРТ ГМ от 22.04.2016: появление 2 новых очагов в лобной и теменной долях до 8 мм, один из них накапливает контрастное вещество, проведена пульс-терапия.
МРТ ГМ от 25.12.2016: в сравнении с МР-данными от 22.04.2016. отмечается появление единичного нового очага в затылочной доле справа, единичного очага в теменной доле слева, паравентрикулярно заднему рогу бокового желудочка, увеличение области повреждения передних отделов мозолистого тела и паравентрикулярной зоны боковых желудочков слева. Отмечается накопление парамагнетика новым паравентрикулярным очагом в теменной доле слева. Проведена пульс-терапия солумедролом 1000 мг № 5 – с частичным регрессом симптомов (сохранялась слабость в ногах, нарушение походки). С 09.01.2017 остро развилось головокружение, нечеткость речи, нарастание слабости в левых конечностях. Вновь проведена терапия солумедролом 1000 мг в/в капельно № 5 – с неполным восстановлением. В связи с сохраняющимися жалобами и ухудшением состояния выполнено повторное МРТ ГМ (по сравнению с месячными данными) – отмечается резкое увеличение размеров очага в проекции правой средней ножки мозжечка, с признаками накопления контрастного вещества в нем. В связи с продолжающейся активностью заболевания и прогрессирующим ухудшением состояния пациенту изменена иммуномодулирующая терапия с бета интерферона-1b на финголимод с февраля 2017 г. Однако в августе нарастает слабость в ногах, шаткость при ходьбе, пациент госпитализируется. По данным МРТ ГМ при контрастном усилении в веществе левых теменной и височных долей визуализируются два очага патологического контрастирования (неоднородный, диффузный тип). В спинном мозге (СМ) на шейном уровне активных очагов не обнаружено. В стационаре пациенту проводится терапия метилпреднизолоном в суммарной дозе 7000 мг с медленным неполным восстановлением около 2 мес. Во время данного обострения уровень инвалидизации по шкале EDSS увеличился с 3,0 баллов до 6,0, после терапии пациент постепенно перестал пользоваться двухсторонней поддержкой (EDSS -5,0). В связи с развитием инвалидизирующего обострения решением врачебной комиссии (ВК) с января 2018 г. была назначена терапия натализумабом 300 мг, в/в инфузии ежемесячно (анализ крови на антитела к вирусу JC – положительно (2,37)).
В связи с продолжающейся активностью заболевания и прогрессирующим ухудшением состояния пациенту изменена иммуномодулирующая терапия с бета интерферона-1b на финголимод с февраля 2017 г. Однако в августе нарастает слабость в ногах, шаткость при ходьбе, пациент госпитализируется. По данным МРТ ГМ при контрастном усилении в веществе левых теменной и височных долей визуализируются два очага патологического контрастирования (неоднородный, диффузный тип). В спинном мозге (СМ) на шейном уровне активных очагов не обнаружено. В стационаре пациенту проводится терапия метилпреднизолоном в суммарной дозе 7000 мг с медленным неполным восстановлением около 2 мес. Во время данного обострения уровень инвалидизации по шкале EDSS увеличился с 3,0 баллов до 6,0, после терапии пациент постепенно перестал пользоваться двухсторонней поддержкой (EDSS -5,0). В связи с развитием инвалидизирующего обострения решением врачебной комиссии (ВК) с января 2018 г. была назначена терапия натализумабом 300 мг, в/в инфузии ежемесячно (анализ крови на антитела к вирусу JC – положительно (2,37)).
Через 4 мес. от начала моноклональной терапии у пациента вновь развивается обострение РС (онемение в левых конечностях, нарастание шаткости походки, координаторных нарушений, уменьшение дистанции ходьбы). На МРТ ГМ отмечается появление новых очагов демиелинизации в юкстакортикальных отделах правой лобной и правой теменной долей, увеличение в размерах некоторых очагов левой теменной доли. При в/в контрастном усилении в веществе левой теменно-височной области, левой лобной доли визуализируются очаги патологического усиления МР-сигнала (диффузный тип контрастирования). МРТ шейного отдела СМ без признаков активности. Проведена терапия метилпреднизолоном (суммарная доза 10 г) в неврологическом стационаре в связи с нарастанием симптомов (появились болезненные судороги в правых конечностях, правой половине лица, усилилась неустойчивость и шаткость при ходьбе). В неврологическом статусе при выписке EDSS 5,5. В связи с неэффективностью терапии препаратом натализумаб решением ВК пациенту назначена терапия окрелизумабом при отсутствии противопоказаний после проведенного обследования. В ноябре выполнены первые инфузии препарата окрелизумаб 300 мг. В мае 2020 г. пациенту проведено 4 курса в/в инфузий окрелизумаба. Переносимость лечения удовлетворительная, нежелательных явлений, в т. ч. инфузионных реакций, не было.
В ноябре выполнены первые инфузии препарата окрелизумаб 300 мг. В мае 2020 г. пациенту проведено 4 курса в/в инфузий окрелизумаба. Переносимость лечения удовлетворительная, нежелательных явлений, в т. ч. инфузионных реакций, не было.
Новых жалоб пациент не предъявляет, обострений РС нет, состояние стабильное, в неврологическом статусе и по данным МРТ ГМ и СМ признаков активности или прогрессирования заболевания не выявлено. Пациент отмечает значительное улучшение качества своей жизни (нет ухудшений, нет госпитализаций, не проводит гормонотерапию, редкие инфузии препарата).
Заключение
Таким образом, в ходе двух клинических исследований эффективности и безопасности окрелизумаба при рецидивирующих формах РС было показано, что данный препарат превосходит по своей эффективности стандартную терапию РС (интерферон бета-1а) в отношении уменьшения СЧО, замедления прогрессирования, уменьшения МР-признаков активности заболевания, а также позволяет у 48% пациентов достичь статуса NEDA. При этом препарат окрелизумаб обладает приемлемым профилем безопасности и удобством применения (в/в введение 1 раз в 6 мес.). Препарат окрелизумаб позволяет добиться замедления прогрессирования заболевания у пациентов с активным РС и улучшения их качества жизни. В нашем клиническом примере препарат доказал свою эффективность и безопасность применения. Возможно, более раннее начало терапии окрелизумабом у данного пациента помогло избежать множества обострений, приостановить процесс прогрессирования и нарастание инвалидизации. В настоящее время решение о назначении ПИТРС принимает ВК медицинского учреждения, где наблюдается пациент, с привлечением специалистов по РС. На заседании ВК обсуждается история болезни пациента и с учетом развития болезни, типа течения РС, наличия показаний и противопоказаний к терапии принимается решение о назначении ПИТРС. Иммунопатогенетическое инновационное лечение пациентов с РС обеспечивается за счет регионального или федерального бюджетов. Включение заболеваний в Федеральную программу высокозатратных нозологий (в настоящее время это «12 ВЗН») позволяет осуществлять закупки препаратов из средств федерального бюджета, что увеличивает доступность новых дорогостоящих препаратов для пациентов с РС.
При этом препарат окрелизумаб обладает приемлемым профилем безопасности и удобством применения (в/в введение 1 раз в 6 мес.). Препарат окрелизумаб позволяет добиться замедления прогрессирования заболевания у пациентов с активным РС и улучшения их качества жизни. В нашем клиническом примере препарат доказал свою эффективность и безопасность применения. Возможно, более раннее начало терапии окрелизумабом у данного пациента помогло избежать множества обострений, приостановить процесс прогрессирования и нарастание инвалидизации. В настоящее время решение о назначении ПИТРС принимает ВК медицинского учреждения, где наблюдается пациент, с привлечением специалистов по РС. На заседании ВК обсуждается история болезни пациента и с учетом развития болезни, типа течения РС, наличия показаний и противопоказаний к терапии принимается решение о назначении ПИТРС. Иммунопатогенетическое инновационное лечение пациентов с РС обеспечивается за счет регионального или федерального бюджетов. Включение заболеваний в Федеральную программу высокозатратных нозологий (в настоящее время это «12 ВЗН») позволяет осуществлять закупки препаратов из средств федерального бюджета, что увеличивает доступность новых дорогостоящих препаратов для пациентов с РС.
Список литературы / References
- Бойко А.Н., Гусев Е.И. Современные алгоритмы диагностики и лечения рассеянного склероза, основанные на индивидуальной оценке состоя- ния пациента. Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(2-2):92-106. https://doi.org/10.17116/jnevro20171172292-106.
- Захарова М.Н. (ред.). Рассеянный склероз: вопросы диагностики и лечения. М.: Медиа Менте; 2018. 240 с.
- Olsson T., Barcellos L.F., Alfredsson L. Interactions between genetic, lifestyle and environmental risk factors for multiple sclerosis. Nat Rev Neurol. 2017;13(1):25-36. https://doi.org/10.1038/nrneurol.2016.187.
- Гусев Е.И., Завалишин И.А., Бойко А.Н. (ред.). Рассеянный склероз. М.: Реал Тайм; 2011. 528 с.
- Kurtzke J.F. Rating neurologic impairment in multiple sclerosis: an Expanded Disability Status Scale (EDSS). Neurology. 1983;33(11):1444-1452. https://doi.org/10.1212/WNL.33.11.
 1444.
1444. - Polman C.H., Reingold S.C., Banwell B., Clanet M., Cohen J.A., Filippi M. et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol. 2011;69(2):292-302. https://doi.org/10.1002/ana.22366.
- University of California, San Francisco MS-EPIC Team:, Cree B.A., Gourraud P.A., Oksenberg J.R., Bevan C., Crabtree-Hartman E., Gelfand J.M. et al. Long-term evolution of multiple sclerosis disability in the treatment era. Ann Neurol. 2016;80(4):499-510. https://doi.org/10.1002/ana.24747.
- Bar-Or A. The immunology of multiple sclerosis. Semin Neurol. 2008;28(1):29-45. https://doi.org/10.1055/s-2007-1019124.
- Столяров И.Д., Бойко А.Н. (ред.). Рассеянный склероз: диагностика, лечение, специалисты. СПб.: ЭЛБИ-СПб.; 2008. 320 с.
- Martin F., Chan A.C. B cell immunobiology in disease: evolving concepts from the clinic. Annu Rev Immunol. 2006;24:467-496. https://doi.org/10.1146/annurev.
 immunol.24.021605.090517.
immunol.24.021605.090517. - Li R., Rezk A., Miyazaki Y., Hilgenberg E., Touil H., Shen P. et al. Proinflammatory GM-CSF-producing B cells in multiple sclerosis and B cell depletion therapy. Sci Transl Med. 2015;7(310):310ra166. https://doi.org/10.1126/scitranslmed.aab4176.
- Genain C.P., Cannella B., Hauser S.L., Raine C.S. Identification of autoantibodies associated with myelin damage in multiple sclerosis. Nat Med. 1999;5(2):170-175. https://doi.org/10.1038/5532.
- Storch M.K., Piddlesden S., Haltia M., Iivanainen M., Morgan P., Lassmann H. Multiple sclerosis: in situ evidence for antibody- and complement-mediated demyelination. Ann Neurol. 1998;43(4):465-471. https://doi.org/10.1002/ana.410430409.
- Serafini B., Rosicarelli B., Magliozzi R., Stigliano E., Aloisi F. Detection of ectopic B-cell follicles with germinal centers in the meninges of patients with secondary progressive multiple sclerosis. Brain Pathol. 2004;14(2):164-174.
 https://doi.org/10.1111/j.1750-3639.2004.tb00049.x.
https://doi.org/10.1111/j.1750-3639.2004.tb00049.x. - Ireland S.J., Blazek M., Harp C.T., Greenberg B., Frohman E.M., Davis L.S., Monson N.L. Antibody-independent B cell effector functions in relapsing remitting multiple sclerosis: clues to increased inflammatory and reduced regulatory B cell capacity. Autoimmunity. 2012;45(5):400-414. https://doi.org/10.3109/08916934.2012.665529.
- Howell O.W., Reeves C.A., Nicholas R., Carassiti D., Radotra B., Gentleman S.M. et al. Meningeal inflammation is widespread and linked to cortical pathology in multiple sclerosis. Brain. 2011;134(Pt 9):2755-2771. https://doi.org/10.1093/brain/awr182.
- Klein C., Lammens A., Schäfer W., Georges G., Schwaiger M., Mössner E. et al. Epitope interactions of monoclonal antibodies targeting CD20 and their relationship to functional properties. MAbs. 2013;5(1):22-33. https://doi.org/10.4161/mabs.22771.
- Bittner S., Ruck T., Wiendl H., Grauer O.M., Meuth S.G. Targeting B cells in relapsing-remitting multiple sclerosis: from pathophysiology to optimal clinical management.
 Ther Adv Neurol Disord. 2017;10(1):51-66. https://doi.org/10.1177/1756285616666741.
Ther Adv Neurol Disord. 2017;10(1):51-66. https://doi.org/10.1177/1756285616666741. - Klein C., Lammens A., Schäfer W., Georges G., Schwaiger M., Mössner E. et al. Response to: monoclonal antibodies targeting CD20. MAbs. 2013;5(3):337-338. https://doi.org/10.4161/mabs.24108.
- Genovese M.C., Kaine J.L., Lowenstein M.B., Del Giudice J., Baldassare A., Schechtman J. et al. Ocrelizumab, a humanized anti-CD20 monoclonal antibody, in the treatment of patients with rheumatoid arthritis: a phase I/II randomized, blinded, placebo-controlled, dose-ranging study. Arthritis Rheum. 2008;58(9):2652-2661. https://doi.org/10.1002/art.23732.
- Hauser S.L., Bar-Or A., Comi G., Giovannoni G., Hartung H.P., Hemmer B. et al. Ocrelizumab versus Interferon Beta-1a in Relapsing Multiple Sclerosis. N Engl J Med. 2017;376(3):221-234. https://doi.org/10.1056/NEJMoa1601277.
- Montalban X., Hauser S.L., Kappos L., Arnold D.L., Bar-Or A., Comi G. et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis.
 N Engl J Med. 2017;376(3):209-220. https://doi.org/10.1056/NEJMoa1606468.
N Engl J Med. 2017;376(3):209-220. https://doi.org/10.1056/NEJMoa1606468. - Kappos L., De Stefano N., Freedman M.S., Cree B.A., Radue E.W., Sprenger T. et al. Inclusion of brain volume loss in a revised measure of ‘no evidence of disease activity’ (NEDA-4) in relapsing-remitting multiple sclerosis. Mult Scler. 2016;22(10):1297-1305. https://doi.org/10.1177/1352458515616701.
В России начнут производить лекарство для лечения рассеянного склероза
Производство еще двух инновационных препаратов будет локализовано в России. Речь идет об уникальном лекарстве, способном противостоять тяжелой, быстро прогрессирующей разновидности рассеянного склероза. Кроме того, в нашей стране начнут производить препарат для лечения гемофилии. Соглашения о локализации были подписаны в рамках Всероссийской GMP- конференции с международным участием, которая в эти дни проходит в Светлогорске Калининградской области.
Препарат для лечения рассеянного склероза разработан международной инновационной компанией (Швейцария), он не имеет аналогов на мировом и российском рынке. Как сообщил глава московского подразделения компании Ларс Нильсен, уже подана заявка на включение препарата в перечень для лечения орфанных заболеваний. Препарат востребован в нашей стране. Общее число больных рассеянным склерозом сейчас составляет примерно 150 тысяч человек, а тяжелой первично прогрессирующей формой, для лечения которой до сих пор не было эффективных средств, 4, 5 тысячи.
Как сообщил глава московского подразделения компании Ларс Нильсен, уже подана заявка на включение препарата в перечень для лечения орфанных заболеваний. Препарат востребован в нашей стране. Общее число больных рассеянным склерозом сейчас составляет примерно 150 тысяч человек, а тяжелой первично прогрессирующей формой, для лечения которой до сих пор не было эффективных средств, 4, 5 тысячи.
Глава российской компании, где будет локализовано производство, Василий Игнатьев, подчеркнул, что производственные, технологические возможности российского участника проекта позволяют обеспечить локализацию с соблюдением всех требований Правил надлежащей производственной практики(GMP), а также хранение и дистрибьюцию препарата на всей территории России. Он подчеркнул, что это не первый совместный проект — швейцарская компания локализовала в нашей стране производство уже 17 высокотехнологичных лекарств. Первая партия лекарства поступит на российский рынок в сентябре 2020 года.
Кроме того, международная фармкомпания также локализует в нашей стране еще один препарат, предназначенный для лечения тяжелой формы гемофилии. В основном он будет востребован для лечения детей и его применение поможет кардинально улучшить качество жизни маленьких пациентов, отметил руководитель российской компании-партнера по проекту локализации Владимир Бабий.
В основном он будет востребован для лечения детей и его применение поможет кардинально улучшить качество жизни маленьких пациентов, отметил руководитель российской компании-партнера по проекту локализации Владимир Бабий.
Как заявил на конференции первый заместитель министра промышленности и торговли Сергей Цыб, благодаря грамотному правовому регулированию фармотрасли, этот сегмент экономики остается одним из самых привлекательных для инвестиций международных фармгигантов. В то же время, отметил Цыб, при сохранении благоприятных условий для локализации фармпроизводств в России, огромное внимание уделяется поддержке собственных инновационных лекарственных разработок, в том числе, нацеленных и на экспорт.
На конференции в Светлогорске присутствовали представители регуляторных органов из разных стран Европы (Венгрия, Хорватия и др.) , Африки (Египет), Латинской Америки, Азии. Сотрудничество в области синхронизации правил и требований, принятых в разных странах, — одно из необходимых условий как переноса к нам иностранных передовых технологий, так и экспорта российских новых вакцин и лекарственных препаратов.
ТАБЛЕТИРОВАННЫЕ ПРЕПАРАТЫ ДЛЯ ПАТОГЕНЕТИЧЕСКОГО ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА | Попова
1. Utz K, Hoog J, Wentrup A et al. Patient preferences for disease-modifying drugs in multiple sclerosis therapy: a choice-based conjoint analysis. Therapeutic Advances in Neurological Disorders, 2014, 7(6): 263-275. doi:10.1177/1756285614555335.
2. Claussen MKorn T. Immune mechanisms of new therapeutic strategies in MS – Teriflunomide. Clinical Immunology, 2012, 142(1): 49-56. doi:10.1016/j.clim.2011.02.011.
3. Bar-Or A. Teriflunomide (Aubagio®) for the treatment of multiple sclerosis. Experimental Neurology, 2014, 262: 57-65. doi:10.1016/j.expneurol.2014.06.005.
4. Garnock-Jones K. Teriflunomide: A Review of Its Use in Relapsing Multiple Sclerosis. CNS Drugs, 2013, 27(12): 1103-1123. doi:10.1007/s40263-013-0118-2.
Teriflunomide: A Review of Its Use in Relapsing Multiple Sclerosis. CNS Drugs, 2013, 27(12): 1103-1123. doi:10.1007/s40263-013-0118-2.
5. O’Connor P, Li D, Freedman M et al. A Phase II study of the safety and efficacy of teriflunomide in multiple sclerosis with relapses. Neurology, 2006, 66(6): 894-900. doi:10.1212/01.wnl.0000203121.04509.31.
6. Confavreux C, Li D, Freedman M et al. Longterm follow-up of a phase 2 study of oral teriflunomide in relapsing multiple sclerosis: safety and efficacy results up to 8.5 years. Multiple Sclerosis Journal, 2012, 18(9): 1278-1289. doi:10.1177/1352458512436594.
7. O’Connor P, Wolinsky J, Confavreux C et al. Randomized Trial of Oral Teriflunomide for Relapsing Multiple Sclerosis. New England Journal of Medicine. 2011, 365(14): 1293-1303. doi:10.1056/nejmoa1014656.
doi:10.1056/nejmoa1014656.
8. Confavreux C, O’Connor P, Comi G et al. Oral teriflunomide for patients with relapsing multiple sclerosis (TOWER): a randomised, doubleblind, placebo-controlled, phase 3 trial. The Lancet Neurology, 2014, 13(3): 247-256. doi:10.1016/s1474-4422(13)70308-9.
9. Vermersch P, Czlonkowska A, Grimaldi L et al. Teriflunomide versus subcutaneous interferon beta-1a in patients with relapsing multiple sclerosis: a randomised, controlled phase 3 trial. Multiple Sclerosis Journal, 2013, 20(6): 705-716. doi:10.1177/1352458513507821.
10. Comi G, Freedman M, Kappos L et al. Pooled safety and tolerability data from four placebocontrolled teriflunomide studies and extensions. Multiple Sclerosis and Related Disorders, 2016, 5: 97-104. doi:10. 1016/j.msard.2015.11.006.
1016/j.msard.2015.11.006.
11. Sbergfeld НW. Diffuse hair loss: Its triggers and management. Cleveland Clinic Journal of Medicine, 2009, 76(6): 361-367. doi:10.3949/ccjm.76a.08080.
12. Litjens N, Burggraaf J, van Strijen E et al. Pharmacokinetics of oral fumarates in healthy subjects. British Journal of Clinical Pharmacology, 2004, 58(4): 429-432. doi:10.1111/j.1365-2125.2004.02145.x.
13. Albrecht P, Bouchachia I, Goebels N et al. Effects of dimethyl fumarate on neuroprotection and immunomodulation. Journal of Neuroinflammation, 2012, 9(1): 163. doi:10.1186/1742-2094-9-163.
14. Zoghi S, Amirghofran Z, Nikseresht A, Ashjazadeh N, Kamali-Sarvestani E, Rezaei N. Cytokine Secretion Pattern in Treatment of Lymphocytes of Multiple Sclerosis Patients with Fumaric Acid Esters. Immunological Investigations, 2011, 40(6): 581-596. doi:10.3109/08820139.2011.569626.
15. Longbrake E, Ramsbottom M, Cantoni C, Ghezzi L, Cross A, Piccio L. Dimethyl fumarate selectively reduces memory T cells in multiple sclerosis patients. Multiple Sclerosis Journal, 2015, doi:10.1177/1352458515608961.
16. Gold R, Kappos L, Arnold D et al. PlaceboControlled Phase 3 Study of Oral BG-12 for Relapsing Multiple Sclerosis. New England Journal of Medicine, 2012 367(12): 1098-1107. doi:10.1056/nejmoa1114287.
17. Schimrigk S, Brune N, Hellwig K et al. Oral fumaric acid esters for the treatment of active multiple sclerosis: an open-label, baseline-controlled pilot study. Eur J Neurol, 2006, 13(6): 604-610. doi:10.1111/j.1468-1331.2006.01292.x.
18. MacManus D, Miller D, Kappos L et al. BG-12 reduces evolution of new enhancing lesions to T1-hypointense lesions in patients with multiple sclerosis. Journal of Neurology, 2010, 258(3): 449-456. doi:10.1007/s00415-010-5777-z.
MacManus D, Miller D, Kappos L et al. BG-12 reduces evolution of new enhancing lesions to T1-hypointense lesions in patients with multiple sclerosis. Journal of Neurology, 2010, 258(3): 449-456. doi:10.1007/s00415-010-5777-z.
19. Fox R, Miller D, Phillips J et al. PlaceboControlled Phase 3 Study of Oral BG-12 or Glatiramer in Multiple Sclerosis. New England Journal of Medicine, 2012, 367(12): 1087-1097. doi:10.1056/nejmoa1206328.
20. O’Gorman J, Russell H, Li J, Phillips G, Kurukulasuriya N, Viglietta V. Effect of Aspirin Pretreatment or Slow Dose Titration on Flushing and Gastrointestinal Events in Healthy Volunteers Receiving Delayed-release Dimethyl Fumarate. Clinical Therapeutics, 2015, 37(7): 1402-1419.e5. doi:10.1016/j.clinthera.2015.03.028.
21. Berkovich R, Weiner L. Effects of dimethyl fumarate on lymphocyte subsets. Multiple Sclerosis and Related Disorders, 2015, 4(4): 339-341. doi:10.1016/j.msard.2015.06.002.
Berkovich R, Weiner L. Effects of dimethyl fumarate on lymphocyte subsets. Multiple Sclerosis and Related Disorders, 2015, 4(4): 339-341. doi:10.1016/j.msard.2015.06.002.
22. Cohen J, Barkhof F, Comi G et al. Oral Fingolimod or Intramuscular Interferon for Relapsing Multiple Sclerosis. New England Journal of Medicine, 2010, 362(5): 402-415. doi:10.1056/nejmoa0907839.
23. Kappos L, Radue E, O’Connor P et al. A PlaceboControlled Trial of Oral Fingolimod in Relapsing Multiple Sclerosis. New England Journal of Medicine, 2010, 362(5): 387-401. doi:10.1056/nejmoa0909494.
24. Попова Е.В., Ялымов А.А., Бойко А.Н., Давыдовская М.В., Кольяк Е.В., Трактирская О.В., Хачанова Н.В., Щур С.Г. Финголимод в лечении ремиттирующего рассеянного склероза: опыт применения в московском городском центре рассеянного склероза. Медицинский совет, 2014, 5: 60-62.
Медицинский совет, 2014, 5: 60-62.
лечение рассеянного склероза, возвращение зрения, спасение от синдрома Хантера
Безусловно, самые дорогие препараты — те, которые создаются для людей с неизлечимыми или смертельными заболеваниями со сложной морфологией. Например, компания Novartis при описании стоимости своих препаратов делает акцент на их клиническом значении, влиянии на пациентов и систему здравоохранения в целом, а также на существенном улучшении качества жизни.
Лекарства от рассеянного склерозаВ начале 2019 года чиновники из FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов в США — «Хайтек») разрешили распространять препарат компании Novartis — «Майзент», предназначенный для лечения различных форм рассеянного склероза, включая клинически изолированный синдром, рецидивирующий ремиттирующий рассеянный склероз (RRMS) и активный вторичный прогрессирующий рассеянный склероз (SPMS).
Рассеянный склероз ― потенциально инвалидизирующее заболевание центральной нервной системы. Это аутоиммунное заболевание, при котором поражается миелин белого вещества головного и спинного мозга. «Склероз» происходит от слова «рубец», именно они как очаги видны на МРТ при этом диагнозе.
Симптомы рассеянного склероза существенно варьируются. Некоторые люди с тяжелым течением заболевания могут потерять способность ходить и есть, в то время как другие могут испытывать длительные периоды ремиссии без каких-либо новых симптомов.
Ремиттирующий рассеянный склероз — наиболее распространенное течение заболевания. Он характеризуется четко выраженными приступами новых или нарастающих неврологических симптомов. Эти приступы, также называемые рецидивами или обострениями, сопровождаются периодами частичного или полного выздоровления (ремиссиями). Во время ремиссий, все симптомы могут исчезнуть, или некоторые симптомы могут становиться постоянными. Однако явного прогрессирования заболевания в периоды ремиссии не наблюдается. Приблизительно у 85% людей с РС первоначально диагностируется именно РРС.
Однако явного прогрессирования заболевания в периоды ремиссии не наблюдается. Приблизительно у 85% людей с РС первоначально диагностируется именно РРС.
Большинство людей с диагнозом РРС в срок от 3–5 лет с появления первых симптомов приходят к вторичному прогрессирующему течению болезни, при котором со временем происходит ухудшение неврологических функций и инвалидизация пациента.
«Майзент», при очень простой схеме приёма — всего один раз в день, стал первым более чем за 15 лет препаратом, специально предназначенным для людей с активным вторичным прогрессирующим склерозом. Ожидается, что годовая цена лечения им составит $88 500.
Лечебное воздействие «Майзента» заключается в секвестировании определенных белых кровяных клеток в лимфатических узлах. Именно они играют одну из ключевых ролей при воспалительной реакции, вызванной РС. Если они не будут затрагивать миелин, то не смогут вызывать чрезмерное воспаление. В третьей фазе исследования препарата, в котором приняли участие 1651 человек, доля пациентов с подтвержденным прогрессированием инвалидности была статистически значимо ниже в группе «Майзента», чем в группе с плацебо. Пациенты, получавшие препарат, имели относительное снижение частоты рецидивов на 55%.
Пациенты, получавшие препарат, имели относительное снижение частоты рецидивов на 55%.
В 2010 году FDA одобрило препарат Gilenya, ставший широко применяемым для лечения РС. Месячный курс данного препарата стоит $2500.
Novartis даже подала иск в прошлом году, пытаясь заблокировать продажи непатентованных версий Gilenya после истечения срока действия основного патента на препарат в августе. Однако пока судебная тяжба ни к чему не привела.
«Этот препарат проникает через гематоэнцефалический барьер. — объясняет доктор Тимоти Уэст, невролог из Калифорнийского университета в Сан-Франциско. — Результаты показывают, что он замедляет прогрессирование РС у людей с более поздней стадией заболевания. При рассеянном склерозе пораженные клетки попадают в мозг и разрушаются изнутри. Это лекарство действует непосредственно в мозге, не оказывая колоссального влияния на работу других систем организма».
Но, несмотря на заверения группы экспертов, первая группа пациентов столкнулась с побочными эффектами. Как оказалось, «Майзент» может вызвать сильные головные боли, повышение артериального давления, повышение уровня печеночных ферментов и уменьшение количества лейкоцитов крови.
Как оказалось, «Майзент» может вызвать сильные головные боли, повышение артериального давления, повышение уровня печеночных ферментов и уменьшение количества лейкоцитов крови.
В марте 2019 года FDA также утвердило препарат «Мавенклад» (действующее вещество — кладрибрин), предназначенный для рецидивирующего ремиттирующего рассеянного склероза (RRMS) и активного вторичного прогрессирующего рассеянного склероза (SPMS). Представители компании сообщили, что годовая стоимость двухлетнего курса лечения составит $99 500.
В США около миллиона человек живут с РС, в России — порядка 150 тыс. человек с подтвержденным диагнозом РС, а во всем мире этим недугом страдают 2,3 млн человек. Последним методом лечения РС, одобренным FDA, был окрелизумаб в 2017 году. Это анти-CD20 моноклональное антитело, поражающее зрелые B-лимфоциты, являясь иммуносупрессором. Он вышел на рынок с заявленной стоимостью $65 000 за год лечения.
Лечение от спинальной мышечной атрофииТа же швейцарская компания Novartis представила в апреле 2019 года препарат «Зольгенсма».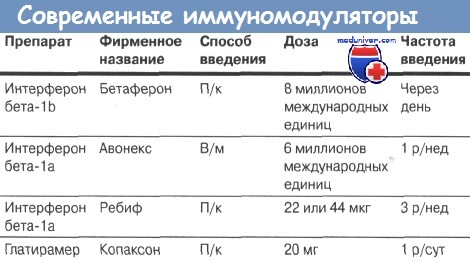 Это генная терапия, которая лечит наследственное состояние, называемое спинальной мышечной атрофией. СМА — редкое генетическое заболевание. Его причиной является мутация в гене SMN1 (ген выживаемости моторных нейронов — «Хайтек»). Ген кодирует синтез белка SMN, который присутствует во всем организме и отвечает за питание и функцию моторных нейронов — специализированных нервных клеток. Лечение направлено на дефектный ген, так как моторные нейроны головного и спинного мозга контролируют работу мышц всего тела. Нехватка белка SMN приводит к гибели моторных нейронов, в результате чего наступает мышечная слабость, вплоть до инвалидности и летального исхода. СМА поражает одного из 6–10 тыс. рождённых детей каждый год.
Это генная терапия, которая лечит наследственное состояние, называемое спинальной мышечной атрофией. СМА — редкое генетическое заболевание. Его причиной является мутация в гене SMN1 (ген выживаемости моторных нейронов — «Хайтек»). Ген кодирует синтез белка SMN, который присутствует во всем организме и отвечает за питание и функцию моторных нейронов — специализированных нервных клеток. Лечение направлено на дефектный ген, так как моторные нейроны головного и спинного мозга контролируют работу мышц всего тела. Нехватка белка SMN приводит к гибели моторных нейронов, в результате чего наступает мышечная слабость, вплоть до инвалидности и летального исхода. СМА поражает одного из 6–10 тыс. рождённых детей каждый год.
Механизм действия «Зольгенсма» прицельно воздействует на саму причину заболевания. Функциональная копия гена SMN доставляется c помощью вирусного вектора на основе адено-ассоциированного вируса к моторным нейронам. Препарат вводится один раз и вызывает экспрессию белка SMN в моторных нейронах. Это приводит к улучшению функции мышц и общего состояния ребенка.
Безопасность и эффективность препарата оценивались на основании двух исследований, одно из которых уже завершилось. Всего в них приняли участие 36 пациентов с инфантильной СМА. Возраст детей на момент начала исследований — от двух недель до восьми месяцев. Первичные доказательства эффективности основаны на данных о состоянии 21 пациента, которых лечили препаратом «Зонгельсма».
По сравнению с естественным течением болезни, пациенты, которых лечили препаратом, демонстрировали значительные улучшения моторного развития — дети смогли держать головку и самостоятельно сидеть.
Но стоимость «Зонгельсма» зашкаливает — целых $2,1 млн за одно введение. В ответ на нападки со стороны прессы и общественности Вас Нарасимхан, исполнительный директор Novartis, сказал, что этот препарат является «историческим достижением» и «знаковой единовременной генной терапией», потому вполне справедливо является таким дорогостоящим. При этом, по его словам, стоимость «Зонгельсмы» составляет всего половину цены существующих методов лечения пациентов с СМА, при учете дополнительных трат на аппараты для поддержки дыхания и вспомогательные средства. Стоимость хронической терапии пациентов, страдающих СМА, в действительности может превышать $4 млн в первые 10 лет жизни ребенка, потому, возможно, если препарат способен не вылечить, но продлить ребенку способность сохранять подвижность — такое лечение можно считать своего рода экономией.
При этом, по его словам, стоимость «Зонгельсмы» составляет всего половину цены существующих методов лечения пациентов с СМА, при учете дополнительных трат на аппараты для поддержки дыхания и вспомогательные средства. Стоимость хронической терапии пациентов, страдающих СМА, в действительности может превышать $4 млн в первые 10 лет жизни ребенка, потому, возможно, если препарат способен не вылечить, но продлить ребенку способность сохранять подвижность — такое лечение можно считать своего рода экономией.
В 2018 году компания Spark Therapeutics представила свой препарат «Лукстурна», возвращающий зрение пациентам, потерявшим его вследствие наследственных патологий сетчатки. Цена медицинского чуда: $425 000 за один глаз, то есть для большинства больных общая сумма составит $850 000. «Лукстурна» — это геннотерапевтический препарат, который может излечить редкую разновидность слепоты — ретинальную дистрофию, появляющаяся в результате наследования мутации в нефункциональной форме гена RPE65 от обоих родителей.
Ген RPE65 кодирует специфичный фермент клеток сетчатки глаза, участвующий в регенерации светочувствительного пигмента, который необходим для палочек и колбочек, чтобы обеспечить человеку нормальное зрение. Мутации в этом гене приводят к снижению или отсутствию уровней активности фермента, блокируя зрительный цикл и приводя к ухудшению зрения. Существует несколько типов наследственных заболеваний сетчатки, связанных с вышеназванным геном. Наиболее распространенными считают врожденный амавроз Лебера и пигментный ретинит. Из-за биаллельных мутаций гена RPE65 (генных мутаций обоих родителей) страдающие этими заболеваниями часто сталкиваются с никталопией (ночной слепотой) из-за снижения светочувствительности в детском или раннем взрослом возрасте и нистагмом (непроизвольными движениями зрачков). По мере прогрессирования заболевания происходят потеря периферического зрения, развитие туннельного зрения и, в конечном итоге, потеря центрального зрения, что означает полную слепоту.
Ретинальная дистрофия или наследственные дегенеративные заболевания сетчатки — это целый ряд болезней, которые отличаются по своей патологии, симптомам, а также последствиями. Очень трудно предсказать, насколько сильно ухудшится зрение, и как быстро будет прогрессировать заболевание, но во многих случаях люди с наследственной дистрофией сетчатки могут полностью потерять свое зрение.
Врожденный амавроз Лебера (ВАЛ) — редкое наследственное заболевание, которое приводит к нарушению деятельности сетчатки глаза и ухудшению зрения в раннем детстве, часто прямо с рождения. Из всех заболеваний, связанных с дегенерацией сетчатки, ВАЛ начинается раньше всего и может иметь наиболее тяжкие последствия. Уровень потери зрения при ВАЛ различается от случая к случаю, но остается стабильным в 75% случаев. У примерно 15% детей отмечается прогрессирующая потеря зрения, а у 10% может отмечаться некоторое незначительное, часто временное, улучшение.
Пигментный ретинит — группа наследственных заболеваний сетчатки, которые приводят к постепенному прогрессирующему снижению зрения. Потеря бокового зрения (иначе известного как «туннельное зрение») и снижение способности видеть в ночное время являются первыми заметными симптомами ПР. Далее страдающие этим заболеванием могут испытывать снижение зрения при чтении (детальное зрение), а затем — потерю цветового и центрального зрения.
Текущие методы лечения таких болезней включают генную терапию, клеточную терапию и протезирование сетчатки. Генная терапия имеет наибольший потенциал для достижения окончательного излечения путем замены мутационного гена. Терапия при помощи препарата «Лукстернa» доставляет нормальную копию гена RPE65 непосредственно в клетки сетчатки, которые затем вырабатывают нормальный белок. Он и преобразует свет в электрический сигнал в сетчатке для восстановления потери зрения пациентов. «Лукстерна» создана на основе встречающегося в природе аденоассоциированного вируса, который был модифицирован с использованием методов рекомбинации ДНК.
«Актиммун» (интерферон гамма-1b) изначально был разработан компанией Horizon Pharma как препарат для лечения рака — это рекомбинантный белок, похожий на тот, что вырабатывается иммунной системой человека — интерферон-гамма. Тесты «Aктиммун» в качестве потенциального лечения онкобольных людей в сочетании с другими препаратами все еще продолжаются.
Но FDA уже одобрило его для лечения двух редких заболеваний — хронического гранулематозного заболевания и тяжелого злокачественного остеопороза.
Хроническое гранулематозное заболевание — наследственное заболевание, при котором иммунная система отсутствует или не функционирует должным образом.
Тяжелый злокачественный остеопороз — «мраморная» болезнь, которая влияет на нормальный рост здоровых костей.
Как и «оригинальный» интерферон, «Aктиммун» является сигнальным белком, который связывается с рецепторами клеточной поверхности. Это приводит к транскрипции генов, которые активируют определенные клетки в иммунной системе. Препарат подталкивает антигены, связанные со злокачественной опухолью, к воздействию на клетки иммунной системы. В целом ожидается, что «Актиммун» будет усиливать ответ иммунной системе, что приведет к гибели опухолевых клеток.
Наиболее распространенными побочными эффектами при приеме «Актиммуна» компания-производитель называет симптомы, напоминающие грипп — лихорадку, головную боль, озноб и быструю утомляемость, которые могут снижаться по мере продолжения лечения. Но риск побочных эффектов куда более незначителен по сравнению с объективной пользой препарата. Уже доказано, что он замедляет течение как мраморной болезни, так и хронического гранулематоза. Стоимость искусственного аналога интерферона-гаммы составляет около $572 тыс. в год.
Помощь пациентам с синдромом ХантераСиндром Хантера представляет собой рецессивное наследственное заболевание, вызванное недостаточным уровнем в организме лизосомального фермента. Проще говоря, необходимый для правильного углеводного обмена фермент не вырабатывается в нужных количествах и полисахариды (естественные сахара) неправильно усваиваются. В связи с отсутствием или наличием дефектного фермента у пациентов с синдромом Хантера полисахариды накапливаются в лизосомах клеток, приводя к клеточному перенасыщению, органомегалии, разрушению тканей и нарушению функций внутренних органов. Частота заболевания в мире составляет один человек на 100 тысяч. В России зарегистрировано около 150 пациентов.
Идурсульфаза — это очищенная форма лизосомального фермента идуронат-2-сульфатазы, полученная на линии клеток человека, обеспечивающей профиль гликозилирования, аналогичный естественному ферменту, которого не хватает у пациентов с болезнью Хантера. Это вещество и стало активным в препарате американской фармацевтической компании «Шайер Хьюман Дженетик Терапис» — «Элапраза», первом и пока единственном, который может существенно облегчить жизнь страдающим от этого нарушения людям. «Элапраза» вводится внутривенно, а курс лечения подразумевает ежедневные инфузии на протяжении всей жизни.
Безопасность и эффективность препарата были оценены в клиническом исследовании контрольной группы, состоявшей из 96 пациентов с синдромом Хантера. Пациенты, получавшие еженедельное лечение продемонстрировали значительное улучшение по сравнению с теми, кто принимал плацебо. У пациентов в возрасте от 16 месяцев до пяти лет «Элапраза» не дала существенного улучшения симптомов, связанных с заболеванием, или отдаленного клинического результата. Однако лечение значительно уменьшило размер селезенки маленьких пациентов так же, как и у детей в возрасте 5 лет и старше. Стоимость «Элапразы» составляет $375 тыс. в год.
Наследственный ангионевротический отекНаследственный ангионевротический отек (HAE) — очень редкое и потенциально смертельное заболевание, которое встречается примерно у одного из 10 тыс. человек в мире. Главный симптом HAE — отеки в различных частях тела. У пациентов часто бывают приступы мучительной боли в животе, тошнота и рвота, вызванные отеком кишечной стенки. Отек дыхательных путей особенно опасен и может привести к смерти от удушья.
У пациентов с НАЭ имеется дефект в гене, который контролирует белок крови, называемый ингибитором С1. Генетический дефект приводит к выработке либо неадекватного, либо нефункционального белка C1-Inhibitor. Нормальный C1-Inhibitor помогает регулировать сложные биохимические взаимодействия систем на основе крови, участвующих в борьбе с болезнями, воспалительной реакцией и коагуляцией. Поскольку дефектный C1-Inhibitor не выполняет надлежащим образом свою регуляторную функцию, может возникнуть биохимический дисбаланс и продуцировать нежелательные пептиды. Они побуждают капилляры высвобождать жидкость в окружающую ткань, вызывая тем самым отек.
«Цинриз» является первым ингибитором C1-эстеразы (C1-INH), одобренным FDA для предотвращения приступов внезапных отеков у детей (от шести лет и старше), подростков и взрослых. Этот препарат с 2008 года успешно используется для снижения частоты, тяжести и продолжительности отеков у подростков и взрослых пациентов, страдающих ангиодистрофией. Было показано, что у детей в возрасте от шести до 11 лет «Цинриз» уменьшает количество и степень тяжести приступов наследственных ангионевротических отеков и практически избавляет от необходимости использования неотложной терапии. Он вводится внутривенно каждые 3–4 дня для предотвращения или смягчения приступов. Эффективность и безопасность «Цинриза» были оценены в 36-недельном клиническом испытании у 12 детей с HAE в возрасте от семи до одиннадцати лет. Пациентов наблюдали в течение 12 недель для установления базовой частоты приступов, затем давали одну дозу препарата (500 или 1000 ед. каждые 3–4 дня) в течение 12 недель, а затем уменьшали или увеличивали дозу в течение последних 12 недель. Эффективность измеряли в зависимости от уменьшения количества приступов при изменении дозы лекарства по сравнению с исходным уровнем. Стоимость годового курса «Цинриз» — $1,1 млн.
Стоимость жизненно важных препаратов зависит от множества исходных данных, но и их польза неоспорима. Обеспечить идентичную замену дефектным клеткам или способствовать выработке нужных для больного ферментов, зачастую могут только сложные разработки, в которых задействованы большое количество специалистов. В России, к большому сожалению, еще не все эти лекарства одобрены или выдаются по квоте всем нуждающимся. Но однажды мы к этому придем.
Экспериментальное лекарство от рассеянного склероза подавило ВИЧ — Наука
ТАСС, 14 августа. Медики из США обнаружили, что финголимод – недавно одобренное лекарство для борьбы с рассеянным склерозом, может блокировать размножение ВИЧ и мешает вирусу попадать в новые клетки. Результаты их исследования опубликовал научный журнал PLOS Pathogens.
«Антиретровирусные препараты пока эффективно справляются с подавлением ВИЧ-инфекции. Однако у них есть побочные эффекты и их действенность со временем уменьшается. Мы впервые показали, что если заблокировать рецепторы S1P, то можно полностью предотвратить передачу вируса от одной клетки к другой. Это уменьшает число вирусных частиц в латентной стадии заражения», – рассказал один из авторов работы, доцент Университета Джорджа Вашингтона (США) Альберто Боске.
В иммунные клетки человека ВИЧ попадает с помощью белков, которыми покрыта его оболочка. Структура этих молекул, а также связанных с ними нитей сахаров по мере размножения вируса быстро меняется. Поэтому иммунитет вступает в своеобразную «гонку вооружений», постоянно вырабатывая новые наборы антител. Если пациент не принимает антиретровирусных лекарств, в этой борьбе почти всегда побеждает ВИЧ.
Эти препараты, как правило, останавливают размножение вируса, блокируя работу одного из его ферментов или других систем, которые критически важны для сборки новых вирусных частиц. Однако это не излечивает больных, так как ВИЧ переходит в «спящий режим» и не проявляет активности до того времени, когда больной перестает принимать лекарства.
Новое лекарство от ВИЧ
Боске и его коллеги обнаружили, что количество подобных «спящих» вирусных частиц можно резко снизить с помощью финголимода – препарата, который создан для борьбы с рассеянным склерозом. Это вещество взаимодействует с рецепторами S1P на поверхности иммунных клеток, заставляя их снижать свою активность во время вспышек рассеянного склероза. Это защищает миелиновую оболочку нервных клеток больных, не давая им разрушаться и дальше.
Вирусологи обратили внимание на то, что рецепторы S1P очень часто встречаются на поверхности тех разновидностей Т-клеток и других компонентов иммунной системы, которые атакует ВИЧ. Вдобавок недавно ученые обнаружили, что если эти рецепторы активируются, то и вирус пробуждается.
Руководствуясь подобными соображениями, Боске и его команда проверили, что произойдет, если сначала заразить культуру иммунных клеток ВИЧ, а затем обработать их финголимодом, а также если использовать этот препарат до заражения. Опыты показали, что лекарство от рассеянного склероза резко замедлило размножение ВИЧ и в первом, и во втором случаях.
Последующие наблюдения показали, что благотворное действие этого препарата было связано с двумя вещами. С одной стороны он блокировал работу рецепторов CD4, которые вирус использует для проникновения в иммунные клетки, а с другой – снижал концентрацию копий ВИЧ в уже зараженных клетках, активируя фермент SAMHD1, который уничтожает копии генома вируса внутри клеток.
При этом финголимод не мешал работе недавно созданных лекарств, которые «пробуждают» ВИЧ и заставляют его покидать зараженные клетки. В теории благодаря этому можно будет снизить размеры резервуара скрытой инфекции в организме больных, применяя различные комбинации из подобных лекарств, заключают исследователи.
Обаджио | Национальное общество рассеянного склероза
Об этом лекарстве- Фирменное наименование: Aubagio® (США) (oh-BAH-gee-oh)
- Химическое название: терифлуномид (ter-i-FLOO-noe-mide)
- Использование в MS: Агент, изменяющий заболевание
- Доступен общий: №
Это пероральный препарат в форме таблеток.
Описание
Aubagio® (терифлуномид), ингибитор синтеза пиримидина, представляет собой пероральное соединение, которое подавляет функцию специфических иммунных клеток, вовлеченных в РС. Это связано с лефлуномидом, лекарством, используемым для лечения ревматоидного артрита. Aubagio может ингибировать ключевой фермент, необходимый лейкоцитам (лимфоцитам), что, в свою очередь, снижает пролиферацию Т- и В-иммунных клеток, активных при РС, а также подавляет выработку Т-клетками химических веществ-мессенджеров.
Aubagio был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для лечения пациентов с рецидивирующими формами рассеянного склероза, включая клинически изолированный синдром, рецидивирующую ремиттирующую болезнь и активное вторично прогрессирующее заболевание у взрослых.
Щелкните здесь, чтобы просмотреть информацию о назначениях FDA для медицинских работников.
Щелкните здесь, чтобы просмотреть Руководство FDA по лекарствам для пациентов.
Поддержка
MS One to One
1-855-MSOne2One (1-855-676-6326)
www.MSOnetoOne.com
Программа финансовой помощи
MS One to One
1-855-MSOne2One (1-855-676-6326)
www.MSOnetoOne.com
Что нужно знать об Aubagio®
В этом видео д-р Джим Боуэн и д-р Лили Юнг Хенсон обсуждают одобренное лечение, изменяющее заболевание, Aubagio® (терифлуномид), созданное в 2013 году. Чтобы узнать больше об Aubagio® и других вариантах лечения, изменяющих болезнь, загрузите Консенсус по заболеванию -Модифицирующие терапии.
Смотреть сейчас
Рассеянный склероз — лечение в клинике Мэйо
Лечение рассеянного склероза в клинике Mayo
Ваша команда по уходу в клинике Mayo
Всемирно известные команды по лечению рассеянного склероза клиники Mayo включают неврологов, специалистов по физиотерапии и реабилитации (физиотерапевтов), урологов, психиатров, нейроофтальмологов и других специалистов, работающих вместе как многопрофильная команда для оценки и лечения каждого человека.
Делая упор на совместную помощь, специалисты очень тесно взаимодействуют со своими коллегами во всех университетских городках.
Это сотрудничество означает, что вы не получите единого мнения — ваша медицинская помощь обсуждается в команде, и для вас работают вместе самые узкоспециализированные эксперты по рассеянному склерозу в мире. Результаты ваших анализов доступны быстро, и ваши встречи планируются согласованно. То, что может занять несколько месяцев в другом месте, обычно можно сделать в клинике Мэйо всего за несколько дней.
Расширенная диагностика и лечение
Новые методы лечения и исследования открывают светлое будущее.
Нажмите здесь, чтобы увидеть инфографику, чтобы узнать большеMS может быть трудно диагностировать, поскольку симптомы часто варьируются от человека к человеку или могут быть вызваны другим заболеванием. Точный диагноз имеет решающее значение для обеспечения наиболее эффективного лечения.
Команда MS клиникиMayo Clinic ежегодно оценивает тысячи людей с помощью MS .Обладая вниманием к MS и обширным опытом, врачи клиники Mayo могут поставить точный диагноз и порекомендовать эффективное лечение с самого начала.
Поскольку MS реже встречается у детей, чем у взрослых, детский MS может быть особенно трудно диагностировать. В клинике Мэйо есть специализированный детский центр рассеянного склероза, в котором работает команда экспертов, занимающихся лечением детей с помощью MS .
В клинике Мэйо исследователи постоянно работают над разработкой новых методов лечения для улучшения результатов для людей с MS .
Например, клиника Мэйо была одной из первых клиник, которая лечила MS интерферонами. Клиника Мэйо также разработала плазмаферез и успешно использует это лечение более 20 лет.
Research
Специалисты Mayo Clinic постоянно изучают новые возможности диагностики и лечения, которые они тестируют в ходе клинических испытаний.
Исследователи изMayo Clinic первыми обнаружили, что определенный тип Т-лимфоцитов (CD8) играет решающую роль в повреждении нервов в MS .Это открытие может привести к созданию новых лекарств, замедляющих или останавливающих повреждение нервов.
Лаборатория исследования рассеянного склероза в клинике Мэйо
Узнайте больше об опыте и рейтингах отделений нейрохирургии и неврологии Mayo Clinic.
Опыт и истории пациентов клиники Мэйо
Наши пациенты говорят нам, что качество их взаимодействия, наше внимание к деталям и эффективность их посещений означают такое медицинское обслуживание, которого они никогда не получали.Посмотрите истории довольных пациентов клиники Мэйо.
Опыт и рейтинги
Специалисты Mayo Clinic по рассеянному склерозу ежегодно оказывают комплексную помощь более чем 3500 взрослым и детям, страдающим рассеянным склерозом.
Программа MS клиники Мэйозаработала национальную репутацию ведущего диагностического и лечебного центра. Программа известна своим междисциплинарным подходом к уходу за пациентами, а также передовыми исследованиями в области улучшенных лекарств и других методов лечения.
Детский центр рассеянного склероза в клинике Майо в Рочестере, штат Миннесота, признан Национальным обществом рассеянного склероза в качестве педиатрической сети MS Center.
КлиникаMayo в Рочестере, штат Миннесота, и клиника Mayo в Джексонвилле, штат Флорида, вошли в число лучших больниц для неврологии и нейрохирургии по версии U.S. News & World Report. Клиника Мэйо в Фениксе / Скоттсдейле, штат Аризона, признана У.S. News & World Report. Клиника Мэйо также входит в число лучших детских больниц по неврологии и нейрохирургии.
Расположение, проезд и проживание
Клиника Мэйо имеет крупные кампусы в Фениксе и Скоттсдейле, штат Аризона; Джексонвилл, Флорида; и Рочестер, штат Миннесота. Система здравоохранения клиники Мэйо имеет десятки отделений в нескольких штатах.
Для получения дополнительной информации о посещении клиники Mayo выберите свое местоположение ниже:
Расходы и страхование
Клиника Мэйо работает с сотнями страховых компаний и является поставщиком услуг внутри сети для миллионов людей.
В большинстве случаев клиника Мэйо не требует направления к врачу. Некоторые страховщики требуют направления или могут иметь дополнительные требования для определенного медицинского обслуживания. Приоритет всех посещений определяется медицинской потребностью.
Узнайте больше о приемах в клинике Мэйо.
Пожалуйста, свяжитесь со своей страховой компанией, чтобы подтвердить медицинское страхование и получить необходимое разрешение до вашего визита. Часто номер службы поддержки вашего страховщика напечатан на обратной стороне вашей страховой карты.
Дополнительная информация о выставлении счетов и страховании:
Клиника Мэйо в Аризоне, Флориде и Миннесоте
Система здравоохранения клиники Мэйо
Программа лечения рассеянного склероза клиники Мэйо
Аризона
Флорида
Миннесота
Лекарства от рассеянного склероза: сравнение ведущих препаратов
У нас нет лекарства от рассеянного склероза. Но FDA одобрило более дюжины лекарств, которые могут замедлить или «изменить» течение вашего рассеянного склероза.Они могут облегчить симптомы, предотвратить более быстрое обострение болезни и снизить частоту повторных приступов.
Вы принимаете их одним из трех способов: в виде таблеток, инъекций или инфузий в вену. Некоторые могут работать для вас лучше, чем другие. Они могут вызывать разную или разную степень побочных эффектов.
Почти все лекарства предназначены для наиболее распространенного типа РС, называемого ремиттирующим РС (РРС). Два препарата лечат более запущенные формы болезни.
Врачи используют определенные лекарства для лечения возвращения или «рецидива» симптомов рассеянного склероза.Другие препараты замедляют прогрессирование болезни. Третья группа препаратов лечит специфические симптомы рассеянного склероза.
Лекарства от рецидивов РС
Рецидивы РС — также называемые обострениями, приступами или обострениями — возникают, когда симптомы возвращаются. Это могут быть новые симптомы, которых у вас не было раньше, или старые симптомы, которые возвращаются или ухудшаются.
Продолжение
Если симптомы достаточно серьезны, чтобы повлиять на вашу способность функционировать, например, потеря равновесия или зрения, врачи могут назначить короткий курс кортикостероидов в высоких дозах.Это помогает уменьшить воспаление и сокращает время рецидива. 3- или 5-дневный курс внутривенных кортикостероидов, таких как метилпреднизолон (Solu-Medrol) или пероральный вариант, такой как преднизон (Deltasone), обычно помогает.
Другие методы лечения рецидивов включают:
H.P. Актар Гель . это тип адренокортикотропного гормона (АКТГ), который медленно попадает в организм после инъекции. Его не всегда легко достать, и он может стоить дорого. Вы и ваш врач можете рассмотреть это, если кортикостероиды вам не подходят.
Плазмаферез . Это означает, что машина заменяет плазменную часть вашей крови эквивалентной жидкостью. Врачи учитывают это в серьезных случаях, когда лечение стероидами не поддается лечению.
Лекарства для прогрессирования заболевания рассеянным склерозом
FDA одобрило следующие лекарства для снижения количества рецидивов рассеянного склероза, замедления наступления инвалидности и, возможно, уменьшения активности нового заболевания. Некоторые врачи также прописывают лекарства «не по прямому назначению» — те, которые были одобрены для лечения других заболеваний.
Инъекционные препараты
- Глатирамера ацетат (Копаксон)
- Интерферон бета-1a (Авонекс, Ребиф)
- Интерферон бета-1b (Бетасерон, Экставиа)
- Пэдумумаб (1гина6феридон) )
Продолжение
Пероральные препараты
- Кладрибин (Mavenclad)
- Диметилфумарат (Текфидера)
- Дироксимел фумарат (Vumerity) Pingolimodia )
- Siponimod (Mayzent)
- Teriflunomide (Aubagio)
Инфузионные лекарства
Инфузированные лекарства вводятся через иглу в вашу вену или под кожу.
- Алемтузумаб (Лемтрада)
- Митоксантрон (Новантрон)
- Натализумаб (Тисабри)
- Окрелизумаб (Окревус)
Прочтите ниже, чтобы узнать больше о том, как эти препараты действуют и как они действуют.
Алемтузумаб (Lemtrada)
Как это работает : FDA одобрило это мощное, долговременное лекарство для лечения рассеянного склероза в 2014 году. Это моноклональные антитела, что означает, что оно может находить и воздействовать на определенные иммунные клетки, чтобы они не повреждались. нервы.Алемтузумаб может вызывать опасные или смертельные побочные эффекты. Ваш врач, вероятно, не пропишет это, пока вы не попробуете хотя бы два других препарата от РС.
Как вы это принимаете : Внутривенно 1 раз в день в течение 5 дней, затем через год в течение 3 дней.
Побочные эффекты : Вам потребуется тщательное наблюдение, включая регулярные анализы крови в течение как минимум 5 лет. Этот препарат может вызвать редкое и смертельное кровотечение. Это также может повлиять на ваши почки. Примерно каждый третий пользователь может получить заболевание щитовидной железы.У вас может возникнуть серьезная реакция на настой. Наиболее частые побочные эффекты включают:
Кладрибин (Мавенклад)
Принцип действия: Кладрибин, модификатор заболевания, предназначен для лечения рецидивирующих форм РС, включая рецидивирующе-ремиттирующую болезнь и активное вторично-прогрессирующее заболевание. Он атакует часть вашей крови, которая атакует миелин, защищающий ваши нервы.
Как принимать: Один раз в день в течение 5 дней в течение первого месяца. Один раз в день в течение 5 дней второй месяц.
Побочные эффекты:
- Низкое количество лейкоцитов
- Выпадение волос
- Сыпь
- Повышенный риск туберкулеза
- Язвы во рту или опоясывающий лишай
Диметилфумарат (Tecfidera
Как это работает
) Исследователи считают, что эта таблетка может блокировать иммунные клетки, которые повреждают нервы. Он также может действовать как антиоксидант, защищая мозг и спинной мозг. Врачи давно используют его для лечения псориаза, еще одного аутоиммунного заболевания.
Как вы принимаете : по одной капсуле два раза в день.
Побочные эффекты : Это может повлиять на ваши показатели крови, поэтому ваш врач будет проверять их каждые несколько месяцев. У вас также может быть отек горла и языка, из-за которого становится трудно дышать. У вас могут быть проблемы с пищеварением, например:
- Тошнота
- Диарея
- Боль в животе
- Приливы, как приливы
Финголимод (Гиления)
Как это работает: Это была первая таблетка, одобренная для РС.Он связывается с лейкоцитами и удерживает их в ваших лимфатических узлах, чтобы они не могли повредить вашу центральную нервную систему. Это может помочь снизить количество рецидивов рассеянного склероза. Он может работать примерно так же, как бета-интерферон, хотя доказательства ограничены.
Как вы принимаете : Одна капсула в день . Поскольку финголимод иногда может вызывать замедление сердечного ритма, ваш врач, вероятно, будет внимательно следить за ним, особенно когда вы начнете.
Побочные эффекты: Этот препарат может вызывать врожденные дефекты.Не принимайте его, если вы беременны или планируете беременность. У вас также может быть больше шансов получить инфекцию или опухоль в глазах, которая может повлиять на ваше зрение. Другие проблемы, на которые следует обратить внимание, включают:
Глатирамерацетат (копаксон, глатопа)
Принцип работы: Это лабораторный белок, который может защищать от клеток, повреждающих миелин, защитный слой нервов. Препарат делает реже рецидивы.
Продолжение
Как вы это принимаете : Укол в руку, живот, бедро или бедро один раз в день или три раза в неделю, в зависимости от вашей дозы.
Побочные эффекты : Серьезные проблемы возникают редко, но вы можете получить:
Интерферон-бета (Avonex, Betaseron, Extavia, Plegridy, Rebif)
Как это работает : Это лабораторные версии вашего белок организма, борющийся с инфекциями. Они существуют дольше всех и являются наиболее часто назначаемыми препаратами от рассеянного склероза. Это лекарство, называемое биологическими препаратами, которое производится из живых клеток. Врачи не уверены, но они думают, что бета-интерферон подавляет в вашем организме сигналы, которые вызывают аутоиммунный ответ, ведущий к РС.
Как вы их принимаете : Одна инъекция предварительно заполненной автоинъекторной ручкой или шприцем через день или один раз в неделю, в зависимости от препарата. Пегилированный интерферон бета-1а (Плегриди) остается активным в вашем организме дольше, чем другие, поэтому вы принимаете его реже.
Продолжение
Побочные эффекты: Они могут включать:
Любые побочные эффекты могут беспокоить вас меньше, если вы сделаете прививку перед сном. Вы можете принимать обезболивающие и жаропонижающие, такие как парацетамол или ибупрофен, перед каждой инъекцией и в течение 24 часов после нее, чтобы облегчить некоторые из этих проблем.
Не следует принимать эти препараты, если у вас аллергия на бета-интерферон или альбумин, основной белок плазмы крови.
Препараты интерферона могут вызвать депрессию или усугубить ее. Они также могут влиять на клетки крови и работу печени и щитовидной железы.
Митоксантрон (Новантрон)
Как это работает : Это бывший противораковый препарат, одобренный для лечения рассеянного склероза. Он ослабляет вашу иммунную систему и снижает количество клеток, атакующих миелин.Это единственный препарат, помимо Окревуса, который назначают при прогрессирующей форме РС, особенно при вторично-прогрессирующем РС. Вот тогда ваше состояние ухудшается сверх RRMS.
Продолжение
Как вы это принимаете : Одна инфузия каждые 3 месяца, до 12 доз в течение 2 или 3 лет.
Побочные эффекты : Из соображений безопасности врачи обычно назначают это только в том случае, если ваш РС быстро ухудшается и другие лекарства не помогли. Это может серьезно повлиять на ваше сердце и повысить вероятность заболевания раком крови.
Продолжение
Вашему организму сложнее бороться с инфекцией, когда вы принимаете Новантрон, поэтому держитесь подальше от больных. Немедленно сообщите своему врачу, если у вас:
- Лихорадка или озноб
- Боль в горле или кашель
- Язвы на губах или во рту
- Одышка
- Боль в желудке, рвота или диарея
- Болезненное или затрудненное мочеиспускание
- Неравномерное или учащенное сердцебиение
- Отек стопы или лодыжек
- Необычное кровотечение или синяк
- Боль, отек, покраснение или раздражение в месте инъекции
У вас могут быть другие побочные эффекты, которые исчезнут, когда ваше тело приспосабливается к лекарство.К ним относятся:
- Сине-зеленый цвет мочи в течение 24 часов после приема Новантрона
- Легкая или умеренная тошнота
- Менструальные изменения у женщин
- Легкое или умеренное выпадение волос (волосы обычно снова отрастают после окончания лечения)
Натализумаб (Тисабри)
Как это работает : Это лекарство с антителами прикрепляется к Т-клеткам и не дает им достичь головного и спинного мозга и атаковать защитный миелин. Обычно его назначают, если ваш рецидивирующий РС очень активен или если вы не ответили на другие лекарства от РС.
Как вы принимаете : Путем инфузии один раз каждые 28 дней в клинике инфузии.
Побочные эффекты : Редко, но можно получить инфекцию мозга, которая может привести к инвалидности или смерти. Сначала симптомы могут быть похожи на рецидив рассеянного склероза. У некоторых людей может быть аллергия на препарат. Общие побочные эффекты включают:
Окрелизумаб (Окревус)
Как это работает : FDA одобрило его в 2017 году. Он лечит RRMS, а также первично-прогрессирующий MS (PPMS).Вот когда ваше состояние неуклонно ухудшается, без периодов рецидивов и ремиссий. Окрелизумаб — это моноклональное антитело, нацеленное на В-клетки, которые повреждают нервы. Исследования показывают, что это может работать лучше для уменьшения рецидивов и замедления рассеянного склероза, чем некоторые препараты бета-интерферона.
Продолжение
Как вы это принимаете : Две инфузии с интервалом в 2 недели, каждые 6 месяцев.
Побочные эффекты : Вы не должны принимать его, если у вас гепатит B. Как и в случае с другими инфузионными препаратами, у вас может появиться кожный зуд, сыпь, раздражение горла или аллергическая реакция.В редких случаях можно получить смертельную инфекцию мозга.
Сипонимод (Майзент)
Как это работает: Сипонимод — это лекарство, модулирующее иммунную систему, которое проникает в центральную нервную систему и помогает контролировать воспаление. Он помогает лимфатическим узлам вашего тела удерживать определенные лейкоциты, не позволяя им циркулировать по всему телу и в центральной нервной системе.
Как вы это принимаете: Вы начинаете медленно и постепенно увеличиваете дозировку, начиная с 0.25 миллиграммов в течение первых 2 дней, затем 0,50 миллиграмма на 3 день, 0,75 миллиграмма на 4 день, до 1,25 миллиграмма на 5 день и до 2 миллиграммов в качестве поддерживающей терапии в дальнейшем.
Побочные эффекты: Побочные эффекты включают расстройства нервной системы и инфекции. К наиболее частым побочным эффектам относятся:
- Диарея
- Головокружение
- Отек конечностей
- Боль в руке или ноге
- Замедление пульса
- Высокое кровяное давление
- Головные боли
Терифлуномид (Aubagio)
работает
: Этот препарат блокирует ферменты, активирующие лейкоциты.Это замедляет выработку иммунных клеток, которые активны, когда РС повреждает нервы.Как принимать: Одна таблетка в день.
Побочные эффекты : Может вызывать серьезные врожденные дефекты. Если вы беременны или думаете о беременности, не принимайте это. Вашему врачу также необходимо будет внимательно следить за вами на предмет повреждений печени, почек или нервов, а также инфекций и высокого кровяного давления. Другие проблемы включают:
Лекарства от симптомов РС
Проблемы с мочевым пузырем
Проблемы с кишечником
Инфекция
Депрессия и эмоциональные проблемы
Усталость
- 44 Типы боли о лечении и преимуществах
-
Модифицирующие заболевание агенты снижают активность и прогрессирование заболевания. Врачи обычно начинают их как можно скорее после постановки диагноза, чтобы минимизировать повреждение нервов. Побочные эффекты зависят от конкретного препарата.
-
Средства для лечения рецидивов в основном включают кортикостероиды.Эти мощные противовоспалительные препараты могут помочь контролировать рецидив и сократить его продолжительность. Длительное использование может вызвать проблемные побочные эффекты.
-
Средства для лечения симптомов включают широкий спектр лекарств, потому что существует много разных симптомов.
-
Баклофен (Габлофен, Лиорезал) — миорелаксант. Он улучшает движение мышц и снимает боль, мышечное напряжение и спазмы из-за спастичности (когда ваши мышцы постоянно сокращаются).Он доступен в виде таблеток и инфузионной системы, которая доставляет лекарство в позвоночный канал.
-
Дальфампридин (Ампира) улучшает трудности при ходьбе или походке. Это единственный препарат, одобренный FDA для лечения этого симптома рассеянного склероза. Это таблетка, которую вы принимаете дважды в день.
-
Дексаметазон (Декадрон) — кортикостероид для лечения рецидивов. Обычно врачи используют внутривенную форму в течение нескольких дней. После этого может потребоваться медленное снижение дозы перорального кортикостероида — дексаметазона или преднизона.
-
Диметилфумурат (Tecfidera) является модифицирующим заболевание агентом. Это капсула, которую вы принимаете два раза в день. Принимая его с едой, вы уменьшите побочный эффект приливов.
-
Финголимод (Gilenya) — агент, модифицирующий заболевание. Он выпускается в виде капсулы для приема один раз в день. Финголимод эффективен для снижения частоты рецидивов у пациентов с ремиттирующим РС. Поскольку это может вызвать аномально медленное сердцебиение, вы примете первую дозу в условиях, когда врач будет контролировать ваше сердце в течение шести часов.
-
Глатирамера ацетат (Copaxone, Glatopa) — это синтетический белок, который действует как агент, модифицирующий заболевание. Это инъекция, вводимая один раз в день под кожу (подкожно). Вы научитесь делать себе эти уколы.
-
Интерферон бета-1а (Avonex, Rebif) является биологическим агентом, модифицирующим заболевание. Авонекс — это внутримышечная инъекция, которую вы можете делать себе один раз в неделю. Ребиф — это инъекции под кожу трижды в неделю.
-
Интерферон бета-1b (Betaseron, Extavia) также является биологическим агентом, модифицирующим заболевание. Обе марки — это инъекции под кожу, которые вы вводите через день.
-
Терифлуномид (Aubagio) является модифицирующим заболевание агентом. Это таблетка, которую вы обычно принимаете один раз в день.
-
Тизанидин (Занафлекс) — миорелаксант. Повышает мышечный тонус и снимает симптомы спастичности.Поставляется как в таблетке, так и в капсуле. Однако вы не можете заменить одно другим. Проверьте рецепт, чтобы убедиться, что вы всегда получаете одну и ту же форму.
- ствол головного мозга
- мозжечок, который координирует движения и контролирует баланс
- спинной мозг
- зрительные нервы
- белое вещество в некоторых областях мозга
- головная боль
- потеря слуха
- зуд
- проблемы с дыханием или дыханием
- судороги
- нарушения речи
- проблемы с глотанием
- МРТ головного и спинного мозга, которые могут выявить поражения
- Анализ спинномозговой жидкости, который может выявить антитела, указывающие на предшествующую инфекцию
- Тест на вызванный потенциал, который измеряет электрическую активность в ответ на стимулы
- замедлить прогрессирование и уменьшить количество и тяжесть рецидивов
- облегчить симптомы
- интерферон бета 1-а (Авонекс и Ребиф)
- интерферон бета-1b (Бетасерон и Экставиа)
- глатирамера ацетат: (Копаксон и Глатопа)
- пегинтерферон бета-1a) (Plegridy)
- терифлуномид (Aubagio)
- финголимод (Gilenya)
- диметил фумарат (Tecfidera
- )
- алемтузумаб (лемтрада)
- митоксантрон (новантрон)
- окрелизумаб (окревус)
- натализумаб (тисабри)
- тепловое и массажное лечение боли
- иглоукалывание при боли и походке
- управление стрессом для улучшения настроения
- упражнения для поддержания силы и гибкости, уменьшить скованность и улучшить настроение
- здоровая диета с большим количеством свежих фруктов, овощей и клетчатки
- отказ от курения или отказ от курения
- Существует разница между употреблением уличной каннабиса и медицинской каннабисом.
- Не все формы каннабиса разрешены во всех штатах.
От рассеянного склероза (РС) нет лекарства, но лекарства и изменения образа жизни могут помочь вам справиться с этим заболеванием.Работайте в тесном сотрудничестве со своим врачом, чтобы найти лечение, которое лучше всего подходит для вас и вызывает наименьшие побочные эффекты.
Лекарства, изменяющие заболевание
Если у вас есть тип рассеянного склероза, называемый ремиттирующим РС, и ваше состояние ухудшается, ваш врач может сначала назначить вам лекарство, изменяющее заболевание. Эти лекарства замедляют прогрессирование вашего заболевания и предотвращают обострения.
Лекарства действуют путем обуздания иммунной системы — основной защиты вашего организма от микробов — так, что она не атакует защитное покрытие под названием миелин, окружающее нервы.
Некоторые лекарства вводятся в виде инъекций под кожу или в мышцу. Укол может вызвать болезненность, покраснение, зуд или ямочки на коже. К ним относятся:
Бета-интерфероны: Это одни из наиболее распространенных лекарств, используемых для лечения рассеянного склероза. Они уменьшают тяжесть и частоту обострений. Они также могут вызывать симптомы гриппа, такие как боли, усталость, жар и озноб, но они должны исчезнуть в течение нескольких месяцев. Они могут повысить вероятность заражения инфекцией. Это потому, что они снижают количество лейкоцитов, которые помогают вашей иммунной системе бороться с болезнями.Они включают:
Продолжение
Глатирамер (Копаксон, Глатопа): Это лекарство останавливает вашу иммунную систему от атаки миелина, который окружает и защищает ваши нервы.
Вы можете принимать другие лекарства в виде таблеток:
Кладрибин (Mavenclad) — это таблетка, которую принимают один раз в день в течение пяти дней в течение одного месяца и один раз в день в течение второго месяца. Возможно, вам понадобится еще один курс через год. Он не предназначен для лечения рецидивирующих форм рассеянного склероза, включая ремиттирующую болезнь и активное вторично прогрессирующее заболевание.Это может повлиять на вашу иммунную систему и сделать вас восприимчивым к другим инфекциям, поэтому вам необходимо будет наблюдать. У вас также может быть выпадение волос и сыпь.
Диметилфумарат (Текфидера) — это таблетка, которую вы принимаете два раза в день. Это может снизить уровень ваших иммунных клеток, поэтому врач будет регулярно проводить анализы крови, чтобы следить за ними. Наиболее частыми побочными эффектами препарата являются приливы, боли в желудке, диарея, тошнота и рвота. Активный ингредиент, аналогичный действующему в Tecfidera, связан с четырьмя случаями ПМЛ.
Продолжение
Дироксимела фумарат (Vumerity) аналогичен Tecfidera. Вы принимаете таблетку два раза в день. Препарат применяется для лечения рецидивирующих форм рассеянного склероза. Наиболее частыми побочными эффектами являются приливы, покраснение, зуд или сыпь; тошнота, рвота, диарея, боль в желудке или расстройство желудка. Однако было показано, что Vumerity легче переносится желудком, чем Tecfidera.
Fingolimod (Gilenya) — также таблетка для приема один раз в день. Если у вас не было ветряной оспы, вам понадобится вакцина.Общие побочные эффекты включают головную боль, диарею, боль в спине, кашель и отклонения в тестах печени. Поскольку лекарство может замедлить частоту сердечных сокращений, врач будет внимательно следить за вами после приема первой дозы. Препарат также связан с прогрессирующей мультифокальной лейкоэнцефалопатией (ПМЛ), редкой инфекцией головного мозга.
Монометилфумарат (Бафиертам) — это таблетка, принимаемая два раза в день, аналогичная диметилфумарату. Общие побочные эффекты включают покраснение, боль в животе, диарею и тошноту. Следует контролировать показатели крови и ферменты печени.
Озанимод (Зепозия) — это таблетка, которую принимают один раз в день. Он начинается с низкой дозы, а затем нарастает в течение первой недели. Общие побочные эффекты включают головокружение, головные боли, респираторные инфекции и симптомы простуды. Не принимайте его, если у вас проблемы с печенью или сердцем.
Продолжение
Сипонимод (Майзент) — это таблетка, принимаемая ежедневно после 5-дневного наращивания до нужной дозы. Это может повлиять на вашу иммунную систему и было связано со свертыванием в конечностях.Наиболее частыми побочными эффектами являются диарея, головокружение, отеки конечностей, высокое кровяное давление, головные боли и замедленное сердцебиение. Вам не следует принимать сипонимод, если вы беременны.
Терифлуномид (Аубаджио) — это таблетка, которую вы принимаете один раз в день. Наиболее частые побочные эффекты включают диарею, отклонения от нормы в печени, тошноту и выпадение волос. Он содержит предупреждение о «черном ящике», самое серьезное предупреждение FDA, потому что оно может привести к проблемам с печенью и врожденным дефектам. Если вы примете его, ваш врач, скорее всего, будет проводить регулярные анализы, чтобы проверить, насколько хорошо работает ваша печень.Не принимайте это, если вы беременны.
Другие лекарства вводят в вену в кабинете врача или в больнице. Но вам нужно принимать их только раз в несколько месяцев:
Продолжение
Алемтузумаб (Лемтрада) и митоксантрон (Новантрон) — химиотерапевтические препараты, предназначенные для лечения рака. Это вариант, если вы не отвечаете на другие посредники. Они обуздывают вашу иммунную систему и не дают ей атаковать нервные покровы. У Novantrone есть предупреждение FDA о «черном ящике», потому что это может привести к повреждению сердца и разновидности лейкемии.
Натализумаб (Тисабри) и окрелизумаб (Окревус) — варианты, если другие препараты вам не помогают. Натализумаб предотвращает попадание иммунных клеток в головной и спинной мозг, где они могут повредить нервы. Окрелизумаб атакует определенные В-клетки и не дает иммунной системе атаковать ваше тело. Лекарства связаны с ПМЛ, поэтому ваш врач проведет анализы крови, чтобы проверить это.
Лечение обострений
Если вы принимаете другие лекарства, легкие обострения со временем пройдут сами по себе.Если они вас не беспокоят, лечить их не нужно.
Стероиды: Если обострение болезни мешает вашей жизни, ваш врач может назначить вам высокие дозы стероидов через вену (внутривенно) или перорально, чтобы быстро облегчить симптомы. Эти препараты успокаивают обострение, но не замедляют течение болезни. Наиболее распространенные из них:
Плазменный обмен: Это может помочь, когда обострение не поддается лечению стероидами. Ваш врач удалит часть вашей крови и отделит жидкую часть (называемую плазмой) от клеток крови.Клетки смешиваются с белковым раствором и возвращаются в ваше тело.
Контроль симптомов
Ваш врач может порекомендовать лечение:
Жесткость и спазмы мышц : Миорелаксанты, такие как баклофен (Лиорезал) и тизанидин (Занафлекс), или седативные средства, такие как клоназепам (Клонопин) и диазепам (Валиум)
Усталость: Амантадин (Симметрел), армодафинил (Нувигил), модафинил (Провигил)
Депрессия: Антидепрессанты, такие как бупропион (Веллбутрин), флуоксетин (Прозак) и сертралин (Золофт000)
Проблем. (Дитропан) или толтеродин (Детрол)
Они также могут посоветовать:
Физиотерапия : квалифицированный медицинский работник научит вас упражнениям, которые помогут вам оставаться активными.Вы также можете узнать, как использовать трость, ходунки или другое вспомогательное устройство, чтобы легче передвигаться.
Вы можете изменить образ жизни
Лекарства — не единственный ответ. Забота о себе поможет вам лучше жить с РС. Следите за тем, чтобы вы:
Больше отдыхали: Соблюдайте регулярный график сна и убедитесь, что в вашей спальне прохладно, темно и нет экранов.
Ешьте здоровую пищу: «РС-диеты не существует». Выбирайте продукты с низким содержанием насыщенных жиров и высоким содержанием клетчатки.Веб-сайт MyPlate Министерства сельского хозяйства США является хорошей отправной точкой.
Продолжение
Поупражняйтесь: Даже прогулка вокруг квартала может помочь. Упражнения укрепляют кости и укрепляют мышцы. Он сдерживает депрессию и помогает лучше спать.
Управляйте стрессом: Это может ухудшить ваши симптомы. Медитируете ли вы, читаете, ведете дневник или болтаете с друзьями, найдите то, что поможет вам контролировать взлеты и падения.
Сохраняйте спокойствие: Повышение температуры тела может ухудшить ваши симптомы.Оставайтесь в кондиционере, если можете. На улице носите свободную дышащую одежду.
Есть ли альтернативные методы лечения?
Многие продукты утверждают, что помогают при симптомах рассеянного склероза. Остерегайтесь тех, кто не занимается научными исследованиями или делает заявления, которые кажутся слишком хорошими, чтобы быть правдой. Поговорите со своим врачом обо всем, что вам хочется принять. Некоторые добавки могут изменить действие ваших лекарств.
Текущие исследования показывают, что эти методы лечения стоит попробовать:
Витамин D: Низкий уровень витамина D в крови может повысить ваши шансы на РС.В настоящее время проводятся исследования, чтобы выяснить, могут ли добавки с витамином D помочь. Вам следует попросить врача проверить ваш уровень и обсудить, нужно ли вам принимать добавки.
Иглоукалывание: Это традиционное китайское лечение утверждает, что энергия, называемая ци, течет по вашему телу по линиям, называемым меридианами. Когда ваша ци не в порядке, это приводит к болезни или боли. Иглотерапевт вводит тонкие иглы в точки вдоль меридианов, чтобы изменить ваш поток энергии. Исследования показывают, что он может помочь при таких симптомах РС, как усталость, боль, настроение, спастичность, онемение, покалывание и проблемы с мочевым пузырем.
10 лекарственных средств, обычно назначаемых при рассеянном склерозе
Рассеянный склероз (РС) — хроническое неврологическое заболевание. Он влияет на центральную нервную систему, включая головной и спинной мозг. По неизвестным причинам иммунная система человека начинает атаковать защитное покрытие — миелин — вокруг нервов. Повреждение миелина нарушает нормальный поток нервных сигналов. Это то, что вызывает симптомы и инвалидность при рассеянном склерозе. Общие симптомы рассеянного склероза включают усталость, слабость и затруднения при ходьбе.
РС поражает почти 400 000 американцев. Это может произойти в любом возрасте, но обычно поражает молодых людей. Точно так же и мужчины, и женщины могут заболеть РС, но он в четыре раза чаще встречается у женщин по сравнению с мужчинами.
При наиболее распространенной форме заболевания симптомы обостряются приступами или рецидивами, которые могут длиться неделями. Затем болезнь на какое-то время стабилизируется без прогрессирования. Лекарства могут помочь снизить частоту приступов и облегчить симптомы, когда они возникают.
Классы лекарств от рассеянного склероза
В настоящее время лекарства от РС не существует.Однако комплексное лечение рассеянного склероза может отсрочить инвалидность и сохранить качество вашей жизни. При выборе лекарств для лечения рассеянного склероза врачи руководствуются рекомендациями экспертов. Классы препаратов для лечения РС включают:
Ваш врач будет наблюдать за вашим рассеянным склерозом после того, как вы начнете лечение. Ваш врач захочет узнать, сохраняются ли у вас симптомы и насколько они серьезны. Это поможет вашему врачу оценить эффективность вашего лечения.Ваш врач также будет отслеживать ваше заболевание и лечение с помощью визуальных обследований, таких как МРТ.
Обычные препараты от рассеянного склероза
Ваш врач может выбирать из каждого класса лекарств от РС. Поиск подходящего лечения может потребовать некоторых методов проб и ошибок. Вот 10 препаратов, обычно назначаемых при РС:
Принимая решение о лечении, поговорите со своим врачом о рисках и преимуществах. Агенты, модифицирующие заболевание, связаны с потенциальными проблемами, которые следует учитывать. Ваш врач может помочь вам принять правильное решение в зависимости от тяжести вашего заболевания, общего состояния здоровья и других факторов. Кроме того, поговорите со своим врачом о физиотерапии и других способах облегчить симптомы и сохранить свое здоровье.
Исследователи продолжают изучать причины и методы лечения рассеянного склероза. Сюда входят клинические испытания терапии стволовыми клетками и стратегии восстановления миелина. Клинические испытания могут дать людям доступ к экспериментальным методам лечения, которых в настоящее время нет на рынке. Если вы заинтересованы в участии в испытании, поговорите со своим врачом.
Рассеянный склероз (РС): типы, симптомы и причины
Рассеянный склероз — хроническое заболевание, поражающее центральную нервную систему, особенно головной, спинной мозг и зрительные нервы.Это может вызвать широкий спектр симптомов по всему телу.
Невозможно предсказать, как будет развиваться рассеянный склероз (РС) у любого человека.
У некоторых людей наблюдаются легкие симптомы, такие как помутнение зрения, онемение и покалывание в конечностях. В тяжелых случаях человек может испытывать паралич, потерю зрения и проблемы с подвижностью. Однако такое бывает редко.
Трудно точно сказать, сколько людей болеют РС. По данным Национального института неврологических расстройств и инсульта (NINDS), 250 000–350 000 человек в США живут с РС.
По оценке Национального общества рассеянного склероза, это число может быть ближе к 1 миллиону.
Однако новые методы лечения доказали свою эффективность в замедлении развития болезни.
Ученые точно не знают, что вызывает рассеянный склероз, но они считают, что это аутоиммунное заболевание, поражающее центральную нервную систему (ЦНС). Когда у человека аутоиммунное заболевание, иммунная система атакует здоровые ткани так же, как она может атаковать вирус или бактерии.
В случае рассеянного склероза иммунная система атакует миелиновую оболочку, которая окружает и защищает нервные волокна, вызывая воспаление.Миелин также помогает нервам быстро и эффективно проводить электрические сигналы.
Рассеянный склероз означает «рубцовая ткань в нескольких областях».
Когда миелиновая оболочка исчезает или повреждается в нескольких областях, остается шрам или склероз. Врачи также называют эти области бляшками или высыпаниями. В основном они влияют на:
По мере развития поражений нерв волокна могут сломаться или повредиться.В результате электрические импульсы от мозга не проходят плавно к целевому нерву. Это означает, что организм не может выполнять определенные функции.
Существует четыре типа РС:
Клинически изолированный синдром (CIS) : Это единственный первый эпизод с продолжительностью симптомов не менее 24 часов. Если позже произойдет еще один эпизод, врач поставит диагноз ремиттирующего РС.
РС с ремиттирующим рецидивом (РСР) : Это наиболее распространенная форма, поражающая около 85% людей с РС.RRMS включает эпизоды новых или усиливающихся симптомов, за которыми следуют периоды ремиссии, во время которых симптомы частично или полностью исчезают.
Первичный прогрессирующий РС (ППРС) : Симптомы прогрессивно ухудшаются без ранних рецидивов или ремиссий. Некоторые люди могут испытывать периоды стабильности и периоды, когда симптомы ухудшаются, а затем улучшаются. Около 15% людей с РС имеют PPMS.
Вторично-прогрессирующий РС (ВПРС) : Сначала люди будут испытывать эпизоды рецидива и ремиссии, но затем болезнь начнет неуклонно прогрессировать.
Узнайте больше о различных типах РС и их значении.
Поскольку РС влияет на ЦНС, которая контролирует все действия в организме, симптомы могут влиять на любую часть тела.
Наиболее частые симптомы рассеянного склероза:
Мышечная слабость : У людей могут развиться слабые мышцы из-за недостаточного использования или стимуляции из-за повреждения нервов.
Онемение и покалывание : Ощущение иголки и иголки — один из самых ранних симптомов рассеянного склероза, который может поражать лицо, тело или руки и ноги.
Знак Лермитта : человек может испытывать ощущение, подобное удару электрическим током, когда он двигает шеей, известное как знак Лермитта.
Проблемы с мочевым пузырем : Человек может испытывать трудности с опорожнением мочевого пузыря или часто или внезапно помочиться (непреодолимое недержание мочи). Утрата контроля над мочевым пузырем — ранний признак рассеянного склероза.
Проблемы с кишечником : Запор может вызвать закупорку каловых масс, что может привести к недержанию кишечника.
Усталость : Это может подорвать способность человека функционировать на работе или дома.Усталость — один из самых распространенных симптомов рассеянного склероза.
Головокружение и головокружение : это общие проблемы, наряду с проблемами равновесия и координации.
Сексуальная дисфункция : И мужчины, и женщины могут потерять интерес к сексу.
Спастичность и мышечные спазмы : Это ранний признак рассеянного склероза. Поврежденные нервные волокна спинного и головного мозга могут вызывать болезненные мышечные спазмы, особенно в ногах.
Тремор : Некоторые люди с рассеянным склерозом могут испытывать непроизвольные дрожащие движения.
Проблемы со зрением : Некоторые люди могут испытывать двоение в глазах или нечеткость зрения, частичную или полную потерю зрения или искажение красно-зеленого цвета. Обычно это затрагивает один глаз за раз. Воспаление зрительного нерва может вызвать боль при движении глаза. Проблемы со зрением — ранний признак рассеянного склероза.
Изменения походки и подвижности : РС может изменить способ ходьбы людей из-за мышечной слабости и проблем с равновесием, головокружения и утомляемости.
Эмоциональные изменения и депрессия : Демиелинизация и повреждение нервных волокон в головном мозге могут вызвать эмоциональные изменения.
Проблемы с обучением и памятью : Они могут затруднить концентрацию, планирование, обучение, расстановку приоритетов и выполнение нескольких задач.
Боль : Боль — частый симптом рассеянного склероза. Невропатическая боль напрямую связана с рассеянным склерозом. Другие виды боли возникают из-за слабости или жесткости мышц.
Менее распространенные симптомы включают:
Существует также более высокий риск:
Они могут влияют на работу и общественную жизнь человека.
На более поздних стадиях люди могут испытывать изменения в восприятии и мышлении, а также в чувствительности к теплу.
РС по-разному влияет на людей. У некоторых это начинается с легкого ощущения, и их симптомы не прогрессируют в течение месяцев или лет. Иногда симптомы ухудшаются быстро, в течение недель или месяцев.
У некоторых людей будут только легкие симптомы, а у других произойдут значительные изменения, которые приведут к инвалидности. Однако у большинства людей бывают времена, когда симптомы ухудшаются, а затем улучшаются.
Признак Лермитта — распространенный симптом рассеянного склероза, который возникает, когда человек двигает головой. Узнайте больше здесь.
Ученые на самом деле не знают, что вызывает РС, но факторы риска включают:
Возраст : Большинство людей получают диагноз в возрасте от 20 до 40 лет.
Пол : Большинство форм РС в два раза чаще поражают женщин, чем мужчин.
Генетические факторы : Восприимчивость может передаваться по наследству в генах, но ученые считают, что для развития рассеянного склероза также необходим триггер окружающей среды, даже у людей с определенными генетическими особенностями.
Курение : Вероятность развития рассеянного склероза у курильщиков выше. У них, как правило, больше поражений и сморщенных мозгов, чем у некурящих.
Инфекции : Воздействие вирусов, таких как вирус Эпштейна-Барра (ВЭБ), или мононуклеоз, может увеличить риск развития рассеянного склероза у человека, но исследования не показали определенной связи. Другие вирусы, которые могут играть определенную роль, включают вирус герпеса человека 6 типа (HHV6) и микоплазменную пневмонию.
Дефицит витамина D : РС чаще встречается у людей, которые меньше подвержены воздействию яркого солнечного света, который необходим организму для выработки витамина D.Некоторые эксперты считают, что низкий уровень витамина D может повлиять на работу иммунной системы.
Дефицит витамина B12 : Организм использует витамин B, когда производит миелин. Недостаток этого витамина может увеличить риск неврологических заболеваний, таких как рассеянный склероз.
Предыдущие теории включали воздействие собачьей чумы, физических травм или аспартама, искусственного подсластителя, но нет никаких доказательств, подтверждающих это.
Вероятно, нет единого триггера для РС, но могут влиять несколько факторов.
Как рассеянный склероз влияет на женщин? Нажмите здесь, чтобы узнать больше.
Врач проведет физикальное и неврологическое обследование, спросит о симптомах и изучит историю болезни человека.
Ни один тест не может подтвердить диагноз, поэтому врач будет использовать несколько стратегий, решая, соответствует ли человек критериям диагноза.
К ним относятся:
Симптомы других состояний схожи с симптомами рассеянного склероза, поэтому врач может предложить другие тесты для выявления других возможных причин.
Если врач ставит диагноз рассеянного склероза, ему необходимо определить, какой это тип и активен он или нет. В будущем человеку могут потребоваться дополнительные тесты, чтобы оценить дальнейшие изменения.
Подробнее о тестах для диагностики РС.
Нет лекарства от РС, но доступно лечение, которое может:
Некоторые люди также используют дополнительные и альтернативные методы лечения, но исследования не дают всегда подтверждайте их полезность.
Лекарства для замедления прогрессирования
Некоторые виды терапии, модифицирующие болезнь (DMT), одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для рецидивирующих форм рассеянного склероза. Они работают, изменяя способ функционирования иммунной системы.
Врач может давать некоторые из них перорально, некоторые в виде инъекций, а некоторые в виде вливаний. Как часто человеку нужно их принимать и смогут ли они это делать дома, будет зависеть от препарата.
Следующие DMT в настоящее время одобрены:
Инъекционные препараты
Пероральные препараты
Инфузионные препараты
, так как есть хорошие шансы использовать эти препараты на ранней стадии что они могут замедлить прогрессирование рассеянного склероза, особенно если человек принимает их, когда симптомы еще не являются серьезными.
Некоторые лекарства более полезны на определенных этапах. Например, врач может назначить митоксантрон на более поздней, более тяжелой стадии рассеянного склероза.
Врач будет следить за тем, насколько хорошо действует препарат, так как могут быть побочные эффекты, а одни и те же препараты подходят не всем. Новые варианты лекарств, поступающие на рынок, оказываются более безопасными и эффективными, чем некоторые существующие.
Побочные эффекты иммунодепрессантов включают более высокий риск инфекций. Некоторые лекарства также могут нанести вред печени.
Если человек замечает побочные эффекты или его симптомы ухудшаются, ему следует обратиться за медицинской помощью.
Лекарства для облегчения симптомов во время обострения
Другие лекарства полезны, когда человек испытывает ухудшение симптомов во время обострения. Они не будут постоянно нуждаться в этих препаратах.
Кортикостероиды : Они уменьшают воспаление и подавляют иммунную систему. Они могут лечить обострение симптомов при определенных типах рассеянного склероза. Примеры включают Solu-Medrol (метилпреднизолон) и Deltasone (преднизон).Стероиды могут иметь побочные эффекты, если человек использует их слишком часто, и они вряд ли принесут долгосрочную пользу.
Поведенческие изменения : При возникновении проблем со зрением врач может порекомендовать время от времени давать глазам отдых или ограничивать время просмотра экрана. Больному рассеянным склерозом может потребоваться научиться отдыхать, когда наступает усталость, и поддерживать темп, чтобы он мог выполнять действия.
Проблемы с подвижностью и равновесием : Могут помочь физиотерапия и приспособления для ходьбы, такие как трость.Также может оказаться полезным лекарство далфампридин (Ампира).
Tremor : Человек может использовать вспомогательные устройства или прикреплять к конечностям утяжелители, чтобы уменьшить тряску. Лекарства также могут помочь при треморе.
Усталость : Достаточный отдых и избегание тепла могут помочь. Физическая и трудотерапия может помочь научить людей более комфортным способам работы. Вспомогательные устройства, например самокат, могут помочь сэкономить энергию. Медикаменты или консультация могут помочь повысить энергию за счет улучшения сна.
Боль : Врач может назначить противосудорожные или спазмолитические препараты или инъекции алкоголя для облегчения невралгии тройничного нерва, острой боли, которая поражает лицо. Обезболивающие, такие как габапентин, могут помочь при боли в теле. Также существуют лекарства для снятия мышечной боли и спазмов при рассеянном склерозе.
Проблемы с мочевым пузырем и кишечником : Некоторые лекарства и диетические изменения могут помочь решить эти проблемы.
Депрессия : Врач может прописать селективный ингибитор обратного захвата серотонина (СИОЗС), поскольку они с меньшей вероятностью вызывают усталость, чем другие антидепрессанты.
Когнитивные изменения : Донепезил, лекарство от болезни Альцгеймера, может помочь некоторым людям.
Узнайте больше о том, как справиться с обострением рассеянного склероза.
Дополнительные и альтернативные методы лечения
Следующее может помочь с различными аспектами рассеянного склероза:
Что такое здоровая диета для человека с рассеянным склерозом? Узнай здесь.
Медицинская марихуана
Исследования показали, что каннабис может облегчить боль, мышечную ригидность и бессонницу. Однако для подтверждения этого недостаточно доказательств.
Люди также должны иметь в виду, что:
Человек должен посоветоваться со своим врачом перед употреблением каннабиса, так как некоторые формы могут иметь побочные эффекты.Курение каннабиса вряд ли принесет пользу и может усугубить симптомы.
Некоторые люди предполагают, что биотин может помочь. Узнайте больше здесь.
Реабилитация и физиотерапия
Реабилитация может помочь улучшить или сохранить способность человека эффективно работать дома и на работе.
Программы обычно включают:
Физиотерапия : Целью программы является обеспечение навыков для поддержания и восстановления максимальной подвижности и функциональных способностей.
Трудотерапия : Терапевтическое использование работы, ухода за собой и игры может помочь поддерживать умственные и физические функции.
Логопед и глотание : Логопед проведет специализированное обучение для тех, кто в этом нуждается.
Когнитивная реабилитация : Это помогает людям справляться с конкретными проблемами мышления и восприятия.
Профессиональная реабилитация : Помогает человеку, чья жизнь изменилась из-за РС, в построении карьерных планов, приобретении профессиональных навыков, получении и сохранении работы.
Плазмообмен
Плазмообмен включает забор крови у человека, удаление плазмы, замену ее новой плазмой и переливание обратно человеку.
Этот процесс удаляет из крови антитела, которые атакуют части тела человека, но неясно, может ли он помочь людям с рассеянным склерозом. Исследования дали неоднозначные результаты.
Плазменный обмен обычно подходит только для тяжелых атак MS.
Терапия стволовыми клетками
Ученые изучают возможность использования терапии стволовыми клетками для регенерации различных клеток организма и восстановления функций тех, кто потерял их из-за состояния здоровья.
Исследователи надеются, что однажды методы терапии стволовыми клетками смогут обратить вспять ущерб, нанесенный РС, и восстановить функциональность нервной системы.
РС — потенциально серьезное заболевание, поражающее нервную систему. Прогрессирование рассеянного склероза у разных людей разное, поэтому трудно предсказать, что произойдет, но большинство людей не испытают серьезную инвалидность.
В последние годы ученые добились быстрого прогресса в разработке лекарств и методов лечения рассеянного склероза.Новые лекарства безопаснее и эффективнее, и они дают большие надежды на замедление прогрессирования болезни.
По мере того, как исследователи узнают больше о генетических особенностях и изменениях, которые происходят с РС, есть также надежда, что они смогут легче предсказать, какой вид РС будет у человека, и разработать наиболее эффективное лечение на самой ранней стадии.
Человек, получающий соответствующее лечение и ведущий здоровый образ жизни, может рассчитывать прожить столько же лет, что и человек без рассеянного склероза.
Важно заручиться поддержкой людей, которые понимают, что значит получить диагноз и жить с РС. MS Healthline — это бесплатное приложение, которое обеспечивает поддержку через беседы один на один и живые групповые обсуждения с людьми, страдающими этим заболеванием. Загрузите приложение для iPhone или Android.
Узнайте больше о том, как рассеянный склероз может повлиять на продолжительность жизни.
Прочтите статью на испанском языке.
Недавние исследования причин и лечения
Рассеянный склероз (РС) вызывает широкий спектр симптомов, затрагивающих головной мозг, зрительные нервы и спинной мозг.Исследования только начинают показывать, кто подвергается риску и что вызывает это заболевание.
РС — хроническое заболевание, от которого страдают 2,8 миллиона человек во всем мире. Хотя варианты лечения в настоящее время ограничены, в настоящее время проводятся испытания нескольких новых подходов.
Исследователи считают, что РС — это аутоиммунное заболевание. При этом заболевании иммунная система атакует здоровые клетки так же, как вирусы или бактерии.
В случае рассеянного склероза иммунная система атакует миелиновую оболочку, окружающую нервные клетки.Атака вызывает образование поражений, которые со временем вызывают рубцевание, что приводит к повреждению нервов и снижению функции.
В результате этого повреждения человек с рассеянным склерозом может испытывать онемение и покалывание, утомляемость, мышечную слабость, головокружение и головокружение, а также проблемы с памятью и зрением, а также другие симптомы.
Существует четыре типа РС: клинически изолированный синдром (КИС), ремиттирующий РС, первично-прогрессирующий РС и вторично-прогрессирующий РС.
CIS — это единичный эпизод симптомов, подобных рассеянному склерозу, который длится не менее 24 часов.Люди с CIS не обязательно болеют РС, но эпизод может быть первым признаком этого состояния.
Лечение рассеянного склероза включает междисциплинарную помощь, включая реабилитацию, лекарственные препараты, модифицирующие болезнь (DMARD), а также дополнительные и альтернативные методы лечения.
Ученые не до конца понимают факторы риска РС и механизмы этого состояния. Однако они делают новый шаг в поисках ответов и улучшений в лечении.
Что показывают последние исследования о факторах риска, механизмах и методах лечения РС? В этой специальной статье « Medical News Today» предлагает более подробный обзор.
Французский невролог Жан-Мартен Шарко впервые описал признаки рассеянного склероза в 1868 году. Он отметил разницу между этим состоянием и тремором возбужденного паралича, симптомом неврологического состояния, позже названного болезнью Паркинсона.
Три симптома, связанные с рассеянным склерозом, в то время назывались триадой Шарко. Они включали характерный тремор, непроизвольные движения глаз, также известные как нистагм, и сканирующую речь, которую некоторые называют стаккато или взрывной речью.
Спустя десятилетия изобретение МРТ помогло врачам диагностировать рассеянный склероз. Лечение стероидами стало обычным явлением, и затем врачи начали использовать лекарства из класса препаратов, называемых интерферонами. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) впервые одобрило интерфероны для использования у людей с РС в 1993 году.
Основные моменты статьи:
Хотя ученые и медицинские работники понимают определяющие особенности РС, некоторые аспекты этого состояния остаются загадкой.
Хотя исследователи признают, что РС является аутоиммунным заболеванием, они не понимают, почему иммунные клетки атакуют миелин.
Кроме того, диагностика рассеянного склероза все еще является неоднозначным процессом, поскольку его симптомы аналогичны симптомам многих других заболеваний.
Кроме того, эксперты не знают, почему у женщин в 2–3 раза больше шансов получить диагноз РС, чем у мужчин.
Исследования показывают, что факторы риска рассеянного склероза включают недостаток витамина D или солнечного света, курение, ожирение, инфицирование вирусом Эпштейна-Барра в анамнезе, принадлежность к женскому полу и, возможно, унаследованные определенные гены, а также факторы окружающей среды.
В последнее время микробиота кишечника стала возможным модулятором риска.
Недавний обзор клинических исследований показал, что у людей с РС были большие популяции Pedobacteria , Flavobacterium , Pseudomonas , Mycoplana , Acinetobacter , Eggerthella , Dorea , Blautia , Blautia , Streptococcus и Akkermansia в кишечнике больше, чем у людей без рассеянного склероза.
У людей с рассеянным склерозом также сократились популяции Prevotella , Bacteroides , Parabacteroides , Haemophilus , Sutterella , Adlercreutzia , Coprobacillus , Lactobacillus , и бактерии Faecalibacterium .
Исследователи предполагают, что балансирование популяций кишечных бактерий у людей с рассеянным склерозом может уменьшить воспаление и гиперактивацию иммунной системы.
Исследования, проведенные Эдинбургским центром исследований рассеянного склероза, показали, что у людей с рассеянным склерозом количество тормозных нейронов меньше, чем у людей, не страдающих этим заболеванием.
Однако у людей с РС было столько же стимулирующих нейронов, сколько у людей без этого заболевания. Это было верно даже для людей, которым поставили диагноз РС много лет назад.
Эти данные помогают выявить типы нейронов, пораженных рассеянным склерозом, проливая больше света на то, как это состояние развивается в организме.Исследование также может дать представление о методах лечения, которые могут защитить целевые нейроны.
DMARD, которые органы здравоохранения недавно одобрили для лечения рассеянного склероза, включают кладрибин (Mavenclad) и сипонимод (Mayzent) для рецидивирующей ремиттирующей и активной вторично-прогрессирующей форм этого состояния.
Кладрибин нацелен на лимфоциты, белые кровяные тельца, ответственные за атаку на миелин. Сипонимод использует определенные лейкоциты, которые атакуют миелин и предотвращают их циркуляцию в организме.
Однако из-за их взаимодействия с иммунной системой эти препараты могут приводить к уменьшению количества лимфоцитов, делая человека уязвимым для инфекций.
Действие лекарств также может способствовать снижению реакции на вакцины у людей, получающих плановую вакцинацию. С введением вакцины COVID-19 ученые исследовали, могут ли люди с РС, принимающие такие лекарства, как кладрибин, иметь адекватный ответ на вакцины.
Последние исследования показывают, что люди, принимающие кладрибин, действительно вырабатывают защитные антитела к другим распространенным вакцинам, несмотря на снижение уровня лимфоцитов, вызванное лекарством.
Этот результат дает ученым и другим представителям медицинского сообщества надежду на то, что люди, принимающие эти препараты от рассеянного склероза, также будут адекватно реагировать на вакцины COVID-19.
Некоторые ученые в настоящее время исследуют возможности лечения РС стволовыми клетками. В исследовании фазы 1, проведенном в Каролинском институте в Стокгольме, Швеция, семь человек с прогрессирующим РС получали вливания стволовых клеток, полученных из собственного костного мозга каждого участника.
Уже через 7 дней после начала терапии стволовыми клетками исследователи обнаружили доказательства положительных изменений в иммунной системе участников.Через 12 недель у пяти из шести участников не было новых характерных поражений на последующих МРТ головного мозга.
По мере развития их понимания состояния многие ученые исследуют первопричину рассеянного склероза.
Анализ текущих данных выявил возможную связь между здоровьем кишечника и состоянием. Постоянно появляются данные, раскрывающие взаимосвязь между кишечной микробиотой и мозгом, и ученые надеются, что модификации диеты, пробиотики и определенные лекарства, которые уравновешивают микробиом кишечника, будут играть роль в лечении рассеянного склероза.
Также в разработке находятся методы ремиелинизации и нейропротекции. Последние направлены на защиту аксонов и миелина от дальнейшего повреждения, в то время как первые могут восстановить утраченные функции для людей с рассеянным склерозом.
